Un nouvel algorithme de diagnostic pour la maladie de Lyme au Canada

 Téléchargez cet article en format PDF
Téléchargez cet article en format PDFPublié par : L’Agence de la santé publique du Canada
Numéro : Volume 46–5 : Surveillance de l’infection nosocomiale
Date de publication : 7 mai 2020
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 46–5, le 7 mai 2020 : Surveillance de l’infection nosocomiale
Aperçu
Algorithme de sérologie à deux volets modifiée pour le sérodiagnostic de la maladie de Lyme : contexte canadien
Todd Hatchette1, Robbin Lindsay2 au nom du Groupe de travail sur le diagnostic de la maladie de Lyme
Affiliations
1 Département de pathologie et de médecine de laboratoire, Université Dalhousie, Halifax, NS
2 Laboratoire national de microbiologie, Agence de la santé publique du Canada, Winnipeg, MB
Correspondance
Citation proposée
Hatchette TF, Lindsay LR au nom du Groupe de travail sur le diagnostic de la maladie de Lyme. Algorithme de sérologie à deux volets modifiée pour le sérodiagnostic de la maladie de Lyme : contexte canadien. Relevé des maladies transmissibles au Canada 2020;46(5):140–7. https://doi.org/10.14745/ccdr.v46i05a05f
Mots-clés : Borrelia burgdorferi, maladie de Lyme, sérologie, sérologie à deux volets standard, essais immunoenzymatiques, tests d’immuno-empreinte, diagnostics
Résumé
Contexte : La maladie de Lyme (ML) est en progression dans de nombreuses régions du centre et de l’est du Canada. Le sérodiagnostic est la méthode la plus couramment utilisée pour étayer le diagnostic en laboratoire de la ML. La sérologie à deux volets standard (SDVS) de la ML consiste à détecter les anticorps dirigés contre Borrelia burgdorferi au moyen d’un essai immunoenzymatique (EIA) suivi d’un test d’immuno-empreinte des IgM et/ou des IgG. Une meilleure sensibilité a cependant été observée avec une approche de sérologie à deux volets modifiée (SDVM), qui consiste à remplacer le test d’immuno-empreinte habituel par un second EIA. Cet article résume les données probantes étayant l’utilisation de la SDVM par rapport à la SDVS pour le sérodiagnostic de la ML au Canada.
Méthodes : La sensibilité et la spécificité de différents EIA ont été comparées entre la SDVM et la SDVS chez des patients ayant des antécédents cliniques de ML et vivant dans des régions où la ML est endémique ou à partir d’échantillons issus de la banque de sérums pour la ML. Cette comparaison à été effectuée par un groupe d’experts canadiens en diagnostic de la maladie de Lyme à partir de publications évaluées par les pairs.
Résultats : La SDVM a systématiquement démontré une meilleure sensibilité dans la détection des infections à B. burgdorferi au stade précoce par rapport à la SDVS tout en maintenant une spécificité élevée.
Conclusion : Des améliorations dans la sensibilité du diagnostic de la ML sans perte importante de spécificité ont été systématiquement observées lorsque la SDVM était comparée à la SDVS dans les études menées dans les régions où la ML est fortement endémique. Notre groupe de travail souscrit à la recommandation des Centres pour le contrôle et la prévention des maladies (CDC) des États-Unis selon laquelle le sérodiagnostic de la ML par SDVM constitue une solution de substitution acceptable à la STDS. Cette recommandation est conditionnelle à la conception et à la réalisation d’études de validation approfondies sur l’efficacité de la STDM par rapport à la STDS dans le contexte canadien, notamment avec l’évaluation de l’efficacité du test dans les régions où la ML est faiblement endémique.
Introduction
La maladie de Lyme (ML) est une infection émergente causée par des spirochètes appartenant au complexe d’espèces Borrelia burgdorferi sensu lato, et transmise à l’homme par des tiques infectéesNote de bas de page 1. Ses principaux vecteurs sont la tique à pattes noires (Ixodes scapularis) dans l’est et le centre du Canada et la tique occidentale à pattes noires (Ixodes pacificus) en Colombie-BritanniqueNote de bas de page 2. Au Canada, les populations de tiques à pattes noires infectées sont endémiques dans certaines parties de la Colombie-Britannique, du Manitoba, de l’Ontario, du Québec, du Nouveau-Brunswick et de la Nouvelle-ÉcosseNote de bas de page 3. Depuis que la ML est devenue une maladie à déclaration obligatoire à l’échelle nationale, le nombre de Canadiens atteints a augmenté, passant de 144 cas en 2009 à 2025 en 2017, un chiffre sans doute inférieur à la réalitéNote de bas de page 1Note de bas de page 2Note de bas de page 4. Puisque le périmètre géographique des tiques à pattes noires continue de s’étendre, de plus en plus de Canadiens seront susceptibles de contracter la MLNote de bas de page 5. On estime à plus de 300 000 le nombre de cas de ML aux États-Unis chaque annéeNote de bas de page 6. Le nombre de tests de diagnostic de la ML réalisés aux États-Unis est largement supérieur à celui du CanadaNote de bas de page 7. Cela a contribué à stimuler les efforts visant à renforcer l’efficacité du diagnostic de la ML, notamment avec l’élaboration et l’approbation de la sérologie à deux volets modifiée (SDVM)Note de bas de page 8. Ce document a pour objectif de résumer les données probantes étayant l’efficacité accrue de la SDVM par rapport à l’algorithme d’analyse actuellement utilisé pour diagnostiquer la ML.
Intervention
Le sérodiagnostic est la méthode de référence la plus souvent utilisée dans le diagnostic en laboratoire de la ML. Il consiste à détecter les anticorps dirigés contre B. burgdorferi par une sérologie à deux volets standard (SDVS) : un essai immunoenzymatique (EIA) suivi d’un test complémentaire d’immuno-empreinte des IgM et/ou des IgG (figure 1). La plupart des laboratoires de santé publique ou hospitaliers effectuent l’EIA à l’échelle locale tandis que le test d’immuno-empreinte est effectué de manière indépendante par les laboratoires de santé publique provinciaux de la Colombie-Britannique et de l’Ontario (et bientôt du Québec) ou par le Laboratoire national de microbiologie (LNM). Le LNM effectue le test d’immuno-empreinte pour toutes les provinces lorsqu’on soupçonne la présence de la ML chez des patients qui ont voyagé en dehors de l’Amérique du Nord (figure 1). Quel que soit le type d’analyse, les résultats sont examinés par le personnel de laboratoire et communiqués au médecin demandeur; les résultats positifs sont également transmis aux autorités locales/provinciales de santé publique.
Figure 1 : Schéma illustrant les étapes de la sérologie à deux volets standard et de la sérologie à deux volets modifiée de la maladie de LymeFigure 1 note a
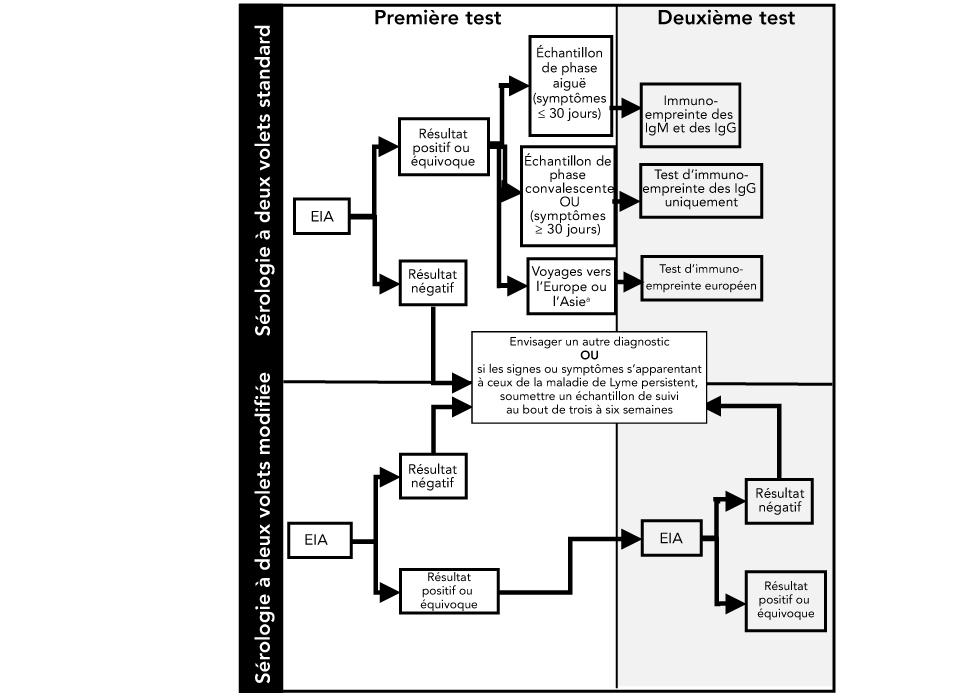
Description textuelle : Figure 1
Figure 1 : Schéma illustrant les étapes de la sérologie à deux volets standard et de la sérologie à deux volets modifiée de la maladie de LymeFigure 1 note a
Des schémas des premiers et deuxièmes tests pour la sérologie à deux volets standard (SDVS) et la sérologie à deux volets modifiée (SDVM) sont illustrés à la figure 1. Premièrement, un test immunoenzymatique (EIA) est fait. Si le résultat est négatif, envisager un autre diagnostic OU si les signes ou symptômes persistent et s’apparentent à ceux de la maladie de Lyme (ML), soumettre un échantillon de suivi au bout de trois à six semaines. Deuxièmement, si le résultat de l’EIA est positif ou équivoque et l’échantillon est prélevé à la phase aigüe (≤ 30 jours), le deuxième test à mener est une immuno-empreinte des IgM et des IgG. Si l’échantillon est prélevé à la phase convalescente OU si les symptômes persistent pour ≥ 30 jours, un test d’immuno-empreinte des IgG uniquement est fait. Si le/la patient(e) a voyagé(e) vers l’Europe ou l’Asie, un test d’immuno-empreinte européen est fait.
Pour les SDVS, un EIA est fait pour le premier test. Si le résultat est négatif, envisager un autre diagnostic OU si les signes ou symptômes persistent et s’apparentent à ceux de la ML, soumettre un échantillon de suivi au bout de trois à six semaines. Si le résultat est positif ou équivoque, le deuxième test est un autre EIA. Le deuxième EIA peut être soit positif, équivoque ou négatif. Si le résultat est négatif, envisager un autre diagnostic OU si les signes ou symptômes persistent et s’apparentent à ceux de la ML, soumettre un échantillon de suivi au bout de trois à six semaines.
Il existe différents EIA pour le premier volet de la SDVS, notamment ceux composés de sonicats de cellules entières (SCE) de la souche de laboratoire de B. burgdorferi B31. Plus récemment, des EIA fondés sur des peptides synthétiques contenant des régions conservées parmi plusieurs souches de B. burgdorferi, comme la séquence protéique variable majeure exprimée (VIsE) de la lipoprotéine de surface, le peptide C6 (région invariable 6 de la protéine VIsE) ou le peptide C10 (partie N-terminal conservée de la protéine de surface externe C), ont été mis au pointNote de bas de page 8Note de bas de page 9. Bien que les essais les plus récents présentent une spécificité supérieure à celle des essais à base de SCE, ils ne sont toujours pas assez spécifiques pour être utilisés comme seul essai. Il est donc recommandé d’effectuer une analyse complémentaire par test d’immuno-empreinteNote de bas de page 9Note de bas de page 10Note de bas de page 11Note de bas de page 12. La SDVS est soumis à un certain nombre de contraintes techniques, notamment le fait que les tests d’immuno-empreinte sont plus difficiles à réaliser que les EIA et que l’interprétation des résultats de l’immuno-empreinte peut être subjective, ce qui peut induire une variabilité inter- et intra-laboratoireNote de bas de page 11. Par ailleurs, comme les tests d’immuno-empreinte sont effectués par un nombre relativement faible de laboratoires de diagnostic de référence aux États-UnisNote de bas de page 7 et au Canada, les délais d’exécution sont généralement plus longs que pour les EIANote de bas de page 8Note de bas de page 11.
L’efficacité de l’algorithme de la SDVS dépend également du stade de l’infection. Une revue systématique récente a montré que la sensibilité de la SDVS pour la ML était faible au stade localisé précoce de l’infection (moins de 50 %), mais particulièrement élevée aux stades tardifs de l’infection (proche de 100 %)Note de bas de page 13. De ce fait, le diagnostic et le traitement de la ML au stade localisé précoce reposent uniquement sur les symptômes cliniques des patients ayant été exposés dans des régions où la tique à pattes noires est endémiqueNote de bas de page 10. Le diagnostic de la ML au stade précoce peut néanmoins s’avérer difficile, car certains patients atteints d’une infection à B. burgdorferi au stade localisé précoce ne présentent pas d’érythème migrant et peuvent manifester des symptômes qui se confondent avec ceux d’autres maladiesNote de bas de page 9Note de bas de page 14. Il est donc important d’améliorer la sensibilité du test diagnostique des infections au stade localisé précoce pour recenser les patients atteints de la ML, les traiter le plus rapidement possible et, éventuellement, empêcher la dissémination de l’infection et son évolution vers une forme grave de la maladie.
Résultats
Sérologie à deux volets modifiée pour le sérodiagnostic de la maladie de Lyme
Plusieurs études ont évalué l’utilisation d’une approche de SDVM dans laquelle le test d’immuno-empreinte habituel est remplacé par un second EIA (figure 1). De multiples combinaisons différentes d’EIA ont été utilisées dans cette « approche à double EIA », notamment un EIA à base de SCE suivi d’un EIA basé sur le peptide C6, un EIA basé sur la protéine VIsE suivi d’un EIA basé sur le peptide C6, un EIA basé sur le peptide C6 suivi d’un EIA basé sur la protéine VIsE et un EIA basé sur la protéine VIsE et le peptide C10 suivi d’un EIA à base de SCENote de bas de page 15Note de bas de page 16Note de bas de page 17Note de bas de page 18Note de bas de page 19Note de bas de page 20. Les échantillons utilisés dans le cadre de ces études provenaient de petites cohortes de patients atteints d’une forme aiguë de la MLNote de bas de page 15Note de bas de page 18, ou des comparaisons étaient réalisées au moyen d’échantillons bien caractérisés issus de la banque de sérums pour la ML des Centres pour le contrôle et la prévention des maladies (CDC)Note de bas de page 16Note de bas de page 19Note de bas de page 21. Les études portaient sur des échantillons d’enfantsNote de bas de page 17Note de bas de page 20 et d’adultesNote de bas de page 16Note de bas de page 19Note de bas de page 21. À quelques exceptions prèsNote de bas de page 22, ces études ont été menées uniquement sur des patients originaires des États-Unis. La SDVM n’a pas été pleinement validée en vue de son utilisation auprès de patients ayant été exposés en Europe ou en Asie.
Bien que différentes combinaisons d’EIA aient été utilisées dans les algorithmes de la SDVM, la STDM a systématiquement démontré une meilleure sensibilité que la SDVS pour la détection des infections à B. burgdorferi, en particulier la ML au stade localisé précoce. Fait important, la SDVM présentait une sensibilité équivalente dans la détection des infections au stade tardif et une spécificité comparable à celle de la SDVS, et ce, quelle que soit la combinaison d’EIA utilisée pour la SDVM (se reporter aux tableau 1 et tableau 2). Plus récemment, le Secrétariat américain aux produits alimentaires et pharmaceutiques (FDA) a validé un algorithme de SDVM pour la confirmation en laboratoire de la maladie de Lyme chez les patients ayant acquis leur infection en Amérique du NordNote de bas de page 23. Cet algorithme de sérodiagnostic a été validé par les CDC des États-Unis, qui le considèrent comme une solution de substitution acceptable à la SDVS, car « l’autorisation de nouveaux tests sérologiques de la maladie de Lyme par la FDA signifie que l’efficacité du test a été évaluée et que celle-ci est substantiellement équivalente ou supérieure à celles des tests prédicats commercialisés légalement »Note de bas de page 24. On ignore si l’approche de la SDVM sera validée aux États-Unis pour les patients susceptibles d’avoir contracté la ML en dehors de l’Amérique du Nord. Au Canada, néanmoins, l’algorithme de la SDVS continuera d’être utilisé en effectuant des tests européens auprès des Canadiens soupçonnés d’avoir contracté la ML en dehors de l’Amérique du Nord (figure 1).
| Taille de l’échantillon | Référence | Manifestations cliniques | Combinaisons d’EIA utiliséesNote a de Tableau 1 | Sensibilité de la SDVM % (IC ou plage) | % Sensibilité de la SDVS % (IC ou plage)Note b de Tableau 1 |
|---|---|---|---|---|---|
| 140 | Note de bas de page 15 | EM, NBP, CL | SCE suivi de C6 | 61 (IC 53–69) | 48 (IC 40–56) |
| 318 | Note de bas de page 11 | EM, NBP | SCE suivi de C6 | 60 (IC 55–66) | 41 (IC 36–46) |
| 55 | Note de bas de page 18 | EM de phase aiguë | SCE suivi de C6; SCE suivi de VlsE CFLIA; VlsE FLIA suivi de C6 | 42,7(38–54) | 32 (25–36) |
| 47 | Note de bas de page 18 | EM de phase convalescente | SCE suivi de C6; SCE suivi de VlsE CFLIA; VlsE FLIA suivi de C6 | 70 (66–72) | 57,3 (55–60) |
| 95 | Note de bas de page 16 | EM, NBP, CL | Vidas suivi de C6 ou VIsENote c de Tableau 1 | 66,8 (65,2–68,4) | 60,2 (56,8–64,2) |
| 114 | Note de bas de page 17 | Tous stades de la maladie combinés | SCE suivi de C6 | 79,8 (IC 71,1–86,5) | 81,6 (IC 73–88) |
| 40 | Note de bas de page 19 | EM de phase aiguë | VlsE suivi de C6; SCE suivi de C6; SCE suivi de VlsE | 54,3 (50–58) | 45,3 (43–50) |
| 38 | Note de bas de page 19 | EM de phase convalescente | VlsE suivi de C6; SCE suivi de C6; SCE suivi de VlsE | 77 (76–79) | 61, 61, 63 |
| 124 | Note de bas de page 19 | Tous stades de l’infection combinés | VlsE suivi de C6; SCE suivi de C6; SCE suivi de VlsE | 76,7 (75–78) | 66, 67, 71 |
| 30 | Note de bas de page 25 | EM de phase aiguë | VlsE/C10 suivi de SCE | 73,3 | 50 |
| 30 | Note de bas de page 25 | EM de phase convalescente | VlsE/C10 suivi de SCE | 83,3 | 76,7 |
| 56 | Note de bas de page 25 | Infection au stade disséminé précoceNote a de Tableau 1 | VlsE/C10 suivi de SCE | 66,1 | 60,7 |
| 29 | Note de bas de page 15 | AL, NBT | SCE suivi de C6 | 100 (IC 86–100) | 100 (IC 86–100) |
| 122 | Note de bas de page 11 | AL, NBT | SCE suivi de C6 | 98 (IC 93–99) | 96 (IC 91–98) |
| 29 | Note de bas de page 16 | AL | Vidas suivi de C6 ou VIsE | 100 | 98,9 (97–100) |
| 50 | Note de bas de page 25 | Infection au stade disséminé tardifNote c de Tableau 1 | VlsE/C10 suivi de SCE | 100 | 100 |
| Taille de l’échantillon | Référence | Cohorte de patientsNote a de Tableau 2 | Combinaisons d’EIA utiliséesNote b de Tableau 2 | Sensibilité de la SDVM % (IC ou plage) | % Sensibilité de la SDVS % (IC ou plage)Note c de Tableau 2 |
|---|---|---|---|---|---|
| Témoins totaux | |||||
| 1 300 | Note de bas de page 15 | Témoins en bonne santé et symptomatiques | SCE suivi de C6 | 99,5 (IC 98,9–99,8) | 99,5 (IC 98,9–99,8) |
| 2 208 | Note de bas de page 11 | Témoins en bonne santé et patients atteints d’autres maladies | SCE suivi de C6 | 99,5 (IC 99,1–99,8) | 99,5 (IC 99,1–99,7) |
| 347 | Note de bas de page 16 | Témoins en bonne santé et patients atteints d’autres maladies | Vidas suivi de C6 ou VIsENote c de Tableau 2 | 98,3 (IC 96,2–99,3) | 98,3 (IC 96,2–99,3) |
| 931 | Note de bas de page 17 | Témoins en bonne santé et symptomatiques | SCE suivi de C6 | 96,6 (94,6–97,6) | 98,7 (96,6–100) |
| 347 | Note de bas de page 19 | Témoins en bonne santé et patients atteints d’autres maladies | VlsE suivi de C6; SCE suivi de C6; SCE suivi de VlsE | 98,6 (97,7–99,4) | 98,1 (95,7–99,7) |
| 190 | Note de bas de page 25 | Témoins en bonne santé et patients atteints d’autres maladies | VlsE/C10 suivi de SCE | 98,9 (97,8–100) | 100 |
| Témoins en mauvaise santé | |||||
| 54 | Note de bas de page 15 | Témoins symptomatiques | SCE suivi de C6 | 100 | 100 |
| 50 | Note de bas de page 18 | Patients atteints d’autres maladies | SCE suivi de C6; SCE suivi de VIsE CLIA; VlsE CLIA suivi de C6 | 99,3 (98–100) | 100 |
| 144 | Note de bas de page 16 | Patients atteints d’autres maladies | Vidas suivi de C6 ou VIsENote d de Tableau 2 | 98,2 (96,5–100) | 97,1 (94,4–99,3) |
| 830 | Note de bas de page 17 | Témoins symptomatiques | SCE suivi de C6 | 96,5 (94,6–97,6) | 98,7 (96,6–100) |
| 144 | Note de bas de page 19 | Patients atteints d’autres maladies | VlsE suivi de C6; SCE suivi de C6; SCE suivi de VlsE | 98,1 (96,5–100) | 97,4 (95,7–99,7) |
| 90 | Note de bas de page 25 | Patients atteints d’autres maladies | VlsE/C10 suivi de SCE | 97,8 | 100 |
Forces et faiblesses de la sérologie à deux volets modifiée
Outre une meilleure sensibilité pour la détection des infections à B. burgdorferi au stade précoce, l’interprétation des résultats de la SDVM est moins subjective que celle du test d’immuno-empreinte (tableau 3). La SDVM s’est également révélée plus rentable que la SDVSNote de bas de page 26. Les tests sont moins laborieux et peuvent être effectués à l’aide d’instruments ou de plates-formes automatisésNote de bas de page 8. À ce titre, la SDVM ne nécessite pas de procéder à un test spécialisé (immuno-empreinte) dans un laboratoire de référence; elle peut donc être réalisée par n’importe quel laboratoire assurant actuellement un test sérologique. Ces différences peuvent contribuer à réduire les délais d’obtention des résultatsNote de bas de page 8Note de bas de page 9.
| Avantages | Inconvénients |
|---|---|
|
|
Les résultats de la SDVM peuvent être soit positifs, soit négatifs, ce qui permet une interprétation plus « tranchée » qu’avec la SDVS, car les tests d’immuno-empreinte des IgM et des IgG peuvent produire des résultats différents qui peuvent être source de confusion pour les médecinsNote de bas de page 11. Bien que la SDVM présente une meilleure sensibilité que la SDVS, celle-ci demeure inférieure à 90 %. Par conséquent, les patients atteints de la ML au stade localisé précoce devraient continuer à être traités sur la base de leur tableau clinique plutôt que leurs résultats sérologiques. La rapidité des délais d’exécution de la SDVM peut néanmoins s’avérer particulièrement utile dans l’évaluation des patients visés par une suspicion clinique de ML, mais sans éruption cutanée (érythème migrant), ou des patients qui présentent des symptômes qui se confondent avec ceux d’autres infections (p. ex. paralysie de Bell ou arthrite), auquel cas les résultats sérologiques faciliteront le diagnosticNote de bas de page 8. Dans ses dernières lignes directrices fondées sur des données probantes, le Royaume-Uni formule la recommandation suivante : « Si l’on soupçonne la présence de la ML chez des personnes ayant été dépistées dans les quatre semaines suivant l’apparition des symptômes et chez qui le test ELISA s’est révélé négatif, répéter ce test quatre à six semaines après la date du premier test »Note de bas de page 12. À l’heure actuelle, même si l’EIA de phase convalescente se révèle positif, il reste malgré tout nécessaire de procéder à une analyse complémentaire avec un test d’immuno-empreinte dans le cadre de la SDVS. Au vu des meilleurs délais d’exécution associés à la SDVM, les cliniciens pourraient être enclins à suivre la recommandation de l’Institut national pour la santé et l’excellence des soins (NICE) et envisager un test en phase aiguë et convalescente, ce qui permettrait d’accroître la certitude diagnostique du test sérologique auprès des patients qui ne présentent pas d’érythème migrant. Cet aspect est particulièrement important lorsque la suspicion clinique est faible, comme pour les patients sans antécédents connus d’exposition aux tiques dans les régions où le risque de contracter la ML est élevé.
En dépit de ses nombreux avantages, la SDVM présente également des inconvénients. Étant donné que les anticorps dirigés contre B. burgdorferi peuvent persister pendant des mois, voire des années après la première infectionNote de bas de page 27, l’algorithme de la SDVM (tout comme la SDVS) ne peut différencier une infection active d’une ancienne infection, ce qui complique le diagnostic sérologique d’une réinfection à B. burgdorferi. En outre, il est possible que l’algorithme de la SDVM génère des faux positifs en fonction du composant IgM des EIA polyclonaux utilisés, car on sait que des faux positifs au test d’immuno-empreinte des IgM surviennent chez les patients en bonne santé ou ceux qui présentent des symptômes de longue dateNote de bas de page 28Note de bas de page 29Note de bas de page 30Note de bas de page 31. Il se peut que la très grande efficacité de la SDVS de la ML au stade tardif soit difficile à reproduire dans le format de la SDVM, en particulier lorsque des EIA polyvalents (contenant des épitopes pour les IgM) sont utilisés, et il est probable que les tests d’immuno-empreinte demeurent nécessaires pour évaluer les cas complexes de MLNote de bas de page 8. Face à ce constat, le recours au test d’immuno-empreinte peut toujours être utile chez les patients qui manifestent les symptômes d’une ML au stade tardif (comme l’arthrite de Lyme) ou ceux soupçonnés de faux positif lorsque leurs résultats sérologiques ne concordent pas avec le tableau clinique. Dans ces conditions, il apparaît raisonnable d’envisager la réalisation d’un test d’immuno-empreinte des IgG, car on observe une forte réponse des anticorps IgG chez les patients atteints de la ML au stade tardif et le test d’immuno-empreinte pourrait permettre d’évaluer la réponse à des protéines Borrelia particulières, ce que certains cliniciens jugent utileNote de bas de page 32Note de bas de page 33. Enfin, la plupart des études sur l’algorithme de la SDVM ont été menées dans des régions où la ML est fortement endémique et les analyses sérologiques se sont limitées principalement aux patients adultes. Aucune étude n’a pour le moment été menée sur l’efficacité de la SDVM dans les régions où le risque de contracter la ML est moindre et chez les populations pédiatriques; ces lacunes dans les connaissances devraient être comblées avec le tempsNote de bas de page 20.
Discussion
Le Réseau des laboratoires de santé publique du Canada souscrit à la recommandation des CDCNote de bas de page 24 selon laquelle le diagnostic sérologique de la ML basé sur une approche de SDVM (remplacement du test d’immuno-empreinte prévu au deuxième volet par un second EIA) constitue une solution de substitution acceptable à la SDVS. Cette recommandation suppose que l’approche de la SDVM a été validée et a démontré une efficacité comparable à celle de la SDVS dans les régions canadiennes où l’incidence de la ML est élevée, ainsi que dans les territoires où l’incidence est faible. Actuellement, seule la Nouvelle-Écosse dispose de données validant l’approche de la SDVM pour le diagnostic de la ML. Portant sur 447 échantillons recueillis auprès de patients atteints de la ML et originaires de cette province, une SDVM consistant en un EIA à base de SCE de B. burgdorferi suivi d’un EIA basé sur le peptide C6 a permis de détecter 25 % plus de cas d’infection au stade localisé précoce que la SDVS, avec une spécificité de 99,5 %Note de bas de page 34. Ces résultats vont dans le sens des données publiées dans les études menées dans les régions des États-Unis où la ML est fortement endémiqueNote de bas de page 11Note de bas de page 15 et viennent appuyer le recours à la SDVM dans cette province. Cette étude de validation a toutefois été réalisée dans la province canadienne où l’incidence de la ML est la plus élevéeNote de bas de page 35. D’autres études de validation de la SDVM devront être menées dans les régions du Canada où l’incidence de la ML est plus faible, car il est essentiel que l’efficacité de la SDVM soit documentée chez les populations où la probabilité d’infection pré-test est plus faibleNote de bas de page 15Note de bas de page 36. Une légère baisse de la spécificité peut faire diminuer la valeur prédictive du test (tableau 4); c’est pourquoi il a été recommandé de ne pas entreprendre d’analyse sérologique de la ML lorsque la probabilité pré-test était inférieure à 20 %Note de bas de page 37. En raison de la variabilité des souches parmi les populations de B. burgdorferi observées au CanadaNote de bas de page 38, et de l’incidence que cette variabilité pourrait avoir sur les tests de diagnostic de la MLNote de bas de page 39, il paraît prudent de s’assurer que la sensibilité accrue de la SDVM démontrée par la littérature sera conservée lorsque l’approche sera appliquée dans les différentes régions du Canada qui abritent les souches diverses et variées de B. burgdorferi.
| Prévalence estimée (%) | Valeur prédictive positive de la SDVM (%) | Valeur prédictive négative de la SDVM (%) | ||
|---|---|---|---|---|
| ML au stade localisé précoceNote b | ML au stade tardifNote c | ML au stade localisé précoceNote a | ML au stade tardifNote b | |
| 5 | 84,8 | 91,3 | 97,6 | 100 |
| 3 | 76,6 | 86 | 98,6 | 100 |
| 1 | 51,7 | 66,8 | 99,5 | 100 |
| 0,1 | 9,6 | 16,6 | 100 | 100 |
Le Groupe de travail sur le diagnostic de la maladie de Lyme du Réseau des laboratoires de santé publique du Canada collabore avec les laboratoires provinciaux pour élaborer des plans de validation de la SDVM. La validation a pour objectif d’établir l’efficacité de la SDVM dans les régions où l’incidence de la ML est variable (et où les souches de B. burgdorferi sont potentiellement différentes) et de déterminer la combinaison, parmi les EIA disponibles au Canada, qui permettrait d’obtenir les données nécessaires pour que les avantages du nouvel algorithme de la SDVM puissent se matérialiser et que la spécificité du test sérologique de la ML puisse être conservée. Un second rapport sera rendu public une fois que ces études auront été achevées.
Conclusion
Le Secrétariat américain aux produits alimentaires et pharmaceutiques a récemment validé un algorithme diagnostique de la SDVM pour la sérologie de la ML, et les CDC des États-Unis ont recommandé le recours à cette nouvelle approche, la considérant comme une solution de substitution acceptable à la SDVS. Un nombre croissant de publications scientifiques impliquant des patients originaires des États-Unis mettent en évidence une meilleure sensibilité dans la détection de l’infection à la ML au stade localisé précoce, ainsi que le maintien d’une spécificité élevée lorsque les algorithmes de la SDVM sont comparés à la SDVS. Les dernières données de la Nouvelle-Écosse, générées par l’entremise de la SDVM, conduisent à des conclusions similaires. L’amélioration de la sensibilité de la SDVM et la réduction des délais d’exécution associées à cette nouvelle approche justifient des études plus approfondies sur ce nouvel algorithme de diagnostic de la ML en vue de son éventuel déploiement au Canada.
Déclaration des auteurs
Le Groupe de travail sur le diagnostic de la maladie de Lyme du Réseau des laboratoires de santé publique du Canada est constitué de T. Hatchette (coprésident), L. R. Lindsay (coprésident), K. Bernat, G. Desnoyers, A. Dibernardo, K. Fonseca, G. German, A. Lang, M. Morshed, R. Needle, S. Patel, K. Thivierge et P. VanCaeseele.
Conflit d’intérêts
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Le Réseau des laboratoires de santé publique du Canada a gracieusement fourni un soutien administratif qui s’est révélé d’une grande utilité lors de l’élaboration de cet énoncé de position.
Financement
Ce projet n’a fait l’objet d’aucun financement particulier.

Cette œuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution 4.0 International