Recommandations du CCNI concernant l’utilisation de VVAI et les personnes infectées par le VIH

 Téléchargez cet article en format PDF
Téléchargez cet article en format PDFPublié par : L’Agence de la santé publique du Canada
Numéro : Volume 46–9 : Protection de la santé des Forces
Date de publication : 3 septembre 2020
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 46–9, le 3 septembre 2020 : Protection de la santé des Forces
Déclaration du comité consultatif
Résumé de l’examen systématique et de la recommandation du CCNI sur le recours au vaccin vivant atténué contre l’influenza (VVAI) chez les personnes infectées par le VIH
Dorothy Moore1,2, Ian Gemmill3,4, Robyn Harrison5,6 au nom du Comité consultatif national de l’immunisation (CCNI)
Affiliations
1 Membre du Groupe de travail sur l’influenza du CCNI
2 Université McGill, Montréal, QC
3 Président du Groupe de travail sur l’influenza du CCNI
4 Queen’s University, Kingston, ON
5 Vice-président du Groupe de travail sur l’influenza du CCNI
6 University of Alberta, Alberta Health Services, Edmonton, AB
Correspondance
Citation proposée
Moore D, Gemmill I, Harrison R, au nom du Comité consultatif national de l’immunisation (CCNI). Résumé de l’examen systématique et de la recommandation du CCNI sur l’utilisation du vaccin à virus atténué contre l’influenza (VVAI) chez les personnes infectées par le VIH. Relevé des maladies transmissibles au Canada 2020:46(9):337–43. https://doi.org/10.14745/ccdr.v46i09a08f
Mots-clés : Comité consultatif national de l’immunisation, CCNI, VIH, vaccin vivant atténué contre l’influenza, examen de la documentation
Résumé
Contexte : La vaccination annuelle contre la grippe est recommandée pour toutes les personnes âgées de six mois et plus, y compris celles qui sont infectées par le VIH. Avant cette déclaration, le Comité consultatif national de l’immunisation (CCNI) a déclaré que le vaccin vivant atténué contre l’influenza (VVAI) était contre-indiqué pour toutes les personnes infectées par le VIH. L’objectif du présent article est de mettre à jour les directives du CCNI sur l’utilisation du VVAI pour les personnes infectées par le VIH.
Méthodes : On a entrepris un examen systématique de la littérature sur l’utilisation du VVAI chez les personnes atteintes du VIH. Le Système canadien de surveillance des effets secondaires suivant l’immunisation a fait l’objet d’une recherche pour trouver des signalements d’effets secondaires à la suite de la vaccination avec un VVAI chez les personnes infectées par le VIH. Le CCNI approuve les recommandations révisées.
Résultats : Le CCNI a conclu que le VVAI est immunogène chez les enfants atteints du VIH et les données disponibles suggèrent qu’il est sans danger, même si elles étaient insuffisantes pour détecter d’éventuels effets secondaires inhabituels. Le VVAI peut être considéré comme une option de vaccination des enfants âgés de 2 à 17 ans qui respectent les critères suivants : 1) recevoir un traitement antirétroviral hautement actif pendant au moins quatre mois; 2) avoir une numération des CD4 de 500/µL ou plus si l’enfant est âgé est de 2 à 5 ans, ou de 200/µL ou plus si l’enfant est âgé de 6 à 17 ans et 3) l’ARN plasmatique du VIH est inférieur à 10 000 copies/ml. Le VVAI reste contre-indiqué pour les adultes atteints du VIH en raison de données insuffisantes. Le CCNI et le Groupe canadien de recherche pédiatrique et périnatale sur le VIH/sida considèrent la vaccination intramusculaire contre la grippe comme étant la norme pour les enfants affectés par le VIH, en particulier pour ceux qui n’ont pas de suppression de la charge virale pour le VIH (i.e. que l’ARN plasmatique du VIH est de 40 copies/ml ou plus). Toutefois, si la vaccination intramusculaire n’est pas acceptée par le patient ou le décideur substitut, le VVAI serait raisonnable pour les enfants qui répondent aux critères énumérés ci-dessus.
Conclusion : Le VVAI peut être considéré comme une option de vaccination annuelle pour certains enfants atteints du VIH.
Introduction
La vaccination annuelle contre la grippe est recommandée pour toutes les personnes infectées par le VIHNote de bas de page 1 qui sont âgées de six mois ou plus. Les vaccins vivants sont généralement contre-indiqués chez les personnes immunodéprimées. Néanmoins, des critères ont été établis pour permettre la vaccination avec des vaccins contre la rougeole, la rubéole, les oreillons et la varicelle lorsque la fonction immunitaire n’est pas gravement affaiblie. Ces vaccins se sont avérés sûrs et sont recommandés pour les personnes séropositives si l’infection par le VIH est contrôlée et si la fonction immunitaire est satisfaisante. La recommandation précédente du Comité consultatif national de l’immunisation (CCNI) contre l’utilisation du vaccin vivant atténué contre l’influenza (VVAI) chez les personnes atteintes de maladies immunitaires, y compris le VIH, était fondée sur l’opinion d’experts et le petit nombre d’études disponibles (recommandation du CCNI de catégorie D)Note de bas de page 2. La monographie de produit indique que l’administration du VVAI aux personnes immunodéprimées devrait être fondée sur une prise en compte minutieuse des avantages et des risques potentielsNote de bas de page 3.
Les protocoles d’immunisation indiquent que le VVAI est contre-indiqué pour les personnes infectées par le VIH en Colombie-Britannique, en Alberta, au Manitoba, en Saskatchewan et au Nouveau-Brunswick, ainsi qu’aux États-UnisNote de bas de page 4Note de bas de page 5Note de bas de page 6Note de bas de page 7Note de bas de page 8Note de bas de page 9Note de bas de page 10. Certaines administrations, comme le Québec, le Royaume-Uni et la FranceNote de bas de page 11Note de bas de page 12Note de bas de page 13 et des organisations professionnelles, dont l’Infectious Diseases Society of America et la British Children’s HIV AssociationNote de bas de page 14Note de bas de page 15, affirment que le VVAI peut être donné aux personnes atteintes du VIH qui respectent des critères précis.
L’objectif de la présente déclaration du comité consultatif est d’examiner les données probantes sur l’efficacité potentielle, l’efficacité réelle, l’immunogénicité et l’innocuité de l’utilisation du VVAI chez les personnes infectées par le VIH et de fournir une orientation à jour sur l’utilisation du VVAI dans cette population.
Méthodes
On a effectué un examen systématique de la documentation sur l’utilisation du VVAI chez les personnes infectées par le VIH. La méthodologie de l’examen systématique a été précisée a priori dans un protocole écrit qui comprenait des questions d’examen, une stratégie de recherche, des critères d’inclusion et d’exclusion et une évaluation de la qualité. Le Groupe de travail sur l’influenza du CCNI a examiné et approuvé le protocole.
Des recherches ont été menées dans six bases de données électroniques (EMBASE, MEDLINE, Scopus, ProQuest Public Health, ClinicalTrials.gov et PROSPERO) dès la date de création au 13 avril 2018 à l’aide des termes de recherche pour le VVAI et le VIH. Les recherches se limitaient aux articles publiés en français et en anglais. De plus, la recherche manuelle des études incluses a été effectuée en vérifiant les listes de référence afin de trouver d’autres publications pertinentes. On a également effectué une recherche manuelle des listes de référence pour tout article de recherche secondaire pertinent récupéré.
Deux examinateurs ont évalué d’indépendamment les titres, les résumés et les articles intégraux admissibles.
Les études ont été incluses si elles respectaient les critères suivants :
- La population ou la sous-population étudiée était composée de personnes infectées par le VIH
- L’étude a évalué l’efficacité potentielle ou réelle, l’immunogénicité, l’innocuité (y compris l’incidence sur les marqueurs de l’infection par le VIH) ou l’excrétion du virus vaccinal
Les études ont été exclues si elles respectaient au moins un des critères suivants :
- L’étude ne présentait pas de données sur : l’efficacité potentielle et réelle, l’immunogénicité, l’innocuité ou les résultats de l’excrétion virale du VVAI
- L’étude était dans une langue autre que l’anglais ou le français
- L’étude était une étude non humaine ou in vitro
- L’article était un éditorial, une opinion ou un reportage
- L’étude ne présentait que des recherches secondaires (e.g. analyse documentaire, examen systématique, méta-analyse)
- Le VVAI examiné n’était pas un VVAI saisonnier fondé sur le « squelette » Ann Arbor.
Les données ont été extraites dans des tableaux de données probantes. Un examinateur a extrait des données et évalué la qualité méthodologique des études admissibles. Un deuxième examinateur a validé l’extraction des données et l’évaluation de la qualité. Le Système canadien de surveillance des effets secondaires suivant l’immunisation (SCSESSI) a également été recherché pour trouver des rapports d’effets secondaires suivant l’immunisation du VVAI chez les personnes infectées par le VIH. Une synthèse narrative des données extraites a été produite et on a élaboré une recommandation pour l’utilisation du VVAI. Le CCNI a évalué de façon critique les données probantes disponibles et approuvé la recommandation.
Résultats
L’examen systématique a permis de récupérer 220 articles, dont huit ont été conservés pour l’extraction et l’analyse de données. Ces huit articles ont fait état des résultats de cinq études portant sur l’immunogénicité, l’innocuité ou les deux du VVAI chez les personnes infectées par le VIH. Quatre études étaient de bonne qualité et une était acceptable selon les cotes de Harris et al.Note de bas de page 16. On n’a relevé aucune étude portant sur l’efficacité potentielle ou l’efficacité réelle du VVAI chez cette population. Un organigramme du processus de sélection des études est présenté à la figure 1. Les principales caractéristiques de l’étude sont résumées au tableau 1.
Figure 1 : L’organigramme du processus de sélection de l’étude pour l’examen systématique de l’efficacité, de l’efficience, de l’immunogénicité et de l’innocuité du vaccin vivant atténué contre l’influenza chez les personnes infectées par le VIH
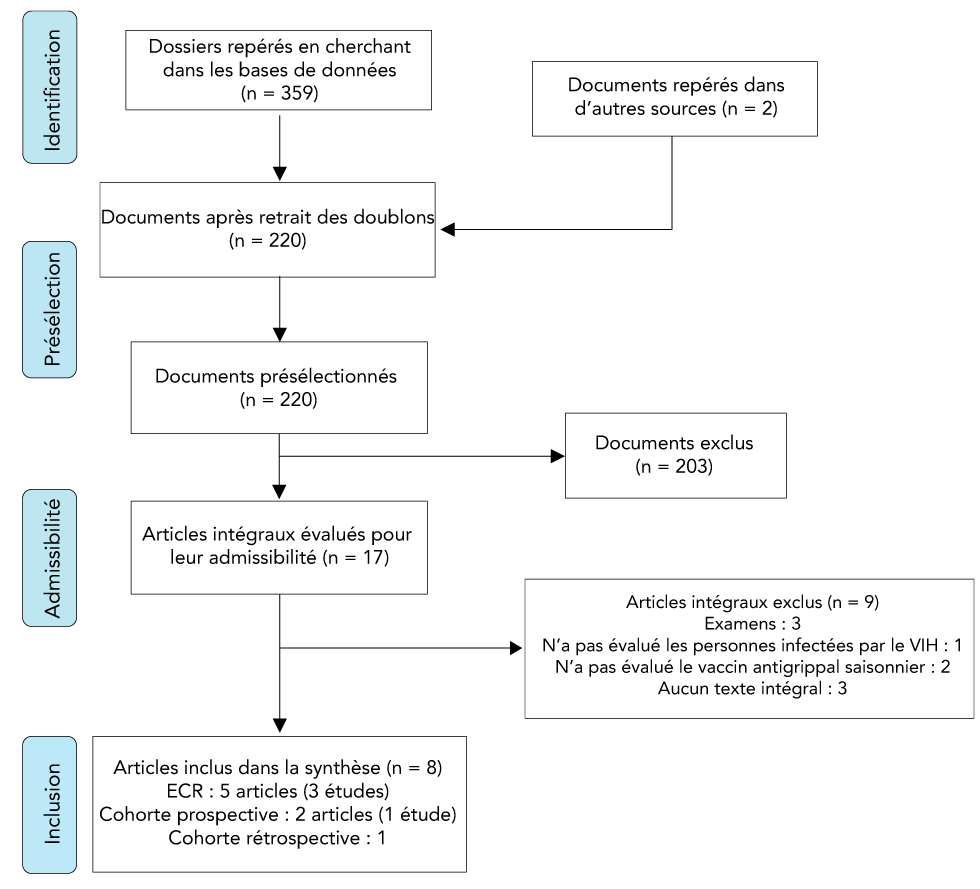
Description textuelle : Figure 1
Figure 1 : L’organigramme du processus de sélection de l’étude pour l’examen systématique de l’efficacité, de l’efficience, de l’immunogénicité et de l’innocuité du vaccin vivant atténué contre l’influenza chez les personnes infectées par le VIH
La figure 1 présente un organigramme du processus de sélection de l’étude pour l’examen systématique. À l’étape du repérage, 359 dossiers ont été sélectionnés au moyen d’une recherche dans une base de données et deux autres dossiers ont été sélectionnés par d’autres sources. Au cours de l’étape de présélection, il est resté 220 dossiers après la suppression des doublons. Après l’examen des dossiers, 203 ont été exclus. À l’étape de l’admissibilité, les articles intégraux ont été évalués et 17 articles ont été jugés admissibles. Neuf articles intégraux ont été exclus, y compris trois examens, un article qui n’évaluait pas les personnes infectées par le VIH, deux qui n’évaluaient pas le vaccin contre la grippe saisonnière et trois qui ne présentaient pas de texte intégral. Huit articles ont été inclus dans la synthèse, y compris cinq essais contrôlés et randomisés (trois études), deux articles à cohorte prospective (une étude) et une cohorte rétrospective.
| Auteur | Conception de l’étude (vaccin administré) |
Population à l’étude | Résultats |
|---|---|---|---|
| King et al., 2000Note de bas de page 17 | Essai contrôlé randomisé(VVAI3 par rapport au placebo) | Adultes âgés de 18 à 58 ans atteints du VIH (n = 57 au total; 28 ont reçu un VVAI3) et sans VIH (n = 54 au total; 27 ont reçu un VVAI3)Critères d’admissibilité pour les patients infectés par le VIH : catégorie d’immunité A1-2, ARN plasmatique du VIH inférieur à 10 000 copies/ml et plus de 200 cellules CD4/µL; si inférieur ou égal à 500 cellules CD4/µL, selon un traitement antirétroviral stable) dans les trois mois précédant la vaccination | Réaction des anticorps IHEffets secondaires dans les 10 jours suivant la vaccinationEffet sur la réplication du VIH et le dénombrement des cellules CD4Excrétion du virus vaccinal |
| King et al., 2001Note de bas de page 18 | Essai contrôlé randomisé(VVAI3) | Enfants de moins de 8 ans atteints du VIH (n = 24); sans VIH (n = 25)Critères d’admissibilité pour les patients infectés par le VIH : catégorie d’immunité N1-2 ou A1-2, ARN plasmatique du VIH inférieur à 10 000 copies/ml dans les 100 jours précédents l’inscription | Réaction des anticorps IHEffets secondaires dans les 10 jours suivant la vaccinationEffet sur la réplication du VIH et le dénombrement des cellules CD4Excrétion du virus vaccinal |
| Levin et al., 2008Note de bas de page 19Weinberg et al., 2010aNote de bas de page 20Weinberg et al., 2010bNote de bas de page 20 | Essai contrôlé randomisé(VVAI3 c. VII3) | Enfants de 5 ans à moins de 18 ans atteints du VIH (n = 243 au total; 122 ont reçu le VVAI3; 121 ont reçu le VII3)Critères d’admissibilité pour le patient infecté par le VIH : VIH stable sur le traitement antirétroviral hautement actif (HAART) pendant environ 16 semaines et avec un ARN plasmatique du VIH-1 de moins de 60 000 copies/ml dans les 60 jours précédant la vaccination. Tous les sujets avaient reçu le VII3 au cours d’une des deux années précédentes | Réaction des anticorps IH et MNRéaction des anticorps IgA et IgG de la muqueuse salivaireRéaction des cellules TEffets secondaires dans les 28 jours suivant la vaccinationEffet sur la réplication du VIH et le dénombrement des cellules CD4Excrétion du virus vaccinal |
| Curtis et al., 2015Note de bas de page 22Weinberg et al., 2016Note de bas de page 23 | Étude de la cohorte prospective(VVAI4) | Enfants et jeunes adultes de 2 à 25 ans atteints du VIH (n = 45) et sans VIH (n = 55)Critères d’admissibilité pour le patient infecté par le VIH : CD4 supérieur à 15 % ou supérieur à 200 cellules/µL avec le TARc, ou supérieur à 25 % ou supérieur à 500 cellules/µL s’il n’est pas sur le TARc. Tous les patients avaient reçu un vaccin antigrippal au cours d’au moins une saison précédente | Réaction des anticorps IH et MNRéaction des anticorps IgA de la muqueuse nasaleRéaction des cellules de mémoire B IgA et IgG; réaction des cellules TEffets secondaires dans les six semaines suivant la vaccinationExcrétion du virus vaccinal |
| Menegay et al., 2017Note de bas de page 24 | Étude de cohorte rétrospective(VVAI c. VII) | Adultes – tous les membres actifs de l’armée de l’air américaine diagnostiqués avec le VIH (n = 437) | Syndrome grippal dans les 30 jours suivant la vaccination |
Immunogénicité
Trois études ont porté sur l’immunogénicité du VVAI chez un total de 191 enfants et jeunes adultes infectés par le VIH, âgés de 2 à 25 ansNote de bas de page 18Note de bas de page 19Note de bas de page 20Note de bas de page 21Note de bas de page 22Note de bas de page 23 et une étude a porté sur l’immunogénicité chez 28 adultes infectés par le VIH âgés de 18 ans et plusNote de bas de page 17. Les quatre études étaient de bonne qualité selon les critères de Harris et al.Note de bas de page 16. Les corrélations immunologiques de la protection contre l’influenza sont relativement bien établies pour les anticorps d’inhibition de l’hémagglutination chez des adultes, mais non pour les anticorps de microneutralisation chez les adultes et non pour aucune réaction sérologique chez les enfants.
Il n’y a pas de différence majeure dans les réactions d’anticorps d’inhibition de l’hémagglutination après l’administration du VVAI entre les personnes atteintes du VIH et celles qui ne l’étaient pasNote de bas de page 17Note de bas de page 18Note de bas de page 22. Dans l’étude de Curtis et al.Note de bas de page 22, la réaction d’inhibition de l’hémagglutination à l’influenza B/Yamagata était meilleure dans le groupe infecté au VIH que dans le groupe de contrôle séronégatifNote de bas de page 22Note de bas de page 23. Les proportions de personnes infectées par le VIH ayant des titrages d’inhibition de l’hémagglutination d’au moins 40 et vaccinées avec le VVAI ou le vaccin inactivé contre l’influenza (VII) étaient semblables pour la grippe A(H1N1) et la grippe A(H3N2), mais plus élevées pour la grippe B et les titrages d’anticorps étaient statistiquement beaucoup plus élevés avec le VII pour la souche d’influenza A(H3N2) et la souche BNote de bas de page 19 ainsi que pour les souches non appariéesNote de bas de page 20. On a observé une augmentation importante des titrages de microneutralisation contre les souches non apparentée, mais non contre la souche du vaccin contre la grippe A(H1N1), dans une étude sur les enfants et les jeunes adultes infectés par le VIHNote de bas de page 22Note de bas de page 23. La proportion de personnes infectées par le VIH dont le titrage de microneutralisation est supérieur ou égal à 1:40 était semblable après la vaccination à l’aide du VVAI et le VII, mais l’ampleur de la réaction était plus élevée pour le VII que pour le VVAINote de bas de page 20.
Le VVAI induit des réactions d’anticorps humoraux et muqueux ainsi que des réactions à médiation cellulaires T et B. Les corrélations de la protection n’ont pas été établies pour le VVAI ou les réactions à médiation cellulaire et le titrage d’inhibition de l’hémagglutination peut sous-estimer la protectionNote de bas de page 25. Deux études ont examiné les réactions des anticorps muqueux. Il n’y a pas de différence importante dans la réaction des anticorps IgA nasaux au VVAI selon l’état sérologiqueNote de bas de page 22Note de bas de page 23 ou dans la réaction des anticorps IgG salivaires au VVAI et au VII chez des personnes infectées par le VIHNote de bas de page 19Note de bas de page 20. Une étude a examiné les réactions des cellules de mémoire B et T. Les réactions des cellules de mémoire B d’IgG ne différaient pas de façon importante selon l’état sérologique pour la grippe A(H1N1) ou A(H3N2). Cependant, une réaction absolue plus faible à la suite de la vaccination pour la lignée B/Yamagata a été observée dans le groupe infecté par le VIHNote de bas de page 22Note de bas de page 23. L’ampleur de l’augmentation de la réaction des cellules T ne différait pas en fonction de l’état sérologiqueNote de bas de page 22Note de bas de page 23.
Innocuité
Cinq études ont rapporté des effets secondaires à la suite d’une immunisation avec le VVAI : trois sur un total de 191 enfants et jeunes adultes infectés par le VIHNote de bas de page 18Note de bas de page 19Note de bas de page 22, un adulte sur 28Note de bas de page 17 et un adulte sur 437 n’ont fait l’objet d’une enquête que pour un syndrome grippal associé au vaccinNote de bas de page 24. Quatre des études étaient de bonne qualité et une a été jugée acceptable.
Chez les enfants et les adultes atteints du VIH, les taux des effets secondaires à la suite d’une immunisation avec le VVAI étaient comparables aux taux observés chez les personnes sans VIH recevant le VVAI, sauf pour plus de douleurs musculaires et une diminution de l’énergie chez les personnes atteintes du VIHNote de bas de page 17Note de bas de page 18Note de bas de page 22. Les taux d’effets secondaires à la suite d’une immunisation chez les personnes atteintes du VIH recevant le VVAI ou le VII étaient également semblables, à l’exception des symptômes nasopharyngés plus fréquents, mais prévus (écoulement nasal et congestion nasale) après l’administration du VVAINote de bas de page 19. Les rapports de syndrome grippal après l’administration du VVAI étaient raresNote de bas de page 24. Aucune étude n’a fait état d’effets secondaires sérieux ou graves à la suite d’une immunisation au VVAI. Il n’y a eu aucun rapport au SCSESSI d’effets secondaires à la suite d’une immunisation au VVAI chez les personnes infectées par le VIH.
Les effets du VVAI sur l’infection par le VIH ont été évalués dans deux études chez les enfantsNote de bas de page 18Note de bas de page 19 et une chez les adultesNote de bas de page 17. Le VVAI n’a eu aucun effet important sur la charge virale de l’ARN du VIH ou le dénombrement de CD4.
Quatre études ont fait état de l’effet de l’état sérologique sur l’excrétion du virus vaccinal du VVAI : trois enfants et jeunes adultes infectés par le VIH sur 191Note de bas de page 18Note de bas de page 19Note de bas de page 22 et un adulte sur 28Note de bas de page 17. L’excrétion du virus vaccinal ne différait pas selon l’état sérologiqueNote de bas de page 17Note de bas de page 18Note de bas de page 19Note de bas de page 22.
Recommandation du CCNI pour la prise de décisions au niveau individuel
À la suite d’un examen approfondi des données probantes, le CCNI a formulé la recommandation suivante :
Le CCNI recommande que le VVAI puisse être considéré comme une option pour les enfants de 2 à 17 ans dont l’infection au VIH est stable, qui suivent un traitement antirétroviral hautement actif (HAART) et dont le système immunitaire fonctionne assez bien* (recommandation discrétionnaire du CCNI).
- Le CCNI conclut qu’il existe des données probantes acceptables fondées sur des données d’immunogénicité pour recommander l’utilisation du VVAI comme option pour les enfants de 2 à 17 ans atteints d’une infection stable par le VIH effectuant un HAART et dont le système immunitaire fonctionne assez bien (données probantes de cote B)
- Le CCNI conclut que, même si le VVAI semble avoir un profil d’innocuité semblable au VII, il n’y a pas suffisamment de données probantes pour détecter des effets secondaires inhabituels liés à l’utilisation du VVAI chez les enfants infectés par le VIH (données probantes de cote I)
* VVAI devrait être considéré uniquement chez les enfants atteints du VIH qui respectent les critères suivants :
- Administration du HAART pendant au moins quatre mois
- Avoir un nombre de cellules CD4 d’au moins 500/µL si la personne est âgée de 2 à 5 ans ou supérieur ou égal à 200/µL si la personne est âgée de 6 à 17 ans (mesuré dans les 100 jours précédant l’administration du VVAI)
- Avoir un niveau d’ARN plasmatique du VIH inférieur à 10 000 copies/ml (mesuré dans les 100 jours précédant l’administration du VVAI)
Même si le CCNI et le Groupe canadien de recherche pédiatrique et périnatale sur le VIH/sida considèrent la vaccination intramusculaire contre la grippe comme étant la norme pour les enfants vivant avec le VIH, en particulier pour ceux qui n’ont pas de suppression de la charge virale du VIH (e.g. intramusculaire, l’ARN plasmatique du VIH de plus de 40 copies/ml), le VVAI serait raisonnable pour les enfants qui respectent les critères susmentionnés, si la vaccination n’est pas acceptée par le patient ou le décideur substitut.
La décision d’utiliser le VVAI chez les enfants atteints d’un VIH stable devrait être prise au cas par cas. Les données probantes sont considérées comme étant de catégorie B puisqu’il n’y a aucune donnée probante directe sur l’efficacité potentielle ou l’efficacité réelle du VVAI chez les personnes infectées par le VIH et que la taille de l’échantillon pour la base de données probantes est petite.
- Il existe des données probantes que le VVAI est immunogène chez les enfants de 2 à 17 ans atteints d’une infection stable par le VIH effectuant un HAART et dont le système immunitaire fonctionne assez bien.
- Le VVAI semble avoir un profil d’innocuité similaire au VII. Toutefois, le nombre total de patients évalués est insuffisant pour détecter efficacement les effets secondaires inhabituels ou rares.
- Les enfants séropositifs reçoivent tous les vaccins de routine administrés durant l’enfance et tous les vaccins parentéraux supplémentaires nécessaires en raison de leur état immunodéprimé réel ou potentiel. L’offre du VVAI par voie intranasale au lieu du VII permet d’éviter une injection intramusculaire par année. Une discussion sur la préférence pour le mode d’administration devrait avoir lieu avant la vaccination et pourrait améliorer l’acceptation du vaccin contre la grippe saisonnièreNote de bas de page 26Note de bas de page 27.
Le CCNI a conclu que la quantité de données probantes disponibles sur l’immunogénicité et l’innocuité du VVAI chez les adultes atteints du VIH est insuffisante pour justifier un changement dans la recommandation actuelle contre l’utilisation du VVAI au sein de ce groupe. (Données probantes de cote I) Cette recommandation est fondée sur l’opinion d’experts.
Les constatations détaillées de l’examen de la documentation et les renseignements supplémentaires à l’appui de cette recommandation se trouvent dans l’énoncé du Comité consultatif du CCNI : Recommandation sur le recours au vaccin vivant atténué contre l’influenza (VVAI) chez les personnes infectées par le VIHNote de bas de page 28.
Conclusion
Le VVAI est immunogène chez les enfants atteints du VIH et semble avoir un profil d’innocuité semblable à celui du VII, même si des effets secondaires inhabituels ou rares peuvent ne pas avoir été détectés. Le CCNI recommande que le VVAI soit considéré comme une option pour les enfants de 2 à 17 ans atteints d’une infection stable par le VIH recevant un HAART et dont le système immunitaire fonctionne assez bien. Les études comprenant une taille d’échantillon suffisante pour détecter des effets secondaires inhabituels ou rares ou visant à traiter de l’efficacité potentielle ou l’efficacité réelle du VVAI chez les enfants peuvent ne pas être faisables, étant donné le nombre limité d’enfants atteints du VIH dans les pays à revenu élevé où le VVAI est utilisé.
Déclaration des auteurs
- D. M. — Rédaction, ébauche originale, examen, révision
- I. G. — Examen, révision
- R. H. — Examen, révision
Déclaration du Comité consultatif national sur l’immunisation (CCNI) : Recommandation sur le recours au vaccin vivant atténué contre l’influenza (VVAI) chez les personnes infectées par le VIH a été préparée par D. Moore, N. Dayneka, L. Zhao, A. Sinilaite, K. Young et I. Gemmill, au nom du Groupe de travail sur l’influenza du CCNI et a été approuvée par le CCNI.
Intérêts concurrents
Aucun.
Remerciements
Membres du Groupe de travail sur l’influenza : I. Gemmill (président), R. Harrison (vice-présidente), C. Bancej, L. Cochrane, N. Dayneka, L. Grohskopf, D. Kumar, J. Langley, P. Wolfe-Roberge, J. McElhaney, A. McGeer, D. Moore, S. Smith, B. Warshawsky et J. Xiong
Membres du CCNI : C. Quach (présidente), S. Deeks (vice-présidente), N. Dayneka, P. De Wals, V. Dubey, R. Harrison, K. Hildebrand, C. Rotstein, M. Salvadori, B. Sander, N. Sicard et S. Smith
Représentants de liaison : L. M. Bucci (Association canadienne de santé publique), E. Castillo (Société des obstétriciens et des gynécologues du Canada), A. Cohn (Centers for Disease Control and Prevention, États-Unis), J. Emili (Collège des médecins de famille du Canada), M. Naus (Comité canadien d’immunisation), D. Moore (Société canadienne de pédiatrie) et A. Pham-Huy (Association pour la microbiologie médicale et l’infectiologie Canada)
Représentants d’office : J. Gallivan (Direction des produits de santé commercialisés, Santé Canada [SC]), E. Henry (Centre de l’immunisation et des maladies respiratoires infectieuses [CIMRI], Agence de la santé publique du Canada [ASPC]), M. Lacroix (Groupe consultatif en éthique de la santé publique, ASPC), J. Pennock (CIMRI, ASPC), R. Pless (Direction des produits biologiques et des thérapies génétiques, SC), G. Poliquin (Laboratoire national de microbiologie, ASPC) et T. Wong (Direction générale de la santé des Premières Nations et des Inuits, Services aux Autochtones Canada)
Le Comité consultatif national de l’immunisation (CCNI) reconnaît et apprécie la contribution de A. House, M. Laplante, S. Ismail, M. Tunis et le Groupe canadien de recherche pédiatrique et périnatale sur le VIH/sida à cette déclaration.
Financement
Le travail du Comité consultatif national sur l’immunisation est appuyé par l’Agence de la santé publique du Canada.

Cette œuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution 4.0 International