Rapport annuel sur la surveillance de la rougeole : 2019

 Téléchargez cet article en format PDF
Téléchargez cet article en format PDFPublié par : L'Agence de la santé publique du Canada
Numéro : Volume 47-3 : L'influenza et les autres virus respiratoires
Date de publication : mars 2021
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 47-3, mars 2021 : L'influenza et les autres virus respiratoires
Surveillance
Surveillance de la rougeole au Canada, 2019
Cameron Coulby1, Francesca Reyes Domingo1, Joanne Hiebert2, Susan G Squires1
Affiliations
1 Centre de l’immunisation et des maladies respiratoires infectieuses, Agence de la santé publique du Canada, Ottawa, ON
2 Laboratoire national de microbiologie, Agence de la santé publique du Canada, Winnipeg, MB
Correspondance
Citation proposée
Coulby C, Reyes Domingo F, Hiebert J, Squires SG. Surveillance de la rougeole au Canada, 2019. Relevé des maladies transmissibles au Canada 2021;47(3):162–74. https://doi.org/10.14745/ccdr.v47i03a05f
Mots-clés : rougeole, santé des voyageurs, surveillance, éradication de la rougeole, vaccination
Résumé
Contexte : L'Agence de la santé publique du Canada (l'Agence) a amélioré la surveillance de la rougeole depuis 1998, année où la transmission de la rougeole a été éliminée au Canada. L'objectif de ce rapport national annuel de surveillance de la rougeole est de fournir un résumé épidémiologique de l'activité de la rougeole déclarée au Canada pour 2019 afin de fournir des données probantes pour appuyer la vérification continue du statut d'élimination de la rougeole au Canada.
Méthodes : Les données de surveillance de la rougeole se trouvent dans la base de données du Système canadien de surveillance de la rougeole et de la rubéole (SCSRR). Des analyses descriptives de la démographie et des facteurs de risque ont été effectuées. Les caractéristiques de l'éclosion ont été résumées et des analyses génotypiques ont été effectuées. Les données de surveillance, de laboratoire et de couverture vaccinale de 2019 ont été utilisées pour évaluer la situation du Canada par rapport aux critères essentiels de l'Organisation panaméricaine de la santé (OPS) pour la vérification de l'élimination de la rougeole.
Résultats : En 2019, 113 cas de rougeole ont été signalés au Canada (taux brut d'incidence de 3,0 cas pour 1 000 000 personnes). Parmi ces cas, 42 (37 %) ont été importés au Canada, et 12 (29 %) ont entraîné une transmission supplémentaire. Les nourrissons de moins d'un an présentaient le taux d'incidence par âge le plus élevé, soit 13,1 cas pour 1 000 000 personnes. Seulement 29 % des cas contenaient une ou plusieurs doses documentées de vaccin contre la rougeole. Un cinquième (19 %) des cas ont été hospitalisé; aucun décès n'a été signalé. Des renseignements sur le génotype étaient disponibles pour 100 % des éclosions signalées en 2019 et 90 % des cas de rougeole non liés aux éclosions. Parmi les cas pour lesquels des renseignements sur le génotype étaient disponibles, 27 % étaient de type B3 et 73 % étaient de type D8.
Conclusion : Même si seulement trois des quatre critères essentiels de l'OPS pour l'élimination de la rougeole ont été respectés entièrement ou partiellement, les données ne démontrent pas le rétablissement de la transmission endémique du virus de la rougeole.
Introduction
Même si elle est évitable par la vaccination, la rougeole demeure une cause majeure de morbidité et de mortalité, surtout chez les enfants de moins de cinq ansNote de bas de page 1. En 2018, la dernière année pour laquelle des estimations sont disponibles, il y a eu environ 9,8 millions de cas de rougeole et 142 000 décès liés à la rougeole dans le mondeNote de bas de page 2. Les efforts déployés à l'échelle mondiale pour éliminer la rougeole (i.e. l'absence de transmission endémique de la rougeole pendant au moins 12 mois dans une région géographique définie dotée d'un système de surveillance efficace) ont commencé en 1963 avec l'introduction du premier vaccin contre la rougeoleNote de bas de page 1Note de bas de page 3.
En 1998, le Canada a été l'un des premiers pays à éliminer la transmission endémique de la rougeole à la suite de l'introduction, à l'échelle nationale, de la vaccination systématique à deux doses contre la rougeole, les oreillons et la rubéole chez les enfants en 1996-1997 Note de bas de page 3Note de bas de page 4. Cependant, le statut d'élimination du Canada est menacé par les voyageurs infectés qui importent la rougeole au Canada, particulièrement pour les groupes de la population canadienne dont les taux de couverture vaccinale contre la rougeole sont sous-optimaux Note de bas de page 3Note de bas de page 4Note de bas de page 5. Par conséquent, il est essentiel que le Canada dispose d'une solide capacité de surveillance de la rougeole, y compris une capacité de laboratoire, pour identifier rapidement les cas de rougeole afin que des mesures de santé publique puissent être prises pour réduire la propagation et empêcher le retour endémique de la rougeoleNote de bas de page 6.
L'Agence de la santé publique du Canada (l'Agence), y compris le Laboratoire national de microbiologie (LNM), collabore avec les provinces et les territoires pour effectuer une surveillance nationale de la rougeole. L'Agence rend compte chaque semaine de l'activité liée à la rougeole sur le site Web canada.ca et à l'Organisation panaméricaine de la santé (OPS)Note de bas de page 7Note de bas de page 8.
L'objectif de ce rapport national annuel de surveillance de la rougeole est de fournir un résumé épidémiologique de l'activité de la rougeole déclarée au Canada pour 2019 afin de fournir des données probantes pour appuyer la vérification continue du statut d'élimination de la rougeole.
Méthodes
Données de surveillance
Le Système canadien de surveillance de la rougeole et de la rubéole (SCSRR) est un système de surveillance actif et amélioré appuyé par toutes les provinces et tous les territoires du Canada. Les cas confirmés de rougeole correspondant à la définition nationale de cas ont été signalés chaque semaine à l'Agence par les provinces et les territoires dans la base de données du SSRSCNote de bas de page 7Note de bas de page 8. Tous les cas confirmés de rougeole avec apparition d'éruptions cutanées entre le 1er janvier 2019 et le 31 décembre 2019 ont été inclus dans le présent rapport. L'Agence attribue des semaines épidémiologiques d'apparition d'éruptions cutanées, la première semaine se terminant le premier samedi de l'année. Un processus de vérification des données a été mené avec toutes les provinces et tous les territoires; ce processus comprenait l'interrogation pour les données manquantes, la détermination des entrées incorrectes et la confirmation des valeurs auprès des administrations déclarantes. Les cas comportant des données manquantes ont été inclus dans l'analyse, au besoin. Les visiteurs au Canada qui ont reçu un diagnostic de rougeole pendant leur séjour ont été inclus dans cette analyse.
On a considéré qu'un cas avait reçu une dose de vaccin contre la rougeole si la date de la vaccination était documentée; autrement, le cas était considéré comme non vacciné. Les cas dont les antécédents de vaccination étaient inconnus ont été considérés comme non vaccinés. Un cas a été considéré comme étant hospitalisé s'il avait été admis à l'hôpital en raison de la rougeole ou de complications liées à la rougeole, mais pas s'il n'avait été vu qu'aux services d'urgence sans prise en charge subséquente.
La province ou le territoire déclarant a identifié la source de l'exposition dans le cadre de l'enquête de santé publique. Les sources d'exposition ont été classées comme étant à l'extérieur du Canada (importées); au Canada et liées à un cas importé (liée à l'importation), au Canada et liées à un cas d'origine inconnue, ou source inconnue/sporadique.
Vérification de l'élimination de la rougeole au moyen d'objectifs et de cibles nationaux et internationaux
L'OPS a établi quatre critères pour la vérification continue de l'élimination de la rougeoleNote de bas de page 9 (tableau 1). Les indicateurs établis par l'OPS d'un système de surveillance efficace sont fondés sur une enquête sur les maladies ressemblant à la rougeole (i.e. les cas soupçonnés), tandis que seuls les cas confirmés doivent être déclarés à l'échelle nationale au Canada. Par conséquent, ces données ne peuvent répondre qu'indirectement aux critères de l'OPS.
| Critère | Indicateur |
|---|---|
| Vérifier l'interruption des cas de rougeole endémique pendant au moins 3 ans à partir du dernier cas endémique connu, en présence d'une surveillance de grande qualité | Zéro cas de transmission endémique |
| Maintenir une surveillance de grande qualité suffisamment sensible pour détecter les cas importés et liés aux importations | Plus de 2 cas suspects pour 100 000 personnes ayant fait l'objet d'une enquête adéquate |
| Vérifier l'absence de souches endémiques du virus de la rougeole grâce à la surveillance virale | Le génotype de la rougeole a été évalué dans 80 % des éclosions |
| Vérifier que l'immunisation est adéquate dans la population | 95 % des cohortes de population âgées de 1 à 40 ans ont reçu un vaccin contre la rougeole |
Génotypage
Le LNM effectue régulièrement le génotypage du virus de tous les cas confirmés par réaction en chaîne de la polymérase à transcription inversée pour lesquels des spécimens viraux (écouvillons respiratoires et/ou urine) sont disponibles. Les 450 nucléotides terminaux du gène de la nucléoprotéine (N) de la rougeole (N-450) ont été séquencés conformément aux lignes directrices de l’Organisation mondiale de la Santé (OMS) Note de bas de page 10Note de bas de page 11. Les séquences ont été alignées avec les séquences de référence du génotype de l’OMS et des arbres phylogénétiques construits par analyse de parcimonie maximale ont été générés dans le logiciel MEGA XNote de bas de page 12. Les séquences virales de la rougeole ont été déposées dans la base de données Measles Nucleotide Surveillance (MeaNS) de l’OMS et les identificateurs (ID) de séquence distincts acquis. Les séquences ont également été comparées à des souches nommées et à des séquences documentées par d’autres membres du Réseau mondial de laboratoires sur la rougeoleNote de bas de page 11Note de bas de page 13. Tous les cas confirmés de rougeole avec apparition d’éruptions cutanées entre le 1er janvier 2019 et le 31 décembre 2019 qui avaient été génotypés ont été inclus dans le présent rapport (n = 73). Les séquences ont été déposées dans la base de données de séquences génétiques GenBank des National Institutes of Health dont les numéros d’accès à la base sont MT386938 à MT387010.
Analyses
Des analyses épidémiologiques descriptives ont été effectuées en fonction des variables disponibles dans la base de données du SSRSC, y compris l’âge, le sexe, le lieu, la date d’apparition, la vaccination, l’hospitalisation, la source d’exposition et le génotypeNote de bas de page 8. Des comparaisons statistiques entre les fréquences ont été effectuées à l’aide d’un test exact de valeur mi-P, selon le cas. Les éclosions de rougeole, définies comme deux cas confirmés ou plus liés sur le plan épidémiologique, virologique ou les deux, ont été décrites en fonction des renseignements disponiblesNote de bas de page 14. Les taux d’incidence ont été calculés à l’aide des estimations de la population de Statistique Canada au 1er juillet 2019.
Résultats
Au total, 113 cas confirmés de rougeole (taux d’incidence de 3,0 cas pour 1 000 000 personnes) ont été signalés dans sept provinces et un territoire en 2019 (figure 1). Environ le tiers de ces cas étaient liés à une éclosion dans la province de Québec. Sur les 113 cas confirmés, 73 (65 %) ont été génotypés. Les génotypes identifiés étaient B3 (n = 20) et D8 (n = 53), deux génotypes circulant dans le monde en 2019, d’après les données soumises dans la base de données MeaNS de l’OMSNote de bas de page 15. Au total, 102 cas ont été confirmés en laboratoire et 11 cas ont été associés épidémiologiquement à un cas confirmé en laboratoire.
Figure 1 : L'historique de l'exposition de cas de référence et de ménage dans la grappe de cas en milieu familial
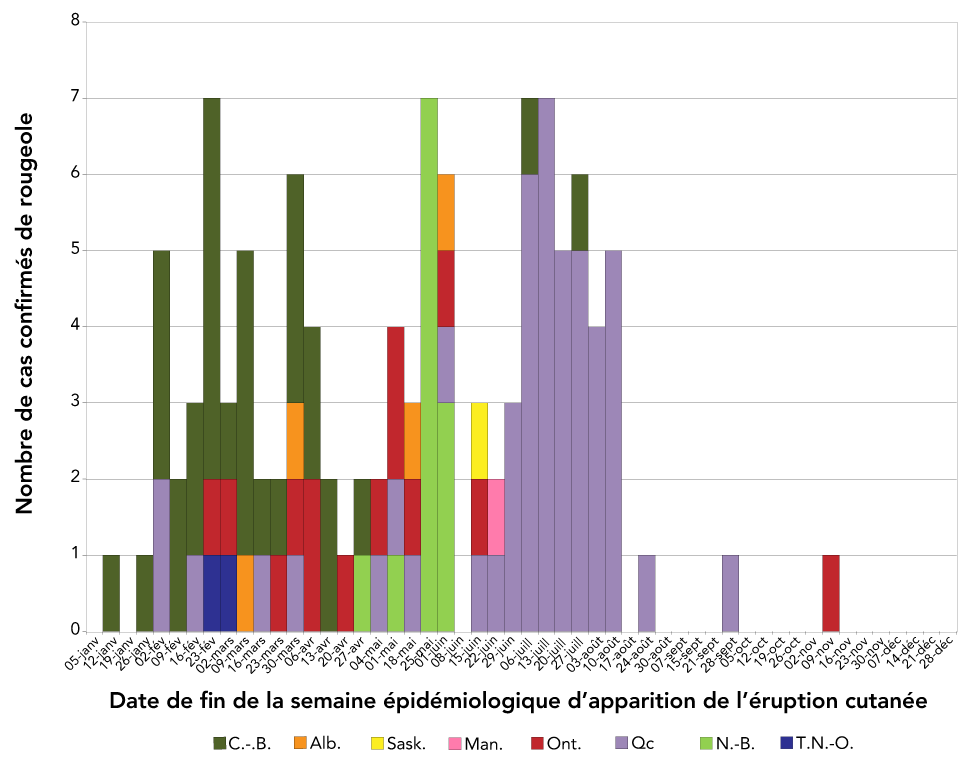
Description textuelle : Figure 1
| Date de fin de la semaine épidémiologique d'apparition de l'éruption cutanée | Nombre de cas | |||||||
|---|---|---|---|---|---|---|---|---|
| Alberta | Manitoba | Nouveau-Brunswick | Colombie-Britannique | Territoires du Nord | Ontario | Québec | Saskatchewan | |
| 5 janvier | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 12 janvier | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 |
| 19 janvier | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 26 janvier | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 |
| 2 février | 0 | 0 | 0 | 3 | 0 | 0 | 2 | 0 |
| 9 février | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 0 |
| 16 février | 0 | 0 | 0 | 2 | 0 | 0 | 1 | 0 |
| 23 février | 0 | 0 | 0 | 5 | 1 | 1 | 0 | 0 |
| 2 mars | 0 | 0 | 0 | 1 | 1 | 1 | 0 | 0 |
| 9 mars | 1 | 0 | 0 | 4 | 0 | 0 | 0 | 0 |
| 16 mars | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 |
| 23 mars | 0 | 0 | 0 | 1 | 0 | 1 | 0 | 0 |
| 30 mars | 1 | 0 | 0 | 3 | 0 | 1 | 1 | 0 |
| 6 avril | 0 | 0 | 0 | 2 | 0 | 2 | 0 | 0 |
| 13 avril | 0 | 0 | 0 | 2 | 0 | 0 | 0 | 0 |
| 20 avril | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 |
| 27 avril | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 |
| 4 mai | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 |
| 11 mai | 0 | 0 | 1 | 0 | 0 | 2 | 1 | 0 |
| 18 mai | 1 | 0 | 0 | 0 | 0 | 1 | 1 | 0 |
| 25 mai | 0 | 0 | 7 | 0 | 0 | 0 | 0 | 0 |
| 1er juin | 1 | 0 | 3 | 0 | 0 | 1 | 1 | 0 |
| 8 juin | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 15 juin | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 |
| 22 juin | 0 | 1 | 0 | 0 | 0 | 0 | 1 | 0 |
| 29 juin | 0 | 0 | 0 | 0 | 0 | 0 | 3 | 0 |
| 6 juillet | 0 | 0 | 0 | 1 | 0 | 0 | 6 | 0 |
| 13 juillet | 0 | 0 | 0 | 0 | 0 | 0 | 7 | 0 |
| 20 juillet | 0 | 0 | 0 | 0 | 0 | 0 | 5 | 0 |
| 27 juillet | 0 | 0 | 0 | 1 | 0 | 0 | 5 | 0 |
| 3 août | 0 | 0 | 0 | 0 | 0 | 0 | 4 | 0 |
| 10 août | 0 | 0 | 0 | 0 | 0 | 0 | 5 | 0 |
| 17 août | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 24 août | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 |
| 31 août | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 7 septembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 15 septembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 21 septembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 28 septembre | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 |
| 5 octobre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 12 octobre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 19 octobre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 26 octobre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 2 novembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 9 novembre | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 |
| 16 novembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 23 novembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 30 novembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 7 décembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 14 décembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 21 décembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 28 décembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
L’information sur l’âge, le sexe et la province ou le territoire de résidence était complète pour tous les cas de rougeole déclarés en 2019. Les cas étaient âgés de moins d’un an à 73 ans, avec un âge médian de 15 ans. Les cas étaient le plus souvent dans le groupe d’âge de 5 à 14 ans (29 %, n = 33) ou dans le groupe d’âge de 25 à 44 ans (25 %, n = 28). Le taux d’incidence de la rougeole diminue à travers tous les groupes d’âge, le taux d’incidence le plus élevé ayant été signalé chez les nourrissons de moins d’un an (13,1 cas pour 1 000 000 personnes) et le plus faible chez les adultes de 65 ans et plus (0,15 cas pour 1 000 000 personnes; figure 2). La majorité des cas (65 %, n = 73) étaient de sexe masculin.
Figure 2 : Cas confirmés de rougeole (N = 113) et taux d’incidence (pour 1 000 000 personnes) selon le groupe d’âge et l’état de vaccination, Canada, 2019
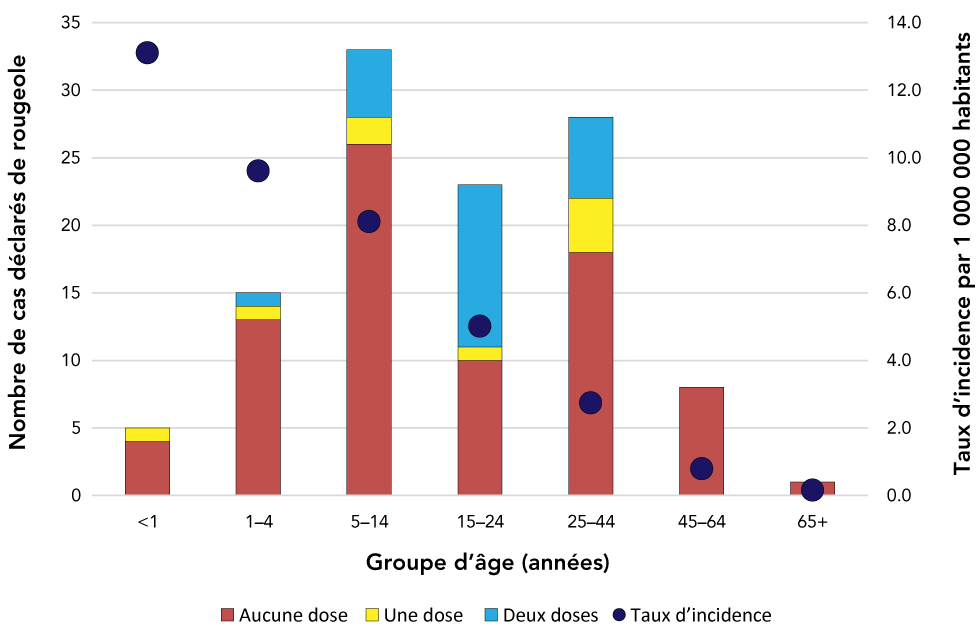
Description textuelle : Figure 2
| Groupe d'âge (années) | Nombre de cas déclarés de rougeole selon l'état de vaccination | Taux d'incidence | ||
|---|---|---|---|---|
| Aucune dose | Une dose | Deux doses | ||
| Moins de 1 | 4 | 1 | 0 | 13,1 |
| 1-4 | 13 | 1 | 1 | 9,6 |
| 5-14 | 26 | 2 | 5 | 8,1 |
| 15-24 | 10 | 1 | 12 | 5,0 |
| 25-44 | 18 | 4 | 6 | 2,7 |
| 45-64 | 8 | 0 | 0 | 0,8 |
| 65 ans et plus | 1 | 0 | 0 | 0,2 |
Vaccination
Sur les 113 cas de rougeole signalés au Canada en 2019, 71 % (n = 80) n’avaient pas reçu de dose (documentée) du vaccin contre la rougeole; de ce nombre, 16 avaient des antécédents de vaccination inconnus. Plus de 40 % des cas de rougeole qui n’étaient pas vaccinés (n = 34) étaient liés à une éclosion dans une collectivité non vaccinée (voir la section sur les éclosions ci-dessous). Il convient de noter que 57 % (n = 13) des cas du groupe d’âge de 15 à 24 ans avaient reçu au moins une dose (documentée) du vaccin contenant le virus de la rougeole, ce qui est considérablement plus élevé que la proportion des cas ayant reçu au moins une dose (documentée) du vaccin contenant le virus de la rougeole dans tout autre groupe d’âge (p < 0,01; figure 2).
Hospitalisation
Les données sur les hospitalisations des 113 cas de rougeole signalés étaient complètes. Au total, 19 % des cas (n = 21) ont été hospitalisés, ce qui a entraîné un taux d’hospitalisation de 0,6 cas pour 1 000 000 personnes. L’âge moyen des cas hospitalisés était de 31 ans (valeur médiane : 34 ans, intervalle : 1 à 73 ans). En moyenne, les cas hospitalisés étaient beaucoup plus âgés que les cas non hospitalisés (p < 0,001). Sur les 21 cas hospitalisés, seulement trois (14 %) avaient reçu une dose (documentée) du vaccin contre la rougeole.
Épidémiologie moléculaire par source d’exposition
Sur les 113 cas confirmés de rougeole en 2019, 42 (37 %) ont été importés au Canada après avoir été exposés à la rougeole pendant un voyage (tableau 2). De ces cas importés, 12 ont transmis la rougeole au Canada, ce qui a donné lieu à 60 autres cas liés à l’importation (tableau 3). Au total, les cas importés et liés à l’importation représentaient 90 % (n = 102) du nombre total de cas, tandis que 10 % (n = 11) étaient associés à une source inconnue ou sporadique d’exposition à la rougeole (tableau 2, tableau 3).
| Région selon l'OMS (nombre de cas) | Pays | Nombre de cas | Génotype (nombre de cas) | Souche nommée par l'OMS, le cas échéant, ID de séquence distincts du MeaNS (nombre de cas) |
|---|---|---|---|---|
| Pacifique Ouest (n = 25) | Philippines | 11 | B3 (n = 11) | MVi/Marikina City.PHL/10.18/, 5306 (n = 4); s.o., 6018 (n = 2); MVi/Gombak.MYS/40.15/, 4274 (n = 1); s.o., 5654 (n = 1); s.o., 5793 (n = 1); s.o., 5904 (n = 1); s.o., 6083 (n = 1) |
| Vietnam | 11 | D8 (n = 6) | MVs/Gir Somnath.IND/42.16/, 4683 (n = 3); s.o., 5840 (n = 2); s.o., 5823 (n = 1) | |
| Cambodge | 1 | D8 (n = 1) | MVs/Gir Somnath.IND/42.16/, 4683 (n = 1) | |
| Plusieurs pays | 2 | D8 (n = 1) | MVs/Gir Somnath.IND/42.16/, 4683 (n = 1) | |
| Europe (n = 6) | France | 1 | B3 (n = 1) | s.o., 5852 (n = 1) |
| Pologne | 1 | D8 (n = 1) | MVs/Gir Somnath.IND/42.16/, 4683 (n = 1) | |
| Ukraine | 1 | D8 (n = 1) | MVs/Gir Somnath.IND/42.16/, 4683 (n = 1) | |
| Royaume-Uni | 1 | D8 (n = 1) | MVs/Gir Somnath.IND/42.16/, 4683 (n = 1) | |
| Plusieurs pays | 2 | D8 (n = 1) | MVs/Gir Somnath.IND/42.16/, 4683 (n = 1) | |
| Amériques (n = 3) | États-Unis | 3 | D8 (n = 3) | MVs/Gir Somnath.IND/42.16/, 4683 (n = 2); MVs/Dagon Seikkan.MMR/5.18, ID (n = 1) |
| Asie du Sud-Est (n = 3) | Bangladesh | 2 | B3 (n = 2) | s.o., 5622 (n = 1); s.o., 6218 (n = 1) |
| Inde | 1 | D8 (n = 1) | s.o., 5970 (n = 1) | |
| Autres (n = 5) | Pakistan | 2 | B3 (n = 1) | s.o., 5309 (n = 1) |
| D8 (n = 1) | MVs/Gir Somnath.IND/42.16/, 4683 (n = 1) | |||
| Plusieurs pays et régions | 3 | B3 (n = 1) | MVi/Marikina City.PHL/10.18/, 5306 (n = 1) | |
| D8 (n = 2) | MVs/Gir Somnath.IND/42.16/, 4683 (n = 1); s.o., 5601 (n = 1) | |||
| Numéro de cas | Catégorie d'exposition | Date de fin de la semaine épidémiologique de l'apparition de l'éruption cutanée | Génotype (souche nommée par l'OMS, le cas échéant, ID de séquence distincts du MeaNS)Tableau 3 footnote a | Description |
|---|---|---|---|---|
| 1 | Inconnu (exposé au Canada ou à l'étranger) | 16 février | B3 (s.o., 5800) |
|
| 2 | Exposition au Canada, non liée à un cas | 23 février | B3 (s.o., 5654) |
|
| 3 | Inconnu (exposé au Canada ou à l'étranger) | 30 mars | D8 (MVs/Gir Somnath.IND/42.16, 4683) |
|
| 4 | Exposition au Canada, non liée à un cas | 30 mars | D8 (MVs/Gir Somnath.IND/42.16, 4683) |
|
| 5 | Exposition au Canada, non liée à un cas | 30 mars | D8 (MVs/Gir Somnath.IND/42.16, 4683) |
|
| 6 | Exposition au Canada, non liée à un cas | 6 avril | D8 (MVs/Gir Somnath.IND/42.16, 4683) |
|
| 7 | Exposition au Canada, non liée à un cas | 6 avril | D8 (MVs/Gir Somnath.IND/42.16, 4683) |
|
| 8 | Exposition au Canada, non liée à un cas | 1er juin | D8 (MVs/Gir Somnath.IND/42.16, 4683) |
|
| 9 | Exposition au Canada, liée à un cas sporadique d'origine inconnue | 15 juin | D8 (MVs/Gir Somnath.IND/42.16, 4683) |
|
| 10 | Exposition au Canada, non liée à un cas | 20 juillet | Non déterminé |
|
| 11 | Exposition au Canada, non liée à un cas | 28 septembre | B3 (s.o., 5230) |
|
Source inconnue
Il y a eu 11 cas (10 %) qui n’étaient ni importés ni liés à l’importation, huit qui n’avaient pas d’antécédents récents de voyage ou de liens connus avec d’autres cas confirmés de rougeole (cas sporadiques), un cas était lié à un cas sporadique d’origine inconnue et la source exacte de l’exposition pour les deux autres cas n’a pu être déterminée (source inconnue), car l’exposition peut s’être produite dans un autre pays où l’activité de la rougeole est connue ou au Canada (tableau 3). Ces cas provenaient de la Colombie-Britannique (n = 5), du Québec (n = 4) et de l’Ontario (n = 2). De ces cas, six concernaient des femmes et cinq des hommes. On indique que 10 de ces 11 cas ont été génotypés; dans sept cas, la souche génotype D8 MVs/Gir Somnath.IND/42.16/ nommée a été détectée, qui circulait à l’échelle mondiale en 2019. Trois souches de génotype B3 distinctes (numéros de séquence 5230, 5654 et 5800) ont été identifiées dans les trois autres cas, dont deux n’ont pas été détectées dans d’autres cas de rougeole génotypés en 2019 (5230 et 5800) (figure 3, tableau 3).
Figure 3 : Arbre phylogénétique construit par analyse de parcimonie maximale de séquences de rougeole N-450 identifiées au Canada en 2019 (n = 73) préparées à l’aide du logiciel MEGA XFootnote a
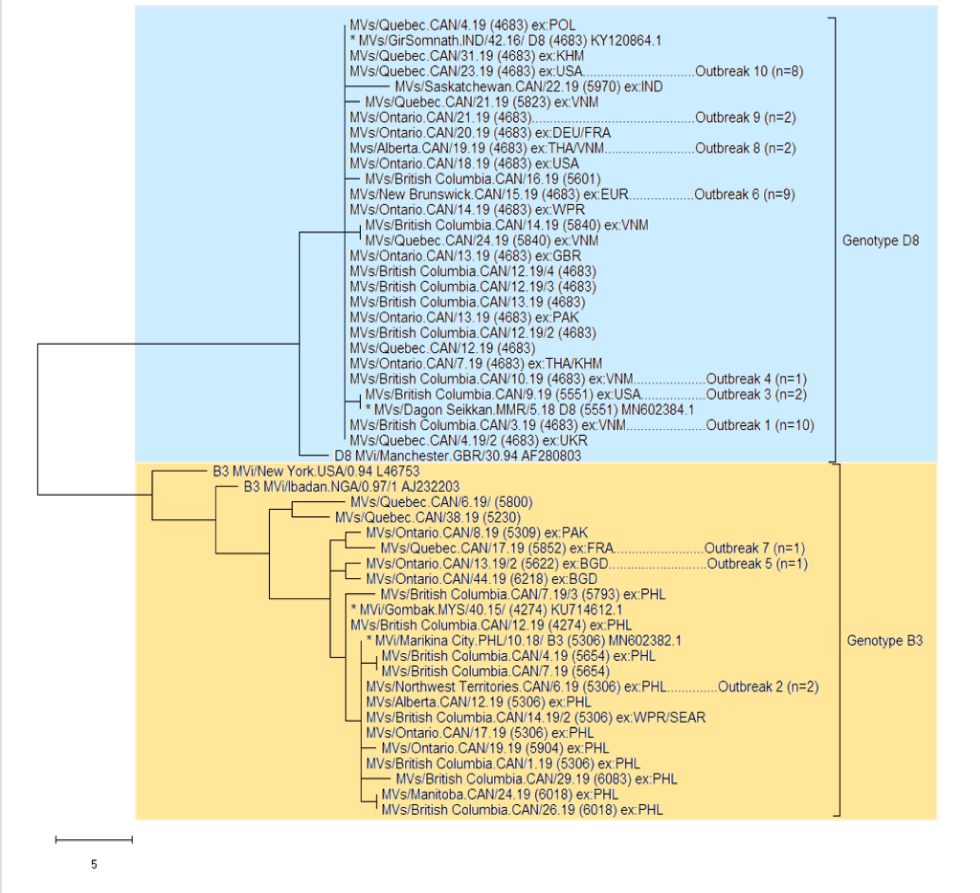
Description textuelle : Figure 3
La figure 3 montre l’arbre phylogénétique des séquences de rougeole N-450 détectées au Canada en 2019 (n=73), ainsi que leur état d’éclosion et leur source d’importation, le cas échéant. Seuls les génotypes B3 (n=20) et D8 (n=53) ont été détectés en 2019 et ces séquences virales sont représentées dans la figure. La figure montre que même si la plupart des virus détectés étaient du génotype D8, on a observé très peu de diversité de séquence, la plupart des séquences étant identiques à celles de la souche nommée MVs/Gir Somnath.IND/42.16 (n = 46) ou très semblables avec une différence maximale de quatre nucléotides. Au total, y compris la souche nommée MVs/Gir Somnath.IND/42.16, six identificateurs de séquence (ID) distincts du génotype D8 ont été détectés et comprenaient une deuxième souche appelée MVs/Dagon Seikkan.MMR/5.18. Les cas associés à la souche MV/Gir Somnath.IND/42.16 identifiée (n = 46) ont été associés à six des sept éclosions de génotype D8 (n = 32 cas séquencés) et à 14 cas sporadiques. Ces cas sporadiques avaient des antécédents de voyage au Cambodge, au Pakistan, en Pologne, en Ukraine, au Royaume-Uni, aux États-Unis (É.-U.) ou dans plusieurs pays (n=3 cas), tandis que cinq cas n’avaient aucun historique de voyage. Les foyers associés aux six MV/Gir Somnath.IND/42.16 ont été attribués à plusieurs pays (n=2), aux États-Unis, au Viet Nam (n=2) ou inconnus. Les sept autres séquences qui n’étaient pas identiques à la souche nommée MVs/Gir Somnath.IND/42.16 avaient voyagé en Inde, aux États-Unis et au Viet Nam (n=3) ou n’avaient pas voyagé (deux cas). Cinq de ces cas étaient sporadiques (un sans déplacement), tandis que les deux autres, identiques aux MV/Dagon Seikkan.
La figure montre également que les cas avec des séquences B3 de génotype détectées (n=20) présentaient une plus grande diversité de séquences avec 13 ID de séquence distincts, dont deux souches nommées : MVi/Gombak.MYS/40.15 et MVi/Marikina City.PHL/10.18. Ces deux souches nommées ne sont qu’un nucléotide différent et les séquences identiques ou très similaires étaient les séquences de génotype B3 principalement détectées (n = 12 cas sporadiques et deux cas associés à une éclosion). La plupart de ces personnes avaient des antécédents de voyage aux Philippines (n=11) ou dans la région du Pacifique occidental et de l’Asie du Sud-Est (n=1). La figure montre que les six autres cas de génotype de rougeole B3 détectés présentaient des ID de séquence distincts. Quatre cas comportaient des antécédents de voyage, deux au Bangladesh (un associé à une éclosion), un en France (associé à une éclosion) et un au Pakistan. Les deux autres cas, qui présentaient également des séquences distinctes, étaient des cas sporadiques sans antécédents de voyage.
Éclosions
Dix éclosions de rougeole ont été recensées pour un total de 74 cas (tableau 4). Sept des 10 éclosions étaient de petite envergure (de 2 à 3 cas par éclosion), et la transmission était limitée aux membres du ménage ou à d’autres contacts du cas index. Trois éclosions étaient plus importantes (de 12 à 34 cas par éclosion), avec transmission à l’échelle de la collectivité.
| Nombre d'éclosions | Province/territoire | Nombre de cas (nombre de générations) | Date de fin de la semaine épidémiologique du début de l'éruption cutanée du cas index | Génotype (souche nommée par l'OMS, le cas échéant, ID de séquence distincts du MeaNS)Tableau 4 footnote a | Description |
|---|---|---|---|---|---|
| 1 | Colombie-Britannique | 13 (n = 5) | 2 février | D8 (MVs/Gir Somnath.IND/42.16, 4683) |
|
| 2 | Territoires du Nord-Ouest | 2 (n = 2) | 16 février | B3 (MVi/Marikina City.PHL/10.18, 5306) |
|
| 3 | Colombie-Britannique | 2 (n = 2) | 9 mars | D8 (MVs/Dagon Seikkan.MMR/5.18, 5551) |
|
| 4 | Colombie-Britannique | 2 (n = 2) | 9 mars | D8 (MVs/Gir Somnath.IND/42.16, 4683) |
|
| 5 | Ontario | 2 (n = 2) | 23 mars | B3 (s.o., 5622) |
|
| 6 | Nouveau-Brunswick | 12 (n = 3) | 27 avril | D8 (MVs/Gir Somnath.IND/42.16, 4683) |
|
| 7 | Québec | 3 (n = 2) | 4 mai | B3 (s.o., 5852) |
|
| 8 | Alberta | 2 (n = 2) | 18 mai | D8 (MVs/Gir Somnath.IND/42.16, 4683) |
|
| 9 | Ontario | 2 (n = 2) | 1er juin | D8 (MVs/Gir Somnath.IND/42.16, 4683) |
|
| 10 | Québec | 34 (inconnu) | 15 juin | D8 (MVs/Gir Somnath.IND/42.16, 4683) |
|
La souche MBV/Gir Somnath.IND/42.16 nommée par l’OMS a été la plus fréquemment détectée en 2019. Au total, 46 cas de rougeole ont été identifiés avec cette souche (41 % de tous les cas), et ces cas ont été associés à six éclosions distinctes et 14 cas sporadiques pour un total de 20 chaînes de transmission. Dans la plus longue éclosion soutenue associée à cette souche, l’éclosion 10, la maladie est apparue au cours de la semaine se terminant le 15 juin dans le premier cas et au cours de la semaine se terminant le 24 août dans le dernier cas.
Vérification de l’élimination de la rougeole au moyen d’objectifs et de cibles nationaux et internationaux
Les données du présent rapport sont fournies à titre de preuve à l’appui de la vérification continue de l’élimination de la rougeole au Canada, pour laquelle l’OPS a établi quatre critères essentielsNote de bas de page 9. Selon les renseignements disponibles, le Canada a satisfait entièrement ou partiellement à trois des quatre critères en 2019 (tableau 5).
| Critère | Description |
|---|---|
| Vérifier l'interruption des cas de rougeole endémique pendant au moins 3 ans à partir du dernier cas endémique connu, en présence d'une surveillance de grande qualité | Critère satisfait entièrement Le Canada a atteint le statut d'élimination de la rougeole en 1998. Depuis, les données moléculaires et épidémiologiques continuent de démontrer qu'aucune souche virale n'a circulé pendant une période d'au moins un an (figure 4)Note de bas de page 4Note de bas de page 16Note de bas de page 17Note de bas de page 18Note de bas de page 19 |
| Maintenir une surveillance de grande qualité suffisamment sensible pour détecter les cas importés et liés aux importations | Critère partiellement satisfait Au Canada, la surveillance nationale de la rougeole effectuée par l'entremise du SCSRR consiste en une surveillance des cas confirmés et ne saisit pas le nombre de cas cliniques ou suspects qui font l'objet d'une enquête, laquelle est menée au niveau provincial et territorial. Toutefois, selon les données obtenues dans le cadre du projet pilote de surveillance de la rougeole et de la rubéole (qui ne comprend pas toutes les provinces et tous les territoires), le taux national d'enquêtes sur des cas soupçonnés se situait entre 12 et 19 pour 100 000 personnes selon une estimation antérieureNote de bas de page 17 Bien que ce critère ne puisse pas être entièrement satisfait, il a été respecté, car les données épidémiologiques et de laboratoire fournies dans le présent rapport indiquent que la capacité de surveillance de la rougeole du Canada est suffisamment sensible pour détecter les cas importés et liés à l'importation et mener des enquêtes sur les cas |
| Vérifier l'absence de souches endémiques du virus de la rougeole grâce à la surveillance virale | Critère satisfait entièrement Des renseignements sur le génotype étaient disponibles pour les 10 éclosions signalées en 2019. Des renseignements sur le génotype étaient également disponibles pour 90 % des cas de rougeole non liés aux éclosions (35 génotypés sur 39 cas) |
| Vérifier que l'immunisation est adéquate dans la population | Critère non satisfait Le Canada mesure actuellement (tous les deux ans) les taux de couverture vaccinale contre la rougeole à 2 et 7 ans, il est donc incapable d'évaluer la couverture vaccinale contre la rougeole pour tous les âges de 1 à 40 ans. D'après l'Enquête nationale de 2017 sur la couverture vaccinale des enfants, la couverture vaccinale pour la première dose du vaccin contenant la rougeole chez les enfants âgés de deux ans était estimée à 90 % et la couverture vaccinale à deux doses du vaccin contenant la rougeole chez les enfants de sept ans était de 86 %Note de bas de page 5 |
Discussion
Il y a eu 113 cas confirmés de rougeole signalés au Canada en 2019, dont la majorité était importée ou liée à l’importation (90 %) et dont les cas n’avaient pas reçu de vaccin contre la rougeole (71 %). Ce nombre est supérieur à la médiane des cas déclarés de 1998 à 2018 (médiane de 32 cas par année) et coïncide avec une tendance à la hausse des taux de rougeole à l’échelle mondiale depuis 2017 Note de bas de page 2Note de bas de page 20Note de bas de page 21Note de bas de page 22. En 2019, les États-Unis ont enregistré le plus grand nombre de cas de rougeole depuis 1992. Plus de 73 % des cas aux États-Unis étaient liés à des éclosions à New York, et la majorité de ces cas n’avaient pas été vaccinés contre la rougeole Note de bas de page 23. Ces éclosions aux États-Unis ont eu un effet direct sur les taux de rougeole au Canada, la plus importante éclosion au Canada en 2019 étant épidémiologiquement liée à une importante éclosion aux États-Unis. D’autres éclosions importantes au Canada ont été causées par des voyageurs non vaccinés qui se sont rendus au Vietnam et en Europe, où des éclosions ont également eu lieu en 2019. Ces éclosions soulignent le risque continu que tout voyage international entraîne la propagation de la rougeole au Canada, et valident l’élargissement par l’Agence, en 2019, de son avis de santé aux voyageurs concernant le risque d’exposition à la rougeole pour tout voyage international, et non seulement dans certaines régionsNote de bas de page 24.
À l’échelle mondiale, seulement quatre des 24 génotypes de rougeole reconnus continuent d’être détectés, soit les génotypes B3, D4, D8 et H1, à la suite des efforts d’éliminationNote de bas de page 4, et seuls les génotypes B3 et D8 ont été détectés dans des cas confirmés de rougeole au Canada en 2019. Le système de classification du génotype saisit les virus ayant des séquences génétiques (N-450) semblables, mais distinctes. Pour obtenir des données efficaces sur l’épidémiologie moléculaire, des niveaux de granularité supplémentaire sont nécessaires. Le Réseau mondial de laboratoires sur la rougeole de l’OMS a mis au point un système de « souches nommées » qui sont définies dans la base de données MeaNS et représentent une lignée, une souche virale précisément définie avec une séquence N-450 spécifique, qui a été fréquemment détectée dans une période de deux ans dans plusieurs paysNote de bas de page 11. De plus, la base de données MeaNS dispose d’un identificateur à quatre chiffres pour toutes les séquences N-450 distinctes ou uniques dans la base de données. Toutes les séquences obtenues à partir de cas de rougeole avec la même séquence N-450 partageront le même ID de séquence distinct. De cette façon, toutes les séquences génétiques possibles des cas déclarés de rougeole peuvent être suivies avec leur ID de séquence distinct et certaines seront également désignées comme appartenant à une lignée de souches nommée, représentant celles ayant une plus grande circulation. En 2019, 19 ID de séquence distincts, dont quatre souches nommées, ont été identifiés dans les 73 cas confirmés de rougeole qui ont été génotypés.
La souche MMV/Gir Somnath.IND/42.16 nommée par l’OMS était la seule souche détectée en 2019 qui a également été détectée dans quelques cas en 2018Note de bas de page 16. Cette souche circule dans le monde entier depuis 2018, d’après les entrées dans la base de données MeaNS, comme en témoigne le nombre de cas associés à cette souche en 2018 et en 2019 (figure 4). De 2018 à 2019, 51 cas de rougeole ont été identifiés avec cette souche et ces cas ont été associés à sept éclosions distinctes et 17 cas sporadiques pour un total de 24 chaînes de transmission. Le délai entre l’apparition de la maladie dans le premier et le dernier cas de la plus longue éclosion soutenue associée à cette souche était de 70 jours, ce qui est bien en deçà des 12 mois de transmission continue qui signaleraient une circulation endémique. La détection de cette souche dans un grand nombre de chaînes de transmission sur une longue période démontre la valeur de l’intégration des données de laboratoire et épidémiologiques et nécessite l’adoption de méthodes de génotypage étendues.
Figure 4 : Nombre de cas de rougeole avec le génotype D8, souche MMV/Gir Somnath.IND/42.16 nommée par l’OMS détectée en 2018 et 2019 (n = 51), selon la semaine épidémiologique de l’apparition des éruptions cutanées, l’état de la chaîne de transmission et la source d’exposition, CanadaNote de bas de page a
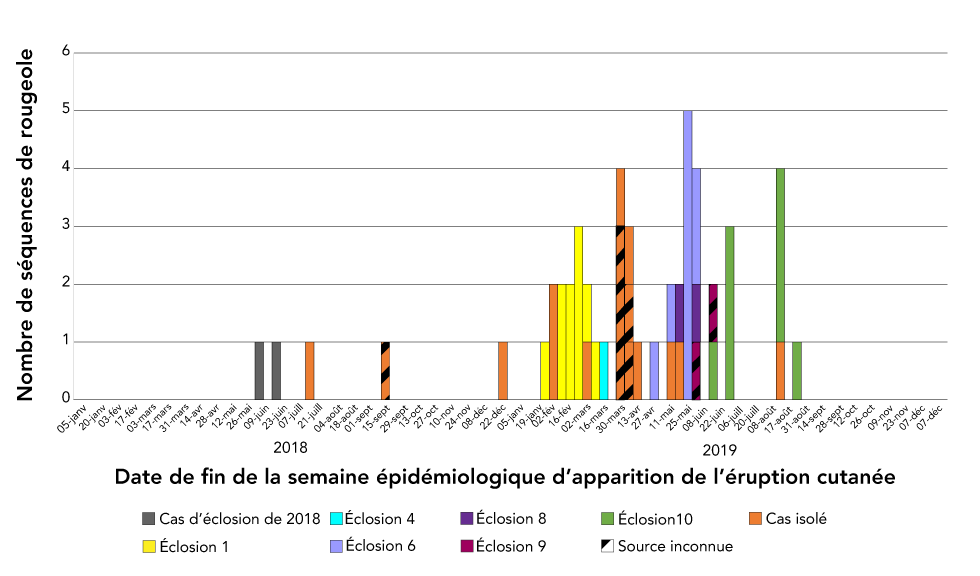
Description textuelle : Figure 4
Date de fin de la semaine épidémiologique d'apparition de l'éruption cutanée |
Nombre de cas | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Cas d'éclosion de 2018 | Éclosion 1 | Éclosion 4 | Éclosion 6 | Éclosion 8 | Éclosion 9 (source inconnue) | Éclosion 10 | Cas isolé - importé | Cas isolé - source inconnue | ||
| 2018 | 6 janvier | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 13 janvier | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 20 janvier | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 27 janvier | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 3 février | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 10 février | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 17 février | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 24 février | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 3 mars | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 10 mars | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 17 mars | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 24 mars | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 31 mars | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 7 avril | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 14 avril | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 21 avril | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 28 avril | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 5 mai | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 12 mai | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 19 mai | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 26 mai | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 2 juin | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 9 juin | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 16 juin | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 23 juin | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 30 juin | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 7 juillet | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 14 juillet | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | |
| 21 juillet | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 28 juillet | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 4 août | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 11 août | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 18 août | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 25 août | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 1er septembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 8 septembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 15 septembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | |
| 22 septembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 29 septembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 6 octobre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 13 octobre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 20 octobre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 27 octobre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 3 novembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 10 novembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 17 novembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 24 novembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 1er décembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 8 décembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 15 décembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 22 décembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | |
| 29 décembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 2019 | 5 janvier | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 12 janvier | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 19 janvier | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 26 janvier | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 2 février | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 | |
| 9 février | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 16 février | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 23 février | 0 | 3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 2 mars | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | |
| 9 mars | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 16 mars | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 23 mars | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 30 mars | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 3 | |
| 6 avril | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 2 | |
| 13 avril | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | |
| 20 avril | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 27 avril | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | |
| 4 mai | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 11 mai | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | |
| 18 mai | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | |
| 25 mai | 0 | 0 | 0 | 5 | 0 | 0 | 0 | 0 | 0 | |
| 1er juin | 0 | 0 | 0 | 2 | 1 | 1 | 0 | 0 | 0 | |
| 8 juin | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 15 juin | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 0 | 0 | |
| 22 juin | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 29 juin | 0 | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 0 | |
| 6 juillet | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 13 juillet | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 20 juillet | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 27 juillet | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 3 août | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 10 août | 0 | 0 | 0 | 0 | 0 | 0 | 3 | 1 | 0 | |
| 17 août | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 24 août | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | |
| 31 août | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 7 septembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 15 septembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 21 septembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 28 septembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 5 octobre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 12 octobre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 19 octobre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 26 octobre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 2 novembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 9 novembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 16 novembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 23 novembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 30 novembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 7 décembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 14 décembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 21 décembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 28 décembre | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
Tant au Canada qu’à l’étranger, le maintien d’un taux élevé de couverture vaccinale au moyen d’un vaccin contre la rougeole exige un effort soutenu de santé publique et constitue un élément essentiel d’une stratégie visant à atteindre et à maintenir l’élimination de la rougeole. Comme les années précédentes, la grande majorité des cas de rougeole n’a pas été vaccinée, ce qui souligne l’importance de respecter les lignes directrices sur la vaccinationNote de bas de page 16Note de bas de page 17Note de bas de page 25Note de bas de page 26Note de bas de page 27. Seulement un cas de rougeole sur cinq en 2019 avait reçu deux doses de vaccin contre la rougeole, y compris cinq cas qui étaient âgés de moins d’un an et qui n’étaient pas encore admissibles à recevoir la première dose systématique de vaccin contre la rougeole selon le calendrier de vaccination systématiqueNote de bas de page 25.
La répartition par âge des cas de rougeole signalés en 2019 était semblable à celle des années précédentes, les groupes d’âge plus jeunes étant plus touchés que les groupes plus âgésNote de bas de page 16Note de bas de page 17Note de bas de page 18. Il convient de noter que plus de la moitié des cas de rougeole dans le groupe d’âge de 15 à 24 ans avaient reçu deux doses de vaccin contre la rougeole. La majorité (n = 7) des cas qui avaient reçu les deux doses de vaccin de ce groupe d’âge étaient liés à une importante éclosion dans une école secondaire où de nombreux élèves avaient été exposés. Étant donné le grand nombre de personnes exposées à cette éclosion, on s’attendrait à certaines réactions immunitaires ou développements de la rougeole malgré le fait que certaines personnes aient reçu les deux doses de vaccin, et ce en dépit d’une couverture vaccinale élevée. De plus, une étude séroépidémiologique menée dans la province de l’Ontario a révélé que ce groupe d’âge pourrait avoir une immunité décroissante contre la rougeoleNote de bas de page 28. Les cas peuvent s’être développés après une réponse immunitaire inappropriée; leur immunité peut avoir diminué à des niveaux non protecteurs au moment de l’exposition; ou le vaccin qu’ils ont reçu peut avoir été conservé, manipulé ou administré de façon inappropriéeNote de bas de page 29Note de bas de page 30.
Selon les renseignements disponibles, le Canada a satisfait entièrement ou partiellement à trois des quatre critères essentiels de l’OPS pour la vérification de l’élimination de la rougeole en 2019. Le Canada ne répond pas au critère relatif à la couverture vaccinale contre la rougeole. Le Canada mesure actuellement (tous les deux ans) les taux de couverture vaccinale contre la rougeole à deux et sept ans, et est donc incapable d’évaluer la couverture vaccinale contre la rougeole pour tous les âges entre 1 et 40 ans, comme le prévoit le cadre d’élimination de l’OPS. En 2017, le taux de couverture vaccinale de la rougeole chez les enfants âgés de deux ans était estimé à 90 % et de 86 % pour les enfants de sept ans qui reçoivent la deuxième dose du vaccin contre la rougeole, ce qui est inférieur à l’indicateur établi par l’OPS de 95 %Note de bas de page 5. Cette estimation provient d’une enquête ayant collecté des données issues des carnets de vaccination conservés par les parents, et dans lesquels certains renseignements peuvent être incomplets, erronés ou tout simplement manquants. Il est fort probable que l’enquête sous-estime la couverture, car les doses de vaccins administrées sans date ou avec une date invalide ne sont pas comptabilisées dans le calcul de la couverture vaccinale.
Forces et faiblesses
Ce rapport comporte plusieurs limites dont il faut tenir compte. Seuls les cas de rougeole ayant été en contact avec le système de santé canadien sont inclus dans le cadre de la surveillance renforcée de la rougeole. De ce fait, il est possible que les visiteurs au Canada qui n’ont pas recours aux soins médicaux et que les cas présentant des symptômes légers ne soient pas détectés. D’autres systèmes de surveillance fédéraux ou provinciaux peuvent utiliser des méthodes d’attribution des cas qui diffèrent du SSRSC, ce qui peut causer des écarts dans le nombre annuel de casNote de bas de page 31. Le SCSRR ne collecte pas d’informations sur la mortalité ni sur la morbidité (e.g. durée d’hospitalisation, séquelles), ce qui ne permet pas d’avoir un portrait global du fardeau de la rougeole. Toutefois, malgré ces limites, le présent rapport sert à brosser un tableau détaillé de la rougeole au Canada en 2019 grâce à une analyse intégrée des données de laboratoire et des données épidémiologiques sur les cas pour tous les cas déclarés.
Conclusion
L’occurrence de cas de rougeole et les éclosions subséquentes de rougeole au Canada en 2019, qui étaient en grande partie attribuables aux importations de rougeole, soulignent l’importance de continuer à améliorer la surveillance de la rougeole et les efforts pour accroître l’adoption du vaccin dans l’ensemble du pays. Bien que l’importation de la rougeole et les zones à faible couverture vaccinale constituent un défi pour le maintien du statut d’élimination de la rougeole au Canada, les données de laboratoire et épidémiologiques fournies par le présent rapport ne démontrent pas le rétablissement de la transmission endémique du virus de la rougeole.
Déclaration des auteurs
- C. C. — Méthodologie, logiciel, analyse formelle, enquête, organisation des données, rédaction de la version initiale, rédaction et révision de la version définitive, édition, visualisation
- F. R. D. — Conceptualisation, méthodologie, analyse formelle, rédaction de la version initiale, rédaction de la version définitive, révision, administration de projet
- J. H. — Méthodologie, validation, enquête, organisation des données, rédaction de la version initiale, rédaction et révision de la version définitive, édition
- S. G. S. — Conceptualisation, méthodologie, rédaction et révision de la version définitive, édition, administration de projet
Intérêts concurrents
Aucun.
Remerciements
Les auteurs tiennent à remercier chaleureusement leurs partenaires provinciaux et territoriaux de surveillance et d’analyse en laboratoire pour leur collaboration et leurs efforts continus visant à fournir et valider les données recueillies par le Système canadien de surveillance de la rougeole et de la rubéole (SCSRR), à acheminer les échantillons aux fins de surveillance moléculaire (génotypage) et à réviser le contenu de ce rapport. Les auteurs tiennent à remercier la Dre C. Dickson pour sa précieuse contribution au rapport.
Financement
Ces travaux ont été soutenus par l’Agence de la santé publique du Canada.
Références
- Footnote 1
-
World Health Organization (WHO). Measles. Geneva (CH): WHO; (accédé 2020-02). http://www.who.int/news-room/fact-sheets/detail/measles
- Footnote 2
-
Patel MK, Dumolard L, Nedelec Y, Sodha SV, Steulet C, Gacic-Dobo M, Kretsinger K, McFarland J, Rota PA, Goodson JL. Progress toward regional measles elimination— worldwide, 2000–2018. MMWR Morb Mortal Wkly Rep 2019;68(48):1105–11. https://doi.org/10.15585/mmwr.mm6848a1
- Footnote 3
-
King A, Varughese P, De Serres G, Tipples GA, Waters J; Working Group on Measles Elimination. Measles elimination in Canada. J Infect Dis 2004;189 Suppl 1:S236–42. https://doi.org/10.1086/378499
- Footnote 4
-
Agence de la santé publique du Canada. L’élimination de la rougeole, de la rubéole et du syndrome de rubéole congénitale au Canada. Ottawa (ON) : Gouvernement du Canada; 2013-04 (accédé 2020-02). https://www.canada.ca/fr/sante-publique/services/immunisation/maladies-pouvant-etre-prevenues-vaccination/elimination-rougeole-rubeole-syndrome-rubeole-congenitale-canada.html
- Footnote 5
-
Agence de la santé publique du Canada. Couverture vaccinale des enfants canadiens : Résultats de l’enquête nationale sur la couverture vaccinale des enfants (ENCVE), 2017. Ottawa (ON) : Gouvernement du Canada; 2019 (accédé 2020-03). https://www.canada.ca/fr/sante-publique/services/publications/vie-saine/2017-enquete-nationale-couverture-vaccinale-enfants.html
- Footnote 6
-
Agence de la santé publique du Canada. Objectifs nationaux de couverture vaccinale et cibles nationales de réduction des maladies évitables par la vaccination d’ici 2025; Cibles de réduction des maladies évitables par la vaccination d'ici 2025; Maladies en voie d'élimination : maintenir l'élimination. Ottawa (ON) : Government of Canada; 2020 (accédé 2020-01). https://www.canada.ca/fr/sante-publique/services/priorites-immunization-et-vaccins/strategie-nationale-immunisation/vaccination-objectifs-nationaux-couverture-vaccinale-cibles-nationales-reduction-maladies-evitables-2025.html#2.0
- Footnote 7
-
Agence de la santé publique du Canada. Définitions nosologiques des maladies transmissibles faisant l’objet d’une surveillance nationale : résultats d’une consultation provinciale territoriale (PT). Relevé des maladies transmissibles au Canada 2009;35-Suppl 2:76–8. https://www.canada.ca/content/dam/phac-aspc/migration/phac-aspc/publicat/ccdr-rmtc/09pdf/35s2-fra.pdf
- Footnote 8
-
Agence de la santé publique du Canada. Projet pilote sur la surveillance de la rougeole et de la rubéole. Ottawa (ON) : Gouvernement du Canada; (accédé 2020-02). https://www.canada.ca/fr/sante-publique/services/surveillance.html#a10
- Footnote 9
-
Pan-American Health Organization. Plan of action. Documentation and verification of measles, rubella and congenital rubella syndrome elimination in the region of the Americas. Washington (DC): PAHO; 2010. https://www.paho.org/immunization/toolkit/resources/paho-publication/PoA-Documentation-Verification-MRCRS-Elimination-e.pdf
- Footnote 10
-
World Health Organization. Expanded Programme on Immunization (EPI). Standardization of the nomenclature for describing the genetic characteristics of wild-type measles viruses. Wkly Epidemiol Rec 1998;73(35):265–9. https://apps.who.int/iris/bitstream/handle/10665/230557/WER7335_265-269.PDF?sequence=1&isAllowed=y
- Footnote 11
-
World Health Organization. Genetic diversity of wild-type measles viruses and the global measles nucleotide surveillance database (MeaNS). Wkly Epidemiol Rec 2015;90(30):373–80. https://apps.who.int/iris/bitstream/handle/10665/242393/WER9030_373-380.PDF?sequence=1&isAllowed=y
- Footnote 12
-
Kumar S, Stecher G, Li M, Knyaz C, Tamura K. MEGA X: molecular Evolutionary Genetics Analysis across computing platforms. Mol Biol Evol 2018;35(6):1547–9. https://doi.org/10.1093/molbev/msy096
- Footnote 13
-
Rota PA, Brown K, Mankertz A, Santibanez S, Shulga S, Muller CP, Hübschen JM, Siqueira M, Beirnes J, Ahmed H, Triki H, Al-Busaidy S, Dosseh A, Byabamazima C, Smit S, Akoua-Koffi C, Bwogi J, Bukenya H, Wairagkar N, Ramamurty N, Incomserb P, Pattamadilok S, Jee Y, Lim W, Xu W, Komase K, Takeda M, Tran T, Castillo-Solorzano C, Chenoweth P, Brown D, Mulders MN, Bellini WJ, Featherstone D. Global distribution of measles genotypes and measles molecular epidemiology. J Infect Dis 2011;204 Suppl 1:S514–23. https://doi.org/10.1093/infdis/jir118
- Footnote 14
-
Une déclaration d’un comité consultatif (DCC), Groupe de travail pour l’élimination de la rougeole et de la rubéole (GTERR). Lignes directrices pour la prévention et le contrôle des éclosions de rougeole au Canada. Une déclaration d’un comité consultatif (DCC), Groupe de travail pour l’élimination de la rougeole et de la rubéole (GTERR). Relevé des maladies transmissibles au Canada 2013; 39(ACS-3):1–52. http://doi.org/10.14745/ccdr.v39i00a03f
- Footnote 15
-
World Health Organization (WHO). Measles and rubella surveillance Data. Geneva (CH): WHO; (accédé 2020-02). https://www.who.int/immunization/monitoring_surveillance/burden/vpd/surveillance_type/active/measles_monthlydata/en/
- Footnote 16
-
Coulby C, Domingo FR, Hiebert J, MacDonald D. Surveillance de la rougeole au Canada : 2018. Relevé des maladies transmissibles au Canada 2020;46(4):87–94. https://doi.org/10.14745/ccdr.v46i04a04f
- Footnote 17
-
Sherrard L, Hiebert J, Squires S. Relevé des maladies transmissibles au Canada Relevé des maladies transmissibles au Canada 2015;41(7):181–93. https://doi.org/10.14745/ccdr.v41i07a01f
- Footnote 18
-
Agence de la santé publique du Canada. Surveillance de la rougeole au Canada : 2017. Ottawa (ON) : Gouvernement du Canada; 2018 (accédé 2020-03). https://www.canada.ca/fr/sante-publique/services/publications/maladies-et-affections/surveillance-de-la-rougeole-canada-2017.html
- Footnote 19
-
Public Health Agency of Canada. Sustainability of Measles, Rubella and Congenital Rubella Syndrome (CRS) Elimination. Country template for the update of country reports (PAHO/WHO). Ottawa (ON): Government of Canada; 2016-04
- Footnote 20
-
World Health Organization. Feasibility assessment of measles and rubella eradication. Geneva (CH): WHO; 2019 (accédé 2020-03). https://www.who.int/immunization/sage/meetings/2019/october/3_Feasibility_Assessment_of_Measles_and_Rubella_Eradication_updatedSAGE.pdf
- Footnote 21
-
Dabbagh A, Laws RL, Steulet C, Dumolard L, Mulders MN, Kretsinger K, Alexander JP, Rota PA, Goodson JL. Progress toward regional measles elimination— worldwide, 2000–2017. MMWR Morb Mortal Wkly Rep 2018;67(47):1323–9. https://doi.org/10.15585/mmwr.mm6747a6
- Footnote 22
-
Une déclaration d’un comité consultatif (DCC), Groupe de travail pour l’élimination de la rougeole et de la rubéole (GTERR). Lignes directrices pour la prévention et le contrôle des éclosions de rougeole au Canada. Une déclaration d’un comité consultatif (DCC), Groupe de travail pour l’élimination de la rougeole et de la rubéole (GTERR). Relevé des maladies transmissibles au Canada 2013; 39(ACS-3):1–52. http://doi.org/10.14745/ccdr.v39i00a03f
- Footnote 23
-
World Health Organization (WHO). Measles and rubella surveillance Data. Geneva (CH): WHO; (accédé 2020-02). https://www.who.int/immunization/monitoring_surveillance/burden/vpd/surveillance_type/active/measles_monthlydata/en/
- Footnote 24
-
Coulby C, Domingo FR, Hiebert J, MacDonald D. Surveillance de la rougeole au Canada : 2018. Relevé des maladies transmissibles au Canada 2020;46(4):87–94. https://doi.org/10.14745/ccdr.v46i04a04f
- Footnote 25
-
Sherrard L, Hiebert J, Squires S. Relevé des maladies transmissibles au Canada Relevé des maladies transmissibles au Canada 2015;41(7):181–93. https://doi.org/10.14745/ccdr.v41i07a01f
- Footnote 26
-
Agence de la santé publique du Canada. Surveillance de la rougeole au Canada : 2017. Ottawa (ON) : Gouvernement du Canada; 2018 (accédé 2020-03). https://www.canada.ca/fr/sante-publique/services/publications/maladies-et-affections/surveillance-de-la-rougeole-canada-2017.html
- Footnote 27
-
Public Health Agency of Canada. Sustainability of Measles, Rubella and Congenital Rubella Syndrome (CRS) Elimination. Country template for the update of country reports (PAHO/WHO). Ottawa (ON): Government of Canada; 2016-04
- Footnote 28
-
World Health Organization. Feasibility assessment of measles and rubella eradication. Geneva (CH): WHO; 2019 (accédé 2020-03). https://www.who.int/immunization/sage/meetings/2019/october/3_Feasibility_Assessment_of_Measles_and_Rubella_Eradication_updatedSAGE.pdf
- Footnote 29
-
Dabbagh A, Laws RL, Steulet C, Dumolard L, Mulders MN, Kretsinger K, Alexander JP, Rota PA, Goodson JL. Progress toward regional measles elimination— worldwide, 2000–2017. MMWR Morb Mortal Wkly Rep 2018;67(47):1323–9. https://doi.org/10.15585/mmwr.mm6747a6
- Footnote 30
-
Agence de la santé publique du Canada. Maladies évitables par la vaccination : Rapport de surveillance en date du 31 décembre 2017. Ottawa (ON) : Gouvernement du Canada; 2020 (accédé 2020-10). https://www.canada.ca/fr/sante-publique/services/publications/vaccins-immunisation/maladies-evitables-vaccination-rapport-surveillance-31-decembre-2017.html
- Footnote 31
-
United States Centre for Disease Control and Prevention. Measles (Rubeola): measles cases and outbreaks. Atlanta (GA): U.S. Department of Health & Human Services; 2019 (accédé 2020-02). https://www.cdc.gov/measles/cases-outbreaks.html
- Footnote 32
-
Agence de la santé publique du Canada. Avis mondial sur la rougeole. Ottawa (ON) : Gouvernement du Canada; 2019 (accédé 2020-05). https://voyage.gc.ca/voyager/sante-securite/conseils-sante-voyageurs/203?_ga=2.162927932.1890263265.1616158351-975465391.1616158350
- Footnote 33
-
Programmes de vaccination systématique et de rattrapage des provinces et des territoires pour les nourrissons et les enfants au Canada. Ottawa (ON) : Gouvernement du Canada; 2018 (accédé 2020-01). https://www.canada.ca/fr/sante-publique/services/renseignements-immunisation-provinces-et-territoires/programmes-vaccination-systematique-provinces-territoires-nourrissons-enfants.html
- Footnote 34
-
Vaccin contre la rougeole : Guide canadien d'immunisation: Tableau 1 : Critères d'immunité contre la rougeole. Ottawa (ON) : Gouvernement du Canada; 2018 (accédé 2020-01). https://www.canada.ca/fr/sante-publique/services/publications/vie-saine/guide-canadien-immunisation-partie-4-agents-immunisation-active/page-12-vaccin-rougeole.html
- Footnote 35
-
Immunisation des voyageurs: Guide canadien d'immunisation. Ottawa (ON) : Gouvernement du Canada; 2017 (accédé 2020-02). https://www.canada.ca/fr/sante-publique/services/publications/vie-saine/guide-canadien-immunisation-partie-3-vaccination-populations-particulieres/page-9-immunisation-voyageurs.html
- Footnote 36
-
Bolotin S, Severini A, Hatchette T, McLachlan E, Savage R, Hughes SL, Wang J, Deeks SL, Wilson S, Brisson M, Halperin SA, Gubbay J, Mazzulli T, Serhir B, Ward BJ, Crowcroft N. Assessment of population immunity to measles in Ontario, Canada: a Canadian Immunization Research Network (CIRN) study. Hum Vaccin Immunother 2019;15(12):2856–64. https://doi.org/10.1080/21645515.2019.1619402
- Footnote 37
-
Breakwell L, Moturi E, Helgenberger L, Gopalani SV, Hales C, Lam E, Sharapov U, Larzelere M, Johnson E, Masao C, Setik E, Barrow L, Dolan S, Chen TH, Patel M, Rota P, Hickman C, Bellini W, Seward J, Wallace G, Papania M. Measles outbreak associated with vaccine failure in adults – Federated States of Micronesia, February-August 2014. MMWR Morb Mortal Wkly Rep 2015;64(38):1088–92. https://doi.org/10.15585/mmwr.mm6438a7
- Footnote 38
-
Hinman AR, Orenstein WA, Mortimer EA Jr. When, where, and how do immunizations fail? Ann Epidemiol 1992;2(6):805–12. https://doi.org/10.1016/1047-2797(92)90074-Z
- Footnote 39
-
Agence de la santé publique du Canada. Définitions nosologiques des maladies transmissibles faisant l'objet d'une surveillance nationale: Résultats d'une consultation provinciale territoriale (PT). Relevé des maladies transmissibles au Canada 2009;35 S2:1–139. https://www.canada.ca/fr/sante-publique/services/rapports-publications/releve-maladies-transmissibles-canada-rmtc/numero-mensuel/2009-35/definitions-nosologiques-maladies-transmissibles-surveillance-nationale.html

Cette œuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution 4.0 International