Prévention de la propagation des variantes de la COVID-19

 Téléchargez cet article en format PDF
Téléchargez cet article en format PDFPublié par : L'Agence de la santé publique du Canada
Numéro : Volume 47-7/8, juillet/août 2021 : Botulisme infantile au Canada, 1979 à 2019
Date de publication : juillet/août 2021
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
RMTC : Volume 47-7/8, juillet/août 2021 : Botulisme infantile au Canada, 1979 à 2019
Science de l’application des connaissances
Possibilité d’intensification des efforts de dépistage et de recherche de contacts pour prévenir les nouvelles éclosions de COVID-19 attribuables à des variants plus transmissibles
Jianhong Wu1,2, Francesca Scarabel1,2, Zachary McCarthy1,2, Yanyu Xiao3, Nicholas H Ogden4
Affiliations
1 Laboratoire de mathématiques industrielles et appliquées, Département de mathématiques et de statistiques, Université York, Toronto, ON
2 Fields-CQAM Laboratoire de mathématiques pour la santé publique, Université York, Toronto, ON
3 Département des sciences mathématiques, Université de Cincinnati, Cincinnati, Ohio, États-Unis
4 Division des sciences des risques pour la santé publique, Laboratoire national de microbiologie, Agence de la santé publique du Canada, Saint-Hyacinthe, QC
Correspondance
Citation proposée
Wu J, Scarabel F, McCarthy Z, Xiao Y, Ogden NH. Possibilité d’intensification des efforts de dépistage et de recherche de contacts pour prévenir les nouvelles éclosions de COVID-19 attribuables à des variants plus transmissibles. Relevé des maladies transmissibles au Canada 2021;47(7/8):363–72. https://doi.org/10.14745/ccdr.v47i78a06f
Mots-clés : SRAS-CoV-2, variants préoccupants, interventions non pharmaceutiques, assouplissements
Résumé
Contexte : Lorsque les interventions de santé publique sont assouplies après plusieurs jours de baisse du nombre de cas de maladie à coronavirus 2019 (COVID-19), il est essentiel de déterminer les stratégies potentielles pour assouplir les restrictions tout en atténuant le risque d’une nouvelle vague de variants préoccupants plus transmissibles. Nous avons estimé les améliorations nécessaires aux interventions en santé publique pour une réouverture partielle de l’économie tout en évitant les pires conséquences d’une nouvelle éclosion, associées à des variants préoccupants plus transmissibles.
Méthodes : Un modèle dynamique de transmission a été utilisé pour quantifier les conditions auxquelles les interventions de santé publique combinées doivent répondre pour rouvrir l’économie sans risque d’éclosion importante. Ces conditions sont celles qui maintiennent le taux de reproduction de contrôle en dessous de l’unité, tout en tenant compte d’une augmentation de la transmissibilité due aux variants préoccupants.
Résultats : Il a été possible de déterminer des combinaisons de la proportion de personnes exposées au virus qui sont retracées et mises en quarantaine avant de devenir infectieuses, la proportion de personnes symptomatiques confirmée et isolée et les taux de contact quotidiens individuels nécessaires pour s’assurer que le taux de reproduction de contrôle demeure inférieur à l’unité.
Conclusion : Notre analyse indique que le succès des mesures restrictives, notamment les décrets de confinement et les fermetures, offre une fenêtre d’opportunité étroite pour intensifier les efforts de détection des cas et de recherche des contacts afin d’empêcher une nouvelle vague associée à la circulation de variants préoccupants plus transmissibles, comme en témoigne la réduction du nombre de cas.
Introduction
La pandémie de maladie à coronavirus 2019 (COVID-19) s’est étendue au Canada au début de 2020, et une vague printanière de transmission de l’épidémie a été contrôlée par des fermetures restrictives qui ont réduit le taux quotidien de personnes en contact les unes avec les autres, ce qui a fait baisser le taux de reproduction de contrôle sous l’unitéNote de bas de page 1. Comme les fermetures restrictives ont été levées au début de l’été 2020, plusieurs études de modélisation ont permis de relever la nécessité d’améliorer la détection et l’isolement des cas, ainsi que le dépistage et la mise en quarantaine des contacts (« dépistage et recherche ») afin de continuer à maîtriser l’épidémie (i.e. pour empêcher l’augmentation du nombre de cas ou pour empêcher le dépassement de la capacité de soins de santé à court et à long terme)Note de bas de page 2Note de bas de page 3Note de bas de page 4Note de bas de page 5. Ces améliorations à la détection, à l’isolement, à la recherche et à la mise en quarantaine peuvent compenser l’augmentation des taux de contact quotidien dans la population générale et la transmission qui en résulte associée à l’assouplissement des restrictionsNote de bas de page 2Note de bas de page 3Note de bas de page 4Note de bas de page 5. Comme nous le savons, l’épidémie a refait surface à la fin de 2020, ce qui laisse entendre que la capacité de dépistage et de recherche était insuffisante pour contrôler l’épidémie, et qu’il fallait imposer d’autres fermetures restrictives pour maîtriser la « deuxième vague ». À mesure que les provinces et les territoires envisageaient d’assouplir les fermetures restrictives, une nouvelle menace est apparue, soit de nouveaux variants plus transmissibles, aussi appelée « variants préoccupants ». Plusieurs de ces variants, qui ont d’abord été identifiés ailleurs dans le monde, se répandent maintenant au Canada, en particulier le variant B.1.1.7. Le variant B.1.1.7 s’est rapidement propagé au Royaume-Uni au cours de l’automne 2020, probablement grâce à l’assouplissement des fermetures restrictives ainsi qu’au taux de transmission intrinsèquement plus élevé du nouveau variant comparativement aux souches de virus précédemment en circulationNote de bas de page 6. Il sera ici question d’explorer la capacité de dépistage et de recherche de contacts qui serait nécessaire pour maintenir le contrôle de l’épidémie de COVID-19 à l’aide de données de l’Ontario, étant donné que davantage de variants transmissibles deviennent dominants, alors que la vaccination a lieu au sein de la population canadienne.
Intervention
Un modèle dynamique de la transmissionNote de bas de page 4 adapté aux cas signalés cumulatifs pendant la première et la deuxième vague de l’épidémie de COVID-19 en Ontario, au Canada, a été utilisé pour quantifier les conditions des interventions combinées en santé publique qui auraient pu permettre de rouvrir partiellement l’économie sans une éclosion importante. Ces conditions sont celles qui maintiennent le taux de reproduction de contrôle sous l’unité tout en tenant compte de la transmissibilité accrue des variants préoccupants. Ces conditions doivent être vérifiées avant que la province n’envisage une nouvelle réouverture après avoir atténué la troisième vague. Les dates approximatives de chacune des vagues de la COVID-19 observées jusqu’à maintenant en Ontario et au Canada sont indiquées au tableau 1.
| Description | Dates approximatives | ||
|---|---|---|---|
| Vague un (la première vague) | Février 2020 à août 2020 | ||
| Vague deux (la deuxième vague) | Septembre 2020 à mi-février 2021 | ||
| Vague trois (la troisième vague) | Mi-février 2021 à juin 2021Tableau 1 footnote a | ||
Dans le modèle, la population est divisée en segments susceptibles (S), exposés (E), infectieux asymptomatiques (A), infectieux avec symptômes (I) et rétablis (R) en fonction du statut épidémiologique des personnes. Le modèle comprend également les cas diagnostiqués qui sont isolés (D), sujets à la quarantaine (Sq) et exposés en quarantaine (Eq), des segments pour modéliser l’impact de la recherche des contacts (i.e. identifier et contacter les personnes qui ont eu des contacts physiques avec des personnes infectées) et la mise en quarantaine de ces contacts retracés. Dans le cadre du modèle, une proportion, q, des personnes exposées au virus sont retracés et mis en quarantaine (la « proportion de quarantaine »). Le modèle dynamique de transmission qui en résulte est un système d’équations différentielles ordinaires.
Le taux de reproduction de contrôle a été calculé comme suit :RC =βρc(1-q)/(δI + α + γI) + βcθ(1-ρ)(1- q)/γA
Dans cette formule, c est le nombre moyen de contacts quotidiens d’une personne dans la population, β est la probabilité de transmission au contact, ρ est la probabilité d’avoir des symptômes chez les personnes infectées, θ est l’infectiosité relative des cas asymptomatiques, δI est le taux de transition des personnes infectées symptomatiques vers la catégorie diagnostiquée et isolée, α est le taux de mortalité, et γI γA et sont les taux de rétablissement des personnes infectées symptomatiques et asymptomatiques, respectivement. Par conséquent, les mesures de l’efficacité du dépistage et de la recherche sont δI (le taux auquel les personnes symptomatiques sont détectées et isolées) et q (la proportion des contacts des cas qui sont retracés et mis en quarantaine avant qu’ils ne deviennent infectieux). La proportion de personnes infectieuses qui n’ont pas été retracées et mises en quarantaine avant d’entrer dans la période infectieuse et qui sont testés, reçoivent une confirmation puis isolés pendant la période infectieuse est donnée par δI/(δI +α +γI). L’accent est mis ici sur la recherche de conditions sur q et δI/(δI +α + γI), qui, selon différents contacts quotidiens et une transmissibilité accrue due aux variants préoccupants, assurent RC < 1.
Des valeurs ont été obtenues pour les paramètres du modèle qui permettent un RC < 1 à l’aide de l’ajustement du modèle et de l’intégration des données à partir de sources multiples. Le modèle dynamique de la transmission a été adapté aux cas signalés en Ontario jusqu’au 23 décembre 2020 à l’aide d’une technique établieNote de bas de page 4 (voir l’appendice) et nous avons tenu compte des différentes phases de distanciation physique dans la province. Grâce à l’ajustement du modèle, les valeurs clés du modèle ont été estimées. Celles-ci comprenaient la proportion de cas détectés et isolés, la proportion de contacts retracés et mis en quarantaine, la probabilité de transmission au contact, l’infectiosité des cas asymptomatiques et les taux de rétablissement à la suite d’une infection. Pour intégrer l’effet des variants préoccupants, nous avons modélisé une augmentation de 40 % de la probabilité de transmission β par rapport aux valeurs estimées avant décembre 2020. Cette valeur de 40 % est tirée des estimations inférieures de la transmissibilité accrue du variant B.1.1.7 obtenues au Royaume-UniNote de bas de page 6Note de bas de page 7. Les niveaux de détection des cas et de recherche des contacts nécessaires pour prévenir une nouvelle vague de COVID-19 ont ensuite été examinés, en supposant que les taux de contact augmentent de trois à 12 par jour.
Résultats
Quantification de l’évolution des mesures de distance physique
Depuis le début de la pandémie de COVID-19, l’Ontario, comme la plupart des provinces et des territoires du Canada, a traversé différentes phases d’augmentation des mesures de distanciation physique et de dépistage amélioré pour atténuer la première vague, suivi d’un assouplissement des fermetures pour rouvrir l’économie, ce qui a mené à la deuxième vague et déclenché une deuxième série de fermetures. Il convient de noter que la deuxième série de fermetures a également été assouplie lorsque le nombre total de cas a diminué, mais que le variant B.1.1.7, plus transmissible, est devenu dominant, entraînant une troisième vague. Bien que la quantification des mesures de distanciation physique dans cette recherche soit basée sur les données et les analyses des deux premières vagues, les conditions nécessaires dérivées pour une réouverture sans nouvelle épidémie à grande échelle, comme celle que connaît la province de l’Ontario, appuient clairement l’appel à une attention urgente pour améliorer la capacité de dépistage et de recherche et de recherche et mise en quarantaine/isolation en préparation de la nouvelle réouverture.
L’escalade des fermetures mise en œuvre en Ontario en 2020 pour atténuer la première vague comportait des étapes à partir de mars 2020 (tableau 2). Le processus de réouverture était plus spécifique par région, mais en général, il comportait trois étapes principales : les phases 1, 2 et 3. Par la suite, des mesures améliorées ont commencé à être mises en œuvre de nouveau dans la province après la phase 3 de la réouverture à l’automne 2020. Le calendrier précis qui saisit l’essence des événements clés et qui est pris en compte dans cette étude de modélisation est présenté au tableau 2. Dans cette étude, la date du 23 décembre a marqué la fin de l’ajustement des données, considérée comme le dernier jour de données précédant le confinement de la province qui n’était pas fortement affecté par les célébrations de Noël. La procédure d’ajustement des données (détaillée dans l’appendice) a également permis de saisir les effets d’événements clés supplémentaires dans la chronologie liés à la probabilité de transmission, à la détection des cas et à la recherche des contacts. Dans plusieurs régions, une exigence relative à l’utilisation de masques ou de couvre-visage dans les espaces publics clos est entrée en vigueur le 7 juillet 2020. De plus, les variations des volumes de dépistage, de recherche des contacts et de détection des cas du 8 au 22 octobre 2020 ont été quantifiées.
| Description | Date | ||
|---|---|---|---|
| Fermeture des écoles jusqu'à la déclaration de situation d'urgence | 14 au 18 mars 2020 | ||
| Déclaration d'urgence jusqu'à la fermeture des lieux de travail non essentiels | 18 au 24 mars 2020 | ||
| Fermeture des lieux de travail non essentiels jusqu'au premier assouplissement des restrictions | 24 mars au 16 mai 2020 | ||
| Certaines entreprises et certains services récréatifs reprennent leurs activités, suivi de la phase 1 de la réouverture | 16 mai au 12 juin 2020 | ||
| Phase 2 de la réouverture | 12 juin au 17 juillet 2020 | ||
| Phase 3 de la réouverture, y compris le retour en présentiel dans les écoles | 17 juillet au 10 octobre 2020 | ||
| Modification de la phase 2 en vigueur dans certaines régions | 10 octobre au 23 novembre 2020 | ||
| Confinement des régions sanitaires de Toronto et de Peel et autres mesures améliorées en Ontario | 23 novembre au 23 décembreTableau 2 footnote a 2020 | ||
Nous avons estimé l’efficacité des interventions mises en œuvre en fonction du taux de contact, de la probabilité de transmission par contact, du taux de détection des cas symptomatiques et de la proportion de contacts retracés, mis en quarantaine ou isolés. Le modèle dynamique de la transmission a été adapté aux cas signalés cumulatifsNote de bas de page 4 à l’aide de données jusqu’au 23 décembre 2020 et a pris en compte différentes interventions en santé publique (détaillées ci-dessous). Les taux quotidiens de contacts individuels ont été estimés entre 2,66 et 12,17 contacts par jour de mars à décembre 2020. La probabilité de transmission estimée par contact β variait entre 0,11 et 0,14. La proportion estimative de quarantaine q est demeurée à près de 40 % au 23 décembre. Le taux de détection et d’isolement des cas symptomatiques δI a été estimé à environ 0,14 par jour. De plus amples détails sur les estimations des paramètres et leur évolution temporelle sont présentés à la figure 1.
Figure 1 : Paramètres estimés selon l’ajustement du modèle aux cas cumulatifs déclarés en Ontario en 2020
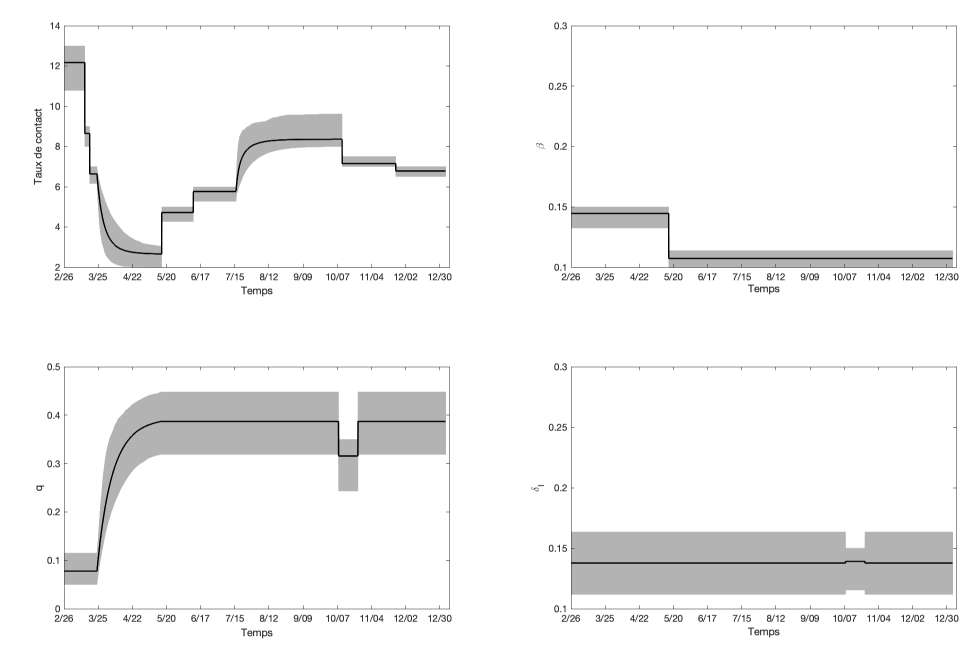
Description textuelle : Figure 1
Le graphique supérieur gauche montre les taux de contact moyens quotidiens estimés c à différentes étapes de la mise en œuvre/assouplissement des fermetures restrictives. Les taux de contact estimatifs étaient les suivants : avant le 14 mars : c = 12,17; du 14 au 18 mars : c = 8,65; du 18 au 24 mars : c = 6,64; le 16 mai (fin de la phase 3) : c = 2,66; du 16 mai au 12 juin (phase 1 de la réouverture) : c = 4,72; du 12 juin au 17 juillet (phase 2 de la réouverture) : c = 5,77; le 10 octobre (fin de la phase 3 de la réouverture) : c = 8,36; du 10 octobre au 23 novembre (phase 2 modifiée, mesures améliorées) : c = 7,14; du 23 novembre au 23 décembre (confinement dans les régions de Toronto et de Peel, autres mesures améliorées) : c = 6,78. Le graphique supérieur droit affiche la probabilité de transmission au contact β, qui variait entre 0,11 et 0,14. Le graphique inférieur gauche montre la proportion de quarantaine q estimée, qui est restée proche de 40 % après la première vague. Le graphique inférieur droit montre le taux estimé de détection et d'isolement des cas symptomatiques δI. On a estimé que ce paramètre demeurait à environ 0,14 par jour pour la plus grande partie de la période, ce qui correspond à environ 45 % des cas symptomatiques détectés et isolés.
Faisabilité de prévenir une nouvelle éclosion avec les variants préoccupants
L’influence des différentes valeurs de paramètres sur le taux de reproduction de contrôle RC a été étudiée, et les niveaux de recherche des contacts et de quarantaine nécessaires pour la lutte contre l’épidémie lorsque le variant préoccupant (B.1.1.7) est le variant dominant ont été évalués. Les variations de la proportion de quarantaine, la proportion de cas symptomatiques détectés et isolés, et les différents taux de contact quotidiens couvrant les valeurs observées lors des première et deuxième vagues ont été particulièrement étudiées.
La figure 2 présente un graphique des valeurs de q (proportion de quarantaine) et β (probabilité de transmission par contact) pour lesquelles RC = 1. Ces graphiques séparent les zones de paramètres qui permettent de contrôler l’épidémie pour des taux de contact journalier entre trois et 12 personnes. Les estimations des paramètres obtenues au cours des première et deuxième vagues ont été incluses, la probabilité de transmission par contact (β) ayant augmenté de 40 % par rapport aux valeurs estimées précédemment, afin de tenir compte de l’augmentation de la transmissibilité des variants préoccupants. Le cercle complet correspond à β = 0,15 (l’estimation la plus faible pour le virus en circulation à l’origine, 0,11, augmenté de 40 %), et le cercle vide correspond à β = 0,2 (l’estimation la plus élevée pour le virus en circulation à l’origine, 0,14, augmenté de 40 %). Pour la fraction de mise en quarantaine, la valeur estimée avant le 23 décembre a été considérée. En particulier, dans le cas d’un taux de contact égal à huit (correspondant au taux de contact estimé à la phase 3 de la réouverture), l’augmentation de la proportion de quarantaine de 40 % à 75 % permettra au taux de reproduction de contrôle de demeurer inférieur à un, même lorsque les variants préoccupants deviennent dominants.
Figure 2 : Limites des valeurs pour la proportion de contacts retracés et mis en quarantaine et la probabilité de transmission
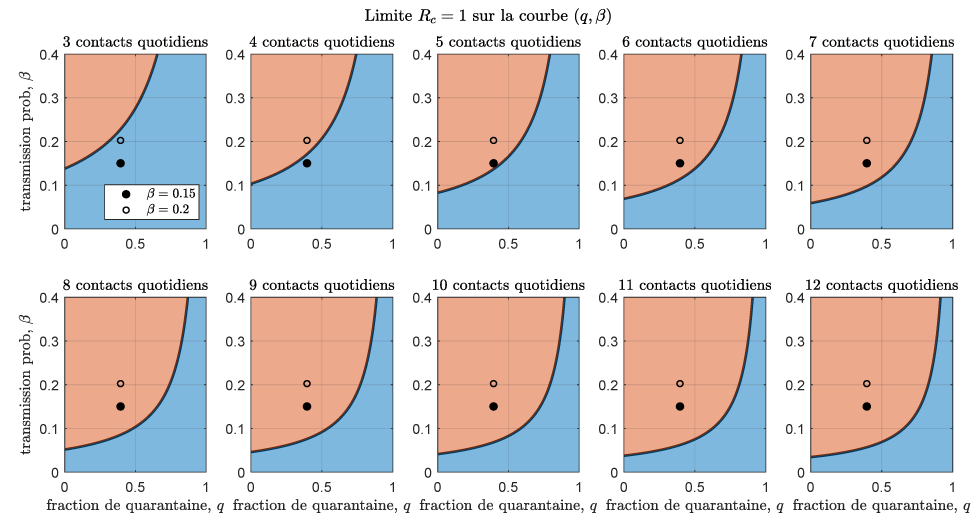
Description textuelle : Figure 2
Chaque graphique de la figure montre la limite des valeurs pour la proportion de contacts suivis et mis en quarantaine q et la probabilité de transmission β qui détermine si l’épidémie est contrôlée. Chaque graphique affiche la limite correspondant aux différentes valeurs du taux de contact quotidien c, de trois à 12. Les cercles représentent les paramètres estimés par ajustement de modèle (proportion de quarantaine au 23 décembre 2020, et les deux valeurs estimées de la probabilité de transmission ont augmenté de 40 % en raison des variants préoccupants, ce qui donne β = 0,15 et β = 0,2. La zone bleue représente la zone du paramètre qui permet le contrôle, tandis que la zone rouge représente la zone de propagation de l’épidémie.
De même, nous avons évalué la recherche de contacts et la mise en quarantaine, ainsi que la détection et l’isolement des cas nécessaires pour lutter contre l’épidémie. La figure 3 présente un graphique de la proportion de cas détectés et isolés, et de contacts retracés et mis en quarantaine, pour laquelle RC = 1. Ces graphiques séparent les combinaisons de valeurs pour la détection des cas et la recherche des contacts qui permettent de contrôler l’épidémie. Il a été estimé qu’une combinaison d’une fraction de quarantaine de 60 % et de recherche et d’isolement de 65 % des personnes symptomatiques est suffisante pour prévenir une éclosion en utilisant le taux de contact estimé à la phase 2 de la réouverture (c = 6 contacts par jour), même en tenant compte de l’estimation la plus élevée de la probabilité de transmission (lignes en pointillés à la figure 3).
Figure 3 : Limites des valeurs pour la proportion de contacts retracés et mis en quarantaine et la proportion de cas symptomatiques détectés et isolés
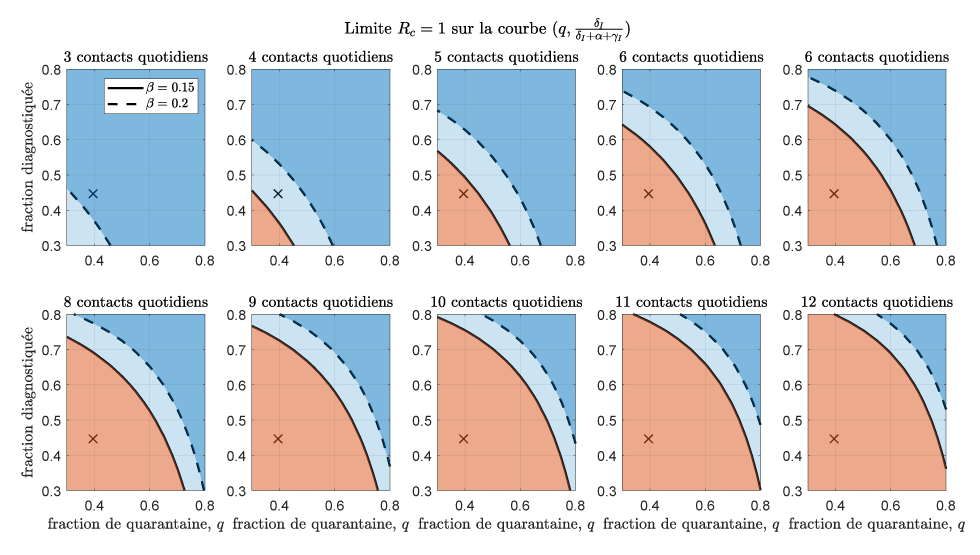
Description textuelle : Figure 3
Chaque graphique de la figure montre la limite des valeurs pour la proportion de contacts retracés et mis en quarantaine q et la proportion de cas symptomatiques détectés et isolés δI/(δI + α+ γI), qui déterminent si l’épidémie est contrôlée. Chaque graphique affiche la limite correspondant aux différentes valeurs du taux de contact quotidien c, de trois à 12. Les croix représentent les paramètres estimés par ajustement de modèle jusqu’au 23 décembre 2020. Les courbes pleines et en pointillés représentent le seuil de contrôlabilité lorsque la probabilité de transmission β se situe aux valeurs estimées inférieures et supérieures, respectivement. La zone bleue représente la zone du paramètre qui permet le contrôle (bleu clair : le contrôle n’est possible que si la transmissibilité est à la valeur inférieure β = 0,15; bleu foncé : contrôle possible également pour la transmissibilité élevée β = 0,2), tandis que la zone rouge représente la zone de propagation de l’épidémie.
Discussion
À l’aide d’un modèle dynamique de transmission adapté aux cas de COVID-19 cumulatifs signalés en Ontario, il a été possible de calculer les conditions dans lesquelles une nouvelle vague aurait pu être évitée malgré la circulation d’un variant préoccupant plus transmissible. Le fait que la province ait connu la troisième vague au printemps 2021 montre qu’il aurait pu y avoir des mesures en place en ce qui concerne le dépistage et la recherche des contacts jusqu’à la mise en quarantaine/isolement, ainsi que des mesures de distanciation physique, pour répondre à ces conditions de réouverture.
Notre étude montre que, si les interventions en santé publique peuvent être maintenues pour assurer une tendance à la baisse des cas menant à une réduction des cas à un niveau tel que la capacité de recherche permet une détection plus complète des cas, et que la recherche des contacts est effectuée efficacement avec une forte proportion de personnes exposées mises en quarantaine (il faut que les deux se produisent assez rapidement), la prévention d’une nouvelle éclosion est possible même dans le pire des cas où les variants préoccupants deviennent dominants. Cependant, selon notre analyse, cela exige une augmentation substantielle de la proportion de cas détectés et de la proportion de contacts qui sont retracés et mis en quarantaine. Plus précisément, si le taux de contact individuel quotidien en Ontario revient à sa valeur estimée lors de la phase 2 de la réouverture (environ six contacts par jour), alors une nouvelle éclosion (la troisième vague) aurait pu être évitée si, pour chaque tranche de 100 nouvelles infections générées, 60 des 100 personnes avaient été retracées et isolées avant de devenir infectieuses. De plus, parmi celles qui ne sont pas retracées et qui développent des symptômes, 65 sur 100 auraient été testées, diagnostiquées et isolées. Par ailleurs, si les taux de détection chez les personnes symptomatiques demeurent à leurs niveaux estimés actuels (i.e. environ 45 personnes symptomatiques sur 100 qui n’ont pas été retracées sont diagnostiquées), un taux de contact estimé pendant la phase 3 de la réouverture (entre huit et neuf contacts par jour) serait viable si, sur 100 nouvelles infections générées, environ 75 étaient retracées et isolées avant d’entrer dans leur période infectieuse.
Ces proportions élevées de quarantaine et d’isolement ne peuvent être atteintes que si le nombre de cas est réduit à de faibles niveaux, ce qui crée un créneau étroit pour prévenir une nouvelle vague. Cet effet en cascade a été discuté précédemmentNote de bas de page 8 . Lorsque des interventions d’atténuation ciblées et cohérentes mènent à un taux accéléré de diminution des cas à un niveau où la réouverture peut commencer avec un très petit nombre de nouvelles infections, les interventions efficaces d’atténuation des effets sur la santé publique peuvent et doivent être davantage mobilisées pour réagir rapidement à tout nouveau point chaud localisé, en évitant une vague subséquente à grande échelle en présence de variants préoccupants. Ces études montrent que la décision de rouvrir doit tenir compte non seulement du taux de diminution des cas et du nombre de cas, mais aussi de la capacité de dépistage, de traçabilité, de quarantaine et d’isolement en matière de santé publique. Cela est particulièrement pertinent pour toute province qui met en œuvre des mesures de confinement afin d’atténuer une vague continue; la création des conditions de réouverture doit comprendre l’amélioration des tests de dépistage et le suivi de la mise en quarantaine et de la logistique de l’isolement.
Forces et faiblesses
Notre étude démontre que des efforts accrus dans les politiques de santé publique en matière de détection des cas symptomatiques et de recherche des contacts auraient pu permettre de contrôler l’épidémie même si un variant préoccupant avec une capacité de transmission accrue de 40 % devenait dominant. Un avantage important de notre méthodologie est qu’elle utilise l’évaluation rétrospective et la quantification des efforts de santé publique (en termes de diagnostic symptomatique et de mise en quarantaine des contacts) dans les vagues épidémiques précédentes (première et deuxième) de COVID-19 afin d’estimer l’augmentation nécessaire des efforts pour prévenir une troisième vague. Toutefois, notre étude repose sur plusieurs hypothèses, dont certaines pourraient être facilement assouplies, tandis que d’autres sont propres au cadre de modélisation choisi. Premièrement, nos estimations ne tiennent pas compte de la diminution du nombre de personnes vulnérables en raison de l’immunité induite par l’infection ou de la distribution des vaccins dans la population; elles présentent donc un scénario quelque peu prudent. De plus, on suppose une augmentation fixe (de 40 %) de la transmissibilité des variants préoccupants, ce qui représente les valeurs inférieures estimées pour le variant B.1.1.7. La méthodologie pourrait être facilement adaptée pour étudier différents niveaux d’augmentation de la transmissibilité, ce qui pourrait être plus descriptif pour d’autres variants préoccupants existants et émergents. Un autre aspect important est que le modèle de transmission est fondé sur l’hypothèse d’un mélange homogène de personnes, ignorant ainsi l’hétérogénéité due à différents âges ou groupes de risque, comportements ou milieux de vie. Un certain degré d’hétérogénéité, par exemple entre différents groupes d’âge et contextes sociaux, pourrait être intégré au modèle en utilisant des compartiments stratifiés, bien que cela se fasse au prix d’une complexité accrue dans l’estimation des paramètresNote de bas de page 9 . D’autres niveaux d’hétérogénéité, par exemple l’hétérogénéité spatiale ou les aggrégats de transmission, nécessiteraient des approches de modélisation plus complexes. Une autre limite est que nous avons adapté le modèle aux cas confirmés en laboratoire. Même s’ils ont l’avantage d’être largement accessibles et opportuns, ces ensembles de données pourraient être biaisés par plusieurs facteurs, notamment les variations dans les tests quotidiens ou dans les protocoles de dépistage.
Conclusion
Nous avons déterminé les conditions dans lesquelles une nouvelle vague (la troisième vague) aurait pu être évitée en Ontario, compte tenu du pire des cas où le variant B.1.1.7 plus transmissible est devenu dominant. Notre analyse indique que des niveaux élevés d’isolement des cas et de quarantaine auraient été nécessaires pour maintenir le contrôle afin d’assurer une réouverture partielle sécuritaire. Bien que cette étude ait porté sur la prévention de la troisième vague en Ontario, l’approche présentée ici peut être adaptée à d’autres régions géographiques et à d’autres circonstances. Plusieurs hypothèses formulées dans le modèle mathématique peuvent être assouplies pour une évaluation potentiellement plus précise. L’analyse du taux de reproduction de contrôle RC, éclairée par l’ajustement du modèle et les nouvelles données probantes, peut être utilisée pour déterminer les estimations des conditions en fonction des mesures du système de santé publique et des niveaux d’activité de la population nécessaires pour la contrôlabilité. Dans cette optique, les résultats obtenus en utilisant cette approche pourraient être utiles aux décideurs qui se posent des questions sur la réouverture étant donné l’émergence de variants supplémentaires du virus SRAS-CoV-2 avec une transmissibilité accrue.
Déclaration des auteurs
- J. W. et N. H. O. — Conception de l’idée originale
- Z. M. C. et Y. X. — Ajustement du modèle effectué
- Z. M. C. et F. S. — Organisation de l’analyse et de la visualisation mathématiques
Tous les auteurs ont discuté des résultats et ont contribué à l’article final.
Intérêts concurrents
Aucun.
Financement
Cette recherche de Z. M. C., F. S. et J. W. a été financée par le programme de recherche rapide contre la maladie à coronavirus 2019 (COVID-19) des Instituts de recherche en santé du Canada (IRSC). J. W. est membre de la Ontario COVID-19 Modelling Consensus Table, parrainée par le ministère de la Santé de l’Ontario, Santé Ontario et Santé publique Ontario.
Références
- Référence 1
-
Ogden NH, Fazil A, Arino J, Berthiaume P, Fisman DN, Greer AL, Ludwig A, Ng V, Tuite AR, Turgeon P, Waddell LA, Wu J. Scénarios de modélisation de l'épidémie de COVID-19 au Canada. Relevé des maladies transmissibles au Canada 2020;46(6):225-31. https://doi.org/10.14745/ccdr.v46i06a08f
- Référence 2
-
Ng V, Fazil A, Waddell LA, Bancej C, Turgeon P, Otten A, Atchessi N, Ogden NH. Projected effects of nonpharmaceutical public health interventions to prevent resurgence of SARS-CoV-2 transmission in Canada. CMAJ 2020;192(37):E1053-64. https://doi.org/10.1503/cmaj.200990
- Référence 3
-
Ludwig A, Berthiaume P, Orpana H, Nadeau C, Diasparra M, Barnes J, Hennessy D, Otten A,Ogden N. Évaluation de l'impact de divers niveaux de détection des cas et de recherche des contacts sur la transmission de la COVID-19 au Canada pendant la levée des fermetures imposées à l'aide d'un modèle à compartiments dynamique. Relevé des maladies transmissibles au Canada 2020;46(11/12):461-74. https://doi.org/10.14745/ccdr.v46i1112a08f
- Référence 4
-
Tang B, Scarabel F, Bragazzi NL, McCarthy Z, Glazer M, Xiao Y, Heffernan JM, Asgary A, Ogden NH, Wu J. De-Escalation by Reversing the Escalation with a Stronger Synergistic Package of Contact Tracing, Quarantine, Isolation and Personal Protection: Feasibility of Preventing a COVID-19 Rebound in Ontario, Canada, as a Case Study. Biology (Basel) 2020;9(5):100. https://doi.org/10.3390/biology9050100
- Référence 5
-
Tuite AR, Fisman DN, Greer AL. Mathematical modelling of COVID-19 transmission and mitigation strategies in the population of Ontario, Canada. CMAJ 2020;192(19):E497-505. https://doi.org/10.1503/cmaj.200476
- Référence 6
-
Volz E, Mishra S, Chand M, Barrett JC, Johnson R, Geidelberg L, Hinsley WR, Laydon DJ, Dabrera G, O'Toole A, Amato R, Ragonnet-Cronin M, Harrison I, Jackson B, Ariani C, Boyd O, Loman NJ, McCrone JT, Goncalves S, Jorgensen D, Myers R, Hill V, Jackson DK, Gaythorpe K, Groves N, Sillitoe J, Kwiatkowski DP; The COVID-19 Genomics UK (COG-UK) Consortium. Flaxman S, Ratmann O, Bhatt S, Hopkins S, Gandy A, Rambaut A, Ferguson NM. Transmission of SARS-CoV-2 Lineage B. 1.1. 7 in England: Insights from linking epidemiological and genetic data. Virological.org 2020. https://virological.org/t/transmission-of-sars-cov-2-lineage-b-1-1-7-in-england-insights-from-linking-epidemiological-and-genetic-data/576
- Référence 7
-
Davies NG, Abbott S, Barnard RC, Jarvis CI, Kucharski AJ, Munday J, Pearson CAB, Russel TW, Tully DC, Abbott S, Gimma a, Waites W, Wong KLM, van Zandvoort, CMMID COVID-19 Working Group, Eggo RM, funk S, Jit M, Atkins KE, Edmunds WJ. Estimated transmissibility and severity of novel SARS-CoV-2 Variant of Concern 202012/01 in England. medRxiv 2020.12.24.20248822. https://doi.org/10.1101/2020.12.24.20248822
- Référence 8
-
Wu J, Tang B, Xiao Y, Tang S, Ahmad A, Orbinski J. Swift mitigations and tipping point cascade effects: Rethinking COVID-19 control and prevention measures to prevent and limit future outbreaks. Health Management Policy and Innovation. 2020;5(1), Special issue on COVID-19. https://hmpi.org/2020/12/17/swift-mitigations-and-tipping-point-cascade-effects-rethinking-covid-19-control-and-prevention-measures-to-prevent-and-limit-future-outbreaks-york-xian-jiaotong-shaanxi-normal-12-7/?pdf=2987
- Référence 9
-
McCarthy Z, Xiao Y, Scarabel F, Tang B, Bragazzi NL, Nah K, Heffernan JM, Asgary A, Murty VK, Ogden NH, Wu J. Quantifying the shift in social contact patterns in response to non-pharmaceutical interventions. J Math Ind 2020;10(1):28. https://doi.org/10.1186/s13362-020-00096-y
Appendice : Détails du modèle dynamique de transmission
Contexte
Un modèle dynamique de transmission est un élément central de l’intervention utilisée pour quantifier les conditions auxquelles les interventions combinées en santé publique doivent répondre pour rouvrir l’économie sans une éclosion importante. Des détails sont fournis sur l’application du modèle dynamique de transmission établi dans l’étude précédenteNote de bas de page 10 à la présente étude, qui a permis de calculer le taux de reproduction de contrôle RC sous les scénarios présentés dans le texte principal (figure 2 et figure 3 dans le texte principal). L’étape clé pour l’utilisation du modèle établi dans l’analyse du RC est l’établissement des paramètres du modèle (i.e. l’estimation des paramètres du modèle à l’aide des données sur l’incidence propres à l’Ontario jusqu’au 23 décembre 2020). Dans cette appendice, nous présentons les méthodes complètes utilisées pour l’établissement des paramètres du modèle et les résultats détaillés de l’ajustement du modèle. Cet établissement des paramètres de modèle a permis d’estimer les améliorations nécessaires aux interventions en santé publique en termes de recherche de contacts et de quarantaine, et de détection et d’isolement pour une réouverture malgré la circulation de variants préoccupants.
Modèle de transmission
On utilise ici le modèle dynamique de la transmission établi dans une étude antérieure Note de bas de page 10 , lequel saisit les caractéristiques essentielles de l’épidémie et les principales interventions en santé publique, notamment la recherche de contacts, la mise en quarantaine, les tests et l’isolement. Les variables du modèle, les paramètres clés et leur description sont présentés dans le texte principal de l’article. De plus, il convient de noter que les personnes mises en quarantaine peuvent s’inscrire dans la catégorie Eq ou Sq, selon que la transmission a eu lieu (avec probabilité de transmission par contact β), tandis que l’autre proportion, 1-q comprend les personnes exposées au virus qui ne sont pas retracées lors de la recherche de contacts et qui, par conséquent, s’inscrivent dans la catégorie des personnes exposées et infectées, mais non mises en quarantaine (E) s’il y a eu une transmission, ou restent dans la catégorie S autrement.
Les équations du modèle mathématique et les détails des paramètres sont présentés dans l’appendice. Le modèle dynamique de transmission a été formulé en fonction de différentes équations ordinaires :
S’ = -(βc+cq(1-β))S(I+θA)/N + λ Sq,
E’ = βc(1-q)S(I+θA)/N - σE,
I’ = σρE – (δI + α + γI)I,
A’ = σ(1 - ρ)E - γAA,
Sq’ = (1-β)cqS(I+θA)/N- λSq,
Eq'=βcqS(I+θA)/N-δqEq,
D’ = δII + δq Eq – (α + γD)D,
R’ = γII + γAA + γDD
Le symbole principal (‘) indique le dérivé par rapport au temps. La liste complète des paramètres du modèle et leurs descriptions figurent au tableau 1.
| Paramètre | Définitions | Moyenne | Écart-type | Source | |
|---|---|---|---|---|---|
| c (t) | c0 | Taux de contact avant le 14 mars 2020 | 12,17 | 0,6172 | Estimation |
| c1 | Taux de contact entre le 14 et le 18 mars 2020 | 8,65 | 0,2696 | Estimation | |
| c2 | Taux de contact constant le 24 mars 2020 | 6,64 | 0,1922 | Estimation | |
| r1 | Diminution exponentielle du taux de contact entre le 24 mars et le 16 mai 2020 | 0,1936 | 0,1086 | Estimation | |
| cb | Taux de contact minimal après le 24 mars 2020 | 2,66 | 0,3314 | Estimation | |
| c3 | Taux de contact entre le 16 mai et le 12 juin 2020 | 4,72 | 0,2224 | Estimation | |
| c4 | Taux de contact entre le 12 juin et le 17 juillet 2020 | 5,77 | 0,4068 | Estimation | |
| cm | Taux de contact maximal entre le 17 juillet et le 10 octobre 2020 | 8,36 | 0,2605 | Estimation | |
| r3 | Augmentation exponentielle du taux de contact entre le 17 juillet et le 10 octobre 2020 | 0,3117 | 0,0032 | Estimation | |
| c5 | Taux de contact entre le 10 octobre et le 23 novembre 2020 | 7,14 | 0,1299 | Estimation | |
| c6 | Taux de contact entre le 23 novembre et le 23 décembre 2020 | 6,78 | 0,1746 | Estimation | |
| β1 | Probabilité de transmission par contact avant le 16 mai 2020 | 0,1446 | 0,0051 | Estimation | |
| β2 | Probabilité de transmission par contact après le 16 mai 2020 | 0,1073 | 0,0076 | Estimation | |
| q0 | Fraction des personnes exposées en quarantaine avant le 24 mars 2020 | 0,0775 | 0,0177 | Estimation | |
| q (t) | r2 | Augmentation exponentielle de la fraction de quarantaine | 0,0835 | 0,0314 | Estimation |
| qb | Fraction de quarantaine maximale avant le 8 octobre 2020 | 0,3949 | 0,0334 | Estimation | |
| q1 | Fraction de quarantaine entre le 8 octobre et le 22 octobre 2020 | 0,3156 | 0,0368 | Estimation | |
| σ | Taux de transition des personnes exposées vers la catégorie des personnes infectées | 1/5 | 0 | Note de bas de page 11 | |
| λ | Taux auquel les contacts non infectés en quarantaine ont retournés dans la collectivité en général | 1/14 | 0 | Note de bas de page 12 | |
| ρ | Probabilité d'apparition de symptômes chez les personnes infectées | 0,7240 | 0,0278 | Estimation | |
| δI | Taux de transition des personnes infectées symptomatiques vers la catégorie des personnes infectées en quarantaine | 0,1378 | 0,0133 | Estimation | |
| δI1 | Taux de transition des personnes infectées symptomatiques vers la catégorie des personnes infectées en quarantaine entre le 8 octobre et le 22 octobre 2020 | 0,1392 | 0,0100 | Estimation | |
| δq | Taux de transition des personnes exposées en quarantaine vers la catégorie des personnes infectées en quarantaine | 0,1217 | 0,0301 | Estimation | |
| γI | Taux de rétablissement des personnes infectieuses symptomatiques | 0,1627 | 0,0164 | Estimation | |
| γA | Taux de rétablissement des personnes infectieuses asymptomatiques | 0,139 | 0 | Note de bas de page 12 | |
| γD | Taux de rétablissement des personnes diagnostiquées en quarantaine | 0,2 | 0 | Note de bas de page 13 | |
| α | Taux de mortalité attribuable à la maladie | 0,008 | 0 | Note de bas de page 13 | |
| θ | Facteur de modification de l'infection asymptomatique | 0,0342 | 0,0068 | Estimation | |
Nous avons obtenu le taux de reproduction de contrôle RC du modèle de transmission ci-dessus en utilisant la méthode de la prochaine générationNote de bas de page 15. Dans l’analyse du taux de reproduction de contrôle RC dans cette étude, nous n’avons pas tenu compte de la diminution de la population vulnérable due à l’immunité ou à la vaccination induite par l’infection et avons supposé que S (t)/N (t) = 1. Le taux de reproduction de contrôle qui en résulte est :
RC =βρc (1-q)/(δI + α + γI) + βc θ(1-ρ)(1- q)/γA
Pour ensuite estimer les paramètres du modèle du 26 février 2020 au 23 décembre 2020, nous avons utilisé le processus suivant. Nous avons d’abord considéré les paramètres θ, λ, σ, ρ, γA, γI, δq, γD, α comme constants dans le temps. Par ailleurs, nous avons considéré que plusieurs paramètres du modèle dépendaient du temps en fonction de la chronologie des événements clés, des mises en œuvre des interventions et des assouplissements en Ontario (décrits en détail dans le texte principal de l’article), soit le taux de contact c, la proportion de quarantaine q, la probabilité de transmission par contact β et le taux de détection des symptômes δI.
Nous avons permis que le taux de contact c change selon l’échéancier des interventions en santé publique mises en œuvre dans la province. Plus précisément, nous avons supposé la forme fragmentaire suivante pour le taux de contact :
| c (t) = |
|---|
| c0, Tinitial < t < T0, (26 février – 14 mars), |
| c1, T0 < t < T1, (14 mars – 18 mars), |
| c2, T1 < t < Ts, (18 mars – 24 mars), |
| (c2-cb)exp(-r2 (t-Ts))+cb, Ts < t <T2, (24 mars – 16 mai), |
| c3, T2 < t <T3, (16 mai – 12 juin), |
| c4, T3< t <T4, (12 juin – 17 juillet), |
| (c4-cm) exp (-r3 (t-T4))+cm, T4 < t <T5, (17 juillet – 10 octobre), |
| c5, T5 < t <T6, (10 octobre – 23 novembre), |
| c6, T6< t <Tf, (23 novembre – 23 décembre). |
Tinitial, T0, T1, Ts, T2, T3, T4, T5, T6, Tf correspondent à des momenTs correspondant aux dates suivantes : 26 février 2020, 14 mars 2020, 18 mars 2020, 24 mars 2020, 16 mai 2020, 12 juin 2020, 17 juillet 2020, 10 octobre 2020, 23 novembre 2020 et 23 décembre 2020, respectivement. Ces dates correspondent aux dates clés détaillées dans le texte principal de l'article. Une fonction exponentielle a été utilisée pour saisir l'adaptation graduelle de la société à des mesures de contrôle plus strictes ou plus souples pendant la fermeture du lieu de travail non essentiel et la phase 3 de la réouverture.
Pour estimer l'évolution potentielle du risque de transmission par contact dans le temps, nous avons modélisé la probabilité de transmission par contact β en utilisant la fonction constante fragmentaire suivante :
| β (t) = |
|---|
| β1 , Tinitial < t < T16mai, (26 février – 16 mai), |
| β2, T16mai < t < Tf, (16 mai – 23 décembre), |
où T16mai correspond à la date du 16 mai 2020 qui a marqué la première date d’assouplissement des restrictions en Ontario.
Nous avons également permis la modification du taux de détection des symptômes entre le 8 octobre 2020 et le 22 octobre 2020 afin de saisir les variations dans les tests, la recherche des contacts et la détection des cas pendant cette période. Nous avons modélisé le taux de détection des symptômes δI comme une constante fragmentaire avec la forme :
| δI (t) = |
|---|
| δI, Tinitial < t < T8oct, (26 février – 8 octobre), |
| δI1, T8oct < t < T22oct, (8 octobre – 22 octobre), |
| δI, T22oct < t < Tf, (22 octobre – 23 décembre), |
où les dates Tinitial, Tf sont définies ci-dessus et T8oct, T22oct correspondent aux dates du 8 octobre 2020 et du 22 octobre 2020, respectivement.
Enfin, la proportion des personnes en quarantaine a également été modélisée en fonction du temps. Nous saisissons ici l’escalade des efforts de recherche de contacts du système de santé publique après la fermeture des lieux de travail non essentiels le 24 mars 2020, avec une augmentation exponentielle modélisée de q. Comme pour le taux de détection, nous avons également tenu compte de la variation de la proportion de quarantaine q entre les dates du 8 octobre 2020 et du 22 octobre 2020. La proportion de quarantaine a été modélisée comme suit :
| q (t) = |
|---|
| q0, Tinitial < t < T8oct, (26 février – 24 mars), |
| (q0 - qb) exp (-r2 (t-Ts)) +qb, Ts < t < T8oct, (24 mars – 8 octobre), |
| q1, T8oct < t < T22oct, (8 octobre – 22 octobre), |
| qb, T22oct < t < Tf, (22 octobre – 23 décembre), |
Une fois que le modèle et ses paramètres ont été associés à une formule appropriée qui nous a permis de saisir les éléments clés dans le parcours de l’Ontario, nous avons incorporé les données sur la maladie à coronavirus 2019 (COVID-19) couplées à une procédure d’ajustement du modèle pour quantifier les valeurs des paramètres du modèle.
Données
Pour paramétrer le modèle de transmission, nous avons utilisé les cas positifs confirmés de COVID-19 en Ontario et les données démographiques sur la population de l’Ontario. La série chronologique des cas cumulatifs de COVID-19 en Ontario a été générée à l’aide de données répertoriées par ligne individuelle du ministère de la Santé de l’Ontario, qui ont été mises à notre disposition par l’entremise de la Ontario COVID-19 Modeling Consensus Table. Ensuite, les données démographiques propres à l’Ontario en ce qui concerne la taille de la population étaient accessibles au public par Statistique CanadaNote de bas de page 15 . Ce sont les principales sources de données qui ont permis l’ajustement du modèle mathématique et les analyses subséquentes.
Ajustement du modèle
Pour estimer les paramètres du modèle, nous avons adapté le modèle de transmission à l’incidence cumulative des cas confirmés de COVID-19 en Ontario. La technique d’ajustement utilisée a été décrite dans l’étude précédenteNote de bas de page 10 et est résumée de la façon suivante : nous avons informé le modèle au moyen de paramètres estimés α, γA d’études existantes (tableau 1), des données nécessaires sur la taille de la population de Statistique CanadaNote de bas de page 15 et des conditions initiales (tableau 2). Nous développons ensuite le modèle de t = Tinitial à Tf (26 février 2020 au 23 décembre 2020) et nous avons déterminé les paramètres qui ont réduit l’erreur carrée la plus faible par rapport à l’incidence cumulative. Les intervalles de confiance pour les paramètres ont été estimés au moyen d’une méthode d’amorce pour générer 1 000 séries chronologiques cumulatives sur l’incidenceNote de bas de page 10. On a supposé que les nouveaux cas signalés suivaient une distribution de Poisson, et le modèle a été adapté à chacune des 1 000 réalisations de la série chronologique observée. Ce processus a permis d’obtenir 1 000 ensembles de valeurs de paramètres pour q, γI, δI, δq, θ, c, β, ρ, et la moyenne et l’écart type estimés pour chacun d’eux sont indiqués dans le tableau 1. La source est rapportée pour les paramètres non ajustés α, γA .
| Valeurs initiales | Définitions | Moyenne | Écart-type | Source |
|---|---|---|---|---|
| S (0) | Population vulnérable initiale | 1,471 x 107 | 0 | DonnéesNote de bas de page 15 |
| E (0) | Population initiale exposée | 16,0081 | 4,9432 | Estimation |
| I (0) | Population infectieuse symptomatique initiale | 12,2829 | 3,7544 | Estimation |
| A (0) | Population infectieuse asymptomatique initiale | 14,2352 | 6,1958 | Estimation |
| Sq(0) | Population vulnérable initiale en quarantaine | 0 | 0 | Présumé |
| Eq(0) | Population exposée mise en quarantaine initiale | 0 | 0 | Présumé |
| D (0) | Population diagnostiquée en quarantaine initiale | 5 | 0 | Données sur l'incidence |
| ρ (0) | Population initiale rétablie | 0 | 0 | Présumé |
L’ajustement du modèle et l’incertitude quantifiée par rapport aux données sur les cas réels en Ontario sont illustrés à la l'appendice figure 1 en ce qui concerne les cas déclarés quotidiennement (en haut à droite) et les cas déclarés cumulatifs (en haut à gauche); le nombre estimé d’individus actifs infectieux symptomatiques I (t) (en bas à gauche) et le nombre estimé de personnes infectieuses asymptomatiques actives A (t) (en bas à droite) et leurs évolutions temporelles sont également illustrées. Les valeurs (y compris les IC à 95 %) et l’évolution dans le temps des paramètres clés β, δI, q, c sont indiquées à la figure 1 dans le texte principal.
Appendice figure 1 : Résultats de l’ajustement du modèle
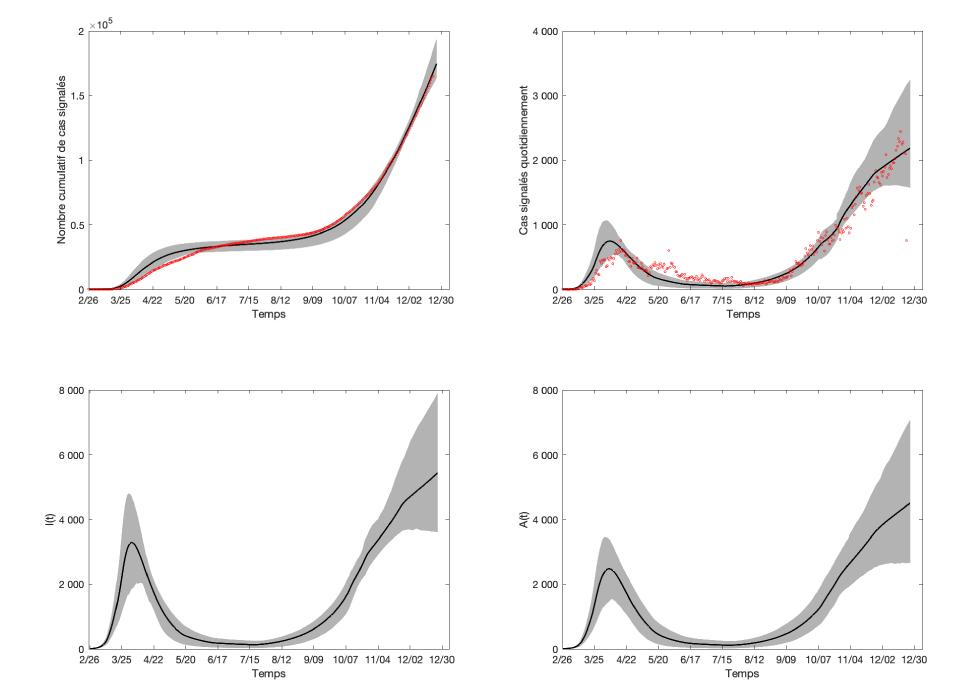
Description textuelle : Appendice figure 1
Le graphique en haut à gauche affiche l’ajustement du modèle par rapport aux cas de COVID-19 déclarés en Ontario, au Canada, en date du 23 décembre 2020. Les points rouges représentent les cas signalés cumulatifs observés, tandis que la ligne noire indique la moyenne des passages du modèle 1 000 et la région en gris représentant l’intervalle de confiance (IC) à 95 %. Le graphique supérieur droit montre que le modèle correspond aux cas signalés quotidiennement en Ontario en date du 23 décembre 2020. Les points rouges représentent le nombre quotidien de cas déclarés dans la province. Le graphique inférieur gauche montre le nombre estimé d’individus symptomatiques infectieux produits par le modèle ajusté et l’IC à 95 %. Le graphique inférieur droit affiche le nombre estimé de personnes infectieuses asymptomatiques actives en Ontario produites par le modèle ajusté, ainsi que l’IC correspondant de 95 %.
Application
Nous avons estimé les paramètres du modèle de transmission en date du 23 décembre 2020, qui ont entièrement éclairé le taux de reproduction de contrôle RC. Pour intégrer les effets des variants préoccupants dans l’analyse de RC, nous avons intégré les estimations existantes de l’augmentation de la transmissibilité du variant B.1.1.7 identifiée pour la première fois au Royaume-Uni Note de bas de page 16Note de bas de page 17 et augmenté les valeurs β estimées de 40 %, comme indiqué dans le texte principal. Nous avons ensuite évalué le RC sous différents scénarios correspondant à la proportion d’individus symptomatiques qui sont testés, dont le résultat est confirmé et qui sont isolés pendant leur période infectieuse δI / (δI + α + γI ), la proportion de contacts tracés et mis en quarantaine (q), la probabilité de transmission par contact (β) et le taux de contact (c) en modifiant les paramètres δI, q, β, c en conséquence. Les principaux résultats de l’étude en termes de conditions sur les mesures de santé publique renforcées (figure 2 et figure 3 dans le texte principal) nécessaires pour maintenir un RC < 1 ont été générés en considérant effectivement le RC comme une fonction de β, δI, c, q. Ainsi, il a été possible d’identifier les niveaux nécessaires de contrôles (renforcés) pour prévenir une vague de variants préoccupants tout en atteignant les taux de contact qui ont été estimés lors de différentes phases d’interventions de santé publique en Ontario.
Références
- Référence 10
-
Tang B, Scarabel F, Bragazzi NL, McCarthy Z, Glazer M, Xiao Y, Heffernan JM, Asgary A, Ogden NH, Wu J. De-Escalation by Reversing the Escalation with a Stronger Synergistic Package of Contact Tracing, Quarantine, Isolation and Personal Protection: Feasibility of Preventing a COVID-19 Rebound in Ontario, Canada, as a Case Study. Biology (Basel) 2020;9(5):100. https://doi.org/10.3390/biology9050100
- Référence 11
-
Special Expert Group for Control of the Epidemic of Novel Coronavirus Pneumonia of the Chinese Preventive Medicine Association. [An update on the epidemiological characteristics of novel coronavirus pneumonia (COVID-19)]. Zhonghua Liu Xing Bing Xue Za Zhi 2020;41(2):139–44. https://doi.or.g/10.3760/cma.j.issn.0254-6450.2020.02.002
- Référence 12
-
Tang B, Wang X, Li Q, Bragazzi NL, Tang S, Xiao Y, Wu J. Estimation of the transmission risk of the 2019-nCoV and its implication for public health interventions. J Clin Med 2020;9(2):462. https://doi.org/10.3390/jcm9020462
- Référence 13
-
Tang B, Xia F, Tang S, Bragazzi NL, Li Q, Sun X, Liang J, Xiao Y, Wu J. The effectiveness of quarantine and isolation determine the trend of the COVID-19 epidemics in the final phase of the current outbreak in China. Int J Infect Dis 2020;95:288–93. https://doi.org/10.1016/j.ijid.2020.03.018
- Référence 14
-
van den Driessche P. Reproduction numbers of infectious disease models. Infect Dis Model 2017;2(3):288–303. https://doi.org/10.1016/j.idm.2017.06.002
- Référence 15
-
Statistiques Canada. Tableau 17-10-0009-01 Estimations de la population, trimestrielles. 2020. https://www150.statcan.gc.ca/t1/tbl1/fr/tv.action?pid=1710000901&request_locale=fr
- Référence 16
-
Volz E, Mishra S, Chand M, Barrett JC, Johnson R, Geidelberg L, Hinsley WR, Laydon DJ, Dabrera G, O’Toole A, Amato R, Ragonnet-Cronin M, Harrison I, Jackson B, Ariani C, Boyd O, Loman NJ, McCrone JT, Goncalves S, Jorgensen D, Myers R, Hill V, Jackson DK, Gaythorpe K, Groves N, Sillitoe J, Kwiatkowski DP; The COVID-19 Genomics UK (COG-UK) Consortium. Flaxman S, Ratmann O, Bhatt S, Hopkins S, Gandy A, Rambaut A, Ferguson NM. Transmission of SARS-CoV-2 Lineage B. 1.1. 7 in England: Insights from linking epidemiological and genetic data. Virological.org 2020. https://virological.org/t/transmission-of-sars-cov-2-lineage-b-1-1-7-in-england-insights-from-linking-epidemiological-and-genetic-data/576
- Référence 17
-
Davies NG, Abbott S, Barnard RC, Jarvis CI, Kucharski AJ, Munday J, Pearson CAB, Russel TW, Tully DC, Abbott S, Gimma A, Waites W, Wong KLM, van Zandvoort, CMMID COVID-19 Working Group, Eggo RM, funk S, Jit M, Atkins KE, Edmunds WJ. Estimated transmissibility and severity of novel SARS-CoV-2 Variant of Concern 202012/01 in England. medRxiv 2020.12.24.20248822. https://doi.org/10.1101/2020.12.24.20248822

Cette œuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution 4.0 International