Caractéristiques et issues des personnes traitées avec le nirmatrelvir/ritonavir au Canada

 Téléchargez cet article en format PDF
Téléchargez cet article en format PDFPublié par : L'Agence de la santé publique du Canada
Numéro : RMTC : Volume 49-10, octobre 2023 : Grippe et autres infections respiratoires
Date de publication : octobre 2023
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 49-10, octobre 2023 : Grippe et autres infections respiratoires
Étude épidémiologique
Caractéristiques et issues cliniques des personnes traitées avec le nirmatrelvir/ritonavir (PaxlovidMC) au Canada, 2022 : une étude de cohorte descriptive
Nadine Sicard1, Susan Squires2, Muhammad Mullah3, Peter Daley4
Affiliations
1 Agence de la santé publique du Canada, Direction générale des programmes des maladies infectieuses, Montréal, QC
2 Agence de la santé publique du Canada, Direction générale des programmes des maladies infectieuses, Ottawa, ON
3 Agence de la santé publique du Canada, Centre de lutte contre les maladies transmissibles et les infections, Ottawa, ON
4 Université Memorial de Terre-Neuve, Faculté de médecine, Division des maladies infectieuses, St. John's, NL
Correspondance
Citation proposée
Sicard N, Squires SG, Mullah MAS, Daley P. Caractéristiques et issues cliniques des personnes traitées avec le nirmatrelvir/ritonavir (PaxlovidMC) au Canada, 2022 : une étude de cohorte descriptive. Relevé des maladies transmissibles au Canada 2023;49(10):484–90. https://doi.org/10.14745/ccdr.v49i10a05f
Mots-clés : nirmatrelvir/ritonavir, Paxlovid, traitement antiviral, COVID-19, bases de données sur la santé, données provinciales agrégées
Résumé
Contexte : Le nirmatrelvir/ritonavir (N/R) (PaxlovidMC) a été autorisé au Canada en janvier 2022. Il s'agissait du premier traitement antiviral oral contre la maladie à coronavirus 2019 (COVID-19) qui a été déployé à grande échelle au Canada. Le N/R étant une nouvelle option thérapeutique visant à réduire la gravité des effets sur les populations à haut risque, son introduction a suscité des questions cliniques et de mise en œuvre, notamment concernant son utilisation et son impact dans le monde réel. L'objectif de cette étude d'observation rétrospective était de décrire les caractéristiques et les issues cliniques des personnes traitées par le N/R au cours des premiers mois la disponibilité dudit traitement au Canada, pendant la vague Omicron.
Méthodes : Des données provinciales agrégées ont été regroupées pour l'analyse. En outre, des statistiques descriptives ont été employées pour étudier les caractéristiques et les issues cliniques des personnes traitées. Le test du khi-carré de Pearson et le rapport de cotes non ajusté, ainsi que des intervalles de confiance à 95 % ont été utilisés pour déterminer les facteurs de risques d'issues cliniques sérieuses. Les données ont été recueillies principalement entre janvier et septembre 2022.
Résultats : Soixante-seize pour cent des personnes traitées avec le N/R étaient âgées de 60 ans et plus, 56 % étant des femmes. 84 % des patients traités avaient reçu au moins trois doses de vaccin contre la COVID-19 et 67 % présentaient des comorbidités. Les issues cliniques sérieuses au 30e jour, toutes causes confondues, étaient rares : 0,4 % ont été déclarés décédés; 0,1 % ont été admis dans une unité de soins intensifs et 2,0 % ont été hospitalisés après l'administration de N/R. Les facteurs de risque statistiquement associés aux issues cliniques sérieuses étaient l'immunosuppression, les comorbidités, l'âge égal ou supérieur à 60 ans et le fait d'être non vacciné.
Conclusion : Au cours des premiers mois de son autorisation au Canada, le N/R a été principalement administré chez des personnes vaccinées âgées de 60 ans et plus et présentant une ou plusieurs comorbidités. Les issues cliniques sérieuses chez les personnes traitées avec le N/R étaient rares et principalement rapportées chez les personnes présentant des facteurs de risque.
Introduction
Le 17 janvier 2022, le nirmatrelvir/ritonavir (N/R ou PaxlovidMC) a été le premier traitement antiviral oral autorisé par Santé Canada Note de bas de page 1 contre la maladie à coronavirus 2019 (COVID-19) pour les adultes présentant des symptômes légers à modérés, des résultats positifs au test de coronavirus 2 du syndrome respiratoire aigu sévère et un risque élevé de progression vers une forme grave de la COVID-19, à savoir l'hospitalisation ou le décès. L'approbation réglementaire a été appuyée par les résultats provisoires de l'essai contrôlé randomisé de phase 2/3 effectué par le fabricant, qui a évalué l'efficacité et l'innocuité du N/R chez les adultes non vaccinés à risque élevé avant l'apparition du variant préoccupant Omicron. Les participants de cette étude étaient admissibles s'ils présentaient au moins une caractéristique ou condition coexistante associée à un risque élevé de progression vers une forme grave de la COVID-19 (comme l'âge supérieur ou égal à 65 ans, le tabagisme, le diabète, l'hypertension, l'immunosuppression, les maladies cardiovasculaires, pulmonaires ou rénales, etc.) Les résultats de cette étude ont démontré une réduction de 89 % des issues cliniques combinées d'hospitalisations liées à la COVID-19 ou de décès toutes causes confondues, soit de 6,4 % à 0,78 % (intervalle de confiance à 95 % [IC] : −7,21 % à −4,03 %) au cours d'un suivi de 28 jours lorsque le traitement est administré dans les cinq jours suivant l'apparition des symptômes, et ce comparativement au placebo. Dans les analyses de sous-groupes, cette même étude rapporte que la réduction du nombre d'hospitalisations liées à la COVID-19 ou de décès toutes causes confondues était moins importante chez les patients de moins de 65 ans (−4,35, IC à 95 % : −5,91 à −2,79) comparativement aux patients âgés de 65 ans et plus (−13,93, IC à 95 % : −20,07 à −7,80) ou chez les patients présentant au plus une comorbidité (−4,76, IC à 95 % : −6,36 à −3,16) comparativement à ceux ayant 2 à 3 comorbidités (−8,96, IC à 95 % : −13,59 à −4,32) Note de bas de page 2.
La nature changeante de la pandémie de COVID-19 a soulevé des questions quant à l'applicabilité des résultats de cette étude aux patients vaccinés et aux nouveaux variants (e.g. Omicron). De plus, les considérations relatives à l'innocuité du N/R incluaient les interactions médicamenteuses avec plusieurs médicaments couramment utilisés pour le traitement des comorbidités pouvant être associées à un risque accru de complication de la COVID-19, ce qui pourrait potentiellement limiter l'utilisation du N/R dans certains groupes de patients.
Compte tenu du manque d'expérience concrète en matière de N/R dans le contexte canadien présentant des taux de vaccination très élevés et la circulation de nouveaux variants, l'évaluation de l'utilisation de N/R a été considérée comme une priorité par plusieurs intervenants. À ce titre, en collaboration avec des représentants des provinces, des territoires, de certains ministères fédéraux et d'experts cliniques, l'Agence de la santé publique du Canada (l'Agence) a élaboré un cadre d'évaluation, dont l'une des composantes visait à documenter les caractéristiques des patients traités par le N/R au Canada et leurs issues cliniques, qui sont présentés dans cette publication. Au moment du lancement de la présente étude, l'efficacité du N/R chez les patients vaccinés était inconnue.
L'Agence de la santé publique du Canada a assumé un rôle de leadership dans cette évaluation, en cohérence avec deux de ses mandats : répondre aux urgences en matière de santé publique et renforcer la collaboration intergouvernementale en santé publique et faciliter les approches nationales en matière de politiques et de planification en santé publique.
Les objectifs de cette évaluation étaient de décrire les caractéristiques et les issues cliniques obtenues au 30e jour chez des personnes ayant reçu le N/R au cours des premiers mois la disponibilité dudit traitement au Canada.
Méthodes
Un cadre d'évaluation a été élaboré en collaboration avec des experts cliniques et des représentants fédéraux et provinciaux au début du déploiement du N/R pour répondre à certaines questions concernant les caractéristiques (données démographiques et facteurs de risque) et les issues cliniques au 30e jour de personnes qui ont reçu le N/R à l'aide d'un devis de cohorte descriptive. Un devis d'étude descriptive a été utilisé étant donné la variabilité des renseignements disponibles dans les différentes administrations et la complexité de l'établissement d'un dénominateur commun qui aurait été nécessaire pour une étude de cohorte. Sept provinces et un ministère fédéral ont fourni des données agrégées pour cette évaluation, données représentant 74 % de la population canadienne.
Sources des données et variables
Un dictionnaire de données définissant les variables a été constitué et utilisé par les administrations participantes considérant les résultats d'une consultation. Les administrations peuvent avoir interprété la définition des variables selon les critères généralement utilisés dans leurs systèmes de données administratives sur les soins de santé. Les méthodes de collecte de données variaient d'une administration à l'autre, et dans plusieurs d'entre elles, les méthodes ont varié au fil du temps. Les administrations ont utilisé l'une des trois méthodes suivantes pour collecter des données sur les caractéristiques et les issues cliniques des personnes ayant reçu le N/R dans leur territoire : la collecte de données primaires généralement effectuée au moyen d'entrevues téléphoniques ou de questionnaires en ligne; la collecte de données secondaires à partir de bases de données ou d'extraction de dossiers préexistants; ou une combinaison des deux méthodes. La plupart des administrations ont exploité des bases de données sur la santé, notamment les systèmes d'information sur l'assurance-médicaments, le registre de vaccination et les raisons de sortie des hôpitaux, pour obtenir les données. Des questionnaires et des revues de dossiers ont parfois été utilisés pour obtenir des renseignements sur les issues cliniques lorsqu'ils n'étaient pas disponibles dans les systèmes d'information.
Les dates de collecte des données variaient d'une administration à l'autre en fonction de la disponibilité des renseignements, mais en règle générale, les données ont été recueillies entre janvier et septembre 2022. La disponibilité et l'évolution dans le temps des renseignements relatifs aux caractéristiques et aux issues cliniques des personnes traitées par le N/R variaient également selon les administrations et au sein d'une même administration, en raison des changements programmatiques en matière de N/R au fil du temps, y compris les critères d'admissibilité et l'accessibilité. Six administrations ont communiqué des données sur les caractéristiques et les issues cliniques, tandis que deux n'ont fourni que des données sur les caractéristiques. La durée de la période de collecte des données variait de 9 à 39 semaines, avec une période médiane de collecte des données de 19 semaines. Les administrations n'ont pas toutes été en mesure de fournir des données pour l'ensemble les variables (figure 1).
Figure 1 : Période de collecte de données en fonction de l'administration, évaluation des caractéristiques et des issues cliniques des personnes traitées avec le nirmatrelvir/ritonavir (PaxlovidMC), CanadaNote de bas de page a, 2022

Figure 1 - Équivalent textuel
Il s'agit d'un graphique à barres présentant la collecte de données par période pour chacune des huit administrations participantes. Sur l'axe des x (horizontal) sont indiquées les semaines de l'année 2022 pour lesquelles l'administration participante a fourni des données. Sur l'axe des y (vertical), les administrations sont identifiées par des lettres de A à H. L'administration A a fourni des données pour les semaines 4 à 30. L'administration B a fourni des données pour les semaines 8 à 20. L'administration C a fourni des données pour les semaines 13 à 34. L'administration D a fourni des données pour les semaines 5 à 20. L'administration E a fourni des données pour les semaines 30 à 38. L'administration F a fourni des données pour les semaines 3 à 19. L'administration G a fourni des données pour les semaines 1 à 38. L'administration H a fourni des données pour les semaines 1 à 36. Les administrations D et F n'ont déclaré que des données sur les variables représentant les caractéristiques. Toutes les autres administrations ont fourni des données sur les variables représentant les caractéristiques et sur les issues cliniques.
Les résultats ont été évalués au 30e jour suivant le premier jour du début du traitement par le N/R. Les issues cliniques graves, notamment l'hospitalisation, l'admission dans une unité de soins intensifs et le décès, ont été mesurées en prenant en compte toutes les causes. Les hospitalisations et les décès ont été choisis puisque l'un des objectifs de la réponse thérapeutique à la COVID-19 est de protéger la population et le système de santé en prévenant les hospitalisations et les décès. Les issues cliniques toutes causes confondues ont été utilisées en raison de la faisabilité limitée d'établir la cause d'une issue clinique spécifiquement à la COVID-19 dans les systèmes de données de la plupart des administrations participantes.
Les administrations participantes ont utilisé un tableau agrégé résumé pour présenter les résultats et les dates de collecte des données. Les tableaux résumés des administrations ont été soumis à l'Agence entre le 15 août 2022 et le 8 novembre 2022.
Analyses
Le personnel de l'Agence a compilé et analysé les résultats des tableaux récapitulatifs provenant des différentes administrations. Des statistiques descriptives ont été utilisées pour étudier les caractéristiques et les issues cliniques des personnes qui ont reçu le N/R. Afin de déterminer les facteurs de risque potentiels associés aux issues cliniques sérieuses (hospitalisations, admission dans une USI ou décès), le test du khi-carré de Pearson a été utilisé pour évaluer l'association entre chacune des variables catégoriques et les issues cliniques sérieuses. De plus, le rapport de cotes (RC) non ajusté et l'IC à 95 % ont été utilisés pour décrire le sens et la force de l'association entre les facteurs de risque et les issues cliniques sérieuses. Le RC représente la probabilité qu'un résultat se produise dans un groupe par rapport à la probabilité que ce résultat se produise dans un autre groupe. Il est à noter qu'en raison de l'absence de données individuelles non agrégées, nous n'avons pu calculer les RC ajustés. Il n'a pas été possible de comparer les données provenant des différentes administrations en raison des différents critères d'admissibilité et des éventuelles variations entre les sources de données ou les définitions des variables. Toutes les analyses statistiques ont été effectuées à l'aide du logiciel R (version 4.1.3).
Résultats
Caractéristiques des patients ayant reçu du nirmatrelvir/ritonavir au Canada
Les données sur le groupe d'âge et le sexe étaient disponibles pour 61 413 patients : 77 % des personnes traitées avec le N/R étaient âgés de 60 ans et plus, tandis que 61 % étaient âgés de 70 ans et plus (figure 2). Cinquante-six pourcentage des patients traités avec le N/R étaient des femmes.
Figure 2 : Répartition par âge des personnes ayant reçu le nirmatrelvir/ritonavir (PaxlovidMC), CanadaNote de bas de page a, 2022 (n = 61 413)

Figure 2 - Équivalent textuel
Il s'agit d'un graphique à barres représentant la répartition par âge des personnes ayant reçu le nirmatrelvir/ritonavir inclus dans l'analyse. De toutes les personnes ayant reçu le traitement, 0,05 % étaient âgés de 0 à 17 ans; 12,96 % avaient entre 18 et 49 ans; 10,12 % avaient entre 50 et 59 ans; 15,82 % avaient entre 60 et 69 ans; 32,36 % avaient entre 70 et 79 ans; 28,33 % étaient âgés de 80 ans ou plus. Les données étaient manquantes ou inconnues pour 0,36 % des personnes traitées.
Les données sur le statut vaccinal (figure 3) et le nombre de comorbidités (figure 4) étaient disponibles pour 59 452 personnes traitées avec le N/R réparties dans sept provinces et territoires : 84 % de celles-ci avaient reçu trois doses de vaccins contre la COVID-19 ou plus, alors que seulement 5 % étaient non vaccinés.
Figure 3 : Répartition du statut vaccinal des personnes ayant reçu le nirmatrelvir/ritonavir (PaxlovidMC), CanadaNote de bas de page a, 2022 (n = 59 452)

Figure 3 - Équivalent textuel
Il s'agit d'un graphique à barres présentant le statut vaccinal des personnes ayant reçu le nirmatrelvir/ritonavir. De celles-ci, 5,44 % étaient non vaccinées; 0,89 % ont reçu une série primaire incomplète; 9,65 % ont reçu une série primaire complète; 43,26 % ont reçu une série primaire et une dose de rappel et 40,54 % ont reçu une série primaire et au moins deux doses de rappel. Les données étaient manquantes ou inconnues pour 0,22 % des personnes traitées.
Figure 4 : Répartition du nombre de comorbidités chez les personnes ayant reçu le nirmatrelvir/ritonavir (PaxlovidMC), CanadaNote de bas de page a Note de bas de page b, 2022 (n = 59 452)
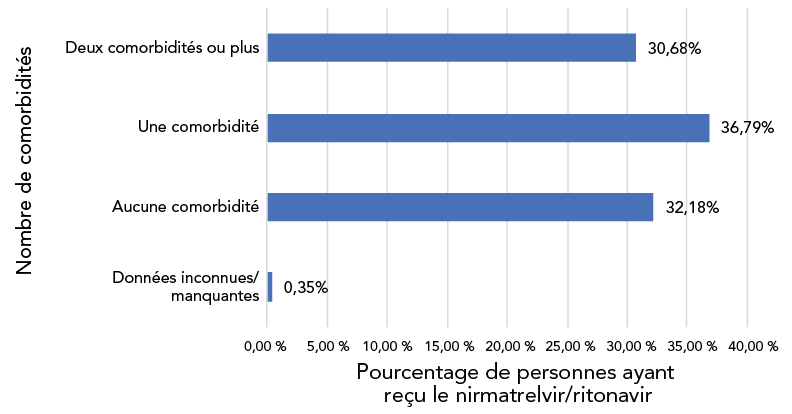
Figure 4 - Équivalent textuel
Il s'agit d'un graphique à barres présentant la répartition du nombre de comorbidités chez les personnes ayant reçu le nirmatrelvir/ritonavir dans le cadre de l'analyse. Parmi celles-ci, 32,18 % ne présentaient aucune comorbidité; 36,79 % avaient une comorbidité; 30,68 % présentaient deux comorbidités ou plus et les données étaient inconnues ou manquantes pour 0,35 %.
Soixante-sept pour cent des personnes traitées ont été identifiés comme présentant une ou plusieurs comorbidités, tandis que 5,8 % ont été déclarés immunodéprimés. Des données sur d'autres facteurs associés à l'administration de N/R étaient disponibles pour un sous-ensemble de patients. Quatre-vingt-quatorze pour cent (n = 13 752/14 638) des patients traités étaient symptomatiques avant le test de dépistage de la COVID, et 95,5 % (n = 11 582/12 129) ont reçu du N/R dans un délai de cinq jours après avoir reçu un test positif. Neuf pour cent (n = 1 689/19 196) des patients ont reçu des traitements additionnels contre la COVID-19 en plus du N/R.
Issues cliniques au 30e jour après le début du traitement avec le nirmatrelvir/ ritonavir
Parmi les 58 881 personnes traitées pour lesquelles des données sur les issues cliniques étaient disponibles, 97,5 % n'ont pas été hospitalisées pour quelque raison que ce soit au cours de la période de 30 jours suivant l'administration du N/R. Les issues cliniques sérieuses toutes causes confondues étaient rares, 0,4 % (n = 243) ont été déclarés décédés; 0,1 % (n = 67) ont été admis à l'USI et 2,0 % ont été hospitalisés dans les 30 premiers jours suivant l'administration du N/R (figure 5).
Figure 5 : Répartition des issues cliniques au 30e jour chez les personnes ayant reçu du nirmatrelvir/ritonavir (PaxlovidMC), CanadaNote de bas de page a, 2022 (n = 58 881)

Figure 5 - Équivalent textuel
Il s'agit d'un graphique à barres présentant la répartition des issues cliniques au 30e jour pour les personne sayant reçu du nirmatrelvir/ritonavir pendant la période d'étude. Parmi celles-ci 97,53 % n'ont pas été hospitalisées; 1,92 % ont été hospitalisées; 0,12 % ont été admises dans une unité de soins intensifs et 0,43 % sont décédées.
Le tableau 1 présente une comparaison des facteurs de risque entre les sujets présentant une issue clinique sérieuse (hospitalisés, admis dans une USI ou décès) et ceux qui n'en ont pas eu. Les facteurs de risque présentant une association statistiquement significative avec les issues cliniques sérieuses (p < 0,0001) comprennent l'immunodépression, le statut vaccinal, l'âge, le sexe et le nombre de comorbidités. Les probabilités/risques d'avoir une issue clinique sévère étaient significativement plus élevées chez les patients immunodéprimés (RC = 3,79, IC à 95 % : 3,28 à 4,37, comparativement aux patients non immunodéprimés), chez les patients non vaccinés ou partiellement vaccinés (RC = 1,91, IC à 95 % : 1,62 à 2,26, comparativement aux patients ayant complété la série primaire ou ayant complété la série primaire et reçu une ou plusieurs doses de rappel), chez les patients plus âgés (60 ans et plus) (RC = 1,64, IC à 95 % : 1,42 à 1,89, comparativement aux patients âgés de moins de 60 ans), chez les patients masculins (RC = 1,25, IC à 95 % : 1,12 à 1,39, comparativement aux sujets féminins) et chez les patients présentant une ou plusieurs comorbidités (RC = 1,97, IC à 95 % : 1,73 à 2,24, comparativement aux patients ne présentant aucune comorbidité).
| Facteur de risque | Pourcentage correspondant aux Issues cliniques sérieuses | Rapport de cotes (IC à 95 %) |
valeur pNote de bas de page b |
|---|---|---|---|
| État d'immunodépression | |||
| Immunodépression | 7,78 | 3,79 (3,28–4,37) | < 0,0001 |
| Non immunodéprimé | 2,18 | Référence | |
| Statut vaccinal | |||
| Non vaccinés/série primaire incomplète | 4,37 | 1,91 (1,62–2,26) | < 0,0001 |
| Série primaire/série primaire et une ou plusieurs doses de rappel | 2,33 | Référence | |
| Âge | |||
| 60 ans et plus | 2,69 | 1,64 (1,42–1,89) | < 0,0001 |
| 0 à 59 ans | 1,64 | Référence | |
| Sexe | |||
| Hommes | 2,73 | 1,25 (1,12–1,39) | < 0,0001 |
| Femmes | 2,20 | Référence | |
| Nombre de comorbidités | |||
| Une ou plusieurs | 2,92 | 1,97 (1,73–2,24) | < 0,0001 |
| Aucune | 1,50 | Référence | |
|
|||
Discussion
Au cours des premiers mois de la disponibilité du N/R au Canada, les résultats de cette cohorte descriptive ont montré que ce traitement était principalement utilisé chez les patients vaccinés (83,80 % avaient reçu trois doses ou plus) et chez les patients de plus de 60 ans (76,51 %); 30,68 % ont été déclarés atteints de deux comorbidités ou plus. Par contre, les participants de l'essai clinique randomisé de phase 2/3 qui a appuyé l'approbation réglementaire n'étaient pas vaccinés, avaient un âge médian de 46 ans et 61 % d'entre eux présentaient deux caractéristiques/conditions coexistantes ou plus qui les exposait à un risque élevé de progression vers une maladie grave Note de bas de page 2. Les définitions des conditions coexistantes et la méthodologie utilisée pour la collecte des données diffèrent dans les deux études, ce qui rend difficile la comparaison directe des caractéristiques des populations étudiées.
Cette étude a estimé que 2,5 % des patients traités par le N/R ont progressé vers des issues cliniques sérieuses toutes causes confondues (hospitalisation, admission à l'USI ou décès). On a également observé une mortalité toutes causes confondues de 0,4 % chez les patients traités avec le N/R. Ces taux d'issues cliniques sérieuses sont légèrement plus élevés que dans d'autres études publiées qui ont rapporté des taux d'issues cliniques sérieuses inférieures à 1 % Note de bas de page 1Note de bas de page 3Note de bas de page 4 ou des taux de mortalité inférieurs à 0,4 %Note de bas de page 4Note de bas de page 5Note de bas de page 6. De plus, une récente étude rétrospective de cohorte menée aux États-Unis a révélé un taux d'hospitalisation lié à la COVID-19 de 0,47 % et un taux de mortalité de 0,01 % chez les patients traités avec le N/R Note de bas de page 7, résultats qui étaient également inférieurs à ceux observés dans la présente étude. Une étude récente menée en Ontario a rapporté un risque de 2,1 % d'hospitalisation liée à la COVID-19 ou de décès au 30e jour chez les patients traités avec le N/R Note de bas de page 8.
Ces différences pourraient s'expliquer par la méthodologie utilisée dans notre évaluation : nous avons mesuré les résultats toutes causes confondues, tandis que d'autres études ont mesuré les résultats spécifiques à la COVID-19. En outre, les sujets ayant reçu du N/R au Canada étaient généralement plus âgés Note de bas de page 1Note de bas de page 5Note de bas de page 6 que les populations dans les autres études, ce qui pourrait expliquer les taux de gravité plus faibles rapportés dans ces études. De nombreuses études ont également suivi les patients pendant des périodes plus longues que la période de 30 jours observée dans la présente évaluation ou ont évalué les issues cliniques sérieuses spécifiques à la COVID-19, ce qui a rendu difficiles les comparaisons avec la présente évaluation. Par ailleurs, d'autres études ont utilisé des devis d'études cas-témoins avec diverses méthodes pour contrôler les biais, alors que la présente étude était une cohorte descriptive.
Dans la présente évaluation, les issues cliniques sérieuses étaient relativement rares et plus fréquentes chez les groupes de sujets suivants : les immunodéprimés, les non-vaccinés/partiellement vaccinés, les personnes ayant une ou plusieurs comorbidités, les personnes âgées de 60 ans ou plus et les hommes. Ces résultats sont cohérents avec d'autres données identifiant les personnes comme étant les plus à risque de connaitre des complications Note de bas de page 9 et qui, par conséquent, bénéficieraient le plus du N/R. Étant donné que cette évaluation n'incluait pas de groupe témoin, l'évaluation n'a pas été en mesure de déterminer si le N/R est efficace pour prévenir des taux plus élevés de complications.
Limites
Cette évaluation présente plusieurs limites. Les caractéristiques et les issues cliniques des personnes ayant reçu le N/R ont été évalués dans les administrations qui ont participé volontairement à la présente évaluation. Étant donné que seules des données agrégées ont été recueillies, il n'a pas été possible d'effectuer des sous-analyses ni d'évaluer les effets de confusion ou d'interaction entre les caractéristiques par rapport aux issues cliniques. Les données provenant de plusieurs administrations ont été regroupées pour former un ensemble de données nationales, bien qu'il y ait des variations dans la répartition des issues cliniques selon les caractéristiques des patients dans les différentes administrations. Nous n'avons pas pu tenir compte des différences entre les données fournies par chaque administration. Les périodes de collecte de données et les critères d'admissibilité variaient selon les administrations et le l'évolution dans le temps, ce qui peut avoir eu une incidence sur la description des caractéristiques. Par exemple, au début de la période où l'approvisionnement en N/R était limité et où les critères étaient plus stricts, les personnes ayant reçu le N/R étaient peut-être plus âgés et pouvaient présenter un risque plus élevé d'avoir des complications. La participation des administrations était volontaire. Bien que les administrations ayant participé représentaient un pourcentage important de la population canadienne (74 %), cette évaluation pourrait ne pas être entièrement représentative de tous les patients traités avec le N/R au Canada. Il est bien établi que la COVID-19 affecte de façon disproportionnée les populations racialisées et marginalisées Note de bas de page 10; toutefois, étant donné que les données sur l'origine ethnique n'étaient pas disponibles pour la présente évaluation, il n'a pas été possible d'évaluer l'effet de l'origine ethnique sur les issues cliniques des patients traités par le N/R. Enfin, les résultats de cette évaluation peuvent avoir sous-estimé la proportion de patients qui n'ont pas eu d'issues cliniques sérieuses, car il est possible que certains patients aient été inclus alors qu'ils n'avaient peut-être pas commencé ou pas terminé le traitement, mais qui ont été considérés comme des « personnes ayant reçu le N/R ».
Conclusion
Malgré les limites qu'ils présentent, ces résultats ont permis d'évaluer les caractéristiques des personnes ayant reçu le N/R au cours des premiers mois de sa disponibilité au Canada et ont fourni des renseignements sur le faible taux d'issues cliniques sérieuses chez les patients, vaccinés pour la plupart, ayant reçu le N/R à l'échelle nationale. En attendant des résultats d'essais cliniques sur plateforme adaptative ou d'autres études contrôlées randomisées sur l'efficacité réelle du N/R, qui nécessiteront plus de temps, cette évaluation a fourni aux administrations participantes des renseignements utiles pour éclairer la prise de décisions concernant les programmes et les politiques en matière de N/R. À mesure que d'autres traitements contre la COVID-19 seront mis au point et distribués, les mêmes questions que celles dont le N/R a fait l'objet peuvent être soulevées. Le modèle de collaboration utilisé dans le cadre de ce projet d'évaluation pourrait être exploité à l'avenir pour répondre à des questions similaires portant sur d'autres thérapies; cependant, il faudrait de préférence s'efforcer d'inclure un groupe de comparaison dans la méthodologie, ce qui permettrait d'ajuster les facteurs de confusion et d'évaluer l'efficacité.
Déclarations des auteurs
N. S. — Supervision, conceptualisation, méthodologie, interprétation des données, rédaction de l'ébauche originale, rédaction, révision et édition
S. S. — Gestion de projet, conceptualisation, méthodologie, interprétation, traitement des données, rédaction de l'ébauche originale, rédaction, révision et édition
M. M. — Analyse des données, méthodologie, organisation des données, analyse statistique, interprétation, rédaction de l'ébauche originale, rédaction, révision et édition
P. D. — Conceptualisation, méthodologie, rédaction de l'ébauche originale, rédaction, révision et édition
Intérêts concurrents
Aucun.
Remerciements
Nous tenons à remercier tous les représentants des provinces participantes et du ministère fédéral qui ont contribué à l'élaboration de la méthodologie d'évaluation et ont fourni des données agrégées pour l'analyse. Ce projet a été mené à bien grâce à leurs contributions et leur collaboration.
Financement
Ces travaux ont été soutenus par l'Agence de la santé publique du Canada (l'Agence). Aucun financement supplémentaire n'a été accordé à l'Agence pour mener cette évaluation; et aucun financement n'a été accordé par l'Agence aux administrations participantes. Tous les travaux d'évaluation ont été effectués à l'aide des ressources existantes.
Références
- Notes de bas de page 1
-
Santé Canada. Portail des vaccins et des traitements contre la COVID-19. PACLOVID. [Consulté le 17 mars 2023]. https://vaccin-covid.canada.ca/paxlovid/details-produit
- Notes de bas de page 2
-
Hammond J, Leister-Tebbe H, Gardner A, Abreu P, Bao W, Wisemandle W, Baniecki M, Hendrick VM, Damle B, Simón-Campos A, Pypstra R, Rusnak JM; EPIC-HR Investigators. Oral Nirmatrelvir for High-Risk, Nonhospitalized Adults with Covid-19. N Engl J Med 2022;386(15):1397–408. https://doi.org/10.1056/NEJMoa2118542
- Notes de bas de page 3
-
Najjar-Debbiny R, Gronich N, Weber G, Khoury J, Amar M, Stein N, Goldstein LH, Saliba W. Effectiveness of Paxlovid in Reducing Severe Coronavirus Disease 2019 and Mortality in High-Risk Patients. Clin Infect Dis 2023;76(3):e342–9. https://doi.org/10.1093/cid/ciac443
- Notes de bas de page 4
-
Ganatra S, Dani SS, Ahmad J, Kumar A, Shah J, Abraham GM, McQuillen DP, Wachter RM, Sax PE. Oral Nirmatrelvir and Ritonavir in Nonhospitalized Vaccinated Patients With Coronavirus Disease 2019. Clin Infect Dis 2023;76(4):563–72. https://doi.org/10.1093/cid/ciac673
- Notes de bas de page 5
-
Arbel R, Wolff Sagy Y, Hoshen M, Battat E, Lavie G, Sergienko R, Friger M, Waxman JG, Dagan N, Balicer R, Ben-Shlomo Y, Peretz A, Yaron S, Serby D, Hammerman A, Netzer D. Nirmatrelvir Use and Severe Covid-19 Outcomes during the Omicron Surge. N Engl J Med 2022;387(9):790–8. https://doi.org/10.1056/NEJMoa2204919
- Notes de bas de page 6
-
Wong CK, Au IC, Lau KT, Lau EH, Cowling BJ, Leung GM. Real-world effectiveness of molnupiravir and nirmatrelvir plus ritonavir against mortality, hospitalisation, and in-hospital outcomes among community-dwelling, ambulatory patients with confirmed SARS-CoV-2 infection during the omicron wave in Hong Kong: an observational study. Lancet 2022;400(10359):1213–22. https://doi.org/10.1016/S0140-6736(22)01586-0
- Notes de bas de page 7
-
Shah MM, Joyce B, Plumb ID, Sahakian S, Feldstein LR, Barkley E, Paccione M, Deckert J, Sandmann D, Gerhart JL, Hagen MB. Paxlovid Associated with Decreased Hospitalization Rate Among Adults with COVID-19 - United States, April-September 2022. MMWR Morb Mortal Wkly Rep 2022;71(48):1531–7. https://doi.org/10.15585/mmwr.mm7148e2
- Notes de bas de page 8
-
Schwartz KL, Wang J, Tadrous M, Langford BJ, Daneman N, Leung V, Gomes T, Friedman L, Daley P, Brown KA. Population-based evaluation of the effectiveness of nirmatrelvir-ritonavir for reducing hospital admissions and mortality from COVID-19. CMAJ 2023;195(6):E220–6. https://doi.org/10.1503/cmaj.221608
- Notes de bas de page 9
-
Velásquez García HA, Adu PA, Harrigan S, Wilton J, Rasali D, Binka M, Sbihi H, Smolina K, Janjua NZ. Risk factors for COVID-19 hospitalization after COVID-19 vaccination: a population-based cohort study in Canada. Int J Infect Dis 2023;127:116–23. https://doi.org/10.1016/j.ijid.2022.12.001
- Notes de bas de page 10
-
Agence de la santé publique du Canada. Rapport de l'administratrice en chef de la santé publique du Canada sur l'état de la santé publique au Canada 2020. Du risque à la résilience : Une approche axée sur l'équité concernant la COVID-19. Ottawa, ON : ASPC; octobre 2020. [Consulté le 17 mars 2023]. https://www.canada.ca/fr/sante-publique/organisation/publications/rapports-etat-sante-publique-canada-administrateur-chef-sante-publique/du-risque-resilience-approche-equite-covid-19.html

Cette œuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution 4.0 International