Rapports de surveillance de l’innocuité des vaccins au Canada suite à l’immunisation

 Téléchargez cet article en format PDF (778 ko)
Téléchargez cet article en format PDF (778 ko)Publié par : L'Agence de la santé publique du Canada
Numéro : RMTC : Volume 50-1/2, janvier/février 2024 : Virus Respiratoire Syncytial (VRS)
Date de publication : janvier/février 2024
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 50-1/2, janvier/février 2024 : Virus Respiratoire Syncytial (VRS)
Aperçu
Rapports de surveillance de l'innocuité des vaccins au Canada suite à l'immunisation avec des vaccins antigrippaux saisonniers, 2021–2022
Elissa Giang1, Yuhui Xu1, Thivya Naganathan1, Natalia Abraham1, Marie-Thérèse Bawolak2, Battouli Said Salim2, Ashley Weeks1, Amanda Shaw1, Susanna Ogunnaike-Cooke1
Affiliations
1 Centre de surveillance de l'immunisation, Direction générale des programmes sur les maladies infectieuses et de la vaccination, Agence de santé publique du Canada, Ottawa, ON
2 Direction des produits de santé commercialisés, Santé Canada, Ottawa, ON
Correspondance
Citation proposée
Giang E, Xu Y, Naganathan T, Abraham N, Bawolak M-T, Said Salim B, Weeks A, Shaw A, Ogunnaike-Cooke S. Rapports de surveillance de l'innocuité des vaccins au Canada suite à l'immunisation avec des vaccins antigrippaux saisonniers, 2021–2022. Relevé des maladies transmissibles au Canada 2024;50(1/2):19–28. https://doi.org/10.14745/ccdr.v50i12a02f
Mots-clés : grippe, effet indésirable du vaccin, pharmacovigilance, innocuité du vaccin, effets secondaires suivant l'immunisation, manifestation clinique inhabituelle à la suite d'une immunisation
Résumé
Contexte : Les vaccins antigrippaux saisonniers (VAS) autorisés au Canada ont tous fait l'objet d'évaluations réglementaires rigoureuses en matière d'innocuité et d'efficacité réelle. Des manifestations cliniques inhabituelles (MCI) à la suite d'une immunisation peuvent survenir, bien qu'elles soient rares. La surveillance continue de l'innocuité des vaccins pendant la phase de post-commercialisation est un élément essentiel des programmes de vaccination. Cela permet de détecter des événements indésirables rares, tardifs ou inattendus. Une mise à jour du résumé d'innocuité après l'introduction de tout nouveau vaccin ou de nouvelles formulations dans les programmes de vaccination est nécessaire pour affiner le profil risque/bénéfice d'un vaccin précis et maintenir la confiance du public. Nous présentons ici un résumé actualisé de l'innocuité des VAS distribués au cours de la saison grippale 2021–2022 à partir des rapports de MCI à la suite d'une immunisation soumis au Système canadien de surveillance des effets secondaires suivant l'immunisation (SCSESSI) et à la Base de données de Canada Vigilance (BDCV).
Méthodes : Nous avons recherché dans le SCSESSI et la BDCV les personnes qui ont été vaccinées avec un VAS entre le 1er octobre 2021 et le 31 mars 2022. Des statistiques descriptives ont été calculées, notamment l'âge médian des personnes vaccinées, les vaccins administrés avec le VAS et les MCI à la suite d'une immunisation les plus fréquemment signalées. Les taux bruts de déclaration de MCI à la suite d'une immunisation ont été calculés en fonction de la gravité de la MCI à la suite d'une immunisation et du type de VAS, en utilisant des données distribuées par doses. Des examens médicaux ont été effectués pour les rapports faisant état de décès, d'événements graves (ou de résultats) après l'administration d'un VAS seul, et d'événements indésirables sélectionnés (i.e., anaphylaxie, syndrome de Guillain-Barré, convulsions fébriles, syndrome oculo-respiratoire). Une analyse de disproportionnalité a été utilisée pour établir les signaux d'innocuité potentiels parmi les paires VAS et MCI à la suite d'une immunisation.
Résultats : Il y a eu 448 rapports de MCI à la suite d'une immunisation, la plupart étant classés comme des événements sans gravité (84,2 %). La majorité des rapports décrivaient la vaccination chez des adultes de plus de 65 ans (38,6 %). Les MCI à la suite d'une immunisation les plus fréquemment signalées étaient la douleur au point de vaccination, l'urticaire, la pyrexie et l'éruption cutanée. L'examen médical des rapports de MCI à la suite d'une immunisation n'a pas permis d'établir que les décès signalés étaient liés à la vaccination par le VAS. Parmi les rapports graves, les troubles du système nerveux étaient les conditions médicales les plus fréquemment rapportées. L'analyse de disproportionnalité a également permis d'identifier un plus grand nombre d'événements liés à des erreurs de vaccination.
Conclusion : Les résultats de notre analyse des déclarations au SCSESSI et à la BDCV après la vaccination par le VAS sont cohérents avec le profil d'innocuité connu des VAS distribués au cours de la saison grippale 2021–2022. La majorité des rapports étaient non graves, les symptômes les plus fréquents de MCI à la suite d'une immunisation se produisant au point de vaccination ou les symptômes systémiques se résorbant d'eux-mêmes. La majorité des erreurs de vaccination signalées concernaient l'administration du vaccin à un endroit inapproprié, bien qu'aucun MCI à la suite d'une immunisation grave n'ait été signalé.
Introduction
La vaccination annuelle avec le vaccin antigrippal saisonnier (VAS) reste la stratégie la plus efficace pour réduire la morbidité et la mortalité liées à l'infection par le virus de la grippe Note de bas de page 1. Au Canada, la vaccination annuelle contre la grippe est recommandée pour toute personne de six mois et plus, l'accent étant mis sur les groupes ciblés présentant le risque le plus élevé de complications liées à la grippe Note de bas de page 1. Plusieurs vaccins antigrippaux sont actuellement autorisés au Canada; au cours de la saison grippale 2021–2022, cinq types de VAS ont été distribués au Canada, notamment le vaccin antigrippal inactivé quadrivalent à base d'œufs à dose standard (IIV4-SD) et à dose élevée (IIV4-HD), le vaccin antigrippal inactivé quadrivalent à dose standard à base de culture cellulaire (IIV4-cc), le vaccin antigrippal actif atténué quadrivalent (LAIV4) et le vaccin antigrippal inactivé à base d'œufs avec adjuvant (IIV3-Adj) Note de bas de page 1. Parmi ces VAS, les manifestations cliniques inhabituelles (MCI) à la suite d'une immunisation non graves les plus fréquemment signalées, tant chez les enfants que chez les adultes, sont les réactions au point de vaccination (e.g., douleur, rougeur, gonflement) et les symptômes systémiques auto-limitants (e.g., fièvre, maux de tête, nausées) Note de bas de page 1.
Tous les vaccins antigrippaux autorisés au Canada sont considérés comme sûrs Note de bas de page 1; néanmoins, la surveillance systématique de l'innocuité des MCI à la suite d'une immunisation à la suite d'un VAS reste un élément essentiel des programmes annuels de vaccination antigrippale. Les MCI à la suite d'une immunisation les plus préoccupantes sont les réactions d'hypersensibilité immédiate telles que l'anaphylaxie, le syndrome de Guillain-Barré (SGB), le syndrome oculo-respiratoire (SOR) et les convulsions fébriles Note de bas de page 1. Les réactions anaphylactiques peuvent être dues à un composant actif ou à un additif du vaccin; toutefois, les réactions anaphylactiques véritables sont rares et se produisent à raison d'une par million de doses pour de nombreux vaccins Note de bas de page 2. Une association prouvée entre l'utilisation du vaccin contre la grippe porcine et le SGB a été établie en 1976 aux États-Unis, qui ont interrompu cette campagne de vaccination précise Note de bas de page 3. Depuis 1976–1977, le SGB n'a pas été systématiquement associé aux vaccins antigrippaux; toutefois, il est nécessaire de surveiller son apparition lors des campagnes de vaccination de masse, en particulier après l'utilisation de vaccins antigrippaux pandémiques Note de bas de page 4. Des MCI à la suite d'une immunisation mineures et inattendues ont également été signalées au Canada, y compris des cas de SOR à la suite de l'administration de vaccins antigrippaux antérieurs Note de bas de page 5. Il existe un faible risque accru de convulsions fébriles lorsqu'un vaccin antigrippal inactivé est administré en même temps que le vaccin PCV13 (pneumocoque) ou le vaccin contre la diphtérie, le tétanos et la coqueluche (dcaT) Note de bas de page 6. Cependant, le risque de convulsions fébriles avec n'importe quelle combinaison de ces vaccins est faible (jusqu'à 30 convulsions fébriles pour 100 000 enfants vaccinés) et doit être interprété dans le contexte de la prévention des infections à pneumocoques et grippales chez les enfants Note de bas de page 6.
Bien que rares, des infections respiratoires aiguës sérieuses et inattendues peuvent survenir à la suite d'une vaccination par le VAS. La surveillance de l'innocuité des vaccins après leur mise sur le marché afin d'établir les MCI à la suite d'une immunisation d'apparition tardive, rares ou inattendues est essentielle pour tout programme de vaccination, afin de permettre une action de santé publique efficace et de maintenir la confiance dans les vaccins et dans le public. L'Agence de la santé publique du Canada (l'Agence) et Santé Canada (SC) se partagent la surveillance de la qualité, de l'innocuité et de l'efficacité réelle des vaccins commercialisés au Canada. Au niveau national, les rapports de MCI à la suite d'une immunisation sont reçus par deux systèmes de surveillance de l'innocuité : Le Système canadien de surveillance des effets secondaires suivant l'immunisation (SCSESSI) Note de bas de page 7 (géré par l'Agence); et la Base de données de Canada Vigilance (BDCV) Note de bas de page 8 (coordonnée par SC). L'objectif de ce rapport est de résumer les rapports de MCI à la suite d'une immunisation de la grippe reçus à la fois par le SCSESSI et la BDCV, afin d'évaluer le profil général d'innocuité des VAS distribués au cours de la saison grippale 2021–2022 et de comparer les tendances d'innocuité des VAS au fil du temps.
Méthodes
Source de données
Le SCSESSI est géré par l'Agence et comprend des systèmes de surveillance passive et active conçus pour détecter des événements rares, tardifs ou inattendus pour tout vaccin autorisé au Canada Note de bas de page 7. Le SCSESSI reçoit des rapports spontanés (passifs) de MCI à la suite d'une immunisation de la part des autorités de santé publique fédérales, provinciales et territoriales. La surveillance active est effectuée dans le cadre du Programme canadien de surveillance active de l'immunisation (IMPACT) par des infirmières contrôleuses désignées sous la supervision de spécialistes en pédiatrie ou en maladies infectieuses Note de bas de page 9. Les rapports de MC à la suite d'une immunisation soumis au SCSESSI n'impliquent pas de relation de cause à effet entre le vaccin et la MCI à la suite d'une immunisation, mais que les effets rapportés sont temporellement associés au vaccin (i.e., ils surviennent après la vaccination dans un délai biologiquement plausible) et qu'ils n'ont pas d'autre cause évidente au moment du rapport. Le formulaire de MCI à la suite d'une immunisation Note de bas de page 10 soumis au SCSESSI recueille des renseignements sur le sexe, l'âge, les vaccins administrés, les doses et le numéro de lot, les antécédents médicaux et les MCI à la suite d'une immunisation survenues. Les MCI à la suite d'une immunisation, y compris les signes, les symptômes et les diagnostics, se voient attribuer des termes préférentiels par du personnel formé à cet effet, à l'aide de la version du « Medical Dictionary for Regulatory Activities » en vigueur au moment de la collecte des données Note de bas de page 11. Un examen systématique des cas médicaux est effectué par des professionnels de la santé formés qui classent les cas à rapporter en utilisant, le cas échéant, des définitions de cas normalisées Note de bas de page 12. Un rapport de MCI à la suite d'une immunisation grave est déterminé sur la base du Conseil international d'harmonisation des exigences techniques pour l'enregistrement des médicaments à usage humain Note de bas de page 13, comme un événement qui entraîne la mort, met en jeu le pronostic vital, nécessite une hospitalisation ou la prolongation d'une hospitalisation existante, entraîne une invalidité ou une incapacité persistante ou significative ou des anomalies ou des malformations congénitales. Tout événement médical qui ne met pas immédiatement la vie en danger, mais qui nécessite une intervention pour prévenir l'une des conséquences énumérées ci-dessus peut également être considéré comme grave.
Santé Canada coordonne la BDCV, qui contient des renseignements sur les effets indésirables présumés des produits de santé (y compris les vaccins), communiqués volontairement par les consommateurs et les professionnels de la santé. De plus, les titulaires d'une autorisation de mise sur le marché (fabricants et distributeurs) sont tenus de signaler à la BDCV, dès qu'ils en ont connaissance, les MCI graves à la suite d'une immunisation impliquant leurs produits de santé commercialisés. Les exigences spécifiques en matière de rapports pour les titulaires d'une autorisation de mise sur le marché sont décrites dans le Règlement sur les aliments et drogues Note de bas de page 14. La fiche d'effets indésirables recueille des renseignements sur la profession du déclarant, l'âge et le sexe de la personne vaccinée, le ou les vaccins administrés, l'effet indésirable ressenti et le niveau de soins obtenu. Les signes et symptômes sont codés à l'aide du Dictionnaire médical des affaires réglementaires Note de bas de page 11 et les rapports sont considérés comme graves sur la base des définitions incluses dans le Règlement sur les aliments et drogues Note de bas de page 14 et de la définition de « grave » du Conseil international d'harmonisation Note de bas de page 13.
Analyse des données
Nous avons recherché dans le SCSESSI et la BDCV les déclarations de MCI à la suite d'une immunisation chez les personnes de tout âge ayant été vaccinées avec un VAS entre le 1er octobre 2021 et le 31 mars 2022 (période d'analyse). Notre recherche a porté sur tous les rapports dans lesquels le VAS a été administré seul ou en même temps qu'au moins un autre vaccin. Étant donné que les professionnels de la santé et les consommateurs peuvent soumettre des rapports sur les MCI à la suite d'une immunisation à leur autorité de santé publique fédérale, provinciale et territoriale (les rapports sont envoyés au SCSESSI) et à la BDCV sur une base volontaire, il existe un risque de doublon des rapports entre les systèmes de surveillance. Afin de minimiser les doublons, les rapports du SCSESSI et de la BDCV ont été regroupés sur la base de renseignements primaires tels que le sexe, l'âge de la personne vaccinée, la date à laquelle le ou les vaccins ont été administrés, les noms commerciaux du ou des vaccins et les MCI à la suite d'une immunisation, afin de consolider les rapports en doublon.
Statistiques descriptives
Nous avons décrit tous les rapports soumis au SCSESSI et à la BDCV pour les personnes de tout âge qui ont été vaccinées avec un VAS au cours de la période d'analyse. Des statistiques descriptives ont été calculées, notamment l'âge médian et le sexe de la personne vaccinée, le délai d'apparition (la date entre la vaccination et l'apparition des premiers symptômes), les administrations concomitantes de vaccins avec le VAS et les termes les plus fréquemment rapportés. Toutes les analyses de données ont été effectuées avec R, le langage de programmation pour l'informatique statistique (R version 4.1.3) Note de bas de page 15.
Les taux bruts de déclaration des MCI à la suite d'une immunisation ont été calculés pour tous les rapports, les rapports graves et par type de VAS (c'est-à-dire IIV3-Adj, IIV4-SD, IIV4-HD, IIV4-cc, LAIV-4) en divisant le nombre de déclarations de MCI à la suite d'une immunisation reçues pendant la période d'analyse par le nombre total de doses de VAS distribuées au Canada pendant la saison grippale 2021–2022.
Examen médical des rapports
Tous les rapports décrivant un décès à la suite d'une vaccination par un VAS et tous les rapports de MCI graves à la suite d'une immunisation ont fait l'objet d'un examen médical (lorsque les dossiers médicaux étaient disponibles). Pour chaque déclaration, nous avons établi la MCI à la suite d'une immunisation principale à l'origine de la déclaration, les classes par système et organe (System Organ Class ou SOC) et les termes privilégiés de la MCI à la suite d'une immunisation principale. De plus, nous avons examiné les rapports et les renseignements médicaux qui les accompagnent, lorsqu'ils étaient disponibles, pour les cas de MCI à la suite d'une immunisation sélectionnées, notamment les cas d'anaphylaxie, de SGB, de convulsions fébriles et de SOR. Le cas échéant, les définitions de cas de la Brighton Collaboration ont été appliquées pour évaluer le niveau de certitude des cas Note de bas de page 16Note de bas de page 17Note de bas de page 18.
Analyse de la disproportionnalité
En utilisant uniquement les rapports du SCSESSI, nous avons calculé la statistique de la composante d'information (CI) pour identifier les paires MCI à la suite d'une immunisation et VAS qui ont été signalées de manière disproportionnée au cours de la saison grippale 2021–2022 par rapport à la déclaration prévue au cours des saisons grippales précédentes (2010–2011 à 2020–2021). Les valeurs supérieures à zéro pour l'intervalle de crédibilité inférieur de la CI (CI0,25) ont été considérées comme statistiquement significatives et ont fait l'objet d'un examen médical, à moins qu'elles n'aient été précédemment incluses dans notre liste de pathologies MCI à la suite d'une immunisation sélectionnées (voir Méthodes, Examen médical des rapports). Des valeurs significatives n'impliquent pas de lien de causalité entre une paire MCI à la suite d'une immunisation et vaccins, mais peuvent suggérer des manifestations inhabituelles potentielles liées à l'innocuité des vaccins qui nécessitent un examen médical plus approfondi.
Résultats
Notre recherche a permis d'identifier 448 rapports de MCI à la suite d'une immunisation dans le SCSESSI et la BDCV suite à la vaccination avec un VAS pendant la période de surveillance et sont résumés dans le tableau 1. Parmi ces rapports, 377 (84,2 %) ont été considérés comme des MCI à la suite d'une immunisation non graves, alors que 71 (15,8 %), dont 13 rapports de décès, répondaient à la définition de cas graves. L'âge médian des vaccinés était de 52 ans (intervalle : 5 mois–104 ans) et la plupart des rapports décrivent la réception du VAS chez des personnes de 65 ans et plus (38,8 %), suivies par des enfants de 5 à 17 ans (21,9 %). Le délai médian d'apparition était d'un jour (intervalle : 0–15 jours). La majorité des déclarations concernaient des femmes (65,2 %) par rapport aux hommes (34,4 %). Sur les 286 rapports concernant le VAS administré seul, 31 (10,8 %) ont été classés comme graves.
| Caractéristiques | N | % |
|---|---|---|
| Système de surveillance | ||
| SCSESSI | 414 | 92,4 |
| BDCV | 34 | 7,6 |
| Gravité | ||
| Non grave | 377 | 84,2 |
| Grave | 71 | 15,8 |
| Sexe | ||
| Femme | 292 | 65,2 |
| Homme | 154 | 34,4 |
| Non spécifié | 2 | 0,4 |
| Délai d'apparition en joursTableau 1 note de bas de page a, médiane (intervalle) | 1,0 | 0,0–15,0 |
| Âge (années), médiane (intervalle) | 52,0 | 0,5–104 |
| Groupes d'âge (années) | ||
| 0 à 4 | 61 | 13,6 |
| 5 à 17 | 98 | 21,9 |
| 18 à 49 | 40 | 8,9 |
| 50 à 64 | 71 | 15,8 |
| 65 ans et plus | 173 | 38,6 |
| Inconnu/non spécifié | 5 | 1,1 |
| Co-administrations | ||
| 1 (vaccin antigrippal saisonnier administré seul) | 286 | 63,8 |
| 2 | 116 | 25,9 |
| 3 ou plus | 46 | 10,3 |
| Profession du déclarant | ||
| Consommateur/non professionnel de la santé | 28 | 6,3 |
| Professionnel de la santé (médecin hygiéniste, médecin, infirmière, pharmacien) | 214 | 47,8 |
| IMPACT | 9 | 2,0 |
| Inconnu/non spécifié | 197 | 43,9 |
Un total de 162 rapports (36,1 %) mentionnaient au moins un vaccin supplémentaire administré le même jour que le VAS. Les vaccins les plus fréquemment co-administrés varient selon les recommandations du calendrier vaccinal en fonction de l'âge. Chez les enfants de 0 à 4 ans, le vaccin contre la rougeole, les oreillons et la rubéole était le vaccin le plus fréquemment administré en même temps que le VAS (60,5 %), suivi du vaccin contre la diphtérie, le tétanos, la coqueluche, la poliomyélite et l'Haemophilus influenzae de type b (dcaT-VPI-Hib, 36,8 %) et du vaccin conjugué C contre le méningocoque (Men-C-C, 36,8 %). Chez les adultes de 65 ans et plus, les vaccins contre la maladie à coronavirus 2019 (COVID-19) (67,1 %) et les vaccins polysaccharides 23 contre le pneumocoque (Pneu-P-23, 31,6 %) ont été les plus fréquemment administrés en même temps que le VAS. Les rapports décrivant la co-administration ne s'excluent pas mutuellement, car les vaccinés peuvent recevoir plus d'un vaccin co-administré le même jour. Les dix (MCI) à la suite d'une immunisation les plus fréquemment rapportés sont présentés dans le tableau 2 et comprennent la douleur au point de vaccination (17,4 %), l'urticaire (11,6 %), l'éruption cutanée (10,7 %) et la pyrexie (10,7 %).
| Terme privilégié du MedDRA | N | %Tableau 2 note de bas de page a |
|---|---|---|
| Douleur au point de vaccination | 78 | 17,4 |
| Urticaire | 52 | 11,6 |
| Pyrexie | 48 | 10,7 |
| Éruption | 48 | 10,7 |
| Erythème au point de vaccination | 43 | 9,6 |
| Gonflement au point de vaccination | 43 | 9,6 |
| Prurit | 39 | 8,7 |
| Erythème | 37 | 8,3 |
| Vomissements | 36 | 8,0 |
| Dyspnée | 33 | 7,4 |
Au cours de la saison grippale 2021–2022, 15 605 176 doses de VAS ont été distribuées au Canada. En se basant uniquement sur les 414 rapports du SCSESSI du tableau 1 (les renseignements historiques de la BDCV n'étant pas disponibles), le taux de déclaration brut global en 2021–2022 était de 2,7 rapports pour 100 000 doses distribuées. De même, en ce qui concerne les rapports graves, avec 41 rapports graves provenant du SCSESSI, le taux brut de déclaration était de 0,3 pour 100 000 doses distribuées. Depuis la saison grippale 2019–2020, on observe une tendance constante à la baisse des taux de déclaration parmi les déclarations totales et les déclarations graves, avec des intervalles de confiance qui ne se chevauchent pas (figure 1).
Figure 1 : Taux brut de déclarationFigure 1 note de bas de page a des effets indésirables suivant l'immunisation suite à la réception du vaccin antigrippal saisonnier, par gravité, pour les saisons grippales 2010–2011 à 2021–2022Figure 1 note de bas de page b
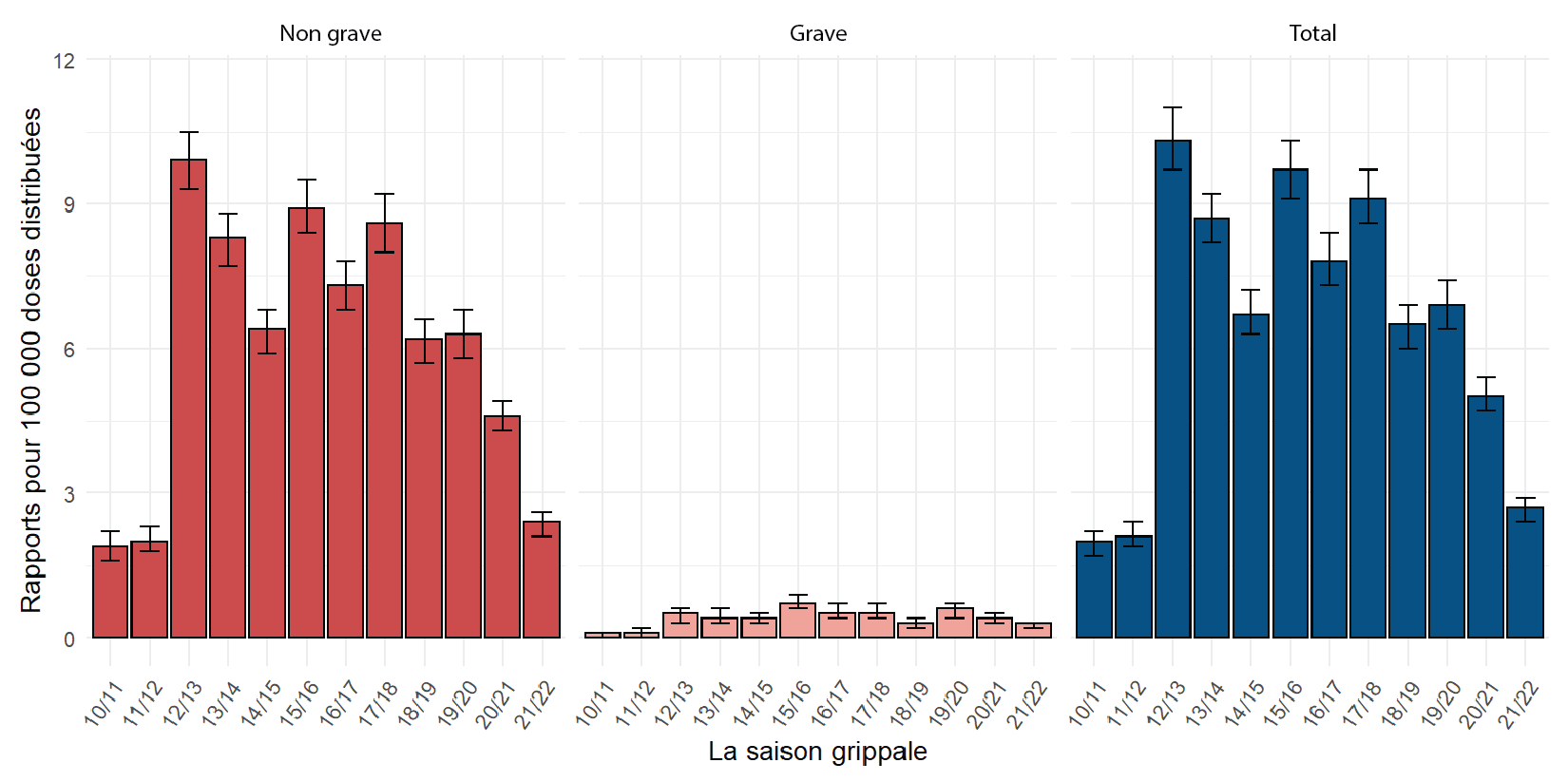
Figure 1 - Équivalent textuel
| Saison grippale | Rapport | Nombre de rapports | Taux de déclaration pour 100 000 doses distribuées |
|---|---|---|---|
| 2010–2011 | Non grave | 209 | 1,9 (1,6–2,2) |
| 2010–2011 | Grave | 8 | 0,1 (0–0,1) |
| 2010–2011 | Total | 217 | 2 (1,7–2,2) |
| 2011–2012 | Non grave | 240 | 2 (1,8–2,3) |
| 2011–2012 | Grave | 12 | 0,1 (0–0,2) |
| 2011–2012 | Total | 252 | 2,1 (1,9–2,4) |
| 2012–2013 | Non grave | 1 054 | 9,9 (9,3–10,5) |
| 2012–2013 | Grave | 48 | 0,5 (0,3–0,6) |
| 2012–2013 | Total | 1 102 | 10,3 (9,7–11) |
| 2013–2014 | Non grave | 946 | 8,3 (7,7–8,8) |
| 2013–2014 | Grave | 50 | 0,4 (0,3–0,6) |
| 2013–2014 | Total | 996 | 8,7 (8,2–9,2) |
| 2014–2015 | Non grave | 795 | 6,4 (5,9–6,8) |
| 2014–2015 | Grave | 49 | 0,4 (0,3–0,5) |
| 2014–2015 | Total | 844 | 6,7 (6,3–7,2) |
| 2015–2016 | Non grave | 935 | 8,9 (8,4–9,5) |
| 2015–2016 | Grave | 78 | 0,7 (0,6–0,9) |
| 2015–2016 | Total | 1 013 | 9,7 (9,1–10,3) |
| 2016–2017 | Non grave | 795 | 7,3 (6,8–7,8) |
| 2016–2017 | Grave | 59 | 0,5 (0,4–0,7) |
| 2016–2017 | Total | 854 | 7,8 (7,3–8,4) |
| 2017–2018 | Non grave | 877 | 8,6 (8–9,2) |
| 2017–2018 | Grave | 55 | 0,5 (0,4–0,7) |
| 2017–2018 | Total | 932 | 9,1 (8,6–9,7) |
| 2018–2019 | Non grave | 695 | 6,2 (5,7–6,6) |
| 2018–2019 | Grave | 34 | 0,3 (0,2–0,4) |
| 2018–2019 | Total | 729 | 6,5 (6–6,9) |
| 2019–2020 | Non grave | 694 | 6,3 (5,8–6,8) |
| 2019–2020 | Grave | 63 | 0,6 (0,4–0,7) |
| 2019–2020 | Total | 757 | 6,9 (6,4–7,4) |
| 2020–2021 | Non grave | 739 | 4,6 (4,3–4,9) |
| 2020–2021 | Grave | 65 | 0,4 (0,3–0,5) |
| 2020–2021 | Total | 804 | 5 (4,7–5,4) |
| 2021–2022 | Non grave | 373 | 2,4 (2,1–2,6) |
| 2021–2022 | Grave | 41 | 0,3 (0,2–0,3) |
| 2021–2022 | Total | 414 | 2,7 (2,4–2,9) |
En fonction du type de VAS, les taux bruts de déclaration étaient les plus élevés pour le vaccin IIV4-HD (4,2 déclarations pour 100 000 doses distribuées), suivi par le vaccin IIV3-SD (2,2 déclarations pour 100 000 doses distribuées), tandis que pour les autres types de VAS, moins de 10 déclarations ont été rapportées (tableau 3). Pour tous les types de VAS, le taux de déclaration des événements graves est resté faible, avec un rapport ou moins pour 100 000 doses distribuées.
| Description du rapport | Type de vaccin antigrippal | |||||
|---|---|---|---|---|---|---|
| IIV3-Adj | IIV4-SD | IIV4-HD | IIV4-cc | LAIV-4 | ||
| Total de rapports | Moins de 10 | 296 | 79 | Moins de 10 | Moins de 10 | |
| Non grave | CDS | 262 | 67 | CDS | CDS | |
| Grave | CDS | 34 | 12 | CDS | CDS | |
| Proportion de cas grave | CDS | 11,5 % | 15,2 % | CDS | CDS | |
| Doses totales distribuées | 69 587 | 13 456 161 | 1 876 475 | 34 533 | 168 420 | |
| Taux de déclaration (IC à 95 %)Tableau 3 note de bas de page b | CDS | 2,2 (2,0–2,5) | 4,2 (3,3–5,2) | CDS | CDS | |
| Taux de cas grave (IC à 95 %) | CDS | 0,3 (0,2–0,4) | 0,6 (0,3–1,1) | CDS | CDS | |
Décès
Un total de 13 cas de décès ont été signalés à la suite d'une vaccination par un VAS. Des renseignements médicaux (e.g., les antécédents médicaux du patient, les renseignements cliniques ayant conduit aux événements, les comorbidités préexistantes et concomitantes) étaient disponibles pour 10 de ces rapports. Parmi ces derniers, les troubles neurocognitifs étaient la cause de décès la plus citée (N = 4/10, 40 %). Six rapports n'indiquaient pas la cause du décès ni les résultats des examens complémentaires (au moment de la rédaction du rapport), mais les six rapports décrivaient des conditions médicales préexistantes, notamment une maladie pulmonaire obstructive chronique, une maladie coronarienne, du diabète, de l'hypertension et une maladie génétique. La majorité des décès (N = 9/13, 69 %) sont survenus chez des adultes de 65 ans et plus, et l'âge médian était de 84 ans (intervalle : 12 mois–98 ans). Les trois autres rapports ne contenaient pas suffisamment de renseignements sur la cause du décès, les antécédents médicaux du patient ou les renseignements cliniques ayant conduit aux événements. Parmi ceux qui disposaient de renseignements suffisants pour évaluer le lien de causalité, aucun n'a été jugé compatible avec un lien de causalité avec la vaccination.
Rapports graves
Un total de 31 rapports ont été classés comme graves à la suite d'une vaccination par un VAS uniquement. Le SOC le plus fréquent était les troubles du système nerveux, y compris le diagnostic de SGB (deux rapports), les crises d'épilepsie (un rapport), la syncope (un rapport) et l'absence épileptique (un rapport). Un rapport de MCI à la suite d'une immunisation a été établir pour les SOC suivants : troubles gastro-intestinaux (un rapport de douleur abdominale); troubles généraux et conditions au site d'administration (un rapport de douleur thoracique); troubles du système immunitaire (un rapport d'anaphylaxie gérée); investigations (un test anormal du liquide céphalo-rachidien); troubles respiratoires, thoraciques et médiastinaux (un rapport de dyspnée) et troubles de la peau et du tissu sous-cutané (un rapport d'urticaire). Les 20 rapports restants n'indiquaient pas l'événement primaire à l'origine du rapport; il n'a donc pas été possible de déterminer le SOC respectif et le terme privilégié pour l'événement primaire.
Événements indésirables graves
Notre recherche n'a pas permis de recenser de cas de SOR rapportés suite à la réception d'un VAS distribué pendant la saison grippale 2021–2022. Notre recherche a permis d'établir vingt-neuf rapports possibles de MCI à la suite d'une immunisation sélectionnées (i.e., anaphylaxie, SGB, convulsions fébriles), qui sont décrits plus en détail ci-dessous.
Anaphylaxie : Un total de 16 rapports comportaient au moins un terme préférentiel évocateur d'anaphylaxie, la plupart d'entre eux (N = 12/16, 75 %) décrivant une anaphylaxie consécutive à la réception du VAS seul. Dans 14 des 16 rapports (87,5 %), le type de VAS reçu était le IIV4-SD. Seuls six rapports répondaient aux critères de définitions de cas de la Brighton Collaboration. Un rapport a été classé au niveau 1 (niveau le plus élevé de certitude diagnostique) et cinq rapports ont été classés au niveau 2. Les 10 rapports restants ne contenaient pas suffisamment de renseignements pour attribuer une certitude entre les niveaux 1–3 des définitions de cas de la Brighton Collaboration ou pour exclure l'anaphylaxie (i.e., le niveau 5). De plus, ces rapports ne contenaient aucun renseignement permettant de confirmer si les réactions observées (au moment de la déclaration) étaient transmises par les immunoglobulines E (IgE). Parmi les six cas confirmés, le délai médian d'apparition était de 43 minutes (intervalle : 4–230 minutes) et la plupart des rapports (N = 12/16, 75 %) décrivent une anaphylaxie suite à la réception du VAS seul.
Syndrome de Guillain-Barré : Quatre cas de SGB possible ont été établis à la suite de la réception d'un VAS. Après application des définitions de cas de la Brighton Collaboration, un rapport a été classé au niveau 3; les trois autres rapports n'ont pas pu être classés, principalement en raison de renseignements médicaux incomplets dans le rapport de MCI à la suite d'une immunisation. Le délai d'apparition était de neuf jours et l'unique rapport décrivait un SGB après l'administration de plus d'un vaccin.
Convulsions fébriles : Il y a eu neuf rapports possibles suggérant des convulsions fébriles. Quatre rapports ont été considérés comme graves : après examen médical, les quatre rapports ont été classés au niveau 1 des définitions de cas de la Brighton Collaboration et sont survenus chez des enfants de deux ans ou moins et d'un âge médian d'un an (intervalle : 1–1,5 ans). Parmi ces rapports, le délai d'apparition pour tous les rapports était d'un jour. Les quatre rapports font état de l'administration concomitante du VAS avec plus d'un vaccin infantile, notamment les vaccins contre la rougeole, les oreillons et la rubéole, le pneumocoque conjugué 13 (Pneu-C-13), la varicelle, le dcaT-VPI-Hib et le vaccin contre l'hépatite B (HB).
Analyse de la disproportionnalité
Par rapport aux saisons grippales précédentes, deux termes privilégiés ont été signalés plus fréquemment que prévu dans la base de données du SCSESSI : « Erreur de vaccination » et « lymphadénopathie ». Un total de 15 cas d'erreur de vaccination ont été signalés, la fréquence des cas observés étant 2,7 fois supérieure (IC/IC0,25 : 1,45/0,57) à la proportion de rapports reçus au cours des saisons grippales précédentes dans le SCSESSI. La raison la plus fréquente de l'erreur de vaccination était l'administration du vaccin dans un endroit inapproprié (N = 13/15, 86,7 %), tandis que les autres rapports indiquaient que le vaccin avait été administré en dehors de l'indication d'âge recommandée. Un examen plus approfondi des rapports d'erreur de vaccination a permis d'établir des conditions de MCI à la suite d'une immunisation compatibles avec une lésion à l'épaule liée à l'administration d'un vaccin (i.e., diminution de l'amplitude articulaire, lésion à l'épaule, altération du mouvement de l'articulation); cependant, tous les rapports ont été considérés comme non graves.
Treize cas de lymphadénopathie ont été signalés, la fréquence des cas observés étant 2,1 fois plus élevée (IC/IC0,25 : 1,10/0,16) que la proportion de rapports de lymphadénopathie dans le SCSESSI observée au cours des saisons grippales précédentes. Étant donné que la majorité des MCI à la suite d'une immunisation signalées n'étaient pas graves et que la lymphadénopathie a été signalée comme MCI à la suite d'une immunisation lors d'essais cliniques Note de bas de page 19 et lors de l'utilisation post-approbation dans le cadre du VAS Note de bas de page 20, aucun autre examen médical n'a été effectué.
Discussion
Cet article décrit les déclarations au SCSESSI et à la BDCV suite à la réception du VAS entre octobre 2021 et mars 2022. La plupart des déclarations concernaient des adultes de 65 ans et plus (38,6 %), groupe pour lequel le VAS est systématiquement recommandé en raison des risques accrus de complications liées à la grippe, y compris les hospitalisations et les décès Note de bas de page 1. Dans l'ensemble, les MCI à la suite d'une immunisation signalées étaient conformes au profil d'innocuité connu du VAS, caractérisé par des études préalables à l'autorisation et par la surveillance post-commercialisation, et comprenaient des réactions au site de vaccination (douleur, gonflement, érythème) et des réactions systémiques (fièvre, nausées, vomissements). Les taux de signalement global et non grave étaient nettement inférieurs à ceux observés au cours des saisons grippales précédentes. Étant donné que la campagne annuelle de VAS n'est pas nouvelle, les personnes vaccinées et les professionnels de la santé peuvent être moins enclins à signaler des MCI à la suite d'une immunisation plus légères et moins graves avec des vaccins qu'ils connaissent bien, un phénomène épidémiologique connu sous le nom d'effet Weber Note de bas de page 21. Certains éléments indiquent que la pandémie de COVID-19 a entraîné une réduction du nombre de déclarations spontanées non graves, qui pourrait être due principalement à des changements dans les pratiques de déclaration par les professionnels de la santé ou les personnes vaccinées. Nos données confirment cette observation, car la réduction est principalement observée dans les rapports non graves, alors que les taux de rapports graves restent dans les intervalles historiques Note de bas de page 22. Les données sont également comparables à celles d'autres études portant sur l'innocuité des VAS dans d'autres pays Note de bas de page 1Note de bas de page 23Note de bas de page 24Note de bas de page 25.
Sur la base des renseignements médicaux disponibles, la plupart des cas de décès consécutifs à la réception du VAS étaient dus à des troubles neurocognitifs. Six rapports (sur les 13 rapports ayant abouti à un décès) indiquaient un large éventail de conditions médicales préexistantes susceptibles d'avoir contribué à augmenter le risque d'effets cliniques graves de l'infection grippale, y compris le décès. Parmi ces rapports, aucune tendance ou preuve supplémentaire suggérant une relation de cause à effet entre la vaccination et le décès n'a été établie. Étant donné que les déclarations reçues dans le SCSESSI et la BDCV ne contiennent pas toujours des renseignements médicaux complets sur le patient, nous n'avons pas été en mesure d'évaluer les facteurs de confusion potentiels (i.e., les conditions médicales préexistantes, les médicaments) ou la causalité pour certaines de ces déclarations.
Parmi les déclarations classées comme graves, les MCI à la suite d'une immunisation les plus fréquemment signalées à la suite de la vaccination avec un VAS seul ont été classées comme troubles du système nerveux et sont mentionnées dans les monographies des produits VAS associés comme ayant été signalées après la vaccination, mais pour lesquels le lien de causalité est inconnu Note de bas de page 19Note de bas de page 26. Il est rassurant de constater que leur apparition est restée rare, bien que les prestataires soient censés communiquer des renseignements sur les risques et les avantages aux personnes vaccinées et aux soignants, ainsi que des conseils sur la conduite à tenir en cas d'événement de ce type Note de bas de page 1.
Les termes d'erreur de vaccination ont été rapportés de manière disproportionnée, la majorité des rapports décrivant des symptômes compatibles avec une lésion à l'épaule liée à l'administration d'un vaccin. Les lésions à l'épaule liées à l'administration d'un vaccin surviennent généralement quelques instants ou quelques jours après l'injection du vaccin et peuvent entraîner un dysfonctionnement prolongé, voire permanent de l'épaule. Bien que l'incidence d'un tel symptôme ne soit pas bien connue, on suppose qu'elle est peu fréquente Note de bas de page 27.
Limites
Il est important de prendre en compte les limites du SCSESSI et de la BDCV qui sont inhérentes aux systèmes de surveillance passive. Il peut s'agir d'une sous-déclaration, d'un biais de déclaration, d'une qualité et d'une exhaustivité variables des rapports, ainsi que de données de dénominateur appropriées permettant de mettre en contexte le nombre de rapports de MCI à la suite d'une immunisation reçus. Il n'existe actuellement aucun mécanisme de suivi du nombre de doses de VAS administrées au niveau national. En l'absence de telles données, les doses de VAS distribuées ont servi de substitut aux doses de VAS administrées; les taux bruts de déclaration doivent donc être interprétés avec prudence. De plus, l'absence d'un groupe de contrôle non vacciné rend difficile l'examen de l'association entre une MCI à la suite d'une immunisation et le ou les vaccins. Il est rarement possible de déterminer la causalité en se basant uniquement sur les rapports soumis aux systèmes nationaux de surveillance passive. Lorsqu'un signal est détecté, une enquête plus approfondie est toujours justifiée au niveau de l'individu et de la population pour déterminer la causalité Note de bas de page 28. Néanmoins, ces systèmes de surveillance permettent de repérer des signaux statistiques d'innocuité pour les MCI à la suite d'une immunisation rares et inattendues et peuvent être utilisés pour tirer des conclusions générales sur l'innocuité des vaccins administrés au Canada.
Conclusion
L'objectif global de la surveillance de l'innocuité après la mise sur le marché est de détecter les problèmes d'innocuité rares ou inhabituels qui peuvent signaler des associations précédemment inconnues entre un vaccin donné et des MCI à la suite d'une immunisation, ou des changements dans les profils d'innocuité attendus en termes de fréquence ou de gravité des MCI à la suite d'une immunisation sélectionnées. Sur la base de ce résumé actualisé, nous n'avons pas observé de tendances ou de schémas préoccupants suite à la réception d'un VAS au Canada au cours de la saison grippale 2021–2022. Nos résultats sont cohérents avec les données issues des essais cliniques avant autorisation et des évaluations d'innocuité après autorisation et confirment que les VAS présentent un profil d'innocuité favorable Note de bas de page 1Note de bas de page 23Note de bas de page 29.
Déclaration des auteurs
- E. G. — Analyse formelle, validation, visualisation des données, rédaction–version originale, rédaction, révision et édition
- Y. X. — Rédaction, révision et édition
- T. N. — Analyse formelle
- A. W. — Rédaction, révision et édition
- A. S. — Rédaction, révision et édition
- M. B. — Rédaction, révision et édition
- B. S. — Rédaction, révision et édition
- S. O. C. — Supervision, rédaction, révision et édition
Intérêts concurrents
Aucun.
Remerciements
Nous reconnaissons les efforts critiques et importants des autorités de santé publique locales, régionales, provinciales et territoriales, du programme IMPACT, des titulaires d'une autorisation de mise sur le marché et du public qui ont soumis des rapports au SCSESSI et à la BDCV pour permettre la surveillance de l'innocuité des vaccins au Canada.
Nous remercions également l'équipe du SCSESSI de la Division de la Surveillance de la sécurité des vaccins de l'Agence pour la saisie et le codage des données sur les effets indésirables des vaccins, les médecins examinateurs pour leur examen des rapports, et le personnel de la Direction des produits de santé commercialisés de Santé Canada pour l'accès aux rapports de la Base de données de Canada Vigilance.
Financement
Ces travaux ont été financés par l'Agence de la santé publique du Canada.

Cette œuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution 4.0 International