Efficacité potentielle, efficacité réelle et immunogénicité des calendriers réduits de vaccination contre le VPH

 Téléchargez cet article en format PDF (430 ko)
Téléchargez cet article en format PDF (430 ko)Publié par : L'Agence de la santé publique du Canada
Numéro : RMTC : Volume 50-6, juin 2024 : Les vaccins anticancéreux
Date de publication : juin 2024
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 50-6, juin 2024 : Les vaccins anticancéreux
Aperçu
Efficacité potentielle, efficacité réelle et immunogénicité des calendriers réduits de vaccination contre le VPH : examen des données probantes disponibles
Joshua Montroy1, Marina I Salvadori1, Nicole Forbes1, Vinita Dubey2, Sarah Almasri1, Anna Jirovec1, Cathy Yan1, Katarina Gusic1, Adrienne Stevens1, Kelsey Young1, Matthew Tunis1
Affiliations
1 Centre des programmes d'immunisation, Agence de la santé publique du Canada, Ottawa, ON
2 Santé publique de Toronto, École de santé publique Dalla Lana de l'Université de Toronto, Toronto, ON
Correspondance
Citation proposée
Montroy J, Salvadori MI, Forbes N, Dubey V, Almasri S, Jirovec A, Yan C, Gusic K, Stevens A, Young K, Tunis M. Efficacité potentielle, efficacité réelle et immunogénicité des calendriers réduits de vaccination contre le VPH : Examen des données probantes disponibles. Relevé des maladies transmissibles au Canada 2024;50(6):183–96. https://doi.org/10.14745/ccdr.v50i06a01f
Mots-clés : VPH, vaccination, réduction de la dose, calendrier de vaccination, efficacité réelle, cancer, examen des données probantes
Résumé
Contexte : Les directives actuelles du Comité consultatif national de l'immunisation (CCNI) recommandent que les vaccins contre le virus du papillome humain (VPH) soient administrés selon un calendrier de deux ou trois doses. Récemment, plusieurs essais cliniques importants ont fait état des avantages cliniques d'une dose unique de vaccin contre le VPH. En conséquence, l'Organisation mondiale de la Santé a publié en 2022 des directives actualisées sur les vaccins contre le VPH, recommandant un calendrier à deux doses pour les personnes de 9 à 20 ans, et reconnaissant l'utilisation d'un calendrier alternatif à dose unique non officiellement approuvé.
Objectif : Cet aperçu vise à fournir un compte rendu détaillé des données probantes disponibles comparant les calendriers de vaccination contre le VPH, qui ont été prises en compte par le CCNI lors de la mise à jour des recommandations sur les vaccins contre le VPH.
Méthodes : Afin de déterminer les données probantes pertinentes, les examens systématiques existants ont été exploités dans la mesure du possible. Les études individuelles ont fait l'objet d'une évaluation critique et la méthodologie GRADE (Grading of Recommendations Assessment, Development and Evaluation) a été utilisée pour évaluer la certitude des données probantes.
Résultats : Les données probantes disponibles suggèrent qu'un calendrier de vaccination contre le VPH à une, deux ou trois doses peut fournir une protection semblable contre l'infection par le VPH. Bien que les niveaux d'anticorps contre les types de vaccins contre le VPH soient statistiquement considérablement plus faibles avec une dose unique qu'avec deux ou trois doses, les titres se maintiennent jusqu'à 16 ans. La signification clinique de titres d'anticorps plus faibles est inconnue, car il n'existe pas de corrélat immunologique établi de la protection.
Conclusion : Bien que les données probantes disponibles sur les calendriers de vaccination contre le VPH à dose unique montrent qu'un tel calendrier soit très efficace, un suivi continu des cohortes à dose unique sera essentiel pour comprendre la durée relative de la protection pour les calendriers à dose réduite et pour orienter les futures directives du CCNI sur les vaccins contre le VPH.
Introduction
Les infections par le papillomavirus humain (VPH) sont à l'origine de plusieurs cancers, dont la quasi-totalité des cancers du col de l'utérus, d'autres cancers anogénitaux, ainsi que des cancers de la tête et du cou et des verrues anogénitales (VAG) Note de bas de page 1Note de bas de page 2. Les vaccins contre le VPH ont été autorisés pour la première fois en 2006 et se sont révélés très efficaces Note de bas de page 3Note de bas de page 4. Au Canada, un calendrier à deux ou trois doses est recommandé pour les personnes en bonne santé de 9 à 14 ans, et un calendrier à trois doses est recommandé pour les personnes en bonne santé de 15 ans et plus, ainsi que pour les personnes immunodéprimées Note de bas de page 5. Récemment, l'Organisation mondiale de la Santé (OMS) a publié un document de synthèse actualisé sur les calendriers de vaccination contre le VPH, précisant que si un calendrier à deux doses est recommandé pour les personnes de plus de 9 ans, un autre calendrier à dose unique non officiellement approuvé peut être utilisé pour les personnes de 9 à 20 ans Note de bas de page 6. Plusieurs autres pays, comme le Royaume-Uni, ont depuis mis à jour leurs recommandations en matière de vaccination contre le VPH pour y inclure un calendrier à dose unique Note de bas de page 7Note de bas de page 8Note de bas de page 9. Cette mise à jour des recommandations s'appuie sur plusieurs facteurs, notamment sur des données probantes émergentes indiquant qu'une dose unique de vaccin contre le VPH confère des niveaux de protection semblables à ceux des calendriers à doses multiples Note de bas de page 10.
Les provinces et territoires canadiens ont demandé au Comité consultatif national de l'immunisation (CCNI) d'examiner les données probantes disponibles et d'éventuellement fournir des directives actualisées sur les calendriers réduits de vaccination contre le VPH. L'Agence de la santé publique du Canada (l'Agence) a préparé cet aperçu afin d'examiner les données probantes cliniques disponibles sur les calendriers réduits de vaccination contre le VPH (en mettant l'accent sur les calendriers à dose unique), dans le but de contribuer à l'élaboration de recommandations fondées sur des données probantes par le CCNI et à la prise de décisions pour les programmes de vaccination au Canada.
Méthodes
Le tableau 1 présente les critères d'admissibilité des études incluses dans cette analyse. Afin de déterminer les études pertinentes, une mise à jour d'un examen systématique de 2022 Note de bas de page 10 réalisée par Cochrane Response en collaboration avec le Groupe stratégique consultatif d'experts sur la vaccination (SAGE) (qui était elle-même une mise à jour modifiée d'un précédent examen de Cochrane Response Note de bas de page 11) a été effectuée. La recherche de la littérature actualisée a permis de recenser toute étude supplémentaire publiée depuis 2022 ou toute donnée actualisée disponible dans les études incluses (e.g., les publications récentes et les comptes rendus de conférences internationales).
| Critère | Admissibilité (une vs deux ou trois doses) |
Admissibilité (deux vs trois doses) |
|---|---|---|
Population |
9 ans et plus |
|
Intervention |
Une dose de GARDASIL®9 ou de CERVARIX®. En raison des limites des données probantes (e.g., durée de suivi limitée) concernant GARDASIL®9, les données probantes indirectes provenant d'études utilisant GARDASIL®4 ont également été prises en compte. |
Deux doses de GARDASIL®9 ou de CERVARIX®. En raison des limites des données probantes (e.g., durée de suivi limitée) concernant GARDASIL®9, les données probantes indirectes provenant d'études utilisant GARDASIL®4 ont également été prises en compte. |
Comparator |
Deux ou trois doses de GARDASIL®9 ou de CERVARIX®(avec un intervalle d'au moins six mois entre la première et la dernière dose de la série). En raison des limites des données probantes (e.g., durée de suivi limitée) concernant GARDASIL®9, les données probantes indirectes provenant d'études utilisant GARDASIL®4 ont également été prises en compte. Remarque : Bien qu'elles ne comparent pas directement le bénéfice clinique des vaccins contre le VPH en fonction du nombre de doses, les études évaluant l'immunogénicité ou l'efficacité potentielle ou réelle d'un calendrier de vaccination à dose unique par rapport à l'absence de vaccination ont également été incluses. |
Trois doses de GARDASIL®9 ou de CERVARIX®. En raison des limites des données probantes (e.g., durée de suivi limitée) concernant GARDASIL®9, les données probantes indirectes provenant d'études utilisant GARDASIL®4 ont également été prises en compte. |
Résultats |
Résultats jugés critiques pour la prise de décision (jugés d'égale criticité) :
Résultats jugés importants pour la prise de décision (jugés d'égale importance) :
|
|
Devis d'étude |
Essais contrôlés randomisés, essais non randomisés et études d'observation. Les études d'observation présentant un risque de biais grave ou critique ont été exclues. |
|
Pour les analyses comparant une dose unique à zéro, deux ou trois doses, la méthodologie GRADE (Grading of Recommendations Assessment, Development and Evaluation) Note de bas de page 12 a été utilisée pour évaluer les données probantes disponibles prises en compte par le CCNI lors de l'élaboration des directives. Après l'évaluation critique des études individuelles, des tableaux récapitulatifs ont été préparés avec des évaluations de la certitude des données probantes en utilisant la méthodologie GRADE. Pour les analyses comparant un calendrier vaccinal contre le VPH à deux doses à un calendrier vaccinal à trois doses, une méthodologie fondée sur AMSTAR 2 (A MeaSurement Tool to Assess systematic Reviews) Note de bas de page 13 a été utilisée pour évaluer les données probantes disponibles prises en compte par le CCNI lors de l'élaboration des directives. Des renseignements détaillés sur la méthodologie utilisée pour la mise à jour de cette étude sont disponibles ailleurs (en anglais seulement).
Résultats
Efficacité potentielle et efficacité réelle contre l'infection à VPH
Une évaluation GRADE des données probantes disponibles issues d'essais contrôlés randomisés (ECR) a conclu qu'un calendrier de vaccination contre le VPH à dose unique entraînait une forte réduction des infections persistantes par rapport à l'absence de vaccin (degré élevé de certitude des données probantes; tableau 2). Actuellement, l'essai KEN SHE (KENya Single-dose HPV-vaccine Efficacy) est le seul ECR démontrant l'efficacité potentielle d'un calendrier à dose unique Note de bas de page 14. Cette étude a randomisé des femmes de 15 à 20 ans (n = 2 275) pour qu'elles reçoivent une dose de GARDASIL®9, de CERVARIX®ou de vaccin contre le méningocoque. Après trois ans de suivi, l'efficacité réelle du vaccin (ER) contre les infections persistantes à VPH16/18 était de 97,5 % (IC à 95 % : 90,0 %–99,4 %) et 98,8 % (IC à 95 % : 91,3 %–99,8 %) pour GARDASIL®9 et CERVARIX®, respectivement. Des résultats semblables ont été observés dans les données probantes non randomisées, une dose unique entraînant probablement une réduction des infections persistantes Note de bas de page 15Note de bas de page 16, incidentes Note de bas de page 16Note de bas de page 17 et prévalentes Note de bas de page 17Note de bas de page 18 à VPH par rapport à l'absence de vaccination (certitude modérée des données probantes; tableau 2, figure 1).
| Nombre d'études | Devis d'étude | Nombre d'événements/nombre de participants | Effet | Certitude des données probantes | Commentaires | ||
|---|---|---|---|---|---|---|---|
| Aucune dose | Une dose | Effet relatif (IC à 95 %) |
Effet absolu (IC à 95 %) |
||||
| Infection persistante à VPH avec des types de vaccins (suivi de 3 à 10 ans) | |||||||
| 1 Note de bas de page 14 | ECRTableau 2 note de bas de page a | 72/757 (9,5 %) | 3/1 518 (0,2 %) | RR 0,02 (0,01–0,07) |
94 de moins pour 1 000 (de 94 de moins à 88 de moins) | Élevée | Une dose unique de vaccin contre le VPH entraîne une forte réduction des infections persistantes par le VPH par rapport à l'absence de vaccin |
| 2 Note de bas de page 15Note de bas de page 16 | Analyse a posteriori de l'ECR | Un faible nombre d'événements dans les groupes d'intervention dans l'ensemble des études (n = 292–2 135); une ER élevée a été estimée dans chaque étudeTableau 2 note de bas de page b | ModéréeTableau 2 note de bas de page c | Une dose unique de vaccin contre le VPH entraîne probablement une forte réduction des infections persistantes par le VPH par rapport à l'absence de vaccin | |||
| Infection prévalente à VPH avec des types de vaccins (suivi de 6 à 11 ans) | |||||||
| 2 Note de bas de page 17Note de bas de page 18 | Une analyse a posteriori de l'ECR, une étude d'observation | Un faible nombre d'événements dans les groupes d'intervention dans toutes les études (n = 87–221); des réductions importantes de la prévalence de l'infection associées à une dose unique dans chaque étudeTableau 2 note de bas de page d | ModéréeTableau 2 note de bas de page c | Une dose unique de vaccin contre le VPH entraîne probablement une réduction des infections prévalentes par le VPH par rapport à l'absence de vaccin | |||
| Infection incidente à VPH avec des types de vaccins (suivi de 10 à 11 ans) | |||||||
| 2 Note de bas de page 16Note de bas de page 17 | Analyse a posteriori de l'ECR | Le nombre d'événements varie d'une étude à l'autre (n = 112–2 858), toutefois, des réductions semblables du risque par rapport aux personnes non vaccinées ont été observéesTableau 2 note de bas de page e | ModéréeTableau 2 note de bas de page c | Une dose unique de vaccin contre le VPH entraîne probablement une réduction des infections incidentes par le VPH par rapport à l'absence de vaccin | |||
| Titres d'anticorps (suivi de 4 à 10 ans) | |||||||
| 3 Note de bas de page 18Note de bas de page 19Note de bas de page 20 | Étude d'observation | Nombre variable de participants dans chaque étude (n = 30–324), avec des durées de suivi et des amplitudes d'effet différentes d'une étude à l'autre. Cependant, la direction de l'effet était cohérente d'une étude à l'autreTableau 2 note de bas de page f | Élevée | Une dose unique de vaccin contre le VPH entraîne une réponse immunitaire accrue par rapport à l'absence de vaccin | |||
| Verrues anogénitales (suivi d'environ 2,5 ans) | |||||||
| 1 Note de bas de page 21 | Étude d'observation | 523/52 779 (1,0 %) | 69/9 898 (0,7 %) | RRIaTableau 2 note de bas de page g 0,32 (0,20–0,52) |
7 de moins pour 1 000 (de 8 de moins à 5 de moins) | ModéréeTableau 2 note de bas de page h | Une dose unique de vaccin contre le VPH réduit probablement le risque de verrues anogénitales par rapport à l'absence de vaccin |
| Papillomatose respiratoire récurrente d'apparition juvénile | |||||||
| s.o. | s.o. | s.o. | s.o. | s.o. | s.o. | s.o. | s.o. |
Figure 1 : Rapports de risque et IC à 95 % pour les infections à VPH persistantes, prévalentes et incidentes de type vaccinale, une dose unique comparée à aucune doseFigure 1 note de bas de page aFigure 1 note de bas de page bFigure 1 note de bas de page cFigure 1 note de bas de page dFigure 1 note de bas de page eFigure 1 note de bas de page fFigure 1 note de bas de page gFigure 1 note de bas de page hFigure 1 note de bas de page iFigure 1 note de bas de page j

Figure 1 - Équivalent textuel
Les études sont réparties dans un tableau en fonction du type d'infection (persistante, prévalente ou incidente) et de la conception de l'étude (i.e., ECR ou non).
Le graphique en forêt illustre le rapport de risque (RR) et l'IC à 95 % des études individuelles.
Cette figure se compose d'un tableau résumant les caractéristiques des études portant sur le risque d'infection par le VPH, d'un graphique en forêt représentant le rapport de risque et d'un graphique représentant le risque de biais pour chaque étude.
| Nom de l'étude | Événements/total 1 dose |
Événements/total 0 dose |
Rapport de risques | Limite inférieure | Limite supérieure |
|---|---|---|---|---|---|
| Infections persistantes, données probantes issues d'ECR | |||||
| Barnabas et al.Figure 1 note de bas de page aFigure 1 note de bas de page b | 3/1 518 | 72/757 | 0,02 | 0,01 | 0,07 |
| Infections persistantes, données probantes non issues d'ECR | |||||
| Basu et al.Figure 1 note de bas de page cFigure 1 note de bas de page d | 2/2 135 | 35/1 265 | 0,03 | 0,01 | 0,14 |
| Kreimer et al.Figure 1 note de bas de page eFigure 1 note de bas de page f | 1/292 | 17/249 | 0,05 | 0,01 | 0,37 |
| Infections incidentes, données probantes non issues d'ECR | |||||
| Kreimer et al.Figure 1 note de bas de page g | 2/112 | 69/1 783 | 0,46 | 0,11 | 1,86 |
| Basu et al.Figure 1 note de bas de page h | 154/2 858 | 192/1 479 | 0,42 | 0,34 | 0,51 |
| Infections prévalentes, données probantes non issues d'ECR | |||||
| Kreimer et al.Figure 1 note de bas de page i | 2/112 | 178/1 783 | 0,18 | 0,04 | 0,71 |
| Batmunkh et al.Figure 1 note de bas de page j | 1/87 | 41/266 | 0,07 | 0,01 | 0,53 |
Pour Barnabas et al., le risque de biais a été jugé modéré en raison de données manquantes sur les résultats. Pour Basu et al., le risque de biais a été jugé modéré en raison des facteurs de confusion et de la sélection des résultats rapportés. Pour Kreimer et al. (2015), le risque de biais a été jugé modéré en raison des facteurs de confusion et de données manquantes. Pour Kreimer et al. (2020), le risque de biais a été jugé modéré en raison des facteurs de confusion et de la sélection des résultats rapportés. Pour Batmunkh et al., le risque de biais a été jugé modéré en raison des facteurs de confusion, de la sélection des participants à l'étude et de la sélection des résultats rapportés.
Une évaluation GRADE des données probantes disponibles a conclu que, par rapport à deux ou trois doses, un calendrier vaccinal à dose unique pourrait ne présenter qu'un faible risque d'infection persistante, incidente ou prévalente par le VPH, ou aucun risque (faible certitude des données, tableau 3 et tableau 4, figure 2 et figure 3). Deux ECR évaluant l'efficacité réelle d'un calendrier de vaccination contre le VPH en deux ou trois doses ont réalisé des analyses a posteriori pour estimer également l'ER d'un calendrier à dose unique, les deux études faisant état d'une ER semblable pour tous les calendriers de vaccination, jusqu'à 10 Note de bas de page 16 ou 11 ans Note de bas de page 17(faible certitude des données probantes; tableau 3 et tableau 4, figure 2 et figure 3).
| Nombre d'études | Devis d'étude | Nombre d'événements/nombre de participants | Effet | Certitude des données probantes | Commentaires | ||
|---|---|---|---|---|---|---|---|
| Deux doses | Une dose | Effet relatif (IC à 95 %) |
Effet absolu (IC à 95 %) |
||||
| Infection persistante à VPH avec des types de vaccins (suivi de 4 à 10 ans) | |||||||
| 2 Note de bas de page 15Note de bas de page 16 | Analyse a posteriori de l'ECR | Un faible nombre d'événements dans les groupes d'intervention (n = 292–2 135) et témoins (n = 611–1 452) dans l'ensemble des études; ER élevée estimée pour les deux groupes dans chaque étudeTableau 3 note de bas de page a | FaibleTableau 3 note de bas de page bTableau 3 note de bas de page c | Une dose unique de vaccin contre le VPH peut n'entraîner que peu ou aucune différence dans les infections persistantes par le VPH par rapport à deux doses | |||
| Infection prévalente à VPH et types de vaccins (suivi de 11 ans) | |||||||
| 1 Note de bas de page 17 | Analyse a posteriori de l'ECR | 1/62 (1,6 %) | 2/112 (1,8 %) | RR 1,11 (0,10–11,97) |
2 de plus pour 1 000 (15 de moins à 177 de plus) | FaibleTableau 3 note de bas de page dTableau 3 note de bas de page e | Une dose unique de vaccin contre le VPH peut n'entraîner que peu ou aucune différence dans les infections prévalentes par le VPH par rapport à deux doses |
| Infection incidente à VPH avec des types de vaccins (suivi de 10 à 11 ans) | |||||||
| 2 Note de bas de page 16Note de bas de page 17 | Analyse a posteriori de l'ECR | Le nombre d'événements varie d'une étude à l'autre (n [une dose] = 112–2 858; n [deux doses] = 62–2 166), car le risque de référence des événements varie d'une étude à l'autre. Toutefois, les estimations de l'ER pour chaque groupe sont semblables d'une étude à l'autreTableau 3 note de bas de page f | FaibleTableau 3 note de bas de page dTableau 3 note de bas de page e | Une dose unique de vaccin contre le VPH peut n'entraîner que peu ou aucune différence dans les infections incidentes par le VPH par rapport à deux doses | |||
| Titres d'anticorps (suivi de 2 à 16 ans) | |||||||
| 1 Note de bas de page 22 | ECR | 310 | 310 | Ratio des MGT allant de 0,11 (0,09–0,14) à 0,21 (0,16–0,26) | s.o. | Élevée | Une dose unique de vaccin contre le VPH entraîne une réponse immunitaire plus faible par rapport à deux doses |
| 2 Note de bas de page 21Note de bas de page 23 | Analyse a posteriori de l'ECR | Nombre de participants différent entre les groupes d'intervention et témoins, dans toutes les études. Toutefois, l'ampleur et la direction de l'effet sont cohérentes dans toutes les études | Élevée | Une dose unique de vaccin contre le VPH entraîne une réponse immunitaire plus faible par rapport à deux doses | |||
| Anomalies histologiques et cytologiques (suivi de 10 ans) | |||||||
| 1 Note de bas de page 16 | Analyse a posteriori de l'ECR | 1/1 128 (0,9 %) | 4/1 511 (2,6 %) | RR 2,99 (0,33–26,80) |
2 de plus pour 1 000 (1 de moins à 23 de plus) | FaibleTableau 3 note de bas de page bTableau 3 note de bas de page e | Une dose unique de vaccin contre le VPH peut n'entraîner que peu ou aucune différence dans les anomalies du col de l'utérus par rapport à deux doses |
| CIN2+ (suivi de 10 ans) | |||||||
| 1 Note de bas de page 16 | Analyse a posteriori de l'ECR | 0/1 128 (0 %) | 0/1 511 (0 %) | Non estimable | Non estimable | FaibleTableau 3 note de bas de page bTableau 3 note de bas de page g | Une dose unique de vaccin contre le VPH peut n'entraîner que peu ou aucune différence dans la CIN2 par rapport à deux doses |
| Cancer associé au VPH (suivi de 10 ans) | |||||||
| 1 Note de bas de page 16 | Analyse a posteriori de l'ECR | 0/1 128 (0 %) | 0/1 511 (0 %) | Non estimable | Non estimable | Très faibleTableau 3 note de bas de page bTableau 3 note de bas de page hTableau 3 note de bas de page i | Données insuffisantes pour déterminer l'association |
| Verrues anogénitales (suivi d'environ 2,5 ans) | |||||||
| 1 Note de bas de page 21 | Étude d'observation | 42/8 046 (0,5 %) | 69/9 898 (0,7 %) | RRIaTableau 3 note de bas de page j 0,74 (0,35–1,60) |
2 de plus pour 1 000 (5 de moins à 4 de plus) | FaibleTableau 3 note de bas de page eTableau 3 note de bas de page k | Une dose unique de vaccin contre le VPH peut n'entraîner que peu ou aucune différence dans le risque de verrues anogénitales par rapport à deux doses |
| Papillomatose respiratoire récurrente d'apparition juvénile | |||||||
| s.o. | s.o. | s.o. | s.o. | s.o. | s.o. | s.o. | s.o. |
| Nombre d'études | Devis d'étude | Nombre d'événements/nombre de participants | Effet | Certitude des données probantes | Commentaires | ||
|---|---|---|---|---|---|---|---|
| Trois doses | Une dose | Effet relatif (IC à 95 %) |
Effet absolu (IC à 95 %) |
||||
| Infection persistante à VPH avec des types de vaccins (suivi de 4 à 10 ans) | |||||||
| 2 Note de bas de page 15Note de bas de page 16 | Analyse a posteriori de l'ECR | Un faible nombre d'événements dans les groupes d'intervention (n = 292–2 135) et témoins (n = 1 460–11 104) dans l'ensemble des études; ER élevée estimée pour les deux groupes dans chaque étudeTableau 4 note de bas de page a | FaibleTableau 4 note de bas de page bTableau 4 note de bas de page c | Une dose unique de vaccin contre le VPH peut n'entraîner que peu ou aucune différence dans les infections persistantes par le VPH par rapport à trois doses | |||
| Infection prévalente à VPH et types de vaccins (suivi de 11 ans) | |||||||
| 1 Note de bas de page 17 | Analyse a posteriori de l'ECR | 27/1 365 (2,0 %) | 2/112 (1,8 %) | RR 0,90 (0,22–3,75) |
2 de moins pour 1 000 (15 de moins à 54 de plus) | FaibleTableau 4 note de bas de page dTableau 4 note de bas de page e | Une dose unique de vaccin contre le VPH peut n'entraîner que peu ou aucune différence dans les infections prévalentes par le VPH par rapport à trois doses |
| Infection incidente à VPH avec des types de vaccins (suivi de 10 à 11 ans) | |||||||
| 2 Note de bas de page 16Note de bas de page 17 | Analyse a posteriori de l'ECR | Le nombre d'événements varie d'une étude à l'autre (n [une dose] = 112–2 858; n [deux doses] = 1 365–2 019), car le risque de référence des événements varie d'une étude à l'autreTableau 4 note de bas de page f | FaibleTableau 4 note de bas de page dTableau 4 note de bas de page e | Une dose unique de vaccin contre le VPH peut n'entraîner que peu ou aucune différence dans les infections incidentes par le VPH par rapport à trois doses | |||
| Titres d'anticorps (suivi de 2 à 16 ans) | |||||||
| 1 Note de bas de page 22 | ECR | 310 | 310 | Ratio des MGT allant de 0,06 (0,05–0,07) à 0,19 (0,15–0,24) | s.o. | Élevée | Une dose unique de vaccin contre le VPH entraîne une réponse immunitaire plus faible par rapport à trois doses |
| 2 Note de bas de page 21Note de bas de page 23 | Analyse a posteriori de l'ECR | Nombre de participants différent entre les groupes d'intervention et témoins, dans toutes les études. Toutefois, l'ampleur et la direction de l'effet sont cohérentes dans toutes les études | Élevée | Une dose unique de vaccin contre le VPH entraîne une réponse immunitaire plus faible par rapport à trois doses | |||
| Anomalies histologiques et cytologiques (suivi de 10 ans) | |||||||
| 1 Note de bas de page 16 | Analyse a posteriori de l'ECR | 1/1 037 (0,9 %) | 4/1 511 (2,6 %) | RR 2,75 (0,31–24,53) |
2 de plus pour 1 000 (1 de moins à 23 de plus) | FaibleTableau 4 note de bas de page bTableau 4 note de bas de page e | Une dose unique de vaccin contre le VPH peut n'entraîner que peu ou aucune différence dans les anomalies du col de l'utérus par rapport à trois doses |
| CIN2+ (suivi de 10 ans) | |||||||
| 1 Note de bas de page 16 | Analyse a posteriori de l'ECR | 0/1 037 (0 %) | 0/1 511 (0 %) | Non estimable | Non estimable | FaibleTableau 4 note de bas de page bTableau 4 note de bas de page g | Une dose unique de vaccin contre le VPH peut n'entraîner que peu ou aucune différence dans la CIN2 par rapport à trois doses |
| Cancer associé au VPH (suivi de 10 ans) | |||||||
| 1 Note de bas de page 16 | Analyse a posteriori de l'ECR | 0/1 037 (0 %) | 0/1 511 (0 %) | Non estimable | Non estimable | Très faibleTableau 4 note de bas de page bTableau 4 note de bas de page hTableau 4 note de bas de page i | Données insuffisantes pour déterminer l'association |
| Verrues anogénitales (suivi d'environ 2,5 ans) | |||||||
| 1 Note de bas de page 21 | Étude d'observation | 91/57 287 (0,2 %) | 69/9 898 (0,7 %) | RRIaTableau 4 note de bas de page j 0,63 (0,37–1,09) |
3 de plus pour 1 000 (1 de moins à 4 de plus) | LowTableau 4 note de bas de page eTableau 4 note de bas de page k | Une dose unique de vaccin contre le VPH peut n'entraîner que peu ou aucune différence dans le risque de verrues anogénitales par rapport à trois doses |
| Papillomatose respiratoire récurrente d'apparition juvénile | |||||||
| s.o. | s.o. | s.o. | s.o. | s.o. | s.o. | s.o. | s.o. |
Figure 2 : Rapports de risque et IC à 95 % pour les infections à VPH persistantes, prévalentes et incidentes de type vaccinal, une dose unique comparée à deux ou trois dosesFigure 2 note de bas de page aFigure 2 note de bas de page bFigure 2 note de bas de page cFigure 2 note de bas de page dFigure 2 note de bas de page e
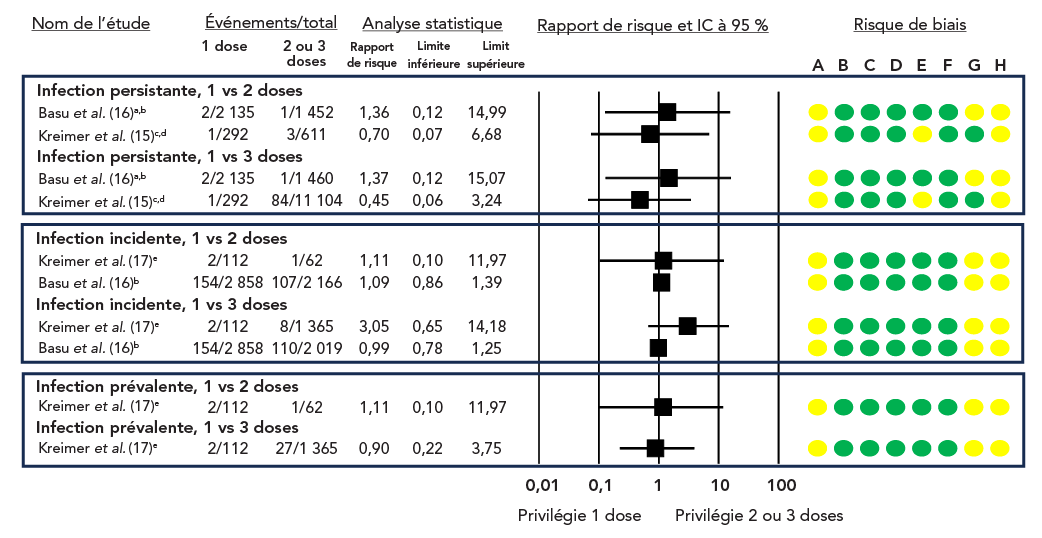
Figure 2 - Équivalent textuel
Les études sont réparties dans un tableau en fonction du type d'infection (persistante, prévalente ou incidente) et de la comparaison (1 dose vs 2 doses ou 1 dose vs 3 doses).
Le graphique en forêt illustre le rapport de risque (RR) et l'IC à 95 % des études individuelles.
Cette figure se compose d'un tableau résumant les caractéristiques des études portant sur le risque d'infection par le VPH, d'un graphique en forêt représentant le rapport de risque et d'un graphique représentant le risque de biais pour chaque étude.
| Nom de l'étude | Événements/total 1 dose |
Événements/total 2 ou 3 doses |
Rapport de risques | Limite inférieure | Limite supérieure |
|---|---|---|---|---|---|
| Infections persistantes, 1 vs 2 doses | |||||
| Basu et al.Figure 2 note de bas de page aFigure 2 note de bas de page b | 2/2 135 | 1/1 452 | 1,36 | 0,12 | 14,99 |
| Kreimer et al.Figure 2 note de bas de page cFigure 2 note de bas de page d | 1/292 | 3/611 | 0,70 | 0,07 | 6,68 |
| Infections persistantes, 1 vs 3 doses | |||||
| Basu et al.Figure 2 note de bas de page aFigure 2 note de bas de page b | 2/2 135 | 1/1 460 | 1,37 | 0,12 | 15,07 |
| Kreimer et al.Figure 2 note de bas de page cFigure 2 note de bas de page d | 1/292 | 84/11 104 | 0,45 | 0,06 | 3,24 |
| Infections incidentes, 1 vs 2 doses | |||||
| Kreimer et al.Figure 2 note de bas de page e | 2/112 | 1/62 | 1,11 | 0,10 | 11,97 |
| Basu et al.Figure 2 note de bas de page d | 154/2 858 | 107/2 166 | 1,09 | 0,86 | 1,39 |
| Infections incidentes, 1 vs 3 doses | |||||
| Kreimer et al.Figure 2 note de bas de page e | 2/112 | 8/1 365 | 3,05 | 0,65 | 14,18 |
| Basu et al.Figure 2 note de bas de page b | 154/2 858 | 110/2 019 | 0,99 | 0,78 | 1,25 |
| Infections prévalentes, 1 vs 2 doses | |||||
| Kreimer et al.Figure 2 note de bas de page e | 2/112 | 1/62 | 1,11 | 0,10 | 11,97 |
| Infections prévalentes, 1 vs 3 doses | |||||
| Kreimer et al.Figure 2 note de bas de page e | 2/112 | 27/1 365 | 0,90 | 0,22 | 3,75 |
Pour Basu et al., le risque de biais a été jugé modéré en raison des facteurs de confusion et de la sélection des résultats rapportés. Pour Kreimer et al. (2015), le risque de biais a été jugé modéré en raison des facteurs de confusion et de données manquantes. Pour Kreimer et al. (2020), le risque de biais a été jugé modéré en raison des facteurs de confusion et de la sélection des résultats rapportés.
Figure 3 : Rapports de risque et IC à 95 % pour les infections persistantes, prévalentes et incidentes à VPH, comparaison entre deux doses et trois dosesFigure 3 note de bas de page aFigure 3 note de bas de page bFigure 3 note de bas de page cFigure 3 note de bas de page dFigure 3 note de bas de page e
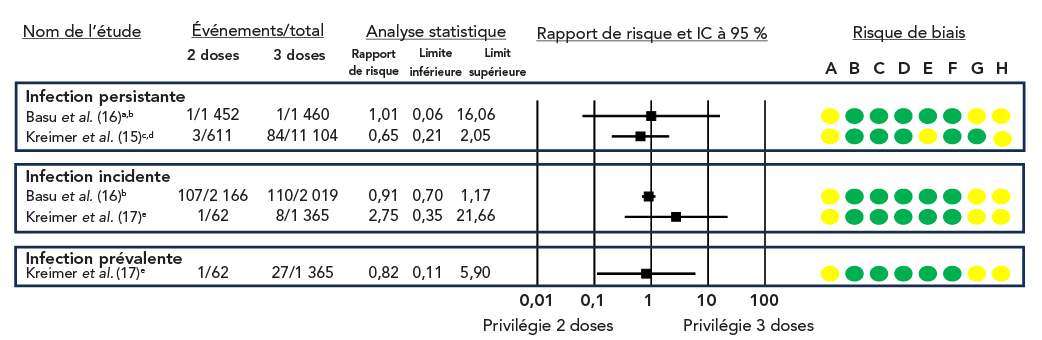
Figure 3 - Équivalent textuel
Les études sont réparties dans un tableau selon le type d'infection (persistante, prévalente ou incidente).
Le graphique en forêt illustre le rapport de risque (RR) et l'IC à 95 % des études individuelles.
Cette figure se compose d'un tableau résumant les caractéristiques des études portant sur le risque d'infection par le VPH, d'un graphique en forêt représentant le rapport de risque et d'un graphique représentant le risque de biais pour chaque étude.
| Nom de l'étude | Événements/total 2 doses |
Événements/total 3 doses |
Rapport de risques | Limite inférieure | Limite supérieure |
|---|---|---|---|---|---|
| Infections persistantes | |||||
| Basu et al.Figure 3 note de bas de page aFigure 3 note de bas de page b | 1/1 452 | 1/1 460 | 1,01 | 0,06 | 16,06 |
| Kreimer et al.Figure 3 note de bas de page cFigure 3 note de bas de page d | 3/611 | 84/11 104 | 0,65 | 0,21 | 2,05 |
| Infections incidentes | |||||
| Basu et al.Figure 3 note de bas de page b | 107/2 166 | 110/2 019 | 0,91 | 0,70 | 1,17 |
| Kreimer et al.Figure 3 note de bas de page e | 1/62 | 8/1 365 | 2,75 | 0,35 | 21,66 |
| Infections prévalentes | |||||
| Kreimer et al.Figure 3 note de bas de page e | 1/62 | 27/1 365 | 0,82 | 0,11 | 5,90 |
Pour Basu et al., le risque de biais a été jugé modéré en raison des facteurs de confusion et de la sélection des résultats rapportés. Pour Kreimer et al. (2015), le risque de biais a été jugé modéré en raison des facteurs de confusion et de données manquantes. Pour Kreimer et al. (2020), le risque de biais a été jugé modéré en raison des facteurs de confusion et de la sélection des résultats rapportés.
L'essai de vaccination au Costa Rica (CVT) a été conçu au départ pour tester l'efficacité d'un calendrier à trois doses de CERVARIX®chez les femmes de 18 à 25 ans (par rapport à un vaccin témoin contre l'hépatite A). Cependant, environ 20 % des participantes n'ont pas terminé leur calendrier à trois doses, principalement en raison d'une grossesse ou d'un renvoi pour colposcopie, créant ainsi des cohortes qui ont reçu un calendrier à dose unique ou à deux doses. Après 11 ans de suivi, l'ER contre l'infection prévalente à VPH16/18 était semblable chez les personnes ayant reçu une dose unique (82,1 %; IC à 95 % : 40,2 %–97,0 %), deux doses (83,8 %; IC à 95 % : 19,5 %–99,2 %) ou trois doses (80,2 %; IC à 95 % : 70,7 %–87,0 %) Note de bas de page 17.
Des résultats semblables ont également été observés dans l'étude du Centre international de recherche sur le cancer (CIRC) en Inde, qui avait été conçue au départ pour comparer deux et trois doses de GARDASIL®chez des jeunes filles de 10 à 18 ans. Toutefois, de nombreuses participantes n'ont pas suivi l'intégralité du calendrier vaccinal, le gouvernement indien ayant suspendu en 2010 le recrutement de jeunes filles pour les essais sur le VPH. L'efficacité réelle du vaccin contre l'infection persistante à VPH16/18 était semblable chez les femmes ayant reçu une dose unique (95,4 %; IC à 95 % : 85 %–99,1 %), deux doses (93,1 %; IC à 95 % : 77,3 %–99,8 %) ou trois doses (93,3 %; IC à 95 % : 77,5 %–99,7 %) après 10 ans de suivi Note de bas de page 16.
Efficacités potentielle et réelle contre les lésions précancéreuses du col de l'utérus
Parmi les études incluses, seul l'essai du CIRC Note de bas de page 16 a fourni des données sur l'effet des différents calendriers de vaccination contre le VPH sur les lésions précancéreuses du col de l'utérus et les cancers liés au VPH. Après 10 ans de suivi, 16/4 626 (0,3 %) des femmes non vaccinées ont présenté une néoplasie cervicale intra-épithéliale (CIN) de grade 1, contre 4/1 511 (0,3 %), 1/1 128 (0,1 %) et 1/1 037 (0,1 %) dans les groupes ayant reçu une dose unique, deux doses et trois doses, respectivement. Aucun cas de CIN2 ou plus n'a été observé dans les groupes vaccinés, quel que soit le nombre de doses reçues, alors que 5/4 626 femmes (0,1 %) du groupe non vacciné ont présenté une CIN2 ou plus importante. De plus, aucun cas de cancer lié au VPH n'a été observé dans aucun des groupes.
Une évaluation GRADE des données probantes disponibles a conclu qu'il pourrait y avoir peu ou aucune différence dans les risques d'anomalies du col de l'utérus ou de CIN2+ entre les calendriers à dose unique et les calendriers à deux ou trois doses (faible certitude des données probantes; tableau 3 et tableau 4).
Efficacités potentielle et réelle contre les verrues anogénitales
Il n'existe actuellement aucune donnée probante d'essai clinique comparant l'effet d'une dose unique à celui de deux ou trois doses sur le risque de VAG. Cependant, une étude d'observation menée aux États-Unis (n = 64 517) a comparé le risque de VAG chez les participantes ayant reçu une dose unique à celles n'ayant reçu aucune dose, deux doses ou trois doses de GARDASIL®Note de bas de page 21. Les taux d'incidence pondérés par le score de propension étaient de 761,9 (IC à 95 % : 685,5–849,1), 256,6 (IC à 95 % : 161,8–432,3), 194,2 (IC à 95 % : 108,0–386,4) et 161,8 (IC à 95 % : 124,4–214,6) pour 100 000 années-personnes dans les groupes non vaccinés, avec une, deux et trois doses, respectivement. Les rapports de risque (RR) pondérés par le score de propension n'ont montré aucune différence statistiquement importante entre les groupes, avec des RR de 0,74 (IC à 95 % : 0,35–1,60) et 0,63 (IC à 95 % : 0,37–1,09) pour deux et trois doses (par rapport à une), respectivement (aucune comparaison directe entre les groupes à deux et trois doses).
Une évaluation GRADE des données probantes disponibles a conclu qu'une dose unique de vaccin contre le VPH réduit probablement le risque de VAG par rapport à l'absence de vaccin (certitude modérée des données probantes; tableau 2), et qu'il peut n'y avoir que peu ou aucune différence de risque par rapport à un calendrier à deux ou trois doses (certitude faible des données probantes; tableau 3 et tableau 4).
Titres d'anticorps
Une évaluation GRADE des données probantes disponibles a conclu qu'une dose unique de vaccin contre le VPH entraîne une réponse immunitaire accrue par rapport à l'absence de vaccin Note de bas de page 18Note de bas de page 19Note de bas de page 20 (degré de certitude élevé; tableau 2, figure 4), et une réponse immunitaire moindre par rapport à deux ou trois doses (degré de certitude élevé; tableau 3 et tableau 4, figure 5).
Figure 4 : Rapport des moyennes géométriques des titres et IC à 95 % de la comparaison entre une dose unique et aucune doseFigure 4 note de bas de page a
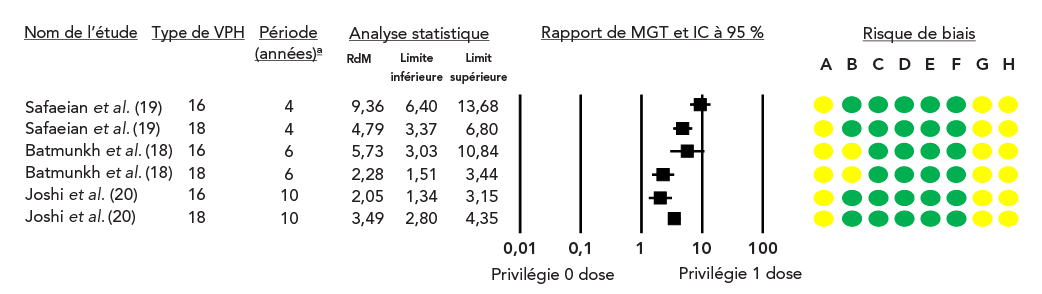
Figure 4 - Équivalent textuel
Les études sont présentées dans un tableau ci-dessous.
Le graphique en forêt illustre le rapport des MGT et l'IC à 95 % des études individuelles.
Cette figure se compose d'un tableau résumant les caractéristiques des études portant sur les MGT après la vaccination contre le VPH, d'un graphique en forêt représentant le rapport des MGT et d'un graphique représentant le risque de biais pour chaque étude.
| Nom de l'étude | Type de VPH | Période (années)Figure 4 note de bas de page a |
Rapport de MGT | Limite inférieure | Limite supérieure |
|---|---|---|---|---|---|
| Safaeian et al. | 16 | 4 | 9,36 | 6,40 | 13,68 |
| Safaeian et al. | 18 | 4 | 4,79 | 3,37 | 6,80 |
| Batmunkh et al. | 16 | 6 | 5,73 | 3,03 | 10,84 |
| Batmunkh et al. | 18 | 6 | 2,28 | 1,51 | 3,44 |
| Joshi et al. | 16 | 10 | 2,05 | 1,34 | 3,15 |
| Joshi et al. | 18 | 10 | 3,49 | 2,80 | 4,35 |
Pour Safaeian et al., le risque de biais a été jugé modéré en raison des facteurs de confusion et de la sélection des résultats rapportés. Pour Batmunkh et al., le risque de biais a été jugé modéré en raison des facteurs de confusion, de la sélection des participants à l'étude et de la sélection des résultats rapportés. Pour Joshi et al., le risque de biais a été jugé modéré en raison des facteurs de confusion et de la sélection des résultats rapportés.
Figure 5 : Rapport des moyennes géométriques des titres et IC à 95 % de la comparaison entre une dose unique et deux ou trois dosesFigure 5 note de bas de page a
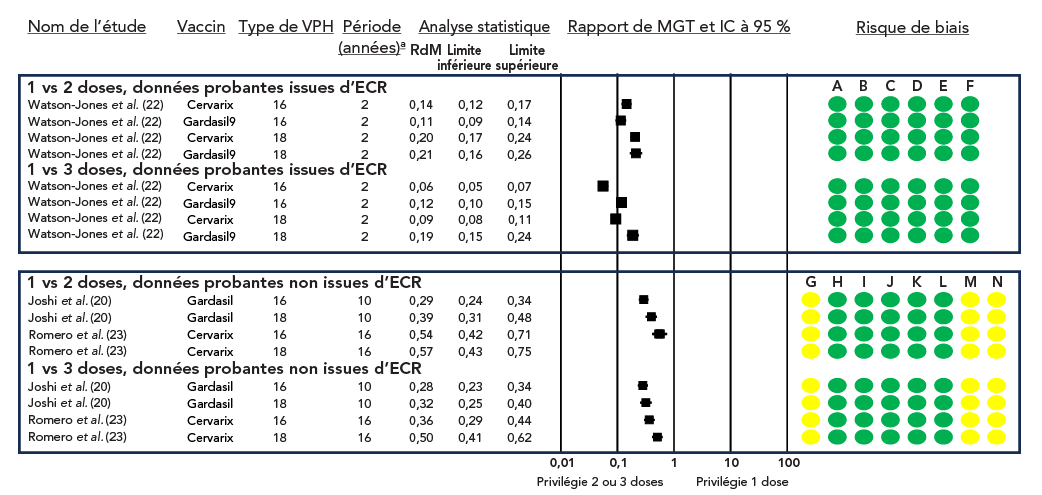
Figure 5 - Équivalent textuel
Les études sont réparties dans un tableau en fonction de la conception de l'étude (i.e., ECR ou non) et de la comparaison (1 dose vs 2 doses ou 1 dose vs 3 doses).
Le graphique en forêt illustre le rapport des MGT et l'IC à 95 % des études individuelles.
Cette figure se compose d'un tableau résumant les caractéristiques des études portant sur les MGT après la vaccination contre le VPH, d'un graphique en forêt représentant le rapport des MGT et d'un graphique représentant le risque de biais pour chaque étude.
| Nom de l'étude | Vaccin | Type de VPH | Période (années)Figure 5 note de bas de page a |
Rapport de MGT | Limite inférieure | Limite supérieure |
|---|---|---|---|---|---|---|
| 1 vs 2 doses, données probantes d'ECR | ||||||
| Watson-Jones et al. | Cervarix | 16 | 2 | 0,14 | 0,12 | 0,17 |
| Watson-Jones et al. | Gardasil9 | 16 | 2 | 0,11 | 0,09 | 0,14 |
| Watson-Jones et al. | Cervarix | 18 | 2 | 0,20 | 0,17 | 0,24 |
| Watson-Jones et al. | Gardasil9 | 18 | 2 | 0,21 | 0,16 | 0,26 |
| 1 vs 3 doses, données probantes issues d'ECR | ||||||
| Watson-Jones et al. | Cervarix | 16 | 2 | 0,06 | 0,05 | 0,07 |
| Watson-Jones et al. | Gardasil9 | 16 | 2 | 0,12 | 0,10 | 0,15 |
| Watson-Jones et al. | Cervarix | 18 | 2 | 0,09 | 0,08 | 0,11 |
| Watson-Jones et al. | Gardasil9 | 18 | 2 | 0,19 | 0,15 | 0,24 |
| 1 vs 2 doses, données probantes non issues d'ECR | ||||||
| Joshi et al. | Gardasil | 16 | 10 | 0,29 | 0,24 | 0,34 |
| Joshi et al. | Gardasil | 18 | 10 | 0,39 | 0,31 | 0,48 |
| Romero et al. | Cervarix | 16 | 16 | 0,54 | 0,42 | 0,71 |
| Romero et al. | Cervarix | 18 | 16 | 0,57 | 0,43 | 0,75 |
| 1 vs 3 doses, données probantes issues d'ECR | ||||||
| Joshi et al. | Gardasil | 16 | 10 | 0,28 | 0,23 | 0,34 |
| Joshi et al. | Gardasil | 18 | 10 | 0,32 | 0,25 | 0,40 |
| Romero et al. | Cervarix | 16 | 16 | 0,36 | 0,29 | 0,44 |
| Romero et al. | Cervarix | 18 | 16 | 0,50 | 0,41 | 0,62 |
Pour Watson-Jones et al., le risque de biais a été jugé faible. Pour Joshi et al., le risque de biais a été jugé modéré en raison des facteurs de confusion et de la sélection des résultats rapportés. Pour Romero et al., le risque de biais a été jugé modéré en raison des facteurs de confusion et de la sélection des résultats rapportés.
L'étude DoRIS (Dose Reduction Immunobridging and Safety study) menée en Tanzanie a randomisé des filles de 9 à 14 ans (n = 930) pour recevoir une, deux ou trois doses de CERVARIX®ou de GARDASIL®9 Note de bas de page 22. Les titres d'anticorps étaient statistiquement considérablement plus faibles chez les receveurs d'une dose que chez les receveurs de deux ou trois doses pour les deux vaccins (figure 5). Cependant, bien que des titres plus faibles aient été observés pour le calendrier à dose unique, la réponse en anticorps s'est maintenue au cours de la deuxième année (fin de l'étude). Chez les personnes ayant reçu deux doses de GARDASIL®9, les titres d'anticorps n'étaient pas inférieurs à ceux des personnes ayant reçu trois doses. Toutefois, ils étaient considérablement plus faibles (et la non-infériorité n'a pas été atteinte) chez les personnes ayant reçu deux doses de CERVARIX®(figure 6).
Figure 6 : Rapport des moyennes géométriques des titres et IC à 95 % de la comparaison entre deux doses et trois dosesFigure 6 note de bas de page aFigure 6 note de bas de page bFigure 6 note de bas de page cFigure 6 note de bas de page dFigure 6 note de bas de page e

Figure 6 - Équivalent textuel
Les études sont réparties dans un tableau en fonction de la conception de l'étude (i.e., ECR ou non).
Le graphique en forêt illustre le rapport des MGT et l'IC à 95 % des études individuelles.
Cette figure se compose d'un tableau résumant les caractéristiques des études portant sur les MGT après la vaccination contre le VPH, d'un graphique en forêt représentant le rapport des MGT et d'un graphique représentant le risque de biais pour chaque étude.
| Nom de l'étude | Vaccin | Type de VPH | Période (années)Figure 6 note de bas de page a |
Rapport de MGT | Limite inférieure | Limite supérieure |
|---|---|---|---|---|---|---|
| ECR | ||||||
| Watson-Jones et al. | Gardasil9 | 16 | 2 | 1,06 | 0,85 | 1,32 |
| Watson-Jones et al. | Gardasil9 | 18 | 2 | 0,91 | 0,71 | 1,16 |
| Watson-Jones et al. | Cervarix | 16 | 2 | 0,40 | 0,32 | 0,48 |
| Watson-Jones et al. | Cervarix | 18 | 2 | 0,47 | 0,37 | 0,59 |
| Bornstein et al.Figure 6 note de bas de page b | Gardasil9 | 16 | 3 | 0,75 | 0,61 | 0,91 |
| Bornstein et al.Figure 6 note de bas de page b | Gardasil9 | 18 | 3 | 0,69 | 0,58 | 0,81 |
| Bornstein et al.Figure 6 note de bas de page c | Gardasil9 | 16 | 3 | 0,85 | 0,69 | 1,04 |
| Bornstein et al.Figure 6 note de bas de page c | Gardasil9 | 18 | 3 | 0,77 | 0,65 | 0,91 |
| Bornstein et al.Figure 6 note de bas de page d | Gardasil9 | 16 | 3 | 1,83 | 1,42 | 2,35 |
| Bornstein et al.Figure 6 note de bas de page d | Gardasil9 | 18 | 3 | 1,24 | 1,00 | 1,52 |
| Bornstein et al.Figure 6 note de bas de page e | Gardasil9 | 16 | 3 | 2,05 | 1,59 | 2,64 |
| Bornstein et al.Figure 6 note de bas de page e | Gardasil9 | 18 | 3 | 1,46 | 1,18 | 1,80 |
| Leung et al. | Gardasil | 16 | 3 | 0,80 | 0,68 | 0,95 |
| Leung et al. | Gardasil | 18 | 3 | 0,60 | 0,49 | 0,73 |
| Romanowski et al. | Cervarix | 16 | 5 | 0,53 | 0,42 | 0,65 |
| Romanowski et al. | Cervarix | 18 | 5 | 0,75 | 0,59 | 0,95 |
| Ogilvie et al. | Gardasil | 16 | 10 | 1,21 | 0,75 | 1,95 |
| Ogilvie et al. | Gardasil | 18 | 10 | 0,72 | 0,37 | 1,39 |
| Analyse a posteriori de l'ECR | ||||||
| Joshi et al. | Gardasil | 16 | 10 | 0,98 | 0,80 | 1,20 |
| Joshi et al. | Gardasil | 18 | 10 | 0,82 | 0,63 | 1,05 |
| Romero et al. | Cervarix | 16 | 16 | 0,61 | 0,48 | 0,77 |
| Romero et al. | Cervarix | 18 | 16 | 0,89 | 0,70 | 1,13 |
Pour Watson-Jones et al., le risque de biais a été jugé faible. Pour Bornstein et al., le risque de biais a été jugé faible. Pour Leung et al., le risque de biais a été jugé faible. Pour Romanowski et al., le risque de biais a été jugé faible. Pour Oglivie et al., le risque de biais a été jugé faible. Pour Joshi et al., le risque de biais a été jugé modéré en raison des facteurs de confusion et de la sélection des résultats rapportés. Pour Romero et al., le risque de biais a été jugé modéré en raison des facteurs de confusion et de la sélection des résultats rapportés.
Deux analyses a posteriori des essais CVT et du CIRC (données jusqu'à 16 Note de bas de page 23 et 10 Note de bas de page 21, respectivement) ont donné des résultats semblables à ceux de l'étude DoRIS, avec un calendrier à dose unique produisant des titres d'anticorps inférieurs, mais soutenus (certitude élevée des données probantes; tableau 3 et tableau 4, figure 5).
Plusieurs ECR fournissent des données comparant les titres d'anticorps d'un calendrier à deux doses par rapport à un calendrier à trois doses (figure 6). Le suivi à long terme d'un ECR canadien chez des filles de 9 à 13 ans recevant GARDASIL®a démontré une réponse en anticorps non inférieure avec deux doses pour les infections à VPH6, VPH11 et VPH16, dix ans après la vaccination (la non-infériorité n'a pas été atteinte pour le VPH18) Note de bas de page 24. Un autre ECR portant sur des filles de 9 à 14 ans et recevant GARDASIL®a mis en évidence une réponse immunitaire non inférieure pour les infections à VPH16 et VPH18, trois ans après la vaccination Note de bas de page 25. Un ECR multinational utilisant GARDASIL®9 a randomisé des filles de 9 à 14 ans pour recevoir deux doses (à 6 ou 12 mois d'intervalle) ou trois doses (à 6 mois d'intervalle), alors que les garçons de 9 à 14 ans ont été randomisés pour recevoir deux doses à 6 ou 12 mois d'intervalle. Alors que les receveurs de deux doses à six mois d'intervalle présentaient généralement des taux d'anticorps inférieurs ou semblables à ceux des receveurs de trois doses, les receveurs de deux doses à 12 mois d'intervalle présentaient généralement des taux d'anticorps supérieurs ou semblables à ceux des receveurs de trois doses en six mois, trois ans après la vaccination Note de bas de page 26, ce qui suggère que l'intervalle entre les doses pourrait être plus important que le nombre de doses. Enfin, dans un ECR portant sur des femmes de 9 à 25 ans ayant reçu CERVARIX®, les titres d'anticorps contre le VPH16 et le VPH18 se sont avérés légèrement plus élevés après un calendrier à trois doses qu'après un calendrier à deux doses, indépendamment des cohortes d'âges (9 à 14 ans et 15 à 25 ans), cinq ans après la vaccination. Cependant, aucun test de non-infériorité n'a été réalisé Note de bas de page 27.
Discussion
L'efficacité réelle, l'efficacité potentielle et l'immunogénicité des différents calendriers de vaccination contre le VPH ont été examinées. Les données probantes disponibles suggèrent que l'ER d'une dose unique contre l'infection par le VPH peut être semblable à celle de deux ou trois doses. Les titres d'anticorps indiquent toutefois une réponse immunitaire plus faible avec une seule dose qu'avec deux ou trois doses. Actuellement, il n'existe pas de corrélation établie concernant la protection contre le VPH. La pertinence clinique de cette diminution de la réponse immunitaire est donc inconnue. L'interprétation des résultats d'autres paramètres cliniques, tels que les risques de CIN et de cytologie anormale, reste difficile en raison des limites des études incluses. Outre les données probantes actuellement disponibles décrites ci-dessus, qui incluent un suivi jusqu'à 16 ans après la vaccination en fonction de l'étude et du résultat de la protection clinique, des données de suivi plus longues sont attendues dans les années à venir dans le cadre de plusieurs études importantes. Alors que les essais continuent d'accumuler des données, le suivi restera important lorsque les participants atteindront l'âge où le risque de référence d'anomalies du col de l'utérus et de cancers associés augmente, les données relatives à ces résultats étant actuellement limitées. Deux autres ECR menés au Costa Rica sont en cours et devraient produire des estimations de l'ER à dose unique chez les femmes de 12 à 16 ans et de 18 à 30 ans d'ici 2025 et 2026, respectivement Note de bas de page 28Note de bas de page 29.
Limites
Les données actuelles présentent plusieurs limites. Les données se limitent principalement aux adolescentes et aux jeunes femmes, et portent essentiellement sur l'infection du col de l'utérus par le VPH et les précurseurs du cancer du col de l'utérus. Cependant, plusieurs autres cancers sont attribuables aux infections à VPH (i.e., d'autres cancers anogénitaux et des cancers de la tête et du cou) Note de bas de page 2, pour lesquels il n'existe pas de données à l'heure actuelle. Bien qu'il n'y ait aucune donnée d'essais cliniques sur l'ER d'une dose unique de vaccin chez les hommes, plusieurs études d'observation rétrospectives portent sur les deux sexes biologiques. Toutefois, seules deux études font état de résultats répartis par sexe, aucune ne faisant état d'une différence de risque d'infection par le VPH entre les différents calendriers de vaccination chez les hommes Note de bas de page 30Note de bas de page 31. Aucune des deux études n'a pu être incluse, car elles ont toutes deux été considérées comme présentant un risque sérieux de biais. Il est possible que des niveaux d'anticorps ou des facteurs immunologiques différents soient nécessaires pour la protection des voies génitales féminines et masculines, ainsi que pour la protection contre les verrues et le cancer de la tête, du cou et de l'anus. Les futures recherches sur l'ER à dose unique contre le VPH et d'autres cancers liés au VPH, y compris les essais où les résultats cliniques sont évalués parmi les populations masculines, seront importantes pour la prise de décision en matière de santé publique. Les données sur l'effet d'un calendrier à dose unique chez les personnes immunodéprimées sont également limitées. Seule une étude d'observation fournissant des données pour ce groupe a été recensée, et aucune différence n'a été observée dans l'incidence de cytologie cervicale anormale entre les calendriers de vaccination chez les femmes séropositives. Cette étude a cependant été considérée comme présentant un risque sérieux de biais et n'a donc pas été retenue Note de bas de page 32.
Conclusion
Les données cliniques actuelles sur les calendriers réduits de vaccination contre le VPH sont prometteuses. Un suivi à plus long terme des participants aux essais cliniques, ainsi que la surveillance des résultats dans le monde réel dans les pays où le passage à des calendriers à dose unique a déjà eu lieu, peuvent aider à mieux comprendre la durée de la protection contre l'infection par le VPH conférée par des calendriers d'administration à dose réduite. De plus, lorsqu'on envisage des changements de programme au niveau de la population, plusieurs facteurs supplémentaires devront probablement être pris en compte, notamment l'incidence sur l'acceptabilité et l'adoption du vaccin contre le VPH, ainsi que sur les inégalités en matière de santé et l'accès au vaccin.
Déclaration des auteurs
- J. M. — Conceptualisation, méthodologie, analyse formelle, conservation des données, rédaction de la version originale
- N. F. — Conceptualisation, méthodologie, analyse formelle, conservation des données, rédaction–révision et édition
- M. S. — Conceptualisation, méthodologie, conservation des données, rédaction–révision et édition, supervision
- V. D. — Conceptualisation, méthodologie, rédaction–révision et édition, supervision
- S. A. — Conceptualisation, méthodologie, analyse formelle, conservation des données, rédaction–révision et édition
- A. J. — Conceptualisation, méthodologie, analyse formelle, conservation des données, rédaction–révision et édition
- C. Y. — Conceptualisation, conservation des données, rédaction–révision et édition
- K. G. — Conceptualisation, conservation des données, rédaction–révision et édition
- K. Y. — Conceptualisation, méthodologie, rédaction–révision et édition, supervision
- M. T. — Conceptualisation, méthodologie, rédaction–révision et édition, supervision
Intérêts concurrents
Aucun.
Remerciements
Nous tenons à remercier les services de bibliothèque de l'Agence de la santé publique du Canada et le Groupe de travail du CCNI sur le VPH pour leur contribution.
Financement
Ce travail a été soutenu par l'Agence de la santé publique du Canada.

Cette œuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution 4.0 International