Ébauche d’évaluation préalable - Bis(triméthylsilyl)amine, produits d’hydrolyse avec la silice (TMSS)
Titre officiel : Ébauche d’évaluation préalable - Bis(triméthylsilyl)amine, produits d’hydrolyse avec la silice (TMSS)
Numéro de registre du Chemical Abstracts Service
68909-20-6
Environnement et Changement climatique Canada
Santé Canada
Septembre 2020
Sommaire
En vertu de l’article 68 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), les ministres de l’Environnement et de la Santé ont procédé à une évaluation préalable du bis(triméthylsilyl)amine, produits d’hydrolyse avec la silice, ci‑après appelé TMSS. Le numéro de registre du Chemical Abstracts Service (no CASNote de bas de page 1 ) pour le TMSS est 68909-20-6. Cette substance a été jugée d’intérêt prioritaire aux fins d’évaluation en raison de préoccupations pour la santé humaine.
Le TMSS est une substance de composition inconnue ou variable, un produit de réaction complexe ou une matière biologique (UVCB). Cette substance est produite par le traitement en surface de la silice amorphe synthétique pyrogénée (no CAS 112945-52-5) à l’aide de l’hexaméthyldisilazane (no CAS 999-97-3). Dans la présente évaluation, le TMSS est représenté par son principal composant (plus de 99 %), à savoir la silice amorphe synthétique pyrogénée traitée en surface.
Le TMSS n’est pas présent à l’état naturel dans l’environnement. Selon les renseignements fournis en réponse à une enquête menée en vertu de l’article 71 de la LCPE, la quantité importée totale déclarée au Canada en 2011 était de 212 498 kg et aucune quantité fabriquée supérieure au seuil de déclaration de 100 kg n’a été déclarée.
Au Canada, le TMSS est principalement utilisé comme charge, agent de suspension, émollient et additif dans la fabrication de cosmétiques, d’écrans solaires, de colles polyvalentes pour ciment, de peintures, de caoutchoucs de silicone, d’encres et d’encres en poudre, et de dispositifs médicaux, ainsi que dans les applications industrielles, notamment dans les secteurs automobile, électrique et électronique. Le TMSS peut être utilisé dans les matériaux d’emballage alimentaire et aussi comme composant d’un additif indirect utilisé dans les établissements de transformation alimentaire. C’est également un formulant utilisé dans les produits antiparasitaires.
Le risque que représente le TMSS pour l’environnement a été caractérisé à l’aide de la Classification du risque écologique des substances organiques (CRE), une approche basée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition et d’une pondération de plusieurs éléments de preuve pour obtenir un classement du risque. Les profils de danger reposent principalement sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Parmi les paramètres pris en compte pour les profils d’exposition, on retrouve le taux potentiel d’émission, la persistance globale et le potentiel de transport sur de grandes distances. Une matrice de risques est utilisée pour attribuer aux substances un potentiel faible, moyen ou élevé selon leurs profils de danger et d’exposition. À la lumière des résultats de l’analyse selon la CRE, on juge qu’il est peu probable que le TMSS soit nocif pour l’environnement.
Compte tenu de tous les éléments de preuve contenus dans la présente ébauche d’évaluation préalable, le TMSS présente un faible risque d’effets nocifs sur l’environnement. Il est proposé de conclure qu’il ne satisfait pas aux critères énoncés aux alinéas 64a) ou b) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
À la lumière des renseignements disponibles concernant les effets du TMSS sur la santé et d’après la lecture croisée de substances présentant une structure chimique et des propriétés physico-chimiques similaires, aucun effet critique n’a été relevé pour ce qui est de l’exposition par voie orale ou cutanée. Par conséquent, l’exposition par voie orale ou cutanée au TMSS, via les milieux environnementaux et les aliments, ou encore les produits de consommation, n’est pas préoccupante.
D’après des études de laboratoire, l’exposition répétée par inhalation au TMSS peut avoir des effets nocifs sur les poumons. L’exposition par inhalation dans les milieux environnementaux devrait être minime. L’évaluation est axée sur l’exposition par inhalation au TMSS lors de l’utilisation de produits en poudre libre contenant du TMSS. En comparant l’exposition estimée au TMSS par inhalation due à l’utilisation de shampoing sec pour cheveux et de fard à joues à un niveau d’effet critique, on a pu établir des marges d’exposition jugées suffisantes pour lever les incertitudes dans les bases de données sur l’exposition et sur les effets sur la santé.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que le TMSS ne satisfait pas aux critères de l’alinéa 64c) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est proposé de conclure que le TMSS ne satisfait à aucun des critères énoncés à l’article 64 de la LCPE.
1. Introduction
En vertu de l’article 68 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE) (Canada 1999), les ministres de l’Environnement et de la Santé ont procédé à une évaluation préalable du bis(triméthylsilyl)amine, produits d’hydrolyse avec la silice, ci‑après appelé TMSS, afin de déterminer si cette substance présente ou pourrait présenter un risque pour l’environnement ou la santé humaine. Cette substance a été jugée d’intérêt prioritaire en raison d’autres préoccupations pour la santé humaine (ECCC, SC [modifié en 2017]).
Les nanomatériaux manufacturés composés de TMSS ou en contenant ne sont pas explicitement pris en compte dans les scénarios d’exposition pour la présente évaluation, mais les produits de consommation examinés pour la caractérisation de l’exposition peuvent comprendre une fraction de ces nanosubstances. De plus, les effets sur la santé associés au TMSS à l’échelle nanométrique peuvent ne pas être explicitement pris en compte par la présente évaluation. Tout risque posé par le TMSS à l’échelle nanométrique pourrait faire l’objet d’un examen séparé à une date ultérieure.
Le risque posé à l’environnement par le TMSS a été caractérisé à l’aide de l’approche de classification des risques écologiques des substances organiques (CRE) (ECCC 2016a). La CRE décrit le danger associé à une substance à l’aide de paramètres clés comme le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité et l’activité biologique et chimique, et tient compte de l’exposition possible des organismes dans les milieux aquatiques et terrestres en fonction de facteurs tels que le taux d’émissions potentielles, la persistance globale et le potentiel de transport à grande distance dans l’atmosphère. Les divers éléments de preuve sont combinés afin d’identifier les substances nécessitant une évaluation plus poussée de leur potentiel d’effets nocifs sur l’environnement ou présentant une faible probabilité d’effets nocifs sur l’environnement.
Pour la présente ébauche d’évaluation préalable, nous avons tenu compte des données sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et l’exposition, y compris des renseignements soumis par des parties intéressées. Les données pertinentes pour le TMSS ont été relevées jusqu’en février 2019. Des données additionnelles ont été présentées par des parties intéressées jusqu’en avril 2019. Les données empiriques provenant d’études clés ainsi que les résultats de la modélisation ont servi à tirer les conclusions proposées. Quand ils étaient disponibles et pertinents, nous avons tenu compte de renseignements présentés dans des évaluations faites par d’autres instances.
La présente ébauche d’évaluation préalable a été préparée par le personnel du Programme d’évaluation des risques de la LCPE de Santé Canada et d’Environnement et Changement climatique Canada. Elle inclut l’apport d’autres programmes de ces ministères. Les parties de la présente évaluation préalable portant sur la santé humaine ont fait l’objet d’examens ou de consultations externes. Des commentaires sur les aspects techniques pertinents pour la santé humaine ont été reçus de Christine F. Chaisson, Judy S. LaKind et Claudia Fruijtier-Pölloth, de Risk Sciences International, Inc. Le volet écologique de cette évaluation est basé sur le document de la CRE (publié le 30 juillet 2016), qui a fait l’objet d’un examen externe et d’une période de commentaires du public de 60 jours. Bien que les commentaires de l’extérieur aient été pris en compte, le contenu définitif et les résultats de la présente ébauche d’évaluation préalable demeurent la responsabilité de Santé Canada et d’Environnement et Changement climatique Canada.
La présente ébauche d’évaluation préalable porte sur les renseignements essentiels pour déterminer si une substance satisfait aux critères énoncés à l’article 64 de la LCPE. À cette fin, nous avons examiné des données scientifiques et suivi une approche fondée sur le poids de la preuve et le principe de précautionNote de bas de page 2 . Cette ébauche d’évaluation préalable présente les informations et considérations essentielles sur lesquelles se fonde la conclusion proposée.
2. Identité de la substance
Aux fins du présent document, cette substance est appelée TMSS, et elle figure sur la Liste intérieure des substances (LIS) sous le nom « bis(triméthylsilyl)amine, produits d’hydrolyse avec la silice ». Le tableau 2‑1 présente le no CASNote de bas de page 3 de la substance, son nom dans la LIS et son nom commun (TMSS).
| No CAS | Nom dans la LIS (nom commun) | Structure chimique représentative a | Masse moléculaire (g/mol) |
|---|---|---|---|
| 68909-20-6 | Bis(triméthylsilyl)amine, produits d’hydrolyse avec la silice (TMSS) | 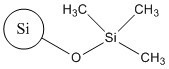
| S.O. |
Abréviation – S.O. = sans objet
a Ces substances appartiennent à la catégorie des UVCB (substances de composition inconnue ou variable, produits de réaction complexes ou matières biologiques). Il s’agit de substances chimiques non définies, c’est-à-dire de substances auxquelles peuvent s’appliquer différentes structures.
Le TMSS est une substance UVCBNote de bas de page 4 et est produit par le traitement en surface de la silice amorphe synthétique pyrogénée (no CAS 112945-52-5) à l’aide de l’hexaméthyldisilazane (HMDS, no CAS 999-97-3) (Becker et al. 2013; SCCS 2015). Dans la présente évaluation, cette substance est représentée par son principal composant (plus de 99 %), à savoir la silice amorphe synthétique pyrogénée traitée en surface (Santé Canada 2019).
La silice amorphe synthétique (SAS) se distingue de la silice cristalline et de la silice amorphe naturelle, mais partage le même no CAS 7631-86-9 (Martin 2007; Fruijtier-Pölloth 2016). En général, la SAS peut désigner diverses formes non traitées de silice amorphe synthétique produite par la méthode humide (c.‑à‑d. SAS colloïdale et précipitée) ou par la méthode thermique (c.‑à‑d. SAS pyrogénée), ou à leurs dérivés traités en surface (ECETOC 2006; Environnement Canada, Santé Canada 2013a). Toutefois, dans la présente évaluation, l’abréviation SAS ne désigne que la silice amorphe synthétique non traitée.
2.1 Choix des analogues et utilisation de modèles QSAR
Une approche de lecture croisée utilisant des données pour des analogues a été utilisée pour éclairer l’évaluation des effets sur la santé humaine. On a sélectionné des analogues qui étaient structurellement similaires aux substances de ce groupe (c.‑à‑d. de propriétés physico-chimiques et toxicocinétiques similaires) et pour lesquels on disposait de données empiriques pertinentes pouvant être utilisées pour effectuer une lecture croisée avec des substances pour lesquelles les données empiriques sont limitées.
Les données de lecture croisée utilisées pour éclairer l’évaluation des effets du TMSS sur la santé humaine sont décrites plus en détail dans les sections pertinentes du présent rapport. Le tableau 2‑2 présente des renseignements sur l’identité et les structures chimiques des analogues utilisés pour éclairer l’évaluation des effets sur la santé humaine.
| No CAS | Nom sur la LIS ou autre nom commun | Formule empirique générale ou structure représentative | Masse moléculaire (g/mol) |
|---|---|---|---|
| 112926-00-8 | SAS colloïdale et SAS précipitée | nSiO2 | 60,08a |
| 112945-52-5 | SAS pyrogénée | nSiO2 | 60,08a |
| 68611-44-9b | Dichlorodiméthylsilane, produits de la réaction avec la silice(silice de diméthyle silylate) | 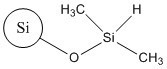 | S.O. |
Abréviation – S.O. = sans objet.
a Masse moléculaire du SiO2.
b La silice de diméthyle silylate est une substance UVCB et n’est pas un produit chimique discret. Elle peut donc être caractérisée par une variété de structures. Le tableau ci‑dessus présente la structure représentative de sa surface où certains des groupes hydroxyles de la surface sont remplacés par des groupes diméthylsilyles.
Les analogues comprennent la SAS colloïdale non traitée et la SAS précipitée, ainsi que la SAS pyrogénée non traitée. Cette dernière est un composé précurseur du TMSS (substance cible) et de la silice de diméthyle silylate (analogue). La silice de diméthyle silylate est un dérivé de la silice dans lequel la surface de la silice pyrogénée a été modifiée par l’ajout de groupes diméthylsilyles, contrairement au TMSS (substance cible) dont la surface a été modifiée par l’ajout de groupes triméthylsiloxys (Becker et al. 2013). Les propriétés physiques et chimiques ainsi que les données toxicologiques de ces analogues figurent à l’annexe A.
3. Propriétés physiques et chimiques
Un résumé des propriétés physiques et chimiques du TMSS et de ses analogues est présenté dans le tableau 3-1. D’autres propriétés physiques et chimiques sont présentées dans ECCC (2016b).
Le traitement en surface de la SAS ne modifie pas ses propriétés solides, dont la taille des particules primaires. Toutefois, le traitement en surface modifie ses propriétés physiques et chimiques, notamment l’hydrophobie et la réduction de l’absorption d’humidité, en fonction du type et de l’importance du traitement en surface (ECETOC 2006; Langer et al. 1958). Le niveau de traitement du TMSS peut varier et entraîner une modification d’une plage de propriétés physico-chimiques, y compris l’accroissement ou la diminution du caractère hydrophobe de la substance. Par conséquent, l’utilisation d’analogues qui couvrent cette plage permet une caractérisation plus complète des propriétés physiques et chimiques ainsi que du devenir et du comportement du TMSS dans l’environnement.
| Propriété | TMSS | SAS non traitée | Silice de diméthyle silylate | Principales références |
|---|---|---|---|---|
| Point de fusion (°C) | 1700 | 1700 | 1700 | Environnement Canada, Santé Canada 2013a; OCDE 2004 |
| Point d’ébullition (°C) | 2300 | 2230 | n.d. | Environnement Canada, Santé Canada 2013a; ESIS c1995–2009 |
| Pression de vapeur (mm Hg à 20 °C) | Négligeable | Négligeable | Négligeable | SCCS 2015; OCDE 2004; US EPA 2011 |
| Solubilité dans l’eau (mg/L) | < 0,01 (négligeable) | 15 – 68 (à 20 °C) pH 5,5 – 6,6) | < 0,0001 (négligeable) | Becker et al. 2013; OCDE 2004; US EPA 2011 |
| Masse volumique (kg/m3 à 20 °C) | 2200 | 2200 | 2000 | Environnement Canada, Santé Canada 2013a; OCDE 2004; ESIS c1995–2009 |
| Masse volumique apparente (substance tassée, kg/m3) | 100 – 300 | 50 – 320 | 30 – 50 | Environnement Canada, Santé Canada 2013a; OCDE 2004; ESIS c1995–2009 |
| Taille des particules primaires (nm) | 5 – 20 a | 5 – 50 (pyrogénée) 5 – 100 (précipitée) | 10 – 50 b | Fruijtier-Pölloth 2012; ECETOC 2006; SCCS 2015 |
| Taille des agrégats (nm) | 100 – 1 000 a | 100 – 1 000 | < 5 000 b | Fruijtier-Pölloth 2012; ECETOC 2006; SCCS 2015 |
| Taille des agglomérats (nm) | Pour la plupart> 125 000a | 1 000 – 250 000 | n.d. | Fruijtier-Pölloth 2012; ECETOC 2006 |
Abréviation : n.d. = non disponible.
a Taille des particules primaires de la SAS traitée en surface (Fruijtier-Pölloth 2012). La taille des particules primaires de TMSS peut également se situer dans la plage de 6,9 à 8,6 nm (ECHA 2016), ce qui correspond à la plage de tailles générique pour les particules primaires de SAS traitée en surface (5 – 20 nm).
b Plage des tailles des particules de silice pyrogénée hydrophobe (SCCS 2015).
La taille des particules primaires de SAS traitée en surface varie de 5 nm à 20 nm (Fruijtier-Pölloth 2012). Toutefois, les particules primaires devraient former des agrégats (100 – 1 000 nm) ou des agglomérats (principalement > 125 000 nm) lors des processus de fabrication et de modification de la surface (Fruijtier-Pölloth 2012; Environnement Canada, Santé Canada 2013a)Note de bas de page 5, Note de bas de page 6 . Ainsi, le TMSS devrait exister principalement sous forme d’agrégats ou d’agglomérats après sa fabrication.
4. Sources et utilisations
Le TMSS n’est pas présent à l’état naturel dans l’environnement. Le TMSS était visé par une enquête menée en vertu de l’article 71 de la LCPE (Canada 2012). Selon les renseignements fournis lors de l’enquête, la quantité totale importée déclarée au Canada en 2011 était de 212 498 kg et aucune quantité fabriquée n’a été déclarée (Environnement Canada 2013). Au Canada, le TMSS est principalement utilisé comme charge, agent de suspension, émollient et additif dans la fabrication de cosmétiques, d’écrans solaires, de colles polyvalentes pour ciment, de peintures, de caoutchoucs de silicone, d’encres et d’encres en poudre, et de dispositifs médicaux (Environnement Canada 2013; MSDS 2016; CosIng 2019). On l’utilise également dans diverses applications industrielles, notamment dans les secteurs automobile, électrique et électronique (Environnement Canada 2013). Le TMSS est un agent d’épaississement des pâtes et des pommades afin d’empêcher la séparation des composants et de maintenir les propriétés d’écoulement des produits en poudre (OCDE 2004).
Le tableau 4-1 présente un résumé des autres utilisations du TMSS au Canada.
| Utilisation | TMSS |
|---|---|
| Additif indirect a | Oui |
| Matériaux d’emballage alimentaire a | Oui |
| Ingrédient non médicinal dans les désinfectants et les médicaments à usage humain ou vétérinaire b | Oui |
| Ingrédient non médicinal dans les produits de santé naturels homologués c | Oui |
| Avis de présence possible dans les cosmétiques en vertu du Règlement sur les cosmétiques d | Oui |
| Produit de formulation dans des produits antiparasitaires homologués e | Oui |
a Communication personnelle, courriels de la Direction des aliments, Santé Canada (SC) au Bureau de l’évaluation des risques des substances existantes (BERSE), SC, 8 octobre 2018 et 11 février 2019; sans référence.
b Communication personnelle, courriels de la Direction des produits thérapeutiques (DPT), SC, au BERSE, SC, 1er octobre 2018 et 14 février 2019; sans référence.
c Communication personnelle, courriels de la Direction des produits de santé naturels et sans ordonnance (DPSNSO), SC, au BERSE, SC, 5 octobre 2018 et 25 février 2019; sans référence.
d Communication personnelle, courriels de la Direction de la sécurité des produits de consommation et des produits dangereux (DSPCPD), SC, au BERSE, SC, 9 octobre 2018 et 14 février 2019; sans référence.
e Communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire (ARLA), de SC, au BERSE, de SC, 22 octobre 2018; sans référence.
Le TMSS peut être utilisé comme charge dans les élastomères de silicone et comme composant dans les formulations antimousse dans la fabrication de matériaux d’emballage alimentaire. Le TMSS peut également être utilisé comme composant d’un additif indirect (lubrifiant) utilisé dans les établissements de transformation alimentaire (communication personnelle, courriels de la Direction des aliments, SC, au BERSE, SC, 8 octobre 2018 et 11 février 2019; sans référence). Le TMSS joue un rôle non médical dans les écrans solaires en tant qu’agent de protection solaire (communication personnelle, courriels de la DPT, SC, au BERSE, SC, 1er octobre 2018 et 14 février 2019; sans référence), et comme agent antimousse, de gonflement, de conditionnement de la peau et de suspension (communication personnelle, courriels de la DPSNSO, SC, au BERSE, SC, 5 octobre 2018 et 25 février 2019; sans référence). D’après les avis présentés conformément au Règlement sur les cosmétiques à Santé Canada, le TMSS est également utilisé dans certains cosmétiques au Canada, principalement dans les maquillages, les hydratants, les produits de coiffure ou de shampoing et les vernis à ongles. Les principaux types de formulation comprennent les poudres libres, les poudres comprimées, les pains solides, les onguents/baumes semi-solides, les lotions, les gels, les crèmes et les formulations liquides (communication personnelle, courriels de la DSPCPD, SC, au BERSE, SC, 9 octobre 2018 et 14 février 2019; sans référence).
5. Potentiel d’effets nocifs sur l’environnement
5.1 Caractérisation des risques pour l’environnement
Le risque posé à l’environnement par le TMSS a été caractérisé à l’aide de l’approche de classification des risques écologiques des substances organiques (CRE) (ECCC 2016a). La CRE est une démarche axée sur la notion de risque; elle attribue un score de risque en tenant compte de nombreuses mesures du danger et de l’exposition, pondérées par différents éléments de preuve. Les divers éléments de preuve sont combinés afin de pouvoir distinguer les substances présentant un pouvoir faible ou élevé et un potentiel d’exposition faible ou élevé dans divers milieux. Cette approche permet de réduire l’incertitude associée à la caractérisation des risques, contrairement à une approche qui serait basée sur un seul paramètre mesuré dans un seul milieu (p. ex., CL50). Les paragraphes suivants résument l’approche, décrite en détail dans le document d’ECCC (2016a).
Les données sur les propriétés physico-chimiques, le devenir (demi-vies chimiques dans divers milieux et biotes, coefficients de partage et bioconcentration dans les poissons), l’écotoxicité aiguë pour les poissons et les volumes de produits chimiques importés et fabriqués au Canada proviennent de publications scientifiques, de bases de données empiriques accessibles (p. ex., la boîte à outils QSAR de l’OCDE, 2014), et des réponses aux enquêtes menées conformément à l’article 71 de la LCPE, ou ont été produites à l’aide de modèles QSAR (relation quantitative structure-activité) ou de modèles du devenir du bilan massique ou de la bioaccumulation. Ces données ont été utilisées soit pour alimenter d’autres modèles de bilan massique, soit pour compléter les profils des risques et de l’exposition des substances.
Nous avons déterminé les profils de dangers en nous fondant principalement sur les mesures du mode d’action toxique, de la réactivité chimique, des seuils de toxicité internes basés sur les réseaux trophiques, de la biodisponibilité et de l’activité chimique et biologique. Les profils d’exposition étaient également basés sur plusieurs paramètres, dont la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Les profils de risque et d’exposition aux critères de décision ont été comparés aux critères de décision afin de catégoriser le potentiel de danger et d’exposition de chaque substance organique en trois niveaux : faible, modéré ou élevé. Nous avons aussi appliqué d’autres règles (p. ex., la cohérence de la classification et la marge d’exposition) pour préciser les classifications préliminaires du danger et de l’exposition.
Une matrice de classification du risque a été utilisée pour attribuer à la substance un score de risque faible, modéré ou élevé en fonction des préoccupations qu’elle suscitait en termes de danger et d’exposition. Les classifications du risque au moyen de la CRE ont été vérifiées selon une approche en deux étapes. La première étape consistait à ajuster la classification du risque posé par les substances, de modéré ou élevé à faible pour celles qui présentaient un taux estimé bas des rejets dans l’eau après le traitement d’un système d’eaux usées, ce qui indique un potentiel d’exposition faible. La deuxième étape consistait à examiner les résultats d’une classification du potentiel de risque faible au moyen de scénarios relativement prudents à l’échelle locale (c.-à-d. dans la zone entourant immédiatement une source ponctuelle de rejet), conçus pour protéger l’environnement. Cette étape avait pour but de déterminer si la classification du risque potentiel devrait être accrue.
La CRE est basée sur une approche pondérée afin de réduire au minimum tout risque de surclassement ou de sous-classement du danger et de l’exposition, et du risque subséquent. ECCC (2016a) présente en détail les démarches équilibrées du traitement des incertitudes. Nous décrivons ci-après deux des domaines d’incertitude les plus importants. Une erreur dans les valeurs de toxicité aiguë empiriques ou modélisées peut modifier la classification du danger, notamment si les paramètres sont fondés sur les valeurs de résidus dans les tissus (c.-à-d. le mode d’action toxique), dont bon nombre sont des valeurs estimées à l’aide de modèles QSAR (boîte à outils QSAR de l’OCDE 2014). L’incidence d’une telle erreur est toutefois atténuée par le fait qu’une surestimation de la létalité médiane générera une valeur prudente (protectrice) pour les résidus dans les tissus qui sera utilisée lors de l’analyse des résidus corporels critiques (RCC). L’erreur due à une sous-estimation de la toxicité aiguë sera atténuée par le recours à d’autres paramètres de danger, tels que le profilage structurel du mode d’action, la réactivité et/ou l’affinité de liaison à l’œstrogène. Les changements ou les erreurs touchant les quantités chimiques pourraient mener à un classement différent de l’exposition, les classements de l’exposition et du risque étant très sensibles à la vitesse d’émission et aux quantités utilisées. Les classements obtenus au moyen de la CRE représentent donc l’exposition et le risque au Canada compte tenu des quantités utilisées actuellement (déterminées par estimations), mais pourraient ne pas rendre compte des tendances futures.
Les données et les éléments critiques pris en compte pour développer les profils propres au TMSS, ainsi que les résultats de la classification du danger, de l’exposition et des risques, sont présentés dans ECCC (2016b).
Selon les données examinées conformément à la CRE, le TMSS a été classé comme présentant un potentiel d’exposition élevé, à la lumière de sa longue persistance globale et des quantités importantes importées chaque année selon les renseignements fournis en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013c). Le TMSS a été classé comme substance présentant un faible potentiel de danger et un faible risque écologique. Bien que les modes d’utilisation actuels donnent lieu à un potentiel d’exposition élevé, et compte tenu du faible potentiel de danger, il est peu probable que le TMSS suscite des préoccupations environnementales au Canada.
6. Potentiel d’effets nocifs sur la santé humaine
6.1 Évaluation de l’exposition
La présente évaluation de l’exposition porte sur les voies d’exposition par lesquelles des effets critiques ont été constatés (c.‑à‑d. par inhalation). Aucun effet critique sur la santé par les voies d’exposition orale et cutanée n’a été constaté pour le TMSS, et les expositions par ces voies n’ont donc pas été quantifiées.
6.1.1 Milieux naturels et aliments
Aucune donnée sur les concentrations mesurées de TMSS n’a été trouvée dans les aliments ou les milieux environnementaux pertinents au Canada ou ailleurs. D’après ses propriétés physiques et chimiques, le TMSS devrait être présent principalement dans les sols et les sédiments lorsqu’il est rejeté dans l’environnement (OCDE 2004). Lorsqu’il est rejeté dans l’air, le TMSS devrait se déposer dans les eaux de surface et les sols en raison de sa masse volumique élevée et de sa pression de vapeur négligeable. S’il est rejeté dans les eaux de surface ou dans l’environnement terrestre, il devrait se répartir dans les sédiments ou rester dans les sols, respectivement, en raison de sa solubilité négligeable dans l’eau, de sa masse volumique élevée et de sa stabilité chimique (Environnement Canada, Santé Canada 2013a). Ainsi, l’exposition au TMSS via l’air ambiant et l’eau potable ne devrait pas être importante.
Le TMSS peut être employé dans la fabrication de matériaux d’emballage alimentaire, ce qui présente un risque de contact direct avec les aliments. L’exposition au TMSS via cette source devrait être négligeable. Le TMSS peut également être employé comme composant d’un additif indirect (lubrifiant) utilisé dans les établissements de transformation alimentaire, sans contact direct avec les aliments. Par conséquent, on ne prévoit pas d’exposition par cette source [communication personnelle, courriels de la Direction des aliments, SC, au BERSE, SC, 8 octobre 2018 et 11 février 2019; sans référence].
6.1.2 Produits de consommation
L’exposition de la population générale au TMSS peut résulter de son utilisation, notamment dans les cosmétiques, les écrans solaires, les colles polyvalentes pour ciment et les peintures. Il existe un risque d’exposition orale résultant de l’utilisation de brillant à lèvres. De même, il existe un risque de contact cutané avec le TMSS en raison de l’utilisation de cosmétiques, d’écrans solaires, de colles polyvalentes pour ciment et de peintures. Cependant, l’exposition par les voies orale et cutanée n’est pas quantifiée, car aucun effet critique sur la santé n’a été constaté pour le TMSS par ces voies d’exposition.
La caractérisation de l’exposition est axée sur les produits de consommation qui présentent un potentiel d’inhalation de TMSS inhalable insoluble, par exemple les cosmétiques formulés sous forme de poudres libres (communication personnelle, courriels de la DSPCPD, SC, au BERSE, SC, 9 octobre 2018 et 14 février 2019; sans référence).
L’utilisation de shampoing sec et de fard à joues a été considérée comme un scénario sentinelle, car ces produits contiennent la plus forte concentration de TMSS parmi les cosmétiques disponibles au Canada, et ils sont formulés sous forme de poudres libres. Les produits formulés sous forme de poudres comprimées (p. ex., le maquillage pour visage) n’ont pas été considérés comme une source potentielle d’exposition préoccupante, car il ne devrait pas se former de « nuage de poussière » inhalable lors de leur utilisation. Ces produits contiennent des particules plus grossières et des liants tels que des huiles ou des cires, qui aident à retenir les particules entre elles (Kogel et al. 2006). En outre, on a estimé que les produits sous forme liquide ou pâteuse (p. ex., les adhésifs et les peintures pour pinceau ou rouleau) ne sont pas associés à un risque d’exposition par inhalation, car le TMSS ne devrait pas s’évaporer de la surface où les produits sont appliqués, en raison de sa pression de vapeur négligeable. En outre, les peintures pour pinceau ou rouleau ne produisent pas de grandes quantités de gouttelettes de pulvérisation, et la plupart des gouttelettes ne seraient pas inhalables (Environnement Canada, Santé Canada 2013b).
Anderson et al. (2017) et Rasmussen (2019) ont mesuré les concentrations atmosphériques de particules d’un diamètre aérodynamique moyen de 4 μm ou moins (PM4) lors de l’utilisation de poudre pour le visage ou le corps contenant du talc. Cette étude a été considérée comme une étude de substitution appropriée pour estimer l’exposition au TMSS. Elle a été jugée appropriée en raison de la pertinence du type d’application du produit et de la similarité des propriétés physiques et chimiques du TMSS et du talc, p. ex., le point de fusion, la pression de vapeur et la solubilité dans l’eau.
Anderson et al. (2017) ont mené une étude pour caractériser les concentrations de poussière inhalable en suspension dans l’air lors de l’utilisation de produits de talc au cours des années 1960 et 1970. Des dispositifs d’échantillonnage de l’air à cyclone capturant les particules PM4 étaient fixés dans la zone de respiration de cinq volontaires. Les concentrations moyennes de PM4 au cours de la simulation d’exposition de 48 minutes ont été calculées à partir de la masse totale mesurée (provenant de 8 applications en 48 minutes) et le volume d’air pendant toute la période d’échantillonnage de 48 minutes. Les concentrations de PM4 inhalables variaient de 0,26 à 5,03 mg/m3, la moyenne étant de 1,46 mg/m3. La concentration moyenne dans l’air par sujet allait de 0,44 à 3,28 mg/m3.
En 2018, Santé Canada a mené une petite étude afin de mesurer les concentrations de particules dans l’air de la zone respiratoire de volontaires adultes pendant qu’ils appliquaient des produits de soins personnels contenant du talc (Rasmussen et al., 2019). Des moniteurs de zone de respiration personnelle à lecture directe et en continu (placés à côté du nez) ont mesuré des concentrations moyennes de PM4 de 0,48 ± 0,18 mg/m3 et 1,80 ± 0,82 mg/m3 chez deux volontaires s’appliquant respectivement de la poudre sur le corps (sujet A) et de la poudre libre sur le visage (sujet B). Les sujets ont appliqué les poudres trois fois. Ces concentrations moyennes se situent dans la plage des concentrations mesurées par Anderson et al. (2017). Les concentrations moyennes dans l’air par sujet, obtenues par Anderson et al. (2017), ont été combinées avec les données pour les poudres corporelle et faciale obtenues parallèlement par Rasmussen et al. (2019), afin d’obtenir une concentration moyenne globale dans l’air de 1,36 ± 0,97 mg/m3 pouvant être inhalée pendant l’utilisation des cosmétiques (annexe B, tableau B-1).
La valeur moyenne de la concentration dans l’air de 1,36 mg/m3 a été utilisée pour estimer les concentrations dans l’air ajustées, lors de l’utilisation de shampoing sec et de fard à joues contenant du TMSS. Le tableau 6-1 présente un résumé des résultats. Les intrants et les facteurs d’ajustement pour ces scénarios sont décrits à l’annexe B (tableau B-1). Ces estimations de l’exposition sont jugées prudentes, car, en raison de la taille des particules de TMSS dans les cosmétiques, elles peuvent ne pas être entièrement inhalables (communication personnelle, courriels de la DSPCPD, SC, au BERSE, SC, 27 mai 2019; sans référence). La plage granulométrique des particules de TMSS dans les poudres libres peut aller des particules inhalables aux particules non inhalables, en raison de leur agglomération.
| Scénario | Concentration maximale | Concentration dans l’air par événement (mg/m3) b | Concentration d’exposition ajustée (mg/m3) c | Concentration d’exposition ajustée de niveau supérieur (mg/m3) d |
|---|---|---|---|---|
| Shampoing sec | 100 %a | 1,36 | 0,019 (MPT de 6 heures) | 0,0011 (exposition continue) |
| Fard à joues | 30 %a | 0,408 | 0,0057 (MPT de 6 heures) | 0,0014 (exposition continue) |
Abréviation : MPT = moyenne pondérée dans le temps.
a Communication personnelle, courriels de la DSPCPD, SC, au BERSE, SC, 9 octobre 2018 et 14 février 2019; sans référence.
b Valeur moyenne de la concentration dans l’air mesurée en mg/m3 (Anderson et al. 2017, Rasmussen et al. 2019) × concentration maximale de TMSS (%) dans le produit.
c Les estimations de l’exposition par inhalation, par événement, ont été amorties sur une période de 6 heures en multipliant la valeur « durée de l’exposition/6 heures » afin de l’aligner avec la durée du traitement par jour (par inhalation) dans l’étude de toxicité. La durée de l’exposition dans les deux scénarios est de 5 minutes.
d Les estimations de l’exposition par inhalation, par événement, pour le TMSS ont été ajustées pour donner une estimation de l’exposition continue (24 heures/jour, 7 jours/semaine) pour le scénario d’exposition chronique conformément aux lignes directrices de l’EPA sur l’évaluation des risques par inhalation (US EPA 2009; voir l’annexe B pour de plus amples détails).
6.2 Évaluation des effets sur la santé
Les données toxicologiques sont limitées pour le TMSS. L’évaluation des effets du TMSS sur la santé a été éclairée par la lecture croisée de ses analogues, de la silice de diméthyle silylate et de la SAS (colloïdale, précipitée et pyrogénée). Entre autres critères d’effet, ces analogues ont été utiles pour estimer la toxicité potentielle du TMSS par voie orale et cutanée, ainsi que l’élimination et la toxicité à court terme du TMSS par inhalation.
La SAS et la SAS traitée en surface, y compris le TMSS, ont été évaluées par le Centre européen d’écotoxicologie et de toxicologie des produits chimiques (ECETOC 2006). Les effets de la silice de diméthyle silylate sur la santé ont été caractérisés par l’EPA (US EPA 2011). La SAS et la SAS traitée en surface ont fait l’objet d’un examen par plusieurs instances internationales, dont l’Organisation de coopération et de développement économiques (OCDE) dans un rapport sur l’Ensemble de données de dépistage (OCDE 2004), et par le Comité scientifique pour la sécurité des consommateurs de la Commission européenne (SCCS 2015). La silice de diméthyle silylate est l’analogue qui ressemble le plus au TMSS, car ces deux substances sont toutes deux des SAS pyrogénées traitées en surface, mais la base de données connexe est limitée (p. ex., il n’y a pas d’étude de toxicité cutanée). La SAS colloïdale, la SAS précipitée et la SAS pyrogénée ont également été utilisées comme analogues.
TMSS
Dans une étude d’exposition par inhalation (corps entier ou nez seulement – non indiqué) de 13 semaines, des rats Wistar (10/sexe/groupe) ont été exposés au TMSS (taille moyenne des particules de 2,8 à 4,5 µm) à une concentration de 0, 0,51, 2,05 ou 10,01 mg/m3 pendant 6 heures par jour, 5 jours par semaine (Wacker 1998 a, b, cité dans ECETOC 2006). À 10,01 mg/m3, on a constaté une augmentation des niveaux de protéines totales, d’aspartate-aminotransférase et de phosphatase alcaline dans le liquide de lavage des poumons, une augmentation des neutrophiles, des macrophages/monocytes et des lymphocytes. L’exposition à 10,01 mg/m3 de TMSS a également augmenté le poids absolu et relatif des poumons et des ganglions lymphatiques trachéo-bronchiques. L’examen histologique a révélé une accumulation de macrophages alvéolaires avec peu de cellules polymorphonucléaires, une hyperplasie épithéliale bronchiolaire-alvéolaire, des infiltrations de cellules inflammatoires interstitielles dans les poumons, et une augmentation de l’histiocytose et des agrégats de macrophage dans les ganglions lymphatiques médiastinaux dans le groupe ayant reçu 10,01 mg/m3. Le traitement n’a pas provoqué de fibrose interstitielle. À la dose de 2,05 mg/m3, les effets étaient limités à une augmentation du nombre relatif de neutrophiles avec une diminution du nombre relatif de macrophages/monocytes sans affecter le nombre absolu de cellules. Cela n’a pas été jugé important sur le plan toxicologique. Une concentration sans effet nocif observé (CSENO) de 2,05 mg/m3 a été déterminée pour la présente évaluation.
Dans une étude d’exposition par inhalation à doses répétées avec peu de détails, des rats et des singes cynomolgus ont été exposés au TMSS à des concentrations de 0, 10, 50 ou 150 mg/m3 (taille des particules non indiquée) pendant 6 heures par jour, 5 jours par semaine, pendant une période allant jusqu’à 12 mois [Dow Corning, 1972, cité dans ECETOC 2006]. Aucun effet n’a été observé à 10 mg/m3. L’exposition à 50 et 150 mg/m3 a provoqué une agrégation de macrophages mousseux dans les alvéoles chez le rat et une fibrose interstitielle chez le singe.
Le TMSS n’était pas génotoxique dans les essais de mutation bactérienne in vitro ou d’aberration chromosomique in vitro (Cabot 1994a, b, c, 1995 cité dans ECETOC 2006).
Silice de diméthyle silylate
Les études toxicocinétiques ont été limitées à des études d’élimination des substances chez le rat. Les études d’élimination de la silice de diméthyle silylate (Degussa 1964 cité dans Becker et al. 2013) ont été menées chez des rats exposés à de la silice de diméthyle silylate en aérosol (200 mg/m3, taille des particules non indiquée), 5 heures par jour pendant 3 jours (Degussa 1964 cité dans Becker et al. 2013). Du silicium dans les poumons a été détecté 24 heures après la dernière exposition, mais aucun silicium n’a été détecté 1 mois après l’exposition. La substance d’essai a été détectée dans les ganglions lymphatiques médiastinaux, mais elle a diminué progressivement 1 à 3 mois après l’exposition. Au bout de 3 mois, 81 % de la substance d’essai avait été éliminé des poumons.
Dans une étude de 6 mois par voie orale, des rats Wistar (40/sexe/dose) ont reçu de la silice de diméthyle silylate dans le régime alimentaire à raison de 0 ou 500 mg/kg p.c./j (US EPA 2011). Des signes cliniques et les poids corporels ont été consignés pendant toute l’étude. Des prélèvements sanguins ont été effectués chaque mois sur 10 rats/sexe et les paramètres hématologiques ont été examinés. Tous les rats ont fait l’objet d’une autopsie et un examen histopathologique a été effectué à la fin de l’étude. La dose sans effet nocif observé (DSENO) a été établie par l’EPA comme étant la seule dose testée, soit 500 mg/kg p.c./j.
Dans une étude d’exposition par inhalation de 2 semaines, des rats Wistar (10/sexe/groupe) ont été exposés à un aérosol de silice de diméthyle silylate (taille des particules inférieure à 10 μm) par inhalation (corps entier) aux concentrations de 0, 31, 87 ou 209 mg/m3 pendant 6 heures par jour, 5 jours par semaine (US EPA 2011). Des changements pathologiques (granulomes, cellularité focale accrue du septum et accumulation de macrophages alvéolaires) dans les poumons ont été observés dans tous les groupes traités. Une diminution de la prise de poids corporel et des modifications des paramètres hématologiques (augmentation du nombre de globules rouges, du volume de cellules entassées et de l’hémoglobine) ont été observées chez les animaux à 87 et 209 mg/m3. La concentration minimale entraînant un effet nocif observé (CMENO) de 31 mg/m3 a été établie par l’EPA sur la base des résultats histopathologiques dans les poumons.
Dans une étude d’exposition par inhalation de 13 semaines, des rats Wistar (10/sexe/groupe) ont été exposés à un aérosol de silice de diméthyle silylate (taille des particules inférieure à 10 μm) par inhalation (corps entier) aux concentrations de 0 ou 35 mg/m3 pendant 6 heures par jour, 5 jours par semaine (US EPA 2011). À la dose de 35 mg/m3, on a observé des modifications dans les poumons, notamment des lésions (tissus spongieux et surfaces tachetées) et des changements histopathologiques (granulomes, fibrose interstitielle). Ces modifications étaient plus graves que les effets pulmonaires observés dans l’étude d’exposition par inhalation de 2 semaines de silice de diméthyle silylate, ce qui semble indiquer une réponse de longue durée.
Dans une étude de toxicité pour la reproduction sur une génération par voie orale, des rats Wistar (10 femelles et 2 mâles/groupe pré-accouplement, 5 femelles pour 1 mâle/groupe ayant reçu une dose) ont reçu de la silice de diméthyle silylate dans le régime alimentaire à raison de 0 ou 500 mg/kg p.c./j pendant 8 ou 17 semaines avant l’accouplement, lors de l’accouplement, pendant la gestation (femelles seulement) et la lactation (femelles seulement) (US EPA 2011). Le traitement n’a eu aucun effet sur l’apparence, le comportement, la prise de poids corporel et la consommation alimentaire des animaux parents. Les animaux des groupes traités (aussi bien ceux issus d’un accouplement après 8 semaines de dose que ceux issus d’un accouplement après 17 semaines de dose) n’ont présenté aucune différence sur le plan de la performance de la reproduction, du poids des organes reproducteurs ou de la fertilité par rapport aux témoins. Aucun effet n’a été observé chez les descendants.
La silice de diméthyle silylate n’était pas génotoxique in vitro dans les essais de mutation bactérienne ou d’aberration chromosomique (US EPA 2011). Dans une étude limitée de deux ans sur la cancérogénicité par voie orale (il n’y a pas eu de témoins concurrents; dose unique), la silice de diméthyle silylate a été administrée dans le régime alimentaire de rats Wistar (20/sexe) à raison de 100 mg/kg p.c./j. Les résultats ont été comparés aux données historiques sur les témoins, et aucun effet de cancérogénicité ou autre lié au traitement n’a été observé (US EPA 2011).
SAS (SAS colloïdale, précipitée et pyrogénée)
Les données de toxicocinétique sur la SAS étaient limitées. L’absorption de SAS précipitée (15 μm) et de SAS pyrogénée (sans cristaux, dont la taille des particules était comprise entre 0,010 et 0,040 μm) par voie orale a été examinée chez les humains (Langendorf et Lang 1967, cité dans EFSA 2018). Des volontaires (5 hommes et 1 femme, 22 à 28 ans, sans régime témoin) ont ingéré 2 500 mg de SAS dans du jus de pomme. Les urines totales ont été recueillies pendant 3 jours avant l’application (valeurs témoins) et pendant 4 jours après l’application pour chaque personne, et la teneur en silicium dans les urines a été déterminée. Il n’y a pas eu de changement significatif de la teneur en silicium dans l’urine entre la préapplication et la postapplication, ce qui semble indiquer une absence d’absorption du silicium après l’ingestion de la SAS. L’élimination de la SAS dans les poumons après exposition par inhalation a été décrite dans deux études.
Dans une étude d’exposition par inhalation de 5 jours, des rats Wistar (10/sexe/groupe) ont été exposés à trois types de SAS (SAS colloïdale, précipitée et pyrogénée – la taille des particules pour chaque type était de 1 à 4 μm), à raison de 0, 1, 5 ou 25 mg/m3 6 heures par jour pendant 5 jours par inhalation par le nez seulement (Arts et al. 2007). À la suite de l’exposition aux trois types de SAS, on a constaté une augmentation du poids absolu et relatif des poumons et des ganglions lymphatiques trachéo-bronchiques à 25 mg/m3. L’examen histopathologique a révélé une accumulation intra-alvéolaire de macrophages et de granulocytes, ainsi qu’une hypertrophie bronchique/bronchiolaire à 5 et 25 mg/m3. Aucune modification du poids des organes et aucune hypertrophie bronchique/bronchiolaire n’ont été observées à 5 et 25 mg/m3 après 3 mois de la période de récupération. La teneur en silicium s’est avérée sensiblement réduite dans les poumons après 1 mois d’exposition par rapport à 1 jour post-exposition, et le silicium n’a pas été détecté après 3 mois d’exposition pour tous les types de SAS. L’OCDE (2004) a établi une CSENO à 1 mg/m3.
Dans une étude d’exposition par inhalation à doses répétées de 13 semaines, des rats Wistar (10/sexe/groupe) ont été exposés à des particules de SAS pyrogénée (taille des particules non indiquée) à 0, 1,3, 5,9 ou 31 mg/m3 par inhalation (corps entier) pendant 6 heures par jour, 5 jours par semaine, et les rats ont été observés pendant des périodes post-récupération de 13, 26, 39 et 52 semaines (Reuzel et al. 1991). L’inhalation de 1,3 mg/m3 de SAS a entraîné une légère prolifération réversible de cellules pro-inflammatoires, plutôt que des changements pathologiques pertinents. Chez les rats exposés à 5,9 et 31 mg/m3, on a observé des lésions pulmonaires macroscopiques (tissus spongieux et surfaces tachetées), ainsi que des modifications histopathologiques pulmonaires (notamment l’accumulation de macrophages alvéolaires et la fibrose interstitielle). Des lésions granulomateuses du poumon ont également été observées chez les rats exposés à 31 mg/m3. Au cours de l’observation post-exposition, on a constaté quelques changements dans les poumons (notamment l’accumulation de macrophages alvéolaires). Les lésions granulomateuses n’étaient pas progressives, c’est‑à‑dire qu’aucun nodule silicogène ne s’est formé. De la silice a été détectée dans les poumons à la fin de la période d’exposition dans les groupes ayant reçu 31 mg/m3, mais on n’en a récupéré chez aucun animal pendant l’observation post-exposition. La CSENO de 1,3 mg/m3 a été établie sur la base des effets inflammatoires observés dans les poumons à la CMENO de 5,9 mg/m3.
Dans une étude d’exposition par voie cutanée à doses répétées de 13 semaines, des rats Sprague-Dawley (10/sexe/groupe) ont été traités par voie topique avec des particules colloïdales de SAS (0,020 μm) à 0 (eau), 500, 1 000 ou 2 000 mg/kg p.c./j sur le dos, sous un pansement semi-occlusif (Ryu et al. 2014). Aucune toxicité systémique n’a été observée chez les animaux traités à la lumière des observations cliniques et des examens hématologiques, biochimiques et histologiques.
La toxicité de la SAS (SAS colloïdale et précipitée) pour le développement a été étudiée chez quatre espèces animales (rat, souris, hamster et lapin) à des doses de gavage oral atteignant 1 600 mg/kg p.c./j (Food and Drug Research Laboratories 1973, cité dans OCDE 2004). Aucun signe significatif d’effet toxique sur la maternité ou le développement n’a été observé chez les espèces étudiées.
La SAS (SAS colloïdale et précipitée) s’est également révélée négative lors d’essais de génotoxicité in vitro et in vivo (OCDE 2004). Dans une étude de cancérogénicité, la SAS (colloïdale et précipitée) a été administrée à des souris pendant 93 semaines et à des rats pendant 103 semaines à raison de 5 % dans le régime alimentaire (équivalant à 6 500 mg/kg p.c./j chez la souris et à 2 500 mg/kg p.c./j chez le rat; la taille des particules n’a pas été indiquée). Aucun effet cancérogène ou autre effet systémique lié au traitement n’a été observé (Takizawa et al. 1988 cité dans OCDE 2004).
6.3 Caractérisation des risques pour la santé humaine
Aucun effet critique n’a été constaté lors de l’exposition à des analogues du TMSS par les voies orale ou cutanée. Par conséquent, l’exposition par voie orale ou cutanée au TMSS présent dans les milieux environnementaux et les aliments, ou encore par l’utilisation de produits de consommation, n’est pas jugée préoccupante.
Les réponses inflammatoires observées dans les poumons des animaux de laboratoire semblaient être fonction à la fois de la concentration et de la durée d’exposition, plutôt que de la concentration maximale d’exposition. Ceci est corroboré par l’observation de changements histopathologiques plus graves, dont la fibrose interstitielle, dans l’étude de 13 semaines, par rapport à l’étude de 5 jours, pour la SAS pyrogénée analogue. Cependant, les CSENO et les CMENO (environ 1 mg/m3 et 5 mg/m3, respectivement) déterminées dans l’étude de 5 jours (Arts et al. 2007) et celle de 13 semaines (Reuzel et al. 1991) étaient similaires, ce qui laisse entendre qu’un mécanisme d’élimination a permis d’éviter les lésions pulmonaires à 1 mg/m3 lors d’expositions plus longues.
Le tableau 6-2 présente les valeurs d’exposition et de danger pertinentes pour le TMSS, ainsi que les marges d’exposition résultantes, aux fins de détermination des risques. Dans la présente évaluation, la CSENO de 2,05 mg/m3 (ajustée à 0,37 mg/m3 en raison de la poursuite de l’exposition), qui a été trouvée dans l’étude d’exposition par inhalation de 13 semaines au TMSS, a été utilisée comme niveau d’effet critique pour la caractérisation des risques.
| Scénario d’exposition | Estimation de l’exposition | Niveau d’effet critique | Paramètre d’effet critique pour la santé | ME |
|---|---|---|---|---|
| Exposition quotidienne par inhalation – shampoing sec (19 ans et +) | 0,0011 mg/m3 (exposition continue)a | CSENO[adj] b = 0,37 mg/m3 | Réponses inflammatoires dans les poumons des rats exposés au TMSS à 10,01 mg/m3 dans une étude d’exposition par inhalation de 13 semaines (6 heures/jour, 5 jours/semaine) | 340 |
| Exposition quotidienne par inhalation – fard à joues (19 ans et +) | 0,0014 mg/m3 (exposition continue)a | CSENO[adj] b = 0,37 mg/m3 | Réponse inflammatoire dans les poumons des rats exposés au TMSS à 10,01 mg/m3 dans une étude d’exposition par inhalation de 13 semaines (6 heures/jour, 5 jours/semaine) | 264 |
Abréviations : ME = marge d’exposition; adj = valeur ajustée.
a Pour tenir compte des différences d’exposition entre l’étude sur les effets dangereux et le profil d’emploi réel, la CSENO et l’estimation de l’exposition pour le TMSS ont toutes deux été ajustées selon un scénario d’exposition continue (24 heures/jour, 7 jours/semaine), conformément aux lignes directrices de l’EPA sur l’évaluation des risques par inhalation (US EPA 2009).
b La CSENO a été ajustée à 0,37 mg/m3 [= 2,05 mg/m3 x (6 heures/24 heures) x (5 jours/7 jours)] pour un scénario d’exposition continue.
Pour l’exposition quotidienne par inhalation au shampoing sec et au fard à joues, on a obtenu les ME de 340 et 264 en comparant la CSENO[adj] de 0,37 mg/m3 aux estimations de l’exposition de 0,0011 mg/m3 et 0,0014 mg/m3, respectivement. Ces estimations de l’exposition sont jugées prudentes, car en raison de la taille des particules de TMSS dans les cosmétiques, elles peuvent ne pas être entièrement inhalables (communication personnelle, courriels de la DSPCPD, SC, au BERSE, SC, 27 mai 2019; sans référence), par rapport aux résultats obtenus dans l’étude d’exposition par inhalation de 13 semaines (OCDE 2004).
En raison de la réponse inflammatoire induite par les particules de silice sans cristaux dans les poumons, qui dépend de la charge des particules totales inhalées, le scénario d’inhalation journalière est jugé prudent et couvre le scénario des expositions ponctuelles. Il a donc été jugé inutile de caractériser quantitativement le risque associé aux scénarios d’inhalation ponctuelle (par événement).
Les marges calculées sont jugées suffisantes pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
6.4 Incertitudes de l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau suivant.
| Principales sources d’incertitude | Incidence |
|---|---|
| La répartition de la taille des particules, leur forme et les propriétés de surface du TMSS dans les produits ne sont pas disponibles. | +/- |
| On ne disposait d’aucune donnée de surveillance canadienne pour les concentrations de TMSS dans l’air, l’eau potable, le sol, la poussière ou la nourriture. | - |
| On a utilisé une étude de substitution pour ce qui est des scénarios d’exposition au shampoing sec et au fard à joues. La concentration atmosphérique mesurée de PM4 due à l’utilisation de poudre pour le corps et de poudre pour le visage a été utilisée comme donnée de substitution pour le TMSS, en raison de la similitude de ces substances en termes de propriétés physiques et chimiques et de mode d’application. | +/- |
Abréviations : + = incertitude quant au potentiel de surestimation de l’exposition/risque; – = incertitude quant au potentiel de sous-estimation du risque d’exposition; +/ – = potentiel inconnu de surestimation ou de sous-estimation du risque.
7. Conclusion
Compte tenu de tous les éléments de preuve contenus dans la présente ébauche d’évaluation préalable, le TMSS présente un faible risque d’effets nocifs sur l’environnement. Il est proposé de conclure qu’il ne satisfait pas aux critères énoncés aux alinéas 64a) ou b) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que le TMSS ne satisfait pas aux critères de l’alinéa 64c) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est proposé de conclure que le TMSS ne satisfait à aucun des critères énoncés à l’article 64 de la LCPE.
Références
Anderson EL, Sheehan PJ, Kalmes RM, Griffin JR. 2017. Assessment of Health Risk from Historical Use of Cosmetic Talcum Powder. Risk Anal. 37(5):918-928. (disponible en anglais seulement)
Arts JHE, Muijser H, Duistermaat E, Junker K, Kuper CF. 2007. Five-day inhalation toxicity study of three types of synthetic amorphous silicas in Wistar rats and post-exposure evaluations for up to 3 months. Food Chem Toxicol. 45(10):1856-67. (disponible en anglais seulement)
Becker LC, Bergfeld WF, Belsito DV, Hill RA, Klaassen CD, Liebler D, Marks JG Jr, Shank RC, Slaga TJ, Snyder PW, Andersen FA. 2013. Safety assessment of silylates and surface-modified siloxysilicates. Int J Toxicol.32(3 Suppl):5S-24S. (disponible en anglais seulement)
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L.C. 1999, ch. 33. Gazette du Canada Partie III, vol. 22, no 3.
Canada, Min. de l’Environnement. 2012. Loi canadienne sur la protection de l’environnement (1999) : avis concernant certaines substances de la Liste intérieure Gazette du Canada, Partie I, vol. 146, no 48, supplément.
Cabot. 1994a. Inhalation toxicity in rats, [Cab-O-Sil] TS-530, laboratory project MB 94-3664 E.Unpublished report. Moreno T. MB Research Laboratories, Spinnerstown, PA, USA. Cabot, Tuscola, Illinois, USA. (disponible en anglais seulement)
Cabot. 1994b. Cab-O-Sil TS-530, Salmonella plate incorporation mutagenicity assay (Ames test), laboratory study G94AZ74.501. Unpublished report. San RHC and Klug ML. Microbiological Associates, Rockville, Maryland, USA. Cabot, Tuscola, Illinois, USA. (disponible en anglais seulement)
Cabot. 1994c. Cab-O-Sil TS-530, chromosome aberrations in Chinese hamster ovary (CHO) cells, laboratory study G94AZ74.330. Unpublished report. Curry PT and Schadly E. Microbiological Associates, Rockville, Maryland, USA. Cabot, Tuscola, Illinois, USA. (disponible en anglais seulement)
Cabot. 1995. Cab-O-Sil TS-500, chromosome aberrations in Chinese hamster ovary (CHO) cells, laboratory study G94BN14.330. Unpublished report. Curry PT and Schadly E. Microbiological Associates, Rockville, Maryland, USA. Cabot, Tuscola, Illinois, USA. (disponible en anglais seulement)
ConsExpo Web [Consumer Exposure Web Model]. 2018. Bilthoven (NL): Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment]. (disponible en anglais seulement)
[CosIng] Cosmetic Ingredients & Substances [database]. Brussels (BE): European Commission. [Consulté le 24 mai 2019]. (disponible en anglais seulement)
[CTFA] Cosmetic, Toiletry and Fragrance Association. 1983. Summary for the Results of Surveys of the amount and Frequency of use of cosmetic products by Women. Report Prepared by Pitkin B, Rodericks JV, Turnbull D. Washington (DC): CTFA Inc. (disponible en anglais seulement)
Degussa AG. 1964. Gewerbehygienisch-toxicologische Untersuchung der Wesselinger hydrophoben ‘‘reaction products of dichlorodimethyl silane with silica"; 1964. Study submitted to the High Production Volume Information System of the US EPA. (disponible en anglais seulement)
Dement JM, Mangin JH, Wallingfor KM, Shuler PJ, Sumwalde RD. 1972. Fiber Exposure During Use of Baby Powders. Prelminary Report. Cincinnati(OH): Enviornmental Investigations Branch, National Institute for Occupational Safety and Health. (disponible en anglais seulement)
Dow Corning. 1972. One-year chronic dust inhalation toxicity study with J-DCA in albino rats and cynomolgus monkeys. Unpublished report. Industrial Bio-Test Laboratories, Northbrook, Illinois, USA. Dow Corning, Midland, Michigan, USA [Summary]. (disponible en anglais seulement)
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l’approche scientifique : classification du risque écologique des substances organiques. Ottawa (Ont.), gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016b. Supporting documentation: data used to create substance-specific hazard and exposure profiles and assign risk classifications. Gatineau (QC): ECCC. Information in support of the science approach document: ecological risk classification of organic substances. substances@ec.gc.ca (disponible en anglais seulement)
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2015. Identification des priorités d’évaluation des risques : résultats de l’examen de 2015. Ottawa (Ont.), gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. [modified 2017 Mar 12]. Catégorisation. Ottawa (Ont.), gouvernement du Canada.
[ECETOC] European Centre for Ecotoxicology and Toxicology of Chemicals. 2006. Synthetic Amorphous Silica (CAS No. 7631-86-9). ECETOC Joint Assessment of Commodity Chemicals (JACC) No. 51. Brussels, Belgium. (disponible en anglais seulement)
[ECHA] European Chemicals Agency. 2016. Opinion on the application for approval of the active substance pyrogenic, synthetic amorphous silicon dioxide, nano, surface treated, Product type: 18. ECHA/BPC/122/2016. Helsinki (FI): ECHA. [Consulté le 1er février 2019]. (disponible en anglais seulement)
EFSA Panel on Food Additives and Nutrient Sources added to Food (ANS), 2018. Scientific Opinion on Re-evaluation of silicon dioxide (E 551) as a food additive. EFSA Journal 2018;16(1):5088. [Consulté le 27 mai 2019] (disponible en anglais seulement)
Environnement Canada. Données de la Mise à jour de l’inventaire de la LIS 2013 recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement, 1999 : avis concernant certaines substances de la Liste intérieure. Données préparées par : Environnement Canada et Santé Canada; Programme des substances existantes.
Environnement Canada, Santé Canada. 2013a. Évaluation préalable pour le Défi concernant le 3-[[2,2'-diméthyl-4'-[[4-[[(p-tolyl)sulfonyl]oxy]phényl]azo]- [1,1'-biphényl]-4-yl]azo]-4-hydroxynaphtalène-2,7- disulfonate de disodium (Acid Red 111) Numéro de registre du Chemical Abstracts Service 6358-57-2. Ottawa (Ont.), gouvernement du Canada. [Consulté le 4 février 2019].
Environnement Canada, Santé Canada. 2013b. Évaluation préalable pour le Défi concernant : le quartz (NR CAS 14808-60-7) et la cristobalite (NR CAS 14464-46-1). Ottawa (Ont.), gouvernement du Canada. [Consulté le 28 juin 2019].
[ESIS] European Chemical Substances Information System [database on the Internet]. c1995–2009. European Chemical Bureau (ECB). [cité en octobre 2010]. (disponible en anglais seulement)
Ficheux AS, Wesolek N, Chevillotte G, Roudot AC. 2015. Consumption of cosmetic products by the French population. First part: Frequency data. Food Chem Toxicol. 78:159-169. (disponible en anglais seulement)
Ficheux AS, Chevillotte G, Wesolek N, Morisset T, Dornic N, Bernard A, Bertho A, Romanet A, Leroy L, Mercat AC, Creusot T, Simon E, Roudot AC. 2016. Consumption of cosmetic products by the French population. Second part: Amount data. Food Chem Toxicol. 90:130-141. (disponible en anglais seulement)
Food and Drug Research Laboratories, Inc. 1973: Teratologic Evaluation of FDA 71-48 (Syloid; silica aerogel). Prep. for: FDA, U. S. Food and Drug Administration; NTIS, National Technical Information Service, U. S. Department of Commerce, USA, PB-223 808. (disponible en anglais seulement)
Fruijtier-Pölloth C. 2012. The toxicological mode of action and the safety of synthetic amorphous silica-a nanostructured material. Toxicology 294(2-3):61-79 (disponible en anglais seulement)
Fruijtier-Pölloth C. 2016. The safety of nanostructured synthetic amorphous silica (SAS) as a food additive (E 551). Arch Toxicol. 90(12): 2885–2916. (disponible en anglais seulement)
Hallegot P and Grégoire S. 2011. Synthetic Amorphous Silica - L’Oréal Study No. PH/OD/11.0273/Si (disponible en anglais seulement)
Haz-Map [database]. [mis à jour en octobre 2018]. Bethesda (MD): US National Library of Medicine. [Consulté le 1er mars 2019]. (disponible en anglais seulement)
Santé Canada (2015). Tableau de la consommation des aliments fondé sur l’Enquête sur la santé dans les collectivités canadiennes, cycle 2.2, Nutrition (2004) réalisée par Statistique Canada, fichier partagé.
Santé Canada. 2017. Document sur l’approche scientifique concernant les substances présentant un faible danger pour la santé humaine. Ottawa (Ont.), gouvernement du Canada.
Santé Canada. 2018a. Draft Inhalation Risk Assessment Guidance. October 2018. Internal Draft. Unpublished report. Ottawa (ON): Existing Substances Risk Assessment Bureau, Health Canada. (disponible en anglais seulement)
Santé Canada. 2018b. Draft Personal Care Products Workbook August 2018. Internal Draft. Unpublished report. Ottawa(ON): Existing Substances Risk Assessment Bureau, Health Canada. (disponible en anglais seulement)
Health Canada. 2019. Data collected from a targeted information gathering initiative for assessments under the Chemicals Management Plan (March – May 2019). Données recueillies par le Programme des substances existantes ECCC, Santé Canada.
Heylings J.2013. Silica overview: Skin Penetration of Synthetic Amorphous Silica: analytical (quantitative) approach. January 15, 2013. (disponible en anglais seulement)
[ISO] Organisation internationale de normalisation. 2007. Air des lieux de travail — Particules ultrafines, nanoparticules et aérosols nanostructurés — Caractérisation et évaluation de l’exposition par inhalation. Genève (CH) : ISO 27628:2007.
IUCLID 2003. Data set for ID 68611-44-9, EC No. 271-893-4, U.S. Environmental Protection Agency. (disponible en anglais seulement)
Johnson IR. 2013. Synthetic Amorphous Silica - In vitro Absorption of Silica from Three Formulations through Dermatomed Human Skin. Dermal Technology Laboratory Study No. JV2218. (disponible en anglais seulement)
Kogel JE, Trivedi NC, Barker JM, Krukowski ST, editors. 2006. Industrial Minerals & Rocks. 7th ed: Commodities, Markets, and Uses. Littleton (Colorado): Society for Mining, Metallurgy, and Exploration, Inc. p. 1190-1191. (disponible en anglais seulement)
Langendorf H, Lang K. 1967. Der Einfluss polymerer Kieselsaeuren auf die renale SiO2-Ausscheidung beim Menschen. Zeitschrift Ernaehrungswissenschaft, 8, 27–32. (non disponible en français)
Langer SH, Connell S, Wender I. 1958. Preparation and properties of trimethylsilyl ethers and related compounds. J Org Chem 23(1): 50-58. (disponible en anglais seulement)
Loretz LG, Api AM, Barraj LM, Burdick J, Dressler WE, Gettings SD, Han Hsu H, Pan YHL, Re TA, Renskers KJ, Rothenstein A, Scrafford CG, Sewall C. 2005. Exposure data for cosmetic products: lipstick, body lotion, and face cream. Food Chem Toxicol 43: 279-291. (disponible en anglais seulement)
Martin KR. 2007. The chemistry of silica and its potential health benefits. The Journal of Nutrition, Health & Aging. 11 (2): 94-97. (disponible en anglais seulement)
[MSDS] Material Safety Data Sheet. 2013. Valspar paint 502 DARK GREEN/AQUA 6UC. Medina (OH): The Valspar Corporation. [Consulté le 10 janvier 2019]. (disponible en anglais seulement)
[MSDS] Material Safety Data Sheet. 2015a. Silicon dioxide, amorphous, hexamethyldisilazane treated, CAS RN 68909-20-6. Morrisville (PA): Gelest, Inc. [Consulté le 1er février 2019]. (disponible en anglais seulement)
[MSDS] Material Safety Data Sheet. 2015b. Elmer’s Stix-All. Westerville (OH): Elmer's Products, Inc. [Consulté le 10 janvier 2019]. (disponible en anglais seulement)
[MSDS] Material Safety Data Sheet. 2016. AEROSIL® R 812 S. Parsippany (NJ): Evonik Corporation USA. [Consulté le 24 mai 2019]. (disponible en anglais seulement)
Nazarenko Y, Zhen H, Han T, Lioy PJ, Mainelis G. 2012. Potential for Inhalation Exposure to Engineered NanoparticlesNanomaterial inhalation exposure from Nanotechnology-Based Cosmetic Powders. Environmental Health Perspectives. 120(6): 885 – 892nanotechnology-based cosmetic powders: a quantitative assessment. J Nanopart Res 14(11) doi:10.1007/s11051-012-1229-2. (disponible en anglais seulement)
[OCDE] Organisation for Economic Co-operation and Development. 2004. IDS Dossier on Synthetic Amorphous Silica and Silicates. October 2004. [Consulté le 27 mai 2019] (disponible en anglais seulement)
OCDE QSAR Toolbox. 2014 Version 3.3. Paris (FR): Organisation for Economic Co-operation and Development, Laboratory of Mathematical Chemistry. (disponible en anglais seulement)
Rasmussen PE, Levesque C, Niu J, Gardner HD, Nilsson G, Macey K. 2019. Characterization of airborne particles emitted during application of cosmetic talc products. Manuscript in preparation. Ottawa (ON): Exposure and Biomonitoring Division, Health Canada. (disponible en anglais seulement)
Reuzel PGJ, Bruijntjes JP, Feron VJ, Woutersen RA. 1991. Subchronic inhalation toxicity of amorphous silicas and quartz dust in rats. Food Chem. Toxicol. 29,341–354. (disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment]. 2006. Cosmetics fact sheet: to assess the risks for the consumer: version mise à jour pour ConsExpo 4 [PDF]. Bilthoven (NL): RIVM. Report No.: 320104001/2006. [Consulté le 17 juin 2019]. (disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment]. 2007a. Paint products fact sheet: to assess the risks for the consumer. Updated version for ConsExpo 4. Bilthoven (NL): RIVM. Report No.: 320104008/2007. [Consulté le 13 mai 2019] (PDF). (disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment]. 2007b. Do-it-yourself products fact sheet: to assess the risks for the consumer. Bilthoven (NL): RIVM. Report No.: 320104007/2007. [Consulté le 13 mai 2019] (PDF). (disponible en anglais seulement)
Ryu HJ, Seong NW, So BJ, Seo HS, Kim JH, Hong JS, Park MK, Kim MS, Kim YR, Cho KB, Seo MY, Kim MK, Maeng EH, Son SW. 2014. Evaluation of silica nanoparticle toxicity after topical exposure for 90 days. Int J Nanomedicine. 9 Suppl 2:127-36. (disponible en anglais seulement)
[SCCS] Scientific Committee on Consumer Safety. 2015. Opinion on Silica, Hydrated Silica, and Silica Surface Modified with Alkyl Silylates (nano form). Adopted by the SCCS on 20 March 2015, Revision of 29 September 2015. Report no. SCCS/1545/15 (disponible en anglais seulement)
Science Direct [database]. [mise à jour 2019]. Search results for silicone rubber. Elsevier B.V. [Consulté le 6 juin 2019]. (disponible en anglais seulement)
Statistics Canada. 2017. Custom tabulation of grooming products data from the Canadian Health Measures Survey Cycle 2 (2010-2011). Prepared for Existing Substances Risk Assessment Bureau, Health Canada by Statistics Canada. Unpublished.
Takizawa, Y; Hirasawa, F.; Noritomi, E.; Aida, M; Tsunoda, H.; Uesugi, S. 1988. Oral ingestion of syloid to mice and rats and its chronic toxicity and carcinogenicity. Acta Medica et Biologica, 36, 27-56 (disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2009. Risk Assessment Guidance for Superfund Volume I: Human Health Evaluation Manual (Part F, Supplemental Guidance for Inhalation Risk Assessment). Washington (D.C.): U.S. EPA, Office of Superfund Remediation and Technology Innovation. (disponible en anglais seulement)
[US EPA] US Environmental Protection Agency. 2011. Screening-level hazard characterization: Silane, Dichlorodimethyl-, Reaction Product with Silica (CAS RN 68611-44-9). Washington (DC): US EPA, Office of Pollution Prevention and Toxics. (disponible en anglais seulement)
Villota R and Hawkes JG. 1986. Food Applications and the Toxicological and Nutritional Implications of Amorphous Silicon Dioxide. Crit Rev Food Sci and Nutr 23(4): 289-321. (disponible en anglais seulement)
Wacker. 1998a. Sub-chronic (13-week) inhalation toxicity study with Wacker HDK SKS300 in rats, additional parameters: Annex 5, silicon content determination in lungs and tracheobronchial lymph nodes. Appendix 4.1, individual data pathology main study. Unpublished report V98.684. Arts JHE and Kuper CF, TNO Nutrition and Food Research Institute, Zeist, Netherlands. Wacker Chemie, Burghausen, Germany. (disponible en anglais seulement)
Wacker. 1998b. Sub-chronic (13-week) inhalation toxicity study with Wacker HDK SKS 300 in rats. Unpublished report V98.497. Arts JHE and Kuper CF, Part 1, 2 and 3. TNO Nutrition and Food Research Institute, Zeist NL. Wacker-Chemie, Burghausen, Germany. (disponible en anglais seulement)
Annexe A. Données obtenues par lecture croisée pour le TMSS
| Rôle | Analogue | Analogue | Cible |
|---|---|---|---|
| No CAS (nom commun ou abréviation) | 68611-44-9 (silice de diméthyle silylate) | No CAS 112926-00-8 (SAS colloïdale); No CAS 112926-00-8 (SAS précipitée); No CAS 112945-52-5 (SAS pyrogénée) | 68909-20-6 (TMSS) |
| Structure représentative | 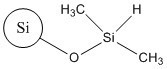 | SiO2 | 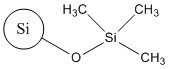 |
| Solubilité dans l’eau (mg/L) | < 0,0001 (négligeable) | Environ 15 – 68 (à 20 °C) (pH 5,5 – 6,6) | Négligeable |
| Log Koe | S.O. | S.O. | S.O. |
| Pression de vapeur (mm Hg) | Négligeable | Négligeable | Négligeable |
| Taille des particules primaires (nm) | 10 – 50 b | 5 – 50 (SAS pyrogénée) 5 – 100 (SAS précipitée) | 5 – 20 a |
| Taille des agrégats (nm) | < 5 000 b | 100 – 1 000 | 100 – 1 000 a |
| Toxicocinétique | Chez les rats exposés à la substance aérosolisée à 200 mg/m3, 5 heures par jour pendant 3 jours, le silicium a été détecté dans les poumons 24 heures post-exposition, mais non après 1 mois d’exposition (Degussa AG 1964, cité dans Becker et al. 2013). | Aucun silicium n’a été absorbé chez les volontaires qui avaient reçu des particules de SAS (précipitée et pyrogénée) par voie orale. Chez les rats exposés à 25 mg/m3 de tous les types de SAS non traitée pendant 6 heures par jour pendant 5 jours, la teneur en silicium dans les poumons a diminué de manière significative après 1 mois d’exposition (par rapport à 1 journée post-exposition) et n’a pas été détectée après 3 mois d’exposition, pour tous les types de SAS. Chez les rats exposés à 31 mg/m3 de silice pyrogénée pendant 13 semaines, la silice a pu être détectée dans les poumons à la fin de la période d’exposition, mais n’a été retrouvée chez aucun animal pendant les 13, 26, 39 et 52 semaines d’observation post-exposition (OCDE 2004). | n.d. |
| Toxicité à dose répétée (voie orale) | Aucun effet lié au traitement chez les rats ayant reçu 500 mg/kg p.c./j dans leur alimentation pendant 6 mois (US EPA 2011 ) | Aucun effet systémique chez les souris ayant reçu 6 500 mg/kg p.c./j dans leur alimentation pendant 93 semaines (OCDE 2004) | n.d. |
| Toxicité à dose répétée (voie cutanée) | n.d. | Pas d’effet nocif constaté à la dose maximale d’essai de 2 000 mg/kg p.c./j pendant 90 jours, chez les rats traités avec la SAS colloïdale par voie topique (Ryu et al. 2014). | n.d. |
| Toxicité à dose répétée (inhalation) | CMENO = 31 mg/m3(rats, 2 semaines d’inhalation, corps entier, 6 h/j, 5 j/semaine, changements pathologiques dans les poumons à la plus faible concentration d’essai, US EPA 2011) CMENO = 35 mg/m3(13 semaines d’inhalation, corps entier, 6 h/j, 5 j/semaine, changements pathologiques dans les poumons chez les rats ayant reçu la plus faible concentration d’essai, US EPA 2011) | CSENO = 1 mg/m3(inhalation pendant 5 jours, 6 h/j, légers changements pathologiques dans les poumons des rats exposés à la SAS (colloïdale, précipitée ou pyrogénée) à 5 mg/m3) (Arts et al. 2007) CSENO = 1,3 mg/m3(13 semaines d’inhalation, corps entier, 6 h/j, 5 j/semaine, changements pathologiques dans les poumons chez les rats exposés à la SAS pyrogénée à 5,9 mg/m3, OCDE 2004) | CSENO = 2,05 mg/m3, CMENO = 10,01 mg/m3 (13 semaines d’inhalation, 6 h/j, 5 j/semaine, changements pathologiques dans les poumons chez les rats exposés au TMSS à 10,01 mg/m3) (ECETOC 2006). |
| Toxicité pour la reproduction ou le développement (voie orale) | Aucun effet nocif/indésirable n’a été observé chez les rats traités avec 500 mg/kg p.c./jour(étude de reproduction sur une génération, Pr‑B 1965) | Aucun effet sur les mères ou pour le développement observé aux doses atteignant 1 600 mg/kg p.c./j de SAS (SAS colloïdale et SAS précipitée) chez les rats, les souris, les hamsters et les lapins (OCDE 2004). | n.d. |
| Génotoxicité | Résultat négatif (US EPA 2011) | Résultat négatif (OCDE 2004). | Résultat négatif (ECETOC 2006). |
| Cancérogénicité | Aucun effet cancérogène observé chez les rats ayant reçu 100 mg/kg p.c./j dans leur alimentation pendant 2 ans (US EPA 2011) | Aucun effet cancérogène observé chez les souris ayant reçu 6 500 mg/kg p.c./j dans leur alimentation pendant 93 semaines (OCDE 2004). | n.d. |
Abréviations : h = heure; CMENO/D = concentration minimale entraînant un effet nocif observé/dose; n.d. = non disponible; S.O. = sans objet; CSENO/D = concentration sans effet nocif observé/dose; Koe = coefficient de partage octanol-eau; pKa = constante de dissociation dans l’acide.
a Plage de tailles des particules de la SAS traitée en surface (Fruijtier-Pölloth 2012).
b Plage de tailles des particules de la silice pyrogénée hydrophobe (SCCS 2015).
Annexe B. Paramètres utilisés pour estimer l’exposition humaine au TMSS
Le tableau B-1 présente les intrants et facteurs d’ajustement pour le scénario d’exposition par inhalation au shampoing sec et au fard à joues.
| Scénario | Conc. dans le produit a | Conc. moyenne dans l’étude (mg/m3) b | CA de niveau 1 (mg/m3) b | DEj (h/j) c | CE ajustée de niveau 2 (mg/m3) d | FE (j/an) e | DEa (an) f | CE ajustée de niveau supérieur (mg/m3) g |
|---|---|---|---|---|---|---|---|---|
| Shampoing sec | 100 % | 1,36 | 1,36 | 0,083 | 0,019 | 84 | 68 | 0,0011 |
| Fard à joues | 30 % | 1,36 | 0,408 | 0,083 | 0,0057 | 365 | 68 | 0,0014 |
Abréviations : Conc. = concentration; CA = concentration dans l’air par événement; j = jour; DEj = durée de l’exposition journalière; FE = fréquence de l’exposition; DEa = durée de l’exposition annuelle; CE = concentration de l’exposition, valeur ajustée; h = heure.
a Concentration maximale de TMSS trouvée dans les shampoings secs (concentration la plus élevée parmi tous les produits sous forme de poudre libre) et dans le fard à joues, d’après les avis soumis en vertu du Règlement sur les cosmétiques à Santé Canada pour le TMSS (communication personnelle, courriels de la DSPCPD, SC, au BERSE, SC, 9 octobre 2018 et 14 février 2019; sans référence).
b CA = concentration moyenne pendant l’étude × concentration maximale de TMSS dans le produit. La concentration moyenne de l’étude est la concentration moyenne de PM4 mesurée dans l’air, par sujet, d’après Anderson et al. 2017 et Rasmussen et al. 2019 (document non publié).
c DEj = durée de l’exposition × nombre d’applications/j = 5 minutes/application × 1 application/j × 1 heure/60 minutes. Une durée d’exposition de 5 minutes/application est basée sur le temps médian passé dans la salle de bain après une douche ou un bain (US EPA 2011, RIVM 2006) et on a supposé qu’il y avait 1 application/j pour le shampoing sec et le fard à joues. L’estimation de la durée de l’exposition est également basée sur un certain nombre de facteurs, notamment la durée d’existence du nuage de particules mesuré dans Rasmussen et al. 2019 (environ 1 minute), la durée moyenne d’échantillonnage de 6 minutes selon Anderson et al. (2017), la formation de nuages secondaires de particules tel qu’observé par Rasmussen et al. (2019) et par le NIOSH dans une étude antérieure (Dement et al. 1972). Il est donc nécessaire de tenir compte du temps passé à proximité du lieu où la personne exerce ces activités.
d Concentration d’exposition de niveau 2 = CA x heures exposition / heures d’exposition selon l’étude sur les animaux (Santé Canada 2018a). La durée de l’exposition dans les deux scénarios est de 5 minutes.
e La FE pour le shampoing sec est de 0,23 fois/j ou 84 jours/année (Ficheux et al. 2015, Santé Canada 2018b) et la FE pour le fard à joues est présumée être quotidienne (Ficheux et al. 2015, Santé Canada 2018b), car ces valeurs présentaient la tendance centrale la plus élevée de l’étude de la plus haute qualité qui était disponible pour chaque type de produit.
f Durée d’exposition présumée d’un adulte à un shampoing sec et à un fard à joues (durée de vie de 80 ans – 12 ans à l’enfance = 68 ans à l’âge adulte).
g CE ajustée = (CA × DEj × FE × DEa ) / TM, où TM (= temps moyen) est calculé comme suit : DEa × 365 j/an × 24 h/j. La concentration d’exposition ajustée est calculée selon l’équation 8 des lignes directrices de l’EPA publiées en 2009, « Risk Assessment Guidance for Superfund Volume I : Human Health Evaluation Manual ».
