Ébauche de l’évaluation préalable - Extrait de Lotus corniculatus
Titre officiel : Ébauche de l’évaluation préalable - Extrait de Lotus corniculatus
Numéro d’enregistrement du Chemical Abstracts Service 84696-24-2
Environnement et Changement climatique Canada
Santé Canada
Décembre 2019
Sommaire
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), les ministres de l’Environnement et de la Santé ont réalisé l’évaluation préalable d’extrait de Lotus corniculatus. Le numéro d’enregistrement du Chemical Abstracts Service (NE CASNote de bas de page 1) de l’extrait de Lotus corniculatus est 84696-24-2. Cette substance a été jugée prioritaire pour une évaluation, car elle satisfait au critère de catégorisation énoncé au paragraphe 73(1) de la LCPE.
Lotus corniculatus est un végétal aussi appelé lotier corniculé, son nom commun. D’après les renseignements déclarés dans les enquêtes menées conformément à l’article 71 de la LCPE, l’extrait de Lotus corniculatus n’était pas fabriqué ni importé au Canada en quantité supérieure au seuil de déclaration de 100 kg, bien qu’il soit mentionné que des extraits de graines et de fleurs de Lotus corniculatus sont présents dans des produits cosmétiques au Canada.
Les risques pour l’environnement associés à l’extrait de Lotus corniculatus ont été caractérisés à l’aide de la classification des risques écologiques (CRE) des substances organiques, une approche fondée sur les risques qui tient compte de plusieurs paramètres liés à la fois au danger et à l’exposition, et de la pondération de plusieurs éléments de preuve. Les profils de danger sont principalement fondés sur les paramètres liés au mode d’action toxique, à la réactivité chimique, à des seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Les paramètres pris en compte dans les profils d’exposition comprennent le taux d’émission potentiel, la persistance globale et le potentiel de transport à longue distance. Une matrice du risque est utilisée pour attribuer un degré de préoccupation potentielle faible, modéré ou élevé aux substances d’après leurs profils de danger et d’exposition. D’après les résultats de l’analyse de la CRE, il serait peu probable que l’extrait de Lotus corniculatus cause des effets nocifs pour l’environnement.
Compte tenu de tous les éléments de preuve contenus dans la présente ébauche de l’évaluation préalable, l’extrait de Lotus corniculatus présente un risque faible de causer des effets nocifs pour l’environnement. Il est proposé de conclure que l’extrait de Lotus corniculatus ne satisfait pas aux critères énoncés aux alinéas 6a) et b) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
La population générale du Canada peut être exposée à l’extrait de Lotus corniculatus par l’utilisation de cosmétiques, notamment de lotion pour le corps et de baume pour les lèvres. Certains phénotypes de Lotus corniculatus sont réputés produire des glycosides cyanogènes, et il est possible que des produits contenant de l’extrait de Lotus corniculatus puissent exposer des consommateurs à l’acide cyanhydrique. Bien que tous les extraits végétaux soient des mélanges complexes de plusieurs substances phytochimiques, l’acide cyanhydrique serait la substance la plus pertinente sur le plan toxicologique, d’après la chimie connue de Lotus corniculatus.
L’acide cyanhydrique est une substance toxique pour la circulation générale qui nuit à la capacité des cellules à utiliser l’oxygène en perturbant la chaîne de transport des électrons, interrompant ainsi la respiration cellulaire. Dans des études réalisées sur des rongeurs, l’acide cyanhydrique a produit des effets sur le système reproducteur masculin, tandis que l’exposition à de faibles concentrations d’acide cyanhydrique est associée à des neuropathies et à des perturbations de la glande thyroïde chez les humains. Les marges entre la concentration estimative de l’exposition au cyanure provenant de l’extrait de Lotus corniculatus utilisé dans des cosmétiques et les concentrations causant un effet critique sont jugées suffisantes pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé en ce qui concerne tous les critères d’effet.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que l’extrait de Lotus corniculatus ne satisfait pas aux critères énoncés à l’alinéa 64c) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est proposé de conclure que l’extrait de Lotus corniculatus ne satisfait à aucun des critères énoncés à l’article 64 de la LCPE.
1. Introduction
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE) (Canada, 1999), les ministres de l’Environnement et de la Santé ont réalisé l’évaluation préalable d’extrait de Lotus corniculatus. Cette substance a été jugée prioritaire pour une évaluation, car elle satisfait au critère de catégorisation énoncé au paragraphe 73(1) de la LCPE (ECCC et SC [modifié en 2007]).
Les risques pour l’environnement associés à l’extrait de Lotus corniculatus ont été caractérisés à l’aide de la classification des risques écologiques (CRE) des substances organiques (ECCC, 2016a). La CRE décrit le danger associé à une substance à l’aide de paramètres clés liés au mode d’action, à la réactivité chimique, à la toxicité interne dérivée du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique, et tient compte de l’exposition possible des organismes des milieux aquatiques et terrestres en fonction de facteurs tels que le taux d’émission potentiel, la persistance globale et le potentiel de transport à longue distance dans l’atmosphère. On combine les différents éléments de preuve pour déterminer les substances nécessitant une évaluation approfondie de leur potentiel de causer des effets nocifs pour l’environnement ou présentant une probabilité faible de causer des effets nocifs pour l’environnement.
La présente ébauche d’évaluation préalable comprend l’examen des données sur les propriétés chimiques, le devenir environnemental, les dangers, les utilisations et les expositions, y compris d’autres renseignements présentés par les intervenants. Les données pertinentes ont été colligées jusqu’en octobre 2018. La documentation ciblée a été fouillée elle aussi jusqu’en octobre 2018. Les données empiriques provenant d’études clés ainsi que les résultats de la modélisation ont servi à tirer les conclusions proposées. Lorsqu’ils étaient disponibles et pertinents, les renseignements contenus dans les évaluations effectuées par d’autres instances ont été pris en compte.
La présente ébauche d’évaluation préalable a été préparée par le personnel du Programme de sécurité des produits de consommation de Santé Canada et le Programme d’évaluation des risques encadré par la LCPE à Environnement et Changement climatique Canada, et comprend des observations provenant du personnel d’autres programmes appartenant à ces ministères. La partie de l’évaluation portant sur l’environnement repose sur le document de CRE (publié le 30 juillet 2016), lequel a fait l’objet d’un examen externe et d’une consultation publique de 60 jours. La partie de la présente évaluation portant sur la santé humaine a fait l’objet d’un examen ou d’une consultation externe. Les commentaires sur les parties techniques contenues dans ce volet ont été formulés par Theresa Lopez, M.Sc., Jennifer Flippin, M.Sc., et Joan Garey, Ph.D. Bien que les commentaires de l’extérieur aient été pris en compte, le contenu définitif et les résultats de la présente ébauche d’évaluation préalable demeurent la responsabilité de Santé Canada et d’Environnement et Changement climatique Canada.
La présente ébauche d’évaluation préalable repose sur des renseignements essentiels permettant de déterminer si la substance satisfait aux critères énoncés à l’article 64 de la LCPE par suite de l’examen des données scientifiques et de l’application d’une approche fondée sur le poids de la preuve et le principe de précautionNote de bas de page 2. Cette ébauche d’évaluation préalable expose les données essentielles et les considérations sur lesquelles les conclusions proposées reposent.
2. Identité de l’extrait de Lotus corniculatus
Lotus corniculatus est une plante à fleurs de la famille des pois, répandue presque partout dans le monde et connue sous le nom de lotier corniculé. Dérivé végétal, l’extrait de Lotus corniculatus est un mélange complexe de plusieurs substances phytochimiques ou ce qu’on appelle des substances de composition inconnue ou variable, produits de réactions complexes ou matières biologiques (UVCB). Ces substances sont de sources naturelles ou le résultat de réactions complexes et ne peuvent être caractérisées par leurs constituants chimiques en raison de leur composition trop complexe ou variable. Un UVCB n’est pas un mélange volontaire de substances distinctes, mais il est considéré comme une seule substance.
Pour éclairer l’évaluation des risques associés à l’extrait de Lotus corniculatus pour l’environnement et la santé humaine, les constituants de l’extrait pouvant être pertinents du point de vue toxicologique ont été identifiés à partir des données empiriques accessibles. Plus particulièrement, Lotus corniculatus est réputé pour son polymorphisme et sa capacité de produire des glycosides cyanogènes, composés végétaux secondaires participant à la métabolisation et à la défense contre les prédateurs. Les phénotypes cyanogènes produisent le glycoside linamarine et sa forme méthylée, la lotaustraline, toutes deux pouvant libérer de l’acide cyanhydrique (HCN) par hydrolyse enzymatique. Les concentrations de glycosides sont les plus élevées dans les feuilles des plantes immatures, mais elles sont généralement faibles dans les graines et les feuilles des plantes adultes (Grant et Sidhu, 1967). Selon de récentes données, les concentrations de glycosides des fleurs seraient semblables à celles des feuilles en croissance (Gebrehiwot et Beuselinck, 2001). La structure chimique de ces composés et le produit de leur hydrolyse sont présentés au tableau 2‑1.
| NE CAS | Nom | Formule chimique représentative | Structure chimique représentative | Poids moléculaire (g/mol) |
|---|---|---|---|---|
| 554-35-8 | Linamarine | C10H17NO6 | ![CC(C)(O[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O)C#N](/content/dam/eccc/images/pded/lotus-corniculatus/20191015-Table2.1.1.jpg) |
247,248 |
| 534-67-8 | Lotaustraline | C11H19NO6 | (O[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O)C#N](/content/dam/eccc/images/pded/lotus-corniculatus/20191015-Table2.1.2.jpg) |
261,27 |
| 74-90-8 | Acide cyanhydrique; acide prussique | HCN | 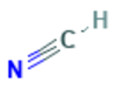 |
27,025 |
Si les phénotypes cyanogènes de Lotus corniculatus étaient utilisés pour obtenir les extraits de plantes, ces produits pourraient contenir de la linamarine et de la lotaustraline. La toxicité potentielle de ces substances repose principalement sur leur capacité à produire de l’HCN, qui peut également se transformer en anion cyanure (CN-) en fonction du pH et de la température (EFSA, 2004). Les végétaux acyanogènes peuvent ne pas produire de glycosides ou les enzymes pour les hydrolyser, ou les deux (Compton et Jones, 1985) et peuvent, par conséquent, être aussi une source potentielle de cyanure.
3. Propriétés physiques et chimiques
Un résumé des valeurs des propriétés physiques et chimiques des principaux composants de l’extrait de Lotus corniculatus est présenté au tableau 3‑1. Lorsque les données expérimentales d’une propriété étaient peu nombreuses ou absentes, les modèles (Q)SAR ont été utilisés pour produire les valeurs prédites pour la substance. D’autres propriétés physiques et chimiques sont présentées dans ECCC, 2016b.
| Propriété | Linamarine | Lotaustraline | HCN | Références principales |
|---|---|---|---|---|
| NE CAS | 554-35-8 | 534-67-8 | 74-90-8 | s.o. |
| État physique | Solide | Solide | Liquide ou gazeux | Kim et al., 2019; OMS, 2004 |
| Point de fusion (°C) | 145 | 147 | -13,24 à -13,4 | PhysProp, 2013; Gail et al., 2012 |
| Point d’ébullition (°C) | 434 | 446 | 25,6 à 25,7 | PhysProp, 2013; Gail et al., 2012 |
| Pression de vapeur (Pa) (à 25 °C) | 8,17 × 10-12 | 1,08 × 10-12 | 98 900 à 100 000 | PhysProp, 2013; Chatwin et al., 1987; Daubert et Danner, 1985 |
| Constante d’Henry (Pa·m3/mol) | 7,6 × 10-9 | 1,01 × 10-8 | 13,5 à 5167,6 | PhysProp, 2013; Gaffney et al., 1987; Yoo et al.,1986 |
| Hydrosolubilité (mg/L) | 5,65 × 105 | 1,8 × 105 | 1 × 106; miscible | PhysProp, 2013; Lide, 1990 |
| Log Koe (sans dimension) | -1,91 | -1,41 | -0,25 à 0,66 | PhysProp, 2013; EPA, 1984; Hansch et al., 1995 |
Abréviations : s.o., sans objet; Koe, coefficient de partage octanol-eau
4. Sources et utilisations
L’extrait de Lotus corniculatus a fait l’objet d’une enquête menée conformément à l’article 71 de la LCPE. Pour l’année civile 2012, aucune quantité fabriquée ou importée au Canada n’a été supérieure au seuil de déclaration de 100 kg.
L’extrait de Lotus corniculatus ne figure pas dans la Base de données sur les ingrédients de produits de santé naturels (BDIPSN). Cependant, Lotus corniculatus figure dans la BDIPSN en tant que substance homéopathique, la plante entière en floraison fraîchement récoltée étant la matière source, et la puissance homéopathique minimale étant de 12C (c.-à-d., une dilution à 10-24), bien qu’aucune préparation homéopathique contenant Lotus corniculatus ne soit actuellement homologuée comme produit de santé naturelle dans la Base de données des produits de santé naturels homologués (BDPSNH) (BDIPSN, 2018; BDPSNH, 2018).
Les déclarations présentées conformément au Règlement sur les cosmétiques à Santé Canada ont permis de déterminer que les extraits de graines et de fleurs de Lotus corniculatus sont présents dans des produits cosmétiques, notamment dans les nettoyants faciaux, les crèmes hydratantes pour la peau, le fond de teint, les exfoliants pour le visage, les shampoings et revitalisants, et les baumes pour les lèvres. Les extraits de graines et de fleurs de Lotus corniculatus figurent dans le dictionnaire de la nomenclature internationale d’ingrédients de cosmétiques (INCI) du Personal Care Products Council (PCPC) avec pour fonction déclarée d’être des crèmes revitalisantes pour la peau.
5. Potentiel de causer des effets nocifs pour l’environnement
5.1 Caractérisation des risques pour l’environnement
Les risques pour l’environnement associés à l’extrait de Lotus corniculatus ont été caractérisés à l’aide de l’approche de classification des risques écologiques (CRE) des substances organiques (ECCC, 2016a). La CRE est une approche fondée sur les risques qui tient compte de plusieurs paramètres liés à la puissance du danger et à l’exposition, ainsi que d’une pondération des multiples éléments de preuve. Les divers éléments de preuve sont réunis pour que l’on puisse distinguer les substances présentant une puissance faible ou élevée et un risque d’exposition faible ou élevé dans divers milieux. Une telle approche permet de réduire l’incertitude globale de la caractérisation du risque comparativement à une approche qui reposerait sur un paramètre unique dans un seul milieu (p. ex., la concentration létale médiane [CL50]) pour la caractérisation. Puisque l’extrait de Lotus corniculatus est un UVCB et ne peut être adéquatement représenté par une seule structure chimique, une approche de classification manuelle fondée sur le jugement a été utilisée. Voici l’approche résumée, décrite en détail dans ECCC (2016a).
Les profils de danger reposent principalement sur des paramètres tels que le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité et l’activité chimique et biologique. Les profils d’exposition sont également fondés sur plusieurs paramètres, dont le taux d’émission potentiel, la persistance globale et le potentiel de transport à grande distance. On a comparé les profils de danger et d’exposition aux critères de décision afin de classer les potentiels de danger et d’exposition de chaque substance organique comme faibles, modérés ou élevés. On a appliqué d’autres règles (p. ex., cohérence de la classification, marge d’exposition) pour préciser les classements préliminaires de danger et d’exposition. Cependant, dans le cas de cet UVCB, les profils de danger et d’exposition n’ont pu être établis entièrement en raison de l’absence de structure représentative permettant d’estimer les propriétés requises et faute de données empiriques pour ces propriétés. Par conséquent, la classification manuelle du danger et de l’exposition a été réalisée par l’examen des constituants UVCB et des renseignements obtenus grâce à l’enquête menée conformément à l’article 71 de la LCPE et à l’aide de décisions fondées sur l’examen de substances similaires et du jugement d’un spécialiste.
On a utilisé une matrice de risques pour attribuer à chaque substance un risque potentiel faible, moyen ou élevé, en se fondant sur le classement des profils de risque et d’exposition. On a vérifié le classement des risques potentiels établis au moyen de la CRE en suivant une approche en deux étapes. La première étape consistait à faire passer le classement des risques de moyen ou élevé à faible dans le cas des substances dont le taux d’émission estimé dans l’eau est faible après traitement des eaux usées, représentant un potentiel d’exposition faible. La deuxième étape consistait à réévaluer le classement du potentiel de risque faible à l’aide de scénarios de risque relativement prudents à échelle locale (c.-à-d., la zone entourant directement la source ponctuelle de rejet) conçus pour ne pas nuire à l’environnement, afin de déterminer si le classement du risque potentiel devrait être revu à la hausse.
La CRE est une approche pondérée qui vise à réduire au minimum le risque d’un surclassement ou d’un sous-classement du danger, de l’exposition et des risques subséquents. Une description détaillée des approches équilibrées de traitement des incertitudes est présentée dans ECCC (2016a). Voici une description de deux des domaines d’incertitude les plus importants. Une erreur dans les valeurs de toxicité aiguë empiriques ou modélisées pourrait modifier le classement du danger, surtout si les paramètres sont fondés sur les valeurs de résidus dans les tissus (c.-à-d. le mode d’action toxique), dont bon nombre sont des valeurs estimées à l’aide de modèles QSAR (boîte à outils QSAR de l’OCDE, 2016). Cependant, l’impact de ce type d’erreur est atténué par le fait qu’une surestimation de la létalité médiane conduira à une valeur prudente (protectrice) de résidus dans les tissus utilisée pour l’analyse des résidus corporels critique (RCC). Une erreur due à une sous-estimation de la toxicité aiguë sera atténuée par le recours à d’autres paramètres de danger, tels que le profilage structurel du mode d’action, la réactivité et/ou l’affinité de liaison à l’œstrogène. Les changements ou les erreurs touchant les quantités chimiques pourraient donner lieu à un classement de l’exposition différent, les classements de l’exposition et du risque étant très sensibles aux taux d’émission et aux quantités utilisées. Les classements obtenus au moyen de la CRE représentent donc l’exposition et le risque au Canada compte tenu des quantités utilisées actuellement (déterminées par calculs), mais pourraient ne pas rendre compte des tendances futures.
Les données critiques et les facteurs à considérer, utilisés pour élaborer les profils spécifiques de l’extrait de Lotus corniculatus, ainsi que les résultats de la classification du danger, de l’exposition et du risque sont présentés dans ECCC (2016b).
Étant donné son faible potentiel de danger et d’exposition, établi d’après les renseignements pris en compte dans la CRE, le potentiel de risque pour l’environnement associé à l’extrait de Lotus corniculatus a été classé comme faible. Il est par conséquent peu probable que l’extrait de Lotus corniculatus entraîne des préoccupations pour l’environnement au Canada.
6. Potentiel de causer des effets nocifs pour la santé humaine
6.1 Évaluation de l’exposition
Entre janvier 2015 et janvier 2018, la présence d’extrait de Lotus corniculatus a été déclarée au Canada dans des cosmétiques. Les produits déclarés sont, notamment, des produits avec et sans rinçage pour le visage (nettoyant, hydratant, fond de teint et exfoliant), des produits pour les cheveux (shampoing et revitalisant), des hydratants pour la peau, qui pourraient être utilisés comme lotion pour le corps, et des baumes pour les lèvres.
L’extrait de Lotus corniculatus pourrait être une source des glycosides cyanogènes linamarine et lotaustraline et/ou de leur produit d’hydrolyse, l’HCN (pour de plus amples renseignements, voir l’annexe A). Dans un relevé sur divers cultivars de Lotus corniculatus, les concentrations d’HCN les plus élevées observées ont varié de 70 à 139 µg/g en poids frais et de 296 à 784 µg/g en poids sec (Borsos et al., 1976). Ces valeurs concordent généralement avec celles de Gebrehiwot et Beuselinck (2001), qui ont indiqué que, pour la plante en entier, la teneur en HCN des cultivars cyanogènes était en moyenne de 636 µg/g en poids sec lorsque cultivés en plein champ et de 800 µg/g en poids sec lorsque cultivé en serre. De même, la teneur moyenne en cyanure dans les feuilles de cultivars cyanogènes (n=158) étudiés par Briggs et Schultz (1990) était d’environ 810 µg/g en poids sec.
La concentration de cyanure la plus élevée dans Lotus corniculatus trouvée dans la documentation était de 1000 µg/g en poids humide, la valeur maximale observée parmi les 204 lignées récoltées dans 33 pays dans le monde (Ross et Jones, 1983). D’après les ratios de Borsos et al. (1976) mentionnés ci-dessus, on estime que cette valeur correspond à environ 5000 µg/g en poids sec. En supposant que l’extrait de Lotus corniculatus n’est pas sciemment enrichi pour favoriser la production de cyanure et qu’aucune mesure n’a été prise pour empêcher toute perte d’HCN pendant l’extractionNote de bas de page 3, la concentration d’HCN dans les extraits ne devrait pas dépasser la concentration maximale observée en poids sec. Par conséquent, on a utilisé plus tard une teneur d’HCN de 5000 µg/g (0,5 %) d’extrait de Lotus corniculatus pour estimer l’exposition.
Les estimations de l’exposition liée à l’utilisation de cosmétiques ont été calculées d’après les profils d’emploi prévus par la population générale. La concentration la plus élevée dans les avis relatifs aux produits présentés à Santé Canada (ou la limite supérieure dans le cas d’une fourchette de valeurs) a été multipliée par la concentration maximale du cyanure total (lié et non lié) dans de la matière végétale, en poids sec (5000 µg/g) afin d’estimer la teneur maximale des produits en cyanure. Dans le cas de produits appliqués sur la peau, l’hydratant pour le corps a été retenu comme scénario d’exposition sentinelle, la quantité maximale de HCN appliqué par voie cutanée étant estimée à 250 µg/jour, ce qui correspond à une charge superficielle de 0,014 µg/cm2/jour pour les adultes. Pour des précisions sur la teneur en HCN des produits visés par un avis, ainsi que sur la valeur estimative de l’exposition, veuillez consulter l’annexe B.
En supposant le poids corporel d’un adulte à 70,9 kg et une absorption complète, la charge cutanée de 250 µg/jour correspond à une dose générale de 3,5 µg/kg p.c./j. Cependant, comme l’HCN est une substance très volatile et que son point d’ébullition est de 25,7 °C, et que la température par défaut à la surface de la peau est de 32 °C (Freitas, 1999), la substance se volatilisera rapidement. Le calculateur de la pénétration d’une dose finie dans la peau (NIOSH, 2013), qui met en application des solutions au modèle de Kasting et Miller (2006) de la cinétique d’absorption d’une dose finie par la peau pour des composés volatils, a été utilisé pour prévoir l’élimination d’une charge superficielle appliquée et estimer la fraction massique totale qui peut être disponible pour une absorption percutanée plutôt qu’éliminée par évaporation. On a fait la somme des quantités d’HCN estimées être distribuées dans la couche cornée de l’épiderme, l’épiderme viable, le derme et la circulation générale, pour obtenir une dose percutanée de 3,4 x 10-5 µg/cm2, laquelle correspond à une concentration plasmatique d’HCN de 0,009 µg/kg p.c./j (annexe C).
L’HCN qui s’évapore de la surface de la peau au lieu d’être absorbé peut entraîner une exposition par inhalation. Par conséquent, les concentrations d’HCN dans l’air ont été déterminées à l’aide de la modélisation de l’exposition ConsExpo (RIVM, 2016). La concentration minimale théorique d’HCN dans l’air a été estimée à 21 µg/m3, en moyenne, pendant l’application de la lotion pour le corps, ce qui correspond à une concentration d’exposition moyenne quotidienne d’HCN de 0,15 µg/m3 et à une concentration plasmatique de 0,03 µg/kg p.c./j, en supposant une absorption totale par inhalation. Les autres paramètres par défaut utilisés dans les scénarios d’exposition ainsi que des précisions sur les calculs sont fournis à l’annexe B.
L’absorption par la peau de substances volatiles directement à partir de la phase gazeuse peut également être une importante voie d’exposition (Weschler et Nazaroff, 2014). Cependant, Gaskin et ses collègues (2013) ont démontré que l’absorption transdermique d’HCN gazeux est relativement faible. Par conséquent, l’absorption cutanée à partir de la phase gazeuse découlant de l’utilisation de cosmétiques est considérée comme négligeable et aucune valeur quantitative n’a été estimée.
L’utilisation de l’extrait de Lotus corniculatus dans les baumes pour les lèvres a également été déclarée, lorsqu’il est possible que le produit soit ingéré. Aux fins de la présente évaluation préalable, il a été supposé que le baume pour les lèvres contenait de l’extrait de Lotus corniculatus à des concentrations allant jusqu’à 1 %, ce qui est la limite supérieure de la fourchette de concentrations la plus élevée déclarée à Santé Canada, et que tout le produit appliqué a été ingéré. L’exposition générale maximale potentielle d’HCN par voie orale découlant de l’utilisation de baume pour les lèvres contenant de l’extrait de Lotus corniculatus est estimée à 0,03 µg/kg p.c./j pour un adulte de 70,9 kg. Le baume pour les lèvres peut également être utilisé par les jeunes enfants et les tout-petits, et la concentration plasmatique maximale pour un tout-petit a été estimée à 0,07 µg/kg p.c./j. Pour des précisions sur les hypothèses et les paramètres par défaut utilisés pour estimer l’exposition par la voie orale, veuillez consulter l’annexe B.
Aucune donnée empirique sur les concentrations d’extrait de Lotus corniculatus dans le milieu environnemental au Canada n’a été trouvée, mais les concentrations devraient être négligeables. L’extrait de Lotus corniculatus ne devrait pas être présent dans les aliments ou les boissons.
6.2 Évaluation des effets sur la santé
La toxicité des glycosides cyanogènes d’origine végétale dépend de l’hydrolyse enzymatique des molécules mères qui libère l’HCN. La toxicité du cyanure a été étudiée en profondeur à la fois chez l’humain et chez les animaux de laboratoire, et les mécanismes d’action biochimiques du cyanure concordent généralement avec ceux de la plupart des mammifères (NRC, 2002). Le cyanure interrompt la respiration cellulaire, entraînant un état d’hypoxie en se liant à la cytochrome C oxydase, le complexe enzymatique final de la chaîne de transport des électrons (située dans la membrane des mitochondries des cellules d’eucaryotes). Essentiellement, la toxicité du cyanure découle de l’incapacité des cellules d’utiliser l’oxygène comme récepteur d’électrons, perturbant ainsi la synthèse de l’adénosine triphosphate (ATP), la principale source d’énergie des cellules (Nelson, 2006). Le cyanure est une substance toxique pour la circulation générale et les organes et systèmes les plus sensibles aux faibles concentrations d’oxygène sont aussi les plus sensibles à la toxicité aiguë causée par le cyanure, en particulier les systèmes nerveux, cardiovasculaires et respiratoires. La description suivante n’est pas conçue pour être exhaustive, mais plutôt pour être un aperçu des valeurs recommandées fondées sur des critères sanitaires pour l’HCN et des doses les plus faibles associées à des effets nocifs trouvées dans des publications. Les effets de l’HCN sur la santé ont été antérieurement examinés par Santé Canada (Canada, 2018), et les molécules libres/simples de cyanure font l’objet de plusieurs évaluations à l’étranger, plus récemment par l’EPA des États‑Unis (EPA, 2010) et la FAO/OMS (2012).
Le National Research Council des États-Unis (NRC, 2000) a élaboré un guide de seuils d’exposition aiguë (ou AEGL-1[2]) pour l’HCN de 1 ppm (1 mg/m3), établi à l’aide d’études de surveillance chez des travailleurs exposés à l’HCN dans leur milieu de travail. Les valeurs de l’AEGL visent à représenter les seuils d’exposition qui sont applicables au grand public, y compris aux sous-populations vulnérables telles que les nourrissons, les enfants, les personnes âgées, les personnes atteintes de l’asthme et celles qui souffrent d’autres maladies (NRC, 2002). Le seuil de l’AEGL-1 pour l’HCN est fondé sur une évaluation du poids de la preuve dans laquelle il a été conclu qu’une exposition de 8 h à l’HCN à 1 mg/m3 ne causerait pas d’effet nocif pour la santé dans la population générale. Comme la valeur est fondée sur une exposition sur de longues périodes de travail (en général 8 h/j), on pense qu’elle représente une approche prudente à la détermination de la valeur de l’AEGL (NRC, 2002). La valeur de l’AEGL-1 sur 8 h a été établie par examen des données de dose-réponse extraites de plusieurs études de surveillance mentionnées et dont l’échelle de temps a été ultérieurement raccourcie pour correspondre aux expositions plus courtes de l’AEGL (voir NRC, 2002). Les analyses de régression ont permis de déterminer que la relation entre la durée de l’exposition (t) et la concentration (C) pour la toxicité de l’HCN chez un primate autre que l’humain est décrite par l’équation C2 × t = k (NRC, 2002), où k est une constante. Par conséquent, une valeur d’AEGL-1 sur 8 h de 1 ppm peut correspondre, par extrapolation, à une valeur d’AEGL-1 sur 10 minutes de 6,9 mg/m3.
Dans des études menées chez des rongeurs, une exposition subchronique au cyanure par l’eau de boisson n’a causé aucun signe clinique associé à une neurotoxicité ni preuve histopathologique d’effets sur l’encéphale ou la glande thyroïde chez les rats et les souris aux doses allant jusqu’à 12,5 mg et 26 mg de cyanure/kg p.c./j, respectivement (NTP, 1993). Cependant, des changements discrets ont été observés dans l’appareil reproducteur masculin, y compris une diminution du poids de la queue des épididymes, des épididymes en entier et des testicules, et des anomalies dans les paramètres du sperme, où les rats semblent être l’espèce la plus sensible. Aucun changement n’a été observé dans les concentrations de spermatozoïdes dans les épididymes par rapport à celles des groupes témoins, et les auteurs ne croient pas que l’effet est pertinent sur le plan biologique chez les rongeurs. Cependant, les humains ont une production de sperme plus faible que chez les rats et l’incidence potentielle d’une baisse de la qualité du sperme est plus importante chez les humains que chez les rats (EPA, 2010). Par conséquent, la limite inférieure de l’intervalle de confiance à 95 % de la dose correspondant à une variation du poids de la queue des épididymes chez les rats mâles égale à un écart-type de la moyenne du groupe témoin (BMDL1ÉT) a été retenue par l’EPA des États‑Unis comme point de départ pour déterminer la dose de référence pour une exposition chronique par voie orale. Les facteurs d’incertitude, dont le total est de 3000, ont été appliqués à la BMDL1ÉT de 1,9 mg/kg p.c./j pour obtenir une dose de référence finale par exposition chronique de 0,6 µg/kg p.c./j (EPA, 2010). Le Comité mixte FAO/OMS d’experts des additifs alimentaires (JECFA) a également calculé une dose journalière maximale admissible provisoire pour l’HCN selon le même point de départ (JECFA, 2011).
L’exposition chronique au cyanure par inhalation a également été mise en évidence chez des travailleurs exposés en milieu de travail. L’EPA des États‑Unis (2010) a déterminé la concentration de référence pour une exposition chronique par inhalation d’après les effets sur la glande thyroïde et des symptômes neurologiques chez les travailleurs dans trois usines de galvanoplastie (El Ghawabi et al., 1975). Les travailleurs masculins (n = 36) exposés de façon chronique à l’HCN pendant 5 à 15 ans ont présenté des taux significativement anormaux d’incorporation de l’iode par la glande thyroïde, une hypertrophie de la glande thyroïde ainsi que des symptômes associés au système nerveux central comme des céphalées, de la faiblesse et des modifications sensorielles du goût et de l’odorat (El Ghawabi et al., 1975). Les résultats des mesures individuelles de zone respiratoire indiquent que la concentration moyenne d’HCN dans toutes les usines variait de 7,07 à 11,5 mg/m3, et que l’excrétion urinaire de thiocyanates était fortement corrélée avec les mesures individuelles d’exposition. Vingt des travailleurs exposés (56 %) ont présenté une hypertrophie légère à modérée de la glande thyroïde et une modification de l’absorption de l’iodure. Ni la durée de l’exposition ni les concentrations dans l’air n’étaient corrélées avec l’incidence d’un effet ou son ampleur, bien que, étant donné la petite taille de l’échantillon et la fourchette relativement étroite des concentrations d’exposition, cette absence de corrélation ne soit pas entièrement inattendue. L’EPA des États‑Unis (2010) a établi la concentration moyenne la plus faible dans l’air à 7,07 mg/m3 comme DMENO. Cette valeur a été corrigée pour une exposition continue de 2,5 mg/m3 en vue de son utilisation comme point de départ pour déterminer la concentration de référenceNote de bas de page 4. Les facteurs d’incertitude, dont le total s’élève à 3000, ont été appliqués à la DMENO corrigée pour établir la concentration finale de référence de l’exposition chronique par inhalation à 0,8 µg/m3 (EPA, 2010).
Les données ne sont pas suffisantes pour évaluer le potentiel cancérogène du cyanure chez les humains. Une étude de deux ans dans laquelle des groupes de rats (10 mâles/10 femelles) ont reçu de la nourriture fumigée par de l’HCN à des doses estimées à 4,3 et à 10,8 mg de cyanure/kg p.c./j n’a pas permis de trouver des données probantes de lésions histopathologiques attribuables au cyanure (Howard et Hanzal, 1955), bien que l’étude présente des limites méthodologiques importantes. Aucune étude évaluant la cancérogénicité de l’HCN par exposition par inhalation n’a été trouvée.
6.3 Caractérisation des risques pour la santé humaine
L’exposition des consommateurs à l’extrait de Lotus corniculatus devrait être limitée à l’utilisation de préparations de cosmétiques. L’extrait de Lotus corniculatus peut contenir des glycosides cyanogènes et/ou le produit d’hydrolyse HCN. Bien que l’extrait de Lotus corniculatus puisse être présent dans les produits pour la peau censés être appliqués de manière topique, et étant donné la forte volatilité de l’HCN, la principale voie d’exposition devrait être l’inhalation. L’ingestion est également possible par utilisation de baume pour les lèvres contenant de l’extrait de Lotus corniculatus.
L’exposition chronique à des concentrations relativement faibles de cyanure a été associée à une neuropathie et à des effets sur la glande thyroïde chez les travailleurs exposés en milieu de travail, ainsi qu’à un taux de croissance réduit et à un dysfonctionnement du système reproducteur chez les mâles dans des études menées chez des rongeurs. L’exposition aiguë à des concentrations de cyanure dont la toxicité est minime est réputée causer des effets légers sur le système nerveux central, surtout des céphalées (NRC, 2000; Canada, 2018). Les concentrations causant un effet critique associées à une toxicité aiguë (par inhalation) et chronique (par voie orale, par inhalation) du cyanure ont été retenues comme points de départ pour une comparaison avec les limites supérieures estimatives de l’exposition au cyanure découlant de l’utilisation de produits contenant de l’extrait de Lotus corniculatus.
Le tableau 6‑1 présente les valeurs pertinentes d’exposition et de danger pour une exposition potentielle d’HCN découlant de l’utilisation de produits cosmétiques sentinelles contenant de l’extrait de Lotus corniculatus, ainsi que les marges d’exposition (ME) résultantes.
| Scénario d’exposition | Exposition estimative | Concentration associée à un effet critique | Effet critique sur la santé | ME |
|---|---|---|---|---|
| Lotion pour le corps - adulte (inhalation, quotidienne) | 0,15 µg/m3 | 2,5 mg/m3 (LOAEL)a | Hypertrophie de la glande thyroïde et modification de l’absorption de l’iodure | > 16 000 |
| Lotion pour le corps - adulte (cutanée, quotidienne) | 0,009 µg/kg p.c./j | 1,9 mg/kg p.c./j (BMDL)b | Diminution du poids de la queue des épididymes chez les rats mâles | > 200 000 |
| Lotion pour le corps - adulte (par utilisation, inhalation) | 21 µg/m3 | 6,9 mg/m3 (ajust. AEGL-1)c | La valeur de l’AEGL‑1 est considérée comme « sans danger » d’après des études sur l’exposition professionnelle | 329 |
| Baume pour les lèvres - adulte (orale, quotidienne) | 0,03 µg/kg p.c./j | 1,9 mg/kg p.c./j (BMDL)b | Diminution du poids des épididymes chez les rats mâles | > 60 000 |
| Baume pour les lèvres - tout-petit (orale, quotidienne) | 0,07 µg/kg p.c./j | 1,9 mg/kg p.c./j (BMDL)b | Diminution du poids des épididymes chez les rats mâles | > 25 000 |
Abréviations : DMENO, dose minimale causant un effet nocif observé; BMDL, limite de confiance inférieure à 95 % de la dose repère
a El Ghawabi, 1975; US EPA, 2010
b NTP, 1993; US EPA, 2010.
c NRC, 2002. La valeur d’AEGL-1 pour une durée de 10 minutes a été déterminée à l’aide de la valeur d’AEGL-1 de 1 ppm pour une durée de 8 heures et de l’extrapolation pour une exposition de 10 minutes d’après l’équation C2 = t × k, où C est la concentration, t est la durée et k est une constante.
D’après l’utilisation de paramètres prudents dans l’estimation de l’exposition découlant de l’utilisation de produits, les marges d’exposition entre les valeurs estimatives d’exposition et les concentrations causant un effet critique observé dans les études épidémiologiques chez les humains ainsi que dans les études menées chez les animaux sont considérées comme suffisantes pour tenir compte de toutes les incertitudes dans les bases de données sur la toxicologie et l’exposition.
6.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Bien qu’il y ait des données canadiennes relatives aux concentrations de l’extrait de Lotus corniculatus utilisé dans des cosmétiques, certaines limites importantes demeurent dans les bases de données sur l’exposition. De même, bien que la toxicité du cyanure et le mode d’action de ce dernier soient bien démontrés, certaines incertitudes dans les effets sur la santé ont été découvertes. Les principales sources d’incertitudes sont présentées dans le tableau 6‑2.
| Principales sources d’incertitudes | Impact |
|---|---|
| La concentration potentielle maximale d’HCN dans l’extrait de Lotus corniculatus n’est pas connue. | +/- |
| Aucune donnée sur le caractère cyanogène ou non des phénotypes de Lotus corniculatus d’où provient l’extrait. Aux fins de la présente évaluation, tous les extraits ont été considérés comme cyanogènes. | + |
| En raison de la volatilité de l’HCN, on ne sait pas si le produit final contiendrait de l’HCN même si l’extrait provenait d’un phénotype cyanogène. Aux fins de la présente évaluation, on a considéré qu’aucune quantité d’HCN n’a été perdue entre le traitement de l’extrait et l’utilisation par le consommateur du produit, et que la conversion des glycosides mères en HCN était complète. | + |
| Aucune donnée sur la cancérogénicité du cyanure par inhalation n’a été trouvée et la seule étude d’exposition par voie orale présente des limites méthodologiques, empêchant l’évaluation du potentiel cancérogène de l’HCN. | +/- |
| Il existe des incertitudes quant à la mesure dans laquelle la toxicité pour la reproduction induite par le cyanure chez les rats mâles est pertinente pour les humains, car la base de données sur le cyanure ne dispose pas d’étude sur la toxicité pour le système reproducteur chez les humains de sexe masculin. | +/- |
| Il n’existe pas d’études d’exposition chronique par voie orale chez les animaux ni d’étude d’exposition chronique ou subchronique par inhalation chez les animaux. | +/- |
| Dans l’étude d’exposition par voie orale de 90 jours menée chez les rats du National Toxicology Program (NTP, 1993), les critères d’effets sur la glande thyroïde n’ont pas été étudiés. | +/- |
| Dans l’étude de toxicité chronique par exposition par inhalation menée chez les humains (El Ghawabi et al., 1975), les critères d’effets sur le système reproducteur masculin n’ont pas été étudiés (l’étude portait sur la glande thyroïde et l’absorption de l’iode). De plus, il n’y avait aucune corrélation entre la durée de l’exposition et le degré d’hypertrophie de la glande thyroïde. | +/- |
| Il existe de nombreuses autres sources d’HCN que l’extrait de Lotus corniculatus ainsi que de potentiel d’interaction lors d’expositions avec d’autres substances chimiques comme le monoxyde de carbone. | - |
+ = Incertitude sur le potentiel de surestimer le risque; - = incertitude sur le potentiel de sous-estimer le risque; +/- = Potentiel inconnu de surestimer ou de sous-estimer le risque.
Bien qu’aucune donnée n’a été trouvée concernant les concentrations de glycosides cyanogènes ou d’HCN dans l’extrait de Lotus corniculatus ou des produits finis, on croit que les hypothèses utilisées sont suffisamment prudentes.
7. Conclusion
Compte tenu de tous les éléments de preuve contenus dans la présente ébauche d’évaluation préalable, l’extrait de Lotus corniculatus présente un risque faible de causer des effets nocifs pour l’environnement. Il est proposé de conclure que l’extrait de Lotus corniculatus ne satisfait pas aux critères énoncés aux alinéas 64a) et b) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que l’extrait de Lotus corniculatus ne satisfait pas le critère énoncé à l’alinéa 64c) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est proposé de conclure que l’extrait de Lotus corniculatus ne satisfait à aucun des critères énoncés à l’article 64 de la LCPE.
Références
[BDIPSN] Base de données sur les ingrédients de produits de santé naturels [base de données]. [modifié le 9 novembre 2018]. Ottawa (Ont.), gouvernement du Canada. [Consulté le 20 novembre 2018].
[BDPSNH] Base de données des produits de santé naturels homologués [base de données]. [6 février 2018]. Ottawa (Ont.), gouvernement du Canada. [Consulté le 20 novembre 2018].
Berrin, J.G., McLauchlan, W.R., Needs, P., Williamson, G., Puigserver, A., Kroon, P.A. et N. Juge. 2002. Functional expression of human liver cytosolic β‐glucosidase in Pichia pastoris: Insights into its role in the metabolism of dietary glucosides. European journal of biochemistry 269(1):249-258. [Disponible en anglais seulement.]
Borsos, O., Haraszti, E. et J. Vetter. 1976. Nehany Lotus corniculatus fajta cianglikozid szintjenek valtozasa a vegetacios idoszak folyaman. Botanikai kozlemenyek. [Disponible en anglais seulement.]
Briggs, M.A. et J.C. Schultz. 1990. Chemical defense production in Lotus corniculatus L. II. Trade-offs among growth, reproduction and defense. Oecologia 83(1):32-37. [Disponible en anglais seulement.]
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999), L.C. 1999, ch. 33, Gazette du Canada, Partie III, vol. 22, nº 3
Canada. 2018. Ébauche d’évaluation préalable – Cyanures. Environnement et Changement climatique Canada et Santé Canada. (consulté le 21 novembre 2018).
Chatwin TD, Trepanowski J, et ME Wadsworth. 1987. Attenuation of cyanide in soils. Phase I Report. Resource Recovery and Conservation Company and the University of Utah [mentionné dans AGDH, 2010]. [Disponible en anglais seulement.]
Compton, S.G. et D.A. Jones. 1985. An investigation of the responses of herbivores to cyanogenesis in Lotus corniculatus L. Biological Journal of the Linnean Society 26(1):21-38. [Disponible en anglais seulement.]
[ConsExpo] Consumer Exposure Model. 2016. Version Web. Bilthoven (NL): Rijksinstituut voor Volksgezondheid en Milieu [Institut national de la santé publique et de l’environnement].
Daubert TE, et RP Danner. 1985. Data compilation tables of properties of pure compounds. New York: Design Institute for Physical Property Data (US) and American Institute of Chemical Engineers. [Disponible en anglais seulement.]
Dorr, R.T. et J. Paxinos. 1978. The current status of laetrile. Annals of internal medicine 89:389-397. [Disponible en anglais seulement.]
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l’approche scientifique : Classification du risque écologique des substances organiques, Ottawa (Ont.), gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016b. Supporting documentation: data used to create substance-specific hazard and exposure profiles and assign risk classifications. Gatineau (Qué.), ECCC. Renseignements à l’appui du Document sur l’approche scientifique : Classification du risque écologique des substances organiques. Disponible sur demande : substances@ec.gc.ca.
[EFSA] 2004. Autorité européenne de sécurité des aliments. Opinion of the Scientific Panel on Food Additives, Flavourings, Processing Aids and Materials in Contact with Food (AFC) on hydrocyanic acid in flavourings and other food ingredients with flavouring properties. Question number EFSA-Q-2003-145. The EFSA Journal 105:1-28. [Disponible en anglais seulement.]
[EFSA] 2007. Autorité européenne de sécurité des aliments. Opinion of the Scientific Panel on Contaminants in the Food Chain on a request from the Commission related to cyanogenic compounds as undesirable substances in animal feed. Question N° EFSA-Q-2003-064. The EFSA Journal 434: 1 – 67. [Disponible en anglais seulement.]
El Ghawabi, S.H., Gaafar, M.A., El-Saharti, A.A., Ahmed, S.H., Malash, K.K. et R. Fares. 1975. Chronic cyanide exposure: a clinical, radioisotope, and laboratory study. Occupational and Environmental Medicine 32(3):215-219. [Disponible en anglais seulement.]
[EPA] 1984. Environmental Protection Agency des États‑Unis. Health effects assessment for cyanide. Washington, DC: US Environmental Protection Agency. EPA540186011. [Disponible en anglais seulement.]
[EPA] 2010. Environmental Protection Agency des États-Unis. Toxicological Review of Hydrogen Cyanide and Cyanide Salts. In Support of Summary Information on the Integrated Risk Information System (IRIS) [PDF]. (Consulté le 21 novembre 2018). [Disponible en anglais seulement.]
[EPA] 2011. Environmental Protection Agency des États-Unis. "Exposure Factors Handbook: 2011 Edition" [PDF]. Office of Research and Development, US EPA, National Center for Environmental Assessment (NCEA), EPA/600/R-090/052F. 1436 p. [Disponible en anglais seulement.]
[EPA] 2012. Environmental Protection Agency des États-Unis. Air Pollution Training Institute, Course 414: Control of Gaseous Emissions [PDF]. Office of Air and Radiation, Office of Air Quality Planning and Standards, Research Triangle Park, NC 27711, 503 p. (Consulté le 19 novembre 2018). [Disponible en anglais seulement.]
[FAO/OMS] Organisation pour l’alimentation et l’agriculture/Organisation mondiale de la santé. 2012. Cyanogenic Glycosides (addendum). Safety Evaluation of Certain Food Additives and Contaminants. Préparé par la soixante-quatorzième réunion du Comité mixte FAO/OMS d’experts des additifs alimentaires (JECFA). WHO Food Additive Series 65. [Disponible en anglais seulement.]
Ficheux, A.S., Wesolek, N., Chevillotte, G. et A.C. Roudot. 2015. Consumption of cosmetic products by the French population. First part: frequency data. Food and Chemical Toxicology 78:159-169. [Disponible en anglais seulement.]
Ficheux, A.S., Chevillotte, G., Wesolek, N., Morisset, T., Dornic, N., Bernard, A., Bertho, A., Romanet, A., Leroy, L., Mercat, A.C. et T. Creusot. 2016. Consumption of cosmetic products by the French population second part: amount data. Food and Chemical Toxicology 90:130-141. [Disponible en anglais seulement.]
Frakes, R.A., Sharma, R.P. et C.C. Willhite. 1986. Comparative metabolism of linamarin and amygdalin in hamsters. Food and chemical toxicology 24:417-420. [Disponible en anglais seulement.]
Freitas, R.A., Jr. 1999. Thermography of the Human Body (Section 8.4.1.1). In: Nanomedicine, Volume I: Basic Capabilities. Landes Bioscience, Austin, Texas. [Disponible en anglais seulement.]
Gaffney JS, Streit GE, Spall WD, et JH Hall. 1987. Beyond acid rain. Do soluble oxidants and organic toxins interact with SO2 and NOx to increase ecosystem effects? Environmental Science and Technology, 21(6): 519. [Disponible en anglais seulement.]
Gail E, Gos S, Kulzer R, Lorosch J, Rubo A, Sauer M, Kellens R, Reddy J, Steir N, et W. Hasenpusch. 2012. Cyano Compounds, Inorganic, Ullmann’s Encyclopedia of Industrial Chemistry. [Disponible en anglais seulement.]
Gaskin, S., Pisaniello, D., Edwards, J.W., Bromwich, D., Reed, S., Logan, M. et C. Baxter. 2013. Chlorine and hydrogen cyanide gas interactions with human skin: In vitro studies to inform skin permeation and decontamination in HAZMAT incidents. Journal of hazardous materials 262:759-765. [Disponible en anglais seulement.]
Gebrehiwot, L. et P.R. Beuselinck. 2001. Seasonal variations in hydrogen cyanide concentration of three Lotus species. Agronomy Journal 93(3):603-608. [Disponible en anglais seulement.]
Grant, W.F. et B.S. Sidhu. 1967. Basic chromosome number, cyanogenetic glucoside variation, and geographic distribution of Lotus species. Canadian Journal of Botany, 45(5), pp.639-647. [Disponible en anglais seulement.]
Hansch C, Leo A, et D. Hoekman. 1995. Exploring QSAR: hydrophobic, electronic and steric constants. Washington, DC: American Chemical Society, 348 p. [Disponible en anglais seulement.]
Hernández, T., Lundquist, P., Oliveira, L., Cristià, R.P., Rodriguez, E. et H. Rosling. 1995. Fate in humans of dietary intake of cyanogenic glycosides from roots of sweet cassava consumed in Cuba. Natural Toxins 3(2):114-117. [Disponible en anglais seulement.]
Howard, J.W., et R.F. Hanzal. 1955. Chronic toxicity to rats of food treated with hydrogen cyanide. Agric. Food Chem. 3:325-329. [Disponible en anglais seulement.]
[JECFA] 2011. Comité mixte FAO/OMS d’experts des additifs alimentaires. Evaluation of Certain Food Additives and Contaminants. World Health Organization (WHO) Technical Report Series 966 [PDF] (Consulté le 12 mars 2019). [Disponible en anglais seulement.]
Jones, D.A. et R. Turkington. 1986. Biological flora of the British Isles. Lotus corniculatus L. J. Ecol. 74(4):1185-1212. [Disponible en anglais seulement.]
Kasting GB, et M.A. Miller. 2006. Kinetics of finite dose absorption through skin 2: Volatile compounds. J Pharm Sci 95(2):268–280. [Disponible en anglais seulement.]
Kim S, Chen J, Cheng T, Gindulyte A, He J, He S, Li Q, Shoemaker BA, Thiessen PA, Yu B, Zaslavsky L, Zhang J, et EE Bolton. 2019. PubChem 2019 update: improved access to chemical data. Nucleic Acids Res. 47(D1):D1102-1109. [Disponible en anglais seulement.]
Lide DR, ed. 1990. CRC Handbook of Chemistry and Physics. 72nd ed. Boca Raton, FL: CRC Press. [Disponible en anglais seulement.]
Meesters, J.A.J., Nijkamp, M.N., Schuur, A.G., et J.D. Te Biesebeek. 2018. Cleaning Products Fact Sheet. Default parameters for estimating consumer exposure - Updated version 2018. RIVM Report 2016-0179. [Disponible en anglais seulement.]
Nelson, L., 2006. Acute cyanide toxicity: mechanisms and manifestations. Journal of Emergency Nursing 32(4):S8-S11. [Disponible en anglais seulement.]
Németh, K., Plumb, G.W., Berrin, J.G., Juge, N., Jacob, R., Naim, H.Y., Williamson, G., Swallow, D.M. et P.A. Kroon. 2003. Deglycosylation by small intestinal epithelial cell β-glucosidases is a critical step in the absorption and metabolism of dietary flavonoid glycosides in humans. European journal of nutrition 42(1):29-42. [Disponible en anglais seulement.]
[NIOSH] National Institute for Occupational Safety and Health. 2013. Finite Dose Skin Permeation Calculator. Consulté le 8 novembre 2018. [Disponible en anglais seulement]
[NRC] 2000. National Research Council. Hydrogen cyanide. In Spacecraft Maximum Allowable Concentrations for Selected Airborne Contaminants, Volume 4. Washington, DC; National Academy Press, p. 330-365. [Disponible en anglais seulement.]
[NRC] 2002. National Research Council. Acute Exposure Guideline Levels for Selected Airborne Chemicals, Volume 2. Subcommittee on Acute Exposure Guideline Levels Committee on Toxicology (Consulté le 21 novembre 2018). [Disponible en anglais seulement.]
[NTP] 1993. National Toxicology Program. NTP technical report on toxicity studies of sodium cyanide (CAS No. 143-33-9) administered in drinking water to F344/N rats and B6C3F1 mice [PDF]. Public Health Service, U.S. Department of Health and Human Services; NTP TR 37; NIH Publication 94-3386. (Consulté le 21 novembre 2018). [Disponible en anglais seulement.]
[OCDE] QSAR Toolbox. 2016. Paris (FR), Organisation de coopération et de développement économiques, Laboratory of Mathematical Chemistry. [Disponible en anglais seulement.]
[OMS] 2004. Concise International Chemical Assessment Document 61: Hydrogen Cyanide and Cyanides, Human Health Aspects, International Programme on Chemical Safety and Inter-Organization Programme for the sound Management of Chemicals, Programme des Nations Unies pour l’environnement (PNUE), Organisation internationale du Travail (OIT) et l’Organisation mondiale de la santé (OMS). [Disponible en anglais seulement.]
[PhysProp] Interactive PhysProp Database [base de données]. c2013. Syracuse, NY: SRC, Inc. [Disponible en anglais seulement.]
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu (Institut hollandais de la santé publique et de l’environnement). 2006. Cosmetics Fact Sheet: To assess the risks for the consumer. RIVM report 320104001/2006 [PDF] (Consulté le 19 novembre 2018). [Disponible en anglais seulement.]
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu (Institut hollandais de la santé publique et de l’environnement). 2014. General Fact Sheet - General default parameters for estimating consumer exposure - Updated version 2014. RIVM Report 090013003/2014 [PDF] (Consulté le 19 novembre 2018). [Disponible en anglais seulement.]
Ross, M.D. et W.T. Jones. 1983. A genetic polymorphism for tannin production in Lotus corniculatus and its relationship to cyanide polymorphism. Theoretical and Applied Genetics 64(3):263-268. [Disponible en anglais seulement.]
Vetter, J., 2000. Plant cyanogenic glycosides. Toxicon 38:11-36. [Disponible en anglais seulement.]
Weschler, C.J. et W.W. Nazaroff. 2014. Dermal uptake of organic vapors commonly found in indoor air. Environmental science & technology 48(2):1230-1237. [Disponible en anglais seulement.]
Yoo KP, Lee SY, et WH Lee. 1986. Ionization and Henry’s Law Constants for Volatile, Weak Electrolyte Water Pollutants. Korean Journal of Chemical Engineering 3: 67. [Disponible en anglais seulement.]
Annexe A – Les glycosides cyanogènes et le potentiel d’exposition à l’HCN par l’utilisation de cosmétiques contenant de l’extrait de Lotus corniculatus
Les glycosides cyanogènes sont des molécules relativement petites qu’on trouve généralement en faibles concentrations dans des végétaux (Briggs et Schultz, 1990), bien que les concentrations varient selon la saison, les concentrations d’HCN étant invariablement plus élevées au printemps et en été qu’en automne et en hiver (Gebrehiwot et Beuselinck, 2001). Les concentrations de cyanure sont les plus élevées dans les feuilles en croissance, et diminuent lorsque les feuilles deviennent matures et épaississent, tandis que les graines contiennent peu voire aucun glycoside cyanogène (Jones et Turkington, 1986; Vetter, 2000). Les données sont moins nombreuses sur la teneur en cyanure des fleurs de Lotus corniculatus, bien que dans un cultivar cultivé en serre, la concentration de cyanure dans les fleurs était semblable à celle mesurée dans les feuilles (Gebrehiwot et Beuselinck, 2001).
Dans les matières végétales intactes, les glycosides cyanogènes sont emmagasinés dans des compartiments cellulaires distincts des enzymes hydrolytiques comme les ß‑glucosidases. Les dommages occasionnés à la plante par le broutage des herbivores ou le traitement pour produire des extraits peuvent rompre la compartimentalisation et déclencher la formation d’HCN. Dans une hydrolyse, un gramme de linamarine peut libérer 109,3 mg d’HCN (équivalant à 105,2 mg de CN-) et un gramme de lotaustraline peut libérer 103,4 mg d’HCN (équivalant à 99,6 mg de CN-). On a longtemps pensé que les humains et les autres mammifères n’avaient pas les enzymes hydrolytiques endogènes permettant la métabolisation des glycosides d’origine alimentaire (Dorr et Paxinos, 1978; Frakes et al., 1986; Hernandez et al., 1995), bien que l’hydrolyse partielle des glycosides et la libération d’HCN puisse s’accomplir par l’action d’enzymes microbiennes du tube digestif (EFSA, 2007). Depuis, des données probantes sur la présence des β-glucosidases endogènes chez les humains ont été obtenues (Berrin et al., 2002; Németh et al., 2003), bien que ces enzymes ne semblent pas avoir une capacité importante pour hydrolyser la linamarine, le glycoside le plus abondant produit par Lotus corniculatus ainsi que par plusieurs autres espèces végétales qui sont importantes dans l’alimentation humaine. Par conséquent, s’ils ne sont pas métabolisés par le microbiote intestinal, les glycosides mères sont absorbés et excrétés dans l’urine sans causer d’exposition à l’HCN (EFSA, 2007).
Il est raisonnable de supposer que l’HCN peut être libéré des glycosides cyanogènes pendant la production et le traitement de l’extrait de Lotus corniculatus si la matière végétale est homogénéisée ou fait l’objet de procédés techniques qui compromettent l’intégrité de la matière. Les extraits provenant de phénotypes acyanogènes qui produisent le glycoside mais pas l’enzyme peuvent également contenir des glycosides intacts. Bien qu’aucune donnée n’ait été trouvée sur la capacité de la microflore cutanée d’hydrolyser des glycosides cyanogènes, il est possible que les glycosides non hydrolysés qui restent dans les extraits végétaux puissent également libérer de l’HCN par ce mécanisme. Quant à la voie orale, tous les glycosides cyanogènes qui sont absorbés de façon percutanée sans être métabolisés par le biote cutané ne devraient pas entraîner d’exposition à l’HCN étant donné l’absence des enzymes hydrolytiques endogènes chez les mammifères.
Annexe B – Paramètres par défaut et hypothèses permettant d’estimer l’exposition à l’acide cyanhydrique, par inhalation et par voie orale, par l’utilisation de cosmétiques
Les scénarios d’exposition sentinelles ont été utilisés pour estimer l’exposition potentielle au cyanure découlant de l’utilisation de produits cosmétiques contenant de l’extrait de Lotus corniculatus. Les hypothèses de scénarios sont présentées en résumés dans le tableau B-1. Les expositions ont été estimées d’après le poids supposé de 70,9 kg pour les adultes et de 15,5 kg pour les tout-petits (Santé Canada, 1998) ainsi que le taux d’inhalation de 16,2 m3/j chez les adultes. Les concentrations dans l’air ont été estimées à l’aide de la version Web de ConsExpo ou des algorithmes provenant du modèle (version Web de ConsExpo, 2016).
Scénario d’exposition |
Hypothèses |
|---|---|
Lotion pour le corps |
Concentration maximale d’HCN dans le produit : 25 mg/kg (concentration maximale de cyanure dans l’extrait de Lotus corniculatus [voir la section 5.1] multipliée par la concentration maximale d’extrait dans le produit selon les déclarations sur les cosmétiques). Quantité de produit : 10 g (Ficheux et al., 2016) Fréquence : 1/jour (Ficheux et al., 2015) Facteur de rétention : 1 (RIVM, 2006) Volume de la pièce : 10 m3 (RIVM, 2014) Taux de renouvellement d’air : 2/h (RIVM, 2014) Durée de l’application : 1 minute (jugement d’un expert) Durée de l’exposition : 10 minutes (EPA, 2011) Superficie de rejet : 17 530 cm2 (Ficheux et al., 2016) Température : 32 °C (température de la peau par défaut; NIOSH, 2013). Pression de vapeur : 959 torr à 32 °C (calculée à l’aide de l’équation d’Antoine – voir l’annexe C) Taux de transfert de masse : 0,167 m/min (Meesters et al., 2018) |
Baume pour les lèvres |
Concentration maximale d’HCN dans le produit : 50 mg/kg (concentration maximale de cyanure dans l’extrait de Lotus corniculatus [voir la section 5.1] multipliée par la concentration maximale d’extrait dans le produit selon les déclarations sur les cosmétiques). Quantité de produit : 0,022 g (Ficheux et al., 2016) Conc. maximale d’HCN conc. (mg/kg) : 50 Fréquence : 2/j, adultes; 1/j, tout-petits (Ficheux et al., 2015) Quantité ingérée : 100 % (pire scénario, en théorie) Facteur de rétention : 1 (RIVM, 2006) |
Annexe C – Pénétration d’une dose finie de substances volatiles dans la peau
L’équation d’Antoine peut être utilisée pour estimer la pression de vapeur dans une certaine fourchette de températures. L’équation est la suivante :
log10p = A - (B / C + T)
Où p est la pression de vapeur (mm HG), T est la température (°C) et A, B et C sont des constantes propres au composant. Les constantes d’Antoine pour l’acide cyanhydrique proviennent d’un document de l’EPA des États‑Unis (2012).
| A | B | C | Tmin oC | Tmax oC |
|---|---|---|---|---|
| 7,52823 | 1329,49 | 260,418 | -16,4 | 46,2 |
Par conséquent, la pression de vapeur de l’acide cyanhydrique à 32 °C (température à la surface de la peau par défaut) peut se calculer comme suit :
log10p = 7.52823 - (1329.49 / 260.418 + 32)
p = 959 mmHG
Le calculateur de la pénétration d’une dose finie dans la peau (NIOSH, 2013) indique l’élimination d’une charge appliquée en surface et peut être utilisé pour estimer les flux, les concentrations dans la peau et la quantité d’une substance chimique qui est absorbée. Dans le cas de substances très volatiles comme le cyanure, l’exposition par voie cutanée variera non seulement selon la charge superficielle, mais également selon le taux d’évaporation par rapport au taux d’absorption. En effet, le calculateur de la pénétration d’une dose finie dans la peau prévoit que, à une température de la peau de 32 °C, le flux d’évaporation maximal dépassera de beaucoup le flux d’absorption maximal (tableau C-1).
| Flux d’absorption maximal ([Jabs] max) | 1,645E-03 μg/cm²/h¹ |
|---|---|
| Temps pour atteindre le flux d’abs. max. | 0,471 heure |
| Flux d’évaporation maximal | 2789,242 μg/cm²/h¹ |
| Temps pour atteindre le flux d’évap. max. | 2,778E-10 heure |
Le calculateur de la pénétration d’une dose finie dans la peau a été utilisé pour estimer la distribution de la perméance après une application cutanée (tableau C-2). La somme de la solution absorbée totale dans toutes les couches de la peau plus celle absorbée dans la circulation générale a été estimée à 6,9 × 10-3 µg/cm2. En présumant une concentration d’HCN de 0,5 %, cette somme correspond à une dose par unité de surface de 3,4 × 10-5 µg/cm2. Cette valeur peut être multipliée par une superficie corporelle de 17 530 cm2 et divisée par le poids corporel d’un adulte de 70,9 kg pour donner une dose générale d’HCN de 0,009 µg/kg p.c./j.
| Élimination de l’HCN | Masse par unité de surface (µg/cm2) |
|---|---|
| Évaporé | 0,564 |
| À la surface de la peau | 0,0 |
| Dans la couche cornée de l’épiderme | 1,57 x 10-06 |
| Dans l’épiderme viable | 4,18 x 10-06 |
| Dans le derme | 5,71 x 10-05 |
| Absorbé dans la circulation générale | 6,84 x 10-03 |
