Ébauche d'évaluation préalable groupe des salicylates
Titre officiel : Ébauche d’évaluation préalable groupe des salicylates
Numéros de registre du Chemical Abstracts Service 69-72-7; 87-22-9; 118-56-9; 68917-75-9; 84012-15-7
Environnement et Changement climatique Canada
Santé Canada
Mars 2020
Sommaire
Conformément à l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), les ministres de l’Environnement et de la Santé ont mené une évaluation préalable de cinq substances appelées collectivement groupe des salicylates. Les substances de ce groupe ont été jugées d’intérêt prioritaire pour une évaluation puisqu’elles satisfaisaient aux critères de catégorisation du paragraphe 73(1) de la LCPE. Leurs numéros de registre du Chemical Abstracts Service (no CASNote de bas de page 1 ), leurs noms sur la Liste intérieure des substances (LIS) et leurs noms communs sont présentés dans le tableau ci-dessous.
| No CAS | Nom sur la LIS | Nom commun |
|---|---|---|
| 68917-75-9a | Essences de wintergreen | Huile de gaulthérie |
| 69-72-7 | Acide salicylique | Acide 2‑hydroxybenzoïque |
| 118-56-9 | Homosalate | 2-Hydroxybenzoate de 3,3,5-triméthylcyclohexyle |
| 87-22-9 | Salicylate de phénéthyle | 2-Hydroxybenzoate de 2-phényléthyle |
| 84012-15-7a | Extrait de bouleau, Betula alba | Extrait de Betula alba |
a Ce no CAS désigne un composé UVCB (substance de composition inconnue ou variable, produit de réaction complexe ou matière biologique).
Dans la présente évaluation, les substances du groupe sont examinées dans l’ordre indiqué dans le tableau ci-dessus, car les données sur les effets du 2-hydroxybenzoate de méthyleNote de bas de page 2 (présent dans l’essence de gaulthérie) et de l’acide 2-hydroxybenzoïque constituent la base des discussions pour certaines des autres substances.
À l’exception de l’extrait de Betula alba, les substances visées par la présente évaluation préalable sont structurellement similaires dans la mesure où elles contiennent un groupe 2-hydroxybenzoate, composé d’un groupe carboxyle occupant la position 2 d’un phénol. La différence entre ces quatre substances réside dans le substituant formant la liaison ester avec le carbone carboxylique. L’extrait de Betula alba est un UVCB (substance de composition inconnue ou variable, produit de réaction complexe ou matière biologique). Il s’agit d’un dérivé de Betula alba, une espèce de la famille des Betulaceae. Les principaux composants de cette substance varient selon la partie de la plante extraite, la méthode d’extraction et le type d’extrait. Bien que l’huile de gaulthérie soit également considérée être un UVCB, l’analyse spectroscopique a montré qu’elle contient généralement jusqu’à 99 % de 2‑hydroxybenzoate de méthyle, un produit chimique discret.
L’huile de gaulthérie, l’acide 2-hydroxybenzoïque et l’extrait de Betula alba sont naturellement présents dans l’environnement, tandis que le 2-hydroxybenzoate de 3,3,5-triméthylcyclohexyle et le 2-hydroxybenzoate de 2-phényléthyle ne le sont pas. Toutes les substances du groupe des salicylates ont été incluses dans des enquêtes menées suite à des avis émis conformément à l’article 71 de la LCPE. L’huile de gaulthérie, l’acide 2-hydroxybenzoïque et le 2-hydroxybenzoate de 3,3,5‑triméthylcyclohexyle ont été importés au Canada en quantités respectives de 100 à 1000 kg, 87 437 kg et 100 000 à 1 000 000 kg pendant l’année de déclaration 2011, alors que le 2-hydroxybenzoate de 2-phényléthyle et l’extrait de Betula alba n’y ont pas été importés au-delà du seuil de déclaration de 100 kg. Selon les renseignements fournis en vertu de l’article 71, aucune de ces substances n’a été fabriquée au Canada.
L’huile de gaulthérie est utilisée au Canada comme ingrédient dans des cosmétiques et des pesticides et comme ingrédient non médicinal (INM) ou médicinal (IM) dans des produits de santé naturels (PSN). Cette substance est un composant de l’extrait de gaulthérie, de l’huile de gaulthérie et de l’arôme de gaulthérie, qui sont des préparations aromatisantes normalisées au Canada.
Au Canada, l’acide 2-hydroxybenzoïque est utilisé comme ingrédient dans des cosmétiques et des matériaux d’emballage alimentaire et comme INM et IM dans des PSN et des médicaments. Cette substance a également été identifiée dans des produits de nettoyage tels que des détergents pour lave-vaisselle.
Le 2-hydroxybenzoate de 3,3,5-triméthylcyclohexyle est principalement utilisé comme ingrédient actif dans des formulations d’écrans solaires, où il agit comme filtre UV. Cette substance a été rapportée utilisée dans divers produits cosmétiques au Canada.
Au Canada, le 2-hydroxybenzoate de 2-phényléthyle est utilisé comme ingrédient dans des cosmétiques et peut être utilisé comme INM dans des PSN. Cette substance peut également être utilisée comme ingrédient d’aromatisant alimentaire.
L’extrait de Betula alba a été rapporté utilisé au Canada comme ingrédient dans des produits de soins personnelsNote de bas de page 3 .
Les risques pour l’environnement des substances du groupe des salicylates ont été caractérisés à l’aide de la classification du risque écologique des substances organiques (CRE), une approche basée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition et d’une pondération de plusieurs éléments de preuve pour obtenir un classement du risque. Les profils de danger reposent principalement sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne dérivés du réseau tropique, à la biodisponibilité et à l’activité chimique et biologique. Les paramètres pris en compte dans les profils d’exposition incluent la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Une matrice de risque est utilisée pour assigner aux substances un potentiel faible, moyen ou élevé selon leurs profils de danger et d’exposition. D’après les résultats de la CRE, il est improbable que les substances du groupe des salicylates soient nocives pour l’environnement.
Compte tenu de tous les éléments de preuve avancés dans la présente ébauche d’évaluation préalable, l’huile de gaulthérie, l’acide 2-hydroxybenzoïques, le 2‑hydroxybenzoate de 3,3,5-triméthylcyclohexyle, le 2-hydroxybenzoate de 2‑phényléthyle et l’extrait de Betula alba présentent un faible risque d’effet nocif sur l’environnement. Il est proposé de conclure que ces substances ne répondent pas aux critères de l’alinéa 64a) ou b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou sa diversité biologique, ou qui constituent ou peuvent constituer un danger pour l’environnement essentiel pour la vie.
Concernant la santé humaine, en se basant sur l’information disponible sur son principal composant, le 2-hydroxybenzoate de méthyle, les effets sur le foie et sur le développement ont été déterminés comme effets critiques associés à l’exposition à l’huile de gaulthérie. Une comparaison de l’exposition orale estimée à l’huile de gaulthérie due à son utilisation comme ingrédient aromatisant alimentaire, de comprimés d’antiacide et de dentifrices a conduit à calculer des marges d’exposition jugées adéquates pour tenir compte des incertitudes des bases de données sur l’exposition et les effets sur la santé.
Une comparaison des niveaux estimés d’exposition à l’huile de gaulthérie due à son utilisation comme ingrédient dans des cosmétiques, y compris des huiles de massage et des hydratants pour le visage, a conduit à calculer des marges d’exposition jugées potentiellement inadéquates pour tenir compte des incertitudes des bases de données sur l’exposition et les effets sur la santé. Une comparaison du niveau d’exposition estimé dû à l’huile de gaulthérie due à son utilisation comme ingrédient dans des crèmes analgésiques a conduit à calculer des marges d’exposition qui sont également considérées potentiellement inadéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
Les effets critiques associés à l’acide 2-hydroxybenzoïque sont des effets sur le foie, les reins et le développement. La comparaison de l’exposition à l’acide 2‑hydroxybenzoïque due à sa présence dans les milieux de l’environnement et les aliments et des niveaux d’effet critique a conduit à calculer des marges d’exposition qui sont jugées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition. Une comparaison des niveaux estimés d’exposition à l’acide 2-hydroxybenzoïque due à son utilisation dans une laque pour cheveux a conduit à calculer des marges d’exposition considérées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
Concernant l’exposition cutanée à l’acide 2-hydroxybenzoïque due à l’utilisation de certains cosmétiques, une comparaison des niveaux d’effet critique et des estimations de l’exposition a conduit à calculer des marges d’exposition considérées potentiellement inadéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
Concernant l’exposition cutanée ou orale à l’acide 2-hydroxybenzoïque due à l’utilisation de certains PSN et drogues, y compris des écrans solaires, des antiacides liquides, des crèmes analgésiques, des crèmes contre l’acné et des crèmes après‑rasage, une comparaison de l’exposition estimée et des niveaux d’effet critique a conduit à calculer des marges d’exposition jugées potentiellement inadéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
En se basant sur les renseignements disponibles, les effets critiques associés à une exposition au 2‑hydroxybenzoate de 3,3,5-triméthylcyclohexyle sont des effets sur la reproduction, les reins, le thymus et la thyroïde. La comparaison de l’exposition au 2‑hydroxybenzoate de 3,3,5-triméthylcyclohexyle due à l’utilisation de produits de bronzage a conduit à calculer une marge d’exposition potentiellement inadéquate pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition. L’utilisation d’hydratants pour le visage (crèmes et aérosols) a conduit à calculer des marges d’exposition jugées adéquates pour tenir compte de ces incertitudes.
En se basant sur des données sur la toxicité d’analogues structurellement apparentés (c.-à-d. le 2-hydroxybenzoate de méthyle), les effets critiques associés à une exposition au 2‑hydroxybenzoate de 2-phényléthyle sont des effets sur le foie et sur le développement. Une comparaison des estimations de l’exposition au 2‑hydroxybenzoate de 2-phényléthyle due à son utilisation comme ingrédient dans des cosmétiques ou ingrédient d’aromatisant alimentaire et du niveau d’effet critique a conduit à calculer des marges d’exposition considérées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
Les renseignements disponibles sur les effets sur la santé de l’extrait de Betula alba et de ses principaux composants indiquent que le danger potentiel de cette substance est faible, et le risque pour la santé humaine est donc considéré faible.
Sur la base des renseignements présentés dans la présente ébauche d’évaluation préalable, il est proposé de conclure que l’huile de gaulthérie, l’acide 2-hydroxybenzoïque et le 2‑hydroxybenzoate de 3,3,5-triméthylcyclohexyle satisfont aux critères de l’alinéa 64c) de la LCPE, car ils pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaine.
Sur la base des renseignements présentés dans la présente ébauche d’évaluation préalable, il est proposé de conclure que le 2-hydroxybenzoate de 2-phényléthyle et l’extrait de Betula alba ne satisfont pas aux critères de l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en quantités ou concentrations ni dans des conditions qui constitue ou peuvent constituer un danger au Canada pour la vie ou la santé humaine.
Par conséquent, il est proposé de conclure que l’huile de gaulthérie, l’acide 2-hydroxybenzoïque et le 2‑hydroxybenzoate de 3,3,5-triméthylcyclohexyle répondent à un ou plusieurs des critères de l’article 64 de la LCPE.
Il est également proposé de conclure que le 2-hydroxybenzoate de 2-phényléthyle et l’extrait de Betula alba ne répondent à aucun des critères de l’article 64 de la LCPE, que l’acide 2‑hydroxybenzoïque ne répond pas aux critères de persistance ni de bioaccumulation, que le 2‑hydroxybenzoate de 3,3,5-triméthylcyclohexyle répond aux critères de bioaccumulation mais pas à ceux de persistance, et que l’huile de gaulthérie satisfait aux critères de persistance mais pas à ceux de bioaccumulation du Règlement sur la persistance et la bioaccumulation de la LCPE.
1. Introduction
Conformément à l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE) (Canada), les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable de cinq substances appelées collectivement groupe des salicylates, afin de déterminer si elles présentent ou peuvent présenter des risques pour l’environnement ou la santé humaine. Les substances de ce groupe ont été identifiées d’intérêt prioritaire pour une évaluation, car elles satisfaisaient aux critères de catégorisation du paragraphe 73(1) de la LCPE (ECCC, SC [modifié en 2017]).
Les risques pour l’environnement dus aux substances du groupe des 2‑hydrobenzoates ont été caractérisés à l’aide de l’approche de classification du risque écologique (CRE) des substances organiques (ECCC 2016a). La CRE décrit le danger d’une substance au moyen de paramètres clés, notamment le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau alimentaire, la biodisponibilité et l’activité chimique et biologique, et tient compte de l’exposition possible des organismes dans les milieux aquatiques et terrestres en se basant sur des facteurs comme les vitesses d’émission potentielles, la persistance globale et le potentiel de transport atmosphérique à grande distance. Les divers éléments de preuve sont combinés pour déterminer les substances qui justifient une évaluation plus approfondie de leur potentiel d’effets nocifs sur l’environnement ou dont la probabilité d’effet nocif sur l’environnement est faible.
La présente ébauche d’évaluation préalable tient compte de renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et les expositions, ainsi que de renseignements soumis par des parties prenantes. Des données pertinentes ont été recueillies jusqu’en novembre 2017. Des données empiriques tirées d’études clés ainsi que des résultats de modélisations ont été utilisés pour tirer nos conclusions. Des renseignements pertinents présentés dans des évaluations faites par d’autres juridictions ont été pris en compte.
La présente ébauche d’évaluation préalable a été préparée par le personnel du Programme d’évaluation des risques de la LCPE de Santé Canada et d’Environnement et Changement climatique Canada. Elle intègre des intrants d’autres programmes de ces ministères. Les parties de la présente évaluation qui portent sur l’environnement et la santé humaine ont fait l’objet d’un examen et/ou de consultations externes. Des commentaires sur les parties techniques relatives à la santé humaine ont été faits par Risk Sciences International et Sandrine Charles, Agence Nationale de Sécurité Sanitaire. La partie de la présente évaluation qui porte sur l’environnement est basée sur le document de la CRE (publié le 30 juillet 2016), qui a fait l’objet d’un examen externe et d’une période de commentaires du public de 60 jours. Bien que des commentaires externes aient été pris en compte, le contenu final et la conclusion de la présente ébauche d’évaluation préalable demeurent la responsabilité de Santé Canada et d’Environnement et Changement climatique Canada.
La présente ébauche d’évaluation préalable est centrée sur des renseignements critiques pour déterminer si des substance répondent aux critères de l’article 64 de la LCPE, en examinant des renseignements scientifiques et en suivant une approche basée sur le poids de la preuveNote de bas de page 4 et le principe de précaution. Dans la présente ébauche d’évaluation préalable, nous présentons les renseignements et les considérations critiques sur lesquels sont basées nos conclusions.
2. Identités des substances
Les numéros de registre du Chemical Abstracts Service (no CASNote de bas de page 5 ), les noms sur la Liste intérieure des substances (LIS) et les noms communs des substances individuelles ou des substances représentatives du groupe des salicylates sont présentés dans le tableau 2‑1.
| No CAS | Nom sur la LIS (nom commun) | Structure chimique et formule moléculaire | Poids moléculaire (g/mol) |
|---|---|---|---|
| 69-72-7 | Acide salicylique (Acide 2-hydroxybenzoïque) | 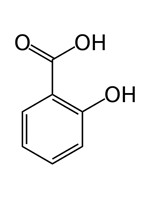 C7H6O3 C7H6O3 |
138,1 |
| 87-22-9 | Salicylate de phénéthyle (2‑Hydroxybenzoate de 2‑phényléthyle) | 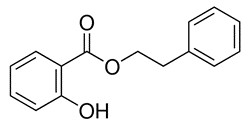 C13H9O3 C13H9O3 |
242,3 |
| 118-56-9 | Homosalate (2‑Hydroxybenzoate de 3,3,5‑triméthylcyclohexyle) | 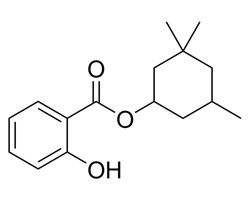 C16H21O3 C16H21O3 |
262,3 |
| No CAS | Nom sur la LIS (nom commun) | Nom chimique représentatif (formule) | Structure chimique représentative |
|---|---|---|---|
| 68917-75-9 | Essences de wintergreen (Huile de gaulthérie) | ~99 % de 2‑hydroxybenzoate de méthyle (C8H8O3) | 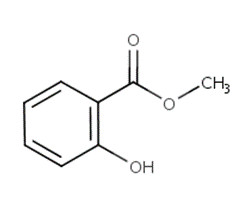 |
| 84012-15-7 | Extrait de bouleau, Betula alba (Extrait de Betula alba) | 10,5 à 82 % de bétuline (C30H50O2) | 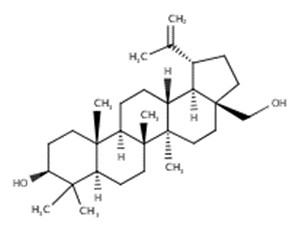 |
a UVCB est l’acronyme pour Unknown or Variable composition Complex reaction products and Biological material.
Dans la présente évaluation, les substances du groupe sont examinées dans l’ordre suivant : huile de gaulthérie, acide 2-hydroxybenzoate, 2-hydroxybenzoate de 3,3,5‑triméthylcyclohexyle, 2-hydroxybenzoate de 2-phényléthyle et extrait de Betula alba, car les données sur les effets sur la santé du 2‑hydroxybenzoate de méthyle (présent dans l’huile de gaulthérie) et de l’acide 2-hydroxybenzoïque constituent la base de la discussion de certaines des autres substances.
L’huile de gaulthérie est une substance chimique de type UVCB dérivée de Gaultheria procumbens ou de Betula lenta. Dans le Chemical Substance Inventory de la Toxic Substances Control Act (TSCA) des États-Unis, l’huile de gaulthérie (no CAS 68917-75-9) est définie comme « extractives and their physically modified derivatives Gaultheria procumbens, Ericacenae or Betula lenta, Betulaceae (extraits et leurs dérivés physiquement modifiés de Gaultheria procumbens, Ericacenae ou Betula lenta, Betulaceae) » (TSCA 2017). Bien qu’étant un UVCB, des études spectroscopiques ont montré que l’huile de gaulthérie peut contenir jusqu’à 99 % de 2-hydroxybenzoate de méthyle, une substance discrète (El-Obeid et al.1979). Tisserand et Young (2014) ont fait remarquer que la toxicité du 2-hydroxybenzoate de méthyle et de l’huile de gaulthérie était « essentiellement identique ».
L’extrait de Betula alba est une substance chimique de type UVCB, dérivée de Betula alba. Selon le Système d’information taxonomique intégré (SITI) établi par des organismes fédéraux aux États-Unis et au Canada, « Betula alba L. » est le synonyme actuel du Betula pubescens ssp pubescens Ehrh (SITI 2017a, SITI 2017b). Dans l’inventaire européen des substances chimiques commerciales existantes (EINECS), l’extrait de Betula alba (no CAS 84012-15-7) est défini comme « extraits et leurs dérivés physiquement modifiés tels que des teintures, des essences concrètes, des essences absolues, des huiles essentielles, des oléorésines, des terpènes, des fractions sans terpènes, des distillats, des résidus, etc. obtenus à partir de Betula alba, Betulaceae » (ECHA 2017a).
La composition des constituants de l’extrait de Betula alba varie selon la partie de la plante utilisée (p. ex. bourgeons, feuilles, écorce), le type d’extrait et le procédé d’extraction. Dans les produits disponibles pour les consommateurs, les ingrédients peuvent être spécifiquement identifiés (p. ex. « extrait de feuille de Betula alba ») ou non (p. ex. « Betula alba »). Des études spectroscopiques ont montré que les extraits de bouleau contiennent des terpénoïdes et leurs esters, des huiles-éthers, des hydrocarbures et leurs époxydes, des stéroïdes, des tanins, des flavonoïdes, des hydroxycoumarines, des vitamines, des proanthocyanidines polymères et un certain nombre de composés non identifiés. Les triterpénoïdes et les hydrocarbures se sont toutefois avérés être les principaux composés (Abyshev et al. 2007). Certains des principaux composés ( ≥ 10 %) ayant fait l’objet d’études publiées dans la littérature comprennent la bétuline (10,5 à 82 %) et ses dérivés (p. ex. l’acide bétulinique) (Laszczyk et al. 2006, Abyshev et al. 2007, Orav et al. 2011, EMEA 2014).
2.1 Sélection d’analogues
À l’exception de l’extrait de Betula alba, le groupe des salicylates comprend l’acide 2-hydroxybenzoïque et certains de ses esters. Les esters de l’acide 2‑hydroxybenzoïque devraient s’hydrolyser en acide 2-hydroxybenzoïque et leurs alcools correspondants, qui seront ensuite métabolisés (JECFA 2002a). La vitesse d’hydrolyse de la liaison ester dépend de la longueur de la chaîne ou de l’encombrement stérique du groupe substituant attaché à la fonction acide (Dittert et al. 1968). Des renseignements sur les propriétés physico-chimiques et la toxicité des salicylates et de leurs analogues sont présentés dans le tableau A-2 de l’annexe A.
Comme les données disponibles sur certains paramètres associés aux substances étudiées étaient limitées, une approche de lecture croisée basée sur des données provenant d’analogues a été utilisée pour étayer les évaluations ayant trait à la santé humaine du groupe des salicylates. Les analogues ont été choisis en fonction de leur similarité structurelle, fonctionnelle ou toxicologique (p. ex. propriétés physico‑chimiques, toxicocinétique et réactivité similaires) et de la disponibilité de données empiriques pertinentes. En raison de la similarité chimique, métabolique et toxique inhérente de la majorité des membres du groupe des salicylates, une substance du groupe a été choisie dans certains cas comme analogue d’une autre substance.
Des détails sur les données de lecture croisée utilisées pour étayer les évaluations des effets des salicylates sur la santé humaine sont discutés dans les sections pertinentes du présent rapport et à l’annexe A. Les analogues utilisés pour l’évaluation des effets sur la santé du groupe des salicylates sont présentés dans le tableau 2‑3.
| No CAS | Nom commun | Structure chimique et formule moléculaire | Poids moléculaire (g/mol) |
|---|---|---|---|
| 119-36-8 | 2-Hydroxybenzoate de méthyle | 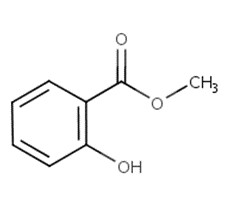 C8H8O3 C8H8O3 |
152,15 |
| 118-55-8 | 2-Hydroxybenzoate de phényle | 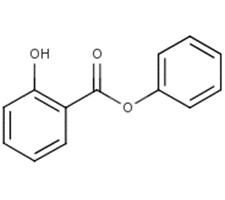 C13H10O3 C13H10O3 |
214,22 |
| 118-58-1 | 2-Hydroxybenzoate de benzyle | 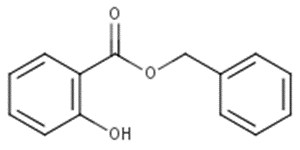 C14H12O3 C14H12O3 |
228,25 |
3. Propriétés physiques et chimiques
Un résumé des propriétés physiques et chimiques des substances du groupe des salicylates est présenté dans le tableau 3‑1. Lorsque l’information expérimentale était limitée ou non disponible, des données provenant d’analogues ont été obtenues par lecture croisée et/ou des modèles (Q)SAR ont été utilisés pour générer des valeurs prospectives. D’autres propriétés physiques et chimiques sont présentées dans ECCC (2016 b).
| Propriété | Huile de gaulthériec | Acide 2‑hydroxy benzoïquea | 2‑Hydroxyben zoate de 3,3,5-triméthyl cyclohexyleb | 2‑Hydroxy benzoate de 2‑phényl-éthylea | Extrait de Betula alba |
|---|---|---|---|---|---|
| État physique | liquide incolore | cristaux blancs | liquide incolore | poudre blanche | poudre blanche |
| Point de fusion (°C) | - 8 | 158 | < -20 | 123e | 210 à 495d |
| Pression de vapeur (Pa) | 4,57 | 0,01 | 0,013 | 1,85E-04e | 4,2E -11 d |
| Constante de Henry (Pa.m3/mol) | 7,9E-08e | 7,34 E-09 | 1,93E -05a,e | 4,87E-07e | 5,34E -06 d |
| Solubilité dans l’eau (mg/L) | 700 | 2 240 | 0,4 | 7,2 à 7,8e | 0,02f |
| log Koe (sans dimension) | 2,55 | 2,26 | > 6 (40C) | 4,80e | 8,18d |
| pKa (sans dimension) | S.O. | 2,98 | S.O. | S.O. | S.O. |
a EpiSuite 2012
b ECHA 2017b
c L’information sur le 2-hydroxybenzoate de méthyle (no CAS 119-36-8) a été utilisée pour l’huile de gaulthérie, car cette substance en est le composant majeur, à plus de 95 %. Les données sur les propriétés du 2‑hydroxybenzoate de méthyle ont été tirées d’EpiSuite (2012).
d L’information sur l’extrait de Betula alba est basée sur celle de l’un de ses principaux composants, la bétuline. Données tirées d’EpiSuite (2012)
e Valeur prédite
f Jäger et al. 2008, pour la bétuline
4. Sources et utilisations
4.1 Sources naturelles
L’acide 2-hydroxybenzoïque est présent dans des plantes sous forme d’acide phénolique libre ou sous formes conjuguées, qui sont générées par des processus métaboliques tels que la glucosylation, la méthylation ou l’hydroxylation du cycle aromatique (Raskin 1992, Lee et al. 1995 cité dans Bandurska 2013). Il est couramment présent sous forme d’un dérivé, la salicine, dans des espèces de saules (Salix alba, S. purpurea, S. daphnoides, et S. fragilis). Des teneurs élevées en acide 2‑hydroxybenzoïque libre ont été rapportées dans les espèces S. lapononum et S. plantifolia (Raskin 1992, Lee et al. 1995 cité par Bandurska 2013). La présence de l’acide 2-hydroxybenzoïque chez les humains est principalement due à la consommation de fruits et de légumes (Paterson et al. 2006) et peut aussi résulter de la décomposition d’autres produits chimiques comme l’acide benzoïque.
L’huile de gaulthérie est une huile essentielle principalement dérivée des espèces du genre Gaultheria, dont Gaultheria procumbens et Betula lenta (TSCA 2017). Les renseignements disponibles indiquent que le principal constituant de l’huile de gaulthérie est le 2-hydroxybenzoate de méthyle (no CAS 119-36-8), qui peut en représenter jusqu’à 99 % (Tisserand et Young 2014, El-Obeid et al. 1979).
L’extrait de Betula alba est dérivé de la famille des Betulaceae et possède un profil de composants complexe. Les principaux composants de cette substance identifiés sont des terpénoïdes et leurs esters, des huiles-éthers, des hydrocarbures et leurs époxydes, des stéroïdes, des tanins, des flavonoïdes, des hydroxycoumarines, des vitamines, des proanthocyanidines polymères et un certain nombre de composés non identifiés. Cependant, il a été montré que les triterpénoïdes et les hydrocarbures sont les principaux composants (Jager et al. 2008, Abyshev et al. 2007). La teneur des différents composants varie avec le type de bouleau, le type d’extrait et d’autres facteurs (Jäger et al. 2008).
Le 2-hydroxybenzoate de 3,3,5-triméthylcyclohexyle et le 2‑hydroxybenzoate de 2‑phényléthyle ne sont pas des substances naturelles et sont synthétisés à partir de dérivés de salicylates.
4.2 Sources anthropiques
Toutes les substances du groupe des salicylates ont été incluses dans des enquêtes menées en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Nous présentons dans le tableau 4‑1 un résumé des quantités totales importées déclarées pour le groupe des salicylates au cours de l’année de déclaration 2011. Aucune des substances du groupe des salicylates n’a été déclarée produite au Canada au-dessus du seuil de déclaration de 100 kg au cours de l’année de déclaration 2011 (Environnement Canada 2013). Aucune importation du 2‑hydroxybenzoate de 2-phényléthyle ou de l’extrait de Betula alba au Canada au-delà du seuil de déclaration de 100 kg n’a été déclarée (Environnement Canada 2013, ECCC 2017).
| Nom commun | Importations totalesa,b (kg) |
|---|---|
| Huile de gaulthérie | 100 à 1000 |
| Acide 2-hydroxybenzoïque | 87 437 |
| 2-Hydroxybenzoate de 3,3,5‑triméthylcyclohexyle | 100 000 à 1 000 000 |
| 2-Hydroxybenzoate de 2‑phényléthyle | < 100 |
| Extrait de Betula alba | < 100 |
a Les valeurs reflètent les quantités déclarées lors d’une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Voir l’enquête pour les inclusions et exclusions spécifiques (annexes 2 et 3).
b ECCC 2017
4.3 Utilisations
L’huile de gaulthérie est classée comme PSN à l’article 2 (extrait) de l’annexe 1 du Règlement sur les produits de santé naturels (RPSN), et est inscrite en tant qu’IM et INM dans divers PSN homologués au Canada. Les types de PSN qui contiennent de l’huile de gaulthérie comprennent des crèmes analgésiques, des pommades et des comprimés antiacides. Cette substance n’est pas un additif alimentaire autorisé au Canada. Toutefois, l’essence de gaulthérie, l’extrait de gaulthérie et la préparation aromatisante à la gaulthérie sont des préparations aromatisantes normalisées inscrites dans la Partie B.10.027 du Règlement sur les aliments et drogues. Ils sont préparés à partir d’huile de gaulthérie et doivent en contenir au moins 3,0 % en volume. L’huile de gaulthérie peut également être ajoutée directement aux aliments. Bien qu’il n’existe pas d’information précise facilement disponible sur l’utilisation de l’huile de gaulthérie dans les aromatisants alimentaires au Canada, cette substance peut être présente dans des aliments au Canada en tant qu’ingrédient aromatisant ou composant de préparations aromatisantes (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, décembre 2017, non référencée). La Flavour and Extract Manufacturers Association (FEMA) a classé l’huile de gaulthérie dans la catégorie GRAS (Generally Recognized as Safe) pour ses utilisations dans des aliments comme des produits de boulangerie, des boissons, des bonbons, de la gomme à mâcher, de la crème glacée et des sirops (Hall et Oser 1965). Au Canada, il a été rapporté que l’huile de gaulthérie était utilisée comme ingrédient dans une variété de cosmétiques, tels que, entre autres, des huiles de massage, des crèmes hydratantes et des dentifrices.
Selon les résultats d’une enquête menée en vertu de l’article 71 de la LCPE et des recherches d’information publique au Canada, de l’acide 2-hydroxybenzoïque est utilisé dans les secteurs suivants : peintures et revêtements, soins personnels, drogues, lubrifiants et graisses, produits de santé naturelle, lessive et lavage de la vaisselle (ECCC 2013, FS 2015). L’acide 2-hydroxybenzoïque peut avoir diverses fonctions selon le type de produit dans lequel il est présent. Il peut être utilisé comme agent anti‑acné, agent antipelliculaire, exfoliant et agent de conservation dans divers produits de soins personnels (ECCC 2013). En raison de ses propriétés kératolytiques, l’acide 2‑hydroxybenzoïque est largement utilisé pour le traitement de nombreuses affections dermatologiques courantes (SCCP 2002).
L’acide 2-hydroxybenzoïque est inscrit sur la Liste des ingrédients dont l’utilisation est restreinte ou interdite dans les cosmétiques (« Liste critique ») et son utilisation dans les cosmétiques est restreinte à une concentration maximale autorisée de 2 % (Santé Canada modifiée en 2015). L’acide 2-hydroxybenzoïque est utilisé dans de nombreux produits cosmétiques, y compris des shampooings et des revitalisants, des nettoyants et des savons, des exfoliants, des colorants et des produits capillaires, des hydratants pour le corps ou le visage, des produits de bronzage, des produits de massage, des antisudorifiques/déodorants, des parfums, des produits de maquillage et des produits démaquillants, des baumes à lèvres et des produits de rasage.
Selon l’information disponible dans la Base de données sur les produits pharmaceutiques (BDPP) interne à Santé Canada, l’acide 2-hydroxybenzoïque est un ingrédient actif de drogues pour les humains ou les animaux. Cette substance est également présente comme INM dans diverses drogues. Les crèmes et les crèmes hydratantes, les shampooings et les produits après-rasage avec ou sans FPS sont parmi les produits topiques qui contiennent de l’acide 2-hydroxybenzoïque en tant qu’INM. Les produits pris par voie orale rapportés contenant de l’acide 2‑hydroxybenzoïque comprennent des antiacides, des absorbants et des antidiarrhéiques. L’acide 2-hydroxybenzoïque est inscrit dans la Base[SS1] de données sur les ingrédients de produits de santé naturels (BDIPSN) avec un rôle médicinal et est classé en tant que PSN à l’article 2 (isolat) de l’Annexe 1 du RPSN. Il y est également inscrit comme INM à usage uniquement topique. Les types de PSN pour lesquels l’acide 2-hydroxybenzoïque inscrit en tant qu’INM comprennent des produits de traitement contre l’acné, des produits de maquillage pour le visage, des cache-cernes et des écrans solaires.
L’acide 2-hydroxybenzoïque peut être utilisé comme composant lors de la production de matériaux d’emballage alimentaire, tels que des durcisseurs à base d’époxy pour revêtements de réservoir à bière, des agents de calfeutrage pour les systèmes de revêtement de sol et des adhésifs pour des applications sans contact direct avec les aliments. Cette substance peut être présente dans les aliments à titre d’additif indirect en raison de son utilisation potentielle dans la formulation de nettoyants. Aux États‑Unis, aux termes des sections respectives CFR Title 21 175.105, 175.300 et 177.2600 des (eCFR des États-Unis [modifié en 2017]), l’acide 2-hydroxybenzoïque est utilisé comme additif alimentaire indirect, spécifiquement en tant que composant d’adhésifs, de revêtements et d’autres articles en caoutchouc destinés à un usage répété. L’acide 2-hydroxybenzoïque a été évalué par le Comité mixte FAO/OMS d’experts des additifs alimentaires (JECFA) pour son utilisation comme ingrédient alimentaire aromatisant (JECFA 2002a, 2002b). L’UE autorise l’utilisation de l’acide 2‑hydroxybenzoïque comme aromatisant (FL n° 08.112) dans toutes les catégories d’aliments aromatisés (Base de données sur les aromatisants alimentaires de l’UE). Par conséquent, même s’il n’existe aucune information définitive sur l’utilisation de l’acide 2‑hydroxybenzoïque comme aromatisant alimentaire au Canada, il est possible que cette substance soit présente dans des aliments au Canada.
Au Canada, le 2-hydroxybenzoate de 3,3,5-triméthylcyclohexyle est principalement utilisé comme filtre UV à large spectre dans des écrans solaires (Environnement Canada 2013, SCCP 2007). L’utilisation du 2-hydroxybenzoate de 3,3,5‑triméthylcyclohexyle comme ingrédient médicinal dans des écrans solaires figure dans les monographies sur les écrans solaires primaires et secondaires de Santé Canada (Santé Canada 2018a, 2018b), dans lesquelles il est indiqué que c’est un ingrédient médicinal acceptable à des concentrations ≤ 15 % qui peut être autorisée sur le marché sans présentation de preuves additionnelles à Santé Canada. Cette substance est inscrite dans la BDIPSN comme substance non PSN étant donné qu’il ne s’agit pas d’une substance naturelle inscrite à l’annexe 1 du RPSN et ne figure sur la liste des ingrédients d’aucun PSN autorisé au Canada. Le 2-hydroxybenzoate de 3,3,5‑triméthylcyclohexyle est un ingrédient utilisé dans des cosmétiques et il est présent, entre autres, dans des produits tels que des crèmes hydratantes, des produits de massage, des produits de bronzage, des parfums et des produits pour le bain.
Au Canada, l’utilisation du 2-hydroxybenzoate de 2-phényléthyle comme ingrédient été rapportée dans un nombre limité de cosmétiques, de produits de nettoyage et de désinfectants pour les mains (ECCC 2017). En 2007, lors d’une analyse des ingrédients de parfum visant le 2-hydroxybenzoate de 2-phényléthyle, Lapszynski et al. ont rapporté des utilisations de cette substance dans des cosmétiques décoratifs, des parfums fins, des shampooings, des savons de toilette et d’autres produits de toilette ainsi que dans des produits non cosmétiques tels que des nettoyants et détergents domestiques. Le 2-hydroxybenzoate de 2-phényléthyle est classé par l’Union européenne comme ingrédient de cosmétique où il agit comme agent parfumant (CosIng [modifié en 2017]). Le 2-hydroxybenzoate de 2-phényléthyle est inscrit dans la BDIPSN avec un rôle non médicinal pour une utilisation orale en tant que rehausseur de flaveur. Toutefois, il n’est rapporté en tant qu’ingrédient dans aucun PSN homologué au Canada. Aux États-Unis, le 2-hydroxybenzoate de 2-phényléthyle est inscrit au Title 21 CFR 175.515 en tant qu’arôme synthétique qui peut être utilisé en une quantité minimale requise pour produire l’effet recherché et conformément aux bonnes pratiques de fabrication (eCFR [modifié en 2017]). Le JECFA a évalué l’utilisation de cette substance comme ingrédient d’aromatisant alimentaire (JECFA 2002a, 2002b). L’Union européenne autorise l’utilisation du 2-hydroxybenzoate de 2-phényléthyle comme aromatisant (FL n° 09.753) dans des aliments (base de données de l’UE sur les arômes alimentaires [modifiée en 2017]). Par conséquent, bien qu’il n’existe aucune information définitive sur son utilisation comme aromatisant alimentaire au Canada, il y est possible que du 2-hydroxybenzoate de 2-phényléthyle soit présent en tant qu’aromatisant dans des aliments.
Selon les renseignements recueillis lors d’une enquête menée en vertu de l’article 71 de la LCPE, l’extrait de Betula alba est utilisé comme agent de remplissage et agent parfumant dans des cosmétiques disponibles pour les consommateurs au Canada (ECCC 2017). L’extrait de Betula alba est utilisé dans des produits cosmétiques tels que des shampooings, des revitalisants, des hydratants, des antisudorifiques/déodorants, des nettoyants, des exfoliants, des parfums, des produits de massage, des produits coiffants, des produits bronzants sans soleil, des produits de maquillage, des démaquillants et des produits pour la coloration les cheveux (communication personnelle, courriel de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, décembre 2016, non référencée). Selon l’information disponible dans la BDPP interne de Santé Canada, l’extrait de Betula alba est utilisé comme INM dans des écrans solaires et des produits de bronzage. L’extrait de Betula alba est également inscrit dans la BDIPSN en tant qu’extrait d’écorce de Betula alba et extrait de feuille de Betula alba, ces deux extraits étant utilisés comme INM dans des PSN (BDIPSN modifié en 2018). Il a été rapporté que l’extrait de feuilles de Betula alba est utilisé à des fins non médicinales en tant qu’astringent cosmétique, ingrédient de parfum et agent de conditionnement de la peau, et que l’extrait d’écorce de Betula alba est utilisé comme ingrédient de parfum et agent de conditionnement de la peau (BDIPSN [modification en 2018]). L’extrait de Betula alba est un INM dans un nombre limité de PSN, y compris des crèmes, des écrans solaires, des capsules à avaler et des désinfectants pour les mains.
Nous donnons dans le tableau 4‑2 un résumé des utilisations au Canada des substances du groupe des salicylates.
| Utilisation | Huile de gaulthérie | Acide 2‑hydroxy benzoïque | 2‑Hydroxy benzoate de 3,3,5-triméthyl cyclohexyle | 2‑hydroxy benzoate de 2‑phényléthyle | extrait de Betula alba |
|---|---|---|---|---|---|
| Matériaux d’emballage alimentairea | Non | Oui | Non | Non | Non |
| Additif indirect | Non | Oui | Non | Non | Non |
| Base de données interne sur les produits pharmaceutiques : ingrédient médicinal (IM) ou non médicinal (INM) dans des désinfectants, des drogues pour usage humain ou vétérinaire au Canadab | Non | IM, INM | IM | Non | INM |
| Base de données sur les ingrédients des produits de santé naturelsc | Oui | Oui | Oui | Oui | Oui |
| Base de données des produits de santé naturels homologués : ingrédient médicinal (IM) ou non médicinal (INM) dans les produits de santé naturels au Canada c | IM, INM | IM, INM | Non | Non | INM |
| Liste des ingrédients dont l’utilisation est restreinte ou interdite dans les cosmétiquesd | Non | Oui | Non | Non | Non |
| Avis de présence dans des cosmétiques, d’après les avis soumis à Santé Canada en vertu du Règlement sur les cosmétiques. | Oui | Oui | Oui | Non | Oui |
| Formulant ou ingrédient actif dans des produits antiparasitaires homologués au Canadae | Formulant et ingrédient actif | Formulant | Non | Formulant | Non |
a Communication personnelle, courriels de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, décembre 2017 (non référencé)
b Communication personnelle, courriels de la Direction des produits thérapeutiques de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, décembre 2017 (non référencé)
c Communication personnelle, courriels de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, décembre 2016 (non référencé)
d Communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, décembre 2016 (non référencé)
e Communication personnelle, courriels de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, décembre 2016 (non référencé)
f Santé Canada 2014.
5. Devenir et comportement dans l’environnement
5.1 Persistance dans l’environnement
D’après les modèles utilisés pour la CRE (ECCC 2016b), l’acide 2-hydroxybenzoïque, le 2-hydroxybenzoate de 2-phényléthyle, le 2-hydroxybenzoate de 3,3,5‑triméthylcyclohexyle et l’extrait de Betula alba devraient se dégrader dans l’air, l’eau, les sédiments ou le sol, et ne pas y persister. L’huile de gaulthérie devrait persister dans l’eau, les sédiments et le sol, mais pas dans l’air (ECCC 2016b).
5.2 Potentiel de bioaccumulation
Étant donné leurs faibles Koe et leurs faibles facteurs de bioconcentration (ECCC 2016b), l’acide 2-hydroxybenzoïque, le 2-hydroxybenzoate de 2-phényléthyle, l’huile de gaulthérie et l’extrait de Betula alba ne devraient pas se bioaccumuler de façon significative dans les organismes.
Étant donné son Koe et son facteur de bioconcentration élevés (ECCC 2016b), le 2‑hydroxybenzoate de 3,3,5‑triméthylcyclohexyle devrait se bioaccumuler de façon significative dans les organismes.
6. Potentiel d’effets nocifs sur l’environnement
6.1 Caractérisation du risque pour l’environnement
Les risques posés à l’environnement par les substances du groupe des salicylates ont été caractérisés à l’aide de l’approche de classification des risques écologique (CRE) des substances organiques (ECCC 2016a). La CRE est une approche basée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition et d’une pondération des éléments de preuve pour classer le risque. Les divers éléments de preuve sont combinés afin de pouvoir distinguer les substances présentant un pouvoir faible ou élevé et un potentiel d’exposition faible ou élevé dans divers milieux. Cette approche permet de réduire l’incertitude associée à la caractérisation des risques, contrairement à une approche qui serait basée sur un seul paramètre mesuré dans un seul milieu (p. ex. CL50). Cette approche est résumée dans les paragraphes suivants et elle est décrite en détail dans un document d’ECCC (2016a).
Les données sur les propriétés physico-chimiques, le devenir (demi-vies chimiques dans divers milieux et biotes, coefficients de partage et bioconcentration dans les poissons), l’écotoxicité aiguë chez les poissons et les quantités de ces produits chimiques importés ou produits au Canada ont été tirées de la littérature scientifique, de bases de données empiriques (p. ex. Boîte à outils [Q]SAR de l’OCDE [2016]) et de réponses à des avis publiés en vertu de l’article 71 de la LCPE. Elles ont aussi été obtenues à partir de modèles de type QSAR (relation quantitative structure-activité), de devenir du bilan massique ou de bioaccumulation. Ces données ont été utilisées comme intrants dans d’autres modèles de bilan massique ou pour compléter les profils de danger et d’exposition de la substance.
Les profils de danger ont été principalement établis en se basant sur des paramètres liés au mode d’action toxique, à la réactivité chimique, à des seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Les profils d’exposition ont aussi été basés sur plusieurs paramètres, dont la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Les profils de danger et d’exposition ont été comparés aux critères de décision afin de classer les potentiels de danger et d’exposition de chaque substance organique comme faible, moyen ou élevé. D’autres règles ont été suivies (p. ex. constance du classement, marge d’exposition) pour améliorer le classement préliminaire du danger ou de l’exposition.
Une matrice de risque a été utilisée pour assigner à chaque substance un risque faible, moyen ou élevé basé sur le classement de son danger et de son exposition. Le classement du risque potentiel obtenu grâce à la CRE a été vérifié en suivant une approche en deux étapes. La première étape consistait à faire passer le classement du risque de moyen ou élevé à faible dans le cas des substances à faible vitesse d’émission estimée dans l’eau après traitement des eaux usées, représentant un faible potentiel d’exposition. La deuxième étape consistait à revoir les résultats du classement du potentiel de risque au moyen de scénarios de risque relativement prudents à l’échelle locale (c.‑à‑d. dans la zone à proximité du point de rejet) conçus pour protéger l’environnement, afin de déterminer si le classement du risque potentiel devrait être reclassé à un niveau supérieur.
La CRE est basée sur une approche pondérée pour réduire au minimum tout risque de surclassification ou sous-classification du danger et de l’exposition, et du risque subséquent. Les approches équilibrées suivies pour traiter des incertitudes sont décrites plus en détail dans ECCC (2016a). Nous décrivons ci-après deux des domaines d’incertitude les plus importants. Des valeurs de toxicité aiguë empiriques ou modélisées erronées pourraient entraîner une modification de la classification du danger, en particulier dans le cas des paramètres basés sur des valeurs de résidus dans les tissus (c.-à-d. mode d’action toxique), dont un grand nombre sont prédites à partir de modèles (Q)SAR. Toutefois, l’impact de ce type d’erreur est atténué par le fait qu’une surestimation de la létalité médiane conduira à une valeur prudente (protectrice) de résidus dans les tissus pour l’analyse des résidus corporels critiques (RCC). Des erreurs de sous-estimation de la toxicité aiguë seront atténuées en recourant à d’autres paramètres de danger, tels que le profilage structurel du mode d’action, la réactivité et/ou l’affinité de liaison à l’estrogène. Les changements ou les erreurs touchant les quantités de produits chimiques pourraient entraîner un classement différent de l’exposition, les classifications de l’exposition et du risque étant très sensibles à la vitesse d’émission et aux quantités utilisées. Les classifications obtenues au moyen de de la CRE reflètent donc l’exposition et le risque au Canada, compte tenu des quantités actuellement utilisées, mais pourraient ne pas rendre compte de tendances futures.
Les données et les éléments critiques pris en compte pour développer les profils propres aux substances du groupe des salicylates, ainsi que les résultats de la classification du danger, de l’exposition et du risque, sont présentés dans ECCC (2016 b).
Nous donnons dans le tableau 6-1 un résumé des classifications du danger et de l’exposition pour les substances du groupe des salicylates.
| Substance | Classification CRE du danger | Classification CRE de l’exposition | Classification CRE du risque |
|---|---|---|---|
| Huile de gaulthérie | faible | faible | faible |
| Acide 2‑hydroxybenzoïque | faible | faible | faible |
| 2‑Hydroxybenzoate de 3,3,5-triméthylcyclohexyle | fort | faible | modéré |
| 2-Hydroxybenzoate de 2-phényléthyle | fort | faible | faible |
| Extrait de Betula alba | faible | faible | faible |
Sur la base de leurs classifications de faible danger et de faible exposition établies à partir des renseignements pris en compte pour la CRE, l’huile de gaulthérie, l’acide 2‑hydroxybenzoïque et l’extrait de Betula alba ont été classés comme présentant un faible potentiel de risque pour l’environnement. Il est donc improbable que ces substances soient préoccupantes pour l’environnement au Canada.
D’après les renseignements pris en compte pour la CRE, le 2‑hydroxybenzoate de 3,3,5-triméthylcyclohexyle été classé comme présentant un potentiel de danger élevé en raison d’alertes structurelles provenant du modèle (Q)SAR de la Boîte à outils de l’OCDE (OCDE 2016), qui a permis d’identifier cette substance comme liant potentiel aux récepteurs endocriniens et ayant des effets nocifs sur les réseaux trophiques aquatiques en raison de son potentiel de bioaccumulation. Le 2‑hydroxybenzoate de 3,3,5-triméthylcyclohexyle a été classé comme substance ayant un potentiel modéré de risque pour l’environnement en raison d’une faible exposition. Ces effets potentiels et leur manifestation dans l’environnement n’ont pas été étudiés davantage en raison de la faible exposition à cette substance. Compte tenu des profils d’utilisation actuels, il est improbable que cette substance soit préoccupante pour l’environnement au Canada.
D’après les renseignements pris en compte pour la CRE, le 2-hydroxybenzoate de 2‑phényléthyle a été classé comme substance ayant un potentiel de danger élevé en raison d’alertes structurelles provenant du modèle (Q)SAR de la Boîte à outils de l’OCDE (OCDE 2016), qui a permis d’identifier cette substance comme liant potentiel aux récepteurs endocriniens. Le 2-hydroxybenzoate de 2‑phényléthyle a initialement été classé comme substance ayant un potentiel modéré de risque pour l’environnement, mais ce classement a été ramené à faible potentiel de risque pour l’environnement suit à un ajustement basé sur les quantités actuellement utilisées (voir la section 7.1.1 d’ECCC 2016a). Ses effets potentiels et leur manifestation dans l’environnement n’ont pas été étudiés davantage en raison de la très faible exposition. Compte tenu des profils d’utilisation actuels, il est peu probable que cette substance soit préoccupante pour l’environnement au Canada.
7. Potentiel d’effets nocifs sur la santé humaine
7.1 Huile de gaulthérie
7.1.1 Évaluation de l’exposition
Aucune donnée de surveillance de l’huile de gaulthérie dans l’air intérieur, l’air extérieur, l’eau, le sol ou la poussière n’a été trouvée au niveau national ou international. Toutefois, compte tenu des faibles quantités déclarées de cette substance au Canada (100 à 1000 kg) (Environnement Canada 2013), l’exposition potentielle à l’huile de gaulthérie due aux milieux de l’environnement devrait être minimale.
Au Canada, l’huile de gaulthérie peut être présente dans certains aliments en tant qu’aromatisant alimentaire ou composant de préparations aromatisantes. En vertu de la réglementation canadienne, les préparations aromatisantes contenant de l’huile de gaulthérie doivent en contenir au moins 3 % en volume. Le JECFA n’a établi aucune spécification pour l’huile de gaulthérie, mais en a établi pour le 2-hydroxybenzoate de méthyle (no CAS119-36-8), qu’il identifie comme « huile de gaulthérie synthétique », avec un « minimum de dosage » de 98 %. Dans son évaluation du 2-hydroxybenzoate de méthyle, le JECFA a conclu qu’aux niveaux actuels d’absorption, il n’y avait « aucun problème de sécurité » lorsqu’il est utilisé comme agent aromatisant (JECFA 2002a, 2002b).
En l’absence de données définitives facilement disponibles sur l’utilisation de l’huile de gaulthérie dans des arômes alimentaires au Canada, une absorption individuelle de 0,0023 mg/kg pc/jour peut être utilisée comme valeur acceptable pour la consommation au Canada (Burdock 2009). Les absorptions individuelles sont une estimation de l’ingestion par habitant (dose journalière maximale dérivée d’une enquête) basée sur des « données sur la disparition » tirées d’enquêtes périodiques menées par la National Academy of Sciences sous contrat avec la FDA (NRC 1989, tel que cité par Burdock 2009). L’hypothèse est faite d’un poids individuel de 60 kg.
Cosmétiques et produits de santé naturels
Dans les déclarations faites en vertu du Règlement sur les cosmétiques, l’huile de gaulthérie a été rapportée présente en tant qu’ingrédient dans une variété de cosmétiques et de PSN, huiles de massage, produits pour le bain, revitalisants, dentifrices, hydratants pour le visage, crèmes analgésiques et comprimés antiacides.
Des scénarios « d’observation » ont été sélectionnés pour évaluer l’exposition potentielle à l’huile de gaulthérie due aux cosmétiques et aux PSN. lI s’agit des scénarios qui ont conduit à calculer le niveau d’exposition le plus élevé par voie orale ou cutanée, en tenant compte des fréquences d’utilisation et des concentrations rapportées.
Des études sur l’absorption percutanée du 2-hydroxybenzoate de méthyle (un composant majeur de l’huile de gaulthérie, en représentant jusqu’à 99 %) ont été examinées pour évaluer l’exposition systémique à l’huile de gaulthérie due à des produits à application cutanée. Des études sur l’absorption percutanée in vivo chez des humains ont montré une activité estérase significative suivant une administration topique de formulations contenant du 2-hydroxybenzoate de méthyle (Cross et al. 1998, Megwa et al. 1995, Behrendt et Kampfmeyer 1989). Une étude in vivo chez des humains a montré que le 2-hydroxybenzoate de méthyle est facilement absorbé après une administration topique de crèmes analgésiques, qu’une exposition répétée peut causer des irritations cutanées (p. ex. purite, érythème, picotement) et que l’absorption peut croître suite à des expositions répétées (Morra et al. 1996). Lors d’une étude in vitro d’absorption cutanée à dose unique chez des humains, du 2-hydroxybenzoate de méthyle (dans de l’acétone) a été appliqué pendant environ 30 minutes (Moody et al. 2007). Aux doses comparables à celles des scénarios d’exposition considérés dans le cadre de la présente évaluation préalable, l’absorption a été rapportée à environ 40 % de la dose appliquée pendant la durée d’exposition de 30 minutes. Lors d’une autre étude in vivo d’absorption cutanée avec de la peau de porc, une absorption de 15 à 55 % du 2-hydroxybenzoate de méthyle pur a été rapportée en 6 heures (Duncan et al. 2002). Pour l’étude du potentiel d’absorption cutanée de l’huile de gaulthérie, nous avons tenu compte des taux relativement élevés de 2-hydroxybenzoate de méthyle absorbé rapportés dans des études in vitro de courtes durées (30 minutes ou 6 heures), de la notion qu’une exposition répétée peut faire augmenter la pénétration et de la variabilité globale de l’absorption de cette substance citée dans d’autres sources (allant de 12 à 93 % lors d’études in vivo chez des humains) (Cross et al. 1998, Yano et al. 1986, cité dans Belsito et al. 2007). Pour tous les scénarios d’absorption par voie dermique présentés ci-dessous, l’absorption cutanée de l’huile de gaulthérie (basée sur celle du 2-hydroxybenzoate de méthyle) est assumée de manière prudente équivalente à celle par voie orale.
Les scénarios d’observation pour estimer l’exposition due aux cosmétiques contenant de l’huile de gaulthérie sont présentés dans le tableau 7‑1. Les huiles de massage et les hydratants pour le visage ont été choisis pour les scénarios d’observation de l’absorption cutanée et les dentifrices non fluorés pour l’exposition par voie orale. Des détails sur le calcul des estimations de l’exposition se trouvent à l’annexe B.
| Produit | Concentration rapportée (%)a | Nourrisson | Petit enfant | Enfant | Adolescent | Adulte |
|---|---|---|---|---|---|---|
| Huile de massageb,c | 10 | S.O. | 11,6 | 8,06 | 4,89 | 4,51 |
| Huile de massageb,c | 3 | 7,2 | S.O. | S.O. | S.O. | S.O. |
| Dentifrice | 3 | S.O. | 0,57 | 0,27 | 0,081 | 0,067 |
| Hydratant pour le visageb | 3 | S.O. | S.O. | S.O. | 1,1 | 0,91 |
a Basé sur les déclarations soumises à Santé Canada en vertu du Règlement sur les cosmétiques. Pour les huiles de massage : des concentrations maximales de 10 % étaient contre-indiquées chez les enfants de moins de 2 ans. Par conséquent, des concentrations maximales de 3 % ont été utilisés pour l’estimation de l’exposition des nourrissons.
b Absorption cutanée assumée équivalente à l’absorption orale
c Exposition estimée au cas par cas
Il est également rapporté que l’huile de gaulthérie est utilisée comme INM dans des crèmes analgésiques à usage topique pour le traitement de douleurs musculaires ou articulaires non spécifiées. L’exposition orale à cette substance peut provenir de la consommation de tisanes et de comprimés antiacides (communication personnelle, courriels de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, décembre 2016 à février 2019, non référencé). L’utilisation de crèmes analgésiques et d’antiacides est considérée comme une source d’exposition intermittente. Les estimations de l’exposition par voie cutanée et par voie orale à l’huile de gaulthérie due à l’utilisation de PSN sont présentées dans le tableau 7-2 ci-dessous. Les concentrations d’huile de gaulthérie dans ces types de produits vont de moins de 1 à 20 % (communication personnelle, courriels de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, décembre 2016 - non référencé).
| Produit | Concentration rapportée (%)a | Voie | Petit enfant | Enfant | Adolescent | Adulte |
|---|---|---|---|---|---|---|
| Crème analgésique | 20 | Cutanée | S.O. | 22,2 | 19,4 | 19,8 |
| Antiacide en compriméc | 0,29 | Orale | S.O. | S.O. | 0,39 | 0,32 |
a Basé sur les déclarations à Santé Canada en vertu du RPSN.
b Cette ligne comprend des estimations de l’exposition systémique en faisant l’hypothèse que l’absorption cutanée est équivalente à l’absorption orale.
c L’étiquette du produit contre-indique son utilisation par des enfants ou des groupes d’âge plus jeunes.
L’exposition à l’huile de gaulthérie due à la consommation de tisane n’a pas été quantifiée parce que la quantité d’huile qui serait extraite lors de l’infusion n’a pas été identifiée. Cependant, la teneur en huile de gaulthérie dans le thé infusé devrait être faible, les méthodes actuelles d’extraction en laboratoire, comme la distillation à la vapeur, ayant conduit à de faibles taux d’extraction rapportés (moins de 0,7 %) (The Essential Oil Company 2017).
7.1.2 Évaluation des effets sur la santé
Il n’existe actuellement aucune classification du danger de l’huile de gaulthérie faite par l’EPA, l’ECHA ou le CIRC. L’huile de gaulthérie est une substance chimique de type UVCB, qui peut contenir jusqu’à 99 % de 2-hydroxybenzoate de méthyle (El-Obeid et al. 1979). Par conséquent, les études des effets du 2-hydroxybenzoate de méthyle sur la santé ont été utilisées pour étayer l’évaluation de l’huile de gaulthérie. Une classification et un étiquetage harmonisés du 2-hydroxybenzoate de méthyle ont récemment été proposés en vue d’une future inscription à l’annexe VI du Règlement relatif à la classification, à l’étiquetage et à l’emballage (CLP) (ECHA 2018). Le 2‑hydroxybenzoate de méthyle a été identifié comme nocif en cas d’absorption (toxicité aiguë de catégorie 4 [Acute Tox 4]), pouvant potentiellement provoquer une réaction allergique cutanée (sensibilisant cutané de catégorie 1B [Skin Sens 1B]) et pouvant potentiellement causer des dommages au fœtus (toxicité pour la reproduction de catégorie 1B [Repr 1B]). Ces classifications peuvent être sujettes à modification tant que l’opinion du comité d’évaluation des risques de l’ECHA n’a pas été adoptée.
Toxicité à dose répétée
Les effets d’une administration subchronique de 2-hydroxybenzoate de méthyle ont été étudiés chez des rats Osborne-Mendel sevrés (n = 10/sexe/groupe) nourris avec des aliments en contenant 0, 0,1 et 1 % (pureté 99 %) pendant 17 semaines (Webb et Hansen 1963). Cela équivalait à environ 0, 50 et 500 mg/kg pc/jour (Santé Canada 1994). Les animaux ayant reçu la dose la plus élevée ont présenté une réduction significative du gain de poids corporel, mais aucun élément au niveau macroscopique ni microscopique n’a été observé.
Du 2-hydroxybenzoate de méthyle synthétique a également été administré à des chiens beagle (n = 3/sexe/groupe) sous forme de gélules de gélatine, à des doses de 0, 150, 300, 500 et 800 mg/kg/jour pendant 7,5 mois (Abbott et Harrisson 1978). Un examen de signes cliniques, hématologiques, urinaires, pathologiques macroscopiques et histologiques a été effectué sur tous les principaux organes. À 150 mg/kg pc/jour, les poids moyens relatifs du foie et des reins étaient supérieurs à ceux des témoins négatifs, mais se situaient dans les limites du normal. Aux doses plus élevées, ces paramètres dépassaient les variations normales et d’autres effets tels que la réduction du poids corporel et la mortalité ont été observés. Une étude a été menée ultérieurement par les mêmes auteurs, au cours de laquelle des chiens beagle (n = 4‑6/sexe/groupe) ont reçu 0, 50, 100 et 167 mg/kg pc/jour de 2-hydroxybenzoate de méthyle dans des capsules pendant 6 mois. Seuls le foie et les reins, les principaux organes d’intérêt, ont fait l’objet d’un examen histologique. Aucun effet nocif lié au traitement n’a été identifié jusqu’à à la dose maximale testée.
Les effets d’une exposition chronique au 2-hydroxybenzoate de méthyle ont également été étudiés chez plusieurs espèces traitées pendant deux ans (Webb et Hansen, 1963). Des rats sevrés Osborne-Mendel (n = 25/sexe/groupe) ont reçu des doses de 0, 0,1, 0,5, 1 ou 2 % de 2-hydroxybenzoate de méthyle dans leur alimentation, équivalant à environ 0, 50, 250, 500 ou 1000 mg/kg pc/jour (Santé Canada 1994). Aux doses égales ou supérieures à 0,5 % (250 mg/kg pc/jour), des lésions pituitaires macroscopiques, une inhibition importante de la croissance, des pelages rugueux, une augmentation importante des poids du cœur et des reins, ainsi que la mort ont été observés. De plus, une augmentation dépendant de la dose du nombre d’animaux présentant une quantité accrue d’os spongieux et une diminution de la longueur de certains os (fémur, humérus, tibia et radius) ont également été observées. Les effets de l’administration de 2‑hydroxybenzoate de méthyle sur les os ont été reproduits chez le rat lors d’une série d’expériences à court terme réalisées par Abbott et Harrisson (1978). Lors de ces expériences, une augmentation de la masse volumique du fémur, de l’humérus, du tibia et du radius a été observée. Toutefois, les auteurs ont noté que les effets sur les os semblaient spécifiques à l’espèce, étant donné qu’ils n’ont été observés que chez le rat et non chez d’autres espèces.
Webb et Hansen (1963) ont également étudié les effets chez le chien beagle (n=2/sexe/groupe) d’une exposition chronique au 2-hydroxybenzoate de méthyle administré par voie orale sous forme de capsules contenant 0, 50, 150, 350 mg/kg/jour, 6 jours par semaine pendant 2 ans. L’administration de 150 et de 350 mg/kg pc/jour a entraîné une diminution du gain de poids corporel et une augmentation du volume du foie. Sous le microscope, ces foies présentaient des cellules hépatiques plus grosses que celles du foie des chiens du groupe de contrôle. Cependant, la métamorphose graisseuse dans le foie des chiens traités n’était pas plus importante que les très petites quantités observées dans le foie des chiens témoins. La dose sans effet nocif observé (DSENO) a été établie à 50 mg/kg p.c./jour sur la base de la réduction du gain de poids corporel et des effets hépatiques observés à la dose subséquente de 150 mg/kg pc/jour.
Concernant l’administration par voie cutanée, Webb et Hansen (1963) ont mené une étude pour laquelle 0,5, 1, 2 ou 4 mL/kg/jour de 2-hydroxybenzoate de méthyle (pureté de 99 %) ont été appliqués sur la peau de lapins (n = 3/groupe), 5 jours par semaine, 6,5 heures par jour, pendant 96 jours. Cela était équivalent à environ 585, 1170, 2360 et 4680 mg/kg pc/jour (en assumant une masse volumique de 1,17 g/mL). À la dose de 2 mL/kg pc/jour, deux des trois lapins ont présenté un léger affaissement des écailles épidermiques. À la dose de 4 mL/kg pc/jour, tous les animaux sont morts dans les 28 jours, après des signes d’anorexie, une perte de poids et une diminution de l’activité. Chez les animaux survivants des autres groupes de dose, le gain de poids était réduit et l’incidence de néphrite spontanée et d’hépatite légère semblait être plus importante par rapport aux données antérieures. Il y avait aussi une dermatite légère à très légère. La dose minimale avec effet nocif observé (DMENO) pour les effets systémiques a été établie à 0,5 mL/kg pc/jour (585 mg/kg pc/jour) sur la base de la réduction du gain de poids corporel, de la néphrite et de l’hépatite légère observée chez les animaux. Aucun groupe témoin n’a été utilisé lors de cette étude.
Concernant l’administration par inhalation, deux études sur les effets du 2‑hydroxybenzoate de méthyle ont été identifiées. Dans la première étude, des rats femelles Alderley Park exemptes d’organismes pathogènes spécifiques (n = 4/groupe) ont été exposées à 700 mg/m3 (120 ppm) de vapeur saturée de 2-hydroxybenzoate de méthyle. Les animaux ont été exposés 20 fois, chaque fois pendant 7 heures par jour, pendant environ 3 à 4 semaines (Gage 1970). Les auteurs n’ont rapporté « aucun signe de toxicité » (c.-à-d. que les animaux sont demeurés en bonne santé) et ont rapporté « des organes normaux » (c.-à-d. que les examens histopathologiques n’ont révélé aucun changement attribuable au traitement). Une DSENO de 700 mg/m3 (120 ppm) a été établie.
Lors d’une autre étude par inhalation, des rats mâles ont été exposés à 1, 2, 8 ou 40 mg/m3 de 2-hydroxybenzoate de méthyle, 4 h par jour pendant 4 mois (Rumyantsev et al 1992, cité dans CIR 2003). Dans le rapport publié par le comité d’experts du Cosmetic Ingredient Review (CIR 2003), il a été noté que la dose élevée entraînait des changements dans le fonctionnement du système nerveux, une diminution de la teneur en hémoglobine et du nombre d’érythrocytes et une modification de la leucine aminopéptidase sérique et de la teneur en créatinine de l’urine. Un examen microscopique du tissu lymphoïde péribronchique a mis en évidence des hémorragies pulmonaires focales, de l’hyperplasie, ainsi qu’une augmentation du nombre de cellules plasmatiques dans les follicules lymphoïdes. Dans les reins, un écaillage de l’épithélium des tubules convolutés, une infiltration focale et des hémorragies focales ont été observés. L’article original de Rumyantsev et al (1992) était en russe, ce qui rendait l’interprétation des résultats impossible. Toutefois, le résumé anglais de l’article indiquait un « seuil de 8 mg/m3 ».
Cancérogénicité et génotoxicité
Bien qu’aucune d’études de référence sur le potentiel cancérogène de l’huile de gaulthérie n’ait été identifiée, l’information disponible indique que cette substance n’est probablement pas cancérogène. Lors d’une étude sur la toxicité chronique pour laquelle de l’huile de gaulthérie a été administrée à des souris d’environ 11,7 mois en plus (l’âge de la manifestation spontanée de tumeurs) dans leurs aliments, il a été onservé que cette substance pouvait retarder l’apparition normale de tumeurs (Strong 1932). D’autres études faites avec des doses plus élevées ou sur des effets sur la survie/pronostic d’animaux porteurs de tumeur ont donné des résultats semblables ou n’ont révélé aucune différence significative comparativement aux animaux témoins (Strong 1934, Strong 1935, Strong 1936, Boyland et Mawson 1938).
Le traitement chronique avec le principal constituant de l’huile de gaulthérie, le 2‑hydroxybenzoate de méthyle, n’a pas non plus mis en évidence d’effets cancérogènes (Webb et Hansen 1963). Concernant sa génotoxicité, l’huile de gaulthérie ne s’est pas révélée mutagène lors d’un essai in vitro sur des cellules neuronales de rat incubées (Celik et Turkez 2016). Le 2-hydroxybenzoate de méthyle s’est également révélé non génotoxique lors d’épreuves de recombinaison (Oda et al. 1978, Kuboyama et Fujii 1992), lors d’essais de mutation génétique bactérienne (Mortelmans et al. 1986, Kuboyama et Fujii 1992, Ishidate et al. 1984, Étude 15-32 citée dans FDA 2006) et lors d’essais sur les anomalies chromosomiques effectués sur des cellules de mammifères (Ishidate et al. 1984, FDA 2006). Lors d’un test in vivo de micronoyaux chez le rat pour déterminer son potentiel clastogène, le 2-hydroxybenzoate de méthyle a également donné des résultats négatifs (FDA 2006).
Toxicité pour la reproduction et le développement
Aucune étude sur les effets potentiels de l’huile de gaulthérie sur la reproduction et le développement n’a été identifiée. Toutefois, ces effets ont été étudiés dans le cas du 2‑hydroxybenzoate de méthyle. Lors d’une étude sur deux générations, du 2‑hydroxybenzoate de méthyle a été administré à des rats Wistar (n = 25/sexe/groupe) à des doses alimentaires de 0, 0,25 ou 0,5 % tout au long de la période d’étude qui a commencé 60 jours avant l’accouplement (Abbott et Harrisson 1978). Cela équivalait à environ 0, 211 et 422 mg/kg pc/jour. La dose a étéadministrée à tous les animaux (parents et jeunes). Des indices de mortinatalité, de viabilité, de lactation et de reproduction ont été calculés. Les auteurs ont noté que la taille de la portée était plus faible chez les groupes traités et que la viabilité des petits était réduite chez le groupe ayant reçu la dose élevée. Toutefois, ces résultats n’ont pas été jugés statistiquement significatifs. Les auteurs ont indiqué que « tous les petits ont été examinés de près pour identifier toute anomalie physique ». Aucun des jeunes rats n’a présenté d’anomalies flagrantes suite à l’exposition de ses parents à une dose allant jusqu’à 0,5 % (422 mg/kg pc/jour) dans l’alimentation. Les auteurs ont conclu que le 2‑hydroxybenzoate de méthyle n’a produit aucune tératologie macroscopique ni aucun effet indésirable important sur la reproduction.
Une étude parallèle sur deux générations a été menée avec des souris (n = 25/sexe/groupe) avec des doses alimentaires de 0, 0,25 ou 0,5 % de 2‑hydroxybenzoate de méthyle pendant une période de 30 jours avant l’accouplement et pendant toute la période à l’étude (Abbott et Harrison 1978). Cela équivalait à environ 0, 300 et 600 mg/kg pc/jour. Le taux de conception était plus élevé chez les groupes traités que chez le groupe témoin. De plus, les indices de viabilité, de lactation et de reproduction étaient comparables ou supérieurs à ceux des témoins. Aucune anomalie physique n’a été observée chez les petits. Tous les petits ont survécu jusqu’au sevrage avec un développement normal en ce qui a trait à leur croissance corporelle, leur apparence et leur comportement. Les auteurs ont conclu que la reproduction n’a pas été affectée et qu’aucune tératologie n’a été observée.
Lors d’une autre étude sur trois générations, du 2-hydroxybenzoate de méthyle a été administré dans l’alimentation à des rats Osborne-Mendel (n = 20/sexe/dose) à des doses de 0, 500, 1500, 3000 ou 5000 ppm (Collins et al. 1971). Cela équivalait à 0, 25, 75, 150 ou 250 mg/kg pc/jour (Santé Canada 1994). Après 100 jours de traitement, les animaux ont été accouplés et leur fertilité a été enregistrée. Le nombre de petits (F1a) comptés incluait les mort-nés, ceux nés vivants et ceux souffrant de graves anomalies. Les portées ont été observées de la même façon le quatrième jour et le nombre et la condition des petits ont été notés. Les jeunes rats F1a ont été sacrifiés au moment du sevrage. Leurs parents (F0) ont été accouplés de nouveau pour obtenir des portées F1b et les mêmes observations ont été faites. Cette fois, au moment du sevrage de la portée, 20 couples de chaque dose ont été sélectionnés pour produire la génération suivante (F2a et F2b). La même procédure a été suivie pour les générations suivantes. Aucun effet indésirable lié au traitement n’a été observé chez les parents F0 (« en bonne santé apparente “), et aucune anomalie grossièrement visible n’a été détectée chez les parents des générations suivantes. De plus, la fertilité n’a été affectée de façon significative à aucune dose (p > 0,05), peu importe la génération, bien que des diminutions aient été observées dans les accouplements des rats du groupe ayant reçu la dose de 5000 ppm. Aucune des portées n’a révélé d’anomalies flagrantes suite à l’administration à leurs parents de doses allant jusqu’à 5000 ppm (250 mg/kg pc/jour). Toutefois, des réductions de la taille de la portée liées à la dose ont été observées, ainsi qu’une réduction du nombre de petits vivants, de leur durée de survie (c.-à-d. encore vivant au jour 4) et du nombre de jeunes au sevrage (c.-à-d. encore vivant au jour 21). Ces effets se sont produits dans les accouplements de deuxième génération et étaient statistiquement significatifs aux doses de 3000 et 5000 ppm (150 et 250 mg/kg pc/jour). Les détails concernant l’apparition de symptômes le moment de la mort entre le jour postnatal (JPN) 4 et le JPN 21 n’ont pas été rapportés dans cette étude. Il n’est donc pas clair si ces effets pourraient être associés à l’exposition directe à la substance due au lait, au régime alimentaire (les jeunes rats peuvent commencer à manger des aliments solides au JPN 21) ou à d’autres facteurs. Ces effets n’étaient pas évidents chez les animaux de première ou de troisième génération et se sont produits en l’absence de toxicité maternelle. Une DSENO de 75 mg/kg pc/jour a été établie sur la base de la taille réduite de la portée, de la survie des petits et du nombre de jeunes sevrés observés pour la dose subséquente.
L’effet du 2-hydroxybenzoate de méthyle a également été examiné lors d’essais de reproduction continue effectués par le National Toxicology Program (NTP 1984a). Pour une première étude, des souris CD-1 (n = 8/sexe/dose) ont reçu 0, 25, 50 ou 100 mg/kg pc/jour de 2-hydroxybenzoate de méthyle ( pureté ≥ 99 %, dans de l’huile de maïs) par gavage pendant 7 jours avant l’accouplement, et pendant environ 100 jours durant la cohabitation. Le poids corporel, la fertilité, le nombre de portées produites, la proportion de petits vivants par portée et le poids corporel moyen des petits ont été enregistrés. Aucun effet sur la fertilité, le nombre de portées, le nombre de petits par portée et la proportion de petits vivants n’a été observé. Le poids des petits vivants, ajusté en fonction de la taille de la portée, était significativement plus élevé à 100 mg/kg pc/jour, mais les auteurs ont noté que cet effet pourrait être dû au hasard puisqu’aucun autre signe de toxicité n’a été observé. Le traitement des petits du groupe témoin et du groupe ayant reçu la plus forte dose a été poursuivi, ces petits ont ensuite été accouplés pour évaluer leur fertilité et de leur performance reproductrice. Les mêmes paramètres ont été examinés, en plus d’un examen histopathologique du foie, du cerveau, de la glande pituitaire et du tractus génital. Aucun effet nocif lié au traitement n’a été noté pour aucun des paramètres examinés jusqu’à la dose maximale testée (100 mg/kg pc/jour).
Pour une deuxième étude, des souris CD-1 (n = 20/sexe/dose, n = 40/sexe dans le groupe témoin) ont reçu 0, 100, 250 ou 500 mg/kg pc/jour de 2-htdroxybenzoate de méthyle ( ≥ 99 %, dans l’huile de maïs) par gavage en suivant un protocole semblable à celui de l’étude précédente (NTP 1984b). La dose maximale testée (c.-à-d. 500 mg/kg pc/jour) a déjà été déterminée dans le cadre d’une étude de deux semaines être la dose maximale tolérée (DMT) en se basant sur la mortalité observée à la dose subséquente (1000 mg/kg pc/jour). La DMT est définie comme la dose la plus élevée pouvant être administrée sans causer une réduction significative du poids corporel, une diminution du gain de poids de plus de 10 % ou entraîner une mortalité significative ( ≤ 10 %). Les animaux ont été sacrifiés et leur foie, leur cerveau, leur glande pituitaire et leur tractus génital ont été soumis à des examens histopathologiques. Les auteurs ont noté une absence de symptômes distincts de toxicité tout au long de l’étude. De plus, aucun effet lié au traitement sur le poids corporel ou la fertilité n’a été observé. Cependant, une diminution significative du nombre moyen de portées, du nombre de petits par portée, de la proportion de petits nés vivants et du poids moyen des petits vivants à la dose testée la plus élevée a été observée, en l’absence de toxicité maternelle manifeste. Une réduction significative du poids des petits vivants a également été observée à la dose de 250 mg/kg pc/jour après l’ajustement en fonction de la taille de la portée. Une DSENO a été établie à 100 mg/kg pc/jour sur la base de la réduction du poids moyen ajusté des petits à la dose subséquente (250 mg/kg pc/jour).
Aucun effet sur la reproduction ou le développement n’a été observé après application cutanée de 2-hydroxybenzoate de méthyle à des doses similaires à celles des études par voie orale susmentionnées. Lorsque de la graisse à base de pétrole contenant 3 % de 2‑hydroxybenzoate de méthyle était appliquée par voie cutanée sur des rates gestantes à des doses de 0, 1, 3 ou 6 g/kg pc/jour, du jour de gestation 6 (JG) au JG15, aucun signe de toxicité maternelle (identifiée par la consommation alimentaire, le poids corporel, les signes cliniques), aucune modification des paramètres de reproduction ni aucune malformation ni variation des fœtus n’a été observé aux doses étudiées (Infurna et al 1990, résumé seulement).
7.1.3 Caractérisation des risques pour la santé humaine
L’ensemble de données sur les dangers de l’huile de gaulthérie a été jugé limité. Les renseignements pertinents disponibles sur les effets sur la santé de son principal composant, le 2‑hydroxybenzoate de méthyle, ont donc été utilisé pour étayer la caractérisation des risques.
Pour les scénarios d’exposition chronique, l’étude de toxicité par voie alimentaire de Collins et al. (1971) sur trois générations de rats Osborne-Mendel traités avec du 2‑hydroxybenzoate de méthyle a été jugée la plus pertinente pour la caractérisation des risques pour la santé des adultes et des adolescents (en âge de procréation). Une DSENO de 75 mg/kg pc/jour a été retenue comme niveau d’effet critique en se basant sur des effets sur le développement tels qu’une portée moins grande, une viabilité et une survie moindres des petits et un nombre réduit de petits sevrés observé à la dose subséquente (150 mg/kg pc/jour), en l’absence de toxicité maternelle. Ces effets se sont manifestés chez les petits nés d’accouplements de rats de la deuxième génération après le traitement quotidien à long terme des parents des générations précédentes.
L’étude sur trois générations de Collins et ses collaborateurs (1971) a également été considérée la plus pertinente pour la caractérisation du risque pour les nourrissons, quelle que soit la durée de l’exposition, sur la base des effets observés sur les petits issus d’accouplements de la deuxième génération ayant lieu du JPN4 au JPN21 et parce qu’une exposition à l’huile de gaulthérie dans le lait maternel ne pouvait être ignorée comme cause possible de ces effets. Une DSENO de 75 mg/kg pc/jour a été établie sur la base de la mortalité des petits observée à la dose subséquente (150 mg/kg pc/jour), en l’absence de toxicité maternelle
La DSENO de 75 mg/kg pc/jour tirée de l’étude sur trois générations de Collins et al. (1971) a également été jugée pertinente pour la caractérisation des risques posés aux enfants et aux tout-petits dus à une exposition chronique à l’huile de gaulthérie. Ceci est basé sur le fait qu’une dose de 75 mg/kg pc/jour n’a eu aucun effet nocif apparent sur les parents, quelle que soit leur génération et est appuyé par les études de toxicité chronique de Webb et Hansen (1963) au cours desquelles des effets ont été observés à la dose de 150 mg/kg pc/j chez des chiens beagle (effets sur le foie et poids corporel moindre) et à la dose de 250 mg/kg pc/jour chez des rats (lésions hypophysaires brutes et lésions osseuses) après administration d’huile de gaulthérie par voie orale pendant 2 ans.
Pour les scénarios d’exposition intermittente à court terme chez les adolescents et les adultes, l’essai de reproduction continue mené par le NTP (1984 b) sur des souris CD-1 traitées avec du 2-hydroxybenzoate de méthyle a été considéré le plus pertinent pour la caractérisation des risques. Pour cette étude, du 2-hydroxybenzoate de méthyle a été administré pendant environ 107 jours et une DSENO de 100 mg/kg pc/jour a été établie comme niveau d’effet critique sur la base d’une réduction significative du poids moyen ajusté des petits observée à la dose subséquente (250 mg/kg pc/jour).
Pour les scénarios d’exposition intermittente à court terme chez les tout-petits et les enfants, l’étude à court terme d’Abbott et Harrisson (1978) sur des chiens beagle traités avec du 2-hydroxybenzoate de méthyle a été jugée la plus pertinente pour la caractérisation des risques. Pour cette étude, du 2-hydroxybenzoate de méthyle a été administré par voie orale sous forme de capsules pendant 7,5 mois. Une DSENO de 150 mg/kg pc/jour a été établie sur la base du poids relatif du foie accru observé à la dose subséquente (300 mg/kg pc/jour). Ce niveau d’effet critique s’appliquait aux expositions par voie cutanée ou orale.
Dans le tableau 7‑3, nous donnons toutes les estimations pertinentes de l’exposition, les niveaux d’effet critique et les marges d’exposition en découlant pour la caractérisation des risques pour la santé humaine dus à l’utilisation de cosmétiques contenant de l’huile de gaulthérie.
| Scénarioa | Exposition systémique (mg/kg pc/jour) | Effet critique | ME |
|---|---|---|---|
| Huile de massageb,c (nourrisson) (Exposition cutanée intermittente à court terme) | 7,2 | DSENO = 75d | 10 |
| Huile de massage (tout-petitsb,c,e) (Exposition cutanée intermittente à court terme), | 11,6 | DSENO = 150f | 13 |
| Huile de massage (adolescentb,c,g) (Exposition cutanée intermittente à court terme) | 4,89 | DSENO =100 h | 20 |
| Hydratant pour le visage (adolescentb,g) (Exposition cutanée quotidienne) | 1,1 | DSENO = 75i | 68 |
| Dentifrice (tout-petits) (Exposition orale quotidienne) | 0,57 | DSENO = 75d | 131 |
| Dentifrice (adolescentg) (Exposition orale quotidienne) | 0,081 | DSENO = 75i | 926 |
a Basé sur les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques.
b Absorption cutanée présumée équivalente à l’absorption orale.
c Exposition estimée par événement.
d DSENO = 75 mg/kw pc/jour établie sur la base de la viabilité et de la survie moindres des petits et du nombre de petits sevrés à la dose subséquente de 150 mg/kg pc/jour, observés lors d’une étude par voie alimentaire sur trois générations.
e Groupe d’âge le plus exposé relativement au poids corporel, parmi les tout-petits et les enfants
f DSENO = 150 mg/kg pc/jour établie sur la base d’une augmentation relative du poids du foie à la dose subséquente de 300 mg/kg pc/jour, lors d’une étude d’exposition par voie orale à court terme.
g Groupe d’âge le plus exposé relativement au poids corporel, parmi les adolescents et les adultes.
h DSENO = 100 mg/kg pc/jour, sur la base de la réduction du poids moyen ajusté des petits à la dose subséquente de 250 mg/kg pc/jour, observée lors d’un essai de reproduction continue.
i DSENO = 75 mg/kg pc/jour sur la base de la taille réduite de la portée, de la viabilité et de la survie moindres des petits et du nombre réduit de petits sevrés à la dose subséquente de 150 mg/kg pc/jour, observés lors d’une étude par voie alimentaire de trois générations.
Concernant l’exposition par voie cutanée à l’huile de gaulthérie due à l’utilisation d’huiles de massage ou d’hydratants pour le visage, les comparaisons du niveau d’effet critique et des niveaux d’exposition estimés a conduit à calculer des marges d’exposition (ME) allant de 10 à 68, jugées potentiellement inadéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition
Concernant l’exposition par voie orale à l’huile de gaulthérie due à l’utilisation de dentifrice, les comparaisons du niveau d’effet critique et des niveaux d’exposition a conduit à calculer des ME de 131 pour les tout-petits et de 296 pour adolescents. Ces valeurs sont jugées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
| Scénarioa | Exposition systémiqueb (mg/kg pc/jour) | Dose avec effet critique (mg/kg pc/jour) | ME |
|---|---|---|---|
| Crème analgésique (enfantc) (Exposition cutanée intermittente à court terme) | 22,2 | DSENO = 150d | 7 |
| Crème analgésique (adultee) (Exposition cutanée intermittente à court terme) | 19,8 | DSENO = 100f | 5 |
| Antiacide (adolescente) (Exposition orale intermittente de courte durée) | 0,39 | DSENO = 100f | 256 |
| Utilisation d’arômatisants alimentaires (adulte) (Exposition orale quotidienne) | 0,0023 | DSENO = 75 g | > 30 000 |
a Assumant que les absorptions par voie cutanée et par inhalation sont équivalentes à l’absorption par voie orale, quand cela est pertinent.
b Estimation basée sur le jour de l’exposition.
c Groupe d’âge le plus exposé relativement au poids corporel, parmi les tout-petits et les enfants.
d DSENO = 150 mg/kg pc/jour établie sur la base de l’augmentation du poids du foie à la dose subséquente de 300 mg/kg pc/jour, lors d’une étude à court terme par voie orale
e Groupe d’âge le plus exposé relativement au poids corporel, parmi les adolescents et les adultes.
f DSENO = 100 mg/kg pc/jour établie sur la base de la réduction moyenne du poids ajusté des petits observée à la dose subséquente de 250 mg/kg pc/jour, lors d’un essai de reproduction continue.
g DSENO = 75 mg/kg pc/jour établie et sur la base de la réduction de la taille de la portée, de la viabilité et de la survie des petits, ainsi que du nombre de petits sevrés à la dose subséquente de 150 mg/kg pc/jour, lors d’une étude par voie alimentaire sur trois générations.
Concernant l’exposition par voie cutanée à l’huile de gaulthérie due à l’utilisation de crèmes analgésiques par des adolescents ou des adultes, la comparaison des niveaux d’effet critique et du niveau estimé d’exposition a conduit à calculer une ME égale à 5, jugée potentiellement inadéquate pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition. Concernant l’exposition par voie cutanée à l’huile de gaulthérie due à l’utilisation de crèmes analgésiques par des enfants, la comparaison des niveaux d’effet critique et du niveau estimé d’exposition a conduit à calculer une ME égale à 7, également jugée potentiellement inadéquate pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
Une comparaison du niveau d’effet critique et du niveau estimé d’exposition par voie orale due à l’utilisation d’huile de gaulthérie comme aromatisant alimentaire ou dans des comprimés d’antiacides a conduit à calculer des ME respectives > 30 000 et de 256, jugées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
7.1.4 Incertitudes de l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau 7‑5 ci-dessous.
| Principale source d’incertitude | Impact |
|---|---|
| Bien que l’huile de gaulthéri soit presque entièrement composée de 2‑hydroxybenzoate de méthyle, des composants mineurs de cette huile peuvent affecter les estimations de l’exposition par voie cutanée. | +/- |
| Aucune étude animale n’a examiné la toxicité à dose répétée de l’huile de gaulthérie pour les voies d’exposition pertinentes (c.-à-d. cutanée, orale ou par inhalation). Les données sur le danger dû à son principal composant, le 2-hydroxybenzoate de méthyle ont été utilisées pour étayer l’évaluation des effets sur la santé, quand cela était pertinent. | +/- |
| Il existe de l’incertitude liée à l’utilisation de l’étude de Collins et al. (1971), puisqu’il s’agit d’une étude portant sur trois générations, mais que la réduction de la taille de la portée, la viabilité des petits, la survie des petits et le nombre de petits sevrés n’ont été observés que chez les petits issus d’accouplements de la deuxième génération. Toutefois, puisque l’acide 2-hydroxybenzoïque (un métabolite du 2‑hydroxybenzoate de méthyle) est également associé à des effets sur le développement, les résultats de l’étude de Collins et al (1971) ont été jugés pertinents pour caractériser les risques pour la santé humaine. | + |
| L’essai de sélection continue effectué par le NTP (1984b) avec du 2‑hydroxybenzoate de méthyle a été identifié comme l’étude critique pour les scénarios d’exposition intermittente à court terme. Cette étude a été menée sur des souris CD-1, qui peuvent représenter une espèce moins sensible que les rats. | - |
+ = incertitude pouvant causer une surestimation de l’exposition/risque, - = incertitude pouvant causer une sous‑estimation du risque d’exposition, +/- = potentiel inconnu de surestimation ou de sous-estimation du risque.
7.2 Acide 2-hydroxybenzoïque
7.2.1 Évaluation de l’exposition
Milieux de l’environnement et aliments
L’acide 2-hydroxybenzoïque n’a pas été identifié dans l’air extérieur ni dans l’air intérieur au Canada. D’après les estimations de distribution de l’acide 2‑hydroxybenzoïque dans l’environnement, faites au moyen de modèles de fugacité de niveau 1, plus de 90 % serait dans le milieu aquatique et environ 0,03 % dans l’air (Anonyme 2001, cité dans ECHA 2017c). L’acide 2‑hydroxybenzoïque a un très faible coefficient de partage air-eau (estimé à 7,34 x 10-9 atm.m3/mol), ce qui indique qu’il est improbable que cette substance passe du milieu aquatique dans l’air.
Lors d’une étude réalisée en 2013, Kone et al. ont étudié la présence de produits pharmaceutiques dans les effluents des usines de traitement des eaux usées (UTEU) et les eaux de surface au Canada. Parmi les analgésiques, l’acide 2‑hydroxybenzoïque a été détecté à la concentration la plus élevée, avec une concentration pic de 59,6 µg/L mesurée dans les effluents d’une UTEU (à Toronto, Ontario) et de 17 µg/L mesurée dans des eaux de surface (Gander, Terre-Neuve). L’acide salicylique a été mesuré ailleurs au Canada dans des eaux de surface et à proximité de stations d’épuration à des concentrations allant du ng/L à quelques µg/L (Comeau et al. 2008, Berryman et al. 2014, Brun et al. 2006, Servos et al. 2007, Verenitch et al. 2006, Crouse et al. 2012). Les auteurs de ces études ont attribué les concentrations variables d’acide 2‑hydroxybenzoïque à la spécificité des sites d’échantillonnage et aux caractéristiques de l’eau (profondeur, température, débit) (Kone et al., 2013).
Dans une publication de 2011, le Conseil national de recherches du Canada (CNRC) a examiné la présence de 954 produits chimiques organiques à partir de quatre bases de données sur les matériaux de construction, l’air intérieur et des échantillons de poussière. Un sous-ensemble de données tiré d’une étude du CNRC de 2010 sur des échantillons d’air intérieur et de poussière provenant de 115 habitations de Québec a été ré-analysé pour identifier certains produits chimiques dont des substances du groupe des salicylates. L’acide 2‑hydroxybenzoïque a été identifié lors du réexamen de chromatogrammes des échantillons de poussière de cette étude. Pour les échantillons dont la concentration en acide 2‑hydroxybenzoïque était supérieure à la limite de détection de la méthode, la moyenne géométrique était de 2,75 µg par g de poussière (CNRC 2011).
Lors de sa 59ème réunion, le JECFA a évalué un groupe d’aromatisants, des dérivés hydroxybenzyliques et alcoxybenzyliques, parmi lesquels figurait l’acide 2‑hydroxybenzoïque (JECFA 2002a, 2002b, 2002c). Dans le cadre de cette évaluation, il a estimé de l’absorption per capita d’acide 2‑hydroxybenzoïque due à l’utilisation comme aromatisant alimentaire en suivant une approche d’absorption journalière maximale dérivée d’une enquête. En suivant cette approche, le JECFA a estimé une absorption de 0,03 µg/jour pour la population des États-Unis (0,000 5 µg/kg pc/jour, basé sur un poids corporel moyen de 60 kg pour la population générale). Le JECFA a conclu qu’il n’y a aucun problème de sécurité aux niveaux d’absorption estimés d’acide 2‑hydroxybenzoïque, quand cette substance est utilisé comme aromatisant alimentaire (JECFA 2002a, 2002b, 2002c). Compte tenu de la faible absorption estimée d’acide 2‑hydroxybenzoïque due aux aromatisants alimentaires (environ 0,5 ng/kg pc/jour), l’exposition potentielle due à cette utilisation est jugée négligeable.
Aucune donnée sur la présence naturelle d’acide 2‑hydroxybenzoïque ou de salicylates dans l’alimentation des Canadiens n’était facilement disponible. Une estimation de l’exposition à l’acide 2‑hydroxybenzoïque d’origine naturelle (en tant que salicylates totaux) a été faite en utilisant les valeurs les plus élevées rapportées dans des épices, des fruits, des légumes et plusieurs autres groupes d’aliments (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, décembre 2017, non référencé). Les données utilisées pour cette estimation ont été tirées des articles de Swain et al. (1985), Paterson et al. (2006) et Wood et al. (2011). Les valeurs rapportées les plus élevées ont été appliquées aux codes d’aliments pertinents de l’ensemble de données du cycle 2.2 (2004) de l’Enquête sur la santé dans les collectivités canadiennes (ESCC). Ces estimations sont prudentes dans la mesure où elles sont basées sur les niveaux les plus élevés rapportés de salicylates totaux en tant que niveaux de remplacement pour le calcul de l’exposition à l’acide 2‑hydroxybenzoïque d’origine naturelle dans les aliments (communication personnelle, courriels de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, décembre 2017 - non référencé).
Une estimation de l’absorption d’acide 2‑hydroxybenzoïque due à sa présence dans l’eau, la poussière et les aliments a été effectuée par Kone et al. (2013), en utilisant la concentration maximale rapportée lors de l’examen des effluents des UTEU et des eaux de surface (59,6 µg/L), la concentration moyenne dans la poussière tirée du rapport de 2011 du CNRC (2,75 µg/g d’acide 2‑hydroxybenzoïque/g de poussière) et les absorptions médianes estimées dans les aliments. Les valeurs de l’absorption pour chaque groupe d’âge sont présentées dans le tableau 7‑6 ci-dessous.
| Voie d’exposition | 0 à 0,5 ana (nourri au lait maternisé)b,c | 0,5 à 4 ansd | 5 à 11 anse | 12 à 19 ansf | 20 à 59 ansg | 60 ans et plush |
|---|---|---|---|---|---|---|
| Eau potablei | 6,4 | 2,7 | 2,1 | 1,2 | 1,3 | 1,3 |
| Poussièrej | 1,4E -02 | 7,3E -03 | 2,8E -03 | 1,0E -04 | 9,7E -05 | 9,5E -0 |
| Alimentsk | S.O. | 106 | 70,6 | 46,4 | 38,7 | 38,7 |
| Total | 6,4 | 108,7 | 72,7 | 47,6 | 40 | 40 |
a Assumé peser 7,5 kg et respirer 2,1 m3 d’air par jour (Santé Canada, 1998) et absorber respectivement 38 et 0 mg de poussière et de sol par jour (Wilson et al. 2013).
b Uniquement pour les nourrissons nourris au lait maternisé, pour une consommation présumée de 0,8 L d’eau par jour (Santé Canada, 1998) pour la reconstitution du lait. Voir la note de bas de page sur l’eau potable pour plus de détails. Groupe d’enfants les plus exposés, plus exposés que les enfants nourris au lait maternel ou les enfants non nourris au lait maternisé (non présentés ci-dessus).
c Uniquement pour les nourrissons non nourris au lait maternisé, pour une consommation présumée de 0,7 L d’eau par jour (Santé Canada 1998), avec environ 50 % des nourrissons non nourris au lait maternisé ayant reçu des aliments solides avant l’âge de 4 mois et 90 % avant l’âge de 6 mois (NHW 1990).
d Assumé peser 15,5 kg, respirer 9,3 m3 d’air par jour, consommer 0,7 L d’eau par jour (Santé Canada 1998) et absorber 41 mg de poussière par jour (Wilson et al. 2013).
e Assumé peser 31,0 kg, respirer 14,5 m3 d’air par jour, consommer 1,1 L d’eau par jour (Santé Canada 1998) et absorber 31 mg de poussière par jour (Wilson et al. 2013).
f Assumé peser 59,4 kg, respirer 15,8 m3 d’air par jour, consommer 1,2 L d’eau par jour (Santé Canada 1998) et absorber 2,2 g de poussière par jour (Wilson et al. 2013).
g Assumé peser 70,9 kg, respirer 16,2 m3 d’air par jour, consommer 1,5 L d’eau par jour (Santé Canada 1998) et absorber 2,5 mg de poussière par jour (Wilson et al. 2013).
h Assumer peser 72,0 kg, respirer 14,3 m3 d’air par jour, consommer 1,6 L d’eau par jour (Santé Canada 1998) et absorber 2,5 mg de poussière par jour (Wilson et al. 2013).
i La concentration maximale d’acide 2‑hydroxybenzoïque (59,6 ug/L) mesurée dans les effluents d’UTEU (Toronto, Ontario) (Kone et al. 2013) a été retenue pour les estimations d’absorption journalière due à l’eau potable.
j La moyenne géométrique des concentrations d’acide 2‑hydroxybenzoïque dans les échantillons de poussière provenant de l’étude sur le terrain menée à Québec (2,75 ug par gramme de poussière, CNRC 2011) a été utilisée pour le calcul des estimations d’absorption due à la poussière.
k Données modifiées extraites de communications personnelles (courriels de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, décembre 2017 - non référencé), en utilisant les valeurs rapportées les plus élevées pour les salicylates dans les épices, les fruits, les légumes et plusieurs autres groupes d’aliments.
Produits disponibles pour les consommateurs
Les recherches faites dans les fiches signalétiques de sécurité, la base de données sur les produits ménagers des États-Unis, le GoodGuide (GoodGuide 2018), les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, la Base de données sur les produits de santé naturels homologués, la Base de données sur les produits pharmaceutiques de Santé Canada et les données d’une enquête menée en vertu de l’article 71 montrent que l’acide 2-hydroxybenzoïque est présent dans des milliers de produits disponibles pour les consommateurs au Canada. La présence d’acide 2-hydroxybenzoïque dans des cosmétiques, des PSN et des drogues en tant qu’INM et dans les produits de nettoyage peut entraîner une exposition directe des Canadiens.
Des scénarios « d’observation » ont été sélectionnés pour évaluer le potentiel d’exposition à l’acide 2-hydroxybenzoïque due à ces produits. ll s’agit de scénarios qui ont conduit au niveau d’exposition le plus élevé à l’acide 2-hydroxybenzoïque par voie orale, cutanée ou par inhalation, en tenant compte des fréquences d’utilisation et des concentrations rapportées de cette substance.
Exposition cutanée
D’après les déclarations faites en vertu du Règlement sur les cosmétiques, de l’acide 2‑hydroxybenzoïque est présent dans environ 2000 produits cosmétiques au Canada (communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, décembre 2016 - non référencé). La concentration d’acide 2‑hydroxybenzoïque dans ces produits va de 0,1 % à la concentration maximale admissible de 2 %. Les types de cosmétiques rapportés contenir de l’acide 2‑hydroxybenzoïque comprennent des hydratants pour le corps, le visage et les pieds, des produits de soins capillaires (teintures, permanentes et produits lissants), des produits de bronzage, des huiles de massage, des antisudorifiques et déodorants, des produits de rasage, entre autres.
Nous avons résumé dans le tableau 7‑7 et le tableau 7‑8 l’exposition cutanée obtenue pour les produits cosmétiques susmentionnés contenant de l’acide 2‑hydroxybenzoïque, pour tous les groupes d’âge pertinents.
Lors d’une étude in vivo d’absorption percutanée réalisée en 1997, de l’acide 2‑hydroxybenzoïque présent à 2 % dans une formulation alcoolique (63 % d’eau, 35 % d’éthanol et 2 % d’acide salicylique) et dans une formulation de crème composée de 80 % d’eau, 2 % d’acide salicylique et 18 % d’excipients cosmétiques (éther butylique de PPG-14, glycérine, alcools cétylique et stéarylique, polyquaternium-37, huile minérale, diméthicone, stéareth-21, cyclométhicone et triéthanolamine) a été appliqué localement sur le visage et le cou de 10 femmes volontaires en bonne santé. Les concentrations de 2-hydroxybenzoate ont été mesurées dans le plasma à intervalles intermittents pendant la période d’application de 14 jours (1 application par jour). Les concentrations de 2-hydroxybenzoate dans le plasma dues à l’administration par voie cutanée ont été comparées à celles dues à une administration par voie orale de 81 mg d’acide 2-acétyloxybenzoïque (acétylsalicylique) afin de déterminer la biodisponibilité cutanée relative (comparaison de la surface sous la courbe). Les auteurs ont rapporté des biodisponibilités de 57,6 % pour la formulation alcoolique et de 44,0 % pour la formulation de crème, soulignant les différences apparentes basées sur le vecteur d’application. Compte tenu de la grande variabilité de la pénétration cutanée de l’acide 2‑hydroxybenzoïque en fonction de différentes formulations et du grand nombre de produits de soins personnels pouvant contenir cette substance, une valeur de 60 % a été sélectionnée pour l’absorption cutanée afin de caractériser l’exposition à l’acide 2‑hydroxybenzoïque due à des produits appliqués sur la peau.
| Scénarioa | Concentration maximale rapportéeb (%) | Exposition systémiquec (mg/kg pc/jour) |
|---|---|---|
| Colorant capillaire permanent | 0,3 | 0,30 |
| Hydratant pour le corps | 2 | 1,76 |
| Hydratant pour le corps (nourrisson)d | 1 | 2,00 |
| Produit de bronzage (adulte) | 1 | 0,37 |
| Hydratant pour les pieds | 2 | 0,73 |
| Hydratant pour les mains | 2 | 0,64 |
| Huile de massage (nourrisson)d | 0,3 | 0,43 |
| Hydratante pour le visage | 2 | 0,44 |
| Après-shampooing (sans rinçage) | 2 | 0,29 |
| Lotion de rasage | 2 | 0,24 |
| Déodorant / antisudorifique (adulte) | 2 | 0,13 |
a Sauf indication contraire, les scénarios présentés dans le tableau ci-dessus décrivent l’exposition des adolescents (le groupe d’âge le plus exposé par rapport au poids corporel).
b Basé sur les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques.
c Cela représente une exposition systémique, en utilisant une valeur d’absorption cutanée de 60 % (Davis et al. 2007).
d Parmi les nourrissons, les adolescents et les adultes, ce groupe d’âge est le plus fortement exposé par rapport au poids corporel.
| Scénarioa | Concentration maximale rapportée b (%) | Exposition systémiquec (mg/kg p.c./jour) |
|---|---|---|
| Hydratant pour le corps | 1 | 1,59 |
| Huile de massage | 0,3 | 0,21 |
| Après-shampooing (sans rinçage) | 2 | 0,69 |
a Sauf indication contraire, les scénarios présentés dans le tableau ci-dessus décrivent l’exposition des tout-petits (le groupe d’âge le plus exposé par rapport au poids corporel).
b Basé sur les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques.
c Il s’agit d’une exposition systémique calculée en utilisant une valeur d’absorption cutanée de 60 % (Davis et al. 2007)
Étant donné le grand nombre et la variété de produits cosmétiques rapportés contenir de l’acide 2‑hydroxybenzoïque, une estimation de l’exposition combinée à l’acide 2‑hydroxybenzoïque due à plusieurs produits a été envisagée, tenant compte des types de produits décrits dans le document intitulé Guidance for the Testing of Cosmetic Ingredients and their Safety Evaluation (SCCS 2016). Ces estimations sont présentées dans le tableau 7‑9. Elles ont été faites en utilisant une valeur d’absorption cutanée de 60 %, quand cela était pertinent.
| Produit | Concentration maximale rapportéea (%) | Nourrissons | Tout-petits | Enfants | Adolescents | Adultes |
|---|---|---|---|---|---|---|
| Hydratant pour le corpsb | 1-2 | 2,00 | 1,59 | 0,97 | 1,76 | 1,70 |
| Hydratant pour le visage | 2 | S.O. | S.O. | S.O. | 0,44 | 0,37 |
| Antisudorifique /déodorantb | 2 | S.O. | S.O. | 0,13 | 0,11 | 0,13 |
| Produit coiffant pour cheveuxb | 1 | S.O. | S.O. | 0,06 | 0,03 | 0,04 |
| Maquillage pour les yeuxb | 1 | S.O. | S.O. | S.O. | 0,002 | 0,002 |
| Produit pour le bainb | 2 | 0,074 | 0,036 | 0,023 | 0,022 | 0,026 |
| Shampooing | 2 | 0,008 | 0,063 | 0,05 | 0,026 | 0,022 |
| Après-shampooing (sans rinçage) | 2 | S.O. | 0,69 | 0,51 | 0,29 | 0,24 |
| - | Exposition combinée totale (mg/kg pc/jour) | 2,08 | 2,34 | 1,74 | 3,11 | 2,53 |
a Basé sur les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques.
b Cela représente une exposition systémique calculée en utilisant une valeur d’absorption cutanée de 60 % (Davis et al. 2007).
« S.O. » : Sans objet, car on ne s’attend pas à ce que ces groupes d’âge utilisent ces produits.
Nous présentons dans le tableau 7‑10 ci-dessous les estimations de l’exposition due à l’utilisation de PSN et de drogues contenant de l’acide 2‑hydroxybenzoïque en tant qu’INM, dont des crèmes contre l’acné, des crèmes analgésiques, des écrans solaires et des crèmes après-rasage. Les estimations de l’exposition à l’acide 2‑hydroxybenzoïque due à l’utilisation d’écrans solaires présentées ci-dessous sont basées sur des données d’enquête et utilisées pour caractériser l’utilisation à long terme (Ficheux et al. 2015, 2016). Les concentrations d’acide 2‑hydroxybenzoïque présent en tant qu’INM dans ces types de produits allait de moins de 1 à 5 % (communication personnelle, courriels de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, décembre 2016 - non référencé).
| Scénario | Concentration déclaréea (%) | Tout-petits | Enfants | Adolescents | Adultes |
|---|---|---|---|---|---|
| Écran solaireb | 0,14 | 0,47 | 0,24 | 0,36 | 0,30 |
| Crème contre l’acnéb,c | 2,07 | S.O. | S.O. | 0,75 | 0,63 |
| Crème analgésiqueb,d | 4,29 | S.O. | 2,8 | 2,5 | 2,5 |
| Crème après-rasageb,e | 2,0 | S.O. | S.O. | 0,97 | 0,81 |
a Basé sur les déclarations faites à Santé Canada en vertu du RPSN.
b Cela représente une exposition systémique calculée en utilisant une valeur d’absorption cutanée de 60 % (Davis et al. 2007).
c Assumé peser 59,4 kg (adolescents) ou 70,9 kg (adultes) (Santé Canada 1998). La quantité présumée de produit appliquée était de 1,2 g (Loretz et al. 2005) et la fréquence d’utilisation de 3x par jour (communication personnelle, courriels de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, décembre 2016 - non référencé).
d La surface exposée est présumée être approximativement équivalente à ½ de la surface d’un tronc (Santé Canada 1998). Quantités de produit estimées en se basant sur des facteurs d’ajustement de la surface corporelle dérivés de l’utilisation d’un hydratant corporel (Ficheux et al. 2016). Fréquence d’utilisation de 4x par jour basée sur les étiquettes de produits (communication personnelle, courriels de la Direction des produits de santé naturels et sans ordonnance de Santé Canada, au Bureau de l’évaluation des risques des substances existantes de Santé Canada, décembre 2016, non référencé).
e Assumé peser 59,4 kg (adolescents) ou 70,9 kg (adultes) (Santé Canada 1998). La quantité présumée de produit appliqué était de 1,2 g (Wormuth et al. 2006) et la fréquence présumée d’utilisation était de 4 fois par jour (communication personnelle, courriels de la Direction des produits de santé naturels et sans ordonnance de Santé Canada, au Bureau de l’évaluation des risques des substances existantes de Santé Canada, décembre 2016, non référencé).
S.O. = sans objet
Exposition par inhalation
L’utilisation de laque pour cheveux a été identifiée comme le scénario d’observation associé au plus fort potentiel d’exposition par inhalation comparativement à celle d’autres cosmétiques contenant de l’acide 2‑hydroxybenzoïque. La concentration moyenne dans l’air pendant l’exposition a été estimée à 0,56 mg/m3, correspondant à 0,00077 mg/kg pc pour un adolescent (exposition la plus élevée relativement à celle d’adultes par rapport au poids corporel) et à 0,001 4 mg/kg pc/jour pour un enfant. Des détails sur les paramètres utilisés pour estimer cette exposition avec ConsExpo Web sont présentés à l’annexe B.
Exposition par voie orale
D’après l’information disponible dans la BDPP de Santé Canada, un nombre limité de drogues pris par voie orale, produits antiacides et absorbants, ont été rapportés contenant de l’acide 2‑hydroxybenzoïque en tant qu’INM. Les concentrations d’acide 2‑hydroxybenzoïque dans ces produits allaient de moins de 0,1 % à 0,2 % (communication personnelle, courriels de la Direction des produits thérapeutiques de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, décembre 2016 - non référencé). En utilisant les renseignements disponibles sur la posologie, l’exposition par voie orale la plus élevée à l’acide 2‑hydroxybenzoïque présent dans ces types de produits a été estimée à 3,5 mg/kg pc par 24 h chez des enfants de 10 à 12 ans et à 3,6 mg/kg pc/jour par 24 h chez des adolescents de 12 ans et plus.
7.2.2 Évaluation des effets sur la santé
Il n’existe actuellement aucune classification du danger l’acide 2‑hydroxybenzoïque établie par l’EPA ou le CIRC. Le Comité d’évaluation des risques de l’ECHA a récemment publié un avis proposant une classification et un étiquetage harmonisés au niveau de l’UE pour l’acide 2‑hydroxybenzoïque (ECHA 2016). Les classifications suivantes ont été adoptées par consensus et incluses à l’annexe VI du règlement CLP en tant que modification : suspecté endommager l’enfant à naître (Repr 2), nocif en cas d’ingestion (toxicité aiguë 4) et provoquant de graves lésions oculaires (Dommage aux yeux 1) (UE 2018).
Toxicité à dose répétée
Les effets à court terme de l’acide 2‑hydroxybenzoïque ont été documentés dans une série de rapports publics contenant des détails limités. De faibles doses d’acide 2‑hydroxybenzoïque administrées par voie orale ont été associées à une toxicité minimale chez différents animaux de laboratoire. Par exemple, lorsque des souris (n = 10) ont reçu 100 mg/kg pc/jour d’acide 2‑hydroxybenzoïque par gavage pendant 57 jours, aucun changement dans le gain de poids ni dans la consommation d’aliments n’a été observé, comparativement à des animaux témoins. En outre, aucun changement histopathologique n’a été observé dans le foie ni les reins (Herz et al. 1951, cité dans JECFA 1962). De même, l’administration de doses d’environ 9, 69 et 237 mg/kg pc/jour à des rats pendant 28 jours, n’a entraîné aucune mortalité, aucune lésion macroscopique significative ni aucun changement du poids du foie, des reins, des glandes surrénales ou des testicules (Anonymous 1971, cité dans ECHA 2017d). À des doses plus élevées, des signes de toxicité ont commencé à se manifester. Par exemple, lorsque des souris ont reçu une dose de 300 mg/kg pc/jour d’acide 2‑hydroxybenzoïque par gavage pendant 34 jours, 60 % des animaux sont morts et des examens histopathologiques ont montré d’importants changements dégénératifs dans le foie et les reins, une nécrose des cellules du foie et une infiltration de graisse dans le foie (Herz et al. 1951, cité dans JECFA 1962). Une nécrose du foie et des reins a également été observée chez des chiens après administration de 300 mg/kg pc/jour pendant 2 semaines. Chez le rat, l’administration de doses de 400, 500 et 600 mg/kg pc/jour d’acide 2‑hydroxybenzoïque pendant 4 à 21 jours a causé la mort dans les 10 jours chez les groupes ayant reçu la dose moyenne et la dose élevée. Au-delà de ces doses, une nécrose du foie et des reins modérée à grave été observée (Barbour et al. 1933, cité dans JECFA 1962). Lors d’une autre étude avec des rats, de l’acide 2‑hydroxybenzoïque à 1 % et à 5 % dans les aliments a été administré pendant 8 semaines (Shporn et al. 1958, cité dans JECFA 1962). Ces doses représentaient respectivement environ 500 et 2500 mg/kg pc/jour (Santé Canada 1994). Dans le rapport du JECFA (1962), la dose élevée de 5 % a été déclarée « définitivement toxique ». Le taux de 1 % semblait être associé à des effets observés vers la fin de l’expérience.
Les effets de l’acide 2‑hydroxybenzoïque ont également fait l’objet d’études sur l’exposition par voie cutanée et par inhalation. Pour une étude de photocancérogenèse de 1 an, une crème contenant 0, 2 ou 4 % d’acide 2‑hydroxybenzoïque a été appliquée sur la peau dorsale de souris (2 mg/cm2) (NTP 2007). L’examen de signes cliniques, du poids corporel, de la rate, des poumons et de la moelle osseuse n’a pas révélé de différences significatives par rapport aux témoins. Les essais ont été jugés limités et les détails fournis étaient insuffisants pour déterminer les doses.
Dans le cadre d’une évaluation des risques pour la santé menée par le National Institute for Occupational Safety and Health (NIOSH 1973), des entrevues médicales ont été menées auprès d’employés d’une usine de fabrication de verre exposés à de la poussière contenant jusqu’à 0,355 mg/m3 d’acide 2‑hydroxybenzoïque. Les travailleurs ont rapporté des symptômes aigus d’irritation des yeux, du nez et de la gorge. Les analyses sanguines effectuées sur ces travailleurs ont montré une absorption négligeable d’acide 2‑hydroxybenzoïque. Le NIOSH a conclu que des concentrations dans l’air de 0,07 mg/m3 d’acide 2‑hydroxybenzoïque n’ont pas causé de taux sanguins significatifs d’acide 2‑hydroxybenzoïque. Cependant, ce niveau dans l’air n’a pas protégé les travailleurs contre les symptômes susmentionnés causés sur le site de contact.
Aucune donnée sur le danger associée aux effets de l’acide 2‑hydroxybenzoïque dus à une administration chronique n’a été identifiée pour aucune des voies d’exposition pertinentes. Le Comité scientifique pour les produits cosmétiques et les produits non alimentaires destinés aux consommateurs (SCCNFP) a réalisé une évaluation de la sécurité de l’acide salicylique et a utilisé des renseignements sur le danger de l’acide 2‑acétyloxybenzoïque pour compléter son examen de la toxicité orale chronique (SCCNFP 2002). Lors d’une étude sur 200 jours, de l’acide 2‑acétyloxybenzoïque a été administré à des rats (n = 10) à une dose de 200 mg/kg pc/jour (Thomas et al. 1977, cité dans SCCNFP 2002). Des observations des signes cliniques, du poids corporel, de l’hématologie, de l’urine, de la pathologie globale et de l’histopathologie ont été faites. Aucun effet significatif lié au traitement n’a été observé comparativement aux animaux témoins. Le SCCNFP note que des doses orales d’acide 2-acétyloxybenzoïque de 100 mg/kg pc ou plus induisent des symptômes de toxicité chez les humains (p. ex. léthargie, nausée, vomissement, bourdonnement et étourdissement) apparaissant à des niveaux dans le plasma de 0,35 mg/mL (Cawley et al. 1953, cité dans SCCNFP 2002).
Quand les données sur l’acide 2‑hydroxybenzoïque étaient limitées, pour étayer son évaluation, le 2‑hydroxybenzoïque de méthyle a été identifié comme analogue approprié. Le 2‑hydroxybenzoïque de méthyle est un ester de l’acide 2‑hydroxybenzoïque, dont la structure contient un groupe méthyle. Le 2‑hydroxybenzoïque de méthyle est facilement métabolisé en acide salicylique (Davidson et al. 1961), et ces deux substances possèdent des propriétés physico‑chimiques et un profil de toxicité aiguë similaires (tableau A-2, annexe A). Les effets du 2‑hydroxybenzoïque de méthyle suite à une administration chronique ont été décrits dans l’Évaluation des effets sur la santé de l’huile de gaulthérie (section 7.1.2).
Cancérogénicité et génotoxicité
Il existe une étude de cancérogénicité par voie orale sur l’acide 2‑hydroxybenzoïque. Pour cette étude, des rats de souche Saitama (n = 34) ont reçu de l’acide 2‑hydroxybenzoïque dans leur alimentation à des doses de 0,5 à 1 % pendant toute leur vie (Umeda 1957). Cela équivaut à des doses d’environ 250 à 500 mg/kg pc/jour (Santé Canada 1994). L’estomac de ces rats présentait une fibrose qui, dans un cas d’ulcère, était accompagnée d’une hypertrophie du foie, d’une rate fibrotique, d’une hémosidérose et d’une atrophie. Cependant, aucun des animaux n’a développé de tumeur dans aucun organe au cours de l’expérience. Les auteurs ont conclu que l’acide 2‑hydroxybenzoïque ne présentait aucune activité cancérogène.
Le potentiel cancérogène d’une application cutanée d’acide 2‑hydroxybenzoïque a été partiellement déterminé grâce à une étude de photocancérogenèse réalisée par le National Toxicology Program (NTP 2007). Pour cette étude, des crèmes contenant 0, 2 ou 4 % d’acide 2‑hydroxybenzoïque ont été appliquées sur la peau dorsale de souris sans poils SKH1 (n = 18/sexe/groupe), qui ont ensuite été exposées à une lumière solaire simulée (LSS) filtrée 5 jours/semaine pendant 40 semaines. Les souris ont été examinées chaque semaine pour vérifier la présence de lésions cutanées correspondant à l’apparition de tumeurs. Des nécropsies et des examens microscopiques ont été effectués sur un certain nombre de tissus et d’organes de toutes les souris, à savoir : lésions macroscopiques, peau, tumeurs cutanées (papillomes épidermoïdes, carcinomes in situ et carcinomes épidermoïdes), rate, poumons et fémur droit (moelle osseuse). Le poids corporel moyen de toutes les souris mâles et femelles traitées était semblable à celui du groupe témoin. Tout au long de l’étude, les animaux traités à l’acide 2‑hydroxybenzoïque ont présenté un taux de survie comparable ou supérieur à celui des témoins. Aucune différence significative en termes d’effets cutanés non cancérogènes n’a été observée dans les groupes traités avec de l’acide 2‑hydroxybenzoïque par rapport aux témoins. De plus, pendant l’exposition à la LSS, les animaux traités à l’acide 2‑hydroxybenzoïque ont présenté une incidence de carcinomes de la peau comparable ou inférieure à celle des témoins. Les auteurs de l’étude ont conclu que l’acide 2‑hydroxybenzoïque avait un certain effet protecteur contre la photocancérogénicité de la lumière à faible intensité.
Le 2-hydroxybenzoate de méthyle, un analogue de l’acide 2‑hydroxybenzoïque, a été évalué dans le cadre de l’évaluation des effets sur la santé de l’huile de gaulthérie et n’a pas été reconnu cancérogène chez différents types d’animaux suite à une administration chronique. De plus, des études menées sur une substance similaire, l’acide 2-acétyloxybenzoïque, n’ont pas révélé de potentiel cancérogène lorsqu’elle a été administrée dans l’eau potable à des souris à des doses de 1 et 5 % et à des rats à des doses de 0,25 et 2 % pendant 115 semaines (Odashima 1979, cité par le SCCNFP 2002). Dans l’ensemble, les renseignements disponibles suggèrent que l’acide 2‑hydroxybenzoïque ne devrait pas être cancérogène.
En ce qui concerne sa génotoxicité, l’acide 2‑hydroxybenzoïque a donné des résultats négatifs lors d’une série d’épreuves in vitro de mutation génétique bactérienne effectués sur des souches de Samonella typhimurium et de Bacillus subtillis (McCann et al. 1975, Kuboyama et al. 1992, Japan Chemical Industry Ecology, cité dans CCRIS). Lors d’une étude in vivo avec des souris albinos suisses mâles, la capacité de l’acide 2‑hydroxybenzoïque à provoquer des échanges de chromatides sœurs et des aberrations chromosomiques a été examinée (Giri et al. 1996). L’acide 2‑hydroxybenzoïque a été administré par gavage (à 2 % ou 350 mg/kg pc dans de la gomme d’acacia) ou par voie intrapéritonéale (à 25, 50, 100, 200 mg/kg pc dans du DMSO). Suite à cette administration, une extraction de la moelle osseuse a été faite. Les auteurs ont conclu que l’acide 2‑hydroxybenzoïque n’induisait ni échange de chromatides sœurs ni aberrations chromosomiques et n’était pas génotoxique dans les cellules de moelle osseuse des souris.
Toxicité pour la reproduction et le développement
Le potentiel de toxicité de l’acide 2‑hydroxybenzoïque pour le développement a été étudié lors d’une étude de gavage par voie orale, pour laquelle des rates Sprague‑Dawley gestantes (n = 10/groupe) ont reçu des doses de 0 et de 20 mg/kg pc/jour d’acide 2‑hydroxybenzoïque (dans l’eau distillée) du JG20 au JG21 (Waltman 1973). L’acide 2‑hydroxybenzoïque a fait augmenter la durée de la gestation de façon significative par rapport aux rates témoins (539,4 ± 2,66 au lieu de 521,8 ± 4,36 h, p < 0,01). La durée de la parturition était normale chez tous les animaux témoins (1 h), mais chez 10 % des animaux traités à l’acide 2‑hydroxybenzoïque elle était de 2 h. Les saignements étaient normaux chez tous les animaux témoins, mais ils ont été légèrement plus importants chez 20 % des animaux traités et des saignements abondants ont été observés chez 20 % des animaux traités. Les auteurs ont noté que les rates Sprague-Dawley typiques donnent naissance à leurs petits habituellement en 1 heure avec peu ou pas de perte de sang à la parturition. Aucun nouveau-né des mères traitées à l’acide salicylique n’est né mort (0/106 au lieu de 1/117 dans le groupe témoin), mais le nombre moyen de petits par portée était plus faible (10,6 au lieu de 11,7 pour le groupe témoin, aucune analyse statistique n’a été effectuée). Comme une seule dose a été testée, aucune relation dose-réponse n’a pu être établie.
Lors d’une autre étude, des rates Wistar gestantes (n = 20/groupe) ont reçu des doses de 0, 0,06, 0,1, 0,2 ou 0,4 % d’acide 2‑hydroxybenzoïque dans leur nourriture pendant la semaine entre JG8 et JG14 (Tanaka et al. 1973a). Cela équivaut à 0, 50, 77, 165 ou 205 mg/kg pc/jour. Aux JG20, 15 rates ont été sacrifiées pour un examen fœtal. La moitié des fœtus ont été examinés afin de détecter des anomalies osseuses du squelette et l’autre moitié afin de détecter des anomalies des organes internes. Les autres rates ont mis bas. Les petits ont été sevrés au JPN21 et autopsiés pour détecter des anomalies viscérales ou squelettiques. Au cours de cette période, leur apparence générale, leur comportement et leur survie ont été suivies quotidiennement et le poids corporel a été enregistré tous les 3 jours. Aucune anomalie externe, interne ou squelettique n’a été observée chez les fœtus jusqu’à la dose de 77 mg/kg pc/jour. À la dose de 165 mg/kg pc/jour, une réduction significative de la longueur de la queue et une tendance à la réduction du poids corporel ont été observées chez les fœtus. Des malformations telles que le spina bifida, des membres déformés et le raccourcissement des os cervicaux ont également été observées chez certains fœtus et petits. À la dose la plus élevée (205 mg/kg pc/jour), des signes de toxicité maternelle tels qu’une perte de poids marquée, une diminution de la consommation alimentaire, un faible poids utérin et un poids placentaire significativement faible ont été observés. Aucun fœtus vivant n’était présent chez 9 des 15 mères du groupe et la taille moyenne de la portée était faible. Chez les fœtus, une réduction du poids corporel et une réduction significative de la longueur du corps et de la queue ont été observées. Une incidence élevée de malformations graves (crâne exposé, spina bifida, doigts manquants sur les membres, membres déformés, hypertrophie unilatérale et/ou reins disloqués, et défauts osseux) a également été observée. La DSENO pour la toxicité maternelle a été établie à 165 mg/kg pc/jour, basée sur la perte de poids, la diminution de la consommation alimentaire et la diminution du poids utérin ou placentaire à la dose subséquente (205 mg/kg pc/jour). La DSENO pour la toxicité pour le développement a été établie à 77 mg/kg pc/jour, basée sur la réduction du poids corporel et des malformations fœtales observées à la dose subséquente (165 mg/kg pc/jour).
Les mêmes auteurs ont mené une étude similaire en suivant une méthodologie identique, sauf que de l’acide 2‑hydroxybenzoïque a été administré aux animaux par gavage plutôt que dans leur nourriture (Tanaka et al. 1973 b). Des rates Wistar (n = 20/groupe) ont reçu des doses de 0, 75, 150 ou 300 mg/kg pc/jour d’acide 2‑hydroxybenzoïque (dans de la carboxyméthylcellulose sodique à 0,5 %) du JG8 au JG14 (6 jours). À la dose la plus faible (75 mg/kg pc/jour), 1,8 % des fœtus examinés présentaient des anomalies externes (pes varus, adiposité) et 2,5 % des anomalies osseuses (vertèbres cervicales, sacrées, caudales) comparativement aux témoins, en l’absence de toxicité maternelle. Chez la progéniture, un cas d’hydronéphrose (2,5 %) et un cas d’hydrouterus (2,5 %) ont été observés. Étant donné que ces anomalies ont été observées antérieurement chez des rates Wistar à des fréquences semblables ou légèrement inférieures (Liberati et al. 2002, Noritake et al. 2013), elles n’ont donc pas été jugées liées au traitement. À la dose de 150 mg/kg pc/jour, une diminution statistiquement significative du poids de l’utérus a été observée sans aucun changement marqué dans le gain de poids corporel, l’apparence générale ni la mortalité chez les mères. La taille de la portée, le poids corporel du fœtus, la longueur du corps et de la queue étaient significativement plus faibles. L’incidence des anomalies externes, internes et squelettiques était respectivement de 27,8, 12,7 et 65,7 %, comparativement à 0 % pour le groupe témoin. Les petits nés des rates gestantes arrivées à terme présentaient une réduction du poids corporel, de la longueur du corps et de la queue, des anomalies externes (pes varus, syndactylie, paupière fermée, orifice vaginal fermé), des anomalies internes (17,2 %, hydronéphrose, dérèglement rénal, absence d’ovaire, absence de corne utérine, retard de la corne utérine) et des anomalies squelettiques (incidence élevée de vertèbres cervicales et thoraciques présentant une déformation ou une fusion avec un os adjacent). Les auteurs ont également noté qu’après 8 semaines, le taux de sevrage était inférieur à 60 %. À la dose la plus élevée (300 mg/kg pc/jour), des signes de toxicité maternelle étaient évidents, notamment une diminution de la consommation d’eau et d’aliments, une salivation, une horripilation, une perte de poids marquée, une réduction du poids de l’utérus et du placenta et la mort. Aucun fœtus vivant n’a été obtenu chez ce groupe à des fins d’examen. La DSENO pour la toxicité maternelle a été établie à 150 mg/kg pc/jour en se basant sur la toxicité générale (perte de poids, diminution de la consommation d’aliments et d’eau, signes cliniques) et la mortalité à la dose subséquente. La DSENO pour la toxicité pour le développement a été établie à 75 mg/kg pc/jour en se basant sur la diminution de la taille de la portée, le poids corporel du fœtus et de l’observation d’anomalies externes, internes et osseuses à la dose subséquente (150 mg/kg pc/jour). Ce niveau avec effet est conforme à celui déclarée par le Comité scientifique des produits cosmétiques et des produits non alimentaires destinés aux consommateurs (SCCNFP 2002). Le Comité d’évaluation des risques (CER) de l’ECHA a également tenu compte de cette information pour son évaluation et a classé l’acide 2‑hydroxybenzoïque dans la catégorie Repr 2 (soupçonné d’endommager l’enfant à naître) (ECHA 2016).
Le potentiel de toxicité pour le développement de l’acide 2‑hydroxybenzoïque a également été étudié lors d’études à dose unique, par différentes voies d’administration. Les effets de l’acide 2‑hydroxybenzoïque administré au début ou à la fin de la gestation ont été examinés lors d’une étude pour laquelle des souris NRMI gestantes (n = 5-13) ont reçu des doses de 0, 500 ou 1000 mg/kg d’acide 2‑hydroxybenzoïque (dans de la carboxyméthylcellulose sodique à 1 %) par gavage le JG 9 ou le JG 17 (Cekanova 1974). Lorsque l’acide 2‑hydroxybenzoïque était administré au début de la gestation (JG 9), une diminution du nombre d’implantations et une augmentation du nombre de fœtus résorbés ont été observées comparativement aux témoins (aucune analyse statistique effectuée), même à la dose faible qui était considérée bien toléré sans mortalité. De plus, l’incidence de malformations des côtes et des vertèbres était plus importante que chez le groupe témoin (4,5 au lieu de 0 %). Lorsque l’acide 2‑hydroxybenzoïque était administré vers la fin de la gestation (JG 17), les auteurs ont noté que, en plus des observations précédentes, il y avait une fréquence très élevée de décès fœtaux. Les résultats de cette étude ont confirmé des rapports antérieurs sur des malformations du squelette induites par du 2‑hydroxybenzoate administré au début de l’organogenèse, alors qu’en fin de grossesse il cause une incidence plus élevée de décès fœtaux (Larsson et Eriksson 1966) et induit des naissances précoces (Eriksson et Larsson 1968). Des résultats semblables ont été observés chez des rates Sprague‑Dawley ayant reçu 0 ou 380 mg/kg pc d’acide 2‑hydroxybenzoïque par injection sous-cutanée (Koshakji et Schulert 1973). Lorsque ces animaux avaient reçu l’acide 2‑hydroxybenzoïque le JG9, une incidence élevée de malformations fœtales, de résorptions et de réduction significative du poids fœtal a été observée. Cependant, chez les rates ayant reçu l’acide 2‑hydroxybenzoïque plus tard au cours de la gestation (JG16), trois cas d’hématurie, une hémorragie fœtale le long du cerveau et de la colonne vertébrale et un taux élevé de mortalité fœtale ont été observés. Bien que les auteurs aient conclu que l’acide 2‑hydroxybenzoïque a des effets sur le développement, ils ont également noté qu’il était associé à une perte de poids corporel marquée, une perte d’appétit, une relaxation complète, de la faiblesse, de la somnolence, une mollesse musculaire, de l’inactivité, une accélération de la respiration et, parfois, un besoin élevé en eau et une excrétion urinaire élevée chez la mère.
Lors d’une étude par voie cutanée menée par E.l. Dupont de Nemours & Co (1973), des doses uniques de 0, 450, 670, 1000, 1500 ou 2250 mg/kg pc d’acide 2‑hydroxybenzoïque (dans du DMSO) ont été appliquées sur le dos de rates CD (n = 3) le JG 12. Les animaux ont été sacrifiés le JG20 et les observations suivantes ont été faites : examen macroscopique de l’utérus et du fœtus, nombre de sites d’implantation, nombre de fœtus vivants, nombre de résorptions précoces/tardives, poids fœtal et longueur du croupion. Aucune analyse statistique n’a été réalisée. La dose de 1500 mg/kg pc/jour a été mortelle pour les femelles gestantes. Comparativement au groupe témoin, le traitement à l’acide 2‑hydroxybenzoïque a entraîné une réduction du nombre de sites d’implantation, une diminution du nombre de fœtus vivants et une augmentation du nombre de résorptions précoces, bien qu’aucune analyse statistique n’ait été effectuée. Un seul fœtus atteint d’exencéphalie a été détecté à la dose la plus faible. Toutefois, le lien entre cet effet et le traitement n’a pas été établi, car il n’existait aucune analyse statistique ni aucune analyse dose-dépendance permettant une comparaison avec des témoins simultanés ou historiques.
Concernant les données sur l’acide 2-acétyloxybenzoïque, le CIR (2003) a noté qu’une faible dose (81 mg) était une exposition généralement considérée non toxique et sans effet sur la reproduction. Cependant, Henderson et ses collaborateurs (2014) ont préparé une revue systématique des données probantes sur l’acide 2‑acétyloxybenzoïque à faible dose à des fins de prévention de la morbidité et de la mortalité dues à la prééclampsie et ont suggéré que la probabilité plus importante d’effet nocif lorsque les analyses étaient limitées aux femmes à risque de prééclampsie faible ou moyen. En particulier, le risque de mortalité périnatale et de décollement placentaire avait tendance à être plus élevé. La comparaison d’autres incidences de saignements maternels et fœtaux n’a mis en évidence aucun effet nocif dû à l’utilisation de faibles doses d’acide 2-acétyloxybenzoïque à partir du deuxième trimestre de la grossesse. La California Environmental Protection Agency (2016) a inscrit l’acide 2-acétyloxybenzoïque sur la liste des substances toxiques pour le développement et la reproduction.
7.2.3 Caractérisation des risques pour la santé humaine
D’après les données disponibles, il est improbable que l’acide 2‑hydroxybenzoïque soit cancérogène ou génotoxique. La toxicité pour le développement a été identifiée comme l’effet critique, et l’étude de Tanaka et al. (1973b) a été jugée la plus pertinente pour la caractérisation des risques dus à une exposition à l’acide 2‑hydroxybenzoïque chez les adultes, les adolescents et les nourrissons. Une DSENO de 75 mg/kg pc/jour a été établie sur la base de réductions statistiquement significatives de la taille de la portée, du poids corporel fœtal, de la longueur du corps et de la queue du fœtus, d’une incidence élevée des effets sur le développement et d’une diminution du taux de sevrage à la dose subséquente (150 mg/kg pc/jour). Ces effets se sont produits à une dose n’ayant produit aucune toxicité maternelle.
Une étude à court terme décrite dans le rapport du JECFA (1962) a été jugée la plus pertinente pour la caractérisation des risques dus à une exposition à l’acide 2‑hydroxybenzoïque chez les tout-petits et les enfants. Pour cette étude (Herz et al. 1951, cité dans JECFA 1962), une DSENO de 100 mg/kg pc/jour a été établie comme niveau d’effet critique sur la base de la mortalité et de lésions du foie et des reins observées à 300 mg/kg pc/jour. Cette DSENO de 100 mg/kg pc/jour est en accord avec les doses avec effet associées à la substance analogue, le 2‑hydroxybenzoate de méthyle. Des doses supérieures à 100 mg/kg pc/jour ont été associées à une réduction du poids corporel, une hypertrophie du foie, une augmentation du poids des reins, un poids moindre de l’utérus et du placenta, des effets sur la reproduction et le développement et la mort (Webb et Hansen 1963, Collins et al. 1971, Abbott et Harrisson 1978, NTP 1984a, 1984b).
Nous présentons dans les tableaux 7‑11 à 7-14 les estimations d’exposition pertinentes, les niveaux d’effet critique et les marges d’exposition en résultant pour la caractérisation des risques pour la santé humaine dus à une exposition à l’acide 2‑hydroxybenzoïque.
| Scénarioa,b | Exposition systémique (mg/kg pc/jour) | Effet critique (mg/kg pc/jour)c | ME |
|---|---|---|---|
| Colorant capillaire permanent | 0,30 | DSENO = 75 | 250 |
| Hydratant pour le corps | 1,76 | DSENO = 75 | 43 |
| Hydratant pour le corps (nourrisson) | 2,00 | DSENO = 75 | 38 |
| Produit de bronzage (adulte) | 0,37 | DSENO = 75 | 203 |
| Hydratant pour les pieds | 0,73 | DSENO = 75 | 102 |
| Hydratant pour les mains | 0,64 | DSENO = 75 | 117 |
| Huile de massage (nourrisson) | 0,43 | DSENO = 75 | 175 |
| Hydratant pour le visage | 0,44 | DSENO = 75 | 170 |
| Après-shampooing (sans rinçage) | 0,29 | DSENO = 75 | 259 |
| Produit de rasage | 0,24 | DSENO = 75 | 312 |
| Déodorant / antisudorifique (adulte) | 0,13 | DSENO = 75 | 577 |
| Exposition par inhalation de produits capillaires en aérosol (adolescent) | 0,000 77d (conversion de 0,56 mg/m3) | DSENO = 75 | > 90 000 |
| Exposition cutanée combinéea,b à des cosmétiques (adolescent) | 3,11 | DSENO = 75 | 24 |
a Sauf indication contraire entre parenthèses, toutes les estimations de l’exposition ci-dessus s’appliquent aux adolescents car, par comparaison aux adultes, ils représentent le groupe le plus exposés par kg de poids corporel.
b Une valeur d’absorption cutanée de 60 % a été utilisée (Davis et al. 1997).
c DSENO = 75 mg/kg pcjour, sur la base des réductions significatives de la taille de la portée, du poids corporel fœtal et de la longueur du corps et de la queue du fœtus, l’incidence de malformations élevée, le taux réduit de sevrage à la dose subséquente de 150 mg/kg pc/jour, observés lors d’une étude prénatale de toxicité pour le développement
d Exposition par inhalation convertie en exposition systémique à partir de la vitesse d’inhalation et du poids corporel par défaut correspondant à un adolescent. Vitesse d’inhalation = 14,5 m3/jour, poids corporel = 59,4 kg
En ce qui concerne les valeurs du tableau 7-11 pour l’exposition cutanée due à l’utilisation de cosmétiques chez les nourrissons, les adolescents ou les adultes, une comparaison du niveau d’effet critique et des expositions estimées a conduit à calculer des ME entre 38 et 577, qui sont jugées potentiellement inadéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition. L’exposition par inhalation due à l’utilisation d’un produit capillaire en aérosol a conduit à calculer une ME > 90 000 (lorsqu’elle est convertie en exposition systémique), considérée adéquate pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
| Scénarioa | Estimation de l’exposition (mg/kg pc/jour) | Effet critique (mg/kg pc/jour)b | ME |
|---|---|---|---|
| Hydratant pour le corps (tout‑petits) | 1,59 | DSENO = 100 | 63 |
| Huile de massage (tout‑petits) | 0,21 | DSENO = 100 | 476 |
| Après-shampooing (sans rinçage, tout-petits) | 0,69 | DSENO = 100 | 145 |
| Exposition par inhalation de produits capillaires en aérosol (enfants) | 0,0014c | DSENO = 100 | > 70 000 |
| Exposition cutanée combinée par les cosmétiques (tout‑petits) | 2,34 | DSENO = 100 | 43 |
a Pour l’estimation de l’exposition systémique due à l’utilisation d’hydratants pour le corps, d’huiles de massage et d’après-shampooings, il a été assumé que 60 % de l’acide 2‑hydroxybenzoïque appliqué sur la peau serait absorbé (Davis et al., 1997).
b DSENO = 100 mg/kg pc/jour, sur la base des dommages au foie et aux reins et de la mortalité à la dose subséquente de 300 mg/kg pc/jour, établie lors d’une étude par gavage de 57 jours.
c Concentration d’exposition de 0,56 mg/m3 convertie en dose d’exposition systémique à partir de la vitesse d’inhalation (14,5 m3/jour) et du poids corporel d’un enfant (31 kg) par défaut (Santé Canada 1998).
Concernant l’exposition par voie cutanée due à l’utilisation d’hydratants pour le corps et d’après-shampooings par les tout-petits et les enfants, une comparaison du niveau d’effet critique des expositions estimées a conduit à calculer des ME respectives de 63 et 145, jugées potentiellement inadéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition. La comparaison des niveaux d’effet critique et de l’exposition par voie cutanée due à l’utilisation d’huiles de massage ou par inhalation de produits capillaires en aérosol a conduit à calculer des ME respectives de 476 et > 70 000, considérées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et les expositions.
| Scénarioa | Exposition systémique (mg/kg pc/jour) | Effet critique (mg/kg pc/jour) | ME |
|---|---|---|---|
| Écran solaire (tout-petits) | 0,47 | DSENO = 100 b | 213 |
| INM dans antiacide liquide (voie orale, court terme, enfants) | 3,5 | DSENO = 100 b | 29 |
| Crème analgésique (enfants) | 2,8 | DSENO = 100 b | 36 |
| Écran solaire (adolescents) | 0,36 | DSENO = 75c | 208 |
| Crème contre l’acné (adolescents) | 0,75 | DSENO = 75c | 100 |
| Crème analgésique (adolescents) | 2,5 | DSENO = 75c | 30 |
| Crème après-rasage | 0,97 | DSENO = 75c | 77 |
| INM dans antiacide liquide (voie oral, court terme, adultes) | 3,6 | DSENO = 75c | 21 |
a Pour l’estimation de l’exposition systémique due à l’utilisation d’écrans solaires, de crèmes analgésiques, de crèmes contre l’acné et de crèmes après-rasage, il a été assumé que 60 % de l’acide 2‑hydroxybenzoïque appliqué sur la peau serait absorbé (Davis et al.1997).
b DSENO = 100, basée sur des dommages au foie et aux reins et la mortalité à la dose subséquente de 300 mg/kg pc/jour observés lors d’une étude par gavage de 57 jours.
c DSENO = 75, basée sur une réduction significative de la taille de la portée, du poids corporel fœtal et de la longueur du corps et de la queue du fœtus, une incidence élevée de malformations et une diminution du taux de sevrage à la dose subséquente de 150 mg/kg pc/jour, observés lors d’une étude sur la toxicité pour le développement prénatal.
Concernant les expositions par voie cutanée et par voie orale dues à l’utilisation d’écrans solaires, d’antiacides liquides et de crèmes analgésiques par les tout-petits et les enfants, la comparaison des niveaux d’effet critique et des estimations d’exposition a conduit à calculer des ME de 29 à 213, jugées potentiellement inadéquates pour tenir compte des incertitudes des bases de données sur les des effets sur la santé et l’exposition.
Concernant les expositions par voie cutanée et par voir orale dues à l’utilisation d’écrans solaires, de crèmes contre l’acné, de crèmes analgésiques, de crèmes après‑rasage et d’antiacides liquides par les adolescents ou les adultes, la comparaison des niveaux d’effet critique et des estimations d’exposition a conduit à calculer des ME de 21 à 208, jugées potentiellement inadéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
| Scénario | Estimation de l’absorption (mg/kg pc/jour) | Effet critique (mg/kg pc/jour) | ME |
|---|---|---|---|
| Absorption due à la présence dans les milieux de l’environnement (eau, poussière) et les aliments destinés aux tout‑petits (groupe le plus exposé par rapport au poids corporel) | 0,109 | DSENO = 100a | 917 |
| Absorption due à la présence dans les milieux de l’environnement (eau, poussière) et les aliments destinés aux adultes | 0,040 | DSENO = 75 b | 1875 |
a DSENO = 100 mg/kg pc/jour, basée sur des dommages au foie et aux reins et la mortalité à la dose subséquente de 300 mg/kg pc/jour observés lors d’une étude par gavage de 57 jours.
b DSENO = 75 mg/kg pc/jour, basée sur des réductions importantes de la taille de la portée, de poids corporel fœtal et de la longueur du corps et de la queue du fœtus et d’une incidence élevée de malformations à la dose subséquente de 150 mg/kg pc/jour, observées lors d’une étude sur la toxicité pour le développement prénatal.
La comparaison de l’absorption d’acide 2‑hydroxybenzoïque due à sa présence dans les milieux de l’environnement et les aliments et des niveaux d’effet critique a conduit à calculer des ME de 917 pour les tout-petits et de 1875 pour les adultes, jugées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
7.2.4 Incertitudes de l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principale source d’incertitude | Impact |
|---|---|
| Manque de données canadiennes sur la présence d’acide 2‑hydroxybenzoïque dans les aliments. Les valeurs utilisées pour calculer l’absorption alimentaire ont été obtenues à partir de mesures du total des salicylates en remplacement de celles de l’acide 2‑hydroxybenzoïque. | + |
| L’exposition potentielle à l’acide 2‑hydroxybenzoïque peut être le résultat de la décomposition d’autres salicylates présents dans des produits disponibles pour les consommateurs. | - |
| L’exposition combinée à l’acide 2‑hydroxybenzoïque due à des cosmétiques a été calculée en utilisant les données sur les concentrations maximales les plus élevées déclarées en vertu du Règlement sur les cosmétiques et en supposant que tous les produits sont utilisés simultanément. | + |
| Il n’existait aucune étude sur la toxicité chronique/cancérogénicité de l’acide 2‑hydroxybenzoïque pour aucune des voies d’exposition. Les données sur le danger pour les analogues 2-hydroxybenzoate de méthyle et acide 2‑acéthyoxybenzoïque ont été utilisées pour étayer l’évaluation de ces paramètres. | +/- |
+ = incertitude pouvant causer une surestimation de l’exposition/risque, - = incertitude pouvant causer une sous-estimation du risque d’exposition, +/- = possibilité non identifiée de causer une surestimation ou une sous-estimation du risque
7.3 2-Hydroxybenzoate de 3,3,5-triméthylcyclohexyle
7.3.1 Évaluation de l’exposition
Milieux de l’environnement
Le 2‑hydroxybenzoate de 3,3,5-triméthycyclohexyle n’a pas été détecté dans l’air intérieur ni dans l’air extérieur au Canada. Toutefois, étant donné sa faible pression de vapeur (0,015 Pa) et son profil d’utilisation (ingrédient dans des écrans solaires et des lotions), l’exposition de la population générale due à sa présence dans l’air extérieur ou intérieur devrait être minimale.
Le 2‑hydroxybenzoate de 3,3,5-triméthycyclohexyle a été détecté dans des échantillons de poussière prélevés dans 115 maisons à Québec lors de l’étude du CNRC (2011) mentionnée plus haut. La moyenne géométrique de toutes les données pour tous les échantillons de données ayant une teneur en 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle supérieure à la limite de détection de la méthode était de 6,50 µg par gramme de poussière.
Aucune étude sur la présence du 2‑hydroxybenzoate de 3,3,5-triméthycyclohexyle dans l’eau potable ou des eaux de surface au Canada n’a été identifiée. Cette substance a été détectée dans plusieurs échantillons d’eau de surface provenant de divers endroits dans le monde. Dans leur analyse de la littérature existante, Hopkins et Blaney (2016) ont rapporté des concentrations de 2‑hydroxybenzoate de 3,3,5-triméthycyclohexyle dans des eaux de surface allant de moins de 0,001 µg/L à moins de 1,0 µg/L, avec une valeur au 75ème percentile d’environ 0,07 µg/L (n = 35, données tirées d’études sur des eaux de surface au Japon et en Slovénie) (Tashiro et al. 2013, Kameda et al. 2011, Cuderman et al. 2007, cité dans Hopkins et Blaney 2016). Pour quelques études, des échantillons d’eau ont été prélevés sur des plages, dont la concentration en 2‑hydroxybenzoate de 3,3,5-triméthycyclohexyle peut être attribuée à l’utilisation d’écrans solaires pendant les activités balnéaires (Tashiro et al. 2013, Kameda et al. 2013 cité dans Hopkins et Blaney 2015, Rodriguez et al. 2015). Le 2‑hydroxybenzoate de 3,3,5-triméthycyclohexyle ne devrait pas persister dans les eaux de surface, car sa demi-vie d’hydrolyse à pH neutre est d’environ 9 jours (ECHA 2017e).
Pour estimer les concentrations de 2‑hydroxybenzoate de 3,3,5-triméthycyclohexyle dans le sol (cette substance pouvant persister dans le sol en raison de son coefficient de partage octanol/eau élevé) une modélisation a été effectuée en utilisant ChemCAN (ChemCAN 2003) et les quantités rapportées dans le commerce au Canada en 2011 (Environnement Canada 2013). À l’aide des résultats de la modélisation et des concentrations mesurées dans la poussière (6,50 µg/g de poussière) et dans les eaux de surface (0,07 µg/L - concentration maximale rapportée tirée d’une recherche des données disponibles), l’absorption de 2‑hydroxybenzoate de 3,3,5-triméthycyclohexyle a été estimée dans la gamme des nanogrammes (environ 40 ng/kg pc/jour), mettant en évidence un potentiel d’exposition minimal dû aux milieux de l’environnement.
Produits disponibles pour les consommateurs
D’après les déclarations faites en vertu du Règlement sur les cosmétiques, du 2‑hydroxybenzoate de 3,3,5-triméthycyclohexyle est présent dans des hydratants pour le visage, des produits de massage, des parfums, du maquillage (non permanent), des produits pour le bain, des shampooings et des produits de bronzage. Pour évaluer le potentiel d’exposition par voie cutanée et par inhalation due à l’utilisation de ces produits, des scénarios « d’observation » ont été choisis, c.-à-d. des scénarios qui ont conduit au niveau d’exposition potentielle le plus élevé, compte tenu des fréquences d’utilisation et des concentrations rapportées. Les produits de bronzage et les hydratants pour le visage ont été utilisés comme produits représentatifs.
Les renseignements disponibles sur le 2‑hydroxybenzoate de 3,3,5-triméthycyclohexyle suggèrent que cette substance a un faible potentiel d’absorption cutanée (NICNAS 2015, SCCP 2007). Lors d’une étude d’absorption cutanée in vitro de 2‑hydroxybenzoate de 3,3,5-triméthycyclohexyle (ligne directrice 428 de l’OCDE) avec de la peau humaine dermatomée, l’absorption a été mesurée dans des conditions non occlusives sur une période de 24 heures (ECHA 2017e). La substance a été appliquée (à raison de 0,5449 mg/cm2) sur des échantillons de peau, et une dose potentiellement absorbable de 7,63 µg/cm2 a été rapportée pour une formulation standard d’écran solaire contenant 10,1 % en poids de 2‑hydroxybenzoate de 3,3,5-triméthycyclohexyle radiomarqué. Cette dose décrit la quantité de 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle potentiellement absorbée par unité de surface lors d’une application cutanée pendant 24 heures. Le taux de récupération moyen des échantillons de peau humaine était de 92,4 %. Étant donnée la similarité entre ce type de produit et les formulations expérimentales, la durée des expériences et la durée des scénarios d’exposition, une dose de 7,63 µg/cm2 (correspondant à une préparation d’écran solaire) a été utilisée pour évaluer l’exposition au 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle présent dans des hydratants pour le visage et des produits de bronzage. Nous donnons dans le tableau 7‑16 ci-dessous un résumé de l’exposition systémique quotidienne au 2‑hydroxybenzoate de 3,3,5-triméthycyclohexyle due à ces ces produits.
| Produit | Concentration maximale déclarée (%)a | Nourrissons | Tout-petits | Enfants | Adolescents | Adultes |
|---|---|---|---|---|---|---|
| Hydratant pour le visageb,c | 30 % | S.O. | S.O. | S.O. | 0,082 | 0,069 |
| Produit de bronzage (vaporisateur)c,d | 10 % | S.O. | S.O. | S.O. | S.O. | 1,20 |
a Basé sur des déclarations faites en vertu du Règlement sur les cosmétiques.
b Il s’agit d’une exposition systémique estimée en utilisant une dose potentiellement absorbable de 7,63 µg/cm2 (ECHA 2017e) et les surfaces du corps et du visage par défaut tirées de Santé Canada (1998).
c Exposition quotidienne
d Exposition par évènement
« S.O. » : Sans objet, car ces groupes d’âge ne sont pas censés utiliser ces produits.
Du 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle est également présent dans un hydratant sous forme d’aérosol pour le visage (communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, décembre 2016 - non référencé). Une telle utilisation peut entraîner une exposition accidentelle par inhalation. Comme aucun paramètre d’exposition spécifique du produit n’était disponible pour les hydratants en aérosol, des valeurs par défaut les déodorants en aérosol ont été modifiées pour représenter ce scénario d’exposition. Ces valeurs se trouvent à l’annexe B. La concentration de cette substance dans l’air pendant l’exposition par un hydratant en aérosol ayant une concentration maximale de 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle de 3 % a été estimée à 4,0 mg/m3. Cette valeur représente la concentration moyenne dans l’air pendant la durée d’exposition estimée à 5 minutes. L’exposition potentielle par inhalation due à l’utilisation d’un produit de bronzage en aérosol est traitée dans la partie de l’évaluation consacrée aux hydratants pour le visage en aérosol.
7.3.2 Évaluation des effets sur la santé
Il n’existe actuellement aucune classification du danger du 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle faite par l’Agence européenne des produits chimiques (ECHA), l’Environmental Protection Agency des États-Unis (EPA) ou le Centre international de recherche sur le cancer (CIRC).
Toxicité à dose répétée
Les effets à court terme du 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle ont été décrits dans un rapport du Scientific Committee on Consumer products (SCCP) (données non publiées 2005, citées dans SCCP 2007). Dans le cadre d’une étude de 2 semaines non conforme aux BPL, des rats (n = 5/sexe/groupe) ont reçu 0, 100, 300 et 1000 mg/kg pc/jour de 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle par gavage. Les signes cliniques, le poids corporel, la consommation alimentaire, l’hématologie et la chimie clinique ont été observés. À la fin de l’étude, tous les animaux ont été sacrifiés et un examen macroscopique a été réalisé. À l’exception d’un léger retard dans le gain de poids corporel et d’une réduction correspondante de l’efficacité alimentaire observés à la dose de 1 000 mg/kg pc/jour, aucun effet sur le poids corporel, la consommation alimentaire ou l’efficacité n’a été observé chez les autres groupes. Une augmentation du temps de coagulation sanguine a été observée chez les mâles à une dose égale ou supérieure à 300 mg/kg pc/jour et chez les femelles à 1000 mg/kg pc/jour. Le taux de bilirubine était moindre aux doses égales ou supérieures à 100 mg/kg pc/jour chez les mâles et aux doses égales ou supérieures à 300 mg/kg pc/jour chez les femelles, tandis que les taux de triglycérides étaient plus élevés à la dose la plus élevée chez les deux sexes. Toutefois, ces effets ont été jugés non nocifs ou seulement potentiellement nocifs par l’auteur (aucune donnée ou information complémentaire fournie). L’auteur a établi une DSENO de 100 mg/kg pc/jour, basée sur la coagulation observée à ≥ 300 mg/kg pc/jour chez les mâles et 1000 mg/kg pc/jour chez les femelles.
L’exposition par voie orale à court terme au 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle a également été étudiée lors d’une étude combinée à dose répétée sur la toxicité pour la reproduction/développement (OCDE TG 422). Le 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle (dans l’huile de maïs) était administré par gavage à raison de 0, 60, 120, 300 et 750 mg/kg pc/jour à des rats mâles pendant 67 jours (n = 10/groupe) et à des femelles (n = 10/groupe) pendant 14 jours avant l’accouplement, pendant la période d’accouplement et jusqu’au jour 3 post-partum (environ 7 semaines) (rapport de l’étude non nommé 2013, ECHA 2017f). Les signes cliniques, la mortalité, la consommation alimentaire, le poids corporel, le nombre de sites d’implantation, les corps jaunes, la taille de la portée, les naissances vivantes, les néo-mortalités et les anomalies graves ont été enregistrés. Tous les parents et les petits ont fait l’objet d’un examen macroscopique. L’évaluation qualitative des organes reproducteurs mâles a été effectuée en portant l’attention sur les premiers stades de la spermatogenèse et l’histopathologie de la structure cellulaire interstitielle. Un examen histologique a également été effectué sur les ovaires qui n’ont pas donné naissance et sur les organes reproducteurs des mâles infertiles. À 300 mg/kg pc/jour, des augmentations statistiquement significatives du poids absolu du foie, du rapport massique foie/cerveau, du poids des reins et du rapport massique reins/cerveau chez les femelles. De plus, l’incidence et/ou la gravité de l’hypertrophie diffuse de l’épithélium folliculaire des glandes thyroïdes chez les femelles était plus importante, tout comme l’incidence et la gravité de la diminution des lymphocytes corticaux dans le thymus chez les mâles. À la dose de 750 mg/kg pc/jour, un animal est mort et un autre a été sacrifié en raison d’une toxicité sévère. Chez les animaux survivants, des concentrations significativement plus élevées d’albumine, une augmentation significative du poids absolu et relatif du foie, une consommation alimentaire réduite et un poids corporel réduit ont été observés. Chez les mâles, le poids absolu de la prostate et des vésicules séminales était significativement réduit. De plus, l’incidence et/ou la gravité de l’hypertrophie diffuse de l’épithélium folliculaire des glandes thyroïdes étaient plus élevées chez les deux sexes, ainsi que l’incidence et la gravité de la diminution des lymphocytes corticaux dans le thymus.
Concernant les effets sur le foie, les auteurs ont indiqué que l’augmentation du poids relatif du foie s’accompagnait d’une légère hypertrophie des hépatocytes centrilobares. En l’absence de changements connexes dans les paramètres biochimiques cliniques, les résultats observés sur le foie ont été considérés comme une réaction d’adaptation à l’augmentation de la charge métabolique causée par le traitement. Concernant les effets sur les reins, les auteurs ont noté que malgré une augmentation du poids des reins observée chez les femelles, ces effets n’étaient pas considérés nocifs en raison de l’absence de changements microscopiques. En ce qui concerne les effets sur le thymus, les auteurs ont indiqué qu’ils étaient considérés être une réponse non spécifique au stress plutôt qu’un effet d’immunosuppression dû à l’absence de tout effet dans les autres tissus lymphatiques. En ce qui concerne les effets observés dans la glande thyroïde, les auteurs ont indiqué qu’ils étaient très probablement associés à la présence d’induction enzymatique dans le foie donnant lieu à une clairance hépatique accrue de l’hormone thyroïde. Les auteurs ont établi une DSENO de 300 mg/kg pc/jour, basée sur la réduction de la consommation alimentaire, la réduction du poids corporel et la mortalité à la dose subséquente. Cependant, étant donné que les reins représentent un organe endocrinien, il ne faudrait pas négliger leurs changements de poids. En ce qui concerne le thymus, Elmore (2006) a noté qu’une diminution de la taille ou du poids du thymus est l’une des premières mesures des effets induits par les composés étant donnée la sensibilité particulière des lymphocytes corticaux (thymocytes). En l’absence d’autres analyses pour déterminer la cause de la diminution des lymphocytes corticaux ou d’autres analyses de paramètres immunitaires, les effets sur le thymus sont considérés pertinents pour la caractérisation des effets sur la santé. De même, les effets sur les glandes thyroïdes n’ont pu être écartés étant donné l’absence d’analyses hormonales et d’évaluation des enzymes hépatiques. Sur la base de ces considérations, une dose de 300 mg/kg pc/jour a été établie comme la DMENO, différente de la DSENO de 300 mg/kg pc/jour établie par les auteurs. Une perturbation du cycle lumière/obscurité résultant en un éclairage constant de la salle expérimentale a été notée. L’impact de cette erreur méthodologique sur les résultats de l’étude n’était pas clair.
Cancérogénicité et génotoxicité
Aucune étude sur la cancérogénicité du 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle n’a été trouvée. Le 2-hydroxybenzoate de méthyle a été identifié comme un analogue approprié avec des données pertinentes sur les dangers pour étayer l’évaluation de la cancérogénicité du 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle. Le 2-hydroxybenzoate de méthyle et le 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle sont tous deux des esters de l’acide 2-hydroxybenzoïque et devraient conduire au même métabolite, l’acide 2-hydroxybenzoïque (TIMES 2017). Les données disponibles sur le 2-hydroxybenzoate de méthyle suggèrent qu’il est improbable qu’il soit cancérigène (section 7.1.2). Concernant sa génotoxicité, toutes les épreuves de mutation génétique bactérienne avec du 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle ont donné des résultats négatifs (Bonin et al. 1982, Zeiger et al. 1987, Anonyme 2005, cité dans ECHA 2017f). De plus, le 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle n’a pas induit de mutations génétiques ni d’aberrations chromosomiques in vitro dans des cellules de mammifères avec ou sans activation métabolique jusqu’à des concentrations cytotoxiques (Anonyme 2005, Anonyme 2006, Anonyme 2013, tous cités dans ECHA 2017f). Bien qu’aucune épreuve de génotoxicité in vivo n’ait été effectuée, l’information disponible indique qu’il est improbable que le 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle soit génotoxique.
Toxicité pour la reproduction et le développement
Dans l’étude combinée sur la toxicité pour la reproduction/développement à dose répétée (OCDE TG 422) mentionnée précédemment, du 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle a été administré à des rats par gavage à des doses de 0, 60, 120, 300 et 750 mg/kg pc/jour avant l’accouplement, pendant les périodes d’accouplement et de gestation et jusqu’au jour 3 après l’accouchement (rapport anonyme 2013, ECHA 2017f). La taille de la portée, les naissances vivantes, les morts‑nés, le rapport entre les sexes et toute anomalie flagrante des portées ont été examinés. Tous les parents et tous les petits ont fait l’objet d’un examen macroscopique à la nécropsie ou après la mort pour identifier tout changement structurel. Aucun effet nocif lié au traitement n’a été observé jusqu’à 120 mg/kg pc/jour. À 300 mg/kg pc/jour, une augmentation statistiquement significative de la perte post-implantation a été notée, entraînant une baisse de l’indice de naissance (79,5 au lieu de 91,8 % chez le groupe témoin). À la dose de 750 mg/kg pc/jour, une diminution statistiquement significative du nombre de spermatozoïdes complets normaux (89 % comparativement à 97,3 % chez le groupe témoin), une réduction de la mobilité des spermatozoïdes et une réduction du nombre moyen de spermatozoïdes mobiles progressifs (52,4 comparativement à 72,7 %) ont été observées, bien que le nombre de spermatozoïdes n’ait pas été affecté. Les poids absolus de la prostate et des vésicules séminales étaient également significativement réduits. Chez les femelles gestantes, le nombre de corps jaunes était inférieur à celui des témoins. Chez une des femelles, la perte post-implantatoire était très élevée et la portée comptait qu’un seul petit. Les deux femelles gestantes restantes de ce groupe n’ont pas donné naissance à des petits vivants, ce qui a entraîné une réduction significative de l’indice de naissance (12,5 comparativement à 91,8 % chez les témoins). Il est à noter qu’une infertilité entraînant un faible nombre de femelles gestantes a été enregistrée chez tous les groupes, infertilité qui pourrait être due à une perturbation du cycle lumière/obscurité pendant la réalisation de cette étude. Aux doses de 60 et 120 mg/kg pc/jour, les chercheurs n’ont noté aucune indication d’un effet sur la reproduction. Toutefois, en raison du faible nombre de femelles gestantes, aucune de ces doses n’a pu être confirmée comme DSENO de façon concluante. Aucun effet sur le développement n'a été observé jusqu'à 300 mg/kg pc/jour. À la dose la plus élevée (750 mg/kg pc/jour), un seul petit avait un poids corporel inférieur à la moyenne du groupe témoin. Cela s’est produit à la dose où la toxicité maternelle était évidente, comme en témoigne la réduction du poids corporel, la réduction de la consommation alimentaire et la mortalité. Toutefois, étant donné le faible nombre de femelles gestantes, ces résultats ont été jugés équivoques. Dans l’ensemble, une DMENO de 300 mg/kg pc/jour a été établie dans la présente évaluation préalable, basée sur l’augmentation de la perte post-implantatoire et la diminution de l’indice de naissance observées dans la partie sur la reproduction/développement et basée sur des changements histopathologiques dans la glande thyroïde et le thymus observés dans la partie sur l’exposition à dose répétée. Tel que susmentionné, l’impact de la perturbation du cycle lumière/obscurité (éclairage constant de la salle expérimentale) et l’impact possible de cette erreur méthodologique sur les résultats de l’étude ne sont pas entièrement compris.
Il existe également des études sur les effets du 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle sur l’activité œstrogène. Pour ce qui est des études in vitro, leurs résultats ont été jugés équivoques (Schlumpf et al. 2001, Schreurs et al. 2002, Ma et al. 2003, Schlumpf et al. 2004, Gomez et al. 2005, Kunz et al. 2005, Schreurs et al. 2005, Kunz et Fent 2006, Kunz et al. 2006, Jimenez-Diaz et al. 2013). Cependant, les résultats sur l’activité œstrogène n’ont pas été obtenus in vivo. Au cours d’une bioépreuve utérotrophe de 3 jours pour laquelle jusqu’à 1 000 mg/kg pc/jour de 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle ont été administrés par injection sous‑cutanée à de jeunes rats Wistar (n = 6/groupe), aucun effet nocif lié au traitement n’a été observé (Anonymous 2002, cité par l’ECHA). Le 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle s’est également révélé inactif lors d’autres épreuves utérotrophes pour lesquelles des rats Long Evans (n = 4 à 6/groupe) ont reçu dans leur nourriture des doses allant jusqu’à 2100 mg/kg pc/jour pendant 3-4 jours (Schumpf et al. 2001, Schlumpf et al. 2004).
7.3.3 Caractérisation des risques pour la santé humaine
Sur la base des données disponibles, il est improbable que le 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle soit cancérogène ou génotoxique. L’étude combinée sur les effets sur le développement/reproduction et à dose répétée (OCDE TG 422) a été jugée la plus appropriée pour la caractérisation des risques d’une exposition à du 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle chez des nourrissons, des adolescents et des adultes. Une DMENO de 300 mg/kg pc/jour a été établie comme niveau d’effet critique, basée sur l’augmentation du poids des reins, des changements histopathologiques dans la glande thyroïde et le thymus, des pertes post-implantatoires accrues et de la diminution de l’indice de naissance. Cette étude a été menée après la publication du rapport produit par le SCCP (2007), dans lequel une marge de sécurité a été calculée à partir d’une DSENO de 100 mg/kg pc/jour basée sur des effets de coagulation observés à la dose subséquente (c.-à-d. 300 mg/kg pc/jour) lors d’une étude de détermination de gamme de 14 jours.
Dans le tableau 7‑17 nous donnons toutes les estimations pertinentes de l’exposition, les niveaux d’effet critique et les marges d’exposition en résultant pour la caractérisation des risques pour la santé humaine posé par le 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle.
| Scénario | Exposition systémique (mg/kg pc/jour) | Effet critique (mg/kg pc/jour) | ME |
|---|---|---|---|
| Produit de bronzage (vaporisateur) (10 %, adultes)a | 1,20 | DMENO = 300b | 250 |
| Hydratant pour le visage (30 %, adolescents)a | 0,082 | DMENO = 300b | 3658 |
| Hydratant pour le visage en aérosol (3,0 %, tout-petis) | 0,015c (conversion de 4 mg/m3) | DMENO = 300b | 20 000d |
| Hydratant pour le visage en aérosol (3,0 %, adultes) | 0,005 7c (conversion de 4 mg/m3) | DMENO = 300b | 52 632d |
a Il s’agit d’une exposition systémique estimée en utilisant une dose potentiellement absorbable de 7,63 µg/cm2 (ECHA 2017e) et des surfaces du corps et du visage par défaut tirées de Santé Canada (1998).
b DMENO = 300 mg/kg pc/jour établie sur la base de l’augmentation du poids des reins, de changements histopathologiques de la glande thyroïde et du thymus, de la perte post-implantatoire accrue et de la diminution de l’indice de naissance observés lors d’une étude combinée de toxicité à dose répétée et pour la reproduction/développement.
c Converti en exposition systémique. Tout-petits : vitesse d’inhalation de 9,3 m3/jour et poids corporel de 15,5 kg; adultes : vitesse d’inhalation de 16,2 m3/jour et poids corporel de 70,9 kg (Santé Canada 1998).
d Absorptions par voie orale et par inhalation assumées équivalentes.
Concernant l’exposition par voie cutanée au 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle due à l’utilisation de produits de bronzage, la comparaison du niveau d’effet critique et des estimations d’exposition a conduit à calculer une ME de 250, jugée potentiellement inadéquate pour tenir compte des incertitudes des bases de données sur l’exposition et les effets sur la santé. La comparaison de l’exposition due à l’utilisation d’un hydratant pour le visage et du niveau d’effet critique a conduit à calculer une ME de 3658, jugée adéquate pour tenir compte des incertitudes des bases de données sur l’exposition et les effets sur la santé.
L’exposition au 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle par inhalation due à l’utilisation d’hydratants pour le visage en aérosol par des adultes et des tout-petits a été convertie en exposition systémique et comparée au niveau d’effet critique. Des ME respectives supérieures à 20 000 ont été calculées et jugées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
7.3.4 Incertitudes de l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principale source d’incertitude | Impact |
|---|---|
| Aucune étude de toxicité chronique n’a été menée avec du 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle pour aucune voie d’exposition pertinente. Les données sur les effets à court terme ont été utilisées pour étayer l’évaluation. | +/- |
| Il existe de l’incertitude concernant l’ensemble de données sur les dangers du 2‑hydroxybenzoate de 3,3,5‑triméthycyclohexyle. L’étude combinée sur la toxicité à dose répétée et pour la reproduction/développement a été associée à des erreurs méthodologiques (c.-à-d. perturbation du cycle de la lumière), qui peuvent avoir eu un impact sur l’interprétation des effets et des niveaux d’effet. | +/- |
7.4 2-Hydroxybenzoate de 2-phényléthyle
7.4.1 Évaluation de l’exposition
Milieux de l’environnement et aliments
Aucune concentration de 2‑hydroxybenzoate de 2‑phényléthyle dans l’air, l’eau ou dans le sol n’a été trouvée. Compte tenu des faibles quantités (<100 kg) déclarées utilisées au Canada (ECCC 2017), il ne devrait pas y avoir d’exposition au 2‑hydroxybenzoate de 2‑phényléthyle due à des rejets potentiels dans l’environnement.
L’utilisation du 2‑hydroxybenzoate de 2‑phényléthyle étant permise comme aromatisant alimentaire aux États-Unis et en Europe, il est possible que cette substance soit également présente dans des aliments au Canada. Lors de sa 59ème réunion, le JECFA a évalué un groupe d’aromatisants de type hydroxybenzylique et alcoxybenzylique, et a réévalué le 2‑hydroxybenzoate de 2‑phényléthyle (JECFA 2002a, 2002b, 2002c). Dans le cadre de cette évaluation, une estimation de l’absorption per capita de 2‑hydroxybenzoate de 2‑phényléthyle due à son utilisation comme aromatisant alimentaire a été réalisée en suivant une approche MSDI. Grâce à cette approche, le JECFA a estimé une absorption de 4 µg/jour pour de la population des États-Unis (0,07 µg/kg pc/jour, basée sur un poids corporel moyen de 60 kg pour la population générale). Le JECFA a conclu que le 2‑hydroxybenzoate de 2‑phényléthyle utilisé comme aromatisant alimentaire ne pose aucun problème de sécurité aux niveaux d’absorption estimés (JECFA 2002a, 2002b, 2002c).
Produits disponibles pour les consommateurs
Selon les renseignements obtenus lors d’une enquête menée en vertu de l’article 71, le 2‑hydroxybenzoate de 2‑phényléthyle a été identifié comme ingrédient de parfum dans des cosmétiques et des produits disponibles pour les consommateurs au Canada (ECCC 2017). Les types de cosmétiques rapportés contenant du 2‑hydroxybenzoate de 2‑phényléthyle comprennent les shampooings et les après-shampooings, les nettoyants pour le corps, les antisudorifiques/déodorants, les crèmes pour la peau et les gels de rasage (ECCC 2017). Les concentrations dans ces produits étaient inférieures à 1 ppm. La présence de 2‑hydroxybenzoate de 2‑phényléthyle a également été rapportée dans des détergents à lessive, des perles parfumées pour lessive, des liquides et des feuilles d’adoucisseur de tissu et des liquides pour lave-vaisselle, à des concentrations maximales de 2 ppm et dans des assainisseurs d’air enfichables à des concentrations maximales de 500 ppm (ECCC 2017).
Lors d’une étude des ingrédients de parfum sur le 2‑hydroxybenzoate de 2‑phényléthyle, Lapczynski et al. (2007) ont estimé l’exposition maximale quotidienne par voie cutanée au 2‑hydroxybenzoate de 2‑phényléthyle due à sa présence comme ingrédient de parfum dans 10 types de produits cosmétiques représentatifs (lotion pour le corps, crème pour le visage, eau de toilette, crème parfumée, antisudorifique, shampooing, produits pour le bain, gel douche, savon de toilette et laque pour cheveux). Les auteurs ont utilisé des données obtenues lors d’une enquête réalisée en 2002 par l’International Fragrance Association (IFRA) pour calculer les 97,5ème percentiles des concentrations de 2‑hydroxybenzoate de 2‑phényléthyle dans les mélanges de parfums les plus courants (1,8827 %) et les concentrations typiques de ces mélanges pour chaque catégorie de cosmétiques (0,3 à 8 %).
Bien que dans les produits cosmétiques contenant du 2‑hydroxybenzoate de 2‑phényléthyle identifiés au Canada les concentrations soient faibles, cette substance peut être présente à des concentrations plus élevées dans d’autres cosmétiques disponibles étant donné que Lapzynski et al. (2007) ont rapporté des niveaux de 1,8827 % au 97,5ème percentile dans la composante parfum de cosmétiques. Sur la base de ces renseignements, des estimations de l’exposition au 2‑hydroxybenzoate de 2‑phényléthyle ont été faites pour des scénarios « d’observation », c’est-à-dire des scénarios qui conduisent au niveau d’exposition potentielle le plus élevé par inhalation ou par voie cutanée.
L’exposition par voie cutanée au 2‑hydroxybenzoate de 2‑phényléthyle a été estimée en utilisant des données de l’IFRA sur les concentrations de cette substance dans des produits cosmétiques représentatifs (ces valeurs étant supérieures à celles rapportées lors d’une enquête menée en vertu de l’article 71). Le scénario d’observation pour décrire l’exposition par voie cutanée à cette substance était l’utilisation d’un hydratant pour le corps qui, d’après les données de l’enquête de 2002 de l’IFRA citées dans Lapczynski et al. (2007), en contenait à une concentration de 0,0076 %. Les expositions par voie cutanée quotidienne ainsi obtenue pour les nourrissons, les tout-petits, les enfants, les adolescents et les adultes étaient respectivement de 0,025, 0,02, 0,012, 0,011 et 0,011 mg/kg pc/jour. L’exposition par inhalation au 2‑hydroxybenzoate de 2‑phényléthyle a été estimée en se basant sur utilisation dans un assainisseur d’air enfichable (ECCC 2017). En utilisant ConsExpo Web (2016), la concentration dans l’air de cette substance due à son utilisation a été estimée à 0,0027 mg/m3 (0,0016 mg/kg pc/jour pour les tout-petits).
7.4.2 Évaluation des effets sur la santé
Il n’existe actuellement aucune classification du danger pour le 2‑hydroxybenzoate de 2‑phényléthyle faite par l’EPA, l’ECHA ou le CIRC. L’ensemble de données sur les dangers du 2‑hydroxybenzoate de 2‑phényléthyle a été jugé limité. Par conséquent, des données sur des analogues, le 2-hydroxybenzoate de benzyle, le 2-hydroxybenzoate de phényle et le 2-hydroxybenzoate de méthyle, ont été utilisées pour étayer l’évaluation de ses effets sur la santé. Les deux premiers analogues diffèrent du 2‑hydroxybenzoate de 2‑phényléthyle par la présence d’un ou deux atomes de carbone au niveau du noyau aromatique et représentent donc des analogues plus proches au niveau des propriétés physico-chimiques (tableau A-2, annexe A). Toutefois, le 2‑hydroxybenzoate de 2‑phényléthyle et ses analogues devraient tous être métabolisés en un composé commun, l’acide 2-hydroxybenzoïque (Davison et al. 1961, TIMES 2017). Par conséquent, ces substances devraient avoir des profils toxicologiques similaires.
Toxicité à dose répétée
Aucune étude sur les effets du 2‑hydroxybenzoate de 2‑phényléthyle suite à son administration à dose répétée n’a été trouvée. De plus, aucune étude sur la toxicité à dose répétée pour son analogue le plus proche, le 2-hydroxybenzoate de benzyle, n’a été trouvée. Les données disponibles sur les dangers du 2-hydroxybenzoate de phényle se limitaient au résumé d’une étude de 51 jours avec des chiens beagle (Kociba et al. 1976, résumé seulement). Lors de cette étude, les chiens ont reçu du 2‑hydroxybenzoate de phényle par voie orale sous forme de capsules. Des doses de 250 mg/kg pc/jour et de 500 mg/kg pc/jour n’ont pas été tolérées par les chiens, une intolérance qui s’est manifestée par une diminution de l’appétit, du poids corporel et de l’activité. L’urine et les fèces sont devenues foncées et le pourcentage de leucocytes neutrophiles a augmenté de façon transitoire. L’activité des transaminases glutamiques pyruviques sériques et des transaminases glutamiques oxaloacétiques sériques a été élevée. Lorsque la dose a été réduite à 125 mg/kg pc/jour, les valeurs de tous les paramètres affectés sont revenues dans les limites normales. L’examen ultérieur des paramètres hématologiques, urinaires, chimiques, cliniques et morphologiques n’a révélé aucune altération liée au traitement. La DSENO a été établie à 125 mg/kg pc/jour sur la base des effets nocifs aux doses subséquentes.
Le 2-hydroxybenzoate de méthyle est un autre analogue du 2‑hydroxybenzoate de 2‑phényléthyle, dont les effets de l’administration à dose répétée ont été décrits précédemment dans la section Évaluation des effets sur la santé de l’huile de gaulthérie. Pour plus de détails, voir la section sur l’huile de gaulthérie.
Cancérogénicité et génotoxicité
Il n’existe aucune étude sur la toxicité chronique ou la cancérogénicité du 2‑hydroxybenzoate de 2‑phényléthyle, du 2‑hydroxybenzoate de benzyle ou du 2‑hydroxybenzoate de phényle. Toutefois, des études sur des animaux de laboratoire ayant reçu du 2-hydroxybenzoate de méthyle pendant deux ans n’ont révélé aucun effet cancérogène. Lors de l’étude menée par Webb et Hansen (1963), des rats Osborne‑Mendel (n = 25/sexe/groupe) ont reçu des doses de 0, 0,1, 0,5, 1 ou 2 % de 2‑hydroxybenzoate de méthyle dans leur nourriture, 6 jours par semaine pendant 2 ans, et des chiens beagle (n = 2/sexe/groupe) en ont reçu par voie orale sous forme de capsules à une dose de 0, 50, 150 ou 350 mg/kg/jour. Aucun effet cancérogène n’a été rapporté. De plus amples détails sur ces études se trouvent dans la section sur l’huile de gaulthérie. D’après cette information, le 2‑hydroxybenzoate de 2‑phényléthyle ne devrait pas être cancérogène.
Aucune étude sur la génotoxicité du 2‑hydroxybenzoate de 2‑phényléthyle n’a été trouvée. Toutefois, les données disponibles sur ses analogues, le 2‑hydroxybenzoate de benzyle, le 2-hydroxybenzoate de phényle et le 2-hydroxybenzoate de méthyle suggèrent une génotoxicité improbable. Lors d’une épreuve de mutation génétique bactérienne sur une série de souches de Salmonella typhimurium (TA100, TA1535, TA1537, TA98), aucun effet mutagène du 2-hydroxybenzoate benzyle n’a été mis en évidence (Zieger et al. 1987). Les tests sur le 2-hydroxybenzoate de phényle ont donné des résultats négatifs pour toutes les souches à l’exception de la TA100, pour laquelle la réponse a été jugée douteuse (augmentation liée à la dose insuffisamment élevée pour déclarer la mutation génétique ou augmentation non liée à la dose observée). Toutefois, des tests de suivi ultérieurs ont conduit à des résultats négatifs pour la TA100. Le 2-hydroxybenzoate de méthyle, analogue du 2-hydroxybenzoate de 2‑phényléthyle, s’est également révélé non génotoxique lors de plusieurs épreuves in vitro comme des épreuves de recombinaison (Oda et al. 1978, Kuboyama et and Fujii 1992), des épreuves de mutation génétique bactérienne (Mortelmans et al. 1986, Kuboyama etFujii 1992, Ishidate et al. 1984) et des épreuves de mutation génétique sur des cellules de mammifères (Ishidate et al. 1984).
Toxicité pour la reproduction et le développement
L’ensemble de données sur la toxicité du 2‑hydroxybenzoate de 2‑phényléthyle pour la reproduction et le développement est limité. Aucune étude avec le 2‑hydroxybenzoate de benzyle n’a été trouvée. Dans le cas du 2‑hydroxybenzoate de phényle, une étude a été réalisée sur des rates Wistar gestantes ayant reçu par gavage soit une dose de 100, 200 ou 300 mg/kg pc/jour de 2‑hydroxybenzoate de phényle (dans de la carboxyméthylcellulose à 0,5 %) du JG7 au JG12 soit une dose de 200, 300 ou 400 mg/kg pc/jour du JG7 au JG9 (Baba et coll. 1966). Au JG20, leurs fœtus ont été prélevés à des fins d’examens. À la dose de 200 mg/kg pc/jour, sept fœtus présentaient une ossification costale retardée avec des côtes dorsales ondulées. La mortalité maternelle a été observée aux doses de 300 et 400 mg/kg pc/jour, associée à une incidence élevée de résorption et de macération du fœtus. Les fœtus du groupe ayant reçu la dose la plus élevée avaient également des côtes en forme d’Y, fusionnées et ondulées. Les auteurs ont noté qu’une réduction du poids fœtal a été observée après l’administration d’une dose élevée ou d’un long traitement, mais aucune donnée n’a été présentée dans le rapport. Des cas d’exencéphalie ont également été signalés, mais la dose à laquelle ces observations ont été faites était inconnue. Bien qu’aucune analyse statistique n’ait été effectuée sur aucun des résultats, les auteurs ont conclu que l’administration de 2‑hydroxybenzoate de phényle entraînait un taux élevé de résorption et de macération et un faible taux d’anomalies chez les fœtus.
Des études sur la toxicité potentielle du 2‑hydroxybenzoate de méthyle pour le développement ont déjà été discutées. De plus amples détails peuvent être trouvés dans la section sur l’évaluation des effets sur la santé de l’huile de gaulthérie. Dans l’ensemble, bien qu’aucune étude n’ait été menée sur les effets du 2‑hydroxybenzoate 2-phényléthyle sur la reproduction et le développement, les renseignements sur les analogues suggèrent que l’exposition à cette substance devrait avoir des effets sur le développement.
Concernant l’activité œstrogène, les effets du 2‑hydroxybenzoate de 2‑phényléthyle in vivo ont été jugés non concluants. Pour une épreuve utérotrophe, des souris CD-1 femelles immatures (n = 12/groupe) ont reçu des doses de 0, 11,1, 33,3, 100 ou 300 mg/kg pc/jour de 2‑hydroxybenzoate de 2‑phényléthyle (dans l’huile d’arachide) par gavage pendant 3 jours à compter du JPN 21. Leur poids corporel a été enregistré quotidiennement tout au long de l’étude. Au JPN 24, les souris ont été pesées, sacrifiées et leur utérus disséqué. Chaque utérus a été épongé et son poids humide a été noté. Aucun décès n’est survenu dans aucun des groupes. Chez les souris ayant reçu 33,3 mg/kg pc/jour, le poids de l’utérus était significativement plus important, correspondant à 115 % de celui des témoins. Bien que les auteurs aient indiqué que les résultats de l’épreuve utérotrophe sur des souris immatures suggèrent que le 2‑hydroxybenzoate de 2‑phényléthyle pourrait exercer une activité œstrogène in vivo, aucune relation de dépendance entre le poids utérin et la dose n’a été observé (Zhang et al. 2012).
7.4.3 Caractérisation des risques pour la santé humaine
Aucune étude sur la toxicité chronique, la cancérogénicité ou la génotoxicité du 2‑hydroxybenzoate de 2‑phényléthyle n’a été trouvée. Toutefois, les renseignements sur ses analogues, la 2‑hydroxybenzoate de benzyle, le 2‑hydroxybenzoate de phényle et le 2‑hydroxybenzoate de méthyle, suggèrent qu’il est improbable qu’il soit cancérigène ou génotoxique.
Une étude sur trois générations de rats Osborne-Mendel ayant reçu du 2‑hydroxybenzoate de méthyle (Collins et al. 1971) a été jugée la plus pertinente pour la caractérisation des risques du 2‑hydroxybenzoate de 2‑phényléthyle pour tous les scénarios d’exposition chez les enfants et les adultes. Une DSENO de 75 mg/kg pc/jour a été établie comme niveau d’effet critique sur la base de la réduction observée à la dose subséquente (150 mg/kg pc/jour) de la taille de la portée, de la viabilité et de la survie des petits et du nombre de petits sevrés, en l’absence de toxicité maternelle.
Nous donnons dans le tableau 7‑19 toutes les estimations d’exposition pertinentes, les niveaux d’effet critique et les marges d’exposition en résultant pour la caractérisation des risques pour la santé humaine posés par le 2‑hydroxybenzoate de 2‑phényléthyle.
| Scénario | Exposition systémiquea (mg/kg pc/jour) | Niveau d’effet critique (mg/kg pc/jour) | Marge d’exposition (ME) |
|---|---|---|---|
| Exposition cutanée due à l’utilisation d’une lotion pour le corps(nourrissons) | 0,025 | DSENO = 75b | 3 000 |
| Exposition cutanée due à l’utilisation d’une lotion pour le corps (adultes) | 0,011 | DSENO = 75b | 6 818 |
| Absorption due à l’utilisation d’aromatisants alimentaires (adultes) |
0,00007 | DSENO = 75b | > 1 000 000 |
| Exposition par inhalation due à un assainisseur d’air enfichable (tout‑petits)b | 0,0016 (conversion de 0,0027 mg/m3) | DSENO = 75b | 46 875 |
a Converti en une exposition systémique, en assumant que l’absorption par voie cutanée est équivalente à l’absorption par voie orale.
b DSENO = 75 mg/kg pc/jour établie sur la base de la taille réduite de la portée, de la viabilité des petits, de la survie des petits, du nombre de petits sevrés à la dose subséquente de 150 mg/kg pc/jour, établie lors d’une étude par voie alimentaire sur trois générations.
Ces ME sont jugées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition. Comme cette substance est habituellement utilisée comme ingrédient de parfum, elle pourrait être présente dans de nombreux types de produits disponibles pour les consommateurs, entraînant un risque d’exposition combinée (Lapzynski et al. 2007, ECCC 2017). Toutefois, l’importante marge d’exposition au 2‑hydroxybenzoate de 2‑phényléthyle calculée pour une utilisation de lotion pour le corps (plusieurs ordres de grandeur) est jugée suffisante pour prendre en compte cette incertitude.
Bien que l’exposition de la population générale au 2‑hydroxybenzoate de 2‑phényléthyle ne soit pas préoccupante aux niveaux actuels, cette substance est jugée préoccupante pour la santé en raison de son potentiel de toxicité pour le développement (basée sur des données croisées provenant de son analogue, le 2-hydroxybenzoate de méthyle). En outre, l’acide 2-hydroxybenzoïque, l’un des métabolites prédits du 2‑hydroxybenzoate de 2‑phényléthyle (TIMES 2017), a été classé par l’ECHA dans la catégorie Repr 2 (soupçonné d’endommager l’enfant à naître). Par conséquent, il pourrait y avoir un risque pour la santé humaine si l’exposition venait à augmenter.
7.4.4 Incertitudes de l’évaluation des risques pour la santé humaine
| Principale source d’incertitude | Impact |
|---|---|
| En l’absence de données substantielles pour le Canada, les données du 95e percentile de l’IFRA ont été utilisées pour déterminer l’utilisation potentielle du 2‑hydroxybenzoate de 2‑phényléthyle. | + |
| L’absorption cutanée a été présumée équivalente à l’absorption par voie orale pour la caractérisation des risques du 2‑hydroxybenzoate de 2‑phényléthyle. | + |
| En raison du manque de données ou de données limitées sur les effets du 2‑hydroxybenzoate de 2‑phényléthyle sur la santé pour les voies et les durées d’exposition pertinentes, des données sur des substances analogues (2-hydroxybenzoate de méthyle) ont été utilisées pour étayer la caractérisation du danger de cette substance. | +/- |
+ = incertitude pouvant causer une surestimation de l’exposition/risque, - = incertitude pouvant causer une sous-estimation du risque d’exposition, +/- = possibilité non identifiée de causer une surestimation ou une sous-estimation du risque.
7.5 Extrait de Betula alba
7.5.1 Évaluation de l’exposition
La section suivante fournit des renseignements sur l’exposition à l’extrait de Betula alba. Comme cette substance présente un faible potentiel de danger (section 7.5.2), des estimations quantitatives de l’exposition de la population générale n’ont pas été faites.
Aucune donnée canadienne ou internationale récente sur les niveaux d’extrait de Betula alba dans l’air ambiant, l’air intérieur, l’eau potable, la poussière ou le sol n’a été trouvée. Toutefois, selon les renseignements soumis dans le cadre d’une enquête menée en vertu de l’article 71 (ECCC 2013), cette substance n’a pas été importée ni produite au Canada en quantités supérieures à 100 kg. Il ne devrait donc pas y avoir de potentiel d’exposition à l’extrait de Betula alba due aux milieux de l’environnement.
Compte tenu du fait qu’il n’existe aucune utilisation rapportée de l’extrait de Betula alba en tant qu’additif alimentaire, ingrédient dans des matériaux d’emballage alimentaire ou additif indirect (voir la section 4.3 - Utilisations), il ne devrait pas y avoir d’exposition de la population générale due aux aliments.
Des renseignements sur les utilisations spécifiques de l’extrait de Betula alba au Canada se trouvent dans la section Utilisations du présent rapport d’évaluation (section 4.3). Une exposition cutanée de la population générale à l’extrait de Betula alba devrait se produire étant donné son utilisation comme ingrédient dans les cosmétiques, les drogues et des produits de santé naturels.
7.5.2 Évaluation des effets sur la santé
L’extrait de Betula alba est une substance chimique de type UVCB dérivée de Betula alba. Les constituants de l’extrait de Betula alba varient selon la partie de la plante utilisée (p. ex. bourgeons, feuilles, écorce), le type de l’extrait et le procédé d’extraction. Certains des principaux composants identifiés incluent la bétuline et ses dérivés (de 10,5 à 82 %) (Laszczyk et al. 2006, Abyshev et al. 2007, Orav et al. 2011, EMEA 2014). Bien que le 2-hydroxybenzoate de méthyle représente un composant majeur chez une espèce de bouleau appelée Betula lenta, il n’a pas été identifié chez Betula alba selon l’information disponible.
Pour les extraits de Betula alba ou les principaux composants, il n’existe actuellement aucune classification du danger faite par l’EPA, l’ECHA ou le CIRC. Étant donné que l’ensemble de données sur les dangers des extraits de Betula alba était limité, les renseignements sur les principaux composants ont également été pris en compte pour l’évaluation des effets de cette substance sur la santé.
Des études sur les effets à court terme de l’extrait de Betula alba ont montré l’absence d’effets systémiques nocifs liés au traitement après l’administration par voie intrapéritonéale (i.p.) et sous-cutanée (s.c.)(Jager et al. 2008). Aucun effet histopathologique ou morphologique n’a été observé chez des rats et des chiens ayant reçu des doses allant respectivement jusqu’à 520 mg/kg pc par jour (i.p.) et 300 mg/kg pc par jour (s.c.) d’extrait de bouleau pendant 28 jours. Pour une étude sur les effets d’extraits de bouleau chez des rats ayant reçu une alimentation riche en matières grasses, des animaux qui avaient reçu jusqu’à 2500 mg/kg pc/jour d’extrait de Betula alba pendant 64 jours ne semblaient présenter aucun signe de toxicité ou de mortalité (Boqué et al. 2012).
Lors d’autres études sur les effets d’extraits de Betula alba ou de leurs composants sur l’immunosuppression (Koffuor et al. 2014), les maladies hépatiques (Di et al. 2009), le sepsis (Zhao et al. 2016), la néphrotoxicité induite par l’arsenic (Prakash et al. 2018) et la malaria (Steele et al. 1999), aucun effet nocif n’a été identifié ni rapporté.
Les données épidémiologiques sur les maladies hépatiques, les affections cutanées, le cancer et l’immunosuppression dues à l’utilisation d’extraits de Betula alba ou de leurs composants ont été associées à une faible incidence d’effets secondaires (Huyke et al. 2006, Huyke et al. 2009, Wolters Kluwer Health Inc. 2010, Shikov et al. 2011, Koffuor et al. 2014, Barret et al. 2017). Toutefois, ces effets ont été jugés légers et transitoires.
Les études chroniques sur les extraits de Betula alba et leurs composants sont actuellement limitées. Toutefois, selon les renseignements disponibles (Boyland et Mawson 1938, Pisha et al. 1995, Zuco 2002, Zhanataev et al. 2004, Jäger et al. 2008, Ciurlea et al. 2010), ces substances ne devraient pas être cancérogènes ni génotoxiques. Certains des composants semblent présenter une activité antitumorigène et ont été sélectionnés par l’Institut national du cancer pour être ajoutés au programme RAID (Rapid Access to Intervention Development), qui offre un processus formalisé permettant de transférer rapidement de nouvelles molécules du laboratoire à la clinique à des fins de tests. Bien qu’aucune étude sur la toxicité pour la reproduction ou le développement n’a été trouvée dans la littérature, des effets nocifs sur la reproduction lié au traitement n’ont pas été observés lors des études à court terme susmentionnées.
7.5.3 Caractérisation des risques pour la santé humaine
L’exposition de la population générale à l’extrait de Betula alba peut se produire suite à l’utilisation d’une vaste gamme de produits, dont des cosmétiques (hydratants, shampooings, nettoyants, produits de bronzage sans soleil, produits coiffants, etc), et de PSN utilisés pour atténuer les symptômes de maux de tête. Les expositions devraient se produire par voie orale ou cutanée.
Dans l’ensemble, étant donné l’absence d’effets systémiques observés lors des études disponibles par différentes voies d’administration (sous-cutanée, intrapéritonéale, orale et cutanée), le potentiel de danger de cette substance est jugé faible. Par conséquent, il n’a pas été jugé nécessaire de caractériser l’exposition (c.-à-d. d’établir des estimations de l’exposition) et le risque pour la santé humaine est jugé faible.
7.5.4 Incertitudes de l’évaluation des risques pour la santé humaine
Bien qu’il existe certaines incertitudes dans la base de données sur les effets sur la santé (p. ex. utilisation des données sur les dangers provenant des principaux composants, manque de données sur les voies d’administration pertinentes, manque d’études sur la toxicité chronique ou pour le développement), ainsi que certaines limites dans les bases de données sur l’exposition, étant donné que l’extrait de Betula alba n’est associé à aucun effet préoccupant sur la santé, une approche qualitative pour la caractérisation des risques est considérée appropriée dans la présente évaluation.
8. Conclusion
Compte tenu de tous les éléments de preuve avancés dans la présente ébauche d’évaluation préalable, le risque d’effets nocifs sur l’environnement dus à l’acide 2‑hydrocybenzoïque, au 2-hydroxybenzoate de 3,3,5-triméthylcyclohexyle, à l’huile de gaulthérie, au 2-hydroxybenzoate de 2-phénylééthyle et à l’extrait de Betula alba sont jugés faibles. Nous concluons que ces cinq substances ne satisfont pas aux critères des alinéas 64a) ou 64b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou sa diversité biologique et qui constituent ou peuvent constituer un danger pour l’environnement essentiel pour la vie.
Sur la base des renseignements présentés dans la présente ébauche d’évaluation préalable, nous concluons que l’huile de gaulthérie, l’acide 2‑hydroxybenzoïque et le 2‑hydroxybenzoate de 3,3,5-triméthylcyclohexyle satisfont aux critères de l’alinéa 64c) de la LCPE puisqu’ils pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaine.
Sur la base des renseignements présentés dans la présente ébauche d’évaluation préalable, nous concluons que le 2-hydroxybenzoate de 2-phényléthyle et l’extrait de Betula alba ne satisfont pas aux critères de l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaine.
Par conséquent, nous concluons que l’huile de gaulthérie, l’acide 2‑hydrobenzoïque et le 2-hydroxybenzoate de 3,3,5-triméthylcyclohexyle satisfont à un ou plusieurs des critères de l’article 64 de la LCPE, et il est conclu que le 2-hydroxybenzoate de 2‑phényléthyle et l’extrait de Betula alba ne satisfont à aucun des critères de cet article.
Il est conclu que l’acide 2-hydroxybenzoïque ne satisfait à aucun des critères de persistance ou de bioaccumulation, que le 2-hydroxybenzoate de 3,3,5‑triméthylcyclohexyle satisfait aux critères de bioaccumulation mais pas à ceux de persistance et que l’huile de gaulthérie satisfait aux critères de persistance mais pas à ceux bioaccumulation du Règlement sur la persistance et la bioaccumulation de la LCPE.
Références
Abbott D.D. et Harrisson J.W.E.; 1978; Methyl salicylate: studies of osseous changes in the rat, reproduction in the rat and mouse, and liver and kidney effects in the dog; rapport non publié de la Flavor and Extract Manufacturers Association, Washington (DC), États-Unis (disponible en anglais seulement).
Abyshev A.Z., Agaev E.M. et Guseinov A.B.; 2007; Studies of the chemical composition of birch bark extracts (Cortex betula) from the Betulaceae family; Pharm. Chem. J., 41(8), p. 22-26 (disponible en anglais seulement).
[AGDH] ministère de la Santé du gouvernement australien; 2017; Human health tier II assessment for salicylic acid and its salts ; Sydney (AU) : Department of Health, National Industrial Chemicals Notification and Assessment Scheme (NICNAS) (disponible en anglais seulement) .
Ahangarpour A., Oroojan A.A., Khorsandi L., Arzani G. et Afshari G.; 2016; Effects of betulinic acid on the male reproductive system of a streptozotocin-nicotinamide-induced diabetic mouse model; World Mens Health, 34(3), p. 209-216 (disponible en anglais seulement).
Alpen E.L., Mandel H.G., Rodwell V.W. et Smith P.K.; 1951; The metabolism of C14 carboxyl salicylic acid in the dog and in man; J. Pharmacol. Exp. Ther., 102(3), p. 150-155 (disponible en anglais seulement) .
Baba T., Nagahama M., Akiyama N. et Miki T.; 1966; Experimental production of malformations due to acetyl salicylate and phenyl salicylate in rats; Osaka City Med. J. l., 12(1), p. 23-29 (disponible en anglais seulement).
Bandurska H.; 2013; Salicylic acid: An update on biosynthesis and action in plant response to water deficit and performance under drought; dans Hayat S., Ahmad A. et Alyemeni M.N. éditeurs, Salicylic acid: Plant growth and development; New York (NY): Springer, p. 1-10 (disponible en anglais seulement).
Barret J.P., Podmelle F., Lipovy B., Rennekampff H.O., Schumann H., Schwieger-Briel A., Zahn T.R. et Metelmann H.R.; 2017; Accelerated re-epithelialization of partial-thickness skin wounds by a topical betulin gel: results of a randomized phase III clinical trials program; Burns, 43(6), p. 1284-1294 (disponible en anglais seulement).
[BDPP] Base de données sur les produits pharmaceutiques [base de données]; [modifiée le 17 juillet 2015]; Ottawa (ON) : Santé Canada.
[BDIPSN] Base de données d’ingrédients de produits de santé naturels ; [modifiée le 3 juillet 2019]; Ottawa (ON) : Santé Canada [consulté le 21 septembre 2017].
[BDPSNH] Base de données des produits de santé naturels homologués ; [modifiée le 6 février 2018]; Ottawa (ON) : Santé Canada.
Behrendt H. et Kampffmeyer H.G.; 1989; Absorption and ester cleavage of methyl salicylate by skin of single-pass perfused rabbit ears; Xenobiotica, 19(2), p. 131-141 (disponible en anglais seulement).
Belsito D., Bickers D., Bruze M., Calow P., Greim H., Hanifin J.M., Rogers A.E., Saurat J.H., Sipes I.G. et Tagami H.; 2007; A toxicologic and dermatologic assessment of salictlates when used as fragrance ingredients; Food Chem. Toxicol., 45, p. S318-S361 (disponible en anglais seulement).
Berryman D., Rondeau M. et Trudeau V.; 2014; Concentrations of medications, hormones, and other emergent contaminants in the St. Lawrence and three of its tributaries [PDF]; Ottawa (ON) : Environnement Canada [consulté le 10 décembre 2017] (disponible en anglais seulement).
Boîte à outils QSAR de l'OCDE [outil de lecture croisée]; 2016; Paris (FR) : Organisation de coopération et de développement économiques, Laboratoire de chimie mathématique (disponible en anglais seulement).
Bonin A.M., Arlauskas A.P., Angus D.S., Baker R.S.U., Gallagher C.H., Greenoak G., Lane Brown M.M., Meher-Homji K.M. et Reeve V.; 1982; UV-absorbing and other sun-protecting substances: genotoxicity of 2-ethylhexyl p-methoxycinnamate; Mut. Res., 105(5), p. 303-308 (disponible en anglais seulement).
Boqué N., Campión J., de la Iglesia R., de la Garza A.L., Milagro F.I., San Román B., Banuelos O. et Martínez J.A.; 2012; Screening of polyphenolic plant extracts for anti-obesity properties in Wistar rats; J. Sci. Food Agric., 93(5), p. 1226-1232 (disponible en anglais seulement).
Boyland E. et Mawson E.H.; 1938; CCLVII. Experiments on the chemotherapy of cancer. II. The effect of aldehydes and glucosides; Biochemistry, 32, p. 1982-1987(disponible en anglais seulement).
Brun G.L., Bernier M., Losier R., Doe K., Jackman P. et Lee H.B.; 2006; Pharmaceutically active compounds in Atlantic Canadian sewage treatment plant effluents and receiving waters, and potential for environmental effects as measured by acute and chronic aquatic toxicity; Environ. Toxicol. Chem., 25(8), p. 2163-2176 (disponible en anglais seulement).
Burdock G.A.; 2009; Fenaroli's Handbook of Flavor Ingredients, 6ème édition. Boca Raton (FL) : CRC Press [consulté le 20 mars 2018] (disponible en anglais seulement).
California Environmental Protection Agency; 2016; Aspirine; California : Office of Environmental Health Hazard Assessment (disponible en anglais seulement).
Canada; 1978; Règlement sur les aliments et drogues, C.R.C., ch. 870.
Canada; 1999; Loi canadienne sur la protection de l'environnement (1999), L.C. 1999, ch. 33; Gazette du Canada, Partie III, vol. 22, no 3.
[CCRIS] Chemical Carcinogenesis Research Information System [base de données]; 2017; Bethesda (MD) : US National Library of Medicine [mise à jour le 2 juin 2010] (disponible en anglais seulement).
[CE] Commission européenne; 2003; Technical Guidance Document on Risk Assessment, Part I [PDF] 1998; Institut pour la santé et la protection des consommateurs, Bureau européen des substances chimiques (disponible en anglais seulement).
Cekanova E., Larsson K.S., Mörck E. et Aberg G.; 1974; Interactions between salicylic acid and pyridyl-3-methanol: anti-inflammatory and teratogenic effects; Acta Pharmacol. Toxicol. (Copenh), 35(2), p. 107-118 (disponible en anglais seulement).
Celik K. et Turkez H.; 2016; Investigation of in vitro cytotoxicity and genotoxicity of wintergreen oil in rat primary neurons and N2a neuroblastoma cells; J. Essent. Oil Bear. Pl., 19(6), p. 1340-1350 (disponible en anglais seulement) .
[CTFA] Cosmetic, Toiletry and Fragrance Association; 1983; Summary of the results of surveys of the amount and frequency of use of cosmetic products by women; Rapport préparé par Pitkin B., Rodericks J.V. et Turnbull D., Environ Corporation, Washington, DC (disponible en anglais seulement).
ChemCAN [Modèle de fugacité de niveau III de 24 régions du Canada]; 2003; ver. 6.00; Peterborough (ON) : Université Trent, Canadian Centre for Environmental Modelling and Chemistry (disponible en anglais seulement).
[ChemID] ChemIDplus [base de données]; 1993-; Bethesda (MD) : National Library of Medicine des États-Unis (disponible en anglais seulement).
[ChemView] ChemView [base de données];[modifiée le 18 août 2017]; Washington (DC) : Environmental Protection Agency des États-Unis [consultée le 22 août 2017] (disponible en anglais seulement).
Cheng X., Shin Y.G., Levine B.S., Smith A.C., Tomaszewski J.E. et Breemen R.B.; 2003; Quantitative analysis of betulinic acid in mouse, rat, and dog plasma using electrospray liquid chromatography/mass spectrometry; Rapid Commun. Mass Spectrom., 17(18), p. 2089-2092 (disponible en anglais seulement).
[CIR] Cosmetic Ingredient Review Expert Panel; 2003; Safety assessment of salicylic acid, butyloctyl salicylate, calcium salicylate, C12-15 alkyl salicylate, capryloyl salicylic acid, hexyldodecyl salicylate, isocetyl salicylate, isodecyl salicylate, magnesium salicylate, MEA-salicylate, ethylhexyl salicylate, potassium salicylate, methyl salicylate, myristyl salicylate, sodium salicylate, TEA-salicylate, and tridecyl salicylate; Int. J. Toxicol., 22(suppl. 3), p. 1-108 (disponible en anglais seulement).
Ciurlea S.A., Tiulea C., Csanyi E., Berko S., Toma C.C., Dehelean C.A. et Loghin F.; 2010; A pharmacotoxicological evaluation of a betulin topical formulation tested on C57BL/6J mouse experimental nevi and skin lesions; Studia Universitatis "Vasile Goldis", Seria Stiintele Vietii, 20(4), p. 5-9 (disponible en anglais seulement).
Clayton G.D. et Clayton F.E. éditeurs; 1981; Patty’s industrial hygiene and toxicology; New York (NY) : Wiley (disponible en anglais seulement).
Clydesdale F.; 1997; Food Additives: Toxicology, Regulation and Properties; Boca Raton (FL) : CRC Press (disponible en anglais seulement).
[CNRC] Conseil national de recherches du Canada; 2011; Data gathering on chemicals released to indoor air of residences from building materials and furnishings; Institut de recherche en construction du CNRC, rapport no B3332.2; préparé pour Santé Canada, Ottawa (ON) (disponible en anglais seulement).
Collins T.F.X., Hansen W.H. et Keeler H.V.; 1971; Effect of methyl salicylate on rat reproduction; Toxicol. Appl. Pharmacol., 18(4), p. 755-765 (disponible en anglais seulement).
[CosIng] Cosmetic Ingredients and Substances [base de données]; 2017; v. 2; Bruxelles (BE), Marché intérieur, industrie, entrepreneuriat et PME [consulté le 29 août 2017] (disponible en anglais seulement).
Comeau F., Surette C., Brun G.L. et Losier; 2008; The occurrence of acidic drugs and caffeine in sewage effluents and receiving waters from three coastal watersheds in Atlantic Canada; Sci. Total Environ., 396, p. 132-146 (disponible en anglais seulement).
Cross S.E., Anderson C. et Roberts M.S.; 1998; Topical penetration of commercial salicylate esters and salts using human isolated skin and clinical microdialysis studies; Br. J. Clin. Pharmacol., 46(1), p. 29-35 (disponible en anglais seulement)
Crouse B.A., Ghoshdastidar A.J. et Tong A.Z.; 2012; The presence of acidic and neutral drugs in treated sewage effluents and receiving waters in the Cornwallis and Annapolis River watersheds and the Mill CoveStewage Treatment Plant in Nova Scotia, Canada; Environ. Res., 112, p. 92-99 (disponible en anglais seulement).
Davis D.A.P., Kraus A.L., Thompson G.A., Olerich M. et Odio M.R.; 1997; Percutaneous absorption of salicylic acid after repeated (14-day) in vivo administration to normal, acnegenic, or aged human skin; J. Pharm. Sci., 86(8), p. 896-9 (disponible en anglais seulement).
Davison C., Zimmerman E.F. et Smith P.K.; 1961; On the metabolism and toxicity of methyl salicylate; J. Pharm. Exp. Ther., 132, p. 207-211 (disponible en anglais seulement) .
Dencker L.; 1976; Tissue localization of some teratogens at early and late gestation related to fetal effects; Acta Pharmacol. Toxicol. (Copenh), 39(suppl 1), p. 1-131 (disponible en anglais seulement) .
[DGPSA] Direction générale des produits de santé et des aliments. 2013. Monographie sur les écrans solaires primaires, version 2.0 . Ottawa (ON) : Santé Canada. consulté 2017 3 oct.].
Di Y.B., Zhang G.Y., Wu G.J., Wang B.G., Gong S.L. et Zhao G.; 2009; Protective effects of betulin on alcoholic liver disease in rats; Journal of Jilin University (Medicine Edition), 35(2), p. 210-213 (disponible en anglais seulement).
Dittert L.W., Caldwell H.C., Ellison T., Irwin G.M., Rivard D.E. et Swintosky J.V.; 1968; Carbonate ester prodrugs of salicylic acid. Synthesis, solubility characteristics, in vitro enzymatic hydrolysis rates, and blood levels of total salicylate following oral administration to dogs; J. Pharm. Sci., 57(5), p. 828-831 (disponible en anglais seulement).
Duncan E.J.S., Brown A., Lundy P., Sawyer T.W., Hamilton M., Hill I. et Conley J.D.; 2002; Site-specific percutaneous absorption of methyl salicylate and VX in domestic swine; J. Appl. Toxicol., 22, p. 141-148 (disponible en anglais seulement).
[ECCC] Environnement et changement climatique Canada; 2016a; Document sur l’approche scientifique : classification du risque écologique des substances organiques ; Ottawa (ON) : gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada; 2016b; Data used to create substance-specific hazard and exposure profiles and assign risk classifications in the Ecological Risk Classification of organic substances; Gatineau (QC); disponible à l'adresse suivante : substances@ec.gc.ca (disponible en anglais seulement).
[ECCC] Environnement et changement climatique Canada; 2017; Données recueillies dans le cadre d'une initiative ciblée de collecte d'information pour les évaluations dans le cadre du Plan de gestion des produits chimiques (août 2017); Données préparées par : ECCC, Santé Canada, Programme des substances existantes (disponible en anglais seulement).
[ECCC] Environnement et changement climatique Canada; 2017b; Réseau de surveillance des produits pharmaceutiques et de soins personnels [modifié le 16 février 2017, consulté le 10 décembre 2017].
[ECCC, SC] Environnement et changement climatique Canada, Santé Canada; [modifié le 12 mars 2017]; Catégorisation des substances chimiques; Ottawa (ON) : gouvernement du Canada.
[ECHA] Agence européenne des produits chimiques; 2016; Comité d'évaluation des risques (CER); Opinion : Proposing harmonised classification and labelling at EU level of salicylic acid [PDF] ; numéro CE : 200-712-3, no CAS 69-72-7; CLH-O-0000000000141412-86-110/F (disponible en anglais seulement).
[ECHA] Agence européenne des produits chimiques; 2017a; Substance information. Birch, Betula alba, ext. CAS RN 84012-15-7 ; Helsinki (FI) : ECHA [mis à jour le 7 décembre 2017] (disponible en anglais seulement).
[ECHA] Agence européenne des produits chimiques; 2017b; Registered substances database: Registered dossier for homosalate CAS RN 118-56-9 ; Helsinki (FI) : ECHA [mis à jour le 13 octobre 2018, consulté le 1er novembre 2018] (disponible en anglais seulement).
[ECHA] Agence européenne des produits chimiques; 2017c; Brief profile: Salicylic acid; CAS RN 69-72-7; Helsinki (FI) : ECHA [modifié le 16 août 2017, consulté le 22 août 2017] (disponible en anglais seulement).
[ECHA] Agence européenne des produits chimiques; 2017d; Guidance on safe use: Salicylic acid; No CAS 69-72-7 ; Helsinki (FI) : ECHA [mis à jour le 4 octobre 2017] (disponible en anglais seulement).
[ECHA] Agence européenne des produits chimiques; 2017e; Brief profile: Homosalate, CAS RN 118-56-9 ; Helsinki (FI) : ECHA [mis à jour le 16 août 2017, consulté le 22 août 2017] (disponible en anglais seulement).
[ECHA] Agence européenne des produits chimiques; 2017f; Guidance on safe use: Homosalate, No CAS 118-56-9 ; Helsinki (FI) : ECHA [mis à jour le 23 avril 2017] (disponible en anglais seulement).
[ECHA] Agence européenne des produits chimiques; 2018; Classification et étiquetage harmonisés – consultations antérieures. Salicylate de méthyle ; Helsinki (FI) : ECHA [modifié en décembre 2018, [consulté le 9 janvier 2019] (disponible en anglais seulement).
E.I. Dupont de Nemours & Co.; 1973; Maternal toxicity, embryotoxicity and teratogenic potential of neoprene accelerators applied to skin of rats during organogenesis; Microfiche no OTS055656789, ancien identificateur du document : 86940000194 (disponible en anglais seulement).
Elmore S.A.; 2006; Enhanced histopathology of the thymus; Toxicol. Path., 34(5), p. 656-665 (disponible en anglais seulement).
El-Obeid H.A. et Hassan M.M.A.; 1979; PMR assay of essential oils : II. Assay of methylsalicylate in wintergreen oil; Spectrosc. Lett., 12(7&8), p. 555-557 (disponible en anglais seulement).
[EMEA] Agence européenne des médicaments; 2014; European Union herbal monograph on Betula pendula Roth and/or Betula pubescens Ehrh as well as hybrids of both species, folium [PDF]; Comité des médicaments à base de plantes (disponible en anglais seulement).
Environnement Canada; 2013; Données de la Mise à jour de l'inventaire de la LIS recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement de 1999 : Avis concernant certaines substances inscrites sur la Liste intérieure; Données préparées par : Environnement Canada, Santé Canada, Programme des substances existantes.
[EPI Suite] Estimation Program Interface Suite for Microsoft Windows [modèle d'estimation]; c2000-2012; version. 4.11; Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics ; Syracuse (NY) : Syracuse Research Corporation (disponible en anglais seulement).
Eriksson M. et Larsson K.S.; 1968; Premature birth induced in mice by salicylate; Nature, 220(5165), p. 385 (disponible en anglais seulement).
EU Food Flavourings Database [base de données] [modifiée en 2016]; Bruxelles (BE) : Commission européenne, Direction générale de la santé et des consommateurs [consultée le 1er mars 2018] (disponible en anglais seulement).
[FDA] Food and Drug Administration des États-Unis; 2006; Application Number 22-029. Pharmacology Review(s) [PDF]; Silver Spring (MD) : Department of Health & Human Services des États-Unis (disponible en anglais seulement).
[FSS] Fiche signatétique de sécurité; 2015; Sunlight Ultra Liquid Dish Detergent - Orange Antibacterial 750mL; Wilton (CT) : Sun Products [consulté le 10 décembre 2017] (disponible en anglais seulement).
Ficheux A.S., Wesolek N., Chevillotte G. et Roudot A.C.; 2015; Consumption of cosmetic products by the French population. First part: Frequency data; Food Chem. Toxicol., 78 p. 159-169 (disponible en anglais seulement).
Ficheux A.S., Chevillotte G., Wesolek N., Morisset T., Dornic N., Bernard A., Bertho A., Romanet A., Leroy L., Mercat A.C., Creusot T., Simon E. et Roudot A.C.; 2016; Consumption of cosmetic products by the French population. Second part: Amount data; Food Chem. Toxicol., 90, p. 130-141 (disponible en anglais seulement).
Gage J.C.; 1970; The subacute inhalation toxicity of 109 industrial chemicals; Br. J. Ind. Med., 27(1), p. 1-18. (disponible en anglais seulement).
Giri A.K., Adhikari N. et Khan K.A.; 1996; Comparative genotoxicity of six salicylic acid derivatives in bone morow cells of mice souris; Mutat. Res., 370(1), p. 1-9 (disponible en anglais seulement).
Goggelmann W. et Schimmer O.; 1986; Mutagenic activity of phytotherapeutical drugs; Prog. Clinical Biol. Research, 206, p. 63-72 (disponible en anglais seulement).
Gomez E., Pillon A., Fenet H., Rosain D., Duchesne M.J., Nicolas J.C., Balaguer P. et Casellas C.; 2005; Estrogenic activity of cosmetic components in reporter cell lines: parabens, UV screens, and musks; J. Toxicol. Environ. Health A, 68(4), p. 239-251 (disponible en anglais seulement).
GoodGuide; 2018; Salicylic Acid [consulté le 3 mars 2018] (disponible en anglais seulement).
Hall R.L. et Oser B.L.; 1965; Recent progress in the consideration of flavoring ingredients under the food additives amendment; Food Technol., 19(2), p. 151-197 (disponible en anglais seulement).
Henderson J.T., Whitlock E.P., O'Connor E., Senger C.A., Thompson J.H. et Rowland M.G.; 2014; Low-dose aspirin for the prevention of morbidity and mortality from preeclampsia : a systematic evidence review for the U.S. Preventive Services Task Force. Evidence synthesis No. 112; AHRQ Publication No. 14-05207-EF-1; Rockville (MD): Agency for Healthcare Research and Quality (disponible en anglais seulement).
Hopkins Z.R. et Blaney L.; 2016; An aggregate analysis of personal care products in the environment: Identifying the distribution of environmentally-relevant concentrations; Environment International, 92-93, p. 301-316 (disponible en anglais seulement).
Huyke C., Laszczyk M., Scheffler A., Ernst R. et Schempp C.M.; 2006; Treatment of actinic keratosis with birch bark extract: a pilot study; J. Dtsch Dermatol. Ges., 4(2), p. 132-137 (disponible en anglais seulement).
Huyke C., Reuter J., Rödig M., Kersten A., Laszczyk M., Scheffler A., Nashan D. et Schempp C.; 2009; Treatment of actinic keratosis with a novel betulin-based oleogel. A prospective, randomized, comparative pilot study; J. Dtsch Dermatol. Ges., 7(2), p. 128-133 (disponible en anglais seulement).
Infurna R., Beyer B., Twitty L., Koehler G., Daughtrey W.; 1990; P47. Evaluation of the dermal absorption and teratogenic potential of methyl salicylate in a petroleum based grease [résumé seulement]; Teratology Society Abstracts, p. 566 (disponible en anglais seulement).
Ishidate M., Sofuni J.R., Yoshikawa K., Hayashi M., Nohmi T., Sawada M. et Matsuoka A.; 1984; Primary mutagenicity screening of food additives currently used in Japan; Food and Chemical Toxicology, 22(8), p. 623-636 (disponible en anglais seulement).
[ITIS] Système intégré d'information taxonomique [base de données]; 2017a; Résultats de recherche pour Betula alba L. (disponible en anglais seulement).
[ITIS] Système intégré d'information taxonomique [base de données]; 2017b; Résultats de recherche pour Betula pubescens ssp. pubescens Ehrh. (disponible en anglais seulement).
Jäger S., Laszczyk M.N. et Scheffler A.; 2008; A preliminary pharmacokinetic study of betulin, the main pentacyclic triterpene from extract of outer bark of birch (Betulae alba cortex); Molecules, 13(12), p. 3224-3235 (disponible en anglais seulement).
[JECFA] Comité mixte FAO/OMS d'experts des additifs alimentaires; 1962; Evaluation of the toxicity of a number of antimicrobials and antioxidants [PDF] ; Genève, Suisse : Organisation mondiale de la santé (disponible en anglais seulement).
[JECFA] Comité mixte FAO/OMS d'experts des additifs alimentaires; 2002a; Safety evaluation of certain food additives and contaminants: hydroxyl- and alkoxy-substituted benzyl derivatives ; Genève, Suisse : Organisation mondiale de la santé (WHO Food Additives Series: 48) (disponible en anglais seulement).
[JECFA] Comité mixte FAO/OMS d'experts des additifs alimentaires; 2002b; Evaluation of certain food additives and contaminants [PDF]; Fifty-seventh report of the Joint FAO/WHO Expert Committee on Food Additives; Genève, Suisse : Organisation mondiale de la santé (WHO Technical Report Series 909) (disponible en anglais seulement).
[JECFA] Comité mixte FAO/OMS d'experts des additifs alimentaires; 2002c; Evaluation of certain food additives and contaminants [PDF]; Fifty-ninth report of the Joint FAO/WHO Expert Committee on Food Additives; Genève, Suisse : Organisation mondiale de la santé (WHO Technical Report Series 913) (disponible en anglais seulement).
Jiménez-Díaz I., Molina-Molina J.M., Zafra-Gómez A., Ballesteros O., Navalón A., Real M., Sáenz J.M., Fernández M.F. et Olea N.; 2013; Simultaneous determination of the UV filters benzyl salicylate, phenyl salicylate, octyl salicylate, homosalate, 3-(4-methylbenzylidine) camphor and 3-benzylidene camphor in human placental tissue by LC-MS/MS. Assessment of their in vitro endocrine activity; J. Chromatogr. B., Analyt. Technol. Biomed. Life Sci. B, 936, p. 80-87 (disponible en anglais seulement).
Jine Y., Lis M., Szczypka M., Obminska-Mrukowicz B.; 2012; Influence of betulinic acid on lymphocyte subsets and humoral immune response in mice; Pol. J. Vet. Sci., 15(2), p. 305-313 (disponible en anglais seulement).
Kim T.H., Shin B.S., Kim K.B., Shin S.W., Seok S.H., Kim M.K., Kim E.J., Kim D., Kim M.G., Park E.S., Kim J.Y. et Yoo S.D.; 2014; Percutaneous absorption, disposition, and exposure assessment of homosalate, a UV filtering agent, in rats; J. Toxicol. Environ. Health A, 77(4), p. 202-213 (disponible en anglais seulement).
Kociba R.J., Kalnins R.V., Wade C.E., Garfield E.L. et Fishbeck W.A.; 1976; Elevated urinary phenol levels in dogs ingesting Salo [résumé]; Toxicol. Appl. Pharmacol., 37, p. 93-192 (disponible en anglais seulement).
Koffuor G.A., Dickson R., Gbedema S.Y., Ekuadzi E., Dapaah G. et Otoo L.F.; 2014; The immunostimulatory and antimicrobial property of two herbal decoctions used in the management of HIV/AIDS in Ghana; Afr. J. Tradit. Complement. Altern. Med., 11(3), p. 166-172 (disponible en anglais seulement).
Kone M., Cologgi D.L., Lu W., Smith D.W. et Ulrich A.C.; 2013; Pharmaceuticals in Canadian sewage treatment plant effluents and surface waters: occurrence and environmental risk assessment; Environ. Technol. Rev., 2(1), p. 17-27 (disponible en anglais seulement).
Koshakji R.P., Schulert A.R.; 1973; Biochemical mechanisms of salicylate teratology in the rat; Biochem. Pharmacol., 22(3), p. 407-416 (disponible en anglais seulement).
Krause M., Klit A., Blomberg Jensen M., Soeborg T., Frederiksen H., Schlumpf M., Lichtensteiger W., Skakkebaek N.E. et Drzewieck K.T.; 2012; Sunscreens: are they beneficial for health? An overview of endocrine disrupting properties of UV filters; Int. J. Androl., 35(3), p. 424-436 (disponible en anglais seulement).
Kuboyama N. et Fujii A.; 1992; Mutagenicity of analgesics, their derivatives, and anti-inflammatory drugs with S9 mix of several animal species; J. Nihon Univ. Sch. Dent., 34(3), p. 183-195 (disponible en anglais seulement).
Kunz P.Y. et Fent K.; 2006; Multiple hormonal activities of UV filters and comparison of in vivo and in vitro estrogenic activity of ethyl-4-aminobenzoate in fish; Aquat. Toxicol., 79(4), p. 305-324 (disponible en anglais seulement).
Kunz P.Y., Galicia H.F. et Fent K.; 2006; Comparison of in vitro and in vivo estrogenic activity of UV filters in fish; Toxicol. Sci., 90(2), p. 349-361 (disponible en anglais seulement).
Lapczynski A., McGinty D., Jones L., Bhatia S., Letizia C.S. et Api A.M.; 2007; Fragrance material review on phenethyl salicylate; Food Chem. Toxicol., 45, p. 467-471 (disponible en anglais seulement).
Laszcyzk M., Jäger S., Simon-Haarhaus B., Scheffler A. et Schempp C.M.; 2006; Physical, chemical and pharmacological characterization of a new oleogel-forming triterpene extract from the outer bark of birch (Betulae cortex); Planta Med., 72(15), p. 1389-1395 (disponible en anglais seulement).
Larsson K.S. et Eriksson M.; 1966; Salicylate-induced fetal death and malformations in two mouse strains; Acta Paediatr. Scand., 55(6), p. 569-576 (disponible en anglais seulement).
Liberati T.A., Roe B.J. et Feuston M.H.; 2002; An oral (gavage) control embryo-fetal development study in the Wistar Hannover rat; Drug Chem. Toxicol., 25(1), p. 109-130 (disponible en anglais seulement).
Loretz L.G., Api A.M., Barraj L.M., Burdick J., Dressler W.E., Gettings S.D., Han Hsu H., Pan Y.H.L., Re T.A., Renskers K.J., Rothenstein A., Scrafford C.G. et Sewall C.; 2005; Exposure data for cosmetic products: lipstick, body lotion, and face cream; Food Chem. Toxicol., 43, p. 279-291 (disponible en anglais seulement).
Loretz L., Api A.M., Barraj L., Burdick J., Davis D.A., Dressler W., Gilberti E., Jarrett G., Mann S., Pan Y.H.L., Re T., Renskers K., Scrafford C. et Vater S.; 2006; Exposure data for personal care products: Hairspray, spray perfume, liquid foundation, shampoo, body wash, and solid antiperspirant; Food Chem. Toxicol., 44, p. 2008-2018 (disponible en anglais seulement).
Loretz L.G., Api A.M., Babcock L., Barraj L.M., Burdick J., Cater K.C., Jarrett G., Mann S., Pan Y.H.L., Re T.A., Renskers K.J. et Scrafford C.G.; 2008; Exposure data for cosmetic products: Facial cleanser, hair conditioner, and eye shadow; Food Chem. Toxicol., 46, p. 1516-1524 (disponible en anglais seulement).
Ma R., Cotton B., Lichtensteiger W. et Schlumpf M.; 2003; UV filters with antagonistic action at androgen receptors in the MDA-kb2 cell transcriptional-activation assay; Toxicol. Sci., 74(1), p. 43-50 (disponible en anglais seulement).
McCann J., Choi E., Yamasaki E. et Ames B.N.; 1975; Detection of carcinogens as mutagens in the Salmonella / microsome test: Assay of 300 chemicals; Proc. Nat. Acad. Sci., 72(12), p. 5135-5139 (disponible en anglais seulement).
Megwa S.A., Benson H.A.E. et Roberts M.S.; 1995; Percutaneous absorption of salicylates from some commercially available topical products containing methyl salicylate or salicylate salts in rats; J. Pharm. Pharmacol., 47, p. 891-896 (disponible en anglais seulement).
Moody R.P., Akram M., Dickson E. et Chu I.; 2007; In vitro dermal absorption of methyl salicylate, ethyl parathion, and malathion: First responder safety; J. Toxicol. Environ. Health A, 70, p. 985-999 (disponible en anglais seulement).
Morra P., Bartle W.R., Walker S.E., Lee S.N., Bowles S.K. et Reeves R.A; 1996; Serum concentrations of salicylic acid following topically applied salicylate derivatives; The Annals of Pharmacotherapy, 30, p. 935-940 (disponible en anglais seulement).
Mortelmans K., Haworth S., Lawlor T., Speck W., Tainer B. et Zeiger E.; 1986; Salmonella mutagenicity tests: II. Results from the testing of 270 chemicals; Environ. Mutagen., 8(suppl. 7), p. 1-119 (disponible en anglais seulement).
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme; 2015; Public Report: Benzoic Acid, 2-hydroxy, 2-butyloctyl ester; Sydney (Australie) (disponible en anglais seulement).
[NIOSH] National Institute for Occupational Safety and Health; 1973; Health Hazard Evaluation Report 71-10-48; Hazard Evaluation Services Branch, Division of Technical Services; Cincinnati (OH) : É.-U. Department of Health, Education, and Welfare [accès restreint] (disponible en anglais seulement).
Noritake K., Ikeda T., Ito K., Miwa Y., Senuma M., Takashima H., Tateishi T., Hisada S. et Maki E.; 2013; A study for collecting background data on Wistar Hannover [Crl:WI(Han)] rats in embryo-fetal development studies – comparative data to Sprague-Dawley rats; J. Toxicol. Sci., 38(6), p. 847-854 (disponible en anglais seulement).
[NTP] National Toxicology Program (États-Unis); 1984a; Methyl salicylate: reproduction and fertility assessment in CD-1 mice when administered by gavage; Research Triangle Park (NC) : É.-U. Department of Health and Human Services, National Toxicology Program (disponible en anglais seulement).
[NTP] National Toxicology Program (États-Unis); 1984b; Methyl salicylate: fertility assessment in CD-1 mice when administered by gavage; Research Triangle Park (NC) : É.-U. Department of Health and Human Services, National Toxicology Program (disponible en anglais seulement).
[NTP] National Toxicology Program (États-Unis); 2007; NTP technical report on the photocarcinogenesis study of glycolic acid and salicylic acid (CAS Nos 79-14-1 and 69-72-7) in SKH-1 mice (simulated solar light and topical application study); Research Triangle Park (NC) : É.-U. Department of Health and Human Services, National Toxicology Program (disponible en anglais seulement).
Oda Y., Hamono Y., Inoue K., Yamamamoto H., Niihara T. et Kunita N.; 1978; Mutagenicity of food flavors in bacteria; Shokuhin Eisei Hen, 9, p. 177-181 (disponible en anglais seulement).
Opdyke D.L.J. éditeur; 1968; Monographs on fragrance raw materials. A collection of monographs originally appearing in Food and Cosmetics Toxicology. An International Journal: Methyl salicylate; Oxford (Royaume-Uni) : Presse Pregamon (disponible en anglais seulement).
Opdyke D.L.J.; 1978; Fragrance raw materials monographs: Phenethyl salicylate; Food Cosmet. Toxicol., 16(suppl 1), p. 849 (disponible en anglais seulement).
Orav A., Arak E., Boikova T. et Raal A.; 2011; Essential oil in Betula spp. leaves naturally growing in Estonia; Biochem. Syst. Ecol., 39, p. 744-748 (disponible en anglais seulement).
Ozaki H., Sugihara K., Tamura Y., Fujino C., Watanabe Y., Uramaru N., Sone T., Ohta S. et Kitamura S.; 2015; Hydrolytic metabolism of phenyl and benzyl salicylates, fragrances and flavoring agents in foods, by microsomes of rat and human tissues; Food Chem. Toxicol., 86, p. 116-123 (disponible en anglais seulement).
Packman E.W., Abbott D.D., Wagner B.M. et Harrisson J.W.E.; 1961; Chronic oral toxicity of oil sweet birch (methyl salicylate) [résumé]; Pharmacologist, 3, p. 62 (disponible en anglais seulement).
Paterson J.R., Srivastava R., Baxter G.J., Graham A.B. et Lawrence J.R.; 2006; Salicylic acid content of spices and its implications; J. Agric. Food Chem., 54, p. 2891-2896 (disponible en anglais seulement).
Pisha E., Chai H., Lee I.S., Chagwedera T.E., Farnsworth N.R., Cordell G.A., Beecher C.W.W., Fong H.H.S., Kinghorn D., Brown D.M., Wani M.C., Wall M.E., Hieken T.J., Gupta T.K.D. et Pezzuto J.M.; 1995; Discovery of betulinic acid as a selective inhibitor of human melanoma that functions by induction of apoptosis; Nature Medicine, 1(10), p. 1046-1051 (disponible en anglais seulement).
Prakash B., Surendran A., Chandraprabha V.R., Pettamanna A. et Nair H.N.R.; 2018; Betulinic acid, natural pentacyclic triterpenoid prevents arsenic-induced nephrotoxicity in male Wistar rats; Comp. Clin. Pathol., 27(1), p. 37-44 [Publié en ligne le 13 septembre 2017] (disponible en anglais seulement).
Rapport d'étude sans nom. 2013. Étude confidentielle non publiée soumise à Santé Canada. Ottawa (ON) : Bureau d'évaluation du risque des substances existantes. Rapport reçu le 23 février 2018. (disponible en anglais seulement)
[REACH] Registration, Evaluation, Authorisation and Restriction of Chemicals; 2005; Dépôt du dossier d'enregistrement (disponible en anglais seulement).
Rodriguez A.S., Sanz M.R., Betancort, Rodriguez J.R.B.; 2015; Occurrence of eight UV filters in beached of Gran Canaria. An approach to environmental risk assessment; Chemosphere, 131, p. 85-90 (disponible en anglais seulement).
Rumiantsev G.I., Novikov S.M., Andrusov V.E., Mel'nikova N.N. et Semenovykh L.N.; 1992; Hygienic standardization of methyl salicylate in the air of workplace; Gigiena Sanitariia, 7-8, p. 28-31 [article en russe; résumé en anglais disponible].
Santé Canada; 1994; Loi canadienne sur la protection de l'environnement : L’évaluation du risque à la santé humaine pour les substances d’intérêt prioritaire; Ottawa (ON) : gouvernement du Canada.
Santé Canada; 1998; Exposure factors for assessing total daily intake of priority substances by the general population of Canada; rapport non publié; Ottawa (ON) : Santé Canada, Direction de l'hygiène du milieu (disponible en anglais seulement).
Santé Canada; 2013; Monographie sur les écrans solaires primaires; Ottawa (ON) : Direction générale des produits de santé et des aliments de Santé Canada [consulté le 23 octobre 2017].
Santé Canada; 2013; Supporting documentation: summary tables of health effects information for methylenediphenyl diisocyanates and diamines; Ottawa (ON) : Santé Canada; Renseignements à l'appui à l'évaluation préalable du groupe de substances DMI/MDA; disponible à l'adresse suivante : substances@ec.gc.ca (disponible en anglais seulement).
Santé Canada; 2014; Essence de thym et essence de gaulthérie [PDF]; Décision d'homologation RD2014-22; Ottawa (ON) : Santé Canada [consulté le 10 décembre 2017].
Santé Canada; [modifié le 14 décembre 2015]; Liste critique des ingrédients de cosmétiques : liste des ingrédients dont l'usage est interdit dans les cosmétiques; Ottawa (ON) : Santé Canada, Direction de la sécurité des produits de consommation [consulté le 10 décembre 2017]..
Santé Canada; 2016; Traitement de l'acné; Ottawa (ON) : gouvernement du Canada .
Santé Canada; 2018a; Monographie sur les écrans solaires primaires; Direction générale des produits de santé et des aliments, Ottawa (ON) : gouvernement du Canada [consulté le 22 janvier 2019].
Santé Canada; 2018b; Monographie sur les écrans solaires secondaires; Direction générale des produits de santé et des aliments, Ottawa (ON) : gouvernement du Canada [consulté le 22 janvier 2019].
[SCCNFP] Comité scientifique des produits de consommation et des produits non alimentaires destinés aux consommateurs; 2002; Opinion on salicylic acid [PDF] ; Bruxelles (BE) : Commission européenne [consulté le 10 octobre 2017] (disponible en anglais seulement).
[SCCP] Comité scientifique des produits de consommation; 2007; Opinion on homosalate [PDF]; Bruxelles, Belgique : Commission européenne [consulté le 10 octobre 2017] (disponible en anglais seulement).
[SCCS] Comité scientifique européen pour la sécurité des consommateurs; 2016; The SCCS notes of guidance for the testing of cosmetic ingredients and their safety evaluation [PDF]. Document n° SCCS/1564/15 [PDF] ; Bruxelles (BE) : Direction générale de la santé et de la sécurité alimentaire [consulté le 10 décembre 2017] (disponible en anglais seulement).
Schreurs R., Lanser P., Seinen W. et Burg B.; 2002; Estrogenic activity of UV filters determined by an in vitro reporter gene assay and an in vivo transgenic zebrafish assay; Arch. Toxicol., 76(5-6), p. 257-261 (disponible en anglais seulement).
Schreurs R.H.M.M., Sonneveld E., Jansen J.H.J., Seinen W. et Burg B.; 2005; Interaction of polycyclic musks and UV filters with the estrogen receptor (ER), androgen receptor (AR), and progesterone receptor (PR) in receptor gene bioassays; Toxicol. Sci., 83(2), p. 264-272 (disponible en anglais seulement).
Schlumpf M., Cotton B., Conscience M., Haller V., Steinmann B. et Lichtensteiger W.; 2001; In vitro and in vivo estrogenicity of UV screens; Environ. Health Perspect.; 109(3), p. 239-244 (disponible en anglais seulement).
Schlumpf M., Schmid P., Durrer S., Conscience M., Maerkel K., Henseler M., Gruetter M., Herzog I., Reolon S., Ceccatelli R., Faass O., Stutz E., Jarry H., Wuttke W. et Lichtensteiger W.; 2004; Endocrine activity and developmental toxicity of cosmetic UV filters – an update; Toxicology, 205(1-2), p. 113-122 (disponible en anglais seulement).
Servos M.R., Smith M., McInnis R., Burnison B.K., Lee B.H., Seto P. et Backus S.; 2007; The presence of selected pharmaceuticals and the antimicrobial triclosan in drinking water in Ontario, Canada; Water Qual. Res. J., 42(2), p. 130-137 (disponible en anglais seulement).
Sexton W.J. et Jarow J.P.; 1997; Effect of diabetes mellitus upon male reproductive function; Urology, 49(4), p. 508-513 (disponible en anglais seulement).
Shikov A.N., Djachuk G.I., Sergeev D.V., Pozharitskaya O.N., Esaulenko E.V., Kosman V.M. et Mararov V.G.; 2011; Birch bark extract as therapy for chronic hepatitis C – a pilot study; Phytomedicine, 18(10), p. 807-810 (disponible en anglais seulement).
Steele J.C.P., Warhurst D.C., Kirby G.C. et Simmonds M.S.J.; 1999; In vitro and in vivo evaluation of betulinic acid as an antimalarial; Phytother. Res., 13(2), p. 115-119 (disponible en anglais seulement).
Strong L.C.; 1932; Possible effect of oil of Gaultheria in diet of mice susceptible to spontaneous carcinoma of the breast. I. A suggestion; Proc. Soc. Exp. Biol. Med., 30(3), p. 386-390 (disponible en anglais seulement).
Strong L.C.; 1934; Possible effect of oil of Gaultheria in diet of mice susceptible to spontaneous carcinoma of the breast. II. A latent period; Am. J. Cancer Res., 20(2), p. 387-389 (disponible en anglais seulement).
Strong L.C.; 1935; Possible effect of oil of Gaultheria in diet of mice susceptible to spontaneous carcinoma of the breast. III. Survival time; Am. J. Cancer Res., 25(4), p. 797-801 (disponible en anglais seulement).
Strong L.C.; 1936; Possible effect of oil of Gaultheria in diet of mice susceptible to spontaneous carcinoma of the mammary gland. V. Growth rate and certain retrogressive changes of tumours after onset of malignancy; Am. J. Cancer Res., 28(3), p. 550-558 (disponible en anglais seulement).
Swain A.R., Dutton S.P. et Truswell A.S.; 1985; Salicylates in foods; J. Am. Diet Assoc., 85(8), p. 950-960 (disponible en anglais seulement).
Tanaka S., Kawashima K., Nakaura S., Nagao S., Kuwamura T., Takanaka A. et Omori Y.; 1973a; Studies on the teratogenicity of food additives (3). Teratogenic effect of dietary salicylic acid in rats; Food Hyg. Safe Sci., 14(6), p. 549-557 (disponible en anglais seulement).
Tanaka S., Kawashima K., Nakaura S., Nagao S., Kuwamura T., Takanaka A. et Omori Y.; 1973b; Studies on teratogenic effects of salicylic acid and aspirin in rats as related to fetal distribution; Cong. Anom., 13(2), p. 73-84 (disponible en anglais seulement).
Tashiro Y. et Kameda Y.; 2013; Concentration of organic sun-blocking agents in seawater of beaches and coral reefs of Okinawa Island, Japan; Marine Pollution Bulletin, 77, p. 333-340 (disponible en anglais seulement).
The Essential Oil Company; 2017; Percent yield guide for essential oil distillation [consulté le 10 décembre 2017] (disponible en anglais seulement).
[TIMES] Tissue Metabolism Simulator [module de prédiction]; 2017; ver.2.27.19; Bourgas (BG) : Université "Prof. Dr Assen Zlatarov", Laboratoire de Chimie Mathématique (disponible en anglais seulement).
Tisserand R. et Young R.; 2014; Essential Oil Safety; 2ème edition, Londres (Royaume-Uni) : Churchill Livingstone (disponible en anglais seulement).
[TSCA] Toxic Substances Control Act Chemical Substance Inventory [base de données]; [mise à jour en juin 2017]; Search Results for CAS RN 68917-75-9; Washington (DC) : Environmental Protection Agency des États-Unis (disponible en anglais seulement).
Udeani G.O., Zhao G.M., Geun Shin Y., Cooke B.P., Graham J., Beecher C.W.W., Kinghorn A.D. et Pezzuto J.M.; 1999; Pharmacokinetics and tissue distribution of betulinic acid in CD-1 mice; Biopharmaceutics & Drug Disposition, 20(8), p. 379-383 (disponible en anglais seulement).
Umeda M.; 1957; T Screening tests of various chemical substances as carcinogenic hazards (report 1); Gann. Jpn. J Cancer Res., 48(1), p. 57-64 (disponible en anglais seulement).
[UE] Union européenne; 2018; Commission Regulation (EU) 2018/1480 of 4 October 2018 amending, for the purposes of its adaptation to technical and scientific progress, Regulation (EC) No 1272/2008 of the European Parliament and of the Council on classification, labelling and packaging of substances and mixtures and correcting Commission Regulation (EU) 2017/776 [PDF]. Journal officiel de l’Union européenne 5.10.2018 (disponible en anglais seulement).
[US eCFR] Code of Federal Regulations Title 21 [base de données] ; [modifié le 1er avril 2017]; Silver Springs (MD) : Food and Drug Administration des États-Unis [consulté le 10 décembre 2017] (disponible en anglais seulement).
Verenitch S.S., Christopher J.L. et Mazumder A.; 2006; Determination of acidic drugs and caffeine in municipal wastewaters and receiving waters by gas chromatography—ion trap tandem mass spectrometry; J. Chromatography, 1116, p. 193-203 (disponible en anglais seulement).
Walker R.M., Chang P.K. et Martin R.A.; 1989; Effects of salicylate on rat liver in short-term toxicity studies; Biochem. Pharmacol., 38(2), p. 382-384 (disponible en anglais seulement).
Waltman R., Tricomi V., Shabanah E.H. et Arenas R.; 1973; The effect of anti-inflammatory drugs on parturition parameters in the rat; Prostaglandines, 4(1), p. 93-106 (disponible en anglais seulement).
Webb W.K. et Hansen W.H.; 1963; Chronic and subacute toxicology and pathology of methyl salicylate in dogs, rats, and rabbits; Toxicol. Appl. Pharmacol., 5(5), p. 576-587 (disponible en anglais seulement).
Wilson R., Jones-Otazo H., Petrovic S., Mitchell I., Bonvalot Y., Williams D. et Richardson G.M.; 2013; Revisiting dust and soil ingestion rates based on hand-to-mouth transfer; Human and Ecological Risk Assessment, 19(1), p. 158-188 (disponible en anglais seulement).
Wolowich W.R., Hadley C.M., Kelley M.T., Walson P.D. et Casavant M.J.; 2003; Plasma salicylate from methyl salicylate cream compared to oil of wintergreen; Journal of Toxicology Clinical Toxicology, 41(4), p. 355-358 (disponible en anglais seulement).
Wolters Kluwer Health Inc.; 2010; Antineoplastics/antibacterials: cutaneous toxicity, treated with betulin emulsions: 15 case reports; Reactions Weekly, 2010 October 16, p. 9; Academic OneFile [consulté le 12 juin 2017] (disponible en anglais seulement).
Wood A., Baxter G., Thies F., Kyle J. et Duthie G.; 2011; A systematic review of salicylates in foods: Estimated daily intake of a Scottish Population; Mol. Nutr. Food Res., 55, p. 7-14 (disponible en anglais seulement).
Wormuth M., Scheringer M., Vollenweider M. et Hungerbuhler K.; 2006; What are the sources of exposure to eight frequently used phthalic acid esters in Europeans?; Risk Anal., 26(3), p. 803-824 (disponible en anglais seulement).
Wu X., Bennett D.H., Ritz B., Cassady D.L., Lee K. et Hertz-Picciotto I.; 2010; Usage pattern of personal care products in California households; Food Chem. Toxicol., 48, p. 3109-3119 (disponible en anglais seulement).
Zeiger E., Anderson B., Haworth S., Lawlor T., Mortelmans K. et Speck W.; 1987; Salmonella mutagenicity tests: III. Results from the testing of 255 chemicals; Environ. Mutagen., 9(suppl 9), p. 1-110 (disponible en anglais seulement).
Zhanataev A.K., Presnova G.A., Chistyakov A.N. et Durnev A.D.; 2004; Effect of betula bark extract on spontaneous and induced mutagenesis in mice; Bulletin of Experimental Biology and Medicine, 138(5), p. 475-478 (disponible en anglais seulement).
Zhang Z., Jia C., Hu Y., Sun L., Jiao J., Zhao L., Zhu D., Li J., Tian Y., Bai H., Li R. et Hu J.; 2012; The estrogenic potential of salicylate esters and their possible risks in foods and cosmetics; Toxicology Letters, 209(2), p. 146-153 (disponible en anglais seulement).
Zhao H., Liu Z., Liu W., Han X. et Zhao M.; 2016; Betulin attenuates lung and liver injuries in sepsis; Int. Immunopharmacol., 30, p. 50-56 (disponible en anglais seulement).
Zuco V., Supino R., Righetti S.C., Cleris L., Marchesi E., Gambacorti-Passerini C. et Formelli F.; 2002; Selective cytotoxicity of betulinic acid on tumor cell lines, but not on normal cells; Cancer Letters, 175(1), p. 17-25 (disponible en anglais seulement).
Annexe A. Approche de lecture croisée
| Considération | Justification |
|---|---|
| 1) Structure chimique. L’accent a été mis sur les analogues qui représentaient des esters de l’acide 2-hydroxybenzoïque. | Les analogues ayant une structure chimique similaire devraient posséder des propriétés physico-chimiques similaires, suivre des voies métaboliques similaires et présenter une réactivité similaire. |
| 2) Métabolites similaires (prédits ou observés). Les esters de l’acide 2‑hydroxybenzoïque devraient tous être hydrolysés pour produire de l’acide 2‑hydroxybenzoïque et l’alcool correspondant. La vitesse d’hydrolyse de la liaison ester dépend de la longueur de la chaîne ou de l’encombrement du groupe substituant attaché à l’acide 2‑hydroxybenzoïque (Dittert et al. 1968). | Les analogues métabolisés par des voies similaires en des produits de dégradation similaires devraient présenter des profils de toxicité similaires. |
| 3) Alertes structurelles communes | Les analogues présentant des alertes structurelles similaires devraient présenter une plus grande similarité en termes de toxicité. |
| 4) Propriétés physico-chimiques similaires. L’accent a été mis sur les structures chimiques ayant des poids moléculaires, des solubilités dans l’eau, des pressions de vapeur et des log Koe similaires. | Les analogues ayant des propriétés physico-chimiques similaires peuvent potentiellement avoir des profils toxicologiques similaires. |
| 5) Disponibilité des données sur les effets sur la santé | Seuls les analogues ayant des données sur les dangers d’une qualité suffisante ont été jugés appropriés pour une lecture croisée. |
| - | Acide 2‑hydroxy-benzoïque | 2‑hydroxy-benzoate de méthyle | 2‑hydroxy-benzoate de phényle | 2‑hydroxy-benzoate de benzyle | 2‑hydroxy-benzoate de 2‑phényléthyle | 2‑hydroxy-benzoate de 3,3,5‑triméthylcyclohexyle |
|---|---|---|---|---|---|---|
| No CAS | 69-72-7 | 119-36-8 | 118-55-8 | 118-58-1 | 87-22-9 | 118-56-9 |
| Structure |  |
 |
 |
 |
 |
 |
| PM (g/mol) | 138,12 | 152,15 | 214,22 | 228,25 | 242,27 | 262,35 |
| Pression de vapeur (Pa) | 0,01 | 4,6 | 1,1E -3 | 4,5E -4 | 1,9E -04 | 0,013 |
| Constante de Henry (atm.m3/mol) | 7,34E -9 | 7,9E -8 | 1,68E -6 | 3,67E -7 | 4,87E -07 | 1,93E -05 |
| Solubilité dans l’eau (mg/L) | 2240 | 700 | 150 | 24,6 | 7,2 à 7,8 | 0,4 |
| log Koe | 2,26 | 2,55 | 3,8 | 4,3 | 4,80 | > 6 |
| DL50 orale (g/kg) | 0,5 à 1,3 | 0,7 à 2,1 | 3 | 2,2 | > 5 | > 5 |
| DL50 cutanée (g/kg) | > 2 à 10 | - | > 5 | > 5 à 14 | > 5 | > 5 |
| Génotoxicité | Négative | Négative | Équivoque | Négative | - | Négative |
| Cancérogénicité | - | Négative | - | - | - | - |
| Toxicité pour la reproduction et le développement (mg/kg pc/jour) | DSENO : 75 (réduction de la taille de la portée, du poids corporel et de la longueur du corps et de la queue du fœtus, incidence élevée de malformations, taux de sevrage réduit à la dose subséquente de 150 mg/kg p.c./jour, en l’absence de toxicité maternelle)a | DSENO : 75 (viabilité réduite des petits, survie des petits, nombre de petits sevrés à la dose suivante de 150 mg/kg pc/jour, en l’absence de toxicité maternelle)b DSENO : 100 (réduction du poids moyen ajusté des petits à la dose suivante de 250 mg/kg pc/jour, en l’absence de toxicité maternelle)c | DMENO : 100 (cas d’encéphalie rapportés, mais la dose à laquelle ces observations ont été faites n’était pas connue. Par conséquent, la présomption est faite qu’il s’agit de la dose la plus faible.)d. | - | - | DMENO : 300 (augmentation de la perte post-implantatoin et diminution de l’indice de naissance)e |
* Sauf indication contraire, les données proviennent de ChemID (1993-) et de la section Propriétés physiques et chimiques du présent rapport.
Références : a) Tanaka et al. 1973 b, b) Collins et al. 1971, c) NTP 1984b ; d) Baba et al. 1966, e) Rapport d’étude anonyme 2013
Annexe B. Expositions potentielles des humains estimées aux substances du groupe des salicylates
Nous présentons dans les tableaux B-1, B-2 et B-3 les paramètres et les hypothèses utilisés pour les estimations de l’exposition par voie cutanée, orale et respiratoire aux cosmétiques, aux médicaments et aux produits de santé naturels pour les groupes d’âge pertinents. Pour les produits utilisés une fois ou plus par jour, l’exposition a été assumée quotidienne. Pour les produits utilisés moins d’une fois par jour, l’estimation de l’exposition a été estimée pour le jour de l’utilisation (c.-à-d. une valeur de 1 a été utilisée pour toute fréquence < 1 pour estimer l’exposition le jour de l’utilisation). L’absorption par voie cutanée de l’huile de gaulthérie et du 2-hydroxybenzoate de 2‑phényléthyle est assumée équivalente à l’absorption par voie orale. L’absorption par voie cutanée de l’acide 2-hydroxybenzoïque a été assumée à 60 % (Davis et al. 1997).
Les estimations de l’exposition pour les groupes d’âge pertinents étaient basées sur les poids corporels suivants (Santé Canada, 1998) :
Nourrissons (de 0 à 0,5 an) : 7,5 kg
Tout-petits (de 0,5 à 4 ans) : 15,5 kg
Enfants (de 5 à 11 ans) : 31,0 kg
Adolescents (de 12 à 19 ans) : 59,4 kg
Adultes (de 20 à 59 ans) : 70,9 kg
| Scénario d’exposition | Hypothèses |
|---|---|
| Hydratant pour le corps | Fréquence d’exposition (par jour) : Nourrissons : 0,8a Tout-petits : 0,8a Enfants : 0,8 b Adolescents : 0,8 b Adultes : 1a Quantité de produit (g)c : Nourrissons : 1,4 Tout-petits : 1,4 Enfants : 2,2 Adolescents : 8,7 Adultes : 10 |
| Produit de bronzage (acide 2-hydroxybenzoïque) | Quantité de produit (adultes, g) : 4d |
| Hydratant pour le visage | Quantité de produit (g) : Adolescents, adultes : 1,2d Fréquence d’exposition (par jour) : Adultes, adolescents : 1,8d |
| Hydratant pour les mains | Fréquence d’exposition (par jour) : Adolescents : 2,1d Quantité de produit (g) : Adolescents : 1,5e |
| Hydratant pour les pieds | Fréquence d’exposition (par jour) : Adolescents : 0,95d Quantité de produit (g) : Adolescents : 3,6c |
| Huile de massage | Quantité de produit (g)c : Adolescents : 2,8 Enfants : 2,3 Tout-petits : 1,8 |
| Antitsudorifique / déodorant (exposition cutanée au pulvérisateur) | Fréquence d’exposition (par jour)b : Enfants : 1,1 Adolescents : 1,1 Adultes : 1,3 Quantité de produit (g)d : Enfants : 0,3 Adolescents : 0,5 Adultes : 0,6 |
| Produit de rasage | Quantité de produit (g) : 1,6f |
| Produit coiffant (exposition cutanée par le pulvérisateur ou la pompe) | Fréquence d’exposition (par jour) Enfants, adolescents : 0,63 b Adultes : 1,51 g Quantité de produit(g) : Adultes, adolescents, enfants : 3,64 g Facteur de rétention : 0,1 |
| Colorant capillaire permanent | Quantité de produit (g) : Adolescents, adultes : 100 h Facteur de rétention : 0,1 h |
| Maquillage pour les yeux (démaquillant) | Fréquence d’exposition (par jour) : Adolescents, adultes : 0,46i Quantité de produit (g) : Adolescents, adultes : 0,5j |
| Produit pour le bain (savon liquide pour le corps) | Fréquence d’exposition (par jour)a Nourrissons : 0,85 Tout-petits : 0,85 Enfants : 0,93 Adolescents : 1,0 Adultes : 1,4 Quantité de produit (g)a : Nourrissons : 4,6 Tout-petits: 4,6 Enfants : 5,9 Adolescents : 11 Adultes : 11 |
| Shampooing | Fréquence d’exposition (par jour) Nourrissons : 0,1i Tout-petits: 0,45 b Enfans : 1,1 g Adolescents : 1,1 g Adultes : 1,1 g Quantité de produit (g) : Nourrissons : 0,5i Tout-petits: 8,1 g Enfants : 11,8 g Adolescents : 11,8 g Adultes : 11,8 g |
| Après-shampooing (sans rinçage) | Fréquence d’exposition (par jour) Tout-petits: 0,45 b Enfants : 0,5 b Adolescents : 1,1k Adultes : 1,1k Quantité de produit (g)k : Tout-petits: 8,1 Enfants, adolescents, adultes : 11,8 Facteur de rétention : 0,1 |
| Laque pour cheveux, acide 2-hydroxybenzoïque (inhalation)h | Concentration : 0,1 % Modèle d’exposition : libération instantanée Durée d’exposition : 5 min Volume de la pièce : 10 m3 (salle de bain) Vitesse de ventilation : 2,5/h (salle de bain) Hauteur de la pièce : 2,5 m Fraction non respirable absorbée : 1 |
| Hydratant pour le visage, 2‑hydroxybenzoate de 3,3,5‑triméthylcyclohexyle (aérosol, inhalation)h | Concentration : 3,0 % Durée d’exposition : 5 min Volume de la pièce : 10 m3 (salle de bain) Taux de ventilation : 2,5/h (salle de bain) Hauteur de la pièce : 2,5 m (hauteur normale) Fraction non respirable absorbée : 1 |
a Ficheux et al 2015
b Wu et al. 2010
c Ficheux et al. 2016
d Loretz et al. 2005
e ConsExpo Web 2016
f Wormuth et al. 2006
g Loretz et al 2006
h ConsExpo Web 2016
i CTFA 1983
j CE 2003
k Loretz et al. 2008
| Scénario d’exposition | Hypothèses |
|---|---|
| Crème analgésiquea (acide 2‑hydroxybenzoïque et huile de gaulthérie) | Superficie : la surface exposée assumée est environ ½ la surface d’un tronc, Santé Canada (1998). Quantité de produit : estimées en fonction des facteurs d’ajustement de la surface corporelle dérivés de l’utilisation d’un hydratant corporel (Ficheux et al. 2016). Fréquence : 4x/joura Absorption cutanée : 60 % (Davis et al. 1997, pour l’acide 2-hydroybenzoïque) |
| Comprimés d’antiacides/antiacides liquides (acide 2‑hydroxybenzoïque et huile de gaulthérie)a,b | |
| Écran solaire (acide 2‑hydroxybenzoïque)a | Concentration : 0,14 %a Quantité de produit par jourc (g) : Tout-petits : 5,4 Enfants : 6,3 Adolescents : 18,2 Adultes : 18,2 Fréquence (/jour)d : Tout-petits: 1,6 Enfants : 1,4 Adolescents : 1,4 Adultes : 1,4 |
| Assainisseur d’air enfichable (2‑hydroxybenzoate de 2-phényléthyle)e | Modèle d’exposition : exposition à la vapeur - vitesse constante Quantité de produit : 1,7 g Concentration : < 1ppmf Durée d’exposition : 24 h Volume de la pièce : 20 m3 Débit de ventilation : 0,6/h Durée d’émission : 24 h |
a Communication personnelle, courriels de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, décembre 2016, non référencé.
b Communication personnelle, courriels de la Direction des produits thérapeutiques de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, décembre 2016, non référencé.
c Ficheux et al. 2016
d Ficheux et al. 2015
e ConsExpo Web 2016
f ECCC 2017
Exposition cutanée au 2-hydroxybenzoate de 3,3,5-triméthylcyclohexyle
La dose absorbable potentielle de 2-hydroxybenzoate de 3,3,5-triméthylcyclohexyle tirée de l’étude d’absorption cutanée de la ligne directrice 428 de l’OCDE (ECHA 2017e) a été utilisée pour caractériser l’exposition systémique au 2-hydroxybenzoate de 3,3,5-triméthylcyclohexyle par voie cutanée pour différents scénarios. Les algorithmes suivants ont été utilisés :
Exposition systémique par événement = (SE x DAP)/PC
et
Charge cutanée (totale) = Conc x Quantité de produit x FR x F)/SE
où :
SE = surface exposée de la peau
DAP = dose absorbable potentielle (plus de 24 heures d’exposition)
F = fréquence d’exposition (incorporée seulement si > 1)
Conc = concentration
FR = facteur de rétention
Quand la DAP était inférieure à la charge cutanée (totale), l’exposition systémique par événement a été utilisée pour caractériser l’exposition systémique étant donné l’absence d’épuisement complet de la dose, sinon la charge cutanée (totale) a été utilisée (en raison de l’épuisement complet de la dose). Lorsque « F » est supérieur à une fois par jour, l’exposition systémique par événement peut être utilisée comme estimation de l’exposition systémique quotidienne. En d’autres termes, aucun ajustement pour la fréquence d’exposition ne serait nécessaire, quel que soit le nombre d’applications du produit au cours d’une période de 24 heures, puisque la DAP représente la quantité cumulative absorbée sur 24 heures.
| Scénario d’exposition d’obsevation | Groupe d’âge | Charge cutanée (mg/cm2) | Dose absorbable potentielle (mg/cm2)a | Exposition systémique (mg/kg pc) |
|---|---|---|---|---|
| Hydratant pour le visage (30 %) | Adolescents | 1012 b | 0,00763 | 0,082c |
| Produit de bronzage (10 %) | Adultes | 0,123d | 0,00763 | 1,20c |
a Dose absorbable potentielle = quantité de 2-hydroxybenzoate de 3,3,5-triméthylcyclohexyle appliquée dans l’étude d’absorption cutanée (0,544 9 mg/cm2, ECHA 2017e) * % d’absorption observée dans l’étude (1,4 % sur 24 heures, ECHA 2017e). De légères différences peuvent apparaître en raison des arrondissements.
b Charge cutanée = 1,2 g (Loertz et al. 2005) * concentration de 2-hydroxybenzoate de 3,3,5-triméthylcyclohexyle * 1000 mg/g (conversion unitaire) * 1,8 application par jour (Loretz et al. 2005) / 637 cm2 (correspondant à l’application du produit sur le visage selon les valeurs par défaut déterminées par Santé Canada 1998). ). De légères différences peuvent apparaître en raison des arrondissements.
c Exposition systémique = (DAP * SE)/PC
d Charge cutanée = 5,2 g (Ficheux et al. 2015) * concentration de 2-hydroxybenzoate de 3,3,5-triméthylcyclohexyle * 1000 mg/g * 4 applications par jour (jugement professionnel) / 11 192,5 cm2 (correspondant à l’application du produit sur le visage, les bras, les jambes, les mains et les pieds, selon les valeurs par défaut déterminées par Santé Canada 1998). De légères différences peuvent apparaître en raison des arrondissements.
