Ébauche d’évaluation préalable groupe des aminoalcools et des alcanolamides gras
Titre officiel: Ébauche d’évaluation préalable groupe des aminoalcools et des alcanolamides gras
Environnement et Changement climatique Canada
Santé Canada
Juillet 2020
Sommaire
En vertu des articles 68 et 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), les ministres de l’Environnement et de la Santé ont réalisé l’évaluation préalable de 11 substances appelées, collectivement et dans le cadre du Plan de gestion des produits chimiques, substances du groupe des aminoalcools et des alcanolamides gras. Les substances de ce groupe ont été jugées prioritaires pour une évaluation, car elles satisfont aux critères de catégorisation énoncés au paragraphe 73(1) de la LCPE ou suscitent d’autres préoccupations pour la santé humaine. Une substance supplémentaire (NE CAS 85204-21-3) a été incluse dans cette évaluation car elle a été jugée prioritaire à la suite de l’approche décrite pour l’identification des priorités d’évaluation des risques (IPER). Leur numéro d’enregistrement du Chemical Abstracts Service (NE CASNote de bas de page 1 ), leur nom dans la Liste intérieure des substances (Liste intérieure ou LI) et leur abréviation sont présentés dans le tableau ci-dessous. Les huit aminoalcools visés dans la présente évaluation préalable ont initialement été appelés substances du groupe des alcanolamines dans le Plan de gestion des produits chimiques, tandis que les trois alcanolamides gras (NE CAS 120-40-1, 142-78-9 et 68603-42-9) ont été retirés du groupe des amides gras, car ils pourraient contenir des résidus d’aminoalcools (c.‑à‑d., NE CAS 141-43-5 ou 111-42-2).
| NE CAS | Sous-groupe | Nom sur la LI | Abréviation |
|---|---|---|---|
| 141-43-5 | 1 | 2-Aminoéthanol | MEA |
| 100-37-8 | 1 | 2-Diéthylaminoéthanol | DEEA |
| 142-78-9 | 1 | N-(2-Hydroxyéthyl)dodécanamide | LME |
| 111-42-2 | 2A | Diéthanolamine (et ses sels) | DEA |
| 120-40-1 | 2A | N,N-Bis(2-hydroxyéthyl)dodécanamide | LDE |
| 68603-42-9a | 2A | Amides de coco, N,N-bis(hydroxyéthyle) | CDE |
| 61791-31-9a | 2B | 2,2’-Iminodiéthanol, dérivés N-alkyles de coco | CADEA |
| 61791-44-4a | 2B | 2,2’-Iminodiéthanol, dérivés N-alkyles de suif | TADEA |
| 102-71-6 | 3 | 2,2’,2’’-Nitrilotriéthanol | TEA |
| 122-20-3b | 3 | 1,1’,1’’-Nitrilotripropan-2-ol | TIPA |
| 85204-21-3 a,c | 3 | Acide 4-[(2-éthylhexyl)amino]-4-oxoisocrotonique, composé avec le 2,2’,2’’-nitrilotris[éthanol] (1:1) | BATEA |
a La substance de ce NE CAS est un UVCB (substance de composition inconnue ou variable, produit de réaction complexe ou matière biologique).
b Cette substance n’a pas été désignée au sens du paragraphe 73(1) de la LCPE, mais elle est visée par la présente évaluation, car elle a été jugée prioritaire pour une évaluation en raison d’autres préoccupations pour la santé humaine.
c Cette substance n’a pas été désignée au sens du paragraphe 73(1) de la LCPE, mais elle est visée par la présente évaluation, car elle a été jugée prioritaire pour une évaluation par suite de l’application de l’approche décrite pour l’Identification des priorités d’évaluation des risques (IPER).
Le MEA est produit de façon endogène chez les humains, les animaux et les végétaux. Le DEA peut également être isolé à partir des végétaux, mais le MEA est la seule substance du groupe présente naturellement dans les aliments. Les substances du groupe des aminoalcools et des alcanolamides gras, à l’exception du MEA et du BATEA, ont été ajoutées dans une enquête menée en vertu de l’article 71 de la LCPE. Seuls la DEA (100 000 à 1 000 000 kg), le CDE (1 000 000 à 10 000 000 kg), le TADEA (1 000 000 à 10 000 000 kg) et le TEA (10 000 à 100 000 kg) ont été déclarés être fabriqués au Canada en 2011 en quantités supérieures au seuil de déclaration de 100 kg. Les quantités fabriquées de MEA au Canada ne sont pas disponibles. La même année, toutes les substances déclarées du groupe des aminoalcools et des alcanolamides gras ont été importées au Canada en 2011 en quantités supérieures au seuil de déclaration de 100 kg, variant de 10 000 à 100 000 kg (pour le CADEA et le LME) et de 1 000 000 à 10 000 000 kg (pour le CDE). D’après la Base de données du Commerce international de marchandises du Canada (CIMC), les quantités totales de MEA importées au Canada entre 2014 et 2017 ont varié de 23 806 266 kg (2015) à 28 829 405 kg (2017). Bien que les quantités fabriquées et importées ne soient pas connues pour le BATEA, le BATEA n’a pas été trouvé dans les produits disponibles pour les consommateurs.
Les substances du groupe des aminoalcools et des alcanolamides gras sont utilisées dans une vaste gamme d’applications industrielles et domestiques comme agents antistatiques, inhibiteurs de corrosion, émulsifiants, stabilisants de mousse, intermédiaires chimiques, agents d’ajustement du pH, surfactants et modificateurs de viscosité. Les utilisations de BATEA par la population générale du Canada n’ont pas été recensées, mais les autres substances du groupe des aminoalcools et des alcanolamides gras peuvent être présentes dans les aliments (MEA) ou peuvent être utilisées dans des matériaux d’emballage alimentaire (MEA, DEEA, DEA, LDE, CDE, CADEA, TADEA, TEA et TIPA), les cosmétiques (MEA, LME, LDE, CDE, TEA et TIPA), les médicaments (MEA, DEA, CDE et TEA), les produits de santé naturels et sans ordonnance (MEA, DEA, LDE et CDE, TEA, TIPA), divers produits nettoyants domestiques (MEA, DEA, CDE, CADEA, TEA et LME) et d’autres produits disponibles aux consommateurs.
Les risques pour l’environnement associés aux substances du groupe des aminoalcools et des alcanolamides gras ont été caractérisés à l’aide de l’approche de Classification du risque écologique des substances organiques (CRE), une approche fondée sur le risque qui tient compte de multiples paramètres liés au risque et à l’exposition et de la pondération de nombreuses données probantes pour catégoriser le risque. Les profils de danger sont principalement fondés sur des paramètres tels que le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dans le réseau trophique, la biodisponibilité, et l’activité chimique et biologique. Les paramètres pris en compte pour les profils d’exposition sont les taux d’émission potentiels, la persistance globale et le potentiel de transport à grande distance. Une matrice de risques est utilisée pour attribuer aux substances un potentiel faible, moyen ou élevé selon leurs profils de danger et d’exposition. D’après les résultats de l’analyse de CRE, on considère que les 11 substances du groupe des aminoalcools et des alcanolamides gras ne causeront probablement pas d’effet nocif pour l’environnement.
Compte tenu de tous les éléments de preuve contenus dans la présente ébauche d’évaluation préalable, le MEA, le DEEA, le LME, la DEA, le LDE, le CDE, le CADEA, le TADEA, le TEA, le TIPA et le BATEA présentent un risque faible de causer des effets nocifs pour l’environnement. Il est proposé de conclure que les 11 substances du groupe des aminoalcools et des alcanolamides gras ne satisfont pas aux critères énoncés aux alinéas 64a) et b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, et à mettre en danger l’environnement essentiel pour la vie.
En ce qui concerne l’évaluation pour la santé humaine, les substances de la présente évaluation préalable ont été classées en trois sous-groupes (les composés monohydroxyles, dihydroxyles et trihydroxyles) en fonction du nombre de groupements alcanol liés à l’atome d’azote dans un groupe amine ou amide. La population générale du Canada peut être exposée aux substances de ce groupe par l’air et l’eau potable, ainsi que par l’utilisation de produits disponibles aux consommateurs.
Dans des études de laboratoire, le composé monohydroxyle MEA a affecté des paramètres de la reproduction et le larynx. La comparaison entre les concentrations du MEA auxquelles la population générale pourrait être exposée par la présence naturelle de cette substance dans des aliments et celles associées à son utilisation dans les nettoyants tout usage en aérosols, utilisation associée à des effets critiques, a donné lieu à une marge d’exposition qui est jugée suffisante pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé. Le DEEA a eu des effets sur le foie et le poids corporel. La comparaison entre les concentrations auxquelles la population générale pourrait être exposée par son utilisation dans les encaustiques et cires pour planchers et celles associées à des effets critiques ont donné lieu à des marges qui sont considérées comme suffisantes pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé. Le LME est considéré comme peu préoccupant pour la santé humaine, compte tenu des données sur les effets sur la santé humaine associés à des substances de structure similaire et le risque est donc jugé faible.
La DEA, le LDE et le CDE sont des composés dihydroxyles. Le LDE et le CDE ont le potentiel de contenir des résidus de DEA. Le Centre international de recherche sur le cancer a classé la DEA et le CDE comme potentiellement cancérigènes pour les humains, mais il n’a pas évalué le LDE. Des études en laboratoire ont montré une augmentation de l’incidence des tumeurs du foie dues à la DEA, ainsi qu’au LDE et au CDE, en raison de la présence de DEA résiduelle. Des effets non cancéreux sur les reins et le foie ont également été observés avec la DEA, le LDE et le CDE, ainsi que des effets non cancéreux supplémentaires dans le sang avec la DEA. Pour la DEA, le LDE et le CDE, une comparaison des niveaux auxquels la population générale peut être exposée par l’eau potable (DEA, CDE) ou par l’utilisation potentielle de matériaux d’emballage alimentaire (LDE uniquement), et l’utilisation de produits disponibles pour les consommateurs (y compris la DEA dans la peinture murale et le détergent à vaisselle, la LDE dans le savon pour le corps et la CDE dans le shampoing) avec des niveaux d’effet critique a permis d’établir des marges d’exposition qui sont jugées adéquates pour tenir compte des incertitudes dans les bases de données sur les effets sur la santé et l’exposition. Le présent document contient une évaluation des risques de cancer posés par la DEA. Les marges entre les niveaux d’exposition de la population générale provenant des expositions quotidiennes à la DEA et les effets du cancer ont été jugées adéquates. Les marges devraient également être adéquates pour les effets cancérogènes des expositions journalières au LDE ou au CDE, étant donné la quantité relativement faible de DEA attendue dans le LDE ou le CDE.
Le CADEA et le TADEA sont des composés dihydroxyles qui sont des 2,2’‑iminodiéthanol gras. Dans des études en laboratoires, le CADEA a affecté des paramètres de la reproduction. La comparaison entre les concentrations de CADEA auxquelles la population générale pourrait être exposée par son utilisation possible dans des matériaux d’emballage alimentaire et de produits disponibles aux consommateurs et celles associées à des effets critiques a donné lieu à des marges d’exposition qui sont jugées suffisantes pour tenir compte des incertitudes dans la base de données sur l’exposition et les effets sur la santé. Dans des études en laboratoire, le TADEA a affecté le poids corporel. La comparaison entre les concentrations du TADEA auxquelles la population générale pourrait être exposée par son utilisation possible dans des matériaux d’emballage alimentaire et de produits disponibles aux consommateurs et celles associées à des effets critiques a donné lieu à des marges d’exposition d’exposition qui sont considérées comme suffisantes pour tenir compte des incertitudes dans la base de données sur l’exposition et les effets sur la santé.
Le TEA, le TIPA et le BATEA sont des composés trihydroxyles. Dans des études en laboratoire, le TEA a causé la formation de tumeurs hépatiques et a affecté des paramètres de la reproduction. La comparaison entre les concentrations de la substance auxquelles la population générale pourrait être exposée par l’utilisation de dentifrice non fluoré et de produits disponibles aux consommateurs et celles associées à des effets critiques a donné lieu à des marges d’exposition qui sont jugées suffisantes pour tenir compte des incertitudes dans la base de données concernant les effets sur la santé et l'exposition pour les effets cancérogènes et non cancérogènes. Aucun effet pour la santé n’a été signalé dans les études en laboratoire réalisées avec le TIPA. Donc, le risque pour la population générale est considéré comme faible. Le BATEA n’a pas été défini comme étant très dangereux pour la santé humaine, d’après le classement fait par d’autres organismes nationaux ou internationaux sur le plan de la cancérogénicité, de la génotoxicité, de la toxicité pour le développement et de la reproduction. Les concentrations de BATEA dans le milieu environnemental sont considérées comme minimes étant donné son utilisation limitée attendue au Canada. De même, le BATEA n’a pas été trouvé dans les produits disponibles aux consommateurs.
Il est proposé de conclure que le MEA, le DEEA, le LME, la DEA, le LDE, le CDE, le CADEA, le TADEA, le TEA, le TIPA et le BATEA ne satisfont pas au critère énoncé à l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Par conséquent, il est proposé de conclure que les 11 substances du groupe des alcanolamines et des alcanolamides gras ne répondent à aucun des critères énoncés à l’article 64 de la LCPE.
1. Introduction
En vertu des articles 68 et 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE], les ministres de l’Environnement et de la Santé ont réalisé l’évaluation préalable de 11 substances appelées, collectivement et dans le cadre du Plan de gestion des produits chimiques, les substances du groupe des aminoalcools et des alcanolamides gras, pour déterminer si elles présentent ou peuvent présenter un risque pour l’environnement ou la santé humaine. Les substances de ce groupe ont été jugées prioritaires pour l’évaluation, car elles satisfont aux critères de catégorisation énoncés à l’alinéa 73(1) de la LCPE ou suscitent des préoccupations pour la santé humaine (ECCC, SC [modifié en 2017]). Une autre substance a été ajoutée à la présente évaluation parce qu’elle a été jugée prioritaire par suite de l’application de l’approche décrite pour l’Identification des priorités d’évaluation des risques (IPER).
Les risques pour l’environnement associés aux substances du groupe des aminoalcools et des alcanolamides gras ont été caractérisés à l’aide de l’approche de Classification du risque écologique (CRE) des substances organiques (ECCC 2016a). La CRE permet de décrire le danger associé à une substance à l’aide de paramètres clés, notamment le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dans le réseau trophique, la biodisponibilité et l’activité chimique et biologique, et d’évaluer l’exposition possible des organismes des milieux terrestres ou aquatiques et de facteurs tels que les taux d’émission potentiels, la persistance globale et le potentiel de transport atmosphérique à grande distance. On combine les différentes données probantes pour déterminer si les substances nécessitent une évaluation approfondie de leur potentiel à causer des effets nocifs pour l’environnement ou si elles ont une probabilité faible de causer de tels effets pour l’environnement.
Certaines substances du groupe des aminoalcools et des alcanolamides gras faisant actuellement l’objet d’une évaluation ont été examinées à l’étranger par l’Organisation de coopération et de développement économiques (OCDE) dans le cadre du Programme d’évaluation coopérative des produits chimiques, et l’ensemble de données d’évaluation (SIDS) et les rapports d’évaluation initiale du SIDS (SIAR) sont accessibles. Ces évaluations sont soumises à un examen rigoureux et à l’approbation des autorités gouvernementales internationales. Santé Canada et Environnement et Changement climatique Canada sont des participants actifs à ce processus et considèrent ces évaluations comme fiables. Dans la présente évaluation préalable, les SIAR de l’OCDE ont servi à éclairer la caractérisation des effets sur la santé. En outre, les effets sur la santé des substances du groupe des aminoalcools et des alcanolamides gras ont été examinés par l’Australian National Industrial Chemicals Notification and Assessment Scheme (NICNAS), l’Environmental Protection Agency des États‑Unis (US EPA), le Centre international de recherche sur le cancer (CIRC) et le National Toxicology Program (NTP) des États‑Unis. Les examens réalisés par ces institutions sont également utilisés pour éclairer la caractérisation des effets sur la santé dans la présente évaluation préalable.
Pour la présente ébauche d’évaluation préalable, nous avons pris en compte les données sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et l’exposition, y compris les autres renseignements présentés par les intervenants. Les données pertinentes ont été recensées jusqu’en juin 2018. Les données empiriques obtenues d’études clés ainsi que quelques résultats provenant de modèles ont servi à formuler les conclusions proposées.
La présente ébauche d’évaluation préalable a été rédigée par le personnel du Programme d’évaluation des risques en vertu de la LCPE à Santé Canada et à Environnement et Changement climatique Canada et comprend des contributions d’autres programmes relevant de ces ministères. Les parties du présent document portant sur la santé humaine ont fait l’objet d’un examen par des pairs externes. Les commentaires sur les parties techniques concernant la santé humaine proviennent de Susan Griffin, d’Andrew Maier et de Pamela Williams, du Risk Science Center de l’Université de Cincinnati (États-Unis). La partie de l’évaluation traitant de l’environnement repose sur le document de CRE (publié le 30 juillet 2016Note de bas de page 2 ), lequel a fait l’objet d’un examen externe et a été soumis à une consultation publique de 60 jours. Bien que les commentaires externes aient été pris en compte, Santé Canada et Environnement et Changement climatique Canada restent responsables du contenu final et de la conclusion de la présente évaluation préalable.
La présente ébauche d’évaluation préalable repose sur des données essentielles permettant de déterminer si les substances satisfont aux critères énoncés à l’article 64 de la LCPE. À cette fin, nous avons examiné des données scientifiques et suivi une approche fondée sur le poids de la preuve et le principe de précautionNote de bas de page 3 . La présente ébauche d’évaluation préalable expose les données essentielles et les considérations sur lesquelles les conclusions proposées s’appuient.
2. Identité des substances
Les numéros d’enregistrement du Chemical Abstracts Service (NE CAS)Note de bas de page 4 , les noms sur la Liste intérieure (LI), les noms communs et les abréviations de chaque substance du groupe des aminoalcools et des alcanolamides gras sont présentés au tableau 2-1.
En ce qui concerne l’évaluation pour la santé humaine, les substances ont été divisées en trois sous-groupes en fonction du nombre de groupements alcanols lié aux groupes amine ou amide (composés monohydroxyles, dihydroxyles et trihydroxyles). Le nombre de groupements alcanol présents influe sur la toxicité potentielle de la substance en perturbant l’homéostasie de la choline (Leung et al., 2005). Les substances du sous‑groupe 2 ont été séparées dans deux groupes en fonction de la présence possible ou non de la DEA, laquelle affecte également l’homéostasie de la choline (Leung et al., 2005). Le sous-groupe 2A est composé de la DEA, du LDE et du CDE. Le LDE est le produit de réaction de l’acide laurique avec la DEA (Johansson 2001). Le CDE, un UVCB, est le produit de condensation de l’huile de noix de cocoNote de bas de page 5 et de la DEA (Johansson 2001). Comme le LDE et la CDE sont des produits de réaction de condensation de leur acide gras correspondant et de la DEA (Johansson 2001), ils devraient contenir des résidus de DEA provenant de la fabrication (CIR 2013b). Le sous-groupe 2B comprend le CADEA et le TADEA, tous deux des UVCB, qui sont du 2,2’-iminodiéthanol gras produit par la réaction de l’oxyde d’éthylène avec des alkylamines (Frauenkron et al., 2012), et n’ont donc pas de résidus de DEA.
| Sous-groupe | NE CAS (abréviation) | Nom sur la LI (nom commun) | Structure chimique et formule moléculaire | Poids moléculaire (g/mol) |
|---|---|---|---|---|
| 1 | 141-43-5 (MEA) | 2-Aminoéthanol (Monoéthanolamine) | 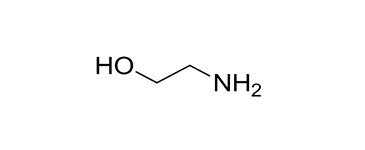 C2H7NO C2H7NO |
61,08 |
| 1 | 100-37-8 (DEEA) | 2-Diéthylamino-éthanol (Diéthyléthanol-amine) | 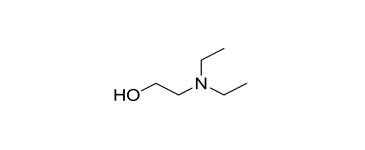 C6H15NO C6H15NO |
117,19 |
| 1 | 142-78-9 (LME) | N-(2-Hydroxyéthyl)-dodécanamide (Monoéthanolamide laurique) | 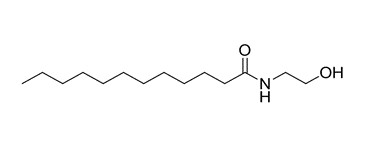 C14H29NO2 C14H29NO2 |
243,39 |
| 2A | 111-42-2 (DEA) | Diéthanolamine (et ses sels) (3-azapentane-1,5-diol) | 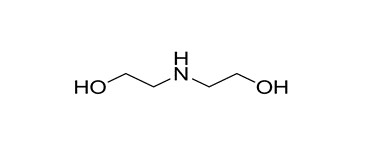 C4H11NO2 C4H11NO2 |
105,14 |
| 2A | 120-40-1 (LDE) | N,N-Bis(2‑hydroxyéthyl)-dodécanamide (Diéthanolamide laurique) | 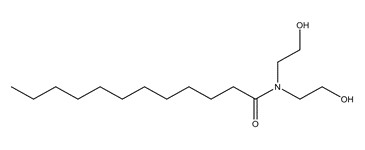 C16H33NO3 C16H33NO3 |
287,44 |
| 2A | 68603-42-9 (CDE) | Amides de coco, N,N-bis(hydroxyéthyle) (N,N-bis(2-hydroxyéthyl) cocamides) | 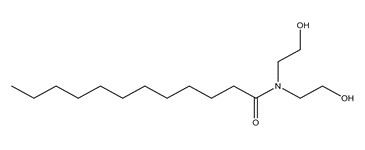 C16H33NO3 C16H33NO3 |
287,44 |
| 2B | 61791-31-9 (CADEA) | 2,2’-Iminodiéthanol, dérivés N-alkyles de coco (N‑(alkyles de coco)-3-azapentane-1,5‑diol) | 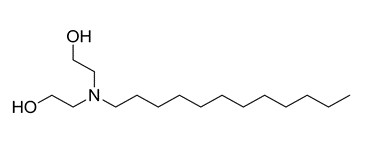 C16H35NO2 C16H35NO2 |
273 |
| 2B | 61791-44-4 (TADEA) | 2,2’-Iminodiéthanol, dérivés N-alkyles de suif (N‑(alkyles de suif)-3-azapentane-1,5‑diol) | 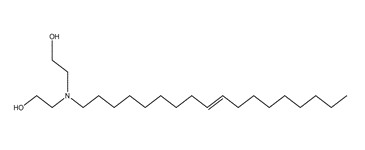 C22H45NO2 C22H45NO2 |
356 |
| 3 | 102-71-6 (TEA) | 2,2’,2’’-Nitrilotriéthanol (2,2’,2’’-nitrilotriséthanol) | 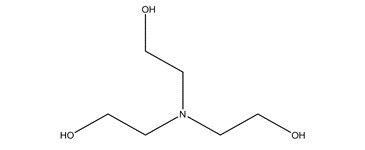 C6H15NO3 C6H15NO3 |
149,19 |
| 3 | 122-20-3 (TIPA) | 1,1’,1’’-Nitrilotripropan-2-ol (1,1’,1’’-Nitrilotrispropane-2‑ol) | 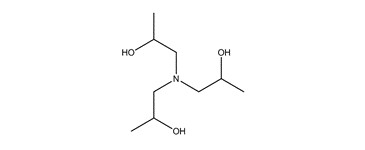 C9H21NO3 C9H21NO3 |
191,27 |
| 3 | 85204-21-3 (BATEA) | Acide4-[(2-éthylhexyl)amino]-4‑oxoisocrotonique, composé avec le 2,2’,2’’-nitrilotris[éthanol] (1:1) (acide (Z)-4-[(2-éthylhexyl)amino]-4‑oxobut-2-ènoïque, compose avec du 2,2’,2’’-nitrilotriséthanol (1:1) | 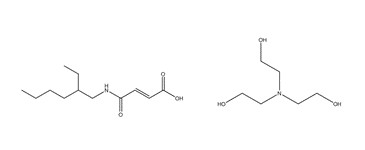 C12H21NO3 C6H15NO3 Combiné avec : C18H36N2O6 C12H21NO3 C6H15NO3 Combiné avec : C18H36N2O6 |
376,49 |
a UVCB, structure représentative/typique (C12), chaîne de longueur variable de C8 à C18, à un nombre d’insaturations de 0 à 2; US EPA, 2010a
b UVCB, structure représentative/typique (C12), chaîne de longueur variable de C6 à C18, à un nombre d’insaturations de 0 à 2; EPA, 2010 b
c UVCB, structure représentative/typique (C18), chaîne de longueur variable de C14 à C18, à un nombre d’insaturations de 0 à 3; EPA, 2010 b
d En tant que produit de réaction complexe, le BATEA est un UVCB dont le poids moléculaire est défini.
2.1 Sélection d’analogues
Une méthode d’extrapolation faisant appel aux données d’analogues et aux résultats des modèles de relations (quantitatives) structure-activité (QSAR), le cas échéant, a été utilisée pour éclairer l’évaluation relative à la santé humaine. Les analogues choisis étaient de structure à celles des substances de ce groupe (toxicocinétique et propriétés physico-chimiques similaires) et leurs données empiriques pertinentes pouvaient être utilisées pour une extrapolation aux substances dont les données empiriques étaient insuffisantes. L’applicabilité des modèles RQSA a été déterminée au cas par cas. Les précisions sur les données d’extrapolation et les modèles (Q)SAR utilisés pour éclairer l’évaluation des effets des substances du groupe des aminoalcools et des alcanolamides gras sur la santé humaine, sont données plus loin, dans les sections correspondantes du présent rapport. Pour connaître les analogues ayant servi à l’évaluation, veuillez consulter le tableau 2-2.
| NE CAS (abréviation) | Nom sur la LIS ou autre nom (nom commun) | Structure chimique et formule moléculaire | Poids moléculaire (g/mol) |
|---|---|---|---|
| 68140-00-1 (CME) a | Amides de coco, N‑(hydroxyéthyl) (N-(2-Hydroxyéthyl) cocamide) |
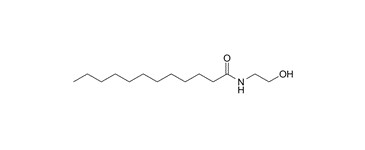 (Principal composant du CME) (Principal composant du CME) |
UVCB (C8-18)a |
| 111-57-9 (SME) | N-(2-Hydroxy-éthyl)stéaramide (N-(2-Hydroxyéthyl)octa-décanamide) |
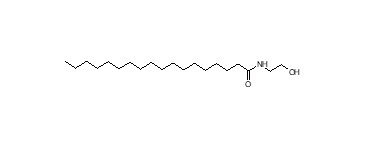 |
328 |
| 111-05-7 (OMIPA) | N-(2-Hydroxy-propyl)oléamide ((9Z)-N-(2-hydroxypropyl)octadéc-9‑ènamide) |
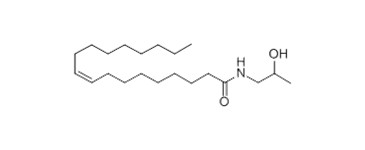 C21H41NO2 C21H41NO2 |
339,56 |
| 93-83-4 (ODE) | N,N-bis(2-hydroxyéthyl)oléamide ((9Z)-N,N-Bis(2‑hydroxyéthyl)octa-déc-9-ènamide) |
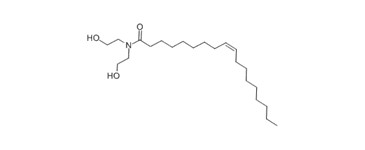 C22H43NO3 |
387,6 |
a UVCB. Structure représentative/typique (C12), longueur de chaîne variable de C8 à C18; degrés d’insaturation de 0 à 2 ; US EPA 2010a.
Les effets du LME sur la santé ont été caractérisés au moyen des analogues N‑(2‑hydroxyéthyl)cocamide (CME) dont le LME est le principal composant, le N‑(2‑hydroxyéthyl)octa-décanamide (SME) et le (9Z)-N-(2-hydroxypropyl)octadéc-9‑ènamide (OMIPA) (annexe D, tableau 1). Les effets de CADEA et de TADEA sur la santé ont été pris en compte conjointement. La contribution de la DEA à la toxicité du LDE et du CDE a été définie à l’aide de l’ODE, car le LDE, le CDE et l’ODE sont des analogues sur le plan structural qui se distinguent par la quantité de DEA (annexe A, tableau 2). Pour de plus amples précisions sur les données d’extrapolation et les modèles (Q)SAR qui ont été retenus pour éclairer l’évaluation des effets sur la santé, veuillez consulter les sections correspondantes, plus loin dans le rapport.
3. Propriétés physiques et chimiques
Un résumé des principales propriétés physiques et chimiques des substances du groupe des aminoalcools et des alcanolamides gras est présenté au tableau 3-1, au tableau 3-2 et au tableau 3-3. Lorsque les données expérimentales étaient limitées, les modèles (Q)SAR ont servi à produire les valeurs prévues de la substance. Les données des analogues ont été utilisées pour l’extrapolation. D’autres propriétés physiques et chimiques sont présentées dans un document d’ECCC (2016 b).
| Abréviation | Solubilité dans l’eau (mg/L) | Log Koe | Pression de vapeur (mm Hg) | pKa |
|---|---|---|---|---|
| MEA | 1,00E+06a | -2,3a | 0,404b | 9,21a |
| DEEA | 1,00E+06b | 0,21c | 1,4b | 10,1c |
| LME | 43,9b,prévu | 3,24b,prévu | 6,57E-09b,prévu | ND |
Abréviations : Koe, coefficient de partage octanol-eau; ND, non déterminé.
a ECHA, c2007-2017a
b ChemIDplus, 1993-
c ECHA, c2007-2017b
| Abréviation | Solubilité dans l’eau (mg/L) | Log Koe | Pression de vapeur(mm Hg) | pKa |
|---|---|---|---|---|
| DEA | 1,00E+06a | -2,46a | 2,80E-04b | 8,99a |
| LDE | 226b,prévu | 2,89b,prévu | 6,70E-09b,prévu | ND |
| CDE | 226c,prévu | 2,89c,prévu | 6,70E-09c,prévu | ND |
| CADEA | 83,13d,prévu | 3,90d,prévu | 1,76E-08d,prévu | 6,2e,prévu |
| TADEA | 0,126d,prévu | 6,63d,prévu | 3,25E-11d,prévu | 8,0e,prévu |
Abréviations : Koe, coefficient de partage octanol-eau; ND, non déterminé.
a ECHA, c2007-2017c
b ChemIDplus, 1993-
c UVCB, propriétés établies d’après les données du LDE (C12) utilisé comme homologue type du mélange (ChemIDplus, 1993-)
d UVCB, valeur prévue d’après la structure représentative figurant au tableau 2-1 pour cette substance (EPI Suite, c.2000-2012)
e US EPA, 2010b
| Abréviation | Solubilité dans l’eau (mg/L) | Log Koe | Pression de vapeur (mm Hg) | pKa |
|---|---|---|---|---|
| TEA | 1,00E+06a | -1a | 3,59E-06a | 7,86a |
| TIPA | 8,20E+05a | -0,15c | 7,5E-05c | 8,06a |
| BATEA | 1,00E+06b | 3,22b,prévu | 0,45b | ND |
Abréviations : Koe, coefficient de partage octanol-eau; ND, non déterminé.
aChemIDplus, 1993-
bECHA c2007-2017
c ECHA, c2013-2018e
4. Sources et utilisations
Le MEA est naturellement présent dans des aliments et le tabac, et peut être produit par des processus biotiques et abiotiques (Frauenkron et al., 2012; Simoneit et al., 2000). La DEA peut être isolée de certaines plantes (Brown et Gray 1986).
Toutes les substances du groupe des aminoalcools et des alcanolamides gras, sauf le MEA et le BATEA, ont été visées par une enquête réalisée en vertu de l’article 71 de la LCPE (Canada, 2012). D’après la base de données du Commerce international de marchandises du Canada (CIMC), les quantités moyennes de MEA importées annuellement au Canada de 2014 à 2017 étaient d’environ 26 millions de kilogrammes et variaient de 23 806 266 kg (2015) à 28 829 405 kg (2017) (Statistique Canada [modifié en 2017]). Un résumé des quantités totales déclarées qui ont été fabriquées ou importées pour chacune des neuf substances visées par l’enquête réalisée en vertu de l’article 71 de la LCPE (Environnement Canada, 2013) ainsi que des quantités importées de MEA selon le CIMC (Statistique Canada [modifié en 2017]) est présenté dans le tableau 4-1.
| Sous-groupe | Abréviation | Quantité totale fabriquéea (kg) | Quantité totale importéea (kg) |
|---|---|---|---|
| 1 | MEA | ND | 23806266 – 28829405b |
| 1 | DEEA | 0c | 347147 |
| 1 | LME | 0c | 10000 - 100000 |
| 2A | DEA | 100 000 - 1 000 000 | 3331373 |
| 2A | LDE | 0c | 69543 |
| 2A | CDE | 1 000 000 - 10 000 000 | 1000000 - 10000000 |
| 2B | CADEA | 0c | 10000 - 100000 |
| 2B | TADEA | 1 000 000 - 10 000 000 | 100000 - 1000000 |
| 3 | TEA | 10 000 - 100 000 | 4595027 |
| 3 | TIPA | 0c | 100000 - 1000000 |
| 3 | BATEA | ND | ND |
Abréviations : ND, non déterminé, car substance non visée par l’enquête réalisée en vertu de l’article 71 de la LCPE.
a Information déclarée dans le cadre de l’enquête réalisée en vertu de l’article 71 de la LCPE (Environnement Canada, 2013), sauf en ce qui concerne le MEA et le BATEA, lesquels n’étaient pas visés par l’enquête. Veuillez consulter les enquêtes pour connaître les inclusions et les exclusions particulières (annexes 2 et 3).
b Les données sur la quantité importée annuellement au Canada pour la « monoéthanolamine et ses sels » pour les années 2014 à 2017 proviennent de la Base de données du Commerce international de marchandises du Canada (Statistique Canada [modifié en 2017]).
c La valeur déclarée dans le cadre d’une enquête réalisée en vertu de l’article 71 de la LCPE était de 0 kg (Environnement Canada, 2013).
Veuillez consulter le tableau 4-2 pour un résumé des principales utilisations des neuf substances, fondées sur les données présentées conformément à l’article 71 de la LCPE (Environnement Canada, 2013), et du MEA, fondées sur les données présentées conformément à l’article 70 de la LCPE (ECCC, 2017). Aucune utilisation n’a été présentée pour le BATEA dans le cadre de l’enquête réalisée en vertu de l’article 70 de la LCPE (ECCC, 2017). Veuillez consulter le tableau 4-3 pour connaître les autres utilisations connues au Canada.
| Utilisationa | Sous-groupe 1 | Sous-groupe 2A/B | Sous-groupe 3 |
|---|---|---|---|
| Adhésifs et produits d’étanchéité | ND | DEA | TEA |
| Antigel et produits de déglaçage | ND | ND | TEA |
| Produits d’entretien pour les vêtements et les chaussures | ND | ND | TEA |
| Produits d’entretien pour automobiles | MEAb | ND | TEA |
| Automobiles, aéronefs et autres moyens de transport | ND | DEA | TEA |
| Matériaux de construction non compris ailleurs dans le présent tableau | ND | DEA, CADEA, TADEA, LDE, CDE | TEA, TIPA |
| Produits nettoyants et d’entretien de mobilier | ND | DEA, CADEA, TADEA, CDE | TEA, TIPA |
| Produits pharmaceutiques | ND | CDE | TEA |
| Articles faits de tissu, de textiles ou de cuir non compris ailleurs dans le présent tableau | ND | DEA, CADEA, TADEA, CDE | TEA |
| Couvre-planchers | ND | ND | TIPA |
| Matériaux d’emballage d’aliments | ND | DEA, LDE | TEA |
| Mobilier et ameublement non compris ailleurs dans le présent tableau | ND | ND | TIPA |
| Encres, toner et colorants | ND | DEA | TEA |
| Lessive et lavage de la vaisselle | MEAb, LME | DEA, CDE, TADEA | TEA |
| Lubrifiants et graisses | ND | DEA, CADEA, TADEA, LDE | TEA, TIPA |
| Matériaux métalliques non compris ailleurs dans le présent tableau | DEEA | DEA | TEA |
| Produits de santé naturels | ND | ND | TEA |
| Extraction de pétrole et de gaz naturel | ND | DEA, CADEA, TADEA | TEA, TIPA |
| Produit anticorrosion | ND | ND | TEA |
| Peintures et revêtements | DEEA | DEA, CADEA, TADEA | TEA |
| Produits, mélanges ou articles manufacturés en papier | MEAb | DEA | TEA |
| Produits de soins personnelsc | MEAb, DEEA, LME | DEA, LDE, CDE | TEA, TIPA |
| Produits en plastique ou en caoutchouc non compris ailleurs dans le présent tableau | ND | DEA, CADEA, LDE | TEA, TIPA |
| Traitement de l’eau | DEEA | DEA, CADEA, TADEA | TEA |
Abréviations : ND, utilisation non déterminée pour les substances du sous-groupe.
a Utilisations déclarées dans le cadre d’une enquête réalisée en vertu de l’article 71 de la LCPE (Environnement Canada, 2013), sauf si indiqué autrement. Veuillez consulter les enquêtes pour connaître les inclusions et les exclusions particulières (annexes 2 et 3).
b Non visé par une enquête réalisée en vertu de l’article 71 de la LCPE. Les utilisations sont déclarées conformément à l’article 70 de la LCPE (1999) (ECCC, 2017).
c Pour les besoins du présent document, un produit de soins personnels est un produit qui est, pour le public, destiné à l’hygiène ou à la toilette. Selon la manière dont le produit est représenté pour la vente et sa composition, les produits de soins personnels peuvent s’inscrire dans l’une des trois catégories suivantes établies par la réglementation canadienne : cosmétiques, drogues ou produits de santé naturels.
| Utilisation | Sous-groupe 1 | Sous-groupe 2A/B | Sous-groupe 3 |
|---|---|---|---|
| Additif alimentairea | ND | ND | ND |
| Matériaux d’emballage alimentairea | MEA, DEEA | DEA, CADEA, TADEA, LDE, CDE | TEA, TIPA |
| Additif indirecta | MEA, DEEA, LME | DEA, CADEA, TADEA, LDE, CDE | TEA |
| Base de données interne des produits pharmaceutiques en tant qu’ingrédient médicinal ou non médicinal dans des produits pharmaceutiques, des désinfectants ou des produits pharmaceutiques à usage vétérinaire au Canadab | MEA | DEA, CDE | TEA |
| Base de données sur les ingrédients de produits de santé naturelsc | MEA | DEA, LDE, CDE | TEA, TIPA |
| Base de données sur les produits de santé naturels homologués, en tant qu’ingrédients médicinaux ou non médicinaux dans des produits de santé naturels en vente au Canadac | ND | DEA, LDE, CDE | TEA, TIPA |
| Liste critique des ingrédients dont l’utilisation est restreinte ou interdite dans les cosmétiquesd | ND | DEA | ND |
| Déclaré présent dans les cosmétiques, selon les déclarations présentées à Santé Canada en vertu du Règlement sur les cosmétiquese | MEA, LME | LDE, CDE | TEA, TIPA |
| Produit de formulation dans les produits antiparasitaires homologués au Canadaf | MEA, LME | DEA, CADEA, TADEA, LDE, CDE | TEA, TIPA |
Abréviations : ND, utilisation non déterminée pour les substances du sous-groupe.
a Communication personnelle, courriels de la Direction des aliments de Santé Canada adressés au Bureau d’évaluation du risque des substances existantes de Santé Canada, s’échelonnant de septembre 2015 à octobre 2018; sans référence.
b La DEA n’est présente que dans les produits pharmaceutiques à usage vétérinaire. Communication personnelle, courriels de la Direction des produits thérapeutiques de Santé Canada adressés au Bureau d’évaluation du risque des substances existantes de Santé Canada, datés de septembre 2015 et d’août 2017; sans référence.
c Communication personnelle, courriels de la Direction des produits de santé naturels et sans ordonnance (DPSNSO) de Santé Canada adressés au Bureau d’évaluation du risque des substances existantes de Santé Canada, datés de septembre 2015 et d’août 2017 et de mars 2020; sans référence.
d Santé Canada (modifié en 2015).
e Communication personnelle, courriels de la Direction de la Sécurité des produits de consommation et des produits dangereux (DSPCPD) de Santé Canada adressés au Bureau d’évaluation du risque des substances existantes de Santé Canada, s’échelonnant de juillet 2015 à juin 2018; sans référence.
f Communication personnelle, courriels de l’Agence de réglementation de la lutte antiparasitaire (ARLA) de Santé Canada adressés au Bureau d’évaluation du risque des substances existantes de Santé Canada, datés de juin 2015 et d’août 2017; sans référence.
La DEA figure parmi les « Dialcanolamines secondaires » sur la Liste des ingrédients dont l’usage est interdit dans les cosmétiques (SC [modifié en 2018]). Cependant, la DEA peut être présente dans des produits contenant du CDE et/ou du LDE, comme résidu issu de la réaction de la DEA avec l’acide ou les acides gras correspondants lors de la fabrication chimique des amides (communication personnelle de la Direction de la Sécurité des produits de consommation et des produits dangereux de Santé Canada adressée au Bureau d’évaluation du risque des substances existantes de Santé Canada, datée de mars 2017; sans référence). La DEA pourrait donc être présente en tant que résidu dans des produits disponibles aux consommateurs canadiens contenant du LDE et/ou du CDE, notamment des cosmétiques.
D’après les fiches de données de sécurité (FDS) sur les produits accessibles au public, le TADEA a été décelé dans un liquide à transmission pour automobile disponible aux consommateurs au Canada (MSDS, 2015i) et le CDE a été décelé dans les lavages automobiles et marins (MSDS 2009; 2010a). En outre, le TEA a été détecté dans une vaste gamme de nettoyants pour la maison, les automobiles et les bateaux (p. ex. vaisselle, lessive, four, tout usage, décapants et dégraissants, revêtement de sièges) et dans certains liquides de refroidissement, adhésifs étanches, époxydes et certaines encres pour imprimantes disponibles aux consommateurs au Canada (MSDS, 2006; 2007g,h; 2008f; 2010a,b; 2011a,b; 2012a,b,c,d,e,f; 2013j; 2015e,j,k,l,m).
5. Potentiel de causer des effets nocifs pour l’environnement
5.1 Caractérisation des risques pour l’environnement
Les risques pour l’environnement associés aux substances du groupe des aminoalcools et des alcanolamides gras ont été caractérisés à l’aide de l’approche de Classification du risque écologique (CRE) des substances organiques (ECCC, 2016a). La CRE est une approche fondée sur le risque qui tient compte de plusieurs paramètres liés au danger et à l’exposition et d’une pondération de plusieurs éléments de preuve pour classer le risque. Les divers éléments de preuve sont réunis pour que l’on puisse distinguer les substances présentant une puissance faible ou élevée et un risque d’exposition faible ou élevé dans divers milieux. Une telle approche permet de réduire l’incertitude globale de la caractérisation du risque comparativement à une approche qui reposerait sur un paramètre unique dans un seul milieu (p. ex. la concentration létale médiane [CL50]) pour la caractérisation. Puisque le CDE, le CADEA, le TADEA et le BATEA sont des substances UVCB et qu’ils ne peuvent être convenablement représentés par une seule structure chimique, une méthode manuelle de classification fondée sur le jugement a été utilisée. L’approche, décrite en détail dans ECCC (2016a), est résumée ci-dessous.
Les données sur les propriétés physicochimiques, le devenir (demi-vies chimiques dans divers milieux et biotes, coefficients de partage et bioconcentration dans les poissons), l’écotoxicité aiguë pour les poissons et les volumes de produits chimiques importés ou fabriqués au Canada ont été extraites de publications scientifiques, de bases de données empiriques accessibles (p. ex. la boîte à outils QSAR de l’OCDE [2016]) et des réponses aux enquêtes menées en vertu de l’article 71 de la LCPE, ou sont des données produites par modélisation de la relation (quantitative) structure-activité (QSAR), du devenir du bilan massique ou de la bioaccumulation. Ces données ont servi à alimenter d’autres modèles de bilan massique ou à remplir les profils de risques et de l’exposition des substances.
Les profils de danger reposent principalement sur des paramètres tels que le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dans le réseau trophique, la biodisponibilité et l’activité chimique et biologique. Les profils d’exposition se reposent également sur plusieurs paramètres dont les taux d’émission potentiels, la persistance globale et le potentiel de transport à grande distance. On a comparé les profils de danger et d’exposition avec les critères de décision afin de classer les potentiels de danger et d’exposition de chaque substance organique comme faible, modéré ou élevé. On a appliqué d’autres règles (p. ex. cohérence de la classification, marge d’exposition) pour préciser les classements préliminaires de danger et d’exposition. Cependant, dans le cas du CDE, du CADEA, du TADEA et du BATEA, il n’a pu être possible d’établir le profil complet du danger et de l’exposition en raison de l’absence de structure représentative pour estimer les propriétés nécessaires et du manque de données empiriques sur ces propriétés. Par conséquent, la classification du danger et de l’exposition a été réalisée manuellement par l’examen des constituants UVCB et des renseignements de la mise à jour de l’Inventaire (Environnement Canada, 2013) et à l’aide de décisions fondées sur l’examen de substances similaires et du jugement d’un spécialiste.
Une matrice de risques a permis d’attribuer à chaque substance un risque potentiel faible, modéré ou élevé, en fonction de la classification de son danger et de son exposition. On a vérifié le classement du risque potentiel établi au moyen de la CRE en suivant une approche en deux étapes. La première étape consistait à modifier à la baisse le classement du risque (qui passe de modéré ou élevé à faible) des substances présentant un taux d’émission estimatif faible dans l’eau après le traitement des eaux usées, ce qui représente un faible potentiel d’exposition. La deuxième étape consistait à réévaluer le classement du faible potentiel de risque à l’aide de scénarios de risque relativement prudents et à échelle locale (c.-à-d., la zone entourant directement le point de rejet) conçus pour ne pas nuire à l’environnement, afin de déterminer si le classement du risque potentiel devrait être revu à la hausse.
La CRE est une approche pondérée qui vise à réduire au minimum le risque d’un surclassement ou d’un sous-classement du danger, de l’exposition et du risque subséquent. Une description détaillée des approches équilibrées de traitement des incertitudes est présentée dans ECCC (2016a). Voici une description de deux des domaines d’incertitude les plus importants. Une erreur dans les valeurs de toxicité aiguë empiriques ou modélisées peut modifier le classement du danger, surtout si les paramètres sont fondés sur les valeurs de résidus dans les tissus (c.-à-d. le mode d’action toxique), dont bon nombre sont des valeurs estimées à l’aide de modèles QSAR (boîte à outils QSAR de l’OCDE, 2016). Cependant, l’impact de ce type d’erreur est atténué par le fait qu’une surestimation de la létalité médiane conduira à une valeur prudente (protectrice) de résidus dans les tissus utilisée pour l’analyse des résidus corporels critique (RCC). L’erreur due à une sous-estimation de la toxicité aiguë sera atténuée par le recours à d’autres paramètres de danger, tels que le profilage structurel du mode d’action, la réactivité et/ou l’affinité de liaison à l’œstrogène. Les changements ou les erreurs touchant les quantités chimiques pourraient mener à un classement de l’exposition différent, les classements de l’exposition et du risque étant très sensibles aux taux d’émission et aux quantités utilisées. Les classements obtenus au moyen de la CRE représentent donc l’exposition et le risque au Canada, compte tenu de l’estimation des quantités utilisées actuellement, mais pourraient ne pas rendre compte des tendances futures.
Les données essentielles et les facteurs à considérer, utilisés pour élaborer les profils spécifiques des substances du groupe des aminoalcools et des alcanolamides gras, ainsi que les résultats de la classification du danger, de l’exposition et des risques, figurent dans ECCC (2016 b).
Le classement du danger et de l’exposition associés aux substances du groupe des aminoalcools et des alcanolamides gras est présenté dans le tableau 5-1.
| Substance | Classement du danger selon la CRE | Classement de l’exposition selon la CRE | Classement du risque selon la CRE |
|---|---|---|---|
| MEA | Faible | Faible | Faible |
| DEEA | Faible | Faible | Faible |
| LME | Faible | Faible | Faible |
| DEA | Faible | Faible | Faible |
| LDE | Faible | Faible | Faible |
| CDE | Faible | Faible | Faible |
| CADEA | Faible | Faible | Faible |
| TADEA | Faible | Faible | Faible |
| TEA | Faible | Faible | Faible |
| TIPA | Faible | Faible | Faible |
| BATEA | Faible | Faible | Faible |
Étant donné le classement faible pour le danger et l’exposition établi au moyen des données prises en compte dans l’analyse de la CRE, le potentiel de risque pour l’environnement associé au MEA, au DEEA, au LME, à la DEA, au LDE, au CDE, au CADEA, au TADEA, au TEA, au TIPA et au BATEA est faible. Il est donc peu probable que ces substances suscitent des préoccupations pour l’environnement au Canada.
6. Potentiel de causer des effets nocifs pour la santé humaine
6.1 Évaluation des substances du sous-groupe 1 (MEA, DEEA et LME)
6.1.1 Évaluation de l’exposition des substances du sous-groupe 1 (MEA, DEEA et LME)
Milieux environnementaux
D’après les valeurs mesurées de pKa, le MEA et le DEEA devraient être surtout sous forme de cations dans des conditions environnementales ayant un potentiel d’adsorber fortement à l’argile, au carbone organique, aux particules et aux aérosols par des interactions ioniques. D’après les prévisions du modèle, le LME est une substance amphiphile neutre dont la pression de vapeur est très faible et la solubilité dans l’eau, modérée.
Aucune donnée de surveillance sur la présence du MEA, du DEEA et du LME dans les milieux de l’environnement au Canada et aucune donnée de surveillance du MEA au Canada n’a été trouvée. Cependant, en général, le MEA a été décelé dans l’air ambiant, dans des aérosols (Miyazaki et al., 2009a; Mader et al., 2004; Yang et al., 2005; Miyazaki et al., 2009b; Huang et al., 2016; Gorzelska et Galloway, 1990), des PM2,5 (Zhang et Anastasio 2003; Yang et al., 2004) et l’eau de brouillard (Zhang et Anastasio, 2003). Le MEA a été décelé dans 7 des 64 échantillons d’eaux souterraines provenant d’une usine de gaz sulfureux désaffectée du sud de l’Alberta (variant d’un point sous le seuil de détection à 18 935 mg/L; moyenne de 0,24 mg/L; Mrklas et al., 2006).
Étant donné leur nature ionique dans des conditions environnementales pertinentes, le MEA et le DEEA ne peuvent pas être utilisés dans les modèles de fugacité habituellement employés pour estimer l’exposition de substances provenant de milieux environnementaux. Toutefois, d’après des données physico-chimiques et la modélisation de la fugacité pour les espèces non chargées (voir le tableau B-1, annexe B), l’absorption humaine de MEA, de DEEA et de LME issus de l’air ambiant et du sol devrait être négligeable (inférieure à 2,5 ng/kg p.c./jour). L’absorption estimée de DEEA à partir de l’air intérieur devrait être minime.
La concentration estimée du DEEA et du LME dans l’eau potable a été déterminée à l’aide du scénario de rejet à l’égout après utilisation par les consommateurs dans les feuilles de calcul sur l’eau potable de l’Unité d’évaluation environnementale (UEE) (Santé Canada, 2015a) et des valeurs indiquées dans la Base de données du Commerce international de marchandises du Canada en 2011 pour le DEEA et le LME (Environnement Canada, 2013). Pour des précisions sur les paramètres de modélisation utilisés pour estimer les concentrations de DEEA et de LME dans l’eau potable, veuillez consulter le tableau B‑4 (annexe B). Les concentrations maximales de DEEA et de LME au 50e centile dans l’eau de surface des 10 plans d’eau récepteurs modélisés sont de 1,19 et de 2,72 µg/L, respectivement. L’absorption estimative résultante dans l’eau potable utilisée chez un nourrisson nourri aux préparations pour nourrissonsNote de bas de page 6 est de 0,00013 mg/kg p.c./jour pour le DEEA et de 0,00029 mg/kg p.c./jour pour le LME.
Aliments et boissons
MEA
L’exposition estimative au MEA découlant de son utilisation possible comme composant dans des matériaux d’emballage d’aliments est de 0,303 µg/kg p.c./jour, tandis que l’exposition découlant de son utilisation comme composant dans des additifs indirects devrait être négligeable (communication personnelle, courriel de la Direction des aliments de Santé Canada adressé au Bureau d’évaluation du risque des substances existantes de Santé Canada, daté d’avril 2018; sans référence).
Pour des précisions sur les méthodes, les données sur la présence dans les aliments et l’exposition alimentaire estimative concernant le MEA due à sa présence naturelle dans les aliments, pour toutes les catégories d’âge, veuillez consulter l’annexe C. Les estimations de la moyenne et du 90e centile de l’exposition au MEA ont varié de 70 à 200 µg/kg p.c./jour et de 170 à 470 µg/kg p.c./jour, respectivement (voir le tableau C‑2). Au 90e centile, l’exposition estimative au MEA la plus élevée par voie alimentaire, en fonction du poids corporel, était de 470 µg/kg p.c./jour pour les enfants de 1 à 8 ans (communication personnelle, courriel de la Direction des aliments de Santé Canada adressé au Bureau d’évaluation du risque des substances existantes de Santé Canada, daté d’avril 2018; sans référence).
L’exposition au MEA découlant de l’utilisation de matériaux d’emballage alimentaire et d’additif indirect est considérée comme minime comparativement à l’exposition au MEA qui est naturellement présent dans des aliments (communication personnelle, courriel de la Direction des aliments de Santé Canada adressé au Bureau d’évaluation du risque des substances existantes de Santé Canada, daté de mars 2018; sans référence).
DEEA et LME
Au Canada, aucune donnée relative au DEEA ou au LME dans des aliments n’a été trouvée. Le LME n’est pas utilisé dans les matériaux d’emballage d’aliments, contrairement au DEEA qui peut être utilisé dans certains matériaux d’emballage alimentaire, mais sans possibilité de contact direct avec des aliments (communication personnelle, courriels de la Direction des aliments de Santé Canada adressés au Bureau d’évaluation du risque des substances existantes de Santé Canada, datés de janvier 2016 et d’août 2017; sans référence). Le DEEA et le LME peuvent être utilisés comme composants dans des additifs indirects utilisés dans des établissements de transformation des aliments (communication personnelle, courriel de la Direction des aliments de Santé Canada adressé au Bureau d’évaluation du risque des substances existantes de Santé Canada, daté d’août 2017; sans référence).
Produits disponibles aux consommateurs
L’exposition potentielle découlant de l’utilisation de produits disponibles aux consommateurs a été estimée. Pour des précisions, veuillez consulter l’annexe D. Les estimations concernant les utilisations qui entraînent l’exposition potentielle la plus élevée par voie cutanée ou par inhalation (retenues comme scénarios sentinelles) sont présentées dans les tableaux 6-1 et 6-2, respectivement. D’autres scénarios d’utilisations potentielles pour le MEA (médicaments à application topique et produits de santé naturels, savon à vaisselle, savon à lessive et nettoyants pour planchers), le DEEA (nettoyants pour automobiles) et le LME (shampoing, savon à vaisselle) ont été pris en compte, mais ont entraîné des expositions plus faibles que celles présentées dans les tableaux 6-1 et 6-2.
Absorption cutanée
Dans une étude d’absorption cutanée in vitro, l’absorption cutanée du MEA non dilué et du MEA en solution aqueuse (22 % p/p) a été établie chez la souris, le rat, le lapin et l’humain à une dose cible de 4 mg/cm2 après une exposition de 6 heures (Sun, 1996). Sans tenir compte des résidus fixés à la peau, le pourcentage de substance absorbée par voie cutanée pour le MEA non dilué et le MEA à 22 % était respectivement de 17 % et de 25 % chez la souris, de 9 % et de 2 % chez le lapin, de 6 % et de 1 % chez le rat, et de 0,6 % et de 1 % chez l’humain. Étant donné que les données sur l’absorption cutanée de la MEA étaient limitées (déterminées seulement pendant 6 heures; aucune mesure des résidus fixés sur la peau) et l’absence de données sur l’absorption cutanée de la DEEA et de la LME, l’absorption cutanée de ces substances a été estimée, de manière prudente, à 100%.
| Substance | Scénario de produita, b | Concentration (%) | Exposition par utilisationsystémique(mg/kg p.c.) | Exposition quotidienne systémique (mg/kg p.c./jour)c |
|---|---|---|---|---|
| MEA | Savon liquide pour le corps (nourrisson) | 3 | 0,18 | 0,16 |
| MEA | Savon liquide pour le corps | 3 | 0,047 | 0,065 |
| MEA | Shampoing (enfants) | 10 | 0,38 | 0,42 |
| MEA | Shampoing | 10 | 0,17 | 0,18 |
| MEA | Colorant capillaire – permanent | 30 | 42 | s.o. |
| MEA | Nettoyant tout usage en aérosol | 1 | 0,044 | 0,044 |
| MEA | Nettoyant pour le four | 2,4 | 0,20 | s.o. |
| DEEA | Encaustique/ cire pour planchers | 1 | 0,078 | s.o. |
| LME | Savon liquide pour le corps (nourrisson) | 3 | 0,18 | 0,16 |
| LME | Savon liquide pour le corps | 3 | 0,047 | 0,065 |
Abréviation : s.o., sans objet.
a Représente l’exposition directe des adultes, sauf si indiqué autrement.
b L’exposition directe découlant de l’utilisation de produits par des adultes a été évaluée, sauf si indiqué autrement. L’exposition potentielle au MEA, au DEEA et au LME par voie cutanée a été estimée en supposant une absorption cutanée de 100 %.
c Ces valeurs tiennent compte de la fréquence d’utilisation quotidienne présumée et, pour les estimations de ConsExpo, la valeur d’exposition quotidienne moyennée sur un an a été utilisée. Pour des précisions sur les modèles et les paramètres utilisés, veuillez consulter l’annexe D.
| Substance | Scénario de produit | Concentration (%) | MPT de la concentration dans l’air pendant 6 heures (mg/m3) | Concentration moyenne dans l’air le jour de l’exposition (mg/m3) |
|---|---|---|---|---|
| MEA | Nettoyant tout usage en aérosol | 1 | 0,083 | 0,021 |
| MEA | Nettoyant pour le four – nettoyage | 2,4 | 0,20 | s.o. |
| DEEA | Encaustique/ cire pour planchers | 1 | 1,84 | s.o. |
Abréviations : s.o., sans objet en raison d’une utilisation intermittente; MPT, moyenne pondérée dans le temps
6.1.2 Évaluation des effets des substances du sous-groupe 1 (MEA, DEEA, et LME) sur la santé
MEA
Les effets du MEA sur la santé ont été évalués par la Commission européenne (CE, 2016) et le Centre international de recherche sur le cancer (CIR, 2015a). Le rapport d’évaluation de la CE a servi à éclairer la caractérisation des effets sur la santé dans la présente évaluation préalable. Une recherche dans la documentation a été réalisée entre septembre 2015 et décembre 2017. Aucune nouvelle étude importante pouvant influer sur la caractérisation du danger et du risque n’a été trouvée.
Toxicité à doses répétées : Dans une étude de toxicité par inhalation de 4 semaines, des groupes de rats Wistar (5/sexe/dose) ont inhalé du MEA en aérosol à raison de 0, 10, 50 ou 150 mg/m3 (6 heures par jour, 5 jours par semaine, exposition du museau uniquement) (CE, 2016). Des effets locaux, notamment de l’inflammation, une hyperplasie et une nécrose de l’épithélium du larynx, ont été observés à 150 mg/m3. Les animaux exposés à la dose de 50 mg/m3 auraient eu une inflammation des sous‑muqueuses et une métaplasie pavimenteuse du larynx, lesquelles étaient réversibles et ont été considérées comme des réactions d’adaptation (CE, 2016). La CE a établi la CSENO dans la circulation générale à 150 mg/m3 et la CSENO locale à 10 mg/m3. Dans la présente évaluation, nous avons considéré que la CSENO était de 50 mg/m3 d’après une nécrose irréversible au niveau du larynx à la dose de 150 mg/m3.
Toxicité pour la reproduction et le développement : Dans une étude de toxicité pour la reproduction sur deux générations, des rats Wistar (25/sexe/dose) ont reçu du chlorhydrate (HCl) de MEA par l’alimentation à des doses de 0, 100, 300 ou 1000 mg/kg p.c./jour (équivalant respectivement à 0, 58, 178 et 580 mg/kg p.c./jour de MEA). Des effets similaires sur la santé sont attendus pour le MEA-HCl et le MEA par exposition par voie orale, alors que ces substances se transforment, dans l’estomac, en le même cation prépondérant (CE, 2016). À la DMENO du MEA de 580 mg/kg p.c./jour, une diminution statistiquement significative du poids absolu et du poids relatif des épididymes et de la queue des épididymes chez les mâles parents F0 et F1, et un nombre réduit statistiquement significatif de sites d’implantation, une augmentation des pertes post-implantatoires chez les sujets des générations F0 et F1 et une réduction de la taille des portées (F1, F2) ont été constatés. La DSENO du MEA a été établie par la CE à 178 mg/kg p.c./jour d’après ses effets sur la reproduction (CE, 2016).
Aucune toxicité pour le développement n’a été observée jusqu’à la dose de 450 ou de 225 mg/kg p.c./jour pour le MEA en solution aqueuse dans une étude de toxicité pour le développement par voie orale et par voie cutanée, respectivement, chez des rats présentant une diminution de la prise de poids corporel chez les mères par les deux voies d’exposition et une irritation cutanée par la voie cutanée, notamment un érythème, une nécrose et des croûtes (Liberacki et al., 1996; Hellwig et Liberacki, 1997; CE, 2016).
Génotoxicité et cancérogénicité : Le MEA n’était pas génotoxique dans les conditions in vitro et in vivo (JETOC, 1996; Dean, 1985, mentionné dans CE, 2016).
Aucune étude de cancérogénicité pour le MEA n’a été trouvée. Cependant, comme le MEA ne touche pas la biosynthèse de la phosphatidylcholine (Zha et al., 1992), il ne devrait pas accroître la formation de tumeurs en perturbant l’homéostasie de la choline (Kirman et al., 2016).
DEEA
Les effets du DEEA sur la santé ont été caractérisés par l’OCDE (2002). Une recherche dans la documentation a été réalisée entre octobre 2001 et décembre 2017. Aucune nouvelle étude significative pouvant influer sur la caractérisation du danger et du risque n’a été trouvée.
Toxicité à doses répétées : Dans une étude de toxicité par inhalation de 14 semaines, des rats F344 (20/dose/sexe) ont été exposés à 0, 11, 25 ou 76 ppm (équivalant à 0, 53, 120 et 365 mg/m3) de DEEA (exposition globale de l’organisme, 6 heures/jour, 5 jours/semaine) (Hinz et al.,1992, mentionné dans OCDE, 2002). Aucun effet neurocomportemental n’a été observé dans une batterie d’observations fonctionnelles, ni modifications négatives dans l’analyse des paramètres biochimiques ou d’urine, ou l’examen histopathologique. L’OCDE considère les changements histologiques indiquant une irritation des voies respiratoires (comme une augmentation de l’incidence et de la gravité de l’hyperplasie localisée, une métaplasie pavimenteuse de l’épithélium des voies respiratoires, une infiltration de cellules inflammatoires dans la muqueuse nasale) à 120 mg/m3 et plus comme des réactions d’adaptation. La DSENO a été établie à la dose la plus élevée, soit à 365 mg/m3.
Toxicité pour le développement : Dans une étude de toxicité pour le développement par inhalation, des rates Sprague-Daley (SD) en gestation (25/groupe) ont été exposées à des doses de 0, 33, 66 et 100 ppm (0, 158, 316, 480 mg/m3) de DEEA (exposition globale de l’organisme, 6 heures/jour) aux jours de gestation (JG) 6 à 15 (Leung et Murphy, 1998, mentionné dans OCDE, 2002). La DSENO chez les mères a été établie à 316 mg/m3 d’après la toxicité maternelle à 480 mg/m3, notamment des râles secs, une diminution du poids corporel (6 %) au JG 15 et une diminution de la prise de poids corporel (52 %) de JG 12 à JG 15. Aucune toxicité pour le développement n’a été observée.
Dans une étude de toxicité pour le développement par voie orale, des lapines en gestation New Zealand White (25/groupe) ont reçu du DEEA dans une suspension à 0,5 % de carboxyméthylcellulose à raison de 0, 15, 50 et 150 mg/kg p.c./jour, par gavage, du JG 6 au JG 28 (ECHA, c2011-2017b). L’étude a pris fin au JG 29. À 150 mg/kg p.c./jour, une toxicité hépatique a été observée chez les mères (augmentation du poids absolu et du poids relatif du foie, augmentation de l’activité de l’aspartate aminotransférase et de la phosphatase alcaline, et augmentation de la concentration des triglycérides et du phosphate inorganique). La DSENO chez les mères a été établie à 50 mg/kg p.c./jour d’après les effets sur le foie à la dose de 150 mg/kg p.c./jour. Aucune toxicité pour le développement n’a été observée.
Génotoxicité et cancérogénicité : Le DEEA n’était pas mutagène in vitro ni clastogène in vivo (OCDE, 2002).
Aucune augmentation de l’incidence de formation des tumeurs ou d’autres effets n’a été observée dans une étude de cancérogénicité par voie orale de deux ans menée chez le rat dont la méthodologie accusait des limites (petit nombre de sujets animaux, dose élevée insuffisante de 50 mg/kg p.c./jour augmentant progressivement à 400 mg/kg p.c./jour)(OCDE, 2002).
LME
Le danger associé au LME a été caractérisé par l’US EPA, dans le cadre d’une évaluation d’amides gras N-dérivés (US EPA, 2010a). Aucun point de référence ni analogue n’a été identifié dans le cadre de la caractérisation préalable des dangers. Le comité d’experts du CIR a également décrit les effets du LME sur la santé dans le cadre d’une évaluation des éthanolamides (CIR, 2015b). Une recherche dans la documentation a été réalisée entre septembre 2009 et décembre 2017. Aucune nouvelle étude importante pouvant influer sur la caractérisation du danger et du risque n’a été trouvée.
Les données empiriques sur la toxicité du LME sont limitées au résultat négatif à un test de mutation bactérienne in vitro (Zeiger, 1987). Dans la présente évaluation, les effets du LME sur la santé ont été caractérisés par la prise en compte des effets sur la santé associés des analogues N-(2-hydroxyéthyl)cocamide (CME) dont le LME est le principal composant, N-(2-hydroxyéthyl)octa-décanamide (SME) et N‑(2‑hydroxypropyl)oléamide (OMIPA) (annexe A, tableau A-1). Ces analogues sont semblables au LME sur le plan de la structure chimique (amides gras avec un groupe hydroxyle), des propriétés physicochimiques (très lipophiles) et de la toxicocinétique (s’hydrolyse en ses acides gras et monoalcanolamines correspondants) (RSI, 2017).
Toxicocinétique : Les amides primaires N-substitués, comme le N‑acyléthanolamide, sont hydrolysés par l’hydrolase des amides gras en l’acide gras correspondant et en MEA (Thabuis et al., 2008). Le LME devrait se métaboliser en MEA et en acide laurique.
Toxicité à doses répétées : Dans une étude de toxicité par voie orale (gavage) de 4 semaines, des rats Wistar (10/sexe/dose) ont reçu une dose de 0, 70, 250 ou 750 mg/kg p.c./jour de CME à raison de 5 jours par semaine (CIR, 2015b). Aucun effet nocif lié au traitement n’a été observé jusqu’à la DSENO de 750 mg/kg p.c./jour, soit la dose testée la plus élevée.
Dans une étude de toxicité par voie cutanée de 4 semaines menée chez le lapin, aucun effet nocif n’a été observé lorsque 2000 mg/kg p.c. de SME (à 10 %, en solution aqueuse) ont été appliqués à la peau intacte ou abrasée des animaux (CIR, 2015b).
Toxicité pour la reproduction et le développement : Dans une étude de toxicité à doses répétées combinée à une étude préalable de la toxicité pour la reproduction et le développement, des rats SD ont été exposés, par gavage, à 0, 100, 300 ou 1000 mg/kg p.c./jour d’OMIPA 2 semaines avant la période d’accouplement, ainsi que pendant les périodes d’accouplement, de gestation et de lactation, jusqu’au jour postnatal 5. Aucune toxicité générale ou toxicité pour la reproduction ou le développement n’a été observée jusqu’à 1000 mg/kg p.c./jour, soit la dose testée la plus élevée (ECHA, c2013-2017f).
Génotoxicité et cancérogénicité : Le LME n’a pas été mutagène dans un test de mutation bactérienne in vitro, avec ou sans activation métabolique (Zeiger et al., 1987). De même, le résultat de l’OMIPA était négatif in vitro dans un test de mutation bactérienne et un test du micronoyau, avec ou sans activation métabolique (ECHA, c2013-2017f).
Aucune donnée sur la cancérogénicité du LME ou de ses analogues (OMIPA, CME, SME) n’a été trouvée.
6.1.3 Caractérisation du risque associé aux substances du sous-groupe 1 (MEA, DEEA et LME)
MEA
Le tableau 6-3 présente les valeurs estimatives de l’exposition pertinente et les concentrations associées à des effets critiques sur la santé, ainsi que les marges d’exposition (ME) résultantes, pour la caractérisation du risque pour la santé humaine associé à une exposition au MEA.
| Scénario d’exposition | Exposition générale | Concentration associée à un effet critique | Paramètre d’effet critique sur la santé | ME |
|---|---|---|---|---|
| Exposition orale quotidienne, à des aliments et des boissons (tout-petits) | 0,47 mg/kg p.c./jour | DSENO = 178 mg/kg p.c./jour | Effets sur la reproduction à 580 mg/kg p.c./jour dans une étude de toxicité pour la reproduction sur deux générations chez le rata. | 379 |
| Exposition par inhalation, par utilisation, à du nettoyant pour le four | 0,20 mg/m3 | CSENO = 50 mg/m3 | Effets sur le larynx, notamment de l’inflammation, une hyperplasie et une nécrose, observés à 150 mg/m3 dans une étude de toxicité par inhalation de 4 semaines chez le rat. | 251 |
| Exposition quotidienne par inhalation, à des nettoyants tout usage en aérosols | 0,021 mg/ m3/jour | CSENO = 8,9 mg/m3/jourb | Effets sur le larynx, notamment de l’inflammation, une hyperplasie et une nécrose, observés à 150 mg/m3 dans une étude de toxicité par inhalation de 4 semaines chez le rat. | 430 |
Abréviations : CSENO, concentration sans effet nocif observé; DSENO, dose sans effet nocif observé.
a Les effets sont une diminution du poids de l’épididyme et de la queue de l’épididyme (chez les mâles parents F0 et F1) et une réduction du nombre de sites d’implantation chez les sujets des générations F0 et F1 associée à une augmentation des pertes post-implantatoires et à une diminution de la taille des portées (F1, F2).
b Transformé en un scénario d’exposition continue de la CSENO de 50 mg/m3 pendant 6 heures par jour, 5 jours par semaine = 50 mg/m3 × (6/24) × (5/7) = 8,9 mg/m3.
Les marges d’exposition sont considérées comme suffisantes pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé concernant le MEA.
Le risque pour la santé humaine dans des scénarios d’exposition cutanée au MEA avec rinçage a été considéré comme faible étant donné que, dans une étude de toxicité pour le développement par exposition cutanée chez le rat (Liberacki et al., 1996), l’absence de toxicité pour le développement et la diminution de la prise de poids corporel chez les mères ont été considérées comme susceptibles d’être secondaires à une irritation cutanée.
DEEA
Le tableau 6-4 présente les valeurs estimatives de l’exposition pertinente et la concentration associée à un effet critique, ainsi que la marge d’exposition résultante, pour la caractérisation du risque pour la santé humaine associé à une exposition au DEEA.
| Scénario d’exposition | Exposition générale | Concentration associée à un effet critique | Paramètre d’effet critique sur la santé | ME |
|---|---|---|---|---|
| Exposition orale quotidienne à de l’eau potable (nourrissons, alimentés aux préparations pour nourrissons) | 0,000 13 mg/ kg p.c./jour | DSENO = 50 mg/kg p.c./jour | Toxicité hépatique pour la mère (augmentation du poids du foie, de l’activité de l’AST et de la PA) à 150 mg/kg p.c./jour dans une étude de toxicité pour le développement par voie orale chez le lapin | 385000 |
| Exposition par voie cutanée, par utilisation, découlant de l’application d’encaustique ou de cire pour planchers (adultes) | 0,078 mg/kg p.c. | DSENO = 50 mg/kg p.c. (extrapolation de voie à voie) | Toxicité hépatique pour la mère (augmentation du poids du foie, de l’activité de l’AST et de la PA) à 150 mg/kg p.c./jour dans une étude de toxicité pour le développement par voie orale chez le lapin | 640 |
| Exposition par inhalation, par utilisation, découlant de l’application d’encaustique ou de cire pour planchers | 1,84 mg/m3 | CSENO = 316 mg/m3 | Diminution du poids corporel et de la prise de poids corporel chez les mères à 480 mg/m3 dans une étude de toxicité pour le développement par inhalation chez le rat | 170 |
Abréviations : AST, aspartate aminotransférase; PA, phosphatase alcaline; CSENO, concentration sans effet nocif observé; DSENO, dose sans effet nocif observé.
Les marges d’exposition sont considérées comme suffisantes pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
LME
Le tableau 6-5 présente les valeurs estimatives de l’exposition pertinente et la concentration associée à un effet critique, ainsi que la marge d’exposition résultante, pour la caractérisation du risque pour la santé humaine associé à l’exposition au LME.
| Scénario d’exposition | Exposition générale | Concentration associée à un effet critique | Paramètre d’effet critique sur la santé | ME |
|---|---|---|---|---|
| Exposition orale quotidienne à de l’eau potable (nourrissons, alimentés aux préparations pour nourrissons) | 0,00029 mg/ kg p.c./jour | DSENO = 1000 mg/kg p.c./jour (DME) | Aucun effet nocif observé dans une étude préalable de toxicité par voie orale à doses répétées combinée à une étude de toxicité pour la reproduction et le développement chez des rats exposés à l’OMIPA | 3400000 |
| Exposition quotidienne par voie cutanée, à du savon liquide pour le corps (nourrissons) | 0,16 mg/kg p.c./jour | DSENO = 2000 mg/kg p.c./jour (DME) | Aucun effet nocif observé dans une étude de toxicité par voie cutanée de 4 semaines chez des lapins exposés au SME | 12500 |
| Exposition par voie cutanée, par utilisation, à du savon liquide pour le corps (nourrissons) | 0,18 mg/kg p.c. | DSENO = 2000 mg/kg p.c. (DME) | Aucun effet nocif observé dans une étude de toxicité par voie cutanée de 4 semaines chez des lapins exposés au SME | 11000 |
Abréviations : DME, dose maximale d’essai; DSENO, dose sans effet nocif observé.
Les marges d’exposition sont considérées comme suffisantes pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
6.1.4 Incertitudes dans l’évaluation du risque pour la santé humaine associé aux substances du sous-groupe 1 (MEA, DEEA et LME)
Les principales sources d’incertitudes sont présentées dans le tableau 7-6.
| Principales sources d’incertitudes | Incidence |
|---|---|
| Aucune donnée récente sur le volume total de MEA fabriqué au Canada. | +/- |
| Aucune donnée canadienne sur la présence du MEA, du DEEA et du LME dans les milieux environnementaux. | +/- |
| Une seule étude a été trouvée; elle indiquait la concentration de MEA dans le jus de citron, et cette denrée a contribué de façon très importante à l’exposition au MEA par le régime alimentaire chez les enfants ainsi que chez les consommateurs de tous les groupes d’âge, combinés. | +/- |
| La moyenne arithmétique de la concentration de MEA la plus élevée déclarée pour un type d’aliment donné a été appliquée à une catégorie entière d’aliments ou de boissons. | + |
| Aucune étude d’exposition à long terme par inhalation pour le MEA. | +/- |
| Aucune étude d’exposition par voie cutanée à doses répétées pour le DEEA. | +/- |
| Aucune étude de toxicité à doses répétées, de cancérogénicité ou de toxicité pour la reproduction ou le développement par les voies d’exposition orales et cutanées pour le LME. | +/- |
+ = Incertitude sur le potentiel de surestimer le risque; +/- = Potentiel inconnu de surestimer ou de sous-estimer le risque
6.2 Évaluation des substances du sous-groupe 2 (DEA, LDE, CDE, CADEA et TADEA)
6.2.1 Évaluation de l’exposition aux substances du sous-groupe 2 (DEA, LDE, CDE, CADEA et TADEA)
Milieux environnementaux
Aucune donnée de surveillance de la concentration de DEA, de CADEA ou de TADEA dans les milieux environnementaux n’a été trouvée et aucune donnée de surveillance de la concentration de LDE ou de CDE dans l’air ou le sol, au Canada ou ailleurs, n’a été déclarée. Le LDE a été détecté dans la poussière domestique dans le cadre d’une étude réalisée en Norvège (Pedersen et al., 2002). Bien qu’elle n’ait pas été trouvée dans l’air et l’eau, la DEA est utilisée dans la purification du gaz naturel, des gaz de raffinerie et des gaz synthétiques et est une substance à déclaration obligatoire au Canada auprès de l’Inventaire national des rejets de polluants (INRP). Les rejets de cette substance dans l’eau d’une raffinerie de pétrole s’élèvent à 340 kg/an (0,34 tonne/an) et les rejets dans l’air de deux autres raffineries de pétrole, à 1100 et à 4600 kg/an (1,1 et 4,6 tonnes/an), respectivement (INRP, 2015).
Étant donné leur nature ionique dans des conditions pertinentes sur le plan environnemental (pH 6 à 8), la DEA et le TADEA ne peuvent pas être utilisés dans les modèles de fugacité habituellement employés pour estimer l’exposition de substances provenant des milieux environnementaux. Cependant, étant donné les données physicochimiques, les résultats de la modélisation de la fugacité des espèces non chargées (voir le tableau B-2, annexe B) et les concentrations mesurées limitées dans les milieux environnementaux relevées dans la documentation, l’absorption de la DEA, du LDE, du CDE, du CADEA et du TADEA provenant de l’air ambiant ou intérieur et du sol devraient être négligeables.
Les concentrations de la DEA, du LDE, du CDE, du CADEA et du TADEA dans l’eau potable ont été estimées à l’aide du scénario de rejet à l’égout après utilisation par les consommateurs dans les feuilles de calcul sur l’eau potable de l’UEE (Santé Canada, 2015a) et des quantités déclarées dans la Base de données du Commerce international de marchandises du Canada en 2011 (Environnement Canada, 2013). Pour des précisions sur les paramètres de modélisation pour l’estimation des concentrations de DEA, de LDE, de CDE, de CADEA et de TADEA dans l’eau potable, veuillez consulter le tableau B‑4 (annexe B). Les concentrations maximales au 50e centile de la DEA, du LDE, du CDE, du CADEA et du TADEA dans l’eau de surface de 10 plans d’eau récepteurs modélisés sont de 7,3, de 0,24, de 68, de 0,34 et de 2,6 µg/L, respectivement.
L’absorption estimative provenant de l’eau potable pour les nourrissons alimentés aux préparations pour nourrissons est de 0,000 78 mg/kg p.c./jour pour la DEA, de 2,5 x 10-5 mg/kg/jour pour le LDE, de 7,3 ×10-3 mg/kg p.c./jour pour le CDE, de 3,6 × 10-5 mg/kg p.c./jour pour le CADEA et de 2,8 × 10-4 mg/kg p.c./jour pour le TADEA.
Aliments
Aucune donnée sur la présence de la DEA, du LDE, du CDE, du CADEA ou du TADEA dans les aliments n’a été trouvée dans les études de surveillance alimentaire. Le CDE a été décelé dans l’une des trois moules d’origine commerciale prélevées au Danemark, mais seulement une concentration relative (aux « composés volatils » totaux) a été fournie (Rasmussen et al., 1993). Les auteurs ont conclu que sa présence dans les tissus du bivalve, présumément en tant que contaminant de l’environnement, résultait d’une séquestration de la substance dans l’eau.
Au Canada, la DEA, le LDE, le CADEA et le TADEA peuvent être utilisés dans certains matériaux d’emballage alimentaire pouvant être en contact direct avec les aliments. Le CDE pourrait être également utilisé dans certains matériaux d’emballage alimentaire, mais sans pouvoir être en contact direct avec des aliments (communication personnelle, courriels de la Direction des aliments de Santé Canada adressés au Bureau d’évaluation du risque des substances existantes de Santé Canada, s’échelonnant de septembre 2015 à mars 2018; sans référence).
L’absorption estimative prudente de DEA, de LDE, de CADEA et de TADEA découlant de l’utilisation de matériaux d’emballage d’aliments est de 0,00016, 0,00023, 0,00082 et 0,00882 mg/kg p.c./jour, respectivement (communication personnelle, courriels de la Direction des aliments de Santé Canada adressés au Bureau d’évaluation du risque des substances existantes de Santé Canada, s’échelonnant de septembre 2015 à juillet 2018; sans référence).
Au Canada, la DEA, le LDE, le CADEA et le TADEA peuvent être utilisés comme composants d’additifs indirects dans des produits employés dans des usines de transformation des aliments ne pouvant pas être en contact direct avec des aliments. Le CDE a été trouvé comme composant d’additifs indirects dans des produits utilisés dans des usines de transformation des aliments, plus particulièrement dans des nettoyants, des lubrifiants pour les surfaces sans contact avec des aliments et des assainissants sans rinçage à l’eau potable, mais pouvant être en contact direct avec des aliments. Cependant, l’exposition à cette substance devrait être négligeable (communication personnelle, courriels de la Direction des aliments de Santé Canada adressés au Bureau d’évaluation du risque des substances existantes de Santé Canada, s’échelonnant de septembre 2015 à mars 2018; sans référence).
Produits disponibles aux consommateurs
L’exposition potentielle découlant de l’utilisation de produits disponibles aux consommateurs a été estimée. Pour des précisions, veuillez consulter l’annexe D. Les estimations pour les utilisations qui donnent lieu à la concentration la plus élevée d’exposition potentielle par voie cutanée ou par inhalation (appelées scénarios sentinelles) sont présentées dans les tableaux 6-7 et 6-8, respectivement. D’autres scénarios d’utilisation possibles pour la DEA, le LDE et le CDE ont été examinés, mais ont donné lieu à des valeurs d’exposition plus faibles que celles présentées dans les tableaux 6-7 et 6-8, notamment pour la DEA dans du savon à lessive, des insectifuges, des traitements pour enfants contre les piqûres d’insectes, des produits d’entretien pour automobiles, des nettoyants pour automobiles et bateaux, des produits de santé naturels à application topique et des produits pharmaceutiques à usage vétérinaire. Cela vaut également pour le LDE et le CDE dans des agents antistatiques, des émulsifiants, des surfactants, des renforçateurs et des stabilisants de mousse, des agents de contrôle de la viscosité, des fixatifs pour les cheveux, des démaquillants, des produits de santé naturels à application topique, des savons liquides pour la vaisselle et la lessive, des nettoyants tout usage, des nettoyants et des décapants pour planchers, et des nettoyants pour automobiles et bateaux.
Absorption cutanée
Plusieurs études d’absorption cutanée réalisées avec la DEA, pertinentes pour les scénarios d’exposition à des cosmétiques d’intérêt chez l’humain, ont été réalisées. Une étude d’absorption cutanée in vitro réalisée chez l’humain a révélé que seulement une petite fraction de la DEA provenant de préparations cosmétiques a pénétré dans la peau humaine (Kraeling et al., 2004). Dans cette étude, de la [14C]-DEA a été ajoutée aux produits commerciaux mis à l’essai, puis appliquée sur de la peau humaine excisée placée dans des cellules à diffusion dynamique. Les produits appliqués étaient un shampoing (0,092 ou 0,28 % de DEA), un colorant capillaire (0,61 % de DEA) et une lotion pour le corps (0,02 % de DEA), lesquels sont restés sur la peau pendant 5 minutes, 30 minutes et 24 heures, respectivement. L’absorption cutanée estimative a été établie à 0,08 %, 0,09 % et 0,9 % pour le shampoing, le colorant capillaire et la lotion pour le corps, respectivement, d’après la quantité qui a été absorbée dans le fluide récepteur après 24 heures. Dans un deuxième volet de la même étude de Kraeling et al. (2004), la lotion pour le corps (0,02 % de DEA) a été appliquée pendant trois jours consécutifs (lavée et réappliquée aux 24 heures). La pénétration dans la peau était de 0,5 % en 24 heures et a augmenté à 0,8 % le jour 2 et à 0,9 % le jour 3, ce qui semble indiquer que l’absorption cutanée a augmenté avec la répétition de l’exposition. Les résidus fixés à la peau ne devraient pas être systématiquement présents, car après 72 heures de doses quotidiennes répétées, la DEA s’est accumulée dans la peau et ne s’est guère diffusée dans le liquide récepteur. Même s’il y a de légères différences entre les deux volets de l’étude, la valeur la plus élevée de l’absorption cutanée pour la DEA (dans la lotion pour le corps), 1 % (arrondi à partir de 0,9 %), a été utilisée pour les scénarios d’exposition cutanée chez l’humain.
Dans le cadre d’une étude in vitro d’absorption cutanée visant à déterminer la quantité de DEA résiduelle absorbée par voie cutanée à partir de produits cosmétiques contenant du CDE, du LDE et du TEA, sept formulations cosmétiques ont été appliquées sur la peau humaine dans des conditions d’utilisation, (et examinées après 24 et 48 heures (Brain et al. 2004). Cela comprend deux formulations de shampoing contenant du CDE (4,02 % de CDE, 0,98 % de DEA et d’autres agents de surface, dilution de 1:10, rincés après une exposition cutanée de 10 minutes) et du LDE (4,75 % de LDE, 0,25 % de DEA, dilution de 1:10, rincés après une exposition cutanée de 10 minutes), ainsi qu’un bain moussant contenant du LDE (4. 75 % de LDE, 0,25 % de DEA, dilution de 1:300, rincé après 30 minutes d’exposition cutanée) et une émulsion sans rinçage à base de TEA (1,99 % de TEA, 0,008 % de DEA, 48 heures d’exposition cutanée). L’absorption cutanée de DEA pour les deux shampooings contenant du CDE (en % de la dose appliquée) était de 0,02 % (après 48 heures) et de 0,03 % (après 24 heures) respectivement. Elle était de 0,01 % (après 24 heures) et de 0,03 % (après 24 heures) pour les deux shampooings contenant du LDE; de 0,5 % (après 24 heures) pour un bain moussant contenant du LDE, et de 0,6 % (48 heures) pour une émulsion sans rinçage contenant du TEA (Brain et al. 2004). Le taux d’absorption cutanée de 1 % utilisé pour la DEA tient compte de la gamme des valeurs d’absorption cutanée in vitro de la DEA à travers la peau humaine à partir de formulations cosmétiques contenant du CDE, du LDE ou du TEA (0,6 % ou moins) (Brain et al. 2004).
Pour l’estimation de l’exposition systémique due à une exposition cutanée potentielle au LDE et au CDE, une absorption cutanée de 1 % (arrondie à la hausse à partir de 0,48 %) a été utilisée sur la base d’une étude d’absorption cutanée humaine in vitro menée par Charles River en 2019 [communication personnelle, résultats préliminaires de Charles River Laboratories Edinburgh Ltd au Bureau de la science de la santé environnementale et de la recherche, SC, 12 novembre 2019; sans référence]. Comme il n’a pas été possible de radiomarquer le mélange de CDE, l’absorption cutanée de CDE chez l’homme a été déterminée par son principal composant, le LDE (Charles River Laboratories Edinburgh Ltd. 2020). Comme la taille moléculaire moyenne du CDE est supérieure à celle du LDE, l’absorption cutanée du CDE devrait être inférieure à celle du LDE.
Dans cette étude in vitro d’absorption cutanée chez l’homme, du savon liquide à des concentrations de 2 et de 20 % de [14C]-LDE a été appliqué sur de la peau humaine excisée dans des cellules de diffusion à flux continu, où les échantillons testés sont restés sur la peau pendant une heure. Les valeurs d’absorption cutanée à 24 heures, incluant et excluant les résidus fixés sur la peau, étaient de 0,07 % et 0,48 % pour le CDE à 2 % (récupération du bilan de masse de 99,3 %), et de 0,14 % et 0,24 % respectivement pour le CDE à 20 % (récupération du bilan de masse de 102,8 %) (Charles River Laboratories Edinburgh Ltd. 2020). Comme la disponibilité de résidus fixés sur la peau pour l’absorption systémique n’était pas établie, la limite supérieure d’absorption cutanée, y compris les résidus fixés sur la peau, 1 % (arrondi à partir de 0,48 %), a été appliquée aux estimations de l’exposition cutanée externe lors de la détermination de l’exposition systémique au LDE et au CDE.
| Substance | Scénario de produita | Concentration (%) | Exposition par utilisation(mg/kg p.c.) | Exposition quotidienne (mg/kg p.c./jour)b |
|---|---|---|---|---|
| DEA | Détergent à vaisselle – lavage à la main | 5 | 0,0002c | 0,00026c |
| DEA | Peinture au latex pour les murs – à partir d’un colorant dilué dans une base | 1d | 0,0051c | s.o. |
| LDE | Savon liquide pour le corps (nourrisson) | 10 | 0,0061c | 0,0052c |
| LDE | Savon liquide pour le corps | 10 | 0,0016c | 0,0022c |
| CDE | Nettoyant tout usage liquide | 2 | 0,00088 | 0,00088c |
| CDE | Masque de beauté/ masque antirides | 10 | 0,028 c | s.o. |
| CDE | Savon liquide pour le corps (nourrisson) | 10 | 0,0061c | 0,0052 c |
| CDE | Savon liquide pour le corps | 10 | 0,0016c | 0,0022c |
| CDE | Shampoing (enfant) | 30 | 0,011c | 0,013c |
| CDE | Shampoing | 30 | 0,005c | 0,005c |
| CADEA | Savon liquide pour le corps (enfant) | 5 | 0,095 | 0,089 |
| CADEA | Savon liquide pour le corps | 5 | 0,078 | 0,11 |
| CADEA | Shampoing | 5 | 0,083 | 0,092 |
| TADEA | Liquide à transmission | 25 | 0,072 | s.o. |
Abréviations : s.o., sans objet en raison d’une utilisation intermittente.
a Représente une exposition directe des adultes, sauf si indiqué autrement.
b Ces valeurs tiennent compte de la fréquence d’utilisation quotidienne présumée et, pour les estimations de ConsExpo, la valeur d’exposition quotidienne moyennée sur un an a été utilisée. Pour des précisions sur les modèles et les paramètres utilisés, veuillez consulter l’annexe D.
c Exposition générale par voie cutanée, en supposant une absorption cutanée de 0,9 %.
d Concentration dans le concentré de colorant.
| Substance | Scénario de produita | Concentration (%) | Concentration MPT dans l’air pendant 6 heures (mg/m3) | Concentration moyenne dans l’air le jour de l’exposition (mg/m3) |
|---|---|---|---|---|
| DEA | Lingettes humides - nettoyage tout usage (exposition aux émanations) | 1 | 0,0012 | 0,00029 |
| DEA | Peinture pour les murs (exposition aux émanations) | 1b | 0,0034 | 0,000085 |
| LDE | Fixatifs pour les cheveux | 1 | 0,00018 | 0,0014 |
Abréviations : MPT, moyenne pondérée dans le temps
a Représente l’exposition directe des adultes.
b Concentration dans le concentré de colorant.
Étant donné le grand nombre (environ 1200) et la variété de produits cosmétiques appliqués sur la peau pour lesquels il a été déclaré qu’ils contiennent du CDE, une estimation de l’exposition globale au CDE découlant de l’utilisation de plusieurs produits appliqués sur la peau a été examinée, en prenant en compte le document du Scientific Committee on Consumer Safety (SCCS) intitulé Guidance for the Testing of Cosmetic Ingredients and their Safety Evaluation (SCCS, 2016). Les valeurs estimatives de l’exposition quotidienne globale au CDE dans les cosmétiques sont présentées dans le tableau 6‑9.
| Produit | Concentrationa (%) | Exposition quotidienneb – adolescents (mg/kg p.c./jour) | Exposition quotidienneb – adultes (mg/kg p.c./jour) |
|---|---|---|---|
| Savon liquide pour le corps | 10 | 0,0019 | 0,0022 |
| Nettoyant facial | 30 | 0,00092 | 0,0018 |
| Shampoing | 30 | 0,0066 | 0,005 |
| Exposition combinée totale (mg/kg p.c./jour)a | - | 0,0094 | 0,0095 |
a Communication personnelle, courriels de la Direction de la sécurité des produits de consommation et des produits dangereux (DSPCPD) de Santé Canada adressés au Bureau d’évaluation du risque des substances existantes de Santé Canada, s’échelonnant de juillet 2015 à juin 2018; sans référence.
b Exposition systémique par voie cutanée, en supposant une absorption cutanée de 1
La DEA a été classée comme potentiellement cancérigène pour l’homme (IARC 2013a). Afin d’estimer le risque potentiel de cancer associé à l’exposition à la DEA, nous avons calculé les doses quotidiennes moyennes à vie (DQMV) pour une exposition quotidienne par l’eau potable (0,00018 mg/kg p.c./jour), l’utilisation quotidienne de détergent liquide pour le lavage manuel de la vaisselle (0,000093 mg/kg p.c./jour) et l’utilisation quotidienne de lingettes nettoyantes humides (0,000048 mg/kg p.c./jour) (voir l’annexe D). De plus, une nouvelle étude importante sur l’absorption cutanée, résumée à la section 6.2.1, a servi de base à la présente évaluation (Charles River Laboratories Edinburgh Ltd. 2020).
6.2.2 Évaluation des effets sur la santé associés aux substances du sous‑groupe 2 (DEA, LDE, CDE, CADEA et TADEA)
Substances du sous-groupe 2A (DEA, LDE et CDE)
Une caractérisation du danger associé à la DEA a été réalisée par l’OCDE (OCDE, 2007a, 2009) et pour les amides gras N‑dérivés (dont le CDE et le LDE) par l’US EPA (EPA 2010a). Le CIRC a classé la DEA (CIRC, 2013a) et le CDE (CIRC, 2013b) comme des substances peut-être cancérogènes pour l’humain (groupe 2B) d’après les données probantes suffisantes chez les animaux soumis à des essais de cancérogénicité, mais non d’après des données sur l’humain. Le comité d’experts du CIR a récemment publié une version du rapport final de l’évaluation de l’innocuité concernant la DEA (CIR, 2017), ainsi que le CDE et le LDE (CIR, 2013b). Les rapports de l’OCDE et du CIRC ont servi à éclairer l’évaluation des effets des substances du sous-groupe 2 sur la santé. Nous avons utilisé les données toxicologiques du LDE et du CDE pour l’extrapolation et combler conointement les lacunes des données. Une recherche dans la documentation a été réalisée d’avril 2006 à décembre 2017. Une analyse dose-réponse commune de l’induction de cancérogénicité par la DEA a été publiée par Kirman et al. (2016) et a été prise en compte dans la caractérisation du danger et du risque dans la présente évaluation.
Comme le CDE, le LDE et leur analogue structurel ODE sont des produits de condensation d’un acide gras correspondant et de la DEA, ils contiennent des résidus de DEA n’ayant pas réagi en différentes concentrations (comme 18,2 %, 0,83 % et 0,19 % de résidus de DEA, respectivement, dans NTP, 1999 b, 1999c, 2001). Dans des études de cancérogénicité cutanée réalisées chez des rongeurs, la DEA et les résidus de DEA contenant des substances chimiques (LDE, CDE et ODE) ont été utilisés pour consolider une analyse dose-réponse de la cancérogénicité des résidus de DEA (similairement à Kirman et al., 2016). En outre, une étude de toxicité cutanée à doses répétées réalisée avec l’ODE a été utilisée pour déterminer la contribution des résidus de DEA à la toxicité du LDE et du CDE.
Même s’il y avait des études de cancérogénicité cutanée chez des animaux pour la DEA, le LDE et le CDE administrés dans l’éthanol, une comparaison directe des concentrations associées à un effet critique déterminées dans ces études, avec celles des expositions cutanées découlant de l’utilisation de produits de formulation chez l’humain devrait surestimer le risque, car elle ne prendrait en compte ni 1) les différences entre les espèces relativement à l’absorption cutanée avec le même véhicule (p. ex. Sun et al., 2008), ni 2) l’absorption cutanée relativement plus élevée dans les études sur des animaux où les doses appliquées de la substance dans l’éthanol étaient plus élevées (Mathews et al., 1997). Étant donné qu’il existe des études d’absorption cutanée réalisées avec des préparations de cosmétiques d’intérêt applicables à l’humain, ainsi que des études d’absorption cutanée menées avec des véhicules contenant de l’éthanol et avec les mêmes espèces animales et lignées utilisées dans les études de toxicité qui nous intéressent, il a été possible d’approfondir les composantes exposition et danger de la caractérisation du risque selon l’absorption cutanée propre à l’espèce, à la substance et au véhicule représentant chaque scénario d’exposition.
Toxicocinétique : L’absorption cutanée relative plus faible de la DEA chez l’humain a été illustrée in vitro après une exposition de 6 heures à 37 % de DEA en solution aqueuse. L’absorption cutanée de la DEA en solution aqueuse dans toute l’épaisseur de la peau était la plus faible (0,2 %) chez l’humain, comparativement à l.absorption cutanée chez la souris (7 %), le rat (0, 6 %) et le lapin (3 %) (Sun et al., 2008). Mathews et al. (1997) ont examiné l’absorption cutanée de la [14C]-DEA dans l’éthanol chez des rats F344 mâles et des souris B63CF1 mâles, reprenant le même véhicule et les mêmes lignées utilisés dans les principales études de toxicité cutanée (d’autres précisions dans les prochaines sections). Après une application cutanée de 48 heures de DEA à 95 % dans une solution d’éthanol, 2 %, 6 % et 12 % des doses administrées (2,1, 7,6 et 27,6 mg/kg p.c. de DEA, respectivement, excluant les résidus fixés sur la peau) ont été absorbées chez les rats et 23 %, 31 % et 57 % des doses administrées (8, 23 et 81 mg/kg p.c. de DEA, respectivement, excluant les résidus fixés sur la peau) ont été absorbées chez les souris. L’absorption cutanée augmente avec la dose appliquée chez les rats et les souris. Kirman et al. (2016) ont utilisé ces données pour estimer l’absorption cutanée chez le rat à 48 heures.
Dans l’annexe E sont présentées les doses administrées par voie cutanée à des rongeurs ayant entraîné un effet sur la santé digne d’intérêt (c.-à-d., concentrations associées à un effet critique), doses transformées en une valeur d’exposition continue pendant 24 heures (c.-à-d., concentrations externes associées à un effet critique), ainsi qu’en valeurs correspondantes d’absorption cutanée utilisées dans l’extrapolation vers la dose interne. Les valeurs en pourcentage de l’absorption cutanée dans l’étude de Mathews et al. (1997) ont été établies après une exposition de 48 heures, mais une valeur d’absorption cutanée fondée sur une exposition de 24 heures a été nécessaire pour transformer une concentration sur 24 heures associée à un effet critique (c.-à-d., une concentration externe associée à un effet critique dans l’annexe E) en une dose interne (c.-à-d., une concentration interne associée à un effet critique dans l’annexe E). Dans une étude d’absorption de la peau humaine exposée in vitro à des doses répétées d’une lotion préparée avec 0,02 % de DEA, la pénétration des doses appliquées était de 0,5 % en 24 heures, laquelle a augmenté à 0,8 % au jour 2 et à 0,9 % au jour 3, ce qui semble indiquer que plus de la moitié de la dose de DEA a été absorbée dans les 24 premières heures (Kraeling et al., 2004). Même s’il peut y avoir des différences entre les espèces, il a été considéré comme raisonnable de supposer que le pourcentage d’absorption cutanée à 24 heures correspondait à la moitié de l’absorption cutanée après une exposition de 48 heures chez la souris. L’utilisation de la moitié plutôt qu’un pourcentage plus élevé de l’absorption cutanée après une exposition de 24 heures est considérée comme prudente (puisqu’elle entraîne un point de départ plus bas).
Pour déterminer la toxicocinétique de la DEA par administration orale, des rats ont reçu de la [14C]-DEA à raison de 7 mg/kg p.c./jour pendant une période allant jusqu’à 8 semaines, et 57 % de la [14C]-DEA totale ont été trouvés dans les tissus, et 24 %, dans l’excrétat. Cela semble indiquer une absorption presque complète et une biodisponibilité élevée par la voie orale (Mathews et al., 1997).
Comme pour la DEA, l’absorption cutanée de LDE dans le savon liquide chez l’homme était de 1% (Charles River Edinburgh Ltd. 2020), ce qui était inférieur à celle des rongeurs. Après l’application cutanée de [14C]-LDE dans de l’éthanol 95 % chez des souris (doses de 50 à 800 mg/kg p.c.) et des rats (doses de 25 ou de 400 mg/kg p.c.) pendant 72 heures, 21 % à 26 % de la radioactivité appliquée (excluant les résidus fixés à la peau) ont été absorbés chez les souris et les rats, respectivement, et l’absorption était similaire quelle que soit la dose administrée chez les souris et les rats (Mathews et al., 1996).
Le LDE a été rapidement éliminé de tous les tissus sauf les tissus adipeux, et a été principalement excrété sous forme de métabolites polaires dans l’urine (80 % à 90 %) après une administration par voie orale à des rats (Mathews et al., 1996). Il a été facilement hydrolysé au niveau de l’acide gras, mais a été résistant à l’hydrolyse du groupe amide chez les rats et les souris (Mathews et al., 1996). Par conséquent, la DEA ne devrait pas être un métabolite du LDE ou du CDE. Le CDE devrait être métabolisé de manière semblable au LDE.
Études à doses répétées : Des études à doses répétées ont été menées chez des rongeurs par voie orale (eau potable), par voie cutanée et par inhalation.
Dans des études de toxicité orale de 2 semaines et de 13 semaines menées chez des rats, les animaux exposés à la DEA dans l’eau potable ont présenté des effets sur les paramètres hématologiques (anémie microcytaire normochrome) et les reins (augmentation du poids absolu et du poids relatif des reins) (NTP, 1992). La DMENO a été établie à 79 mg/kg p.c./jour (étude menée avec la dose d’essai minimale, par voie orale, sur 2 semaines), ainsi qu’à 25 mg/kg p.c./jour chez les mâles et à 14 mg/kg p.c./jour chez les femelles (étude menée avec la dose d’essai minimale, par voie orale, sur 13 semaines), d’après les effets observés sur les paramètres hématologiques et les reins. Dans des études d’exposition par voie orale de 2 semaines et de 13 semaines menées chez la souris, la DEA dans l’eau potable a causé des effets sur le foie (augmentation du poids du foie et changements histologiques), outre les effets sur les reins (NTP, 1992).
Dans des études de toxicité cutanée de 2 semaines et de 13 semaines menées chez le rat ou la souris, une irritation cutanée a été observée (notamment une ulcération, une acanthose) (NTP, 1992). Chez le rat, l’application cutanée de la DEA a entraîné des effets sur les paramètres hématologiques (anémie microcytaire normochrome) et les reins (augmentation du poids relatif et du poids absolu des reins, de la concentration d’azote uréique, de l’activité de la lactate déshydrogénase urinaire et de l’incidence de la nécrose de l’épithélium tubulaire). Chez la souris, des effets sur le foie (augmentation du poids du foie et changements histologiques, études de 2 semaines et de 13 semaines) et sur les reins (augmentation du poids des reins, étude de 13 semaines) liés à l’application de la DEA ont été constatés (NTP, 1992). La DMENO de 125 mg/kg p.c./jour (la dose d’essai minimale, étude de toxicité cutanée de 2 semaines chez la souris), établie d’après une augmentation du poids relatif et du poids absolu des reins et la DMENO de 32 mg/kg p.c./jour (la dose d’essai minimale, étude de toxicité cutanée de 13 semaines chez la souris), établie d’après les effets sur les paramètres hématologiques et les reins ont été trouvées.
Dans une étude de toxicité par inhalation de 2 semaines, la CSENO a été établie à 200 mg/m3, d’après des effets généraux légers comme une diminution du poids corporel et une augmentation du poids du foie à 400 mg/m3 (BASF, 1993a, mentionné dans OCDE, 2008). Dans des études de toxicité par inhalation de 3 mois, l’exposition de rats (museau seulement) à des aérosols de DEA a provoqué une anémie normochrome, des effets sur le foie (augmentation du poids du foie et de l’activité de la phosphatase alcaline dans le sérum) et sur les reins (augmentation du poids des reins et changements histologiques), ainsi qu’une irritation des voies respiratoires supérieures, effets qui ont été réversibles et considérés comme une réaction d’adaptation (BASF AG, 2002, mentionné dans OCDE, 2008; Gamer, 2008). L’OCDE (2007a) a déterminé que la CSENO établie d’après les effets généraux était de 15 mg/m³ et que la CSENO établie d’après l’irritation des voies respiratoires supérieures était de 3 mg/m³.
Dans une étude de toxicité par voie orale de 13 semaines menée chez des rats exposés au LDE (Guant et al., 1967), des effets négatifs sur les reins et des paramètres hématologiques ont été relevés. Dans cette étude, des rats SPF (15/sexe/dose) ont reçu dans leur régime alimentaire 0 %, 0,1 %, 0,5 %, 1,0 % ou 2,0 % de LDE (contenant 5,6 % de résidus de DEA). Une diminution importante du poids relatif et du poids absolu des reins a été observée chez les femelles à partir de 0,5 % de LDE. Une diminution du taux d’hémoglobine, de l’hématocrite et du nombre d’érythrocytes a été constatée chez les femelles des groupes traités à 1 % et à 2 %, et des effets moins prononcés ont été observés chez les mâles. La DSENO et la DMENO ont été établies à 0,1 % (équivalant à 50 mg/kg p.c./jour) et à 0,5 % (équivalant à 250 mg/kg p.c./jour), respectivement, d’après l’augmentation du poids des reins et une anémie.
Dans une étude de toxicité cutanée de 14 semaines, la peau de souris B6C3F1 (10/sexe/dose) a été exposée au LDE (0,83 % de résidus de DEA) dans de l’éthanol aux doses de 0, 50, 100, 200, 400 ou 800 mg/kg p.c./jour (NTP, 1999b). Aucun effet lié au traitement n’a été causé sur le poids corporel ou les paramètres hématologiques. Une augmentation du poids relatif et du poids absolu des reins a été observée chez les mâles ayant reçu 100 mg/kg p.c./jour ou plus. Chez les femelles, le poids du foie était bien supérieur chez les animaux ayant reçu 200 mg/kg p.c./jour ou plus, par rapport aux témoins (ayant reçu seulement le véhicule). Une augmentation des lésions cutanées au lieu d’application, notamment une hyperplasie épidermique et des glandes sébacées, une inflammation chronique, une parakératose, et un ulcère, a été observée chez les mâles et les femelles ayant reçu 200 mg/kg p.c./jour ou plus. La DSENO a été établie à 50 mg/kg p.c./jour d’après une augmentation du poids des reins. Dans une étude de toxicité cutanée de 14 semaines menée chez le rat, la DSENO a été établie à 100 mg/kg p.c./jour d’après une diminution du poids corporel final et de la prise de poids corporel chez les mâles et une augmentation du poids des reins chez les femelles, à 200 mg/kg p.c./jour (NTP, 1999b).
Pour le CDE, dans une étude de toxicité cutanée de 14 semaines, des rats F344/N (10/sexe/dose) ont reçu du CDE (contenant 18,2 % de résidus de DEA) dans de l’éthanol, par application cutanée, à raison de 0, 25, 50, 100, 200 ou 400 mg/kg p.c./jour, 5 jours par semaine (NTP, 2001). Chez les femelles, le poids absolu et le poids relatif des reins ont augmenté de façon importante à 50 mg/kg p.c./jour et plus, l’incidence de régénérescence des tubules rénaux ayant été plus élevée à 100 mg/kg p.c./jour et la gravité accrue à 200 mg/kg p.c./jour et plus. À 200 mg/kg p.c./jour et plus, une anémie (diminution du nombre d’érythrocytes, du taux d’hémoglobine et de l’hématocrite) a été relevée chez les femelles, et une diminution du poids corporel et de la prise de poids corporel a été constatée chez les individus des deux sexes. À 400 mg/kg p.c./jour, chez les mâles, il y a eu une augmentation du poids du foie. Une irritation de la peau (notamment une hyperplasie épidermique, une hyperplasie des glandes sébacées, une inflammation, une parakératose et des ulcères) aux lieux d’application a été observée à 100 mg/kg p.c./jour et plus. La DSENO a été établie à 50 mg/kg p.c./jour d’après une augmentation du poids des reins associée à des changements histopathologiques à 100 mg/kg p.c./jour chez les femelles.
Comme le CDE et le LDE des études de toxicité cutanée à doses répétées décrites ci‑dessus contenaient des résidus de DEA, et que des effets nocifs similaires ont été observés sur les reins des animaux traités par la DEA, il n’est pas clair que les effets nocifs observés peuvent être attribués à la DEA et/ou au CDE ou au LDE. Une étude de toxicité cutanée de 13 semaines réalisée avec l’ODE, un analogue structural du CDE et du LDE, contenant une quantité minime de DEA comme impureté (0,19 %) (NTP, 1999c), a été trouvée. Dans cette étude, la peau de souris B6C3F1 (10/sexe/dose) a été exposée à 0, 50, 100, 200, 400 ou 800 mg/kg/jour d’ODE dans de l’éthanol. Une augmentation du poids relatif et du poids absolu des reins (chez les mâles uniquement) et du poids du foie (chez les deux sexes) a été observée à 50 mg/kg p.c./jour et plus. Aux doses plus élevées, une diminution de la prise de poids corporel (à 400 mg/kg p.c./jour chez les femelles et à 800 mg/kg p.c./jour chez les deux sexes) a été constatée. Aucun effet nocif n’a été relevé dans l’évaluation des paramètres hématologiques, de biochimie clinique et d’histopathologie. Des lésions cutanées (notamment une hyperplasie épidermique, une parakératose, une inflammation, une hypertrophie des glandes sébacées et un ulcère) au lieu d’application ont été observées chez toutes les souris traitées et, en général, la gravité de ces lésions augmentait avec la dose. La DMENO a été établie à 50 mg/kg p.c./jour (dose d’essai minimale). Puisque des effets sur les reins ont été observés à une dose d’ODE plus faible que celle de LDE ou de CDE dans ces études de toxicité cutanée chez des rongeurs, et étant donné la quantité relativement plus faible de la DEA résiduelle dans l’ODE, il est peu probable que les résidus de DEA soient les uniques responsables des effets observés sur les reins dans les études réalisées avec le LDE ou le CDE.
Toxicité pour la reproduction et le développement : Dans une étude de toxicité pour le développement par voie orale menée chez le rat (Price et al., 2005, mentionné dans OCDE, 2008), l’administration de la DEA par gavage a causé une toxicité maternelle, notamment une augmentation de la mortalité et une diminution du poids corporel, de la prise de poids corporel et de la consommation d’aliments à 200 mg/kg p.c./jour. Une toxicité pour le développement a également été observée à la même dose, comme l’indique la diminution de la prise de poids corporel chez les petits (y compris au début de la période postnatale). La DSENO pour le developpement a été établie à 50 mg/kg p.c./jour d’après l’augmentation de la mortalité postnatale à 125 mg/kg p.c./jour dans l’absence de la toxicité maternelle (OCDE, 2007a). Une étude sur la toxicité pour le développement par inhalation menée sur un groupe de rats exposés à la DEA en aérosol (museau uniquement) a révélé une toxicité maternelle sous forme d’hémorragie vaginale observée au JG 14 à 200 mg/m3, mais aucune toxicité pour le développement (BASF, 1993b, mentionné dans OCDE, 2008). La CSENO maternelle a été établie à 50 mg/m3. Une étude de toxicité pour le développement par voie cutanée menée sur un groupe de lapins exposés à la DEA en solution aqueuse a révélé une toxicité maternelle (diminution de la prise de poids corporel) à 100 mg/kg p.c./jour et plus, mais aucune indication de toxicité pour le développement (CIR, 2017).
Une étude de toxicité pour le développement, suivant les lignes directrices de l’OCDE pour les essais de produits chimiques 414, a été menée pour le CDE (Pitterman, 1994). Des rats (SD) femelles en gestation ont reçu du CDE (aucune information sur la composition des résidus de DEA dans la substance à l’essai) aux doses de 0, 100, 300 ou 1000 mg/kg p.c./jour dans de l’huile d’arachide, par gavage (voie orale), du JG 6 au JG 15. À part la salivation observée dans tous les groupes de traitement, aucune autre toxicité maternelle générale n’a été observée. Les traitements n’ont pas entraîné d’effet sur le développement aux doses allant jusqu’à 1000 mg/kg/jour.
Génotoxicité et cancérogénicité : Selon les données disponibles, la DEA, le CDE et le LDE ne sont pas génotoxiques. La DEA, le CDE et le LDE n’ont été mutagènes ni dans les tests d’Ames, avec ou sans activation métabolique S9 (Dean et al., 1985, NTP, 2001) ni dans un essai sur lymphomes de souris (NTP, 1992, 1999a,b, 2001). La DEA et le CDE n’ont pas été clastogènes dans les tests d’aberration chromosomique et n’ont pas augmenté la fréquence des échanges de chromatides sœurs et des aberrations chromosomiques dans les cellules ovariennes de hamster chinois cultivées (NTP, 2001). Dans les cellules ovariennes de hamster chinois, le LDE a augmenté la fréquence des échanges de chromatides sœurs, mais n’a pas eu d’effet dans le test d’aberration chromosomique, avec ou sans activation métabolique (NTP, 1999c). Dans les tests du micronoyau in vivo, des souris B6C3F1 ont été traitées, par voie cutanée, par la DEA (jusqu’à l’équivalent de 1250 mg/kg p.c./jour) ou le LDE (jusqu’à 800 mg/kg p.c./jour) pendant 13 semaines, sans augmentation des micronoyaux (NTP, 1992, NTP, 1999c). Par contre, une augmentation de la fréquence des micronoyaux dans les érythrocytes normochromes périphériques à la dose maximale d’essai (800 mg/kg) causée par le CDE a été observée chez les souris mâles et femelles (NTP, 2001).
La DEA s’est révélée être cancérogène pour les souris par exposition par voie cutanée (NTP, 1999a). Chez des souris B6C3F1 (50/sexe/dose), les animaux de chaque cage ont été exposés par voie cutanée à la DEA en solution d’éthanol aux concentrations de 0, 40, 80 ou 160 mg/kg p.c./jour, à raison de 5 jours par semaine, pendant 103 semaines (NTP, 1999a). Des effets non cancérogènes liés au traitement, notamment une hyperkératose et une acanthose, ont été observés au lieu d’application. La survie des femelles exposées, et non celle des mâles, a été bien inférieure à celle des individus des groupes témoins (exposés seulement au véhicule) correspondants. Le poids corporel moyen chez les femelles des groupes traités était inférieur à celui des individus des groupes témoins (véhicule) pendant la deuxième année de l’étude. Le traitement a causé une augmentation des tumeurs au foie chez les souris mâles et femelles par rapport aux individus des groupes témoins. L’incidence des tumeurs hépatocellulaires (adénomes, carcinomes et hépatoblastomes combinés) chez les deux sexes combinés était de 72/100, 97/100, 100/100 et 99/100 à 0, 40, 80 et 160 mg/kg p.c./jour, respectivement (annexe F, tableau F-1). En raison de l’incidence élevée des tumeurs, une évaluation dose-réponse n’a pas pu être déterminée. L’exposition à la DEA a également entraîné une augmentation de l’incidence des tumeurs aux reins chez les souris mâles, les incidences observées ayant été de 3/50, 7/50, 8/50 et 9/50 dans les groupes exposés à 0, 40, 80 et 160 mg/kg p.c./jour, respectivement.
Par contre, la DEA n’était pas cancérogène dans une étude similaire menée chez le rat exposé par voie cutanée (NTP, 1999a). Des rats F344/N (50/sexe/dose) ont été exposés par voie cutanée à la DEA en solution d’éthanol aux concentrations de 0, 8 (femelles uniquement), 16, 32 et 64 (mâles uniquement) mg/kg p.c./jour, à raison de 5 jours par semaine, pendant 103 semaines. Une irritation cutanée semblable à celle observée chez la souris a été relevée chez le rat. Le traitement par la DEA a causé une diminution du poids corporel chez les mâles du groupe exposé à 64 mg/kg p.c./jour par rapport à ceux du groupe témoin, à partir de la semaine 8. Aucune augmentation de l’incidence des tumeurs n’a été constatée.
Dans une étude de cancérogénicité par voie cutanée de 2 ans menée avec le CDE, la peau de souris B6CF1 (50/sexe/dose) et de rats F344/N (50/sexe/dose) a été exposée à du CDE (contenant 18,2 % de résidus de DEA), dans de l’éthanol 95 % aux doses de 0, 100 ou 200 mg/kg p.c./jour, à raison de 5 jours par semaine (NTP, 2001). Chez les souris, le CDE a affecté la peau au lieu d’application (hyperplasie épidermique, hyperplasie des glandes sébacées et hyperkératose) et causé une augmentation des néoplasmes au foie (adénome hépatocellulaire, carcinome hépatocellulaire et hépatoblastome) chez des individus des deux sexes (annexe F, tableau F-1), une diminution du poids corporel chez les femelles à 100 mg/kg p.c./jour et plus, et une augmentation des tumeurs aux reins chez les mâles à 200 mg/kg p.c./jour. Chez le rat, une irritation de la peau similaire chez les souris a été observée au lieu d’application, mais aucune cancérogénicité n’a été relevée.
Dans une étude de cancérogénicité par voie cutanée de 2 ans menée avec le LDE et limitée par deux groupes de doses, la peau de souris B6CF1 (50/sexe/dose) et de rats F344/N (50/sexe/groupe) a été exposée au LDE (contenant 0,83 % de résidus de DEA) dans de l’éthanol 95 % aux doses de 0, 100 ou 200 mg/kg p.c./jour, à raison de 5 jours par semaine (NTP, 1999b). Chez les souris, le LDE a affecté la peau et causé une augmentation des tumeurs au foie à 100 mg/kg p.c./jour et plus (annexe F, tableau F-1), et une diminution du poids corporel a été observée chez les femelles à 200 mg/kg p.c./jour, mais aucune augmentation des tumeurs aux reins n’a été constatée. Chez le rat, le LDE a également eu des effets sur la peau, mais aucun effet cancérogène n’a été observé.
Les données sur l’ODE, un analogue structural du CDE et du LDE contenant une faible quantité de résidus de DEA), a été utilisé pour obtenir une analyse de réponses aux doses par groupement des résidus de DEA contenant des substances chimiques (annexe F). Dans une étude de deux ans sur le cancer de la peau réalisée avec l’ODE et limitée par deux groupes de doses, la peau de souris B6CF1 (50/sexe/dose) et de rats F344/N (50/sexe/dose) a été exposée à l’ODE (0,19 % de résidus de DEA) dans de l’éthanol 95 % aux doses de 0, 15 ou 30 mg/kg p.c./jour, à raison de 5 jours par semaine (NTP, 1999c). À 15 et à 30 mg/kg p.c./jour, l’ODE a affecté la peau, mais n’a eu aucun effet cancérogène chez la souris et le rat.
Une évaluation de réponses aux doses des tumeurs du foie n’a pas pu être réalisée en utilisant l’étude cutanée individuelle chez les souris exposées à la DEA, ou aux substances contenant de la DEA (CDE, LDE ou ODE). Cependant, ces quatre études indépendantes de cancérogénicité par voie cutanée chez des souris exposées à la DEA, ou à des substances contenant de la DEA (CDE, LDE ou ODE), ont été menées dans le même laboratoire dans des conditions similaires (NTP, 1999a,b,c et 2001). La formation de tumeurs était associée dans ces études à la concentration des résidus de DEA dans le CDE et le LDE (NTP, 1999b, 2001), tandis que le CIRC (2013b) a indiqué que la réponse tumorale chez les souris exposées au CDE semble être due à la présence de résidus de DEA dans la solution d’essai.
Kirman et al., (2016) ont combiné les données de ces études indépendantes de cancérogénicité par voie cutanée et ont mené une analyse par modélisation de la dose repère (DR) pour consolider la relation entre la DEA et l’incidence des tumeurs de foie. Dans cette étude, la dose de chaque substance administrée a été multipliée par la proportion des résidus de DEA dans chaque substance à l’essai pour déterminer la quantité de DEA administrée (annexe F, tableau F-1). Kirman et al. ont ensuite multiplié chaque dose de DEA administrée par une fraction de l’absorption cutanée à 48 heures d’après Mathews et al., (1997) pour déterminer les doses absorbées de résidus de DEA. Ces dernières ont été utilisées pour déterminer les doses correspondant à une augmentation de 10 % de l’excès de risque (DE10) de formation de tumeurs hépatiques combinées chez la souris et sa limite inférieure à 95 % (DEL10), soit à 0,49 et à 0,39 mg/kg p.c./jour, respectivement (équivalant à une DR10 et à une BMDL10). Cependant, dans leur analyse, une incertitude a été introduite par l’extrapolation des doses internes provenant des doses administrées de façon externe ayant des valeurs d’absorption cutanée différentes établies sur des expositions de 48 heures plutôt que 24 heures.
Dans la présente évaluation, les données de quatre études indépendantes de cancérogénicité ont été combinées sur la base d’une approche adaptée de Kirman et al., 2016 (annexe F, tableau F-1), mais la modélisation de la dose repère a été menée pour la dose de DEA administrée de façon externe plutôt que pour la dose de DEA absorbée de façon interne. La modélisation a été réalisée à l’aide du modèle de cancérogénicité multistade BMDS (version 2.5) de l’EPA des États‑Unis (annexe F, figure F-1). Les résultats ont révélé que la DR10 et la BMDL10 de la DEA administrée de façon externe ayant causé une augmentation de de la formation de tumeurs au foie chez les deux sexes de souris étaient de 1,84 mg/kg p.c./jour et de 1,46 mg/kg p.c./jour, respectivement (annexe F, figure F-1). Cette valeur a été transformée pour une exposition continue de 24 heures établie à 1,04 mg/kg p.c./jour d’après une valeur estimative d’absorption cutanée de 13,4 %, transformée en une BMDL10 interne de 0,14 mg/kg p.c./jour (annexe F).
Mode d’action
Les données probantes, appuyant un mode d’action non génotoxique pour la cancérogénicité au foie induite par la DEA, ont été décrites en profondeur par rapport au cadre du mode d’action établi (Leung et al., 2005, et Kirman et al., 2016) et appuyées par le CIRC (2013a). Comme la DEA est un analogue structural de la choline, elle inhibe probablement le transport de la choline, entraînant probablement une carence en choline (Leung et al., 2005, Kirman et al., 2016). Elle réduit ultérieurement la capacité de la S-adénosylméthionine, la source du groupe méthyle dans la méthylation de l’ADN, à entraîner une hypométhylation de l’ADN et une expression génique aberrante pouvant participer à la cancérogenèse (Leung et al., 2005, Kirman et al., 2016). La carence en choline induite par la DEA est, par conséquent, un mode d’action plausible de la cancérogénicité de la DEA chez les rongeurs (Leung et al., 2005, Kirman et al., 2016). Les souris pourraient être plus sensibles que les rats, car les tumeurs hépatiques induites par la DEA n’ont été observées que chez les souris B6C3F1, et non chez les rats F344/N, comme cela a été révélé par l’étude du NTP (1999a). De même, la DEA (160 mg/kg p.c./jour pendant 4 semaines) administrée à une lignée différente de souris (C57BL/6) n’a pas entraîné de diminution du potentiel de méthylation de l’ADN malgré une diminution de la choline (Lehman-McKeeman et al., 2002).
Le régime alimentaire normal des humains apporte une quantité suffisante de choline pour soutenir le fonctionnement normal des organes (Zeisel et al., 1994), tandis que les rongeurs oxydent la choline plus rapidement que les humains (Sidransky et al., 1960) et ont un besoin plus grand de choline dans leur régime alimentaire. La différence entre les rongeurs et les humains résidant dans les effets de la DEA sur l’induction de la synthèse de l’ADN, un élément important de la cancérogenèse, a également été étudiée in vitro (Kamendulis et Klaunig, 2005). La synthèse de l’ADN a été augmentée dans les hépatocytes de souris ou de rats après un traitement par 10 μg/mL de DEA, mais n’a pas varié dans les hépatocytes d’origine humaine traités par 750 μg/mL de DEA, ce qui semble indiquer une sensibilité d’au moins 75 fois plus faible chez les humains que chez les rongeurs. Cependant, la choline est un élément nutritif essentiel pour les humains. Selon les données de l’étude du National Health and Nutrition Examination Survey (NHANES) réalisée en 2003-2004, 90 % de la population américaine a un apport de choline insuffisant (recommandation de 425 mg/jour pour les hommes et de 550 mg/kg pour les femmes) (Zeisel et da Costa, 2009). Bien que les humains soient moins sensibles que les rongeurs à une carence en choline, la pertinence de l’induction de tumeurs par ce mode d’action chez l’humain ne peut être exclue, surtout pour les sous-groupes qui sont très sensibles à une carence alimentaire de choline (CIRC, 2013a).
Bien qu’il soit admis que la DEA puisse subir une nitrosation pour former de la NDELA, une substance peut-être cancérogène chez l’humain (groupe 2B) (CIRC, 2000a), aucune formation de NDELA in vivo à des posologies tumorigènes de DEA n’a été observée, ce qui semble indiquer que la formation de la NDELA n’est pas utile pour le mécanisme de la cancérogénicité induite par la DEA (Stott et al., 2000a).
Substances du sous-groupe 2B (TADEA et CADEA)
Le TADEA et le CADEA, en tant que substances faisant partie de la cocamine de polyéthylène glycol et d’ingrédients connexes, ont été évalués par le comité d’experts du CIR (CIR, 2015c). Étant donné la similarité du TADEA et du CADEA sur le plan de la structure et des propriétés physicochimiques, les effets du TADEA et du CADEA sur la santé ont été élucidés conjointement.
Toxicité à doses répétées : Dans une étude de toxicité orale à doses répétées de 13 semaines, des groupes de rats Wistar (25/sexe/dose, sauf à la dose maximale où les groupes étaient composés de 10 rats/sexe) ont reçu, dans leur alimentation, du TADEA dissous dans de l’huile de maïs à des concentrations de 0, 170, 500, 1500 ou 4500 ppm (soit environ 0,15, 50, 150 et 450 mg/kg p.c./jour) (Goater et al., 1965, mentionné dans CIR, 2015c). Le poids corporel et la prise de poids corporel ont diminué à la dose maximale de 450 mg/kg p.c./jour. Il n’y a eu aucun effet sur les paramètres hématologiques et le poids des organes. À l’examen histopathologique, une histiocytose dans les ganglions mésentériques a été constatée chez le rat à 150 et à 450 mg/kg p.c./jour (CIR, 2015c). Cette observation peut indiquer que la substance à l’essai a été ingérée par des macrophages intestinaux ayant migré et s’étant agrégés aux ganglions abdominaux. Cette histiocytose n’est pas considérée comme un effet nocif (Greaves, 2011). La DSENO a été établie à 150 mg/kg p.c./jour d’après les effets sur les paramètres du poids corporel chez le rat à 450 mg/kg p.c./jour.
Dans une étude de toxicité à doses répétées de 4 semaines, des lapins NWZ (5/sexe/dose) ont reçu, par voie cutanée, du TADEA à des doses de 0 ou de 40 mg/kg p.c./jour sur de la peau abrasée, à raison de 5 jours par semaine (US EPA, 2010b). Une irritation cutanée (notamment un érythème et de l’œdème modérés et graves, une desquamation légère à marquée, un caractère coriace modéré et une craquelure légère à grave des lieux d’exposition) est apparue et a atteint la forme la plus grave à la semaine 2. La DSENO était de 40 mg/kg p.c./jour, car aucun effet général lié au traitement n’a été observé à la seule dose d’essai.
Toxicité pour la reproduction et le développement : Dans une étude de toxicité pour la reproduction et le développement par voie orale suivant les lignes directrices de l’OCDE pour les essais de produits chimiques 422 (ECHA, c2013-2018i), des rats Wistar (10/sexe/dose) ont reçu, par gavage, du CADEA à des concentrations de 0, 10, 30 et 125 mg/kg p.c./jour, à partir de deux semaines avant la période d’accouplement, et pendant les périodes d’accouplement et de gestation, ainsi qu’au début de la période de lactation, pour un total de 45 jours consécutifs. Aucun effet nocif sur le poids corporel n’a été constaté chez les femelles des groupes de traitement pendant les périodes de préaccouplement et de gestation, mais une prise de poids corporel plus faible a été observée chez les femelles traitées à raison de 125 mg/kg/jour pendant la période de lactation par rapport aux femelles des groupes témoins. Aucun effet lié au traitement n’a été observé lors des évaluations comportementales hebdomadaires portant sur la réactivité sensorielle, la force de préhension et l’activité motrice. Aucun effet important n’a été détecté lors de l’examen des paramètres hématologiques et biochimiques cliniques. Dans le groupe exposé à la dose maximale (125 mg/kg p.c./jour), le nombre de corps jaunes et de sites d’implantation était le plus faible et celui des pertes post‑implantatoires, le plus élevé, se manifestant par des portées plus petites. La DSENO pour la toxicité pour le développement, prise en compte, était de 30 mg/kg p.c./jour.
Génotoxicité : Le TADEA n’était pas génotoxique in vitro ni génotoxique in vivo. In vitro, le TADEA n’était pas mutagène dans un test de mutation bactérienne (Haworth, 1981, mentionné dans CIR, 2015c) et un essai sur lymphomes de souris (Kirby, 1980, mentionné dans CIR, 2015c), avec ou sans activation métabolique. Dans un test d’aberration chromosomique in vitro, le résultat du test a été négatif en l’absence d’activation métabolique, mais positif avec activation métabolique (Thiagar, 1982, mentionné dans CIR, 2015c). Le TADEA n’a pas induit de synthèse non programmée de l’ADN dans des cultures primaires d’hépatocytes de rats fraîchement préparées (Coppinger, 1983, mentionné dans CIR, 2015c). In vivo, un test du micronoyau a donné un résultat négatif chez les souris exposées, par gavage, à une dose unique (10 860 mg/kg p.c.) de TADEA (Allen et al., 1984, mentionné dans CIR, 2015c). Aucune aberration chromosomique n’a été induite dans la moelle épinière chez le rat, quelle que soit la dose d’essai de TADEA (39, 130 ou 390 mg/kg p.c.) administrée par gavage (Esher, 1982, mentionné dans CIR, 2015c).
Aucune donnée de cancérogénicité n’a été trouvée pour le CADEA et le TADEA.
6.2.3 Caractérisation du risque associé aux substances du sous-groupe 2 (DEA, LDE, CDE, CADEA et TADEA)
DEA
Une comparaison d’une concentration d’exposition cutanée externe associée à un effet critique chez les rongeurs avec une valeur d’exposition cutanée externe chez les humains peut donner lieu à une surestimation du risque pour la santé humaine en raison d’une absorption cutanée relativement plus faible de la DEA chez les humains (annexe E, tableaux 2 et 3). C’est pourquoi, concernant les scénarios d’exposition cutanée à la DEA, les concentrations internes associées à un effet critique chez les rongeurs ont été comparées aux valeurs d’exposition cutanée interne chez les humains. Les dernières ont été déterminées par l’application d’un facteur de 0,9 % (Kraeling et al., 2004) aux scénarios d’exposition cutanée externe, comme mentionné antérieurement. Nous avons d’abord établi la valeur d’absorption cutanée à 48 heures la plus pertinente à la dose appliquée chez les rongeurs (Mathews et al., 1997; utilisée par Kirman et al., 2016, pour déterminer une équation de régression linéaire), puis l’avons divisée par deux pour une estimation sur 24 heures (d’après Kraeling et al., 2004, comme mentionné antérieurement). Nous avons appliqué cette valeur d’absorption cutanée à 24 heures à la concentration externe associée à un effet critique (ajustée pour une exposition continue de 24 heures, si nécessaire) pour déterminer la concentration interne d’effet critique (voir l’annexe F).
Paramètres autres que le cancer : Les concentrations estimatives d’exposition pertinente et les concentrations associées à un effet critique (paramètres autres que le cancer), ainsi que les marges d’exposition résultantes, pour la caractérisation du risque pour la santé humaine associé à une exposition à la DEA, sont présentées dans le tableau 6-10.
| Scénario d’exposition | Exposition générale | Concentration associée à un effet critique | Paramètre d’effet critique sur la santé | ME |
|---|---|---|---|---|
| Exposition orale quotidienne à l’eau potable (nourrissons, alimentés aux préparations pour nourrissons) | 0,00078 mg/ kg p.c./jour | DMENO = 14mg/kg p.c./jour (DEM) (femelles) | Effets sur les paramètres hématologiques et les reins dans une étude de toxicité par voie orale de 13 semaines menée chez le rat | 18000 |
| Exposition cutanée quotidienne au détergent à vaisselle (adultes) | 0,00026 mg/ kg p.c./jour(interne) | DMENO = 1,4a mg/kg p.c./jour (DEM) | Effets sur les paramètres hématologiques et les reins dans une étude de toxicité par voie cutanée de 13 semaines menée chez le rat | 5400 |
| Exposition par voie cutanée, par utilisation : peinture pour les murs (adultes) | 0,0051 mg/kg p.c. (interne) | DMENO = 36,3b mg/kg p.c. (DEM) | Augmentation du poids relatif et du poids absolu des reins dans une étude de toxicité par voie cutanée de 2 semaines menée chez le rat | 7100 |
| Exposition quotidienne par inhalation : utilisation de lingettes humides tout usage | 0,00029 mg/m3/jour | CSENO = 2,68 mg/m3/ jourc | Effets généraux sur les reins et le foie chez le rat à la dose de 150 mg/m3 dans une étude de toxicité par inhalation de 3 mois | 9200 |
| Exposition par inhalation, par utilisation, à de la peinture pour les murs | 0,0034 mg/m3 | CSENO = 50 mg/m3 | Toxicité maternelle (hémorragie vaginale) à 200 mg/m3 dans une étude de toxicité pour le développement par inhalation | 14700 |
Abréviations : DEM, dose d’essai minimale; DMENO, dose minimale avec effet nocif observé; CSENO, concentration sans effet nocif observé.
a La DMENO cutanée de 32 mg/kg p.c./jour a été ajustée pour une exposition continue (32 × 5/7) et extrapolée à une concentration d’effet interne de 1,4 mg/kg p.c./jour [(= 32 × 5/7) × 6 %], où 6 % est la valeur d’absorption cutanée estimative chez le rat pour la valeur d’absorption cutanée de 32 mg/kg p.c./jour en 24 heures (annexe E).
b La valeur d’absorption cutanée totale de 6 2 % a été calculée sur la base d’une régression linéaire des valeurs d’absorption en fonction de la dose [y=0,460x + 4,14, établie par Kirman et al. 2016, où x est la dose (125 mg/kg pc) et Y est le pourcentage total d’absorption cutanée (62 %) en 48 heures]. Pour tenir compte des résidus maximums fixés sur la peau de 5 % (Mathews et al. 1977), on a estimé l’absorption cutanée, excluant les résidus fixés sur la peau, à 57 % (62 % - 5 %) en 48 heures. On a supposé une absorption cutanée de 29 % (= 57 % X 1/2) en 24 heures. Par conséquent, la dose avec effet critique externe de 125 mg/kg pc/jour a été extrapolée à la dose avec effet interne de 36,3 mg/kg pc/jour (= 125 mg/kg pc/jour X 29 %).
c La CSENO de 15 mg/m3 (6 heures/jour, 5 jours/semaine) a été transformée en une CSENO continue (24 heures/jour, 7 jours/semaine) à 2,68 mg/m3 [= 15 × (6/24) × (5/7)].
Les marges d’exposition sont considérées comme suffisantes pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
LDE
Le tableau 6-11 présente les valeurs estimatives d’exposition pertinentes, les concentrations associées à un effet critique (paramètres autres que le cancer) et les marges d’exposition résultantes, pour la caractérisation du risque pour la santé humaine associé à une exposition au LDE.
| Scénario d’exposition | Exposition générale | Concentration associée à un effet critique | Paramètre d’effet critique sur la santé | ME |
|---|---|---|---|---|
| Exposition orale quotidienne à des matériaux d’emballage d’aliments (adultes) | 0,00023 mg/kg p.c./jour | DSENO = 50 mg/kg p.c./jour | Augmentation du poids des reins et anémie à 250 mg/kg p.c./jour dans une étude par voie orale de 13 semaines chez le rat | 217390 |
| Exposition cutanée quotidienne au savon liquide pour le corps (adultes) | 0,0022a mg/kg p.c./jour | DSENO = 3,5 mg/kg/jour b | Augmentation du poids des reins à 100 mg/kg p.c./jour dans une étude de toxicité cutanée de 14 semaines menée chez le rat | 1590 |
| Exposition cutanée quotidienne au savon liquide pour le corps (nourrissons) | 0,0052 mg/kg p.c./jour a | DSENO = 3,5 mg/kg/jour b | Augmentation du poids des reins à 100 mg/kg p.c./jour dans une étude de toxicité cutanée de 14 semaines menée chez le rat | 670 |
Abréviations : DSENO, dose sans effet nocif observé.
a Les doses internes d’exposition cutanée chez l’homme ont été estimées par l’application de la limite supérieure de l’apport cutané, à savoir 1 %, aux estimations de l’exposition cutanée externe.
b La NOAEL cutanée de 50 mg/kg p.c./jour a été extrapolée à la dose avec effet interne de 3,5 mg/kg p.c./jour (=50 mg/kg pc/jour x 7 %), où 7 % [= 21 % x (24 heures/72 heures)] correspond à la valeur estimative de l’absorption cutanée chez le rat en 24 heures, en supposant un taux d’absorption cutanée constant sur 72 heures
Les marges d’exposition calculées sont considérées comme suffisantes pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
CDE
Le tableau 6-12 présente les valeurs estimatives d’exposition pertinentes et les concentrations associées à un effet critique (paramètres autres que le cancer), ainsi que les marges d’exposition résultantes, pour la détermination du risque pour la santé humaine lié à une exposition au CDE.
| Scénario d’exposition | Exposition générale | Concentration associée à un effet critique | Paramètre d’effet critique sur la santé | ME |
|---|---|---|---|---|
| Exposition orale quotidienne à de l’eau potable (nourrissons alimentés aux préparations pour nourrissons) | 0,0073 mg/ kg p.c./jour | DSENO = 50 mg/kg p.c./jour (extrapolation de voie à voie) | Augmentation du poids des reins et anémie à 250 mg/kg p.c./jour dans une étude de par voie orale de 13 semaines menée chez le rat | 6800 |
| Exposition cutanée quotidienne au shampoing (enfant) | 0,013 mg/kg p.c./joura | DSENO = 3,5 mg/kg p.c./jourb | Augmentation du poids des reins associée à des changements histopathologiques à 100 mg/kg p.c./jour dans une étude de toxicité cutanée de 14 semaines menée chez le rat femelle | 39 |
| Exposition cutanée quotidienne combinée à des cosmétiques (adultes)c | 0,94 mg/kg p.c./jour | DSENO = 50 mg/kg p.c./jourb | Augmentation du poids des reins associée à des changements histopathologiques à 100 mg/kg p.c./jour dans une étude de toxicité cutanée de 14 semaines menée chez le rat femelle | 53 |
Abréviations : DSENO, dose sans effet nocif observé.
a Les doses internes d’exposition cutanée chez l’homme ont été estimées par l’application de la limite supérieure de l’apport cutané, à savoir 1 %, aux estimations de l’exposition cutanée externe.
b La NOAEL cutanée de 50 mg/kg p.c./jour a été extrapolée à la dose avec effet interne de 3,5 mg/kg p.c./jour (=50 mg/kg pc/jour x 7 %), où 7 % [= 21 % x (24 heures/72 heures)] correspond à la valeur estimative de l’absorption cutanée chez le rat en 24 heures, en supposant un taux d’absorption cutanée constant sur 72 heures
c Représente la valeur estimative d’exposition combinée la plus élevée parmi les différents groupes d’âge (adolescents et adultes) découlant de l’utilisation de cosmétiques (savons liquides pour le corps, nettoyants faciaux et shampoings)
Les marges d’exposition calculées sont jugées suffisantes pour tenir compte des incertitudes dans les bases de données sur les effets sur la santé et l’exposition.
Effet cancérogène : Les concentrations estimatives d’exposition pertinente, les concentrations associées à un effet critique, et les marges d’exposition résultantes, pour la détermination du risque associé à une exposition à la DEA, sont présentées dans le tableau 6-13.
Le CIRC (CIRC, 2013b) a classé le CDE comme une substance potentiellement cancérogène pour l’humain (groupe 2B). Cependant, les effets cancérogènes ont été causés par la présence d’impuretés, des résidus de DEA, dans des produits contenant du CDE (CIRC, 2013b).
La caractérisation du risque cancérogène de la DEA impliquait la présence de DEA résiduelle dans les produits contenant du CDE et du LDE.
| Scénario d’exposition | Exposition générale | Concentration associée à un effet critique | Paramètre d’effet critique sur la santé | ME |
|---|---|---|---|---|
| Exposition orale quotidienne à de l’eau potable, pendant toute la durée de la vie | 0,00018 mg/ kg p.c./jour (DQMV) | BMDL10 = 0,12 mg/kg p.c./jour a(extrapolation de voie à voie) | Tumeurs au foie dans des études de cancérogénicité par voie cutanée de 2 ans menées chez des souris exposées à la DEA ou à des substances en contenant | 660 |
| Exposition cutanée quotidienne à du détergent à vaisselle, pendant toute la durée de la vie | 0,00018 mg/kg p.c./jour (DQMV) | BMDL10 = 0,12 mg/kg p.c./jour a | Tumeurs au foie dans des études de cancérogénicité par voie cutanée de 2 ans menées chez des souris exposées à la DEA ou à des substances en contenant | 660 |
| Exposition quotidienne par inhalation à des lingettes humides tout usage, pendant toute la durée de la vie | 0,000048 mg/kg p.c./jour (DQMV) | BMDL10 = 0,12 mg/kg p.c./jour a(Extrapolation de voie à voie) | Tumeurs au foie dans des études de cancérogénicité par voie cutanée de 2 ans menées chez des souris exposées à la DEA ou à des substances en contenant | 2500 |
Abréviations : BMDL, limite de confiance inférieure à 95 % de la dose repère; DQMV, dose quotidienne moyenne à vie
a La BMDL10 cutanée externe de 1,04 mg/kg p.c./jour a été transformée en dose interne (0,12 mg/kg p.c./jour= 1,04 mg/kg p.c./jour X 12 %) en fonction d’une absorption cutanée hypothétique de 12 % (pour des précisions, veuillez consulter l’annexe E).
L’exposition cutanée par l’ingestion de DEA dans l’eau potable ou par l’utilisation de produits disponibles aux consommateurs (comme le détergent à vaisselle et les lingettes humides tout usage) a donné lieu à des ME de 660 et plus.
Dans cette caractérisation du risque, les renseignements suivants ont été pris en compte. 1) Le mode d’action non génotoxique; 2) les différences interspécifiques dans la toxicocinétique (absorption cutanée réduite chez les humains par rapport aux rongeurs); 3) les différences interspécifiques dans la toxicodynamique (l’oxydation de la choline est plus rapide chez les rongeurs que chez les humains, la synthèse de l’ADN induite par la DEA est au moins 75 fois moins sensible chez les humains que chez les rongeurs). Par conséquent, les ME calculées sont considérées comme suffisantes pour tenir compte des incertitudes dans les bases de données sur l’exposition et la santé humaine en ce qui concerne le paramètre cancérogène.
Même si les expositions de la population générale à la DEA, au LDE et au CDE ne sont pas préoccupantes aux concentrations actuelles, ces substances auraient un effet préoccupant pour la santé en raison de leur potentiel cancérogène. Par conséquent, l’exposition à ces substances pourrait être préoccupante pour la santé humaine si elle devait augmenter.
CADEA
Les concentrations estimatives d’exposition pertinente, les concentrations associées à un effet critique et les marges d’exposition résultantes, pour la caractérisation du risque pour la santé humaine associé à l’exposition au CADEA, sont présentées dans le tableau 6-14.
| Scénario d’exposition | Exposition générale | Concentration associée à un effet critique | Paramètre d’effet critique sur la santé | ME |
|---|---|---|---|---|
| Exposition orale quotidienne à des matériaux d’emballage d’aliments (adulte) | 0,00082 mg/ kg p.c./jour | DSENO = 30 mg/kg p.c./jour | Diminution du nombre de corps jaunes et de sites d’implantation, et augmentation des pertes post‑implantatoires, à 125 mg/kg p.c./jour de CADEA, dans une étude de toxicité orale pour la reproduction et le développement menée chez le rat | 37000 |
| Exposition cutanée quotidienne à du savon liquide pour le corps (enfant) | 0,089 mg/kg p.c./jour | 40 mg/kg p.c./jour | Aucun effet général n’a été observé dans une étude de toxicité cutanée à doses répétées de 4 semaines menée chez des lapins auxquels on a appliqué du TADEA à la seule dose d’essai | 450 |
| Exposition cutanée quotidienne à du savon liquide pour le corps (adulte) | 0,11 mg/kg p.c./jour | 40 mg/kg p.c./jour | Aucun effet général n’a été observé dans une étude de toxicité cutanée à doses répétées de 4 semaines menée chez des lapins auxquels on a appliqué du TADEA à la seule dose d’essai | 360 |
Abréviation : DSENO, dose sans effet nocif observé.
Les marges d’exposition sont considérées comme suffisantes pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
TADEA
Les concentrations estimatives d’exposition pertinente, les concentrations associées à un effet critique et les marges d’exposition résultantes, pour la caractérisation du risque pour la santé humaine associé à l’exposition au TADEA, sont présentées dans le tableau 6-15.
| Scénario d’exposition | Exposition générale | Concentration associée à un effet critique | Paramètre d’effet critique sur la santé | ME |
|---|---|---|---|---|
| Exposition orale quotidienne à des matériaux d’emballage d’aliments (adultes) | 0,0088 mg/kg p.c./jour | DSENO = 30 mg/kg p.c./jour(extrapolation) | Diminution du nombre de corps jaunes et de sites d’implantation, et augmentation des pertes post-implantatoires à 125 mg/kg p.c./jour de CADEA, dans une étude sur la toxicité orale pour la reproduction et le développement menée chez le rat | 3400 |
| Exposition cutanée par utilisation de liquide à transmission (adultes) | 0,072 mg/kg p.c./jour | 40 mg/kg p.c./jour | Aucun effet général observé chez les lapins auxquels du TADEA a été administré à la seule dose d’essai dans une étude de toxicité cutanée à doses répétées de 4 semaines | 560 |
Abréviations : DSENO, dose sans effet nocif observé.
Les marges d’exposition sont considérées comme suffisantes pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
6.2.4 Incertitudes dans l’évaluation du risque pour la santé humaine associé aux substances du sous-groupe 2 (DEA, LDE CDE, TADEA et CADEA)
Les principales sources d’incertitudes sont présentées dans le tableau ci-dessous (tableau 6-16).
| Principales sources d’incertitudes | Impact |
|---|---|
| Concentration de DEA résiduelle dans le CDE et le LDE | +/- |
| Manque de données canadiennes dans les milieux environnementaux | +/- |
| Absence d’étude de cancérogénicité pour une exposition à la DEA par voie orale ou par inhalation | +/- |
| Absence d’étude de toxicité orale à doses répétées à long terme pour le CDE et le CADEA | +/- |
+/- = potentiel inconnu de surestimer ou de sous-estimer le risque.
6.3 Évaluation des substances du sous-groupe 3 (TEA, TIPA et BATEA)
6.3.1 Évaluation de l’exposition des substances du sous-groupe 3 (TEA, TIPA et BATEA)
Milieux environnementaux
Aucun rapport sur la surveillance de TEA, de TIPA et de BATEA n’a été trouvé pour les milieux environnementaux au Canada ou ailleurs.
Étant donné leur nature ionique dans des conditions pertinentes sur le plan de l’environnement, le TEA et le TIPA ne peuvent pas être utilisés dans les modèles de fugacité habituellement employés pour estimer l’exposition à des substances provenant de milieux environnementaux. Cependant, d’après les données physicochimiques et les résultats de la modélisation de la fugacité concernant les espèces non chargées (voir le tableau B-3, annexe B), les absorptions humaines de TEA et de TIPA provenant de l’air ambiant ou intérieur et du sol, devraient être négligeables.
Les valeurs estimatives du TEA et du TIPA dans l’eau potable ont été établies à l’aide du scénario de rejet à l’égout après utilisation par les consommateurs dans les feuilles de calcul sur l’eau potable de l’UEE (Santé Canada, 2015a) et les quantités indiquées dans la Base de données du Commerce international de marchandises du Canada en 2011 (Environnement Canada, 2013). Pour des précisions sur les paramètres utilisés dans le modèle pour estimer les concentrations de TEA et de TIPA dans l’eau potable, veuillez consulter le tableau B-4 (annexe B). Les concentrations maximales de TEA et de TIPA au 50e centile dans l’eau de surface des 10 plans d’eau récepteurs modélisés sont de 11,9 et de 8,87 µg/L, respectivement. L’absorption estimative résultante pour le TEA et le TIPA dans l’eau potable utilisée par un nourrisson alimenté aux préparations pour nourrissons est de 0,0013 mg/kg p.c./jour pour le TEA et de 0,00092 mg/kg p.c./jour pour le TIPA.
En ce qui concerne le BATEA, l’exposition est considérée comme minime.
Aliments
Aucune donnée sur le TEA, le TIPA ou le BATEA n’a été trouvée dans les études de surveillance alimentaire. Au Canada, le TEA et le TIPA peuvent être utilisés dans certains matériaux d’emballage alimentaire pouvant être en contact direct avec des aliments (communication personnelle, courriels de la Direction des aliments de Santé Canada adressés au Bureau d’évaluation du risque des substances existantes de Santé Canada, s’échelonnant de septembre 2015 à mars 2018; sans référence).
Les absorptions estimatives prudentes de TEA et de TIPA associées à des matériaux d’emballage d’aliments sont de 0,0329 et de 0,0067 mg/kg p.c./jour, respectivement (communication personnelle, courriels de la Direction des aliments de Santé Canada adressés au Bureau d’évaluation du risque des substances existantes de Santé Canada, s’échelonnant de septembre 2015 à mars 2018; sans référence).
Au Canada, le TEA peut être utilisé comme composant d’additifs indirects dans des produits utilisés dans des usines de transformation alimentaire ne pouvant pas être en contact direct avec des aliments (communication personnelle, courriel de la Direction des aliments de Santé Canada adressé au Bureau d’évaluation du risque des substances existantes de Santé Canada, daté d’août 2017; sans référence).
Produits disponibles aux consommateurs
L’exposition potentielle découlant de l’utilisation de produits disponibles aux consommateurs a été estimée. Pour des précisions, veuillez consulter l’annexe D. Les valeurs estimatives pour les utilisations qui donnent la concentration potentielle la plus élevée par voie orale, par voie cutanée ou par inhalation (scénarios sentinelles) sont présentées aux tableaux 6-17 et 6-18, respectivement. D’autres scénarios d’utilisations potentiels ont été envisagés pour le TEA (maquillage, produits coiffants, fixatifs pour les cheveux, shampoings et revitalisants, nettoyants pour automobiles et bateaux, additifs de liquide de refroidissement, encres d’imprimantes, adhésifs et époxydes imperméables à l’eau, produits pharmaceutiques et produits de santé naturels) et le TIPA (shampoings, produits de santé naturels), mais les expositions se sont révélées plus faibles que celles présentées dans les tableaux 6-17 et 6-18. Le BATEA n’a été décelé dans aucun produit disponible aux consommateurs.
Absorption cutanée
L’absorption cutanée du TEA chez les humains a été mesurée à l’aide de techniques en cellules de diffusion in vitro (Kraeling et Bronaugh, 2003). Le pourcentage de TEA absorbé et accumulé dans les fluides récepteurs a été déterminé par l’ajout de [14C]-TEA dans la préparation en tant qu’agent émulsifiant pour simuler une exposition à des cosmétiques. L’étude a révélé que le ratio du TEA absorbé et accumulé dans les fluides récepteurs sur la dose appliquée était de 1 % (arrondi à partir de 0,43 %) dans la préparation à 1 % ou à 5 % de TEA à la fin de l’étude de 24 heures. Après l’application d’une formulation à 1 % et 5 % de TEA pendant 24 heures, les quantités de TEA absorbées dans le liquide récepteur n’ont pas augmenté de manière significative entre 24 et 72 heures, même si une quantité substantielle de TEA (6,9 % à 9,6 %) est restée dans la peau à la fin de l’étude, ce qui suggère que les résidus de TEA fixés sur la peau n’étaient pas biodisponibles pour une absorption systémique (Kraeling et Bronaugh 2003). Par conséquent, une valeur d’absorption cutanée de 1 % a été utilisée pour l’estimation de l’exposition cutanée au TEA chez les humains.
| Substance | Scénario de produita | Concen-tration (%) | Voie d’expo-sition | Exposition par utilisation(mg/kg p.c.) | Exposition quotidienne (mg/kg p.c./jour) |
|---|---|---|---|---|---|
| TEA | Dentifrice, non fluoré (tout-petits) | 3 | Orale | 0,41 | 0,57 |
| TEA | Dentifrice, blanchissant | 10 | Orale | 0,11 | 0,23 |
| TEA | Nettoyant tout usage en aérosol, cutané | 10 | Cutanée | 0,0044b | 0,0044b |
| TEA | Crème et lotion hydratantes pour le corps (nourrisson) | 10 | Cutanée | 0,19b | 0,32b |
| TEA | Crème et lotion hydratantes pour le corps | 10 | Cutanée | 0,062b | 0,068b |
| TEA | Écran solaire | 10 | Cutanée | 0, 26b | 0,36b |
| TEA | Écran solaire (tout‑petits) | 10 | Cutanée | 0,35b | 0,56b |
| TIPA | Produits coiffants (gel/cire/pâte) (enfants) | 3 | Cutanée | 0,17 | 0,095 |
| TIPA | Produits coiffants (gel/cire/pâte) | 3 | Cutanée | 0,08 | 0,044 |
| TIPA (exposition aiguë unique-ment) | Nettoyant pour BBQ, en aérosol | 5 | Cutanée | 0,42 | s.o. |
Abréviation : s.o.; sans objet
a Représente une exposition directe chez les adultes, sauf si indiqué autrement.
b Exposition générale par voie cutanée, selon une absorption cutanée supposée de 1 %.
| Sub-stance | Scénario de produit | Concen-tration (%) | Concentration MPT dans l’air pendant 6 heures (mg/m3) | Exposition quotidienne (mg/m3) |
|---|---|---|---|---|
| TEA | Nettoyage tout usage, en aérosol | 10 | 0,83 | 0,21 |
Abréviations : MPT, moyenne pondérée dans le temps
Étant donné le grand nombre (environ 8000) et la variété de produits cosmétiques appliqués sur la peau qui contiendraient du TEA, une estimation de l’exposition globale au TEA dans plusieurs produits a été prise en compte, conformément au document intitulé Guidance for the Testing of Cosmetic Ingredients and their Safety Evaluation du SCCS (SCCS, 2016). Les expositions quotidiennes globales estimatives au TEA dans les cosmétiques sont présentées dans le tableau 6-19.
| Produit | Concentrationa (%) | Exposition quotidienne – adolescent (mg/kg p.c./jour)b | Exposition quotidienne – adulte (mg/kg p.c./jour)b |
|---|---|---|---|
| Crème, lotion et gel hydratants pour le corps | 10 | 0,064 | 0,068 |
| Hydratant pour le visage (crème/lotion/gel) | 10 | 0,036 | 0,030 |
| Savon pour le corps (liquide) | 10 | 0,0019 | 0,0022 |
| Shampoing | 10 | 0,0022 | 0,0018 |
| Revitalisant capillaire (sans rinçage) | 3 | 0,0073 | 0,0061 |
| Produits coiffants (gel/cire/pâte) | 10 | 0,0032 | 0,0027 |
| Fard à paupières | 10 | 0,0018 | 0,0015 |
| Exposition totale combinée(mg/kg p.c./jour)a | - | 0,12 | 0,11 |
a D’après les déclarations faites en vertu du Règlement sur les cosmétiques à Santé Canada.
b Exposition générale par voie cutanée, selon une absorption cutanée supposée de 0,43 %.
c En supposant que le savon liquide pour le corps pour nourrissons (également caractérisé) est aussi utilisé pour laver les cheveux.
Le TEA est associé à un critère d’effet cancérogène potentiel (précisions dans la section sur les effets sur la santé). Afin d’estimer le risque cancérogène potentiel associé à une exposition au TEA, les doses quotidiennes moyennes à vie ont été calculées pour une exposition quotidienne à du dentifrice non fluoré (0,12 mg/kg p.c./jour), une utilisation globale quotidienne de produit hydratant pour le corps (0,077 mg/kg p.c./jour), une utilisation combinée de cosmétiques et de nettoyants (0,094 mg/kg p.c./jour) et une utilisation quotidienne de nettoyants tout usage en aérosols (0,034 mg/kg p.c./jour) (voir l’annexe D).
6.3.2 Évaluation des effets sur la santé des substances du sous-groupe 3 (TEA, TIPA et BATEA)
TEA
Le TEA est inclassable quant à sa cancérogénicité pour les humains (groupe 3) (CIRC, 2000b). Cependant, une étude du NTP des États‑Unis (2004), menée après l’examen réalisé par le CIRC (2000b), a obtenu des données probantes d’activité cancérogène chez des souris femelles (NTP, 2004). Le comité d’experts du CIR a examiné les effets du TEA sur la santé (CIR, 2013a).
Toxicocinétique : comme la DEA, le TEA présente une absortion cutanée faible chez l’homme (0,43 %, 24 heures) (Kraeling et Bronaugh 2003) que chez les rongeurs. À l’exclusion des résidus liés à la peau, le TEA a été largement absorbé chez les souris (82 %) et les rats (71 %) en 24 ou 48 heures après application cutanée aux doses testées (1000 mg/kg p.c. dans l’acétone et 2000 mg/kg p.c. à l’état pur ou dans l’eau), quel que soit le support utilisé (Stott et al. 2000b).
Toxicité à doses répétées : Dans une étude de toxicité par inhalation de 4 semaines, des groupes de rats Wistar (10/sexe/groupe) ont été exposés à du TEA par inhalation (museau uniquement) à des concentrations de 0, 20, 100 ou 500 mg/m3, pendant 6 heures par jour, à raison de 5 jours par semaine (Gamer, 2008). Une inflammation des sous‑muqueuses du larynx, observée chez les mâles de tous les groupes traités et les femelles exposées à 100 mg/m3 et plus, a été considérée comme une réaction d’adaptation. Faute d’aucun autre effet, la DSENO a été établie à 500 mg/m3 (équivalant à 89 mg/m3 pour une exposition continue), la concentration d’essai la plus élevée. Cette DSENO est cohérente avec les résultats d’une étude non publiée de toxicité par inhalation de 2 semaines (12 jours) réalisée chez des rats F344 (5/sexe/groupe) exposés à des concentrations plus élevées (0, 125, 250, 500, 1000 ou 2000 mg/m3, 6 heures/jour), dans laquelle une légère inflammation aiguë des sous‑muqueuses du larynx a été observée à 1000 mg/m3 et plus (étude du NTP non publiée, mentionnée dans Gamer et al., 2008).
Dans une étude de toxicité cutanée de 13 semaines, des rats F344/N (10/sexe/dose) ont été exposés à du TEA par une application cutanée (résidus de MEA et de DEA inférieurs à 0,4 % chacun) à des concentrations de 0, 125, 250, 500 ou 1000 mg/kg p.c./jour de TEA dans l’acétone ou de 2000 mg/kg p.c./jour (net) (5 jours par semaine) (NTP, 1999d). Une irritation cutanée locale a été observée chez les deux sexes à 1000 mg/kg p.c./jour et plus. Le poids corporel a diminué chez les femelles exposées à 1000 mg/kg p.c./jour et plus, et chez les mâles exposés à 2000 mg/kg p.c./jour. Une augmentation du poids absolu et du poids relatif des reins a été constatée chez les deux sexes à 500 mg/kg p.c./jour et plus. La DSENO a été établie à 250 mg/kg p.c./jour. Des souris B6C3F1 (10/sexe/dose) ont été exposées à 0, 250, 500, 1000 ou 2000 mg/kg p.c./jour de TEA dans l’acétone ou à 4000 mg/kg de TEA net par application cutanée pendant 13 semaines (NTP, 1999d). À 4000 mg/kg p.c./jour, une augmentation du poids absolu et du poids relatif des reins et une irritation cutanée locale (notamment une desquamation et une altération de la couleur) ont été observées chez les deux sexes. La DSENO était de 2000 mg/kg p.c./jour.
Toxicité pour la reproduction et le développement : Dans une étude préalable de toxicité pour la reproduction et le développement, des rats Wistar (10/sexe/dose) ont reçu, par gavage, du TEA dissous dans l’eau à une concentration de 0, 100, 300 ou 1000 mg/kg p.c./jour pendant 2 semaines avant la période d’accouplement, pendant la période d’accouplement et pendant toute la période de gestation et de lactation jusqu’au jour postnatal 4 (BASF, 2010). Une diminution de la prise de poids corporel a été observée chez les femelles du groupe exposé à la dose la plus élevée (1000 mg/kg p.c./jour) pendant la gestation et les jours postnataux 1 à 4. Une légère augmentation des pertes post-implantatoires et une diminution associée de la taille des portées ont été relevées à 1000 mg/kg p.c./jour. La DSENO maternelle a été établie à 300 mg/kg p.c./jour.
Génotoxicité et cancérogénicité : Aucun potentiel de génotoxicité n’a été relevé pour le TEA in vitro ou in vivo. Le TEA n’a pas été mutagène dans les tests de mutation bactérienne, avec ou sans activation métabolique (Inoue et al., 1982; Dean et al.,1985; Mortelmans et al., 1986), et dans un test de conversion génique chez la levure (Dean, 1985), ni clastogène dans un test d’échange de chromatides sœurs dans des cellules ovariennes de hamster chinois, avec ou sans activation métabolique (Galloway et al., 1987; Inoue et al., 1982), ou des cellules hépatiques de rats en culture (Dean, 1985). Le résultat d’un test de transformation à l’aide de cellules d’embryons de hamsters traitées par TEA était négatif (Inoue et al., 1982). Le résultat du test du micronoyau était négatif; il a été réalisé chez des souris mâles et femelles, 13 semaines après une application cutanée de 1000 à 4000 mg/kg p.c./jour de TEA (NTP, 2004).
Dans une étude de cancérogénicité par voie orale de 2 ans, des groupes de rats F344 (50/sexe/dose) ont reçu du TEA dans de l’eau potable à une concentration de 0 %, 1 % ou 2 % (équivalant à 0, 1400 ou 2800 mg/kg p.c./jour). Tout au long de l’expérience, une diminution du poids corporel chez les deux sexes et de la mortalité chez les femelles (à la semaine 60, environ) a été constatée à 1400 mg/kg p.c./jour et plus. L’administration du TEA a été suspendue dans les deux groupes de femelles en raison de l’augmentation de la mortalité et reprise avec la moitié de chaque concentration. À 700 mg/kg p.c./jour et plus, une augmentation du poids absolu et du poids relatif des reins associée à une augmentation des lésions non néoplasique (comme une néphropathie chronique, une minéralisation des papilles, une pyélonéphrite) a été constatée. Aucune augmentation de l’incidence des tumeurs liée au traitement n’a été observée (Maekawa et al., 1986).
Le NTP des États‑Unis a mené des études de cancérogénicité par voie cutanée de 2 ans chez des souris B6C3F1 et des rats F344/N. Il y a une association manifeste entre le traitement par le TEA et la formation de tumeurs hépatocellulaires chez les deux sexes et d’hépatoblastomes chez les souris mâles, mais aucun effet cancérogène n’a été observé chez les rats traités par le TEA (NTP, 1999d). Cependant, les souris utilisées dans l’étude ont été infectées de façon chronique à Helicobacter hepaticus, un organisme qui cause une hépatite. On ne peut donc pas conclure à une relation entre le TEA et la présence de néoplasmes au foie (CIRC, 2000b).
Dans une deuxième étude de cancérogénicité par voie cutanée de 2 ans, des groupes de souris B6C3F1 (50/sexe/dose) ont reçu du TEA (contenant 0,49 % de DEA) dans de l’acétone à des concentrations variant de 0 à 2000 mg/kg p.c./jour, administré par application cutanée, à raison de 5 jours par semaine (NTP, 2004). Une irritation cutanée liée à la dose est apparue au lieu d’application. Une diminution du poids corporel a été constatée chez les mâles exposés à 2000 mg/kg p.c./jour de la semaine 17 à la semaine 37 et à la fin de l’étude. Comme dans la première étude (NTP, 1999d), le TEA a augmenté l’incidence des néoplasmes hépatocellulaires chez les souris femelles, mais non chez les souris mâles. La fréquence des tumeurs hépatocellulaires (adénomes ou carcinomes) chez les femelles était de 12/50 (24 %), 23/50 (46 %), 24/50 (48 %) et 34/50 (68 %) aux concentrations de 0, 100, 300 ou 1000 mg/kg p.c./jour, respectivement (NTP, 2004). À l’aide d’un modèle de cancérogénicité multistade, les valeurs de BMD10 et de BMDL10 ont été établies à 60 et à 42 mg/kg p.c./jour, respectivement, d’après l’augmentation des tumeurs au foie chez les souris femelles traitées par le TEA (pour des précisions, veuillez consulter la figure F-2 à l’annexe F).
Mode d’action : Puisque la DEA et le TEA sont des analogues structuraux de la choline et que la diminution de la choline est probablement un mode d’action pour la cancérogénicité de la DEA, le potentiel du TEA à causer une diminution de la choline dans la tumorigenèse a également été étudié (Stott et al., 2004). Dans une étude de toxicité cutanée de 3 semaines portant sur le mode d’action potentiel, des rongeurs ont reçu du TEA dans l’acétone par voie cutanée (souris B6C3F1 femelles et TEA contenant 0,04 % de résidus de DEA, dans le premier essai; souris B6C3F1 femelles, rats CDF et TEA contenant 0,45 % de résidus de DEA, dans le deuxième essai) à raison de 5 jours par semaine pendant 3 semaines. Le traitement par le TEA a entraîné une diminution importante des concentrations de phosphocholine et de bétaïne chez des souris traitées par du TEA contenant une quantité minime de résidus de DEA (0,04 %) ou une quantité élevée de résidus de DEA (0,45 %). Aucun changement n’a été observé dans les métabolites de la choline chez les rats, ce qui concorde avec l’absence de formation de tumeurs chez les rats exposés au TEA. Comme avec la DEA, le TEA a inhibé l’absorption de la [3H]choline liée à la dose dans des cellules ovariennes de hamster chinois, mais cet effet était moins puissant avec le TEA qu’avec la DEA (Stott et al., 2004). Stott et al. (2004) ont conclu que le TEA pourrait causer des tumeurs hépatiques au moyen d’un mode d’action diminuant la choline. Bien que les résidus de DEA dans le TEA puissent contribuer à la diminution de la choline, le TEA en tant que tel pourrait également entraîner une diminution de la choline (Stott et al., 2004). Puisque le mode d’action de diminution de la choline ne peut être exclu chez les humains, la cancérogénicité du TEA a été considérée comme pertinente pour les humains.
TIPA
Le TIPA a été évalué dans la catégorie des isopropanolamines dans le rapport d’évaluation initiale du SIDS (OCDE, 2009). Une recherche dans la documentation a été menée entre octobre 2008 et décembre 2017. Aucune nouvelle étude importante pouvant avoir une incidence sur la caractérisation du danger et du risque n’a été trouvée.
Toxicité à doses répétées : Dans une étude de toxicité orale de 14 semaines (100 jours), des chiens (4/sexe/dose) ont reçu des aliments contenant du TIPA à des concentrations de 0, 500, 2000 ou 7500 ppm (équivalant à 0, 16,8, 71,2 ou 272 mg/kg p.c./jour, respectivement) (OCDE, 2009). Le traitement n’a eu aucun effet sur la consommation d’aliments ou le poids corporel. Aucun effet lié au traitement n’a été relevé dans l’examen du poids des organes, des paramètres hématologiques, de l’analyse d’urine, des paramètres biochimiques et de l’histopathologie. La DSENO a été établie à 272 mg/kg p.c./jour.
Dans une étude de toxicité cutanée à doses répétées de 4 semaines, des rats Fischer 344 (5/sexe/dose) ont été exposés, par la peau, à du TIPA aux concentrations de 0, 300, 1000 ou 3000 mg/kg p.c./jour, à raison de 5 jours/semaine (OCDE, 2009). Des timbres ont été appliqués au dos de chaque rat et couverts de coton non absorbant. Une augmentation liée à la dose de l’incidence d’irritation de la peau au lieu d’application, notamment un léger érythème et des croûtes, a été observée. Aucune toxicité générale n’a été relevée chez les animaux traités. La DSENO a été établie à 3000 mg/kg p.c./jour, la dose maximale d’essai, d’après la toxicité générale (OCDE 2009).
Toxicité pour la reproduction et le développement : La toxicité du TIPA pour la reproduction et le développement a été examinée dans une étude de toxicité pour la reproduction sur une génération (ECHA, c2013-2018a). Des rats SD (25/sexe/dose) ont reçu de la nourriture contenant du TIPA aux concentrations de 0, 500, 2000 ou 7500 ppm (équivalant à 40, 200 ou 700 mg/kg p.c./jour, respectivement) pendant 5 semaines précédant la période d’accouplement, pendant les périodes d’accouplement, de gestation, de lactation et de sevrage. Les rejetons (20 rats F1 sélectionnés/sexe/groupe) ont reçu la même nourriture contenant du TIPA (équivalant à 0/0, 39,7/43,7, 160/182 ou 609/700 mg/kg p.c./jour pour les rejetons mâles et femelles, respectivement) pendant 90 jours après le sevrage. Aucun effet lié au traitement n’a été observé et la DSENO a été établie à 609/700 mg/kg p.c./jour (mâles/femelles), la dose maximale d’essai.
Génotoxicité et cancérogénicité : Les résultats de la substance aux tests de génotoxicité in vitro et in vivo ont été négatifs. Le résultat a été négatif dans un test de mutagénicité bactérienne avec Salmonella typhimurium (TA 1535, TA 1537, TA 98 et TA 100), avec et sans activation métabolique (OCDE, 2009). Les résultats du TIPA ont été négatifs dans un test de mutation génique in vitro sur des cellules de mammifères (cellules ovariennes de hamster chinois) et deux tests d’aberration chromosomique (cellules ovariennes de hamster chinois ou lymphocytes de rats), avec et sans activation métabolique. Dans un test des micronoyaux réalisé in vivo conformément aux lignes directrices de l’OCDE pour les essais de produits chimiques 474, des souris NMRI (5/sexe/groupe) ont reçu, par gavage, une dose unique de TIPA à une concentration de 500, 1000 ou 2000 mg/kg p.c. (OCDE, 2009). Le TIPA n’a pas entraîné d’augmentation du taux de micronoyaux des érythrocytes polychromatiques dans la moelle épinière 24 ou 48 heures après le traitement, quelle qu’ait été la dose (OCDE, 2009).
Des rats Wistar mâles (21 à 28/dose) ont reçu 2 % de TIPA dans leur alimentation pendant 104 semaines, et aucune hyperplasie ni lésion prénéoplasique n’a été relevée dans le foie. Parmi les limites de cette étude de cancérogénicité, notons que seuls des animaux mâles ont été utilisés, une concentration unique a été évaluée et seul le foie a été examiné (ECHA, 2013-2018e).
BATEA
Aucune donnée de toxicité n’a été trouvée pour cette substance. Le BATEA n’a pas été considéré comme très dangereux pour la santé humaine d’après les classements établis par d’autres organismes nationaux ou étrangers concernant la cancérogénicité, la génotoxicité, la toxicité pour le développement et la toxicité pour la reproduction. Il ne figure pas non plus dans la Liste des substances extrêmement préoccupantes, candidates en vue d’une autorisation de l’Agence européenne des produits chimiques (ECHA [modifié en 2017]). Il n’est pas justifié de mener d’autres études sur les effets sur la santé pour le moment, étant donné la faible exposition attendue de la population générale du Canada au BATEA.
6.3.3 Caractérisation du risque associé aux substances du sous-groupe 3 (TEA, TIPA et BATEA)
TEA
Effets autres que cancérogènes : Les concentrations estimatives d’exposition pertinente, les concentrations associées à un effet critique et les marges d’exposition résultantes, pour la caractérisation du risque pour la santé humaine associé à l’exposition au TEA, sont présentées dans le tableau 6-20.
| Scénario d’exposition | Exposition générale | Concentration associée à un effet critique | Paramètre d’effet critique sur la santé | ME |
|---|---|---|---|---|
| Exposition orale quotidienne par du dentifrice non fluoré (tout-petits) | 0,57 mg/kg p.c./jour | DSENO = 300 mg/kg p.c./jour | Diminution de la prise de poids corporel chez les mères à 1000 mg/kg p.c./jour dans une étude préalable de toxicité orale pour la reproduction et le développement chez le rat | 530 |
| Exposition cutanée quotidienne à un produit hydratant pour le corps (nourrisson) | 0,32 mg/kg p.c./jour | DSENO = 177,5 mg/kg p.c./joura (dose interne) | Augmentation du poids des reins à 500 mg/kg p.c./jour chez le rat dans une étude de toxicité cutanée de 13 semaines | 550 |
| Exposition quotidienne combinée, par voie cutanée, à des cosmétiques (adolescents et adultes)c | 0,15 mg/kg p.c./jour | DSENO = 220 mg/kg p.c./joura (dose interne) | Augmentation du poids des reins à 500 mg/kg p.c./jour chez le rat dans une étude de toxicité cutanée de 13 semaines | 1480 |
| Exposition quotidienne, par inhalation, à des nettoyants tout usage en aérosols | 0,21 mg/ m3/jour | CSENO = 89,3 mg/m3 b | Aucun effet de toxicité générale observé à la dose maximale d’essai dans une étude de toxicité par inhalation de 28 jours menée chez le rat | 430 |
| Exposition par inhalation, par utilisation, à des nettoyants tout usage en aérosols | 0,83 mg/m3 (MPT - 6 h) | CSENO = 500 mg/m3 | Aucun effet de toxicité générale observée à la dose maximale d’essai dans une étude de toxicité par inhalation de 28 jours menée chez le rat | 600 |
Abréviations : CSENO, concentration sans effet nocif observé; DSENO, dose sans effet nocif observé.
a La DSENO de 250 (mg/kg p.c./jour) a été extrapolée au point de départ interne de 177,5 mg/kg p.c./jour, d’après une absorption cutanée de 71 % de TEA en 24 heures, chez les rats.
b La CSENO de 500 mg/m3, établie sur une exposition intermittente des animaux (pendant 6 heures par jour, à raison de 5 jours par semaine), a été adaptée pour une exposition continue (24 heures/jour, 7 jours/semaine) comme suit : 500 mg/m3 × (6/24) × (5/7) = 89,3 mg/m3.
c Représente l’exposition estimative combinée la plus élevée parmi les différents groupes d’âge (adolescents et adultes) dont on s’attend qu’ils utilisent plusieurs cosmétiques (crème hydratante pour le corps, crème hydratante pour le visage, savon liquide pour le corps, shampoing, après-shampoing, gel/cire/pâte, fard à paupières).
Afin de prendre en compte la différence importante entre l’absorption cutanée du TEA chez les humains et celle du TEA chez les rongeurs, le risque pour la santé humaine associé à une exposition cutanée au TEA a été caractérisé par comparaison d’une concentration associée à un effet critique interne adaptée, établie à partir d’études animales, avec une dose cutanée interne estimative établie d’après les valeurs d’absorption cutanée de 1 % chez les humains et de 71 % chez les rats.
La ME de 550 pour l’exposition cutanée quotidienne à un hydratant corporel chez les nourrissons a été établie à 0,32 mg/kg p.c./jour (interne), alors que la DSENO interne est de 177,5 mg/kg p.c./jour. L’exposition cutanée combinée (globale) à plusieurs cosmétiques a été estimée dans différents groupes d’âge, notamment l’exposition au TEA dans des produits hydratants pour le corps, des produits hydratants pour le visage, du savon liquide pour le corps, du shampoing, du revitalisant capillaire (sans rinçage), des produits coiffants en gel, en cire ou en pâte et des fards à paupières. L’exposition maximale combinée estimative (dose cutanée interne) était de 0,12 mg/kg p.c./jour chez les adolescents, d’où une ME de 1480 lorsque comparée à une DSENO de 177,5 mg/kg p.c./jour. La ME calculée est jugée suffisante pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé humaine.
L’exposition quotidienne par inhalation découlant de l’utilisation de nettoyants tout usage en aérosols a été estimée à 0,207 mg/kg p.c./jour, et la CSENO, à 89,3 mg/m3/jour, a été établie d’après l’absence de toxicité générale à la dose d’essai la plus élevée d’une étude de toxicité par inhalation de 28 jours, d’où une ME de 430. En ce qui concerne les scénarios d’exposition aiguë par inhalation, l’exposition estimative de 0,83 mg/m3 (moyenne pondérée dans le temps – 6 heures) découlant de l’utilisation de nettoyants tout usage en aérosols a été comparée à la DSENO de 500 mg/m3 (6 heures/jour, 12 jours), d’où une ME de 600.
Les ME sont considérées comme suffisantes pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
Effet cancérogène : Les concentrations estimatives d’exposition pertinente, les concentrations associées à un effet critique et les marges d’exposition résultantes, pour la caractérisation du risque pour la santé humaine associé à l’exposition au TEA sont présentées au tableau 6-21.
| Scénario d’exposition | Exposition générale | Concentration associée à un effet critiquea | Paramètre d’effet critique sur la santé | ME |
|---|---|---|---|---|
| Exposition orale quotidienne, à vie, à du dentifrice non fluoré | 0,12 mg/kg p.c./jour (dose interne, DQMV)b | BMDL10 = 21,3 mg/kg p.c./jour (interne) | Augmentation des tumeurs au foie dans une étude de cancérogénicité par voie cutanée de 2 ans menée chez des souris femelles | 202 |
| Exposition cutanée quotidienne, à vie, à un produit hydratant pour le corps | 0,077 mg/kg p.c./jour (dose interne, DQMV) | BMDL10 = 21,3 mg/kg p.c./jour (interne) | Augmentation des tumeurs au foie dans une étude de cancérogénicité par voie cutanée de 2 ans menée chez des souris femelles | 246 |
| Exposition cutanée quotidienne combinée, à vie, à des cosmétiques et des nettoyants | 0,094 mg/kg p.c./jour (dose interne, DQMV) | BMDL10 = 21,3 mg/kg p.c./jour (interne) | Augmentation des tumeurs au foie dans une étude de cancérogénicité par voie cutanée de 2 ans menée chez des souris femelles | 205 |
| Exposition par inhalation, à vie, à des nettoyants tout usage en aérosols | 0,034 mg/kg p.c./jour (dose interne, DQMV)b | BMDL10 = 21,3 mg/kg p.c./jour (interne) | Augmentation des tumeurs au foie dans une étude de cancérogénicité par voie cutanée de 2 ans menée chez des souris femelles | 723 |
Abréviations : BMDL, limite de confiance inférieure à 95 % de la dose repère; DQMV, dose quotidienne moyenne à vie
a La valeur de BMDL10 de 42 mg/kg p.c./jour (5 jours par semaine) est équivalente à la BMDL10 de 30 mg/kg p.c./jour pour une exposition continue (7 jours par semaine). Une BMDL10 interne de 21,3 mg/kg p.c./jour a été établie à l’aide d’une absorption cutanée de 71 % chez la souris (Stott et al., 2000b).
b Suppose une absorption de 100 % par voie orale ou par inhalation.
Par comparaison des valeurs estimatives de l’exposition à la dose quotidienne moyenne à vie pour une exposition par voie orale à du dentifrice non fluoré, une exposition par voie cutanée à des produits hydratants pour le corps ou l’utilisation combinée de cosmétiques et de nettoyants tout usage en aérosols, et l’exposition par inhalation à des nettoyants tout usage en aérosols avec un risque accru de formation de tumeurs au foie chez les souris femelles (BMDL10 de 21,3 mg/kg p.c./jour), les ME ont été établies à 180 et plus.
Ces ME ont été jugées satisfaisantes pour tenir compte des incertitudes dans les bases de données sur l’exposition et la santé humaine pour les raisons suivantes : 1) le mode d’action cancérogène non génotoxique du TEA par diminution de la choline; 2) la faible puissance du TEA comme substance cancérogène pour le foie, comme le montre l’absence d’induction de la formation de tumeurs au foie chez les rats et l’induction chez les souris femelles uniquement; 3) ce mode d’action est moins pertinent chez les humains, en raison des différences interspécifiques sur le plan de la métabolisation (voir la section 6.2.2, Mode d’action); 4) les DQMV sont des valeurs estimatives prudentes, car on suppose que ces produits (dentifrice non fluoré, produit hydratant pour le corps, savon à vaisselle) sont utilisés tous les jours pendant toute la vie.
Même si les expositions de la population générale au TEA ne sont pas préoccupantes aux concentrations actuelles, le TEA est tenu pour avoir un effet préoccupant pour la santé en raison de sa cancérogénicité potentielle. Par conséquent, il pourrait être préoccupant pour la santé humaine si l’exposition devait augmenter.
TIPA
Les concentrations estimatives d’exposition pertinente, les concentrations associées à un effet critique et les marges d’exposition résultantes, pour la caractérisation du risque pour la santé humaine associé à l’exposition au TIPA, sont présentées dans le tableau 6-22.
| Scénario d’exposition | Exposition générale | Concentration associée à un effet critique | Paramètre d’effet critique sur la santé | ME |
|---|---|---|---|---|
| Exposition orale quotidienne à des matériaux d’emballage d’aliments (adultes) | 0,006 7 mg/ kg p.c./jour | DSENO = 700 mg/kg p.c./jour | Aucun effet nocif relevé dans le groupe ayant reçu la dose la plus élevée dans une étude de toxicité orale pour la reproduction et le développement sur une génération menée chez le rat | 104000 |
| Exposition cutanée quotidienne à des produits coiffants (gel/cire/pâte) (enfants) | 0,095 mg/kg p.c./jour | DSENO = 3000 mg/kg p.c./jour | Aucun effet nocif n’a été observé dans une étude de toxicité cutanée à doses répétées de 28 jours menée chez le rat | 31600 |
| Exposition par voie cutanée, par utilisation, à des produits coiffants (gel/cire/pâte) (enfants) | 0,17 mg/kg p.c./jour | DSENO = 3000 mg/kg p.c./jour | Aucun effet nocif n’a été observé dans une étude de toxicité cutanée à doses répétées de 28 jours menée chez le rat | 17600 |
| Exposition cutanée, par utilisation, à des nettoyants pour BBQ, en aérosols | 0,423 mg/kg p.c./jour | DSENO = 3000 mg/kg p.c./jour | Aucun effet nocif n’a été observé dans une étude de toxicité cutanée à doses répétées de 28 jours menée chez le rat | 7090 |
Abréviations : DSENO, dose sans effet nocif observé; ME, marge d’exposition.
Les marges d’exposition sont considérées comme suffisantes pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
6.3.4 Incertitudes dans l’évaluation du risque pour la santé humaine associé aux substances du sous-groupe 3 (TEA, TIPA et BATEA)
Les principales sources d’incertitudes sont présentées dans le tableau 6-23 ci-dessous. Il est fort probable que l’utilisation des concentrations maximales et de la limite supérieure de la fourchette des quantités contenues dans les produits de consommation soit une estimation prudente de l’exposition de la population générale.
| Principales sources d’incertitudes | Impact |
|---|---|
| Aucune donnée récente sur le volume total de la fabrication et de l’importation de BATEA | +/- |
| Aucune donnée mesurée dans les milieux environnementaux au Canada | +/- |
| Aucune étude de cancérogenèse par exposition par voie orale ou par inhalation avec le TEA | +/- |
+/- = potentiel inconnu de surestimer ou de sous-estimer le risque.
7. Conclusion
Compte tenu de tous les éléments de preuve contenus dans la présente ébauche d’évaluation préalable, le MEA, le DEEA, le LME, la DEA, le LDE, le CDE, le CADEA, le TADEA, le TEA, le TIPA et le BATEA présentent un risque faible de causer des effets nocifs pour l’environnement. Il est proposé de conclure que les 11 substances du groupe des aminoalcools et des alcanolamides gras ne satisfont pas aux critères énoncés aux alinéas 64a) et b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, et à mettre en danger l’environnement essentiel pour la vie.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que le MEA, le DEEA, le LME, la DEA, le LDE, le CDE, le CADEA, le TADEA, le TEA, le TIPA et le BATEA ne satisfont pas au critère énoncé à l’alinéa 64c), car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est proposé de conclure que les 11 substances du groupe des aminoalcools et des alcanolamides gras ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
Références
[ACI] American Cleaning Institute. 2010. Consumer product ingredient safety: Exposure and Risk Screening Methods for Consumer Product Ingredients, 2nd edition. Appendix II-A-1 & Appendix II-B-1: Dermal exposure parameters to estimate screening exposures to consumer products – North America. Washington (DC): American Cleaning Institute. [Disponible en anglais seulement]
Allen, JA, Proudlock, RJ, et K. McCaffrey. 1984. Micronucleus Test on E-2352.01 (ECM BTS 902/01) Tamet. Unpublished Report No. P+G 1114/84560; for Procter and Gamble N.V., Stroombeek-Bever, Belgium; from Huntingdon Research Centre plc, Huntingdon, Angleterre. [Disponible en anglais seulement].
BASF AG. 1993a. Product Safety, Report - Study on the inhalation toxicity including neurotoxicological examination of Diethanolamn as a liquid aerosol in rats, 14-day test, BASF Project No. 36I0233/90009, BG No. 158, Experimental Toxicology and Ecology, BASF AG, Ludwigshafen, Allemagne, rapport non publié, 25 février 1993. [Disponible en anglais seulement].
BASF AG. 1993b. Product Safety, Study of the prenatal inhalation toxicity of Diethanolamine in rats after inhalation, BASF Project No. 31R0233/90010, Experimental Toxicology and Ecology, BASF AG, Ludwigshafen, Allemagne, rapport non publié, 8 juillet 1993. [Disponible en anglais seulement].
BASF AG. 2002. Product Safety, Diethanolamine – Subchronic inhalation toxicity study in Wistar rats, liquid aerosol/vapor exposure, study focus on irritation of upper respiratory tract, BASF Project No. 51I0299/99125, Experimental Toxicology and Ecology, BASF AG, Ludwigshafen, Allemagne, rapport non publié, 2 avril 2002. [Disponible en anglais seulement].
BASF AG. 2010. Product Safety, Results of a Production/developmental toxicity screening test in Wistar rats with 2,2’,2”-Nitrioethanol(Triethanolamine) (CAS No. 102-71-6), BASF SE, Ludwigshafen, Allemagne, rapport non publié, 26 août 2010. [Disponible en anglais seulement].
[BDIPSN] Base de données sur les ingrédients de produits de santé naturels [base de données]. [Modifiée le 21 mars 2019]. Ottawa (Ont.), Santé Canada [consultée en mai 2018].
[BDPSNH] Base de données sur les produits de santé naturels homologués. [Modifiée le 6 février 2018]. Ottawa (Ont.), Santé Canada. [Consultée en mai 2018]
Brain KR, Walters KA, Green DM, Brain S, Loretz LJ, Sharma RK, Dressler WE.2005.Percutaneous penetration of diethanolamine through human skin in vitro: application from cosmetic vehicles. Food Chem Toxicol. 43(5):681-90
Brown, LSR., Gray, DO. 1986. Diethanolamine, a secondary amine from the compositae. Journal of Natural Products. 49(5): 910-912.
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L.C. 1999, ch. 33. Gazette du Canada, Partie III, vol. 22, no 3.
Canada, ministère de l’Environnement. 2012. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances de la Liste intérieure [PDF]. Gazette du Canada, Partie I, vol. 146, no 48, supplément.
[CE] Commission européenne. 2003. Technical Guidance Document on risk assessment, Part I. 1998. Institut pour la santé et la protection du consommateur, Bureau européen des substances chimiques. [Disponible en anglais seulement].
[CE] Commission européenne. 2016. European Union risk assessment report: 2-aminoethanol: CAS No. 141-43-5. [Consulté le 3 janvier 2018]. [Disponible en anglais seulement].
Cerrillo I, Fernández-Pachón MS, Collado-González J, Escudero-López B, Berná G, Herrero-Martín G, Martin F, Ferreres F, et A. Gil-Izquierdo. 2015. Effect of fermentation and subsequent pasteurization processes on amino acids composition of orange juice. Plant Food Human Nutr. 70(2): 153–159. [Disponible en anglais seulement].
Charles River Laboratories Edinburgh Ltd. 2020. In vitro percutaneous absorption of radiolabelled lauramide DEA and radiolabelled triethyl phosphate (TEP) at 2 dose levels through human skin (OECD 428 and SCCS): 24 h design. Study No. 784630. CRL Edinburgh Ltd, UK, rapport non publié, 13 février 2020.
ChemCAN [level III fugacity model of 24 regions of Canada]. 2003. Ver. 6.00. Peterborough (Ont.) : Trent University, Canadian Centre for Environmental Modelling and Chemistry. [Disponible en anglais seulement].
[ChemIDplus] [Base de données]. 1993- . Bethesda (MD): US National Library of Medicine. [Mise à jour non précisée; consulté le 31 janvier 2018]. [Disponible en anglais seulement].
[CIR] Cosmetic Ingredient Review Expert Panel. 2013a. Fiume MM, Heldreth B, Bergfeld WF, Belsito DV, Hill RA, Klaassen CD, Liebler D, Marks JG, Shank RC, Slaga TJ, Snyder PW, et FA Andersen. Safety assessment of triethanolamine and triethanolamine-containing ingredients as used in cosmetics. Int J Toxicol. 32 (3 Suppl):59S-83S. [Disponible en anglais seulement].
[CIR] Cosmetic Ingredient Review Expert Panel. 2013b. Fiume MM, Heldreth B, Bergfeld WF, Belsito DV, Hill RA, Klaassen CD, Liebler DC, Marks JG Jr, Shank RC, Slaga TJ, Snyder PW, et FA Andersen. Safety assessment of diethanolamides as used in cosmetics. Int J Toxicol. 32(3 Suppl):36S-58S. [Disponible en anglais seulement].
[CIR] Cosmetic Ingredient Review Expert Panel. 2015a. Fiume MM, Heldreth BA, Bergfeld WF, Belsito DV, Hill RA, Klaassen CD, Liebler DC, Marks JG Jr, Shank RC, Slaga TJ, Snyder PW, et FA Andersen. Safety Assessment of Ethanolamine and Ethanolamine Salts as Used in Cosmetics. Int J Toxicol. 34(2 suppl):84S-98S. [Disponible en anglais seulement].
[CIR] Cosmetic Ingredient Review Expert Panel. 2015b. Fiume MM, Heldreth BA, Bergfeld WF, Belsito DV, Hill RA, Klaassen CD, Liebler DC, Marks JG Jr, Shank RC, Slaga TJ, Snyder PW, et FA Andersen. Safety Assessment of Ethanolamides as Used in Cosmetics. Int J Toxicol. 34(1 Suppl):18S-34S. [Disponible en anglais seulement].
[CIR] Cosmetic Ingredient Review Expert Panel. 2015c. Safety Assessment of PEGs Cocamine and Related Ingredients as Used in Cosmetics. Rapport final modifié. [Données de publication : 10 juillet 2015. Consulté le 15 décembre 2017]. [Disponible en anglais seulement].
[CIR] Cosmetic Ingredient Review Expert Panel. 2017. Fiume MM, Heldreth B, Bergfeld WF, Belsito DV, Hill RA, Klaassen CD, Liebler DC, Marks JG Jr, Shank RC, Slaga TJ, Snyder PW, Andersen FA. 2017. Safety Assessment of Diethanolamine and Its Salts as Used in Cosmetics. Int J Toxicol. 36(5‑suppl 2): 89S‑110S.
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risk to Human. 2000a. N‑Nitrosodiethanolamine. IARC Monogr Eval Carcinog Risks Hum 77:403-438. [Disponible en anglais seulement].
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risk to Human. 2000b. Triethnolamine. IARC Monogr Eval Carcinog Risks Hum 77:381-401. [Disponible en anglais seulement].
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risk to Human. 2013a. Diethanolamine. IARC Monogr Eval Carcinog Risks Hum 101:117-140. [Disponible en anglais seulement].
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risk to Human. 2013b. Coconut oil diethanolamine condensate. IARC Monogr Eval Carcinog Risks Hum 101:141-148. [Disponible en anglais seulement].
ConsExpo Web [Consumer Exposure Web Model]. 2016. Bilthoven (NL): Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement]. [Disponible en anglais seulement].
Coppinger, WJ. 1983. Unscheduled DNA Synthesis Assay in Primary Cultures of Rat Hepatocytes. Report No. M0021, The Procter & Gamble Company, BTF – Miami Valley Laboratories, Cincinnati, OH, États‑Unis. [Disponible en anglais seulement].
Dean, BJ, Brooks, TM, Hodson-Walker, G, et DH Hutson. 1985. Genetic toxicology testing of 41 industrial chemicals. Mutat Res. 153(1-2):57–77.
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l’approche scientifique : Classification du risque écologique des substances organiques. Ottawa (Ont.), gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016 b. Supporting documentation: data used to create substance-specific hazard and exposure profiles and assign risk. Gatineau (QC) : ECCC. Information à l’appui du Document sur l’approche scientifique : Classification du risque écologique des substances organiques. Disponible sur demande à : substances@ec.gc.ca.
[ECCC] Environnement et Changement climatique Canada. 2017. Data submission under the Canadian Environmental Protection Act, 1999, Section 70. Non-CBI use information for CAS RN 141-43-5 and 85204-21-3. [Disponible en anglais seulement].
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2015. Identification des priorités d’évaluation des risques : résultats de l’examen de 2015.
[ECHA] European Chemicals Agency. c2007-2017a. Registered substance database; search results for CAS RN 141-43-5. Helsinki (Finlande) : ECHA. [Mise à jour le 2 mars 2017; consulté le 28 novembre 2017]. [Disponible en anglais seulement].
[ECHA] European Chemicals Agency. c2007-2017b. Registered substance database; search results for CAS RN 111-42-2. Helsinki (Finlande) : ECHA. [Mise à jour le 2 mars 2017; consulté le 28 novembre 2017]. [Disponible en anglais seulement].
[ECHA] European Chemicals Agency. c2011-2017. Registered substance database; search results for CAS RN 100-37-8. Helsinki (Finlande) : ECHA. [Mise à jour le 2 mars 2017; consulté le 28 novembre 2017]. [Disponible en anglais seulement].
[ECHA] European Chemicals Agency. c2013-2017. Registered substance database; search results for CAS RN 111-05-7. Helsinki (FI): ECHA. [Mise à jour le 18 avril 2017; consulté le 15 janvier 2018]. [Disponible en anglais seulement].
[ECHA] European Chemicals Agency. [modifié en 2017]. Candidate List of substances of very high concern for Authorisation. Helsinki (Finlande) : ECHA. [Consulté le 3 décembre 2018]. [Disponible en anglais seulement].
[ECHA] European Chemicals Agency. c2013-2018a. Registered substance database; search results for CAS RN 122-20-3. Helsinki (Finlande) : ECHA. [Mise à jour le 2 mars 2017; consulté le 28 novembre 2017]. [Disponible en anglais seulement].
[ECHA] European Chemicals Agency. c2013-2018b. Registered substance database; search results for CAS RN 111-57-9. Helsinki (Finlande) : ECHA. [Mise à jour le 16 mars 2018; consulté le 15 janvier 2018]. [Disponible en anglais seulement].
[ECHA] European Chemicals Agency. c2013-2018c. Registered substance database; search results for CAS RN 61791-31-9. Helsinki (Finlande): ECHA. [Mise à jour le 13 juin 2018; consulté le 15 janvier 2018]. [Disponible en anglais seulement].
[ECHA] European Chemicals Agency. c2013-2018d. Registered substance database; search results for CAS RN 93-83-4. Helsinki (FI): ECHA. [Mise à jour le 13 juin 2018; consulté le 15 janvier 2018]. [Disponible en anglais seulement].
Edgerton SA, Kenny DV, et DW Joseph. 1989. Determination of amines in indoor air from steam humidification. Environ Sci Technol. 23:484-488. [Disponible en anglais seulement].
Environnement Canada. 2013. Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement, 1999 : Avis concernant certaines substances de la Liste intérieure. Données préparées par : Environnement Canada et Santé Canada; Programme des substances existantes.
[EPI Suite] Estimation Programs Interface Suite for Microsoft Windows [modèle d’estimation]. c2000-2017. Ver. 4.11. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. [Disponible en anglais seulement].
Esher, HJ. 1982. In vivo Cytogenetics Study in Rats. Unpublished Report No. MRI-182-PG-82-58; for The Procter and Gamble Company, Cincinnati, OH, USA; from EG&G/Mason Research Institute, Worcester, MA, États‑Unis. [Disponible en anglais seulement].
Exxon Biomedical Sciences. 1990. Project Number 208618, Sponsored research by SyntheticOrganic Chemicals Manufacturing Association, 3 mai 1990. [Disponible en anglais seulement].
Ficheux AS, Wesolek N, Chevillotte G, et AC Roudot, 2015. Consumption of cosmetic products by the French population. First part: Frequency data. Food Chem Toxicol. 78: 159-169. [Disponible en anglais seulement].
Ficheux AS, Chevillotte G, Wesolek N, Morisset T, Dornic N, Bernard A, Bertho A, Romanet A, Leroy L, Mercat AC, Creusot T, Simon E, et AC Roudot. 2016. Consumption of cosmetic products by the French population second part: Amount data. Food Chem Toxicol. 90: 130-141. [Disponible en anglais seulement].
Frauenkron M, Melder J, Ruider G, Rossbacher R, et H. Höke. 2012. Ethanolamines and propanolamines. Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH & Co. KGaA. Vol. 13, p. 405-431. [Disponible en anglais seulement].
Galgano F, Caruso M, Perretti G, et F. Favati. 2011. Authentication of Italian red wines on the basis of the polyphenols and biogenic amines. Eur Food Res Technol. 232(5): 889–897. [Disponible en anglais seulement].
Galloway SM, Armstrong MJ, Reuben C, Colman S, Brown B, Cannon C, Bloom AD, Nakamura F, Ahmed M, Duk S, et al., 1987. Chromosome aberrations and sister chromatid exchanges in Chinese hamster ovary cells: evaluations of 108 chemicals. Environ Mol Mutagen.10 (Suppl 10):1-175. [Disponible en anglais seulement].
Gamer AO, Rossbacher R, Kaufmann W, et B. van Ravenzwaay. 2008. The inhalation toxicity of di- and triethanolamine upon repeated exposure. Food Chem Toxicol. 46:2173–2183. [Disponible en anglais seulement].
Giachetti, C. 1998. Determination of triethanolamine in air samples by gas chromatography-mass spectrometry. Chromatographia. 48:443-449. [Disponible en anglais seulement].
Goater T, Griffiths OD, et TF McElligott. 1965. Ninety-day oral toxicity of ethomeen T/12-albino rats. Report No. IHR/173. Industrial Hygiene Research Laboratories, Macclesfield, Cheshire. [Disponible en anglais seulement].
González S, Petrovic M, et D. Barceló. 2004. Simultaneous extraction and fate of linear alkylbenzene sulfonates, coconut diethanol amides, nonylphenol ethoxylates and their degradation products in wastewater treatment plants, receiving coastal waters and sediments in the Catalonian area (NE Spain). J Chromatogr A. 1052:111-120. [Disponible en anglais seulement].
Gorzelska K, et JN Galloway. 1990. Amine nitrogen in the atmospheric environment over the North Atlantic Ocean. Global Biogeochem Cycles. 4:309-333. [Disponible en anglais seulement].
Greaves P. 2011. Histopathology of preclinical toxicity studies, Fourth Edition: Interpretation and relevance in drug safety evaluation. 4th edition. Amsterdam, Pays-Bas : Academic Press; p. 115. [Disponible en anglais seulement].
Guant IF, Farmer M, Grasso P, et SD Gangolli. 1967. Short-term feeding study of lauric diethanolamide in rats. Food Cosmet Toxicol. 5(4):497-503. [Disponible en anglais seulement].
Haworth, SR. 1981. Salmonella/Mammalian-Microsome Mutagenesis Assay (Ames Test). Report No. 003-468-677-1; préparé pour The Procter and Gamble Company, Cincinnati, OH, États‑Unis; d’EG&G Mason Research Institute, Rockville, MD, États‑Unis. [Disponible en anglais seulement].
Hellwig J, et AB Liberacki. 1997. Evaluation of the pre-, peri-, and postnatal toxicity of monoethanolamine in rats following repeated oral administration during organogenesis. Fundam Appl Toxicol. 40(1):158-62. [Disponible en anglais seulement].
Helman RG, Hall JW, et JY Kao. 1986. Acute dermal toxicity: in vivo and in vitro comparisons in mice. Fundam Appl Toxicol. 7(1):94-100. [Disponible en anglais seulement].
Hinz JP, Thomas JA, et R Ben-Dyke. 1992. Evaluation of the inhalation toxicity of diethylethanolamine (DEEA) in rats, Fundam. Appl Toxicol 18: 418-424. [Disponible en anglais seulement].
Huang X, Deng C, Zhuang G, Lin J, et M Xiao. 2016. Quantitative analysis of aliphatic amines in urban aerosols based on online derivatization and high performance liquid chromatography. Environ Sci-Process Impacts. 18:796-801. [Disponible en anglais seulement].
Inoue, K, Sunakawa, T, Okamoto, K, et Y Tanaka. 1982. Mutagenicity tests and in vitro transformation assays on triethanolamine. Mutat Res. 101(4):305–313. [Disponible en anglais seulement].
[INRP] Inventaire national des rejets de polluants. 2015. Jeux de données de l’INRP. Ottawa (Ont.), gouvernement du Canada. Résultats de recherche sur la diéthanolamine. [Consulté le 15 septembre 2017].
JETOC. 1996. Mutagenicity Test Data of Existing Chemical Substances, January 1996. Japan Chemical Industry Ecology-Toxicology & Information Center, Japon. [Disponible en anglais seulement].
Johansson, I. 2001. Amides, fatty acid. In : Kirk-Othmer encyclopedia of chemical technology. Version en ligne. John Wiley & Sons Inc. 2:442-463. [Disponible en anglais seulement].
Kamendulis LM, et JE Klaunig. 2005. Species differences in the induction of hepatocellular DNA synthesis by diethanolamine. Toxicol Sci. 87(2):328-36. [Disponible en anglais seulement].
Kelly MT, Blaise A, et M Larroque. 2010. Rapid automated high performance liquid chromatography method for simultaneous determination of amino acids and biogenic amines in wine, fruit and honey. J of Chromatogr A 1217(47): 7385–7392. [Disponible en anglais seulement].
Kirby, PE. 1980. Test for Chemical Induction of Mutation in Mammalian Cells in Culture – the L5178Y TK+/- Mouse Lymphoma Assay. Report No. 003-692-420-7; préparé pour The Procter and Gamble Company, Cincinnati, OH, USA; from EG&G Mason Research Institute, Rockville, MD, États‑Unis. [Disponible en anglais seulement].
Kirman CR, Hughes B, Becker RA, et SM Hays. 2016. Derivation of a No-significant-risk-level (NSRL) for dermal exposures to diethanolamine. Regul Toxicol Pharmacol. 76:137-51. [Disponible en anglais seulement].
Kohri N, Matsuda T, Umeniwa K, Miyazaki K, et T Arita. 1982. Development of assay method in biological fluids and biological fate of triethanolamine. Yakuzaigaku. 42(4):342-348. [Disponible en anglais seulement].
Kraeling MEK, et RL Bronaugh. 2003. In vitro absorption of triethanolamine through human skin. J Toxicol: Cutan Ocul Toxicol. 22(3):137-145. [Disponible en anglais seulement].
Kraeling MEK, Yourick JJ, et RL Bronaugh. 2004. In vitro human skin penetration of diethanolamine. 2004. Food Chem. Toxicol., 42(10):1553–1561. [Disponible en anglais seulement].
Lakritz L, Spinelli AM, et AE Wasserman. 1975. Determination of amines in fresh and processed pork. J Agric Food Chem. 23:344-346. [Disponible en anglais seulement].
Lehman-McKeeman LD, Gamsky EA, Hicks SM, Vassallo JD, Mar MH, et SH Zeisel. 2002. Diethanolamine induces hepatic choline deficiency in mice. Toxicol Sci. 67(1):38-45. [Disponible en anglais seulement].
Leung HW et SR Murphy.1998. Developmental toxicity study in Sprague-Dawley rats by whole-body exposure to N,N -diethylethanolamine vapor, J Appl Toxciol 18: 191-196. [Disponible en anglais seulement].
Leung, HW, Kamendulis, LM, et WT Stott. 2005. Review of the carcinogenic activity of diethanolamine and evidence of choline deficiency as a plausible mode of action. Regul Toxicol Pharmacol. 43(3):260–271. [Disponible en anglais seulement].
Liberacki AB, Neeper-Bradley TL, Breslin WJ, et GJ Zielke. 1996. Evaluation of the developmental toxicity of dermally applied monoethanolamine in rats and rabbits. Fundam Appl Toxicol. 31(1):117-23. [Disponible en anglais seulement].
Loretz LG, Api AM, Barraj LM, Burdick J, Dressler WE, Gettings SD, Han Hsu H, Pan YHL, Re TA, Renskers KJ, Rothenstein A, Scrafford CG, et C Sewall. 2005. Exposure data for cosmetic products: lipstick, body lotion, and face cream. Food Chem Toxicol. 43: 279-291. [Disponible en anglais seulement].
Loretz L, Api AM, Barraj L, Burdick J, Davis DA, Dressler W, Gilberti E, Jarrett G, Mann S, Pan YHL, Re T, Renskers K, Scrafford C, et S Vater. 2006. Exposure data for personal care products: Hairspray, spray perfume, liquid foundation, shampoo, body wash, and solid antiperspirant. Food Chem Toxicol. 44: 2008‑2018. [Disponible en anglais seulement].
Loretz LG, Api AM, Babcock L, Barraj LM, Burdick J, Cater KC, Jarrett G, Mann S, Pan YHL, Re TA, Renskers KJ, et CG Scrafford. 2008. Exposure data for cosmetic products: Facial cleanser, hair conditioner, and eye shadow. Food Chem Toxicol 46: 1516-1524. [Disponible en anglais seulement].
Mader BT, Yu JZ, Xu JH, Li QF, Wu WS, Flagan RC, et JH Seinfeld. 2004. Molecular composition of the water-soluble fraction of atmospheric carbonaceous aerosols collected during ACE-Asia. J Geophys Res- Atmos. 109:D06206. [Disponible en anglais seulement].
Maekawa A, Onodera H, Tanigawa H, Furuta K, Kanno J, Matsuoka C, Ogiu T, et Y Hayashi. 1986. Lack of carcinogenicity of triethanolamine in F344 rats. J Toxicol Environ Health.19(3):345-357. [Disponible en anglais seulement].
Manetta AC, Di Giuseppe L, Tofalo R, Martuscelli M, Schirone M, Giammarco M, et G Suzzi. 2016. Evaluation of biogenic amines in wine: Determination by an improved HPLC-PDA method. Food Control 62: 351–356. [Disponible en anglais seulement].
Mathews JM, Garner CE, Black SL, et HB Mathews. 1997. Diethanolamine absorption, metabolism and disposition in rat and mouse following oral, intravenous and dermal administration. Xenobiotica, 27 : 733-746. [Disponible en anglais seulement].
Mathews JM, deCosta K, et BF Thomas. 1996. Lauramide diethanolamine absorption, metabolism, and disposition in rats and mice after oral, intravenous, and dermal administration. Drug Metab Dispos. 24(7):702-10. [Disponible en anglais seulement].
Mayer HK, Fiechter G, et E Fischer. 2010. A new ultra-pressure liquid chromatography method for the determination of biogenic amines in cheese. J Chromatogr A 1217(19): 3251−3257. [Disponible en anglais seulement].
Mayr CM, et P Schieberle. 2012. Development of stable isotope dilution assays for the simultaneous quantitation of biogenic amines and polyamines in foods by LC-MS/MS. J Agric Food Chem. 60(12): 3026–3032. [Disponible en anglais seulement].
Miyazaki Y, Kondo Y, Shiraiwa M, Takegawa N, Miyakawa T, Han S, Kita K, Hu M, Deng ZQ, Zhao Y, Sugimoto N, Blake DR, et RJ Weber. 2009a. Chemical characterization of water-soluble organic carbon aerosols at a rural site in the Pearl River Delta, China, in the summer of 2006. J Geophys Res- Atmos. 114:14208. [Disponible en anglais seulement].
Miyazaki Y, Aggarwal SG, Singh K, Gupta PK, et K Kawamura. 2009b. Dicarboxylic acids and water-soluble organic carbon in aerosols in New Delhi, India, in winter: Characteristics and formation processes. J Geophys Res- Atmos. 114:19206. [Disponible en anglais seulement].
Mortelmans K, Haworth S, Lawlor T, Speck W, Tainer B, et E. Zeiger. 1986. Salmonella mutagenicity tests: II. Results from the testing of 270 chemicals. Environ Mutagen. 8(suppl 7):1-119. [Disponible en anglais seulement].
Mrklas O, Bentley LR, Lunn SRD, et A Chu. 2006. Principal component analyses of groundwater chemistry data during enhanced bioremediation. Water Air Soil Pollut. 169:395-411. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2006. Lysol Brand II Disinfectant Spray, Crisp Linen (Trial Size Aerosol). Parsippany (NJ): Reckitt Benckiser North America, Inc. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2007f. Maja Gel De Bano Perfumado. San Juan (Puerto Rico): Puerto Rico Supplies Group Inc. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2007g. Mothers Leather Conditioner. Huntington Beach (CA): Mothers Polishes Waxes Cleaners. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2007h. Zero by Woolite For All Colours, Fabric Wash (Liquid) – Canadian. Parsippany (NJ): Reckitt Benckiser North America, Inc. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2008a. Mr. Clean Multi Surfaces Antibacterial Spray (Orange and Lemon Scents). Cincinnati (OH): The Procter & Gamble Company. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2008f. Magenta color ink for Brother MFC 3100 and MFC 210C, MFC240. Mississauga (Ont.): Ko-Rec-Type. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2008g. Shampoo Dr. Cabello-Cabellos Teñidos. San Juan (PR): Puerto Rico Merchandising. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2009. Boat Clean Plus. Mississauga (ON): Aurora Marine Insustries Inc. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2010a. Deep Crystal Economy Car Wash. Irving (CA): Meguiar’s USA. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2010b. Coppertone Lotions (Low/No Oil). Pointe Claire (QC): Schering-Plough HealthCare Products Canada. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2010c. Hero Liquid Laundry Detergent. Oakville (Ont.): Jempak GK Inc. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2011a. Hertel Multi – Ultra Concentrated Cleaner. Montreal (QC): Lavo Inc. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2011b. Lysol Antibacterial Hand Soap No Touch Kitchen System. Parsippany (NJ): Reckitt Benckiser LLC. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2012a. Sunlight Liquid Laundry Detergent 3X - Green Clean Citrus Fresh 946 mL. Wilton (CT): Sun Products Corporate Office. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2012b. Coppertone QuickCover Lotion Sprays. Pointe Claire (QC): Merck. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2012c. LePage No More Nails Ultra Heavy Duty Adhesive. Mississauga (ON): Henkel Canada Corporation. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2012d. Liquid Dish Detergent and Antibacterial Hand Soap - premium all variants. Salt Lake City (UT): Sun Products Corporation. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2012e. Grime Eater Extra Strength Laundry Soil & Stain Remover. Mississauga (ON): Grime Eater Products Inc. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2012f. Stone effects Countertop Epoxy Coat 4X1.2L. Toronto (ON): Tremco Canada Division. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2013h. Hertel Multi All Purpose Cleaner. Montreal (QC): Lavo Inc. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2013j. Water Pump Lube. Mississauga (ON): Radiator Specialty Co., of Canada. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2013k. BBQ Grill Cleaner. Gurnee (IL): Weiman Products [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2014b. Trewax Gold Label High Gloss Sealer. Kennesaw (GA): Beaumont Products Inc [Consulté le 14 juin 2018]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2014c. Lemon Suds. Acheson (AB): Sci-Tech Engineered Chemicals. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2014d. Tub-O-Towels. Cleveland (OH): Federal Process Corporation. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2015e. Micro-Gloss. Wilton (IA): Micro-Surface Finishing Products, Inc. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2015h. AN COL THALO BLU (TBL) 1793. Pittsburgh (PA): PPG Industries, Inc. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2015i. Mobil multi-vehicle ATF. Spring (TX): Exxon Mobil Corporation. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2015j. Micro-Gloss. Wilton (IL): Micro-Surface Finishing Products, Inc. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2015k. SA-8 Battery Cleaners 5 Oz. AE. Halton Hills (ON): ITW Permatex Canada. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2015l. Heavy-Duty Oven & Grill Cleaner. Atlanta (GA): Zep Commercial Sales & Service. [Consulté le 22 septembre 2017]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2015m. Simple Green® Pro Grade Heavy-Duty Cleaner. Huntington Beach (CA): Sunshine Makers, Inc. [Consulté le 1er mars 2018]. [Disponible en anglais seulement].
[MSDS] Material Safety Data Sheet. 2017c. Goo Gone Oven & Grill Cleaner. Gumee (IL):Goo Gone [Consulté le 13 juin 2018]. [Disponible en anglais seulement].
NICNAS. 2009. Priority Existing Chemical Assessment Report No. 30 Triclosan [Internet]. Sydney (Australia): National Industrial Chemicals Notification and Assessment Scheme. [Disponible en anglais seulement].
[NTP] National Toxicology Program. 1992. Toxicity Studies of Diethanolamine (CAS No. 111-42-2) Administered Topically and in Drinking Water to F344/N Rats and B6C3F1 Mice (Tech. Rep. Ser. No. 20; NIH Publication No. 92-3343), Department of Health and Human Services, Research Triangle Park, NC. [Disponible en anglais seulement].
[NTP] National Toxicology Program (US). 1999a. NTP toxicology and carcinogenesis studies of diethanolamine (cas no. 111–42–2) in F344/N rats and B6C3F1 mice (dermal studies). Natl Toxicol Program Tech Rep Ser 478 :1–212. [Disponible en anglais seulement].
[NTP] National Toxicology Program (US). 1999b. NTP toxicology and carcinogenesis studies of lauric acid diethanolamine condensate (CAS No. 120–40–1) in F344/N rats and B6C3F1 mice (Dermal studies). Natl Toxicol Program Tech Rep Ser 480:1-200. [Disponible en anglais seulement].
[NTP] National Toxicology Program (US). 1999c. NTP toxicology and carcinogenesis studies of oleic acid diethanolamine condensate (CAS No. 93–83–4) in F344/N rats and B6C3F1 mice (Dermal studies) Natl Toxicol Program Tech Rep Ser 481:1-198. [Disponible en anglais seulement].
[NTP] National Toxicology Program (US). 1999d. NTP toxicology and carcinogenesis studies of triethanolamine (CAS No. 102-71-6) in F344/N rats and B6C3F1 mice (dermal studies). Natl Toxicol Program Tech Rep Ser. 449:1-298. [Disponible en anglais seulement].
[NTP] National Toxicology Program (US). 2001. NTP Toxicology and carcinogenesis studies of coconut oil acid diethanolamine condensate (CAS No. 68603‑42‑9) in F344/N rats and B6C3F1 mice (dermal studies). Natl Toxicol Program Tech Rep Ser 479:5-226. [Disponible en anglais seulement].
[NTP] National Toxicology Program(US). 2004. NTP toxicology and carcinogenesis studies of triethanolamine (CAS No. 102-71-6) in B6C3F1 mice (dermal studies). Natl Toxicol Program Tech Rep Ser (518):5-163. [Disponible en anglais seulement].
Ockerman HW. 1978. Source Book for Food Scientists (1978). AVI Publishing Co., Inc., Westport, CT. p. 471. [Disponible en anglais seulement].
[OCDE] Organisation de coopération et de développement économiques. 1995. Lignes directrices de l’OCDE pour les essais de produits chimiques : essai no 105 : Solubilité dans l’eau. OCDE, Paris.
[OCDE] Organisation de coopération et de développement économiques. 2002. SIDS initial assessment report: 2-Diethylaminoethanol: CAS No. 100-37-8. SIAM [SIDS Initial Assessment Meeting] 15; 2002 October; Boston, États‑Unis. [Consulté le 15 décembre 2017]. [Disponible en anglais seulement].
[OCDE] Organisation de coopération et de développement économiques. 2007a. SIDS initial assessment report: 2,2’-Iminodiethanol: CAS No. 111-42-2. SIAM [SIDS Initial Assessment Meeting] 24; avril 2007; Paris, France. [Consulté le 15 décembre 2017]. [Disponible en anglais seulement].
[OCDE] Organisation de coopération et de développement économiques. 2007b. Revised Guidelines for the Testing of Chemicals. TG 105: Water Solubility. OCDE, Paris. [Disponible en anglais seulement].
[OCDE] Organisation de coopération et de développement économiques. 2008. SIDS Data Set 2,2’‑Iminodiethanol: CAS No. 111-42-2. [Disponible en anglais seulement].
[OCDE] Organisation de coopération et de développement économiques. 2009. SIDS initial assessment report: 1,1’,1"-nitrilotripropan-2-ol (TIPA). OECD HPV Chemical Programme, SIDS Dossier approved at SIAM 29, 20-23 octobre 2009. [Consulté le 15 décembre 2017]. [Disponible en anglais seulement].
[OCDE] QSAR Toolbox. [Outil d’extrapolation]. 2016. Paris (France) : Organisation de coopération et de développement économiques, Laboratory of Mathematical Chemistry. [Disponible en anglais seulement].
Pedersen EK, Bjørseth O, Syversen T, et M Mathiesen. 2002. Emissions from heated indoor dust. Environ Int. 27:579-587. [Disponible en anglais seulement].
Pittermann, W. 1994. Embryotoxicity Study (Including Teratogenicity) in the Rat (Segment II). Report number RT920403. Henkel KGaA, Duesseldorf, Allemagne. [Disponible en anglais seulement].
Preti R, Antonelli ML, Bernacchia R, et G Vinci. 2015. Fast determination of biogenic amines in beverages by a core-shell particle column. Food Chem. 187: 555−562. [Disponible en anglais seulement].
Price CJ, Marr MC, Myers CM, et GD Jahnke. 2005. Postnatal developmental of rat pups after maternal exposure to Diethanolamine. Birth Defects Res. B Dev Reprod Toxicol. 74:243-254. [Disponible en anglais seulement].
Rasmussen T, Anthoni U, Christophersen C, et PH Nielsen. 1993. Volatile compounds from the marine indicator organism Mytilus edulis. Chemosphere. 27:2123-2125. [Disponible en anglais seulement].
Redruello B, Ladero V, del Rio B, Fernández M, Martin MC, et MA Alvarez. 2017. A UHPLC method for the simultaneous analysis of biogenic amines, amino acids and ammonium ions in beer. Food Chem. 217, 117–124. [Disponible en anglais seulement].
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement]. 2006a. Cosmetics fact sheet: to assess the risks for the consumer: version mise à jour pour ConsExpo 4 [PDF]. Bilthoven (NL): RIVM. Report No.: 320104001/2006. [Disponible en anglais seulement].
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement]. 2006b. General Fact Sheet: Limiting conditions and reliability, ventilation, room size, body surface area. Version mise à jour pour ConsExpo 4 [PDF]. Bilthoven (NL): RIVM Report No.: 320104002/2006. [Disponible en anglais seulement].
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement]. 2007. Paint products fact sheet: to assess the risks for the consumer: version mise à jour pour ConsExpo 4 [PDF]. Bilthoven (NL): RIVM. Report No.: 320104008/2007. [Disponible en anglais seulement].
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement]. 2018. Cleaning products fact sheet: default parameters for estimating consumer exposure (version mise à jour 2018) [PDF]. Bilthoven (NL): RIVM. Report No.: 2016-0179. [Disponible en anglais seulement].
[RSI] Risk Sciences International. 2017. Addressing human health hazard data gaps through the use of read-across for a group of alkanol amides. Final report. Ottawa (Ont.), Santé Canada. [Accès réservé]. [Disponible en anglais seulement].
Santé Canada. [Modifié en 2018]. Liste critique des ingrédients de cosmétiques : liste des ingrédients dont l’usage est interdit dans les cosmétiques. Ottawa (Ont.), Santé Canada, Direction de la sécurité des produits de consommation et des produits dangereux. Consulté le 10 juillet 2018].
Santé Canada. 1995. Enquête sur l’exposition des êtres humains aux contaminants dans le milieu : un guide pour les calculs de l’exposition. Rapport non publié. Ottawa (Ont.), gouvernement du Canada.
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport non publié. Ottawa (Ont.), gouvernement du Canada. [Disponible en anglais seulement]
Santé Canada. 2015a. Feuilles de calcul [format Excel] sur l’eau potable de l’Unité d’évaluation environnementale. Ottawa (Ont.), Santé Canada. [Mentionné le 8 avril 2016].
[SCCS] Scientific Committee on Consumer Safety. 2010. The SCCS’s Notes of Guidance for the Testing of Cosmetic Ingredients and their Safety Evaluation, 7th Revision. [Disponible en anglais seulement].
[SCCS] Scientific Committee on Consumer Safety. 2012. The SCCS’s Notes of Guidance for the Testing of Cosmetic Substances and their Safety Evaluation, 8th Revision. European Commission. Report No. SCCS/1501/12. [Mai 2018]. [Disponible en anglais seulement].
[SCCS] Scientific Committee on Consumer Safety. 2015. The SCCS’s Notes of Guidance for the Testing of Cosmetic Ingredients and their Safety Evaluation. 9th Revision. European Commission. Report No. SCCS/1564/15, Revised version of 25 April 2016. [Consulté le 31 mai 2018]. [Disponible en anglais seulement].
Schulte KE, Dreymann H, et H Möllmann. 1972. Absorption, distribution in the organs and metabolism of diethylaminoethanol after oral administration to rats. Pharm-Forsch. 22:1381‑1390. [Disponible en anglais seulement].
Sci-Tech Inc. 2013. Lemon Suds Technical Data Sheet (Product # 0206). Acheson (AB): Sci-Tech Engineered Chemicals. [Consulté le 6 juin 2018]. [Disponible en anglais seulement].
Sidransky H, et E Farbere. 1960. Liver choline oxidase activity in man and in several species of animals. Arch Biochem Biophys. 87:129-33. [Disponible en anglais seulement].
Simoneit BRT, Oros DR, et VO Elias. 2000. Molecular tracers for smoke from charring/burning of chitin biopolymer. Chemosphere - Glob Change Sci. 2:101-105. [Disponible en anglais seulement].
SimpleTreat [modèle d’estimation]. 2015. Ver. 4.0.8. Bilthoven (Pays-Bas) : National Institute of Public Health and the Environment (RIVM). [Disponible en anglais seulement].
Statistique Canada. 2012. Custom tabulation of grooming products data from the Canadian Health Measures Survey Cycle 1 (2007-2009). Préparé par Statistique Canada pour le Bureau d’évaluation du risque des substances existantes de Santé Canada. Rapport non publié. [Disponible en anglais seulement].
Statistique Canada. 2015. Enquête sur la santé dans les collectivités canadiennes (ESCC) 2015. Fichier partagé. Ottawa (Ont.), Canada. Valeurs estimatives obtenues à l’aide de SAS 9.3 [GRID] jusqu’à SAS EG 5.1.
Statistique Canada. [Modifié en 2017]. Base de données sur le commerce international canadien de marchandises. Ottawa (Ont.), gouvernement du Canada. [Consulté le 29 novembre 2017].
Stott WT, Bartels MJ, Brzak KA, Mar M, Markham DA, Thornton CM, et SH Zeisel. 2000a. Potential mechanisms of tumorigenic action of diethanolamine in mice. Toxicol Lett. 114(1-3):67-75. [Disponible en anglais seulement].
Stott WT, Waechter JM, Rick DL, et AL Mendrala. 2000b. Absorption, distribution, metabolism and excretion of intravenously and dermally administered triethanolamine in mice. Food Chem Toxicol. 38(11):1043-51. [Disponible en anglais seulement].
Stott WT, Radtke BJ, Linscombe VA, Mar MH, et SH Zeisel. 2004. Evaluation of the potential of triethanolamine to alter hepatic choline levels in female B6C3F1 mice. Toxicol Sci.79(2):242-7. [Disponible en anglais seulement].
Strittholt CA, McMillan DA, He T, Baker RA, et ML Barker. 2016. A randomized clinical study to assess ingestion of dentrifrice by children. Regul Toxicol Pharmacol. 75: 66-71. [Disponible en anglais seulement].
Sun JD., Beskitt JL, Tallant MJ et SW Frantz. 1996. In vitro skin penetration of monoethanolamine and diethanolamine using excised skin from rats, mice, rabbits, and humans. J Toxicol: Cutan Ocul Toxicol. 15(2):131-146. [Disponible en anglais seulement].
Thabuis C, Tissot-Favre D, Bezelgues JB, Martin JC, Cruz-Hernandez C, Dionisi F et F Destaillats. 2008. Biological functions and metabolism of oleylethanolamide. Lipids. 43 : 887-894. [Disponible en anglais seulement].
Thiagar, A. 1982. Cytogenicity Study – Chinese Hamster Ovary (CHO) Cells In vitro. Study No. T1807.338; pour The Procter & Gamble Company, Cincinnati, OH, États‑Unis; Microbiological Associates Inc., Bethesda, MD, États‑Unis. [Disponible en anglais seulement].
TSCATS. 1990. OTS 0530455, New Doc. I. D. 88-900000214, containing a report dated December 30, 1966 (1 year dog study) and July 31, 1967 (2 year rat study) for Pennsalt Chem. Corp., 2 août 1990, Atochem N. America, Inc. [Disponible en anglais seulement].
[UEE] Unité d’évaluation environnementale. 2005. Cosmetics Exposure Workbook. (Outil interne non publié de Santé Canada).
[US EPA] Environmental Protection Agency des États‑Unis. 2010a. Screening-level hazard characterization, fatty nitrogen derived (FND) amides category. [Disponible en anglais seulement].
[US EPA] Environmental Protection Agency des États‑Unis. 2010b. Screening-level hazard characterization, fatty nitrogen derived (FND) amines category. [Disponible en anglais seulement].
[US EPA] Environmental Protection Agency des États‑Unis. 2011. Exposure Factors Handbook. 2011 Edition. Washington (DC): Environmental Protection Agency des États‑Unis, National Centre for Environmental Assessment. [Disponible en anglais seulement].
[US EPA] Environmental Protection Agency des États‑Unis. 2015. EPA’s 2011 national-scale air toxics assessment. Washington (DC): US Environmental Protection Agency. [Consulté le 27 juin 2018]. [Disponible en anglais seulement].
van Gorsel H, Li C, Kerbel EL, Smits M, et AA Kader. 1992. Compositional characterization of prune juice. J Agric Food Chem. 40(5): 784–789. [Disponible en anglais seulement].
Wang Y, Ye D, Zhu B, Wu G, et C Duan. 2014. Rapid HPLC analysis of amino acids and biogenic amines in wines during fermentation and evaluation of matrix effect. Food Chem. 163:6-15. [Disponible en anglais seulement].
Wilson R, Jones-Otazo H, Petrovic S, Mitchell I, Bonvalot Y, Williams D, et GM Richardson. 2013. Revisiting dust and soil ingestion rates based on hand-to-mouth transfer. Hum Ecol Risk Assess. 19(1):158-188. [Disponible en anglais seulement].
Wormuth M, Scheringer M, Vollenweider M, et K Hungerbuhler. 2006. What are the sources of exposure to eight frequently used phthalic acid esters in Europeans? Risk Anal. 26(3): 803-824. [Disponible en anglais seulement].
Wu X, Bennett DH, Ritz B, Cassady DL, Lee K, et I Hertz-Picciotto. 2010. Usage pattern of personal care products in California households. Food Chem Toxicol 48: 3109-3119. [Disponible en anglais seulement].
Yang H, Xu J, Wu W, Wan CH, et JZ Yu. 2004. Chemical characterization of water-soluble organic aerosols at Jeju Island collected during ACE-Asia. Environ Chem. 1:13-17. [Disponible en anglais seulement].
Yang H, Yu JZ, Ho SSH, Xu J, Wu W, Wan CH, Wang X, Wang X, et L Wang. 2005. The chemical composition of inorganic and carbonaceous materials in PM2.5 in Nanjing, China. Atmos Environ. 39:3735-3749. [Disponible en anglais seulement].
Zeiger E, Anderson B, Haworth S, et T Lawlor. 1987. Mortelmans K, et W Speck. Salmonella mutagenicity tests: III. Results from the testing of 255 chemicals. Environ Mutagen. 9 Suppl 9:1-109. [Disponible en anglais seulement].
Zeisel, SH, et JK Blusztajn. 1994. Choline and human nutrition. Annu Rev Nutr. 14:269-296. [Disponible en anglais seulement].
Zeisel SH, et KA da Costa. 2009. Choline: An essential nutrient for public health. Nutr Rev. Nov; 67(11): 615–623. [Disponible en anglais seulement].
Zha X1, Jay FT, et PC Choy. 1992. Effects of amino acids and ethanolamine on choline uptake and phosphatidylcholine biosynthesis in baby hamster kidney-21 cells. Biochem Cell Biol. 70(12):1319-24. [Disponible en anglais seulement].
Zhang Q, et C Anastasio. 2003. Free and combined amino compounds in atmospheric fine particles (PM2.5) and fog waters from Northern California. Atmos Environ. 37:2247-2258. [Disponible en anglais seulement].
Annexes
Annexe A. Données d’extrapolation pour le LME, le CDE et le LDE
| - | CME | SME | OMIPA | LME |
|---|---|---|---|---|
| Rôle | Analogue | Analogue | Analogue | Cible |
| NE CAS | 68140-00-1 | 111-57-9 | 111-05-7 | 142-78-9 |
| Structure chimique | 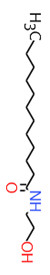 |
 |
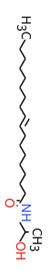 |
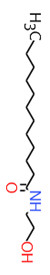 |
| Solubilité dans l’eau (mg/L) | 43,9a | 1b | 0,02-0,75c | 43,9d,prévu |
| Logoe | 3,24a,prévu | 5,55b,prévu | 6,39c,prévu | 3,24d,prévu |
| Pression de vapeur (mm Hg) | 1,37E -07a | 1,4E-09 b | 1,82E-08c | 6,57E -09d,prévu |
| Toxicité à doses répétées (orale) | DSENO = 750 mg/kg p.c./jour (4 semaines, rat, par gavage; aucun effet lié au traitement à la dose maximale d’essai) (CIR, 2015b) | ND | ND | ND |
| Toxicité à doses répétées (cutanée) | ND | DSENO = 2000 mg/kg p.c./jour (lapin, aucun effet sur la circulation générale) (CIR, 2015b) | ND | ND |
| Toxicité à doses répétées (inhalation) | ND | ND | ND | ND |
| Toxicité pour la reproduction et/ou le développement (orale) | ND | ND | DSENO = 1000 mg/kg p.c./jour (étude de toxicité à doses répétées combinée avec une étude préalable de la toxicité pour la reproduction et le développement, chez les rats, par gavage; aucun effet de toxicité générale, ou sur la reproduction ou le développement à la dose maximale d’essai) (ECHA, c2013-2017f) | ND |
| Toxicité génétique | ND | ND | Toxicité génétique in vitro négative (ECHA, c2013-2017f) | ND |
Abréviations : Koe, coefficient de partage octanol-eau; ND, non disponible.
a The Good Scents Company Information System (disponible en anglais seulment)
b ECHA, c2013-2018g
c ECHA, c2013-2017f
d ChemIDplus,1993-
| Nom chimique | ODE | LDE | CDE |
|---|---|---|---|
| Rôle | Analogue | Cible | Cible |
| NE CAS | 93-83-4 | 120-40-1 | 68603-42-9 |
| DEA, comme impureté | 0,19 % (NTP, 1999c) | 0,83 % (NTP, 1999b) | 18,2 % (NTP, 2001) |
| Structure chimique |  |
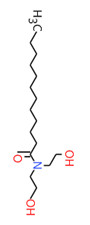 |
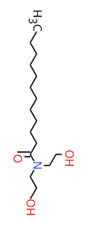 |
| Solubilité dans l’eau (mg/L) | 1a | 226b,prévu | 226c,prévu |
| Logoe | > 6a | 2,89b,prévu | 2,89c,prévu |
| Pression de vapeur (mm Hg) | 4,5E -07a | 6,70E-09b,prévu | 6,70E-09c,prévu |
| Métabolisation | ND | Chez les rats exposés à du LDE purifié, aucun LDE ou DEA inchangés, ni métabolite de la DEA n’ont été détectés, mais des produits intermédiaires formés après une hydroxylation en ω‑ et/ou en ω-1 à 4 ont été récupérés (Mathews et al., 1996) | ND |
| Toxicité à doses répétées (cutanée) | DMENO = 50 mg/kg p.c./jour (étude de toxicité cutanée de 13 semaines, à la dose d’essai la plus faible, menée chez les souris; effets sur les reins et le foie; NTP, 1999c) | DSENO = 50 mg/kg p.c./jour (étude de toxicité cutanée de 14 semaines, menée chez les rats, toxicité pour les reins; NTP, 1999b) | DSENO = 50 mg/kg p.c./jour (étude de toxicité cutanée de 14 semaines, menée chez les rats, toxicité pour les reins; NTP, 2001) |
| Toxicité pour la reproduction et/ou le développement (orale) | ND | ND | DSENO= 1000 mg/kg p.c./jour (aucune toxicité pour le développement à la dose maximale d’essai chez les rats) (Pitterman, 1994); % résidus de DEA non mentionné |
| Toxicité génétique | Négative (NTP, 1999c) | Négative (NTP, 1999b) | Négative (NTP, 2001) |
| Cancérogénicité | Négative (NTP, 1999c) | Positive (NTP, 1999b) | Positive (NTP, 2001) |
Abréviations : Koe, coefficient de partage octanol-eau; ND, non déterminé.
a ECHA, c2013-2018h
b ChemIDplus, 1993-;
c UVCB, propriétés fondées sur celles du LDE (C12) pris comme homologue typique, en mélange (ChemIDplus, 1993‑).
Annexe B. Concentrations dans les milieux environnementaux tels que l’air et le sol, les absorptions quotidiennes correspondantes chez les humains, ainsi que les paramètres utilisés pour l’estimation des concentrations dans l’eau potable
Les concentrations indiquées dans la documentation ont été utilisées pour déterminer les absorptions estimatives des substances dans l’air ambiant et le sol, s’il y a lieu. Sinon, les concentrations dans l’air ambiant et le sol ont été estimées pour les formes neutres ou non chargées à l’aide de la modélisation ChemCAN (2003). Pour la modélisation ChemCAN, la région des Plaines à forêts mixtes en Ontario a été choisie, car il s’agit de la région la plus industrialisée et la plus peuplée du Canada. Comme intrant pour le modèle ChemCAN, les demi-vies propres aux compartiments ont été établies à l’aide d’EPI Suite (EPI Suite, c2000-2017) et les taux de charge ont été déterminés par multiplication du pourcentage de partitionnement de la masse au niveau III du modèle de fugacité d’EPI Suite pour l’air, l’eau et le sol par la quantité (kg) sur le marché.
| - | MEA | DEEA | LME |
|---|---|---|---|
| Concentration dans l’air (µg/m3) | 3,74 x 10-4 a | 3,60 x 10-8 b | 1,21 x 10-7 b |
| Concentration dans le sol (µg/kg)c | 22,2 | 0,496 | 0,326 |
| Absorption découlant d’une exposition à l’air ambiant, chez les tout-petits âgés de 6 mois à 4 ans (mg/kg p.c./jour)d | 2,78 x 10-8 | 2,70 x 10-12 | 9,08 x 10-12 |
| Absorption découlant d’une exposition à l’air intérieur, chez les tout-petits âgés de 6 mois à 4 ans (mg/kg p.c./jour)d | 1,94 x 10-7 | 1,9 x 10-11 | 6,35 x 10-11 |
| Absorption découlant d’une exposition à du sol, chez les tout-petits âgés de 6 mois à 4 ans (mg/kg p.c./jour)d | 2,01 x 10-8 | 4,48 x 10-10 | 2,94 x 10-10 |
a Zhang et Anastasio, 2003. Fraction dissoute ou soluble en PM2,5. Transformée à partir des pmol/m3.
b Représente les concentrations à l’air libre avec dégradation dans les Plaines à forêts mixtes de l’Ontario – ChemCan, 2003, sauf si indiqué autrement.
c Représente les concentrations dans du sol brut avec dégradation dans les Plaines à forêts mixtes de l’Ontario –– ChemCan, 2003.
d Tout-petits, en supposant qu’ils pèsent 15,5 kg et respirent 9,3 m3 d’air par jour (Santé Canada, 1998), et qu’ils ingèrent 14 mg de sol par jour (Wilson et al., 2013).
| - | DEA | LDE | CDE | CADEA | TADEA |
|---|---|---|---|---|---|
| Concentration dans l’air (µg/m3)a | 4,38 x 10-11 | 2,39 x 10-8 | 6,81 x 10-6 | 5,45 x 10-8 | 3,48 x 10-6 |
| Concentration dans le sol (µg/kg)b | 4,45 | 0,213 | 61,3 | 0,316 | 32,8 |
| Absorption découlant d’une exposition à l’air ambiant, chez les tout‑petits âgés de 6 mois à 4 ans (mg/kg p.c./jour)c | 3,3 x 10-15 | 1,79 x 10-12 | 5,11 x 10-10 | 4,09 x 10-12 | 2,61 x 10-10 |
| Absorption découlant d’une exposition à l’air intérieur, chez les tout‑petits âgés de 6 mois à 4 ans (mg/kg p.c./jour)c | 2,3 x 10-14 | 1,25 x 10-11 | 3,58 x 10-9 | 2,86 x 10-11 | 1,83 x 10-9 |
| Absorption découlant d’une exposition à du sol, chez les tout‑petits âgés de 6 mois à 4 ans (mg/kg p.c./jour)c | 4,02 x 10-9 | 1,92 x 10-10 | 5,54 x 10-8 | 2,85 x 10-10 | 2,96 x 10-8 |
a Représente les concentrations dans l’air libre avec dégradation dans les Plaines à forêts mixtes de l’Ontario – ChemCan, 2003, sauf si indiqué autrement.
b Représente les concentrations dans le sol brut avec dégradation dans les Plaines à forêts mixtes de l’Ontario – ChemCan, 2003, sauf si indiqué autrement.
c Tout-petits, en supposant qu’ils pèsent 15,5 kg et respirent 9,3 m3 d’air par jour (Santé Canada, 1998), et qu’ils ingèrent 14 mg de sol par jour (Wilson et al., 2013).
| - | TEA | TIPA |
|---|---|---|
| Concentration dans l’air (µg/m3)a | 2,15 x 10-12 | 1,78 x 10-12 |
| Concentration dans le sol (µg/kg)b | 7,00 | 1,51 |
| Absorption découlant d’une exposition à l’air ambiant, chez les tout-petits âgés de 6 mois à 4 ans (mg/kg p.c./jour)c | 1,61 x 10-16 | 1,34 x 10-16 |
| Absorption découlant d’une exposition à l’air intérieur, chez les tout-petits âgés de 6 mois à 4 ans (mg/kg p.c./jour)c | 0,001 88 | 9,35 x 10-16 |
| Absorption découlant d’une exposition à du sol, chez les tout-petits âgés de 6 mois à 4 ans (mg/kg p.c./jour)c | 6,32 x 10-9 | 1,36 x 10-9 |
a Représente les concentrations dans l’air libre avec dégradation dans les Plaines à forêts mixtes de l’Ontario –
b Représente les concentrations dans le sol brut avec dégradation dans les Plaines à forêts mixtes de l’Ontario – ChemCan, 2003, sauf si indiqué autrement.
c Tout-petits, en supposant qu’ils pèsent 15,5 kg et respirent 9,3 m3 d’air par jour (Santé Canada, 1998), et qu’ils ingèrent 14 mg de sol par jour (Wilson et al., 2013).
Étant donné l’absence de données de surveillance de l’eau de surface ou de l’eau potable pour détecter la présence de DEEA, de LME, de DEA, de LDE, de CDE, de CADEA, de TADEA, de TEA et de TIPA, et le profil d’emploi des consommateurs pour ces substances, un scénario de rejet à l’égout a été utilisé pour estimer les concentrations dans l’eau potable. La feuille de calcul sur l’eau potable de l’UEE a été employée pour déterminer la concentration des substances dans l’eau de surface pour l’ingestion potentielle par l’eau potable (Santé Canada, 2015a) à l’aide des paramètres présentés dans le tableau B‑4.
| Paramètres | DEEA | LME | DEA | LDE | CDE | CADEA | TADEA | TEA | TIPA |
|---|---|---|---|---|---|---|---|---|---|
| Utilisation totale annuelle (kg) | 347147 | 100000 | 4331373 | 69543 | 20000000 | 100000 | 11000000 | 4695027 | 1000000 |
| Élimina-tion estimative(%) | 88a | 3a | 94b | 88a | 88a | 88a | 92a | 91c | 68a |
a Estimé à l’aide de SimpleTreat 4.0.8 (2015)
b OCDE, 2007b (essai de simulation 303A de l’OCDE)
c OCDE, 1995 (essai de simulation 303A de l’OCDE)
Annexe C. Exposition estimative au MEA dans la nourriture
Aucune donnée canadienne sur la présence du MEA dans les aliments n’a été trouvée. Les données sur sa présence dans les aliments dans la documentation scientifique, lorsqu’elles étaient appropriées et utiles à la population canadienne, ont donc été utilisées dans la présente évaluation. La moyenne arithmétique la plus élevée de la concentration de MEA relevée dans la documentation scientifique ou la concentration moyenne calculée à l’aide de différents points de données pour un type d’aliment donné a été appliquée de façon prudente pour représenter la concentration du MEA dans une catégorie entière d’aliments ou de boissons (tableau C-1). Les concentrations moyennes de MEA utilisées dans la présente évaluation ont varié de 1,2 ppm dans le miel à 40,3 ppm dans le jus d’orange (tableau C-1).
| Catégorie d’aliments visée par l’évaluation de l’exposition par voie alimentaire | Concentration de MEA appliquée (ppm) | Aliments sur lesquels la concentration de MEA a été appliquée | Référence |
|---|---|---|---|
| Fromage | 13,0 | Fromages à pâte dure | Mayer et al., 2010 |
| Yogourt | 4,86 | Yogourt, nature, 3,5 % matières grasses | Mayr et Schieberle, 2012 |
| Chocolat | 7,22 | Chocolat, 75 % de cacao | Mayr et Schieberle, 2012 |
| Fruits – tous les types (tous) | 1,56 | Moût de raisin non fermenté | Wang et al., 2014 |
| Miel | 1,2 | Miel de rhododendron | Kelly et al., 2010 |
| Jus - agrumes | 40,3* | Jus d’orange Navel | Cerrillo et al., 2015 |
| Jus - pruneaux | 3,4 | Jus de pruneaux | van Gorsel et al., 1992 |
| Jus - autres | 2,45 | Nectar d’abricot | Preti et al., 2015 |
| Viandes et volaille – conservées dans le sel | 13,4 | Salami italien | Mayr et Schieberle, 2012 |
| Viandes et volaille – régulières | 8 | Porc (jambon), cuit | Lakritz et al., 1975 |
| Poisson – tous les types | 6,54 | Thon, en conserve | Mayr et Schieberle, 2012 |
| Légumes – fermentés | 13,01 | Choucroute | Mayr et Schieberle, 2012 |
| Vin - rouge, y compris le rosé et les vins panachés | 38,07 | Vin rouge italien | Galgano et al., 2011 |
| Vin - blanc | 9,9 | Vin blanc italien | Manetta et al., 2016 |
| Bière | 8,4 | Bière belge foncée | Redruello et al., 2017 |
*Unités transformées des mg/L en µg/g (ppm) à l’aide de la densité du jus d’orange (1 048 g/mL).
Les données sur la consommation alimentaire provenant de la plus récente édition de l’Enquête sur la santé dans les collectivités canadiennes (ESCC) (Statistique Canada, 2015) ont été utilisées. Santé Canada a estimé l’exposition au MEA par voie alimentaire découlant de sa présence naturelle dans des aliments en multipliant la moyenne arithmétique de la concentration du MEA supposée pour chaque catégorie d’aliments par la quantité de cet aliment qui serait consommée par répondant dans l’enquête. Cette estimation a permis d’obtenir l’entière distribution des valeurs estimatives de l’exposition au MEA pour divers groupes d’âge. Puisque bon nombre des aliments contenant du MEA sont considérés comme faisant régulièrement partie du régime alimentaire des Canadiens, les valeurs estimatives moyennes et au 90e centile ont été calculées (tableau C-2). Ces valeurs estimatives sont considérées comme prudentes.
| Groupe d’âge* (ans) | Moyenne | 90e centile |
|---|---|---|
| 1-3 | 0,20 | 0,47 |
| 4-8 | 0,18 | 0,47 |
| 9-13 | 0,10 | 0,25 |
| 14-18 | 0,08 | 0,22 |
| 19-30 | 0,08 | 0,20 |
| 31-50 | 0,07 | 0,18 |
| 51-70 | 0,07 | 0,19 |
| 71 et + | 0,07 | 0,17 |
*Garçons/hommes et filles/femmes confondus
Annexe D. Paramètres utilisés pour estimer l’exposition humaine découlant de l’utilisation de produits disponibles aux consommateurs
Hypothèses pour les scénarios sentinelles d’exposition
Les scénarios d’exposition sentinelles ont été utilisés pour l’estimation de l’exposition potentielle aux substances du groupe des aminoalcools et des alcanolamides gras. Les hypothèses des scénarios sont résumées dans le tableau D-1. Les expositions ont été estimées à l’aide de la version ConsExpo Web ou des algorithmes du modèle (ConsExpo Web, 2016). Les expositions ont été estimées pour un poids corporel par défaut de 70,9, 59,4, 31, 15,5 et 7,5 kg, pour les adultes (20 ans et plus), les adolescents (12 à 19 ans), les enfants (5 à 11 ans), les tout-petits (6 mois à 4 ans) et les nourrissons (0 à 6 mois), respectivement (Santé Canada, 1998). Pour les expositions potentielles estimatives par voie cutanée, l’absorption cutanée était de 0,9 % pour la DEA et de 0,43 % pour le TEA. Sinon, les risques ont été déterminés d’après les expositions par voie cutanée. À moins d’indication contraire, les valeurs par défaut proviennent de la fiche d’information de ConsExpo valable pour le scénario présenté.
| Scénario d’exposition | Hypothèses |
|---|---|
| Colorant capillaire permanent (adultes de 20 ans et plus) | Concentration du MEA (30 %), du CDE (10 %) (Communication personnelle, courriels de la DSPCPD de Santé Canada adressés au BERSE de Santé Canada, s’échelonnant de juillet 2015 à juin 2018; sans référence) Contact cutané direct avec le produit – application instantanée |
Nettoyant tout usage en aérosols – pulvérisation (adultes de 20 ans et plus) | Concentration de MEA (1 %), de CDE (2 %), de TEA (10 %) (MSDS, 2008a, 2013h, 2015m) Fréquence d’utilisation : 365/an Inhalation, exposition aux aérosols Durée de la pulvérisation : 0,23 minute Contact cutané direct avec le produit – application instantanée |
Nettoyant pour le four – pulvérisateur à gâchette (adultes de 20 ans et plus) | Concentration de MEA : 2,4 % (MSDS, 2017c) Fréquence d’utilisation : 5/an Inhalation, exposition aux aérosols – rejet instantané Durée de l’exposition : 0,25 minute Contact cutané direct avec le produit – application instantannée |
Encaustique/cire pour planchers (adultes de 20 ans et plus) | Concentration de DEEA : 10 % (MSDS, 2014b) Fréquence d’utilisation : 52/an Inhalation, exposition aux émanations – évaporation Volume de la pièce : 58 m3 Contact cutané direct avec le produit – application instantanée |
Savon liquide pour le corps (nourrissons de 0 à 6 mois, tout‑petits de 6 mois à 4 ans, enfants de 5 à 11 ans, adolescents de 12 à 19 ans, adultes de 20 ans et plus) | Concentration de LME (3 %; nourrissons et adultes), LDE (10 %; adultes uniquement), CDE (10 %), CADEA (5 %; enfants et adultes), TEA (30 %) (MSDS, 2007f; communication personnelle, courriels de la DSPCPD de Santé Canada adressés au BERSE de Santé Canada, s’échelonnant de juillet 2015 à juin 2018; sans référence) Contact cutané direct avec le produit – application instantanée Fréquence : 0,85 application/jour (nourrissons et tout‑petits, Ficheux et al., 2015), 0,93 application/jour (enfants; Ficheux et al., 2015), 1,0 application/jour (adolescents, Ficheux et al., 2015), 1,4 application/jour (adultes; Loretz et al., 2006) |
Savon à vaisselle, lavage manuel (adultes 20 ans et plus) | Concentration de DEA : 5 % (MSDS, 2014c) Contact cutané direct avec le produit pendant le lavage manuel – application instantanée |
Peinture à l’eau pour les murs – à partir de colorant dilué dans une base (adultes de 20 ans et plus) | Concentration de la DEA (dans un concentré de colorant) : 1 % (MSDS, 2015h) Fréquence d’utilisation : 2/an Contact cutané direct avec le produit (de peinture mélangée) |
Fard à paupières (enfants de 5 à 11 ans, adolescents de 12 à 19 ans, adultes de 20 ans et plus) | Concentration de TEA : 10 % (communication personnelle, courriels de la DSPCPD de Santé Canada adressés au BERSE de Santé Canada, s’échelonnant de juillet 2015 à juin 2018; sans référence) Contact cutané direct avec le produit – application instantanée |
Masque de beauté/masque antirides (adultes de 20 ans et plus) | CDE (10 %), Communication personnelle, courriels de la DSPCPD de Santé Canada adressés au BERSE de Santé Canada, s’échelonnant de juillet 2015 à juin 2018; sans référence) Contact cutané direct avec le produit – application instantanée |
Nettoyant facial (Enfants de 5 à 11 ans, adolescents de 12 à 19 ans, adultes de 20 ans et plus) | CDE (30 %), communication personnelle, courriels de la DSPCPD de Santé Canada adressés au BERSE de Santé Canada, s’échelonnant de juillet 2015 à juin 2018; sans référence) Contact cutané direct avec le produit – application instantanée |
Fixatif pour les cheveux – en aérosols (adultes 20 ans et plus) | Concentration de LDE (1 %), de TEA (3 %) (communication personnelle, courriels de la DSPCPD de Santé Canada adressés au BERSE de Santé Canada, s’échelonnant de juillet 2015 à juin 2018; sans référence) Fréquence (Loretz et al., 2006) : 1,49 application/jour Modèle d’exposition orale aux aérosols non respirables et exposition par inhalation aux aérosols – pulvérisation vers une personne Volume de la pièce : 10 m3 |
Shampoing (tout-petits de 6 mois à 4 ans, enfants de 5 à 11 ans, adolescents de 12 à 19 ans, adultes de 20 ans et plus) | Concentration de CDE (30 %), de CADEA (5 %), de TEA (10 %) (communication personnelle, courriels de la DSPCPD de Santé Canada adressés au BERSE de Santé Canada, s’échelonnant de juillet 2015 à juin 2018, sans référence; MSDS, 2008g) Contact cutané direct avec le produit – application instantanée |
Revitalisant capillaire – sans rinçage (tout‑petits de 6 mois à 4 ans, enfants de 5 à 11 ans, adolescents de 12 à 19 ans, adultes de 20 ans et plus) | Concentration de TEA : 3 % (communication personnelle, courriels de la DSPCPD de Santé Canada adressés au BERSE de Santé Canada, s’échelonnant de juillet 2015 à juin 2018; sans référence) Contact cutané direct avec le produit – application instantanée |
Liquide à transmission automatique à changer soi‑même (adultes 20 ans et plus) | Concentration de TADEA : 25 % (= 0,25 fraction du poids) (MSDS, 2015i). Fondé sur le changement d’huile à moteur Exposition cutanée pendant que vous remplacez le liquide à transmission d’un véhicule personnel Superficie du bout des doigts : 6 cm2 (RIVM, 2006b) Volume de produit resté sur une main : Quantité de produit en contact avec la peau Absorption cutanée (aiguë) à court terme |
Lingettes humides – nettoyant tout usage, application (adultes 20 ans et plus) | Concentration de la DEA : 1 % (MSDS, 2014d). Fréquence d’utilisation : 88/an Inhalation, exposition aux émanations – évaporation Durée de l’exposition : 240 minutes |
Dentifrice – non fluoré (tout-petits de 6 mois à 4 ans et adultes de 20 ans et plus) et blanchiment (adultes de 20 ans et plus uniquement) | Concentration de TEA : 3 % dans le dentifrice non fluoré, 10 % dans le dentifrice blanchissant (communication personnelle, courriels de la DSPCPD de Santé Canada adressés au BERSE de Santé Canada, s’échelonnant de juillet 2015 à juin 2018; sans référence) Voie orale – exposition directe (ingestion) |
Crème et lotion hydratantes pour le corps (nourrissons de 0 à 6 mois, tout‑petits de 6 mois à 4 ans, enfants de 5 à 11 ans, adolescents de 12 à 19 ans, adultes de 20 ans et plus) | Concentration de TEA : 30 % (communication personnelle, courriels de la DSPCPD de Santé Canada adressés au BERSE de Santé Canada, s’échelonnant de juillet 2015 à juin 2018; sans référence) Contact cutané direct avec le produit – application instantanée |
Hydratant pour le visage (lotion) (adolescents de 12 à 19 ans, adultes de 20 ans et plus) | Concentration de TEA : 30 % (communication personnelle, courriels de la DSPCPD de Santé Canada adressés au BERSE de Santé Canada, s’échelonnant de juillet 2015 à juin 2018; sans référence) Contact cutané direct avec le produit – application instantanée |
Écran solaire (tout-petits de 6 mois à 4 ans, adultes de 20 ans et plus) | Concentration de TEA : 10 % (MSDS, 2010b) Contact cutané direct avec le produit – application instantanée |
Produits coiffants (gel/cire/pâte) (enfants de 5 à 11 ans, adolescents de 12 à 19 ans et adultes de 20 ans et plus) | Concentration de TEA (10 %) et de TIPA (3 %) (communication personnelle, courriels de la DSPCPD de Santé Canada adressés au BERSE de Santé Canada, s’échelonnant de juillet 2015 à juin 2018; sans référence). Contact cutané direct avec le produit – application instantanée |
Nettoyant pour BBQ en aérosols, application (pulvérisation) | Concentration de TIPA : 5 % (MSDS, 2013k) Utilisation du scénario ConsExpo 4.1 de nettoyant pour le four en aérosols (RIVM, 2018) Fréquence d’utilisation : 5/an Contact cutané direct avec le produit – application instantanée Surface exposée : 225 cm2 |
Nettoyant tout usage en aérosols, application (pulvérisation) | Concentration de TEA : 10 % (MSDS, 2015m) Fréquence d’utilisation : 365/an Inhalation - exposition aux aérosols Volume de la pièce : 15 m3 |
Hypothèses et calculs concernant la dose quotidienne moyenne à vie (DQMV) et de la concentration quotidienne moyenne à vie dans l’air (CQMVA)
Pour estimer le risque de cancer associé à une exposition à la DEA et au TEA, les doses quotidiennes moyennes à vie (DQMV) et les concentrations quotidiennes moyennes à vie dans l’air (CQMVA) découlant de l’utilisation de certains produits ont été calculées comme suit.
DQMV = [Somme de (taux d’exposition quotidienne (mg/kg p.c./jour)groupe d’âge × durée de l’exposition (années)groupe d’âge)] / durée de la vie (= 70 ans)
CQMVA = [Somme de (concentration quotidienne dans l’air moyennée par année (mg/m3/jour)groupe d’âge × durée de l’exposition (années)groupe d’âge)] / durée de la vie (= 70 ans)
| Groupe d’âge | Nourrisson (0 à 6 mois) | Tout-petit (6 mois à 4 ans) | Enfant (5 à 11 ans) | Adolescent (12 à 19 ans) | Adulte 20 ans et + (20 à 70 ans) |
|---|---|---|---|---|---|
| Durée de l’exposition (ans) | 0,5 | 4,5 | 7 | 8 | 51 |
Annexe E. Valeurs estimatives d’absorption cutanée de la DEA (excluant les résidus fixés sur la peau) pour calcul des concentrations internes associées à un effet critique systémique
| Concentration associée à un effet critiquea | Valeur d’absorption cutanée (48 heures, excluant les résidus fixés sur la peau)b | Valeur estimative de l’absorption cutanée (24 heures) | Concentrations externes associées à un effet critique (mg/kg p.c./jour, continu) | Concentrations internes associées à un effet critique(mg/kg p.c./jour) |
|---|---|---|---|---|
| DMENO = 32 mg/kg p.c./jour, dans une étude de toxicité cutanée à doses répétées de 13 semaines menée chez des rats auxquels on a appliqué de la DEA dans de l’éthanol 95 % sur la peau | 12 % chez les rats auxquels on a administré 23 mg/kg p.c. de DEA dans de l’éthanol 95 % par application cutanée | 6 % | 22,9 | 1,4 |
| DMENO = 125 mg/kg p.c./jour, dans une étude de toxicité cutanée à doses répétées de 2 semaines chez des rats auxquels on a appliqué de la DEA dans de l’éthanol 95 % sur la peau | Environ 57 % [y = 0,460 x + 4,14 (établie par Kirman et al., 2016)], où la dose (x) = 125 mg/kg p.c., l’absorption cutanée totale (y) = 62 %. Pour tenir compte des résidus maximums fixés sur la peau de 5 % (Mathews et al. 1977), l’absorption cutanée, excluant les résidus fixés sur la peau, a été estimée à 57 % (62 % - 5 %)] | 29 % | 125 | 36,3 |
| BMDL10 = 1,46 mg/kg p.c./jour, établie d’après une étude de cancérogénicité de 2 ans menée chez des souris exposées à la DEA dans de l’éthanol 95 %, par application cutanée | 23 % chez les souris exposées à 8 mg/kg p.c. de DEA dans de l’éthanol 95 % par application cutanée | 12 % | 1,04 | 0,12 |
a NTP, 1992, 1999a
b Mathews et al., 1997
| Produit (% DEA) | Absorption cutanée (%) à 24 heures |
|---|---|
| Shampoing (0,092 ou 0,28 % de DEA) | 0,08 |
| Colorants capillaires (0,61 % de DEA) | 0,09 |
| Lotions pour le corps (0,02 % de DEA) | 0,90 |
aLes shampoings, colorants capillaires et lotions pour le corps sont demeurés sur la peau pendant 5 minutes, 30 minutes et 24 heures, respectivement (Kraeling et al., 2004).
| Rats – dose appliquée sur la peau (mg/kg p.c.) | Rats - absorption cutanée (%, excluant les résidus fixés sur la peau) à 48 heures | Souris – dose appliquée sur la peau (mg/kg p.c.) | Souris - absorption cutanée (%) à 48 heures |
|---|---|---|---|
| 2,1 | 2 | 8 | 23 |
| 7,6 | 6 | 23 | 31 |
| 27,6 | 12 | 81 | 56 |
a Mathews et al,, 1997
Estimation des concentrations cutanées internes associées à un effet critique systémitque : On a déterminé les doses internes pour les concentrations associées à un effet critique (tableau E-1) pour dégager les différences d’absorption cutanée entre les humains (tableau E-2) et les rongeurs (tableau E-3). Il a été constaté que les valeurs d’absorption cutanée augmentaient avec les doses administrées chez les souris, comme suit : 2 % (2,1 mg/kg p.c.), 6 % (7,6 mg/kg p.c.) et 12 % (27,5 mg/kg p.c.) en 48 heures. Par conséquent, chaque concentration associée à un effet critique a été comparée à la dose appliquée la plus proche dans l’étude de Mathews et al. (1997), pour déterminer la valeur d’absorption cutanée la plus appropriée.
La DMENO quotidienne par voie cutanée de 32 mg/kg p.c./jour a été trouvée dans une étude de toxicité cutanée de 3 mois menée chez des rats présentant des effets sur les paramètres hématologiques (anémie) et une toxicité rénale (augmentation du poids des reins). Lorsque la concentration associée à un effet critique de 32 mg/kg a été plus proche de la dose de 27,5 mg/kg p.c., l’absorption cutanée de 12 % a été retenue pour cette dose particulière en 48 heures. La quantité de DEA absorbée en 24 heures représente plus de la moitié de la quantité absorbée en 48 heures (Kraeling et al., 2004). L’absorption cutanée en 24 heures a été estimée de façon prudente à 6 %, représentant la moitié de l’absorption cutanée (12 %) à 48 heures. Par conséquent, la concentration interne associée à un effet critique est équivalente à 1,4 mg/kg p.c./jour lorsque transformée en un scénario d’exposition continue et appliquée à une absorption cutanée en 24 heures.
Pour le scénario d’exposition par voie cutanée par utilisation, la DMENO issue de la concentration associée à un effet critique à 125 mg/kg p.c./jour a été établie d’après une augmentation du poids absolu et du poids relatif des reins dans une étude de 2 semaines menée chez le rat. Puisque l’absorption cutanée à la dose de 125 mg/kg p.c. se trouvait à l’extérieur de la fourchette des doses d’essai dans l’étude de Mathews et al. (1997), la valeur d’absorption cutanée de 62 % a été estimée comme l’absoprtion cutanée globale en 48 heures d’après une régression linéaire des valeurs d’absorption comme une fonction de la dose (Kirman et al. 2016). L’absorption cutanée, excluant les résidus fixés sur la peau, a été estimée à 57% pour tenir compte des 5% maximum de résidus fixés sur la peau (Mathews et al. 1977). L’absorption cutanée de 29 % en 24 heures chez les rats a été considérée de façon prudente comme la moitié de la valeur (57 %) en 48 heures. Par conséquent, le point de départ interne de 36,3 mg/kg p.c./jour (= 125 mg/kg p.c./jour × 29 %) a été estimé.
La BMDL10 des résidus de DEA appliqués pour l’induction de la formation de tumeurs hépatiques a été établie à 1,46 mg/kg p.c./jour (à raison de 5 jours par semaine), ce qui équivaut à une dose journalière moyenne de 1,04 mg/kg p.c./jour (= 1,46 mg/kg p.c./jour × 5/7 jours). Selon les données obtenues, l’absorption cutanée serait de 23 % chez les souris auxquelles de la DEA a été administrée à raison de 8 mg/kg p.c./jour (la dose la plus proche de la BMDL) après une exposition de 48 heures (Mathews et al., 1997) avec la même espèce animale (souris) et le même véhicule (éthanol 95 %) qui ont été utilisés dans les études de cancérogénicité par voie cutanée du NTP (NTP, 1999abc, 2001). L’absorption de la DEA chez la souris après une exposition cutanée de 24 h a été considérée comme étant la moitié de l’absorption en 48 heures (23 % × 0,5 = 12,4 %). Cette absorption cutanée de 12 % a été utilisée pour obtenir la BMDL10 interne par extrapolation de la BMDL10 externe de 1,04 mg/kg p.c./jour, la BMDL10 interne résultante étant de 0,12 mg/kg p.c./jour (1,04 × 12 %). La BMDL10 pour la dose externe par voie orale a été considérée comme équivalant à la BMDL10 interne de 0,12 mg/kg p.c./jour suivant l’hypothèse d’une absorption par voie orale de 100 % chez les animaux selon une extrapolation de voie à voie.
Annexe F. Modélisation de la dose repère (BMD)
| Substance | Teneur en résidus de DEA | Substance test administrée [Dose quotidienne (mg/kg p.c./jour)] | DEA administré [Dose quotidienne (mg/kg p.c./jour)] | Tumeurs hépatiquesb | Référence |
|---|---|---|---|---|---|
| DEA | 100 % | 0 40 80 160 | 0 40 80 c 160 c | 72/100 97/100 100/100 99/100 | NTP, 1999a |
| CDE | 18,20 % | 0 100 200 | 0 18,2 36,4 | 62/100 85/100 97/100 | NTP, 2001 |
| LDE | 0,83 % | 0 100 200 | 0 0,83 1,7 | 58/100 74/99 73/100 | NTP, 1999b |
| ODE | 0,19 % | 0 15 39 | 0 0,029 0,074 | 62/99 71/100 70/100 | NTP, 1999c |
a Adapté de Kirman et al., 2016 (colonnes concernant les tumeurs hépatiques).
b Nombre d’animaux présentant des tumeurs hépatiques (y compris des adénomes hépatocellulaires, des carcinomes et des hépatoblastomes) dans le nombre total d’animaux observés (les données chez les souris mâles et femelles ont été combinées, car aucune différence importante n’a été observée entre les sexes).
c Ces groupes n’ont pas été utilisés pour établir la dose repère (BMD), car tous les animaux ont présenté des effets et le taux d’incidence des tumeurs hépatiques a atteint 100 %.

Description longue
La BMD10 et la BMDL10 (limite de confiance inférieure à 95 % de la dose repère) pour l’augmentation de l’incidence des tumeurs au foie chez la souris ont été établies à 1,84 et à 1,46 mg/kg p.c./jour, respectivement, à l’aide du modèle de cancérogénicité multistade BMDS 2.5 (US EPA). La BMD10 de 1,84 mg/kg p.c./jour et la BMDL10 de 1,46 mg/kg p.c./jour ont été obtenues à l’aide des études dans lesquelles des animaux ont été exposés à raison de 5 jours par semaine. La BMDL10 pour une exposition continue (7 jours par semaine) serait 1,04 mg/kg p.c./jour [1,46 mg/kg p.c. × (5/7)].

Description longue
Les doses de TEA appliquées sur la peau de souris ont été tracées en fonction de l’incidence des tumeurs hépatocellulaires (adénomes et carcinomes) en utilisant un modèle de cancérogénicité multistade, le programme BMDS 2.5 (US EPA). La BMD10 et la BMDL10 ont été établies à 60 et à 42 mg/kg p.c./jour, respectivement, et ont été calculées à l’aide des données d’une étude dans laquelle des animaux ont été exposés 5 jours par semaine. La BMDL10 à 42 mg/kg p.c./jour, pour une exposition continue (7 jours par semaine) serait de 30 mg/kg p.c./jour [42 mg/kg p.c. × (5/7)].
