Ébauche d’évaluation préalable - Groupe des décènes
Titre officiel : Ébauche d’évaluation préalable - Groupe des décènes
Numéros de registre du Chemical Abstracts Service
68649-11-6
68649-12-7
Environnement et Changement climatique Canada
Santé Canada
Janvier 2021
Sommaire
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE], le ministre de l’Environnement et le ministre de la Santé ont réalisé une évaluation préalable de deux substances qui, collectivement, sont appelées substances du groupe des décènesNote de bas de page 1 . Les substances de ce groupe ont été désignées prioritaires pour une évaluation, car elles satisfont aux critères de catégorisation énoncés au paragraphe 73(1) de la LCPE. Leur numéro d’enregistrement du Chemical Abstracts Service (NE CASNote de bas de page 2 ), leur nom sur la Liste intérieure des substances (LI) et leurs noms communs sont présentés dans le tableau ci-dessous.
| NE CAS | Nom sur la LI | Nom commun ou abréviation |
|---|---|---|
| 68649-11-6a | Dimère du déc-1-ène hydrogéné | Di(déc-1-ène) hydrogéné |
| 68649-12-7a | Tétramère du déc-1-ène, mélangé avec le trimère du déc-1-ène hydrogéné | Poly(déc-1-ène) hydrogéné |
a Les substances de ces nos CAS sont des UVCB (substances de composition inconnue ou variable, produits de réaction complexes ou matières biologiques).
D’après les renseignements présentés en réponse à une enquête réalisée en vertu de l’article 71 de la LCPE, les quantités importées de di(déc-1-ène) hydrogéné et de poly(déc-1-ène) hydrogéné au Canada en 2011 variaient de 10 000 à 100 000 kg et étaient de 203 742 kg, respectivement. Dans la même année, aucune fabrication canadienne de di(déc-1-ène) hydrogéné n’a été déclarée en quantités supérieures au seuil de déclaration de 100 kg, tandis que le poly(déc-1-ène) hydrogéné a été déclaré fabriqué en quantités variant de 1 000 à 10 000 kg. Le di(déc-1-ène) hydrogéné est utilisé dans des lubrifiants, des graisses et des produits autoadministrés, ainsi que dans des applications minières. Le poly(déc-1-ène) hydrogéné est utilisé dans les lubrifiants, les graisses pour l’entretien des automobiles, ainsi que dans les secteurs de l’automobile, de l’aviation et des transports.
Les risques associés aux substances du groupe des décènes pour l’environnement ont été caractérisés à l’aide de la classification du risque écologique des substances organiques (CRE). Cette approche, fondée sur les risques, tient compte de plusieurs paramètres liés au danger et à l’exposition et est basée sur une pondération des éléments de preuve pour obtenir un classement du risque. Les profils de danger reposent principalement sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne établis à partir du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Parmi les paramètres pris en compte pour établir les profils d’exposition, il y a la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. La méthode fait appel à une matrice des risques pour attribuer à ces substances un degré de préoccupation potentielle faible, modéré ou élevé, en fonction de leurs profils de danger et d’exposition. Selon les résultats de l’analyse de la CRE, il est peu probable les substances du groupe des décènes puissent nuire à l’environnement.
Compte tenu de tous les éléments de preuve contenus dans la présente ébauche d’évaluation préalable, le di(déc-1-ène) hydrogéné et le poly(déc-1-ène) hydrogéné présentent un risque faible de causer des effets nocifs pour l’environnement. Il est proposé de conclure que le di(déc-1-ène) hydrogéné et poly(déc-1-ène) hydrogéné ne satisfont pas aux critères énoncés aux alinéas 64a) et b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique ou à mettre en danger l’environnement essentiel pour la vie.
En ce qui concerne l’évaluation des effets de ces substances sur la santé humaine, aucun effet critique sur la santé n’a été trouvé avec le di(déc-1-ène) hydrogéné et le poly(déc-1-ène) hydrogéné par les voies d’exposition orales et cutanées. Ce résultat a été fondé sur les données sur les effets sur la santé de ces substances ainsi que sur leurs analogues. Par conséquent, l’exposition par voie orale à ces substances du groupe des décènes découlant de la possible libération dans l’eau de surface et de l’exposition aux rouges à lèvres n’est pas préoccupante. De plus, l’exposition par voie cutanée de produits pour l’automobile et de produits autoadministrés contenant ces substances n’est pas préoccupante. En ce qui a trait à l’exposition par inhalation, l’effet critique sur la santé est les effets histopathologiques observés dans les cavités nasales et les poumons des rats exposés au di(déc-1-ène) hydrogéné en aérosols. Le di(déc-1‑ène) hydrogéné et du poly(déc-1-ène) hydrogéné ont été trouvés dans des produits d’entretien des armes à feu en pulvérisateur (c.-à-d., nettoyants, lubrifiants, agents de préservation [NLP]). Les marges d’exposition entre les concentrations du di(déc-1-ène) hydrogéné et du poly(déc-1-ène) hydrogéné après l’utilisation de produits NLP par pulvérisateur pour l’entretien des armes à feu et les concentrations provoquant des effets critiques dans des études en laboratoires sont considérées comme potentiellement insuffisantes pour tenir compte des incertitudes dans les effets sur la santé et les bases de données sur l’exposition.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que le di(déc-1-ène) hydrogéné et le poly(déc-1‑ène) hydrogéné satisfont aux critères énoncés à l’alinéa 64c) de la LCPE, car ils pénètrent dans l’environnement en une quantité ou une concentration, ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est proposé de conclure que le di(déc-1-ène) hydrogéné et le poly(déc-1-ène) hydrogéné répondent à un ou plusieurs des critères de l’article 64 de la LCPE.
Il est également proposé de conclure que le poly(déc-1-ène) hydrogéné satisfait aux critères de persistance, mais non à ceux de bioaccumulation, et que le di(déc-1-ène) hydrogéné ne satisfait pas aux critères de persistance et de bioaccumulation, énoncés dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
1. Introduction
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE] (Canada 1999), le ministre de l’Environnement et le ministre de la Santé ont réalisé l’évaluation préalable de deux substances appelées collectivement substances du groupe des décènes pour déterminer si ces substances présentent ou peuvent présenter un risque pour l’environnement ou la santé humaine. Les substances de ce groupe ont été désignées prioritaires pour une évaluation, car elles satisfont aux critères de catégorisation énoncés au paragraphe 73(1) de la LCPE (ECCC, SC [modifié 2017]).
Les risques pour l’environnement associés aux substances du groupe des décènes ont été caractérisés à l’aide de l’Approche de classification du risque écologique des substances organiques (CRE) (ECCC 2016a). La CRE décrit le danger d’une substance à l’aide de paramètres clés comme le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité et l’activité biologique et chimique, et tient compte de l’exposition possible des organismes dans les milieux aquatiques et terrestres en fonction de facteurs tels que le taux d’émissions potentielles, la persistance globale et le potentiel de transport à grande distance dans l’atmosphère. On combine les différents éléments de preuve pour déterminer quelles substances nécessitent une évaluation approfondie de leur potentiel de causer des effets nocifs pour l’environnement ou présentent une probabilité faible de causer de tels effets.
La présente ébauche d’évaluation préalable comprend l’examen des données sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et les expositions, y compris d’autres renseignements présentés par les intervenants. Les données pertinentes ont été colligées jusqu’en juin 2019. Les données empiriques provenant d’études clés ainsi que les résultats de la modélisation ont été utilisés pour arriver aux conclusions proposées. Lorsqu’ils étaient pertinents, les renseignements contenus dans les évaluations effectuées par d’autres instances ont été pris en compte.
La présente ébauche d’évaluation préalable a été préparée par le personnel du Programme d’évaluation des risques encadré par la LCPE à Santé Canada et à Environnement et Changement climatique Canada et comprend des observations provenant du personnel d’autres programmes régis par ces ministères. Les parties de la présente ébauche d’évaluation préalable portant sur la santé humaine ont fait l’objet d’un examen et d’une consultation externes. Les commentaires sur les parties techniques contenues dans ce volet ont été formulés par Theresa Lopez, Jennifer Flippin et Joan Garey de Tetra Tech, Owings Mills, Maryland, États‑Unis. La partie de l’évaluation portant sur l’environnement repose sur le document de CRE (publié le 30 juillet 2016), lequel a fait l’objet d’un examen externe et d’une consultation publique de 60 jours. Bien que les commentaires de l’extérieur aient été pris en compte, le contenu définitif et les résultats de la présente ébauche d’évaluation préalable demeurent la responsabilité de Santé Canada et d’Environnement et Changement climatique Canada.
La présente ébauche d’évaluation préalable repose sur des renseignements critiques permettant de déterminer si les substances satisfont aux critères énoncés à l’article 64 de la LCPE. À cette fin, des données scientifiques ont été examinées, et une approche du poids de la preuve et le principe de prudence ont été adoptésNote de bas de page 3 . La présente ébauche d’évaluation préalable expose les renseignements essentiels et les facteurs sur lesquels repose la conclusion proposée.
2. Identité des substances
Le groupe des décènes est constitué de deux poly(alphaoléfines) (PAO) qui sont toutes deux des UVCB (substances de composition inconnue ou variable, produits de réaction complexes ou matières biologiques). Les PAO sont produites par des réactions cartalytiques de polymérisation avec le décène et sont formées de longues chaînes d’hydrocarbures à longues chaînes ramifiées (C20-C40) dans lesquelles les doubles liaisons carbone-carbone sont hydrogénées pour être transformées en liaisons simples (ECHA 2017). Kapur et coll. (2006) et Scheuermann et coll. (2011) ont remarqué que les mélanges de PAO hydrogénées résultants sont composés de divers isomères structuraux. Le di(déc-1-ène) hydrogéné est composé à 98 % de dimères de décènes, à 1 % de monomères de décènes et à 1 % de trimères de décènes, tandis que le poly(déc-1-ène) hydrogéné est composé à 85 % de trimères de décènes, à 13 % de tétramères de décènes et à 2 % de pentamères de décènes et d’autres polymères de décènes (MAK 2011). Le numéro de registre du Chemical Abstracts Service (nos CASNote de bas de page 4 ), le nom sur la Liste intérieure des substances (LIS), le nom commun, la structure représentative du dimère (di(déc-1-ène) hydrogéné) et du trimère (poly(déc-1‑ène) hydrogéné) les plus abondants, et le poids moléculaire de chaque substance du groupe des décènes sont présentés au tableau 2‑1.
| No CAS | Nom sur la LIS (nom commun) | Structure chimique et formule moléculaire | Poids moléculaire (g/mol)a |
|---|---|---|---|
| 68649-11-6 | Dimère du déc-1-ène hydrogéné (di(déc-1‑ène) hydrogéné) |  (Structure représentative d’un dimère) (Structure représentative d’un dimère)C20H42 | 282,556 |
| 68649-12-7 | Tétramère du déc-1-ène, mélangé avec le trimère du déc-1-ène hydrogéné (poly(déc-1-ène) hydrogéné) |  (Structure représentative d’un trimère) (Structure représentative d’un trimère)C30H62 | 422,81 |
a Le poids moléculaire est établi en fonction des structures représentatives.
2.1 Sélection d’analogues et utilisation de modèles (Q)SAR
Une méthode d’extrapolation faisant appel aux données d’analogues et aux résultats des modèles de relations (quantitatives) structure-activité (QSAR), le cas échéant, a été utilisée pour éclairer l’évaluation relative à la santé humaine. Les analogues choisis étaient de structure ou de fonctions similaires à celles des substances de ce groupe (toxicocinétique et propriétés physico-chimiques similaires) et leurs données empiriques pertinentes pouvaient être utilisées pour une extrapolation aux substances dont les données empiriques étaient insuffisantes. Des précisions sur les données d’extrapolation choisies pour éclairer l’évaluation des effets des substances du groupe des décènes sur la santé humaine sont présentées dans les annexes A et B, en plus des sections pertinentes du présent rapport.
Six hydrocarbures à longues chaînes ramifiées (nos CAS 68037-01-4, 151006-58-5, 151006-60-9, 151006-62-1, 163149-28-8, 1000172-11-1) ont été retenus comme analogues des deux substances du groupe des décènes. Notre choix reposait sur des similitudes sur le plan de la structure, des propriétés physico-chimiques, des résultats du profilage issus de la Boîte à outils QSAR de l’OCDE (2019), des résultats sur la toxicité aiguë et des données des paramètres ultimes relatifs aux effets sur la santé. Bien que les différences sur le plan des propriétés physico-chimiques des analogues soient reconnues (voir l’annexe B), les analogues choisis pour le di(déc-1-ène) hydrogéné et le poly(déc-1-ène) hydrogéné (ECHA c2007‑2019a, c2007‑2019b) faisaient partie du dossier REACH de l’ECHA, de même que la caractérisation du danger du poly(déc-1-ène) hydrogéné par l’EPA des États‑Unis faisait partie du Défi des substances chimiques produites en grande quantité (High Production Volume [HPV] Challenge Program)Note de bas de page 5 (US EPA 2010).
Les renseignements sur l’identité et les structures chimiques représentatives des analogues utilisés pour éclairer la présente évaluation sont présentés au tableau 2‑2.
| No CASa | Nom sur la LIS ou ailleurs(nom commun) | Structure chimique et formule moléculaire | Poids moléculaire (g/mol) |
|---|---|---|---|
| 68037-01-4 | Homopolymère de déc-1-ène hydrogéné |  n est inconnu n est inconnu(US EPA 2010) C30H62 et C40H82 (ECHA 2019a)b | 422-562b |
| 151006-58-5 | Dodéc-1-ène dimérisé avec du déc-1-ène hydrogéné |  (ECHA) (ECHA)C20-22H42-46 (ECHA 2019b)b | 282-310b |
| 151006-60-9 | Dodéc-1-ène polymérisé avec du déc-1-ène hydrogéné |  n et m sont inconnus n et m sont inconnus(US EPA 2010) C32-34H66-70 (ECHA 2019c)b | 450-478b |
| 151006-62-1 | Trimère du dodéc-1-ène hydrogéné |  (US EPA 2010) (US EPA 2010)C36H74 (ECHA 2017) | 506,0 |
| 163149-28-8 | Dodéc-1-ène polymérisé avec du déc-1-ène et de l’oct-1-ène hydrogéné |  n, m et p sont inconnus n, m et p sont inconnus(US EPA 2010) C26-30H54-62 (ECHA 2019d)b | 366-422b |
| 1000172-11-1 | 7-méthylène-pentadécène mélangé avec du tétradéc-1-ène, dimères et trimères, hydrogénés | 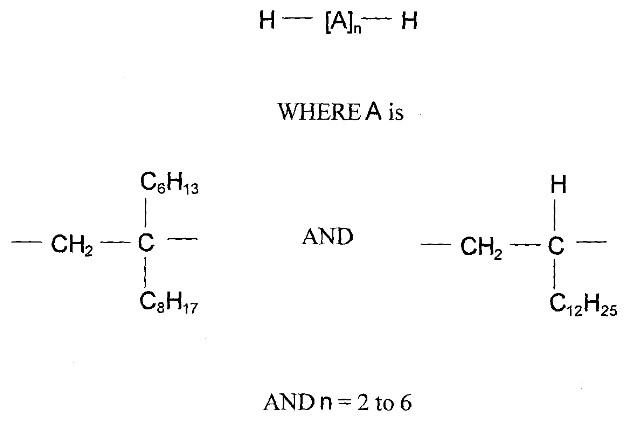 (ECHA c2007-2019c) (ECHA c2007-2019c)C28-80H58-162 (ECHA c2007-2019c)b | 394-1122b |
a Cette substance est un UVCB.
b La formule et le poids moléculaires estimés sont fondés sur une représentation publiée dans le Brief Profile ou la Registered Substance Database d’ECHA.
3. Propriétés physiques et chimiques
Un résumé des propriétés physiques et chimiques des substances du groupe des décènes est présenté au tableau 3‑1. Pour d’autres propriétés physiques et chimiques, veuillez consulter ECCC (2016b).
| Propriété | Di(déc-1-ène) hydrogéné | Poly(déc-1-ène) hydrogéné | Principales références |
|---|---|---|---|
| État physique | Liquide | Liquide | US EPA 2019; ECHA c2007-2019a, c2007-2019b |
| Point de fusion (°C) | -73 (expérimental) | -73 (expérimental) -20 (expérimental)a | ECHA c2007-2019a; c2007-2019b; US EPA 2010, 2019 |
| Pression de vapeur (Pa) | 1,889 (expérimental) | < 13 (expérimental) 2,5 × 10-7 (expérimental)b | ECHA c2007-2019b; US EPA 2019; |
| Constante d’Henry (Pa·m3/mol) | 9,14 × 106(prédite – méthode Bond) | 1,55 × 108 (prédite – méthode Bond) | EPISuite c2000-2012 |
| Solubilité dans l’eau (mg/L) | < 0,1 à 20 °C (expérimental) | < 1,0 × 10-6 (expérimental)c | ECHA c2007-2019a; c2007-2019b; US EPA 2010, 2019 |
| log Koe (sans dimension) | > 6,5 (expérimental) | > 5 (expérimental) | ECHA c2007-2019a, c2007-2019b |
| log Koc (sans dimension) | 5,713 (prédite – Méthode d’ICM) | 8,284 (prédite – Méthode d’ICM) | EPISuite c2000-2012 |
Abréviations : Koe, coefficient de partage octanol-eau; Koc, coefficient de partage octanol-carbone; ICM, indice de connectivité moléculaire
a Cette valeur est extrapolée à partir d’une étude normalisée réalisée avec le trimère de dodéc-1-ène hydrogéné (Hogg et Bartlett 1995), cité dans ECHA c2007-2019b.
b Cette valeur est extrapolée à partir d’une étude normalisée réalisée avec le trimère de dodéc-1-ène hydrogéné (Howarth et coll. 1995), cité dans ECHA c2007-2019b.
c Cette valeur est extrapolée à partir du trimère de dodéc-1-ène hydrogéné (Seary 2000), cité dans ECHA c2007-2019b.
4. Sources et utilisations
Les substances du groupe des décènes ne sont pas présentes à l’état naturel. Les deux substances du groupe des décènes ont été incluses dans une enquête réalisée conformément à un avis émis en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Un résumé des données déclarées sur les quantités totales fabriquées et importées des substances du groupe des décènes pour l’année 2011 est présenté au tableau 4‑1.
| Nom commun | Qté totale fabriquéea (kg) | Qté totale importéea (kg) | Année de la déclaration | Enquête de référence |
|---|---|---|---|---|
| Di(déc-1-ène) hydrogéné | N.d. | 10 000 – 100 000 | 2011 | Environnement Canada 2013 |
| Poly(déc-1-ène) hydrogéné | 1 000 – 10 000 | 203 742 | 2011 | Environnement Canada 2013 |
Abréviations : N.d., non déclarée
a Les valeurs sont les quantités déclarées en réponse à une enquête réalisée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Voir l’enquête pour connaître les inclusions et les exclusions particulières (annexes 2 et 3).
Un résumé des principales utilisations des substances du groupe des décènes établi à partir des renseignements obtenus dans le cadre d’une enquête réalisée en vertu de l’article 71 de la LCPE (Environnement Canada 2013) est présenté au tableau 4‑2. Le tableau 4-3 présente d’autres utilisations au Canada.
| Principales utilisationsa | Di(déc-1-ène) hydrogéné | Poly(déc-1-ène) hydrogéné |
|---|---|---|
| Produits autoadministrésb | O | N |
| Lubrifiants et graisses | O | O |
| Produits d’entretien pour automobiles | N | O |
| Secteurs de l’automobile, de l’aviation et des transports | N | O |
| Applications minières | O | N |
Abréviations : O, oui, cette utilisation a été déclarée pour cette substance; N, non, cette utilisation n’a pas été déclarée pour cette substance
a Utilisations non confidentielles déclarées en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Voir l’enquête pour connaître les inclusions et les exclusions particulières (annexes 2 et 3).
b Les produits autoadministrés sont des produits disponibles pour l’achat sans ordonnance d’un médecin et appartiennent à l’une des trois grandes catégories suivantes : cosmétiques, produits de santé naturels et produits pharmaceutiques sans ordonnance.
| Additifs indirectsa,b | O | O |
| Ingrédients médicinaux ou non dans des produits de santé naturels homologuésc | O | N |
| Déclarés présents dans les cosmétiques conformément au Règlement sur les cosmétiques à Santé Canadad | O | N |
| Utilisation | Di(déc-1-ène) hydrogéné | Poly(déc-1-ène) hydrogéné |
|---|
a Communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, du 31 juillet 2018; sans référence.
b Même s’ils ne sont pas définis dans la Loi sur les aliments et drogues (LAD), les additifs indirects peuvent être considérés, à des fins administratives, comme des substances utilisées dans les usines de transformation alimentaire et pouvant devenir des résidus adventifs dans les aliments (p. ex., nettoyants, assainissants).
c De la Base de données sur les ingrédients des produits de santé naturels (BDIPSN) [modifiée le 6 février 2018], Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, du 27 août 2018; sans référence.
d Communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau d’évaluation du risque des substances existantes de santé Canada, du 25 juillet 2018; sans référence
Le di(déc-1-ène) hydrogéné et le poly(déc-1-ène) hydrogéné ont été décelés dans divers lubrifiants et graisses disponibles pour les consommateurs, notamment dans l’huile pour engrenages et l’huile à transmission (SDS 2013a; MSDS 2015) et l’huile à moteur et l’huile pour engrenages (MSDS 2004 a,b; MSDS 2009, 2010, 2012a,b; SDS 2013b), respectivement. Les deux substances ont été trouvées dans des nettoyants, des lubrifiants et des agents de préservation (NLP) utilisés pour l’entretien des armes à feu (SDS 2016; SDS 2018). En tant qu’ingrédient dans les liquides de PAO, le di(déc-1-ène) hydrogéné peut également être utilisé comme composant des liquides hydrauliques d’un aéronef et des liquides de refroidissement (Mattie et coll. 2017).
5. Devenir et comportement dans l’environnement
5.1 Persistance dans l’environnement
D’après les modèles utilisés dans la CRE (ECCC 2016b), le di(déc-1-ène) hydrogéné ne devrait pas être persistant dans l’eau, l’air, les sédiments et le sol, tandis que le poly(déc-1-ène) hydrogéné devrait l’être dans l’eau, les sédiments et le sol, mais pas dans l’air.
5.2 Potentiel de bioaccumulation
Bien que les valeurs de Koe soient élevées, le di(déc-1-ène) hydrogéné et le poly(déc-1-ène) hydrogéné, dont les facteurs de bioconcentration sont très faibles (ECCC 2016b), ne devraient pas s’accumuler de façon importante dans les organismes.
6. Potentiel de causer des effets nocifs pour l’environnement
6.1 Caractérisation du risque écologique
Les risques pour l’environnement associés aux substances du groupe des décènes ont été caractérisés à l’aide de l’Approche de la classification du risque écologique des substances organiques (CRE) [ECCC 2016a]. La CRE est une approche axée sur la notion de risque; elle attribue un score de risque en tenant compte de nombreuses mesures du danger et de l’exposition, pondérées par différents éléments de preuve. Les différentes données probantes sont combinées pour que l’on puisse distinguer les substances présentant une puissance faible ou élevée et un potentiel d’exposition faible ou élevé dans divers milieux. Une telle approche permet de réduire l’incertitude globale de la caractérisation du risque comparativement à une approche qui reposerait sur un paramètre unique dans un seul milieu (p. ex., la concentration létale médiane [CL50]) pour la caractérisation. Voici l’approche résumée, présentée en détail dans ECCC (2016a).
Les données sur les propriétés physico-chimiques, le devenir (demi-vies chimiques dans divers milieux et biotes, coefficients de partage et bioconcentration dans les poissons), l’écotoxicité aiguë pour les poissons et les volumes de produits chimiques importés et fabriqués au Canada proviennent de publications scientifiques, de bases de données empiriques accessibles (p. ex., la boîte à outils QSAR de l’OCDE [2016]) et des réponses aux enquêtes réalisées en vertu de l’article 71 de la LCPE, ou sont des données produites par modélisation à l’aide de la relation quantitative structure-activité (QSAR), du devenir du bilan massique ou de la bioaccumulation. Ces données ont servi à alimenter d’autres modèles de bilan massique ou à remplir les profils de risques et d’exposition des substances.
Les profils de danger reposent principalement sur des paramètres tels que le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité et l’activité chimique et biologique. Les profils d’exposition sont également fondés sur plusieurs paramètres, dont le taux d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. On a comparé les profils de danger et d’exposition aux critères de décision afin de classer les potentiels de danger et d’exposition de chaque substance organique comme faibles, modérés ou élevés. On a appliqué d’autres règles (p. ex., cohérence de la classification, marge d’exposition) pour préciser les classements préliminaires de danger et d’exposition.
Une matrice de risques a permis d’attribuer à chaque substance un risque potentiel faible, modéré ou élevé, en fonction du classement de son danger et de son exposition. On a vérifié le classement du risque potentiel établi au moyen de la CRE en suivant une approche en deux étapes. La première étape consistait à faire passer le classement des risques de moyen ou élevé à faible dans le cas des substances dont le taux d’émission estimé dans l’eau est faible après traitement des eaux usées, ce qui représente un potentiel d’exposition faible. La deuxième étape consistait à réévaluer le classement du potentiel de risque faible à l’aide de scénarios de risque relativement prudents à l’échelle locale (c.-à-d., la zone entourant directement la source ponctuelle de rejet), conçus pour ne pas nuire à l’environnement, afin de déterminer si le classement du risque potentiel devrait être revu à la hausse.
La CRE est une approche pondérée qui vise à réduire au minimum le risque d’un surclassement ou d’un sous-classement du danger, de l’exposition et des risques subséquents. ECCC (2016a) explique en détail les approches équilibrées utilisées pour traiter les incertitudes. Voici une description de deux des domaines d’incertitude les plus importants. Une erreur dans les valeurs de toxicité aiguë empiriques ou modélisées pourrait modifier le classement du danger, surtout si les paramètres sont fondés sur les valeurs de résidus dans les tissus (c.-à-d., le mode d’action toxique), dont bon nombre sont des valeurs estimées à l’aide de modèles QSAR (boîte à outils QSAR de l’OCDE, 2014). Toutefois, l’impact de ce type d’erreur est atténué par le fait qu’une surestimation de la létalité médiane conduira à une valeur prudente (sans danger) de résidus dans les tissus pour l’analyse critique des résidus corporels. Une erreur due à une sous-estimation de la toxicité aiguë sera atténuée par le recours à d’autres paramètres de danger, tels que le profilage structurel du mode d’action, la réactivité et/ou l’affinité de liaison à l’œstrogène. Les changements ou les erreurs touchant les quantités chimiques pourraient donner lieu à un classement de l’exposition différent, les classements de l’exposition et du risque étant très sensibles aux taux d’émission et aux quantités utilisées. Les classements obtenus au moyen de la CRE représentent donc l’exposition et le risque au Canada, compte tenu des quantités utilisées actuellement (déterminées par estimations), mais pourraient ne pas rendre compte des tendances futures.
Les données essentielles et les facteurs à considérer, utilisés pour élaborer les profils spécifiques des substances du groupe des décènes, ainsi que les résultats de la classification du danger, de l’exposition et du risque sont présentés dans ECCC (2016b).
Étant donné le classement faible pour le danger et l’exposition, établi au moyen des données prises en compte dans l’analyse de la CRE, le potentiel de risque pour l’environnement associé au di(déc-1-ène) hydrogéné a été classé comme faible. Il est peu probable que cette substance soit préoccupante pour l’environnement au Canada.
Selon l’information examinée dans le cadre de la CRE, le potentiel d’exposition du poly(déc-1-ène) hydrogéné a été classé comme modéré en raison de sa longue persistance globale et du volume utilisé modéré, déclaré dans une enquête réalisée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Le poly(déc-1-ène) hydrogéné a été classé comme une substance dont le potentiel de danger est faible. Le poly(déc-1-ène) hydrogéné a été classé comme une substance dont le potentiel de risque pour l’environnement est faible. Compte tenu des profils d’utilisation actuels, il est peu probable que le poly(déc-1-ène) hydrogéné entraîne des préoccupations pour l’environnement au Canada.
7. Potentiel de causer des effets nocifs pour la santé humaine
7.1 Évaluation pour la santé humaine
Les données de toxicité pour l’évaluation du danger du di(déc-1-ène) hydrogéné et du poly(déc-1-ène) hydrogéné ont été appuyées par les données présentées à l’European Chemicals Agency (ECHA) dans le cadre du programme REACH (ECHA c2007-2019a, c2007‑2019b) et de la caractérisation préalable du danger du poly(déc-1‑ène) hydrogéné de l’Environmental Protection Agency des États‑Unis (US EPA), conformément au programme Défi HPV (US EPA 2010). La recherche documentaire s’est échelonnée jusqu’en juin 2019. Une étude sur la toxicité aiguë et sur deux semaines, par inhalation, réalisée par l’Air Force Research Laboratory des États‑Unis (Mattie et coll. 2017; Wegner et coll. 2018) a été trouvée pour le di(déc-1-ène) hydrogéné et alimente la caractérisation du danger.
Des données pertinentes, quoique limitées, propres aux substances du groupe des décènes sont présentées ci-dessous, en plus de renseignements sur les effets des analogues sur la santé. Les données sur les analogues ont éclairé plusieurs critères d’évaluation : la génotoxicité, la toxicité à doses répétées, la toxicité pour la reproduction et le développement. D’autres renseignements sur le choix des analogues sont présentés à la section 2.1 et à l’annexe A. L’annexe B est un résumé des propriétés physico-chimiques et des données accessibles sur les effets sur la santé, relatives aux substances du groupe des décènes et à leurs analogues. Les études de toxicité trouvées pour les analogues des substances du groupe des décènes étaient souvent réalisées à l’aide de produits comme matériel à l’essai. Par conséquent, la composition des différents produits, en matière de substances à l’étude, pourrait être variable.
7.1.1 Génotoxicité
Dans l’ensemble, les substances du groupe des décènes ne devraient avoir aucune génotoxicité, étant donné les résultats négatifs in vivo et in vitro des analogues (voir l’annexe B).
7.1.2 Voie d’exposition orale
Les données toxicologiques pour l’exposition par voie orale au di(déc-1-ène) hydrogéné et au poly(déc-1-ène) hydrogéné étaient limitées à la toxicité aiguë, où la DL50Note de bas de page 6 était supérieure à 4 100 mg/kg ou plus (soumis à l’essai sous forme d’Emery 3002, SF-0203-41, SF‑0201‑3, Emery 3004) (ECHA c2007-2019a). Plusieurs études de toxicité à doses répétées chez le rat ont été trouvées (annexe B) pour des analogues des substances du groupe des décènes (nos CAS 68037-01-4, 151006-58-5, 151006-62-1). La durée des études d’exposition par administration alimentaire ou par gavage variait de 28 à 91 jours. Des études de toxicité pour la reproduction et le développement chez des rats exposés par gavage (études combinant toxicité à doses répétées et toxicité pour la reproduction; sur une génération; sur deux générations) ont été trouvées pour certains des analogues des substances du groupe des décènes (nos CAS 68037-01-4, 151006-62-1, 1 000 172‑11‑1). Les études sur les analogues ont déterminé les doses sans effet nocif observé (DSENO) à la dose d’essai la plus élevée de 1000 mg/kg p.c. et plus (ECHA c2007-2019a, c2007-2019c; Mobil 1990a, 1990b; Stonybrook 1995a; US EPA 2010). À l’aide d’une méthode d’extrapolation, on a déterminé que le groupe des décènes était peu préoccupant pour la santé humaine par exposition par voie orale.
7.1.3 Voie d’exposition cutanée
Les données toxicologiques pour l’exposition par voie cutanée au di(déc-1-ène) hydrogéné et au poly(déc-1-ène) hydrogéné étaient limitées à la toxicité aiguë. Une DL50 par voie cutanée a été déterminée pour le di(déc-1-ène) hydrogéné et était supérieure à 3000 mg/kg p.c. chez le lapin (ECHA c2007-2019a, c2007-2019b). Des études d’exposition par voie cutanée réalisées chez le rat (dont le site d’application n’était pas couvert) ont été trouvées pour les analogues du groupe des décènes (annexe B). Une étude de toxicité à doses répétées sur 28 jours (no CAS 163149-28-8) et une étude de toxicité pour le développement, réalisées chez le rat depuis le jour de gestation 0 jusqu’au jour de gestation 19 (no CAS 68037-01-4) ont donné, à la dose d’essai la plus élevée, des DSENO de 2000 mg/kg p.c./jour (Mobil 1995, 1988; US EPA 2010). Dans une étude d’induction de tumeurs cutanées chez la souris, il n’y a pas eu d’augmentation de l’incidence après l’application de l’homopolymère du déc-1-ène hydrogéné (no CAS 68037-01-4), un analogue du groupe des décènes, pendant 104 semaines (Kettering 1990; US EPA 2010). Même si aucune étude de toxicité cutanée à doses répétées à plus long terme, fondée sur l’absence d’effets nocifs observés chez les animaux dans les études de toxicité subchronique par voie orale, n’a été trouvée, afin de connaître les effets généralisés des substances cibles ou des analogues du groupe des décènes, les substances de ce groupe sont jugées peu préoccupantes pour la santé humaine par l’exposition par voie cutanée.
7.1.4 Exposition par inhalation
Un résumé de la toxicité par inhalation déterminée à partir d’études de toxicité aiguë pouvant être attribuée aux substances du groupe des décènes est présenté à l’annexe B. Une augmentation du taux de mortalité, des effets macroscopiques et des signes cliniques a été notée dans plusieurs études de toxicité aiguë par exposition de l’organisme entier à des aérosols réalisées chez les rats et peut être attribuée au di(déc-1-ène) hydrogéné (ECHA c2007-2019a).
Des études de toxicité aiguë et à long terme par inhalation menées par l’Air Force Research Laboratory des États‑Unis (Mattie et coll. 2017; Wegner et coll. 2018) ont été trouvées pour le di(déc-1-ène) hydrogéné.
L’étude de détermination des doses aiguës a été réalisée conformément à l’essai no 403 (toxicité aiguë par inhalation) des Lignes directrices de l’Organisation de coopération et de développement économiques (OCDE), où des groupes de rats Fischer 344 mâles et femelles (10/sexe/dose) ont été exposés à 0, 100, 500 ou 1000 mg/m3 d’aérosols de PAO liquide pendant six heures. La PAO liquide étudiée est principalement composée de di(déc-1-ène) hydrogéné (à hauteur de 80 % à 99,5 %) avec un additif de marque (à hauteur de 0,5 % à 20 %). Pour modifier le plan expérimental, on a évalué un groupe distinct de rats après une période de récupération de deux semaines sur le plan des observations neurocomportementales, de la pathologie macroscopique, de la chimie clinique et des effets histopathologiques. Les épreuves neurocomportementales appliquées chez les rats mâles et femelles ayant été exposés à 500 et à 1000 mg/m3 ont révélé une réduction importante de l’activité motrice par rapport aux rats du groupe témoin. Après une période de récupération de 14 jours des rats, les résultats des épreuves neurocomportementales ont été semblables à ceux du groupe témoin. Pour déterminer la variation du poids corporel, on a utilisé le rapport du poids mesuré au jour 1 après exposition sur le poids mesuré le jour de l’exposition. Comparativement au groupe témoin, une diminution importante du rapport de poids corporels a été observée chez les femelles exposées à 500 mg/m3 et dans les groupes de mâles et de femelles exposés à 1000 mg/m3. À la fin de la période de récupération, aucun effet sur le poids corporel n’a été rapporté. D’après les résultats, la consommation de nourriture et d’eau aurait également diminué de façon importante par rapport au groupe témoin, un (1) jour après l’exposition, dans les groupes de rats ayant perdu du poids. Toutes les variations du poids d’un organe ont été attribuées à des différences dans la consommation de nourriture et d’eau ayant mené à des variations du poids corporel chez les rats des groupes exposés à 1000 mg/m3. Aucun effet négatif sur la chimie clinique et l’hématologie n’a été rapporté chez les animaux exposés comparativement aux animaux du groupe témoin. Sur le plan de l’histopathologie, aucune lésion n’a été observée dans les poumons ou les cavités nasales des rats du groupe témoin, ou dans la première et la deuxième section des cavités nasales (NL1, NL2) après une exposition aiguë. Toutes les concentrations auraient causé des lésions à la fois dans les cavités nasales postérieures (NL3, NL4) et les poumons des rats. On a observé une relation dose-réponse pour l’incidence et la gravité des lésions, comme indiqué au tableau 7‑1 et au tableau 7-2. À 100 mg/m3, des lésions ont été constatées dans les cavités nasales (NL4; dégénérescence multifocale, nécrose) et les poumons (inflammation), la gravité ayant été minime dans les deux types de tissus, tandis que chez les animaux exposés à des concentrations plus élevées, l’incidence des lésions était de 100 % dans les cavités nasales et de 90 % dans les poumons. Dans les cavités nasales, la gravité de la réponse augmentait avec la progression de la position des sections histologiques vers l’extrémité postérieure de ces cavités, tandis que la gravité à la section NL3 était légère, dans l’ensemble, celle à la section NL4 était généralement marquée dans les groupes d’animaux exposés aux concentrations de 500 mg/m3 et de 1000 mg/m3. La gravité des lésions des tissus épithéliaux s’est accrue avec l’augmentation de la concentration de 500 mg/m3 à 1000 mg/m3, progressant d’une dégénérescence multifocale accompagnée de nécrose et d’œdème à des lésions multifocales accompagnées de nécrose, d’inflammation neutrophile, d’œdème et de perte d’épithélium. Chez deux rats, une inflammation pulmonaire a été rapportée (l’une focale, l’autre multifocale) à 100 mg/m3. À 500 mg/m3, la gravité générale était minime, mais chez certains rats, la réponse était légère. À 1000 mg/m3, la gravité variait de minime à légère pour chaque rat. Une inflammation pulmonaire a été observée chez tous les rats ayant une incidence histopathologique pulmonaire, dont certains des groupes de 500 et de 1000 mg/m3 montraient une accumulation de neutrophiles ainsi que de lymphocytes, de macrophages et de débris (Mattie et coll. 2017; Wegner et coll. 2018).
| Section de tissus | Groupe témoin | 100 mg/m3 | 500 mg/m3 | 1000 mg/m3 |
|---|---|---|---|---|
| Cavités nasales NL3a | 0 | 0 | 16/20 | 18/20 |
| Cavités nasales NL4a | 0 | 10/20 | 20/20 | 20/20 |
| Poumonsa | 0 | 2/20 | 18/20 | 18/20 |
a Incidence mesurée par le nombre de rats présentant des lésions/nombre de rats du groupe de rats exposés (Mattie et coll. 2017).
| Section de tissus | Groupe témoin | 100 mg/m3 | 500 mg/m3 | 1000 mg/m3 |
|---|---|---|---|---|
| Cavités nasales NL3a | 0 | 0 | 1,10 ± 0,16 | 1,00 ± 0,01 |
| Cavités nasales NL4a | 0 | 0,90 ± 0,22 | 3,20 ± 0,14 | 3,10 ± 0,10 |
| Poumonsa | 0 | 0,11 ± 0,08 | 1,21 ± 0,12 | 1,47 ± 0,16 |
a Gravité = moyenne ± erreur type de la moyenne; cote de gravité : 0 = normale; 1 = minime; 2 = légère; 3 = modérée; 4 = marquée; 5 = grave (Mattie et coll. 2017).
Encore moins d’animaux ont été touchés et la gravité diminuait après une période de récupération de 14 jours, mais les animaux touchés n’ont pas tous récupéré complètement. À 100 mg/m3, 95 % des rats ont récupéré de leurs lésions aux cavités nasales, tandis qu’un des 20 rats y présentait une dégénérescence multifocale. Lors de l’évaluation de la section des tissus NL3, presque tous les rats ont récupéré (95 % et 100 % aux concentrations intermédiaire et élevée). Cependant, une récupération des lésions à la section NL4 des tissus des cavités nasales n’a été rapportée que chez 42 % et 70 % des rats exposés à 500 mg/m3 et à 1000 mg/m3, respectivement. La gravité en général aurait été minime après une période de récupération, quelle que soit la concentration. Certains rats ayant été exposés à 1000 mg/m3 ont montré des signes de régénération, mais de la dégénérescence, de la nécrose, de l’œdème et de l’inflammation étaient encore présents chez les rats touchés. Dans les poumons, on a observé une incidence de récupération similaire et une gravité générale minime, quelle que soit la concentration. Après la période de récupération, aucune inflammation, nécrose ou dégénérescence dans les poumons n’a été rapportée après une exposition aiguë à 100 mg/m3. Cependant, une inflammation neutrophile multifocale a été constatée chez les rats exposés à 500 mg/m3 et à 1000 mg/m3, outre des poumons granulomateux à 1000 mg/m3 (Mattie et coll. 2017; Wegner et coll. 2018). Les auteurs de l’étude ont établi la valeur de DSENO à 6 heures à 100 mg/m3 pour les effets histopathologiques observés dans les voies respiratoires (Mattie et coll. 2017). D’après les effets histopathologiques observés et la récupération incomplète après une période de repos de 14 jours rapportés chez les rats exposés, on a établi la valeur de la concentration minimale avec effet nocif observé (CMENO), aiguë à 100 mg/m3 pour la caractérisation du risque dans la présente évaluation préalable.
Une étude de toxicité par inhalation à doses répétées a été réalisée avec le liquide de PAO conformément à l’Essai no 412 des Lignes directrices de l’OCDE, après l’étude de détermination des doses de toxicité aiguë mentionnée plus haut. Des groupes de rats Fischer 344 mâles et femelles (10/sexe/concentration) ont été exposés à des aérosols de 0, 20, 100 ou 300 mg/m3 de liquide de PAO durant 6 heures par jour, 5 jours par semaine et ce, pendant 2 semaines (10 expositions). Les épreuves neurocomportementales ont été menées les jours 9 et 10 de l’exposition, tandis que les valeurs de chimie clinique, d’histopathologie, d’hématologie et de pathologie macroscopique ont été déterminées après la nécropsie réalisée au jour 10 de l’exposition. Aucun effet important n’a été rapporté dans les épreuves neurocomportementales ainsi que sur la consommation de nourriture et d’eau, le poids corporel et le poids des organes chez les rats exposés par rapport aux rats du groupe témoin. Le seul résultat de chimie clinique (augmentation significative de l’aspartate aminotransférase chez les femelles exposées à 20 mg/m3 par rapport aux femelles du groupe témoin) n’a pas été jugé comme un bon indicateur d’une relation dose-réponse. Une diminution importante des lymphocytes (en pourcentage) ainsi qu’une diminution importante des neutrophiles (en pourcentage) ont été rapportées avec une augmentation de la dose chez les rats femelles, quelle que soit la concentration; une réponse similaire a été observée chez les mâles à compter de 100 mg/m3. Des variations importantes, mais sporadiques, ont été constatées dans le nombre de leucocytes (100 mg/m3) et de plaquettes (20 mg/m3) chez les femelles, ainsi que dans le volume moyen des plaquettes chez les rats mâles (100 mg/m3) et les rats femelles (20 mg/m3), par comparaison aux rats du groupe témoin. Des lésions histopathologiques ont été rapportées dans la partie postérieure des cavités nasales (NL4) ainsi que dans les poumons des animaux exposés à 300 mg/m3. Une lésion dans les cavités nasales a été décelée à 100 mg/m3, mais il a été établi qu’elle n’était pas liée à l’exposition. À la concentration de 300mg/m3, des lésions ont été observées dans la partie postérieure des cavités nasales (NL4) et les poumons des rats mâles et femelles. Des lésions dans les cavités nasales, de gravité globale minime (cote moyenne = 0,71 ± 0,13) ont été trouvées chez 12 des 20 rats. Une inflammation, souvent décrite comme produit des neutrophiles et d’origine multifocale, ainsi que des débris nécrotiques, une perte de l’épithélium et une nécrose ont été constatés chez les rats touchés exposés à 300 mg/m3. Une régénération de l’épithélium a également été rapportée chez certains animaux. À la même concentration (300 mg/m3), 19 des 20 rats ont présenté des lésions aux poumons dont la gravité a été jugée somme toute légère (cote moyenne = 1,25 ± 0,12; 6 animaux ont eu un score léger et 13 ont eu un score minime). Une inflammation pulmonaire a été constatée chez la plupart des animaux touchés exposés à 300 mg/m3, tandis que seulement deux rats ont présenté des débris nécrotiques et une apoptose de cellules isolées en plus de l’inflammation. Les auteurs ont établi la concentration sans effet nocif observé (CSENO) à 100 mg/m3 chez le rat, d’après les effets sur l’histopathologie des voies respiratoires observés à 300 mg/m3 (Mattie et coll. 2017; Wegner et coll. 2018).
7.2 Évaluation de l’exposition
La présente évaluation de l’exposition est axée sur la voie d’exposition par laquelle les effets critiques sur la santé ont été trouvés, c.-à-d. les effets non cancérogènes dans les poumons après inhalation de di(déc-1-ène) hydrogéné et de poly(déc-1-ène) hydrogéné provenant de produits en pulvérisateur disponibles pour les consommateurs.
7.2.1 Milieu environnemental
Aucune donnée n’a été trouvée sur la présence du di(déc-1-ène) hydrogéné et du poly(déc-1‑ène) hydrogéné dans l’air, l’eau ou le sol au Canada. Cependant, ces substances peuvent être rejetées dans l’environnement par des installations canadiennes qui les fabriquent ou les transforment. Aucun résultat sur la surveillance du di(déc-1-ène) hydrogéné ou du poly(déc-1-ène) hydrogéné dans l’air ambiant ou l’eau des installations de fabrication ou de transformation n’a été rapporté.
D’après la modélisation de la fugacité, le di(déc-1-ène) hydrogéné et le poly(déc-1-ène) hydrogéné ont davantage tendance à se répartir dans le sol et/ou l’eau que dans l’air (EPISuite c2000-2012). Bien que les substances du groupe des décènes puissent être rejetées dans l’eau dans le cadre d’activités industrielles au Canada, l’exposition de la population générale au Canada par la voie orale (c.‑à‑d. l’eau potable) n’a pas été quantifiée, car aucun effet critique sur la santé n’a été décelé par cette voir d’exposition (se reporter à la section 6.2).
Le di(déc-1-ène) hydrogéné et le poly(déc-1-ène) hydrogéné peuvent être présents comme composants d’additifs indirects, surtout dans les lubrifiants utilisés dans les établissements de transformation alimentaire sans possibilité de contact avec les aliments (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, en août 2018; sans référence). Par conséquent, il ne devrait pas y avoir d’exposition à ces substances par les aliments.
7.2.2 Produits disponibles pour les consommateurs
Au Canada, le di(déc-1-ène) hydrogéné est présent dans environ 45 produits cosmétiques, tels que des produits hydratants, des nettoyants, des rouges à lèvres et du maquillage (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, en août 2018; sans référence) et comme ingrédient non médicinal dans un produit de santé naturel actif utilisé de façon topique comme la crème revitalisante pour la peau (communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, en août 2018; sans référence). Le di(déc-1-ène) hydrogéné est également présent dans les lubrifiants et graisses disponibles pour les consommateurs, y compris l’huile pour engrenages et l’huile à transmission (Environnement Canada 2011; SDS 2013a; MSDS 2015). La principale voie d’exposition au di(déc-1-ène) hydrogéné découlant de l’utilisation de produits disponibles pour les consommateurs devrait être cutanée (sauf pour le rouge à lèvres, dont l’exposition se fait par voie orale) par suite d’un contact direct avec la peau. Cependant, l’exposition par les voies cutanée et orale n’a pas été quantifiée, car aucun effet critique n’a été constaté par ces voies d’exposition (se reporter à la section 7.1).
Au Canada, les produits disponibles pour les consommateurs qui contiennent un poly(déc-1-ène) hydrogéné sont principalement des lubrifiants et des graisses, comme l’huile à moteur et l’huile pour engrenages (Environnement Canada 2011; MSDS 2004a, 2004b; MSDS 2009, 2010, 2012a,b; SDS 2013b). La principale voie d’exposition au poly(déc-1-ène) hydrogéné découlant de l’utilisation de ces produits devrait être la voie cutanée par suite d’un contact cutané direct pendant l’utilisation. Cependant, l’exposition par la voie cutanée n’a pas été quantifiée, car aucun effet critique n’a été constaté par cette voie d’exposition.
Le di(déc-1-ène) hydrogéné et le poly(déc-1-ène) hydrogéné peuvent également être présents au Canada comme ingrédients dans l’huile utilisée pour l’entretien des armes à feu (pour nettoyer, lubrifier ou préserver). Le di(déc-1-ène) hydrogéné était présent dans la forme liquide d’un produit, qui peut être versé ou appliqué à l’aide d’un pulvérisateur à gâchette (SDS 2018), tandis que le di(déc-1-ène) hydrogéné et le poly(déc-1-ène) hydrogéné ont tous deux été trouvés sous forme d’aérosols en pulvérisateur de produits NLP (SDS 2016). Étant donné que les effets critiques sur la santé se produisent par inhalation d’aérosols, seule l’exposition par inhalation découlant de l’utilisation de produits en aérosols et de l’utilisation de produits en pulvérisateur à gâchette a été estimée. Les valeurs estimatives des concentrations maximales de di(déc-1-ène) hydrogéné et de poly(déc-1-ène) hydrogéné dans l’air découlant de l’utilisation d’une bombe aérosol de NLP et d’un pulvérisateur à gâchette de NLP pour l’entretien des armes à feu provenaient de modèles de ConsExpo Web (ConsExpo Web 2016). Pour des précisions sur le modèle particulier et les paramètres utilisés, veuillez consulter l’annexe C.
| Produit | Produits chimiques | Concentration dans le produit (% en poids) | Concentration maximale le jour de l’expositionb (mg/m3) |
|---|---|---|---|
| Bombe aérosol de NLP | Mélange de di(déc-1-ène) hydrogéné et de poly(déc-1‑ène) hydrogéné | 40 % 60 % 100 %c | 26 39 65 |
| Pulvérisateur à gâchette de NLP | Di(déc-1-ène) hydrogéné | 10 %-40 % | 0,70-2,80 |
a La concentration maximale a été établie par exposition à des gouttelettes inhalables étant donné les effets sur les tissus des cavités nasales.
b Valeur estimative de la concentration maximale pendant une application de 20 minutes (ConsExpo Web).
c Étant donné que le di(déc-1-ène) hydrogéné et le poly(déc-1-ène) hydrogéné sont présents dans le même produit, les concentrations maximales ont également été calculées à l’aide d’une concentration maximale de 100 % dans le produit.
7.3 Caractérisation du risque pour la santé humaine
Aucun effet critique négatif sur la santé n’a été constaté par les voies d’exposition orale et cutanée pour les substances du groupe des décènes d’après les données sur les effets des analogues sur la santé. Par conséquent, les expositions par voies orale et cutanée au di(déc-1-ène) hydrogéné et au poly(déc-1-ène) hydrogéné découlant de l’utilisation de produits disponibles pour les consommateurs ou de milieux environnementaux ne sont pas préoccupantes pour la santé humaine.
Des effets critiques ont été trouvés pour les substances du groupe des décènes par l’exposition par inhalation. Dans les études toxicologiques accessibles menées avec du di(déc-1-ène) hydrogéné, la CMENO de 100 mg/m3 a été retenue d’une étude de toxicité aiguë chez le rat, et établie d’après les effets histopathologiques observés dans les cavités nasales et les poumons. Des effets neurocomportementaux ont été observés à des concentrations plus élevées.
Dans le tableau 7‑4 sont présentées toutes les valeurs pertinentes d’exposition et de danger des substances du groupe des décènes, ainsi que celles des marges d’exposition (ME) résultante, pour la détermination des risques.
| Scénario d’exposition | Concentration dans le produit(% en poids) | Concentration maximale le jour de l’exposition(mg/m3) | Concentration liée à l’effet critique | Critère d’effet critique pour la santé | ME |
|---|---|---|---|---|---|
| Aérosols de NLP pour armes à feu (di(déc-1‑ène) hydrogéné et poly(déc-1‑ène) hydrogéné) | 40 % à 100 % | 26‑65 | CMENO = 100 mg/m3 | Modifications histopathologiques dans les cavités nasales et les poumons | 2-3 |
| Pulvérisateur à gâchette de NLP pour armes à feu (di(déc-1‑ène) hydrogéné) | 10 % à 40 % | 0,70‑2,80 | CMENO = 100 mg/m3 | Modifications histopathologiques dans les cavités nasales et les poumons | 35-142 |
Les marges d’exposition calculée entre l’effet critique et les valeurs estimatives de l’exposition découlant de l’utilisation de pulvérisateurs de NLP pour l’entretien des armes à feu sont jugées potentiellement insuffisantes pour tenir compte des incertitudes dans les effets sur la santé et les bases de données sur l’exposition.
7.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitudes sont présentées dans le tableau ci-dessous.
| Principales sources d’incertitudes | Impact |
|---|---|
| Manque de données sur l’exposition au di(déc-1-ène) hydrogéné et au poly(déc-1-ène) hydrogéné dans le milieu environnemental. | +/- |
| Aucune information sur la quantité et la taille des particules inhalables contenant du di(déc-1-ène) hydrogéné et du poly(déc-1-ène) hydrogéné, rejetées lors de l’utilisation de pulvérisateurs de NLP pour l’entretien des armes à feu. | + |
| Il n’y a aucune étude de toxicité subchronique et chronique pour la reproduction et le développement chez l’animal pour l’exposition par inhalation aux substances du groupe des décènes. Il n’y a non plus aucune étude de toxicité à doses répétées chez l’animal pour l’exposition par inhalation lorsqu’il y a une récupération après une exposition aux aérosols. | +/- |
| L’étude par inhalation sur laquelle repose le critère d’effet a été menée avec une substance contenant un additif de marque (0,5 % à 20 %) ajoutée à la substance d’intérêt (80 % à 99 % di(déc-1-ène) hydrogéné). | +/- |
+ = incertitude visant l’incertitude quant au potentiel de surestimer l’exposition et les risques; - = incertitude visant l’incertitude quant au potentiel de sous-estimer l’exposition et les risques; +/- = potentiel inconnu d’entraîner une surestimation ou une sous-estimation du risque.
8. Conclusion
Compte tenu de tous les éléments de preuve contenus dans la présente ébauche d’évaluation préalable, le di(déc-1‑ène) hydrogéné et le poly(déc-1-ène) hydrogéné présentent un risque faible de causer des effets nocifs pour l’environnement. Il est proposé de conclure que le di(déc-1-ène) hydrogéné et le poly(déc-1-ène) hydrogéné ne satisfont pas aux critères énoncés aux alinéas 64a) et b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la biodiversité ou à mettre en danger l’environnement essentiel pour la vie.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que le di(déc-1-ène) hydrogéné et le poly(déc-1‑ène) hydrogéné satisfont au critère énoncé à l’alinéa 64c) de la LCPE, car ils pénètrent dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est donc proposé de conclure que le di(déc-1-ène) hydrogéné et le poly(déc-1‑ène) hydrogéné satisfont à un ou plusieurs des critères énoncés à l’article 64 de la LCPE.
Il est également proposé de conclure que le poly(déc-1-ène) hydrogéné répond aux critères de persistance, mais pas à ceux de bioaccumulation, et que le di(déc-1‑ène) hydrogéné ne répond pas aux critères de persistance et de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation en application de la LCPE.
Bibliographie
[BDPSNH] Base de données sur les produits de santé naturels homologués [base de données]. [Modifiée le 6 février 2018]. Ottawa, Ont. : gouvernement du Canada. [consulté le 27 août 2018].
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L.C. 1999, c. 33. Gazette du Canada Partie III, vol. 22, no 3.
[ConsExpo Web] Consumer Exposure Web Model. 2016. Bilthoven (NL): Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement] [Disponible en anglais]
Daniel EM. 1994. An oral (gavage) 91-day toxicity study of EthylFlo 166 in rats with an in utero exposure phase. Report by Springborn Laboratories, Inc., Spencerville OH, conducted for Albermarle Corporation, Baton Rouge LA. [consulté le 10 juin 2019] [Summary; Study 4 in Repeated-dose toxicity in HPVIS (US EPA 2019)]. [Disponible en anglais seulement]
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l’approche scientifique : classification du risque écologique des substances organiques. Ottawa (Ont.) : gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016b. Supporting documentation: data used to create substance-specific hazard and exposure profiles and assign risk classifications. Gatineau (QC): ECCC. Information étayant le Document sur l’approche scientifique : classification du risque écologique des substances organiques. Disponible sur demande à : substances@ec.gc.ca. [Disponible en anglais seulement]
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. [modifié le 12 mars 2017]. Catégorisation. Ottawa (Ont.) : gouvernement du Canada. [consulté le 12 septembre 2019].
[ECHA] European Chemicals Agency. 2017. CLH report: Proposal for harmonised classification and labelling based on Regulation (EC) No 1272/2008 (CLP Regulation), Annex VI, Part 2: Substance name: Branched hexatriacontane Synonym: Alkane 4 or 1-Dodecene trimer, hydrogenated. [consulté en juin 2019]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. c2007-2019a. Registered substances database; search results for CAS RN 68649-11-6. Helsinki (FI): ECHA. [mis à jour le 25 mars 2019; consulté le 19 juin 2019]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. c2007-2019b. Registered substances database; search results for CAS RN 68649-12-7. Helsinki (FI): ECHA. [mis à jour le 9 novembre 2018; consulté le 19 juin 2019]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. c2007-2019c. Registered substances database; search results for CAS RN 1000172-11-1. Helsinki (FI): ECHA. [mis à jour le 9 novembre 2018; consulté le 25 juin 2019]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. c2007-2019d. Registered substances database; search results for CAS RN 68037-01-4. Helsinki (FI): ECHA. [mis à jour le 29 avril 2019; consulté le 16 septembre 2019]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. 2019a. Brief profile: Dec-1-ene, homopolymer, hydrogenated Dec-1-ene, oligomers, hydrogenated; CAS RN 68037-01-4. Helsinki (FI): ECHA. [mis à jour le 8 juillet 2019; consulté le 11 juillet 2019]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. 2019b. Brief profile: 1-Dodecene dimer with 1-Decene, hydrogenated; CAS RN 151006-58-5. Helsinki (FI): ECHA. [mis à jour le 8 juillet 2019; consulté le 11 juin 2019]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. 2019c. Brief profile: Reaction products of 1-decene and 1-dodecene, hydrogenated; CAS RN 151006-60-9. Helsinki (FI): ECHA. [mis à jour le 8 juillet 2019; consulté le 11 juillet 2019]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. 2019d. Brief profile: Reaction products of 1-decene, 1-dodecene and 1-octene, hydrogenated; CAS RN 163149-28-8. Helsinki (FI): ECHA. [mis à jour le 7 juillet 2019; consulté le 11 juillet 2019]. [Disponible en anglais seulement]
Environnement Canada. 2013. Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement, 1999 : Avis concernant certaines substances de la Liste intérieure. Données préparées par : Environnement Canada, Santé Canada; Programme des substances existantes.
[EPI Suite] Estimation Program Interface Suite for Microsoft Windows [estimation model]. c2000-2012. Ver. 4.11. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. [Disponible en anglais seulement]
Kapur GS, Sarpal AS, Sarin R, Jain SK, Srivastava SP, Bhatnagar AK. 2006. Detailed characterisation of polyalphaolefins and their branched structures using multi-pulse NMR techniques. J Synth Lubric. 15-3, 191 0265-6582. [Disponible en anglais seulement]
[Kettering] Kettering Laboratory. 1990. Dermal Carcinogenicity Study on Decene Homopolymer. Performed by Mobil Environmental and Health Science Laboratory. [consulté le 10 juin 2019] [Summary; Study 5 Genetic toxicity in vivo in US EPA HPVIS (US EPA 2019)]. [Disponible en anglais seulement]
[MAK] 2011. The MAK Collection for Occupational Health and Safety. Polyalphaolefine, MAK, 51. [PDF] [MAK Value Documentation in German]. [Disponible en anglais seulement]
Mattie DR, Wegner MD, Wong BA, James RA, Mumy KL, McInturf SM, Marcel BJ, et TR Sterner. 2017. Acute and two-week inhalation toxicity studies in rats for polyalphaolefin (PAO) fluid AFRL-RH-WP-TR-2017-0078. Air Force Research Laboratory 711th Human Performance Wing; Airman Systems Directorate; Bioeffects Division; Molecular Bioeffects Branch; Wright-Patterson AFB OH 45433-5707 [consulté le 4 juillet 2019]. [Disponible en anglais seulement]
[Mobil] Mobil Environmental Health and Safety Department. 1985. Micronucleus assay of bone marrow and peripheral red blood cells from rats treated via dermal administration of Synthetic Hydrocarbon-Hydrogenated Polyolefins. [consulté le 10 juin 2019] [Summary; Study 1 Genetic toxicity in vivo in HPVIS (US EPA 2019)]. [Disponible en anglais seulement]
[Mobil] Mobil Environmental Health and Safety Department. 1988. Developmental toxicity screen in rats exposed dermally to decene homopolymer. [consulté le10 juin 2019] [Summary; Developmental toxicity/teratogenicity in HPVIS (US EPA 2019)]. [Disponible en anglais seulement]
[Mobil] Mobil Environmental Health and Safety. 1990a. Range-finding study: oral administration of unadditized decene homopolymer to rats. Performed by Mobil Environmental Health and Safety Department [consulté le 10 juin 2019] [Summary; Study 1 Repeated-dose toxicity in HPVIS (US EPA 2019)]. [Disponible en anglais seulement]
[Mobil] Mobil Environmental Health and Safety Department. 1990b. 90-day oral administration of unadditized decene homopolymer to rats. [consulté le 10 juin 2019] [Summary; Study 2 Repeated-dose toxicity in HPVIS (US EPA 2019)]. [Disponible en anglais seulement]
[Mobil] Mobil Chemical Co. 1995. Four-week systemic toxicity study following daily dermal administration to rats. [consulté le 10 juin 2019] [Summary; Study 5 in Repeated-dose toxicity in HPVIS (US EPA 2019)]. [Disponible en anglais seulement]
[MSDS] Material Safety Data Sheet. 2004a. Castrol Syntec Synthetic Motor Oil (All SAE Grades) 0W-30, 5W-20, 5W-30, 5W-40, 10W-30, 10W-40, 20W-50, 5W-50. Castrol Canada Inc. [Disponible en anglais seulement]
[MSDS] Material Safety Data Sheet. 2004b. PC Ultra Disc Brake Caliper Lube 59ML (Lubricant). Permatex Canada, Inc. [Disponible en anglais seulement]
[MSDS] Material Safety Data Sheet. 2009. Mystik® JT-4® Synthetic ATV/UTV Engine Oil (Motor Oil), SAE 0W-40. CITGO Petroleum Corporation. [Disponible en anglais seulement]
[MSDS] Material Safety Data Sheet. 2010. Mystik® JT-7® Synthetic Blend Gear Lubricant, SAE 75W-90 (Gear Oil). CITGO Petroleum Corporation. [Disponible en anglais seulement]
[MSDS] Material Safety Data Sheet. 2012a. Tufoil for Engines (Engine lubricant). Fluoramics Inc. [Disponible en anglais seulement]
[MSDS] Material Safety Data Sheet. 2012b. Tufoil for Engines (Engine lubricant). Marine Engine Oil; SAE 25W-40 Synthetic Blend. Mercury Marine. [Disponible en anglais seulement]
[MSDS] Material Safety Data Sheet. 2015. Quaker State Full Synthetic 75W-140 (GL-5) – Transmission Oil. Shell Canada Products. [Disponible en anglais seulement]
[OCDE] Boîte à outils QSAR [outil d’extrapolation]. 2014. Ver. 3.3. Paris (FR): Organisation for Economic Co-operation and Development, Laboratory of Mathematical Chemistry. [Disponible en anglais seulement]
[OCDE] Boîte à outils QSAR [outil d’extrapolation]. 2019. Ver. 4.3. Paris (FR): Organisation for Economic Co-operation and Development, Laboratory of Mathematical Chemistry. [Disponible en anglais seulement]
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement (NL)]. 2009. The ConsExpo Spray Model. Modelling and experimental validation of the inhalation exposure of consumers to aerosols from spray cans and trigger sprays. Bilthoven (NL): RIVM. Report No.: 320104005/2009. [Disponible en anglais seulement]
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement (NL)]. 2010. New default values for the spray model. Bilthoven (NL): RIVM, Mars 2010. [Disponible en anglais seulement]
[SafePharm] SafePharm Laboratories Ltd. 1995a. Twenty-eight day sub-acute oral (gavage) toxicity study in the rat – Limit test, including recovery groups. Rapport non publié préparé pour Chevron Research and Technology Company. [consulté le 10 juin 2019] [Summary; Study 6 in Repeated-dose toxicity in HPVIS (US EPA 2019)] [Disponible en anglais seulement]
[SafePharm] SafePharm Laboratories Limited (1995b). Micronucleus test in the mouse. Rapport non publié préparé pour Chevron Research and Technology Company. [consulté le 10 juin 2019]. [Summary; Study 4 Genetic toxicity in vivo in HPVIS (US EPA 2019)].
[SafePharm] SafePharm Laboratories Limited. 1995c. Micronucleus test in the mouse. Rapport non publié préparé pour Chevron Research and Technology Company. [consulté le 10 juin 2019] [Summary; Study 3 Genetic toxicity in vivo in HPVIS (US EPA 2019)]. [Disponible en anglais seulement]
[SafePharm] SafePharm Laboratories Limited. 1995d. Salmonella typhimurium and Escherichia coli/Mammalian-Microsome Reverse Mutation Assay. Rapport non publié préparé pour Chevron Research and Technology Company. [consulté le 10 juin 2019] [Summary; Study 6 Genetic toxicity in vitro in HPVIS (US EPA 2019)]. [Disponible en anglais seulement]
[SafePharm] SafePharm Laboratories Limited. 1995e. Chromosome aberration test in human lymphocytes. Rapport non publié préparé pour Chevron Research and Technology Company. [consulté le 10 juin 2019] [Summary; Study 4 Genetic toxicity in vitro in HPVIS (US EPA 2019)]. [Disponible en anglais seulement]
Santé Canada. 1994. L’évaluation du risque à la santé humaine des substances d’intérêt prioritaire. Ottawa (Ont.) : ministre d’Approvisionnements et Services Canada. No au cat. : En40-215/41E.
Scheuermann SS, Eibl S, Bartl P. 2011. Detailed characterisation of isomers present in polyalphaolefin dimer and the effect of isomeric distribution on bulk properties. Lubric Sci. 23:221–232. [Disponible en anglais seulement]
[SDS] Safety Data Sheet. 2013a. Mystik JT-7 Extended Ranged Synthetic Gear Oil, SAE 75W-140. CITGO Petroleum Corporation. [Disponible en anglais seulement]
[SDS] Safety Data Sheet. 2013b. MotoMaster Synthetic Gear Oil SAE 75W-90. CITGO Petroleum Corporation. [Disponible en anglais seulement]
[SDS] Safety Data Sheet. 2016. CLP Aerosol. [PDF] Jacksonville (FL): Safariland, LLC. [Disponible en anglais seulement]
[SDS] Safety Data Sheet. 2018. CLP Liquid. [PDF] Jacksonville (FL): Safariland, LLC. [Disponible en anglais seulement]
SITEK Research Laboratories. 2001. Test for chemical induction of gene mutation at the HGPRT locus in cultured Chinese hamster ovary (CHO) cells with and without metabolic activation with a confirmatory assay. Rapport non publié préparé pour Chevron Research and Technology Company, unpublished report. [consulté le 10 juin 2019] [Summary; Study 3 Genetic toxicity in vitro in HPVIS (US EPA 2019)]. [Disponible en anglais seulement]
[Stonybrook] Stonybrook Laboratories, Inc. 1995a. 90-day oral feeding study in Fischer 344 rats with hydrogenated polyalpha Decene in the diet, (1995) Performed by Stonybrook Laboratories, Inc. for Mobil Corporation. [consulté le 10 juin 2019] [Summary; Study 3 Repeated-dose toxicity in HPVIS (US EPA 2019)] [Disponible en anglais seulement]
[Stonybrook] Stonybrook Laboratories, Inc. 1995b. An Ames Salmonella/mammalian microsome mutagenesis assay. [consulté le 10 juin 2019] [Summary; Study 1 Genetic toxicity in vitro in HPVIS (US EPA 2019)] [Disponible en anglais seulement]
[Stonybrook] Stonybrook Laboratories, Inc. 1995c. Assay for induction of chromosomal aberrations in cultured Chinese hamster ovary (CHO) cells. Performed by Stonybrook Laboratories, Inc. [consulté le 10 juin 2019] [Summary; Study 2 Genetic toxicity in vitro in HPVIS (US EPA 2019)] [Disponible en anglais seulement]
Thompson PW. (1995) Salmonella typhimurium and Escherichia coli/mammalian-microsome reverse mutation assay. Report by Safepharm Laboratories Limited, Derby U.K. conducted for Chevron Research & Technology Company, Richmond, CA. [consulté le 10 juin 2019] [Summary; Study 5 Genetic toxicity in vitro in HPVIS (US EPA 2019)]. [Disponible en anglais seulement]
[US EPA] United States Environmental Protection Agency. 2010. Screening-level hazard characterization. Sponsored chemical. [PDF] 1-Decene, tetramer, mixed with 1-decene trimer, hydrogenated (CAS RN 68649‑12‑7). [consulté le 14 mai 2019]. [Disponible en anglais seulement]
[US EPA] United States Environmental Protection Agency. 2019. ChemView [database on the Internet]. Search results for CAS RN 68649-12-7. [Mis à jour le 9 août 2019]. [Disponible en anglais seulement]
Wegner MD, Sterner TR, Mumy KL, Wong BA, Mattie DR. 2018. Histopathology results for acute and two-week inhalation toxicity studies with polyalphaolefin (PAO) fluid in rats. Interim report. Air Force Research Laboratory; 711th Human Performance Wing; Airman Systems Directorate; Human-centered ISR Division; Molecular Mechanisms Branch; Wright-Patterson AFB OH 45433. [consulté le 4 juin 2019]. [Disponible en anglais seulement]
Annexe A. Méthode d’extrapolation
| Considération | Justification |
|---|---|
1) Structure chimique. L’accent a été placé sur les analogues ayant de longues chaînes d’hydrocarbures (C20-C40) ramifiées dans lesquelles les doubles liaisons carbone-carbone ont été hydrogénées pour former des liaisons simples. Aucun groupe fonctionnel additionnel n’a été inclus. | Les analogues ayant une structure chimique similaire devraient avoir des profils de toxicité similaires. |
2) Profilages communs de la Boîte à outils QSAR de l’OCDE/des alertes structurales | Les analogues donnant des alertes structurales similaires devraient présenter une plus grande similarité sur le plan des propriétés physico-chimiques, des voies d’exposition, de la biodisponibilité et de la toxicité. |
3) Propriétés physico-chimiques similaires. L’accent a été placé sur les structures chimiques présentant un poids moléculaire, une solubilité dans l’eau, une pression de vapeur et un log Koe similaires. | Les analogues présentant des propriétés physico-chimiques similaires pourraient avoir un profil toxicologique similaire. |
4) Effets sur la santé similaires. L’accent a été placé sur les analogues dont des données sur les effets sur la santé sont disponibles pour les substances (du groupe des décènes) cibles et analogues : toxicité aiguë, irritation, sensibilisation (données pivots). | Les analogues ayant des résultats de données pivots similaires présenteront des profils toxicologiques similaires pour d’autres critères d’évaluation du danger. |
Annexe B. Résumé des dangers du di(déc-1-ène) hydrogéné, du poly(déc-1-ène) hydrogéné et de substances analogues
| Nom chimique | Di(déc-1-ène) hydrogéné | Tétramère du déc-1-ène, mélangé avec le trimère du déc-1‑ène hydrogéné (poly(déc-1‑ène) hydrogéné) | Homopolymère du déc-1‑ène hydrogéné | Dodéc-1‑ène dimérisé avec du déc-1‑ène hydrogéné |
|---|---|---|---|---|
Rôle | Substance cible | Substance cible | Analogue 1 | Analogue 2 |
No CAS | 68649-11-6 | 68649-12-7 | 68037-01-4 | 151006-58-5 |
Structure chimique |  (Structure représentative des dimères) (Structure représentative des dimères) |  (Structure représentative des trimères) (Structure représentative des trimères) |  n inconnue n inconnue |  |
Formule moléculaire | C20H42 | C30H62 | C30H62 and C40H82 (ECHA 2019a) | C20-22H42-46 (ECHA 2019b) |
Poids moléculaire (g/mol) | 282,556 | 422,81 | 422-562 (ECHA 2019a) | 282-310 (ECHA 2019b) |
Point de fusion (°C) | -73 (expérimental) (ECHA c2007-2019a) | -73 (expérimental) (US EPA 2010, 2019) | < -57 (ECHA 2019a) | ND |
Point d’ébullition (°C) | ND | ND | 217 – 596 à 101,3 kPa (ECHA 2019a) | ND |
Pression de vapeur (Pa) | 1,889 (expérimental) (ECHA c2007-2019a) | < 13 (expérimental) (US EPA 2010, 2019) | < 0,545 Pa à 20 °C (ECHA c2007-2019d) | ND |
Solubilité dans l’eau (mg/L) | < 0,1 à 20 °C (expérimental) (ECHA c2007-2019a) | ND | 0,1 (100 µg/L) à 20 °C et à pH 7 (mesuré; essai no 105 des Lignes directrices de l’OCDE [Nexbase 2006]) (ECHA c2007-2019d) | ND |
log Koe (sans dimension) | > 6,5 (expérimental [Nexbase 2002]) (ECHA c2007-2019a) | > 5 (expérimental) (ECHA c2007-2019b) | > 6,5 à 20 °C et à pH 7 (mesuré; essai no 117 des Lignes directrices de l’OCDE [Nexbase 2006]) (ECHA c2007-2019d) | ND |
Toxicité aiguë (voie orale) | DL50 > 4 100 mg/kg ou 5 mL/kg p.c. chez le rat [SF-0203-41] (ECHA c2007-2019a) DL50 > 5 000 mg/kg chez le rat [Emery 3002] (ECHA c2007-2019a) DL50 > 15 380 mg/kg p.c. chez le rat [Synfluid SF‑0201‑3] (ECHA c2007-2019a) | DL50 > 5 000 mg/kg p.c. chez le rat [Emery 3004] (ECHA c2007-2019a) | DL50 > 5 000 mg/kg p.c. chez le rat [Emery 3006] (ECHA c2007-2019a) | DL50 > 5 000 mg/kg p.c. chez le rat [Oronite XS 101] (ECHA c2007-2019a) |
Toxicité aiguë (inhalation) | CMENO = 100 mg/m3, établie d’après les effets histopatho-logiques observés dans les cavités nasales et les poumons, chez le rat (6 h; exposition de l’animal en entier suivie d’une période de récupération de 14 j) (Mattie et coll. 2017; Wegner et coll. 2018) CL50 (4 h) = 900-1 400 mg/m3 (femelle); 1 400- 2 000 mg/m3 (mâle), chez le rat [SF-0203-41]; mortalité (différentes concentrations); effets sur les poumons révélés à la nécropsie macroscopique chez tous les animaux morts (ECHA c2007-2019a) CL50 (1 h) : incapacité de déterminer la CL50 en raison de la mortalité des rats dans les 3 jours suivant l’exposition; des signes cliniques, des pertes de poids corporel et des variations du poids des poumons et de la trachée ont été rapportés [Oronite Synfluid PAO 2cSt] (ECHA c2007-2019a) CL50 (4 h) < 10 000 mg/m3 chez le rat; 6/10 des rats sont morts dans les 12 heures suivant l’exposition [Synfluid SF 0201-3] (ECHA c2007-2019a) |
| CL50 (4 h) > 5,2 mg/L (5 200 mg/m3), chez le rat [MRD-05465] (ECHA c2007-2019a) CL50 (4 h) > 2,5 mg/L (2 500 mg/m3), chez le rat (US EPA 2010) | ND |
Toxicité aiguë (voie cutanée) | DL50 > 3 000 mg/kg p.c. chez le lapin [Synfluid SF 0201‑3] (ECHA c2007-2019a) | ND | DL50 > 2 mL/kg p.c. ou 1640 mg/kg, chez le lapin [SF-0802-37; homopolymère de déc-1‑ène hydrogéné] (ECHA c2007-2019b) | DL50 > 2 000 mg/kg p.c. chez le rat [Oronite XS 101] (ECHA c2007-2019a) |
Sensibilisation cutanée | N’est pas un sensibilisant cutané chez le cobaye [Ethylflo 362NF; Ethylflo 364NF; Oronite Synfluid PAO 2cST] (ECHA c2007-2019a) | ND | N’est pas un sensibilisant cutané chez le cobaye [Silkflo 366 NF] (ECHA c2007-2019a) | ND |
Toxicité à court terme à doses répétées (voie orale) | ND | ND | Étude chez le rat, par gavage (28 j) : DSENO = 5 000 mg/kg p.c./j (DME) (Mobil 1990a; US EPA 2010) Étude chez le rat, par l’alimentation (28 j) : DSENO = 6 245 mg/kg p.c./jour (mâle); 6 771 mg/kg p.c./j (femelle); (DME) [Nexbase 2006 FG] (ECHA c2007-2019a) | Étude chez le rat, par gavage (29 j) : DSENO = 1 000 mg/kg p.c./j [Oronite XS 101] (ECHA c2007-2019a)
|
Toxicité à court terme à doses répétées (voie cutanée) | ND | ND | ND | ND |
Toxicité subchronique à doses répétées (voie orale) | ND | ND | Étude chez le rat, par gavage (91 j, étude de toxicité combinant l’exposition à doses répétées et la toxicité pour la reproduction) : DSENO = 1 000 mg/kg/j (DME) [Ethylflo 166] (Daniel 1994; ECHA c2007-2019a; US EPA 2010) Étude chez le rat, par l’alimentation (exposition de 90 j, suivie de 4 semaines de récupération) : DSENO = 4 159,4 mg/kg p.c./j (mâle); 4 619,9 mg/kg p.c./j (femelle); [Nexbase 2006 FG] (ECHA c2007-2019a) Étude chez le rat, par l’alimentation (90 j) : DSENO = 20 000 ppm ou 1 000 mg/kg p.c./ja (DME) (Stonybrook Laboratories 1995a; US EPA 2010) Étude chez le rat, par l’alimentation (90 j) : DSENO = 20 000 ppm or 1 000 mg/kg p.c./ja (DME) (Mobil 1990b; US EPA 2010) | ND |
Toxicité pour la reproduction et le développement (voie orale) | ND | ND | Étude de toxicité pour la reproduction, à doses répétées, chez le rat, par gavage : DSENO repro-duction = 1 000 mg/kg/j (DME) [Ethylflo 166] (Daniel 1994; ECHA c2007-2019a; US EPA 2010) | ND |
Toxicité pour la reproduction et le développement (voie cutanée) | ND | ND | Étude de toxicité pour le développement, chez le rat (JG 0-19) : DSENO déve-loppement = 2 000 mg/kg/j (DME) (Mobil 1988; US EPA 2010) | ND |
Génotoxicité | ND | ND | Résultat négatif au test du micronoyau in vivo (ECHA c2007-2019a; Mobil 1985; US EPA 2010) Résultat négatif au test sur la mutagénicité (ECHA c2007-2019a) | Résultat négatif au test du micronoyau in vivo (ECHA c2007-2019a) |
Cancérogénicité | ND | ND | Étude de toxicité cutanée, chez la souris (104 semaines) : 50 uL/ application, 2 fois/semaine, par induction de tumeurs cutanées (Kettering 1990; US EPA 2010) | ND |
a Conversion de dose fondée sur 1 ppm dans la nourriture = 0,05 mg/kg p.c./j chez le rat (Santé Canada 1994).
Abréviations : DME = dose maximale à l’essai; ND = non déterminée.
| Nom chimique | Di(déc-1-ène) hydrogéné (di(déc-1-ène hydrogéné) | Tétramère du déc-1-ène, mélangé avec le trimère du déc-1‑ène hydrogéné (poly(déc-1-ène) hydrogéné) | Dodéc-1-ène polymérisé avec du déc-1-ène hydrogéné | Trimère du dodéc-1-ène hydrogéné |
|---|---|---|---|---|
Rôle | Substance cible | Substance cible | Analogue 3 | Analogue 4 |
No CAS | 68649-11-6 | 68649-12-7 | 151006-60-9 | 151006-62-1 |
Structure chimique |  |  (Structure représentative d’un trimère) (Structure représentative d’un trimère) |  n et m sont inconnues n et m sont inconnues |  |
Formule moléculaire | C20H42 | C30H62 | C32-34H66-70 (ECHA 2019c) | C36H74 (ECHA 2017) |
Poids moléculaire (g/mol) | 282,556 | 422,81 | 450-478 (ECHA 2019c) | 506,0 (ECHA 2017) |
Point de fusion (°C) | -73 (expérimental) (ECHA c2007-2019a) | -73 (expérimental) (US EPA 2010, 2019) | ND | ND |
Point d’ébullition (°C) | ND | ND | ND | ND |
Pression de vapeur (Pa) | 1,889 (expérimental) (ECHA c2007-2019a) | < 13 (expérimental) (US EPA 2010, 2019) | ND | 2,5 × 10-7 à 25 °C (EC 2017) |
Solubilité dans l’eau (mg/L) | < 0,1 à 20 °C (expérimental) (ECHA c2007-2019a) | ND | ND | < 0,1-0,482 mg/L à 20 °C; < 1E-6 mg/L (EC 2017) |
log Koe (sans dimension) | > 6,5 (expérimental) [Nexbase 2002] (ECHA c2007-2019a) | > 5 (expérimental) (ECHA c2007-2019b) | ND | >3,87 à 20 °C; > 6,5 à 20 °C; > 7,64 (EC 2017) |
Toxicité aiguë (voie orale) | DL50 > 4 100 mg/kg ou 5 mL/kg p.c. chez le rat [SF-0203-41] (ECHA c2007-2019a) DL50 > 5 000 mg/kg chez le rat [Emery 3002] (ECHA c2007-2019a) DL50 > 15 380 mg/kg p.c. chez le rat [Synfluid SF‑0201‑3] (ECHA c2007-2019a) | DL50 > 5 000 mg/kg p.c. chez le rat [Emery 3004] (ECHA c2007-2019a) | DL50 >5 000 mg/kg p.c. chez le rat [Alcane 5] (ECHA c2007-2019a; US EPA 2010) | DL50 > 5 000 mg/kg p.c. chez le rat [Alcane 4] (ECHA c2007-2019a; US EPA 2010)
|
Toxicité aiguë (inhalation) | CMENO = 100 mg/m3, d’après les effets histopathologiques présents dans les cavités nasales et les poumons des rats (6 heures; exposition de l’animal en entier suivie d’une période de récupération de 14 j) (Mattie et coll. 2017; Wegner et coll. 2018) CL50 (4 h) = 900-1 400 mg/m3 (femelle); 1 400-2 000 mg/m3 (mâle), chez le rat [SF-0203-41]; mortalité (différentes concentrations); effets sur les poumons observés à la nécropsie macroscopique chez tous les animaux qui sont morts (ECHA c2007-2019a) CL50 (1 h) : incapacité à déterminer la CL50 en raison de la mortalité chez les rats dans les 3 j suivant l’exposition; des signes cliniques, la perte de poids corporel, et des variations du poids des poumons et de la trachée ont été rapportés [Oronite Synfluid PAO 2cSt] (ECHA c2007-2019a) CL50 (4 h) < 10 000 mg/m3 chez le rat; 6/10 rats sont morts dans les 12 h suivant l’exposition [Synfluid SF 0201‑3] (ECHA c2007-2019a) | ND | 4 ours CL50 > 5,0 mg/L (5 000 mg/m3) chez le rat [Alcane 5] (ECHA c2007-2019a; US EPA 2010) | 4 ours CL50 > 5,06 mg/L (5 060 mg/m3) chez le rat [Alcane 4] (ECHA c2007-2019a; US EPA 2010) |
Toxicité aiguë (voie cutanée) | DL50 > 3 000 mg/kg p.c. chez le lapin [Synfluid SF 0201‑3] (ECHA c2007-2019a) | ND | CL50 > 2 000 mg/kg p.c. chez le rat [Alcane 5] (ECHA c2007-2019a; US EPA 2010) | CL50 > 2 000 mg/kg p.c. chez le rat [Alcane 4] (ECHA c2007-2019a; US EPA 2010) |
Sensibilisation cutanée | N’est pas un sensibilisant cutané chez le cobaye [Ethylflo 362NF; Ethylflo 364NF; Oronite Synfluid PAO 2cST] (ECHA c2007-2019a) | ND | ND | ND |
Toxicité à court terme à doses répétées (voie orale) | ND | ND | ND | Étude chez le rat, par gavage (28 j) : DSENO = 1 000 mg/kg (dose unique) p.c./j [Alcane 4] (ECHA c2007-2019a; SafePharm Laboratories 1995a; US EPA 2010) |
Toxicité à court terme à doses répétées (voie cutanée) | ND | ND | ND | ND |
Toxicité subchronique à doses répétées (voie orale) | ND | ND | ND | Étude par voie orale chez le rat, par gavage (10 semaines) : DSENO = 1 000 mg/kg p.c./j (DME) [Alcane 4] (ECHA c2007-2019a) |
Toxicité subchronique à doses répétées (voie cutanée) | ND | ND | ND | ND |
Toxicité à long terme à doses répétées (voie orale) | ND | ND | ND | ND |
Toxicité pour la reproduction et le développement (voie orale) | ND | ND | ND | Étude sur la toxicité pour la reproduction sur une génération, chez le rat, par gavage : DSENO reproduction et développement = 1 000 mg/kg p.c. (DME) [Alcane 4] (ECHA c2007-2019b) |
Toxicité pour la reproduction et le développement (voie cutanée) | ND | ND | ND | ND |
Génotoxicité | ND | ND | Résultat négatif au test du micronoyau in vivo (ECHA c2007-2019c; SafePharm 1995c)
Résultat négatif à l’épreuve de mutagénicité in vitro (Thompson 1995; US EPA 2010) | Résultat négatif au test du micronoyau in vivo (SafePharm 1995b; ECHA c2007-2019a) Résultat négatif à l’épreuve de mutagénicité in vitro (ECHA c2007-2019a; SafePharm 1995d; SITEK Research Laboratories 2001; US EPA 2010) Résultat négatif à l’épreuve de clastogénicité in vitro (ECHA c2007-2019a; SafePharm 1995e; US EPA 2010) |
Cancérogénicité | ND | ND | ND | ND |
a Conversion de dose fondée sur 1 ppm dans la nourriture = 0,05 mg/kg p.c./j chez le rat (Santé Canada 1994).
Abréviation : DME = dose maximale à l’essai; ND = non déterminée.
| Nom chimique | Di(déc-1-ène) hydrogéné (di(déc-1-ène) hydrogéné) | Tétramère du déc-1-ène, mélangé avec le trimère du déc-1 ène hydrogéné (poly(déc-1-ène) hydrogéné) | Dodéc-1-ène polymérisé avec du déc-1-ène et de l’oct-1-ène hydrogéné | Mélange de 7‑méthylène-pentadécane et de tétradéc-1-ène, dimères et trimères, hydrogénés |
|---|---|---|---|---|
Rôle | Substance cible | Substance cible | Analogue 5 | Analogue 6 |
No CAS | 68649-11-6 | 68649-12-7 | 163149-28-8 | 1000172-11-1 |
Structure chimique |  |  (Structure représentative des trimères) (Structure représentative des trimères) |  n, m et p sont inconnues n, m et p sont inconnues | 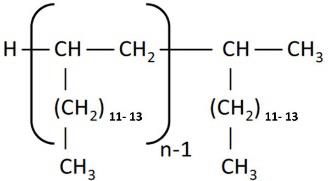 Où n = 2-4 Où n = 2-4 |
Formule moléculaire | C20H42 | C30H62 | C26-30H54-62 (ECHA 2019d) | C28-80H58-162 (ECHA c2007-2019c) |
Poids moléculaire (g/mol) | 282,556 | 422,81 | 366-422 (ECHA 2019d) | 394-1122 (ECHA c2007-2019c) |
Point de fusion (°C) | -73 (expérimental) (ECHA c2007-2019a) | -73 (expérimental) (US EPA 2010, 2019) | ND | -63 à -39 [Durasyn 124] (ECHA c2007-2019c) |
Point d’ébullition (°C) | ND | ND | ND | 187-570 [Durasyn 124] (ECHA c2007-2019c) |
Pression de vapeur (Pa) | 1,889 (expérimental) (ECHA c2007-2019a) | < 13 (expérimental) (US EPA 2010, 2019) | ND | < 0,013 à 20 °C (0,000 1 mmHg à 68 °F [Durasyn 124] (ECHA c2007-2019c) |
Solubilité dans l’eau (mg/L) | < 0,1 à 20 °C (expérimental) (ECHA c2007-2019a) | ND | < 0,4 mg/L à 24 °C et à pH 7 (étudié sous forme de MCP 1602) (ECHA 2019d) | ND |
log Koe (sans dimension) | > 6,5 (expérimental) [Nexbase 2002] (ECHA c2007-2019a) | > 5 (expérimental) (ECHA c2007-2019b) | ND | ND |
Toxicité aiguë (voie orale) | DL50 > 4 100 mg/kg ou 5 mL/kg p.c. chez le rat [SF-0203-41] (ECHA c2007-2019a) DL50 > 5 000 mg/kg chez le rat [Emery 3002] (ECHA c2007-2019a) DL50 > 15 380 mg/kg p.c. chez le rat [Synfluid SF-0201-3] (ECHA c2007-2019a) | DL50 > 5 000 mg/kg p.c. chez le rat [Emery 3004] (ECHA c2007-2019a) | DL50 > 2 000 mg/kg p.c. chez le rat [copolymère avec un octène, un décène et un dodécène] (US EPA 2010) | ND |
Toxicité aiguë (inhalation) | CMENO = 100 mg/m3 établie d’après les effets histopatho-logiques observés dans les cavités nasales et les poumons des rats (6 h; exposition de l’animal entier suivie d’une période de récupération de 14 j) (Mattie et coll. 2017; Wegner et coll. 2018) CL50 (4 h) = 900-1 400 mg/m3 (femelle); 1 400-2 000 mg/m3 (mâle) chez le rat [SF-0203-41]; mortalités (à différentes concentrations); effets sur les poumons observés à la nécropsie macroscopique chez tous les animaux qui moururent (ECHA c2007-2019a) CL50 (1 h) : incapacité de déterminer la CL50, car les rats sont morts dans les 3 j suivant l’exposition; des signes cliniques, une perte de poids corporel et des variations du poids des poumons et de la trachée ont été rapportés [Oronite Synfluid PAO 2cSt] (ECHA c2007-2019a) CL50 (4 h) < 10 000 mg/m3 chez le rat; 6/10 rats sont morts dans les 12 h suivant l’exposition [Synfluid SF 0201-3] (ECHA c2007-2019a) | ND | ND | ND |
Toxicité aiguë (voie cutanée) | DL50 > 3 000 mg/kg p.c. chez le lapin [Synfluid SF 0201‑3] (ECHA c2007-2019a) | ND | ND | ND |
Sensibilisation cutanée | N’est pas un sensibilisant cutané chez le cobaye [Ethylflo 362NF; Ethylflo 364NF; Oronite Synfluid PAO 2cST] (ECHA c2007-2019a) | ND | ND | ND |
Toxicité à court terme à doses répétées (voie orale) | ND | ND | ND | ND |
Toxicité à court terme à doses répétées (voie cutanée) | ND | ND | Étude de toxicité cutanée chez le rat (4 semaines d’exposition suivies de 2 semaines d’observation) : DSENO = 2 000 mg/kg/j (DME) [copolymère avec un octène, un décène et un dodécène] (Mobil 1995; US EPA 2010) | ND |
Toxicité subchronique à doses répétées (voie orale) | ND | ND | ND | Étude de toxicité orale chez le rat, par gavage (provenant de l’étude de toxicité pour la reproduction) : DSENO = 1 000 mg/kg p.c./j (DME) [Durasyn 164X] (ECHA c2007-2019c) |
Toxicité pour la reproduction et le développement (voie orale) | ND | ND | ND | Étude de toxicité orale pour la reproduction sur 2 générations chez le rat, par gavage : DSENO reproduction et développement = 1 000 mg/kg p.c./j (DME) [Durasyn 164X] (ECHA c2007-2019c) |
Toxicité pour la reproduction et le développement (voie cutanée) | ND | ND | ND | ND |
Génotoxicité | ND | ND | Résultat négatif à l’épreuve de mutagénicité in vitro (Stonybrook 1995b; US EPA 2010) Résultat négatif à l’épreuve de clastogénicité in vitro (Stonybrook 1995c; US EPA 2010) | Résultat négatif à l’épreuve de mutagénicité in vitro (ECHA c2007-2019c) |
Cancérogénicité | ND | ND | ND | ND |
a Conversion de dose fondée sur 1 ppm de nourriture = 0,05 mg/kg p.c./jour chez le rat (Santé Canada 1994).
Abréviation : DME = dose maximale à l’essai; ND = non déterminée
Annexe C. Exposition par inhalation chez l’humain découlant de l’utilisation de produits en pulvérisateur pour l’entretien des armes à feu
| Scénario d’exposition | Paramètres et hypothèses |
|---|---|
Paramètres communs pour un adulte nettoyant une seule arme à feu désassemblée (pistolet) avec un NLP | La modélisation ConsExpo Web (2016) a été utilisée pour estimer l’exposition par inhalation d’aérosols. Tous les paramètres proviennent de ConsExpo Web (2016) sauf si indiqué autrement. Modèle : exposition Mode de rejet : pulvérisation (ciblée) Durée de l’exposition : 20 minutes (jugement professionnel exercé par visionnement de vidéos d’utilisateurs qui pulvérisaient un lubrifiant ou un nettoyant sur une arme à feu de manière intermittente pendant des périodes de 2 à 5 minutes sur une période de nettoyage d’une durée de 20 minutes) Durée de la pulvérisation : 20 secondes (jugement professionnel exercé par visionnement de vidéos d’utilisateurs professionnels pulvérisant un produit sur une petite arme à feu) Volume de la pièce : 20 m3 (local d’entretien/local non précisé); hauteur du plafond : 2,5 m Taux de renouvellement d’air : 0,6/h Groupe d’âge : 19 ans et plus |
Pulvérisateur d’aérosols | Fraction atmosphérique : 0,2 g/g pour les lubrifiants, en vaporisateur, pénétrants en pulvérisateur (RIVM 2009) Diamètre médian des aérosols : 23,3 µm (distribution log-normale; coefficient de variation arithmétique : 1,3 pour les lubrifiants, vaporisateur, pénétrants en pulvérisateur (RIVM 2009) Taux de production massique : 1,5 g/s pour les lubrifiants, en vaporisateur, pénétrants en pulvérisateur (Tuinman et coll. 2007, mentionné dans RIVM 2009) Densité des particules non volatiles : 1,8 g/cm3 (d’après les valeurs par défaut pour les produits antiparasitaires, en pulvérisateur, de manière ciblée, en vaporisateur, mentionné dans ConsExpo Web 2016) Diamètre maximal des particules inhalées : 49,9 µm (pour englober les tailles plus grandes des particules pouvant pénétrer dans les cavités nasales) |
Pulvérisateur à gâchette | Fraction atmosphérique : 0,008 g/g (pour un produit prêt à l’emploi, de manière ciblée, pour les fissures) (RIVM 2010) Diamètre médian des aérosols : 7,7 µm (distribution log‑normale; Coefficient de variation arithmétique : 1,9; pour un produit prêt à l’emploi, de manière ciblée, pour les fissures) (RIVM 2010) Taux de production massique : 1,6 g/s; par défaut, pour tous les pulvérisateurs à gâchette, dans RIVM (2009) Densité des particules non volatiles : 1,8 g/cm3 (d’après les valeurs par défaut établies pour les produits antiparasitaires, pulvérisations, de manière ciblée, pulvérisateur à gâchette, dans ConsExpo Web 2016) Diamètre maximal des particules inhalées : 49,9 µm (pour englober les tailles plus grandes des particules pouvant pénétrer dans les cavités nasales) |
