Ébauche d’évaluation préalable - Groupe des hexaméthylènetétramines
Titre officiel : Ébauche d’évaluation préalable - Groupe des hexaméthylènetétramines
Numéros de registre du Chemical Abstracts Service
4080-31-3
51229-78-8
58713-21-6
Environnement et Changement climatique Canada
Santé Canada
Mars 2021
Sommaire
En vertu de l’article 68 ou de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), le ministre de l’Environnement et le ministre de la Santé ont procédé à l’évaluation préalable des substances appelées collectivement par le cadre du Plan de gestion des produits chimiques « groupe des hexaméthylènetétramines ». Les substances de ce groupe ont été jugées prioritaires pour une évaluation, car elles satisfont aux critères de catégorisation énoncés au paragraphe 73(1) de la LCPE ou suscitent d’autres préoccupations pour la santé humaine. Leurs numéros de registre du Chemical Abstracts Service (no CASNote de bas de page 1), leurs noms sur la Liste intérieure des substances (LIS) et leurs noms communs ou abréviations sont énumérés dans le tableau ci-dessous.
| NO CAS | Nom dans la LIS | Nom commun |
|---|---|---|
| 4080-31-3a | 3-Chloroallylochlorure de méthénamine |
|
| 51229-78-8c | Chlorure de (Z)-1-(3-chloroprop-2-ényl)-3,5,7-triaza-1-azoniatricyclo[3.3.1.1³,7]décane |
|
| 58713-21-6c | 1,3,5,7-Tétraazatricyclo[3.3.1.1³,7]décane, chlorhydrate |
|
a Ce no CAS est un mélange de chlorures de cis-1-(3-chloroallyl)-3,5,7-triaza-1-azoniaadamantane et de trans-1-(3-chloroallyl)-3,5,7-triaza-1-azoniaadamantane (CTAC).
b Selon la base de données de la Commission européenne sur les substances et ingrédients cosmétiques (CosIng), le « quaternium‑15 » est représenté par le no CAS 4080-31-3 ou par un mélange contenant les nos CAS 4080-31-3 et 51229-78-8.
c Cette substance n’a pas été retenue en vertu du paragraphe 73(1) de la LCPE, mais elle est incluse dans la présente évaluation, car elle est considérée comme prioritaire en raison d’autres préoccupations liées à la santé humaine.
d En Europe, le Comité scientifique pour la sécurité des consommateurs (SCCS) utilise le terme « quaternium‑15 » pour désigner le cis‑CTAC (no CAS 51229-78-8).
Les substances du groupe des hexaméthylènetétramines ont été visées par une enquête menée en vertu de l’article 71 de la LCPE. Au cours de l’année civile 2011, on a importé au Canada entre 10 000 et 100 000 kg de cis/trans‑CTAC et entre 1 000 à 10 000 kg de cis‑CTAC. Le cis/trans-CTAC et le cis-CTAC n’ont pas été synthétisés au Canada au-delà du seuil de déclaration de 100 kg. Aucune quantité de chlorhydrate de méthénamine n’a été fabriquée ou importée au-delà du seuil de déclaration de 100 kg au Canada. Au Canada, le cis/trans-CTAC et le cis-CTAC sont utilisés dans les secteurs de l’automobile, de l’aéronautique et des transports, dans les produits d’entretien automobile et dans les peintures et revêtements. Les produits de consommation contenant ces deux substances comprennent les produits de nettoyage, les peintures, les adhésifs et les produits de soins personnels (c.-à-d. les cosmétiques, les ingrédients non médicinaux des médicaments en vente libre et les produits de santé naturels). Le cis/trans-CTAC est également un ingrédient médicinal dans les produits pharmaceutiques. En outre, il peut être utilisé comme composant dans les matériaux d’emballage alimentaire, ainsi que dans les nettoyants de surface en contact avec les aliments et les nettoyants pour les mains utilisés dans les établissements de transformation des aliments. Le cis-CTAC peut être utilisé comme composant dans les nettoyants pour les mains et les lubrifiants employés dans les établissements de transformation des aliments. On a déclaré le cis/trans-CTAC, le cis-CTAC et le chlorhydrate de méthénamine comme été trouvés comme produits de formulation dans les produits antiparasitaires homologués au Canada, le cis/trans-CTAC étant aussi présent comme un ingrédient actif dans les produits antiparasitaires.
Les risques pour l’environnement associés aux substances du groupe des hexaméthylènetétramines ont été caractérisés en suivant la Classification du risque écologique (CRE) des substances organiques, laquelle est une méthode fondée sur le risque qui tient compte de plusieurs paramètres liés au danger et à l’exposition, et sur une pondération des multiples éléments de preuve. Les profils des dangers reposent principalement sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne établis dans le réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Les paramètres pris en compte dans les profils d’exposition incluent le taux d’émission potentiel, la persistance globale et le potentiel de transport à grande distance. Une matrice de risque est utilisée pour attribuer aux substances un degré faible, moyen ou élevé de préoccupation potentielle, selon leurs profils de danger et d’exposition. Selon les résultats de l’analyse par l’approche de la CRE, le cis/trans-CTAC, le cis-CTAC et le chlorhydrate de méthénamine sont considérés comme peu susceptibles de causer des dommages écologiques.
Compte tenu de toutes les sources de données disponibles présentées dans cette ébauche d’évaluation préalable, le cis/trans-CTAC, le cis-CTAC et le chlorhydrate de méthénamine présentent un faible risque de dommages pour l’environnement. Il est proposé de conclure que le cis/trans-CTAC, le cis-CTAC et le chlorhydrate de méthénamine ne satisfont à aucun des critères énoncés aux alinéas 64a) ou 64b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
On a procédé à une évaluation commune de l’effet du cis/trans-CTAC et du cis-CTAC sur la santé humaine, car la Nomenclature internationale des ingrédients cosmétiques (INCI) leur attribue la dénomination commune « quaternium‑15 » et ils contiennent un ou plusieurs isomères du composé 3-chloroallylochlorure de méthénamine (CTAC). On a déterminé que les effets sur les testicules et le foie étaient les effets critiques associés au cis/trans-CTAC et au cis-CTAC, par la voie cutanée d’exposition, d’après les données disponibles dans des études de laboratoire. Une comparaison des niveaux d’effets critiques avec les estimations de l’exposition résultant de l’utilisation d’un écran solaire en vente libre ou d’un hydratant corporel (en tant que produit de santé naturel) chez des sous-populations plus jeunes (p. ex., les nourrissons, les tout-petits et les enfants) a donné lieu à des marges d’exposition (ME) qui ont été jugées potentiellement inadéquates pour compenser les incertitudes des bases de données sur l’exposition et les effets sur la santé. Les ME résultantes pour ces produits dans d’autres sous-populations (p. ex., les adolescents et les adultes) ont été jugées adéquates. Les ME résultantes pour les shampoings, les produits hydratants pour le corps (cosmétiques), les permanentes et défrisants, la peinture d’intérieur, les lingettes de nettoyage pour meubles et les détachants ont été jugées adéquates.
On a déterminé que la toxicité générale (c.-à-d. la réduction du poids corporel, la consommation alimentaire) et les effets sur le développement étaient les effets critiques de l’exposition au cis/trans-CTAC et au cis CTAC par la voie orale, d’après les données des études disponibles sur les animaux de laboratoire. Une comparaison des niveaux d’effets critiques avec les estimations de l’exposition par voie orale (c.-à-d. l’exposition alimentaire due à l’utilisation d’emballages alimentaires, à l’eau potable et au contact main-à-la-bouche avec certains produits de consommation) a donné lieu à des ME qui ont été jugées adéquates.
L’ensemble des données sur les effets sur la santé du chlorhydrate de méthénamine a été jugé limité, et les données toxicologiques d’un analogue (c.-à-d. la méthénamine) ont été prises en considération. La méthénamine a été évaluée dans le cadre de l’évaluation préalable du groupe des composés hétérocycliques publiée en juin 2019, dans laquelle on a trouvé que la toxicité pour le développement et la sensibilisation potentielle de la peau étaient des effets critiques. En ce qui concerne l’exposition, le chlorhydrate de méthénamine a été découvert comme impureté uniquement dans des produits de consommation contenant du cis/trans-CTAC. La comparaison des niveaux d’effet critique avec une estimation de l’exposition de la sous-population la plus exposée au cis/trans-CTAC contenant du chlorhydrate de méthénamine en tant qu’impureté a donné lieu à des ME qui sont jugées adéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que le cis/trans-CTAC et le cis-CTAC satisfont aux critères énoncés à l’alinéa 64c) de la LCPE, car ils pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que le chlorhydrate de méthénamine ne satisfait pas aux critères énoncés à l’alinéa 64c) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est proposé de conclure que le cis/trans-CTAC et le cis-CTAC satisfont à un ou plusieurs des critères énoncés à l’article 64 de la LCPE.
Il est proposé de conclure que le chlorhydrate de méthénamine ne satisfait à aucun des critères énoncés à l’article 64 de la LCPE.
Il est également proposé que le cis/trans-CTAC et le cis-CTAC ne satisfassent pas aux critères de persistance ou de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
1. Introduction
En vertu des articles 68 ou 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE) (Canada 2012), le ministre de l’Environnement et le ministre de la Santé ont effectué une évaluation préalable de trois substances désignées collectivement dans le Plan de gestion des produits chimiques sous le nom de « groupe des hexaméthylènetétramines » afin de déterminer si ces substances présentent ou peuvent présenter un risque pour l’environnement ou la santé humaine. Les substances de ce groupe ont été désignées prioritaires aux fins de l’évaluation, car elles satisfont aux critères de catégorisation énoncés au paragraphe 73(1) de la LCPE ou suscitent des inquiétudes quant à la santé humaine (ECCC, SC [modifiée 2017]).
Les risques pour l’environnement dus aux substances du groupe des 2-hydrobenzoates ont été caractérisés à l’aide de la Classification du risque écologique (CRE) des substances organiques (ECCC 2016a). La CRE décrit les dangers d’une substance à l’aide de paramètres clés, y compris le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne obtenus à partir du réseau trophique, la biodisponibilité, ainsi que l’activité chimique et biologique, et elle tient compte de l’exposition possible des organismes dans les milieux aquatique et terrestre, d’après des facteurs comme les taux d’émission potentiels, la persistance globale et le potentiel de transport à grande distance dans l’atmosphère. Les divers éléments de preuve sont combinés pour déterminer les substances qui justifient une évaluation plus approfondie de leur potentiel d’effets nocifs sur l’environnement ou dont la probabilité d’effet nocif sur l’environnement est faible.
On a procédé à une évaluation commune de l’effet du cis/trans‑CTAC et du cis‑CTAC sur la santé humaine, car la Nomenclature internationale des ingrédients cosmétiques (INCI) leur attribue la dénomination commune « quaternium‑15 » et ils contiennent un ou plusieurs isomères du composé 3-chloroallylochlorure de méthénamine (CTAC). Cette approche est similaire à celle adoptée en France par l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES) (2014) dans un rapport de toxicité et par l’EPA dans une décision d’admissibilité à la réhomologation du Dowicil®CTAC (USEPA 1995), qui réévaluait les utilisations pesticides du cis/trans‑CTAC et du cis‑CTAC. Les données de l’EPA (1995) ont servi de base à la réévaluation des utilisations pesticides du CTAC au Canada (Santé Canada 2005).
Pour le chlorhydrate de méthénamine, une approche par lecture croisée a été appliquée, dans le cadre de laquelle les données toxicologiques de l’analogue méthénamine ont été utilisées pour éclairer l’évaluation des effets sur la santé. Dans le cadre de l’évaluation préalable du groupe des hétérocycles (ECCC, SC), Santé Canada et Environnement et changement climatique Canada avaient déjà évalué la méthénamine.
La présente ébauche d’évaluation préalable tient compte de renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et l’exposition, ainsi que de renseignements communiqués par des parties prenantes. On a retrouvé des données pertinentes jusqu’en septembre 2014. Des recherches dans les publications scientifiques ont été poussées jusqu’en novembre 2019 pour obtenir des données toxicologiques. Quand ils étaient disponibles et pertinents, nous avons tenu compte de renseignements présentés dans des évaluations faites ailleurs dans le monde.
La présente ébauche d’évaluation préalable a été préparée par le personnel du Programme d’évaluation des risques de la LCPE travaillant à Santé Canada et à Environnement et Changement climatique Canada. Elle inclut des contributions d’autres programmes de ces deux ministères. Les parties de la présente évaluation préalable portant sur la santé humaine ont fait l’objet d’examens ou de consultations externes. Les commentaires sur les parties techniques contenues dans ce volet ont été formulés par Jennifer Flippin, Theresa Lopez et Joan Garey, toutes affiliées à Tetra Tech. Le volet environnemental de la présente évaluation est fondé sur le document décrivant la classification du risque écologique (publié le 30 juillet 2016), qui a fait l’objet d’une évaluation externe et d’une période de consultation publique de 60 jours. Les commentaires externes ont été pris en compte. Toutefois Santé Canada et Environnement et Changement climatique Canada demeurent responsables du contenu définitif et des conclusions de la présente ébauche d’évaluation préalable.
La présente ébauche d’évaluation préalable est axée sur les renseignements essentiels pour déterminer si une substance satisfait aux critères énoncés à l’article 64 de la LCPE. À cette fin, nous avons examiné des données scientifiques et suivi une approche fondée sur le poids de la preuve et le principe de prudenceNote de bas de page 2. La présente évaluation préalable contient les renseignements et considérations critiques sur lesquels reposent les conclusions proposées.
2. Identité des substances
Le tableau 2-1 indique les numéros de registre du Chemical Abstracts Service (no CAS), les noms inscrits sur la Liste intérieure des substances (LIS), ainsi que les noms communs ou les acronymes des substances individuelles du groupe des hexaméthylènetétraminesNote de bas de page 3.
| NO CAS | Nom dans la LIS (noms communs) | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 4080-31-3a | 3-chloroallylochlorure de méthénamine (cis/trans‑CTAC,quaternium‑15b) | ![[N+]12(CN3CN(C1)CN(C2)C3)C\C=C\Cl.[ClH-]](/content/dam/eccc/images/pded/hexamethylenetetramines/20210203-t21a.jpg) C9H16ClN4·Cl C9H16ClN4·Cl | 251 |
| 51229-78-8 | chlorure de (Z)-1-(3-chloroprop-2-ényl)-3,5,7-triaza-1-azoniatricyclo[3.3.1.1³,7]décane (cis‑CTAC,quaternium‑15c) | (C3)C\C=C/Cl.[ClH-]](/content/dam/eccc/images/pded/hexamethylenetetramines/20210203-t21b.jpg) C9H16ClN4·Cl C9H16ClN4·Cl | 251 |
| 58713-21-6 | 1,3,5,7-tétraazatricyclo[3.3.1.1³,7]décane, chlorhydrate (chlorhydrate de méthénamine) | 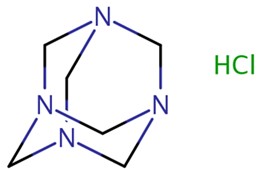 C6H12N4·HCl C6H12N4·HCl | 177 |
a La substance portant ce no CAS est un mélange de chlorure de cis-1-(3-chloroallyl)-3,5,7-triaza-1-azoniaadamantane (CTAC) et trans-1-(3-chloroallyl)-3,5,7-triaza-1-azoniaadamantane (SCCS 2011).
b Selon la base de données de la Commission européenne sur les substances et ingrédients cosmétiques (CosIng), le « quaternium‑15 » est représenté par le no CAS 4080-31-3 ou par un mélange contenant les nos CAS 4080-31-3 et CAS 51229-78-8 (CE 2019).
c En Europe, le Comité scientifique pour la sécurité des consommateurs (SCCS) utilise le terme « quaternium‑15 » pour désigner le cis CTAC (no CAS 51229-78-8).
Le cis/trans‑CTAC et le cis‑CTAC sont tous deux désignés par le nom commun « quaternium‑15 » de l’INCI (USEPA 1995; Becker et coll. 2010; SCCS 2011). La première substance représente un mélange d’isomères qui contient environ 31 % à 60 % de cis‑CTAC et 20 % à 53 % de trans‑CTAC (USEPA 1995; SCCS 2011). Étant donné que les études toxicologiques menées sur le mélange ne font pas toujours état de la concentration relative de chaque isomère, il n’est pas possible de distinguer de manière définitive si les effets sur la santé sont dus à l’un ou l’autre isomère. En conséquence, le cis/trans‑CTAC et le cis‑CTAC ont été évalués ensemble dans le cadre de l’évaluation de la santé humaine et les données toxicologiques des deux substances ont été prises en considération.
Le chlorhydrate de méthénamine représente une impureté dans le cis/trans‑CTAC. Certaines études toxicologiques ont indiqué qu’il représente 3,1 % du cis/trans‑CTAC (Carney et coll. 2006; Carney et coll. 2008; Hansen et coll. 2008, tous cités dans CSSC 2011) et peut atteindre des concentrations atteignant 7 % (CSSC 2011).
2.1 Sélection d’analogues
Une approche de lecture croisée utilisant des données provenant d’analogues, lorsque nécessaire a été utilisée pour éclairer les évaluations des risques pour la santé humaine. Les analogues ont été identifiés sur la base de leur similitude avec des substances de ce groupe (structure, propriétés physico-chimiques similaires, toxicocinétique, réactivité, etc.) qui présentaient des données empiriques pertinentes pouvant être utilisées pour effectuer une lecture croisée des paramètres pour lesquels les données empiriques étaient limitées. La méthénamine a été le seul analogue trouvé contenant des données toxicologiques pertinentes pour le cis/trans‑CTAC, le cis‑CTAC et le chlorhydrate de méthénamine en ce qui concerne les paramètres toxicologiques pour lesquels les données étaient limitées. Le tableau 2-2 présente des renseignements sur l’identité et la structure chimique de la méthénamine. Pour de plus amples renseignements sur les propriétés physico-chimiques et un résumé des données toxicologiques, consultez l’Annexe A.
| NO CAS | Nom commun | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 100-97-0 | méthénamine | 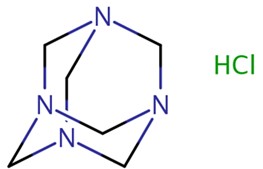 C6H12N4 C6H12N4 | 140 |
Toutes les substances du groupe des hexaméthylènetétramines partagent un squelette similaire dans leur structure chimique, avec 4 atomes d’azote reliés en un cycle (considéré comme une « amine quaternaire »). L’analogue méthénamine contient aussi ce squelette structurel. Bien que la méthénamine et les substances du groupe des hexaméthylènetétramines diffèrent sur les plans de la pression de vapeur et de la constante de la loi d’Henry, elles sont comparables en ce qui concerne la solubilité dans l’eau et les coefficients de partage octanol-eau (voir l’Annexe A).
Les structures chimiques du cis/trans‑CTAC et du cis‑CTAC contiennent également un groupe fonctionnel monohaloalcène, qui n’est pas présent dans la structure chimique de l’analogue méthénamine. Certains monohaloalcènes ont été associés à l’induction de la formation d’adduits à l’ADN à la suite de biotransformations médiées par le cytochrome P450 en métabolites époxydes (Guengerich et coll. 2003). En ce qui concerne le cis/trans‑CTAC et le cis‑CTAC, des simulations du métabolisme réalisées à l’aide de logiciels de modélisation ont révélé que des métabolites d’époxyde étaient observés dans des conditions in vitro, mais pas in vivo (OCDE QSAR Toolbox 2017; TIMES 2016). Pour examiner l’impact du groupe fonctionnel des haloalcènes, les produits chimiques contenant cette sous-structure ont été pris en considération.
Le 1-chloropropène a été identifié comme un monohaloalcène représentatif, bien qu’il soit différent du cis/trans‑CTAC et du cis‑CTAC en ce qui concerne la similarité structurelle et les propriétés physico-chimiques. Les données toxicologiques des haloalcènes contenant des chaînes de carbone plus longues dans une plage similaire à celle du cis/trans‑CTAC et du cis‑CTAC n’étaient pas pertinentes. Des informations sur l’identité et la structure chimique du 1-chloropropène sont présentées dans le tableau 2‑3. Pour de plus amples renseignements sur les propriétés physico-chimiques et un résumé des données toxicologiques, consultez l’Annexe A.
| NO CAS | Nom commun | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 590-21-6 | 1-chloropropène | 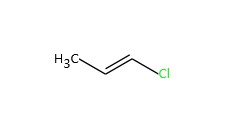 C3H5Cl C3H5Cl | 76 |
3. Propriétés physiques et chimiques
Un résumé des données sur les propriétés physiques et chimiques estimées des substances du groupe des hexaméthylènetétramines est présenté dans le tableau 3-1. ECCC (2016 b) présente des propriétés physico-chimiques supplémentaires.
| Propriété | cis/trans‑CTACa | cis‑CTACb | Chlorhydrate de méthénamineb |
|---|---|---|---|
| État physique | Solide | Solide | ND |
| Pression de vapeur (Pa) | 5,59 × 10−7 | 1,74 × 10−6 | 2,46 × 10−5 |
| Constante de la loi d’Henry (Pa m3/mol) | 1,76 × 10−8 | 1,76 × 10−8 | 1,03 × 10−8 |
| Solubilité dans l’eau (mg/L) | 1,0 × 106 | 1,0 × 106 | 1,0 × 106 |
| Log Koe (sans dimension) | -5,29 | -5,29 | -5,67 |
Abréviations : ND = non disponible; Koe = coefficient de partage octanol-eau.
a ChemID Plus 1993-.
b Epi Suite c2000-2012.
4. Sources et utilisations
Tous les hexaméthylènetétramines ont été visées par une enquête menée en vertu de l’article 71 de la LCPE (Canada 2012). Le tableau 4-1 présente un résumé des renseignements communiqués sur les quantités totales fabriquées ou importées des substances du groupe des hexaméthylènetétramines à partir de l’année de déclaration 2011 (Environnement Canada 2013).
| Nom commun | Quantité fabriquée totalea (kg) | Quantité totale importéea (kg) |
|---|---|---|
| cis/trans‑CTAC | ND | 10 000 – 100 000 |
| cis‑CTAC | ND | 1 000 – 10 000 |
| chlorhydrate de méthénamine | ND | ND |
Abréviations : ND = aucune valeur déclarée au-delà du seuil de déclaration de 100 kg (Canada 2012).
a Les valeurs reflètent les quantités déclarées en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Veuillez consulter l’enquête pour en connaître les inclusions et exclusions particulières (annexes 2 et 3). Les quantités confidentielles sont présentées sous la forme d’une plage de valeurs.
Le tableau 4-2 présente un résumé des principales utilisations des substances du groupe des hexaméthylènetétramines selon les renseignements fournis en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Le tableau 4-3 présente des informations supplémentaires sur les utilisations au Canada provenant d’autres sources.
| Principales utilisationsa | Cis/trans‑CTAC | Cis-CTAC | Chlorhydrate de méthénamine |
|---|---|---|---|
| Secteurs de l’automobile, de l’aéronautique et des transports | O | N | N |
| Produits d’entretien automobile | O | N | N |
| Peintures et revêtements | O | N | N |
| Produits de soins personnels | N | O | N |
Abréviations : O = oui, utilisation déclarée pour cette substance; N = non, utilisation non déclarée pour cette substance.
a Utilisations non confidentielles déclarées en réponse à l’enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Voir les enquêtes pour les inclusions et les exclusions particulières (annexes 2 et 3).
| Utilisation | Cis/trans‑CTAC | Cis-CTAC | Chlorhydrate de méthénamine |
|---|---|---|---|
| Additifs indirectsa | O | O | N |
| Matériaux d’emballage alimentairea | O | N | N |
| Ingrédients médicinaux ou non médicinaux dans des désinfectants ou des produits pharmaceutiques à usage humain ou vétérinaireb | O | N | N |
| Ingrédients médicinaux ou non médicinaux dans des produits de santé naturels homologuésc | O | N | N |
| Utilisation dans des cosmétiques, d’après les déclarations faites en vertu du Règlement sur les cosmétiquesd | O | Oe | N |
| Principe actif ou formulant dans les produits antiparasitaires homologuésf | O (principe actif et formulant) | O (formulant) | O (formulant) |
a Communication personnelle, courriel de la Direction des aliments (DA), Santé Canada (SC), au Bureau de l’évaluation du risque des substances existantes (BERSE), SC, 4 février 2019; sans référence.
b Communication personnelle, courriel de la Direction des produits thérapeutiques (DPT), SC, au BERSE, SC, 4 février 2019; sans référence.
c BDPSNH [modifié 2019].
d Communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux (DSPCPD), SC, au BERSE, SC, 4 février 2019; sans référence.
e Toute notification de cosmétique sous le nom « quaternium‑15 » de l’INCI peut également faire référence au cis‑CTAC, car il n’est pas possible de savoir si les cosmétiques contiennent du cis/trans‑CTAC ou du cis‑CTAC.
f Communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire (ARLA), SC, au BERSE, SC, 4 février 2019; sans référence.
INCI désigne sous le nom de « quaternium‑15 » à la fois cis/trans‑CTAC et le cis‑CTAC (SCCS 2011; CE 2019). Le quaternium‑15 a une fonction déclarée d’agent de conservation dans les produits de consommation, tels que les produits de soins personnelsNote de bas de page 4 (cosmétiques, médicaments en vente libre, produits de santé naturels) et adhésifs et peintures (PubChem 2004- ). Au Canada, le quaternium‑15 serait présent dans divers produits cosmétiques, notamment dans des produits de bain à rincer, des éclaircissants pour les cheveux, des nettoyants pour le visage, des revitalisants sans rinçage, du maquillage en poudre pour le visage, des mascaras, des hydratants pour le visage et le corps, des shampoings, des produits de rasage pour le visage et le corps, et des produits de coiffure (permanente et défrisant) (communication personnelle, courriel de la DSPCPD, SC, au BERSE, SC, 4 février 2019, sans référence). Le quaternium‑15 est également présent dans les produits pharmaceutiques en vente libre au Canada, plus particulièrement dans les lotions solaires (communication personnelle, courriel de la DPT, SC, au BERSE, SC, 4 février 2019, sans référence). En outre, le cis/trans‑CTAC, répertorié sous le nom de quaternium‑15, est présent dans les produits de santé naturels (PSN), tels que les hydratants corporels (communication personnelle, courriel de la DPSN, SC, au BERSE, SC, 4 février 2019, sans référence).
Les autres utilisations du cis/trans‑CTAC dans les produits de consommation comprennent la peinture d’intérieur, les adhésifs pour papier peint et divers produits de nettoyage, notamment les nettoyants à base d’eau de javel, les nettoyants pour cuvette de toilette, les lingettes de nettoyage pour automobile et les lingettes pour meubles (ECCC 2016a; communication personnelle, courriel de la DPT, SC, au BERSE, SC, 4 février 2019, sans référence; SDS 2013; SDS 2015a; SDS 2016). Le cis‑CTAC a également été trouvé dans un produit détachant (SDS 2018). Ailleurs dans le monde, le cis/trans‑CTAC a été trouvé dans un produit de polissage pour parquets aux États-Unis (SDS 2015b). Cependant, il a été confirmé que ce produit n’était pas disponible au Canada (communication personnelle, courriel de Church & Dwight Canada Corp. au BERSE, SC, 6 février 2020, sans référence).
5. Devenir et comportement dans l’environnement
5.1 Persistance dans l’environnement
Selon les modèles utilisés par l’approche de la CRE (ECCC 2016c), le cis/trans‑CTAC, le cis‑CTAC et le chlorhydrate de méthénamine ne devraient pas persister dans l’eau, l’air, les sédiments ou le sol.
5.2 Potentiel de bioaccumulation
Compte tenu de leur faible valeur de Koe et de leur faible facteur de bioconcentration (ECCC 2016c), le cis/trans‑CTAC, le cis‑CTAC et le chlorhydrate de méthénamine ne devraient pas se bioaccumuler de manière significative dans les organismes.
6. Potentiel d’effets nocifs sur l’environnement
6.1 Caractérisation du risque écologique
Les risques pour l’environnement occasionnés par les substances du groupe des hexaméthylènetétramines ont été caractérisés à l’aide de la classification du risque écologique (CRE) des substances organiques (ECCC 2016a). La CRE est une démarche fondée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition et qui repose sur la pondération de plusieurs éléments de preuve. Les divers éléments de preuve sont combinés afin de faire la différence entre des substances présentant une puissance et un potentiel d’exposition plus ou moins élevés dans divers milieux. Une telle approche permet de réduire l’incertitude globale de la caractérisation du risque comparativement à une approche qui reposerait sur un paramètre unique dans un seul milieu (p. ex. la concentration létale médiane [CL50]) pour la caractérisation. La méthode, qui est décrite en détail dans ECCC (2016a), est résumée ci-dessous.
Les données sur les propriétés physico-chimiques, le devenir (demi-vies chimiques dans divers milieux et biotes, coefficients de partage et bioconcentration dans les poissons), l’écotoxicité aiguë pour les poissons et les volumes de produits chimiques importés et fabriqués au Canada proviennent de publications scientifiques, de bases de données empiriques accessibles (p. ex., la boîte à outils QSAR de l’OCDE, 2016), et des réponses aux enquêtes menées en vertu de l’article 71 de la LCPE, ou ont été produites à l’aide de la modélisation de la relation (quantitative) structure-activité (QSAR) ou du devenir du bilan massique ou de la bioaccumulation. Ces données ont été utilisées comme intrants dans d’autres modèles de bilan massique ou pour compléter les profils d’exposition et de danger de la substance.
Nous avons déterminé les profils de dangers en nous fondant principalement sur les mesures du mode d’action toxique, de la réactivité chimique, des seuils de toxicité internes basés sur les réseaux trophiques, de la biodisponibilité et de l’activité chimique et biologique. Les profils d’exposition sont également fondés sur plusieurs paramètres, dont le taux d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Les profils de risque et d’exposition ont été comparés aux critères de décision afin de classer les risques et le potentiel d’exposition de chaque substance comme faible, moyen ou élevé. Des règles supplémentaires ont été appliquées (p. ex., régularité de la classification, marge d’exposition) pour raffiner les classifications préliminaires du risque et de l’exposition.
Nous avons utilisé une matrice de risque pour classer le risque associé à chaque substance comme étant faible, modéré ou élevé, suivant la classification du danger et de l’exposition. Les risques classés selon la CRE ont été vérifiés en suivant une approche en deux étapes. La première étape consistait à modifier à la baisse la classification du risque (qui passe de modéré ou élevé à faible) des substances présentant un faible taux estimé d’émission dans l’eau après le traitement des eaux usées, ce qui représente un faible risque d’exposition. La deuxième étape consistait à revoir les résultats de classification faibles à la lumière de scénarios de risque relativement prudents à l’échelle locale (c.-à-d. dans la zone à proximité immédiate du point de rejet) conçus pour protéger l’environnement, afin de déterminer si le risque devrait être reclassé à un niveau supérieur.
La CRE est fondée sur une approche pondérée pour réduire au minimum la possibilité d’une classification trop élevée ou trop faible du danger, de l’exposition et du risque subséquent. Une description détaillée des approches équilibrées de traitement des incertitudes est présentée dans ECCC (2016a). Dans ce qui suit, nous décrivons deux des domaines d’incertitude les plus importants. Des valeurs de toxicité aiguë empiriques ou modélisées erronées pourraient conduire à des modifications du classement du danger, en particulier dans le cas des paramètres liés à des valeurs de résidus dans les tissus (c.-à-d. mode d’action toxique), dont un grand nombre sont prévues à partir de modèles QSAR. Toutefois, l’incidence de ce type d’erreur est atténuée par le fait qu’une surestimation de la létalité médiane donnera une valeur prudente (protectrice) des résidus dans les tissus qui servira à l’analyse critique des résidus corporels. L’erreur due à une sous-estimation de la toxicité aiguë sera atténuée grâce à l’utilisation d’autres paramètres de risque tels que le profil structurel du mode d’action, la réactivité ou l’affinité de liaison à l’estrogène. Les changements ou les erreurs touchant les quantités chimiques pourraient mener à un classement différent de l’exposition, les classements de l’exposition et du risque étant très sensibles à la vitesse d’émission et aux quantités utilisées. Les classements obtenus au moyen de la CRE reflètent donc l’exposition et le risque au Canada compte tenu des quantités utilisées actuellement (déterminées par estimations), mais pourraient ne pas rendre compte des tendances futures.
Les données essentielles et les facteurs à considérer, utilisés pour élaborer les profils spécifiques des substances du groupe des hexaméthylènetétramines, ainsi que les résultats de la classification du danger, de l’exposition et des risques figurent dans ECCC (2016 b).
| Substance | Classification du danger selon la CRE | Classification de l’exposition selon la CRE | Classification du risque selon la CRE |
|---|---|---|---|
| Cis/trans‑CTAC | faible | modérée | faible |
| Cis-CTAC | faible | faible | faible |
| Chlorhydrate de méthénamine | faible | faible | faible |
D’après les classifications de faible danger et de faible exposition selon les données examinées selon la CRE, le cis‑CTAC et le chlorhydrate de méthénamine ont été classés comme substances présentant un faible de risque écologique. Il est peu probable que ces substances soient préoccupantes pour l’environnement au Canada.
D’après les renseignements examinés selon la CRE, le cis/trans‑CTAC a été classé substance comme présentant un potentiel d’exposition modéré en raison de sa longue persistance globale et des quantités importées annuelles modérées, selon les renseignements divulgués en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Le cis/trans‑CTAC a été classé comme substance présentant un faible potentiel de danger et un faible risque écologique. Bien que les modes d’utilisation entraînent un potentiel d’exposition modéré, compte tenu du faible potentiel de danger, il est peu probable que le cis/trans‑CTAC suscite des préoccupations pour l’environnement au Canada.
7. Potentiel d’effets nocifs sur la santé humaine
7.1 Cis/trans‑CTAC et cis‑CTAC
7.1.1 Évaluation de l’exposition
Milieux naturels
Le cis/trans‑CTAC et le cis‑CTAC ont une faible pression de vapeur et une grande solubilité dans l’eau. Aucune donnée de surveillance canadienne dans l’air ambiant ou dans l’eau potable n’a été trouvée pour ces deux substances.
En raison de la forte solubilité dans l’eau du cis/trans‑CTAC et du cis‑CTAC, l’exposition par l’eau potable est possible. Les concentrations estimées dans les eaux de surface ont été calculées à l’aide du tableur Environmental Assessment Unit (EAU) pour l’eau potable (Santé Canada 2015). Les concentrations maximales modélisées au 50e centile dans les eaux de surface pour le cis/trans‑CTAC et le cis‑CTAC sont respectivement de 5,1 × 10-4 mg/L et de 7,2 × 10-5 mg/L. Ces concentrations ont été calculées à l’aide des renseignements sur les quantités totales importées divulguées en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Les concentrations dans les eaux de surface ont été utilisées pour estimer l’absorption quotidienne des deux substances par l’eau potable, l’absorption la plus élevée (par unité de poids corporel) étant de 6,7 × 10-5 mg/kg p.c./j et de 9,4 × 10-6 mg/kg p.c./j chez les enfants de 0 à 5 mois, nourris au lait maternisé, pour le cis/trans‑CTAC et le cis‑CTAC, respectivement. L’utilisation de concentrations modélisées dans les eaux de surface à partir des volumes totaux importés au Canada pour estimer l’apport en eau potable est jugée prudente. Pour caractériser les risques pour la santé humaine (tableau 7-3), on a estimé l’ingestion d’eau potable pour chaque cis/trans‑CTAC et cis‑CTAC séparément. En outre, on a estimé la dose journalière combinée ingérée par l’eau potable, ainsi que l’exposition alimentaire due à l’utilisation dans les applications pour emballage alimentaire (voir la section sur les aliments, ci-dessous) pour le cis/trans‑CTAC.
Aliments
Le cis/trans‑CTAC peut être utilisé dans les applications d’emballage alimentaire au Canada comme agent de conservation antimicrobien dans les adhésifs, qui sont séparés des aliments par une barrière fonctionnelle ou pour lesquels la quantité d’adhésifs qui entre en contact avec les aliments ne doit pas dépasser la quantité à l’état de traces au niveau des coutures et des bords des emballages. La substance peut également être utilisée dans la fabrication de résines de polyuréthane en contact avec des aliments secs lorsque la migration de la substance dans les aliments n’est pas prévue à la température ambiante. Par conséquent, on ne prévoit aucune exposition résultant de ces utilisations (communication personnelle, courriel de la Direction des aliments, SC au BERSE, SC, 4 février 2019; sans référence).
Le cis/trans‑CTAC peut également être utilisé comme agent de conservation dans les liants pigmentaires en latex utilisés dans la fabrication de papier et de carton en contact avec des aliments aqueux et gras, et dans la fabrication de revêtements acryliques pour les cartons en contact direct avec les aliments. La dose journalière probable par voie orale résultant de ces utilisations est estimée à 1,3 × 10-4 mg/kg p.c./j, ce qui représente l’exposition alimentaire de la population générale âgée de douze mois et plus (communication personnelle, courriel de la Direction des aliments, SC, au BERSE, SC, 4 février 2019 et 13 septembre 2019; sans référence).
Le cis/trans‑CTAC et le cis‑CTAC peuvent également être utilisés comme composants d’additifs indirects, tels que les nettoyants de surface en contact avec les aliments, les nettoyants pour les mains ou les lubrifiants utilisés dans les établissements de transformation des aliments. Puisque l’utilisation de ces nettoyants est suivie d’un rinçage à l’eau potable après le traitement, il n’y a pas de contact alimentaire avec le lubrifiant utilisé. Par conséquent, on ne prévoit pas d’exposition par voie alimentaire résultant de ces utilisations (communication personnelle, courriel de la Direction des aliments, SC, au BERSE, SC, 4 février 2019; sans référence).
Produits de consommation
Comme le quaternium‑15 peut désigner autant le cis/trans‑CTAC que le cis‑CTAC, les produits de consommation contenant du quaternium‑15 ont été considérés comme contenant l’une ou l’autre de ces deux substances. L’exposition par les produits de soins personnels (cosmétiques, produits de santé naturels (PSN) et médicaments en vente libre) devrait se faire principalement par voie cutanée en raison de la faible pression de vapeur de ces substances (comprise entre 5,59 × 10-7 et 1,74 × 10-6 Pa). Les estimations de l’exposition cutanée à ces produits sont présentées au tableau 7-1 ci-dessous. D’autres scénarios d’exposition cutanée ont été envisagés pour les autres types de produits énumérés dans la section 4, mais les estimations de l’exposition étaient inférieures à celles présentées dans le tableau 7-1. Des détails sur la méthode et les paramètres utilisés pour calculer les estimations de l’exposition cutanée sont présentés à l’Annexe B. Étant donné que les mêmes produits et concentrations sont pris en compte pour les deux substances, l’exposition au cis/trans‑CTAC et l’exposition au cis‑CTAC sont jugées équivalentes.
L’exposition estimée par inhalation à d’autres produits de consommation tels que la peinture d’intérieur, les lingettes de nettoyage et les détachants est négligeable (moins de 2,5 ng/kg p.c./j). L’exposition cutanée à ces produits est à prévoir par contact direct avec le produit, et chez les tout-petits par contact avec des surfaces traitées après l’application de lingettes pour meubles et de détachants. En outre, les tout-petits peuvent être exposés accidentellement par voie orale, par contact main-à-la-bouche, après l’utilisation de lingettes pour meubles et de détachants. Les estimations de l’exposition par ces produits sont présentées dans le tableau 7-2. Des scénarios supplémentaires pour les autres types de produits énumérés ont été envisagés, mais l’exposition estimée était inférieure à celles qui sont présentées dans le tableau 7-2. L’annexe B fournit des détails sur la méthode et les paramètres utilisés pour estimer l’exposition.
| Scénario d’exposition | Concentration maximale | Estimation de l’exposition cutanée |
|---|---|---|
| Hydratant corporel (cosmétique); voie cutanée; 14 à 18 ans – 19 ans et plusa; exp. quoditienne, 0,13 à 0,16 mg/kg p.c./j | 0,1 %b | 0,13 à 0,16 mg/kg p.c./j |
| Shampooing; voie cutanée; 19 ans et plusa; chaque jour | 10 %b | 0,17 mg/kg p.c./j |
| Écran solaire; voie cutanée; 6 à 11 mois; 19 ans et plus; chaque jour | 0,07 %c | 0,15 à 0,66 mg/kg p.c./j |
| Hydratant corporel (PSN)d; voie cutanée; 6 à 11 mois; 19 ans et plus; chaque jour | 0,1 %e | 0,13 à 0,32 mg/kg p.c./j |
| Produit pour permanente/défrisant des cheveux; voie cutanée; 19 ans et plusa; par événement | 0,1 %b | 0,11 mg/kg p.c. par événement |
a Produit destiné à une sous-population plus âgée uniquement (communication personnelle, courriel de la DSPCPD, SC, au BERSE, SC, daté du 10 septembre 2019; sans référence).
b Communication personnelle, courriel de la DSPCPD, SC, au BERSE, SC, 4 février 2019; sans référence.
c Communication personnelle, courriel de la DPT, SC, au BERSE, SC, 4 février 2019; sans référence.
d Produit contenant du cis/trans‑CTAC.
e Communication personnelle, courriel de la DPSNSO, SC, au BERSE, SC, 4 septembre 2019; sans référence.
| Scénario d’exposition | Concentration maximale | Estimation de l’exposition par voie cutanée (mg/kg p.c. par événement) | Estimation de l’exposition par voie orale (mg/kg p.c. par événement) |
|---|---|---|---|
| Peinture d’intérieur; 19 ans et plus; par événementa | 0,1 %b | 4,9 × 10-2 | S.O. |
| Lingette de nettoyage pour meubles; 19 ans et plus; par événementa | 1 %c | 6,8 × 10-3 | S.O. |
| Lingette de nettoyage pour meubles – après l’application; âgés de 1 an; par événementa | 1 %c | 1,5 × 10-2 | 2,3 × 10-3 |
| Détachants; 19 ans et plus; par événementd | 0,05 %e | 4,1 × 10-3 | S.O. |
| Détachants – après l’application; âgés de 1 an; par événementd | 0,05 %e | 4,0 × 10-2 | 6,1 × 10-3 |
Abréviations : s. o. = sans objet.
a Le produit contient du cis/trans‑CTAC.
b ECCC 2016a.
c SDS 2015a.
d Le produit contient du cis‑CTAC.
e SDS 2018.
7.1.2 Évaluation des effets sur la santé
Comme le cis/trans‑CTAC et le cis‑CTAC partagent le nom commun « quaternium‑15 » et sont parfois identifiés sous leur seul nom commun, les données toxicologiques du cis/trans‑CTAC et du cis‑CTAC ont été mises en commun dans l’évaluation des effets sur la santé. Ces substances avaient déjà été évaluées par l’EPA des États-Unis (USEPA) dans le cadre d’un document de décision d’admissibilité à la réhomologation qui évaluait les risques pour la santé humaine et l’environnement associés aux utilisations de pesticides (USEPA 1995). Une approche qualitative a été adoptée pour la caractérisation des risques, car l’USEPA n’avait pas trouvé de critère d’effet toxicologique préoccupant à l’époque. Comme l’évaluation de l’USEPA portait sur les principaux types de formulation homologués au Canada et était pertinente pour les utilisations de pesticides homologués au Canada, l’Agence de réglementation de la lutte antiparasitaire (ARLA) s’est appuyée sur l’évaluation de l’USEPA (1995) pour sa réévaluation du cis/trans‑CTAC et du cis‑CTAC (Santé Canada 2004; Santé Canada 2005). Depuis, d’autres agences à l’étranger ont évalué ces substances, notamment l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES) en France (2014). D’autres groupes indépendants tels que le Comité scientifique pour la sécurité des consommateurs en Europe (CSSC 2011) et le Cosmetic Ingredient Review (CIR) (1986) ont également procédé à des évaluations. Ces évaluations ont examiné des études supplémentaires sur les effets sur la santé qui n’ont pas été prises en compte par l’EPA (1995)).
Selon la classification et l’étiquetage harmonisés approuvés par l’Union européenne, le cis‑CTAC est nocif en cas d’ingestion (Acute Tox 4), il est présumé nocif pour l’enfant à naître (Repr 2), il provoque une irritation cutanée (Skin Irrit 2) et peut provoquer une réaction allergique (Skin Sens 1) (ECHA 2019). Aucune classification n’a été trouvée pour le cis/trans‑CTAC. Dans l’évaluation des effets sur la santé qui suit, les données toxicologiques pour le cis/trans‑CTAC et le cis‑CTAC ont été prises en considération.
Toxicité à doses répétées
Les effets du cis/trans‑CTAC à la suite d’une exposition subchronique par voie orale ont été décrits dans le rapport d’une étude dans laquelle des rats Sprague-Dawley (n = 10/sexe/dose) ont reçu 0, 7,5, 15, 30 ou 60 mg/kg p.c./j de cis/trans‑CTAC dans leur régime alimentaire pendant 90 jours (Humiston et coll., 1972, cité dans SCCS 2011). Toutes les doses ont été associées à une diminution significative de la consommation alimentaire et du poids corporel (jusqu’à 20 %), à une augmentation du poids relatif du cerveau et à une augmentation du poids relatif des testicules. À des doses égales ou supérieures à 15 mg/kg p.c./j, des concentrations d’alanine aminotransférase significativement plus faibles ont également été observées. À la dose maximale (60 mg/kg p.c./jour), on a constaté une augmentation du poids relatif du foie (accompagnée d’un gonflement hépatocellulaire), une augmentation significative des taux d’azote uréique sérique et une diminution significative des concentrations de phosphatase alcaline. Une dose sans effet nocif observé (DSENO) de 15 mg/kg p.c./j a été trouvée dans le rapport, mais une dose minimale entraînant un effet nocif observé (DMENO) de 7,5 mg/kg p.c./j a été sélectionnée sur la base de la toxicité générale (diminution de la consommation alimentaire et du poids corporel), et des effets sur le cerveau et les testicules. En outre, des effets sur les testicules ont également été observés dans d’autres études toxicologiques faisant partie de l’ensemble des données sur les effets sur la santé.
Un rapport d’une étude orale subchronique sur des chiens beagle a également été trouvé (Schwetz et coll. 1976, cité dans SCCS 2011). Dans cette étude, des chiens beagle (n = 4/sexe/dose) ont reçu par voie orale 0, 7,5, 15 et 30 mg/kg p.c./j de cis/trans‑CTAC dans des capsules de gélatine pendant 91 à 92 jours. À des doses égales et supérieures à 15 mg/kg p.c./jour, on a observé une diminution du poids absolu et du poids relatif du cœur, ainsi qu’une baisse significative des taux d’aspartate et d’alanine aminotransférase. À la dose maximale, une femelle a été euthanasiée au 84e jour en raison d’une toxicité manifeste. De plus, le poids absolu et le poids relatif du foie étaient significativement plus élevés que celui des témoins, ce qui s’est accompagné d’une vascularite oblitérante et d’une périvasculite des vaisseaux sanguins hépatiques, d’une infiltration des cellules mononucléaires et d’une hyperplasie des cellules réticulo-endothéliales du foie. Des altérations du tissu cardiaque (c’est-à-dire dégénérescence myocardique multifocale, nécrose et inflammation) ont également été observées chez un chien mâle à la dose élevée. D’autres chiens mâles ont présenté une réduction significative du volume de cellules concentrées, du nombre de globules rouges et blancs et du pourcentage d’hémoglobine. Le rapport a indiqué que le foie et éventuellement le cœur étaient les organes cibles et une dose sans effet observé (DSEO) de 7,5 mg/kg p.c./j a été établie.
Les effets du cis/trans‑CTAC ont également été examinés dans le cadre d’études avec administration par voie cutanée. Le cis/trans‑CTAC (dans l’eau) a été appliqué par voie topique dans des conditions occlusives à des lapins néo-zélandais blancs (n = 10/sexe/dose) à des concentrations de 0, 2,9, 11,8 ou 60 % (p/v), 6 heures par jour pendant 91 jours (Corley et coll. 1988, cité dans SCCS 2011). Cela équivalait à environ 0, 50, 200 ou 1 000 mg/kg p.c./j. on a observé une irritation de la peau dépendante de la dose. À la concentration maximale, on a constaté une augmentation du nombre de globules blancs et de plaquettes (pas d’autres détails). Les résultats pathologiques bruts étaient limités à la peau (p. ex., croûtes), et étaient accompagnés par une réaction inflammatoire dans l’épiderme et le derme (une dermatite ulcéreuse). Le rapport suggère qu’aucune toxicité systémique n’a été observée jusqu’à 1 000 mg/kg p.c./j.
Le cis/trans‑CTAC (dans l’eau) a également été appliqué par voie topique à des souris (en conditions occlusives, souche inconnue, n = 10/sexe/dose) à des doses de 0, 100, 400 et 1 200 mg/kg p.c./j, 6 heures par jour pendant 90 jours (Quast et coll. 1996, cité dans SCCS 2011). Le rapport indique qu’il n’y a pas eu de résultats de toxicité systémique jusqu’à la dose maximale d’essai (1 200 mg/kg p.c./j).
En général, les études cutanées susmentionnées n’ont pas révélé d’indications de toxicité systémique jusqu’à la dose maximale d’essai pour le cis/trans‑CTAC. Toutefois, cela n’a pas été le cas pour les études réalisées avec le cis‑CTAC pour des durées d’exposition plus courtes. Dans une étude à court terme sur la peau, 0, 10, 25, 50 et 100 mg/kg p.c./j de cis‑CTAC (en solution aqueuse) ont été appliqués par voie topique sur la peau intacte ou abrasée de lapins sexuellement immatures (n = 5/sexe/dose) pendant 7 heures par jour, 5 jours par semaine, pendant 3 semaines (Dow Chemical Company 1983, cité dans Becker et coll. 2010 et CIR 1986). À 50 mg/kg p.c./j, les lapins présentaient une diminution de la spermatogenèse et une irritation cutanée. À 100 mg/kg p.c./jour, on a constaté une diminution significative du poids absolu des testicules, du poids relatif des testicules par rapport au cerveau et de l’irritation cutanée. Une diminution de la spermatogenèse a été observée chez 4 mâles sur 5 dont la peau était intacte et chez 3 mâles sur 5 dont la peau était abîmée. Aucun autre effet lié au traitement n’a été observé en ce qui concerne la mortalité, le comportement, le poids corporel, les valeurs hématologiques, la chimie clinique, les analyses d’urine, la pathologie brute, l’histopathologie ou le poids des organes. Sur la base de ces données, une DSENO de 25 mg/kg p.c./j a été établie d’après les effets sur les testicules à la dose suivante de 50 mg/kg p.c./j.
Dans une étude de suivi, le dos abrasé de lapins néo-zélandais blancs sexuellement matures (n = 7/dose) a été traité par voie topique avec du cis‑CTAC (dans l’eau) à des doses de 0, 25, 50 ou 100 mg/kg p.c./j (Lockwood et coll. 1978, cité dans SCCS 2011; Dow Chemical Company 1983, cité dans CIR 1986). La substance d’essai a été laissée en contact avec la peau pendant 7 heures par jour, 5 jours par semaine pendant 30 jours. Des effets locaux tels que l’inflammation chronique, la dégénérescence et la nécrose de la peau ont été observés sur le site d’application. En ce qui concerne les effets systémiques, une diminution significative du poids du foie a été observée aux doses moyennes et élevées. À la dose maximale, le poids corporel et la consommation alimentaire ont diminué de manière significative. Une DSENO de 25 mg/kg p.c./j a été trouvée par les auteurs de l’étude (sans autre précision), vraisemblablement en raison des effets hépatiques observés à la dose suivante de 50 mg/kg p.c./j. Bien que cette étude de suivi n’ait pas révélé d’effets sur les testicules, il convient de noter que les stades de vie des animaux étaient différents (des lapins sexuellement immatures dans l’étude précédente par rapport à des animaux sexuellement matures dans l’étude actuelle).
Des études examinant des prototypes de formulations cosmétiques contenant du cis/trans‑CTAC ou du cis CTAC ont également été signalées (McCollister et coll. 1969, cité dans SCCS 2011; Anonyme 1980, cité dans NTP 1991). En général, ces études n’ont pas révélé de signes de toxicité systémique jusqu’à la dose maximale d’essai de 3 000 mg/kg p.c./j. Toutefois, en raison de la présence d’autres ingrédients dans les produits, de détails limités sur les groupes de contrôle concurrents et d’informations limitées sur la chimie analytique, ces études ont été jugées peu utiles pour la caractérisation des risques.
Toxicité pour la reproduction et le développement
Des effets sur les testicules et la spermatogenèse ont été observés dans certaines des études examinées dans la section Toxicité à doses répétées ci-dessus (Humiston et coll. 1972, cité dans SCCS 2011; Dow Chemical Company 1983, cité dans Becker et coll. 2010). La dose minimale avec effet déterminée pour les voies orale et cutanée était de 7,5 mg/kg p.c./j (DMENO) et 25 mg/kg p.c./j (DSENO), respectivement, sur la base des effets sur le poids des testicules et la spermatogenèse à des doses plus élevées (Dow Chemical Company 1983, cité dans Becker et coll. 2010, et CIR 1986).
Des études examinant la toxicité pour le développement par voie orale ont été trouvées pour le cis/trans‑CTAC et le cis‑CTAC. Dans un rapport d’étude sur la toxicité pour le développement prénatal, des lapins néo-zélandais blancs (n = 26 femelles/groupe) ont reçu par gavage 0, 2,5, 8 et 25 mg/kg p.c./j de cis/trans‑CTAC (31,3 % de cis CTAC, 32,5 % de trans‑CTAC, dans l’eau), aux jours de gestation (JG) 7 à 27 (Carney et coll., cité dans SCCS 2011). À la dose maximale de 25 mg/kg p.c./j, on a constaté une toxicité maternelle sous forme de diminution de la prise de poids et de la consommation alimentaire pendant toute la période d’administration. On a également observé une diminution du poids moyen de l’utérus des femelles gravides et du poids moyen du fœtus à la même dose. Le rapport a établi une CSEO de 8 mg/kg p.c./j pour la toxicité maternelle et la toxicité pour le développement. Aucune toxicité pour le développement n’a été observée en l’absence de toxicité maternelle.
En ce qui concerne le cis‑CTAC, le potentiel de toxicité pour le développement a été évalué dans une étude du développement prénatal, dans le cadre de laquelle des rats Fischer 344 (n = 33 à 34 femelles/groupe) ont reçu par gavage 0, 5, 25 ou 75 mg/kg p.c./j de cis‑CTAC (pureté de 97,9 %, dans l’eau) aux jours de gestation 6 à 15 (John et coll. 1982, cité dans SCCS 2011). À la dose moyenne de 25 mg/kg p.c./j, les mères ont présenté une diminution transitoire du poids corporel et de la consommation alimentaire pendant la période de traitement, tandis que les fœtus ont présenté une augmentation significative de l’incidence des malformations totales (principalement des anomalies oculaires telles que la microphtalmie [17 % des portées] et l’anophtalmie). À la dose maximale, 75 mg/kg p.c./j, les mères ont présenté une diminution significative du poids corporel, de la prise de poids et de la consommation d’eau et de nourriture. Les mères ont également présenté une augmentation du poids absolu et du poids relatif du foie et une augmentation significative de la fréquence des résorptions. Les fœtus dans ce groupe de dose présentaient une fréquence plus élevée de malformations totales (p. ex., 19 % des portées présentaient une microphtalmie) et pesaient nettement moins que les témoins. Même si cela n’était pas significatif, on a noté que deux fœtus du groupe à faible dose (5 mg/kg p.c./j) présentaient des malformations. Un fœtus présentait une micrognathie (mâchoire trop petite) et une anophtalmie, tandis que l’autre fœtus présentait une polydactylie. Un troisième fœtus mort in utero présentait une exencéphalie, mais ce cas n’a pas été inclus dans l’évaluation statistique. Un cas d’anophtalmie a également été trouvé dans le groupe témoin. Une CSEO de 5 mg/kg p.c./j a été signalée par les auteurs pour la toxicité maternelle et fœtale. Cependant, comme les malformations ont été observées d’une manière dépendante de la dose à des doses plus élevées, atteignant une signification statistique, les malformations observées à 5 mg/kg p.c./j ont été jugées pertinentes du point de vue toxicologique. Une DMENO de 5 mg/kg p.c./j a été établie en raison des malformations. Pour la toxicité maternelle, une DSENO de 5 mg/kg p.c./j a été établie en raison d’une diminution du poids corporel et de la consommation alimentaire à la dose suivante de 25 mg/kg p.c./j.
Il a été signalé que les rats Fischer 344 avaient une forte propension aux malformations oculaires fœtales et que les malformations observées dans l’étude précédente étaient probablement liées à un effet de cluster génétique spontané (Carney et coll. 2005, cité dans SCCS 2011). Pour tester cette hypothèse, une autre étude de toxicité pour le développement prénatal a été réalisée, dans laquelle des rats Fischer 344 (n = 33 femelles) ont reçu par gavage 0, 25 ou 75 mg/kg p.c./j de cis‑CTAC (pureté de 98,9 %, dans l’eau) aux jours de gestation 6 à 15 (Carney et coll. 2005, cité dans SCCS 2011). Par rapport à l’étude précédente, on a observé une diminution similaire du poids corporel maternel, de la prise de poids et de la consommation alimentaire. Chez les fœtus, on a observé une incidence de 6,3 % et 6,4 % de microphtalmie/anophtalmie dans les groupes ayant reçu des doses de 25 et 75 mg/kg p.c./jour, respectivement. Ces incidences étaient similaires aux valeurs des témoins historiques et ne présentaient pas de dépendance à la dose, ce qui laisse supposer que les résultats de l’étude précédente représentaient un effet de cluster génétique spontané. Cependant, l’interprétation de cette étude a été compromise par le fait que la dose de 5 mg/kg p.c./j n’a pas été incluse ou examinée. Dans l’ensemble, une DMENO de 5 mg/kg p.c./j (sur la base des malformations) a été choisie à des fins de caractérisation des risques, car elle représentait le paramètre dénotant la plus grande sensibilité dans l’ensemble de données pour ce qui est de la voie orale. Cette valeur était conforme à la dose avec effet critique définie par l’ANSES (2014).
En ce qui concerne la voie d’exposition cutanée, nous avons trouvé un rapport sur un essai combiné de toxicité préliminaire pour la reproduction et le développement à doses répétées pour le cis/trans‑CTAC, et un rapport sur un essai de toxicité pour le développement pour le cis‑CTAC. Dans le premier rapport, le cis/trans‑CTAC (31 % cis‑CTAC, 32 % trans‑CTAC, dans l’eau) a été appliqué par voie topique à des rats Crl:CD(SD) (n = 10/sexe/dose) à des doses équivalentes de 0, 75, 225 et 750 mg/kg p.c./j (Carney et coll. 2006, cité dans SCCS 2011). Des effets cutanés (p. ex., desquamation, érythème, œdème) ont été signalés à tous les niveaux de dose chez les animaux parents, et le groupe ayant reçu la dose maximale a été euthanasié en raison de la gravité des lésions cutanées. À la dose moyenne, on a constaté une diminution significative du poids corporel (8,1 %) chez les femelles, une réduction significative de la consommation alimentaire chez les deux sexes et une réduction des niveaux de triglycérides (signification statistique inconnue). Chez les petits, on a constaté une réduction du poids corporel (7,5-15 %), qui était statistiquement significative au jour postnatal (JPN) 21 chez les petites femelles à la dose moyenne. La consommation de nourriture a également été fortement réduite chez les chiots. Aucun effet lié au traitement sur la performance reproductive, la survie des petits et le rapport des sexes n’a été observé. Une CSEO de 75 mg/kg p.c./j a été choisie sur la base de la toxicité générale (p. ex., le poids corporel) et de la toxicité pour la reproduction (sans autres détails) observées à la dose suivante de 225 mg/kg p.c./j.
En ce qui concerne le cis‑CTAC, nous avons trouvé une étude de toxicité pour le développement prénatal au cours de laquelle 344 rats Fischer (n = 25 femelles/groupe) ont reçu par voie topique (de manière occlusive) 0, 250 ou 500 mg/kg p.c./j de cis‑CTAC (dans l’eau) aux jours 6 à 15 de leur gestation (Dow Chemical Company 1984, cité dans Becker et coll. 2010). Les auteurs ont conclu à l’absence de toxicité maternelle ou d’effets sur la progéniture jusqu’à la dose maximale d’essai de 500 mg/kg p.c./j.
Génotoxicité et cancérogénicité
En ce qui concerne la génotoxicité, le cis‑CTAC s’est révélé faiblement mutagène dans les essais de mutagénicité bactérienne (Zieger et coll. 1988). Il était mutagène chez les souches TA98 et TA100 de Salmonella typhimurium, et dans E. coli avec et sans activation métabolique (Kuramochi 1994, cité dans SCCS 2011). Le cis/trans‑CTAC s’est révélé mutagène avec activation métabolique dans un test in vitro de mutation cellulaire génique de mammifère, mais n’était pas mutagène en l’absence d’activation métabolique (Linscombe et coll. 1988, cité dans SCCS 2011). Le cis‑CTAC s’est révélé clastogène dans un test in vitro d’aberration chromosomique sur mammifères, en l’occurrence des cellules pulmonaires de hamster chinois, mais n’était pas clastogène pour les lymphocytes du sang entier de rat (Murli 1994, cité dans SCCS 2011). Le cis‑CTAC n’a pas induit de synthèse non programmée de l’ADN dans les hépatocytes de rat (Domoradzki 1981, cité dans SCCS 2011).
Bien qu’on eût recensé quelques résultats positifs dans les essais in vitro, le cis‑CTAC ne s’est pas révélé être génotoxique dans les essais in vivo. Il n’a pas induit de micronoyaux dans les érythrocytes de souris (Day et Shabrang 2000, cité dans CSSC 2011) et n’a pas induit de synthèse non programmée de l’ADN (Cifone 2002, cité dans CSSC 2011) jusqu’à des doses de 1 000 mg/kg p.c./j qui étaient associées à des signes de toxicité.
Nous n’avons trouvé aucune étude ayant examiné les effets du cis/trans‑CTAC ou du cis‑CTAC à la suite d’une exposition chronique ou sur la cancérogénicité. Les données toxicologiques pour l’analogue méthénamine (no CAS 100-97-0) ont été prises en considération. Afin d’étudier l’impact du groupe fonctionnel des monohaloalcènes dans la structure chimique du cis/trans‑CTAC et du cis‑CTAC, les données toxicologiques du 1-chloropropène (no CAS 590-21-6) ont également été prises en compte. Aucune de ces substances n’a été associée à une quelconque classification des dangers par le Centre international de recherche sur le cancer (CIRC), l’ECHA ou l’EPA. Pour plus d’informations sur les propriétés physico-chimiques et les données sommaires sur les effets sur la santé, voir l’Annexe A.
En ce qui concerne la méthénamine, aucune toxicité systémique ou indication de cancérogénicité n’a été observée dans les études portant sur des doses chroniques atteignant 2 500 mg/kg p.c./j (Brendel 1964; Kewitz 1966, cité dans ECHA 2008; Della Porta et coll. 1968; Natvig et coll. 1971; Lijinsky et Taylor 1977).
Pour le 1-chloropropène, une seule étude limitée de cancérogénicité a été trouvée, dans laquelle des souris Swiss Ha:ICR mâles et femelles (n = 30/groupe) ont été soumises à quatre traitements différents sur une période de 342 à 649 jours : application cutanée répétée (35 mg/kg p.c./j), application cutanée dans un essai d’initiation-promotion de tumeurs (35 à 83 mg/kg p.c./j), injection sous-cutanée (5 mg/kg p.c./j) et gavage oral (5 mg/kg p.c./j) (Van Duuren et coll. 1979). Les signes cliniques et le poids corporel ont été documentés. À la fin de l’étude, des examens macroscopiques bruts complets ont été effectués et tous les tissus et organes anormaux ont été excisés pour un examen histopathologique. Aucune augmentation de l’incidence des tumeurs liée au traitement n’a été observée dans les expériences cutanées et sous-cutanées. Toutefois, l’administration intragastrique a été associée à une augmentation significative du nombre de souris femelles présentant des tumeurs du préestomac (43 % contre 17 % dans le groupe témoin). Un cadre décrivant le mode d’action pour évaluer la pertinence des tumeurs du préestomac des rongeurs dans l’évaluation du risque de cancer a été publié, et il définit les critères de décision à utiliser pour examiner les données sur les tumeurs afin de classifier la cancérogénicité potentielle pour l’humain (Proctor et coll. 2007). Selon ce cadre, les tumeurs qui se limitent au préestomac (organe dont l’humain est dépourvu) et qui ne sont observées qu’à la suite d’une administration par gavage oral peuvent ne pas être pertinentes pour l’exposition des humains. Ces tumeurs peuvent résulter d’une irritation chronique et d’une hyperplasie du préestomac, conduisant finalement à la formation de tumeurs. L’irritation chronique du tissu épithélial n’est généralement pas compatible avec les conditions d’exposition des humains, qui sont susceptibles d’être inférieures à un seuil d’irritation (Proctor et coll. 2007).
Dans l’ensemble, les données disponibles sur le 1‑chloropropène et l’analogue méthénamine semblent indiquer que le cis/trans‑CTAC et le cis‑CTAC ne sont pas susceptibles de causer une cancérogénicité qui serait pertinente pour la santé humaine.
Sensibilisation
Le cis‑CTAC a entraîné des réponses de sensibilisation lors d’un essai de stimulation locale des ganglions lymphatiques (ELGL), avec une valeur CE3 (la concentration efficace induisant une multiplication par trois de la prolifération des cellules ganglionnaires par rapport aux témoins) de 20,8 % (De Jong et coll. 2007). Les souris BALB/c ont été traitées avec 25 μL de cis‑CTAC sur la peau dorsale des deux oreilles soit pendant 3 jours, soit pendant 3 jours, une fois par semaine puis 3 jours supplémentaires. Les animaux ont ensuite été euthanasiés et les ganglions lymphatiques auriculaires ont été excisés et soumis à un essai de stimulation lymphocytaire. En outre, le cis/trans‑CTAC et le cis‑CTAC ont également été associés à des dermatites de contact et sont considérés comme des allergènes humains, avec des fréquences de 0,6 % à 1,9 % et de 7,1 % à 9,6 % dans les études épidémiologiques menées en Europe et aux États-Unis, respectivement (SCCS 2011).
Dégagement de formaldéhyde
Le cis/trans‑CTAC et le cis‑CTAC peuvent être métabolisés en formaldéhyde, une substance qui a été classée comme cancérogène du groupe 1 (CIRC 2012). Dans une étude toxicocinétique, des rats auxquels ayant reçu par gavage jusqu’à 47 mg/kg p.c./j de cis/trans‑CTAC ont éliminé une grande partie de la dose sous forme de dioxyde de carbone. Moins de 0,12 % de la dose administrée a été identifiée comme étant du formaldéhyde (SCCS 2011). Certaines organisations internationales ont également considéré le quaternium‑15 comme un « libérateur de formaldéhyde » dans les produits de consommation (SCCS 2011; Becker 2017). On a respectivement détecté 1 000 ou 2 000 ppm de formaldéhyde dans des crèmes contenant 0,1 ou 2 % de quaternium‑15, selon une analyse polarographique (Jordan et coll. 1979, cité dans CIR 1986). Toutefois, aucun rejet n’a été constaté pour d’autres produits tels que les shampoings.
Dans une étude examinant les rejets de formaldéhyde des agents de conservation, différents types de produits cosmétiques (p. ex., shampoing, gel de bain, parfum, nettoyant pour les mains, dentifrice et vernis à ongles) ont été mélangés avec du quaternium‑15 à une concentration de 1 mg par gramme de produit (Lv et coll. 2015). La quantité de formaldéhyde libérée par les produits s’est avérée dépendre du pH, du temps, de la température et du type de produit. Une plus grande quantité de formaldéhyde a été libérée par les produits dont la durée d’utilisation et la température sont plus élevées et ceux qui contiennent plus d’eau (shampoing, gel de bain, nettoyant pour les mains). Bien qu’aucune estimation ponctuelle n’ait été fournie par les auteurs, l’examen visuel des données a révélé que la plus grande quantité de formaldéhyde pouvant être libérée par ces produits était d’environ 2,5 mg/L.
Il existe une incohérence dans la manière dont les rejets de formaldéhyde provenant des agents de conservation sont gérés par les différentes autorités dans le monde. L’USEPA (1995) a relevé une exposition potentielle au formaldéhyde pour les consommateurs. Toutefois, à l’époque, l’USEPA avait déterminé que le risque était faible, car l’exposition en milieu résidentiel était minime.
Le gouvernement australien n’a pas considéré le formaldéhyde comme substance préoccupante et a indiqué qu’il n’était pas susceptible d’être volatil à partir des solutions à faible concentration présentes dans les produits contenant du cis/trans‑CTAC ou du cis‑CTAC (AGDH 2014). Dans l’Union européenne (UE), le quaternium‑15 était auparavant autorisé dans les cosmétiques jusqu’à une concentration maximale de 0,2 %. Cependant, en juin 2019, le quaternium‑15 a été ajouté à la liste de l’EU des substances interdites dans les cosmétiques.
Le quaternium‑15 n’est pas actuellement interdit au Canada. Cependant, la présence de formaldéhyde dans les cosmétiques au Canada est limitée à 0,01 % dans les produits non en aérosol qui libèrent des vapeurs de formaldéhyde, à 0,1 % dans les produits buccaux, à 0,2 % dans les produits non buccaux et à 5 % dans les durcisseurs d’ongles (Santé Canada 2018). Une directive sur la qualité de l’air intérieur résidentiel pour le formaldéhyde a également été publiée (Santé Canada 2006). Étant donné les restrictions sur le formaldéhyde dans les cosmétiques et l’existence de lignes directrices sur la qualité de l’air intérieur, la présente évaluation a porté uniquement sur le cis/trans‑CTAC et le cis‑CTAC, et le risque d’exposition au formaldéhyde n’a pas été caractérisé.
7.1.3 Caractérisation des risques pour la santé humaine
D’après les données disponibles, le cis/trans‑CTAC et le cis‑CTAC ne devraient pas être génotoxiques in vivo. En outre, ils ne devraient pas avoir d’effets cancérogènes qui seraient pertinents pour la santé humaine, sur la base des données toxicologiques disponibles sur le chloropropène-1 et l’analogue méthénamine.
Pour la caractérisation du risque, l’étude à court terme sur l’exposition cutanée réalisée à l’aide du cis‑CTAC chez des lapins en développement a été prise en compte pour les scénarios d’exposition cutanée concernant les nourrissons, les tout-petits et les enfants. Ces scénarios comprenaient un hydratant corporel (PSN), un écran solaire, des lingettes de nettoyage de meubles et un détachant. Une DSENO de 25 mg/kg p.c./j a été établie sur la base des effets testiculaires observés à la dose suivante de 50 mg/kg p.c./j (Dow Chemical Company 1983, cité dans Becker et coll. 2010; CIR 1986).
Pour les scénarios d’exposition cutanée incluant des adolescents et des adultes (c’est-à-dire hydratant corporel [PSN et cosmétiques], shampoing, écran solaire, permanente ou défrisant de cheveux, peinture d’intérieur, lingette de nettoyage de meubles et nettoyant pour taches), l’étude de toxicité cutanée à court terme menée chez des lapins en âge de procréer a été sélectionnée pour la caractérisation du risque. Une DSENO de 25 mg/kg p.c./j a été déterminée d’après les effets sur le foie à la dose suivante de 50 mg/kg p.c./j (Lockwood et coll. 1978, cité dans SCCS 2011; Dow Chemical Company 1983, cité dans CIR 1986). Cette valeur est conforme au niveau d’effet déterminé en France par l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES) (2014).
Pour les scénarios d’exposition par voie orale incluant des adolescents et des adultes, on a utilisé l’étude de toxicité pour le développement prénatal menée chez le rat (John et coll. 1982, cité dans SCCS 2011) pour caractériser les risques. Une DMENO de 5 mg/kg p.c./j a été déterminée sur la base des malformations fœtales survenues en l’absence de toxicité pour la mère. La même étude a également été sélectionnée pour les scénarios d’exposition par voie orale pour les nourrissons, les tout-petits et les enfants. Toutefois, une DSENO de 5 mg/kg p.c./j a été utilisée pour la caractérisation du risque d’après la toxicité maternelle (réduction du poids corporel et de la consommation alimentaire) observée à la dose suivante de 25 mg/kg p.c./j. Ces niveaux d’effet sont du même ordre de grandeur que ceux établis dans d’autres études de toxicité. Par exemple, une DMENO de 7,5 mg/kg p.c./j a été établie sur la base de la toxicité générale et des effets sur le cerveau et les testicules dans une étude subchronique par voie orale chez le rat (Humiston et coll. 1972, cité dans SCCS 2011). Dans une autre étude par voie orale (test de dépistage de la toxicité pour le développement prénatal chez le lapin), une DSEO de 8 mg/kg p.c./j a été établie d’après la toxicité pour les mères et le développemental observée à la dose suivante de 25 mg/kg p.c./j (Carney et coll. 2008, cité dans SCCS 2011).
Le tableau 7 3 présente toutes les valeurs d’exposition et de danger pertinentes pour le cis/trans‑CTAC et le cis CTAC, ainsi que les marges d’exposition (ME) qui en résultent, pour la détermination du risque.
| Scénario d’exposition | Estimation de l’exposition | Niveau d’effet critique (mg/kg p.c./j) | ME |
|---|---|---|---|
| Hydratant corporel (cosmétique) (concentration de 0,1 %); voie cutanée; 14 à 18 ans – 19 ans et plus; chaque jour | 0,16 (14 à 18 ans) – 0,13 (19 ans et plus) mg/kg p.c./j | 25a | 156 (14-18 ans) – 192 (19 ans et plus) |
| Shampoing (10 % concentration); voie cutanée; 19 ans et plus; chaque jour | 0,17 mg/kg p.c./j | 25a | 147 |
| Hydratant corporel (PSN) (concentration de 0,1 %)b; voie cutanée; chaque jour | 0,32 (0 à 5 mois) à 0,13 (19 ans et plus) mg/kg p.c./j | 25 a,c | 79 (0 à 5 mois) – 185 (19 ans et plus) |
| Écran solaire (concentration de 0,07 %); voie cutanée; 6 à 11 mois – 19 ans et plus; chaque jour | 0,66 (6 à 11 mois) – 0,15 (19 ans et plus) mg/kg p.c./j | 25 a,c | 38 (6 à 11 mois) – 167 (19 ans et plus) |
| Permanente/défrisant pour cheveux (concentration de 0,1 %); voie cutanée; 19 ans et plus; par événement | 0,11 mg/kg p.c. par événement | 25a | 227 |
| Peinture d’intérieur (concentration de 0,1 %)b; voie cutanée; 19 ans et plus; par événement | 4,9 × 10-2 mg/kg p.c. par événement | 25a | 510 |
| Lingette pour nettoyage de meubles (concentration de 1 %)b; voie cutanée; 19 ans et plus; par événement | 6,8 × 10-3 mg/kg p.c. par événement | 25a | 3 676 |
| Lingette pour nettoyage de meubles – après application (concentration de 1 %)b; voie cutanée; tout-petits de 1 an; par événement | 1,5 × 10-2 mg/kg p.c. par événement | 25c | 1 729 |
| Lingette pour nettoyage de meubles – après application (concentration de 1 %)b; voie orale; tout-petits de 1 an; par événement | 2,3 × 10-3 mg/kg p.c. par événement | 5d | 2 304 |
| Détachant (concentration de 0,05 %)e; voie cutanée; 19 ans et plus; par événement | 4,1 × 10-3 mg/kg p.c. par événement | 25a | 6 098 |
| Détachant – après application (concentration de 0,05 %)e; voie cutanée; tout-petits de 1 an; par événement | 4,0 × 10-2 mg/kg p.c. par événement | 25c | 618 |
| Détachant – après application (concentration de 0,05 %)e; voie orale tout-petits de 1 an; par événement | 6,1 × 10-3 mg/kg p.c. par événement | 5d | 823 |
| Emballage alimentaire et ingestion d’eau potable (combinée, cis/trans‑CTAC)f; voie orale; tout-petits de 1 an – 19 ans et plus; chaque jour | 1,5 × 10-4 (tout-petits de 1 an) mg/kg p.c./j à 1,4 × 10-4 (19 ans et plus) | 5d,g | 33 333 (tout-petits de 1 an) à 35 714 (19 ans et plus) |
| Emballage alimentaire (cis/trans‑CTAC)f; voie orale; 1+ ans; chaque jour | 1,3 × 10-4 mg/kg p.c./j | 5d | 38 462 |
| Eau potable (cis/trans‑CTAC); voie orale 0-5 mois; chaque jour | 6,7 × 10-5 mg/kg p.c./j | 5d | 74 627 |
| Eau potable (cis‑CTAC); voie orale 0-5 mois; chaque jour | 9,4 × 10-6 mg/kg p.c./j | 5d | 531 915 |
a DSENO = 25 mg/kg p.c./j, sur la base des effets hépatiques observés à la dose suivante de 50 mg/kg p.c./jour lors d’une étude par voie cutanée de 30 jours chez des lapins sexuellement matures.
b Exposition au cis/trans‑CTAC.
c Une DSENO de 25 mg/kg p.c./j a été déterminée d’après les effets testiculaires observés à la dose suivante de 50 mg/kg p.c./j dans une étude cutanée de 3 semaines chez des lapins sexuellement immatures.
d DSENO = 25 mg/kg p.c./j, sur la base des effets hépatiques observés à la dose suivante de 50 mg/kg p.c./j lors d’une étude par voie cutanée de 30 jours chez des rats.
e Exposition au cis‑CTAC.
f Les doses journalières probables provenant des emballages alimentaires représentent l’exposition alimentaire de la population générale âgée de 12 mois et plus.
g DMENO = 5 mg/kg p.c./j, sur la base de la toxicité pour le développement (c’est-à-dire les malformations) dans une étude de toxicité pour le développement prénatal par voie orale chez le rat.
En ce qui concerne l’exposition cutanée due à l’utilisation de lotions de protection solaire et de produits hydratants pour le corps (PSN), la comparaison des niveaux d’effet critique avec l’exposition estimée a donné des ME se situant entre 38 et 79 pour les jeunes sous-populations (nourrissons et enfants), et ces ME sont jugées potentiellement inadéquates pour répondre aux incertitudes dans les bases de données sur l’exposition et les effets sur la santé. Les ME résultantes pour ces produits pour les sous-populations d’adolescents et d’adultes ont été jugées adéquates. Pour d’autres produits de consommation (hydratants corporels [cosmétiques], shampoings, permanentes et défrisants, peinture d’intérieur, lingettes de nettoyage pour meubles et détachants), les ME ont été jugées adéquates.
En ce qui concerne l’exposition orale due à l’utilisation d’emballages alimentaires, à l’eau potable et à l’exposition main-à-la-bouche, la comparaison des niveaux d’effet critique avec l’exposition estimée a permis d’établir des ME qui sont jugées adéquates pour compenser les incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
7.1.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les plus importantes sources d’incertitude sont présentées dans le tableau suivant.
| Source clé d’incertitude | Incidence |
|---|---|
| Le nom « quaternium‑15 » de l’INCI est attribué à la fois au cis/trans‑CTAC et au cis‑CTAC, et nous avons supposé que les cosmétiques contenant du quaternium‑15 pouvaient contenir l’une ou l’autre substance présente comme ingrédient | +/- |
| Absence de concentrations mesurées de cis/trans‑CTAC et de cis‑CTAC dans les milieux naturels. | +/- |
| Aucune donnée sur les effets sur la santé du trans‑CTAC n’a été trouvée, ce qui empêche de comparer la toxicité des deux isomères (c’est-à-dire le cis‑CTAC et le trans‑CTAC). | +/- |
| Aucune étude sur la toxicité chronique ou la cancérogénicité n’a été trouvée pour le cis/trans‑CTAC ou le cis‑CTAC. Les données toxicologiques de l’analogue méthénamine et du 1-chloropropène ont été prises en considération. | +/- |
| Il n’y avait pas suffisamment de preuves pour aborder les malformations oculaires comme un effet de cluster génétique, comme le proposent Carney et coll., 2005. | + |
+ = incertitude liée au risque de surestimer l’exposition ou le risque; – = incertitude liée au risque de causer une sous-estimation de l’exposition ou du risque; +/- = risque non connu de surestimer ou de sous-estimer le risque.
7.2 Chlorhydrate de méthénamine
7.2.1 Évaluation de l’exposition
Aucune concentration mesurée de chlorhydrate de méthénamine dans les milieux naturels n’a été retrouvée, et aucune quantité fabriquée ou importée de chlorhydrate de méthénamine au Canada n’a été signalée au-delà du seuil de déclaration de 100 kg, d’après les renseignements divulgués en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Le chlorhydrate de méthénamine a été trouvé comme impureté à une concentration de 7 % dans un mélange de cis/trans‑CTAC (SCCS 2011). Les quantités de chlorhydrate de méthénamine déclarées au Canada ne tiennent pas compte de sa présence en tant qu’impureté dans le cis/trans‑CTAC. Une concentration estimée dans les eaux de surface a été calculée à l’aide du tableur EAU pour l’eau potable (Santé Canada 2015), en utilisant les renseignements sur les importations totales de cis/trans‑CTAC divulguées en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013), et en supposant une impureté de chlorhydrate de méthénamine de 7 %. La concentration maximale modélisée de chlorhydrate de méthénamine dans les eaux de surface au 50e centile est de 2,88 × 10-5 mg/L, ce qui donne une dose journalière estimée de 3,4 × 10-6 mg/kg p.c./j dans une préparation pour nourrissons de 0 à 5 mois, qui constituent le groupe d’âge le plus exposé (par unité de poids corporel). L’utilisation de concentrations modélisées dans les eaux de surface et l’hypothèse selon laquelle le volume total de cis/trans‑CTAC importé au Canada contient 7 % de chlorhydrate de méthénamine pour estimer l’exposition par l’intermédiaire de l’eau potable, est jugée prudente.
Aucune utilisation du chlorhydrate de méthénamine dans les produits de consommation n’a été trouvée au Canada. Cependant, l’utilisation de produits de consommation contenant du cis/trans‑CTAC (concentrations maximales entre 0,1 % et 10 % selon le tableau 7-1) peut entraîner une exposition cutanée au chlorhydrate de méthénamine, car celui-ci peut exister sous forme d’impureté à hauteur de 7 % dans le mélange de cis/trans‑CTAC présent dans le produit. Pour évaluer l’exposition potentielle au chlorhydrate de méthénamine en raison de sa présence en tant qu’impureté dans le cis/trans‑CTAC, l’exposition a été calculée pour la sous-population la plus exposée au cis/trans‑CTAC, à savoir l’exposition à un écran solaire à une concentration de 0,07 %. L’exposition au cis/trans‑CTAC a été ajustée de 7 % pour tenir compte de la quantité maximale de chlorhydrate de méthénamine présente, ce qui donne une exposition estimée de 1,1 × 10-2 à 4,6 × 10-2 mg/kg p.c./j (de 6 à 11 mois à 19 ans et plus; de 0,15 à 0,66 mg/kg p.c./j d’exposition au cis/trans‑CTAC × 7 %).
7.2.2 Évaluation des effets sur la santé
L’ensemble des données relatives aux effets sur la santé du chlorhydrate de méthénamine est limité. Pour pallier ces limitations, les données toxicologiques de l’analogue méthénamine (no CAS 100-97-0) ont été prises en considération. Cet analogue représente la forme non ionisée du chlorhydrate de méthénamine. Après dissociation en solutions aqueuses, le chlorhydrate de méthénamine devrait présenter une toxicité, des voies métaboliques et une réactivité similaires à celles de l’analogue méthénamine.
Le gouvernement du Canada a évalué la méthénamine dans le cadre de l’évaluation préalable du groupe des hétérocycles (ECCC, SC 2019). La caractérisation des effets de la méthénamine sur la santé a été basée sur des études internationales menées par l’ECHA (2008) et l’OCDE (2007). Une recherche bibliographique a été effectuée entre juin 2018 (un an avant l’évaluation du groupe des hétérocycles) et août 2019. On n’a retrouvé aucune étude sur les effets sur la santé dont les résultats auraient pu avoir un impact sur l’évaluation de ces effets (c.-à-d. menant à des critères d’effet critiques différents ou à des points de départ plus bas que ceux indiqués dans l’évaluation).
Les effets critiques constatés pour la méthénamine étaient la sensibilisation cutanée à fortes doses et les effets sur le développement (ECCC, SC 2019). Pour ces effets critiques, une concentration efficace positive (CE3) de 30,6 % et une DSENO de 27 mg/kg p.c./j ont été choisies comme points de départ pour la caractérisation du risque, respectivement.
7.2.3 Caractérisation des risques pour la santé humaine
L’exposition de la population générale au chlorhydrate de méthénamine peut se produire par l’eau potable ou par l’utilisation de produits de consommation contenant du cis/trans‑CTAC, dans lesquels le chlorhydrate de méthénamine peut être présent sous forme d’impureté (jusqu’à 7 %). On a calculé une marge d’exposition en comparant l’exposition estimée au chlorhydrate de méthénamine par l’eau potable et par l’utilisation d’un écran solaire contenant 0,07 % de cis/trans‑CTAC à la dose avec effet critique de 27 mg/kg p.c./j (DSENO), telle qu’établie dans l’évaluation préalable du groupe des hétérocycles (ECCC, SC 2019). Il en résulte des marges d’exposition allant de 587 à 2 454 pour les écrans solaires, pour les groupes de population des nourrissons aux adultes, et de plus de 1 000 000 pour l’eau potable, valeurs jugées adéquates pour compenser les incertitudes dans les bases de données sur l’exposition et les effets sur la santé. En ce qui concerne la sensibilisation cutanée, il a été noté que la concentration maximale dans les produits de 10 % est environ 44 fois inférieure à la CE3 de 30,6 %. Les produits associés à cette concentration (c’est-à-dire les shampoings) sont des produits à rincer et sont susceptibles d’entraîner un potentiel d’exposition plus faible. Tous les autres produits sont associés à des concentrations qui sont au moins 400 fois inférieures à la CE3.
7.2.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les plus importantes sources d’incertitude sont présentées au tableau suivant.
| Source clé d’incertitude | Incidence |
|---|---|
| Absence de concentrations mesurées de chlorhydrate de méthénamine dans les milieux environnementaux ou les produits de consommation au Canada. | +/- |
+ = incertitude liée au risque de surestimer l’exposition ou le risque; – = incertitude liée au risque de causer une sous-estimation de l’exposition ou du risque; +/- = risque non connu de surestimer ou de sous-estimer le risque.
8. Conclusion
Compte tenu de toutes les sources de données disponibles présentées dans ce projet d’évaluation préalable, le cis/trans‑CTAC, le cis‑CTAC et le chlorhydrate de méthénamine présentent un faible risque de dommages pour l’environnement. Il est donc proposé de conclure que le cis/trans‑CTAC, le cis‑CTAC et le chlorhydrate de méthénamine ne satisfont à aucun des critères énoncés aux alinéas 64a) ou 64b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que le cis/trans‑CTAC et le cis‑CTAC satisfont aux critères énoncés à l’alinéa 64c) de la LCPE, car ils pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que le chlorhydrate de méthénamine ne satisfait pas aux critères énoncés à l’alinéa 64c) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est proposé de conclure que le cis/trans‑CTAC et le cis‑CTAC satisfont à un ou plusieurs des critères énoncés à l’article 64 de la LCPE.
Il est proposé de conclure que le chlorhydrate de méthénamine ne satisfait à aucun des critères énoncés à l’article 64 de la LCPE.
Il est également proposé que le cis/trans‑CTAC et le cis‑CTAC ne satisfassent pas aux critères de persistance ou de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
Références
[AGDH] Australian Government Department of Health. 2014. Formaldehyde donors: human health tier II assessment. Sydney (AU): Department of Health, National Industrial Chemicals Notification and Assessment Scheme (NICNAS).
[ANSES] Agence nationale de sécurité sanitaire alimentation, environnement, travail. 2014. Profil toxicologique du cis‑CTAC (no CAS 51229-78-8). Rapport d’expertise collective.
[BDPSNH] Base de données des produits de santé naturels homologués [base de données]. [modifié le 6 février]. Ottawa (Ontario) : Gouvernement du Canada. [consulté le 18 septembre 2019].
Becker LC, Bergfeld WF, Belsito DV, Klaassen CD, Hill R, Leibler D, Marks JG Jr, Shank RC, Slaga TJ, Snyder PW et Alan Andersen F. 2010. « Final report of the amended safety assessment of Quaternium‑15 as used in cosmetics ». Int J Toxicol. 29(3 Suppl):98S-114S.
Becker LC. 2017. « Quaternium‑15 ». Int J Toxicol. 36(5 Supple 2):52S.
Bremmer HF, Prud’homme de Lodder LCH et van Engelen JGM. 2006. Cosmetics Fact Sheet. Bilthoven (NL): Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment]. RIVM Report 320104001/2006. (Disponible en anglais seulement)
Brendel R. 1964. « Untersuchungen an ratten zur verträglichkeit von hexamethylentetramin ». Arzneimittel-Forsch. 14:51-53.
Canada, ministère de l’Environnement. 2012. « Loi canadienne sur la protection de l’environnement, 1999 : Avis concernant certaines substances de la Liste intérieure [PDF] ». Supplément, Gazette du Canada, Partie I,146, no 48.
[CE] Commission européenne. 2019. Cosmetic Ingredients and Substances (CosIng) Simple Search Database [Internet]. Brussels (BE): EC. (Disponible en anglais seulement)
ChemIDplus [base de données]. 1993- . Bethesda (MD): US National Library of Medicine. [consulté le 4 mars 2019].
[CIR] Cosmetic Ingredient Review. 1986. « Final report on the safety assessment of quaternium 15 ». J Am Coll Toxicol. 5:61-101.
[ConsExpo Web] Consumer Exposure Web Model. 2019. Bilthoven (NL): Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement]. (Non disponible en français)
De Jong WH, De Klerk A, Beek MT, Veenman C et Van Loveren H. 2007. « Effect of prolonged repeated exposure to formaldehyde donors with doses below the EC3 value on draining lymph node responses ». J Immunotoxicol. 4(3):239-246.
Della Porta G, Colnaghi MI et Parmiani G. 1968. « Non-carcinogenicity of methenamine in mice and rats ». Food Cosmet Toxicol. 6(6): 707-715.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. [modifié le 12 mars 2017]. Catégorisation. Ottawa (Ontario) : Gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2019. Évaluation préalable groupe des composés hétérocyclique. Numéros de registre du Chemical Abstracts Service 100-97-0, 110-91-8, 4174-09-8. Ottawa (Ontario) : Environnement Canada, Santé Canada. [consulté le 21 septembre 2019].
[ECCC] Environnement et Changement climatique Canada. 2016a. Data collected from a targeted information gathering initiative for assessments under the Chemicals Management Plan (Fall 2016). Data prepared by ECCC, Health Canada; Existing Substances Program.
[ECCC] Environnement et Changement climatique Canada. 2016 b. Document sur l’approche scientifique : classification du risque écologique des substances organiques. Ottawa (Ontario) : Gouvernement du Canada.
[ECCC] Environnement et Changement climatique. 2016c. Supporting documentation: data used to create substance-specific hazard and exposure profiles and assign risk classifications. Gatineau (QC): ECCC. Information in support of the science approach document: ecological risk classification of organic substances. Available from: substances@ec.gc.ca.
[ECHA] European Chemicals Agency. 2008. Risk Assessment: Methenamine. Final Approved Version, 27.05.2008. Helsinki (FI): ECHA. p. 1-134.
[ECHA] European Chemicals Agency. 2019. Table of harmonised entries in Annex VI to CLP. [xlsx, 583KB] Helsinki (FI): ECHA. [consulté le 21 septembre 2019]. (Disponible en anglais seulement)
Environnement Canada. 2013. Données de la mise à jour de l’inventaire de la LIS recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement, 1999 : avis concernant certaines substances de la Liste intérieure. Données préparées par : Environnement Canada, Santé Canada; Programme des substances existantes.
[EPI Suite] Estimation Program Interface Suite for Microsoft Windows [modèle d’estimation]. c2000-2012. Ver. 4.11. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. (Disponible en anglais seulement)
Ficheux AS, Chevillotte G, Wesolek N, Morisset T, Dornic N, Bernard A, Bertho A, Romanet A, Leroy L, Mercat AC, Creusot T, Simon E et Roudot AC. 2016. « Consumption of cosmetic products by the French population second part: Amount data ». Food Chem Toxicol. 90:130-141.
Ficheux AS, Wesolek N, Chevillotte G et Roudot AC, 2015. « Consumption of cosmetic products by the French population. First part: Frequency data ». Food Chem Toxicol. 78:159-169.
Guengerich FP. 2003. « Cytochrome P450 oxidations in the generation of reactive electrophiles: epoxidation and related reactions ». Arch Biochem Biophys. 409(1):59-71.
[IARC] Centre international de recherche sur le Cancer. 2012. Chemical Agents and Related Occupations: IARC Monographs on the Evaluation of Carcinogenic Risks to Humans Volume 100F: Formaldehyde. Lyon (FR): International Agency for Research on Cancer, World Health Organization.
Lijinsky W et Taylor HW. 1977. « Feeding tests in rats on mixtures of nitrite with secondary and tertiary amines of environmental importance ». Food Cosmet Toxicol. 15(4):269-274.
Loretz LG, Api AM, Babcock L, Barraj LM, Burdick J, Cater KC, Jarrett G, Mann S, Pan YHL, Re TA, Renskers KJ et Scrafford CG. 2008. « Exposure data for cosmetic products: Facial cleanser, hair conditioner, and eye shadow ». Food Chem Toxicol. 46:1516-1524.
Lv C, Hou J, Xie W et Cheng H. 2015. « Investigation on formaldehyde release from preservatives in cosmetics ». Int J Cosmet Sci. 37(5):474-478.
[NTP] National Toxicology Program. 1991. Executive summary of safety and toxicity information: N-(3-chloroallyl)hexaminium chloride. CAS Number 4080-31-3. Chemical Evaluation Committee Draft Report. [PDF]. Research Triangle Park (NC): US Department of Health and Human Services, National Toxicology Program. (Disponible en anglais seulement)
Natvig H, Andersen J et Rasmussen EW. 1971. « A contribution to the toxicological evaluation of hexamethylenetetramine ». Food Cosmet Toxicol. 9(4):491-500.
[OCDE] Organisation pour la coopération et le developpement économique. 2007. SIDS Initial Assessment Profile Methenamine. SIAM 24. Paris (FR): Organisation for Economic Cooperation and Development.
OCDE QSAR Toolbox [outil de lecture croisée]. 2014. Version 3.3. Paris (FR): Organisation pour la coopération et le developpement économique, Laboratoire de chimie mathématique.
OCDE QSAR Toolbox [outil de lecture croisée]. 2017. Ver. 4.2. Paris (FR): Organisation pour la coopération et le developpement économique, Laboratoire de chimie mathématique.
Proctor DM, Gatto NM, Hong SJ et Allamneni KP. 2007. « Mode-of-action framework for evaluating the relevance of rodent forestomach tumors in cancer risk assessment ». Toxicol Sci. 98(2):313-326.
PubChem [Base de données]. 2004- . Bethesda (MD): US National Library of Medicine, National Center for Biotechnology Information. [consulté le 13 décembre 2019]. (Disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement]. 2007. Paint products fact sheet: to assess the risks for the consumer. Updated version for ConsExpo4. [PDF, 264KB] Bilthoven (NL): RIVM. Report No.: 320104008/2007. [consulté le 19 septembre 2019]. (Disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement]. 2018. Cleaning products fact sheet: default parameters for estimating consumer exposure – updated version 2018. [PDF, 3.46MB] Bilthoven (NL): RIVM. Report No.: 2016-0179. [consulté le 19 septembre 2019]. (Disponible en anglais seulement)
Santé Canada. 2004. Proposed Acceptability for Continuing Registration. Reevaluation of 1-(3-chloroallyl)-3,5,7-triaza-1-azonia adamantine chloride. Ottawa (ON): Gouvernement du Canada. PACR2004-17.
Santé Canada. 2005. Re-evaluation Decision Document. 1-(3-chloroallyl)-3,5,7-triaza-1-azoniaadamantane chloride. Ottawa (ON): Gouvernement du Canada. RRD2005-03.
Santé Canada. 2006. Lignes directrices sur la qualité de l’air intérieur résidentiel : Formaldéhyde. Ottawa (Ontario) : Gouvernement du Canada. [consulté le 2 mars 2020].
Santé Canada. 2015. Environmental Assessment Unit Drinking Water Spreadsheets [format Excel]. Ottawa (ON): Santé Canada. [cited 2019 Sep 18].
Santé Canada. 2018. Liste critique des ingrédients de cosmétiques : liste des ingrédients dont l’usage est interdit dans les cosmétiques. Ottawa (Ontario) : Gouvernement du Canada. [consulté le 7 octobre 2019].
Santé Canada. 2019. Canadian exposure factors used in human health risk assessment. Rapport non publié. Ottawa (ON): Gouvernement du Canada.
[SCCS] Scientific Committee on Consumer Safety. 2011. Scientific Committee on Consumer Safety Opinion on Quaternium‑15 (cis-isomer). [PDF, 566KB] Adopté par le SCCS lors de sa 13e réuion péniaire, les 13 et 14 décembre 2011. Bruxelles (BE): Rapport no SCCS/1344/10 de la Comission européenne. (Disponible en anglais seulement)
[SDS] Safety Data Sheet. 2013. Shur Stick Cellulose Adhesive [PDF]. Mississauga (ON): GH International Sealants ULC [consulté le 7 juillet 2019] [accès restreint].
[SDS] Safety Data Sheet. 2015 b. Orange Glo Hardwood Refinisher [PDF]. Ewing (NJ): Church & Dwight Co., Inc [consulté le 7 juillet 2019] [accès restreint].
[SDS] Safety Data Sheet. 2015a. Furniture Wipes [PDF]. Gurnee (IL): Weiman Products [consulté le 7 juillet 2019] [accès restreint].
[SDS] Safety Data Sheet. 2016. Trim Shine Wipes [PDF]. East Rutherford (NJ): CCA Industries [consulté le 7 juillet 2019] [accès restreint].
[SDS] Safety Data Sheet. 2018. Skout’s Honor Urine Destroyer [PDF]. Irvine (CA): Skout’s Honor L.L.C. [consulté le 7 juillet 2019] [accès restreint].
[TIMES] Tissue Metabolism Simulator [module de prédiction]. 2016. Ver. 2.27.19. Bourgas (BG): University “Prof. Dr. Assen Zlatarov,” Laboratoire de chimie mathématique.
[USEPA] US Environmental Protection Agency. 1995. Reregistration Eligibility Decision (RED): Dowicil®CTAC. EPA 738-R-95-017 [PDF, 620KB]. Washington (DC): US EPA, Office of Prevention, Pesticides and Toxic Substances. (Disponible en anglais seulement)
[USEPA] United States Environmental Protection Agency. 2012. Standard Operating Procedures for Residential Pesticide Exposure Assessment. [PDF, 4.95MB] Washington (DC): Health Effects Division, Office of Pesticide Programs, Office of Chemical Safety and Pollution Prevention. (Disponible en anglais seulement)
Van Duuren BL, Goldschmidt BM, Loewengart G, Smith AC, Melchionne S, Seldman I et Roth D. 1979. « Carcinogenicity of halogenated olefinic and aliphatic hydrocarbons in mice ». JNCI. 63(6):1433-1439.
Wu X, Bennett DH, Ritz B, Cassady DL, Lee K et Hertz-Picciotto I. 2010. « Usage pattern of personal care products in California households ». Food Chem Toxicol. 48(11):3109-3119.
Zieger E, Anderson B, Haworth S, Lawlor T et Mortelmans K. 1988. « Salmonella mutagenicity tests: IV. Results from the testing of 300 chemicals ». Environ Mol Mutagen. 11(Suppl 12):1-157.
| 1-chloropropène (no CAS 590-21-6) | Méthénamine (no CAS 100-97-0) | Chlorhydrate de méthénamine (no CAS 58713-21-6) | Cis/trans‑CTAC (no CAS 4080-31-3) | Cis-CTAC (no CAS 51229-78-8) | |
|---|---|---|---|---|---|
MM (g/mol) | 76 | 140 | 177 | 251 | 251 |
PV (Pa) | 6,8 × 104 | 12,1 | 2,46 × 10-5 | 5,59 × 10-7 | 1,74 × 10-6 |
CLH (Pa·m3/mol) | 5,6 × 103 | 1,7 × 104 | 1,03 × 10-8 | 1,76 × 10-8 | 1,76 × 10-8 |
SE (mg/L) | 2,4 × 103 | 4,5 × 105 | 1 × 106 | 1 × 106 | 1 × 106 |
Log Koe (sans unité) | 2,04 | -4,15 | -5,67 | -5,29 | -5,29 |
DL50 orale (g/kg) | 1,95 | >20 | - | 0,08-2,8 | >2 |
DL50 cutanée (g/kg) | 20 | >2 | - | 0,57-0,6 | 0,6-0,9 |
Toxicité avec DR (mg/kg p.c./j) | - | Voie orale : DSENO (50 sem., rats) = 80 (DMA)3 DSENO (90 d, rats) = 1 280 (DMA)4 DMENO = 5 000 d’après la mort et la décoloration de la fourrure 5 | - | Voie orale : DMENO (90 d, rats) = 7,5 d’après la toxicité générale (↓p.c., CA)9 DSEO (91-92 d, chiens) = 7,5 d’après les effets sur le foie/le cœur à la dose suivante 10 Voie cutanée : DSENO (91 d, lapins) = 1 000 (DMA)11 DSENO (90 d, souris) = 1200 (DMA)12 | Voie cutanée : DSENO (3 sem., lapins immatures) = 25 d’après les effets testiculaires à la dose suivante22 DSENO (30 d, lapins adultes) = 25 d’après les effets sur le foie à la dose suivante23 |
Toxicité chronique (mg/kg p.c./j) | Voie orale : DMENO (623 d) = 5 mg/kg p.c./j lapins adultes) = 25 d’après les effets sur le foie à la dose suivante 1 Voie cutanée : DSENO (342-468 d) = 35 mg/kg p.c./j (DMA)1 DSENO (581 d) = 35-83 mg/kg p.c./j (DMA)1 Voie sous-cutanée DSENO (622 d) = 5 mg/kg p.c./j (DMA)1
| Voie orale : DSENO (60 sem., souris) = 2500 (DMA)5 DSENO (104 sem., rats) = 2 000 (DMA)5 DSENO (333 d, rats) = 1 130 (DMA)4 DSENO (vie, rats) = 100 (DMA)6 DSENO (vie, chats) = 61 (DMA)7 | - | - | - |
Cancer | Positif (tumeurs du préestomac)1 | Négatif4,5,6,7 | - | - | - |
Toxicité pour la reproduction / développement (mg/kg p.c./j) | - | Voie orale : DSENO (humains) = 27 (DMA)8 | - | Voie orale : DSEO (lapins) = 8 d’après la toxicité pour les mères et pour le développement à la dose suivante13 Voie cutanée : DSEO (10 sem., rat) = 75 sur la base de ↓p.c. chez les mères et les fœtus 14 | Voie orale : DMENO (rats) = 5 d’après les malformations fœtales 24 DMENO = 25 d’après la toxicité pour les mères25 Voie cutanée : DSENO (rats) = 500 (DMA)26 |
Génotoxicité | In vitro : positif2 | Négatif8 | - | In vitro : positif15,16,17, négatif18,19 In vivo : négatif20,21 | In vitro : positif15,16,17, négatif18,19 In vivo : négatif 20,21 |
Abréviations : p.c. = poids corporel; j = jours; CA = consommation alimentaire; LH = constante de la loi de Henry; DMA = dose maximale d’essai; DL = dose létale; MM = masse moléculaire; DSENO = dose sans effet nocif observé; DR = dose répétée; PV = pression de vapeur; SE = solubilité dans l’eau.
Références :
1Van Duuren et coll. 1979; 2OCDE QSAR Toolbox 2017; 3Lijinsky and Taylor 1977; 4Brendel 1964; 5Della Porta et coll. 1968; 6Natvig et coll. 1971; 7Kewitz 1966, cité dans ECHA 2008; 8ECHA 2008; 9Humiston et coll. 1972, cité dans SCCS 2011; 10Schwetz et coll. 1976, cité dans SCCS 2011; 11Corley et coll. 1988, cité dans SCCS 2011; 12Quast et coll. 1996, cité dans SCCS 2011; 13Carney et coll. 2008, cité dans SCCS 2011; 14Carney et coll. 2006, cité dans SCCS 2011; 15Zieger et coll. 1988; 16Kuramochi 1994, cité dans SCCS 2011; 17Linscombe et coll. 1988, cité dans SCCS 2011; 18Murli 1994, cité dans SCCS 2011; 19Domoradzki 1981, cité dans SCCS 2011; 20Day and Shabrang 2000, cité dans SCCS 2011; 21Cifone 2002, cité dans SCCS 2011; 22Dow Chemical Company 1983, cité dans Becker et coll. 2010 et CIR 1986; 23Lockwood et coll. 1978, cité dans SCCS 2011, Dow Chemical Company, cité dans CIR 1986; 24John et coll. 1982, cité dans SCCS 2011; 25Carney et coll. 2005, cité dans SCCS 2011; 26Dow Chemical Company 1984, cité dans Becker et al 2010.
Annexe B. Paramètres permettant d’estimer l’exposition humaine résultant de l’utilisation de produits de consommation au Canada
Les estimations de l’exposition ont été calculées sur la base des poids corporels par défaut de 74 kg pour les plus de 19 ans, 62 kg pour les 14 à 18 ans, 42 kg pour les 9 à 13 ans, 23 kg pour les 4 à 8 ans, 15 kg pour les 2 à 3 ans, 11 kg pour les tout-petits de 1 an, 9,1 kg pour les 6 à 11 mois et 6,3 kg pour les 0 à 5 mois (Santé Canada 2019). Les paramètres d’exposition cutanée estimés pour les produits de soins personnels et les autres produits de consommation sont décrits dans les tableaux B-1 et B-2, respectivement. Sauf indication contraire, l’exposition par les produits de consommation a été estimée à l’aide de ConsExpo Web (ConsExpo Web 2019). Les paramètres par défaut de ConsExpo Web ont été utilisés sauf indication contraire dans les tableaux B-1 et B-2. En outre, on a supposé que l’absorption cutanée était de 100 % dans tous les scénarios.
| Produit | Hypothèses |
|---|---|
Hydratant corporel (cosmétique) | Concentration de quaternium‑15 : 0,1 %a Fréquence d’utilisationb : 1 fois par jour (19 ans et plus) (Ficheux et coll. 2015; Wu et coll. 2010), 0,8 par jour (14 à 18 ans) (Wu et coll. 2010) Voie cutanée – Contact direct, application instantanée Quantité de produit : 10 g (19 ans et plus et 14 à18 ans) (Ficheux et coll. 2016) Facteur de rétention : 0,1 |
Shampoing | Concentration de quaternium‑15 : 10 %a Fréquence d’utilisationc : 1,1 fois par jour (19 ans et plus) (Loretz et coll. 2008) Voie cutanée – Contact direct, application instantanée Quantité de produit : 11,8 g (19 ans et plus) (Loretz et coll. 2008) Facteur de rétention : 0,1 |
Écran solaire | Concentration de quaternium‑15 : 0,07 %d Fréquence d’utilisation : 1,4 fois par jour (19 ans et plus, 14-18 ans, 9-13 ans et 4-8 ans), 1,6 par jour (2 à 3 ans, tout-petits de 1 an, 6 à 11 mois) (Ficheux et coll. 2015) Voie cutanée – Contact direct, application instantanée Quantité de produit : 18,2 g (19 ans et plus et 14 à 18 ans), 6,3 g (9 à 13 ans et 4 à 8 ans), et 5,4 g (2 à 3 ans, tout-petits de 1 an et 6 à 11 mois) (Ficheux et coll. 2016) Facteur de rétention : 0,1 |
Hydratant corporel (PSN) | Concentration de quaternium‑15 : 0,1 %e Fréquence d’utilisation : 1 fois par jour (19 ans et plus) (Ficheux et coll. 2015; Wu et coll. 2010), 0,8 par jour pour tous les autres groupes d’âge (Wu et coll. 2010) Voie cutanée – Contact direct, application instantanée Quantité de produit : 10 g (19 ans et plus et 14 à 18 ans) (Ficheux et coll. 2016), 7,7 g (9 à 13 ans), 5 g (4 à 8 ans), 4,1 g (2 à 3 ans), 3,1 g (tout-petits de 1 an), 2,5 g (6 à 11 mois), 2 g (0 à 5 mois) (avec ajustements de la superficie) Facteur de rétention : 0,1 |
Permanente / défrisant pour cheveux | Concentration de quaternium‑15 : 0,1 %a Fréquence d’utilisationc : 0,016 fois par jour (19 ans et plus) (Wu et coll. 2010; Ficheux et coll. 2015) Voie cutanée – Contact direct, application instantanée Quantité de produit : 80 g (19 ans et plus) (Bremmer 2006) Facteur de rétention : 0,1 |
a Communication personnelle, courriel de la DSPCPD, SC, au BERSE, SC, 4 février 2019; sans référence.
b Produit destiné à être utilisé par les personnes de 14 ans et plus (communication personnelle, courriel de la DSPCPD, SC, au BERSE, SC, 10 septembre 2019; sans référence).
c Produit destiné à être utilisé par les adultes seulement (19 ans et plus) (communication personnelle, courriel de la DSPCPD, SC, au BERSE, SC, 10 septembre 2019; sans référence).
d Communication personnelle, courriel de la DPT, SC, au BERSE, SC, 4 février 2019; sans référence.
e Communication personnelle, courriel de la DPSNSO, SC, au BERSE, SC, 4 septembre 2019; sans référence.
| Scénario d’exposition (substance) | Hypothèses |
|---|---|
Peinture d’intérieur (cis/trans‑CTAC) | Concentration de cis/trans‑CTAC : 0,1 %a Sous-population : adultes (19 ans et plus) Scénario : peinture au pinceau/rouleau (application), peinture d’intérieur à l’eau (RIVM 2007) Voie cutanée – contact direct avec le produit Taux de contact : 30 mg/min Durée de l’application : 120 min |
Lingette pour le nettoyage des meubles (cis/trans‑CTAC) | Concentration de cis/trans‑CTAC : 1 % b Sous-population : adultes (19 ans et plus) Scénario : lingettes tout usage – nettoyage (application) (RIVM 2018) Voie cutanée – contact direct avec le produit Surface exposée : 225 cm2 Quantité de produit : 0,6 g |
Lingette pour le nettoyage des meubles – après application (exposition aux surfaces traitées) (cis/trans‑CTAC) | Concentration de cis/trans‑CTAC : 1 %b Sous-population : tout-petits de 1 an Voie cutanée Scénario : Algorithme d’exposition cutanée après application (matelas) Document « Residential SOPs » de l’EPA (2012), Section 7 (USEPA 2012) Valeur calculée à l’aide l’algorithme suivant (USEPA 2012) : Dose (mg/kg p.c./j) = [RD × AS/p.c. × F × Fpa × FP × AC] RD : résidu déposé (mg/cm2) calculé en supposant : RD = (QP/SC) × FCP × FCS × C Où : QP : quantité de produit (g) = 11,5 (pour lingettes humides pour nettoyer les canapés en cuir) (RIVM 2018) SC : superficie du canapé (m2) = 5,5 (superficie du canapé en cuir à traiter) (RIVM 2018) FCP : facteur de conversion de poids = 1 000 mg/g FCS : facteur de conversion de superficie = 1 m2/10 000 cm2 C : concentration (fraction) : 0,01 AS/p.c. : ratio aire de surface / poids corporel (cm2/kg) = 482 (sur la base d’une surface corporelle de 5 300 cm2 et d’un poids corporel de 11 kg pour les enfants de 1 an (Santé Canada 2019)) F : fraction du résidu en contact avec le corps = 0,5 (valeur par défaut selon USEPA 2012) Fpa : fraction de la substance disponible pour le transfert à partir du matelas traité = 0,06 (valeur par défaut selon USEPA 2012) FP : facteur de protection = 0,5 (valeur par défaut selon USEPA 2012) AC : absorption cutanée = 100 % Voie orale, contact accidentel Valeur calculée à l’aide l’algorithme suivant pour l’exposition post-application main-à-la-bouche(USEPA 2012) : Exposition = [CRM × (FB × SM) × (TE × N_Rempl) × (1 – (1 – ES)Fréq_MàB/N_Rempl)] / p.c. CRM : charge de résidus sur les mains (mg/cm2); valeur calculée à l’aide de l’algorithme suivant : CRM = [Fpimains × exposition cutanée (mg) (calculée ci-dessus; 1,66 × 10-1 mg)] / (SM × 2) Fpimains : fraction de principe actif sur les mains par rapport aux résidus de surface totaux d’après l’étude Jazzercise (sans unité) = 0,15 (USEPA 2012) SM : superficie d’une main (cm2) = 150 (USEPA 2012) FB : fraction de la main mise à la bouche par événement (sans unité) = 0,13 (USEPA 2012) SM : superficie d’une main (cm2) = 150 (USEPA 2012) TE : temps d’exposition (heures/jour) = 4 (enfants de 1-2 ans, sur les tapis)) (USEPA 2012) N_Rempl : nombre d’intervalles de remplissage par jour= 4 (USEPA 2012) ES : facteur d’extraction de salive = 0,48 (USEPA 2012) Fréq_MàB : nombre d’événements de mise à la bouche par heure = 20 (USEPA 2012) p.c. : poids corporel (kg) = 11 (pour les enfants de 1 an) (Santé Canada 2019) |
Détachant pour tapis / meubles (cis‑CTAC) | Concentration de cis‑CTAC : 0,05 % c Sous-population : adultes (19 ans et plus) Scénario : Détachant pour taches sur tapis (application) (RIVM 2018) Contact cutané direct avec le produit – application instantanée Surface exposée : 75 cm2 Quantité de produit : 0,6 g |
Détachant pour tapis / meubles – après application (enfants jouant sur les surfaces traitées) (cis‑CTAC) | Concentration de cis‑CTAC : 0,05 %c Sous-population : tout-petits de 1 an Scénario : après l’application du détachant (frottement sur le tapis) Calculs basés sur les « Residential SOPs » de l’EPA (2012), Section 7 (USEPA 2012) Voie cutanée Valeur calculée à l’aide l’algorithme suivant (USEPA 2012) : Exposition = [RD × Fpa × CT × TE × AC × FA] / p.c. RD : résidu déposé (mg/cm2) calculé en supposant : RD = RS × FCP × FCS × C Où : RS : résidus en surface (g/m2) = 77 (résidus à la surface du tapis à la suite de l’utilisation du détachant pour enlever des taches) (RIVM 2018) FCP : facteur de conversion de poids = 1 000 mg/g FCS : facteur de conversion de superficie = 1 m2/10 000 cm2 C : concentration (fraction) : 0,0005 CT : coefficient de transfert (cm2/h) = 1 927 (coefficient de transfert pour les adultes (6 800 cm2/h) ajusté pour la superficie du corps des enfants de 1-2 ans (0,28 = 5 300 cm2/18 700 cm2) (Santé Canada 2019) Fpa : fraction disponible pour le transfert = 0,06 (valeur par défaut pour les tapis; USEPA 2012) TE : temps d’exposition = 4 heures (pour les tapis et les enfants de 1-2 ans) AC : absorption cutanée = 100 % FA : facteur d’ajustement (fraction) = 0,25 (jugement professionnel, en supposant que 25 % du tapis est traité pour les taches) p.c. : poids corporel (kg) = 11 (pour les enfants de 1 an) (Santé Canada 2019) Contact oral accidentel (main mise à la bouche) Valeur calculée à l’aide l’algorithme suivant pour l’exposition post-application main-à-la-bouche(USEPA 2012) : Exposition = [CRM × (FB × SM) × (TE × N_Rempl) × (1 – (1 – ES)Fréq_MàB/N_Rempl)] / p.c. CRM : charge de résidus sur les mains (mg/cm2); valeur calculée à l’aide de l’algorithme suivant : CRM = [Fpimains × exposition cutanée (mg) (valeur calculée ci-dessus; 4,4 × 10-1 mg)] / (SM × 2) Fpimains : fraction de principe actif sur les mains par rapport aux résidus de surface totaux d’après l’étude Jazzercise (sans unité) = 0,15 (USEPA 2012) SM : superficie d’une main (cm2) = 150 (USEPA 2012) FB : fraction de la main mise à la bouche par événement (sans unité) = 0,13 (USEPA 2012) SM : superficie d’une main (cm2) = 150 (USEPA 2012) TE : temps d’exposition (heures/jour) = 4 (enfants de 1 à 2 ans, sur les tapis)) (USEPA 2012) N_Rempl : nombre d’intervalles de remplissage par jour= 4 (USEPA 2012) ES : facteur d’extraction de salive = 0,48 (USEPA 2012) Fréq_MàB : nombre d’événements de mise à la bouche par heure = 20 (USEPA 2012) p.c. : poids corporel (kg) = 11 (pour les enfants de 1 an) (Santé Canada 2019) |
a ECCC 2016a.
b SDS 2015a.
c SDS 2017.
