Ébauche d’évaluation préalable - Groupe des parabènes
Titre officiel : Ébauche d’évaluation préalable - Groupe des parabènes
Numéros de registre du Chemical Abstracts Service : 94-13-3, 94-18-8, 94-26-8, 99-76-3, 120-47-8, 4191-73-5, 4247-02-3
Environnement et Changement climatique Canada
Santé Canada
Mars 2020
Résumé
En vertu de l’article 68 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), le ministre de l’Environnement et la ministre de la Santé ont effectué une évaluation préalable de sept substances appelées collectivement le « groupe des parabènes ». L’évaluation des risques que représentent les substances de ce groupe a été jugée prioritaire dans le cadre de l’examen en 2015 de l’Établissement des priorités d’évaluation des risques (EPER) sur la base des préoccupations pour la santé humaine. Les numéros de registre du Chemical Abstracts Service (NR CASNote de bas de page 1 ) de ces substances, leurs noms sur la Liste intérieure des substances (LIS) et leurs noms communs sont énumérés dans le tableau ci-dessous.
| NR CAS | Nom dans la LIS | Nom commun |
|---|---|---|
| 94-13-3 | 4-hydroxybenzoate de propyle | propylparabène |
| 94-18-8 | 4-hydroxybenzoate de benzyle | benzylparabène |
| 94-26-8 | 4-hydroxybenzoate de butyle | butylparabène |
| 99-76-3 | 4-hydroxybenzoate de méthyle | méthylparabène |
| 120-47-8 | 4-hydroxybenzoate d’éthyle | éthylparabène |
| 4191-73-5 | 4-hydroxybenzoate d’isopropyle | iso-propylparabène |
| 4247-02-3 | 4-hydroxybenzoate d’isobutyle | iso-butylparabène |
Selon les renseignements divulgués en réponse à une enquête menée en vertu de l’article 71 de la LCPE, le méthylparabène a été fabriqué et importé au Canada en 2011 en quantités de 981 kg et 563 000 kg, respectivement. Selon une enquête distincte, l’éthylparabène, le propylparabène, le butylparabène, l’iso-propylparabène, l’iso-butylparabène ne sont pas fabriqués au Canada au-delà du seuil de déclaration de 100 kg, mais ont été importés au Canada en 2016 en quantités de 4000 kg, 8500 kg, 100 à 1000 kg, 280 kg et 230 kg, respectivement. Le benzylparabène n’a pas été importé ou fabriqué au-delà des valeurs seuils en 2016.
Les parabènes sont largement utilisés comme agents de conservation et ingrédients parfumants dans les produits cosmétiques, comme les crèmes hydratantes, le maquillage, le dentifrice, les produits pour les cheveux et le rasage, et ils sont utilisés comme agents de conservation antimicrobiens, ingrédients parfumants et exhausteurs de goût dans les produits de santé naturels (PSN). Les parabènes sont également utilisés dans les produits antiparasitaires, les produits de consommation et les médicaments d’ordonnance et en vente libre. Le méthylparabène et le propylparabène sont autorisés comme agents de conservation dans certains aliments et boissons vendus au Canada. Les parabènes sont également présents naturellement dans les aliments comme les baies, les fruits, le vin et la vanille.
Les risques environnementaux associés aux substances du groupe des parabènes ont été caractérisés à l’aide de la Classification du risque écologique (CRE) des substances organiques, une méthode fondée sur le risque qui tient compte de plusieurs paramètres liés au danger et à l’exposition, et sur une pondération des multiples éléments de preuve. Les profils de danger sont établis principalement d’après des paramètres concernant le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité et l’activité chimique et biologique. Parmi les paramètres pris en compte pour les profils d’exposition, mentionnons la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Une matrice de risques est utilisée pour attribuer aux substances un potentiel faible, moyen ou élevé, basé sur leurs profils de danger et d’exposition. D’après la conclusion de l’analyse par la CRE, il a été établi qu’il est peu probable que les substances du groupe des parabènes ont des effets nocifs sur l’environnement.
Compte tenu de toutes les sources de données disponibles présentées dans cette ébauche d’évaluation préalable, le risque d’effets nocifs pour l’environnement du méthylparabène, de l’éthylparabène, du propylparabène, du butylparabène, du benzylparabène, de l’iso-propylparabène et de l’iso-butylparabène est faible. Il est proposé de conclure que le méthylparabène, l’éthylparabène, le propylparabène, le butylparabène, le benzylparabène, l’iso-propylparabène et l’iso-butylparabène ne répondent pas aux critères des alinéas 64a) ou b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ni à mettre en danger l’environnement essentiel pour la vie.
Les animaux exposés au méthylparabène dans une étude à doses répétées ont montré des signes cliniques de mauvaise santé, d’érosion de l’estomac, d’atrophie de la rate et de la thyroïde et de mortalité à la dose maximale. Aucun effet indésirable n’a été signalé dans les études de toxicité pour la reproduction et le développement prénatal ni dans une étude sur le développement de la reproduction chez les hommes. Les principales sources d’exposition de la population générale du Canada au méthylparabène comprennent les cosmétiques, les PSN et les médicaments sur ordonnance et en vente libre. Les marges d’exposition fondées sur les données de biosurveillance de la population générale âgée de 3 à 79 ans ont été jugées adéquates. Les marges d’exposition entre la dose avec effet critique et les estimations de l’exposition à certains PSN sont jugées potentiellement inadéquates pour compenser les incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
L’exposition répétée à des doses élevées d’éthylparabène a entraîné une dépression, une diminution de l’activité motrice et la mortalité dans les études sur des animaux. L’exposition gestationnelle à l’éthylparabène a entraîné un élargissement des ventricules cérébraux et une hydronéphrose chez les fœtus. Le développement prénatal de l’appareil reproducteur chez les mâles et le développement pubertaire chez les mâles n’ont pas été affectés par l’exposition à l’éthylparabène. La population générale du Canada est principalement exposée à l’éthylparabène par les cosmétiques, les PSN et les médicaments en vente libre. Les marges d’exposition fondées sur les données de biosurveillance de la population générale ont été jugées adéquates pour compenser les incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
Le propylparabène n’a pas démontré d’effets indésirables importants dans les études de toxicité par voie alimentaire à doses répétées. Aucun effet indésirable n’a été signalé dans un test de toxicité pour la reproduction et le développement, ni dans des études sur le développement pubertaire et reproductif des mâles et des femelles. Les principales sources d’exposition de la population générale du Canada au propylparabène sont les cosmétiques, les PSN et les médicaments sur ordonnance et en vente libre. Les marges d’exposition fondées sur les données de biosurveillance de la population générale ont été jugées adéquates pour compenser les incertitudes dans les bases de données sur l’exposition et les effets sur la santé. Les marges d’exposition entre la dose avec effet critique et les estimations de l’exposition par voie orale à certains PSN (à la dose et à la fréquence maximales recommandées dans le mode d’emploi) sont jugées insuffisantes pour compenser les incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
L’effet critique du butylparabène a été le développement prénatal de l’appareil reproducteur. L’exposition gestationnelle au butylparabène a été associée à un retard de la puberté, à une modification de la morphologie des organes reproducteurs, ainsi qu’à une réduction du nombre et de la motilité des spermatozoïdes chez les descendants. La population générale du Canada est principalement exposée au butylparabène par les cosmétiques, les PSN et les médicaments en vente libre. Les marges d’exposition fondées sur les données de biosurveillance de la population générale âgée de 3 à 79 ans ont été jugées adéquates. Les marges d’exposition entre les effets critiques et l’estimation de l’exposition à certains cosmétiques, médicaments en vente libre et PSN sont jugées potentiellement inadéquates pour compenser les incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
La base de données sur les effets du benzylparabène sur la santé est limitée. Une approche par lecture croisée a été utilisée pour sélectionner un effet critique du développement reproductif prénatal basé sur le butylparabène. Aucune source d’exposition de la population canadienne au benzylparabène n’a été trouvée. Toutefois, une étude de biosurveillance a révélé la présence de benzylparabène dans l’urine de Canadiennes enceintes. Les marges d’exposition fondées sur les données de biosurveillance du Canada, des États-Unis et de l’Europe sont jugées adéquates pour compenser les incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
L’exposition répétée à l’iso-propylparabène a entraîné des changements dans l’histochimie sérique, ainsi que des effets rénaux et hépatiques. La principale source d’exposition à l’iso-propylparabène est l’utilisation de cosmétiques, de PSN et de médicaments en vente libre. Les marges d’exposition entre la dose avec effet critique et les estimations de l’exposition à l’iso-propylparabène sont jugées adéquates pour compenser les incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
L’effet critique constaté pour l’iso-butylparabène a été une réduction de la motilité des spermatozoïdes et une réduction du nombre de spermatozoïdes épididymaires chez les jeunes mâles après l’administration d’une dose aux mères (exposition gestationnelle et postnatale). La principale source d’exposition à l’iso-butylparabène est l’utilisation de cosmétiques, de PSN et de médicaments en vente libre. Les marges d’exposition entre la dose avec effet critique et les estimations de l’exposition aux cosmétiques, aux médicaments en vente libre et aux PSN contenant de l’iso-butylparabène sont jugées potentiellement inadéquates pour compenser les incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
À la lumière des renseignements présentés dans cette ébauche d’évaluation préalable, il est proposé de conclure que le méthylparabène, le propylparabène, le butylparabène, et l’iso-butylparabène répondent aux critères de l’alinéa 64c) de la LCPE, car ils pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la santé et la vie humaines.
À la lumière des renseignements présentés dans cette ébauche d’évaluation préalable, il est proposé de conclure que l’éthylparabène, le benzylparabène et l’iso-propylparabène ne satisfont pas aux critères mentionnés à l’alinéa 64c) de la LCPE, car ces substances ne pénètrent pas dans l’environnement en une quantité ou une concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est donc proposé de conclure que le méthylparabène, le propylparabène, le butylparabène et l’iso-butylparabène répondent à un ou plusieurs des critères énoncés à l’article 64 de la LCPE et que l’éthylparabène, le benzylparabène et l’iso-propylparabène ne répondent à aucun des critères dudit article.
Il est également proposé que le méthylparabène, le propylparabène, le butylparabène et l’iso-butylparabène ne répondent pas aux critères de persistance ou de bioaccumulation établis dans le Règlement sur la persistance et la bioaccumulation pris en vertu de la LCPE.
1. Introduction
En vertu de l’article 68 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), le ministre de l’Environnement et la ministre de la Santé ont effectué une évaluation préalable de sept substances appelées collectivement le « groupe des parabènes » afin de déterminer si elles présentent ou pourraient présenter un risque pour l’environnement ou pour la santé humaine. L’évaluation des risques que représentent les substances de ce groupe a été jugée prioritaire dans le cadre de l’examen de 2015 de l’Établissement des priorités d’évaluation des risques (EPER) sur la base des préoccupations pour la santé humaine (ECCC, SC 2015).
Les risques environnementaux associés aux substances du groupe des parabènes ont été caractérisés au moyen de l’approche de la CRE (ECCC, 2016a). La CRE décrit les dangers d’une substance à l’aide de paramètres clés, y compris le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne obtenus à partir du réseau trophique, la biodisponibilité, ainsi que l’activité chimique et biologique, et elle tient compte de l’exposition possible des organismes dans les milieux aquatique et terrestre, d’après des facteurs comme les taux d’émission potentiels, la persistance globale et le potentiel de transport à grande distance dans l’atmosphère. Les divers éléments de preuve sont combinés afin de relever les substances nécessitant une évaluation plus poussée de leur potentiel d’effets nocifs sur l’environnement ou présentant une faible probabilité d’effets nocifs sur l’environnement.
Pour la présente ébauche d’évaluation préalable, nous avons pris en compte des données sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et l’exposition, y compris des renseignements soumis par des parties intéressées. Nous avons recensé des informations allant jusqu’en avril 2018. Nous avons utilisé des données empiriques tirées d’études clés ainsi que des résultats de modélisation pour tirer nos conclusions. Lorsqu’ils étaient disponibles et pertinents, les renseignements figurant dans des évaluations effectuées par d’autres autorités compétentes ont été utilisés.
La présente ébauche d’évaluation préalable a été préparée par le personnel du Programme d’évaluation des risques de la LCPE à Santé Canada et à Environnement et Changement climatique Canada et comprend des observations provenant du personnel d’autres programmes régis par ces ministères. La partie de cette évaluation portant sur la santé humaine a été soumise à un examen et/ou à une consultation externe. Phillipa Darbre (Université de Reading, Royaume-Uni), Kurunthachalam Kannan (Université d’État de New York à Albany, New York), Po-Chin Huang (National Institute of Environmental Health Sciences, Taiwan), Chris Kirman et Sean Hays (tous deux de Summit Toxicology) ont formulé des commentaires sur les parties techniques concernant la santé humaine. La partie de cette évaluation portant sur l’environnement repose sur le document de CRE (publié le 30 juillet 2016), qui a fait l’objet d’un examen externe et d’une consultation publique de 60 jours. Même si les commentaires de l’extérieur ont été pris en considération, Santé Canada et Environnement et Changement climatique Canada assument l’entière responsabilité du contenu final et des conclusions de la présente évaluation préalable.
La présente ébauche d’évaluation préalable repose sur des renseignements critiques permettant de déterminer si les substances satisfont aux critères énoncés à l’article 64 de la LCPENote de bas de page 2 . Cette ébauche d’évaluation préalable présente les renseignements et les considérations critiques sur lesquels sont fondées les conclusions proposées.
2. Identité des substances
Les numéros de registre CASNote de bas de page 3 , les noms figurant sur la LIS et les noms communs des substances individuelles du groupe des benzoates sont présentés au tableau 2-1.
| NR CAS | Nom dans la LIS (nom commun) | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 94-13-3 | 4-hydroxybenzoate de propyle (propylparabène) | 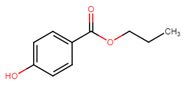 C10H12O3 C10H12O3 |
180,20 |
| 94-18-8 | 4-hydroxybenzoate de benzyle (benzylparabène) | 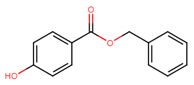 C14H12O3 C14H12O3 |
228,25 |
| 94-26-8 | 4-hydroxybenzoate de butyle (butylparabène) | 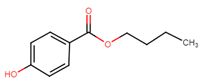 C11H14O3 C11H14O3 |
194,23 |
| 99-76-3 | 4-hydroxybenzoate de méthyle (méthylparabène) | 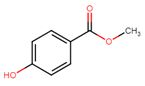 C8H8O3 C8H8O3 |
152,15 |
| 120-47-8 | 4-hydroxybenzoate d’éthyle (éthylparabène) | 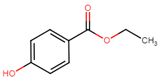 C9H10O3 C9H10O3 |
166,17 |
| 4191-73-5 | 4-hydroxybenzoate d’isopropyle (iso-propylparabène) | 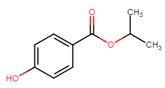 C10H12O3 C10H12O3 |
180,20 |
| 4247-02-3 | 4-hydroxybenzoate d’isobutyle (iso-butylparabène) | 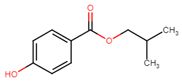 C11H14O3 C11H14O3 |
194,23 |
3. Propriétés physiques et chimiques
Les tableaux 3.1 et 3.2 résument les propriétés physicochimiques des substances du groupe des parabènes. D’autres propriétés physiques et chimiques sont données par le document d’ECCC (2016 b).
| Propriété | Méthyl-parabène | Éthyl-parabène | Propyl-parabène | Butyl-parabène | Principales références |
|---|---|---|---|---|---|
| Point de fusion (°C), exp. | 127 à 128 | 116 à 117 | 96 à 97 | 68 à 69 | Grant et coll. 1984; Dymicky et Hutanen 1979 |
| Point d’ébullition (°C), exp. | 275 (décomp.) | 297,5 | N.D. | N.D. | EPI Suite, c2000-2012 |
| Pression de vapeur (mm Hg, 25 °C), est.a | 2,37 × 10-4 | 9,29 × 10-5 | 5,55 × 10-4 | 1,86 × 10-4 | EPI Suite, c2000-2012 |
| Constante de la loi d’Henry (atm·m3/mol, 25 °C), est.b | 2,23 × 10-9 | 4,79 × 10-9 | 6,37 × 10-9 |
8,45 × 10-9 | EPI Suite, c2000-2012 |
| Solubilité dans l’eau (g/L, 25 °C), exp. | 2,5 | 0,75 | 0,50 | 0,17 | Dymicky et Hutanen 1979 |
| log KOE (sans dimension), exp. | 1,96 | 2,47 | 3,04 | 3,57 | Hansch et coll. 1995 |
| pKa (sans dimension), exp. | 8,17 | 8,22 | 8,35 | 8,37 | Dymicky et Hutanen 1979 |
Abréviations : N.D. = Non disponible; décomp.= décomposition; est. = valeur estimée; exp. = valeur expérimentale.
a Les estimations calculées de la pression de vapeur pour les parabènes spécifiés ont été obtenues à l’aide du logiciel MPBPWIN (EPISuite).
b Les estimations calculées de la constante de la loi d’Henry ont été obtenues à l’aide du programme HENRYWIN (EPISuite) basé sur la méthode de contribution des liaisons de Meylan et Howard (1991).
| Propriété (unité) | Benzyl-parabène | iso-propyl-parabène | iso-butyl-parabène | Principales références |
|---|---|---|---|---|
| Point de fusion (°C), exp. | 111 | 86 | 73 | Cavill and Vincent 1947; US EPA 2017 |
| Point d’ébullition (°C), est.a | 355 | 276 | 291 | ChemSpider 2017a,b,c |
| Pression de vapeur (mm Hg, 25 °C), est.a | 3,37 × 10–6 | 1,16 × 10–3 | 3,81 × 10–4 | EPI Suite, c2000-2012 |
| Constante de la loi d’Henry (atm·m3/mol, 25 °C), est.b | 2,92 × 10–10 | 6,37 × 10–9 | 8,45 × 10–9 | EPI Suite, c2000-2012 |
| Solubilité dans l’eau (mg/L, 25 °C), est.c | 1,07 × 102 | 6,90 × 102 | 2,24 × 102 | EPI Suite c2000-2012g |
| log KOE (sans dimension), est.d | 3,56 (exp,) | 2,91 | 3,4 | EPI Suite c2000-2012; Lehner et coll. 1993 |
Abréviations : est.= valeur estimée; exp.= valeur expérimentale.
a Les estimations calculées du point d’ébullition et de la pression de vapeur pour les parabènes spécifiés ont été obtenues à l’aide du programme MPBPWIN (EPISuite).
b Les estimations calculées des constantes de la loi d’Henry ont été obtenues à l’aide du programme HENRYWIN (EPISuite) basé sur la méthode de contribution des liaisons de Meylan et Howard (1991).
c Les estimations calculées de la solubilité dans l’eau ont été obtenues à l’aide du programme WSKOWWWIN (EPISuite), d’après la méthode de Meylan et al (1996).
d Valeurs estimées sauf indication contraire. Les estimations du coefficient de partage logarithmique octanol-eau ont été obtenues à l’aide du programme KOWWIN (EPISuite), d’après la méthode de contribution atome/fragment de Meylan et Howard (1995).
d Les estimations calculées du coefficient d’adsorption dans le sol ont été obtenues à l’aide du programme PCKOCWIN (EPISuite).
4. Sources et utilisations
Toutes les substances du groupe des parabènes ont été incluses dans des enquêtes réalisées en vertu de l’article 71 de la LCPE (Canada 2012, 2017). Le tableau 4-1 présente un résumé des renseignements déclarés sur la fabrication totale et les quantités totales importées pour le groupe des parabènes. Aucune quantité de benzylparabène n’a été fabriquée ou importée au Canada au-delà du seuil de déclaration de 100 kg.
| Nom commun | Quantité fabriquée totalea (kg) | Quantité importée totalea (kg) | Année de déclaration | Enquête |
|---|---|---|---|---|
| Méthylparabène | 981 | 563 190 | 2011 | Canada 2012 |
| Éthylparabène | non déclaréeb | 4029 | 2016 | Canada 2017 |
| Propylparabène | non déclaréeb | 8526 | 2016 | Canada 2017 |
| Butylparabène | non déclaréeb | 100 à 1000 | 2016 | Canada 2017 |
| iso-propylparabène | non déclaréeb | 284 | 2016 | Canada 2017 |
| iso-butylparabène | non déclaréeb | 232 | 2016 | Canada 2017 |
a Les valeurs représentent les quantités déclarées dans le cadre des enquêtes réalisées en vertu de l’article 71 de la LCPE (Canada 2012, 2017). Voir les enquêtes pour des inclusions ou des exclusions spécifiques (annexes 2 et 3).
b Aucune quantité déclarée supérieure au seuil de déclaration de 100 kg.
Le tableau 4 2 présente un résumé des principales utilisations des substances du groupe des parabènes selon les renseignements communiqués dans le cadre d’enquêtes menées en vertu de l’article 71 de la LCPE (Canada 2012, 2017).
| Nom commun | Soins personnelsa | Produits de santé naturelsa | Médicamentsa | Aliments et boissonsa | Année de déclaration |
|---|---|---|---|---|---|
| Méthylparabène | Oui | Oui | Oui | Non | 2011 |
| Éthylparabène | Oui | Non | Oui | Non | 2016 |
| Propylparabène | Oui | Oui | Oui | Oui | 2016 |
| Butylparabène | Oui | Non | Oui | Non | 2016 |
| iso-propylparabène | Oui | Non | Non | Non | 2016 |
| iso-butylparabène | Oui | Non | Non | Non | 2016 |
a Renseignements non confidentiels sur les utilisations déclarées dans le cadre des collectes de données menées en vertu de l’article 71 de la LCPE (Environnement Canada, 2013, 2017). Voir les enquêtes pour les inclusions ou les exclusions spécifiques (annexes 2 et 3).
Les parabènes sont utilisés dans une grande variété de produits. Les membres de ce groupe peuvent être utilisés au Canada dans les aliments (additifs), les matériaux d’emballage alimentaire, les médicaments sur ordonnance et en vente libre, les PSN, les cosmétiques, les produits de consommation et les produits antiparasitaires. Le méthylparabène, l’éthylparabène, le propylparabène et le butylparabène figurent dans la base de données sur les ingrédients du Personal Care Products Council, qui contient des renseignements sur les fonctions de préservation et de parfum dans une vaste gamme de produits. L’iso-propylparabène et l’iso-butylparabène ont des fonctions de préservation dans une large gamme de produits (PCPC 2018). À l’heure actuelle, il n’existe aucune restriction concernant la concentration des parabènes utilisés dans les produits cosmétiques au Canada. Toutefois, selon la directive de la Commission européenne, le méthylparabène et l’éthylparabène sont autorisés à une concentration maximale de 0,4 % (p/p) comme esters simples et à une concentration maximale totale de 0,8 % (p/p) pour les mélanges d’esters. Le butylparabène et le propylparabène sont autorisés à une concentration maximale de 0,14 % pour la somme des concentrations individuelles et de 0,8 % pour les mélanges de méthylparabène, d’éthylparabène, de propylparabène et de butylparabène. Le benzylparabène, l’iso-propylparabène et l’iso-butylparabène sont interdits dans les cosmétiques, dans l’UE (CosIng 2019). Au Canada, les parabènes sont limités dans les PSN à une limite supérieure de 10 mg/kg p.c./jour d’exposition par voie orale totale pour le méthylparabène, l’éthylparabène et le propylparabène. L’éthylparabène est également limité à un total de 0,4 % dans les produits topiques, et jusqu’à 0,8 % pour les parabènes en mélange. Le méthylparabène et le propylparabène sont inscrits dans la Base de données sur les ingrédients des produits de santé naturels (BDIPSN) à des fins non médicinales comme ingrédient parfumant et agent de conservation antimicrobien; le butylparabène est inscrit à des fins non médicinales comme exhausteur de goût et agent de conservation antimicrobien; l’éthylparabène, le benzylparabène, l’iso-propylparabène et l’iso-butylparabène figurent à des fins non médicinales comme agents de conservation antimicrobien (BDIPSN 2019).
Selon les avis soumis de 2014 à 2017à Santé Canada en vertu du Règlement sur les cosmétiquesiso-propylparabène et l’iso-butylparabène sont utilisés dans les produits cosmétiques au Canada. Le méthylparabène, l’éthylparabène, le propylparabène, le butylparabène et l’iso-butylparabène sont utilisés dans une vaste gamme de produits, notamment les lotions, les produits de maquillage, les nettoyants, les produits d’hygiène buccale, les après-shampoings et les shampoings. Le méthylparabène est le plus répandu dans les cosmétiques, suivi du propylparabène, de l’éthylparabène, du butylparabène, de l’iso-butylparabène, de l’iso-butylparabène et de l’iso-propylparabène (données internes, Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 18 août 2017; sans référence).
Le méthylparabène, l’éthylparabène, le propylparabène, le butylparabène, l’iso-propylparabène et l’iso-butylparabène sont déclarés comme ingrédients non médicinaux des médicaments en vente libre. Le méthylparabène, l’éthylparabène et le propylparabène sont également déclarés comme ingrédients non médicinaux dans les médicaments sur ordonnance. Le méthylparabène entre dans la composition de médicaments sur ordonnance et en vente libre, y compris les médicaments oraux, les médicaments intraveineux et intramusculaires, les écrans solaires, les crèmes et les onguents. L’éthylparabène est présent dans des médicaments sur ordonnance et en vente libre, y compris des médicaments oraux, des lingettes anti-infectieuses, des écrans solaires, des shampoings médicamenteux, des baumes et des crèmes. Le propylparabène entre dans la composition de médicaments sur ordonnance et en vente libre, y compris les médicaments oraux, les médicaments intramusculaires/intraveineux, les lingettes anti-infectieuses, les écrans solaires, les crèmes et onguents médicamenteux. Le butylparabène entre dans la composition de médicaments en vente libre, y compris les médicaments oraux, les lingettes anti-infectieuses, les écrans solaires et les crèmes médicamenteuses. L’iso-propylparabène entre dans la composition de médicaments en vente libre comme les crèmes hydratantes et les produits de maquillage du visage qui contiennent des écrans solaires. L’iso-butylparabène entre dans la composition de médicaments en vente libre, y compris les traitements contre l’acné, les écrans solaires et les baumes médicamenteux (communication personnelle, courriel de la Direction des produits thérapeutiques, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 25 mai 2017; sans référence).
Le méthylparabène, l’éthylparabène, le propylparabène, le butylparabène, l’iso-propylparabène et l’iso-butylparabène sont également présents comme ingrédients non médicinaux dans les PSN. Le méthylparabène est présent dans les PSN homologués, notamment les médicaments et suppléments oraux, les dentifrices, les filtres solaires. L’éthylparabène est présent dans les PSN, y compris les médicaments oraux traditionnels, les suppléments, les écrans solaires, les nettoyants, les crèmes et onguents médicamenteux. Le propylparabène est présent dans les PSN, y compris les médicaments oraux, les suppléments, les produits d’hygiène buccale, les écrans solaires, les crèmes et onguents médicamenteux. Le butylparabène est présent dans les PSN, y compris les médicaments contre la toux, les remèdes traditionnels, les écrans solaires, les traitements contre l’acné, les crèmes et onguents médicamenteux. L’iso-propylparabène est présent dans un PSN homologué, un traitement contre l’acné. L’iso-butylparabène est présent dans les PSN homologués, y compris les traitements contre l’acné, les peelings chimiques, les écrans solaires et les crèmes médicamenteuses (communication personnelle, courriels de la Direction des produits de santé naturels et sans ordonnance de Santé Canada, à Direction de la sécurité des produits de consommation et des produits dangereux deSanté Canada, 20 février 2017 et 20 mars 2019; sans référence).
Les produits qui contiennent du méthylparabène comprennent les lingettes de nettoyage et les fournitures d’artisanat pour enfants (marqueurs lavables et bâton de colle) (SDS 2010, 2008a, 2008 b). Le propylparabène a également été identifié dans les lingettes de nettoyage (SDS 2010). Aucun autre parabène dans cette évaluation n’a été trouvé dans les produits de consommation.
Le méthylparabène est un composant dans la fabrication de matériaux d’emballage alimentaire, sans contact direct avec les aliments, et un composant dans les additifs indirectsNote de bas de page 4 utilisés dans les établissements de transformation des aliments, avec possibilité de contact avec les aliments. Le propylparabène est un composant dans la fabrication de matériaux d’emballage alimentaire, avec ou sans contact direct avec les aliments, et un composant dans les additifs indirects utilisés dans les établissements de transformation des aliments, avec possibilité de contact avec les aliments. Le méthylparabène et le propylparabène peuvent également être utilisés comme composants dans les nettoyants pour les mains et les produits pour la peau utilisés par les employés des établissements de transformation des aliments, avec rinçage subséquent à l’eau potable; par conséquent, le contact avec les aliments n’est pas prévu. L’éthylparabène et l’iso-butylparabène peuvent être utilisés comme composants dans les nettoyants pour les mains utilisés par les employés des établissements de transformation des aliments, avec rinçage subséquent à l’eau potable; par conséquent, le contact avec les aliments n’est pas prévu.
Les parabènes sont naturellement présents dans les aliments, notamment les baies, les fruits, le vin et la vanille (Soni et coll. 2005). Le méthylparabène et le propylparabène figurent sur la Liste des agents de conservation autorisés et sont tous deux autorisés en tant qu’agents de conservation jusqu’à 1000 ppm dans certains aliments (Communication personnelle, courriel de la Direction des aliments, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 13 mars 2017; sans référence).
Le méthylparabène, l’éthylparabène, le propylparabène et le butylparabène sont des produits de formulation dans les produits antiparasitaires réglementés par la Loi sur les produits antiparasitaires. Ils sont utilisés au Canada dans une vaste gamme de produits antiparasitaires (Communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 13 mars 2017; sans référence).
Le benzylparabène figure inclus dans la BDIPSN, mais n’est pas présent dans les PSN homologués (communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 20 février 2017; sans référence). Selon les avis soumis de 2014 à 2017 à Santé Canada en vertu du Règlement sur les cosmétiques, le benzylparabène n’est pas présent comme ingrédient dans les produits cosmétiques au Canada. On n’a relevé aucune autre utilisation du benzylparabène au Canada.
| Utilisation | Méthyl-parabène | Éthyl-parabène | Propyl-parabène | Butyl-parabène |
|---|---|---|---|---|
| Additif alimentairea | Oui | Non | Oui | Non |
| Matériaux d’emballage alimentairea | Oui | Non | Oui | Non |
| Additifs indirectsa | Oui | Oui | Oui | Non |
| Dans la Base de données sur les produits pharmaceutiques, présents comme ingrédient médicinal ou non médicinal dans les désinfectants ou dans des médicaments destinés aux humains ou aux animaux au Canadab | Oui | Oui | Oui | Oui |
| Dans la Base de données sur les ingrédients des produits de santé naturelsc | Oui | Oui | Oui | Oui |
| Dans la Base de données des produits de santé naturels homologués, présents comme ingrédients médicinaux ou non médicinaux dans des produits de santé naturels au Canadad | Oui | Oui | Oui | Oui |
| Avis indiquant sa présence dans les cosmétiques, établi d’après les notifications soumises en vertu du Règlement sur les cosmétiques à Santé Canadae | Oui | Oui | Oui | Oui |
| Formulant dans des produits antiparasitaires homologués au Canadaf | Oui | Oui | Oui | Oui |
a Communication personnelle, courriel de la Direction des aliments, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 13 mars 2017, sans référence.
b BDPP 2017.
c BDIPSN 2019.
d BDPSNH 2018.
e Données internes, Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 18 août 2017, sans référence.
f Communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 13 mars 2017, sans référence
| Utilisation | Benzylparabène | iso-propylparabène | iso-butylparabène |
|---|---|---|---|
| Additif alimentairea | N | N | N |
| Matériaux d’emballage alimentairea | N | N | N |
| Additifs indirectsa | N | N | Oui |
| Dans la Base de données sur les produits pharmaceutiques, présents comme ingrédient médicinal ou non médicinal dans les désinfectants ou dans des médicaments destinés aux humains ou aux animaux au Canadab | N | Oui | Oui |
| Dans la Base de données sur les ingrédients des produits de santé naturelsc | Oui | Oui | Oui |
| Dans la Base de données des produits de santé naturels homologués, présents comme ingrédients médicinaux ou non médicinaux dans des produits de santé naturels au Canadad | N | Oui | Oui |
| Présence dans les cosmétiques, d’après les notifications soumises en vertu du Règlement sur les cosmétiques à Santé Canadae | N | Oui | Oui |
| Formulant dans des produits antiparasitaires homologués au Canadaf | N | N | N |
a Communication personnelle, courriel de la Direction des aliments, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 13 mars 2017, sans référence.
b BDPP 2017.
c BDIPSN 2019.
d BDPSNH 2018.
e Données internes, Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 18 août 2017, sans référence.
f Communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 13 mars 2017, sans référence.
5. Devenir et comportement dans l’environnement
5.1 Persistance dans l’environnement
Selon les modèles utilisés dans l’approche CRE (ECCC 2016b), les substances du groupe des parabènes devraient se dégrader et ne pas être persistantes dans l’eau, l’air, les sédiments ou le sol.
5.2 Potentiel de bioaccumulation
Étant donné leur faible valeur Koe et leur faible facteur de bioconcentration (ECCC 2016b), les substances du groupe des parabènes ne devraient pas se bioaccumuler de façon significative dans les organismes.
6. Risque d’effets nocifs sur l’environnement
6.1 Caractérisation des risques environnementaux
Les risques environnementaux associés aux substances du groupe des parabènes ont été caractérisés à l’aide de l’approche de Classification du risque écologique (CRE) des substances organiques (ECCC, 2016a). La CRE est une approche fondée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition et qui repose sur la pondération de plusieurs éléments de preuve. Les divers éléments de preuve sont combinés afin de pouvoir distinguer les substances présentant un pouvoir faible ou élevé et un potentiel d’exposition faible ou élevé dans divers milieux. Cette approche permet de réduire l’incertitude associée à la caractérisation des risques, contrairement à une approche qui serait basée sur un seul paramètre mesuré dans un seul milieu (p. ex. CL50). Les paragraphes suivants résument l’approche, décrite en détail dans le document d’ECCC (2016a).
Les données sur les propriétés physico-chimiques, le devenir (demi-vie chimique dans divers milieux et biotes, coefficients de partage et bioconcentration dans le poisson), sur l’écotoxicité aiguë pour le poisson et sur les quantités produites et importées au Canada proviennent de la littérature scientifique, de bases de données empiriques (p. ex., boîte à outils QSAR de l’OCDE) et des réponses aux enquêtes menées en vertu de l’article 71 de la LCPE. D’autres données ont été obtenues en utilisant des modèles de type QSAR (relation quantitative structure-activité) ou de bioaccumulation et de devenir du bilan massique. Ces données ont été utilisées soit pour alimenter d’autres modèles de bilan massique, soit pour compléter les profils des risques et de l’exposition des substances.
Nous avons déterminé les profils de dangers en nous fondant principalement sur les mesures du mode d’action toxique, de la réactivité chimique, des seuils de toxicité internes basés sur les réseaux trophiques, de la biodisponibilité et de l’activité chimique et biologique. Les profils d’exposition étaient également basés sur plusieurs paramètres, dont la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Les profils de risque et d’exposition aux critères de décision ont été comparés aux critères de décision afin de catégoriser le potentiel de danger et d’exposition de chaque organique selon trois niveaux : faible, modéré ou élevé. Nous avons aussi appliqué d’autres règles (p. ex., la cohérence de la classification et la marge d’exposition) pour préciser les classifications préliminaires du danger et de l’exposition.
Une matrice de risque a été utilisée pour attribuer à chaque substance un risque potentiel faible, moyen ou élevé, basé sur la classification de son danger et de son exposition. Les classifications du risque potentiel au moyen de la CRE ont été vérifiées en suivant une approche en deux étapes. La première étape servait à ajuster les résultats de la classification de risque moyen ou élevé à risque faible pour les substances présentant une faible vitesse d’émission estimée dans l’eau après le traitement des eaux usées, et représentant un faible potentiel d’exposition. La deuxième étape servait à revoir les résultats d’une classification de risque potentiel faible ou moyen de scénarios de risque relativement prudents, d’échelle locale (c.-à-d. dans la zone à proximité du point de rejet), conçus pour protéger l’environnement, afin de déterminer si la classification du risque potentiel devrait être accrue.
La CRE emploie une méthode de pondération qui vise à réduire au minimum la probabilité de surestimer ou de sous-estimer le danger, l’exposition et le risque qui en découle. Les approches équilibrées pour tenir compte des incertitudes sont décrites en détail dans le document ECCC (2016a). Voici une description de deux des domaines d’incertitude les plus importants. Des valeurs de toxicité aiguë empiriques ou modélisées erronées pourraient conduire à des modifications du classement du danger, en particulier dans le cas des paramètres liés à des concentrations de résidus dans les tissus (c.-à-d. le mode d’action toxique), bon nombre de ces paramètres étant prévus à partir de modèles QSAR (Boîte à outils QSAR de l’OCDE 2016). L’effet d’une telle erreur est toutefois atténué par le fait que toute surestimation de la létalité médiane générera une valeur prudente (protectrice) de la valeur utilisée lors de l’analyse des résidus corporels critiques. De même, toute erreur de sous-estimation de la toxicité aiguë est atténuée par le recours à d’autres mesures du danger, telles que l’établissement du profil structural du mode d’action, de la réactivité ou de l’affinité pour les récepteurs d’œstrogènes. Les changements ou les erreurs dans les quantités chimiques pourraient entraîner des classifications différentes de l’exposition, car la classification de l’exposition et du risque dépend grandement du taux d’émission et des quantités utilisées. Les classifications obtenues au moyen de la CRE reflètent donc l’exposition et le risque au Canada, compte tenu des quantités vraisemblablement utilisées actuellement, mais pourraient ne pas rendre compte des tendances futures.
Les données et considérations critiques utilisées pour élaborer les profils spécifiques des substances du groupe des parabènes, ainsi que les résultats de la classification des dangers, de l’exposition et des risques, sont présentées dans ECCC (2016b).
Les classifications des dangers et de l’exposition pour les sept substances du groupe des parabènes sont résumées dans le tableau 6-1.
| Substance | Classification CRE du danger | Classification CRE de l’exposition | Classification CRE du risque |
|---|---|---|---|
| Méthylparabène | faible | faible | faible |
| Éthylparabène | faible | faible | faible |
| Propylparabène | faible | faible | faible |
| Butylparabène | faible | faible | faible |
| Benzylparabène | faible | faible | faible |
| Iso-propylparabène | faible | faible | faible |
| Iso-butylparabène | faible | faible | faible |
À la lumière des classifications de faible danger et de faible exposition, selon les données examinées dans le cadre de la CRE, le méthylparabène, l’éthylparabène, le propylparabène, le butylparabène, le benzylparabène, l’iso-propylparabène et l’iso-butylparabène présentent un faible potentiel de risque pour l’environnement. Selon les alertes structurelles fournies par la boîte à outils de l’OCDE, le propylparabène, le butylparabène, le benzylparabène et l’iso-propylparabène sont des liants potentiels des récepteurs endocriniens. La perturbation endocrinienne est examinée plus en détail dans certaines parties sur les effets sur la santé, et l’annexe C présente un examen de certains des effets œstrogéniques des parabènes. Les effets potentiels et la façon dont ils peuvent se manifester dans l’environnement n’ont pas été étudiés plus avant en raison de la faible exposition à ces substances. Il est donc peu probable que ces substances susciteront des préoccupations pour l’environnement au Canada.
7. Potentiel d’effets nocifs sur la santé humaine
7.1 Méthylparabène
7.1.1 Évaluation de l’exposition
Le méthylparabène est présent naturellement dans certains aliments et a été trouvé dans les milieux naturels. Le méthylparabène est également présent dans un certain nombre de produits, notamment les cosmétiques, les médicaments sur ordonnance et en vente libre, les PSN, certains produits de consommation et des produits antiparasitaires. Il peut également être utilisé comme additif alimentaire ou comme composant dans les matériaux d’emballage alimentaire. Bon nombre de ces sources contribuent à l’exposition quotidienne totale au méthylparabène. Les concentrations urinaires et l’exposition estimée des Canadiens au méthylparabène dans l’urine sont présentées dans la section suivante.
Biosurveillance
Les données de biosurveillance recueillies lors du cycle 4 (2014-2015) de l’Enquête canadienne sur les mesures de la santé (ECMS) ont révélé une moyenne géométrique pour la concentration urinaire de 17 µg/L (intervalle de confiance à 95 % de 13 à 22 µg/L) de méthylparabène chez les Canadiens de 3 à 79 ans, selon un échantillonnage aléatoire (n = 2564) (Santé Canada 2017a). Chez les femmes (3 à 9 ans; n = 1289), la moyenne géométrique de la concentration urinaire était de 30 µg/L (intervalle de confiance à 95 % de 21 à 43 µg/L) plus élevée que chez les hommes (3 à 79 ans, n = 1275) avec 9,4 µg/L (moyenne géométrique, intervalle de confiance à 95 % de 6,9 à 13 µg/L). Parmi les différents groupes d’âge, le groupe ayant la concentration urinaire la plus élevée était celui des adultes de 40 à 59 ans (n = 312), avec une moyenne géométrique de la concentration urinaire de 21 µg/L (intervalle de confiance à 95 % de 11 à 38 µg/L)Note de bas de page 5 . Le groupe d’âge pour lequel la concentration urinaire était la plus faible était celui des enfants de 6 à 11 ans (n = 514), pour lesquels la moyenne géométrique de la concentration urinaire était de 7,6 µg/L (intervalle de confiance à 95 % de 6,4 à 9,1 µg/L) (Santé Canada 2017a). Dans l’ensemble de la population (3 à 79 ans), 8,39 % des échantillons étaient inférieurs à la limite de détection (1,3 ng/mL; Santé Canada 2017b). La plus forte proportion des échantillons inférieurs à la limite de détection était de 11,22 % chez les adultes de 40 à 59 ans. Dans deux autres études canadiennes à plus petite échelle, les concentrations urinaires moyennes chez les femmes étaient de 101,3 µg/L (n = 28, dont 9 patientes enceintes) et la moyenne géométrique était de 94,86 µg/L chez les femmes enceintes (n = 31 femmes). Les concentrations médianes étaient de 25,45 et 27,21 µg/L, respectivement (Genuis et coll. 2013; Fisher et coll. 2017). La concentration urinaire moyenne chez les hommes (n = 11), d’après Genuis et coll. (2013) était de 95,53 µg/L (médiane de 25,95 µg/L). La différence dans les concentrations chez les adultes (moyenne ou moyenne géométrique) rapportée par l’ECMS par rapport à Genuis et coll. (2013) et Fisher et coll. (2017) peut être due à des différences dans la population analysée (c.‑à‑d. de petites populations locales et une population de femmes enceintes, par rapport à un large échantillon national représentatif de la population générale).
Le méthylparabène a été détecté à une concentration médiane de 97,0 µg/L (forme libre plus parabène conjugué, la plage de 25 à 75 centiles étant de 39,9 à 272,3 µg/L) dans l’urine prélevée chez des nourrissons coréens (n = 46) dans les 48 heures suivant la naissance (Kang et coll. 2013). Quarante et un nouveau-nés de faible poids à la naissance à l’Unité de soins intensifs néonataux présentaient une moyenne géométrique de la concentration urinaire de 203 µg/L de méthylparabène total (Calafat et coll. 2009), cette moyenne géométrique étant supérieure à celle rapportée pour les plus jeunes enfants dans l’ECMS (moyenne géométrique de 12 µg/L de méthylparabène total chez les enfants de 3 à 5 ans) ou l’étude NHANES (moyenne géométrique de 33,5 µg/L de méthylparabène total chez les enfants de 6 à 11 ans) (Santé Canada 2017a; Calafat et coll. 2010).
On a décelé la présence de méthylparabène dans le lait maternel à une concentration médiane de 0,22 µg/L chez 56 Canadiennes (moyenne géométrique = 0,0672 µg/L, 95e centile = 6,792 µg/L), 3 mois après la naissance (Fisher et coll. 2017). Le méthylparabène a été détecté dans des échantillons placentaires de 12 femmes de Barcelone (maximum = 11,77 ng/g poids frais) et dans le liquide amniotique de 40 femmes enceintes dans une étude indienne (moyenne géométrique = 8,01 µg/L) (Valle-Sistac et coll. 2016; Shekhar et coll. 2017). Le méthylparabène a été détecté dans le sang du cordon ombilical à une concentration moyenne de 0,037 µg/L chez 50 couples mère-enfant aux États‑Unis (Towers et coll. 2015). Dans une étude de Mulla et coll. (2015), 181 nouveau-nés qui avaient reçu des médicaments contenant du méthylparabène comme excipient présentaient une concentration sanguine médiane de 12 µg/L
Les équivalents de biosurveillance par âge pour les parabènes ont été calculés à partir des doses journalières admissibles (DJA) déjà publiées (Aylward et coll. 2017a). À l’aide d’une méthode similaire, les doses journalières estimées ont été calculées à partir des données de biosurveillance de l’ECMS pour la population générale, les femmes enceintes et les nouveau-nés (Santé Canada 2017a; Fisher et coll. 2017; Kang et coll. 2013). Dans chacune des trois études de biosurveillance, le méthylparabène total (c.‑à‑d. les espèces libres et conjuguées) a été mesuré dans l’urine par CPLHP, après traitement avec la β-glucuronidase et la sulfatase. Les nouveau‑nés ont été inclus parce que la détection du méthylparabène dans le sang du cordon ombilical, le placenta et le liquide amniotique indique que le méthylparabène traverse le placenta et qu’une exposition in utero est possible (Shekhar et coll. 2017; Valle-Sistac et coll. 2016; Towers et coll. 2015). Les concentrations urinaires de méthylparabène chez les nouveau-nés coréens ont été utilisées en l’absence de données provenant d’une population canadienne. On considère qu’il s’agit d’un choix prudent parce que les concentrations urinaires de méthylparabène au 95e centile dans la population générale de la Corée dépassent celles de la population canadienne générale (Honda et coll. 2018).
Dans une étude de pharmacocinétique chez les humains en réponse à une exposition orale au méthylparabène, au butylparabène et à l’iso-butylparabène, trois adultes (deux hommes et une femme) ont ingéré 10 mg chacun (de 0,12 à 0,19 mg/kg p.c.) de parabène radiomarqué (Moos et coll. 2016). La demi‑vie d’élimination du méthylparabène était de 6,9 heures, et 83,4 % de la dose appliquée a été éliminé dans l’urine en 24 heures sous forme de méthylparabène, de méthylparabène avec hydroxylation du cycle, d’acide para-hydroxybenzoïque (PHBA) et d’acide para-hydroxyhippurique (PHHA), un conjugué glycine du PHBA. Après 48 heures, 17,4 % de la dose administrée par voie orale a été récupéré sous forme de méthylparabène total (libre, plus espèces conjuguées; Moos et coll. 2016). Un taux élevé de récupération de la dose radiomarquée administrée dans l’urine indique qu’il s’agit du principal mode d’élimination du méthylparabène, des conjugués et des métabolites. Le méthylparabène administré par voie orale a une demi‑vie courte et n’est pas le principal métabolite récupéré. Le PHBA et le PHHA ont été détectés comme étant le principal métabolite des trois parabènes testés. Cependant, le PHBA est un biomarqueur inadéquat, car il est produit par hydrolyse de tous les parabènes et ne reflète pas les différences dans la toxicocinétique de chaque composé (Ye et coll. 2006; Wang et coll. 2013b). En revanche, le méthylparabène est un biomarqueur spécifique de l’exposition, et les valeurs d’élimination urinaire fractionnée (EUF) rapportées chez les participants de l’étude ont montré peu de variation (allant de 0,155 à 0,192). L’utilisation d’une valeur EUF par voie orale peut sous-estimer ou surestimer l’exposition par voie cutanée, et l’utilisation du parabène d’origine comme biomarqueur fournit une mesure moins robuste de l’exposition, car ce n’est pas le principal métabolite. En raison de l’utilisation répandue du méthylparabène, l’utilisation du composé d’origine comme biomarqueur peut également donner lieu à une contamination pendant l’échantillonnage et l’analyse, ce qui peut surestimer l’exposition (Aylward et coll. 2017a).
Les doses journalières estimées ont été calculées à l’aide de l’équation suivante (Saravanabhavan et coll. 2014) : DJE = TEU/ EUF et TEU = [CUCr × TEC]/ P.C.; où DJE est la dose journalière estimée en µg/kg p.c./j, TEU est le taux d’élimination urinaire en µg/kg p.c./j, EUF est l’élimination urinaire fractionnée basée sur une exposition orale, CUCr est la concentration urinaire en µg/g de créatinine, TEC est le taux d’élimination de créatinine en mg/j, et p.c. est le poids corporel en kg. La valeur d’élimination urinaire fractionnée de 0,174, ou 17,4 % pour le méthylparabène a été rapportée dans Moos et coll. (2016), et le taux d’élimination de créatinine a été calculé en utilisant l’équation de Mage (Saravanabhavan et coll. 2014).
Les valeurs de concentrations urinaires utilisées pour calculer la dose journalière estimée étaient les valeurs de l’intervalle de confiance à 95 % du 95e centile (ou les valeurs les plus élevées disponibles), pour la concentration urinaire ajustée en fonction de la créatinine (µg/g Cr) pour chaque groupe d’âge pris en compte. Le méthylparabène était inférieur à la limite de détection dans 8 % de tous les échantillons. Toutefois, des méthodes entièrement validées ont été utilisées pour mesurer le méthylparabène. Un niveau élevé de variabilité a été associé aux données de biosurveillance de l’ECMS pour le méthylparabène dans les groupes d’âge au 95e centile et, dans certains cas, pour la moyenne géométrique (Santé Canada 2017a). Cela peut être dû à l’utilisation d’un échantillonnage ponctuel, qui est sujet à une variabilité selon le moment de l’échantillonnage ou les variations de l’exposition au méthylparabène (p. ex., en raison des variations dans l’utilisation des produits de soins personnels), et l’exposition peut être sous-estimée en raison de sa courte demi‑vie (Fisher et coll. 2017). On a résolu ces incertitudes en choisissant la limite supérieure de l’intervalle de confiance à 95 % du 95e centile comme valeur limite supérieure prudente pour calculer la dose journalière estimée. Il s’agit d’une estimation prudente qui tient compte de la variation inhérente à l’échantillonnage ponctuel, car il a été démontré que les concentrations de méthylparabène au 95e centile de l’échantillon ponctuel étaient semblables au 95e centile de la distribution des concentrations composites de la première urine du matin sur 24 heures, et ce principe est généralement applicable aux échantillons ponctuels de parabènes (Aylward et coll. 2017b). Lorsque cette valeur n’a pas été déclarée pour un groupe d’âge, la valeur limite supérieure de l’intervalle de confiance à 95 % pour la valeur la plus élevée disponible a été utilisée à sa place. L’utilisation des données de biosurveillance de l’ECMS permet d’accroître la confiance à l’égard de la dose journalière estimée, car celle-ci est fondée sur une population nationale importante et représentative.
Les doses journalières estimées et les principaux paramètres sont présentés dans le tableau 7‑1. Les values calculées ici pour la population canadienne sont semblables aux doses journalières de méthylparabène calculées au 95e centile pour une population allemande adulte (variant de 26,9 à 56,5 µg/kg p.c./j), rapportées dans Moos et coll. (2017). Voir l’annexe A pour de plus amples renseignements sur le calcul des doses journalières estimées.
| Source, pays | Âge (années)a | TEC (mg/j)b | CUCr, P95 (IC) (µg/g Cr)c | EUFd | DJE, P95 (IC) (µg/kg p.c./j) |
|---|---|---|---|---|---|
| ECMS (cycle 4, 2014-2015)c, Canada | 3 à 5 | 130 | 430 (200 à 660)e | 0,174 | 21 (10 à 32) |
| ECMS (cycle 4, 2014-2015)c, Canada | 6 à 11 | 418 | 620 (340 à 890)f | 0,174 | 48 (26 à 69) |
| ECMS (cycle 4, 2014-2015)c, Canada | 12 à 19 | 1182 | 370 (100 à 640)e | 0,174 | 42 (11 à 73) |
| ECMS (cycle 4, 2014-2015)c, Canada | 20 à 59g | 1248 | 310 (130 à 490)e | 0,174 | 31 (13 à 50) |
| ECMS (cycle 4, 2014-2015)c, Canada | 60 à 79 | 1017 | 620 (340 à 890) | 0,174 | 50 (28 à 72) |
| Fisher et coll. 2017, Canada | Femmes enceintes | - | 403h | 0,174 | 46 |
| Kang et coll. 2013, Corée | Nouveau-nés | 9,6 | 106i | 0,174 | 14 |
Abréviations : TEC = taux d’élimination de la créatinine; CUCr = concentration urinaire ajustée pour la créatinine; P95 = 95e centile; IC = intervalle de confiance; EUF = élimination urinaire fractionnée; DJE = dose journalière estimée.
a Les groupes d’âge sont définis selon les groupes d’âge déclarés dans l’ECMS (Santé Canada 2017a).
b Le taux d’élimination de la créatinine a été calculé en utilisant l’équation de Mage [0,993*1,64 [140 – Âge] (Poids1,5 Taille0,5)/1000]. Voir l’annexe A pour les valeurs utilisées pour le poids et la taille selon l’âge.
c Santé Canada 2017a.
d Moos 2016.
e Ces values étaient associées à une variabilité d’échantillonnage élevée (c.‑à‑d. un coefficient de variation entre 16,6 % et 33,3 %). Santé Canada recommande d’utiliser ces données avec prudence (Santé Canada 2017a).
f Les données de l’ECMS pour le 95e centile de cette strate d’âge ont été supprimées en raison d’une variabilité élevée, et les données du groupe d’âge « 60 à 79 ans » ont été utilisées comme substitut. Bien que la valeur du 95e centile pour ce groupe ne soit pas connue, cette approche est jugée prudente parce que la valeur utilisée pour estimer la dose journalière est la valeur la plus élevée déclarée au 95e centile pour le méthylparabène.
g Les groupes d’âge « 20 à 39 » et « 40 à 59 » sont présentés ensemble. La valeur du 95e centile rapportée la plus élevée des deux groupes est présentée ici.
h Cette valeur est la concentration urinaire de parabène ajustée en fonction de la densité (µg/L) au 95e centile. Aucune valeur ajustée en fonction de la créatinine n’a été rapportée dans Fisher et coll. 2017. Les intervalles de confiance n’ont pas été indiqués. La DJE a été calculée à l’aide de l’équation suivante : DJE = (CU*TDU)/EUF (Saravanabhavan et coll. 2014), où CU est la concentration urinaire, TDU est le taux de débit urinaire (0,20 L/kg p.c./j, Aylward et coll. 2015) et EUF est le taux d’élimination urinaire fractionnée.
iCette valeur est la concentration de parabène dans l’urine ajustée en fonction de la créatinine au 75e centile; le 95e centile n’a pas été indiqué (Kang et coll. 2013). Les intervalles de confiance n’ont pas été indiqués.
Milieux naturels
Le méthylparabène a été trouvé dans les sols agricoles et la poussière domestique au Canada (Viglino et coll. 2011; Fan et coll. 2010) et dans l’eau potable (Blanco et coll. 2009), les sols agricoles, industriels et forestiers (Perez et coll. 2011; Nunez et coll. 2008), l’air extérieur (Moreau-Guigon et coll. 2016; Ramirez et coll. 2010), l’air intérieur (résidentiel) (Laborie et coll. 2016; Alliot et coll. 2014; Moreau-Guigon et coll. 2016) et la poussière domestique (Wang et coll. 2012; Ramirez et coll. 2011; Tran et coll. 2016; Canosa et coll. 2007) dans d’autres pays. Les estimations moyennes de la dose journalière de méthylparabène pour la population générale, d’après les études réalisées à l’étranger, varient de 0,002 à 0,011 µg/kg p.c./j pour tous les groupes d’âge, des nourrissons aux adultes de plus de 60 ans.
En l’absence de données canadiennes de surveillance, l’exposition par l’eau, le sol et l’air a été modélisée à l’aide de ChemCAN (ChemCAN 2003). On a constaté que le méthylparabène se répartissait principalement dans l’eau et les sédiments. Les données modélisées indiquent que l’exposition de la population générale par les milieux naturels au Canada est négligeable.
Aliments
Le méthylparabène (identifié comme méthylparabène, parahydroxybenzoate de méthyle) et son sel de sodium (sel de sodium ou acide parahydroxybenzoïque) sont autorisés comme additifs alimentaires (agents de conservation) dans les aliments vendus au Canada. Les aliments auxquels ils peuvent être ajoutés et leur concentration maximale d’utilisation dans ces aliments figurent à la Partie 2 de la Liste des agents de conservation autorisés (communication personnelle, courriel de la Direction des aliments, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 18 avril 2018; sans référence). Cependant, ces utilisations ont été approuvées il y a de nombreuses années, et les résultats d’une enquête menée par Santé Canada en 2017 sur les utilisations actuelles du méthylparabène par l’industrie alimentaire indiquent que son utilisation dans les aliments est limitée. L’utilisation principale dans les aliments en tant qu’agent de conservation est actuellement dans certaines préparations ou dispersions colorantes, qui sont ensuite incorporées dans un nombre limité de produits alimentaires, tels que certains produits de confiserie, des marinades et des boissons non normalisées, y compris certaines boissons aromatisées et gazeuses ou concentrées (dont les boissons congelées). De plus, le méthylparabène et son sel de sodium sont actuellement utilisés dans les préparations enzymatiques comme agents de conservation et agents antimicrobiens afin de détruire les organismes de production utilisés pour produire diverses enzymes, après fermentation. Toute concentration de méthylparabène présente dans la préparation enzymatique finie serait faible, de sorte qu’il n’aurait aucune fonction dans l’aliment fini (communication personnelle, courriel de la Direction des aliments, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 18 avril 2018; sans référence). Pour la population générale (de 1 à plus de 71 ans), les estimations prudentes de l’exposition par voie alimentaire au méthylparabène en raison de sa présence dans certaines préparations colorantes varient de 0,013 à 0,073 mg/kg p.c./j au 90e centile. Les estimations de l’exposition par voie alimentaire due à son utilisation dans certaines préparations enzymatiques varient de 0,053 à 0,240 mg/kg p.c./j au 90e centile. Les données de biosurveillance (Fisher et coll. 2017) indiquent que les nourrissons allaités au sein devraient être exposés à 98,04 ng de méthylparabène/kg p.c./j (0,000098 mg/kg p.c./j) par le lait maternelNote de bas de page 6.
Cosmétiques et produits de consommation
Le méthylparabène a été trouvé dans une grande variété de cosmétiques, notamment dans les lotions, les produits de maquillage, les nettoyants, les produits d’hygiène buccale, les après-shampoing et les shampoings, ainsi que dans les lingettes nettoyantes (SDS 2010), les marqueurs lavables (SDS 2008a) et les bâtons de colle (SDS 2008b). On a estimé que l’exposition résultant de l’utilisation quotidienne de cosmétiques et de produits de consommation a été prise en compte dans les données de biosurveillance. En raison de l’utilisation d’un échantillonnage ponctuel et de la courte demi-vie métabolique du méthylparabène, les données de biosurveillance ne tenaient pas compte de l’exposition aux produits utilisés de façon intermittente. Les estimations de l’exposition pour les utilisations intermittentes qui entraînent les niveaux les plus élevés d’exposition potentielle au méthylparabène par voie cutanée, ci‑après nommées scénarios sentinelles, sont présentées dans le tableau 7‑2.
Pour l’exposition potentielle par voie cutanée, des coefficients d’absorption cutanée et de métabolisme déterminés expérimentalement d’après une étude in vitro de l’absorption cutanée et du métabolisme dans la peau humaine ont été utilisés pour estimer la dose interne (Charles River Laboratories 2018). La moyenne (plus de deux écarts-types) pour chaque paramètre (pourcentage d’absorption ou quantité absorbée) a été utilisée pour estimer la dose générale résultant de l’exposition par voie cutanée à chaque parabène. Si la moyenne plus deux écarts-types dépassaient la valeur maximale mesurée pour ce paramètre, on utilisait la valeur maximale pour estimer l’exposition par voie cutanée. La proportion de parabène appliquée identifiée par CPLHP dans la fraction liquide réceptrice (composée d’échantillons frais et congelés) a été utilisée pour estimer de façon prudente la quantité de parabène appliquée qui reste après l’hydrolyse en PHBA dans la peau. De plus amples renseignements sur l’étude et sur la façon dont les résultats ont été appliqués à la modélisation de la dose systémique due à l’exposition par voie cutanée sont disponibles sur demande (Santé Canada 2018b).
Les expositions potentielles ont été estimées d’après des hypothèses prudentes et des valeurs par défaut. L’annexe B présente plus de détails sur les valeurs par défaut et les modèles utilisés pour générer les estimations de l’exposition. Les estimations de l’exposition pour chaque scénario sont exprimées par événement et/ou par jour, selon la fréquence d’exposition et les effets critiques sur la santé (voir la section 7.1.3, Caractérisation des risques pour la santé humaine).
| Scénario | Concentration dans le produit (%) | Groupe d’âge (années) | Charge cutanée (µg/cm2/24 h) | Exposition systémique (mg/kg p.c./j) |
|---|---|---|---|---|
| Permanente / défrisant (par application) | 1 à 3a | Enfants (5 à 11) |
124 à 372 | 0,44 à 1,33b,c |
| Permanente / défrisant (par application) | 1 à 3a | Adultes (> 20) |
125 à 376 | 0,21 à 0,62b,c |
a Données internes, Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 18 août 2017, sans référence.
b Valeur calculée avec un taux d’absorption cutanée de 40,80 %.
c Valeur calculée avec un raffinement du métabolisme de 44,97 % de méthylparabène.
Médicaments et PSN
Le méthylparabène est présent en tant qu’ingrédient non médicinal dans les médicaments sur ordonnance et en vente libre et les PSN administrés par de multiples voies. On estime que l’exposition résultant de l’utilisation quotidienne de médicaments sur ordonnance, de médicaments en vente libre et de PSN est prise en compte dans les données de biosurveillance. Les scénarios sentinelles associés aux médicaments en vente libre et aux PSN à usage intermittent sont présentés dans le tableau 7‑3. L’exposition orale et cutanée au méthylparabène dans les médicaments sur ordonnance n’a pas été prise en compte dans cette évaluation, car la concentration de méthylparabène dans les produits pharmaceutiques approuvés au Canada est conforme aux normes d’utilisation et est prise en compte dans l’approche risques/avantages de la Direction des produits thérapeutiques. Les valeurs par défaut et les modèles utilisés dans les scénarios d’exposition sont présentés à l’annexe B.
| Scénario | Quantité dans le produita,b | Groupe d’âge (années) |
Charge cutanée (µg/cm2/24 h) | Exposition systémique (mg/kg p.c./j) |
|---|---|---|---|---|
| Médicament antidiarrhéiquea (prise orale, par jour) |
1,5 %c | Tout-petits (0,5 à 4) |
N.D. | 50,81 |
| Médicament antidiarrhéiquea (prise orale, par jour) |
3,0 %c | Adolescents (12 à 19) |
N.D. | 106,1 |
| Pastille contre la touxa (prise orale, par jour) | 5 mg/ pastillec | Enfants (5 à 11) |
N.D. | 1,61 |
| Médicament contre les brûlures d’estomaca (prise orale, par jour) |
1,14 %c | Adultes (> 20) |
N.D. | 51 |
| Médicament contre le mal des transportsb (prise orale, par jour) |
0,15 %d | Tout-petits (0,5 à 4) |
N.D. | 2,4 |
| Produit de contraste radiologiquea (prise orale, par événement) | 0,05 %c | Nourrissons (0 à 0,5) |
N.D. | 14,0 |
| Produit de contraste radiologiquea (prise orale, par événement) | 0,05 %c | Tout-petits (0,5 à 4) |
N.D. | 29,0 |
| Produit de contraste radiologiquea (prise orale, par événement) | 0,05 %c | Adultes (> 20) |
N.D. | 6,35 |
| Crème solairea,b (application cutanée, par jour) | 0,44 %c,d | Tout-petits (0,5 à 4) |
17.16 | 1,21e,f |
| Crème solairea,b (application cutanée, par jour) | 0,44 %c,d | Adultes (> 20) |
17.16 | 0,91e,f |
a Produits de santé naturels.
b Médicaments en vente libre.
c Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 20 février 2017, sans référence.
d Communication personnelle, courriel de la Direction des produits thérapeutiques, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 25 mai 2017, sans référence.
e Valeur calculée avec une quantité cutanée maximale de 8,50 µg/cm2/24 h.
f Valeur calculée avec un raffinement du métabolisme de 44,97 % de méthylparabène.<
7.1.2 Évaluation des effets sur la santé
Le méthylparabène a fait l’objet d’un examen approfondi et des évaluations des principaux risques ont été réalisées par le Cosmetics Ingredient Review (CIR) (Andersen 2008), le Comité scientifique pour la sécurité des consommateurs (CSPC 2005a, 2005b, 2006, 2008; CSSC 2010, 2011, 2013), l’Autorité européenne de sécurité alimentaire (EFSA 2004), l’Agence européenne des médicaments (EMA 2015), l’Australian National Industrial Chemicals Notification and Assessment Service (NICNAS 2016) et des scientifiques indépendants (Soni et coll. 2005). Une recherche a été effectuée dans la littérature publiée en date de mars 2017 afin de trouver de l’information pertinente pour compléter les données utilisées dans les évaluations et les examens dans le monde.
Toxicocinétique
Le méthylparabène est fortement métabolisé chez les animaux par voie orale et par voie cutanée (Jones et coll. 1956; Kiwada et coll. 1979, 1980; Tsukamoto et Terada 1964; Aubert et coll. 2012). Chez le rat, le méthylparabène est absorbé à un niveau plus élevé que le propylparabène et le butylparabène lorsqu’il est administré par voie orale ou cutanée. Une dose unique de 100 mg/kg de méthylparabène radiomarqué a été administrée à des rats par voie orale et cutanée (Aubert et coll. 2012). Les concentrations plasmatiques maximales (Cmax) ont été atteintes en moins de 1 heure et de 8 heures, respectivement, par voie orale et cutanée. Toutes les voies d’administration ont produit un seul pic dans le plasma, correspondant à celui du PHBA, et le méthylparabène n’a pas été détecté. Plus de 70 % de la dose orale a été éliminé en 24 heures, < 1 % dans les selles et < 1 % dans les tissus. Environ 50 % de la dose cutanée appliquée de méthylparabène n’a pas été absorbée après 24 heures, 14 % à 26 % a été éliminée dans l’urine et < 2 % a été éliminé dans les matières fécales. Le reste a été retrouvé dans les tissus externes (p. ex., cheveux, ongles) (Aubert et coll. 2012). Lorsqu’une dose unique de méthylparabène a été administrée par voie orale (1 g/kg) ou intraveineuse (50 mg/kg) à des chiens, le composé d’origine n’a pas été détecté dans le plasma, et le PHBA a été détecté en 1 heure (Jones et coll. 1956). La majeure partie de la dose appliquée (66,1 %) a été éliminée dans les 24 heures sous forme de PHBA et d’autres métabolites. Le composé d’origine était presque indétectable (0,014 %). Comme on l’a observé chez le rat, les parabènes à chaîne plus courte étaient métabolisés plus rapidement et plus complètement que les espèces à chaîne plus longue (méthylparabène > éthylparabène > propylparabène > butylparabène). L’élimination par voie urinaire avait augmenté à 96 % après 24 heures lorsque des chiens ont reçu 1 g/kg p.c./j de méthylparabène par jour pendant 1 an. Au moment du sacrifice, de petites quantités de méthylparabène ont été détectées dans le cerveau et la rate, et du PHBA a été détecté dans tous les tissus (Jones et coll. 1956).
Chez les humains, les parabènes sont éliminés rapidement dans l’urine et récupérés principalement en isoformes hydrolysées et conjuguées. Le méthylparabène n’a pas été détecté dans l’urine ou le plasma d’un seul volontaire mâle après l’administration orale de 70 mg/kg de méthylparabène; 50 % du méthylparabène administré a été récupéré dans les 12 heures, et 11 % l’a été en PHBA libre (Jones et coll. 1956). Moos et coll. (2016) ont rapporté l’ingestion de 10 mg de méthylparabène par 3 volontaires adultes (équivalant à 0,12 à 0,19 mg/kg p.c.). La demi‑vie d’élimination était de 6,9 heures, 83,4 % de la dose administrée ayant été récupéré dans l’urine dans les 24 heures. Après 48 heures, 17,4 % de la dose administrée a été récupéré dans l’urine sous forme de méthylparabène libre et conjugué. Environ 64 % de la dose administrée a été récupéré sous forme de PHHA, le principal métabolite. Ye et coll. (2006), qui avaient signalé une concentration de parabènes libres et conjugués dans l’urine chez 100 adultes, et Wang et Kannan (2013) et Wang et coll. (2013), qui avaient fait état de résultats similaires chez les enfants et les adultes, ont indiqué que 95 % à 98 % des parabènes récupérés dans l’urine l’étaient sous forme conjuguée. La principale isoforme était le parabène conjugué au sulfate, qui représentait 67 % du méthylparabène récupéré (Ye et coll. 2006). Bien que la majorité des parabènes semblent être rapidement éliminés de l’organisme, le méthylparabène a été détecté à de faibles concentrations dans le tissu mammaire tumoral, le tissu adipeux humain et le cerveau (Barr et coll. 2012; Wang et coll. 2015; van der Meer 2017). On n’a pas indiqué si les parabènes étaient libres ou conjugués. Dans une étude sur des humains, on a démontré que le méthylparabène s’accumulait dans la couche cornée de l’avant-bras lors d’une application quotidienne, mais qu’il ne persistait pas 48 heures après la fin de l’application (Ishiwatari et coll. 2007).
Des études ex vivo ont montré que les parabènes sont métabolisés par les carboxylestérases dans le foie, la peau, les kératinocytes, la graisse sous-cutanée et le sang chez les humains, et par les UDP-glucuronosyltransférases dans les microsomes du foie. L’hydrolyse dans les cellules hépatiques humaines est significativement plus importante que dans les cellules cutanées, d’environ 2 ordres de grandeur (Jewell et coll. 2007b; Harville et coll. 2007), mais les deux sont plus efficaces que le plasma (Prusakiewicz et coll. 2006). Dans les fractions subcellulaires du foie et de la peau chez les humains, le méthylparabène est hydrolysé 2 à 10 fois plus rapidement que le propylparabène et le butylparabène (Jewell et coll. 2007a, 2007b; Harville et coll. 2007; Lobemeier et coll. 1996; Abbas et coll. 2010; Prusakiewicz et coll. 2006). Dans le plasma humain, le méthylparabène était stable après 24 heures. En revanche, la concentration de propylparabène diminuait de 47 % après 6 heures, et les concentrations de butylparabène et de benzylparabène diminuaient de moitié en 1 heure. L’hydrolyse du méthylparabène dans les microsomes hépatiques est plus rapide que dans le sang, avec une demi‑vie de 22 minutes, comparativement à 87 minutes pour le butylparabène (Abbas et coll. 2010).
Contrairement à la cinétique humaine, les fractions de peau et de cellules hépatiques chez le rat hydrolysent les parabènes à peu près au même rythme que dans les études in vitro (Harville et coll. 2007). Toutefois, les cellules de peau chez le rat hydrolysent les parabènes à un taux de 2 à 3 ordres de grandeur supérieurs à celui des cellules de peau chez les humains, ce qui est conforme aux taux globaux d’hydrolyse par les carboxylestérases chez ces espèces (Harville et coll. 2007; Prusakiewicz et coll. 2006). Dans ces essais, l’hydrolyse dans les tissus du rat augmente également avec la longueur de la chaîne, contrairement à ce que l’on constate chez les humains. Les parabènes à chaîne plus courte (méthylparabène et éthylparabène) sont métabolisés dans les fractions de cellules hépatiques chez les humains à un taux comparable à celui du foie chez le rat. Toutefois, le butylparabène a été métabolisé dans le foie du rat à un taux 10 fois plus élevé que dans le foie humain (Harville et coll. 2007).
Études à doses répétées
Dans une étude conforme à la ligne directrice 407 de l’OCDE et aux bonnes pratiques de laboratoire (BPL), des rats Wistar (5/sexe/dose) ont été exposés à 0, 50, 250 et 1000 mg/kg p.c./j de méthylparabène dans du propylène glycol par gavage pendant 28 jours. Cinq autres animaux dans le groupe témoin et le groupe exposé à des doses élevées ont bénéficié de 14 jours de récupération. Deux animaux du groupe ayant reçu la dose élevée ont été sacrifiés en raison de problèmes de santé et ils présentaient une légère érosion de l’estomac et une atrophie de la rate et du thymus. Parmi les autres signes constatés chez les animaux sacrifiés, mentionnons la léthargie, une posture voûtée, une respiration laborieuse, des râles, un gonflement de l’abdomen, une horripilation, la diarrhée, la ptose, l’hypothermie, la déshydratation et une apparence maigre. Les animaux survivants du groupe ayant reçu la dose élevée ont présenté une horripilation et une posture voûtée. Les animaux du groupe ayant reçu la dose élevée et une femelle du groupe ayant reçu la dose moyenne ont également présenté une respiration laborieuse, des râles et des halètements. Le rapport rate/poids corporel ou le poids de la rate étaient plus élevés chez tous les mâles traités au méthylparabène à la fin du traitement. Ces changements ont disparu à la fin de la période de rétablissement et n’ont pas été corroborés par des résultats histopathologiques connexes. Aucun autre changement significatif sur le plan toxicologique n’a été noté dans les paramètres observés ou les observations fonctionnelles, l’ophtalmoscopie, le poids corporel, le poids des organes, la consommation alimentaire, les paramètres hématologiques, le cycle œstral et la spermatogenèse (Beerens-Heijnen 2009; REACH 2018a). Une dose sans effet nocif observé (DSENO) de 250 mg/kg p.c./j a été choisie pour cette étude, en raison des signes cliniques et de la toxicité générale à 1000 mg/kg p.c./j.
Des effets similaires n’ont pas été signalés dans les études sur l’administration de méthylparabène par voie alimentaire. Seize rats Wistar mâles ont reçu une dose de méthylparabène dans leur alimentation à raison de 0, 100, 1000 ou 10 000 ppm par jour (équivalant à 11,2 ± 0,5, 110,0 ± 3,3, 1141,1 ± 58,9 mg/kg p.c./j, selon la consommation par animal et le poids corporel) pendant 8 semaines à compter du jour postnatal (JPN) 22. Les paramètres évalués comprenaient les signes cliniques, la consommation d’aliments, le poids corporel, le poids des organes et la pathologie clinique des viscères thoraciques, abdominaux et pelviens. Aucun des paramètres évalués n’a montré d’effets indésirables liés au composé ou à la dose. Une augmentation statistiquement significative du poids relatif moyen du foie a été observée dans le groupe du méthylparabène à 10 000 ppm, bien que le poids absolu du foie n’ait pas augmenté de façon significative. Un rat du groupe exposé à 10 000 ppm de méthylparabène a été trouvé mort au 31e jour de l’étude. Des taches d’urine sur la fourrure abdominale ont été observées chez 3 rats du groupe exposé à 10 000 ppm de méthylparabène (Hoberman et coll. 2008). Dans une étude similaire à doses répétées, 8 rats Crj:Wistar par groupe ont reçu du méthylparabène dans leur alimentation, à raison de 0 %, 0,1 % et 1,0 % par jour (102 ± 2,75 et 1030 ± 38,0 mg/kg p.c./j, valeurs calculées sur la base de la consommation alimentaire) pendant 8 semaines à partir du JPN 25. Aucune différence statistiquement significative dans le poids corporel n’a été rapportée, et la consommation alimentaire était similaire dans tous les groupes testés (Oishi 2004). Dans chacune des études de 8 semaines, la DSENO était la dose maximale d’essai, soit 10 000 ppm ou 1 % (1030 à 1141 mg/kg p.c./j).
Douze rats albinos sevrés (8 par dose) ont reçu 2 % ou 8 % de méthylparabène (équivalant à 900 à 1200 et 5500 à 5900 mg/kg p.c./j) pendant 96 semaines dans le régime alimentaire. Les animaux ayant reçu 8 % de méthylparabène ont pris du poids plus lentement que les témoins négatifs, aux premiers stades de l’expérience. L’effet était plus important chez les mâles et diminuait à la fin de l’expérience. À la dose de 2 %, aucun signe de toxicité n’a été observé chez les animaux traités, par rapport aux témoins. La DSENO dans cette étude était de 2 % (900 à 1200 mg/kg p.c./j; Matthews et coll. 1956).
Au cours d’une étude de toxicité cutanée de 13 semaines, des rats albinos (10/dose) ont été exposés à des doses topiques quotidiennes de 0,7 % de méthylparabène dans une crème médicamenteuse, sur la peau dorsale antérieure et rasée, qui représentait 10 % à 15 % de la surface corporelle totale (soit 4,12 g/kg p.c. de crème ou 288 mg/kg p.c. de méthylparabène). Une diminution significative du poids corporel a été constatée chez les mâles du groupe d’essai, et des changements macroscopiques et histopathologiques importants ont été observés sur le site d’application. De légers changements dans les paramètres hématologiques et la chimie sanguine n’ont pas été jugés significatifs sur le plan toxicologique, et les auteurs ont conclu qu’il n’y avait pas d’effets toxiques généralisés cumulatifs (CTFA 1981, cité dans Andersen 2008). Dans une étude de toxicité cutanée de 3 mois, une préparation de produit cosmétique contenant 0,2 % de méthylparabène a été administrée à des groupes de 5 lapins mâles et de 5 lapines à 6,6 ou 11 mg/cm2 sur 8,4 % de la surface du corps. Le produit a causé un érythème, un œdème et la desquamation au site d’application, mais la prise de poids, la consommation alimentaire, les paramètres hématologiques et la chimie sanguine, les valeurs d’analyse d’urine et le poids des organes étaient négatifs lorsqu’il y avait des changements significatifs sur le plan toxicologique, et il n’y a eu aucune mortalité dans les groupes d’essais (CTFA 1980, cité dans Andersen 2008).
Génotoxicité
Le méthylparabène n’était pas mutagène selon les tests d’Ames, avec ou sans activation métabolique (REACH 2018a; Andersen 2008; Ishidate et coll. 1984; Prival et coll. 1982, 1991; Blevins et Taylor 1982; Kawachi et Yahagi 1980; Morita et coll. 1981), mais a induit un nombre significatif d’aberrations chromosomiques dans des cellules ovariennes de hamster chinois (CHO) à 0,5 à 1,0 mg/mL (REACH 2018a; Ishidate et coll. 1978). Dans les fibroblastes dermiques humains, le méthylparabène présentait une faible cytotoxicité, mais induisait une apoptose et une nécrose à une concentration de 1 % (Carvalho et coll. 2012). Cependant, le méthylparabène s’est révélé négatif dans les essais de génotoxicité in vivo (REACH 2018a; Andersen 2008; Kawachi et Yahagi 1980). Dans l’ensemble, le poids de la preuve indique que le méthylparabène n’est pas susceptible d’être génotoxique in vivo (EFSA 2004; Andersen 2008).
Cancérogénicité
Un groupe de rats Fischer 344 mâles (8/groupe) a été exposé au méthylparabène à raison de 4 % dans le régime alimentaire (environ 4000 mg/kg p.c./j) pendant 9 jours. Le méthylparabène n’a induit aucun changement dans l’histopathologie ni le marquage au méthyl-3[H]thymidine dans l’épithélium du préestomac (Rodrigues et coll. 1986). La DSENO pour le méthylparabène était de 4 % (~ 4000 mg/kg p.c./j), soit la dose maximale d’essai.
Dans un essai de cancérogénicité, on a injecté du méthylparabène à des rats Fischer 344 (80/dose élevée, 60/dose élevée-moyenne, 40/dose faible-moyenne, 20/dose faible, 100/groupe témoin) par voie sous-cutanée deux fois par semaine pendant 52 semaines, à raison de 0,6, 1,1, 2,0 et 3,5 mg/kg p.c./j. La prise de poids et la mortalité dans les groupes ayant reçu le méthylparabène étaient semblables à ceux des groupes ayant reçu l’excipient et des groupes témoins négatifs, et aucune pathologique des organes liée à la substance d’essai n’a été signalée. Le nombre total d’animaux porteurs de tumeurs dans les groupes ayant reçu le méthylparabène était également dans la même fourchette que chez les groupes témoins (méthylparabène : 5/100 mâles, 17/100 femelles; témoin négatif : 10/50 mâles, 12/50 femelles; contrôle avec excipient : 6/50 mâles, 14/50 femelles). Chez les femelles traitées au méthylparabène (toutes doses confondues), des tumeurs ont été observées au point d’injection (1/100), dans le tissu mammaire (8/100), dans l’utérus (9/100) et à d’autres endroits (7/50). Chez les mâles, on a trouvé des tumeurs au point d’injection (2/100) et à d’autres points d’injection (3/100). Chez les témoins négatifs et les témoins avec excipient, des tumeurs ont été observées chez les femelles au point d’injection (0/50, 1/50, respectivement), dans le tissu mammaire (1/50, 3/50, respectivement), dans l’utérus (5/50, 5/50, respectivement) et ailleurs (7/50, 8/50, respectivement). Le nombre total animaux porteurs de tumeurs dans les groupes traités au méthylparabène, de la dose la plus élevée à la dose la plus faible, était de 11 %, 18 %, 8 % et 25 %, ce qui indique une absence de dépendance à la dose (Mason et coll. 1971). Aucune analyse statistique n’a été présentée dans cette étude, mais les auteurs ont déclaré que l’incidence des tumeurs dans les groupes traités n’était pas significativement différente de celle du groupe témoin.
Effets sur la reproduction et le développement
Les effets œstrogéniques potentiels des parabènes sont examinés à l’annexe C.
Une série d’études de conception similaire à la ligne directrice 414 de l’OCDE (Étude de la toxicité pour le développement prénatal) a été réalisée chez le lapin, le hamster, le rat et la souris (REACH 2018a). Bien que semblables à la ligne directrice 414 de l’OCDE, ces études sont antérieures aux BPL et aux lignes directrices de l’OCDE, et ne comprennent pas d’analyse statistique. Des lapines Dutch-belted accouplées (9 à 11 lapines par groupe) et des hamsters Golden femelles accouplées (21 à 22 animaux gravides par groupe) ont reçu du méthylparabène par gavage à raison de 0, 3, 14, 65 et 300 mg/kg p.c./j à partir du jour de gestation (JG) 6 au JG 18 (lapines) et du JG 6 au JG 10 (hamsters). Des rates Wistar accouplées (22 à 24 rates gravides par groupe) et des souris CD‑1 femelles accouplées (21 à 25 souris gravides par groupe) ont reçu du méthylparabène à raison de 0, 5,5, 25,5, 118 et 550 mg/kg p.c./j entre le JG 6 et le JG 15. Aucun effet sur le poids corporel, les signes cliniques, la mortalité ou le tractus génital des mères n’a été observé à aucune dose dans aucune des études. Le nombre de corps jaunes, de sites d’implantation par mère, de sites de résorption et de fœtus vivants et morts n’a pas non plus été affecté par le traitement. Le traitement n’a pas modifié non plus le rapport mâles/femelles chez les petits ni le poids corporel des fœtus. Aucune anomalie du squelette ou des tissus mous n’a été observée chez les petits. La DSENO pour les effets sur la mère et le développement pour les quatre études est la dose maximale d’essai, soit 300 ou 550 mg/kg p.c./j.
Dans une étude sur le développement pubertaire des femelles, des rats Sprague‑Dawley prépubertaires (10 rates par groupe) ont reçu par voie orale 0, 62,5, 250, 1000 mg/kg p.c./j de méthylparabène dans de l’huile de maïs entre les JPN 21 à 40. De l’éthynylestradiol (EE, 1 mg/kg p.c./j) a été administré comme témoin positif. Un retard statistiquement significatif de l’ouverture vaginale a été observé chez les animaux du groupe ayant reçu la dose élevée de méthylparabène (JPN 36,8 ± 1,96), comparativement au groupe témoin de l’excipient (JPN 33,6 ± 3,23). L’ouverture vaginale a été observée à JPN 21,4 ± 0,53 dans le groupe ayant reçu l’éthynylestradiol (Vo et coll. 2010). L’importance biologique de cet effet n’est pas claire, car on a signalé que les données historiques se rapportant aux témoins se situaient entre JPN 33,0 et JPN 36,6 (Stump et coll. 2014). Vo et coll. (2010) ont également indiqué que les concentrations sériques de thyroxine (T4) étaient significativement réduites à 1,38 ± 0,07 ng/mL dans le groupe ayant reçu la dose élevée de méthylparabène, par rapport à 3,00 ± 0,32 ng/mL dans le groupe témoin ayant reçu l’excipient et à 2,73 ± 0,50 ng/mL dans le groupe ayant reçu l’EE. On a observé une diminution significative du nombre de cycles œstraux de 4 jours dans le groupe ayant reçu la dose élevée, mais le nombre de jours de chaque phase du cycle de 4 jours (prœstrus, œstrus, métœstrus et diœstrus) n’était pas significativement différent. On a également observé une diminution significative du poids des ovaires, et une augmentation du poids des surrénales, de la thyroïde et du foie dans le groupe ayant reçu la dose élevée de méthylparabène. Des changements histopathologiques qualitatifs sont survenus dans le groupe ayant reçu la dose moyenne de méthylparabène, mais on n’a pas observé de changement à la dose élevée. Aucun changement significatif n’a été observé dans le poids corporel moyen entre le méthylparabène et le groupe ayant reçu l’excipient. Toutefois, on a observé une forte variation du poids corporel à la dose de 1000 mg/kg p.c./j (110,3 ± 20,59 g, comparativement à 118,69 ± 6,4 g dans le groupe avec excipient; Vo et coll. 2010). La taille de l’échantillon (10 animaux par dose) est inférieure au nombre (15 par dose) recommandé dans le document de l’EPA Guideline for Female Pubertal Assays (2009). On a par ailleurs rapporté que dans des études de restriction alimentaire, on avait constaté une réduction de 9 % et de 12 % du poids corporel des femelles, ce qui avait entraîné la modification du nombre de cycles œstraux de 4‑5 jours, une réduction significative du poids des ovaires et une diminution significative des taux de T4 (Stump et coll. 2014). Les différences dans les niveaux de T4 peuvent également être liées au stade du cycle œstral. Compte tenu de la variation du poids des animaux à la dose maximale de méthylparabène, combinée à la taille réduite de l’échantillon, il n’est pas clair si les effets signalés sont secondaires par rapport à une réduction du poids corporel, ou constituent une variation dans un petit échantillon. De plus, si la date de début de la surveillance du cycle œstral était le jour de l’ouverture du vagin, conformément au document de l’EPA Guideline for Female Pubertal Assays (2009), ou si la surveillance avait commencé au milieu du cycle, le temps de surveillance n’aurait pas été suffisant pour observer deux cycles œstraux complets avant le sacrifice des animaux au JPN 41. Il est également normal que les jeunes animaux aient des cycles anormaux et qu’il faille attendre jusqu’à 8 semaines pour que les cycles deviennent normaux, ce qui amène l’EPA à dire que la cyclicité œstrale peut ne pas être établie pendant la durée des essais de développement de la puberté, même chez les animaux témoins.
Vo et coll. (2010) ont rapporté une diminution significative de la concentration sérique de T4 chez les rates pubères à la dose de 1000 mg/kg/j de méthylparabène, mais les auteurs n’ont pas signalé d’effet dépendant de la dose sur la concentration de T4 avec les autres parabènes analysés dans cette même étude. Cette constatation ne concorde pas avec deux autres études sur les effets du parabène sur la fonction thyroïdienne. Dans une étude in vitro, Taxvig et coll. (2011) ont indiqué que le méthylparabène, l’éthylparabène et le butylparabène étaient des agonistes du récepteur thyroïdien et, d’après la prolifération de cellules GH3 induite par T3 dans une étude in vitro, ils ont déterminé que le butylparabène et l’éthylparabène étaient plus puissants que le méthylparabène. Dans une étude épidémiologique, Kœppe et coll. (2013) ont indiqué que le méthylparabène n’avait pas démontré d’association statistiquement significative avec les taux d’hormones thyroïdiennes dans la population étudiée par l’enquête NHANES en 2007-2008 (bien que certaines associations chez les femelles adultes étaient presque significatives). L’éthylparabène, le propylparabène et le butylparabène ont chacun présenté des associations inverses statistiquement significatives avec T3 et T4, mais leurs concentrations urinaires étaient inférieures de 1 à 2 ordres de grandeur à celles du méthylparabène. Les données disponibles indiquent que le méthylparabène a l’effet le moins puissant parmi tous les parabènes testés, de sorte que l’absence d’effet proportionnel à la dose sur les concentrations de T4, chez les autres parabènes étudiés par Vo et coll. (2010), pose problème. En raison des préoccupations décrites ici concernant les effets décrits dans cette étude (Vo et coll. 2010), aucune DSENO n’a été choisie.
Deux études sur le développement pubertaire chez les mâles ont été trouvées pour le méthylparabène. Du méthylparabène a été administré par voie alimentaire à des rats Crj:Wistar mâles (8 animaux par groupe) à raison de 0 %, 0,1 % et 1,0 % (équivalant à 102 ± 2,75, et 1030 ± 38,0 mg/kg p.c./j) pendant 8 semaines à partir des JPN 25 à 27. Aucun effet lié au traitement n’a été observé pour ce qui est du poids des organes reproducteurs (testicules, épididyme, prostate, vésicules séminales et glandes préputiales) dans aucun des groupes traités. Aucun changement des taux de testostérone, d’hormone lutéinisante (LH) et d’hormone folliculostimulante (FSH), par rapport aux témoins, n’a été observé à aucune dose. La numération des spermatozoïdes dans la queue de l’épididyme et les testicules était normale, tout comme la distribution des spermatogonies, des spermatocytes, des spermatides ronds et des spermatides allongés dans les tubules de stade VII–VIII. La DSENO pour cette étude était de 1030 mg/kg p.c./j, soit la dose maximale d’essai (Oishi 2004). Il convient de noter que le CSSC (CSPC 2008; CSSC 2011) a exprimé des doutes quant à la qualité de cette étude et d’autres études produites par le laboratoire d’Oishi, qui ont fait état i) de valeurs moyennes pour certains paramètres qui se situaient bien au‑delà des intervalles des données historiques se rapportant aux témoins et ii) d’écarts-types pour des paramètres comme les concentrations de sperme dans l’épididyme et les taux de testostérone nettement inférieurs à la variabilité biologique normale qui a été observée par d’autres groupes. Le CSSC a conclu que la qualité des études d’Oishi ne peut être correctement évaluée, car la description complète des essais et les données brutes complètes n’étaient plus disponibles.
Dans une étude subséquente, du méthylparabène a été administré par voie alimentaire à des rats Wistar mâles (15 à 16 animaux par dose) à raison de 0, 100, 1000 et 10 000 ppm (équivalant à 0, 11,2 ± 0,5, 110,0 ± 3,3, et 1141,1 ± 58,9 mg/kg p.c./j) pendant 8 semaines, à partir du JPN 22. Les paramètres évalués comprenaient le poids des organes et l’histopathologie des tissus reproducteurs, ainsi que la production, la motilité et la morphologie du sperme. Aucun des paramètres évalués n’a montré d’effets significatifs dans les groupes traités par rapport au régime administré au groupe témoin. Aucun effet n’a été observé concernant le poids des organes reproducteurs (testicules, épididymes, prostate ventrale et vésicules séminales). On a observé une augmentation statistiquement significative du poids relatif moyen du foie dans le groupe ayant reçu 10 000 ppm, bien que le poids absolu du foie n’ait pas augmenté de façon significative. On n’a observé aucun effet sur la motilité des spermatozoïdes, la concentration de spermatozoïdes dans la queue de l’épididyme ou les testicules, ou dans la production quotidienne de spermatozoïdes. L’exposition au méthylparabène a entraîné une incidence significativement plus élevée de spermatozoïdes anormaux dans les groupes exposés à 1000 ppm et 10 000 ppm, soit 5,0 ± 3,1 % et 4,0 ± 1,7 %, par rapport à 2,3 ± 1,5 % dans le groupe témoin. Ces spermatozoïdes étaient en grande partie sans tête. Les auteurs ont déclaré qu’ils ne considéraient pas que l’effet était lié au traitement, étant donné la faible incidence de ces effets, l’absence de dépendance à la dose et le fait qu’aucun autre paramètre reproducteur n’a été modifié par le méthylparabène (Hoberman et coll. 2008). Une DSENO de 1141 mg/kg p.c./j, la dose maximale d’essai, a été établie pour cette étude.
Épidémiologie
Une recherche dans la littérature a été réalisée afin de trouver des données épidémiologiques pour le méthylparabène, l’accent étant mis sur les effets sur la reproduction et le système endocrinien. Les études ont été évaluées et leur qualité a été cotée selon l’échelle NOS (échelle d’évaluation de la qualité de Newcastle-Ottawa) et l’outil d’évaluation de la qualité pour les études d’observation transversales et par cohorte, du National Heart, Lung and Blood Institute des National Institutes of Health (RSI 2018). Les concentrations urinaires de méthylparabène ont été évaluées dans des études épidémiologiques portant sur la fertilité, la santé de la reproduction, les taux d’hormones, la croissance et le développement des enfants et des adolescents, la sensibilisation allergique et le poids corporel. La majorité des études n’ont pas trouvé d’association entre les concentrations de méthylparabène et les paramètres d’intérêt. Des associations positives faibles ont été constatées concernant l’augmentation du délai avant la grossesse, la diminution de la probabilité de naissance vivante avec insémination intra-utérine, les taux de certaines hormones chez les femmes enceintes, les taux de croissance chez les nouveau-nés et tout-petits de sexe masculin et la sensibilisation allergique (Smarr et coll. 2017; Dodge et coll. 2015; Aker et coll. 2016, 2018; Wu 2017; Philippat et coll. 2014; Guo et coll. 2017; Savage et coll. 2012; Spanier et coll. 2014; Lee-Sarwar et coll. 2017; Vernet et coll. 2017). Une faible association inverse avec l’indice de masse corporelle (IMC) et le poids corporel a été constatée chez les adolescents, les femmes enceintes et les adultes (Den Hond et coll. 2013; Smith et coll. 2012; Kang et coll. 2016; Polinski et coll. 2018), et une faible association inverse a été observée entre les concentrations de méthylparabène dans le sang du cordon ombilical et les taux de testostérone dans les fœtus (Kolatorova et coll. 2018). Outre les taux de croissance chez les nouveau-nés et les tout-petits et les taux de testostérone fœtale, différentes études de qualité similaire ont donné des résultats contradictoires pour ces paramètres ou des paramètres similaires. On trouvera plus de renseignements à ce sujet dans Santé Canada (2018a).
7.1.3 Caractérisation des risques pour la santé humaine
Une DSENO de 250 mg/kg p.c./j a été rapportée pour l’exposition par voie orale (gavage) au méthylparabène dans une étude de 28 jours à doses répétées, d’après des signes cliniques de mauvaise santé, d’érosion gastrique, d’atrophie de la rate et de la thyroïde, et de mortalité à 1000 mg/kg p.c./j (Beerens-Heijnen 2009). Des effets semblables n’ont pas été signalés dans les études portant sur l’administration de doses répétées par voie alimentaire jusqu’à 1140 mg/kg p.c./j (Hoberman et coll. 2008; Oishi 2004; Matthews et coll. 1956). Le poids de la preuve indique que le méthylparabène n’est pas génotoxique. Une étude de cancérogenèse (Mason et coll. 1971) a indiqué que le méthylparabène n’est pas cancérogène. Cependant, la dose de 3,5 mg/kg p.c./j peut avoir été trop faible pour détecter un effet.
Vo et coll. (2010) ont signalé plusieurs effets sur le développement pubertaire chez les femelles à la dose de 1000 mg/kg/j de méthylparabène. Comme il est mentionné ci‑dessus, les effets signalés posent problème pour plusieurs raisons. On a rapporté un niveau élevé de variation dans le poids corporel du groupe ayant reçu la dose élevée, et la taille de l’échantillon par dose (n = 10) était inférieure à celle recommandée dans le document de l’EPA Guideline for Female Pubertal Assays (2009). Comme on a signalé que bon nombre des effets constatés avec le méthylparabène à la dose élevée sont également associés à une réduction du poids corporel, la pertinence biologique de ces effets n’a pas été clairement établie. De plus, l’absence d’effets similaires signalés pour d’autres parabènes, en particulier en ce qui concerne les taux sériques d’hormones thyroïdiennes, contredit la tendance dominante observée dans d’autres études. Les résultats d’études in vitro et épidémiologiques indiquent un gradient d’effet des parabènes sur la fonction thyroïdienne, les effets observés en réponse à l’exposition au méthylparabène étant d’une importance significativement inférieure aux effets associés à l’exposition à des parabènes à plus longue chaîne, comme le butylparabène (Taxvig et coll. 2011; Kœppe et coll. 2013). Ailleurs dans le monde, on a eu des opinions partagées au sujet de cette étude. L’Association médicale européenne (EMA 2015) a conclu qu’aucun effet constant n’a été observé avec le méthylparabène jusqu’à la dose maximale d’essai. Le CSSC a noté que les principaux résultats liés au méthylparabène sont les effets sur le poids des organes et a conclu que cette étude ne pouvait pas être utilisée pour déterminer une DSENO, car il ne s’agit pas d’une étude réalisée conformément aux lignes directrices et les effets ne sont pas liés à la dose (CSSC 2010, 2013). RIVM a choisi une DSENO de 250 mg/kg p.c./j basée sur le retard de l’ouverture vaginale, la longueur du cycle œstral et le poids des organes (RIVM 2017), mais déclare qu’elle est partiellement d’accord avec le CSSC et que des études supplémentaires des effets signalés sont nécessaires. Santé Canada est d’accord avec le CSSC et l’EMA pour dire que cette étude ne fournit pas un critère d’évaluation approprié pour la sélection d’un point de départ quantitatif.
Dans une série d’études de toxicité pour le développement prénatal, l’exposition gestationnelle au méthylparabène jusqu’à la dose maximale d’essai de 550 mg/kg p.c./j n’a pas entraîné d’effets indésirables (REACH 2018a). Deux études sur le développement pubertaire chez les mâles n’ont pas non plus mis en évidence d’effets du méthylparabène jusqu’à la dose maximale d’essai (Oishi 2004; Hoberman et coll. 2008). Toutefois, le CSSC a fait état de préoccupations importantes au sujet des résultats de l’étude d’Oishi. La DSENO pour les effets sur la reproduction chez les mâles est donc de 1141 mg/kg p.c./j, soit la dose maximale d’essai provenant de l’étude de qualité supérieure. Hoberman et coll. (2008) ont également rapporté des paramètres toxicologiques dans une étude à doses répétées (signes cliniques, consommation alimentaire, poids corporel, poids des organes et pathologie clinique des viscères thoraciques, abdominaux et pelviens) et n’ont observé aucun effet significatif à la dose maximale. Un point de départ de 250 mg/kg p.c./j, fondé sur la toxicité générale dans une étude à doses répétées, a été choisi pour le méthylparabène et devrait englober les effets sur la reproduction.
La population canadienne est exposée au méthylparabène par l’intermédiaire des cosmétiques, des médicaments sur ordonnance et en vente libre, des PSN, des aliments et de certains produits de consommation. Les données de surveillance disponibles pour certaines sources dans les milieux naturels et les données obtenues ailleurs dans le monde indiquent que les Canadiens sont également exposés au méthylparabène par l’intermédiaire de ces sources.
L’évaluation de l’exposition de la population générale au méthylparabène est fondée sur les données de biosurveillance de l’ECMS, de l’étude P4 (Plastics and Personal-Care Product Use in Pregnancy Study) et d’une étude des nouveau-nés coréens dans les 48 heures suivant leur naissance (Santé Canada 2017a; Fisher et coll. 2017; Kang et coll. 2013). Les données de biosurveillance fournissent des mesures internes réelles de l’exposition parce qu’elles comprennent des mesures spécifiques du méthylparabène dans l’urine. Ces mesures sont considérées comme des estimations fiables de la concentration urinaire de méthylparabène résultant de voies et de sources multiples, y compris la plupart des produits de consommation qui contiennent du méthylparabène. L’urine est la principale voie d’élimination du méthylparabène, et le biomarqueur (méthylparabène libre et conjugué) est propre au composé d’origine. Le méthylparabène a une demi‑vie relativement courte et un faible taux d’élimination urinaire fractionnée. Pour tenir compte de l’incertitude associée à la robustesse de l’utilisation du méthylparabène comme biomarqueur et de l’échantillonnage aléatoire/ponctuel, la limite supérieure de l’intervalle de confiance à 95 % de la concentration urinaire au 95e centile (ou la valeur maximale disponible pour la population générale) pour chaque groupe d’âge a été utilisée afin d’estimer la dose journalière, et ce scénario est donc jugé prudent. L’utilisation des données de biosurveillance de l’ECMS permet d’accroître la confiance à l’égard de la dose journalière estimée, car celle-ci est fondée sur une population nationale importante et représentative. Les marges d’exposition résultant des doses journalières estimées sont présentées dans le tableau 7‑4.
| Source, pays | Groupe d’âge (années) | Limite supérieure de la dose journalière estimée à P95 (mg/kg p.c./j) | Niveau d’effet critiquea (mg/kg p.c./j) |
ME |
|---|---|---|---|---|
| ECMS (cycle 4, 2014-2015), Canada | 3 à 5 | 0,032 | DSENO 250 | 7866 |
| ECMS (cycle 4, 2014-2015), Canada | 6 à 11 | 0,069 | DSENO 250 | 3629 |
| ECMS (cycle 4, 2014-2015), Canada | 12 à 19 | 0,073 | DSENO 250 | 3415 |
| ECMS (cycle 4, 2014-2015), Canada | 20 à 59 | 0,050 | DSENO 250 | 5043 |
| ECMS (cycle 4, 2014-2015), Canada | 60 à 79 | 0,072 | DSENO 250 | 3461 |
| Fisher et coll. 2017, Canada | Femmes enceintes | 0,046 | DSENO 250 | 5325 |
| Kang et coll. 2013, Corée | Nouveau-nés | 0,014 | DSENO 250 | 17 785 |
Abréviations : DSENO = dose sans effet nocif observé.
a Effets critiques : signes cliniques de mauvaise santé, érosion de l’estomac, atrophie de la rate et de la thyroïde, et mortalité.
Sur la base des paramètres prudents utilisés pour modéliser la dose journalière estimée, les marges d’exposition sont jugées adéquates pour tenir compte du risque pour les populations de 3 à 79 ans, les femmes enceintes et les nouveau-nés. On ne disposait pas de données de biosurveillance pour les enfants de moins de 3 ans (autres que les nouveau-nés). À l’exception de la consommation de lait maternel, on ne s’attend pas à ce que l’exposition de ce groupe diffère significativement de celle du groupe d’âge le plus jeune étudié par l’ECMS ou du groupe néonatal présenté ici. La consommation de lait maternel a été modélisée à partir de données canadiennes et ne devrait pas poser de risque. Par conséquent, les concentrations urinaires déclarées et les doses journalières estimées pour tous les groupes d’âge indiquent que l’exposition chez les enfants de moins de 3 ans ne devrait pas présenter un risque.
En raison de la courte demi‑vie du méthylparabène administré par voie orale et de la méthode d’échantillonnage aléatoire employée dans les études de biosurveillance, il n’est pas clair que les données de biosurveillance tiennent compte adéquatement des expositions élevées aux cosmétiques, aux PSN et aux médicaments en vente libre à usage intermittent (c.‑à‑d. produits qui ne sont pas utilisés quotidiennement). Les scénarios d’exposition sentinelle et les ME sont présentés dans le tableau 7‑5.
| Scénario d’exposition | Groupe d’âge (années) |
Exposition systémique (mg/kg p.c./j) | Niveau d’effet critiquea (mg/kg p.c./j) |
ME |
|---|---|---|---|---|
| Permanente / défrisantb (application cutanée, par événement) |
Enfants (5 à 11) |
0,44 à 1,33 | DSENO 250 | 188 à 568 |
| Permanente / défrisantb (application cutanée, par événement) |
Adultes (> 20) |
0,21 à 0,62 | DSENO 250 | 403 à 1190 |
| Médicament antidiarrhéiquec (prise orale, par jour) |
Tout-petits (0,5 à 4) |
50,81 | DSENO 250 | 5 |
| Médicament antidiarrhéiquec (prise orale, par jour) |
Adolescents (12 à 19) |
106,1 | DSENO 250 | 2 |
| Pastille contre la touxc (prise orale, par jour) |
Enfants (5 à 11) |
1,61 | DSENO 250 | 155 |
| Médicament contre les brûlures d’estomacc (prise orale, par jour) |
Adultes (> 20) |
51 | DSENO 250 | 5 |
| Médicament contre le mal des transportsd (prise orale, par jour) |
Tout-petits (0,5 à 4) |
2,4 | DSENO 250 | 104 |
| Produit de contraste radiologiquec (prise orale, par événement) |
Nourrissons (0 à 0,5) |
14,0 | DSENO 250 | 18 |
| Produit de contraste radiologiquec (prise orale, par événement) |
Tout-petits (0,5 à 4) |
29,0 | DSENO 250 | 9 |
| Produit de contraste radiologiquec (prise orale, par événement) |
Adultes (> 20) |
6,35 | DSENO 250 | 39 |
| Crème solairec,d (application cutanée, par jour) |
Tout-petits (0,5 à 4) |
1,21 | DSENO 250 | 207 |
| Crème solairec,d (application cutanée, par jour) |
Adultes (> 20) |
0,91 | DSENO 250 | 275 |
Abréviations : DSENO = dose sans effet nocif observé.
a Effets critiques : signes cliniques de mauvaise santé, érosion de l’estomac, atrophie de la rate et de la thyroïde, et mortalité.
b Cosmétiques.
c Produits de santé naturels.
d Médicaments en vente libre.
Les marges d’exposition, par voie orale, aux médicaments antidiarrhéiques, aux médicaments contre les brûlures d’estomac et aux produits de contraste radiologique sont potentiellement inadéquates pour compenser les incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
7.2 Éthylparabène
7.2.1 Évaluation de l’exposition
L’éthylparabène est présent naturellement dans certains aliments et a été trouvé dans les milieux naturels. L’éthylparabène est présent dans un certain nombre de produits, y compris les cosmétiques, les médicaments sur ordonnance et en vente libre, les PSN et les produits antiparasitaires. De plus, il peut être utilisé comme composant dans les additifs indirects utilisés dans les établissements de transformation alimentaire. Toutes ces sources peuvent contribuer à l’exposition quotidienne totale à l’éthylparabène. Les concentrations urinaires et l’exposition estimée des Canadiens à l’éthylparabène sont présentées dans la section suivante.
Biosurveillance
L’éthylparabène a été mesuré par l’ECMS et dans d’autres études canadiennes de biosurveillance. Selon les données de biosurveillance recueillies lors du cycle 4 de l’ECMS, 64,86 % des Canadiens testés présentaient une concentration urinaire d’éthylparabène qui était inférieure au seuil de détection. La concentration urinaire d’éthylparabène au 95e centile chez les Canadiens de 3 à 79 ans était de 73 µg/LNote de bas de page 7 (n = 2564, intervalle de confiance à 95 % de 33 à 110 µg/L). La fréquence de détection la plus élevée a été trouvée chez les adultes de 40 à 59 ans, chez qui l’éthylparabène était inférieur à la limite de détection dans 52,56 % des échantillons et le 95e centile était de 98 µg/LNote de bas de page 7 (n = 312, intervalle de confiance à 95 % de 44 à 150 µg/L). La plus faible fréquence de détection a été trouvée chez les enfants de 6 à 11 ans (n = 514, où 78,79 % des échantillons présentaient des concentrations urinaires inférieures au seuil de détection et le 95e centile était de 3,4 µg/LNote de bas de page 7, intervalle de confiance à 95 % de 1,3 à 5,5 µg/L) (Santé Canada 2017a). Dans des études régionales menées au Canada, la moyenne géométrique de la concentration urinaire d’éthylparabène chez les femmes enceintes était de 15,13 µg/L (n = 31) et la concentration urinaire moyenne chez les femmes adultes était de 24,4 µg/L (n = 28, dont 9 patientes enceintes, médiane = 10,17 µg/L). La concentration urinaire moyenne chez les hommes (n = 11) était de 12,87 µg/L (médiane = 10,37 µg/L; Genuis et coll. 2013).
On a décelé la présence d’éthylparabène dans le lait maternel à une concentration de 0,0023 µg/L (moyenne géométrique) chez 56 Canadiennes (95e centile = 0,614 µg/L), 3 mois après la naissance (Fisher et coll. 2017). L’éthylparabène a également été détecté dans le placenta, le liquide amniotique et le sang du cordon ombilical. La moyenne géométrique de la concentration dans le liquide amniotique était de 1,87 µg/L (Inde, Shekhar et coll. 2017), la moyenne détectée dans le sang du cordon ombilical était de 0,68 µg/L (États‑Unis, Geer et coll. 2017) et la concentration maximale détectée dans le placenta était de 0,62 ng/ g poids frais (Espagne, Valle-Sistac et coll. 2016). L’éthylparabène a été détecté à une concentration médiane de 2,9 µg/L (forme libre plus parabène conjugué, plage de 1,0 à 8,0 µg/L) dans l’urine prélevée chez des nourrissons coréens dans les 48 heures suivant la naissance (Kang et coll. 2013).
À l’aide d’une méthode semblable à celle qui a été décrite pour le méthylparabène (voir la section 7.1.1), on a calculé les doses journalières estimées pour la population générale, les femmes enceintes et les nouveau-nés, d’après les données de biosurveillance (ECMS, Santé Canada 2017a; Fisher et coll. 2017; Kang et coll. 2013). Dans chacune des trois études de biosurveillance, l’éthylparabène total (c.‑à‑d. les espèces libres et conjuguées) a été mesuré dans l’urine par CPLHP, après traitement avec la β-glucuronidase et la sulfatase. Les nouveau-nés ont été inclus, car la détection de l’éthylparabène dans le sang du cordon ombilical, le placenta et le liquide amniotique indique que l’éthylparabène traverse le placenta et qu’il peut y avoir exposition in utero (Shekhar et coll. 2017; Geer et coll. 2017; Valle-Sistac et coll. 2016). Les concentrations urinaires chez les nouveau-nés coréens ont été utilisées en l’absence de données provenant d’une population canadienne. Ce choix est jugé approprié, car la concentration urinaire d’éthylparabène au 95e centile dans la population générale de la Corée est à peu près équivalente à celle de la population canadienne générale (Honda et coll. 2018).
Les données d’une étude pharmacocinétique sur le méthylparabène, le butylparabène et l’iso-butylparabène chez l’humain (Moos et coll. 2016) ont été utilisées pour modéliser l’élimination urinaire fractionnée de l’éthylparabène (Moos et coll. 2017). Les auteurs ont observé que dans une étude antérieure (Moos et coll. 2016), l’élimination urinaire fractionnée du méthylparabène, du butylparabène et de l’iso-butylparabène diminuait avec l’accroissement de la longueur de la chaîne alkyle. À l’inverse, la valeur log Koe augmente avec la longueur de la chaîne alkyle. Une valeur d’élimination urinaire fractionnée pour l’éthylparabène (et les autres parabènes, notamment le propylparabène) a été calculée par régression linéaire de la valeur log Koe par rapport aux valeurs d’élimination urinaire fractionnée obtenues expérimentalement pour le méthylparabène, le butylparabène et l’iso-butylparabène. Un taux d’élimination urinaire fractionnée de 0,137 a donc été calculé pour l’éthylparabène et est utilisé ici pour calculer la dose journalière estimée. Tout comme avec le méthylparabène, l’éthylparabène est un biomarqueur spécifique du composé d’origine, mais il ne devrait pas être le principal métabolite dans l’urine. Bien qu’il n’existe aucune étude chez l’humain concernant le métabolisme de l’éthylparabène, on a constaté dans une étude sur l’exposition orale et intraveineuse chez le chien que 64 % de la dose appliquée était éliminé dans l’urine en 24 heures sous forme de PHBA et d’autres métabolites (Jones et coll. 1956). Ce résultat correspond à une élimination urinaire fractionnée relativement faible de l’éthylparabène chez les humains. L’utilisation d’une valeur EUF par voie orale peut sous-estimer ou surestimer l’exposition par voie cutanée et l’utilisation du parabène d’origine comme biomarqueur fournit une mesure moins robuste de l’exposition, car ce n’est pas le principal métabolite. Tout comme avec le méthylparabène, l’utilisation du composé d’origine comme biomarqueur peut donner lieu à une contamination pendant l’échantillonnage ou l’analyse en raison de son utilisation généralisée comme agent de conservation (Aylward et coll. 2017a).
Les doses journalières estimées ont été calculées, avec un intervalle de confiance à 95 % au 95e centile (ou les valeurs les plus élevées disponibles), à l’aide des concentrations urinaires ajustées en fonction de la créatinine (µg/g Cr) pour chaque groupe d’âge, comme il est décrit pour le méthylparabène (section 7.1.1). Un niveau élevé de variabilité a été associé aux données de biosurveillance de l’ECMS pour l’éthylparabène dans les groupes d’âge au 95e centile, et la moyenne géométrique n’a pas été calculée pour l’ensemble de la population ou pour les groupes d’âge, car près de 65 % des échantillons étaient sous le seuil de détectionNote de bas de page 8. (Santé Canada 2017a). La prévalence des échantillons inférieurs à la limite de détection peut être due à un métabolisme rapide ou à une faible exposition. Selon les données soumises à Santé Canada, l’éthylparabène est utilisé dans environ 75 % moins de produits (c.‑à‑d. cosmétiques, PSN et médicaments) que le méthylparabène et n’est pas autorisé comme additif alimentaire, ce qui indique qu’une faible exposition peut expliquer en partie, sinon en totalité, les faibles niveaux de détection de l’éthylparabène. Tout comme avec le méthylparabène, la variabilité peut être attribuable à des variations dans le profil d’emploi des produits contenant de l’éthylparabène, ou à l’utilisation d’un échantillonnage ponctuel, qui est sujet à une variabilité d’après le moment de l’échantillonnage et peut sous-estimer l’exposition aux substances à courte demi‑vie. La variabilité et le métabolisme potentiellement rapide ont été pris en compte dans le choix de la limite supérieure de l’intervalle de confiance à 95 % au 95e centile, comme une limite supérieure prudente, pour estimer les doses journalières. Il s’agit d’une estimation prudente qui tient compte de la variation inhérente à l’échantillonnage ponctuel. L’utilisation des données de biosurveillance de l’ECMS permet d’accroître la confiance à l’égard de la dose journalière estimée, car celle-ci est fondée sur une population nationale importante et représentative. La valeur d’élimination urinaire fractionnée de 0,137 ou 13,7 % pour l’éthylparabène a été extrapolée dans Moos et coll. (2017), et le taux d’élimination de la créatinine a été calculé en utilisant l’équation de Mage (Saravanabhavan et coll. 2014).
Les doses journalières estimées et les principaux paramètres sont présentés dans le tableau 7‑6. Les valeurs calculées ici pour la population canadienne sont semblables aux doses journalières de l’éthylparabène calculées au 95e centile pour une population allemande adulte (variant de 3,4 à 17,4 µg/kg p.c./j), comme rapporté dans Moos et coll. (2017). Voir l’annexe A pour de plus amples renseignements sur le calcul des doses journalières estimées.
| Source, pays | Âge (années)a |
TEC (mg/j)b | CUCr, P95 (IC) (µg/g Cr)c | EUFd | DJE, P95 (IC) (µg/kg p.c./j) |
|---|---|---|---|---|---|
| ECMS (cycle 4, 2014-2015)c, Canada | 3 à 5 | 130 | 120 (54 à 90)e | 0,137 | 7,4 (3,4 à 12) |
| ECMS (cycle 4, 2014-2015)c, Canada | 6 à 11 | 418 | 4,6 (2,2 à 7,1)f | 0,137 | 0,46 (0,22 à 0,71) |
| ECMS (cycle 4, 2014-2015)c, Canada | 12 à 19 | 1182 | 120 (54 à 90)e | 0,137 | 18 (8,0 à 28) |
| ECMS (cycle 4, 2014-2015)c, Canada | 20 à 59g | 1248 | 120 (54 à 90)e | 0,137 | 16 (7,0 à 25) |
| ECMS (cycle 4, 2014-2015)c, Canada | 60 à 79 | 1017 | 70 (29 à 110)f | 0,137 | 7,3 (3,0 à 12) |
| Fisher et coll. 2017, Canada | Femmes enceintes | - | 84h | 0,137 | 12 |
| Kang et coll. 2013, Corée | Nouveau-nés | 9,6 | 15i | 0,137 | 0,32 |
Abréviations : TEC = taux d’élimination de la créatinine; CUCr = concentration urinaire ajustée pour la créatinine; P95 = 95e centile; IC = intervalle de confiance; EUF = élimination urinaire fractionnée; DJE = dose journalière estimée
a Les groupes d’âge sont définis d’après les groupes d’âge déclarés dans l’ECMS (Santé Canada 2017a).
b Le taux d’élimination de la créatinine a été calculé en utilisant l’équation de Mage [0,993*1,64 [140 – âge] (Poids1,5 Taille0,5)/1000]. Voir l’annexe A pour les valeurs utilisées pour le poids et la taille selon l’âge.
c Santé Canada 2017a.
d Moos et coll. 2017.
e Les données de l’ECMS pour le 95e centile dans cette strate d’âge ont été supprimées en raison d’une grande variabilité et on a utilisé les données pour les « femmes de 3 à 79 ans » comme données de substitution. Bien que la valeur au 95e centile pour ce groupe ne soit pas connue, cette approche est jugée prudente, car la valeur utilisée pour estimer la dose journalière est la valeur au 95e centile la plus élevée déclarée pour l’éthylparabène.
f Ces valeurs étaient associées à une variabilité d’échantillonnage élevée (c.‑à‑d. un coefficient de variation entre 16,6 % et 33,3 %). Santé Canada recommande d’utiliser ces données avec prudence (Santé Canada 2017a).
g Les groupes d’âge « 20-39 » et « 40-59 » sont présentés ensemble. Lorsque les valeurs au 95e centile étaient indiquées pour les deux groupes d’âge, la valeur la plus élevée est présentée ici. Lorsqu’une valeur était supprimée, la valeur de l’autre groupe est présentée ici.
h Cette valeur est la concentration urinaire de parabène ajustée en fonction de la densité (µg/L) au 95e centile. Aucune valeur ajustée en fonction de la créatinine n’a été rapportée dans Fisher et coll. 2017. Les intervalles de confiance n’ont pas été indiqués. La DJE a été calculée à l’aide de l’équation suivante : DJE = (CU*TDU)/EUF (Saravanabhavan et coll. 2014), où CU est la concentration urinaire, TDU est le taux de débit urinaire (0,20 L/kg p.c./j, Aylward et coll. 2015) et EUF est le taux d’élimination urinaire fractionnée.
i Cette valeur est la concentration de parabène dans l’urine ajustée en fonction de la créatinine au 75e centile; le 95e centile n’a pas été indiqué (Kang et coll. 2013). Les intervalles de confiance n’ont pas été indiqués.
Milieux naturels
L’éthylparabène a été trouvé dans les sols agricoles et la poussière domestique au Canada (Viglino et coll. 2011; Fan et coll. 2010). Dans d’autres pays, cette substance a été trouvée dans l’eau potable (Carmona et coll. 2014), les sols agricoles et forestiers (Perez et coll. 2011; Nunez et coll. 2008), l’air extérieur (Ramirez et coll. 2010; Moreau-Guigon et coll. 2016), l’air à l’intérieur des résidences (Laborie et coll. 2016; Alliot et coll. 2014; Moreau-Guigon et coll. 2016) et la poussière domestique (Wang et coll. 2012; Ramirez et coll. 2011; Tran et coll. 2016; Canosa et coll. 2007). La dose journalière moyenne estimée de l’éthylparabène pour la population générale, basée sur les études réalisées dans divers pays, varie de < 0,001 à 0,013 µg/kg p.c./j pour tous les groupes d’âge, des nourrissons aux adultes de 60 ans et plus.
En l’absence de données canadiennes de surveillance, l’exposition par l’eau, le sol et l’air a été modélisée à l’aide de ChemCAN (ChemCAN 2003). On a constaté que l’éthylparabène se répartissait principalement dans les sédiments et l’eau. Les données modélisées indiquent que l’exposition de la population générale par les milieux naturels au Canada est négligeable.
Aliments
L’exposition à l’éthylparabène par les aliments devrait être négligeable (communication personnelle, courriel de la Direction des aliments, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 18 avril 2018; sans référence). Les données de biosurveillance (Fisher et coll. 2017) indiquent que les nourrissons allaités au sein devraient être exposés à 12,17 ng éthylparabène/kg p.c./j (0,000012 mg/kg p.c./j) via le lait maternelNote de bas de page 9.
Cosmétiques
L’éthylparabène a été trouvé dans une grande variété de cosmétiques, y compris les lotions, les produits de maquillage, les produits d’hygiène buccale, les nettoyants et les produits de soins capillaires. L’exposition résultant de l’utilisation quotidienne de produits cosmétiques a été prise en compte par les données de biosurveillance. En raison de l’utilisation d’un échantillonnage aléatoire et de la courte demi-vie métabolique de l’éthylparabène, l’exposition aux produits utilisés de façon intermittente pourrait ne pas avoir été prise en compte par les données de biosurveillance. Le tableau 7‑7 présente les scénarios sentinelles établis pour les produits à usage intermittent.
Pour ce qui est de l’exposition potentielle par voie cutanée, on a utilisé les coefficients de métabolisme et d’absorption cutanée établis par des expériences dans une étude in vitro de l’absorption cutanée et du métabolisme dans la peau humaine, pour estimer une dose interne, comme il est décrit à la section 7.1.1. De plus amples renseignements sont disponibles sur demande (Charles River Laboratories 2018; Santé Canada 2018b).
Les expositions potentielles ont été estimées d’après des hypothèses prudentes et des valeurs par défaut. L’annexe B présente plus de détails sur les valeurs par défaut et les modèles utilisés pour générer les estimations de l’exposition. L’exposition générale estimée pour chaque scénario est exprimée par événement ou par jour, selon la fréquence d’exposition et les effets critiques sur la santé (voir la section 7.2.3, Caractérisation des risques pour la santé humaine).
| Scénario | Concentration dans le produit (%)a | Groupe d’âge (années) |
Charge cutanée (µg/cm2/24 h) | Exposition systémique (mg/kg p.c./j) |
|---|---|---|---|---|
| Maquillage d’enfant (par application) |
0,1 à 0,3 | Tout-petits (0,5 à 4) |
2,99 à 8,97 | 0,04 à 0,12b,c |
| Maquillage d’enfant (par application) |
0,1 à 0,3 | Adultes (> 20) |
2,98 à 8,94 | 0,013 à 0,038b,c |
a Données internes, Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 18 août 2017, sans référence.
b Valeur calculée d’après la charge cutanée du produit exprimée en quantité maximale appliquée sur la peau.
c Valeur calculée avec un raffinement du métabolisme de 47,93 % d’éthylparabène.
Médicaments et PSN
L’éthylparabène est présent en tant qu’ingrédient non médicinal dans les médicaments sur ordonnance et en vente libre et les PSN administrés par de multiples voies. On estime que l’exposition résultant de l’utilisation quotidienne de médicaments sur ordonnance, de médicaments en vente libre et de PSN est prise en compte dans les données de biosurveillance. Le tableau 7‑8 présente les scénarios sentinelles établis à partir des produits à usage intermittent. Les valeurs par défaut et les modèles utilisés dans les scénarios d’exposition sont présentés à l’annexe B.
| Scénario | Quantité dans le produit (%) | Groupe d’âge (années) |
Charge cutanée (µg/cm2/24 h) | Exposition systémique (mg/kg p.c./j) |
|---|---|---|---|---|
| Médicament chinois traditionnel (prise orale, par jour) | 10 mg/capsulea | Adultes (> 20) |
N.D. | 1,69 |
| Désinfectant pour les mains (application cutanée, par événement) | 62 %a | Tout-petits (0,5 à 4) |
1240,0 | 5,42a,b |
| Désinfectant pour les mains (application cutanée, par événement) | 62 %a | Adultes (> 20) |
1383,0 | 3,44b,c |
| Crème solaire (application cutanée, par jour) | 0,4 %a,b | Tout-petits | 15,60 | 1,54c,d |
| Crème solaire (application cutanée, par jour) | 0,4 %a,b | Adultes | 15,60 | 1,17c,d |
a Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 20 février 2017, sans référence.
b Valeur calculée avec 40,38 % d’absorption cutanée.
c Valeur calculée avec un raffinement du métabolisme de 47,93 % d’éthylparabène.
d Valeur calculée avec une quantité cutanée maximale de 10,18 µg/cm2/24 h.
7.2.2 Évaluation des effets sur la santé
L’éthylparabène a été étudié à fond. Des évaluations des principaux risques ont été réalisées par le CIR (Andersen 2008), le CSSC de l’Union européenne (CSPC 2005a, 2005b, 2006, 2008; CSSC 2010, 2011, 2013), l’EFSA (2004), le NICNAS (2016) et des scientifiques indépendants (Soni et coll. 2005). Une recherche a été effectuée dans la littérature publiée en date de mars 2017 afin de trouver de l’information pertinente pour compléter les données utilisées dans les évaluations et les examens dans le monde.
Toxicocinétique
Une dose unique d’éthylparabène a été administrée par voie orale (1 g/kg) ou intraveineuse (50 mg/kg) à des chiens. Le composé d’origine n’a jamais été détecté dans le plasma, et le PHBA a été détecté dans l’heure qui a suivi (Jones et coll. 1956). La majeure partie de la dose appliquée (64 %) a été éliminée dans les 24 heures sous forme de PHBA et d’autres métabolites. Seulement 0,034 % du composé d’origine a été éliminé. Au moment du sacrifice, de petites quantités de l’éthylparabène total ont été détectées dans le cerveau et le pancréas (Jones et coll. 1956). L’éthylparabène a également été détecté à de faibles concentrations dans le tissu mammaire tumoral, le tissu adipeux humain et dans le cerveau (Barr et coll. 2012; Wang et coll. 2015; van der Meer 2017).
Dans les études ex vivo, l’éthylparabène est métabolisé dans le foie, la peau, la graisse sous-cutanée et le sang chez les humains. L’hydrolyse dans les cellules hépatiques humaines est significativement plus importante que dans les cellules cutanées (Jewell et coll. 2007b; Harville et coll. 2007), mais les deux sont plus efficaces que dans le plasma (Prusakiewicz et coll. 2006). Dans les fractions subcellulaires du foie et de la peau, l’éthylparabène a été hydrolysé 2 à 10 fois plus rapidement que le propylparabène et le butylparabène (Jewell et coll. 2007a, 2007b; Harville et coll. 2007; Lobemeier et coll. 1996; Abbas et coll. 2010; Prusakiewicz et coll. 2006). Dans le plasma humain, l’éthylparabène était stable après 24 heures, comparativement au propylparabène, au butylparabène et au benzylparabène, dont les concentrations étaient réduites de moitié en 1 à 6 heures. L’hydrolyse de l’éthylparabène dans les microsomes hépatiques est plus rapide que dans le sang, avec une demi‑vie de 35 minutes (Abbas et coll. 2010). Les estérases trouvées dans les kératinocytes et la graisse sous-cutanée agissent sur l’éthylparabène, mais avec moins d’efficacité que sur les parabènes à chaîne longue (Lobemeier et coll. 1996).
Contrairement à la cinétique humaine, les fractions de peau et de cellules hépatiques chez le rat hydrolysent les parabènes à peu près au même rythme que dans les études in vitro (Harville et coll. 2007). Toutefois, les cellules cutanées chez le rat hydrolysent l’éthylparabène à un taux de 2 à 3 ordres de grandeur supérieurs à celui des cellules de la peau humaine (Harville et coll. 2007; Prusakiewicz et coll. 2006). Dans ces essais, l’hydrolyse dans les tissus du rat augmente également avec la longueur de la chaîne, contrairement à ce que l’on constate chez les humains. L’éthylparabène est métabolisé dans les fractions des cellules hépatiques humaines à un taux de 2 à 3 fois plus lent que dans le foie du rat (Harville et coll. 2007).
Études à doses répétées
Au cours d’une étude de toxicité orale de 25 semaines, des rats SD-JCL (5/sexe/dose d’essai, 12/groupe témoin) ont reçu 0,2 %, 1,0 % et 2,0 % d’éthylparabène dans leur alimentation (ce qui correspondait à environ 120, 600 et 1200 mg/kg p.c./j). On a observé une diminution du poids corporel chez les mâles dans les groupes ayant reçu les doses moyenne et élevée au cours des semaines 19 à 25 et 22 à 23, respectivement, et une augmentation du poids corporel des mâles dans le groupe ayant reçu la dose faible entre les semaines 22 et 25. La phosphatase alcaline augmentait de façon significative chez les mâles de tous les groupes traités, mais elle n’était pas proportionnelle à la dose et les auteurs n’ont pas jugé qu’elle était biologiquement significative. Aucune différence significative n’a été trouvée dans les signes cliniques, la consommation alimentaire, les effets hématologiques, les protéines sériques, les taux de phosphatase alcaline dans le cholestérol (chez les femelles), le poids des organes ou les anomalies histopathologiques. Une DSENO de 1200 mg/kg p.c./j (la dose maximale d’essai) a été établie (Sado 1973, cité dans Soni et coll. 2005 et REACH 2018b).
Douze rats albinos sevrés par dose ont reçu 2 % ou 8 % d’éthylparabène (équivalant à 900 à 1200 et 5500 à 5900 mg/kg p.c./j) dans leur alimentation pendant 12 semaines. Les animaux ayant reçu 8 % d’éthylparabène ont pris du poids plus lentement que les témoins négatifs aux premiers stades de l’expérience. Divers signes de toxicité, dont la dépression et une diminution de l’activité motrice ainsi que la mortalité, ont également été observés dans ce groupe. Les reins, le foie, le cœur, le poumon, la rate et le pancréas de tous les rats ayant survécu à l’étude étaient normaux. Le seul résultat significatif était la mortalité dans le groupe ayant reçu la dose élevée. Ces animaux présentaient une consolidation pulmonaire et une pneumonie, qui ont également été observées chez les animaux témoins. À la dose de 2 %, aucun signe de toxicité n’a été observé chez les animaux traités, par rapport aux témoins. La DSENO dans cette étude était de 2 % d’éthylparabène (900 à 1200 mg/kg p.c./j), d’après les effets observés à la concentration de 8 % (Matthews et coll. 1956).
Génotoxicité
L’éthylparabène n’est pas mutagène selon les tests d’Ames, mais donne des résultats positifs dans les tests d’aberration chromosomique dans les fibroblastes pulmonaires du hamster chinois à 0,25 mg/mL, et dans les tests du lymphome et des micronoyaux chez la souris, avec ou sans activation métabolique (Finot et coll. 2017; Ishidate et coll. 1978, 1984; Ishidate et Yoshikawa 1980; Kawachi et Yahagi 1980). L’éthylparabène s’est révélé négatif in vivo, y compris dans un test d’aberration chromosomique sur moelle osseuse de souris (Kawachi et Yahagi 1980). Dans l’ensemble, le poids de la preuve indique que l’éthylparabène n’est pas susceptible d’être génotoxique in vivo (EFSA 1996; Andersen 2008).
Cancérogénicité
Des rats Fischer 344 mâles (8/groupe) ont été exposés à du PHBA, du méthylparabène, de l’éthylparabène, du propylparabène et du butylparabène à raison de 4 % dans leur alimentation (environ 4000 mg/kg p.c./j) pendant 9 jours. L’éthylparabène a causé une augmentation de 2,9 fois de la concentration de méthyl‑3[H]thymidine marquée dans l’épithélium du préestomac, ce qui indiquait une prolifération cellulaire. Le traitement avec tous les parabènes a entraîné des lésions visibles au microscope optique (épaississement des muqueuses, pédicelles d’insertion et papilles) dont la gravité augmentait avec la longueur de la chaîne (Rodrigues et coll. 1986). La dose minimale entraînant un effet nocif observé (DMENO) dans cette étude était de 4 %, d’après la prolifération cellulaire et les lésions dans l’épithélium du préestomac.
Effets sur la reproduction et le développement
Les effets œstrogéniques potentiels des parabènes sont examinés à l’annexe C.
Des rates Wistar gravides (8 à 12/groupe) ont reçu 0 %, 0,1 %, 1,0 % ou 10 % d’éthylparabène (équivalant à 54 à 63, 517 à 658 et 2970 à 3260 mg/kg p.c./j) aux JG 8 à 15. Au JG 21, les mères ont été sacrifiées et 305 fœtus ont été divisés en deux groupes et préparés pour l’observation des caractéristiques des viscères et des os. Des saignements dans la région pariétale du cerveau ont été observés chez 12/64 fœtus dans le groupe ayant reçu la dose élevée, chez 13/40 fœtus dans le groupe ayant reçu la dose moyenne et chez 1/44 fœtus dans le groupe ayant reçu la dose faible, comparativement à 2/32 fœtus dans le groupe témoin. Un élargissement anormal des ventricules latéraux et du troisième ventricule du cerveau a été observé chez 2/32 fœtus du groupe témoin et chez 8/64 fœtus du groupe ayant reçu la dose élevée. Une hydronéphrose a été observée chez 4/64 fœtus à la dose élevée, 1/40 à la dose moyenne, 1/44 à la dose faible et 1/32 dans le groupe témoin. Des malformations osseuses ont été observées dans les groupes ayant reçu les doses élevée (18/61) et faible (27/46), ainsi que dans le groupe témoin (8/32). Toutefois, seulement 4/44 animaux du groupe ayant reçu la dose moyenne ont présenté des effets osseux, ce qui donne à penser que l’effet n’était pas spécifique à la substance d’essai. Le poids corporel des mères était plus faible dans tous les groupes traités, en particulier dans le groupe ayant reçu la dose élevée (363,8 ± 50,1, 363,2 ± 41,5 et 326,6 ± 39,5 g, respectivement, pour les doses faible, moyenne et élevée) au JPN 20, comparativement au groupe témoin (412,0 ± 36,2 g). Dans une deuxième étape de l’étude, 6 rates gravides dans les deux groupes ont reçu 0,1 % ou 10 % d’éthylparabène dans leur alimentation entre les JG 8 et 15. Elles ont pu accoucher spontanément, et les nouveau-nés ont été nourris pendant environ 1 mois. Les auteurs rapportent qu’aucun cas de tératogenèse n’a été observé à 1 mois chez 98 petits dont les mères avaient été traitées à l’éthylparabène dans la deuxième phase de l’expérience, et qu’il n’y avait pas de différence apparente par rapport aux témoins quant au rapport mâle/femelle et au poids corporel des petits. Les auteurs ont indiqué que le taux de croissance et le comportement des descendants des mères traitées à l’éthylparabène étaient normaux. La proportion de naissances vivantes était plus élevée dans les groupes testés que dans le groupe témoin, et il n’y avait aucune différence de poids corporel chez les mères après la naissance (Moriyama et coll. 1975; REACH 2018b). Aucune analyse statistique n’a été effectuée dans le cadre de cette étude. Les auteurs ont conclu que l’éthylparabène n’avait pas causé d’effet nocif significatif. Cette position a été soutenue par le CIR (Andersen 2008). Le NICNAS (2016) a déterminé que, d’après les malformations osseuses, l’hydronéphrose et l’élargissement du troisième ventricule du cerveau, une DSENO de 517 à 658 mg/kg p.c./j a été établie pour la toxicité pour le développement, et une DSENO de 517 à 658 mg/kg p.c./j a été établie pour la toxicité maternelle. Une DSENO de 517 à 658 mg/kg p.c./j a été choisie pour cette étude en raison de l’élargissement des ventricules latéraux et du troisième ventricule du cerveau et de l’hydronéphrose.
Dans une étude sur le développement précoce de la reproduction, on a administré par voie sous-cutanée 0 ou 400 mg/kg p.c./j d’éthylparabène du JG 7 au JG 21 à des rates Wistar gravides (14/groupe d’essai). Aucun effet n’a été observé sur la toxicité maternelle ou les paramètres de la reproduction, y compris le nombre d’implantations, le nombre de fœtus, la perte post-implantation, les résorptions ou le rapport mâles/femelles. Aucun effet toxique significatif n’a été observé chez les fœtus ni aucun effet sur le poids à la naissance ou la distance anogénitale chez les petits. Les testicules, les surrénales et les ovaires des fœtus exposés étaient histologiquement similaires à ceux des témoins. Dans le groupe étudié, on n’a constaté aucun changement dans les taux d’hormones des fœtus (progestérone, testostérone, thyroxine) et le sérum des mères (triiodothyronine, thyroxine, progestérone, 17α‑hydroxyprogestérone), les testicules des fœtus (testostérone, progestérone) et les ovaires des fœtus (œstradiol) (Taxvig et coll. 2008). Dans cette étude, la DSENO était de 400 mg/kg p.c./j, la dose d’essai maximale utilisée dans l’essai.
On a administré de l’éthylparabène dans l’alimentation de rats Crj:Wistar mâles (8 animaux/groupe) à 0 %, 0,1 % et 1,0 % (équivalant à 102 ± 2,75 et 1030 ± 38,0 mg/kg p.c./j) pendant 8 semaines à compter des JPN 25 à 27. Aucun effet lié au traitement n’a été observé pour ce qui est du poids des organes reproducteurs (testicules, épididyme, prostate, vésicules séminales et glandes préputiales) dans aucun des groupes traités. Aucun changement des taux de testostérone, de LH et de FSH par rapport aux témoins n’a été observé à aucune dose. La numération des spermatozoïdes dans la queue de l’épididyme et les testicules était normale, tout comme la distribution des spermatogonies, des spermatocytes, des spermatides ronds et des spermatides allongés dans les tubules de stade VII–VIII. La DSENO pour cette étude était de 1030 mg/kg p.c./j, soit la dose maximale d’essai (Oishi 2004). Comme il est décrit dans la section sur le méthylparabène, le CSSC (2008, 2011) a exprimé des réserves quant à la qualité de cette étude et d’autres études produites par le laboratoire d’Oishi, qui ont rapporté i) des valeurs moyennes pour certains paramètres qui se situaient bien à l’extérieur des intervalles des données historiques se rapportant aux témoins et ii) des écarts-types pour les principaux paramètres, notamment les concentrations de sperme dans l’épididyme et les taux de testostérone qui étaient bien inférieurs à la variabilité biologique normale qui a été observée par d’autres groupes. Le CSSC a conclu que la qualité des études d’Oishi ne peut être correctement évaluée, car la description complète des essais et les données brutes complètes n’étaient plus disponibles.
Épidémiologie
Une recherche dans la littérature a été effectuée pour trouver des données épidémiologiques sur l’éthylparabène, l’accent étant mis sur les effets sur la reproduction et le système endocrinien. Les études ont été évaluées et leur qualité a été cotée selon l’échelle NOS (échelle d’évaluation de la qualité de Newcastle-Ottawa) et l’outil d’évaluation de la qualité pour les études d’observation transversales et par cohorte, du National Heart, Lung and Blood Institute des National Institutes of Health (RSI 2018). Des études épidémiologiques ont été trouvées, qui portaient sur la relation entre la concentration urinaire d’éthylparabène et la fertilité, la santé de la reproduction, les taux sériques d’hormones, la croissance et le développement des enfants et des adolescents, le poids corporel, la sensibilisation allergique et la santé respiratoire chez les enfants. La majorité des études ne faisaient pas état d’une association entre l’éthylparabène et le paramètre d’intérêt. Des associations positives faibles ont été constatées entre les concentrations d’éthylparabène et la morphologie anormale du sperme chez les patients d’une clinique de fertilité, le poids et la taille à la naissance chez les nouveau-nés mâles et la sensibilisation allergique (Jurewicz et coll. 2017; Philippat et coll. 2014; Guo et coll. 2017; Savage et coll. 2012; Spanier et coll. 2014; Vernet et coll. 2017). Une faible association inverse a été observée entre la concentration d’éthylparabène et les taux sériques d’hormones thyroïdiennes chez les femmes adultes (Kœppe et coll. 2013) et l’IMC chez les femmes enceintes (Polinski et coll. 2018). Outre les taux de croissance chez les nouveau‑nés et les tout-petits et les taux sériques d’hormones thyroïdiennes, différentes études de qualité similaire ont donné des résultats contradictoires pour ces paramètres ou des paramètres similaires. On trouvera plus de renseignements à ce sujet dans Santé Canada (2018a).
7.2.3 Caractérisation des risques pour la santé humaine
L’éthylparabène s’est révélé faiblement toxique dans les études à doses répétées, avec des DSENO de 900 à 1200 mg/kg p.c./j (Sado 1973; Matthews et coll. 1956). Une DSENO de 900 mg/kg p.c./j a été rapportée pour l’exposition par voie alimentaire à l’éthylparabène dans une étude de 12 semaines à doses répétées, d’après les signes de dépression, de diminution de l’activité motrice et de létalité à 5500 mg/kg p.c./j (Matthews et coll. 1956). Selon le poids de la preuve, l’éthylparabène n’était pas génotoxique et les études in vivo indiquent que cette substance n’est pas cancérogène.
L’administration d’éthylparabène dans le régime alimentaire à des doses allant jusqu’à 1030 mg/kg p.c./j n’a pas entraîné d’effets observés sur le développement pubertaire des rats mâles (Oishi 2004). Toutefois, le CSSC a émis des réserves au sujet de la qualité des études réalisées par le laboratoire d’Oishi. Dans une étude sur le développement reproductif prénatal, aucun effet n’a été observé sur les paramètres de reproduction chez les petits après l’administration par voie sous-cutanée pendant la gestation de doses atteignant 400 mg/kg p.c./j (Taxvig et coll. 2008). Dans une étude plus ancienne sur la toxicité pour le développement prénatal, l’exposition à l’éthylparabène avait entraîné un gonflement des ventricules latéraux et du troisième ventricule du cerveau et une hydronéphrose à la dose maximale d’essai (2970 à 3260 mg/kg p.c./j) (Moriyama et coll. 1975). Des saignements du cerveau pariétal ont également été observés dans les groupes ayant reçu les doses moyenne et élevée, mais ils n’étaient pas proportionnels à la dose, car l’effet a été observé chez 13/40 fœtus à la dose moyenne et chez 12/64 fœtus à la dose élevée. Le poids corporel des mères a diminué de façon notable à la dose élevée. Cependant, l’effet sur les ventricules cérébraux des fœtus est considéré comme étant indépendant du poids corporel de la mère. Une DSENO de 517 mg/kg p.c./j a donc été choisie comme point de départ pour l’éthylparabène, en raison de sa toxicité pour le développement prénatal. Une DSENO de 900 mg/kg p.c./j a été choisie comme point de départ pour la toxicité générale, d’après les études à doses répétées.
La population canadienne est exposée à l’éthylparabène par l’intermédiaire des cosmétiques, des médicaments sur ordonnance et en vente libre et des PSN. Les données de surveillance disponibles pour certaines sources dans les milieux naturels et les données obtenues ailleurs dans le monde permettent de croire que les Canadiens sont également exposés à l’éthylparabène par ces sources.
L’évaluation de l’exposition de la population générale à l’éthylparabène est fondée sur les données de biosurveillance de l’ECMS, sur l’étude Plastics and Personal-Care Product Use in Pregnancy Study (étude P4) et une étude des nouveau-nés coréens dans les 48 heures suivant leur naissance (Santé Canada 2017a; Fisher et coll. 2017; Kang et coll. 2013). Ces données englobent les expositions à l’éthylparabène attribuables à des sources et des voies multiples, reflétant ainsi l’exposition intégrée due à l’utilisation de la plupart des produits de consommation qui contiennent de l’éthylparabène. Les données de biosurveillance sont donc considérées comme des estimations fiables de l’exposition de la population générale canadienne à l’éthylparabène. L’urine est la principale voie d’élimination de l’éthylparabène et le biomarqueur (éthylparabène libre et conjugué) est spécifique du composé d’origine. Toutefois, l’élimination urinaire fractionnée de l’éthylparabène est relativement faible et la majorité des échantillons étaient inférieurs à la limite de détection. Pour tenir compte de l’incertitude associée à la robustesse de l’utilisation de l’éthylparabène comme biomarqueur, les estimations de la dose journalière ont été fondées sur la limite supérieure du 95e centile (ou la valeur d’exposition la plus élevée disponible) pour chaque groupe d’âge, et elles sont donc considérées comme un scénario prudent. Les marges d’exposition résultant des doses journalières estimées sont présentées dans le tableau 7‑9.
| Source, pays | Groupe d’âge (années) | Limite supérieure de la dose journalière estimée à P95 (mg/kg p.c./j) | Niveau d’effet critique (mg/kg p.c./j) |
ME |
|---|---|---|---|---|
| ECMS (cycle 4, 2014-2015), Canada | 3 à 5 | 0,012 | DSENO 900a | 76 322 |
| ECMS (cycle 4, 2014-2015), Canada | 6 à 11 | 0,00071 | DSENO 900a | 1 270 729 |
| ECMS (cycle 4, 2014-2015), Canada | 12 à 19 | 0,028 | DSENO 517b | 18 458 |
| ECMS (cycle 4, 2014-2015), Canada | 20 à 59 | 0,025 | DSENO 517b | 20 866 |
| ECMS (cycle 4, 2014-2015), Canada | 60 à 79 | 0,012 | DSENO 900a | 78 212 |
| Fisher et coll. 2017, Canada | Femmes enceintes | 0,012 | DSENO 517b | 41 466 |
| Kang et coll. 2013, Corée | Nouveau-nés | 0,00031 | DSENO 900a | 2 827 403 |
Abréviations : DSENO = dose sans effet nocif observé.
a Effets critiques : dépression, diminution de l’activité motrice et mortalité.
b Effets critiques : hydronéphrose des fœtus et gonflement des ventricules latéraux et du troisième ventricule du cerveau des fœtus.
Sur la base des paramètres prudents utilisés pour modéliser la dose journalière estimée, les marges d’exposition sont jugées adéquates pour tenir compte du risque pour les populations de 3 à 79 ans, les femmes enceintes et les nouveau-nés. On ne disposait pas de données de biosurveillance pour les enfants de moins de 3 ans (autres que les nouveau-nés). À l’exception de la consommation de lait maternel, on ne s’attend pas à ce que l’exposition de ce groupe diffère significativement de celle du groupe d’âge le plus jeune étudié par l’ECMS ou du groupe néonatal présenté ici. La consommation de lait maternel a été modélisée à partir de données canadiennes et ne devrait pas poser de risque. Par conséquent, les concentrations urinaires déclarées et les doses journalières estimées pour tous les groupes d’âge indiquent que l’exposition chez les enfants de moins de 3 ans ne devrait pas présenter un risque.
En raison de la courte demi‑vie de l’éthylparabène administré par voie orale et de la méthode d’échantillonnage ponctuel employée dans les études de biosurveillance, il n’a pas été établi clairement que les données de biosurveillance traitent adéquatement les expositions élevées aux cosmétiques et aux PSN à usage intermittent. Les scénarios d’exposition sentinelle et les ME sont présentés dans le tableau 7‑10.
| Scénario d’exposition | Groupe d’âge (années) | Exposition systémique (mg/kg p.c./j) | Niveau d’effet critique (mg/kg p.c./j) | ME |
|---|---|---|---|---|
| Maquillage d’enfantc (application cutanée, par événement) |
Tout-petits (0,5 à 4) |
0,04 à 0,12 | DSENO 900b | 7500 à 22 500 |
| Médicament chinois traditionneld (prise orale, par jour) |
Adultes (> 20) |
1,69 | DSENO 517a | 306 |
| Désinfectant pour les mainsd (application cutanée, par événement) | Tout-petits (0,5 à 4) |
5,42 | DSENO 900b | 166 |
| Désinfectant pour les mainsd (application cutanée, par événement) | Adultes (> 20) |
3,44 | DSENO 517a | 150 |
| Crème solaired (application cutanée, par jour) |
Tout-petits (0,5 à 4) |
1,54 | DSENO 900b | 584 |
| Crème solaired (application cutanée, par jour) |
Adultes (> 20) |
1,17 | DSENO 517a | 442 |
Abréviations : DSENO = dose sans effet nocif observé.
a Effets critiques : hydronéphrose des fœtus et gonflement des ventricules latéraux et du troisième ventricule du cerveau des fœtus
.b Effets critiques : dépression, diminution de l’activité motrice et mortalité.
c Cosmétiques.
d Produits de santé naturels.
Les marges d’exposition de tous les produits sont jugées adéquates pour compenser les incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
7.3 Propylparabène
7.3.1 Évaluation de l’exposition
Le propylparabène est présent naturellement dans certains aliments et a été trouvé dans les milieux naturels. Le propylparabène est également présent dans un certain nombre de produits, y compris les médicaments sur ordonnance et en vente libre, les PSN, les cosmétiques, les produits antiparasitaires et certains produits de consommation. Il peut être utilisé comme additif alimentaire ou comme composant dans les matériaux d’emballage alimentaire. Bon nombre de ces sources contribuent à l’exposition quotidienne totale au propylparabène. Les concentrations urinaires et l’exposition estimée des Canadiens au propylparabène sont présentées dans la section suivante.
Biosurveillance
Les données de biosurveillance recueillies lors du cycle 4 de l’Enquête canadienne sur les mesures de la santé ont indiqué une moyenne géométrique de la concentration urinaire de 2,5 µg/L (intervalle de confiance à 95 % de 1,8 à 3,5 µg/L) de propylparabène chez les Canadiens de 3 à 79 ans (n = 2564). Les principales valeurs des études canadiennes de biosurveillance sont présentées dans le tableau 7-18. Chez les femmes, la moyenne géométrique de la concentration urinaire était plus élevée à raison de 4,9 µg/LNote de bas de page 10 (intervalle de confiance à 95 % de 3,2 à 7,6 µg/L, n = 1289) comparativement aux mâles, avec 1,3 µg/L (intervalle de confiance à 95 % de 0,96 à 1,8 µg/L, n = 1275). Parmi les différents groupes d’âge, le groupe le plus exposé était celui des adultes de 60 à 79 ans, avec une moyenne géométrique de la concentration urinaire de 3,0 µg/L8 (intervalle de confiance à 95 % de 2,0 à 4,6 µg/L). Les enfants de 6 à 11 ans présentaient l’exposition la plus faible avec une moyenne géométrique de la concentration urinaire de 1,2 µg/L (intervalle de confiance à 95 % de 0,99 à 1,6 µg/L) (Santé Canada 2017a). Dans l’ensemble de la population (de 3 à 79 ans), 20,83 % des échantillons étaient sous la limite de détection. La proportion la plus élevée d’échantillons sous la limite de détection était de 26,39 % chez les adultes de 60 à 79 ans. Dans deux études canadiennes à plus petite échelle, la concentration urinaire moyenne chez les femmes était de 26,45 µg/L (n = 28, y compris 9 patientes enceintes, médiane = 2,8 µg/L) et la moyenne géométrique de la concentration urinaire chez les femmes enceintes était de 25,50 µg/L (n = 31) (Genuis et coll. 2013; Fisher et coll. 2017). La concentration urinaire moyenne chez les mâles (n = 11), rapportée par Genuis et coll. (2013), était de 61,9 µg/L (médiane de 3,09 µg/L). La différence entre la moyenne et la moyenne géométrique de la concentration urinaire, d’après l’ECMS et Genuis et coll. (2013) et Fisher et coll. (2017), peut être attribuable à des différences dans la population analysée (c.‑à‑d. des petites populations locales et une population de femmes enceintes, par rapport à un grand échantillon national représentatif de la population générale).
Le propylparabène a été détecté à une concentration médiane de 4,0 µg/L (forme libre plus parabène conjugué, plage de 0,84 à 15,2 µg/L) dans l’urine prélevée chez des nourrissons coréens dans les 48 heures suivant la naissance (Kang et coll. 2013). Les nouveau-nés de faible poids à la naissance se trouvant en unité de soins intensifs néonatale (n = 41, âge ≤ 4 semaines) présentaient une concentration urinaire de 2,6 µg/L de propylparabène libre et de 16,8 µg/L de parabènes totaux (moyennes géométriques rapportées; Calafat et coll. 2009), une concentration supérieure à celles des plus jeunes enfants d’après les études de l’ECMS ou NHANES (Santé Canada 2017a; Calafat et coll. 2010).
Le propylparabène a été détecté dans le lait maternel à une concentration de 0,0277 µg/L chez 56 Canadiennes (moyenne géométrique, 95e centile = 1,320 µg/L), 3 mois après la naissance (Fisher et coll. 2017). Le propylparabène a été détecté dans le placenta dans un échantillon de 12 femmes (Barcelone, maximum = 1,28 ng/g poids frais) et dans le liquide amniotique chez 40 femmes enceintes (Inde, moyenne géométrique = 7,84 µg/L) (Valle-Sistac et coll. 2016; Shekhar et coll. 2017). Le propylparabène a été détecté dans le sang du cordon ombilical à une concentration moyenne de 5,59 µg/L dans 34 échantillons aux États‑Unis (Geer et coll. 2017). Le propylparabène était indétectable dans le sang de 73,9 % des nouveau-nés (n = 181) qui avaient reçu des médicaments contenant du propylparabène comme excipient. La concentration maximale détectée dans le sang était de 147 µg/L (Mulla et coll. 2015).
Les doses journalières estimées de propylparabène ont été calculées pour la population générale, les femmes enceintes et les nouveau-nés, d’après les données de biosurveillance et selon la méthode décrite pour le méthylparabène à la section 7.1.1 (ECMS, Santé Canada 2017a; Fisher et coll. 2017; Kang et coll. 2013). Dans chacune des trois études de biosurveillance, le propylparabène total (c.‑à‑d. les espèces libres et conjuguées) a été mesuré dans l’urine par CPLHP, après traitement avec la β‑glucuronidase et la sulfatase. La valeur d’élimination urinaire fractionnée de 0,097 ou 9,7 % du propylparabène a été extrapolée dans Moos et coll. (2017), d’après les valeurs mesurées pour le méthylparabène et le butylparabène chez les adultes. Le taux d’élimination de la créatinine a été calculé en utilisant l’équation de Mage (Saravanabhavan et coll. 2014). Les nouveau-nés ont été inclus, parce que la détection du propylparabène dans le sang du cordon ombilical, le placenta et le liquide amniotique indique que le propylparabène traverse le placenta et que l’exposition in utero est possible (Shekhar et coll. 2017; Geer et coll. 2017; Valle-Sistac et coll. 2016). Les concentrations urinaires de propylparabène chez les nouveau-nés coréens ont été utilisées en l’absence de données pour une population canadienne. Il s’agit d’un choix jugé prudent, car les concentrations urinaires de propylparabène au 95e centile dans la population générale de la Corée dépassent celles de la population canadienne générale (Honda et coll. 2018).
Comme nous l’avons décrit pour l’éthylparabène (voir la section 7.2,1), Moos et coll. (2017) ont utilisé une régression linéaire des valeurs d’élimination urinaire fractionnée, d’après une étude pharmacocinétique chez les humains (Moos et coll. 2016) du méthylparabène, du butylparabène et de l’iso-butylparabène, et la valeur log Koe pour modéliser l’élimination urinaire fractionnée de propylparabène, pour obtenir la valeur 0,097 (Moos et coll. 2017). Une faible récupération du propylparabène dans l’urine est compatible avec les résultats d’autres études. Dans des études chez l’humain dans le cadre desquelles 20 mg/kg p.c./j de propylparabène ont été administrés par voie orale, on a détecté la présence de PHBA dans le sang en 60 minutes, mais le parabène d’origine n’a été détecté à aucun moment (Heim 1960, cité dans Andersen 2008). Dans une autre étude, un seul volontaire a ingéré 2 g de propylparabène par jour pendant 5 jours, et 17,4 % de la dose a été éliminée sous forme de PHBA dans l’urine. Seul le propylparabène conjugué a été trouvé dans l’urine. Le parabène non métabolisé n’a pas été détecté (par conséquent, la majeure partie de la dose n’a pas été retrouvée) (Sabalitschka et Neufeld-Crzelliter 1954, cité dans Soni et coll. 2005). Voir la section 7.3.2 pour plus de détails sur la toxicocinétique du propylparabène. La valeur de 9,7 % a donc été utilisée comme valeur d’élimination urinaire fractionnée dans le calcul des équivalents de biosurveillance et de la dose journalière estimée pour le propylparabène. Comme les autres parabènes, le propylparabène est un biomarqueur spécifique du composé d’origine et il est principalement éliminé dans l’urine, mais ce n’est pas le principal métabolite. L’utilisation d’une valeur EUF par voie orale peut sous‑estimer ou surestimer l’exposition par voie cutanée et l’utilisation du parabène d’origine comme biomarqueur fournit une mesure moins robuste de l’exposition, car ce n’est pas le principal métabolite. En raison de son utilisation répandue comme agent de conservation, l’utilisation du composé d’origine comme biomarqueur peut donner lieu à une contamination lors du prélèvement et de l’analyse des échantillons (Aylward et coll. 2017a).
Les doses journalières estimées ont été calculées, avec un intervalle de confiance à 95 % au 95e centile (ou les valeurs les plus élevées disponibles), à l’aide des concentrations urinaires ajustées en fonction de la créatinine (µg/g Cr) pour chaque groupe d’âge, comme il est décrit pour le méthylparabène (section 7.1.1). Le propylparabène était sous le seuil de détection dans environ 20 % de tous les échantillons de l’ECMS. Toutefois, des méthodes entièrement validées ont été utilisées pour mesurer le propylparabène, et les données de biosurveillance chez les humains fournissent une vue réaliste de l’exposition de la population générale. Le nombre d’échantillons présentant des niveaux indétectables de propylparabène peut être dû à un métabolisme rapide ou à une faible exposition. Selon les données présentées à Santé Canada, le propylparabène est utilisé dans environ 35 % moins de produits (c.‑à‑d. cosmétiques, PSN et médicaments sur ordonnance et en vente libre) que le méthylparabène, ce qui indique qu’une exposition moindre peut expliquer en partie, sinon en totalité, les faibles taux de détection du propylparabène. Un niveau élevé de variabilité (d’après le coefficient de variation) a été associé aux données de biosurveillance de l’ECMS pour le propylparabène dans les groupes d’âge au 95e centile, et, pour certains groupes d’âge, à la moyenne géométrique. Pour tenir compte de la variabilité, on a choisi les limites inférieure et supérieure de l’intervalle de confiance à 95 % au 95e centile, pour calculer la dose journalière estimée. L’utilisation des données de biosurveillance de l’ECMS permet d’accroître la confiance à l’égard de la dose journalière estimée, car ces données proviennent d’une population importante et représentative à l’échelle nationale.
Les doses journalières estimées et les principaux paramètres sont présentés dans le tableau 7‑11. Les valeurs calculées ici pour la population canadienne sont similaires aux doses journalières de propylparabène calculées au 95e centile pour une population allemande adulte (variant de 9,8 à 26,9 µg/kg p.c./j), rapportées dans Moos et coll. (2017). Voir l’annexe A pour de plus amples renseignements sur le calcul des doses journalières estimées.
| Source, pays | Âge (années)a |
TEC (mg/j)b | CUCr, P95 (IC) (µg/g Cr)c | EUFd | DJE, P95 (IC) (µg/kg p.c./j) |
|---|---|---|---|---|---|
| ECMS (cycle 4, 2014-2015)c, Canada | 3 à 5 | 130 | 68 (20 à 120)e | 0,097 | 5,9 (1,7 à 10) |
| ECMS (cycle 4, 2014-2015)c, Canada | 6 à 11 | 418 | 190 (110 à 280)f | 0,097 | 26 (15 à 39) |
| ECMS (cycle 4, 2014-2015)c, Canada | 12 à 19 | 1182 | 85 (42 à 130)e | 0,097 | 17 (8,6 à 27) |
| ECMS (cycle 4, 2014-2015)c, Canada | 20 à 59g | 1248 | 96 (29 à 160)e | 0,097 | 17 (5,3 à 29) |
| ECMS (cycle 4, 2014-2015)c, Canada | 60 à 79 | 1017 | 190 (110 à 280)e | 0,097 | 28 (16 à 41) |
| Fisher et coll. 2017, Canada | Femmes enceintes | - | 111h | 0,097 | 23 |
| Kang et coll. 2013, Corée | Nouveau-nés | 9,6 | 37,3i | 0,097 | 1,1 |
Abréviations : TEC = taux d’élimination de la créatinine; CUCr = concentration urinaire ajustée pour la créatinine; P95 = 95e centile; IC = intervalle de confiance; EUF = élimination urinaire fractionnée; DJE = dose journalière estimée.
a Les groupes d’âge sont définis d’après les groupes d’âge déclarés dans l’ECMS (Santé Canada 2017a).
b Le taux d’élimination de la créatinine a été calculé en utilisant l’équation de Mage [0,993*1,64 [140 – Âge] (Poids1,5 Taille0,5)/1000]. Voir l’annexe A pour les valeurs utilisées pour le poids et la taille selon l’âge.
c Santé Canada 2017a.
d Moos et coll. 2016.
e Ces valeurs étaient associées à une variabilité d’échantillonnage élevée (c.‑à‑d. un coefficient de variation entre 16,6 % et 33,3 %). Santé Canada recommande d’utiliser ces données avec prudence (Santé Canada 2017a).
f Les données de l’ECMS pour le 95e centile dans cette strate d’âge ont été supprimées en raison d’une grande variabilité et les données pour la tranche d’âge « 60 à 79 » ont été utilisées comme données de substitution. Bien que la valeur au 95e centile pour ce groupe n’est pas connue, cette approche est jugée prudente, car la valeur utilisée pour estimer la dose journalière est la valeur au 95e centile qui a été rapportée pour le propylparabène.
g Les groupes d’âge « 20-39 » et « 40-59 » sont présentés ensemble. La valeur au 95e centile pour la tranche d’âge de 20 à 39 ans a été supprimée en raison d’une grande variabilité. La valeur au 95e centile pour le groupe d’âge de 40 à 59 ans est présentée ici.
h Cette valeur est la concentration de parabène dans l’urine (µg/L), ajustée en fonction de la densité, au 95e centile. Aucune valeur ajustée en fonction de la créatinine n’a été rapportée dans Fisher et coll. 2017. Les intervalles de confiance n’ont pas été indiqués. La DJE a été calculée à l’aide de l’équation suivante : DJE = (CU*TDU)/EUF (Saravanabhavan et coll. 2014), où CU est la concentration urinaire, TDU est le taux de débit urinaire (0,20 L/kg p.c./j, Aylward et coll. 2015) et EUF est le taux d’élimination urinaire fractionnée.
i Cette valeur est la concentration de parabène dans l’urine ajustée en fonction de la créatinine au 75e centile; le 95e centile n’a pas été indiqué (Kang et coll. 2013). Les intervalles de confiance n’ont pas été indiqués.
Milieux naturels
Le propylparabène a été trouvé dans les sols agricoles et la poussière domestique au Canada (Viglino et coll. 2011; Fan et coll. 2010). Dans d’autres pays, il a été trouvé dans l’eau potable (Carmona et coll. 2014), les potagers, les sols agricoles, industriels et forestiers (Ferreira 2011; Perez et coll. 2011; Nunez et coll. 2008), l’air extérieur (Moreau-Guigon et coll. 2016), l’air à l’intérieur des résidences (Laborie et coll. 2016; Alliot et coll. 2014; Moreau-Guigon et coll. 2016) et la poussière domestique (Wang et coll. 2012; Ramirez et coll. 2011; Tran et coll. 2016; Canosa et coll. 2007). La dose journalière moyenne estimée de propylparabène pour la population générale du Canada, d’après ces études, va de 0,004 à 28 µg/kg p.c./j pour tous les groupes d’âge, des nourrissons aux adultes de 60 ans et plus.
En l’absence de données canadiennes de surveillance, l’exposition par l’eau et l’air a été modélisée à l’aide de ChemCAN (ChemCAN 2003). On a constaté que le propylparabène se répartissait principalement dans les sédiments et l’eau. Les données modélisées indiquent que l’exposition de la population générale par les milieux naturels est négligeable.
Aliments
L’utilisation du propylparabène (identifié comme propylparabène ou 4-hydroxybenzoate de propyle) et de son sel de sodium (identifié comme sel de sodium de l’acide parahydroxybenzoïque de propyle) est permise comme additif alimentaire (agent de conservation) dans les aliments vendus au Canada. Les aliments auxquels ils peuvent être ajoutés et leur concentration maximale d’utilisation dans ces aliments figurent à la Partie 2 de la Liste des agents de conservation autorisés (communication personnelle, courriel de la Direction des aliments, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 18 avril 2018; sans référence). Toutefois, ces utilisations ont été approuvées il y a de nombreuses années et les résultats d’une enquête réalisée en 2017 par Santé Canada sur les utilisations actuelles du propylparabène par l’industrie alimentaire semblent indiquer qu’elles sont limitées. Il est principalement utilisé dans les aliments comme agent de conservation dans certaines préparations ou dispersions de colorant, lesquelles sont ensuite incorporées dans un nombre limité de produits alimentaires, tels que certains produits de confiserie, des marinades ou des boissons non normalisées, y compris certaines boissons aromatisées et gazeuses ou concentrées (y compris les boissons congelées) (communication personnelle, courriel de la Direction des aliments, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 18 avril 2018; sans référence). Pour la population générale (tranches d’âge de 1 à 71 ans et plus), les estimations prudentes de l’exposition au propylparabène, en raison de son utilisation dans certaines préparations colorantes, vont de 0,013 à 0,073 mg/kg p.c./j au 90e centile. Les données de biosurveillance (Fisher et coll. 2017) indiquent que les nourrissons allaités au sein devraient être exposés à 33,04 ng/kg p.c./j (0,000033 mg/kg p.c./j) via le lait maternel.
Cosmétiques et produits de consommation
Le propylparabène a été trouvé dans les lingettes nettoyantes (SDS 2010) et une grande variété de cosmétiques, y compris les lotions, les produits de maquillage, les nettoyants et les produits de soins capillaires. On a estimé que l’exposition résultant de l’utilisation quotidienne de produits cosmétiques et de produits de consommation a été prise en compte dans les données de biosurveillance. En raison de l’utilisation d’un échantillonnage ponctuel et de la courte demi-vie métabolique du propylparabène, l’exposition aux produits utilisés de façon intermittente n’a probablement pas été prise en compte par les données de biosurveillance. Des scénarios sentinelles d’exposition aux cosmétiques à usage intermittent sont présentés dans le tableau 7‑12.
Pour ce qui est de l’exposition potentielle par voie cutanée, les coefficients de métabolisme et d’absorption cutanée, établis par des expériences dans une étude in vitro sur l’absorption cutanée et le métabolisme dans la peau humaine, ont été utilisés pour estimer une dose interne, comme il est décrit à la section 7.1.1 et de plus amples renseignements sont disponibles sur demande (Charles River Laboratories; Santé Canada 2018b).
Les expositions potentielles ont été estimées d’après des hypothèses prudentes et des valeurs par défaut. L’annexe B présente plus de détails sur les valeurs par défaut et les modèles utilisés pour générer les estimations de l’exposition. L’estimation de l’exposition pour chaque scénario est exprimée par événement ou sur une base journalière, selon la fréquence d’exposition (voir la section 7.3.3, Caractérisation des risques pour la santé humaine).
Scénario |
Concentration dans le produit (%) |
Groupe d’âge |
Charge cutanée (µg/cm2/24 h) |
Exposition systémique (mg/kg p.c./j) |
|---|---|---|---|---|
Maquillage d’enfant |
0,1 à 0,3a |
Tout-petits |
2,99 à 8,97 |
0,031 à 0,93b,c |
Maquillage d’enfant |
0,1 à 0,3a |
Adultes |
2,98 à 8,94 |
0,0099 à 0,030b,c |
a Données internes, Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 18 août 2017, sans référence.
b Valeur calculée d’après la charge cutanée du produit exprimée en quantité maximale appliquée sur la peau.
c Valeur calculée avec un raffinement du métabolisme de 36,97 % de propylparabène.
Médicaments et PSN
Le propylparabène est présent en tant qu’ingrédient non médicinal dans les médicaments sur ordonnance et en vente libre et les PSN administrés par de multiples voies. On estime que l’exposition résultant de l’utilisation quotidienne de médicaments sur ordonnance, de médicaments en vente libre et de PSN est prise en compte dans les données de biosurveillance. Les scénarios sentinelles utilisés pour les produits à usage intermittent sont présentés dans le tableau 7‑13. Les valeurs par défaut et les modèles utilisés dans les scénarios d’exposition sont présentés à l’annexe B.
| Scénario | Concentration dans le produit (%) | Groupe d’âge (années) |
Charge cutanée (µg/cm2/24 h) | Exposition systémique (mg/kg p.c./j) |
|---|---|---|---|---|
| Médicament contre les brûlures d’estomaca (par jour) |
0,65c | Adultes (> 20) |
N.D. | 29,33 |
| Traitement au fluorurea (par événement) | 0,2c | Enfants (5 à 11) |
N.D. | 0,52 |
| Traitement au fluorurea (par événement) | 0,2c | Adultes (> 20) |
N.D. | 0,23 |
| Crème solaireb (application cutanée, par jour) |
0,1d | Nourrisson (0 à 0,5) |
4,59 | 1,84e, g |
| Crème solairea (application cutanée, par jour) |
0,4c | Tout-petits (0,5 à 4) |
15,6 | 0,78df,h |
| Crème solairea (application cutanée, par jour) |
0,4c | Adultes (> 20) |
15,6 | 0,58f,h |
Abréviation : s.o., sans objet
a Produits de santé naturels.
b Médicaments en vente libre.
c Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 20 février 2017, sans référence.
d Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 20 février 2017, sans référence.
e Valeur calculée d’après la charge cutanée du produit exprimée en quantité maximale appliquée sur la peau.
f Valeur calculée avec une quantité cutanée maximale de 8,23 µg/cm2/24 h.
g Aucun raffinement du métabolisme n’a été appliqué au groupe des nourrissons.
h Valeur calculée avec un raffinement du métabolisme de 29,86 % de propylparabène.
7.3.2 Évaluation des effets sur la santé
Le propylparabène a été étudié à fond. Des évaluations des principaux risques ont été réalisées par le CIR (Andersen 2008), le CSSC de l’Union européenne (CSPC 2005a, 2005b, 2006, 2008; CSSC 2010, 2011, 2013), EFSA (2004), EMA (2015), NICNAS (2016) et des scientifiques indépendants (Soni et coll. 2005). Une recherche a été effectuée dans la littérature publiée en date de mars 2017 afin de trouver de l’information pertinente pour compléter les données utilisées dans les évaluations et les examens dans le monde.
Toxicocinétique
Une dose unique de 100 mg/kg propylparabène radiomarqué a été administrée à des rats par voie orale et cutanée (Aubert et coll. 2012). Les concentrations plasmatiques maximales (Cmax) ont été atteintes en moins de 1 heure et de 8 heures, respectivement, par voie orale et cutanée. Toutes les voies d’administration ont produit un seul pic dans le plasma, correspondant à celui du PHBA et le parabène d’origine n’a pas été détecté. Plus de 70 % de la dose orale a été éliminé en 24 heures, avec < 4 % détectée dans les matières fécales et < 1 % dans les tissus. Environ 60 % de la dose cutanée appliquée n’a pas été absorbée après 24 heures, 17 % à 20 % de la dose ont été éliminés dans l’urine et < 2 % dans les matières fécales, le reste se trouvant dans les tissus externes (p. ex., cheveux, ongles) (Aubert et coll. 2012). Lorsqu’une dose unique de propylparabène a été administrée par voie orale (1 g/kg) ou intraveineuse (50 mg/kg) à des chiens, le composé d’origine n’a jamais été décelé dans le plasma, et le PHBA a été détecté en deçà de 1 heure (Jones et coll. 1956). La dose appliquée a été éliminée à 53 % dans les 24 heures sous forme de PHBA et d’autres métabolites; le composé d’origine a été éliminé à raison de 0,042 %. L’élimination par voie urinaire a augmenté à 96 % après 24 heures lorsque les chiens ont reçu 1 g/kg p.c./j de propylparabène par jour pendant 1 an. Au moment du sacrifice, de petites quantités de tout le propylparabène ont été détectées dans le cerveau (Jones et coll. 1956).
Lorsque des sujets humains ont reçu par voie orale jusqu’à 20 mg/kg p.c. de propylparabène en une seule dose, le composé d’origine n’a pas été détecté dans le sang, mais le PHBA l’a été dans les 60 minutes (Heim 1960, cité dans Andersen 2008). Un seul volontaire ayant reçu 2 g de propylparabène par voie orale pendant 5 jours a éliminé 17,4 % de PHBA. Cinquante-cinq pourcent du propylparabène éliminé a été conjugué à de l’acide sulfurique, mais la forme d’origine n’a pas été détectée dans l’urine. Dans cette étude, la majeure partie de la dose administrée n’a pas été retracée compte (Sabalitschka et Neufeld-Crzelliter 1954, cité dans Soni et coll. 2005). Ces résultats concordent avec ceux de Ye et coll. (2006) qui ont indiqué que les parabènes dans l’urine se trouvaient principalement sous forme conjuguée (95 % à 98 % des parabènes détectés). La principale isoforme était le parabène conjugué au sulfate, qui représentait 55 % du propylparabène récupéré. Bien que la majeure partie du propylparabène semble avoir été rapidement éliminée de l’organisme chez les humains, on a détecté des concentrations de propylparabène dans le tissu mammaire tumoral, le tissu adipeux et le cerveau (Barr et coll. 2012; Wang et coll. 2015; van der Meer 2017). On n’a pas indiqué si les parabènes étaient libres ou conjugués.
Dans les fractions subcellulaires du foie et de la peau, le propylparabène est métabolisé jusqu’à un ordre de grandeur moins efficacement que le méthylparabène et l’éthylparabène (Jewell et coll. 2007a, 2007b; Harville et coll. 2007; Lobemeier et coll. 1996; Abbas et coll. 2010; Prusakiewicz et coll. 2006). Dans le plasma humain, le propylparabène a été réduit à 47 % après 6 heures. Le propylparabène avait une demi‑vie de 67 minutes dans les microsomes hépatiques humains (Abbas et coll. 2010). Les estérases identifiées dans les kératinocytes et la graisse sous-cutanée montrent une préférence pour les parabènes à chaîne plus longue (c.‑à‑d. le propylparabène et le butylparabène), avec une affinité décroissante pour les parabènes à chaîne courte (Lobemeier et coll. 1996).
Contrairement à la cinétique humaine, les fractions de peau et de cellules hépatiques chez le rat hydrolysent les parabènes à peu près au même rythme que dans les études in vitro (Harville et coll. 2007). Cependant, les cellules de peau de rat hydrolysent le propylparabène à un taux de 3 ordres de grandeur supérieur à celui des cellules de la peau humaine, ce qui correspond aux taux globaux d’hydrolyse pour les carboxylestérases chez ces espèces (Harville et coll. 2007; Prusakiewicz et coll. 2006). L’hydrolyse dans les tissus du rat augmente également avec la longueur de la chaîne, contrairement à ce que l’on constate chez les humains. Contrairement aux parabènes à chaîne plus courte, le propylparabène était métabolisé dans le foie du rat à un taux environ 10 fois plus élevé que dans le foie humain (Harville et coll. 2007).
Études à doses répétées
Dans une étude conforme à la Ligne directrice 422 de l’OCDE (Étude combinée de toxicité à doses répétées et de dépistage de la toxicité pour la reproduction et le développement), des rats Wistar (11/sexe/groupe) ont reçu 0, 1500, 4500 ou 15 000 ppm de propylparabène dans leur alimentation (correspondant à 59,3 à 98,0, 178,3 à 305,1 et 605,0 à 980,9 mg/kg p.c./j pour les mâles et 116,0 à 137,3, 341,9 à 431,8 et 1076,4 à 1380,0 mg/kg p.c./j pour les femelles) pendant 7 semaines ou plus. Les rats mâles ont été traités pendant 28 jours et les rates ont été traitées pendant 14 jours avant l’accouplement, pendant l’accouplement et pendant la gestation jusqu’à la première génération (F1) au JPN 4. Aucun signe de toxicité indésirable n’a été observé chez les mâles et les femelles traitées, peu importe la dose. On a observé une réduction de la prise de poids corporel chez les mâles du groupe ayant reçu la dose élevée, mais il n’y a pas eu de changement significatif dans le poids corporel résultant. Dans le groupe ayant reçu la dose élevée, on a également observé une augmentation de la concentration sérique de triglycérides, sans autres changements connexes (REACH 2018c). Les effets sur la reproduction sont examinés dans une autre section ci‑dessous. Les détails complets de cette étude n’étaient pas disponibles dans le dossier REACH. Une DSENO de 1076 mg/kg p.c./j est établie pour la toxicité chronique.
Douze rats albinos sevrés par dose ont reçu 2 % ou 8 % de propylparabène (équivalant à 900 à 1200 et 5500 à 5900 mg/kg p.c./j) dans leur alimentation pendant 96 semaines. Les animaux ayant reçu 8 % de propylparabène ont pris du poids plus lentement que les témoins négatifs aux premiers stades de l’expérience. L’effet était plus important chez les mâles et diminuait à la fin de l’expérience. À la dose de 2 %, aucun signe de toxicité n’a été observé chez les animaux traités, par rapport aux témoins. La DSENO établie pour cette étude est de 2 % de propylparabène (900 à 1200 mg/kg p.c./j, Matthews et coll. 1956).
Génotoxicité
Le propylparabène s’est révélé négatif dans les tests d’Ames et négatif également dans les tests d’aberration chromosomique des fibroblastes pulmonaires de hamster chinois à des concentrations atteignant 0,45 mg/mL (REACH 2018c; McCann et coll. 1975; Andersen 2008; Kier et coll. 1986; Morita et coll. 1981; Kawachi et Yahagi 1980; Odashima 1976). Le propylparabène a induit une cytotoxicité et une apoptose/nécrose à 1 % dans les fibroblastes dermiques humains et une diminution de la prolifération cellulaire et des ruptures d’ADN dans les cellules Vero à 500 µM et a induit des échanges de chromatides, des aberrations chromosomiques et des résultats positifs dans les tests des comètes à 1 à 1,5 mM dans les cellules CHO-K1 (Tayama et coll. 2008; Carvalho et coll. 2012; Martin et coll. 2010). Le propylparabène s’est révélé négatif dans les essais de génotoxicité in vivo, y compris un test de létalité dominante (Ayar et Uysal 2013; Odashima 1976; EFSA 2004). Dans l’ensemble, le poids de la preuve indique que le propylparabène n’est pas susceptible d’être génotoxique in vivo (EFSA 1996; Andersen 2008).
Cancérogénicité
Des rats Fischer 344 mâles (8/groupe) ont été exposés au PHBA, à du méthylparabène, de l’éthylparabène, du propylparabène et du butylparabène à raison de 4 % dans leur alimentation (environ 4000 mg/kg p.c./j) pendant 9 jours. Le propylparabène a donné lieu à une augmentation de 6,7 fois du marquage au méthyl‑3[H]thymidine dans l’épithélium du préestomac, indiquant une prolifération cellulaire. Le propylparabène a provoqué un épaississement de la muqueuse et le traitement avec tous les parabènes a causé des lésions visibles au microscope optique (épaississement des muqueuses, pédicelles d’insertion et papilles) dont la gravité augmentait avec la longueur de la chaîne (Rodrigues et coll. 1986).
Des rats Fischer 344 mâles (5/groupe) ont été traités à raison de 0 %, 1 % ou 4 % de propylparabène dans leur alimentation (environ 1000 et 4000 mg/kg p.c./j) pendant 9 jours. On a observé une augmentation de 1,5 fois le taux de marquage dans la région préfundus du préestomac dans le groupe ayant reçu 1 % et de 2,5 fois dans le groupe ayant reçu 4 %. Sur le plan histologique, une hyperplasie et des lésions ont été observées dans les deux groupes, avec une gravité accrue dans le groupe ayant reçu 4 % (Nera 1984). À l’opposé de ces résultats, des rats Fischer 344 mâles (5/groupe) ont reçu 3 % de propylparabène dans leur alimentation pendant 8 semaines et n’ont présenté aucun effet de marquage ou d’hyperplasie dans le préestomac ou l’estomac glandulaire (Shibata et coll. 1990). De même, des hamsters dorés mâles ayant reçu 3 % de propylparabène dans leur alimentation pendant 20 semaines n’ont pas présenté de lésions prolifératives, d’hyperplasie ou d’augmentation des indices de marquage dans le préestomac (Hirose et coll. 1986). Dans l’ensemble, les résultats des études sur la prolifération cellulaire laissent à entendre qu’il y a un effet de seuil à une exposition supérieure à 3 % de propylparabène dans l’alimentation.
Effets sur la reproduction et le développement
Les effets œstrogéniques potentiels des parabènes sont examinés à l’annexe C.
Dans une étude conforme à la Ligne directrice 422 de l’OCDE (Étude combinée de toxicité à doses répétées et de dépistage de la toxicité pour la reproduction et le développement), des rats Wistar (11/sexe/groupe) ont reçu 0, 1500, 4500 ou 15 000 ppm de propylparabène dans leur alimentation (soit 59,3 à 98,0, 178,3 à 305,1 et 605,0 à 980,9 mg/kg p.c./j pour les mâles et 116,0 à 137,3, 341,9 à 431,8 et 1076,4 à 1380,0 mg/kg p.c./j pour les femelles) jusqu’à 7 semaines. Les rats mâles ont été traités pendant 28 jours et les rates pendant 14 jours avant l’accouplement, pendant l’accouplement et pendant la gestation jusqu’à la génération F1 au JPN 4. Les signes de toxicité générale ont été décrits dans une section précédente. Aucun effet n’a été observé chez la génération parentale en ce qui a trait aux paramètres de la reproduction (motilité, morphologie et numération des spermatozoïdes, cycle œstral, performance de l’accouplement, fertilité, durée de la gestation, dénombrement des corps jaunes, taux d’implantation, perte post-implantation et postnatale et taille des portées) et aucun résultat lié aux substances testées n’a été observé chez les descendants, ni pendant les 4 premiers jours après la naissance, et ni à l’autopsie (REACH 2018c). Les détails complets de cette étude n’étaient pas disponibles dans le dossier REACH. Une DSENO de 1076 mg/kg p.c./j est établie pour les effets sur la reproduction.
Dans une étude sur le développement et la reproduction pubertaire chez les mâles et les femelles, des rats Crl:CD juvéniles (25/sexe/dose) ont été traités par gavage à raison de 0, 10, 100 ou 1000 mg/kg p.c./j de propylparabène entre les JPN 4 à 90. Environ au JPN 100, les mâles et femelles traités ont été accouplés avec des femelles/mâles non traités. La génération F1 a été sacrifiée au JPN 91 (fin de l’administration de la dose) ou après une période sans traitement et avec rétablissement au JPN 132 (25 à 27 jours après la cohabitation des mâles et au jour de lactation 5 à 7 pour les femelles). La survie, le sexe, la dysmorphologie externe macroscopique et le poids corporel des petits de la génération F2 ont été évalués, et les animaux ont été euthanasiés par la suite aux JPN 4 à 6. Chez la génération F1, aucun effet nocif n’a été observé concernant le poids corporels, la prise de poids corporel, la consommation alimentaire, les paramètres pathologiques cliniques, le poids des organes ou les résultats de l’examen macroscopique ou histopathologique des tissus reproducteurs (ovaires, utérus, testicules, épididymes, prostate et vésicules séminales) à aucune dose. Aucun effet n’a été noté sur l’âge du développement sexuel, le cycle œstral, les indices d’accouplement et de fertilité, le nombre moyen de jours avant l’accouplement, le taux de conception, l’indice de gestation ou la durée de la gestation. Au JPN 24, le poids de l’utérus a été examiné chez 6 animaux par dose. On n’a observé aucun résultat macroscopique utérin lié au traitement ni aucun changement du poids absolu ou relatif de l’utérus à quelque dose que ce soit. En comparaison, tous les rats traités avec E2 (1 µg/kg p.c./j) présentaient un utérus rempli de liquide à l’autopsie et une augmentation statistiquement significative du poids absolu et relatif de l’utérus, par rapport au groupe témoin (4,3 et 4,2 fois, respectivement). À la fin de l’administration de la dose (JPN 91), on a observé une augmentation significative du poids relatif de l’utérus dans le groupe ayant reçu 1000 mg/kg p.c./j. Ce groupe présentait également un nombre accru d’animaux aux stades prœstrus et œstrus (4/10 et 2/10, respectivement) comparativement aux témoins (3/10 et 1/10), ce qui avait augmenté le liquide endométrial et luminal (une caractéristique naturelle de ces stades de l’œstrus) et ainsi contribué à l’augmentation du poids. Les données sur le cycle œstral indiquent que ces animaux avaient des cycles normaux au JPN 89 et aucune différence n’a été constatée dans la durée des cycles œstraux, la durée du prœstrus et de l’œstrus ou le nombre moyen de cycles par rapport à ceux des femelles du groupe témoin. Une ouverture vaginale précoce a été observée chez le groupe ayant reçu la dose élevée (jour 31,2), par rapport aux témoins (jour 33,9), mais elle se situait dans la plage des données historiques se rapportant aux témoins pour l’installation d’essai (29 à 33,9 jours). Dans le groupe témoin, 7/25 femelles présentaient un développement tardif (35 à 43 jours) qui se situait à l’extérieur de l’intervalle des données historiques se rapportant aux témoins, d’où une valeur moyenne élevée chez les témoins. On a observé de petits testicules mous chez 3/75 animaux (1/25 à 10, 2/25 at 100 et 0/25 à 1000 mg/kg p.c./j), mais on a considéré que cela n’était pas lié au traitement, car on sait qu’elles apparaissent spontanément chez cette souche d’animaux. Un seul cas d’adénocarcinome mammaire chez 1 femelle à la dose de 1000 mg/kg p.c./j lors de l’examen macroscopique à l’autopsie à la fin de l’administration des doses a été jugé accidentel, en raison de l’absence d’observation de lésions précurseurs dans le groupe à la fin de la période de rétablissement, ce qui est à l’intérieur de la plage historique pour l’installation d’essai, lésions dont la présence spontanée chez des rats juvéniles et adultes est connue. Chez les femelles traitées et accouplées à des mâles naïfs, aucun effet n’a été observé sur le rapport mâles/femelles chez les descendants, le nombre de petits vivants et morts à la naissance, le nombre d’implantations et de naissances vivantes. Chez les femelles naïves accouplées à des mâles traités, le nombre de corps jaunes, de sites d’implantation, d’embryons vivants, d’embryons morts, de résorptions précoces, de pertes avant et après implantation n’était pas différent dans les groupes traités par rapport aux témoins. Aucun signe clinique, aucune malformation ni aucun effet sur la viabilité ou le poids corporel n’ont été observés chez les petits des groupes traités ou naïfs (Sivaraman et coll. 2018; Pouliot 2013). La DSENO déterminée pour cette étude est de 1000 mg/kg p.c./j.
Dans une étude sur le développement pubertaire mâle, des rats Wistar (20 par groupe) ont reçu 0, 3, 10, 100 ou 1000 mg/kg p.c./j de propylparabène par gavage pendant 8 semaines à partir du JPN 21. Dix animaux par groupe ont été sacrifiés à la fin du traitement, et les 10 autres ont été sacrifiés après une période d’élimination de 26 semaines. On a observé une hypersalivation chez les animaux ayant reçu la dose élevée jusqu’à la fin de la période de traitement. Aucun autre signe clinique lié au traitement et aucun effet sur le poids corporel moyen n’ont été observés. Aucun effet n’a été observé à la date du début de la puberté (mesurée par la séparation balanopréputiale) sur le poids des organes reproducteurs mâles (épididyme, prostate, vésicules séminales et testicules), les paramètres du sperme dans l’épididyme, les taux d’hormones (LH, FHS et testostérone), l’histopathologie à la fin du traitement ou de la période de rétablissement. Le propylparabène n’a pas eu d’effet sur le nombre moyen de spermatozoïdes dans les testicules ni sur le nombre moyen de spermatozoïdes dans l’épididyme ou les paramètres moyens de motilité dans tout groupe à la fin du traitement ou du rétablissement. On a noté une réduction du nombre de spermatozoïdes entre la fin du traitement (77 jours) et la fin du rétablissement (258) chez 1/10 animaux ayant reçu 10 mg/kg p.c./j et 1/10 animaux ayant reçu 1000 mg/kg p.c./j. Les mêmes animaux présentaient une atrophie/hypoplasie testiculaire sévère ou une hypospermatogenèse. Ces effets ont été jugés sporadiques et, à la fin de la période de rétablissement, le nombre moyen de spermatozoïdes testiculaires n’était pas significativement différent du nombre constaté chez les témoins (Gazin et coll. 2013). Une DSENO de 1000 mg/kg p.c./j, soit la dose maximale d’essai, a été établie pour cette étude.
Des rats Crj:Wistar mâles immatures (8 animaux par groupe) ont reçu 0 %, 0,01 %, 0,1 % et 1,0 % de propylparabène dans leur alimentation (équivalant à 12,4 ± 3,04, 125 ± 30,0 et 1290 ± 283 mg/kg p.c./j) pendant 4 semaines à partir des JPN 19 à 21. Une réduction significative du poids corporel a été observée à la dose maximale. On n’a observé aucun effet lié au traitement sur les testicules, l’épididyme, la prostate ventrale, les vésicules séminales et la glande préputiale (poids corporel absolu ou relatif). Les réserves de spermatozoïdes dans la queue de l’épididyme (nombre de spermatozoïdes/queue de l’épididyme) et les concentrations de spermatozoïdes (nombre de spermatozoïdes/g dans la queue de l’épididyme) ont diminué en fonction de la dose, de façon significative à 0,1 % et plus. La production quotidienne de spermatozoïdes et son efficacité dans les testicules ont également diminué en fonction de la dose et la diminution était significative chez tous les groupes traités. La concentration sérique de testostérone a diminué en fonction de la dose. La diminution était significative à une dose de 1,00 % et la concentration de testostérone à cette dose était de 64,6 % de la valeur constatée chez le groupe témoin (Oishi 2004). Le CSSC (2008, 2011) a exprimé des doutes quant à la capacité du laboratoire d’Oishi d’évaluer les paramètres mesurés et a conclu que la qualité des études d’Oishi ne pouvait être adéquatement évaluée, car la description complète des essais et les données brutes complètes n’étaient pas disponibles. Plus précisément, dans cette étude et dans d’autres, le laboratoire d’Oishi a rapporté i) des valeurs moyennes pour certains paramètres qui se situaient bien au‑delà des intervalles des données historiques se rapportant aux témoins et ii) des écarts-types pour des paramètres comme les concentrations de sperme dans l’épididyme et les taux de testostérone nettement inférieurs à la variabilité biologique normale qui a été observée par d’autres groupes. De plus, les effets décrits par Oishi (2004) n’ont pas été observés dans Sivaraman et coll. (2018) ou Gazin et coll. (2013) qui ont chacun étudié un groupe plus nombreux pour une période plus longue d’administration de la dose. De plus, les paramètres liés au sperme observés étaient moins précis que ceux rapportés dans Gazin et coll. (2013) et les données historiques se rapportant aux témoins n’ont pas été indiquées. Le succès de la reproduction rapporté dans Sivaraman et coll. (2018) indique également que les effets rapportés ici n’étaient pas biologiquement significatifs.
Dans une étude sur le développement pubertaire des femelles, des rats Sprague‑Dawley prépubertaires (10 animaux par groupe) ont reçu par voie orale 0, 62,5, 250, 1000 mg/kg p.c./j de propylparabène dans de l’huile de maïs aux JPN 21 à 40. De l’éthynylestradiol (1 mg/kg p.c./j) a été administré comme contrôle positif. Aucun effet lié au traitement n’a été observé en ce qui concerne le poids corporel, le poids des organes (à l’exception des surrénales), le jour de l’ouverture vaginale, ni le cycle œstral. Une augmentation significative du poids des surrénales a été observée à la dose maximale. Les concentrations sériques de T4 ont été significativement réduites dans le groupe ayant reçu la dose moyenne, mais non dans le groupe ayant reçu la dose élevée ou la dose faible. Une hypertrophie du myomètre et une augmentation significative de l’épaisseur de la paroi utérine ont été observées dans le groupe ayant reçu la dose élevée, bien qu’il n’y ait pas eu d’augmentation correspondante du poids de l’utérus (Vo et coll. 2010). On n’a pas indiqué le jour œstral des animaux sacrifiés ni aucun effet sur le poids relatif de l’utérus. Comme le soulignent Stump et coll. (2014) et Sivaraman et coll. (2018), la fin de l’œstrus est en corrélation avec les effets histologiques utérins, et la variabilité naturelle du stade œstral terminal entraîne une variabilité du poids de l’utérus. Il n’est donc pas manifeste que la variation de l’épaisseur de la paroi utérine soit liée à la substance d’essai.
Épidémiologie
Une recherche a été réalisée dans la littérature pour trouver des données épidémiologiques concernant le propylparabène, l’accent ayant été mis sur les effets sur la reproduction et le système endocrinien. Les études ont été évaluées et leur qualité a été cotée selon l’échelle NOS (échelle d’évaluation de la qualité de Newcastle-Ottawa) et l’outil d’évaluation de la qualité pour les études d’observation transversales et par cohorte, du National Heart, Lung and Blood Institute des National Institutes of Health (RSI 2018). On a trouvé des études épidémiologiques portant sur l’exposition au propylparabène avec un lien concernant la fertilité, la santé de la reproduction, les taux sériques d’hormones, la croissance et le développement chez les enfants, la sensibilisation allergique et la santé respiratoire. La majorité des études ne faisaient pas état d’une association entre le propylparabène et le paramètre d’intérêt. Des associations positives ont été signalées entre les concentrations de propylparabène et la diminution des chances de naissance vivante lors de l’insémination intra-utérine, le poids à la naissance chez les mâles et la sensibilisation allergique (Dodge et coll. 2015; Philippat et coll. 2014; Savage et coll. 2012; Spanier et coll. 2014). Une association inverse a été établie entre les concentrations de propylparabène et les taux sériques d’hormones thyroïdiennes chez les femmes adultes (femmes enceintes et population générale), l’IMC dans la population générale et les femmes enceintes (Kœppe et coll. 2013; Kang et coll. 2016; Aker et coll. 2018; Smith et coll. 2012; Polinski et coll. 2018), et entre les concentrations de propylparabène dans le sang du cordon ombilical et les taux de testostérone chez les fœtus (Kolatorova et coll. 2018). Pour tous les autres paramètres ayant une association déterminée, autres que le taux de testostérone chez les fœtus, différentes études de qualité similaire ont donné des résultats contradictoires pour ces paramètres ou des paramètres similaires. On trouvera plus de renseignements à ce sujet dans Santé Canada (2018a).
7.3.3 Caractérisation des risques pour la santé humaine
Le propylparabène s’est révélé faiblement toxique lors d’études à des doses répétées de 900 à 1200 mg/kg p.c./j par le régime alimentaire qui n’ont pas entraîné d’effets indésirables (REACH 2018c; Matthews et coll. 1956). Le poids de la preuve indique que le propylparabène n’est pas génotoxique ou cancérogène.
Dans une étude sur le développement pubertaire et la reproduction des mâles et des femelles, des doses orales (par gavage) de propylparabène atteignant 1000 mg/kg p.c./j n’ont pas induit d’effets sur un large éventail de paramètres de la fertilité et du développement du système reproducteur chez les rats mâles et femelles (Sivaraman et coll. 2018; Pouliot 2013). Une étude menée selon la Ligne directrice 422 de l’OCDE, mentionnée dans le dossier REACH, confirme ces résultats (REACH 2018c). Aucun effet n’a été observé sur le développement pubertaire des mâles ni sur les paramètres du sperme dans une autre étude, à des doses atteignant 1000 mg/kg p.c./j (Gazin et coll. 2013). Deux études (Oishi 2004 et Vo et coll. 2010) ont rapporté des effets sur le développement pubertaire des mâles et des femelles. Cependant, les rapports de Sivaraman et coll. et Pouliot réfutent efficacement ces résultats et, comme nous l’avons mentionné ailleurs, le CSSC fait état de plusieurs réserves concernant les articles d’Oishi. Compte tenu de l’ensemble des données probantes, une DSENO de 1000 mg/kg p.c./j, soit la dose maximale d’essai dans Sivaraman et coll. (2008), a été choisie comme point de départ pour le propylparabène.
La population canadienne est exposée au propylparabène par les aliments, les produits de consommation, les cosmétiques, les médicaments sur ordonnance et en vente libre et les PSN. Les données de surveillance disponibles de certaines sources pour les milieux naturels et les données obtenues ailleurs dans le monde semblent indiquer que les Canadiens sont également exposés au propylparabène par l’intermédiaire de ces sources.
L’évaluation de l’exposition de la population générale au propylparabène est fondée sur les données de biosurveillance de l’ECMS, de l’étude Plastics and Personal-Care Product Use in Pregnancy Study (ou P4) et une étude des nouveau-nés coréens dans les 48 heures suivant leur naissance (Santé Canada 2017a; Fisher et coll. 2017; Kang et coll. 2013). Ces données englobent les expositions au propylparabène par diverses sources et voies potentielles multiples, et sont considérées comme des estimations fiables de l’exposition de la population générale canadienne au propylparabène. Les données de biosurveillance fournissent une mesure interne de l’exposition, parce qu’elles comprennent des mesures spécifiques du propylparabène dans l’urine et parce qu’elles reflètent l’exposition intégrée au propylparabène par diverses sources multiples, y compris les produits de consommation contenant du propylparabène. L’urine est la principale voie d’élimination du propylparabène et le biomarqueur (propylparabène libre et conjugué) est spécifique au composé d’origine. Toutefois, le propylparabène a un faible taux d’élimination urinaire fractionnée et une courte demi‑vie. Pour tenir compte de l’incertitude associée à la robustesse de l’utilisation du propylparabène comme biomarqueur, les estimations de la dose journalière ont été basées sur la valeur d’exposition à la limite supérieure au 95e centile (ou la valeur la plus élevée disponible) pour chaque groupe d’âge et cette approche est donc considérée comme un scénario prudent. Les marges d’exposition résultant des doses journalières estimées sont présentées dans le tableau 7‑14.
| Source, pays | Groupe d’âge (années) | Limite supérieure de la dose journalière estimée à P95 (mg/kg p.c./j) | Niveau d’effet critiquea (mg/kg p.c./j) |
ME |
|---|---|---|---|---|
| ECMS (cycle 4, 2014-2015), Canada | 3 à 5 | 0,010 | DSENO 1000 (DME) | 96 476 |
| ECMS (cycle 4, 2014-2015), Canada | 6 à 11 | 0,039 | DSENO 1000 (DME) | 25 725 |
| ECMS (cycle 4, 2014-2015), Canada | 12 à 19 | 0,027 | DSENO 1000 (DME) | 37 493 |
| ECMS (cycle 4, 2014-2015), Canada | 20 à 59 | 0,029 | DSENO 1000 (DME) | 34 436 |
| ECMS (cycle 4, 2014-2015), Canada | 60 à 79 | 0,0541 | DSENO 1000 (DME) | 24 530 |
| Fisher et coll. 2017, Canada | Femmes enceintes | 0,023 | DSENO 1000 (DME) | 43 668 |
| Kang et coll. 2013, Corée | Nouveau-nés | 0,0011 | DSENO 1000 (DME) | 895 645 |
Abréviations : DME = dose maximale d’essai; DSENO = dose sans effet nocif observé.
a Effets critiques : aucun effet sur la reproduction, le développement du système reproducteur ou le développement prénatal.
Sur la base des paramètres prudents utilisés pour modéliser la dose journalière estimée, les marges d’exposition sont jugées adéquates pour tenir compte du risque pour les populations de 3 à 79 ans, les femmes enceintes et les nouveau-nés. On ne disposait pas de données de biosurveillance pour les enfants de moins de 3 ans (autres que les nouveau-nés). À l’exception de la consommation de lait maternel, on ne s’attend pas à ce que l’exposition de ce groupe diffère significativement de celle du groupe d’âge le plus jeune étudié par l’ECMS ou du groupe néonatal présenté ici. La consommation de lait maternel a été modélisée à partir de données canadiennes et ne devrait pas poser de risque. Par conséquent, les concentrations urinaires déclarées et les doses journalières estimées pour tous les groupes d’âge indiquent que l’exposition chez les enfants de moins de 3 ans ne devrait pas présenter un risque.
En raison de la courte demi‑vie du propylparabène administré par voie orale et de la méthode d’échantillonnage ponctuel utilisée dans les études de biosurveillance, on ne sait pas vraiment si les données de biosurveillance tiennent compte adéquatement de l’exposition élevée aux cosmétiques, aux médicaments sur ordonnance et en vente libre et aux PSN à usage intermittent. Les scénarios d’exposition sentinelle sont présentés dans le tableau 7‑15.
| Scénario d’exposition | Groupe d’âge (années) |
Exposition systémique (mg/kg p.c./j) | Niveau d’effet critiquea (mg/kg p.c./j) |
ME |
|---|---|---|---|---|
| Maquillage d’enfantb (application cutanée, par événement) |
Tout-petits (0,5 à 4) |
0,031 à 0,93 | DSENO 1000 (DME) | 1075 à 32 258 |
| Médicament contre les brûlures d’estomacc (prise orale, par jour) |
Adultes (> 20) |
29,33 | DSENO 1000 (DME) | 34 |
| Traitement au fluorurec (prise orale, par événement) | Enfants (5 à 11) |
0,52 | DSENO 1000 (DME) | 1923 |
| Traitement au fluorurec (prise orale, par événement) | Adultes (> 20) |
0,23 | DSENO 1000 (DME) | 4348 |
| Crème solaired (application cutanée, par jour) |
Nourrisson (0 à 0,5) |
1,84 | DSENO 1000 (DME) | 544 |
| Crème solairec (application cutanée, par jour) |
Tout-petits (0,5 à 4) |
0,78 | DSENO 1000 (DME) | 1282 |
| Crème solairec (application cutanée, par jour) |
Adultes (> 20) |
0,58 | DSENO 1000 (DME) | 1724 |
Abréviations : DME = dose maximale d’essai; DSENO = dose sans effet nocif observé.
a L’effet critique était l’absence d’effet sur la reproduction, le développement du système reproducteur ou le développement prénatal.
b Cosmétiques.
c Produits de santé naturels.
d Médicaments en vente libre.
Les marges d’exposition par voie orale aux médicaments contre les brûlures d’estomac sont jugées potentiellement inadéquates pour compenser les incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
Les données dans une étude in vitro du métabolisme cutané du propylparabène laissaient entendre que le propylparabène peut être hydrolysé en éthylparabène et en méthylparabène dans la peau (Santé Canada 2018b). L’exposition potentielle est incorporée dans les données de biosurveillance pour le méthylparabène et l’éthylparabène. Les risques potentiels associés à cette voie d’exposition présumée sont décrits aux sections 7.1.3 et 7.2.3.
7.4 Butylparabène
7.4.1 Évaluation de l’exposition
Le butylparabène est présent naturellement dans certains aliments et a été trouvé dans les milieux naturels. Il est également présent dans un certain nombre de produits, y compris les médicaments en vente libre, les PSN, les cosmétiques et les produits antiparasitaires. Toutes ces sources peuvent contribuer à l’exposition quotidienne totale au butylparabène. Les concentrations urinaires et l’exposition estimée des Canadiens au butylparabène sont présentées dans la section suivante.
Biosurveillance
Selon les données de biosurveillance recueillies lors du cycle 4 de l’ECMS, plus de 83 % des Canadiens testés présentaient une concentration urinaire de butylparabène inférieure au seuil de détection (0,30 ng/mL). La concentration urinaire au 95e centile chez les Canadiens de 3 à 79 ans était de 4,3 µg/LNote de bas de page 11 (intervalle de confiance à 95 % de 2,0 à 6,6 µg/L, n = 2564) de butylparabène. Le butylparabène a été détecté plus fréquemment chez les femmes que chez les hommes, 76,26 % des échantillons étant inférieurs au seuil de détection comparativement à 90,12 %. Parmi les différents groupes d’âge, le groupe présentant la fréquence de détection la plus élevée était celui des adultes de 60 à 79 ans, car 80,0 % des échantillons présentaient des concentrations de butylparabène inférieures au seuil de détection, et le 95e centile était de 6,8 µg/L (intervalle de confiance à 95 % de 4,4 à 9,1 µg/L). Le groupe d’âge présentant la fréquence de détection la plus faible était celui des enfants de 6 à 11 ans, chez lesquels 90,08 % présentaient des concentrations urinaires inférieures au seuil de détection, et le 95e centile était de 1,1 µg/L9 (intervalle de confiance à 95 % de 0,3 à 1,8 µg/L) (Santé Canada 2017a). Dans des études régionales réalisées au Canada, la concentration urinaire moyenne de butylparabène chez les femmes était de 2,08 µg/L (n = 28, y compris 9 patientes enceintes, médiane = 0,3 µg/L) et la moyenne géométrique chez les femmes enceintes (n = 31) était de 3,28 µg/L. La concentration urinaire moyenne chez les hommes (n = 11) était de 0,36 µg/L (médiane = 0,35 µg/L; Genuis et coll. 2013).
Le butylparabène a été détecté à une concentration maximale de 1,4 µg/L (forme libre plus parabène conjugué, la médiane était « non détectable ») dans l’urine prélevée chez des nourrissons coréens dans les 48 heures suivant la naissance (Kang et coll. 2013). Le butylparabène n’a pas été détecté dans le lait maternel chez 56 Canadiennes (LD = 0,1 µg/L), 3 mois après la naissance (Fisher et coll. 2017). Le butylparabène a été détecté dans le placenta dans un échantillon de 12 femmes (Barcelone, maximum = 0,90 ng/g poids frais) et dans le liquide amniotique chez 40 femmes enceintes (Inde, moyenne géométrique = 1,79 µg/L) (Valle-Sistac et coll. 2016; Shekhar et coll. 2017). Le butylparabène a été détecté dans le sang du cordon ombilical à une moyenne de 0,033 µg/L chez 50 couples mère-enfant et à une moyenne de 0,07 µg/L dans 34 échantillons dans deux études réalisées aux États‑Unis (Towers et coll. 2015; Geer et coll. 2017).
En utilisant la méthode décrite pour le méthylparabène (section 7.1.1), les doses journalières estimées ont été calculées pour la population générale, les femmes enceintes et les nouveau-nés, d’après les données de biosurveillance (ECMS, Santé Canada 2017a; Fisher et coll. 2017; Kang et coll. 2013). Dans chacune des trois études de biosurveillance, le butylparabène total (c.‑à‑d. les espèces libres et conjuguées) a été mesuré dans l’urine par CPLHP, après traitement avec la β-glucuronidase et la sulfatase. Les nouveau-nés ont été inclus parce que la détection du butylparabène dans le sang du cordon ombilical, le placenta et le liquide amniotique indique que le butylparabène traverse le placenta et qu’il peut y avoir une exposition in utero (Shekhar et coll. 2017; Valle-Sistac et coll. 2016; Towers et coll. 2015; Geer et coll. 2017). Les concentrations urinaires chez les nouveau-nés coréens ont été utilisées en l’absence de données provenant d’une population canadienne. Cette approche est jugée prudente, car les concentrations urinaires de butylparabène au 95e centile chez la population générale de la Corée dépassent celles de la population canadienne générale (Honda et coll. 2018).
Dans une étude de pharmacocinétique réalisée afin d’étudier l’exposition orale au méthylparabène, au butylparabène et à l’iso-butylparabène chez les humains, trois adultes (deux hommes et une femme) ont ingéré 10 mg chacun de parabène radiomarqué (Moos et coll. 2016). La demi‑vie d’élimination du butylparabène était de 3,7 heures et 80,8 % de la dose appliquée a été éliminé dans l’urine dans les 24 heures sous forme de butylparabène, avec hydroxylation du cycle butylparabène, de PHBA et de PHHA. Après 48 heures, 5,6 % de la dose administrée a été récupéré sous forme de butylparabène total (libre, plus espèces conjuguées; Moos et coll. 2016). Le taux élevé de récupération de la dose administrée dans l’urine indique qu’il s’agit du principal mode d’élimination du butylparabène. Toutefois, le butylparabène a une courte demi‑vie et n’est pas le principal métabolite récupéré. Néanmoins, le butylparabène est un biomarqueur spécifique de l’exposition et les valeurs d’élimination urinaire fractionnée rapportées chez les participants à l’étude ont montré peu de variation (de 0,052 à 0,064). La valeur de 5,6 % a été utilisée comme valeur d’élimination urinaire fractionnée dans le calcul des équivalents de biosurveillance et de la dose journalière estimée de butylparabène, d’après les résultats de Moos et coll. (2016). L’utilisation d’une valeur EUF par voie orale peut sous-estimer ou surestimer l’exposition par voie cutanée et l’utilisation du parabène d’origine comme biomarqueur fournit une mesure moins robuste de l’exposition, car ce n’est pas le principal métabolite. Comme pour les autres parabènes d’utilisation courante, l’utilisation du composé d’origine comme biomarqueur peut donner lieu à une contamination durant la collecte et l’analyse, ce qui pourrait gonfler davantage l’estimation (Aylward et coll. 2017a).
Les doses journalières estimées ont été calculées, avec un intervalle de confiance à 95 % au 95e centile (ou les valeurs les plus élevées disponibles), à l’aide des concentrations urinaires ajustées en fonction de la créatinine (µg/g Cr) pour chaque groupe d’âge, comme il est décrit pour le méthylparabène (section 7.1.1). Un niveau élevé de variabilité a été associé aux données de biosurveillance de l’ECMS pour le butylparabène dans les groupes d’âge au 95e centile et la moyenne géométrique n’a pas été calculée pour l’ensemble de la population, ou pour les groupes d’âge, car plus de 83 % des échantillons étaient sous la limite de détectionNote de bas de page 12 (Santé Canada 2017a). Étant donné la courte demi‑vie du butylparabène (Moos et coll. 2016), la prépondérance des échantillons sous la limite de détection peut être attribuable au métabolisme rapide ou à une faible exposition. Selon les données soumises par Santé Canada, le butylparabène est utilisé dans environ 85 % moins de produits (c.‑à‑d. cosmétiques, PSN et médicaments en vente libre) que le méthylparabène et n’est pas autorisé comme additif alimentaire, ce qui indique qu’on peut s’attendre à une faible exposition pour une partie des plus faibles concentrations détectées de butylparabène. On a tenu compte de l’incertitude due à la variabilité et au métabolisme rapide potentiel en sélectionnant les limites inférieure et supérieure de l’intervalle de confiance à 95 % au 95e centile, comme valeurs limites inférieure et supérieure prudentes pour le calcul de la dose journalière estimée, une approche prudente qui tient compte de la variation inhérente d’un échantillonnage ponctuel. La valeur d’élimination urinaire fractionnée de 0,056 ou 5,6 % pour le butylparabène a été rapportée par Moos et coll. (2016) et les valeurs spécifiques des groupes d’âge pour des volumes urinaires sur 24 heures ont été estimées par Aylward et coll. (2015).
Les doses journalières estimées et les principaux paramètres sont présentés dans le tableau 7‑16. Les valeurs calculées ici pour la population canadienne sont similaires aux doses journalières de butylparabène calculées au 95e centile pour une population allemande adulte (variant de 2,2 à 7,6 µg/kg p.c./j), comme rapporté dans Moos et coll.
| Source, pays | Âge (années)a |
TEC (mg/j)b | CUCr, P95 (IC) (µg/g Cr)c | EUFd | DJE, P95 (IC) (µg/kg p.c./j) |
|---|---|---|---|---|---|
| ECMS (cycle 4, 2014-2015)c, Canada | 3 à 5 | 130 | 3,1 (< LD à 5,1)e | 0,056 | 0,46 (NC à 0,8) |
| ECMS (cycle 4, 2014-2015)c, Canada | 6 à 11 | 418 | 0,8 (0,3 à 1,3)e | 0,056 | 0,19 (0,07 à 0,31) |
| ECMS (cycle 4, 2014-2015)c, Canada | 12 à 19 | 1182 | 9,2 (< LD à 15)f | 0,056 | 3,3 (NC à 5,3) |
| ECMS (cycle 4, 2014-2015)c, Canada | 20 à 59g | 1248 | 9,2 (< LD à 15)f | 0,056 | 2,9 (NC à 4,72) |
| ECMS (cycle 4, 2014-2015)c, Canada | 60 à 79 | 1017 | 6,7 (2,1 à 11)e | 0,056 | 1,7 (0,53 à 2,8) |
| Fisher et coll. 2017, Canada | Femmes enceintes | - | 12,20h | 0,056 | 4,4 |
| Kang et coll. 2013, Corée | Nouveau-nés | 9,6 | 3,4i | 0,056 | 0,18 |
Abréviations : TEC = taux d’élimination de la créatinine; CUCr = concentration urinaire ajustée pour la créatinine; P95 = 95e centile; IC = intervalle de confiance; EUF = élimination urinaire fractionnée; DJE = dose journalière estimée; NC = valeur non calculée.
a Les groupes d’âge sont définis d’après les groupes d’âge déclarés dans l’ECMS (Santé Canada 2017a).
b Le taux d’élimination de la créatinine a été calculé en utilisant l’équation de Mage [0,993*1,64 [140 – Âge] (Poids1,5 Taille0,5)/1000]. Voir l’annexe A pour les valeurs utilisées pour le poids et la taille selon l’âge.
c Santé Canada 2017a.
d Moos et coll. 2016.
e Ces valeurs étaient associées à une variabilité d’échantillonnage élevée (c.‑à‑d. un coefficient de variation entre 16,6 % et 33,3 %). Santé Canada recommande d’utiliser ces données avec prudence (Santé Canada 2017a).
f Les données de l’ECMS pour le 95e centile dans cette strate d’âge ont été supprimées en raison d’une grande variabilité et on a utilisé les données pour les « femmes de 3 à 79 ans » comme données de substitution. Bien que la valeur au 95e centile pour ce groupe n’est pas connue, cette approche est jugée prudente, car la valeur utilisée pour estimer la dose journalière est la valeur au 95e centile la plus élevée déclarée pour l’éthylparabène.
g Les groupes d’âge « 20-39 » et « 40-59 » sont présentés ensemble. Lorsque les valeurs au 95e centile étaient indiquées pour les deux groupes d’âge, la valeur la plus élevée est présentée ici. Lorsqu’une valeur était supprimée, la valeur de l’autre groupe est présentée ici.
h Cette valeur est la concentration de parabène dans l’urine (µg/L), ajustée en fonction de la densité, au 95e centile. Aucune valeur ajustée en fonction de la créatinine n’a été rapportée dans Fisher et coll. 2017. Les intervalles de confiance n’ont pas été indiqués. La DJE a été calculée à l’aide de l’équation suivante : DJE = (CU*TDU)/EUF (Saravanabhavan et coll. 2014), où CU est la concentration urinaire, TDU est le taux de débit urinaire (0,20 L/kg p.c./j, Aylward et coll. 2015) et EUF est le taux d’élimination urinaire fractionnée.
i Cette valeur est la concentration de parabène dans l’urine ajustée en fonction de la créatinine au 75e centile; le 95e centile n’a pas été indiqué (Kang et coll. 2013). Les intervalles de confiance n’ont pas été indiqués.
Milieux naturels
Le butylparabène a été trouvé dans les sols agricoles et la poussière domestique au Canada (Viglino et coll. 2011; Fan et coll. 2010). Dans des études réalisées dans d’autres pays, cette substance a été trouvée dans l’eau potable (Carmona et coll. 2014), les sols agricoles, industriels et forestiers (Perez et coll. 2011; Nunez et coll. 2008), l’air extérieur (Moreau-Guigon et coll. 2016), l’air à l’intérieur des résidences (Laborie et coll. 2016; Moreau-Guigon et coll. 2016) et la poussière domestique (Wang et coll. 2012; Ramirez et coll. 2011; Tran et coll. 2016; Canosa et coll. 2007). La dose journalière moyenne estimée de butylparabène pour la population générale du Canada d’après ces études va de < 0,001 à 0,003 µg/kg p.c./j pour tous les groupes d’âge, des nourrissons aux adultes de 60 ans et plus.
En l’absence de données canadiennes de surveillance, le volume importé total et déclaré de butylparabène au Canada (jusqu’à 1000 kg) a été utilisé comme valeur prudente pour estimer les concentrations théoriques de butylparabène dans l’environnement, à l’aide du modèle de fugacité de niveau III ChemCAN, version 6.00 (ChemCAN 2003). Les concentrations théoriques dans l’environnement calculées selon cette approche ont été utilisées pour estimer l’exposition potentielle pour la population générale du Canada par les milieux naturels. Ce résultat consiste en une dose estimée de 0,342 ng/kg p.c./j par l’air, l’eau et le sol. Cette approche indique que l’exposition de la population générale par les milieux naturels au Canada est potentiellement négligeable.
Aliments
L’exposition au butylparabène par les aliments devrait être négligeable (communication personnelle, courriel de la Direction des aliments, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 18 avril 2018; sans référence). Selon les données de biosurveillance (Fisher et coll. 2017), le butylparabène n’a pas été détecté dans le lait maternel chez 56 Canadiennes (LD = 0,1 µg/L), 3 mois après la naissance; par conséquent, les nourrissons allaités au sein ne devraient pas être exposés au butylparabène via le lait maternel.
Cosmétiques
Le butylparabène a été trouvé dans une variété de cosmétiques, y compris les lotions, les produits de rasage, les produits de soins capillaires, les produits d’hygiène buccale et les nettoyants. On a estimé que l’exposition résultant de l’utilisation quotidienne de produits cosmétiques et de produits de consommation a été prise en compte dans les données de biosurveillance. En raison de l’utilisation d’un échantillonnage ponctuel et de la courte demi-vie métabolique du butylparabène, les données de biosurveillance ne tenaient pas compte adéquatement de l’exposition aux produits utilisés de façon intermittente. Les scénarios sentinelles utilisés pour les produits à usage intermittent sont présentés dans le tableau 7‑17.
Des coefficients d’absorption cutanée et de métabolisme déterminés expérimentalement dans une étude in vitro de l’absorption cutanée et du métabolisme dans la peau humaine ont été utilisés pour estimer une dose interne à la suite de l’exposition potentielle par voie cutanée, comme il est décrit à la section 7.1.1. De plus amples renseignements sont disponibles sur demande (Charles River Laboratories 2018; Santé Canada 2018b).
L’exposition potentielle a été estimée à l’aide d’hypothèses prudentes et des valeurs par défaut décrites à l’annexe B. L’estimation de l’exposition pour chaque scénario est exprimée par événement ou sur une base journalière, selon la fréquence d’exposition (voir la section 7.4.3, Caractérisation des risques pour la santé humaine).
| Scénario | Concentration dans le produit (%)a | Groupe d’âge (années) |
Charge cutanée (µg/cm2/24 h) | Exposition systémique (mg/kg p.c./j) |
|---|---|---|---|---|
| Colorant capillaire (permanente, par événement) | 1 à 3 | Adolescents (12 à 19) |
137,0 à 411,0 | 0,36 à 1,09b,c |
| Colorant capillaire (permanente, par événement) | 1 à 3 | Adultes (> 20) |
156,9 à 470,59 | 0,30 à 0,91b,c |
a Données internes, Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 18 août 2017, sans référence.
b Valeur calculée avec 54,71 % d’absorption cutanée.
c Valeur calculée avec un raffinement du métabolisme de 39,35 % de butylparabène.
Médicaments en vente libre et PSN
Le butylparabène est présent en tant qu’ingrédient non médicinal dans les médicaments en vente libre et les PSN administrés par de multiples voies. On estime que les données de biosurveillance englobent l’exposition résultant de l’utilisation quotidienne de médicaments en vente libre et de PSN. Les scénarios sentinelles utilisés pour les produits à usage intermittent sont présentés dans le tableau 7‑18. Les valeurs par défaut et les modèles utilisés dans les scénarios d’exposition sont présentés à l’annexe B.
| Scénario | Concentration dans le produit (%) | Groupe d’âge (années) |
Charge cutanée (µg/cm2/24 h) | Exposition systémique (mg/kg p.c./j) |
|---|---|---|---|---|
| Plante médicinale contre la touxa (prise orale, par jour) |
0,02c | Adolescents (12 à 19) |
N.D. | 0,14 |
| Plante médicinale contre la touxa (prise orale, par jour) |
0,02c | Adultes (> 20) |
N.D. | 0,12 |
| Analgésique pour enfants en suspensionb (prise orale, par jour) |
0,13d | Tout-petits (0,5 à 4) |
N.D. | 2,10 |
| Antiacideb (prise orale, par jour) |
0,033d | Adolescents (12 à 19) |
N.D. | 0,44 |
| Antiacideb (prise orale, par jour) |
0,033d | Adultes (> 20) |
N.D. | 0,37 |
| Crème analgésiquea (application cutanée, par jour) | 0,0088 à 0,044c | Enfants (5 à 11) |
0,16 à 0,78 | 0,012 à 0,060e,f |
| Crème analgésiquea (application cutanée, par jour) | 0,0088 à 0,044c | Adultes (> 20) |
0,16 à 0,78 | 0,011 à 0,053e,f |
| Crème médicamentée pour les mainsa (application cutanée, par jour) |
0,06c | Enfants (5 à 11) |
3,36 | 0,020e,f |
| Crème médicamentée pour les mainsa (application cutanée, par jour) |
0,06c | Adultes (> 20) |
3,36 | 0,017e,f |
| Crème solairea (application cutanée, par jour) | 0,4c | Tout-petits (0,5 à 4) |
15,6 | 0,44g,h |
| Crème solairea (application cutanée, par jour) | 0,4c | Adultes (> 20) |
15,6 | 0,33g,h |
a Produits de santé naturels.
b Médicament en vente libre.
c Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 20 février 2017, sans référence.
d Communication personnelle, courriel de la Direction des produits thérapeutiques, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 25 mai 2017, sans référence.
e Valeur calculée d’après la charge cutanée du produit exprimée en quantité maximale appliquée sur la peau.
f Valeur calculée avec un raffinement du métabolisme de 47,93 % d’éthylparabène.
g Valeur calculée avec une quantité cutanée maximale de 3,94 µg/cm2/24 h.
h Valeur calculée avec un raffinement du métabolisme de 35,33 % de butylparabène.
7.4.2 Évaluation des effets sur la santé
Le butylparabène a été étudié à fond. Des évaluations des principaux risques ont été réalisées par le CIR (Andersen 2008), le CSSC de l’Union européenne (CSPC 2005a, 2005b, 2006, 2008; CSSC 2010, 2011, 2013), EFSA (2004), NICNAS (2016) et des scientifiques indépendants (Soni et coll. 2005). Une recherche a été effectuée dans la littérature publiée en date de mars 2017 afin de trouver de l’information pertinente pour compléter les données utilisées dans les évaluations et les examens dans le monde.
Toxicocinétique
Le butylparabène est fortement métabolisé chez les animaux par voie orale, cutanée et sous‑cutanée (Jones et coll. 1956; Kiwada et coll. 1979, 1980; Tsukamoto et Terada 1964; Aubert et coll. 2012). Une dose unique de 100 mg/kg de butylparabène radiomarqué a été administrée à des rats par voie orale, cutanée et sous‑cutanée (Aubert et coll. 2012). Les concentrations plasmatiques maximales (Cmax) ont été atteintes en moins de 1 heure, en 8 heures et entre 2 à 4 heures, respectivement, par voie orale, cutanée et sous‑cutanée. Toutes les voies d’administration ont produit un seul pic dans le plasma, correspondant au PHBA, et aucun parabène d’origine n’a été détecté. Plus de 70 % de la dose orale a été éliminé dans l’urine en 24 heures, avec ≤ 3 % détectée dans les matières fécales et une quantité négligeable dans les tissus. Plus de 50 % de la dose cutanée appliquée n’a pas été absorbé après 24 heures, environ 25 % a été éliminée dans l’urine et < 2 % dans les matières fécales, le reste se trouvant principalement dans les tissus externes (p. ex., cheveux, ongles) (Aubert et coll. 2012). Lorsqu’une dose unique de butylparabène a été administrée par voie orale (1 g/kg) ou intraveineuse (50 mg/kg) à des chiens, le composé d’origine n’a pas été détecté dans le plasma pour les parabènes testés, et le PHBA a été détecté en deçà de 1 heure (Jones et coll. 1956). La majeure partie de la dose appliquée (40 % à 47 %) a été éliminée dans les 24 heures sous forme de PHBA, et moins de 1 % du composé appliqué a été éliminé sous forme de butylparabène. Au moment du sacrifice, de petites quantités de butylparabène ont été détectées dans le cerveau, le pancréas et la rate (Jones et coll. 1956). Chez les rats, < 1 % de la dose orale de butylparabène était demeuré dans les tissus 24 ou 72 heures après l’administration de la dose (Mathews 1956).
Moos et coll. (2016) ont fait état de l’ingestion de 10 mg de butylparabène par 3 volontaires adultes (équivalant à 0,12 à 0,19 mg/kg p.c.). La demi‑vie d’élimination était de 3 à 4 heures, 80 % de la dose administrée étant récupéré dans l’urine dans les 24 heures. Après 48 heures, 5,6 % du butylparabène libre et conjugué a été récupéré dans l’urine. Le PHHA, le principal métabolite, représentait 62 % de la dose appliquée récupéré dans l’urine. Sur 26 mâles en santé, on a appliqué sur tout le corps 2 mg/cm2 de crème standard contenant 2 % de butylparabène (équivalant environ à 11 mg/kg p.c./j), ainsi que 2 % de diéthylphtalate et de dibutylphtalate. La récupération moyenne de butylparabène dans l’urine était de 0,32 % de la dose appliquée, dont la majeure partie était conjuguée à du glucuronate et à du sulfate, et 2,1 % était sous forme de parabène libre. Le butylparabène a été détecté à de faibles concentrations dans le tissu mammaire tumoral et dans le tissu adipeux humain, bien que l’on n’ait pas indiqué si le parabène était libre ou conjugué (Barr et coll. 2012; Wang et coll. 2015).
Dans les fractions subcellulaires du foie et de la peau chez les humains, le butylparabène est hydrolysé 2 à 10 fois moins efficacement que les parabènes à chaîne plus courte (Jewell et coll. 2007a, 2007b; Harville et coll. 2007; Lobemeier et coll. 1996; Abbas et coll. 2010; Prusakiewicz et coll. 2006). Dans des expériences ex vivo sur du plasma humain, la demi‑vie du butylparabène était d’environ 1 heure. Dans les microsomes hépatiques, le butylparabène a une demi‑vie de 87 minutes (Abbas et coll. 2010). Les estérases identifiées dans les kératinocytes et la graisse sous-cutanée démontrent une préférence pour le butylparabène, ainsi qu’une affinité décroissante pour les parabènes lorsque la longueur de leur chaîne est plus courte (Lobemeier et coll. 1996).
Contrairement à la cinétique humaine, les fractions des cellules hépatiques et la peau chez le rat hydrolysent le butylparabène à peu près à la même vitesse que dans les études in vitro (Harville et coll. 2007). Toutefois, les cellules de peau de rat hydrolysent le butylparabène à un rythme d’environ 3 ordres de grandeur supérieur à celui des cellules de peau humaine (Harville et coll. 2007; Prusakiewicz et coll. 2006). L’hydrolyse dans les tissus du rat augmente également avec la longueur de la chaîne, contrairement à ce que l’on constate chez les humains. Les parabènes à chaîne plus courte (méthylparabène et éthylparabène) sont métabolisés dans les fractions de cellules hépatiques chez les humains à un taux comparable à celui du foie chez le rat. Toutefois, le butylparabène a été métabolisé dans le foie du rat à une vitesse 10 fois plus élevée que dans le foie humain (Harville et coll. 2007).
Études à doses répétées
Dans une étude de 6 semaines, des souris ICR/Jcl (10/sexe/groupe) ont été exposées à 0 %, 0,6 %, 1,25 %, 2,5 %, 5 % ou 10 % de butylparabène dans leur alimentation (correspondant à environ 900, 1875, 3750, 7500 ou 15 000 mg/kg p.c./j). Tous les rats dans les deux groupes ayant reçu la dose maximale étaient morts dans les 2 semaines et la prise de poids chez les rats ayant reçu les deux doses suivantes était inférieure à 10 % de celle du groupe témoin. Toutes les doses supérieures à 0,6 % ont entraîné une atrophie marquée du tissu lymphoïde dans les organes, y compris la rate, le thymus et les ganglions lymphatiques, ainsi qu’une dégénérescence multifocale et une nécrose du parenchyme hépatique. Aucun changement significatif dans les organes viscéraux n’a été observé dans le groupe ayant reçu la dose de 0,6 % ni chez les témoins (Inai et coll. 1985). Aucune analyse statistique n’a été rapportée. La DSENO déterminée dans cette étude était de 0,6 % (environ 900 mg/kg p.c./j).
Douze rats albinos sevrés par dose (6 mâles et 6 femelles) ont reçu 2 % ou 8 % de butylparabène (équivalant à 900 à 1200 et 5500 à 5900 mg/kg p.c./j) dans leur alimentation pendant 12 semaines. Les animaux ayant reçu 8 % de butylparabène ont présenté une prise de poids plus lente que les témoins négatifs aux premiers stades de l’expérience. Des signes de toxicité, dont la dépression et une diminution de l’activité motrice ainsi que la mortalité, ont également été observés dans ce groupe. Tous les mâles dans le groupe ayant reçu la dose de 8 % sont morts avant la fin des 12 semaines de traitement. De même, des effets similaires, mais moins prononcés ont été observés chez les femelles. À la dose de 2 %, aucun signe de toxicité n’a été observé chez les animaux traités, par rapport aux témoins. Aucune analyse statistique n’a été rapportée. La DSENO dans cette étude était de 2 % de butylparabène (900 à 1200 mg/kg p.c./j), d’après les effets observés à 8 % (Matthews et coll. 1956).
Génotoxicité
Le butylparabène s’est révélé négatif dans les tests d’Ames et dans les essais chromosomiques jusqu’à 0,06 mg/mL, mais a induit des réponses positives dans un test d’échange de chromatides sœurs, un test d’aberration chromosomique et un test des comètes entre 0,4 et 0,75 mM (Ishizaki 1978; Ishidate et coll. 1978, 1984; Tayama et coll. 2008; Morita et coll. 1981; Kawachi et Yahagi 1980). Le butylparabène n’était pas génotoxique dans les essais in vivo, y compris l’essai de mortalité dominante et les essais d’aberration chromosomique in vivo (EFSA 2004; Kawachi et Yahagi 1980). Dans l’ensemble, le poids de la preuve indique que le butylparabène n’est pas susceptible d’être génotoxique in vivo (EFSA 1996; Andersen 2008).
Cancérogénicité
Des rats Fischer 344 mâles (8/groupe) ont été exposés à du PHBA, du méthylparabène, de l’éthylparabène, du propylparabène et du butylparabène à 4 % dans leur alimentation (environ 4000 mg/kg p.c./j) pendant 9 jours. Le butylparabène a causé une augmentation de 11,3 fois du marquage au méthyl-3[H]thymidine dans l’épithélium du préestomac, ce qui indiquait une prolifération cellulaire. Le butylparabène a provoqué un épaississement de la muqueuse et le traitement avec tous les parabènes a entraîné des lésions visibles au microscope optique (épaississement des muqueuses, pédicelles d’insertion et papilles) dont la gravité augmentait avec la longueur de la chaîne (Rodrigues et coll. 1986).
Des souris ICL/Jcr (50/groupe) ont reçu 0 %, 0,15 %, 0,3 % ou 0,6 % de butylparabène dans leur alimentation pendant 102 semaines (équivalant à environ 235, 494 et 964 mg/kg p.c./j chez les mâles et 172, 373 et 772 mg/kg p.c./j chez les femelles). Un nombre élevé d’animaux est mort dans tous les groupes (groupe témoin et groupes d’essais) avant 78 semaines. La fréquence des tumeurs était semblable entre les groupes d’essais, par rapport au groupe témoin, et il n’y avait aucune différence significative entre les groupes ayant reçu une dose. En tout, 21 néoplasmes ont été observés dans le groupe témoin, et 21, 19 et 33 dans les groupes ayant reçu les doses faible, moyenne et élevée de butylparabène, respectivement. Les auteurs ont signalé qu’il n’y avait pas de différence apparente dans la fréquence des néoplasmes ou le délai avant la mort, entre le groupe d’essai et le groupe témoin (Inai et coll. 1985). Aucune analyse statistique n’a été rapportée. La DSENO établie pour cette étude est de 772 mg/kg p.c./j, soit la dose maximale d’essai.
Effets sur la reproduction et le développement
Les effets œstrogéniques potentiels des parabènes sont examinés à l’annexe C.
Dans une étude sur le développement précoce de l’appareil reproducteur des mâles et des femelles, des rates Wistar gravides (18 mères/groupe; 12 à 18 petits/groupe) ont reçu par voie orale 0, 10, 100 ou 500 mg/kg p.c./j de butylparabène du JG 7 au JPN 22. L’exposition au butylparabène n’a pas eu d’effet sur les paramètres de la reproduction maternelle, y compris la prise de poids des mères, la durée de la gestation, la taille des portées, la survie prénatale ou périnatale des descendants, ou le poids corporel des petits soit à la naissance ou pendant la période postnatale. On a observé une réduction de la distance anogénitale chez les nouveau‑nés des deux sexes, une diminution du poids des ovaires et une augmentation de la croissance des glandes mammaires chez les femelles des groupes exposés aux doses moyenne et élevée. Les effets ont démontré une dépendance à la dose. Le nombre de spermatozoïdes épididymaires a diminué de façon à la dose de 10 mg/kg p.c./j et plus. L’histologie de la prostate a été altérée avant la puberté et le poids de la prostate chez les adultes (au JPN 90) a diminué dans le groupe ayant reçu la dose élevée. L’expression testiculaire des marqueurs de la stéroïdogenèse CYP 19a1 (aromatase) et Nr5a1 a été réduite à toutes les doses chez les animaux prépubères et adultes, respectivement (Boberg et coll. 2016). La DSENO établie pour cette étude était de 100 mg/kg p.c./j, d’après la distance anogénitale réduite chez les deux sexes, le poids réduit des ovaires et la croissance des glandes mammaires. Le nombre de spermatozoïdes épididymaires a été modifié chez les descendants mâles du groupe ayant reçu 10 mg/kg p.c./j, mais aucun autre effet n’a été observé sur le sperme ou les tissus reproducteurs à cette dose.
Dans une étude sur le développement précoce de l’appareil reproducteur masculin, des rates Sprague‑Dawley gravides (6-8 mères/groupe) ont reçu par voie sous-cutanée 0, 100 ou 200 mg/kg p.c./j de butylparabène entre le JG 6 et le JPN 20. Dans le groupe ayant reçu la dose élevée, le nombre de petits nés vivants et la proportion de petits ayant survécu au sevrage ont considérablement diminué. Le poids des testicules, des vésicules séminales et de la prostate a diminué de façon significative chez les descendants mâles du groupe ayant reçu 100 mg/kg p.c./j au JPN 49. Le nombre et la motilité des spermatozoïdes dans l’épididyme, ainsi que le nombre de spermatides ronds et allongés dans le tubule séminifère au stade VII ont diminué de façon significative chez les descendants des deux groupes testés. Chez les descendants du groupe ayant reçu la dose élevée, l’expression testiculaire de ER-α et ER-β mRNA avait significativement augmenté au JPN 90 (Kang et coll. 2002). La DMENO établie dans cette étude était de 100 mg/kg p.c./j, d’après la réduction du poids des organes reproducteurs et la réduction également de la numération et de la motilité des spermatozoïdes.
Des rates Wistar gravides (7 à 8 mères par groupe) ont reçu par voie orale 0, 64, 160, 400 ou 1000 mg/kg p.c./j de butylparabène entre le JG 12 et le JPN 21. Les petits ont été observés jusqu’au jour 180 (n = 1 petit par portée, 7-8 portées). Aucun effet n’a été observé sur la toxicité maternelle, les paramètres de fertilité (nombre de petits, petits par portée, taux de naissances vivantes, proportion des sexes des petits). Les concentrations des hormones FSH et LH dans le sérum maternel étaient supérieures à celles des témoins, et les concentrations d’alanine aminotransférase et d’aspartate aminotransférase avaient augmenté de manière significative à 400 et 1000 mg/kg p.c./j. Chez les petits, on a observé une diminution significative du poids corporel dans le groupe ayant reçu 400 mg/kg p.c./j entre les JPN 0 et 49, et dans le groupe ayant reçu 1000 mg/kg p.c./j entre les JPN 0 et 77. On a observé la réduction de la distance anogénitale et une séparation préputiale retardée chez les mâles F1 à 400 et 1000 mg/kg p.c./j. Aux doses moyenne et élevée, on a observé une réduction du poids des testicules aux JPN 21 à 90, une réduction du poids de l’épididyme en tout temps sauf au JPN 35, ainsi qu’une réduction du poids des vésicules séminales au JPN 21. Une modification de l’histopathologie testiculaire a été observée dans les groupes ayant reçu 400 et 1000 mg/kg p.c./j, caractérisée par une réduction et une disposition lâche des cellules germinales et des couches réduites de tubules séminifères. On a observé une réduction dépendante de la dose du nombre de spermatozoïdes dans la queue de l’épididyme et également de la production quotidienne de spermatozoïdes, qui étaient statistiquement significatives à 400 et 1000 mg/kg p.c./j. Chez les petits, les taux sériques de testostérone, d’œstradiol, de progestérone, de LH et de FSH étaient modifiés de façon significative sur 1 à 3 jours d’observation (JPN 21, 35, 49, 90 et 180) dans le groupe ayant reçu 400 mg/kg p.c./j, et sur 2 à 5 jours d’observation dans le groupe ayant reçu 1000 mg/kg p.c./j, mais n’avaient pas été modifiés sous ces doses. La DMENO établie dans cette étude est de 400 mg/kg p.c./j, d’après l’apparition tardive de la puberté, la modification de la morphologie testiculaire et la réduction du nombre de spermatozoïdes dans la queue de l’épididyme et de leur production (Zhang et coll. 2014).
Dans deux études du développement du système reproducteur chez les mâles, le butylparabène a été administré par le régime alimentaire à des rats Wistar mâles (8 animaux par groupe) à 0 %, 0,01 %, 0,1 % et 1,0 % (équivalant à 10,4 ± 3,07, 103 ± 31,2 et 1026 ± 310 mg/kg p.c./j) pendant 8 semaines à partir du JPN 21 environ, et à des souris Crj:CD‑1 (8 animaux par groupe) à 0 %, 0,01 %, 0,1 % et 1,0 % (équivalant à 14,4 ± 3,60, 146 ± 35,9 et 1504 ± 357 mg/kg p.c./j) pendant 10 semaines à partir du JPN 28 environ. Chez les rats, aucun changement significatif du poids corporel n’a été observé à aucune dose. Les poids absolu et relatif des épididymes ont diminué de façon significative aux doses élevée, moyenne et élevée, respectivement. Le poids absolu des vésicules séminales a diminué de façon significative à la dose élevée. Aucun changement n’a été constaté dans le poids des testicules, de la prostate ventrale ou des glandes préputiales. La réserve de spermatozoïdes dans la queue de l’épididyme (nombre de spermatozoïdes/queue) dans tous les groupes traités a diminué de façon significative, et la numération des spermatozoïdes (nombre de spermatozoïdes/g) du groupe ayant reçu la dose maximale était considérablement plus faible que dans le groupe témoin (91,8 ± 29,4 × 107/ g, comparativement à 169,8 ± 91,4 × 107/ g). La production quotidienne de sperme et l’efficacité de la production (production quotidienne de sperme/ g testicules) dans les testicules étaient également significativement plus faibles dans les groupes traités par rapport aux témoins. La concentration de testostérone dans le sérum était réduite, avec dépendance à la dose, et était significative à 0,1 % ou plus (Oishi 2001). Chez la souris, aucun effet lié au traitement n’a été observé à quelque dose que ce soit pour le poids corporel ou le poids du foie, de la prostate ventrale, des vésicules séminales ou des glandes préputiales. Toutefois, le poids absolu et le poids relatif des épididymes étaient significativement plus élevés dans le groupe ayant reçu la dose élevée, par rapport au groupe témoin. On a observé une diminution du nombre de spermatides ronds aux stades VII–VIII dans les tubules séminifères dans le groupe ayant reçu la dose élevée, et le nombre de spermatides allongés avait diminué dans tous les groupes traités, de façon proportionnelle à la dose. La concentration sérique de testostérone a diminué de façon significative à la dose maximale (Oishi 2002). La DMENO pour chacune de ces études est de 0,01 % dans le régime alimentaire (équivalant à 10,4 mg/kg p.c./j chez le rat et à 14,4 mg/kg p.c./j chez la souris). Comme nous l’avons expliqué dans les sections traitant du méthylparabène, de l’éthylparabène et du propylparabène, le CSSC (2008, 2011) a exprimé des doutes quant à la qualité de cette étude et d’autres études produites par le laboratoire d’Oishi, qui ont fait état i) de valeurs moyennes pour certains paramètres qui se situaient bien au-delà des intervalles des données historiques se rapportant aux témoins et ii) d’écarts-types pour des paramètres comme les concentrations de sperme dans l’épididyme et les taux de testostérone nettement inférieurs à la variabilité biologique normale qui a été observée par d’autres groupes. Le CSSC a conclu que la qualité des études d’Oishi ne peut être correctement évaluée, car la description complète des essais et les données brutes complètes n’étaient plus disponibles.
Dans une autre étude du développement du système reproducteur chez les mâles, du butylparabène a été administré dans le régime alimentaire à des rats Wistar mâles (15 à 16 animaux par dose) à 0, 100, 1000 et 10 000 ppm (équivalant à 0, 10,9 ± 0,4, 109,3 ± 8,2 et 1087,6 ± 67,8 mg/kg p.c./j) pendant 8 semaines, à partir du JPN 22. Des lésions oculaires, constituant un effet secondaire à un saignement de l’orbite, ont été observées dans les groupes ayant reçu le butylparabène, probablement à la suite d’un prélèvement sanguin dans le sinus orbital. Les paramètres évalués comprenaient le poids des organes et l’histopathologie des tissus reproducteurs, ainsi que la production, la motilité et la morphologie du sperme. Aucun effet significatif sur les paramètres évalués n’a été observé dans les groupes traités, par rapport au groupe témoin. Aucun effet n’a été observé concernant le poids des organes reproducteurs (testicules, épididymes, prostate ventrale et vésicules séminales). Aucun effet n’a été observé sur la motilité des spermatozoïdes, leur concentration dans la queue de l’épididyme ou les testicules, la production quotidienne de sperme ou le nombre de spermatozoïdes anormaux. Les taux sériques de testostérone ont diminué à la semaine 3 de façon significative dans les groupes ayant reçu les doses moyenne et élevée, et à la semaine 9 dans le groupe ayant reçu la dose élevée. Le taux de FSH a augmenté à la semaine 9 dans le groupe ayant reçu la dose élevée, et la LH a diminué à la semaine 5 dans les groupes ayant reçu les doses élevée et faible. Les auteurs ont rapporté une DSENO de 1087,6 mg/kg p.c./j, soit la dose maximale d’essai (Hoberman et coll. 2008).
Épidémiologie
Une recherche dans la littérature a été réalisée pour trouver des données épidémiologiques concernant le butylparabène, notamment les effets sur la reproduction et le système endocrinien. Les études ont été évaluées et leur qualité a été cotée selon l’échelle NOS (échelle d’évaluation de la qualité de Newcastle-Ottawa) et l’outil d’évaluation de la qualité pour les études d’observation transversales et par cohorte, du National Heart, Lung and Blood Institute des National Institutes of Health (RSI 2018). Des études épidémiologiques ont été trouvées, qui traitaient de la relation entre la concentration urinaire de butylparabène et la fertilité, la santé de la reproduction, les taux sériques d’hormones, la croissance et le développement chez les enfants, le poids corporel, la sensibilisation allergique et la santé respiratoire. La majorité des études n’ont pas fait état d’une association entre le butylparabène et le paramètre d’intérêt. Des associations positives entre le butylparabène et la motilité réduite des spermatozoïdes, la morphologie des spermatozoïdes anormaux et certaines hormones chez les femmes enceintes (diminution de l’œstradiol et augmentation de l’hormone thyroïdienne, T4), le poids des mâles à la naissance et la sensibilisation allergique (Jurewicz et coll. 2017; Aker et coll. 2016; Philippat et coll. 2014; Savage et coll. 2012; Spanier et coll. 2014). Une association inverse a été établie entre la concentration de butylparabène et la durée du cycle menstruel chez les jeunes femmes et le taux sérique d’hormone thyroïdienne (T3) chez les femmes adultes (femmes enceintes et population générale), et l’IMC chez les femmes enceintes (Nishihama et coll. 2016; Kœppe et coll. 2013; Aker et coll. 2018; Polinski et coll. 2018). Pour tous les paramètres associés à un effet identifié, différentes études de qualité similaire ont donné des résultats contradictoires pour ces paramètres ou des paramètres similaires. On trouvera plus de renseignements à ce sujet dans Santé Canada (2018a).
7.4.3 Caractérisation des risques pour la santé humaine
Dans les études à doses répétées, l’administration de butylparabène par voie alimentaire n’a pas entraîné d’effets indésirables à des doses allant de 900 à 1200 mg/kg p.c./j, mais des doses de 1875 mg/kg p.c./j et plus étaient associées à l’atrophie des organes, la nécrose et la mortalité des organes (Inai et coll. 1985; Matthews et coll. 1956). Le poids de la preuve indique que le butylparabène n’est ni génotoxique ni cancérogène.
Chez des jeunes rats mâles ayant reçu jusqu’à 1087 mg/kg p.c./j pendant 8 semaines à partir du JPN 22, on n’a pas observé d’effet sur le poids des organes reproducteurs ou sur la qualité du sperme (Hoberman et coll. 2008). Toutefois, lorsque le butylparabène était administré à des mères pendant la gestation (JG 6 ou 7 jusqu’au JPN 20 ou 21), l’exposition a été associée à des effets sur le développement de l’appareil reproducteur des mâles et des femelles chez les descendants, y compris la puberté retardée, une modification de la morphologie et de la croissance des organes reproducteurs, et une réduction du nombre et de la morphologie de spermatozoïdes (Boberg et coll. 2016; Kang et coll. 2002; Zhang et coll. 2014). Une réduction du nombre de spermatozoïdes a été observée à la dose de 10 mg/kg p.c./j chez Boberg et coll. (2016). Toutefois, en l’absence d’effets connexes sur les tissus reproducteurs ou le succès de la reproduction, cet effet n’a pas été jugé nocif. Un point de départ de 100 mg/kg p.c./j, soit la DMENO établie dans les études réalisées par Boberg et coll. (2016) et Kang et coll. (2002), est considéré comme assurant une protection contre ces effets.
La population canadienne est exposée au butylparabène par les cosmétiques, les médicaments en vente libre et les PSN. Les données de surveillance disponibles pour certaines sources dans les milieux naturels et les données obtenues ailleurs dans le monde indiquent que les Canadiens sont également exposés au butylparabène par ces sources. L’exposition par les aliments devrait être négligeable.
L’évaluation de l’exposition de la population générale au butylparabène est fondée sur les données de biosurveillance de l’ECMS, de l’étude Plastics and Personal-Care Product Use in Pregnancy Study (ou P4) et d’une étude des nouveau-nés coréens dans les 48 heures suivant leur naissance (Santé Canada 2017a; Fisher et coll. 2017; Kang et coll. 2013). Les données de biosurveillance fournissent des mesures internes réelles de l’exposition parce qu’elles comprennent des mesures spécifiques du butylparabène dans l’urine. Elles sont considérées comme des estimations fiables de la concentration urinaire de butylparabène résultant de voies et sources multiples, y compris la plupart des produits de consommation qui contiennent du butylparabène. L’urine est la principale voie d’élimination du butylparabène et le biomarqueur (butylparabène libre et conjugué) est spécifique au composé d’origine. Le butylparabène a une courte demi‑vie et un faible taux d’élimination urinaire fractionnée. Afin de tenir compte de l’incertitude associée à la robustesse de l’utilisation du butylparabène comme biomarqueur, les estimations de la dose journalière sont basées sur la limite supérieure au 95e centile de la valeur d’exposition (ou la valeur maximale disponible) pour chaque groupe d’âge, et par conséquent on estime qu’il s’agit d’un scénario prudent. Les marges d’exposition résultant des doses journalières estimées sont présentées dans le tableau 7‑19.
| Source, pays | Groupe d’âge (années) | Limite supérieure de la dose journalière estimée à P95 (mg/kg p.c./j) | Niveau d’effet critiquea (mg/kg p.c./j) |
ME |
|---|---|---|---|---|
| ECMS (cycle 4, 2014-2015), Canada | 3 à 5 | 0,00076 | DMENO : 100 | 131 053 |
| ECMS (cycle 4, 2014-2015), Canada | 6 à 11 | 0,00031 | DMENO : 100 | 319 875 |
| ECMS (cycle 4, 2014-2015), Canada | 12 à 19 | 0,0053 | DMENO : 100 | 18 759 |
| ECMS (cycle 4, 2014-2015), Canada | 20 à 59 | 0,0047 | DMENO : 100 | 21 206 |
| ECMS (cycle 4, 2014-2015), Canada | 60 à 79 | 0,0028 | DMENO : 100 | 36 048 |
| Fisher et coll. 2017, Canada | Femmes enceintes | 0,0044 | DMENO : 100 | 22 950 |
| Kang et coll. 2013, Corée | Nouveau-nés | 0,00018 | DMENO : 100 | 567 260 |
Abréviations : DMENO, dose minimale entraînant un effet nocif observé.
a Effets critiques : Réduction de la distance anogénitale chez les deux sexes, morphologie des organes reproducteurs, nombre de spermatozoïdes et motilité.
Sur la base des paramètres prudents utilisés pour modéliser la dose journalière estimée, les marges d’exposition sont jugées adéquates pour tenir compte du risque pour les populations de 3 à 79 ans, les femmes enceintes et les nouveau-nés. On ne disposait pas de données de biosurveillance pour les enfants de moins de 3 ans (autres que les nouveau-nés). À l’exception de la consommation de lait maternel, on ne s’attend pas à ce que l’exposition de ce groupe diffère significativement de celle du groupe d’âge le plus jeune étudié par l’ECMS ou du groupe néonatal présenté ici. D’après les données canadiennes de biosurveillance, les nourrissons ne devraient pas être exposés au butylparabène par le lait maternel. Par conséquent, les concentrations urinaires déclarées et les doses journalières estimées pour tous les groupes d’âge indiquent que l’exposition chez les enfants de moins de 3 ans ne devrait pas présenter un risque.
Le butylparabène est présent dans les milieux naturels à des concentrations négligeables pour tous les groupes d’âge, sauf les nourrissons recevant du lait maternisé. Pour ce groupe d’âge, l’exposition est estimée à 3,34 ng/kg p.c./j, ce qui donne une marge d’exposition de 2,99 × 107. La marge d’exposition est jugée adéquate pour tenir compte du risque potentiel.
En raison de la courte demi‑vie du propylparabène administré par voie orale et de la méthode d’échantillonnage ponctuel utilisée dans les études de biosurveillance, on ne voit pas vraiment si les données de biosurveillance tiennent compte adéquatement de l’exposition élevée aux cosmétiques, aux médicaments en vente libre et aux PSN à usage intermittent (c.‑à‑d. les produits qui ne sont pas utilisés quotidiennement). Les scénarios d’exposition sentinelle et les ME sont présentés dans le tableau 7‑20.
| Scénario d’exposition | Groupe d’âge (années) |
Exposition systémique (mg/kg p.c./j) | Niveau d’effet critiquea (mg/kg p.c./j) |
ME |
|---|---|---|---|---|
| Colorant capillaireb (permanent, application cutanée, par événement) | Adolescents (12 à 19) |
0,36 à 1,09 | DMENO : 100 | 92 à 276 |
| Colorant capillaireb (permanent, application cutanée, par événement) | Adultes (> 20) |
0,30 à 0,91 | DMENO : 100 | 110 à 330 |
| Plante médicinale contre la touxc (prise orale, par jour) |
Adolescents (12 à 19) |
0,14 | DMENO : 100 | 691 |
| Plante médicinale contre la touxc (prise orale, par jour) |
Adultes (> 20) |
0,12 | DMENO : 100 | 4122 |
| Analgésique pour enfants en suspensiond (prise orale, par jour) |
Tout-petits (0,5 à 4) |
2,10 | DMENO : 100 | 48 |
| Antiacided (prise orale, par jour) |
Adolescents (12 à 19) |
0,44 | DMENO : 100 | 225 |
| Antiacided (prise orale, par jour) |
Adultes (> 20) |
0,37 | DMENO : 100 | 269 |
| Crème analgésiquec (application cutanée, par jour) | Enfants (5 à 11) |
0,012 à 0,060 | DMENO : 100 | 5015 à 25 072 |
| Crème analgésiquec (application cutanée, par jour) | Adultes (> 20) |
0,011 à 0,053 | DMENO : 100 | 5686 à 28 431 |
| Crème médicamentée pour les mainsc (application cutanée, par jour) |
Enfants (5 à 11) |
0,020 | DMENO : 100 | 14 644 |
| Crème médicamentée pour les mainsc (application cutanée, par jour) |
Adultes (> 20) |
0,017 | DMENO : 100 | 17 667 |
| Crème solairec (application cutanée, par jour) |
Tout-petits (0,5 à 4) |
0,44 | DMENO : 100 | 227 |
| Crème solairec (application cutanée, par jour) |
Adultes (> 20) |
0,33 | DMENO : 100 | 303 |
Abréviations : DMENO, dose minimale entraînant un effet nocif observé.
a Effets critiques : Réduction de la distance anogénitale chez les deux sexes, morphologie des organes reproducteurs, nombre de spermatozoïdes et motilité.
b Cosmétiques.
c Produits de santé naturels.
d Médicament en vente libre.
Les marges calculées d’exposition aux colorants capillaires, aux plantes médicinales contre la toux, aux analgésiques pour enfants en suspension, aux antiacides et aux crèmes solaires sont jugées potentiellement inadéquates pour compenser les incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
Selon les données provenant d’une étude in vitro du métabolisme cutané du butylparabène, cette substance pourrait être hydrolysée en éthylparabène et en méthylparabène dans la peau. L’exposition potentielle est incorporée dans les données de biosurveillance pour le méthylparabène et l’éthylparabène. Les risques potentiels associés à cette voie d’exposition présumée sont décrits aux sections 7.1.3 et 7.2.3.
7.5 Benzylparabène
7.5.1 Évaluation de l’exposition
Le benzylparabène a été trouvé dans les milieux naturels et des études de biosurveillance à l’extérieur du Canada. Aucune autre exposition n’a été trouvée au Canada. Les concentrations potentielles de benzylparabène chez les Canadiens sont présentées dans la section suivante.
Biosurveillance
Le benzylparabène n’était pas visé par l’Enquête canadienne sur les mesures de la santé. Dans une étude à grande échelle menée en Allemagne (n = 660 adultes), le taux de détection était de 1,4 % (limite de quantification, LQ = 0,5 µg/L), avec une concentration maximale dans l’urine de 1,2 µg/L (Moos et coll. 2015). Dans une étude régionale à petite échelle aux États‑Unis (n = 100 adultes), le benzylparabène a été détecté chez 39 % des participants, avec une concentration urinaire au 95e centile de 0,5 µg/L (Ye et coll. 2006). Le benzylparabène a été détecté dans l’urine de 40,96 % femmes enceintes (LD = 0,2 µg/L, n = 31 femmes, 532 échantillons) dans une étude canadienne, avec une concentration urinaire au 95e centile de 0,57 µg/L (Fisher et coll. 2017). Dans la même étude, le benzylparabène n’était pas détectable (LD = 0,1 µg/L) dans le lait maternel de 56 femmes 3 mois après la naissance. Dans une étude danoise de couples mère-enfant (n = 143), le benzylparabène a été détecté chez 2,1 % des mères et 4,2 % des enfants (6 à 11 ans), avec des taux de détection maximaux de 1,1 et 0,65 µg/L, respectivement (Frederiksen et coll. 2013). Dans une étude régionale aux États‑Unis, le benzylparabène a été détecté (LQ = 0,03 µg/L) dans l’urine de 15 % des enfants de 3 à 10 ans (n = 40), et la concentration au 95e centile était de 0,42 µg/L (Wang et coll. 2013). Le benzylparabène a été détecté dans le placenta à une concentration maximale de 0,12 ng/g poids frais (Espagne, n = 12) (Valle-Sistac 2016).
Les doses journalières ont été calculées pour les populations représentées par les principales données de biosurveillance (Fisher et coll. 2017; Moos et coll. 2015; Ye et coll. 2006; Frederiksen et coll. 2013; Wang et coll. 2013). En l’absence de données canadiennes pour les populations générales, nous avons utilisé des données de sources américaines et européennes pour estimer la dose journalière. Les concentrations dans l’urine de femmes enceintes canadiennes ont également été modélisées. Dans chacune des études sur le propylparabène, le benzylparabène total (c.‑à‑d. les espèces libres et conjuguées) a été mesuré dans l’urine par CPLHP, après traitement avec la β-glucuronidase et la sulfatase.
Comme pour les autres parabènes, l’utilisation du benzylparabène comme biomarqueur est spécifique au composé d’origine. Le benzylparabène est moins largement utilisé que les autres parabènes (p. ex., aucune utilisation n’a été signalée au Canada), de sorte que le risque de contamination lors du prélèvement et de l’analyse des échantillons est jugé minime ou négligeable. Aylward (2017a) a estimé un taux d’élimination urinaire fractionnée de 1 % de la dose appliquée, d’après la valeur log Koe de 3,56 et l’équation de régression rapportée par Moos et coll. (2017). Toutefois, compte tenu des différences structurales entre le benzylparabène et les espèces de parabènes pour lesquelles l’élimination urinaire fractionnée a été mesurée (et sur lesquelles la régression linéaire est basée), Aylward et coll. (2017a) ont rapporté une très faible confiance à l’égard de la valeur estimée pour le benzylparabène.
Les doses journalières ont été estimées d’après le 95e centile ou les valeurs les plus élevées disponibles pour la concentration urinaire ajustée en fonction de la créatinine (µg/g Cr) ou la concentration urinaire (µg/L) pour chaque population, comme il est décrit pour le méthylparabène (section 7.1.1). Dans toutes les populations décrites dans le présent document, la concentration de benzylparabène était sous la limite de détection dans la majorité des échantillons. La prévalence des échantillons sous la limite de détection (variant de 0,1 à 0,5 µg/L) peut être attribuable à un métabolisme rapide, à une faible exposition ou aux deux. L’utilisation du 95e centile ou de la valeur la plus élevée disponible dépendait de la disponibilité des données et est considérée comme une estimation prudente qui tient compte de la variation inhérente à l’échantillonnage ponctuel.
Les doses journalières estimées et les principaux paramètres sont présentés dans le tableau 7‑21.
| Source, pays | Âge (années) | % < LD ou LQ | LD ou LQ (µg/L) | TDU (L/kg p.c./j)a | TEC (mg/j)b | CU | EUFc | DJE, P95 (IC) (µg/kg p.c./j) |
|---|---|---|---|---|---|---|---|---|
| Moos et coll. 2015, Allemagne | Adultes (20-30) (n = 660) |
98,6 | 0,5 | N.D. | 1440 | 3,1 µg/g Cr (max) | 0,01 | 6,3 |
| Frederiksen et coll. 2013, Danemark | Enfants (6-11) (n = 143) |
95,8 | 0,18 | N.D. | 418 | 1,0 µg/g Cr (max) | 0,01 | 1,3 |
| Fisher et coll. 2017, Canada | Femmes enceintes (n = 31) |
59,0d | 0,20 | 0,020 | N.D. | 0,57 µg/L (P95) | 0,01 | 1,1e |
| Ye et coll. 2006, USA | Adultes (n = 100) |
61,0 | 0,10 | 0,020 | N.D. | 0,5 µg/L (P95) | 0,01 | 1,0e |
| Wang et coll. 2013, USA | Enfants (3-10) (n = 40) |
85,0 | 0,03 | 0,030 | N.D. | 0,42 µg/L (P95) | 0,01 | 1,3e |
Abréviations : LD = limite de détection; LQ = limite de quantification; TEC = taux d’élimination de la créatinine; TDU = taux de débit urinaire; CU = concentration urinaire; EUF = élimination urinaire fractionnée; DJE = dose journalière estimée; N.D. = non applicable; max = valeur déclarée maximale; P95 = 95e centile.
a Aylward et coll. 2015.
b Le taux d’élimination de la créatinine a été calculé en utilisant l’équation de Mage [0,993*1,64 [140 – Âge] (Poids1,5 Taille0,5)/1000].
c Aylward et coll. 2017a.
d La valeur < LD est basée sur 542 échantillons prélevés chez 31 sujets (Fisher et coll. 2017).
e Lorsque les concentrations ajustées pour la créatinine n’ont pas été signalées, la DJE a été calculée d’après la concentration urinaire (µg/L) à l’aide de l’équation suivante : DJE = (CU*TDU)/EUF (Saravanabhavan et coll. 2014), où CU est la concentration urinaire (µg/L), TDU est le taux de débit urinaire (L/kg p.c./j) et EUF est le taux d’élimination urinaire fractionnée.
Milieux naturels
Le benzylparabène était sous la limite de détection dans la poussière domestique (8 ng/g) et les sols agricoles (2,8 ng/g) dans les études canadiennes de surveillance (Fan 2010; Viglino 2011). Dans des études réalisées ailleurs, le benzylparabène a été trouvé dans l’eau potable (Azzouz et Ballesteros 2014) et la poussière domestique (Wang et coll. 2012; Ramirez et coll. 2011; Tran et coll. 2016; Canosa et coll. 2007). En l’absence de données canadiennes de surveillance, comme le benzylparabène n’a été ni importé, ni fabriqué au Canada d’après les enquêtes menées en vertu de l’article 71, nous avons utilisé comme valeur prudente de rejet une limite supérieure de 100 kg pour estimer les concentrations théoriques de benzylparabène dans l’environnement à l’aide du modèle de fugacité de niveau III ChemCAN, version 6.00 (ChemCAN 2003). Les concentrations théoriques dans l’environnement calculées selon cette approche ont été utilisées pour estimer l’exposition potentielle pour la population générale du Canada par les milieux naturels. On a ainsi obtenu une dose estimée de 0,034 ng/kg p.c./j par l’air, l’eau et le sol. Cette approche indique que l’exposition de la population générale par les milieux naturels au Canada est potentiellement négligeable, ce qui est corroboré par des données provenant d’études internationales de surveillance.
Aliments
L’exposition au benzylparabène par les aliments devrait être négligeable (communication personnelle, courriel de la Direction des aliments, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 18 avril 2018; sans référence).
Selon les données de biosurveillance (Fisher et coll. 2017), le benzylparabène n’a pas été détecté dans le lait maternel chez 56 Canadiennes (LD = 0,1 µg/L), 3 mois après la naissance. Par conséquent, les nourrissons allaités au sein ne devraient pas être exposés au benzylparabène par le lait maternel.
7.6.2 Évaluation des effets sur la santé
Le benzylparabène a fait l’objet de plusieurs examens et évaluations des principaux risques des parabènes, y compris les examens réalisés par la CIR (Andersen 2008), le CSSC de l’Union européenne (2010, 2011), l’EFSA (2004) et des scientifiques indépendants (Soni et coll. 2005). Une recherche a été effectuée dans la littérature publiée en date de mars 2017 afin de trouver de l’information pertinente pour compléter les données utilisées dans les évaluations et les examens dans le monde.
Toxicocinétique
Deux volontaires humains ont reçu 2 g de benzylparabène par jour pendant 5 jours, qui a été éliminé dans l’urine à raison d’environ 6 % sous forme de composé d’origine inchangé, 87 % sous forme de conjugué de sulfate et de petites quantités sous forme de PHBA et d’acide benzoïque (Sabalitschka et Neufeld-Crzelliter 1954, cité dans Andersen 2008). Dans un rapport sur la concentration urinaire des parabènes chez 100 adultes, Ye et coll. (2006) ont signalé que la concentration de benzylparabène libre était inférieure à la limite de détection chez tous les sujets, mais que le benzylparabène conjugué (glucuronidé et sulfaté) a été détecté à de faibles concentrations dans 39 % des échantillons. Le benzylparabène a été détecté en faibles concentrations chez les humains dans le tissu mammaire tumoral, le tissu adipeux et le cerveau, mais on n’a pas indiqué si le benzylparabène était libre ou conjugué (Barr et coll. 2012; Wang et coll. 2015; van der Meer 2017).
Le taux d’hydrolyse du benzylparabène dans les cellules hépatiques et de la peau humaines est similaire à celui du butylparabène (Jewell et coll. 2007a, 2007b) ou intermédiaire entre les taux des parabènes à chaîne courte et ceux à chaîne longue (Abbas et coll. 2010). Dans les cellules hépatiques humaines, le benzylparabène est hydrolysé 5 à 10 fois plus lentement que le méthylparabène. Dans les cellules cutanées humaines, le benzylparabène est métabolisé environ 5 fois plus lentement que le méthylparabène (Jewell et coll. 2007a, 2007b). Dans un autre essai in vitro, le benzylparabène avait une demi‑vie d’hydrolyse de 43 minutes dans les microsomes hépatiques humains, soit environ le double du taux constaté avec le méthylparabène (Abbas et coll. 2010).
Études à doses répétées
Selon le CIR, les cobayes ayant reçu 1 g de benzylparabène par jour dans le régime alimentaire pendant 19 jours n’ont montré aucun signe de toxicité (Ishizeki 1955, cité dans Andersen 2008).
Génotoxicité
On a estimé que le benzylparabène était négatif dans un test d’Ames, avec et sans activation métabolique, d’après les prévisions de l’outil QSAR (REACH 2018d).
Effets sur la reproduction et le développement
Voir l’annexe C pour un examen des effets œstrogéniques in vitro du benzylparabène.
On a administré du benzylparabène par gavage à des rates Sprague‑Dawley à 0,0064, 0,032, 0,16, 0,8, 4, 20 et 100 mg/kg p.c./j du JPN 21 à 23. De l’œstradiol a été administré comme contrôle positif à 1, 5, 25, 100, 400 µg/kg p.c./j. Aucun effet n’a été observé sur la mortalité, le stress physiologique ou le poids corporel chez les animaux, à quelque dose que ce soit. Le poids relatif de l’utérus a augmenté de façon significative en fonction de la dose, passant de 107 % à 136 % dans le groupe témoin, pour une dose de 0,16 mg/kg p.c./j de benzylparabène et plus. L’administration de 5 à 400 µg/kg p.c./j d’œstradiol a induit une augmentation de 155 % à 440 % du poids relatif de l’utérus, par rapport au groupe témoin. La DSENO déterminée pour cette étude est de 0,032 mg/kg p.c./j, d’après les effets utérotrophiques à 0,16 mg/kg p.c./j (Hu et coll. 2013).
Épidémiologie
Des études épidémiologiques ont été menées sur la relation entre le benzylparabène et la fertilité, le poids corporel et la croissance chez les enfants. Aucun lien n’a été établi entre la concentration de benzylparabène et le délai avant la grossesse, la croissance chez les tout-petits, ou l’IMC chez les enfants et adolescents obèses (Smarr et coll. 2017; Guo et coll. 2017; Xue et coll. 2015). On trouvera plus de renseignements à ce sujet dans Santé Canada (2018a).
7.5.3 Caractérisation des risques pour la santé humaine
Données sur le danger obtenues par lecture croisée
Il n’existe pas d’étude fiable sur le benzylparabène, en particulier pour les paramètres de la reproduction. Compte tenu des similarités en matière de propriétés physico-chimiques, de toxicocinétique et de fonctionnalité dans les essais in vitro (voir l’annexe F), le butylparabène a été choisi comme analogue approprié pour le benzylparabène en ce qui concerne ces paramètres. Par conséquent, comme point de départ, une DMENO de 100 mg/kg p.c./j pour le butylparabène, basée sur les effets sur le développement précoce du système reproducteur (c.‑à‑d. distance anogénitale réduite chez les deux sexes, poids des organes reproducteurs, et morphologie, nombre et motilité des spermatozoïdes) a été appliquée au benzylparabène (Boberg et coll. 2016; Kang et coll. 2002; Zhang et coll. 2014).
Le benzylparabène n’a pas été trouvé dans les produits de consommation, les cosmétiques, les médicaments sur ordonnance ou en vente libre, les PSN ou les pesticides. L’exposition par les aliments et les milieux naturels devrait être négligeable. Le benzylparabène a été détecté dans l’urine de femmes enceintes, dans le cadre d’une étude canadienne de biosurveillance, ainsi que les chez les adultes et les enfants dans des études de biosurveillance en Europe et aux États‑Unis. Ces données englobent l’exposition au benzylparabène par de multiples sources et voies potentielles, connues et inconnues, et peuvent être considérées comme des estimations fiables de l’exposition de la population générale. On s’attend à ce que l’urine soit la principale voie d’élimination du benzylparabène, tout comme les autres parabènes, et le biomarqueur (benzylparabène libre et conjugué) est spécifique au composé d’origine. Il subsiste une incertitude concernant le facteur d’élimination urinaire fractionnée modélisé, et la demi‑vie chez les humains est inconnue. Pour tenir compte de l’incertitude associée à la robustesse de l’utilisation du benzylparabène comme biomarqueur, les estimations de la dose journalière ont été basées sur la valeur d’exposition à la limite supérieure du 95e centile (ou la valeur la plus élevée disponible) pour chaque groupe d’âge et sont par conséquent considérées comme un scénario prudent. Les marges d’exposition résultant des doses journalières estimées sont présentées dans le tableau 7‑22.
| Source, pays | Groupe d’âge (années) | Dose journalière estimée à P95 (mg/kg p.c./j) | Niveau d’effet critiquea (mg/kg p.c./j) |
ME |
|---|---|---|---|---|
| Moos et coll. 2015, Allemagne | Adultes (20 à 30) |
0,0063 | DMENO : 100 | 15 875 |
| Frederiksen et coll. 2013, Danemark | Enfants (6 à 11) |
0,0013 | DMENO : 100 | 74 257 |
| Fisher et coll. 2017, Canada | Femmes enceintes | 0,0011 | DMENO : 100 | 87 719 |
| Ye et coll. 2006, États‑Unis | Adultes | 0,001 | DMENO : 100 | 100 000 |
| Wang et coll. 2013, États‑Unis | Enfants (3 à 10) |
0,0013 | DMENO : 100 | 79 365 |
Abréviations : DMENO, dose minimale entraînant un effet nocif observé.
a Effets critiques : Réduction de la distance anogénitale chez les deux sexes, poids des organes reproducteurs, nombre et motilité des spermatozoïdes.
Sur la base des paramètres prudents utilisés pour modéliser la dose journalière estimée, les marges d’exposition sont jugées adéquates pour tenir compte du risque chez les adultes, les femmes enceintes et les enfants. Les concentrations urinaires rapportées et les doses journalières estimées pour tous les groupes d’âge indiquent que l’exposition chez les enfants de moins de 3 ans ne devrait pas présenter de risque.
7.6 Iso-propylparabène
7.6.1 Évaluation de l’exposition
L’iso-propylparabène a été trouvé dans les milieux naturels au Canada, et sa présence a été rapportée dans des études de biosurveillance réalisées à l’extérieur du Canada. L’iso‑propylparabène est présent dans les médicaments en vente libre, les PSN et les cosmétiques. Toutes ces sources peuvent contribuer à l’exposition quotidienne totale à l’iso-propylparabène. Les concentrations urinaires et l’exposition estimée des Canadiens à l’iso-propylparabène sont présentées dans la section suivante.
Biosurveillance
L’iso-propylparabène n’était pas visé par l’Enquête canadienne sur les mesures de la santé. Dans une étude à grande échelle réalisée en Allemagne (n = 660 adultes), le taux de détection était de 4 %, avec une concentration maximale dans l’urine de 99,5 µg/L (Moos et coll. 2015). Dans une autre étude, de moindre ampleur, sur des adultes et des enfants en Allemagne (n = 59 femmes, 39 hommes et 59 enfants de 6 à 8 ans), le taux de détection dans l’urine était de 3 % et la concentration maximale était de 175 µg/L (Moos et coll. 2014). Dans une étude danoise de couples mère-enfant (n = 143), l’iso‑propylparabène a été détecté chez 15 % des mères et 3 % des enfants (6 à 11 ans), la concentration moyenne détectée étant de 0,63 et 0,13 µg/L, respectivement (Frederiksen et coll. 2013). Dans une étude grecque réalisée auprès d’enfants de 4,24 ± 0,24 ans (n = 500), l’iso‑propylparabène a été détecté chez 3,8 % des participants avec une concentration maximale détectée de 15,0 µg/L (Myridakis et coll. 2016).
Milieux naturels
Aucune étude de surveillance canadienne faisant état de l’iso-propylparabène n’a été trouvée. Dans des études réalisées dans d’autres pays, l’iso‑propylparabène a été trouvé dans l’eau potable (Azzouz et Ballesteros 2014), les sols agricoles et forestiers (Nunez 2008) et la poussière domestique (Ramirez et coll. 2011). En l’absence de données canadiennes de surveillance, nous avons utilisé le volume importé total déclaré d’iso-propylparabène au Canada (284 kg) comme valeur prudente pour estimer les concentrations théoriques de l’iso-propylparabène dans l’environnement, à l’aide du modèle de fugacité de niveau III ChemCAN, version 6.00 (ChemCAN 2003). Les concentrations théoriques dans l’environnement calculées selon cette approche ont été utilisées pour estimer l’exposition potentielle pour la population générale du Canada par les milieux naturels. On obtient ainsi une dose estimée de 0,097 ng/kg p.c./j par l’air, l’eau et le sol. Cette approche indique que l’exposition de la population générale par les milieux naturels au Canada est potentiellement négligeable, ce qui est corroboré par des données provenant d’études internationales de surveillance.
Aliments
On ne s’attend pas à ce qu’il y ait une exposition à l’iso-propylparabène par les aliments (communication personnelle, courriel de la Direction des aliments, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 18 avril 2018; sans référence). Aucune étude canadienne faisant état de la concentration d’iso‑propylparabène dans le lait maternel n’a été trouvée.
Cosmétiques
L’iso-propylparabène a été trouvé dans les cosmétiques, y compris les lotions, les nettoyants et les produits de soins capillaires. L’estimation de l’exposition par voie orale et cutanée, d’après les scénarios sentinelles associés à l’utilisation de cosmétiques contenant de l’iso-propylparabène, a été évaluée et les scénarios sentinelles sont présentés dans les tableaux 7‑23 et 7‑24, respectivement. L’exposition potentielle a été estimée d’après des hypothèses prudentes et les valeurs par défaut décrites à l’annexe B. L’estimation de l’exposition pour chaque scénario est exprimée en termes d’événement ou sur une base journalière, selon la fréquence d’exposition (voir la section 7.6.3, Caractérisation des risques pour la santé humaine).
| Scénario | Concentration dans le produit (%)a | Groupe d’âge (années) |
Exposition systémique (mg/kg p.c./j) |
|---|---|---|---|
| Baume à lèvres (par jour) | 0,1 à 0,2 | Adolescents (12 à 19) |
0,00040 à 0,00081 |
a Données internes, Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 18 août 2017, sans référence.
Des coefficients d’absorption cutanée et de métabolisme déterminés expérimentalement dans une étude in vitro de l’absorption cutanée et du métabolisme dans la peau humaine ont été utilisés pour estimer la dose interne à la suite de l’exposition potentielle par voie cutanée, comme il est décrit à la section 7.1.1. De plus amples renseignements sont disponibles sur demande (Charles River Laboratories 2018; Santé Canada 2018b). Les estimations de l’exposition par voie cutanée sont présentées dans le tableau 7‑24. Les valeurs par défaut et les modèles utilisés dans les scénarios d’exposition sont présentés à l’annexe B.
| Scénario | Concentration dans le produit (%)a | Groupe d’âge (années) |
Charge cutanée (µg/cm2/24 h) | Exposition systémique (mg/kg p.c./j) |
|---|---|---|---|---|
| Lotion pour le corps (par application) |
0,05 à 0,1 | Tout-petits (0,5 à 4) |
0,42 à 0,84 | 0,11 à 0,22b,d |
| Produits autobronzants (par application) |
0,3 à 1 | Adultes (> 20) |
0,78 à 2,60 | 0,16 à 0,54b,e |
| Exfoliant corporel (par application) |
0,3 à 1 | Adolescents (12 à 19) |
0,57 à 1,89 | 0,14 à 0,47b,e |
| Colorant capillaire (permanente, par événement) | 0 à 0,01 | Adolescents (12 à 19) |
13,70 | 0,12c,e |
| Hydratant pour le visage (par jour) |
0,3 à 1 | Adolescents (12 à 19) |
8,88 à 29,59 | 0,089b,d à 0,11c,d |
| Nettoyant pour le corps (liquide, par jour) | 3 à 10 | Tout-petits (0,5 à 4) |
0,06 à 0,19 | 0,016 à 0,052b,e |
a Données internes, Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 18 août 2017, sans référence.
b Valeur calculée d’après la charge cutanée du produit exprimée en quantité maximale appliquée sur la peau.
c Valeur calculée avec une quantité cutanée maximale de 11,09 µg/cm2/24 h.
d Valeur calculée avec un raffinement du métabolisme de 81,98 % d’iso-propylparabène (d’après la préparation de la lotion hydratante).
e Valeur calculée avec un raffinement du métabolisme de 86,98 % d’iso-propylparabène (d’après la préparation de la lotion non hydratante).
Médicaments en vente libre et PSN
L’iso-propylparabène est présent en tant qu’ingrédient non médicinal dans les médicaments en vente libre et les PSN, principalement dans les produits de maquillage avec protection solaire alléguée. Les scénarios sentinelles pour l’exposition par voie orale et cutanée sont présentés dans le tableau 7‑25. Les valeurs par défaut et les modèles utilisés dans les scénarios d’exposition sont présentés à l’annexe B.
| Scénario | Concentration dans le produit (%)a | Groupe d’âge (années) |
Charge cutanée (µg/cm2/24 h) | Exposition systémique (mg/kg p.c./j) |
|---|---|---|---|---|
| Maquillage pour le visage (par jour) |
0,12 | Adolescents (12 à 19) |
1,22 | 0,01b,c |
a Communication personnelle, courriel de la Direction des produits thérapeutiques, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 25 mai 2017, sans référence.
b Valeur calculée d’après la charge cutanée du produit exprimée en quantité maximale appliquée sur la peau.
c Valeur calculée avec un raffinement du métabolisme de 86,98 % d’iso-propylparabène.
7.6.2 Évaluation des effets sur la santé
L’iso-propylparabène a été pris en compte dans plusieurs examens et évaluations des principaux risques des parabènes, y compris les examens réalisés par le CIR (Andersen 2008), le CSSC de l’Union européenne (CSPC 2005b; CSSC 2010, 2011) et des scientifiques indépendants (Soni et coll. 2005). Une recherche a été effectuée dans la littérature publiée en date de mars 2017 afin de trouver de l’information pertinente pour compléter les données utilisées dans les évaluations et les examens dans le monde.
Toxicocinétique
L’iso-propylparabène a été détecté dans des échantillons de biosurveillance chez les humains principalement sous forme conjuguée, ce qui indique qu’il est métabolisé par les mêmes voies que les autres parabènes. L’iso‑propylparabène a été détecté principalement sous forme conjuguée dans l’urine et le lait maternel chez les humains (Azzouz et coll. 2016). Dans des échantillons d’urine provenant de 14 volontaires humains, l’iso-propylparabène libre a été détecté, dans 2 échantillons seulement, à 0,15 et 0,18 µg/L, mais l’iso-propylparabène conjugué à l’acide glucuronique a été détecté dans 7 échantillons (plage de parabènes totaux de 0,21 à 2,1 µg/L). Dans des échantillons de lait maternel provenant de 7 volontaires humaines, l’iso-propylparabène libre a été détecté, dans 1 seul échantillon, à 0,73 µg/L. L’iso-propylparabène conjugué à l’acide glucuronique a été détecté dans 2 échantillons (plage de parabènes totaux de 0,90 à 1,22 µg/L).
Études à doses répétées
Des rats Fischer 344 (10/sexe/groupe) ont reçu 0 %, 0,25 %, 1,25 %, 2,5 % ou 5 % d’iso-propylparabène (correspondant à environ 0, 128, 640, 1280 et 2560 mg/kg p.c./j) dans leur alimentation pendant 13 semaines. On a observé une réduction du poids chez les mâles à 2,5 et 5,0 % et chez les femelles à 1,25 % et au‑dessus. Une augmentation du taux de gamma-GTP sérique et du cholestérol total a été rapportée chez les mâles à 2,5 % ou plus et une augmentation du taux de gamma-GTP sérique, de l’ALP et de l’azote uréique dans le sang chez les femelles à 1,25 % ou plus. Un gonflement hépatocellulaire centrolobulaire et des hépatocytes remplis de vacuoles ont été observés dans le foie chez les mâles ayant reçu les deux doses les plus élevées et chez les femelles du groupe ayant reçu la dose la plus élevée. Des effets histologiques rénaux (gravité accrue de la formation d’éosinophiles intracytoplasmiques dans l’épithélium tubulaire rénal proximal) ont également été signalés chez les mâles du groupe ayant reçu la dose la plus élevée. La DSENO sélectionnée pour cette étude était de 1,25 % (correspondant à environ 640 mg/kg p.c./j) (Onodera 1994).
Des rats Sprague‑Dawley de 5 semaines (10/groupe) ont été traités par voie cutanée à raison de 0, 50, 100, 300 ou 600 mg/kg p.c./j d’iso-propylparabène ou d’iso‑butylparabène, quotidiennement pendant 28 jours dans une étude à doses répétées conforme au protocole 410 de l’OCDE. La substance à l’essai a été dissoute dans de l’éthanol et appliquée sous forme de crème sur la peau rasée du dos à raison de 50 µL/cm2 sur 10 % de la surface corporelle. Aucun effet n’a été observé sur le poids corporel, le poids des organes ou les concentrations sériques de la triiodothyronine, de la thyréostimuline, de l’insuline, des œstrogènes, de l’hormone folliculo-stimulante ou de la testostérone. Les groupes ayant reçu l’iso-propylparabène n’ont montré aucune lésion spécifique sur le site d’application chez les rats mâles ou femelles (Kim 2015). La DSENO établie pour cette étude est de 600 mg/kg/j, soit la dose maximale d’essai.
Génotoxicité
L’iso-propylparabène s’est révélé négatif dans les tests d’Ames, ainsi que dans les tests d’aberration chromosomique et d’échange de chromatides sœurs sur les cellules de hamsters chinois et les fibroblastes d’embryons humains (REACH 2018e; Ishidate et Odashima 1977; Ishidate et coll. 1984; Kawachi et Yahagi 1980; Sasaki 1980). Les résultats ont été négatifs dans un essai d’aberration chromosomique in vivo sur des vers à soie (Kawachi et Yahagi 1980). On ne prévoit pas que l’iso‑propylparabène soit génotoxique in vivo.
Effets sur la reproduction et le développement
Voir l’annexe C, qui présente un examen des effets œstrogéniques in vitro de l’iso‑propylparabène.
Dans un essai utérotrophique modifié, des rates Sprague-Dawley immatures (8 animaux par groupe) ont reçu par voie sous-cutanée de l’iso-propylparabène à raison de 0, 62,5, 250 et 1000 mg/kg p.c./j pendant 3 jours à partir du JPN 14. Une augmentation significative du poids humide de l’utérus par rapport au poids corporel a été observée chez les animaux ayant reçu la dose de 1000 mg/kg/j d’iso‑propylparabène. Cet effet a été réduit, même s’il était demeuré significativement différent du groupe témoin ayant reçu l’excipient, avec l’ajout d’ICI 182,780, un antagoniste du récepteur des œstrogènes (Vo et Jeung 2009). La DSENO établie pour cette étude est de 250 mg/kg p.c./j, basée sur les effets utérotrophiques à 1000 mg/kg/j.
Dans une étude sur le développement pubertaire chez les femelles, des rates Sprague‑Dawley prépubertaires (10/groupe) ont reçu par voie orale 0, 62,5, 250, 1000 mg/kg p.c./j d’iso-propylparabène dans de l’huile de maïs, entre les JPN 21 et 40. De l’éthynylestradiol (1 mg/kg p.c./j) a été administré comme contrôle positif. Aucune diminution statistiquement significative du poids corporel n’a été observée, bien qu’à la dose maximale, le poids corporel ait été de 102,45 ± 4,38 g, par rapport au poids corporel chez les témoins de 118,69 ± 6,4 g. Un retard statistiquement significatif de l’ouverture vaginale a été observé chez les rates ayant reçu la dose moyenne et élevée d’iso-propylparabène (JPN 36,2 ± 1,03 et 36,7 ± 0,71), par rapport au groupe témoin (JPN 33,6 ± 3,23). L’ouverture vaginale s’est produite au JPN 21,4 ± 0,53 dans le groupe ayant reçu l’éthynylestradiol. Les moments de l’ouverture vaginale chez les rates des groupes ayant reçu les doses moyenne et élevée étaient dans la plage de données historiques se rapportant aux témoins (JPN 33,0 à 36,6, Stump et coll. 2014). Une diminution significative du nombre de cycles œstraux de 4 jours a également été observée dans le groupe ayant reçu la dose élevée, mais le nombre de jours de chaque stade du cycle de 4 jours (prœstrus, œstrus, métœstrus et diœstrus) n’était pas significativement différent. Les concentrations sériques d’œstradiol ont été significativement réduites dans le groupe ayant reçu la dose élevée (16,23 ± 6,86 pg/mL, par rapport à 47,07 ± 14,72 pg/mL dans le groupe témoin), et le taux de T4 a été réduit dans le groupe ayant reçu la dose moyenne (1,73 ± 0,34 ng/mL, par rapport à 3,00 ± 0,32 ng/mL dans le groupe témoin), mais non dans le groupe ayant reçu la dose élevée. Une diminution significative du poids des ovaires et des reins a été observée dans le groupe ayant reçu la dose élevée d’iso-propylparabène. Des changements histopathologiques dans les ovaires et l’utérus ont également été observés à la dose élevée d’iso-propylparabène (Vo et coll. 2010). Comme nous l’avons mentionné dans la section traitant du méthylparabène, certains des effets décrits ici résultent d’une réduction du poids corporel de 9 % à 12 % (Stump et coll. 2014). Le poids corporel moyen rapporté pour les animaux du groupe ayant reçu la dose la plus élevée a été réduit de 13,7 % par rapport au groupe témoin, ce qui donne à penser que les changements dans le cycle œstral, la réduction du poids des organes ainsi que l’histologie utérine pourraient être secondaires par rapport à la réduction du poids corporel. En raison de la nature problématique de plusieurs résultats présentés ici et de l’absence d’effets proportionnels à la dose, aucune DSENO n’a été établie.
Épidémiologie
Aucune étude épidémiologique traitant de l’iso-propylparabène n’a été trouvée.
7.6.3 Caractérisation des risques pour la santé humaine
Dans une étude de 13 semaines, l’exposition par voie alimentaire à l’iso‑propylparabène a entraîné des changements dans l’histochimie sérique et des effets organiques sur les reins et le foie à 2,5 % (environ 1280 mg/kg p.c./j) et plus (Onodera 1994). L’exposition cutanée à l’iso-propylparabène, jusqu’à 600 mg/kg p.c./j pendant 28 jours, n’a pas entraîné d’effets sur le site d’application ni sur le poids des organes ou les taux sériques d’hormones (Kim 2015). Une DSENO de 640 mg/kg p.c./j a par conséquent été sélectionnée comme point de départ pour l’exposition à l’iso‑propylparabène, d’après les effets sur l’histochimie sérique et les organes dans une étude de 13 semaines.
La population canadienne est exposée à l’iso-propylparabène par l’intermédiaire des cosmétiques, des médicaments en vente libre et des PSN. L’exposition par les aliments et les milieux naturels devrait être négligeable. Pour tenir compte du risque potentiel associé à l’exposition à l’iso-propylparabène par ces produits, les marges d’exposition résultant de l’exposition modélisée dans des scénarios sentinelles sont présentées dans le tableau 7‑26.
| Scénario | Groupe d’âge | Exposition systémique (mg/kg p.c./j) | Niveau d’effet critiquea (mg/kg p.c./j) |
ME |
|---|---|---|---|---|
| Baume à lèvresb (prise orale, par jour) |
Adolescents (12 à 19) |
0,00040 à 0,00081 | DSENO 640 | 7,9 × 105 à 1,6 × 106 |
| Lotion pour le corpsb (application cutanée, par événement) |
Tout-petits (0,5 à 4) |
0,11 à 0,22 | DSENO 640 | 2909 à 5818 |
| Produit de bronzageb (application cutanée, par événement) |
Adultes (> 20) |
0,16 à 0,54 | DSENO 640 | 1185 à 4000 |
| Exfoliant corporelb (application cutanée, par événement) |
Adolescents (12 à 19) |
0,14 à 0,47 | DSENO 640 | 1362 à 4571 |
| Colorant capillaireb (permanente, par événement) | Adolescents (12 à 19) |
0,12 | DSENO 640 | 5333 |
| Hydratant pour le visageb (par jour) |
Adolescents (12 à 19) |
0,089 à 0,11 | DSENO 640 | 5818 à 7191 |
| Nettoyant pour le corpsb (liquide, par jour) |
Tout-petits (0,5 à 4) |
0,016 à 0,052 | DSENO 640 | 12300 à 40 000 |
| Produits de maquillage pour le visagec (par jour) |
Adolescents (12 à 19) |
0,01 | DSENO 640 | 64 000 |
Abréviations : DSENO = dose sans effet nocif observé.
a Effets critiques : changements dans l’histochimie sérique, effets sur les reins et le foie.
b Cosmétiques.
c Médicaments en vente libre.
Les marges d’exposition calculées sont jugées adéquates pour compenser les incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
7.7 Iso-butylparabène
7.7.1 Évaluation de l’exposition
L’iso-butylparabène a été trouvé dans les milieux naturels au Canada, et sa présence a été rapportée dans des études de biosurveillance réalisées à l’extérieur du Canada. L’iso‑butylparabène est présent dans les médicaments en vente libre, les PSN et les cosmétiques, et il a été identifié comme composant dans des additifs indirects utilisés dans les établissements de transformation alimentaire. Bon nombre de ces sources contribuent à l’exposition quotidienne totale à l’iso-butylparabène. Les concentrations urinaires et l’exposition estimée des Canadiens à l’iso‑butylparabène sont présentées dans la section suivante.
Biosurveillance
L’iso-butylparabène n’était pas visé par l’Enquête canadienne sur les mesures de la santé. Dans une étude régionale au Canada, les concentrations urinaires moyennes d’iso-butylparabène étaient de 0,22 µg/L chez les femmes (n = 28, y compris 9 patientes enceintes) et de 0,29 µg/L chez les hommes (Genuis et coll. 2013). Dans une étude canadienne chez des femmes enceintes (n = 31), l’iso‑butylparabène a été détecté dans 38,93 % des échantillons et sa concentration au 95e centile dans l’urine était de 2,96 µg/L. Dans la même étude, l’iso‑butylparabène n’a pas été détecté dans le lait maternel chez 56 Canadiennes, 3 mois après la naissance (Fisher et coll. 2017). Dans une étude à grande échelle en Allemagne (n = 660 adultes), le taux de détection était de 24 %, avec une concentration dans l’urine de 3,1 µg/L au 95e centile (Moos et coll. 2015). Dans une étude danoise de couples mère-enfant (n = 143), l’iso‑butylparabène n’a pas été détecté chez les mères ou les enfants (6 à 11 ans) (Frederiksen et coll. 2013). Toutefois, dans une étude grecque chez des enfants de 4,24 ± 0,24 ans (n = 500), l’iso‑butylparabène a été détecté chez 10 % des participants avec une concentration détectée maximale de 50,4 µg/L (Myridakis et coll. 2016).
Milieux naturels
L’iso-butylparabène a été trouvé dans l’eau potable (Azzouz et Ballesteros 2014) et les sols agricoles (Perez 2011) dans d’autres pays. On n’a trouvé aucune étude canadienne de surveillance faisant état de l’iso-butylparabène.
En l’absence de données canadiennes de surveillance, nous avons utilisé le volume importé total d’iso-butylparabène au Canada (232 kg) comme valeur prudente pour estimer les concentrations théoriques d’iso-butylparabène dans l’environnement en utilisant le modèle de fugacité de niveau III ChemCAN, version 6.00 (ChemCAN 2003). Les concentrations théoriques dans l’environnement calculées selon cette approche ont été utilisées pour estimer l’exposition potentielle pour la population générale du Canada par les milieux naturels. On obtient ainsi une dose estimée de 0,079 ng/kg p.c./j par l’air, l’eau et le sol. Cette approche indique que l’exposition de la population générale par les milieux naturels au Canada est potentiellement négligeable, ce qui est corroboré par des données provenant d’études internationales de surveillance.
Aliments
On ne s’attend pas à ce qu’il y ait une exposition à l’iso-butylparabène par les aliments (communication personnelle, courriel de la Direction des aliments, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 18 avril 2018; sans référence). Les données de biosurveillance (Fisher et coll. 2017) indiquent que l’iso-butylparabène n’a pas été détecté dans le lait maternel chez 56 Canadiennes (LD = 0,1 µg/L), 3 mois après la naissance. Par conséquent, les nourrissons allaités au sein ne devraient pas être exposés à l’iso‑butylparabène par le lait maternel.
Cosmétiques
L’iso-butylparabène a été trouvé dans les cosmétiques, notamment les lotions, les nettoyants, les produits de maquillage et les produits de soins capillaires. Les scénarios sentinelles pour l’exposition aux cosmétiques par voie orale et cutanée sont présentés dans les tableaux 7‑27 et 7‑28, respectivement. L’annexe B présente plus de détails sur les hypothèses et les valeurs par défaut utilisées pour estimer l’exposition. L’exposition générale estimée pour chaque scénario est exprimée par événement ou par jour, selon la fréquence d’exposition et les effets critiques sur la santé (voir la section 7.7.3, Caractérisation des risques pour la santé humaine).
| Scénario | Concentration dans le produit (%)a | Groupe d’âge (années) |
Exposition systémique (mg/kg p.c./j) |
|---|---|---|---|
| Baume à lèvres (par événement) |
0 à 0,1 | Tout-petits (0,5 à 4) |
6,5 × 10-4 |
| Rouge à lèvres (par jour) |
0,1 à 0,3 | Adolescents (12 à 19) |
1,2 × 10-3 à 4,0 × 10-4 |
a Données internes, Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 18 août 2017, sans référence.
Des coefficients d’absorption cutanée et de métabolisme déterminés expérimentalement dans une étude in vitro de l’absorption cutanée et du métabolisme dans la peau humaine ont été utilisés pour estimer une dose interne à la suite de l’exposition potentielle par voie cutanée, comme il est décrit à la section 7.1.1. De plus amples renseignements sont disponibles sur demande (Charles River Laboratories 2018; Santé Canada 2018b). L’estimation de l’exposition par voie cutanée est présentée dans le tableau 7‑28. Les valeurs par défaut et les modèles utilisés dans les scénarios d’exposition sont présentés à l’annexe B.
| Scénario | Concentration dans le produit (%)a | Groupe d’âge (années) |
Charge cutanée (µg/cm2/24 h) | Exposition systémique (mg/kg p.c./j) |
|---|---|---|---|---|
| Lotion pour le corps (par application) |
0,3 à 1 | Tout-petits (0,5 à 4) |
2,51 à 8,35 | 0,46 à 1,54b,e |
| Huile pour le corps (par application) |
1 à 3 | Adultes (> 20) |
2,23 à 6,68 | 0,26 à 0,79b,e |
| Exfoliant corporel (par application) |
0,3 à 1 | Adolescents (12 à 19) |
0,57 à 1,89 | 0,094 à 0,31b,e |
| Maquillage pour le visage (par jour) |
0,1 à 1,5 | Adolescents (12 à 19) |
1,02 à 15,26 | 0,0064b,e à 0,079d,e |
| Hydratant pour le visage (par jour) |
1 à 3 | Adolescents (12 à 19) |
29,59 à 88,77 | 0,090d,e à 0,15c,e |
| Lotion oculaire (par jour) |
3 à 10 | Adolescents (12 à 19) |
54 à 180 | 0,0061 à 0,020c,e |
| Produits autobronzants (par application) |
0 à 0,1 | Adultes (> 20) |
0,26 | 0,036b,e |
| Shampoing (par jour) |
0,1 à 0,5 | Adultes (> 20) |
0,12 à 0,59 | 0,0011 à 0,0053b,e |
| Après-shampoing (rinçage, par événement) | 0,3 à 1 | Tout-petits (0,5 à 4) |
0,61 à 2,05 | 0,010 à 0,033b,e |
| Nettoyant pour le corps (liquide, par jour) | 0,1 à 0,5 | Nourrissons (0 à 0,5) |
0,0031 à 0,016 | 0,0012 à 0,0062b,f |
a Données internes, Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 18 août 2017, sans référence.
b Valeur calculée d’après la charge cutanée du produit exprimée en quantité maximale appliquée sur la peau.
c Valeur calculée avec 23,18 % d’absorption cutanée.
d Valeur calculée avec une quantité cutanée maximale de 12,64 µg/cm2/24 h.
e Valeur calculée avec un raffinement du métabolisme de 58,25 % d’iso-butylparabène.
f Aucun raffinement du métabolisme n’a été appliqué au groupe des nourrissons.
Médicaments en vente libre et PSN
L’iso-butylparabène est présent en tant qu’ingrédient non médicinal dans les médicaments en vente libre et les PSN, surtout dans les produits de traitement de l’acné, les produits de maquillage avec protection solaire alléguée et les crèmes solaires. À l’exception des produits figurant dans le tableau 7‑29, l’exposition à ces produits est dépassée par l’exposition aux cosmétiques (lotions, maquillage et produits de nettoyage), dont les valeurs sont présentées dans le tableau 7‑28. Les scénarios sentinelles pour l’exposition par voie orale et cutanée sont présentés dans le tableau 7‑28. Les valeurs par défaut et les modèles utilisés dans les scénarios d’exposition sont présentés à l’annexe B.
| Scénario | Concentration dans le produit (%) | Groupe d’âge (années) |
Charge cutanée (µg/cm2/24 h) | Exposition systémique (mg/kg p.c./j) |
|---|---|---|---|---|
| Crème solairea (par jour) |
0,0115c | Nourrissons (0 à 0,5) |
0,45 | 0,18e,f |
| Crème analgésiqueb (par jour) |
0,015d | Adultes (12 à 19) |
0,27 | 0,027e,g |
| Traitement ponctuel de l’acnéb (par jour) |
0,01d | Adolescents (12 à 19) |
0,17 | 0,00026e, g |
a Produits de santé naturels.
b Médicaments en vente libre.
c Communication personnelle, courriel de la Direction des produits thérapeutiques, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 25 mai 2017, sans référence.
d Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 20 février 2017, sans référence.
e Valeur calculée d’après la charge cutanée du produit exprimée en quantité maximale appliquée sur la peau.
f Aucun raffinement du métabolisme n’a été appliqué au groupe des nourrissons.
g Valeur calculée avec un raffinement du métabolisme de 48,95 % d’iso-butylparabène.
7.7.2 Évaluation des effets sur la santé
L’iso-butylparabène a fait l’objet de plusieurs examens et évaluations des principaux risques des parabènes, y compris ceux réalisés par le CIR (Andersen 2008), le CSSC de l’Union européenne (CSPC 2005a, 2005b; CSSC 2010, 2011), EFSA (2004), NICNAS (2016) et des scientifiques indépendants (Soni et coll. 2005). Une recherche a été effectuée dans la littérature publiée en date de mars 2017 afin de trouver de l’information pertinente pour compléter les données utilisées dans les évaluations et les examens dans le monde.
Toxicocinétique
Moos et coll. (2016) ont fait état de l’ingestion de 10 mg d’iso-butylparabène par 3 volontaires adultes (équivalant à 0,12-0,19 mg/kg p.c.). La demi‑vie d’élimination pour tous les participants était de 3 à 4 heures, 85 % de la dose administrée ayant été récupéré en 24 heures. Après 48 heures, 6,8 % de l’iso-butylparabène libre et conjugué avait été récupéré dans l’urine. Le PHHA était le principal métabolite, représentant 57 % de la dose appliquée et récupérée dans l’urine. L’iso‑butylparabène a été détecté principalement sous forme conjuguée dans l’urine, le sang et le lait maternel humains, bien que dans une moindre mesure que pour les autres parabènes (Azzouz et coll. 2016). Dans des échantillons d’urine provenant de 14 volontaires humains, de l’iso‑butylparabène libre a été détecté dans 1 seul échantillon à 0,13 µg/L, mais l’iso‑butylparabène conjugué à l’acide glucuronique a été détecté dans 9 échantillons (plage des parabènes totaux de 0,13 à 0,99 µg/L). Dans des échantillons de lait maternel provenant de 7 volontaires humains, l’iso-butylparabène libre et conjugué a été détecté dans un seul échantillon, le parabène libre à 0,15 µg/L et les parabènes totaux (libre +conjugué) à 0,75 µg/L. Dans des échantillons de sang provenant de 8 volontaires humains, le parabène libre n’a pas été détecté dans aucun échantillon, mais le parabène conjugué l’a été dans deux échantillons (plage des parabènes totaux de 0,14 à 0,29 µg/L).
Études à doses répétées
Dans une étude de 6 semaines, des souris ICR/Jcl (10/sexe/groupe) ont été exposées à 0 %, 0,6 %, 1,25 %, 2,5 %, 5 % ou 10 % d’iso-butylparabène dans leur alimentation (correspondant à environ 900, 1875, 3750, 7500 ou 15 000 mg/kg p.c./j). Tous les rats dans les deux groupes ayant reçu la dose maximale sont morts dans les 2 semaines et la prise de poids dans les deux doses suivantes était inférieure à 10 % de celle du groupe témoin. Toutes les doses supérieures à 0,6 % ont entraîné une atrophie marquée du tissu lymphoïde dans les organes, y compris la rate, le thymus et les ganglions lymphatiques ainsi qu’une dégénérescence multifocale et une nécrose du parenchyme hépatique. Aucun changement significatif des organes viscéraux n’a été observé dans le groupe ayant reçu la dose de 0,6 % ou chez les témoins (Inai et coll. 1985). La DSENO établie pour cette étude est de 0,6 % (environ 900 mg/kg p.c./j).
Des rats Sprague‑Dawley âgés de 5 semaines (10/groupe) ont été traités par voie cutanée à raison de 0, 50, 100, 300 ou 600 mg/kg p.c./j d’iso-butylparabène pendant 28 jours dans une étude à doses répétées conforme au protocole 410 de l’OCDE. La substance à l’essai a été dissoute dans de l’éthanol et appliquée sous forme de crème sur la peau rasée du dos à raison de 50 µL/cm2 sur 10 % de la surface corporelle. Aucun effet n’a été observé sur le poids corporel, le poids des organes ou les concentrations sériques de la triiodothyronine, de la thyréostimuline, de l’insuline, des œstrogènes, de l’hormone folliculo-stimulante ou de la testostérone. On a observé une hyperplasie épidermique et d’autres effets cutanés locaux chez les animaux ayant reçu la dose de 100 mg/kg p.c./j d’iso-butylparabène et plus (Kim 2015). La DSENO établie pour cette étude est de 50 mg/kg p.c./j d’après l’hyperplasie épidermique observée à 100 mg/kg p.c./j.
Génotoxicité
L’iso-butylparabène s’est avéré négatif dans les tests d’Ames et dans les tests d’aberration chromosomique sur des cellules de hamsters chinois et des fibroblastes d’embryons humains (Kawachi et Yahagi 1980, Ishidate et coll. 1984). Il s’est également révélé négatif dans un essai d’aberration chromosomique in vivo sur des vers à soie, mais les résultats étaient ambigus dans un essai in vivo d’aberration chromosomique sur la moelle osseuse du rat (Kawachi et Yahagi 1980). On ne s’attend pas à ce que l’iso‑butylparabène soit génotoxique in vivo.
Cancérogénicité
Des souris ICL/Jcr (50/groupe) ont reçu 0 %, 0,15 %, 0,3 % ou 0,6 % d’iso‑butylparabène dans leur alimentation pendant 102 semaines (équivalant à 259, 470 et 940 mg/kg p.c./j chez les mâles et 223, 372 et 887 mg/kg p.c./j chez les femelles). Un nombre élevé d’animaux sont morts dans tous les groupes (groupe témoin et groupes d’essai) avant 78 semaines. Les incidences sur les tumeurs étaient semblables dans les groupes d’essai par rapport au groupe témoin, et il n’y avait pas de différence significative entre les groupes exposés. En tout, 21 néoplasmes ont été observés dans le groupe témoin, et 26, 22 et 27 ont été observés dans les groupes ayant reçu les doses faible, moyenne et élevée d’iso-butylparabène, respectivement. Il n’y avait pas de différence significative dans la fréquence des néoplasmes ou le délai avant la mort des animaux entre les groupes d’essai et le groupe témoin (Inai et coll. 1985). L’analyse statistique n’a pas été présentée. La DSENO établie pour cette étude est de 0,6 % (887 mg/kg p.c./j), soit la dose maximale d’essai.
Effets sur la reproduction et le développement
Voir l’annexe C pour un examen des effets œstrogéniques in vitro de l’iso‑butylparabène.
L’iso-butylparabène administré par voie sous-cutanée a entraîné une augmentation du poids de l’utérus chez des souris Crj:CD ovariectomisées à 250 mg/kg p.c./j (Koda et coll. 2005). Cependant, dans un essai sur la puberté des femelles, le même effet n’a pas été observé lorsque les souris avaient reçu la dose plus tard dans leur développement. Dans une étude du développement pubertaire des femelles, des rates Sprague‑Dawley prépubertaires (10/groupe) ont reçu par voie orale 0, 62,5, 250 et 1000 mg/kg p.c./j d’iso-butylparabène dans de l’huile de maïs entre les JPN 21 et 40. Aucun effet significatif n’a été observé dans le poids des organes, le jour de l’ouverture vaginale ou le cycle œstral. Aucune différence significative dans le poids de l’utérus n’a été observée au JPN 41 à quelque dose testée que ce soit, par rapport au groupe témoin ayant reçu l’excipient. Une augmentation significative de l’épaisseur de la paroi utérine a été observée chez les animaux traités à toutes les doses d’iso-butylparabène. Toutefois, on ne voit pas bien l’importance de cet effet, car le cycle œstral au moment du sacrifice n’avait pas été indiqué. Des changements significatifs ont également été observés dans le nombre de corps jaunes et de follicules kystiques, à toutes les doses (Vo et coll. 2010).
Des rates Sprague‑Dawley gravides (3 mères/groupe; 8 petits/groupe) ont reçu 0 ou 2,5 mg/kg p.c./j d’iso-butylparabène par gavage entre le JG 5 et le JPN 21. Aucun effet n’a été observé sur les principaux événements du développement chez les petits (détachement du pavillon de l’oreille, éruption des incisives, séparation des paupières, rétention du mamelon, descente des testicules et séparation du prépuce), le poids corporel des petits, le poids relatif des testicules ou des épididymes, ou les taux sériques des hormones (17β-œstradiol, testostérone et hormone folliculo-stimulante). Les descendants mâles présentaient une réduction significative de la motilité des spermatozoïdes et du nombre de spermatozoïdes dans l’épididyme (Yang 2016). La DMENO établie pour cette étude était de 2,5 mg/kg p.c./j, la seule dose utilisée dans l’essai.
Épidémiologie
Dans une étude transversale menée auprès de patients mâles d’une clinique de fertilité, la concentration d’iso-butylparabène dans l’urine était associée positivement à une forte capacité de coloration de l’ADN, ce qui indiquait des dommages à l’ADN. Aucune association n’a été observée avec d’autres paramètres de qualité du sperme, notamment la morphologie, la motilité et la concentration, ni avec les taux sériques de FSH, de testostérone ou d’œstradiol (Jurewicz et coll. 2017).
7.7.3 Caractérisation des risques pour la santé humaine
Dans une étude de 6 semaines, des doses d’iso-butylparabène dans le régime alimentaire dépassant 0,6 % (environ 900 mg/kg p.c./j) ont entraîné une atrophie et une nécrose des organes (Inai et coll. 1985). Une exposition cutanée atteignant 600 mg/kg p.c./j n’a pas entraîné d’effets sur le poids des organes ou les taux sériques d’hormones. Une hyperplasie épidermique a été observée sur le site d’application à 100 mg/kg p.c./j (Kim 2015). On n’a trouvé aucun signe laissant entendre que l’iso-butylparabène est génotoxique ou cancérogène.
Dans une étude sur le développement de l’appareil reproducteur des femelles, on a observé des changements significatifs dans le nombre de corps jaunes ovariens et de follicules kystiques et dans l’épaisseur de la paroi utérine à toutes les doses (Vo et coll. 2010). Lorsque l’iso-butylparabène a été administré à des mères entre le JG 5 et le JPN 21, aucun effet significatif n’a été observé pour plusieurs paramètres du développement chez les petits. Cependant, on a observé une réduction significative de la motilité des spermatozoïdes et du nombre de spermatozoïdes dans les épididymes chez les petits mâles (Yang 2016). Cet effet est conforme à la conclusion selon laquelle la concentration d’iso-butylparabène dans l’urine est associée positivement à la capacité de coloration de l’ADN chez les patients mâles dans une clinique de fertilité (Jurewicz et coll. 2017). Cette étude a utilisé le même schéma d’administration de la dose et les mêmes paramètres d’évaluation que les études de Boberg et coll. (2016) et Kang et coll. (2002), qui ont été les principales études utilisées pour déterminer le point de départ du butylparabène. Toutefois, une seule dose d’iso-butylparabène a été administrée dans l’étude de Yang (2016) et elle était inférieure à la dose la plus faible de butylparabène (10 mg/kg p.c./j) administrée dans l’étude de Boberg et coll. (2016). Plusieurs études in vitro ont montré que l’iso-butylparabène présente une activité œstrogénique équivalente ou supérieure à celle du butylparabène (Terasaki et coll. 2009; van Meeuwen et coll. 2008), ce qui semble indiquer que l’on peut s’attendre à des effets similaires in vivo. Dans l’ensemble, cette analyse suggère que, bien que la réduction de la concentration et de la motilité des spermatozoïdes ne soit pas clairement négative en l’absence d’autres effets sur les organes reproducteurs et le développement, dans ce cas‑ci, elle peut être considérée comme un effet critique pour déterminer un point de départ. Par conséquent, un point de départ de 2,5 mg/kg p.c./j, soit la DMENO établie dans Yang et coll. (2016), a été choisi pour l’iso-butylparabène.
La population canadienne est exposée à l’iso‑butylparabène par les cosmétiques, les médicaments en vente libre et les PSN. L’exposition par les aliments et les milieux naturels devrait être négligeable. Pour tenir compte du risque potentiel associé à l’exposition à l’iso‑butylparabène par ces produits, les marges d’exposition obtenues par modélisation avec les scénarios sentinelles sont présentées dans le tableau 7‑30.
| Scénario | Groupe d’âge (années) | Exposition systémique (mg/kg p.c./j) | Niveau d’effet critiquea (mg/kg p.c./j) |
ME |
|---|---|---|---|---|
| Baume à lèvresb (prise orale, par événement) |
Tout-petits | 6,5 × 10-4 | DMENO 2,5 | 3846 |
| Rouge à lèvresb (prise orale, par jour) |
Adolescents | 1,2 × 10-3- 4,0 × 10-4 |
DMENO 2,5 | 2083 à 6250 |
| Lotion pour le corpsb (application cutanée, par événement) |
Tout-petits | 0,46 à 1,54 | DMENO 2,5 | 1,6 à 5,4 |
| Huile pour le corpsb (application cutanée, par événement) |
Adultes | 0,26 à 0,79 | DMENO 2,5 | 3,2 à 9,5 |
| Exfoliant corporelb (application cutanée, par événement) |
Adolescents | 0,094 à 0,31 | DMENO 2,5 | 8 à 27 |
| Produits de maquillage pour le visageb (application cutanée, par jour) |
Adolescents | 0,0064 à 0,079 | DMENO 2,5 | 32 à 393 |
| Lotion pour le visageb (application cutanée, par jour) |
Adolescents | 0,090 à 0,15 | DMENO 2,5 | 17 à 28 |
| Lotion oculaireb (application cutanée, par jour) |
Adolescents | 0,0061 à 0,020 | DMENO 2,5 | 122 à 407 |
| Produit de bronzageb (application cutanée, par événement) |
Adultes | 0,036 | DMENO 2,5 | 69 |
| Shampoingb (application cutanée, par jour) |
Adultes | 0,0011 à 0,0053 | DMENO 2,5 | 469 à 2344 |
| Après-shampoingb (rinçage, application cutanée, par événement) | Tout-petits | 0,010 à 0,033 | DMENO 2,5 | 75 à 249 |
| Nettoyant pour le corpsb (liquide, application cutanée, par jour) | Nourrissons | 0,0012 à 0,0062 | DMENO 2,5 | 401 à 2005 |
| Crème solairec (application cutanée, par jour) | Nourrissons | 0,18 | DMENO 2,5 | 14 |
| Crème analgésiqued (application cutanée, par jour) |
Adultes | 0,027 | DMENO 2,5 | 94 |
| Traitement ponctuel de l’acnéd (application cutanée, par jour) | Adolescents | 0,00026 | DMENO 2,5 | 9442 |
Abréviations : DMENO, dose minimale entraînant un effet nocif observé.
a Effets critiques : Réduction du nombre et de la motilité des spermatozoïdes.
b Cosmétiques.
c Produits de santé naturels.
d Médicament en vente libre.
Les marges calculées pour l’exposition à divers produits ⸺ lotions corporelles, huiles corporelles, exfoliants corporels, produits de maquillage pour le visage, lotions pour le visage, lotions oculaires, produits autobronzants, shampoings, après-shampoing, nettoyants pour le corps (exposition des nourrissons), crèmes solaires et crèmes analgésiques ⸺ sont jugées potentiellement insuffisantes pour compenser les incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
7.8 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau suivant.
| Substance | Principale source d’incertitude | Incidence |
|---|---|---|
| Méthylparabène, éthylparabène, propylparabène, butylparabène et benzylparabène | Les données de biosurveillance utilisées pour estimer l’exposition aux parabènes sont basées sur des échantillons ponctuels d’urine, qui reflètent des expositions récentes et peuvent ne pas refléter l’exposition à moyen et long terme. L’utilisation de la limite supérieure de confiance au 95e centile de la concentration urinaire, pour les échantillons ponctuels d’urine, est une approche prudente pour caractériser l’exposition à moyen et long terme. | + |
| Méthylparabène, éthylparabène, propylparabène, butylparabène et benzylparabène | Le taux d’élimination urinaire fractionnée utilisé pour estimer la dose journalière à partir des données de biosurveillance est basé sur l’exposition orale et peut ne pas tenir compte avec précision de l’exposition cutanée. | +/- |
| Benzylparabène | Aucune donnée de biosurveillance pour les concentrations de benzylparabène dans l’urine ou le plasma n’a été trouvée pour la population générale au Canada. | +/- |
| Méthylparabène et butylparabène | Le taux d’élimination urinaire fractionnée humain utilisé pour calculer la dose journalière à partir des données de biosurveillance était basé sur un petit échantillon, et on a tenu compte de considérations additionnelles concernant l’incertitude dans les marges d’exposition. | + |
| Éthylparabène et propylparabène | Le taux d’élimination urinaire fractionnée humain utilisé pour calculer la dose journalière à partir des données de biosurveillance a été extrapolé à partir des données pharmacocinétiques chez les humains pour les autres parabènes, et on a tenu compte de considérations additionnelles concernant l’incertitude dans les marges d’exposition. | + |
| Benzylparabène | Faible degré de confiance à l’égard du taux d’élimination urinaire fractionnée estimé du benzylparabène. | +/- |
| Éthylparabène | Environ 65 % des échantillons de l’ECMS contenaient de l’éthylparabène à une concentration inférieure à la limite de détection. | - |
| Propylparabène | Environ 20 % des échantillons de l’ECMS contenaient du propylparabène à une concentration inférieure à la limite de détection. | - |
| Butylparabène | Environ 83 % des échantillons de l’ECMS contenaient du butylparabène à une concentration inférieure à la limite de détection. | - |
| Propylparabène et butylparabène | L’analyse des échantillons de l’ECMS ne faisait pas de différence entre les formes n- et iso- du propylparabène et du butylparabène | + |
| Propylparabène | Les études de toxicocinétique indiquent que les humains peuvent métaboliser le propylparabène moins efficacement que les rats. | - |
| Méthylparabène | On n’a trouvé aucune étude de toxicité chronique chez des animaux exposés au méthylparabène par voie orale ou cutanée. On n’a pas trouvé non plus d’étude fiable sur le développement pubertaire des femelles après exposition au méthylparabène. | +/- |
| Éthylparabène | On n’a trouvé aucune étude de toxicité chronique chez des animaux exposés à l’éthylparabène par voie orale ou cutanée. On n’a pas trouvé non plus d’étude fiable sur le développement pubertaire des mâles/femelles après exposition à l’éthylparabène. | +/- |
| Propylparabène | On n’a trouvé aucune étude de toxicité chronique chez des animaux exposés au propylparabène par voie orale ou par voie cutanée. | |
| Butylparabène | On n’a trouvé aucune étude de toxicité chronique chez des animaux exposés au butylparabène par voie orale ou cutanée. On n’a pas trouvé non plus d’étude fiable sur le développement pubertaire des femelles après exposition au butylparabène. | +/- |
| Benzylparabène | Il existe une base de données limitée d’études décrivant les dangers du benzylparabène, pour tous les paramètres. | +/- |
| Iso-propylparabène | On n’a trouvé aucune étude de toxicité chronique chez des animaux exposés à l’iso‑propylparabène par voie orale ou cutanée. On n’a pas trouvé non plus d’étude fiable sur le développement pubertaire des mâles/femelles, la reproduction ou le développement prénatal après exposition à l’iso-propylparabène. | +/- |
| Iso-butylparabène | On n’a trouvé aucune étude de toxicité chronique chez des animaux exposés à l’iso‑butylparabène par voie orale ou cutanée. On n’a pas trouvé non plus d’étude fiable sur le développement pubertaire des mâles/femelles, la reproduction ou le développement prénatal chez les femmes après exposition à l’iso-butylparabène. | +/- |
| Tous les parabènes | Les concentrations confirmées de parabènes dans les cosmétiques indiquent que la modélisation de l’exposition basée sur les avis présentés à Santé Canada peut surestimer l’exposition aux parabènes par les cosmétiques. | + |
- + = incertitude quant au potentiel de surestimation de l’exposition/risque;
- – = incertitude quant au potentiel de sous-estimation du risque d’exposition;
- +/ – = potentiel inconnu de surestimation ou de sous-estimation du risque.
8. Conclusion
Compte tenu de toutes les sources de données disponibles présentées dans cette ébauche d’évaluation préalable, le risque d’effets nocifs pour l’environnement du méthylparabène, de l’éthylparabène, du propylparabène, du butylparabène, du benzylparabène, de l’iso-propylparabène et de l’iso-butylparabène est faible. Il est proposé de conclure que le méthylparabène, l’éthylparabène, le propylparabène, le butylparabène, le benzylparabène, l’iso-propylparabène et l’iso-butylparabène ne répondent pas aux critères des alinéas 64a) ou b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou durable sur l’environnement ou sa diversité biologique ou qui mettent en danger ou pourraient mettre la vie d’une manière ou d’une autre en danger.
À la lumière des renseignements présentés dans cette ébauche d’évaluation préalable, il est proposé de conclure que le méthylparabène, le propylparabène, le butylparabène et l’iso-butylparabène répondent aux critères de l’alinéa 64c) de la LCPE, car ils pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la santé et la vie humaines.
À la lumière des renseignements présentés dans cette ébauche d’évaluation préalable, il est proposé de conclure que le méthylparabène, le propylparabène, le butylparabène, le butylparabène et l’iso-butylparabène répondent aux critères de l’alinéa 64c) de la LCPE, car ils pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la santé et la vie humaines.
Il est donc proposé de conclure que le méthylparabène, le propylparabène, le butylparabène et l’iso-butylparabène répondent à un ou plusieurs des critères énoncés à l’article 64 de la LCPE et que l’éthylparabène, le benzylparabène et l’iso-propylparabène ne répondent à aucun des critères énoncés à cet article.
Il est également proposé que le méthylparabène, le propylparabène, le butylparabène et l’iso-butylparabène ne répondent pas aux critères de persistance ou de bioaccumulation établis dans le Règlement sur la persistance et la bioaccumulation pris en vertu de la LCPE.
Références
Abbas S, Greige-Gerges H, Karam N, Piet MH, Netter P, Magdalou J. 2010. Metabolism of Parabens (4-Hydroxybenzoic Acid Esters) by Hepatic Esterases and UDP-Glucuronosyltransferases in Man. Drug Metab. Pharmacokinet. 25(6): 568–577 (Disponible en anglais seulement)
Adler-Hradecky C, Kelenty B. 1960. On the toxicity and local analgesic activity of p-hydroxybenzoic acid esters. Archives Internationales de Pharmacodynamie et de Therapie. 128: 135-142. [Tel que cité dans Andersen 2008.] (Disponible en anglais seulement)
Adoamnei E, Mendiola J, Moñino-García M, Vela-Soria F, Iribarne-Durán LM, Fernández MF, Olea N, Jørgensen N, Swan SH, Torres-Cantero AM. 2018. Urinary concentrations of parabens and reproductive parameters in young men. Sci.Total Environ. 621: 201-209 (Disponible en anglais seulement)
Aker AM, Johns L, McElrath TF, Cantonwine DE, Mukherjee B, Meeker JD. 2018. Associations between maternal phenol and paraben urinary biomarkers and maternal hormones during pregnancy: A repeated measures study. Environment International 113:341-349. (Disponible en anglais seulement)
Aker AM, Watkins DJ, Johns LE, Ferguson KK, Soldin OP, Del Toro LVA, Alshawabkeh AN, Cordero JF, Meeker JD. 2016. Phenols and parabens in relation to reproductive and thyroid hormones in pregnant women. Environmental Research 151: 30–37 (Disponible en anglais seulement)
Alliot F, Moreau-Guigon E, Bourges C, Desportes A, Teil MJ, Blanchard M, Chevreuil M. 2014. A multi-residue method for characterization of endocrine disruptors in gaseous and particulate phases of ambient air. Atmospheric Environment 92: 1-8 (Disponible en anglais seulement)
Andersen FA. 2008. Final amended report on the safety assessment of methylparaben, ethylparaben, propylparaben, isopropylparaben, butylparaben, isobutylparaben, and benzylparaben as used in cosmetic products. International Journal of Toxicology, 27(4):1-82. (Disponible en anglais seulement)
Aubert N, Ameller T, Legrand JJ. 2012. Systemic exposure to parabens: Pharmacokinetics, tissue distribution, excretion balance and plasma metabolites of [14C]-methyl-, propyl- and butylparaben in rats after oral, topical or subcutaneous administration. Food and Chemical Toxicology 50: 445–454 (Disponible en anglais seulement)
Ayar A, Uysal H. 2013. Examination of the Genotoxic Effects of Various Parabens Used as Food Additives with the Drosophila Wing Spot Test (SMART). Journal of Applied Biological Sciences 7(2): 83-88 (Disponible en anglais seulement)
Aylward LL, Hays SM, Kirman C, Summit Toxicology, LLP. 2017a. Derivation of Biomonitoring Equivalents for Selected Esters of para-Hydroxybenzoic Acid (Parabens). Health Canada Contract number 4500354002. (Non trouvé)
Aylward LL, Hays SM, Zidek A. 2017b. Variation in urinary spot sample, 24 h samples, and longer-term average urinary concentrations of short-lived environmental chemicals: implications for exposure assessment and reverse dosimetry. J Expo Sci Environ Epidemiol 27:582-590. (Disponible en anglais seulement)
Aylward LL, Vezina A, Deveau M, St. Amand A, Nong A, Hays S. 2015. Biomonitoring Equivalents for interpretation of urinary fluoride. Reg. Toxicol. Pharmacol. 72:158-167. (Disponible en anglais seulement)
Azzouz A, Ballesteros E. 2014. Trace analysis of endocrine disrupting compounds in environmentalwater samples by use of solid-phase extraction and gaschromatography with mass spectrometry detection. Journal of Chromatography A 1360: 248–257 (Disponible en anglais seulement)
Azzouz A, Rascon AJ, Ballesteros E. 2016. Determination of free and conjugated forms of endocrine-disrupting chemicals in human biological fluids by GC−MS. Bioanalysis 8(11): 1145–1158 (Disponible en anglais seulement)
Barr L, Metaxas G, Harbach CAJ, Savoy LA, Darbre PD. 2012. Measurement of paraben concentrations in human breast tissue at serial locations across the breast from axilla to sternum. J. Appl. Toxicol. 32(2012): 219–232 (Disponible en anglais seulement)
[BDIPSN] Base de données d’ingrédients de produits de santé naturels [base de données]. [Modifiée le 21 mars 2019]. Ottawa (Ont.), Gouvernement du Canada. [Site consulté le 26 mars 2019].
[BDPP] Base de données sur les produits pharmaceutiques [base de données]. [Modifiée le 17 juillet 2015]. Ottawa (Ont.), Gouvernement du Canada. [Site consulté le 7 mars 2017].
[BDPSNH] Base de données des produits de santé naturels homologués [base de données]. [Modifiée le 6 février 2018]. Ottawa (Ont.), Gouvernement du Canada. [Site consulté le 26 mars 2019].
Beerens-Heijnen, CGM. 2009. Repeated dose 28-day oral toxicity study with methyl 4-hydroxybenzoate by daily gavage in the rat followed by a 14-day recovery period. 25 September 2009. NOTOX Project 489456. (Disponible en anglais seulement)
Blanco E, Casais MC, Mejuto MC, Cela R. 2009. Combination of off-line solid-phase extraction and on-column sample stacking for sensitive determination of parabens and p-hydroxybenzoic acid in waters by non-aqueous capillary electrophoresis. Analytica Chimica Acta 647: 104–111. (Disponible en anglais seulement)
Blevins RD, Taylor DE. 1982. Mutagenicity screening of twenty-five cosmetic ingredients with the salmonella/microsome test. J. Eniron. Sci. Health, A17(2): 217-239 (Disponible en anglais seulement)
Boberg J, Axelstad M, Svingen T, Mandrup K, Christiansen S, Vinggaard AM, Hass U. 2016. Multiple Endocrine Disrupting Effects in Rats Perinatally Exposed to Butylparaben. Toxicological Sciences 152(1): 244–256 (Disponible en anglais seulement)
Boberg J, Taxvig C, Christiansen S, Hass U. 2010. Possible endocrine disrupting effects of parabens and their metabolites. Reproductive Toxicology 30:301-312. (Disponible en anglais seulement)
Bremmer HF, Prud’homme de Lodder LCH, van Engelen JGM. 2006. Cosmetics Fact Sheet [PDF]. RIVM report 320104001/2006. (Disponible en anglais seulement)
Byford JR, Shaw LE, Drew MGB, Pope GS, Sauer MJ, Darbre PD. 2002. Oestrogenic activity of parabens in MCF7 human breast cancer cells. Journal of Steroid Biochemistry & Molecular Biology 80: 49–60 (Disponible en anglais seulement)
Calafat AM, Weuve J, Xiaoyun Y, Jia LT, Hu H, Ringer S, Huttner K, Hauser R. 2009. Exposure to bisphenol A and other phenols in neonatal intensive care unit premature infants. Environ. Health Perspect. 117(4): 639-644 (Disponible en anglais seulement)
Calafat AM, Ye X, Wong LY, Bishop AM, Needham LL. 2010. Urinary concentrations of four parabens in the US population: NHANES 2005–2006. Environmental health perspectives; 118(5):679-685. (Disponible en anglais seulement)
Canada, Ministère de l’environnement. 2012. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances de la Liste intérieure [PDF]. Gazette du Canada, Partie I, vol. 146, n° 48, Supplément.
Canada, Ministère de l’environnement. 2017. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant les substances visées par la mise à jour de l’inventaire de 2017. Gazette du Canada, Partie I, vol. 151, n° 2.
Canada. 1978. Règlement sur les aliments et drogues. C.R.C., ch. 870.
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L.C. 1999, ch. 33. Gazette du Canada, Partie III, vol. 22, n° 3.
Canosa P, Rodrgues I, Rubi E, Cela R. 2007. Determination of Parabens and Triclosan in Indoor Dust Using Matrix Solid-Phase Dispersion and Gas Chromatography with Tandem Mass Spectrometry. Anal. Chem. 79:1675-1681. (Disponible en anglais seulement)
Carmona E, Andreu V, Pico Y. 2014. Occurrence of acidic pharmaceuticals and personal care products in Turia River Basin: From waste to drinking water. Science of the Total Environment 484: 53–63 (Disponible en anglais seulement)
Carvalho CM, Menezes PFC, Letenski GC, Praes CEO, Feferman IHS, Lorencini M. 2012. In vitro induction of apoptosis, necrosis and genotoxicity by cosmetic preservatives: application of flow cytometry as a complementary analysis by NRU. International Journal of Cosmetic Science 34: 176–182 (Disponible en anglais seulement)
[CE] Commission européenne. 2003. Technical Guidance Document on Risk Assessment, Part I. 1998. Institute for Health and Consumer Protection, European Chemicals Bureau. (Disponible en anglais seulement)
Charles River Laboratories. 2018. The In Vitro Percutaneous Absorption and Metabolism of Radiolabelled Iso-Propylparaben, Radiolabelled Iso-Butylparaben, Radiolabelled Methylparaben, Radiolabelled Ethylparaben, Radiolabelled Propylparaben and Radiolabelled Butylparaben in Two Test Preparations Through Human Skin. Test Facility Study No. 781278, Report No. 39507. (Disponible en anglais seulement)
ChemCAN [level III fugacity model of 24 regions of Canada]. 2003. Version 6.00. Peterborough (ON): Trent University, Canadian Centre for Environmental Modelling and Chemistry. (Disponible en anglais seulement)
ChemSpider. 2017a. CSID:6912. (Site consulté le 22 août 2017) (Disponible en anglais seulement)
ChemSpider. 2017b. CSID:18995. (Site consulté le 22 août 2017) (Disponible en anglais seulement)
ChemSpider. 2017c. CSID:19066. (Site consulté le 22 août 2017) (Disponible en anglais seulement)
[ConsExpo] Consumer Exposure Model [Internet]. 2006. Version 4.1. Bilthoven (NL): Rijksinstituut voor Volksgezondheid en Milieu (National Institute for Public Health and the Environment). (Disponible en anglais seulement)
[CoRAP] ECHA Community Rolling Action Plan. 2016. Substance Evaluation Report: 4-hydroxybenzoic acid. 7 June 2016. EC 202-804-9. (Disponible en anglais seulement)
[CSPC] Comité scientifique des produits de consommation de la Commission européenne. 2005a. Extended opinion on the safety evaluation of parabens. 28 January 2005. SCCP/0873/05. (Disponible en anglais seulement)
[CSPC] Comité scientifique des produits de consommation de la Commission européenne. 2005b. Extended opinion on parabens, underarm cosmetics and breast cancer. 28 January 2005. SCCP/0874/05 (Disponible en anglais seulement)
[CSPC] Comité scientifique des produits de consommation de la Commission européenne. 2006. Opinion on parabens. COLIPA no. P82. 10 October 2006. SCCP/1017/06. (Disponible en anglais seulement)
[CSPC] Comité scientifique des produits de consommation de la Commission européenne. 2008. Opinion on parabens. COLIPA no. P82. 24 June 2008. SCCP/1183/08. (Disponible en anglais seulement)
[CSSC] Comité scientifique pour la sécurité des consommateurs de la Commission européenne. 2010. Opinion on parabens. COLIPA no. P82. 14 December 2010. SCCS/1348/10. (Disponible en anglais seulement)
[CSSC] Comité scientifique pour la sécurité des consommateurs de la Commission européenne. 2011. Clarification on Opinion SCCS/1348/10 in the light of the Danish clause of safeguard banning the use of parabens in cosmetic products intended for children under three years of age. 10 October 2011. SCCS/1446/11. (Disponible en anglais seulement)
[CSSC] Comité scientifique pour la sécurité des consommateurs de la Commission européenne. 2013. Opinion on parabens: Updated request for a scientific opinion on propyl- and butylparaben. COLIPA n° P82. 3 May 2013. SCCS/1514/13. (Disponible en anglais seulement)
[CSSC] Comité scientifique pour la sécurité des consommateurs de la Commission européenne. 2015. The SCCS’s notes of guidance for the testing of cosmetic substances and their safety evaluation. 9th Revision. 29 September 2015. SCCS/1564/15. (Disponible en anglais seulement)
[CTFA] Cosmetic, Toiletry and Fragrance Association. 1980a. Safety data test summary: Acute oral toxicity, Ethylparaben. Unpublished data submitted by CTFA (Jan. 25, 1980; CTFA Code No. 2-7-89) [Tel que cité dans Andersen 2008] (Disponible en anglais seulement)
[CTFA] Cosmetic, Toiletry and Fragrance Association. 1980b. Safety data test summary: Oral, dermal, and ocular testing of product containing Butylparaben. Unpublished data submitted by CTFA (CTFA Code No. 2-7-12) [Tel que cité dans Andersen 2008] (Disponible en anglais seulement)
[CTFA] Cosmetic, Toiletry and Fragrance Association. 1980g. Subchronic (three month) dermal toxicity study in rabbits with product AI-0025 containing Methylparaben, study B-7049. Unpublished data submitted by CTFA (Oct. 1980; CTFA Code No. 2-7-75) [Tel que cité dans Andersen 2008] (Disponible en anglais seulement)
[CTFA] Cosmetic, Toiletry and Fragrance Association. 1981f. Thirteen-week subchronic dermal toxicity study in albino rats with medicated cream containing Methylparaben and medicated lotion containing Propylparaben. Study project code ATOI65. Unpublished data submittedby CTFA (April24. 1981;CfFA Code No. 2-7-113). [Tel que cité dans Andersen 2008] (Disponible en anglais seulement)
[CTFA] Cosmetic, Toiletry and Fragrance Association. 1983. Summary for the Results of Surveys of the amount and Frequency of use of cosmetic products by Women. Report Prepared by Pitkin B, Rodericks JV, Turnbull D. Environ Corporation 1850 K Street, N.W, Washington, DC. (Disponible en anglais seulement)
[CTFA] Cosmetic, Toiletry and Fragrance Association. 1985. Benzylparaben: Acute oral toxicity, acute dermal irritation/corrosion, acute eye irritation/corrosion, and COLIPA summary. Unpublished data submitted by CTFA. [Tel que cité dans Andersen 2008] (Disponible en anglais seulement)
[Danish EPA] Danish Environmental Protection Agency. 2008. Survey and health assessment of chemical substances in hobby products for children. Survey of Chemical Substances in Consumer Products, No. 93. Danish Ministry of the Environment. (Disponible en anglais seulement)
CosIng. 2019. Cosmetic Ingredient Database, European Commission, Health and Consumers – Cosmetics. [Site consulté le 17 avril 2019]. (Disponible en anglais seulement)
Deierlein AL, Wolff MS, Pajak A, Pinney SM, Windham GC, Galvez MP, Rybak M, Calafat AM, Kushi LH, Biro FM, Teitelbaum SL. 2017. Phenol concentrations during childhood and subsequent measures of adiposity among young girls. Am.J.Epidemiol 186(5): 581-592 (Disponible en anglais seulement)
Den Hond E; Paulussen M; Geens T; Bruckers L; Baeyens W; David F. 2013. Biomarkers of human exposure to personal care products: Results from the Flemish Environment and Health Study (FLEHS 2007-2011). Science of the Total Environment 463-464, 102-110. (Disponible en anglais seulement)
Dodge LE, Williams PL, Williams MA, Missmer SA, Toth TL, Calafat AM, Russ H. 2015. Paternal Urinary Concentrations of Parabens and Other Phenols in Relation to Reproductive Outcomes among Couples from a Fertility Clinic. Environmental Health Perspectives 123(7): 665-671 (Disponible en anglais seulement)
Dymicky M, Hutanen CN. 1979. Inhibition of Clostridium botulinum by p-Hydroxybenzoic Acid n-Alkyl Esters. Antimicrobial Agents and Chemotherapy 15(6): 798-801 (Disponible en anglais seulement)
ECCC. Information in support of the science approach document: ecological risk classification of organic substances. Disponible à : substances@ec.gc.ca. (Disponible en anglais seulement)
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2015. Identification des priorités d’évaluation des risques : résultats de l’examen de 2015. Ottawa (Ont.), Gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. [Document modifiée le 12 mars 2017]. Catégorisation. Ottawa (Ont.), Gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l’approche scientifique : classification du risque écologique des substances organiques. Ottawa (Ont.), Gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016b. Supporting documentation: data used to create substance-specific hazard and exposure profiles and assign risk classifications. Gatineau (QC). (Disponible en anglais seulement)
[EFSA] Autorité européenne de sécurité des aliments. 2004. Opinion of the Scientific Panel on Food Additives, Flavourings, Processing Aids and Materials in Contact with Food on a Request from the Commission related to para hydroxybenzoates. The EFSA Journal 83: 1-26 (Disponible en anglais seulement)
Elder DP, Crowley PJ. 2012. Antimicrobial preservatives part two: choosing a preservative. American Pharmaceutical Review. (Disponible en anglais seulement)
[EMA] Agence européenne des médicaments. 2015. Reflection paper on the use of methyl- and propylparaben as excipients in human medicinal products for oral use. 22 October 2015. EMA/CHMP/SWP/272921/2012. (Disponible en anglais seulement)
[EPA] United States Environmental Protection Agency. 2009. Endocrine Disruptor Screening Program Test Guidelines OPPTS 890.1450: Pubertal Development and Thyroid Function in Intact Juvenile/ Peripubertal Female Rats. October 2009. EPA 740-C-09-009. (Disponible en anglais seulement)
Environnement Canada. 2013. Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu du de l’article 71 de la Loi canadienne sur la protection de l’environnement de 1999 : Avis modifiant l’Avis concernant certaines substances de la Liste intérieure. Données préparées par Environnement Canada et Santé Canada, Programme des substances existantes.
Environnement Canada. 2017. Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu du de l’article 71 de la Loi canadienne sur la protection de l’environnement de 1999 : Avis modifiant l’Avis concernant certaines substances de la Liste intérieure. Données préparées par Environnement Canada et Santé Canada, Programme des substances existantes.
[EPI Suite] Estimation Program Interface Suite for Microsoft Windows [estimation model]. c2000-2012. Ver. 4.11. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. (Disponible en anglais seulement)
Fan X, Kubwabo C, Rasmussen P, Jones-Otazo H. 2010. Simultaneous quantitation of parabens, triclosan, and methyl triclosan in indoor house dust using solid phase extraction and gas chromatography-mass spectrometry. J. Environ. Monit. 12: 1891–1897 (Disponible en anglais seulement)
Ferreira AMC, Moder M, Laespada MEF. 2011. Stir bar sorptive extraction of parabens, triclosan and methyl triclosan from soil, sediment and sludge with in situ derivatization and determination by gas chromatography–mass spectrometry. Journal of Chromatography A 1218: 3837–3844 (Disponible en anglais seulement)
Ficheux AS, Chevillotte G, Wesolek N, Morisset T, Dornic N, Bernard A, Bertho A, Romanet A, Leroy L, Mercat AC, Creusot T, Simon E, Roudot AC. 2016. Consumption of cosmetic products by the French population second part: Amount data. Food and Chemical Toxicology 90: 130-141 (Disponible en anglais seulement)
Ficheux AS, Wesolek N, Chevillotte G, Roudot AC, 2015. Consumption of cosmetic products by the French population. First part: Frequency data. Food and Chemical Toxicology 78: 159-169 (Disponible en anglais seulement)
Finot F. et al. 2017. Genotoxic risk of ethyl-paraben could be related to telomere shortening. J. Appl. Toxicol. 37: 758–771 (Disponible en anglais seulement)
Fisher M, MacPherson S, Braun JM, Hauser R, Walker M, Feeley M, Mallick R, Bérubé R, Arbuckle TE. 2017. Paraben concentrations in maternal urine and breast milk and its association with personal care product use. Environmental Science & Technology; 51(7):4009-4017. (Disponible en anglais seulement)
Frederiksen H, Nielsen JKS, Morck TA, Hansen PW, Jensen JF, Nielsen O, andersen AM, Knud LE. 2013. Urinary excretion of phthalate metabolites, phenols and parabens in rural and urban Danish mother–child pairs. International Journal of Hygiene and Environmental Health 216: 772– 783 (Disponible en anglais seulement)
Furia, T.E. 1972. Handbook of Food Additives, Vol.1, 2nd Ed. (Disponible en anglais seulement)
Gazin V, Marsden E, Marguerite F. 2013. Oral Propylparaben Administration to Juvenile Male Wistar Rats Did Not Induce Toxicity in Reproductive Organs. Toxicological Sciences 136(2): 392–401 (Disponible en anglais seulement)
Geer LA, Pycke BFG, Waxenbaum J, Sherer DM, Abulafia O, Halden RU. 2017. Association of birth outcomes with fetal exposure to parabens, triclosan and triclocarban in an immigrant population in Brooklyn, New York. Journal of Hazardous Materials 323: 177–183 (Disponible en anglais seulement)
Genuis SJ, Birkholz D, Curtis L, Sandau C. 2013. Paraben Levels in an Urban Community of Western Canada. ISRN Toxicology 2013(Article ID 507897) (Disponible en anglais seulement)
Giulivo M, de Alda ML, Capri E, Barceló D. 2016. Human exposure to endocrine disrupting compounds: Their role in reproductive systems, metabolic syndrome and breast cancer. A review. Environmental Research 151: 251–264 (Disponible en anglais seulement)
Gomez E, Pillon A, Fenet H, Rosain D, Duchesne MJ, Nicolas JC, Balaguer P, Casellas C. 2005. Estrogenic activity of cosmetic components in reporter cell lines: Parabens, UV screens and musks. Journal of Toxicology and Environmental Health, Part A, 68:239–251. (Disponible en anglais seulement)
Gomez-Berrada MP, Gautier F, Parent-Massin D, Ferret PJ. 2013. Retrospective exposure data for baby and children care products: An analysis of 48 clinical studies. Food and Chemical Toxicology 57: 185–194. (Disponible en anglais seulement)
Grant DJW, Mehdizadeh M, Chow AHL, Fairbrother JE. 1984. Non-linear van’t Hoff solubility - temperature plots and their pharmaceutical interpretation. International Journal of Pharmaceutics 18 25-38 (Disponible en anglais seulement)
Guo J, Wu C, Lu D, Jiang S, Liang W, Chang X, Xu H, Wang G, Zhou Z. 2017. Urinary paraben concentrations and their associations with anthropometric measures of children aged 3 years. Environmental Pollution 222:307-314 (Disponible en anglais seulement)
Haman C, Dauchy X, Rosin C, Munoz JF. 2015. Occurrence, fate and behavior of parabens in aquatic environments: a review. Water Research; 68: 1-11. (Disponible en anglais seulement)
Harville HM, Voorman R, Prusakiewicz JJ. 2007. Comparison of Paraben Stability in Human and Rat Skin. Drug Metabolism Letters 1: 17-21 (Disponible en anglais seulement)
Hays SM, Aylward LL, LaKind JS, Bartels MJ, Barton HA, Boogaard PJ, Brunk C, DiZio S, Dourson M, Goldstein DA, Kilpatrick ME, Krewski D, Krishnan, K, Lipscomb J, Nordberg M, Okino M, Tan Y-M, Viau C, Yager JW. 2008. Guidelines for the derivation of Biomonitoring Equivalents: Report from the Biomonitoring Equivalents Expert Workshop. Reg. Toxicol. Pharmacol. 51:S4-S15. (Disponible en anglais seulement)
Heim, F., F. Leuschner, and G. Wunderlich. 1957. Metabolism of phydroxybenzoic acid ethyl ester. Klin. Wochenschr. 35:823-825. [Tel que cité dans Andersen 2008] (Disponible en anglais seulement)
Hirose M, Inoue T, Asamoto M, Tagawa Y, Ito N. 1986. Comparison of the effects of 13 phenolic compounds in induction of proliferative lesions of the forestomach and increase in the labelling indices of the glandular stomach and urinary bladder epithelium of Syrian golden hamsters. Carcinogenesis 7(8): 1285-1289 (Disponible en anglais seulement)
Hoberman AM, Schreur DK, Leazer T, Daston GP, Carthew P, Re T, Loretz L, Mann P. 2008. Lack of Effect of Butylparaben and Methylparaben on the Reproductive System in Male Rats. Birth Defects Research (Part B) 83: 123–133 (Disponible en anglais seulement)
Honda M, Robinson M, Kannan K. 2018. Parabens in human urine from several Asian countries, Greece, and the United States.Chemosphere 201:13-19. (Disponible en anglais seulement)
Hossaini A, Larsen JJ, Larsen JC. 2000. Lack of Oestrogenic Effects of Food Preservatives (Parabens) in Uterotrophic Assays. Food and Chemical Toxicology 38: 319-323 (Disponible en anglais seulement)
Hu P, Chen X, Whitener RJ, Boder ET, Jones JO, Porollo A, Chen J, Zhao L. 2013. Effects of Parabens on Adipocyte Differentiation. Toxicological Sciences 131(1): 56–70 (Disponible en anglais seulement)
Inai K, Aoki Y, Akamizu H, Eto R, Nishida T, Tokuoka S. 1985. Tumorgenicity study of butyl and isobutyl p-hydroxybenzoates administered orally to mice. Fd Chem. Toxic. 23(6): 575-578 (Disponible en anglais seulement)
Ishidate M, Odashima S. 1977. Chromosome tests with 134 compounds on Chinese hamster cells in vitro – a screening for chemical carcinogens. Mutation Research 48: 337-354 (Disponible en anglais seulement)
Ishidate M, Sofuni T, Yoshikawa K, Hayashi M, Nohmi T, Sawada M, Matsuoka A. 1984. Primary mutagenicity screening of food additives currently in use in Japan. Fd Chem. Toxic 22(8):623-636 (Disponible en anglais seulement)
Ishidate M, Yoshikawa K. 1980. Chromosome Aberration Tests with Chinese Hamster Cells in vitro with and without Metabolic Activation - A Comparative Study on Mutagens and Carcinogens. Arch. Toxicol. 4: 41-44 (Disponible en anglais seulement)
Ishidate, M., Hayashi, M., Sawada, M., Yoshikawa, K., Ono M., Nakadate, M. 1978. Cytotoxicity Test on Medical Drugs-Chromosome Aberration Tests with Chinese Hamster Cells In Vitro. Eisei Shikenjo Hokoku. 96:55-61. (Disponible en anglais seulement)
Ishiwatari S, Suzuki T, Hitomi T, Yoshino T, Matsukuma S, Tsuji T. 2007. Effects of methyl paraben on skin keratinocytes. J. Appl. Toxicol. 27: 1–9 (Disponible en anglais seulement)
Ishizaki, M., Ueno, S., Oyamada, N., and Katsumura, K. 1978. Studies on degradation of food additives by irradiation (IV): Reaction of butyl p-hydroxybenzoate with potassium nitrate or sodium nitrite by irradiation of ultraviolet ray and mutagenicity of its reaction products. Food Hygene and Safety Science 19(3): 305–10. (Disponible en anglais seulement)
Ishizeki C, Aoyama S, Hatta Y, Fujita Y, Oda Y, Urabe M. 1955. Studies on food antiseptics. I. Bull. Natl. Hyg. Lab. Tokyo73:237-243. [Tel que cité dans Andersen 2008.] (Disponible en anglais seulement)
Jacobsen, D. W., Metcalfe, D. D., Sampson, H. A., & Simon, R. A. (1996). “Adverse reactions to benzoates and parabens.” Food allergy: adverse reactions to food and food additives, (Ed. 2), 375-386. (Disponible en anglais seulement)
Jakimska A, Huerta B, Bargańska Z, Kot-Wasik A, Rodríguez-Mozaz S, Barceló D. 2013. Development of a liquid chromatography–tandem mass spectrometry procedure for determination of endocrine disrupting compounds in fish from Mediterranean rivers. Journal of Chromatography A, 1306:44–58. (Disponible en anglais seulement)
Janjua NR, Mortensen GK, Andersson AM, Kongshoi Brian, Skakkebaek NE, Wulf HC. 2007. Systemic Uptake of Diethyl Phthalate, Dibutyl Phthalate, and Butyl Paraben Following Whole-Body Topical Application and Reproductive and Thyroid Hormone Levels in Humans. Environ. Sci. Technol 41(2007): 5564-5570 (Disponible en anglais seulement)
Jewell C, Bennett P, Mutch Elaine, Ackermann C, Williams FM. 2007a. Inter-individual variability in esterases in human liver. Biochemical Pharmacology 74: 932–939 (Disponible en anglais seulement)
Jewell C, Prusakiewiecz JJ, Ackermann C, Payne NA, Fate G, Voorman R, Williams FM. 2007b. Hydrolysis of a series of parabens by skin microsomes and cytosol from human and minipigs and in whole skin in short-term culture. Toxicology and Applied Pharmacology 225: 221–228 (Disponible en anglais seulement)
Jones PS, Thispen D, Morrison JL, Richardson AP. 1956. p-Hydroxybenzoic Acid Esters as Preservatives III. The Physiological Disposition of p-Hydroxybenzoic Acid and Its Esters. Journal of the American Pharmaceutical Association XLV(4): 268-273 (Disponible en anglais seulement)
Jurewicz J, Radwan M, Wielgomas B, Dziewirska E, Karwacka A, Klimowska A, Kaluzny P, Radwan P, Bochenek M, Hanke W. 2017a. Human Semen Quality, Sperm DNA Damage, and the Level of Reproductive Hormones in Relation to Urinary Concentrations of Parabens. JOEM 59(11): 1034-1040. (Disponible en anglais seulement)
Jurewicz J, Radwan M, Wielgomas B, Klimowska A, Kaluzny P, Radwan P, Jakubowski L, Hanke W. 2017b. Environmental exposure to parabens and sperm chromosome disomy. International Journal of Environmental Health Research, 27(5): 332-343. (Disponible en anglais seulement)
Kang H et al. 2016. Urinary concentrations of parabens and their association with demographic factors: A population-based cross-sectional study. Environmental Research 146: 245–251 (Disponible en anglais seulement)
Kang S et al. 2013. Urinary paraben concentrations among pregnant women and their matching newborn infants of Korea, and the association with oxidative stress biomarkers. Science of the Total Environment 461–462: 214–221 (Disponible en anglais seulement)
Kang S, Che JH, Ryu DY, Kim TW, Li GX, Lee YS. 2002. Decreased Sperm Number and Motile Activity on the F1 Offspring Maternally Exposed to Butyl p-Hydroxybenzoic Acid (Butyl Paraben). Science of the Total Environment 461–462: 214–221 (Disponible en anglais seulement)
Kanno J, Onyon L, Peddada S, Ashby J, Elard J, Owens W. 2003. The OECD Program to Validate the Rat Uterotrophic Bioassay. Phase 2: Dose-Response Studies. Environmental Health Perspectives 111(12):1530-1549. (Disponible en anglais seulement)
Kawachi T, Yahagi T. 1980. Cooperative programme on short-term assays for carcinogenicity in Japan. IARC Sci Publ. 27:323-30. (Disponible en anglais seulement)
Kier LE et al. 1986. The Salmonella typhimurium/mammalian microsomal assay: A report of the U.S. Environmental Protection Agency Gene-Tox Program. Mutation Research 168: 69-240 (Disponible en anglais seulement)
Kim JW, Ramaswamy BR, Chang KH, Isobe T, Tanabe S. 2011. Multiresidue analytical method for the determination of antimicrobials, preservatives, benzotriazole UV stabilizers, flame retardants and plasticizers in fish using ultra high-performance liquid chromatography coupled with tandem mass spectrometry. Journal of Chromatography A, 1218 (22): 3511–3520. (Disponible en anglais seulement)
Kim S, Kim S, Won S, Choi K. 2017. Considering common sources of exposure in association studies - Urinary benzophenone-3 and DEHP metabolites are associated with altered thyroid hormone balance in the NHANES 2007–2008. Environment International 107: 25–32 (Disponible en anglais seulement)
Kim S, Kwack SJ, Lim SK, Kim YJ, Roh TH, Choi SM, Kim HS, Lee BM. 2015. Toxicological evaluation of isopropylparaben and isobutylparaben mixture in SpragueeDawley rats following 28 days of dermal exposure. Regulatory Toxicology and Pharmacology 73: 544-551 (Disponible en anglais seulement)
Kiwada H, Awazu S, Hanono M. 1979. The study on the biological fate of paraben at the dose of practical useage in rat. I. The metabolism and excretion of ethyl p-hydroxybenzoate (ethyl paraben) and p-hydroxybenzoic acid. J. Pharm. Dyn. 2: 356-364 (Disponible en anglais seulement)
Kiwada H, Awazu S, Hanono M. 1980. The study on the biological fate of paraben at the dose of practical useage in rat. II. The pharmacokinetic study on the blood concentration after the administration of ethyl paraben or p-hydroxybenzoic acid. J. Pharm. Dyn. 3: 353-363 (Disponible en anglais seulement)
Koda T, Umezu T, Kamata R, Morohoshi K, Ohta T, Morita M. 2005. Uterotrophic effects of benzophenone derivatives and a p-hydroxybenzoate used in ultraviolet screens. Environmental Research 98: 40–45 (Disponible en anglais seulement)
Kœppe ES, Ferguson KK, Colacino JA, Meeker JD. 2013. Relationship between urinary triclosan and paraben concentrations and serum thyroid measures in NHANES 2007–2008. Science of the Total Environment 445–446: 299–305 (Disponible en anglais seulement)
Kolatorova L, Viktu J, Hampl R, Adamcova K, Skodova T, Simkova M, Parizek A, Starka L, Duskova M. 2018. Exposure to bisphenols and parabens during pregnancy and relations to steroid changes. Environmental Research 163:115-122. (Disponible en anglais seulement)
Laborie S, Moreau-Guigon E, Alliot F, Desportes A, Oziol L. 2016. A new analytical protocol for the determination of 62 endocrine-disrupting compounds in indoor air. Talanta Elsevier 147: 132-141 (Disponible en anglais seulement)
Lee-Sarwar, K., Hauser, R., Calafat, A. M., Ye, X., O’Connor, G. T., Sandel, M., et al. (2017). Prenatal and early-life triclosan and paraben exposure and allergic outcomes. Journal of Allergy & Clinical Immunology, 27, 27. (Disponible en anglais seulement)
Lemini C, Hernandez A, Jaimez R, Franco Y, Avila ME, Castell A. 2004. Morphometric analysis of mice uteri treated with the preservatives methyl, ethyl, propyl, and butylparaben. Toxicology and Industrial Health 20: 123-132 (Disponible en anglais seulement)
Lemini C, Jaimez R, Avila ME, Franco Y, Larrea F, Lemus AE. 2003. In vivo and in vitro estrogen bioactivities of alkyl parabens. Toxicology and Industrial Health 19: 69-79. (Disponible en anglais seulement)
Lemini C, Silva C, Timossi D Luque A, Valverde M, Gonzalez-Martinez A, Hernandez C, Rubio-Poo C, Chavez Lara B, Valenzuela F. 1997. Estrogenic effects of p-hydroxybenzoic acid in CD1 mice. Environmental Research 75: 130-134. (Disponible en anglais seulement)
Lobemeier C, Tschoetschel C, Westie S, Heymann E. 1996. Hydrolysis of Parabenes by Extracts from Differing Layers of Human Skin. Biol. CHEM. 377: 647-651 (Disponible en anglais seulement)
Loretz L, Api AM, Barraj L, Burdick J, Davis DA, Dressler W, Gilberti E, Jarrett G, Mann S, Pan YHL, Re T, Renskers K, Scrafford C, Vater S. 2006. Exposure data for personal care products: Hairspray, spray perfume, liquid foundation, shampoo, body wash, and solid antiperspirant. Food Chem Toxicol 44: 2008-2018. (Disponible en anglais seulement)
Loretz LG, Api AM, Babcock L, Barraj LM, Burdick J, Cater KC, Jarrett G, Mann S, Pan YHL, Re TA, Renskers KJ, Scrafford CG. 2008. Exposure data for cosmetic products: Facial cleanser, hair conditioner, and eye shadow. Food Chem Toxicol 46: 1516-1524. (Disponible en anglais seulement)
Loretz LG, Api AM, Barraj LM, Burdick J, Dressler WE, Gettings SD, Han Hsu H, Pan YHL, Re TA, Renskers KJ, Rothenstein A, Scrafford CG, Sewall C. 2005. Exposure data for cosmetic products: lipstick, body lotion, and face cream. Food Chem Toxicol 43: 279-291. (Disponible en anglais seulement)
Martin JMP, Peropadre A, Herrero O, Freire PF, Labrador V, Hazen MJ. 2010. Oxidative DNA damage contributes to the toxic activity of propylparaben in mammalian cells. Mutation Research 702: 86–91 (Disponible en anglais seulement)
Mason MM, Cate CC, Baker J. 1971. Toxicology and Carcinogenesis of Various Chemicals Used in the Preparation of Vaccines. Clinical Toxicology 4(2): 185-204 (Disponible en anglais seulement)
Matthews C, Davidson J, Bauer E, Morrison JL, Richardson AP. 1956. p-Hydroxybenzoic Acid Esters as Preservatives II. Acute and Chronic Toxicity in Dogs, Rats, and Mice. Journal of the American Pharmaceutical Association XLV(4): 260-267 (Disponible en anglais seulement)
McCann J, Choi E, Yamasaki E, Ames BN. 1975. Detection of carcinogens as mutagens in the Salmonella/microsome test: Assay of 300 chemicals. Proc. Nat. Acad. Sci. USA 72(12): 5135-5139 (Disponible en anglais seulement)
Meeker JD, Yang T, Ye X, Calafat AM, Hauser R. 2011. Urinary Concentrations of Parabens and Serum Hormone Levels, Semen Quality Parameters, and Sperm DNA Damage. Environmental Health Perspectives 119(2): 252-257 (Disponible en anglais seulement)
Meylan W, Howard PH. 1991. Bond contribution method for estimating Henry’s Law constants. Environmental Toxicology and Chemistry 10: 1283-1293 (Disponible en anglais seulement)
Meylan W, Howard PH. 1993. Conputer estimation of the atmospheric gas-phase reaction rate of organic compounds with hydroxyl radicals and ozone. Chemosphere 26(12): 2293-2299 (Disponible en anglais seulement)
Minguez-Alarcon L et al. 2016. Urinary paraben concentrations and in vitro fertilization outcomes among women from a fertility clinic. Fertility and Sterility 105(3): 714-721 (Disponible en anglais seulement)
Moos RK, Angerer J, Dierkes G, Brüning T, Koch HM. 2016. Metabolism and elimination of methyl, iso- and n-butyl paraben in human urine after single oral dosage. Arch Toxicol 90: 2699–2709 (Disponible en anglais seulement)
Moos RK, Angerer J, Wittsiepe J, Wilhelm M, Brüning T, Koch HM. 2014. Rapid determination of nine parabens and seven other environmental phenols in urine samples of German children and adults. International Journal of Hygiene and Environmental Health 217: 845–853 (Disponible en anglais seulement)
Moos RK, Apel P, Schroter-Kermani C, Kolossa-Gehring M, Bruning T, Koch HM. 2017. Daily intake and hazard index of parabens based upon 24h urine samples of the German Environmental Specimen Bank from 1995 to 2012. J. Expo. Sci. Environ. Epidemiol. 27(6): 591-600 (Disponible en anglais seulement)
Moos RK, Koch HM, Angerer J, Apel P, Schröter-Kermani C, Brüning T, Kolossa-Gehring M. 2015. Parabens in 24 h urine samples of the German EnvironmentalSpecimen Bank from 1995 to 2012. International Journal of Hygiene and Environmental Health 218: 666–674 (Disponible en anglais seulement)
Moreau-Guigon E, Alliot F, Gasperi J, Blanchard M, Teil MJ, Mandin C, Chevreuil M. 2016. Seasonal fate and gas/particle partitioning of semi-volatile organic compounds in indoor and outdoor air. Atmospheric Environment 147: 423-433 (Disponible en anglais seulement)
Morita K, Ishigaki M, Abe T. 1981. Mutagenicity of Materials related with Cosmetics. J. Soc. Cosmet. Chem. Japan. 15(3): 243-253 (Disponible en anglais seulement)
Moriyama I, Hiraoka K, Yamaguchi R. 1975. Teratogenic effects of food additive ethyl-p-hydroxy benzoate studies in pregnant rats. Acta Obst et Hynaec Jap 22(2): 94-106 (Disponible en anglais seulement)
Mulla H et al. 2015. An Observational Study of Blood Concentrations and Kinetics of Methyl- and Propyl-Parabens in Neonates. Pharm Res 32: 1084–1093 (Disponible en anglais seulement)
Myridakis A, Chalkiadaki G, Fotou M, Kogevinas M, Chatzi L, Stephanou EG. 2016. Exposure of Preschool-Age Greek Children (RHEA Cohort) to Bisphenol A, Parabens, Phthalates, and Organophosphates. Environ. Sci. Technol. 50: 932−941 (Disponible en anglais seulement)
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme. 2016. Parabens: Human helath tier II assessment. Australian Government, Department of Health. (Disponible en anglais seulement)
[NTP] National Toxicology Program. 2005. Butylparaben [CAS No. 94-26-8] Review of Toxicological Literature. (Disponible en anglais seulement)
Nera EA, Lok E, Iverson F, Ormsby E, Karpinski KF, Clayson DB. Short-term pathological and proliferative effects of butylated hydroxyanisole and other phenolic antioxidants in the forestomach of Fischer 344 rats. Toxicology 32: 197-213 (Disponible en anglais seulement)
Nishihama T, Kawakami N, Hatanaka T, Kawakami J, Adachi I. 2003. Age Dependency of Esterase Activity in Rat and Human Keratinocytes. Biol. Pharm. Bull. 26(9): 1311-1314 (Disponible en anglais seulement)
Nishihama Y, Yoshinaga J, Iida A, Konishi S, Imai H, Yoneyama M, Nakajima D, Shiraishi H. 2016. Association between paraben exposure and menstrual cycle in female university students in Japan. Reprod. Toxicol. 63: 107-113 (Disponible en anglais seulement)
Nunez L, Tadeo JL, Garcia-Valcarcel AI, Turiel E. 2008. Determination of parabens in environmental solid samples by ultrasonic-assisted extraction and liquid chromatography with triple quadrupole mass spectrometry. Journal of Chromatography A 1214: 178–182 (Disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2007. Essai n° 440 : Bio-essai utérotrophique chez les rongeurs : Essai de dépistage à court terme des propriétés oestrogéniques, Lignes directrices de l’OCDE pour les essais de produits chimiques, Section 4, Éditions OCDE, Paris.
Odashima, S., 1976. The cooperative development in Japan of methods for screening chemicals for carcinogenicity. IARC Scientific Publication (United Nations) 12, 61–79. (Disponible en anglais seulement)
OECD QSAR Toolbox. 2016. Paris (FR): Organisation de coopération et de développement économiques, Laboratory of Mathematical Chemistry. (Disponible en anglais seulement)
Ohta R, Tagaki A, Ohmukai H, Marumo H, Ono A, Matsushima Y, Inoue T, Ono H, Kanna J. 2012. Ovariectomized mouse uterotrophic assay of 36 chemicals. The Journal of Toxicological Sciences 37(5): 879-889 (Disponible en anglais seulement)
Oishi S. 2001. Effects of butylparaben on the male reproductive system in rats. Toxicology and Industrial Health 17: 31-39 (Disponible en anglais seulement)
Oishi S. 2002. Effects of propyl paraben on the male reproductive system. Food and Chemical Toxicology 40: 1807–1813 (Disponible en anglais seulement)
Oishi S. 2004. Lack of spermatotoxic effects of methyl and ethyl esters of p-hydroxybenzoic acid in rats. Food and Chemical Toxicology 42: 1845–1849 (Disponible en anglais seulement)
Okubo T, Yokoyama Y, Kano K, Kano I. 2001. ER-dependent estrogenic activity of parabens assessed by proliferation of human breast cancer MCF-7 cells and expression of ERa and PR. Food and Chemical Toxicology 39: 1225–1232 (Disponible en anglais seulement)
Onodera H, Mitsumori K, Yasuhara K, Shimo T, Kurokawa N, Takahashi M. 1994. 13 week subchronic oral toxicity study of isopropyl p-hydroxybenzoate in F344 rats. Eisei Shikenjo Hokoku. 112: 82-88 (Disponible en anglais seulement)
[PCPC] Personal Care Products Council. 2018. Cosmetic Ingredient Identification Database (International Cosmetic Ingredient Dictionary (INCI)). [Site consulté le 25 mai May]. (Disponible en anglais seulement)
Perez RA, Albero B, Miguel E, Sanchez-Brunete C. 2011. Determination of parabens and endocrine-disrupting alkylphenols in soil by gas chromatography–mass spectrometry following matrix solid-phase dispersion or in-column microwave-assisted extraction: a comparative study. Anal Bioanal Chem 402:2347–2357 (Disponible en anglais seulement)
Petersen B, Wulf HC. 2014. Application of sunscreen – theory and reality. Photodermatology, Photoimmunology & Photomedicine. 30:96-101. (Disponible en anglais seulement)
Philippat C, Botton J, Calafat AM, Ye X, Charles MA, Slama R, EDEN Study Group. 2014. Prenatal Exposure to Phenols and Growth in Boys. Epidemiology 25: 625–635 (Disponible en anglais seulement)
Polinski KJ, Dabelea D, Hamman RF, Adgate JL, Calafat AM, Ye X, et al. 2018. Distribution and predictors of urinary concentrations of phthalate metabolites and phenols among pregnant women in the healthy start study. Environ Res 162:308-317. (Disponible en anglais seulement)
Pouliot L. 2013. Propylparaben: Three-Month Oral Developmental Study in Juvenile Rats. Test Facility Study No. 9000049. BMS Reference No. DN12114. 30 October 2013. Charles River Laboratories Preclinical Services. (Disponible en anglais seulement)
Prival MJ, Sheldon AT, Popkin D. 1982. Evaluation, using Salmonella typhimurium, of the mutagenicity of seven chemicals found in cosmetics. Fd Chem. Toxic. 20: 427-432 (Disponible en anglais seulement)
Prival MJ, Simmon VF, Mortelmans KE. 1991. Bacterial mutagenicity testing of 49 food ingredients gives very few positive results. Mutation Research 260: 321-329 (Disponible en anglais seulement)
Prusakiewicz JJ, Ackermann C, Voorman R. 2006. Comparison of skin esterase activities from different species. Pharmaceutical Research 23(7): 1517-1524 (Disponible en anglais seulement)
Pugazhendhi D, Pope GS, Darbre PD. 2005. Oestrogenic activity of p-hydroxybenzoic acid (common metabolite of paraben esters) and methylparaben in human breast cancer cell lines. Journal of Applied Toxicology 25:301-309. (Disponible en anglais seulement)
Ramírez N, Marcé RM, Borrull F. 2010. Development of a thermal desorption-gas chromatography–mass spectrometry method for determining personal care products in air. Journal of Chromatography A 1217: 4430–4438 (Disponible en anglais seulement)
Ramírez N, Marcé RM, Borrull F. 2011. Determination of parabens in house dust by pressurised hot water extraction followed by stir bar sorptive extraction and thermal desorption–gas chromatography–mass spectrometry. Journal of Chromatography A 1218: 6226– 6231 (Disponible en anglais seulement)
[REACH] Enregistrement, évaluation, autorisation et restriction des substances chimiques. 2018a. A registration dossier for Methyl 4-hydroxybenzoate [CAS RN 99-76-3] submitted to REACH. [Cité en mai 2018]. (Disponible en anglais seulement)
[REACH] Enregistrement, évaluation, autorisation et restriction des substances chimiques. 2018b. A registration dossier for Ethyl 4-hydroxybenzoate [CAS RN 120-47-8] submitted to REACH. [Cité en mai 2018]. (Disponible en anglais seulement)
[REACH] Enregistrement, évaluation, autorisation et restriction des substances chimiques. 2018c. A registration dossier for Propyl 4-hydroxybenzoate [CAS RN 94-13-3] submitted to REACH. [Cité en mai 2018]. (Disponible en anglais seulement)
[REACH] Enregistrement, évaluation, autorisation et restriction des substances chimiques. 2018d. A registration dossier for Benzyl 4-hydroxybenzoate [CAS RN 94-18-8] submitted to REACH. [Cité en mai 2018]. (Disponible en anglais seulement)
[REACH] Enregistrement, évaluation, autorisation et restriction des substances chimiques. 2018e. A registration dossier for Isopropyl 4-hydroxybenzoate [CAS RN 4191-73-5] submitted to REACH. [Cité en mai 2018]. (Disponible en anglais seulement)
Reddy A, Norris DF, Momeni SS, Waldo B, Ruby JD. The pH of beverages in the United States. The Journal of the American Dental Association 147(4):255-63. (Disponible en anglais seulement)
Renz L, Volz C, Michanowicz D, Ferrar K, Christian C, Lenzner D, El-Hefnawy T. 2013. A study of parabens and bisphenol A in surface water and fish brain tissue from the Greater Pittsburgh Area. Ecotoxicology; 22(4):632-41. (Disponible en anglais seulement)
[RIVM] The Netherlands National Insititute for Public Health and the Environment. Exposure to and toxicity of methyl-, ethyl- and propylparaben: A literature review with a focus on endocrine-disruption properties. RIVM Report 2017-0028. (Disponible en anglais seulement)
Rodrigues C, Lok E, Nera E, Iverson F, Page D, Karpinski K, Clayson DB. 1986. SHORT-TERM Effects of various phenols and acids onteh Fischer 344 male rat forestomach epithelium. Toxicology, 38: 103-117 (Disponible en anglais seulement)
Routledge EJ, Parker J, Odum J, Ashby J, Sumpter JP. 1998. Some alkyl hydroxy benzoate preservatives (parabens) are estrogenic. Toxicology and Applied Pharmacology 153: 12–19 (Disponible en anglais seulement)
[RSI] Risk Sciences International. 2018. Final Report: Reproductive and Endocrine Effects Associated with Parabens. Raport prepare pour Santé Canada. 13 avril 2018. (Disponible en anglais seulement)
Sabalitschka T, Neufeld-Crzellitzer. 1954. Zum Verhalten der p-oxybenzosaureester im menschlichen Korper (translated from the original German. Arzneimittelforsch 4: 575-579. [Tel que cité dans Andersen 2008 and Soni 2005] (Disponible en anglais seulement)
Sado, I., 1973. Synergistic toxicity of official permissible preservative food additives. Japanese Journal of Hygiene 28, 463–476. [Tel que cité dans Soni 2005 and REACH 2018b] (Disponible en anglais seulement)
Santé Canada. [Document modifié le 14 décembre 2015]. Liste critique des ingrédients de cosmétiques. Ottawa (Ont.), Gouvernement du Canada. [Site consulté le 18 août 2017].
Santé Canada. 1995. Enquête sur l’exposition des êtres humains aux contaminants dans le milieu : Un guide pour les calculs de l’exposition. Ottawa (Ont.), Santé Canada, Programme « Les Grands Lacs : Impact sur la santé ».
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport non publié. Ottawa (ON): Santé Canada, Direction de l’hygiène du milieu (Disponible en anglais seulement)
Santé Canada. 2015. Tableau de la consommation des aliments fondé sur l’Enquête sur la santé dans les collectivités canadiennes, cycle 2.2, Nutrition (2004) réalisée par Statistique Canada, fichier partagé. Ottawa.
Santé Canada. 2017a. Quatrième rapport sur la biosurveillance humaine des substances chimiques de l’environnement au Canada. Résultats de l’Enquête canadienne sur les mesures de la santé Cycle 4 (2014 à 2015) [PDF].
Santé Canada. 2017b. Standard Operating Procedure: Analysis of parabens in human urine by UPLC MS MS. Food Directorate - Western Region Laboratory. WES-MET-0185, Revision 9. (Disponible en anglais seulement)
Santé Canada. 2018a. Supporting Documentation: Evaluation of Epidemiologic Studies on Parabens. Ottawa (ON): Santé Canada. Disponible à : substances@ec.gc.ca. (Disponible en anglais seulement)
Santé Canada. 2018b. Supporting Documentation: Results and interpretation of an in vitro dermal absorption and metabolism study of methyl, ethyl, propyl, butyl, iso-propyl, and iso-butylparaben. Ottawa (ON): Santé Canada. Disponible à : substances@ec.gc.ca. (Disponible en anglais seulement)
Saravanabhavan G, Walker M, Guay M, Aylward L. 2014. Urinary excretion and daily intake rates of diethyl phthalate in the general Canadian population. Science of the Total Environment 500-501: 191-198. (Disponible en anglais seulement)
Sasaki M, Sugimura K, Yoshida A, Abe S. 1980. Cytogenic effects of 60 chemical on cultured human and Chinese hamster cells. La Kromosomo 2(20): 574-584 (Disponible en anglais seulement)
Savage JH, Matsui EC, Wood RA, Keet CA. 2012. Urinary levels of triclosan and parabens are associated with aeroallergen and food sensitization. J Allergy Clin Immunol 130(2): 453-460 (Disponible en anglais seulement)
Schlumpf M, Kypke K, Wittassek M, Angerer J, Mascher H, Mascher D, Vökt C, Birchler M, Lichtensteiger W. 2010. Exposure patterns of UV filters, fragrances, parabens, phthalates, organochlor pesticides, PBDEs, and PCBs in human milk: correlation of UV filters with use of cosmetics. Chemosphere 81(10):1171-1183. (Disponible en anglais seulement)
[SDS] Safety Data Sheet 2008a. Washable Ink. Hauppauge, New York, USA. Liqui-Mark (Disponible en anglais seulement)
[SDS] Safety Data Sheet 2008b. Embellishment Glue Stick. Chatsworth, California, USA. Pioneer Photo Albums. (Disponible en anglais seulement)
[SDS] Safety Data Sheet 2010. All Purpose Wipe. Lin’an Hangzhou, Zhejiang, China. Lin’an Thumb Cleaning Products Co. Ltd. (Disponible en anglais seulement)
Shekhar S, Sood S, Showkat S, Lite C, Chandrasekhar A, Vairamani M, Barathi S, Santosh W. 2017. Detection of phenolic endocrine disrupting chemicals (EDCs) from maternal blood plasma and amniotic fluid in Indian population. General and Comparative Endocrinology 241: 100–107 (Disponible en anglais seulement)
Shibata MA, Yamada M, Hirose M, Asakawa E, Tatematsu M, Ito N. 1990. Early proliferative responses of forestomach and glandular stomach of rats treated with five different phenolic antioxidants. Carcinogenesis 11(3): 425-429 (Disponible en anglais seulement)
Sivaraman L, Pouliot L, Wang B, Brodie T, Graziano M, McNerney ME. 2018. Safety assessment of propylparaben in juvenile rats. Regulatory Toxicology and Pharmacology 92: 370–381 (Disponible en anglais seulement)
Smarr MM, Sundaram R, Honda M, Kannan K, Buck LG. 2017. Urinary concentrations of parabens and other antimicrobial chemicals and their association with couples’ fecundity. Environ. Health Perspect. 125(4): 730-736 (Disponible en anglais seulement)
Smith KW et al. 2012 Predictors and Variability of Urinary Paraben Concentrations in Men and Women, Including before and during Pregnancy. Environmental Health Perspectives 120(11): 1538-1543 (Disponible en anglais seulement)
Smith KW, Souter I, Dimitriadis I, Ehrlich S, Williams PL, Calafat AM, Hauser R. 2013. Urinary Paraben Concentrations and Ovarian Aging among Women from a Fertility Center. Environmental Health Perspectives 121(11-12): 1299-1305 (Disponible en anglais seulement)
Soni MG, Burdock GA, Taylor SL and Greenberg NA. 2001. Safety assessment of propyl paraben: a review of the published literature. Food and Chemical Toxicology, 39 (6):513-532. (Disponible en anglais seulement)
Soni MG, Carabin IG, Burdock GA. 2005. Safety assessment of esters of p-hydroxybenzoic acid (parabens). Food and Chemical Toxicology, 43(7):985-101 (Disponible en anglais seulement)
Spanier AJ, Fausnight T, Camacho TF, Braun JM. 2014. The associations of triclosan and paraben exposure with allergen sensitization and wheeze in children. Allergy Asthma Proc 35: 475–481 (Disponible en anglais seulement)
Statistique Canada. 2012. Custom tabulation of grooming products data from the Canadian Health Measures Survey Cycle 1 (2007-2009). Préparé par Statistique Canada pour le Bureau d’évaluation du risque des substances existantes de Santé Canada. Non publié. (Disponible en anglais seulement)
Strittholt CA, McMillan DA, He T, Baker RA, Barker ML 2016. A randomized clinical study to assess ingestion of dentrifrice by children. Regulatory Toxicology and Pharmacology 75: 66-71 (Disponible en anglais seulement)
Stump DG, Connor JCO, Lewis JM, Marty MS. 2014. Key Lessons from Performance of the U.S. EPA Endocrine Disruptor Screening Program (EDSP) Tier 1 Male and Female Pubertal Assays. Birth Defects Research (Part B) 101: 43–62 (Disponible en anglais seulement)
Sun L, Yu T, Guo J, Zhang Z, Hu Y, Xiao X, Sun Y, Xiao H, Li J, Zhu D, Sai L, Li J. 2016. The estrogenicity of methylparaben and ethylparaben at doses close to the acceptable daily intake in immature Sprague-Dawley rats. Scientific Reports 6(25173):1-9 (Disponible en anglais seulement)
Taxvig C, Olesen PT, Nellemann C. 2011. Use of external metabolizing systems when testing for endocrine disruption in the T-screen assay. Toxicology and Applied Pharmacology 250: 263–269 (Disponible en anglais seulement)
Taxvig C, Vinggaard AM, Hass U, Axelstad M, Boberg J, Hansen PR, Frederiksen H, Nellemann C. 2008. Do Parabens Have the Ability to Interfere with Steroidogenesis? Toxicological Sciences 106(1), 206–213 (2008) (Disponible en anglais seulement)
Tayama S, Nakagawa Y, Tayama K. 2008. Genotoxic effects of environmental estrogen-like compounds in CHO-K1 cells. Mutation Research 649:114–125 (Disponible en anglais seulement)
Terasaki M, Kamata R, Shiraishi F, Makino M. 2009. Evaluation of estrogenic activity of parabens and their chlorinated derivateives by using the yeast two-hybrid assay and the enzyme-linked immunosorbent assay. Environmental Toxicology and Chemistry, 28(1):204–208 (Disponible en anglais seulement)
Towers CV et al. 2015. Transplacental passage of antimicrobial paraben preservatives. Journal of Exposure Science and Environmental Epidemiology 25: 604–607 (Disponible en anglais seulement)
Tran TM, Minh TB, Kumosani TA, Kannan K. 2016. Occurrence of phthalate diesters (phthalates), p-hydroxybenzoic acid esters (parabens), bisphenol A diglycidyl ether (BADGE) and their derivatives in indoor dust from Vietnam: Implications for exposure. Chemosphere 144: 1553–1559 (Disponible en anglais seulement)
Tsukamoto, H., Terada, S., 1964. Metabolism of drugs. XLVII. Metabolic fate of p-hydroxybenzoic acid and its derivatives in rabbits. Chemical and Pharmaceutical Bulletin 12(7):765–769. (Disponible en anglais seulement)
Valle-Sistac J, Molins-Delgado D, Díaz M, Ibáñez L, Barceló D, Díaz-Cruz MS. 2016. Determination of parabens and benzophenone-type UV filters in human placenta. First description of the existence of benzyl paraben and benzophenone-4. Environment International 88: 243–249 (Disponible en anglais seulement)
van Meeuwen JA, van Son O, Piersma AH, de Jong PC, van den Berg M. 2008. Aromatase inhibiting and combined estrogenic effects of parabens and estrogenic effects of other additives in cosmetics. Toxicology and Applied Pharmacology 230:372–382. (Disponible en anglais seulement)
Vernet C et al. 2017. In utero exposure to select phenols and phthalates and respiratory health in five-year-old boys: A prospective study. Environ. Health Perspect. 125(9) (Disponible en anglais seulement)
Viglino L, Prevost M, Sauve S. 2011. High throughput analysis of solid-bound endocrine disruptors by LDTD-APCI-MS/MS. J. Environ. Monit. 13: 583–590 (Disponible en anglais seulement)
Vo TTB, Jeung EB. 2009. An Evaluation of Estrogenic Activity of Parabens Using Uterine Calbindin-D9k Gene in an Immature Rat Model. TOXICOLOGICAL SCIENCES 112(1), 68–77 (Disponible en anglais seulement)
Vo TTB, Yoo YM, Choi KC, Jeung EB. 2010. Potential estrogenic effect(s) of parabens at the prepubertal stage of a postnatal female rat model. Reproductive Toxicology 29: 306–316 (Disponible en anglais seulement)
Wang L, Asimakopoulos AG, Kannan K. 2015. Accumulation of 19 environmental phenolic and xenobiotic heterocyclic aromatic compounds in human adipose tissue. Environment International 78: 45–50 (Disponible en anglais seulement)
Wang L, Liao C, Liu F, Wu Q, Guo Y, Moon HB, Nakata H, Kannan K. 2012. Occurrence and Human Exposure of p Hydroxybenzoic Acid Esters (Parabens), Bisphenol A Diglycidyl Ether (BADGE), and Their Hydrolysis Products in Indoor Dust from the United States and Three East Asian Countries. Environmental Science & Technology (46): 11584-11593 (Disponible en anglais seulement)
Wang L, Wu Y, Zhang W, Kannan K. 2013b. Characteristic profiles of urinary p-hydroxybenzoic acid and its esters (parabens) in children and adults from the United States and China. Envirionmental Science & Technology, 47:2069-2076. (Disponible en anglais seulement)
Wang, L. and Kannan, K. 2013a. Alkyl Protocatechuates as Novel Urinary Biomarkers of Exposure to p-Hydroxybenzoic Acid Esters (Parabens). Environment International, 59, 27-32. (Disponible en anglais seulement)
Wilson R, Jones-Otazo H, Petrovic S, Mitchell I, Bonvalot Y, Williams D, Richardson GM. 2013. Revisiting dust and soil ingestion rates based on hand-to-mouth transfer. Human and Ecological Risk Assessment 19(1): 158-188. (Disponible en anglais seulement)
Wolff MS; Pajak A; Pinney SM; Windham GC; Galvez M; Rybak M. 2017. Associations of urinary phthalate and phenol biomarkers with menarche in a multiethnic cohort of young girls. Reproductive Toxicology 67: 56-64 (Disponible en anglais seulement)
Wolff MS; Teitelbaum SL; McGovern K; Pinney SM; Windham GC; Galvez M. 2015. Environmental phenols and pubertal development in girls. Environment International 84: 174-180 (Disponible en anglais seulement)
Wormuth M, Scheringer M, Vollenweider M, Hungerbuhler K. 2006. What are the sources of exposure to eight frequently used pthalic acid esters in Europeans? Risk Anal 26(3): 803-824. (Disponible en anglais seulement)
Wu C et al. 2017. Maternal urinary paraben levels and offspring size at birth from a Chinese birth cohort. Chemosphere 172: 29-36 (Disponible en anglais seulement)
Wu X, Bennett DH, Ritz B, Cassady DL, Lee K, Hertz-Picciotto I. 2010. Usage pattern of personal care products in California households. Food Chem Toxicol 48: 3109-3119 (Disponible en anglais seulement)
Xue J, Wu Qian, Sakthivel S, Pavithran PV, Vasukutty JR, Kannan K. 2015. Urinary levels of endocrine-disrupting chemicals, including bisphenols, bisphenol A diglycidyl ethers, benzophenones, parabens, and triclosan in obese and non-obese Indian children. Environmental Research 137: 120–128 (Disponible en anglais seulement)
Yang Y, Hong Y, Chae SA. 2016. Reduction in semen quality after mixed exposure to bisphenol A and isobutylparaben in utero and during lactation periods. Human and Experimental Toxicology 35(8): 902-911 (Disponible en anglais seulement)
Ye X, Bishop AM, Reidy JA, Needham LL, Calafat AM. 2006. Parabens as urinary biomarkers of exposure in humans. Environmental health perspectives; 114(12):1843-1846. (Disponible en anglais seulement)
Zhang L et al. 2014. Effects of n-butylparaben on steroidogenesis and spermatogenesis through changed E2 levels inmale rat offspring. Environmental Toxicology and pharmacology 37: 705–717 (Disponible en anglais seulement)
Annexe A. Dose journalière estimée de parabènes à partir des données de biosurveillance
La dose journalière estimée de parabènes a été calculée à partir des données de biosurveillance à l’aide de l’équation suivante :
Dose journalière estimée (µg/kg p.c./j) = TEU (µg/kg p.c./j)/EUF
où TEU est le taux d’élimination urinaire et EUF est le taux d’élimination urinaire fractionnée.
La valeur TEU a été calculée à l’aide de l’équation suivante (Saravanabhavan et coll. 2014) :
TEU (µg/kg p.c./j) = [CUCr (µg/g Cr) × TEC (mg/j)]/ P.C. (kg)
où CUCr est la concentration urinaire ajustée en fonction de la créatinine, TEC est le taux d’élimination de créatinine et P.C. est le poids corporel.
La valeur TEC a été calculée en utilisant l’équation de Mage :
TEC = [0,993*1,64 [140 – Âge] (Poids1,5 Taille0,5)/1000]
Les valeurs par défaut utilisées pour calculer la TEC sont présentées dans le tableau A‑1.
| Groupe d’âge d’après les sourcesa | Âge (années)b | Poids (kg)c | Taille (cm)d |
|---|---|---|---|
| 3 à 5 | 2,5 | 15,5 | 90 |
| 6 à 11 | 8 | 31 | 127 |
| 12 à 19 | 15,5 | 59,4 | 162 |
| 20 à 59 | 39,5 | 70,9 | 163 |
| 60 à 79 | 60 | 72 | 163 |
| Nouveau-nés | 0 | 3,3e | 50e |
a Santé Canada 2017a, Kang et coll. 2013.
b À l’exception des nouveau-nés, les âges ont été choisis de manière à aligner les groupes d’âge indiqués dans la littérature sur les groupes d’âge par défaut du PGPC.
c À l’exception des nouveau-nés, les poids ont été basés sur les valeurs par défaut des scénarios d’exposition du PGPC.
d Les tailles sont les valeurs au 50e centile des Normes de croissance de l’enfant de l’OMS (https://www.who.int/childgrowth/standards/fr/).
e La taille et le poids des nouveau-nés sont les valeurs au 50e centile des Normes de croissance de l’enfant de l’OMS (https://www.who.int/childgrowth/standards/fr/).
| Substance | Âge (ans)a | TEC (mg/j)b | Paramètre | CUCr, P95 (IC) (µg/g Cr)c | TEU (µg/kg p.c./j) |
EUFd | DJE, P95 (IC) (µg/kg p.c./j) |
|---|---|---|---|---|---|---|---|
| Méthylparabène | 2,25 | 130 | MG | 21 (16–27) | 0,18 (0,13–0,23) | 0,174 | 1,0 (0,77–1,3) |
| Méthylparabène | 2,25 | 130 | P95 | 430 (200–660)e | 3,6 (1,7–5,5) | 0,174 | 21 (10–32) |
| Méthylparabène | 8 | 418 | MG | 8,4 (7,1–9,8) | 0,11 (0,10–0,13) | 0,174 | 0,65 (0,55–0,76) |
| Méthylparabène | 8 | 418 | P95 | 620 (340–890)f | 8,4 (4,6–12) | 0,174 | 48 (26–69) |
| Méthylparabène | 15,5 | 1182 | MG | 9,9 (6,7–15)e | 0,20 (0,13–0,30) | 0,174 | 1,1 (0,77–1,7) |
| Méthylparabène | 15,5 | 1182 | P95 | 370 (100–640)e | 7,4 (2,0–13) | 0,174 | 42 (11–73) |
| Méthylparabène | 39,5 | 1248 | MG | 19 (10–35)e | 0,33 (0,18–0,62) | 0,174 | 1,9 (1,0–3,54) |
| Méthylparabène | 39,5 | 1248 | P95 | 310 (130–490)e | 5,5 (2,3–8,6) | 0,174 | 31 (13–50) |
| Méthylparabène | 60 | 1017 | MG | 20 (16–23) | 0,28 (0,23–0,32) | 0,174 | 1,6 (1,3–1,9) |
| Méthylparabène | 60 | 1017 | P95 | 620 (340–890) | 8,8 (4,8–13) | 0,174 | 50 (28–72) |
| Éthylparabène | 2,25 | 130 | MG | NCg | NC | 0,137 | NC |
| Éthylparabène | 2,25 | 130 | P95 | 120 (54–90)h | 1,0 (0,45–1,6) | 0,137 | 7,4 (3,4–12) |
| Éthylparabène | 8 | 418 | MG | NCg | NC | 0,137 | NC |
| Éthylparabène | 8 | 418 | P95 | 4,6 (2,2–7,1)e | 0,06 (0,03–0,10) | 0,137 | 0,46 (0,22–0,71) |
| Éthylparabène | 15,5 | 1182 | MG | NCg | NC | 0,137 | NC |
| Éthylparabène | 15,5 | 1182 | P95 | 120 (54–90)h | 2,4 (1,1–3,8) | 0,137 | 18 (8,0–28) |
| Éthylparabène | 39,5 | 1248 | MG | NCg | NC | 0,137 | NC |
| Éthylparabène | 39,5 | 1248 | P95 | 120 (54–90)h | 2,1 (0,95–3,3) | 0,137 | 16 (7,0–25) |
| Éthylparabène | 60 | 1017 | MG | NCg | NC | 0,137 | NC |
| Éthylparabène | 60 | 1017 | P95 | 70 (29–110)e | 0,99 (0,41–1,6) | 0,137 | 7,3 (3,0–12) |
| Propylparabène | 2,25 | 130 | MG | 2,6 (2,0–3,4) | 0,02 (0,02–0,03) | 0,097 | 0,22 (0,17–0,29) |
| Propylparabène | 2,25 | 130 | P95 | 68 (20–120)e | 0,57 (0,17–1,0) | 0,097 | 5,9 (1,7–10) |
| Propylparabène | 8 | 418 | MG | 1,4 (1,1–1,7) | 0,02 (0,01–0,02) | 0,097 | 0,19 (0,15–0,24) |
| Propylparabène | 8 | 418 | P95 | 190 (110–280)f | 2,6 (1,5–3,8) | 0,097 | 26 (15–39) |
| Propylparabène | 15,5 | 1182 | MG | 1,7 (1,2–2,4) | 0,03 (0,02–0,05) | 0,097 | 0,35 (0,25–0,49) |
| Propylparabène | 15,5 | 1182 | P95 | 85 (42–130)e | 1,7 (0,8–2,6) | 0,097 | 17 (8,6–27) |
| Propylparabène | 39,5 | 1248 | MG | 5,1 (3,0–8,5)i | 0,09 (0,05–0,15) | 0,097 | 0,93 (0,54–1,5) |
| Propylparabène | 39,5 | 1248 | P95 | 96 (29–160)e | 1,7 (0,5–2,8) | 0,097 | 17 (5,3–29) |
| Propylparabène | 60 | 1017 | MG | 2,9 (2,0–4,2)e | 0,04 (0,03–0,06) | 0,097 | 0,42 (0,29–0,61) |
| Propylparabène | 60 | 1017 | P95 | 190 (110–280)e | 2,7 (1,6–4,0) | 0,097 | 28 (16–41) |
| Butylparabène | 2,25 | 130 | MG | NCg | NC | 0,056 | NC |
| Butylparabène | 2,25 | 130 | P95 | 3,1 (< LD–5,1)e | 0,03 (NC–0,04) | 0,056 | 0,46 (NC–0,8) |
| Butylparabène | 8 | 418 | MG | NCg | NC | 0,056 | NC |
| Butylparabène | 8 | 418 | P95 | 0,8 (0,3–1,3)e | 0,01 (0,00–0,02) | 0,056 | 0,19 (0,07–0,31) |
| Butylparabène | 15,5 | 1182 | MG | NCg | NC | 0,056 | NC |
| Butylparabène | 15,5 | 1182 | P95 | 9,2 (< LD–15)h | 0,18 (NC–0,30) | 0,056 | 3,3 (NC–5,3) |
| Butylparabène | 39,5 | 1248 | MG | NCg | NC | 0,056 | NC |
| Butylparabène | 39,5 | 1248 | P95 | 9,2 (< LD–15)h | 0,16 (NC–0,26) | 0,056 | 2,9 (NC–4,72) |
| Butylparabène | 60 | 1017 | MG | NCg | NC | 0,056 | NC |
| Butylparabène | 60 | 1017 | P95 | 6,7 (2,1–11)e | 0,09 (0,03–0,16) | 0,056 | 1,7 (0,53–2,8) |
Abréviations : TEC = taux d’élimination de la créatinine; CUCr = concentration urinaire ajustée pour la créatinine; TEU = taux d’élimination urinaire; EUF = élimination urinaire fractionnée; DJE = dose journalière estimée; MG = moyenne géométrique; P95 = 95e centile; IC = intervalle de confiance; NC = valeur non calculée; LD = limite de détection.
a L’âge utilisé pour calculer la clairance de la créatinine était l’âge médian des groupes d’âge utilisés dans les scénarios d’exposition.
b Le taux d’élimination de la créatinine a été calculé en utilisant l’équation de Mage [0,993*1,64 [140 – Âge] (Poids1,5 Taille0,5)/1000].
c Les valeurs de la moyenne géométrique des concentrations urinaires et les valeurs P95 (Santé Canada 2017a) étaient pour les groupes d’âge déclarés dans l’ECMS qui ressemblaient le plus aux groupes d’âge pour les estimations du TDU.
d Moos et coll. 2016, 2017.
e Ces valeurs étaient associées à une variabilité d’échantillonnage élevée (c.‑à‑d. un coefficient de variation entre 16,6 % et 33,3 %). Santé Canada recommande d’utiliser ces données avec prudence (Santé Canada 2017a).
f Les données de l’ECMS pour le 95e centile dans cette strate d’âge ont été supprimées en raison d’une grande variabilité et la tranche d’âge « 60 à 79 ans » a été utilisée comme données de substitution. Bien que la valeur au 95e centile pour ce groupe ne soit pas déclarée, cette approche est jugée prudente, car la valeur utilisée pour estimer la dose journalière est la valeur au 95e centile qui a été rapportée pour cette substance.
g Les moyennes géométriques n’ont pas été calculées, car > 40 % des échantillons étaient sous la limite de détection (Santé Canada 2017a).
h Les données de l’ECMS pour le 95e centile dans cette strate d’âge ont été supprimées en raison d’une grande variabilité et on a utilisé les données pour les « femmes de 3 à 79 ans » comme données de substitution. Bien que la valeur au 95e centile pour ce groupe ne soit pas connue, cette approche est jugée prudente, car la valeur utilisée pour estimer la dose journalière est la valeur au 95e centile pour cette substance.
i Les données de l’ECMS pour la moyenne géométrique dans cette strate d’âge ont été supprimées en raison d’une grande variabilité et le groupe « Filles et femmes, 3 à 79 ans » a été utilisé comme données de substitution. Bien que la moyenne géométrique pour ce groupe ne soit pas connue, cette approche est jugée prudente, car la valeur utilisée pour estimer la dose journalière est la moyenne géométrique pour cette substance.
| Population | Années d’échantillonnage | Méthyl-parabène | Éthyl-parabène | Propyl-parabène | Butyl-parabène | n | Source |
|---|---|---|---|---|---|---|---|
| Corée, population générale, P95 | 2006-2007 | 165,5 | 16,7 | 88,6 | 16,7 | 26 | Honda et coll. 2018 |
| États‑Unis, population générale, P95 | 2005-2006 | 112,0 | 8,5 | 62,9 | 7,0 | 2548 | Calafat et coll. 2010 |
| Chine, population générale, P95 | 2010-2012 | 101,5 | 9,9 | 75,2 | 0,6 | 47 | Honda et coll. 2018 |
| Canada, population générale, 3 à 79 ans, IC à la limite supérieure de P95 | 2014-2015 | 73,6 | 16,3 | 37,9 | 2,4 | 2564 | Santé Canada, 2017a |
| Allemagne, femmes de 20 à 30 ans, P95 | 1995-2012 | 52,7 | 10,1 | 26,9 | 7,0 | 330 | Moos et coll. 2017 |
| Corée, femmes enceintes, P75 | 2011 | 51,9 | 30,0 | 13,8 | 0,2 | 46 | Kang et coll. 2013 |
| Corée, nouveau-nés, P75 | 2011 | 46,9 | 1,8 | 4,7 | 0,9 | 46 | Kang et coll. 2013 |
| Canada, femmes enceintes, P95 | 2009-2010 | 46,4 | 12,3 | 22,9 | 4,4 | 31 | Fisher et coll. 2017 |
| Japon, population générale, P95 | 2010-2012 | 34,3 | 14,6 | 20,7 | 6,7 | 36 | Honda et coll. 2018 |
Abréviations : P95 = 95e centile; IC = intervalle de confiance; P75 = 75e centile.
*Dose journalière estimée (µg/kg p.c./j)
Annexe B. Paramètres pour estimer l’exposition par voie orale et cutanée aux produits
L’exposition aux produits a été estimée à l’aide de l’outil ConsExpo Web (2016), avec des paramètres particuliers tirés de la littérature publiée. Les estimations de l’exposition ont été calculées en utilisant les poids corporels par défaut de 70,9 kg pour les adultes (20 ans et plus), 59,4 kg pour les adolescents (12 à 19 ans), 15,5 kg pour les tout-petits (6 mois à 4 ans) et 7,5 kg pour les nourrissons (Santé Canada 1998). Les paramètres d’exposition estimée par inhalation et par voie cutanée pour les cosmétiques et autres produits de consommation sont décrits dans le tableau A-3. Sauf indication contraire, les valeurs des paramètres sont tirées des fiches ConsExpo pertinentes (Bremmer et coll. 2006) pour le scénario présenté.
| Scénario d’exposition |
Hypothèses |
|---|---|
| Rouge à lèvres / baume à lèvres (voie orale) |
Tout-petits : Fréquence d’utilisation : 4,1/semaine (Wu et coll. 2010) Quantité par utilisation : 0,01 g (Loretz et coll. 2005) Adolescents / adultes : Fréquence d’utilisation : 2,4/jour (Loretz et coll. 2005) Quantité par utilisation : 0,01 g (Loretz et coll. 2005) Facteur d’ingestion : 1,0 |
| Lotion pour le corps (voie cutanée) |
Tout-petits : Fréquence d’utilisation : 0,8/jour (Ficheux et coll. 2015) Quantité par utilisation : 4,1 g (Ficheux et coll. 2015) Superficie exposée : 4910 cm2 (Santé Canada 1995) Adultes : Fréquence d’utilisation : 1/jour (Ficheux et coll. 2015) Quantité par utilisation : 10 g (Ficheux et coll. 2015) Superficie exposée : 16 925 cm2 (Santé Canada 1995) Facteur de rétention : 1,0 |
| Permanente / défrisant capillaire (voie cutanée) |
Enfants : Fréquence d’utilisation : 0,1/mois (Wu et coll. 2010) Quantité par utilisation : 75 g (superficie ajustée d’après la valeur pour adultes) Superficie exposée : 605 cm2 (Santé Canada 1995) Adultes : Fréquence d’utilisation : 0,5/mois (Wu et coll. 2010) Quantité par utilisation : 80 g Superficie exposée : 637,5 cm2 (Santé Canada 1995) Facteur de rétention : 0,1 |
| Hydratant facial (voie cutanée) |
Adolescents : Fréquence d’utilisation : 1,8/jour (Loretz et coll. 2005) Quantité par utilisation : 1,2 g (Loretz et coll. 2005) Superficie exposée : 730 cm2 (Santé Canada 1995) Adultes : Fréquence d’utilisation : 1,8/jour (Loretz et coll. 2005) Quantité par utilisation : 1,2 g (Loretz et coll. 2005) Superficie exposée : 637,5 cm2 (Santé Canada 1995) Facteur de rétention : 1,0 |
| Lotion oculaire (voie cutanée) |
Adolescents : Fréquence d’utilisation : 1,8/jour (hydratant facial, Loretz et coll. 2005) Quantité par utilisation : 0,09 g (superficie ajustée à partir de la valeur pour l’hydratant facial, Loretz et coll. 2005) Superficie exposée : 50 cm2 (Santé Canada 1995) Adultes : Fréquence d’utilisation : 1,8/jour (hydratant facial, Loretz et coll. 2005) Quantité par utilisation : 0,09 g (superficie ajustée à partir de la valeur pour l’hydratant facial, Loretz et coll. 2005) Superficie exposée : 50 cm2 (Santé Canada 1995) Facteur de rétention : 1,0 |
| Produits de maquillage pour le visage (voie cutanée) |
Adolescents et adultes : Fréquence d’utilisation : 1,2/jour (Loretz et coll. 2006) Quantité par utilisation : 0,54 g (Loretz et coll. 2006) Superficie exposée : 637 cm2 (Santé Canada 1995) Facteur de rétention : 1,0 |
| Après-shampoing (rinçage, voie cutanée) |
Tout-petits : Fréquence d’utilisation : 13,5/mois (Wu et coll. 2010) Quantité par utilisation : 8,9 g (superficie ajustée d’après Loretz et coll. 2008) Superficie exposée : 605 cm2 (Santé Canada 1995) Adultes : Fréquence d’utilisation : 33/mois (Loretz et coll. 2008) Quantité par utilisation : 13,1 g (Loretz et coll. 2008) Superficie exposée : 1092,5 cm2 (Santé Canada 1995) Facteur de rétention : 0,01 |
| Colorant capillaire (permanente, voie cutanée) |
Adolescents : Fréquence d’utilisation : 0,3/mois (Statistique Canada 2012) Quantité par utilisation : 100 g Superficie exposée : 730 cm2 (Santé Canada 1995) Adultes : Fréquence d’utilisation : 0,67/mois (Statistique Canada 2012) Quantité par utilisation : 100 g Superficie exposée : 637,5 cm2 (Santé Canada 1995) Facteur de rétention : 0,1 |
| Nettoyant pour le corps (liquide, voie cutanée) |
Nourrissons : Fréquence d’utilisation : 0,85/jour (Ficheux et coll. 2015) Quantité par utilisation : 4,6 g (Ficheux et coll. 2016) Superficie exposée : 3350 cm2 (Santé Canada 1995) Tout-petits : Fréquence d’utilisation : 0,85/jour (Ficheux et coll. 2015) Quantité par utilisation : 4,6 g (Ficheux et coll. 2016) Superficie exposée : 4910 cm2 (Santé Canada 1995) Adultes : Fréquence d’utilisation : 1,4/jour (Loretz et coll. 2006) Quantité par utilisation : 11 g (Loretz et coll. 2006) Superficie exposée : 16 925 cm2 (Santé Canada 1995) Facteur de rétention : 0,01 |
| Huile pour le corps (voie cutanée) |
Adultes : Fréquence d’utilisation : 1/jour ou moins (jugement professionnel) Quantité par utilisation : 3,2 (même valeur que pour l’huile de massage, Ficheux et coll. 2016) Superficie exposée : 14 380 cm2 (Santé Canada 1995) Facteur de rétention : 1,0 |
| Shampoing (voie cutanée) |
Nourrissons : Fréquence d’utilisation : 3,0/mois (CTFA 1983) Quantité par utilisation : 0,5 g (CTFA 1983) Superficie exposée : 330 cm2 (Santé Canada 1995) Adultes : Fréquence d’utilisation : 33/mois (Loretz et coll. 2006) Quantité par utilisation : 11,8 g (Loretz et coll. 2006) Superficie exposée : 1092 cm2 (Santé Canada 1995) Facteur de rétention : 0,01 |
| Maquillage d’enfant (voie cutanée) |
Tout-petits : Fréquence d’utilisation : 12/année (Bremmer et coll. 2006) Quantité par utilisation : 1,3 g (Bremmer et coll. 2006) Superficie exposée : 435 cm2 (Santé Canada 1995) Adultes : Fréquence d’utilisation : 6/année (Bremmer et coll. 2006) Quantité par utilisation : 1,9 g (Bremmer et coll. 2006) Superficie exposée : 638 cm2 (Santé Canada 1995) Facteur de rétention : 1,0 |
| Produit autobronzant (voie cutanée) |
Adultes : Fréquence d’utilisation : 1,4/semaine (jugement professionnel) Quantité par utilisation : 4,4 g (lotions corporelles, Loretz et coll. 2005) Superficie exposée : 16 925 cm2 (Santé Canada 1995) Facteur de rétention : 1,0 |
| Exfoliant corporel (voie cutanée) |
Adolescents : Fréquence d’utilisation : 2/semaine (exfoliant facial, ConsExpo) Quantité par utilisation : 28 g (superficie ajustée à partir de la valeur pour l’exfoliant facial, ConsExpo) Superficie exposée : 14 740 cm2 (Santé Canada 1995) Adultes : Fréquence d’utilisation : 2/semaine (exfoliant facial, ConsExpo) Quantité par utilisation : 32 g (superficie ajustée à partir de la valeur pour l’exfoliant facial, ConsExpo) Superficie exposée : 16 925 cm2 (Santé Canada 1995) Facteur de rétention : 0,1 |
| Médicament antidiarrhéique (voie orale)a |
Tout-petits : Dose : 7,5 mL Fréquence : jusqu’à 7 fois par jour Adolescents : Dose : 30 mL Fréquence : jusqu’à 7 fois par jour |
| Pastille contre la toux (voie orale) a |
Enfants : Dose : 1 pastille Fréquence : 1 à 10 par jour |
| Médicament contre les brûlures d’estomac (voie orale) a |
Adultes : Dose : 10 à 20 mL Fréquence : jusqu’à 16 fois par jour |
| Médicament contre le mal des transports (voie orale)b |
Tout-petits : Dose : 8,3 mL (25 mg d’une solution de 15 mg/5 mL) Fréquence : jusqu’à 3 fois par jour |
| Produit de contraste radiologique (voie orale) a |
Nourrissons : Dose : 180-210 mL Fréquence : une fois Tout-petits : Dose : 900 mL Fréquence : une fois Adultes : Dose : 900 mL Fréquence : une fois |
| Agent antiviral (voie orale)b,c |
Tout-petits : Dose : 20 mL Fréquence : 4 fois par jour |
| Anticonvulsivant (voie orale)b,c |
Enfants : Dose : 80 mL (dose journalière maximale) Fréquence : 1 |
| Relaxant des muscles lisses respiratoires (voie orale)b,c |
Enfants : Dose : 87,19 mL Fréquence : 1 |
| Solution antitussive (voie orale)b,c |
Adolescents : Dose : 30 mL Fréquence : 6 fois par jour (dose maximale) |
| Médicament chinois traditionnel (voie orale) a |
Adultes : Dose : 3 à 4 capsules Fréquence : 3 fois par jour |
| Traitement au fluor (voie orale) a |
Enfants : Dose : 8 mL Fréquence : 1/année Adultes : Dose : 8 mL Fréquence : 1/année |
| Plante médicinale contre la toux (voie orale)a |
Adolescents et adultes : Dose : 5-10 mL Fréquence : 1 à 5 fois par jour |
| Analgésique pour enfants en suspension (voie orale)b |
Tout-petits : Dose : 5 mL Fréquence : jusqu’à 5 fois par jour |
| Antiacide (voie orale)b |
Adultes : Dose : 10-20 mL Fréquence : jusqu’à 4 fois par jour |
| Crème solaire (voie cutanée) |
Nourrissons : Fréquence d’utilisation : 3/jour (jugement professionnel) Quantité par utilisation : 3,9 g (1,3 mg/cm2, Petersen 2014) Superficie exposée : 3020 cm2 (Santé Canada 1995) Tout-petits : Fréquence d’utilisation : 3/jour (jugement professionnel) Quantité par utilisation : 6,8 g (1,3 mg/cm2, Petersen 2014) Superficie exposée : 4910 cm2 (Santé Canada 1995) Adultes : Fréquence d’utilisation : 3/jour (jugement professionnel) Quantité par utilisation : 22,0 g (1,3 mg/cm2, Petersen 2014) Superficie exposée : 16 925 cm2 (Santé Canada 1995) Facteur de rétention : 1,0 |
| Traitement antibactérien / antifongique (voie cutanée)b |
Nourrissons (scénario de crème pour l’érythème fessier) : Fréquence d’utilisation : 1,1/jour (Gomez-Berrada et coll. 2013) Quantité par utilisation : 3,5 g (Gomez-Berrada et coll. 2013) Superficie exposée : 258 cm2 (Santé Canada 1995) |
| Désinfectant pour les mains (voie cutanée) |
Tout-petits : Fréquence d’utilisation : 0,8/jour (Wu et coll. 2010) Quantité par utilisation : 0,7 g (Santé Canada 2015) Superficie exposée : 350 cm2 (Santé Canada 1995) Adultes : Fréquence d’utilisation : 2,9/jour (Wu et coll. 2010) Quantité par utilisation : 0,7 g (Santé Canada 2015) Superficie exposée : 910 cm2 (Santé Canada 1995) Facteur de rétention : 1,0 |
| Crème analgésique (voie cutanée)a,b |
Enfants : Fréquence d’utilisation : jusqu’à 3 fois par jour Quantité par utilisation : 3,6 g (valeur extrapolée d’après les valeurs pour les lotions corporelles, Wu et coll. 2010) Superficie exposée : 6035 cm2 (tronc et jambes, Santé Canada 1995) Adultes : Fréquence d’utilisation : jusqu’à 3 fois par jour Quantité par utilisation : 7,2 g (superficie ajustée à partir de la valeur pour les lotions corporelles, Ficheux et coll. 2016) Superficie exposée : 12 190 cm2 (tronc et jambes, Santé Canada 1995) Facteur de rétention : 1,0 |
| Crème médicamentée pour les mains (voie cutanée)b |
Enfants : Fréquence d’utilisation : jusqu’à 3 fois par jour Quantité par utilisation : 0,9 g (superficie ajustée à partir de la valeur pour la crème pour les mains, Loretz et coll. 2005) Superficie exposée : 480 cm2 (Santé Canada 1995) Adultes : Fréquence d’utilisation : jusqu’à 3 fois par jour Quantité par utilisation : 1,7 g (Loretz et coll. 2005) Superficie exposée : 910 cm2 (Santé Canada 1995) Facteur de rétention : 1,0 |
| Traitement ponctuel de l’acnéa (voie cutanée) |
Adolescents : Fréquence d’utilisation : 2 fois par jour Quantité par utilisation : 0,14 g (superficie ajustée à partir de la valeur pour les produits de maquillage pour le visage, Loretz et coll. 2006) Superficie exposée : 159 cm2 (1/4 du visage, Santé Canada 1995) Facteur de rétention : 1,0 |
a Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 20 février 2017, sans référence.
b Communication personnelle, courriel de la Direction des produits thérapeutiques, Santé Canada, à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 25 mai 2017, sans référence.
Annexe C. Examen des effets œstrogéniques des parabènes
Essais in vitro
Plusieurs études ont suggéré que l’activité œstrogénique est un mode d’action commun des parabènes (Soni et coll. 2005, Boberg et coll. 2010). Il a été démontré que les parabènes se lient aux récepteurs des œstrogènes in vitro pour activer la transcription des gènes œstrogénodépendants et la prolifération cellulaire œstrogénodépendantes. La puissance œstrogénique des parabènes varie de 3 à 6 ordres de grandeur inférieurs au 17-β-œstradiol et augmente avec la longueur de la chaîne, selon la hiérarchie méthylparabène < éthylparabène < propylparabène < butylparabène < iso‑propylparabène ≈ iso-butylparabène ≈ benzylparabène (Byford et coll. 2002; Routledge et coll. 1998; Terasaki et coll. 2009; Okubo 2001; van Meeuwen et coll. 2008), comme il est résumé dans le tableau C‑1. La puissance du méthylparabène est la plus faible des parabènes lorsqu’il est testé en parallèle et il est souvent indétectable dans les essais. Dans les cellules cancéreuses du sein MCF7 chez la femme, à un excès molaire de 1 000 000 fois, les parabènes inhibaient de façon compétitive 21 % (méthylparabène) à 86 % (butylparabène) le 17-β œstradiol de se lier à ER-α (Byford et coll. 2002). Cependant, dans un essai de transcription sur des lignées de cellules à gène rapporteur HELN, le méthylparabène n’a pas été en mesure d’activer la transcription à médiation par les récepteurs des œstrogènes (Gomez 2005). Le méthylparabène s’est également révélé inactif dans les essais de liaison par les récepteurs des œstrogènes dans les essais avec levure-hybride-2 et les essais ELISA, où d’autres parabènes testés avaient une puissance relative selon la hiérarchie éthylparabène < propylparabène < butylparabène ≈ iso-propylparabène ≈ iso-butylparabène ≈ benzylparabène, allant de 2,0 × 10-5 à 3,5 × 10-3 fois moins d’affinité que le 17‑β‑œstradiol (Terasaki et coll. 2009). Dans une étude de prolifération cellulaire avec des cellules MCF7, l’iso‑propylparabène et l’iso-butylparabène ont induit le niveau de prolifération le plus élevé avec une puissance proliférative relative inférieure de 170 000 à celle du 17-β-œstradiol. La puissance proliférative relative du méthylparabène était de 6 000 000 fois plus faible que celle du 17-β-œstradiol (Okubo 2001). Dans un essai similaire sur des cellules MCF7, tous les parabènes sauf le méthylparabène, ont pu induire une prolifération cellulaire de 100 % par rapport au 17-β-œstradiol. Dans cette étude, la puissance relative des parabènes allait de 10-5 pour le butylparabène, le benzylparabène, l’iso‑propylparabène et l’iso-butylparabène à 10-6 pour l’éthylparabène et le propylparabène et à 10-7 pour le méthylparabène (van Meeuwen et coll. 2008). L’acide parahydroxybenzoïque (PHBA), le principal métabolite des parabènes, produit de faibles effets œstrogéniques dans les lignées cellulaires humaines du cancer du sein, y compris la liaison au récepteur des œstrogènes, induisant l’expression génétique et la prolifération cellulaire. Toutefois, ces effets étaient d’une ampleur égale ou inférieure à ceux du méthylparabène (Pugazhendhi et coll. 2005). Dans plusieurs essais de liaison, la liaison du PHBA au récepteur des œstrogènes va de faible à absente et est généralement considérée comme étant < 1 000 000 fois moins puissante que celle de l’œstradiol (Routledge et coll. 1998; Lemini et coll. 2003; Soni et coll. 2005).
| Parabène | Essai de liaison aux récepteurs des œstrogènesa | Essai de prolifération des cellules MCF7b |
|---|---|---|
| Méthylparabène | ≤ 10-7 | 10-7 |
| Éthylparabène | ≤ 10-5 | 10-6 |
| Propylparabène | 10-5 à 10-4 | 10-6 |
| Butylparabène | 10-5 à 10-3 | 10-6 à 10-5 |
| Benzylparabène | 10-4 à 10-3 | 10-5 |
| Iso-propylparabène | 10-5 à 10-3 | 10-5 |
| Iso-butylparabène | 10-4 à 10-3 | 10-5 |
a Routledge et coll. 1998; Terasaki et coll. 2009.
b Okubo 2001; van Meeuwen et coll. 2008.
Essais utérotrophiques
Dans des essais utérotrophiques effectués sur des rats et des souris immatures (JPN 18 à 23) ou ovariectomisées, tous les parabènes administrés par voie orale et sous-cutanée ont donné des résultats positifs (tableau C‑1). Toutefois, la dose efficace pour le méthylparabène, l’éthylparabène, le propylparabène et le butylparabène variait grandement selon les études. Le méthylparabène a induit une augmentation statistiquement significative du poids absolu et relatif de l’utérus chez les rates Sprague‑Dawley immatures à la dose de 20 mg/kg p.c./j administrée par voie orale (Sun 2016), mais il n’a induit aucun effet à des doses orales atteignant 800 mg/kg p.c./j chez les rates immatures (Routledge et coll. 1998). De même, une dose de 165 mg/kg p.c./j administrée par voie sous-cutanée a induit des changements de poids de l’utérus chez les souris CD1 ovariectomisées (Lemini et coll. 2003), mais une dose atteignant 800 mg/kg p.c./j n’a induit aucun effet chez des rates ovariectomisées (Routledge et coll. 1998). L’éthylparabène a induit des effets utérotrophiques à 4 mg/kg p.c./j par voie orale chez des rates Sprague‑Dawley immatures (Sun 2016), mais n’a causé aucun effet à des doses orales atteignant 1000 mg/kg p.c./j chez des souris ovariectomisées (Ohta et coll. 2012). Administré par voie sous-cutanée à des souris ovariectomisées, l’éthylparabène a induit des effets utérotrophiques à 18 mg/kg p.c./j (Lemini et coll. 2003) et n’a provoqué aucun effet à 1000 mg/kg p.c./j (Ohta et coll. 2012). Le propylparabène a induit une augmentation du poids de l’utérus chez les souris CD1 ovariectomisées à une dose sous-cutanée de 20 mg/kg p.c./j (Lemini et coll. 2003) et n’a eu aucun effet jusqu’à 1000 mg/kg p.c./j par voie orale ou sous-cutanée chez les souris ovariectomisées (Ohta et coll. 2012). Le butylparabène a induit une augmentation statistiquement significative du poids de l’utérus chez des souris CD1 ovariectomisées à 21 mg/kg p.c./j (dose sous-cutanée) (Lemini et coll. 2003) et n’a pas induit d’effet dans le même modèle à 300 mg/kg p.c./j (Ohta et coll. 2012). Le butylparabène a induit des effets utérotrophiques chez des rates immatures à des doses sous-cutanées allant de 70 à 600 mg/kg p.c./j (Lemini et coll. 2003; Routledge et coll. 1998; Hossaini et coll. 2000) et chez des rates ovariectomisées à 800 mg/kg p.c./j (Routledge et coll. 1998), et n’a produit aucun effet chez des rates immatures à des doses orales atteignant 1200 mg/kg p.c./j (Routledge et coll. 1998). Le PHBA, le principal métabolite des parabènes, a induit une augmentation du poids de l’utérus, proportionnelle à la dose, chez des souris CD1 ovariectomisées à 5 mg/kg p.c./j (dose sous-cutanée) (Lemini et coll. 1997), mais n’a pas induit d’effets utérotrophiques chez des rates Wistar immatures à des doses sous-cutanées atteignant 150 mg/kg p.c./j dans deux études distinctes (Lemini et coll. 2003; Hossaini et coll. 2000), ce qui laisse entendre un effet spécifique selon l’espèce.Les résultats des analyses utérotrophiques sont résumés dans le tableau C‑2.
| Parabène | Modèle utérotrophique | Voie d’exposition | DMENO (mg/kg p.c./jour) | DSENO (mg/kg p.c./j) | Référence |
|---|---|---|---|---|---|
| Méthylparabène | Rate immature | Orale | 20 | 4 | Sun 2016 |
| Méthylparabène | Rate immature | Orale | N.D. | 800 (DME) | Routledge et coll. 1998 |
| Méthylparabène | Rate immature | SC | 55 | 16,5 | Lemini et coll. 2003 |
| Méthylparabène | Rate immature | SC | N.D. | 80 (DME) | Routledge et coll. 1998 |
| Méthylparabène | Souris OVX | SC | 165 | 55 | Lemini et coll. 2003 |
| Méthylparabène | Souris OVX | SC | 55 (DMinE) | N.D. | Lemini et coll. 2004 |
| Méthylparabène | Rate OVX | SC | N.D. | 800 (DME) | Routledge et coll. 1998 |
| Éthylparabène | Rate immature | Orale | 4 | 0,8 | Sun et coll. 2016 |
| Éthylparabène | Rate immature | SC | 180 | 60 | Lemini et coll. 2003 |
| Éthylparabène | Souris OVX | Orale | N.D. | 1000 (DME) | Ohta et coll. 2012 |
| Éthylparabène | Souris OVX | SC | 18 | 6 | Lemini et coll. 2003 |
| Éthylparabène | Souris OVX | SC | 60 (DMinE) | N.D. | Lemini et coll. 2004 |
| Éthylparabène | Souris OVX | SC | N.D. | 1000 (DME) | Ohta et coll. 2012 |
| Propylparabène | Rate immature | SC | 65 | 20 | Lemini et coll. 2003 |
| Propylparabène | Souris OVX | Orale | N.D. | 1000 (DME) | Ohta et coll. 2012 |
| Propylparabène | Souris OVX | SC | 20 | 6,5 | Lemini et coll. 2003 |
| Propylparabène | Souris OVX | SC | 65 (DMinE) | N.D. | Lemini et coll. 2004 |
| Propylparabène | Souris OVX | SC | N.D. | 1000 (DME) | Ohta et coll. 2012 |
| Butylparabène | Rate immature | Orale | N.D. | 1200 (DME) | Routledge et coll. 1998 |
| Butylparabène | Rate immature | SC | 70 | 21 | Lemini et coll. 2003 |
| Butylparabène | Rate immature | SC | 400 | 200 | Routledge et coll. 1998 |
| Butylparabène | Rate immature | SC | 600 | 400 | Hossaini et coll. 2000 |
| Butylparabène | Souris OVX | Orale | N.D. | 1000 (DME) | Ohta et coll. 2012 |
| Butylparabène | Souris OVX | SC | 21 | 7 | Lemini et coll. 2003 |
| Butylparabène | Souris OVX | SC | 70 (DMinE) | N.D. | Lemini et coll. 2004 |
| Butylparabène | Souris OVX | SC | 1000 | 300 | Ohta et coll. 2012 |
| Butylparabène | Rate OVX | SC | 800 | N.D. | Routledge et coll. 1998 |
| PHBA | Souris OVX | SC | 5 | 0,5 | Lemini et coll. 1997 |
| PHBA | Rate immature | SC | N.D. | 5 (DME) | Hossaini 2000 |
| PHBA | Rate immature | SC | N.D. | 150 (DME) | Lemini et coll. 2003 |
