Ébauche d’évaluation préalable groupe des substances ignifuges
Titre officiel : Ébauche d’évaluation préalable - Groupe des substances ignifuges
Numéros de registre du Chemical Abstracts Service :
- 78-40-0
- 78-51-3
- 78-42-2
- 298-07-7
- 115-86-6
- 56803-37-3
- 68937-41-7
- 29761-21-5
- 65652-41-7
- 58965-66-5
Environnement et Changement climatique Canada
Santé Canada
Novembre 2021
Résumé
En vertu des articles 68 ou 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE], le ministre de l’Environnement et celui de la Santé ont réalisé une évaluation préalable de 10 des 13 substances appelées collectivement groupe des substances ignifuges. On a jugé que l’évaluation de ces 13 substances était prioritaire. Une démarche distincte a déterminé que trois de ces 13 substances étaient peu préoccupantes, et les décisions relatives à ces substances sont formulées dans un document distinctNote de bas de page 1. En conséquence, la présente évaluation préalable ne vise que les 10 substances mentionnées dans le tableau ci-après, et nous y ferons référence ci‑après en tant que groupe des substances ignifuges. Nous donnons dans le tableau suivant le numéro de registre du Chemical Abstracts Service (no CASNote de bas de page 2), le nom sur la Liste intérieure des substances (LIS), le nom commun et l’abréviation pour ces substances. Les substances de ce groupe ont été évaluées en deux sous-goupes (organophosphates aryliques et organophosphates alkyliques), à l’exception d’une substance qui a été évaluée ci-dessous.
| No CAS | Nom sur la LIS | Nom(s) commun(s) [abréviation] | Sous-groupe |
|---|---|---|---|
| 115-86-6a | Phosphate de triphényle | Phosphate de triphényle [PTPh] | Organophosphate arylique |
| 56803-37-3 | Phosphate de tert-butylphényle et de diphényle | Phosphate de tert‑butylphényle et de diphényle [PBPhDPh] | Organophosphate arylique |
| 65652-41-7a | Phosphate de di-tert-butyle et de phényle | Phosphate de bis(tert-butylphényle) et de phényle [PBBPhPh] | Organophosphate arylique |
| 29761-21-5 | Phosphate d’isodécyle et de diphényle | Phosphate de 8‑méthylnonyle et de diphényle [PMNDPh] | Organophosphate arylique |
| 68937-41-7c | Phénol isopropylé, phosphate (3:1) | Phosphate de tris(propan-2-ylphényle) [PTPPh] | Organophosphate arylique |
| 78-40-0b | Phosphate de triéthyle | Phosphate de triéthyle [PTE] | Organophosphate alkylique |
| 78-51-3 | Phosphate de tris(2‑butoxyéthyle) | Phosphate de tris(2-butoxyéthyle) [PTBOE] | Organophosphate alkylique |
| 78-42-2b | Phosphate de tris(2-éthylhexyle) | Phosphate de tris(2-éthylhexyle) [PTEHx] | Organophosphate alkylique |
| 298-07-7b | Hydrogénophosphate de bis(2‑éthylhexyle) | Hydrogénophosphate de bis(2-éthylhexyle) [PBEHx] | Organophosphate alkylique |
| 58965-66-5a | 1,2,4,5-Tétrabromo-3,6-bis(pentabromophénoxy) benzène | 2,3,5,6-Tétrabromo-1,4-phénylènebisoxy bis(2,3,4,5,6-pentabromobenzène) [TBPhBOBPBBz] | Non applicable |
a Cette substance ne satisfaisait pas aux critères de catégorisation, mais a été incluse dans la présente évaluation, car elle a été jugée d’intérêt prioritaire suite aux résultats de l’approche suivie pour l’identification des priorités d’évaluation des risques.
b Ce no CAS est un UVCB (substances de composition inconnue ou variable, produits de réaction complexes ou matières biologiques).
c Cette substance n’a pas été désignée en vertu du paragraphe 73(1) de la LCPE, mais a été incluse dans la présente évaluation, car elle est considérée d’intérêt prioritaire en raison d’autres préoccupations pour la santé humaine.
Aucune de ces substances de ce groupe n’existe naturellement dans l’environnement. D’après les renseignements divulgués lors d’enquêtes menées en vertu de l’article 71 de la LCPE pour les années de déclaration 2008, 2011 ou 2015, aucun des organophosphates (OP) aryliques n’a été produit au Canada. Les quantités totales de PTPh, PBPhDPh et PTPPh importées au Canada durant ces années se situaient entre 100 000 kg et 1 000 000 de kg, et les quantités importées de PBBPhPh et le PMNDPh se situaient entre 10 000 et 100 000 kg. Dans le cas des OP alkyliques, on a divulgué l’importation au Canada de PTBOE et de PBEHx, chacun en quantités allant de 1000 à 10 000 kg en 2011. Pour la même année, les importations totales de PTE au Canada allaient de 100 000 à 1 000 000 kg, alors que celles de PTBOE, de PTEHx et de PBEHx allaient de 10 000 à 100 000 kg. On n’a pas signalé de production de TBPhBOBPBBz au Canada, mais il y a été importé et utilisé en 2008 (en quantités inférieures à 10 000 kg). Il a été signalé que le principal producteur nord-américain de TBPhBOBPBBz a cessé cette production avant 2012 et que cette substance n’est ni actuellement importée ni utilisée au Canada.
Au Canada, les OP alkyliques et aryliques visés par la présente évaluation sont surtout ajoutés comme ignifuges ou plastifiants à divers fluides hydrauliques, matières plastiques, produits en caoutchouc, textiles, mousses, peintures, adhésifs et produits d’étanchéité, et matériaux de construction. Certaines de ces substances sont aussi utilisées dans des emballage alimentaire (PTPh, PMNDPh, PTE, PTEHx, PTBOE), mousse (PTE) et comme formulant dans des produits antiparasitaires (PTPh, PTPPh, PTEHX). Le PTPh est aussi utilisé dans des produits de soins pour les ongles au Canada. Le TBPhBOBPBBz est un additif ignifuge qui a été utilisé dans des matières plastiques et des caoutchoucs au Canada.
D’après des données expérimentales et modélisées, les substances du sous-groupe des OP aryliques ne devraient pas être persistantes dans l’eau, le sol, les sédiments, ni l’air. Toutefois, le PTPh a été mesuré sur des sites éloignés (p. ex., dans l’Arctique canadien et européen) possiblement en raison du transport atmosphérique de particules auxquelles il est lié, et il est considéré persistant dans l’air. Des études sur la bioconcentration d’OP aryliques, des études du métabolisme et la modélisation de la bioaccumulation suggèrent que le PTPh, le PBPhDPh et le PMNDPh auront un potentiel de bioaccumulation faible à modéré. Pour le PBBPhPh plus hydrophobe, et possiblement le PTPPh (selon l’UVCB), un potentiel de bioaccumulation modéré à élevé a été déterminé à partir de données mesurées et prédites.
D’après les études empiriques sur l’écotoxicité et des données modélisées, les OP aryliques visés par la présente évaluation sont jugés être fortement toxiques pour les organismes aquatiques, avec des effets aigus et chroniques démontrés à des concentrations inférieures à 1 mg/L. Les données sur la toxicité des substances individuelles dans les sédiments et le sol sont limitées. Toutefois, des tests réalisés avec le mélange PTPh-PBPhDPh-PBBPhPh et l’UVCB PTPPh ont mis en évidence une toxicité modérée à élevée dans ces milieux. Il existe des données limitées sur la toxicité pour la faune terrestre qui indiquent les concentrations de OP acryliques ayant un effet sur les organismes. Des études récentes suggèrent que ces substances peuvent induire des effets neurocomportementaux et sur le développement dans le biote, ainsi que d’autres effets dont une perturbation des systèmes reproducteurs et endocriniens.
On prévoit que les OP aryliques de ce groupe peuvent se retrouver dans l’environnement au Canada suite à des procédés industriels, à l’utilisation de produits par des consommateurs, au rejet d’effluents de systèmes de traitement des eaux usées dans des eaux de surface et suite à l’épandage de biosolides sur les terres. Étant donné qu’il est probable que ces substances soient utilisées ensemble ou de manière interchangeable pour les utilisations recensées et étant donné leurs propriétés communes, les quantités d’OP aryliques ont été combinées en une quantité totale pour chaque utilisation pour la production de scénarios d’exposition combinée dans l’environnement. Des analyses du quotient de risque basées sur des estimations de l’exposition et des renseignements sur la toxicité ont été faites pour des scénarios mettant en jeu des rejets industriels et des rejets dus à des produits utilisés par des consommateurs. Ces analyses ont mis en évidence qu’il existe un risque d’effets nocifs pour les organismes aquatiques et ceux vivant dans les sédiments et pour la faune consommant des poissons contenant des substances du sous-groupe des OP aryliques. En se basant sur les utilisations actuelles des OP aryliques, l’analyse a indiqué que le risque d’effets nocifs sur les organismes endogés est faible.
Quant à l’évaluation des effets du sous-groupe des OP alkyliques sur l’environnement, le risque posé par le PTE, le PTEHx et le PBEHx a été caractérisé au moyen de la Classification des risques écologiques (CRE) des substances organiques. La CRE est une approche basée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition et d’une pondération des éléments de preuve pour classer le risque. Les profils de danger sont basés principalement sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne dérivés du réseau alimentaire, à la biodisponibilité et à l’activité chimique et biologique. Les profils d’exposition sont basés sur la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. À partir d’une matrice des risques, nous avons classé comme étant faible, modéré ou élevé les risques potentiels posés par chaque substance en fonction de ses classifications relatives au danger et à exposition. D’après les résultats de la CRE, il est improbable que les substances du sous-groupe des OP alkyliques, PTE, PTEHx et PBEHx, aient des effets nocifs sur l’environnement. En conséquence, seul le PTBOE a été considéré dans la partie ayant trait à l’environnement de l’évaluation des OP alkyliques.
En se basant sur des données expérimentales limitées et des données modélisées, le PTBOE n’est pas persistant dans l’eau, le sol, les sédiments ni dans l’air. Toutefois, cette substance a été mesurée dans l’Arctique canadien, indiquant une persistance suffisante pour permettre le transport à grande distance. Le PTBOE a un faible potentiel de bioaccumulation ou de bioamplification dans le biote et est considéré avoir une toxicité modérée à élevée pour les organismes aquatiques, avec des effets aigus et chroniques mis en évidence par environ moins de 1,0 à 100 mg/L de la concentration, et une toxicité modérée pour les organismes endogés basée sur des données limitées. Des scénarios d’exposition ont été développés pour des rejets dans les eaux de surface dus à des activités industrielles ou à l’utilisation de produits de consommation. Des analyses de quotient de risque basées sur une comparaison d’estimations prudentes avec les renseignements disponibles sur la toxicité ont été faites et ont mis en évidence un faible potentiel de risque pour les organismes aquatiques ou endogés.
Le TBPhBOBPBBz est extrêmement hydrophobe et persistant, mais peut être susceptible à une dégradation photolytique produisant des polybromophénylènebisoxybis(polybromobenzène)s (PBPhBOBPBBz) faiblement bromés. On considère que le TBPhBOBPBBz a un potentiel limité de biodisponibilité et de bioaccumulation. Toutefois, les facteurs de bioconcentration et de bioaccumulation basés sur des modèles de deux produits de la phototransformation du TBPhBOBPBBz (des PBPhBOBPBBz à quatre ou cinq atomes de brome) indiquent un potentiel très élevé de bioaccumulation dans les organismes aquatiques. Les produits de la débromation (p. ex., des PBPhBOBPBBz à quatre ou cinq atomes de brome) biodisponibles ou bioaccumulables du TBPhBOBPBBz devraient avoir un potentiel de toxicité intrinsèque bien plus élevé. Le potentiel de risques pour l’environnement au Canada occasionnés par le TBPhBOBPBBz est faible puisqu’à notre connaissance cette substance n’est actuellement ni importée ni produite au Canada.
En tenant compte de tous les éléments de preuve avancés dans la présente ébauche d’évaluation préalable, le PTPh, le PBPhDPh, le PBBPhPh, le PMNDPh et le PTPPh posent un risque d’effets nocifs sur l’environnement. Il est proposé de conclure que ces substances satisfont aux critères de l’alinéa 64(a) de la LCPE, car elles pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions qui ont ou qui peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou sa diversité biologique. Toutefois, il est proposé de conclure que ces mêmes substances ne satisfont pas aux critères de l’alinéa 64(b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger pour l’environnement essentiel à la vie. De plus, il est proposé de conclure que le PTBOE, le PTE, le PTEHx, le PBEHx et le TBPHBOBPBBz ne satisfont pas aux critères des alinéas 64(a) et 64(b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou sa diversité biologique ou qui constituent ou peuvent constituer un danger pour l’environnement essentiel à la vie.
En ce qui a trait le danger pour la santé humaine, le PBBPhPh a été évalué en suivant l’approche suivie pour l’Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée. Le potentiel d’exposition de la population générale au PBBPhPh était considéré négligeable. Le PBBPhPh est donc considéré peu préoccupant pour la santé humaine aux degrés actuels d’exposition.
D’après des études en laboratoire, les effets critiques sur la santé des substances du sous-groupe des OP aryliques comprennent un gain de poids corporel moindre pour le PTPh, des modifications du poids des organes pour le PBPhDPh, des effets nocifs sur le foie et les glandes surrénales pour le PTPPh et des effets sur le foie pour le PMNDPh. Aucun effet sur la reproduction ou le développement n’a été observé avec le PTPh, le PBPhDPh ou le PMNDPh. Des effets sur la reproduction ont été observés après une exposition à du PTPPh. La population générale du Canada est exposée au PTPh et au PTPPh dans des milieux environnementaux et par les aliments, au PBPhDPh dans des milieux environnementaux et à ces trois substances en étant couché sur un matelas ou un meuble contenant de la mousse. Les enfants peuvent aussi être exposés à ces substances en portant à la bouche des jouets et des produits contenant de la mousse, comme des tapis de sieste ou de table à langer. Dans le cas du PMNDPh, les Canadiens ne devraient y être exposés que dans les milieux environnementaux. Le PTPh est aussi présent dans divers produits de soins pour les ongles, comme du vernis à ongles. Les comparaisons des degrés estimés d’exposition au PTPh, au PBPhDPh et au PMNDPh et des niveaux d’effet critiques ont conduit à calculer des marges d’exposition qui sont considérées adéquates pour tenir compte des incertitudes des bases de données sur l’exposition et les effets sur la santé. Pour le PTPPh, les marges calculées associées à des expositions dues au contact avec des milieux environnementaux et aux aliments, ainsi qu’à la mise en bouche de certains produits contenant de la mousse comme des jouets et au contact dans un siège pour enfant, sont considérées adéquates. Toutefois, les marges associées à un contact prolongé avec le PTPPh dans le cas des tout-petits et des enfants couchés sur un matelas contenant de la mousse sont considérées potentiellement inadéquates pour tenir compte des incertitudes des bases de données sur l’exposition et les effets sur la santé.
Pour le sous-groupe des OP alkyliques, d’après des études en laboratoire, les effets critiques sur la santé incluent des effets sur le foie pour le PTE, des effets sur le foie chez les mâles pour le PTBOE, des effets sur la thyroïde pour le PTEHx et des effets sur le foie pour le PBEHx. L’exposition de la population générale du Canada à ces substances peut être due à la poussière (PTE, PTBOE, PTEHx), à l’air intérieur (PTE, PTBOE, PTEHx), à l’eau potable (PTE, PTBOE, PBEHx), aux aliments (PTBOE), au lait maternel (PTBOE) et à l’utilisation de produits de consommation, dont des matelas ou des meubles contenant de la mousse (PTE, PTBOE), des sièges pour enfant (PTE, PTBOE), des nettoyants tout usage pour four (PTE), des enduits de lissage (PTEHx) et des huiles pour engrenages (PBEHx). Les enfants peuvent aussi être exposés lors de la mise en bouche de jouets contenant de la mousse ou de produits de consommation contenant du PTE ou du PTBOE. Une comparaison des niveaux estimés d’exposition au PTBOE, au PTEHx et au PBEHx et des niveaux d’effet critiques a conduit à calculer des marges d’exposition considérées adéquates pour tenir compte des incertitudes des bases de données sur l’exposition et les effets sur la santé. Pour le PTE, les marges d’exposition calculées associées à une exposition aux milieux environnementaux et aux aliments, ainsi qu’aux nettoyants tout usage et aux enduits de lissage, sont considérées adéquates. Toutefois, les marges associées à un contact cutané prolongé avec le PTE en étant allongé sur un matelas ou un meuble contenant de la mousse (tous les âges) ou assis dans un siège pour enfant sont considérées potentiellement inadéquates pour tenir compte de ces incertitudes.
Il ne devrait pas y avoir d’exposition de la population générale au TBPhBOBPBBz due aux milieux environnementaux, aux aliments ou à l’utilisation de produits de consommation. Le risque pour la santé humaine est donc considéré faible.
En tenant compte de tous les renseignements présentés dans la présente ébauche d’évaluation préalable, il est proposé de conclure que le PTPPh et le PTE satisfont aux critères de l’alinéa 64(c) de la LCPE, car ils pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaines.
En tenant compte de tous les renseignements présentés dans la présente ébauche d’évaluation préalable, il est proposé de conclure que le PTPh, le PBPhDPh, le PBBPhPh, le PMNDPh, le PTBOE, le PTEHx, le PBEHx et le TBPhBOBPBBz ne satisfont pas aux critères de l’alinéa 64(c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaines.
Il est donc proposé de conclure que le PTPh, le PBPhDPh, le PBBPhPh, le PMNDPh, le PTPPh et le PTE satisfont à un ou plusieurs des critères de l’article 64 de la LCPE, et que le PTBOE, le PTEHx, le PBEHx et le TBPHBOBPBBz ne satisfont à aucun de ces critères. Il est aussi conclu que le PTPh et le PTE satisfont aux critères de persistance, mais pas à ceux de bioaccumulation, que le PBPhDPh et le PMNDPh ne satisfont pas aux critères de persistance et de bioaccumulation, que le PBBPhPh et le PTPPh ne satisfont pas aux critères de persistance, mais satisfont à ceux de bioaccumulation du Règlement sur la persistance et la bioaccumulation de la LCPE.
List des abréviations
- AC
- Absorption cutanée
- AchE
- Acetylcholinesterase
- AJT
- Absorption journalière totale
- AMC
- Procédure d’ajustement des moindres carrés
- ARLA
- Agence de réglementation de la lutte antiparasitaire
- ATSDR
- Agency for Toxic Substances and Disease Registry
- BERSE
- Bureau d’évaluation du risque des substances existantes
- CE50
- Concentration efficace moyenne
- CEE
- Concentration environnementale estimée
- CESE
- Concentration estimée sans effet
- CI
- Concentration inhibitrice
- CIRC
- Centre international de recherche sur le cancer
- CL50
- Concentration létale moyenne (tue 50 % de la population testée)
- CMAT
- Concentration maximale admissible tolérable
- CMEO
- Concentration minimale avec effet observé
- CRE
- Classification des risques écologiques de substances organiques
- CSEO
- Concentration sans effet observé
- DA
- Direction des aliments
- DDC
- Déclaration de données chimiques
- DE
- Durée de l’exposition
- DMENO
- Dose minimale avec effet nocif observé
- DPC
- Distance parcourue caractéristique
- DR(L)
- Dose de référence (limite inférieure de confiance)
- DSENO
- Dose sans effet nocif observé
- DSPCPD
- Direction de la sécurité des produits de consommation et des produits dangereux
- EA
- Environment Agency (gouvernement du Royaume-Uni)
- ECCC
- Environnement et Changement climatique Canada
- ECHA
- Agence européenne des produits chimiques
- EPA
- Environmental Protection Agency des États-Unis
- EPDC
- Enquête sur la poussière domestique au Canada
- EROD
- Éthoxyrésorufine-O-déséthylase
- ESCC
- En quête sur la santé des collectivités canadiennes
- ESIS
- Systèmes européens d’information sur les substances chimiques
- ET
- Efficacité de transfert
- ETPEI
- Exposition des tout-petits aux COSV dans l’environnement intérieur
- FAT
- Facteur d’amplification trophique
- FBA
- Facteur de bioaccumulation
- FBC
- Facteur de bioconcentration
- FCC
- Facteur de contact cutané
- FM550
- Firemaster 550
- FPT
- Facteur de pénétration dans les textiles
- Kco
- Coefficient de partage carbone organique–eau
- Koa
- Coefficient de partage octanol-air
- Koe
- Coefficient de partage octanol–eau
- LCPE
- Loi canadienne sur la protection de l’environnement
- LDM
- Limite de détection de la méthode
- LIS
- Liste intérieure des substances
- MdA
- Mode d’action
- ME
- Marge d’exposition
- MM
- Masse moléculaire
- ND
- Non détecté
- No CAS
- Numéro de registre du Chemical Abstracts Service
- NRM
- Niveau de risque minimal
- OCDE
- Organisation de coopération et de développement économiques
- OMS
- Organisation mondiale de la santé
- OPI
- Organophosphate ignifuge
- PBBEHE
- Phosphate de bis(2-butoxyéthyle) et d’hydroxyéthyle
- PBBPhPh
- Phosphate de bis(tert-butylphényle) et de phényle
- PBEHx
- Phosphate de bis(2-éthylhexyle)
- PBPhBOBPBBz
- Polybromo-1,4-phénylènebisoxybispolybromobenzène
- PBPhDPh
- Phosphate de tert-butylphényle et de diphényle
- PBT
- Poly(téréphtalate de butane-1,4-diyle)
- PC
- Poids corporel
- PET
- Poly(téréphtalate d’éthane-1,2-diyle)
- PGI
- Persistance globale
- PGPC3
- Plan de gestion des produits chimiques (phase 3)
- PISSC
- Programme international sur la sécurité chimique
- PMNDPh
- Phosphate de 8-méthylnonyle et de diphényle
- PPU
- Pièce la plus utilisée
- PT2PPh
- Phosphate de tris(2-(propan-2-yl)phényle)
- PT3PPh
- Phosphate de tris(3-(propan-2-yl)phényle)
- PTBOE
- Phosphate de tris(2-butoxéthyle)
- PTDCP
- Phosphate de tris(1,3-dichloropropan-2-yle)
- PTE
- Phosphate de triéthyle
- PTEHx
- Phosphate de tris(2-éthylhexyle)
- PTPh
- Phosphate de triphényle
- PTPPh
- Phosphate de tris[(propan-2-yl)phényle]
- PUF
- Mousse de polyuréthane
- PVC
- Poly(chlorure d’éthényle)
- QR
- Quotient de risque
- QSAR
- Relation quantitative structure-activité
- RCC
- Résidu corporel critique
- RHA
- Récepteur des hydrocarbures aryliques
- RIVM
- Institut national des Pays-Bas pour la santé publique et l’environnement
- SC
- Santé Canada
- SD
- Sprague-Dawley
- SMILES
- Simplified molecular-input line-entry system
- SPT
- Seuil de préoccupation toxicologique
- STEU
- Système de traitement des eaux usées
- TAGD
- Transport atmosphérique à grande distance
- TBPhBOBPBBz
- 2,3,5,6-Tétrabromo-1,4-phénylènebisoxybis(2,3,4,5,6-pentabromobenzène)
- UVCB
- Substances de composition inconnue ou variable, produits de réaction complexes ou matière biologique
- VCT
- Valeur critique de toxicité
- VM
- Vitesse de migration
- VRT
- Valeur de référence de la toxicité
1. Introduction
En vertu des articles 68 ou 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE] (Canada 1999), le ministre de l’Environnement et celui de la Santé ont réalisé l’évaluation préalable de 10 des 13 substances appelées collectivement dans le cadre du Plan de gestion des produits chimiques groupe des substances ignifuges, afin de déterminer si ces 10 substances présentent ou pourraient présenter un risque pour l’environnement ou la santé humaine. Ces 10 substances ont été jugées d’intérêt prioritaire pour une évaluation, car elles satisfont aux critères de catégorisation du paragraphe 73(1) de la LCPE ou en raison d’autres inquiétudes pour la santé humaine (ECCC et SC [modifié en 2017]) ou suite aux résultats de l’approche suivie pour la Détermination des priorités en matière d’évaluation des risques (ECCC et SC 2015, Environnement Canada et Santé Canada 2014).
Les trois autres substances (no CAS dans le tableau 1-1) ont été évaluées conformément au Document sur l’approche scientifique : classification du risque écologique [CRE] des substances organiques (ECCC 2016a) et la démarche de l’approche suivie dans l’Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée (ECCC et SC 2018) et on les a jugées peu préoccupantes pour la santé humaine et l’environnement. Ainsi, elles ne seront pas considérées davantage dans le présent rapport. Les conclusions pour ces substances apparaissent dans Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée (ECCC et SC 2018).
Nous appellerons groupe des substances ignifuges les dix substances visées par la présente évaluation préalable.
| No CAS | Nom sur la LIS | Approche suivie pour la substance | Référence |
|---|---|---|---|
| 26446-73-1 | Phosphate de bis(méthylphényle) et de phényle | CRE, Évaluation préalable rapide | ECCC et SC 2018 |
| 68527-01-5 | Alcènes en C12‑30, α-, bromo chloro | CRE, Évaluation préalable rapide | ECCC et SC 2018 |
| 68527-02-6 | Alcènes en C12-24, chloro | CRE, Évaluation préalable rapide | ECCC et SC 2018 |
Aux fins de leur examen, ces substances, sauf une, ont été réparties en deux sous-groupes : les organophosphates aryliques (OP aryliques) et les organophosphates alkyliques (OP alkyliques), selon la similitude de leur structure, leurs propriétés physiques et chimiques et leur toxicité. Le TBPhBOBPBBz a été évalué comme substance distincte. Puisque ces substances peuvent être utilisées de manière similaire dans des applications similaires, le risque posé par les substances de chaque sous‑groupe a été évalué en utilisant des hypothèses d’exposition similaires.
Nous avons jugé que trois substances du groupe des substances ignifuges (PTE, PTEHx et PBEHx) présentaient un faible potentiel d’effets nocifs sur l’environnement au moyen de la CRE (ECCC 2016b, annexe A). Ces résultats ont été pris en compte pour appuyer les conclusions de la présente évaluation préalable réalisée en vertu de l’article 64 de la LCPE. En conséquence, dans l’évaluation des OP alkyliques, seul le PTBOE est examiné dans la partie traitante de l’environnement.
Les risques posés à la santé humaine par le PBBPhPh ont été étudiés en suivant l’approche de l’Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée (ECCC et SC 2018). Son potentiel d’exposition directe a été évalué en se basant sur des considérations telles que des éléments de preuve indiquant sa présence dans un produit utilisé par la population générale, et le potentiel d’exposition indirecte a été tiré de la démarche générale de l’Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée (ECCC et SC 2018). En se basant sur l’évaluation de l’exposition directe et de l’exposition indirecte faite dans le cadre de cette approche, l’exposition de la population générale au PBBPhPh a été jugée négligeable. Cette substance est donc jugée peu préoccupante pour la santé humaine aux niveaux actuels d’exposition.
Certaines substances du groupe de substances ignifuges visées par la présente évaluation ont fait l’objet d’étude au palier international dans le cadre du Programme d’évaluation coopérative des produits chimiques de l’Organisation de coopération et de développement économiques (OCDE). Ces évaluations font l’objet d’un examen rigoureux (incluant un examen par des pairs) et sont jugées acceptables par de nombreuses autorités gouvernementales d’autres pays. Santé Canada et Environnement et Changement climatique Canada sont des participants actifs à ce processus et jugent que ces évaluations sont fiables. Certaines des substances ont aussi été examinées par l’Agency for Toxic Substances and Disease Registry (ATSDR), le Programme international sur la sécurité des substances chimiques (PISSC), l’Environment Agency du gouvernement du Royaume-Uni et l’Environmental Protection Agency des États-Unis (EPA), et on peut se procurer ces évaluations. Elles ont fait l’objet d’un examen rigoureux (dont un examen par des pairs). Santé Canada juge qu’elles sont fiables, et elles ont été utilisées pour informer la caractérisation des effets sur la santé de la présente évaluation.
La présente ébauche d’évaluation préalable tient compte de renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et les expositions, y compris de renseignements divulgués par des parties prenantes. Des données pertinentes ont été trouvées jusqu’à mars 2018. Des recherches bibliographiques ciblées ont été faites jusqu’à décembre 2019. Des données empiriques tirées d’études clés ainsi que des résultats de modélisations ont aussi été utilisés pour tirer nos conclusions.
La présente ébauche d’évaluation préalable a été préparée par le personnel du Programme d’évaluation des risques de la LCPE travaillant à Santé Canada et Environnement et Changement climatique Canada. Elle comprend des contributions d’autres programmes de ces ministères. Les parties portant sur l’environnement et la santé humaine ont fait l’objet d’un examen ou de consultations externes. Des commentaires sur les parties techniques ayant trait à l’environnement ont été reçus d’Alana Greaves, Ph. D. (Université Carleton), d’Ian Doyle, Ph. D. (Environment Agency du Royaume-Uni), Miriam Diamond, Ph. D. (Université de Toronto), Pamela Campbell, Ph. D. (ToxEcology – Environmental Consulting Ltd) et Royi Mazor, Ph. D. (ICL Group). Des commentaires sur les parties techniques relatives à la santé humaine ont été reçus de chercheurs choisis par Risk Sciences International, dont Supratik Kar, Ph. D. (Jackson State University), Ole Jakob Nøstbakken, Ph. D. (Institut de recherche marine, Norvège) et Kevin Crofton, Ph. D. (Environmental Protection Agency). Les parties ayant trait à l’environnement de l’évaluation du PTE, du PTEHx et du PBEHx sont basées sur le document de la CRE (publié le 30 juillet 2016), qui a fait l’objet d’un examen externe ainsi que d’une période de commentaires du public de 60 jours. Pour le PBBPhPh, la partie de la présente évaluation portant sur la santé est basée sur l’approche suivie pour l’Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée (publiée le 10 juin 2017), qui a fait l’objet d’une période de commentaires du public de 60 jours. Bien que des commentaires de l’extérieur aient été pris en compte, Santé Canada et Environnement et Changement climatique Canada demeurent responsables du contenu final et des conclusions de la présente évaluation préalable.
La présente évaluation préalable est axée sur des renseignements critiques pour déterminer si ces substances satisfont aux critères de l’article 64 de la LCPE, en étudiant des renseignements scientifiques et en suivant une approche basée sur le poids de la preuve et le principe de précautionNote de bas de page 3. Nous y présentons les renseignements et considérations critiques à partir desquels nous avons tiré nos conclusions.
2. Évaluation du sous-groupe des organophosphates aryliques (PTPh, PBPhDPh, PBBPhPh, PMNDPh, PTPPh)
2.1 Identité des substances
Nous donnons dans le tableau 2-1 le no CAS, le nom sur la Liste intérieure des substances (LIS), le nom commun et l’abréviation des substances discrètes du sous-groupe des organophosphates aryliques (OP aryliques).
| No CAS (abréviation) | Nom sur la LIS (nom commun) | Structure chimique représentative et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 115-86-6 (PTPh) | Phosphate de triphényle (Phosphate de triphényle) | 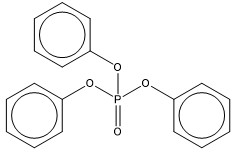 C18H15O4P C18H15O4P
|
326,29 |
| 56803-37-3 (PBPhDPh) | Phosphate de tert‑butylphényle et de diphényle (Phosphate de tert-butylphényle et de diphényle) | 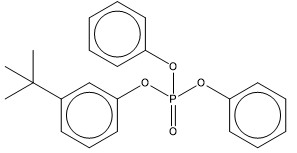 C22H23O4P C22H23O4P
|
382,40 |
| 65652-41-7 (PBBPhPh) | Phosphate de di(tert-butylphényle) et de phényle (Phosphate de bis(tert-butylphényle) et de phényle) | 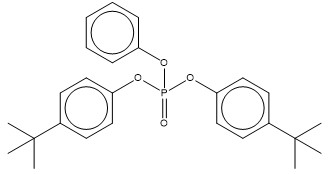 C26H31O4P C26H31O4P
|
438,5 |
| 29761-21-5 (PMNDPh) | Phosphate d’isodécyle et de diphényle (Phosphate de 8‑méthylnonyle et de diphényle) | 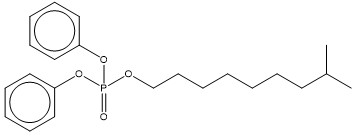 C22H31O4P C22H31O4P
|
390,46 |
Abréviations — no CAS : numéro de registre du Chemical Abstracts Service; LIS : Liste intérieure des substances
Les substances de ce sous-groupe sont des organophosphates comportant deux ou trois groupes aryles (c.-à-d. diarylique ou triarylique) et divers degrés d’alkylation (tableau 2-1). Ce sous-groupe comporte quatre substances discrètes et un UVCB (substances de composition inconnue ou variable, produits de réaction complexes ou matières biologiques : PTPPh). Une des substances discrètes, le PTPh, constitue la structure de base du PBPhDPh, du PBBPhPh et est un composant du PTPPh. Selon l’OCDE (2002b), la pureté du PTPh est supérieure à 99,6 %. Le PTPh est également couramment présent dans des mélanges ignifuges commerciaux (McGee et coll. 2013, Phillips et coll. 2017). Le PBPhDPh et le PBBPhPh sont des variations des phosphates de tert-butyl-triphényle et sont typiquement présents ensemble, avec le PTPh, dans les mélanges commerciaux (Mihajlovic 2015, Phillips et coll. 2017). Les nos CAS 68937-40-6 et 220352-35-2 peuvent quelques fois être utilisés pour désigner des mélanges commerciaux de PBPhDPh, de PBBPhPhH et de PTPh (EA 2009b, SDS 2013). Le PBPhDPh est un mélange d’isomères dans lesquels le groupe tert-butyle se trouve à différentes positions sur les anneaux phényles. L’autre substance discrète, le PMNDPh, est un phosphate d’alkyle et de diaryle, qui est généralement pur à plus de 90 % dans le PMNDPh vendu dans le commerce (EA 2009a).
Le PTPPh est un UVCB, c’est-à-dire un mélange de, potentiellement, plus de 50 isomères de phosphates de triphényle isopropylés (EPA 2010). Les formulations commerciales de PTPPh contiennent du PTPh en diverses concentrations allant d’environ 5 à 50 %, selon la qualité du produit, ainsi que des concentrations relatives d’isomères isopropylés (annexe A) [EA 2009d, Sjögren et coll. 2009]. Les divers produits commerciaux de PTPPh sont élaborés à partir de matières premières ayant des rapports phénols isopropylés/phénol différents et contiennent les mêmes isomères, mais à des concentrations différentes, reflétant les divers degrés d’isopropylation (EA 2009d). D’autres nos CAS sont associés au PTPPh, soit pour l’UVCB (p. ex., 26967-76-0) ou pour des isomères spécifiques présents dans l’UVCB (p. ex., 72668-27-0, 26967-76-0 et 68937-41-7) [EA 2009d, Sjögren et coll. 2009]. Par exemple, le no CAS 68937-41-7 du PTPPh de la présente évaluation a aussi été utilisé pour représenter un isomère du phosphate de tris(propan-2-ylphényle) présent dans le PTPPh (p. ex., phosphate de tris(4-(propan-2-yl)phényle) [Sjögren et coll. 2009].
Pour l’évaluation relative à l’environnement, l’approche suivie pour le PTPPh était de sélectionner deux substances représentatives couvrant la plage de solubilité dans l’eau, l’hydrophobicité et le potentiel de bioaccumulation (tableau 2-2). Le PTPh, qui n’est pas alkylé, est le composant le plus soluble dans l’eau et a été retenu pour représenter le devenir et la toxicité dans l’eau. Ce composant constitue la plus grande proportion (jusqu’à 50 %) du PTPPh commercial. Un isomère de phosphate de tris(propan-2-ylphényle) a été choisi pour représenter le composant du PTPPh le plus grand (encombrement stérique), avec le degré d’alkylation, l’hydrophobicité et le potentiel de bioaccumulation les plus élevés. Un des isomères de phosphate de tris(propan-2-ylphényle) présent dans le PTPPh, le phosphate de tris(3-(propan-2-yl)phényle) [PT3PPh] (no CAS 72668-27-0) a été détecté et documenté dans des mélanges de PTPPh (ECHA c2007-2018d, Phillips et coll. 2017) et a été retenu comme structure représentative du PTPPh pour la modélisation du devenir (y compris la bioaccumulation) et de la toxicité dans les sédiments.
Pour l’évaluation des risques posés à la santé humaine, nous avons suivi une approche similaire à celle susmentionnée pour la modélisation de l’exposition de la population générale du Canada au PTPPh, le PTPh étant considéré comme représentatif des composants du PTPPh plus solubles dans l’eau, alors que des isomères avec les plus forts degrés d’alkylation (comme le T3PTPPh) ont été considérés comme représentatifs des composants moins solubles dans l’eau. Des données de surveillance limitées ont été trouvées pour certains isomères isopropylés présents dans le PTPPh, elles ont été complétées avec des données modélisées pour le T3PTPPh. Des données de surveillance et des données modélisées pour le PTPh ont aussi été prises en compte. Ceci est décrit plus en détail à la section 2.7.1.4.
| No CAS | Nom de la substance (abréviation) | Structure représentative et formule moléculaire | % dans l’UVCB | Utilisation pour l’évaluation |
|---|---|---|---|---|
| 115-86-6 | Phosphate de triphényle (PTPh) |  C18H15O4P C18H15O4P
|
5 à 50 % | Structure représentative pour les composants du PTPPh les plus solubles dans l’eau |
| 72668-27-0 | Phosphate de tris(3-(propan-2-yl)phényle) (PT3PPh) | 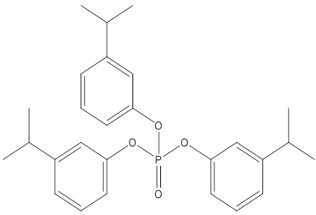 C27H33O4P C27H33O4P
|
< 1 à 11 %a | Structure représentative pour les composants du PTPPh les moins solubles dans l’eau |
a < 1 % pour le PT3PPh mentionné spécifiquement par Phillips et coll. (2017) dans un mélange commercial. 11 % d’isomères du tris(propan-2-ylphényle) généralement (EA 2009d).
Abréviation : no CAS : numéro de registre du Chemical Abstracts Service
2.1.1 Sélection d’analogues et utilisation de modèles QSAR
Pour l’évaluation des risques pour l’environnement, toutes les substances du sous‑groupe des OP aryliques ont été considérées être des analogues en raison de leur structure et de leurs fonctionnalités similaires (p. ex., toxicocinétique). Dans les parties de la présente évaluation portant sur l’analyse des risques et les effets sur l’environnement, pour la sélection des valeurs critiques de toxicité (VCT), nous avons suivi une démarche de lecture croisée, basée sur les OP aryliques pour lesquels existaient des données empiriques pertinentes afin représenter les substances sur lesquelles peu de données étaient connues.
Pour l’évaluation des risques pour la santé humaine, nous avons suivi une approche de lecture croisée basée sur des données pertinentes à un analogue pour l’évaluation de l’exposition au PTPPh. Le phosphate de tris(1,3-dichloropropan-2-yle), appelé ci-après PTDCP, a été retenu comme analogue pour l’absorption cutanée, en raison de similarités structurelles et fonctionnelles et des données disponibles, des données limitées étant disponibles sur l’absorption cutanée des substances du sous-groupe des OP aryliques. Tout comme le PTPPh, le PTDCP est un organophosphate. Le PTDCP comporte trois groupes alkyles, chacun avec deux atomes de chlore, et est couramment utilisé comme substance ignifuge et plastifiante. Nous donnons plus de détails sur cette démarche de lecture croisée à la section 2.7.1.4. Les renseignements sur l’identité et la structure chimique du PTDCP figurent au tableau 2-3.
| No CAS (abréviation) | Nom sur la LIS (nom commun) | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 13674-87-8 (PTDCP) | Phosphate de tris[2-chloro-1-(chlorométhyl)éthyle] (phosphate de tris(1,3-dichloropropan-2-yle) | 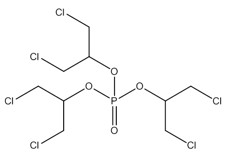 C9H15Cl6O4P C9H15Cl6O4P
|
430,91 |
Abréviations — no CAS : numéro de registre du Chemical Abstracts Service; LIS : Liste intérieure des substances
2.2 Propriétés physiques et chimiques
Nous donnons dans le tableau 2-4 un résumé des données sur les propriétés physiques et chimiques des substances du sous-groupe des OP aryliques. Des données expérimentales ont été tirées des publications scientifiques, de rapports de l’industrie ainsi que d’évaluations internationales (p. ex., EA 2009a, EA 2009b, EA 2009c, EA 2009d, PISSC 1991, OCDE 2002b). Des modèles QSAR ont aussi été utilisés pour générer des valeurs prédites. Des renseignements physico-chimiques spécifiques des substances ont été publiés dans un document d’ECCC (2020a).
Quand plus d’un résultat empirique de modèle approprié ou valide était disponible pour une propriété donnée, la moyenne a été calculée et utilisée comme valeur clé pour ce paramètre. L’approche des trois solubilités (Schenker et coll. 2005) a été suivie pour vérifier quantitativement les valeurs moyennes finales à des fins de cohérence interne.
| Propriété | PTPh | PBPhDPh | PBBPhPh | PMNDPh | PTPPh (T3PTPPh structure représentative) |
|---|---|---|---|---|---|
| Point de fusion (°C) (valeur retenue) | 50 | 89 | 75 | -50 | -26 |
| Pression de vapeur (Pa) (moyenne de données modélisées et expérimentales) | 1,68 × 10-4 a,b | 1,41 × 10-6 a | 1,07 × 10-6 a | 2,82 × 10-6 a | 1,07 × 10-6 a |
| Constante de Henry (Pa·m3/mol) (moyenne de données modélisées) | 0,03 c | 1,56 × 10-2 | 0,05501 c | 1,42 × 10-2 c | 2,97 × 10-2 c |
| Solubilité dans l’eau (mg/L) (moyenne de données modélisées et expérimentales) | 2,25 f | 0,13 e | 8,53 × 10-3 e | 2,42 × 10-1 g | 3,39 × 10-3 f |
| log Koe(sans dimension) (moyenne de données modélisées et expérimentales) | 4,42 h | 5,68 i | 7,29 i | 6,34 i | 7,55 g |
| log Kco (sans dimension) (moyenne de données modélisées) | 3,59 j | 4,36 j | 5,22 j | 4,.60 j | 5,89 j |
| log Koa (sans dimension) (moyenne de données modélisées) | 9,39 k | 10,80 k | 13,49 k | 11,10 k | 13,0 k |
Abréviations — Koe : coefficient de partage octanol–eau; Kco : coefficient de partage carbone organique–eau; Koa : coefficient de partage octanol-air.
a MPBPWIN 2010 (méthode Antoine, méthode Grain modifiée et méthode Mackay).
b Dobry et Keller 1957, Huckins et coll. 1991.
c HENRYWIN 2008, New EQC 2011.
d New EQC 2011, HENRYWIN 2008, Muir 1984.
e Rapport d’étude 2013, KOWWIN 2010, WATERNT 2010, TEST 2012, ACD/Percepta c1997-2012.
f Hollifield 1979, Saeger et coll. 1979, Ofstad et Sletten 1985, WSKOWWIN 2010, WATERNT 2010, TEST 2012, ACD/Percepta c1997-2012.
g Saeger et coll. 1979, KOWWIN 2010, ACD/Percepta c1997-2012, WATERNT 2010, TEST 2012.
h Rapport d’étude 2013, Saeger et coll. 1979, Hansch et coll. 1995, Kenmotsu et coll. 1980, Sasaki et coll. 1981, KOWWIN 2010, ACD/Percepta c1997-2012, ACD/Labs.
i Rapport d’étude 2013, KOWWIN 2010, ACD/Percepta c1997-2012.
j KOCWIN 2010.
k KOAWIN 2010, EPI Suite c2000-2012.
2.3 Sources et utilisations
Les substances du sous-groupe des OP aryliques sont produites à parti d’alcools synthétiques (Mihajlovic 2015) et ne sont pas naturellement présentes dans l’environnement. Les phosphates de triaryle ignifuges ont été créés à l’origine pour être utilisés dans des matières plastiques inflammables (EA 2009c, Weil 1993).
Toutes les substances du sous-groupe des OP aryliques ont été visées par des enquêtes menées en vertu de l’article 71 de la LCPE (Canada 2009a, 2012). Une enquête de suivi auprès d’intervenants industriels clés (producteurs et utilisateurs) a aussi été menée pour mieux définir les estimations des quantités utilisées et des utilisations de ces substances (ECCC 2016b). La production des substances du sous-groupe des OP aryliques n’a pas été déclarée au cours d’aucune des années pour lesquelles des données ont été collectées (voir le tableau 2-5 pour les années de déclaration par substance) [ECCC 2016b, Environnement Canada 2009, 2013]. Toutefois, 30 entreprises ont déclaré des importations totalisant 100 000 à 10 000 000 kg de ces substances au Canada en 2008, en 2011 et en 2015 (tableau 2-5). L’ampleur avec laquelle les quantités déclarées représentent les quantités présentes dans des biens manufacturés importés au Canada est inconnue, car il est improbable que ces utilisations satisfassent aux critères de divulgation de ces enquêtes.
| Substance | Importations totalesa (kg) | Année de déclaration | Référence |
|---|---|---|---|
| PTPh | 100000 à 1000000 | 2011, 2015 | Environnement Canada 2013, ECCC 2016b |
| PBPhDPh | 100000 à 1000000 | 2008, 2015 | Environnement Canada 2009, ECCC 2016b |
| PBBPhPh | 10000 à 100000 | 2011, 2015 | Environnement Canada 2013, ECCC 2016b |
| PMNDPh | 10000 à 100000 | 2008, 2015 | Environnement Canada 2009, ECCC 2016b |
| PTPPh | 100000 à 1000000 | 2011, 2015 | Environnement Canada 2013, ECCC 2016b |
a Les valeurs reflètent les quantités déclarées en réponse aux enquêtes menées en vertu de l’article 71 de la LCPE (Environnement Canada 2009, 2013, ECCC 2016b). Voir les enquêtes pour les inclusions et exclusions spécifiques (annexes 2 et 3).
Aux États-Unis, les estimations des quantités produites (production et importation) en 2012 étaient de plus de 31 500 000 lb/an (14 300 000 kg/an) pour le total de ces cinq OP aryliques. Ces estimations sont basées sur la période de déclaration des données du Chemical Data Reporting (CDR) de la Toxic Substances Control Act (TSCA). Le marché nord-américain des substances ignifuges, qui dépend du marché aux États-Unis, devrait croître en moyenne de 2,5 à 3 % par an pendant entre 2016 et 2121. En Amérique du Nord, le secteur des substances ignifuges qui augmente le plus vite est celui des composés organophosphorés (IHS 2018).
Le PTPh et le PMNDPh sont produits ou importés dans la zone économique européenne en quantités allant de 100 000 à 1 000 000 kg/an par substance, et le PTPPh en quantités allant de 1 000 000 à 10 000 000 kg/an (ECHA c2007-2018d). Le PTPh, le PMNDPh et le PTPPh sont tous considérés comme des substances chimiques produites en grand volume (PGV) par l’OCDE (ECHA c2007-2018c, c2007-2018d, c2007-2018e).
Les organophosphates ignifuges (incluant les OP aryliques) sont utilisés le plus souvent comme substances ignifuges dans l’électronique, des lubrifiants, des matières plastiques, des caoutchoucs, des résines, des textiles, des élastomères, des adhésifs et des produits d’étanchéité. De plus, ils sont couramment utilisés comme plastifiants dans bon nombre de ces mêmes applications (IHS 2018). En tant que plastifiants, les OP aryliques sont utilisés pour rehausser la souplesse et la durabilité de certains matériaux, comme le poly(chlorure d’éthényle) [PVC], des mousses de polyuréthane (PUF) souples et rigides et des matières thermoplastiques (Marklund 2005).
Au Canada, les OP aryliques visés par la présente évaluation sont principalement utilisés comme additifs ignifuges ou plastifiants dans des produits de consommation et des produits commerciaux, tels que des fluides hydrauliques, des matières plastiques, des caoutchoucs synthétiques, des textiles, des peintures, des adhésifs et des matériaux de construction (ECCC 2016b, Environnement Canada 2009, 2013). Nous présentons dans le tableau 2-6 un résumé des principales utilisations des substances du sous-groupe des OP aryliques déclarées lors d’enquêtes menées en vertu de l’article 71 de la LCPE (ECCC 2016b, Environnement Canada 2009, 2013). D’autres utilisations au Canada sont présentées dans le tableau 2-7.
Globalement, les substances du sous-groupe des OP aryliques sont utilisées dans des circuits imprimés, des pellicules photographiques, des résines, des meubles, des sièges et lits en mousse, des produits en caoutchouc, des lubrifiants et des graisses, des liquides hydrauliques, des fluides de base pour des fluides pour la production d’énergie, des adhésifs, des revêtements de textile, des peintures et des dispersions de pigment, des encres et des revêtements, des revêtements de sol, des jouets, des matériaux de construction, des draperies, des chaussures, des produits en cuir et des produits en papier ou en carton (EA 2009b, EA 2009c, ECHA c2007-2018c, c2007-2018d, c2007-2018e, OCDE 2002b).
| Principales utilisationsa | PTPh | PBPhDPh | PBBPhPh | PMNDPh | PTPPh |
|---|---|---|---|---|---|
| Adhésifs et produits d’étanchéité | O | N | N | N | O |
| Peintures et revêtements | O | O | O | O | O |
| Lubrifiants et graisses | O | O | O | O | O |
| Matières plastiques et formulation de caoutchouc | O | N | N | N | O |
Abréviations — O : oui, cette utilisation a été déclarée pour cette substance; N : non, cette utilisation n’a pas été déclarée pour cette substance.
a Utilisations non confidentielles d’OP aryliques déclarée en réponse à des enquêtes menées en vertu de l’article 71 de la LCPE (Environnement Canada 2009, 2013, ECCC 2016b). Voir les enquêtes pour les inclusions et exclusions spécifiques (annexes 2 et 3).
| Utilisation | PTPh | PMNDPh | PBPHDPh | PTPPh |
|---|---|---|---|---|
| Matériaux d’emballage alimentairea | O | O | N | N |
| Présence dans des cosmétiques, basée sur des déclarations faites en vertu du Règlement sur les cosmétiquesb | O | N | N | N |
| Formulant dans des produits antiparasitaires homologuésc | O | N | N | O |
Abréviations — O : oui, cette utilisation a été déclarée pour cette substance; N : non, cette utilisation n’a pas été déclarée pour cette substance.
a Communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 11 janvier 2017; non référencé.
b Communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 12 janvier 2017; non référencé.
c Communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 21 décembre 2017 et 8 février 2018; non référencé.
Au Canada, le PTPh et le PMNDPh peuvent être utilisés comme composant pour la production de certaines encres d’imprimerie appliquées sur la couche extérieure de structures en matière plastique stratifiées pour des applications d’emballage alimentaire (Environnement Canada 2013-2014). Aux États-Unis, l’utilisation du PTPh est approuvée en tant qu’additif dans des adhésifs (CFR 2017a).
Au Canada, le PTPh et le PTPPh peuvent être utilisés comme formulants dans des produits antiparasitaires et sont actuellement homologués dans quelques produits, dont des peintures antisalissures pour des applications marines ou utilisations commerciales (communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 8 février 2018; non référencé).
2.4 Rejets dans l’environnement
Les rejets anthropiques dans l’environnement proviennent des diverses pertes survenant pendant la production, l’utilisation industrielle, l’utilisation de produits de consommation ou commerciaux, la durée de vie utile et l’élimination d’une substance. Les rejets des substances du sous-groupe des OP aryliques dans l’environnement au Canada dus à leur utilisation comme additifs ignifuges ou plastifiants devraient être ponctuels (p. ex., par des installations de traitement industrielles, des systèmes de traitement des eaux uséesNote de bas de page 4). Les OP aryliques peuvent aussi pénétrer dans l’environnement à la suite de l’utilisation et à l’élimination des produits de consommation (p. ex., lixiviation de matières plastiques de type PVC et de mousse de PUF qui contiennent ces substances) [Gad 2014]. Les rejets dus à des produits de consommation et à des produits commerciaux peuvent survenir dans des environnements intérieurs ou extérieurs.
Les rejets de substances du sous-groupe des OP aryliques dans l’environnement dus à des activités industrielles (p. ex., mélange de matières plastiques et de caoutchoucs, mélange de lubrifiants) devraient se produire principalement dans l’air et les sédiments suite au traitement des eaux usées. Des rejets dans le sol pourraient aussi se produire à cause de l’épandage de biosolides sur des terres agricoles et des pâturages. Les activités industrielles ne devraient pas engendrer de rejet important.
2.5 Devenir et comportement dans l’environnement
2.5.1 Distribution environnementale
Nous présentons dans le tableau 2-8 les résultats de la modélisation de la fugacité de niveau III des substances du sous-groupe des OP aryliques.
| Substances | Rejet dans : | Air (%) | Eau (%) | Sol (%) | Sédiments (%) |
|---|---|---|---|---|---|
| PTPh | Air (100 %) | 4,7 | 5,2 | 89,5 | < 1 |
| OP aryliques sauf PTPh | Air (100 %) | 1,6 à 2,6 | 2,4 à 4,1 | 87,7 à 90,5 | 2,8 à 8,2 |
| PTPh | Eau (100 %) | < 1 | 88,4 | < 1 | 11,5 |
| OP aryliques sauf PTPh | Eau (100 %) | < 1 | 22,6 à 58,9 | < 1 | 41,1 à 77,3 |
| PTPh et autres OP aryliques | Sol (100 %) | < 1 | < 1 | 99,8 à 100 | < 1 |
Ces données indiquent qu’une fois rejetés dans l’air, ces OP aryliques se retrouveront principalement dans le sol, avec un petit pourcentage (< 5 %) restant dans l’air ou dans l’eau, un maximum de 8,2 % se retrouvant dans les sédiments. Une fois rejetés dans l’eau, ces OP aryliques se retrouveront dans l’eau et les sédiments et ceux rejetés dans le sol y resteront. Des substances du sous-groupe des OP aryliques, le PTPh est celui qui se retrouvera le plus dans l’eau, les autres OP aryliques se retrouvant moins dans l’eau et plus dans les sédiments.
2.5.2 Persistance
2.5.2.1 Dégradation abiotique et biotique
Étant donné les rejets et les caractéristiques de partage probable des substances du sous-groupe des OP aryliques, la persistance dans l’environnement concerne principalement l’eau, les sédiments et le sol. Des données empiriques et des données modélisées ont été prises en compte dans les éléments de preuve pour la persistance. Plusieurs études sur la dégradation ont été trouvées pour le PTPh, ainsi que pour le PBPhDPh, le PMNDPh et le PTPPh (tableaux 2-9 et 2-10). Bon nombre des études sur la persistance (avant 2009) ont été prises en compte dans d’autres évaluations internationales (EA 2009a, 2009b, 2009c, 2009d, ECHA c2007-2018c, c2007-2018d, c2007-2018em OCDE 2002b), et sont résumées dans un document d’ECCC (2020b). Quand ils étaient pertinents, les renseignements présentés dans ces évaluations ont été pris en compte et sont inclus plus bas.
Des modélisations de l’oxydation atmosphérique des substances du sous-groupe des OP aryliques indiquent une demi-vie inférieure à un jour (phase gazeuse) [tableau 2-9] (AOPWIN 2010, OCDE 2009a). Toutefois, Liu et coll. (2014) ont trouvé que le PTPh est persistant quand il est lié à des aérosols. Ils ont estimé une durée de vie atmosphérique de 5,6 jours pour le PTPH adsorbé sur des particules exposées à des radicaux OH. Puisque la modélisation avec AOPWIN (2010) indique que le PBPhDPh, le PBBPhPh et le PMNDPh sont principalement associés à des particules dans l’air et puisque la surveillance a montré que le PTPh est aussi associé aux particules atmosphériques, il est raisonnable de penser que les prédictions pour la persistance des OP aryliques en phase gazeuse sous-estiment probablement la persistance dans l’air.
Les OP aryliques visés par la présente évaluation peuvent s’hydrolyser (en phosphate de diphényle et phénol) dans des conditions alcalines, mais ce processus ne devrait pas avoir un effet important sur leur devenir dans les conditions de pH typiques de l’environnement du Canada [entre 6 et 8] (tableau 2-9) [Anderson et coll. 1993, David et Seiber 1999, EA 2009d, HYDROWIN 2010, Muir et coll. 1983, Su et coll. 2016a].
Généralement, les données empiriques et les données modélisées sur la biodégradation indiquent que le PTPh, le PBPhDPh et le PMNDPh sont d’une manière intrinsèque facilement biodégradables (Jurgens et coll. 2014, Muir et coll. 1985, 1989, Saeger et coll. 1979) et ne sont pas persistants dans l’eau (tableaux 2-10 et 2-11). Des études expérimentales suggèrent que les OP aryliques alkylés avec peu de chaînes alkyliques ou des chaînes plus courtes sont plus biodégradables que ceux ayant des chaînes plus longues ou plus de chaînes, et que la biodégradation commence avec une hydrolyse du groupe phosphate (Saeger et coll. 1979). La transformation en phosphate de diphényle a été signalée par Quintana et coll. (2006), qui ont aussi rapporté sa complète élimination après 47 jours lors d’une étude sur la biodégradation aérobie avec boue activée. Le PBPhDPh n’est pas considéré persistant dans la boue. Une biodégradation complète se produit en 11 jours dans l’eau, et de 84 à 93 % de la dégradation survient en une journée dans de la boue domestique activée (Heitkamp et coll. 1986). Les données empiriques et les données modélisées sont en accord et indiquent que le PMNDPh n’est pas persistant. Muir et coll. (1985) ont rapporté des demi-vies empiriques dans l’eau et les sédiments de 0,44 et 39 jours respectivement. Ceci est en accord avec la valeur de 37,5 jours pour la biodégradation totale modélisée.
Les modèles QSAR prédisent une biodégradation primaire en quelques jours ou quelques mois, et une dégradation totale en quelques semaines ou quelques années (tableau 2-10, ECCC 2020b). La modélisation pour le PBPhDPh, le PBBPhPh et le PTPPh suggère une biodégradation totale plus lente (jusqu’à quelques années) [ECCC 2020b]. Globalement, les données empiriques et les données modélisées fournissent assez de preuves qui indiquent que les OP aryliques subissent une dégradation primaire significative et qu’en conséquence, ils ne sont pas persistants dans l’eau. L’application d’une procédure d’extrapolation de la demi-vie basée sur Boethling et coll. (1995), en utilisant des proportions 1/1/4 pour eau/sol/sédiments suggère que les OP aryliques seront décomposés plutôt rapidement dans le sol et les sédiments.
| Substance | Processus du devenir | Conditions du test | Paramètre de dégradation (demi-vie sauf indication contraire) | Référence |
|---|---|---|---|---|
| PTPh | Biodégradation | Boue aérobie activée, 28 j, laboratoire |
Boue vivante : 2,8 j Boue stérilisée : 8 j |
Jurgens et coll. 2014 |
| PTPh | Biodégradation | Aérobie (CO2) et anaérobie, sable loameux, 25 °C, laboratoire, période d’incubation jusqu’à 102 j | 32 à 37 j | Anderson et coll. 1993 |
| PTPh | Biodégradation | Échantillons d’eau et de sédiments de mares et de rivières, laboratoire, jusqu’à 64 j, aérobie |
Mare : Rivière : |
Muir et coll. 1989 |
| PTPh | Biodégradation | Eau et sédiments, mésocosme, 15 semaines, aérobie | 30 j | Muir et coll. 1982 |
| PBPhDPh | Biodégradation | Échantillons d’eau et de sédiments de mares et de rivières, laboratoire, jusqu’à 64 j, aérobie |
Mare : Rivière : |
Muir et coll. 1989 |
| PBPhDPh | Biodégradation | Eau de rivière, laboratoire, aérobie | Dégradation (84 à 93 %) en 10 à 21 j | Saeger et coll. 1979 |
| PBPhDPh | Biodégradation | Boue activée, aérobie | Minéralisation complète en 11 j | Heitkamp et coll. 1986 |
| PMNDPh | Biodégradation | Eau de rivière, laboratoire, aérobie | Dégradation (20 à 54 %) en 10 à 21 j | Saeger et coll. 1979 |
| PTPPha (28 à 32v% PTPh, 70 % PTPPh) | Biodégradation | Inoculum de boue activée, 28 j, aérobie | 74 à 80 %b (en tant qu’évolution du CO2) | IUCLID 2000 |
| PTPPha (28 à 32 % PTPh, 70 % PTPPh) | Biodégradation | Aérobie aqueux, 26 j | 94 % | IUCLID 2000 |
Abréviations — j : jour.
a Produit commercial contenant du PTPh et du PTPPh.
b Dégradation dans deux solutions, 10 et 20 mg/L.
| Milieu | Processus du devenir | Paramètre de dégradation / unité | Modèle | Référence |
|---|---|---|---|---|
| Eau | Biodégradation totale aérobie |
% DBO = 1 à 84 Demi-vie primaire : 4,45 j à 2 m 17 j Demi-vie ultime : 10,44 j à 6 ans 5 m 15 j |
CATALOGIC 2014 % DBO (demande biologique en oxygène) |
CATALOGIC 2014 |
| Eau | Biodégradation primaire aérobie |
Value = 3,167 à 3,9 « biodégradation rapide » (jours à semaines) |
BIOWIN 4.10 sous-modèle 4 |
BIOWIN 2010a |
| Eau | Biodégradation totale aérobie | « biodégradation rapide » (semaines à mois) |
BIOWIN 4.10 sous-modèle 3 |
BIOWIN 2010b |
| Eau | Biodégradation totale aérobie | -0,4076 à 0,0835 « biodégradation lente » |
BIOWIN 4.10 sous-modèle 5 : probabilité linéaire MITI |
BIOWIN 2010c |
| Eau | Biodégradation totale aérobie |
0,0009 à 0,0302 « biodégradation lente » |
BIOWIN 4.10 sous-modèle 6 : probabilité non linéaire MITI |
BIOWIN 2010d |
a Sous modèle 4b : Expert survey (résultats qualitatifs).
b Sous-modèle 3 : Expert survey (résultats qualitatifs).
c Sous-modèle 5 : probabilité linéaire MITI.
d Sous-modèle 6 : probabilité non linéaire MITI.
2.5.2.2 Transport sur de grandes distances
Le modèle de dépistage des POP de l’OCDE peut être utilisé pour trouver les substances chimiques fortement persistantes et ayant un fort potentiel de transport sur de grandes distances (Scheringer et coll. 2006). La distance parcourue caractéristique (DPC) calculée pour les substances du sous-groupe des OP aryliques se situe entre 397 et 2441 km, indiquant un certain potentiel de transport atmosphérique vers les régions du nord du Canada, mais elle reste inférieure à la limite (5097 km, DPC du BPC 28) suggérée pour les polluants mondiaux par Klasmeier et coll. (2006). Ce modèle permet aussi de calculer une persistance globale (PGl) de 54 à 87 jours et l’efficacité de transfert (ET), qui est le pourcentage du flux émis dans l’air qui est déposé à la surface (eau et sol) dans une région éloignée. L’ET pour ces OP aryliques se situe entre 0,19 et 9,19 %, les valeurs pour le PTPh, le PBPhDPh et le PMNDPh étant supérieures à la limite de 2,248 % (BPC 28) établie à partir des substances de référence du modèle connues empiriquement pour être déposées de l’air sur l’eau ou le sol, et les valeurs pour le PBBPhPh et le T3PTPPh (structure représentative) étant inférieures. L’ET élevée suggère que les OP aryliques de log Koe élevé, comme le PBBPhPh et le PTPPh, peuvent être déposés dans des régions éloignées.
Pour les substances de ce sous-groupe, des études de surveillance et de suivi des concentrations environnementales dans des zones éloignées n’ont permis de désigner que le PTPh. Le PTPh (phase particulaire) a été détecté loin dans l’Arctique canadien (moyenne des mesures en bateau de 84 ± 264 pg/m3; moyenne des mesures sur terre de 22 ± 26 pg/m3) ]Sühring et coll. 2016]. Le PTPh a aussi été mesuré dans l’air dans d’autres zones internationales de l’Arctique à des concentrations allant jusqu’à 60 pg/m3 (Möller et coll. 2012, Salamova et coll. 2014a). Bien que du PTPh ait été mesuré dans des endroits éloignés de l’Arctique, on ne sait pas si des sources locales comme les fluides hydrauliques utilisés dans des navires ou les aéronefs ont pu avoir une influence sur les concentrations mesurées. Le PTPh a aussi été mesuré dans des sédiments océaniques dans des endroits éloignés allant du nord du Pacifique à l’océan Arctique central (valeurs allant de non-détection à 105 pg/g p.s.) [Ma et coll. 2017]. De même, le PTPh a été mesuré dans des poissons, des oiseaux et des mammifères de l’Arctique dans l’archipel de Svalbard (Norvège) [Hallanger et coll. 2015] et dans des mammifères à l’est du Groenland (Strobel et coll. 2018a, 2018b).
En conséquence, bien que le PTPh ne doive pas être sujet à un transport atmosphérique à grande distance d’après la modélisation, des mesures empiriques suggèrent qu’il atteint des régions éloignées. On ne comprend pas bien encore si la présence de cette substance dans des zones éloignées résulte du transport sur de grandes distances lié à des particules (Liu et coll. 2014) ou à des sources locales, mais on ne peut ignorer le potentiel de transport du PTPh sur de grandes distances.
2.5.3 Potentiel de bioaccumulation
La plage des log Koe de 4,42 à 7,55 des substances du sous-groupe des OP aryliques suggère un certain potentiel de bioaccumulation ou de bioamplification dans le biote. Des données empiriques et des données modélisées ont été prises en compte pour la bioaccumulation. Plusieurs études sur la bioconcentration ont été trouvées pour le PTPh, et quelques études empiriques sont disponibles pour le PBPhDPh, le PMNDPh et le PTPPh. De nombreuses études sur la bioconcentration (avant 2009) ont été examinées et résumées dans d’autres évaluations internationales (EA 2009a, 2009b, 2009c, 2009d, OCDE 2002b). Quand ils étaient pertinents, des renseignements présentés dans des évaluations faites ailleurs dans le monde ont été pris en compte et sont inclus ci-après et dans le tableau 2-12.
Des facteurs de bioconcentration (FBC) faibles à modérés sont généralement rapportés dans ces études (p. ex., FBC approximatif dans la plage de quelques centaines à quelques milliers (tableau 2-11). Quelques études plus anciennes sur des mélanges commerciaux contenant les OP aryliques les plus hydrophobes sont disponibles (PBBPhPh, PTPPh). Elles suggèrent que les FBC déterminés pour les poissons (tête-de-boule) sont supérieurs à cette plage pour le PTPPh. Toutefois, ces études ont des limites quant à l’interprétation des données en raison de l’utilisation de mélanges et d’une mortalité liée au traitement. Nous n’en tiendrons pas davantage compte.
Aucune étude en laboratoire rapportant des facteurs de bioaccumulation (FBA) n’est disponible pour aucun des OP aryliques. Bengtsson et coll. (1986) ont réalisé une étude à long terme sur l’accumulation alimentaire avec le PTPh et le vairon (Phoxinus phoxinus). Elle a mis en évidence une très faible accumulation dans les poissons. Les FBC et les FBA modélisés correspondent à un potentiel de bioaccumulation généralement faible à modéré pour la plupart des OP aryliques, avec un potentiel de bioaccumulation prédit élevé pour le PBBPhPh et le PTPPh (tableau 2-12).
Parmi les OP aryliques, seul le PTPh a fait l’objet d’études sur le transfert trophique et la dynamique des réseaux trophiques (Brandsma et coll. 2015, Eulaers et coll. 2014, Greaves and Letcher 2014, Greaves et coll. 2016b, Guo et coll. 2017, Kim et coll. 2011). Si les résultats sont variables, ils suggèrent généralement une bioamplification limitée ou même une dilution trophique du PTPh (Brandsma et coll. 2015, Greaves et coll. 2016, Hallanger et coll. 2015). Des études sur le transfert trophique et la dynamique des réseaux trophiques pourraient être importantes pour le PBBPhPh et le PTPPh étant donné leur plus grande hydrophobicité et leur potentiel de bioaccumulation, suggéré par une modélisation du FBC et du FBA (tableau 2-12).
Des concentrations faibles à modérées de PTPh dans le biote (p. ex., jusqu’à 25 ng/g p.h.) suggèrent que le métabolisme peut limiter sa bioaccumulation (EA 2009d, van der Veen 2012, Wei et coll. 2015).
Les voies et les vitesses du métabolisme des OP aryliques, bien que probablement spécifiques à l’espèce, sont structurellement dépendantes et généralement plus lentes en fonction de la substitution du groupe alkyle (Muir et coll. 1983, Strobel et coll. 2018a, 2018b). Généralement, les OP aryliques peuvent être métabolisés dans le biote (Greaves et coll. 2016a, Sasaki et coll. 1984). Par exemple, les demi-vies mesurées du PTPh dans le biote vont de 5 heures à plus de 4 jours (Hou et coll. 2016, Sasaki et coll. 1981, Su et coll. 2014, 2015a, Wang et coll. 2017) [tableau 2-11]. Toutefois, certains métabolites (p. ex., le PDPh) sont considérés plus stables que leurs parents, et les effets inconnus de ces métabolites stables constituent une lacune dans les données (Crump et coll. 2012, Su et coll. 2014, Strobel et coll. 2018a). Il n’y a pas de donnée empirique disponible sur le FBC du PBBPhPh.
| Substance | Organisme d’essai | Concentration d’exposition (mg/L) | FBC (L/kg poids humide (p.h.), poisson complet sauf indication contraire) | Référence |
|---|---|---|---|---|
| PTPh | Poisson zèbre (Danio rerio) | 0,0042 | 46 (muscle) à 224 (branchies) | Wang et coll. 2017 |
| PTPh | Poisson zèbre (Danio rerio) | 0,021 | 45 (muscle) à 182 (branchies) | Wang et coll. 2017 |
| PTPh | Tête-de-boule (Pimephales promelas) | 0,001 à 0,021 | 700 à 2468 | Cleveland et coll. 1986 |
| PTPh | Médaka (Oryzias latipes) | 0,25 | 84 à 390 | Sasaki et coll. 1981, 1982 |
| PTPh | Médaka (Oryzias latipes) | 1,0 | 250 à 500 | Sasaki et coll. 1981, 1982 |
| PBPhDPh (Santicizer 154) | Crapet arlequin (Lepomis macrochirus) | 0,0172 (moyenne) | 1850 | Hamelink et Eaton 1979 |
| PBPhDPh | Tête-de-boule (Pimephales promelas) | 0,017 à 0,315 | 1997 à 4535 | Cleveland et coll. 1986 |
| PBPhDPh |
Truite arc-en-ciel (Salmo gairdneri) Tête-de-boule (Pimephales promelas) |
0,005 et 0,050 |
Truite arc-en-ciel : 1096 Tête-de-boule : 1010 (calculé en utilisant la radioactivité totale, méthode de test statique) |
Muir et coll. 1983 |
| PMNDPh | Tête-de-boule (Pimephales promelas) | 0,017 à 0,315 | 441 à 862 | Cleveland et coll. 1986 |
| PTPPh (Reofos 35) | Crapet arlequin (Lepomis macrochirus) | 0,0031a | 512 | ECHA c2007-2018d |
| PTPPh (Reofos 35) | Crapet arlequin (Lepomis macrochirus) | 0,024a | 634 | ECHA c2007-2018d |
a concentration moyenne dans l’eau mesurée.
| Substance | Organisme d’essai | FBC (L/kg p.h.) | FBA (L/kg p.h.) | kM (/jour) | Modèle |
|---|---|---|---|---|---|
| PTPh | Poisson | 96,8a | 97,1a | 3,60 | BCFBAF 2012 |
| PTPh | Poisson | 323,6b | NA | 0,009 | BCF de base, CATALOGIC 2014 |
| PBPhDPh | Poisson | 1010a | 1638 a | 0,346 | BCFBAF 2012 |
| PBPhDPh | Poisson | 1380,4b | NA | 0,022 | BCF de base, CATALOGIC2014 |
| PBBPhPhc | Poisson | 575a | 26131a | 0,238 | Arnot et coll. 2008a, 2008b |
| PBBPhPh | Poisson | 47,9b | NA | 0,022 | BCF de base, CATALOGIC 2014 |
| PMNDPh | Poisson | 289,2a | 578,7 | 0,922 à 0,955 | BCFBAF 2012 |
| PMNDPh | Poisson | 691,8b | NA | 0,019 | BCF de base, CATALOGIC2014 |
| PTPPh (T3PTPPh) | Poisson | 355a | 22508 a | 0,238d | Arnot et coll. 2008a, 2008b |
| PTPPh (T3PTPPh) | Poisson | 11,22b | NA | 0,022 | BCF de base, CATALOGIC 2014 |
Abréviations — p.h. : poids humide; ND : non disponible; kM : constante de vitesse métabolique
a FBC et FBA rapportés pour des poissons de niveau trophique moyen et ajusté pour la biotransformation (métabolisme).
b FBC corrigé au moyen de facteurs d’atténuation tels que la taille moléculaire, le métabolisme du parent chimique, la solubilité dans l’eau et l’ionisation.
c Lecture croisée à partir de la kM du PTPPh pour le PBBPhPh, en raison du manque de données disponibles sur la bioaccumulation du PBBPhPh.
d Valeur kM estimée à partir d’une étude empirique sur le FBC des poissons pour le PTPPh (ECHA c2007–2018d, tableau 2-12).
2.6 Potentiel d’effets nocifs sur l’environnement
2.6.1 Évaluation des effets sur l’environnement
2.6.1.1 Mode et mécanisme d’action
Les substances du sous-groupe des OP aryliques ont des modes d’action (MdA) similaires, car ils sont généralement considérés réactifs ou non narcotiques. Le profilage des OP aryliques de la présente évaluation et leurs métabolites potentiels (taux d’occurrence > 20 %) de la Boîte à outils de l’OCDE pour les alertes structurelles associées à la toxicité et au MdA ont révélé des profils d’alerte incluant la neurotoxicité, l’activité de liaison aux œstrogènes, des effets sur la reproduction et le développement (ADN, ARN et interactions des protéines).
Les MdA QSAR trouvés pour le sous-groupe incluent : MdA Verhaar – classe 5 – phosphates, esters, composé organique neutre; MdA OASIS – réactif non spécifié; MdA TEST – inhibition de l’acétylcholinestérase (AchE) ]ASTER 1999; Boîte à outils QSAR de l’OCDE 2016, TEST 2016]. Les alertes de l’OCDE comprennent la mutagénicité in vivo, bien que le PMNDPh ait aussi été trouvé avec la liaison protéine ou l’ADN.
Shi et coll. (2018) ont rapporté que le PTPh a des effets nocifs sur les neurones en développement, incluant l’induction d’une neurotoxicité pour le développement par des voies impliquant la régulation du cytosquelette, la croissance de l’axone, la maturation des neurones et une différentiation du système nerveux. Ces auteurs ont aussi rapporté une inhibition marquée de l’activité totale de l’AChE chez les larves de poisson-zèbre, qui est considérée comme un biomarqueur d’une exposition neurotoxique. Ces auteurs ont aussi suggéré que le PTPh est une neurotoxine, en raison de sa similarité structurelle avec des pesticides de type organophosphate neurotoxiques, dont le chlorpyrifos. La similarité de structure chimique peut signaler de possibles effets similaires à ceux des pesticides de type organophosphate sur la morphogénèse médiée par des neurotransmetteurs. Bien que des résumés d’études antérieures suggèrent des conclusions contradictoires sur la neurotoxicité des OP aryliques (van der Veen et de Boer 2012), des études plus récentes ont dégagé des préoccupations quant à leur neurotoxicité (Behl et coll. 2015, Jarema et coll. 2015, Shi et coll. 2018).
Les études ont aussi souligné la perturbation endocrine comme inquiétude liée aux OP, dont le PTPh, le PBPhDPh, le PMNDPh et le PTPPhH, avec des preuves de perturbation des systèmes reproducteur et thyroïdien (Liu et coll. 2013, Zhang et coll. 2014, Kim et coll. 2015).
2.6.1.2 Effets sur les organismes aquatiques
Nous résumons aux tableaux 2-13 et 2-14 les plages des concentrations avec effet trouvées par des études expérimentales sur la toxicité aquatique. Bon nombre des études sur la toxicité aiguë et chronique (avant 2009) ont été examinées et résumées par d’autres évaluations internationales (EA 2009a, 2009b, 2009c, 2009d, OCDE 2002b). Quand ils étaient pertinents, les renseignements présentés dans les évaluations faites ailleurs dans le monde ont été pris en compte, et ils sont inclus plus bas.
Bien que les valeurs expérimentales soient légèrement plus élevées que celles prédites par la modélisation QSAR (ECOSAR 2012, voir ECCC 2020c), il y a un accord global entre les résultats expérimentaux et ceux modélisés.
Le PTPh, le PTPPh et le PBPhDPh ont déclenché une toxicité pour le développement après fertilisation chez des embryons de poisson-zèbre (Behl et coll. 2015). Parmi les paramètres de toxicité pour le développement, on a signalé une colonne vertébrale courbée, des œdèmes, une petite tête et de petits yeux à des concentrations de 0,65, 2,2 et 3,7 mg/L.
On doit noter que certains essais de toxicité mentionnés dans la présente évaluation ont été réalisés avec des mélanges commerciaux (p. ex., pour le PBPhDPh, le PBBPhPh et le PTPPh) [tableau 2-14], et que pour certaines études des solvants ont été utilisés, qui conduisaient quelques fois à des concentrations de traitement excédant la limite de solubilité de la substance dans l’eau. Toutefois, les études retenues pour l’évaluation des effets aquatiques ont été réalisées en suivant les lignes directrices standards ou ont conduit à des résultats suffisamment fiables (ECHA c2007-2018d, c2007-2018e, OCDE 2002b). Ces facteurs affectent la comparabilité globale des données expérimentales, ainsi que la comparabilité des données expérimentales modélisées. Néanmoins, presque toutes les données sur la toxicité aquatique (expérimentales et modélisées) pour toutes les catégories d’organismes suggèrent que toutes les substances du sous-groupe des OP aryliques ont une toxicité aquatique élevée (c.-à-d. < 1 mg/L).
Parmi les OP aryliques visés par la présente évaluation, le PTPh est celui pour lequel on a réalisé les essais de toxicité aquatique les plus exhaustifs (OCDE 2002b), et il a été déterminé qu’il accroît la toxicité de mélanges commerciaux et des UVCB (c.-à-d. PTPPh) qui en contiennent (Cleveland et coll. 1986, ECHA c2007-2018d). Lors de récentes études aquatiques, le PTPh a été associé à des effets sur la survie, la croissance et la reproduction, ainsi qu’à des effets sur l’activité endocrine, le métabolisme, la génotoxicité, la neurotoxicité et la cardiotoxicité (Behl et coll. 2015, Du et coll. 2015, Du et coll. 2016, Liu et coll. 2013, McGee et coll. 2013, Sun et coll. 2016, Yuan et coll. 2018, Zhang et coll. 2014). McGee et coll. (2013) ont rapporté que le PTPh et un isomère du PTPPh (phosphate de triaryle mono-isopropylé) ont conduit à des effets sur la formation de la boucle et la fonction cardiaques durant l’embryogenèse du poisson-zèbre (Danio rerio), bien que par des mécanismes différents. L’isomère du PTPPh a induit une cardiotoxicité par une voie dépendante du RHA (récepteur des hydrocarbures aryliques), alors que la cardiotoxicité du PTPh était indépendante du RHA. Du et coll. (2015) ont aussi constaté des anomalies du développement cardiaque spécifiques chez le poisson-zèbre causés par le PTPh.
Des études suggèrent que certains des OP aryliques visés par la présente évaluation conduisent à des perturbations des systèmes reproducteur et thyroïdien. Par exemple, lors d’une étude de 21 jours sur le poisson-zèbre, Liu et coll. (2013) ont mis en évidence des effets du PTPh (0,04 à 1,0 mg/L) sur le système reproducteur liés à des perturbations des hormones stéroïdiennes et de la vitellogénine (VTG) et une fécondité moindre. La VTG est essentielle pour la maturation des ovocytes et une reproduction réussie chez les femelles de poisson et est synthétisée dans le foie des femelles en réponse aux œstrogènes (Liu et coll. 2009). Zhang et coll. (2014) ont rapporté des preuves indiquant que le PTPh se comporte comme un agoniste du récepteur œstrogénique α (ERα). Kim et coll. (2015) ont observé que les concentrations d’hormones thyroïdiennes augmentent et que les niveaux de plusieurs gènes responsables de la synthèse des hormones thyroïdiennes étaient régulés à la hausse chez les larves du poisson-zèbre, allant dans le sens d’un potentiel de perturbation des hormones thyroïdiennes du PTPh. De plus, des modifications de l’expression de divers gènes dans les cellules thyroïdiennes (GH3 et FRTL-5) indiquent que le PTPh peut stimuler la synthèse des hormones thyroïdiennes in vitro. Une étude des effets d’une toxicité chronique sur la longueur du corps, la fécondité et la survie de Daphnia magna âgés de moins de 12 h exposés à 0, 5, 50 ou 500 μg/L de PTPh pendant 21 jours a mis en évidence une diminution significative de la longueur corporelle des générations F0 et F1 et une inhibition de la fécondité de la génération F0 à la concentration nominale de 500 μg/L (Yuan et coll. 2018).
Glazer et coll. (2018) ont rapporté des effets du PMNDPh, du PBPhDPh et du PTPPh sur le développement et le comportement neurologique d’embryons de poisson-zèbre de 0 à 5 jours après la fertilisation jusqu’à 7 mois. Ces auteurs ont rapporté que les solutions de PTPPh et de PBPhDPh contenaient de forts pourcentages de PTPh, à savoir 54,8 et 35,5 % respectivement. Un traitement avec 0,13 mg/L de PTPPh a produit une colonne vertébrale courbe chez plus de 50 % des individus, 6 jours après la fertilisation. L’exposition à 1,3 mg/L de PTPPh a produit un œdème péricardique chez tous les individus 4 à 5 jours après la fertilisation. Une colonne vertébrale courbe a été observée chez plus de 50 % des individus exposés à 1,14 mg/L de PBPhDPh 4 à 5 jours après la fertilisation. L’exposition au PMNDPh n’a pas provoqué d’augmentation de la mortalité ni de malformations à aucune des concentrations jusqu’à 3,96 mg/L. Entre 5 et 7 mois, les poissons ont subi une batterie de tests comportementaux pour évaluer leur réponse sensorimotrice, leur interaction sociale et leur évasion des prédateurs. À 0,0045 mg/L, l’activité de base du PTPPh (test de comportement) était réduite de manière significative. L’exposition au PBPhDPh a conduit à des effets significatifs caractérisés par une réduction de l’activité à des concentrations de 0,1 et 0,01 mg/L. Le comportement des larves et des adultes n’a pas été affecté par une exposition au PMNDPh à aucune des concentrations de traitement.
Jarema et coll. (2015) et Behl et coll. (2015) ont évalué les effets neurocomportementaux d’une exposition aiguë ou chronique de larves de poisson-zèbre à des OP, dont le PTPh, le PBPhDPh, le PMNDPh et le PTPPh. Ils ont rapporté que le PTPh et le PTPPh causent des modifications du comportement à 6 jours après la fertilisation (dose minimale avec effet observé (DMEO) de PTPh = 0,13 mg/L, DMEO de PTPPh = 0,54 mg/L). Ces quatre OP aryliques ont causé des modifications du comportement à 6 jours après la fertilisation après une exposition aiguë (DMEO de 0,22 à 4,68 mg/L). Noyes et coll. (2015) ont aussi montré des sensibilités neurologiques et morphologiques similaires du poisson-zèbre aux OP aryliques (isomères de PTPh, PBPhDPh, PMNDPh et PTPPh). Une exposition au PTPh à 1 et 5 jours après la fertilisation a conduit à une survie moindre avec concentration élevée d’œdèmes et à des réponses locomotrices hypoactives. Sun et coll. (2016) ont évalué la neurotoxicité pour le développement du PTPh au cours des premiers stades de vie de larves de médaka (Oryzias latipes). L’activité totale de l’AChE des larves de médaka des groupes exposés au PTPh était significativement inhibée à 0,12 et 0,62 mg/L. Ces résultats apportent la preuve d’effets potentiels sur développement du système nerveux vertébré.
Avec pour intention d’estimer les effets en milieu aquatique pour la présente évaluation, le PTPh a été utilisé pour une lecture croisée pour les substances du sous-groupe des OP aryliques, étant donné la disponibilité des études sur la toxicité de cette substance et le fait que le PTPh a la plus forte probabilité de se retrouver dans l’eau. Une CE10 à 30 jours (croissance) de 0,037 mg/L (Sitthichaikasem 1978) pour le PTPh a été retenue comme valeur critique de toxicité (VCT) étant donné qu’elle représente l’effet le plus faible basé sur des données expérimentales fiables sur la toxicité aquatique pour les substances du sous-groupe des OP aryliques.
L’incertitude associée à l’utilisation du PTPh pour une lecture croisée de la toxicité aquatique des quatre autres OP aryliques a été prise en compte qualitativement, basée sur une analyse et une comparaison des composés parents et des métabolites stables (estimé au moyen de CATALOGIC avec une probabilité d’occurrence de plus de 20 %). Pour l’analyse, il a été tenu compte de la similarité des structures chimiques, des propriétés physiques et chimiques, de la toxicodynamique et de la toxicocinétique du PTPh et des métabolites et de celles du parent et des métabolites des quatre autres OP aryliques (en utilisant ACD Percepta, EPI Suite et la Boîte à outils de l’OCDE). La comparaison des propriétés physiques et chimiques a mis en évidence des différences appréciables de plusieurs ordres de grandeur de certains paramètres, dont le log Koe et la constante de Henry. De plus, des différences entre les métabolites du PTPh et au moins un des métabolites de quatre autres OP étaient aussi évidentes pour les effets neurotoxiques et comportementaux potentiels, les effets sur la reproduction et le développement exprimés par des paramètres toxicodynamiques tels que la liaison à l’ADN, la liaison aux protéines et la toxicité dans des conditions de dose répétée (Hazard Evaluation Support System database (HESS) 2020). Donc, non seulement il existe des différences potentielles de toxicocinétique parmi les métabolites, mais le paramètre actuel utilisé comme VCT peut ne pas être assez sensible pour couvrir des effets, dont la neurotoxicité, les effets sur la thyroïde et le développement. En conséquence, l’approche susmentionnée a été utilisée pour calculer le facteur d’évaluation (FE) afin de rendre compte des différences entre les métabolites potentiels du PTPh et ceux des quatre autres OP aryliques.
Pour calculer la concentration estimée sans effet (CESE) pour les organismes aquatiques, nous avons appliqué un facteur global d’évaluation de 100. Ce facteur de 100 a été déterminé en tenant compte de la sensibilité des espèces et du mode d’action pour les organismes aquatiques. Spécifiquement, un facteur de 1 a été appliqué à la VCT pour tenir compte de la variation interspécifique et intraspécifique, étant donné qu’un grand ensemble de données était disponible (sept espèces de trois catégories, vertébrés, invertébrés et algues), et un facteur de 1 a aussi été appliqué pour tenir compte de l’extrapolation de la mortalité à la toxicité sublétale. De plus, comme susmentionné, une analyse des substances du sous-groupe des OP aryliques suggère que la toxicité aquatique peut être déclenchée par les composés parents et leurs métabolites respectifs. Les métabolites prédits incluent des substances narcotiques et réactives ou ayant une action spécifique (c.-à-d. inhibitrices de l’AChE), indiquant un fort potentiel de variation de la toxicité d’une espèce à l’autre et d’une substance à l’autre. Les principaux paramètres d’intérêt sont la neurotoxicité et des effets sur le comportement, la reproduction ou le développement résultant d’interactions ADN-ARN-protéines (p. ex., génotoxicité). Afin de tenir compte de la réactivité des métabolites, nous avons utilisé un facteur d’évaluation de 100 pour tenir compte des différences dans le mode d’action des métabolites des OP aryliques pouvant déclencher des effets (incluant la neurotoxicité et l’inhibition de l’AChE, qui peut être irréversible) à des concentrations inférieures à celles du PTPh et d’autres substances parents. En conséquence, la CESE des substances du sous-groupe des OP aryliques a été calculée en appliquant trois facteurs, 1 × 1 × 100. Elle est donc de 0,037 mg/L/100 = 0,00037 mg/L.
| Nom commun | Organisme testé | Paramètre | Gamme/valeur (mg/L) | Référence |
|---|---|---|---|---|
| PTPh |
Truite arc-en-ciel (Oncorhynchus mykiss) Médaka (Oryzias latipes) Cyprin doré (Carassius auratus) |
CL50 96 h | 0,4 à 1,2 | ECHA c2007-2018c, Mayer et coll. 1981, Sasaki et coll. 1981 |
| PTPh | Truite arc-en-ciel (Oncorhynchus mykiss) | CE10 30 j | 0,037 | Sitthichaikasem 1978 |
| PTPh | Truite arc-en-ciel (Oncorhynchus mykiss) | CMEO 30 j | 0,055 | Sitthichaikasem 1978 |
| PTPh | Mysis effilée (Americamysis bahia) | CL50 96 h | ≥ 0,18 à ≤ 0,32 | ECHA c2007-2018c |
| PTPh | Daphnie (Daphnia magna) | CE50 96 h | 1,0 | Mayer et coll. 1981 |
| PTPh | Daphnie (Daphnia magna) | CSEO 21 j | 0,254 à 0,831 | ECHA c2007-2018c |
| PTPh | Daphnie (Daphnia magna) | CMEO 21 j | 0,254 à 0,831 | ECHA c2007-2018c |
| PTPh | Algue (Pseudokirch-neriella subcapitata) | CMEO 72 h | 0,5 à 5 | Millington et coll. 1988 |
| PTPh | Algue (Desmodesmus subspicatus) | CMEO 72 h | 0,5 à 5 | Millington et coll. 1988 |
| PTPh | Algue (Desmodesmus subspicatus) | CSEO 72 h | 0,25 à 2,5 | Millington et coll. 1988 |
| PTPh (15 à 20 %)a, PBPhDPh (35 à 40 %)b, PBBPhPh (23 à 28 %)b | Tête-de-boule (Pimephales promelas) | CL50 96 h | 0,65 à 2,3 | Adams et coll. 1983, Cleveland et coll. 1986 |
| PTPh (15 à 20 %)a, PBPhDPh (35 à 40 %)b, PBBPhPh (23 à 28 %)b | Tête-de-boule (Pimephales promelas) | CMAT 60‑90 j | > 0,14 à < 0,83 | Adams et coll. 1983, Cleveland et coll. 1986 |
| PTPh (27 à 32 %)b, PBPhDPh (35 à 40 %)b, PBBPhPh (23 à 28 %)b | Daphnie (Daphnia magna) | CE50 48 h | 0,202 à 2,9 | Adams et coll. 1983, Sanders et coll. 1985 |
| PTPh (27 à 32 %)b, PBPhDPh (35 à 40 %)b, PBBPhPh (23 à 28 %)b | Daphnie (Daphnia magna) | CMAT 21 j | 0,010 à < 0,226 | Adams et coll. 1983, Sanders et coll. 1985 |
| PMNDPh (91 %)a, PTPh (6 %)a | Truite arc-en-ciel (Oncorhynchus mykiss) | CE50 96 h | > 0,15 | ECHA c2007-2018e |
| PMNDPh (91 %)a, PTPh (6 %)a | Tête-de-boule (Pimephales promelas Rafinesque) | CMAT 90 j | > 0,19 à < 0,38 | Cleveland et coll. 1986 |
| PMNDPh (91 %)a, PTPh (6 %)a | Daphnie (Daphnia magna) | CE50 48 h | 0,042 à 0,48 | ECHA c2007-2018e, Adams et Heindolph 1985 |
| PMNDPh (91 %)a, PTPh (6 %)a | Daphnie (Daphnia magna) | CSEO 21 j | 0,0038 à > 0,0062 | ECHA c2007-2018e |
| PMNDPh (91 %)a, PTPh (6 %)a | Algue (Pseudokirch-neriella subcapitata) | CE50 72-96 h | > 0,1 | ECHA c2007-2018e, EG and G Bionomics 1979a |
| PTPPh (PTPh > 5 %) | Tête-de-boule (Pimephales promelas Rafinesque) | CE10 30 j | 0,0031 | ECHA c2007-2018d |
| PTPPh (PTPh > 5 %) | Tête-de-boule (Pimephales promelas Rafinesque) | CMEO 30 j | 0,0082 | ECHA c2007-2018d |
| PTPPh (PTPh > 5 %) | Tête-de-boule (Pimephales promelas Rafinesque) | CMAT 30 j | 0,005 | ECHA c2007-2018d |
| PTPPh | Moucheron (Chironomus plumosus) | CL50 48 h | 1,5 à 2,2 | ECHA c2007-2018d, Sanders et coll. 1985 |
| PTPPh | Daphnie (Daphnia magna) | CSEO 21 j | 0,019 à 0,0415 | ECHA c2007-2018d, Sanders et coll. 1985 |
| PTPPh | Daphnie (Daphnia magna) | CMEO 21 j | 0,106 | ECHA c2007-2018d, Sanders et coll. 1985 |
| PTPPh | Daphnie (Daphnia magna) | CMAT 21 j | 0,0663 | ECHA c2007-2018d, Sanders et coll. 1985 |
| PTPPh | Algue (Selenastrum capricornutum Printz) | CE50 72 h | > 2,5 | ECHA c2007-2018d |
| PTPPh | Algue (Selenastrum capricornutum Printz) | CSEO 72 h | 0,31 | ECHA c2007-2018d |
Abréviations – CL : concentration létale; CE : concentration efficace moyenne; CMAT : concentration maximale admissible tolérable; CMEO : concentration minimale avec effet observé; CSEO : concentration sans effet observé; h : heure, j : jour.
a Composition rapportée dans l’étude.
b Composition rapportée dans la SDS 2012 disponible pour le public.
| Nom commun | Organisme testé | Paramètre | Valeur (mg/kg) | Référence |
|---|---|---|---|---|
| PTPPh (PTPh < 5 %)a | Moucheron (Chironomus riparius) | CE50 28 j émergence | 87 | ECHA 2007-2018 |
| PTPPh (PTPh < 5 %)a | Moucheron (Chironomus riparius) | CE10 28 j/CMEO | 37 | ECHA 2007-2018 |
| PTPPh (PTPh < 5 %)a | Moucheron (Chironomus riparius) | CSEO 28 j | < 37 | ECHA 2007-2018 |
Abréviations – CE : concentration efficace moyenne; CMEO : concentration minimale avec effet observé; CSEO : concentration sans effet observé
a Composition rapportée dans l’étude.
Pour les substances du sous-groupe des OP aryliques, nous n’avons trouvé qu’une seule étude sur la toxicité du PTPPh dans les sédiments qui pourrait conduire à une VCT (tableau 2-14). Lors d’un test de toxicité pour les chironomes réalisé avec des sédiments dopés (ligne directrice 218 de l’OCDE), les effets d’un PTPPh commercial sur des moucherons (Chironomus riparius) exposés pendant 28 jours à des concentrations allant de 37 à 688 mg/kg ont été mesurés. Le nombre total d’adultes qui émergeaient et leur vitesse de développement ont été étudiés (ECHA c2007-2018d). La CE50 (émergence) a été établie à 87 mg/kg p.s. D’après les effets observés sur la vitesse de développement, la CMEO (et CE10) pour cette étude était de 37 mg/kg et la CSEO était inférieure à 37 mg/kg. Lors d’une deuxième étude, Huckins et coll. (1991) ont étudié la toxicité du PTPh dans les sédiments et l’eau sus-jacente, mais les niveaux d’effet d’une exposition dans les sédiments n’ont pas été déterminés, et cette étude n’a donc pas été prise en compte.
Bien que l’approche globale suivie pour la présente évaluation consiste à utiliser des structures représentatives (PTPh ou T3PTPPh) pour le PTPPh (plutôt que de tester l’UVCB complet), et étant donné le manque de données sur la toxicité dans les sédiments pour ce sous-groupe et des analogues potentiels, l’étude expérimentale avec l’UVCB (ECHA c2007-2018d) a été retenue pour la VCT. De plus, étant donné l’homogénéité prévue de l’UVCB PTPPh (les composants sont tous des OP aryliques allant du PTPh à divers isomères de PTPh isopropylés) [annexe A], ainsi que la proche similitude des composants de cet UVCB avec les substances du sous-groupe des OP aryliques, nous avons supposé que les résultats des tests de toxicité seraient pertinents pour tout le sous‑groupe. Les composants hydrophobes du PTPPh (p. ex., composants isopropylés tels que le T3PTPPh) devraient se retrouver davantage dans les sédiments que le PTPh.
En utilisant le PTPPh pour représenter la toxicité des sédiments pour le sous‑groupe des OP aryliques, un facteur d’évaluation de 100 a été appliqué à la VCT de 37 mg/kg (CE10 de 28 j). Ce facteur de 100 correspond à un facteur de 50 pour tenir compte de la variation interspécifique et intraspécifique, étant donné qu’il n’y a qu’une seule espèce (Chironomus riparius) d’une seule catégorie (invertébrés) dans l’ensemble de données sur la toxicité, et à un facteur de 2 pour tenir compte du mode d’action réactif de l’OP arylique. Ceci conduit donc à une CESE de 0,37 mg/kg (37/50 × 2 × 1).
2.6.1.3 Effets sur les organismes endogés
Nous avons trouvé des études sur la toxicité dans le sol du PTPPh (UVCB), du PTPh et du PBPhDPh, ainsi que de mélanges commerciaux contenant des combinaisons de substances du sous-groupe des OP aryliques (tableau 2-15). Bien que des tests avec une seule substance soient privilégiés, étant donné le manque de données sur la toxicité dans les sols pour des substances individuelles de ce sous-groupe et des analogues potentiels, ainsi que le fait que les mélanges commerciaux sont constitués d’environ 99 % de substances du sous-groupe des OP aryliques, ces études ont été prises en compte pour l’évaluation et jugées pertinentes pour le sous-groupe dans son ensemble.
| Composition du mélange | Organisme testé | Paramètre | Valeur (mg/kg) | Référence |
|---|---|---|---|---|
| PTPh (40,6 %), PBPhDPh (47,5 %), PBBPhPh (10,9 %)a | Plantes (tomate (Lycopersicon esculentum), navet (Brassica rapa), ivraie (Lolium perenne), oignon (Allium cepa), concombre (Cucumis sativus) et laitue (Lactuca sativa)) | CE50 21 j croissance/émergence | 182 à 787 | Rapport d’étude 2015 |
| PTPh (40,6 %), PBPhDPh (47,5 %), PBBPhPh (10,9 %)a | Plantes (tomate (Lycopersicon esculentum), navet (Brassica rapa), ivraie (Lolium perenne), oignon (Allium cepa), concombre (Cucumis sativus) et laitue (Lactuca sativa)) | CSEO 21 j croissance/émergence | 12,3 à 111 | Rapport d’étude 2015 |
| PTPh (45,7 %), PBPhDPh (40 à 46 %), PBBPhPh (12 à 18 %)a | Lombric (Eisenia fetida) |
CSEO 28 j mortalité/poids CSEO 56 j reproduction |
> 100 | Rapport d’étude 2014 |
| PTPPh (PTPh < 5 %)a |
Blé (Triticum aestivum) Radis (Raphanus sativus) Ambérique (Phaseolus aureus) |
CL50 19 j | > 100 | ECHA c2007-2018d |
| PTPPh (PTPh < 5 %)a | Lombric (Eisenia fetida) | CE50 28 j reproduction | > 1000 | ECHA c2007-2018d |
| PTPPh (PTPh < 5 %)a | Lombric (Eisenia fetida) | CMEO 28 j reproduction | 500 | ECHA c2007-2018d |
| PTPPh (PTPh < 5 %)a | Lombric (Eisenia fetida) | CSEO 28 j reproduction | 250 | ECHA c2007-2018d |
Abréviations — CL : concentration létale, CE : concentration efficace moyenne, CMEO : concentration minimale avec effet observé, CSEO : concentration sans effet observé
a Composition tirée de la référence citée.
Les études disponibles incluent des études de 19 à 21 jours avec des plantes, pour lesquelles la survie et la croissance (hauteur, poids, émergence) ont été étudiées, et des études de 28 jours avec le lombric sur les effets des OP aryliques sur la survie et la reproduction.
Pour le rapport d’étude de 2015, les effets d’un mélange commercial de PTPh (40,6 %), PBPhDPh (47,5 %) et PBBPhPh (10,9 %) sur l’émergence des semis et la croissance de deux espèces terrestres de plantes monocotylédones et de quatre espèces terrestres de plantes dicotylédones ont été étudiés (tomate (Lycopersicon esculentum), navet (Brassica rapa), ivraie (Lolium perenne), oignon (Allium cepa), concombre (Cucumis sativus) et laitue (Lactuca sativa). Les graines ont été semées dans des sols contenant la substance à tester à des concentrations allant de 4,1 à 1000 mg/kg sol sec. Des effets nocifs ont été observés sur l’émergence des semis ou le début de la croissance des six espèces testées. Les CSEO allaient de 12,3 à 111 mg/kg, les CMEO de 37 à 1000 mg/kg et les CE50 de 181,7 à 786,9 mg/kg.
Pour le calcul d’une CESE pour les organismes endogés pour le sous‑groupe des OP aryliques, le niveau d’effet le plus bas mesuré (CE50 21 j de 182 mg/kg pour la croissance réduite de la tomate) a été retenu comme VCT. Un facteur d’évaluation de 20 a été utilisé pour calculer la CESE pour le sous-groupe des OP aryliques pour le sol. Ce facteur d’évaluation comprend un facteur de 5 pour l’extrapolation d’un niveau d’effet médian (CE50) à un niveau faible ou nul, et un facteur de 2 pour tenir compte de la variation interspécifique et intraspécifique, seulement deux catégories d’espèces (producteurs primaires et invertébrés) étant représentées dans l’ensemble de données sur la toxicité (incluant au moins sept espèces). Un facteur de 2 a aussi été appliqué pour tenir compte du mode d’action réactif des OP aryliques. Avec ce facteur d’évaluation globale de 20 (5 × 2 × 2), une CESE de 9,09 mg/kg p.s. a été calculée.
2.6.1.4 Effets sur la faune
La toxicité pour les mammifères a été étudiée en suivant une démarche reposant sur une valeur de toxicité de référence (VTR) pour la faune (Sample et coll. 1996), pour laquelle les effets chez le rat ont été normalisés pour le poids corporel typique du vison (Mustela vison) et de la loutre de rivière (Lontra canadensis) [annexe C]. Les VTR représentent les vitesses d’absorption sans effet prédites chez le récepteur mammifère. Aux fins de la présente évaluation, le vison et la loutre de rivière sont jugés représentatifs de la faune mammifère canadienne. Pour l’évaluation de la faune, la substance ayant un fort potentiel de bioaccumulation et pour laquelle on disposait de données sur la toxicité pour les mammifères, le PTPPh (structure représentative, T3PTPPh), a été choisie pour l’estimation de la VTR, car elle est jugée représentative d’une substance du sous-groupe des OP aryliques ayant un potentiel élevé d’exposition de la faune.
En raison du manque de données sur la toxicité pour la faune des substances du sous-groupe des OP aryliques, des données sur les rongeurs prises en compte pour la partie sur la santé de la présente évaluation ont aussi été utilisées pour la partie sur l’environnement. Pour une étude de 91 jours avec le PTPPh, par gavage pour laquelle des rats ont reçu un mélange commercial, le Reofos 35, contenant 65 % de PTPPh et 35 % de PTPh (EA 2009 b), la DMENO a été établie à 25 mg/kg/jour, basée sur des modifications histopathologiques nocives observées dans les glandes surrénales à toutes les doses (voir la section 2.7.3.4). Lors d’une étude sur la reproduction du rat durant laquelle ils ont été exposés par voie orale à un autre mélange commercial de PTPPh, la dose sans effet nocif observé (DSENO) pour la performance réduite de la reproduction des mâles et des femelles a été établie à 25 mg/kg p.c./j. La DSENO pour la toxicité néonatale de la F1 a été établie à 25 mg/kg/jour (ECHA c2007-2018d). Une DMENO de 25 mg/kg p.c./j a été retenue, basée sur des modifications histopathologiques nocives observées dans les glandes surrénales, et une DMENO pour la performance réduite de reproduction chez les mâles et les femelles a été établie à 25 mg/kg p.c./j (ECHA c2007-2018d).
Un facteur d’évaluation de 10 a été appliqué à la VTR pour la faune afin de tenir compte de la variation interspécifique et intraspécifique. Les estimations de la VCT du PTPPh de 14,05 mg/kg p.c./j pour le vison et de 8,36 mg/kg p.c./j pour la loutre de rivière ont été déterminées à partir de la DMENO de l’étude susmentionnée sur le rat. Les VTR résultantes étaient respectivement de 1,4 et 0,84 mg/kg p.c./j pour le vison et la loutre de rivière (tableau 2-16).
| Nom commun | VCT (mg/kg p.c./j) | VTR (mg/kg p.c./j) |
|---|---|---|
| Vison (Mustela vison) | 14,05 | 1,4 |
| Loutre de rivière (Lontra canadensis) | 8,36 | 0,84 |
2.6.2 Évaluation de l’exposition environnementale
Bien que pour l’analyse de l’exposition nous ayons pris en compte des concentrations mesurées des substances du sous-groupe des OP aryliques dans l’environnement au Canada, ces mesures ne sont pas suffisantes pour évaluer l’exposition pour l’analyse des risques. Pour l’analyse de l’exposition, nous avons aussi estimé les rejets des OP aryliques dans l’eau par les installations industrielles en nous intéressant principalement aux principales utilisations rapportées : formulation de produits en matière plastique et en caoutchouc, formulation de lubrifiants et d’additifs pour lubrifiant et formulation de peintures et revêtements. Les concentrations environnementales estimées sont établies en utilisant les données canadiennes disponibles, dont les quantités des substances, les facteurs d’émission estimés et les caractéristiques du milieu récepteur. Des scénarios d’exposition spécifiques sont décrits ci-après.
Étant donné que la lixiviation potentielle d’OP aryliques à partir de divers produits commerciaux ou de consommation (p. ex., matières plastiques, caoutchoucs, autres articles manufacturés), nous avons également étudié les voies de rejet dans l’eau et les concentrations environnementales estimées qui pourraient en résulter.
2.6.2.1 Concentrations mesurées dans les milieux environnementaux et les eaux usées
Il existe des données de surveillance canadiennes du PTPh dans la plupart des milieux environnementaux : air, eau, sédiments marins, eaux usées et biote (tableau 2-17). Des données récentes de surveillance environnementale des autres OP aryliques visés par la présente évaluation manquent pour le Canada et ailleurs dans le monde. Les concentrations environnementales ont été estimées à partir des renseignements canadiens disponibles, dont des quantités de substance estimées, des vitesses de rejet estimées et des caractéristiques du milieu récepteur. Des concentrations environnementales ont été estimées pour des scénarios de rejet industriel, tel que décrit à la section 2.6.2.2.
| Milieu (unité) | Lieu | Concentration maximale, moyenne, médiane ou plage | Référence |
|---|---|---|---|
| Air (pg/m3) | Toronto |
< 87 à 2220 827 (moyenne) 700 (médiane) |
Shoeib et coll. 2014 |
| Air (pg/m3) | Arctique |
22 à 84 (moyenne) ND à 1930 (médiane) |
Sühring et coll. 2016 |
| Air (pg/m3) | Toronto | 1063 (moyenne) | Abdollahi et coll. 2017 |
| Air (pg/m3) | Ville de Québec | ND à 512 (médiane) | Sühring et coll. 2016 |
| Pluie (mg/L) | Toronto | ND à 3,4 × 10-8 | Truong 2016 |
| Eau de surface (mg/L) | Lacs Huron, Érié et Michigan; rivière Don; ruisseaux Etobicoke et Highland |
1,3 × 10-7 à 2,39 × 10-4 (flux max., ruisseau urbain) < LD à 2,1 × 10-5 |
Venier et coll. 2014, Truong 2016 |
| Sédiments (sédiments marins de surface) (mg/kg p.s.) | Marges du bassin Canada, océan Arctique | ND à 7,4 × 10-5 (moyenne = 1,1 × 10-5) | Ma et coll. 2017 |
| Poisson (ng/g p.h.) | Grand lac de l’Ours, Grands Lacs (Canada et É.‑U.) | 0,10 à 25 | McGoldrick et coll. 2014, Guo et coll. 2017 |
| Tissus d’oiseaux (œufs d’oiseaux) (ng/g p.h.) | Lac Huron | ND à 4,18 (ND à 0,81) | Chen et coll. 2012, Greaves et coll. 2014, Su et coll. 2014 |
|
Eaux usées (valeurs médianes) : influent (mg/L) effluent (mg/L) biosolides (mg/kg p.s.) |
8 STEU |
Influent : 8,1 × 10-5 à 7,5x 10-4 Médian : 1,8 × 10-4 Effluent : 1,1 × 10-5 à 7,2 × 10-4 Médian : 9,1 × 10-5 Biosolides : 0,012 à 0,83 |
ECCC 2016d, Truong 2016 |
Abréviations — LD : limite de détection; ND : non détecté; UTEU : usine de traitement des eaux usées
2.6.2.2 Calcul des CEE et hypothèses générales
Pour étayer la caractérisation des risques posés par les substances du sous‑groupe des OP aryliques, nous avons calculé des concentrations environnementales estimées (CEE) dans divers milieux pertinents. Les rejets dans les eaux de surface peuvent résulter de rejets industriels dans les égouts, suivis du traitement par un système de traitement des eaux usées (STEU). L’épandage de biosolides de STEU sur des terres agricoles conduit à une exposition du sol, et des processus d’équilibrage ont lieu dans la colonne d’eau conduisant à un partage et une exposition des sédiments situés près des points de rejet. De plus, des CEE pour la faune ont été calculées pour deux espèces piscivores, le vison (Mustela vison) et la loutre de rivière (Lontra canadensis), à partir de l’absorption journalière totale (AJT) en utilisant des teneurs estimées d’OP arylique PTPPh dans les poissons.
En se basant sur les principales utilisations des OP aryliques, les scénarios d’exposition suivants résultant d’activités de formulation industrielles ont été pris en compte pour la présente évaluation : formulation d’additifs de lubrifiant, de lubrifiants, de produits en matière plastique, de produits en caoutchouc, de peintures et revêtements. Aucun scénario d’exposition due à l’utilisation de lubrifiants et graisses industriels, commerciaux ou de consommation n’a été créé, car nous avons déterminé que l’exposition de l’environnement découlant de cette utilisation serait limitée. Il est anticipé que ces produits seront confinés pendant leur utilisation et que des programmes existent pour leur collecte à la fin de leur vie utile à des fins de recyclage ou d’élimination dans des installations de traitement de déchets. Les rejets potentiels dus au nettoyage de contenants et au transport, y compris le chargement et le déchargement, ne sont pas pris en compte pour la présente évaluation. Étant donné que la lixiviation d’OP aryliques à partir de divers produits commerciaux ou de consommation (p. ex., matières plastiques, caoutchoucs, autres articles manufacturés) pourrait se produire, nous en avons tenu compte pour la présente évaluation des CEE dans les eaux de surface. L’exposition résultant de ces rejets dus à des produits commerciaux et de consommation a été évaluée en utilisant des données sur des concentrations mesurées dans des eaux de surface. Les CEE pour les scénarios d’exposition dans les eaux de surface, les sédiments et les sols sont présentées dans le tableau 2-19.
Les scénarios ont été créés en se basant sur des renseignements disponibles et en utilisant une combinaison d’éléments génériques et représentatifs du site. La quantité de substance utilisée annuellement par une installation est basée sur la moyenne des quantités totales d’OP aryliques déclarées par les entreprises. Pour quelques scénarios, la quantité la plus élevée d’OP aryliques déclarée par une installation individuelle a aussi été prise en compte (ECCC 2016 b, Environnement Canada 2009, 2013). Les volumes de dilution quotidiensNote de bas de page 5 sont soit propres au site représentatif, soit basés sur une distribution des volumes de dilution quotidiens associés à des installations pertinentes du secteur industriel quand les emplacements des installations sont inconnus. Les facteurs de rejet dans les eaux usées et le nombre de journées de rejet d’une installation reposent sur des hypothèses issues de sources génériques de renseignements. Pour l’approche suivie, nous avons présumé que les effluents industriels provenant de décharges indirectes sont typiquement envoyés dans un STEU secondaire, le type de traitement le plus courant au Canada. Tous les paramètres utilisés pour le calcul des CEE sont fournis dans le document ECCC 2020d.
Pour tous les calculs des CEE, la quantité totale de substance utilisée annuellement sur un site a été présumée être la somme des quantités des cinq substances individuelles déclarées par une entreprise (Environnement Canada 2009, 2013). Cette hypothèse a été posée, car il est attendu qu’étant donné leurs propriétés et utilisations similaires, les cinq OP aryliques pourraient être utilisés en combinaison ou de manière interchangeable. En fait, de nombreuses formulations commerciales contiennent plus d’un des OP aryliques visés par la présente évaluation, et ils sont donc utilisés ensemble. Une efficacité d’élimination moyenne des STEU secondaires de 86 % est utilisée pour le calcul des CEE pour la vie aquatique, les sédiments et les sols. Cette valeur est basée sur des taux d’élimination mesurés du PTPh (ECCC 2016c) et un taux modélisé pour le PTPPh (SimpleTreat 2003).
Une approche de partage à l’équilibre sédiments-eau a été suivie pour estimer les CEE des OP aryliques dans les sédiments. Pour cette approche, nous avons supposé que les sédiments en suspension dans la colonne d’eau sont en équilibre chimique avec la phase aqueuse (ECHA 2016). Nous avons supposé que les sédiments du fond sont en équilibre avec les sédiments en suspension, d’après l’EPA (2003). En faisant ces hypothèses, les sédiments du fond, les sédiments en suspension et la phase aqueuse d’un plan d’eau sont tous en équilibre. Les caractéristiques typiques des sédiments en suspension et des sédiments de fond, tel que suggéré par Gobas (2007 and 2010), ont été utilisées pour le calcul. Les CEE ont été standardisées pour une teneur en carbone organique de 3 %, typique des sédiments de fond des rivières et lacs canadiens.
L’estimation de l’exposition des sols a été basée sur une approche décrite par l’Agence européenne des produits chimiques (ECHA 2016) mettant en jeu l’épandage de biosolides de STEU sur des terres. Avec cette approche, la concentration de la substance accumulée (CEEsol) dans les 20 premiers cm de sol après 10 ans d’épandage est estimée. Toutefois, étant donné que le PTPh peut se dégrader rapidement dans le sol, cette approche a été modifiée pour en tenir compte. La demi-vie de dégradation dans le sol du PTPh est de 37 jours (Andersen et coll. 1993). Les concentrations ont été déterminées sur une base annuelle immédiatement après l’épandage et à la fin de l’année (365 jours) avant l’épandage subséquent, pendant une période de 10 ans. Étant donné sa demi‑vie, la concentration de PTPh dans le sol ne s’accumule pas beaucoup au cours des 10 ans, et les concentrations dans le sol sont maximales immédiatement après l’épandage (diminuant significativement au cours de l’année).Les hypothèses sur les quantités et les taux d’élimination faites pour le calcul de la CEEsol sont les mêmes que celles faites pour la CEE aquatique.
Les estimations de l’exposition de la faune piscivore aux substances du sous‑groupe des OP aryliques sont basées sur le modèle d’exposition de la faune de l’EPA de 1993 (ECCC 2020c). Ce modèle comprend une estimation de l’absorption journalière totale (AJT) par le vison (Mustela vison) et la loutre de rivière (Lontra canadensis) [ECCC 2020c], qui ont été choisis comme espèces représentatives de la faune locale dans un environnement de rivière au Canada. Ce scénario a pour but d’évaluer l’exposition du vison et de la loutre de rivière vivant à proximité d’une zone de rejet. Pour le calcul de l’AJT, une concentration dans l’eau (Ce) de 2,7 × 10-3 mg/L a été retenue, basée sur la CEE dans l’eau la plus prudente de tous les scénarios d’exposition (tableau 2-18). L’AJT a été ensuite estimée en utilisant des paramètres pour le PTPPh (substance représentative, T3PTPPh) étant donné que, d’après l’évaluation de la bioaccumulation, c’est la substance qui a la plus forte probabilité de s’accumuler dans des organismes et d’être transférée dans la chaîne trophique. Ceci a conduit à des AJT respectives de 1,65 et 1,78 mg/kg p.c./j pour le vison et la loutre de rivière.
Des scénarios d’exposition ont été développés pour la production et l’utilisation industrielles de substances du groupe des substances ignifuges.
Formulation d’additifs de lubrifiant
D’après les renseignements déclarés en réponse à des enquêtes menées en vertu de l’article 71 de la LCPE (Environnement Canada 2009, 2013, ECCC 2016 b), les OP aryliques visés par la présente évaluation sont importés sous forme de mélanges ou de substance pure ou mélangée à d’autres substances pour préparer des ensembles d’additifs pour lubrifiant qui sont vendus à des formulateurs de lubrifiants industriels. Deux CEE ont été calculées pour ce scénario : une pour un utilisateur industriel de grandes quantités représentatif et l’autre pour un utilisateur industriel générique représentatif. Pour ce dernier, étant donné que différentes entreprises sont considérées comme de possibles formulateurs d’additifs, une distribution des volumes de dilution quotidiens associés à des STEU secondaires et tertiaires recevant des effluents du secteur des producteurs de substances chimiques a été utilisée. Une composition représentative de 5 % d’OP aryliques dans des ensembles d’additifs pour lubrifiant a été retenue, basée sur des fiches signalétiques disponibles.
Formulation de lubrifiants
D’après les renseignements déclarés en réponse à des enquêtes menées en vertu de l’article 71 de la LCPE (Environnement Canada 2009, 2013, ECCC 2016 b), des OP aryliques sont importés à des fins d’utilisation dans des produits lubrifiants. Étant donné que différentes entreprises sont considérées comme de possibles formulateurs de lubrifiants, une valeur minimale représentative des volumes de dilution quotidiens pour les STEU recevant des effluents des installations de mélange de lubrifiants a été utilisée. D’après les fiches signalétiques disponibles pour des lubrifiants contenant des substances de ce sous-groupe dans la plage de 0,1 à 1 %, une concentration représentative a été retenue pour les calculs pour représenter la quantité d’OP aryliques présente dans les produits lubrifiants finaux. La principale source de rejet durant les activités de formulation est le débordement pendant l’emballage de l’ensemble d’additifs final (OCDE 2004a). Un taux d’élimination sur place représentatif de 50 % a été appliqué. Ce taux d’élimination tient compte de l’utilisation courante de séparateurs huile-eau dans les installations de mélange de lubrifiants (OCDE 2011).
Formulation de produits en matière plastique
D’après les renseignements déclarés en réponse à des enquêtes menées en vertu de l’article 71 de la LCPE (Environnement Canada 2009, 2013, ECCC 2016 b), des OP aryliques sont importés dans des ensembles d’additifs pour matière plastique pour les producteurs de matières plastiques et mélangés à une résine polymère pour produire divers produits en matière plastique, comme de la mousse de PUF et des PVC. Ces substances servent de plastifiants et d’additifs ignifuges dans des produits en matière plastique. D’après les renseignements disponibles, la formulation d’ensembles d’additifs pour matière plastique n’est pas une utilisation majeure des OP aryliques au Canada (Environnement Canada 2009, 2013, ECCC 2016 b). Ce scénario couvre le mélange et la conversion de matières plastiques. Puis que nous ne connaissons pas tous les emplacements des entreprises utilisant potentiellement ces ensembles d’additifs, nous avons utilisé une distribution des volumes de dilution quotidiens associés aux STEU secondaires et tertiaires recevant des effluents du secteur de la production de matières plastiques. Des plastifiants et des additifs ignifuges peuvent être respectivement présents à des concentrations de 1 à 50 % et 5 à 40 dans divers types de produits en matière plastique (OCDE 2009b). Une valeur représentative de 5 % a été retenue pour les calculs.
Formulation de produits en caoutchouc
Ce scénario représente la formulation de produits en caoutchouc contenant des additifs d’OP arylique. D’après les renseignements déclarés en réponse à des enquêtes menées en vertu de l’article 71 de la LCPE (Environnement Canada 2009, 2013, ECCC 2016 b), des installations de mélange de caoutchouc importent des OP aryliques pour leurs propriétés ignifuges et plastifiantes. D’après les renseignements disponibles, cette activité ne devrait pas être très répandue, et nous avons donc calculé les CEE pour un site représentatif. Des plastifiants et des substances ignifuges peuvent être présents à des concentrations de 1 à 10 % dans divers types de produits en caoutchouc (OCDE 2004b). Une valeur représentative de 5 % a été retenue pour les calculs.
Formulation de peintures et revêtements
D’après les renseignements déclarés en réponse à des enquêtes menées en vertu de l’article 71 de la LCPE (Environnement Canada 2009, 2013, ECCC 2016 b), des distributeurs importent des OP aryliques qu’ils vendent à des formulateurs de peintures et revêtements qui les ajoutent dans leurs produits à cause de leurs propriétés plastifiantes et ignifuges. Tous les emplacements des entreprises utilisant potentiellement ces ensembles pour formuler des peintures et des revêtements n’étant pas connus, une distribution des volumes de dilution quotidiens associés aux STEU secondaires et tertiaires recevant des effluents du secteur de la formulation de peintures et revêtements a été utilisée. Les utilisateurs finaux de produits de peinture ne sont pas pris en compte pour ce scénario, car ils sont inconnus et les clients potentiels sont probablement très dispersés. Des peintures et revêtements à base d’eau ou d’huile devraient contenir des OP aryliques. Toutefois, le scénario est centré sur les peintures à base d’eau (latex), car elles présentent le plus fort potentiel de rejet dans les eaux usées. En se basant sur les fiches signalétiques disponibles, une concentration représentative de 1 % d’OP aryliques a été retenue pour les produits finaux de peinture et revêtement.
Utilisation industrielle d’adhésifs par le secteur de l’automobile
Des OP aryliques sont présents dans des produits d’étanchéité pour automobile utilisés lors de l’assemblage des véhicules. Le produit d’étanchéité est appliqué entre deux feuilles de métal et durci dans un four. Une fois durci, il est fixé à la feuille de métal (Environnement Canada 2013). Toutefois, des OP aryliques pourraient se retrouver dans un circuit d’eaux usées avant que le produit ne soit durci, pendant le processus de nettoyage (phosphatation). Il n’existe aucun renseignement sur les quantités de produit d’étanchéité utilisées dans des ateliers de tôlerie ni sur la composition de ces produits, qui pourraient être potentiellement perdues dans les eaux usées pendant la phosphatation. En raison du manque de renseignements nécessaires sur les quantités de produits d’étanchéité appliqués et les pertes potentielles dans les eaux usées, aucune analyse quantitative de l’exposition n’a pu être faite. Toutefois, des OP aryliques devraient être rejetés dans l’environnement, mais le risque subséquent dû à cette activité devrait être faible.
Rejet par des produits commerciaux ou de consommation
Des produits domestiques, comme des produits électroniques, des produits en matière plastique ou en caoutchouc (voir la sous-section 2.7.3), peuvent rejeter des substances ignifuges dans l’air intérieur et la poussière. Elles peuvent ensuite s’accumuler sur les vêtements, puis se retrouver dans les eaux usées du lavage. Ces substances peuvent ensuite être transportées jusqu’à un STEU et rejetées dans l’environnement aquatique (Schreder et La Guardia 2014, Saini et coll. 2016, Haglund et coll. 2016). Nous avons évalué l’exposition environnementale résultant des rejets d’OP aryliques issus de produits commerciaux et de produits de consommation, à partir de données de surveillance des eaux de surface (Truong 2016). La valeur médiane la plus élevée pour le PTPh mesurée dans des ruisseaux urbains était de 0,04 µg/L. Elle a été retenue comme CEE aquatique représentative due au rejet d’OP aryliques à partir de produits de consommation.
2.6.3 Caractérisation des risques pour l’environnement
L’approche suivie par la présente évaluation préalable pour l’environnement était d’examiner les renseignements disponibles et de tirer des conclusions en suivant une approche basée sur le poids de la preuve et le principe de précaution, tel que requis par la LCPE. Des éléments de preuve ont été réunis pour déterminer le potentiel d’effets nocifs des substances du sous-groupe des OP aryliques sur l’environnement au Canada. Les éléments de preuve pris en compte incluaient des éléments directs utilisés pour la caractérisation des risques (p. ex., propriétés ou paramètres mesurés), ainsi que des éléments indirects (p. ex., classification du danger ou caractéristiques du devenir déterminées par d’autres agences de réglementation).
2.6.3.1 Analyse de quotient de risque
Des analyses de quotient de risque (QR) ont été faites en intégrant des estimations du pire cas d’exposition réaliste (CEE; voir la section Évaluation de l’exposition environnementale) à des renseignements sur la toxicité pour l’environnement (CESE; voir la partie Évaluation des effets sur l’environnement) afin de déterminer s’il existe un potentiel d’effets nocifs sur l’environnement au Canada. Nous présentons dans le tableau 2-18 les plages de QR pour les substances du sous-groupe des OP aryliques dans l’eau, les sédiments, les sols et la faune. Pour les scénarios en milieu aquatique, les QR pour l’eau sont supérieurs à 1 pour tous sauf pour deux — formulation d’additifs pour lubrifiant et rejets dus à des produits de consommation — suggérant un risque pour l’environnement aquatique dans les conditions actuelles de rejet et à proximité des sources de rejet. Pour tous les scénarios pour les sols, les QR étaient inférieurs à 1, suggérant un faible risque pour les organismes endogés dans les conditions actuelles de rejet. Pour les sédiments, les QR sont supérieurs à 1 dans tous les scénarios, suggérant dans les conditions actuelles de rejet un certain risque pour les organismes qui y vivent.
Des résidus corporels critiques (RCC) ont été calculés pour les cinq OP aryliques chez le poisson en utilisant les CEE les plus élevées et les FBA (annexe B). L’analyse a montré que les OP n’ont pas le potentiel de s’accumuler assez dans les tissus pour excéder le seuil de létalité après une exposition aiguë (2 à 8 mmol/kg) ou chronique (0,2 à 0,8 mmol/kg) [annexe B, FBA du tableau B‑1] (McCarty et coll. 1992, Escher et coll. 2011). Toutefois, ceci n’exclut pas la possibilité d’effets à une charge corporelle inférieure aux seuils de létalité trouvés. Il est raisonnable d’attendre de tels effets pour des substances telles que celles du sous-groupe des OP aryliques, qui ont un mode d’action réactif.
Les FBA modélisés indiquent un potentiel de bioaccumulation faible à modéré pour le PTPh, le PBPhDPh et le PMNDPh (97,1) et un potentiel élevé pour le PBBPhPh et le PTPPh (26 131 et 22 508). En conséquence, les mammifères piscivores devraient être plus exposés à ces derniers qu’aux autres OP aryliques du sous-groupe. Une analyse de risque prudente a été faite pour deux espèces fauniques piscivores — le vison et la loutre de rivière — pour le PTPPh (composant T3PTPPh) pour représenter les OP aryliques les plus susceptibles de conduire à une exposition des mammifères piscivores. Les vitesses d’absorption sans effet prédites (VRT, section 2.6.1.1) ont été comparées aux valeurs de l’absorption journalière totale (AJT, section 2.6.1.4) pour le vison et la loutre de rivière. Le calcul du quotient de risque pour ces deux espèces indique un potentiel de risque dans le cas du PTPPh.
| Milieu | CEE ou AJT | CESE ou VRT | QR |
|---|---|---|---|
| Eau | 4,0 × 10-5 à 0,0027 mg/L | 0,00037 mg/L | 0,1 à 7,11 |
| Sédiments | 0,5 à 9,5 mg/kg | 0,37 mg/kg | 1,22 à 25,57 |
| Sol | 0,2 à 2,4 mg/kg | 9,09 mg/kg | 0,02 à 0,27 |
| Faunea (vison) | 1,65 mg/kg p.c./j | 1,4 mg/kg p.c./j | 1,18 |
| Faunea (loutre de rivière) | 1,78 mg/kg p.c./j | 0,83 mg/kg p.c./j | 2,14 |
a PTPPh (composant T3PTPPh)
Abréviations — CEE : concentration environnementale estimée; AJT : absorption journalière totale; CESE : concentration estimée sans effet; VRT : valeur de référence de toxicité; QR : quotient de risque.
| Scénario d’exposition | CEE aquatique (mg/L) | QR aquatique (CESE : 0,00037 mg/L) | CEE sédiments (mg/kg) | QR sédiments (CESE : 0,37 mg/kg p.s.) | CEE sol (mg/kg) | QR sol (CESE : 9,09 mg/kg p.s.) |
|---|---|---|---|---|---|---|
| Formulation d’additifs de lubrifiant (utilisation en grande quantité) | 2,5 × 10-4 | 0,67 | 0,45 | 1,22 | 0,2 | 0,02 |
| Formulation d’additifs de lubrifiant (utilisation générique) | 6,4 × 10-4 | 1,72 | 1,18 | 3,2 | 0,86 | 0,01 |
| Formulation de lubrifiants (utilisation générique) | 1,37 × 10-3 | 3,70 | 2,82 | 7,62 | 0,38 | 0,04 |
| Formulation de produits en matière plastique (utilisation générique) | 2,43 × 10-3 | 6,57 | 6,78 | 18,33 | 1,52 | 0,17 |
| Formulation de produits en caoutchouc (utilisation en grande quantité) | 2,7 × 10-3 | 7,11 | 9,46 | 25,57 | 1,18 | 0,13 |
| Formulation de peintures et revêtements (utilisation générique) | 1,45 × 10-3 | 3,91 | 4,04 | 10,92 | 2,4 | 0,27 |
| Rejet par des produits de consommation (basé sur des mesures) | 4,0 × 10-5 | 0,10 | S.O. | S.O. | S.O. | S.O. |
a Il est improbable que des biosolides provenant de systèmes de traitement d’eaux usées industrielles soient épandus sur des terres.
Abréviations — S.O. : sans objet CEE : concentration environnementale estimée; CESE : concentration estimée sans effet; VRT : valeur de référence de toxicité; QR : quotient de risque.
2.6.3.2 Considérations sur les éléments de preuve
Pour caractériser les risques posés à l’environnement par les substances du sous-groupe des OP aryliques, nous avons tenu compte de renseignements techniques pour divers éléments de preuve (comme discuté dans les sections pertinentes du présent document) et les avons pondérés qualitativement. Les éléments de preuve cruciaux sur lesquels reposent les conclusions de l’évaluation sont présentés au tableau 2-20, avec une discussion globale sur le poids de la preuve à la section 2.6.3.3. Le niveau de confiance fait référence à l’influence combinée de la qualité et de la variabilité des données, des lacunes dans les données, de la causalité, de la plausibilité et de toute extrapolation requise. La pertinence fait référence à l’impact que l’élément de preuve a pour la détermination du potentiel d’effets nocifs sur l’environnement au Canada. Les qualificateurs utilisés pour l’analyse vont de faible à élevé, la pondération assignée donnant cinq résultats possibles.
| Élément de preuve | Niveau de confiancea | Pertinence pour l’évaluationb | Pondération attribuéec |
|---|---|---|---|
| Persistance dans l’environnement | modéré | modéré | modéré |
| Transport à grande distance | faible | modéré | faible-modéré |
| Bioaccumulation : PTPh, PBPhDPh, PMNDPh | modéré | modéré | modéré |
| Bioaccumulation : PBBPhPh, PTPPh (structure représentative T3PTPPh) | faible | modéré | modéré |
| Mode d’action ou autres données non systémique | modéré | élevé | modéré-élevé |
| CESE pour les organismes vivant dans l’eau, les sédiments ou le sol | modéré | élevé | modéré-élevé |
| VRT pour la faune | faible | élevé | modéré |
| RCC pour le poisson | faible | modéré | faible-modéré |
| Concentrations mesurées dans l’environnement au Canada | faible | élevé | modéré |
| CEE pour les scénarios aquatiques industriels | modéré | élevé | modéré-élevé |
| CEE pour les scénarios industriels dans les sédiments ou les sols, AJT pour le scénario industriel pour la faune | faible | modéré | faible-modéré |
| QR pour l’eau | modéré | élevé | modéré-élevé |
| QR pour les sédiments, les sols et la faune | faible | élevé | modéré |
a Le niveau de confiance st déterminé en fonction de la qualité des données, de la variabilité des données, des lacunes dans les données et de la pertinence des données.
b La pertinence fait référence à l’impact de l’élément de preuve pour l’évaluation.
c Une pondération est attribuée à chaque élément de preuve en fonction du niveau combiné de confiance et de pertinence.
Abréviations — CESE : concentration sans effet observé; VRT : valeur de référence de la toxicité; RCC : résidu corporel critique; CEE : concentration environnementale estimée; QR : quotient de risque
2.6.3.3 Éléments de preuve pondérés pris en compte pour déterminer le potentiel d’effets nocifs des substances du sous-groupe des OP aryliques sur l’environnement au Canada
Généralement, les substances du sous-groupe des OP aryliques ne devraient pas être très persistantes dans l’eau, le sol ou les sédiments. On a toutefois mis en évidence la dégradation ultime relativement lente du PBBPhPh et du PTPPh. Si, d’une part, les modélisations de l’oxydation atmosphérique de ces substances prédisent une demi-vie inférieure à 1 jour (phase gazeuse); d’autre part, les données empiriques sur le PTPh indiquent une persistance quand il est lié à des aérosols (durée de vie de 5,6 jours pour le PTPh adsorbé sur des particules exposées à des radicaux OH). Il n’existe pas de données empiriques équivalentes pour le PBPhDPh, le PBBPhPh, le PMNDPh et le PTPPh, mais il est possible que compte tenu de l’adsorption sur des particules, la persistance de ces substances dans l’air soit sous-estimée. De plus, du PTPH a été mesuré dans des lieux éloignés en Arctique, confortant l’hypothèse que le PTPh peut être jugé persistant dans l’air.
Les quelques études sur la bioconcentration et la modélisation QSAR du PBBPhPh et possiblement du PTPPh (composant représentatif T3PTPPh) prédisent un potentiel de bioaccumulation modéré à élevé. Les estimations pour le FBA étaient très pertinentes pour l’évaluation, en raison de leur utilisation pour l’analyse des RCC et l’analyse des risques posés à la faune. Bien qu’une valeur kM estimé, calculé à partir d’une étude empirique sur le FBC du PTPPh, ait été utilisé pour la modélisation du FBA, une valeur équivalente pour le PBBPhPh n’a pas pu être calculée en raison du manque d’études empiriques sur la bioconcentration. Une lecture croisée à partir de la valeur kM calculée pour le PTPPh a donc été faite pour le PBBPhPh, une approche qui est jugée raisonnable étant donné les similitudes entre ces deux substances en termes de structure chimique et de propriétés physico-chimiques. En conséquence, les données mesurées sur le FBA pour le PTPPh et le PBBPhPh amélioreraient la faible confiance dans les données sur le potentiel de bioaccumulation assigné à ces substances ainsi que la faible confiance dans les analyses de RCC et d’AJT pour la faune.
Les métabolites des substances du sous-groupe des OP aryliques ont pour la plupart été identifiés, des diesters correspondants et une variété de métabolites hydroxylés, qui semblent plus stables que leurs parents respectifs. Au moyen des modèles Toolbox de l’OCDE, il a été déterminé que les métabolites prédits contiennent au moins un profil d’alerte d’intérêt, p. ex., la neurotoxicité, des effets sur la reproduction et le développement (interactions avec l’ADN, L’ARN et les protéines). Il existe des différences entre la réactivité et le mode d’action des OP aryliques parents et leurs métabolites (tel qu’indiqué par les profils de danger des modèles Toolbox de l’OCDE). Des études sur l’industrie, les publication scientifiques, la modélisation QSAR et l’analyse des RCC apportent des preuves d’une toxicité aquatique élevée, aiguë et chronique.
Pour l’évaluation des effets en milieu aquatique, le PTPh a été utilisé pour une lecture croisée pour le sous-groupe des OP aryliques, étant donné la disponibilité des études sur la toxicité de cette substance et le fait que le PTPh a la plus forte probabilité de se retrouver dans l’eau. L’incertitude associée à la lecture croisée à partir du PTPh pour les quatre autres OP aryliques pour la toxicité aquatique a été prise en compte qualitativement en se basant sur une analyse et une comparaison des structures chimiques, des propriétés physiques et chimiques, de la toxicodynamique et de la toxicocinétique du composé parent et des métabolites stables. Des différences ont été trouvées dans tous les domaines de comparaison. Ces différences ont été prises en compte pour la détermination du facteur d’évaluation pour la vie aquatique (100), qui est considéré suffisamment protecteur pour les autres OP aryliques.
Bien que les CESE aient été calculées à partir d’études sur la toxicité réalisées avec des mélanges, les études retenues sont de qualité acceptable, tiennent compte de paramètres sensibles et sont réalisées avec des mélanges de substances du sous-groupe des OP aryliques, dont le PBBPhPh et le PTPPh, qui sont considérés les plus hydrophobes et qui devraient se retrouver sur des solides organiques. Avec l’utilisation des facteurs d’évaluation, les CESE calculées sont censées assurer une protection adéquate des organismes vivant dans les sols ou les sédiments contre les substances du sous-groupe des OP aryliques.
L’évaluation de l’exposition apporte un élément de preuve clé, donnant l’exposition estimée et l’exposition mesurée aux OP aryliques dans l’environnement au Canada. Toutefois, la surveillance environnementale de tous les OP aryliques visés par la présente évaluation, à l’exception du PTPh, est limitée. Les quantités individuelles des substances du sous-groupe des OP aryliques ont été additionnées dans le cas des principales utilisations industrielles pour estimer les CEE (eau, sédiments, sol et VTR pour la faune) représentant des scénarios d’utilisation combinée. Ceci est jugé raisonnable en raison de leurs utilisations en commun et de leur utilisation potentielle comme substance de remplacement et leur présence simultanée dans des mélanges/formulations commerciaux. Bien que la confiance dans les CEE pour les eaux de surface soit modérée, la confiance dans celles pour les sols et les sédiments est faible étant donné la nature générique des approches et la manque de concentrations mesurées dans ces milieux au Canada.
L’analyse de quotient de risque a montré que les CEE pour les eaux de surface et les sédiments excèdent les CESE calculées pour ces milieux, indiquant donc un risque d’effets nocifs sur les organismes aquatiques et benthiques dans les conditions actuelles d’utilisation de ces substances. Pour l’évaluation de la faune, le PTPPh (structure représentative T3PTPPh), ayant un potentiel de bioaccumulation élevé, a été utilisé pour représenter l’exposition et la toxicité des OP aryliques. Les quotients de risque suggèrent un risque pour la faune pour le PTPPh, (structure représentative T3PTPPh), en utilisant des estimations de l’exposition et des AJT. Les analyses des RCC indiquent que les OP aryliques n’ont pas un potentiel d’accumulation dans les tissus suffisant pour conduire à la mort en raison d’une exposition aiguë ou chronique à la plus forte concentration prédite dans les eaux de surface.
2.6.3.4 Sensibilité de la conclusion aux incertitudes clés
Il existe une incertitude associée à l’utilisation du PTPh pour une lecture croisée pour la toxicité aquatique de tous les OP aryliques. Les OP sont connus pour être métabolisés, et l’analyse de modélisation suggère que la toxicité puisse être causée non seulement par la substance parent, mais aussi par ses métabolites. Un facteur d’évaluation important a été utilisé pour tenir compte du niveau d’incertitude associé à l’utilisation du PTPh pour une lecture croisée pour les autres OP aryliques et aux diverses voies d’effets nocifs de leurs métabolites potentiels. Il existe des différences parmi les OP dans leur réactivité et le mode et le mécanisme d’action des métabolites.
Il n’existe pas de données de surveillance environnementale pour les autres substances du sous-groupe des OP aryliques, hormis le PTPh. Des données de surveillance canadiennes pourraient contribuer à préciser l’évaluation de l’exposition, qui est estimée à partir des quantités utilisées et des données mesurées pour le PTPh.
Les scénarios d’exposition trouvés pour le sous-groupe des OP aryliques ont été créés en se basant sur des renseignements déclarés en réponse à des enquêtes menées en vertu de l’article 71 de la LCPE et à un suivi auprès des parties intéressées. En l’absence de données spécifiques, des hypothèses réalistes ont été faites pour estimer les CEE. Pour les expositions industrielles, une précision des utilisateurs industriels pourrait contribuer à améliorer la fiabilité des CEE.
Il existe des lacunes dans les données en ce qui concerne le rejet d’OP aryliques dû à l’utilisation et à l’élimination de produits de consommation. Toutefois, les expositions potentielles déterminées en utilisant des concentrations de PTPh dans des ruisseaux de la région de Toronto sont 10 à 1000 fois inférieures à celles déterminées pour des scénarios d’exposition industrielle. Des renseignements supplémentaires sur l’exposition due aux rejets à partir de produits utilisés ou éliminés ne conduiraient pas à une conclusion différente, conclusion basée sur des scénarios d’exposition pour des activités industrielles de formulation.
Les données sur la bioaccumulation du PBBPhPh et du PTPPh sont peu nombreuses, et les résultats de la modélisation suggèrent pour ces substances un potentiel élevé de bioaccumulation dans les organismes aquatiques. Les données empiriques et les résultats de la modélisation pour le FBA des OP aryliques ont été utilisés pour estimer l’exposition des mammifères piscivores. Les résultats du modèle sont jugés prudents en raison d’autres éléments de preuve, comme la biotransformation métabolique. Des renseignements supplémentaires sur le potentiel de bioaccumulation de ces substances pourraient permettre de clarifier cet aspect de l’évaluation.
Il existe des incertitudes sur les estimations de l’exposition dans les sédiments en raison de l’utilisation du partage à l’équilibre, en particulier dans le cas des OP hautement hydrophobes, dont le PBBPhPh et le PTPPh. Les estimations de partage au moyen du coefficient de partage sédiments-carbone organique (KCO) tendent à surestimer les expositions, conduisant à des CEE prudentes. Étant donné le comportement de partage prédit pour les OP aryliques, à l’exclusion du PTPh, et le manque de données sur les concentrations mesurées, l’importance des sédiments comme milieu important d’exposition constitue une lacune dans les données.
Pour l’évaluation ayant trait aux effets sur l’environnement, les études montrent que les OP aryliques peuvent avoir un potentiel d’effets nocifs chez les poissons, incluant une neurotoxicité, des effets sur la reproduction et le développement et une perturbation du système endocrinien. Le manque de données caractérisant la toxicité pour la faune constitue un domaine clé d’incertitude, en particulier pour les substances ayant un potentiel de bioaccumulation dans le biote, comme le PBBPhPh et le PTPPh.
2.7 Potentiel d’effets nocifs sur la santé humaine
PBBPhPh
Les risques posés par le PBBPhPh pour la santé humaine ont été caractérisés à l’aide l’Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée (ECCC et SC 2017). Le potentiel d’exposition de la population générale au PBBPhPh a été jugé négligeable et non préoccupant pour la santé humaine. Par conséquent, le PBBPhPh est jugé peu préoccupant pour la santé humaine aux degrés d’exposition actuels.
2.7.1 Évaluation de l’exposition au sous-groupe des organophosphates aryliques (PTPh, PBPhDPh, PTPPh, PMNDPh)
2.7.1.1 PTPh
Milieux environnementaux et aliments
Les données de surveillance canadiennes pour le PTPh dans l’air ambiant et les eaux de surface sont résumées à la sous-section 2.6.2.1 (tableau 2‑17). Par mesure de prudence, la concentration maximale dans l’air ambiant (2 220 pg/m3) de l’étude Shoeib et coll. (2014) a été utilisée pour estimer l’exposition de la population générale.
Le PTPh a également été mesuré dans l’air intérieur au Canada (Vykoukalová et coll. 2017; Yang et coll. 2019). Yang et coll. (2019) ont mesuré le PTPh dans l’air intérieur des maisons dans la région du Grand Toronto (n = 32) et d’Ottawa (n = 19) en 2015 sur une période d’échantillonnage de 3 semaines. Les données ont été recueillies dans les chambres à coucher de toutes les maisons (n = 51), ainsi que dans la pièce la plus utilisée (PPU) de 26 des maisons. Le PTPh a été mesuré avec une fréquence de détection de 100 % dans les chambres à coucher et de 96 % dans la PPU. Les concentrations de PTPh se situaient respectivement entre 0,34 et 17 000 pg/m3 (LDM = 0,34), avec des moyennes géométriques de 3 480 et 3 440 pg/m3 et des concentrations au 95e centile de 11 700 et 15 200 pg/m3 dans les chambres à coucher et les PPU (Yang et coll. 2019). Le PTPh a également été mesuré ailleurs dans des maisons d’autres pays (p. ex., Cequier et coll. 2014; Luongo et Östman 2016; Takeuchi et coll. 2014; Vykoukalová et coll. 2017), ainsi que dans des centres de soins pour enfants aux États‑Unis (Stubbings et coll. 2018) et en Europe (Bergh et coll. 2011; Fromme et coll. 2014). La valeur au 95e centile de 15 200 pg/m3 pour les PPU dans l’étude de Yang et coll. (2019) a été jugée la plus appropriée pour estimer l’exposition de la population générale au Canada.
Nous avons trouvé deux études canadiennes sur l’eau potable qui incluaient le PTPh : Williams et coll. (1982) ont mentionné une concentration moyenne de PTPh de 1,3 ng/L pour 24 échantillons d’eau potable provenant de 12 stations de traitement de l’eau qui puisaient leur eau dans le réseau des Grands Lacs (fréquence de détection non indiquée; les concentrations variaient de non détectables à 4,8 ng/L). La Ville de Toronto a ciblé le PTPh dans le cadre d’un programme municipal de surveillance de l’eau potable en 2002 et 2003 et elle n’a pas constaté sa présence à des concentrations supérieures à la limite de détection de 200 ng/L pendant toute cette période (p. ex., City of Toronto 2002a, b, c, d, 2003a, b, c). Étant donné l’absence de données récentes sur l’eau potable au Canada, nous avons utilisé, par prudence, la CEE maximale en milieu aquatique estimée de 2,7 µg/L pour tous les organophosphates aryliques (section 2.6.2.2, tableau 2‑19) afin de calculer l’ingestion de PTPh par la population générale par l’eau potable.
Plusieurs études ont mesuré la concentration de PTPh dans la poussière domestique au Canada. Le PTPh a été mesuré dans des échantillons archivés de poussière domestique (n = 818) prélevés en 2007-2008 dans diverses villes canadiennes dans le cadre de l’Enquête sur la poussière domestique au Canada (EPDC) [communication personnelle, courriels du Bureau de la science et de la recherche en santé environnementale de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 28 octobre 2013; non référencé]. Le PTPh a été détecté dans 99,4 % des échantillons de l’étude de référence, avec des concentrations allant de l’absence de détection (limite de détection de la méthode, LDM = 130 ng/g) à 91 000 ng/g et un 95e centile de 11 000 ng/g. Yang et coll. (2019) ont mesuré le PTPh dans la poussière des maisons de la région du Grand Toronto (n = 32) et d’Ottawa (n = 19) en 2015 sur une période d’échantillonnage de 3 semaines. Les données ont été recueillies dans les chambres à coucher de toutes les maisons (n = 51) ainsi que dans la PPU de 26 des maisons, avec des fréquences de détection de 100 % dans les deux cas. Les concentrations de PTPh variaient de 2,16 à 75 600 ng/g (LDM = 0,25 ng/g) dans la poussière des chambres à coucher, avec une moyenne géométrique de 4 760 ng/g et un 95e centile de 20 700 ng/g. Les concentrations dans les PPU variaient de 996 à 16 900 ng/g, avec une moyenne géométrique de 4 880 ng/g et un 95e centile de 15 800 ng/g. Vykoukalová et coll. (2017) et Harrad et coll. (2016) ont également mesuré le PTPh dans la poussière des maisons de Toronto dans les plages de concentrations trouvées par Yang et coll. (2019) et dans l’EPDC. Des concentrations de PTPh dans la poussière des maisons et des garderies en divers endroits du monde ont également été rapportées à des concentrations similaires (Brommer et Harrad 2015; Castorina et coll. 2017; Fromme et coll. 2014; Stubbings et coll. 2018; Vykoukalová et coll. 2017). La concentration au 95e centile de 20 700 ng/g, d’après l’étude de Yang et coll. (2019), a été utilisée pour estimer l’exposition de la population générale au PTPh par la poussière.
Compte tenu de l’absence de données canadiennes récentes pour le sol, nous avons utilisé, par prudence, la CEE maximale estimée de 2 400 ng/g pour le sol pour tous les OP aryliques (voir la section 2.6.2.2), afin d’estimer l’exposition de la population générale au PTPh par le sol, ce qui s’est traduit par une exposition négligeable pour tous les groupes d’âge.
On ne s’attend pas à une exposition potentielle au PTPh découlant de son utilisation comme composant dans la fabrication de matériaux d’emballage alimentaire (voir la section 2.3), car la substance n’entre pas en contact avec les aliments (communication personnelle, courriels de la Direction des aliments de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 8 août 2014; non référencé). Toute contribution inattendue à l’exposition alimentaire globale provenant de ces utilisations serait prise en compte dans les données sur l’occurrence pour les aliments transformés qui ont été employés dans l’évaluation décrite ci‑dessous.
En raison de diverses utilisations anthropiques, le PTPh a été trouvé à des concentrations généralement faibles dans les aliments. Le PTPh a été détecté dans une étude sur les poissons au Canada (voir le tableau 2‑17). Comme nous n’avons trouvé que très peu de données sur la présence du PTPh au Canada, les données utilisées dans l’évaluation de l’exposition par la voie alimentaire provenaient principalement de l’étude américaine Total Diet Study de la Food and Drug Administration des États‑Unis et, dans une moindre mesure, d’études réalisées en Europe et en Chine (annexe E, tableau E‑1). Dans l’ensemble, les données disponibles sur le PTPh dans les aliments étaient peu nombreuses, et certaines études ont également fait état de faibles fréquences de détection. Les concentrations maximales de PTPh dans les aliments et les boissons utilisées pour estimer les expositions dans la présente évaluation variaient de 0,27 µg/kg dans les œufs à 290 µg/kg dans les confiseries et les aliments à base de sucre (annexe E, tableau E-1). L’exposition moyenne et le 90e centile de « toutes les personnes » au PTPh dans tous les groupes d’âge variaient de 0,72 à 3,11 µg/kg p.c./j et de 1,27 à 5,64 µg/kg p.c./j, respectivement (annexe E, tableau E-3).
Il n’existe pas de données canadiennes sur le PTPh dans le lait maternel mais, en Suède, au Japon, au Vietnam et aux Philippines, on a détecté du PTPh dans le lait maternel (Sundkvist et coll. 2010; Kim et coll. 2014). Dans l’étude qui a examiné le PTPh dans le lait maternel dans les pays asiatiques (Kim et coll. 2014), on a constaté une fréquence de détection globale de 86 %, et les concentrations de PTPh dans le lait maternel des femmes vivant dans les zones urbaines ou à proximité d’un site de recyclage de déchets électroniques ou d’un site d’enfouissement de déchets étaient comprises entre l’absence de détection (LDM de 0,01 à 0,08 ng/g de lipides) à 140 ng/g de lipides. Dans l’étude suédoise, les échantillons de lait maternel ont été obtenus auprès de 286 femmes dans quatre villes suédoises, et le PTPh a été mesuré dans les six échantillons testés (dont cinq étaient des composites d’échantillons prélevés entre 1997 et 2003) [Sundkvist et coll. 2010]. Une concentration de 10 ng/g de lipides a été trouvée pour les échantillons groupés de 90 femmes à Uppsala en 1998, et seul un échantillon prélevé chez une femme à Umeå en 2007 a donné une concentration plus élevée de PTPh dans cette étude, soit 11 ng/g de lipides. Étant donné les échantillons plus gros des échantillons de l’étude suédoise, la valeur de 10 ng/g de lipides de l’échantillon composite mesurée chez les femmes suédoises a été utilisée pour estimer l’exposition des nourrissons allaités (0,035 µg/kg p.c./j, annexe F, tableau F-1).
Les estimations de l’exposition au PTPh par les milieux environnementaux et les aliments pour la population générale canadienne variaient de 0,14 µg/kg p.c./j pour les nourrissons allaités à 5,82 µg/kg p.c./j pour les enfants de 0,5 à 4 ans, les principales sources d’exposition étant la poussière pour les nourrissons et les aliments pour les enfants de 0,5 an et plus (annexe F).
Produits de consommation
Cosmétiques :
D’après les déclarations reçues par Santé Canada en vertu du Règlement sur les cosmétiques, le PTPh est utilisé dans divers produits pour le soin des ongles au Canada, comme les couches de base, les couches de finition et les vernis à ongles (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, au Bureau d’évaluation du risque des substances existantes de Santé Canada, 12 janvier 2017; non référencé). Dans ces produits, le PTPh a une fonction de plastifiant (Mendelsohn et coll. 2016). Étant donné que le PTPh a une faible pression de vapeur (1,68 × 10-4 Pa), on considère que la principale voie d’exposition est par la peau (Mendelsohn et coll. 2016). Par conséquent, nous présentons seulement des estimations par voie cutanée. Des données limitées sur l’absorption cutanée ont été trouvées pour le PTPh (Frederiksen et coll. 2018), mais étant donné qu’une étude toxicologique par voie cutanée était disponible, seules les expositions cutanées externes ont été calculées (voir la section 2.7.3.1). Le tableau 2‑21 résume les doses cutanées externes pour les produits pour le soin des ongles offerts au consommateur contenant du PTPh. Étant donné que ces produits peuvent être utilisés ensemble, les expositions cutanées externes estimées pour les trois produits ont été cumulées pour les adultes et les adolescents. Le lecteur trouvera à l’annexe G, tableau G-1, plus de détails sur la méthode et les paramètres utilisés pour estimer l’exposition par voie cutanée externe au PTPh due aux produits pour le soin des ongles.
| Groupe d’âge | Couche de base a | Vernis à ongles | Couche de finition a | Total |
|---|---|---|---|---|
| 20 ans et plus | 0,06 | 0,68 | 0,10 | 0,84 |
| 12-19 ans | 0,07 | 0,81 | 0,12 | 0,99 |
| 5-11 ans | S.O. | 0,58 | S.O. | 0,58 |
Abréviations — S.O. : sans objet.
a On ne prévoit pas que ces produits seront utilisés par des enfants de moins de 12 ans.
Autres produits :
Au Canada, le PTPh a été déclaré comme ingrédient de lubrifiants et de graisses, mais on ne s’attend pas à ce que les consommateurs y soient exposés (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, au Bureau d’évaluation du risque des substances existantes de Santé Canada, 6 juin 2014; non référencé).
Articles manufacturés :
Le PTPh est l’une des nombreuses substances ignifuges qui sont incorporées dans les PUF flexibles pendant la production de la mousse (Marklund 2005). Le PTPh est couramment présent dans les mélanges commerciaux de substances ignifuges, dont l’une est le Firemaster 550, ou FM550 (McGee et coll. 2013; Phillips et coll. 2017). Certaines études ont rapporté qu’une concentration de FM550 sous la forme de la somme du PTPh et de deux substances bromées (acide benzoïque, le 2,3,4,5-tétrabromobenzoate de 2-éthylhexyle ou TBB et tétrabromophtalate de bis(2-éthylhexyle) ou TBPH) qui constituent la majeure partie de ce mélange (Stapleton et coll. 2012), tandis que d’autres ont utilisé un échantillon de FM550 authentique pour sa quantification (Cooper et coll. 2016). Le PTPh a été détecté dans plusieurs produits de consommation au Canada, comme les produits contenant de la mousse, notamment les meubles tels que les canapés, et les produits pour enfants tels que les tapis de sieste, les écharpes porte-nourrisson, les matelas pour nourrisson, les sièges pour nourrisson et enfant, les coussins de table à langer, les matelas portables et les berceuses (CEH 2013a,b; CEC 2015b; Cooper et coll. 2016; Danish EPA 2015; Stapleton et coll. 2011).
Une étude de la Commission de coopération environnementale (CEC), a porté sur la présence de 16 substances ignifuges dans les meubles contenant de la mousse achetés au Canada, aux États‑Unis et au Mexique entre décembre 2014 et avril 2015 (CEC 2015b). Le PTPh (déclaré sous forme de TPP) était la troisième substance ignifuge la plus fréquemment détectée parmi les six qui ont été mesurées, et on l’a trouvé à des concentrations comprises entre 200 et 11 500 ppm (0,02 % à 1,15 % p/p). Le PTPh présentait les fréquences de détection les plus élevées pour les produits achetés au Canada. Le PTPh a été détecté dans 5 %, 0,7 % et 2 % des produits achetés au Canada, au Mexique et aux États‑Unis, respectivement, et était surtout présent dans les échantillons de mousse, par opposition aux tissus (CEC 2015b). L’exposition par voie cutanée prolongée au PTPh, c’est‑à‑dire lorsqu’une personne s’allonge ou s’assoit sur un matelas ou un meuble contenant du PTPh, a été estimée (tableau 2‑22) et représente le scénario d’exposition sentinelle couvrant l’exposition par voie cutanée à d’autres types de produits, tels que les sièges pour nourrisson et enfant et les coussins de table à langer. L’annexe G décrit ce scénario en détail.
Nous n’avons trouvé aucune étude sur les produits pour enfants contenant du PTPh au Canada. Il a toutefois été détecté dans des jouets en plastique, en caoutchouc, en bois, en mousse et en textile à Anvers, en Belgique (Ionas et coll. 2014), et dans divers produits pour enfants aux États-Unis (Stapleton et coll. 2011). On s’attend à ce que certains des mêmes types de produits pour enfants que ceux qui contiennent du PTPh en Europe et aux États‑Unis soient présents au Canada. Par conséquent, nous avons calculé des valeurs estimées de l’exposition au PTPh par la mise en bouche (tableau 2‑22), comme le décrit l’annexe G.
| Voie et durée de l’exposition | Source | Groupe d’âge | Exposition estimée (mg/kg p.c./j) |
|---|---|---|---|
| Cutanée (quotidienne) | Meubles ou matelas pour enfants contenant de la mousse | 0 à 6 mois | 0,021 à 0,13 |
| Cutanée (quotidienne) | Meubles ou matelas pour enfants contenant de la mousse | 0,5 à 4 ans | 0,015 à 0,10 |
| Cutanée (quotidienne) | Meubles ou matelas contenant de la mousse | 20 ans et plus | 5,6 × 10-3 à 4,7 × 10-2 |
| Orale (quotidienne) | Mousse dans les jouets et produits pour enfants | 0 à 6 mois | 1,33 × 10-5 à 2,47 × 10-5 |
| Orale (quotidienne) | Mousse dans les jouets et produits pour enfants | 0,5 à 4 ans | 1,29 × 10-5 à 2,39 × 10-5 |
2.7.1.2 PBPhDPh
Milieux environnementaux et aliments
La concentration de PBPhDPh dans l’air a été prévue sur la base d’estimations par modélisation environnementale à l’aide de ChemCAN (2003), dans lequel un scénario prudent a été établi d’après la quantité maximale déclarée d’environ 100 000 kg de cette substance importée au Canada. Étant donné l’absence de données canadiennes récentes pour le sol, la CEE maximale estimée pour le sol de 2400 ng/g pour tous les OP aryliques (voir la section 2.6.2.2) a été utilisée pour estimer l’exposition de la population générale au PBPhDPh par le sol. Selon les concentrations prévues de PBPhDPh dans l’air et le sol, l’exposition estimée due à ces sources serait négligeable pour la population générale canadienne.
Étant donné l’absence de données canadiennes sur le PBPhDPh dans l’eau potable, nous avons utilisé par prudence la CEE maximale en milieu aquatique estimée de 2,7 µg/L pour tous les OP aryliques (section 2.6.2.2, tableau 2‑19) pour calculer l’ingestion de PBPhDPh par la population générale par l’eau potable.
Le PBPhDPh (rapporté comme du PtBPhDPh, phosphate de tert-butylphényle et de diphényle, no CAS 56803-37-3) a été mesuré dans des échantillons de poussière de plancher active prélevés dans 144 maisons dans 13 villes (dont la population dépasse 100 000 habitants) au Canada dans le cadre de l’EPDC (communication personnelle, courriel du Bureau de la science et de la recherche en santé environnementale de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 18 décembre 2018; non publié). Le PBPhDPh a été détecté dans 91,7 % des échantillons, avec des concentrations allant de < LDM (15,26 ng/g) à un maximum de 3 329 ng/g. La limite de quantification (LQ) était de 48,55 ng/g, et les 50e et 95e centiles étaient de 51,73 ng/g et 340 ng/g, respectivement. L’un des isomères qui composent le PBPhDPh (le phosphate de 4-tert-butylphényle et diphényle, no CAS 981-40-8, rapporté comme du PtBPhDPh) a été rapporté dans des échantillons de poussière intérieure prélevés dans 190 maisons dans le cadre de l’étude Toddler’s Exposure to SVOCs in the Indoor Environment (TESIE – exposition des tout-petits aux COSV dans l’environnement intérieur) en Caroline du Nord, aux États‑Unis (Phillips et coll. 2018). Le PBPhDPh a été détecté dans 94,7 % des 188 échantillons, avec une plage de concentrations allant de moins de 2,4 ng/g (limite de détection de la méthode) à 85 986 ng/g. La moyenne géométrique était de 510,9 n/g et le 90e centile était de 2 544 ng/g. La concentration de PBPhDPh au 95e centile (340 ng/g) selon l’EPDC a été utilisée pour estimer l’exposition de la population générale au PBPhDPh.
Aucune donnée sur la présence de PBPhDPh dans les aliments ou le lait maternel n’a été trouvée.
L’estimation de l’exposition au PBPhDPh par les milieux environnementaux pour la population générale canadienne variait de 1,7 ng/kg p.c./j pour les nourrissons allaités à 290 ng/kg p.c./j pour les nourrissons nourris au lait maternisé, la poussière et l’eau étant respectivement les sources d’exposition (annexe F, tableau F-2).
Produits de consommation
Articles manufacturés :
Le PBPhDPh est l’un des nombreux ignifugeants utilisés dans les mélanges commerciaux de substances ignifuges qui ont été mesurés dans des échantillons de PUF souples provenant d’un certain nombre de produits contenant de la mousse (Cooper et coll. 2016; Phillips et coll. 2017; Stapleton et coll. 2012). Le Firemaster 600 (ou FM600) est un mélange contenant deux substances bromées, le PTPh, et différents phosphates de tert-butyle et de triphényle, dont au moins un isomère du PBPhDPh (le phosphate de 4-tert-butylphényle et de diphényle, rapporté sous le nom de 4PtBPhDPh), représenterait environ 2,6 % de ce mélange pour un pourcentage comptabilisé de 95,3 %) [Phillips et coll. 2017]. Ce même isomère du PBPhDPh (4PtBPhDPh) est également présent dans un mélange de PTPh et de phosphates de tert-butyle et de triphényle, appelé dans les publications « mélange de TBPP », et le 4tBPDPP aurait une fraction massique d’environ 36 % des 79,5 % de ce mélange qui ont été comptabilisés (Phillips et coll. 2017). Un ou deux de ces mélanges ignifuges ont été mesurés dans des échantillons de PUF prélevés aux États-Unis entre février 2014 et juin 2016, provenant de matelas pour enfants, d’autres produits pour enfants, de canapés et de causeuses, de chaises, de berceuses et de fauteuils inclinables, et de matelas (Cooper et coll. 2016). Le mélange de TBPP a également été détecté dans des tapis de sieste (CEH 2013b), des canapés (Stapleton et coll. 2012) et une chaise en mousse pour enfants (CEH 2013a) achetés aux États-Unis. Comme il est indiqué précédemment (section 2.7.1.1), du PTPh a également été trouvé dans un certain nombre de produits contenant de la mousse, notamment des matelas, des meubles, des produits pour enfants et des jouets, et il est possible que certains de ces produits contiennent du PBPhDPh, car on a rapporté que les mélanges commerciaux de PBPhDPh contenaient un certain pourcentage de PTPh résiduel (EA 2009b; Phillips et coll. 2017).
Bien qu’on n’ait trouvé aucune étude portant sur les concentrations de PBPhDPh dans les produits contenant de la mousse achetés au Canada, on s’attend à ce que certains des mêmes types de produits et contenant des mélanges ignifuges, dont le PBPhDPh, soient également présents au Canada. Nous avons donc estimé l’exposition par voie cutanée et orale au PBPhDPh par des produits contenant de la mousse (tableau 2‑23). Une exposition cutanée prolongée au PBPhDPh pourrait se produire lorsqu’une personne s’allonge ou s’assoit sur un matelas ou un meuble contenant du PBPhDPh. Aucune donnée sur l’absorption cutanée n’a été trouvée pour le PBPhDPh et, par conséquent, nous avons fait l’hypothèse prudente d’une absorption cutanée de 100 %. Les valeurs d’exposition ont été estimées de la manière décrite à l’annexe G, et le tableau 2‑23 résume les scénarios d’exposition pour les articles manufacturés contenant du PBPhDPh. Les estimations de l’exposition au PBPhDPh par la mise en bouche ont été estimées de la manière décrite à l’annexe G.
| Voie et durée de l’exposition | Source | Groupe d’âge | Exposition estimée (mg/kg p.c./j) |
|---|---|---|---|
| Cutanée (quotidienne)a | Meubles ou matelas pour enfants contenant de la mousse | 0 à 6 mois | 0,018 à 0,098 |
| Cutanée (quotidienne)a | Meubles ou matelas pour enfants contenant de la mousse | 0,5 à 4 ans | 0,012 à 0,074 |
| Cutanée (quotidienne)a | Meubles ou matelas contenant de la mousse | 20 ans et plus | 0,005 à 0,034 |
| Orale (quotidienne) | Mousse dans les produits pour enfants | 0 à 6 mois | 1,11 × 10-5 à 1,81 × 10-5 |
| Orale (quotidienne) | Mousse dans les produits pour enfants | 0,5 à 4 ans | 1,07 × 10-5 à 1,75 × 10-5 |
a On présume que l’absorption cutanée est équivalente à l’absorption par voie orale.
2.7.1.3 PMNDPh
Milieux environnementaux et aliments
Nous n’avons trouvé aucune donnée de surveillance environnementale du PMNDPh dans l’air, l’eau ou le sol au Canada. Les concentrations de PMNDPh dans l’air ont été prévues à partir d’estimations par modélisation environnementale à l’aide de ChemCAN (2003), et un scénario a été établi sur la base de la quantité maximale de PMNDPh importée au Canada, soit environ 1 000 000 kg (voir le tableau 2‑5). Étant donné l’absence de données canadiennes récentes pour le sol, nous avons utilisé la CEE maximale estimée pour le sol de 2400 ng/g pour tous les OP aryliques (voir la section 2.6.2.2) pour estimer l’exposition de la population générale au PMNDPh par le sol. Selon les concentrations prévues de PMNDPh dans l’air et le sol, l’exposition estimée par ces sources devrait être négligeable pour la population générale canadienne.
Par prudence, nous avons utilisé la CEE maximale estimée pour l’eau de 2,7 µg/L pour tous les OP aryliques (section 2.6.2.2, tableau 2‑19) pour calculer l’ingestion de PMNDPh par la population générale par l’eau potable.
Le PMNDPh (rapporté comme du phosphate d’isodécyle et de diphényle, no CAS 29761-21-5) a été mesuré dans des échantillons de poussière active de plancher prélevés dans 144 maisons dans 13 villes (plus de 100 000 habitants) au Canada dans le cadre de l’EPDC (communication personnelle, courriel du Bureau de la science et de la recherche en santé environnementale de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 18 décembre 2018; non référencé). Le phosphate d’isodécyle et de diphényle a été détecté dans 100 % des échantillons, avec une plage de concentrations allant d’une valeur inférieure à la LDM (22,32 ng/g) à un maximum de 17 851 ng/g. La LQ était de 71,03 ng/g, et les 50e et 95e centiles étaient respectivement de 1225 ng/g et 7582 ng/g. Le PMNDPh a également été mesuré à des concentrations similaires dans la poussière intérieure des maisons au Royaume‑Uni et en Norvège (Kademoglou et coll. 2017), dans des maisons, des bureaux et des voitures en Espagne et aux Pays‑Bas (Bjornsdotter et coll. 2018) et dans des habitacles de voiture en Grèce (Christia et coll. 2018). La concentration au 95e centile de 7582 ng/g, selon l’EPDC, a été utilisée pour estimer l’exposition de la population générale au PMNDPh par la poussière.
On ne prévoit pas d’exposition potentielle au PMNDPh en raison de son utilisation comme composant de matériaux d’emballage alimentaire, car la substance n’entre pas en contact direct avec les aliments (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 11 janvier 2017; non référencé). Aucune donnée canadienne sur la présence du PMNDPh dans les aliments n’a été trouvée. Le PMNDPh (rapporté sous forme d’IDPP) a été quantifié dans 6 des 12 échantillons de poissons en Espagne, avec une concentration maximale de 851 ng/g de lipides mesurée dans un seul barbeau (LDM = 2,13 ng/g de lipides) [Santin et coll. 2016]. D’après la consommation de poisson présentant cette concentration maximale de PMNDPh, l’ingestion estimée de PMNDPh par la population générale est négligeable.
L’estimation de l’exposition au PMNDPh par les milieux environnementaux pour la population générale canadienne variait de 38 ng/kg p.c./j pour les nourrissons allaités à 326 ng/kg p.c./j pour les nourrissons nourris au lait maternisé, les sources d’exposition étant la poussière et l’eau respectivement (annexe F, tableau F-3).
Produits de consommation
Le PMNDPh a été trouvé comme composant d’une peinture marine à base d’eau dans un produit de consommation au Canada (MSDS 2011). L’exposition par voie cutanée au PMNDPh a été estimée à 2,2 mg/kg p.c./j à l’aide de ConsExpo Web (2016). On trouvera plus de détails concernant ce scénario au tableau G-1 de l’annexe G. Étant donné que le PMNDPh a une faible pression de vapeur (2,82 × 10-6 Pa), l’exposition par inhalation devrait être négligeable.
2.7.1.4 PTPPh
Le PTPPh présent dans les produits commerciaux est un mélange d’isomères isopropylés relativement similaires et de diverses quantités de PTPh (voir la section 2.1). Comme nous l’avons mentionné ci‑dessus, le PTPh a d’autres applications, et nous avons trouvé des données sur les concentrations de PTPh dans de nombreux milieux environnementaux (section 2.6.2.1), les aliments et les produits de consommation (voir la section 2.7.1.1). Une partie du PTPh mesuré dans ces études pourrait provenir d’un mélange de PTPPh. Par conséquent, les données sur le PTPh, qui est considéré comme le composant du PTPPh le plus soluble dans l’eau, combinées aux données limitées trouvées pour les isomères isopropylés plus volumineux et moins solubles dans l’eau et les données modélisées pour un phosphate de tris(3-(propan-2-yl)phényle (PT3PPH, voir le tableau 2‑2 pour l’identité des isomères), seront prises en considération lors de l’estimation de l’exposition de la population générale canadienne au PTPPh.
Milieux environnementaux et aliments
Comme nous l’avons vu à la section 2.1, les isomères du phosphate de tris(isopropylphényle) représentent les composants les plus gros (stériques) du PTPPh, avec le plus fort degré d’alkylation et d’hydrophobie. L’un de ces isomères, le phosphate de tris(3-isopropylphényl) [PT3PPH], a été choisi comme isomère représentatif du PTPPh pour estimer les concentrations dans l’air ambiant et dans le sol des espèces isopropylées du PTPPh et ces données ont été comparées aux quelques données de surveillance limitées, comme il est indiqué ci‑dessous. Nous avons utilisé le logiciel ChemCAN (2003) pour modéliser les concentrations de PT3PPH dans l’air en utilisant la quantité maximale de PTPPh importée au Canada, soit environ 1 000 000 kg (voir le tableau 2‑5).
Selon Salamova et coll. (2014), le PT2PPH n’a pas été détecté dans l’air ambiant de deux lieux éloignés, mais a été mesuré entre 3,6 et 5,3 pg/m3 (concentrations de particules) dans deux villes (Chicago et Cleveland) et un site rural (Sturgeon Point). Ce même isomère n’a pas été détecté (LDM = 13,8 ppb) dans 40 échantillons de particules atmosphériques prélevés en 2013 sur quatre sites à Houston, au Texas (Clark et coll. 2017). Le PT2PPH a également été détecté dans les échantillons d’air prélevés en 2014 à huit sites à Bursa, en Turquie (Kurt-Karakus et coll. 2018). Aucune des concentrations rapportées de PT2PPH n’était supérieure à la concentration dans l’air ambiant estimée pour le PT3PPH à l’aide de ChemCAN. Par conséquent, la concentration modélisée a été utilisée afin d’estimer de manière prudente l’exposition de la population générale canadienne aux isomères isopropylés du PTPPh.
L’isomère PT2PPH (rapporté sous forme de TIPPP) a également été surveillé dans l’air intérieur dans une étude de Vykoukalová et coll. (2017) portant sur 23 maisons à Toronto, dans 20 maisons en Indiana aux États‑Unis et dans 20 maisons à Brno, en République tchèque. Le PT2PPH a été détecté dans 97 % des échantillons prélevés à Toronto, pour une plage de concentrations allant de 0,002 à 0,034 ng/m3 avec une médiane de 0,007 ng/m3. La concentration maximale de PT2PPH (0,034 ng/m3) dans cette étude a été utilisée pour estimer l’exposition de la population générale aux composants isopropylés du PTPPh.
Étant donné l’absence de données sur l’eau potable au Canada, nous avons choisi par prudence la valeur estimée de la CEE maximale en milieu aquatique de 2,7 µg/L pour tous les OP aryliques (section 2.6.2.2) pour calculer l’ingestion de PTPPh par la population générale par l’eau potable.
Le PT2PPH a été mesuré dans la poussière domestique à Toronto (Vykoukalová et coll. 2017) et à Vancouver (Shoeib et coll. 2019). Des échantillons ont été prélevés en 2013 dans 23 maisons de Toronto dans l’étude de Vykoukalová et coll. (2017) et le PT2PPH (rapporté sous forme de TIPPP) a été mesuré avec une plage de concentrations allant de 4,26 à 74,3 ng/g, avec une médiane de 20,4 ng/g et une fréquence de détection de 100 %. Les échantillons de Vancouver (n = 92) ont été prélevés en 2007-2008 pour l’étude de Shoeib et coll. (2019), et le PT2PPH a été mesuré dans une plage de concentrations de 10 à 1500 ng/g (LDM = 0,5 ng/g), avec une moyenne de 57 ng/g et une fréquence de détection de 25 %. Le PTPPh (rapporté sous forme de TIPPP, phosphate de tris(isopropylphényl), no CAS 64532-95-2) a été mesuré dans des échantillons de poussière de plancher active prélevés dans 144 maisons dans 13 villes (de plus de 100 000 habitants) au Canada dans le cadre de l’EPDC (communication personnelle, courriel du Bureau de la science et de la recherche en santé environnementale de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 18 décembre 2018; non référencé). Le TIPPP a été détecté dans 76,4 % des échantillons, avec des concentrations allant de < LDM (42,40 ng/g) à un maximum de 52 713 ng/g. La LQ était de 135 ng/g, et les 50e et 95e centiles étaient de 72,45 ng/g et 518 ng/g, respectivement. Dans le cadre de l’étude TESIE en Caroline du Nord, aux États-Unis, Phillips et coll. (2018) ont mesuré six isomères isopropylés du PTPPh dans des échantillons de poussière intérieure prélevés dans 190 maisons. L’isomère le plus substitué qui a été mesuré dans les échantillons de poussière dans cette étude était le phosphate de bis(2,4-diisopropylphényle) et de phényle dans 8 % des échantillons, avec une plage de concentrations allant de moins de 3,5 ng/g (LDM) à 29 637 ng/g. Nous avons utilisé la concentration de TIPPP au 95e centile (518 ng/g) d’après l’EPDC a pour estimer l’exposition de la population générale au PTPPh.
En l’absence de données canadiennes récentes pour le sol, nous avons utilisé la CEE maximale estimée pour le sol de 2400 ng/g pour tous les OP aryliques (voir la section 2.6.2.2) pour estimer l’exposition de la population générale au TIPPP par le sol.
Le PTPPh (phosphate de tris(propan-2-ylphényle)) a été détecté dans 9 des 12 échantillons de poisson prélevés en Espagne, avec une concentration maximale de 601 ng/g dans les lipides, mesurée dans une seule carpe (LDM de 51,6 ng/g dans les lipides) [Santin et coll. 2016]. L’ingestion estimée de PTPPh par la population générale, d’après la consommation de poisson à cette concentration maximale de PTPPh, a été jugée négligeable. Gunderson (1988) a estimé l’exposition alimentaire totale aux « phosphates d’isopropylphényle et de phényles mélangés » dans le cadre de l’étude Total Diet Study de la FDA des États‑Unis (1982-1984). Pour tous les groupes d’âge de la population considérés entre 6 mois et 65 ans, l’exposition variait de 0,1 à 0,7 ng/kg p.c./j. Comme le PTPh est un composant du PTPPh et que les données dans les publications font état d’une exposition négligeable ou d’estimations notablement datées, nous avons estimé l’exposition au PTPPh par les aliments à partir des estimations fondées sur le PTPh (voir la section 2.7.1.1 et l’annexe E, tableau E-3).
Les estimations de l’ingestion de PTPh (annexe F, tableau F-1) et celles des composants isopropylés du PTPPh ont été additionnées pour obtenir des estimations prudentes de l’exposition au PTPPh par les milieux environnementaux et les aliments (annexe F, tableau F-4). Les estimations de l’exposition par l’air ambiant et le sol étaient négligeables. Les estimations de l’absorption de PTPPh pour la population générale variaient de 0,14 µg/kg p.c./j pour les nourrissons allaités, la poussière étant la principale source d’exposition, à 5,79 µg/kg p.c./j pour les enfants de 0,5 à 4 ans, les aliments étant la principale source d’exposition (annexe F, tableau F-4).
Produits de consommation
Articles manufacturés :
Le PTPPh, tout comme le PTPh, est l’une des nombreuses substances ignifuges qui sont incorporées dans les PUF souples lors de la production des mousses (Marklund 2005). Le PTPPh est un constituant du mélange commercial ignifuge Firemaster 550 (FM550), qui contient environ 40 % de PTPPh, environ 20 % de PTPh et environ 40 % à 50 % de deux substances bromées (TBB et TBPH), comme nous l’avons indiqué ci‑dessus (voir la section 2.7.1.1) [McGee et coll. 2013; Stapleton et coll. 2008; Phillips et coll. 2017, 2018]. Dans les études qui analysent les meubles et autres produits en mousse pour mesurer les substances ignifuges, on recherche souvent le FM550 comme mélange d’ignifugeants. Les concentrations de FM550 peuvent être rapportées sous forme de somme du PTPh et des deux substances bromées, sans inclure la portion composée de PTPPh (Stapleton et coll. 2012). Un étalon de FM550 a également été utilisé pour l’identification de ce mélange commercial dans les meubles, qui devrait également inclure le composant PTPPh (Cooper et coll. 2016).
Comme nous l’avons indiqué précédemment (section 2.7.1.1), dans une étude de la Commission de coopération environnementale (CCE), on a mesuré 16 substances ignifuges dans des meubles offerts aux consommateurs au Canada, aux États‑Unis et au Mexique entre décembre 2014 et avril 2015. Le PTPPh (déclaré sous forme de PIP) n’a été trouvé dans aucun des échantillons. Toutefois, le PTPh (qui n’est pas un composant du PTPPh et qui est déclaré sous forme de TPP) était la troisième substance ignifuge la plus fréquemment détectée parmi les six qui avaient été détectées dans les échantillons (CCE 2015 b). Le PTPh a été détecté dans environ 5 % des échantillons testés et provenant du Canada, tandis que le 2,3,4,5‑tétrabromobenzoate de 2-éthylhexyle (TBB, no CAS 183658-27-7) et le 3,4,5,6‑tétrabromophtalate de bis(2-éthylhexyle) [TBPH, no CAS 26040-51-7] ont chacun été détectés dans moins de 0,5 % des échantillons testés et provenant du Canada (CCE 2015 b). Une étude américaine a analysé la mousse provenant d’un certain nombre de types de produits, à la recherche de substances ignifuges, dont le FM550 (p. ex., canapés, chaises, berceuses, matelas, coussins de matelas, matelas pour enfant, sièges pour enfant, oreillers, autres produits pour enfant) et a détecté du FM550 dans 10 % des échantillons testés. Celle-ci était la deuxième substance ignifuge la plus détectée, tant pour l’ensemble des échantillons que pour les échantillons de sofas américains achetés entre 1985 et 2010 (Cooper et coll. 2016).
Nous avons estimé l’exposition par voie cutanée prolongée au PTPPh, c.-à-d. lorsqu’une personne s’allonge ou s’assoit sur un meuble ou lorsqu’un enfant s’assoit dans un siège pour nourrisson ou enfant fabriqué avec une mousse traitée au PTPPh ou un mélange commercial (p. ex., FM550) contenant du PTPPh (tableau 2‑24). L’exposition a été estimée de la manière décrite à l’annexe G pour le PTPh et le PT3PPH , un isomère isopropylé du PTPPh représentatif, volumineux et moins soluble dans l’eau. Les valeurs de l’exposition estimée, résumées dans le tableau 2‑24, représentent la fourchette calculée pour chacune de ces substances. Les données limitées d’absorption cutanée ont été trouvées pour le PTPh, mais aucune donnée d’absorption cutanée n’a été trouvée pour le PTPPh ou l’isomère PT3PPH . Frederiksen et coll. (2018) ont rapporté des coefficients de flux et de perméabilité pour le PTPh et d’autres organophosphates ignifuges, mais n’ont pas inclus dans les valeurs rapportées les résidus dans l’épiderme. Certaines substances peuvent demeurer partiellement dans la peau et ensuite être libérées de manière systémique (Roberts et coll. 2004, étude citée dans OMS 2006), de sorte que l’utilisation des valeurs de l’étude de Frederiksen et coll. (2018) pourrait sous-estimer l’exposition systémique au composant PTPh du PTPPh commercial. Des données sur l’absorption cutanée in vitro ont été rapportées pour d’autres organophosphates ignifuges, de sorte qu’une approche de lecture croisée pour le PTDCP (voir la section 2.1.1) a été utilisée. L’étude de Frederiksen et coll. (2018) semble indiquer que le PTDCP est absorbé légèrement plus par la peau que le PTPh, de sorte que ses valeurs de flux et de perméabilité sont légèrement plus élevées que celles rapportées pour le PTPh. Cette approche est par conséquent jugée prudente. Une valeur ajustée d’absorption cutanée de 30 % pour le PTDCP (EU RAR 2008 b) a été utilisée pour représenter l’absorption cutanée du PTPPh.
Aucune étude propre au Canada et mesurant les substances ignifuges dans les produits pour enfants n’a été trouvée, mais on s’attend à ce que les mêmes types de produits pour enfants contenant de la mousse que ceux qui ont été trouvés aux États‑Unis et en Europe soient présents au Canada et que certains de ces produits contiennent du PTPPh (CCE 2015 b; Cooper et coll. 2016; Miljøministeriet 2015; Ionas et coll. 2014; Stapleton et coll. 2011). L’exposition au PTPPh par la mise en bouche a été estimée de la manière décrite à l’annexe G, sur la base de l’ingestion calculée du PTPh et du PT3PPH (tableau 2‑24). L’exposition des enfants au PTPPh par la mise en bouche de ces produits est jugée minime, en partie d’après la faible solubilité dans l’eau du PTPh et du PTPPh (voir le tableau 2‑4).
| Voie et durée de l’exposition | Source | Groupe d’âge | Estimation de l’exposition a (mg/kg p.c./j) |
|---|---|---|---|
| Cutanée (quotidienne) | Meubles ou matelas pour enfants contenant de la mousse | 0 à 6 mois | 0,0052 à 0,040 |
| Cutanée (quotidienne) | Meubles ou matelas pour enfants contenant de la mousse | 0,5 à 4 ans | 0,0036 à 0,030 |
| Cutanée (quotidienne) | Meubles ou matelas pour enfants contenant de la mousse | 5 à 11 ans | 0,0024 à 0,021 |
| Cutanée (quotidienne) | Meubles ou matelas contenant de la mousse | 12 à 19 ans | 0,0020 à 0,019 |
| Cutanée (quotidienne) | Meubles ou matelas contenant de la mousse | 20 ans et plus | 0,001 à 0,014 |
| Cutanée (quotidienne) | Mousse dans les sièges pour nourrisson | 0 à 6 mois | 5,1 × 10-4 à 1,2 × 10-3 |
| Cutanée (quotidienne) | Mousse dans les sièges pour enfant | 0,5 à 4 ans | 4,1 × 10-4 à 9,4 × 10-4 |
| Orale (quotidienne) | Mousse dans les produits pour enfants | 0 à 6 mois | 1,08 à 2,47 x10-5 |
| Orale (quotidienne) | Mousse dans les produits pour enfants | 0,5 à 4 ans | 1,04 à 2,39 x10-5 |
a Les plages d’exposition estimée représentent l’exposition à l’isomère PT3PPH (plus faible exposition) et au PTPh (plus grande exposition). Voir l’annexe G pour plus de détails.
2.7.2 Données de biosurveillance du sous-groupe des OP aryliques
On a mesuré le phosphate de diphényle (PDPh) dans de nombreuses études de biosurveillance humaine au Canada (Kosarac et coll. 2016; Yang et coll. 2017), aux États‑Unis (Ospina et coll. 2018; Butt et coll. 2014, 2016; Hoffman et coll. 2017; Thomas et coll. 2016) et ailleurs (Cequier et coll. 2015; Fromme et coll. 2014; He et coll. 2018). Le PDPh a également été mesuré dans le sérum (Li et coll. 2017; Ma et coll. 2017), ainsi que dans les cheveux et les ongles (Alves et coll. 2017; Liu et coll. 2016). Le PDPh est un métabolite primaire de plusieurs organophosphates ignifuges, dont le PTPh et le PBPhDPh (Kosarac et coll. 2016; He et coll. 2018; Bjornsdotter et coll. 2018). Le PDPh peut également être utilisé seul dans diverses applications industrielles, et l’origine de ce composé dans l’urine est donc inconnue (Kosarac et coll. 2016; Bjornsdotter et coll. 2018). Par conséquent, pour le PTPh ni le PBPhDPh, on ne dispose de biomarqueurs appropriés ou de données suffisantes sur la cinétique et le métabolisme de ces substances à partir desquelles il serait possible d’estimer le degré d’exposition. Un biomarqueur plus spécifique pour le PTPh a été trouvé par Su et coll. (2016c), mais des renseignements supplémentaires et des concentrations mesurées de ce métabolite chez l’humain sont nécessaires avant de pouvoir l’utiliser pour estimer l’exposition humaine.
Des données limitées de biosurveillance humaine ont été trouvées pour certains isomères du PTPPh (Phillips et coll. 2018) et du PMNDPh (Gibson et coll. 2018). Cependant, les données sur les biomarqueurs appropriés ainsi que sur la cinétique et le métabolisme de ces substances sont insuffisantes pour établir des estimations de l’exposition.
2.7.3 Évaluation des effets sur la santé du sous-groupe des OP aryliques (PTPh, PBPhDPh, PTPPh, PMNDPh)
2.7.3.1 PTPh
L’ATSDR (2012) et l’OCDE (2002 b) ont étudié le PTPh. Ces examens constituent une base pour la caractérisation des effets sur la santé dans la présente ébauche d’évaluation préalable. Des recherches ciblées dans les publications scientifiques ont été menées pour couvrir la période de 2011 (soit un an avant le rapport de l’ATSDR 2012) jusqu’en octobre 2018. Nous n’avons trouvé aucune étude sur les effets sur la santé qui aurait un impact sur la caractérisation des risques (c.‑à‑d. qui donnerait lieu à des critères d’effet critiques différents ou à des points de départ plus bas que ceux présentés dans le rapport ATSDR 2012).
Une évaluation de l’innocuité du PTPh utilisé dans les cosmétiques était également disponible (CIR 2018).
Toxicocinétique
Le phosphate de triphényle (PTPh) était dégradé par hydrolyse dans l’homogénat de foie de rat en phosphate de diphényle comme principal métabolite (OCDE 2002b). L’absorption cutanée et la pénétration percutanée du PTPh ont été étudiées en utilisant de la peau humaine dans des cellules de diffusion de Franz. Le PTPh avait tendance à s’accumuler dans les tissus de la peau, principalement dans les couches supérieures. Seules de « petites quantités » de PTPh ont traversé la peau pour atteindre le fluide récepteur dans les 72 heures (Frederiksen et coll. 2018). Le PTPh a le potentiel d’être absorbé par voie cutanée après une application d’un cosmétique chez l’humain (Mendelsohn et coll. 2016, étude citée dans CIR 2018). Une valeur moyenne de 41 % de PTPh était retenue dans les poumons lors d’une inhalation à un débit de 18 L/minute. Ce taux de rétention augmente avec la taille des particules et le débit (Landhal et coll. 1951, 1952, étude citée dans ATSDR 2012).
Cancérogénicité et génotoxicité
Aucune étude de cancérogénicité n’a été trouvée pour le PTPh. Le PTPh n’est pas jugé génotoxique d’après les preuves négatives de mutagénicité dans des tests in vitro sur Salmonella typhimurium, avec et sans activation métabolique (ATSDR 2012).
Études de toxicité à doses répétées et pour la reproduction et le développement
Deux études de toxicité par voie orale pendant 4 mois ont été trouvées. Des rats ont été exposés au PTPh à des doses de 0, 161, 345, 517 ou 711 mg/kg p.c./j dans leur alimentation. On a constaté une réduction statistiquement significative du poids à la croissance aux concentrations de 345 mg/kg p.c./j et plus dans l’étude de Sobotka et coll. (1986, étude citée dans OCDE 2002b). Ce changement n’a été observé qu’à partir de 711 mg/kg p.c./j par Hinton et coll. (1987, étude citée dans OCDE 2002b). Cependant, seules des données limitées ont été rapportées et un certain nombre de paramètres standards de toxicité à doses répétées étaient absents, notamment le poids des organes et l’histopathologie des organes autres que les organes lymphoïdes (rate, thymus, ganglions lymphatiques), ainsi que des données sur l’hématologie et la chimie clinique autres que les protéines sériques. Sur la base des données disponibles, la dose sans effet nocif observé (DSENO) est établie à 161 mg/kg p.c./j. Dans une autre étude de 4 mois sur la fertilité et le développement, le PTPh n’a eu aucun effet jusqu’à la dose maximale d’essai de 690 mg/kg p.c./j (Welsh et coll. 1987, étude citée dans OCDE 2002b).
Dans une étude de toxicité par voie orale de 90 jours, des rats Wistar ont reçu du PTPh à des doses de 0, 20, 105 et 583 mg/kg p.c./j pour les mâles et de 0, 22, 117 et 632 mg/kg p.c./j pour les femelles (ECHA c2007-2018c). L’augmentation du poids du foie, liée au traitement dans les groupes ayant reçu la dose maximale (environ 30 % et 21 % pour les mâles et les femelles, respectivement) a été considérée comme étant un effet nocif, bien qu’aucune modification histopathologique nocive n’ait été observée dans le foie. La dose minimale avec effet observé (DMEO) pour cette étude était de 105 mg/kg p.c./j.
Dans une étude de toxicité par voie orale à court terme, des rats Wistar ont été exposés à des doses de 0, 23,5, 161,4 ou 701 mg/kg p.c./j de PTPh dans leur alimentation pendant 28 jours (ECHA c2007-2018c). Chez les mâles, on a observé une diminution de la prise de poids corporel à 161,4 mg/kg p.c./j. À 701 mg/kg p.c./j, on a observé une augmentation de la consommation alimentaire chez les mâles et les femelles. Une augmentation statistiquement significative du poids du foie a également été observée à 701 mg/kg p.c./j chez les deux sexes. Les mâles présentaient une fréquence plus élevée d’hypertrophie du foie. Cette tendance est en corrélation avec l’apparition d’une légère hypertrophie et d’un léger changement cytoplasmique des hépatocytes périportaux observés chez les mâles à 161,4 mg/kg p.c./j, par rapport aux femelles à 701 mg/kg p.c./j. Une modification distincte de la fonction hépatique a également été observée à 701 mg/kg p.c./j chez les femelles. La DSENO a été fixée à 161,4 mg/kg p.c./j, sur la base de la diminution de la prise de poids corporel et des effets sur le foie à la dose d’essai suivante. Dans une autre étude, on a observé seulement une légère diminution de la prise de poids corporel et une augmentation du poids du foie à la dose de 350 mg/kg p.c./j après 35 jours de traitement (Sutton et coll. 1960, étude citée dans OCDE 2002b).
Dans une étude à court terme de toxicité par voie cutanée, la mise à nu et intacte ou sr la peau abrasée de lapins a été exposée à des doses de 0, 100 ou 1 000 mg/kg p.c./j de PTPh pendant 3 semaines. Aucun effet sur le poids corporel, l’hématologie et la chimie clinique, le poids des organes ou l’histopathologie n’a été observé. Le seul effet lié au traitement était une dépression liée à la dose (valeur statistiquement significative seulement à 1000 mg/kg p.c./j) de l’acétylcholinestérase dans le plasma, des érythrocytes et du cerveau chez les lapins traités au PTPh, sans aucun signe clinique d’augmentation de l’activité cholinergique. La pertinence toxicologique de ces effets n’est pas claire. Aucun effet n’a été observé sur les organes reproducteurs des lapins ayant reçu du PTPh jusqu’à la dose d’essai maximale de 1000 mg/kg p.c./j. La DSENO a été établie à 1000 mg/kg p.c./j (Monsanto 1979, étude citée dans OCDE 2002b).
Aucun effet sur le développement ou la reproduction n’a été observé dans l’étude de 4 mois sur la fertilité et le développement par voie orale chez le rat jusqu’à des doses atteignant 690 mg/kg p.c./j (Welsh et coll. 1987, étude citée dans OCDE 2002b).
2.7.3.2 PBPhDPh
Des recherches ont été effectuées jusqu’en octobre 2018 dans les publications scientifiques pour trouver des articles portant sur les effets sur la santé du PBPhDPh. Un rapport d’évaluation des risques environnementaux de l’agence britannique pour l’environnement (EA 2009a) et un rapport de l’EPA (2009) étaient disponibles pour le PBPhDPh. Des recherches ciblées dans les publications scientifiques ont été menées jusqu’à mars 2018. Nous n’avons trouvé aucune nouvelle étude sur les effets sur la santé qui aurait un impact sur la caractérisation des risques (c.‑à‑d. une étude qui présenterait des critères d’effet critique différents ou des points de départ plus bas que ceux décrits dans le présent document). La majeure partie des études réalisées à la fin des années 1970 et au début des années 1980 ont été menées sur le Phosflex 51B, un mélange commercial de substances ignifuges phosphorées, tandis que des études plus récentes ont porté sur d’autres préparations commerciales, notamment le Durad 220B et le Phosflex 61B. La différence de composition entre ces produits commerciaux n’est pas claire. Les dossiers de l’IUCLID (2001) et de l’EPA (2009) décrivent ces substances comme étant constituées de 75 % à 80 % p/p de PBPhDPh et de 20 % à 25 % p/p de PTPh (EA 2009a).
Toxicocinétique
Aucune donnée sur l’absorption, la distribution, le métabolisme et l’élimination du PBPhDPh n’est disponible.
Cancérogénicité et génotoxicité
Aucune étude de cancérogénicité n’a été trouvée pour le PBPhDPh. Le PBPhDPh n’est pas jugé génotoxique sur la base des données disponibles, car il n’a pas induit de mutation dans les études de mutagénicité in vitro, ni d’aberrations chromosomiques ou d’échange de chromosomes sœurs dans un test cytogénétique sur le lymphome de souris L5178Y (EA 2009a).
Toxicité à doses répétées
Dans une étude de toxicité subchronique par voie orale, des rats Sprague-Dawley (SD) ont reçu du Phosflex 51B pendant 90 jours à des doses correspondant à 0, 6,6, 26,7 et 107,5 mg/kg p.c./j pour les mâles et à 0, 7,7, 30,0 et 124,8 mg/kg p.c./j pour les femelles. À la dose maximale, on a observé une augmentation significative du poids absolu et relatif du foie chez les deux sexes, une augmentation significative du poids des reins chez les mâles, et une augmentation du poids des glandes surrénales chez les femelles. Cependant, il n’y a pas eu d’augmentation correspondante en termes de changements histopathologiques dans ces organes. Une DMEO de 107,5 mg/kg p.c./j a été établie pour cette étude (Freudenthal et coll. 2001; EA 2009a).
Aucune étude de toxicité à court terme par voie orale ou cutanée à doses répétées n’a été trouvée pour le PBPhDPh. Aucune toxicité systémique n’a été observée dans une étude de toxicité pour le développement de 15 jours et dans une étude de toxicité pour la reproduction de 8 semaines à des doses atteignant 1000 mg/kg p.c./j (Experimur 2003; Stauffer Chemical Company 1981, tous deux cités dans EA 2009a). Le seul effet observé, c’est‑à‑dire l’augmentation du poids du foie à la dose maximale dans l’étude de 8 semaines, a été considéré par les auteurs (Stauffer Chemical Company 1981, étude citée dans EA 2009a) comme une réponse adaptative (induction enzymatique), plutôt que comme une conséquence de la toxicité du composé. Aucun examen histopathologique du foie n’a été réalisé.
Toxicité pour la reproduction et le développement
Dans une étude de toxicité pour la reproduction par voie orale, des rats SD ont été exposés par gavage au Phosflex 61B (pureté non précisée) à des doses de 0, 50, 250 ou 1 000 mg/kg p.c./j pendant 8 semaines (soit 2 semaines avant l’accouplement, 2 semaines d’accouplement, et une période de gestation et de lactation pour un total de 8 semaines). Aucune modification des signes cliniques de toxicité, de consommation alimentaire, du poids corporel ou du poids des organes n’a été observée, et aucune modification histologique liée au traitement n’a été notée dans les organes reproducteurs. On n’a constaté aucune différence significative dans la taille des portées ou dans le nombre de petits vivants (Experimur 2003, étude citée dans EA 2009a).
Dans une autre étude de toxicité pour le développement par voie orale, des rates gravides ont été exposées au Phosflex 51B à des doses de 0, 100, 400 ou 1 000 mg/kg p.c./j du 6e au 20e jours de gestation (JG). On a observé une réduction du poids corporel des mères et des fœtus (8 %) dans le groupe exposé à la dose élevée, due probablement à une diminution de la consommation alimentaire. Une augmentation significative du poids absolu et relatif du foie, liée à la dose, a également été observée dans tous les groupes traités, ce qui a été considéré par les auteurs comme une réponse adaptative (induction enzymatique). La DSENO pour la toxicité pour le développement est de 1 000 mg/kg p.c./j (Stauffer Chemical Company 1981, étude citée dans EA 2009a).
Aucune étude de toxicité pour la reproduction par voie cutanée n’a été trouvée pour le PBPhDPh.
2.7.3.3 PMNDPh
Une recherche a été lancée jusqu’à mars 2018 dans les publications scientifiques afin de trouver des articles traitant des effets sur la santé. Un rapport d’évaluation des risques environnementaux publié par l’agence britannique pour l’environnement (EA 2009c) était disponible pour le PMNDPh. Nous n’avons trouvé aucune étude sur les effets sur la santé qui aurait un impact sur la caractérisation des risques (c.‑à‑d. qui aurait pu fournir des critères d’effet critique différents ou des points de départ plus bas que ceux rapportés dans le présent document).
Toxicocinétique
Le PMNDPh peut être absorbé après une exposition par voie orale et respiratoire, mais le degré d’absorption ne peut être prédit (ECHA c2007-2018e). Aucune donnée n’était disponible sur la distribution, le métabolisme ou l’élimination de cette substance.
Cancérogénicité et génotoxicité
Nous n’avons trouvé aucune étude de cancérogénicité pour le PMNDPh. Il n’est pas jugé génotoxique (EA 2009c).
Toxicité à doses répétées
Dans une étude de toxicité par voie orale à court terme avec peu de données publiées, des rats ont été exposés au PMNDPh à des doses de 3, 9, 30, 90 ou 900 mg/kg p.c./j dans l’alimentation pendant 28 jours (Monsanto 1984, étude citée dans EA 2009c). Une diminution de la cholinestérase sérique a été observée à 90 mg/kg p.c./j, tandis qu’une hypertrophie des cellules centrolobulaires du foie, une cholangite du foie, ainsi qu’une augmentation de la cholinestérase et du cholestérol totaux ont été observées à 900 mg/kg p.c./j. La DSENO a été établie à 90 mg/kg p.c./j. Dans une autre étude de toxicité par voie orale de 28 jours, une dose minimale entraînant un effet nocif observé (DMENO) de 250 mg/kg p.c./j a été établie sur la base d’une hypertrophie du foie observée à toutes les doses (Monsanto 1979a, étude citée dans EA 2009c).
Dans une étude de toxicité subchronique par voie orale, des rats SD ont reçu du PMNDPh dans leur alimentation pendant 90 jours à des doses de 9,3, 93,8 ou 465 mg/kg p.c./j pour les mâles et de 11,1, 110 ou 533 mg/kg p.c./j pour les femelles. Une diminution statistiquement significative du poids corporel et de la consommation alimentaire a été observée chez les deux sexes à la dose élevée. Une augmentation du poids du foie a également été observée chez les animaux ayant reçu des doses moyenne et élevée. La fréquence combinée de l’hypertrophie ou de l’hyperplasie hépatocellulaire a augmenté en proportion de la dose chez les deux sexes. Les femelles ayant reçu la dose élevée ont également présenté une augmentation des pigments bruns hépatocellulaires. Les paramètres hématologiques et biochimiques ont également été modifiés dans tous les groupes traités chez les deux sexes. Au moment du sacrifice, les changements hématologiques comprenaient une augmentation de l’hématocrite, une diminution de l’hémoglobine et une augmentation du nombre de globules rouges chez les deux sexes, ainsi qu’une diminution du nombre de globules blancs et une augmentation du nombre de plaquettes chez les femelles. La DMENO pour la toxicité systémique a été établie à 9,3 mg/kg p.c./j, soit la plus faible dose d’essai. Aucune DSENO n’a pu être calculée (Monsanto 1983b, étude citée dans EA 2009c).
Toxicité pour la reproduction et le développement
Dans une étude de toxicité pour le développement par voie orale, des rats SD ont été exposés au PMNDPh à des doses de 300, 1000 ou 3000 mg/kg p.c./j aux jours 6 à 15 de la gestation. Une diminution du poids corporel liée à la dose a été observée chez les mères à 1000 et 3000 mg/kg p.c./j. La DSENO maternelle était de 300 mg/kg p.c./j. La DSENO pour le développement était de 3000 mg/kg p.c./j (Monsanto 1980, étude citée dans EA 2009c). Dans une étude similaire, Robinson et coll. (1986) ont également établi une DSENO pour les fœtus de 3000 mg/kg p.c./j basée sur l’absence d’effets sur le poids corporel des fœtus, sur le ratio des sexes chez les fœtus ou sur le nombre de fœtus vivants et morts.
2.7.3.4 PTPPh
Une recherche a été effectuée jusqu’en octobre 2018 dans les publications scientifiques afin de trouver des articles traitant des effets sur la santé. Un rapport d’évaluation des risques environnementaux publié par l’agence britannique pour l’environnement (EA 2009b) et un rapport de caractérisation préliminaire des dangers de l’EPA (2010) étaient disponibles pour le PTPPh. Un dossier d’homologation fourni à l’ECHA (ECHA c2007-2018d) était également disponible. Les études disponibles sur les effets sur la santé qui auraient un impact sur la caractérisation des risques sont présentées ci‑dessous. Le PTPPh est un mélange produit commercialement d’isomères de phosphate de triphényle isopropylés avec un nombre non indiqué de groupes isopropyles, et il couvre une plage de substances présentant différents degrés d’alkylation. La composition de la substance testée n’est pas toujours clairement décrite dans les publications scientifiques auxquelles nous avons accès.
Toxicocinétique
Aucune information sur l’absorption, la distribution, le métabolisme ou l’élimination du PTPPh n’était disponible.
Cancérogénicité et génotoxicité
Aucune étude de cancérogénicité n’a été trouvée pour le PTPPh. Le PTPPh n’est pas jugé génotoxique (EA 2009b).
Toxicité à doses répétées
Dans une étude par gavage de 91 jours, dans laquelle du Reofos 35Note de bas de page 6 a été administré à des rats à des doses de 0, 25, 100 ou 325 mg/kg/j, aucune DSENO n’a été déterminée, et la DMENO a été établie à 25 mg/kg/j sur la base des modifications histopathologiques nocives observées dans les glandes surrénales à toutes les doses. Les changements macroscopiques et au poids des organes dans les glandes surrénales étaient en corrélation avec une vacuolisation diffuse de la zone fasciculée et étaient caractérisés par des cellules hypertrophiées avec un cytoplasme spumeux. En outre, les cellules de la zone fasciculée présentes près de la zone réticulaire affichaient de grandes vacuoles claires uniques qui s’étendaient vers l’extérieur en fonction de la gravité. Au moment de la récupération, la vacuolisation diffuse n’était pas présente. Toutefois, les cellules proches de la zone réticulaire présentaient de grandes vacuoles cytoplasmiques uniques (dues à une vacuolisation accrue) [ECHA c2007-2018d].
Dans une étude de toxicité pour le développement à court terme décrite ci‑dessous, la DMENO pour la toxicité systémique parentale à la suite d’une exposition orale au Reofos 65Note de bas de page 7 a été établie à 25 mg/kg/j. Des effets ont été observés sur la consommation alimentaire (femelles uniquement), le poids des organes, l’hématologie ou la chimie du sérum. Aux doses de 25 mg/kg/j et plus, le poids moyen des glandes surrénales chez les mâles et les femelles et le poids du foie chez les mâles ont augmenté. Les effets constatés sur le poids des glandes surrénales et du foie correspondaient à la gravité accrue des effets macroscopiques et histopathologiques sur ces organes (glandes surrénales pâles ou hypertrophiées et vacuolisation du cortex surrénal et hypertrophie hépatocellulaire centrolobulaire) [ECHA c2007-2018d].
Dans deux études de toxicité par voie cutanée de 4 semaines succinctement rapportées, on a appliqué du Kronitex 50 (à 100, 500 ou 2000 mg/kg p.c./j) ou du Reolube HYD 46 (un produit commercial de PTPPh) [à 40, 200 ou 1000 mg/kg p.c./j] sur la peau rasée de rats à raison de 6 heures par jour, 5 jours par semaine, pendant 4 semaines (EA 2009b). Dans l’étude sur le Kronitex, on a constaté une augmentation du poids des glandes surrénales chez les mâles ayant reçu des doses moyennes et élevées (sans autre précision). L’examen histopathologique a révélé une légère modification graisseuse du cortex surrénal chez les mâles ayant reçu 500 mg/kg p.c./j (2/5) et 2000 mg/kg p.c./j (3/5) de Kronitex 50. Sur la base des données limitées fournies, la DSENO pour le Kronitex 50 a été établie à 100 mg/kg p.c./j. Pour ce qui est du Reolube HYD 46, on a noté une légère augmentation du poids absolu et relatif des surrénales chez les animaux traités, mais ce constat n’a pas été mis en corrélation avec les résultats microscopiques (aucun autre détail n’a été fourni; EA 2009b). Un poids plus faible des testicules a également été observé chez les mâles ayant reçu la dose élevée, tandis que l’examen histopathologique a montré une légère atrophie des tubules testiculaires chez les rats témoins et traités (pas d’autre détail). Sur la base des données limitées disponibles, une DSENO de 200 mg/kg p.c./j a été établie pour Reolube HYD 46. Par conséquent, la DSENO globale pour l’exposition par voie cutanée est établie à 200 mg/kg p.c./j.
Dans une étude de toxicité subchronique par inhalation utilisant le MIL-H-19457B (Durad MP280) comme substance d’essai (aucun détail sur la composition ou la pureté), des rats, des hamsters et des lapins ont été exposés à des doses de 10 et 100 mg/m3 sous forme d’aérosol de fluide hydraulique, de manière continue pendant 90 jours. Une toxicité générale a été observée sous forme d’effets sur le poids des organes, l’hématologie ou la chimie du sérum. Aucune concentration sans effet nocif observé (CSENO) n’a pu être déterminée (ECHA c2007-2018d).
Toxicité pour la reproduction et le développement
Dans une étude de toxicité pour la reproduction par voie orale, des rats Crl:CD(SD) IGS BR ont été exposés à Reofos 65 par gavage à des doses de 0, 25, 100 ou 400 mg/kg p.c./j. Les rats ont été exposés à du Reofos 65 pendant 15 jours avant l’accouplement. Les mâles ont reçu la substance d’essai pendant toute la période d’accouplement et jusqu’au jour précédant l’autopsie, soit un total de 29 doses. Les femelles ont reçu la substance d’essai jusqu’au 4e jour de lactation, au 25e jour après l’accouplement ou au 25e jour après la cohabitation, soit un total de 41 à 54 doses (ECHA c2007-2018d). Aux doses de 25 mg/kg p.c./j et plus, les effets parentaux comprenaient l’augmentation du poids des ovaires ou des oviductes, des glandes surrénales (mâles et femelles) et du foie (mâles uniquement), ainsi que la baisse de masse de l’épididyme. Des changements macroscopiques ou microscopiques correspondants dans ces tissus ont généralement été observés. La performance reproductive des mâles et des femelles a également été affectée aux doses de 100 et 400 mg/kg p.c./j, ce qui s’est traduit par une réduction importante des indices de fertilité et de copulation ou conception. Les premiers stades du développement postnatal ont également été affectés aux doses de 100 et 400 mg/kg p.c./j. Le nombre de petits nés et la taille des portées vivantes ont diminué dans ces groupes, tandis que le nombre de petits trouvés morts ou euthanasiés in extremis a augmenté. Tous les petits de cinq des six portées du groupe ayant reçu 400 mg/kg/j ont été trouvés morts ou euthanasiés in extremis avant le jour postnatal 4 (JPN 4). D’après les résultats de cette étude, la DSENO pour la performance reproductive des mâles et des femelles était de 25 mg/kg p.c./j. La DSENO pour la toxicité néonatale a été établie à 25 mg/kg p.c./j (ECHA c2007-2018d).
Dans une étude par voie orale de toxicité pour le développement, des rates CD ont reçu par gavage du Reofos 35 à des doses de 0, 100, 200 ou 400 mg/kg p.c./j, une fois par jour, entre les JG 0 et 19. Une diminution statistiquement significative de la prise de poids corporel a été observée à 400 mg/kg p.c./j. Cette diminution a été mise en corrélation avec une diminution de la consommation alimentaire liée à la substance d’essai et a été considérée comme défavorable. Des foyers rouges ou blancs et un gonflement de la muqueuse de la partie non glandulaire de l’estomac ont été observés à la dose élevée. Le Reofos 35 ne s’est pas avéré tératogène. La DSENO a été établie à 200 mg/kg p.c./j pour la toxicité maternelle et à 400 mg/kg p.c./j pour la toxicité pour le développement (ECHA c2007-2018d).
Dans une étude de toxicité par voie cutanée de 28 jours dans laquelle des rats RIAF ont reçu 40, 200 ou 1 000 mg/kg p.c./j de Reolube HYD 46, on a observé une diminution du poids des testicules chez les mâles ayant reçu 1000 mg/kg p.c./j. L’examen microscopique des testicules a révélé une légère atrophie tubulaire tant chez les témoins que dans les groupes traités. La DSENO a été établie à 200 mg/kg p.c./j (ECHA c2007-2018d).
2.7.4 Caractérisation des risques du sous-groupe des OP aryliques (PTPh, PBPhDPh, PTPPh, PMNDPh) pour la santé humaine
2.7.4.1 PTPh
Aucune étude de cancérogénicité n’a été trouvée pour le PTPh. On ne s’attend pas à ce que le PTPh soit génotoxique. D’après les études disponibles, la DSENO pour l’exposition répétée par voie orale au PTPh de 161 mg/kg p.c./j, tenant compte de la diminution du poids corporel et des effets hépatiques (ECHA c2007-2018c; OCDE 2002b), a été sélectionnée comme critère d’effet critique pour caractériser les risques pour la santé humaine dus à l’exposition orale au PTPh. Aucune toxicité pour le développement n’a été observée jusqu’à 690 mg/kg p.c./j (Welsh et coll. 1987, étude citée dans OCDE 2002b). Aucun effet indésirable n’a été observé après une exposition cutanée de 3 semaines au PTPh (Monsanto 1979, étude citée dans OCDE 2002b). La DSENO de cette étude a été utilisée pour caractériser les risques pour la santé humaine dus à l’exposition par voie cutanée ponctuelle ou intermittente au PTPh. Compte tenu de la durée de l’étude de toxicité par voie cutanée, la DSENO orale pour la dose répétée a également été prise en compte pour déterminer la pertinence des marges d’exposition (ME) calculées.
Le tableau 2‑25 présente les valeurs pertinentes (estimations de l’exposition et points de départ des dangers) ainsi que les ME résultantes pour la caractérisation des risques dus à l’exposition au PTPh.
| Scénario d’exposition | Exposition systémique | Niveau d’effet critique | Critère d’effets critiques sur la santé | ME |
|---|---|---|---|---|
| Milieux environnementaux et aliments | 0,00014 à 0,0058 mg/kg p.c./j | DSENO = 161 mg/kg p.c./j | Diminution de la prise de poids corporel dans l’étude de 4 mois de toxicité par voie orale | 27 759 à 1 150 000 |
| Mise en bouche de la mousse dans les jouets et produits pour enfants (orale) | 1,33 × 10-5 à 2,47x10-5 mg/kg p.c./j (0 à 6 mois) | DSENO = 161 mg/kg p.c./j | Diminution de la prise de poids corporel dans l’étude de 4 mois de toxicité par voie orale | > 1 million |
| Mise en bouche de la mousse dans les jouets et produits pour enfants (orale) | 1,29 × 10-5 à 2,39x10-5 mg/kg p.c./j (0,5 à 4 ans) | DSENO = 161 mg/kg p.c./j | Diminution de la prise de poids corporel dans l’étude de 4 mois de toxicité par voie orale | > 1 million |
| Meubles ou matelas pour enfants contenant de la mousse (cutanée) | 0,021 à 0,13 mg/kg p.c./j (0 à 6 mois) | DSENO = 1 000 mg/kg p.c./j | Aucun effet nocif dans une étude de 3 semaines de toxicité par voie cutanée | 7 692 à 47 619 |
| Meubles ou matelas pour enfants contenant de la mousse (cutanée) | 0,015 à 0,10 mg/kg p.c./j (0,5 à 4 ans) | DSENO = 1 000 mg/kg p.c./j | Aucun effet nocif dans une étude de 3 semaines de toxicité par voie cutanée | 10 000 à 66 667 |
| Meubles ou matelas contenant de la mousse (cutanée) | 5,6 × 10-3 à 4,7 × 10-2 mg/kg p.c./j (20 ans et plus) | DSENO = 1 000 mg/kg p.c./j | Aucun effet nocif dans une étude de 3 semaines de toxicité par voie cutanée | 21 277 à 178 571 |
| Vernis à ongles (cutanée) | 0,84 à 0,99 mg/kg p.c./événement | DSENO = 1 000 mg/kg p.c./j | Aucun effet nocif dans une étude de 3 semaines de toxicité par voie cutanée | 1 010 à 1 190 |
Abréviation – DSENO : dose sans effet nocif observé.
Les ME calculées sont jugées adéquates pour compenser les incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
2.7.4.2 PBPhDPh
Aucune étude sur la cancérogénicité n’a été retrouvée pour le PBPhDPh. On ne s’attend pas à ce que le PBPhDPh soit génotoxique. D’après les études disponibles, une DMEO pour l’exposition répétée au PBPhDPh par voie orale de 107,5 mg/kg p.c./j, basée sur la variation du poids des organes (foie, reins et glandes surrénales) dans une étude de 90 jours menée avec un mélange de PBPhDPh et de PTPh (Freudenthal et coll. 2001), a été considérée comme étant le critère d’effet le plus pertinent pour la caractérisation des risques pour la santé humaine dus à l’exposition au PBPhDPh. Aucune étude à court terme sur l’exposition orale ou cutanée n’a été trouvée pour le PBPhDPh. Dans les deux études de toxicité pour la reproduction et le développement, aucun effet systémique indésirable n’a été observé jusqu’à la dose de 1000 mg/kg p.c./j (Experimur 2003; Stauffer Chemical Company 1981, tous deux cités dans EA 2009a). Ces études ne signalent aucun effet sur le développement ou la reproduction. La DMEO de 107,5 mg/kg p.c./j a été choisie comme niveau d’effet critique pour caractériser les risques pour la santé humaine par les milieux environnementaux et les articles manufacturés contenant de la mousse.
Le tableau 2‑26 présente les valeurs pertinentes (estimations de l’exposition et points de départ des dangers) ainsi que les ME résultantes pour la caractérisation des risques dus à l’exposition au PBPhDPh.
| Scénario d’exposition | Exposition systémique | Niveau d’effet critique b | ME |
|---|---|---|---|
| Milieux environnementaux | 1,72 × 10-6 à 2,90 × 10-4 mg/kg p.c./j | DMEO = 107,5 mg/kg p.c./j | 370 690 à 62 500 000 |
| Mise en bouche de la mousse dans les produits pour enfants (orale) | 1,11 × 10-5 à 1,81 × 10-5 mg/kg p.c./j (0 à 6 mois) | DMEO = 107,5 mg/kg p.c./j | > 1 million |
| Mise en bouche de la mousse dans les produits pour enfants (orale) | 1,07 × 10-5 à 1,75 × 10-5 mg/kg p.c./j (0,5 à 4 ans) | DMEO = 107,5 mg/kg p.c./j | > 1 million |
| Meubles ou matelas pour enfants contenant de la mousse (cutanée)a | 0,018 à 0,098 mg/kg p.c./j (0 à 6 mois) | DMEO = 107,5 mg/kg p.c./j | 1 097 à 5 972 |
| Meubles ou matelas pour enfants contenant de la mousse (cutanée)a | 0,012 à 0,074 mg/kg p.c./j (0,5 à 4 ans) | DMEO = 107,5 mg/kg p.c./j | 1 453 à 8 958 |
| Matelas contenant de la mousse (cutanée)a | 0,005 à 0,034 mg/kg p.c./j (20 ans et plus) | DMEO = 107,5 mg/kg p.c./j | 3 162 à 21 500 |
Abréviation – DMEO : dose minimale avec effet observé.
a On présume que l’absorption cutanée est équivalente à l’absorption par voie orale.
b Variation du poids des organes (foie, reins et glandes surrénales dans les 90 jours).
Les ME calculées sont jugées adéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
2.7.4.3 PMNDPh
Aucune étude de cancérogénicité n’a été retrouvée pour le PMNDPh. On ne s’attend pas à ce que le PMNDPh soit génotoxique. Aucune DSENO pour les effets systémiques n’a été déterminée dans une étude de toxicité subchronique à doses répétées par voie orale (Monsanto 1983b, étude citée dans EA 2009c). Des changements histologiques du foie ont été observés chez les rats des deux sexes, ainsi qu’une diminution du poids corporel et de la consommation alimentaire. Les paramètres hématologiques et biochimiques ont également été altérés dans tous les groupes traités chez les deux sexes. Au moment du sacrifice final, les changements hématologiques comprenaient une augmentation de l’hématocrite, une diminution de l’hémoglobine et une augmentation du nombre de globules rouges chez les deux sexes, ainsi qu’une diminution du nombre de globules blancs et une augmentation du nombre de plaquettes chez les femelles. La DMENO pour la toxicité systémique a été établie à 9,3 mg/kg p.c./j (Monsanto 1983b, étude citée dans EA 2009c).
On ne disposait d’aucune étude de toxicité par voie cutanée pour le PMNDPh. La DSENO de 300 mg/kg p.c./j, basée sur une diminution du poids corporel liée à la dose d’après une étude de toxicité pour le développement par voie orale, a été utilisée pour caractériser les risques pour la santé humaine dus à une exposition cutanée à court terme au PMNDPh lors de l’utilisation d’une peinture marine.
Le tableau 2‑27 présente les valeurs pertinentes (estimations de l’exposition et points de départ des dangers) ainsi que les ME résultantes pour la caractérisation des risques dus à l’exposition au PMNDPh.
| Scénario d’exposition | Exposition systémique | Niveau d’effet critique | Critère d’effets critiques sur la santé | ME |
|---|---|---|---|---|
| Milieux environnementaux | 3,84 × 10-5 à 3,26 × 10-4 mg/kg p.c./j | DMENO = 9,3 mg/kg p.c./j | Changements histologiques du foie, diminution du poids corporel et de la consommation alimentaire, changements hématologiques | 28 528 à 242 188 |
| Peinture marine (cutanée)a | 2,2 mg/kg p.c./j | DSENO = 300 mg/kg p.c./j | Diminution du poids corporel liée à la dose | 136 |
Abréviations — DMENO : dose minimale entraînant un effet nocif observé; DSENO : dose sans effet nocif observé.
a On présume que l’absorption cutanée est équivalente à l’absorption par voie orale.
Sur la base des approches prudentes utilisées pour estimer l’exposition au PMNDPh par les milieux environnementaux et les produits de consommation, la ME calculée est jugée adéquate pour lever toute incertitude dans les bases de données sur l’exposition et les effets sur la santé.
2.7.4.4 PTPPh
Aucune étude de cancérogénicité n’a été trouvée pour le PTPPh. On ne s’attend pas à ce qu’il soit génotoxique (EA 2009b). Aucune DSENO n’a été trouvée dans les études disponibles. Dans une étude de toxicité par voie orale de 91 jours, on a observé des modifications histopathologiques indésirables sur les glandes surrénales à la plus faible dose d’essai (25 mg/kg p.c./j), et dans une étude de toxicité à court terme pour le développement et la reproduction, on a observé des effets sur les glandes surrénales et le foie chez les animaux parents (ECHA c2007-2018d). Des effets sur le développement ont également été relevés à des doses plus élevées, à partir de 100 mg/kg p.c./j. Les études disponibles sur la toxicité par voie cutanée présentaient des données limitées, et n’ont donc pas été utilisées pour caractériser les risques pour la santé humaine liés à l’exposition au PTPPh par les meubles contenant de la mousse. Une DMENO de 25 mg/kg p.c./j a donc été utilisée comme critère d’effet le plus pertinent pour caractériser les risques pour la santé humaine de toutes les formes d’exposition potentielle au PTPPh.
Le tableau 2‑28 présente les valeurs pertinentes (estimations de l’exposition et points de référence des dangers) ainsi que les ME résultantes pour la caractérisation des risques dus à l’exposition au PTPPh.
| Scénario d’exposition | Exposition systémique | Niveau d’effet critique b | ME |
|---|---|---|---|
| Milieux environnementaux et aliments | 1,4 × 10-4 à 5,79 × 10-3 mg/kg p.c./j | DMENO = 25 mg/kg p.c./j (DME) | 4 318 à 178 571 |
| Mise en bouche de la mousse dans les produits pour enfants (orale) | 1,08 × 10-5 à 2,47 × 10-5 mg/kg p.c./j (0 à 6 mois)a | DMENO = 25 mg/kg p.c./j (DME) | > 1 million |
| Mise en bouche de la mousse dans les produits pour enfants (orale) | 1,04 × 10-5 à 2,39 × 10-5 mg/kg p.c./j (0,5 à 4 ans)a | DMENO = 25 mg/kg p.c./j (DME) | > 1 million |
| Meubles ou matelas pour enfants contenant de la mousse (cutanée)c | 0,0052 à 0,040 mg/kg p.c./j (0 à 6 mois)a | DMENO = 25 mg/kg p.c./j (DME orale) | 625 à 4 808 |
| Meubles ou matelas pour enfants contenant de la mousse (cutanée)c | 0,0036 à 0,030 mg/kg p.c./j (0,5 à 4 ans)a | DMENO = 25 mg/kg p.c./j (DME orale) | 833 à 6 944 |
| Meubles ou matelas pour enfants contenant de la mousse (cutanée)c | 0,0024 à 0,021 mg/kg p.c./j (5 à 11 ans)a | DMENO = 25 mg/kg p.c./j (DME orale) | 1 190 à 10 417 |
| Meubles ou matelas contenant de la mousse (cutanée)c | 0,0020 à 0,019 mg/kg p.c./j (12 à 19 ans)a | DMENO = 25 mg/kg p.c./j (DME orale) | 1 316 à 12 500 |
| Meubles ou matelas contenant de la mousse (cutanée)c | 0,0014 à 0,014 mg/kg p.c./j (20 ans et plus)a | DMENO = 25 mg/kg p.c./j (DME) | 1 786 à 17 857 |
| Mousse dans les sièges pour nourrisson (cutanée)c | 5,1 × 10-4 à 1,2 × 10-3 mg/kg p.c./j (0 à 6 mois)a | DMENO = 25 mg/kg p.c./j (DME) | 20 833 à 49 020 |
| Mousse dans les sièges pour enfant (cutanée)c | 4,1 × 10-4 à 9,4 × 10-4 mg/kg p.c./j (0,5 à 4 ans)a | DMENO = 25 mg/kg p.c./j (DME) | 26 596 à 60 976 |
Abréviations — DMENO : dose minimale entraînant un effet nocif observé; DME : dose maximale d’essai.
a La plage des estimations de l’exposition représente l’exposition à l’isomère PT3PPH (exposition la plus faible) et au PTPh (exposition la plus élevée). Voir l’annexe G pour plus de détails.
b Des modifications histopathologiques nocives ont été observées dans les glandes surrénales à toutes les doses dans une étude de 91 jours, ainsi que des effets sur les glandes surrénales et le foie dans une étude de toxicité pour la reproduction et le développement.
c Un taux d’absorption cutanée ajusté de 30 % pour le PTDCP (EU RAR 2008b) a été utilisé pour représenter l’absorption cutanée du PTPPh.
Les ME pour l’exposition au PTPPh par les milieux environnementaux et les aliments, la mise en bouche des jouets ou produits en mousse, l’utilisation des sièges pour nourrisson ou enfant, et l’utilisation de matelas contenant de la mousse (par les enfants, les adolescents et les adultes) sont jugées adéquates pour lever toute incertitude dans les bases de données sur l’exposition et les effets sur la santé. Les ME calculées pour le contact cutané prolongé avec le PTPPh lors d’une longue utilisation des meubles ou des matelas contenant de la mousse pour nourrissons et enfants sont jugées potentiellement inadéquates pour compenser les incertitudes dans les bases de données.
2.7.5 Incertitudes dans l’évaluation des risques pour la santé humaine
Le tableau ci‑dessous résume les principales sources d’incertitude.
| Principale source d’incertitude | Impact |
|---|---|
| Le PTPPh est une substance UVCB avec des proportions variables d’isomères dans les différents mélanges, ce qui rend difficile la modélisation de l’exposition ou la recherche d’études ayant mesuré les concentrations de PTPPh ou de l’un de ses composants. | +/- |
| Peu de données limitées sur la mesure du PTPh dans les aliments vendus au Canada étaient disponibles. Nous avons utilisé des données provenant d’autres pays pour estimer l’exposition. | +/- |
| Nous avons supposé que les concentrations maximales rapportées dans un aliment donné étaient représentatives d’une catégorie plus large dans son ensemble. | + |
| Les estimations prudentes de l’exposition alimentaire au PTPh ont été appliquées au PTPPh. | + |
| Données limitées sur les concentrations de PTPh, de PBPhDPh et de PTPPh dans les matelas ou les meubles contenant de la mousse vendus au Canada. Des données provenant d’autres pays ont été utilisées pour faciliter l’estimation de l’exposition. | +/- |
| Données limitées sur les utilisations déclarées du PMNDPh au Canada, compte tenu de la fréquence de détection élevée dans les maisons. | +/- |
| Absence de données sur la migration du PTPh, du PBPhDPh et du PTPPh à l’extérieur des matériaux en mousse. | +/- |
| Les données sur l’absorption cutanée du PTPh, du PBPhDPh et du PTPPh étaient limitées et, par conséquent, une approche de lecture croisée d’analogues a été utilisée. Sinon, nous avons posé l’hypothèse d’une absorption cutanée de 100 %. | +/- |
| Il n’existe pas d’étude de toxicité chronique pour le PTPh, le PBPhDPh, le PTPPh ou le PMNDPh, et la base de données globales sur le PBPhDPh et le PTPPh est limitée. | +/- |
| Aucune donnée n’était disponible sur la toxicité par voie cutanée (PBPhDPh, PTPPh, PMNDPh) ou sur la toxicité par inhalation (PTPh). | +/- |
| Utilisation d’un mélange commercial contenant diverses quantités de la substance chimique évaluée et de pureté inconnue dans les études toxicologiques (PBPhDPh et PTPPh) | +/- |
+ : incertitude pouvant entraîner une surestimation de l’exposition ou du risque; – : incertitude pouvant entraîner une sous-estimation de l’exposition ou du risque; +/- = : potentiel inconnu de surestimation ou de sous-estimation.
3. Évaluation du sous-groupe des organophosphates alkyliques (PTE, PTBOE, PTEHx, PBEHx)
3.1 Identité des substances
Les quatre substances du sous-groupe des organophosphates (OP) alkyliques visées par la présente évaluation préalable sont des substances ignifuges organophosphorées dont la formule générale est représentée à la figure 3-1.
Nous donnons dans le tableau 3-1 le no CAS, le nom sur la LIS, le nom commun ou l’acronyme des substances individuelles de ce sous-groupe. Une liste d’autres noms chimiques (p. ex., noms commerciaux) est disponible dans le National Chemical Inventories (NCI 2015).
|
No CAS (abréviation) |
Nom sur la LIS (nom commun) |
Structure chimique représentative et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
|
78-40-0 (PTE) |
Phosphate de triéthyle (phosphate de triéthyle) |
 C6H15O4P C6H15O4P
|
182,15 |
|
78-51-3 (PTBOE) |
Phosphate de tris(2-butoxyéthyle) (phosphate de tris(2-butoxéthyle)) |
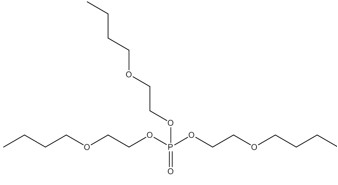 C18H39O7P C18H39O7P
|
398,47 |
|
78-42-2 (PTEHx) |
Phosphate de tris(2-éthylhexyle) (phosphate de tris(2-éthylhexyle)) |
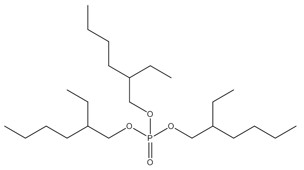 C24H51O4P C24H51O4P
|
434,64 |
|
298-07-7 (PBEHx) |
Hydrogénophosphate de bis(2-éthylhexyle) (phosphate de bis(2-éthylhexyle)) |
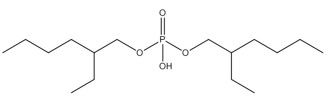 C16H35O4P C16H35O4P
|
322,42 |
Abréviations — CAS : Chemical Abstracts Service; LIS : Liste intérieure des substances
3.1.1 Choix d’analogues et utilisation de modèles QSAR
Pour évaluer les risques pour la santé humaine, nous avons fait une lecture croisée à partir d’un analogue pour évaluer l’exposition au PTBOE. Nous avons retenu le phosphate de tris(1-chloropropan-2-yle), appelé ci-après PTCP, comme analogue pour l’absorption cutanée en raison de similitudes de structure et de fonction et de la disponibilité de données, les données sur l’absorption cutanée du PTBOE étant limitées. Le PTCP est, comme le PTBOE, un organophosphate comportant trois groupes alkyles. Le PTCP est toutefois un organophosphate halogéné, chaque groupe alkyle comportant un atome de chlore. Le PTCP est couramment utilisé comme additif ignifuge et plastifiant. Plus de détails sur l’approche de lecture croisée sont donnés à la section 3.7.1.2. Des renseignements sur l’identité et la structure chimiques du PTCP sont donnés dans le tableau 3-2.
|
No CAS (abréviation) |
Nom sur la LIS | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
|
13674-84-5 (PTCP) |
Phosphate de tris(2-chloro-1-méthyléthyle) | 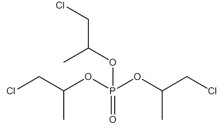 C9H18Cl3O4P C9H18Cl3O4P
|
327,57 |
3.2 Propriétés physiques et chimiques
Nous résumons au tableau 3‑3 les propriétés physiques et chimiques des substances du sous-groupe des organophosphates alkyliques. Si les données expérimentales pour une propriété étaient limitées ou non disponibles, nous avons utilisé les données des modèles de relation quantitative structure-activité (QSAR) pour générer des prévisions pour les valeurs de la substance. Les données physiques et chimiques propres aux différentes substances sont présentées dans ECCC (2020e).
| Propriété | PTE | PTBOE | PTEHx | PBEHx |
|---|---|---|---|---|
| Point de fusion (°C) | -56,4 c (valeur expérimentale) | -70 l (valeur expérimentale) | -74 g (valeur expérimentale) | -50 k (valeur non indiquée) |
| Pression de vapeur (Pa) | 5,2 × 101 à 25 °C a (valeur calculée) | 6,14 × 10-6 b,l (valeur calculée) | 1,1 × 10-5 à 25 °C h (valeur expérimentale) | 4,65 × 10-8 à 25 °C a (valeur calculée) |
| Constante de la loi d’Henry (Pa·m3/mol) | 3,60 × 10-8 à 20 °C d (valeur expérimentale) | 3,09 × 10-6 b (valeur calculée) | 7,96 × 10-3 à 25 °C i (valeur non indiquée) | 4,15 × 10-3 à 25 °C d (valeur calculée) |
| Solubilité dans l’eau (mg/L) | 5,00 × 105 à 25 °C d (valeur expérimentale) | 793 b,m (valeur calculée) | 0,6 à 24 °C d (valeur expérimentale) | 182 à 25 °C d (valeur expérimentale) |
| Log Koe (sans dimension) | 0,8 d (valeur expérimentale) | 3,87 b,l (valeur calculée) | 9,49 a (valeur estimée) | 6,07 a (valeur calculée) |
| Log Kco (sans dimension) | 1,81 f (valeur non indiquée) | 2,90 a (valeur calculée) | 6,87 e (valeur non indiquée) | 4,23 f (valeur non indiquée) |
| Log Koa (sans dimension) | 2,4 à 25 °C j (valeur calculée) | 12,77 b,a (valeur calculée) | 8,5 à 25 °C j (valeur calculée) | 11,18 a (valeur calculée) |
a EPI Suite (c2000-2012).
b Valeur ajustée selon les moindres carrés, d’après Schenker et coll. (2005).
c Lide (2005).
d TOXNET (2015).
e Dandan et coll. (2017).
f PubChem (2018).
g Lewis (2012).
h Hinckley et coll. (1990).
I J-CHECK (2014).
j Kanazawa et coll. (2010).
k Verschueren (2001).
l OMS (2000).
m MITI (1992).
3.3 Sources et utilisations
Les substances du groupe des organophosphates alkyliques sont commercialement produites et ne sont pas naturellement présentes dans l’environnement. Toutes les substances du sous-groupe des organophosphates alkyliques ont été incluses dans une enquête récente menée en vertu de l’article 71 de la LCPE (Canada 2012). Le tableau 3‑4 présente un résumé des données déclarées concernant les quantités totales fabriquées et importées pour l’année de déclaration 2011 pour le sous-groupe des organophosphates alkyliques.
| Nom commun | Quantité totale fabriquée a (kg) | Quantité totale importée a (kg) |
|---|---|---|
| PTE | 0 | 100000 à 1000000 |
| PTBOE | 1000 à 10000 | 10000 à 100000 |
| PTEHx | 0 | 10000 à 100000 |
| PBEHx | 1000 à 10000 | 10000 à 100000 |
a Les valeurs sont indicatives des quantités déclarées en 2011 en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Canada 2012). Veuillez consulter l’enquête pour connaître les inclusions et exclusions particulières (annexes 2 et 3).
Le tableau 3‑5 présente un résumé des principales utilisations du sous-groupe des organophosphates alkyliques selon les données déclarées en réponse à l’enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Le tableau 3‑6 présente les utilisations supplémentaires relevées au Canada.
| Principales utilisations a | PTE | PTBOE | PTEHx | PBEHx |
|---|---|---|---|---|
| Adhésifs et produits d’étanchéité | O | N | N | N |
| Peintures et revêtements | O | O | O | N |
| Matériaux de construction | O | N | N | N |
| Lubrifiants et graisses | N | N | O | O |
| Revêtements de sol | N | O | O | N |
| Usages industriels | N | N | N | O |
Abréviations — O : oui, cette utilisation a été déclarée pour cette substance; N : non, cette utilisation n’a pas été déclarée pour cette substance.
a Utilisations non confidentielles divulguées en réponse à l’enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Veuillez consulter l’enquête pour connaître les inclusions et exclusions particulières (annexes 2 et 3).
| Utilisation | PTE | PTBOE | PTEHx | PBEHx |
|---|---|---|---|---|
| Matériaux d’emballage alimentaire a | O | O | O | N |
| Formulant dans les produits antiparasitaires homologués au Canada b | N | N | O | N |
Abréviations — O : oui, cette utilisation a été déclarée pour cette substance; N : non, cette utilisation n’a pas été déclarée pour cette substance.
a Communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 11 janvier 2017; non référencé).
b Communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 8 février 2018; non référencé).
En règle générale, le PTE, le PTBOE et le PTEHx sont plus particulièrement utilisés comme substances ignifuges et plastifiantes, tandis que le PBEHx est utilisé comme lubrifiant et additif pour les pressions extrêmes dans les fluides de travail des métaux, entre autres applications (Ash et Ash 2009). À l’échelle mondiale, le PTBOE est aussi couramment utilisé dans les cires pour le sol et comme plastifiant dans les caoutchoucs et les plastiques (OMS 2000). Les produits de phosphate diphényle alkylique ont été créés à l’origine pour améliorer la souplesse à basse température du PVC, par rapport aux phosphates triaryliques (EA 2009a; Weil 1993).
Au Canada, le PTE peut être utilisé comme composant dans la fabrication d’un nombre limité de pellicules stratifiée pour les matériaux d’emballage alimentaire, le PTBOE peut être employé comme composant dans la fabrication d’un nombre limité d’adhésifs utilisés dans les couches intermédiaires des matériaux d’emballage alimentaire, et le PTEHx peut être utilisé comme composant dans la fabrication d’encres d’impression (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 11 janvier 2017; non référencé). Aux États‑Unis, l’utilisation du PTE, du PTBOE et du PTEHx est autorisée comme composants des adhésifs destinés à être employés dans des matériaux d’emballage alimentaire, l’utilisation du PTBOE et du PTEHx est autorisée comme composants d’agents démoussants dans la fabrication de papier et de carton, et enfin l’utilisation du PTEHx est également autorisée comme composant du papier et du carton qui entrent en contact avec les aliments secs (US CFR 2017a,b).
Au Canada, le PTEHx, le PTE et le PTBOE peuvent être utilisés comme formulants dans les produits antiparasitaires et ils sont actuellement homologués dans quelques produits destinés à l’usage domestique ou commercial (communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 8 février 2018; non référencé).
3.4 Rejets dans l’environnement
Les rejets de PTBOE dans l’environnement peuvent se produire sous forme de pertes au cours des processus de fabrication, de ses utilisations industrielles, de ses utilisations par les consommateurs ou les entreprises, pendant la durée de vie des produits dont il est un composant et lors de l’élimination d’une substance. L’utilisation du PTBOE par les installations industrielles au Canada est susceptible d’entraîner des rejets ponctuels dans l’environnement. Les rejets de PTBOE dans l’environnement canadien, en raison de son utilisation par les consommateurs dans une variété de produits, devraient être diffus. Des rejets par dispersion sont possibles en raison de l’utilisation de produits commerciaux et de produits de consommation dans les environnements intérieurs et extérieurs. Bien que l’on ait déjà signalé que le PTBOE avait été fabriqué au Canada, les données actuellement disponibles indiquent que cette substance n’est pas couramment fabriquée au Canada (Environnement Canada 2013).
Les rejets dans l’environnement se produisent principalement dans l’eau, par l’intermédiaire des eaux usées. Les rejets dans le sol se produisent en raison de l’épandage de biosolides contenant du PTBOE sur les terres agricoles et les pâturages (Yager et coll. 2013, 2014).
3.5 Devenir et comportement dans l’environnement
3.5.1 Répartition dans l’environnement
Le tableau 3‑7 présente la plage des résultats de la fugacité de niveau III du PTBOE obtenus par modélisation. Selon les résultats de la modélisation, en cas de rejet dans l’air, le PTBOE se répartira en grande partie dans le sol, avec un pourcentage mineur (moins de 1 %) dans les sédiments et moins de 3 % dans l’eau. Lorsqu’il est rejeté dans l’eau, le PTBOE se répartit dans l’eau (84 %), 16 % se retrouvent dans les sédiments, et moins de 1 % dans le sol ou l’air. Lorsqu’il est rejeté dans le sol, le PTBOE y demeure presque entièrement (99,7 %).
| Milieu environnemental | Air (%) | Eau (%) | Sol (%) | Sédiments (%) |
|---|---|---|---|---|
| Air (100 %) | < 1 | 2,8 | 96,7 | < 1 |
| Eau (100 %) | < 1 | 84,4 | < 1 | 15,6 |
| Sol (100 %) | < 1 | < 1 | 99,7 | < 1 |
a Les propriétés physiques et chimiques et les demi-vies dans l’environnement (t1/2) du PTBOE dans les milieux environnementaux sont requises pour la modélisation et sont énumérées dans le document ECCC 2020e.
3.5.2 Persistance
3.5.2.1 Dégradation abiotique et biotique
Sur la base des rejets probables et des caractéristiques de répartition du PTBOE, sa persistance dans l’environnement est plus pertinente pour les compartiments eau, sédiments et sol. Les données empiriques et modélisées ont été prises en compte dans le poids de la preuve concernant la persistance de cette substance (tableau 3‑8).
Les prévisions modélisées pour le PTBOE dans l’air semblent indiquer une demi-vie inférieure à 1 jour (phase gazeuse) et une persistance globale (PGl) de 137 jours (Outil de dépistage de l’OCDE [OCDE 2009a]). Cependant, on a signalé que le PTBOE était souvent détecté dans les particules en suspension dans l’air ambiant, y compris dans l’atmosphère au-dessus des Grands Lacs (51 à 262 pg/m3) [Salamova et coll. 2014].
Les résultats du modèle HYDROWIN (2010) semblent indiquer que le taux d’hydrolyse du PTBOE est relativement stable aux pH de 5 (95,46 jours) à 9 (92,87 jours). Cependant, il augmente au pH de 10 (74,67 jours). La demi-vie de 95,2 jours au pH de 8 (pH 8,2 dans l’eau naturelle du lac Ontario), plus pertinent sur le plan environnemental (Howard et Deo 1979), a été utilisée dans la présente évaluation pour prévoir le devenir du PTBOE dans l’eau. Andresen et coll. (2007) ont estimé les demi‑vies in situ du PTBOE en se basant sur les concentrations corrigées par dilution, rapportées pour les eaux de surface dans la baie de Heligoland (mer du Nord). Les auteurs ont rapporté des demi-vies pour le PTBOE inférieures à 14 jours (fourchette de 8 à 30 jours compte tenu de l’incertitude des flux et de la détermination des concentrations).
Cao et coll. (2017) ont présenté des données provenant de carottes de sédiments du lac Michigan, avec des concentrations mesurées de PTBOE à des profondeurs de 0,5 cm à 29,5 cm. L’analyse a indiqué des apports en PTBOE datant d’aussi loin que 1860. La profondeur des carottes associée à des dépôts plus récents a montré que les concentrations de PTBOE sont restées relativement constantes, les concentrations maximales de 19,34 et 14,98 ng/g p.s. ayant été observées à des profondeurs de 8,5 et 0,5 cm dans les carottes, respectivement. La première correspond à un dépôt de PTBOE en 1968, et la deuxième à un dépôt de PTBOE en 2009. La mesure du PTBOE en profondeur indique que cette substance peut persister dans les sédiments, potentiellement dans des conditions anaérobies.
Quintana et coll. (2006) ont réalisé un test de dégradation aérobie en laboratoire avec des boues activées comme inoculum et du lait en poudre comme source de carbone supplémentaire, et ils ont constaté qu’il fallait 16 jours pour éliminer complètement le PTBOE avec une demi-vie d’environ 5 jours. Les chercheurs ont conclu que la dégradation microbienne des phosphates trialkyliques commence par l’hydrolyse microbienne de l’une des liaisons ester pour former des phosphates dialkyliques, qui sont ensuite dégradés davantage selon des mécanismes encore inconnus.
Le modèle CATALOGIC (2014) prévoit que 7 % du PTBOE se biodégrade dans des conditions aérobies en 28 jours et on estime que la demi-vie primaire est de 70 jours. La biodégradation a aussi été prévue à l’aide des modèles BIOWIN 3 et BIOWIN 4, qui semblent indiquer également que le PTBOE n’est pas persistant dans l’eau. Bien que cela ne corresponde pas aux prévisions de BIOWIN 5 ou BIOWIN 6 (ces sous-modèles ne prévoient pas de dégradation rapide du PTBOE), les résultats globaux soutiennent généralement un mécanisme de dégradation primaire initial et rapide, mais une biodégradation finale plus lente.
Les résultats de la classification des risques écologiques (CRE) [ECCC 2016 b] indiquent que les trois autres substances du sous-groupe des organophosphates alkyliques (PTE, PTEHx et PBEHx) ne sont pas jugées persistantes.
Bien qu’il y ait une certaine variabilité entre les résultats en ce qui concerne la modélisation de la biodégradation, on constate dans l’ensemble un poids suffisant de la preuve indiquant que le PTBOE est fortement dégradé en 182 jours et qu’il n’est donc pas jugé persistant dans l’eau. L’application d’une procédure d’extrapolation de la demi-vie basée sur Boethling et coll. (1995) utilisant un rapport de 1:1:4 pour le système eau:sol:sédiments semble indiquer que le PTBOE se décomposera dans le sol et les sédiments et ne produira pas d’exposition à long terme par ces milieux.
| Processus de devenir | Méthode d’essai ou base du modèle | Critère d’effet de dégradation ou prévision | Référence |
|---|---|---|---|
| Oxydation atmosphérique | Système expert | Demi-vie : 1,994a | AOPWIN 2010a,b |
| Réaction avec l’ozone | Système expert | S.O. | AOPWIN 2010b |
| Hydrolyse | Système expert |
Demi-vie : 95,46 jours (pH 6) 95,43 jours (pH 7) 95,2 jours (pH 8) |
HYDROWIN 2010b |
| Biodégradation primaire aérobie, eau | Sous-modèle 4 : système expert |
Valeur = 4,5162 « biodégradation rapide » (en heures et en jours) |
BIOWIN 2010b |
| Biodégradation ultime aérobie, eau | Sous-modèle 3 : système expert |
Valeur de 3,3413 « biodégradation rapide » (plusieurs jours à plusieurs semaines) |
BIOWIN 2010b |
| Biodégradation aérobie, eau | Sous-modèle 5 : probabilité linéaire MITI | Valeur de 0,4283 « biodégradation lente » | BIOWIN 2010b |
| Biodégradation aérobie, eau | Sous-modèle 6 : probabilité non linéaire MITI |
Valeur probable de 0,1587 « biodégradation lente » |
BIOWIN 2010b |
| Demande biochimique en oxygène | % DBO |
7 ± 6 Demi-vie primaire : 2 mois et 10 jours Demi-vie ultime : 8 mois et 24 jours |
CATALOGIC 2014 |
Abréviations — S.O. : non applicable; DBO : demande biologique en oxygène; MITI : Ministry of International Trade and Industry (Japon).
a Valeur basée sur une durée de la journée de 12 heures, une concentration de radicaux hydroxyles de 1,5 × 106 molécules/cm3 (moyenne annuelle sur 12 heures) et une température du système de 25 °C.
b EPI Suite c2000-2012.
3.5.2.2 Transport à grande distance
Nous avons modélisé le potentiel de transport atmosphérique à grande distance du PTBOE. Le modèle d’évaluation préliminaire des POP de l’OCDE (QSAR Toolbox; OCDE 2016; Scheringer et coll. 2009) estime une distance parcourue caractéristique (DPC) de 47 km dans l’air. Cette distance, associée à une faible pression de vapeur (9,47 × 10-6 Pa), indique que le PTBOE devrait avoir un faible potentiel de transport dans l’air. Cependant, il existe peu de modèles pour prévoir le potentiel de transport à grande distance (p. ex., l’outil de dépistage Pov et LRTP; OCDE 2009a), et comme ils ne tiennent pas compte des substances associées à la phase particulaire, on estime que ces modèles sous-estimeraient le potentiel de transport global vers les régions éloignées.
Bien que la modélisation du PTBOE semble indiquer un potentiel de transport à grande distance limité pour cette substance, les concentrations mesurées dans les endroits éloignés indiquent que le PTBOE peut se déplacer sur de grandes distances. Par exemple, Möller et coll. (2012) ont signalé la persistance du PTBOE dans les particules en suspension dans l’air au cours de deux expéditions polaires en 2010 et 2011 — dans un cas, de l’est de l’Asie vers le Haut-Arctique, et dans l’autre cas de l’est de l’Asie vers l’océan Indien puis vers l’Antarctique — fournissant ainsi des preuves du potentiel de transport à grande distance du PTBOE vers l’Arctique et l’Antarctique. Le PTBOE a été détecté dans 45 % et 40 % des échantillons, respectivement, avec des concentrations allant des valeurs non détectées à 81 pg/m3 et des valeurs non détectées à 77 pg/m3, respectivement.
De Silva et coll. (2016a) ont évalué le potentiel de transport à grande distance de divers organophosphates, y compris le PTBOE, en examinant leur profil dans la neige et la glace du Haut-Arctique. Une calotte glaciaire a été sélectionnée dans l’archipel arctique canadien, à 75° de latitude nord, et au sommet de la calotte glaciaire à une altitude de 2200 m. Afin d’obtenir une série temporelle robuste et continue, ils ont opté pour une carotte de glace plus longue avec une profondeur de fond datant de 1979. Les organophosphates, y compris le PTBOE, ont été détectés dans chaque couche annuelle de glace de 2014 à 1979. En 2015, le PTBOE était l’un des six analytes trouvés et représentait 7,3 % de la concentration totale d’organophosphates dans la carotte de glace.
De Silva et coll. (2016 b) ont étudié plus à fond la déposition et le transport du PTBOE dans l’Arctique. La présence d’organophosphates, y compris le PTBOE, a été rapportée dans des eaux de surface prélevées dans le bassin versant alimenté par le glacier du lac Hazen (82° N) dans le parc national Quttinirpaaq au nord de l’île d’Ellesmere, au Canada. Un échantillon prélevé à une profondeur de 260 m dans la colonne d’eau du lac Hazen était dominé par le PTBOE (0,89 à 8,4 ng/L). De tous les organophosphates analysés, les concentrations de PTBOE étaient les plus élevées et les plus fréquemment détectées non seulement dans les échantillons d’eau prélevés dans le lac Hazen, mais aussi dans les cours d’eau de décharge prélevés dans les rivières Ruggles et Turnabout.
3.5.3 Potentiel de bioaccumulation
Dans cette section traitant du potentiel de bioaccumulation du PTBOE, nous examinons plusieurs paramètres, y compris les propriétés physiques et chimiques de la substance (c.‑à‑d. les valeurs log Koe, log Koa, la taille moléculaire et le diamètre transversal de la molécule), le facteur de bioconcentration (FBC), le facteur de bioamplification (FBM), le facteur d’amplification trophique (FAT) et le facteur de bioaccumulation (FBA). Nous examinons également le calcul du potentiel de bioaccumulation et le rôle des constantes de vitesse de biotransformation métabolique pour déterminer le potentiel de bioaccumulation.
La valeur log Koe de 3,87 du PTBOE indique un faible potentiel de bioaccumulation ou de bioamplification dans le biote.
Dans une étude évaluant le devenir des contaminants organiques émergents dans un bassin versant d’eau douce touché par des grandes et des petites stations d’épuration en Suède, le PTBOE a été détecté dans des eaux de surface, des effluents d’eaux usées et des perches (Perca fluviatilis) entre septembre 2014 et décembre 2015 (Blum et coll. 2018). Une valeur de log(FBA) de 3,5 en poids de lipides et une valeur de log(FBA) de 1,2 en poids humide (p.h.) ont été estimées sur la base de concentrations de PTBOE dans les poissons de 230 ng/g de lipides et de 1,1 ng/g p.h. respectivement.
Nous avons repéré une étude empirique sur la bioconcentration du PTBOE. Elle indiquait que le PTBOE présente un faible potentiel d’accumulation dans les poissons. La bioconcentration de PTBOE chez la carpe commune d’eau douce (Cyprinus carpio) a été étudiée à 25 °C dans des conditions d’écoulement continu à un pH de 6,0 à 8,5 pendant 42 jours en 1990 (J-CHECK c2010-). Des carpes mâles et femelles (moyenne de 3,80 % de lipides) ont été exposées à des concentrations de PTBOE de 0,2 mg/L et de 0,02 mg/L (concentrations inférieures à la valeur empirique de solubilité dans l’eau de 1670 mg/L). Des facteurs de bioconcentration (FBC) de 4,10 L/kg p.h. et de moins de 5,79 L/kg p.h., respectivement, ont été déterminés pour ces deux concentrations.
D’après l’analyse 3D de 30 conformères du PTBOE calculée à l’aide du modèle BCFmax avec des facteurs d’atténuation (Dimitrov et coll. 2005), le diamètre maximal du PTBOE se situe entre 10,18 nm et 18,39 nm et le diamètre effectif est de 12,16 nm. Le modèle a utilisé un sous-ensemble de produits chimiques, y compris les benzènes halogénés, les biphényles et les dioxines, et un diamètre transversal seuil de 0,95 nm (9,5 Å) a été proposé pour la perméation membranaire des molécules. Cela indique que le taux d’absorption du PTBOE pourrait être faible en raison des effets stériques à la surface des branchies des poissons, ce qui permettrait aux processus d’élimination d’atténuer l’accumulation.
Le PTBOE a été trouvé avec un facteur d’amplification trophique limité dans les réseaux trophiques des Grands Lacs (FAT de 0,59 à 1,6), bien que les résultats ne soient pas concluants, parce que les organismes benthiques n’ont pas été échantillonnés ou n’étaient pas représentés dans les calculs du FAT (Greaves et coll. 2016 b).
Le FBC et le FBA du PTBOE ont également été estimés à l’aide de modèles basés sur la structure, de modèles QSAR et d’un modèle cinétique d’équilibre des masses à trois niveaux trophiques (Arnot et Gobas 2003a). Toutes les estimations du FBC et du FBA, sauf celles obtenues à l’aide du sous-modèle 1 du modèle BCFBAF dans EPIWIN v4,0, ont été corrigées pour tenir compte du métabolisme, car il s’agit d’une voie d’élimination fondamentale pour de nombreuses substances chimiques, y compris le PTBOE. Les résultats de la modélisation du FBC et du FBA pour les poissons de niveau trophique moyen, pour le PTBOE, sont de 24,9 et 60,0 L/kg p.h., respectivement (ECCC 2020e).
En résumé, la valeur log Koe de 3,87 pour le PTBOE, combinée aux indications d’encombrement stérique, de transformation métabolique, de faibles FBC mesurés et de faibles FBC/FBA prévus, indique un faible potentiel de bioaccumulation ou de bioamplification dans le biote. Selon les résultats de la CRE (ECCC 2016 b), les trois autres substances du sous-groupe des OP aryliques (PTE, PTEHx et PBEHx) présentent également un faible potentiel de bioconcentration et ne devraient pas se bioaccumuler de manière importante dans les organismes.
3.6 Potentiel d’effets nocifs sur l’environnement
D’après les résultats de l’analyse CRE, on estime qu’il est peu probable que le PTE, le PTEHx et le PBEHx soient nocifs pour l’environnement (ECCC 2016a, 2016 b; annexe A). Par conséquent, aucune analyse écologique du PTE, du PTEHx ou du PBEHx n’est présentée dans le présent chapitre.
3.6.1 Évaluation des effets sur l’environnement
Des données empiriques d’écotoxicité ont été examinées pour évaluer les effets environnementaux du PTBOE. Le PTBOE devrait être principalement rejeté par des sources industrielles et des produits de consommation, par les eaux usées. Selon les résultats modélisés, on s’attend à une exposition des organismes aquatiques principalement parce qu'une fois le PTBOE libéré dans l’eau, une proportion élevée (96 %) devrait demeurer dans l’eau. Bien qu’une partie du PTBOE puisse se répartir dans les sédiments (~ 4 %), et par analogie avec les biosolides, la phase aqueuse est considérée comme étant le principal milieu dont il faut tenir compte pour la présente évaluation. Il existe également des données limitées sur la toxicité dans les sols et les sédiments. Compte tenu du potentiel d’accumulation limité du PTBOE dans les organismes et de l’analyse de l’exposition de la chaîne alimentaire en milieu aquatique/sol, l’analyse du milieu aquatique/sol et de la faune n’est pas justifiée.
3.6.1.1 Mode ou mécanisme d’action
Le PTBOE est considéré comme une substance ayant un mode d’action (MdA) réactif et à action spécifique. Les alertes fournies par le modèle QSAR Toolbox de l’OCDE (2016) trouvées pour cette substance comprennent la liaison à l’ADN et aux protéines, la mutagénicité in vivo et l’hépatotoxicité. En outre, ASTER (1999) a établi un MdA pour l’inhibition de l’AChE médiée par les organophosphates pour cette substance. D’après les résultats du modèle QSAR Toolbox de l’OCDE (2016), le PTBOE ne présente pas non plus d’activités de liaison aux œstrogènes et aux androgènes.
3.6.1.2 Effets sur les organismes aquatiques
La toxicité aquatique du PTBOE, déterminée à partir d’études empiriques, est résumée dans le tableau 3‑9. Les résultats de la modélisation sont résumés dans Environnement et Changement climatique Canada (2020e).
La toxicité aquatique du PTBOE a été associée à des effets sur la survie, la croissance, la reproduction, l’activité endocrinienne et le métabolisme. Le PTBOE présente également une génotoxicité, une neurotoxicité et une cardiotoxicité chez les organismes aquatiques.
Une étude de 21 jours sur la toxicité chronique a montré que l’exposition à une plage de concentrations sublétales nominales de PTBOE (0,0147 à 1,47 mg/L) n’a pas eu d’impact sur la croissance, la survie ou la reproduction de Daphnia magna, bien que l’on ait constaté une tendance à la baisse en termes de reproduction entre la dose la plus faible et la dose maximale (Giraudo et coll. 2015). Le profilage de la transcription génique dans cette étude a révélé la transcription différentielle de 101 gènes en réaction au PTBOE. La plupart des gènes répondants participaient au métabolisme des protéines, à la biosynthèse et au métabolisme énergétique, ce qui indique que le PTBOE pourrait avoir des effets chroniques en perturbant ces voies. Les auteurs ont également rapporté une CL50 aiguë sur 48 h de 147 mg/L pour Daphnia magna dans la même étude.
Dans un article de suivi, Giraudo et coll. (2017) ont exposé des Daphnia magna à une concentration de PTBOE pertinente pour l’environnement (0,01 mg/L) sur trois générations de 21 j et ont évalué les effets sur le profilage de la transcription génique, le métabolisme des protéines et le cycle de vie (survie, reproduction, croissance). L’exposition chronique au PTBOE n’a pas eu d’impact sur la survie ou la reproduction de Daphnia magna, mais a eu un effet sur la croissance, sous la forme d’une réduction de la mue, ce qui pourrait mener à une diminution de la taille des daphnies sur plusieurs générations. Les effets observés indiquent le potentiel de perturbation endocrinienne par le PTBOE chez Daphnia magna.
Une série d’essais a été réalisée sur divers organismes pour déterminer la concentration d’inhibition (CI), la concentration létale (CL) et la concentration efficace (CE) du PTBOE (Douville et coll. 2016). Les valeurs CI25 et CI50 sur 72 h pour l’inhibition de la croissance chez l’algue verte Pseudokirshneriella subcapitata étaient de 6,02 mg/L et 30 mg/L, respectivement. En outre, les valeurs CL50 et CE50 (effets morphologiques) sur 96 h du PTBOE chez l’invertébré Hydra attenuata ont été établies à 44,2 mg/L et 17,5 mg/L, respectivement. Lors d’une exposition au PTBOE, la CL50 sur 24 h pour le crustacé Thamnocephalus platyurus a été établie à 55,8 mg/L. La CL50 sur 48 h pour le PTBOE chez Daphnia magna était de 147 mg/L.
Du et coll. (2015) ont étudié la toxicité du PTBOE pour l’éclosion des embryons de poisson-zèbre (0 à 96 h après la fertilisation). Ils ont rapporté une CE50 sur 96 h de 4,1 mg/L pour l’altération de la fonction cardiaque (œdème du péricarde) et une CL50 sur 96 h de 3,34 mg/L.
Une étude sur des larves de poisson-zèbre (Liu et coll. 2017) a rapporté une CL50 sur 96 h de 3,49 mg/L. Le PTBOE n’a pas affecté de manière significative les taux d’éclosion ou de survie. Cependant, les auteurs ont signalé des effets sur le développement, à savoir des malformations, un retard de la croissance et une diminution de la fréquence cardiaque, chez le poisson-zèbre, causés par le PTBOE à des concentrations de 1, 1 et 0,2 mg/L, respectivement, à partir de 2 h après la fertilisation. L’exposition au PTBOE a également eu un impact important (c.‑à‑d. plage de CMEO de 0,02 à 2 mg/L) sur l’abondance de l’ARNm des gènes impliqués dans l’axe hormone de croissance-acteur de croissance analogue à l’insuline (GH/IGF), 144 h après la fertilisation. Des études approfondies sur le système de l’axe GH/IGF indiquent que ces voies de signalisation constituent un régulateur neuroendocrinien clé de la croissance chez les poissons (Wood et coll. 2005).
Dans une étude des effets sur la reproduction et la fonction endocrinienne, Xu et coll. (2017) ont exposé des paires de poissons-zèbres adultes à du PTBOE à des concentrations de 0, 5, 50 et 500 µg/L pendant 21 jours. Des effets sur la reproduction ont été observés à 50, 5, 500 et 500 µg/L, à savoir une diminution de la production totale d’œufs, du diamètre des œufs, du taux de survie de la génération F1 et du taux d’éclosion de la génération F1, respectivement. Les auteurs indiquent que le PTBOE pourrait perturber l’équilibre des hormones sexuelles en altérant les circuits de régulation de l’axe hypothalamo-hypophyso-gonadique, affecter le développement gonadique et éventuellement mener à une perturbation de la performance de la reproduction.
La CMEO dénotant la plus grande sensibilité, soit 0,01 mg/L (réduction de la mue), déterminée pour Daphnia magna exposée au PTBOE sur trois générations de 21 j (Giraudo et coll. 2017), a été choisie comme valeur critique de toxicité (VCT). Une CMEO inférieure de 0,005 mg/L a été rapportée dans les publications scientifiques, mais les effets à 0,005 mg/L n’ont pas été considérés comme pouvant être facilement traduits au niveau de l’organisme ou de la population. D’autres facteurs d’évaluation ont alors été pris en compte pour lever les incertitudes potentielles associées à l’extrapolation de la VCT à une concentration environnementale qui assurerait la protection de la plupart des espèces dans l’eau. Avec une VCT sélectionnée selon un critère d’effet à long terme et sublétal, aucun facteur d’évaluation supplémentaire n’a été appliqué pour l’extrapolation des critères d’effet sublétaux de court terme à long terme et à la mortalité. En raison du grand nombre d’espèces d’essai (sept) et de leur diversité (trois catégories de groupes trophiques) dans l’ensemble de données, aucun facteur d’évaluation supplémentaire n’a été appliqué pour l’extrapolation de la variation interspécifique. Cependant, étant donné que le PTBOE est considéré comme ayant un MdA réactif et spécifique, un facteur d’évaluation supplémentaire de 2 a été appliqué pour tenir compte des différences potentielles de sensibilité entre les espèces. Collectivement, cela donne un facteur d’évaluation de 2 (basé sur la multiplication des facteurs d’application : 1 × 1 × 2), et la CESE résultante est de 0,005 mg/L.
| Organisme d’essai | Critère d’effet | Valeur (mg/L) | Référence |
|---|---|---|---|
| Larves du poisson-zèbre (Danio rerio) | CL50 96 h | 0,29 | Ma et coll. 2016 |
| Larves du poisson-zèbre (Danio rerio) | CL50 96 h | 3,49 | Liu et coll. 2017 |
| Larves du poisson-zèbre (Danio rerio) | CL50 96 h | 3,34 | Du et coll. 2015 |
| Larves du poisson-zèbre (Danio rerio) | CE50 96 h | 4,1 | Du et coll. 2015 |
| Larves du poisson-zèbre (Danio rerio) | CSEO 96 h (baisse du rythme cardiaque) | 0,02 | Liu et coll. 2017 |
| Larves du poisson-zèbre (Danio rerio) | CMEO 96 h (baisse du rythme cardiaque) | 0,2 | Liu et coll. 2017 |
| Larves du poisson-zèbre (Danio rerio) | CSEO 120 h (anomalies du développement) | 2,55 | Noyes et coll. 2015 |
| Poisson zèbre (Danio rerio) | CSEO 21 j (production moindre d’œufs) | 0,005 | Xu et coll. 2017 |
| Poisson zèbre (Danio rerio) | CMEO 21 j (production moindre d’œufs) | 0,05 | Xu et coll. 2017 |
| Poisson zèbre (Danio rerio) | CMEO 21 j (réduction du diamètre des œufs) | 0,005 | Xu et coll. 2017 |
| Poisson zèbre (Danio rerio) | CSEO 21 j (diminution de la survie de la génération F1) | 0,05 | Xu et coll. 2017 |
| Poisson zèbre (Danio rerio) | CMEO 21 j (diminution de la survie de la génération F1) | 0,5 | Xu et coll. 2017 |
| Poisson zèbre (Danio rerio) | CSEO 21 j (diminution de l’éclosion de la génération F1) | 0,05 | Xu et coll. 2017 |
| Poisson zèbre (Danio rerio) | CMEO 21 j (diminution de l’éclosion de la génération F1) | 0,5 | Xu et coll. 2017 |
| Médaka (Oryzias latipes) | CL50 48 h | 6,8 | Tsuji et coll. 1986 |
| Truite arc-en-ciel (Oncorhynchus mykiss) | CL50 96 h | 24 | ECHA c2007-2018f |
| Daphnies (Daphnia magna) | CE50 48 h (immobilité) | 53 | ECHA c2007-2018f |
| Daphnies (Daphnia magna) | CL50 48 h | 147 | Douville et coll. 2016 |
| Daphnies (Daphnia magna) | CL50 48 h | 147 | Giraudo et coll. 2015 |
| Daphnies (Daphnia magna) | CSEO 21 j (inhibition de la croissance, de la survie ou de la reproduction) | 1,47 | Giraudo et coll. 2015 |
| Daphnies (Daphnia magna) | CMEO 21 j (réduction de la mue) | 0,01 | Giraudo et coll. 2017 |
| Algue (Pseudokirshneriella subcapitata) | CI25 72 h (inhibition de la croissance) | 6,02 | Douville et coll. 2016 |
| Algue (Pseudokirshneriella subcapitata) | CI50 72 h (inhibition de la croissance) | 30 | Douville et coll. 2016 |
| Algue (Pseudokirshneriella subcapitata) | CE50 72 h (inhibition de la croissance) | 61 | ECHA c2007-2018f |
| Hydre (Hydra attenuata) | CE50 96 h (changements morphologiques) | 17,5 | Douville et coll. 2016 |
| Hydre (Hydra attenuata) | CL50 96 h | 44,2 | Douville et coll. 2016 |
| Crustacé Thamnocephalus platyurus | CL50 24 h | 55,8 | Douville et coll. 2016 |
Abréviations — CE50 : concentration d’une substance dont on estime qu’elle provoque un certain effet sur 50 % des organismes testés; CL50 : concentration d’une substance dont on estime qu’elle est létale pour 50 % des organismes testés; CI50 : concentration inhibitrice qui provoque une réduction de 50 % d’une mesure biologique quantitative telle que le taux de croissance; CI25 : concentration inhibitrice qui provoque une réduction de 25 % d’une mesure biologique quantitative telle que le taux de croissance; CMEO : concentration minimale entraînant un effet observé; CSEO : concentration sans effet observé; h : heure; j : jour.
a Effet sur trois générations consécutives de Daphnia magna.
3.6.1.3 Effets sur les sédiments et les organismes endogés
Il n’existe pas de données disponibles caractérisant la toxicité du PTBOE pour les organismes benthiques.
Nous avons trouvé deux études portant sur les effets du PTBOE sur les organismes terrestres. Des tests normalisés sur la toxicité aiguë du PTBOE ont été réalisés sur des lombrics (Eisenia fetida) et trois espèces végétales différentes, Lolium perenne, Lactuca sativa et Brassica rapa (ECHA c2007-2018f).
Les données disponibles ont été extraites d’une étude sur les lombrics dans la base de données européenne des substances homologuées (ECHA c2007-2018f). Dans un test de reproduction des lombrics réalisé conformément à la ligne directrice 207 de l’OCDE, des lombrics adultes (Eisenia fetida) ont été exposés au PTBOE à des concentrations nominales de 62,5, 125, 250, 500 et 1000 mg/kg de sol artificiel, pendant 14 jours. Une CL50 de 544 mg/kg de sol sec sur 14 jours, avec des limites de confiance à 95 % de 250 et 1000 mg/kg de sol sec a été déterminée.
Des essais sur la levée et la croissance des plantules (OCDE 2006) ont été réalisés pour évaluer les effets de l’exposition au PTBOE sur l’ivraie vivace (Lolium perenne), la laitue (Lactuca sativa) et la moutarde (Brassica rapa) [ECHA c2007-2018f]. La croissance (en poids sec) était le critère d’effet indiquant la plus grande sensibilité des trois espèces végétales à l’exposition au PTBOE. Parmi les trois espèces, Lactuca sativa était la plus sensible au PTBOE, avec une DE10 et une DE50 sur 21 j de 22,7 et 238,7 mg/kg, respectivement, après la normalisation du carbone organique pour refléter les conditions naturelles du sol (c.‑à‑d. 3,4 %). De même, des valeurs DE10 et DE50 de 70,5 et 165,8 mg/kg, respectivement, ont été déterminées pour Brassica rapa. Lolium perenne était l’espèce la moins sensible au PTBOE, avec des valeurs DE10 et DE50 de 109,8 et 572,3 mg/kg, respectivement.
Tout comme pour le processus de détermination de la CESE en milieu aquatique, le critère d’effet dénotant la plus grande sensibilité était la DE10 sur 21 j de 22,7 mg/kg (croissance – poids sec) pour Lactuca sativa exposé au PTBOE (ECHA c2007-2018f). Ce critère d’effet a été choisi comme VCT pour les récepteurs terrestres. Des facteurs d’évaluation supplémentaires ont ensuite été pris en compte pour traiter les incertitudes potentielles associées à l’extrapolation de la VCT à une concentration environnementale qui assurera la protection de la plupart des espèces dans le sol. Un facteur d’évaluation de 5 a été appliqué pour tenir compte des incertitudes associées à l’extrapolation du court terme au long terme. Étant donné la disponibilité et la diversité limitées des études, un facteur de sensibilité des espèces de 5 a également été appliqué. Comme le PTBOE est considéré comme une substance ayant un mode d’action réactif et spécifique, un facteur de mode d’action supplémentaire de 2 a été appliqué pour tenir compte de la sensibilité potentiellement différente des espèces. Dans l’ensemble, cela donne un facteur d’évaluation de 50 (basé sur le cumul des facteurs d’application de 5 × 5 × 2), et la CESE résultante est de 0,45 mg/kg.
| Organisme d’essai | Critère d’effet | Valeur (mg/kg p.s.)a |
|---|---|---|
| Lombric (Eisenia fetida) | CL50 14 j (reproduction) | 544 |
| Plante (Lolium perenne) | DE50 21 j (levée des plantules) | 885,4 |
| Plante (Lolium perenne) | DE50 21 j (croissance – hauteur) | 610,2 |
| Plante (Lolium perenne) | DE50 21 j (croissance – poids sec) | 572,3 |
| Plante (Lolium perenne) | DE10 21 j (levée des plantules) | 476,0 |
| Plante (Lolium perenne) | DE10 21 j (survie) | 380,0 |
| Plante (Lolium perenne) | DE10 21 j (croissance – hauteur) | 206,5 |
| Plante (Lolium perenne) | DE10 21 j (croissance – poids sec) | 110,0 |
| Plante (Brassica rapa) | DE50 21 j (survie) | 893,6 |
| Plante (Brassica rapa) | DE50 21 j (croissance – hauteur) | 283,3 |
| Plante (Brassica rapa) | DE50 21 j (croissance – poids sec) | 165,8 |
| Plante (Brassica rapa) | DE10 21 j (levée des plantules) | 165,0 |
| Plante (Brassica rapa) | DE10 21 j (survie) | 950,2 |
| Plante (Brassica rapa) | DE10 21 j (croissance – hauteur) | 132,1 |
| Plante (Brassica rapa) | DE10 21 j (croissance – poids sec) | 70,5 |
| Plante (Lactuca sativa) | DE50 21 j (croissance – hauteur) | 723,2 |
| Plante (Lactuca sativa) | DE50 21 j (croissance – poids sec) | 238,7 |
| Plante (Lactuca sativa) | DE10 21 j (levée des plantules) | 1057,2 |
| Plante (Lactuca sativa) | DE10 21 j (croissance – hauteur) | 333,6 |
| Plante (Lactuca sativa) | DE10 21 j (croissance – poids sec) | 22,7 |
Abréviations — p.s. : poids sec; CL50 : concentration d’une substance que l’on juge létale pour 50 % des organismes testés; DEX : dose efficace à laquelle l’espèce testée présente un effet au niveau x %.
a Les valeurs de toxicité pour les plantes ont été normalisées à 3,4 % de carbone organique pour refléter les conditions naturelles du sol à partir de 0,96 % (conditions expérimentales).
3.6.1.4 Effets sur la faune sauvage
Egloff et coll. (2014) ont injecté du PTBOE dans la cellule aérienne d’embryons de poulet à des concentrations allant de 0 à 45 400 ng/g et ont ensuite étudié le succès du bêchage (c.‑à‑d. le bris d’une coquille d’œuf à l’aide d’une dent de délivrance), le développement, l’expression de l’ARNm hépatique par 9 gènes cibles, les niveaux d’hormones thyroïdiennes et les concentrations de l’acide biliaire en circulation. Les résultats de l’exposition à la dose maximale de PTBOE ont montré un niveau de détection négligeable des composés d’origine dans les embryons au moment du bêchage, ce qui indiquait leur dégradation métabolique complète. On a également constaté que l’exposition au PTBOE avait des effets limités sur les embryons de poulet, à l’exception de l’induction de l’ARNm du CYP3A37 hépatique. Cependant, le PTBOE a provoqué une diminution relativement faible, mais significative (9 %), de la masse corporelle des embryons de poulet (Egloff et coll. 2014). Une légère régulation à la hausse de l’ARNm du CYP3A37 a été observée, avec une augmentation maximale par un facteur de cinq. L’induction du CYP3A37 semble indiquer l’activation du récepteur xénobiotique du poulet, qui est l’analogue du PXR et du récepteur constitutif des androstanes des mammifères (Egloff et coll. 2014).
Crump et coll. (2016) ont comparé les effets de plusieurs produits chimiques dans l’environnement sur la cytotoxicité, l’activité de l’éthoxyrésorufine-O-dééthylase (EROD) et l’expression de l’ARNm chez une espèce d’oiseau piscivore sauvage, le cormoran à aigrettes (Phalacrocorax auritus). Une diminution significative de la viabilité des hépatocytes embryonnaires s’est manifestée à 300 μM (119,54 mg/L) après 24 heures, alors qu’aucun effet n’a été observé à 1 μM (0,39 mg/L). Cependant, les concentrations réelles n’ont pas été quantifiées dans les cellules de cormoran ou le milieu de culture dans cette étude. Les auteurs ont noté que cet aspect serait un ajout important dans les futures études afin de déterminer la valeur réelle de l’absorption et des niveaux d’exposition résultants chez la faune aviaire. L’inclusion d’une courbe concentration-réponse complète n’a pas été possible pour le composé, en raison du nombre limité d’hépatocytes de cormoran. La concentration maximale a été choisie parce qu’elle s’accompagnait d’une diminution de la viabilité cellulaire des hépatocytes de poulet ou du goéland argenté dans des études antérieures et la concentration la plus faible n’a eu aucun effet sur la viabilité. Les résultats d’un essai in vitro sur des hépatocytes d’embryons aviaires ont indiqué une diminution significative de la viabilité, avec des valeurs CL50 allant de 61,7 à 94,6 mM (0,15 à 0,23 mg/L) [Porter et coll. 2013]. Cependant, les résultats de l’analyse typologique des données de puces à ADN pour le PTBOE ont montré que cette substance n’avait pas affecté les gènes cibles.
Fernie et coll. (2015) ont rapporté l’absorption in vivo et des effets d’une exposition alimentaire chronique au PTBOE chez des crécelles d’Amérique (Falco sparverius) en captivité, en se concentrant sur les systèmes physiologiques (p. ex., le statut oxydatif hépatique, la fonction thyroïdienne et la fonction hépatique). Le PTBOE était l’une des quatre substances qui affectaient de manière significative l’activité de la désiodase du cycle extérieur de la T4 hépatique à des concentrations pertinentes pour l’environnement. Les auteurs suggèrent également que le PTBOE pourrait être impliqué dans l’altération du statut thyroïdien chez les crécelles d’Amérique, car les concentrations plasmatiques de triiodothyronine (T3) ont été globalement modifiées avec une augmentation de la T3 après une exposition de 7 jours. Fernie et coll. (2017) ont également rapporté que le PTBOE a été détecté dans le plasma des oisillons de faucon pèlerin (Falco peregrinus) à une fréquence plus élevée par rapport aux quatre substances ignifuges organophosphatées étudiées, à des concentrations de 1,0 à 7,5 ng/g p.h. (Fernie et coll. 2017).
3.6.2 Évaluation de l’exposition environnementale
Afin d’éclairer la caractérisation des risques du PTBOE, les concentrations environnementales estimées (CEE) dans les milieux pertinents ont été calculées. Les rejets de PTBOE dans l’environnement sont susceptibles de se produire lors d’activités de formulation industrielle et par l’utilisation de produits ménagers. Les rejets, par ces sources, entraîneront l’exposition des eaux de surface et du sol. En raison des données limitées sur l’écotoxicité du PTBOE dans les sédiments, un quotient de risque n’a pas été calculé pour ce milieu. Le milieu d’exposition prédominant est l’eau.
Les rejets dans les eaux de surface provenant des activités industrielles consistent en rejets indirects dans les égouts et en rejets ultérieurs provenant des systèmes de traitement des eaux usées (STEU). Les rejets sur le sol sont une extension du scénario aquatique et résultent de l’application de biosolides sur les terres agricoles. De plus, l’exposition des eaux de surface dans l’environnement résultant des rejets de PTBOE provenant des produits commerciaux et de consommation a été évaluée à l’aide des données mesurées dans les eaux de surface (Truong 2016).
Des scénarios d’exposition au PTBOE ont été élaborés pour les principales utilisations des OP alkyliques (formulation des produits de nettoyage et d’entretien de l’ameublement et formulation des peintures et des revêtements) d’après les renseignements communiqués en réponse aux enquêtes menées en vertu de l’article 71 de la LCPE (Environnement Canada 2013; ECCC 2016 b). Les rejets potentiels, dus au nettoyage et au transport des contenants, y compris le chargement et le déchargement, ne sont pas pris en compte dans cette évaluation. Les CEE pour chaque scénario d’exposition dans les eaux de surface et le sol sont présentées dans le tableau 3‑13.
Les scénarios ont été élaborés sur la base des données disponibles et de considérations génériques. La quantité totale de substance utilisée annuellement dans une installation est basée sur la moyenne de la quantité de PTBOE déclarée par les entreprises (Environnement Canada 2013; ECCC 2016 b). Les volumes de dilution quotidiens sont basés sur la répartition des volumes de dilution quotidiens associés aux installations pertinentes pour le secteur industriel. Les facteurs de rejets vers les eaux usées et le nombre de jours de rejets par une installation donnée sont basés sur des hypothèses provenant de sources de données génériques. L’approche suppose que les effluents industriels sont envoyés dans un STEU secondaire, qui est le type de traitement le plus courant au Canada. Nous avons utilisé un taux d’efficacité d’élimination par les STEU secondaires de 82 % dans les calculs des CEE. Cette valeur est basée sur les taux d’élimination mesurés pour le PTBOE (ECCC 2016c).
L’estimation de l’exposition des sols au PTBOE a été réalisée en suivant une démarche décrite par l’Agence européenne des produits chimiques (ECHA 2016) visant l’épandage de biosolides provenant de STEU. Dans cette approche, on estime la concentration de la substance accumulée (CEEsol) dans la couche supérieure de 20 cm du sol après 10 années d’épandage de biosolides. Cependant, comme le PTBOE peut se dégrader rapidement dans le sol, cette approche a été modifiée pour tenir compte de la dégradation dans le sol. La demi-vie de biodégradation du PTBOE dans le sol est de 70 jours (CATALOGIC 2014). Les concentrations ont été déterminées sur une base annuelle immédiatement après l’application et à la fin de l’année (365 jours) avant l’application suivante, sur une période de 10 ans. Compte tenu de la demi-vie, la concentration de PTBOE dans le sol ne s’accumule pas beaucoup en 10 ans, et les concentrations dans le sol sont maximales immédiatement après l’épandage (et elles diminuent considérablement au cours de l’année).
Comme le PTBOE est importé en vrac sous forme liquide pure ou dans un mélange liquide, des résidus peuvent se former dans les conteneurs de transport, et les opérations de nettoyage des contenants peuvent entraîner des rejets de cette substance dans l’environnement. Bien que les concentrations environnementales de PTBOE résultant de ces rejets puissent être élevées, elles seraient probablement épisodiques et brèves. Compte tenu de ces considérations et des lacunes actuelles dans les données associées aux activités et aux pratiques de nettoyage des contenants, nous n’avons pas procédé à une caractérisation quantitative de l’exposition due à ces rejets.
3.6.2.1 Concentrations mesurées dans les milieux environnementaux et les eaux usées
Les concentrations de PTBOE au Canada sont disponibles pour l’air, les précipitations, les eaux de surface, les sédiments lacustres, les biosolides et le biote. Elles sont résumées dans le tableau 3‑11, et des détails supplémentaires figurent dans ECCC (2020f).
Dans le cadre d’une étude de l’air de l’Arctique canadien, des échantillons ont été prélevés à partir d’un navire et sur terre de 2007 à 2013 pour analyser le transport à grande distance des organophosphates. Le PTBOE a été détecté dans l’air à des concentrations allant de moins de la limite de détection à 157 pg/m3, avec une augmentation de 6,6 % de la concentration au cours de la période d’étude (Sühring et coll. 2016). On a également prélevé des échantillons d’air au‑dessus des Grands Lacs pour déterminer les concentrations de PTBOE (communication personnelle, courriel de Jantunen et coll., 2018; non référencé). Les concentrations atmosphériques de PTBOE détectées allaient de 15 à 138 pg/m3, la valeur la plus élevée ayant été obtenue au‑dessus du lac Érié (29 à 138 pg/m3).
À l’échelle planétaire, le PTBOE a été détecté dans l’air (valeurs non détectées à 3,8 × 105 pg/m3), l’eau (du seuil de détection à 0,013 mg/L), les sédiments (du seuil de détection à 1,97 mg/kg p.s.), le sol (du seuil de détection à 0,45 mg/kg p.s.), le biote (du seuil de détection à 8,84 mg/kg p.h.) et d’autres échantillons prélevés dans divers milieux aux États-Unis, en Allemagne, dans l’Arctique, en Suède, en Norvège, en Suisse, en Autriche, en Chine, au Japon, aux Philippines, en Espagne, en République tchèque, en Nouvelle-Zélande, en Australie, dans l’Antarctique et en Serbie de 1980 à 2014 (Fries et Puttman 2001; Fries et Mihajlovic 2011; Wang et coll. 2011; Bollman et coll. 2012; Rodil et coll. 2012; Esteban et coll. 2014; Eulaers et coll. 2014; Salamova et coll. 2014; Liu et coll. 2014; Cui et coll. 2017; Giulivo et coll. 2017).
| Milieu (unité) | Endroit | Concentration à moyenne ou plage a | Référence(s) |
|---|---|---|---|
| Air (pg/m3) | Grands Lacs | 15 à 262 | Salamova et coll. 2014, Jantunen et coll. 2018 (non publiée) |
| Air (pg/m3) | Arctique | N.D. à 157 | Suhring et coll. 2016 |
| Eaux de surface (mg/L) | Toronto (Ontario)b | 1,0 × 10-4 à 1,03 × 10-2 | Hao et coll. 2018 |
| Eaux de surface (mg/L) | Rivière Don | 2,4 × 10-4 à 5,2 × 10-3 | Truong 2016 |
| Eaux de surface (mg/L) | Lac Érié | 7,5 × 10-5 ± 3,9 × 10-5 | Venier et coll. 2014 |
| Précipitations (mg/L) | Bassin des Grands Lacs, Toronto (Ontario) | N.D. à 2,32 × 10‑3 | Truong 2016 |
| Précipitations (mg/L) | Sud de l’Ontario | 7,0 × 10-6 à 1,0 × 10-4 | Jantunen et coll. 2013 |
| Sédiments (mg/kg p.s.) | Lac Supérieur | N.D. à 4,6 × 10-4 | Cao et coll. 2017 |
| Sédiments (mg/kg p.s.) | Lac Ontario | N.D. à 2,37 × 10‑2 | Cao et coll. 2017 |
| Eaux usées (mg/L) | Systèmes de traitement des eaux usées (STEU) de la région de Toronto | Effluent : 2,9 × 10‑4 à 1,02 × 10-2 | Hao et coll. 2018 |
| Eaux usées (mg/L) | 3 STEU dans la région de Toronto | Effluent : 4,0 × 10-4 à 5,6 × 10-3 | Truong 2016 |
| Eaux usées (mg/L) | 8 STEU au Canada |
Influent : 0,0011 à 0,031 Effluent : 8,4 × 10-5 à 1,3 × 10-2 |
ECCC 2016c |
| Biosolides (mg/kg p.s.) | 8 STEU au Canada | Biosolides : 0,62 à 13,5 | ECCC 2016c |
| Eaux usées (mg/L) | STEU secondaires dans l’ouest du Canada |
Influent : 3,29 × 10-3c Effluent : 5,47 × 10-4c |
Woudneh et coll. 2015 |
| Biosolides (mg/kg p.s.) | STEU secondaires dans l’ouest du Canada | Biosolides : 2,24c | Woudneh et coll. 2015 |
| Poissons d (mg/kg p.h.) |
Lac Ontario Lac Érié |
N.D. à 1,35 × 10‑2 | Chu et Letcher 2015, Greaves et coll. 2016 b, McGoldrick et coll. 2014, McGoldrick et Murphy 2016 |
| Poissons d (mg/kg p.h.) | Grands Lacs | N.D. à 9,8 × 10-3 | Chu et Letcher 2015, Greaves et coll. 2016 b, McGoldrick et coll. 2014, McGoldrick et Murphy 2016 |
| Poissons d (mg/kg p.h.) |
Grand lac de l’Ours Lac Kusawa Lac Cold Lac Athabasca |
< 2,6 × 10-4 à 3,2 × 10-3 (médiane) | Chu et Letcher 2015, Greaves et coll. 2016 b, McGoldrick et coll. 2014, McGoldrick et Murphy 2016 |
| Oiseaux e (mg/kg p.h.) | Grands Lacs | N.D. à 1,3 × 10‑2 | Chen et coll. 2012, Greaves et Letcher 2014, Greaves et coll. 2016 b, Letcher et coll. 2011, Su et coll. 2015 b |
Abréviations — N.D. : seuil de détection; p.h. : poids humide; p.s. : poids sec.
a Dans les cas où les plages de concentrations sont données, les données représentent les concentrations minimales à maximales, sauf indication contraire.
b Les cours d’eau urbains échantillonnés dans la région de Toronto sont le ruisseau Etobicoke, la rivière Don et le ruisseau Highland, et les eaux riveraines sont la baie Humber et le port de Toronto. Truong (2016) a rapporté que la rivière Don présentait la plus forte concentration de PTBOE, soit 5,220 µg/L.
c Les valeurs pour les influents, les effluents et les biosolides sont rapportées comme étant la moyenne des mesures en double (Woudneh et coll. 2015).
d Les échantillons de biote prélevés provenaient d’une variété d’espèces de poissons, pour lesquelles on a utilisé des œufs ou des tissus de truite de lac (Salvelinus namaycush), d’éperlan arc-en-ciel (Osmerus mordax), de chabot visqueux (Cottus cognatus), de gobie à taches noires (Neogobius melanostomus), de chabot de profondeur (Myoxocephalus thompsonii), de gaspareau (Alosa pseudoharengus), de doré (Sander vitreus), de perche-truite (Percopsis omiscomaycus), de perchaude (Perca flavescens) ou de baret (Morone americana).
e Les échantillons d’oiseaux ont été prélevés d’œufs de goélands argentés (Larus argentatus) dans les Grands Lacs.
3.6.2.2 Formulation de produits de nettoyage et d’entretien de l’ameublement
Le PTBOE agit comme plastifiant ou agent de coalescence dans les produits de nettoyage et d’entretien de l’ameublement. Une concentration représentative de 3 % de PTBOE dans les produits finaux a été choisie, à partir des données disponibles sur les produits. Selon les renseignements divulgués en réponse aux enquêtes menées en vertu de l’article 71 de la LCPE (Environnement Canada 2013; ECCC 2016 b), les nettoyants tout usage, les dégraissants, les produits d’entretien des revêtements de sol, les assainisseurs et les désinfectants sont considérés comme des produits finaux contenant du PTBOE. Comme on ne connaît pas tous les emplacements des entreprises qui pourraient utiliser cette substance pour formuler des produits de nettoyage et d’entretien de l’ameublement, nous avons utilisé une répartition des volumes de dilution quotidiens associés aux STEU secondaires et tertiaires recevant les effluents du secteur de la formulation des produits de nettoyage et d’entretien de l’ameublement.
Formulation des peintures et revêtements
Selon les renseignements déclarés en réponse aux enquêtes menées en vertu de l’article 71 de la LCPE (Environnement Canada 2013; ECCC 2016 b), les entreprises qui formulent des peintures et des revêtements importent le PTBOE comme plastifiant, qui est ensuite mélangé dans le procédé de formulation des produits finaux, soit les peintures et les revêtements. Comme on ne connaît pas tous les emplacements des entreprises pouvant utiliser cette substance pour formuler des peintures et des revêtements, nous avons utilisé une distribution des volumes de dilution quotidiens associés aux STEU secondaires et tertiaires recevant les effluents du secteur des peintures et des revêtements.
Ce scénario ne tient pas compte des utilisateurs finaux des peintures et des revêtements, puisqu’ils sont inconnus et que les clients potentiels sont dispersés. On s’attend à ce que le PTBOE soit présent dans différents types de peintures et de revêtements. Cependant, le scénario s’est concentré sur les peintures à base d’eau (latex), car ces peintures présentent le plus grand potentiel de rejets dans les eaux usées.
Produits commerciaux et produits de consommation
Des études récentes montrent que les substances ignifuges, comme le PTBOE, sont rejetées par les produits ménagers (p. ex., les produits électroniques, les plastiques, le caoutchouc, etc.) dans l’air intérieur et la poussière, et s’accumulent ensuite sur les tissus, comme les vêtements et les rideaux, qui agissent alors comme des filtres passifs. Lors du lavage, les substances ignifuges imprégnées dans les vêtements et autres tissus lavés peuvent être rejetées dans les eaux usées domestiques puis transportées vers les STEU avant d’atteindre le milieu aquatique (Schreder et La Guardia 2014; Saini et coll. 2016). Les substances ignifuges peuvent également être rejetées dans les eaux usées domestiques lors du lavage des sols, des tapis, des murs, des fenêtres et autres éléments d’intérieur. L’exposition environnementale résultant des rejets de PTBOE par les produits de consommation a été évaluée à l’aide de données de surveillance des eaux de surface (Truong 2016). La valeur médiane la plus élevée de PTBOE mesurée dans les cours d’eau urbains était de 0,00118 mg/L (Truong 2016), et cette valeur a été sélectionnée comme CEE aquatique représentative résultant des rejets de PTBOE par les produits de consommation.
3.6.3 Caractérisation des risques pour l’environnement
L’approche adoptée dans la présente évaluation préalable des risques pour l’environnement a consisté à examiner les données d’évaluation et à formuler des propositions de conclusions en utilisant une approche fondée sur le poids de la preuve et le principe de précaution, telle tel l’exige la LCPE. Des éléments de preuve ont été recueillis afin de déterminer la possibilité que le PTBOE soit nocif pour l’environnement au Canada. Les sources de données prises en compte comprennent celles qui appuient directement la caractérisation des risques pour l’environnement (p. ex., les propriétés ou les critères d’effet mesurés), ainsi que les sources de données indirectes (p. ex., la classification des risques de danger ou de devenir par d’autres organismes de réglementation).
3.6.3.1 Analyse des quotients de risque
L’analyse des quotients de risque a été effectuée en intégrant des estimations réalistes de l’exposition (les CEE; voir la section Évaluation de l’exposition environnementale) aux données sur la toxicité environnementale (CESE; voir la section Évaluation des effets sur l’environnement) afin de déterminer s’il existe un potentiel d’effets nocifs sur l’environnement au Canada. Nous avons calculé les quotients de risque (QR) en divisant la CEE par la CESE pour les divers milieux environnementaux pertinents et les scénarios d’exposition connexes. Les QR ont été calculés pour les milieux aquatiques et d’autres scénarios d’exposition pertinents pour le PTBOE (tableau 3‑12).
Les valeurs CEE figurant dans le tableau 3‑12 représentent le niveau d’exposition dans les eaux réceptrices près du point de rejet du STEU pour chaque site. Une CESE aquatique de 0,005 mg/L a été calculée à partir de la CMEO sur 21 jours et 3 générations de 0,01 mg/L pour les daphnies (Daphnia magna) [Giraudo et coll. 2017, section 3.6.1.2]. Les QR qui en résultent vont de 0,02 à 0,56. De même, des QR pour le sol de 0,06 et 0,79 ont été calculés pour le scénario de formulation des produits de nettoyage et d’entretien de l’ameublement et pour le scénario de formulation de peintures et de revêtements, respectivement. Selon cette analyse, il est peu probable que les organismes pélagiques et terrestres subissent des effets nocifs dans l’environnement canadien, compte tenu des niveaux actuels d’utilisation du PTBOE.
| Scénario d’exposition | CEE en milieu aquatique (mg/L) | CESE en milieu aquatique (mg/L) | QR en milieu aquatique | CEE pour le sol (mg/kg) | CESE pour le sol (mg/kg) | QR pour le sol |
|---|---|---|---|---|---|---|
| Formulation de produits de nettoyage et d’entretien de l’ameublement | 2,82 × 10-3 | 0,005 | 0,56 | 0,36 | 0,45 | 0,79 |
| Formulation de peintures et de revêtements | 8,1 × 10-5 | 0,005 | 0,02 | 0,03 | 0,45 | 0,06 |
| Rejets par les produits commerciaux et de consommation | 1,18 × 10-3 | 0,005 | 0,24 | S.O. | S.O. | S.O. |
Abréviations — S.O. : sans objet.; CEE : concentration environnementale estimée; CESE : concentration estimée sans effet; QR : quotient de risque.
3.6.3.2 Considérations ayant trait aux éléments de preuve
Afin de caractériser les risques environnementaux du PTBOE, nous avons examiné les renseignements techniques concernant les divers éléments de preuve (comme il est indiqué dans les sections pertinentes du présent rapport), et nous les avons pondérés qualitativement. Les principaux éléments de preuve à l’appui de la conclusion de l’évaluation sont présentés dans le tableau 3‑13. Une discussion générale sur le poids de la preuve figure à la section 3.6.3.4. Le niveau de confiance désigne l’influence combinée de la qualité et de la variabilité des données, des lacunes dans les données, de la causalité, de la plausibilité et de toute extrapolation nécessaire au sein de l’ensemble des sources de données. La pertinence représente impact des sources de données pour ce qui est de la détermination du potentiel d’effets nocifs dans l’environnement canadien. Les qualificatifs utilisés dans l’analyse allaient des niveaux faible à élevé, la pondération attribuée ayant cinq résultats possibles.
| Élément de preuve | Niveau de confiance a | Pertinence pour l’évaluation b | Pondération attribuée c |
|---|---|---|---|
| Propriétés physiques et chimiques | Modéré | Modérée | Modérée |
| Persistance dans l’environnement | Modéré | Modérée | Modérée |
| Transport sur de grandes distances | Faible | Élevée | Modérée |
| Bioaccumulation dans les organismes aquatiques et terrestres | Modéré | Faible | Faible à modérée |
| Mode d’action ou autres données non systémiques | Modéré | Élevée | Modérée à élevée |
| CESE pour les organismes aquatiques ou endogés | Modéré | Élevée | Modérée à élevée |
| Données de surveillance pour mesurer les concentrations dans les eaux de surface, les effluents des eaux usées, les sédiments, l’air, le biote | Modéré | Modérée | Modérée |
| Valeurs CEE dans l’eau | Modéré | Élevée | Modérée à élevée |
| Valeurs CEE dans le sol | Faible | Élevée | Modérée |
| Valeurs QR pour l’eau | Modéré | Élevée | Modérée à élevée |
| Valeurs QR pour le sol | Faible | Élevée | Modérée |
a Le niveau de confiance est déterminé en fonction de la qualité des données, de leur variabilité, de leurs lacunes et de leur pertinence.
b La pertinence fait référence à l’impact des éléments de preuve dans l’évaluation.
c La pondération est attribuée à chaque élément de preuve en fonction du niveau combiné de confiance et de pertinence dans l’évaluation.
Abréviations — CEE : concentration environnementale estimée; CESE : concentration estimée sans effet; QR : quotient de risque.
3.6.3.3 Poids de la preuve pour déterminer le potentiel d’effets nocifs dans l’environnement canadien
Les faibles volumes fabriqués et importés de PTBOE déclarés au Canada et le faible transport sur de grandes distances selon les résultats des modèles sont incompatibles avec la possibilité de rejets généralisés dans l’environnement canadien, d’après les concentrations élevées signalées dans les divers milieux environnementaux. Le PTBOE a été fréquemment détecté dans des échantillons, y compris l’air, l’eau, les sédiments, les biosolides et le sol trouvés près des sources et démontre un potentiel de persistance. Par conséquent, la principale préoccupation concernant le PTBOE concerne les expositions proches et distantes.
Bien que les concentrations de PTBOE dans les sédiments aient semblé relativement constantes sur environ 40 ans selon une étude de terrain basée sur ce qui était considéré comme les apports passés de PTBOE, ces données sont incertaines, car les variables n’ont pas été contrôlées dans des études de terrain. Dans l’ensemble, le poids de la preuve est suffisant pour indiquer que le PTBOE est fortement dégradé dans l’eau, les sédiments et le sol, d’après des études empiriques et des modélisations qui montrent que le PTBOE n’est pas persistant.
La confiance à l’égard des données concernant le transport à grande distance est faible en raison de la variabilité des résultats modélisés et empiriques. D’après la modélisation, le PTBOE ne serait pas considéré comme hautement persistant dans l’air. Il ne serait pas considéré non plus comme hautement susceptible d’être transporté dans l’atmosphère sur grande distance. Cependant, on a trouvé la substance associée à des particules atmosphériques, dont on a démontré qu’elles augmentent la persistance d’autres organophosphates. Le PTBOE a été détecté dans certains échantillons à de très faibles concentrations dans des régions éloignées comme l’Arctique et l’Antarctique.
La valeur sélectionnée de 3,81 pour le log Koe, le taux rapide de biotransformation métabolique (kM) et les faibles FBC et FBA du PTBOE indiquent un potentiel limité de bioaccumulation et de bioamplification dans le biote. Compte tenu des volumes actuellement utilisés et du faible potentiel de bioaccumulation ou de bioamplification dans le biote, le PTBOE ne devrait pas avoir d’effets sur la chaîne alimentaire ni causer d’effets nocifs dus au transfert dans la chaîne alimentaire.
D’après la modélisation informatique, le mode d’action du PTBOE est jugé réactif et spécifique. Ces éléments de preuve sont étayés par des résultats empiriques montrant que le PTBOE peut avoir des effets nocifs aigus (p. ex., mortalité) et chroniques (p. ex., comportement et physiologie) sur un certain nombre d’organismes aquatiques (p. ex., poissons et daphnies) et terrestres (p. ex., lombrics et plantes) à de faibles concentrations. Bien qu’il existe une certaine incertitude quant aux limitations des données toxicologiques disponibles, en particulier pour les organismes endogés, on estime que les valeurs de la CESE calculées assurent une protection adéquate des organismes vivant en milieu aquatique et dans le sol.
Des scénarios propres aux sites industriels ont été créés pour couvrir une plage d’activités industrielles dont on sait qu’elles pourraient utiliser le PTBOE au Canada. Dans ces scénarios, nous avons estimé l’exposition au PTBOE par les eaux réceptrices près du point de rejet des STEU de chaque site, et dans les sols. L’évaluation de l’exposition a une pondération élevée, puisqu’il s’agit d’un élément clé de la preuve pertinente appuyant la conclusion proposée pour le PTBOE. Les valeurs CEE estimées à partir des scénarios de rejets industriels dans l’eau se situent dans la fourchette des concentrations mesurées de PTBOE au Canada. Comme ces CEE prévues en milieu industriel s’appuient sur certaines hypothèses prudentes, on estime que la mesure du PTBOE dans le sol et les eaux de surface améliorerait davantage la confiance à l’égard des estimations de l’exposition. L’importance des rejets de produits est un élément d’incertitude, en raison du manque de données caractérisant l’exposition environnementale due à ces sources. Cependant, sur la base des données disponibles, l’analyse des risques indique que les niveaux actuels ne sont pas susceptibles de présenter un risque. Bien qu’il soit peu probable que l’exposition actuelle de l’environnement canadien au PTBOE soit préoccupante, on estime que cette substance présente un risque élevé en raison de sa toxicité intrinsèque pour les espèces aquatiques. Si l’exposition venait à augmenter, il pourrait y avoir un risque environnemental préoccupant au Canada.
3.6.3.4 Sensibilité de la conclusion aux incertitudes clés
L’une des incertitudes relevées pour le PTBOE est l’absence de données permettant de quantifier l’exposition environnementale due aux rejets de PTBOE pendant le cycle de vie et lors de l’élimination des produits de consommation. La quantité de PTBOE dans les produits de consommation est un élément important de l’incertitude, car nous estimons que l’ampleur de l’importation de la substance ne caractérise pas adéquatement les quantités de PTBOE incluses dans divers produits importés. La détection fréquente de PTBOE dans les effluents des STEU et les biosolides ainsi que dans les eaux de surface indique également un rejet généralisé de cette substance. Les CEE caractérisant les rejets par les produits de consommation ont été estimées sur la base de mesures tenant compte de sources multiples et on n’a pas démontré qu’elles entraînaient un risque. Ainsi, nous estimons que l’absence de données concernant les rejets par les produits a un impact neutre sur la présente évaluation.
Les principaux éléments d’incertitude pour la présente évaluation comprennent le manque de données caractérisant la toxicité du PTBOE pour les organismes vivant dans les sédiments et le sol (et le manque de données provenant d’analogues appropriés). Dans la présente évaluation, nous avons montré le potentiel d’exposition au PTBOE dans les sédiments sur la base des concentrations mesurées, et dans les sols en raison de l’épandage potentiel de biosolides. Pour ce qui est des sédiments, une étude semble indiquer une persistance élevée potentielle, ce qui indiquerait une accumulation du produit chimique au fil du temps. Cependant, en l’absence de données toxicologiques permettant d’évaluer si les concentrations prévues sont nocives pour les organismes vivant dans les sédiments, il est possible que la présente évaluation sous-estime le risque global pour l’environnement.
Dans la présente évaluation, nous n’avons pas pris en compte le risque pour les mammifères récepteurs de la faune associé à la consommation de proies contenant des concentrations accumulées de PTBOE. Cependant, le niveau de confiance est modéré, car cette substance ne se bioaccumulera pas de manière appréciable et sera métabolisée. L’exposition et le risque dus au transfert de cette substance dans la chaîne alimentaire seraient donc faibles. Il est peu probable que cette incertitude ait un effet sur la présente évaluation des risques.
3.7 Potentiel d’effets nocifs sur la santé humaine
3.7.1 Évaluation de l’exposition du sous-groupe des organophosphates alkyliques (PTE, PTBOE, PTEHx, PBEHx)
3.7.1.1 PTE
Milieux environnementaux et aliments
Nous n’avons trouvé aucune donnée sur les concentrations de PTE dans l’air extérieur au Canada. Selon les quelques données pour d’autres pays (Aragon et coll. 2012, 2013; Liu et coll. 2016), l’air ambiant n’est pas considéré comme une source d’exposition importante pour le PTE.
Dans une étude canadienne par Yang et coll. (2017), le PTE n’a pas été détecté dans l’air intérieur de 51 maisons de Toronto et Ottawa au‑dessus de la limite de détection (0,34 pg/m3). Cependant, le PTE a été mesuré dans l’air intérieur de maisons en Suède (Staaf et Ostman 2005; Bergh et coll. 2011; Luongo et Östman 2016), en Allemagne (Zhou et coll. 2017a) et au Japon (Saito et coll. 2007; Kanazawa et coll. 2010; Takeuchi et coll. 2014, 2015). L’absence de détection du PTE dans l’étude canadienne peut découler des différences dans le protocole d’échantillonnage, des limites de détection, ainsi que de la taille et de l’emplacement des échantillons. Pour assurer une approche prudente et tenir compte des émissions transitoires potentielles de PTE depuis des matériaux de construction et des bâtiments, nous avons caractérisé l’exposition humaine au PTE par l’air intérieur en utilisant la valeur maximale de 297 ng/m3 de l’étude suédoise de Luongo et Östman (2016). Cette étude a mesuré le PTE dans l’air intérieur de 62 appartements à Stockholm en 2009 et a rapporté la plus forte concentration de PTE dans l’air intérieur.
Des enquêtes canadiennes réalisées de 1978 à 1980 (Lebel et coll. 1981; Williams et Lebel 1981; Williams et coll. 1982) ont détecté du PTE dans l’eau potable en Ontario et au Québec. Les auteurs ont rapporté des concentrations allant jusqu’à 23 ng/L. Cependant, les taux de récupération du PTE, selon la méthode utilisée dans ces enquêtes, étaient faibles (c.‑à‑d. environ 25 %), et les concentrations réelles de PTE étaient probablement plus élevées lorsque cette substance était détectée. Des chercheurs d’autres pays (p. ex., l’Espagne, la Chine et la Corée) ont également mesuré du PTE dans l’eau potable (Rodil et coll. 2012; Ding et coll. 2015; Lee et coll. 2016). Une étude des eaux de surface en Ontario a rapporté des concentrations de PTE atteignant 105 ng/L (Truong 2016). Les échantillons ont été prélevés entre 2014 et 2015 et, selon le lieu d’échantillonnage, les fréquences de détection rapportées se situaient entre 11 % et 100 %. La présence de PTE dans les eaux de surface a également été signalée en Allemagne (Bollman et coll. 2012; Wolschke et coll. 2015), en Espagne (Rodil et coll. 2012) et en Chine (Wang et coll. 2011; Yan et coll. 2012). L’utilisation des données canadiennes sur les eaux de surface (valeur maximale de 105 ng/L) a été considérée comme la plus applicable et la plus prudente pour estimer l’exposition humaine au PTE par l’eau potable au Canada.
D’après une étude réalisée en 2013 sur la poussière dans 818 maisons au Canada, le PTE a été mesuré dans 16 % des échantillons de poussière avec des concentrations allant d’une valeur non détectée (LDM = 0,09 µg/g) à 2,83 µg/g, et un 95e centile de 0,32 µg/g (communication personnelle, courriels du Bureau de la science et de la recherche en santé environnementale de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 28 octobre 2013; non référencé). Deux autres études canadiennes avec un échantillonnage plus petit (134 et 51 échantillons) n’ont pas été détecté le PTE au‑dessus du seuil de détection de la méthode, respectivement 90 ng/g et 0,25 ng/g (Fan et coll. 2014; Yang et coll. 2017). Par prudence, nous avons utilisé la valeur du 95e centile de l’Enquête sur la poussière domestique au Canada pour caractériser l’exposition humaine au PTE occasionnée par la poussière en milieu résidentiel. Les concentrations de PTE dans la poussière résidentielle au Canada sont similaires à celles rapportées ailleurs dans le monde (Ali et coll. 2012; Dodson et coll. 2012; Luongo et Östman 2016; Wu et coll. 2016; Zhou et coll. 2017b).
Nous n’avons retrouvé aucune donnée sur les concentrations de PTE dans le sol au Canada. Le PTE a été détecté dans une étude réalisée en Chine (Cui et coll. 2017), et la concentration maximale (0,011 mg/kg p.s.) de PTE dans des échantillons de sol prélevés dans des parcs et des zones résidentielles représentait une exposition négligeable pour tous les groupes d’âge de la population canadienne.
Tomizawa et coll. (2004) ont fait état de concentrations plus élevées de PTE dans les matériaux d’emballage alimentaire que dans le contenu des aliments, dans les échantillons prélevés au Royaume‑Uni, en Italie et en France. Selon l’étude, les concentrations de PTE dans les flocons d’avoine et leur emballage au Royaume‑Uni étaient de 270 ng/g et 470 ng/g, respectivement, et les concentrations de PTE dans les pâtes et leur emballage en Italie étaient de 90 ng/g et 150 000 ng/g, respectivement. En France, deux échantillons distincts de pâtes et d’emballage de pâtes présentaient respectivement des concentrations de PTE de 80 ng/g et 4700 ng/g et de 90 ng/g et 130 000 ng/g. Les auteurs ont supposé que le PTE s’était infiltré dans les aliments depuis l’emballage. Une exposition potentielle au PTE, due à son utilisation comme composant dans la fabrication de matériaux d’emballage alimentaire (voir la section 3.3), n’est pas prévue lorsque la substance est séparée des aliments par une barrière fonctionnelle efficace (communication personnelle, courriels de la Direction des aliments de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 10 avril 2019; non référencé).
Le PTE a été mesuré dans le lait maternel de femmes au Japon, aux Philippines et au Vietnam (Kim et coll. 2014). L’étude a fait état d’une fréquence de détection globale du PTE dans le lait maternel de 16 % avec des concentrations de PTE dans le lait maternel allant de valeurs non détectées (LDM entre 0,01 et 0,08 ng/g de lipides) à 15 ng/g de lipides (Kim et coll. 2014). Compte tenu de la faible fréquence de détection et de la petite taille de l’échantillonnage, nous n’avons pas utilisé cette étude pour estimer l’exposition de la population canadienne générale au PTE par le lait maternel.
L’absorption journalière totale estimée de PTE, en raison de sa présence dans les milieux environnementaux, a été calculée et varie de 0,054 µg/kg p.c./j (60 ans et plus) à 0,16 µg/kg p.c./j (0,5 à 4 ans) [annexe F, tableau F-5].
Produits de consommation
Articles manufacturés :
Le PTE a été trouvé dans les composants en mousse et en tissu de 10 de 15 modèles populaires de sièges pour nourrisson et enfant testés aux États-Unis (Miller et Gearhart 2016). Dans un siège pour enfant, on a également trouvé la substance dans un composant en velcro. Le PTE a également été trouvé dans la mousse d’un coin de lit pour nourrisson, dans des surmatelas et dans des sièges pour nourrisson et enfant au Canada (communication personnelle, courriel de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, mai 2019; non référencé). Les estimations de l’exposition par voie cutanée prolongée au PTE pour la population générale s’étendant sur des matelas ou des meubles contenant de la mousse et pour les enfants de 0 à 6 mois et de 0,5 à 4 ans assis dans des sièges sont présentées dans le tableau 3‑14. L’annexe G présente plus de détails sur les paramètres utilisés pour estimer ces expositions.
Autres produits :
Le PTE a été signalé comme ingrédient dans un nombre limité de produits de consommation, y compris un décapant tout usage (MSDS 2015) et dans des produits d’étanchéité en mousse (MSDS 2014a). L’exposition par voie cutanée aiguë résultant de l’utilisation d’un décapant tout usage contenant du PTE a été estimée à l’aide d’un scénario représentatif de nettoyage d’un four. Des données limitées sur l’absorption cutanée du PTE ont été trouvées (Marzulli et coll. 1965; Thors et coll. 2016). L’article de Marzulli et coll. (1965) ne comportait aucun détail concernant la conception de l’étude, et il n’est donc pas possible d’en déterminer la qualité. Thors et coll. (2016) ont inclus le PTE dans une étude qui a démontré que l’eau agit comme amplificateur de pénétration cutanée des composés organophosphorés et que les solutions à faible dilution des composés testés, comme une solution de PTE à 10 %, ont une pénétration cutanée plus élevée que les solutions plus concentrées. Nous n’avons trouvé aucun analogue approprié pour l’absorption cutanée du PTE, étant donné sa très grande solubilité dans l’eau et d’autres propriétés physico-chimiques. Une absorption cutanée de 100 % a donc été présumée (c.‑à‑d. équivalente à une absorption par voie orale). L’utilisation de produits d’étanchéité en mousse contenant du PTE vendus au détail au Canada, est une source potentielle d’exposition par inhalation. On s’attend à ce que ces produits soient surtout vendus à des professionnels, bien qu’une faible fraction puisse être achetée par des bricoleurs. L’exposition par inhalation peut se produire pendant l’application et on l’a estimée à l’aide d’un scénario représentatif. Les valeurs estimées de l’exposition par toutes les voies pertinentes sont résumées au tableau 3‑14 et les détails sur les paramètres utilisés pour estimer ces expositions figurent à l’annexe G.
| Voie et durée de l’exposition | Source | Groupe d’âge | Estimation de l’exposition a |
|---|---|---|---|
| Orale (quotidienne) | Mousse dans les produits pour enfants | 0 à 6 mois | 0,018 à 0,54 mg/kg p.c./j |
| Orale (quotidienne) | Mousse dans les produits pour enfants | 0,5 à 4 ans | 0,017 à 0,53 mg/kg p.c./j |
| Cutanée (quotidienne) | Sièges de retenue pour nourrisson b | 0 à 6 mois | 0,28 à 8,60 mg/kg p.c./j |
| Cutanée (quotidienne) | Sièges de retenue pour enfant b | 0,5 à 4 ans | 0,22 à 6,91 mg/kg p.c./j |
| Cutanée (quotidienne) | Meubles ou matelas contenant de la mousse | 0 à 6 mois | 2,8 à 294 mg/kg p.c./j |
| Cutanée (quotidienne) | Meubles ou matelas contenant de la mousse | 0,5 à 4 ans | 2,0 à 224 mg/kg p.c./j |
| Cutanée (quotidienne) | Meubles ou matelas contenant de la mousse | 5 à 11 ans | 1,3 à 156 mg/kg p.c./j |
| Cutanée (quotidienne) | Meubles ou matelas contenant de la mousse | 12 à 19 ans | 1,1 à 134 mg/kg p.c./j |
| Cutanée (quotidienne) | Meubles ou matelas contenant de la mousse | 20 ans et plus | 0,75 à 103 mg/kg p.c./j |
| Cutanée (par événement) | Nettoyage de four à l’aide d’un décapant tout usage (activité combinée de pulvérisation et de nettoyage) c | 20 ans et plus) | 1,28 mg/kg p.c./événement |
| Inhalation (par événement) | Produit d’étanchéité en mousse d | 20 ans et plus) | 500 mg/m3 |
a Une valeur d’absorption cutanée de 100 % a été utilisée pour estimer l’exposition par voie cutanée.
b Le PTE a été trouvé dans les composants en mousse et en tissu des sièges pour nourrisson et enfant (Miller et Gearhart 2016).
c L’exposition potentielle par inhalation de PTE, due à l’utilisation de nettoyant pour four, est couverte par le scénario d’inhalation de produit d’étanchéité en mousse.
d L’exposition potentielle par voie cutanée au PTE, due à l’utilisation de produits d’étanchéité en mousse, est couverte par le scénario d’exposition par voie cutanée due à l’utilisation de nettoyant pour four.
3.7.1.2 PTBOE
Milieux environnementaux et aliments
Les données de surveillance canadiennes du PTBOE dans l’air ambiant et les eaux de surface sont résumées à la section 3.6.2.1 (tableau 3‑11). L’absorption estimée de PTBOE par l’air ambiant est négligeable (≤ 2,5 ng/kg p.c./j).
Au Canada, une étude a rapporté des concentrations de PTBOE dans l’air intérieur (Yang et coll. 2019). L’échantillonnage de l’air intérieur dans 51 maisons à Toronto et à Ottawa a révélé des concentrations atteignant 6040 pg/m3; la fréquence de détection du PTBOE était de 84 % dans les échantillons des chambres à coucher et de 81 % dans les échantillons des pièces les plus utilisées. Des concentrations de PTBOE dans l’air intérieur ont également été rapportées dans des maisons en Europe et en Asie (Kanazawa et coll. 2010; Bergh et coll. 2011; Takeuchi et coll. 2014; Cequier et coll. 2014; Luongo et Östman 2016). Des concentrations élevées de PTBOE dans l’air intérieur (valeurs maximales > 10 ng/m3) ont été rapportées dans des garderies et des écoles (Fromme et coll. 2014; Cequier et coll. 2014; Bergh et coll. 2011; Zhou et coll. 2017a). Par ailleurs, on a démontré que les concentrations de PTBOE dans la poussière sont corrélées aux concentrations de PTBOE dans l’air intérieur (Cequier et coll. 2014; Fromme et coll. 2014). Par conséquent, et en l’absence d’études sur les substances ignifuges à base d’organophosphates alkyliques dans l’air intérieur des garderies et des écoles au Canada, la concentration au 95e centile de 833 ng/m3 (833 000 pg/m3) pour le PTBOE dans l’air intérieur de l’étude allemande de Fromme et coll. (2014) susmentionnée a été utilisée pour estimer l’exposition de la population jeune au PTBOE présent dans l’air intérieur des garderies et des écoles. Pour les adultes, la valeur au 95e centile de 5640 pg/m3, d’après l’étude canadienne, convenait le mieux pour caractériser l’exposition au PTBOE par l’air intérieur.
Le PTBOE a été mesuré dans l’eau potable au Canada dans diverses enquêtes sur l’eau entre 1978 et 1983 (Lebel et coll. 1981; Williams et Lebel 1981; Williams et coll. 1982; Lebel et coll. 1983; Lebel et coll. 1987). La plupart des échantillons ont été prélevés dans des usines de traitement municipales, mais certains ont été prélevés au robinet dans des maisons. Les concentrations variaient de valeurs inférieures à la limite de détection à 6000 ng/L. Les concentrations élevées ont été mesurées après des périodes de non-utilisation pendant lesquelles l’eau avait stagné dans les tuyaux. Certains composants des tuyaux de robinet (c.‑à‑d. les joints en caoutchouc, les rondelles, les joints toriques et les joints d’étanchéité) ont été décelés comme sources de PTBOE (Lebel et coll. 1981; Williams et Lebel 1981; Williams et coll. 1982; Lebel et coll. 1983; Lebel et coll. 1987). Des concentrations de PTBOE ont également été mesurées dans l’eau potable en Europe (Esteban et coll. 2014; Rodil et coll. 2012) et en Asie (Ding et coll. 2015; Lee et coll. 2016), et dans les eaux de surface au Canada (Truong 2016; Venier et coll. 2014) et ailleurs dans le monde (Christensen et coll. 2010; Elliot et VanderMeulen 2017; Bollman et coll. 2012; Gorga et coll. 2015; Zushi et coll. 2016). On a estimé l’exposition de la population canadienne générale au PTBOE par l’eau potable en utilisant la concentration maximale de PTBOE de 560 ng/L rapportée dans l’enquête nationale sur l’eau dans 29 municipalités du Canada (Williams et Lebel 1981).
Le PTBOE a été mesuré dans la poussière intérieure dans des études canadiennes à des concentrations allant de 0,73 µg/g à 275 µg/g (EPDC, n = 818; Won et Lusztyk 2011; Fan et coll. 2014; Yang et coll. 2017; communication personnelle, courriels du Bureau de la science et de la recherche en santé environnementale de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 28 octobre 2013; non référencé). La fréquence de détection du PTBOE dans ces études variait de 88 % à 100 %. Les données de l’EPDC ont été considérées comme étant les plus appropriées pour caractériser l’exposition au PTBOE occasionnée par la poussière en milieu résidentiel. On a rapporté que la concentration au 95e centile de PTBOE dans la poussière était de 104 µg/g (communication personnelle, courriel du Bureau de la science et de la recherche en santé environnementale de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 28 octobre 2013; non référencé). Les concentrations de PTBOE dans la poussière en milieu résidentiel au Canada sont semblables à celles qui ont été constatées ailleurs, sauf au Japon, où on a observé des concentrations plus élevées.
Des concentrations élevées de PTBOE dans la poussière (valeurs maximales > 1000 µg/g) ont été trouvées dans des garderies et des écoles aux États-Unis, en Europe et en Asie (Bergh et coll. 2011; Cequier et coll. 2014; Fromme et coll. 2014; Mizouchi et coll. 2015; Langer et coll. 2016; Dodson et coll. 2017; Zhou et coll. 2017b). Compte tenu de la présence de concentrations élevées de PTBOE dans la poussière des milieux éducatifs, et en l’absence d’études sur les substances ignifuges à base de phosphates alkyliques dans la poussière des garderies et des écoles au Canada, nous avons utilisé les données de l’étude allemande de Fromme et coll. (2014) dans la présente évaluation pour estimer l’exposition de la population plus jeune (6 mois à 4 ans) au PTBOE par la poussière présente dans les garderies et les écoles. Cette étude a analysé des échantillons de poussière provenant de 63 garderies entre 2011 et 2012 et a rapporté que la concentration maximale au 95e centile était de 3633 µg/g selon les études pertinentes sur la présence de PTBOE dans la poussière des garderies.
Aucune donnée sur les concentrations de PTBOE dans le sol n’a été trouvée au Canada. Le PTBOE a été détecté dans une étude réalisée en Chine (concentration maximale de 0,15 mg/kg dans le sol de surface d’une zone résidentielle) [Cui et coll. 2017]. Compte tenu de l’absence de données canadiennes, la CEE maximale estimée dans le sol pour le PTBOE (scénario d’exposition par la formulation de produits de nettoyage et d’entretien de l’ameublement) de 360 ng/g a été utilisée pour estimer l’absorption de PTBOE par l’ingestion de sol. Les niveaux d’absorption étaient négligeables dans tous les groupes d’âge.
L’exposition potentielle au PTBOE résultant de son utilisation en tant que composant dans la fabrication de matériaux d’emballage alimentaire (voir la section 3.3) n’est pas prévue, car la substance n’entre pas en contact direct avec les aliments. Toute contribution non prévue à l’exposition alimentaire globale et à l’utilisation d’emballages alimentaires serait prise en compte dans les données sur la présence de la substance dans des aliments transformés qui ont été utilisées dans l’évaluation.
Le PTBOE a été mesuré dans des poissons au Canada (McGoldrick et coll. 2014; Greaves et coll. 2016b) et a été trouvé dans certains aliments (c.‑à‑d. flocons d’avoine, pain de blé entier, bonbons au caramel, jus de pomme, aliments pour nourrisson, pêches en conserve et sucettes glacées à saveur de fruit) dans les résultats de l’étude américaine Total Diet Study (US FDA 2006). Dans une étude menée en Chine, le PTBOE a été mesuré dans les produits laitiers, la viande et les légumes (Zhang et coll. 2016). Comme nous n’avons trouvé que très peu de données sur la présence de PTBOE au Canada, les données employées dans l’évaluation de l’exposition par la voie alimentaire provenaient surtout des études américaines sur l’alimentation totale et, dans une moindre mesure, de l’étude chinoise. Dans l’ensemble, seules des données limitées étaient disponibles pour le PTBOE dans les aliments, et certaines études ont aussi signalé de faibles fréquences de détection. Les concentrations maximales de PTBOE dans les aliments et les boissons, utilisées dans la présente évaluation, variaient de 0,29 ppb dans les produits laitiers à 110 ppb dans les produits céréaliers (annexe E, tableau E-2). Les valeurs moyennes et le 90e centile du groupe « toutes personnes » pour l’exposition au PTBOE dans tous les groupes d’âge variaient respectivement de 0,38 à 1,65 µg/kg p.c./j et de 0,66 à 2,73 µg/kg p.c./j, (annexe E, tableau E-4).
Le PTBOE a été mesuré par deux études dans le lait maternel de femmes en Suède, au Japon, aux Philippines et au Vietnam (Sundkvist et coll. 2010; Kim et coll. 2014). Les chercheurs qui ont étudié le lait maternel de femmes dans les pays asiatiques a rapporté une fréquence de détection globale de 39 % et les concentrations de PTBOE dans le lait maternel de femmes vivant dans des zones urbaines ou à proximité d’un site de recyclage de déchets électroniques, ou près d’une décharge, allaient de valeurs non détectées (LDM entre 0,01 et 0,08 ng/g de lipides) à 206 ng/g de lipides (Kim et coll. 2014). Dans l’étude suédoise, le PTBOE a été mesuré dans 4 des 6 échantillons, dont 5 étaient des échantillons composites et groupés de lait maternel prélevés entre 1997 et 2003 (Sundkvist et coll. 2010). Collectivement, les échantillons représentaient le lait maternel de 286 femmes, et une concentration maximale de 63 ng/g de lipides a été mesurée dans un échantillon composite provenant de 69 femmes d’Uppsala en 1997. Étant donné la taille plus importante de l’échantillon dans l’étude suédoise, la valeur de 63 ng/g de lipides obtenue avec l’échantillon composite mesuré chez les femmes suédoises a été utilisée pour estimer l’exposition des nourrissons allaités (0,22 µg/kg p.c./j; voir l’annexe F, tableau F-6).
L’absorption journalière estimée de PTBOE présent dans les milieux environnementaux et les aliments a été calculée et variait de 0,7 µg/kg p.c./j (60 ans et plus) à 18,3 µg/kg p.c./j (nourrissons allaités de 0 à 6 mois) [annexe F, tableau F-6].
Produits de consommation
On a trouvé du PTBOE dans la mousse de deux canapés sur 132 produits d’ameublement achetés au Canada, aux États‑Unis et au Mexique entre décembre 2014 et avril 2015; les deux canapés avaient été achetés au Canada (CCE 2015b). Le PTBOE a également été trouvé dans 9 des 15 modèles populaires de sièges pour nourrisson et enfant testés aux États-Unis. Dans les 9 cas, le PTBOE a été trouvé dans le composant en mousse, et dans 5 des 9 cas, il a également été trouvé dans le tissu (Miller et Gearhart 2016). Les valeurs d’exposition par voie cutanée prolongée ont été estimées pour ces produits et sont résumées au tableau 3‑15 (voir l’annexe G, tableau G-5, pour plus de détails au sujet des paramètres). Des données limitées sur l’absorption cutanée ont été trouvées pour le PTBOE. Frederiksen et coll. (2018) ont rapporté des coefficients de flux et de perméabilité pour le PTBOE et d’autres substances ignifuges à base d’organophosphates, mais n’ont pas intégré dans les valeurs rapportées les résidus dans l’épiderme. Comme nous l’indiquons à la section 2.7.1.4, cette méthode pourrait sous-estimer l’exposition systémique. En outre, les données relatives au PTBOE sont considérées comme semi-quantitatives par les auteurs, et le coefficient de perméabilité qui incorporait les résidus dans le derme n’a pas été corrigé en fonction du taux de récupération (Frederiksen et coll. 2018). Des données sur l’absorption cutanée in vitro ont été présentées pour d’autres organophosphates ignifuges (Frederiksen et coll. 2018; EU RAR 2008a). Les données de l’étude de Frederiksen et coll. (2018) semblent indiquer que le PTCP a une capacité de pénétration cutanée équivalente ou supérieure à celle du PTBOE, de sorte qu’une approche de lecture croisée du PTCP a été utilisée (voir la section 3.1.1). Des taux d’absorption cutanée de 23 % et 40 % ont été rapportés pour le PTCP d’après des études d’absorption cutanée in vitro utilisant des membranes de peau humaine avec application directe de PTCP radiomarqué (TNO Quality of Life 2005, 2006b, cité dans EU RAR 2008a). Les deux valeurs proviennent d’études dans lesquelles on avait testé des doses différentes. L’absorption cutanée de 40 % était basée sur des expériences utilisant des concentrations plus faibles, jugées plus représentatives de l’exposition par contact cutané avec la mousse (EU RAR 2008a). Par conséquent, une absorption cutanée de 40 % a été utilisée pour l’exposition au PTBOE par les sièges pour nourrisson et enfant et les meubles contenant de la mousse.
En Europe, le PTBOE a été mesuré dans des jouets en plastique, en caoutchouc, en bois et en mousse et textiles (Ionas et coll. 2014). Aucune étude sur les produits pour enfants au Canada comportant du PTBOE n’a été trouvée, mais il est possible que certains des mêmes types de jouets dans lesquels on a constaté la présence de PTBOE en Europe soient présents au Canada. Les estimations de l’exposition au PTBOE par la mise en bouche ont été estimées de la manière décrite à l’annexe G.
Au Canada, on a signalé la présence de PTBOE dans un petit nombre de produits de consommation (MSDS 2014b). L’exposition découlant de l’application de peinture antirouille contenant du PTBOE a été définie comme scénario sentinelle pour l’exposition. L’exposition cutanée a été estimée et les résultats sont résumés dans le tableau 3‑15 (voir l’annexe G, tableau G-1, pour plus de détails sur les paramètres). Comme le PTBOE a une faible pression de vapeur, l’exposition par inhalation lors d’utilisation de produits de consommation devrait être négligeable.
| Voie et durée de l’exposition | Source | Groupe d’âge | Estimation de l’exposition systémique |
|---|---|---|---|
| Orale (quotidienne) | Mousse dans les jouets et produits pour enfants | 0 à 6 mois | 0,003 à 0,008 mg/kg p.c./j |
| Orale (quotidienne) | Mousse dans les jouets et produits pour enfants | 0,5 à 4 ans | 0,003 à 0,008 mg/kg p.c./j |
| Cutanée (quotidienne)a | Mousse dans les sièges pour nourrisson et dans les meubles | 0 à 6 mois | 0,021 à 0,049 mg/kg p.c./j |
| Cutanée (quotidienne)a | Mousse dans les sièges pour enfant et meubles | 0,5 à 4 ans | 0,017 à 0,040 mg/kg p.c./j |
| Cutanée (quotidienne)a | Meubles contenant de la mousse | 20 ans et plus | 0,029 à 0,068 mg/kg p.c./j |
| Cutanée (par événement)a | Peinture antirouille | 20 ans et plus | 0,76 mg/kg p.c./événement |
a L’absorption cutanée a été estimée à 40 %.
3.7.1.3 PTEHx
Milieux environnementaux et aliments
Le PTEHx a été mesuré à de faibles concentrations (< 1 ng/m3) dans l’air ambiant au Canada et ailleurs dans le monde (Suhring et coll. 2016; Salamova et coll. 2014; Li et coll. 2017; Möller et coll. 2012; Zhou et coll. 2017a). L’absorption estimée de PTEHx par l’air ambiant est jugée négligeable.
Deux études ont mesuré le PTEHx dans des échantillons de poussière et d’air intérieur dans des maisons canadiennes (Vykoukalová et coll. 2017; Yang et coll. 2019). L’étude de Vykoukalová et coll. (2017) comportait un échantillon de 23 maisons bâties à Toronto, et a été menée en 2013. L’étude de Yang et coll. (2019) portait sur un échantillon de 51 maisons à Toronto et à Ottawa, et a été menée en 2015. Yang et coll. (2019) ont rapporté des concentrations plus élevées de PTEHx dans la poussière et l’air intérieur, mais des fréquences de détection plus faibles que dans l’étude de Vykoukalová et coll. (2017). Par prudence, les concentrations de PTEHx au 95e centile dans la poussière (1780 ng/g) et dans l’air intérieur (11,4 ng/m3) de l’étude de Yang et coll. (2019) ont été utilisées pour caractériser l’exposition de la population générale au PTEHx, dans la présente évaluation préalable. Les concentrations de PTEHx dans la poussière et l’air intérieur des maisons canadiennes sont similaires à celles qui ont été rapportées dans les maisons américaines et européennes (Coelho et coll. 2016; Langer et coll. 2016; Luongo et Östman 2016; Vykoukalová et coll. 2017; Zhou et coll. 2017a,b).
Lebel et coll. (1981) ont mesuré le PTEHx dans l’eau potable d’une des six stations de traitement de l’eau testées dans l’est de l’Ontario en 1978 et ont rapporté une concentration de PTEHx de 0,3 ng/L. Cette substance a également été mesurée dans les eaux de surface de Toronto, du lac Érié et du lac Huron (Venier et coll. 2014; Truong 2016). Cependant, les concentrations n’ont pas été rapportées, car la fréquence de détection du PTEHx était faible (c.‑à‑d. moins de 20 %). D’autres chercheurs ont également observé une même faible fréquence de détection, voire d’absence, de PTEHx dans les eaux de surface aux États-Unis, en Europe et en Chine (Bohlen et coll. 1989; Weber et Ernst 1983; Ernst 1988; Rodil et coll. 2012; Yan et coll. 2012; Venier et coll. 2014). L’absorption estimée de PTEHx par l’eau potable est jugée négligeable.
Aucune donnée sur les concentrations de PTEHx dans le sol n’a été trouvée au Canada. Une étude en Chine a apporté la détection de PTEHx (Cui et coll. 2017). La concentration maximale de PTEHx dans le sol prélevé dans des parcs, des zones résidentielles et des rizières ou champs de légumes était de 0,015 mg/kg p.s. (plage : valeurs non détectées à 0,015 mg/kg p.s.; LDM = 0,0004 mg/kg). D’après ces valeurs, on s’attend à ce que l’exposition au PTEHx par le sol soit négligeable pour tous les groupes d’âge de la population canadienne.
On ne s’attend pas à ce qu’il y ait une exposition au PTEHx en raison de son utilisation comme composant dans la fabrication de matériaux d’emballage alimentaire, car cette substance n’entre pas en contact direct avec les aliments (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 19 janvier 2018; non référencé). Le PTEHx avait précédemment été détecté dans un groupe réduit d’aliments aux États‑Unis, d’après les données de l’étude Total Diet Study de la FDA au cours de la période 1980 à 1991 (Gartrell et coll. 1986a, 1986b; KAN-DO Office and Pesticides Team 1995). Cependant, d’après des données ultérieures de l’étude Total Diet Study, soit 1991 à 2005, le PTEHx n’a pas été détecté (US FDA 2006). Le PTEHx n’a pas été détecté dans des poissons au Canada (McGoldrick et coll. 2014) ni en Europe surtout (Giulivo et coll. 2017). Cette substance n’a pas été trouvée dans une enquête alimentaire en Suède (Poma et coll. 2017), mais a été trouvée à de faibles concentrations dans certains aliments en Belgique (Poma et coll. 2018) et en Chine (Ma et coll. 2013; Zhang et coll. 2016). Cependant, l’applicabilité de ces résultats à l’exposition de la population générale au Canada est limitée. Selon le poids global de la preuve, l’exposition de la population canadienne générale au PTEHx par les aliments devrait être minime.
L’absorption journalière quotidienne estimée de PTEHx en raison de sa présence dans les milieux environnementaux a été calculée et varie de 0,002 µg/kg p.c./j (adultes de 25 ans et plus) à 0,012 µg/kg p.c./j (nourrissons de 0 à 6 mois) [annexe F, tableau F-7].
Produits de consommation
Au Canada, la présence du PTEHx a été signalée comme ingrédient d’un produit d’étanchéité pour joints de revêtement de sol (Ash et Ash 2009, étude citée dans Knovel; Hoffmann Mineral 2018). L’exposition cutanée est possible lors de son utilisation, et on l’a estimée entre 0,21 et 1,3 mg/kg (voir l’annexe G, tableau G-1, pour plus de détails).
3.7.1.4 PBEHx
Milieux environnementaux et aliments
Aucune donnée de surveillance environnementale n’a été trouvée pour le PBEHx dans l’air, la poussière ou le sol. L’exposition au PBEHx par ces milieux ne devrait pas contribuer de manière importante à l’exposition globale à cette substance, en raison de ses propriétés physico-chimiques et de sa présence limitée dans les produits de consommation.
Hoa et coll. (2018) ont rapporté des concentrations comprises entre 0,13 et 0,48 µg/L de PBEHx dans les eaux de surface (cours d’eau, n = 20, fréquence de détection = 4/20, LD = 1,5 à 30 ng/L) échantillonnées dans la région de Toronto en 2014 et 2015. La valeur maximale trouvée par cette étude a été utilisée pour estimer l’absorption de cette substance par la population générale par l’eau potable.
Nous n’avons trouvé aucune donnée sur la présence de PBEHx dans les aliments ou le lait maternel.
En utilisant les valeurs d’absorption par l’eau potable pour les Canadiens, décrites à l’annexe F, l’absorption journalière totale estimée de PBEHx en raison de sa présence dans l’eau potable variait de 0,0097 µg/kg p.c./j (adolescents de 12 à 19 ans) à 0,051 µg/kg p.c./j (nourrissons nourris au lait maternisé, de 0 à 6 mois).
Produits de consommation
Au Canada, on a signalé la présence de PBEHx comme ingrédient dans l’huile pour engrenage, un produit de consommation servant à l’entretien des automobiles (Environnement Canada 2013; MSDS 2013). L’exposition cutanée au PBEHx peut survenir lors de l’utilisation de cette huile, et on l’a estimée à 0,13 mg/kg p.c./événement pour les adultes (voir l’annexe G, tableau G-1 pour plus de détails).
3.7.1.5 Données de biosurveillance pour le sous-groupe des OP alkyliques
En règle générale, les organophosphates sont métabolisés en diesters correspondants ou en métabolites hydroxylés et conjugués (Van den Eede et coll. 2013; Dodson et coll. 2014; Fromme et coll. 2014; Su et coll. 2015b; Kosarac et coll. 2016; Völkel et coll. 2018).
Le diéthylphosphate, un métabolite du PTE, a été mesuré dans des échantillons d’urine dans le cadre de l’enquête nationale américaine sur la santé et la nutrition (National Health et Nutrition Examination Survey, NHANES 2000-2004) et dans une étude de biosurveillance chez l’humain au Japon (Yoshida 2012). Cependant, si le diéthylphosphate est un métabolite du PTE, il est également un métabolite de plusieurs pesticides organophosphatés et par conséquent il ne constitue pas un biomarqueur approprié de l’exposition au PTE. Le PTE a également été mesuré dans d’autres matrices biologiques (p. ex., le placenta, les cheveux, le sérum et le sang total) en Asie (Ding et coll. 2016; Qiao et coll. 2016; Zhao et coll. 2017).
Le phosphate de bis(2-butoxyéthyle) [BBOEP], le phosphate de desbutyle tris(2-butoxyéthyle) [PBBEHE] et le phosphate de tris(2-(3-hydroxy)butoxyéthyle) [OH-PTBOE] sont des métabolites habituels du PTBOE. En raison du manque de spécificité et du faible pourcentage d’élimination dans l’urine, le BBOEP pourrait ne pas être un biomarqueur approprié pour estimer l’exposition au PTBOE par dosimétrie inverse (Völkel et coll. 2018). De même, le taux d’élimination urinaire du OH-PTBOE est encore plus faible. Pour ces raisons, il a été proposé que le PBBEHE soit le biomarqueur le plus approprié pour estimer l’exposition au PTBOE. L’élimination urinaire fractionnaire a été établie à 0,0838, d’après une étude toxicocinétique menée chez trois volontaires masculins et trois volontaires féminins après l’administration d’une seule dose par voie orale (Völkel et coll. 2018). Selon les résultats de cette étude, les concentrations maximales de PBBEHE ont été observées entre la première et la troisième heure après l’administration du PTBOE. En calculant la moyenne pour tous les participants, la demi-vie du PBBEHE a été établie à 3,9 heures.
Deux études de biosurveillance menées au Canada ont permis de détecter la présence de PBBEHE dans l’urine. Dans une étude, le PBBEHE n’a pas été détecté au‑dessus de la limite de détection de 0,2 ng/mL dans l’urine de 20 femmes enceintes canadiennes (Kosarac et coll. 2016). Dans l’autre étude, le PBBEHE a été détecté dans 18 % des échantillons d’urine de 44 femmes préménopausées de Toronto et d’Ottawa (Yang et coll. 2019). Les concentrations moyennes et le 95e centile de PBBEHE dans l’urine, ajustés pour la créatinine, ont été établis à 4,86 ng/g de créatinine et 33,7 ng/g de créatinine, respectivement. La dosimétrie inverse a été utilisée pour estimer l’absorption journalière sur la base de ces concentrations urinaires. Par conséquent, l’absorption journalière a été estimée à 9,8 × 10-4 µg/kg p.c./j (d’après la concentration moyenne) et à 6,8 × 10-3 µg/kg p.c./j (d’après la concentration au 95e centile). Les détails concernant la dosimétrie inverse figurent à l’annexe G.
Le PBEHx a été mesuré comme métabolite urinaire du PTEHx dans une étude de méthodologie (Su et coll. 2015b). Cependant, le PBEHx lui‑même est une substance qui peut être présente dans l’environnement et dans les produits de consommation, et l’origine du composé dans l’urine est donc inconnue.
3.7.2 Évaluation des effets sur la santé du sous-groupe des organophosphates alkyliques (PTE, PTBOE, PTEHx, PBEHx)
3.7.2.1 PTE
L’OCDE (2002a) a étudié le PTE pour un dossier d’ensemble de données de dépistage (SIDS). Cette étude a servi à mieux éclairer la caractérisation des effets du PTE sur la santé. Nous avons effectué des recherches ciblées dans les publications scientifiques parues entre 2001 (un avant l’étude de l’OCDE) jusqu’à mars 2018. Nous n’avons trouvé aucune étude traitant des effets sur la santé qui aurait un impact sur la caractérisation des risques (c.‑à‑d. qui aurait pu fournir des critères d’effet critique différents ou des points de départ plus faibles).
Toxicocinétique
Le PTE administré par voie orale à des rongeurs est rapidement éliminé dans l’urine (90 % en 16 heures).
Cancérogénicité et génotoxicité
Aucune étude de cancérogénicité n’a été trouvée pour le PTE.
La plupart des études sur la génotoxicité ont donné des résultats négatifs. Le PTE s’est avéré faiblement mutagène dans certains tests non standards avec des bactéries, des virus et des levures (OCDE 2002a). Un test de suivi de l’hypoxanthine-guanine phosphoribosyltransférase (HGPRT) dans des cultures de cellules V79 a donné des résultats négatifs (OCDE 2002a). Le PTE n’a démontré aucun effet nocif sur l’ADN. Les résultats obtenus sur la drosophile (Drosophila melanogaster), dans des tests documentés et limités de létalité récessive, sont contradictoires, tandis que les études in vivo sur la souris (cytogénicité dans la moelle osseuse, test de létalité dominante) ont donné des résultats négatifs (OCDE 2002a). Sur la base de toutes les données disponibles sur la génotoxicité, le PTE ne devrait pas être mutagène.
Toxicité à doses répétées
Dans une étude de 90 jours, des rats ont été exposés par gavage au PTE à des concentrations de 60, 200 ou 700 mg/kg p.c./j (ECHA c2007-2018a). Une augmentation du poids du foie et une hypertrophie hépatocellulaire minime à légère ont été observées dans le groupe exposé à la dose élevée. Une accumulation de gouttelettes hyalines et une augmentation du poids des reins (également observée sous forme d’hypertrophie rénale) et une augmentation des taux de potassium et de calcium dans le sang accompagnaient également ces résultats. La DSENO pour cette étude a été établie à 200 mg/kg p.c./j (ECHA c2007-2018a).
Dans une étude par gavage à doses répétées, des rats Wistar ont reçu pendant 28 jours du PTE à des doses de 0, 10, 100 ou 1000 mg/kg p.c./j. Des changements ont été observés dans le groupe ayant reçu 1000 mg/kg p.c./j, notamment une légère hypertrophie hépatocellulaire chez les deux sexes, une augmentation du poids absolu du foie (significative uniquement chez les femelles) et une diminution de la prise de poids corporel chez les mâles (10 %). Ces effets ont été causés par une augmentation de l’activité métabolique dans le foie et étaient un signe d’adaptation de la fonction hépatique. La DSENO a donc été établie à 1000 mg/kg p.c./j (Bayer 1992, étude citée dans OCDE 2002a).
D’autres études de toxicité par voie orale du PTE étaient également disponibles. Dans une étude, aucun effet nocif n’a été observé avec une dose unique pendant 4 semaines chez les souris (274 mg/kg p.c./j; 1/5 de la DL50) [Pyatlin 1968, étude citée dans US EPA 1985]. Dans une autre étude, seuls des changements non significatifs du poids des organes des rats, par rapport aux témoins, ont été observés après une exposition de 9 semaines à une dose de 335 mg/kg p.c./j (Oishi et coll. 1982, étude citée dans US EPA 1985). On a également démontré que le PTE pouvait avoir un effet dépresseur sur le système nerveux central et causer une légère inhibition des cholinestérases à des doses élevées (BUA 37 1989, étude citée dans US EPA 1985).
Dans une étude de toxicité par inhalation à court terme, des rats ont été exposés au PTE 12 fois (5 heures/jour, 5 jours/semaine) à des concentrations de 0, 366 ou 1786 mg/m3 sous forme d’aérosol. Environ 35 % de l’aérosol était respirable. Les effets observés dans le groupe ayant reçu la dose élevée comprenaient la léthargie, la baisse du réflexe d’orientation auditive, une instabilité de la démarche et un écoulement nasal d’une substance proche de la porphyrine, tous ces effets survenant quotidiennement, mais s’atténuant avec l’exposition suivante. Cependant, les signes cliniques, le poids des organes, la chimie clinique et l’hématologie étaient normaux, et aucune pathologie macroscopique ou microscopique n’a été observée (Eastman Kodak 1984, étude citée dans OCDE 2002a; US EPA 1985). Dans une autre étude, aucune toxicité aiguë par inhalation, autre que des effets de narcose transitoire, n’a été observée après une exposition unique de 4 heures à une concentration atteignant 8817 mg/m3. Une CSEO a été établie à 1400 mg/m³, sur la base d’un retard marginal de la prise de poids chez les rats mâles au cours de la première semaine (ECHA c2007-2018a). Selon les données disponibles, il n’y a pas d’effets systémiques critiques après des expositions aiguës uniques ou périodiques ou intermittentes au PTE par voie d’inhalation.
Toxicité pour la reproduction et le développement
Dans une étude de toxicité pour la reproduction, des rats SD ont reçu du PTE à des concentrations de 0,1 %, 0,5 %, 1,0 %, 5,0 % ou 10 % en poids dans leur régime alimentaire (ce qui correspond à 67, 335, 670, 3350 ou 6700 mg/kg p.c./j, respectivement). Les mâles ont reçu du PTE pendant 92 jours avant l’accouplement et jusqu’à 120 jours au total, et les femelles ont reçu du PTE pendant 150 jours (jusqu’au sevrage au 21e jour). On a ensuite examiné les femelles et leurs descendants pour déterminer les effets sur la reproduction (Gumbmann et coll. 1968). En raison d’une anorexie sévère dans le groupe ayant reçu la dose élevée, il a fallu exclure ce groupe de l’étude de la toxicité du PTE. La reproduction a été affectée négativement à une concentration de 1 % de PTE, et a été complètement inhibée à 5 % de PTE. La croissance des jeunes a été légèrement retardée (mais non de manière significative) dans tous les groupes ayant reçu du PTE, après ajustement des poids au sevrage selon une taille de portée constante. Dans cette étude, on n’a observé aucun résultat remarquable pour ce qui est du poids des testicules ou de leur examen histologique. La DSENO a été établie à 335 mg/kg p.c./j en raison des effets sur la fertilité. Un retard significatif dans la prise de poids, le poids élevé du foie et des surrénales et des lésions du foie ont été observés à 3350 mg/kg p.c./j. La DSENO maternelle a été établie à 670 mg/kg p.c./j.
Dans une étude de toxicité pour le développement, des rats Wistar ont été exposés par gavage au PTE entre les jours 6 et 15 après l’accouplement à des doses de 0, 25, 125 ou 625 mg/kg p.c./j (Bayer 1995). On n’a observé aucun effet sur le développement jusqu’à la dose maximale d’essai. Une réduction de la prise de poids corporel, de la consommation alimentaire et de l’élimination par les matières fécales, considérée comme signe de toxicité maternelle, a été observée à 625 mg/kg p.c./j (DSENOmat = 125 mg/kg p.c./j).
Dans une étude de toxicité pour la reproduction de 28 jours avec des doses atteignant 1000 mg/kg p.c./j, aucune modification du poids des testicules n’a été observée (Bayer 1992, étude citée dans OCDE 2002a).
3.7.2.2 PTBOE
Le PTBOE a été étudié par l’ATSDR (2012), l’IPCS (OMS 2000) et l’ECETOC (1992b). Nous avons utilisé ces examens pour caractériser les effets du PTBOE sur la santé. Nous avons effectué des recherches dans les publications scientifiques parues entre 2011 (un avant le rapport de l’ATSDR) et mars 2018. Nous n’avons trouvé aucune étude sur les effets sur la santé qui aurait un impact sur la caractérisation des risques (c.‑à‑d. qui aurait pu fournir des critères d’effet critique différents ou des points de départ plus faibles que ceux indiqués dans le rapport ATSDR 2012).
Toxicocinétique
Les métabolites habituels du PTBOE comprennent le phosphate de bis(2-butoxyéthyle) [BBOEP], le phosphate de desbutyle tris(2-butoxyéthyle) [PBBEHE] et le phosphate de tris(2-(3-hydroxy)butoxyéthyle) [OH-PTBOE] (Völkel et coll. 2018). Le PTBOE peut être absorbé par voie cutanée, par voie orale et par inhalation. Les métabolites ont été détectés dans l’urine et peuvent également être éliminés dans l’air expiré et les matières fécales. Les composés d’origine inchangés ont été détectés dans l’urine à l’état de trace seulement (US EPA 1985).
Cancérogénicité et génotoxicité
Aucune étude de cancérogénicité n’a été trouvée pour le PTBOE. Des tests de mutation génétique sur des cellules bactériennes et mammifères ont donné des résultats négatifs, mais aucun test visant à déterminer les dommages chromosomiques n’a été trouvé. Par conséquent, le PTBOE ne devrait pas être génotoxique (ATSDR 2012).
Toxicité à doses répétées
Dans une étude de 18 semaines, des rats SD ont reçu par le régime alimentaire du PTBOE à des doses correspondant à 0, 17, 173 ou 578 mg/kg p.c./j pour les mâles et à 0, 21, 209 ou 698 mg/kg p.c./j pour les femelles (Monsanto 1987a, étude citée par OMS 2000; Reyna et Thake 1987, étude citée par ATSDR 2012). L’examen microscopique a montré une légère hypertrophie hépatocellulaire périportale et une vacuolisation périportale chez les mâles aux doses moyennes et élevées. Aucune histopathologie importante n’a été rapportée chez les rates. Le poids du foie a augmenté dans le groupe ayant reçu la dose maximale, mais de façon non significative. Le poids corporel, la consommation alimentaire et les observations cliniques étaient similaires chez les rats traités et les rats témoins. Les paramètres hématologiques et de chimie clinique étaient normaux, à l’exception d’une augmentation du nombre de plaquettes dans le groupe ayant reçu la dose maximale. La DMENO a été établie à 173 mg/kg p.c./j. Une LICDR10 de 8,88 mg/kg p.c./j pour la vacuolisation des hépatocytes chez les mâles a été calculée par l’ATSDR (2012) afin d’établir un niveau de risque minimal (NRM) intermédiaire par voie orale.
Des résultats mitigés ont été observés dans deux autres études subchroniques par voie orale. Aucun effet indésirable n’a été observé à 200 mg/kg p.c./j après 14 semaines d’exposition au PTBOE, et une DMENO de 2000 mg/kg p.c./j a été établie sur la base d’un gonflement modéré des hépatocytes périportaux chez les rats mâles (Tsuda et coll. 1993; Saitoh et coll. 1994, tous deux cités dans OMS 2000). Cependant, aucune DSENO n’a été trouvée dans une autre étude de 18 semaines dans laquelle le poids du foie et des reins avait augmenté (20 % par rapport aux témoins) et des effets de narcose avaient été observés à 255 mg/kg p.c./j (Laham et coll. 1984a, 1985a, étude citée dans OMS 2000).
Exposition à court terme
Dans une étude de la toxicité pour le développement de 10 jours (voir les détails ci‑dessous), une diminution importante de la prise de poids (35 %) a été observée chez les mères à 1500 mg/kg p.c./j (Monsanto Co 1985b, étude citée dans ATSDR 2012). On a également observé une ataxie et une léthargie. La DSENO systémique était de 500 mg/kg p.c./j dans cette étude. Une LICDR de 477 mg/kg p.c./j a été établie par l’ATSDR (2012) pour une exposition aiguë par voie orale de courte durée (14 jours ou moins) au PTBOE.
Dans deux autres études de la toxicité par voie orale disponibles (études de 14 jours et de 4 semaines chez des rats soumis à un régime alimentaire), les effets observés étaient limités à une légère baisse du poids corporel et de la consommation alimentaire chez les femelles ayant reçu des aliments contenant 375 ou 750 mg/kg p.c./j (aucun effet chez les mâles). On n’a observé à l’autopsie aucune modification liée au composé (Komsta 1989, étude citée dans OMS 2000; Monsanto 1985a, étude citée dans OMS 2000).
Dans une étude de toxicité par voie cutanée de 21 jours, des lapins de Nouvelle-Zélande (6/sexe/groupe) ont été exposés à 0, 10, 100 ou 1000 mg/kg p.c./j de PTBOE pendant 3 semaines (5 jours/semaine; fourrure coupée, mais peau non abrasée; occlusion pendant 6 heures/jour) [Monsanto 1985d, étude citée dans ATSDR 2012]. Rien n’indique que l’exposition cutanée au PTBOE ait entraîné des effets systémiques indésirables. On a constaté une irritation locale, un œdème, une atonie et une desquamation à toutes les doses.
Plusieurs études ont mesuré l’activité des cholinestérases des globules rouges. Cependant, une diminution statistiquement significative (ampleur non indiquée) n’a été observée que dans une seule étude chez le rat après 9 semaines de traitement. Cet effet n’a pas été retrouvé après 18 semaines de traitement. Aucun signe clinique n’a été associé à la diminution de l’activité des cholinestérases (ATSDR 2012).
Toxicité pour la reproduction et le développement
Dans une étude tératologique au cours de laquelle 25 rates accouplées ont reçu du PTBOE par gavage à des doses de 0, 250, 500 ou 1500 mg/kg p.c./j des JG 6 à 15, on n’a observé aucun effet sur le développement (Monsanto Co 1985b, étude citée dans ATSDR 2012). Le traitement n’a eu aucun effet sur la résorption fœtale, la viabilité fœtale, les pertes post-implantatoires, le nombre total d’implantations ou la fréquence des malformations fœtales. Les signes de toxicité maternelle, par exemple l’ataxie, la léthargie et une diminution significative de la prise de poids (35 %) ont été observés à 1500 mg/kg p.c./j. Par conséquent, la DSENO pour la toxicité pour le développement est de 1500 mg/kg p.c./j et la DSENO pour la toxicité maternelle est de 500 mg/kg p.c./j (ATSDR 2012).
3.7.2.3 PTEHx
Le PTEHx a fait l’objet d’un examen par l’EPA (US EPA 2009), l’OMS (OMS 2000) et l’ECETOC (1992a). Ces examens ont permis de mieux caractériser les effets du PTEHx sur la santé. Nous avons effectué des recherches dans les publications scientifiques afin de trouver des articles publiés entre 2008 (un an avant le rapport de l’EPA) et mars 2018.
Toxicocinétique
Le PTEHx devrait être métabolisé en PBEHx et en dihydrogénophosphate de 2-éthylhexyle (no CAS 1070-03-7). Compte tenu des signes de désalkylation comme voie métabolique primaire, on s’attend à ce que le 2-éthylhexanol soit le principal métabolite du PTEHx (ACC 2005; Kluwe et coll. 1985).
Le PTEHx ou ses métabolites étaient répartis dans les poumons (13 % de la radioactivité totale après 5 minutes), le contenu de l’estomac (64 % après la première heure), le cerveau (9 %) et le foie (16 %). Des quantités plus faibles (moins de 2 %) ont été trouvées dans d’autres organes ou tissus (rate, rein, os, muscle et graisse) [MacFarland et Punte 1966, étude citée dans OMS 2000].
Cancérogénicité et génotoxicité
La toxicité chronique et la cancérogénicité du PTEHx ont été étudiées sur des rats et des souris (US NTP 1984, étude citée dans OMS 2000). Le PTEHx a été administré à 50 rats Fischer-344 mâles (2000 mg/kg p.c./j et 4000 mg/kg p.c./j) et 50 femelles (1000 mg/kg p.c./j et 2000 mg/kg p.c./j) par gavage pendant 5 jours/semaine pendant 103 semaines. Le PTEHx a également été administré de manière similaire à 50 souris mâles et 50 souris femelles B6C3F1 à raison de 500 mg/kg p.c./j et 1000 mg/kg p.c./j. Le National Toxicology Program (NTP) américain a conclu qu’il existait des preuves de cancérogénicité d’après une augmentation de la fréquence des carcinomes hépatocellulaires chez les souris femelles à la dose élevée (1000 mg/kg p.c./j) et des signes équivoques de cancérogénicité d’après une augmentation de la fréquence des phéochromocytomes chez les rats mâles aux deux doses. Cependant, les phéochromocytomes présentaient une fréquence de fond variable chez les rats, et la fréquence de ces tumeurs dans deux essais biologiques antérieurs du NTP était égale à la fréquence observée dans l’essai biologique du PTEHx. Le seul autre résultat néoplasique significatif consistait en carcinomes hépatocellulaires dans le groupe de souris femelles ayant reçu une dose élevée. Ces résultats indiquent donc que le PTEHx ne présente pas de risque cancérogène significatif pour l’humain (OMS 2000). Dans l’étude de toxicité chronique chez la souris, la DMENO pour l’hyperplasie des cellules folliculaires de la thyroïde était de 357 mg/kg p.c./j. Aucune DSENO chez la souris n’a été établie. La DSENO pour la toxicité chronique chez les rats mâles était de 2857 mg/kg p.c./j et chez les rates de 1428 mg/kg p.c./j.
On ne s’attend pas à ce que le PTEHx soit génotoxique (US EPA 2009).
Toxicité à doses répétées
On n’a observé qu’une baisse de la prise de poids corporel chez des rats ayant reçu 0, 250, 500, 1000, 2000 ou 4000 mg/kg p.c./j et des souris ayant reçu 0, 500, 1000, 2000, 4000 ou 8000 mg/kg p.c./j de PTEHx par gavage (5 jours/semaine) pendant 13 semaines. Aucune mort, aucun effet toxique, ni aucune altération histologique induite n’ont été attribués à l’administration de PTEHx à l’une ou l’autre de ces doses de traitement (US NTP 1984, étude citée dans OMS 2000; Kluwe et coll. 1985). La suppression de la prise de poids corporel à la dose maximale chez les rats mâles et femelles était de 5 %. Chez les souris mâles et femelles, la suppression de la prise de poids à la dose maximale était respectivement de 7 % et 5 %. Cependant, ces changements minimes n’ont pas été jugés significatifs sur le plan biologique. Par conséquent, les valeurs DSENO chez les rats et les souris ont été établies à 2860 mg/kg p.c./j et 5710 mg/kg p.c./j, respectivement (OMS 2000). Cette étude n’a pas examiné les effets sur la thyroïde.
Les résultats préliminaires obtenus par une étude de toxicité par voie orale dans laquelle des rats ont reçu du PTEHx à des doses de 0, 300, 1000 ou 3000 mg/kg p.c./j pendant 28 jours consécutifs indiquent que seule la prise de poids des mâles a été perturbée dans le groupe ayant reçu 3000 mg/kg p.c./j. Dans le groupe ayant reçu la dose élevée, des effets limités ont été observés pour ce qui est des paramètres hématologiques et la chimie sérique, notamment une réduction du volume moyen des plaquettes (chez les deux sexes) et une augmentation du nombre de globules blancs (chez les femelles uniquement). Aucune modification histologique ou lésion n’a été observée chez les rats traités hormis les effets décrits plus bas sur les testicules et l’épididyme (3000 mg/kg p.c./j). Par conséquent, la DSENO pour cette étude a été établie à 1000 mg/kg p.c./j pour le PTEHx, en raison d’une diminution de la prise de poids corporel (Pelletier et coll. 2020).
Dans d’autres études disponibles de toxicité par voie orale, les effets du PTEHx sur la santé qui ont été observés étaient principalement liés à une diminution du poids corporel aux concentrations élevées. Aucune mort, aucun effet toxique ni aucune altération histologique induite n’ont été attribués à l’administration de PTEHx à quelque dose que ce soit, hormis une suppression légère à modérée de la prise de poids corporel (US NTP 1984; Kluwe et coll. 1985; Smyth et Carpenter 1948, étude citée dans OMS 2000).
Dans le cadre d’une étude limitée de toxicité par voie cutanée à doses répétées, du PTEHx a été appliqué sur la peau rasée et intacte de la partie supérieure du dos de lapins mâles (MacFarland et Punte 1966, étude citée dans OMS 2000). Les animaux ont reçu en tout 10 (4/6 animaux) ou 20 applications (2/6 animaux). Les animaux semblaient normaux et ont pris du poids. Aucune altération n’a été observée à l’autopsie. On a observé un érythème modéré après la première application (250 mg de PTEHx non dilué). Après des applications ultérieures de 0,1 mL à raison de 5 jours/semaine (10 ou 20 applications), l’érythème n’avait pas augmenté en intensité, mais on a observé une augmentation progressive de la taille de la zone affectée. Une desquamation, des zones hémorragiques et un épaississement de la peau ont également été observés. L’examen microscopique a révélé une hyperkératose et une parakératose.
Dans une étude de toxicité par inhalation de 3 mois, on a exposé des cobayes, des chiens et des singes rhésus au PTEHx pendant 6 heures/jour, 5 jours/semaine pour un total de 60 expositions, et aucun effet significatif n’a été observé jusqu’à une concentration de 85 mg/m3. Une mortalité élevée a été observée dans l’étude sur les cobayes en raison d’infections respiratoires et elle a donc été jugée invalide. Chez les chiens, on a observé de légers changements inflammatoires chroniques dans les poumons et une détérioration des performances d’évitement conditionnel en fonction de la concentration administrée (MacFarland et Punte 1966).
Toxicité pour la reproduction et le développement
Dans une étude de toxicité pour le développement et de tératogénicité, des rats Wistar ont été exposés quotidiennement par gavage à 0, 500 et 1000 mg/kg p.c./j de PTEHx aux jours 6 à 20 après l’accouplement (ECHA c2007-2018b). Aucune toxicité maternelle n’a été constatée dans aucun des groupes traités. Un examen pathologique des fœtus (examens externes, des viscères et du squelette) n’a révélé aucun effet lié à la substance testée. D’après les résultats de cette étude, la DSEO pour les effets maternels et pour le développement a été établie à 1000 mg/kg p.c./j.
La toxicité du PTEHx pour la reproduction a été observée dans l’étude de 28 jours chez le rat décrite ci‑dessus. L’exposition à de fortes doses de PTEHx (3000 mg/kg p.c./j) a entraîné la rétention de spermatides matures dans les testicules. D’autres perturbations de l’histologie des testicules et de l’épididyme ont également été observées (Pelletier et coll. 2020). La DSENO pour les effets sur la reproduction est donc de 1000 mg/kg p.c./j pour le PTEHx.
3.7.2.4 PBEHx
Le PBEHx a fait l’objet d’un examen par l’EPA (US EPA 2009) et l’ECETOC (1992a). Ces examens ont permis de mieux caractériser les effets du PBEHx sur la santé. Nous avons effectué une recherche dans les publications scientifiques afin de trouver des articles publiés entre 2008 (un an avant l’examen de l’EPA 2009) et mars 2018. Nous n’avons trouvé aucune étude sur les effets sur la santé qui aurait un impact sur la caractérisation des risques (c.‑à‑d. qui aurait pu fournir des critères d’effet critique différents ou des points de départ plus faibles).
Toxicocinétique
Aucun renseignement sur la distribution, l’absorption, le métabolisme ou l’élimination du PBEHx n’est disponible. Le PBEHx est un métabolite primaire du PTEHx (ACC 2005; Kluwe et coll. 1985).
Cancérogénicité et génotoxicité
Nous n’avons trouvé aucune étude sur la cancérogénicité du PBEHx.
Le PBEHx n’a pas montré de génotoxicité dans plusieurs essais de mutagénicité in vivo et in vitro (US EPA 2009).
Toxicité à doses répétées
Dans une étude de 28 jours, des rats Wistar ont été exposés par gavage à 0, 30, 150 ou 750 mg/kg p.c./j de PBEHx (ECHA c2007-2018b). La DSENO pour cette étude est de 30 mg/kg p.c./j d’après les effets sur la fonction hépatique liés au traitement à 150 mg/kg p.c./j. Chez les mâles, la concentration en protéines a significativement diminué à 750 mg/kg p.c./j, le poids relatif du foie a augmenté à partir de 30 mg/kg p.c./j chez les mâles et de 750 mg/kg p.c./j chez les femelles, et une hypertrophie hépatocellulaire s’est manifestée à partir de 150 mg/kg p.c./j. Une hypertrophie de l’épithélium folliculaire de la glande thyroïde a été observée à partir de 150 mg/kg p.c./j, et était secondaire par rapport aux résultats de l’activation du métabolisme hépatique. L’évaluation histopathologique a révélé une hyperplasie diffuse de la zone fasciculée des glandes surrénales à partir de 150 mg/kg p.c./j chez les mâles et de 750 mg/kg p.c./j chez les femelles. À l’autopsie, le poids absolu et relatif des glandes surrénales a augmenté chez les mâles à la dose de 750 mg/kg p.c./j. Dans une étude préliminaire de toxicité par voie orale de 28 jours avec des rats Fischer ayant reçu par gavage 20, 60 et 180 mg/kg p.c./j de PBEHx, on a observé divers effets, dont la prise de poids corporel (mâles), le poids des organes, l’histopathologie de l’estomac, l’hématologie et la chimie sérique à partir de 60 mg/kg p.c./j (Pelletier et coll. 2020).
Aucune étude de toxicité par voie cutanée n’était disponible pour le PBEHx.
Toxicité pour la reproduction et le développement
Nous n’avons trouvé aucune étude sur la toxicité du PBEHx pour le développement.
Dans l’étude de 28 jours chez le rat Wistar décrite ci‑dessus, le poids des vésicules séminales a diminué en corrélation avec une réduction de la sécrétion dans la prostate et les vésicules séminales lors de l’examen histopathologique à 750 mg/kg p.c./j. De plus, une proportion légèrement accrue de spermatides rondes dans l’épididyme a été observée. Les auteurs de l’étude ont noté que ces résultats pourraient indiquer un effet systémique primaire, mais qu’il est plus probable qu’ils reflètent un retard de maturation sexuelle, conséquence du mauvais état de ces animaux. La DSENO pour les effets sur la reproduction a été établie à 750 mg/kg p.c./j pour le PBEHx (ECHA c2007-2018b).
3.7.3 Caractérisation des risques du sous-groupe des OP alkyliques (PTE, PTBOE, PTEHx, PBEHx) pour la santé humaine
3.7.3.1 PTE
Aucune étude de cancérogénicité n’a été trouvée pour le PTE. Compte tenu de toutes les données disponibles sur la génotoxicité, le PTE ne devrait pas être génotoxique. D’après les études disponibles, deux études d’exposition par voie orale chez le rat ont été sélectionnées comme études critiques pour caractériser les risques pour la santé humaine dus à l’exposition au PTE. On a utilisé une étude par voie orale de 90 jours dans laquelle des effets hépatiques ont été observés, avec une DSENO de 200 mg/kg p.c./j, pour caractériser les risques d’une exposition répétée (ECHA c2007-2018a). Ces résultats assurent une protection contre les effets sur la reproduction observés à des doses plus élevées (DSENO de 335 mg/kg p.c./j). La deuxième étude était une étude de toxicité par voie orale de 28 jours chez le rat, réalisée par Bayer Co. (1995), avec une DSENO de 1000 mg/kg p.c./j. Nous avons sélectionné ces études en raison des critères d’effet examinés, de la qualité de la méthode utilisée, et de l’établissement de valeurs DSENO les plus appropriées.
Aucune étude de toxicité par voie cutanée n’était disponible, et pour cette raison la DSENO de 1000 mg/kg p.c./j établie d’après l’étude par voie orale de 28 jours susmentionnée a été utilisée comme point de départ pour caractériser les risques liés à une exposition à court terme. Les risques pour la santé humaine liés à l’exposition cutanée potentielle au PTE par l’utilisation de produits de consommation, notamment un produit d’étanchéité en mousse ou un décapant tout usage, sont jugés faibles.
Les renseignements disponibles d’après les études de toxicité par inhalation indiquent que les effets observés (narcose) après une exposition aiguë à de fortes concentrations de PTE sont légers, transitoires et réversibles une fois que le sujet est éloigné de la source d’exposition. Par conséquent, le risque pour la santé humaine lié à l’exposition potentielle au PTE par inhalation, en raison de l’utilisation de produits de consommation, notamment un produit d’étanchéité en mousse ou un décapant tout usage, est jugé faible.
Le tableau 3‑16 présente les valeurs pertinentes (estimations de l’exposition et points de départ des dangers) ainsi que les ME résultantes pour la caractérisation des risques dus à l’exposition au PTE.
| Scénario d’exposition | Exposition systémique | Niveau d’effet critique | Critère d’effets critiques sur la santé | ME |
|---|---|---|---|---|
| Milieux environnementaux | 0,054 à 0,16 µg/kg p.c./j | DSENO = 200 mg/kg p.c./j | Effets hépatiques dans l’étude de 90 jours | > 1 million |
| Mise en bouche de la mousse dans les produits pour enfants (orale) | 0,018 à 0,54 mg/kg p.c./j (0 à 6 mois) | DSENO = 200 mg/kg p.c./j | Effets hépatiques dans l’étude de 90 jours | 370 à 11 111 |
| Mise en bouche de la mousse dans les produits pour enfants (orale) | 0,017 à 0,53 mg/kg p.c./j (0,5 à 4 ans) | DSENO = 200 mg/kg p.c./j | Effets hépatiques dans l’étude de 90 jours | 377 à 11 765 |
| Mousse ou tissu dans ou sur les sièges pour nourrisson (cutanée) | 0,28 à 8,60 mg/kg p.c./j (0 à 6 mois; 100 % absorption) | DSENO = 200 mg/kg p.c./j (orale) | Effets hépatiques dans l’étude de 90 jours | 23 à 714 |
| Mousse ou tissu dans ou sur les sièges pour enfant (cutanée) | 0,22 à 6,91 mg/kg p.c./j (0,5 à 4 ans; 100 % absorption) | DSENO = 200 mg/kg p.c./j (orale) | Effets hépatiques dans l’étude de 90 jours | 29 à 909 |
| Matelas ou meubles contenant de la mousse (cutanée) | 2,8 à 294 mg/kg p.c./j (0 à 6 mois; 100 % absorption) | DSENO = 200 mg/kg p.c./j (orale) | Effets hépatiques dans l’étude de 90 jours | < 1 à 71 |
| Matelas ou meubles contenant de la mousse (cutanée) | 2,0 à 224 mg/kg p.c./j (0,5 à 4 ans; 100 % absorption) | DSENO = 200 mg/kg p.c./j (orale) | Effets hépatiques dans l’étude de 90 jours | < 1 à 100 |
| Matelas ou meubles contenant de la mousse (cutanée) | 1,3 à 156 mg/kg p.c./j (5 à 11 ans; 100 % absorption) | DSENO = 200 mg/kg p.c./j (orale) | Effets hépatiques dans l’étude de 90 jours | 1 à 154 |
| Matelas ou meubles contenant de la mousse (cutanée) | 1,31 à 134 mg/kg p.c./j (12 à 19 ans; 100 % absorption) | DSENO = 200 mg/kg p.c./j (orale) | Effets hépatiques dans l’étude de 90 jours | 1 à 153 |
| Matelas ou meubles contenant de la mousse (cutanée) | 0,75 à 103 mg/kg p.c./j (20 ans et plus; 100 % absorption) | DSENO = 200 mg/kg p.c./j (orale) | Effets hépatiques dans l’étude de 90 jours | 2 à 267 |
Abréviations — DSENO : dose sans effet nocif observé. On présume une absorption cutanée de 100 % pour les scénarios d’exposition cutanée, car l’absorption cutanée est considérée, dans la présente évaluation, comme étant équivalente à l’absorption par voie orale, étant donné qu’une étude de toxicité par voie orale est utilisée pour la caractérisation des risques.
Compte tenu de l’approche prudente utilisée pour estimer l’exposition au PTE par les milieux environnementaux, la mise en bouche d’articles en mousse et l’utilisation d’un décapant tout usage et d’un produit d’étanchéité en mousse, les ME calculées sont jugées adéquates pour répondre à toute incertitude dans les bases de données sur l’exposition et les effets sur la santé. Cependant, les ME calculées pour l’exposition cutanée prolongée au PTE, par exemple lorsqu’une personne s’allonge sur un matelas ou un meuble contenant de la mousse (tous les groupes d’âge) ou qu’un nourrisson ou un enfant est assis dans un siège, sont jugées potentiellement inadéquates pour compenser les incertitudes dans les bases de données.
3.7.3.2 PTBOE
Aucune étude de cancérogénicité n’a été trouvée pour le PTBOE et on ne s’attend pas à ce qu’il soit génotoxique (ATSDR 2012). Nous avons retenu une étude de toxicité par voie orale de 18 semaines comme étude la plus pertinente pour caractériser les risques pour la santé humaine liés à l’exposition au PTBOE (Reyna et Thake 1987, étude citée dans ATSDR 2002). Une LICDR10 de 8,88 mg/kg p.c./j a été calculée par l’ATSDR (2012) sur la base d’une vacuolisation hépatocellulaire périportale chez les mâles entre 173 à 209 mg/kg p.c./j (DSENO = 17-21 mg/kg p.c./j). Aucune étude de toxicité par voie cutanée à long terme n’était disponible, et cette valeur LICDR10 a donc été utilisée comme point de départ pour la caractérisation des risques liés à l’exposition quotidienne par voie cutanée. Aucun effet sur la reproduction ou le développement n’a été observé après une exposition par voie cutanée à des doses atteignant 1000 mg/kg p.c./j de PTBOE (Monsanto 1985d, étude citée dans ATSDR 2012). La DSENO de 1000 mg/kg p.c./j a été utilisée pour caractériser les risques pour la santé humaine dus à l’exposition cutanée à court terme au PTBOE, par l’utilisation de peinture antirouille.
La population canadienne générale peut être exposée au PTBOE par la poussière, l’air intérieur, l’eau et les aliments, y compris le lait maternel. L’exposition la plus élevée au PTBOE, due à l’utilisation de produits de consommation, survient lorsqu’une personne s’assoit sur un sofa ou qu’un nourrisson ou un enfant est placé dans un siège contenant du PTBOE, ou encore si on utilise de la peinture antirouille. Le tableau 3‑17 présente les valeurs pertinentes (estimations de l’exposition et points de départ des dangers) ainsi que les ME obtenues pour la caractérisation des risques d’exposition au PTBOE.
| Scénario d’exposition | Exposition systémique | Niveau d’effet critique | Critère d’effets critiques sur la santé | ME |
|---|---|---|---|---|
| Milieux environnementaux et aliments | 0,7 à 18,7 µg/kg p.c./j | LICDR= 8,88 mg/kg p.c./j | Vacuolisation hépatocellulaire périportale chez les mâles dans une étude chez le rat de 18 semaines | 475 à 12 686 |
| Mise en bouche de la mousse dans les jouets et produits pour enfants (orale) | 0,003 à 0,008 mg/kg p.c./j (0 à 6 mois) | LICDR= 8,88 mg/kg p.c./j | Vacuolisation hépatocellulaire périportale chez les mâles dans une étude chez le rat de 18 semaines | 1110 à 2960 |
| Mise en bouche de la mousse dans les jouets et produits pour enfants (orale) | 0,003 à 0,008 mg/kg p.c./j (0,5 à 4 ans) | LICDR= 8,88 mg/kg p.c./j | Vacuolisation hépatocellulaire périportale chez les mâles dans une étude chez le rat de 18 semaines | 1100 à 2960 |
| Siège de retenue pour enfant ou sofa contenant de la mousse (cutanée)a | 0,021 à 0,049 mg/kg p.c./j (0 à 6 mois) | LICDR= 8,88 mg/kg p.c./j | Vacuolisation hépatocellulaire périportale chez les mâles dans une étude chez le rat de 18 semaines | 181 à 423 |
| Siège de retenue pour enfant ou sofa contenant de la mousse (cutanée)a | 0,017 à 0,040 mg/kg p.c./j (0,5 à 4 ans) | LICDR= 8,88 mg/kg p.c./j | Vacuolisation hépatocellulaire périportale chez les mâles dans une étude chez le rat de 18 semaines | 222 à 522 |
| Meubles contenant de la mousse (cutanée)a | 0,029 à 0,068 mg/kg p.c./j (20 ans et plus) | LICDR= 8,88 mg/kg p.c./j | Vacuolisation hépatocellulaire périportale chez les mâles dans une étude chez le rat de 18 semaines | 131 à 306 |
| Peinture antirouille (cutanée)a | 0,76 mg/kg p.c./événement | DSENO = 1000 mg/kg p.c./j (HDT) | Aucun effet d’après une étude de 3 semaines chez le lapin | 1316 |
| Données de biosurveillance (femmes adultes) | 0,0068 µg/kg p.c./j | LICDR= 8,88 mg/kg p.c./j | Vacuolisation hépatocellulaire périportale chez les mâles dans une étude chez le rat de 18 semaines | > 1 million |
Abréviations — LICDR : limite inférieure de l’intervalle de confiance de la dose-repère; DSENO : dose sans effet nocif observé; DME : dose maximale d’essai.
a Une absorption cutanée ajustée de 40 % pour le PTCP (EU RAR 2008a) a été utilisée pour représenter l’absorption cutanée du PTBOE.
Compte tenu de l’approche prudente utilisée pour estimer l’exposition au PTBOE par les milieux environnementaux, les aliments et les produits de consommation, les ME calculées sont jugées adéquates compenser toute incertitude dans les bases de données sur l’exposition et les effets sur la santé.
3.7.3.3 PTEHx
Des tests ont été réalisés avec le PTEHx pour déterminer sa toxicité chronique et sa cancérogénicité pour les rats et les souris. On a constaté une augmentation des phéochromocytomes chez les rats mâles des deux groupes de doses et des carcinomes hépatocellulaires chez les souris femelles du groupe ayant reçu la dose élevée. Chez les rats, les phéochromocytomes présentent une fréquence de fond variable. Compte tenu de la faible fréquence des carcinomes hépatocellulaires, de son occurrence chez un seul sexe d’une espèce et de l’absence de signe de génotoxicité, on estime que le PTEHx ne présente pas un risque cancérogène significatif pour les humains (US NTP 1984, étude citée dans OMS 2000). De plus, on ne s’attend pas à ce que le PTEHx soit génotoxique (US EPA 2009). La DMENO de 357 mg/kg p.c./j, établie d’après l’hyperplasie des cellules folliculaires de la thyroïde dans l’étude chronique chez la souris, a été sélectionnée comme niveau d’effet critique pour caractériser les risques pour la santé humaine dus à l’exposition quotidienne au PTEHx. L’étude de toxicité par voie cutanée disponible était limitée, et par conséquent la DSENO de 1000 mg/kg p.c./j, établie par une étude par voie orale à doses répétées de 28 jours, a été utilisée pour caractériser les risques d’une exposition aiguë cutanée à des produits de consommation contenant du PTEHx (Pelletier et coll. 2020).
Le tableau 3‑18 présente les valeurs pertinentes (estimations de l’exposition et points de départ des dangers) ainsi que les ME résultantes pour la caractérisation des risques dus à l’exposition au PTEHx.
| Scénario d’exposition | Exposition systémique | Niveau d’effet critique | Critère d’effets critiques sur la santé | ME |
|---|---|---|---|---|
| Milieux environnementaux | 0,002 à 0,012 µg/kg p.c./j | DMENO = 357 mg/kg p.c./j | Hyperplasie des cellules folliculaires de la thyroïde dans une étude de 103 semaines | > 1 million |
| Agent de scellement de joint de revêtement de sol (cutanée)a | 0,21 à 1,3 mg/kg p.c./événement | DSENO = 1000 mg/kg p.c./j | Diminution de la prise de poids corporel dans l’étude de toxicité par voie orale de 28 jours | 769 à 4762 |
Abréviations — DMENO : dose minimale entraînant un effet nocif observé; DSENO : dose sans effet nocif observé.
a L’absorption cutanée est présumée être équivalente à l’absorption par voie orale.
En raison de l’approche prudente utilisée pour estimer l’exposition au PTEHx par les milieux environnementaux et les produits de consommation, les ME calculées sont jugées adéquates pour compenser toute incertitude dans les bases de données sur l’exposition et les effets sur la santé.
3.7.3.4 PBEHx
Aucune étude de cancérogénicité n’a été trouvée pour le PBEHx. Toutefois, on peut présumer que le PBEHx ne présente probablement pas de risque de cancérogénicité pour les humains, compte tenu de l’étude de cancérogénicité du PTEHx. On ne s’attend pas à ce que le PBEHx soit génotoxique. Une DSENO de 30 mg/kg p.c./j, établie d’après des effets hépatiques dans une étude de toxicité par voie orale de 28 jours (ECHA c2007-2018b), a été retenue comme critère d’effet le plus pertinent pour la caractérisation des risques liés à l’exposition au PBEHx.
La principale source d’exposition au PBEHx devrait être l’eau potable et l’utilisation d’huiles pour engrenages. Le tableau 3‑19 présente les valeurs pertinentes (estimations de l’exposition et points de départ des dangers) ainsi que les ME résultantes pour la caractérisation des risques dus à l’exposition au PBEHx.
| Scénario d’exposition | Exposition systémique | Niveau d’effet critique b | ME |
|---|---|---|---|
| Eau potable | 0,0097 à 0,051 µg/kg p.c./j | DSENO = 30 mg/kg p.c./j | > 588 235 |
| Huile pour engrenage (cutanée)a | 0,13 mg/kg p.c./événement | DSENO = 30 mg/kg p.c./j | 231 |
Abréviations — DSENO : dose sans effet nocif observé.
a On présume que l’absorption cutanée est de 100 %. Comme nous utilisons une étude de toxicité par voie orale pour caractériser les risques, nous considérons que l’absorption cutanée est équivalente à l’absorption orale.
b Effets sur la fonction hépatique (étude de 28 jours).
En raison de l’approche prudente utilisée pour estimer l’exposition au PBEHx par l’eau potable et par l’utilisation d’un nombre limité de produits de consommation, les ME calculées sont jugées adéquates pour compenser toute incertitude dans les bases de données sur l’exposition et les effets sur la santé.
3.7.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci‑dessous.
| Principale source d’incertitude | Impact |
|---|---|
| Nous avons trouvé peu de données canadiennes de surveillance de l’environnement (y compris les aliments). Des données provenant d’autres pays ont été utilisées pour estimer l’exposition, le cas échéant. | +/- |
| Pour l’évaluation de l’exposition par voie alimentaire, les principales sources de données (États Unis et Chine) sur la présence des substances indiquent de très faibles taux de détection positive du PTBOE dans les aliments, et ce renseignement n’a pas été pris en compte de manière quantitative dans l’évaluation de l’exposition. | + |
| Les concentrations maximales de PTBOE rapportées ont été appliquées à toutes les catégories d’aliments et nous avons présumé qu’elles étaient représentatives d’une catégorie plus large dans leur ensemble. | +/- |
| Il y a peu de données disponibles sur la présence de PTE et de PTBOE dans la mousse des sièges pour nourrisson et enfant et de PTBOE dans les meubles contenant de la mousse au Canada. | + |
| Absence de données sur la migration du PTBOE et du PTE hors des matériaux en mousse. | +/- |
| Données limitées sur l’absorption cutanée pour le PTE, le PTBOE, le PTEHx et le PBEHx. Par conséquent, nous avons utilisé une approche avec analogues, ou nous avons présumé une absorption cutanée de 100 %. | + |
| Aucune étude de toxicité chronique pour le PTE ou le PTBOE n’a été trouvée, et la base de données globale sur le PBEHx est limitée. | - |
| L’étude du NTP de 13 semaines sur l’exposition par voie orale chez le rat n’a pas examiné les effets du PTEHx sur la thyroïde. | - |
| La base de données sur la toxicité cutanée du PTE, du PTBOE, du PTEHx et du PBEHx est limitée. | +/- |
+ : incertitude pouvant entraîner une surestimation de l’exposition ou du risque; – : incertitude pouvant entraîner une sous-estimation de l’exposition ou du risque; +/- : potentiel inconnu pour ce qui est de surestimer ou de sous‑estimer le risque.
4. Évaluation du tétrabromo-1,4-phénylènebisoxybis(pentabromobenzène) [TBPhBOBPBBz]
4.1 Identité de la substance
Nous donnons dans le tableau 4-1 le no CAS, le nom sur la LIS, le nom commun, la structure chimique, la formule moléculaire et la masse moléculaire du tétrabromo1,4-phénylènebisoxybis(pentabromobenzène). Cette substance sera appelée ci-après par son abréviation TBPhBOBPBBz.
| No CAS (acronyme) | Nom sur la LIS (nom commun) | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
|
58965-66-5 (TBPhBOBPBBz) |
1,2,4,5-Tétrabromo-3,6-bis(pentabromophénoxy)benzène (tétrabromo-1,4-phénylènebisoxybis(pentabromobenzène) |
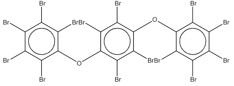 C18Br14O2 C18Br14O2
|
1366,85 |
Abréviations — CAS : Chemical Abstracts Service; LIS : Liste intérieure des substances
Des impuretés jusqu’à un niveau de 10 % peuvent être présentes dans cette substance, et peuvent inclure le décabromodiphényléther (décaBDE; no CAS 1163-19-5), l’octabromodibenzo-p-dioxine (no CAS 2170-45-8) et l’hexabromobenzène (no CAS 87-82-1). Le décaBDE a déjà fait l’objet d’une évaluation et est géré en vertu du Programme sur les substances existantes (EC 2006, EC 2010).
4.1.1 Choix d’analogues et utilisation de modèles QSAR
Une approche de lecture croisée à partir des données sur un analogue et les résultats de modèles QSAR (relation (quantitative) structure-activité) appropriés ont été utilisés pour éclairer les évaluations ayant trait à l’environnement et à la santé humaine. L’analogue a été choisi en se basant sur des similarités structurales ou fonctionnelles avec le TBPhBOBPBBz et la présence de données empiriques pertinentes. L’applicabilité de modèles QSAR a été déterminée au cas par cas. Des détails sur la lecture croisée et les modèles QSAR retenus pour informer l’évaluation du TBPhBOBPBBz ayant trait à l’environnement sont discutés dans les sections pertinentes du présent document.
L’analogue utilisé pour informer l’évaluation ayant trait à l’environnement est présenté dans le tableau 4-2. Le décabromodiphényléther (décaBDE) représente l’analogue structurel le plus proche disponible et est jugé approprié pour certaines propriétés physico-chimiques, de transformation et d’écotoxicité quand des données fiables sur le TBPhBOBPBBz ne sont pas disponibles.
| No CAS (acronyme) | Nom sur la LIS (nom commun) | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 1163-19-5 (décaBDE) |
Polybromodiphényléthers dont la formule moléculaire est C12H(10-n)BrnO, où 4 ≤ n ≤ 10 (PBDE) (décabromodiphényléther ou oxybis(pentabromobenzène)) |
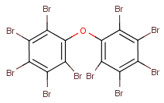 C12Br10O C12Br10O
|
959,171 |
a Environnement Canada 2010.
Abréviations — CAS : Chemical Abstracts Service; LIS : Liste intérieure des substances
4.2 Propriétés physiques et chimiques
Un résumé des données sur les propriétés physiques et chimiques du TBPhBOBPBBz est présenté dans le tableau 4‑3, ainsi que la plage des valeurs pour chaque propriété. Nous n’avons pas trouvé de données empiriques pour les propriétés physico-chimiques de cette substance. Par conséquent, nous avons estimé par lecture croisée les données empiriques pertinentes à partir de son analogue, le décaBDE, et tous les résultats modélisés disponibles. Cependant, il n’existe que quelques valeurs modélisées fiables pour le TBPhBOBPBBz, car, en raison de sa grande taille moléculaire et de sa chimie, cette substance est peu représentée dans les ensembles d’apprentissage des modèles. Comme les propriétés physico-chimiques énumérées dans le tableau 4‑3 pour le TBPhBOBPBBz sont basées sur des extrêmes et des valeurs obtenues dans le domaine de modélisation du décaBDE, plutôt que pour le TBPhBOBPBBz lui‑même, ces valeurs doivent être interprétées avec prudence. Compte tenu de ses caractéristiques structurales (trois cycles phénoliques entièrement bromés), il est raisonnable de s’attendre à ce que le TBPhBOBPBBz soit plus hydrophobe que le décaBDE.
| Propriété | Valeur ou plage | Type de données | Principale référence |
|---|---|---|---|
| État physique | Solide | Expérimentale | Rapport d’étude 1984 |
| Point de fusion (°C) | 350a à 419 | Modélisée | MPBPWIN 2010; TEST 2016 |
| Pression de vapeur (Pa) | 4,63 × 10-6 | Expérimentale (lecture croisée du décaBDE) | EC 2006 |
| Constante de la loi d’Henry (Pa·m3/mol) | 6,63 × 10-7a | Modélisé | HENRYWIN v3.20 2011 (méthode de contribution des liaisons) |
| Solubilité dans l’eau (mg/L) | < 0,0001 | Expérimentale (lecture croisée du décaBDE) | EC 2006; EC 2010 |
| Log Koe (sans dimension) | 8,7 | Expérimentale (lecture croisée du décaBDE) | EC 2010 |
| Log Koe (sans dimension) | > 10a | Modélisée | ACD/Percepta c1997-2012 |
| Log Kco (sans dimension) | 7,43a | Modélisée | KOCWIN 2010 |
| Dmin (nm) | 1,80 | Modélisée | CATALOGIC 2014 |
| Dmax (nm) | 1,98 | Modélisée | CATALOGIC 2014 |
Abréviations — Dmax : diamètre transversal maximal efficace; Dmin : diamètre transversal minimal efficace; Koe : coefficient de partage octanol-eau; Kco : coefficient de partage carbone organique–eau.
a Les prévisions sont incertaines, car la structure ou la valeur prévue sont aux limites du domaine d’application du modèle.
4.3 Sources et utilisations
Selon les renseignements déclarés en réponse aux enquêtes menées en vertu de l’article 71 de la LCPE, le TBPhBOBPBBz n’a pas été fabriqué au Canada en 2008, mais il a été importé et utilisé au Canada cette même année (moins de 10 000 kg), notamment dans des matériaux en plastique et en caoutchouc (Environnement Canada 2009). Toutefois, le TBPhBOBPBBz n’est ni importé ni utilisé actuellement au Canada. Selon Hardy et coll. (2012), la principale entreprise nord-américaine qui fabriquait cette substance a cessé de la fabriquer et en a limité sa distribution en 2010 et en janvier 2011. De plus, les fournisseurs en ligne de TBPhBOBPBBz commercial indiquent que le principal produit nord‑américain a été abandonné et n’est plus disponible et qu’il a été remplacé par le décabromodiphényl éthane (DBDPE) [SpecialChem 2000]. Cependant, Chen et coll. (2013) ont noté que d’autres fournisseurs en Asie continuent de commercialiser le TBPhBOBPBBz ou des produits contenant cette substance. Le TBPhBOBPBBz est répertorié comme produit chimique à faible volume de production (moins de 1000 000 kg/an) dans le Système d’information européen sur les substances chimiques (European Chemical Substance Information Systems, ESIS) [site consulté en novembre 2016] (ESIS 1995-2012).
Le TBPhBOBPBBz est considéré comme une substance ignifuge additive (Su et coll. 2016a), et comme substance potentielle de remplacement du décabromodiphényl éther (décaBDE) commercial (Kierkegaard et coll. 2004; Covaci et coll. 2011; EFSA 2012). Selon les données générales sur l’utilisation de cette substance, celle‑ci peut être utilisée dans des résines techniques et d’autres systèmes où des températures élevées sont employées pendant le traitement, notamment le nylon, le poly(téréphtalate d’éthane-1,2-diyle) [PET], le poly(téréphtalate de butane-1,4-diyle) [PBT] et les résines styréniques (SpecialChem 2000). En supposant qu’il s’agit d’un produit de remplacement du décaBDE et qu’il a été remplacé par le décabromodiphényl éthane (DBDPE), le TBPhBOBPBBz pourrait avoir des utilisations similaires à celles du décaBDE et du DBDPE dans les produits électriques et électroniques (p. ex., les téléviseurs, les ordinateurs, les électroménagers, les câbles et les fils) et dans la production de textiles (p. ex., les tissus d’ameublement et les draperies). Bien que cette substance n’ait pas été importée ou fabriquée au Canada, selon les données disponibles, il est possible qu’elle soit présente dans des produits commerciaux ou des produits de consommation vendus au Canada.
4.4 Rejets dans l’environnement
À l’heure actuelle, on ne dispose d’aucune donnée empirique sur les rejets de TBPhBOBPBBz au Canada. Comme les données actuelles indiquent que la substance n’est pas fabriquée, importée ou utilisée au Canada, les rejets de TBPhBOBPBBz dans l’environnement canadien sont probablement très faibles.
4.5 Devenir et comportement dans l’environnement
4.5.1 Devenir dans l’environnement
Compte tenu des propriétés physiques et chimiques du TBPhBOBPBBz et du devenir du décaBDE dans l’environnement (EC 2006), le TBPhBOBPBBz devrait résider principalement dans la fraction organique des particules, du sol ou des sédiments, selon le milieu dans lequel il est rejeté.
Le rapport d’évaluation de 2006 sur les PBDE (Environnement Canada 2006) indiquait que si 100 % du décaBDE étaient rejetés dans l’eau, 98,1 % seraient associés aux sédiments, 1,9 % se répartiraient dans l’eau, et des quantités négligeables se retrouveraient dans l’air et le sol. Si 100 % du décaBDE était rejeté dans l’air, 80,1 % se répartiraient dans le sol, 19 % dans les sédiments, et 0,6 % et 0,4 % dans l’air et l’eau, respectivement. Si le décaBDE était libéré dans le sol, 99,9 % y resteraient, et de très petites quantités se retrouveraient dans d’autres milieux.
Bien que les prévisions des modèles (New EQC 2011) indiquent qu’il subsiste un certain niveau d’incertitude, étant donné la tendance du TBPhBOBPBBz à se lier à la matière organique dans la colonne d’eau, ainsi que sa forte persistance, son potentiel de transport sur de grandes distances dans la colonne d’eau est probablement élevé. Des quantités limitées de TBPhBOBPBBz devraient atteindre l’air, et le potentiel de transport sur de grandes distances devrait être faible, comme le montre la distance parcourue caractéristique (DPC) estimée de 480 à 735 km pour le décaBDE (EC 2006). La DPC a été définie comme la distance parcourue par une parcelle d’air jusqu’à ce qu’environ 63 % de la substance chimique soit éliminé par des processus de dégradation ou de déposition (Klasmeier et coll. 2006).
4.6 Persistance et bioaccumulation
Les études empiriques sur la persistance et la bioaccumulation du TBPhBOBPBBz sont rares. Ce que l’on sait en gros de la persistance du TBPhBOBPBBz, c’est que cette substance n’est pas facilement biodégradable, qu’elle peut être sensible à l’hydrolyse en raison de sa structure chimique, et il a été empiriquement démontré qu’elle subit une débromation réductrice par étapes photolytiques dans une certaine mesure, bien que de nombreux scénarios en vertu desquels les expériences ont été menées ne reflètent pas les conditions environnementales naturelles (Chen et coll. 2013). Il n’y a pas de données empiriques disponibles sur la bioaccumulation, la bioamplification, ou l’amplification trophique du TBPhBOBPBBz. Sa valeur log Koe élevée (> 10) et sa grande taille moléculaire, avec un diamètre transversal de 1,8 à 2,0 nm, indiquent que cette substance a probablement un potentiel de biodisponibilité et de bioaccumulation très limité. Dans une étude sur les poissons, le TBPhBOBPBBz n’a pas présenté de signes de bioconcentration, même lorsque la substance était dissoute dans l’eau avec un solvant porteur qui aurait permis aux concentrations d’essai de dépasser la limite de solubilité estimée (Rapport d’étude 1988). Cependant, les modèles de calcul ont montré que les produits de phototransformation du TBPhBOBPBBz pouvaient être pertinents pour l’environnement, soit les PBPhBOBPBBz (polybromophénylènebisoxybis(polybromobenzène))-Br4, Br5 et Br6 (Chen et coll. 2011), qui pourraient potentiellement être bioaccumulables (les valeurs FBC vont de 3200 à 10 700 L/kg, avec des valeurs FBA supérieures à 106 L/kg). Des données additionnelles sur la persistance et la bioaccumulation sont résumées dans un document d’Environnement et Changement climatique Canada (2020g).
4.7 Potentiel d’effets nocifs sur l’environnement
4.7.1 Évaluation des effets sur l’environnement
Le TBPhBOBPBBz a, selon les prévisions, un mode d’action narcotique de base à la surface (QSAR Toolbox; OCDE 2016). Selon des données préliminaires, la substance peut également agir par un ou plusieurs modes d’action spécifiques. Des alertes structurelles concernant la toxicité potentielle pour la reproduction et le développement ont été trouvées via le schéma DART (QSAR Toolbox; OCDE 2016). Les métabolites des produits de bromation inférieurs de la photodégradation du TBPhBOBPBBz, par exemple le PBPhBOBPBBz-Br4 hydroxylé, sont connus également pour avoir des effets sur la reproduction ou le développement, et on a démontré qu’ils présentaient un léger potentiel de perturbation de la thyroïde à la fois dans des essais in silico et in vitro (Hill et coll. 2018).
Comme il est indiqué dans la section sur l’identité de la substance, les produits techniques contenant du TBPhBOBPBBz contiennent également des quantités mineures de décaBDE et des impuretés d’octabromodibenzo-p-dioxine (no CAS 2170-45-8) [< 10 %]. De plus, il a été démontré que l’exposition à la lumière du soleil de la forme dissoute et en poudre de TBPhBOBPBBz et de décaBDE entraîne la formation de congénères moins bromés, ainsi que des polybromodibenzofuranes et de dibenzofuranes (Su et coll. 2016a, 2016b). Su et coll. (2014, 2016b) ont étudié les effets de la dégradation photolytique du TBPhBOBPBBz sur des hépatocytes d’embryons de poulet et ont montré que la dégradation du TBPhBOBPBBz par la lumière naturelle du soleil génère des sous-produits qui induisent l’expression in vitro de gènes, en particulier le CYP1A4 médié par le récepteur des hydrocarbures aryliques (AhR), mais à un degré bien moindre que les sous-produits formés lors de l’irradiation du décaBDE. Su et coll. (2016b) ont montré que l’irradiation par la lumière du soleil peut transformer le TBPhBOBPBBz et le décaBDE dissous dans un solvant en photoproduits toxiques dont les puissances relatives prévues sont 30 fois et 3 fois inférieures à celles des BPC de type dioxine, d’après l’expression in vitro de l’ARNm du CYP1A4/5. Dans l’ensemble, plusieurs incertitudes subsistent, notamment la mesure dans laquelle les études sur la photodégradation du TBPhBOBPBBz (basées sur une substance en poudre ou dissoute dans un solvant) représentent des conditions environnementales naturelles. En outre, étant donné que seuls les effets in vitro au niveau des gènes ont été rapportés, il n’est pas certain que ces effets se traduisent par des effets nocifs sur les organismes entiers, pour ce qui est du TBPhBOBPBBz. Cependant, la capacité des dibenzo-p-dioxines polychlorées (PCDD) et des dibenzofurannes polychlorés (PCDF) ou d’autres hydrocarbures aromatiques halogénés (p. ex., BPC) à se lier à l’AhR est en corrélation avec leur capacité à induire l’expression génétique et à produire une toxicité (Abbot 1998).
Les résultats des études empiriques disponibles sur la toxicité aquatique pour le TBPhBOBPBBz et le décaBDE dans l’eau, les sédiments et le sol sont résumés dans les tableaux 4‑4 et 4‑5. Une analyse détaillée de la toxicité aquatique du décaBDE figure dans l’évaluation de cette substance (Environnement Canada 2006).
| Nom commun | Organisme d’essai | Critère d’effet | Valeur (mg/L) | Référence |
|---|---|---|---|---|
| TBPhBOBPBBz | Cladocère (Daphnia magna) | CE50 48 h | 680b | Rapport d’étude 1986b |
| TBPhBOBPBBz | Truite arc-en-ciel (Oncorhynchus mykiss) | CSEO | 1000a,b | Study submission 1986c |
| TBPhBOBPBBz | Médaka (Oryzias latipes) | CL50 48 h | 200c | Rapport d’étude 1988 |
| DécaBDE | Dactylèthre (Xenopus laevis) | CMAT (métamorphose différée) | 0,001032d | Qin et coll. 2010 |
Abréviations — CL50 : concentration létale à 50 %; CE50 : concentration entraînant un effet à 50 %; CSEO : concentration sans effet observé; CMAT : concentration maximale acceptable de toxiques.
a L’étude n’a révélé aucune mortalité ni aucun effet nocif, à quelque concentration de traitement que ce soit, avec une concentration maximale de 1000 mg/L.
b La substance d’essai a été ajoutée directement à l’eau de dilution et testée sous forme de suspension. Par conséquent, la toxicité est susceptible d’être sous-estimée.
c L’huile de ricin hydrogénée utilisée comme dispersant dans l’eau a donné une substance d’essai avec des concentrations expérimentales beaucoup plus élevées (2, 20, 200 mg/L) que la limite de solubilité dans l’eau pour le TBPhBOBPBBz (< 0,0001 mg/L) et par conséquent, cette étude est jugée moins fiable.
d La valeur CMAT a été calculée en prenant la moyenne géométrique de la CSEO (0,0001 mg/L) et de la CMEO (0,001 mg/L).
| Milieu | Organisme d’essai | Critère d’effet | Valeur (mg/kg poids sec (p.s.)) | Référence |
|---|---|---|---|---|
| Sédiments | Oligochète (Lumbriculus variegatus) | CSEO 28 j | 5000a | ACCBFRIP 2001a, 2001b |
| Sol | Lombric (Eisenia fetida) | CSEO (28 j pour la survie et 56 j pour la reproduction) | 5000a | ACCBFRIP 2001c |
Abréviations — CSEO : concentration sans effet observé a, basée sur les concentrations nominales.
a Valeur basée sur les concentrations nominales.
En ce qui concerne le décaBDE, les premières évaluations des dangers semblaient indiquer qu’il ne devrait pas y avoir d’effets toxiques aigus ou chroniques significatifs chez les organismes aquatiques à des concentrations inférieures aux limites de solubilité dans l’eau (p. ex., EC 2006; UKEA 2009). Cependant, des études plus récentes sur la toxicité de la substance en milieu aquatique ont rapporté des effets sur les organismes aquatiques, les poissons et les amphibiens, notamment des effets sur la croissance, la reproduction, le développement, la perturbation des hormones thyroïdiennes et des altérations neurocomportementales après une exposition à de faibles concentrations de décaBDE (Kuo et coll. 2010; Noyes et coll. 2011; Qin et coll. 2010; UKHSE 2012). La CSEO aquatique la plus faible pour l’exposition par l’eau était inférieure à 0,001 mg/L pour la métamorphose différée chez les amphibiens (Qin et coll. 2010). L’exposition des poissons au décaBDE par le régime alimentaire (études d’alimentation) avec des têtes-de-boule, à des concentrations pertinentes pour l’environnement, a montré que la substance peut interférer avec le système hormonal thyroïdien chez les poissons juvéniles (Noyes et coll. 2011, 2013). Ainsi, il existe toujours une possibilité que le TBPhBOBPBBz puisse avoir des effets sur le développement ou la reproduction des organismes à de très faibles concentrations. Cependant, étant donné la faible biodisponibilité prévue du TBPhBOBPBBz, ces effets pourraient être minimes. Les produits de débromation plus biodisponibles et bioaccumulables (p. ex., PBPhBOBPBBz Br4-) devraient avoir un potentiel toxique beaucoup plus élevé pour ce qui est de la reproduction et du développement. Il est à noter que la prévision de la toxicité aquatique pour les congénères du PBPhBOBPBBz Br4 à Br6 a été établie à l’aide d’ECOSAR. Cependant, les valeurs log Koe de ces substances (estimées entre 7,2 et 8,3) sont considérées comme se trouvant à l’extérieur du domaine du modèle (jusqu’à un log Koe de 5), et ces valeurs sont donc considérées comme incertaines et ne sont pas rapportées. Enfin, les dérivés de type dioxine produits par la photodégradation à la lumière solaire du TBPhBOBPBBz dissous dans des solvants peuvent accroître les effets toxiques potentiels du TBPhBOBPBBz dans l’environnement s’ils se forment dans des conditions naturelles.
4.7.2 Évaluation de l’exposition environnementale
Le TBPhBOBPBBz est considéré comme une substance ignifuge additive et a été utilisé dans des produits en plastique et en caoutchouc. Le TBPhBOBPBBz n’est pas fabriqué au Canada, et il n’est actuellement ni importé ni utilisé au Canada. Même si cette substance n’est actuellement ni importée ni fabriquée au Canada, il est possible qu’elle soit présente dans des produits commerciaux ou des produits de consommation vendus au Canada, mais il n’existe aucune donnée sur les quantités réelles de la substance dans ces produits au Canada. Selon Hardy et coll. (2012), le principal producteur nord‑américain de cette substance a cessé de la fabriquer il y a un certain temps et en a limité la distribution en 2010 et en janvier 2011.
Des campagnes d’échantillonnage ont été menées pour trouver le TBPhBOBPBBz et ses produits débromés dans l’environnement. Trouborst et coll. (2015) n’ont rapporté aucune détection de TBPhBOBPBBz et de substances PBPhBOBPBBz moins bromées dans les échantillons de sédiments prélevés en 2012 et 2013 dans l’écosystème des Grands Lacs. Les taux de récupération du TBPhBOBPBBz se sont avérés inférieurs à 50 % (26 % à 40 %) et il a été démontré qu’avec un degré de bromation croissant au‑dessus de 10 atomes de brome, il était de plus en plus difficile d’extraire et d’isoler les PBPhBOBPBBz de la matrice sédimentaire enrichie. La fiabilité de ces résultats est donc sujette à caution. Su et coll. (2017) ont également rapporté que le PBPhBOBPBBz ou le polybromodiphénoxybenzène méthoxylé (MeO-PBPhBOBPBBz) n’a été détecté dans aucun des 65 échantillons analysés d’eau ou de sédiments prélevés en 2010 dans les lacs Ontario et Érié.
Chen et coll. (2011) ont échantillonné des œufs de goéland argenté (Larus argentatus) en 2009 dans 14 sites de colonies dans la région des Grands Lacs et ont détecté des substances MeO-PBPhBOBPBBz. Plus précisément, ils ont trouvé un certain nombre d’échantillons contenant des PBPhBOBPBBz Br4 à Br6 méthoxylés dans les homogénats d’œufs. Chen et coll. (2011) ont indiqué que ces congénères méthoxylés pourraient être des métabolites de produits contenant du TBPhBOBPBBz débromé. Les concentrations totales de MeO-PBPhBOBPBBz allaient de moins de 0,2 à 36,8 ng/g p.h. dans des homogénats d’œufs regroupés (recueillis en 2009), dans 14 sites de colonies de goélands argentés dans la région des Grands Lacs, la concentration la plus élevée étant celle de l’île Channel-Shelter dans la baie de Saginaw (lac Huron).
Compte tenu des rejets industriels dans l’eau dus à la fabrication de plastique, on pourrait s’attendre à une exposition au TBDPB dans les sédiments et les sols. Cependant, comme le TBPhBOBPBBz n’est ni fabriqué, importé ou utilisé au Canada et que l’échantillonnage (bien que limité) n’a pas permis de détecter cette substance dans l’environnement canadien, son potentiel d’exposition est donc jugé négligeable et n’est pas étudié plus à fond.
4.7.3 Caractérisation des risques pour l’environnement
Le risque de rejet généralisé de TBPhBOBPBBz dans l’environnement canadien est actuellement jugé négligeable, car cette substance n’est ni fabriquée ni utilisée au Canada, et elle n’a pas été détectée dans l’environnement. La très faible solubilité dans l’eau du TBPhBOBPBBz (estimée à < 0,0001 mg/L d’après les données sur les analogues) et son log Koe élevé (estimé à 8,7 d’après les données sur les analogues; valeur modélisée > 10), limitent probablement sa biodisponibilité. Cette substance ne devrait pas s’accumuler grandement dans les organismes. Le TBPhBOBPBBz a un faible potentiel de toxicité d’après les données de toxicité empiriques. Cependant, des données de toxicité analogues pour le décaBDE semblent indiquer des effets potentiels sur les amphibiens à de faibles concentrations. Il existe donc une incertitude quant au potentiel de toxicité chronique du TBPhBOBPBBz pour la reproduction et le développement.
Bien que l’exposition actuelle de l’environnement au TBPhBOBPBBz ne soit pas préoccupante, cette substance a été envisagée comme substance de remplacement du décaBDE et du DBDPE. Bien qu’il y ait une certaine incertitude quant au potentiel de photodégradation de cette substance pour former des congénères moins bromés des PBPhBOBPBBz et des produits de type dioxine, ces substances peuvent être beaucoup plus biodisponibles, bioaccumulables et donc intrinsèquement plus toxiques que le TBPhBOBPBBz. Bien qu’il soit peu probable que l’exposition actuelle au TBPhBOBPBBz dans l’environnement canadien soit préoccupante, on estime néanmoins que le TBPhBOBPBBz présente un risque élevé en raison de ses produits de photodégradation potentiels. Il pourrait donc y avoir un risque pour l’environnement canadien si l’exposition venait à augmenter.
4.7.4 Sensibilité de la conclusion aux principales incertitudes
Des études empiriques ont montré que le TBPhBOBPBBz peut subir une débromation photolytique réductrice par étapes qui suit des modèles de dégradation cinétique de premier ordre lorsqu’il est exposé aux rayons UV ou à la lumière naturelle du soleil et lorsqu’il est dissous dans des solvants (p. ex., tétrahydrofurane, méthanol ou n‑hexane). La possibilité que les formes débromées soient plus biodisponibles ou intrinsèquement toxiques que la substance d’origine, le TBPhBOBPBBz, est préoccupante. La formation de composés bromés de type dioxine-furane à partir du TBPhBOBPBBz, par l’exposition naturelle à la lumière du soleil, suscite également des inquiétudes. Cependant, il n’existe pas de données permettant d’étayer la possibilité que cette transformation se produise dans les milieux aquatiques ou terrestres.
En supposant que la photolyse du TBPhBOBPBBz se produise dans un milieu naturel, il subsiste des incertitudes quant à l’ampleur de la production des produits de transformation (PBPhBOBPBBz, dioxine et furane). Comme le TBPhBOBPBBz n’a pas été détecté dans les sédiments (un puits prévisible pour cette substance), la présence de MeO-PBPhBOBPBBz dans les œufs de goélands argentés semble indiquer que ces derniers pourraient avoir accumulé ces contaminants en étant exposés à des matières dans des installations de déchets solides. Des travaux supplémentaires sont toutefois nécessaires pour déterminer la source des MeO-PBPhBOBPBBz accumulés afin de tirer des conclusions quant à l’exposition au TBPhBOBPBBz dans l’environnement canadien.
4.8 Potentiel d’effets nocifs sur la santé humaine
4.8.1 Évaluation de l’exposition au TBPhBOBPBBz
Selon les renseignements déclarés en réponse aux enquêtes menées en vertu de l’article 71 de la LCPE (Environnement Canada 2009), le TBPhBOBPBBz a déjà été importé au Canada. Toutefois, selon des renseignements ultérieurs, le TBPhBOBPBBz n’est plus fabriqué par le principal producteur nord-américain (Hardy et coll. 2012), et le principal produit nord-américain a été abandonné (SpecialChem 2000).
D’après les renseignements généraux sur l’utilisation du TBPhBOBPBBz, cette substance peut être utilisée comme additif chimique dans les fils, les câbles, certaines matières plastiques et les résines styréniques. Le TBPhBOBPBBz ne produit pas d’efflorescence (Weil et Levchik 2003), et on ne s’attend donc pas à ce qu’il soit grandement rejeté par toute matière plastique ou polymère.
Selon les renseignements disponibles, on ne s’attend pas à ce que la population générale au Canada soit exposée au TBPhBOBPBBz.
4.8.2 Évaluation des effets du TBPhBOBPBBz sur la santé
D’après les classifications effectuées par d’autres organismes nationaux ou internationaux en matière de cancérogénicité, de génotoxicité, de toxicité pour le développement ou de toxicité pour la reproduction, le TBPhBOBPBBz ne présente pas un risque élevé pour la santé humaine. Cette substance ne figure pas non plus sur la Liste des substances extrêmement préoccupantes candidates pour une autorisation, de l’Agence européenne des produits chimiques (ECHA 2018). Pour le moment, une étude plus approfondie des effets de cette substance sur la santé n’est pas justifiée, car on ne prévoit pas à ce que la population canadienne générale y soit exposée.
4.8.3 Caractérisation des risques du TBPhBOBPBBz pour la santé humaine
On ne s’attend pas à ce que la population générale soit exposée au TBPhBOBPBBz par l’intermédiaire des milieux environnementaux, des aliments ou de l’utilisation de produits de consommation, et les organismes nationaux ou internationaux n’ont pas désigné cette substance comme présentant un risque élevé. Compte tenu de ces facteurs, le risque pour la santé humaine est jugé faible.
4.8.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Bien que la base de données sur l’exposition comporte certaines limitations (p. ex., aucune surveillance environnementale), une approche qualitative de la caractérisation des risques est jugée appropriée pour cette évaluation, car on ne s’attend pas à ce que le TBPhBOBPBBz soit utilisé au Canada.
5. Conclusion
En tenant compte de tous les éléments de preuve avancés dans la présente ébauche d’évaluation préalable, il existe un risque d’effets nocifs sur l’environnement dû au PTPh, au PBPhDPh, au PBBPhPh, au PMNDPh et au PTPPh. Il est proposé de conclure que ces substances satisfont aux critères de l’alinéa 64 a) de la LCPE, car elles pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions qui ont ou qui peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou sa diversité biologique. Toutefois, il est proposé de conclure que ces mêmes substances ne satisfont pas aux critères de l’alinéa 64 b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger pour l’environnement essentiel à la vie.
En tenant compte de tous les éléments de preuve avancés dans la présente ébauche d’évaluation préalable, le PTE, le PTBOE, le PTEHx, le PBEHx et le TBPhBOBPBBz présentent un faible risque d’effets nocifs sur l’environnement. Il est proposé de conclure que le PTE, le PTBOE, le PTEHx, le PBEHx et le TBPHBOBPBBz ne satisfont pas aux critères des alinéas 64 a) et 64 b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou sa diversité biologique ou qui constituent ou peuvent constituer un danger pour l’environnement essentiel à la vie.
En tenant compte de tous les renseignements présentés dans la présente ébauche d’évaluation préalable, il est proposé de conclure que le PTPPh et le PTE satisfont aux critères de l’alinéa 64 c) de la LCPE, car ils pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaines.
En tenant compte de tous les renseignements présentés dans la présente ébauche d’évaluation préalable, il est proposé de conclure que le PTPh, le PBPhDPh, le PBBPhPh, le PMNDPh, le PTBOE, le PTEHx, le PBEHx et le TBPhBOBPBBz ne satisfont pas aux critères de l’alinéa 64 c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaines.
Il est donc proposé de conclure que le PTPh, le PBPhDPh, le PBBPhPh, le PMNDPh, le PTPPh et le PTE satisfont à un ou plusieurs des critères de l’article 64 de la LCPE.
Il est également proposé de conclure que le PTBOE, le PTEHx, le PBEHx et le TBPhBOBPBBz ne satisfont à aucun des critères de l’article 64 de la LCPE.
Il est également proposé de conclure que le PTPh et le PTE satisfont aux critères de persistance, mais pas à ceux de la bioaccumulation, que le PBPhDPh et le PMNDPh ne satisfont pas aux critères de persistance et de bioaccumulation, que le PBBPhPh et le PTPPh ne satisfont pas aux critères de persistance, mais satisfont à ceux de bioaccumulation du Règlement sur la persistance et la bioaccumulation de la LCPE.
Références
Abbott B. et Birnbaum L. 1998. « Dioxin and teratogenesis ». Dans : Puga A et Wallace K, directeurs. Molecular biology of the toxic response. Taylor and Francis. p. 439-449. (Disponible en anglais seulement.)
Abdollahi A, Eng A, Jantunen L, Ahrens L, Shoeib M, Parnis J et Harner T. 2017. « Characterization of polyurethane foam (PUF) and sorbent impregnated PUF (SIP) disk passive air samplers for measuring organophosphate flame retardants ». Chemosphere. 167 :212-219. (Disponible en anglais seulement.)
ACD/Percepta [prediction module]. c1997-2012. Toronto (ON) : Advanced Chemistry Development, Inc. (Disponible en anglais seulement.)
[ACC] American Chemistry Council. 2005. Phosphoric Acid Derivatives Category Test Plan and Data Assessment. (Disponible en anglais seulement.)
[ACCBFRIP] American Chemistry Council Brominated Flame, Retardant Industry Panel. 2001b. Decabromodiphenyl ether : A prolonged sediment toxicity test with Lumbriculus variegatus using spiked sediment with 5% total organic carbon. Rapport final. No de project 439A-114, Wildlife International, Ltd., February. (Disponible en anglais seulement.)
[ACCBFRIP] American Chemistry Council, Brominated Flame Retardant Industry Panel. 2001a. Decabromodiphenyl ether : A prolonged sediment toxicity test with Lumbriculus variegatus using spiked sediment with 2% total organic carbon. Rapport final. No de project 439A-113, Wildlife International, Ltd., February. (Disponible en anglais seulement.)
Adams WF, Kimerle RA, Heidolph BB et Michael PR. 1983. « Field comparison of laboratory-derived acute and chronic toxicity data ». Aquatic Toxicology and Hazard Assessment : Sixth Symposium, ASTM STP 802. Dans : Bishop RD, Cardwell RD et Heidolph BB, directeurs. American Society for Testing and Materials. p. 367-385. (Disponible en anglais seulement.)
Adams WJ et Heidoph BB. 1985. « Short-cut chronic toxicity estimates using Daphnia magna ». Aquatic Toxicology and Hazard Assessment : Seventh Symposium, ASTM STP 854. Dans : Cardwell RD, Purdy R et Bahner RC, directeurs. American Society for Testing and Materials. p. 87-103. (Disponible en anglais seulement.)
Ali N, Dirtu A, Van den Eede N, Goosey E, Harrad S, Neels H, Mannetje A, Coakley J, Douwes J et Covaci A. 2012. « Occurrence of alternative flame retardants in indoor dust from New Zealand : Indoor sources and human exposure assessment ». Chemosphere. 88 :1276-1282. (Disponible en anglais seulement.)
Alves A, Covaci A et Voorspoels S. 2017. « Method development for assessing the human exposure to organophosphate flame retardants in hair and nails ». Chemosphere 168 :692-698. (Disponible en anglais seulement.)
Anderson C, Wischer D, Schmieder A et Spiteller M. 1993. « Fate of triphenyl phosphate in soil ». Chemosphere. 27(5) :869-879. (Disponible en anglais seulement.)
Andresen JA, Muir D, Ueno D, Darling C, Theobold N et Bester K. 2007. « Emerging pollutants in the North Sea in comparison to Lake Ontario, Canada data ». Environ Toxicol Chem. 26 (6) :1081-1089. (Disponible en anglais seulement.)
[AOPWIN] Atmospheric Oxidation Program for Microsoft Windows [modèle d’estimation]. 2010. Ver. 1.92a. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. (Disponible en anglais seulement.)
Aragon M, Borrull F et Marce RM. 2013. « Thermal desorption-gas chromatography-mass spectrometry method to determine phthalate and organophosphate esters from air samples ». J Chromatogr A. 1303 :76-82. (Disponible en anglais seulement.)
Aragon M, Marce RM et Borrull F. 2012. « Determination of phthalates and organophosphate esters in particulated material from harbour air samples by pressurised liquid extraction and gas chromatography‑mass spectrometry ». Talanta. 101 :473-478. (Disponible en anglais seulement.)
Arnot JA et Gobas FAPC. 2003a. « A Generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs ». QSAR Comb Sci. 22(3) :337-345. (Disponible en anglais seulement.)
Arnot JA et Gobas FAPC. 2003b. Categorization of organic substances on the Domestic Substances List for bioaccumulation potential. Rapport à Environnement Canada, Direction des substances existantes. Juin 2003. Gatineau (QC) : Environnement Canada. (Disponible en anglais seulement.)
Arnot JA, Mackay D et Bonnell M. 2008b. « Estimating metabolic biotransformation rates in fish from laboratory data ». Environ Toxicol Chem. 27(2) :341-351. (Disponible en anglais seulement.)
Arnot JA, Mackay D, Parkerton TF et Bonnell M. 2008a. « A database of fish biotransformation rate for organic chemicals ». Environ Toxicol Chem. 27(11) :2263-2270. (Disponible en anglais seulement.)
Ash M et Ash I. 2009. Specialty Chemicals - Source Book. 4th ed. Endicott (NY). Synapse Information Resources, Inc. [Consulté le 4 mai 2018 depuis Knovel.] (Disponible en anglais seulement.)
[ASTER] Assessment Tools for the Evaluation of Risk. 1999. Duluth (MN) : US Environmental Protection Agency, Mid-Continent Ecology Division. [Accès restreint.] (Disponible en anglais seulement.)
[ATSDR] Agency for Toxic Substances and Disease Registry. 2012. Toxicological profile for Phosphate Ester Flame Retardants [PDF].Atlanta (GA) : US Department of Health and Human Services, Public Health Service [Consulté le 26 octobre 2017.] (Disponible en anglais seulement.)
Bayer AG. 1995. Triethylphosphate. Developmental toxicity study in rats after oral administration, with cover letter dated 10/24/95. Triethylphosphate (78-40-0). Fiche No OTS0558192. (Disponible en anglais seulement.)
Behl M, Hsieh JH, Shafer TJ, Mundy WR, Rice JR, Boyd WA, Freedman JH, Hunter ES 3rd, Jarema KA, Padilla S et coll. 2015. « Use of alternative assays to identify and prioritize organophosphorus flame retardants for potential developmental and neurotoxicity ». Neurotoxicol Teratol. 52 :181-193. (Disponible en anglais seulement.)
Bengtsson GE, Tarkpea M, Sletten T, Carlberg GE et Kringstad A. 1986. « Bioaccumulation and effects of some technical triaryl phosphate products in fish and Nitocra spinipes ». Environ Toxicol Chem. 5 :853-861. (Disponible en anglais seulement.)
Berger M et Schwarzbauer J. 2016. « Historical deposition of riverine contamination on terrestrial floodplains as revealed by organic indicators from an industrial point source ». Water Air Soil Pollut. 227 :1-14. (Disponible en anglais seulement.)
Bergh C, Torgrip R, Emenius G et Ostman C. 2011. « Organophosphate and phthalate esters in air and settled dust – a multi-location indoor study ». Indoor Air. 21 :67-76. (Disponible en anglais seulement.)
[BCFBAF] Bioaccumulation Program for Windows [modèle d’estimation] 2012. Ver. 3.10. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. (Disponible en anglais seulement.)
[BIOWIN] Biodegradation Probability Program for Microsoft Windows [modèle d’estimation]. 2008. Ver. 4.10. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. (Disponible en anglais seulement.)
Bjornsdotter MK, Romera-Garcia E, Borrull J, de Boer J, Rubio S et Ballesteros-Gomez A. 2018. « Presence of diphenyl phosphate and aryl-phosphate flame retardants in indoor dust from different microenvironments in Spain and the Netherlands and estimation of human exposure ». Environ Int. 112 :59-67. (Disponible en anglais seulement.)
Blum KM, Andersson PL, Ahrens L, Wiberg K, Haglund p. 2018. « Persistence, mobility and bioavailability of emerging organic contaminants discharged from sewage treatment plants ». Sci Total Environ. 612 :1532-1542. (Disponible en anglais seulement.)
Boethling RS, Howard PH, Beauman JA et Larosche ME. 1995. « Factors for intermedia extrapolation in biodegradability assessment ». Chemosphere. 30 :741-752. (Disponible en anglais seulement.)
Bohlen H, Hicke K, Stoebel AO, Zierott M et Thiemann W. 1989. « Die Belastung der Unterweser im bremischen Raum mit Halogenorganika und Phosphorsaeureestern I ». Vom Wasser. 72 :185-197 [Cité par ECETOC 1992a.] (Disponible en allemand seulement.)
Bollmann UE, Moller A, Xie Z, Ebinghaus R et Einax JW. 2012. « Occurrence and fate of organophosphorus flame retardants and plasticizers in coastal and marine surface waters ». Water Res. 46 :531-538. (Disponible en anglais seulement.)
Brandsma SH, Leonards PEG, Leslie HA et de Boer J. 2015. « Tracing organophosphorus and brominated flame retardants and plasticizers in an estuarine food web ». Sci Total Environ. 505 :22-31. (Disponible en anglais seulement.)
Brommer S et Harrad S. 2015. « Sources and human exposure implications of concentrations of organophosphate flame retardants in dust from UK cars, classrooms, living rooms, and offices ». Environ Int. 83 :202-207. (Disponible en anglais seulement.)
Butt C, Congleton J, Hoffman K, Fang M et Stapleton H. 2014. « Metabolites of organophosphate flame retardants and 2-ethylhexyl tetrabromobenzoate (EH-TBB) in urine from paired mothers and toddlers ». Environ Sci Technol. 48 :10432-10438. (Disponible en anglais seulement.)
Butt C, Hoffman K, Chen A, Lorenzo A, Congleton J et Stapleton H. 2016. « Regional comparison of organophosphate flame retardant (PFR) urinary metabolites and tetrabromobenzoic acid (TBBA) in mother-toddler pairs from California and New Jersey ». Environ Int. 94 :627-634. (Disponible en anglais seulement.)
Canada, ministère de l’Environnement. 2012. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances de la Liste intérieure [PDF]. Gazette du Canada, Partie I, vol. 146, n° 48, supplément.
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L.C. 1999, ch.33. Gazette du Canada, partie III, vol. 22, n°3.
Cao D, Guo J, Wang Y, Li Z, Liang K, Corcoran MB, Hosseini S, Bonina SM, Rockne KJ, Sturchio NC et coll. 2017. « Organophosphate esters in sediment of the Great Lakes ». Environ Sci Technol. 51(3) :1441-1449. (Disponible en anglais seulement.)
Castorina R, Bradman A, Stapleton H, Butt C, Avery D, Harley K, Gunier R, Holland N et Eskenazi B. 2017. « Current-use flame retardants : Maternal exposure and neurodevelopment in children of the CHAMACOS cohort ». Chemosphere 189 :574-580. (Disponible en anglais seulement.)
CATALOGIC [modèle environmental fate and ecotoxicity model]. 2014. Ver. 5.11.15. Bourgas (BG) : University Prof. Dr. Assen Zlatarov, Laboratory of Mathematical Chemistry. (Disponible en anglais seulement.)
[CCE] Commission de coopération environnementale. 2015a. Amélioration des connaissances trilatérales sur les ignifugeants que contiennent des produits manufacturés : analyse de la chaîne d’approvisionnement de certains ignifugeants que contiennent des produits manufacturés utilisés à l’intérieur [PDF]. Montréal (Québec) : CCE. 32 p. [Consulté le 3 mars 2018.]
[CCE] Commission de coopération environnementale. 2015b. Amélioration des connaissances trilatérales sur les ignifugeants que contiennent des produits manufacturés : analyse de certains ignifugeants contenus dans les meubles de bureau et de maison [PDF]. Montréal (Québec) : CCE. 16 p. [Consulté le 3 mars 2018.]
[CEH] Center for Environmental Health. 2013a. Playing on poisons : Harmful flame retardants in children’s furniture [PDF]. Oakland (CA) : Center for Environmental Health. 19 p. [Consulté le 17 mars 2016.] (Disponible en anglais seulement.)
[CEH] Center for Environmental Health. 2013b. Naptime nightmares : toxic flame retardants in child care nap mats [PDF]. Oakland (CA) : CEH. 18 p. [Consulté le 17 mars 2016.] (Disponible en anglais seulement.)
[CIR] Cosmetic Ingredient Review. 2018. Safety Assessment of Triphenyl Phosphate as Used in Cosmetics. Rapport final. 18 septembre 2018. Washington (DC) : CIR. [Consulté le 23 octobre 2018.] (Disponible en anglais seulement.)
Cequier E, Ionas AC, Covaci A, Marcé RM, Becher G et Thomsen C. 2014. « Occurrence of a broad range of legacy and emerging flame retardants in indoor environments in Norway ». Environ Sci Technol. 48 :6827-6835. (Disponible en anglais seulement.)
Cequier E, Sakhi AK, Marce RM, Becher G et Thomsen C. 2015. « Human exposure pathways to organophosphate triesters — A biomonitoring study of mother–child pairs ». Environ Int. 75 :159-165. (Disponible en anglais seulement.)
Chau HC, Kadokami K, Duong HT, Kong L, Nguyen T, Nguyen TQ et Ito Y. 2018. « Occurrence of 1153 organic micropollutants in the aquatic environment of Vietnam ». Environ Sci Pollut Res. 25 :7147-7156. (Disponible en anglais seulement.)
ChemCAN [modèle de fugacité de niveau III de 24 régions du Canada]. 2003. Version 6.00. Peterborough (ON) : Trent University, Canadian Centre for Environmental Modelling and Chemistry (Disponible en anglais seulement.)
ChemIDplus [base de données]. 1993– . Bethesda (MD) : US National Library of Medicine. [Consulté le 16 février 2018.] (Disponible en anglais seulement.)
Chen D, Letcher RJ et Chu S. 2012. « Determination of non-halogenated, chlorinated and brominated organophosphate flame retardants in herring gull eggs based on liquid chromatography–tandem quadrupole mass spectrometry ». J Chromatogr A. 1220 :169-174. (Disponible en anglais seulement.)
Chen D, Letcher RJ, Gauthier LT et Chu S. 2013. « Tetradecabromodiphenoxybenzene flame retardant undergoes photolytic debromination ». Environ Sci Technol. 47 :1373−1380. (Disponible en anglais seulement.)
Chen D, Letcher RJ, Gauthier LT, Chu S, McCrindle R et Potter D. 2011. « Novel methoxylated polybrominated diphenoxybenzene congeners and possible sources in herring gull eggs from the Laurentian Great Lakes of North America ». Environ Sci Technol. 45 :9523-9530. (Disponible en anglais seulement.)
Christensen V, Lee K, Kieta K et Elliott S. 2010. Presence of selected chemicals of emerging concern in water and bottom sediment from the St. Louis River, St. Louis Bay, and Superior Bay, Minnesota and Wisconsin. Rapport final. Reston (VA) : U.S. Geological Survey Scientific Investigations Report 2012-5184. 23 p. (Disponible en anglais seulement.)
Christia C, Poma G, Besis A, Samara C et Covaci A. 2018. « Legacy and emerging organophosphorus flame retardants in car dust from Greece : Implications for human exposure ». Chemosphere. 196 :231-239. (Disponible en anglais seulement.)
Chu S et Letcher RJ. 2015. « Determination of organophosphate flame retardants and -plasticizers in lipid-rich matrices using dispersive solid-phase extraction as a sample cleanup step and ultra-high performance liquid chromatography with atmospheric pressure chemical ionization mass spectrometry ». Anal Chim Acta. 885 :183-190. (Disponible en anglais seulement.)
City of Toronto. 2002a. Water quality quarterly report (January–March 2002). Quarterly Report. Toronto (ON) : Works and Emergency Services. 23 p. (Disponible en anglais seulement.)
City of Toronto. 2002b. Water quality quarterly report (April–June 2002). Quarterly Report. Toronto (ON) : Works and Emergency Services. 22 p. (Disponible en anglais seulement.)
City of Toronto. 2002c. Water quality quarterly report (July–September 2002). Quarterly Report. Toronto (ON) : Works and Emergency Services. 22 p. (Disponible en anglais seulement.)
City of Toronto. 2002d. Water quality quarterly report (October–December 2002). Quarterly Report. Toronto (ON) : Works and Emergency Services. 22 p. (Disponible en anglais seulement.)
City of Toronto. 2003a. Water quality quarterly report (January–March 2003). Quarterly Report. Toronto (ON) : Works and Emergency Services. 18 p. (Disponible en anglais seulement.)
City of Toronto. 2003b. Water quality quarterly report (April–June 2003). Quarterly Report. Toronto (ON) : Works and Emergency Services. 19 p. (Disponible en anglais seulement.)
City of Toronto. 2003c. Water quality quarterly report (July–September 2003). Quarterly Report. Toronto (ON) : Works and Emergency Services. 20 p. (Disponible en anglais seulement.)
Clark A, Yoon S et Sheesley RJ « Spatial and temporal distributions of organophosphate ester concentrations from atmospheric particulate matter samples collected across Houston, TX ». Environ Sci Technol. 51 :4239−4247. (Disponible en anglais seulement.)
Cleveland L, Mayer FL, Buckler DR et Palawski DU. 1986. « Toxicity of five alkyl-aryl phosphate ester chemicals to four species of freshwater fish ». Environ Toxicol Chem. 5 :273-282. (Disponible en anglais seulement.)
Coelho SD, Sousa AC, Isobe T, Kim JW, Kunisue T, Nogueira AJ et Tanabe S. 2016. « Brominated, chlorinated and phosphate organic contaminants in house dust from Portugal ». Sci Total Environ. 569-570 :442-449. (Disponible en anglais seulement.)
[ConsExpo Web] Consumer Exposure Web Model. 2016. Bilthoven (NL) : Rijksinstituut voor Volksgezondheid en Milieu [institut national pour la santé publique et l’environnement.] (Disponible en anglais et en néerlandais [site Web].)
Cooper EM, Kroeger G, Davis K, Clark C, Ferguson PL et Stapleton H. 2016. « Results from screening polyurethane foam based consumer products for flame retardant chemicals : Assessing impacts on the change in the furniture flammability standards ». Environ Sci Technol. 50 :10653-10660. (Disponible en anglais seulement.)
Covaci A, Harrad S, Abdallah M A-E, Ali N, Law RJ, Herzke D et de Wit C. 2011. « Novel brominated flame retardants : A review of their analysis, environmental fate and behaviour ». Environ Int. 37 :532-556. (Disponible en anglais seulement.)
Crump D, Chiu S et Kennedy SW. 2012. « Effects of tris(1,3-dichloro-2-propyl) phosphate and tris(1‑chloropropyl) phosphate on cytotoxicity and mRNA expression in primary cultures of avian hepatocytes and neuronal cells ». Toxicol Sci. 126 :140-8. (Disponible en anglais seulement.)
Crump D, Farhat A, Chiu S, Williams K, Jones S et Langlois V. 2016. « Use of a novel double-crested cormorant ToxChip PCR array and the EROD assay to determine effects of environmental contaminants in primary hepatocytes ». Environ Sci Technol. 50 :3265−3274. (Disponible en anglais seulement.)
Cui K, Wen J, Zeng F, Li S, Zhou X et Zeng Z. 2017. « Occurrence and distribution of organophosphate esters in urban soils of the subtropical city, Guangzhou, China ». Chemosphere. 175 :514-520. (Disponible en anglais seulement.)
Dandan C, Jiehong G, Yawei W, Zhuona L, Kang L, Margaret C, Soheil H, Solidea B, Karl R, Neil S, John G, Jingfu L, An L et Guibin J. 2017. « Organophosphate esters in sediment of the Great Lakes ». Environ Sci Technol. 51 :1441−1449. (Disponible en anglais seulement.)
David MD et Seiber JN. 1999. « Accelerated hydrolysis of industrial organophosphates in water and soil using sodium perborate ». Environ Pollut. 105 :121-128. (Disponible en anglais seulement.)
De Silva AO, St. Pierre K, St. Louis V, Spencer C, Lehnherr I et Muir DC. 2016b. « Organophosphate flame retardants and plasticizers in the High Arctic : Deposition and transport in Lake Hazen ». Dans : 7th SETAC World Congress, SETAC North America 37th Annual Meeting / Society of Environmental Toxicology and Chemistry Abstract Book. Pensacola [FL] p. 311. (Disponible en anglais seulement.)
De Silva AO, Young C, Spencer C, Muir DC, Criscitiello A, Sharp M, Cook C et Pickard H. 2016a. « Long range transport of organophosphate flame retardants and plasticizers : Deposition in a High Arctic ice cap ». Dans : 7th SETAC World Congress, SETAC North America 37th Annual Meeting / Society of Environmental Toxicology and Chemistry Abstract Book. Pensacola [FL.] p. 311-312. (Disponible en anglais seulement.)
Dimitrov S, Dimitrova N, Parkerton T, Comber M, Bonnell M et Mekenyan O. 2005. « Base-line model for identifying the bioaccumulation potential of chemicals ». SAR QSAR Environ Res. 16(6) :531-554. (Disponible en anglais seulement.)
Ding J, Shen X, Liu W, Covaci A et Yang F. 2015. « Occurrence and risk assessment of organophosphate esters in drinking water from Eastern China ». Sci Total Environ. 538 :959-965. (Disponible en anglais seulement.)
Ding J, Xu Z, Huang W, Feng L et Yang F. 2016. « Organophosphate ester flame retardants and plasticizers in human placenta in Eastern China ». Sci Total Environ. 554-555 :211-217. (Disponible en anglais seulement.)
Dobry A et Keller R. 1957. « Vapor pressures of some phosphate and phosphonate esters ». J Phys Chem. 61 :1448-1449. (Disponible en anglais seulement.)
Dodson RE, Perovich LJ, Covaci A, Van den Eede N, Ionas AC, Dirtu AC, Brody JG et Rudel RA. 2012. « After the PBDE phase-out : A broad suite of flame retardants in repeat house dust samples from California ». Environ Sci Technol. 46(24) :13056-13066. (Disponible en anglais seulement.)
Dodson RE, Rodgers KM, Carey G, Laurent JGC, Covaci A, Poma G, Malarvannan G, Spengler JD, Rudel RA et Allen JG. 2017. « Flame retardant chemicals in college dormitories : Flammability standards influence dust concentrations ». Environ Sci Technol. 51(9) :4860-4869. (Disponible en anglais seulement.)
Dodson RE, Van den Eede N, Covaci A, Perovich LJ, Brody JG et Rudel RA. 2014. « Urinary biomonitoring of phosphate flame retardants : Levels in California adults and recommendations for future studies ». Environ Sci Technol. 48 :13625-13633. (Disponible en anglais seulement.)
Douville M, Jean K et Houde M. 2016. « Multitrophic aquatic toxicity of emerging brominated and phosphorus flame retardants ». Fresenius Environ Bull. 25(5) :1-8. (Disponible en anglais seulement.)
Du Z, Wang G, Gao S et Wang Z. 2015. « Aryl organophosphate flame retardants induced cardiotoxicity during zebrafish embryogenesis : By disturbing expression of the transcriptional regulators ». Aquat Toxicol. 161 :25-32. (Disponible en anglais seulement.)
Du Z, Zhang Y, Wang G, Peng J, Wang Z et Gao S. 2016. « TPhP exposure disturbs carbohydrate metabolism, lipid metabolism, and the DNA damage repair system in zebrafish liver ». Sci Rep. 6, 21827. (Disponible en anglais seulement.)
[EA] Environment Agency. 2009a. Environmental risk evaluation report : tertbutylphenyl diphenyl phosphate (CAS no. 56803-37-3) [PDF]. Bristol (R.U.) : Environment Agency. 94 p. [Consulté le 9 avril 2018.] (Disponible en anglais seulement.)
[EA] Environment Agency. 2009b. Environmental risk evaluation report : Isopropylated triphenyl phosphate (CAS no. 28108-99-8, 26967-76-0 & 68937-41-7)) [PDF]. Bristol (R.U.) :Environment Agency. 93 p. [Consulté le 12 avril 2018.] (Disponible en anglais seulement.)
[EA] Environment Agency. 2009c. Environmental risk evaluation report : Isodecyl diphenyl phosphate (CAS no. 29761-21-5) [PDF]. Bristol (R.U.) : Environment Agency. 93 p. [Consulté le 10 avril 2018.] (Disponible en anglais seulement.) (Disponible en anglais seulement.)
[EA] Environment Agency. 2009d. Environmental risk evaluation report : Triphenyl phosphate (CAS no. 115-86-6) [PDF]. Bristol (R.U.) : Environment Agency. 93 p. [Consulté le 10 avril 2018.] (Disponible en anglais seulement.)
EC et SC. 2014. Approche d’identification des substances chimiques et des polymères jugés prioritaires pour l’évaluation des risques en vertu de la Partie 5 de la Loi canadienne sur la protection de l’environnement de 1999 [LCPE (1999)]. Ottawa (Ontario) : Environnement Canada, Santé Canada.
[ECCC et SC] Environnement et Changement climatique Canada et Santé Canada. 2015. Identification des priorités d’évaluation des risques : résultats de l’examen de 2015. Ottawa (Ontario) : Gouvernement du Canada.
[ECCC et SC] Environnement et Changement climatique Canada et Santé Canada. [version du 12 mars 2017.] Catégorisation. Ottawa (Ontario) : Gouvernement du Canada. [Consulté le 15 octobre 2018.]
[ECCC et SC] Environnement et Changement climatique Canada et Santé Canada. 2018. Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée [PDF]. Ottawa (Ontario) : Gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2013-2014. Data for certain organic flame retardants substance grouping collected under the Canadian Environmental Protection Act, 1999, section 71 : Notice with respect to certain organic flame retardant substances. Données préparées par Environnement et Changement climatique Canada et Santé Canada; Programme des substances existantes. (Disponible en anglais seulement.)
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l’approche scientifique : classification du risque écologique des substances organiques. Ottawa (Ontario) : Gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada; 2016b; Documents supportant les données utilisées pour la création des profils de danger et d’exposition spécifiques aux substances et attribuer des classifications de risque; Gatineau (QC) : Environnement et Changement climatique Canada; Informations à l’appui du document sur l’approche scientifique : Classification des risques écologiques des produits biologiques substances. Disponible auprès de : substances@ec.gc.ca.
[ECCC] Environnement et Changement climatique Canada. 2016c. Data collected under the Canadian Environmental Protection Act, 1999: Early stakeholder engagement to help inform the plan to address the remaining 1 550 substances under the Chemicals Management Plan. Données produites par ECCC et Santé Canada; programme des substances existantes. (Disponible en anglais seulement.)
[ECCC] Environnement et Changement climatique Canada. 2016d. Occurrence and Fate of Certain Organic Flame Retardants in Municipal Wastewater Treatment Systems : Organophosphorus. Rapport non publié. Ottawa (ON) : Gouvernement du Canada. (Disponible en anglais seulement.)
[ECCC] Environnement et Changement climatique Canada. 2020a. Supporting documentation : Physical and Chemical Properties for the Aryl Organophosphate Subgroup. Gatineau (QC) : ECCC. Renseignements soutenant l’ébauche d’évaluation préalable du groupe des ignifuges. Disponible auprès de : substances@ec.gc.ca. (Disponible en anglais seulement.)
[ECCC] Environnement et Changement climatique Canada. 2020b. Supporting documentation : Ecological Persistence for the Aryl Organophosphate Subgroup. Gatineau (QC) : ECCC. Renseignement en soutien à l’ébauche d’évaluation préalable du groupe des ignifuges. Disponible auprès de : substances@ec.gc.ca. (Disponible en anglais seulement.)
[ECCC] Environnement et Changement climatique Canada. 2020c. Supporting documentation : Ecotoxicity for the Aryl Organophosphate Subgroup. Information in support of the Draft Screening Assessment Report for the Flame Retardants Group. Gatineau (QC) : ECCC. Renseignement en soutien à l’ébauche d’évaluation préalable du groupe des ignifuges. Disponible auprès de : substances@ec.gc.ca. (Disponible en anglais seulement.)
[ECCC] Environnement et Changement climatique Canada. 2020d. Supporting documentation : Ecological exposure for the Aryl Organophosphate Subgroup. Gatineau (QC) : ECCC. Renseignement en soutien à l’ébauche d’évaluation préalable du groupe des ignifuges. Disponible auprès de : substances@ec.gc.ca. (Disponible en anglais seulement.)
[ECCC] Environnement et Changement climatique Canada. 2020e. Supporting Documentation : Substance Identity, Physical/Chemical Properties and Environmental Fate and Behaviour for Ethanol, 2-butoxy-, phosphate (3 :1). Gatineau (QC) : ECCC. Renseignement en soutien à l’ébauche d’évaluation préalable du groupe des ignifuges. Disponible auprès de substances@ec.gc.ca. (Disponible en anglais seulement.)
[ECCC] Environnement et Changement climatique Canada. 2020f. Supporting documentation : Environmental Concentrations. Flame Retardants Group : Ethanol, 2-butoxy-, phosphate (3 :1), Chemical Abstracts Service Registry Number 78-51-3. Gatineau (QC) : ECCC. Renseignement en soutien à l’ébauche d’évaluation préalable du groupe des ignifuges. Disponible auprès de substances@ec.gc.ca. (Disponible en anglais seulement.)
[ECCC] Environnement et Changement climatique Canada. 2020g. Supporting documentation : Potential for persistence and bioccumulation for benzene, 1,2,4,5-tetrabromo-3,6-bis(pentabromophenoxy). Renseignement en soutien à l’ébauche d’évaluation préalable du groupe des ignifuges. Gatineau (QC) : ECCC. Disponible auprès de substances@ec.gc.ca. (Disponible en anglais seulement.)
[ECETOC] Centre d’écologie et de toxicologie de l’industrie chimique européenne. 1992a. Joint Assessment of Commodity Chemicals (JACC) No 20. Tris(2-ethylhexyl)phosphate, bis(2-ethylhexyl)phosphate, mono(2- ethylhexyl)phosphate [PDF]. Bruxelles (BE) : Rapport du Centre d’écologie et de toxicologie de l’industrie chimique européenne. ISSN-0773-6339-20. [Consulté le 22 mars 1028] (Disponible en anglais seulement.)
[ECETOC] Centre d’écologie et de toxicologie de l’industrie chimique européenne. 1992b. Joint Assessment of Commodity Chemicals (JACC) No 21. Tris-(2-Butoxyethyl)-Phosphate CAS 78-51-3 [PDF.] Bruxelles (BE) : Rapport du Centre d’écologie et de toxicologie de l’industrie chimique européenne. ISSN-0773-6339-21. [Consulté le 26 octobre 2017.] (Disponible en anglais seulement.)
[ECHA] Agence européenne des produits chimiques. [Version du 15 juin 2015.] Liste des substances extrêmement préoccupantes candidates en vue d’une autorisation [Internet.] Helsinki (Finlande) : Agence européenne des produits chimiques. [Consulté le 28 juin 2018.]
[ECHA] Agence européenne des produits chimiques. 2016. Guidance on information requirements and chemical safety assessment. Chapter R.16 : Environmental exposure estimation, Version 3.0 [PDF]. Helsinki (FI) : ECHA. (Disponible en anglais seulement.)
[ECHA] Agence européenne des produits chimiques. 2018. Liste des substances extrêmement préoccupantes candidates en vue d’une autorisation [Internet]. Helsinki (Finlande) : Agence européenne des produits chimiques. (Disponible en anglais seulement.)
[ECHA] Agence européenne des produits chimiques. c2007-2018b. Base de données sur les substances enregistrées, résultats de la recherche pour le no CAS 78-42-2. Helsinki (FI) : ECHA. [Consulté le 4 avril 2018.] (Disponible en anglais seulement.)
[ECHA] Agence européenne des produits chimiques. c2007-2018c. Base de données sur les substances enregistrées, résultats de la recherche pour le no CAS 115-86-6. Helsinki (FI) : ECHA. [Consulté le 4 avril 2018.] (Disponible en anglais seulement.)
[ECHA] Agence européenne des produits chimiques. c2007-2018d. Base de données sur les substances enregistrées, résultats de la recherche pour le no CAS 68937-41-7. Helsinki (FI) : ECHA. [Consulté le 9 avril 2018.] (Disponible en anglais seulement.)
[ECHA] Agence européenne des produits chimiques. c2007-2018e. Base de données sur les substances enregistrées, résultats de la recherche pour le no CAS 29761-21-5. Helsinki (FI) : ECHA. [Consulté le 9 avril 2018.] (Disponible en anglais seulement.)
[ECHA] Agence européenne des produits chimiques. c2007-2018f. Base de données sur les substances enregistrées, résultats de la recherche pour le no CAS 78-51-3. Helsinki (FI) : ECHA. [Consulté le 10 juin 2020.] (Disponible en anglais seulement.)
[ECHA] Agence européenne des produits chimiques.c2007-2018a. Base de données sur les substances enregistrées, résultats de la recherche pour le no CAS 78-40-0. Helsinki (FI) : ECHA. [Consulté le 4 avril 2018.] (Disponible en anglais seulement.)
[ECOSAR] Ecological Structure Activity Relationships Class Program [modèle d’estimation]. 2012. Ver. 1.11. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. (Disponible en anglais seulement.)
[EFSA] Autorité européenne de sécurité des aliments. 2012. Scientific Opinion on Emerging and Novel Brominated Flame Retardants (BFRs) in Food. EFSA Comité des contaminants dans la chaîne alimentaire. EFSA Journal. 10(10) :2908. (Disponible en anglais seulement.)
EG & G BIONOMICS, 1979a. The chronic toxicity of S-148 (BN-79-1384345-2) to the water flea (Daphnia magna). Rapport de EG & G Bionomics numéro BW-19-10-549. Rapport de recherche présenté à la Monsanto company, BN-81-170. [Cité par EA 2009c.] (Disponible en anglais seulement.)
EG & G BIONOMICS, 1979b. Toxicity of S-148 (BN-79-1384345-ld) to the freshwater alga Selenastrum capricornutum. Rapport de EG & G Bionomics numéro BP-79-4-61. Rapport d’essais de toxicité présenté à la Monsanto Industrial Chemicals Company, BN-79-122. [Cité par EA 2009c.] (Disponible en anglais seulement.)
Egloff C, Crump D, Porter E, Williams K, Letcher R, Gauthier L et Kennedy S. 2014. « Tris(2‑butoxyethyl)phosphate and triethyl phosphate alter embryonic development, hepatic mRNA expression, thyroid hormone levels, and circulating bile acid concentrations in chicken embryos ». Toxicol Appl Pharmacol. 279 :303-310. (Disponible en anglais seulement.)
Elliott S et VanderMeulen D. 2017. « A regional assessment of chemicals of concern in surface waters of four Midwestern United States national parks ». Sci Total Environ. 579 :1726-1735. (Disponible en anglais seulement.)
Environnement Canada. 2006. Rapport d’évaluation écologique préalable des polybromodiphényléthers (PBDEs). Ottawa (Ontario) : Gouvernement du Canada.
Environnement Canada. 2009. Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu du de l’article 71 de la Loi canadienne sur la protection de l’environnement de 1999 : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure. Données préparées par Environnement Canada et Santé Canada, Programme des substances existantes.
Environnement Canada. 2010. Rapport sur l’état des connaissances scientifiques écologiques concernant le décabromodiphényléther (décaBDE) - Bioaccumulation et transformation. Ottawa (Ontario) : Gouvernement du Canada.
Environnement Canada. 2012. Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement, 1999 : Avis concernant certaines substances de la Liste intérieure. Données préparées par : Environnement Canada et Santé Canada; Programme des substances existantes.
Environnement Canada. 2013. Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement, 1999 : Avis concernant certaines substances de la Liste intérieure. Données préparées par : Environnement Canada et Santé Canada; Programme des substances existantes.
[EPI Suite] Estimation Program Interface Suite for Microsoft Windows [modèle d’estimation]. c2000-2012. Ver. 4.11. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. (Disponible en anglais seulement.)
Ernst W. 1988. « Evaluation of contaminants of low degradability in estuaries ». Biotechnology. 129 :60-63. [Cité par OMS 2000.] (Disponible en anglais seulement.)
Escher BI, Ashauer R, Dyer S, Hermens J, Lee JH, Leslie HA, Mayer P, Meador et J, Warne MSJ. 2011. « Crucial role of mechanisms and modes of toxic action for tissue residues of organic chemicals ». Integr Environ Assess Manag. 7 :28-49. (Disponible en anglais seulement.) (Disponible en anglais seulement.)
[ESIS] Système européen d’information sur les substances chimiques [base de données] 1995-2012. Centre commun de recherches (JRC). Commission européenne, ESIS : Inventaire européen des substances chimiques commerciales existantes. [Consulté le 24 novembre 2016.] (Données en anglais.)
Esteban S, Gorga M, Gonzalez-Alonso S, Petrovic M, Barcelo D et Valcarcel Y. 2014. « Monitoring endocrine disrupting compounds and estrogenic activity in tap water from Central Spain ». Environ Sci Pollut Res Int. 21 :9297-9310. (Disponible en anglais seulement.)
[EU RAR] European Union Risk Assessment Report. 2008a. Tris(2-chloro-1-methylethyl)phosphate (TCPP) [PDF]. Luxembourg : Office des publications officielles des Communautés européennes. [Consulté le 30 avril 2018.] (Disponible en anglais seulement.)
[EU RAR] European Union Risk Assessment Report. 2008b. Tris[2-chloro-1-(chloromethyl)ethyl]phosphate (TDCP) [PDF].Luxembourg : Office des publications officielles des Communautés européennes. [Consulté le 1er octobre 2018.] (Disponible en anglais seulement.)
Eulaers I, Veerle L, Jaspers B, Halley DJ, Lepoint G, Nygård T, Rianne Pinxten T, Adrian Covaci A et Eens M. 2014. « Brominated and phosphorus flame retardants in White-tailed Eagle Haliaeetus albicilla nestlings : Bioaccumulation and associations with dietary proxies (δ13C, δ15N and δ34S ». Sci Total Environ. 478 :48-57. (Disponible en anglais seulement.)
Fan X, Kubwabo C, Rasmussen PE et Wu F. 2014. « Simultaneous determination of thirteen organophosphate esters in settled indoor house dust and a comparison between two sampling techniques ». Sci Total Environ. 491-492 :80-86. (Disponible en anglais seulement.)
[FDS] Fiche de données de sécurité. 2011. Aquagard II Aluminum Koat [PDF]. Lakewood (NJ) : Flexabar Corporation, USA. [Consulté le 17 avril 2019.] (Disponible en anglais seulement.)
[FDS] Fiche de données de sécurité. 2012. Fyrquel GT. St Louis (Missouri) : ICL Industries Products, USA. [Consulté le 18 juin 2019.] (Disponible en anglais seulement.)
[FDS] Fiche de données de sécurité. 2013. Mystik JT-7 Extended Range Synthetic Gear Oil, SAE 75W-140. Houston (TX) : CITGO Petroleum Corporation. [Consulté le 16 juin 2016.] (Disponible en anglais seulement.)
[FDS] Fiche de données de sécurité. 2014a. 1.75 Froth Polyol HFC INT [PDF]. Calgary (AB) : Dow Chemical Canada ULC. [Consulté le 16 juin 2016.]
[FDS] Fiche de données de sécurité. 2014b. TRMCLD 2X3.78L WATER BASE GLOSS BLACK. Concord (ON) : Rust-Oleum Consumer Brands Canada. [Consulté le 20 juin 2016.]
[FDS] Fiche de données de sécurité. 2015. EZ STRIP all purpose remover [PDF] Windsor (ON) : EZ Strip USA Inc. [Consulté le 9 avril 2018.] (Disponible en anglais seulement.)
[FDS] Fiche de données de sécurité. 2018a. Reofos® 35 [PDF]. CT (USA) : Lanxess Solutions US In. [Consulté le 1er novembre 2018.] (Disponible en anglais seulement.)
[FDS] Safety Data Sheet. 2018b. Reofos® 65 [PDF]. Ontario (Canada) : Lanxess Canada [Consulté le 1er novembre 2018.] (Disponible en anglais seulement.)
Fernie K, Palace V, Peters L, Basu N, Letcher R, Karouna-Renier N, Schults S, Lazarus R et Rattner R. 2015. « Investigating endocrine and physiological parameters of captive American kestrels exposed by diet to selected organophosphate flame retardants ». Environ Sci Technol. 49(12) :7448-7455. (Disponible en anglais seulement.)
Fernie KJ, Chabot D, Champoux L, Brimble S, Alaee M, Marteinson S, Chen D, Bird DM et Letcher RJ. 2017. « Spatiotemporal patterns and relationshhips among the diet, biochemistry, and exposure to flame retardants in an apex avian predator, the peregrine falcon ». Environ Res 158 : 43-53. (Disponible en anglais seulement.)
Ficheux AS, Morriset T, Chevillotte G, Postic C et Roudot AC. 2014. « Probabilistic assessment of exposure to nail cosmetics in French consumers ». Food Chem Toxicol. 66 :36-43. (Disponible en anglais seulement.)
Frederiksen M, Stapleton HM, Vorkamp K, Webster TF, Jensen NM, Sørensen JA, Nielsen F, Knudsen LE, Sørensen LS, Clausen PA et coll. 2018. « Dermal uptake and percutaneous penetration of organophosphate esters in a human skin ex vivo model ». Chemosphere. 197 :185-192. (Disponible en anglais seulement.)
Freudenthal RI, Brandwene D et Clous W. 2001. « A subchronic toxicity study of Phosflex 51B in Sprague-Dawley rats ». Int J Toxicol. 20(5) :269-274. (Disponible en anglais seulement.)
Fries E, Mihajlovic I. 2011. « Pollution of soils with organophosphorus flame retardants and plasticizers ». J Environ Monit. 13 :2692-2694. (Disponible en anglais seulement.)
Fries E, Püttmann W. 2001. « Occurrence of organophosphate esters in surface water and ground water in Germany ». J Environ Monit. 3 :621-626. (Disponible en anglais seulement.)
Fromme H, Lahrz T, Kraft M, Fembacher L, Mach C, Dietrich S, Burkardt R, Völkel W et Göen T. 2014. « Organophosphate flame retardants and plasticizers in the air and dust in German daycare centers and human biomonitoring in visiting children (LUPE 3) ». Environ Int. 71 :158-163. (Disponible en anglais seulement.)
Gad SC. 2014. Phosphate Ester Flame Retardants. Encyclopedia of Toxicology. 3e éd. Elsevier Academic Press, p. 909-912. (Disponible en anglais seulement.)
Gartrell MJ, Craun JC, Podrebarac DS et Gunderson EL. 1986a. « Pesticides, selected elements, and other chemicals in adult total diet samples, October 1980-March 1982. » J Assoc Off Anal Chem. 69 :146-161 [Cité par ECETOC 1992a.] (Disponible en anglais seulement.)
Gartrell MJ, Craun JC, Podrebarac DS et Gunderson EL. 1986b. « Chemical contaminants monitoring. Pesticides, selected elements, and other chemicals in infant and toddler total diet samples, October 1980-March 1982 ». J Assoc Off Anal Chem. 69 :123-145 [Cité par ECETOC 1992a.] (Disponible en anglais seulement.)
Gibson E, Stapleton H, Calero L, Holmes D, Burke K, Martinez R, Cotes B, Nematollahi A, Evans D et Herbstman J. 2018. « Flame retardant exposure assessment : Findings from a behavioural intervention study ». J Expo Sci Environ Epidemiol. 29 :33-48. (Disponible en anglais seulement.)
Giraudo M, Douville M et Houde M. 2015. « Chronic toxicity evaluation of the flame retardant tris (2-butoxyethyl) phosphate (TBOEP) using Daphnia magna transcriptomic response ». Chemosphere. 132 :159-165. (Disponible en anglais seulement.)
Giraudo M, Dubé MM, Gagnon P, Douville M et Houde M. 2017. « Multigenerational effects evaluation of the flame retardant tris(2-butoxyethyl) phosphate (TBOEP) using Daphnia magna ». Aquat Toxicol. 190 :142-149. (Disponible en anglais seulement.)
Giulivo M, Capri E, Kalogianni E, Milacic R, Majone B, Ferrari F, Eljarrat E et Barcelo D. 2017. « Occurrence of halogenated and organophosphate flame retardants in sediment and fish samples from three European river basins ». Sci Total Environ. 586 :782-791. (Disponible en anglais seulement.)
Glazer L, Hawkey AB, Wells CN, Drastal M, Odamah KA, Behl M et Levin ED. 2018. « Developmental exposure to low concentrations of organophosphate flame retardants causes life-long behavioral alterations in zebrafish ». Toxicol Sci. 165(2) :487-498. (Disponible en anglais seulement.)
Gorga M, Insa S, Petrovis M et Barcelo D. 2015. « Occurrence and spatial distribution of EDCs and related compounds in waters and sediments of Iberian rivers ». Sci Total Environ. 503-504 :69-86. (Disponible en anglais seulement.)
Greaves AK et Letcher RJ. 2014. « Comparative body compartment composition and in ovo transfer of organophosphate flame retardants in North American Great Lakes herring gulls ». Environ Sci Technol. 48 :7942-7950. (Disponible en anglais seulement.)
Greaves AK, Letcher RJ, Chen D, McGoldrick DJ, Gauthier LT et Backus SM. 2016b. « Retrospective analysis of organophosphate flame retardants in herring gull eggs and relation to the aquatic food web in the Laurentian Great Lakes of North America ». Environ Res. 150 :255-263. (Disponible en anglais seulement.)
Greaves AK, Su G et Letcher RJ. 2016a. « Environmentally relevant organophosphate triesters in herring gulls : In vitro biotransformation and kinetics and diester metabolite formation using a hepatic microsomal assay ». Toxicol Appl Pharmacol. 308 :59-65. (Disponible en anglais seulement.)
Gumbmann MR, Gagne WE et Williams SN. 1968. « Short-term toxicity studies of rats fed triethylphosphate in the diet ». Toxicol Appl Pharmacol. 12(3) :360-371 [Cité par OCDE 2002a.] (Disponible en anglais seulement.)
Gunderson EL. 1988. « FDA Total Diet Study, April 1982–April 1984, dietary intakes of pesticides, selected elements, and other chemicals ». J Assoc Off Anal Chem. 71(6) :1200−1209. (Disponible en anglais seulement.)
Guo J, Venier M et Salamova A, 2017. « Bioaccumulation of dechloranes, organophosphate esters, and other flame retardants in Great Lakes fish ». Sci Total Environ. 583 :1-9. (Disponible en anglais seulement.)
Haglund P, Renberg M, Alsberg, T, Lundin L, Kaj L, Lilielind P et Hjelt M. 2016. « Hazardous compounds released from textiles and the associated load they place on Swedish sewage treatment plants » [PDF]. Umeå Universitet. Suède, 67 p. (Disponible en anglais seulement avec sommaire en suédois.)
Hallanger IG, Sagerup K, Evenset A, Kovacs KM, Leonards P, Fuglei E, Routti H, Aars J, Strøm H, Lydersen C et Gabrielsen GW. 2015. « Organophosphorous flame retardants in biota from Svalbard, Norway ». Mar Pollut Bull. 101 :442-447. (Disponible en anglais seulement.)
Hamelink JL et Eaton JG. 1979. « Proposed standard practice for conducting bioconcentration tests with fishes and saltwater bivalve molluscs ». ASTM Draft No. 9. (Disponible en anglais seulement.)
Hansch C, Leo A et Hoekman D. 1995. Exploring QSAR : Hydrophobic, electronic and steric constants. Washington (DC) : American Chemical Society. 348 p. (Disponible en anglais seulement.)
Hao C, Helm P, Morse D et Reiner E. 2018. « Liquid chromatography-tandem mass spectrometry direct injection analysis of organophosphorus flame retardants in Ontario surface water and wastewater effluent ». Chemosphere. 191 :288-295. (Disponible en anglais seulement.)
Hardy ML, Hall T et Le Van ST. 2012. « Comment on “Novel methoxylated polybrominated diphenoxybenzene congeners and possible sources in herring gull eggs from the Laurentian Great Lakes of North America” ». Environ Sci Technol. 46 :3587−3588. (Disponible en anglais seulement.)
Harrad S, Brommer S et Mueller JF. 2016. « Concentrations of organophosphate flame retardants in dust from cars, homes, and offices : An international comparison ». Emerg Contam. 2 :66-72. (Disponible en anglais seulement.)
Hays SM, Aylward LL, Gagne M, Nong A et Krishnan K. 2010. « Biomonitoring equivalents for inorganic arsenic ». Regul Toxicol Pharmacol. 58 :1-9. (Disponible en anglais seulement.)
He C, Toms LM, Thai P, Van den Eede N, Want X, Li Y, Baduel C, Harden F, Heffernan A, Hobson P et coll. 2018. « Urinary metabolites of organophosphate esters : Concentrations and age trends in Australian children ». Environ Int. 111 :124-130. (Disponible en anglais seulement.)
Heitkamp MA et Cerniglia CE. 1986. « Microbial degradation of t-butylphenyl diphenyl phosphate : a comparative microcosm study among five diverse ecosystems ». Toxicity Assessment : An International Quarterly. 1(1) :103-122. (Disponible en anglais seulement.)
[HENRYWIN] Henry’s Law Constant Program for Microsoft Windows [modèle d’estimation]. 2008. Ver. 3.20. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. (Disponible en anglais seulement.)
[HESS] Hazard Evaluation Support System. 2020. Tokyo (JP) : Division de l’évaluation de la sécurité, Centre de gestion des produits chimiques, Institut national de technologie et d’évaluation (NITE). (Disponible en anglais et en japonais [site Web].)
Hill KL, Mortensen AK, Techlechiel D, Willmore WG, Sylte I, Jenssen BM et Letcher RJ. 2018. « In vitro and in silico competitive binding of brominated polyphenyl ether contaminants with human and gull thyroid hormone transport proteins ». Environ Sci Technol. 52 :1533-1541. (Disponible en anglais seulement.)
Hinckley DA, Bidleman TF et Foreman WT. 1990. « Determination of vapor pressures for nonpolar and semipolar organic compounds from gas chromatographic retention data. » J Chem Eng Data. 35 :232-237. (Disponible en anglais seulement.)
Hoa C, Helm PA, Morse D et Reiner EJ. 2018. « Liquid chromatography-tandem mass spectrometry direct injection analysis of organophosphorus flame retardants in Ontario surface water and wastewater effluent ». Chemosphere. 191 :288-295. (Disponible en anglais seulement.)
Hoffman K, Lorenzo A, Butt CM, Adair L, Herring AH, Stapleton HM et Daniels JL. 2017. « Predictors of urinary flame retardant concentration among pregnant women ». Environ Int. 98 :96-101. (Disponible en anglais seulement.)
Hoffmann Mineral. 2018. Guide Formulation – 2K-PU joint sealant for floor joints, pourable good mechanical properties / improved adhesive strength 40 Shore A . Neuburg an der Donau (Allemagne : Hoffmann Mineral GmbH. [Consulté le 13 avril 2018.] (Disponible en anglais.)
Hollifield HC. 1979. « Rapid nephelometric estimate of water solubility of highly insoluble organic chemicals of environmental interest ». Bull Environ Contam Toxicol. 23 :579-586. (Disponible en anglais seulement.)
Hou R, Xu Y et Wang Z. 2016. « Review of OPFRs in animals and humans : Absorption, bioaccumulation, metabolism, and internal exposure research ». Chemosphere. 153 :78-90. (Disponible en anglais seulement.)
Howard PH et Deo PG. 1979. « Degradation of aryl phosphates in aquatic environments ». Bull Environ Contam Toxicol. 22 :337-344. (Disponible en anglais seulement.)
Huckins JN, Fairchild JF et Boyle TP. 1991. « Role of exposure mode in the bioavailability of triphenyl phosphate to aquatic organisms ». Arch Environ Contam Toxicol. 21 :481-485. (Disponible en anglais seulement.)
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [modèle d’estimation]. 2010. Version 2.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. (Disponible en anglais seulement.)
[IHS] IHS Markit. 2018. Flame Retardants. Specialty Chemicals Update Program. [Consulté le 30 novembre 2018.] (Disponible en anglais seulement.)
Ionas AC, Dirtu AC, Anthonissen T, Neels H et Covaci A. 2014. « Downsides of the recycling process : Harmful organic chemicals in children’s toys ». Environ Int. 65 :54-62. (Disponible en anglais seulement.)
[IPCS] Programme international sur la sécurité des substances chimiques. 1991. Environmental Health Criteria 112 : tri-n-butyl phosphate [PDF]. Genève (CH) : Programme des Nations Unis pour l’environnement, Organisation internationale du travail et Organisation mondiale de la santé. [Consulté le 26 octobre 2017.] (Disponible en anglais seulement.)
[IUCLID] International Uniform Chemical Information Database [base de données]. 2000. Données de IUCLID sur le phosphate de tris(4-isopropylphényle), no CAS 68937-41-7. Édition de l’année 2000 sur cédérom, Bureau européen des substances chimiques, Commission européenne. [Cité par EA 2009b.] (Données en anglais.)
[IUCLID] International Uniform Chemical Information Database [base de données]. 2001. Données de IUCLID sur le phosphate de tris(4-méthylphényle). Great Lakes Chemical Corporation. [Cité par UKEA 2009.] (Disponible en anglais seulement.)
Jantunen L, Struger J, Backus S, Kraft J et Brommer S. 2013. « Organophosphate flame retardants in southern Ontario tributaries and precipitation”. Affiche présentée à l’Eastern Canada Trace Organic Workshop, Saskatoon, 22-25 avril 2012. (Disponible en anglais seulement.)
Jarema KA, Hunter DL, Shaffer RM, Behl M et Padilla S. 2015. « Acute and developmental behavioral effects of flame retardants and related chemicals in zebrafish ». Neurotoxicol Teratol. 52 :194-209. (Disponible en anglais seulement.)
[J-CHECK] Japan CHEmicals Collaborative Knowledge database [base de données]. Depuis 2010. Tokyo (JP) : Institut national de technologie et d’évaluation (NITE). [Consulté le 7 novembre 2014.] (Disponible en japonais et en anglais.)
Jurgens SS, Helmus R, Waaijers SL, Uittenbogaard D, Dunnebier D, Vleugel M, Kraak MHS, de Voogt P et Parsons JR. 2014. « Mineralisation and primary biodegradation of aromatic organophosphorus flame retardants in activated sludge ». Chemosphere. 111 :238-242. (Disponible en anglais seulement.)
Kademoglou K, Xu F, Padilla-Sanchez JA, Haug L, Covaci A et Collins CD. 2017. « Legacy and alternative flame retardants in Norwegian and UK indoor environment : Implications of human exposure via dust ingestion ». Environ Int. 102 :48-56. (Disponible en anglais seulement.)
Kanazawa A, Saito I, Araki A, Takeda M, Ma M, Saijo T et Kishi R. 2010. « Association between indoor exposure to semi-volatile organic compounds and building-related symptoms among the occupants of residential dwellings ». Indoor Air. 20 :72-84. (Disponible en anglais seulement.)
KAN-DO Office and Pesticides Team. 1995. « Accumulated pesticide and industrial chemical finding from a ten-year study of ready-to-eat foods ». J Assoc Off Anal Chem. 78(3) :614-631 [Cité par OMS 2000.] (Disponible en anglais seulement.)
Kierkegaard A, Bjorkland J et Fridean U. 2004. « Identification of the flame retardant decabromodiphenyl ethane in the environment ». Environ Sci Technol. 38 :3247-3253. (Disponible en anglais seulement.)
Kim JW, Isobe T, Muto M, Tue NM, Katsura K, Marlarvannan G, Sudaryanto A, Chang KH, Prudente M, Viet PH et coll. 2014. « Organophosphorus flame retardants (PFRs) in human breast milk from several Asian countries ». Chemosphere. 116 :91-97. (Disponible en anglais seulement.)
Kim JW, Ramaswamy BR, Chang KH, Isobe T et Tanage S. 2011. « Multiresidue analytical method for the determination of antimicrobials, preservatives, benzotriazole UV stabilizers, flame retardants and plasticizers in fish using ultra high performance liquid chromatography coupled with tandem mass spectrometry ». J Chromatogr A. 1218 :3511-3520. (Disponible en anglais seulement.)
Kim S, Jung J, Lee I, Jung D, Youn H « Thyroid disruption by triphenyl phosphate, an organophosphate flame retardant, in zebrafish (Danio rerio) embryos/larvae, and in GH3 and FRTL-5 cell lines ». Aquat Toxicol. 160 :188-196. (Disponible en anglais seulement.)
Klasmeier J, Matthies M, MacLeod M, Fenner K, Scheringer M, Stroebe M, Le Gall AC, McKone TE, van de Meent D et Wania F. 2006. « Application of multimedia models for screening assessment of long-range transport potential and overall persistence ». Environ Sci Technol. 40 :53-60. (Disponible en anglais seulement.)
Kluwe WM, Huff JE, Matthews HB, Irwin R et Haseman JK. 1985. « Comparative chronic toxicities and carcinogenic potentials of 2-ethylhexyl-containing compounds in rats and mice ». Carcinogenesis. 6 :1577-1583. (Disponible en anglais seulement.)
Kosarac I, Kubwabo C et Foster WG. 2016. « Quantitative determination of nine urinary metabolites of organophosphate flame retardants using solid phase extraction and ultra-performance liquid chromatography coupled to tandem mass spectrometry (UPLC-MS/MS) ». J Chromatogr B. 1014 :24-30. (Disponible en anglais seulement.)
[KOAWIN] Octanol-Air Partition Coefficient Program for Microsoft Windows [modèle d’estimation]. 2010. Ver. 1.10. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. (Disponible en anglais seulement.)
[KOCWIN] Organic Carbon Partition Coefficient Program for Microsoft Windows [modèle d’estimation.] 2010. Ver. 2.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. (Disponible en anglais seulement.)
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [modèle d’estimation]. 2010. Ver. 1.68. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. (Disponible en anglais seulement.)
Kuo YM, Sepúlveda MS, Sutton TM, Ochoa-Acuῆa HG, Muir AM, Miller B et Hua I. 2010. « Bioaccumulation and biotransformation of decabromodiphenyl ether and effects on daily growth in juvenile lake whitefish (Coregonus clupeaformis) ». Ecotoxicology. 19(4) :751-60. (Disponible en anglais seulement.)
Kurt-Karakus P, Alegria H, Birgul A, Gungormus E et Jantunen L. 2018. « Organophosphate ester (OPEs) flame retardants and plasticizers in air and soil from a highly industrialized city in Turkey ». Sci Total Environ. 625 :555-565. (Disponible en anglais seulement.)
Langer S, Fredricsson M, Weschler CJ, Beko G, Strandberg B, Remberger M, Toftum J et Clausen G. 2016. « Organophosphate esters in dust samples collected from Danish homes and daycare centers ». Chemosphere. 154 :559-566. (Disponible en anglais seulement.)
LeBel GL, Williams DT et Benoit FM. 1981. « Gas chromatographic determination of trialkyl/aryl phosphates in drinking water, following isolation using macroreticular resin ». J Assoc Off Anal Chem. 64(4) :991-998. (Disponible en anglais seulement.)
LeBel GL, Williams DT et Benoit FM. 1983. « Problems in collection of representative samples for determination of tributoxyethyl phosphate in potable water ». J Assoc Off Anal Chem. 66(1) :202-203 [Cité par OMS 2000.] (Disponible en anglais seulement.)
LeBel GL, Williams DT et Benoit FM. 1987. « Use of large volume resin cartridges for the determination of organic contaminants in drinking water derived from the Great Lakes ». Adv Chem Ser. 214 :309-325 [Cité par OMS 2000.] (Disponible en anglais seulement.)
Lee S, Jeong W, Kannan K et Moon HB. 2016. « Occurrence and exposure assessment of organophosphate flame retardants (OPFRs) through the consumption of drinking water in Korea ». Water Res. 103 :182-188. (Disponible en anglais seulement.)
Lewis RJ. 2012. Sax’s Dangerous Properties of Industrial Materials. 12e éd. Hoboken, (NJ) : Wiley-Interscience, Wiley & Sons, Inc. p. V5 :4461. (Disponible en anglais seulement.)
Li P, Jin Y, Hu J, Xu J, Sun Y et Ma Y. 2017. « Concentrations of organophosphorus, polybromobenzene, and polybrominated diphenyl ether flame retardants in human serum, and relationships between concentrations and donor ages ». Chemosphere. 171 :654-660. (Disponible en anglais seulement.)
Lide DR, directeur. 2005. CRC Handbook of Chemistry and Physics. 86e éd. Boca Raton (FL) : CRC Press, Taylor & Francis. (Disponible en anglais seulement.)
Liu CS, Yu LQ, Deng J, Lam PKS, Wu RSS et Zhou B. 2009. « Waterborne exposure to fluotelomer alcohol 6 :2 FTOH alters plasma sex hormone and gene transcription in the hypothalamic-pituitary-gonadal (HPG) axis of zebrafish ». Aquat Toxicol. 93 :131-137. (Disponible en anglais seulement.)
Liu LY, He K, Hites R et Salamova A. 2016. « Hair and nails as noninvasive biomarkers of human exposure to brominated and organophosphate flame retardants ». Environ Sci Technol. 50 :3065−3073. (Disponible en anglais seulement.)
Liu X, Ji K et Choi K. 2012. « Endocrine disruption potentials of organophosphate flame retardants and related mechanisms in H295R and MVLN cell lines and in zebrafish ». Aquat Toxicol. 114-115 :173-181. (Disponible en anglais seulement.)
Liu X, Ji K, Jo A, Moon HB et Choi K. 2013. « Effects of TDCPP or TPP on gene transcriptions and hormones of HPG axis, and their consequences on reproduction in adult zebrafish (Danio rerio) ». Aquat Toxicol. 134-135 :104-111. (Disponible en anglais seulement.)
Liu Y, Liggio J, Harner T, Jantunen L, Shoeib M et Li SM. 2014. « Heterogeneous OH initiated oxidation : A possible explanation for the persistence of organophosphate flame retardants in air ». Environ Sci Technol. 48 :1041−1048. (Disponible en anglais seulement.)
Liu Y, Wu D, Xu Q, Yu L, Liu C et Wang J. 2017. « Acute exposure to tris (2-butoxyethyl) phosphate (TBOEP) affects growth and development of embryo-larval zebrafish ». Aquat Toxicol. 191 :17-24. (Disponible en anglais seulement.)
Luongo G et Östman C. 2016. « Organophosphate and phthalate esters in settled dust from apartment buildings in Stockholm ». Indoor Air. 26 :414-425. (Disponible en anglais seulement.)
Ma Y, Cui K, Zeng F, Wen J, Liu H, Zhu F, Ouyang G, Luan T et Zeng Z. 2013. « Microwave-assisted extraction combined with gel permeation chromatography and silica gel cleanup followed by gas chromatography–mass spectrometry for the determination of organophosphorus flame retardants and plasticizers in biological samples ». Anal Chim Acta. 786 :47-53. (Disponible en anglais seulement.)
Ma Y, Xie Z, Lohmann R, Mi W et Gao G. 2017. « Organophosphate ester flame retardants and plasticizers in ocean sediments from the North Pacific to the Arctic Ocean ». Environ Sci Technol. 51 :3809−3815. (Disponible en anglais seulement.)
Ma Z, Tang S, Su G, Miao Y, Liu H, Xie Y, Giesy JP, Saunders DMV, Hecker M et Yu H. 2016. « Effects of tris (2-butoxyethyl) phosphate (TBOEP) on endocrine axes during development of early life stages of zebrafish (Danio rerio) ». Chemosphere. 144 :1920-1927. (Disponible en anglais seulement.)
Marklund A. 2005. Levels and sources of organophosphorus flame retardants and plasticizers in indoor and outdoor environments [PDF]. Umea (Suède) : Umeå Universitet. [Consulté le 23 mai 2016.] (En anglais avec un sommaire en suédois.)
Marzulli FN, Callahan JF et Brown DWC. 1965. « Chemical structure and skin penetrating capacity of a short series of organic phosphates and phosphoric acid ». J Invest Dermatol. 44(5) :339-344. (Disponible en anglais seulement.)
Mayer FL, Adams WJ, Finley MT, Michael PR, Mehrle PM et Saeger VW. 1981. « Phosphate ester hydraulic fluids : An aquatic environmental assessment of Pydrauls 50E and 115E ». Dans : Aquatic Toxicology and Hazard Assessment, Branson D, Dickson K, directeurs. American Society for Testing and Materials. p. 103-123 [Cité par EA 2009d.]. (Disponible en anglais seulement.)
McCarty LS, Dixon DG, Mackay D et Smith AD. 1992. « Residue‐based interpretation of toxicity and bioconcentration QSARs from aquatic bioassays : Neutral narcotic organics ». Environ Toxicol Chem. 11(7) :917-930. (Disponible en anglais seulement.)
McGee SP, Konstantinov A, Stapleton HM et Volz DC. 2013. « Aryl phosphate esters within a major PentaBDE replacement product induce cardiotoxicity in developing zebrafish embryos : Potential role of the aryl hydrocarbon receptor ». Toxicol Sci. 133(1) :144-156. (Disponible en anglais seulement.)
McGoldrick DJ et Murphy EW. 2016. « Concentration and distribution of contaminants in lake trout and walleye from the Laurentian Great Lakes (2008-2012) ». Environ Pollut. 217 :85-96. (Disponible en anglais seulement.)
McGoldrick DJ, Letcher RJ, Barresi E, Keir JM, Small J, Clark MG, Sverko E et Backus SM. 2014. « Organophosphate flame retardants and organosiloxanes in predatory freshwater fish from locations across Canada ». Environ Pollut. 193 :254-261. (Disponible en anglais seulement.)
Mendelsohn E, Hagopian A, Hoffman K, Butt CM, Lorenzo A, Congleton J, Webster TF et Stapleton HM. 2016. « Nail polish as a source of exposure to triphenyl phosphate ». Environ Int. 86 :45-51. (Disponible en anglais seulement.)
Mihajlovic I. 2015. « Recent development of phosphorus flame retardants in thermoplastic blends and nanocomposites ». Dans : . Flame retardants : Polymer blends, composites and nanocomposites. Visakh PM et Arao Y, directeurs. Suisse : Springer International. p. 79-114. (Disponible en anglais seulement.)
[Miljøministeriet] Agence danoise de protection de l’environenment. 2015. Chemical substances in car safety seats and other textile products for children. Enquête sur les produits chimiques dans les produits de consommation No. 135. Copenhague (DK) : ministère de l’Environnement du Danemark. 159 p. [Consulté le 13 février 2018.] (En danois et en anglais.)
Miller GZ et Gearhart J. 2016. Traveling with toxics : Flame retardants & other chemicals in children’s car seats [PDF]. Michigan (US) : HealthyStuff, Ecology Center. [Consulté le 29 mars 2018.] (Disponible en anglais seulement.)
[MITI] Ministère du commerce international et de l’industrie du Japon. 1992. Biodegradation and bioaccumulation data of existing chemicals based on the CSCL Japan. Tokyo : Japan Chemical Industry Ecology-Toxicology & Information Centre. (Disponible en anglais.)
Mizouchi S, Ichiba M, Takigama H, Kajiwara N, Takumuku T, Miyajima T, Kodama H, Someya T et Ueno D. 2015. « Exposure assessment of organophosphorus and organobromine flame retardants via indoor dust from elementary schools and domestic houses ». Chemosphere. 123 :17-25. (Disponible en anglais seulement.)
Möller A, Sturm R, Xie Z, Cai M, He J et Ebinghaus R. 2012. « Organophosphorus flame retardants and plasticizers in airborne particles over the Northern Pacific and Indian Ocean toward the polar regions : Evidence for global occurrence ». Environ Sci Technol. 46 :3127−3134. (Disponible en anglais seulement.)
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [modèle d’estimation]. 2010. Ver. 1.43. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. (Disponible en anglais seulement.)
Muir DCG et Grift NP. 1983. « Extraction and cleanup procedures for determination of diaryl- phosphates in fish, sediment and water samples ». J Assoc Off Anal Chem. 66 :684-690. (Disponible en anglais seulement.)
Muir DCG, Grift NP et Lockhart WL. 1982. « Comparison of laboratory and field results for prediction of the environmental behavior of phosphate esters ». Environ Toxicol Chem. 1 :113-119. (Disponible en anglais seulement.)
Muir DCG, Lint D et Grift NP. 1985. « Fate of three phosphate ester flame retardants in small ponds ». Environ Toxicol Chem. 4 :663-675. (Disponible en anglais seulement.)
Muir DCG, Yarechewski AL et Grift NP. 1983. « Environmental dynamics of phosphate esters. III. Comparison of the bioconcentration of four triaryl phosphates by fish ». Chemosphere. 12 :155-166 [Cité par EA 2009a.] (Disponible en anglais seulement.)
Muir DCG, Yarechewski AL et Grift NP. 1989. « Biodegradation of four triaryl/alkyl phosphate esters in sediment under various temperature and redox conditions ». Toxicol Environ Chem. 18 :269-286 [aussi cité par EA 2009c, OCDE SIDS] (Disponible en anglais seulement.)
Muir DG. 1984. « Phosphate esters. Anthropogenic Compounds ». Dans : The Handbook of Environmental Chemistry. vol. 3. Springer-Verlag. p. 41-66. (Disponible en anglais seulement.)
[NCI] National Chemical Inventories [logiciel.] 2015. Issue 2. Columbus (OH) : American Chemical Society, Chemical Abstracts Service. (Disponible en anglais seulement.)
[New EQC] New Equilibrium Criterion Model. 2011. Ver. 1.00 (version bêta). Peterborough (ON) : Trent University, Canadian Centre for Environmental Modelling and Chemistry. (Disponible en anglais seulement.)
[New EQC] New Equilibrium Criterion Model. 2012. Ver. 1.01 (version bêta). Peterborough (ON) : Trent University, Canadian Centre for Environmental Modelling and Chemistry. (Disponible en anglais seulement.)
[NHANES 2000-2004] Centers for Disease Control and Prevention (CDC) et National Center for Health Statistics (NCHS) 2000-2004. National Health and Nutrition Examination Survey Data. Hyattsville (MD) : U.S. Department of Health and Human Services, Centers for Disease Control and Prevention. (Disponible en anglais seulement.)
Norris B et Smith S. 2002. Research into the mouthing behaviour of children up to 5 years old. Consumer and Competition Policy Directorate. (Disponible en anglais seulement.)
Noyes P, Haggard D, Gonnerman G et Tanguay R. 2015. « Advanced morphological – behavioral test platform reveals neurodevelopmental defects in embryonic zebrafish exposed to comprehensive suite of halogenated and organophosphate flame retardants ». Toxicol Sci. 145 :177-195. (Disponible en anglais seulement.)
Noyes PD, Hinton DE et Stapleton HM. 2011. « Accumulation and debromination of decabromodiphenyl Ether (BDE-209) in juvenile fathead minnows (Pimephales promelas) induces thyroid disruption and liver alterations ». Toxicol Sci. 122(2) :265-274. (Disponible en anglais seulement.)
Noyes PD, Lema SC, Macaulay LJ, Douglas NK et Stapleton HM. 2013. « Low level exposure to the flame retardant BDE-209 reduces thyroid hormone levels and disrupts thyroid signaling in fathead minnows ». Environ. Sci. Technol. 47 :10012-10021. (Disponible en anglais seulement.)
[OCDE] Organisation pour la coopération et le développement économiques. 2002a. SIDS initial assessment report Triethylphosphate : CAS No. 78-40-0, SIAM [SIDS Initial Assessment Meeting], 1, 1993 et 3, 1995; Allemagne. [Consulté le 26 octobre 2017.] (Disponible en anglais seulement.)
[OCDE] Organisation pour la coopération et le développement économiques. 2002b. SIDS initial assessment profile Triphenyl phosphate : CAS No. 115-86-6. SIAM [SIDS Initial Assessment Meeting] 15, 2002; Allemagne. [Consulté le 5 avril 2018.] (Disponible en anglais seulement.)
[OCDE] Organisation pour la coopération et le développement économiques. 2004a. Emission scenario document on lubricants and lubricant additives [PDF]. Paris (France) : Direction de l’environnement de l’OCDE. (Series on Emission Scenario Documents No. 10; Report No. : ENV/JM/MONO(2004)21, JT00174617). [Consulté le 15 février 2019.] (Disponible en anglais seulement.)
[OCDE] Organisation pour la coopération et le développement économiques. 2004b. Emission scenario document on additives in rubber industry [PDF]. Paris (France) : OCDE, Direction de l’environnement. (Series on Emission Scenario Documents No. 6; Report No. : ENV/JM/MONO(2004)11, JT00166668). [Consulté le 15 février 2019.] (Disponible en anglais seulement.)
[OCDE] Organisation pour la coopération et le développement économiques. 2011. Emission scenario document on the use of metalworking fluids [PDF]. Paris (France) : OCDE, Direction de l’environnement. (Series on Emission Scenario Documents No. 28; Report No. : ENV/JM/MONO(2011)18, JT03304938). [Consulté le 15 février 2019.] (Disponible en anglais seulement.)
[OCDE] Organisation pour la coopération et le développement économiques 2009a OECD Pov and LRTP Screening Tool. Ver. 2.2. Paris (FR) : Organisation pour la coopération et le développement économique (OCDE). Logiciel d’estimation de la persistance globale (Pov) et du potentiel de transport à grande distance (LRTP) de substances organiques. (Disponible en anglais seulement.)
[OCDE] Organisation pour la coopération et le développement économiques. 2009b. Emission scenario document on plastic additives [PDF]. Paris (FR) : Direction de l’environnement de l’OCDE, (Series on Emission Scenario Documents No. 3; Report No. : ENV/JM/MONO(2004)8/REV1, JT03267870). [Consulté le 15 février 2019.] (Disponible en anglais seulement.)
[OCDE] Organisation pour la coopération et le développement économiques. 2016. QSAR Toolbox. Ver. 3.4. Paris (FR) : Organisation pour la coopération et le développement économiques, Laboratoire de chimie mathématique. (Disponible en anglais seulement.)
Ofstad EB et Sletten T. 1985. « Composition and water solubility determination of a commercial tricresylphosphate ». Sci Total Environ. 43 :233-241. (Disponible en anglais seulement.)
[OMS] Organisation mondiale de la santé. 2000. Environmental Health Criteria 218 : Flame retardants : tris(2-butoxyethyl) phosphate, tris(2-ethylhexyl) phosphate and tetrakis(hydroxymethyl) phosp honium salts [PDF]. Genève : Organisation mondiale de la santé [Consulté le 26 octobre 2017.] (Disponible en anglais seulement.)
[OMS] Organisation mondiale de la santé. 2006. Environmental Health Criteria 235 : Dermal Absorption. Publié en coopération par le Programme environnemental des Nations Unis, l’Organisation international du travail et Organisation mondiale de la santé, et produit dans le cadre du Programme interorganisations pour la gestion rationnelle des produits chimiques [PDF]. Genève : Organisation mondiale de la santé. [Consulté le 9 novembre 2018.] (Disponible en anglais seulement.)
Ospina M, Jayatilaka N, Wong LY, Restrepo P et Calafat A. 2018. Exposure to organophosphate flame retardant chemicals in the U.S. general population : Data from the 2013–2014 National Health and Nutrition Examination Survey. Environ Int. 110 :32-41. (Disponible en anglais seulement.)
Pelletier G, Rigden M, Wang GS, Caldwell D, Siddique S, Leingartner K, Kosarac I, Cakmak S et Kubwabo C. 2020. « Comparison of tris(2-ethylhexyl) phosphate and di(2-ethylhexyl) phosphoric acid toxicities in a rat 28-day oral exposure study ». J Appl Toxicol. 40(5) :600-618. (Disponible en anglais seulement.)
Phillips AL, Hammel SC, Hoffman K, Lorenzo AM, Chen A, Webster TF et Stapleton HM. 2018. « Children’s residential exposure to organophosphate ester flame retardants and plasticizers : Investigating exposure pathways in the TESIE study ». Environ Int. 116 :176-185. (Disponible en anglais seulement.)
Phillips AL, Hammel SC, Konstantinov A et Stapleton HM. 2017. »Characterization of individual isopropylated and tert-butylated triarylphosphate (ITP and TBPP) isomers in several commercial flame retardant mixtures and house dust standard reference material SRM 2585 ». Environ Sci Technol. 51 :13443-13449. (Disponible en anglais seulement.)
Poma G, Glynn A, Malarvannan G, Covaci A et Darnerud PO. 2017. « Dietary intake of phosphorus flame retardants (PFRs) using Swedish food market basket estimations ». Food Chem Toxicol. 100 :1-7. (Disponible en anglais seulement.)
Poma G, Malysheva SV, Goscinny S, Malarvannan G, Voorspoels S, Covaci A et Van Loco J. 2018. « Occurrence of selected halogenated flame retardants in Belgian foodstuff ». Chemosphere. 194 :256-265. (Disponible en anglais seulement.)
Porter E, Crump D, Egloff C, Chiu S et Kennedt SW. 2013. « Use of an avian hepatocyte assay and the avian toxchip polymerse chain reaction array for testing prioritization of 16 organic flame retardants ». Environ Toxicol Chem. 33(3) :573-582. (Disponible en anglais seulement.)
PubChem [base de données] 2004– . Bethesda (MD) : US National Library of Medicine, National Center for Biotechnology Information. [mise à jour le 17 novembre 2018, consulté le 16 novembre 2018.] (Disponible en anglais seulement.)
Qiao L, Zheng XB, Zheng J, Lei WX, Li HF, Wang MH, He CT, Chen SJ, Yuan JG, Luo XJ et coll. 2016. « Analysis of human hair to assess exposure to organophosphate flame retardants : Influence of hair segments and gender differences ». Environ Res. 148 :177-183. (Disponible en anglais seulement.)
Qin X et Xia X. 2010. « Thyroid disruption by technical decabromodiphenyl ether (DE-83R) at low concentrations in Xenopus laevis ». J Environ Sci. 22(5) :744-751. (Disponible en anglais seulement.)
Quintana JB, Rodil R et Reemtsma T. 2006. « Determination of phosphoric acid mono- and diesters in municipal wastewater by solid-phase extraction and ion-pair liquid chromatography-tandem mass spectrometry ». Anal Chem. 78 :1644-1650. (Disponible en anglais seulement.)
Rapport d’étude. 1984. Étude confidentielle non publiée sur le Saytex® 120, présentée à Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques. Gatineau (QC) : Environnement et Changement climatique Canada, Division de la mobilisation et du développement de programmes.
Rapport d’étude. 1986a. Étude confidentielle non publiée sur le Saytex® 120, présentée à Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques. Gatineau (QC) : Environnement et Changement climatique Canada, Division de la mobilisation et du développement de programmes.
Rapport d’étude. 1986b. Étude confidentielle non publiée sur le Saytex® 120, présentée à Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques. Gatineau (QC) : Environnement et Changement climatique Canada, Division de la mobilisation et du développement de programmes.
Rapport d’étude. 1986c. Étude confidentielle non publiée sur le Saytex® 120, présentée à Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques. Gatineau (QC) : Environnement et Changement climatique Canada, Division de la mobilisation et du développement de programmes.
Rapport d’étude. 1988. Étude confidentielle non publiée sur le Saytex® 120, présentée à Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques. Gatineau (QC) : Environnement et Changement climatique Canada, Division de la mobilisation et du développement de programmes.
Rapport d’étude. 2003a. Étude confidentielle non publiée sur le PHOSFLEX 61B, présentée à Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques. Gatineau (QC) : Environnement et Changement climatique Canada, Division de la mobilisation et du développement de programmes.
Rapport d’étude. 2003b. Étude confidentielle non publiée sur le PHOSFLEX 31L, présentée à Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques. Gatineau (QC) : Environnement et Changement climatique Canada, Division de la mobilisation et du développement de programmes.
Rapport d’étude. 2003c. Étude confidentielle non publiée sur le PHOSFLEX 61B, présentée à Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques. Gatineau (QC) : Environnement et Changement climatique Canada, Division de la mobilisation et du développement de programmes.
Rapport d’étude. 2009. Étude confidentielle non publiée sur le PHOSFLEX 71B, présentée à Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques. Gatineau (QC) : Environnement et Changement climatique Canada, Division de la mobilisation et du développement de programmes.
Rapport d’étude. 2013. Étude confidentielle non publiée sur le PHOSFLEX 71B, présentée à Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques. Gatineau (QC) : Environnement et Changement climatique Canada, Division de la mobilisation et du développement de programmes.
Rapport d’étude. 2014. Étude confidentielle non publiée sur le PHOSFLEX 71B, présentée à Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques. Gatineau (QC) : Environnement et Changement climatique Canada, Division de la mobilisation et du développement de programmes.
Rapport d’étude. 2015. Étude confidentielle non publiée sur le PHOSFLEX 71B, présentée à Environnement Canada dans le cadre du Défi du Plan de gestion des produits chimiques; Gatineau (QC) : Environnement et Changement climatique Canada, Division de la mobilisation et du développement de programmes.
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [institut national pour la santé publique et l’environnement] 2008. Chemicals in Toys A general methodology for assessment of chemical safety of toys with a focus on elements [PDF]. Bilthoven (NL) : RIVM. Report 320003001/2008. [Consulté le 9 juillet 2018.] (Disponible en anglais seulement.)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [institut national pour la santé publique et l’environnement] 2007. Do-it-yourself products fact sheet : to assess the risks for the consumer [PDF]. Bilthoven (NL) : RIVM. Report No. : 320104007/2007. [Consulté le 7 mars 2018 (Disponible en anglais seulement.)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [institut national pour la santé publique et l’environnement] 2016. Cleaning products fact sheet : Default parameters for estimating consumer exposure [PDF]. Bilthoven (NL) : RIVM. Report 2016-0179. [Consulté le 31 janvier 2018.] (Disponible en anglais seulement.)
Robinson EC, Hammond BG, Johannsen FR, Levinskas GJ et Rodwell DE. 1986. « Teratogenicity studies of alkylaryl phosphate ester plasticizers in rats ». Fundam Appl Toxicol. 7(1) :138-143 [Cité par EA 2009b.] (Disponible en anglais seulement.)
Rodil R, Quintana JB, Concha-Grana E, Lopez-Mahia P, Muniategui-Lorenzo S et Prada-Rodriguez D. 2012. « Emerging pollutants in sewage, surface and drinking water in Galicia (NW Spain) ». Chemosphere. 86 :1040-1049. .] (Disponible en anglais seulement.)
Saeger VW, Hicks O, Kaley RG, Michael PR, Mieure JP « Environmental fate of selected phosphate esters ». Environ Sci Technol. 13(7) :840-844. .] (Disponible en anglais seulement.)
Saini A, Thaysen C, Jantunen L, McQueen RH et Diamond ML. 2016. « From clothing to laundry water : Investigating the fate of phthalates, brominated flame retardants, and organophosphate esters ». Environ Sci Technol. 50 :9280-9297. .] (Disponible en anglais seulement.)
Saito I, Onuki A et Seto H. 2007. « Indoor organophosphate and polybrominated flame retardants in Tokyo ». Indoor Air. 17 :28-36. .] (Disponible en anglais seulement.)
Saitoh M, Umemura T, Kawasaki Y, Momma J, Matsushima Y, Matsumoto M, Eshita N, Isama K et Kaniwa M. 1994. « Étude de la toxicité subchronique des du phosphate de tributoxyéthyle ches les rats Wistar ». Eiser Shikensko Hokoku. 112 :27-39 [Cité par OMS 2000.] (Disponible en japonais seulement).
Salamova A, Ma Y, Venier M et Hites R. 2014. « High levels of organophosphate flame retardants in the Great Lakes atmosphere ». Environ Sci Technol Lett. 1 :8-14. .] (Disponible en anglais seulement.)
Sample BE, Opresko DM et Suter GW. 1996. Toxicological Benchmarks for Wildlife : 1996 Revision. Oak Ridge (TN) : Oak Ridge National Laboratory. Report no. ES/ER/TM-86/R3. [Consulté le 26 avril 2019.] (Disponible en anglais seulement.)
Sanders HO, Hunn JB, Robinson-Wilson E et Mayer FL Jr. 1985. « Toxicity of seven potential polychlorinated biphenyl substitutes to algae and aquatic invertebrates ». Environ Toxicol Chem. 4 :149-154. (Disponible en anglais seulement.)
Santé Canada. 1995. Enquête sur l’exposition des êtres humains aux contaminants dans le milieu : un guide pour les calculs de l’exposition [PDF]. Ottawa (Ontario) : Programme « Les Grands Lacs : impact sur la santé », Direction générale de la protection de la santé, Santé Canada. [Consulté le 2 mai 2018.]
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport non publié. Ottawa (ON) : Santé Canada, Direction des substances contrôlées et de la santé environnementale. (Disponible en anglais seulement.)
Santin G, Elijarrat E et Barcelo D. 2016. « Simultaneous determination of 16 organophosphorus flame retardants and plasticizers in fish by liquid chromatography-tandem mass spectrometry ». J Chromatogr A. 1441 :34-43. .] (Disponible en anglais seulement.)
Sasaki K, Suzuki T, Takeda M et Uchiyama M. 1982. « Bioconcentration and excretion of phosphoric acid triesters by killifish (Oryzeas latipes). » Bull Environ Contam Toxicol. 28 :752-759 [Cité par OCDE SIDS TPP 2002, critère de santé environnementale 111.] (Disponible en anglais seulement.)
Sasaki K, Suzuki T, Takeda M et Uchiyama M. 1984. « Metabolism of phosphoric acid triesters by rat liver homogenate ». Bull Environ Contam Toxicol. 33 :281-288. (Disponible en anglais seulement.)
Sasaki K, Takeda M et Uchiyama M. 1981. « Toxicity, absorption and elimination of phosphoric acid triesters by killifish and goldfish. » Bull Environ Contam Toxicol. 27 :775-782. (Disponible en anglais seulement.)
Schenker U, MacLeod M, Scheringer M et Hungerbuhler K. 2005. « Improving data quality for environmental fate models : A least-squares adjustment procedure for harmonizing physicochemical properties of organic compounds ». Environ Sci Technol. 39 :8434-8441. (Disponible en anglais seulement.)
Scheringer M, MacLeod M et Wegmann F. 2006. The OECD Pov and LRTP Screening Tool. Version 2.0. Organisation pour la coopération et le développement économiques, Zurich (CH) : École polytechnique fédérale de Zurich. (Disponible en anglais seulement.)
Scheringer M, MacLeod M et Wegmann F. 2009. The OECD Pov and LRTP Screening Tool, Version 2.2 [PDF]. Zurich (CH) : École polytechnique fédérale de Zurich. (Disponible en anglais seulement.)
Schreder ED et La Guardia MJ. 2014. « Flame retardant transfers from US households (dust and laundry wastewater) to the aquatic environment ». Environ Sci Technol. 48 :11575-11583. (Disponible en anglais seulement.)
Shi Q, Wang M, Shi F, Yang L, Guo Y, Feng C, Liu J et Zhou B. 2018. « Developmental neurotoxicity of triphenyl phosphate in zebrafish larvae ». Aquat Toxicol. 203 :80-87. (Disponible en anglais seulement.)
Shoeib M, Ahrens L, Jantunen L et Harner T. 2014. « Concentrations in air of organobromine, organochlorine and organophosphate flame retardants in Toronto Canada. » Atmos Environ. 99 :140-147. (Disponible en anglais seulement.)
Shoeib T, Webster G, Hassan Y, Tepe S, Yalcin M, Turgut C, Kurt-Karakus PB et Jantunen L. 2019. « Organophosphate esters in house dust : A comparative study between Canada, Turkey and Egypt ». Sci Total Environ. 650 :193-201. (Disponible en anglais seulement.)
SimpleTreat [modèle d’élimination par les usines de traitement des eaux usées] 2003. Ver. 3.1. Bilthoven (NL) : Rijksinstituut voor Volksgezondheid en Milieu (RIVM), Institut national pour la santé publique et l’environnement, laboratoire d’évaluation du risque écologique. (Disponible en anglais seulement.)
Sitthichaikasem S. 1978. Some toxicologcal effects of phosphate esters on rainbow trout and bluegill [thèse.] Ames (IA) : Iowa State University. 6473. (Disponible en anglais seulement.)
Sjögren B, Iregren A et Järnberg J. 2009. Phosphate triesters with flame retardant properties. The Nordic Expert Group for Criteria Documentation of Health Risks from Chemicals. Université de Göteborg, Suède. (Disponible en anglais seulement.)
Smyth HF et Carpenter CP. 1948. « Further experience with the range finding test in the industrial toxicology laboratory ». J Ind Hyg Toxicol. 30 :63-68. (Disponible en anglais seulement.)
SpecialChem - Universal Selector [base de données]. 2000. Résultats de recherche pour le no CAS 58965-66-5. [Consulté le 28 février 2018.] (Données en anglais.)
Staaf T et Ostman C. 2005. « Organophosphate trimesters in indoor environments ». J Environ Monit. 7 :883-887. (Disponible en anglais seulement.)
Stapleton HM, Allen JG, Kelly SM, Konstantinov A, Klosterhaus S, Watkins D, McClean MD et Webster TF. 2008. « Alternate and new brominated flame retardants detected in U.S. house dust ». Environ Sci Technol. 42 :6910-6916. (Disponible en anglais seulement.)
Stapleton HM, Klosterhaus S, Keller A, Ferguson PL, van Bergen S, Cooper E, Webster TF et Blum A. 2011. « Identification of flame retardants in polyurethane foam collected from baby products ». Environ Sci Technol. 45 :5323-5331. (Disponible en anglais seulement.)
Stapleton HM, Sharma S, Getzinger G, Ferguson PL, Gabriel M, Webster TF et Blum A. 2012. « Novel and high volume use flame retardants in US couches reflective of the 2005 PentaBDE phase out ». Environ Sci Technol. 46 :13432-13439. (Disponible en anglais seulement.)
Statistique Canada. 2015. Enquête sur la santé dans les collectivités canadiennes (CCHS). Ottawa (Ontario) : Statistique Canada.
Strobel A, Letcher RJ, Willmore WG, Sonne C et Dietz R. 2018b. « Structure-dependent in vitro metabolism of alkyl-substituted analogues of triphenyl phosphate in East Greenland polar bears and ringed seals ». Environ Sci Technol Lett. 5(4) :214-219. (Disponible en anglais seulement.)
Strobel A, Willmore WG, Sonne C, Dietz R et Letcher RJ. 2018a. « Organophosphate esters in East Greenland polar bears and ringed seals : Adipose tissue concentrations and in vitro depletion and metabolite formation ». Chemosphere. 196 :240-250. (Disponible en anglais seulement.)
Stubbings WA, Schreder ED, Thomas MB, Romanak K, Venier M et Salamova A. 2018. « Exposure to brominated and organophosphate ester flame retardants in U.S. childcare environments : Effect of removal of flame-retarded nap mats on indoor levels ». Environ Pollut. 238 :1056-1068. (Disponible en anglais seulement.)
Su G, Greaves AK, Teclechiel D et Letcher RJ. 2016a. « In vitro metabolism of photolytic breakdown products of tetradecabromo-1,4-diphenoxybenzene flame retardant in herring gull and rat liver microsomal assays ». Environ Sci Technol. 50 :8335−8343. (Disponible en anglais seulement.)
Su G, Letcher RG, Crump D, Gooden DM et Stapleton HM. 2015a. « In vitro metabolism of the flame retardant triphenyl phosphate in chicken embryonic hepatocytes and the importance of the hydroxylation pathway ». Environ Sci Technol Lett. 2 :100-104. (Disponible en anglais seulement.)
Su G, Letcher RJ et Yu H. 2016c. « Organophosphate flame retardants and plasticizers in aqueous solution : pH-dependent hydrolysis, kinetics, and pathways ». Environ Sci Technol. 50 :8103-8111. (Disponible en anglais seulement.)
Su G, Letcher RJ, Crump D, Farmahin R, Giesy JP et Kennedy SW. 2014. « Photolytic degradation products of two highly brominated flame retardants cause cytotoxicity and mRNA expression alterations in chicken embryonic hepatocytes ». Environ Sci Technol. 48 :12039−12046. (Disponible en anglais seulement.)
Su G, Letcher RJ, Crump D, Farmahin R, Giesy JP et Kennedy SW. 2016b. « Sunlight irradiation of highly brominated polyphenyl ethers generates polybenzofuran products that alter dioxin-responsive mRNA expression in chicken hepatocytes ». Environ Sci Technol. 50 :2318−2327. (Disponible en anglais seulement.)
Su G, Letcher RJ, McGoldrick DJ et Backus SM. 2017. « Halogenated flame retardants in predator and prey fish from the Laurentian Great Lakes : Age-dependent accumulation and trophic transfer ». Environ Sci Technol. 51 :8432−8441. (Disponible en anglais seulement.)
Su G, Letcher RJ, Moore JN, Williams LL, Martin PA, de Solla SR et Bowerman WW. 2015b. « Spatial and temporal comparisons of legacy and emerging flame retardants in herring gull eggs from colonies spanning the Laurentian Great Lakes of Canada and United States ». Environ Res. 142 :720-730. (Disponible en anglais seulement.)
Su, G, Letcher, RJ, Yu, H, Gooden, DM et Stapleton, HM. 2016. « Determination of glucuronide conjugates of hydroxyl triphenyl phosphate (OH-TPHP) metabolites in human urine and its use as a biomarker of TPHP exposure ». Chemosphere. 149 :314-319. (Disponible en anglais seulement.)
Sühring R, Diamond ML, Scheringer M, Wong F, Pućko M, Stern G, Burt A, Hung H, Fellin P, Li H et Jantunen LM. 2016. « Organophosphate esters in Canadian Arctic air : Occurrence, levels and trends ». Environ Sci Technol. 50 :7409-7415. (Disponible en anglais seulement.)
Sun S, Tan H, Peng T, Wang S, Xu W, Qian H, Jin Y et Fu Z. 2016. « Developmental neurotoxicity of organophosphate flame retardants in early life stages of Japanese medaka (Oryzias latipes) ». Environ Toxicol Chem. 35(12) :2931-2940. (Disponible en anglais seulement.)
Sundkvist A, Olofsson U et Haglund p. 2010. « Organophosphorus flame retardants and plasticizers in marine and fresh water biota and in human milk ». J Environ Monit. 12 :943-951. (Disponible en anglais seulement.)
Takeuchi S, Kojima H, Saito I, Jin K, Kobayashi S, Tanaka-Kagawa T et Jinno H. 2014. « Detection of 34 plasticizers and 25 flame retardants in indoor air from houses in Sapporo, Japan ». Sci Total Environ. 491-492 :28-33. (Disponible en anglais seulement.)
Takeuchi S, Tanaka-Kagawa T, Saito I, Kojima H, Jin K, Satoh M, Kobayashi S et Jinno H. 2015. « Differential determination of plasticizers and organophosphorus flame retardants in residential indoor air in Japan ». Environ Sci Pollut Res Int. 25(8) :7113-7120. (Disponible en anglais seulement.)
[TEST] Toxicity Estimation Software Tool. 2016. Ver. 4.2. Washington (DC) : US Environmental Protection Agency. (Disponible en anglais seulement.)
Thomas MB, Stapleton H, Dills RL, Violtte H, Christakis D et Sathyanarayama S. 2016. « Demographic and dietary risk factors in relation to urinary metabolites of organophosphate flame retardants in toddlers ». Chemosphere. 185 :918-925. (Disponible en anglais seulement.)
Thors L, Koch B, Koch M, Hägglund L et Bucht A. 2016. « In vitro human skin penetration model for organophosphorus compounds with different physicochemical properties ». Toxicol In Vitro. 32 :198-204. (Disponible en anglais seulement.)
TNO Quality of Life. 2005. In vitro percutaneous absorption of [14C]tris(2-chloro-1-methylethyl)phosphate (TCPP) through human skin membranes using flow-through diffusion cells. Rapport non publié. [Cité par EU RAR 2008a.] (Disponible en anglais seulement.)
TNO Quality of Life. 2006a. In vitro percutaneous absorption of neat [1,3-14C]TDCP (Tris (1,3-chloro-2-propyl) phosphate) through human skin membranes using flow-through diffusion cells. Rapport non publié [Cité par EU RAR 2008b.] (Disponible en anglais seulement.)
TNO Quality of Life. 2006b. In vitro percutaneous absorption of neat [14C]TCPP (Tris(2-chloro-1-methylethyl)phosphate) through human skin membranes using flow-through diffusion cells. Rapport non publié. [Cité par EU RAR 2008a.] (Disponible en anglais seulement.)
Tomizawa S, Takano I, Kobayashi M, Tamura Y, Tateishi Y, Sakai N, Kitayama K, Nagayama T, Kamata K et Saito K. 2004. « Identification of unknown peaks in foods during residual pesticide analysis ». Shokuhin Eiseigaku Zasshi. 45 :259-263. (Disponible en anglais seulement.)
[TOXNET] Toxicology Data Network. [base de données] 2015. National Library of Medicine HSDB Database. [Consulté le 16 novembre 2018.] (Disponible en anglais seulement.)
Trouborst L, Chu S, Chen D et Letcher R. 2015. « Methodology and determination of tetradecabromo-1, 4-diphenoxybenzene flame retardant and breakdown by-products in sediments from the Laurentian Great Lakes ». Chemosphere. 118 :342-349. (Disponible en anglais seulement.)
Truong JW. 2016. Organophosphate esters (OPEs) as emerging contaminants in the environment : Indoor sources and transport to receiving waters [mémoire de maîtrise] Toronto (ON) : Université de Toronto. (Disponible en anglais seulement.)
Tsuda M, Saito M, Umemura T, Kawasaki Y, Momma J, Matsushima Y, Matsumoto M, Isama K, Kawiwa M et Kurokawa Y. 1993. « A 14-week oral toxicity study of tributoxyethyl phosphate (TBEP) in rats ». J Toxicol Sci. 18(4) :421-429 [Cité par OMS 2000.] (Disponible en anglais seulement.)
Tsuji S, Tonogai Y et Ito Y. 1986. « The influence of rearing temperatures on the toxicity of various environmental pollutants for Killifish (Oryzias latipes) ». Eisei Kagaku 32 (1) :46-53. (Disponible en anglais seulement.)
[US CFR] US Code of Federal Regulations. 2017a. Washington (DC) : National Archives and Records Administration’s Office of the Federal Register (OFR); Government Publishing Office. Title 21, Vol. 3, b. I, Part 175.105 : Adhesives. [Consulté le 4 mai 2018.] (Disponible en anglais seulement.)
[US CFR] US Code of Federal Regulations. 2017b. Washington (DC) : National Archives and Records Administration’s Office of the Federal Register (OFR); Government Publishing Office. Title 21, Vol. 3, b. I, Part 176.210 : Defoaming agents used in the manufacture of paper and paperboard. [Consulté le 4 mai 2018.] (Disponible en anglais seulement.)
[US CPSC] US Consumer Product Safety Commission, 2005. Migration of Flame Retardant Chemicals in Upholstered Furniture Foam [PDF]. Washington (DC) : Division of Chemistry, US CPSC. [Consulté le 29 mars 2018.] (Disponible en anglais seulement.)
[US CPSC] US Consumer Product Safety Commission. 2006. CPSC Staff Preliminary risk assessment of flame retardant chemicals in upholstered furniture foam [PDF]. Bethesda (MD) : US CPCS. [Consulté le 29 mars 2018.] (Disponible en anglais seulement.)
[US EPA] United States Environmental Protection Agency. 1985. Chemical Hazard Information Profile : Triethyl Phosphate, Oak Ridge National Lab. (Disponible en anglais seulement.)
[US EPA] United States Environmental Protection Agency. 1993. Wildlife Exposure Factors Handbook. Washington (DC) : Office of Research and Development, US EPA. Volumes I and II. [Consulté le 21 janvier 2020] (Disponible en anglais seulement.)
[US EPA] United States Environmental Protection Agency. 2009. Screening-level hazard characterization of high production volume chemicals : Phosphoric acid derivatives (INTERIM). Washington (DC) : High Production Volume Chemicals Branch, Risk Assessment Division, Office of Pollution Prevention and Toxics, US EPA,. p. 32. [Consulté le 4 juin 2020] (Disponible en anglais seulement.)
[US EPA] United States Environmental Protection Agency. 2010. Screening-level hazard characterization of isopropylated triphenyl phosphate (3 :1) [No CAS : 68937-41-7]. Washington (DC) : High Production Volume Chemicals Branch, Risk Assessment Division, Office of Pollution Prevention and Toxics, US EPA,. p. 32. [Consulté le 4 juin 2020] (Disponible en anglais seulement.)
[US EPA] United States Environmental Protection Agency. 2012. Chemical Data Reporting data collected under the Environmental Protection Agency’s Toxic Substances Control Act. Washington (DC) : US EPA. [Consulté le 4 juin 2020] (Disponible en anglais seulement.)
[US FDA] US Food and Drug Administration. 2006. Total Diet Study Market Baskets 1991-3 through 2003-4 [PDF]. College Park (MD) : Center for Food Safety and Applied Nutrition. [Consulté le 17 janvier 2018.] (Disponible en anglais seulement.)
Van den Eede N, Maho W, Erratico C, Neels H et Covaci A. 2013. « First insights in the metabolism of phosphate flame retardants and plasticizers using human liver fractions ». Toxicol Lett. 223(1) :9-15. (Disponible en anglais seulement.)
Van der Veen I et de Boer J. 2012. « Phosphorus flame retardants : properties, production, environmental occurrence, toxicity and analysis ». Chemosphere. 88 :1119-1153. (Disponible en anglais seulement.)
[VCCLab] Virtual Computational Chemistry Laboratory. ALOGPS 2005 [interface non java]. Ver. 2.1. Munich (DE) : VCCLab. [Tetko IV, Gasteiger J, Todeschini R, Mauri A, Livingstone D, Ertl P, Palyulin VA, Radchenko EV, Zefirov NS, Makarenko AS, Tanchuk VY et Prokopenko VV. 2005. « Virtual computational chemistry laboratory - design and description ». J Comput Aided Mol Des. 19 :453-463.] http ://www.vcclab.org/lab/alogps/. (Disponible en anglais seulement.)
Venier M, Dove A, Romanak K, Backus S et Hites R. 2014. « Flame retardants and legacy chemicals in Great Lakes’ water ». Environ Sci Technol. 48 :9563-9572. (Disponible en anglais seulement.)
Versar Inc. 1986a. Standard scenarios for estimating exposure to chemical substances during use of consumer products. Washington (DC) : Versar Inc. Vol I. Rédigé pour l’Environmental Protection Agency des États-Unis, Office of Toxic Substances. [Consulté le 24 juin 2015.] (Disponible en anglais seulement.)
Versar Inc. 1986b. Standard scenarios for estimating exposure to chemical substances during use of consumer products. Washington (DC) : Versar Inc. Vol II. Rédigé pour l’Environmental Protection Agency des États-Unis, Office of Toxic Substances. [Consulté le 24 juin 2015.] (Disponible en anglais seulement.)
Verschueren, K. 2001. Handbook of environmental data on organic chemicals. 4e éd. Volumes 1-2. New York (NY) :. John Wiley & Sons. 855 p. (Disponible en anglais seulement.)
Völkel, W, Fuchs, V, Wöckner, M et Fromme, H. 2018. « Toxicokinetic of tris(2-butoxyethyl) phosphate (TBOEP) in humans following single oral administration ». Archives Toxicol. 92(2) :651-660. (Disponible en anglais seulement.)
Vykoukalová M, Venier M, Vojta S, Melymuk L, Becanova J, Romanak K, Prokes R, Okeme J, Saini A, Diamond M et coll. 2017. « Organophosphate esters flame retardants in the indoor environment ». Environ Int. 106 :97-104. (Disponible en anglais seulement.)
Wang G, Shi H, Du Z, Chen H, Peng J et Gao S. 2017. « Bioaccumulation mechanism of organophosphate esters in adult zebrafish ». Environ Pollut. 229 :177-187. (Disponible en anglais seulement.)
Wang X-W, Liu J-F et Yin Y-G. 2011. « Development of an ultra-high-performance liquid chromatography–tandem mass spectrometry method for high throughput determination of organophosphorus flame retardants in environmental water ». J Chromatogr A. 1218 :6705-6711. (Disponible en anglais seulement.)
[WATERNT] Water Solubility Program. [modèle d’estimation] 2010. Ver. 1.01. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. (Disponible en anglais seulement.)
Weber K et Ernst W. 1983. « Occurrence et fluctuations des produits chimiques organiques environnementaux dans les estuaires allemands ». Vom Wasser. 61 :111-123 [Cité par ECETOC 1992a.]
(Disponible en allemande seulement.)
Wei G, Li D, Zhuo M, Liao Y, Xie Z, Guo T, Li J, Zhang S et Liang Z. 2015. « Organophosphorus flame retardants and plasticizers : Sources, occurrence, toxicity and human exposure ». Environ Pollut. 196 :29-46. (Disponible en anglais seulement.)
Weil ED et Levchik S. 2003. « Current practice and recent commercial developments in flame retardancy of polyamides ». J Fire Sci. 22 :251-264. (Disponible en anglais seulement.)
Weil ED. 1993. « Flame retardants (Phosphorus) ». Dans : Kirk-Othmer Encyclopedia of Chemical Technology. Version en ligne. New York (NY) : John Wiley and Sons, Inc. [accès restreint.] (Disponible en anglais seulement.)
Williams DT et LeBel GL. 1981. « A national survey of tri(haloalkyl)-, trialkyl-, and triarylphosphates in Canadian drinking water ». Bull Environ Contam Toxicol. 27 :450-457. (Disponible en anglais seulement.)
Williams DT, Nestmann ER, LeBel GL, Benoit FM et Otson R. 1982. « Determination of mutagenic potential and organic contaminants of Great Lakes Drinking Water ». Chemosphere. 11(3) :263-276. (Disponible en anglais seulement.)
[Wilson et Meridian] Wilson Scientific Consulting Inc. et Meridian Environmental Inc. 2015 [modifié.] Critical review of soil ingestion rates for use in contaminated site human health risk assessments in Canada. Rapport préparé par un fournisseur pour la Division des sites contaminés, Programme de la sécurité des milieux, Santé Canada : Ottawa (ON). (Disponible en anglais seulement.)
Wilson R, Jones-Otazo H, Petrovic S, Mitchell I, Bonvalot Y, Williams D et Richardson GM. 2013. « Revisiting dust and soil ingestion rates based on hand-to-mouth transfer » [PDF]. Hum Ecol Risk Assess.19(1) :158-188. [Consulté le 18 décembre 2014.] (Disponible en anglais seulement.)
Wolschke H, Sühring R, Xie Z et Ebinghaus R. 2015. « Organophosphorus flame retardants and plasticizers in the aquatic environment : A case study of the Elbe River, Germany ». Environ Pollut. 206 :488-493. (Disponible en anglais seulement.)
Won D et Lusztyk E. 2011. Data gathering on chemicals released to indoor air of residences from building materials and furnishings. Ottawa (ON) : Institut de recherches en construction du CNRC. Rapport no B3332.2. Rédigé pour Santé Canada. (Disponible en anglais seulement.)
Wood AW, Duan C et Bern HA. 2005. « Insulin-like growth factor signaling in fish ». Int Rev Cytol. 243 :215-286. (Disponible en anglais seulement.)
Woudneh MB, Benskin JP, Wang G, Grace R, Hamilton MC et Cosgrove JR. 2015. « Quantitative determination of 13 organophosphorous flame retardants and plasticizers in a wastewater treatment system by high performance liquid chromatography tandem mass spectrometry ». J Chromatogr A. 1400 :149-155. (Disponible en anglais seulement.)
[WSKOWWIN] Water Solubility for Organic Compounds Program for Microsoft Windows [modèle d’estimation]. 2010. Vers. 1.42. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. (Disponible en anglais seulement.)
Wu M, Yu G, Cao Z, Wu D, Liu K, Deng S, Huang J, Wang B et Wang Y. 2016. « Characterization and human exposure assessment of organophosphate flame retardants in indoor dust from several microenvironments of Beijing, China ». Chemosphere. 150 :465-471. (Disponible en anglais seulement.)
Xu F, Garcia-Bermejo A, Malarvannan G, Gomara B, Neels H et Covaci A. 2015. « Multi-contaminant analysis of organophosphate and halogenated flame retardants in food matrices using ultrasonication and vacuum assisted extraction, multi-stage cleanup and gas chromatography-mass spectrometry ». J Chromatogr A. 1401 :33-41. (Disponible en anglais seulement.)
Xu Q, Wu D, Dang Y, Yu L, Liu C et Wang J. 2017. « Reproduction impairment and endocrine disruption in adult zebrafish (Danio rerio) after waterborne exposure to TBOEP ». Aquat Toxicol. 182 :163-171. (Disponible en anglais seulement.)
Yager TJB, Crock JG, Smith DB, Furlong ET, Hageman PL, Foreman WT, Gray JL et ReVello RC. 2013. Effects of Surface Applications of Biosolids on Groundwater Quality and Trace-Element Concentrations in Crops near Dear Trail, Colorado, 2004-2010 [PDF]. Reston (VA) : U.S. Geological Survey and U.S. Department of the Interior. Scientific Investigations Report. [Consulté le 26 juillet 2018.] (Disponible en anglais seulement.)
Yager TJB, Furlong ET, Kolpin DW, Kinney CA, Zaugg SD et Burkhardt MR. 2014. « Dissipation of contaminants of emerging concern in biosolids applied to nonirrigated farmland in Eastern Colorado », Journal of the American Water Resources Association. 50 (2) :343-357. (Disponible en anglais seulement.)
Yalkowsky SH, He Y et Jain p. 2010. Handbook of Aqueous Solubility Data. 2e éd. Boca Raton (FL) : CRC Press. p 1185. (Disponible en anglais seulement.)
Yan XJ, He H, Peng Y, Wang XM, Gao ZQ, Yang SG et Sun C. 2012. « Determination of organophosphorus flame retardants in surface water by solid phase extraction coupled with gas chromatography-mass spectrometry ». Fenxi Huaxue/ Chin J Anal Chem. 40 :1693-1697. (Disponible en anglais.)
Yang C, Diamond ML, Latifovic L, Tsirlin D, Harris SA et Jantunen L. 2017. Semivolatile organic compounds in Canadian homes; A comprehensive household exposure study. Rapport non publié. Toronto (ON) : Université de Toronto, Cancer Care Ontario et Environnement et Changement climatique Canada. (Disponible en anglais seulement.)
Yang C, Harris SA, Jantunen LM, Sidiqque S, Kubwabo C, Tsirlin D, Latifovic L, Fraser B, St‑Jean M, De La Campa R, You H, Kulka R et Diamond ML. 2019. « Are cell phones an indicator of personal exposure to organophosphate flame retardants and plasticizers? » Environ Int. 122 :104-116. (Disponible en anglais seulement.)
Yoshida T et Yoshida J. 2012. « Simultaneous analytical method for urinary metabolites of organophosphorus compounds and moth repellents in general population ». J Chromatogr B. 880 :66-73. (Disponible en anglais seulement.)
Yuan S, Li H, Dang Y et Liu C. 2018. « Effects of triphenyl phosphate on growth, reproduction and transcription of genes of Daphnia magna ». Aquat Toxicol. 195 :58-66. (Disponible en anglais seulement.)
Zhang Q, Lu M, Dong X, Wang C, Zhang C, Liu W et Zhao M. 2014. « Potential estrogenic effects of phosphorus-containing flame retardants ». Environ Sci Technol. 48 :6995−7001. (Disponible en anglais seulement.)
Zhang X, Zou W, Mu Li, Chen Y, Ren C, Hu X et Zhou Q. 2016. « Rice ingestion is a major pathway for human exposure to organophosphate flame retardants (OPFRs) in China ». J Hazard Mater. 318 :686-693. (Disponible en anglais seulement.)
Zhao F, Chen M, Gao F, Shen H et Hu J. 2017. « Organophosphorus flame retardants in pregnant women and their transfer to Chorionic villi ». Environ Sci Technol. 51 :6489-6497. (Disponible en anglais seulement.)
Zhou L, Hiltscher M, Gruber D et Puttmann W. 2017a. « Organophosphate flame retardants (OPFRs) in indoor and outdoor air in the Rhine/Main area, Germany : Comparison of concentrations and distribution profiles in different microenvironments ». Environ Sci Pollut Res Int. 24 :10992-11005. (Disponible en anglais seulement.)
Zhou L, Hitscher M et Puttmann W. 2017b. « Occurrence and human exposure assessment of organophosphate flame retardants in indoor dust from various microenvironments of the Rhine/Main region, Germany ». Indoor Air. 27 :1113-1127. (Disponible en anglais seulement.)
Zushi Y, Hashimoto S et Tanabe K. 2016. « Nontarget approach for environmental monitoring by GCxGC-HRTOFMS in the Tokyo Bay basin ». Chemosphere. 156 :398-406. (Disponible en anglais seulement.)
Annexe A. Classification des risques écologiques (CRE) des substances organiques
Le risque posé à l’environnement par les substances du sous-groupe des OP alkyliques (PBEHx, PTEHx et PTE) a été caractérisé au moyen de la classification des risques écologiques des substances organiques (CRE) [ECCC, 2016a]. La CRE est une approche basée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition et d’une pondération des éléments de preuve pour classer les risques. Les divers éléments de preuve sont combinés afin de pouvoir distinguer les substances présentant un pouvoir faible ou élevé et un potentiel d’exposition faible ou élevé dans divers milieux. Cette approche permet de réduire l’incertitude associée à la caractérisation des risques, contrairement à une approche qui serait basée sur un seul paramètre mesuré dans un seul milieu (p. ex., la concentration létale à 50 % ou CL50).
Les données sur les propriétés physico-chimiques, le devenir (demi-vies chimiques dans divers milieux et biotes, coefficients de partage et bioconcentration dans les poissons), l’écotoxicité aiguë pour les poissons et les volumes de produits chimiques importés et fabriqués au Canada proviennent de publications scientifiques, de bases de données empiriques accessibles (p. ex., QSAR Toolbox; OCDE 2016) et des réponses aux enquêtes menées en vertu de l’article 71 de la LCPE ou ont été produites à l’aide de divers modèles QSAR ou de modèles de devenir du bilan massique ou de bioaccumulation. Ces données ont été utilisées comme intrants dans d’autres modèles de bilan massique ou pour compléter les profils de danger et d’exposition de cette substance.
Les profils de danger ont été principalement établis en se basant sur des paramètres liés au mode d’action toxique, à la réactivité chimique, à des seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Les profils d’exposition ont aussi été basés sur plusieurs paramètres, dont la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Les profils de danger et d’exposition ont été comparés aux critères de décision afin de classer les potentiels de danger et d’exposition de chaque substance organique comme faibles, moyens ou élevés. D’autres règles ont été suivies (p. ex., constance du classement, marge d’exposition) pour améliorer le classement préliminaire du danger ou de l’exposition.
Une matrice de risque a été utilisée pour assigner à chaque substance un risque faible, moyen ou élevé basé sur le classement de son danger et de son exposition. Le classement des risques éventuels obtenu grâce à la CRE a été vérifié en suivant une approche en deux étapes. La première étape consistait à faire passer le classement du risque de moyen ou élevé à faible dans le cas des substances à faible vitesse d’émission estimée dans l’eau après traitement des eaux usées, représentant un faible potentiel d’exposition. La deuxième étape consistait à revoir les résultats du classement du potentiel de risque au moyen de scénarios de risque relativement prudents à l’échelle locale (c. à d. dans la zone à proximité du point de rejet) conçus pour protéger l’environnement, afin de déterminer si le niveau des risques éventuels devrait être reclassé à la hausse.
La CRE repose sur une approche pondérée afin de réduire au minimum tout risque de surestimation ou de sous-estimation de la classe du danger et de l’exposition, et du risque subséquent. Les approches équilibrées suivies pour traiter des incertitudes sont décrites en détail dans un document d’ECCC (2016a). Nous décrivons plus bas deux des domaines d’incertitude les plus importants. Des valeurs erronées de toxicité, empiriques ou modélisées, pourraient conduire à des modifications du classement du danger, en particulier dans le cas des paramètres liés à des concentrations de résidus dans les tissus (c.-à-d. mode d’action toxique), dont bon nombre sont prévues par les modèles QSAR (QSAR Toolbox; OCDE 2016). Toutefois, l’impact de ce type d’erreur est atténué par le fait qu’une surestimation de la létalité médiane conduira à une valeur prudente (protectrice) de résidus dans les tissus pour l’analyse critique des résidus corporels. L’erreur due à une sous-estimation de la toxicité aiguë sera atténuée par le recours à d’autres paramètres de danger, comme le profilage structurel du mode d’action, la réactivité ou l’affinité de liaison à l’estrogène. Les changements ou les erreurs touchant les quantités chimiques pourraient mener à un classement différent de l’exposition, les classements de l’exposition et du risque étant très sensibles à la vitesse d’émission et aux quantités utilisées. Les classements obtenus au moyen de la CRE reflètent donc l’exposition et le risque au Canada compte tenu des quantités utilisées actuellement (estimations), mais pourraient ne pas rendre compte de tendances futures.
Les données critiques et les éléments pris en compte pour développer les profils spécifiques à ces substances et les résultats de la classification du danger, de l’exposition et du risque sont présentés dans le document d’ECCC (2016b).
Les classifications de danger et d’exposition pour trois substances du sous-groupe des OP alkyliques sont résumées dans le tableau A-1.
| Substance | Classification du danger selon la CRE | Classification de l’exposition selon la CRE | Classification du risque selon la CRE |
|---|---|---|---|
| PBEHx | Modéré | Faible | Faible |
| PTEHx | Modéré | Faible | Faible |
| PTE | Élevé | Faible | Modéré |
Selon les renseignements examinés dans le cadre de la CRE, le potentiel d’exposition du PBEHx a été classé comme étant faible. Son potentiel de danger a également été classé comme étant modéré d’après son mode d’action réactif et son potentiel de provoquer des effets nocifs dans les réseaux trophiques aquatiques et terrestres, étant donné son potentiel modéré de bioaccumulation. Compte tenu des modes d’utilisation actuels, il est peu probable que le PBEHx suscite des préoccupations pour l’environnement au Canada.
Selon les renseignements examinés dans le cadre de la CRE, le potentiel d’exposition du PTEHx a été classé comme étant faible. Son potentiel de danger a également été classé comme étant modéré en raison de son mode d’action réactif et de son potentiel de causer des effets nocifs dans les réseaux trophiques aquatiques, étant donné son potentiel de bioaccumulation modéré. En outre, les alertes structurelles des modèles Toolbox de l’OCDE ont indiqué que le PTEHx était un liant potentiel de protéines. Les effets potentiels et la façon dont ils peuvent se manifester dans l’environnement n’ont pas été étudiés plus à fond, en raison de la faible exposition à cette substance. Compte tenu des modes d’utilisation actuels, il est peu probable que le PTEHx suscite des préoccupations pour l’environnement au Canada.
Selon les renseignements examinés dans le cadre de la CRE, le potentiel d’exposition du PTE a été classé comme étant faible. Son potentiel de danger a par contre été classé comme étant élevé, en raison de la concordance entre son mode d’action réactif et son rapport d’écotoxicité élevée, ces deux valeurs indiquant que cette substance chimique est probablement très puissante. En outre, les alertes structurelles des modèles Toolbox de l’OCDE ont indiqué que le PTEHx est un liant potentiel de protéines. Le PTE a été classé comme présentant des risques modérés pour l’environnement. Compte tenu des modes d’utilisation actuels, il est peu probable que cette substance soit préoccupante pour les organismes ou l’intégrité générale de l’environnement au Canada.
Annexe B. Composants du PTPPh
|
Composants du PTPPh Exemple 1a |
% |
Composants du PTPPh Exemple 2b |
% | |
|---|---|---|---|---|
|
24 | PTPH | 44,6 | |
| Phosphate de 2-(propan-2-yl)phényle et diphényle | 24 | Phosphate de 2-(propan-2-yl)phényle et diphényle | 26,9 | |
| Phosphate de 2,4-di(propan-2-yl)phényle et de diphényle | 18 | Phosphate de 3-(propan-2-yl)phényle et de diphényle | 0,3 | |
| Phosphate de bis(2-(propan-2-yl)phényle) et de phényle | 10 | Phosphate de 4-(propan-2-yl)phényle et de diphényle | 4,9 | |
| Phosphate de bis((propan-2-yl)phényle) et de phényle | 10 | Phosphate de 2,4-di(propan-2-yl)phényle et de diphényle | 7,2 | |
| Phosphate de 4-(propan-2-yl)phényle et de diphényle | 6 | Phosphate de bis(2-(propan-2-yl)phényle) et de phényle | 11,1 | |
| Phosphate de propan-2-ylphényle, de di(propan-2-yl)phényle et de phényle | 7 | Phosphate de bis(3-(propan-2-yl)phényle) et de phényle | 0,8 | |
| Phosphate de bis(di(propan-2-yl)phényle) et de phényle | < 1 | Phosphate de bis(4-(propan-2-yl)phényle) et de phényle | 1,1 | |
| - | - | Phosphate de tris(3-(propan-2-yl)phényle) [PT3PPh] | 0,1 |
a Tel que rapporté dans Sjogren et coll. 2009.
b Tel que rapporté dans Phillips et coll. 2017.
Annexe C. Résidus corporels critiques (RCC)
| Substance | Log Koe | FBAa (ou FBC) (L/Kg) | RCC (mmol/kg) | Effets aigus sur les RCC? (2 à 8 mmol/kg) | Effets chroniques sur les RCC? (0,2 à 0,8 mmol/kg) |
|---|---|---|---|---|---|
| PTPh | 4,42 | 573 | 0,004 | Non | Non |
| PBPhDPh | 5,68 | 1638 | 0,01 | Non | Non |
| PBBPhPh | 7,29 | 26 131 | 0,15 | Non | Non |
| PMNDPh | 6,34 | 862 | 0,006 | Non | Non |
| PTPPh | 7,55 | 22 508 | 0,13 | Non | Non |
a Les valeurs FBA (ou FBC) représentent les valeurs maximales trouvées pour les substances (empiriques ou modélisées) [ECCC 2019c].
Annexe D. Formule utilisée pour le calcul de l’absorption journalière totale des substances du sous-groupe des OP aryliques dans l’analyse des risques pour les mammifères de la faune sauvage
Une CEE pour la faune sauvage a été calculée à partir d’une absorption journalière totale (AJT) par le vison (Mustela vison) et la loutre de rivière (Lontra canadensis) qui consomment du poisson, selon l’approche de l’EPA (1993).
AJT = (TML x (Ci x Pi / EBi x EAi) + (Cs x TAs) + (Ce x TAe)) x EA
où :
AJT : absorption journalière totale (mg/kg p.c./j)
TML : taux métabolique libre normalisé pour les récepteurs fauniques d’intérêt (kcal/kg p.c./j)
Ci : concentration de contaminant dans la ième espèce de proie (mg/kg)
Pi : proportion de la ième espèce de proie dans l’alimentation (%)
EBi : énergie brute de la ième espèce de proie (kcal/kg proie)
EAi : efficacité de l’assimilation de la ième espèce de proie par le récepteur faunique d’intérêt
Cs : concentration du contaminant dans le sol ou les sédiments (mg/kg p.s.)
TAs : taux d’absorption du sol ou des sédiments (kg p.s./kg p.c./j)
Ce : concentration de contaminant dans l’eau (mg/L)
TAe : taux d’absorption de l’eau (L/kg p.c./j)
EA : efficacité de l’assimilation alimentaire du contaminant par le prédateur (%)
Pt : proportion du temps que le récepteur passe dans la zone contaminée (%)
Annexe E. Données utilisées pour l’estimation de l’exposition par le régime alimentaire
Les données sur la consommation alimentaire utilisées dans la présente évaluation proviennent de l’Enquête sur la santé dans les collectivités canadiennes (ESCC) [Statistique Canada 2015]. La Direction des aliments de Santé Canada a estimé de façon prudente l’exposition par voie alimentaire au PTPh et au PTBOE en multipliant les concentrations maximales présumées pour chaque catégorie d’aliments (tableaux E-1 et E-2) par la quantité de ces aliments qui aurait été consommée par chaque répondant à l’ESCC. Nous avons ainsi obtenu une distribution complète des estimations de l’exposition au PTPh et au PTBOE pour divers groupes d’âge. Comme nous avons constaté que le PTPh et le PTBOE étaient présents dans plusieurs des principaux groupes d’aliments qui composent régime alimentaire des Canadiens, nous avons calculé les estimations de l’exposition alimentaire moyenne et le 90e centile de « toutes les personnes » pour le PTPh et le PTBOE (tableaux E-3 et E-4).
| Catégorie d’aliments utilisée dans l’évaluation de l’exposition par voie alimentaire | Concentration maximale de PTPh (ppb) | Aliments contenant la concentration maximale | Référence |
|---|---|---|---|
| Alcool | 30 | Vin, vin sec de table, vin rouge/blanc | US FDA 2006 |
| Aliments pour nourrisson | 176 | Aliments pour nourrisson, biscottes zwieback | US FDA 2006 |
| Boissons | 18 | Limonade, boisson concentrée, congelée, reconstituée | US FDA 2006 |
| Condiments et sauces | 50 | Sauce blanche | US FDA 2006 |
| Confiseries et aliments à base de sucre | 290 | Bonbons, caramels | US FDA 2006 |
| Produits laitiers | 0,73 | Produits laitiers | Zhang et coll. 2016 |
| Œufs | 0,27 | Œufs de poule | Xu et coll. 2015 |
| Graisses et huiles | 267 | Margarine, régulière | US FDA 2006 |
| Poissons et fruits de mer | 1,56 | Frais, congelés, en conserve, crustacés et poissons | Poma et coll. 2017 |
| Fruits | 12 | Fraises | US FDA 2006 |
| Céréales et grains | 110,5 | Riz | Zhang et coll. 2016 |
| Jus | 130 | Jus de pomme-banane | US FDA 2006 |
| Viande | 1,54 | Viande | Poma et coll. 2017 |
| Soupes et ragoûts | 39 | Ragoût de bœuf et de légumes, en conserve | US FDA 2006 |
| Légumes | 10 | Légumes | US FDA 2006 |
| Catégorie d’aliments utilisée dans l’évaluation de l’exposition par voie alimentaire | Concentration maximale de PTBOE (ppb) | Aliments contenant la concentration maximale | Référence |
|---|---|---|---|
| Boissons | 8 | Jus de pomme | US FDA 2006 |
| Confiseries et aliments à base de sucre | 90 | Sucette glacée aux fruits | US FDA 2006 |
| Produits laitiers | 0,29 | Produits laitiers | Zhang et coll. 2016 |
| Poissons et fruits de mer | 13,53 | Baret (Morone americana) | Greaves et coll. 2016b |
| Fruits | 17 | Pêches, en conserve dans un sirop léger-moyen | US FDA 2006 |
| Céréales et grains | 110 | Flocons d’avoine, nature, cuits | US FDA 2006 |
| Viande | 0,34 | Viande | Zhang et coll. 2016 |
| Légumes | 3,54 | Légumes | Zhang et coll. 2016 |
Parmi les données disponibles sur la présence de ces substances, nous avons supposé que la concentration maximale indiquée pour un aliment au sein d’une catégorie d’aliments plus large représentait, de manière prudente, la catégorie dans son ensemble. Par exemple, nous avons constaté que la margarine contenait la plus forte concentration de PTPh pour tous les aliments de la catégorie « graisses et huiles » pour lesquels des données étaient disponibles. Par conséquent, nous avons présumé que sa concentration maximale était représentative de l’ensemble de cette catégorie.
Les concentrations maximales dans les aliments et les boissons utilisées dans la présente évaluation variaient de 0,27 ppb dans les œufs à 290 ppb dans les confiseries et les aliments à base de sucre pour le PTPh, et de 0,29 ppb dans les produits laitiers à 110 ppb dans les céréales et grains pour le PTBOE (tableaux E-1 et E-2).
La valeur moyenne et le 90e centile de l’exposition au PTPh de « toutes les personnes » dans tous les groupes d’âge et de sexe allaient de 0,72 à 3,11 µg/kg p.c./j et 1,27 et 5,64 µg/kg p.c./j, respectivement (tableau E-3). La valeur moyenne et le 90e centile de l’exposition au PTBOE de « toutes les personnes » dans tous les groupes d’âge et de sexe allaient de 0,38 à 1,65 µg/kg p.c./j et de 0,66 à 2,73 µg/kg p.c./j, respectivement (tableau E-4).
| Groupe d’âge, hommes et femmes (années) | Exposition au PTPh par le régime alimentaire pour « toutes les personnes » (µg/kg p.c./j) - Moyenne | Exposition au PTPh par le régime alimentaire pour « toutes les personnes » (µg/kg p.c./j) - 90e cent. |
|---|---|---|
| 1 à 3 | 3,11 | 5,64 |
| 4 à 8 | 2,73 | 4,81 |
| 9 à 13 | 1,63 | 2,87 |
| 14 à 18 | 1,08 | 1,97 |
| 19 à 30 | 0,90 | 1,65 |
| 31 à 50 | 0,79 | 1,39 |
| 51 à 70 | 0,72 | 1,27 |
| 71 et plus | 0,74 | 1,29 |
Abréviations — 90e cent. : 90e centile.
| Groupe d’âge, hommes et femmes (années) | Exposition au PTBOE par le régime alimentaire pour « toutes les personnes » (µg/kg p.c./j) - Moyenne | Exposition au PTBOE par le régime alimentaire pour « toutes les personnes » (µg/kg p.c./j) - 90e cent. |
|---|---|---|
| 1 à 3 | 1,65 | 2,73 |
| 4 à 8 | 1,32 | 2,12 |
| 9 à 13 | 0,83 | 1,43 |
| 14 à 18 | 0,55 | 1,05 |
| 19 à 30 | 0,47 | 0,83 |
| 31 à 50 | 0,44 | 0,81 |
| 51 à 70 | 0,38 | 0,67 |
| 71 et plus | 0,38 | 0,66 |
Abréviations — 90e cent. : 90e centile.
Annexe F. Estimations de l’absorption journalière par divers groupes d’âge dans la population générale canadienne
Les hypothèses pour les divers groupes d’âge au sein de la population générale du Canada sont les suivantes :
- 0 à 6 mois : Poids présumé de 7,5 kg, inhalation de 2,1 m3 d’air par jour (Santé Canada 1998), et ingestion de 38 mg de poussière par jour, respectivement (Wilson et coll. 2013). On présume que les nourrissons de 0 à 6 mois n’ingèrent pas de sol, en raison des soins qui leur sont donnés.
- Exclusivement pour les nourrissons allaités : Consommation présumée de 0,742 L de lait maternel par jour (Santé Canada 1998), et on suppose que le lait maternel est la seule source d’alimentation.
- Exclusivement pour les nourrissons nourris avec une préparation : Consommation présumée de 0,8 L d’eau par jour (Santé Canada 1998), l’eau étant utilisée pour reconstituer la préparation .
- 0,5 à 4 ans : Poids présumé de 15,5 kg, inhalation de 9,3 m3 d’air par jour, consommation présumée de 0,7 L d’eau par jour, ingestion de 41 mg de poussière par jour (Wilson et coll. 2013) et ingestion de 14 mg de sol par jour (Wilson et Meridian 2015 [modifié]).
- 5 à 11 ans : Poids présumé de 31,0 kg, inhalation de 14,5 m3 d’air par jour, consommation présumée de 1,1 L d’eau par jour, ingestion de 31 mg de poussière par jour (Wilson et coll. 2013) et ingestion de 21 mg de sol par jour (Wilson et Meridian 2015 [modifié]).
- 12 à 19 ans : Poids présumé de 59,4 kg, inhalation de 15,8 m3 d’air par jour, consommation présumée de 1,2 L d’eau par jour, ingestion de 2,2 mg de poussière par jour (Wilson et coll. 2013) et ingestion de 1,4 mg de sol par jour (Wilson et Meridian 2015 [modifié]).
- 20 à 59 ans : Poids présumé de 70,9 kg, inhalation de 16,2 m3 d’air par jour, consommation présumée de 1,5 L d’eau par jour, ingestion de 2,5 mg de poussière par jour (Wilson et coll. 2013) et ingestion de 1,6 mg de sol par jour (Wilson et Meridian 2015 [modifié]).
- 60 ans et plus : Poids présumé de 72,0 kg, inhalation de 14,3 m3 d’air par jour, consommation présumée de 1,6 L d’eau par jour, ingestion de 2,5 mg de poussière par jour (Wilson et coll. 2013) et ingestion de 1,5 mg de sol par jour (Wilson et Meridian 2015 [modifié]).
- Les expositions à < 2,5 ng/kg p.c./j sont jugées négligeables.
| Voie d’exposition | 0 à 6 mois (lait maternelb) | 0 à 6 mois (préparation) | 0,5 à 4 ans | 5 à 11 ans | 12 à 19 ans | 20 à 59 ans | 60 ans et plus |
|---|---|---|---|---|---|---|---|
| Air intérieurc | 3,8 × 10-3 | 3,8 × 10-3 | 8,1 × 10-3 | 6,4 × 10-3 | 3,6 × 10-3 | 3,1 × 10-3 | 2,7 × 10-3 |
| Eau potabled | S.O. | 2,9 × 10-1 | 1,2 × 10-1 | 9,6 × 10-2 | 5,5 × 10-2 | 5,7 × 10-2 | 6,0 × 10-2 |
| Alimentse | 3,5 × 10-2 | S.O. | 5,6 | 4,8 | 2,9 | 1,7 | 1,3 |
| Poussièref | 1,0 × 10-1 | 1,0 × 10-1 | 5,5 × 10-2 | 2,1 × 10-2 | 7,7 × 10-4 | 7,3 × 10-4 | 7,2 × 10-4 |
| Sol | S.O. | S.O. | 2,17 × 10-3 | 1,63 × 10-3 | 5,66 × 10-5 | 5,42 × 10-5 | 5,00 × 10-5 |
| Absorption totale | 1,43 × 10-1 | 3,97 × 10-1 | 5,82 | 4,93 | 2,93 | 1,71 | 1,35 |
Abréviations — S.O. : sans objet.
a L’absorption estimée de PTPh par l’air ambiant était négligeable si on utilisait la concentration maximale de PTPh dans l’air extérieur (0,0022 µg/m3; Shoeib et coll. 2014). Aucune donnée de surveillance des sols en Amérique du Nord n’a été trouvée. On disposait d’une CEE estimée pour les sols représentant le pire scénario (c.‑à‑d. la CEE maximale de 2400 ng/g pour tous les OP aryliques) et une concentration maximale de 46 µg/kg d’après une étude des sols dans des zones commerciales en Chine (Cui et coll. 2017), mais elle donnait lieu à une exposition négligeable.
b Nous n’avons trouvé aucune donnée sur la surveillance du PTPh au Canada dans le lait maternel. La concentration de PTPh dans le lait maternel, soit 0,35 µg/L, était basée sur une valeur rapportée de 10 ng/g de lipides × 3,4 % (teneur en lipides du lait maternel) × 1,03 g/mL (masse volumique du lait maternel), trouvée dans des échantillons groupés de lait maternel prélevés en 1998 auprès de 90 femmes en Suède (Sundkvist et coll. 2010).
c La concentration de PTPh dans l’air intérieur au 95e centile (0,0152 µg/m3, pour Toronto et Ottawa, Ontario) [Yang et coll. 2018] a été utilisée pour estimer la valeur limite supérieure de l’absorption journalière due à l’exposition à l’air intérieur. On présume que les Canadiens passent 21 heures à l’intérieur chaque jour (Santé Canada 1998).
d La CEE maximale estimée en milieu aquatique pour tous les OP aryliques de 2,7 µg/L a été choisie à titre d’approche prudente pour calculer l’absorption de PTPh par l’eau potable pour la population générale.
e Voir l’annexe E pour plus de détails sur l’évaluation de l’exposition au PTPh par le régime alimentaire.
f La concentration de 20 700 µg/kg de PTPh au 95e centile dans la poussière des chambres à coucher à Toronto et à Ottawa (Ontario) [Yang et coll. 2019] a été sélectionnée pour estimer la valeur limite supérieure de l’absorption journalière due à l’exposition à la poussière.
| Voie d’exposition | 0 à 6 mois (lait maternel) | 0 à 6 mois (préparation) | 0,5 à 4 ans | 5 à 11 ans | 12 à 19 ans | 20 à 59 ans | 60 ans et plus |
|---|---|---|---|---|---|---|---|
| Eau potableb | S.O. | 2,9 × 10-1 | 1,2 × 10-1 | 9,6 × 10-2 | 5,5 × 10-2 | 5,7 × 10-2 | 6,0 × 10-2 |
| Poussièrec | 1,7 × 10-3 | 1,7 × 10-3 | 9,0 × 10-4 | 3,4 × 10-4 | 1,3 × 10-5 | 1,2 × 10-5 | 1,2 × 10-5 |
| Absorption totale | 1,7 × 10-3 | 2,9 × 10-1 | 1,2 × 10-1 | 9,6 × 10-2 | 5,5 × 10-2 | 5,7 × 10-2 | 6,0 × 10-2 |
Abréviations — S.O. : sans objet.
a L’absorption de PBPhDPh par d’autres milieux (air intérieur, aliments, air ambiant et sol) était négligeable.
b Aucune donnée de surveillance pour le PBPhDPh dans l’eau n’a été trouvée, et la CEE aquatique maximale de 2,7 µg/L (valeur décrite à la section 2.6.2.2 et rapportée dans le tableau 2‑19) pour les OP aryliques a donc été utilisée pour estimer l’absorption de PBPhDPh par l’eau.
c La concentration de PBPhDPh au 95e centile mesurée dans la poussière domestique au Canada (340 ng/g) a été utilisée pour estimer l’absorption de PBPhDPh par la poussière (communication personnelle, courriel du Bureau de la science et de la recherche en santé environnementale de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 18 décembre 2018; non référencé).
| Voie d’exposition | 0 à 6 mois (lait maternel) | 0 à 6 mois (préparation) | 0,5 à 4 ans | 5 à 11 ans | 12 à 19 ans | 20 à 59 ans | 60 ans et plus |
|---|---|---|---|---|---|---|---|
| Eau potableb | S.O. | 2,9 × 10-1 | 1,2 × 10-1 | 9,6 × 10-2 | 5,5 × 10-2 | 5,7 × 10-2 | 6,0 × 10-2 |
| Poussièrec | 3,8 × 10-2 | 3,8 × 10-2 | 2,0 × 10-2 | 7,6 × 10-3 | 2,8 × 10-4 | 2,7 × 10-4 | 2,6 × 10-4 |
| Absorption totale | 3,8 × 10-2 | 3,3 × 10-1 | 1,4 × 10-1 | 1,0 × 10-1 | 5,5 × 10-2 | 5,7 × 10-2 | 6,0 × 10-2 |
Abréviations — S.O. : sans objet.
a L’absorption de PMNDPh par d’autres milieux (air intérieur, aliments, air ambiant et sol) était négligeable.
b Aucune donnée de surveillance pour le PMNDPh dans l’eau n’a été trouvée, et la CEE aquatique maximale de 2,7 µg/L (valeur décrite à la section 2.6.2.2 et rapportée dans le tableau 2‑19) pour les OP aryliques a donc été utilisée pour estimer l’absorption de PMNDPh par l’eau.
c La concentration de PMNDPh au 95e centile mesurée dans la poussière domestique au Canada (7582 ng/g) a été utilisée pour estimer l’absorption de PMNDPh par la poussière (communication personnelle, courriel du Bureau de la science et de la recherche en santé environnementale de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 18 décembre 2018; non référencé).
| Voie d’exposition | 0 à 6 mois (lait maternel b) | 0 à 6 mois (préparation) | 0,5 à 4 ans | 5 à 11 ans | 12 à 19 ans | 20 à 59 ans | 60 ans et plus |
|---|---|---|---|---|---|---|---|
| Air intérieurc | 3,8 × 10-3 | 3,8 × 10-3 | 8,1 × 10-3 | 6,4 × 10-3 | 3,6 × 10-3 | 3,1 × 10-3 | 2,7 × 10-3 |
| Eau potabled | S.O. | 2,9 × 10-1 | 1,2 × 10-1 | 9,6 × 10-2 | 5,5 × 10-2 | 5,7 × 10-2 | 6,0 × 10-2 |
| Alimentse | 3,5 × 10-2 | S.O. | 5,6 | 4,8 | 2,9 | 1,7 | 1,3 |
| Poussièref | 1,0 × 10-1 | 1,0 × 10-1 | 5,6 × 10-2 | 2,2 × 10-2 | 7,9 × 10-4 | 7,5 × 10-4 | 7,4 × 10-4 |
| Solg | S.O. | S.O. | 2,2 × 10-3 | 1,6 × 10-3 | 5,7 × 10-5 | 5,4 × 10-5 | 5,0 × 10-5 |
| Absorption totale | 1,4 × 10-1 | 4,0 × 10-1 | 5,8 | 4,9 | 3,0 | 1,8 | 1,4 |
Abréviations — S.O. : sans objet.
a Nous avons calculé l’absorption estimée de PTPPh en ajoutant l’absorption estimée de PTPh (tableau F-1) et l’absorption des composants isopropylés du PTPPh (données décrites à la section 2.6.2.2) pour représenter la plage des propriétés physico-chimiques des composants de cette substance UVCB (voir la section 2.1 et le tableau 2‑2). Nous avons estimé l’absorption de PTPh en utilisant les données de surveillance décrites dans le tableau F-1, mais sans la CEE aquatique maximale (2,7 µg/L) pour les OP aryliques, afin d’éviter un double comptage, car cette valeur a également été appliquée au TIPPP. L’absorption des isomères isopropylés a été estimée à l’aide de données de surveillance et de concentrations environnementales modélisées. Les concentrations dans l’air ambiant ont été modélisées à l’aide de ChemCAN (2003), dans lequel un scénario a été établi à partir d’une quantité maximale importée au Canada d’environ 1 000 000 kg (les plages des quantités importées sont présentées dans le tableau 2‑5). La CEE aquatique maximale de 2,7 µg/L (valeur décrite à la section 2.6.2.2 et rapportée dans le tableau 2‑19) pour les OP aryliques a été utilisée pour estimer l’absorption de TIPPP par l’eau. La CEE maximale dans le sol (2400 ng/g) pour les OP aryliques n’a pas été utilisée, afin d’éviter un double comptage, car cette valeur a été appliquée au PTPh.
b Aucune donnée de surveillance pour aucun des isomères du PTPPh isopropylé dans le lait maternel n’a été trouvée, et par conséquent, seules les données pour le PTPh ont été prises en compte dans l’estimation de l’absorption du PTPPh.
c La concentration maximale de PT2PPH dans l’air intérieur, d’après une étude de Vykoukalová et coll. (2017) [0,034 ng/m3] a été utilisée pour estimer l’exposition aux composants isopropylés du PTPPh. Les valeurs estimées de l’absorption ont ensuite été ajoutées aux valeurs estimées pour le PTPh comme il est décrit dans le tableau F-1.
d Aucune donnée pertinente de surveillance du TIPPP ou d’autres isomères isopropylés du PTPPh dans l’eau n’a été trouvée, et la CEE aquatique maximale de 2,7 µg/L (valeur décrite à la section 2.6.2.2 et rapportée dans le tableau 2‑19 pour les OP aryliques a donc été utilisée pour estimer l’absorption des composants isopropylés du PTPPh par l’eau.
e Seule l’absorption estimée du PTPh a été prise en compte dans l’estimation de l’exposition au PTPPh par les aliments.
f Pour estimer les valeurs d’absorption des composants isopropylés du PTPPh par la poussière, nous avons utilisé le 95e centile de 518 ng/g d’un isomère isopropylé du PTPPh dans la poussière (TIPPP), d’après le projet de l’EPDC (communication personnelle, courriel du Bureau de la science et de la recherche en santé environnementale de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 18 décembre 2018; non référencé). Les valeurs estimées de l’absorption ont ensuite été ajoutées aux valeurs estimées pour le PTPh, comme il est décrit dans le tableau F-1.
g Aucune donnée de surveillance des sols pour le PTPh en Amérique du Nord n’a été trouvée. Une étude des sols dans des zones commerciales en Chine (Cui et coll. 2017) a rapporté une concentration maximale de 46 µg/kg de PTPh, était disponible, mais l’exposition résultante était négligeable. L’absorption estimée de PT3PPH par l’air ambiant et le sol était négligeable si on tenait compte des concentrations environnementales modélisées à l’aide de ChemCAN (2003) [223 pg/m3 pour l’air ambiant, 4,45 ng/g pour le sol]. L’absorption estimée de PTPh par l’air ambiant était négligeable si on utilisait la concentration maximale de PTPh dans l’air extérieur (0,0022 µg/m3; Shoeib et coll. 2014).
| Voie d’exposition | 0 à 6 mois (lait maternel) | 0 à 6 mois (préparation) | 0,5 à 4 ans | 5 à 11 ans | 12 à 19 ans | 20 à 59 ans | 60 ans et plus |
|---|---|---|---|---|---|---|---|
| Air intérieurb | 7,3 × 10-2 | 7,3 × 10-2 | 0,16 | 0,12 | 6,9 × 10-2 | 5,9 × 10-2 | 5,2 × 10-2 |
| Eau potablec | S.O. | 1,1 × 10-2 | 4,7 × 10-3 | 3,7 × 10-3 | 2,1 × 10-3 | 2,2 × 10-3 | 2,3 × 10-3 |
| Poussièred | 1,6 × 10-3 | 1,6 × 10-3 | 8,5 × 10-4 | 3,2 × 10-4 | 1,2 × 10-5 | 1,1 × 10-5 | 1,1 × 10-5 |
| Absorption totale | 7,5 × 10-2 | 8,6 × 10-2 | 0,16 | 0,13 | 7,1 × 10-2 | 6,2 × 10-2 | 5,4 × 10-2 |
Abréviations — S.O. : sans objet.
a L’absorption de PTE par d’autres milieux (air ambiant, aliments et sol) était négligeable.
b La concentration maximale dans l’air intérieur à Stockholm (Suède) de 297 ng/m3 (Luongo et Östman 2016) a été choisie pour estimer la valeur limite supérieure de l’absorption journalière par exposition à l’air intérieur. On présume que les Canadiens passent 21 heures à l’intérieur chaque jour (Santé Canada 1998).
c La concentration maximale de PTE (105 ng/L) dans les eaux de surface de cours d’eau à Toronto (Ontario) [Truong 2016] a été choisie pour estimer la valeur limite supérieure de l’absorption journalière par exposition à l’eau potable.
d La concentration de PTE au 95e centile (0,32 µg/g) dans l’étude canadienne de référence (données préliminaires de l’Enquête sur la poussière domestique au Canada; Kubwabo et coll. (en préparation), Bureau de la science et de la recherche en santé environnementale de Santé Canada, 13 décembre 2013; non référencé), mesurée dans diverses villes au Canada, a été choisie pour estimer la valeur limite supérieure de l’absorption journalière par exposition à la poussière.
| Voie d’exposition | 0 à 6 mois (lait maternel)b | 0 à 6 mois (préparation) | 0,5 à 4 ans | 5 à 11 ans | 12 à 19 ans | 20 à 59 ans | 60 ans et plus |
|---|---|---|---|---|---|---|---|
| Air intérieurc | 7,9 × 10-2 | 7,9 × 10-2 | 1,7 × 10-1 | 1,3 × 10-1 | 7,5 × 10-2 | 1,1 × 10-3 | 9,8 × 10-4 |
| Eau potabled | S.O. | 6,0 × 10-2 | 2,5 × 10-2 | 2,0 × 10-2 | 1,1 × 10-2 | 1,2 × 10-2 | 1,2 × 10-2 |
| Alimentse | 2,2 × 10-1 | S.O. | 2,7 | 2,1 | 1,4 | 8,3 × 10-1 | 6,7 × 10-1 |
| Poussièref | 18 | 18 | 9,6 | 3,6 | 1,3 × 10-1 | 3,7 × 10-3 | 3,6 × 10-3 |
| Absorption totale | 18,3 | 18,1 | 12,5 | 5,9 | 1,6 | 0,85 | 0,69 |
Abréviations — S.O. : sans objet.
a L’absorption de PTBOE par d’autres milieux (air ambiant et sol) était négligeable.
b Aucune donnée de surveillance du PTBOE dans le lait maternel au Canada n’a été trouvée. La concentration de PTBOE dans le lait maternel, 2,21 µg/L, était basée sur la concentration maximale de PTBOE de 63 ng/g de lipides × 3,4 % (teneur en lipides du lait maternel) × 1,03 g/mL (masse volumique du lait maternel), trouvée dans des échantillons groupés de lait maternel prélevés en 1997 auprès de 69 femmes en Suède (Sundkvist et coll. 2010).
c La concentration de PTBOE dans l’air intérieur au 95e centile (5640 pg/m3) dans des maisons de Toronto et Ottawa, au Canada (Yang et coll. 2019), a été choisie pour estimer la valeur limite supérieure de l’absorption journalière par exposition à l’air intérieur. Pour les groupes d’âge sous 20 ans (c.‑à‑d. les enfants et les adolescents), nous avons également utilisé le 95e centile de la concentration de PTBOE dans l’air intérieur (833 ng/m3 ou 833 000 pg/m3) dans des garderies en Allemagne (Fromme et coll. 2014) pour tenir compte de l’exposition à des concentrations élevées de PTBOE dans les garderies ou les milieux éducatifs pendant 8 heures de la journée. On présume que les Canadiens passent 21 heures à l’intérieur chaque jour (Santé Canada 1998).
d La concentration maximale de PTBOE (560 ng/L) dans l’eau potable provenant de stations municipales de traitement de l’eau partout au Canada (Williams et Lebel 1981) a été choisie pour estimer l’absorption journalière par exposition à l’eau potable.
e Nous avons utilisé l’estimation au 90e centile pour toutes les personnes d’après l’annexe E, tableau E-4. L’absorption estimée maximale pour les groupes d’âge pertinents a été utilisée (p. ex., la valeur au 90e centile pour les enfants de 1 à 3 ans a été utilisée pour les enfants de 0,5 à 4 ans).
f Pour les groupes d’âge supérieurs à 20 ans, la concentration de PTBOE au 95e centile (104 µg/g) dans l’étude canadienne de référence (communication personnelle, courriels du Bureau de la science et de la recherche en santé environnementale de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada, 28 octobre 2013; non référencé), mesurée dans diverses villes canadiennes, a été choisie pour estimer l’absorption journalière par exposition à la poussière. Pour les groupes d’âge de 20 ans et moins (c.‑à‑d. les enfants et les adolescents), la concentration de PTBOE au 95e centile dans la poussière (3633 µg/g) dans des garderies en Allemagne (Fromme et coll. 2014) a été choisie pour estimer la valeur limite supérieure de l’absorption journalière par exposition à la poussière.
| Voie d’exposition | 0 à 6 mois | 0,5 à 4 ans | 5 à 11 ans | 12 à 19 ans | 20 à 59 ans | 60 ans et plus |
|---|---|---|---|---|---|---|
| Air intérieurb | 2,8 × 10-3 | 6,0 × 10-3 | 4,7 × 10-3 | 2,7 × 10-3 | 2,3 × 10-3 | 2,0 × 10-3 |
| Poussièrec | 9,0 × 10-3 | 4,7 × 10-3 | 1,8 × 10-3 | 6,6 × 10-5 | 6,3 × 10-5 | 6,2 × 10-5 |
| Absorption totale | 1,2 × 10-2 | 1,1 × 10-2 | 6,5 × 10-3 | 2,8 × 10-3 | 2,4 × 10-3 | 2,1 × 10-3 |
a L’absorption de PTEHx par d’autres milieux (eau potable, air ambiant, aliments et sol) était négligeable.
b La concentration de PTEHx dans l’air intérieur au 95e centile (11 400 pg/m3) dans des maisons de Toronto et Ottawa, au Canada (Yang et coll. 2019), a été choisie pour estimer la valeur limite supérieure de l’absorption journalière par exposition à l’air intérieur. On présume que les Canadiens passent 21 heures à l’intérieur chaque jour (Santé Canada 1998).
c La concentration de PTEHx dans la poussière au 95e centile (1780 ng/g) dans des maisons de Toronto et Ottawa, au Canada (Yang et coll. 2019), a été choisie pour estimer l’absorption journalière par exposition à la poussière.
Annexe G. Paramètres utilisés pour estimer l’exposition humaine par les articles manufacturés et les produits de consommation
Produits
Des scénarios d’exposition sentinelle ont été utilisés pour estimer l’exposition potentielle aux substances du groupe des substances ignifuges. Les valeurs estimées de l’exposition ont été calculées en fonction des poids corporels par défaut de 70,9 kg, 59,4 kg, 31,0 kg et 15,5 kg pour les personnes de 20 ans et plus, de 12 à 19 ans, de 5 à 11 ans et de 6 mois à 4 ans), respectivement (Santé Canada 1998). Ces valeurs ont été estimées à l’aide du logiciel ConsExpo Web (ConsExpo Web 2016) ou d’algorithmes (voir plus de détails ci‑dessous). Les hypothèses propres aux différents scénarios sont présentées dans le tableau G‑1.
| Produit (substance) | Hypothèses |
|---|---|
|
Couche de finition (il est présumé qu’elle est appliquée sur les ongles des doigts et des orteils)a (PTPh) |
Concentration de PTPh : 10 % Exposition par voie cutanée : Fréquenceb (utilisation/jour) : 0,18 (20 ans et plus), 0,2 (12 à 19 ans) [Ficheux et coll. 2014] Quantité sur la peau : 160 mg (20 ans et plus et 2 à 19 ans) [Ficheux et coll. 2014] |
|
Vernis à ongles (2 couches sur les ongles des doigts et des orteils)a (PTPh) |
Concentration de PTPh : 30 % Exposition par voie cutanée : Fréquenceb (utilisation/jour) : 0,18 (20 ans et plus), 0,2 (12 à 19 ans), 0,13 (5 à 11 ans et 0,5 à 4 ans) [Ficheux et coll. 2014] Quantité sur la peau : 160 mg (20 ans et plus et 12 à 19 ans), 60 mg (5 à 11 ans et 0,5 à 4 ans) [Ficheux et coll. 2014] |
|
Couche de base (il est présumé qu’elle est apposée sur les ongles des doigts et des orteils)a (PTPh) |
Concentration de PTPh : 10 % Exposition par voie cutanée : Fréquenceb (utilisation/jour) : 0,18 (20 ans et plus), 0,2 (12 à 19 ans) [Ficheux et coll. 2014] Quantité sur la peau : 160 mg (20 ans et plus et 12 à 19 ans) [Ficheux et coll. 2014] |
|
Peinture à base d’eau (PMNDPh) |
Fraction en poids de la substance : 1,5 % Scénario : Application au pinceau et au rouleau, selon la fiche d’information sur les produits (RIVM 2007). Exposition par voie cutanée : Taux de contact : 89 mg/min Durée de l’exposition : 120 min |
|
Décapant tout usage pour four (PTE) |
Concentration de PTE : ≤ 7 % (MSDS 2015) Scénario : Fiche d’information sur les produits de nettoyage de four (RIVM 2016). Exposition cutanée – pendant la pulvérisation Quantité de produit : 0,7 g Exposition cutanée – pendant le nettoyage Quantité de produit : 0,6 g |
|
Produit d’étanchéité en mousse (PTE) |
Concentration de PTE : ≤ 5 % (MSDS 2014a) Scénario : Fiche d’information sur un isolant en mousse pour travaux de bricolage (RIVM 2007). Inhalation – Exposition à la vapeur – libération instantanée Durée de l’exposition : 30 min Durée de l’application : 30 min Quantité totale de produit : 825 g Volume de la pièce : 57,5 m3 Taux de ventilation : 1,5 h-1 |
|
Peinture antirouille (PTBOE) |
Concentration : ≤ 5 % (MSDS 2014b) Adapté du scénario pour le vernis à base de solvant dans VERSAR (1986a) Exposition par voie cutanée : Surface de contact avec la peau (SC) : 154,75 cm2 (10 % des bras et des avant-bras; Santé Canada 1998) Taux de couverture du produit (TCR) : 0,007 g/cm2 (d’après un taux présumé de consommation de la substance de 600 pi2/gallon et d’une masse volumique du produit de 1,03 g/mL) Exposition estimée = (SC × TCR × concentration) / poids corporel |
|
Agent de scellement de joint de revêtement de sol (PTEHx) |
Concentration : ≤ 6 % (Hoffmann Mineral 2018) Scénario : Fiche d’information pour produits généraux de revêtement, pour travaux de bricolage (RIVM 2007). Exposition par voie cutanée : Quantité de produit : 0,25 g Scénario : Fiche d’information pour agents de scellement de joints de revêtement de sol, travaux de bricolage (RIVM 2007). Exposition par voie cutanée : Taux de contact : 50 mg/min Durée de l’exposition : 30 min |
|
Huile pour engrenages (PBEHx) |
Concentration : ≤ 5 % (MSDS 2013) Adapté de scénarios pour les huiles moteur et les graisses de lubrification dans VERSAR (1986b) Superficie de contact avec la peau (SC) : 12 cm2 (2 doigts et 2 pouces, Santé Canada 1998) Épaisseur du film sur la peau (Ép) : 15,88 × 10-3 cm Masse volumique (MV) : 1 g/cm3 (graisses lubrifiantes, VERSAR 1986b) Exposition estimée = (concentration × SC × Ép × MV) / poids corporel |
a Un facteur de rétention de 1 et un facteur d’absorption de 1 ont été utilisés.
b Valeur non prise en compte dans l’exposition par événement.
Articles manufacturés
D’après les renseignements disponibles, l’exposition cutanée a été estimée pour le contact direct avec des matelas contenant de la mousse et des articles fabriqués connexes pour tous les groupes d’âge, et l’exposition par voie orale a été estimée pour les enfants de 0 à 6 mois et de 0,5 à 4 ans. Les paramètres d’exposition et les valeurs utilisés pour estimer l’exposition sont présentés ci‑dessous et sont basés sur des hypothèses prudentes.
Absorption cutanée = [SC × FCC × FPT × VM × DE × AC] / p.c.
Absorption orale = [SC × VM × DE] / p.c.
| Groupe d’âge | Superficie de contact avec la peaua (SC) | Durée de l’expositionb (DE) | Poids corporelc (p.c.) |
|---|---|---|---|
| 0 à 6 mois | 545 à 1840 cm2 | 12 h/j | 7,5 kg |
| 0,5 à 4 ans | 792 à 2890 cm2 | 12 h/j | 15,5 kg |
| 5 à 11 ans | 1258 à 4830 cm2 | 10 h/j | 31,0 kg |
| 12 à 19 ans | 1972 à 8100 cm2 | 10 h/j | 59,4 kg |
| 20 ans et plus | 2033 à 9100 cm2 | 8 h/j | 70,9 kg |
a Pour ce scénario, nous avons utilisé une plage de superficies de contact (SC) pour représenter le contact cutané avec un matelas. Pour la valeur SC la plus faible utilisée, nous avons présumé qu’une personne porte un short et un t-shirt qui couvrent la moitié de ses membres. La superficie exposée est basée sur l’exposition d’une fraction de la moitié inférieure des membres (bras et jambes) et de l’arrière de la tête. Les valeurs de la superficie des membres (Santé Canada 1995) ont été multipliées par 0,5 pour tenir compte de la couverture offerte par les vêtements, puis par un tiers pour tenir compte de la forme triangulaire des membres, un seul côté étant directement en contact avec le matelas (US CPSC 2006). La superficie de la tête (Santé Canada 1995) a été multipliée par un facteur de 0,5 pour représenter l’exposition de l’arrière de la tête uniquement. Pour la valeur SC plus élevée utilisée, nous avons présumé que la moitié du corps était en contact cutané avec le matelas (US EPA 2012).
b La durée de l’exposition en position couchée a été ajustée à partir des données indiquées dans US CPSC (2006) pour la position assise et décontractée afin de tenir compte des durées plus longues en position couchée par rapport à la position assise.
c Santé Canada (1998).
| Paramètre | PTDCP | TBB | PTPh | PBPhDPh | PT3PPH (isomère dans le PTPPh) |
|---|---|---|---|---|---|
| Solubilité dans l’eau (mg/L) | 18,1 | 0,00282 | 2,25 | 0,13 | 0,00339 |
| Log Koe (sans dimension) | 3,69 | 7,71 | 4,42 | 5,68 | 7,55 |
| Vitesse de migration depuis une mousse recouverte (mg/cm2/h) a | 5,62 × 10-5 | 1,97 × 10-5 |
2,45 × 10-5 b 4,54 × 10-5 c |
2,03 × 10-5 b 3,32 × 10-5 c |
2,00 × 10-5 b 1,98 × 10-5 c |
a Les vitesses de migration pour le PTDCP et le TBB ont été déterminées dans des études de migration réalisées par l’US CPSC sur de la mousse de meubles traitée (US CPSC 2005). Dans cette étude, une maquette de mini-siège consistant en un bloc de mousse recouvert d’un tissu en coton et fixé sur du contreplaqué a été préparée. Le mini-siège a été mouillé avec une solution saline pour imiter la sueur, et une pression a été appliquée pour imiter la pression exercée par une personne assise. Les vitesses de migration du PTDCP et du TBB ont été déterminées d’après la quantité quotidienne maximale extraite pour chaque substance (8 et 2,8 µg, respectivement) sur un papier filtre (5 cm de diamètre) au cours de la période du test de migration (6 heures) [US CPSC 2005].
b Valeur calculée d’après une ligne droite tracée entre les valeurs de solubilité dans l’eau et les vitesses de migration pour le PTDCP et le TBB, avec l’équation y = (2 × 10-6) × solubilité dans l’eau + 2 × 10-5.
c Valeur calculée à l’aide d’équations différentielles basées sur les vitesses de migration du PTDCP et du TBB, des solubilités dans l’eau et des valeurs log Koe en utilisant l’équation vitesse de migration = x (log de la solubilité dans l’eau) + y (log Koe). Pour le PTDCP, cette valeur est de 0,0000562 mg/cm2/h = x (1,26) + y (3,69) et pour le TBB, elle est de 0,0000197 = x (-2,55) + y (7,71). En résolvant pour x et y, on obtient x = 0,0000188 et y = 0,0000088. Pour le PTPh, la vitesse de migration = 0,0000188 (log de la solubilité dans l’eau) + 0,0000088 (log Koe) = 0,0000188 (0,35) + 0,0000088 (4,42) = 4,54 × 10-5 mg/cm2/h. Pour le PBPhDPh, la vitesse de migration = 0,0000188 (log de la solubilité dans l’eau) + 0,0000088 (log Koe) = 0,0000188 (-89) + 0,0000088 (5,68) = 3,32 × 10-5 mg/cm2/h. Pour le PT3PPH, la vitesse de migration = 0,0000188 (log de la solubilité dans l’eau) + 0,0000088 (log Koe) = 0,0000188 (-2,47) + 0,0000088 (7,55) = 1,98 × 10-5 mg/cm2/h.
| Paramètre | PTPh | PBPhDPh | PTPPh (PT3PPH) | PTPPh (PTPh / PT3PPH) |
|---|---|---|---|---|
| Facteur de contact cutané a (FCC) | 1 | 1 | 1 | 1 |
| Facteur de pénétration dans les textiles b (FPT) | S.O. | S.O. | S.O. | S.O. |
| Vitesse de migration c (VM) (mg/cm2/h) | 2,45 × 10-5 à 4,54 × 10-5 | 2,03 × 10-5 à 3,32 × 10-5 | 1,98 × 10-5 à 2,00 × 10-5 | Voir les valeurs pour le PTPh et le PT3PPH |
| Absorption cutanée (AC) | S.O. | 100 %d | 30 %e | 30 %e |
| Exposition estimée f – 0 à 6 mois (mg/kg p.c./j) | 0,021 à 0,13 | 0,018 à 0,098 | 0,0052 à 0,018 | 0,0052 à 0,040g |
| Exposition estimée f – 0,5 à 4 ans (mg/kg p.c./j) | 0,015 à 0,10 | 0,012 à 0,074 | 0,0037 à 0,013 | 0,0036 à 0,030g |
| Exposition estimée f – 5 à 11 ans (mg/kg p.c./j) | 0,010 à 0,071 | 0,0082 à 0,052 | 0,0024 à 0,0093 | 0,0024 à 0,021g |
| Exposition estimée f – 12 à 19 ans (mg/kg p.c./j) | 0,0081 à 0,062 | 0,0067 à 0,045 | 0,0020 à 0,0081 | 0,0020 à 0,019g |
| Exposition estimée f – 20 ans et plus (mg/kg p.c./j) | 5,6 × 10-3 à 4,7 × 10-2 | 0,005 à 0,034 | 0,001 à 0,006 | 0,0014 à 0,014g |
Abréviations — S.O. : sans objet.
a Aucun facteur de contact cutané propre à une substance donnée, c.‑à‑d. la fraction de la substance sur une surface qui adhère à la peau, n’a été trouvé pour le PTPh, le PBPhDPh ou le PTPPh dans les publications scientifiques. Une valeur de 1 a donc été choisie, avec l’hypothèse implicite que la totalité de la substance chimique en contact avec la peau peut être absorbée.
b Un facteur de pénétration dans les textiles (FPT) n’a pas été appliqué, car les vitesses de migration utilisées pour l’extrapolation ont été obtenues à l’aide d’échantillons de mousse couverts (voir le tableau G-3).
c Voir le tableau G-3 pour le calcul des vitesses de migration.
d Nous avons présumé que l’absorption cutanée du PBPhDPh était de 100 %, en raison des données limitées sur cette substance.
e L’absorption cutanée du PTPh et du PT3PPH a été ajustée à 30 %, en raison de l’utilisation du PTDCP comme analogue pour le PTPPh (EU RAR 2008b).
f Valeur calculée selon l’équation suivante : absorption cutanée = [SC × FCC × FPT × VM × DE × AC] / p.c. Voir le tableau G-2 pour les valeurs SC, DE et p.c., et le tableau G-3 pour les vitesses de migration (VM).
g La plage des estimations de l’exposition représente l’exposition à l’isomère PT3PPH (plus faible exposition) et au PTPh (plus grande exposition × 30 % AC).
| Groupe d’âge | Superficie de contact avec la peaua (SC) | Durée de l’expositionb (DE) | Poids corporelc (p.c.) |
|---|---|---|---|
| 0 à 6 mois | 215 cm2 | 3 h/j | 7,5 kg |
| 0,5 à 4 ans | 357 cm2 | 3 h/j | 15,5 kg |
| 20 ans et plus | 1395 cm2 | 6 h/j | 70,9 kg |
a Pour ce scénario, nous avons présumé qu’une personne porte un short et un t-shirt qui couvrent la moitié de ses membres. La superficie exposée est basée sur l’exposition d’une fraction de la moitié inférieure des membres (bras et jambes). Les valeurs de la superficie des membres (Santé Canada 1995) ont été multipliées par 0,5 pour tenir compte de la couverture offerte par les vêtements, puis par un tiers pour tenir compte de la forme triangulaire des membres, un seul côté étant directement en contact avec la mousse (c.‑à‑d. enfant ou nourrisson dans un siège ou personne assise sur un sofa) [US CPSC 2006].
b La durée d’exposition en position assise a été ajustée à partir des données rapportées par la CPSC (US CPSC 2006) pour une position assise décontractée.
c Santé Canada (1998).
| Paramètre | PTDCP | TCEP | PTBOE | PTE |
|---|---|---|---|---|
| Solubilité dans l’eau (mg/L) | 18,1 | 7820 | 1670 | 500 000 |
| Log Koe sans dimension) | 3,69 | 1,78 | 3,81 | 0,8 |
| Vitesse de migration à partir de mousse recouverte (mg/cm2/h)a | 0,00297 | 0,0207 |
0,00624b 0,0143c |
1,0b 0,0325c |
a Les vitesses de migration pour le PTDCP et le TCEP ont été déterminées dans des études de migration réalisées par l’EPA du Danemark (2015) sur de la mousse de meubles traitée, selon ECHA (2018). Les vitesses de migration du TCEP et du PTDCP ont été déterminées pour des produits pour enfants (c.‑à‑d. sièges pour nourrisson ou enfant, écharpes porte-nourrisson, matelas pour nourrisson) en immergeant des morceaux de mousse provenant de ces produits (généralement avec une partie du revêtement en tissu inclus dans les échantillons) dans une solution simulant la sueur, et en incubant les échantillons à 37 °C pendant 3 heures (Danish EPA 2015). La vitesse de migration du PTDCP utilisée ici est la moyenne des valeurs trouvées pour tous les échantillons pour cette substance ignifuge, tandis que la vitesse de migration du TCEP provenait d’un seul article (ECHA 2018).
b Valeur calculée d’après une ligne droite tracée entre les valeurs pour la solubilité dans l’eau et la vitesse de migration pour le PTDCP et le TCEP, selon l’équation y = (2 × 10-6) × solubilité dans l’eau + 0,0029.
c Valeur calculée à l’aide d’équations différentielles basées sur les vitesses de migration du PTDCP et du TCEP, leurs solubilités dans l’eau et leurs valeurs log Koe selon l’équation de vitesse de migration = x (log de la solubilité dans l’eau) + y (log Koe). Pour le PTDCP, cette valeur est de 0,00297 mg/cm2/h = x (1,26) + y (3,69), et pour le TCEP, elle est de 0,0207 = x (3,89) + y (1,78). En résolvant pour x et y, on obtient x = 0,0059 et y = -0,0012. Pour le PTBOE, la vitesse de migration = 0,0059 (log de la solubilité dans l’eau) – 0,0012 (log Koe) = 0,0059 (3,22) – 0,0012 (3,81) = 1,43 × 10-2 mg/cm2/h. Pour le PTE, la vitesse de migration = 0,0059 (log de la solubilité dans l’eau) – 0,0012 (log Koe) = 0,0059 (5,70) – 0,0012 (0,8) = 3,25 × 10-2 mg/cm2/h.
| Paramètre | PTE (siège pour nourrisson ou enfant) | PTE (position assise sur un matelas ou un meuble contenant de la mousse) | PTBOE (siège pour nourrisson ou enfant ou sofa) | PTPPh (PTPh / PT3PPH) (siège pour nourrisson ou enfant) |
|---|---|---|---|---|
| Facteur de contact cutané a (FCC) | 1 | 1 | 1 | 1 |
| Facteur de pénétration dans les textiles b (FPT) | 0,1 | 0,1 | 0,1 | S.O. |
| Vitesse de migration c (VM) (mg/cm2/h) | 3,25 × 10-2 à 1,0 | 3,25 × 10-2 à 1,0 | 6,24 × 10-3 à 1,43 × 10-2 | 1,98 × 10-5 à 4,54 × 10-5 |
| Absorption cutanée (AC) | 100 % d | 100 % d | 40 % e | 30 % f |
| Exposition estimée – 0 à 6 mois (mg/kg p.c./j) | 0,28 à 8,60 g | 2,8 à 294 h | 0,021 à 0,049 g | 5,1 × 10-4 à 1,2 × 10-3 g |
| Exposition estimée – 0,5 à 4 ans (mg/kg p.c./j) | 0,22 à 6,91 g | 2,0 à 224 h | 0,017 à 0,040 g | 4,1 × 10-4 à 9,4 × 10-4 g |
| Exposition estimée – 5 à 11 ans (mg/kg p.c./j) | S.O. | 1,3 à 156 h | S.O. | S.O. |
| Exposition estimée – 12 à 19 ans (mg/kg p.c./j) | S.O. | 1,1 à 134 h | S.O. | S.O. |
| Exposition estimée – 20 ans et plus (mg/kg p.c./j) | S.O. | 0,75 à 103 h | S.O. | S.O. |
Abréviations — S.O. : sans objet.
a Aucun facteur de contact cutané propre à une substance, c.‑à‑d. la fraction de la substance sur une surface qui adhère à la peau, n’a été trouvé pour le PTE ou le PTBOE dans les publications scientifiques. Une valeur de 1 a donc été choisie, avec l’hypothèse implicite que la totalité de la substance chimique en contact avec la peau peut être absorbée.
b Un facteur de pénétration dans les textiles (FPT) a été appliqué pour le PTE et le PTBOE afin de tenir compte des vitesses de migration utilisées pour l’extrapolation (c.‑à‑d. le PTDCP et le PTCP), déterminées pour de la mousse non couverte (ECHA 2018). Aucune donnée propre aux substances pour la pénétration dans du tissu n’a été trouvée dans les publications scientifiques. Une valeur de 0,1 (Driver et coll. 2007, étude citée dans ECHA 2018) a donc été utilisée pour la valeur FPT pour le PTE et le PTBOE. Une valeur FPT n’a pas été appliquée pour estimer l’exposition au PTPPh, car les vitesses de migration utilisées pour l’extrapolation étaient déjà comptabilisées par les valeurs pour les échantillons de mousse recouverte (voir le tableau G-3).
c Voir le tableau G-6 pour le calcul des vitesses de migration pour le PTE et le PTBOE et le tableau G-3 pour le PTPPh.
d Nous avons présumé que l’absorption cutanée du PTE était de 100 %, en raison des données limitées propres à la substance.
e L’absorption cutanée du PTBOE a été ajustée à 40 %, d’après l’utilisation du TCPP comme analogue (EU RAR 2008a).
f Les valeurs d’absorption cutanée du PTPh et du PT3PPH ont été ajustées à 30 %, d’après l’utilisation du PTDCP comme analogue (EU RAR 2008b).
g Valeur obtenue selon l’équation suivante : absorption cutanée = [SC × FCC × FPT × VM × DE × AC] / p.c. Voir le tableau G-5 pour les valeurs SC, DE et p.c., et le tableau G-6 pour les vitesses de migration (VM).
h Valeur calculée pour le PTE selon l’équation suivante : absorption cutanée = [SC × FCC × FPT × VM × DE × AC] / p.c. Voir le tableau G-2 pour les valeurs SC, DE et p.c., et le tableau G-6 pour les vitesses de migration (VM).
| Groupe d’âge | Superficie mise en bouchea (SC) | Durée de l’expositionb (DE) | Poids corporelc (p.c.) |
|---|---|---|---|
| 0 à 6 mois | 10 cm2 | 24,5 min/j | 7,5 kg |
| 0,5 à 4 ans | 20 cm2 | 24,5 min/j | 15,5 kg |
a La superficie pour les nourrissons de 0 à 6 mois est tirée de multiples références (RIVM 2008). La superficie pour les enfants de 0,5 à 4 ans découle du jugement professionnel représentant deux fois la superficie de la bouche ouverte d’un enfant de 0,5 à 4 ans.
b La durée de mise en bouche des produits pour enfants contenant de la mousse, comme les tapis de sieste, les sièges pour nourrisson ou enfant et les petits meubles est basée sur la durée pour les « autres objets » dans Norris et Smith (2002) [étude citée dans US EPA (2011)].
c Santé Canada (1998).
| Substance | 0 à 6 mois (mg/kg p.c./j) | 0,5 à 4 ans (mg/kg p.c./j) |
|---|---|---|
| PTPh | 1,33 × 10-5 à 2,47 × 10-5 | 1,29 × 10-5 à 2,39 × 10-5 |
| PBPhDPh | 1,11 × 10-5 à 1,81 × 10-5 | 1,07 × 10-5 à 1,75 × 10-5 |
| PTPPhb | 1,08 × 10-5 à 2,47 × 10-5 | 1,04 × 10-5 à 2,39 × 10-5 |
| PTE | 0,018 à 0,54 | 0,017 à 0,53 |
| PTBOE | 3,40 × 10-3 à 7,79 × 10-3 | 3,29 × 10-3 à 7,53 × 10-3 |
a Valeurs calculées selon l’équation suivante : absorption par voie orale = [SC × VM × DE] / p.c. Voir le tableau G‑8 pour les valeurs SC et DE, et les tableaux G-3 et G-6 pour les vitesses de migration (VM). On présume que chaque substance est complètement absorbée lors de l’exposition par voie orale, et qu’un revêtement textile sur l’objet en mousse n’affecterait pas la migration (en d’autres mots, nous n’appliquons aucun facteur de pénétration dans les textiles, c.‑à‑d. la valeur FPT).
b La plage des estimations de l’exposition représente l’exposition à l’isomère PT3PPH (exposition la plus faible) et au PTPh (exposition la plus élevée).
Annexe H. Estimation de l’absorption de PTBOE d’après les études de biosurveillance du PBBEHE dans l’urine par dosimétrie inverse
Yang et coll. (2019) ont eu recours à la dosimétrie inverse pour estimer l’absorption journalière à partir des concentrations dans l’urine des femmes canadiennes préménopausées (18 à 44 ans) Les valeurs d’absorption journalière basée sur les concentrations ajustées en fonction de la créatinine ont été calculées par dosimétrie inverse, comme l’indique l’équation ci‑dessous. Voir le tableau H-1.
Absorption journalière = ([urine]CR × CR) / [p.c. × EUF]
| Symbole | Description | Valeur |
|---|---|---|
| [urine]CR | Concentration urinaire du PBBEHE ajustée en fonction de la créatinine (ng/mL)a |
4,86 (moyenne) 33,7 (95e centile) |
| CR | Élimination de la créatinine en 24 h (g/j) | 1,2 (hommes/femmes de 20 ans et plus)b |
| p.c. | Poids corporel (kg) | 70,9 (20 ans et plus)c |
| EUF | Élimination urinaire fractionnelle | 0,0838d |
| Absorption journalière | Absorption (µg/kg p.c./j) |
9,8 × 10-4 (basée sur la valeur moyenne [urine]CR) 6,8 × 10-3 (basée sur le 95e centile de la valeur [urine]CR) |
a Yang et coll. 2019
b Hays et coll. 2010
c Santé Canada 1998.
d Après l’administration orale de PTBOE à des sujets humains (n = 6) dans une étude de toxicocinétique (Völkel et coll. 2018), le pourcentage moyen d’élimination du PBBEHE en 39 h était de 8,38 %.
