Ébauche d’évaluation préalable - Heptaméthylnonane
Titre officiel : Ébauche d’évaluation préalable - 2,2,4,4,6,8,8-heptaméthylnonane (Heptaméthylnonane)
Numéro d’enregistrement du Chemical Abstracts Service: 4390-04-9
Environnement et Changement climatique Canada
Santé Canada
Janvier 2020
Résumé
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), les ministres de l’Environnement et de la Santé ont réalisé l’évaluation préalable du 2,2,4,4,6,8,8‑heptaméthylnonane, ci-après appelé heptaméthylnonane (HMN). Le numéro d’enregistrement du Chemical Abstracts Service (NE CASNote de bas de page 1 de l’HMN est 4390-04-9. Cette substance fait partie des substances désignées comme étant d’intérêt prioritaire pour une évaluation, car elle satisfait aux critères de catégorisation du paragraphe 73(1) de la LCPE.
L’HMN est un hydrocarbure aliphatique très ramifié et n'est pas présent naturellement dans l’environnement. La substance est principalement utilisée comme crème revitalisante pour la peau, émollient ou solvant dans des produits de soins personnels. D’après l’information obtenue dans une enquête menée conformément à un avis émis en vertu de l’article 71 de la LCPE, la substance aurait été importée au Canada en quantités variant de 10 000 à 100 000 kg et n’aurait pas été fabriquée au Canada en quantités supérieures au seuil de déclaration de 100 kg.
Le risque pour l’environnement associé à l’HMN a été caractérisé à l’aide de la classification du risque écologique (CRE) des substances organiques, une approche fondée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition, et d'une pondération de plusieurs éléments de preuve pour déterminer le classement des risques. Les profils de danger sont principalement fondés sur les paramètres liés au mode d’action toxique, à la réactivité chimique, à des seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Les paramètres pris en compte pour les profils d’exposition sont les taux d’émission potentiels, la persistance globale et le potentiel de transport à grande distance. Une matrice du risque est utilisée pour attribuer un degré de préoccupation potentielle faible, modéré ou élevé aux substances en fonction de leurs profils de danger et d’exposition. D’après les résultats de l’analyse de la CRE, on considère qu’il est peu probable que l’HMN cause des effets nuisibles à l’environnement.
Compte tenu de tous les éléments de preuve contenus dans la présente ébauche d’évaluation préalable, l’HMN présente un risque faible de causer des effets nocifs pour l’environnement. Il est proposé de conclure que l’HMN ne satisfait pas aux critères énoncés aux alinéas 64a) et b) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique ou à mettre en danger l’environnement essentiel pour la vie.
Le potentiel de danger pour l’humain de l’HMN est considéré comme faible en raison de l’absence d’effet génotoxique ou d’effet sur la reproduction ou le développement, et d’autres effets nuisibles pour la santé humaine jusqu’à 1000 mg/kg p.c./jour, maximum établi d’après les études sur l’ingestion par voie orale associée à l’HMN, et jusqu’à 1393 mg/m3, maximum établi d’après les études d’exposition par inhalation menées sur une substance de structure apparentée. Comme le potentiel de danger de l’HMN et le risque pour la santé humaine associé à cette substance sont considérés comme faibles, l’exposition de la population générale n’a pas été estimée.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que l’HMN ne satisfait pas au critère énoncé à l’alinéa 64c) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est proposé de conclure que l’HMN ne satisfait à aucun des critères énoncés à l’article 64 de la LCPE.
1. Introduction
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE) (Canada 1999), les ministres de l’Environnement et de la Santé ont réalisé l’évaluation préalable du 2,2,4,4,6,8,8‑heptaméthylnonane, ci-après appelé heptaméthylnonane (HMN), afin de déterminer si cette substance présente ou peut présenter un risque pour l’environnement ou la santé humaine. Cette substance a été jugée prioritaire pour une évaluation, car elle satisfait au critère de catégorisation énoncé au paragraphe 73(1) de la LCPE (ECCC, SC [modifié en 2017]).
Les risques pour l’environnement associés à l’HMN ont été caractérisés à l’aide de la classification des risques écologiques (CRE) des substances organiques (ECCC 2016a). La CRE décrit le danger d’une substance à l’aide de paramètres clés comme le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité et l’activité biologique et chimique, et tient compte de l’exposition possible des organismes dans les milieux aquatiques et terrestres en fonction de facteurs tels que le taux d’émissions potentielles, la persistance globale et le potentiel de transport à grande distance dans l’atmosphère. On combine les différents éléments de preuve pour déterminer quelles substances nécessitent une évaluation approfondie de leur potentiel de causer des effets nocifs pour l’environnement ou présentent une probabilité faible de causer de tels effets.
La présente ébauche d’évaluation préalable comprend l’examen des données sur les propriétés chimiques, le devenir environnemental, les dangers, les utilisations et les expositions, y compris d’autres renseignements présentés par les intervenants. Les données pertinentes ont été colligées jusqu’en février 2019. Les recherches bibliographiques ciblées ont été réalisées jusqu’en juin 2019. Les données empiriques provenant d’études clés ainsi que les résultats de la modélisation ont servi à tirer les conclusions proposées. Lorsqu’ils étaient pertinents, les renseignements contenus dans les évaluations effectuées par d’autres instances ont été pris en compte.
La présente ébauche d’évaluation préalable a été préparée par le personnel du Programme d’évaluation des risques encadré par la LCPE à Santé Canada et à Environnement et Changement climatique Canada, et comprend des observations provenant du personnel d’autres programmes régis par ces ministères. Les parties de la présente ébauche d’évaluation préalable portant sur la santé humaine ont fait l’objet d’un examen et/ou de consultations externes. Les commentaires sur les parties techniques contenues dans ce volet ont été formulés par Jennifer Flippin, Theresa Lopez et Joan Garey, toutes affiliées à Tetra Tech. La partie de l’évaluation portant sur l’environnement repose sur le document de CRE (publié le 30 juillet 2016), lequel a fait l’objet d’un examen externe et d’une consultation publique de 60 jours. Bien que les commentaires de l’extérieur aient été pris en compte, le contenu définitif et les résultats de la présente ébauche d’évaluation préalable demeurent la responsabilité de Santé Canada et d’Environnement et Changement climatique Canada.
La présente ébauche d’évaluation préalable repose sur des renseignements essentiels permettant de déterminer si cette substance satisfait aux critères énoncés à l’article 64 de la LCPE par l’examen des données scientifiques et l’application d’une approche fondée sur le poids de la preuve et le principe de précautionNote de bas de page 2. La présente ébauche d’évaluation préalable expose les renseignements essentiels et les facteurs sur lesquels repose la conclusion proposée.
2. Identité de la substance
Le numéro d’enregistrement du Chemical Abstracts Service (NE CASNote de bas de page 3 ) de l’HMN, son nom sur la Liste intérieure des substances (LIS) et son nom commun sont indiqués dans le tableau 2-1.
| NE CAS | Nom sur la LIS (noms communs, abréviation) | Structure chimique et formule moléculaire | Poids moléculaire (g/mol) |
|---|---|---|---|
| 4390-04-9 | 2,2,4,4,6,8,8-Heptaméthylnonane (heptaméthylnonane [HMN], isohexadécanea) | 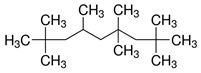 C16H34 |
226,45 |
a Le nom commun « isohexadécane » est un terme général utilisé pour décrire les hydrocarbures saturés ramifiés de 16 atomes de carbone (CIR 2012).
2.1 Sélection d’analogues
Une méthode d’extrapolation faisant appel aux données d’un analogue a été utilisée pour éclairer l’évaluation des effets de l’HMN sur la santé humaine. L’analogue a été choisi en raison de sa similarité de structure et/ou de fonction à l’HMN (propriétés physicochimiques, toxicocinétique et réactivité similaires) et de ses données empiriques pertinentes qui pouvaient être utilisées pour l’extrapolation à des critères d’effet pour lesquels les données empiriques étaient limitées. Dans le tableau 2-2, sont présentées les caractéristiques de l’analogue utilisé pour alimenter l’évaluation de l’HMN. L’annexe A fournit d’autres précisions sur les facteurs pris en compte dans la recherche d’analogues possibles. Pour de plus amples renseignements sur les propriétés physicochimiques de l’analogue et des données sur les effets de cette substance sur la santé, veuillez consulter l’annexe B. Les détails sur les données d’extrapolation utilisées pour éclairer l’évaluation portant sur les effets de l’HMN sur la santé humaine sont présentés dans les sections pertinentes du présent rapport.
| NE CAS | Noms communs | Structure chimique | Poids moléculaire (g/mol) |
|---|---|---|---|
| 13475-82-6 |
|
UVCB (structure représentative)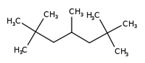 C12H26 |
UVCB (d’après la structure représentative) 170 |
a Le nom commun « isohexadécane » représente un groupe d’hydrocarbures saturés aliphatiques ou ramifiés composés exclusivement d’atomes d’hydrogène et de carbone (formule générale : C12H26). En théorie, il peut y avoir 355 isomères d’isododécane différents (ANSES 2013).
b Substance UVCB. UVCB est le sigle anglais désignant les substances de composition inconnue ou variable, les produits de réaction complexes ou les matières biologiques. Ces substances sont de sources naturelles ou le résultat de réactions complexes et ne peuvent être caractérisées par leurs constituants chimiques en raison de leur composition trop complexe ou variable. Un UVCB n’est pas un mélange intentionnel de substances distinctes, mais il est considéré comme une seule substance.
3. Propriétés physiques et chimiques
Un résumé des propriétés physiques et chimiques de l’HMN, accompagnées d’une fourchette de valeurs s’il y a lieu, est présenté dans le tableau 3-1. Quand les données expérimentales sur une propriété étaient limitées ou inaccessibles, on utilisait les données de l’analogue pour effectuer une extrapolation et/ou les modèles (Q)SAR pour produire des valeurs pour la substance. D’autres propriétés physiques et chimiques sont présentées dans ECCC (2016b).
| Propriété | Valeur ou fourchette | Type de données | Principale référence |
|---|---|---|---|
| État physique | Liquide blanc | Expérimentales | Sigma Aldrich 2015 |
| Point d’ébullition (°C) | 240 | Expérimentales | Sigma Aldrich 2015 |
| Pression de vapeur (Pa) | 130 (20 °C) | Expérimentales | Sigma Aldrich 2015 |
| Constante de Henry (atm·m3/mol) | 2,90 x101 – 1,12 x102 | Modélisées | EPI Suite c2000-2012 |
| Solubilité dans l’eau (mg/L) | 0,002 05 | Modélisées | EPI Suite c2000-2012 |
| Log Koe (sans unité) | 7,79 | Modélisées | EPI Suite c2000-2012 |
| Log Koc (sans unité) | 4,15 – 6,76 | Modélisées | EPI Suite c2000-2012 |
| Log Koa (sans unité) | 4,72 | Modélisées | EPI Suite c2000-2012 |
4. Sources et utilisations
L’HMN est un hydrocarbure aliphatique très ramifié et ne serait pas présent naturellement dans l’environnement. Cette substance à structure ramifiée peut être produite par alkylation, puis par une combinaison d’alcanes à courte chaîne, suivie d’une isomérisation (CIR 2012). D’après les renseignements présentés dans le cadre d’une enquête menée conformément à un avis émis en vertu de l’article 71 de la LCPE pendant l’année de déclaration 2011, l’HMN n’était pas fabriqué au Canada en quantités supérieures au seuil de 100 kg et a été importé au Canada en quantités variant de 10 000 à 100 000 kg (Environnement Canada 2013).
Au Canada, l’HMN est un ingrédient dans divers produits de soins personnelsNote de bas de page 4 disponibles aux consommateurs et est utilisé dans les secteurs des produits de soins personnels et des produits pharmaceutiques (Environnement Canada 2013). Comme ingrédient cosmétique, il a des fonctions de revitalisant pour la peau, d’émollient ou de solvant (CIR 2012). Cette substance serait un ingrédient dans des milliers de produits cosmétiques déclarés à Santé Canada conformément au Règlement sur les cosmétiques et à la Loi sur les aliments et drogues, et elle est souvent déclarée comme présente dans les lotions hydratantes, le maquillage, les nettoyants pour la peau et les revitalisants capillaires (communication personnelle, courriels de Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada, adressés au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, datés de juillet 2018; sans référence).
L’HMN figure dans la Base de données sur les ingrédients des produits de santé naturels (BDIPSN) avec un rôle non médicinal comme revitalisant de la peau, émollient et solvant, et dans la Base de données des produits de santé naturels homologués (BDPSNH) comme ingrédient dans un grand nombre de produits de santé naturels homologués, plus souvent présent dans les crèmes et lotions pour la peau et les écrans solaires, (communication personnelle, courriels de la Direction des produits de santé naturels et sans ordonnance, Santé Canada adressés au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, datés de décembre 2018; sans référence).
D’après les données de la base de données interne de Santé Canada sur les produits pharmaceutiques, l’HMN est un ingrédient non médicinal présent dans certains produits pharmaceutiques sans ordonnance, notamment dans les écrans solaires (communication personnelle, courriels de la Direction des produits thérapeutiques de Santé Canada adressés au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, datés de janvier 2019; sans référence).
L’HMN n’est pas un additif alimentaire approuvé au Canada et son utilisation n’a jamais été déclarée comme composant dans des matériaux d’emballage d’aliments ou des additifs indirects au Canada, d’après les renseignements obtenus auprès de la Direction des aliments de Santé Canada (communication personnelle, courriels de la Direction des aliments de Santé Canada adressés au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, datés de janvier 2019; sans référence). D’après les renseignements obtenus auprès de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada, l’HMN ne serait pas utilisé comme matière active ou formulant de pesticides au Canada (communication personnelle, courriels de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada adressés au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, datés de juillet 2018; sans référence).
5. Potentiel de causer des effets nuisibles à l’environnement
5.1 Caractérisation des risques pour l’environnement
Les risques pour l’environnement associés à l’HMN ont été caractérisés à l’aide de l’approche de classification des risques écologiques (CRE) des substances organiques (ECCC 2016a). La CRE est une approche axée sur la notion de risque; elle attribue un score de risque en tenant compte de nombreuses mesures du danger et de l’exposition, pondérées par différents éléments de preuve. Les divers éléments de preuve sont réunis pour que l’on puisse distinguer les substances présentant une puissance faible ou élevée et un potentiel d’exposition faible ou élevé dans divers milieux. Une telle approche permet de réduire l’incertitude globale de la caractérisation du risque comparativement à une approche qui reposerait sur un paramètre unique dans un seul milieu (p. ex., la concentration létale médiane [CL50]) pour la caractérisation. Voici l’approche résumée, décrite en détail dans ECCC (2016a).
Les données sur les propriétés physicochimiques, le devenir (demi-vies chimiques dans divers milieux et biotes, coefficients de partage et bioconcentration dans les poissons), l’écotoxicité aiguë pour les poissons et les volumes de produits chimiques importés ou fabriqués au Canada proviennent de publications scientifiques, des bases de données empiriques accessibles (p. ex., la boîte à outils QSAR de l’OCDE 2017), et les réponses fournies aux enquêtes menées conformément à l’avis donné en vertu de l’article 71 de la LCPE, ou sont des données produites par modélisation de la relation (quantitative) structure-activité (QSAR), du devenir du bilan massique ou de la bioaccumulation. Ces données ont servi à alimenter d’autres modèles de bilan massique ou à remplir les profils de risques et de l’exposition des substances.
Les profils de danger reposent principalement sur des paramètres tels que le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité et l’activité chimique et biologique. Les profils d’exposition sont également fondés sur plusieurs paramètres, dont le taux d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. On a comparé les profils de danger et d’exposition aux critères de décision afin de classer les potentiels de danger et d’exposition de chaque substance organique comme faibles, modérés ou élevés. On a appliqué d’autres règles (p. ex., cohérence de la classification, marge d’exposition) pour préciser les classements préliminaires de danger et d’exposition.
Une matrice de risques a permis d’attribuer à chaque substance un risque potentiel faible, modéré ou élevé, en fonction du classement de son danger et de son exposition. On a vérifié le classement du risque potentiel établi au moyen de la CRE en suivant une approche en deux étapes. La première étape consistait à faire passer le classement des risques de moyen ou élevé à faible dans le cas des substances dont le taux d’émission estimé dans l’eau est faible après traitement des eaux usées, représentant un potentiel d’exposition faible. La deuxième étape consistait à réévaluer le classement du potentiel de risque faible à l’aide de scénarios de risque relativement prudents à échelle locale (c.-à-d., la zone entourant directement la source ponctuelle de rejet) conçus pour ne pas nuire à l’environnement, afin de déterminer si le classement du risque potentiel devrait être revu à la hausse.
La CRE est une approche pondérée qui vise à réduire au minimum le risque d’un surclassement ou d’un sous-classement du danger, de l’exposition et des risques subséquents. Une deCREiption détaillée des approches équilibrées de traitement des incertitudes est présentée dans ECCC (2016a). Voici une deCREiption de deux des domaines d’incertitude les plus importants. Des valeurs de toxicité aiguë empiriques ou modélisées erronées pourraient entraîner des modifications du classement du danger, en particulier dans le cas des paramètres liés à des valeurs de résidus dans les tissus (c.-à-d. mode d’action toxique), dont bon nombre sont des valeurs estimées à l’aide de modèles QSAR (la boîte à outils QSAR de l’OCDE 2016). L’incidence d’une telle erreur est toutefois atténuée par le fait qu’une surestimation de la létalité médiane générera une valeur prudente (protectrice) pour les résidus dans les tissus qui sera utilisée lors de l’analyse des résidus corporels critiques (RCC). Une erreur due à une sous-estimation de la toxicité aiguë sera atténuée par le recours à d’autres paramètres de danger, tels que le profilage structurel du mode d’action, la réactivité et/ou l’affinité de liaison à l’œstrogène. Les changements ou les erreurs touchant les quantités chimiques pourraient donner lieu à un classement de l’exposition différent, les classements de l’exposition et du risque étant très sensibles aux taux d’émission et aux quantités utilisées. Les classements obtenus au moyen de la CRE représentent donc l’exposition et le risque au Canada compte tenu des quantités utilisées actuellement (déterminées par estimations), mais pourraient ne pas rendre compte des tendances futures.
Les données critiques et les paramètres pris en compte pour mettre au point les profils propres à l’HMN ainsi que les résultats de la classification du danger, de l’exposition et du risque sont présentés dans ECCC (2016b).
D’après les données prises en compte dans l’approche de CRE, le potentiel d’exposition de l’HMN est classé comme faible. Le potentiel de danger de l’HMN est classé comme modéré compte tenu du ratio d’écotoxicité élevé et de son potentiel à causer des effets nuisibles aux réseaux trophiques aquatiques en raison de son potentiel de bioaccumulation. Les effets potentiels et la façon dont ils peuvent se manifester dans l’environnement n’ont pas été approfondis en raison de la faible exposition à cette substance. Le potentiel de risque pour l’environnement de l’HMN a été jugé faible. Étant donné son profil d’utilisation actuel, cette substance ne suscitera probablement pas de préoccupation pour l’environnement au Canada.
6. Potentiel de causer des effets nocifs pour la santé humaine
6.1 Évaluation de l’exposition
Comme le potentiel de danger de l’HMN est considéré comme faible (voir l’évaluation des effets sur la santé ci-dessous), les valeurs quantitatives de l’exposition de la population générale n’ont pas été estimées. La présente section fournit de l’information générale sur l’exposition à l’HMN.
Aucune donnée canadienne ni donnée étrangère récente n’a été trouvée sur les concentrations d’HMN dans l’air ambiant, l’air intérieur, l’eau potable, la poussière ou le sol. Les rejets d’HMN dans l’eau peuvent découler d’activités industrielles de formulation de la substance dans des produits de soins personnels ou du rejet à l’égout de ces produits après leur utilisation.
L’exposition de la population générale par l’alimentation devrait être nulle.
La population générale du Canada devrait être exposée à l’HMN par inhalation et par voie cutanée, compte tenu de sa pression de vapeur et de son utilisation comme ingrédient dans un grand nombre de types de produits de soins personnels au Canada (p. ex., crèmes hydratantes, maquillage, nettoyants pour la peau, revitalisants capillaires, écrans solaires et crèmes contre l’acné).
6.2 Évaluation des effets sur la santé
Les principes généraux décrits dans l’approche scientifique destinée aux substances présentant un potentiel faible de danger pour la santé humaine (SC 2017) ont été pris en compte dans la présente évaluation des effets sur la santé. Le potentiel de danger de l’HMN est considéré comme faible en raison de l’absence d’effet génotoxique et d’effet sur la reproduction ou le développement, et d’autres effets nuisibles en lien avec la santé humaine, et ce, jusqu’à 1000 mg/kg p.c./jour, d’après les études de toxicité par voie orale menées sur l’HMN, et jusqu’à 1393 mg/m3, d’après les études de toxicité par inhalation menées sur un analogue (voir précisions ci-dessous).
Toxicocinétique
Une étude portant sur l’absorption et l’ingestion alimentaire de 100 mg/kg p.c./jour d’HMN chez le rat a donné lieu à une absorption apparente de 98 % d’après la différence entre la dose ingérée et la fraction éliminée dans les fèces (Tulliez et Bories 1975). Aucune étude de toxicocinétique sur la distribution et l’élimination de l’HMN n’a été trouvée. En ce qui concerne la métabolisation, il a été constaté que l’HMN est métabolisé en acide 2,2,4,4,6,8,8-heptaméthylnonanedicarboxylique après une exposition par voie orale à court terme chez le rat (Ikeda et coll. 1988). Ce métabolite principal a été isolé dans le foie et constitue un anion lipophile stable qui ne devrait pas être métabolisé par une β-oxydation en raison de la présence de deux groupes α‑méthyl adjacents sur les atomes de carbone terminaux. Par conséquent, il devrait être lentement excrété et s’accumuler là où il s’est formé.
Toxicité à doses répétées
Les études portant sur les effets sur la santé découlant de doses répétées d’HMN étaient limitées à quatre études de toxicité par voie orale à court terme (5, 14, 28 et environ 49 jours). Une étude de 5 jours par voie orale, ayant produit peu d’observations, a été menée chez des rats Wistar mâles (n = 5/groupe) auxquels on a administré 250 mg/kg p.c./jour d’HMN (dans de l’huile d’arachide) (Bomhard et coll. 1990). Des examens microscopiques ont été menés sur les tissus des reins dans le but de déterminer l’abondance des gouttelettes hyalines sur une échelle de 0 à 4. La cote sur l’activité a été de 2,0 pour l’HMN, ce qui correspond à une « réponse légère » (gouttelettes hyalines) dans un grand nombre de tubules proximaux. Comme cette étude ne comportait aucun groupe témoin, la pertinence de ces résultats du point de vue toxicologique n’est pas connue.
Dans une étude de toxicité par voie alimentaire de 14 jours visant à examiner les effets de l’HMN sur le foie, des rats Wistar-Imamichi mâles (n = 6/groupe) ont reçu 0 ou 1 % (p/p) d’HMN dans leur alimentation, équivalant à 0 ou à environ 1300 mg/kg p.c./jour (Ikeda et coll. 1988). Au jour 15, les animaux ont été sacrifiés et les foies ont été extraits. On a mesuré l’activité enzymatique (aniline hydroxylase, aminopyrine déméthylase, carnitine acétyltransférase, carnitine palmitoyltransférase, catalase, acyl gras-CoA-oxydase insensible au cyanure et acide dodécanoïque hydrolase), la teneur en cytochrome (CYP) P450 (une enzyme) et en protéines. Des examens microscopiques ont également été menés. Chez les animaux traités, on a observé une diminution significative du poids corporel (-10 %) et une augmentation significative du poids des foies (poids absolu et relatif, de 21 % et de 32 %, respectivement), de l’activité de la catalase, de l’activité d’oxydation de l’acyl gras-CoA-oxydase insensible au cyanure, de l’activité de la énoyl-CoA-hydralase peroxisomale et de l’activité d’enzymes mitochondriales (carnitine-pamitoyl-transférase, carnitine acétyltransférase). De plus, la teneur en cytochromes P450 a augmenté de 57 %, augmentation accompagnée d’une augmentation de l’activité de l’aniline hydroxylase, de l’aminopyrine déméthylase et de l’acide dodécanoïque oxydase. On a relevé une importante diminution de la concentration des triglycérides, des phospholipides, du cholestérol libre et du cholestérol total dans le sérum. Les examens histopathologiques ont révélé que, dans les tissus du foie, les peroxysomes étaient plus abondants, et étaient accompagnés d’une induction du réticulum endoplasmique lisse. Selon les auteurs, l’ensemble de ces effets semble indiquer que l’HMN peut être associé à l’induction de la prolifération des peroxysomes dans le foie. Bien que la dose administrée dans cette étude soit élevée (c.-à-d., 1300 mg/kg p.c./jour), ce qui peut ne pas être utile pour l’exposition humaine, cette étude donne un aperçu du mode d’action possible associé aux effets sur le foie (c.-à-d., la prolifération des peroxysomes).
Les études antérieures étaient axées sur des organes précis (c.-à-d., le foie et les reins), mais n’ont pas fourni plus de données de toxicité sur d’autres systèmes vitaux. Des données sur les autres systèmes étaient indiquées dans une étude de toxicité par gavage (voie orale) où des rats Crj:CD(SD) (n = 5/sexe/dose) ont reçu 0, 100, 300 ou 1000 mg/kg p.c./jour d’HMN (pur à 99,9 %, dans de l’huile de maïs) pendant 28 jours. D’autres animaux (n = 5/sexe) ont fait partie de l’étude, dans le groupe témoin et dans le groupe des animaux ayant reçu la dose la plus élevée, et ont bénéficié d’une période de récupération de 14 jours après la période d’exposition (Hatano Research Institute 1991). Les méthodes étaient comparables à celles de l’essai no 407 des Lignes directrices de l’Organisation de coopération et de développement économiques (OCDE). Tous les groupes exposés, y compris le groupe témoin, ont présenté des signes de salivation transitoire, accompagnés d’une augmentation liée à la dose de l’incidence aux doses élevées. À 300 mg/kg p.c./jour, on a observé une augmentation significative du poids des foies (de 19 % à 22 % par rapport au groupe témoin) qui était accompagnée d’une hypertrophie des hépatocytes centrolobulaires (foie) et d’une diminution de la concentration des triglycérides (diminution de 40 % par rapport au groupe témoin). Comme ces effets n’étaient plus présents après la période de récupération et n’étaient ni associés à des modifications telles qu’une dégénérescence ou une nécrose (p. ex., nécrose, fibrose, inflammation) ni accompagnés d’un changement de nature biologique significatif dans les marqueurs de dommages au foie (p. ex., alanine aminotransférase, aspartate aminotransférase), ils ont été considérés comme une réponse adaptative et non nocive, ce qui concorde avec les recommandations proposées par l’European Society of Toxicologic Pathology (Hall et coll. 2012) et l’Environmental Protection Agency des États‑Unis (US EPA 2002). À 1000 mg/kg p.c./jour, les animaux ont également présenté de longs temps de prothrombine et de thromboplastine activée (70 % et 27 % par rapport au groupe témoin, respectivement) qui ont duré jusque dans la période de récupération. Cependant, ces effets étaient moins marqués à la fin de la période de récupération (17 % et 12 % par rapport au groupe témoin, respectivement) et étaient accompagnés d’une augmentation significative du nombre de plaquettes, ce qui semble indiquer que ces effets sont réversibles. Les auteurs ont également indiqué qu’il n’y a eu aucune observation pathologique associée aux changements à l’analyse hématologique et de chimie clinique, et que ces modifications mentionnées n’ont pas dépassé de façon marquée la fourchette des fluctuations physiologiques. On a constaté trois cas de calculs dans les reins de femelles à la dose élevée, mais ces effets n’étaient plus présents à la fin de la période de récupération. Une dose sans effet observé (DSEO) de 100 mg/kg p.c./jour a été trouvée par les auteurs (aucun autre détail n’a été fourni). Toutefois, étant donné que les effets sur les organes étaient adaptatifs, réversibles et non nocifs, et que les variations des analyses hématologiques et de chimie clinique se trouvaient dans les limites historiques des groupes témoin, une dose sans effet nocif observé (DSENO) de 1000 mg/kg p.c./jour a été prise en compte, et représente la dose maximale à l’essai (DME).
Dans une autre étude à court terme sur la toxicité pour la reproduction et le développement de l’HMN, des rats Crl:CD(SD) (n = 12/sexe/groupe) ont reçu 0, 100, 300, 1000 mg/kg p.c./jour d’HMN (pur à 98,4 %, dans de l’huile de maïs) par gavage pendant 49 jours chez les mâles et environ 5 à 7 semaines chez les femelles (14 jours avant l’accouplement au jour postnatal [JPN] 3 des petits) (MHLW 2007). L’étude a été menée conformément à l’essai no 421 des Lignes directrices de l’OCDE. Des signes cliniques, de la mortalité et une variation du poids corporel et de la consommation d’aliments ont été enregistrés. L’examen macroscopique a été mené sur tous les principaux organes et tissus, mais l’examen histopathologique n’a eu lieu que sur les organes reproducteurs et ceux présentant des anomalies macroscopiques. Une faible incidence de la salivation (1 ou 2 cas) a été constatée aux doses égales ou supérieures à 300 mg/kg p.c./jour, mais elle a été considérée comme transitoire, puisqu’elle a disparu immédiatement après l’administration. À 1000 mg/kg p.c./jour, 70 % des mâles avaient une hypertrophie des hépatocytes centrolobulaires (foie). Les auteurs ont établi la DSEO à 300 mg/kg p.c./jour pour les mâles, en fonction des effets sur le foie observés à la deuxième dose de 1000 mg/kg p.c./jour, bien qu’ils aient noté que ces changements ne soient pas accompagnés d’une nécrose des cellules hépatiques ou de changements laissant entendre qu’il y aurait des dommages. D’après ces données, on a estimé que cette étude ne révélait aucun effet nocif jusqu’à la dose d’essai maximale de 1000 mg/kg p.c./jour.
Aucune étude plus longue et par d’autres voies d’administration n’a été trouvée pour l’HMN. Cependant, trois études de toxicité subchronique d’administration par inhalation et par voie orale ont été trouvées pour l’analogue, l’isododécane. D’après les données, l’isododécane est un produit de qualité commerciale et technique dont le point d’ébullition varie de 160 à 170 °C, et est composé de moins de 2 ppm d’hydrocarbures C4 au total, de 0,3 % (p/p) d’hydrocarbures C8 au total, de 97,7 % (p/p) d’hydrocarbures C12 au total (composés de 82 % de 2,2,4,6,6-pentaméthylheptane et de 17,7 % d’autres substances), de moins de 0,1 % (p/p) d’hydrocarbures C16 au total, de moins de 10 ppm de substances aromatiques, de 10 ppm d’eau et de 2 mg de brome/100 g de matériel (Appelman et coll. 1982). L’isododécane et l’HMN présentent des similarités en matière de structure et de profils de ramification, et sont comparables du point de vue de la longueur de la chaîne carbonée. D’après ce qui précède, ils devraient avoir des voies métaboliques similaires (TIMES 2016), présenter une réactivité similaire (boîte à outils QSAR de l’OCDE 2017) et avoir des propriétés physicochimiques similaires (annexe B; ECHA 2019a).
Les effets de l’isododécane découlant de l’exposition par inhalation ont été examinés dans le cadre d’une étude de 13 semaines où des rats (n = 20/sexe/groupe) ont été exposés par l’organisme entier à 0, 12,5, 50, 100 ou 200 ppm d’isododécane (équivalant à 0, 87, 348, 697, 1393 mg/m3, respectivement) pendant 6 h/jour, 5 jours/semaine (Appelman et coll. 1982, données brutes non accessibles). Des observations ont été notées sur l’apparence générale, la croissance, l’analyse hématologique, la chimie clinique et la composition de l’urine. Un examen macroscopique a été mené sur les principaux organes, mais l’examen histopathologique n’a été réalisé que sur les reins. Aux concentrations supérieures ou égales à 348 mg/m3, une augmentation liée à la dose de l’incidence de la néphrose tubulaire des reins des mâles a été observée. Les lésions étaient caractérisées par une perte d’éosinophilie cytoplasmique, une striation, une perte de la bordure en brosse, une augmentation de la taille des cellules et des noyaux de l’épithélium (principalement les tubules proximaux). Ces changements étaient parfois accompagnés de petits ou très petits agrégats de cellules inflammatoires mononucléées. Les auteurs ont relevé des différences dans les analyses hématologiques, de la chimie du sang et de l’urine, ainsi que dans le poids des organes, mais ont indiqué qu’elles étaient dans la fourchette de variabilité biologique sans relation dose-réponse claire. Par conséquent, ces différences n’ont pas été considérées comme pertinentes sur le plan toxicologique. L’examen macroscopique à l’autopsie n’a pas révélé de lésion macroscopique pouvant être attribuée au traitement. Les auteurs ont établi une « dose sans effet toxique » à 12,5 ppm (87 mg/m3). Cependant, il existe des données probantes voulant que l’administration de solvants à base d’hydrocarbures soit associée à l’accumulation d’α2µ-globulines et à la néphropathie chez les mâles (Bomhard et coll. 1990; CIR 2002; McKee et coll. 2015). La néphropathie induite par les α2µ-globulines chez les rats mâles est considérée comme un effet propre au genre et à l’espèce, et ne serait pas pertinente sur le plan de la santé humaine (US EPA 1991; Hard et coll. 1993).
Des effets sur les reins ont également été rapportés dans le résumé d’une étude de toxicité par inhalation de 13 semaines menée chez des rats (lignée non précisée, n = 20/sexe/groupe) exposés à 0, 200, 600, 1800 ppm (0, 1400, 4200, 12 600 mg/m3) d’isododécane pendant 6 h/jour, 5 jours/semaine (Appelman et coll. 1980, l’article complet n’est pas accessible). Une augmentation du poids relatif des reins et du volume d’urine de faible densité a été observée chez les mâles aux concentrations égales ou supérieures à 4200 mg/m3, et chez les femelles à la concentration la plus élevée (12 600 mg/m3). Toutefois, des changements macroscopiques et histopathologiques (c.-à-d., reins verdâtres, néphrose tubulaire) n’ont été observés que chez les mâles. D’après les données probantes associant l’exposition à du solvant à base d’hydrocarbures à une néphropathie induite par des α2µ-globulines (Bomhard et coll. 1990; CIR 2002; McKee et coll. 2015), ces effets n’ont pas été considérés comme pertinents sur le plan de la santé humaine. Aucun effet propre à la voie d’administration (p. ex., sensibilisation respiratoire) ni effet lié au traitement au point de contact n’a été rapporté dans les études de toxicité par inhalation.
Dans une étude de toxicité par voie orale de 13 semaines, des rats Wistar (n = 20/sexe/groupe) ont reçu 0, 330, 1000, 3000 mg/kg p.c./jour d’isododécane par gavage (Bayer Corp. 1983). La dose la plus faible était associée à une diminution de la concentration d’α-globulines et à une augmentation du poids absolu et du poids relatif de certains organes (foie, rate, reins). Cependant, des changements histopathologiques ont été observés dans les reins des mâles (c.-à-d., dégénérescence tubulaire légère à grave). À 1000 mg/kg p.c./jour, il y a eu une diminution du poids corporel (-9 %) et des changements dans le poids relatif de certains organes (c.-à-d., augmentation du poids relatif du cœur, des poumons, du foie, de la rate, des reins, des surrénales, des testicules ou des ovaires). Toutefois, des changements histopathologiques n’ont été observés que dans le foie (dégénérescence très légère ou légère accompagnée d’inflammation chez 6 animaux sur 10 animaux) et les reins (dégénérescence des tubules et inflammation) des mâles. Il y a également eu des changements dans l’analyse chimique clinique (p. ex., augmentation de la concentration d’urée, de protéines, d’albumine, de transaminase glutamique oxaloacétique et de calcium, et diminution des α-globulines et des β-globulines), mais ceux-ci ont été considérés comme secondaires aux changements observés dans le foie et les reins. Outre ces effets, la dose de 3000 mg/kg p.c./jour a été associée à des changements hématologiques (p. ex., diminution de la numération des érythrocytes [-5 %], du contenu en hémoglobine [-9 %] et de l’hématocrite [-8 %]) qui étaient dans les limites historiques des sujets du groupe témoin pour cette lignée (Envigo 2019). Les auteurs ont noté que l’isododécane était toléré par les rates à la dose de 330 mg/kg sans causer de dommages (aucune autre précision n’a été fournie). On présume que les auteurs ont considéré la dose de 330 mg/kg p.c./jour comme la dose minimale ayant causé un effet nocif observé (DMENO) chez les rats mâles, établie d’après la dégénérescence tubulaire. Toutefois, des effets sur les reins rapportés sont souvent observés après une exposition à des solvants à base d’hydrocarbures et ces effets ont été associés à une néphropathie induite par les α2µ-globulines, un phénomène propre au genre et à l’espèce chez les rats mâles (CIR 2002; McKee et coll. 2015). Par conséquent, ils ne sont pas pertinents du point de vue de la santé humaine. Une DSENO de 330 mg/kg p.c./jour a été établie d’après les effets sur le foie observés à la dose suivante de 1000 mg/kg p.c./jour. Il a été constaté que, bien que des changements dégénératifs au foie aient été observés aux doses égales ou supérieures à 1000 mg/kg p.c./jour, ces effets ont été caractérisés comme étant « très légers » ou « légers ». De plus, bien que l’incidence de la dégénérescence et de l’inflammation ait augmenté à la dose de 3000 mg/kg p.c./jour, la gravité n’a pas changé (à l’exception d’un animal sur 10 dont l’effet a été caractérisé comme étant « modéré »). Cela semble indiquer que la DSENO est plus proche de 1000 mg/kg p.c./jour que de 330 mg/kg p.c./jour. Dans cette étude, la plupart des effets ont été causés aux doses plus élevées, soit aux doses égales ou supérieures à 1000 mg/kg p.c./jour. Cette dose est généralement considérée par l’OCDE et la Food and Drug Administration (FDA) des États‑Unis comme une dose limite dans les études de toxicité par voie orale (OCDE 2018; FDA 2010; SC 2017). Les effets observés au-delà de cette dose limite pourraient ne pas être pertinents concernant les expositions humaines habituelles.
Le groupe d’experts du Cosmetic Ingredient Review (CIR) a mené une évaluation de l’innocuité des isoparaffines utilisées dans les cosmétiques, lesquelles comprennent de l’HMN (appelé « isohexadécane ») (CIR 2012). L’évaluation visait les isoparaffines dont la longueur de la chaîne carbonée variait de C7 à C70. Le CIR a indiqué qu’aucune toxicité significative n’a été trouvée dans les études de toxicité par voie orale et par inhalation qui étaient accessibles. Cependant, le groupe d’experts était préoccupé par la néphrotoxicité et a noté la participation de l’α2µ-globuline dans le mécanisme de néphrotoxicité induite par les isoparaffines et la prolifération des cellules des tubules rénaux chez les rats mâles de différentes lignées, ce qui n’a pas été observé dans la lignée NCI-Black-Reiter de rats ne produisant pas l’α2µ-globuline, une protéine. Le groupe d’experts a convenu que les résultats associés à l’α2µ-globuline chez le rat n’étaient pas pertinents chez l’humain, ce qui concorde avec les recommandations décrites par l’US EPA (1991). Le groupe d’experts du CIR a conclu que les isoparaffines mentionnées ci-dessus (y compris l’HMN) étaient sans danger dans les pratiques actuelles d’utilisation et de concentrations définies dans l’évaluation (principalement des solvants et des émollients; entre 0,000 1 et 90 %).
Toxicité pour la reproduction et le développement
Le potentiel de l’HMN d’entraîner une toxicité pour la reproduction et le développement a été examiné dans un essai préalable mené conformément à l’essai no 421 des Lignes directrices de l’OCDE (MHLW 2007). Dans cette étude, des rats Crl:CD(SD) (n = 12/sexe/groupe) ont reçu 0, 100, 300 ou 1000 mg/kg p.c./jour d’HMN (pur à 98,4 %, dans de l’huile de maïs) par gavage pendant au moins 49 jours pour les mâles et pendant 5 à 7 semaines pour les femelles (14 jours avant l’accouplement au jour postnatal [JPN] 3 des petits). Il n’y avait aucun effet lié au traitement sur les organes de reproduction, la performance de reproduction (p. ex., cyclicité œstrale, nombre d’animaux qui se sont accouplés, nombre de femelles fécondées, nombre de femelles gestantes, durée de l’accouplement) ou le développement (le nombre de corps jaunes, d’implantations, de jours de gestation, de néonates et de mort-né, ainsi que la viabilité, les anomalies externes et le ratio mâles-femelles). En ce qui concerne la toxicité pour les parents, la reproduction et le développement, une DSEO de 1000 mg/kg p.c./jour, la dose maximale à l’essai (DME), a été déterminée par les auteurs. D’après ces données, l’HMN ne devrait pas être une substance toxique pour la reproduction ou le développement.
Cancérogénicité et génotoxicité
Aucune étude sur les effets de l’HMN (ou de ses analogues) après une exposition chronique n’a été trouvée. Cependant, aucune alerte structurale de cancérogénicité n’a été relevée pour l’HMN à l’aide du logiciel de modélisation QSAR (boîte à outils QSAR de l’OCDE 2017; Derek Nexus 2016).
En ce qui concerne la génotoxicité, l’HMN n’était pas mutagène pour les souches bactériennes telles que Salmonella typhimurium TA100, TA1535, TA98 et TA1537, et Escherichia coli uvrA, avec et sans activation métabolique (J-CHECK c2010-2019). L’HMN a également obtenu un résultat négatif dans un test d’aberration chromosomique in vitro sur des cellules de poumon de hamster chinois (CHL) (J‑CHECK c2010-2019). La substance n’a induit aucune aberration chromosomique ni polyploïdie dans les cellules jusqu’aux concentrations toxiques, avec et sans activation métabolique. Bien qu’aucune donnée de génotoxicité in vivo n’ait été trouvée, l’HMN n’a été associé à aucune alerte structurale de mutagénicité (boîte à outils QSAR de l’OCDE 2017; Derek Nexus 2016). D’après ces données, l’HMN ne devrait pas être génotoxique.
6.3 Caractérisation des risques pour la santé humaine
La population générale pourrait être exposée à l’HMN par inhalation et par voie cutanée, principalement lorsqu’il est utilisé comme ingrédient dans des produits de soins personnels au Canada. Une exposition indirecte par le milieu environnemental devrait contribuer de façon minime à l’exposition par rapport au potentiel d’une exposition directe à un produit de soins personnels.
D’après les données accessibles sur les effets sur la santé, l’HMN ne devrait être ni génotoxique ni cancérogène ni entraîner de toxicité pour la reproduction ou le développement. Concernant la toxicité par doses répétées, les seuls effets observés après des doses administrées par voie orale allant jusqu’à 1000 mg/kg p.c./jour d’HMN ont été des changements morphologiques au foie, lesquels n’ont pas été considérés comme nocifs, mais plutôt des réponses physiologiques adaptatives, car ils n’ont pas été observés après une période de récupération.
Bien qu’aucune étude de toxicité par inhalation n’ait été trouvée sur l’HMN, les données accessibles sur l’analogue isododécane indiquent que le seul effet lié au traitement observé était une néphrose tubulaire dans les reins d’animaux mâles aux concentrations allant jusqu’à 1393 mg/m3. Puisque cet effet est couramment observé après l’administration de solvant à base d’hydrocarbures, effet qui est considéré comme un phénomène propre au genre et à l’espèce chez les rats mâles, il n’est pas jugé pertinent pour la caractérisation des risques pour la santé humaine. Aucun effet propre à la voie d’exposition ou lié au traitement au point de contact n’a été trouvé.
Dans l’ensemble, on estime que l’HMN représente une substance dont le potentiel de danger est faible en raison de l’absence d’effets génotoxiques, d’effets sur la reproduction ou le développement, ou d’autres effets nocifs pertinents du point de vue de la santé humaine jusqu’à la dose de 1000 mg/kg p.c./jour établie d’après les études de toxicité par voie orale menées sur l’HMN et jusqu’à la dose de 1393 mg/m3 établie d’après les études de toxicité par inhalation menées sur un analogue.
6.4 Incertitudes dans l’évaluation des risques pour la santé
Les principales sources d’incertitudes sont présentées dans le tableau ci-dessous.
| Principales sources d’incertitudes | Effet |
|---|---|
| Aucune étude portant sur la génotoxicité in vivo et la cancérogénicité de l’HMN n’a été trouvée. | +/- |
| Les études sur la toxicocinétique de l’HMN étaient limitées. Dans une étude de toxicité par voie orale à court terme, l’HMN s’est révélé être biotransformé en un métabolite stable qui pourrait s’accumuler au lieu de formation (p. ex., le foie). Aucune donnée sur la métabolisation de l’HMN chez l’humain n’a été trouvée. Cependant, les études menées sur des animaux de laboratoire à l’aide de l’HMN semblent indiquer que les effets sur le foie devraient être des effets adaptatifs et réversibles, et non nocifs. | +/- |
| Aucune étude de toxicité subchronique et chronique menée chez des animaux par les voies d’administration orales et cutanées n’a été trouvée pour l’HMN. | +/- |
| Aucune étude de toxicité par inhalation sur l’HMN n’a été trouvée. La méthode par extrapolation faisant appel à des données sur l’analogue isododécane a été appliquée. Les études de toxicité par inhalation sur l’isododécane ont révélé une néphropathie chez les rats mâles, mais cet effet n’a pas été considéré comme pertinent du point de vue de la santé humaine. | +/- |
+ = incertitude pouvant entraîner une surestimation de l’exposition/du risque; - = incertitude pouvant entraîner une sous-estimation de l’exposition/du risque; +/- = potentiel inconnu d’entraîner une surestimation ou une sous‑estimation du risque.
7. Conclusion
Compte tenu de tous les éléments de preuve contenus dans la présente ébauche d’évaluation préalable, l’HMN présente un risque faible de causer des effets nocifs pour l’environnement. Il est proposé de conclure que l’HMN ne satisfait pas aux critères énoncés aux alinéas 64a) et b) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique ou à mettre en danger l’environnement essentiel pour la vie.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que l’HMN ne satisfait pas au critère énoncé à l’alinéa 64c) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est proposé de conclure que l’HMN ne satisfait à aucun des critères énoncés à l’article 64 de la LCPE.
Références
[ANSES] Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail. 2013. Avis de l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail relatif à la demande d’autorisation d’emploi de l’isododécane pour la fabrication de matériaux organiques entrant au contact d’eau destinée à la consommation humaine. Avis de l’Anses, Saisine no 2012-SA-0143 [PDF]. Maisons-Alfort Cedex (FR), ANSES [consulté le 23 mai 2019].
Appelman LM, Bosland MC, et JP Bruyntjes. 1982. Subchronic (13-week) inhalation toxicity study with isododecane in rats. Report no. V82.275/212294. Submitted to TSCA on 11/18/99 by Bayer Corporation. Microfiche No. OTS0559847. New Doc ID: 88000000040. Old Doc ID: 8EHQ-1199-14600. [Disponible en anglais seulement]
Appelman LM, Bosland MC, et JP Bruyntjes. 1980. Subchronic (13-week) inhalation toxicity study with isododecane in rats. Report no. V81.069/292473. Submitted to TSCA on 12/8/99 by Bayer Corporation. Microfiche No. OTS0559857. New Doc ID: 88000000050. Old Doc ID: 8EHQ-1299-14610. [Disponible en anglais seulement]
Bayer Corporation. 1983. Isododekan, subchronische toxikologische untersuchungen an ratten (versuch mit schlundsondenapplikation uber 3 monate). Submitted to TSCA on 11/18/99 by Bayer Corporation. Microfiche No: OTS0559846. New Doc ID: 88000000039. Old Doc ID: 8EHQ-1199-14599. [Article en allemand].
[BDIPSN] Base de données d’ingrédients de produits de santé naturels [base de données]. [Modifié le 18 janvier 2019]. Ottawa (Ont.), gouvernement du Canada. [Consulté le 4 février 2019]
[BDPSNH] Base de données sur les produits de santé naturels homologués [base de données]. [modifié le 6 février 2018]. Ottawa (Ont.), gouvernement du Canada. [Consulté le 6 février 2018]
Bharati A, King CM. 2004. Allergic contact dermatitis from isohexadecane and isopropyl myristate. Contact Dermatitis. 50(4): 252-263. [Disponible en anglais seulement]
Bomhard E, Marsmann M, Ruhl-Fehlert C, Zywietz A. 1990. Relationships between structure and induction of hyaline droplet accumulation in the renal cortex of male rats by aliphatic and alicyclic hydrocarbons. Arch Toxicol. 64(7): 530-538. [Disponible en anglais seulement]
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L.C. 1999, ch. 33. Gazette du Canada, Partie III, vol. 22, no 3.
ChemIDplus [database]. 1993- . Bethesda (MD): US National Library of Medicine. [Consulté le 4 mars 2019]. [Disponible en anglais seulement]
[CIR] Cosmetic Ingredient Review. 2012. Safety assessment of IsoParaffins as used in Cosmetics [PDF].Int J Toxicol. 31(6) : 270S-295S. [Consulté le 10 janvier 2019] [Disponible en anglais seulement]
Derek Nexus [toxicity prediction module]. 2016. Ver. 5.0.2. Leeds (UK): Lhasa Limited. [Accès réservé]. [Disponible en anglais seulement]
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l’approche scientifique : classification du risque écologique des substances organiques. Ottawa (Ont.), gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016b. Supporting documentation: data used to create substance-specific hazard and exposure profiles and assign risk classifications. Gatineau (QC): ECCC. Information in support of the science approach document: classification des risques écologiques (CRE) des substances organiques. Accessible à : substances@ec.gc.ca. [Disponible en anglais seulement]
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2015. Identification des priorités d’évaluation des risques : résultats de l’examen de 2015. Ottawa (Ont.), gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. [Modifié le 12 mars 2017]. Catégorisation. Ottawa (Ont.), gouvernement du Canada.
[ECHA] European Chemicals Agency 2019a. Guidance on safe use: 2,2,4,6,6-pentamethylheptane; CAS RN 13475-82-6. Helsinki (FI) : ECHA. [Mis à jour le 5 février 2019; consulté le 4 mars 2019]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency 2019b. Guidance on safe use: 2,2,4,6,8,8-heptamethylnonane; CAS RN 4390-04-9. Helsinki (FI) : ECHA. [Mis à jour le 20 février 2019; consulté le 4 mars 2019]. [Disponible en anglais seulement]
Envigo. 2019. Historical control data of haematological data in HsdRccHanTM: WIST, Wistar Hannover rats. Compiled from toxicity studies performed at RCC Ltd. Itingen/Switzerland [PDF]. New Jersey: Envigo. [Disponible en anglais seulement]
Environnement Canada. 2013. Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement de 1999 : Avis modifiant l’Avis concernant certaines substances de la Liste intérieure. Données préparées par Environnement Canada et Santé Canada, Programme des substances existantes.
[EPI Suite] Estimation Program Interface Suite for Microsoft Windows [estimation model]. c2000-2012. Ver. 4.11. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. [Disponible en anglais seulement]
[FDA] Food and Drug Administration. 2010. Guidance for industry: M3(R2) Nonclinical safety studies for the conduct of human clinical trials and marketing authorization for pharmaceuticals. Rockville (MD): US Department of Health and Human Sciences. [Disponible en anglais seulement]
Hall AP, Elcombe CR, Foster JR, Harada T, Kaufmann W, Knippel A, Kϋttler K, Malarkey DE, Maronpot RR, Nishikawa A, Nolte T, Schulte A, Strauss V, et MJ York. 2012. Liver hypertrophy: a review of adaptive (adverse and non-adverse) changes – conclusions from the 3rd international ESTP expert workshop. Toxicol Pathol. 40(7): 971-994. [Disponible en anglais seulement]
Hard GC, Rodgers IS, Baetcke KP, Richards WL, McGaughy RE, et LR Valcovic. 1993. Hazard evaluation of chemicals that cause accumulation of α2μ-globulin, hyaline droplet nephropathy, and tubule neoplasia in the kidneys of male rats. Environ Health Perspect. 99: 313-349. [Disponible en anglais seulement]
Hatano Research Institute. 1991. 28-day repeat oral administration toxicity study of 2,2,4,4,6,8,8‑heptamethylnonane in rats (14-day recovery period). Japan: Food and Drug Safety Center, Hatano Research Institute. Entrusted by the Environmental Health Bureau of the Ministry of Health and Welfare. [Disponible en anglais seulement]
[SC] Santé Canada. 2017. Document sur l’approche scientifique. Document sur l’approche scientifique concernant les substances présentant un faible danger pour la santé humaine. Ottawa (Ont.), Santé Canada. Décembre 2017.
Ikeda T, Ida-Enomoto M, Mori I, Fukada K, Iwabuchi H, Komai T, et T Suga. 1988. Induction of peroxisome proliferation in rat liver by dietary treatment with 2,2,4,46,8,8-heptamethylnonane. Xenobiotica. 18(11): 1271-1280. [Disponible en anglais seulement]
[J-CHECK] Japan CHEmicals Collaborative Knowledge database [database]. c2010-2019. Tokyo (JP) : National Institute of Technology and Evaluation (NITE). [Consulté le 4 mars 2019]. [Disponible en anglais seulement]
McKee RH, Adenuga MD, et JC Carrillo. 2015. Characterization of the toxicological hazards of hydrocarbon solvents. Crit Rev Toxicol. 45(4):273-365. [Disponible en anglais seulement]
[MHLW] Ministry of Health, Labour and Welfare (Japan). 2007. Oral administration simple reproduction study of 2,2,4,6,8,8-heptamethylnonane employing rats. Japan: Chemical Substance Safety Measures Office, Evaluation and Licensing Division, Pharmaceutical and Food Safety Bureau, Ministry of Health, Labour, and Welfare. [Disponible en anglais seulement]
[OCDE] Organisation de coopération et de développement économiques. 2018. Lignes directrices de l’OCDE pour les essais de produits chimiques, Section 4 Effets sur la santé. Essai no 408 : Toxicité orale à doses répétées – rongeurs : 90 jours [PDF].
OECD QSAR Toolbox. 2016. Paris (FR) : Organisation for Economic Co-operation and Development, Laboratory of Mathematical Chemistry. [Disponible en anglais seulement]
[PSS] Product Safety Summary. 2016. IsoparTM M Fluid [PDF]. ExxonMobil. [Consulté le 31 janvier 2019]. [Disponible en anglais seulement]
Sigma Aldrich. 2015. Safety Data Sheet for 2,2,4,4,6,8,8-Heptamethylnonane [PDF]. St. Louis (MO). [Consulté le 10 mars 2019]
[TIMES] TIssue MEtabolism Simulator [prediction module]. 2016. Ver. 2.27.19. Bourgas (BG) : University “Prof. Dr. Assen Zlatarov”, Laboratory of Mathematical Chemistry. [Disponible en anglais seulement]
Tulliez J et G Bories. 1975. Metabolism of paraffinic and naphthalenic hydrocarbons in higher animals. I. Retention of paraffins (normal, cyclo and branched) in rats. Ann Nutr Aliment. 29(3): 201-211. [Article en français].
[US EPA] US Environmental Protection Agency. 1991. Alpha2u-globulin: association with chemically induced renal toxicity and neoplasia in the male rat. Washington (DC): US EPA, Risk Assessment Forum. [Disponible en anglais seulement]
[US EPA] US Environmental Protection Agency. 2002. Hepatocellular hypertrophy. HED Guidance Document #G2002.01. Washington (DC): US EPA, Health Effects Division, Office of Pesticide Programs. [Disponible en anglais seulement]
Annexe A. Méthode d’extrapolation
| Facteur | Justification |
|---|---|
| 1) Structure chimique. L’accent a été mis sur les analogues présentant un profil de ramification et une longueur de chaîne carbonée similaires. | Les analogues présentant une structure chimique similaire devraient avoir des profils de toxicité similaires. |
| 2) Métabolites similaires (prédits ou observés). La métabolisation de l’HMN se produit principalement par hydroxylation, puis par carboxylation. Chez le rat, le métabolite principal est l’acide 2,2,4,4,6,8,8‑heptamethylnonanedicarboxylique. | Les analogues qui sont métabolisés par des voies métaboliques similaires en produits de dégradation similaires devraient avoir des profils de toxicité similaires. |
| 3) Alertes structurales communes | Les analogues donnant des alertes structurales similaires devraient être davantage similaires sur le plan de la toxicité. |
| 4) Propriétés physicochimiques similaires. L’accent a été mis sur les structures chimiques présentant un poids moléculaire, une solubilité dans l’eau, une pression de vapeur et un log Koe similaires. | Les analogues dont les propriétés physicochimiques sont similaires pourraient avoir des profils toxicologiques similaires. |
Annexe B. Propriétés physicochimiques et résumé des effets de l’HMN et de l’isododécane sur la santé
| - | Isododécane (CAS 13475-82-6) | HMN (CAS 4390-04-9) |
|---|---|---|
| Structure chimique | 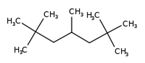 |
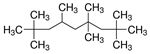 |
| Poids moléculaire (g/mol) | 170 | 226 |
| Point de fusion (°C) | -67a | -70f |
| Point d’ébullition (°C) | 178a | 240 |
| Pression de vapeur (Pa) | 100b | 130 |
| Solubilité dans l’eau (mg/L) | 4,86 × 10-3b | 2,05 × 10-3 |
| Log Koe (sans unité) | 6,96b | 7,79 |
| Toxicité aiguë par voie orale (mg/kg p.c./jour) | s.o. | DL50 > 2 g/kg p.c.g |
| Toxicité par doses répétées (mg/kg p.c./jour) | Étude par voie orale chez le rat (13 semaines)c :
Étude par inhalation chez le rat (13 semaines)d :
Étude par inhalation chez le rat (13 semaines)e :
|
Étude par voie orale chez le rat (28 jours)g :
|
| Toxicité pour la reproduction et le développement | s.o. | DSENO=1000 mg/kg p.c./jour (DME)h |
| Cancérogénicité | s.o. | s.o. |
| Génotoxicité in vitro | Négative | Négative |
| Génotoxicité in vivo | s.o. | s.o. |
Abréviations : HMN, heptaméthylnonane; DME, dose maximale à l’essai; s.o., sans objet; DSENO, dose sans effet nocif observé; CSEO, concentration sans effet observé.
Références : aChemID 1993-; bECHA 2019a; cBayer Corp. 1983, article en allemand; dAppelman et coll. 1982, données brutes non accessibles; eAppelman et coll. 1980, étude complète non accessible; fECHA 2019b; gHatano Research Institute 1991; hMHLW 2007
