Ébauche d’évaluation préalable ortho-phénylphénolate de sodium (OPPS)
Titre officiel: Ébauche d’évaluation préalable 2-Phénylphénolate de sodium (ortho-phénylphénolate de sodium; OPPS)
Numéro de registre du Chemical Abstracts Service: 132-27-4
Environnement et Changement climatique Canada
Santé Canada
Février 2020
Synopsis
En vertu de l’article 68 de la Loi canadienne sur la protection de l’environnement 1999 (LCPE), les ministres de l’Environnement et de la Santé ont réalisé une évaluation préalable du 2-phénylphénolate de sodium, ci-après appelé ortho-phénylphénolate de sodium (OPPS). Le numéro de registre du Chemical Abstracts Service (no CASNote de bas de page 1) de l’OPPS est le 132-27-4. Cette substance a été identifiée d’intérêt prioritaire en raison d’inquiétudes pour la santé humaine.
L’OPPS n’est pas présent naturellement dans l’environnement. D’après les renseignements soumis lors d’une enquête menée en vertu de l’article 71 de la LCPE, la quantité déclarée produite au Canada en 2008 se situait dans la gamme de 10 000 à 100 000 kg, et celle importée dans la gamme de 1000 à 10 000 kg.
L’OPPS est un agent de conservation pour les matériaux. Au Canada, l’OPPS est utilisé dans des matériaux de construction et dans des produits disponibles pour les consommateurs (comme des lubrifiants pour pneu/caoutchouc). Il peut être utilisé comme composant de matériaux d’emballage alimentaire et additifs fortuits ou comme ingrédient non médicinal dans des produits de santé naturels et des drogues sans ordonnance. C’est aussi un ingrédient actif et un formulant dans des produits antiparasitaires homologués au Canada.
Les risques posés à l’environnement par l’OPPS ont été caractérisés à l’aide de la classification du risque écologique des substances organiques (CRE), une approche basée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition et d’une pondération de plusieurs éléments de preuve pour obtenir un classement du risque. Les profils de danger reposent principalement sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne dérivés du réseau tropique, à la biodisponibilité et à l’activité chimique et biologique. Les paramètres pris en compte pour les profils d’exposition incluent la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Une matrice de risque est utilisée pour assigner aux substances un potentiel faible, moyen ou élevé selon leurs profils de danger et d’exposition. D’après les résultats de la CRE, il est improbable que l’OPPS soit nocif pour l’environnement.
Compte tenu de tous les éléments de preuve disponible avancés dans la présente ébauche d’évaluation préalable, l’OPPS présente un faible risque d’effet nocif sur l’environnement. Nous concluons que l’OPPS ne répond pas aux critères de l’alinéa 64a) ou b) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ni dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou sa diversité biologique, ou qui constituent ou peuvent constituer un danger pour l’environnement essentiel pour la vie.
L’OPPS a fait l’objet d’examens au niveau international, par le Centre international de recherche sur le cancer, la Réunion conjointe FAO/OMS sur les résidus de pesticides, l’Environmental Protection Agency des États-Unis et l’Environmental Protection Agency de la Californie. En 2008, l’OPPS a été évalué par l’Agence de réglementation de la lutte antiparasitaire de Santé Canada. Lors d’études en laboratoire, il a été montré que l’OPPS était associé à une incidence accrue de tumeurs de la vessie. Aux doses plus faibles, les effets de l’OPPS et d’une substance de structure similaire incluaient un gain de poids corporel moindre.
La principale source d’exposition à l’OPPS due à des produits disponibles pour les consommateurs au Canada est celle due aux lubrifiants pour pneu/caoutchouc. La population générale pourrait aussi être exposée à de l’OPPS en raison de la consommation d’aliments ou de son utilisation dans des matériaux d’emballage alimentaire et d’autres produits disponibles pour les consommateurs.
La comparaison de l’exposition estimée à l’OPPS due aux lubrifiants pour pneu/caoutchouc et du niveau d’effet critique déterminé lors d’études en laboratoire a conduit à calculer une marge d’exposition considérée adéquate pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition. Le risque pour la santé humaine dû à l’exposition à l’OPPS présent dans de l’emballage alimentaire est considéré très faible et contribue de manière négligeable à l’exposition totale à l’OPPS par voie alimentaire des Canadiens.
En se basant sur les renseignements présentés dans la présente ébauche d’évaluation préalable, il est conclu que l’OPPS ne satisfait pas aux critères de l’alinéa 64(c) de la LCPE, car il ne pénètre pas dans l’environnement eu une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaine.
Il est donc conclu que l’OPPS ne satisfait à aucun des critères de l’article 64 de la LCPE.
1. Introduction
En vertu de l’article 68 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE) (Canada 1999), les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable du 2-phénylphénolate de sodium, aussi nommé ortho‑phénylphénolate de sodium et appelé ci-après OPPS, afin de déterminer si cette substance présente ou peut présenter un risque pour l’environnement ou la santé humaine. Cette substance a été identifiée d’intérêt prioritaire en raison d’inquiétudes pour la santé humaine (ECCC, SC [modifié en 2017]).
L’OPPS a fait l’objet d’examens au niveau international dans le cadre du Programme des monographies sur le cancer du Centre international de recherche sur le cancer (CIRC 1999), par la Réunion conjointe FAO/OMS sur les résidus de pesticides (JMPR 1999), par l’Environmental Protection Agency des États-Unis (EPA 2006) et par l’Environmental Protection Agency de la Californie (Cal EPA 2007). L’OPPS a aussi fait l’objet d’un examen par l’Agence de réglementation de la lutte antiparasitaire de Santé Canada (Santé Canada 2008a, 2008b). Ces évaluations font l’objet d’un examen rigoureux et ont été utilisés pour éclairer la caractérisation des effets sur la santé de la présente évaluation préalable.
Les risques posés à l’environnement par l’OPPS ont été caractérisés en suivant l’approche de Classification du risque écologique (CRE) des substances organiques (ECCC 2016a). La CRE décrit le danger d’une substance au moyen de paramètres clés, dont le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau alimentaire, la biodisponibilité et l’activité chimique et biologique. Elle tient compte de l’exposition possible des organismes dans les milieux aquatiques et terrestres en se basant sur des facteurs comme les vitesses d’émission potentielles, la persistance globale et le potentiel de transport atmosphérique à grande distance. Les divers éléments de preuve sont combinés pour déterminer les substances qui justifient une évaluation plus approfondie de leur potentiel d’effets nocifs sur l’environnement ou dont la probabilité d’effet nocif sur l’environnement est faible.
La présente ébauche d’évaluation préalable tient compte de renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et les expositions, ainsi que de renseignements soumis par des parties prenantes. Des données pertinentes sur l’OPPS ont été recueillies jusqu’en janvier 2019. Des données empiriques tirées d’études clés ainsi que des résultats de modélisations ont été utilisés pour tirer nos conclusions. Des renseignements pertinents présentés dans des évaluations faites par d’autres juridictions ont été pris en compte.
La présente ébauche d’évaluation préalable a été préparée par le personnel du Programme d’évaluation des risques de la LCPE de Santé Canada et d’Environnement et Changement climatique Canada. Elle intègre des intrants d’autres programmes de ces ministères. La partie de la présente évaluation ayant trait à l’environnement est basée sur le document de la CRE (publié en juillet 2016), document qui a fait l’objet d’un examen externe et d’une période de commentaires du public de 60 jours.
La présente ébauche d’évaluation préalable est centrée sur des renseignements critiques afin de déterminer si cette substance satisfait aux critères de l’article 64 de la LCPE, en examinant les renseignements scientifiques et en suivant une approche basée sur le poids de la preuve et le principe de précautionNote de bas de page 1. Dans la présente ébauche d’évaluation préalable, nous présentons les renseignements et les considérations critiques sur lesquels sont basées nos conclusions.
2. Identité de la substance
Le numéro de registre du Chemical Abstracts Service (no CASNote de bas de page 2 ), le nom sur la Liste intérieure des substances (LIS) et la structure moléculaire de l’OPPS sont présentés dans le tableau 2‑1.
| No CAS | Nom sur la LIS (autre nom; abréviation) | Structure et formule moléculaires | Masse moléculaire (g/mol) |
|---|---|---|---|
| 132-27-4 | 2-Biphénylate de sodium (ortho-phénylphénolate de sodium; OPPS) |
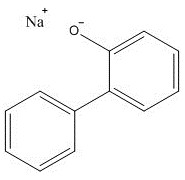 C12H10O.Na C12H10O.Na
|
192,19 |
2.1 Sélection d’un analogue
Une approche de lecture croisée au moyen de données d’un analogue a été suivie pour éclairer l’évaluation ayant trait à la santé humaine. Nous avons retenu un analogue ayant des propriétés structurelles et fonctionnelles similaires à celle de l’OPPS (propriétés physico-chimiques et toxicocinétiques similaires) et pour lequel il existait des données empiriques pertinentes pouvant être utilisées pour faire une lecture croisée. Il existait peu de données empiriques sur la toxicité de l’OPPS. L’OPPS est le sel de sodium du 2-phénylphénol (OPP), et les résultats des études de toxicité conduites avec l’OPP ont été utilisées pour l’approche de lecture croisée afin d’éclairer l’évaluation des effets sur la santé l’OPPS. Les données sur l’identité de l’OPP sont présentées dans le tableau 2-2. Les propriétés physiques et chimiques de l’OPP et un résumé de la lecture croisée des données toxicologiques pour l’OPPS sont présentés à l’Annexe A.
| No CAS | sur la LIS (autre ; abréviation) | Structure et formule moléculaires | Masse moléculaire (g/mol) |
|---|---|---|---|
| 90-43-7 | Biphényl-2-ol (ortho-phénylphénolate; OPP) |
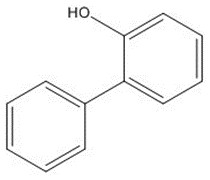 C12H10O C12H10O
|
170,2 |
3. Propriétés physiques et chimiques
Nous présentons dans le tableau 3-1 les propriétés physiques et chimiques de l’OPPS. Quand les données expérimentales sur une propriété étaient limitées ou indisponibles, nous avons utilisé des données sur des analogues pour faire une lecture croisée et/ou des modèles (Q)SAR pour générer des valeurs prédites. Des propriétés physiques et chimiques supplémentaires sont rapportées dans un document d’ECCC (2016b).
| Propriété | OPPS | OPP | Référence |
|---|---|---|---|
| Pression de vapeur (Pa) | 1,2 | 0,27 | ECHA c2007-2019 et HSDB 1983- |
| Solubilité dans l’eau (mg/L) | 1,00E+06 (pH 13.6) | 530 à 640 (pH 5-9) | ECHA c2007-2019 |
| log Koe | 2,95 | 3,18 | ECHA c2007-2019 |
| Demi-vie dans l’air (heure) | - | 14 | EPA 2006 |
Abréviation : Koe= coefficient de partage octanol-eau.
4. Sources et utilisations
L’OPPS n’est pas présent naturellement dans l’environnement (CIRC 1999).
L’OPPS a été visé par une enquête menée en vertu de l’article 71 de la LCPE (Canada 2009). En 2008, de 10 000 à 100 000 kg d’OPPS ont été déclarés produits au Canada et de 1000 à 10 000 kg importés (Environnement Canada 2009).
D’après les déclarations faites lors de cette enquête (Environnement Canada 2009), l’OPPS a été utilisé commercialement dans des matériaux de construction, mais aussi par des consommateurs. L’OPPS est utilisé comme agent de conservation de matériaux (Santé Canada 2008a). D’autres utilisations identifiées au Canada sont présentées dans le tableau 4-1.
| Utilisation | OPPS |
|---|---|
| Additif fortuita | O |
| Matériaux pour emballage alimentairea | O |
| Base de données interne sur les produits de drogues en tant qu’ingrédient médicinal ou non médicinal dans des produits pharmaceutiques finals, des désinfectants ou des drogues vétérinaires au Canadab | O |
| Base de données sur les ingrédients de produits de santé naturelsc | O |
| Bse de données sur les produits de santé naturels en tant qu’ingrédient médicinal ou non médicinal dans des produits de santé naturels au Canadac | O |
| Formulant et ingrédient actif dans des produits antiparasitaires homologués au Canadad | O |
| Déclaré présent dans des cosmétiques en vertu du Règlement sur les cosmétiquese,f | N |
Abréviation : O = oui, utilisation de cette substance rapportée; N = non, utilisation non rapportée.
a Communication personnelle, courriels de la Direction des aliments de Santé Canada (SC) au Bureau d’évaluation du risque des substances existantes (BERSE) de SC, août 2018; non référencé.
b Communication personnelle, courriels de la Direction des produits thérapeutiques de SC au BERSE de SC, août 2018; non référencé.
c Communication personnelle, courriels de Direction des produits de santé naturels et sans ordonnance de SC au BERSE de SC, août 2018; non référencé.
d Communication personnelle, courriels de l’Agence de réglementation de la lutte antiparasitaire de SC au BERSE de SC, août 2018; non référencé.
e Communication personnelle, courriels de la Direction de la sécurité des produits de consommation de SC au BERSE de SC, août 2018 et mars 2019; non référencé.
f Au niveau international, l’OPPS a été déclaré utilisé comme agent de conservation dans des cosmétiques (SCCS 2015, 2018)
D’après les renseignements accessibles au public et les fiches signalétiques de sécurité (FSS), l’OPPS a été identifié dans des lubrifiants pour pneu/caoutchouc disponibles pour les consommateurs au Canada (FSS 2015). L’OPPS a aussi été rapporté utilisé ailleurs comme intermédiaire dans des colorants, des résines et des produits du caoutchouc, comme germicide, comme agent de conservation, comme désinfectant domestique dans des formulations pour lavage de la vaisselle et dans de l’emballage alimentaire (NTP 1991).
5. Potentiel d’effets nocifs sur l’environnement
5.1 Caractérisation des risques pour l’environnement
Les risques posés à l’environnement par l’OPPS ont été caractérisés à l’aide de l’approche de classification du risque écologique (CRE) des substances organiques (ECCC 2016a). La CRE est une approche basée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition et d’une pondération des éléments de preuve pour classer le risque. Les divers éléments de preuve sont combinés afin de pouvoir distinguer les substances présentant un pouvoir faible ou élevé et un potentiel d’exposition faible ou élevé dans divers milieux. Cette approche permet de réduire l’incertitude associée à la caractérisation des risques, contrairement à une approche qui serait basée sur un seul paramètre mesuré dans un seul milieu (p. ex. CL50). Cette approche est résumée dans les paragraphes suivants et elle est décrite en détail dans un document d’ECCC (2016a).
Les données sur les propriétés physico-chimiques, le devenir (demi-vies chimiques dans divers milieux et biotes, coefficients de partage et bioconcentration dans les poissons), l’écotoxicité aiguë chez les poissons et les quantités de ces produits chimiques importés ou produits au Canada ont été tirées de la littérature scientifique, de bases de données empiriques (p. ex. Boîte à outils [Q]SAR de l’OCDE [2016]) et de réponses à des enquêtes menées en vertu de l’article 71 de la LCPE. Elles ont aussi été obtenues à partir de modèles de type (Q)SAR (relation quantitative structure-activité), de devenir du bilan massique ou de bioaccumulation. Ces données ont été utilisées comme intrants dans d’autres modèles de bilan massique ou pour compléter les profils de danger et d’exposition de la substance.
Les profils de danger ont été principalement établis en se basant sur des paramètres liés au mode d’action toxique, à la réactivité chimique, à des seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Les profils d’exposition ont aussi été basés sur plusieurs paramètres, dont la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Les profils de danger et d’exposition de cette substance ont été comparés aux critères de décision afin de les classer comme faible, moyen ou élevé. D’autres règles ont été suivies (p. ex. constance du classement, marge d’exposition) pour améliorer le classement préliminaire du danger ou de l’exposition.
Une matrice de risque a été utilisée pour assigner à chaque substance un risque faible, moyen ou élevé basé sur le classement de son danger et de son exposition. Le classement du risque potentiel obtenu grâce à la CRE a été vérifié en suivant une approche en deux étapes. La première étape consistait à faire passer le classement du risque de moyen ou élevé à faible dans le cas des substances à faible vitesse d’émission estimée dans l’eau après traitement des eaux usées, représentant un faible potentiel d’exposition. La deuxième étape consistait à revoir les résultats du classement du potentiel de risque au moyen de scénarios de risque relativement prudents à l’échelle locale (c.‑à‑d. dans la zone à proximité du point de rejet) conçus pour protéger l’environnement, afin de déterminer si le classement du risque potentiel devrait être reclassé à un niveau supérieur.
La CRE est basée sur une approche pondérée pour réduire au minimum tout risque de sur‑classification ou de sous-classification du danger et de l’exposition, et du risque subséquent. Les approches équilibrées suivies pour traiter des incertitudes sont décrites plus en détail dans ECCC (2016a). Nous décrivons ci-après deux des domaines d’incertitude les plus importants. Des valeurs de toxicité aiguë empiriques ou modélisées erronées pourraient entraîner une modification de la classification du danger, en particulier dans le cas des paramètres basés sur des valeurs de résidus dans les tissus (c.-à-d. mode d’action toxique), dont un grand nombre sont prédites à partir de modèles (Q)SAR (Boîte à outils QSAR de l’OCDE 2016). Toutefois, l’impact de ce type d’erreur est atténué par le fait qu’une surestimation de la létalité médiane conduira à une valeur prudente (protectrice) de résidus dans les tissus pour l’analyse des résidus corporels critiques (RCC). Des erreurs de sous-estimation de la toxicité aiguë seront atténuées en recourant à d’autres paramètres de danger, tels que le profilage structurel du mode d’action, la réactivité et/ou l’affinité de liaison à l’estrogène. Les changements ou les erreurs touchant les quantités de produits chimiques pourraient entraîner un classement différent de l’exposition, les classifications de l’exposition et du risque étant très sensibles à la vitesse d’émission et aux quantités utilisées. Les classifications obtenus au moyen de de la CRE reflètent donc l’exposition et le risque au Canada, compte tenu des quantités actuellement utilisées, mais pourraient ne pas rendre compte de tendances futures.
Les données et les éléments critiques pris en compte pour développer les profils propres à l’OPPS, ainsi que les résultats de la classification du danger, de l’exposition et du risque, sont présentés dans un document d’ECCC (2016 b).
En se basant sur les classements de faible danger et de faible exposition en vertu des renseignements pris en compte pour la CRE, l’OPPS a été classé comme ayant un faible potentiel d’effets nocifs sur l’environnement. Il est improbable que cette substance soit inquiétante pour l’environnement au Canada.
6. Potentiel d’effets nocifs sur la santé humaine
6.1 Évaluation de l’exposition
Milieux de l’environnement et aliments
L’OPPS n’est pas présent naturellement dans l’environnement. Aucune donnée sur la présence d’OPPS dans des milieux pertinents de l’environnement au Canada ou ailleurs n’a été identifiée. La constante de dissociation (pKa) de l’OPPS indique qu’il est instable dans l’environnement et se dissocie pour former l’OPP, son acide conjugué, et de l’hydroxyde de sodium dans l’eau (ECHA c2007-2019). La dissociation de l’OPPS en OPP est la voie de dégradation prédominante. L’OPPS ne devrait pas être persistant dans l’environnement (ECHA c2007-2019). Il a été rapporté que l’OPP est photochimiquement instable dans un milieu aqueux neutre et qu’il se dégrade complètement en 14 jours quand il est exposé au rayonnement solaire (Santé Canada 2008a, EPA 2006). De plus, en raison de ses propriétés physiques et chimiques (tableau 3-1), l’OPPS ne devrait pas se volatiliser (EPA 2014), il devrait être immobile dans les sols, et il est improbable qu’il contamine les eaux souterraines ou les eaux de surface (Santé Canada 2008a, EPA 2006). Sur la base des renseignements disponibles, l’exposition de la population générale à l’OPPS due à l’eau, à l’air ou au sol devrait donc être négligeable.
L’OPPS peut être utilisé comme composant dans des matériaux d’emballage alimentaire pouvant potentiellement entrer en contact direct avec les aliments. L’absorption journalière probable d’OPPS due à son utilisation dans des matériaux d’emballage alimentaire est estimée à 6,2 ng/kg pc/jour pour un adulte de 19 ans ou plus. L’OPPS peut aussi être utilisé comme composant dans des additifs fortuits (p. ex. nettoyants, lubrifiants) utilisés dans des établissements de traitement d’aliments. Il ne devrait pas y avoir d’exposition due à son utilisation dans des additifs fortuits, puisqu’il ni a aucun contact direct de cet additif avec les aliments (communication personnelle de la Direction des aliments de SC au Bureau d’évaluation du risque des substances existantes de SC, août 2018, non référencé).
L’OPPS peut être présent sur des aliments en tant que résidu en raison de son utilisation comme produit antiparasitaire au Canada (Santé Canada 2008a). L’EPA des États-Unis (2006) a rapporté que le plus forte exposition journalière estimée de la population des États-Unis à l’OPPS est de 0,021 mg/kg/jour pour les enfants (1 à 2 ans). L’évaluation de l’EPA a été considérée pertinente pour la situation canadienne, tel qu’indiqué dans un document de Santé Canada (2008a). En tenant compte de la contribution de l’exposition journalière par voie alimentaire à l’OPPS due à sa présence comme résidu de pesticide dans des aliments, l’exposition estimée de la population canadienne à l’OPPS due à des matériaux d’emballage alimentaire est considérée contribuer de manière négligeable à l’exposition alimentaire totale à l’OPPS.
Produits disponibles pour les consommateurs
Du lubrifiant pour pneu/caoutchouc est un produit disponible pour les consommateurs qui pourrait raisonnablement être utilisé par la population générale. La principale voie d’exposition devrait être dermique, étant donné que ces produits sont utilisés à l’extérieur et/ou dans un garage. L’inhalation devrait contribuer pour une très petite part à l’exposition totale, étant donné le flux d’air élevé, les matrices visqueuses de ces produits et la faible pression de vapeur de l’OPPS. Les estimations de l’exposition par voie dermique sont présentées dans le tableau 6-1. Un facteur d’absorption dermique de 100% a été assumé. Les détails de ces estimations sont présentés à l’Annexe B (tableau B-1). D’autres scénarios d’utilisation potentielle de l’OPPS ont été pris en compte (ingrédient non médicinal dans des produits de santé naturels, ingrédient non médicinal dans des drogues sans ordonnance), mais ont conduit à estimer des expositions inférieures à celles rapportées dans le tableau 6-1.
| Scénario avec le produit | Concentration (%) | Voie d’exposition | Exposition par événement (systémique)a |
|---|---|---|---|
| Lubrifiant pour pneu/caoutchouc (19 ans ou plus) | 0,2b | Dermique | 0,02 mg/kg pc |
a Exposition systémique en assumant une absorption de 100 % par voie dermique.
b FSS (2015).
6.2 Évaluation des effets sur la santé
L’OPP et son sel de sodium (OPPS) ont fait l’objet d’examens par le JMPR de la FAO/OMS (1999), l’EPA des États-Unis (EPA 2006), l’EPA de la Californie (Cal EPA 2007) et l’Agence de réglementation de la lutte antiparasitaire de Santé Canada (Santé Canada 2008a, 2008b). Le CIRC a classé l’OPPS comme carcinogène possible pour les humains (groupe 2B) (CIRC 1999). Les examens réalisés par l’EPA des États-Unis et Santé Canada ont été utilisés comme sources principales pour éclairer la caractérisation des effets sur la santé de la présente évaluation préalable. Ils ont été complétés par des renseignements provenant des autres examens susmentionnés. L’EPA des États-Unis a aussi publié un plan de travail pour l’OPP et ses sels (2014), comportant des détails supplémentaires sur des études. L’OPP et son sel de sodium ont aussi fait l’objet d’un examen par le National Industrial Chemicals Notification and Assessment Scheme (NICNAS) de l’Australie (2016) et par le Comité scientifique de la Commission européenne sur la sécurité des consommateurs (SCCS 2015, 2018). L’Agence européenne des produits chimiques (ECHA) dispose d’un dossier d’enregistrement sur l’OPPS (ECHA c2007-2019). Une recherche bibliographique a été réalisée pour la période allant de janvier 1998 à janvier 2019. Elle était centrée sur les utilisations autres que les utilisations comme pesticides (CIRC 1999). Aucune étude qui aurait pu conduire à une caractérisation différente des effets sur la santé n’a été identifiée.
Suite à l’ingestion d’une simple dose d’OPPS par gavage (250 to 500 mg/kg bw), environ 85 % de la dose était absorbée par les rats et excrétée dans l’urine dans les 24 heures. Moins de 8 % ont été détectés dans les tissus (y compris les tissus adipeux, le foie, les reins, la vessie, l’estomac et les intestins, le cerveau et le sang) après 24 heures et moins de 1 % après 7 jours (CIRC 1999, JMPR1999, EPA 2007). L’OPPS est rapidement excrété dans l’urine, mais jusqu’à 26 et 4 % de la dose orale peuvent aussi être excrétés respectivement dans la bile et les fèces chez le rat (Sato et al. 1988 cité ans Cal EPA 2007). Chez les mammifères (y compris les rongeurs et les humains), l’OPPS absorbé par voie orale a produit des métabolites comme des conjugués de sulfate et de glucuronide d’OPP, de la phénylhydroquinone (PHQ) non conjuguée, de la phénylbenzoquinone (PBQ) et du 1,1’-biphényle-2,5-diol (CIRC 1999, JMPR 1999). Chez le rat, les concentrations urinaires des métabolites étaient plus importantes chez le mâle que chez la femelle (Nakao et al. 1983 et Morimoto et al. 1989 cités dans CIRC 1999 et JMPR 1999).
Des rats F344 (10/sexe/groupe) ont reçu de l’OPPS dans leurs aliments, à raison de 0, 1250, 5000, 10 000, 20 000 ou 40 000 ppm (égal à 0, 86, 180, 350, 700, 1350 ou 2450 mg/kg pc/jour) pendant 13 semaines. Les gains de poids corporel étaient inférieurs de 15 à 17 % chez les deux sexes aux doses de 350 mg/kg pc/jour ou plus (Iguchi et al. 1979 cité dans JMPR 1999). Chez les mâles, aux doses de 700 mg/kg pc/jour ou plus, les activités de l’alanine aminotransférase (ALT) et de l’aspartate aminotransférase (AST) étaient moindres, avec des poids relatifs du foie accrus observés à 1350 mg/kg pc/jour ou plus. Les tumeurs de l’épithélium de la vessie (papillomes et carcinomes transitoires chez les mâles, papillomes chez les femelles) étaient accrues à 2450/1350 mg/kg pc/jour ou plus chez les mâles/femelles, avec une inflammation des reins (pyélonéphrite) chez les deux sexes à 2450 mg/kg pc/jour et une augmentation liée à la dose de l’alcalinité de l’urine (Iguchi et al. 1979 et Hiraga et Fujii 1981 cités dans JMPR 1999, Cal EPA 2007 et SCCS 2015). Pour cette étude, la dose sans effet nocif observé (DSENO) est considérée être de 180 mg/kg pc/jour, basée sur un gain de poids corporel moindre à 350 mg/kg pc/jour ou plus, en accord avec le document du JMPR (1999).
Lors de deux études sur la cancérogénicité, des rats F344 ont reçu de l’OPPS dans leurs aliments. Pour la première étude, les mâles (50/groupe) ont reçu 0, 7000 ou 20 000 ppm d’OPPS (équivalent à 0, 270 ou 770 mg/kg pc/jour) et les femelles (50/groupe) 0, 5000 ou 10 000 ppm (équivalent à 0, 224 ou 466 mg/kg pc/jour), pendant 104 semaines avec une période de récupération de 2 semaines. Pour la deuxième étude, les rats (25/sexe/groupe) ont reçu de l’OPPS tel que susmentionné, avec un groupe additionnel recevant 2500 ppm (équivalent à 95/113 mg/kg pc/jour pour les mâles/femelles) et une période de récupération de 56 semaines (jusqu’à la mort de tous les animaux) (Fujii et Hiraga 1985 cité dans CIRC 1999, Hiraga 1983 cité dans Cal EPA 2007). Les incidences de néphrite interstitielle du rein étaient accrues chez les deux sexes aux doses de 224/270 mg/kg pc/jour et plus lors de la première étude et aux doses de 270/466 mg/kg pc/jour et plus lors de la deuxième (mâles/femelles). Une augmentation liée à la dose de l’atrophie focale du pancréas a été observée chez les femelles à 224 mg/kg pc/jour ou plus lors de la première étude uniquement. Des papillomes et/ou des carcinomes de la vessie ont été observés chez les deux sexes lors des deux études uniquement à 224/270 mg/kg pc/jour ou plus. Lors des deux études, les poids corporels étaient moindres chez les femelles à 466 mg/kg pc/jour et chez les mâles à 770 mg/kg pc/jour, bien que les données sur le poids corporel n’étaient disponibles que sous forme de résumé pour la première étude et qu’aucune donnée individuelle n’ait été disponible pour la deuxième étude (Cal EPA 2007). L’EPA de la Californie (Cal EPA 2007) a retenu une dose minimale avec effet observé de 224 mg/kg pc/jour, la dose la plus faible testée, basée sur des incidences accrues de néphrite interstitielle chez les deux sexes et lors des deux études et sur des incidences accrues d’atrophie focale du pancréas chez les femelles lors de la première étude. L’EPA de la Californie (Cal EPA 2007) a indiqué que l’élément de cancérogénicité de cette étude était acceptable, mais pas l’élément de toxicité chronique en raison des données insuffisantes sur l’hématologie et l’ophtalmologie.
Lors d’une étude de 13 semaines et d’une étude de toxicité chronique/cancérogénicité, les souris se sont avérées moins sensibles que les rats à des doses d’OPPS administrées par voie alimentaire. Pour l’étude de 13 semaines, une DSENO de 730/1021 mg/kg pc/jour (mâles/femelles) a été retenue, basée sur un gain de poids corporel moindre chez les mâles à 1581 mg/kg pc/jour ou plus et un poids relatif du foie accru chez les femelles à 1926 mg/kg pc/jour ou plus (Shibata et al. 1985 cité dans Cal EPA 2007 et SCCS 2015, JMPR 1999). Pour l’étude de toxicité chronique/cancérogénicité, à la dose minimale avec effet nocif observé (DMENO) de 480 mg/kg pc/jour, une diminution du poids corporel, une augmentation de l’activité de la phosphatase alcaline (ALP) et une diminution de la densité de l’urine ont été observées chez les femelles (Hagiwara et al. 1984 cité dans CIRC 1999, Ito et al. 1983 cité dans Cal EPA 2007). Bien qu’une augmentation des tumeurs du foie ait été observée chez les deux sexes à 3009 mg/kg pc/jour, aucune tumeur de la vessie n’a été observée.
Globalement, l’OPPS n’était pas génotoxique in vitro, mais les données étaient contradictoires in vivo (examinées dans CIRC 1999 et Cal EPA 2007). Bien que les résultats des études in vivo aient été négatifs (y compris lors de tests d’aberration chromosomique, létal dominant et de Comet), une transformation des cellules et des cassures de l’ADN ont été observées dans la vessie des rats mâles ayant reçu 500 mg/kg pc/jour ou plus d’OPPS dans leur alimentation pendant une semaine ou 3 à 5 mois, respectivement. Des cassures de l’ADN ou des adduits ont également été observés chez des souris exposées par voie orale ou dermique à une dose unique de 330 mg/kg pc ou plus (CIRC 1999, Sasaki et al. 2002, Cal EPA 2007, De Boeck et al. 2015).
Le mode d’action cancérigène de l’OPPS sur la vessie n’est pas clair. Aux doses élevées, il pourrait y avoir saturation de voies de détoxification de la phase II, conduisant à des niveaux accrus des métabolites PHQ ou PBQ, qui peuvent induire une cancérogénicité par hyperplasie régénérative non génotoxique de la vessie ou par de possibles mécanismes génotoxiques (CIRC 1999, Cal EPA 2007, CDC 2017). Un autre mécanisme a été proposé par l’EPA de la Californie (Cal EPA 2007), à savoir qu’il pourrait y avoir des dommages à l’ADN médiés par des espèces oxygénées réactives lors de la conversion de la PHQ en PBQ et une prolifération cellulaire due à une cytotoxicité induite chimiquement dans l’urothélium de la vessie.
Le CIRC a classé l’OPPS comme possiblement cancérigène pour les humains (groupe 2B) (CIRC 1999). L’EPA des États-Unis (2006) et Santé Canada (2008a) ont identifié l’OPPS et ses sels comme probablement non cancérigènes dans une gamme de doses spécifiques, sans quantification du risque. Ils ont été considérés probablement non cancérigènes pour les humains à moins de 200 mg/kg pc/jour, mais probablement cancérigènes à plus de 200 mg/kg pc/jour (EPA 2006).
Lors d’une étude sur la toxicité pour le développement, des souris Jcl:ICR (20 femelles gravides/groupe) ont reçu 0, 100, 200 ou 400 mg/kg pc/jour d’OPPS dans l’eau par gavage des jours de gestation (JG) 7 à 15, puis ont été sacrifiées le JG 18 (Ogata et al. 1978b cité dans Cal EPA 2007 et dans Kwok et Silva 2013). À 100 mg/kg pc/jour ou plus, une diminution du poids fœtal chez les deux sexes, une incidence accrue de fente palatine chez les fœtus et d’autres variations du squelette ont été observées (Kwok et Silva 2013) en présence d’un gain de poids corporel moindre de la mère. À 200 mg/kg pc/jour, il y avait une augmentation du décès maternel avec saignement vaginal. L’EPA de la Californie (Cal EPA 2007) n’a pas déterminé de DMENO maternelle, car il n’y avait pas assez de données pour différencier sans ambiguïté l’ampleur de la diminution du gain de poids corporel de la mère à 100 mg/kg pc/jour (poids utérin non mesuré). Bien qu’une DMENO pour le développement de 100 mg/kg pc/jour ait été retenue par l’EPA de la Californie (Cal EPA 2007), cette étude n’a pas été considérée acceptable en raison des limites significatives du rapport, dont le manque de données individuelles (Cal EPA (2007).
2-Pénylphénol (OPP)
Dans la présente section, nous nous intéressons aux études sur la toxicité pour la reproduction, pour le développement, la toxicité chronique/cancérogénicité et la génotoxicité de l’OPP. L’OPPS est le sel de sodium de l’OPP, qui a des propriétés physico-chimiques similaires. En solution aqueuse, l’OPPS et l’OPP sont dans un équilibre qui dépend du pH (JMPR 1999, EPA 2014). Leurs toxicocinétiques par voie orale sont similaires chez les mammifères (JMPR 1999, Cal EPA 2007, NICNAS 2016), bien que l’OPPS entraîne une augmentation de l’alcalinité de l’urine (Annexe A).
Chez les mammifères, l’OPP ne devrait pas avoir d’effets sur les voies estrogènes, androgènes et thyroïdiennes, ni sur l’immunotoxicité. Nous n’en discuterons donc pas plus dans la présente évaluation (examiné par l’EPA des États-Unis en 2015 et 2016, respectivement). Le CIRC (1999) a classé l’OPP dans le groupe 3 (pas classable quant à sa cancérogénicité pour les humains). Il a indiqué que l’OPPS et l’OPP induisent des tumeurs à la vessie chez le rat mâle, l’OPPS étant plus dangereux.
Lors d’une étude sur la toxicité chronique/cancérogénicité, des souris (50/sexe/groupe) ont reçu des doses d’OPP de 250 à 1000 mg/kg pc/jour dans leur alimentation pendant 2 ans. Une DMENO de 250 mg/kg pc/jour a été retenue par l’EPA des États-Unis (2014), basée sur une augmentation du poids absolu et du poids relatif du foie et une diminution du poids absolu et du poids relatif de la rate chez les deux sexes, ainsi que des nodules et des masses accrus dans le foie à 500 mg/kg pc/jour ou plus (Quast et McGuirk 1995 cité dans JMPR 1999 et dans EPA 2006, 2014). L’EPA de la Californie (2007) a aussi retenu une DMENO de 250 mg/kg pc/jour à partir de cette étude.
Lors d’une étude sur la toxicité chronique/cancérogénicité, des rats F344 (46 à 50/sexe/dose) ont reçu de l’OPP dans leur alimentation à raison de 0, 800, 4000 ou 8000/10 000 ppm (correspondant respectivement à 0, 39/49, 200/248 or 402/648 mg/kg pc/jour chez les mâles et les femelles) pendant 2 ans, avec un sacrifice à 1 an (20/sexe/groupe pour les témoins et les groupes recevant une dose élevée et 10/sexe/groupe pour les groupes recevant une dose moyenne ou faible) (Wahle et Christenson 1996 cité dans Cal EPA 2007 et dans EPA 2014). L’EPA des États-Unis (2006, 2014) a retenu une DSENO de 39 mg/kg pc/jour, basée sur un poids corporel, un gain de poids corporel, une consommation d’aliments et une efficacité des aliments moindres, des signes cliniques et des signes pathologiques de toxicité amplifiés à 200 mg OPP/kg pc/jour ou plus. L’EPA de la Californie (2007) a calculé une dose de référence (DR10) de 222,8 mg/kg pc/jour avec une limite inférieure de 95 % (LDR10) de 185,2 mg/kg pc/jour, basée sur les incidences combinées de papillomes et de carcinomes de la vessie chez les rats mâles.
Des études sur la génotoxicité de l’OPP ont donnés des résultats contradictoires in vitro et in vivo (Cal EPA 2007, SCCS 2015). À l’opposé de l’étude de l’EPA de la Californie (2007), l’EPA des États-Unis (2006, 2014) a considéré que l’OPP n’était pas génotoxique aux doses qui ne résultaient pas en une cytotoxicité. Le mode d’action de l’OPP conduisant à une augmentation des tumeurs de la vessie n’est pas clair, mais les possibilités avancées sont celles précédemment décrites pour l’OPPS (CIRC 1999, Cal EPA 2007, CDC 2017).
Pour une étude sur deux générations de la toxicité pour la reproduction, des rats Sprague Dawley (SD) (30/sexe/groupe) ont reçu 0, 20, 100 ou 500 mg/kg pc/jour dans leur alimentation. Deux accouplements/générations ont produit des portées de générations F1 et F2 (Eigenberg et Lake 1995 cité dans Bomhard et al. 2002, dans Kwok et Silva 2013 et dans ECHA c2007-2019, EPA 2006, 2014). La DSENO pour la toxicité des parents était de 100 mg/kg pc/jour, basée sur une diminution du poids corporel et du gain de poids corporel chez les deux sexes, avec des effets sur les reins et la vessie chez les mâles (dont une inflammation chronique et une hyperplasie de l’urètre et de la vessie), une mortalité (due à une défaillance rénale chez un mâle adulte) et une diminution du poids corporel chez les petits âgés de 21 jours des générations F1 et F2 à 500 mg/kg pc/jour. L’EPA des États-Unis (2014) a indiqué que le poids moindre des petits n’était pas dû à des effets sur la lactation chez les femelles, mais a considéré qu’il était lié à la consommation d’aliments traités par les petits. Aucun effet nocif sur la reproduction n’a été observé lors de cette étude.
Il existe trois études sur la toxicité pour le développement réalisées avec des souris, des rats et des lapins ayant reçu de l’OPP par gavage. Pour l’étude avec les rats (24 à 36 rates gravides/groupe recevant de l’OPP dans de l’huile de coton pendant les JG 6 à 15 et sacrifiées au JG 21), l’EPA des États-Unis (2006, 2014) et Santé Canada (2008a) ont retenu une DSENO de 100 mg/kg pc/jour, basée sur une diminution du gain de poids corporel, de la consommation d’aliments et de l’efficacité des aliments à 300 mg/kg pc/jour (John et al. 1978 cité dans EPA 2006, 2014 et dans Cal EPA 2007, Santé Canada 2008a). L’EPA des États-Unis (2006, 2014) et Santé Canada ont considéré l’étude avec les lapins comme une étude sur le développement co-critique, avec une DSENO maternelle de 100 mg/kg pc/jour , basée sur des effets sur les reins (inflammation et dégénération tubulaire) à 250 mg/kg pc/jour (1 des 24 lapines gravides/groupe ayant reçu l’OPP dans de l’huile de maïs par gavage pendant les JG 7 à 19 et sacrifiée au JG 28) sans effet nocif sur le fœtus (Zablotny et al. 1991 cité dans EPA 2006 et dans Cal EPA 2007, Santé Canada 2008a). Aucun effet sur les fœtus n’a été observé lors de ces deux études jusqu’à une dose de 700 mg/kg pc/jour. À l’opposé, l’étude avec les souris (21 souris gravides/groupe recevant par gavage l’OPP dans de l’huile d’olive pendant les JG 7 à 15, puis sacrifiées au JG 18) a mis en évidence de graves effets sur le fœtus (y compris paupières ouvertes, fente palatine, exencéphalie) à la plus faible dose testée de 1450 mg/kg pc/jour (DMENO), en présence de mortalité maternelle (0, 4, 7 et 16 des 21/groupe à 0, 1450, 1740 et 2100 mg/kg pc/jour) (Ogata et al. 1978b cité dans Cal EPA 2007 et dans Kwok et Silva 2013). L’EPA de la Californie (2007) a considéré que l’étude avec les souris était inacceptable en raison des doses utilisées qui conduisaient à de nombreux décès des mères et en un nombre inadéquat de fœtus/groupe disponibles pour des examens des viscères et du squelette.
Les résultats d’une étude de 3 semaines sur la toxicité dermique chez le rat (Cal EPA 2007, EPA 2006, 2014) n’ont pas été pris en compte pour la présente évaluation, car la comparaison des propriétés physico-chimiques de l’OPP et de l’OPPS suggère que l’absorption dermique de l’OPP est inférieure et que l’OPPS est plus corrosif pour le derme (SCCS 2015).
6.3 Caractérisation des risques pour la santé humaine
Nous donnons dans le tableau 6-2 l’estimation de l’exposition, le niveau d’effet critique ainsi que la ME en découlant pour la caractérisation des risques pour la santé humaine dus à une exposition à l’OPPS.
| Scénario d’exposition (groupe d’âge pour l’estimation la plus élevée) | Exposition systémiquea | Niveau d’effet critique | Paramètre d’effet critique sur la santé | ME |
|---|---|---|---|---|
| Exposition dermique par événement due à l’utilisation de lubrifiant pour pneu/caoutchouc (19ans ou plus) | 0,02 mg/kg pc | DSENO orale (maternelle) = 100 mg/kg pc/jour tirée d’études sur la toxicité pour le développement avec des rats et des lapins | DSEMO maternelle de 100 mg/kg pc/jour basée sur une diminution du gain de poids corporel, de la consommation d’aliments et de l’efficacité des aliments à 300 mg/kg pc/jour basée sur des effets rénaux chez des lapins à 250 mg/kg pc/jour (OPP, analogue). | 5000 |
Abréviations : ME = marge d’exposition; DSENO = dose sans effet nocif observé.
a. En assumant une absorption de 100 % par voie orale ou dermique.
Lors d’une étude sur la toxicité pour le développement de l’OPPS avec des souris (Ogata et al. 1978b), il a été suggéré que des effets potentiels sur le développement pouvaient survenir en présence de toxicité maternelle, mais étant donné les limites significatives de cette étude (dont un manque de données individuelles) elle n’a pas été utilisée pour la caractérisation des risques par événement d’exposition dermique à l’OPPS lors de l’utilisation d’un lubrifiant. Au lieu de cela, en accord avec une évaluation précédente de Santé Canada (Santé Canada 2008a) et d’autres examens internationaux (EPA 2006), une DSENO de 100 mg/kg pc/jour a été retenue pour l’exposition induite à court terme par voie orale à l’OPPS, basée sur des études de toxicité pour le développement avec des rats et des lapins exposés par gavage à l’analogue OPP. Ceci était basé sur des effets maternels observés aux doses élevées en l’absence de toxicité pour le développement. La ME indiquée dans le tableau 6-2 est considérée adéquate pour tenir compte de incertitudes des bases de données sur les effets sur la santé de l’OPPS et l’exposition à cette substance.
Les risques pour la santé humaine dus à une exposition chronique par voie alimentaire à des résidus de pesticides ont été étudiés par Santé Canada (2008a) lors de la réévaluation des utilisations pesticides de l’OPPS. Cette exposition a été comparée à une DJA de 0,39 mg/kg pc/jour (basée sur la DSENO de 39 mg/kg pc/jour retenue par l’EPA des États-Unis (2006) et a été jugée acceptable pour ce qui est du risque pour la santé humaine. L’utilisation d’OPPS dans des matériaux d’emballage alimentaire est considérée contribuer de manière négligeable à l’exposition totale à l’OPPS par voie alimentaire de la population générale, et le risque pour la santé humaine dû à l’exposition à l’OPPS présent dans de l’emballage alimentaire est considéré très faible.
Bien que l’exposition de la population générale à l’OPPS ne soit pas inquiétante aux niveaux actuels, cette substance est considérée avoir un effet inquiétant sur la santé basé sur son danger potentiel, dû à son classement comme substance du groupe 2B (possiblement cancérigène pour les humains) par le CIRC (CIRC 1999).
6.4 Incertitudes de l’évaluation des risques pour la santé humaine
Nous présentons dans le tableau 6-3 ci-après les sources clés d’incertitude de la présente évaluation.
| Source clé d’incertitude | Impact |
|---|---|
| Aucune donnée canadienne sur la mesure de l’OPPS dans des milieux de l’environnement pertinents. | +/- |
| Aucune donnée sur l’absorption dermique de l’OPPS. | + |
| Aucune étude sur la toxicité pour la reproduction ni aucune étude adéquate sur la toxicité pour le développement de l’OPPS, par une voie quelconque. | +/- |
+/- = incertitude provoquant potentiellement une surestimation ou une sous-estimation du risque; + = incertitude provoquant potentiellement une surestimation du risque
7. Conclusion
Compte tenu de tous les éléments de preuve avancés dans la présente ébauche d’évaluation préalable, le risque d’effet nocif de l’OPPS sur l’environnement est faible. Il est conclu que l’OPPS ne satisfait pas aux critères de l’alinéa 64(a) ou (b) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ni dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou sa diversité biologique ou qui constituent ou peuvent constituer un danger pour l’environnement essentiel à la vie.
En se basant sur les renseignements présentés dans la présente ébauche d’évaluation préalable, il est conclu que l’OPPS ne satisfait pas aux critères de l’alinéa 64(c) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaine.
IL est donc conclu que l’OPPS ne satisfait à aucun des critères de l’article 64 de la LCPE.
Références
Boîte à outils QSAR de l’OCDE; 2016; Paris (France) : Organisation pour la coopération et le développement économiques, Laboratoire de chimie mathématique (disponible en anglais seulement).
Bomhard E.M., Brendler-Schwaab S.Y., Freyberger A., Herbold B.A., Leser K.H. et Richter M.; 2002; O‑phenylphenol and its sodium and potassium salts: A toxicological assessment; Critical Reviews in Toxicology, 32(6), p. 551-626 (disponible en anglais seulement).
Brusick D.; 2005; Analysis of genotoxicity and the carcinogenic mode of action for ortho-phenylphenol; Environmental and molecular mutagenesis, 45, p. 460-481 (disponible en anglais seulement).
[Cal EPA] Environmental Protection Agency de la Californie; 2007; Ortho-phenylphenol (OPP) and sodium ortho-phenylphenate (SOPP) risk characterization document: Dietary exposure; Department of Pesticide Regulation, April 9, 2007, 225 p. plus Appendices (disponible en anglais seulement).
Canada; 1999; Loi canadienne sur la protection de l’environnement (1999) ; S.C. 1999, c.33. Canada Gazette Part III, vol. 22, no. 3.
Canada, ministère de l’Environnement; 2009; Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure (PDF) ; Gazette du Canada, Partie I, vol. 143, no 40, p. 2945-2956.
[CDC] Centers for Disease Control and Prevention des États-Unis; 2017; Biomonitoring summary; ortho-Phenylphenol, CAS No. 90-43-7 , 3 p. (disponible en anglais seulement).
ChemIDplus [base de données]; 1993- ; Bethesda (MD) : US National Library of Medicine [consulté l 28 août 2018] (disponible en anglais seulement).
[CIRC] Centre international de recherche sur le cancer; 1999; ortho-Phenylphenol and its sodium salt; Monographie du CIRC 73, p. 451-480 (disponible en anglais seulement).
[ECCC] Environnement et Changement climatique Canada; 2016a; Document sur l’approche scientifique : Classification du risque écologique des substances organiques ; Ottawa (ON) : gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada; 2016b; Supporting documentation: data used to create substance-specific hazard and exposure profiles and assign risk classifications; Gatineau (QC) : ECCC; renseignements pour le Document sur l’approche scientifique : Classification du risque écologique des substances organiques; disponible à : substances@ec.gc.ca.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada; [modifié le 12 mars 2017]; Catégorisation de substances chimiques ; Ottawa (ON) : gouvernement du Canada [consulté le 3 décembre 2019].
[ECHA] Agence européenne des produits chimiques; c2007-2019; Registered substances database; search results for CAS RN 132-27-4 ; Helsinki (Finlande) : ECHA [consultée en janvier 2019] (disponible en anglais seulement).
[EFSA] Autorité européenne de sécurité des aliments; 2008; Conclusion on pesticide peer review regarding the risk assessment of the active substance 2-phenylphenol; EFSA Scientific Report (2008), 217, p. 1-67 (disponible en anglais seulement).
Environnement Canada; 2009; Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure; Données préparées par : Environnement Canada, Santé Canada, Programme des substances existantes.
[EPA] Environmental Protection Agency des États-Unis; 1984; Health and Environmental Effects Profile for 2-Phenylphenol; Environmental Criteria and Assessment Office, Office of Health and Environmental Assessment, Office of Research and Development. U.S. Environmental Protection Agency, Cincinnati, OH45268 (disponible en anglais seulement).
[EPA] Environmental Protection Agency des États-Unis; 2006; Reregistration eligibility decision for 2-phenylphenol and salts (orthophenylphenol or OPP); Report No. 739-R-06-004; July 2006 [PDF]. Office of Prevention, Pesticides and Toxic Substances, 146 p. (disponible en anglais seulement).
[EPA] Environmental Protection Agency des États-Unis; 2011; Exposure Factors Handbook 2011 ; National Center for Environmental Assessment. Office of Research and Development. U.S. Environmental Protection Agency, Washington, DC 20460 (disponible en anglais seulement).
[EPA] Environmental Protection Agency des États-Unis; 2014; ortho-Phenyl phenol (oPP) and salts final work plan; Registration Review: Initial Docket Case Number 2575; Docket Number EPA-HQ_OPP-2013-0524 , mars 2014. 74 p. (disponible en anglais seulement).
[EPA] Environmental Protection Agency des États-Unis; 2015; EDSP Weight of Evidence Conclusions on the Tier 1 Screening Assays for the List 1 Chemicals: O-phenylphenol (o-PP); 56 p. + memorandum, daté du 29 juin 2015 (disponible en anglais seulement).
[EPA] Environmental Protection Agency des États-Unis; 2016; 2-Phenylphenol: Summary of Hazard and Science Policy Council (HASPOC) Meeting on July 21, 2016: Recommendations on the Requirements for Immunotoxicity Study (OCSPP 870.7800); Memorandum, daté du 30 août 2016, 6 p. (disponible en anglais seulement).
[FSS] Fiche signalétique de sécurité; 2015; 12097 Tire & Rubber Lube; Dixon, USA : Plews and Edelmann [consultée le 19 septembre 2018] (disponible en anglais seulement).
[JMPR] Joint Meeting of the FAO Panel of Experts on Pesticide Residues in Food and the Environment and the WHO Core Assessment Group; 1999; Toxicological evaluations - 2-Phenylphenol and its sodium salt; Rome, 20-29 septembre 1999; Programme international sur la sécurité des produits chimiques; [consulté en février 2019] (disponible en anglais seulement).
[JMPR] Joint Meeting of the FAO Panel of Experts on Pesticide Residues in Food and the Environment and the WHO Core Assessment Group; 2000; 2-Phenylphenol and its sodium salt (056), p. 605-636 dans Pesticide residues in food − 1999; Evaluations Part 1 – Residues; FAO Plant Production and Protection Paper 157 [PDF]. Sponsored jointly by FAO and WHO; Rome, 2000 (disponible en anglais seulement).
Kwok E.S.C. et Silva M.; 2013; Re-evaluation of developmental and reproductive toxicity of ortho-phenylphenol (OPP) and sodium ortho-phenylphenate (SOPP); Cell. Dev. Biol., 2(3), p. 123 (disponible en anglais seulement).
[NICNAS] National Industrial Chemicals Notification and Assessments Scheme (Australie); 2016; Human health Tier II assessment for biphenylol and its sodium salt (disponible en anglais seulement).
[NTP] National Toxicology Program;1991; NTP Chemical Repository Data Sheet: o-Phenylphenol;
Research Triangle Park, NC; cité dans IARC Monographs on the evaluation of carcinogenic risks to humans, volume 73; Organisation mondiale de la santé, Centre international de recherche sur le cancer, 1999 (disponible en anglais seulement).
Santé Canada; 2008a; Projet de décision de réévaluation : 2-Phénylphénol et ses sels; PRVD 2008-04; 25 janvier 2008; Agence de réglementation de la lutte antiparasitaire, 23 p.
Santé Canada; 2008b;. Décision de réévaluation : 2-Phénylphénol et ses sels; RVD 2008-13; 7 avril 2008; Agence de réglementation de la lutte antiparasitaire, 5 p.
Santé Canada; 2013; Interim guidance on human health risk assessment for short-term exposure to carcinogens at contaminated sites [PDF] ; Ottawa (ON) : Santé Canada [consulté en janvier 2019].
Santé Canada; 2014; Document de principes SPN2014-01, Paramètres des facteurs d’exposition généraux utilisés pour les évaluations de l’exposition alimentaire, professionnelle et résidentielle ; 6 novembre 2014; Agence de réglementation de la lutte antiparasitaire, 19 p.
Santé Canada; 2015; Tableau de la consommation d’aliments provenant de Statistique Canada, Enquête sur la santé dans les collectivités canadiennes, cycle 2.2, Nutrition (2004), dossier paratgé, Ottawa.
Sasaki Y.F., Kawaguchi S., Kamaya A., Ohshita M., Kabasawa K., Iwama K., Taniguchi K. et Tsuda S.; 2002; The comet assay with 8 mouse organs: results with 39 currently used food additives; Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 519, p. 103-119 (disponible en anglais seulement).
[SCCS] Comité scientifique de la sécurité des consommateurs; 2015; Scientific opinion on o-phenylphenol, sodium o-phenylphenate and potassium o-phenylphenate; rapport SCCS/1555/15, version révisée du 15 décembre 2015, 122 p. (disponible en anglais seulement).
[SCCS] Comité scientifique de la sécurité des consommateurs; 2018; Addendum to the scientific opinion on o-phenylphenol, sodium o-phenylphenate and potassium o-phenylphenate (SCCS/1555/15); Here: the use a preservative of sodium o-phenylphenate, potassium o-phenylphenate, MEA o-phenylphenate (CAS n. 132-27-4, 13707-65-8, 84145-04-0); rapport SCCS/1587/18, 36 p. (disponible en anglais seulement).
[UE] Union européenne; 2015; Règlement (UE) no 528/2012 du Parlement européen et du Conseil du 22 mai 2012 concernant la mise à disposition sur le marché et l’utilisation des produits biocides; Rapport d’évaluation : Biphenyl-2-ol Product-type PT 2 (Preventol O Extra); mars 2015, 76 p. (disponible en anglais seulement).
Annexe A : lecture croisée OPP-OPPS
| Nom chimique | 2-Phénylphénol (OPP) | 2-Phénylphénolate de sodium (OPPS) |
|---|---|---|
| No CAS | 90-43-7 | 132-27-4 |
| Rôle | Analogue | Substance visée |
| Structure chimique | 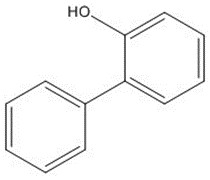 |
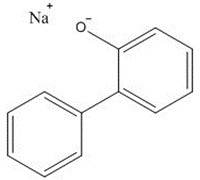 |
| Masse moléculaire (g/mol) | 170,2 | 192,2 |
| Pression de vapeur (Pa à 25 °C) | 0,27 | 1,2 |
| Solubilité dans l’eau (mg/L) | 530-640 (pH 5-9) | 1,00E+06 (pH 13,6) |
| Log Koe (sans dimension) | 3,18 | 2,95 |
| pKa | 9,55 | ND |
| Absorption, distribution, métabolisme, excrétion | Simple dose orale d’OPP absorbée à 80 à 90 % par les rats, les souris et les chèvres dans les 24 heures (p. ex. 85 à 86 % absorbés par les rats mâles ou femelles). Moins de 8 % d’une simple dose d’OPP radiomarqué administré par gavage à des rats ont été détectés dans leurs tissus (dont les tissus adipeux, le foie, les reins, la vessie, l’estomac et les intestins, le cerveau et la sang) après 24 h, moins de 1 % étant détecté 7 jours après le gavage. Métabolites urinaires (rongeurs, humains) : conjugués de sulfate et de glucuronide d’OPP, phénylhydroquinone (PHQ) non conjuguée, phénylbenzoquinone (PBQ) et 1,1’-biphényle-2,4'-diol. Chez les rats, les concentrations urinaires des métabolites étaient supérieures chez les mâles. L’excrétion de l’OPP était rapide et complète (85-100 %) chez les souris, les rats et les humains, et l’urine était la principale voie d’excrétion chez toutes les espèces étudiées. Chez les rats, jusqu’à 26 et 4 % d’une dose orale étaient respectivement excrétés dans la bile et les fèces (CIRC 1999, JMPR 1999, Cal EPA 2007, NICNAS 2016). | Une dose simple d’OPPS administrée par gavage à des rats est absorbée à environ 85 % dans les 24 heures. Une simple dose d’OPPS radiomarqué administrée à des rats a conduit à des résultats identiques à ceux obtenus pour l’OPP. Métabolites urinaires (humains, rongeurs) : conjugués de sulfate et de glucuronide d’OPP, PHQ non conjuguée, PBQ 1,1’‑biphényle-2,5-diol. Chez les rats, les concentrations urinaires des métabolites étaient supérieures chez les mâles. L’OPPS est principalement excrété dans l’urine dans les 24 heures et les résultats sur l’excrétion dans la bile et les fèces étaient similaires à ceux pour l’OPP, quand l’OPPS était administré par voie orale à des rats (CIRC 1999, JMPR 1999, Cal EPA 2007, NICNAS 2016). |
| Irritation des yeux et de la peau, sensibilisation de la peau | Irritant pour les yeux, irritant puissant pour la peau, non sensibilisant pour la peau (Bomhard et al. 2002). | Corrosif puissant pour les yeux et la peau, non sensibilisant pour la peau (Bayer 1983 cité dans ECHA c2007-2019, Toxicological Research Laboratory 1994 cité dans ECHA c2007-2019, Bomhard et al. 2002). |
| Toxicité subchronique à dose répétée (voie orale) | NR | Étude de 13 semaines avec des rats. Augmentation liée à la dose de l’alcalinité de l’urine. Diminution du gain de poids corporel à 350 mg/kg pc/jour ou plus. Augmentation du poids relatif des reins, diminution de l’activité de l’AST et de l’ALT chez les mâles à 700 mg/kg pc/jour ou plus. DSENO de 180 mg/kg pc/jour (JMPR 1999), 350 mg/kg pc/jour (Cal EPA 2007). Étude de 13 semaines avec des souris. DSENO = 730/1021 mg/kg pc/jour, basée sur une diminution du gain de poids corporel chez les mâles à 1581 mg/kg pc/jour ou plus et sur une augmentation du poids relatif du foie chez les femelles à 1926 mg/kg pc/jour ou plus (JMPR 1999, Cal EPA 2007) |
| Toxicité à long terme à dose répétée (voie orale, alimentaire) | Étude de 2 ans sur la cancérogénicité chez le rat. Diminution du poids corporel et du gain de poids corporel chez les deux sexes, diminution de la consommation alimentaire chez les femelles et diminution de l’efficacité des aliments (sexe non spécifié) et augmentation des signes cliniques et des signes pathologiques de toxicité chez les femelles à 200 mg d’OPP/kg pc/jour. Incidence accrue de carcinomes et de papillomes de la vessie chez les mâles (EPA 2006, 2014, Cal EPA 2007); LDR10 = 185,2 mg/kg pc/jour (Cal EPA 2007). DSENO de 39 mg/kg pc/jour (DTMin) considérée protectrice d’événements précurseurs conduisant au développement de tumeurs de la vessie et du foie qui surviennent à des doses supérieures à 200 mg/kg/jour ou plus (EPA 2006). | Études de 2 ans avec des rats sur la toxicité chronique/cancérogénicité. À 224 mg/kg pc/jour ou plus, incidences accrues de néphrite interstitielle et d’atrophie focal pancréatique chez les femelles (Cal EPA 2007), avec diminution du poids corporel suggéré aux doses plus élevées. Incidence accrue de papillomes et/ou de carcinomes de la vessie chez les deux sexes à 224 mg/kg pc/jour ou plus (CIRC 1999, Cal EPA 2007). Étude de 2 ans avec des souris sur la toxicité chronique/cancérogénicité. À 480 mg/kg pc/jour ou plus, il y avait chez les femelles une diminution du poids corporel, une augmentation de l’activité de l’ALP et une diminution de la densité de l’urine. Incidence accrue de tumeurs du foie chez les deux sexes à 3009 mg/kg pc/jour, diminution du poids corporel et de la densité de l’urine chez les mâles (CIRC 1999, Cal EPA 2007). |
| Toxicité pour la reproduction (voie orale) | Étude sur la toxicité pour la reproduction avec deux générations de rats. DSENO parentale = 100 mg/kg pc/jour, basée sur une diminution du poids corporel et du gain de poids corporel chez les deux sexes, des effets sur les reins et la vessie chez les mâles (y compris une inflammation chronique et une hyperplasie de l’urètre et de la vessie), une mortalité (due à une défaillance des reins chez un mâle adulte) et une diminution du poids corporel des petits âgés de 21 jours à 500 mg/kg pc/jour. DSENO pour la toxicité pour la reproduction = 500 mg/kg pc/jour (DTMin) (EPA 2006, 2014). | Lecture croisée à partir de données sur l’OPP. |
| Toxicité pour le développement (voie orale) | Étude sur la toxicité pour le développement avec des rats. DSENO maternelle de 100 mg/kg pc/jour (DTMin), basée sur une diminution du gain de poids corporel, de la consommation d’aliments et de l’efficacité des aliments à 300 mg/kg pc/jour. DSENO pour le développement = 700 mg/kg pc/jour (DTMax) (Santé Canada 2008a, EPA 2006, Cal EPA 2007). Étude sur la toxicité pour le développement avec des lapins. DSENO maternelle de 100 mg/kg pc/jour (DTMin), basée sur des effets sur les reins (inflammation et dégénération tubulaire) à 250 mg/kg pc/jour ou plus. DSENO pour le développement = 250 mg/kg pc/jour (DTMin) (Santé Canada 2008a, EPA 2006, Cal EPA 2007). | Lecture croisée à partir des résultats d’études sur la toxicité pour le développement de l’OPP avec des lapins. |
| Génotoxicité | Résultats équivoques chez les rongeurs in vivo et in vitro avec des cellules de mammifères (CIRC 1999, Cal EPA 2007, SCCS 2015). Évidence de potentiel génotoxique soutenu par Cal EPA (2007), mais pas par l’EPA (2006, 2014). | Globalement, non génotoxique in vitro, mais les données étaient contradictoires in vivo (étudié dans CIRC 1999, Cal EPA 2007). |
| Cancérogénicité | Pas classable (CIRC groupe 3) (CIRC 1999). | Possiblement cancérogène pour les humains (CIRC groupe 2B) (CIRC 1999). |
Abréviations : ND = non disponible; NR = lecture croisée non requise pour la caractérisation des risques; DSENO = dose sans effet nocif observé; DMENO = dose minimale avec effet nocif observé; DTMax = dose testée maximale; DTMin = dose testée minimale
Annexe B : exposition dermique des humains due à des produits disponibles pour les consommateurs
Les hypothèses du scénario d’exposition de référence sont résumés dans le tableau B‑1. L’absorption dermique a été assumée à 100 %.
| Scénario d’exposition | Hypothèses |
|---|---|
Lubrifiant pour pneu/caoutchouc (19 ans ou plus) |
Concentration d’OPPS : 0,2 % (FSS 2015). Une approche de couche mince soulignée dans l’Exposure factors handbook de l’EPA (EPA 2011) a été suivie. Exposition estimée = (Concentration × SP × T × MMPC) / PC Il a été assumé que l’exposition due à la manipulation d’un chiffon recouvert du produit peut être décrite par un scénario de couche mince. Cette approche est caractéristique du dépôt dermique d’une huile minérale suite à la manipulation d’un chiffon saturé avec cette huile, c.-à-d. que l’épaisseur de l’huile minérale (couche mince) estimée restée sur la peau (T) est de 1,64 × 10−3 cm. Cette épaisseur a donc été assumée s’appliquer à l’OPPS pour la caractérisation de l’exposition dermique due à ces produits lubrifiants. En assumant une même masse volumique de 1302 mg/cm3 pour l’OPPS et le produit complet (MMPC) et une surface de peau exposée(SP) de 455 cm2 (la moitié de la surface des deux mains/paumes), la charge dermique a été estimée à 1,8 mg par événement d’exposition de 60 minutes en utilisant la concentration de 0,2 %. En utilisant un poids corporel (PC) de 74 kg (considéré représentatif d’un Canadien moyen adulte de 19 ans ou plus) (Santé Canada 2015), l’exposition dermique a été estimée à 0,02 mg/kg pc/événement. |
