Ébauche d’évaluation préalable - Terpènes et terpénoïdes - Groupe des monoterpènes acycliques, monocycliques et bicycliques
Titre officiel : Ébauche d’évaluation préalable - Terpènes et terpénoïdes - Groupe des monoterpènes acycliques, monocycliques et bicycliques
Environnement et Changement climatique Canada
Santé Canada
Mars 2020
Sommaire
Conformément aux articles 68 ou 74 de la Loi canadienne sur la protection de l’environnement (1999)(LCPE), les ministres de l’Environnement et de la Santé ont mené une évaluation préalable de 15 des 76 substances appelées collectivement groupe des terpènes et des terpénoïdes dans le Plan de gestion des produits chimiques. Ces 15 substances ont été identifiées d’intérêt prioritaire pour une évaluation puisqu’elles satisfaisaient aux critères de catégorisation du paragraphe 73(1) de la LCPE, ou en raison de préoccupations pour la santé humaine. Les risques pour l’environnement et la santé humaine posés par quatre des autres 61 substances ont ensuite été jugés peu préoccupants et les décisions les concernant sont présentées dans des rapports séparésNote de bas de page 1, Note de bas de page 2. Les décisions concernant les 57 substances restantes seront communiquées dans plusieurs évaluations des risques séparées. Par conséquent, la présente évaluation préalable porte sur les 15 substances énumérées dans le tableau ci-dessous, ci-après appelées groupe des monoterpènes acycliques, monocycliques et bicycliques. Leurs numéros de registre du Chemical Abstracts Service (no CASNote de bas de page 3), leurs noms sur la Liste intérieure des substances (LI) et leurs noms utilisés dans la présente évaluation sont présentés dans le tableau ci-dessous.
| No CAS | Nom sur la LI | Nom utilisé dans la présente évaluation |
|---|---|---|
| 80-56-8 | Pin-2(3)-ène | alpha-Pinène |
| 1113-21-9 | (E,E)-3,7,11,15-Tétraméthylhexadéca-1,6,10,14-tétraén-3-ol | Géranyllinalol |
| 8000-46-2 a,b | Essences de géranium | Essence de géranium |
| 8002-09-3 a | Essences de pin | Essence de pin |
| 8006-64-2 a | Essence de térébenthine | Essence de térébenthine |
| 8007-01-0 a | Essences de rose | Essence de rose |
| 8007-02-1 a | Essences de lemon-grass des Indes occidentales | Essence de lemon-grass |
| 8008-31-9 a,b | Essences de mandarine | Essence de mandarine |
| 8008-52-4 a | Essences de coriandre | Essence de coriandre |
| 8008-57-9 a | Essences d’orange douce | Essence d’orange douce |
| 8014-19-5 a,b | Essences de palmarosa | Essence de palmarosa |
| 8015-77-8 a,b | Essences de bois de rose | Essence de bois de rose |
| 8016-85-1 a,b | Essences de tangerine | Essence de tangerine |
| 8021-28-1 a,b | Essences de sapin | Essence de sapin |
| 9005-90-7 a,b | Térébenthine | Térébenthine |
a Cette substance est un UVCB (substance de composition inconnue ou variable, produit de réaction complexe ou matière biologique).
b Cette substance n’a pas été identifiée en vertu du paragraphe 73(1) de la LCPE, mais est visée par la présente évaluation, car elle est considérée comme prioritaire en raison d’autres préoccupations liées à la santé humaine.
Les terpènes sont des composés à unités répétées d’isoprène et sont regroupés selon leur nombre de ces unités. Les monoterpènes ont la plus petite taille et sont formés de deux unités d’isoprène. De nombreux composants des huiles essentielles d’origine végétale peuvent être extraits de différentes parties des plantes (p. ex. les feuilles, les graines, la tige, les fleurs, la racine, les fruits, le bois, l’écorce, l’herbe, la gomme, les bourgeons, les bulbes, les boutons floraux). La concentration de ces principaux composants peut être influencée par divers facteurs, tels que l’origine végétale, l’espèce, la température, le sol et la géographie. De plus, beaucoup de ces essences ont des chémotypes différents (c.-à-d. différents composants chimiques majeurs produits à partir de plantes du même genre et de la même espèce). Par conséquent, les huiles essentielles extraites de ces plantes peuvent être chimiquement différentes même si leur origine est la même.
À l’exception de l’essence de térébenthine, toutes les substances du groupe des monoterpènes acycliques, monocycliques et bicycliques ont été incluses dans les enquêtes menées en vertu de l’article 71 de la LCPE. Elles sont généralement utilisées comme parfums dans des produits de soins personnelsNote de bas de page 4 (p. ex. des lotions pour le corps, des shampooings, des drogues et des produits de santé naturels), des produits de nettoyage, et des assainisseurs d’air.
Les risques posés à l’environnement par les substances du groupe des monoterpènes acycliques, monocycliques et bicycliques ont été caractérisés à l’aide de l’approche de classification des risques écologiques des substances organiques (CRE), une approche basée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition et d’une pondération des éléments de preuve pour classer le risque. Les profils de danger sont principalement établis en se basant sur des paramètres liés au mode d’action toxique, à la réactivité chimique, à des seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Les paramètres pris en compte dans les profils d'exposition comprennent la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Une matrice de risque a été utilisée pour assigner à chaque substance un risque faible, moyen ou élevé basé sur le classement de son danger et de son exposition. Sur la base des résultats de l’analyse de la CRE, les substances du groupe des monoterpènes acycliques, monocycliques et bicycliques sont classées comme présentant un faible potentiel de risque pour l’environnement.
Compte tenu de tous les éléments de preuve avancés dans la présente ébauche d’évaluation préalable, les 15 substances du groupe des monoterpènes acycliques, monocycliques et bicycliques présentent un faible risque pour l’environnement. Il est proposé de conclure que ces 15 substances du groupe des monoterpènes acycliques, monocycliques et bicycliques ne répondent pas aux critères de l’alinéa 64a) ou b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou sa diversité biologique, ou qui constituent ou peuvent constituer un danger pour l’environnement essentiel pour la vie.
L’exposition humaine due à l’utilisation de produits de soins personnels, de produits de nettoyage, d’assainisseurs d'air contenant ces monoterpènes et de solvants (pour nettoyer les pinceaux et enlever la peinture) a été caractérisée.
Concernant la santé humaine, l’essence de bois de rose, l’essence de palmarosa, l’essence de géranium, le géranyllinalol et l’essence d’orange douce présentaient un faible potentiel de danger. Ils ont donc fait l’objet d’une évaluation qualitative. Compte tenu du faible potentiel de danger de ces substances, leur risque pour la santé humaine est également considéré faible.
Les effets critiques sur la santé associés à l’exposition à l’essence de coriandre étaient des effets sur les reins et le foie ainsi que des changements dans la biochimie sérique. La comparaison des niveaux estimés d’exposition à l’essence de coriandre présents dans des aliments et des produits disponibles pour les consommateurs et des niveaux avec effet critique permet de calculer des marges d’exposition jugées adéquates pour tenir compte des incertitudes des données sur l’exposition et les effets sur la santé utilisées pour caractériser le risque.
Dans le cas de l’essence de rose, les effets critiques sur la santé étaient importants et liés à la dose : une diminution des valeurs d’hématocrite et d’hémoglobine et une augmentation considérable du poids de la rate ont été observées. Une comparaison des niveaux estimés d’exposition des nourrissons et les tout-petits à l’essence de rose due à un hydratant corporel en contenant 3 % et des niveaux avec effet critique a permis de calculer des marges d’exposition considérées potentiellement inadéquates pour tenir compte des incertitudes des données sur l’exposition et les effets sur la santé utilisées pour caractériser les risques.
En l'absence d'études disponibles sur les effets sur la santé de l’essence de lemon‑grass, les renseignements sur les effets sur la santé des extraits de lemon-grass et du citral, le principal composant de l’essence de lemon-grass, ont été utilisés. Lors des études à doses répétées, l’extrait de lemon-grass entraînait une augmentation des niveaux de certaines enzymes hépatiques, ainsi qu'une congestion vasculaire et des lésions dans le foie. Le citral a entraîné une toxicité pour la reproduction. Une comparaison des niveaux estimés d’exposition à l’essence de lemon-grass présente dans des aliments et des produits disponibles pour les consommateurs et des niveaux avec effet critique a permis de calculer des marges d’exposition jugées adéquates pour tenir compte des incertitudes des données sur l’exposition et les effets sur la santé utilisées pour caractériser les risques.
Aucune donnée pertinente sur la toxicité des essences de tangerine et de mandarine n’a été trouvée. Les données sur les effets sur la santé de leurs principaux composants, à savoir le limonène, le gamma-terpinène et le citral, ont donc été utilisées. Alors que le limonène présentait un faible potentiel de danger, un isomère du gamma-terpinène (alpha-terpinène) a manifesté un potentiel de toxicité pour le développement ou la reproduction et l’effet critique sur la santé était donc la toxicité pour le développement. De plus, les effets de l’exposition par inhalation étaient basés sur les effets observés lors d’une étude sur l’exposition par inhalation au citral. Une comparaison des niveaux estimés d’exposition aux essences de mandarine et de tangerine due à l’utilisation d’un hydratant pour le corps et d’un supplément alimentaire et des niveaux avec effet critique a permis de à calculer des marges d’exposition jugées potentiellement inadéquates pour tenir compte des incertitudes des données sur l’exposition et les effets sur la santé utilisées pour caractériser les risques.
Les effets critiques sur la santé de l’alpha-pinène étaient, selon la durée de l’exposition, des effets sur les reins et le foie ou des effets sur la vessie et une diminution de la queue des spermatozoïdes. Les comparaisons des niveaux estimés d’exposition à l’alpha-pinène présent dans des aliments, des milieux de l’environnement et des produits disponibles pour les consommateurs avec les niveaux avec effet critique ont permis de calculer des marges d’exposition jugées adéquates pour tenir compte des incertitudes des données sur l’exposition et les effets sur la santé utilisées pour caractériser les risques.
Pour la térébenthine et l’essence de térébenthine, les renseignements sur les effets critiques sur la santé étaient basés sur les effets observés pour leur principal composant, l’α-pinène. Les comparaisons des niveaux estimés d’exposition à la térébenthine ou à l’essence de térébenthine due à leur utilisation comme diluant ou décapant pour peinture ou à leur présence comme ingrédient non médicinal dans des produits topiques médicamenteux en vapeur et des contre-irritants avec les niveaux avec effet critique a conduit à calculer des marges d’exposition jugées potentiellement inadéquates pour tenir compte des incertitudes des données sur les effets pour la santé et l’exposition utilisées pour caractériser les risques.
Les renseignements sur l’effet critique sur la santé de l’essence de sapin sont également basés sur les effets observés pour son principal composant, l’alpha-pinène. Une comparaison des niveaux estimés d’exposition à l’essence de sapin contenue dans des aliments et des produits disponibles pour les consommateurs et des niveaux avec effet critique a permis de calculer des marges d’exposition jugées adéquates pour tenir compte des incertitudes des données sur l’exposition et les effets sur la santé utilisées pour caractériser les risques.
Dans le cas de l’essence de pin, les effets critiques sur la santé étaient la toxicité pour la reproduction et une toxicité systémique. Les comparaisons des niveaux d’exposition estimés à l’essence de pin présente dans des aliments et des produits disponibles pour les consommateurs avec les niveaux avec effet critique ont permis de calculer des marges d’exposition jugées adéquates pour tenir compte des incertitudes des données sur l’exposition et les effets sur la santé utilisées pour caractériser les risques.
Pour l’essence de rose, de tangerine, de mandarine ou de térébenthine et pour la térébenthine, les comparaisons des niveaux avec effet critique sur la santé avec les niveaux d’exposition potentielle des Canadiens ont permis de calculer des marges d’exposition jugées potentiellement inadéquates pour tenir compte des incertitudes des bases de données sur les effets et les expositions.
Sur la base des renseignements présentés dans la présente ébauche d’évaluation préalable, il est proposé de conclure que l’essence de bois de rose, l’essence de palmarosa, l’essence de géranium, le géranyllinalol, l’essence de coriandre, l’essence de lemon‑grass, l’essence d’orange douce, l’alpha-pinène, l’essence de sapin et l’essence de pin ne satisfont pas aux critères de l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaine.
Sur la base des renseignements présentés dans la présente ébauche d’évaluation préalable, il est proposé de conclure que l’essence de rose, l’essence de mandarine, l’essence de tangerine et l’essence de térébenthine et la térébenthine répondent aux critères de l’alinéa 64c) de la LCPE, car elles pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaine.
Par conséquent, il est conclu que l’essence de rose, l’essence de mandarine, l’essence de tangerine, l’essence de térébenthine et la térébenthine répondent à un ou plusieurs des critères de l’article 64 de la LCPE et que les dix autres substances du groupe des monoterpènes acycliques, monocycliques et bicycliques ne répondent à aucun de ces critères.
Il est également conclu que l’essence de rose, l’essence de térébenthine et la térébenthine ne répondent pas aux critères de persistance ni de bioaccumulation, que l’essence de mandarine et l’essence de tangerine répondent aux critères de bioaccumulation, mais pas à ceux de persistance du Règlement sur la persistance et la bioaccumulation de la LCPE.
1. Introduction
Conformément à l’article 68 ou 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE) (Canada), les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable de 15 des 76 substances appelées collectivement groupe des terpènes et des terpénoïdes dans le cadre du Plan de gestion des produits chimiques, afin de déterminer si ces 15 substances présentent ou peuvent présenter un risque pour l’environnement ou la santé humaine. Ces 15 substances ont été identifiées d’intérêt prioritaire pour une évaluation, car elles répondaient aux critères de catégorisation du paragraphe 73 (1) de la LCPE ou en raison d’autres préoccupations pour la santé humaine (ECCC, SC 2017a).
Quatre des 61 autres substances (énumérées dans le tableau 1-1 ci-dessous) ont été étudiées dans le document sur l’approche scientifique de la Classification du risque écologique (CRE) des substances organiques (2016a) et soit dans le document sur l’Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances (Santé Canada, 2016), soit à l’aide du document sur l’Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée (ECCC, SC, 2018a). Elles ont été jugées peu préoccupantes pour la santé humaine et l’environnement et ne sont donc pas examinées plus en détail dans le présent rapport. Les conclusions pour deux de ces quatre substances sont présentées dans l’évaluation préalable intitulée Substances jugées comme étant peu préoccupantes au moyen de l’approche de la Classification des risques écologiques des substances organiques et de l’approche fondée sur le seuil de préoccupation toxicologique (SPT) (ECCC, SC 2018b). Les conclusions proposées pour les deux autres substances sont présentées dans Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée (ECCC, SC 2018a). Les décisions concernant les 57 autres substances seront communiquées dans différentes évaluations des risques.
| No CAS | Nom sur la LIS | Approche suivie pour évaluer la substance | Référence |
|---|---|---|---|
| 68916-97-2 | Essences de marruke blanc | CRE/SPT | ECCC, SC 2018b |
| 29350-73-0 | [1S-(1α,4α,4aα,6α,8aβ)]-Décahydro-4-isopropyl-1,6-diméthylnaphtalène, dérivé didéhydrique | CRE/SPT | ECCC, SC 2018b |
| 4572-09-2 | Acide 3β-hydroxy-11-oxo-oléan-12-én-29-oïque composé (1:) préparé avec l’allantoïne | CRE/evaluation préalable rapide | ECCC, SC 2018a |
| 25428-43-7 | (Ræ, Ræ)-(±)-α, 4-Diméthyl-α-(4-méthyl-3-pentényl) cyclohex-3-ène-1-méthanol | CRE/evaluation préalable rapide | ECCC, SC 2018a |
Les 15 substances évaluées dans la présente ébauche d’évaluation préalable seront ci‑après appelées groupe des monoterpènes acycliques, monocycliques et bicycliques. Ces 15 substances ont été divisées en deux sous-groupes : les monoterpènes acycliques et les monoterpènes monocycliques et bicycliques. Les substances de chaque sous-groupe ont été évaluées individuellement en raison de différences considérables ayant trait à l’exposition, au danger et à la caractérisation de leur risque.
Les risques pour l’environnement dus aux substances du groupe des monoterpènes acycliques, monocycliques et bicycliques ont été caractérisés à l’aide de l’approche de classification du risque écologique (CRE) des substances organiques (ECCC 2016a). La CRE décrit le danger d’une substance au moyen de paramètres clés, notamment le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau alimentaire, la biodisponibilité et l’activité chimique et biologique, et tient compte de l’exposition possible des organismes dans les milieux aquatiques et terrestres en se basant sur des facteurs comme les vitesses d’émission potentielles, la persistance globale et le potentiel de transport atmosphérique à grande distance. Les divers éléments de preuve sont combinés pour déterminer les substances qui justifient une évaluation plus approfondie de leur potentiel d’effets nocifs sur l’environnement ou dont la probabilité d’effet nocif sur l’environnement est faible.
La présente ébauche d’évaluation préalable tient compte de renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et les expositions, ainsi que de renseignements soumis par des parties prenantes. Des données pertinentes ont été recueillies jusqu’en juin 2017. Des données empiriques tirées d’études clés ainsi que des résultats de modélisations ont été utilisés pour tirer nos conclusions. Des renseignements pertinents présentés dans des évaluations faites par d’autres juridictions ont été pris en compte.
La présente ébauche d’évaluation préalable a été préparée par le personnel du Programme d’évaluation des risques de la LCPE de Santé Canada et d’Environnement et Changement climatique Canada. Elle intègre des intrants d’autres programmes de ces ministères. Les parties de la présente évaluation qui portent la santé humaine ont fait l’objet d’un examen et/ou de consultations externes. Des commentaires sur les parties techniques relatives à la santé humaine ont été faits par Herman Gibb, Gary Drendel et Jennifer Pitt (TetraTech Inc.). La partie de la présente évaluation qui porte sur l’environnement est basée sur le document de la CRE (publié le 30 juillet 2016), qui a fait l’objet d’un examen externe et d’une période de commentaires du public de 60 jours. Bien que des commentaires externes aient été pris en compte, le contenu final et la conclusion de la présente ébauche d’évaluation préalable demeurent la responsabilité de Santé Canada et d’Environnement et Changement climatique Canada.
La présente ébauche d’évaluation préalable est centrée sur des renseignements critiques pour déterminer si des substances répondent aux critères de l’article 64 de la LCPE, en examinant des renseignements scientifiques et en suivant une approche basée sur le poids de la preuve et le principe de précautionte de bas de page 5. Dans la présente ébauche d’évaluation préalable, nous présentons les renseignements et les considérations critiques sur lesquels sont basées nos conclusions.
2. Identité des substances
Les numéros de registre du Chemical Abstracts Service (no CAS), les noms sur la Liste intérieure des substances (LIS) des substances individuelles du groupe des monoterpènes acycliques, monocycliques et bicycliques ainsi que leurs principaux composants dans le cas des UVCB sont présentés dans le tableau 2‑1.
Tous les terpènes et les terpénoïdes sont dérivés du diphosphate de 3-méthylbut-3-ényle, l’unité de base à 5 atomes de carbone, et de son isomère le diphosphate de 3‑méthylbut-2-ényle, aussi appelé unité de 2-méthylbuta-1,3-diène (isoprène) (Figure 1). Les terpènes sont formés d’une répétition d’unité isoprène, et sont classés en fonction du nombre d’unités qu’ils contiennent (Caputi et Aprea 2011). Les monoterpènes contiennent deux unités d’isoprène. Les diterpènes, les triterpènes et les tétraterpènes contiennent respectivement deux, trois et quatre unités de monoterpène. De plus, les sesquiterpènes et les sesterpènes contiennent respectivement trois et cinq unités isoprène.

Figure 1 : Unité d’isoprène
Unité d’isoprène. Figure de la formule structurale (à gauche) et de la formule squelettique (à droite) d’une unité d’isoprène ou 2-méthyl-1,3-butadiène, suivit par la notation SMILES : [C(C=C)(=C)C]
Ces essences essentielles dérivées de plantes contiennent de nombreux composants qui peuvent être extraits de différentes parties de la plante (p. ex. les feuilles, les graines, les tiges, les fleurs, la racine, les fruits, le bois, l’écorce, l’herbe, la gomme, les bourgeons, les bulbes, les boutons floraux). (Tisserand et Young 2014). De plus, la concentration de ces principaux composants peut être influencée par divers facteurs, tels que l’origine de la plante, l’espèce, la température, le sol et la géographie. Beaucoup de ces essences ont des chémotypes différents (c.-à-d. différents composants chimiques majeurs produits à partir de plantes du même genre et de la même espèce). Par conséquent, les essences essentielles extraites de ces plantes peuvent être chimiquement différentes même si leur origine est la même.
Pour le regroupement des terpènes et des terpénoïdes, le premier critère a été le nombre d’unités d’isoprène et le deuxième le nombre de cycles dans les « composants principaux ». Par exemple, l’un des sous-groupes est appelé le groupe des monoterpènes acycliques, car la structure de ses principaux composants (linalol, géraniol et citronellol) contient deux unités d’isoprène et aucun cycle.
| No CAS | Nom sur la LIS | Nom(s) chimique(s) représentatif(s), structure(s), et leur gamme de concentration(s) dans l’huile essentielle |
|---|---|---|
| 8015-77-8 | Essences de bois de rose | (C)O)C\C=C(\C)C](/content/dam/eccc/images/pded/terpenes/20191121-table2-1_01f.jpg) Linalol (~81-99)a |
| 8014-19-5 | Essences de palmarosa | 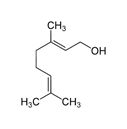 Géraniol (~70-92%)b 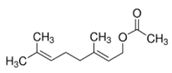 Acétate de géranyle (~4-16%)b |
| 8000-46-2 | Essences de géranium | (C)O)C\C=C(\C)C](/content/dam/eccc/images/pded/terpenes/20191121-table2-1_04f.jpg) Linalol (~5-14%)c 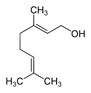 Géraniol (~20-30%)c 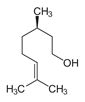 Citronellol (~37-48%)c |
| 1113-21-9 | (E,E)-3,7,11,15-Tétraméthylhexadéca-1,6,10,14-tétraén-3-ol (substance discrète) | (CC\C=C(\CC\C=C(\CC\C=C(\C)C)C)C)C](/content/dam/eccc/images/pded/terpenes/20191121-table2-1_07f.jpg) |
| 8008-52-4 | Essences de coriandre | 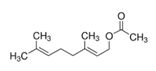 Acétate de géranyle (~0-46%)d (C)O)C\C=C(\C)C](/content/dam/eccc/images/pded/terpenes/20191121-table2-1_09f.jpg) Linalol (~59-88%)d ![CC1=CC[C@H]2C[C@@H]1C2(C)C](/content/dam/eccc/images/pded/terpenes/20191121-table2-1_10f.jpg) α-Pinène (~ 0,1-11%)d |
| 8007-01-0 | Essences de rose | 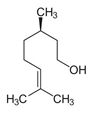 Citronellol (~15-48%)e 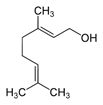 Géraniol (~6-32%)e |
| 8007-02-1 | Essences de lemon‑ grass des Indes occidentales | 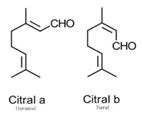 Citral total (mélange des deux isomères) (~67-92%)f 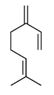 β-Myrcène (~6-27%)f 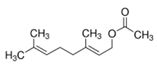 Acétate de géranyle (~12%)f 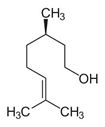 Citronellol (~0-24%)f |
| 8008-57-9 | Essences d’orange douce | ![C([C@@H]1CCC(C)=CC1)(C)=C](/content/dam/eccc/images/pded/terpenes/20191121-table2-1_17f.jpg) Limonène (~84-96%)h |
| 8008-31-9 et 8016 -85-1 | Essences de mandarine et essences de tangerine | ![C([C@@H]1CCC(C)=CC1)(C)=C](/content/dam/eccc/images/pded/terpenes/20191121-table2-1_18f.jpg) Limonène (~52-92%)g 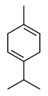 γ-Terpinène (~rt-61 %)g 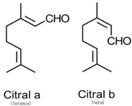 Citral total (mélange des deux isomères) (C)O)C\C=C(\C)C](/content/dam/eccc/images/pded/terpenes/20191121-table2-1_21f.jpg) Linalol (~0,2-59%)g (~15-19%)g 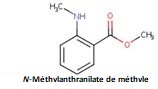 (~0-58%)g  α-Terpinène  δ-Terpinène (α-terpinène et δ-terpinène mentionnés uniquement à titre de comparaison et de référence) |
| 80-56-8 | α-Pinène (substance discrète) | ![C1([C@@H]2C[C@@H](C1=C)CC2)(C)C](/content/dam/eccc/images/pded/terpenes/20191121-table2-1_25f.jpg) α-Pinène ![CC1=CC[C@H]2C[C@@H]1C2(C)C](/content/dam/eccc/images/pded/terpenes/20191121-table2-1_26f.jpg) |
| 8006-64-2 et 9005 -90-7 | Essence de térébenthine et térébenthine | ![CC1(C)[C@H]2CCC(=C)[C@@H]1C2](/content/dam/eccc/images/pded/terpenes/20191121-table2-1_27f.jpg) α-Pinène (~44-94%)I ![C([C@@H]1CCC(C)=CC1)(C)=C](/content/dam/eccc/images/pded/terpenes/20191121-table2-1_28f.jpg) β-Pinène (~0,9-30%)i, l (~1-15%)i ![C1([C@@H]2C[C@@H](C1=C)CC2)(C)C](/content/dam/eccc/images/pded/terpenes/20191121-table2-1_29f.jpg) Limonène (~0,7-25%)i ![C1([C@@H]2C[C@@H](C1=C)CC2)(C)C](/content/dam/eccc/images/pded/terpenes/20191121-table2-1_30f.jpg) (~1-15%)i |
| 8021-28-1 | Essences de sapin | ![CC1=CC[C@H]2C[C@@H]1C2(C)C](/content/dam/eccc/images/pded/terpenes/20191121-table2-1_31f.jpg) ![C1([C@@H]2C[C@@H](C1=C)CC2)(C)C](/content/dam/eccc/images/pded/terpenes/20191121-table2-1_32f.jpg) α-Pinène (~6-26%)j ![CC1(C)[C@H]2CCC(=C)[C@@H]1C2](/content/dam/eccc/images/pded/terpenes/20191121-table2-1_33f.jpg) β-Pinène (~28-56%)j, l ![C([C@@H]1CCC(C)=CC1)(C)=C](/content/dam/eccc/images/pded/terpenes/20191121-table2-1_34f.jpg) Limonène (~2-16%)j |
| 8002-09-3 | Essences de pin | ![C([C@@H]1CCC(C)=CC1)(C)(C)O](/content/dam/eccc/images/pded/terpenes/20191121-table2-1_35f.jpg) α-Terpinéol (~0-65%)k ![CC1=CC[C@H]2C[C@@H]1C2(C)C](/content/dam/eccc/images/pded/terpenes/20191121-table2-1_36f.jpg) α-Pinène (~12-69%)k ![CC1(C)[C@H]2CCC(=C)[C@@H]1C2](/content/dam/eccc/images/pded/terpenes/20191121-table2-1_37f.jpg) β-Pinène (~0,17-33%)k, l 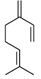 β-Myrcène (~0-18%)k ![C1([C@@H]2C[C@@H](C1=C)CC2)(C)C](/content/dam/eccc/images/pded/terpenes/20191121-table2-1_39f.jpg) (~08-11%) k ![C([C@@H]1CCC(C)=CC1)(C)=C](/content/dam/eccc/images/pded/terpenes/20191121-table2-1_40f.jpg) Limonène (~0-16%)k |
* UVCB est l’acronyme pour Unknown or Variable composition Complex reaction products and Biological material. Ces matières proviennent de sources naturelles ou de réactions complexes. Un UVCB n’est pas un mélange intentionnel de substances discrètes et est considéré comme une substance simple.
a Gamme de concentration du ou des principaux composants de l’essence essentielle d’Aniba rosaeodora; données de Tisserand et Young (2014), Simić et al (2004) et Chantraine et al (2009).
b Gamme de concentration du ou des principaux composants de l’essence essentielle de Cymbopogon martinii; données de Tisserand et Young (2014), Sarma et al (1998), Rajeswara et al (2009) et Raina et al (2003).
c Gamme de concentration du ou des principaux composants de l’essence essentielle de Pelargonium graveolens; données de Tisserand et Young (2014) et Jain et al (2001).
d Gamme de concentration du ou des principaux composants de l’essence essentielle de Coriandrum sativum; données de Tisserand et Young (2014) et Ebrahimi et al (2010).
e Gamme de concentration du ou des principaux composants de l’essence essentielle de Rosa damascena; données de Tisserand et Young (2014), Loghmani-Khouzani et al (2007), Boskabady et al (2011), Babu et al (2002) et Dobreva (2013).
f Gamme de concentration du ou des composants principaux de l’essence essentielle de Cymbopogon flexuosus ou de Cymbopogon citratus; données de Tisserand et Young (2014), Chowdhury et al (2010) et Nath et al (1994).
g Gamme de concentration du ou des principaux composants de Citrus reticulata et/ou de l’essence essentielle de Citrus nobilis; données de Tisserand et Young (2014), Chutia et al (2009), Sawamura et al (2004), Lota et al (2000).
h Gamme de concentration du ou des principaux composants de l’essence de Citrus sinensis; données de Tisserand et Young (2014), Sharma et Tripathi (2008), Njoroge et al (2009).
i Gamme deconcentration du ou des principaux composants de l’essence essentielle extraite de différentes espèces de la famille des « Pinaceae » (Pinus palustris, Pinus caribaea, Pinus elliottii, Pinus insularis, Pinus merkusii, Pinus pinaster, Pinus yunnanensis); données de Tisserand et Young (2014) et du NTP (2002)
j Gamme de concentration du ou des principaux composants de l’essence essentielle d’Abies balsamea; données de Tisserand et Young (2014) et Ross et al (1996).
k Gamme deconcentration du ou des principaux composants de l’essence essentielle extraite de différentes espèces de la famille des « Pinaceae » (Pinus palustris, Pinus mugo, Pinus sylvestris); données de Tisserand et Young (2014), EPA (2009), Sadof (1997), Maciąg et al (2007), Ustun et al (2006) et Harborne et Baxter (2001).
l Il n’existe aucune donnée pertinente sur la toxicité de cette substance.
3. Propriétés physiques et chimiques
Nous donnons dans le tableau 3-1 un résumé des propriétés physiques et chimiques des substances du groupe des monoterpènes acycliques, monocycliques et bicycliques. Lorsque les renseignements expérimentaux sur une propriété était limitée ou non disponible, des données sur des analogues ont été utilisées pour une lecture croisée et/ou les modèles (Q)SAR ont été utilisés pour prédire les valeurs. D’autres propriétés physiques et chimiques sont présentées dans un document d’ECCC (2016b).
| Substance(s) | Nom commun et nO CAS des principaux composants | Masse molécu-laire (g/mol)a | Solubilité dans l’eau (mg/L)a | PV (Pa)a | Constante de Henry (atm-m3/mol)a | log Koe |
|---|---|---|---|---|---|---|
| Essence de bois de rose | Linalol (78-70-6) | 154,25 | 1590 (E) | 21 (E) | 2,15 x 10-5 (E) | 2,9 (E) |
| Essence de palmarosa | Géraniol (106-24-1) | 154,25 | 255,8 (M) | 4 (E) | 1,15 x 10-5 (E) | 3,5 (E) |
| Essence de palmarosa | Acétate de géranyle (105-87-3) | 196,29 | 18,24 (M) | 4,4 (E) | 2,42 x 10-3 (M) | 4 (E) |
| Essencede géranium | Citronellol (106‑22-9) | 156,27 | 105,5 (M) | 5,9 (E) | 5,68 x 10-5 (M) | 3,9 (E) |
| Essencede géranium | Géraniol (106-24-1) | 154,25 | 255,8 (M) | 4 (E) | 1,15 x 10-5 (E) | 3,5 (E) |
| Essencede géranium | Linalol (78-70-6) | 154,25 | 1590 (E) | 21 (E) | 2,15 x 10-5 (E) | 2,9 (E) |
| Géranyllinalol | ND | 290,49 | 6,98 x 10-3 (M) | 2,07 x 10-4 (M) | 7,75 x 10-4 (M) | 7,97 (M) |
| Essence de coriandre | Linalol (78-70-6) | 154,25 | 1590 (E) | 21 (E) | 2,15 x 10-5 (E) | 2,9 (E) |
| Essence de coriandre | Acétate de géranyle (105-87-3) | 196,29 | 18,24 (M) | 4,4 (E) | 2,42 x 10-3 (M) | 4 (E) |
| Essence de coriandre | α-Pinène (80-56-8) | 136,24 | 2,49 à 25°C (E) | 633 (E) | 1,07 x 10-1 (M) | 4,44 – 4,83 (E) |
| Essence de rose | Citronellol (106‑22-9) | 156,27 | 105,5 (M) | 5,9 (E) | 5,68 x 10-5 (M) | 3,9 (E) |
| Essence de rose | Géraniol (106-24-1) | 154,25 | 255,8 (M) | 4 (E) | 1,15 x 10-5 (E) | 3,5 (E) |
| Essence de lemon-grass | Citral total (les deux isomères no CAS 5392-40-5) | 152,24 | 1340 à 37°C (E) 590 à 25°C (E)b | 12 (M) < 130 à 40°C LD 104 de l’OCDEb | 3,76 x 10-4 (M) | 3,5 (M) |
| Essence de lemon-grass | β-Myrcène (123-35-3) | 136,24 | 5,6 (E) | 268 (E) | 6,43 x 10-2 (E) | 4,17 (E) |
| Essence de lemon-grass | Acétate de géranyle (105-87-3) | 196,29 | 18,24 (M) | 4,4 (E) | 2,42 x 10-3 (M) | 4 (E) |
| Essence de lemon-grass | Citronellol (106‑22-9) | 156,27 | 105,5 (M) | 5,9 (E) | 5,68 x 10-5 (M) | 3,9 (E) |
| Essence d’orange douce | Limonène (5989-27-5) | 136,24 | 7,57 - 13,8 à 25°C (E) | 192 (E) | 3,19 x 10-2 (E) | 4,38-4,57 (E) |
| Huiles essentielle de mandarine et de tangerine | Limonène (5989-27-5) | 136,24 | 7,57 - 13,8 à 25°C (E) | 192 (E) | 3,19 x 10-2 (E) | 4,38-4,57 (E) |
| Huiles essentielle de mandarine et de tangerine | Citral total (les deux isomères no CAS 5392-40-5) | 152,24 | 1340 à 37°C (E) 590 à 25°C (E)b | 12 (M) < 130 à 40°C LD 104 de l’OCDEb | 3,76 x 10-4 (M) | 3,5 (M) |
| Huiles essentielle de mandarine et de tangerine | Linalol (78-70-6) | 154,25 | 1590 (E) | 21 (E) | 2,15 x 10-5 (E) | 2,9 (E) |
| Huiles essentielle de mandarine et de tangerine | N-Méthylanthranilate de méthyle (85-91-6) | 165,19 | 257 à 25°C (M) | 2,78 (M) | 2,69 x 10-8 (M) | 2,81 (M) |
| Huiles essentielle de mandarine et de tangerine | γ‑Terpinène (99-85-4) | 136,24 | 8,68 à 22°C (E) | 145 (E) | 2,25 x 10-2 (E) | 4,5 (E) |
| Huiles essentielle de mandarine et de tangerine | α-Terpinène (99-86-5) | 136,24 | 5,92 à 25°C (M) | 222 (M) | 3,65 x 10-1 (M) | 4,25 (E) |
| Huiles essentielle de mandarine et de tangerine | δ-Terpinène (586-62-9) | 136,24 | 9,5 à 23°C (E) | 99 (E) | 1,40 x 10-2 (E) | 4,47 (E) |
| α-Pinène | S.O. | 136,24 | 2,49 à 25°C (E) | 633 (E) | 1,07 x 10-1 (M) | 4,44 – 4,83 (E) |
| Essence de térébenthine et térébenthine | α-Pinène (80-56-8) | 136,24 | 2,49 à 25°C (E) | 633 (E) | 1,07 x 10-1 (M) | 4,44 – 4,83 (E) |
| Essence de térébenthine et térébenthine | β-Pinène (127-91-3) | 136,24 | 7,06 à 25°C (M) | 391 (E) | 1,61 x 10-1 (M) | 4,16 (E) |
| Essence de térébenthine et térébenthine | Limonène (5989-27-5) | 136,24 | 7,57 - 13,8 à 25°C (E) | 192 (E) | 3,19 x 10-2 (E) | 4,38-4,57 (E) |
| Essence de térébenthine et térébenthine | Camphène (79-92-5) | 136,24 | 4,6 à 25°C (E) | 335 (E) | 1,61 x 10-1 (M) | 4,22 (E) |
| Essence de sapin | α-Pinène (80-56-8) | 136,24 | 2,49 à 25°C (E) | 633 (E) | 1,07 x 10-1 (M) | 4,44 – 4,83 (E) |
| Essence de sapin | β-Pinène (127-91-3) | 136,24 | 7,06 à 25°C (M) | 391 (E) | 1,61 x 10-1 (M) | 4,16 (E) |
| Essence de sapin | Limonène (5989-27-5) | 136,24 | 7,57 - 13,8 à 25°C (E) | 192 (E) | 3,19 x 10-2 (E) | 4,38-4,57 (E) |
| Essence de sapin | Camphène (79-92-5) | 136,24 | 4,6 à 25°C (E) | 335 (E) | 1,61 x 10-1 (M) | 4,22 (E) |
| Essence de pin | α-Terpinéol (98-55-5) | 154,25 | 710 à 25°C (E) | 5,64 (E) | 1,22 x 10-5 (E) | 2,98-3,28 (E) |
| Essence de pin | α-Pinène (80-56-8) | 136,24 | 2,49 à 25°C (E) | 633 (E) | 1,07 x 10-1 (M) | 4,44 – 4,83 (E) |
| Essence de pin | β-Pinène (127-91-3) | 136,24 | 7,06 à 25°C (M) | 391 (E) | 1,61 x 10-1 (M) | 4,16 (E) |
| Essence de pin | β-Myrcène (123-35-3) | 136,24 | 5,6 (E) | 268 (E) | 6,43 x 10-2 (E) | 4,17 (E) |
| Essence de pin | Limonène (5989-27-5) | 136,24 | 7,57 - 13,8 à 25°C (E) | 192 (E) | 3,19 x 10-2 (E) | 4,38-4,57 (E) |
| Essence de pin | Camphène (79-92-5) | 136,24 | 4,6 à 25°C (E) | 335 (E) | 1,61 x 10-1 (M) | 4,22 (E) |
Abréviations : Koe = coefficient de partage octanol-eau; ND = non disponible.
(E) Expérimental
(M) Modélisé
a EPA 2012b
b Extrait du document de l’OCDE sur le citral
4. Devenir et comportement dans l’environnement
4.1 Persistance dans l’environnement
La majorité des substances du groupe des monoterpènes acycliques, monocycliques et bicycliques ne devraient pas persister dans l’air, l’eau, le sol ou les sédiments (ECCC 2016b).
L’essence de bois de rose devrait persister dans l’eau, le sol et les sédiments, mais pas dans l’air (ECCC 2016b).
4.2 Potentiel de bioaccumulation
Les valeurs de log Koe des essences de bois de rose, de palmarosa, de coriandre, de rose, de lemon-grass, d’orange douce, de l’α-pinène, de l’essence de térébenthine, de la térébenthine et de l’essence de pin sont légèrement élevées (log Koe entre 2 et 5). Les facteurs de bioconcentration de ces substances sont inférieurs à 5000 L/kg Par conséquent, la bioaccumuation de ces substances dans les organismes ne devrait pas être significative (ECCC 2016b).
Étant donné leurs facteurs de bioconcentration élevés (supérieurs à 5000 L/kg), l’essence de géranium, le géranyllinalol, l’essence de mandarine, l’essence de tangerine et l’essence de sapin (ECCC 2016b)ne devraient pas se bioaccumuler significativement dans les organismes.
5. Potentiel d’effets nocifs sur l’environnement
5.1 Caractérisation du risque pour l’environnement
Les risques posés à l’environnement par les substances du groupe des monoterpènes acycliques, monocycliques et bicycliques ont été caractérisés à l’aide de l’approche de classification des risques écologique (CRE) des substances organiques (ECCC 2016a). La CRE est une approche basée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition et d’une pondération des éléments de preuve pour classer le risque. Les divers éléments de preuve sont combinés afin de pouvoir distinguer les substances présentant un pouvoir faible ou élevé et un potentiel d’exposition faible ou élevé dans divers milieux. Cette approche permet de réduire l’incertitude associée à la caractérisation des risques, contrairement à une approche qui serait basée sur un seul paramètre mesuré dans un seul milieu (p. ex. CL50). Cette approche est résumée dans les paragraphes suivants et elle est décrite en détail dans un document d’ECCC (2016a)
Les données sur les propriétés physico-chimiques, le devenir (demi-vies chimiques dans divers milieux et biotes, coefficients de partage et bioconcentration dans les poissons), l’écotoxicité aiguë chez les poissons et les quantités de ces produits chimiques importés ou produits au Canada ont été tirées de la littérature scientifique, de bases de données empiriques (p. ex. Boîte à outils [Q] SAR de l’OCDE [2016]) et de réponses à des avis publiés en vertu de l’article 71 de la LCPE. Elles ont aussi été obtenues à partir de modèles de type QSAR (relation quantitative structure-activité), de devenir du bilan massique ou de bioaccumulation. Ces données ont été utilisées comme intrants dans d’autres modèles de bilan massique ou pour compléter les profils de danger et d’exposition de la substance.
Les profils de danger ont été principalement établis en se basant sur des paramètres liés au mode d’action toxique, à la réactivité chimique, à des seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Les profils d’exposition ont aussi été basés sur plusieurs paramètres, dont la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Les profils de danger et d’exposition ont été comparés aux critères de décision afin de classer les potentiels de danger et d’exposition de chaque substance organique comme faible, moyen ou élevé. D’autres règles ont été suivies (p. ex. constance du classement, marge d’exposition) pour améliorer le classement préliminaire du danger ou de l’exposition.
Une matrice de risque a été utilisée pour assigner à chaque substance un risque faible, moyen ou élevé basé sur le classement de son danger et de son exposition. Le classement du risque potentiel obtenu grâce à la CRE a été vérifié en suivant une approche en deux étapes. La première étape consistait à faire passer le classement du risque de moyen ou élevé à faible dans le cas des substances à faible vitesse d’émission estimée dans l’eau après traitement des eaux usées, représentant un faible potentiel d’exposition. La deuxième étape consistait à revoir les résultats du classement du potentiel de risque au moyen de scénarios de risque relativement prudents à l’échelle locale (c.‑à‑d. dans la zone à proximité du point de rejet) conçus pour protéger l’environnement, afin de déterminer si le classement du risque potentiel devrait être reclassé à un niveau supérieur.
La CRE est basée sur une approche pondérée pour réduire au minimum tout risque de surclassification ou sous-classification du danger et de l’exposition, et du risque subséquent. Les approches équilibrées suivies pour traiter des incertitudes sont décrites plus en détail dans lun document d’ECCC (2016a). Nous décrivons ci-après deux des domaines d’incertitude les plus importants. Des valeurs de toxicité aiguë empiriques ou modélisées erronées pourraient entraîner une modification de la classification du danger, en particulier dans le cas des paramètres basés sur des valeurs de résidus dans les tissus (c.-à-d. mode d’action toxique), dont un grand nombre sont prédites à partir de modèles (Q)SAR. Toutefois, l’impact de ce type d’erreur est atténué par le fait qu’une surestimation de la létalité médiane conduira à une valeur prudente (protectrice) de résidus dans les tissus pour l’analyse des résidus corporels critiques (RCC). Des erreurs de sous-estimation de la toxicité aiguë seront atténuées en recourant à d’autres paramètres de danger, tels que le profilage structurel du mode d’action, la réactivité et/ou l’affinité de liaison à l’estrogène. Les changements ou les erreurs touchant les quantités de produits chimiques pourraient entraîner un classement différent de l’exposition, les classifications de l’exposition et du risque étant très sensibles à la vitesse d’émission et aux quantités utilisées. Les classifications obtenues au moyen de la CRE reflètent donc l’exposition et le risque au Canada, compte tenu des quantités actuellement utilisées, mais pourraient ne pas rendre compte de tendances futures.
Les données et les éléments critiques pris en compte pour développer les profils propres aux substances du groupe des monoterpènes acycliques, monocycliques et bicycliques, ainsi que les résultats de la classification du danger, de l’exposition et du risque sont présentés dans un document d’ECCC (2016 b).
Nous avons résumé dans le tableau 5-1 les classifications du danger et de l’exposition pour les substances de ce groupe.
| Substance | Classification CRE du danger | Classification CRE de l’exposition | Classification CRE du risque |
|---|---|---|---|
| Essence de bois de rose | faible | faible | faible |
| Essence de de palmarosa | faible | faible | faible |
| Essence de de géranium | faible | faible | faible |
| Géranyllinalol | faible | faible | faible |
| Essence de de coriandre | faible | faible | faible |
| Essence de de rose | faible | faible | faible |
| Essence de de lemon-grass | faible | faible | faible |
| Essence de d’orange douce | faible | faible | faible |
| Essence de de mandarine | faible | faible | faible |
| Essence de de tangerine | faible | faible | faible |
| α-Pinène | modéré | faible | faible |
| Essence de térébenthine | faible | faible | faible |
| Térébenthine | faible | faible | faible |
| Essence de de sapin | faible | faible | faible |
| Essence de de pin | modéré | faible | faible |
Sur la base de leurs classifications de faible danger et de faible exposition établies à partir des renseignements pris en compte pour la CRE, l’essence de bois de rose, l’essence de palmarosa, l’essence de géranium, le géranyllinalol, l’essence de coriandre, l’essence de rose, l’essence de lemon-grass, l’essence de mandarine, l’essence de tangerine, l’essence de térébenthine, la térébenthine et l’essence de sapin ont été classés comme présentant un faible potentiel de risque pour l’environnement. Il est donc improbable que ces substances soient préoccupantes pour l’environnement au Canada.
D’après les renseignements pris en compte pour la CRE, l’α-pinène a été classé comme présentant un potentiel de danger modéré en raison de son risque modéré de causer des effets nocifs dans les réseaux trophiques aquatiques dus à son potentiel de bioaccumulation. L’essence de pin a également été classée comme présentant un potentiel de danger modéré en raison de son rapport de toxicité élevé. Toutefois, les effets potentiels et leur manifestation dans l’environnement n’ont pas été étudiés davantage en raison de la très faible exposition à ces substances. Compte tenu des profils d’utilisation actuels, il est peu probable que ces deux substances soient préoccupantes pour l’environnement au Canada.
6. Approche d’évaluation de la santé humaine
Caractérisation des effets sur la santé
Pour la caractérisation des effets sur la santé des terpènes acycliques et monocycliques/bicycliques et des terpénoïdes, la préférence a été donnée aux données sur le danger de l’essence entière. En l’absence de données bonne qualité sur le danger de l’essence entière, une approche basée sur les composants principaux a été suivie. Les composants individuels pour lesquels des données sur le danger étaient disponibles et qui étaient présents en concentrations significatives (c.-à-d. généralement supérieures à 10 %) ont été utilisés pour la caractérisation des effets sur la santé.
En raison de leur potentiel de danger limité, l’essence de bois de rose, l’essence de palmarosa, l’essence de géranium, le géranyllinalol, l’essence d’orange douce et/ou leurs principaux composants ont été évalués en suivant une approche qualitative.
Une approche quantitative a été suivie pour l’essence de rose, l’essence de coriandre, l’essence de lemon-grass, les essences essentielles de mandarine et de tangerine, l’α‑pinène, l’essence de térébenthine et la térébenthine, l’essence de sapin et l’essence de pin, car des effets critiques sur la santé ont été identifiés pour ces substances.
Absorption cutanée
Étant donné la similarité entre les propriétés physico-chimiques des principaux composants des terpènes acycliques et monocycliques/bicycliques et des terpénoïdes, une approche de groupe a été suivie pour laquelle une valeur d’absorption cutanée unique est utilisée pour représenter l’absorption cutanée de tous les terpènes acycliques et monocycliques/bicycliques et terpénoïdes.
Des études in vitro d’absorption cutanée humaine ont été identifiées pour le géraniol, le citronellol et le linalol (Gilpin et al. 2010, ECHA 2018a). Ces études ont indiqué que l’absorption cutanée se situait dans la gamme de 4,3 à 19,5 % (valeur moyenne de l’absorption cutanée plus 1 ou 2 écarts-types en fonction de la variabilité (CSSC 2010), selon que le site est occlus ou non).
Deux études in vivo (Schuster et al. 1986, Jager et al. 1992) menées sur des sujets humains ont été identifiées. Pour ces études, des mesures du plasma en série ont été effectuées après l’application cutanée d’un médicament contre la toux contenant de l’α‑pinène (n = 12) et d’une huile de massage contenant du linalol (n = 1). Les valeurs estimées de l’absorption cutanée étaient de 31 à 42 % et plus élevées que celles observées lors d’études in vitro. Toutefois, tous les terpènes et les terpénoïdes ont des pressions de vapeur modérées à élevées et une partie significative de la dose absorbée devrait l’être par inhalation. Cela est confirmé par l’absorption rapide observée lors des études in vivo, où les concentrations plasmatiques maximales ont été obtenues en 6 à 19 minutes, ce qui correspond davantage à une absorption chimique par inhalation. De plus, une évaluation de la volatilité a été effectuée lors de l’une des études in vitro, et une perte par évaporation de 93 % après 1 heure et de 97 % après 24 heures a été rapportée (ECHA 2018a), ce qui suggère que la majeure partie de la dose appliquée par voie cutanée serait perdue par évaporation et donc susceptible à l’inhalation.
D’après les renseignements disponibles, une estimation limite supérieure de l’absorption cutanée tirée des études in vitro de 20 % et 4 % a été établie pour les sites cutanés occlus et non occlus. Les valeurs retenues représentent la quantité absorbée par voie cutanée pendant une exposition de 24 heures et tiennent aussi compte de la volatilisation d’une partie de la dose appliquée pendant l’étude. Comme les études in vivo chez l’humain suggèrent que l’inhalation peut également être une voie d’exposition, une évaluation des risques par inhalation est également effectuée avec l’hypothèse que la dose appliquée (80 ou 96 % pour les sites occlus et non occlus) peut être vaporisée et potentiellement absorbée par inhalation.
Dans les scénarios avec lotion pour le corps et avec ingrédient non médicinal dans un produit médicamenté topique en vapeur, une absorption cutanée de 20 % pour des conditions de peau occluse a été utilisée, aucune valeur d’absorption cutanée n’étant disponible pour des conditions de peau semi-occluse. Le scénario avec huile de massage a été jugé représentatif d’un scénario sans occlusion pendant le massage et d’un scénario avec semi-occlusion après le massage quand la personne était vêtue. Puisque les résultats de l’étude in vitro d’absorption cutanée suggèrent une perte significative par évaporation (93 %) au cours de la première heure suivant l’application cutanée (ECHA 2018a), l’utilisation de conditions de peau non occluse pour représenter le scénario avec huile de massage (c.-à-d. absorption dermique de 4 %) a été jugée appropriée. Pour tous les autres scénarios (p. ex., hydratant pour le visage, écran solaire et nettoyants), la peau a été présumée sans occlusion et la valeur d’absorption cutanée de 4 % pour les conditions de peau sans occlusion a été retenue.
Extrapolation d’une voie d’exposition à une autre
En l’absence de données sur les effets sur la santé spécifiques à une voie d’exposition, une approche d’extrapolation d’une voie d’exposition à une autre a été suivie pour la caractérisation quantitative du risque. Pour les extrapolations à partir de l’inhalation ou de la voie orale, la biodisponibilité a été présumée équivalente pour ces deux voies. Quand un scénario d’utilisation entraînait une exposition par plus d’une voie (cutanée, inhalation ou orale) et que l’effet critique pour la santé était provoqué par toutes les voies d’exposition, le calcul de l’exposition a été fait en additionnant les expositions systémiques par toutes les voies d’exposition pertinentes.
7. Monoterpènes acycliques
7.1 Essence de bois de rose
7.1.1 Sources et utilisations
L’essence de bois de rose est une substance naturelle obtenue par distillation à la vapeur du bois d’Aniba rosaeodora, une espèce principalement indigène du Brésil, du Pérou et de la Guyane française (Burdock 2010).
Selon les résultats d’une enquête menée en vertu de l’article 71 de la LCPE (Canada 2012), de l’essence de bois de rose n’a été importée ni fabriquée au Canada au-delà du seuil de déclaration de 100 kg (Environnement Canada 2013).
L’essence de bois de rose est utilisée dans un certain nombre de produits cosmétiques, tels que des produits de soin de la peau et des cheveux (lotions/nettoyants), des parfums, des déodorants et des produits de massage. Elle est également utilisée en aromathérapie et figure sur la liste des ingrédients de parfum utilisés dans des biens de consommation publiée par l’International Fragrance Association (IFRA 2017).
D’après les déclarations faites en vertu Règlement sur les cosmétiques de Santé Canada, l’essence de bois de rose, aussi appelée essence d’Aniba rosaeodora, essence d’Aniba rosodora ou essence de rose, est utilisée dans une vaste gamme de produits cosmétiques au Canada (communication personnelle, courriels de la Direction de la sécurité des produits de consommation, 2017; non référencé). De plus, l’essence essentielle de rose et l’essence de bois d’Aniba rosaeodora sont présentes respectivement en tant ingrédient médicinal ou non médicinal dans de nombreux produits de santé naturels (courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, juillet 2015; non référencé).
Il a été rapporté que l’essence de bois de rose est utilisée dans des aliments, y compris des boissons alcoolisées et non alcoolisées, des produits de boulangerie/pâtisserie, des produits laitiers congelés, des gélatines/poudings, des produits à base de viande et des bonbons/gommes à mâcher (Burdock 2010). L’essence de bois de rose figure dans le Substances Added to Food inventory de la FDA des États-Unis et dans le Food Chemicals Codex en tant qu’aromatisant (FDA 2018, FCC 2018). Aucune information définitive n’est disponible sur l’utilisation potentielle de l’essence de bois de rose comme aromatisant alimentaire au Canada. Toutefois, étant donné l’utilisation de cette substance comme aromatisant alimentaire aux États-Unis, elle pourrait être présente dans les aliments vendus au Canada.
D’autres utilisations de l’essence de bois de rose sont énumérées dans le tableau 7.1-1.
| Utilisation | Détails |
|---|---|
| Arômatisant alimentairea | Utilisations rapportées dans des boissons alcoolisées et non alcoolisées, des produits de boulangerie/pâtisserie, des produits laitiers congelés, des gélatines/poudings, des produits à base de viande et des bonbons/gommes à mâcher (Burdock 2010) |
| Base de données sur les ingrédients de produits de santé naturelsb | IM, INM (astringent cosmétique, ingrédient parfumé ou agent de conditionnement de la peau dans des produits topiques, exhausteur de flaveur dans des produits d’hygiène buccale) |
| Base de données sur les produits de santé naturels homologués : présents comme ingrédient médicinal ou non médicinal dans des produits de santé naturels au Canadab | IM, INM |
| Déclarés présents dans des cosmétiques Santé Canada en vertu du Règlement sur les cosmétiques | Produits de soins de la peau et des cheveux, parfums et déodorants |
| Formulant dans des produits antiparasitaires homologués au Canadad | Formulant |
Abréviations : IM = ingrédient médicinal; INM = ingrédient non médicinal.
a Communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, 2015, Burdock 2010 (non référencé)
b Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, 2015 (non référencé)
c Communication personnelle, courriel de la Direction de la sécurité des produits de consommationde Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, 2016 (non référencé)
d Communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada juin 2015 (non référencé)
7.1.2 Potentiel d’effets nocifs pour la santé humaine
Étant donné les faibles quantités (< 100 kg) de la substance rapportées utilisées au Canada (Environnement Canada 2013), l’exposition à l’essence bois de rose due aux milieux de l’environnement ne devrait pas avoir d’impact sur la santé humaine.
Aucune étude pertinente sur les effets sur la santé de l’essence de bois de rose n’a été identifiée. Par conséquent, les renseignements sur les effets sur la santé du linalol, le principal composant de l’essence de bois de rose, qui en constitue de 81 à 99 %, ont été utilisés pour l’évaluation des risques.
Linalol a fait l’objet d’une étude internationale dans un SIDS Initial Assessment Report de l’OCDE (OCDE/SIDS 2002). En termes de toxicité subchronique et de toxicité pour la reproduction chez les mammifères, il a été conclu que le linalol avait une toxicité « modérée à faible ». Cette conclusion était basée principalement sur deux études réalisées sur l’essence de coriandre (contenant 72,9 % de linalol). Lors de la première étude, des effets de faible gravité (non nocifs) (p. ex. changements dans les protéines sériques et l’histologie du foie et des reins) ont été observés chez des rats après exposition pendant 28 jours par gavage à raison de 160, 400 ou 1000 mg/kg pc/jour d’essence de coriandre. Une DSENO de 160 mg/kg pc/jour a été établie pour ces effets (OCDE/SIDS 2002, Burdock et al. 2009, Letizia et al. 2003). Lors de la deuxième étude, des rates ont reçu 250, 500 ou 1000 mg/kg pc/jour par gavage entre le 7e jour avant la cohabitation et le 4e jour après la parturition. Aucun effet sur les paramètres de reproduction n’a été observé. Des effets nocifs sur le développement fœtal ont été considérés réels uniquement en présence de toxicité maternelle à 1000 mg/kg pc/jour, basés sur une diminution de la taille de la portée et une augmentation de la morbidité/mortalité chez les petits. Par conséquent, une DSENO de 250 mg/kg pc/jour a été établie (Letizia et al. 2003). Les effets sur la progéniture ont été observés uniquement à des doses causant également une toxicité maternelle et, par conséquent, il a été jugé que le linalol ne présente pas de danger pour la reproduction ou le développement (Letizia et al. 2003).
Bien que l’OCDE ait étudié le linalol dans son SIDS Initial Assessment Report, ses évaluations des paramètres de toxicité à dose répétée et pour le développement étaient surtout basées sur des études menées avec de l’essence de coriandre plutôt qu’avec du linalol pur. Étant donné l’incertitude associée à l’extrapolation des résultats avec l’essence de coriandre à ceux avec le linalol/essence de bois de rose, ainsi que la disponibilité récente de données de qualité sur le linalol publiées après le rapport SIDS de l’OCDE, le point de départ des études de l’OCDE a été jugé non pertinent pour la présente évaluation.
Une autre étude prise en compte par l’OCDE a évalué l’effet du linalol sur les enzymes de métabolisation de médicaments chez le rat après l’administration d’une dose unique de 500 mg/kg pc/jour pendant 64 jours (OCDE/SIDS 2002). En ce qui concerne la génotoxicité ou la cancérogénicité, aucune préoccupation au sujet du linalol n’a été mentionnée dans le rapport. De plus, malgré des charges à court terme sur le foie dues à la circulation entérohépatique, le linalol devrait être rapidement excrété dans l’urine. Compte tenu de toutes ces considérations, l’OCDE a jugé que la toxicité globale du linalol était faible.
Une recherche bibliographique a été effectuée pour trouver des données sur le linalol plus récentes que celles prises en compte dans l’évaluation SIDS de 2002 de l’OCDE. Lors d’une étude de toxicité pour le développement, des rates ont reçu des doses de 0, 250, 500 ou 1000 mg/kg pc/jour de linalol par gavage du 7e au 17e jour de gestation (JG). Les animaux n’ont présenté aucun effet nocif jusqu’à la dose de 1000 mg/kg pc/jour, à part une diminution non significative du poids corporel maternel et une réduction significative de la consommation alimentaire pendant les JG 7 à 10, effets qui ont disparu lors de l’arrêt du traitement (JG 18 à 21). Les auteurs ont établi une DSENO maternelle de 500 mg/kg pc/jour basée sur ces effets et ont conclu qu’aux doses testées le linalol n’était pas toxique pour le développement des rats (Politano et al. 2008). Bien que cette étude n’ai pas mis en évidence d’inquiétudes quant à la toxicité pour le développement, les auteurs ont indiqué une DSENO maternelle de 500 mg/kg pc/jour pour une diminution non significative du poids corporel maternel et une reduction significative de la consummation alimentaire pendant les JG 7-10 à la dose de 1000 mg/kg pc/jour. Étant donné l’absence d’effets sur le développement jusqu’à la dose de 1000 mg/kg pc/jour et le fait que les effets maternels ont disparu lors de l’arrêt du traitement, les résultats observes lors de cette étude ne sont pas considérés négatifs.
Un rapport d’étude non publié soumis au Research Institute for Fragrance Materials (RIFM) a également été identifié dans la littérature. Les détails de cette étude n’étaient pas disponibles pour pouvoir faire une évaluation indépendante, mais des résumés ont été publiés dans des revues à comité de lecture. Lors de cette étude, des rats ont reçu 250, 1000 ou 4000 mg/kg pc/jour de linalol par voie cutanée pendant 90 jours. Une DSENO de 250 mg/kg pc/jour a été établie par les auteurs, basée sur une diminution du poids corporel (aucune donnée spécifique disponible) chez les rates uniquement à la dose de 1000 mg/kg pc/jour (Letizia et al. 2003). L’Agence de réglementation de la lutte antiparasitaire (ARLA) de Santé Canada avait prudemment fixé la DMENO de cette étude à 250 mg/kg pc/jour en se basant sur un léger érythème (qui s’est dissipé après 3 semaines) et une activité légèrement réduite sporadique chez les rats. Toutefois, étant donné la réversibilité des effets sur la peau et l’activité réduite non significative, nous avons considéré pour la présente évaluation que la DSENO est de 250 mg/kg pc/jour.
Dans les évaluations du linalol et de l’essence de bois de rose effectuées par le Comité mixte FAO/OMS d’experts des additifs alimentaires, il a été conclu que ces substances ne posent pas de problème de sécurité aux niveaux estimés de consommation en tant qu’aromatisant alimentaire (OMS 2004a). L’essence de bois de rose a également été classée par la FDA des États-Unis comme généralement sans danger (generally recognized as safe : GRAS) lorsqu’elle est utilisée comme aromatisant ou adjuvant (FDA 2017a).
Sur la base des renseignements disponibles, aucun effet préoccupant pour la santé n’a été identifié. Par conséquent, aucun point de départ n’a été défini et une approche qualitative de la caractérisation des risques a été adoptée. Il a donc été jugé que l’exposition de la population générale à l’essence de bois de rose présente un faible risque pour la santé humaine.
7.2 Essence de palmarosa
7.2.1 Sources et utilisations
L’essence de palmarosa est une substance naturelle extraite de la plante Cymbopogon martinii (Rajeswara et al. 2009).
Selon les résultats d’une enquête menée en vertu de l’article 71 de la LCPE (Canada 2012), l’essence de palmarosa n’a été ni importée ni produite au Canada en 2011 au‑delà du seuil de déclaration de 100 kg (Environnement Canada 2013). Il a toutefois été rapporté qu’elle y a été importée ou produite en quantités inférieures ou égales au seuil de déclaration.
Selon les avis soumis à Santé Canada en vertu du Règlement sur les cosmétiques, l’essence de palmarosa ou essence de Cymbopogon martinii est utilisée au Canada dans une vaste gamme de produits cosmétiques, tels que des produits de soins de la peau et des cheveux (lotions/nettoyants), des parfums, des déodorants et des produits pour le massage (communication personnelle, courriel de la Direction de la sécurité des produits de consommation de Santé Canada 2017; non référencé). L’essence essentielle de palmarosa est également présente comme ingrédient médicinal ou non médicinal dans de nombreux produits de santé naturels (courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, juillet 2015; non référencé).
L’essence de palmarosa figure également sur la liste de l’International Fragrance Association en tant qu’ingrédient de parfum utilisé dans des biens de consommation (IFRA 2017).
Le site Web de l’American Cleaning Institute (ACI) mentionne l’utilisation potentielle de l’essence de palmarosa dans les produits d’entretien ménager, y compris des nettoyants tout usage et des produits d’entretien pour la vaisselle et le linge (ACI 2017).
Il a été rapporté que l’essence de palmarosa est utilisée comme aromatisant dans des aliments, y compris dans des boissons alcoolisées et non alcoolisées, des produits de boulangerie/pâtisserie, des produits laitiers congelés, des gélatines et poudings et des bonbons (Burdock 2010). L’essence de palmarosa figure en tant qu’agent aromatisant dans le Substances Added to Food inventory de la FDA et dans le Food Chemicals Codex (FDA 2018, FCC 2018). Aucune information définitive n’est disponible sur l’utilisation potentielle de l’essence de palmarosa comme aromatisant alimentaire au Canada. Toutefois, comme cette substance est utilisée comme aromatisant alimentaire aux États-Unis, elle est possiblement présente comme aromatisant dans des aliments vendus au Canada.
D’autres utilisations de l’essence de palmarosa sont présentées dans le tableau 7.2-1.
| Utilisation | Détails |
|---|---|
| Aromatisant alimentairea | Utilisations rapportées dans des boissons alcoolisées et non alcoolisées, des produits de boulangerie/pâtisserie, des produits laitiers congelés, des gélatines/poudings et des bonbons (Burdock 2010) |
| Base de données sur les ingrédients des produits de santé naturelsb | IM, INM (ingrédient de parfum, exhausteur de flaveur) |
| Base de données sur les produits de santé naturels homologués : présent comme ingrédient médicinal ou non médicinal dans des produits de santé naturels au Canadab | IM, INM |
| Déclaré présent dans des cosmétiques, d’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques. | Produits de soins de la peau et des cheveux, parfums, déodorants et produits pour le massage |
| Formulant dans des produits antiparasitaires homologués au Canadad | Formulant |
Abréviations : IM = ingrédient médicinal; INM = ingrédient non médicinal.
a Communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada 2015 (non référencé); Burdock 2010.
b Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada juillet 2015; non référencé.
c Communication personnelle, courriel de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada janvier 2016 (non référencé).
d Communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada juin 2015 (non référencé).
7.2.2 Potentiel d’effets nocifs sur la santé humaine
Étant donné les faibles quantités (< 100 kg) d’essence de palmarosa rapportées utilisées au Canada (Environnement Canada 2013), l’exposition à cette substance due aux milieux de l’environnement ne devrait pas avoir d’impact sur la santé humaine.
Peu d’information sur les effets de l’essence de palmarosa sur la santé est disponible. Lors d’une étude d’exposition par inhalation, des rats mâles ont reçu une dose unique de 13,73 mg/L d’essence de palmarosa pendant 10 minutes toutes les 48 heures pendant 30 jours. Aucun effet nocif n’a été observé (Andrade et al. 2014). Afin d’étayer la caractérisation des risques, l’information sur les effets sur la santé disponible pour les principaux composants de l’essence de palmarosa, à savoir le géraniol (entre 70 et 92 %) et l’acétate de géranyle (entre 4 et 16 %), a été prise en compte.
Une évaluation des effets du géraniol sur la santé humaine menée par le National Industrial Chemicals Notification and Assessment Scheme (NICNAS) en Australie (NICNAS 2012) n’a révélé aucun risque de génotoxicité après plusieurs épreuves in vitro. Compte tenu de ces résultats, le géraniol a été classé par la NICNAS comme étant peu susceptible d’être carcinogène. De plus, sur la base d’un test combiné de criblage de la toxicité à dose répétée et pour la reproduction et le développement réalisé avec des rats ayant reçu par voie cutanée 0, 50, 150 ou 450 mg/kg pc/j, le géraniol n’a pas été classé comme substance toxique pour la reproduction ou le développement. Les effets observés lors de cette étude se limitaient à des réactions inflammatoires locales. D’autres études à dose répétée par voie orale chez le rat ont confirmé l’absence d’effets nocifs à des doses allant jusqu’à 550 mg/kg pc/jour. Le NICNAS (2012) a conclu que les principaux effets critiques du géraniol sur la santé étaient une irritation locale des yeux et de la peau et une sensibilisation cutanée.
En 2009, le danger de l’acétate de géranyle a été évalué par l’EPA en tant que produit chimique parrainé (faisant partie de la catégorie des terpénoïdes-alcools primaires et esters connexes), dans le cadre du High Production Volume (HPV) Challenge Program (EPA 2009). Les études de toxicité de l’acétate de géranyle n’ont pas révélé d’inquiétudes quant à sa génotoxicité. Aucun effet nocif n’a été rapporté jusqu’à la dose maximale d’environ 500 mg/kg pc/jour lors d’une étude à dose répété avec des rats recevant un mélange d’acétate de géranyle et d’acétate de citronellyle dans leur alimentation pendant 17 semaines (Hagan et al. 1967). Des effets nocifs ont été rapportés chez des rats et des souris mâles et femelles ayant reçu des doses de 2000 mg/kg pc/jour et plus d’acétate de géranyle de qualité alimentaire (c.-à-d. contenant 71 % d’acétate de géranyle et 29 % d’acétate de citronellyle) (équivalant à 1400 mg/kg pc/jour d’acétate de géranyle) lors d’une étude à dose répétée par voie orale pendant 13 semaines. Les effets comprenaient la diminution du poids corporel, des lésions à l’estomac et la vacuolisation du foie, des reins et du myocarde, ainsi que l’augmentation du nombre de décès (NTP 1987). Aucune cancérogénicité n'a pas été rapportée lors d’une étude de deux ans par gavage chez des rats et des souris mâles et femelles (1000 ou 2000 mg/kg ps/jour pour les rats et 500 ou 1000 mg/kg pc/jour pour les souris). Cependant, cette étude était limitée à cause d’une survie moindre des animaux de certains groupes (NTP 1987).
Le géraniol et l’acétate de géranyle ont été évalués à l’échelle internationale par le Comité mixte FAO/OMS d’experts des additifs alimentaires et, sur la base des niveaux d’absorption estimés, n’ont pas été jugés inquiétants en tant qu’arômatisants alimentaires (OMS 2004a). L’essence de palmarosa a été classée par la FDA comme étant généralement reconnue sans danger (GRAS) lorsqu’elle est utilisée comme agent aromatisant ou adjuvant (FDA 2017a).
Sur la base des renseignements disponibles, aucun effet préoccupant pour la santé n’a été identifié. Par conséquent, aucun point de départ n’a été défini et une approche qualitative a été suivie pour la caractérisation des risques. Il a donc été jugé que l’exposition de la population générale à l’essence de palmarosa présente un faible risque pour la santé humaine.
7.3 Essence de géranium
7.3.1 Sources et utilisations
L’huile de géranium est une substance naturelle extraite par distillation à la vapeur des tiges, des feuilles et des fleurs de diverses espèces de pélargonium, produits principalement en Afrique et en Chine (Gupta et al. 2001, IBC 2014).
Selon les résultats d’une enquête menée en vertu de l’article 71 de la LCPE (Canada 2012), aucune essence de géranium n’a été ni importée ni produite au Canada en 2011 au-delà du seuil de déclaration de 100 kg (Environnement Canada 2013). Il a toutefois été rapporté qu’elle y a été importée ou produite en quantités inférieures ou égales au seuil de déclaration.
Selon les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, l’essence géranium, l’extrait de géranium rosat, l’essence de fleur de géranium rosat, l’essence de géranium rosat, l’essence de géranium maculatum ou l’extrait à la vapeur de fleurs/feuilles/tiges de Pelargonium graveolens est utilisé dans une vaste gamme de cosmétiques au Canada, tels que des produits de soins de la peau et des cheveux (écrans solaires/lotions/nettoyants), des parfums, des désodorisants et des produits pour le massage (communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada, 2015; non référencé). L’essence essentielle de géranium est également présente comme ingrédient médicinal ou non médicinal dans de nombreux produits de santé naturels et médicaments (courriels de la Direction des produits de santé naturels et sans ordonnance et de la Direction des produits thérapeutiques de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, mars 2017 et juin 2015; non référencé).
L’essence de géranium figure également sur la liste des ingrédients de parfum utilisé dans les biens de consommation de l’International Fragrance Association (IFRA 2017).
L’essence géranium figure au Substances Added to Food inventory de la FDA et dans le Food Chemicals Codex comme aromatisant (FDA 2018, FCC 2018). Aucune information définitive n’est disponible concernant l’utilisation potentielle de l’essence de géranium comme aromatisant alimentaire au Canada. Toutefois, étant donné l’utilisation de cette substance comme aromatisant alimentaire aux États-Unis, elle pourrait être présente dans des aliments vendus au Canada.
D’autres utilisations de l’essence géranium sont présentées dans le tableau 7.3-1.
| Utilisation | Détails |
|---|---|
| Arômisant alimentairea | Figure au Substances Added to Food inventory de la FDA et au Food Chemicals Codex (FDA 2018, FCC 2018) |
| Base de données sur les produits pharmaceutiquesb | INM (crèmes pour la peau, antifongiques oraux) |
| Base de données sur les ingrédients des produits de santé naturelsc | IM, INM (parfum dans des produits topiques, exhausteur de flaveur dans des produits d’hygiène buccale) |
| Base de données sur les produits de santé naturels homologués: présent comme ingrédient médicinal ou non médicinal dans des produits de santé naturels au Canadac | IM, INM |
| Déclaré présent dans des cosmétiques, d’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques. | Produits de soins de la peau et des cheveux, parfums et déodorants |
| Formulant dans des produits antiparasitaires homologués au Canada | Ingrédient actif et formulant |
Abréviations : IM = ingrédient médicinal; INM = ingrédient non médicinal.
a Communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada 2015 (non référencé); FDA 2018; FCC 2018.
b Communication personnelle, courriel de la Direction des produits thérapeutiques de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada juin 2015 (non référencé).
c Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, juillet 2015 (non référencé).
d Communication personnelle, courriel de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, juillet 2015 (non référencé).
e Communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, juin 2015 (non référencé).
7.3.2 Potentiel d’effets nocifs sur la santé humaine
Étant donné les faibles quantités (< 100 kg) de cette substance rapportées utilisées au Canada (Environnement Canada 2013), l’exposition à l’essence de géranium due aux milieux de l’environnement ne devrait pas avoir d’impact sur la santé humaine.
Aucune étude sur la génotoxicité, la cancérogénicité ou les effets sur la reproduction et le développement n’a été trouvée. Par conséquent, pour étayer l’évaluation des risques, l’information disponible sur le danger pour la santé des principaux composants de l’essence de géranium, à savoir le citronellol (37-48 %), le géraniol (20-30 %) et le linalol (5-14 %), a été prise en compte.
Aucune génotoxicité ni aucun effet sur le développement n’a été observé lors d’une épreuve de micronoyaux érythrocytairex mammifères in vivo et d’une étude de toxicité pour le développement chez le rat après administration par voie orale de jusqu’à 750 mg/kg pc/jour de citronellol (ECHA 2016). Lors d’une autre étude, des groupes de 10 rats et de 10 rates ont reçu dans leur alimentation du citronellol et du linalol (à parts égales en poids) à des concentrations calculées pour apporter une dose de 0 ou 100 mg/kg pc par jour (50 mg de chaque substance), pendant 12 semaines. L’absorption moyenne réellle était de 102 mg/kg pc/jour (51 mg de chaque substance) pour les rats et de 112 mg/kg pc par jour (56 mg de chaque substance) pour les rates. Sur la base de l’absence d’effet nocif à la dose maximale de citronellol testée, l’auteur a établi la CSEO à 51 mg/kg pc/jour chez le rat et à 56 mg/kg pc/jour chez la rate (OMS 2004a).
Le géraniol a été évalué par l’Australie (NICNAS 2012) et les seuls effets observés sur la santé étaient une irritation des yeux et de la peau et une sensibilisation cutanée. De plus amples renseignements sur les effets du géraniol sur la santé sont fournis dans la section sur le potentiel d’effets nocifs sur la santé humaine de l’essence de palmarosa (section 7.2.2).
Un troisième composant de l’essence de géranium, à savoir le linalol, a été fait l’objet à l’échelle internationale d’un SIDS Initial Assessment Report (OCDE/SIDS 2002), dans lequel il a été conclu que la toxicité globale du linalol était faible. D’autres études publiées après le SIDS de l’OCDE en 2002 n’ont pas mis en évidence de préoccupations relatives à la toxicité pour le développement ni d’effets suite à une exposition par voie dermique à dose répétée allant jusqu’à 1000 mg/kg pc/jour. De plus amples renseignements sur les effets du linalol sur la santé sont fournis dans la section sur le potentiel d’effets nocifs de l’essence de bois de rose pour la santé humaine (section 7.1.2).
Le citronellol, le géraniol et le linalol ont été évalués à l’échelle internationale par le Comité mixte FAO/OMS d’experts des additifs alimentaires, et il a été conclu qu’ils ne sont pas considérés préoccupants (OMS 2004a). L’essence géranium a également été classée par la FDA comme étant généralement sans danger (GRAS) lorsqu’elle est utilisée comme aromatisant ou adjuvant (FDA 2017a).
Sur la base des renseignements disponibles, aucun effet préoccupant sur la santé n’a été identifié. Par conséquent, aucun point de départ n’a été défini et une approche qualitative a été suivie pour la caractérisation des risques. Il a donc été jugé que l’exposition de la population générale à l’essence de géranium présente un faible risque pour la santé humaine.
7.4 Géranyllinalol
7.4.1 Sources et utilisations
Le géranyllinalol est une substance naturelle présente dans certaines essences essentielles, y compris l’essence concrète de champaca, l’essence absolue de jasmin et l’essence de feuilles d’hamamélis (Good Scents 2017).
Selon les résultats d’une enquête menée en vertu de l’article 71 de la LCPE (Canada 2012), le géranyllinalol n’a été ni importé ni produit au Canada en 2011 au-delà du seuil de déclaration de 100 kg (Environnement Canada 2013). Il a toutefois été rapporté qu’il y a été importé ou produit en quantités inférieures ou égales au seuil de déclaration.
Les résultats d’une enquête menée en vertu de l’article 71 de la LCPE ont rapporté des utilisations du géranyllinalol dans des produits de soins personnels (Environnement Canada, 2013). Il est principalement utilisé comme ingrédient de parfum dans des produits de soins personnelsNote de bas de page 6 (cosmétiques, parfums, shampooings, savons) et dans des nettoyants et détergents ménagers (Lapczynski et al. 2008). Selon les avis soumis à Santé Canada en vertu du Règlement sur les cosmétiques, la présence de géranyllinalol n’a pas été rapportée dans des produits cosmétiques. En Europe, il a été rapporté que le géranyllinalol est utilisé comme parfum dans des cosmétiques (COSING 2017). Il figure également sur la liste des ingrédients de parfum utilisés dans des biens de consommation de l’International Fragrance Association (IFRA 2017).
En Europe, le géranyllinalol est une substance aromatisante dont l’utilisation dans les aliments est autorisée (Food Flavourings Database de l’UE 2016). Aucune information définitive n’est disponible sur l’utilisation potentielle du géranyllinalol comme aromatisant alimentaire au Canada. Toutefois, comme l’utilisation de cette substance comme aromatisant alimentaire est autorisée dans l’Union européenne, elle est possiblement présente dans des aliments vendus au Canada.
D’autres utilisations du géranyllinalol sont présentées au tableau 7.4-1.
| Utilisation | Détails |
|---|---|
| Arômatisant alimentairea | Approuvé pour utilisation en Europe (Food Flavourings Database de l’UE 2016) |
a Communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, mars 2017 (non référencé); Food Flavourings Database de l’UE 2016.
7.4.2 Potentiel d’effets nocifs sur la santé humaine
Étant donné les faibles quantités (< 100 kg) de la substance rapportées utilisées au Canada (Environnement Canada 2013), l’exposition au géranyllinalol due aux milieux de l’environnement ne devrait pas avoir d’impact sur la santé humaine.
L’Autorité européenne de sécurité des aliments (EFSA) a établi que l’utilisation du géranyllinalol comme substance aromatisante ne pose pas de problème d’innocuité aux niveaux d’absorption estimés (EFSA 2015b). Aucune étude pertinente sur la toxicité du géranyllinalol (p. ex., subchronique, pour la reproduction et le développement) n’a été identifiée dans la littérature.
Vingt-neuf volontaires ont reçu du géranyllinalol à 1 % (690 µg/cm2) dans du pétrolatum par voie cutanée sur un site quelconque dans le dos sous occlusion pendant 48 h ou 72 h. Aucune irritation ni sensibilisation n’a été observée (RIFM 1982b, Lapczynski et al. 2008). Aucune étude par inhalation n’a été identifiée.
En l’absence de génotoxicité, de cancérogénicité et de toxicité pour la reproduction ou le développement du géranyllinalol, l’EFSA a utilisé le linalol (qui a une double liaison terminale isolée à proximité immédiate du groupe alcool tertiaire) comme substance de remplacement pour évaluer la toxicité du géranyllinalol (EFSA 2012). Le linalol a fait l’objet d’un examen à l’échelle internationale dans le cadre d’un rapport SIDS de l’OCDE, et sa toxicité globale a été jugée faible (OCDE/SIDS 2002). D’autres études qui n’ont pas fait l’objet d’un examen pour ce rapport n’ont également révélé aucun risque de toxicité pour le développement à dose répétée par voie cutanée jusqu'à 1000 mg/kg pc/jour. De plus amples renseignements sur les effets du linalol sur la santé sont fournis dans la section sur le potentiel d’effets nocifs de l’essence de bois de rose sur la santé humaine (section 7.1.2).
Sur la base des renseignements disponibles, aucun effet préoccupant pour la santé n’a été identifié. Par conséquent, aucun point de départ n’a été défini et une approche qualitative a été suivie pour la caractérisation des risques. Il est donc jugé que l’exposition de la population générale au géranyllinalol présente un faible risque pour la santé humaine.
7.5 Essence de coriandre
7.5.1 Sources et utilisations
L’essence de coriandre est une substance naturelle extraite par distillation à la vapeur de diverses parties de la plante Coriandrum sativum L. (Mandal et Mandal 2015). La composition de l’essence essentielle obtenue à partir des différentes parties de la plante (graines, fruits ou feuilles) peut varier considérablement (Mandal et Mandal 2015).
Selon les résultats d’une enquête menée en vertu de l’article 71 de la LCPE (Canada 2012), de l’essence de coriandre n’a été importée ni produite au‑delà du seuil de déclaration de 100 kg au Canada en 2011 (Environnement Canada 2013).
Selon les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, l’essence de coriandre, l’huile du fruit de Coriandrum sativum (coriandre), est utilisée dans plus de 150 produits cosmétiques au Canada à des concentrations allant de < 0,1 à 100 % (communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada, janvier 2016; non référencé). Parmi les types de produits rapportés, on retrouve des lotions pour le corps, des produits pour le massage, des nettoyants, des parfums, du maquillage, des produits de soins capillaires et des produits pour le bain. La majorité des produits (> 75 %) contiennent de l’essence de coriandre à une concentration maximale de 1 %. En général, les produits contenant des concentrations plus élevées d’essence de coriandre doivent être dilués avant utilisation (communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, juillet 2018; non référencé).
Au Canada, l’essence de coriandre est utilisée dans des produits cosmétiques tels que des produits de soins de la peau et des cheveux (écrans solaires, lotions, nettoyants), des parfums, des déodorants et des produits pour le massage. L’utilisation de cette substance dans des produits de soins personnels importés ainsi que dans des médicaments a été rapportée dans le cadre d’une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). De plus, de l’essence de feuilles de coriandre, de l’essence de graines de coriandre ou de l’essence de fruits de Coriandrum sativum (coriandre) peut être présente dans des produits de santé naturels comme ingrédient médicinal ou non médicinal (communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada novembre 2018; non référencé). L’essence de coriandre figure également sur la liste des ingrédients de parfum utilisés dans les biens de consommation par l’International Fragrance Association (IFRA 2017).
Les feuilles et les graines de la coriandre sont utilisées pour rehausser le goût des aliments (Laribi et al. 2015). Aux États-Unis, l’essence de coriandre est utilisée dans des boissons alcoolisées et non alcoolisées, des condiments, des produits à base de viande, des produits de boulagerie/pâtisserie, des bonbons/gommes à mâcher, des produits laitiers, des gélatines/poudings et des confiseries/glaçages (Burdock 2010). L’essence de coriandre figure dans le Substances Added to Food inventory de la FDA et dans le Food Chemicals Codex en tant qu’aromatisant (FDA 2018, FCC 2018). Aucune information définitive n’est disponible sur l’utilisation potentielle de l’essence de coriandre comme aromatisant alimentaire au Canada. Toutefois, étant donné que cette substance est utilisée comme aromatisant alimentaire aux États-Unis, elle est possiblement présente comme aromatisant dans des aliments vendus au Canada.
D’autres utilisations de l’essence de coriandre sont présentées dans le tableau 7.5-1.
| Utilisation | Détails |
|---|---|
| Arômatisant alimentairea | Utilisations rapportées dans des boissons alcoolisées et non alcoolisées, des condiments, des produits à base de viande, des produit de boulangerie/pâtisserie, des bonbons/gommes à mâcher, des produits laitiers, des gélatines/poudings, des confiseries/glaçages (Burdock 2010) |
| Additifs indirectsa | Composant d’un produit anti-insecticide destiné à être utilisé dans des établissements de traitement des aliments Aucun risque de contact avec les aliments |
| Base de données sur les produits pharmaceutiquesb | INM (écran solaire, dérivés de l’aminoéthanol) |
| Base de données sur les ingrédients des produits de santé naturelsc | INM (exhausteur de flaveur, ingrédient de parfum) |
| Base de données sur les produits de santé naturels homologués : présent comme ingrédient médicinal ou non médicinal dans des produits de santé naturels au Canadac | INM |
| Déclaré présent dans des cosmétiques, d’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques. | Produits de soins de la peau et des cheveux, parfums et déodorants |
| Formulant dans des produits antiparasitaires homologués au Canada | Formulant |
Abréviations : INM = ingrédient non médicinal.
a Communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, janvier 2017 (non référencé); Burdock 2010.
b Communication personnelle, courriel de la Direction des produits thérapeutiques de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, mars 2017 (non référencé).
c Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnancede Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, novembre 2018 (non référencé).
d Communication personnelle, courriel de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, janvier 2016 (non référencé).
e Communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, janvier 2018 (non référencé).
7.5.5 Potentiel d’effets nocifs sur la santé humaine
7.5.2.1 Évaluation de l’exposition
Étant donné les faibles quantités de cette substance rapportées utilisées au Canada (Environnement Canada 2013), l’exposition à cette substance due aux milieux de l’environnement ne devrait pas avoir d’impact sur la santé humaine.
L’exposition alimentaire des Canadiens à l’essence de coriandre utilisée comme aromatisant alimentaire a été estimée en utilisant la consommation individuelle de 4,92 x 10-2 mg/kg pc/jour établie pour la population américaine dans le Handbook of Flavor Ingredients de Fenaroli (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, 2017, non référencé).
Pour évaluer le potentiel d’exposition à l’essence de coriandre due à des cosmétiques appliqués par voie cutanée, des scénarios de référence ont été élaborés en se basant sur une combinaison de fréquences d’utilisation et de concentrations rapportées d’essence de coriandre dans ces produits. Ces scénarios représentaient l’exposition la plus élevée, comparativement à celle due à d’autres cosmétiques et produits de santé naturels à application cutanée rapportés contenir cette substance. L’exposition à l’essence de coriandre due à l’utilisation d’hydratants pour le corps et d’huiles pour le massage a été choisie comme scénario de référence pour les applications cutanées. Ces données sont résumées dans l’annexe A (tableaux A-1 et A-2).
L’exposition quotidienne la plus élevée devrait être due à l’utilisation d’un hydratant pour le corps ayant une concentration maximale d’essence de coriandre rapportée de 3 %. L’exposition systémique par voie cutanée ou par inhalation due un hydratant pour le corps (en assumant une absorption cutanée de 20 %) allait de 7,20 x 10-1 à 1,60 mg/kg pc/jour (adultes et nourrissons) (courriels de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, 2016 et 2018, non référencé). L’exposition systémique par voie cutanée ou inhalation due à une huile pour le massage (calculée à partir de 2 gouttes d’huile [mode d’emploi] ayant une concentration maximale de 30 %) allait de 1,72 x 10-2 à 1,42 x 10-1 mg/kg pc/jour (adultes et nourrissons). De plus, l’essence de coriandre est présente comme ingrédient non médicinal dans quelques produits de DPT et la DPSNN. Ces produits comprennent des crèmes hydratantes pour le visage et des correcteurs contenant un écran solaire, des fonds de teint, des shampooings et des analgésiques musculaires. Toutefois, d’après la quantité de produit par utilisation et les fréquences d’utilisation, l’exposition à l’essence de coriandre due à ces produits est présumée inférieure aux estimations les plus élevées de l’exposition cutanée due à l’utilisation d’hydratants pour le corps à 3 % (courriel de la Direction des produits thérapeutiques de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, janvier 2017, non référencé).
Un produit thérapeutique contre le rhume administré par voie orale contient 0,2 mg d’essence de coriandre comme ingrédient non médicinal (courriel de la Direction des produits thérapeutiques de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, avril 2018, non référencé). L’exposition systémique maximale due à ce produit a été calculée à 5,00 x 10‑2 mg/kg pc/jour pour les enfants de 12 ans et plus, en assumant la présence de 0,2 mg d’essence de coriandre dans chaque dose de 5 mL administrée (avec un maximum autorisé de 80 mL par jour) et un poids corporel moyen de 59,4 kg pour les adolescents (SC 1998). L’exposition systémique des enfants de 6 à 12 ans et les adultes était respectivement de 5,16 x 10-2 et 4,51 x 10-2 mg/kg pc/jour.
Une exposition à l’essence de coriandre par inhalation devrait être due à l’utilisation de certains cosmétiques (p. ex. parfum en vaporisateur) et produits d’aromathérapie. Le jour de l’exposition, la concentration moyenne due à un parfum contenant 10 % d’huile de coriandre a été établie à 0,019 mg/m3 (exposition systémique de 4,30 x 10-3 à 8,90 x 10-3 mg/kg pc/jour, adultes à 5 ans) (l’ensemble des paramètres de calcul se trouvent à l’annexe A, tableau A-3). L’exposition par inhalation à l’essence de coriandre provenant due à un diffuseur d’aromathérapie a été calculée à l’aide d’un document de l’Agence de protection de l’environnement du Danemark sur l’évaluation sanitaire des substances chimiques contenues dans des essences essentielles et des huiles parfumées (Agence de protection de l’environnement du Danemark 2008). Les détails du scénario et des paramètres d’exposition sont fournis à l’annexe D (tableaux D1-D2). Une gamme d’exposition systémique allant de 6,00 x 10-2 à 1,50 x 10-1 mg/kg pc/jour a été calculée pour l’essence de coriandre.
7.5.2.2 Évaluation des effets sur la santé
Évaluation du danger de l’essence de coriandre
L’essence de coriandre a été classée par la FDA comme étant généralement reconnue sans danger (GRAS) lorsqu’elle est utilisée comme aromatisant alimentaire ou adjuvant (FDA 2017a). De telles classifications sont fondées sur l’identité chimique d’une substance (groupe de congénères) et sur la connaissance de leur devenir métabolique.
Peu d’information sur les effets de l’essence de coriandre sur la santé est disponible. Deux rapports d’étude non publiés soumis au Research Institute for Fragrance Materials (RIFM) en 1990 ont été trouvés dans des revues à comité de lecture, ainsi qu’un SIDS de l’OCDE (Belsito et al. 2008, OCDE/SIDS 2002).
Lors d’une étude à dose répétée, des rats et des rates ont reçu par gavage pendant 28 jours une dose 160, 400 ou 1000 mg/kg pc/jour d’essence de coriandre dans une solution à 1 % de méthylcellulose (Belsito et al. 2008, Burdock et Carabin 2009, Letizia et al. 2003, OECD/SIDS 2002). Aucun changement dans la survie, les signes cliniques, le poids corporel et la consommation alimentaire n’a été observé à aucune des doses. Toutefois, une augmentation du taux de protéines et d’albumine dans le sérum du sang et du poids du foie et des reins, ainsi que des signes histopathologiques, tels que des lésions dégénératives dans le cortex rénal et une vacuolisation cytoplasmique hépatocellulaire périportale du foie, ont été rapportées aux doses 400 ou 1 000 mg/kg pc/jour. Une DSENO de 160 mg/kg pc/jour a été établie par les auteurs, basée sur l’augmentation du poids du foie et des reins et des signes histopathologiques.
Lors d’une étude sur la toxicité pour la reproduction et le développement, une dose 250, 500 ou 1000 mg/kg pc/jour d’essence de coriandre a été administrée par voie orale à des rats et des rates, du 7e jour avant la cohabitation au 4e jour après la parturition (Letizia et al. 2003). Les auteurs ont rapporté une augmentation de la salivation, une présence de taches d’urine sur la fourrure, une réduction de la fonction motrice et une augmentation du poids corporel chez les rates ayant reçu 500 ou 1000 mg/kg pc/jour. Une DSENO de 250 mg/kg pc/jour a été établie sur la base des effets maternels observés. Les effets sur le développement comprenaient une diminution de la taille de la portée et une augmentation de la morbidité et de la mortalité des petits à la dose la plus élevée. En l’absence d’effets significatifs de la toxicité chez les mères, l’essence de coriandre ne semble pas affecter ni la performance de reproduction chez celles-ci ni le développement de leur progéniture. Les effets sur la progéniture ont été observés uniquement aux doses provoquant une toxicité maternelle. Par conséquent, les auteurs ont jugé que l’essence de coriandre ne représentait pas un danger pour la reproduction ou le développement.
Une étude de génotoxicité a donné des résultats négatifs (Burdock et Carabin 2009).
Les renseignements sur les effets sur la santé des principaux composants de l’essence de graines de coriandre, le linalol (59 à 88 %), l’acétate de géranyle (0 à 46 %) et l’α‑pinène (0,1 à 11 %) ont été pris en compte pour mieux évaluer les risques.
Évaluation du danger des principaux composants
L’acétate de géranyle et le linalol ont été évalués à l’échelle internationale par le Comité mixte FAO/OMS d’experts des additifs alimentaires (JECFA), et sur la base des niveaux d’absorption estimés, il a été jugé qu’ils ne sont pas préoccupants pour la santé en tant qu’arômes (OMS 2004a).
Un examen de la littérature sur le linalol et l’acétate de géranyle n’a révélé aucune préoccupation quant à leur génotoxicité ou leur cancérogénicité. De plus, à des doses inférieures à 1000 mg/kg pc/jour, aucun effet nocif n’a été rapporté lors d’études à dose répétée ou sur la reproduction et le développement. De plus amples renseignements sur le linalol et l’acétate de géranyle sont fournis dans la section sur le Potentiel d’effets nocifs sur la santé humaine des essences de bois de rose et de palmarosa (sections 7.1.2 et 7.2.2).
En 2010, l’α-pinène a été examiné en tant que produit chimique parrainé (faisant partie du groupe des terpènes bicycliques) dans le cadre du HPV Challenge Program de l’EPA (EPA 2009), examen qui a permis d’établir une CSENO de 50 ppm et une CMENO de 100 ppm. De plus amples renseignements sur les effets de l’α-pinène sur la santé sont fournis dans la section sur l’évaluation des effets sur la santé de l’α-pinène (section 8.3.2).
7.5.2.3 Caractérisation des risques pour la santé humaine
Une DSENO de 160 mg/kg pc/jour a été établie lors d’une étude de 28 jours chez le rat sur la base des effets sur les reins et le foie et des changements biochimiques sériques suite à une exposition par voie orale à 400 mg/kg pc/jour d’essence de coriandre (OCDE/SIDS 2002). Aucune donnée sur les dangers dus à une exposition à l’essence de coriandre par voie cutanée ou par inhalation n’a été identifiée. Par conséquent, la DSENO orale de 160 mg/kg pc/jour a été utilisée pour la caractérisation du risque ainsi que pour l’extrapolation d’une voie d’exposition à une autre. Il a été assumé que l’absorption d’essence de coriandre par inhalation était équivalente à celle par voie orale.
| Scénario d’expositiona | Exposition systémique (mg/kg pc/jour) | MEb |
|---|---|---|
| Arômatisant alimentaire (absorption alimentaire) | 4,90 x 10-2 (6 mois et plus) | 3265 (6 mois et plus) |
| Exposition systémique par la voie cutanée et par inhalation due à l’utilisation de lotions pour le corps (3 %)c | 7,16 x 10-1 - 1,60 (adultes et nourrissons) | 100 - 224 (nourrissons et adultes) |
| Exposition systémique par la voie cutanée et par inhalation due à l’utilisation d’une huile pour le massage (2 gouttes avec une concentration maximale de 30 %)d | 1,72 x 10-2 - 1,42 x 10-1 (adultes et nourrissons) | 1125 - 9 300 (nourrissons et adultes) |
| Exposition systémique due à l’inhalation d’un produit parfumé (10 %) | 4,30 x 10-3 - 8,90 x 10-3 (adultes - enfants de 5 à 11 ans) | 17 977 et 37 209 (enfants de 5 à 11 ans - adultes) |
| Exposition orale due à un médicament contre le rhume (0,2 mg) | 4,50 x 10-2 - 5,40 x 10-2 (6 ans et plus) | 2963 à 3555 (6 ans et plus) |
| Exposition systémique par inhalation due à un produit d’aromathérapiee | 6,00 x 10-2 - 1,50 x 10-1 (tous les groupes d’âge) | 1066 - 2666 (tous les groupes d’âge) |
a Les paramètres et les calculs du scénario d’exposition pour l’essence de coriandre fournis dans l’annexe A.
b Marge d’exposition pour l’essence de coriandre calculée au cours d’une étude par voie orale de 28 jours chez le rat en fonction d’une dose avec effet critique (DSENO = 160 mg/kg pc/jour) établie sur la base de la vacuolisation cytoplasmique hépatocellulaire, de lésions dégénératives dans le cortex rénal et de changements dans la biochimie sérique observés.
c En présumant une absorption cutanée de 20 % (avec occlusion).
d En présumant une absorption cutanée de 4 % (sans occlusion).
e Consulter l’annexe D pour plus de détails sur les scénarios d’aromathérapie.
Pour tous les scénarios, les marges d’exposition (ME) entre le niveau d’effet critique et l’exposition estimée sont considérées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
7.5.2.4 Incertitudes de l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principale source d’incertitude | Impact |
|---|---|
| L’extrapolation des données d’absorption cutanée du linalol et du citronellol à l’essence de coriandre comporte un certain degré d’incertitude. Toutefois, comme le linalol est un constituant majeur de l’essence de coriandre et que le citronellol possède des propriétés physiques et chimiques similaires à l’essence de coriandre, l’absorption dermique de ces composés devrait être similaire. | +/- |
| L’extrapolation d’une voie d’exposition à une autre pour l’essence de coriandre a été effectuée dans le cas des scénarios d’exposition par voie cutanée et par inhalation par comparaison avec le niveau d’effet critique tiré d’études par voie orale. | +/- |
| Il n’existe aucune étude sur la toxicité chronique ni sur la cancérogénicité chez des animaux pour toutes les voies d’exposition. | +/- |
| Il n’existe aucune étude sur l’exposition par voie cutanée ou par inhalation. | +/- |
| Il existe peu d’études avec des animaux portant sur la toxicité de l’essence de coriandre à dose répétée pour les voies d’exposition pertinentes (c.-à-d. voie cutanée, voie orale ou inhalation). Les données sur les dangers des principaux composants, linalol et acétate de géranyle, ont servi à l’évaluation des effets sur la santé, le cas échéant. | +/- |
| La composition de l’essence de coriandre utilisée pour l’étude de 28 jours à dose répétée avec le rat est inconnue. Par conséquent, nous ne savons pas si la composition de l’essence de coriandre utilisée pour cette étude est représentative de l’essence de coriandre à laquelle les Canadiens sont exposés. | +/- |
+ = incertitude pouvant causer une surestimation de l’exposition/risque, - = incertitude pouvant causer une sous-estimation du risque d’exposition, +/- = possibilité non identifiée de causer une surestimation ou une sous-estimation du risque.
7.6 Essence de rose
7.6.1 Sources et utilisations
L’essence de rose est une substance naturelle extraite par distillation à la vapeur des fleurs de diverses espèces de Rosa, principalement R. damascena, R. centifolia et R. gallica (Burdock 2010, FCC 2018).
Selon les résultats d’une enquête menée en vertu de l’article 71 de la LCPE (Canada 2012), l’essence de rose n’a pas été importée ni produite au Canada en 2011 au-delà du seuil de déclaration de 100 kg (Environnement Canada 2013).
L’essence de rose, essence/extrait de fleur de Rosa damascena, ou l’essence de fleur de rose est utilisée dans une vaste gamme de produits cosmétiques au Canada. Selon les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, l’exposition de la population générale à l’essence de rose peut être due à l’utilisation quotidienne de plus de 900 produits cosmétiques ayant des concentrations allant de < 0,1 à 100 % (communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada, juillet 2015, non référencé). Parmi les types de produits rapportés, on retrouve des lotions pour le corps, des produits pour le massage, des nettoyants, des parfums, du maquillage, des produits de soins capillaires et des produits pour le bain. La majorité des produits (> 75 %) contient l’essence de rose à une concentration maximale de 1 %. En général, les produits contenant des concentrations plus élevées doivent être dilués avant utilisation (communication personnelle, courriel de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, juillet 2018,; non référencé).
L’essence de rose figure sur la liste des ingrédients de parfum utilisés dans des biens de consommation de l’International Fragrance Association (IFRA 2017).
L’information du site Web de l’American Cleaning Institute indique l’utilisation potentielle de l’essence de rose comme parfum dans des produits d’entretien ménager, y compris des nettoyants tout usage et des produits pour la lessive ou le linge (ACI 2017).
L’essence de rose a été rapportée utilisée comme aromatisant alimentaire, notamment dans des bonbons/gommes à mâcher, des produits de boulagerie/pâtisserie, des boissons alcoolisées, des produits laitiers et des gélatines/poudings (Burdock, 2010). L’essence de rose figure dans le Substances Added to Food Inventory de la FDA et le Food Chemicals Codex comme aromatisant alimentaire (FDA 2018, FCC 2018). Aucune information définitive n’est disponible sur l’utilisation potentielle de l’essence de rose comme aromatisant alimentaire au Canada. Toutefois, étant donné que cette substance est utilisée comme aromatisant alimentaire aux États-Unis, elle est possible qu’elle soit présente dans des aliments vendus au Canada.
D’autres utilisations de l’essence de rose sont présentées dans le tableau 7.6-1.
| Utilisation | Détails |
|---|---|
| Arômatisant alimentairea | Utilisations rapportées dans des bonbons/gommes à mâcher, des produits de boulangerie/pâtisserie, des boissons alcoolisées, des produits laitiers et des gélatines/poudings (Burdock 2010) |
| Base de données sur les ingrédients des produits de santé naturelsb | IM, INM (parfum dans des produits topiques, agent de conditionnement de la peau) |
| Base de données sur les produits de santé naturels homologués : présents comme ingrédient médicinal ou non médicinal dans des produits de santé naturels au Canadab | IM, INM |
| Déclaré présent dans des cosmétiques, d’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques. | Produits de soins de la peau et des cheveux, parfums et déodorants |
| Formulant dans des produits antiparasitaires homologués au Canadad | Formulant |
Abréviations : IM = ingrédient médicinal; INM = ingrédient non médicinal.
a Communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, 2015 (non référencé).
b Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, avril 2017 (non référencé).
c Communication personnelle, courriel de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, juillet 2015 (non référencé).
d Communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, juin 2015 (non référencé).
7.6.2 Potentiel d’effets nocifs sur la santé humaine
7.6.2.1 Évaluation de l’exposition
Étant donné les faibles quantités (< 100 kg) de cette substance rapportées utilisées au Canada (Environnement Canada 2013), l’exposition à l’essence de rose provenant due aux milieux de l’environnement ne devrait pas avoir d’impact sur la santé humaine.
L’exposition alimentaire des Canadiens à l’essence de rose utilisée comme aromatisant alimentaire a été estimée en utilisant la valeur de 9,18 x 105 mg/kg p.c./jour pour la consommation individuelle établie dans le Handbook of Flavor Ingredients de Fenaroli pour la population américaine (communication personnelle, courriels de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, 2017, non référencé).
Pour évaluer le potentiel d’exposition à l’essence de rose due à des cosmétiques appliqués sur la peau, des scénarios de référence ont été élaborés en se basant sur une combinaison de fréquences d’utilisation et de concentrations rapportées d’essence de rose dans ces produits. Ces scénarios représentaient l’exposition la plus importante, comparativement à celles dues d’autres cosmétiques appliqués sur la peau ou à des produits de santé naturels. L’exposition à l’essence de rose due à l’utilisation d’un hydratant pour le corps, d’un hydratant pour le visage ou d’une huile pour le massage a été considérée comme le scénario de référence pour les produits appliqués par voie cutanée. Ces scénarios d’exposition sont résumés à l’annexe B (tableaux B-1, B-2 et B‑3).
L’exposition quotidienne la plus élevée à l’essence de rose devrait être due à l’utilisation d’un hydratant pour le corps ou pour le visage dont les concentrations rapportées d’essence de rose se situent entre 1 et 3 %. L’exposition systémique par voie cutanée et par inhalation due à un hydratant pour le corps (en assumant une absorption cutanée de 20 % pour la peau occluse) allait de 7,08 x 10-1 à 1,60 mg/kg pc/jour pour tous les groupes d’âge. Étant donné l’incertitude concernant l’utilisation de lotions corporelles à concentration maximale de 3 % chez des nourrissons et des tout-petits, l’exposition systémique par voie cutanée et par inhalation due à une lotion pour le corps leur étant destinée a été calculée à la concentration de 1 % et allait de 4,25 x 10-1 à 5,34 x 10-1 mg/kg pc/jour. L’exposition systémique par voie cutanée et par inhalation due à un hydratant pour le visage ou à une huile pour le massage (en assumant une absorption cutanée de 4 % pour la peau non occluse) allait de 5,66 x 10-2 à 7,18 x 10-2 mg/kg pc/jour pour les jeunes de 12 à 19 ans et pour les adultes et de 4,55 x 10-2 à 3,74 x 10-1 mg/kg pc/jour pour les nourrissons.
Selon sa source, l’essence de rose peut contenir du méthyleugénol à une concentration de 0 à 3,3 % (Tisserand et Young 2014). Le méthyleugénol a été évalué dans le cadre du Plan de gestion des produits chimiques. Il a été conclu qu’il peut pénétrer l’environnement en une quantité ou concentration ou dans des conditions qui constituent ou qui peuvent constituer un danger au Canada pour la vie ou la santé humaine (ECCC, SC 2010). Au Canada et en Europe, le méthyleugénol n’est autorisé qu’en tant que composant naturel d’extraits botaniques. Sa concentration maximale autorisée est de 0,01 % en parfumerie fine, 0,004 % dans les eaux de toilette, 0,002 % dans des crèmes parfumées, 0,000 2 % dans les autres produits sans rinçage et les produits pour hygiène buccale et 0,001 % dans les produits à rincer (SC 2015, SCCS 2000).
Plusieurs produits de santé naturels à usage topique contenant de l’essence de fleur de Rosa damascena ou de l’essence essentielle de rose comme ingrédient non médicinal ont été identifiés et, sont donc susceptibles d’entraîner une exposition par voie cutanée. L’information sur la concentration d’essence de rose n’était pas disponible pour tous ces produits (courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation des risques liés aux substances existantes de Santé Canada, juillet 2015, non référencé). L’exposition à l’essence de rose due à ces produits de santé naturels devrait être comparable ou inférieure aux estimations les plus élevées faites pour l’exposition cutanée à l’essence de rose due à l’utilisation de cosmétiques.
L’exposition à l’essence de rose par inhalation peut être due à l’utilisation de certains produits cosmétiques (p. ex. parfums à vaporiser) ou pour aromathérapie. La concentration moyenne le jour de l’exposition à un parfum contenant 100 % d’essence de rose a été établi à 1,90 x 10-1 mg/m3 (ou exposition systémique allant de 4,30 x 10-2 à 8,90 x 10-2 mg/kg pc/jour) (adultes à enfants de 5 ans). Les paramètres pour le calcul sont donnés à l’annexe B, tableau B-4. L’exposition à l’essence de rose par inhalation due à un diffuseur d’aromathérapie a été calculée à l’aide d’un document de l’Agence de protection de l’environnement du Danemark sur l’évaluation sanitaire des substances chimiques présentes dans des essences essentielles et des huiles parfumées (Agence de protection de l’environnement du Danemark 2008). Les détails du scénario et les paramètres d’exposition sont présentés à l’annexe D (tableaux D1 à D2). Des expositions systémiques allant de 6,00 x 10-2 à 1,50 x 10-1 mg/kg pc/jour ont été calculées.
7.6.2.2 Évaluation des effets sur la santé
L’essence de rose a été classée par la FDA comme étant généralement reconnue sans danger (GRAS) lorsqu’elle est utilisée comme aromatisant alimentaire ou adjuvant (FDA 2017a).
Aucune étude sur la génotoxicité, la cancérogénicité ou la toxicité chronique de l’essence de rose n’a été trouvée dans la littérature.
L’essence de rose a été évaluée dans le cadre d’une série d’études sur la toxicité à court terme.
Lors d’une étude à dose répétée, des rats mâles et femelles (10 par dose) ont reçu par gavage 85 mg/kg (0,1 mL/kg) ou 425 mg/kg (0,5 mL/kg) d’essence de rose diluée dans 1 mL/kg d’éthanol cinq fois par semaine pendant 30 jours (Kirov et al. 1988a). L’exposition à la dose la plus élevée (425 mg/kg) a provoqué une anémie prononcée (réduction de l’hémoglobine et de l’hématocrite de 30 à 35 %), une augmentation du poids de la rate, ainsi qu’une diminution du poids corporel et du poids relatif du foie, des reins et des testicules.
Lors d’une étude de suivi, les auteurs ont examiné l’effet de l’essence de rose sur la dystrophie lipidique du foie (Kirov et al. 1988b). Des rats mâles Wistar (20 par groupe) ont reçu par voie orale 1 mL/kg d’éthanol à 40 % seul ou avec 0,01 mL/kg (8,5 mg/kg) ou 0,05 mL/kg (42,5 mg/kg) d’essence de rose, pendant 6 mois. Cette étude a montré un effet hépato-protecteur de l’essence de rose qui s’est manifesté par une diminution de la dystrophie et de l’infiltration lipidique et une baisse des niveaux de glycogène (Kirov et al. 1988b).
Lors d’une étude sur la toxicité pour le développement (Kirov et al. 1988d), des rates gravides (20) ont reçu par voie orale 0,1 mL/kg (85 mg/kg) d’essence de rose diluée dans de l’huile de tournesol entre les JG1 et JG21. D’autres rates ont également reçu par voie orale une dose unique de 0,35 mL/kg (305 mg/kg) ou de 1,75 mL/kg (1488 mg/kg) d’essence de rose non diluée (correspondant à 1/2 et 1/10 de la DL50) les JG 5, 7, 9, 11 ou 13. Aucune perte avant ou après l’implantation ni aucune malformation fœtale n’a été observée. Toutefois, une incidence accrue d’ossification retardée du crâne (fontanelles élargies et sutures crâniennes) a été observée chez les animaux ayant reçu 305 ou 1488 mg/kg d’essence de rose les jours 7 et 9. Aucun autre détail sur l’étendue et l’occurrence de l’ossification retardée du crâne n’était disponible. Il n’a pas été possible d’établir une relation dose-effet, car aucune analyse statistique n’a été présentée.
Pour mieux étayer l’évaluation des risques, les renseignements disponibles sur les dangers des principaux composants de l’essence de rose, à savoir le citronellol (15 à 48 %) et le géraniol (6 à 32 %), ont été pris en compte. D’après ces renseignements, aucun effet préoccupant pour la santé n’a été identifié pour l’un ou l’autre composant. De plus amples renseignements sur les effets sur la santé du géraniol et du citronellol sont fournis dans les sections sur le potentiel d’effets nocifs sur la santé humaine des essences de palmarosa et de géranium (sections 7.2.2 et 7.3.2).
7.6.2.3 Caractérisation des risques pour la santé humaine
Une DSENO de 85 mg/kg a été établie pour l’essence, tirée d’une étude à dose répétée de 30 jours chez le rat. Le niveau d’effet est basé sur une diminution significative et liée à la dose des valeurs d’hématocrite et d’hémoglobine ainsi que sur une augmentation significative concomitante du poids de la rate (Kirov et al. 1988a). Il n’existe aucune donnée sur le danger de l’exposition à l’essence de rose par voie cutanée ou par inhalation. Pour la présente évaluation, une DSENO orale de 85 mg/kg pc/jour a été utilisée pour la caractérisation des risques et l’extrapolation d’une voie d’exposition à une autre. Il a été assumé qu’après la prise en compte de la quantité absorbée par voie cutanée, l’absorption de l’essence de rose par inhalation était équivalente celle par voie orale.
| Scénario d’expositiona | Exposition systémique (mg/kg pc/jour) | MEb |
|---|---|---|
| Arômatisant alimentaire (absorption alimentaire) | 9,18 x 10-5 (6 mois et plus) | 925 926 (6 mois et plus) |
| Exposition systémique par voie cutanée et par inhalation due à l’utilisation d’une lotion pour le corps (3 %)c | 1,27 - 1,60 (tout-petits - nourrissons) 7,03 x 10-1 - 8,46 x 10-1 (tous les autres groupes d’âge) | 53 et 67 (nourrissons - tout-petits) 100 à 121 (tous les autres groupes d’âge) |
| Exposition systémique par voie cutanée et par inhalation due à l’utilisation d’une lotion pour le corps (1 %)c | 4,25 x 10-1 - 5,34 x 10-1 (tout-petits - nourrissons) | 159 - 200 (nourrissons - tout-petits) |
| Exposition systémique par voie cutanée et par inhalation due à l’utilisation d’une huile pour massage (5 gouttes à une concentration maximale de 30 %)d | 4,55 x 10-2 - 3,74 x 10-1 (adultes - nourrissons) | 227 - 1870 (nourrissons - adultes) |
| Exposition systémique par voie cutanée et par inhalation due à l’utilisation d’un hydratant pour le visage (3 %) d | 5,66 x 10-2 - 7,18 x 10-2 (adultes - 12 à 19 ans) | 1184 - 1501 (12 à 19 ans - adultes) |
| Exposition systémique par inhalation due à un produit parfumé (100 %) | 4,30 x 10-2 - 8,80 x 10-2 (adultes - 5 à 11 ans) | 966 - 1977 (5 à 11 ans - adultes) |
| Exposition systémique par inhalation due à un produit pour aromathérapiee (1,45 mg/m3) | 6,00 x 10-2 - 1,50 x 10-1 (tous les groupes d’âge) | 567 - 1417 (tous les groupes d’âge) |
a Les paramètres et les calculs du scénario d’exposition pour l’essence de rose sont décrits à l’annexe B.
b Marge d’exposition calculée en fonction d’une dose avec effet critique (DSENO = 85 mg/kg p.c./jour) pour l’essence de rose établie lors d’une étude par voie orale de 30 jours chez le rat sur la base de la diminution des taux d’hématocrite et l’augmentation du poids de la rate.
c En présumant une absorption cutanée de 20 % (avec occlusion).
d En présumant une absorption cutanée de 4 % (sans occlusion).
e Voir l’annexe D pour plus de détails sur les scénarios d’aromathérapie.
La ME entre le niveau d’effet critique et l’exposition quotidienne estimée à l’essence de rose due à un hydratant pour le corps à 3 % pour nourrissons et tout-petits allait de 53 à 67, jugée potentiellement inadéquate pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition. Il est à noter, cependant, qu’il n’est pas certain que des lotions pour le corps à la concentration maximale de 3 % seraient utilisées quotidiennement chez les nourrissons et les tout-petits. Par conséquent, la ME pour la concentration inférieure de 1 % a également été prise en compte pour les nourrissons et les tout-petits. Cette valeur conduit à une ME allant de 159 à 200, jugée adéquate pour tenir compte des incertitudes de la base de données.
Pour tous les autres scénarios d’exposition, la ME entre le niveau d’effet critique et l’exposition estimée allait de 100 à 925 926, jugée adéquate pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
7.6.2.4 Incertitudes de l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principale source d’incertitude | Impact |
|---|---|
| L’extrapolation des données d’absorption cutanée du linalol et du citronellol à l’essence de rose comporte un certain degré d’incertitude. Toutefois, comme tous les monoterpènes acycliques, monocycliques et bicycliques et leurs constituants possèdent des propriétés physico-chimiques similaires, l’absorption dermique de ces composés devrait être similaire. | +/- |
| Il existe un certain degré d’incertitude quant à l’utilisation quotidienne d’une lotion pour le corps à la concentration maximale de 3 % d’essence de rose chez toutes les sous-populations, comme les nourrissons et les tout-petits. | + |
| Une extrapolation d’une voie d’exposition à une autre voie a été effectuée pour les scénarios d’exposition par inhalation et par voie cutanée à l’essence de rose en comparant l’exposition par ces voies au niveau avec effet établi lors d’études par voie orale. | +/- |
| Il n’existe aucune étude sur la toxicité chronique, la génotoxicité, la cancérogénicité chez des animaux, pour toutes les voies d’exposition. | - |
| La composition de l’essence de rose utilisée pour l’étude de 30 jours à dose répétée chez le rat est inconnue. Par conséquent, nous ne savons pas si la composition de l’essence de rose utilisée pour cette étude est représentative de l’essence de rose à laquelle les Canadiens sont exposés. | +/- |
+ = incertitude pouvant causer une surestimation de l’exposition/risque, - = incertitude pouvant causer une sous‑estimation du risque d’exposition, +/- = possibilité non identifiée de causer une surestimation ou une sous‑estimation du risque.
7.7 Essence de lemon-grass
7.7.1 Sources et utilisations
L’essence de lemon-grass est une substance naturelle extraite par distillation à la vapeur de Cymbopogon citratus ou de Cymbopogon flexuosus, espèces de graminées indigène en Inde, au Sri Lanka, en Birmanie et en Thaïlande (Burdock 2010, Chowdhury et al. 2010, Tisserand and Young 2014). Selon son origine, cette plante est communément appelée le lemon-grass de l’Inde occidentale (Cymbopogon citratus) ou de l’Inde orientale (Cymbopogon flexuosus) (Tisserand et Young 2014).
Selon les résultats d’une enquête menée en vertu de l’article 71 de la LCPE (Canada 2012), en 2011, l’essence de lemon-grass n’a été importée ni produite au Canada au‑delà du seuil de déclaration de 100 kg (Environnement Canada 2013).
D’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, l’essence de lemon-grass (essence de Cymbopogon schoenanthus, essence de Cymbopogon flexuosus, essence de feuilles de Cymbopogon citratus) est utilisée dans plus de 700 produits cosmétiques au Canada, ayant des concentrations allant de < 0,1 à 100 % (communication personnelle, courriels de la Direction de la sécurité des produits de consommation, 2017, non référencé). Parmi les types de produits rapportés, on retrouve des lotions pour le corps, des produits pour le massage, des nettoyants, des parfums, du maquillage, des produits pour soins capillaires et des produits pour le bain. La majorité des produits (> 65 %) en contient à une concentration maximale de 1 %. En général, les produits contenant de l’essence de lemon-grass à des concentrations plus élevées doivent être dilués avant l’utilisation (communication personnelle, courriel de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, juillet 2018, non référencé).
L’essence de lemon-grass figure également sur la liste des ingrédients de parfum utilisé dans des biens de consommation de l’International Fragrance Association (IFRA 2017).
L’information du site Web de l’American Cleaning Institute indique l’utilisation potentielle de l’essence de lemon-grass comme parfum dans les produits d’entretien ménager, y compris des nettoyants tout usage et des produits pour la lessive et le linge (ACI 2017).
Le lemon-grass est utilisé depuis longtemps dans la cuisine asiatique comme herbe. Il est couramment utilisé dans des soupes, des caris et des tisanes (Olorunnisola et al. 2014). Il a également été rapporté utilisé dans dans des aliments, y compris des boissons alcoolisées et non alcoolisées, des produits de boulangerie/pâtisserie, des graisses/huiles, des produits laitiers congelés, des gélatines/poudings, des produits à base de viande et des bonbons/gommes à mâcher (Burdock 2010). L’essence de lemon-grass figure dans le Substances Added to Food inventory de la FDA et le Food Chemicals Codex comme aromatisant (FDA 2018, FCC 2018). Aucune information définitive n’est disponible sur l’utilisation potentielle de l’essence de lemon-grass comme aromatisant alimentaire au Canada. Toutefois, étant donné l’utilisation de cette substance comme aromatisant alimentaire aux États-Unis, elle pourrait être présente dans des aliments vendus au Canada.
D’autres utilisations de l’essence de lemon-grass sont présentées dans le tableau 7.7-1.
| Utilisation | Détails |
|---|---|
| Arômatisant alimentairesa | Utilisations rapportées dans des boissons alcoolisées et non alcoolisées, des produits de boulangerie/pâtisserie, des graisses/huiles, des produits laitiers congelés, des gélatines/poudings, des produits à base de viande et des bonbons/gommes à mâcher (Burdock 2010) |
| Additifs indirectsa | Composant dans un désinfectant pour surfaces entant en contact avec les aliments |
| Base de données sur les produits pharmaceutiquesb | INM (désinfectant) |
| Base de données sur les ingrédients des produits de santé naturelsc | IM, INM (Essence de Cymbopogon flexuosus comme agent masquant, essence de Cymbopogon schoenanthus comme parfum, essence de lemon-grass d’Inde orientale comme exhausteur de flaveur) |
| Base de données sur les produits de santé naturels homologués : présents en tant qu’ingrédient médicinal ou non médicinal dans des produits de santé naturels au Canadac | IM, INM |
| Déclaré présent dans des cosmétiques, d’après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques. | Produits de soins de la peau et des cheveux, parfums et déodorants |
| Formulant dans des produits antiparasitaires homologués au Canada | Ingrédient actif et formulant |
Abréviations : IM = ingrédient médicinal; INM = ingrédient non médicinal.
a Communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, janvier 2017 (non référencé); Burdock 2010.
b Communication personnelle, courriel de la Direction des produits thérapeutiques de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, mars 2017 (non référencé).
c Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, février 2018 (non référencé).
d Communication personnelle, courriel de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, janvier 2016 (non référencé).
e Communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, janvier 2018 (non référencé).
7.7.2 Potentiel d’effets nocifs sur la santé humaine
7.7.2.1 Évaluation de l’exposition
Étant donné les faibles quantités (< 100 kg) d’essence de lemon-grass rapportées utilisées au Canada (Environnement Canada 2013), l’exposition à cette substance due aux milieux de l’environnement ne devrait pas avoir d’impact sur la santé humaine.
D’après l’évaluation de la sécurité des complexes aromatisants naturels réalisée par le JECFA lors de sa 61e réunion (OMS 2004b), l’absorption par personne de la population des États-Unis d’essence de lemon-grass due à son utilisation comme aromatisant alimentaire a été estimée à 19 μg/personne par jour (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau de l’évaluation des risques des substances existantes de Santé Canada, juillet 2017, non référencé). Ceci conduit à estimer une absorption de 2,68 x 10-4 mg/kg pc/jour (basée sur un poids corporel de 70,9 kg pour un adulte).
L’essence de lemon-grass a également été identifiée comme additif alimentaire indirect potentiel en raison de son utilisation comme composant dans des désinfectants pour surfaces entrant en contact avec les aliments (qui ne sont pas rincées à l’eau potable après utilisation). Toutefois, le risque d’exposition due à cette source est négligeable puisque toute surface en contact avec les aliments doit être lavée et complètement séchée après utilisation du produit (communication personnelle, courriels de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, 2017, non référencé).
Pour évaluer le potentiel d’exposition à l’essence de lemon-grass due à des cosmétiques, des scénarios de référence ont été élaborés en se basant sur une combinaison de fréquences d’utilisation et de concentrations rapportées d’essence de lemon-grass dans ces produits. Ces scénarios représentent l’exposition cutanée la plus importante, comparativement à celles dues à l’application cutanée d’autres cosmétiques et produits de santé naturels contenant cette substance. Les expositions à l’essence de lemon-grass dues à l’utilisation d’un hydratant pour le corps et d’une huile pour massage ont été considérées être les scénarios de référence pour estimer l’exposition quotidienne par voie cutanée. Ces données sont résumées dans l’annexe C (tableaux C-1, C-2 et C-3).
L’exposition quotidienne par voie dermique la plus importante à l’essence de lemon‑grass devrait être due à l’utilisation d’un hydratant pour le corps ayant une concentration maximale rapportée de 5 % ou d’une huile de massage. L’exposition par inhalation due à un hydratant pour le corps a été estimée au moyen de la concentration moyenne le jour de l’exposition (de 1,60 x 10-2 à 5,90 x 10-2 mg/m3) et des expositions systémiques par voie cutanée par inhalation (1,19 à 2,67 mg/kg pc/jour chez les adultes et les nourrissons). Dans le cas de l’huile de massage, la concentration moyenne inhalée de 8,00 x 10-2 à 8,20 x 10-2 mg/m3 et les expositions systémiques par voie cutanée et par inhalation allaient de 1,20 x 10-1 à 9,82 x 10-1 mg/kg pc/jour (adultes et nourrissons).
L’exposition au lemon-grass par inhalation peut être due à l’utilisation de certains cosmétiques (p. ex., parfum en vaporisateur) et produits d’aromathérapie. La concentration moyenne le jour de l’exposition due à un parfum contenant 30 % d’essence de lemon-grass a été établie à 5,80 x 10-2 mg/m3 (adultes à 5 ans) (paramètres de calcul complets à l’annexe C, tableau C-4). L’exposition à l’essence de lemon-grass par inhalatio due à un diffuseur d’aromathérapie a été calculée en utilisant un document de l’Agence de protection de l’environnement du Danemark sur l’évaluation sanitaire des substances chimiques contenues dans des essences essentielles et des huiles parfumées (Agence de protection de l’environnement du Danemark 2008). Ce scénario a été élaboré à partir de la description des profils d’utilisation, et une concentration moyenne dans l’air de 1,45 mg/m3 a été mesurée au cours des 4 heures d’exposition. Les détails du scénario et les paramètres d’exposition sont présentés à l’annexe D (tableaux D1 à D3).
Il a été rapporté que plusieurs produits désinfectants (lingettes/vaporisateurs) contiennent de l’essence de lemon-grass comme ingrédient non médicinal (concentration allant de 0,05 à 1 %) (communication personnelle, courriel de la Direction des produits thérapeutiques de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, janvier 2017, non référencé). L’information tirée du site Web de l’American Cleaning Institute indique l’utilisation potentielle de l’essence de lemon-grass comme parfum dans des produits d’entretien ménager, y compris des nettoyants tout usage et des produits pour la lessive et le linge (ACI 2018). Afin d’évaluer l’exposition potentielle à l’essence de lemon-grass due à son utilisation dans des produits d’entretien ménager, son utilisation dans un nettoyant tout usage pour plancher a été évaluée. Il a été assumé que la concentration maximale d’essence de lemon-grass serait de 1 %, puisqu’elle est typiquement utilisée comme parfum dans les produits de nettoyage et qu’il s’agit de la limite maximale de concentration suggérée pour des produits de nettoyage ménagers (Fleurarome Limitee 2016). L’exposition systémique a été estimée à 2,52 x 10-3 mg/kg pc/jour pour les adultes et à 5,66 x 10-3 mg/kg pc/jour pour les tout-petits. Ces calculs ont été réalisés en utilisant les paramètres d’exposition décrits à l’annexe D (tableau D4). Il était prévu que l’utilisation de l’essence de lemon-grass dans un nettoyant pour plancher entraînerait l’exposition potentielle la plus élevée en raison de son utilisation dans les produits de nettoyage. Les détails du scénario et les paramètres d’exposition sont présentés à l’annexe C (tableau C4-C5).
De l’essence de lemon-grass figurait comme ingrédient non médicinal dans un supplément nutritionnel administré par voie orale en contenant 0,12 mg/comprimé (communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques existant de Santé Canada, février 2018, non référencé). L’exposition systémique la plus élevée due à ce produit a été calculée à 3,39 x 10-3 mg/kg pc/jour (utilisé par des adultes seulement).
7.7.2.2 Évaluation des effets sur la santé
Évaluation du danger de l’essence de lemon-grass
Selon la conclusion de l’évaluation réalisée par le Comité mixte FAO/OMS d’experts des additifs alimentaires, l’essence de lemon-grass ne pose pas de problème d’innocuité en tant qu’aromatisant alimentaire aux niveaux d’absorption estimés (OMS 2004b). L’essence de lemon-grass a également été classée par la FDA comme étant généralement reconnue sans danger (GRAS) lorsqu’elle est utilisée comme aromatisant alimentaire ou adjuvant (FDA 2017a).
Peu d’information toxicologique est disponible sur l’essence de lemon-grass.
Un certain nombre d’études par voie orale à court terme avec de l’extrait de lemon‑grass, par opposition à de l’essence de lemon-grass, ont été trouvées dans la littérature. Les extraits de lemon-grass devraient contenir les mêmes composants principaux que l’essence (Mu'azu et al. 2016, Schaneberg et Khan 2002). Par conséquent, les données de ces études ont été jugées pertinentes pour la caractérisation des effets sur la santé de l’essence de lemon-grass.
Les effets de l’administration par voie orale d’extraits de lemon-grass ont été étudiés chez le rat et la souris lors d’études à dose répétée. Des rats Wistar ont reçu 0, 250, 500 ou 1000 mg/kg pc/jour d’extrait de lemon-grass dans de l’eau ou de l’éthanol par gavage pendant 28 jours (Tarkang et al. 2012). Lors d’une étude de 90 jours, les mêmes concentrations de l’extrait aqueux ont été administrées aux rats par voie orale. Aucun changement significatif du poids corporel ni du poids des organes n’a été observé à la suite de l’exposition à l’un ou l’autre de ces extraits. Le groupe ayant reçu la dose de 1000 mg/kg pc/jour d’extrait dans l’eau pendant 90 jours et d’extrait dans l’éthanol pendant 28 jours a présenté des niveaux accrus d’alanine aminotransférase (ALT) et de phosphatase alcaline (ALP), indiquant des dommages au foie. De plus, l’examen histopathologique a révélé une congestion vasculaire et des lésions dans le foie. En plus des effets sur le foie, les examens ont également révélé une légère déformation tubulaire dans les reins des rats ayant reçu la dose de 1000 mg/kg pc/jour d’extrait dans l’éthanol pendant 28 jours.
Lors d’une étude semblable, l’administration par voie orale de 1, 10 ou 100 mg/kg pc/jour d’essence de lemon-grass par gavage à des souris mâles (7 à 8 animaux par groupe) pendant 21 jours n’a entraîné aucun changement significatif du poids du corps ou des organes, de la pathologie globale, de l’histologie, des analyses urinaires ni de la biochimie clinique (Costa et al. 2011). Des rats ont reçu par voie orale des concentrations plus élevées d’essence de lemon-grass (jusqu’à 3 000 mg/kg pc/jour) pendant 14 jours et ont présenté à 1 500 mg/kg pc/jour ou plus des effets nocifs, notamment une atrophie de la muqueuse gastrique, une infiltration de cellules inflammatoires et une nécrose hépatocytaire (Fandohan et al. 2008). Certains changements dans des paramètres hématologiques et des enzymes indicatifs de la fonction rénale ont été observés au cours d’une étude de 30 jours avec des rats Wistar ayant reçu de 0 à 5000 mg/kg pc/jour de lemon-grass (extrait dans l’éthanol) par voie orale. Toutefois, aucune relation dose-réponse n’a été identifiée et il a été jugé que les paramètres sont dans les limites normales de biologie et de laboratoire (Ademuyiwa et al. 2016).
Des lymphocytes humains exposés à de l’essence de lemon-grass (in vitro) ont subi des dommages à l’ADN lors d’un test des comètes ou d’un test de diffusion d’ADN à 100 µg/mL ou plus (Sinha et al. 2014). Inversement, les résultats du test de comètes pour les dommages à l’ADN étaient négatifs suite à l’exposition in vivo de souris mâles à 100 mg/kg pc/jour d’essence de lemon-grass pendant 21 jours (Costa et al. 2011).
Aucune étude sur la toxicité chronique, pour la reproduction/développement ou sur la cancérogénicité de l’essence de lemon-grass n’a été identifiée dans la littérature. Pour étayer l’évaluation des risques, l’information disponible sur le danger des principaux composants de l’essence de lemon-grass, à savoir le citral total (67 à 92 %), le β‑myrcène (6 à 27 %), l’acétate de géranyle (12 %) et le citronellol (0 %-24 %) ont été pris en compte.
Évaluation du danger des principaux composants
Citral
Le Comité mixte FAO/OMS d’experts des additifs alimentaires a évalué le citral et conclu qu’aux niveaux d’absorption estimés, il ne pose pas de problème d’innocuité en tant qu’aromatisant alimentaire (OMS 2004b).
Le citral n’a pas été rapporté comme toxique pour la reproduction ou le développement (MHW, Japon 2002). Des rats, mâles et femelles, ont reçu 40, 200 ou 1000 mg/kg pc/jour de citral par gavage pendant environ 46 jours avant et pendant l’accouplement et la gestation. La dose la plus élevée (1 000 mg/kg p.c./jour) a entraîné une baisse du poids corporel et de la consommation alimentaire, ainsi que des effets histopathologiques dans le préestomac des femelles, et une baisse du poids corporel des petits. Sur la base de ces résultats, une DSENO pour la toxicité maternelle a été établie à 200 mg/kg pc/jour.
Lors d’une étude sur la toxicité pour le développement prénatal, des doses de 20, 60 ou 200 mg/kg pc/jour de citral ont été administrées à des lapins par gavage (25/dose) entre les JG6 et JG28. Les mères du groupe ayant reçu la dose de 200 mg/kg pc/jour ont présenté une diminution du poids corporel et du gain de poids, une réduction de la consommation alimentaire, de la mortalité (2 lapins) et de l’avortement (1 lapin). De plus, une portée de petits d’une mère du groupe ayant reçu la dose de 200 mg/kg pc/jour a développé des malformations externes dues à une toxicité maternelle sévère (ECHA 2016). Cependant, il est bon de noter que les lapins blancs de Nouvelle-Zélande sont particulièrement difficiles à gaver et des signes d’irritation de l’estomac (rougeur sévère de la muqueuse de l’estomac) ont été observés chez les lapins morts du groupe ayant reçu la dose élevée. En se basant sur ces résultats, une DSENO pour la toxicité maternelle a été établie à 60 mg/kg pc/jour. Les questions liées au gavage pourraient également être responsables de la différence entre la DSENO de l’étude précédente et celle de celle-ci (c.-à-d. 200 mg/kg pc/jour contre 60 mg/kg pc/jour).
Lors d’une étude par inhalation, des rates gravides ont été exposées (corps entier) à 10, 34 ou 68 ppm de citral pendant 6 heures par jour du JG6 au JG15 (Gaworski et al. 1992). Les doses de 10 et 34 ppm ont été administrées sous forme de vapeur, tandis que la dose de 68 ppm a été administrée par une combinaison d’aérosol et de vapeur. Les effets observés à 68 ppm chez les mères comprenaient la mortalité (1 femelle au JG10), l’avortement (1 femelle au JG17), la baisse du poids corporel, l’opacité oculaire, les difficultés respiratoires, l’écoulement nasal et la salivation. Ces effets étaient associés à une irritation grave des voies respiratoires. Les changements dans le poids corporel et les signes de toxicité se sont inversés à l’arrêt de l’exposition. À 68 ppm, en présence d’une toxicité maternelle, le fœtus présentait une diminution non significative du poids corporel et de la taille des os hypoplasiques. Aucun effet n’a été noté sur les mères ou la progéniture recevant les deux doses les plus faibles. La CSEO ajustée a donc été établie à 53,75 mg/m3 (34 ppm ou 215 mg/m3 ajustée à 6 heures d’exposition par jour) sur la base de la toxicité maternelle à 68 ppm (CMENOaj = 105,75 mg/m3, sur la base d’une DMENO de 423 mg/m3 ajustée pour une exposition quotidienne de 6 heures). Aucune toxicité pour le développement n’a été observée en l’absence de toxicité maternelle (Gaworski et al. 1992).
Citral a déjà fait l’objet d’un examen et d’un rapport SIDS par l’OCDE (OCDE/SIDS 2002). Dans la conclusion de ce rapport, il a été jugé que, d’après le poids de la preuve, le citral n’est pas considéré poser un danger génotoxique. De plus, plusieurs études de courte durée à dose répétée avec des rongeurs n’ont révélé aucun effet nocif à des niveaux expositions inférieurs à 1000 mg/kg pc/jour.
Lors d’une étude de 2 ans par voie alimentaire avec des rats et des souris, le citral n’a pas causé de cancérogénicité chez les rats, mâles ou femmelles, ni chez les souris mâles (NTP 2001). Des preuves équivoques de lymphome malin ont mises en évidence chez des souris femelles. Des lymphomes sont apparus avec une tendance à la hausse chez les souris femelles traitées et ils étaient considérablement plus nombreux que ceux des témoins. Toutefois, la fréquence des incidences se situait dans les limites des valeurs de contrôle historiques du NTP et ne pouvait être directement associée à l’administration du citral (Ress et al. 2003).
β-Myrcène
Le Centre international de recherche sur le cancer (CIRC) considère le β-myrcène comme une substance d’intérêt prioritaire moyen à évaluer et le classe dans le groupe 2B : possiblement carcinogène pour les humains (CIRC 2014). Aux fins de la Proposition 65, l’Office of Environmental Health Hazard Assessment (OEHHA) de la Californie a inscrit le β-myrcène sur la liste des substances chimiques reconnues par l’État pour causer le cancer (OEHHA 2018). Toutefois, l’Autorité européenne de sécurité des aliments (EFSA) avait établie que l’utilisation du β-myrcène comme substance aromatisante aux doses d’absorption estimées ne pose pas de problème d’innocuité (EFSA 2015a).
Des rats et des rates F344/N (n = 10/sexe/dose) ont reçu des doses de 0, 250, 500, 1000, 2000 ou 4000 mg/kg pc/jour de β-myrcène par gavage, 5 jours par semaine pendant 14 semaines (NTP 2010). Tous les rats (mâles et femelles) des groupes ayant reçu une dose de 4000 mg/kg pc/jour sont morts au cours des deux premières semaines. Le poids corporel moyen a diminué de façon significative chez les mâles ayant reçu une dose de 500 mg/kg pc/jour ou plus. Le poids des reins et du foie des deux sexes était significativement plus élevé à toutes les doses. À partir de 500 mg/kg pc/jour, le poids du thymus des mâles était significativement moindre et de manière liée à la dose. La néphropathie chronique progressive, la néphropathie due à la α‑2u‑globuline et la dégénérescence des tubules rénaux ont augmenté chez les deux sexes de tous les groupes traités. L’incidence de dégénérescence de l’épithélium olfactif chez les rats, mâles et femelles, du groupe ayant reçu la dose de 2000 mg/kg pc/jour a augmenté de façon significative. Les auteurs ont établi une DMENO de 250 mg/kg pc/jour sur la base de ces résultats (NTP 2010).
Des souris B6C3F1, mâles et femelles (n = 10/sexe/dose), ont reçu par voie orale par gavage une dose de 0, 250, 500, 1000, 2000 ou 4000 mg/kg pc de β-myrcène 5 jours par semaine pendant 14 semaines (NTP 2010). Comme chez les rats, les doses de 4000 et 2000 mg/kg pc/jour ont été létales pour tous les animaux. Le poids des reins des femelles ayant reçu 1000 mg/kg pc/jour et le poids du foie des femelles ayant reçu 500 ou 1000 mg/kg pc/jour ont augmenté de façon significative. Aucune augmentation significative de la fréquence des érythrocytes normochromatiques à micronoyaux n’a été observée chez les souris, mâles ou femelles. Le β-myrcène n’est pas jugé génotoxique à ces doses. Les auteurs ont établi une DSENO de 250 mg/kg pc/jour sur la base de l’absence d’effets nocifs et une DMENO de 500 mg/kg pc/jour sur la base de l’augmentation significative du poids du foie et de la diminution significative du poids corporel (NTP 2010).
Lors d’une étude de 90 jours effectuée à la demande de l’EFSA pour obtenir des données toxicologiques supplémentaires sur le β-myrcène en tant qu’agent aromatisant, des rats mâles et femelles (10/sexe/groupe) ont reçu dans leur alimentation 0, 700, 2100 ou 4200 ppm (soit 0, 20,4, 58,8 ou 115,2 mg/kg pc/jour pour les mâles et 0, 50, 150 ou 300 mg/kg pc/jour pour les femelles) de β-myrcène (Bastaki et al. 2018). Aucun effet nocif n’a été observé (Bataski et al. 2018). Les auteurs ont établi des DSENO respectives de 115 et 136 mg/kg pc/jour pour les mâles et les femelles sur la base des effets observés à des doses élevées (Bastaki et al. 2018).
Des rats Wistar (15 mâles/45 femelles/dose) ont reçu des doses de 0, 100, 300 ou 500 mg/kg pc/jour de β-myrcène par gavage pendant 91 jours avant et pendant l’accouplement dans le cas des mâles et pendant 21 jours avant et pendant l’accouplement, la grossesse et la lactation jusqu’au 21e jour postnatal (91 jours au total) dans le cas des femelles (Paumgartten et al. 1998). Aucun décès n’a été provoqué et aucun autre signe de toxicité n’a été observé chez les mâles. Une augmentation significative du poids du foie et des reins sans aucun changement morphologique a été observée chez les mâles du groupe ayant reçu 500 mg/kg pc/jour. La dose de 500 mg/kg pc/jour a causé une augmentation significative du taux de résorption, une diminution du nombre de fœtus vivants et une augmentation de la fréquence des malformations du squelette telles que la fusion de l’os zygomatique et la dislocation du sternum et des côtes extra-lombaires. Sur la base de ces données, les auteurs ont établi la DSENO pour la toxicité pour la reproduction à 300 mg/kg pc/jour (Paumgartten et al., 1998).
Des doses de 0, 250, 500, 1 000 ou 1 500 mg/kg pc/jour de β-myrcène on été administrées par gavage à des rates gravides du 15e jour de la gestation au jour du sevrage (jour postnatal 21) (Delgado et al. 1993b). La mort de cinq mères au cours de la première semaine de traitement et la diminution du poids à la fin de la grossesse, qui a continué après l’accouchement, suggèrent une toxicité maternelle à 1500 mg/kg pc/jour. Le nombre de rates accouplées ayant accouché était significativement plus faible aux doses de 1000 et 1500 mg/kg pc/jour. Une diminution significative du poids des petits et une augmentation significative de leur mortalité pendant la lactation ont été observées aux doses de 500 mg/kg pc/jour ou plus. Sur la base de ces résultats, les auteurs ont établi une DSENO pour la toxicité pour le développement à 250 mg/kg pc/jour (Delgado et al. 1993b).
Des rats Wistar ont reçu des doses de 0, 250, 500 ou 1200 mg/kg pc/jour de β-myrcène par gavage du 6e au 15 ème jour de gestation (Delgado et al. 1993a). Aucun effet nocif n’a été observé à 250 et 500 mg/kg pc/jour. Une diminution du gain de poids au cours des premiers jours de traitement et un décès chez les mères traitées ont suggéré une toxicité maternelle à 1200 mg/kg pc/jour. Une diminution significative du nombre de foyers d’implantation, du nombre de fœtus vivants et du poids du fœtus, ainsi qu’un retard important de l’ossification des os du crâne, des vertèbres caudales et des membres antérieurs et postérieurs ont été rapportés uniquement à 1200 mg/kg pc/jour. Sur la base de ces résultats, les auteurs ont établie la DSENO pour la toxicité maternelle et la fœtotoxicité à 500 mg/kg pc/jour (Delgado et al. 1993a).
Un essai à la dose de 5 mg/eap de β-myrcène mené sur les ganglions lymphatiques poplités du rat (EGLP) a produit des résultats positifs (Friedrich et al. 2007). Un test d’amorçage des lymphocytes T effectué avec du β-myrcène agissant comme EGLP secondaire a donné des résultats négatifs, indiquant une réponse immunostimulante provoquée par le β-myrcène en raison de ses propriétés irritantes (Friedrich et al. 2007).
Dans le cadre d’une étude menée conformément à la ligne directrice 405 de l’OCDE, l’irritation oculaire a été examinée après l’administration 0,1 mL de myrcène non dilué dans les yeux de lapins blancs mâles de Nouvelle-Zélande (ECHA 2009). Aucun lavage n’a été effectué et les animaux ont été observés pendant 8 jours. Après 1 heure, une rougeur modérée des conjonctives associée à un chémosis léger à grave a été rapportée chez tous les animaux traités. Cependant, l’irritation a disparu en 8 jours (ECHA 2009).
Une étude in vitro a été menée avec le modèle d’épiderme humain EPISKIN pour évaluer le potentiel d’irritation cutanée (ECHA 2009). Un volume de 10 µL de β‑myrcène non dilué a été appliqué directement sur 3 échantillons d’épiderme pendant 15 minutes et le pourcentage de viabilité cellulaire a été évalué. Le contrôle positif et le traitement au β-myrcène ont donné des valeurs de viabilité cellulaire respectives de 18,7 et 25,9 %. Comme la viabilité cellulaire était inférieure à 50 %, le β-myrcène est considéré comme irritant (ECHA 2009).
En ce qui concerne le test de sensibilisation cutanée, une réponse négative a été obtenu lors d’un essai de stimulation locale des ganglions lymphatiques (ELGL) réalisé chez des souris CBA/J femelles (4/groupe) traitées avec 25 µL de β-myrcène à 2,5, 5, 10, 25 ou 50 % dans un mélange acétone/huile d’olive (4/1 v/v) pendant 3 jours consécutifs (ECHA 2009). Dans tous les groupes traités, la valeur de l’IC était inférieure à 3 et aucun signe clinique ni aucune mortalité n’ont été observés pendant l’étude (ECHA 2009).
Toutes les études de génotoxicité in vitro, test d’Ames, étude sur la présence d’aberrations chromosomiques et essai sur lymphomes de souris, n’ont mis en évidence de signe d’activité génotoxique. Le β-myrcène n’est pas considéré comme génotoxique (ECHA 2009).
Lors d’une étude de deux ans menée par le National Toxicology Program (NTP), des rats F344/N ont reçu par gavage 0, 250, 500 ou 1000 mg/kg pc/jour de β-myrcène, 5 jours par semaine (NTP 2010). Tous les mâles du groupe recevant 1000 mg/kg pc/jour sont morts avant la fin de l’étude en raison d’une toxicité rénale élevée. La fréquence de la néphrose des tubules rénaux a augmenté de façon significative chez tous les groupes traités des deux sexes, sauf chez les femelles ayant reçu la dose de 250 mg/kg. Une augmentation significative de la néphropathie a été observée chez les femelles exposées. La néphrose s’est manifestée par une lésion unique et elle était plus marquée chez les mâles que chez les femelles. La pathogenèse de cette lésion est inconnue, mais pourrait être une réponse à une lésion répétée des cellules épithéliales des tubules rénaux et pourrait être liée à la néoplasie (NTP 2010). Les auteurs ont conclu que, dans les conditions de cette étude par gavage de deux ans, des preuves évidentes de l’activité cancérogène du β -myrcène chez les rats mâles et des preuves équivoques chez les femelles ont été observées (NTP 2010).
Lors d’une étude de deux ans menée par le National Toxicology Program (NTP), des souris B6C3F1 ont reçu par gavage 0, 250, 500 ou 1 000 mg/kg pc/jour de β-myrcène, 5 jours par semaine (NTP 2010). Le taux de survie a diminué de façon significative chez les deux sexes ayant reçu la dose de 1000 mg/kg pc/jour. Le poids corporel moyen des mâles du groupe ayant reçu 1000 mg/kg pc/jour et celui des femelles ayant reçu 500 mg/kg pc/jour était inférieur à celui des témoins, respectivement 11 et 17 semaines. Les cas d’adénome hépatocellulaire, de carcinome et d’hépatoblastome étaient significativement plus nombreux chez le groupe ayant reçu 500 mg/kg pc/jour que chez les témoins, tout comme les cas d’adénome hépatocellulaire chez le groupe ayant reçu 250 mg/kg pc/jour. Dans le groupe ayant reçu la dose de 500 mg/kg pc/jour, une augmentation significative de l’incidence d’atrophie du follicule lymphoïde a été observée dans la rate des femelles, ainsi qu’une aggravation liée à la dose chez les mâles et les femelles. Chez les femelles du groupe ayant reçu 500 mg/kg pc/jour, une augmentation significative des cas d’inflammation et d’hyperplasie épithéliale du préestomac a été observée. L’inflammation était principalement chronique (NTP 2010). Les auteurs ont conclu que, dans les conditions de l’étude de gavage de deux ans, des preuves évidentes de l’activité cancérogène du β -myrcène ont été relevées chez les souris mâles, ainsi que des preuves équivoques chez les femelles (NTP 2010).
Acétate de géranyle
Les études disponibles n’ont pas permis d’établir la génotoxicité ni le potentiel cancérogène de l’acétate de géranyle chez les animaux de laboratoire (EPA 2009). De plus, les effets nocifs rapportés lors d’études à dose répétée avec des rongeurs n’ont été observés qu’après une exposition à des doses équivalentes ou supérieures à 1400 mg/kg pc/jour de cette substance (EPA 2009). De plus amples renseignements sur les effets de l’acétate de géranyle sur la santé sont fournis dans la section sur le potentiel d’effets nocifs sur la santé humaine de l’essence de palmarosa (section 7.2.2).
Citronellol et géraniol
D’après les renseignements disponibles, aucun effet préoccupant sur la santé n’a été identifié pour l’une ou l’autre de ces substances. De plus amples renseignements sur les effets du citronellol et du géraniol sur la santé sont fournis dans les sections sur le potentiel d’effets nocifs sur la santé humaine de l’essence de géranium (section 7.3.2) et de l’essence de palmarosa (section 7.2.2).
7.7.2.3 Caractérisation des risques pour la santé humaine
Voies orale et cutanée
Des données sur la toxicité du β‑myrcène sont disponibles, en contrepartie, l’essence de lemon-grass n’en contient que de 6 % à 27 %. C’est pourquoi nous estimons que les données sur la toxicité de l’huile ou de l’extrait de lemon-grass et du citral sont plus représentatives de la toxicité de l’essence de lemon-grass.
La plus faible DSENO a été obtenue en administrant du citral par voie orale aux lapins pendant leur développement (ECHA 2016). Le citral n’est pas tératogène, mais des effets sur les mères, notamment une réduction du poids corporel et du gain pondéral, une baisse de la consommation de nourriture ainsi que des cas de mortalité et d’avortement ont été observés à une dose de 200 mg/kg p.c./jour. En contrepartie, lors d’une étude sur la reproduction et le développement de rats exposés au citral, on a observé des effets sur les mères à une dose beaucoup plus élevée de 1000 mg/kg p.c./jour (MHW, Japon 2002), ce qui indique des effets propres aux espèces. Fait important, il est particulièrement difficile de gaver les lapins blancs néo-zélandais, et des signes d’irritation de l’estomac (rougeurs marquées sur la muqueuse stomacale) ont été observés chez les sujets morts du groupe exposé à une forte dose, ce qui semble indiquer que la différence entre les DSENO pourrait être en partie due à l’administration de la substance par gavage.
Étant donné la grande différence entre les DSENO mesurées lors d’études sur le rat et le lapin, et qu’il existe des données de qualité sur les effets de l’extrait de lemon-grass chez le rat, il n’a pas été proposé de se servir de l’étude sur le lapin comme point de départ pour la toxicité par voie orale. La dose critique recommandée pour l’administration par voie orale est plutôt une DSENO de 500 mg/kg p.c./jour, déterminée lors d’une étude de 90 jours sur des rats exposés à l’extrait de lemon-grass. Cette dose est basée sur la concentration accrue des enzymes hépatiques ALT et ALP ainsi que sur la congestion vasculaire et la cicatrisation dans le foie des sujets exposés à une dose de 1000 mg/kg p.c./jour (Tarkang et coll. 2012).
On n’a recensé aucune donnée relative aux effets sur la santé d’une exposition par voie cutanée à l’huile ou à l’extrait de lemon-grass ou au citral. Par conséquent, la DSENO susmentionnée de 500 mg/kg p.c./jour par voie orale et l’extrapolation d’une voie d’exposition à l’autre ont servi à caractériser les risques.
Inhalation
Il n’existe aucune donnée sur les effets de l’inhalation d’huile ou d’extrait de lemon-grass sur la santé. Par conséquent, les données sur l’inhalation de citral total qui, en concentration variant de 67 % à 92 %, constitue le principal composant de la lemon-grass ont servi de point de départ. On s’attendait à ce que l’incertitude liée à l’utilisation des données d’un composant soit moins élevée que celle liée à l’extrapolation d’une voie d’exposition à une autre. Lors d’une étude sur la toxicité du citral pour le développement des rats, on a déterminé que la dose critique correspondait à une CSENO de 215 mg/m3, soit 34 ppm (ajustée à 53,75 mg/m3 pour représenter une exposition de 6 h/jour). Cette dose est basée sur le taux de mortalité et d’avortement observé chez les mères exposées à une concentration de 423 mg/m3, soit 68 ppm (Gaworski et coll. 1992).
Puisqu’on ne sait pas si la toxicité par inhalation observée découle d’une unique exposition ou d’expositions répétées et que l’étude a signalé une grave irritation des voies respiratoires, on a jugé approprié de comparer les concentrations dans l’air associées à une exposition par inhalation et la CSENO ajustée de 53,75 mg/m3 tirée de l’étude sur la toxicité par inhalation.
Étant donné que la plupart des huiles de lemon-grass contiennent du citral, on considère que la toxicité par inhalation du citral est équivalente à celle de l’extrait de lemon-grass.
| Scénario d’expositiona | Exposition | Marge d’expositionb |
|---|---|---|
| Aromatisant alimentaire (apport alimentaire) | 2,68 × 10-4 mg/kg p.c./jour (adultes) | 1 865 671 (adultes) |
| Exposition par inhalation à partir de lotions pour le corps (5 %) | 1,6 × 10-2 à 5,9 × 10-2 mg/m3 (24 h) (tous groupes d’âge) | 911 à 3359 (tous groupes d’âge) |
| Exposition systémique par voie cutanée et par inhalation à partir de lotions pour le corps (5 %)c | 1,19 à 2,67 mg/kg p.c./jour (tous groupes d’âge) | 187 à 422 (tous groupes d’âge) |
| Exposition par inhalation à partir d’huiles de massage (4 gouttes à une concentration maximale de 100 %) | 8,00 × 10-2 à 8,20 × 10-2 mg/m3 (tous groupes d’âge) | 655 à 672 (tous groupes d’âge) |
| Exposition systémique par voie cutanée et par inhalation à partir d’huiles de massage (4 gouttes à une concentration maximale de 100 %)d | 1,20 × 10-1 à 9,82 × 10-1 mg/kg p.c./jour (adultes-nourrissons) | 509 à 4176 (nourrissons-adultes) |
| Exposition par inhalation à des parfums (30 %) | 5,80 × 10-2 mg/m3 (adultes-enfants de 5 à 11 ans) | 927 (enfants de 5 à 11 ans-adultes) |
| Exposition par inhalation à partir de produits d’aromathérapiee (1,45 mg/m3) (4 h) | 2,40 × 10-1 mg/m3 (moyenne sur 24 h) (tous groupes d’âge) | 224 (tous groupes d’âge) |
| Exposition systémique par voie cutanée et par inhalation due au mélange, au chargement et à l’application de nettoyants à plancher tout usage (1 %)d | 2,52 × 10-3 mg/kg p.c./jour (adultes) | 198 400 (adultes) |
| Exposition par inhalation due au mélange, au chargement et à l’application de nettoyants à plancher tout usage (1 %) | 1,90 × 10-3 mg/m3 (24 h) (adultes) | 28 300 (adultes) |
| Exposition systémique par voie cutanée, par inhalation et par voie orale de façon accidentelle due au contact avec des planchers nettoyés (1 %)d | 5,66 × 10-3 mg/kg p.c./jour (bambins) | 88 390 (bambins) |
| Exposition systémique par voie orale à partir de suppléments nutritifs (ingrédients non médicinaux) (0,12 mg/comprimé) | 3,39 × 10-3 mg/kg p.c./jour (adultes) | 147 492 (adultes) |
a L’annexe C présente les paramètres et les calculs utilisés dans les scénarios d’exposition à l’essence de lemon-grass.
b Pour les scénarios d’exposition par voie cutanée et d’expositions combinées, la dose critique (DSENO = 500 mg/kg p.c./jour) est basée sur la concentration accrue des enzymes hépatiques ALT et ALP ainsi que la congestion vasculaire et la cicatrisation dans le foie de rats exposés à de l’extrait de lemon-grass par voie orale dans le cadre d’une étude de 90 jours. Pour les scénarios d’exposition par inhalation, la dose critique (CSENOaj = 53,75 mg/m3) est basée sur le taux de mortalité et d’avortement observé chez les mères dans le cadre d’une étude sur la toxicité du citral par inhalation pour le développement des rats.
c On considère une absorption cutanée de 20 % (zone de peau recouverte).
d On considère une absorption cutanée de 4 % (zone de peau non recouverte).
e Consulter l’annexe D pour obtenir des précisions sur les scénarios liés à l’aromathérapie.
La marge d’exposition entre la dose critique et l’estimation d’exposition est jugée adéquate pour rendre compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
7.7.2.4 Incertitudes de l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principale source d’incertitude | Effet |
|---|---|
| Il existe un degré d’incertitude lié à l’extrapolation des données d’absorption par voie cutanée du linalol et du citronellol à l’essence de lemon-grass. Toutefois, comme tous les monoterpènes acycliques, monocycliques et bicycliques et leurs constituants ont des propriétés physicochimiques similaires, on s’attend à ce que l’absorption cutanée de ces composés soit similaire. | +/- |
| Nous avons extrapolé les scénarios d’exposition cutanée à l’essence de lemon-grass en comparant l’exposition par voie cutanée à la dose d’effet critique tirée d’une étude sur l’exposition par voie orale. | +/- |
| La composition des principaux composants de l’essence de lemon-grass varie selon la plante, son origine, son espèce, la température, le sol et le lieu géographique. Par conséquent, la méconnaissance de la composition de l’essence de lemon-grass présente dans les produits offerts aux Canadiens constitue une source d’incertitude de l’évaluation. | +/- |
| Il n’existe aucune étude sur des animaux sur la toxicité chronique, la toxicité pour la reproduction et le développement ou la cancérogénicité pour l’ensemble des voies d’exposition. | +/- |
| Il n’existe aucune étude sur l’exposition par voie cutanée ou par inhalation. | +/- |
| Peu d’études menées sur des animaux ont porté sur la toxicité de doses d’essence de lemon-grass administrées de manière répétée par les voies d’exposition pertinentes (voie cutanée, voie orale et inhalation). Les données sur les dangers associés au principal composant, le citral, ont servi à éclairer l’évaluation des effets sur la santé humaine, le cas échéant. | +/- |
| On ne connaît pas la composition de l’extrait de lemon-grass administrée lors de l’étude de 90 jours menée sur des rats. Par conséquent, on ne sait pas si la composition de l’extrait de lemon-grass est représentative de celle de l’essence de lemon-grass à laquelle les Canadiens sont exposés. | +/- |
8. Monoterpènes monocycliques et bicycliques
8.1 Essence d’orange douce
8.1.1 Sources et utilisations
L’essence d’orange douce est une substance d’origine naturelle obtenue par la distillation de l’écorce fraîchement pelée ou du jus du fruit du Citrus sinensis. Cet agrume est surtout présent en Asie, autour de la Méditerranée, en Afrique du Nord et aux États-Unis (Burdock 2010).
D’après les renseignements divulgués lors d’une enquête menée en vertu de l’article 71 de la LCPE (Canada 2012), on a élaboré 2568 kg d’essence d’orange douce au Canada en 2011, et on en a importé 36 576,37 kg (Environnement Canada 2013).
Selon les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, l’essence d’orange douce, aussi appelée Citrus sinensis, l’essence d’écorce (d’orange) de Citrus sinensis, l’essence de Citrus aurantium, l’essence (d’orange) de Citrus aurantium dulcis et l’essence d’écorce (d’orange) de Citrus aurantium dulcis entrent dans la composition d’un grand éventail de produits cosmétiques au Canada (communication personnelle, courriels de la Direction de la sécurité des produits de consommation, 2015; sans référence). De plus, l’huile essentielle d’orange douce est un ingrédient médicinal tandis que l’essence d’orange pressée à froid, l’essence d’orange distillée et l’essence d’écorce (d’orange) de Citrus aurantium dulcis sont des ingrédients non médicinaux dans de nombreux produits de santé naturels (courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, juillet 2015; sans référence).
L’essence d’orange douce figure également à la liste de l’International Fragrance Association à titre de parfum employé dans les produits de consommation (IFRA 2017).
D’après les renseignements divulgués lors d’une enquête menée en vertu de l’article 71 de la LCPE, on utilise aussi la substance comme solvant ou odorisant dans les produits de nettoyage et d’entretien de mobilier, les détergents à lessive et à vaisselle, les produits d’assainissement de l’air, les produits d’entretien de vêtements ou de chaussures et d’automobiles ainsi que dans les lubrifiants et graisses (Environnement Canada 2013). Des renseignements sur le site de l’American Cleaning Institute (ACI) suggèrent que l’essence d’orange douce pourrait être employée comme parfum dans des produits d’entretien ménager comme les nettoyants tout usage et les détergents à lessive et à vaisselle (ACI 2017).
L’essence d’orange douce est utilisée dans les boissons alcoolisées ou non alcoolisées, les produits de boulangerie, les bonbons et la gomme à mâcher, les condiments, les produits laitiers congelés, les gélatines et les poudings, les sauces et les produits carnés (Burdock 2010). Elle figure aussi à l’inventaire des substances ajoutées aux aliments de la FDA et au Codex des produits chimiques alimentaires à titre d’agent aromatisant (USFDA 2018; FCC 2018).
Le tableau 8.1-1 présente d’autres utilisations de l’essence d’orange douce.
| Utilisation | Précisions |
|---|---|
| Aromatisant alimentairea | Utilisations déclarées dans les boissons alcoolisées ou non alcoolisées, les produits de boulangerie, les bonbons et la gomme à mâcher, les condiments, les produits laitiers congelés, les gélatines et les poudings, les sauces et les produits carnés (Burdock 2010) |
| Base de données sur les ingrédients de produits de santé naturelsb | IM, INM |
| Base de données sur les produits de santé naturels homologués présents en tant qu’ingrédients médicinaux ou non médicinaux dans les produits de santé naturels au Canadab | IM, INM |
| Signalée comme étant présente dans les cosmétiques, selon les déclarations présentées à Santé Canada en vertu du Règlement sur les cosmétiquesc | Produits de soin pour la peau, les cheveux et la bouche, désodorisants, parfums et produits de massage |
| Formulant dans des produits antiparasitaires homologués au Canadad | Formulant |
Abréviations : IM, ingrédient médicinal; INM, ingrédient non médicinal.
a Communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada 2015; sans référence; Burdock 2010
b Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada; février 2017, sans référence
c Communication personnelle, courriel de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, juillet 2015, sans référence
d Communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, juin 2015; sans référence
8.1.2 Potentiel d’effets nocifs sur la santé humaine
La FDA a reconnu de manière générale l’innocuité de l’essence d’orange douce (GRAS : Generally Recognized As Safe) lorsqu’elle est employée comme aromatisant ou additif alimentaire (USFDA 2017a).
Dans le cas du milieu environnant, selon Kim et coll. (2016) le limonène qui constitue de 84 % à 96 % de l’essence d’orange douce devrait se répartir presque entièrement dans l’air étant donné sa forte pression de vapeur (192 Pa).
Dans le cadre de quatre études canadiennes menées à Windsor, Regina, Halifax et Edmonton, on a mesuré les quantités de limonène dans l’air extérieur (SC 2010a, b, 2012, 2013). Dans l’ensemble de ces études, les concentrations de limonène dans l’air extérieur mesurées allaient d’une concentration inférieure au seuil de détection de la méthode à 111,60 µg/m3, tandis que les moyennes géométriques de la concentration variaient de la concentration inférieure au seuil de détection à 0,168 µg/m3.
On a mesuré les quantités de limonène lors d’une étude pancanadienne sur l’air intérieur réalisée de 2009 à 2011 dans le cadre du deuxième cycle de l’Enquête canadienne sur les mesures de la santé (ECMS). La présence de limonène a été détectée dans 99,84 % des échantillons, dont la moyenne géométrique de la concentration était de 21,30 µg/m3 (données pondérées pour les ménages) et le 95e centile de la concentration était de 228,1 µg/m3 (Zhu et coll. 2013). Les quatre études canadiennes susmentionnées ont aussi mesuré la concentration de limonène dans l’air intérieur. Celle-ci se situait entre une concentration inférieure au seuil de détection de la méthode et 625,50 µg/m3, tandis que les moyennes géométriques de la concentration allaient de 6,542 à 32,008 µg/m3 dans l’ensemble de ces études de surveillance de l’air intérieur. De plus, des quantités de limonène ont été détectées dans l’air intérieur après la construction d’une nouvelle résidence (Won et coll. 2017) ainsi que dans de nombreux produits offerts aux consommateurs et matériaux de construction comme les diluants à peinture à l’huile et les vernis, les produits nettoyants, les assainisseurs d’air, les tapis, les planchers lamellaires, les peintures, les adhésifs et les poutres en I (Won et Yang 2012; Won et coll. 2013; Won et coll. 2014).
Il existe peu de données sur les effets de l’essence d’orange douce sur la santé.
Aucun effet nocif n’a été observé lors d’une étude de 28 jours sur la toxicité par voie orale au cours de laquelle des rats mâles et femelles ont reçu par gavage des doses de 0, 240, 600 et 1500 mg/kg p.c./jour d’essence d’orange douce dans une solution de méthylcellulose à 1 % (USEPA 2018).
On a aussi évalué la toxicité de l’essence d’orange douce dans le cadre d’un essai de dépistage de la toxicité pour la reproduction et le développement (USEPA 2018). Des rattes ont reçu par gavage des doses de 0, 375, 750 ou 1500 mg/kg p.c./jour d’huile d’orange douce pendant 28 jours (de 7 jours avant la cohabitation jusqu’au 4e jour de lactation). À la plus forte dose (1500 mg/kg p.c./jour), seule une hausse marquée de mortinatalité et de mortalité des petits a été observée. Étant donné que l’on a observé aucun effet nocif de l’essence d’orange douce à l’approche de la dose limite et que les études n’ont remarqué aucun effet nocif sur le développement du composant principal de l’essence d’orange douce, aucune préoccupation liée à la toxicité pour la reproduction n’a été signalée.
Une autre étude s’est penchée sur l’innocuité et la faisabilité de l’application topique d’essence d’orange sur la poitrine comme nouvelle méthode d’administration de limonène pour la prévention et le traitement du cancer du sein (Miller et coll. 2012). Dans la première partie de l’étude, des souris femelles SKH-1 (4 par groupe) ont reçu par gavage ou par application topique de 10 % à 20 % d’essence d’orange dans une huile de base. On a posé des collerettes à celles ayant reçu la substance par voie cutanée pour éviter qu’elles lèchent l’huile. Aucun effet nocif n’a été observé chez un groupe ou l’autre. Dans la deuxième partie de l’étude, l’innocuité de l’application topique de l’essence d’orange a été évaluée chez 44 femmes qui ont massé quotidiennement leur poitrine avec une solution de 3 gouttes d’essence d’orange dans 1,35 ml d’huile de base pendant 4 semaines. Aucun effet nocif n’a été relevé. Les concentrations de limonène dans le plasma et dans du liquide mammaire prélevé par ponction n’avaient pas beaucoup changé après l’application pendant 4 semaines, et les concentrations dans les tissus n’ont pas été mesurées.
On a évalué la génotoxicité de l’essence d’orange douce à l’aide de divers systèmes d’essai. Lors de l’essai de mutagénécité inverse sur bactéries, l’essence d’orange douce a donné un résultat négatif lorsque mise à l’essai avec les souches TA 1535, TA 1537, TA 1538, TA98 et TA100, avec et sans activation métabolique exogène (Letizia et coll. 2003). Pendant l’essai de mutation génique des cellules de mammifère réalisé sur des cellules de lymphome de souris, on a obtenu des résultats positifs pour l’essence d’orange douce avec et sans activation métabolique (Letizia et coll. 2003). Toutefois, les auteurs ont relevé que le faible pH de la substance à l’essai a pu donner des résultats confondants et engendrer des résultats positifs. De plus, les résultats positifs obtenus après une activation métabolique n’ont été observés qu’à des concentrations hautement cytotoxiques. L’essence d’orange employée comme additif alimentaire (la nature de la substance à l’essai n’a pas été précisée) n’a pas causé d’aberration chromosomique dans les fibroblastes du hamster chinois (Ishidate et coll. 1984).
La recherche documentaire n’a permis de recenser aucune étude sur la toxicité chronique ou la cancérogénicité de l’essence d’orange douce.
Pour mieux éclairer l’évaluation des risques, nous avons étudié les renseignements disponibles sur les dangers associés au composant principal de l’essence d’orange douce, le limonène (84 % à 96 %).
Évaluation des dangers associés au composant principal
Limonène
Selon la FDA, l’innocuité du limonène est généralement reconnue (GRAS) lorsque la substance est employée comme aromatisant ou additif alimentaire (USFDA 2017a). Plusieurs agences internationales ont déjà évalué le limonène, notamment l’Organisation mondiale de la santé (OMS) dans un Résumé succinct international sur l’évaluation des risques chimiques (CICAD) publié en 1998, le Programme national australien de notification et d’évaluation des produits chimiques industriels (NICNAS) lors de l’évaluation de cette substance chimique prioritaire existante réalisée en 2002 et l’Environmental Protection Agency des États-Unis (USEPA), en 2009, dans le cadre du Défi des substances chimiques produites en grande quantité (High Production Volume [HPV] Challenge Program), selon lequel le limonène est une substance commanditée de la catégorie des hydrocarbures monoterpéniques. De façon générale, les agences ont examiné les mêmes études sur la toxicité pour les trois évaluations. Selon la FDA, l’innocuité du (+)‑limonène (NR CAS 5989-27-5), du (±)‑limonène (NR CAS 7705-14-8) et du (-)‑limonène (NR CAS 5989-54-8) est généralement reconnue (GRAS) lorsque ces substances sont employées comme aromatisants ou additifs alimentaires (USFDA 2018).
Lors de différentes études à doses répétées, on a observé des effets dans les reins de rats et dans le foie de rats et de chiens. Dans une étude, des rats mâles ont reçu par gavage des doses de 0, 2, 5, 10, 30 ou 75 mg/kg p.c./jour de limonène, 5 jours par semaine pendant 13 semaines (Webb et coll. 1989). Cette étude visait à analyser la néphrotoxicité du limonène chez les rats Fisher mâles, qui survient en raison d’un mécanisme étranger aux humains. Outre les effets néphrotoxiques, l’exposition au limonène a été associée à une hausse du poids du foie aux deux plus fortes doses, ce qui a permis d’établir une DSEO de 10 mg/kg p.c./jour. Aucun changement histopathologique concomitant n’a été observé. Dans une autre étude, l’exposition de rats à une dose de 400 mg/kg pendant 30 jours a entraîné une augmentation de 20 % à 30 % des enzymes hépatiques, une hausse du poids du foie et une diminution du taux de cholestérol (Ariyoshi et coll. 1974). L’exposition de chiens à des doses de 1,2 ml/kg p.c./jour (environ 1000 mg/kg p.c./jour) de limonène pendant 6 mois a causé une augmentation du nombre d’enzymes hépatiques et une légère hausse du poids du foie (Webb et coll. 1990).
Pour la caractérisation des risques présentée dans le CICAD de l’OMS publié en 1998, on s’est fondé sur une DSEO de 10 mg/kg p.c./jour en fonction de la hausse du poids du foie chez le rat décrit dans Webb et coll. 1989. On souligne dans le CICAD qu’aucun changement histopathologique n’a été observé et, en outre, qu’« étant donné que la quantité et l’activité des différentes enzymes hépatiques n’ont pas été étudiées, la hausse du poids relatif du foie pourrait être due à l’induction enzymatique ». Dans l’évaluation du limonène réalisée par le NICNAS (2002), on indique que même si des effets ont été observés dans le foie de rats et de chiens, ces effets ne sont pas dus à la toxicité de la substance, mais plutôt à une adaptation physiologique. On conclut donc qu’il est impossible de déterminer une DSENO pour les effets dans le foie. Étant donné l’absence de résultats histopathologiques et la probabilité que les effets dans le foie soient causés par une adaptation physiologique, ces effets ne sont pas jugés nocifs.
La toxicité du limonène pour le développement a été évaluée lors d’études de gavage réalisées chez le rat (0, 591, 2869 mg/kg p.c./jour), la souris (0, 591, 2869 mg/kg p.c./jour) et le lapin (0, 250, 500, 1000 mg/kg p.c./jour) [Webb et coll. 1990, Tisserand et Young 2014]. Dans l’ensemble des études, le limonène n’a pas été considéré comme toxique pour le développement, et des effets ont été observés chez les petits seulement en cas de toxicité maternelle. On a observé la présence de toxicité maternelle chez le rat et la souris uniquement à une dose de 2869 mg/kg p.c./jour. Chez le lapin, des décès maternels ont été observés dans le groupe ayant reçu la dose la plus forte (1000 mg/kg p.c./jour).
On n’a relevé aucune préoccupation sur le plan de la génotoxicité dans l’ensemble des évaluations. Le NTP a mené une étude de 2 ans sur la cancérogénicité chez les rats et souris mâles et femelles (1990) qui a détecté une hausse des cas d’hyperplasie et de la présence d’adénomes et d’adénocarcinomes dans les reins des rats mâles. Toutefois, cet effet n’a pas été jugé pertinent pour les humains, puisque l’α2‑microglobuline qui lui est associée est une protéine spécifique au rat mâle qui n’est pas présente chez l’humain. En 1999, le CIRC a confirmé que les preuves de cancérogénicité étaient suffisantes pour les animaux, mais insuffisantes pour les humains, et a donc conclu que le limonène ne peut être classé comme cancérigène pour les humains (groupe 3).
En ce qui concerne les effets non cancérigènes relevés lors de l’étude du NTP, on a observé un nombre anormal de noyaux ainsi qu’une cytomégalie dans le foie des souris, mais seulement chez les mâles recevant la plus forte dose (500 mg/kg p.c./jour) [NTP 1990]. Après l’examen des données, on a déterminé que ces effets étaient probablement dus à une adaptation physiologique. Aucun effet nocif n’a été observé. On a confirmé la probabilité que les effets sur le foie découlent d’une adaptation physiologique dans le rapport du NICNAS en 2002. De plus, la survie des rattes était considérablement réduite lorsqu’elles recevaient la plus forte dose (600 mg/kg p.c./jour) [NTP 1990]. L’Autorité européenne de sécurité des aliments (EFSA) a choisi une DSENO de 215 mg/kg p.c./jour (300 mg/kg p.c./jour ajustée pour une exposition de 5 jours/semaine) en se fondant sur le taux de survie réduit des rattes observé dans l’étude du NTP (EFSA 2015a).
La conclusion générale tirée de ces évaluations est qu’à l’exception des propriétés irritantes et sensibilisantes du limonène (probablement liées à son oxydation plutôt qu’à la substance même), on peut considérer que la toxicité de la substance et assez faible. La recherche documentaire n’a pas permis de retrouver d’étude sur la toxicité pour les animaux postérieure à ces évaluations.
Des patients volontaires ont reçu à trois reprises des doses de 10, 225 ou 450 mg/m3 de limonène dans une chambre d’exposition pendant des périodes de 2 heures. Ils n’ont ressenti aucun symptôme d’irritation ou lié au système nerveux central. Une diminution considérable de la capacité vitale de ces volontaires a été relevée après une exposition à la plus forte dose. Ce changement était toutefois de faible ampleur et a été jugée probablement négligeable sur le plan fonctionnel (Falk-Filipsson et coll. 1993).
Aucun effet préoccupant sur la santé n’a été relevé sur la base des renseignements disponibles. Par conséquent, les points de départ n’ont pas été déterminés et une méthode qualitative de caractérisation des risques a été choisie. On considère donc que l’exposition de la population générale à l’orange douce constitue un faible risque pour la santé humaine.
8.2 Essences de mandarine et de tangerine
8.2.1 Sources et utilisations
Bien que les essences de mandarine et de tangerine aient des NR CAS distincts, elles ont la même origine végétale (Citrus reticulata) et leurs noms sont employés de façon interchangeable tant dans les études sur les effets sur la santé que dans les listes d’ingrédients de produits offerts aux consommateurs et de produits de santé naturels (communication personnelle, courriel de la Direction de la sécurité des produits de consommation de Santé Canada et de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, février 2017, sans référence; Burdock 2010). Elles seront donc évaluées comme une seule substance dans le présent rapport d’évaluation préalable.
Les essences de mandarine et de tangerine sont des substances d’origine naturelle obtenues par l’expression à froid de l’écorce des fruits presque mûrs ou des feuilles de l’espèce végétale Citrus reticulata (Burdock 2010; Lota et coll. 2000; Fleisher et Fleisher 1990). Selon les renseignements fournis lors d’une enquête menée en vertu de l’article 71 de la LCPE (Canada 2012), on n’a déclaré, pour l’année 2011 au Canada, aucune production d’essence de mandarine ou de tangerine en quantités supérieures au seuil de déclaration de 100 kg, alors que de 100 à 1000 kg y ont été importés (Environnement Canada 2013).
Selon les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, les essences de mandarine et de tangerine, aussi connues sous le nom d’essence d’écorce de Citrus reticulata (et divers synonymes tels C. nobilis, C. tangerina et C. depressa) sont employées dans plus de 675 produits cosmétiques au Canada en des concentrations variant de < 0,1 % à 100 %. Parmi les types de produits déclarés figurent notamment les lotions pour le corps, les produits de massage, les nettoyants, les parfums, le maquillage, les produits de soin pour les cheveux et les produits de bain. La majorité de ces produits (> 75 %) contient de l’essence de mandarine ou de tangerine en une concentration d’au plus 1 % (communication personnelle de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2016; sans référence).
D’après les renseignements fournis lors d’une enquête menée en vertu de l’article 71 de la LCPE, on emploie aussi l’essence de mandarine comme odorisant dans des produits de soin personnel (Environnement Canada 2013). Cette substance figure également à la liste de l’International Fragrance Association à titre de parfum utilisé dans les produits de consommation (IFRA 2017). On se sert en outre de l’essence de mandarine en aromathérapie. Le site Web de la base de données sur les produits cosmétiques Skin Deep indique que l’essence de tangerine est employée comme parfum, agent revitalisant pour la peau et agent masquant dans les cosmétiques (EWG Skin Deep 2017). Selon l’International Fragrance Association, cette substance est aussi utilisée comme parfum dans des produits de consommation (IFRA 2017).
Des renseignements donnés par le site de l’American Cleaning Institute (ACI) suggèrent que l’essence de mandarine pourrait être employée comme parfum dans des produits d’entretien ménager comme les nettoyants tout usage et les détergents à lessive et à vaisselle (ACI 2017).
Les essences de mandarine et de tangerine sont utilisées dans les boissons alcoolisées ou non alcoolisées, les produits de boulangerie, les bonbons et la gomme à mâcher, les produits laitiers congelés, les gélatines et les poudings (Burdock 2010). Les deux essences figurent aussi à l’inventaire des substances ajoutées aux aliments de la FDA et au Codex des produits chimiques alimentaires à titre d’agent aromatisant (USFDA 2018; FEMA 2017; FCC 2018). Il n’existe aucune donnée précise sur l’utilisation potentielle de l’essence de mandarine ou de tangerine comme aromatisant alimentaire au Canada. Toutefois, puisqu’on sait que les substances sont employées à ce titre aux États-Unis, elles pourraient être présentes en tant qu’aromatisants alimentaires dans des aliments vendus au Canada.
Le tableau 8.2-1 présente d’autres utilisations des essences de mandarine et de tangerine.
| Utilisation | Précisions |
|---|---|
| Aromatisant alimentairea | Utilisations déclarées dans les boissons alcoolisées ou non alcoolisées, les produits de boulangerie, les bonbons et la gomme à mâcher, les produits laitiers congelés, les gélatines et les poudings (Burdock 2010) |
| Base de données sur les ingrédients de produits de santé naturelsb | INM (exhausteur de saveur, parfum ou agent revitalisant pour la peau dans les produits à application topique) |
| Base de données sur les produits de santé naturels homologués présents en tant qu’ingrédients médicinaux ou non médicinaux dans les produits de santé naturels au Canadab | INM |
| Liste critique des ingrédients dont l’utilisation est restreinte ou interdite dans les cosmétiquesd | Bien que les essences de mandarine et de tangerine (NR CAS 8008-31-9 et 8016‑85‑1) ne figurent pas à la Liste critique des ingrédients dont l’utilisation est restreinte ou interdite dans les cosmétiques, l’utilisation de l’essence de feuille du Citrus reticulata (NR CAS 8014-17-3) est interdite en concentration supérieure à 0,1 % dans les produits sans rinçage (SC 2015). |
| Signalées comme étant présentes dans les cosmétiques, selon les déclarations présentées à Santé Canada en vertu du Règlement sur les cosmétiquesc | Produits de soin pour la peau, les cheveux et la bouche, désodorisants, parfums et produits de massage |
| Formulant dans des produits antiparasitaires homologués au Canadad | Formulant |
8.2.2 Potentiel d’effets nocifs sur la santé humaine
8.2.2.1 Évaluation de l’exposition
Compte tenu des faibles quantités de la substance déclarées comme ayant été utilisées au Canada (Environnement Canada 2013), l’exposition à l’essence de mandarine ou de tangerine causée par l’environnement ne devrait pas avoir d’effet sur la santé humaine.
L’exposition alimentaire des Canadiens aux deux essences employées comme aromatisants alimentaires a été estimée à l’aide de valeurs de consommation individuelle de 1,12 × 10-2 mg/kg p.c./jour pour l’essence de mandarine et de 5,52 × 10‑2 mg/kg p.c./jour pour l’essence de tangerine, menant à un apport alimentaire combiné de 6,64 × 10-2 mg/kg p.c./jour pour la population américaine, tel que déterminé dans le Fenaroli’s Handbook of Flavor Ingredients (communications personnelles, courriels de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques pour les substances existantes, 2017; sans référence).
Pour évaluer le potentiel d’exposition à l’essence de mandarine ou de tangerine à partir de cosmétiques, des scénarios sentinelles ont été choisis en fonction des fréquences d’utilisation de ces produits et des concentrations déclarées d’essences de mandarine et de tangerine contenues dans ceux-ci. Ces scénarios représentaient la plus forte exposition par voie cutanée par rapport aux autres cosmétiques à application topique et aux produits de santé naturels répertoriés et déclarés contenir la substance. Les expositions à l’essence de mandarine lors de l’utilisation d’un hydratant corporel, d’un écran solaire et d’une huile de massage ont servi de scénarios sentinelles pour estimer l’exposition quotidienne par voie cutanée. L’annexe E présente ces données et l’ensemble des paramètres utilisés pour les calculs (tableaux E-1, E-2 et E-3).
Les plus fortes expositions cutanées quotidiennes à l’essence de mandarine ou de tangerine devraient découler de l’utilisation d’un hydratant corporel, d’un écran solaire ou d’une huile de massage ayant respectivement des concentrations maximales déclarées de 5 %, 1 % et 100 % de la substance (l’huile de massage devrait être accompagnée de consignes pour la dilution de quelques gouttes d’essence dans une huile de base). L’exposition systémique par voie cutanée et par inhalation causée par un hydratant corporel ou une huile de massage (considérant une absorption cutanée de 20 % sur une zone de peau recouverte pour l’hydratant corporel et une absorption cutanée de 4 % sur une zone de peau non recouverte pour l’huile de massage) se situait respectivement entre 1,21 et 1,46 mg/kg p.c./jour et entre 1,12 × 10-1 et 1,33 × 10-1 mg/kg p.c./jour pour les femmes en âge de procréer. L’exposition systémique par voie cutanée à partir d’un écran solaire (considérant une absorption cutanée de 4 % sur une zone de peau non recouverte) variait entre 1,44 × 10-1 et 1,72 × 10-1 mg/kg p.c./jour. De plus, on a calculé que l’exposition systémique par voie cutanée et par inhalation due au mélange, au chargement et à l’application de nettoyants tout usage (1 % d’essence de mandarine ou de tangerine) et au mélange, au chargement et à l’étendage de vêtements lavés à la machine (5 % d’essence de mandarine ou de tangerine) était respectivement de 8,26 × 10-3 et de 1,68 × 10-2 mg/kg p.c./jour. Ces données et les paramètres utilisés sont présentés à l’annexe E (tableaux E-1 à E-3, E-5 et E-6).
De nombreux produits de santé naturels contenant de l’essence de mandarine et de tangerine comme ingrédients non médicinaux sont à application topique (traitements contre l’acné, lotions et huiles essentielles d’aromathérapie); leur utilisation entraîne donc une exposition par voie cutanée. Il n’existe pas de données sur les quantités d’essence de mandarine ou de tangerine entrant dans la composition de la plupart de ces produits (courriel de la Direction des produits de santé naturels et sans ordonnance au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, juillet 2015; sans référence). Cependant, l’exposition à l’essence de mandarine et de tangerine contenues dans ces produits de santé naturels devrait être comparable, ou moindre, aux estimations maximales de l’exposition cutanée à ces essences occasionnée par l’utilisation de cosmétiques ou d’écrans solaires.
Certains produits de santé naturels contenant l’essence de mandarine et de tangerine comme ingrédient non médicinal sont aussi utilisés par voie orale, comme des vitamines, des suppléments, des pastilles et des rince-bouche. On s’attend à ce que la consommation d’un supplément nutritif entraîne la plus forte exposition systémique à l’essence de mandarine ou de tangerine par voie orale, soit une exposition systémique estimée de 4,20 × 10-1 mg/kg p.c./jour.
Une exposition à l’essence de mandarine et de tangerine par inhalation peut être causée par l’utilisation de certains produits cosmétiques (parfum en aérosol) et d’aromathérapie. On a déterminé que la concentration moyenne lors d’une journée d’exposition à un parfum contenant 30 % d’essence de mandarine ou de tangerine est de 5,80 × 10-2 mg/m3 (soit une exposition systémique variant entre 1,30 × 10-2 et 1,50 × 10-2 mg/kg p.c./jour chez les femmes en âge de procréer). (L’ensemble des paramètres de calcul sont présentés au tableau E-3 de l’annexe E.) Nous avons calculé l’exposition par inhalation à l’essence de mandarine ou de tangerine émise par un diffuseur d’aromathérapie à partir du document de l’APE du Danemark sur l’évaluation des risques pour la santé des substances chimiques contenues dans les huiles essentielles et les huiles parfumées (APE du Danemark 2008). L’annexe D présente le scénario et les paramètres d’exposition (tableaux D1 et D2). L’exposition systémique par inhalation due à l’aromathérapie se situait entre 5,50 × 10-2 et 6,40 × 10‑2 mg/kg p.c./jour pour les essences de mandarine et de tangerine.
8.2.2.2 Évaluation des effets sur la santé
Évaluation des dangers occasionnés par les essences de mandarine et de tangerine
Selon la FDA, l’innocuité des essences de mandarine et de tangerine est généralement reconnue (GRAS : Generally Recognized As Safe) lorsque les substances sont employées comme aromatisants ou additifs alimentaires (USFDA 2017a).
La recherche documentaire n’a pas trouvé d’étude sur la génotoxicité, la cancérogénicité ou la toxicité subchronique, chronique ou pour le développement et la reproduction des essences de mandarine et de tangerine. Par conséquent, afin de mieux éclairer l’évaluation des risques associés à ces essences, nous avons examiné les renseignements disponibles sur les dangers liés à leurs principaux composants, nommément le limonène (52 à 96 %), le γ-terpinène (traces à 61 %), le citral total (15 à 19 %), le N‑méthylanthranilate de méthyle (0 à 58 %) et le linalol (0,2 à 59 %).
Évaluation des dangers associés aux composants principaux
Le limonène
On considère que le limonène présente une toxicité assez faible. De plus amples renseignements sur les effets du limonène sur la santé sont présentés dans la section sur le potentiel d’effets nocifs sur la santé humaine de l’essence d’orange douce (section 8.1.2).
Le γ‑terpinène
On a mentionné que le γ‑terpinène entrait dans la composition des essences de mandarine (traces à 61 %) et de tangerine (traces à 4,5 %). L’α‑terpinène et le δ‑terpinène en sont des isomères et des analogues. La principale différence entre ces molécules est la position d’une double liaison dans le cycle. Elles possèdent des propriétés physicochimiques et des profils mécanistes comparables, donnent un résultat négatif au test de mutagénécité d’Ames et ont tendance à former quelques métabolites courants (à l’aide d’un simulateur métabolique du métabolisme hépatique du rat par la fraction S9) qui présentent des caractéristiques structurelles associées au potentiel d’avoir des effets toxiques pour le développement et la reproduction. L’évaluation a été réalisée au moyen de la version 4.2 de la boîte à outils QSAR de l’OCDE, de la version 2.28 du simulateur Oasis TIMES, de la version 3.5 de la plateforme Leadscope Enterprise et de la base de données en ligne PubChem.
Des rattes enceintes ont reçu par gavage des doses de 0, 30, 60, 125 ou 250 mg/kg p.c./jour d’α‑terpinène (89 % pur) une fois par jour du 6e au 15e jour de gestation (JG). On a observé une importante diminution du gain pondéral des mères lorsqu’elles recevaient une dose de 250 mg/kg p.c./jour, du début de l’exposition jusqu’à la fin de la grossesse. Toutefois, dans le groupe ayant reçu une dose de 125 mg/kg p.c./jour, les mères n’ont perdu du poids que pendant la période de traitement (du JG 6 au JG 15), et cette perte était réversible dès la fin du traitement (du JG 15 au JG 21). L’étude ne contient pas de donnée sur la consommation, toutefois le mauvais goût de la substance pourrait avoir entraîné une baisse de la consommation alimentaire pendant le traitement causant la diminution du poids corporel. On a relevé une baisse importante du poids corporel des fœtus à une dose de 250 mg/kg p.c./jour. De plus, une hausse considérable des anomalies fœtales dans le squelette, comme des côtes plus courtes et une bifurcation du basisphénoïde et du retard de l’ossification a été observée aux doses d’au moins 60 mg/kg p.c./jour. Les auteurs de l’étude ont conclu selon les résultats que l’α‑terpinène peut avoir un effet nocif sur le développement embryofœtal du rat à une dose d’au moins 60 mg/kg p.c. et ont fixé une DSENO de 30 mg/kg p.c./jour pour son embryofœtotoxicité. Bien qu’on ait observé une diminution du gain pondéral chez la mère à une dose de 250 mg/kg p.c./jour, on ne considère pas cet effet comme nocif en l’absence d’autres signes de toxicité (Araujo et coll. 1996).
Aucun effet nocif n’a été observé lors d’une étude sur le développement de rats mâles et femelles (10 sujets/dose/sexe sauf pour les mâles témoins et la plus forte dose : 5 mâles/dose) qui ont reçu des doses de 0, 800, 2500 ou 5000 ppm (équivalant à 0, 54, 155 ou 301 mg/kg p.c./jour respectivement) de δ‑terpinène pendant 42 jours (accouplement, grossesse et lactation) et ont eu une période de rétablissement de 14 jours (ECHA 2013). On n’a toutefois pas dans ce cas analysé le squelette des petits à l’instar de d’Araujo et coll. (1996). Selon les résultats de la présente étude, la DSENO du δ‑terpinène relative à la toxicité pour la reproduction et aux effets sur la mère et le développement est de 5000 ppm, ce qui équivaut à 300,8 mg/kg p.c./jour.
Citral total
Lors de son évaluation du citral, le Comité mixte FAO-OMS d’experts sur les additifs alimentaires a conclu que, selon les concentrations d’ingestion estimées, la substance n’était pas préoccupante sur le plan de la sécurité lorsqu’elle est employée comme aromatisant alimentaire (OMS 2004 b). On n’a pas signalé que le citral n’a pas été signalé comme étant toxique pour la reproduction ou le développement (MHW, Japon 2002). Une recherche documentaire sur le citral total n’a pas permis de relever des préoccupations relatives à la génotoxicité ou à la cancérogénicité. Lors d’une étude sur la toxicité du citral pour le développement des rats, on a déterminé que la dose critique correspondait à une CSENO de 215 mg/m3, soit 34 ppm (ajustée à 53,75 mg/m3 pour représenter une exposition de 6 h/jour). Cette dose est basée sur le taux de mortalité et d’avortement observé chez les mères exposées à une concentration de 423 mg/m3, soit 68 ppm (Gaworski et coll. 1992). Plus d’information sur les effets du citral sur la santé est présentée dans la section sur l’évaluation des effets sur la santé de l’essence de lemon-grass (section 7.7.2.2).
N‑méthylanthranilate de méthyle
Lors de son évaluation du N‑méthylanthranilate de méthyle, le Comité mixte FAO-OMS d’experts sur les additifs alimentaires a conclu que la substance n’était pas préoccupante sur le plan de la sécurité lorsqu’elle était employée comme agent aromatisant dans les aliments (OMS 2006a). Le Comité scientifique pour la sécurité des consommateurs (CSSC) de la Commission européenne a conclu que le N‑méthylanthranilate de méthyle était phototoxique et qu’une concentration d’au plus 0,1 % de cette substance peut être employée de façon sécuritaire dans de nombreux produits cosmétiques sans rinçage comme les désodorisants et les antisudorifiques (CSSC 2011). Toutefois, le CSSC estime qu’on ne peut exclure le risque associé aux produits (y compris les parfums et les produits et écrans solaires) destinés à l’application sur des zones exposées au soleil, en particulier le visage et le cou (CSSC 2011).
Pendant 13 semaines, on a administré à des rats mâles et femelles des doses de 0, 300, 1200 ou 3600 ppm (équivalant à 21, 82 ou 244 mg/kg p.c. pour les mâles et à 24, 95 ou 280 mg/kg p.c. pour les femelles). On a observé une hausse statistiquement significative, mais très faible (< 10 %), du poids absolu et du poids relatif des reins chez les sujets ayant reçu des doses de 1200 et 3600 mg/kg p.c./jour, mais aucun effet n’a été constaté lors des examens histologiques (Gaunt et Sharratt 1970). Une DSENO de 280 mg/kg p.c./jour a été observée compte tenu de l’absence d’effets nocifs à toutes les doses (OMS 2006a).
À l’aide de la version 3.3 de la boîte à outils QSAR, l’Agence européenne des produits chimiques (AÏCHA) a prédit une DSENO de 507 mg/kg p.c./jour pour l’exposition par voie cutanée et une DSENO de 162,5 mg/m3 pour l’exposition par inhalation (ECHA 2015).
Linalol
Une recherche documentaire sur le linalol n’a pas permis de relever des préoccupations relatives à la génotoxicité ou à la cancérogénicité de la substance. En outre, on n’a signalé aucun effet nocif à des doses inférieures à 1000 mg/kg p.c./jour lors d’études sur la toxicité pour la reproduction et le développement ou d’essais à court terme sur la toxicité. De plus amples renseignements sur les effets du linalol sur la santé figurent dans la section sur le potentiel d’effets nocifs sur la santé humaine portant sur l’essence de bois de rose (section 7.1.2).
8.2.2.3 Caractérisation des risques pour la santé humaine
Nous avons déterminé que le paramètre préoccupant est la DSENO sur le développement de 30 mg/kg p.c./jour en se fondant sur la hausse des anomalies du squelette du fœtus et du retard de l’ossification observée à une dose de 60 mg/kg p.c./jour observée par une étude par voie orale sur le développement des rats réalisée avec de l’α-terpinène (analogue par lecture croisée au composant principal, le γ‑terpinène). La sous-population vulnérable est constituée des femmes en âge de procréer (adolescentes et femmes adultes), nous donc n’avons caractérisé que le risque posé à cette sous-population.
Pour l’exposition par voie cutanée et par inhalation, nous avons extrapolé d’une voie d’exposition à une autre à partir des paramètres mentionnés dans les sections précédentes.
La dose critique établie pour le citral, l’un des composants des essences de mandarine et de tangerine (en concentrations de 15 % à 19 %), a aussi été prise en compte pour l’exposition par inhalation. La dose critique correspondait à une CSENO de 215 mg/m3, soit 34 ppm (ajustée à 53,75 mg/m3 pour représenter une exposition de 6 h/jour), et se fondait sur le taux de mortalité et d’avortement observé chez les mères exposées à une concentration de 423 mg/m3 lors d’une étude sur la toxicité du citral pour le développement du rat (Gawarski et coll. 1992). Nous ne savons pas si la toxicité observée découlait, comme dans le cas de l’huile de lemon-grass, d’une seule exposition et de plus, les auteurs de l’étude ont signalé une irritation grave des voies respiratoires. Nous avons estimé qu’il était approprié de comparer les concentrations atmosphériques du scénario d’exposition par inhalation directement avec la CSENO ajustée obtenue par l’étude sur la toxicité par inhalation (section 7.7.2). Pour garantir qu’une exposition potentielle au citral par inhalation causée par l’utilisation de l’essence de mandarine ou de tangerine ne soit pas préoccupante, on a comparé la concentration dans l’air la plus élevée (1,45 mg/m3 sur 24 h) tirée du scénario d’aromathérapie, ajustée selon la concentration maximale de 20 % de citral dans ces essences (soit 0,29 mg/m3), à la CSENO ajustée du citral de 53,75 mg/m3. Cette comparaison a permis d’obtenir une marge d’exposition de 185, laquelle est jugée adéquate pour compenser les incertitudes des bases de données.
Les principaux composants des essences de mandarine et de tangerine sont le limonène (52 à 96 %), le γ‑terpinène (traces à 61 %), le citral total (15 % à 19 %), le N‑méthylanthranilate de méthyle (0 % à 58 %) et le linalol (0,2 % à 59 %). En l’absence de données toxicologiques sur le γ‑terpinène, l’α‑terpinène, un analogue par lecture croisée du γ‑terpinène, a servi à éclairer la caractérisation des risques associés aux essences de mandarine et de tangerine. Comme on n’a relevé aucun effet toxicologique préoccupant pour les autres composants principaux des essences de mandarine et de tangerine outre la dose critique par inhalation pour le citral déterminée ci-dessus et la phototoxicité associée au N‑méthylanthranilate de méthyle, on a jugé approprié d’ajuster toutes les estimations d’exposition pour une concentration de 60 %, soit la concentration maximale de γ‑terpinène présente dans les essences de mandarine et de tangerine (Lota et coll. 2000). Cette démarche est prudente, car nous présumons que la quantité de γ‑terpinène dans les essences de mandarine et de tangerine correspond à la quantité maximale détectée et que le γ‑terpinène et l’α‑terpinène présentent une toxicité équivalente.
| Scénario d’expositiona | Exposition systémique (mg/kg p.c./jour)b | Marge d’expositionc |
|---|---|---|
| Aromatisant alimentaire (apport alimentaire) | 3,98 × 10-2 (6 mois et plus) | 754 (6 mois et plus) |
| Exposition systémique par voie cutanée et par inhalation à partir de lotions pour le corps (5 %)d | 7,25 × 10-1 à 8.74 × 10-1 (adolescents-adultes) | 34 à 41 (adultes-adolescents) |
| Exposition systémique par voie cutanée à partir d’écrans solaires (1 %)e,g | 8,63 × 10-2 à 1,03 × 10-1 (adultes-adolescents) | 291 à 348 (adolescents-adultes) |
| Exposition systémique par inhalation à partir de parfums (30 %) (5,8 × 10-2 mg/m3) | 8,00 × 10-3 à 9,00 × 10-3 (adultes-adolescents) | 3750 à 3333 (adolescents à -adultes) |
| Exposition systémique par voie cutanée et par inhalation à partir d’huiles de massage (4 gouttes à concentration maximale de 100 %)e | 6,71 × 10-2 à 8,00 × 10-2 (adultes-adolescents) | 375 à 447 (adolescents A adultes) |
| Exposition systémique par inhalation à partir de produits d’aromathérapie (1,45 mg/m3)f | 3,00 × 10-2 à 4,00 × 10-2 (adultes à adolescents) | 750 à 1000 (adolescents-adultes) |
| Exposition systémique par voie cutanée et par inhalation due au mélange, au chargement et à l’application de nettoyants liquides tout usage (1 %)e | 4,95 × 10-3 (adultes) | 6060 (adultes) |
| Exposition systémique par voie cutanée et par inhalation due au mélange, au chargement et à l’étendage de vêtements lavés à la machine (5 %)e | 1,01 × 10-2 (adultes) | 2969 (adultes) |
| Ingrédient non médicinal dans des suppléments nutritifs | 2,54 × 10-1 (adultes) | 118 (adultes) |
a L’annexe E présente les paramètres et les calculs utilisés dans les scénarios d’exposition à l’essence de mandarine et de tangerine.
b Exposition ajustée pour une concentration de 60 %, soit la concentration maximale de γ‑terpinène présente dans l’essence de mandarine et de tangerine (61 % dans les feuilles, Lota et coll. 2000)
c Marge d’exposition calculée à l’aide de la dose critique (DSENO = 30 mg/kg p.c./jour) pour le γ‑terpinène, fondée sur la hausse des anomalies du squelette des fœtus, du retard de l’ossification et du poids des organes observée lors d’une étude par voie orale sur le développement des rats réalisée avec de l’α‑terpinène (analogue par lecture croisée au γ‑terpinène).
d On considère une absorption cutanée de 20 % (zone de peau recouverte).
e On considère une absorption cutanée de 4 % (zone de peau non recouverte).
f Consulter l’annexe D pour obtenir des précisions sur le scénario d’exposition par aromathérapie.
g On n’a pas calculé de scénarios d’exposition par inhalation aux écrans solaires, car on a présumé que les produits solaires seraient employés à l’extérieur, et donc, que l’exposition par inhalation à ces produits serait négligeable par rapport à l’exposition par voie cutanée.
La marge d’exposition entre la dose critique et l’estimation d’exposition quotidienne à l’essence de mandarine due à l’utilisation d’un hydratant corporel se situait entre 34 et 41. De plus, la marge d’exposition calculée pour l’exposition découlant de la consommation d’un supplément nutritif était de 118. Ces marges d’exposition sont jugées comme potentiellement inadéquates pour compenser les incertitudes des bases de données sur les effets sur la santé et l’exposition.
Pour tous les autres scénarios, les marges d’exposition entre la dose critique et l’estimation d’exposition sont jugées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
8.2.2.4 Incertitudes de l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principale source d’incertitude | Effet |
|---|---|
| Les estimations d’exposition découlant de l’utilisation de l’essence de mandarine ou de tangerine dans les écrans solaires ne tenaient pas compte de l’exposition potentielle à la substance par inhalation, ce qui pourrait se traduire par une sous-estimation de l’exposition systémique totale en raison de la volatilité de la substance. Cependant, comme les écrans solaires sont généralement employés à l’extérieur, on ne s’attend pas à ce que l’exposition par inhalation représente une grande part de l’exposition systémique globale. | - |
| Le fait de combiner les expositions par voie cutanée et par inhalation dans les scénarios relatifs aux produits nettoyants et de calculer l’exposition pour chaque voie à partir d’hypothèses prudentes pourrait produire des estimations prudentes. | + |
| Les estimations d’exposition par inhalation à l’essence de mandarine ou de tangerine contenue dans des produits dépendent largement de paramètres comme le volume de la pièce, le taux de renouvellement d’air, le temps passé dans la zone d’exposition et le calcul de la moyenne pondérée dans le temps. Or, chacun de ces paramètres est variable et comporte une incertitude. Nous avons donc utilisé des hypothèses prudentes. | + |
| Il existe un degré d’incertitude lié à l’extrapolation des données d’absorption par voie cutanée du linalol et du citronellol aux essences de mandarine et de tangerine. Toutefois, comme tous les monoterpènes acycliques, monocycliques et bicycliques et leurs constituants ont des propriétés physicochimiques similaires, on s’attend à ce que l’absorption par voie cutanée de ces composés soit similaire. | +/- |
| L’extrapolation d’une voie d’exposition à une autre pour les essences de mandarine et de tangerine a été réalisée pour les scénarios d’exposition par voie cutanée et par inhalation à partir de la dose critique tirée d’une étude par voie orale. | +/- |
| Il n’existe aucune étude sur l’exposition par voie cutanée ou par inhalation. | +/- |
| L’α‑terpinène employé lors de l’étude sur sa dose critique était pur à 89 %, ce qui représente une incertitude, car on ne sait pas si les effets critiques observés auraient pu être causés par une autre substance. | +/- |
| On s’est servi du composant principal des essences de mandarine et de tangerine (le γ‑terpinène) pour éclairer l’évaluation des effets sur la santé. En raison de la grande variation des concentrations (allant de traces à une concentration de 61 %) de γ‑terpinène dans les essences de mandarine et de tangerine, les dangers potentiels associés au γ‑terpinène pourraient ne pas correspondre à ceux liés aux essences. | + |
| On a utilisé l’α‑terpinène et le δ‑terpinène comme analogues par lecture croisée du γ‑terpinène, ce qui est considéré comme une démarche prudente étant donné qu’on présume que le danger observé associé à l’α‑terpinène correspond à celui des essences de mandarine et de tangerine. | + |
+ = incertitude quant au potentiel de surestimation de l’exposition ou du risque; – = incertitude quant au potentiel de sous-estimation du risque d’exposition; +/ – = potentiel inconnu de surestimation ou de sous-estimation du risque.
8.3 L’α‑pinène
8.3.1 Sources et utilisations
L’α‑pinène est une substance d’origine naturelle obtenue par la distillation de la térébenthine qui entre dans la composition de plus de 400 huiles essentielles différentes et se trouve en plus fortes concentrations dans l’Achillea millefolium, l’Artemisia tridentata, le romarin italien, le thym sauvage, la lavande française, la coriandre et le cumin (Burdock 2010). On a également signalé sa présence dans plus de 200 produits naturels, dont de nombreux fruits, légumes, épices et herbes (Burdock 2010).
Selon les renseignements fournis lors d’une enquête menée en vertu de l’article 71 de la LCPE (Canada 2009), on a élaboré de 1 000 000 à 10 000 000 kg d’α‑pinène au Canada en 2008, et on en a importé entre 500 et 5300 kg (Environnement Canada 2009).
Selon les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, l’α‑pinène entre dans la composition d’un nombre restreint de produits cosmétiques, en des concentrations variant de < 0,1 % à 30 % (communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canda, 2017; sans référence). Une brume pour le visage, des nettoyants, des parfums, des revitalisants et des produits pour le bain sont certains des produits déclarés. La majorité des produits (> 60 %) contient une concentration de 1 % ou moins d’α‑pinène.
La substance figure également à la liste de l’International Fragrance Association à titre de parfum employé dans les produits de consommation (IFRA 2017).
D’après les renseignements fournis lors d’une enquête menée en vertu de l’article 71 de la LCPE, la substance est aussi employée dans les emballages alimentaires, les produits de papier, les peintures et revêtements, et les matériaux de construction en bois, car elle est produite lors du processus de réduction du bois en pâte (Environnement Canada 2009). On trouve également de l’α‑pinène dans les assainisseurs d’air pour voiture (FDS 2004).
L’α‑pinène est utilisé dans les boissons alcoolisées ou non alcoolisées, les produits de boulangerie, les bonbons et la gomme à mâcher, les condiments, les produits laitiers congelés, les gélatines et les poudings, et les produits carnés (Burdock 2010). Il figure dans l’inventaire des substances ajoutées aux aliments de la FDA, le Codex des produits chimiques alimentaires et la Base de données des aromatisants alimentaires de l’Union européenne à titre d’agent aromatisant (USFDA 2018; OMS 2006 b; FEMA 2017; FCC 2018; UE 2016). Il n’existe aucune donnée précise sur l’utilisation potentielle de l’α‑pinène comme aromatisant alimentaire au Canada. Toutefois, puisqu’on sait que la substance est employée à ce titre aux États-Unis, elle pourrait être présente en tant qu’aromatisant alimentaire dans des aliments vendus au Canada.
D’autres utilisations de l’α‑pinène sont présentées dans le tableau 8.3-1.
| Utilisation | Précisions |
|---|---|
| Aromatisant alimentairea | Utilisations déclarées dans les boissons alcoolisées ou non alcoolisées, les produits de boulangerie, les bonbons et la gomme à mâcher, les condiments, les produits laitiers congelés, les gélatines et les poudings, et les produits carnés (Burdock 2010) |
| Base de données sur les ingrédients de produits de santé naturelsb | INM |
| Base de données sur les produits de santé naturels homologués présents en tant qu’ingrédients médicinaux ou non médicinaux dans les produits de santé naturels au Canadab | INM |
| Signalé comme étant présent dans les cosmétiques, selon les déclarations présentées à Santé Canada en vertu du Règlement sur les cosmétiquesc | Produits de soin pour la peau et les cheveux (lotions, nettoyants), et parfums |
| Formulant dans des produits antiparasitaires homologués au Canadad | Formulant |
Abréviations : INM, ingrédient non médicinal.
a Communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, janvier 2017; sans référence; Burdock 2010.
b Communication personnelle, courriel de la Direction des produits de santé naturels de Santé Canada et sans ordonnance au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, décembre 2016; sans référence.
c Communication personnelle, courriel de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, janvier 2016; sans référence.
d Communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, janvier 2018; sans référence.
8.3.2 Potentiel d’effets nocifs sur la santé humaine
8.3.2.1 Évaluation de l’exposition
L’α‑pinène devrait se répartir presque entièrement dans l’air étant donné sa forte pression de vapeur (633 Pa) et le milieu environnant (Kim et coll. 2016). De plus, en raison de sa faible hydrosolubilité (2,49 mg/L) et de sa constante de Henry très élevée (0,30 atm-m3/mol), l’α‑pinène devrait se volatiliser rapidement depuis la surface de l’eau.
Comme l’α‑pinène est naturellement présent dans les conifères, son émission par les arbres et son rejet par des produits du bois en constituent d’importantes sources dans l’air extérieur et intérieur, respectivement (NTP 2002).
Air extérieur
On a déclaré l’α‑pinène à l’Inventaire national des rejets de polluants (INRP) d’Environnement et Changement climatique Canada. Pour l’année de déclaration 2015, 4 751 000 kg (4751 tonnes) d’α‑pinène ont été rejetés dans l’atmosphère par diverses entreprises canadiennes (ECCC 2016c). En examinant les rejets déclarés d’α‑pinène et leur proximité avec les zones résidentielles, nous avons repéré une installation sentinelle de fabrication de produits de bois d’ingénierie située de 200 à 500 m d’une zone résidentielle qui avait déclaré des rejets de 83 300 kg (83,3 t) [ECCC 2016c]. Par conséquent, les concentrations mesurées à 200 m de la source d’émission ont servi à simuler l’exposition potentielle à l’α‑pinène découlant de rejets industriels. SCREEN3, un modèle gaussien de dispersion atmosphérique simple à l’échelle du dépistage, a permis de modéliser la concentration d’α‑pinène dans l’air ambiant associée aux rejets industriels (SCREEN3 1996). Il a été élaboré à partir du modèle Industrial Source Complex (ISC), qui permet d’évaluer les concentrations de polluants provenant de diverses sources dans un complexe industriel. SCREEN3 est conçu pour estimer les concentrations maximales de substances chimiques à des altitudes de répartition choisies et à différentes distances de la source de rejet pour une source d’émission continue donnée. La concentration d’exposition maximale calculée est choisie à l’aide d’une matrice de données météorologiques intégrée de différentes combinaisons de conditions météorologiques, y compris la vitesse éolienne, la turbulence et l’humidité. Le facteur déterminant de la dispersion atmosphérique dans le modèle SCREEN3 est le vent. Ce modèle prédit directement les concentrations attribuables aux rejets d’une source ponctuelle, diffuse ou en volume. SCREEN3 fournit la concentration maximale d’exposition sous le vent dominant, une heure après un rejet. Supposant un scénario de rejet continu sur 24 heures et en tenant compte des différentes directions du vent pendant cette période, une concentration maximale d’exposition pendant 24 heures est estimée en multipliant la concentration mesurée par un facteur de 0,4. En ce qui concerne les expositions s’échelonnant sur une année, on peut s’attendre à ce qu’avec les changements de direction des vents, la concentration de la substance dans l’air pour une source de rejet régionale ne varie pas dans la même mesure que celle mesurée pour une source ponctuelle de rejet. Puisque les conditions météorologiques donnant lieu à une exposition d’une heure peuvent persister plus longtemps, la concentration maximale pour une année est calculée en multipliant la concentration maximale d’une heure par un facteur de 0,2. Les résultats sont inclus dans le présent document et fournis à l’annexe F (tableaux F‑4 et F‑5). Comme présentée dans le tableau F‑5, l’estimation de la limite supérieure annuelle des émissions d’α‑pinène à 200 m de l’installation était de 6,76 µg/m3 (source ponctuelle de rejet).
Dans le cadre de quatre études canadiennes menées à Windsor, Regina, Halifax et Edmonton, on a mesuré les quantités d’α‑pinène dans l’air extérieur (SC 2010a, b, 2012, 2013). Dans l’ensemble de ces études, les concentrations d’α‑pinène dans l’air extérieur mesurées allaient d’une concentration inférieure au seuil de détection de la méthode à 8,33 µg/m3, tandis que les concentrations moyennes géométriques variaient entre une concentration inférieure au seuil de détection et 0,32 µg/m3. Nous avons choisi la concentration la plus élevée d’α‑pinène dans l’air extérieur au 95e percentile d’un grand échantillonnage (> 30 échantillons) comme étant représentative de l’exposition de la population générale à la substance à partir de l’air extérieur (1,55 µg/m3 en fonction des échantillons prélevés pendant 24 h au cours de l’étude menée à Regina) [SC 2010b].
Air intérieur
On a mesuré les quantités d’α‑pinène lors d’une étude pancanadienne sur l’air intérieur réalisée de 2009 à 2011 dans le cadre du deuxième cycle de l’Enquête canadienne sur les mesures de la santé (ECMS). La présence d’α‑pinène a été détectée dans 99,92 % des échantillons. On a trouvé une moyenne géométrique de la concentration de 5,62 µg/m3 (données pondérées pour les ménages) et une concentration au 95e centile de 43,45 µg/m3 (Zhu et coll. 2013).
Les concentrations d’α‑pinène ont aussi été mesurées dans l’air intérieur lors des quatre études canadiennes susmentionnées. Elles se situaient entre une concentration inférieure au seuil de détection de la méthode et 1010 µg/m3, tandis que les concentrations moyennes géométriques se situaient entre 0,30 et 26,86 µg/m3 dans l’ensemble de ces études de surveillance de l’air intérieur. Selon les données de l’étude réalisée à Windsor, la concentration la plus élevée dans l’air intérieur, au 95e centile, était de 380,63 µg/m3 (SC 2010a).
On a aussi procédé à l’échantillonnage de l’air personnel lors de l’étude d’évaluation de l’exposition réalisée à Windsor et au cours de laquelle des participants adultes ont transporté une cartouche de 1,0 L pour l’analyse des composés organiques volatils pendant 24 h pendant 5 jours consécutifs. Les concentrations d’α‑pinène dans les échantillons d’air personnel se situaient entre 0,66 et 1199,74 µg/m3. Les concentrations moyennes géométriques des échantillons d’air personnel prélevés en hiver et en été étaient respectivement de 7,37 et 33,09 µg/m3, tandis que les concentrations du 95e percentile en hiver et en été étaient respectivement de 59,29 et 531,80 µg/m3 (SC 2010a).
De plus, des quantités d’α‑pinène ont été détectées dans l’air intérieur après la construction d’une nouvelle résidence, issues principalement des planchers de parquet (Won et coll. 2017). On a aussi signalé des émissions d’α‑pinène depuis d’échantillons de matériaux de construction au Canada, notamment le calfeutrage, les carreaux de plafond, les tapis, les comptoirs, les panneaux de gypse, les planchers lamellaires, les panneaux de fibres à densité moyenne, les panneaux de copeaux orientés, le pin massif, le contreplaqué et les poutres-solives en I. Les matériaux ayant les émissions d’α‑pinène les plus élevées à 24 h étaient le pin massif (968,5 µg/m3), les poutres-solives en I (22,0 à 363,0 µg/m3), le contreplaqué (125,7 µg/m3) et les panneaux de gypse (42,1 µg/m3) [Won et coll. 2013, 2014, Won et Lusztyk 2011]. Après 24 h, les concentrations atmosphériques dans la chambre se situaient entre 0,01 et 968,5 µg/m3 (Won et Lusztyk 2011). De plus, on a aussi détecté des émissions d’α‑pinène provenant de thibaudes, de planchers composites, de meubles, de diluants à peinture, de vernis et d’assainisseurs d’air (Won et Yang 2012). On envisage de tenir compte de ces sources lors de l’évaluation de l’exposition causée par l’air intérieur.
Aliments et produits offerts aux consommateurs
Selon l’évaluation de l’innocuité d’aromatisants alimentaires présentée par le Comité mixte FAO-OMS d’experts sur les additifs alimentaires lors de sa 63e réunion (OMS 2006 b), on estime que l’absorption par personne d’essence d’α‑pinène employée comme aromatisant alimentaire est de 2,44 mg/personne pour la population américaine (communications personnelles, courriels de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, 2018; sans référence). En se basant sur un poids corporel de 70,9 kg pour un adulte, on peut estimer une absorption de 3,40 × 10-2 mg/kg p.c./jour.
En se fondant sur une estimation de la consommation annuelle de divers aliments aux États-Unis et sur des données sur la présence quantitative d’α‑pinène dans la nourriture (Stofberg et Grundschober 1987), le Comité a aussi déterminé que l’absorption relative d’α‑pinène due à sa présence naturelle dans les aliments est environ 10 fois plus grande que celle découlant de l’utilisation de la substance comme aromatisant. Par conséquent, on estime que l’exposition alimentaire à l’α‑pinène causée par sa présence naturelle dans les aliments est de 24,4 mg/personne/jour pour la population américaine, soit environ 4,10 × 10-1 mg/kg p.c./jour.
Pour évaluer le potentiel d’exposition par voie cutanée à l’α‑pinène à partir de cosmétiques, un scénario sentinelle a été choisi en fonction des fréquences d’utilisation de ces produits et des concentrations déclarées d’α‑pinène contenues dans ceux‑ci. La plus forte exposition quotidienne à l’α‑pinène devrait être causée par l’utilisation de son essence sous forme liquide dans les brumes pour le visage en concentration maximale déclarée de 10 %. L’exposition systémique par voie cutanée et par inhalation à partir de la brume pour le visage (en présumant une absorption cutanée de 4 %) se situait entre 3,66 × 10-1 mg/kg p.c./jour pour les adultes et 4,28 × 10-1 pour les adolescents. De plus, on a mesuré que l’exposition systémique d’un bambin à la substance par voie cutanée, par inhalation et par ingestion non alimentaire découlant d’un contact avec un plancher nettoyé (contenant 1 % d’α‑pinène) était de 4,22 × 10-2 mg/kg p.c./jour, tandis que l’exposition systémique d’un adulte par voie cutanée et par inhalation causée par le mélange, le chargement et l’application d’un nettoyant à plancher tout usage (aussi à concentration de 1 % d’α‑pinène) était de 1,75 × 10-2 mg/kg p.c./jour. Les tableaux F-1 à F-3 de l’annexe F présentent ces données et l’ensemble des paramètres employés.
L’exposition à l’α‑pinène par inhalation potentiellement causée par un diffuseur d’aromathérapie a été calculée à l’aide d’un document d’évaluation des effets pour la santé des substances chimiques contenues dans les huiles essentielles et les huiles parfumées, rédigé par l’APE du Danemark (2008). Des précisions sur le scénario et les paramètres d’exposition sont présentées à l’annexe D (tableaux D1 et D3). L’exposition à la substance par inhalation peut aussi découler de l’utilisation d’un assainisseur d’air en gel (contenant de 1 % à 5 % d’α‑pinène). L’exposition systémique par inhalation causée par l’utilisation d’appareil d’aromathérapie allait de 5,53 × 10-2 mg/kg p.c./jour pour les adultes à 1,45 × 10‑1 mg/kg p.c./jour pour les bambins et, dans le cas d’utilisation d’assainisseurs d’air en gel, de 8,0 × 10-3 mg/kg p.c./jour pour les adultes à 2,10 × 10-2 mg/kg p.c./jour pour les bambins.
8.3.2.2 Évaluation des effets sur la santé
À l’échelle internationale, le Comité mixte FAO-OMS d’experts des additifs alimentaires a évalué l’α‑pinène et jugé que selon les concentrations d’ingestion estimées, la substance n’est pas préoccupante sur le plan de la sécurité lorsqu’elle est employée comme aromatisant alimentaire (OMS 2006 b). La FDA souligne que l’α‑pinène peut être utilisé en toute sécurité comme aromatisant à la quantité minimale nécessaire pour produire l’effet désiré (USFDA 2017b).
Il existe peu de données toxicologiques sur l’α‑pinène.
En 2010, l’EPA a effectué la caractérisation préliminaire des dangers causés par l’α‑pinène (une substance commanditée de la catégorie des hydrocarbures terpéniques bicycliques) dans le cadre du Défi des substances chimiques produites en grande quantité (USEPA 2010). De plus, l’EPA a réalisé une lecture croisée des valeurs analogues du camphène (une autre substance évaluée de la même catégorie) afin d’établir, pour l’exposition par voie orale, une DSENO de 250 mg/kg p.c./jour et une DMENO de 1000 mg/kg p.c./jour (USEPA 2010).
Dans le cadre d’une étude de détermination des doses par inhalation corporelle entière d’une durée de deux semaines, on a exposé deux groupes de rats et de souris (5 sujets/genre/dose) à des doses de 100 à 1600 ppm (557 à 8912 mg/m3) d’α‑pinène pendant 6 h 10 par jour, 5 jours par semaine (NTP 2016). Tous les rats et souris exposés aux doses de 800 et 1600 ppm sont morts la première semaine. Une hausse du poids relatif du foie et des reins a été notée chez les rats mâles et femelles exposés à une dose de 400 ppm. On a aussi observé une hausse du poids relatif du foie et des reins chez les souris mâles, mais seulement du foie chez les souris femelles. Seules les femelles exposées à une dose de 100 ppm ont présenté une hausse du poids absolu et relatif des reins. Aucune analyse histopathologique n’a été réalisée. D’après la baisse considérable du poids corporel des rats et souris femelles et la hausse du poids relatif du foie et des reins chez les rats et souris qui ont été observées par les auteurs de l’étude à une dose de 400 ppm, on a déterminé une CSENO de 200 ppm (1246 mg/kg p.c./jour ou DSENOaj = 222 mg/kg p.c./jour) et une CMENO de 400 ppm (2492 mg/kg p.c./jour ou DSENOaj = 445 mg/kg p.c./jour) pour l’exposition à court terme (NTP 2016).
Dans le cadre d’une étude sur l’exposition par inhalation de 14 semaines, on a exposé le corps entier de deux groupes de rats et de souris (10 sujets/genre/dose) à des doses de 25 à 400 ppm (139 à 2228 mg/m3) de vapeur d’α‑pinène pendant 6 h 10 par jour, 5 jours par semaine (NTP 2016). Le décès de 6 rattes sur 10 avant la fin de l’étude laisse à penser qu’elles sont plus sensibles que les rats mâles (NTP 2016). On a observé une hausse de la masse du foie tant chez les rats mâles que femelles exposés à une dose de 400 ppm. Une hausse de la masse des reins a été observée chez les rattes exposées à 50 et 200 ppm, tandis qu’un nombre réduit de spermatozoïdes par épididyme a été noté chez les rats mâles exposés à 200 et 400 ppm. On a observé une hausse des cas d’hyperplasie de l’urothélium de la vessie des souris mâles et femelles à des doses de 100 ppm et plus, ainsi qu’une hausse de la masse du foie à 400 ppm. Les souris mâles montraient aussi un nombre réduit de spermatozoïdes par épididyme aux doses de 100 ppm et plus. D’après la hausse considérable des cas d’hyperplasie de l’urothélium de la vessie chez les souris mâles et femelles et la réduction du nombre de spermatozoïdes par épididyme chez les souris mâles observées à des doses de 100 ppm et plus, les auteurs de l’étude ont conclu que la CSENO était de 50 ppm (66 mg/kg p.c./jour) et la CMENO de 100 ppm (122 mg/kg p.c./jour) pour l’exposition à long terme (NTP 2016).
L’α‑pinène a donné des résultats négatifs au test d’Ames et à l’essai in vivo de micronoyaux. À l’inverse, lors d’une étude sur l’exposition in vitro à l’α‑pinène, on a observé une hausse des effets aneugènes (aberration chromosomique) et clastogènes (micronoyaux) de la substance sur les cellules V-79 de hamsters chinois. Ces effets s’accompagnaient d’une production accrue d’espèces réactives à l’oxygène et d’altérations mitotiques (Catanzaro et coll. 2012).
On a évalué l’absorption, la distribution et l’élimination de l’α‑pinène chez des patients volontaires à la suite d’une seule courte exposition par inhalation de 2 heures à des doses de 0, 10, 225 ou 450 mg/m3 d’α‑pinène dans une chambre d’exposition (Falk et coll. 1990). L’α‑pinène avait un degré d’absorption élevé et a vite été éliminé du sang, ce qui indique que la substance est rapidement métabolisée. On a jugé que l’élimination de l’α‑pinène s’effectuait en trois étapes : la substance est vite détectée après 4,8 et 5,6 minutes, éliminée rapidement après 38 et 40 minutes puis lentement après 695 et 555 minutes pour le (+)-α‑pinène et le (-)-α‑pinène, respectivement. Bien qu’au départ l’α‑pinène s’élimine rapidement du sang, la longue demi-vie de la substance suggère une forte affinité pour les tissus peu irrigués, comme les tissus adipeux. L’étude a aussi permis d’observer une hausse considérable de symptômes d’irritation des yeux, du nez et de la gorge liés à la dose administrée chez les cinq sujets. Cependant, l’exposition à court terme n’a pas entraîné d’effets sur le système nerveux central ou de changements à la fonction pulmonaire.
8.3.2.3 Caractérisation des risques pour la santé humaine
L’étude de 14 semaines menée par le NTP (2016) a permis de déterminer que la dose d’effets critiques pour l’α‑pinène est une CSENO de 50 ppm, ce qui équivaut à 66 mg/kg p.c./jour ou à 49,73 mg/m3 lorsque la dose est ajustée pour tenir compte d’une exposition de 6 heures par jour, 5 jours par semaine (consulter l’annexe F-6 pour plus de détails sur les conversions de doses). La dose critique a été déterminée en fonction de la hausse considérable des cas d’hyperplasie de l’urothélium de la vessie chez les souris mâles et femelles observée à une dose égale ou supérieure à 100 ppm (équivalant à 133[JC1] mg/kg p.c./jour lorsqu’ajustée pour une exposition de 6 heures par jour, 5 jours par semaine) et de la réduction du nombre de spermatozoïdes par épididyme chez les souris mâles observée à des doses de 100 ppm et plus.
On n’a recensé aucune donnée relative aux effets sur la santé d’une exposition par voie orale ou cutanée à l’α‑pinène. Par conséquent, on a extrapolé les données sur l’exposition par inhalation pour obtenir l’exposition par voie orale. On a converti la CSENO de 50 ppm pour l’exposition par inhalation en dose orale (équivalant à 66 mg/kg p.c./jour lorsqu’ajustée pour une exposition de 6 heures par jour, 5 jours par semaine) à l’aide de valeurs normales d’inhalation et de poids corporels. On a présumé que l’absorption par inhalation et l’absorption par voie orale sont équivalentes. L’EPA a recommandé une DSENO de 250 mg/kg p.c./jour pour l’α‑pinène, en se basant sur une lecture croisée des valeurs analogues du camphène. Toutefois, les données sur l’α‑pinène contenues dans la présente évaluation ont été jugées plus pertinentes et prudentes.
Étant donné leur durée, tous les scénarios pour l’α‑pinène décrivent des expositions chroniques (les produits sont employés sur une base quotidienne ou hebdomadaire), les résultats de l’étude de détermination des doses de deux semaines n’ont pas servi à la caractérisation des risques associés à la substance.
Les effets critiques observés lors de l’étude de 14 semaines sur l’exposition par inhalation étaient de nature systémique (hyperplasie de l’urothélium de la vessie et réduction des spermatozoïdes dans les épididymes). Ils devraient survenir à la suite d’expositions répétées, car ils n’ont pas été observés lors de l’étude de détermination des doses de deux semaines. Par conséquent, il a été jugé approprié de calculer les expositions par inhalation en fonction du poids corporel et de comparer ces expositions à une dose systémique ajustée tirée de l’étude par inhalation. On a calculé les expositions systémiques par inhalation à l’aide de la concentration dans l’air moyenne pondérée sur 24 heures provenant du scénario d’exposition et des taux d’inhalation et poids corporels décrits par Santé Canada (1998).
| Scénario d’expositiona | Exposition systémique (mg/kg p.c./jour) | Marge d’expositionb |
|---|---|---|
| Exposition systémique par inhalation et par l’alimentation à partir de l’environnement (air, aromatisant alimentaire, présence naturelle dans les aliments) | 3,20 × 10-1 à 5,73 × 10-1 (95e percentile) (bambins-adultes) 2,00 × 10-2 à 4,59 × 10-1 (moyenne géométrique) (bambins et adultes) | 115 à 206 (95e percentile) (adultes-bambins) 144 à 3293 (moyenne géométrique) (adultes-bambins) |
| Exposition systémique par inhalation à partir de l’environnement (air intérieur) | 1,22 × 10-1 à 3,19 × 10-1 (adultes et bambins) | 207 à 543 (bambins à adultes) |
| Exposition systémique par inhalation à partir de rejets industriels (air extérieur) | 1,54 × 10-3 à 4,06 × 10-3 (adultes et bambins) | 16 272 à 42 730 (bambins à adultes) |
| Exposition systémique par voie cutanée et par inhalation à partir de brumes pour le visage (10 %)c | 3,66 × 10-1 à 4,28 × 10-1 (adultes et adolescents) | 154 à 180 (adolescents à adultes) |
| Exposition systémique par voie cutanée et par inhalation due au mélange, au chargement et à l’application de nettoyants tout usage (1 %)c | 1,75 × 10-2 (adultes) | 3771 (adultes) |
| Exposition systémique par voie cutanée, par inhalation et par ingestion non alimentaire due au contact avec des planchers nettoyés (1 %)c | 4,23 × 10-2 (bambins) | 1561 (bambins) |
| Exposition systémique par voie cutanée et par inhalation due au mélange, au chargement et à l’étendage de vêtements lavés à la machine (1 %)c | 1,73 × 10-2 (adultes) | 3815 (adultes) |
| Exposition systémique par inhalation à partir de produits d’aromathérapied | 5,53 × 10-2 à 1,45 × 10-1 (adultes-bambins) | 455 à 1194 (bambins-adultes) |
| Exposition systémique par inhalation à partir d’assainisseurs d’air en gel (5 %) | 8,00 × 10-3 à 2,10 × 10-2 (adultes-bambins) | 3143 à 8253 (bambins-adultes) |
a L’annexe F présente les paramètres et les calculs utilisés dans les scénarios d’exposition à l’α‑pinène.
b Marge d’exposition calculée à partir de la dose critique (DSENOaj = 66 mg/kg p.c./jour), en fonction de l’hyperplasie de l’urothélium de la vessie (mâles et femelles) et de la réduction du nombre de spermatozoïdes dans les épididymes (mâles) observées lors d’une étude de 14 semaines sur l’exposition par inhalation à l’α‑pinène chez la souris.
c On considère une absorption cutanée de 4 % (zone de peau non recouverte).
d L’annexe D donne plus de détails sur les scénarios d’exposition par aromathérapie.
Pour l’ensemble des scénarios, les marges d’exposition entre la dose critique et l’estimation d’exposition des scénarios figurant au tableau 8.3-2 sont jugées suffisantes pour compenser les incertitudes des bases de données sur les effets sur la santé et l’exposition.
8.3.2.4 Incertitudes de l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principale source d’incertitude | Effet |
|---|---|
| Le fait de combiner les expositions par voie cutanée et par inhalation dans les scénarios relatifs aux produits nettoyants et de calculer l’exposition pour chaque voie à partir d’hypothèses prudentes pourrait produire des estimations prudentes. | + |
| Les estimations d’exposition par inhalation à l’α‑pinène contenu dans des produits dépendent largement de paramètres comme le volume de la pièce, le taux de renouvellement d’air, le temps passé dans la zone d’exposition et le calcul de la moyenne pondérée dans le temps. Chacun de ces paramètres est variable et comporte une incertitude. Des hypothèses prudentes ont été utilisées. | + |
| Il existe un degré d’incertitude lié à l’extrapolation des données d’absorption par voie cutanée du linalol et du citronellol à l’α‑pinène. Toutefois, comme tous les monoterpènes acycliques, monocycliques et bicycliques et leurs constituants ont des propriétés physicochimiques similaires, on s’attend à ce que l’absorption par voie cutanée de ces composés soit similaire. | +/- |
| L’extrapolation d’une voie d’exposition à une autre pour l’α‑pinène a été réalisée pour des scénarios d’exposition par voie cutanée à partir de la dose critique tirée d’une étude par inhalation. | +/- |
| Il existe peu de renseignements sur les effets de l’exposition à doses répétées à l’α‑pinène pour les voies d’exposition pertinentes et différentes durées. | +/- |
+ = incertitude quant au potentiel de surestimation de l’exposition ou du risque; – = incertitude quant au potentiel de sous-estimation du risque d’exposition; +/ – = potentiel inconnu de surestimation ou de sous-estimation du risque.
8.4 Essence de térébenthine et térébenthine
8.4.1 Sources et utilisations
La térébenthine est une substance d’origine naturelle provenant des oléorésines semi-fluides de diverses espèces de conifère du genre Pinus, surtout le Pinus palustris (NTP 2002; Burdock 2010). La térébenthine (NR CAS 9005-90-7) et l’essence de térébenthine (NR CAS 8006-64-2) sont souvent employées de manière interchangeable et les publications scientifiques n’en donnent pas des définitions constantes. Cela dit, leurs compositions sont pratiquement identiques.
Les écrits scientifiques nous informent que les principaux composants de la térébenthine et de l’essence de térébenthine sont l’α‑pinène (44 % à 94 %), le β‑pinène (0,9 % à 30 %), le limonène (0,7 % à 25 %) et le camphène (1 % à 15 %) [Tisserand et Young 2014; NTP 2002]. Or, une analyse préliminaire récente des essences de térébenthine vendues par des quincailleries canadiennes a montré que la fraction volatile de la substance est principalement composée de limonène, de terpinolène et d’environ 20 % d’α‑terpinène et de γ‑terpinène. La même analyse de la composition effectuée pour des térébenthines et essences de térébenthine vendues par des boutiques de matériel d’art a permis de confirmer que la fraction volatile de ces substances contient principalement de l’α‑pinène et du β‑pinène (SC 2019).
D’après les renseignements divulgués lors d’une enquête menée en vertu de l’article 71 de la LCPE (Canada 2012), on a produit environ 18 000 000 kg de térébenthine au Canada en 2011, et on n’a pas importé la substance en quantités dépassant le seuil de déclaration de 100 kg (Environnement Canada 2013).
On n’a pas mené d’enquête en vertu de l’article 71 de la LCPE relativement à la substance dont le NR CAS est 8006-64-2. Cependant, aux États-Unis en 2005, on a rapporté avoir produit ou importé cette substance en quantités se situant entre 100 000 000 et 500 000 000 lb (USEPA 2010).
D’après la Base de données sur le commerce international canadien de marchandises (CICM), de 2014 à 2017, on a importé au Canada environ en moyenne 17 000 kg par année d’« essences de térébenthine, de bois de pin ou de papeterie au sulfate » (code du Système harmonisé 380510) [CICM 2017].
Selon les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, on trouve de la térébenthine ou de l’essence de térébenthine dans un nombre restreint de produits cosmétiques au Canada, en des concentrations de 0,1 % ou moins (communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada, 2017, sans référence).
Selon les renseignements fournis lors d’une enquête menée en vertu de l’article 71 de la LCPE, on emploie aussi la térébenthine comme odorisant dans les produits de nettoyage et d’entretien de mobilier, les détergents à lessive et à vaisselle, les produits d’assainissement de l’air, les produits d’entretien de vêtements, de chaussures et d’automobiles ainsi que dans les lubrifiants et graisses (Environnement Canada 2013).
La térébenthine figure également à la liste de l’International Fragrance Association à titre de parfum ajouté aux produits de consommation (IFRA 2017).
On trouve aussi l’essence de térébenthine dans des produits d’entretien automobile (FDS 2013) et dans des solvants à base de térébenthine (FDS 2013).
La térébenthine et l’essence de térébenthine figurent dans l’inventaire des substances ajoutées aux aliments de la FDA et dans le Codex des produits chimiques alimentaires à titre d’agent aromatisant (USFDA 2018). La térébenthine se trouve dans les produits de boulangerie (Burdock 2010) et l’essence de térébenthine se trouve dans les boissons alcoolisées ou non alcoolisées, les produits de boulangerie, les bonbons et la gomme à mâcher, les condiments, les produits laitiers congelés, les gélatines et les poudings, et les produits carnés (Burdock 2010). Il n’existe aucune donnée précise sur l’utilisation potentielle de la térébenthine ou de l’essence de térébenthine comme aromatisants alimentaires au Canada. Toutefois, puisqu’on sait que les substances sont employées à ce titre aux États-Unis, elles pourraient être présentes en tant qu’aromatisants alimentaires dans des aliments vendus au Canada.
La térébenthine a déjà été le diluant à peinture et à vernis le plus populaire, mais elle a depuis été remplacée par des produits moins chers à base de pétrole. On l’utilise maintenant, surtout pour des applications spécialisées comme les peintures en aérosol, les revêtements pour poterie et céramique, les couleurs pour artistes et les peintures pour navires. Elle peut aussi entrer dans la composition de cirages à chaussures et d’encaustiques pour meubles (NTP 2002).
D’autres utilisations de la térébenthine et de l’essence de térébenthine sont présentées dans le tableau 8.4-1.
| Utilisation | Essence de térébenthine (NR CAS 8006-64-2) | Térébenthine (NR CAS 9005-90-7) |
|---|---|---|
| Aromatisant alimentairea | O | O |
| Additif indirecta | Composant de nettoyants; aucune possibilité de contact direct avec les aliments, car la substance est rincée à l’eau potable. | N |
| Base de données sur les ingrédients de produits de santé naturelsb | O – IM, INM (base, parfum, agent de réduction de la viscosité) | N |
| Base de données sur les produits de santé naturels homologués présents comme ingrédients médicinaux ou non médicinaux dans les produits de santé naturels au Canadab | O – IM, INM | O – INM |
| Signalées comme étant présentes dans les cosmétiques, selon les déclarations présentées à Santé Canada en vertu du Règlement sur les cosmétiquesc | O (produits de soin pour la peau et les cheveux et produits de massage) | O (produits de soin pour la peau et les cheveux et produits de massage) |
| Formulant dans des produits antiparasitaires homologués au Canadad | O | O |
Abréviations : O, utilisation déclarée pour cette substance; N, aucune utilisation déclarée pour cette substance; IM, ingrédient médicinal; INM, ingrédient non médicinal.
a Communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, 2015 et janvier 2017; sans référence
b Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, décembre 2016 et février 2017; sans référence
c Communication personnelle, courriel de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, janvier 2016; sans référence
d Communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, janvier 2018; sans référence
8.4.2 Potentiel d’effets nocifs sur la santé humaine
8.4.2.1 Évaluation de l’exposition
Étant donné le milieu environnant, l’α‑pinène (qui constitue de 44 % à 94 % de la térébenthine et de l’essence de térébenthine) a servi à éclairer la répartition dans l’environnement de ces substances. En raison de sa pression de vapeur élevée (633 Pa), l’α‑pinène devrait se répartir presque entièrement dans l’air (Kim et coll. 2016). De plus, compte tenu de sa faible hydrosolubilité (2,49 mg/L) et de sa constante de Henry très élevée (0,30 atm-m3/mol), l’α‑pinène devrait se volatiliser rapidement depuis la surface de l’eau.
On n’a trouvé aucune donnée sur la surveillance de l’essence de térébenthine dans l’air, mais son composant principal, l’α‑pinène, est abordé à la section 8.3.2.1.
L’exposition alimentaire des Canadiens à la térébenthine et à l’essence de térébenthine utilisées comme aromatisants alimentaires a été estimée à l’aide de valeurs de consommation individuelle de 8,05 × 10-5 mg/kg p.c./jour pour la térébenthine (NR CAS 9005-90-7) et de 1,71 × 10-3 mg/kg p.c./jour pour l’essence de térébenthine (NR CAS 8006-64-2) telles que déterminées pour la population américaine dans le Fenaroli’s Handbook of Flavor Ingredients (communications personnelles, courriels de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, 2017; sans référence).
L’essence de térébenthine peut aussi entrer dans la composition d’additifs alimentaires accidentels, comme les nettoyants. Toutefois, il n’existe aucune possibilité de contact direct avec les aliments, car le produit nettoyant est rincé à l’eau potable (communications personnelles, courriels de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, 2017; sans référence).
Pour évaluer le potentiel d’exposition maximale à la térébenthine à partir de cosmétiques, des scénarios sentinelles ont été choisis en fonction des fréquences d’utilisation de ces produits et des concentrations déclarées de térébenthine et d’essence de térébenthine contenues dans ceux-ci. On s’attend à ce que l’exposition quotidienne la plus élevée à la térébenthine par voie orale découle de l’utilisation d’un baume pour les lèvres contenant une concentration maximale déclarée de 0,1 % de térébenthine ou d’essence de térébenthine. L’exposition systémique par voie orale causée à partir d’un baume pour les lèvres se situait entre 2,90 × 10-4 et 4,00 × 10‑4 mg/kg p.c./jour pour tous les groupes d’âge. On a aussi calculé l’exposition systémique par voie cutanée et par inhalation pour un cirage à chaussures en crème contenant 10 % de térébenthine (adultes : 9,85 × 10-2 mg/kg p.c./jour), un dissolvant pour peintures à l’huile contenant 100 % de térébenthine (adultes : 2,65 mg/kg p.c./jour), un décapant contenant 100 % de térébenthine (adultes : 4,37 × 101 mg/kg p.c./jour) et une cire pour voitures contenant 10 % de térébenthine (adultes : 2,93 × 101 mg/kg p.c./jour). Les tableaux G-1 à G-3 de l’annexe G présentent ces données et l’ensemble des paramètres employés.
On a aussi déclaré utiliser l’essence de térébenthine comme ingrédient non médicinal dans un produit de vapeurs médicamentées à application topique à une concentration de 4,68 % et dans un contre-irritant topique à une concentration de 25 % (communication personnelle de la Direction des produits de santé naturels de Santé Canada et sans ordonnance au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, 2018 et 2019; sans référence). L’exposition systémique par voie cutanée et par inhalation se situait respectivement entre 5,11 et 7,02 mg/kg p.c./jour et entre 2,06 et 4,86 mg/kg p.c./jour pour le produit de vapeurs médicamentées et le contre-irritant.
8.4.2.2 Évaluation des effets sur la santé
Nous n’avons recensé aucun classement des effets de la térébenthine ou des essences de térébenthine sur la santé qui aurait été effectuée par une agence réglementaire nationale ou internationale.
La FDA des États-Unis souligne que la térébenthine et les essences de térébenthine peuvent être utilisées en toute sécurité comme aromatisants à la quantité minimale nécessaire pour produire l’effet désiré (USFDA 2017c).
On a recensé différentes études de l’administration d’essence de térébenthine à court terme et à doses répétées à des animaux. Toutefois, ces études sont considérées comme scientifiquement inadéquates pour pouvoir les inclure dans la présente évaluation, car des données importantes sont manquantes, notamment en ce qui a trait aux concentrations et aux méthodes d’exposition, à la composition de la substance étudiée, aux animaux témoins et aux doses répétées.
En 2010, l’EPA des États-Unis a effectué la caractérisation préliminaire des dangers associés à la térébenthine et à l’essence de térébenthine (des substances commanditées de la catégorie des hydrocarbures terpéniques bicycliques) dans le cadre du Défi des substances chimiques produites en grande quantité (USEPA 2010). Lors de l’analyse, on n’a recensé aucune étude à court terme portant sur la toxicité chronique, la toxicité pour la reproduction et le développement, la génotoxicité ou la cancérogénicité de la térébenthine ou de l’essence de térébenthine. Des points de départ ont plutôt été déterminés pour ces substances par lecture croisée des valeurs analogues de l’α‑pinène (CSENO = 50 ppm, DMENO = 100 ppm) et du camphène (DSENO = 250 mg/kg p.c./jour, DMENO = 1000 mg/kg p.c./jour). On n’a relevé aucune préoccupation lors d’essais in vitro de génotoxicité sur bactéries.
La térébenthine et l’essence de térébenthine ont donné des résultats négatifs à l’essai de mutagénécité sur bactéries, à l’essai in vitro de mutation génique des cellules de mammifère et à l’essai in vitro d’aberrations chromosomiques dans les lymphocytes humains, tous réalisés avec et sans activation métabolique exogène (ECHA 2018 b).
On a évalué les effets de l’exposition par inhalation à court terme de la térébenthine sur huit hommes volontaires qui sont restés dans une chambre d’exposition contenant 450 mg/m3 d’un mélange de térébenthine composé d’α‑pinène, de β‑pinène et de δ‑3‑carène (10:1:5) à quatre reprises sur une période de 2 semaines, pour une exposition totale de 12 heures (Johard et coll. 1993). Un lavage bronchoalvéolaire a été effectué avant et après chaque exposition pour détecter une réaction inflammatoire. Vingt heures après la dernière exposition, le nombre de macrophages et de mastocytes dans le liquide de lavage bronchique était considérablement plus élevé qu’avant les expositions, ce qui indique une réaction aiguë des cellules alvéolaires.
Dans le cadre d’une étude semblable, huit volontaires ont été exposés à 450 mg/m3 de térébenthine dans une chambre d’exposition pendant 2 heures tout en faisant de l’exercice léger (Falk-Filipsson 1996). Les participants ont souligné une augmentation importante de l’inconfort dans la gorge ou les voies respiratoires après l’exposition à la térébenthine comparativement aux expositions témoins. On a aussi relevé une résistance accrue notable des voies respiratoires 30 minutes après la fin de l’exposition à la térébenthine. On a observé une légère augmentation négligeable de l’inconfort dans le nez après l’exposition à la térébenthine. Aucun changement important de symptômes liés au système nerveux central n’a été relevé après l’exposition à la térébenthine par rapport aux expositions témoins.
Pour mieux éclairer l’évaluation des risques, les renseignements disponibles sur les dangers associés aux composants principaux de la térébenthine et de l’essence de térébenthine, soit l’α‑pinène (44 % à 94 %), le β‑pinène (0,9 % à 30 %), le limonène (0,7 % à 25 %) et le camphène (1 % à 15 %), ont été examinés.
Évaluation des dangers associés aux composants principaux
L’α‑pinène et le β‑pinène
En 2010, l’EPA a analysé l’α‑pinène et le β‑pinène (des substances commanditées de la catégorie des hydrocarbures terpéniques bicycliques) dans le cadre du Défi des substances chimiques produites en grande quantité (USEPA 2009), ce qui a permis d’obtenir une CSENO de 50 ppm et une CMENO de 100 ppm. De plus amples renseignements sur les effets de l’α‑pinène et du β‑pinène sur la santé sont présentés dans la section « Évaluation des effets sur la santé » portant sur l’α‑pinène (section 8.3.2.2).
Limonène
On considère que la toxicité du limonène est assez faible. De plus amples renseignements sur les effets du limonène sur la santé sont présentés dans la section sur le potentiel d’effets nocifs sur la santé humaine portant sur l’essence d’orange douce (section 8.1.2).
Camphène
Lors d’une étude à doses répétées de 28 jours, des rats mâles et femelles ont reçu par voie orale des doses de 0, 62,5, 250 et 1000 mg/kg p.c./jour de camphène. En se fondant sur la hausse du poids du foie et la vacuolisation des hépatocytes observées chez les mâles et les femelles à une dose de 1000 mg/kg p.c./jour, on a établi une DSENO de 250 mg/kg p.c./jour et une DMENO de 1000 mg/kg p.c./jour (USEPA 2010).
8.4.2.3 Caractérisation des risques pour la santé humaine
Durées d’exposition chronique :
Inhalation :
Il existe peu ou pas de données relatives aux effets sur la santé de l’exposition par inhalation à la térébenthine ou à l’essence de térébenthine. Par conséquent, les données sur l’inhalation d’α‑pinène ⸺ le principal composant de la térébenthine et de l’essence de térébenthine (en concentrations variant de 44 % à 94 %) ⸺ ont servi de point de départ. La dose critique est la CSENO de 50 ppm, équivalant à une CSENOaj de 49,73 mg/m3 ou à une DSENOaj de 66 mg/kg p.c./jour lorsque la dose est ajustée pour tenir compte d’une exposition de 6 heures par jour, 5 jours par semaine (consulter l’annexe F-6 pour plus de détails sur les conversions de doses), déterminée lors de l’étude de 14 semaines menée par le NTP (2016). La dose critique a été établie en fonction de la hausse considérable des cas d’hyperplasie de l’urothélium de la vessie chez les souris mâles et femelles observée à une concentration égale ou supérieure à 100 ppm (équivalant à 133 mg/kg p.c./jour lorsqu’ajustée pour une exposition de 6 heures par jour, 5 jours par semaine) et de la réduction du nombre de spermatozoïdes par épididyme chez les souris mâles observée à des doses de 100 ppm et plus.
Voie orale :
L’EPA a effectué une lecture croisée des données sur le camphène pour attribuer une DSENO orale de 250 mg/kg p.c./jour à la térébenthine et à l’essence de térébenthine en se fondant sur une étude sur l’administration répétée de camphène. Or, la térébenthine et l’essence de térébenthine ne comporte que de 1 % à 15 % de camphène, par rapport à 44 % à 94 % d’α‑pinène. Étant donné qu’il existe des données de qualité sur l’α‑pinène et que la DSENO générale pour l’α‑pinène (équivalant à une DSENOaj de 66 mg/kg p.c./jour) était inférieure à celle pour le camphène (250 mg/kg p.c./jour), on s’est servi de la CSENO par inhalation de 50 ppm (ajustée à 66 mg/kg p.c./jour) de l’α‑pinène et d’une extrapolation d’une voie d’exposition à l’autre pour quantifier le risque, puisqu’on obtient un point de départ plus prudent avec l’α‑pinène qu’avec le camphène. Le calcul repose sur l’hypothèse de l’équivalence de l’absorption par voie orale et de celle par inhalation.
Voie cutanée :
Il n’existe aucune donnée relative aux effets sur la santé d’une exposition par voie cutanée à la térébenthine ou à l’essence de térébenthine. Par conséquent, la CSENO par inhalation de 50 ppm (équivalant à 66 mg/kg p.c./jour lorsqu’ajustée pour une exposition de 6 heures par jour, 5 jours par semaine) susmentionnée et l’extrapolation d’une voie d’exposition à l’autre ont servi à caractériser les risques. Nous avons utilisé une valeur d’absorption cutanée de 20 % (zone de peau recouverte) ou de 4 % (zone de peau non recouverte) pour extrapoler d’une voie à l’autre.
Durées d’exposition à court terme :
Il n’existe aucune donnée relative aux effets sur la santé de la térébenthine ou de l’essence de térébenthine. Par conséquent, nous avons examiné les données sur l’α‑pinène, composant principal de la térébenthine et de l’essence de térébenthine. Nous avons pris comme point de départ la CSENO critique de 200 ppm, qui équivaut à une DSENOaj de 222 mg/kg p.c./jour ou à une CSENOaj de 199 mg/m3 lorsque la dose est ajustée pour tenir compte d’une exposition de 6 heures par jour, 5 jours par semaine (consulter l’annexe F-6 pour plus de détails sur les conversions de doses), qui a été établie lors de l’étude de 14 semaines menée par le NTP (2016). Cette concentration a été déterminée en fonction de la baisse importante du poids corporel des rattes et souris femelles et de la hausse du poids relatif du foie et des reins chez les rats et les souris qui ont été observées à une dose de 400 ppm. L’extrapolation d’une voie à une autre a permis de déterminer les données d’exposition pour les voies orale et cutanée.
Comme les effets critiques observés lors de l’étude de détermination des doses par inhalation de deux semaines et de l’étude sur l’exposition par inhalation de 14 semaines étaient de nature systémique (hyperplasie de l’urothélium de la vessie et réduction des spermatozoïdes dans les épididymes dans l’étude de 14 semaines; baisse du poids corporel et hausse du poids relatif du foie et des reins dans l’étude de deux semaines) et qu’ils devraient survenir à la suite d’expositions répétées, il a été jugé approprié de calculer les expositions par inhalation en fonction du poids corporel et de comparer ces expositions à une dose systémique ajustée tirée de l’étude sur l’exposition par inhalation. Nous avons calculé les expositions systémiques par inhalation à l’aide de la concentration dans l’air moyenne pondérée sur 24 heures provenant du scénario d’exposition et des taux d’inhalation et poids corporels décrits dans Santé Canada, 1998.
Aux fins de caractérisation des risques et en se fondant sur une recension des écrits, on considère que l’α‑pinène et le β‑pinène sont les principaux composants de la térébenthine et de l’essence de térébenthine. Comme l’α‑pinène a servi d’analogue pour la lecture croisée du β‑pinène, nous avons jugé que le danger associé à l’α‑pinène était équivalent à celui de la térébenthine et de l’essence de térébenthine.
L’exposition occasionnée par l’utilisation de l’essence de térébenthine dans certains aliments et baumes pour les lèvres est considérée comme chronique, étant donné qu’en général les consommateurs emploient quotidiennement ces produits. Toutefois, on juge que l’exposition occasionnée par l’utilisation de l’essence de térébenthine dans des cirages à chaussures en crème, des dissolvants ou décapants à peinture, des encaustiques pour meubles, des cires pour voitures et à titre d’ingrédient non médicinal dans un produit de vapeurs médicamentées est de courte durée, puisque les consommateurs utilisent ces produits de façon intermittente ou occasionnelle au cours de l’année. Les estimations d’exposition, les doses critiques et les marges d’exposition résultantes pour des scénarios d’exposition chronique et à court terme sont présentées dans les tableaux 8.4-2 et 8.4-3, respectivement.
| Scénario d’expositiona | Exposition systémique (mg/kg p.c./jour) | Marge d’expositionb |
|---|---|---|
| Aromatisant alimentaire (apport alimentaire) – voie orale | 8,05 × 10-5 à 1,709 × 10-3 (6 mois et plus) | 38 619 à 819 876 (6 mois et plus) |
| Baume pour les lèvres (0,1 %) | 0,0029 à 0,004 (tous les groupes d’âge sauf les nourrissons) | 16 500 à 22 759 (tous les groupes d’âge sauf les nourrissons) |
a L’annexe G présente les paramètres et les calculs utilisés dans les scénarios d’exposition à la térébenthine et à l’essence de térébenthine.
b Marge d’exposition calculée à partir de la dose critique (DSENOaj = 66 mg/kg p.c./jour), en fonction de l’hyperplasie de l’urothélium de la vessie (mâles et femelles) et de la réduction du nombre de spermatozoïdes dans les épididymes (mâles) observées lors d’une étude de 14 semaines sur l’exposition par inhalation à l’α‑pinène chez la souris.
| Scénario d’expositiona | Exposition systémique (mg/kg p.c./jour) | Marge d’expositionb |
|---|---|---|
| Exposition systémique par voie cutanée et par inhalation à partir de cirages à chaussures (10 %)c | 9,85 × 10-2 (adultes) | 2254 (adultes) |
| Exposition systémique par voie cutanée et par inhalation à partir de dissolvants à peinture (100 %)c | 2,65 (adultes) | 84 (adultes) |
| Exposition systémique par voie cutanée et par inhalation à partir de décapants (100 %)c | 4,37 × 101 (adultes) | 5 (adultes) |
| Exposition systémique par voie cutanée et par inhalation à partir d’encaustiques pour meubles (5 %)c | 6,67 × 10-2 (adultes) | 3 328 (adultes) |
| Exposition systémique par voie cutanée et par inhalation à partir de cires pour voitures (10 %)b | 2,93 × 10-1 (adultes) | 757 (adultes) |
| Exposition systémique par voie cutanée et par inhalation à partir de la substance employée comme ingrédient non médicinal dans un produit de vapeurs médicamentées (2 %)d | 5,11 à 7,02 (adultes-bambins) | 32 à 43 (bambins-adultes) |
| Exposition systémique par voie cutanée et par inhalation à partir de la substance employée comme ingrédient non médicinal dans un contre-irritant (25 %)d | 2,06 à 4,86 (adultes-bambins) | 46 à 108 (bambins-adultes) |
a L’annexe G présente les paramètres et les calculs utilisés dans les scénarios d’exposition à la térébenthine et à l’essence de térébenthine.
b Marge d’exposition calculée à partir de la dose critique (DSENOaj = 222 mg/kg p.c./jour), en fonction de la baisse du poids corporel et de la hausse du poids relatif du foie et des reins observées lors de l’étude de détermination des doses par inhalation d’α‑pinène chez le rat et la souris d’une durée de deux semaines.
c Absorption cutanée de 4 % (zone de peau non recouverte)
d Absorption cutanée de 20 % (zone de peau recouverte)
La marge d’exposition entre la dose critique et l’estimation d’exposition quotidienne à l’essence de térébenthine due sont utilisation comme dissolvant et décapant à peinture ou à l’emploi de la substance comme ingrédient non médicinal dans un produit de vapeurs médicamentées et dans un contre-irritant tombait entre 5 et 108. Nous jugeons que ces marges d’exposition sont potentiellement inadéquates pour compenser les incertitudes des bases de données sur les effets sur la santé et l’exposition.
Une analyse récente de la fraction volatile des essences de térébenthine vendues dans des quincailleries canadiennes a montré que certaines essences commercialisées peuvent contenir une faible quantité d’α‑pinène, mais d’importantes concentrations d’α‑terpinène et de γ‑terpinène (SC 2019). La caractérisation des risques associés à ces essences de térébenthine de composition différente devrait ressembler davantage au profil de danger de l’α‑terpinène et du γ‑terpinène préalablement décrit dans l’évaluation de l’essence de mandarine (section 8.2.2.2) qu’au profil des essences composées principalement d’α‑pinène.
Pour tous les autres scénarios, les marges d’exposition entre la dose critique et l’estimation d’exposition associée aux scénarios présentés aux tableaux 8.4-2 et 8.4-3 sont jugées adéquates pour rendre compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
8.4.2.4 Incertitudes de l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principale source d’incertitude | Effet |
|---|---|
| Le fait de combiner les expositions par voie cutanée et par inhalation, et de calculer l’exposition pour chaque voie à partir d’hypothèses prudentes pourrait produire des estimations prudentes. | + |
| Les estimations d’exposition par inhalation à l’essence de térébenthine contenue dans des produits dépendent largement de paramètres comme le volume de la pièce, le taux de renouvellement d’air, le temps passé dans la zone d’exposition et le calcul de la moyenne pondérée dans le temps. Chacun de ces paramètres est variable et comporte une incertitude. Nous avons utilisé des hypothèses prudentes. | + |
| Il existe un degré d’incertitude lié à l’extrapolation des données d’absorption par voie cutanée du linalol et du citronellol à la térébenthine et à l’essence de térébenthine. Toutefois, comme tous les monoterpènes acycliques, monocycliques et bicycliques et leurs constituants ont des propriétés physicochimiques similaires, on s’attend à ce que l’absorption par voie cutanée de ces composés soit similaire. | +/- |
| L’extrapolation d’une voie d’exposition à une autre pour l’essence de térébenthine a été réalisée pour des scénarios d’exposition par voies cutanée et orale à partir de la dose critique tirée d’une étude par inhalation. | +/- |
| La concentration des principaux composants de la térébenthine et de l’essence de térébenthine varie en fonction de la plante, de son origine, de son espèce, de la température, du sol et de la zone géographique. Par conséquent, la composition inconnue de la térébenthine ou de l’essence de térébenthine présente dans les produits offerts aux Canadiens constitue une source d’incertitude de l’évaluation. | +/- |
| Nous n’avons pas retrouvé d’étude sur la toxicité à court terme, la toxicité chronique, la toxicité pour la reproduction ou le développement ou la cancérogénicité de la térébenthine ou de l’essence de térébenthine. | +/- |
| Il n’existe aucune étude adéquate sur des animaux qui a porté sur la toxicité à doses répétées de l’essence de térébenthine par les voies d’exposition pertinentes (voie cutanée, voie orale et inhalation). Les données sur les dangers associés au principal composant, l’α‑pinène, ont servi à éclairer l’évaluation des effets sur la santé humaine, le cas échéant. | +/- |
| Le recours à une étude de détermination des doses pour caractériser le risque associé à des scénarios d’exposition chronique et à court terme pourrait faire en sorte qu’on sous-estime le danger, étant donné que l’étude ne comprenait pas une analyse exhaustive des données sur la toxicité. | - |
8.5 Essence de sapin
8.5.1 Sources et utilisations
L’essence de sapin est une substance d’origine naturelle obtenue par la distillation à la vapeur des aiguilles et des rameaux de l’Abies balsamea un arbre indigène de l’Amérique du Nord, en particulier le Canada et le nord des États-Unis (Burdock 2010).
Selon les renseignements fournis lors d’une enquête menée en vertu de l’article 71 de la LCPE (Canada 2012), on a fabriqué environ 100 kg d’essence de sapin au Canada en 2011 et on n’a pas importé la substance en quantités supérieures au seuil de déclaration de 100 kg (Environnement Canada 2013).
Selon les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, on trouve de l’essence de sapin dans environ 90 produits cosmétiques au Canada, en des concentrations variant de < 0,1 % à 100 % (communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada 2017; sans référence). Parmi les produits déclarés, on trouve des lotions corporelles, des produits de massage, des nettoyants, du maquillage, du parfum et des produits pour le bain. La majorité des produits (> 60 %) contient une concentration de 1 % ou moins d’essence de sapin.
La substance figure également à la liste de l’International Fragrance Association à titre de parfum employé dans les produits de consommation (IFRA 2017).
D’après les renseignements divulgués lors d’une enquête menée en vertu de l’article 71 de la LCPE, on emploie aussi l’essence de sapin comme agent odorisant dans les produits de nettoyage et d’entretien de mobilier, les détergents à lessive et à vaisselle, les produits d’entretien de vêtements, de chaussures et d’automobiles, les lubrifiants et graisses (Environnement Canada 2013). Des renseignements sur le site de l’American Cleaning Institute suggèrent que l’essence de sapin pourrait être employée comme parfum dans des nettoyants domestique tout usage (ACI 2017).
L’essence de sapin est employée dans les boissons alcoolisées ou non alcoolisées, les produits de boulangerie, les bonbons, les produits laitiers congelés, les gélatines et les poudings (Burdock 2010). Elle figure dans l’inventaire des substances ajoutées aux aliments de la FDA des États-Unis et le Codex des produits chimiques alimentaires à titre d’agent aromatisant (USFDA 2018). Il n’existe aucune donnée précise sur l’utilisation potentielle de l’essence de sapin comme aromatisant alimentaire au Canada. Toutefois, puisqu’on sait que la substance est employée à ce titre aux États-Unis, elle pourrait être présente en tant qu’aromatisant alimentaire dans des aliments vendus au Canada.
Le tableau 8.5-1 mentionne d’autres utilisations de l’essence de sapin.
| Utilisation | Précisions |
|---|---|
| Aromatisant alimentairea | Utilisations déclarées dans les boissons alcoolisées ou non alcoolisées, les produits de boulangerie, les bonbons, les produits laitiers congelés, les gélatines et les poudings (Burdock 2010) |
| Base de données sur les ingrédients de produits de santé naturelsb | Exhausteur de saveur et parfum |
| Base de données sur les produits de santé naturels homologués présents en tant qu’ingrédients médicinaux ou non médicinaux dans les produits de santé naturels au Canadab | IM, INM |
| Signalée comme étant présente dans les cosmétiques, selon les déclarations présentées à Santé Canada en vertu du Règlement sur les cosmétiquesc | Produits de soin pour la peau et les cheveux, parfums et désodorisants |
| Formulant dans des produits antiparasitaires homologués au Canadad | Formulant |
Abréviations : IM, ingrédient médicinal; INM, ingrédient non médicinal.
a Communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, 2015; sans référence
b Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, juillet 2015; sans référence
c Communication personnelle, courriel de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, janvier 2016; sans référence
d Communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, juin 2015; sans référence
8.5.2 Potentiel d’effets nocifs sur la santé humaine
8.5.2.1 Évaluation de l’exposition
Compte tenu des faibles quantités de la substance déclarées comme ayant été utilisées au Canada (Environnement Canada 2013), l’exposition à l’essence de sapin causée par l’environnement ne devrait pas avoir d’effet sur la santé humaine.
On a souvent détecté la présence des principaux composants de l’essence de sapin, soit le β‑pinène (environ 28 % à 56 %) et l’α‑pinène (environ 6 % à 26 %), dans l’air intérieur et extérieur (SC 2010a, b, 2012, 2013). Le β‑pinène, un composé semblable à l’α‑pinène, est un constituant naturel des conifères et est rejeté par la végétation et les produits du bois. De façon générale, les concentrations de β‑pinène détectées sont inférieures à celles d’α‑pinène, et nous considérons qu’elles sont prises en compte dans l’évaluation de l’α‑pinène.
L’exposition alimentaire des Canadiens à l’essence de sapin utilisée comme aromatisant alimentaire a été estimée à l’aide d’une valeur de consommation individuelle de 1,58 × 10-3 mg/kg p.c./jour pour la population américaine, telle que déterminée dans le Fenaroli’s Handbook of Flavor Ingredients (communications personnelles, courriels de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, 2017; sans référence).
Pour évaluer le potentiel d’exposition par voie cutanée à l’essence de sapin à partir de cosmétiques, Nous avons choisi des scénarios sentinelles en fonction des fréquences d’utilisation de ces produits et des concentrations déclarées d’essence de sapin contenues dans ceux-ci. Ces scénarios représentaient la plus forte exposition par voie cutanée par rapport aux autres cosmétiques à application topique et aux produits de santé naturels, selon les produits répertoriés et déclarés contenir la substance. Les expositions à l’essence de sapin lors de l’utilisation d’un hydratant corporel, d’une huile de massage et d’un hydratant pour le visage ont servi de scénarios sentinelles pour estimer l’exposition quotidienne par voie cutanée. Ces données sont présentées à l’annexe H (tableaux H-1 à H-3).
La plus forte exposition quotidienne à la substance devrait découler de l’utilisation d’un hydratant corporel ayant une concentration maximale déclarée de 1 % d’essence de sapin. L’exposition systémique par voie cutanée et par inhalation causée par un hydratant corporel (considérant une absorption cutanée de 20 %) se situait entre 0,291 et 0,535 mg/kg p.c./jour pour tous les groupes d’âge. De plus, l’exposition systémique par voie cutanée et par inhalation à partir d’une huile de massage (3 %) variait de 0,0638 mg/kg p.c./jour pour les adultes et de 0,295 mg/kg p.c./jour pour les nourrissons, et à partir d’un hydratant pour le visage (3 %) variait de 0,238 mg/kg p.c./jour pour les jeunes de 12 à 19 ans et 0,416 mg/kg p.c./jour pour les adultes.
L’exposition par inhalation à l’essence de sapin peut être causée par l’utilisation d’un parfum en aérosol (100 % d’essence de sapin), d’un assainisseur d’air ou de cubes de cire (1 % à 5 % d’essence de sapin). L’exposition systémique par inhalation à partir d’un parfum contenant 100 % d’essence de sapin se situait entre 0,0889 mg/kg p.c./jour pour les adultes et 0,0434 mg/kg p.c./jour pour les enfants de 5 ans (soit 0,19 mg/m3), tandis que l’exposition par inhalation causée par un assainisseur d’air ou des cubes de cire variait entre 0,165 pour les adultes et 0,432 mg/kg p.c./jour pour les bambins (soit 0,72 mg/m3). L’ensemble des paramètres utilisés pour les calculs est présenté à l’annexe H, dans les tableaux H‑3 à H-5.
L’essence de sapin est aussi déclarée être employée comme ingrédient non médicinal dans un médicament liquide contre le rhume à une concentration de 0,27 % (communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation des risques pour les substances nouvelles de Santé Canada, janvier 2018, sans référence). L’exposition systémique par voie orale causée par ce médicament allait de 1,14 à 2,61 mg/kg p.c./jour (enfants de 3 ans et plus et adultes). De plus, on a signalé la présence d’essence de sapin dans un baume pectoral à une concentration maximale de 3 % (communication personnelle, courriel de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques des substances nouvelles, 2019, sans référence). Pour ce produit, l’exposition systémique par voie cutanée et par inhalation se situait entre 0,822 mg/kg p.c./jour pour les adultes et 1,11 mg/kg p.c./jour pour les nourrissons. L’ensemble des paramètres utilisés pour les calculs est présenté dans le tableau H-5 de l’annexe H.
8.5.2.2 Évaluation des effets sur la santé
Nous n’avons retrouvé aucun classement des effets de l’essence de sapin sur la santé qui aurait été effectuée par une agence réglementaire nationale ou internationale.
La FDA des États-Unis souligne que l’essence de sapin peut être utilisée en toute sécurité comme aromatisant à la quantité minimale nécessaire pour produire l’effet désiré (USFDA 2017c).
Il existe peu de données toxicologiques sur l’essence de sapin. En 2007, l’EPA a examiné l’essence de sapin lors de la préparation du Biopesticides Registration Action Document pour l’essence de sapin baumier. Des études de référence acceptables sur la toxicité chronique de l’essence de sapin baumier (toxicité chronique par voie orale, par voie cutanée et par inhalation) ont été analysées, et puisqu’aucun effet notable n’a été relevé, on n’a pas jugé nécessaire de réaliser des études plus poussées (p. ex., étude à doses répétées ou sur l’immunotoxicité) [USEPA 2007].
La recherche documentaire n’a permis de recenser aucune étude sur la génotoxicité, la cancérogénicité ou la toxicité pour le développement et la reproduction de l’essence de sapin.
Afin de mieux éclairer l’évaluation des risques associés à l’essence de sapin, on a examiné les données disponibles sur les dangers liés à ses principaux composants, soit le β‑pinène (28 à 56 %), l’α‑pinène (6 à 26 %) et le limonène (2 à 16 %).
En 2010, l’EPA a effectué la caractérisation préliminaire des dangers associés à l’α‑pinène et au β‑pinène (des substances commanditées de la catégorie des hydrocarbures terpéniques bicycliques) dans le cadre du Défi des substances chimiques produites en grande quantité (USEPA 2009), ce qui a permis de déterminer une CSENO de 50 ppm et une CMENO de 100 ppm. De plus amples renseignements sur les effets de l’α‑pinène sur la santé sont présentés dans la section « Évaluation des effets sur la santé » portant sur l’α‑pinène (section 8.3.2.2).
On considère que la toxicité du limonène est assez faible. De plus amples renseignements sur les effets du limonène sur la santé apparaissent dans la section sur le potentiel d’effets nocifs sur la santé humaine occasionnés par l’essence d’orange douce (section 8.1.2).
8.5.2.3 Caractérisation des risques pour la santé humaine
Durées d’exposition chronique :
Inhalation :
Il n’existe aucune donnée relative aux effets sur la santé de l’essence de sapin ou de son principal composant, le β‑pinène. Par conséquent, les données sur l’exposition par inhalation à l’α‑pinène, une substance composant de 6 % à 26 % de l’essence de sapin et utilisé par l’EPA pour la lecture croisée du β‑pinène (USEPA 2010), ont servi de point de départ. Lors de l’étude de 14 semaines menée par le NTP (2016), on a déterminé une CSENO de 50 ppm, ce qui équivaut à 49,73 mg/m3 ou à 66 mg/kg p.c./jour après avoir ajusté la dose pour tenir compte d’une exposition de 6 heures par jour, 5 jours par semaine (consulter l’annexe F-6 pour plus de détails sur les conversions de doses). La concentration a été établie en fonction de la hausse considérable des cas d’hyperplasie de l’urothélium de la vessie chez les souris mâles et femelles observée à une dose égale ou supérieure à 100 ppm (équivalant à 99,46 mg/m3 lorsqu’ajustée pour une exposition de 6 heures par jour, 5 jours par semaine) et de la réduction du nombre de spermatozoïdes par épididyme chez les souris mâles observée à des doses de 100 ppm et plus.
Voies orale et cutanée :
Il n’existe aucune donnée relative aux effets sur la santé d’une exposition par voie orale ou cutanée à l’essence de sapin ou à son composant principal le β‑pinène. Par conséquent, les données orales sur le camphène, utilisées par l’EPA pour la lecture croisée du β‑pinène (USEPA 2010), peuvent servir de point de départ. La dose critique correspond à une DSENO de 250 mg/kg p.c./jour déterminée lors d’une étude de 28 jours sur le rat et est fondée sur la hausse du poids du foie et la vacuolisation des hépatocytes observées à une dose de 1000 mg/kg p.c./jour.
Toutefois, la DSENO pour l’α‑pinène (équivalant à 66 mg/kg p.c./jour lorsqu’ajustée pour une exposition de 6 heures par jour, 5 jours par semaine; consulter l’annexe F-6 pour plus de détails sur les conversions de doses) représente un point de départ plus prudent que celle pour le camphène (250 mg/kg p.c./jour). Elle a donc servi pour la caractérisation des risques et l’extrapolation d’une voie d’exposition à l’autre. On présume que les absorptions par voie orale et par inhalation sont équivalentes pour extrapoler l’exposition par inhalation à celle par voie orale, et que l’absorption cutanée est de 20 % (zone de peau recouverte) ou de 4 % (zone de peau non recouverte) pour extrapoler l’exposition par inhalation à celle par voie cutanée.
Durées d’exposition à court terme :
Inhalation, voies orale et cutanée :
Il n’existe pas de donnée relative aux effets sur la santé de l’essence de sapin. Par conséquent, nous avons étudié les données sur l’α‑pinène, l’un des composants de l’essence de sapin. Nous avons pris comme point de départ la CSENO critique de 200 ppm, qui équivaut à une DSENOaj de 222 mg/kg p.c./jour ou à une CSENOaj de 199 mg/m3 lorsque la dose est ajustée pour tenir compte d’une exposition de 6 heures par jour, 5 jours par semaine (consulter l’annexe F-6 pour plus de détails sur les conversions de doses), qui a été établie lors de l’étude de 14 semaines menée par le NTP (2016). Cette concentration a été déterminée en fonction de la baisse importante du poids corporel des rattes et souris femelles et de la hausse du poids relatif du foie et des reins chez les rats et les souris qui ont été observées à une dose de 400 ppm. L’extrapolation d’une voie à l’autre a permis de déterminer les données d’exposition pour les voies orale et cutanée.
Les effets critiques observés lors de l’étude de détermination des doses par inhalation de deux semaines et de l’étude sur l’exposition par inhalation de 14 semaines étaient de nature systémique (hyperplasie de l’urothélium de la vessie et réduction des spermatozoïdes dans les épididymes dans l’étude de 14 semaines; baisse du poids corporel et hausse du poids relatif du foie et des reins dans l’étude de deux semaines) et ils devraient survenir à la suite d’expositions répétées. Par conséquent, il a été jugé approprié de calculer les expositions par inhalation en fonction du poids corporel et de comparer ces expositions à une dose systémique ajustée tirée de l’étude sur l’exposition par inhalation. On a calculé les expositions systémiques par inhalation à l’aide de la concentration dans l’air moyenne pondérée sur 24 heures provenant du scénario d’exposition et des taux d’inhalation et poids corporels décrits dans Santé Canada, 1998.
Puisque les principaux composants de l’essence de sapin sont le β‑pinène et l’α‑pinène, et que l’α‑pinène a servi d’analogue pour la lecture croisée du β‑pinène, nous avons jugé que la toxicité de l’α‑pinène était équivalente à celle de l’essence de sapin.
Tous les scénarios d’exposition sentinelles sont considérés comme ayant une durée chronique, sauf ceux relatifs à l’utilisation de l’essence de sapin comme ingrédient non médicinal dans un médicament liquide contre le rhume et à la présence de l’essence dans un baume pectoral (3 %), qui sont considérés comme étant de courte durée. Les médicaments liquides contre le rhume et les baumes pectoraux sont utilisés à l’occasion au cours de l’année et devraient être employés pendant au plus 5 à 7 jours chaque fois.
Les estimations d’exposition, les doses critiques et les marges d’exposition résultantes pour des scénarios d’exposition chronique et à court terme sont présentées dans les tableaux 8.5-2 et 8.5-3, respectivement.
| Scénario d’expositiona | Exposition systémique (mg/kg p.c./jour) | Marge d’expositionb |
|---|---|---|
| Aromatisant alimentaire (apport alimentaire) – voie orale | 1,58 × 10-3 (6 mois et plus) | 41 772 (6 mois et plus) |
| Exposition systémique par voie cutanée et par inhalation à partir d’hydratants corporels (1 %) c | 2,91 × 10-1 à 5,35 × 10-1 (adultes-nourrissons) | 123 à 227 (nourrissons-adultes) |
| Exposition systémique par voie cutanée et par inhalation à partir d’huiles de massage (3 %)d | 6,38 × 10-2 à 2,95 × 10-1 (adultes-nourrissons) | 224 à 1035 (nourrissons-adultes) |
| Exposition systémique par voie cutanée et par inhalation à partir d’hydratants pour le visage (3 %)d | 2,38 × 10-1 à 4,16 × 10-1 (12 à 19 ans-adultes) | 159 à 278 (adultes-12 à 19 ans) |
| Exposition systémique par inhalation à partir de parfums (100 %) | 8,89 × 10-2 à 4,34 × 10-2 (adultes-5 à 11 ans) | 743 à 1520 (adultes–5 à 11 ans) |
| Exposition systémique par inhalation à partir d’assainisseurs d’air (cubes de cire) (5 %) | 1,65 × 10-1 à 4,32 × 10-1 (adultes-bambins) | 153 à 401 (bambins-adultes) |
a L’annexe H présente les paramètres et les calculs utilisés dans les scénarios d’exposition à l’essence de sapin.
b Marge d’exposition calculée à partir de la dose critique (DSENOaj = 66 mg/kg p.c./jour), en fonction de l’hyperplasie de l’urothélium de la vessie (mâles et femelles) et de la réduction du nombre de spermatozoïdes dans les épididymes (mâles) observées lors d’une étude de 14 semaines sur l’exposition par inhalation à l’α‑pinène chez la souris.
c On présume une absorption cutanée de 20 % (zone de peau recouverte).
d On présume une absorption cutanée de 4 % (zone de peau non recouverte).
| Scénario d’exposition | Exposition (mg/kg p.c./jour) | Marge d’expositiona |
|---|---|---|
| Exposition systémique par voie orale à partir de la substance employée comme ingrédient non médicinal dans un médicament liquide contre le rhume (0,27 %) | 1,14 à 2,61 (adultes-enfants de 3 ans et plus) | 85 à 195 (enfants de 3 ans et plus-adultes) |
| Exposition systémique par voie cutanée et par inhalation à partir de baumes pectoraux (3 %) | 8,22 × 10-1 à 1,11 (adultes-nourrissons) | 201 à 270 (nourrissons-adultes) |
a Marge d’exposition calculée à partir de la dose critique (DSENOaj = 222 mg/kg p.c./jour), en fonction de la baisse du poids corporel et de la hausse du poids relatif du foie et des reins observées lors de l’étude de détermination des doses par inhalation d’α‑pinène chez le rat et la souris d’une durée de deux semaines.
La marge d’exposition entre la dose critique et l’exposition estimée à l’essence de sapin à partir d’un médicament liquide contre le rhume était de 85 pour les enfants âgés de 3 ans et plus, ce qui est jugé adéquat pour compenser les incertitudes des bases de données sur les effets sur la santé et l’exposition. De plus, la marge d’exposition entre la dose critique et l’estimation d’exposition à l’essence de sapin à partir d’un baume pectoral employé selon les instructions du fabricant (une application par jour) se situait entre 201 et 270, ce qui est considéré comme adéquat pour rendre compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
Pour tous les autres scénarios, les marges d’exposition entre la dose critique et l’estimation d’exposition variaient entre 123 et 41 772, et sont donc jugées adéquates pour compenser les incertitudes des bases de données sur les effets sur la santé et l’exposition.
8.5.2.4 Incertitudes de l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
Principale source d’incertitude |
Effet |
|---|---|
Les estimations d’exposition par inhalation à l’essence de sapin contenue dans des produits dépendent largement de paramètres comme le volume de la pièce, le taux de renouvellement d’air, le temps passé dans la zone d’exposition et le calcul de la moyenne pondérée dans le temps. Chacun de ces paramètres est variable et comporte une incertitude. Des hypothèses prudentes ont été utilisées. |
+ |
Il existe un degré d’incertitude lié à l’extrapolation des données d’absorption par voie cutanée du linalol et du citronellol à l’essence de sapin. Toutefois, comme tous les monoterpènes acycliques, monocycliques et bicycliques et leurs constituants ont des propriétés physicochimiques similaires, on s’attend à ce que l’absorption par voie cutanée de ces composés soit similaire. |
+/- |
L’extrapolation d’une voie d’exposition à une autre pour l’essence de sapin a été réalisée pour des scénarios d’exposition par voies cutanée et orale à partir de la dose critique tirée d’une étude par inhalation. |
+/- |
La composition des principaux composants de l’essence de sapin varie en fonction de la plante, de son origine, de son espèce, de la température, du sol et de la zone géographique. Par conséquent, la composition inconnue de la térébenthine ou de l’essence de térébenthine présente dans les produits offerts aux consommateurs constitue une source d’incertitude de l’évaluation. |
+/- |
Il n’existe aucune étude sur des animaux sur la toxicité chronique, la toxicité pour la reproduction et le développement ou la cancérogénicité pour l’ensemble des voies d’exposition. |
+/- |
Aucune étude sur des animaux n’a porté sur la toxicité à doses répétées de l’essence de sapin par les voies d’exposition pertinentes (voie cutanée, voie orale et inhalation). Les données sur les dangers associés à l’un de ses composants, l’α‑pinène, ont servi à éclairer l’évaluation des effets sur la santé. |
+/- |
Le recours à une étude de détermination des doses pour caractériser le risque associé à des scénarios d’exposition chronique et à court terme pourrait faire en sorte que l’on sous-estime le danger, étant donné que l’étude ne comprenait pas une analyse exhaustive des données sur la toxicité. |
- |
8.6 Huile de pin
8.6.1 Sources et utilisations
L’huile de pin est une substance d’origine naturelle obtenue par la distillation à la vapeur de différentes espèces du genre Pinus, principalement le Pinus sylvestris, un arbre indigène des pays baltes, le Pinus mugo, indigène des Alpes suisses, et le Pinus palustris, indigène de l’Amérique du Nord (Rose 2009).
Selon les renseignements fournis lors d’une enquête menée en vertu de l’article 71 de la LCPE (Canada 2012), on a produit de 100 à 1000 kg d’huile de pin au Canada en 2011, et on en a importé entre 100 000 et 1 000 000 kg (Environnement Canada 2013).
Selon les déclarations divulguées à Santé Canada en vertu du Règlement sur les cosmétiques, l’huile de pin entre dans la composition de plus de 65 produits cosmétiques au Canada, en des concentrations variant de < 0,1 % à 100 % (communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada, 2017; sans référence). Parmi les produits déclarés, on trouve des lotions corporelles, des produits de massage, des nettoyants, des parfums, du maquillage, des produits de soin pour les cheveux et des produits pour le bain. La majorité des produits (> 85 %) comporte 1 % ou moins d’huile de pin.
La substance figure à la liste de l’International Fragrance Association à titre de parfum employé dans les produits de consommation (IFRA 2017).
D’après les renseignements fournis lors d’une enquête menée en vertu de l’article 71 de la LCPE, on emploie aussi l’huile de pin comme solvant ou désodorisant dans les produits de soins personnels, les produits de nettoyage et d’entretien de mobilier, les détergents à lessive et à vaisselle, les assainisseurs d’air, les produits d’entretien automobile, les lubrifiants et graisses, et les peintures et revêtements (Environnement Canada 2013). L’huile de pin entre aussi dans la composition de produits ménagers (FDS 2008; FDS 2015). Des renseignements sur le site de l’American Cleaning Institute (ACI) suggèrent que l’huile de pin pourrait être employée dans des nettoyants tout usage et des détergents à lessive et à vaisselle (ACI 2017).
L’huile de pin est employée dans les boissons alcoolisées ou non alcoolisées, les produits de boulangerie, les produits laitiers congelés, les gélatines et poudings, et les bonbons (Burdock 2010). L’huile de pin (NR CAS 8002-09-03) ne fait pas l’objet d’un classement alimentaire aux États-Unis ou en Europe. Toutefois, l’huile d’écorce de pin blanc (NR CAS 977089-62-5), l’essence d’aiguilles de pin (NR CAS 8000-26-8), l’essence de pin sylvestre (NR CAS 8023-99-2), l’huile de résine de pin (NR CAS 977009-97-4) et l’huile de pin blanc (NR CAS 977019-44-5) sont des substances aromatisantes autorisées aux États-Unis (USFDA 2018). Il n’existe aucune donnée précise sur l’utilisation potentielle de l’huile de pin comme aromatisant alimentaire au Canada. Toutefois, puisqu’on sait que la substance est employée à ce titre aux États-Unis, elle pourrait être présente en tant qu’aromatisant alimentaire dans des aliments vendus au Canada.
Le tableau 8.6-1 présente d’autres utilisations de l’huile de pin.
| Utilisation | Précisions |
|---|---|
| Aromatisant alimentairea | Utilisations déclarées dans les boissons alcoolisées ou non alcoolisées, les produits de boulangerie, les produits laitiers congelés, les gélatines et poudings, et les bonbons (Burdock 2010) |
| Additif indirecta | Composant des gommes pour couvercles de canettes et les revêtements pour planchers |
| Base de données sur les produits pharmaceutiquesb | INM (ingrédient dans les médicaments destinés aux humains et les désinfectants assimilés aux drogues) |
| Base de données sur les ingrédients de produits de santé naturelsc | IM, INM |
| Base de données sur les produits de santé naturels homologués présents en tant qu’ingrédients médicinaux ou non médicinaux dans les produits de santé naturels au Canadac | IM, INM |
| Signalée comme étant présente dans les cosmétiques, selon les déclarations présentées à Santé Canada en vertu du Règlement sur les cosmétiquesd | Produits de soin pour la peau et les cheveux, désodorisants et produits de massage |
Abréviations : IM, ingrédient médicinal; INM, ingrédient non médicinal.
a Communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, 2015; sans référence
b Communication personnelle, courriel de la Direction des produits thérapeutiques de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, juin 2015; sans référence
c Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, février 2017; sans référence
d Communication personnelle, courriel de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, juillet 2015; sans référence
8.6.2 Potentiel d’effets nocifs sur la santé humaine
8.6.2.1 Évaluation de l’exposition
Étant donné le milieu environnant, nous avons utilisé l’α‑pinène (qui constitue de 12 % à 69 % de l’huile de pin) pour nous informer de la répartition de la substance dans l’environnement. En raison de sa forte pression de vapeur (633 Pa), l’α‑pinène devrait se répartir presque entièrement dans l’air (Kim et coll. 2016). De plus, compte tenu de sa faible hydrosolubilité (2,49 mg/L) et de sa constante de Henry très élevée (0,30 atm‑m3/mol), l’α‑pinène devrait se volatiliser rapidement depuis la surface de l’eau.
On n’a trouvé aucune donnée sur la surveillance de l’huile de pin dans l’air, mais son composant principal, l’α‑pinène, est abordé à la section 8.3.2.1.
L’exposition alimentaire des Canadiens à l’huile de pin utilisée comme aromatisant alimentaire a été estimée à l’aide d’une valeur de consommation individuelle de 2,97 × 10-4 mg/kg p.c./jour pour la population américaine, telle que déterminée dans le Fenaroli’s Handbook of Flavor Ingredients (communications personnelles, courriels de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, 2017; sans référence).
L’huile de pin peut entrer dans la composition de certains matériaux d’emballage alimentaire, comme dans les gommes employées pour sceller les couvercles de canettes, et constituer un additif accidentel, comme dans les revêtements pour planchers (aucun contact direct avec la nourriture). On estime que l’exposition à l’huile de pin à partir de matériaux d’emballage alimentaire et d’additifs accidentels est négligeable (communications personnelles, courriels de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, 2017; sans référence).
Pour évaluer le potentiel d’exposition par voie cutanée à l’huile de pin à partir de cosmétiques, des scénarios sentinelles ont été choisis en fonction des fréquences d’utilisation de ces produits et des concentrations déclarées d’essence de sapin contenues dans ceux-ci. Ces scénarios représentaient la plus forte exposition par voie cutanée par rapport aux autres cosmétiques à application topique et aux produits de santé naturels, selon les produits répertoriés et déclarés contenir la substance. Les expositions à l’huile de pin lors de l’utilisation d’un hydratant corporel et d’un produit de massage ont servi de scénarios sentinelles pour estimer l’exposition quotidienne par voie cutanée. Ces données sont présentées à l’annexe I (tableaux I-1 et I-2).
La plus forte exposition quotidienne à la substance devrait découler de l’utilisation d’un hydratant corporel ayant une concentration maximale déclarée de 0,3 % d’huile de pin. L’exposition systémique par voie cutanée et par inhalation causée par un hydratant corporel (considérant une absorption cutanée de 20 %) se situait entre 7,24 × 10-2 mg/kg p.c./jour pour les adultes et 1,61 × 10-1 mg/kg p.c./jour pour les nourrissons. De plus, l’exposition systémique par voie cutanée et par inhalation à partir d’un produit de massage (concentration maximale de 1 % d’huile de pin) variait entre 2,13 × 10-2 mg/kg p.c./jour pour les nourrissons et 9,82 × 10-2 mg/kg p.c./jour pour les adultes.
L’exposition par inhalation à l’huile de pin peut être causée par l’utilisation d’un parfum en aérosol (100 % d’huile de pin). Pour un parfum contenant 100 % d’huile de pin, l’exposition par inhalation se situait entre 8,89 × 10-2 mg/kg p.c./jour pour les adultes et 4,34 × 10-2 mg/kg p.c./jour pour les enfants de 5 ans, soit 0,19 mg/m3 (l’ensemble des paramètres utilisés pour les calculs est présenté dans le tableau I-3 de l’annexe I). De plus, on a mesuré que l’exposition systémique d’un bambin à la substance par voie cutanée, par inhalation et par ingestion non alimentaire découlant d’un contact avec un plancher nettoyé (avec un produit contenant 5 % d’huile de pin) était de 2,13 × 10-1 mg/kg p.c./jour, tandis que l’exposition systémique d’un adulte par voie cutanée et par inhalation causée par le mélange, le chargement et l’application d’un nettoyant à plancher tout usage (aussi à concentration de 5 % d’huile de pin) était de 8,81 × 10-2 mg/kg p.c./jour. L’exposition systémique par inhalation à partir d’un nettoyant automatique pour toilettes (contenant 10 % d’huile de pin) se situait entre 6,63 × 10-2 mg/kg p.c./jour pour les adultes et 1,74 × 10-1 mg/kg p.c./jour pour les bambins, soit 2,90 × 10‑2 mg/m3. Les données et paramètres employés sont présentés dans les tableaux I-4 et I-5 de l’annexe I.
On a aussi signalé l’utilisation de l’huile de pin comme ingrédient non médicinal dans des produits de santé naturels à une concentration de 4 mg/ml (communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation des risques pour les substances nouvelles de Santé Canada, janvier 2018, sans référence). L’exposition systémique par voie orale causée par ces produits se situait entre 2,82 mg/ kg p.c./jour pour les adultes et 3,37 mg/ kg p.c./jour pour les adolescents.
Un produit thérapeutique à application topique contenant 8,1 % d’huile de pin comme ingrédient non médicinal entrait aussi dans la composition d’un liquide antiseptique (communication personnelle, courriel de la Direction des produits thérapeutiques de Santé Canada au Bureau d’évaluation des risques pour les substances existantes de Santé Canada, juillet 2015; sans référence). Toutefois, l’exposition par voie cutanée à partir de ce produit devrait être moindre que les expositions maximales estimées causées par l’utilisation de cosmétiques.
8.6.2.2 Évaluation des effets sur la santé
Évaluation des dangers associés à l’huile de pin
Nous n’avons retrouvé aucun classement des effets de l’huile de pin sur la santé qui aurait été effectuée par une agence réglementaire nationale ou internationale.
Il existe peu de données toxicologiques sur l’huile de pin.
Deux études par voie cutanée à court terme ont permis d’évaluer les effets de l’exposition à l’huile de pin chez le rat. Les détails de ces études n’étaient pas accessibles pour réaliser une évaluation indépendante, mais des résumés ont été publiés dans le Sommaire des données toxicologiques de l’huile de pin (1998) de la Direction de la toxicologie médicale du département de l’Alimentation et de l’Agriculture de la Californie (CDFA 1998) et dans la décision d’admissibilité à la réhomologation de l’huile de pin par l’EPA (USEPA 2006). Dans la première étude, aucun effet nocif n’a été observé après l’application sur la peau de rats (10 sujets/sexe/groupe) d’un mélange d’huile de pin non dilué (substance à l’essai non précisée) à des concentrations de 0, 50, 113 ou 226 mg/kg p.c./jour, 5 jours par semaine pour 90 jours. Nous avons déterminé que la DSENO était supérieure à 226 mg/kg p.c./jour. Dans la deuxième étude, les rats n’ont montré aucun effet nocif après une exposition cutanée de 14 jours à des concentrations allant jusqu’à 940 mg/kg p.c./jour (USEPA 2006).
Lors d’une étude sur le développement, des rattes enceintes (25 sujets/groupe) ont reçu par gavage des doses de 0, 50, 600 ou 1200 mg/kg p.c./jour d’un mélange d’huile de pin pendant les jours de gestation 6 à 15 (USEPA 2006). À une dose de 600 mg/kg p.c./jour, on a observé une baisse importante du poids fœtal des mâles et une hausse des cas d’ossification incomplète du pubis ou de l’ischion chez les petits. Aucun effet n’a été observé chez les mères à cette dose. À 1200 mg/kg p.c./jour, on a observé une hausse importante des signes cliniques de toxicité chez les mères, comme une baisse de la consommation alimentaire, un gain de poids corporel, une salivation excessive, de l’alopécie, de l’ataxie et des souillures d’urine sur le pelage de la région abdominale. Six des 25 rats du groupe recevant une dose de 1200 mg/kg p.c./jour sont morts et la nécropsie a révélé une hausse considérable du poids de leurs surrénales. En se fondant sur ces résultats, les auteurs de l’étude ont déterminé une DSENO sur le développement de 50 mg/kg p.c./jour (USEPA 2006). Dans le cadre de la présente évaluation, on n’a pas considéré les effets sur les fœtus et les mères observés à une dose de 600 mg/kg p.c./jour comme étant suffisamment nocifs. On a jugé que les effets nocifs sur le développement du fœtus apparaissaient seulement en cas de toxicité maternelle à une dose de 1200 mg/kg p.c./jour. Par conséquent, une DSENO de 600 mg/kg p.c./jour a été définie.
L’huile de pin donne généralement un résultat négatif aux essais de génotoxicité in vitro et in vivo (USEPA 2006), bien qu’une étude ait relevé la génotoxicité de la substance chez les drosophiles et qu’une autre ait montré que l’huile de pin cause des aberrations chromosomiques dans les lymphocytes humains (Lazutka et coll. 2001). On n’a recensé aucune étude sur la toxicité chronique ou la cancérogénicité de l’huile de pin. En 2006, l’Office of Prevention, Pesticides and Toxic Substances de l’EPA a évalué l’huile de pin dans le cadre d’une décision d’admissibilité à la réhomologation (RED) [USEPA 2006].
Afin de mieux éclairer l’évaluation des risques associés à l’huile de pin, nous avons examiné les renseignements disponibles sur les dangers liés à ses principaux composants, soit l’α‑terpinéol (0 % à 65 %), l’α‑pinène (12 % à 69 %), le β‑pinène (0,17 %à 33 %), le β‑myrcène (0 % à 18 %), le camphène (0,8 % à 11 %) et le limonène (0 % à 16 %).
Évaluation des dangers associés aux composants principaux
L’α‑terpinéol
Nous n’avons recensé aucun classement des effets de l’α‑terpinéol sur la santé qui aurait été effectuée par une agence réglementaire nationale ou internationale.
Aucun effet nocif n’a été observé lors d’une étude sur le développement de rats mâles et femelles (10 sujets/dose/sexe) qui ont reçu par gavage des doses de 0, 60 ou 250 mg/kg p.c./jour de terpinéol pendant 42 jours (accouplement, grossesse et lactation) et ont eu une période de rétablissement de 14 jours (ECHA 2018c). À partir des résultats de l’étude, les auteurs ont constaté que la DSENO pour les mères et les effets sur le développement pouvait aller jusqu’à 250 mg/kg p.c./jour (ECHA 2018c).
On n’a observé aucun effet nocif au cours d’une étude d’administration répétée de doses lors de laquelle des rats mâles et femelles (10 animaux/dose/sexe) ont reçu dans leur alimentation des doses de 0, 1000, 2500 ou 10 000 ppm (équivalant à 0, 40, 100 ou 400 mg/kg p.c./jour)[JC1] d’acétate d’α‑terpényle pendant 20 semaines (ECHA 2018c). L’ECHA a effectué une lecture croisée des valeurs de l’acétate d’α‑terpényle (analogue structurel ou étalon analogue) pour déterminer une DSENO orale de 314 mg/kg p.c./jour, ajustée pour tenir compte de la masse moléculaire de l’α‑terpinéol (ECHA 2018c).
L’α‑terpinéol n’a pas donné un résultat positif aux essais de mutagénécité sur bactéries et n’a pas causé de mutation génique dans les cellules de mammifère, avec et sans activation métabolique exogène (Belsito et coll. 2008, Bhatia et coll. 2008). Lors d’une étude à doses répétées de 14 jours menée sur 3 à 4 rats, l’administration de nourriture additionnée de 1 % d’α‑terpinéol a entraîné une baisse de la consommation alimentaire, du poids corporel et des taux d’ApoA-1 (composant d’une lipoprotéine de haute densité). On a également observé une hausse des taux de cholestérol et de triglycérides ainsi que du poids du foie (Imaizumi et coll. 1985).
On a évalué le potentiel de l’α‑terpinéol à causer des tumeurs pulmonaires chez les souris A/He femelles (Stoner et coll. 1973). On a administré la substance à des souris par injection intrapéritonéale 3 fois par jour pendant 8 semaines, ce qui donne des doses cumulatives totales de 1,9 et 9,6 g/kg (soit 80 et 400 mg/kg p.c./dose ou 35 et 170 mg/kg p.c./jour). Les souris ont été sacrifiées 12 semaines après la dernière injection. À une dose de 1,9 g/kg, deux sujets sont morts et on a observé des tumeurs chez trois des 18 animaux survivants. À une dose de 9,6 g/kg, cinq sujets sont morts et on a observé des tumeurs chez l’une des 15 souris survivantes. Étant donné qu’il n’y avait pas de différence importante entre le nombre de cas de tumeurs chez les animaux traités et les animaux témoins, on a déterminé que le l’α‑terpinéol n’était pas cancérigène dans le cadre de cette étude.
L’α‑pinène et β‑pinène
En 2010, l’EPA a analysé l’α‑pinène et le β‑pinène (des substances commanditées de la catégorie des hydrocarbures terpéniques bicycliques) dans le cadre du Défi des substances chimiques produites en grande quantité (USEPA 2009), ce qui a permis de déterminer une CSENO de 50 ppm et une CMENO de 100 ppm. De plus amples renseignements sur les effets de l’α‑pinène sur la santé sont présentés dans la section sur l’évaluation des effets de l’α‑pinène sur la santé (section 8.3.2.2).
Le β-myrcène
Le β-myrcène n’est pas préoccupant sur le plan de la sécurité. De plus amples renseignements sur les effets du β‑myrcène sur la santé sont présentés dans la section sur l’évaluation des effets portant sur l’essence de lemon-grass sur la santé (section 7.7.2.2).
Camphène
L’EPA des États-Unis a observé une DSENO de 250 mg/kg p.c./jour et une DMENO de 1000 mg/kg p.c./jour pour le camphène (USEPA 2010). De plus amples renseignements sur les effets du camphène sur la santé sont présentés dans la section sur l’évaluation des effets la térébenthine et l’essence de térébenthine sur la santé (section 8.4.2.2).
Limonène
Nous considérons que la toxicité du limonène est assez faible. De plus amples renseignements sur les effets du limonène sur la santé sont présentés dans la section sur le potentiel d’effets nocifs de l’essence d’orange douce sur la santé humaine (section 8.1.2).
8.6.2.3 Caractérisation des risques pour la santé humaine
Voie orale :
La dose critique établie pour l’huile de pin correspond à une DSENO de 600 mg/kg p.c./jour, laquelle a été trouvée par une étude sur le développement du rat en fonction de l’ataxie chez les mères, l’altération du réflexe de redressement, la hausse du poids des surrénales et les morts fœtales observées à une dose de 1200 mg/kg p.c./jour (Parent 1998, cité dans USEPA 2006).
Voie cutanée :
Aucun effet n’a été observé lors de deux études d’exposition à l’huile de pin par voie cutanée. Or, une étude a évalué les effets de doses d’au plus 226 mg/kg p.c./jour, tandis que très peu de renseignements ont été fournis dans l’analyse de la deuxième étude. En l’absence d’autres données et afin d’avoir un point de départ prudent, la DSENO orale de 600 mg/kg p.c./jour pour l’huile de pin déterminée ci-dessus a servi pour la caractérisation des risques et l’extrapolation d’une voie d’exposition à l’autre.
Inhalation :
Il n’existe aucune donnée sur les effets de l’exposition par inhalation à l’huile de pin sur la santé. On peut envisager deux options de point de départ pour l’exposition par inhalation. D’abord, la DSENO orale de 600 mg/kg p.c./jour déterminée ci-dessus pourrait servir à la quantification des risques et à l’extrapolation d’une voie d’exposition à l’autre. On présumerait que l’absorption de l’huile de pin par inhalation équivaut à son absorption par voie orale. La deuxième option serait d’utiliser les données sur l’exposition par inhalation à l’α‑pinène, qui constitue de 12 % à 69 % de l’huile de pin. Toutefois, puisqu’on n’a recensé aucun effet critique préoccupant pour la santé du composant principal, l’α‑terpinéol, qui constitue de 0 % à 65 % de l’huile de pin, et qu’il existe des données de qualité sur l’huile mère, nous avons décidé d’utiliser la DSENO orale de 600 mg/kg p.c./jour pour l’huile de pin pour caractériser les risques associés à l’exposition par inhalation.
| Scénario d’expositiona | Exposition systémique (mg/kg p.c./jour) | Marge d’expositionb |
|---|---|---|
| Aromatisant alimentaire (apport alimentaire) – voie orale | 2,97 × 10-4 (6 mois et plus) | 2 020 202 (6 mois et plus) |
| Exposition systémique par voie cutanée et par inhalation à partir de lotions corporelles (0,3 %) c | 7,24 × 10-2 à 1,61 × 10-1 (adolescents-nourrissons) | 3735 à 8287 (nourrissons-adolescents) |
| Exposition systémique par voie cutanée et par inhalation à partir d’huiles de massage (1 %) d | 2,13 × 10-2 à 9,82 × 10-2 (adultes-nourrissons) | 6107 à 28 232 (nourrissons-adultes) |
| Exposition systémique par inhalation à partir de parfums (100 %) (0,19 mg/m3) | 8,89 × 10-2 à 4,34 × 10-2 (adultes-5 à 11 ans) | 6749 à 13 825 (5 à 11 ans-adultes) |
| Exposition systémique par voie cutanée et par inhalation due au mélange, au chargement et à l’application de nettoyants à plancher tout usage (5 %) | 8,81 × 10-2 (adultes) | 6810 (adultes) |
| Exposition systémique par voie cutanée, par inhalation et par voie orale de façon accidentelle due au contact avec des planchers nettoyés (5 %) | 2,13 × 10-1 (bambins) | 2817 (bambins) |
| Exposition systémique par inhalation à partir de nettoyants automatiques pour toilettes (10 %) (0,29 mg/m3) | 6,63 × 10-2 à 1,74 × 10-1 (adultes-bambins) | 3448 à 9050 (bambins-adultes) |
| Exposition systémique par voie orale à partir de la substance employée comme ingrédient non médicinal dans des produits de santé naturels (0,4 %) | 2,82 à 3,37 (adultes-adolescents) | 178 à 213 (adolescents-adultes) |
a L’annexe I présente les paramètres et les calculs utilisés dans les scénarios d’exposition à l’huile de pin.
b Marge d’exposition calculée à partir de la dose critique (DSENO = 600 mg/kg p.c./jour) en fonction de la hausse du poids des surrénales et des morts observées lors d’une étude par voie orale sur la toxicité de l’huile de pin pour le développement.
c On considère une absorption cutanée de 20 % (zone de peau recouverte).
d On considère une absorption cutanée de 4 % (zone de peau non recouverte).
Les marges d’exposition entre la dose critique et l’estimation d’exposition pour les scénarios présentés dans le tableau 8.6.2 sont jugées adéquates pour rendre compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
8.6.2.4 Incertitudes de l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principale source d’incertitude | Effet |
|---|---|
| Le fait de combiner les expositions par voie cutanée et par inhalation dans les scénarios relatifs aux produits nettoyants et de calculer l’exposition pour chaque voie à partir d’hypothèses prudentes pourrait produire des estimations prudentes. | + |
| Les estimations d’exposition par inhalation à l’huile de pin contenue dans des produits dépendent largement de paramètres comme le volume de la pièce, le taux de renouvellement d’air, le temps passé dans la zone d’exposition et le calcul de la moyenne pondérée dans le temps. Chacun de ces paramètres est variable et comporte une incertitude. Des hypothèses prudentes ont été utilisées. | + |
| Il existe un degré d’incertitude lié à l’extrapolation des données d’absorption par voie cutanée du linalol et du citronellol à l’huile de pin. Toutefois, comme tous les monoterpènes acycliques, monocycliques et bicycliques et leurs constituants ont des propriétés physicochimiques similaires, on s’attend à ce que l’absorption par voie cutanée de ces composés soit similaire. | +/- |
| L’extrapolation d’une voie d’exposition à une autre pour l’huile de pin a été réalisée pour des scénarios d’exposition par voie cutanée à partir de la dose critique tirée d’une étude par inhalation. | +/- |
| Il n’existe aucune étude sur des animaux portant sur la toxicité chronique ou la cancérogénicité causée par l’exposition par inhalation. | +/- |
| Il n’existe aucune étude sur l’exposition par voie cutanée ou par inhalation. | +/- |
| Il existe peu ou pas d’études sur des animaux qui ont porté sur la toxicité à doses répétées de l’huile de pin par les voies d’exposition pertinentes (voie cutanée, voie orale et inhalation). Les données sur les dangers associés à ses principaux composants, l’α‑terpinéol et l’α‑pinène, ont servi à éclairer l’évaluation des effets sur la santé, le cas échéant. | +/- |
| On ne connaît pas la composition de l’huile de pin employée lors de l’étude sur le développement des rats. Par conséquent, on ne sait pas si la composition de l’huile de pin employée est représentative de celle de l’huile de pin à laquelle les Canadiens sont exposés. | +/- |
+ = incertitude quant au potentiel de surestimation de l’exposition ou du risque; – = incertitude quant au potentiel de sous-estimation du risque d’exposition; +/ – = potentiel inconnu de surestimation ou de sous-estimation du risque.
9. Conclusion
Compte tenu de tous les éléments de preuve contenus dans la présente ébauche d’évaluation préalable, les substances du groupe des monoterpènes acycliques, monocycliques et bicycliques présentent un faible risque d’effets nocifs sur l’environnement. Il est proposé de conclure que les 15 substances du groupe des monoterpènes acycliques, monocycliques et bicycliques ne satisfont pas aux critères énoncés aux alinéas 64a) ou b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que l’essence de bois rose, l’essence de palmarosa, l’essence de géranium, le géranyl-linalol, l’essence de coriandre, l’essence de lemon-grass, l’essence d’orange douce, l’α‑pinène, l’essence de sapin et l’huile de pin ne satisfont pas aux critères énoncés à l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Selon les informations contenues dans la présente ébauche d’évaluation préalable, il est proposé de conclure que l’essence de rose, l’essence de mandarine, l’essence de tangerine, l’essence de térébenthine et la térébenthine satisfont aux critères énoncés à l’alinéa 64c) de la LCPE, car elles pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Par conséquent, il est proposé de conclure que l’essence de rose, l’essence de mandarine, l’essence de tangerine, l’essence de térébenthine et la térébenthine satisfont à un ou à plusieurs des critères énoncés à l’article 64 de la LCPE et que les 10 autres substances du groupe des monoterpènes acycliques, monocycliques et bicycliques ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
Il est également proposé de conclure que l’essence de rose, l’essence de térébenthine et la térébenthine ne répondent pas aux critères de persistance et de bioaccumulation, tandis que les essences de mandarine et de tangerine répondent aux critères de bioaccumulation, mais pas à ceux de persistance énoncés dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
Références
[ACI] American Cleaning Institute. 2017. [Base de données] [Consultée en juin 2017]. (Disponible en anglais seulement.)
[ACI] American Cleaning Institute. 2018. [Base de données] [Consultée en mars 2018]. (Disponible en anglais seulement.)
Ademuyiwa AJ, Elliot SO, Olamide KY, Omoyemi AA, Funmi OS. 2016. « Studies on the nephroprotective and nephrotoxicity effects of ethanolic extract of cymbopogon citratus (lemongrass) on Wistar albino rats ». World Journal of Pharmacy and Pharmaceutical Sciences vol. 5, p. 244-256. (Disponible en anglais seulement.)
Andrade BFMT, Braga CP, dos Santos KC, Barbosa LN, Rall VLM, Sforcin JM, Fernandes AAH, Fernandes Jr A. 2014. « Effect of inhaling Cymbopogon martinii esential oil and geraniol on serum biochemistry parameters and oxidative stress in rats ». Biochemistry Research International vol. 2014, p. 493183. (Disponible en anglais seulement.)
Api AM, Belsito D, Bhatia S, Bruze S, Calow P, Dagli ML, Dekant W, Fryer AD, Kromidas L, La Cava S, Lalko JF, Lapczynski A, Liebler DC, Miyachi Y, Politano VT, Ritacco G, Salvito D, Shen J, Schultz TW, Siper IG, Wall B, Wilcox DK. 2015. « RIFM fragrance ingredient safety assessment, Linalool, CAS registry number 78-70-6 ». Food and Chemical Toxicology vol. 82, p. S29-S38. (Disponible en anglais seulement.)
Araujo IB, Souza CAM, De-Carvalho RR, Kuriyama SN, Paumgartten FJR. 1996. « Study of the embryofoetotoxicity of alpha-terpinene in the rat ». Food and Chemical Toxicology vol. 34, p. 477-482. [UUID : IUC5-3f029228-1d93-4ed0-bf1f-c4aae558616e]. (Disponible en anglais seulement.)
Ariyoshi T, Arakaki M, Ideguchi K, Ishizuka Y, Ide H. 1974. « Studies on the metabolism of d-Limonene 9p-Mentha-1,8-diene) : III. Effects of d-limonene on the Lipids and Drug-Metabolizing enzymes in rat livers ». Xenobiotica vol. 5, p. 33-38. (Disponible en anglais seulement.)
Babu KGD, Singh B, Joshi VP, Singh V. 2002. « Essential oil composition of Damask rose (Rosa damascena Mill.) distilled under different pressures and temperatures ». Flavour and Fragrance Journal, vol. 17, p. 136–140. (Disponible en anglais seulement.)
Bastaki M, Aubanel M, Bauter M, Cacher T, Demyttenaere J, Diop MM, Harman CL, Hayashi S-M, Krammer G, Li X, Llewellyn C, Mendes O, Renskers KJ, Schnabel J, Smith BPC, Taylor SV. 2018. « Absence of renal adverse effects from beta-myrcene dietary administration in OECD guideline-compliant subchronic toxicity study. » Food and Chemical Toxicology vol. 120, p. 222-229. (Disponible en anglais seulement.)
Belsito D, Bickers D, Bruze M, Calow P, Greim H, Hanifin JM, Rogers AE, Saurat JH, Siper IG, tagami H. 2008. « A toxicologic and dermatologic assessment of cyclic and non-cyclic terpene alcohols when used as fragrance ingredients ». Food and Chemical Toxicology vol. 46, p. S1-S71. (Disponible en anglais seulement.)
Bhatia SP, Letizia CS, Api AM. 2008. « Fragrance material review on alpha-terpineol ». Food and Chemical Toxicology vol. 46, p. S280-S285. (Disponible en anglais seulement.)
Boskabady MH, Shafei MN, Saberi Z, Amini S. 2011. « Pharmacological effects of rosa damascena. Ranian » Journal of Basic Medical Sciences. vol. 14, p. 295–307. (Disponible en anglais seulement.)
Burdock GA, Carabin IG. 2009. « Safety assessment of coriander (Coriandrum sativum L.) essential oil as a food ingredient ». Food and Chemical Toxicology vol. 47, p. 22-34. [UUID : IUC5-be7b52ca-9a16-470c-8e00-8d555aa229ff]. (Disponible en anglais seulement.)
Burdock GA. 2010. Fenaroli’s handbook of flavor ingredients. 6e édition Boca Raton (FL) : CRC Press. (Disponible en anglais seulement.)
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999), ch. 33. Gazette du Canada, Partie III, vol. 22, nº 3.
Canada. Ministère de l’Environnement. 2009. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure [PDF], Gazette du Canada, Partie I, vol. 143, nº 40, p. 2945-2956.
Canada. Ministère de l’Environnement. 2012. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances de la Liste intérieure [PDF]. Gazette du Canada, Partie I, vol. 146, nº 48, Supplément.
[CBI] Centre for the Promotion of Imports from developing countries. 2014. Exporting rose geranium oil to Europe [PDF]. Pays-Bas ministère des Affaires étrangères, la Haie, Pays-Bas. (Disponible en anglais seulement.)
Caputi L, Aprea E. 2011. « Use of terpenoids as natural flavouring compounds in food industry. Recent Patents on Food », Nutrition and Agriculture. vol. 3, p. 9-16. (Disponible en anglais seulement.)
Catanzaro I, Caradonna F, Barbata G, Saverini M, Mauro M, Sciandrello G. 2012. « Genomic instability induced by alph-pinene in Chinese hamster cell line ». Mutagenesis vol. 27, p. 463-469. (Disponible en anglais seulement.)
Chantraine JM, Dhénin JM, Moretti C. 2009. « Chemical variability of rosewood (Aniba rosaeodora Ducke) essential oil in French Guiana », Journal of Essential Oil Research. vol. 21, p. 486-495. (Disponible en anglais seulement.)
Chowdhury SR. Chowdhury AR. 2010. « Chemical composition of the essential oil of cymbopogon flexuosus (steud) wats. growing in kumaon region ». Journal of Essential Oil Bearing Plants. vol. 13, p. 588-593.
Chutia M, Deka Bhuyan P, Pathak MG, Sarma T C, Boruah P. 2009. « Antifungal activity and chemical composition of citrus reticulata blanco essential oil against phytopathogens from north east india ». LWT - Food Science and Technology. vol. 42, p. 777-780. (Disponible en anglais seulement.)
[CICM] Base de données sur le commerce international canadien de marchandises, 2017. [Consulté en septembre 2017]
[CIRC] Centre international de recherche sur le cancer. 2014. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans [PDF]. Rapport au groupe consultatif sur les priorités recommandées pour les monographies du CIRC de 2015 à 2019. Lyon (France). (Disponible en anglais seulement.)
ConsExpo. 2016. ConsExpo Web Consumer Exposure Models. RIVM Report 2016-0171. Institut national pour la santé publique et l’environnement. Bilthoven, Pays-Bas. (Disponible en anglais seulement.)
[COSING] The European Commission Database for Information on Cosmetic Substances and Ingredients. 2017. European Cosmetic ingredient inventory [Base de données]. Directive de la Commission européenne sur les cosmétiques. [Consultée en juin 2017.] (Disponible en anglais seulement.)
Costa C, Bidinotto LT, Takahira RK, Salvadori DMF, Barbisan LF, Costa M. 2011. « Cholesterol reduction and lack of genotoxic or toxic effects in mice after repeated 21-day oral iontake of lemongrass (Cymbopogon citratus) essential oil ». Food and Chemical Toxicology vol. 49, p. 2268-2272. (Disponible en anglais seulement.)
[CTFA] Cosmetic, Toiletry and Fragrance Association. 1983. Summary for the results of surveys of the amount and frequency of use of cosmetic products by women. Report produit par Pitkin B, Rodericks JV, Turnbull D. Environ Corporation 1850 K Street, N.W., Washington, DC. (Disponible en anglais seulement.)
Curry P, Kramer G, Newhook R, Sitwell J, Somers D, Tracy B, Oostdam JY. 1993. Reference values for Canadian populations. Produit par le Groupe de travail sur les valeurs de référence, Direction de l’hygiène du milieu, Santé Canada. 1988 (actualisé en 1993). (Disponible en anglais seulement.)
Delgado IF, Carvalho RR, de Almeida Nogueira ACM, Mattos AP, Figueiredo LH, Oliveira SHP, Chahoud I, Paumgartten FJR. 1993a. « Study on embryo-foetotoxicity of beta-myrcene in the rat ». Food and Chemical Toxicology vol. 31, p. 31-35. (Disponible en anglais seulement.)
Delgado IF, de Almeida Nogueira ACM, Souza CAM, Costa AMN, Figueiredo LH, Mattos AP, Chahoud I, Paumgartten FJR. 1993b. « Peri- and postnatal developmental toxicity of beta-myrcene in the rat ». Food and Chemical Toxicology vol. 31, p. 623-628. (Disponible en anglais seulement.)
Dobreva A. 2013. « Dynamics of the Headspace Chemical Components of Rosa damascena Mill. Flowers Ana Dobreva », Journal of Essential Oil Bearing Plants, vol. 16, no 3, p. 404-411. (Disponible en anglais seulement.)
Ebrahimi SN, Hadian J, Ranjbar H. 2010. « Essential oil compositions of different accessions of Coriandrum sativum L. from Iran ». Natural Product Research vol. 24, p. 1287-1294. (Disponible en anglais seulement.)
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2010. Évaluation préalable pour le Défi concernant le 4-Allylvératrole (Méthyleugénol), Ottawa (Ontario), Canada, ECCC, SC.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2018a. Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée [PDF], Ottawa (Ontario), gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2018b. Évaluation préalable – Substances jugées comme étant peu préoccupantes au moyen de l’approche de la Classification du risque écologique des substances organiques et de l’approche fondée sur le seuil de préoccupation toxicologique (SPT) [PDF], Ottawa (Ontario), gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l’approche scientifique : Classification du risque écologique des substances organiques, Ottawa (Ontario), gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016b. Supporting documentation : data used to create substance-specific hazard and exposure profiles and assign risk classifications. Gatineau (Québec.), ECCC. Information de soutien du document sur l’approche scientifique : classification des risques écologiques des substances organiques. Disponible auprès de : substances@ec.gc.ca. (Disponible en anglais seulement.)
[ECCC] Environnement et Changement climatique Canada. 2016c. Inventaire national des rejets de polluants [Base de données], Gatineau (Québec), Canada, ECCC.
[ECHA] Agence européenne des produits chimiques. 2009. Registration dossier for beta-myrcene. (Disponible en anglais seulement.)
[ECHA] Agence européenne des produits chimiques. 2013. Registration dossier for delta-terpinene. (Disponible en anglais seulement.)
[ECHA] Agence européenne des produits chimiques. 2015. Registration dossier for methyl N‑methylanthranilate. (Disponible en anglais seulement.)
[ECHA] Agence européenne des produits chimiques. 2016. Registration dossier for citrate. (Disponible en anglais seulement.)
[ECHA] Agence européenne des produits chimiques. 2018a. Registration dossier for linalool. (Disponible en anglais seulement.)
[ECHA] Agence européenne des produits chimiques. 2018b. Registration dossier for turpentine oil. (Disponible en anglais seulement.)
[ECHA] Agence européenne des produits chimiques. 2018c. Registration dossier for alpha-terpineol. (Disponible en anglais seulement.)
[ECHA]. Agence européenne des produits chimiques. 2010. Registration dossier for citronellol. (Disponible en anglais seulement.)
[EFSA] Autorité européenne de sûreté des aliments. 2012. « Scientific Opinion on the safety and efficacy of aliphatic, alicyclic and aromatic saturated and unsaturated tertiary alcohols and esters with esters containing tertiary alcohols ethers (chemical group 6) when used as flavouring for all animal species [PDF] ». EFSA Journal vol. 10, p. 2966. (Disponible en anglais seulement.)
[EFSA] Autorité européenne de sûreté des aliments. 2013. « Scientific Opinion on flavouring group evaluation 06, revision 4 (FGE.06Rev4) : Straight- and branched-chain aliphatic unsaturated primary alcohols, aldehydes, carboxylic acids and esters from chemical group 1,3 and 4 ». EFSA Journal vol. 11, p. 3091. (Disponible en anglais seulement.)
[EFSA] Autorité européenne de sûreté des aliments. 2015a. « Scientific Opinion on flavouring Group Evaluation 78, Revision 2 (FGE.78Rev2) : Consideration of aliphatic and alicyclic and aromatic hydrocarbons evaluated by JECFA (63rd meeting) structurally related to aliphatic hydracrbons evaluated by EFSA in FGE.25Rev3 ». EFSA Journal vol. 13, p. 4067. (Disponible en anglais seulement.)
[EFSA] Autorité européenne de sûreté des aliments. 2015b. « Scientific Opinion on Flavouring Group Evaluation 18, Revision 3 (FGE.18Rev3) : Aliphatic, alicyclic and aromatic saturated and unsaturated tertiary alcohols, aromatic tertiary alcohols and their esters from chemical groups 6 and 8 ». EFSA Journal 13 :4118. (Disponible en anglais seulement.)
Environnement Canada. 2009. Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu du paragraphe 71 de la Loi canadienne sur la protection de l’environnement de 1999 : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure. Données produites par : Environnement Canada, Santé Canada; Programme des substances existantes.
Environnement Canada. 2013. Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu du de l’article 71 de la Loi canadienne sur la protection de l’environnement de 1999 : Avis modifiant l’Avis concernant certaines substances de la Liste intérieure. Données produites par : Environnement Canada, Santé Canada; Programme des substances existantes.
[APE du Danemark] Agence de protection de l’environnement du Danemark. 2008. Survey and health assessment of chemical substances in essential oils and fragrance oils [PDF]. Survey of Chemical Substances in Consumer Products, No. 92. (Disponible en anglais seulement.)
[EWG Skin Deep] EWG’s Skin Deep Cosmetics Database. 2017. [Base de données] [Consultée en juin 2017.] (Disponible en anglais seulement.)
Falk AA, Hagberg MT, Lof AE, Wigaeus-Hjelm EM, Wang ZP. 1990. « Uptake, distribution and elimination of alpha-pinene in man after exposure by inhalation ». Scandinavian Journal of Work, Environment and Health vol. 16, p. 372-378. (Disponible en anglais seulement.)
Falk-Filipsson A, Löf A, Hagberg M, Hjelm EW, Wang Z. 1993. « d-Limonene exposure to humans by inhalation : Uptake, distribution, elimination, and effects on the pulmonary function ». Journal of Toxicology and Environmental Health vol. 38, p. 77-88. (Disponible en anglais seulement.)
Falk-Filipsson A. 1996. « Short term inhalation exposure to turpentine : toxicokinetics and acute effects in men ». Occupational and Environmental Medicine vol. 53, p. 100-105. (Disponible en anglais seulement.)
Fandohan P, Gnonlonfin B, Laleye A, Gbenou JD, Darboux R, Moudachirou M. 2008. « Toxicity and gastric tolerance of essential oils from Cymbopogon citratus, Ocimum gratissimum and Ocimum basilicum in Wistar rats ». Food and Chemical Toxicology vol. 46, p. 2493-2497. (Disponible en anglais seulement.)
[FCC] Food Chemicals Codex. 2018. Food Chemicals Codex, 11e édition. Washington, D.C.National Academy Press. [Consulté en mars 2019.] (Disponible en anglais seulement.)
[FDS] Fiche de données de sécurité. 2013. Mothers California Gold Natural Formula Paste Wax. Mothers Polishes Waxes and Cleaners, Huntington Beach (Californie). (Disponible en anglais seulement.)
[FDS] Fiche de données de sécurité. 2013. Térébenthine. Recochem Inc, Montréal (Québec).
[FDS] Fiche de données de sécurité. 2015a. Blue Label Paste Wax Brown. RPM Wood Finishes Group. Hickory, (Caroline du Nord). (Disponible en anglais seulement.)
[FDS] Fiche de données de sécurité. 2015b. Febreze Wax Melts – Jolly Pine. Proctor & Gamble – Fabric and Home Care Division. Cincinnati (Ohio). (Disponible en anglais seulement.)
[FDS] Fiche de données de sécurité. 2016. Febreze Small Spaces Fresh-Cut Pine. Proctor & Gamble Inc. Toronto, (Ontario). (Disponible en anglais seulement.)
[FEMA] Flavor and Extract Manufacturers Association. 2017. [Base de données] [Consultée en juin 2017.] (Disponible en anglais seulement.)
Ficheux AS, Chevillotte G, Wesolek N, Morisset T, Dornic N, Bernard A, Bertho A, Romanet A, Leroy L, Mercat AC, Creusot T, Simon E, Roudot AC. 2016. « Consumption of cosmetic products by the French population. Second part : Amount data ». Food and Chemical Toxicology vol. 90, p. 130-141. (Disponible en anglais seulement.)
Ficheux AS, Wesolek N, Chevillotte G, Roudot AC. 2015. « Consumption of cosmetic products by the French population. First part : Frequency data ». Food and Chemical Toxicology vol. 78, p. 159-169. (Disponible en anglais seulement.)
Fleisher Z, Fleisher A. 1990. « Mandarin Leaf Oil (Citrus reticula Blanco) aromatic plants of the Holy Land and Sinai Part III ». Journal of Essential Oil Research vol. 2, p. 331-334. (Disponible en anglais seulement.)
Fleurarome Limitée. 2016. [Consulté en août 2018.]
Florin I, Rutberg L, Curvall M, Enzell CR. 1980. « Screening of tobacco smoke constituents for mutagenicity using the ames test ». Toxicology vol. 18, p. 219-232. (Disponible en anglais seulement.)
Friedrich K, Delgado IF, Santos LMF, Paumgartten FJR. 2007. « Assessment of sensitization potential of monoterpenes using the rat popliteal lymph node assay ». Food and Chemical Toxicology vol. 45, p. 1516-1522. (Disponible en anglais seulement.)
Gaworski CL, Vollmuth TA, York RG, Heck JD, Aranyj C. 1992. « Developmental toxicity evaluation of inhaled citral in Sprague-Dawley rats ». Food and Chemical Toxicology vol. 30, p. 269-275. [UUID : IUC5-58348bc7-e77e-4648-bc31-3f59b72919ae]. (Disponible en anglais seulement.)
Gilpin S, Hui X, Maibach H. 2010. « In vitro human skin penetration of geraniol and citronellol ». Dermatitis vol. 21, p. 41–48. (Disponible en anglais seulement.)
[Goodscents] env. 1980-2017. Oak Creek, (Wisconsin). [Consulté en juillet 2017.] (Disponible en anglais seulement.)
Harborne, JB, Baxter, H, editors. 2001. Chemical dictionary of economic plants. West Sussex, Royaume-Uni, John Wiley & Sons, Ltd. (Disponible en anglais seulement.)
Harrington, J. 2019. « Do face mists have any real skin-care benefits? We found out ». Skincare.com. (Disponible en anglais seulement.)
Imaizumi K, Hanada K, Mawatari K, Sugano M. 1985. « Effect of essential oils on the concentration of serum lipids and apolopoproteins in rats ». Agricultural and Biological Chemistry vol. 49, p. 2795-2796. (Disponible en anglais seulement.)
[IFRA] International Fragrance Association Ingredient List. 2017. [Base de données]. International Fragrance Association. [Consulté en juin 2017.] (Disponible en anglais seulement.)
[MHW, Japon] Ministère de la santé, du travail et du bien-être du Japon. 2002. Toxicity Testing Reports of Environmental Chemicals, vol. 9 [Cité par [OCDE/SIDS] Organisation pour la coopération et le développement économiques/Ensemble de données préalables. 2001. Rapport d’évaluation initiale sur les ensembles de données d’évaluation : Citral [PDF]. Suisse, 2001]. (Disponible en anglais seulement.)
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme. 2012. Human health tier II assessment for geraniol and related compounds. (Disponible en anglais seulement.)
[NTP] National Toxicology Program. 1987. Technical report on the carcinogenesis studies of food grade geranyl acetate (71% geranyl acetate, 29% citronellyl acetate) (CAS No. 105-87-3) in F344/N rats and B6C3F1 mice (gavage study) [PDF]. Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program. NTP Toxicity Report 252. (Disponible en anglais seulement.)
[NTP] National Toxicology Program. 1990. NTP technical report on the toxicology and carcinogenesis studies of d-limonene (CAS No. 5989-27-5) in F344/N rats and B6C3F1 mice (gavage studies) [PDF]. Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program. NTP Technical Report Series No. 347. (Disponible en anglais seulement.)
[NTP] National Toxicology Program. 2001. NTP technical report on the toxicology and carcinogenesis studies of citral (microencapsulated) in F344/N rats and B6C3F1 mice [PDF]. Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program. NTP Toxicity Report 505. (Disponible en anglais seulement.)
[NTP] National Toxicology Program. 2002. Review of Toxicological Literature on Turpentine (Turpentine oil, wood turpentine, sulfate turpentine, sulfite turpentine) [8006-64-2] [PDF]. Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program. (Disponible en anglais seulement.)
[NTP] National Toxicology Program. 2010. NTP technical Report on the Toxicology and Carcinogenesis Studies of Beta-Myrcene (CAS No. 123-35-3) in F344/N Rats and B6C3F1 Mice [PDF]. Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program. NTP Toxicity Report 557. (Disponible en anglais seulement.)
[NTP] National Toxicology Program. 2016. NTP technical report on the toxicity studies of alpha-pinene. Administered by inhalation to F344/N rats and B6C3F1/N mice [PDF]. Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program. NTP Toxicity Report 81.[UUID : IUC5-b1db582e-b461-4c40-852c-985f175c248e]. (Disponible en anglais seulement.)
Ishidate Jr M, Sofuni T, Yoshikawa K, Hayashi M, Nohmi T, Sawada M, Matsuoka A. 1984. « Primary mutagenicity screening of food additives currently used in Japan ». Food and Chemical Toxicology vol. 22, p. 623-636. (Disponible en anglais seulement.)
Jackson, L. 2008. « Why there won’t be a solar powered car ». The Washington Times. (Disponible en anglais seulement.)
Jager W, Buchbauer G, Jirovetz L, Fritzer M. 1992. « Percutaneous absorption of lavender oil from a massage oil ». Journal of the Society of Cosmetic Chemists vol. 43, p. 49-54. (Disponible en anglais seulement.)
Jain N, Aggarwal KK, Syamasundar KV, Srivastava SK, Kumar S. 2001. « Essential oil composition of geranium (pelargonium sp.) from the plains of northern India ». Flavour and Fragrance Journal. vol. 16, p. 44-46. (Disponible en anglais seulement.)
Johard U, Larsson K, Löf Agneta, Eklund A. 1993. « Controlled short-time terpen exposure induces an increase of the macrophages and the mast cells in bronchoalveolar lavage fluid ». American Journal of Industrial Medecine vol. 23, p. 793-799. (Disponible en anglais seulement.)
Kim S, Thiessen PA, Bolton EE, Chen J, Fu G, Gindulyte A, Han L, He J, He S, Shoemaker BA, Wang J, Yu B, Zhang J, Bryant SH. 2016. « PubChem Substance and Compound databases. » Nucleic Acids Research. Vol. 44, p. D1202-D1213. (Disponible en anglais seulement.)
Kirov M, Bainova A, Spasovski M. 1988a. « Rose oil : acute and subacute oral toxicity ». Medico Biologic Information vol. 3,p. 8-14.[UUID : IUC5-e21d82aa-b6d7-498b-b9bc-eea4b68a3e39]. (Disponible en anglais seulement.)
Kirov M, Burkova T, Kapurdov V, Spasovski M. 1988b. « Rose oil :lipotropic effect in modelled fatty dystrophy of the liver (morphological and enzymistochemical study ». Medico Biologic Information vol. 3, p. 18-22. (Disponible en anglais seulement.)
Kirov M, Vergieva T, Spasovski M. 1988c. « Rose oil : embryotoxic and teratogenic activity ». Medico Biologic Information vol. 3, p. 15-17. (Disponible en anglais seulement.)
Lapczynski A, Bhatia SP, Letizia CS, Api AM. 2008. « Fragrance material review on geranyl linalool ». Food and Chemical Toxicology, vol. 46, p. 176-178. (Disponible en anglais seulement.)
Laribi, B, Kouki K, M’Hamdi M, Bettaieb T. 2015. « Coriander (Coriander sativum L.) and its bioactive constituents ». Filoterapia, vol. 103, p. 9-26. (Disponible en anglais seulement.)
Lazutka JR, Mierauskiene J, Slapsyte G, Dedonyte V. 2001. « Genotoxicity of dill (Anethum graveolens L.), peppermint (Mentha x piperita L.) and pine (Pinus sylvestris L.) essential oils in human lymphocytes and Drosophila melanogaster ». Food and Chemical Toxicology vol. 39, p. 485-492. (Disponible en anglais seulement.)
Letizia CS, Cocchiara J, Api AM. 2003. « Fragrance material review on linalool ». Food and Chemical Toxicology vol. 41, p. 943-964. (Disponible en anglais seulement.)
Loghmani-Khouzani H, Sabzi Fini O, Safari J. 2007. « Essential oil composition of rosa damascena mill cultivated in central Iran ». Scientia Iranica. vol. 14, p. 316-319. (Disponible en anglais seulement.)
Loretz LG, Api AM, Barraj LM, Burdick J, Dressler WE, Gettings SD, Han Hsu H, Pan YHL, Re TA, Renskers KJ, Rothenstein A, Scrafford CG, Sewall C. 2005. « Exposure data for cosmetic products : lipstick, body lotion, and face cream ». Food Chem Toxicol vol. 43, p. 279-291. (Disponible en anglais seulement.)
Lota M L, De Rocca Serra D, Tomi F, Casanova J. 2000. « Chemical variability of peel and leaf essential oils of mandarins from citrus reticulata blanco ». Biochemical Systematics and Ecology vol. 28, p. 61-78. (Disponible en anglais seulement.)
Maciąg A, Milaković D, Antolović V, Kalemba D. 2007. « Essential oil composition and plant-insect relations in Scots pine (Pinus sylvestris L.) ». Food Science and Biotechnology vol. 71, p. 71–95. (Disponible en anglais seulement.)
Mandal S, Mandal M. 2015. « Coriander (Coriander sativum L.) essential oil : Chemistry and biological activity ». Asian Pacific Journal of Tropical Biomedicine vol. 5, p. 421-428. (Disponible en anglais seulement.)
Maxxam. 2019. Open Characterization – Volatile Organic Compounds. Rapport non publié. Mississauga (ON) : Maxxam. (Disponible en anglais seulement.)
Meguiar’s Online Forum. 2010. How to apply a very thin coat of wax with a G110v2. [Consulté en mai 2018] (Disponible en anglais seulement.)
Miller JA, Thompson PA, Hakim IA, Lopez AM, Thompson CA, Chew W, Hsu C-H, Chow H-H S. 2012. « Safety and festibiliy of tropical application of limonene as a massage oil to the breast ». Journal of Cancer Therapy vol. 3, p. 5A. (Disponible en anglais seulement.)
Mu’azu K, Abdullahi M, Inuwa B, Umaru SM, Adam SI, Khalid MA. 2016. !Effect of different extraction method on yield & composition of essential oil from lemongrass (Cymbopogon citratus) & eucalyptus citriodora leave!. Asian Journal of Biochemical and Pharmaceutical Research vol. 6, p. 2231-2560. (Disponible en anglais seulement.)
Nath SC, Saha BN, Bordoloi DN, Mathur RK, Leclercq PA. 1994. « The Chemical Composition of the Essential Oil of Cymbopogon flexuosus (Steud) Wats. Growing in Northeast India ». Journal of Essential Oil Research vol. 6, p. 85-87. (Disponible en anglais seulement.)
Njoroge SM, Phi NTL, Sawamura M. 2009. « Chemical composition of peel essential oils of sweet oranges (citrus sinensis) from Uganda and Rwanda ». Journal of Essential Oil-Bearing Plants. vol. 12, p. 26-33. (Disponible en anglais seulement.)
O.Berk Leaders in Packing Solutions. O.Berk online product catalog – fine mist sprayers. [Consulté en septembre 2018.] (Disponible en anglais seulement.)
OCDE QSAR Toolbox. 2016. Organisation de coopération et de développement économiques, Laboratoire de chimie mathématique. Paris (France) (Disponible en anglais seulement.)
[OCDE/SIDS] Organisation de coopération et de développement économiques, Ensemble de données préalables 1995. Identifiers, Physical and Chemical properties of camphene [PDF]. OCDE Paris. (Disponible en anglais seulement.)
[OCDE/SIDS] Organisation de coopération et de développement économiques, Ensemble de données préalables. 2001. Screening Information Dataset Initial Assessment Profile : Citral. OCDE Paris. (Disponible en anglais seulement.)
[OCDE/SIDS] Organisation de coopération et de développement économiques, Ensemble de données préalables. 2002. OECD SIDS Initial Assessment Report for SIAM 14 : Linalool. [PDF] OCDE Paris. (Disponible en anglais seulement.)
[OEHHA] The Office of Environmental Health Hazard Assessment. 2018. Chemical Listed Effective March 27, 2015 as Known to the State of California to Cause Cancer : Beta-Myrcene. [Consulté en août 2018] (Disponible en anglais seulement.)
Olorunnisola, SK, Asiyanbi HT, Hammed AM, Simsek S.l. 2014. « Biological properties of lemongrass : An overview ». International Food Research Journal vol. 21, p. 455-462. (Disponible en anglais seulement.)
[OMS] Comité mixte FAO/OMS d’experts des additifs alimentaires. 2004a. « Aliphatic branched-chain saturated and unsaturated alcohols, aldehydes, acids, and related esters ». Who Food Additives Series, vol. 52. Genève, Organisation mondiale de la Santé. (Disponible en anglais seulement.)
[OMS] Comité mixte FAO/OMS d’experts des additifs alimentaires. 2004b. « Safety evaluation of certain food additives and contaminants [PDF] ». Who Food Additives Series, vol. 61. Genève, Organisation mondiale de la Santé. (Disponible en anglais seulement.)
[OMS] Comité mixte FAO/OMS d’experts des additifs alimentaires. 2006a. Safety evaluation of certain food additives [PDF]. Sixty-fifth meeting of the Joint FAO/WHO Expert Committee on Food additives (JECFA). Who Food Additives Series : 56. Genève, Organisation mondiale de la Santé. (Disponible en anglais seulement.)
[OMS] Comité mixte FAO/OMS d’experts des additifs alimentaires. 2006b. Safety evaluation of certain food additives [PDF]. Sixty-third meeting of the Joint FAO/WHO Expert Committee on Food additives (JECFA). Who Food Additives Series : 54. Genève, Organisation mondiale de la Santé. (Disponible en anglais seulement.)
Paumgartten FJR, De-Carvalho RR, Souza CAM, Madi K, Chahoud I. 1998. « Study of the effects of beta-myrcene on rat fertility and general reproductive performance ». Brazilian Journal of Medical and Biological Research vol. 31, p. 955-965. (Disponible en anglais seulement.)
Politano VT, Lewis EM, Hoberman AM, Christian MS, Diener RM, Api AM. 2008. « Evaluation of the developmental toxicity of linalool in rats ». International Journal of Toxicology vol. 27, p. 183-188. (Disponible en anglais seulement.)
Raina VK, Srivastava SK, Aggarwal KK, Syamasundar KV, Khanuja SPS. 2003. « Essential oil composition of cymbopogon martinii from different places in India ». Flavour and Fragrance Journal, vol. 18, p. 312-315.
Rajeswara Rao BR, Rajput DK, Patel RP. 2009. « Essential oil profiles of different parts of Palmarosa (cymbopogon martinii (roxb.) wats. var. motia burk) ». Journal of Essential Oil Research, vol. 21, p. 519-521. (Disponible en anglais seulement.)
Ress NB, Hailey JR, Maronpot RR, Bucher JR, Travlos GS, Haseman JK, Orzech DP, Johnson JD, Hejtmancik MR. 2003. « Toxicology and carcinogenesis studies of microencapsulated citral in rats and mice ». Toxicological Science vol. 71, p. 198-206. (Disponible en anglais seulement.)
[RIFM] Research Institute for fragrance Materials, Inc. 1982a. Acute toxicity studies. RIFM Rapport numéro 1689, 29 septembre, RIFM, Woodcliff Lake, (New-Jersey). (Disponible en anglais seulement.)
[RIFM] Research Institute for fragrance Materials, Inc. 1982b. Report on human maximization studies. RIFM Rapport numéro 1643, 28 juin, RIFM, Woodcliff Lake, (New-Jersey). (Disponible en anglais seulement.)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’Environnement (PB)]. 2006. Cosmetics fact sheet : to assess the risks for the consumer : updated version for ConsExpo 4 [PDF]. Bilthoven (PB), RIVM. Rapport numéro : 320104001/2006. (Disponible en anglais seulement.)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’Environnement (PB)]. 2007. Paint products fact sheet : to assess the risks for the consumer : updated version for ConsExpo 4 [PDF]. Bilthoven (PB), RIVM. Rapport numéro : 320104008/2007. (Disponible en anglais seulement.)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’Environnement (PB)]. 2010. New default values for the spray model [PDF]. Bilthoven (PB), RIVM. (Disponible en anglais seulement.)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’Environnement (PB)]. 2014. General fact sheet : general default parameters for estimating consumer exposure–updated version 2014 [PDF]. Bilthoven (PB), RIVM. Rapport numéro : 090013003/2014. (Disponible en anglais seulement.)
Rose, J. 2009. 375 Essential Oils and Hydrosols. Publié par Frog, Ltd. États-Unis, ISBN 1-883319-89-7, p. 181-182. (Disponible en anglais seulement.)
Ross J, Gagnon H, Girard D, Hachey JM. 1996. « Chemical composition of the bark oil of balsam fir Abies balsamea (L.) mill ». Journal of Essential Oil Research. vol. 8, p. 343-346. (Disponible en anglais seulement.)
Sadof CS. 1997. « Monoterpene composition of pinus sylvestris varieties resistant and susceptible to Dioryctria zimmermani ». Journal of Chemical Ecology. vol. 23, p. 1917-1927. (Disponible en anglais seulement.)
Sarma PC, Printaj B, Pathak GM, Kanjilal PB. 1998. « Comparision of the Major Components of the Oils of Eight Selections of Cymbopogon martinii (Roxb.) Wats. var. martinii ». Journal of Essential Oil Research vol. 10, p. 673-674. (Disponible en anglais seulement.)
Saverini M, Catanzaro I, Sciandrello G, Avellone G, Indelicato S, Marci G, Palmisano L. 2012. « Genotoxicity of citrus wastewater in prokaryotic and eukaryotic cells and efficiency of heterogeneous photocatalysis by TiO(2) ». Journal of Photochemistry and Photobiology vol. 108, p. 8-15. (Disponible en anglais seulement.)
Sawamura M, Thi Minh Tu N, Onishi Y, Ogawa E, Choi HS. 2004. « Characteristic odor components of citrus reticulata blanco (ponkan) cold-pressed oil ». Bioscience, Biotechnology and Biochemistry vol. 68, p. 1690-1697. (Disponible en anglais seulement.)
[SC] Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport non publié. Ottawa (Ontario), Canada, SC, Direction de l’hygiène du milieu. (Disponible en anglais seulement.)
[SC] Santé Canada. 1999. Loi canadienne sur la protection de l’environnement. Liste des substances d’intérêt prioritaire, Ottawa (Ontario), Canada.
[SC] Santé Canada. 2010a. Étude d’évaluation de l’exposition à Windsor (2005-2006) : Sommaire des données d’échantillonnage des composés organiques volatiles [PDF], Ottawa (Ontario), Canada, 85 p.
[SC] Santé Canada. 2010b. Étude de la qualité de l’air intérieur à Regina (2007) : Sommaire des données d’échantillonnage des composés organiques volatiles [PDF], Ottawa (Ontario), Canada, 164 p.
[SC] Santé Canada. 2012. Étude de la qualité de l’air intérieur à Halifax (2009) : Sommaire des données d’échantillonnage des composés organiques volatils, Ottawa (Ontario), Canada, 49 p.
[SC] Santé Canada. 2013. Étude de la qualité de l’air intérieur à Edmonton (2010) : Sommaire des données des composés organiques volatils (COV) [PDF], Ottawa (Ontario), Canada, 51 p.
[SC] Santé Canada. 2015. Liste critique des ingrédients [Internet] [PDF], Ottawa (Ontario), Santé Canada, Sécurité des produits de consommation, Canada.
[SC] Santé Canada. 2016. Document sur l’approche scientifique – Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances [PDF], Ottawa (Ontario), gouvernement du Canada.
[SC] Santé Canada. 2019. Maxxam : Open Characterization – Volatile Organic Compounds. Rapport non publié. Ottawa (Ontario) Canada, 3 p. (Disponible en anglais seulement.)
[SCCS] Scientific Committee on Consumer Safety. 2000. Opinion concerning methyleugenol adopted by the SCCNFP during the 14th plenary meeting of 24 October 2000. Direction Générale de la Santé et des Consommateurs, Bruxelles, Belgique. (Disponible en anglais seulement.)
[SCCS] Scientific Committee on Consumer Safety. 2010. Basic criteria for the in vitro assessment of dermal absorption of cosmetic ingredients adopted by the SCCS at its 7th plenary meeting of 22 June 2010 [PDF]. Commission européenne, Direction Générale de la Santé et des Consommateurs, Bruxelles, Belgique. (Disponible en anglais seulement.)
[SCCS] Scientific Committee on Consumer Safety. 2011. Opinion on methyl-N-methylanthranilate (Photoxicity only) [PDF] 13-14 December. Direction Générale de la Santé et des Consommateurs, Bruxelles, Belgique. (Disponible en anglais seulement.)
Schaneberg BT, Khan IA. 2002. « Comparison of extraction methods for marker compounds in the essential oil of lemon grass by GC ». Journal of Agriculture and Food Chemistry vol. 50, p. 1345-1349. (Disponible en anglais seulement.)
Schuster O, Haag F, Priester H. 1986. « Transdermal absorption of terpenes from essential oils of Pinimenthol-S ointment ». Medizinische Welt vol. 37, p. 100-102. (Disponible en anglais seulement.)
[SCREEN3] Screening Tool Program for Windows. 1996. Version 4.10. Research Triangle Park (Caroline du Nord), U.S. Environmental Protection Agency, Office of Air Quality Planning and Standards Emissions, Monitoring, and Analysis Division. (Disponible en anglais seulement.)
Sharma N, Tripathi A. 2008. « Effects of citrus sinensis (L.) osbeck epicarp essential oil on growth and morphogenesis of Aspergillus niger (L.) van tieghem ». Microbiological Research. vol. 163, p. 337-344. (Disponible en anglais seulement.)
[SIMDUT] Fiche sur les matières dangereuses utilisées au travail. 2004. RM-Novelty car fragrance-citrus burst, tropical punch. Prelam Enterprises Ltd., Moncton (Nouveau-Brunswick).
[SIMDUT] Fiche sur les matières dangereuses utilisées au travail. 2008. Fantastik Vanish Drop-Ins Automatic Toilet Bowl Cleaner – Blue. S.C. Johnson and Son, Limited. Brantford (Ontario). (Disponible en anglais seulement)
[SIMDUT] Fiche sur les matières dangereuses utilisées au travail. 2015. Scotch Pine General Purpose Cleaner. G.K. Chemical Specialties Co. Inc. Scarborough (Ontario). (Disponible en anglais seulement.)
Simić A, Soković MD, Ristić M, Grujić-Jovanović S, Vukojević J, Marin PD. 2004. « The chemical composition of some lauraceae essential oils and their antifungal activities ». Phytotherapy Research. vol. 18, p. 713-717. (Disponible en anglais seulement.)
Sinha S, Jothiramajayam M, Ghosh M, Mukherjee A. 2014. « Evaluation of toxicity of essential oils palmarosa, citronella, lemongrass and vetiver in human lymphocytes ». Food and Chemical Toxicology vol. 68, p. 71-77. (Disponible en anglais seulement.)
Stofberg J, Grundschober F. 1987. « Consumption ratio and food predominance of flavouring materials ». Perfumer and Flavorist vol. 12, p. 27. (Disponible en anglais seulement.)
Stoner GD, Shimkin MB, Kniazeff AJ, Weisburger JH, Weisburger EK, Gori GB. 1973. « Test for carcinogenicity of food additives and chemotherapeutic agents by the pulmonary tumor response in strain A mice ». Cancer Research vol. 33, p. 3069-3085. (Disponible en anglais seulement.)
Tarkang PA, Agbor GA, Tsabang N, Tchokouaha LRY, Tchamgoue DA, Kemeta D, Mengue YSN, Mba JR, Weyepe F. 2012. « Effect of long-term oral administration of the queous and ethanolleaf extracts of Cymbopogoncitratus (DC. ex Nees) Stapf ». Annals of Biological Research vol. 3, p. 5561-5570. [UUID : IUC5-67feff4e-b21a-415e-8e8e-f9f37a998db8]. (Disponible en anglais seulement.)
Tisserand R, Young R. 2014. Essential Oil Safety. 2e éd. Londres (Royaume-Uni) : Churchill Livingstone. (Disponible en anglais seulement.)
[UE] Union européenne. 2016 Food Flavourings Database [base de données]. Bruxelles (Belgique), Commission européenne, Direction Générale de la Santé et des Consommateurs. [Consultée en 2018.] (Disponible en anglais seulement.)
[USEPA] United States Environmental Protection Agency. 1988. Recommentations for and documentation of biological values for use in risk assessment. EPA/600/6-87/008. Cincinnati (OH) : US Environmental Protection Agency, Office of Research and Development; Office of Health and Environmental Assessment. (Disponible en anglais seulement.)
[USEPA] United States Environmental Protection Agency. 1992. Screening procedures for estimating the air quality impact of stationary sources [PDF]. Revised. Office of Air and Radiation, Office of Air Quality Planning and Standards. EPA-454/R-92-019. [cited in Nov. 2016]. (Disponible en anglais seulement.)
[USEPA] United States Environmental Protection Agency. 2006. Reregistration eligibility decision for pine oil (Case 3113) [PDF]. Washington (DC) : US Environmental Protection Agency, Office of pollution prevention and toxics; Syracuse research corporation. (Disponible en anglais seulement.)
[USEPA] United States Environmental Protection Agency. 2007. Biopesticides registration action document Balsam fir oil (PC Code 129035) [PDF]. Washington (DC) : US Environmental Protection Agency, Office of pollution prevention and toxics; Syracuse research corporation. (Disponible en anglais seulement.)
[USEPA] United States Environmental Protection Agency. 2009. Screening-level hazard characterization terpenoid primary alcohols and related esters category. SPONSORED CHEMICALS : dl-Citronellol (CASRN 106-22-9), Geraniol (CASRN 106-24-1), Nerol (CASRN 106-25-2), Acetylated myrcene (mixture) (CASRN 68412-04-4), Geranyl acetate (CASRN 105-87-3), Citronellyl acetate (CASRN 150-84-5), Linalyl acetate (CASRN 115-95-7), Citral (CASRN 5392-40-5), Linalool (CASRN 78-70-6), Citral diethyl acetal (CASRN 7492-66-2). [PDF] Washington (DC) : US Environmental Protection Agency, Office of pollution prevention and toxics; Syracuse research corporation. (Disponible en anglais seulement.)
[USEPA] United States Environmental Protection Agency. 2010. Screening-level hazard characterization : Bicyclic terpene hydrocarbons category [PDF]. Washington (DC) : US Environmental Protection Agency, Office of pollution prevention and toxics; Syracuse research corporation. (Disponible en anglais seulement.)
[USEPA] United States Environmental Protection Agency. 2011. Exposure Factors Handbook 2011 Edition (Final Report).[PDF] U.S. Environmental Protection Agency, Washington, DC, EPA/600/R-09/052F. (Disponible en anglais seulement.)
[USEPA] United States Environmental Protection Agency. 2012a. Standard Operating Procedures for Residential Pesticide Exposure Assessment [PDF]. US Environmental Protection Agency, Office of pollution prevention and toxics; Syracuse Research Corporation. (Disponible en anglais seulement.)
[USEPA] United States Environmental Protection Agency. 2012b. EPI Suite- Estimation Program Interface Suite for Microsoft Windows [estimation model]. c2000-2012. Version. 4.11. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (New-York), Syracuse Research Corporation. (Disponible en anglais seulement.)
[USEPA] United States Environmental Protection Agency. 2018. ChemView database on chemical health and safety data. The Toxic Substaces Control Act (TSCA). Washington (DC) : US Environmental Protection Agency. (Disponible en anglais seulement.)
[USEPA] US Environmental Protection Agency.1991. Prepared for the Risk Assessment Forum. EPA/625/3-91/019F; Washington, DC : Alpha2u-Globulin : Association with Chemically Induced Renal Toxicity and Neoplasia in the Male Rat. (Disponible en anglais seulement.)
[USFDA] United States Food and Drug Administration. 2017d. Food Additive Status List. [Consultée en juin 2017] US Food and Drug Administration. (Disponible en anglais seulement.)
[USFDA] US Food and Drug Administration. 2017a. Code of Federal Regulations Title 21, Volume 3 : Section 182.20 Essential oils, oleoresins (solvent-free), and natural extractives (including distillates). (Disponible en anglais seulement.)
[USFDA] US Food and Drug Administration. 2017b. Code of Federal Regulations Title 21, Volume 3 : Section 172.515 Synthetic flavoring substances and adjuvants. (Disponible en anglais seulement.)
[USFDA] US Food and Drug Administration. 2017c. [version du 1er avril 2017]. Code of Federal Regulations Title 21, Volume 3 : Section 172.510 Natural flavoring substances and natural substances used in conjunction with flavors. (Disponible en anglais seulement.)
[USFDA] US Food and Drug Administration. 2018. Substances Added to Food (formerly EAFUS). (Disponible en anglais seulement.)
Ustun O, Sezik E, Kurkcuoglu M, Baser K H C. 2006. « Study of the essential oil composition of pinus sylvestris from Turkey ». Chemistry of Natural Compounds. vol. 42, p. 26-31. (Disponible en anglais seulement.)
Versar. 1986. Standard scenarios for estimating exposure to chemical substances during use of consumer products : volume 1 and 2. Produit pour l’Environmental Protection Agency. Washington (DC) EPA Contract No : 68-02-3968. (Disponible en anglais seulement.)
Webb DR, Kanerva RL, Hysell DK, Alden CL, Lehman-McKeeman LD. 1990. « Assessment of the subchronic oral toxicity of d-limonene in dogs ». Food and Chemical Toxicology vol. 28, p. 669-675. (Disponible en anglais seulement.)
Webb DR, Ridder GM, Alden CL. 1989. « Acute and subchronic nephrotoxicity of d-limonene in Fischer 344 rats ». Food and Chemical Toxicology vol. 27, p. 639-649. (Disponible en anglais seulement.)
Won D, Lusztyk E. 2011. Data gathering on chemicals released to indoor air of residences from building materials and furnishings. Rapport finalOttawa (Ontario) : CNRC. 158 p. Rapport numéro : B3332.2. (Disponible en anglais seulement.)
Won, D, Nong, G, Yang, W, Collins, P. 2014. Final Report. Ottawa (Ontario) : CNRC. 154 p. Rapport numéro : A1-000342.2. (Disponible en anglais seulement.)
Won, D, Nong, N, Yang, W, Schleibinger, H. 2013. Material Emissions Data : 52 Building Materials Tested for 124 Compounds. Rapport final. Ottawa (Ontario) : CNRC. 286 p. Rapport numéro : A1-000342. (Disponible en anglais seulement.)
Won, D, Yang, W, Edwards, D. 2017. VOC Emissions Inventory and Model Verification for New Home Construction. Report 2 : Indoor Air Quality Modeling. Rapport final. Ottawa (Ontario) : CNRC. Rapport numéro : A1-010476. (Disponible en anglais seulement.)
Won, D, Yang, W. 2012. Material Emission Information from 105 Building Materials and Consumer Products. Rapport final. Ottawa (Ontario) : CNRC. 151 p. Rapport numéro : B3341.1. (Disponible en anglais seulement.)
Wu X, Bennett DH, Ritz B, Cassady DL, Lee K, Hertz-Picciotto I. 2010. « Usage pattern of personal care products in California households ». Food Chem Toxicol vol. 48, p. 3109-3119. (Disponible en anglais seulement.)
Zhu J, Wong SL, Cakmak S. 2013. « Nationally representative levels of selected volatile organic compounds in Canadian residential indoor air : Population-based survey ». Environ Sci Technol. vol. 47, p. 13276-13283. (Disponible en anglais seulement.)
Annexes
Annexe A. Paramètres utilisés pour estimer l’exposition à l’essence de coriandre
| Groupe d’âge | Quant. moy. de produit (g/app.) a | Fréq. quot. moyenne b | Conc. air (mg/m3) (24 h) c | Expos. cutan. (mg/kg p.c./j) d | Expos. inhal. (mg/kg p.c./j) e | Expos. comb. (mg/kg p.c./j) f |
|---|---|---|---|---|---|---|
| 0 à 6 mois | 2,5 | 0,8 | 1,40 × 10-2 | 1,60 | 3,92 × 10-3 | 1,60 |
| 6 mois à 4 ans | 4,1 | 0,8 | 2,20 × 10-2 | 1,27 | 1,32 × 10-2 | 1,28 |
| 5 à 11 ans | 5 | 0,8 | 3,00 × 10-2 | 7,74 × 10-1 | 1,40 × 10-2 | 7,88 × 10-1 |
| 12 à 19 ans | 8,7 | 0,8 | 4,80 × 10-2 | 7,03 × 10-1 | 1,28 × 10-2 | 7,16 × 10-1 |
| 20 ans et plus | 10 | 1 | 5,50 × 10-2 | 8,46 × 10-1 | 1,26 × 10-2 | 8,59 × 10-1 |
a Cité par Ficheux et coll. 2016.
b Cité par Ficheux et coll. 2015, Wu et coll. 2010.
c Les concentrations dans l’air ont été modélisées à l’aide du modèle ConsExpo d’émission constante de vapeur par évaporation en supposant que 80 % de la dose appliquée était disponible pour l’évaporation (quantité demeurant sur l’épiderme après l’absorption cutanée de la substance) (80 %× [quantité de produit/application] × [applications/jour] × concentration de 3 %) et en utilisant les paramètres suivants : durée d’exposition de 24 h, durée d’émission de 1 h, volume de la pièce de 80 m3, taux de ventilation de 1/h, aire couverte égale à la peau exposée (présumée être égale à la tête, aux bras et aux mains) (1365 cm2 pour 0 à 6 mois, 1970 cm2 pour 6 mois à 4 ans, 2900 cm2 pour 5 à 11 ans, 4540 cm2 pour 12 à 19 ans et 4735 cm2 pour les adultes tel que cité par Santé Canada 1998), matrice de poids moléculaire de 125 g/mole et une température d’application de 37 °C.
d Exposition cutanée calculée à l’aide de la formule suivante : [application moyenne (g/application) × fréquence quotidienne moyenne (applications/jour) × concentration du produit (3 %) × absorption cutanée pour la peau recouverte (20 %) × facteur de conversion (1000 mg/g)] ÷ masse corporelle (7,5 kg pour 0 à 6 mois, 15,5 kg pour 6 mois à 4 ans, 31,0 kg pour 5 à 11 ans, 59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
e Exposition par inhalation calculée à l’aide de la formule suivante : [(concentration dans l’air, mg/m3) (moyenne pondérée sur 24 h) × (taux d’inhalation, m3/j) (2,1 m3/j pour 0 à 6 mois, 9,3 m3/j pour 6 mois à 4 ans, 14,5 m3/j pour 5 à 11 ans, 15,8 m3/j pour 12 à 19 ans et 16,2 m3/j pour 20 ans et plus tel que cité par Santé Canada 1998] ÷ masse corporelle (7,5 kg pour 0 à 6 mois, 15,5 kg pour 6 mois à 4 ans, 31,0 kg pour 5 à 11 ans, 59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
f Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j).
| Groupe d’âge | Quant. moy. de produit (g/j) a | Conc. dans l’air (24 h) (mg/m3) b | Expos. cutan. (mg/kg p.c./j) c | Expos. inhal. (mg/kg p.c./j) d | Expos. comb. (mg/kg p.c./j) e |
|---|---|---|---|---|---|
| 0 à 6 mois | 2,60 × 10-2 | 1,20 × 10-2 | 1,39 × 10-1 | 3,36 × 10-3 | 1,42 × 10-1 |
| 6 mois à 4 ans | 2,60 × 10-2 | 1,20 × 10-2 | 6,72 × 10-2 | 7,20 × 10-3 | 7,44 × 10-2 |
| 5 à 11 ans | 2,60 × 10-2 | 1,20 × 10-2 | 3,36 × 10-2 | 5,61 × 10-3 | 3,92 × 10-2 |
| 12 à 19 ans | 2,60 × 10-2 | 1,20 × 10-2 | 1,75 × 10-2 | 3,19 × 10-3 | 2,07 × 10-2 |
| 20 ans et plus | 2,60 × 10-2 | 1,10 × 10-2 | 1,47 × 10-2 | 2,51 × 10-3 | 1,72 × 10-2 |
a Calculé à partir de deux gouttes d’huile (instructions de l’étiquette) = 0,1 mL à partir d’une concentration maximale de 30 %, puis multipliée par la masse volumique de l’essence de coriandre de 0,868 g/mL = 0,1 × 0,3 × 0,868. Fréquence présumée d’un massage par jour.
b Les concentrations dans l’air ont été modélisées à l’aide du modèle ConsExpo d’émission constante de vapeur par évaporation en supposant que 96 % de la dose appliquée était disponible pour l’évaporation (quantité demeurant sur l’épiderme après l’absorption cutanée de la substance) (96 %× [quantité de produit/jour]), et en utilisant les paramètres suivants : durée d’exposition de 24 h, durée d’émission de 1 h, volume de la pièce de 80 m3, taux de ventilation de 1/h, aire d’émission égale à la peau exposée (aire totale moins la tête pour les enfants de 0 à 11 ans et aire totale moins une demi-tête et le tronc pour les adultes et les adolescents) (3020 cm2 pour 0 à 6 mois, 4910 cm2 pour 6 mois à 4 ans, 8450 cm2 pour 5 à 11 ans, 12 795 cm2 pour 12 à 19 ans et 14 380 cm2 pour 20 ans et plus, tel que cité par Santé Canada 1998), matrice de poids moléculaire de 125 g/mole et une température d’application de 37 °C.
c Exposition cutanée calculée à l’aide de la formule suivante : [application moyenne (g/j) × absorption cutanée pour la peau exposée (4 %) × facteur de conversion (1000 mg/g)] ÷ masse corporelle (7,5 kg pour 0 à 6 mois, 15,5 kg pour 6 mois à 4 ans, 31,0 kg pour 5 à 11 ans, 59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
d Exposition par inhalation calculée à l’aide de la formule suivante : [concentration dans l’air (mg/m3) (moyenne pondérée sur 24 h) × taux d’inhalation (m3/j) (2,1 m3/j pour 0 à 6 mois, 9,3 m3/j pour 6 mois à 4 ans, 14,5 m3/j pour 5 à 11 ans, 15,8 m3/j pour 12 à 19 ans et 16,2 m3/j pour 20 ans et plus, tel que cité par Santé Canada 1998] ÷ masse corporelle (7,5 kg pour 0 à 6 mois, 15,5 kg pour 6 mois à 4 ans, 31,0 kg pour 5 à 11 ans, 59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
e Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j).
| Groupe d’âge | Quant. moy. de produit (g/app.) a | Fréq. quot. moy. a | Conc. du produit (%) | Conc. dans l’air (mg/m3) (24 h) c | Exposition (mg/kg p.c./j)c |
|---|---|---|---|---|---|
| 5 à 11 ans | 0,33 | 1,7 | 10 | 0,019 | 8,89 × 10-3 |
| 12 à 19 ans | 0,33 | 1,7 | 10 | 0,019 | 5,05 × 10-3 |
| 20 ans et plus | 0,33 | 1,7 | 10 | 0,019 | 4,34 × 10-3 |
a Cité par Loretz et coll. 2005.
b Paramètres utilisés avec ConsExpo = durée d’exposition de 5 min, volume de la pièce : 10 m3 (salle de bain), taux de ventilation : 0/h.
c Dose interne (mg/kg p.c./j) = ([moyenne en mg/m3] × taux d’inhalation (14,5 m3/j pour 5 à 11 ans, 15,8 m3/j pour 12 à 19 ans, 16,2 m3/j pour 20 ans et plus)) ÷ masse corporelle (31 kg pour 5 à 11 ans 59,4 kg pour 12 à 19 ans, 70,9 kg pour 20 ans et plus). Taux d’inhalation et masses corporelles tels que cités par Santé Canada1998.
Annexe B. Paramètres utilisés pour estimer l’exposition à l’essence de rose
| Groupe d’âge | Quant. moy. de produit (g/app.) a | Fréq. quot. moy. b | Conc. air (mg/m3) (24 h) c | Expos. cutan. (mg/kg p.c./j) d | Expos. inhal. (mg/kg p.c./j) e | Expos. comb. (mg/kg p.c./j) f |
|---|---|---|---|---|---|---|
| 0 à 6 mois | 2,5 | 0,8 | 5,40 × 10-3 | 1,60 | 1,51 × 10-3 | 1,60 |
| 6 mois à 4 ans | 4,1 | 0,8 | 7,80 × 10-3 | 1,27 | 4,68 × 10-3 | 1,27 |
| 5 à 11 ans | 5 | 0,8 | 1,10 × 10-2 | 7,74 × 10-1 | 5,15 × 10-3 | 7,79 × 10-1 |
| 12 à 19 ans | 8,7 | 0,8 | 1,80 × 10-2 | 7,03 × 10-1 | 4,79 × 10-3 | 7,08 × 10-1 |
| 20 ans et plus | 10 | 1 | 1,90 × 10-2 | 8,46 × 10-1 | 4,34 × 10-3 | 8,51 × 10-1 |
a Cité par Ficheux et coll. 2016.
b Cité par Ficheux et coll. 2015, Wu et coll. 2010.
c Les concentrations dans l’air ont été modélisées à l’aide du modèle ConsExpo d’émission constante de vapeur par évaporation en supposant que 80 % de la dose appliquée était disponible pour l’évaporation (quantité demeurant sur l’épiderme après l’absorption cutanée de la substance) (80 %× [quantité de produit/application] × [applications/jour] × concentration de 3 %) et en utilisant les paramètres suivants : durée d’exposition de 24 h, durée d’émission de 1 h, volume de la pièce de 80 m3, taux de ventilation de 1/h, aire couverte égale à la peau exposée (présumée être égale à la tête, aux bras et aux mains) (1365 cm2 pour 0 à 6 mois, 1970 cm2 pour 6 mois à 4 ans, 2900 cm2 pour 5 à 11 ans, 4540 cm2 pour 12 à 19 ans et 4735 cm2 pour les adultes, tel que cité par Santé Canada 1998), matrice de poids moléculaire de 125 g/mole et une température d’application de 37 °C.
d Exposition cutanée calculée à l’aide de la formule suivante : [application moyenne (g/application) × fréquence quotidienne moyenne (applications/jour) × concentration du produit (3 %) × absorption cutanée pour la peau recouverte (20 %) × facteur de conversion (1000 mg/g)] ÷ masse corporelle (7,5 kg pour 0 à 6 mois, 15,5 kg pour 6 mois à 4 ans, 31,0 kg pour 5 à 11 ans, 59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
e Exposition par inhalation calculée à l’aide de la formule suivante : [concentration dans l’air (mg/m3) (moyenne pondérée sur 24 h) × taux d’inhalation (m3/j) (2,1 m3/j pour 0 à 6 mois, 9,3 m3/j pour 6 mois à 4 ans, 14,5 m3/j pour 5 à 11 ans, 15,8 m3/j pour 12 à 19 ans et 16,2 m3/j pour 20 ans et plus, tel que cité par Santé Canada 1998] ÷ masse corporelle (7,5 kg pour 0 à 6 mois, 15,5 kg pour 6 mois à 4 ans, 31,0 kg pour 5 à 11 ans, 59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
f Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j).
| Groupe d’âge | Quant. moy. de produit (g/app.) a | Fréq. quot. moy. b | Conc. air (mg/m3) (24 h) c | Expos. cutan. (mg/kg p.c./j) d | Expos. inhal. (mg/kg p.c./j) e | Expos. comb. (mg/kg p.c./j) f |
|---|---|---|---|---|---|---|
| 0 à 6 mois | 2,5 | 0,8 | 1,80 × 10-3 | 5,33 × 10-1 | 5,04 × 10-3 | 5,34 × 10-1 |
| 6 mois à 4 ans | 4,1 | 0,8 | 2,60 × 10-3 | 4,23 × 10-1 | 1,56 × 10-3 | 4,25 × 10-1 |
| 5 à 11 ans | 5 | 0,8 | 3,70 × 10-3 | 2,58 × 10-1 | 1,73 × 10-3 | 2,60 × 10-1 |
| 12 à 19 ans | 8,7 | 0,8 | 5,80 × 10-3 | 2,34 × 10-1 | 1,54 × 10-3 | 2,36 × 10-1 |
| 20 ans et plus | 10 | 1 | 6,30 × 10-3 | 2,82 × 10-1 | 1,44 × 10-3 | 2,84 × 10-1 |
a Cité par Ficheux et coll. 2016.
b Cité par Ficheux et coll. 2015, Wu et coll. 2010.
c Les concentrations dans l’air ont été modélisées à l’aide du modèle ConsExpo d’émission constante de vapeur par évaporation en supposant que 80 % de la dose appliquée était disponible pour l’évaporation (quantité demeurant sur l’épiderme après l’absorption cutanée de la substance) (80 %× [quantité de produit/application] × [applications/jour] × concentration de 1 %), et en utilisant les paramètres suivants : durée d’exposition de 24 h, durée d’émission de 1 h, volume de la pièce de 80 m3, taux de ventilation de 1/h, aire couverte égale à la peau exposée (présumée être égale à la tête, aux bras et aux mains) (1365 cm2 pour 0 à 6 mois, 1970 cm2 pour 6 mois à 4 ans, 2900 cm2 pour 5 à 11 ans, 4540 cm2 pour 12 à 19 ans et 4735 cm2 pour les adultes, tel que cité par Santé Canada 1998), matrice de poids moléculaire de 125 g/mole et une température d’application de 37 °C.
d Exposition cutanée calculée à l’aide de la formule suivante : [application moyenne (g/application) × fréquence quotidienne moyenne (applications/jour) × concentration du produit (1 %) × absorption cutanée pour la peau recouverte (20 %) × facteur de conversion (1000 mg/g)] ÷ masse corporelle (7,5 kg pour 0 à 6 mois, 15,5 kg pour 6 mois à 4 ans, 31,0 kg pour 5 à 11 ans, 59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
e Exposition par inhalation calculée à l’aide de la formule suivante : [concentration dans l’air (mg/m3) (moyenne pondérée sur 24 h) × taux d’inhalation (m3/j) (2,1 m3/j pour 0 à 6 mois, 9,3 m3/j pour 6 mois à 4 ans, 14,5 m3/j pour 5 à 11 ans, 15,8 m3/j pour 12 à 19 ans et 16,2 m3/j pour 20 ans et plus, tel que cité par Santé Canada 1998] ÷ masse corporelle (7,5 kg pour 0 à 6 mois, 15,5 kg pour 6 mois à 4 ans, 31,0 kg pour 5 à 11 ans, 59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
f Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + Exposition par inhalation (mg/kg p.c./j).
| Groupe d’âge | Quant. moy. de produit (g/j) a | Conc. dans l’air (24 h) (mg/m3) b | Expos. cutan. (mg/kg p.c./j) c | Expos. inhal. (mg/kg p.c./j) d | Expos. comb. (mg/kg p.c./j) e |
|---|---|---|---|---|---|
| 0 à 6 mois | 6,84 × 10-2 | 3,10 × 10-2 | 3,65 × 10-1 | 8,68 × 10-3 | 3,74 × 10-1 |
| 6 mois à 4 ans | 6,84 × 10-2 | 3,10 × 10-2 | 1,77 × 10-1 | 1,86 × 10-2 | 1,95 × 10-1 |
| 5 à 11 ans | 6,84 × 10-2 | 3,00 × 10-2 | 8,83 × 10-2 | 1,40 × 10-2 | 1,02 × 10-1 |
| 12 à 19 ans | 6,84 × 10-2 | 3,00 × 10-2 | 4,61 × 10-2 | 7,98 × 10-3 | 5,40 × 10-2 |
| 20 ans et plus | 6,84 × 10-2 | 3,00 × 10-2 | 3,86 × 10-2 | 6,85 × 10-3 | 4,55 × 10-2 |
a Calculé à partir de cinq gouttes d’huile (instructions de l’étiquette) = 0,25 mL (chaque goutte équivaut à 0,05 mL) à partir d’une concentration maximale de 30 % multiplié par la masse volumique de l’essence de rose de 0,9125 g/mL = 0,25 × 0,3 × 0,9125. Fréquence présumée d’un massage par jour.
b Les concentrations dans l’air ont été modélisées à l’aide du modèle ConsExpo d’émission constante de vapeur par évaporation en supposant que 96 % de la dose appliquée était disponible pour l’évaporation (quantité demeurant sur l’épiderme après l’absorption cutanée de la substance) (96 %× [quantité de produit/jour]), et en utilisant les paramètres suivants : durée d’exposition de 24 h, durée d’émission de 1 h, volume de la pièce de 80 m3, taux de ventilation de 1/h, aire d’émission égale à la peau exposée (aire totale moins la tête pour les enfants de 0 à 11 ans et aire totale moins une demi-tête et le tronc pour les adultes et les adolescents) (3020 cm2 pour 0 à 6 mois, 4910 cm2 pour 6 mois à 4 ans, 8450 cm2 pour 5 à 11 ans, 12 795 cm2 pour 12 à 19 ans et 14 380 cm2 pour 20 ans et plus, tel que cité par Santé Canada 1998), matrice de poids moléculaire de 125 g/mole et une température d’application de 37 °C.
c Exposition cutanée calculée à l’aide de la formule suivante : [application moyenne (g/j) × absorption cutanée pour la peau exposée (4 %) × facteur de conversion (1000 mg/g)] ÷ masse corporelle (7,5 kg pour 0 à 6 mois, 15,5 kg pour 6 mois à 4 ans, 31,0 kg pour 5 à 11 ans, 59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998)
d Exposition par inhalation calculée à l’aide de la formule suivante : [concentration dans l’air (mg/m3) (moyenne pondérée sur 24 h) × taux d’inhalation (m3/j) (2,1 m3/j pour 0 à 6 mois, 9,3 m3/j pour 6 mois à 4 ans, 14,5 m3/j pour 5 à 11 ans, 15,8 m3/j pour 12 à 19 ans et 16,2 m3/j pour 20 ans et plus, tel que cité par Santé Canada 1998] ÷ masse corporelle (7,5 kg pour 0 à 6 mois, 15,5 kg pour 6 mois à 4 ans, 31,0 kg pour 5 à 11 ans, 59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
e Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j)
| Groupe d’âge* | Quant. moy. de produit (g/évén.) a | Moyenne d’évén. par jour a | Conc. air (mg/m3) (24 h) c | Expos. cutan. (mg/kg p.c./j) c | Expos. inhal. (mg/kg p.c./j) d | Expos. comb. (mg/kg p.c./j) e |
|---|---|---|---|---|---|---|
| 12 à 19 ans | 1,0 | 1,5 | 9,90 × 10-2 | 3,03 × 10-2 | 2,63 × 10-2 | 5,66 × 10-2 |
| 20 ans et plus | 2,0 | 1,5 | 9,20 × 10-2 | 5,08 × 10-2 | 2,10 × 10-2 | 7,18 × 10-2 |
* Le scénario d’hydratant pour le visage ne comporte que deux groupes d’âge.
a Cité par Loretz et coll. 2005, Ficheux et coll. 2015 et 2016.
b Les concentrations dans l’air ont été modélisées à l’aide du modèle ConsExpo d’émission constante de vapeur par évaporation en supposant que 96 % de la dose appliquée était disponible pour l’évaporation (quantité demeurant sur l’épiderme après l’absorption cutanée de la substance) (96 % × [quantité de produit/application] × [applications/jour] × concentration de 3 %), et en utilisant les paramètres suivants : durée d’exposition de 24 h, durée d’émission de 1 h, volume de la pièce de 1 m3 (volume personnel approximatif de la respiration), l’aire d’évaporation est égale à la surface d’application présumée être équivalente à la moitié de la tête (730 cm2 pour 12 à 19 ans et 637,5 cm2 pour les adultes, tel que cité par Santé Canada 1998), taux de ventilation de 2/h (mélange approximatif de l’air entre la zone de respiration personnelle et la pièce), matrice de poids moléculaire de 125 g/mole et une température d’application de 37 °C.
c Exposition cutanée calculée à l’aide de la formule suivante : [application moyenne (g/application) × fréquence quotidienne moyenne (applications/jour) × concentration du produit (3 %) × absorption cutanée pour la peau recouverte (4 %) × facteur de conversion (1000 mg/g)] ÷ masse corporelle (59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
c Exposition par inhalation calculée à l’aide de la formule suivante : [concentration dans l’air (mg/m3) (moyenne pondérée sur 24 h) × taux d’inhalation (m3/j) (15,8 m3/j pour 12 à 19 ans et 16,2 m3/j pour 20 ans et plus, tel que cité par Santé Canada 1998] ÷ masse corporelle (59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
d Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j).
| Groupe d’âge | Quant. moy. de produit (g/app.) a | Fréq. quot. moy. a | Conc. du produit (%) | Conc. dans l’air (mg/m3) (24 h) b | Exposition (mg/kg p.c./j) c |
|---|---|---|---|---|---|
| 5 à 11 ans | 0,33 | 1,7 | 100 | 0,19 | 8,89 × 10-2 |
| 12 à 19 ans | 0,33 | 1,7 | 100 | 0,19 | 5,05 × 10-2 |
| 20 ans et plus | 0,33 | 1,7 | 100 | 0,19 | 4,34 × 10-2 |
a Cité par Loretz et coll. 2005.
b Paramètres utilisés avec ConsExpo : durée d’exposition de 5 min, volume de la pièce : 10 m3 (salle de bain), taux de ventilation : 0/h.
c Dose interne (mg/kg p.c./j) = ([moyenne en mg/m3] × taux d’inhalation (14,5 m3/j pour 5 à 11 ans, 15,8 m3/j pour 12 à 19 ans, 16,2 m3/j pour 20 ans et plus)) ÷ masse corporelle (31 kg pour 5 à 11 ans, 59,4 kg pour 12 à 19 ans, 70,9 kg pour 20 ans et plus). Taux d’inhalation et masses corporelles tels que cités par Santé Canada 1998.
Annexe C. Paramètres utilisés pour estimer l’exposition à l’essence de citronelle
| Groupe d’âge | Quant. moy. de produit (g/app.) a | Fréq. quot. moy. b | Conc. air (mg/m3) (24 h) c | Expos. cutan. (mg/kg p.c./j) d | Expos. inhal. (mg/kg p.c./j) e | Expos. comb. (mg/kg p.c./j) f |
|---|---|---|---|---|---|---|
| 0 à 6 mois | 2,5 | 0,8 | 1,6 × 10-2 | 2,67 | 4,49 × 10-3 | 2,67 |
| 6 mois à 4 ans | 4,1 | 0,8 | 2,4 × 10-2 | 2,12 | 1,44 × 10-2 | 2,13 |
| 5 à 11 ans | 5 | 0,8 | 3,4 × 10-2 | 1,29 | 1,59 × 10-2 | 1,31 |
| 12 à 19 ans | 8,7 | 0,8 | 5,4 × 10-2 | 1,17 | 1,44 × 10-2 | 1,19 |
| 20 ans et plus | 10 | 1 | 5,9 × 10-2 | 1,41 | 1,35 × 10-2 | 1,42 |
a Cité par Ficheux et coll. 2016.
b Cité par Ficheux et coll. 2015, Wu et coll. 2010.
c Les concentrations dans l’air ont été modélisées à l’aide du modèle ConsExpo d’émission constante de vapeur par évaporation en supposant que 80 % de la dose appliquée était disponible pour l’évaporation (quantité demeurant sur l’épiderme après l’absorption cutanée de la substance) (80 %× [quantité de produit/application] × [applications/jour] × concentration de 5 %), et en utilisant les paramètres suivants : durée d’exposition de 24 h, durée d’émission de 1 h, volume de la pièce de 80 m3, taux de ventilation de 1/h, aire couverte égale à la peau exposée (présumée être égale à la tête, aux bras et aux mains) (1365 cm2 pour 0 à 6 mois, 1970 cm2 pour 6 mois à 4 ans, 2900 cm2 pour 5 à 11 ans, 4540 cm2 pour 12 à 19 ans et 4735 cm2 pour les adultes, tel que cité par Santé Canada 1998), matrice de poids moléculaire de 125 g/mole et une température d’application de 37 °C.
d Exposition cutanée calculée à l’aide de la formule suivante : [application moyenne (g/application) × fréquence quotidienne moyenne (applications/jour) × concentration du produit (5 %) × absorption cutanée pour la peau recouverte (20 %) × facteur de conversion (1000 mg/g)] ÷ masse corporelle (7,5 kg pour 0 à 6 mois, 15,5 kg pour 6 mois à 4 ans, 31,0 kg pour 5 à 11 ans, 59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
e Exposition par inhalation calculée à l’aide de la formule suivante : [concentration dans l’air (mg/m3) (moyenne pondérée sur 24 h) × taux d’inhalation (m3/j) (2,1 m3/j pour 0 à 6 mois, 9,3 m3/j pour 6 mois à 4 ans, 14,5 m3/j pour 5 à 11 ans, 15,8 m3/j pour 12 à 19 ans et 16,2 m3/j pour 20 ans et plus, tel que cité par Santé Canada 1998] ÷ masse corporelle (7,5 kg pour 0 à 6 mois, 15,5 kg pour 6 mois à 4 ans, 31,0 kg pour 5 à 11 ans, 59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
f Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j).
| Groupe d’âge | Quant. moy. de produit (g/j) a | Conc. dans l’air (24 h) (mg/m3) b | Expos. cutan. (mg/kg p.c./j) c | Expos. inhal. (mg/kg p.c./j) d | Expos. comb. (mg/kg p.c./j) e |
|---|---|---|---|---|---|
| 0 à 6 mois | 1,80 × 10-1 | 8,20 × 10-2 | 9,59 × 10-1 | 2,30 × 10-2 | 9,82 × 10-1 |
| 6 mois à 4 ans | 1,80 × 10-1 | 8,10 × 10-2 | 4,64 × 10-1 | 4,86 × 10-2 | 5,13 × 10-1 |
| 5 à 11 ans | 1,80 × 10-1 | 8,00 × 10-2 | 2,32 × 10-1 | 3,74 × 10-2 | 2,69 × 10-1 |
| 12 à 19 ans | 1,80 × 10-1 | 8,00 × 10-2 | 1,21 × 10-1 | 2,13 × 10-2 | 1,42 × 10-1 |
| 20 ans et plus | 1,80 × 10-1 | 8,00 × 10-2 | 1,01 × 10-1 | 1,83 × 10-2 | 1,20 × 10-1 |
a Calculé à partir de quatre gouttes d’huile, soit 0,2 mL (selon l’hypothèse que chaque goutte équivaut à 0,05 mL) du maximum de concentration de 100 % (il s’agissait du seul ingrédient indiqué) multiplié par la masse volumique de l’essence de citronelle de 0,899 g/mL → 0,2 × 1 × 0,899. Fréquence présumée d’un massage par jour.
b Les concentrations dans l’air ont été modélisées à l’aide du modèle ConsExpo d’émission constante de vapeur par évaporation en supposant que 96 % de la dose appliquée était disponible pour l’évaporation (quantité demeurant sur l’épiderme après l’absorption cutanée de la substance) (96 % × [quantité de produit/jour]), et en utilisant les paramètres suivants : durée d’exposition de 24 h, durée d’émission de 1 h, volume de la pièce de 80 m3, taux de ventilation de 1/h, aire d’émission égale à la peau exposée (aire totale moins la tête pour les enfants de 0 à 11 ans et aire totale moins une demi-tête et le tronc pour les adultes et les adolescents) (3020 cm2 pour 0 à 6 mois, 4910 cm2 pour 6 mois à 4 ans, 8450 cm2 pour 5 à 11 ans, 12 795 cm2 pour 12 à 19 ans et 14 380 cm2 pour 20 ans et plus, tel que cité par Santé Canada 1998), matrice de poids moléculaire de 125 g/mole et une température d’application de 37 °C.
c Exposition cutanée calculée à l’aide de la formule suivante : [application moyenne (g/j) × absorption cutanée pour la peau exposée (4 %) × facteur de conversion (1000 mg/g)] ÷ masse corporelle (7,5 kg pour 0 à 6 mois, 15,5 kg pour 6 mois à 4 ans, 31,0 kg pour 5 à 11 ans, 59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
d Exposition par inhalation calculée à l’aide de la formule suivante : [concentration dans l’air (mg/m3) (moyenne pondérée sur 24 h) × taux d’inhalation (m3/j) (2,1 m3/j pour 0 à 6 mois, 9,3 m3/j pour 6 mois à 4 ans, 14,5 m3/j pour 5 à 11 ans, 15,8 m3/j pour 12 à 19 ans et 16,2 m3/j pour 20 ans et plus, tel que cité par Santé Canada 1998] ÷ masse corporelle (7,5 kg pour 0 à 6 mois, 15,5 kg pour 6 mois à 4 ans, 31,0 kg pour 5 à 11 ans, 59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
e Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j).
| Groupe d’âge | Quant. moy. de produit (g/app.) a | Fréq. quot. moy. a | Conc. du produit (%) | Conc. dans l’air (mg/m3) b (24 h) |
|---|---|---|---|---|
| 5 à 11 ans | 0,33 | 1,7 | 30 | 0,058 |
| 12 à 19 ans | 0,33 | 1,7 | 30 | 0,058 |
| 20 ans et plus | 0,33 | 1,7 | 30 | 0,058 |
a Loretz et coll. 2005.
b Paramètres utilisés avec ConsExpo = durée d’exposition de 5 min, volume de la pièce : 10 m3 (salle de bain), taux de ventilation : 0/h.
| Scénario d’exposition | Groupe d’âge | Concentration | Absorp. cutanée (µg/kg p.c./j) | Expos. inhal. (µg/m3) | Absorp. orale (µg/kg p.c./j) |
|---|---|---|---|---|---|
| Mélange, chargement et application d’un nettoyant à planchers tout-usage | Adulte | 1 % | 2,08 | 1,90 | S.O. |
| Exposition occasionnée par le contact avec un plancher nettoyé | Bambin | 1 % | 1,29 | 1,90 | 3,22 |
*Le tableau C‑6 donne des détails sur la méthode et les paramètres utilisés pour estimer l’inhalation et l’exposition cutanée à l’essence de citronelle de produits offerts aux consommateurs.
| Scénario d’exposition | Hypothèses* |
|---|---|
| Mélange, chargement et application d’un nettoyant à planchers tout-usage (liquide) (adulte) | Concentration d’essence de citronelle : 1 % (concentration maximale présumée lorsque l’essence de citronelle est utilisée comme parfum dans les nettoyants). Mélange et chargement (cutanée) : Quantité de produit : 0,01 g. Absorption cutanée : 4 % (peau non recouverte). Mélange et chargement (inhalation : modèle d’exposition à la vapeur, évaporation, aire d’émission constante). Durée de l’exposition : 0,75 min. Quantité de produit : 500 g. Volume de la pièce : 1 m3. Taux de ventilation : 0,5/h. Zone d’émission : 20 cm2. Durée d’émission : 0,3 min. Température à l’application : 20 °C. Coefficient de transfert massique : 10 m/h. Matrice de poids moléculaire : 36 g/mole. Application (cutanée) : Quantité de produit : 0,36 g. Absorption cutanée : 4 % (peau exposée). Application (inhalation : modèle d’exposition à la vapeur, évaporation, modèle d’émission croissante) : Durée de l’exposition : 240 min. Quantité de solution utilisée : 900 g. Dilution (nombre de fois) : 62. Volume de la pièce : 58 m3. Taux de ventilation : 0,5/h. Zone d’émission : 22 m2. Durée d’application : 20 min. Température à l’application : 20 °C. Coefficient de transfert massique : 10 m/h. Matrice de poids moléculaire : 18 g/mole. Exposition combinée : cutanée totale (mélange & chargement + application) + inhalation totale (mélange & chargement + application). |
| Exposition occasionnée par le contact avec un plancher nettoyé (bambin) | Concentration d’essence de citronelle : 1 % (concentration maximale présumée lorsque l’essence de citronelle est utilisée comme parfum dans les nettoyants). Calculs basés sur les procédures opérationnelles normalisées de l’USEPA (2012) pour les résidences, section 7. Cutanée : Calculée à l’aide de l’algorithme suivant : Exposition (mg/kg p.c./j) = [résidu déposé (mg/cm2) × fraction disponible pour le transfert (%) × coefficient de transfert (cm2/h) × temps d’exposition (h) × absorption cutanée (%)] ÷ masse corporelle Résidu déposé (µg/cm2) : Calculé en supposant 14,4 g de produit par 22 m2 de plancher (fiche d’information sur les nettoyants de ConsExpo 2018) × 1000 mg/g × 1 m2/10 000 cm2 Coefficient de transfert : 2200 cm2/h (ajusté à l’aire de la peau d’un bambin de six mois à quatre ans à l’aide de la formule suivante : coefficient de transfert d’un adulte de 6800 cm2/h × (5780 cm2 aire de la peau du bambin/18 200 cm2, aire de la peau d’un adulte)) Fraction disponible pour le transfert : 8 % Temps d’exposition : 2 h, le temps d’exposition pour les surfaces dures correspond au temps passé dans les cuisines et les salles de bain Absorption cutanée : 4 % (peau exposée) Ingestion accidentelle (contact des mains avec la bouche) : Calculée à l’aide de l’algorithme suivant : Exposition (mg/j) = [RM (mg/cm2) × (FM × SM (cm2)) × (TE × N_répét.) × (1 – (1 – ES)Freq_mb/N_répét)] RM : charge de résidus sur les mains (mg/cm2), calculée à l’aide de l’algorithme suivant : RM = [Fiamains × exposition cutanée (mg) (calculée ci‑dessus)] / (SAH × 2) Fiamains : 0,15 (sans unités), fraction de l’ingrédient actif trouvée sur les mains par rapport au total des résidus sur la surface, selon l’étude sur la gymnastique jazz SM : 150 cm2, aire typique d’une main FM : 0,13 (sans unité), fraction de la main pénétrant dans la bouche par événement TE : 2 h, temps d’exposition par jour N_répét : 4, nombre d’intervalles de renouvellement à l’heure ES : 0,48, facteur d’extraction dans la salive Freq_mb : 20, nombre de contacts main-bouche à l’heure Inhalation : Concentration dans l’air découlant de l’application de nettoyant à planchers (voir les paramètres plus haut) Exposition combinée : cutanée + orale + inhalation |
*L’exposition aux produits a été estimée à l’aide de ConsExpo Web (2016). Les estimations de l’exposition ont été calculées à partir des masses corporelles et taux d’inhalation par défaut de 70,9 kg/16,2 m3/j, 59,4 kg/15,8 m3/j, 31 kg/14,5 m3/j, 15,5 kg/9,3 m3/j, et 7,5 kg/2,1 m3/j pour les adultes (20 ans et plus), adolescents (12 à 19 ans), enfants (5 à 11 ans), bambins (6 mois à 4 ans) et bébés (0 à 6 mois), respectivement (Santé Canada 1998). Sauf indication contraire, les valeurs par défaut proviennent de la fiche d’information pertinente de ConsExpo pour le scénario présenté.
Annexe D. Paramètres utilisés pour estimer le pire cas d’exposition du scénario d’aromathérapie
| Paramètres du pire cas utilisé pour calculer la concentration moyenne | Référence : APE danoise 2008 |
|---|---|
| Quantité d’huile | 10 gouttes = 0,4 g |
| Volume de la pièce | 17,4 m3 (petite pièce) |
| Durée d’utilisation de la lampe | 2 h |
| Temps d’exposition par cycle | 4 h |
| Taux d’échange d’air | 50 % à l’heure |
| Type de diffuseur | Aroma Lamps |
| Concentration moyenne en 4 h | 1,45 mg/m3 |
| Groupe d’âge* | Concentration dans l’air de la pièce (mg/m3) (4 h) a | Concentration moyenne dans l’air (mg/m3) (24 h) b | Exposition (mg/kg p.c./j) c | Exposition ajustée pour la mandarine et la tangerine (mg/kg p.c./j) d, e |
|---|---|---|---|---|
| 0 à 6 mois | 1,45 | 0,24 | 6,77 × 10-2 | S.O. |
| 6 mois à 4 ans | 1,45 | 0,24 | 1,45 × 10-1 | S.O. |
| 5 à 11 ans | 1,45 | 0,24 | 1,13 × 10-1 | S.O. |
| 12 à 19 ans | 1,45 | 0,24 | 6,43 × 10-2 | 3,86 × 10-2 |
| 20 ans et plus | 1,45 | 0,24 | 5,52 × 10-2 | 3,33 × 10-2 |
* Les taux d’inhalation et masse corporelle normalisés de Santé Canada (1998) ont été utilisés dans ce calcul.
a Tous les paramètres figurent au tableau D-1.
b Calculée à l’aide de la formule suivante : (concentration dans l’air (1,45 mg/m3) × 4 h) / 24 h.
c Dose par exposition = (concentration moyenne dans la pièce (24 h) × taux d’inhalation quotidien)/ masse corporelle.
d Dose d’exposition réduite à 60 % pour tenir compte de la quantité maximale de γ‑terpinène dans l’essence de mandarine et de tangerine (61 % dans la feuille, Lota et coll. 2000).
| Scénario d’inhalation lors d’aromathérapie (essence de citronelle) | Concentration moyenne dans la pièce (mg/m3) (4 h)* |
|---|---|
| Aucun groupe d’âge spécifique | 1,45 |
* Les paramètres sont détaillés au tableau D-1.
Annexe E. Paramètres utilisés pour estimer l’exposition à l’essence de mandarine et de tangerine
| Groupe d’âge | Quant. moy. de produit (g/app) a | Fréq. quot. moy. b | Expos. cutan. (mg/kg p.c./j) c | Expos. inhal. (mg/kg p.c./j) d | Expos. comb. (mg/kg p.c./j) e | Exposition combinée ajustée (mg/kg p.c./j) f |
|---|---|---|---|---|---|---|
| 12 à 19 ans | 8,7 | 0,8 | 1,17 | 3,72 × 10-2 | 1,21 | 7,25 × 10-1 |
| 20 ans et plus | 10 | 1 | 1,41 | 4,57 × 10-2 | 1,46 | 8,74 × 10-1 |
a Cité par Ficheux et coll. 2016.
b Cité par Ficheux et coll. 2015, Wu et coll. 2010.
c Exposition cutanée calculée à l’aide de la formule suivante : [application moyenne (g/application) × fréquence quotidienne moyenne (applications/jour) × concentration du produit (5 %) × absorption cutanée pour la peau recouverte (20 %) × facteur de conversion (1000 mg/g)] ÷ masse corporelle (59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
d Exposition par inhalation calculée à l’aide de la formule suivante : [concentration dans l’air (mg/m3) (moyenne pondérée sur 24 h) × taux d’inhalation (m3/j) (15,8 m3/j pour 12 à 19 ans et 16,2 m3/j pour 20 ans et plus, tel que cité par Santé Canada 1998] ÷ masse corporelle (59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998). Les concentrations dans l’air ont été modélisées à l’aide du modèle ConsExpo d’émission constante de vapeur par évaporation en supposant que 80 % de la dose appliquée était disponible pour l’évaporation (quantité demeurant sur l’épiderme après l’absorption cutanée de la substance) (80 %× [quantité de produit/application] × [applications/jour] × concentration de 5 %) et en utilisant les paramètres suivants : durée d’exposition de 24 h, durée d’émission de 1 h, volume de la pièce de 80 m3, taux de ventilation de 1/h, aire couverte égale à la peau exposée (présumée être égale à la tête, aux bras et aux mains) (1365 cm2 pour 0 à 6 mois, 1970 cm2 pour 6 mois à 4 ans, 2900 cm2 pour 5 à 11 ans, 4540 cm2 pour 12 à 19 ans et 4735 cm2 pour les adultes, tel que cité par Santé Canada 1998), matrice de poids moléculaire de 125 g/mole et une température d’application de 37 °C. Les concentrations dans l’air se situaient entre 0,14 et 0,20 mg/m3.
e Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j).
f Dose d’exposition réduite à 60 % pour tenir compte de la quantité maximale de γ‑terpinène dans l’essence de mandarine et de tangerine (61 % dans la feuille, Lota et coll. 2000).
| Groupe d’âge | Quant. moy. de produit (g/j) a | Fréq. quot. moy. | Conc. du produit (%) | Masse corporelle (kg) b | Exposition (mg/kg p.c. /j) c | Exposition ajustée (mg/kg p.c./j) d |
|---|---|---|---|---|---|---|
| 12 à 19 ans | 18,2 | 1,4 | 1 | 59,4 | 1,72 × 10-1 | 1,03 × 10-1 |
| 20 ans et plus | 18,2 | 1,6 | 1 | 70,9 | 1,44 × 10-1 | 8,63 × 10-2 |
a En fonction de l’exposition chronique à partir des données de Ficheux et coll. 2015, 2016.
b Cité par Santé Canada 1988.
c Suppose une absorption cutanée de 4 % (peau exposée).
d Dose d’exposition réduite à 60 % pour tenir compte de la quantité maximale de γ‑terpinène dans l’essence de mandarine et de tangerine (61 % dans la feuille, Lota et coll. 2000).
| Groupe d’âge | Quant. moy. de produit (g/app) a | Fréq. quot. moy. a | Conc. dans l’air (mg/m3) b (24 h) | Exposition (mg/kg p.c./j) c | Exposition ajustée (mg/kg p.c./j) d |
|---|---|---|---|---|---|
| 12 à 19 ans | 0,33 | 1,7 | 0,058 | 1,54 × 10-2 | 9,26 × 10-3 |
| 20 ans et plus | 0,33 | 1,7 | 0,058 | 1,33 × 10-2 | 7,95 × 10-3 |
a Cité par Loretz et coll. 2005.
b Paramètres utilisés avec ConsExpo = durée d’exposition de 5 min, volume de la pièce : 10 m3 (salle de bain), taux de ventilation : 0/h.
c Dose interne (mg/kg p.c./j) = ([moyenne en mg/m3] × taux d’inhalation (15,8 m3/j pour 12 à 19 ans, 16,2 m3/j pour 20 ans et plus)) ÷ masse corporelle (59,4 kg pour 12 à 19 ans, 70,9 kg pour 20 ans et plus). Taux d’inhalation et masses corporelles tels que cités par Santé Canada1998.
d Dose d’exposition réduite à 60 % pour tenir compte de la quantité maximale de γ‑terpinène dans l’essence de mandarine et de tangerine (61 % dans la feuille, Lota et coll. 2000).
| Groupe d’âge | Quant. moy. de produit (g/j) a | Conc. air (24 h) (mg/m3) b | Expos. cutan. (mg/kg p.c. /j) c | Expos. inhal. (mg/kg p.c./j) d | Expos. comb. (mg/kg p.c./j) e | Exposition combinée ajustée (mg/kg p.c./j) f |
|---|---|---|---|---|---|---|
| 12 à 19 ans | 1,68 × 10-1 | 7,50 × 10-2 | 1,13 × 10-1 | 1,99 × 10-2 | 1,33 × 10-1 | 8,00 × 10-2 |
| 20 ans et plus | 1,68 × 10-1 | 7,40 × 10-2 | 9,50 × 10-2 | 1,69 × 10-2 | 1,12 × 10-1 | 6,71 × 10-2 |
a Calculé à partir de quatre gouttes d’huile, soit 0,2 mL (une goutte équivaut à 0,05 mL) à partir d’une concentration maximale de 100 % multiplié par la masse volumique de l’essence de mandarine et de tangerine de 0,842 g/mL → 0,2 × 1 × 0,842. Fréquence présumée d’un massage par jour.
b Les concentrations dans l’air ont été modélisées à l’aide du modèle ConsExpo d’émission constante de vapeur par évaporation en supposant que 96 % de la dose appliquée était disponible pour l’évaporation (quantité demeurant sur l’épiderme après l’absorption cutanée de la substance) (96 % × quantité de produit/jour), et en utilisant les paramètres suivants : durée d’exposition de 24 h, durée d’émission de 1 h, volume de la pièce de 80 m3, taux de ventilation de 1/h, aire d’émission égale à la peau exposée (aire totale moins la tête pour les enfants de 0 à 11 ans et aire totale moins une demi-tête et le tronc pour les adultes et les adolescents) (3020 cm2 pour 0 à 6 mois, 4910 cm2 pour 6 mois à 4 ans, 8450 cm2 pour 5 à 11 ans, 12 795 cm2 pour 12 à 19 ans et 14 380 cm2 pour 20 ans et plus, tel que cité par Santé Canada 1998), matrice de poids moléculaire de 125 g/mole et une température d’application de 37 °C.
c Exposition cutanée calculée à l’aide de la formule suivante : [application moyenne (g/j) × absorption cutanée pour la peau exposée (4 %) × facteur de conversion (1000 mg/g)] ÷ masse corporelle (59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
d Exposition par inhalation calculée à l’aide de la formule suivante : [concentration dans l’air (mg/m3) (moyenne pondérée sur 24 h) × taux d’inhalation (m3/j) (15,8 m3/j pour 12 à 19 ans et 16,2 m3/j pour 20 ans et plus, tel que cité par Santé Canada 1998] ÷ masse corporelle (59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
e Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j).
f Dose d’exposition réduite à 60 % pour tenir compte de la quantité maximale de γ‑terpinène dans l’essence de mandarine et de tangerine (61 % dans la feuille, Lota et coll. 2000).
| Scénario d’exposition a | Groupe d’âge | Concentration ou quantité | Absorp. cutanée (µg/kg p.c./j) b | Expos. inhal. (µg/kg p.c./j) b | Absorp. orale (µg/kg p.c./j) b |
|---|---|---|---|---|---|
| Mélange, chargement et application d’un nettoyant liquide tout usage pour planchers | Adulte | 1 % | 1,25 (2,09) | 3,70 (6,17) (27,0 µg/m3 sur 24 h) | S.O. |
| Mélange, étendage chargement et de vêtements lavés à la machine | Adulte | 5 % | 9,09 (15,1) | 1,02 (1,69) (7,40 µg/m3 sur 24 h) | S.O. |
| Ingrédient non médicinal de suppléments alimentaires | Adulte | 3,53 % | S.O. | S.O. | 254 (423) |
a Le tableau E-6 donne les détails sur la méthode et les paramètres utilisés pour estimer l’inhalation et l’exposition cutanée à l’essence de mandarine présente dans des produits offerts aux consommateurs.
b La dose d’exposition est réduite à 60 % pour tenir compte de la quantité maximale de γ‑terpinène dans l’essence de mandarine et de tangerine (61 % dans les feuilles, Lota et coll. 2000). Les doses entre parenthèses sont les doses non ajustées.
| Scénario d’exposition | Hypothèses* |
|---|---|
| Mélange, chargement et application d’un nettoyant tout usage pour planchers (liquide) (adulte) | Concentration d’essence de mandarine : 1 % (concentration maximale présumée lorsque l’essence de mandarine et de tangerine est utilisée comme parfum dans un nettoyeur, selon l’ACI 2018). Mélange et chargement (cutanée) : Quantité de produit : 0,01 g Absorption cutanée : 4 % (peau exposée) Mélange et chargement (inhalation : modèle d’exposition à la vapeur, évaporation, aire d’émission constante) Durée de l’exposition : 0,75 min Quantité de produit : 500 g Volume de la pièce : 1 m3 Taux de ventilation : 0,5/h Zone d’émission : 20 cm2 Durée d’émission : 0,3 min Température à l’application : 20 °C Coefficient de transfert massique : 10 m/h Matrice de poids moléculaire : 36 g/mole Application (cutanée) : Quantité de produit : 0,36 g Absorption cutanée : 4 % (peau exposée) Application (inhalation : modèle d’exposition à la vapeur, évaporation, modèle d’émission croissante) : Durée de l’exposition : 240 min Quantité de solution utilisée : 900 g Dilution (nombre de fois) : 62 Volume de la pièce : 58 m3 Taux de ventilation : 0,5/h Zone d’émission : 22 m2 Durée d’application : 20 min Température à l’application : 20 °C Coefficient de transfert massique : 10 m/h Matrice de poids moléculaire : 18 g/mole Exposition combinée : cutanée totale (mélange & chargement + application) + inhalation totale (mélange & chargement + application) × 60 % (ajustement basé sur la quantité maximale de γ‑terpinène dans l’essence de mandarine et de tangerine) |
| Mélange, chargement (produit liquide) et étendage de vêtements lavés à la machine (adulte) | Concentration d’essence de mandarine : 5 % (concentration maximale présumée lorsque l’essence de mandarine est utilisée comme parfum dans un détergent liquide pour les machines à laver, selon ACI 2018). Mélange et chargement (cutanée) : Quantité de produit : 0,53 g Absorption cutanée : 4 % (peau exposée) Mélange et chargement (inhalation : modèle d’exposition à la vapeur, évaporation, aire d’émission constante) : Durée de l’exposition : 0,75 min Quantité de produit : 500 g Volume de la pièce : 1 m3 Taux de ventilation : 0,6/h Zone d’émission : 20 cm2 Durée d’émission : 0,3 min Température à l’application : 20 °C Coefficient de transfert massique : 10 m/h Matrice de poids moléculaire : 90 g/mole Étendage de vêtements lavés à la machine (cutanée) : Quantité de produit : 6,9 mg Absorption cutanée : 4 % (peau exposée) Étendage des vêtements lavés à la machine (inhalation : modèle d’exposition à la vapeur, évaporation, aire d’émission constante) : Durée de l’exposition : 240 min Quantité de solution utilisée : 5000 g Dilution (nombre de fois) : (liquide régulier) : 1300 Volume de la pièce : 20 m2 Taux de ventilation : 0,6/h Zone d’émission : 10 m2 Durée d’application : 17 min Température à l’application : 20 °C Coefficient de transfert massique : 10 m/h Matrice de poids moléculaire : 18 g/mole Exposition combinée : (cutanée totale (mélange et chargement + étendage de vêtements lavés à la machine) + inhalation totale (mélange et chargement + étendage de vêtements lavés à la machine)) × 60 % (ajustée pour la quantité maximale de γ-terpinène dans l’essence de mandarine et de tangerine) |
| Ingrédient non médicinal de suppléments alimentaires (adulte) | Concentration : 3,53 % Quantité d’essence de mandarine et de tangerine par capsule : 15 mg (Chaque paquet de 12,75 grammes contient 30 capsules. Donc, chaque capsule pèse 425 mg (12,75 grammes/30 capsules × 1000 mg/gramme). La concentration d’essence de mandarine et de tangerine est de 3,53 %. 425 mg × 3,53 % = 15 mg) Dose quotidienne : 0,254 mg/kg p.c./j (selon les instructions d’utilisation qui mentionnent 2 capsules par jour, 15 mg/capsule × 2 capsules/jour × 60 % ajustement pour la γ‑terpinène/70,9 kg (masse d’un adulte). |
* L’exposition aux produits a été estimée à l’aide de ConsExpo Web (2016). Les estimations de l’exposition ont été calculées à partir des masses corporelles et taux d’inhalation par défaut de 70,9 kg/16,2 m3/j, 59,4 kg/15,8 m3/j, 31 kg/14,5 m3/j, 15,5 kg/9,3 m3/j, et 7,5 kg/2,1 m3/j pour les adultes (20 ans et plus), adolescents (12 à 19 ans), enfants (5 à 11 ans), bambins (6 mois à 4 ans) et bébés (0 à 6 mois), respectivement (Santé Canada 1998). Sauf indication contraire, les valeurs par défaut proviennent de la fiche d’information pertinente de ConsExpo pour le scénario présenté.
Annexe F. Paramètres utilisés pour estimer l’exposition à l’α-pinène
| Groupe d’âge* | Quant. de produit (g/j) a | Conc. dans l’air (24 h) b | Expos. cutan. (mg/kg p.c./j) c | Expos. inhal. (mg/kg p.c./j) d | Expos. comb. (mg/kg p.c./j) e |
|---|---|---|---|---|---|
| 12 à 19 ans | 0,83 | 1,4 | 5,56 × 10-2 | 3,72 × 10-1 | 4,28 × 10-1 |
| 20 ans et plus | 0,83 | 1,4 | 4,66 × 10-2 | 3,20 × 10-1 | 3,66 × 10-1 |
* Le scénario de brume pour le visage ne s’applique qu’à deux groupes d’âge.
a Calculé en utilisant la limite supérieure de volume par pulvérisation de 0,16 mL et l’hypothèse que le nombre maximum de pulvérisations par jour serait de 6. Quant. moy. de produit (g/j) = 0,16 mL/pulvérisation (catalogue O. Berk) × 6 pulvérisations/jour (estimation supérieure, Harrington – Skincare.com, 2019) × masse volumique d’α‑pinène (0,86 g/mL) = 0,83 g/j.
b Les concentrations dans l’air ont été modélisées à l’aide du modèle ConsExpo d’émission constante de vapeur par évaporation en supposant que 96 % de la dose appliquée était disponible pour l’évaporation (quantité demeurant sur l’épiderme après l’absorption cutanée de la substance) (96 % × [quantité de produit/jour] × concentration de 10 %), et en utilisant les paramètres suivants : durée d’exposition de 24 h, durée d’émission de 1 h, volume de la pièce de 1 m3, (volume personnel approximatif de la respiration), l’aire d’évaporation est égale à la surface d’application présumée être équivalente à la moitié de la tête (730 cm2 pour 12 à 19 ans et 637,5 cm2 pour les adultes, tel que cité par Santé Canada 1998), taux de ventilation de 2/h (pour approximer le mélange de l’espace d’air personnel avec la pièce), matrice de poids moléculaire de 125 g/mole et une température d’application de 37 °C.
c Exposition cutanée calculée à l’aide de la formule suivante : [quantité de produit (g/j) × concentration du produit (10 %) × absorption cutanée de la peau exposée (4 %) × facteur de conversion (1000 mg/g)] ÷ masse corporelle (59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
d Exposition par inhalation calculée à l’aide de la formule suivante : [concentration dans l’air (mg/m3) (moyenne pondérée sur 24 h) × taux d’inhalation (m3/j) (15,8 m3/j pour 12 à 19 ans et 16,2 m3/j pour 20 ans et plus, tel que cité par Santé Canada 1998] ÷ masse corporelle (59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
e Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j).
| Scénario d’exposition* | Groupe d’âge | Concentration ou quantité | Absorp. cutanée (µg/kg p.c./j) | Expos. inhal. (µg/kg p.c./j | Absorp. orale (µg/kg p.c./j) |
|---|---|---|---|---|---|
| Mélange, chargement et application d’un nettoyant tout usage à planchers | Adulte | 1 % | 2,09 | 15,45 (68 µg/m3 sur 24 h) | S.O. |
| Exposition occasionnée par le contact avec un plancher nettoyé | Bambin | 1 % | 0,59 | 40,58 (68 µg/m3 sur 24 h) | 1,12 |
| Mélange, chargement et étendage de vêtements lavés à la main | Adulte | 1 % | 4,53 | 12,79 (56 µg/m3 sur 24 h) | S.O. |
| Assainisseur d’air en gel | Toutes les sous-populations | 5 % | S.O. | 7,99-21 (35 µg/m3 sur 24 h) | S.O. |
* Le tableau F‑3 énumère les détails de la méthode et les paramètres utilisés pour estimer l’absorption par inhalation ou cutané d’α-pinène depuis des produits offerts aux consommateurs.
| Scénario d’exposition | Hypothèses* |
|---|---|
| Mélange, chargement et application d’un nettoyant tout usage à planchers liquide (adulte) | Concentration d’α-pinène : 1 % (Concentration maximale présumée lorsque l’α-pinène est utilisée comme fragrance dans un nettoyant). Mélange et chargement (cutané) : Quantité de produit : 0,01 g Absorption cutanée : 4 % (peau exposée) Mélange et chargement (inhalation : modèle d’exposition à la vapeur, évaporation, aire d’émission constante) Durée de l’exposition : 0,75 min Quantité de produit : 500 g Volume de la pièce : 1 m3 Taux de ventilation : 0,5/h Zone d’émission : 20 cm2 Durée d’émission : 0,3 min Température à l’application : 20 °C Coefficient de transfert massique : 10 m/h Matrice de poids moléculaire : 36 g/mole Application (cutanée) : Quantité de produit : 0,36 g Absorption cutanée : 4 % (peau exposée) Application (inhalation : modèle d’exposition à la vapeur, évaporation, modèle d’émission croissante) : Durée de l’exposition : 240 min Quantité de solution utilisée : 900 g Dilution (nombre de fois) : 62 Volume de la pièce : 58 m3 Taux de ventilation : 0,5/h Zone d’émission : 22 m2 Durée d’application : 20 min Température à l’application : 20 °C Coefficient de transfert massique : 10 m/h Matrice de poids moléculaire : 18 g/mole Exposition combinée : cutanée totale (mélange & chargement + application) + inhalation totale (mélange & chargement + application) |
| Exposition occasionnée par le contact avec un plancher nettoyé (bambin) | Concentration d’α-pinène : 1 % (concentration maximale présumée lorsque l’α-pinène est utilisée comme fragrance dans un nettoyant). Calculs basés sur les procédures opérationnelles normalisées de l’USEPA (2012) pour les résidences, section 7. Cutanée : Calculée à l’aide de l’algorithme suivant : Exposition (mg/kg p.c./j) = [résidu déposé (mg/cm2) × fraction disponible pour le transfert (%) × coefficient de transfert (cm2/h) × temps d’exposition (h) × absorption cutanée (%)] ÷ masse corporelle Résidu déposé (µg/cm2) : Calculé en supposant que 14,4 g du produit sont appliqués sur 22 m2 de plancher (fiche d’information sur les nettoyants ConsExpo 2018) × 1000 mg/g × 1 m2/10 000 cm2 Coefficient de transfert : 2200 cm2/h [ajusté à l’aire de la peau d’un bambin de six mois à quatre ans à l’aide de la formule suivante : coefficient de transfert d’un adulte de 6800 cm2/h × (5780 cm2 aire de la peau du bambin/18 200 cm2 aire de la peau d’un adulte)]. Fraction disponible pour le transfert : 8 % Temps d’exposition : 2 h, le temps d’exposition pour les surfaces dures correspond au temps passé dans les cuisines et les salles de bain Absorption cutanée : 4 % (peau exposée) Ingestion accidentelle (contact des mains avec la bouche) : Calculée à l’aide de l’algorithme suivant : Exposition (mg/j) = [RM (mg/cm2) × (FM × SM (cm2)) × (TE × N_répét.) × (1 – (1 – ES)Freq_mb/N_répét)] RM : charge de résidus sur les mains (mg/cm2), calculée à l’aide de l’algorithme suivant : RM = [Fiamains × exposition cutanée (mg) (calculée ci‑dessus)] / (SAH × 2) Fiamains : 0,15 (sans unités), fraction de l’ingrédient actif trouvée sur les mains par rapport au total des résidus sur la surface, selon l’étude sur la gymnastique jazz SM : 150 cm2, aire typique d’une main FM : 0,13 (sans unités), fraction de la main pénétrant dans la bouche par événement TE : 2 h, temps d’exposition par jour N_répét : 4, nombre d’intervalles de renouvellement à l’heure ES : 0,48, facteur d’extraction dans la salive Freq_mb : 20, nombre de contacts main-bouche à l’heure Inhalation : Concentration dans l’air découlant de l’application de nettoyant à planchers (voir les paramètres plus haut) Exposition combinée : cutanée + orale + inhalation |
| Mélange, chargement et étendage de vêtements lavés à la main (adulte) | Concentration d’α-pinène : 1 % (concentration maximale présumée lorsque l’α-pinène est utilisée comme fragrance dans un détergent à lessive). Mélange et chargement (cutané) : Quantité de produit : 0,53 g (poudre ordinaire) Absorption cutanée : 4 % (peau exposée) Mélange et chargement (exposition par inhalation : exposition à la vapeur et l’évaporation, modèle d’émission constante) : Durée de l’exposition : 0,75 min Quantité de solution utilisée : 500 g Volume de la pièce : 1 m3 Taux de ventilation : 0,6/h Zone d’émission : 20 cm2 Durée d’émission : 0,3 min Température à l’application : 20 °C Coefficient de transfert massique : 10 m/h Matrice de poids moléculaire : 90 g/mole Lavage à la main (cutané) : Quantité de produit : 0,194 g (liquide ordinaire) Absorption cutanée : 4 % (peau exposée) Lavage à la main (inhalation : exposition à la vapeur évaporée, émission constante) : Durée de l’exposition : 10 min Quantité de solution utilisée : 15 kg Dilution (nombre de fois) : 110 (liquide ordinaire) Volume de la pièce : 20 m3 Taux de ventilation : 0,6/h Zone d’émission : 1500 cm2 Durée d’émission : 10 min Température à l’application : 40 °C Coefficient de transfert massique : 10 m/h Matrice de poids moléculaire : 18 g/mole Étendage des vêtements lavés à la main (cutané) : Quantité de produit : 79 mg (liquide ordinaire) Absorption cutanée : 4 % (peau exposée) Étendage des vêtements lavés à la main (inhalation : exposition à la vapeur, évaporation, zone d’émission en croissance) : Durée de l’exposition : 240 min Quantité de solution : 5 kg Dilution (nombre de fois) : 110 (liquide ordinaire) Volume de la pièce : 20 m3 Taux de ventilation : 0,6/h Zone d’émission : 10 m2 Durée d’application : 17 min Température à l’application : 20 °C Coefficient de transfert massique : 10 m/h Matrice de poids moléculaire : 18 g/mole Exposition combinée : Cutanée (mélange & chargement + lavage à la main + étendage des vêtements lavés à la machine) + Inhalation (mélange & chargement + lavage à la main + étendage des vêtements lavés à la machine) |
| Assainisseur d’air en gel (inhalation) | Concentration d’α-pinène : 1 à 5 % (SDS, 2016) Scénario : assainisseur d’air en gel Inhalation : exposition à la vapeur — scénario d’émission instantanée Fréquence : toute la journée, quotidiennement Durée de l’exposition : 24 h/j Quantité de produit : 1 gel ~ 5,5 mL de produit pouvant durer jusqu’à 30 jours. Même quantité présumée être émise chaque jour (5,5 mL/30 jours ~ 0,2 mL ou 0,2 g/j) Volume de la pièce : 20 m3 Taux de ventilation : 0,6/h Exposition (mg/kg p.c./j) = (Concentration dans l’air (mg/m3) × taux d’inhalation quotidien (m3/j)) ÷ masse corporelle (kg) |
* L’exposition aux produits a été estimée à l’aide de ConsExpo Web (2016). Les estimations de l’exposition ont été calculées à partir des masses corporelles et taux d’inhalation par défaut de 70,9 kg/16,2 m3/j, 59,4 kg/15,8 m3/j, 31 kg/14,5 m3/j, 15,5 kg/9,3 m3/j, et 7,5 kg/2,1 m3/j pour les adultes (20 ans et plus), adolescents (12 à 19 ans), enfants (5 à 11 ans), bambins (6 mois à 4 ans) et bébés (0 à 6 mois), respectivement (Santé Canada 1998). Sauf indication contraire, les valeurs par défaut proviennent de la fiche d’information pertinente de ConsExpo pour le scénario présenté.
| Variables | Variables d’entrée |
|---|---|
| Type de source | Ponctuelle |
| Aire effective d’émission a | 100 × 50 m2 |
| Taux d’émission d’α‑pinène | 2,64 (g/s) 83,3 × 106 g/ [(365 × 24 × 3600 s) |
| Hauteur du récepteur b | 1,74 m (taille moyenne d’un adulte) |
| Hauteur de la cheminée a | 10 m |
| Diamètre intérieur de la cheminée a | 3 m |
| Vitesse de sortie du gaz de la cheminée | 1 m/s |
| Température de sortie du gaz de la cheminée | 333 K |
| Température ambiante de l’air | 293 K |
| Facteur d’ajustement c | 0,4 (direction variable du vent pendant 24 h) 0,2 (direction moyenne du vent pendant 1 an) |
| Option : urbain ou rural | Rural |
| Météorologie d | 1 (tous les événements météorologiques) |
| Distance minimale et maximale | 10 à 3000 m |
a Jugement professionnel.
b Curry et coll. 1993.
c USEPA 1992.
d Valeur par défaut de SCREEN3.
e L’émission de 83,3 tonnes (ECCC 2016 b) a été convertie en grammes puis divisée par le nombre de secondes dans une année afin d’estimer le taux d’émission.
| Distance (m) | Concentration sur 1 h (µg/m3) | Concentration sur 24 h (µg/m3) (multipliée par 0,4) | Concentration annuelle (µg/m3) (multipliée par 0,2) |
|---|---|---|---|
| 10 | 1,32 × 104 | 5,26 × 103 | 2,63 × 103 |
| 100 | 713,8 | 2,86 × 102 | 1,43 × 102 |
| 200 | 338,2 | 1,35 × 102 | 6,76 × 101 |
| 300 | 273,2 | 1,09 × 102 | 5,46 × 101 |
| 400 | 275 | 1,10 × 102 | 5,50 × 101 |
| 500 | 251,8 | 1,01 × 102 | 5,04 × 101 |
| 600 | 221,9 | 8,88 × 101 | 4,44 × 101 |
| 700 | 193,8 | 7,75 × 101 | 3,88 × 101 |
| 800 | 169,6 | 6,78 × 101 | 3,39 × 101 |
| 900 | 149,4 | 5,98 × 101 | 2,99 × 101 |
| 1000 | 132,6 | 5,30 × 101 | 2,65 × 101 |
| 1100 | 118,6 | 4,74 × 101 | 2,37 × 101 |
| 1200 | 106,9 | 4,28 × 101 | 2,14 × 101 |
| 1300 | 97 | 3,88 × 101 | 1,94 × 101 |
| 1400 | 88,56 | 3,54 × 101 | 1,77 × 101 |
| 1500 | 81,3 | 3,25 × 101 | 1,63× 101 |
| Espèce | Dose (ppm) | Dose (mg/m3)a | Dose (mg/kg p.c./j)b | Dose ajustée (mg/kg p.c./j)c | Dose ajustée (mg/m3)c |
|---|---|---|---|---|---|
| Sourisd | 25 | 139,25 | 185,67 | 33,15 | 24,87 |
| Sourisd | 50 | 278,50 | 371,33 | 66,31 | 49,73 |
| Sourisd | 100 | 557 | 742,67 | 132,62 | 99,46 |
| Sourisd | 200 | 1114 | 1485,33 | 265,24 | 198,93 |
| Sourisd | 400 | 2228 | 2970,67 | 530,48 | 387,86 |
| Rate | 100 | 557 | 622,96 | 111,24 | 99,46 |
| Rate | 200 | 1114 | 1245,92 | 222,49 | 198,93 |
| Rate | 400 | 2228 | 2491,84 | 444,97 | 397,86 |
| Rate | 800 | 4456 | 4983,68 | 889,94 | 795,74 |
| Rate | 1600 | 8912 | 9967,37 | 1779,89 | 1591,43 |
a Une mole de vapeur ou de gaz parfaits occupe 24,45 L à 25 °C et 760 mm de mercure. Donc, dans ces conditions, la conversion des ppm en mg/m3 est = [ppm × poids moléculaire (g)] / 24,45. Pour l’α-pinène, 1 ppm = 5,57 ppm (mg/m3 = (1 ppm × 136,24) / 24,45).
b La dose (mg/kg p.c./j) a été calculée à l’aide de la formule suivante : [concentration (mg/m3) × taux d’inhalation quotidien (m3/j)] / masse corporelle (kg).
c La dose pour des conditions d’exposition a été ajustée dans l’étude d’inhalation de 6 h d’exposition par jour pour 5 jours par semaine, et a été calculée à l’aide de la formule suivante : dose ajustée = dose × (6 h/24 h) × (5 jours/7 jours).
d La masse corporelle et le taux d’inhalation de la souris proviennent de Santé Canada (1999), annexe E, et sont la moyenne pour les souris mâles et femelles.
e La masse corporelle et le taux d’inhalation des rats proviennent de USEPA (1988) et constituent une moyenne des rats Fisher 344 mâles ou femelles.
Annexe G. Paramètres utilisés pour estimer l’exposition à térébenthine ou l’essence de térébenthine
| Groupe d’âge | Quant. moy. de produit (g/app) a | Fréq. quot. moy. a | Conc. du produit (%) | Masse corporelle (kg) b | Dose par exposition (mg/kg p.c./j) c |
|---|---|---|---|---|---|
| 0 à 6 mois | S.O. | S.O. | S.O. | S.O. | S.O. |
| 6 mois à 4 ans | 0,01 | 0,58 | 0,1 | 15,5 | 3,74 × 10-4 |
| 5 à 11 ans | 0,01 | 0,89 | 0,1 | 31 | 2,87 × 10-4 |
| 12 à 19 ans | 0,01 | 2,35 | 0,1 | 59,4 | 3,96 × 10-4 |
| 20 ans et plus | 0,01 | 2,35 | 0,1 | 70,9 | 3,31 × 10-4 |
a Cité par Loretz et coll. 2005, et Wu et coll. 2010.
b Cité par Santé Canada 1998.
c On suppose que l’absorption orale est équivalente à celle par inhalation.
| Scénario d’exposition* | Groupe d’âge | Concentration | Absorp. cutanée (µg/kg p.c./j) | Expos. inhal. (µg/kg p.c./j) | Absorp. orale (µg/kg p.c./j) |
|---|---|---|---|---|---|
| Cirage à chaussures en crème | Adulte | 10 % | 73,3 | 25,1 (0,11 mg/m3 sur 24 h) | S.O. |
| Diluant pour peinture à l’huile | Adulte | 100 % | 1168 | 1,49 × 103 (6,5 mg/m3 sur 24 h) | S.O. |
| Décapant à peinture | Adulte | 100 % | 282 | 43 413 (190 mg/m3 sur 24 h) | S.O. |
| Cire à meuble en pâte | Adulte | 5 % | 21,0 | 45,7 (0,2 mg/m3 sur 24 h) | S.O. |
| Cire pour automobiles | Adulte | 10 % | 42,1 | 251 (1,1 mg/m3 sur 24 h) | S.O. |
| Ingrédient non médicinal dans les produits médicamentés topiques sous forme de vapeur | Enfants (6 mois à 4 ans) | 4,68 % | 2,04 × 103 | 4,98 × 103 (8,3 mg/m3 sur 24 h) | S.O. |
| Ingrédient non médicinal dans les produits médicamentés topiques sous forme de vapeur | Adulte | 4,68 % | 9,94 × 102 | 4,11 × 103 (18 mg/m3 sur 24 h) | S.O. |
| Ingrédient non médicinal de produits anti‑irritation | Enfants (6 mois à 4 ans) | 25 % | 4,78 × 103 | 84,0 (0,14 mg/m3 sur 24 h) | S.O. |
| Ingrédient non médicinal de produits anti‑irritation | Adulte | 25 % | 2,00 × 103 | 59,4 (0,26 mg/m3 sur 24 h) | S.O. |
* Le tableau G‑3 donne des détails sur la méthode et les paramètres utilisés pour estimer l’exposition par inhalation et l’exposition cutanée à l’essence de térébenthine à partir de produits offerts aux consommateurs.
S.O. : Sans objet
| Scénario d’exposition | Hypothèses* |
|---|---|
| Cirage à chaussures en crème (adulte) | Concentration : 10 % (Household Products Database 1993) Cutanée : Quantité de produit : 1,3 g. Absorption cutanée : 4 % (peau exposée). Inhalation — exposition à la vapeur, émission instantanée Durée de l’exposition : 240 min Quantité de produit : 1,04 g (80 % de la quantité cutanée du produit). Volume de la pièce : 58 m3 Taux de ventilation : 0,6/h. Température à l’application : 20 °C. Exposition totale = cutanée + inhalation. |
| Diluant pour peinture à l’huile (adulte) | Concentration : 100 % (MSDS 2013) Scénario : Diluant à peinture utilisé pour nettoyer les pinceaux dans une grande boîte de conserve (1,4 kg). Cutanée : Quantité de produit : 2,07 g (Versar 1986) Absorption cutanée : 4 % (peau exposée). Inhalation — exposition à la vapeur, modèle d’évaporation, émission constante. Durée de l’exposition : 30 min (Versar 1986) Quantité de produit : 290 g (Exposure Factors Handbook, USEPA 2011) [la quantité de produit a été estimée à partir des quantités moyennes utilisées par année et le nombre annuel d’utilisations, les diluants à peinture sont utilisés en moyenne 6,78 fois par année, et en moyenne on en utilise 69,45 onces par année, ce qui donne une estimation de 290 grammes/utilisation (69,45 onces/année ÷ 6,78 utilisations/année = 10,24 onces/utilisation ou 290 grammes)] Volume de la pièce : 20 m3 (RIVM 2014) (pièce non précisée) Taux de ventilation : 0,6/h (RIVM 2014) (pièce non précisée) Coefficient de transfert massique : 10 m/h Durée d’émission : 30 min Zone d’émission : 0,078 m2 (Versar 1986) (l’ouverture d’une boîte de conserve de café de 1,4 kg) Matrice de poids moléculaire : 136 g/mole. Exposition totale = cutanée + inhalation. |
| Décapant à peinture (adulte) | Concentration : 100 % (MSDS, 2013) Scénario : Décapage de la peinture d’une porte. On applique le décapant et on le laisse ensuite agir pendant 15 minutes puis on retire la pâte produite à l’aide d’un grattoir. Cutanée : Quantité de produit : 0,5 g (RIVM 2007) Absorption cutanée : 4 % (peau exposée) Inhalation — exposition à la vapeur, zone d’évaporation en croissance (RIVM 2007). Exposition et durée d’application : 60 min. Quantité de produit : 1 kg. Volume de la pièce : 20 m3. Taux de ventilation : 0,6/h. Zone d’émission : 2 m2. Température : 20 °C. Matrice de poids moléculaire : 3000 g/mole. Exposition totale = cutanée + inhalation. |
| Cire à meuble en pâte (adulte) | Concentration : 5 % (SDS 2015a) Scénario : Application de la cire en pâte sur un meuble. La méthode de la pellicule mince décrite dans le document de l’EPA des États-Unis et de Versar a été utilisée (Versar 1986, USEPA 2011). Cutanée : Épaisseur de la pellicule : 1,64 × 10-3 cm (estimation de l’épaisseur de l’huile minérale restant sur la peau après l’essuyage) (USEPA 2011). Aire de la peau exposée : 455 cm2 (la moitié des deux mains ou les paumes). Masse volumique : 1 g/cm3 (masse volumique présumée de la cire pour automobile). Absorption cutanée : 4 % (peau exposée). Inhalation — exposition à la vapeur, évaporation depuis une surface croissante. Exposition et durée d’émission : 60 min (jugement professionnel). Quantité de produit : 13,8 g (la quantité variait de 4,2 à 13,8 g, puisque du poli à meuble à base de cire en pâte n’a pas été inclus, la quantité maximale de produit a été utilisée dans l’évaluation) (Versar 1986). Volume de la pièce : 58 m3 (salon) (RIVM 2014). Taux de ventilation : 0,5/h (salon) (RIVM 2014). Zone d’émission : 1,44 m2 (aire d’une table à café et de tables d’appoint) (Versar 1986). Température : 20 °C. Matrice de poids moléculaire : 216 g/mole (masse moléculaire de la cire de carnauba) Exposition totale = cutanée + inhalation. |
| Cire pour automobiles (adulte) | Concentration : < 10 % (SDS 2013) Scénario : application de cire sur une voiture dans un garage. La méthode de la pellicule mince décrite dans le document de l’EPA des États-Unis et de Versar a été utilisée (Versar 1986, US EPA 2011). Cutanée : Épaisseur de la pellicule : 1,64 × 10-3 cm (estimation de l’épaisseur de l’huile minérale restant sur la peau après l’essuyage) (Versar 1986). Aire de la peau exposée : 455 cm2 (la moitié des deux mains ou les paumes). Masse volumique : 1 g/cm3 (masse volumique présumée de la cire pour automobile). Absorption cutanée : 4 % (peau exposée). Inhalation — exposition à la vapeur, évaporation depuis une surface croissante. Exposition et durée d’émission : 60 min (jugement professionnel). Quantité de produit : 28 g (environ 1 once du produit est utilisée pour cirer une voiture) (Meguiar’s Online Forum, 2010) Volume de la pièce : 34 m3 (garage) (RIVM 2014). Taux de ventilation : 1,5/h (garage) (RIVM 2014). Zone d’émission : 5,57 m2 (60 pi2 surface typique d’une voiture, Jackson — Washington Times, 2008). Température : 20 °C. Matrice de poids moléculaire : 216 g/mole (masse moléculaire de la cire de carnauba). Exposition totale = cutanée + inhalation. |
| Ingrédient non médicinal dans les produits médicamentés topiques sous forme de vapeur (bambin, adulte) | Concentration : 4,68 % Instructions de l’étiquette : Appliquez en frottant sur la poitrine, la gorge et le dos. Répétez trois à quatre fois par jour, particulièrement au coucher. Cutanée : Quantité de produit (enfant de 6 mois à 4 ans) : 0,84 g par application (valeur pour les lotions pour le corps : 4,1 g par application (Ficheux et coll. 2015) ajustée par la surface du torse divisée en 2 pour représenter la poitrine, la gorge et le dos). 3,36 g par jour (0,84 g/application × 4 applications/jour) Quantité de produit (adulte) : 1,88 g par utilisation (valeur pour les lotions pour le corps de 10 g par application (Ficheux et coll. 2015) ajustée pour l’aire du torse divisée par 2 pour représenter la poitrine, la gorge et le dos). 7,52 g par jour (1,88 g/application × 4 applications/jour). Absorption cutanée : 20 % (peau recouverte). Inhalation — exposition à la vapeur, modèle d’évaporation, émission constante : Quantité disponible pour l’inhalation : 80 % de la quantité indiquée ci‑dessus de produit (voir le résumé d’absorption cutanée pour plus de détails). Durée de l’exposition : 6 h (24 h divisées par 4 applications quotidiennes) Matrice de poids moléculaire : 600 g/mole (à base de gelée de pétrole) Volume de la pièce : 1 m3 (zone respiratoire). Taux de ventilation : 0,6/h (pièce non précisée, RIVM 2014). Transfert massique : 10 m/h. Zone d’émission : 3185 cm2 (adulte) (la surface du tronc divisée par 2 représente la poitrine, le dos et la gorge). 1010 cm2 (enfant) (la surface du tronc divisée par 2 représente la poitrine, le dos et la gorge). Durée d’émission : 1 h. Exposition par inhalation (mg/kg p.c./j) = (concentration dans l’air (mg/m3 sur 24 h) × taux d’inhalation quotidien (m3/j)) ÷ masse corporelle (kg). Exposition totale (mg/kg p.c./j) = cutanée + inhalation. |
| Ingrédient non médicinal de produits anti-irritation (bambin, adulte) | Concentration : 25 % Instructions de l’étiquette : Utilisez jusqu’à quatre fois par jour. Cutanée : Quantité de produit (enfant de 6 mois à 4 ans) : 0,37 g par application (quantité d’huile à massage de 1,8 g par utilisation (Ficheux et coll. 2016) ajustée par l’aire du tronc divisé par deux pour représenter le dos). 1,48 g par jour (0,37 g/application × 4 applications/jour) Quantité de produit (adulte) : 0,71 g par application (quantité d’huile à massage de 3,2 g par utilisation (Ficheux et coll. 2016) ajustée par l’aire du tronc divisé par deux pour représenter le dos). 2,84 g par jour (0,71 g/application × 4 applications/jour). Absorption cutanée : 20 % (peau recouverte) Inhalation — exposition à la vapeur, modèle d’évaporation, émission constante : Quantité disponible pour l’inhalation : 80 % de la quantité de produit mentionnée plus haut (voir le résumé pour l’absorption cutanée pour plus de détails). Durée de l’exposition : 24 h Matrice de poids moléculaire : 600 g/mole (base de gelée de pétrole) Volume de la pièce : 80 m3 (mélange approximatif pendant la journée) Taux de ventilation : 1/h Transfert de masse : 10 m/h Zone d’émission : 3185 cm2 (adulte) (la surface du tronc divisée par 2 représente la poitrine, le dos et la gorge) 1010 cm2 (enfant) (la surface du tronc divisée par 2 représente la poitrine, le dos et la gorge) Durée d’émission : 1 h Exposition par inhalation (mg/kg p.c./j) = (concentration dans l’air (mg/m3 sur 24 h) × taux d’inhalation quotidien (m3/j)) ÷ masse corporelle (kg) Exposition totale (mg/kg p.c./j) = cutanée + inhalation |
* L’exposition aux produits a été estimée à l’aide de ConsExpo Web (2016). Les estimations de l’exposition ont été calculées à partir des masses corporelles et taux d’inhalation par défaut de 70,9 kg/16,2 m3/j, 59,4 kg/15,8 m3/j, 31 kg/14,5 m3/j, 15,5 kg/9,3 m3/j, et 7,5 kg/2,1 m3/j pour les adultes (20 ans et plus), adolescents (12 à 19 ans), enfants (5 à 11 ans), bambins (6 mois à 4 ans) et bébés (0 à 6 mois), respectivement (Santé Canada 1998). Sauf indication contraire, les valeurs par défaut proviennent de la fiche d’information pertinente de ConsExpo pour le scénario présenté.
Annexe H. Paramètres utilisés pour estimer l’exposition à l’essence de sapin
| Groupe d’âge | Quant. moy. de produit (g/app) a | Fréq. quot. moy. b | Conc. air (mg/m3) (24 h) c | Expos. cutan. (mg/kg p.c./j) d | Expos. inhal. (mg/kg p.c./j) e | Expos. comb. (mg/kg p.c./j) f |
|---|---|---|---|---|---|---|
| 0 à 6 mois | 2,5 | 0,8 | 7,6 × 10-3 | 5,33 × 10-1 | 2,13 × 10-3 | 5,35 × 10-1 |
| 6 mois à 4 ans | 4,1 | 0,8 | 1,2 × 10-2 | 4,23 × 10-1 | 7,20 × 10-3 | 4,30 × 10-1 |
| 5 à 11 ans | 5 | 0,8 | 1,5 × 10-2 | 2,58 × 10-1 | 7,02 × 10-3 | 2,65 × 10-1 |
| 12 à 19 ans | 8,7 | 0,8 | 2,6 × 10-2 | 2,34 × 10-1 | 6,92 × 10-3 | 2,41 × 10-1 |
| 20 ans et plus | 10 | 1 | 3,8 × 10-2 | 2,82 × 10-1 | 8,68 × 10-3 | 2,91 × 10-1 |
a Cité par Ficheux et coll. 2016.
b Cité par Ficheux et coll. 2015, Wu et coll. 2010.
c Les concentrations dans l’air ont été modélisées à l’aide du modèle ConsExpo d’émission constante de vapeur par évaporation en supposant que 80 % de la dose appliquée était disponible pour l’évaporation (quantité demeurant sur l’épiderme après l’absorption cutanée de la substance) (80 %× [quantité de produit/application] × [applications/jour] × concentration de 1 %), et en utilisant les paramètres suivants : durée d’exposition de 24 h, durée d’émission de 1 h, volume de la pièce de 80 m3, taux de ventilation de 1/h, aire couverte égale à la peau exposée (présumée être égale à la tête, aux bras et aux mains) (1365 cm2 pour 0 à 6 mois, 1970 cm2 pour 6 mois à 4 ans, 2900 cm2 pour 5 à 11 ans, 4540 cm2 pour 12 à 19 ans et 4735 cm2 pour les adultes, tel que cité par Santé Canada 1998), matrice de poids moléculaire de 125 g/mole et une température d’application de 37 °C.
d Exposition cutanée calculée à l’aide de la formule suivante : [application moyenne (g/application) × fréquence quotidienne moyenne (applications/jour) × concentration du produit (1 %) × absorption cutanée pour la peau recouverte (20 %) × facteur de conversion (1000 mg/g)] ÷ masse corporelle (7,5 kg pour 0 à 6 mois, 15,5 kg pour 6 mois à 4 ans, 31,0 kg pour 5 à 11 ans, 59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998)
e Exposition par inhalation calculée à l’aide de la formule suivante : [concentration dans l’air (mg/m3) (moyenne pondérée sur 24 h) × taux d’inhalation (m3/j) (2,1 m3/j pour 0 à 6 mois, 9,3 m3/j pour 6 mois à 4 ans, 14,5 m3/j pour 5 à 11 ans, 15,8 m3/j pour 12 à 19 ans et 16,2 m3/j pour 20 ans et plus, tel que cité par Santé Canada 1998] ÷ masse corporelle (7,5 kg pour 0 à 6 mois, 15,5 kg pour 6 mois à 4 ans, 31,0 kg pour 5 à 11 ans, 59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
f Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j)
| Groupe d’âge | Quant. moy. de produit (g/j) a | Conc. dans l’air (24 h) (mg/m3) b | Expos. cutan. (mg/kg p.c./j) c | Expos. inhal. (mg/kg p.c./j) d | Expos. comb. (mg/kg p.c./j) e |
|---|---|---|---|---|---|
| 0 à 6 mois | 1,8 | 2,4 × 10-2 | 2,88 × 10-1 | 6,72 × 10-3 | 2,95 × 10-1 |
| 6 mois à 4 ans | 1,8 | 2,4 × 10-2 | 1,39 × 10-1 | 1,44 × 10-2 | 1,54 × 10-1 |
| 5 à 11 ans | 2,5 | 3,3 × 10-2 | 9,68 × 10-2 | 1,54 × 10-2 | 1,12 × 10-1 |
| 12 à 19 ans | 2,9 | 3,8 × 10-2 | 5,86 × 10-2 | 1,01 × 10-2 | 6,87 × 10-2 |
| 20 ans et plus | 3,2 | 4,2 × 10-2 | 5,42 × 10-2 | 9,60 × 10-3 | 6,38 × 10-2 |
a Cité par Ficheux et coll. 2016. Fréquence présumée d’un massage par jour. La concentration de l’essence de sapin est basée sur la concentration supérieure d’huiles essentielles dans l’huile de massage (RIVM, 2006).
b Les concentrations dans l’air ont été modélisées à l’aide du modèle ConsExpo d’émission constante de vapeur par évaporation en supposant que 96 % de la dose appliquée était disponible pour l’évaporation (quantité demeurant sur l’épiderme après l’absorption cutanée de la substance) (96 % × [quantité de produit/jour] × [concentration de 3 % dans l’huile de massage]), et en utilisant les paramètres suivants : durée d’exposition de 24 h, durée d’émission de 1 h, volume de la pièce de 80 m3, taux de ventilation de 1/h, aire d’émission égale à la peau exposée (aire totale moins la tête pour les enfants de 0 à 11 ans et aire totale moins une demi-tête et le tronc pour les adultes et les adolescents) (3020 cm2 pour 0 à 6 mois, 4910 cm2 pour 6 mois à 4 ans, 8450 cm2 pour 5 à 11 ans, 12 795 cm2 pour 12 à 19 ans et 14 380 cm2 pour 20 ans et plus, tel que cité par Santé Canada 1998), matrice de poids moléculaire de 125 g/mole et une température d’application de 37 °C.
c Exposition cutanée calculée à l’aide de la formule suivante : [application moyenne (g/j) × concentration de l’huile de massage (3 %) × absorption cutanée pour la peau exposée (4 %) × facteur de conversion (1000 mg/g)] ÷ masse corporelle (7,5 kg pour 0 à 6 mois, 15,5 kg pour 6 mois à 4 ans, 31,0 kg pour 5 à 11 ans, 59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998)
d Exposition par inhalation calculée à l’aide de la formule suivante : [concentration dans l’air (mg/m3) (moyenne pondérée sur 24 h) × taux d’inhalation (m3/j) (2,1 m3/j pour 0 à 6 mois, 9,3 m3/j pour 6 mois à 4 ans, 14,5 m3/j pour 5 à 11 ans, 15,8 m3/j pour 12 à 19 ans et 16,2 m3/j pour 20 ans et plus, tel que cité par Santé Canada 1998] ÷ masse corporelle (7,5 kg pour 0 à 6 mois, 15,5 kg pour 6 mois à 4 ans, 31,0 kg pour 5 à 11 ans, 59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
e Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j).
| Groupe d’âge * | Quantité de produit (g/use) a | Utilisation par jour a | Conc. dans l’air (24 h) b | Expos. cutan. (mg/kg p.c./j) c | Expos. inhal. (mg/kg p.c./j) d | Expos. comb. (mg/kg p.c./j) e |
|---|---|---|---|---|---|---|
| 12 à 19 ans | 1,5 | 1 | 7,8 × 10-1 | 3,03 × 10-2 | 2,07 × 10-1 | 2,38 × 10-1 |
| 20 ans et plus | 1,5 | 2 | 1,6 | 5,08 × 10-2 | 3,66 × 10-1 | 4,16 × 10-1 |
* Le scénario d’hydratant du visage ne s’applique qu’à deux groupes d’âge.
a Cité par Ficheux et coll. 2016, Ficheux et coll. 2015, et Loretz et coll. 2005.
b Les concentrations dans l’air ont été modélisées à l’aide du modèle ConsExpo d’émission constante de vapeur par évaporation en supposant que 96 % de la dose appliquée était disponible pour l’évaporation (quantité demeurant sur l’épiderme après l’absorption cutanée de la substance) (96 %× [quantité de produit/jour] × concentration de 3 %), et en utilisant les paramètres suivants : durée d’exposition de 24 h, durée d’émission de 1 h, volume de la pièce de 1 m3, (volume personnel approximatif de la respiration), l’aire d’évaporation est égale à la surface d’application présumée être équivalente à la moitié de la tête (730 cm2 pour 12 à 19 ans et 637,5 cm2 pour les adultes, tel que cité par Santé Canada 1998), taux de ventilation de 2/h (pour approximer le mélange entre l’espace d’air personnel avec la pièce), matrice de poids moléculaire de 125 g/mole et une température d’application de 37 °C.
c Exposition cutanée calculée à l’aide de la formule suivante : [quantité de produit (g/j) × concentration du produit (3 %) × absorption cutanée par la peau exposée (4 %) × facteur de conversion (1000 mg/g)] ÷ masse corporelle (59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
d Exposition par inhalation calculée à l’aide de la formule suivante : [concentration dans l’air (mg/m3) (moyenne pondérée sur 24 h) × taux d’inhalation (m3/j) (15,8 m3/j pour 12 à 19 ans et 16,2 m3/j pour 20 ans et plus, tel que cité par Santé Canada 1998] ÷ masse corporelle (59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
e Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j).
| Groupes d’âge | Quant. moy. de produit (g/app) a | Fréq. quot. moy. a | Conc. dans l’air (mg/m3) (24h) b | Exposition (mg/kg p.c./j) c |
|---|---|---|---|---|
| 5 à 11 ans | 0,33 | 1,7 | 0,19 | 8,89 × 10-2 |
| 12 à 19 ans | 0,33 | 1,7 | 0,19 | 5,05 × 10-2 |
| 20 ans et plus | 0,33 | 1,7 | 0,19 | 4,34 × 10-2 |
a Cité par Loretz et coll. 2005
b Paramètres utilisés avec ConsExpo = durée d’exposition de 5 min, volume de la pièce : 10 m3 (salle de bain), taux de ventilation : 0/h
c Exposition par inhalation calculée à l’aide de la formule suivante : [concentration dans l’air (mg/m3) (moyenne pondérée sur 24 h) × taux d’inhalation (m3/j) (14,5 m3/j pour 5 à 11 ans, 15,8 m3/j pour 12 à 19 ans et 16,2 m3/j pour 20 ans et plus, tel que cité par Santé Canada 1998] ÷ masse corporelle (31,0 kg pour 5 à 11 ans, 59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
| Scénario d’exposition* | Groupe d’âge | Concentration | Absorp. cutanée (mg/kg p.c./j) | Expos. inhal. (mg/kg p.c./j) | Absorp. orale (mg/kg p.c./j) |
|---|---|---|---|---|---|
| Assainisseur d’air (à la cire) | Toutes les sous-populations | 5 % | S.O. | 1,65 × 10-1 à 4,32 × 10-1 (0,72 mg/m3 sur 24 h) | S.O. |
| Ingrédient non médicinal dans une médication liquide froide | Enfants de trois ans et plus et adultes | 0,27% | S.O. | S.O. | 1,14 à 2,61 |
| Baume pour la poitrine | Adultes et bébés | 3 % | 1,59 × 10-1 à 3,27 × 10-1 | 6,63 × 10-1 à 7,80 × 10-1 (1,30 à 2,90 mg/m3 sur 24 h) | S.O. |
*Le tableau H‑5 énumère les détails de la méthode et les paramètres utilisés pour estimer l’absorption par inhalation ou l’absorption cutanée d’essence de sapin depuis des produits offerts aux consommateurs.
| Scénario d’exposition |
Hypothèses* |
|---|---|
| Assainisseur d’air (à la cire) (inhalation) (toutes les sous-populations) |
Concentration d’essence de sapin: 1 à 5% (SDS, 2015b) Inhalation — exposition à la vapeur, scénario de taux constant Durée de l’exposition: 4h (feuille d’information du scénario d’assainisseur d’air de ConsExpo Cosmetics, RIVM 2006). Quantité de produit: chaque cube de cire contient 78grammes de produit et dure environ 16h; chaque utilisation dure 3h ou consomme 14,63g de produit (78grammes/16h × 3 h/j) Volume de la pièce: 58m3 (salon) (scénario d’assainisseur d’air de la fiche d’information de ConsExpo Cosmetics, RIVM 2006) Taux de ventilation: 0,5/h (salon) (scénario d’assainisseur d’air de la fiche d’information de ConsExpo Cosmetics, RIVM 2006) Durée d’émission: 3h (scénario d’assainisseur d’air de la fiche d’information de ConsExpo Cosmetics, RIVM 2006) Exposition par inhalation (mg/kgp.c./j) = (concentration dans l’air (mg/m3 sur 24h)× taux d’inhalation quotidien (m3/j))÷ masse corporelle (kg) |
| Ingrédient non médicinal dans une médication liquide froide (enfants de trois ans et plus, et adultes) |
Concentration d’essence de sapin: 0,27% (communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance, Santé Canada, au Bureau d’évaluation des risques des substances existantes, Santé Canada, février 2018, sans référence). Instructions de l’étiquette Enfants de 3 à 9ans: 5mL jusqu’à trois fois par jour, pendant 4 à 5 jours (0,27%× 5mL× 3 fois/j× 1g/mL (masse volumique présumée du sirop)/ 15,5kg (masse corporelle de 6mois à 4ans) = 2,61mg/kgp.c./j) Adultes: de 10mL à 3 fois par jour pendant4 à 5 jours (0,27%× 10mL× 3 fois/j× 1g/mL (masse volumique présumée du sirop)/ 70,9kg (masse d’un adulte) = 1,14mg/kgp.c./j) |
| Baume pour la poitrine (tous les groupes d’âge) |
Concentration: 1-3% (communication personnelle, courriel de la Direction de la sécurité des produits de consommation, Santé Canada, au Bureau d’évaluation des risques des substances existantes, Santé Canada, 2019, sans référence). Instructions de l’étiquette: Une application par jour. Appliquer une petite quantité de gel et frotter le dos et la poitrine avant le coucher (communication personnelle avec la direction de la sécurité des produits de consommation, 2019). Cutanée Quantité de produit (enfant de 6mois à 4ans): 0,84g par application (quantité de lotion pour le corps de 4,1g par utilisation (Ficheux et coll. 2015) ajustée par la surface du tronc divisée par2 pour représenter la poitrine, la gorge et le dos). 3,36g par jour (0,84g/application× 1 application/jour) Quantité de produit (adulte): 1,88g par application (quantité de lotion pour le corps de 10g par utilisation (Ficheux et coll. 2015) ajustée pour la surface du tronc divisée par2 pour représenter la poitrine, la gorge et le dos). 7,52g par jour (1,88g/application× 1 application/jour). Absorption cutanée: 20% (peau recouverte) Inhalation — exposition à la vapeur, modèle d’évaporation, émission constante: Quantité disponible pour l’inhalation: 80% de la quantité de produit mentionnée plus haut (voir le résumé pour l’absorption cutanée pour plus de détails). Durée de l’exposition: 24h Matrice de poids moléculaire: 600g/mole (base de gelée de pétrole) Volume de la pièce: 1m3 (zone de respiration personnelle) Taux de ventilation: 0,6/h (pièce non précisée, RIVM 2014) Transfert de masse: 10m/h Zone d’émission: 3185cm2 (adulte) (la surface du tronc divisée par 2 représente la poitrine, le dos et la gorge) 1010cm2 (enfant) (la surface du tronc divisée par 2 représente la poitrine, le dos et la gorge) Durée d’émission: 1h Exposition par inhalation (mg/kgp.c./j) = (concentration dans l’air (mg/m3 sur 24h)× taux d’inhalation quotidien (m3/j))÷ masse corporelle (kg) Exposition totale (mg/kgp.c./j) = cutanée+ inhalation |
*L’exposition aux produits a été estimée à l’aide de ConsExpo Web (2016). Les estimations de l’exposition ont été calculées à partir des masses corporelles et taux d’inhalation par défaut de 70,9 kg/16,2 m3/j, 59,4 kg/15,8 m3/j, 31 kg/14,5 m3/j, 15,5 kg/9,3 m3/j, et 7,5 kg/2,1 m3/j pour les adultes (20 ans et plus), adolescents (12 à 19 ans), enfants (5 à 11 ans), bambins (6 mois à 4 ans) et bébés (0 à 6 mois), respectivement (Santé Canada 1998). Sauf indication contraire, les valeurs par défaut proviennent de la fiche d’information pertinente de ConsExpo pour le scénario présenté.
Annexe I. Paramètres utilisés pour estimer l’exposition à l’essence de pin
| Groupe d’âge | Quant. moy. de produit (g/app)a | Fréq. quot. moy.b | Conc. air (mg/m3) (24h)c | Expos. cutan. (mg/kgp.c./j)d | Expos. inhal. (mg/kgp.c./j)e | Expos. comb. (mg/kgp.c./j)f |
|---|---|---|---|---|---|---|
| 0 à 6 mois | 2,5 | 0,8 | 2,3×10-3 | 1,60×10-1 | 6,44×10-4 | 1,61×10-1 |
| 6 mois à 4ans | 4,1 | 0,8 | 3,7×10-3 | 1,27×10-1 | 2,22×10-3 | 1,29×10-1 |
| 5 à 11ans | 5 | 0,8 | 4,5×10-3 | 7,74×10-2 | 2,10×10-3 | 7,95×10-2 |
| 12 à 19ans | 8,7 | 0,8 | 7,9×10-3 | 7,03×10-2 | 2,10×10-3 | 7,24×10-2 |
| 20ans et plus | 10 | 1 | 1,2×10-2 | 8,46×10-2 | 2,74×10-3 | 8,74×10-2 |
a Cité par Ficheux et coll. 2016.
b Cité par Ficheux et coll. 2015, Wu et coll. 2010.
c Les concentrations dans l’air ont été modélisées à l’aide du modèle ConsExpo d’émission constante de vapeur par évaporation en supposant que 80 % de la dose appliquée était disponible pour l’évaporation (quantité demeurant sur l’épiderme après l’absorption cutanée de la substance) (80 %× [quantité de produit/application] × [applications/jour] × concentration de 0,3 %), et en utilisant les paramètres suivants : durée d’exposition de 24 h, durée d’émission de 1 h, volume de la pièce de 80 m3, taux de ventilation de 1/h, aire couverte égale à la peau exposée (présumée être égale à la tête, aux bras et aux mains) (1365 cm2 pour 0 à 6 mois, 1970 cm2 pour 6 mois à 4 ans, 2900 cm2 pour 5 à 11 ans, 4540 cm2 pour 12 à 19 ans et 4735 cm2 pour les adultes, tel que cité par Santé Canada 1998), matrice de poids moléculaire de 125 g/mole et une température d’application de 37 °C.
d Exposition cutanée calculée à l’aide de la formule suivante : [application moyenne (g/application) × fréquence quotidienne moyenne (applications/jour) × concentration du produit (0,3 %) × absorption cutanée pour la peau recouverte (20 %) × facteur de conversion (1000 mg/g)] ÷ masse corporelle (7,5 kg pour 0 à 6 mois, 15,5 kg pour 6 mois à 4 ans, 31,0 kg pour 5 à 11 ans, 59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
e Exposition par inhalation calculée à l’aide de la formule suivante : [concentration dans l’air (mg/m3) (moyenne pondérée sur 24 h) × taux d’inhalation (m3/j) (2,1 m3/j pour 0 à 6 mois, 9,3 m3/j pour 6 mois à 4 ans, 14,5 m3/j pour 5 à 11 ans, 15,8 m3/j pour 12 à 19 ans et 16,2 m3/j pour 20 ans et plus, tel que cité par Santé Canada 1998] ÷ masse corporelle (7,5 kg pour 0 à 6 mois, 15,5 kg pour 6 mois à 4 ans, 31,0 kg pour 5 à 11 ans, 59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
f Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j).
| Groupe d’âge | Quant. moy. de produit (g/j) a | Conc. dans l’air (24 h) (mg/m3) b | Expos. cutan. (mg/kg p.c./j) c | Expos. inhal. (mg/kg p.c./j) d | Expos. comb. (mg/kg p.c./j) e |
|---|---|---|---|---|---|
| 0 à 6 mois | 1,8 | 8,0 × 10-3 | 9,60 × 10-2 | 2,24 × 10-3 | 9,82 × 10-2 |
| 6 mois à 4 ans | 1,8 | 8,0 × 10-3 | 4,65 × 10-2 | 4,80 × 10-3 | 5,13 × 10-2 |
| 5 à 11 ans | 2,5 | 1,1 × 10-2 | 3,23 × 10-2 | 5,15 × 10-3 | 3,74 × 10-2 |
| 12 à 19 ans | 2,9 | 1,3 × 10-2 | 1,95 × 10-2 | 3,46 × 10-3 | 2,30 × 10-2 |
| 20 ans et plus | 3,2 | 1,4 × 10-2 | 1,81 × 10-2 | 3,20 × 10-3 | 2,13 × 10-2 |
a Cité par Ficheux et coll. 2016. Fréquence présumée d’un massage par jour.
b Les concentrations dans l’air ont été modélisées à l’aide du modèle ConsExpo d’émission constante de vapeur par évaporation en supposant que 96 % de la dose appliquée était disponible pour l’évaporation (quantité demeurant sur l’épiderme après l’absorption cutanée de la substance) (96 % × [quantité de produit/jour] × [concentration de 1 % dans l’huile de massage]), et en utilisant les paramètres suivants : durée d’exposition de 24 h, durée d’émission de 1 h, volume de la pièce de 80 m3, taux de ventilation de 1/h, aire d’émission égale à la peau exposée (aire totale moins la tête pour les enfants de 0 à 11 ans et aire totale moins une demi-tête et le tronc pour les adultes et les adolescents) (3020 cm2 pour les 0 à 6 mois, 4910 cm2 pour 6 mois à 4 ans, 8450 cm2 pour 5 à 11 ans, 12 795 cm2 pour 12 à 19 ans et 14 380 cm2 pour 20 ans et plus, tel que cité par Santé Canada 1998), matrice de poids moléculaire de 125 g/mole et une température d’application de 37 °C.
c Exposition cutanée calculée à l’aide de la formule suivante : [application moyenne (g/j) × concentration de l’huile de massage (1 %) × absorption cutanée pour la peau exposée (4 %) × facteur de conversion (1000 mg/g)] ÷ masse corporelle (7,5 kg pour 0 à 6 mois, 15,5 kg pour 6 mois à 4 ans, 31,0 kg pour 5 à 11 ans, 59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
d Exposition par inhalation calculée à l’aide de la formule suivante : [concentration dans l’air (mg/m3) (moyenne pondérée sur 24 h) × taux d’inhalation (m3/j) (2,1 m3/j pour 0 à 6 mois, 9,3 m3/j pour 6 mois à 4 ans, 14,5 m3/j pour 5 à 11 ans, 15,8 m3/j pour 12 à 19 ans et 16,2 m3/j pour 20 ans et plus, tel que cité par Santé Canada 1998] ÷ masse corporelle (7,5 kg pour 0-6 mois, 15,5 kg pour 6 mois à 4 ans, 31,0 kg pour 5 à 11 ans, 59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
e Exposition combinée (mg/kg p.c./j) = exposition cutanée (mg/kg p.c./j) + exposition par inhalation (mg/kg p.c./j)
| Groupe d’âge | Quant. moy. de produit (g/app) a | Fréq. quot. moy. a | Conc. dans l’air (mg/m3) (24 h) b | Exposition (mg/kg p.c./j) c |
|---|---|---|---|---|
| 5 à 11 ans | 0,33 | 1,7 | 0,19 | 8,89 × 10-2 |
| 12 à 19 ans | 0,33 | 1,7 | 0,19 | 5,05 × 10-2 |
| 20 ans et plus | 0,33 | 1,7 | 0,19 | 4,34 × 10-2 |
a Cité par Loretz et coll. 2005.
b Paramètres utilisés avec ConsExpo = durée d’exposition de 5 min, volume de la pièce : 10 m3 (salle de bain), taux de ventilation : 0/h
c Exposition par inhalation calculée à l’aide de la formule suivante : [concentration dans l’air (mg/m3) (moyenne pondérée sur 24 h) × taux d’inhalation (m3/j) (14,5 m3/j pour 5 à 11 ans, 15,8 m3/j pour 12 à 19 ans et 16,2 m3/j pour 20 ans et plus, tel que cité par Santé Canada 1998] ÷ masse corporelle (31,0 kg pour 5 à 11 ans, 59,4 kg pour 12 à 19 ans et 70,9 kg pour 20 ans et plus, tel que cité par Santé Canada 1998).
| Scénario d’exposition* | Groupe d’âge | Concentration | Absorp. cutanée (µg/kg p.c./j) | Expos. inhal. (µg/kg p.c./j) | Absorp. orale (µg/kg p.c./j) |
|---|---|---|---|---|---|
| Mélange, chargement et application d’un nettoyant tout usage à planchers | Adulte | 5 % | 10,4 | 77,7 (340 µg/m3 sur 24 h) | S.O. |
| Exposition occasionnée par le contact avec un plancher nettoyé | Bambin | 5 % | 2,97 | 204 (340 µg/m3 sur 24 h) | 5,58 |
| Nettoyeur automatique de cuvette de toilettes | Bambin, adulte | 10 % | S.O. | 66,3 à 174 (290 µg/m3 sur 24 h) | S.O. |
| Ingrédient non médicinal dans les produits de santé naturels | Adulte, adolescent | 4 mg/mL | S.O. | S.O. | 2820 à 3370 |
*Le tableau I‑ 5 détaille les méthodes et les paramètres utilisés pour estimer l’absorption par inhalation ou l’absorption cutanée d’essence de pin depuis des produits offerts aux consommateurs.
| Scénario d’exposition |
Hypothèses* |
|---|---|
| Mélange, chargement et application d’un nettoyant tout usage à planchers (liquide) (adulte) |
Concentration d’essence de pin : 5 % (MSDS 2015) Mélange et chargement (cutanée) : Quantité de produit : 0,01 g Absorption cutanée : 4 % (peau exposée) Mélange et chargement (inhalation : modèle d’exposition à la vapeur, évaporation, surface d’émission constante) Durée de l’exposition : 0,75 min Quantité de produit : 500 g Volume de la pièce : 1 m3 Taux de ventilation : 0,5/h Zone d’émission : 20 cm2 Durée d’émission : 0,3 min Température à l’application : 20 °C Coefficient de transfert massique : 10 m/h Matrice de poids moléculaire : 36 g/mole Application (cutanée) : Quantité de produit : 0,36 g Absorption cutanée : 4 % (peau exposée) Application (inhalation : modèle d’exposition à la vapeur, évaporation, modèle d’émission croissante) Durée de l’exposition : 240 min Quantité de solution utilisée : 900 g Dilution (nombre de fois) : 62 Volume de la pièce : 58 m3 Taux de ventilation : 0,5/h Zone d’émission : 22 m2 Durée de l’exposition : 20 min Température à l’application : 20 °C Coefficient de transfert massique : 10 m/h Matrice de poids moléculaire : 18 g/mole Exposition combinée : cutanée totale (mélange & chargement + application) + inhalation totale (mélange & chargement + application) |
| Exposition occasionnée par le contact avec un plancher nettoyé (bambin) |
Concentration d’essence de pin : 5 % (MSDS, 2015) Calculs fondés sur les procédures opérationnelles normalisées de l’EPA des États-Unis (USEPA, 2012a), partie 7. Cutanée : Calculée à l’aide de l’algorithme suivant : Exposition (mg/kg p.c./j) = [résidu déposé (mg/cm2) × fraction disponible pour le transfert (%) × coefficient de transfert (cm2/h) × temps d’exposition (h) × absorption cutanée (%)] ÷ masse corporelle Résidu déposé (µg/cm2) : Calculé en supposant 14,4 g de produit par 22 m2 de plancher (Fiche d’information sur le nettoyage de ConsExpo 2018) × 1000 mg/g × 1 m2/10 000 cm2 Coefficient de transfert : 2200 cm2/h (ajusté à l’aire de la peau d’un bambin de six mois à quatre ans à l’aide de la formule suivante : coefficient de transfert d’un adulte de 6800 cm2/h × (5780 cm2 aire de la peau du bambin/18 200 cm2, aire de la peau d’un adulte)) Fraction disponible pour le transfert : 8 % Temps d’exposition : 2 h, le temps d’exposition pour les surfaces dures correspond au temps passé dans les cuisines et les salles de bain Absorption cutanée : 4 % (peau exposée) Ingestion accidentelle (contact des mains avec la bouche) : Calculée à l’aide de l’algorithme suivant : Exposition (mg/j) = [RM (mg/cm2) × (FM × SM (cm2)) × (TE × N_répét) × (1 – (1 – ES)Freq_mb/N_répét)] RM : charge de résidus sur les mains (mg/cm2), calculée à l’aide de l’algorithme suivant : RM = [Fiamains × exposition cutanée (mg) (calculée ci‑dessus)] / (SAH × 2) Fiamains : 0,15 (sans unités), fraction de l’ingrédient actif trouvée sur les mains par rapport au total des résidus sur la surface, selon l’étude sur la gymnastique jazz SM : 150 cm2, aire typique d’une main FM : 0,13 (sans unités), fraction de la main pénétrant dans la bouche par événement TE : 2 h, temps d’exposition par jour N_répét : 4, nombre d’intervalles de renouvellement à l’heure ES : 0,48, facteur d’extraction dans la salive Freq_mb : 20, nombre de contacts main-bouche à l’heure Inhalation : Concentration dans l’air découlant de l’application de nettoyant à planchers (voir les paramètres plus haut) Exposition combinée : cutanée + orale + inhalation |
| Nettoyeur automatique de cuvette de toilettes (scénario de pain attaché au rebord dans ConsExpo) (adulte) |
Concentration d’essence de pin : 10 % (MSDS 2008) Cutanée, l’exposition devrait être minime Inhalation — exposition à la vapeur, modèle d’émission instantanée Durée de l’exposition : 50 min Pain solide sur le rebord : 0,21 g Volume de la pièce : 2,5 m3 Ventilation : 0/h |
| Ingrédient non médicinal dans les produits de santé naturels (adulte, adolescent) |
Quantité d’essence de pin : 20 mg par 5 mL (une cuiller à thé) Exposition quotidienne (adulte) : (20 mg/cuiller à thé × 2 cuillers à thé/dose × 5 doses/jour) ÷ masse corporelle (70,9 kg (adulte) ou 59,4 kg (adolescent)) = 2,82 mg/kg p.c./j (adulte), 3,37 mg/kg p.c./j (adolescent) |
*L’exposition aux produits a été estimée à l’aide de ConsExpo Web (2016). Les estimations de l’exposition ont été calculées à partir des masses corporelles et taux d’inhalation par défaut de 70,9 kg/16,2 m3/j, 59,4 kg/15,8 m3/j, 31 kg/14,5 m3/j, 15,5 kg/9,3 m3/j, et 7,5 kg/2,1 m3/j pour les adultes (20 ans et plus), adolescents (12 à 19 ans), enfants (5 à 11 ans), bambins (6 mois à 4 ans) et bébés (0 à 6 mois), respectivement (Santé Canada 1998). Sauf indication contraire, les valeurs par défaut proviennent de la fiche d’information pertinente de ConsExpo pour le scénario présenté.
