Évaluation - Groupe des benzotriazoles et des benzothiazoles
Titre officiel : Évaluation - Groupe des benzotriazoles et des benzothiazoles
Environnement et Changement climatique Canada
Santé Canada
Mars 2025
No de cat. : En84-391/2024F-PDF
ISBN : 978-0-660-72466-9
Résumé
En vertu de l’article 68 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), le ministres de l’Environnement et le ministre de la Santé ont réalisé une évaluation de 15 substances collectivement appelées ci-après « Groupe des benzotriazoles et des benzothiazoles ». Leurs numéros au registre du Chemical Abstracts Service (no CASFootnote 1 ), leurs noms sur la Liste intérieure des substances (LIS), leurs noms communs et abréviations courantes, ainsi que le sous-groupe (benzotriazoles ou benzothiazoles) auquel elles appartiennent, sont présentés dans les tableaux ci-dessous.
| No CAS | Nom dans la LIS | Abréviation ou nom commun |
|---|---|---|
| 95-14-7 | Benzotriazole | Benzotriazole |
| 3147-75-9 | 2-(2H-Benzotriazol-2-yl)-4-(1,1,3,3-tétraméthylbutyl)phénol | UV-329 |
| 3846-71-7 | 2-Benzotriazol-2-yl-4,6-di-tert-butylphénol | UV-320 |
| 3896-11-5 | Bumétrizole | UV-326 |
| 29385-43-1a | Méthyl-1H-benzotriazole | Tolyltriazole |
| 36437-37-3 | 2-(2H-Benzotriazol-2-yl)-4-(tert-butyl)-6-(sec-butyl)phénol | UV-350 |
| 70321-86-7 | 2-(2H-Benzotriazol-2-yl)-4,6-bis(1-méthyl-1-phényléthyl)phénol | UV-234 |
| 80595-74-0 | N,N-Bis(2-éthylhexyl)-5-méthyl-benzotriazole-1-méthylamine | ND |
| 94270-86-7a | N,N-Bis(2-éthylhexyl)-ar-méthyl-benzotriazole-1-méthanamine | ND |
Abréviations : ND = non disponible.
a La substance associée à ce numéro de registre CAS est un « UVCB » (substances de composition inconnue ou variable, produits de réaction complexes ou matières biologiques).
| No CAS | Nom dans la LIS | Abréviation ou nom commun |
|---|---|---|
| 95-31-8 | N-tert-Butylbenzothiazole-2-sulfénamide | TBBS |
| 95-33-0 | N-Cyclohexylbenzothiazole-2-sulfénamide | CBS |
| 120-78-5 | Disulfure de di(benzothiazol-2-yle) | MBTS |
| 149-30-4 | Benzothiazole-2-thiol | MBT |
| 2492-26-4 | Sulfure de sodium et de benzothiazol-2-yle | SMBT |
| 4979-32-2 | N,N-Dicyclohexylbenzothiazole-2-sulfénamide | DCBS |
Les substances du sous-groupe des benzotriazoles ne devraient pas être présentes à l’état naturel, tandis que les substances du sous-groupe des benzothiazoles devraient être rarement présentes à l’état naturel. Les substances des 2 sous-groupes sont utilisées dans diverses applications. Selon les renseignements fournis en réponse à une enquête menée en vertu de l’article 71 de la LCPE, le tolyltriazole a été la seule substance fabriquée au Canada en 2015 en quantités supérieures au seuil de déclaration de 100 kg, et en une quantité comprise entre 1 000 kg et 10 000 kg. Deux substances, l’UV-320 et le no CAS 80595-74-0, n’ont pas été importées en quantités supérieures à 100 kg, tandis que les autres substances du groupe des benzotriazoles et des benzothiazoles ont été importées au Canada en quantités totales, pour chaque substance, variant de 100 à 10 000 000 kg, d’après les données présentées pour 2014 ou 2015. Les substances du sous-groupe des benzotriazoles sont utilisées dans divers produits, notamment les cosmétiques, les emballages alimentaires et les lubrifiants et les graisses. Certaines de ces substances sont utilisées comme stabilisateurs de la lumière ultraviolet et inhibiteurs de corrosion. Les substances du sous-groupe des benzothiazoles sont utilisées dans les produits automobiles, les produits en caoutchouc, les lubrifiants et les graisses et l’industrie minière. Le TBBS, le CBS, le MBTS, le MBT et le DCBS sont souvent utilisés comme accélérateurs pour la vulcanisation du caoutchouc, et le SMBT est utilisé comme inhibiteur de corrosion.
Les risques pour l’environnement associés aux substances du groupe des benzotriazoles ont été caractérisés à l’aide de la Classification du risque écologique (CRE) des substances organiques, laquelle est une méthode fondée sur le risque qui tient compte de plusieurs paramètres liés au danger et à l’exposition, assortie d’une pondération des multiples éléments de preuve. Les profils des dangers reposent principalement sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne établis dans le réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Parmi les paramètres pris en compte pour les profils d’exposition, mentionnons le taux d’émission potentiel, la persistance globale et le potentiel de transport à grande distance. Une matrice de risque est utilisée pour attribuer aux substances un degré de préoccupation potentielle faible, moyen ou élevé, selon leurs profils de danger et d’exposition. D’après les résultats de l’analyse de la CRE, les substances du sous-groupe des benzotriazoles sont considérées comme étant peu susceptibles de causer des dommages à l’environnement.
Toutes les substances du sous-groupe des benzothiazoles contiennent toutes le groupement MBT (2-mercaptobenzothiazole). Il s’avère que ce groupement est la principale partie des molécules de ce sous-groupe qui peut être rejetée dans l’environnement au Canada, soit par utilisation et rejet directs du MBT, soit par rejet indirect découlant de la dégradation des composés d’origine. Les précurseurs du MBT sont considérés comme des substances qui contiennent un groupement MBT et qui peuvent se dégrader en MBT par transformation (par exemple, par hydrolyse, réaction d’oxydoréduction, digestion ou métabolisation) dans des conditions environnementales, industrielles ou pertinentes sur le plan physiologique. Par conséquent, l’évaluation du sous-groupe des benzothiazoles tient compte du MBT et de toutes les substances qui sont des précurseurs de celui-ci (ces substances étant dénommées ci-après « MBT et ses précurseurs »). Dans la présente évaluation, le potentiel de causer des effets cumulatifs a été examiné, en fonction de l’exposition cumulative aux substances de la grande classe des benzothiazoles qui sont des précurseurs du MBT. En cas d’exposition à l’eau, les composés d’origine devraient se dégrader en MBT qui restera en grande partie dans l’eau étant donné sa solubilité. Toutefois, la sorption aux particules est possible. Dans ce cas, on s’attend à ce que les substances sorbées puissent se déposer dans les sédiments.
Les secteurs prédominants pour lesquels des rejets dans l’eau peuvent se produire comprennent le secteur de la fabrication des pneus et d’autres produits en caoutchouc, l’utilisation des substances dans les fluides de travail des métaux et certains sous-secteurs de l’industrie minière. L’épandage de biosolides peut également entraîner des rejets dans les milieux terrestres.
Les données expérimentales sur la toxicité indiquent que le MBT peut être nocif pour les organismes aquatiques à de faibles concentrations. Le MBT devrait être persistant, mais son potentiel de bioaccumulation est faible. Des analyses du quotient de risque ont été effectuées pour comparer les concentrations estimées en milieu aquatique aux concentrations causant des effets nocifs chez les organismes aquatiques selon différents scénarios d’exposition. Les scénarios d’exposition pour la fabrication des pneus et d’autres produits en caoutchouc, l’utilisation dans les lubrifiants et l’utilisation dans certains sous-secteurs miniers indiquent que le MBT présente un risque pour les organismes aquatiques. Les scénarios comportant des rejets dans le sol n’indiquent aucun risque.
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation, les substances du sous-groupe des benzotriazoles présentent un faible risque d’effets nocifs pour l’environnement. Il a été conclu que les substances du sous-groupe des benzotriazoles ne satisfont pas aux critères énoncés aux alinéas 64a) et b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation, le MBT et ses précurseurs présentent un risque d’effets nocifs pour l’environnement. Il a été conclu que le MBT et ses précurseurs, y compris les substances du sous-groupe des benzothiazoles, satisfont aux critères énoncés à l’alinéa 64a) de la LCPE, car ils pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique. Toutefois, il a été conclu que les substances du sous-groupe des benzothiazoles ne satisfont pas au critère énoncé à l’alinéa 64b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à mettre en danger l’environnement essentiel pour la vie.
En ce qui concerne le volet de la santé humaine, l’UV-350 a été évalué selon l’approche fondée sur le seuil de préoccupation toxicologique (SPT), qui est basée sur le danger que peuvent présenter des structures chimiques similaires, ainsi que sur les données de génotoxicité propres à chaque produit chimique, lorsque ces renseignements sont disponibles. L’exposition estimée pour l’UV-350 était plus faible que la valeur SPT, ce qui indique un faible risque pour la santé humaine. Par conséquent, l’UV-350 est considéré comme étant peu préoccupant pour la santé humaine aux niveaux actuels d’exposition.
Pour le sous-groupe des benzotriazoles, les effets préoccupants du benzotriazole et du tolyltriazole pour la santé, basés en grande partie sur les effets sur la santé associés au benzotriazole, comprennent les effets sur les reins, le foie, l’utérus, la prostate, les ganglions lymphatiques et la moelle osseuse, ainsi que sur la cancérogénicité. Pour le tolyltriazole, les autres effets préoccupants comprennent les modifications des paramètres sanguins. Comme la base de données sur les effets de l’UV-329 sur la santé était limitée, les effets critiques de cette substance sur la santé ont été établis d’après les effets sur la santé associés à l’UV-320, une substance de structure apparentée. Ces effets touchaient surtout le foie. Pour l’UV-326, les effets préoccupants sur la santé sont des effets systémiques. Les principaux effets préoccupants de l’UV-234 sur la santé sont des effets hépatiques. En l’absence de données sur les effets sur la santé propres au n° CAS 80595-74-0, ces effets ont été considérés comme étant les mêmes que ceux qui ont été établis pour la substance de structure apparentée ayant le n° CAS 94270-86-7, qui comprennent des effets sur le développement, des effets systémiques et des effets sur le thymus, les tissus lymphoïdes et la rate.
La population générale au Canada peut être exposée à certaines substances du sous-groupe des benzotriazoles par les milieux environnementaux, comme l’eau potable et l’air intérieur, la consommation de certains poissons et fruits de mer ainsi que du lait maternel et l’utilisation de produits disponibles aux consommateurs, tels que les cosmétiques (par exemple les produits pour les ongles, les rouges à lèvres, le fard à joues et le savon), les stylos à encre et les produits automobiles (par exemple les lubrifiants, les produits pour la réparation du système de refroidissement et la peinture protectrice amovible pour automobile). L’exposition de la population générale au Canada au n° CAS 94270-86-7 devrait être semblable à celle qui est associée au n° CAS 80595-74-0, en raison de sa structure chimique et des utilisations répertoriées. La comparaison des concentrations auxquelles des effets critiques sur la santé se produisent (ou en leur absence, la dose maximale d’essai dans les principales études) et des concentrations auxquelles la population générale peut être exposée a permis d’établir des marges qui sont jugées adéquates pour tenir compte des incertitudes dans les bases de données sur les effets sur la santé et l’exposition au benzotriazole, à l’UV-329, à l’UV-326, au tolyltriazole, à l’UV-234, au n° CAS 80595-74-0 et au n° CAS 94270-86-7.
Pour le sous-groupe des benzothiazoles, l’effet préoccupant du MBT sur la santé est le cancer de la vessie, selon la classification du Centre international de recherche sur le cancer (CIRC), qui considère le MBT comme un cancérogène du groupe 2A (« probablement cancérogène pour l’humain »). En l’absence de données sur la cancérogénicité propres aux substances TBBS, CBS, MBTS, SMBT et DCBS, les effets de la substance de structure apparentée qu’est le MBT ont été utilisés pour éclairer les évaluations des risques de cancer. En ce qui concerne les effets non cancérogènes, l’effet préoccupant pour la santé est l’effet sur les reins dans le cas du CBS, et les variations du poids du foie dans le cas du MBT et du SMBT. En raison du nombre limité de données qui sont propres au MBTS, on s’est appuyé sur celles du MBT et du SMBT, de structures similaires, pour déterminer les effets critiques sur la santé.
L’exposition potentielle de la population générale au Canada au sous-groupe des benzothiazoles a été estimée d’après les concentrations potentielles de ces substances dans l’eau potable, l’apport alimentaire de certains poissons et fruits de mer, et les produits disponibles aux consommateurs, comme les granulés de caoutchouc utilisés sur le gazon synthétique et les lubrifiants automobiles. La comparaison entre les concentrations entraînant un effet critique et les concentrations d’exposition estimatives au TBBS, CBS, MBTS, MBT, SMBT et DCBS a permis d’établir que les marges sont suffisantes pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé. Dans la présente évaluation, on a déterminé le potentiel d’accumulation des effets en examinant l’exposition cumulative par les voies orale et cutanée à un sous-ensemble du sous-groupe des benzothiazoles (c’est-à-dire le MBT, le MBTS et le CBS) qui peuvent être présents en même temps dans les granulés de caoutchouc. Le risque cumulatif de cancer qui en résulte est jugé faible.
Pour l’évaluation des risques pour la santé humaine, on a pris en compte les groupes de personnes au sein de la population canadienne qui, en raison d’une plus grande sensibilité ou d’une plus grande exposition, peuvent être plus vulnérables aux effets nocifs dus à l’exposition à des substances. Le potentiel de sensibilisation au cours de la période de reproduction et de développement a été évalué. Les expositions ont été systématiquement évaluées en fonction de l’âge afin de tenir compte des différences physiques et comportementales aux différents âges. Les jeunes enfants (c’est-à-dire âgés de 1 an) devraient être plus exposés à l’air ambiant que les adultes. Tous ces sous-groupes de la population ont été pris en compte lors de l’évaluation des effets nocifs potentiels pour la santé humaine.
À la lumière des renseignements contenus dans la présente évaluation, il a été conclu que le benzotriazole, UV-329, UV-320, UV-326, tolyltriazole, UV-350, UV-234, n° CAS 80595-74-0, n° CAS 94270-86-7, TBBS, CBS, MBTS, MBT, SMBT et DCBS ne satisfont pas au critère de l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou une concentration ou des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il a été conclu que les 9 substances du sous-groupe des benzotriazoles ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE, et que le MBT et ses précurseurs, y compris les 6 substances du sous-groupe des benzothiazoles, satisfont à un ou plusieurs des critères énoncés à l’article 64 de la LCPE.
Il a également été établi que certaines substances du groupe du MBT et de ses précurseurs répondent aux critères de persistance, mais que le MBT et ses précurseurs ne répondent pas aux critères de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation pris en vertu de la LCPE.
1. Introduction
En vertu de l’article 68 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE) (Canada 1999), les ministres de l’Environnement et de la Santé ont évalué 15 substances collectivement appelées ci‑après « Groupe des benzotriazoles et des benzothiazoles », afin de déterminer si elles présentent ou peuvent présenter un risque pour l’environnement ou la santé humaine. Dix de ces quinze substances ont été jugées prioritaires aux fins de l’évaluation, car elles répondent aux critères de catégorisation décrits dans ECCC et SC (modifié en 2017). De plus, une substance a été jugée prioritaire par d’autres mécanismes. Les 4 autres substances (TBBS, CBS, benzotriazole et UV‑320) ont été incluses dans la présente évaluation, car elles ont été jugées prioritaires dans le cadre de la Détermination des priorités en matière d’évaluation des risques (ECCC et SC 2016a; Environnement Canada, Santé Canada 2014).
Les 2 autres substances incluses dans le groupe des benzotriazoles et des benzothiazoles au début de la troisième phase du Plan de gestion des produits chimiques (PGPC) (no CAS 21564‑17‑0, thiocyanate de (2‑benzothiazol‑2‑ylthio)méthyle; no CAS 80584‑90‑3, N,N‑bis(2‑éthylhexyl)‑4‑méthyl‑1H‑benzotriazole‑1‑méthylamine) ont été prises en compte dans le Document sur l’approche scientifique : Classification du risque écologique des substances organiques (CRE) (ECCC 2016a) et dans le Document sur l’approche scientifique : Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances (Santé Canada 2016) ou dans l’approche utilisée pour l’Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée (ECCC et SC 2018a) et on les a jugées peu préoccupantes pour la santé humaine et l’environnement. Les conclusions pour ces 2 substances sont présentées dans l’Évaluation préalable des substances jugées comme étant peu préoccupantes au moyen de l’approche de la Classification du risque écologique des substances organiques et de l’approche fondée sur le seuil de préoccupation toxicologique (ECCC et SC 2018b) et l’Évaluation rapide des substances auxquelles l’exposition de la population générale est limitée (ECCC et SC 2018a). Ces 2 substances ne sont pas traitées plus avant dans le présent rapport, même si le n° CAS 21564‑17‑0 est considéré dans l’évaluation des risques pour l’environnement comme étant un précurseur potentiel du 2‑mercaptobenzothiazole (MBT). Les 15 substances examinées dans la présente évaluation sont collectivement appelées ci‑après « Groupe des benzotriazoles et des benzothiazoles ». Aux fins de la présente évaluation, le groupe des benzotriazoles et des benzothiazoles est composé de 2 groupes chimiquement distincts, le sous‑groupe des benzotriazoles et le sous‑groupe des benzothiazoles. Par conséquent, la présente évaluation est divisée en 2 chapitres.
Les risques que représentent les 9 benzotriazoles pour l’environnement ont été caractérisés selon l’approche de la CRE (ECCC 2016a).
L’UV‑350, qui fait partie du sous‑groupe des benzotriazoles, a été inclus dans le Document sur l’approche scientifique : Approche fondée sur le seuil de préoccupation toxicologique pour certaines substances (Santé Canada 2016). Dans cette approche, Santé Canada a utilisé un arbre de décision fondé sur la structure et les données de génotoxicité propres à la substance chimique (par exemple, test d’Ames), pour attribuer une valeur seuil à l’exposition humaine à un produit chimique, valeur sous laquelle la probabilité qu’il y ait un risque pour la santé humaine est faible (cette valeur est le SPT). Pour chaque substance visée par l’approche fondée sur le SPT, l’exposition potentielle de la population générale au Canada a été caractérisée et comparée au SPT attribué à la substance. L’UV‑350 a été associé à une exposition inférieure au SPT qui lui a été attribuée. Par conséquent, cette substance est jugée peu préoccupante pour la santé humaine aux niveaux actuels d’exposition.
Certaines des substances du groupe des benzotriazoles et des benzothiazoles ont été examinées ailleurs dans le monde, notamment par le Programme coopératif d’évaluation des produits chimiques de l’Organisation de coopération et de développement économiques (OCDE), le Centre international de recherche sur le cancer (CIRC), l’Agence européenne des produits chimiques (ECHA), l’Agence danoise de protection de l’environnement (Danish EPA) et l’Environnemental Protection Agency des États‑Unis (US EPA). Ces évaluations ont fait l’objet d’un examen rigoureux et sont considérées comme fiables. Environnement et Changement climatique Canada et Santé Canada ont examiné partiellement une substance du sous‑groupe des benzotriazoles afin de mieux comprendre les effets sur la santé d’une substance de structure apparentée, en l’occurrence le BDTPNote de bas de page 2, dans une évaluation préalable (ECCC, SC 2016b). Ces évaluations ont été utilisées pour contribuer à la caractérisation des effets sur la santé de certaines substances dans la présente évaluation.
Dans la présente évaluation, on examine les données sur les propriétés chimiques, le devenir environnemental, les dangers, les utilisations et les expositions, ainsi que d’autres renseignements présentés par les intervenants. Les données pertinentes ont été relevées jusqu’en septembre 2021, et des recherches ciblées dans la littérature scientifique ont été menées jusqu’en juin 2019. Les conclusions s’appuient sur des données empiriques tirées d’études clés et sur des résultats obtenus par modélisation. Lorsqu’ils étaient disponibles et pertinents, les renseignements contenus dans les évaluations effectuées par d’autres instances ont été utilisés.
La présente évaluation a été préparée par le personnel des programmes d’évaluation des risques de la LCPE travaillant à Santé Canada et Environnement et Changement climatique Canada. Elle tient compte des renseignements fournis par d’autres programmes de ces ministères. Les parties de la présente évaluation qui portent sur l’environnement et la santé humaine ont fait l’objet d’un examen ou de consultations externes. Des commentaires sur les parties techniques concernant l’environnement ont été reçus de l’Agence allemande pour l’environnement (Umweltbundesamt), de M. James Armitage (AES Armitage Environmental Sciences, Inc.) et de Mme Connie Gaudet. Des commentaires sur les parties techniques concernant la santé humaine ont été reçus de M. Silvia Díaz‑Cruz, Y.S. Liu et K. Kannan (Risk Sciences International). La partie sur l’environnement traitant de l’évaluation du sous‑groupe des benzotriazoles est basée sur le document sur la CRE (publié le 30 juillet 2016), qui a fait l’objet d’un examen à l’externe et d’une période de consultation publique de 60 jours. De plus, l’ébauche du présent rapport d’évaluation (publiée le 6 mars 2021) a fait l’objet d’une période de consultation publique de 60 jours. Même si les commentaires externes ont été pris en compte, le contenu final et les résultats de l’évaluation demeurent la responsabilité de Santé Canada et d’Environnement et Changement climatique Canada.
Les évaluations reposent principalement sur les renseignements essentiels pour déterminer si les substances répondent aux critères énoncés à l’article 64 de la LCPE en tenant compte des données scientifiques, y compris, le cas échéant, les renseignements sur les sous‑groupes de la population pouvant être plus sensibles ou plus exposés, sur les milieux vulnérables et sur les effets cumulatifsNote de bas de page 3. L’évaluation s’appuie également sur le poids de la preuve et le principe de précautionNote de bas de page 4. Dans les pages qui suivent, nous exposerons ces renseignements essentiels et les facteurs sur lesquels les conclusions sont fondées.
2. Benzotriazoles
2.1 Identité des substances
Les numéros CAS, les noms sur la Liste intérieure des substances (LIS) et les noms communs (ou abréviations) des différents benzotriazoles du sous‑groupe des benzotriazoles sont présentés dans le tableau 2‑1.
| No CAS | Nom dans la LIS (nom commun ou abréviation) |
Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 95-14-7 | Benzotriazole (Benzotriazole) | ![c12c(nn[nH]1)cccc2](/content/dam/eccc/images/pded/benzotriazoles-benzothiazoles/20210126-t21a.jpg) C6H5N3 |
119,13 |
| 3147-75-9 | 2-(2H-Benzotriazol-2-yl)-4-(1,1,3,3-tétraméthylbutyl)phénol (UV-329) | 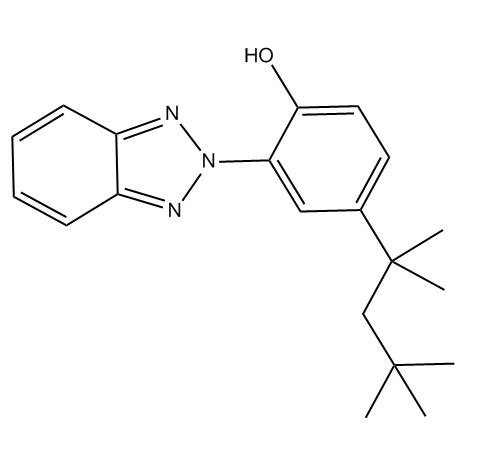 C20H25N3O |
323,43 |
| 3846-71-7 | 2-Benzotriazol-2-yl-4,6-di-tert-butylphénol (UV-320) |
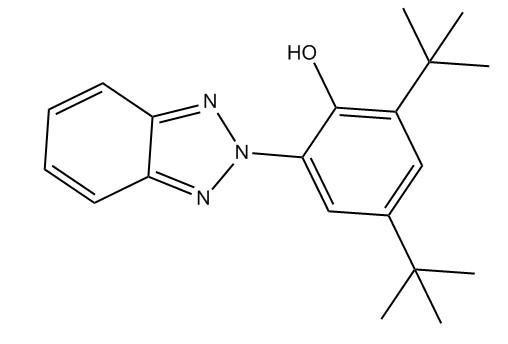 C20H25N3O |
323,43 |
| 3896-11-5 | Bumétrizole (UV-326) |
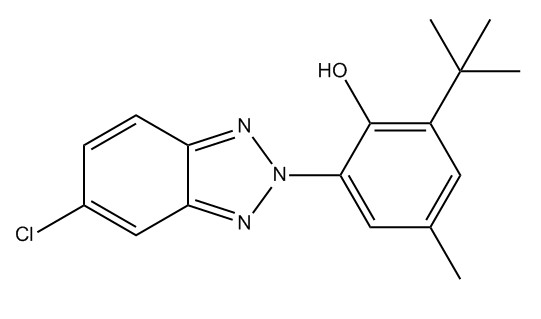 C17H18ClN3O |
315,80 |
| 29385-43-1a | Méthyl‑1H‑benzotriazole (Tolyltriazole) |
![c1cc2c(cc1)[nH]nn2.[*]C](/content/dam/eccc/images/pded/benzotriazoles-benzothiazoles/20210126-t21e.jpg) C7H7N3 |
133,15 |
| 36437-37-3 | 2‑(2H‑Benzotriazol‑2‑yl)‑4‑(tert‑butyl)‑6‑(sec‑butyl)phénol (UV-350) |
C](/content/dam/eccc/images/pded/benzotriazoles-benzothiazoles/20210126-t21f.jpg) C20H25N3O |
323,44 |
| 70321-86-7 | 2‑(2H‑Benzotriazol‑2‑yl)‑4,6‑bis(1‑méthyl‑1‑phényléthyl)phénol (UV-234) |
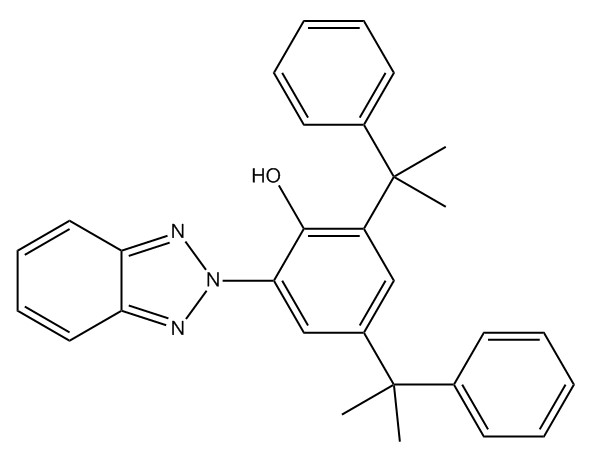 C30H29N3O |
447,58 |
| 80595-74-0 | N,N‑Bis(2‑éthylhexyl)‑5‑méthyl‑benzotriazole‑1‑méthylamine | 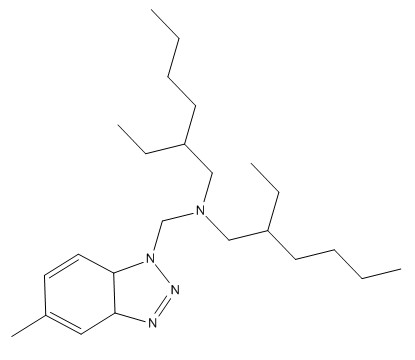 C24H42N4 |
386,63 |
| 94270‑86‑7b | N,N‑Bis(2‑éthylhexyl)‑ar‑méthyl‑benzotriazole‑1‑méthanamine | 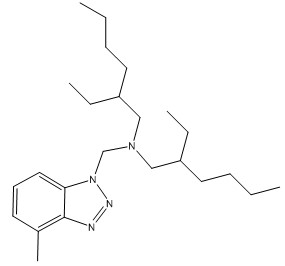 C24H42N4 |
386,63 |
a Mélange commercial de 4‑méthylbenzotriazole et de 5‑méthylbenzotriazole.
b Mélange de N,N‑bis(2‑éthylhexyl)‑4‑méthyl‑1H‑benzotriazole‑1‑méthylamine, de N,N‑bis(2‑éthylhexyl)‑5‑méthyl‑benzotriazole‑1‑méthylamine, de N,N‑bis(2‑éthylhexyl)‑6‑méthyl‑benzotriazole‑1‑méthylamine et de N,N‑bis(2‑éthylhexyl)‑7‑méthyl‑benzotriazole‑1‑méthylamine.
2.1.1 Choix des analogues et utilisation de modèles QSAR
Une méthode d’extrapolation faisant appel à des données d’analogues et aux résultats des modèles de relations (quantitatives) structure‑activité (QSAR), le cas échéant, a été utilisée pour éclairer l’évaluation relative à la santé humaine. On a sélectionné des analogues qui étaient similaires sur le plan structurel ou fonctionnel aux substances de ce sous‑groupe (propriétés physico‑chimiques et toxicocinétiques similaires), et pour lesquelles on disposait de données empiriques pouvant être utilisées pour effectuer une lecture croisée avec des substances pour lesquelles les données empiriques étaient limitées. Ainsi, on a déterminé l’applicabilité des modèles QSAR au cas par cas. Les détails des données de lecture croisée et des modèles QSAR choisis pour éclairer l’évaluation des effets du sous‑groupe des benzotriazoles sur l’environnement et la santé humaine sont traités plus à fond dans les sections pertinentes du rapport et à l’annexe A.
La plupart des analogues auxquels nous avons eu recours pour évaluer les substances du sous‑groupe des benzotriazoles sont des substances déjà incluses dans ce sous‑groupe (c’est-à-dire le benzotriazole, l’UV‑320, l’UV‑326, l’UV‑350, l’UV‑234, le n° CAS 94270‑86‑7). Le tableau 2‑2 contient les renseignements sur l’identité et la structure chimique de l’analogue utilisé pour étayer la présente évaluation et qui ne fait pas partie du sous‑groupe des benzotriazoles.
| No CAS | Nom dans la LIS (nom courant) |
Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 2440‑22‑4 | 2‑(2H‑Benzotriazol‑2‑yl)-p‑crésol (Drométrizole) |
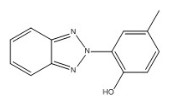 C13H11N3O |
225 |
2.2 Propriétés physiques et chimiques
Un résumé des propriétés physiques et chimiques des substances du sous‑groupe des benzotriazoles est présenté dans les tableaux 2‑3 et 2‑4. Quand les données expérimentales pour une propriété d’une substance étaient limitées ou absentes, on a utilisé la méthode de la lecture croisée avec les données provenant d’analogues, ou encore des modèles QSAR pour générer les valeurs prévues pour la substance. D’autres propriétés physico‑chimiques figurent dans ECCC (2016 b). À des fins de description des propriétés physico‑chimiques, les benzotriazoles ont été subdivisés en benzotriazoles phénoliques et non phénoliques. Les substances UV‑329, UV‑320, UV‑326, UV‑350 et UV‑234 sont toutes des benzotriazoles phénoliques (en d’autres mots, le fragment ‑OH est lié au cycle C6H5) et elles ont une structure chimique et des propriétés physico‑chimiques similaires, figurant dans le tableau 2‑3. Le tableau 2‑4 présente les données des propriétés physico‑chimiques pour les benzotriazoles non phénoliques.
| Propriété | Portée | Références clés |
|---|---|---|
| Point de fusion (°C) | 39,7 à 80 | ECHA c2007‑2019; GSBL 2018 |
| Pression de vapeur (Pa) | 4,14×10‑9 à 1,14×10‑6 | Médiane des modèles : MPBPWIN 2010; TEST 2016 |
| Constante de la loi d’Henry (Pa·m³/mol) | 1,37×10‑15 à 1,17×10‑13 | HENRYWIN 2008 |
| Solubilité dans l’eau (mg/L) | 4,55×10‑4 à 7×10‑3 | ECHA c2007‑2019; WATERNT 2010 |
| Log Koe (sans dimension) | 6,85 à 8,98 | KOWWIN, 2010 |
| Log Kco (sans dimension) | 4,95 à 6,39 | Médiane des modèles : KOCWIN 2010; ACD/Percepta c1997‑2012 |
| Log Koa (sans dimension) | 18,17 à 22,22 | KOAWIN, 2010 |
| pKa (sans dimension) | 10,2 à 10,3 | ACD/Percepta c1997‑2012 |
Abréviations : Koe = coefficient de partage octanol‑eau; Kco = coefficient de partage carbone organique‑eau; Koa = coefficient de partage octanol‑air; pKa = constante de dissociation des acides.
| Propriété | Portée | Références clés |
|---|---|---|
| Point de fusion (°C) | 76 à 196,31 | Danish EPA 2013; MPBPWIN 2010 |
| Pression de vapeur (Pa) | 4,34x10‑7 à 14 | ECHA c2007‑2018; MPBPWIN 2010 |
| Constante de la loi d’Henry (Pa·m³/mol) | 9,04×10‑8 à 1,62×10‑7 | HENRYWIN 2008 |
| Solubilité dans l’eau (mg/L) | 0,01175 à 19 800 | WSKOWWIN, 2010 |
| Log Koe (sans dimension) | 1,44 à 7,62 | KOWWIN, 2010 |
| Log Kco (sans dimension) | 1,724 à 5,849 | KOCWIN, 2010 |
| Log Koa (sans dimension) | 6,661 à 13,052 | KOAWIN, 2010 |
| pKa (sans dimension) | 6,7 à 8,7 | ACD/Percepta c1997‑2012; ECHA c2007‑2019 |
Abréviations : Koe = coefficient de partage octanol‑eau; Kco = coefficient de partage carbone organique‑eau; Koa = coefficient de partage octanol‑air; pKa = constante de dissociation des acides.
2.3 Sources et utilisations
es substances du sous‑groupe des benzotriazoles ne devraient pas être présentes dans la nature. Toutes les substances du sous‑groupe des benzotriazoles ont été visées par une enquête menée en vertu d’un avis émis conformément à l’article 71 de la LCPE (Canada 2017). Le tableau 2‑5 présente un résumé des renseignements fournis sur les quantités totales fabriquées et importées pour le sous‑groupe des benzotriazoles. Aucune activité de fabrication ou d’importation n’a été déclarée pour l’UV‑320 ou le n° CAS 80595‑74‑0 au‑dessus du seuil de déclaration de 100 kg. Aucune activité de fabrication ou d’importation n’a été déclarée pour l’UV‑320 ou le no CAS 80595‑74‑0 au‑delà du seuil de déclaration de 100 kg.
| Substance | Quantité totale fabriquée (kg) | Quantité totale importée (kg) | Année de déclaration |
|---|---|---|---|
| Benzotriazole | N.R.b | 10 000 à 100 000 | 2014 ou 2015 c |
| UV‑329 | N.R.b | 1 000 à 10 000 | 2015 |
| UV‑326 | N.R.b | 100 à 1 000 | 2015 |
| Tolyltriazole | 1 000 à 10 000 | 10 000 à 100 000 | 2014 ou 2015 c |
| UV‑350 | N.R.b | 100 à 1 000 | 2015 |
| UV‑234 | N.R.b | 1 000 à 10 000 | 2015 |
| N° CAS 94270‑86‑7 | N.R.b | 10 000 à 100 000 | 2015 |
a Les valeurs reflètent les quantités déclarées en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Canada 2017). Voir l’enquête pour connaître les inclusions et exclusions particulières (annexes 2 et 3).
b N.R. = La substance indiquée n’a pas été fabriquée en une quantité supérieure au seuil de déclaration de 100 kg pour 2015.
c Les quantités totales importées qui sont indiquées pour cette substance comprennent les quantités déclarées pour 2014 par certaines entreprises et pour 2015 par d’autres entreprises.
Le tableau 2‑6 présente un résumé des principales utilisations des substances du sous‑groupe des benzotriazoles dans les produits commerciaux et dans les produits disponibles aux consommateurs au Canada, selon les renseignements fournis en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Canada 2017). D’autres utilisations ont été déclarées, mais il s’agit de renseignements commerciaux confidentiels. Ces autres utilisations, même si elles ne sont pas présentées ici, ont été prises en compte dans la présente évaluation des risques.
| Principales utilisationsa, b | Benzotriazole | UV‑329 | UV‑326 | Tolyltriazole | UV‑350 | UV‑234 | N° CAS 94270‑86‑7 |
|---|---|---|---|---|---|---|---|
| Déglaçage et antigel | N | N | N | O | N | N | N |
| Automobiles, aéronefs et transport | O | O | N | O | O | O | N |
| Matériaux de construction | N | O | N | N | O | N | N |
| Appareils électriques et électroniques | N | N | N | N | N | O | N |
| Lessive et lavage de la vaisselle | N | N | N | O | N | N | N |
| Entretien de la pelouse et du jardin | N | N | N | N | N | O | N |
| Lubrifiants et graisses | O | N | N | O | N | N | O |
| Peintures et revêtements | O | N | N | N | N | O | N |
| Lutte antiparasitaire | Oc | N | N | N | N | N | N |
| Matières plastiques | N | N | O | N | O | N | N |
| Traitement de l’eau | O | N | N | O | N | N | N |
| Autre | Od,e | N | N | Od | N | N | N |
Abréviations : O = oui, une utilisation a été déclarée pour cette substance, N = non, aucune utilisation n’a été déclarée pour cette substance, ou son utilisation est considérée comme un renseignement confidentiel.
a Utilisations non confidentielles déclarées en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Canada 2017). Voir l’enquête pour les inclusions et exclusions particulières (annexes 2 et 3).
b Aucune utilisation de l’UV‑320 et du 80595‑74‑0 en quantité supérieure au seuil de 100 kg n’a été déclarée.
c Substance utilisée comme produit de formulation dans les produits antiparasitaires (communication personnelle, courriels de l’Agence de réglementation de la lutte antiparasitaire (ARLA) de Santé Canada au Bureau d’évaluation des risques des substances existantes (BERSE) de Santé Canada, 2023; sans référence).
d Substance utilisée comme inhibiteur de corrosion dans les systèmes d’eau de refroidissement en circuit fermé, non utilisée dans des produits disponibles aux consommateurs.
e Substance utilisée dans des produits de nettoyage, non utilisée dans des produits disponibles aux consommateurs.
À la lumière des déclarations présentées à Santé Canada en vertu du Règlement sur les cosmétiques, certaines substances du sous‑groupe des benzotriazoles étaient présentes dans les cosmétiques, notamment les trousses de tatouage temporaire et les produits pour les ongles contenant du benzotriazole, des blocs de savon contenant de l’UV‑329 et les brillants à lèvres, les teintures pour les lèvres et les joues, et les produits pour les ongles contenant de l’UV‑326 (communication personnelle, courriels de la Direction de la Sécurité des produits de consommation et des produits dangereux, Santé Canada, au Bureau d’évaluation des risques des substances toxiques existantes (BERSE), Santé Canada, 2017, 2018; sans référence).
Trois substances du sous‑groupe des benzotriazoles figurent sur la liste des produits de formulation de l’Agence de réglementation de la lutte antiparasitaire (ARLA). Le benzotriazole, l’UV‑326 et l’UV‑329 sont présents dans les produits antiparasitaires actuellement homologués au Canada (communication personnelle, courriels de l’ARLA, de Santé Canada, au BERSE, de Santé Canada, 2023; sans référence).
Certaines substances du sous‑groupe des benzotriazoles peuvent être utilisées comme composants dans la fabrication de matériaux d’emballage alimentaire ou dans des additifs indirects utilisés dans les établissements de transformation des aliments. Elles pourraient entrer en contact direct avec des aliments (communication personnelle, courriels de la Direction des aliments, de Santé Canada, au BERSE, de Santé Canada, 2017, 2018; sans référence). Le benzotriazole peut être utilisé comme composant dans des adhésifs sans contact direct avec les aliments. En outre, le benzotriazole peut être utilisé comme composant dans des additifs destinés à des chaudières, des systèmes de refroidissement et des autoclaves, des lubrifiants, des nettoyants et des détartrants, sans contact direct avec les aliments, et en cas de contact avec des aliments, les surfaces en contact avec les aliments sont rincées à fond à l’eau potable après le traitement. L’UV‑329 peut également être utilisé comme stabilisateur UV dans certaines résines. L’UV‑326 peut être utilisé dans les polyoléfines pour les emballages alimentaires destinés à tout type d’aliment, sauf les aliments gras et les aliments contenant plus de 8 % d’alcool. Le tolyltriazole peut être utilisé comme composant dans certains lubrifiants employés dans la fabrication des boîtes de conserve pour aliments, où toute quantité résiduelle possible du lubrifiant est éliminée par lavage. En outre, le tolyltriazole peut servir de composant dans certains produits employés dans les systèmes d’eau, les nettoyants et les lubrifiants destinés à être utilisés sur des équipements ou des pièces de machine n’ayant pas de contact direct avec les aliments. L’UV‑234 peut être utilisé comme stabilisateur UV dans certaines résines et comme stabilisateur dans les bandes transporteuses en caoutchouc employées pour le transport des aliments. Les nos CAS 80595‑74‑0 et 94270‑86‑7 peuvent être utilisés comme composants de lubrifiants pouvant avoir un contact indirect avec les aliments.
Le benzotriazole figure dans la Base de données sur les ingrédients des produits de santé naturels (BDIPSN) et joue un rôle non médicinal en tant qu’agent de conservation antimicrobien à usage topique, mais il ne figure pas dans la Base de données sur les produits de santé naturels homologués (BDPSNH) comme substance présente dans des produits de santé naturels (PSN) actuellement homologués au Canada (BDPSNH [modifié en 2023]; BDIPSN [modifié en 2023]; communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance, de Santé Canada, au BERSE, de Santé Canada, 2018; sans référence). Le benzotriazole est utilisé comme ingrédient non médicinal dans divers désinfectants pour les instruments médicaux, dans les hôpitaux et les établissements alimentaires, et en milieu institutionnel et industriel (communication personnelle, courriel de la Direction des produits thérapeutiques, Santé Canada, au BERSE, Santé Canada, 2018; sans référence). Aucune utilisation en tant qu’ingrédients médicinaux ou non médicinaux dans les médicaments, y compris dans les produits de santé naturels, n’a été trouvée pour les autres substances du sous‑groupe des benzotriazoles au Canada (BDPSNH [modifié en 2018]; BDIPSN [modifié en 2019]; communication personnelle, courriels de la DPSNSO, Santé Canada, au BERSE, Santé Canada, 2017, 2018; sans référence; communication personnelle, courriels de la Direction des produits thérapeutiques, de Santé Canada, au BERSE, de Santé Canada, 2017, 2018; sans référence).
Ailleurs dans le monde, les substances du sous‑groupe des benzotriazoles peuvent être utilisées comme stabilisateurs de la lumière UV et inhibiteurs de corrosion. Elles peuvent également être présentes dans divers produits : produits de bricolage, peintures et revêtements, marqueurs et encres, textiles, produits en plastique, produits pour le lavage de la vaisselle et le nettoyage, produits automobiles et autres produits à usage industriel (par exemple, Danish EPA 2013; Rovira et Domingo 2019; Janna et al. 2011; Liu et al. 2017; Luongo et al. 2016; OCDE 2009a; US EPA 2009; US NTP 2011; Vetter et Lorenz 2013; SDS 2013, 2016a, 2016 b, 2017, 2018). Dans le cas de l’UV‑320, la Convention de Rotterdam a indiqué que la substance, répertoriée dans la catégorie des utilisations industrielles, est interdite de fabrication, d’importation et d’utilisation au Japon (Convention de Rotterdam 2008). Aucune utilisation de l’UV‑320 n’a été relevée au Canada.
2.4 Potentiel d’effets nocifs pour l’environnement
2.4.1 Caractérisation des risques pour l’environnement
Les risques associés aux 9 benzotriazoles pour l’environnement ont été caractérisés selon l’approche de la CRE (ECCC 2016a), qui est résumée à l’annexe B. L’approche CRE décrit le danger d’une substance à l’aide de paramètres clés, notamment le mode d’action toxique, la réactivité chimique, les seuils de toxicité internes établis d’après le réseau alimentaire, la biodisponibilité et l’activité chimique et biologique, et elle examine l’exposition possible des organismes dans les milieux aquatiques et terrestres selon divers facteurs, dont les taux d’émissions potentiels, la persistance globale et le potentiel de transport à grande distance dans l’air. Les différentes données probantes sont combinées afin de déterminer les substances qui requièrent une évaluation approfondie de leur potentiel d’effets nocifs pour l’environnement ou qui présentent une faible probabilité d’avoir de tels effets.
Les données essentielles et les données utilisées pour élaborer les profils spécifiques des substances du sous‑groupe des benzotriazoles, ainsi que les résultats de la classification des dangers, de l’exposition et des risques, sont présentées dans ECCC (2016 b).
| Nom sur la Liste intérieure des substances (abréviation) | Danger selon la classification CRE | Exposition selon la classification CRE | Risque selon la classification CRE |
|---|---|---|---|
| Benzotriazoleb (Benzotriazole) |
Faible | Faible | Faible |
| 2‑(2H‑Benzotriazol‑2‑yl)‑4‑(1,1,3,3‑tétraméthylbutyl)phénol (UV‑329) |
Élevé | Faible | Modéré |
| 2‑Benzotriazol‑2‑yl‑4,6‑di‑tert‑butylphénol (UV‑320) |
Élevé | Faiblea | Modéré |
| Bumétrizole (UV‑326) |
Élevé | Faible | Modéré |
| Méthyl‑1H‑benzotriazole (Tolyltriazole) |
Faible | Faible | Faible |
| 2‑(2H‑Benzotriazol‑2‑yl)‑4‑(tert‑butyl)‑6‑(sec‑butyl)phénol (UV‑350) |
Élevé | Faible | Modéré |
| 2‑(2H‑Benzotriazol‑2‑yl)‑4,6‑bis(1‑méthyl‑1‑phényléthyl)phénol (UV‑234) |
Élevé | Faible | Modéré |
| N,N‑Bis(2‑éthylhexyl)‑5‑méthyl‑benzotriazole‑1‑méthylamine | Élevé | Faible | Faible |
| N,N‑Bis(2‑éthylhexyl)‑ar‑méthyl‑benzotriazole‑1‑méthanamineb | Faible | Faible | Faible |
Abréviations : CRE = Classification du risque écologique.
a Selon la CRE (ECCC 2016a), le potentiel d’exposition à cette substance a été jugé modéré. Le présent rapport comprend une mise à jour de l’évaluation selon la CRE.
b Selon la CRE, substance classée au niveau faible par analogie avec le méthyl‑benzotriazole.
D’après les renseignements examinés selon l’approche CRE, 6 substances du sous‑groupe des benzotriazoles ont été classées comme présentant un potentiel de danger élevé, en raison d’une concordance entre le mode d’action réactif et le ratio de toxicité élevé, ces 2 valeurs indiquant que ces substances chimiques sont probablement très puissantes. Le profil établi pour ces substances indique qu’elles présentent un risque élevé de provoquer des effets nocifs dans les réseaux alimentaires aquatiques, étant donné leur potentiel de bioaccumulation. Ces substances ont été classées comme présentant un risque écologique faible ou modéré. Cependant, la classification des risques a été ramenée à « risque écologique faible » à la suite de l’ajustement de la classification des risques en fonction des quantités utilisées actuellement (voir la section 7.1.1 de l’Approche de la CRE [ECCC 2016a]). Les effets potentiels et la manière dont ils peuvent se manifester dans l’environnement n’ont pas été étudiés plus avant en raison de la faible exposition à ces substances. D’après les modes d’utilisation actuels, il est peu probable que ces substances soient préoccupantes dans l’environnement au Canada.
Comme les 3 autres substances présentent un faible danger et une faible exposition selon les renseignements examinés dans le cadre de la CRE, elles ont été classées comme présentant un faible risque écologique. Il est donc peu probable que ces substances soient préoccupantes pour l’environnement au Canada.
2.5 Potentiel d’effets nocifs pour la santé humaine
L’UV‑350 a été inclus dans le document Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances (Santé Canada 2016). Selon cette approche, on a utilisé un arbre de décision qui tient compte des caractéristiques de la structure chimique et des données de génotoxicité propres à la substance (par exemple, par un test d’Ames), lorsqu’elles étaient disponibles, pour attribuer une valeur seuil pour l’exposition humaine à un produit chimique, seuil sous lequel la probabilité de présenter un risque pour la santé humaine est faible (cette valeur est le SPT). Nous avons utilisé les représentations structurales des substances pour calculer les valeurs du SPT. Les substances ont été examinées en fonction des critères d’exclusion. Ensuite, pour chaque substance évaluée selon l’approche du SPT, des estimations prudentes de l’exposition ont été générées. Les expositions environnementales ont été estimées d’après les rejets potentiels dans l’environnement dus aux activités commerciales. L’exposition a été estimée pour les substances pouvant être utilisées dans les produits disponibles aux consommateurs, comme les ingrédients de parfumerie dans les cosmétiques, dans les lubrifiants, les adhésifs et les aliments (par exemple, les substances utilisées dans la fabrication des matériaux d’emballage alimentaire ou des additifs indirects). Pour chaque substance, l’exposition estimée a été comparée au SPT qui lui a été attribué et lorsque ce SPT était inférieur à l’exposition estimée, elle a été jugée peu préoccupante pour la santé humaine, compte tenu des concentrations actuelles d’exposition. Les résultats de l’approche basée sur le SPT pour l’UV‑350 sont présentés dans le tableau 2‑8. Des renseignements supplémentaires concernant les données et les éléments utilisés dans l’approche basée sur le SPT sont présentés dans le document sur l’approche scientifique (Santé Canada 2016).
| Substance | Valeur du SPT (µg/kg p.c./j) | Estimation de l’absorption dans l’environnement (µg/kg p.c./j) | Exposition estimée d’après l’utilisation de produits disponibles aux consommateurs (µg/kg p.c./j) |
|---|---|---|---|
| UV‑350 | 1,5 | 1,21 × 10‑3 | Non prévue |
À la lumière de ces résultats, l’UV‑350 a été jugé peu préoccupant pour la santé humaine aux niveaux actuels d’exposition.
2.5.1 Évaluation de l’exposition
La présente section décrit l’exposition potentielle aux substances du sous‑groupe des benzotriazoles par les milieux naturels, les aliments et les produits disponibles aux consommateurs. Pour caractériser le risque posé par chaque substance, nous avons choisi les scénarios donnant lieu aux expositions les plus élevées. Des renseignements supplémentaires concernant les scénarios d’exposition sont résumés dans les annexes C, D et F.
Milieux environnementaux
L’exposition de la population générale au Canada au n° CAS 80595‑74‑0 et à l’UV‑320 dans les milieux naturels n’est pas prévue, car aucune activité de fabrication ou d’importation de ces substances n’a été déclarée au‑delà du seuil de déclaration, selon les renseignements fournis en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Canada 2017), et aucune concentration mesurée de ces substances dans les milieux naturels au Canada ou ailleurs n’a été relevée.
Air
À l’exception du benzotriazole et du tolyltriazole, les substances du sous‑groupe des benzotriazoles ont une faible pression de vapeur, et on n’a trouvé aucune donnée sur les concentrations atmosphériques pour aucune de ces substances. Par conséquent, on ne s’attend pas à une exposition aux autres substances du sous‑groupe des benzotriazoles (c’est-à-dire UV‑329, UV‑326, UV‑234 et n° CAS 94270‑86‑7) par l’air (extérieur ou intérieur). Le benzotriazole et le tolyltriazole ont cependant été mesurés dans l’air intérieur aux États‑Unis (Xue et al. 2017).
| Substance | Concentration moyenne (µg/m³) |
Concentration maximale (µg/m³) |
Endroit | Référence |
|---|---|---|---|---|
| Benzotriazole | 0,0032 | 0,015 | Maisons aux É.‑U. | Xue et al. 2017 |
| Benzotriazole | 0,0061 | 0,011 | Lieux publics aux É.‑U. | Xue et al. 2017 |
| Tolyltriazole | 0,0021 | 0,0084 | Maisons aux É.‑U. | Xue et al. 2017 |
| Tolyltriazole | 0,0045 | 0,010 | Lieux publics aux É.‑U. | Xue et al. 2017 |
L’absorption estimée de benzotriazole et de tolyltriazole présents dans l’air a été calculée à partir des concentrations les plus élevées indiquées dans le tableau 2‑9. Cela correspondait à une exposition quotidienne estimée de 8,7 × 10‑6 mg/kg p.c./j pour le benzotriazole et de 6,0 × 10‑6 mg/kg p.c./j pour le tolyltriazole, les tout‑petits (0,5 à 4 ans) étant les plus exposés par rapport au poids corporel. L’exposition potentielle de la population générale au Canada au benzotriazole ou au tolyltriazole présent dans l’air extérieur ou ambiant devrait être inférieure à celle constatée pour l’air intérieur, en raison de leurs sources et de leurs utilisations.
Eau
À l’exception du n° CAS 94270‑86‑7, les autres substances du sous‑groupe des benzotriazoles ont été mesurées dans divers types d’eau au Canada et dans d’autres pays, notamment l’eau de surface, l’eau souterraine, l’eau potable et les eaux usées. Les données de ces études et leurs références sont résumées à l’annexe E. Les concentrations mesurées dans les eaux de surface au Canada ont été utilisées comme valeurs de substitution pour les concentrations dans l’eau potable afin d’estimer l’absorption de chacune de ces substances, lorsque ces données étaient disponibles. Par souci de prudence, la valeur maximale déclarée pour chaque substance a été utilisée pour estimer les apports provenant de l’eau potable.
Les substances UV‑326, UV‑329 et UV‑234 ont été mesurées dans les eaux de surface canadiennes, et on a obtenu 0,0843 µg/L, moins de 0,00058 µg/L, et entre 0,00005 µg/L et 0,00032 µg/L, respectivement (Lu et al. 2016a). L’exposition quotidienne estimée à l’UV‑326 par l’eau potable pour le groupe d’âge le plus exposé par rapport au poids corporel (nourrissons de 0 à 6 mois consommant une préparation pour nourrissons) était de 9,0 × 10‑6 mg/kg p.c./j. Les doses d’UV‑329 et d’UV‑234 absorbées dans l’eau potable ont été jugées négligeables.
Vu l’absence de données pour la surveillance du benzotriazole, du tolyltriazole et du n° CAS 94270‑86‑7 dans les eaux de surfaces de l’eau potable, on a modélisé les concentrations dans l’eau à l’aide de la valeur supérieure de la quantité totale importée indiquée dans le tableau 2‑5 et du modèle de fugacité de niveau III ChemCAN v6.00 (ChemCAN 2003). Les doses prévues résultantes de benzotriazoles, de tolyltriazole et du n° CAS 94270‑86‑7 dans l’eau potable ont été jugées négligeables.
Poussière
Les concentrations de certaines substances du sous‑groupe des benzotriazoles dans la poussière ont été mesurées et relevées. Le benzotriazole et le tolyltriazole ont été détectés dans la poussière des routes (sous forme de particules en suspension dans une phase aqueuse) en Norvège à des valeurs atteignant 135 ng/L et 1 260 ng/L, respectivement (Asheim et al. 2019), et ont été mesurés dans la poussière intérieure aux États‑Unis et dans certains pays d’Asie de l’Est à des concentrations atteignant 125 ng/g et 159 ng/g, respectivement (Wang et al. 2013). Compte tenu de ces valeurs, on s’attend à ce que les expositions potentielles à la poussière soient négligeables pour les substances du sous‑groupe des benzotriazoles.
Aliments
La dose journalière probable (DJP) d’UV‑329 en raison de son utilisation comme stabilisateur UV dans certaines résines pour emballage alimentaire est de 3 x 10‑6 µg/kg p.c./j (communication personnelle, courriels de la Direction des aliments, Santé Canada, au BERSE, Santé Canada, 2017, 2018; sans référence). D’autres substances de ce sous‑groupe (c’est-à-dire l’UV‑326 et l’UV‑234) pourraient être utilisées dans les matériaux d’emballage alimentaire pouvant entrer en contact direct avec les aliments, mais cette exposition serait négligeable (communication personnelle, courriels de la Direction des aliments, Santé Canada, au BERSE, Santé Canada, 2017, 2018; sans référence). En outre, l’exposition potentielle aux substances du sous‑groupe des benzotriazoles pouvant être utilisées dans des additifs indirects a été jugée négligeable ou non à prévoir (communication personnelle, courriels de la Direction des aliments, Santé Canada, au BERSE, Santé Canada, 2017, 2018; sans référence).
En raison de leurs diverses autres utilisations industrielles, certains benzotriazoles peuvent pénétrer dans l’environnement et ont été détectés dans certains poissons et autres organismes aquatiques. Les données disponibles sur les concentrations de benzotriazoles dans les aliments sont limitées. On a trouvé des données sur la présence de certaines de ces substances seulement pour certains poissons et fruits de mer. Deux études canadiennes faisaient état de concentrations d’un nombre limité de benzotriazoles dans des poissons de l’Ontario (Lu et al. 2016a, b) et des auteurs à l’étranger (Brorström‑Lundén et al. ont fait état de concentrations de 6 benzotriazoles dans des poissons et des fruits de mer en Suède, en Espagne, en Chine et en Inde, respectivement. On a estimé de manière prudente l’exposition par le régime alimentaire aux benzotriazoles individuels des consommateurs qui ont déclaré avoir consommé du poisson ou des fruits de mer (base « mangeurs seulement ») en multipliant la concentration maximale de chaque substance (Annexe F) par la quantité totale de poisson et de fruits de mer consommée par chaque répondant à l’Enquête sur la santé dans les collectivités canadiennes (Statistique Canada 2015). Cette approche a permis d’obtenir une série d’estimations de l’exposition au benzotriazole pour différentes tranches d’âge (tableau 2‑10). L’exposition par le régime alimentaire n’a pas été estimée pour les nourrissons de moins d’un an, car seulement 2 % des répondants à l’enquête ont déclaré avoir consommé du poisson ou des fruits de mer (communication personnelle, courriels de la Direction des aliments, Santé Canada, au BERSE, Santé Canada, 2019; sans référence).
| Substance | Exposition moyenne | Exposition au 90e centile |
|---|---|---|
| Benzotriazole | 4,3 x 10‑6 à 1,4 x 10‑5 | 8,6 x 10‑6 à 2,8 x 10‑5 |
| UV‑329 | 3,9 x 10‑5 à 1,2 x 10‑4 | 7,7 x 10‑5 à 2,5 x 10‑4 |
| UV‑326 | 9,5 x 10‑6 à 3,0 x 10‑5 | 1,9 x 10‑5 à 6,2 x 10‑5 |
| Tolyltriazole | 4,6 x 10‑6 à 1,4 x 10‑5 | 9,2 x 10‑6 à 3,0 x 10‑5 |
| UV‑234 | 7,5 x 10‑5 à 2,3 x 10‑4 | 1,5 x 10‑4 à 4,9 x 10‑4 |
a Aucune donnée sur leur occurrence n’a été trouvée pour les nos CAS 80595‑74‑0 et 94270‑86‑7.
b L’exposition estimée par le régime alimentaire a été prise en compte pour les personnes de 1 an et plus, les estimations pour toutes les substances étant les plus élevées d’après le poids corporel pour les tout‑petits de 1 an.
c L’exposition par le régime alimentaire à l’UV‑320 n’a pas été estimée, car cette substance n’est présente dans aucun produit de consommation au Canada et aucune entreprise n’a déclaré d’utilisation dans l’enquête menée en vertu de l’article 71 de la LCPE (Canada 2017). De plus, les données limitées à l’étranger sur la présence de cette substance dans les aliments n’ont pas été jugées pertinentes pour les aliments disponibles pour la population générale au Canada.
Lait maternel
Nous n’avons trouvé aucune donnée canadienne signalant la présence de substances du sous‑groupe des benzotriazoles dans le lait maternel humain. Certains benzotriazoles ont été mesurés dans le lait maternel ailleurs dans le monde par Kim et al. (2019), Lee et al. (2015) et Molins‑Delgado et al. (2018). Les concentrations moyennes obtenues par certaines de ces études ont été utilisées pour calculer l’exposition potentielle des nourrissons par le lait maternel. Le tableau 2‑11 présente les concentrations et l’exposition estimée résultant de la consommation de lait maternel.
| Substance | Concentration moyenne (ng/g p.l.b) |
Pays (référence) | Exposition estiméea (mg/kg p.c./j) |
|---|---|---|---|
| UV‑329 | 4,5 | Corée (Lee et al. 2015) | 1,8 × 10‑5 |
| UV‑326 | 23 | Japon, Philippines, Vietnam (Kim et al. 2019) | 9,4 × 10‑5 |
| UV‑234 | 0,12 | Japon, Philippines, Vietnam (Kim et al. 2019) | Négligeable |
a Des renseignements additionnels sur les calculs de l’exposition estimée figurent à l’annexe D.
b p.l. = poids de lipides.
Le rapport de Molins‑Delgado et al. (2018) a été jugé lacunaire pour certains paramètres (par exemple, la méthode de séparation semble inadéquate pour l’analyse des benzotriazoles d’intérêt, la faible masse volumique mesurée du lait maternel, et les incohérences entre les concentrations de benzotriazole rapportées en ng/g de lait et en ng/g en poids de lipides). De plus, la taille de l’échantillon n’a pas été jugée suffisante pour produire des rapports statistiquement significatifs de la tendance centrale (c’est-à-dire la moyenne), étant donné les faibles taux de détection de l’UV‑320 et de l’UV‑329. Par conséquent, cette étude n’a pas été utilisée pour estimer l’exposition aux benzotriazoles par le lait maternel au Canada.
Biosurveillance
Certaines données de biosurveillance d’autres pays ont été trouvées pour certains benzotriazoles, par exemple, des concentrations urinaires maximales de 11,0 ng/mL de benzotriazole et de 4,8 ng/mL de tolyltriazole dans 7 pays (États‑Unis, Grèce, Vietnam, Corée, Japon, Chine et Inde) (Asimakopoulos et al. 2013 b), et des concentrations urinaires maximales de 42 ng/mL de benzotriazole et de 7,1 ng/mL de tolyltriazole en Chine (Zhou et al. 2018). La source des benzotriazoles mesurés dans l’urine n’est pas claire. Étant donné l’incertitude quant à l’applicabilité de ces données à la population générale au Canada, les données de biosurveillance n’ont pas été utilisées pour estimer l’exposition.
Produits disponibles aux consommateurs
L’exposition potentielle de la population générale au Canada aux substances du sous‑groupe des benzotriazoles provenant des produits disponibles aux consommateurs a été évaluée. Les scénarios d’exposition sentinelle (c’est-à-dire les scénarios qui ont donné les estimations les plus élevées de l’exposition) sont décrits dans la présente section. Les concentrations figurant ici représentent les valeurs maximales déclarées.
Aucun produit de consommation contenant de l’UV‑320 n’a été trouvé. Par conséquent, on ne s’attend pas à ce que la population générale au Canada soit exposée aux produits contenant de l’UV‑320.
L’exposition orale estimée aux substances du sous‑groupe des benzotriazoles inclut le brillant à lèvres contenant de l’UV‑326 à une concentration atteignant 0,3 % (communication personnelle, courriel de la Direction de la Sécurité des produits de consommation et des produits dangereux, Santé Canada, au BERSE, Santé Canada, 2017; sans référence), où une exposition quotidienne de 0,0019 mg/kg p.c./j pour un tout‑petit a été estimée. Un stylo à encre liquide contenant du benzotriazole à 1 % peut donner lieu à une exposition orale estimée à 0,032 mg/kg p.c. par exposition ponctuelle et à 0,0016 mg/kg p.c./j pour un tout‑petit (SDS 2017). L’exposition ponctuelle est représentative des scénarios d’exposition potentielle qui pourraient se produire le jour de l’utilisation (par exemple, un tout‑petit dessinant sur sa peau ou mettant un stylo dans sa bouche), ce qui ne devrait pas se produire quotidiennement.
D’après les utilisations déclarées, on ne s’attend pas à une exposition orale aux autres substances du sous‑groupe des benzotriazoles provenant de l’utilisation de produits disponibles aux consommateurs.
L’estimation de l’exposition cutanée aux substances du sous‑groupe des benzotriazoles résultant de l’utilisation de produits disponibles aux consommateurs est présentée dans le tableau 2‑12. On s’attend à ce que l’exposition au n° CAS 80595‑74‑0 contenu dans l’huile pour direction assistée et l’huile hydraulique soit similaire à l’exposition au n° CAS 94270‑86‑7, en raison de leur similarité fonctionnelle, de leur utilisation interchangeable sur certaines fiches de données de sécurité (par exemple, SDS 2008, 2016c) et des renseignements sur l’utilisation fournis dans le cadre d’une enquête menée en vertu de l’article 71 de la LCPE (Canada 2017). Ainsi, on s’attend à ce que l’exposition estimée au no CAS 80595‑74‑0 soit similaire à toute exposition potentielle au no CAS 94270‑86‑7.
| Substance | Scénario d’utilisation | Concentration (référence) | Exposition ponctuelle (mg/kg p.c.) (groupe d’âgeb) |
Exposition quotidienne (mg/kg p.c./j) (groupe d’âgeb) |
|---|---|---|---|---|
| Benzotriazole | Stylo à encre liquide | (SDS 2017) | 0,032 (tout‑petit) | S.O. |
| Benzotriazole | Produit pour ongles (faux ongles) | 1 %a | 0,027 (adolescent) | S.O. |
| UV‑329 | Bloc de savon | 0,1 %a | 0,00025 (nourrisson) | Jusqu’à 0,00028 (nourrisson) |
| UV‑326 | Poli en gel et colle pour ongles | 10 %a | 0,032 (tout‑petit) | S.O. |
| UV‑326 | Teintures pour les lèvres et les joues | 0,1 %a | 0,027 (adolescent) | 0,027 (adolescent) |
| Tolyltriazole | Réparation de système de refroidissement | (SDS 2013, 2018) | 0,021d (adulte) | S.O. |
| UV‑234 | Peinture amovible protectrice en aérosol pour automobiles | 0,1 % (SDS 2016a) | 0,021d (adulte) | S.O. |
| N° CAS 80595‑74‑0c | Huile hydraulique/pour servodirection | (SDS 2016b) | 0,021d (adulte) | S.O. |
Abréviation – S.O. = sans objet.
a Les concentrations sont basées sur les déclarations présentées à Santé Canada en vertu du Règlement sur les cosmétiques (communication personnelle, courriels de la Direction de la Sécurité des produits de consommation et des produits dangereux, Santé Canada, au BERSE, Santé Canada, 2017, 2018; sans référence).
b Ces valeurs sont celles issues des scénarios sentinelles dans lesquels les valeurs estimatives d’exposition ont été les plus élevées. Un facteur d’absorption cutanée de 100 % a été utilisé pour toutes les substances.
c On s’attend à ce que la source d’exposition au n° CAS 94270‑86‑7 soit similaire à celle du n° CAS 80595‑74‑0, en raison de leur similarité structurelle, de leur présence dans des mélanges comme il est indiqué sur certaines SDS disponibles, et selon les renseignements sur l’utilisation présentés en vertu d’une enquête menée en vertu de l’article 71 de la LCPE (Canada 2017).
d On suppose, de façon prudente, que 100 % de l’exposition à la substance est absorbée par voie cutanée, bien que l’on puisse également s’attendre à une certaine répartition dans l’air, ce qui entraînerait une exposition par inhalation.
Des estimations de l’exposition par inhalation ont également été calculées pour certaines substances du sous‑groupe des benzotriazoles. D’après une modélisation par ConsExpo Web (ConsExpo Web 2016; SDS 2016a), l’exposition ponctuelle découlant de l’utilisation d’une peinture en aérosol pour automobile contenant 0,1 % d’UV‑234 est estimée à 0,0046 mg/kg p.c. pour un adulte. L’exposition potentielle par inhalation au produit de revitalisation des ongles contenant 1 % de benzotriazole et du produit de réparation de systèmes de refroidissement contenant 1 % de tolyltriazole est jugée négligeable (ConsExpo Web 2016; communication personnelle, courriels de la Direction de la Sécurité des produits de consommation et des produits dangereux, Santé Canada, au BERSE, Santé Canada, 2018; sans référence). Les autres substances du sous‑groupe des benzotriazoles sont présentes uniquement dans des produits disponibles aux consommateurs non pulvérisables au Canada. Et comme leur pression de vapeur très faible (10‑6 Pa ou moins), l’exposition potentielle par inhalation a été jugée minime.
Prise en compte des sous‑groupes de la population pouvant être plus exposés
Au sein de la population canadienne, il existe des groupes de personnes qui, en raison d’une plus grande exposition, peuvent être davantage vulnérables aux effets nocifs découlant de l’exposition à des substances. Le potentiel d’exposition élevé dans la population canadienne a été évalué. Les expositions ont été systématiquement estimées en fonction de l’âge afin de tenir compte des différences physiques et comportementales aux différentes périodes de la vie. Pour ce qui est de l’évaluation de l’exposition de fond par les milieux naturels, l’exposition estimée par l’air ambiant était plus élevée chez les jeunes enfants (c’est-à-dire 1 an) que chez les adultes.
2.5.2 Évaluation des effets sur la santé
Le benzotriazole et le tolyltriazole ont été inclus dans une évaluation des risques pour la santé et un projet de critères de qualité axés sur la santé pour le sol et l’eau potable par l’EPA danoise (Danish EPA 2013). L’UV‑326 a été évalué par le Programme coopératif d’évaluation des produits chimiques dans le Rapport d’évaluation initiale (SIAR) de l’Ensemble de données de dépistage (EDD) de l’OCDE (OCDE 2009a). Au Canada, l’UV‑234 et le drométrizole ont été inclus comme analogues dans l’évaluation du BDTP par Environnement et Changement climatique Canada et Santé Canada dans le cadre du Plan de gestion des produits chimiques (PGPC) (ECCC, SC 2016b). Le drométrizole est utilisé comme analogue dans la présente évaluation. Par conséquent, ces évaluations ont été utilisées pour contribuer à la caractérisation des effets sur la santé de l’UV‑326 et de l’UV‑234, y compris le choix des effets critiques et des points de départ pertinents.
Des recherches dans la littérature scientifique récente ont été menées jusqu’en février 2019 pour ces substances. Une étude de toxicité à doses répétées combinée à une évaluation préalable des effets du drométrizole sur la reproduction et le développement a été trouvée lors des recherches, mais cette étude n’est pas considérée comme présentant de nouveaux renseignements significatifs (ECHA c2007‑2019).
2.5.2.1 Études des effets propres aux substances sur la santé
On disposait de données limitées sur les effets sur la santé propres à certaines substances chimiques du sous‑groupe des benzotriazoles. Santé Canada a examiné des substances analogues en raison de leurs similarités avec ces substances chimiques sur le plan de la structure chimique, des propriétés physico-chimiques ou de la métabolisation. L’annexe A décrit plus en détail l’approche de lecture croisée utilisée pour les substances du sous‑groupe des benzotriazoles. Les données propres aux substances chimiques sont présentées en premier, suivies des données sur les substances analogues utilisées pour caractériser les effets sur la santé des substances du sous‑groupe des benzotriazoles. Même si l’UV‑350 fait partie du sous‑groupe des benzotriazoles, les données concernant ses effets sur la santé sont présentées dans la section consacrée aux données sur les analogues, car son potentiel de nocivité pour la santé humaine a été caractérisé selon l’approche fondée sur le SPT (Santé Canada 2016). Ces données ne sont donc pertinentes que dans le contexte de son utilisation comme analogue dans la présente évaluation.
Benzotriazole
La génotoxicité du benzotriazole a été jugée ambiguë d’après divers essais in vitro, notamment le test d’Ames et le test d’aberration chromosomique (Danish EPA 2013).
Dans une étude de cancérogénicité à long terme menée chez des rats (50/sexe/dose) ayant reçu la substance par voie orale, des doses de 0, 6 700 ou 12 100 ppm (environ 0, 335 ou 605 mg/kg p.c./j) de benzotriazole ont été administrées par les aliments pendant 78 semaines (Danish EPA 2013). Les effets non cancérogènes relevés dans les 2 groupes exposés consistaient en une diminution du poids corporel et en l’apparition d’effets sur les cellules de divers organes, notamment une inflammation de la prostate, une néphrose et des changements cytoplasmiques dans les cellules hépatiques chez les mâles, et une inflammation de l'utérus, une néphrose et des changements cytoplasmiques dans les cellules hépatiques chez les femelles. En ce qui concerne les effets cancérogènes, des nodules néoplasiques du foie sont apparus chez certains mâles exposés à la dose élevée (5/45). Certains mâles exposés à la dose faible, mais non à la dose élevée, ont présenté des tumeurs cérébrales (une oligodendroglie et 2 gliomes). Un gliome était également présent chez une femelle ayant reçu la dose élevée. Chez les femelles, l'incidence des polypes du stroma endométrial dans le groupe ayant reçu la dose faible (10/45) était significativement plus élevée que chez celles du groupe témoin (2/48). Toutefois, la fréquence dans le groupe ayant reçu la dose élevée n’était pas significative, et lorsque l’on combinait la fréquence des polypes du stroma endométrial et des sarcomes du stroma endométrial, il n'y avait pas de différences significatives entre les groupes exposés et le groupe témoin. La fréquence des adénomes et des carcinomes à cellules C de la glande thyroïde a augmenté. Des tumeurs bénignes de la glande thyroïde ont été observées chez les femelles exposées à de faibles doses (4/43), tandis que des tumeurs malignes de la glande thyroïde ont été observées chez les femelles exposées à des doses faibles (1/43) et à des doses élevées (3/50). L’EPA danoise a estimé que la dose la plus faible de 6 700 ppm (335 mg/kg p.c./j) était la DMENO, pour les effets cancérogènes et non cancérogènes observés dans divers organes et tissus (Danish EPA 2013).
La toxicité pour la reproduction et le développement n’a pas été prise en compte dans l’évaluation faite par l’EPA danoise (2013), mais 2 études sur la reproduction et le développement ont été trouvées lors d’une recherche ultérieure dans la littérature scientifique. Dans une étude de toxicité pour la reproduction et le développement réalisée chez des rats Wistar (12/sexe/dose), du benzotriazole dilué dans du polyéthylène glycol a été administré par gavage (voie orale) à des doses de 0, 12,5, 50 ou 200 mg/kg p.c./j. Les animaux ont reçu les doses à partir de 14 jours avant la période d’accouplement jusqu’entre les jours de lactation 8 et 14 pour les femelles, et entre les jours 39 et 50 pour les mâles. Le rendement reproductif et la toxicité générale ont été examinés, mais les effets sur les spermatozoïdes et les cycles œstraux n’ont pas notés. Aucun effet lié au traitement n’a été observé jusqu’à la dose maximale d’essai (ECHA c2007‑2019). Dans une autre étude de toxicité pour la reproduction et le développement, du benzotriazole a été administré dans de l'huile de maïs par gavage (voie orale) à des rats CD (SD) (12/sexe/dose) à des doses de 0, 30, 100 ou 300 mg/kg p.c./j pendant 42 à 45 jours (Japan Bioassay Research Center 2007). Pour former le groupe témoin et le groupe exposé à la dose élevée, on a réuni 5 des 12 mâles ayant fécondé une femelle et 5 femelles supplémentaires d’une autre colonie, et ces groupes respectifs ont eu une période de récupération de 2 semaines. On n’a observé aucun effet du composé sur la performance reproductive. On n’a pas non plus observé d’effet sur le nombre d’implantations, le nombre de petits, le ratio mâles:femelles et la viabilité des petits pendant les 4 jours de lactation. Chez les mères, une régénération des tubules proximaux (reins) a été observée aux doses moyennes et élevées, ce que les auteurs ont interprété comme pouvant indiquer des dommages à l'épithélium des tubules proximaux (tels qu’une nécrose et/ou un décollement). À la dose maximale d’essai, on a observé divers changements réversibles et irréversibles touchant l’hématologie et la biochimie clinique chez les mâles et les femelles adultes. La dose sans effet nocif observé (DSENO) administrée à doses répétées dans la circulation générale était de 30 mg/kg p.c./j. Elle a été établie par les auteurs d’après les effets rénaux constatés chez les femelles adultes exposées aux doses élevées. La DSENO pour la reproduction et le développement a été établie à 300 mg/kg p.c./j d’après l’absence d’effet nocif jusqu’à la dose maximale d’essai (Japan Bioassay Research Center 2007).
Tolyltriazole
Les essais de génotoxicité in vitro du tolyltriazole ont donné des résultats ambigus (Danish EPA 2013).
Dans une étude de 28 jours, des rats Wistar (6/sexe/dose) ont reçu du tolyltriazole dilué dans du polyéthylène glycol par gavage oral à des doses de 0, 50, 150 ou 450 mg/kg p.c./j. On a constaté des signes de toxicité hépatique potentielle. Dans le groupe ayant reçu la dose maximale, on a constaté une réduction de la concentration des érythrocytes et de l’hémoglobine, une baisse de l’hématocrite chez les mâles, une diminution des protéines plasmatiques et une augmentation de l’activité de l’aspartate aminotransférase (AST) et de l’alanine aminotransférase (ALT) chez les mâles et les femelles. La DSENO a été établie à 150 mg/kg p.c./j d’après les résultats des analyses hématologiques et de la biochimie clinique à 450 mg/kg p.c./j (ECHA c2007‑2019).
On n’a trouvé aucune étude de toxicité du tolyltriazole pour le développement ou la reproduction ni sur sa cancérogénicité. Par conséquent, le benzotriazole, qui est structurellement apparenté, a donc été utilisé pour éclairer l’évaluation des effets du tolyltriazole sur la santé pour ces critères d’effet. Les critères d’effet critiques pour le benzotriazole et les doses correspondantes qui sont utilisés pour la caractérisation du risque du tolyltriazole sont décrits dans la section pertinente du présent rapport. Des résumés figurent à l’annexe A aux fins de comparaison.
UV‑329
Selon de nombreuses études in vitro, l’UV‑329 n’est pas jugé génotoxique (ECHA c2007‑2019; NTP 2011).
On ne disposait d’aucune étude permettant d’évaluer la toxicité subchronique ou chronique de l’UV‑329, ni sa toxicité pour la reproduction et le développement ou son potentiel cancérogène. Par conséquent, comme il est décrit ci‑dessous, on a procédé à un regroupement d’analogues appropriés avec les données disponibles sur les effets sur la santé d’après des similarités de structure chimique (Boîte d’outils QSAR de l’OCDE 2016) et des propriétés physico‑chimiques en vue d’une lecture croisée. Les substances de ce groupe ont été utilisées pour déterminer, par lecture croisée, les effets sur la reproduction, le développement et les critères d’effet cancérogènes lorsque des données étaient disponibles. Dans l’ensemble, la toxicité pour la reproduction et le développement n’était pas préoccupante d’après les données sur le drométrizole, l’UV‑326, l’UV‑350 et l’UV‑234. Le potentiel cancérogène n’était pas préoccupant d’après les données sur le drométrizole et l’UV‑326. Les données de toxicité à court et à long terme de l’UV‑320 ont été choisies pour la lecture croisée afin de caractériser le risque lié à l’exposition quotidienne et à l’exposition ponctuelle à l’UV‑326. D’après les analogues disponibles, cette approche a été jugée prudente et appropriée. Les effets critiques et les concentrations correspondantes pour l’UV‑320 ayant servi à caractériser les risques de l’UV‑329, ainsi que les résumés des données pertinentes sur les effets sur la santé, figurent à l’annexe A aux fins de comparaison.
UV‑320
À la lumière de nombreuses études in vitro, l’UV‑320 n’est pas jugé génotoxique (NTP 2011).
On ne disposait d’aucune étude sur la cancérogénicité ou la toxicité pour la reproduction et le développement pour l’UV‑320. La même stratégie de lecture croisée que celle qui a été utilisée pour l’UV‑329 a été employée pour l’UV‑320. Voir la section sur les effets sur la santé de l’UV‑326 ci‑dessous. De même, les critères d’effet critiques et les doses correspondantes qui sont utilisés pour la caractérisation du risque de l’UV‑320 et les résumés des données pertinentes sur les effets sur la santé figurent à l’annexe A aux fins de comparaison.
Dans une étude par gavage oral de 4 semaines, des rats CD(SD)IGS mâles et femelles (10/sexe à la dose maximale et chez les témoins, 5/sexe pour les autres doses) ont reçu 0, 0,5, 2,5, 12,5 ou 62,5 mg/kg p.c./j pendant 28 jours avec une période de récupération de 14 jours (Hirata‑Koizumi et al. 2007). Les effets observés comprenaient une consommation alimentaire accrue chez les 2 sexes exposés à la dose élevée. Des changements hématologiques et de la biochimie clinique ont été observés à partir de 2,5 mg/kg p.c./j et de 0,5 mg/kg p.c./j, respectivement, chez les mâles; des variations dans la chimie clinique ont été observées chez les femelles du groupe ayant reçu la dose élevée. Chez les mâles, on a observé une augmentation significative du poids relatif du foie, une hypertrophie macroscopique du foie, une hypertrophie des hépatocytes, une prolifération des canaux biliaires et une diminution de la fréquence des changements dans les lipides hépatocellulaires à 0,5 mg/kg p.c./j. À 2,5 mg/kg p.c./j et plus, chez les mâles, on a remarqué une augmentation significative du poids absolu du foie, des plaques blanches ou rouges sur le foie et la présence de lésions microscopiques dans le foie (dégénérescence vacuolaire des hépatocytes, nécrose focale), le cœur (infiltration cellulaire) et la rate (hématopoïèse extramédullaire). À 12,5 mg/kg p.c./j et plus, chez les femelles, le poids absolu et relatif du foie a augmenté de façon significative, et on a observé une hypertrophie du foie, une hypertrophie hépatocytaire et une augmentation de la mitose hépatocytaire. À la même dose, on a noté une hypertrophie de l’épithélium tubulaire des reins chez les mâles. Une dégénérescence ou une hypertrophie du myocarde est apparue chez les mâles et les femelles à 12,5 mg/kg p.c./j et à 62,5 mg/kg p.c./j, respectivement. Dans les groupes ayant reçu la dose maximale chez les mâles ou les femelles, on a également observé une augmentation significative du poids absolu et relatif des organes, une augmentation de la mitose hépatocytaire, une pigmentation hépatocellulaire ou des corps d’inclusion cytoplasmiques, une présence marquée des tubules basophiles, des plaques blanches ou rouges dans le foie, une prolifération des canaux biliaires, une diminution de la fréquence des changements dans les lipides hépatocellulaires, une dégénérescence des vacuoles hépatocytaires, une hypertrophie de l’épithélium tubulaire dans les reins, ainsi qu’une hyperplasie diffuse des cellules folliculaires dans la glande thyroïde. De nombreux effets (effets histopathologiques sur le foie et le cœur, changements hématologiques et de la biochimie du sang et du poids des organes, dont le cœur, le foie, le rein) ont persisté après la période de récupération. On a établi la DMENO à 0,5 mg/kg p.c./j pour les rats mâles (Hirata‑Koizumi et al. 2007).
Une étude de toxicité chronique à doses répétées par gavage (voie orale) a été menée chez des rats CD(SD)IGS pendant 52 semaines. Comme dans l’étude à court terme décrite ci‑dessus, les auteurs ont constaté des effets principalement de nature hépatique. Après l’administration de doses (0, 0,1, 0,5, 2,5 mg/kg p.c./j chez les mâles et 0, 0,5, 2,5, 12,5 mg/kg p.c./j chez les femelles) pendant 13 et 52 semaines, la moitié des animaux (10/sexe/dose) ont été euthanasiés et examinés, et les animaux restants ont été exposés pendant les 52 semaines avant d’être examinés. Chez les rats mâles, une diminution significative du poids corporel a été observée dans le groupe ayant reçu la dose élevée à partir du 36e jour, qui a atteint 25 % vers la fin des 52 semaines. Des changements ont été notés lors de l’analyse de l’urine et du sang, les effets les plus constants étant une osmolalité urinaire plus élevée, une numération plaquettaire plus élevée et des changements de nature anémique (par exemple, des valeurs plus faibles de la numération des globules rouges et de l'hématocrite) chez les mâles ayant reçu la dose élevée à la fois à 13 et à 52 semaines. Certains de ces effets ont également été observés chez les mâles ayant reçu la dose moyenne et les femelles ayant reçu la dose élevée, à l’un ou l’autre moment. Des différences dans les paramètres de la chimie clinique ont été notées chez les mâles ayant reçu les doses moyennes et élevées aux 2 moments (notamment une augmentation des concentrations de phosphatase alcaline [PA] et du ratio albumine:globuline [A:G] découlant d'un pourcentage plus grand d'albumine et d'un pourcentage plus faible de certains types de globulines dans la fraction protéique totale). Chez les femelles exposées à des doses élevées, les effets similaires sur la PA et le ratio A:G n'étaient significatifs qu'après 52 semaines et 13 semaines, respectivement. Certaines augmentations du poids relatif des organes ont été relevées chez les mâles ayant reçu des doses élevées. Cependant, les effets étaient probablement dus à la diminution du poids corporel, car le poids absolu des organes correspondants était inchangé. Le foie faisait exception, son poids absolu et relatif ayant augmenté chez les mâles exposés à la dose moyenne et chez les mâles et femelles exposés à la dose élevée, une hépatomégalie évidente et des résultats histopathologiques correspondants ont été constatés chez certains animaux. Chez les mâles en particulier, les types et l’incidence des changements microscopiques ont semblé indiquer une aggravation progressive de l’hépatotoxicité entre les semaines 13 et 52. Une hypertrophie centrolobulaire a été constatée aux 2 moments, tandis que certains mâles présentaient également des foyers hépatocellulaires modifiés, des dépôts de lipofuscine et une dégénérescence kystique des hépatocytes au terme de l'étude. Dans l'ensemble, les auteurs ont considéré que la DSENO pour la toxicité chronique était de 0,1 mg/kg p.c./j pour les mâles et de 2,5 mg/kg p.c./j pour les femelles.
Des études supplémentaires ont été menées chez le rat pendant 17 à 90 jours par gavage (voie orale) et par le régime alimentaire. Les effets constatés dans ces études comprenaient une toxicité hépatique et rénale. La DMENO a été déterminée à 0,5 mg/kg p.c./j, soit la dose d’essai la plus faible, dans une étude de 28 jours sur des rats castrés (Ciba‑Geigy Corp. 1968; Hirata‑Koizumi et al. 2008a, c).
UV‑326
Sur le plan international, l’UV‑326 a été examiné par l’OCDE dans un rapport d’évaluation initiale (SIAR) de l’Ensemble de données de dépistage (EDD) (OCDE 2009a).
Les études in vitro et in vivo disponibles ont montré que l’UV‑326 n’était pas génotoxique (OCDE 2009a).
Il n’y avait aucune preuve d’activité cancérogène de la substance à des doses de 382,6 mg/kg p.c./j chez des rats mâles et de 501,9 mg/kg p.c./j chez des femelles, de 62 mg/kg p.c./j chez des souris mâles et de 59 mg/kg p.c./j chez des souris femelles par les aliments sur une période de 2 ans. À la lumière de ces résultats, on a jugé que la substance n’avait pas de potentiel cancérogène (OCDE 2009a).
Selon l’OCDE, la DSENO globale pour la toxicité orale à doses répétées était basée sur une étude de toxicité subchronique chez des chiens Beagle (5/sexe/dose chez les témoins et dans les groupes ayant reçu la dose élevée, et 4/sexe/dose dans d’autres groupes exposés). Les animaux ont reçu des doses de 0, 200, 1 000 ou 5 000 ppm d’UV‑326 par leur régime alimentaire pendant 13 semaines (ce qui équivaut à environ 0, 6,2, 29,6 ou 168 mg/kg p.c./j pour les mâles et 0, 6,5, 32,2 ou 153 mg/kg p.c./j pour les femelles). La dose critique et le critère d’effet correspondant étaient une DSENO de 29,6 mg/kg p.c./j pour les mâles, établis d’après des variations du poids du foie à la dose maximale d’essai, et de 32,2 mg/kg p.c./j pour les femelles, d’après une perte de poids significative à la dose maximale d’essai (OCDE 2009a).
Dans une étude de toxicité de référence à doses répétées, combinée à une évaluation préalable de la toxicité pour la reproduction et le développement, des rats (12/sexe/dose et 5 femelles/groupe, pour la récupération) ont reçu de l’UV‑326 par gavage à des doses de 0, 62,5, 250 ou 1 000 mg/kg p.c./j pendant 42 jours (mâles) ou 44‑56 jours (jour 14 avant l’accouplement jusqu’au 6e jour de lactation; femelles). Aucun effet sur la reproduction ou le développement n’a été observé jusqu’à la dose maximale d’essai de 1 000 mg/kg p.c./j. La DSENO pour la toxicité parentale chez le rat était de 1 000 mg/kg p.c./j, ce qui était la dose maximale d’essai (OCDE 2009a).
En outre, 2 études de toxicité pour le développement ont été réalisées chez des rats Sprague‑Dawley (SD) et des souris NMRI (25‑30/sexe/groupe). Les animaux ont reçu la substance par gavage à raison de 0, 300, 1 000 ou 3 000 mg/kg p.c./j pendant les jours de gestation (JG) 6‑15. Aucun effet sur le développement des rats n’a été observé jusqu’à la dose maximale d’essai de 3 000 mg/kg p.c./j. La DSENO pour la toxicité pour le développement chez la souris était de 1 000 mg/kg p.c./j, établie d’après une augmentation statistiquement significative de la proportion de fœtus présentant une ossification incomplète des sternèbres à 3 000 mg/kg p.c./j (OCDE 2009a).
UV‑234
L’UV‑234 a été utilisé comme analogue du BDTP, et ses effets sur la santé sont présentés dans l’évaluation préalable de cette substance (ECCC, SC 2016b).
Les essais de génotoxicité in vitro et in vivo disponibles (ECCC, SC 2016b) ont montré que l’UV‑234 était négatif.
Il n’y avait pas d’étude de toxicité pour la reproduction ou de cancérogénicité pour l’UV‑234, et c’est pourquoi les substances phénoliques du sous‑groupe des benzotriazoles ont été utilisées en lecture croisée pour cette substance, compte tenu des similarités de la structure chimique (Boîte d’outils QSAR de l’OCDE 2016) et des propriétés physico‑chimiques, comme il est mentionné ci‑dessus. Lorsque des données étaient disponibles, les substances de ce groupe ont été utilisées en lecture croisée pour examiner les critères d’effet cancérogène et sur la reproduction. Dans l’ensemble, aucune toxicité pour la reproduction n’a été observée d’après les données obtenues chez les animaux pour le drométrizole, l’UV‑326 et l’UV‑350. Le potentiel cancérogène n’était pas préoccupant, d’après les données sur le drométrizole et l’UV‑326. Les critères d’effet critiques et les doses correspondantes qui sont utilisés pour caractériser le risque de l’UV‑234 et les résumés des données pertinentes sur les effets sur la santé figurent à l’annexe A aux fins de comparaison.
Dans le cadre d’une étude par voie orale à court terme, des rats Tif:RAIf (SPF) (10/sexe/dose) ont reçu 0, 300, 2 000 ou 10 000 ppm dans leur régime alimentaire (soit 26,0, 170,9 ou 922,8 mg/kg p.c./j chez les mâles et à 25,9, 177,2 et 944,7 mg/kg p.c./j chez les femelles) pendant 28 jours. On a constaté une augmentation significative du poids moyen du foie et des ratios de poids foie:corps et foie:cerveau chez les femelles exposées à 300 ppm et plus. D’autres effets liés au traitement dans le foie ont été observés à des doses plus élevées (ECHA c2007‑2019). La DMENO est considérée comme étant de 300 ppm (26 mg/kg p.c./j).
Dans une étude de toxicité subchronique, on a administré de l’UV‑234 dans les aliments à des doses de 0, 50, 300, 2 000 ou 10 000 ppm (soit 0, 2,5, 15, 100 ou 500 mg/kg p.c./j chez les mâles et à 3,7, 22,5, 155,1 et 802,2 mg/kg p.c./j chez les femelles) à des rats albinos (10/sexe/dose) pendant 92 à 94 jours. La DSENO avait précédemment été fixée à 2,5 mg/kg p.c./j, d’après des effets au foie à la dose suivante (ECCC, SC 2016b; NTP 2011).
Une étude de toxicité pour le développement a été menée chez des rats albinos Tif:RAIF (SPF) (nombre non indiqué). Des doses de 0, 300, 1 000 ou 3 000 mg/kg p.c./j ont été administrées par gavage à des femelles gravides entre les JG 6 et 15. Une DSENO de 300 mg/kg p.c./j a été établie d’après des effets sur le développement (diminution du poids corporel, maturation squelettique retardée) à la DMENO de 1 000 mg/kg p.c./j, tandis que la DSENO chez les parents a été établie à 3 000 mg/kg p.c./j, d’après l’absence d’effet chez les rats de la génération de la mère (ECCC, SC 2016b).
N° CAS 80595‑74‑0
Il n’y avait pas de données sur les effets du n° CAS 80595‑74-0 sur la santé. Le n° CAS 94270‑86‑7 a été sélectionné comme analogue approprié pour une lecture croisée, avec les données sur les dangers à court terme, d’après des similarités de la structure chimique (Boîte d’outils QSAR de l’OCDE 2016) et des propriétés physico‑chimiques. Les critères d’effet critiques et les doses correspondantes pour le n° CAS 94270‑86‑7, qui ont été utilisés pour caractériser les risques du n° CAS 80595‑74‑0, sont décrits dans les sections pertinentes du présent rapport et les résumés figurent à l’annexe A aux fins de comparaison.
N° CAS 94270‑86‑7
Dans une étude de toxicité à doses répétées, combinée à une évaluation préalable de la toxicité pour la reproduction et le développement, des rats Wistar (10/sexe/dose dans la génération parentale) ont reçu par gavage 0, 15, 45 ou 150 mg/kg p.c./j pendant 29 jours pour les mâles et 42 à 45 jours pour les femelles (2 semaines avant la période d’accouplement jusqu’au jour 4 de la lactation). À 150 mg/kg p.c./j, les femelles présentaient une posture voûtée, une horripilation et des matières fécales pâles, principalement pendant les 2 dernières semaines du traitement, ainsi qu’une diminution du poids corporel (8,7 %), de la prise de poids corporel (10 %) et de la consommation alimentaire. Un poids légèrement inférieur du thymus a été observé, ce qui correspond à l’observation d’une atrophie du tissu lymphoïde (involution) présente chez 4 des 7 femelles examinées dans le groupe ayant reçu la dose élevée (2 atrophies minimes, 1 légère, 1 modérée). Parmi les autres observations microscopiques, mentionnons un grade moyen inférieur de foyers hématopoïétiques dans la rate, chez ce groupe. Une réduction de la taille moyenne des portées lors du premier contrôle des portées a été constatée à la dose élevée (9,1 contre 11,6 chez le groupe témoin). Les auteurs ont estimé que le poids corporel plus faible des petits (2,5 % et 1,7 % aux jours 1 et 4 de lactation, respectivement) à la dose de 150 mg/kg p.c./j était consécutif à la réduction du poids corporel chez leurs mères. Il y a eu moins de portées dans le groupe ayant reçu la dose élevée (n = 8, valeur mesurée le jour 1 de la lactation et n = 7, valeur mesurée le jour 4 de la lactation), par rapport au groupe témoin (n = 10). On n’a observé aucun changement significatif sur le plan toxicologique pour aucun des autres paramètres du développement examinés dans cette étude (c’est-à-dire durée de la gestation, mise bas et examen macroscopique). Au terme de l’étude (jour postnatal 4), le développement des petits n’avait pas été affecté par le traitement, à 15 mg/kg p.c./j ou à 45 mg/kg p.c./j. La DSENO pour les parents et pour la reproduction de 45 mg/kg p.c./j a été établie d’après des changements dans le système lymphatique et une diminution de la taille des portées, respectivement, à la DMENO de 150 mg/kg p.c./j. Aucun effet sur le développement n’a été observé jusqu’à la dose maximale d’essai (Peter 2013).
2.5.3 Études des effets sur la santé des analogues
Drométrizole
Le drométrizole a été utilisé comme analogue du BDTP par Environnement et Changement climatique Canada et Santé Canada et ses effets sur la santé sont présentés dans l’évaluation préalable de cette substance (ECCC, SC 2016b).
Les résultats pour le drométrizole ont été jugés ambigus pour ce qui est de la génotoxicité, d’après divers essais in vitro et in vivo (ECCC, SC 2016b).
Dans 2 études de toxicité chronique/cancérogénicité par voie orale de 2 ans chez la souris et le rat, le drométrizole ne s’est pas avéré cancérogène. Aucun effet cancérogène lié au traitement n’a été observé lorsque des souris MAGf (SPF) (50/sexe/dose) ont reçu 0, 5, 50 ou 500 ppm de drométrizole (soit 0, 0,8, 6,5 ou 64 et 0, 0,8, 6,7 ou 62 mg/kg p.c./j pour les mâles et les femelles, respectivement). De même, aucun effet cancérogène lié au traitement n’a été observé lorsque des rats de la souche CFY (50/sexe/dose) ont reçu 0, 100, 300, 1 000 ou 3 000 ppm (soit 0, 4, 14, 47 ou 142 et 0, 6, 17, 58 ou 169 mg/kg p.c./j pour les mâles et les femelles, respectivement) (ECCC, SC 2016b).
Dans une étude de toxicité par voie orale pour la reproduction et le développement, des rats SD et des souris NMRI ont reçu par gavage 0, 150, 500 ou 1 000 mg/kg p.c./j de drométrizole aux jours de gestation 6 à 15. Aucune toxicité maternelle et aucun effet tératogène n’ont été notés. La DSENO pour la toxicité maternelle et pour le développement a été établie à 1 000 mg/kg p.c./j (ECCC, SC 2016b).
UV‑350
L’UV‑350 a été inclus dans le document sur l’Approche fondée sur le seuil de préoccupation toxicologique (SPT) (Santé Canada 2016). Les données présentées dans cette section ont été utilisées à des fins de lecture croisée.
Dans 2 études combinées de toxicité à doses répétées assorties d’une évaluation préalable de la toxicité pour la reproduction et le développement, des rats Crl:CD(SD) (12/sexe/dose et 5/sexe dans le groupe des rats d’une autre colonie) ont reçu des doses de 0, 0,5, 2,5 ou 12,5 mg/kg p.c./j et de 0, 0,8, 4, 20 ou 100 mg/kg p.c./j d’UV‑350 par gavage pendant 42 jours pour les mâles, et entre 14 jours avant l’accouplement jusqu’au jour 4 de la lactation pour les femelles. Aucun effet sur la reproduction ou le développement n’a été observé dans les 2 études jusqu’aux doses maximales d’essai (Foundation Animal Bio Science Safety Research Institute 2011; Japan Bioassay Research Center 2006).
Prise en compte des sous‑groupes de la population qui pourraient être plus sensibles
Au sein de la population canadienne, des groupes de personnes pourraient, en raison d’une plus grande sensibilité, être davantage vulnérables aux effets nocifs découlant de l’exposition à des substances. Dans les études disponibles, on a pris en compte le potentiel de sensibilité à différentes périodes de la vie ou en fonction du sexe. Les différences entre les sexes ont été examinées dans des études présentes dans la base de données sur les dangers. Les effets sur la santé propres à chacun des sexes ont permis de caractériser les risques associés à l’UV‑234 et au no CAS 80595‑74‑0. Dans la présente évaluation, les études prises en compte comprenant des études chez des animaux de laboratoire, dans lesquelles les auteurs ont examiné les effets sur la reproduction et le développement chez les jeunes, et la toxicité chez les femelles gravides. Les résultats d’une étude de toxicité pour la reproduction et le développement ont été établis comme effets critiques sur la santé pour caractériser les risques de l’exposition à l’UV‑326.
2.5.4 Caractérisation des risques pour la santé humaine
Des études de toxicité par voie orale ont été utilisées pour caractériser les risques liés à l’exposition par voie cutanée ou par inhalation, en l’absence de données sur les effets sur la santé par diverses voies pour toutes les substances du sous‑groupe des benzotriazoles. Les tableaux 2‑13, 2‑14 et 2‑15 fournissent l’exposition estimée et les points de départ pertinents pour l’évaluation des dangers des substances du sous‑groupe des benzotriazoles, ainsi que les marges d’exposition (ME) qui en résultent.
La DMENO de 335 mg/kg p.c./j, établie dans une étude de toxicité chronique et de cancérogénicité de 78 semaines réalisée par l’EPA danoise (Danish EPA 2013), a été utilisée comme critère d’effet le plus pertinent pour caractériser les risques de cancer associés à l’exposition quotidienne au benzotriazole et au tolyltriazole, d’après les effets néoplasiques observés dans divers organes et tissus chez le rat. La DMENO de 335 mg/kg p.c./j, provenant de la même étude, a également été utilisée comme critère d’effet le plus pertinent pour caractériser les risques non cancérogènes dus à l’exposition quotidienne à ces substances. En outre, l’approche est jugée prudente, car les valeurs d’exposition utilisées n’ont pas été amorties sur la durée de la vie (en d’autres mots, on n’a pas estimé les doses journalières moyennes pour la durée de la vie – DJMDV), et le groupe d’âge le plus exposé a été utilisé pour caractériser les risques. Pour caractériser les risques liés à une exposition ponctuelle au benzotriazole, on a utilisé la DSENO parentale obtenue dans l’étude de toxicité pour la reproduction et le développement de 42 jours menée chez le rat à doses répétées de 30 mg/kg p.c./j, d’après les effets sur les reins observés à 100 mg/kg p.c./j. De plus, pour caractériser les risques liés à l’exposition ponctuelle au tolyltriazole, on a utilisé la DSENO de 150 mg/kg p.c./j obtenue dans une étude à doses répétées de 28 jours. Bien que ces DSENO soient associées à des concentrations critiques plus faibles que la DMENO de 335 mg/kg p.c./j utilisée pour caractériser les risques de cancer et les risques d’effets non cancérogènes liés à l’exposition quotidienne, les ME calculées (comme il est indiqué ci‑dessous) d’après les résultats l’étude de toxicité chronique et de cancérogénicité de 78 semaines assurent une protection suffisante contre les effets observés dans les études de courte durée et les autres effets non cancérogènes indiqués à la section 2.5.2.
Les ME résultant de la DMENO de 335 mg/kg p.c./j varient de 210 000 à 9 300 000. Ces ME sont jugées suffisantes pour lever les incertitudes dans les bases de données sur l’exposition et les effets sur la santé, y compris l’utilisation d’une DMENO comme point de départ. Les ME calculées qui auraient résulté de l’utilisation des DSENO de 30 mg/kg p.c./j ou de 150 mg/kg p.c./j pour l’exposition quotidienne au benzotriazole et au tolyltriazole, respectivement, seraient également jugées adéquates. Les ME découlant de l’utilisation de ces points de départ pour l’exposition ponctuelle à ces 2 substances vont de 940 à 5 600, et sont également jugées adéquates. Les ME découlant de l’utilisation de ces points de départ pour l’exposition ponctuelle à ces 2 substances vont de 940 à 5 600, et sont également jugées adéquates.
| Scénario d’exposition | Exposition estimée (mg/kg p.c./j) | Dose critique (mg/kg p.c./j) | Critères d’effet critiques pour la santé | MEc |
|---|---|---|---|---|
| Milieu environnemental (air), aliments, exposition quotidienne, tout‑petit, benzotriazole | 3,7 × 10‑5 | DMENO = 335 | Tumeurs cérébrales chez les rats mâles, et polypes du stroma endométrial et tumeurs à cellules C de la glande thyroïde chez les femelles | 9 100 000a |
| Stylo à encre liquide, exposition cutanée, exposition quotidienne, tout‑petit, benzotriazole | 1,6 × 10‑3 | DMENO = 335 | Tumeurs cérébrales chez les rats mâles, et polypes du stroma endométrial et tumeurs à cellules C de la glande thyroïde chez les femelles | 210 000a |
| Stylo à encre liquide, voie orale, exposition ponctuelle, tout‑petit, benzotriazole | 0,032 | DSENO = 30 | Effets histopathologiques dans les reins de rats femelles | 940b |
| Produit pour les ongles, exposition cutanée, exposition ponctuelle, adolescent, benzotriazole | 0,027 | DSENO = 30 | Effets histopathologiques dans les reins de rats femelles | 1 100b |
| Milieu environnemental (air) et aliments, exposition quotidienne, tout‑petit, tolyltriazole | 3,6 × 10‑5 | DMENO = 335 | Tumeurs cérébrales chez les rats mâles, et polypes du stroma endométrial et tumeurs à cellules C de la glande thyroïde chez les femelles | 9 300 000a |
| Réparation de système de refroidissement, exposition cutanée, exposition ponctuelle, adulte, tolyltriazole | 0,027 | DSENO = 30 | Réduction de la concentration d’érythrocytes, d’hémoglobine et d’hématocrite chez les mâles, diminution des protéines plasmatiques et augmentation de l’activité de l’ALT et de l’AST chez les mâles et les femelles | 5 600b |
Abréviations : ALT = alanine aminotransférase; AST = aspartate aminotransférase; DMENO = dose minimale entraînant un effet nocif observé; ME = marge d’exposition; DSENO = dose sans effet nocif observé; PdD = point de départ.
a Comme les ME pour chaque groupe d’âge sont jugées adéquates, les valeurs d’exposition n’ont pas été ajustées aux doses journalières moyennes pour la durée de la vie (DJMDV). De tels ajustements entraîneraient des ME plus élevées.
b ME cible = 100 (x 10 pour la variation interspécifique; x 10 pour la variation intraspécifique).
Pour caractériser le risque lié à l’exposition quotidienne par voie orale à l’UV‑329, une DSENO de 0,1 mg/kg p.c./j a été établie d’après des effets critiques sur la santé, notamment des effets sur l’hématologie et la chimie clinique de l’urine, une hypertrophie du foie, une augmentation du poids absolu et relatif du foie, une hypertrophie centro-lobulaire hépatocytaire accompagnée d’éosinophiles avec un cytoplasme granulaire, et une altération des foyers hépatocellulaires chez les rats mâles dans une étude de toxicité chronique par voie orale avec l’UV‑320, selon une approche de lecture croisée. Cette DSENO sert également à caractériser les risques liés à l’exposition quotidienne à l’UV‑329 par voie cutanée. Pour ce qui est de l’exposition cutanée ponctuelle, une DMENO de 0,5 mg/kg p.c./j a été établie d’après des changements dans la biochimie clinique, le poids relatif du foie, une hypertrophie macroscopique du foie, une hypertrophie hépatocytaire, une prolifération des canaux biliaires et une diminution de la fréquence des modifications dans les lipides hépatocellulaires chez les rats mâles, selon une étude par voie orale de 28 jours avec l’UV‑320 avec une approche de lecture croisée. Les ME résultantes, de l’ordre de 360 à 2 000, ont été jugées suffisantes pour lever les incertitudes dans les bases de données sur les effets sur la santé et l’exposition à l’UV‑329.
Pour ce qui est de l’exposition quotidienne par voie orale et cutanée à l’UV‑326, une DSENO de 29,6 mg/kg p.c./j a été établie d’après divers effets, dont la perte de poids sans diminution de la consommation alimentaire dans une étude par voie orale de 13 semaines chez le chien. Pour l’exposition ponctuelle par voie cutanée à l’UV‑326, une DSENO de 1 000 mg/kg p.c./j a été établie d’après les effets sur le développement in utero relevés dans une étude de toxicité pour le développement par voie orale chez la souris. On s’est appuyé sur une étude de toxicité subchronique pour caractériser les risques de l’exposition quotidienne, car la dose ayant provoqué un effet critique dans l’étude de toxicité subchronique était inférieure à la dose observée dans l’étude de toxicité chronique, ce qui est considéré comme une approche prudente. Même si le chien était considéré comme l’espèce la plus sensible dans les études à doses répétées, on a utilisé l’étude chez la souris pour déterminer la toxicité pour le développement, étant donné l’absence d’études de toxicité pour le développement chez le chien. Les ME résultantes, comprises entre 2 500 et 16 000, ont été jugées suffisantes pour lever les incertitudes dans les bases de données sur les effets sur la santé et sur l’exposition pour l’UV‑326.
Pour ce qui est de l’exposition quotidienne par voie orale à l’UV‑234, une DSENO de 2,5 mg/kg p.c./j a été établie d’après une augmentation du poids absolu et relatif du foie, avec des changements histopathologiques connexes dans le foie des femelles à la DMENO de 15 mg/kg p.c./j dans une étude par voie orale de 92 à 94 jours chez le rat. Cette DSENO est également utilisée pour caractériser le risque pour l’exposition ponctuelle à l’UV‑234 par voie cutanée et par inhalation. Les ME résultantes, comprises entre 120 et 5 100, ont été jugées suffisantes pour lever les incertitudes dans les bases de données sur les effets sur la santé et l’exposition à l’UV‑234. La ME pour les expositions ponctuelles (c’est-à-dire la pulvérisation de peinture aérosol protectrice non permanente pour automobiles) est jugée prudente, car l’exposition devrait être due à des situations peu fréquentes et les risques ont été caractérisés d’après une étude de toxicité subchronique dans laquelle l’exposition était quotidienne.
Aucune cancérogénicité n’a été relevée dans les études disponibles relatives aux substances du sous‑groupe des benzotriazoles phénoliques, d’après les données obtenues avec des analogues.
| Scénario d’exposition | Exposition estimée (mg/kg p.c./j) | Dose critique (mg/kg p.c./j) | Critères d’effet critiques pour la santé | ME |
|---|---|---|---|---|
| Aliments, tout‑petit, UV‑329 | 2,5 × 10‑4 | DSENO = 0,1 | Éventail d’effets urinaires et hématologiques et d’effets sur la biochimie du sang, hypertrophie du foie, augmentation du poids absolu et relatif du foie, hypertrophie centro-lobulaire des hépatocytes avec cytoplasme granulaire éosinophile, foyers hépatocellulaires modifiés chez les rats mâles à 0,5 mg/kg p.c./j | 400b |
| Bloc de savon, voie cutanée, exposition quotidienne, nourrisson, UV‑329 | 2,8 × 10‑4 | DSENO = 0,1 | Éventail d’effets urinaires et hématologiques et d’effets sur la biochimie du sang, hypertrophie du foie, augmentation du poids absolu et relatif du foie, hypertrophie centro-lobulaire des hépatocytes avec cytoplasme granulaire éosinophile, foyers hépatocellulaires modifiés chez les rats mâles à 0,5 mg/kg p.c./j | 360b |
| Bloc de savon, voie cutanée, exposition ponctuelle, nourrisson, UV‑329 | 2,5 × 10‑4 | DMENO = 0,5 | Changements dans la biochimie clinique, poids relatif du foie, hypertrophie macroscopique du foie, hypertrophie des hépatocytes, prolifération des canaux biliaires et diminution de la fréquence des changements dans les lipides hépatocellulaires chez les rats mâles | 2 000c |
| Brillant à lèvres, voie orale, exposition quotidienne, tout‑petit, UV‑326 | 1,9 × 10‑3 | DSENO = 29,6 | Perte de poids sans diminution de la consommation alimentaire chez le chien | 16 000b |
| Teintures pour les lèvres et les joues, voie cutanée, exposition quotidienne, adolescent, UV‑326 | 0,012 | DSENO = 29,6 | Perte de poids sans diminution de la consommation alimentaire chez le chien | 2 500b |
| Produit pour les ongles, voie cutanée, exposition ponctuelle, adolescent, UV‑326 | 0,39 | DSENO = 1 000 | Aucun effet observé jusqu’à la dose maximale chez les mères et aucun effet sur le développement des f&oeligtus | 2 600b |
| Aliments, voie orale, exposition quotidienne, tout‑petit, UV‑234 | 4,9 × 10‑4 | DSENO = 2,5 | Augmentation du poids absolu et relatif du foie avec changements histopathologiques connexes dans le foie chez les femelles à 15 mg/kg p.c./j | 5 100b |
| Peinture amovible protectrice en aérosol pour automobiles, voie cutanée, exposition ponctuelle, adulte, UV‑234a | 0,021 | DSENO = 2,5 | Augmentation du poids absolu et relatif du foie avec changements histopathologiques connexes dans le foie chez les femelles à 15 mg/kg p.c./j | 120b |
| Peinture amovible protectrice en aérosol pour automobiles, par inhalation, exposition ponctuelle, adulte, UV‑234a | 4,6 × 10‑3 | DSENO = 2,5 | Augmentation du poids absolu et relatif du foie avec changements histopathologiques connexes dans le foie chez les femelles à 15 mg/kg p.c./j | 540 b |
Abréviations : DMENO = dose minimale entraînant un effet nocif observé; ME = marge d’exposition; DSENO = dose sans effet nocif observé; PdD = point de départ.
a La ME est jugée très prudente, car l’exposition est censée être ponctuelle, et donc se produire très rarement au cours de la vie d’une personne, mais le risque a été caractérisé d’après une étude de toxicité subchronique dans laquelle l’exposition se produisait quotidiennement.
b ME cible = 100 (x 10 pour la variation interspécifique; x 10 pour la variation intraspécifique).
c ME cible = 300 (x 10 pour la variation interspécifique; x 10 pour la variation intraspécifique; x 3 pour l’utilisation d’une DMENO).
Afin de caractériser les risques liés à l’exposition ponctuelle par voie cutanée au n° CAS 80595‑74‑0, une DSENO de 45 mg/kg p.c./j a été établie d’après des effets critiques sur la santé, y compris une diminution de la prise de poids corporel, une réduction du poids du thymus, une atrophie du tissu lymphoïde, et un grade moyen inférieur des foyers hématopoïétiques das la rate des rats femelles dans une étude de toxicité subchronique par voie orale avec le n° CAS 94270‑86‑7, selon une approche de lecture croisée. La ME est jugée prudente, car les expositions sont censées être des événements ponctuels uniques qui se produisent très rarement au cours de la vie d’une personne, mais le risque a été caractérisé d’après une étude de toxicité subchronique dans laquelle l’exposition était quotidienne (tableau 2‑16). La ME résultante de 170 est donc jugée adéquate pour tenir compte des incertitudes dans la base de données sur l’exposition et sur les effets sur la santé pour cette substance.
| Scénario d’exposition | Exposition estimée (mg/kg p.c./j) | Dose critique (mg/kg p.c./j) | Critères d’effet critiques pour la santé | ME |
|---|---|---|---|---|
| Huile de servodirection/hydraulique, voie cutanée, exposition ponctuelle, adulte, n° CAS 80595‑74‑0 | 0,27 | DSENO = 45 | Diminution de la prise de poids corporel. Réduction du poids du thymus, atrophie du tissu lymphoïde, et grade moyen inférieur des foyers hématopoïétiques dans la rate des rats femelles | 170a |
Abréviations : ME = marge d’exposition; DSENO = dose sans effet nocif observé; PdD = point de départ. Incertitudes dans l’évaluation des risques pour la santé humaine
a ME cible = 100 (x 10 pour la variation interspécifique; x 10 pour la variation intraspécifique).
2.5.5 Incertitudes dans l’évaluation des risques pour la santé humaine
Le tableau 2‑16 ci‑dessous présente les principales sources d’incertitude.
| Principale source d’incertitude | Incidence |
|---|---|
| Absence de données de surveillance pour les substances du sous‑groupe des benzotriazoles dans les milieux naturels ambiants au Canada (par exemple, l’eau de surface, l’air), l’eau potable ou le lait maternel. | +/‑ |
| Comme les données canadiennes sur l’occurrence de ces substances étaient limitées, les concentrations de benzotriazole utilisées dans l’évaluation de l’exposition par le régime alimentaire provenaient d’études réalisées à l’étranger. | +/‑ |
| Absence d’études de toxicité chronique ou subchronique chez les animaux par voie cutanée ou par inhalation, et il y a peu d’études de toxicité chronique chez les animaux par voie orale pour les substances du sous‑groupe des benzotriazoles. Il a donc fallu procéder à une extrapolation de voie à voie. | +/‑ |
| Les données empiriques sur les dangers propres aux substances nos CAS 80595‑74‑0 et CAS 94270‑86‑7 sont inexistantes ou limitées. | +/‑ |
+ = incertitude quant au potentiel de surestimation de l’exposition/risque; – = incertitude quant au potentiel de sous‑estimation du risque d’exposition; +/ – = potentiel inconnu de surestimation ou de sous‑estimation du risque.
3. Benzothiazoles
3.1 Identité des substances
Le no CAS, les noms sur la Liste intérieure des substances (LIS) et les noms communs ou abréviations des différentes substances du sous‑groupe des benzothiazoles sont présentés dans le tableau 3‑1.
| No CAS | Nom dans la LIS (nom commun ou abréviation) |
Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 95‑31‑8 | N‑tert‑Butylbenzothiazole-2‑sulfénamide (TBBS) |
 C11H14N2S2 |
238,37 |
| 95‑33‑0 | N‑Cyclohexylbenzothiazole-2‑sulfénamide(CBS) |  C13H16N2S2 |
264,41 |
| 120‑78‑5 | Disulfure de di(benzothiazol‑2‑yle) (MBTS) |
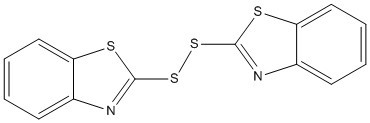 C14H8N2S4
C14H8N2S4 | 332,47 |
| 149‑30‑4 | Benzothiazole‑2‑thiol (2‑mercaptobenzothiazole; MBT) |
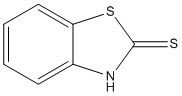 C7H5NS2 |
167,24 |
| 2492‑26‑4 | Sulfure de sodium et de benzothiazol‑2‑yle (SMBT) |
![Structure chimique représentative de la 2(3H)-Benzothiazolethione, sel de sodium, avec notation SMILES : [S-]C1=NC2=CC=CC=C2S1.[Na+]](/content/dam/eccc/images/pded/benzotriazoles-benzothiazoles/20210126-t31e.jpg) C7H4NNaS2 |
189,23 |
| 4979‑32‑2 | N,N‑Dicyclohexylbenzo-thiazole-2‑sulfénamide (DCBS) |
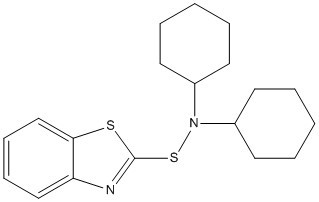 C19H26N2S2 |
346,55 |
3.1.1 Choix des analogues et utilisation de modèles QSAR
Afin d’évaluer les risques pour la santé humaine et l’environnement, on a eu recours à la lecture croisée consistant à exploiter les données sur des analogues et les résultats de modèles QSAR, le cas échéant. Les analogues choisis présentaient une structure ou des fonctionnalités similaires aux substances de ce groupe (toxicocinétique et propriétés physico‑chimiques similaires), et on disposait de données empiriques pertinentes qui pouvaient être reportées par lecture croisée aux substances pour lesquelles on disposait de peu de données empiriques. Ainsi, on a déterminé l’applicabilité des modèles QSAR au cas par cas. Les détails des données de lecture croisée et des modèles QSAR choisis pour étayer les évaluations des risques pour l’environnement et la santé humaine posés par le sous‑groupe des benzothiazoles sont examinés dans les sections pertinentes du présent rapport. Pour évaluer le sous‑groupe des benzothiazoles, on a également employé la lecture croisée s’appuyant sur des ensembles de données plus robustes pour des substances du sous‑groupe.
3.2 Propriétés physiques et chimiques
Un résumé des propriétés physiques et chimiques des substances du sous‑groupe des benzothiazoles est présenté dans le tableau 3‑2.
Quand les données expérimentales pour une propriété d’une substance étaient limitées ou absentes, on a utilisé la méthode de la lecture croisée avec les données provenant d’analogues, ou encore des modèles QSAR pour générer les valeurs prévues pour la substance. Les données expérimentales pour le MBT étaient disponibles, et donc le log Koe et la solubilité dans l’eau du MBT ont été utilisés pour le SMBT. Une valeur expérimentale du log Koe pour le MBTS a été extrait de la base de données EPI Suite à l’aide du logiciel SMILES (c2000‑2012). Pour la pression de vapeur, on a utilisé le résultat médian des prévisions obtenues à l’aide de plusieurs modèles. On a modélisé les valeurs de la constante de la loi d’Henry en utilisant la méthode d’estimation des liaisons de l’EPI Suite (c2000‑2012), avec des intrants expérimentaux (c’est-à-dire la solubilité dans l’eau et le log Koe). Les valeurs du log Kco ont été modélisées à l’aide des modèles KOCWIN (2010) et ACD/Percepta (c1997‑2012), et la valeur médiane a été choisie comme log Kco.
| Propriété | TBBS | CBS | MBTS | MBT | SMBTa | DCBS | Référence(s) |
|---|---|---|---|---|---|---|---|
| Point de fusion (°C) |
108 | 93‑100 | 180 | 180 | 180 | 99 | HSDB 1983‑2017 |
| Pression de vapeur (Pa) |
6,12 × 10‑5 | < 4,53 × 10‑5 | 8,28 × 10‑8 | 2,60 × 10‑8 | 2,60 × 10‑8 | < 1 × 10‑5 | MPBPWIN 2010; MPBPWIN 2010; EC 2008; ECHA c2007‑2019; CompTox 2018 |
| Constante de la loi d’Henry (atm·m³/mol) |
8,47 × 10‑10 | 6,58 × 10‑10 | 2,34 × 10‑13 | 3,63 × 10‑8 | 3,63 × 10‑8 | 2,63 × 10‑9 | HENRYWIN 2008 |
| Solubilité dans l’eau (mg/L) |
1,23 | 0,32 | <0,05 | 118 | 118 | 1,9 × 10‑3 | ECHA c2007‑2019; HPVIS c1998‑2017 |
| Log Koe (sans dimension) |
4,67 | 5,0 | 4,66 | 2,41 | 2,41 | 5,5 | KOWWIN 2010; HSDB 1983‑2017; EPI Suite c2000‑2012b; CompTox 2018; ECHA c2007‑2019 |
| Log Kco (sans dimension) b |
4,06 | 4,13 | 5,21 | 2,51 à 3,13 | 2,51 à 3,13 | 4,82 | Médiane des modèles KOCWIN 2010; ACD/Percepta c1997‑2012; ECHA c2007‑2019 |
| Log Koa (sans dimension) |
12,13 | 11,04 | 13,43 | 8,24 | 8,24 | 11,77 | KOAWIN, 2010 |
| pKa (sans dimension) |
1,3 | 0,6 | 2,7 | 6,9 | 6,9 | 0,4 | ACD/Percepta c1997‑2012 |
Abréviations : Koe = coefficient de partage octanol‑eau; Kco = coefficient de partage carbone organique‑eau; Koa = coefficient de partage octanol‑air; pKa = constante de dissociation des acides.
a Les valeurs du MBT ont été utilisées par lecture croisée et appliquées au SMBT.
b Approche expérimentale d’ajustement des valeurs, à l’aide de la valeur empirique du log Koe pour le CBS (EPI Suite c2000‑2012).
Le MBT et le SMBT sont des substances polaires et donc solubles. Elles devraient s’ioniser à environ 50 % à un pH de 6,9, d’après la valeur pKa (ACD/Percepta c1997‑2018). En revanche, le MBTS est peu soluble en raison de la liaison disulfure qui, effectivement, ne produit aucun moment dipolaire net. La valeur pKa modélisée de 2,4 indique que dans des conditions très acides, cette substance se chargera positivement par protonation de l’azote du cycle thiazole (ACD/Percepta c1997‑2012). À un pH pertinent à l’environnement, le MBTS sera principalement présent sous sa forme neutre. Le TBBS, le DCBS et le CBS ont une très faible solubilité dans l’eau en raison de leurs caractéristiques structurelles propres aux molécules non polaires (groupements diméthyle, dicyclohexyle et cyclohexyle, respectivement), et seront neutres aux pH ambiants dans l’environnement.
3.3 Sources et utilisations
Les substances du sous‑groupe des benzothiazoles (par exemple, le MBT provenant d’une bactérie marine) devraient rarement être présentes à l’état naturel (EC 2008). Toutes les substances du sous‑groupe des benzothiazoles ont été incluses dans une enquête menée en vertu d’un avis émis conformément à l’article 71 de la LCPE (Canada 2017). Le tableau 3‑3 présente un résumé des renseignements fournis sur les quantités totales fabriquées et importées pour le sous‑groupe des benzotriazoles. Aucune activité de fabrication ou d’importation n’a été déclarée pour l’UV‑320 ou le n° CAS 80595‑74‑0 au‑dessus du seuil de déclaration de 100 kg.
| Substance | Quantité totale fabriquéea (kg) | Quantité totale importéea (kg) |
|---|---|---|
| TBBS | N.R.b | 100 000 à 1 000 000 |
| CBS | N.R.b | [100 000 à 1 000 000] 1 000 000 à 10 000 000c |
| MBTS | N.R.b | 100 000 à 1 000 000 |
| MBT | N.R.b | 10 000 à 100 000 |
| SMBT | N.R.b | 10 000 à 100 000 |
| DCBS | N.R.b | 100 000 à 1 000 000 |
a Les valeurs représentent les quantités déclarées en réponse à une enquête menée en vertu de l’article 71 de la LCPE (ECCC 2018). Voir l’enquête pour les inclusions et exclusions particulières (annexes 2 et 3).
b N.R. = La substance indiquée n’a pas été fabriquée en une quantité supérieure au seuil de déclaration de 100 kg.
c Valeur mise à jour, remplaçant les quantités importées déclarées initialement lors d’une enquête menée en vertu de l’article 71 de la LCPE, afin de tenir compte des données additionnelles fournies par les intervenants jusqu’en septembre 2021 (collecte volontaire de données sur les benzothiazoles, ECCC, 2021; sans référence).
Le tableau 3‑4 présente un résumé des principales utilisations des substances du sous‑groupe des benzothiazoles dans les produits commerciaux et les produits disponibles aux consommateurs au Canada, selon les renseignements fournis en réponse à une enquête menée en vertu de l’article 71 de la LCPE (ECCC 2018). D’autres utilisations ont été déclarées, mais il s’agissait de renseignements commerciaux confidentiels. Nous avons pris en compte ces autres utilisations dans l’évaluation des risques, bien qu’elles ne figurent pas ici.
| Principales utilisationsa | TBBS | CBS | MBTS | MBT | SMBT | DCBS |
|---|---|---|---|---|---|---|
| Automobiles, aéronefs et transport | N | N | O | O | N | N |
| Nettoyage et entretien des meubles | N | N | N | O | N | N |
| Lubrifiants et graisses | N | N | N | N | O | N |
| Matériaux métalliques | N | N | O | N | N | N |
| Matériaux en caoutchouc | O | O | O | O | N | O |
| Autre | N | N | N | O | Ob | N |
Abréviations : O = oui, une utilisation a été déclarée pour cette substance, N = non, aucune utilisation n’a été déclarée pour cette substance, ou son utilisation est considérée comme un renseignement confidentiel.
a Utilisations non confidentielles déclarées en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Canada 2017). Voir l’enquête pour les inclusions et exclusions particulières (annexes 2 et 3).
b Substance utilisée comme réactif de flottation ou agent moussant dans l’industrie minière.
Le MBT, le MBTS, le CBS, le TBBS et le DCBS sont utilisés comme agents de vulcanisation dans la fabrication de pneus et d’autres produits en caoutchouc, et ils représentaient 97 % des quantités totales importées en 2015 (ECCC 2018; collecte de données sur les benzothiazoles à participation volontaire, ECCC 2021, sans référence). Le SMBT est utilisé comme inhibiteur de corrosion dans les lubrifiants et comme agent de flottation dans certains sous‑secteurs de l’industrie minière, et la quantité combinée pour ces utilisations était égale à 2 % de la quantité totale importée en 2015 (Canada 2018). En 2015, le 1 % restant de la quantité totale importée des substances du sous‑groupe des benzothiazoles a été utilisé dans d’autres applications, notamment dans la fabrication de véhicules à moteur et de pièces automobiles, dans des produits de nettoyage et d’entretien de meubles, pour le traitement de l’eau et autres (ECCC 2018). À la lumière des déclarations présentées à Santé Canada en vertu du Règlement sur les cosmétiques, la présence dans les cosmétiques des substances du sous‑groupe des benzothiazoles n’a pas été déclarée (communication personnelle, courriels de la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, au BERSE, Santé Canada, 2017, 2018; sans référence).
Par le passé, certaines substances du sous‑groupe des benzothiazoles ont été homologuées comme principe actif dans des produits antiparasitaires au Canada ou figuraient sur la Liste des produits de formulation de l’ARLA. Toutefois, aucune de ces substances n’a été déclarée dans les produits antiparasitaires actuellement homologués au Canada (communication personnelle, courriels de l’ARLA, de Santé Canada, au BERSE, de Santé Canada, 2017, 2018; sans référence).
Certaines substances du sous‑groupe des benzothiazoles peuvent être utilisées comme composants dans la fabrication de matériaux d’emballage alimentaire ou comme composants des additifs indirects utilisés dans les établissements de transformation des aliments et pouvant entrer en contact, à des degrés divers, avec les aliments (communication personnelle, courriels de la Direction des aliments, de Santé Canada, au BERSE, de Santé Canada, 2017, 2018; sans référence). Le TBBS peut être utilisé comme matière première dans la fabrication de certains joints de fûts ou de couches extérieures de tuyaux destinés à des utilisations avec contact avec des aliments. Le MBTS peut être utilisé comme composant dans des élastiques susceptibles d’entrer en contact avec des aliments, des revêtements extérieurs en caoutchouc pour des tuyaux flexibles destinés au transfert d’aliments, et des joints en caoutchouc pour les couvercles de fûts en polyéthylène pouvant également entrer en contact direct, bien que minime, avec les aliments. Le MBT peut être utilisé comme matière première dans la fabrication de gants destinés à être utilisés en contact avec des aliments, ainsi que dans un revêtement utilisé pour apprêter l’intérieur des fermetures métalliques trouvant des applications dans les emballages alimentaires. En outre, le MBT peut être utilisé dans divers produits de nettoyage destinés à être employés sur des surfaces en contact ou non avec des aliments, ainsi que dans des produits d’entretien de surfaces n’entrant pas en contact avec les aliments, des produits de nettoyage et de traitement des eaux de refroidissement et d’autoclave sans contact avec des aliments, et dans du détergent pour lave‑vaisselle dont l’utilisation est suivie d’un rinçage complet à l’eau potable. Le SMBT peut être utilisé comme composant d’un auxiliaire de traitement utilisé pour la fabrication du papier et du carton. En outre, le SMBT est utilisé comme composant d’un nettoyant dont l’utilisation est suivie d’un rinçage complet à l’eau potable, dans les systèmes de recirculation d’eau ouverts et fermés dans lesquels l’eau n’entre pas en contact avec les aliments, et dans les systèmes de chaudière dans lesquels la substance n’entre pas en contact avec les aliments.
Le CBS, le MBTS et le MBT figurent dans la BDIPSN en tant que produits non PSN, mais ils ne figurent pas dans la BDPSNH comme substances présentes dans des PSN actuellement homologués au Canada. Le TBBS, le SMBT et le DCBS ne figuraient ni dans la BDIPSN ni dans la BDPSNH (BDPSNH [modifié en 2023]; BDIPSN [modifié en 2023]; communication personnelle, courriel de la DPSNSO, de Santé Canada, au BERSE, de Santé Canada, 2017, 2018; sans référence). Aucune des substances du sous‑groupe ne figure dans des produits médicinaux actuellement homologués (communication personnelle, courriel de la Direction des produits thérapeutiques, Santé Canada, au BERSE, Santé Canada, 2017, 2018; sans référence).
D’autres renseignements sur l’utilisation des substances du sous‑groupe des benzothiazoles ont été trouvés dans des données publiques. Étant donné que la fonction des benzothiazoles est souvent d’accélérer la vulcanisation du caoutchouc, on s’attend à ce que ces substances soient utilisées dans divers produits en caoutchouc, y compris les produits disponibles aux consommateurs (par exemple, Danish EPA 2003; EC 2008; ECHA 2014a; OCDE 2003, 2004a, 2008). La présence du MBT dans les sucettes pour bébé a fait l’objet d’un examen dans la littérature scientifique internationale examinée par les pairs et cette substance a été détectée dans quelques échantillons. La présence du MBT a été détectée dans un échantillon de caoutchouc naturel sur 19, dans des sucettes achetées aux Pays‑Bas (Bouma et al. 2003) et 2 sucettes pour bébé ont montré une migration vers l’eau et les simulants alimentaires acides après 24 heures (Danish Institute for Food Inspection et Nutrition, Danish Department for Food, 1999, cité dans EC 2005). Dans une étude réalisée en 2018 par Santé Canada sur les sucettes en caoutchouc disponibles sur le marché canadien (n = 20), on n’a trouvé aucune concentration de MBT supérieure à la limite de quantification (LQ) de 10 mg/kg (communication personnelle, courriels de la Direction de la Sécurité des produits de consommation et des produits dangereux, Santé Canada, au BERSE, Santé Canada, 2017, 2018; sans référence). Le MBT, le MBTS, le CBS et d’autres benzothiazoles ont été détectés sur des terrains en gazon synthétique comportant des granulés de caoutchouc (RIVM 2017). Des études ont également signalé la présence de certains benzothiazoles dans les textiles (Liu et al. 2017; Rovira et Domingo 2019). Le SMBT peut être utilisé comme inhibiteur de corrosion et serait employé dans les produits automobiles (Ash 2001; SDS 2011).
3.4 Rejets dans l’environnement
Des rejets de MBT ont été déclarés à l’Inventaire national des rejets de polluants (INRP) par 6 entreprises entre 2003 et 2019. Les quantités déclarées de rejets annuels variaient entre 0,001 tonne et 6,69 tonnes et il s’agissait principalement de rejets de particules dans l’air. La fabrication de pneus et d’autres produits en caoutchouc était la principale source des rejets déclarés à l’INRP. Les substances du sous‑groupe des benzothiazoles peuvent être rejetées dans l’eau par les installations qui les utilisent dans la préparation ou la fabrication de produits (par exemple, les pneus et les produits en caoutchouc). Comme il est mentionné à l’annexe G, on s’attend à ce que le CBS, le TBBS et le DCBS s’hydrolysent en MBT dans les milieux aqueux ou soient rejetés sous forme de MBT en raison de leur profil d’emploi. En outre, les renseignements figurant dans une note technique (NOCIL, [date inconnue]) indiquent que l’utilisation industrielle du MBTS entraînera la réduction du disulfure en MBT. Par conséquent, le CBS, le TBBS, le DCBS et le MBTS seront considérés comme des substances contribuant à la présence du MBT ou comme des précurseurs du MBT. Ces substances peuvent être rejetées dans l’environnement directement en raison de l’usure des pneus (pneus en service et en fin de vie), ainsi que par certaines activités dans l’industrie minière. Les rejets indirects peuvent résulter de l’épandage sur le sol de biosolides provenant des systèmes de traitement des eaux uséesNote de bas de page 5 (STEU) qui reçoivent des eaux usées contenant des substances du sous‑groupe des benzothiazoles. Les caractéristiques des STEU détermineront en définitive le comportement des benzothiazoles en termes de dégradation et de répartition entre les effluents et les boues d’épuration. Toutefois, les propriétés physico‑chimiques du MBTS (valeur estimée du log Kco = 5,21) indiquent qu’il se répartira dans les boues, et, selon les conditions de l’eau, une fraction du MBT et du SMBT se répartira également dans les boues. Enfin, l’utilisation de substances du sous‑groupe des benzothiazoles dans les lubrifiants pourrait également entraîner des rejets dans l’environnement.
3.5 Devenir et comportement dans l’environnement
3.5.1 Distribution dans l’environnement
Les substances du sous‑groupe des benzothiazoles devraient contribuer à augmenter l’exposition au groupement MBT dans l’environnement. Par conséquent, les données pour le MBT seront prises en compte pour établir le devenir de tous les benzothiazoles, sauf indication contraire.
Si des substances du sous‑groupe des benzothiazoles étaient rejetées dans l’air, elles devraient s’associer à la phase particulaire et se sédimenter par des processus de dépôt humide ou sec. Le sous‑groupe est caractérisé par une pression de vapeur négligeable et de faibles valeurs de la constante de la loi d’Henry. Ces propriétés font en sorte que la volatilisation serait négligeable à partir des surfaces du sol et des eaux de surface et, par conséquent, qu’il ne devrait pas y avoir de transport atmosphérique à grande distance. Cependant, l’utilisation des benzothiazoles, en particulier dans les pneus, peut contribuer à leur présence dans les particules en suspension dans l’air (Johannessen et al. 2022a). Par exemple, des analyses semi‑quantitatives d’extraits obtenus avec des échantillonneurs d’air passifs mis en place dans 18 grandes villes dans le monde ont montré que les concentrations totales variaient de 0,17 à 136 pg/m³ pour le benzothiazole et 3 de ses dérivés (Johannessen et al. 2022b).
S’il est rejeté dans l’eau, le MBTS devrait se répartir dans les sédiments en raison de sa faible solubilité dans l’eau et de sa valeur log Kco élevée. Étant donné leur solubilité modérée dans l’eau et leur log Kco modérément élevé, le MBT et le SMBT devraient rester principalement dans le compartiment eau. Cependant, comme le MBT et le SMBT sont ionisables, la forme non ionisée moins soluble du MBT et du SMBT peut également être sorbée sur les particules en suspension et les sédiments de fond. Ni et al. (2008) ont constaté que le MBT se répartit entre la phase aqueuse et les particules en suspension. Il est donc possible que le MBT se dépose sur les sédiments lorsqu’il est sorbé sur les particules en suspension.
Étant donné que le MBT est très stable dans l’eau, son potentiel de transport à grande distance dans l’eau a été évalué à l’aide du modèle Transport and Persistence Level III Model (TaPL3 2003), sa forme neutre étant utilisée comme substance modèle. Zarfl et al. (2011) ont proposé un seuil de distance de transport caractéristique de 5 200 km pour définir les substances organiques ayant un grand potentiel de transport à grande distance dans l’eau. La distance de transport prévue pour le MBT était bien supérieure à 5 200 km, en supposant une rivière ayant un courant de 3,6 km/h et une profondeur de 20 m ou 5 m (les 2 scénarios modélisés ont donné des conclusions similaires). Par conséquent, les rejets de MBT dans une rivière entraîneraient probablement un transport sur toute la longueur de la rivière, et la dilution plutôt que la dégradation serait le principal facteur affectant les concentrations pouvant donner lieu à une exposition (Mackay et al. 2014). On s’attend à une exposition à proximité des points de rejet locaux, jusqu’à une certaine distance.
Lorsqu’elles sont rejetées dans le sol, les substances du sous‑groupe des benzothiazoles devraient être relativement immobiles et demeurer dans le sol. Dans le cas du MBTS, cela est dû en grande partie à sa faible solubilité dans l’eau et à sa valeur de log Kco élevée. Selon la modélisation faite avec le logiciel EQuilibrium Criterion (EQC), le MBT et le SMBT resteraient dans le sol (voir le tableau 3‑5), en raison de leur valeur modérée de log Kco. De plus, l’étude de Ni et al. (2008) indique que le MBT neutre sera sorbé sur les particules.
| Substance rejetée dans : | Air (%) | Eau (%) | Sol (%) | Sédiments (%) |
|---|---|---|---|---|
| Air (100 %) | 9,1 × 10‑4 | 9,2 | 91 | 6,0 × 10‑2 |
| Eau (100 %) | 1,5 × 10‑2 | 99 | 0,13 | 0,77 |
| Sol (100 %) | 1,0 × 10‑2 | 7,8 | 92 | 6,0 × 10‑2 |
3.5.2 Persistance dans l’environnement
Selon les données disponibles, le MBT est considéré comme une substance persistante. Le TBBS et le MBTS se dégraderont pour former du MBT dans l’environnement, le SMBT se dissociera dans l’eau pour produire du MBT et des ions sodium, et le CBS s’hydrolysera en benzothiazole et en MBT. Le DCBS n’est pas persistant dans l’eau, car il s’hydrolyse pour former du MBT et de la dicyclohexylamine. Toutefois, le DCBS peut être persistant dans le sol.
L’analyse de la dégradation biotique et abiotique des benzothiazoles s’est appuyée sur des études trouvées dans la littérature scientifique et sur des logiciels de modélisation de l’environnement. Dans un article de synthèse, De Wever et Verachtert (1997) indiquent que le MBT pourrait être méthylé pour former du 2‑méthylthiobenzothiazole (MTBT) ou photolysé pour donner du benzothiazole ou du 2‑hydroxybenzothiazole. Le taux de dégradation dans les milieux naturels est inconnu. Brownlee et al. (1992) ont étudié la méthylation du MBT. Cependant, ils ont constaté après analyse que le taux de transformation du MTBT était de 2 %. Une analyse plus poussée des produits de la photolyse, dans l’étude de De Wever et Verachtert (1997), indique qu’il y a production de benzothiazole et de 2‑hydroxybenzothiazole. Les taux de transformation rapportés pour chacun d’eux étaient faibles, la fourchette la plus élevée étant de 28 % à 47 % pour le benzothiazole. Liao et al. (2018) ont indiqué que les benzothiazoles subissent une dégradation chimique, biologique et photolytique dans l’environnement, créant ainsi divers produits de transformation.
Selon le modèle BIOWIN (2010), le MBT ne se biodégrade pas facilement, mais de plus il ne résiste pas à la biodégradation, ce qui est conforme à EC (2008). De plus, selon EC (2008), le MBT serait persistant. La dégradation du MBT dépendra de l’environnement auquel il est exposé (par exemple, la photolyse ne peut se produire qu’en présence de lumière). La modélisation à l’aide du logiciel OASIS Catalogic prévoit que les demi‑vies de biodégradation du MBT seront de l’ordre de quelques années (CATALOGIC 2014). Par conséquent, le MBT est considéré comme persistant et il existe un potentiel d’exposition chronique.
On s’attend à ce que plusieurs des autres benzothiazoles visés par la présente évaluation subissent une dégradation abiotique en MBT, totalement ou partiellement (voir l’annexe G pour de plus amples informations), par des réactions telles que l’hydrolyse ou la réduction. D’après les renseignements trouvés dans les dossiers de l’ECHA sur le TBBS, le DCBS et le MBTS (EC 2008; ECHA c2007‑2019), ces substances se dégraderont dans l’eau pour former du MBT dans l’environnement. Plus particulièrement, EC (2008) a précisé que le MBTS s’hydrolyse en MBT en quelques jours, bien qu’on ait rapporté que, dans certaines conditions, l’hydrolyse ne se produit pas ou se produit plus lentement. Le CBS s’hydrolyse à la fois en benzothiazole et en MBT (ECHA c2007‑2019; ChemRisk LLC 2010). Le DCBS s’hydrolyse dans l’eau pour former du MBT et de la dicyclohexylamine, dont les demi‑vies d’hydrolyse sont comprises entre 58 et 82 heures à un pH de 4 à 9 (EC 2018). Toutefois, on estime que le DCBS est persistant dans le sol. Dans une étude réalisée conformément à la Ligne directrice 307 de l’OCDE, le DCBS radiomarqué au 14C a présenté une dégradation limitée en 120 jours à 12 °C, le taux de radioactivité diminuant à 75 % à 87 % de sa concentration initiale, et les demi‑vies étaient comprises entre 315 et 615 jours (EC 2018; ECHA c2007‑2019).
Le tableau 3‑6 résume les résultats de la modélisation, avec le logiciel OASIS Catalogic, de la biodégradation des substances du sous‑groupe des benzothiazoles.
| Substance | Demi‑vie de biodégradation dans l’eau (jours) | Demi‑vie de biodégradation dans le sol (jours)a | Demi‑vie de biodégradation dans les sédiments (jours)a |
|---|---|---|---|
| MBTS | 2 415b | 2 415 | 9 663 |
| MBT | 1 930 | 1 930 | 7 222 |
| SMBT | 1 930 | 1 930 | 7 222 |
sup>aLa biodégradation dans le sol et les sédiments est déterminée selon l’approche de Boethling; t1/2(eau) = t1/2(sol) = 4 t1/2(sédiments)/4 (Boethling et al. 1995).
bDonnées empiriques d’après la base d’apprentissage d’OASIS Catalogic (CATALOGIC 2014).
3.5.3 Potentiel de bioaccumulation
Selon les données disponibles, les substances du sous‑groupe des benzothiazoles sont peu susceptibles de se bioaccumuler. Le MBT et le SMBT ont une solubilité modérée dans l’eau et des valeurs log Koe de 2,41, ce qui indique un faible potentiel de bioaccumulation. Le MBTS a une valeur log Koe de 4,21 et une faible solubilité dans l’eau. Cependant, on suppose que le MBTS se dégradera en MBT, de sorte qu’il est peu probable que le MBTS se bioaccumule. Selon les données empiriques présentées dans l’évaluation européenne des risques pour le CBS (EC 2008), le MBTS a un très faible potentiel de bioaccumulation avec des facteurs de bioconcentration (FBC) rapportés compris entre 1,0 et 51 L/kg. Les facteurs de bioaccumulation (FBA) modélisés d’après les scénarios de FBC les plus défavorables pour le MBT et le MBTS indiquent également que les substances du sous‑groupe des benzothiazoles ont un faible potentiel de bioaccumulation. Cela est attribuable au faible log Koe du MBT, ce qui indique qu’il ne devrait pas être absorbé dans les tissus adipeux, en plus de sa biotransformation rapide (BCFBAF 2010). L’affinité du MBT pour les phospholipides (c’est-à-dire le partage membrane‑eau) devrait également être faible, compte tenu de son log Koe relativement faible. Comme le MBTS devrait se dégrader en MBT, il présentera des caractéristiques de bioaccumulation similaires.
Les données concernant la bioaccumulation du DCBS sont contradictoires. Dans un essai de bioaccumulation correspondant à la Ligne directrice 305C de l’OCDE, le poisson Cyprinus carpio a été exposé au DCBS à des concentrations variant de 0,01 µg/L à 1 mg/L pendant 6 à 10 semaines, et des FBC de 15 à 7 310 ont été établis (ECHA c2007‑2019). À la lumière de cette étude, l’ECHA a classé le DCBS comme substance fortement accumulable dans les organismes vivants, classement assorti de quelques incertitudes. Par exemple, les auteurs ont cité une étude de surveillance réalisée au Japon dans laquelle on n’a trouvé aucun DCBS (< 4,4 µg/kg) dans un biote composé de poissons et de moules, ce qui semble indiquer que la bioaccumulation dans un milieu réel pourrait être limitée, et donc donner lieu à des quantités négligeables de résidus dans les organismes aquatiques. Les FBC et les FBA prévus, modélisés à l’aide des logiciels BCFBAF (2010) et OPERA (Mansouri et al. 2018), étaient compris entre 60 et 1 977 L/kg, mais les cotes de confiance étaient faibles. On ignore donc dans quelle mesure le DCBS pourrait s’accumuler dans les organismes aquatiques.
Le tableau 3‑7 résume les principales données concernant la bioconcentration du sous‑groupe des benzothiazoles dans les organismes aquatiques.
| Substance | Organisme d’essai | kma (1/j, poissons de 10 g) | Concentration expérimentale | FBC (L/kg) | FBAb (L/kg) | Référence (FBC) |
|---|---|---|---|---|---|---|
| MBTS | QSAR (Pimephales promelas) |
N.D. | N.D. | 1 330 | N.D. | EC 2008 |
| MBTS | Cyprinus carpio | 5,07 | 0,2 | 1,0‑7,2 | N.D. | EC 2008, OCDE 2003 |
| MBTS | C. carpio | 5,07 | 0,02 | < 1,4‑51 | 52c | EC 2008, OCDE 2003 |
| MBT | C. carpio | 10,38 | 0,1 | < 0,8 | N.D. | EC 2008 |
| MBT | C. carpio | 10,38 | 0,01 | < 8,0 | 8,3c | EC 2008 |
| DCBS | C. carpio | N.D. | 0,0001 | 3 380‑7 310 | N.D. | ECHA c2007‑2019 |
| DCBS | C. carpio | N.D. | 1 | 15‑80 | N.D. | ECHA c2007‑2019 |
Abréviations : FBA = facteur de bioaccumulation (L/kg); FBC = facteur de bioconcentration (L/kg); km = constante du taux de biotransformation (1/j); N.D. = non déterminé.
a D’après BCFBAF 2010.
b Valeur calculée en utilisant le modèle cité dans Arnot et al. 2008a, 2008b.
c Valeur calculée pour les poissons de niveau trophique moyen d’après la détermination par bilan massique du taux de métabolisation d’après l’étude empirique du FBC (Arnot et al. 2008a, 2008b).
3.6 Potentiel d’effets nocifs pour l’environnement
3.6.1 Évaluation des effets sur l’environnement
3.6.1.1 Mode ou mécanisme d’action
Comme il est indiqué dans l’approche de la CRE (ECCC 2016a; 2016b), le mode d’action (MdA) a été établi selon plusieurs approches QSAR. Plus précisément, le profileur Verhaar, le profileur de mode d’action d’OASIS et le logiciel ASTER ont été utilisés pour caractériser le mode d’action des substances du sous‑groupe des benzothiazoles.
Selon les profileurs Verhaar et ASTER, le MBTS a un mode d’action (réactivité basée sur les sulfhydryles dans le cas d’ASTER), tandis que le profileur OASIS indique que toutes les substances du sous‑groupe des benzothiazoles ont des modes d’action non narcotiques.
Malgré quelques écarts entre la modélisation du MdA du MBT et de celui du SMBT, les études indiquent que ces substances ont des MdA spécifiques avec les acides nucléiques et les protéines. En outre, on a indiqué que les benzothiazoles ont une activité biologique à large spectre (Liao et al. 2018). Par exemple, on a démontré que le MBT inhibe une variété d’enzymes, notamment la tyrosinase, la lactate déshydrogénase et les enzymes du glutathion, ou entrave leur activité (Choi et al. 2007; De Wever et al. 1994; Stephensen et al. 2005). On a également constaté que le MBT nuit à la chaîne respiratoire par son interaction avec les flavoprotéines (De Wever et al. 1994).
Les recherches montrent que le MBT inhibe la thyroperoxydase (TPO) chez les poissons et les grenouilles; des effets ont également été observés dans les microsomes de la glande thyroïdienne de rats lors d’un test de détection à haut débit à plusieurs étapes (Friedman et al. 2016; Nelson et al. 2016; Stinckens et al. 2016; Tietge et al. 2013). Selon Friedman (2016), l’inhibition de la TPO peut entraîner une diminution de la synthèse d’hormones thyroïdiennes et, en fin de compte, des effets indésirables, notamment un dysfonctionnement neurologique. Nelson et al. (2016) et Stinckens et al. (2016) ont examiné cette voie d’effets indésirables, et ils ont trouvé que le MBT inhibe la TPO chez Pimephales promelas et Danio rerio, entraînant une réduction des taux d’hormones thyroïdiennes, qui se manifestait par un retard du gonflement de la vessie natatoire antérieure chez les 2 espèces. Ces critères d’effet ont été associés à la liaison ADN/protéine, notamment les valeurs de la CE50 causant une réduction de la pigmentation dans l’œil et le corps, et une malformation de la bouche (Stinckens et al. 2016). Miyata et Ose (2012) ont également démontré que le développement des amphibiens peut être sensible aux modifications de l’homéostasie de la glande thyroïde, tout comme Tietge et al. (2013), qui ont montré que le MBT inhibe la voie des hormones thyroïdiennes chez Xenopus laevis. Ces auteurs ont utilisé des protocoles d’essai de 7 et 21 jours pour évaluer les effets sur la métamorphose et la glande thyroïde, démontrant éventuellement que le MBT perturbe la fonction thyroïdienne chez les amphibiens.
Enfin, les travaux de Zeng et al. (2016) concernant les effets de 12 benzothiazoles (dont le MBT et le MBTS) sur les lignées cellulaires de Oncorhynchus mykiss ont montré que le MBT induit des dommages à l’ADN, mais uniquement à des concentrations qui provoquent une perte de viabilité cellulaire de plus de 30 %. La même étude de Zeng et al. n’a révélé aucun effet dû à l’exposition au MBTS en ce qui concerne la cytotoxicité ou la génotoxicité. Cependant, l’exposition au MBTS induisait des dommages génétiques dans les cellules de mammifères (BUA 1993).
En résumé, les études in vitro et in vivo publiées dans la littérature scientifique, ainsi que le MdA établi par la méthode QSAR, indiquent de façon constante que le MBT se lie aux protéines et à l’ADN, et entrave ainsi le système endocrinien des organismes aquatiques. Étant donné que tous les membres du sous‑groupe des benzothiazoles sont probablement des précurseurs du MBT, les effets décrits ci‑dessus sont applicables à l’ensemble du sous‑groupe aux fins de l’évaluation des effets sur l’environnement.
3.6.1.2 Effets sur les organismes aquatiques
Les études disponibles sur les risques des benzothiazoles pour l’environnement comprennent des données sur les poissons, les invertébrés et les algues. Les résultats importants comprennent ceux qui sont présentés dans l’évaluation européenne des risques (EC 2008), Nawrocki et al. (2005) et Stinckens et al. (2016). Nous avons également consulté les rapports de l’American Chemistry Council (ACC 2001), l’ensemble de données de l’OCDE sur le N‑tert‑butylbenzothiazole‑2‑sulfénamide (OCDE 2003) et le document de caractérisation des dangers de l’EPA sur le benzothiazole et les thiazoles à base de morpholine (US EPA 2010). L’annexe H contient plus de détails sur les effets.
Les effets du MBT sur les premiers stades de vie d’O. mykiss ont été caractérisés conformément à la Ligne directrice no 203 (LD 203) de l’OCDE et à la norme d’essai no 797.1600 de la TSCA (EC 2008; ECHA c2007‑2019). Les résultats de ces études sont présentés dans le tableau 3‑8. Dans un essai réalisé selon la LD 203 de l’OCDE, des spécimens d’O. mykiss juvéniles ont été exposés au MBT dans un système à écoulement continu, et les concentrations mesurées ont été utilisées pour déterminer la CL50. Dans un autre essai en écoulement continu, des spécimens d’O. mykiss (60 jours après l’éclosion) ont été exposés au MBT pendant 89 jours, la longueur des larves ayant été l’indicateur le plus sensible à partir duquel la concentration minimale entraînant un effet observé (CMEO) et la concentration sans effet observé (CSEO) ont été déterminées (0,078 mg/L et 0,041 mg/L, respectivement). Stinckens et al. (2016) ont décrit un essai de toxicité aiguë sur des embryons de poissons réalisé selon les lignes directrices de l’OCDE avec D. rerio, pour caractériser la perturbation des hormones thyroïdiennes résultant de l’exposition au MBT (voir le tableau H‑1).
Tietge et al. (2013) ont étudié les effets du MBT sur X. laevis en utilisant des protocoles de 7 jours et de 21 jours pour évaluer les critères d’effet relatifs à l’histologie et au fonctionnement de la glande thyroïde. Des effets sur la glande thyroïde ont été constatés même aux plus faibles concentrations d’essai, notamment une diminution des hormones thyroïdiennes T3 et T4 à 18 µg/L. Un retard dans le développement métamorphique a été constaté à des concentrations plus élevées (0,11 mg/L et plus; voir le tableau H‑1). Des données sur les effets du MBT sur les invertébrés aquatiques ont été trouvées dans le rapport d’évaluation des risques de l’UE pour le CBS (EC 2008), Nawrocki et al. (2005), et dans la base de données des substances homologuées en Europe (ECHA c2007‑2019). Les critères d’effet trouvés dans ces études sont cohérents : les concentrations médianes produisant un effet aigu étaient dans la plage de 1 à 16 mg/L, et les CSEO aiguë et chronique étaient de 0,84 mg/L et 0,24 mg/L, respectivement (tableau 3‑8).
Plusieurs études sur les algues ont été trouvées dans les rapports publiés (EC 2008; ACC 2001; OCDE 2003; US EPA 2010). Ces données montrent des effets dans la plage de 0,1 à 1 mg/L. Cependant, ces études n’étaient pas disponibles pour examen et par conséquent Santé Canada n’a tenu compte de ces critères d’effet pour établir les concentrations estimées sans effet (CESE). L’étude sur Selenastrum capricornutum figurant dans le tableau H‑1 a été prise en compte pour la détermination du facteur d’évaluation afin d’éclairer les variations selon l’espèce, car l’évaluation des risques de l’UE (EU RAR 2008) contenait suffisamment de détails pour conclure que cette étude était acceptable. Toutefois, les détails n’étaient pas suffisants pour en permettre un examen indépendant.
Les essais empiriques portant sur le MBTS dans la base de données de l’ECHA (données non présentées) n’indiquent aucun effet à des concentrations bien supérieures à la limite de solubilité dans l’eau. La très faible solubilité du MBTS ainsi que le log Kco élevé semblent indiquer que le MBTS ne serait pas présent dans le milieu aquatique à des concentrations élevées (la valeur rapportée de la solubilité dans l’eau étant < 50 µg/L).
Pour caractériser les effets du sous‑groupe des benzothiazoles, la CSEO chronique sur 89 jours de 0,041 mg/L pour la croissance des larves d’O. mykiss a été utilisée comme valeur critique de toxicité (VCT), car il s’agissait du critère d’effet dénotant la plus grande sensibilité. Conformément à l’approche du facteur d’évaluation (FE) décrite par Okonski et al. (2021), cette valeur a été divisée par un facteur d’évaluation de 20. Ce facteur d’évaluation global comprenait un facteur de 2 tenant compte de la variation entre les espèces (FVE), car on disposait d’un ensemble de données de taille modérée. Plus précisément, l’ensemble de données comprend 5 espèces réparties en 3 catégories (c’est-à-dire vertébrés, invertébrés et producteurs primaires), comme le montrent les tableaux 3‑8 et H‑1. Un facteur de prudence de 10 pour le mode d’action (FMdA) est utilisé pour tenir compte de l’incertitude relative à l’activité biologique à large spectre du MBT chez les organismes récepteurs aquatiques, en particulier les amphibiens. Il n’a pas été nécessaire d’extrapoler la toxicité aiguë à la toxicité chronique, car la VCT est un critère sans effet, à long terme et sublétal. On a donc utilisé un facteur de normalisation des critères d’effet (FNCE) de 1. Le FE de 20 (FNCE × FVE × FMdA = 1 × 2 × 10) a été appliqué à la VCT de 0,041 mg/L, d’où une CESE en milieu aquatique de 0,0021 mg/L ou 2,1 µg/L.
CESEaquatique = VCT ÷ (FNCE × FVE × FMdA) = 0,041 mg/L ÷ (1 × 2 × 10) = 0,0021 mg/L
Le tableau 3‑8 résume les principales études de toxicité aquatique pour le sous‑groupe des benzothiazoles.
| Nom commun | Organisme d’essai | Critère d’effet | Valeur (mg/L) | Référence |
|---|---|---|---|---|
| MBT | Truite arc‑en‑ciel (Oncorhynchus mykiss) |
CL50 96 h | 0,73 | EC 2008 |
| MBT | Truite arc‑en‑ciel (O. mykiss) |
CL50 192 h | 0,67 | EC 2008 |
| MBT | Truite arc‑en‑ciel (O. mykiss) |
CSEO 89 j (longueur des larves) | 0,041 | EC 2008 |
| MBT | Truite arc‑en‑ciel (O. mykiss) |
CMEO 89 j (longueur des larves) |
0,078 | EC 2008 |
| MBT | Cladocère (Daphnia magna) |
CSEO 21 j (survie) |
0,24 | EC 2008 |
| MBT | Cladocère (D. magna) |
CE50 48 h (mobilisation) |
8,5 | ECHA c2007‑2019 |
| MBT | Cladocère (D. magna) |
CE100 48 h (mobilisation) |
16,04 | ECHA c2007‑2019 |
| MBT | Cladocère (Ceriodaphina dubia) |
CE50 48 h (mortalité) |
4,19 | Nawrocki et al. 2005 |
| MBT | Cladocère (C. dubia) |
CE50 7 j (mortalité) |
1,25 | Nawrocki et al. 2005 |
| MBT | Cladocère (C. dubia) |
CSEO 7 j (mortalité) |
0,84 | Nawrocki et al. 2005 |
Abréviations : CSEO = concentration sans effet observé; CMEO = concentration minimale entraînant un effet observé; CL50 = concentration létale médiane; CEx = concentration d’une substance qu’on estime causer un effet sur un pourcentage x des organismes à l’essai.
3.6.1.3 Effets sur les organismes vivant dans les sédiments
Il y a peu de données sur la toxicité des substances du sous‑groupe des benzothiazoles pour les sédiments. Les renseignements se limitent aux recherches internes d’Environnement et Changement climatique Canada sur le MBTS (communication personnelle, données de recherche non publiées sur les benzothiazoles de la Division de la recherche sur les contaminants aquatiques, ECCC, à la Division de l’évaluation des risques pour l’environnement, ECCC, 2018; sans référence). Les recherches communiquées sur Hyalella azteca et Hexagenia spp n’indiquent aucun effet sur la croissance et la survie à des concentrations nominales de MBTS atteignant 100 mg/kg poids sec. Chez Tubifex tubifex, on n’a constaté aucun effet sur la survie, la production de cocons et l’éclosion des cocons à des concentrations de MBTS atteignant 100 mg/kg poids sec. On a observé une différence statistiquement significative à la concentration maximale d’essai du MBTS, c’est-à-dire une réduction de la production de jeunes à 100 mg/kg poids sec. Compte tenu des propriétés physico‑chimiques et des résultats de la modélisation par le logiciel EQC, on ne s’attend pas à ce que le MBT et le SMBT demeurent dans les sédiments. Par conséquent, aucune CESE pour les sédiments n’a été établie pour le MBT ou le SMBT. De plus, la CESE pour les sédiments n’a été calculée pour aucune des autres substances du sous‑groupe des benzothiazoles, car dans la présente évaluation, nous présumons que ces substances se dégraderont en MBT lorsqu’elles seront rejetées dans l’environnement. Le tableau 3‑9 résume les principales études de toxicité du sous‑groupe des benzothiazoles pour les sédiments, et le tableau H‑2 indique les études supplémentaires qui ont été évaluées.
| Nom commun | Organisme d’essai | Critère d'effet | Valeur (mg/kg) | Référence |
|---|---|---|---|---|
| MBTS | Ver de boue (Tubifex tubifex) |
CMEO, 28 j | 100 | Communication interne, sans référence |
| MBTS | Ver de boue (Tubifex tubifex) |
CSEO, 28 j | 10 | Communication interne, sans référence |
Abréviations : CSEO = concentration sans effet observé; CMEO = concentration minimale entraînant un effet observé.
3.6.1.4 Effets sur les organismes vivant dans le sol
Il y a peu de données sur les effets des substances du sous‑groupe des benzothiazoles sur les organismes vivant dans le sol, et on n’a trouvé aucune donnée sur le MBT. Des données ont été extraites de la base de données des substances homologuées de l’ECHA (ECHA c2007‑2019) concernant les effets du MBTS sur les lombrics et les plantes. Plus précisément, on a trouvé des études réalisées selon la LD 222 de l’OCDE pour les lombrics et la LD 208 de l’OCDE pour les plantes terrestres. Les 2 études n’indiquent aucun effet aux concentrations maximales d’essai (1 000 mg/kg). Les études sur les lombrics ont examiné divers critères d’effet, dont la mortalité (28 jours), la biomasse (28 jours) et la reproduction (56 jours), tandis que les études sur les plantes ont examiné la levée des plantules, la longueur des pousses et le poids frais des pousses (toutes ces valeurs sur 14 jours).
Une étude sur les lombrics réalisée selon la ligne directrice no 222 de l’OCDE pour le TBBS (ECHA c2007‑2019) sera utilisée pour caractériser les effets du sous‑groupe des benzothiazoles dans le sol. Au cours de l’étude de la biomasse des lombrics sur 28 jours et de l’étude sur la reproduction des lombrics sur 56 jours, il est probable qu’une partie importante du TBBS se soit dégradée en MBT. Aucune mortalité ou différence de biomasse n’a été observée au cours des 28 jours, mais il y avait une différence statistiquement significative entre le nombre de juvéniles dans le groupe témoin et dans les différentes concentrations d’essai. Par conséquent, la CMEO pour la reproduction a été établie à 237,2 mg/kg p.s. de sol et la CSEO pour la reproduction a été établie à 133,3 mg/kg p.s. de sol, ce qui a donné une concentration maximale acceptable de toxique toxique (CMAT; moyenne géométrique entre la CSEO et la CMEO) de 177,8 mg/kg p.s. de sol. Cette valeur de 178 mg/kg p.s. de sol sera utilisée comme VCT pour le calcul de la CESE. Un facteur d’évaluation global de 100 a été appliqué à la VCT. Cela comprend un facteur de 10 pour la variation interspécifique (FVE) de sensibilité afin de tenir compte des données limitées concernant les effets des substances de ce sous‑groupe sur les organismes vivant dans le sol (2 espèces parmi 2 catégories d’invertébrés et de producteurs primaires), et un facteur de 10 pour tenir compte du MdA (FMdA), car l’ensemble de données ne reflétait pas les effets qui pourraient survenir en raison du MdA propre à ce groupe. Aucune normalisation des critères d’effet (FNCE) n’était requise, car la VCT est un critère d’effet sublétal faible à long terme.
L’application de ce facteur d’évaluation global de 100 (FNCE × FVE × FMdA = 1 × 10 × 10) à la VCT de 177,8 mg/kg p.s. donne une CESE de 1,8 mg/kg p.s. de sol.
CESE sol = VCT ÷ (FNCE × FVE × FMdA) = 177,8 mg/kg ÷ (1 × 10 × 10) = 1,8 mg/kg
Dans la présente évaluation, on présume que tout TBBS rejeté se dégradera en MBT. Par conséquent, cette CESE sera utilisée pour caractériser l’ensemble du sous‑groupe des benzothiazoles.
3.6.2 Évaluation de l’exposition par l’environnement
La caractérisation de l’exposition était axée sur les scénarios d’exposition les plus pertinents pour le sous‑groupe des benzothiazoles (voir le tableau 3‑10). Le MBT et le MBTS sont utilisés principalement comme agents de vulcanisation dans le secteur de la fabrication des pneus et d’autres produits en caoutchouc. Des scénarios ont donc été examinés pour la fabrication de pneus et d’autres produits en caoutchouc, de pneus en service et de pneus en fin de durée de vie. Comme le SMBT est utilisé comme inhibiteur de corrosion dans des lubrifiants, les scénarios de rejets de la substance découlant de l’utilisation de lubrifiants qui en contiennent et de l’utilisation de ce produit chimique par des installations de formulation de lubrifiants ont été pris en compte. Le SMBT est également utilisé comme agent de flottation dans certains sous‑secteurs de l’industrie minière, et un scénario pour ce profil d’emploi a été examiné. Dans le cas des scénarios pour les pneus, le CBS, le TBBS et le DCBS ont été considérés comme des précurseurs du MBT. Aucune donnée de surveillance environnementale pertinente n’était disponible pour l’une ou l’autre de ces substances.
De nombreux pneus en fin de durée de vie sont recyclés et réutilisés pour diverses utilisations, notamment dans les produits dérivés des pneus, les agrégats dérivés des pneus dans des applications de génie civil et les combustibles dérivés des pneus et peuvent aussi être éliminés dans les sites d’enfouissement. Ces utilisations sont très variables et il y a peu de données. Par conséquent, la concentration environnementale estimée (CEE) n’a pas été calculée.
Pour ce qui est des rejets de SMBT par les installations de préparation de lubrifiants, la quantité de SMBT utilisée dans ces installations représente un très faible pourcentage de la quantité totale de substances du sous‑groupe des benzothiazoles employée. Ces rejets sont donc considérés comme insignifiants par rapport à d’autres scénarios d’exposition. C’est pourquoi aucune CEE n’a été calculée pour ce scénario.
Une quantité totale de 1 000 000 à 10 000 000 kg de benzothiazoles a été importée en 2015 (ECCC 2018). La majeure partie de cette quantité a été utilisée au prorata dans la fabrication de pneus (~ 94 %), le reste l’ayant été dans d’autres produits en caoutchouc (~ 3 %), des lubrifiants (~ 1 %), l’exploitation minière (~ 1 %) et le dernier 1 % dans d’autres applications (voir la section 3.3).
| Scénario | Description du scénario | Substances comprises |
|---|---|---|
| 1 | Fabrication de pneus et d’autres produits en caoutchouc | L’une ou l’autre des substances suivantes : MBT, MBTS, TBBS, CBS ou DCBS |
| 2 | Usure des pneus en service | L’une ou l’autre des substances suivantes : MBT, MBTS, TBBS, CBS ou DCBS |
| 3 | Utilisation dans les mines | SMBT |
| 4 | Utilisation dans les lubrifiants | SMBT |
3.6.2.1 Calcul des CEE et hypothèses générales
Les substances du sous‑groupe des benzothiazoles ne devraient pas se biodégrader de manière appréciable à court ou à moyen terme. Cependant, on s’attend à ce que le CBS, le DCBS, le MBTS et le TBBS réagissent au cours des procédés de fabrication ou se dégradent dans les eaux usées en MBT. Compte tenu de la persistance et de la solubilité du MBT, on s’attend à ce que celui‑ci soit rejeté dans les eaux de surface par les STEU.
Les scénarios de rejets industriels étaient basés sur la quantité totale de benzothiazole utilisé dans des procédés, chaque substance contribuant à augmenter la concentration de MBT dans les eaux usées.
En règle générale, les méthodes suivantes ont été utilisées pour calculer les CEE pour l’eau et le sol :
(équation 1)
où :
Q = quantité de substance (kg/a)
CE = coefficient d’émission pour le rejet dans l’eau (fraction)
Mr = rapport des masses des précurseurs qui se décomposent en MBT (le cas échéant)
TEsur‑place‑1 = taux d’élimination dû au prétraitement sur place (fraction)
TEsur‑place‑2 = taux d’élimination dû au traitement secondaire sur place (fraction)
TEhors‑site = taux d’élimination par les STEU hors site (fraction)
N = nombre de jours d’exploitation (jours)
F = débit des effluents de l’installation industrielle ou du STEU (L/j)
FD = facteur de dilution du plan d’eau récepteur (sans unité). La combinaison des éléments F × FD représente le volume quotidien d’eau de dilution (L/j).
On a utilisé une approche décrite par l’ECHA (2016b) pour estimer les concentrations de MBT dans le sol découlant de l’épandage de biosolides produits par un STEU secondaire. Dans cette approche, on suppose que les eaux usées d’une installation contenant du MBT sont acheminées vers un STEU secondaire et que le MBT peut être présent dans les boues (par sorption) et être transporté par les biosolides. Cette approche est représentée par l’équation 2 ci‑dessous. Cette approche suppose également que les biosolides sont épandus sur le sol une fois par an et que le MBT s’accumule dans les 20 premiers centimètres de la couche supérieure du sol pendant 10 ans, sans perte attribuable à des mécanismes comme la dégradation, la volatilisation, le lessivage, etc. Les valeurs par défaut ont été utilisées pour le taux d’épandage de biosolides sur les terres et pour la masse volumique d’un sol sec, comme indiqué ci‑dessous. La CEE calculée selon cette approche est une estimation prudente, car la dégradation et d’autres mécanismes de perte n’ont pas été pris en compte. Cependant, la dégradation du MBT devrait être minime, en raison de sa persistance.
(équation 2)
où :
Cs = concentration de la substance dans les biosolides (mg/kg de poids sec)
A = taux annuel d’épandage des biosolides sur le sol (kg/m2‑an); la valeur par défaut est de 0,83 kg/m2‑an
N = nombre d’années d’épandage de biosolides (an); la valeur par défaut est de 10 ans
d = profondeur de mélange (m); la valeur par défaut est de 0,2 m
ρ = masse volumique du sol sec (kg/m³); la valeur par défaut est de 1 200 kg/m³.
3.6.2.2 Scénario d’exposition 1 : Fabrication de pneus et d’autres produits en caoutchouc
L’utilisation des benzothiazoles dans la fabrication de pneus a été évaluée pour représenter les installations qui emploient des procédés qui seraient applicables dans les scénarios de fabrication de pneus et d’autres produits en caoutchouc. Plus précisément, les benzothiazoles sont utilisés comme accélérateurs de vulcanisation dans la fabrication de pneus. Lorsqu’elles sont utilisées, ces substances réagissent et sont donc chimiquement liées dans les produits. Cependant, il est possible qu’il subsiste après la vulcanisation un faible pourcentage des matières premières qui n’ont pas réagi. En outre, lors de la fabrication de pneus, les substances contenant des benzothiazoles peuvent être rejetées dans les eaux usées lors du mélange, de la vulcanisation et d’autres procédés. Les eaux usées peuvent passer par des systèmes de traitement sur place, notamment un séparateur huile/eau, un réservoir de sédimentation, un système de traitement biologique ou d’autres systèmes de traitement, avant d’être rejetées dans les eaux de surface ou acheminées vers un STEU hors site.
Les CEE en milieu aquatique (équation 1) ont été calculées à l’aide d’une simulation de Monte-Carlo. Dans cette approche probabiliste, les paramètres Q, TEsur‑place‑2, TEhors‑site, N, F et FD ont été établis de manière déterministe, à l’aide des valeurs propres à chaque installation de fabrication de pneus. Les paramètres CE, Mr, et TEsur‑place‑1, dont la plage de valeurs a été déterminée, ont été représentés selon une courbe de distribution uniforme. Les valeurs des paramètres sont présentées dans le tableau 3‑11.
| Paramètre | Type d’information | Valeur (unité) | Remarques |
|---|---|---|---|
| Quantité (Q) |
Valeur propre à l’installation | RCC (kg/an) | Les quantités utilisées en 2015 ont été fournies par chaque installation de fabrication de pneus (communication personnelle, réponses fournies par les usines de pneus, septembre 2018 à septembre 2021, sans référence). |
| Coefficient d’émission (CE) |
Distribution uniforme | 0,0002 à 0,0005 (fraction) | Les benzothiazoles peuvent être rejetés dans les eaux usées par divers procédés. Les coefficients d’émission possibles propres à chaque procédé ont été pris en compte. Comme la plupart des usines de pneus utilisent des poudres de benzothiazole à l'état brut en sacs prépesés, on n’y manipule pas de poudres chimiques à l’état brut. Par conséquent, les coefficients d’émission associés à la manipulation des poudres n’étaient pas applicables, et n’ont pas été utilisés dans le calcul. On a utilisé le coefficient d’émission faible de 0,0002 pour les procédés sans prétraitement (ChemRisk LLC 2010; OCDE 2004b). On a utilisé le coefficient d’émission élevé de 0,0005 pour les procédés industriels sans manipulation de produits chimiques (ECB 2003; OCDE 2009b). |
| Rapport des masses (Mr) | Distribution uniforme | 0,32 à 1,0 (fraction) | Les benzothiazoles se dégraderont en MBT. Le rapport de masses des précurseurs se dégradant en MBT est déterminé par le pourcentage d’un précurseur se transformant en MBT, le nombre de moles de MBT formées lorsqu’une mole d’un précurseur se dégrade, et le rapport des masses moléculaires entre le MBT et le précurseur. Les rapports des masses des benzothiazoles varient de 0,32 à 1,0. |
| Taux d’élimination des systèmes de traitement sur place (TEsur‑place‑1) | Distribution uniforme | 0 à 0,1 (fraction) | La plupart des usines canadiennes de pneus disposent d’un séparateur huile/eau et/ou d’un réservoir de sédimentation pour le prétraitement des eaux usées provenant des procédés de vulcanisation. Ces 2 technologies de prétraitement ne permettent pas d’éliminer efficacement le MBT, car cette substance a une masse volumique supérieure à celle de l’eau (1,42 g/mL) et elle est relativement soluble. Par conséquent, on a utilisé une plage de 0 à 0,1 pour le taux d’élimination par un prétraitement sur place (TEsur‑place‑1). |
| Taux d’élimination par les systèmes de traitement secondaire sur place (TEsur‑place‑2) | Valeur propre à l’installation | 0 ou 0,62 (fraction) | Le taux d’élimination par un système de traitement biologique sur place est de 0,62 (SimpleTreat 2003). On a utilisé une valeur de 0 % lorsqu’il n’y avait pas de système de traitement biologique sur place. |
| Taux d’élimination par un STEU hors site (TEhors‑site) |
Valeur propre à l’installation | 0 ou 0,62 (fraction) | Le taux d’élimination par un système de traitement biologique hors site est de 0,62 (SimpleTreat 2003). On a utilisé une valeur de 0 % lorsqu’une installation n’achemine pas ses eaux usées vers un système de traitement biologique hors site. |
| Jours d’exploitation (N) |
Valeur unique | 365 (jours) | On suppose qu’une usine de pneus fonctionne habituellement 365 jours par année et qu’elle utilise des benzothiazoles de manière continue pendant toute l’année. |
| Débit (F) |
Valeur propre à l’installation | RCC (L/j) | F est le débit des effluents. On a utilisé les valeurs du débit des effluents propre à chaque installation fournies par chaque usine de pneus. |
| Facteur de dilution (FD) |
Valeur maximale de 10 | Sans unité | On détermine le facteur de dilution (FD) en comparant le débit des effluents propre à l’usine et le débit du plan d’eau récepteur. Pour déterminer les critères d’effet direct, on utilise la valeur maximale de FD qui est de 10, afin de tenir compte des conditions près du point de rejet. Cette valeur repose sur l’hypothèse qu’il n’y a pas de dilution complète juste après le rejet dans de grands plans d’eau. La valeur de FD pour toutes les usines de pneus est de 10. La valeur F × FD est égale au volume quotidien d’eau de dilution. |
Abréviations : RCC = renseignements commerciaux confidentiels.
En utilisant l’approche décrite ci‑dessus, on a obtenu la CEE en milieu aquatique de chaque usine de pneus. Voici les résultats obtenus pour les CEE en milieu aquatique et dans le sol :
Les CEE en milieu aquatique au 10ecentile (P10) de toutes les installations varient de 0,22 à 11 µg/L.
Les CEE en milieu aquatique au 50ecentile (P50) de toutes les installations varient de 0,39 à 19 µg/L.
Les CEE en milieu aquatique au 90ecentile (P90) de toutes les installations varient de 0,66 à 32 µg/L.
Les valeurs au 10e centile (P10), au 50e centile (P50) et au 90e centile (P90) des CEE dans le sol des installations concernées sont de 0,21, 0,38 et 0,63 mg/kg p.s., respectivement.
3.6.2.3 Scénario d’exposition 2 : Usure des pneus en service
Les pneus sont utilisés sur une foule de véhicules circulant sur route et hors route. On a estimé qu’environ 33 millions de nouveaux pneus ont été mis en service en 2006, et ce chiffre a été utilisé dans le présent rapport comme quantité annuelle de nouveaux pneus en service (ChemInfo 2012). La durée de vie d’un pneu est d’environ 6 ans (Badila 2013). Lorsqu’un pneu est en service, il perd environ 40 % de sa bande de roulement au cours de sa durée de vie (Badila 2013). Les particules produites en raison de l’usure des pneus en service peuvent contenir des benzothiazoles, qui peuvent ensuite être transportés de la route vers les plans d’eau avoisinants. Afin de déterminer les CEE des benzothiazoles provenant de l’usure des pneus dans l’eau de surface, il faut connaître les données suivantes : la quantité de particules produites par l’usure des pneus, la concentration des benzothiazoles dans ces particules, le devenir de ces particules, le taux de lessivage des substances contenues dans les particules, le volume d’eau de ruissellement, le taux d’élimination dans l’eau de ruissellement et le facteur de dilution du plan d’eau récepteur.
Les benzothiazoles contenus dans les particules produites par l’usure des pneus peuvent être lessivés lorsque ces particules sont exposées à l’eau. Dans une étude récente sur le lessivage des particules produites par l’usure des pneus sur les routes, on a détecté de faibles concentrations de MBT, la concentration maximale ayant été de 28 µg/L (28 µg de MBT par litre de lixiviat). La concentration de CBS était inférieure au seuil de quantification (SQ = 1,0 µg/L), mais l’étude n’a pas indiqué de taux de lessivage précis (Unice et al. 2015). Selon d’autres études, les benzothiazoles et certains autres additifs chimiques présents dans les particules produites par l’usure des pneus sont lessivables et on a détecté le lessivage des benzothiazoles dans les particules produites par l’usure des pneus. Cependant, aucun taux de lessivage propre aux benzothiazoles n’a été fourni (Wagner et al. 2018; Muller et al. 2022; Wagner et al. 2022).
Un pneu peut contenir plusieurs types de benzothiazoles. Lorsqu’un benzothiazole est lessivé, le pourcentage de substance lessivée est inconnu et il est difficile de quantifier un taux de lessivage propre à une substance donnée. En raison de cette incertitude et de l’absence de taux de lessivage, on suppose, par prudence, que les benzothiazoles (qu’il s’agisse de MBTS, de CBS, de DCBS, de TBBS ou de MBT) seront lessivés à raison de 1 % par année de la quantité totale de benzothiazole dans le pneu qui n’est pas chimiquement liée et qui est lessivable. Cette hypothèse équivaut à un taux de lessivage de 6 % des benzothiazoles provenant des particules produites par l’usure des pneus, pendant la durée de vie d’un pneu. Cette hypothèse repose sur le fait que le taux de lessivage d’un plastifiant qui n’est pas chimiquement lié dans des produits en polychlorure de vinyle (PVC) destinés à des usages extérieurs est de 0,16 % par an (OCDE 2009). Ce taux de lessivage de 6 % des benzothiazoles pour toute la durée de vie d’un pneu pourrait être une hypothèse très prudente, étant donné que la majeure partie des benzothiazoles est chimiquement liée dans les pneus et que le taux de lessivage d’un benzothiazole pourrait ne pas être aussi élevé que celui des autres substances chimiques qui ne sont pas chimiquement liées dans un pneu ou d’autres produits en caoutchouc.
La concentration de benzothiazole dans des particules produites par l’usure des pneus est d’environ 1 % en poids (OCDE 2004b). La substance est chimiquement liée par les procédés de vulcanisation lors de la fabrication des pneus. On suppose que toutes les particules d’usure se retrouvant de part et d’autre de la route seront chassées par les eaux de ruissellement et de pluie et finiront par atteindre un plan d’eau récepteur. Même si la substance est chimiquement liée aux particules d’usure des pneus, on suppose qu’un faible pourcentage de la substance pourrait encore ne pas réagir et donc être lessivé à l’extérieur des particules produites par l’usure des pneus. Par prudence, on utilise dans les calculs un taux de lessivage de 1 % par année de la substance qui n’a pas réagi et qui provient des particules produites par l’usure des pneus.
On suppose que les substances du sous‑groupe des benzothiazoles seront principalement présentes sous forme de MBT dans les eaux de ruissellement, car de nombreuses substances d’intérêt qui sont lessivées se dégradent en MBT. Certaines eaux de ruissellement peuvent être gérées par divers systèmes de gestion des eaux pluviales, ce qui permettrait une certaine élimination du MBT. Toutefois, par souci de prudence, on présume que le taux d’élimination du MBT dans les eaux pluviales de ruissellement est nul. La substance lessivée est diluée par les eaux pluviales de ruissellement, et davantage encore dans un plan d’eau récepteur. Le volume des eaux pluviales de ruissellement est calculé à partir des volumes de précipitations annuelles, de la superficie couverte et des coefficients de ruissellement dans les différentes municipalités. On utilise un débit de saison humide dans un plan d’eau récepteur. On calcule le facteur de dilution en comparant le débit total du plan d’eau récepteur au volume des eaux de ruissellement. On utilise la valeur la moins élevée entre le facteur de dilution calculé et la valeur maximale de 10.
Compte tenu des paramètres ci‑dessus, la CEE estimative la plus élevée dans les eaux de surface est de 0,023 µg/L.
3.6.2.4 Scénario d’exposition 3 : Utilisation dans l’industrie minière
Le SMBT est utilisé comme réactif de flottation dans les applications minières (ECCC 2018). Ce scénario s’applique à certains sous‑secteurs miniers où les installations canadiennes utilisent le SMBT dans leurs procédés de flottation. Lorsqu’il est utilisé dans l’eau, le SMBT se dissocie en MBT. Après avoir été consommé, le MBT peut être déversé dans un bassin de décantation sur le site minier, puis rejeté dans l’environnement.
Afin de calculer une CEE dans les eaux de surface, les paramètres nécessaires comprennent la quantité de substance utilisée, le coefficient d’émission pour la substance rejetée dans un bassin de décantation, les taux d’élimination de la substance par les systèmes de traitement sur place, le débit rejeté dans l’environnement et le facteur de dilution du plan d’eau récepteur.
Dans une installation minière, le SMBT est dosé de manière appropriée dans des cuves de flottation avec d’autres produits chimiques. Dans l’eau, le SMBT se dissocie en MBT. C’est pourquoi on a supposé qu’une certaine partie du MBT pourrait ne pas réagir dans une cuve de flottation où il pourrait être dissous dans l’eau de traitement provenant du procédé de flottation. Le MBT pourrait également être rejeté dans l’eau provenant des procédés qui suivent la flottation. Le MBT pourrait également être rejeté dans l’eau provenant des procédés subséquents à la flottation. Ainsi, on suppose que 25 % du SMBT utilisé dans les procédés de flottation pourrait être rejeté dans un bassin de décantation où il serait présent sous forme de MBT.
Une installation minière peut disposer d’un système de traitement des eaux de procédés avant que celles‑ci soient rejetées dans un bassin de décantation où on utilise le taux d’élimination du système de traitement sur place applicable. Dans un bassin de décantation, l’élimination des résidus miniers se fait par décantation, et on utilise donc le taux d’élimination de 1 % du système de traitement primaire.
Une installation minière peut réutiliser le surnageant du bassin de décantation autant que possible, de sorte que tous les volumes d’eau déversés dans un bassin de décantation ne seront pas rejetés dans l’environnement. Le pourcentage du débit déversé dans un plan d’eau récepteur est réglementé par la province où se trouve l’installation minière.
Lorsque le MBT est rejeté dans l’environnement, il est dilué par le plan d’eau récepteur. On obtient le facteur de dilution en comparant le débit total du plan d’eau récepteur au débit d’effluents du bassin de décantation, et on utilise la valeur la plus faible entre un facteur de dilution calculé et le facteur maximal de 10. Ce facteur de dilution reflète les conditions à proximité du point de rejet.
Pour ce qui est des installations concernées qui rejettent les effluents des bassins de décantation contenant du MBT vers un plan d’eau récepteur, la CEE maximale dans les eaux de surface est estimée à 4,9 µg/L.
3.6.2.5 Scénario d’exposition 4 : Utilisation dans les lubrifiants
Le SMBT peut être utilisé comme inhibiteur de corrosion dans divers types de lubrifiants, entre autres les fluides de travail des métaux, les lubrifiants automobiles et les lubrifiants industriels. L’utilisation du SMBT dans les fluides de travail des métaux peut entraîner des rejets dans l’environnement lorsque ces fluides sont expulsés de la surface du métal par rinçage pendant les procédés de nettoyage et de finition. L’utilisation du SMBT dans d’autres types de lubrifiants risque moins d’entraîner des rejets dans l’environnement, car la plupart des lubrifiants usés sont recyclés et éliminés conformément aux exigences provinciales. Par conséquent, dans ce scénario, on estime la CEE due à l’utilisation de SMBT dans des fluides de travail des métaux.
Dans ce scénario, on envisage une situation dans laquelle une installation industrielle manipule du SMBT dans les fluides de travail des métaux. Les hypothèses concernant le volume annuel traité (16 000 L), les jours de fonctionnement (247) et le coefficient d’émission pour les rejets dans les eaux usées (11 %) sont tirées du document de l’OCDE sur le scénario d’émission pour les fluides de travail des métaux (OCDE 2011). Dans les eaux usées, le SMBT se dissocie en MBT. Le taux d’élimination du MBT par un système de traitement a été estimé à l’aide du modèle SimpleTreat, et le volume quotidien d’eau de dilution a été calculé d’après le débit des effluents du STEU et le taux de dilution applicable du plan d’eau récepteur. En outre, la concentration de la substance de 2 % dans les fluides de travail des métaux a été tirée de Brinksmeier et al. (2015). On présume que les eaux usées seront traitées par un séparateur huile/eau sur place avant d’être acheminées vers un STEU. Le taux d’élimination d’un séparateur huile/eau est de 10 % et le taux d’élimination d’un système de traitement biologique secondaire est de 62 %. Selon cette approche, la CEE calculée dans les eaux de surface est de 6,5 µg/L.
L’équation 2 a permis de calculer la CEE dans le sol, découlant de l’utilisation du SMBT dans des fluides de travail des métaux, ce qui a donné une CEE dans le sol de 0,18 mg/kg p.s.
3.6.3 Caractérisation des risques pour l’environnement
L’approche suivie dans la présente évaluation des risques pour l’environnement consistait à examiner les données d’évaluation et à formuler des conclusions s’appuyant sur la méthode du poids de la preuve et le principe de prudence. Des données ont été recueillies pour déterminer le potentiel de nocivité du sous‑groupe des benzothiazoles dans l’environnement canadien. Les éléments de preuve examinés comprennent, notamment, ceux qui sont évalués dans la présente évaluation et qui soutiennent la caractérisation des risques pour l’environnement au Canada. On examine également les éléments de preuve fiables, secondaires ou indirects, lorsqu’il y en a, y compris les classements de danger ou les caractéristiques de devenir établis par d’autres organismes de réglementation. Dans la présente évaluation, le potentiel de causer des effets cumulatifs a été déterminé d’après l’exposition cumulative aux substances de la grande classe des benzothiazoles qui sont des précurseurs du MBT.
3.6.3.1 Analyse des quotients de risque
Des analyses des quotients de risque ont été réalisées en comparant les diverses estimations d’exposition réalistes en cas de pire éventualité (CEE; voir la section Évaluation de l’exposition de l’environnement) avec les données d’écotoxicité (CESE; voir la section Évaluation des effets sur l’environnement) en vue de déterminer s’il existe un potentiel d’effets nocifs pour l’environnement au Canada. On calcule le quotient de risque (QR) en divisant la CEE par la CESE pour les milieux naturels pertinents et les scénarios d’exposition associés. Les tableaux 3‑12 et 3‑13 présentent les QR obtenus pour le sous‑groupe des benzothiazoles.
| Scénario d’exposition (substances) | CEE pour le MBT en milieu aquatique (µg/L) | CESE pour le MBT en milieu aquatique (µg/L) | QR |
|---|---|---|---|
| Fabrication de pneus et d’autres produits en caoutchouc (MBT et ses précurseurs) | P10 = 0,22 à 11a | 2,1 | 0,11 à 5,2 (QR > 1 pour P10 pour 2 installations sur 6)a |
| Fabrication de pneus et d’autres produits en caoutchouc (MBT et ses précurseurs) | P50 = 0,39 à 19a | 2,1 | 0,19 à 9,1 (QR > 1 pour P50 pour 5 installations sur 6)a |
| Fabrication de pneus et d’autres produits en caoutchouc (MBT et ses précurseurs) | P90 = 0,66 à 32a | 2,1 | 0,31 à 15 (QR > 1 pour P90 pour 5 installations sur 6) |
| Usure des pneus en service (MBT et ses précurseurs) | 0,023 | 2,1 | 0,011 |
| Utilisation dans le secteur minier (SMBT) | 4,9 | 2,1 | 2,3 |
| Utilisation dans les lubrifiants (SMBT) | 6,8 | 2,1 | 3,2 |
Abréviations : P10 = 10e centile de la courbe de distribution des CEE; P50 = 50e centile de la courbe de distribution des CEE; P90 = 90e centile de la courbe de distribution des CEE.
a Valeurs indiquées sous forme de plage.
| Scénario d’exposition (substances) | CEE pour le MBT dans le sol (mg/kg p.s.) |
CESE pour le MBT dans le sol (mg/kg p.s.) | QR |
|---|---|---|---|
| Épandage sur le sol de biosolides provenant de la fabrication de pneus et d’autres produits en caoutchouc (MBT et ses précurseurs) |
P10 = 0,21 | 1,8 | 0,12 |
| Épandage sur le sol de biosolides provenant de la fabrication de pneus et d’autres produits en caoutchouc (MBT et ses précurseurs) |
P50 = 0,38 | 1,8 | 0,21 |
| Épandage sur le sol de biosolides issus de la fabrication de pneus et d’autres produits en caoutchouc (MBT et ses précurseurs) |
P90 = 0,63 | 1,8 | 0,35 |
| Application sur le sol de biosolides provenant de l’utilisation dans les lubrifiants (SMBT) |
0,18 | 1,8 | 0,10 |
Abréviations : P10 = 10e centile de la courbe de distribution des CEE; P50 = 50e centile de la courbe de distribution des CEE; P90 = 90e centile de la courbe de distribution des CEE.
3.6.3.2 Examen des sources de données
Afin de caractériser le risque du sous‑groupe des benzothiazoles pour l’environnement, les informations techniques concernant les diverses sources de données ont été prises en compte et pondérées qualitativement. Les principales sources de données étayant la conclusion de l’évaluation sont présentées dans le tableau 3‑14, et une discussion générale sur le poids de la preuve figure à la section 3.6.3.3. Le degré de confiance renvoie à l’influence combinée de la qualité et de la variabilité des données, des lacunes dans les données, de la causalité, de la plausibilité et de toute extrapolation requise pour les données probantes. La pertinence désigne l’effet d’une source de données probante sur la détermination du risque de causer des effets nocifs sur l’environnement au Canada. Les qualificateurs utilisés dans l’analyse varient de faibles à élevés, et la pondération de chaque donnée variait selon 5 résultats possibles.
| Source de données | Niveau de confiancea | Pertinence pour l’évaluationb | Importance accordéec |
|---|---|---|---|
| Similarité de la structure chimique aux fins de lecture croisée | Élevé | Élevée | Élevée |
| Distribution dans l’environnement | Élevé | Élevée | Élevée |
| Persistance dans l’environnement | Modéré | Élevée | Modérée à élevée |
| Transport à grande distance | Faible | Modérée | Faible à modérée |
| Bioaccumulation dans les organismes aquatiques | Élevé | Modérée | Modérée à élevée |
| Mode d’action ou autres données non apicalesd | Élevé | Élevée | Élevée |
| CESE pour les organismes aquatiques | Élevé | Élevée | Élevée |
| CESE pour les organismes vivant dans le sol | Faible | Modérée | Faible à modérée |
| CEE dans l’eau | Modéré | Élevée | Modérée à élevée |
| CEE dans le sol | Modéré | Modérée | Modérée |
| QR pour l’eau | Modéré | Élevée | Modérée à élevée |
| QR pour le sol | Modéré | Modérée | Modérée |
a Le niveau de confiance est déterminé d’après la qualité des données, leur variabilité et les lacunes dans celles-ci (en d’autres mots, les données sont‑elles pertinentes considérant les fins envisagées?).
b La pertinence renvoie à l’impact de la source de données sur l’évaluation.
c Une pondération est attribuée à chaque source de données en fonction de la pondération globale combinée du niveau de confiance et de la pertinence pour l’évaluation.
d Les critères d’effet non apicaux font référence aux critères d’effet autres que la mortalité, la croissance et la reproduction (c’est-à-dire les critères d’effet ayant des effets sur la population).
3.6.3.3 Poids de la preuve pour déterminer le potentiel d’effets nocifs pour l’environnement
Les substances du sous‑groupe des benzothiazoles sont constituées du MBT ou de substances qui se dégradent en MBT par diverses voies de transformation (par exemple, hydrolyse, oxydoréduction, digestion ou métabolisation) dans des conditions environnementales, industrielles ou physiologiques pertinentes. Par conséquent, on suppose qu’en matière de lecture croisée, le comportement du MBT sera représentatif de celui de toutes ces substances (voir l’annexe G).
Il existe d’autres substances qui sont des précurseurs potentiels du MBT, mais qui n’ont pas été incluses dans le sous‑groupe des benzothiazoles. Elles peuvent néanmoins contribuer à la présence globale du MBT dans l’environnement. Une liste non exhaustive de ces précurseurs potentiels du MBT est fournie à l’annexe I.
La répartition du MBT dans l’environnement est bien caractérisée grâce à divers paramètres, dont les propriétés physico‑chimiques, la modélisation par le logiciel EQC et les données figurant dans la littérature scientifique. Selon ces sources de données, la majeure partie du MBT se dissoudra librement une fois dans l’eau, et qu’il se liera principalement aux particules lorsqu’il sera dans l’air ou dans le sol. La persistance a été évaluée à l’aide de modèles et de données empiriques. Il existe des données indiquant que les substances d’origine se dégradent en MBT. Cependant, il n’est pas certain que le MBT se dégradera davantage. Les données empiriques trouvées dans la littérature scientifique indiquent que la dégradation se produit dans des conditions précises qui peuvent ne pas être représentatives de tous les environnements. On manque également d’information sur le taux et l’ampleur de la transformation du MBT, même dans les conditions précises qui ont été étudiées. Bien que la dégradation biotique n’ait pas été un élément clé de la conclusion de l’évaluation, les processus de dégradation abiotique tels que l’hydrolyse indiquent que toutes les substances du sous‑groupe des benzothiazoles peuvent se dégrader en MBT. Il a également été déterminé que le DCBS n’est pas persistant dans l’eau, car il s’hydrolysera pour former du MBT et de la dicyclohexylamine. Cependant, le DCBS peut être persistant dans le sol.
Les données sur la bioaccumulation étaient suffisantes et ont finalement montré que les benzothiazoles ne devraient pas se bioaccumuler.
En ce qui concerne le transport à grande distance (TGD) dans l’eau, on dispose d’un minimum de données sur le sous‑groupe des benzothiazoles. Le modèle TaPL3 a été utilisé pour caractériser le TGD. Cependant, il ne prend en compte que la forme neutre de la substance, même si le MBT sera partiellement ionisé aux pH trouvés dans l’environnement. Cela influe donc sur la fiabilité des prévisions faites à l’aide des prévisions de ce modèle.
On disposait de renseignements sur le MdA obtenus par modélisation et publiés dans la littérature scientifique. Plus précisément, on a constaté que le MBT a des effets sur le système endocrinien, car il inhibe la TPO, ce qui entraîne une réduction de la pigmentation et des malformations chez les organismes exposés. En outre, différents types de données empiriques et modélisées confirment invariablement cet effet nocif. Ces renseignements ont été obtenus de sources et d’études fiables qui s’appuyaient sur des méthodes normalisées ou des lignes directrices. Par conséquent, ces renseignements étaient très pertinents pour formuler une conclusion, car les renseignements sur le MdA spécifique ont orienté le choix du facteur d’évaluation pour le calcul de la CESE.
Le calcul de la CESE pour les organismes aquatiques était basé sur un vaste ensemble de données qui comprenait des études de toxicité chronique pour les poissons, les invertébrés et les algues, ainsi que le MdA des benzothiazoles. Par conséquent, il existe une grande confiance à l’égard de la CESE calculée pour les milieux aquatiques, ce qui est très pertinent pour l’évaluation des risques pour l’environnement.
La CESE pour les organismes vivant dans le sol était basée sur des données analogues pour le sous‑groupe des benzothiazoles. Le MBTS a été caractérisé à l’aide de 2 études, l’une sur les lombrics et l’autre sur les plantes. Les données limitées concernant la toxicité du MBTS dans le sol donnent lieu à une faible confiance. Les données concernant la toxicité dans le sol sont modérément pertinentes, car elles ne constituent pas un élément majeur de la conclusion dans la présente évaluation. Pour les autres substances du sous‑groupe des benzothiazoles, les effets sur les organismes du sol ont été caractérisés par lecture croisée à partir des données pour le TBBS.
Des CEE ont été calculées pour les milieux aquatiques et les sols en partant du principe que le MBT peut être rejeté dans l’un ou l’autre de ces milieux. Des scénarios d’exposition ont été élaborés à partir de taux d’élimination modélisés, de données pertinentes fournies par les parties intéressées et d’hypothèses. Par conséquent, un degré de confiance modéré a été attribué aux CEE finales pour le milieu aquatique et le sol. Les QR ont été pondérés d’après le degré de confiance accordé aux valeurs de CEE et de CESE.
Comme le démontrent les éléments de preuve disponibles, y compris les QR d’une valeur supérieure à 1 dans plusieurs scénarios d’exposition en milieu aquatique, le MBT et ses précurseurs, dont les substances du sous‑groupe des benzothiazoles, peuvent être nocifs pour l’environnement au Canada. En particulier, il a été démontré que l’utilisation du MBT et de ses précurseurs dans la fabrication de pneus et d’autres produits en caoutchouc, les activités minières et le secteur des lubrifiants pourrait être nocive pour l’environnement. Il est peu probable que les rejets de particules provenant de l’usure des pneus soient préoccupants pour l’environnement aux concentrations d’exposition actuelles.
3.6.3.4 Sensibilité de la conclusion compte tenu des principales incertitudes
Il subsiste une incertitude quant à la mesure dans laquelle les précurseurs du MBT se dégradent en MBT. On a examiné cette incertitude en supposant que le pire scénario serait une transformation complète en MBT, à moins qu’une autre hypothèse ne soit étayée par d’autres données (c’est-à-dire des données sur le CBS; voir l’annexe G). La transformation complète en MBT a été considérée comme le pire des scénarios, car le MBT présente un plus grand danger pour les organismes et est plus soluble dans l’eau et donc plus biodisponible et mobile dans l’environnement que ses précurseurs. Par conséquent, des données supplémentaires sur sa transformation dans l’environnement pourraient modifier les scénarios d’exposition, ce qui pourrait avoir une incidence sur la conclusion.
En outre, on sait que le MBT peut avoir des effets sur le système endocrinien des organismes exposés, bien que ces effets soient variables d’une espèce à l’autre. Les effets sur l’histologie et les hormones de la glande thyroïde chez les amphibiens ont été décrits (Tietge et al. 2013). Les résultats n’étaient cependant pas suffisants pour soutenir leur utilisation comme VCT pour l’établissement d’une CESE. Il existe donc une incertitude quant à la dose de MBT la plus faible entraînant des effets. Même si des données additionnelles sur les effets endocriniens auraient pu réduire la CESE, étant donné qu’on a utilisé un facteur d’évaluation prudent pour le MdA, il est peu probable que ces données changeraient la conclusion de l’évaluation.
Les scénarios d’exposition établis pour le sous‑groupe des benzothiazoles sont élaborés d’après les renseignements fournis en réponse à une enquête menée en vertu de l’article 71 de la LCPE et du suivi effectué auprès des parties intéressées. En l’absence de données précises, des hypothèses réalistes sont formulées afin d’estimer les CEE. Deux hypothèses clés qui pourraient avoir influé sur la conclusion relative aux taux d’élimination et d’émission. Dans une modélisation par le modèle SimpleTreat, on a supposé que le taux d’élimination par un séparateur huile/eau sur place dans les installations industrielles applicables variait de 0 à 10 %, et on a estimé à 62 % le taux d’élimination d’une installation hors site de traitement biologique des eaux usées. La précision des CEE calculées dépend donc des hypothèses formulées dans chaque scénario, et les CEE pourraient varier (à la hausse ou à la baisse) si l’une de ces hypothèses devait changer.
3.7 Potentiel d’effets nocifs pour la santé humaine
3.7.1 Évaluation de l’exposition
L’exposition potentielle aux substances du sous‑groupe des benzothiazoles par les milieux naturels, les aliments et les produits disponibles aux consommateurs est décrite ci‑dessous. Pour caractériser le risque posé par chaque substance, nous avons choisi les scénarios donnant lieu aux expositions les plus élevées. Des renseignements additionnels concernant les scénarios d’exposition sont résumés à l’annexe C.
Milieux naturels et aliments
Les substances du sous‑groupe des benzothiazoles ont une pression de vapeur très faible ou faible, et leurs concentrations dans l’air en phase vapeur devraient donc être négligeables. Les concentrations mesurées de certaines de ces substances dans l’air et dans la poussière ont été trouvées dans la littérature scientifique. Par exemple, le MBT a été détecté dans la poussière des routes à une concentration maximale de 19,4 ng/L sous forme de particules en suspension dans une phase aqueuse (Asheim et al. 2019) et a été mesuré dans la fraction PM10 des particules en suspension dans l’air dans une rue fréquentée à une concentration moyenne de 64 pg/m³ (Avagyan et al. 2014). Compte tenu de ces valeurs, on s’attend à ce que l’exposition potentielle de la population générale au Canada à l’air et à la poussière soit négligeable pour les substances du sous‑groupe des benzothiazoles.
Vu l’absence de données de surveillance des substances du sous‑groupe des benzothiazoles dans l’eau de surface ou l’eau potable au Canada, les concentrations théoriques de ces substances dans l’eau de surface, utilisées comme données de substitution pour les substances dans l’eau potable, ont été calculées à partir des courbes de distribution des CEE calculées à la section 3.6.2. Les CEE au 50e centile dans les milieux aquatiques, calculées pour ces substances à la section sur l’évaluation de l’exposition par l’environnement, variaient de 0,39 à 19 µg/L et étaient basées sur les valeurs obtenues pour les installations de fabrication de pneus ou de produits en caoutchouc qui rejettent leurs eaux usées.
Dans le scénario de fabrication de pneus et de produits en caoutchouc, la plage des CEE indiquée à la section 3.6.2.2 représente les concentrations possibles de MBT dans un plan d’eau récepteur, près du point de rejet d’un STEU. Ces scénarios, élaborés afin d’évaluer l’exposition de l’environnement, devraient donner des concentrations estimatives élevées, étant donné que l’évaluation de l’exposition de l’eau potable devrait se produire en aval plutôt qu’au point de rejet, et pourrait donc donner lieu à une surestimation des concentrations qui pourraient être mesurées dans l’eau potable. Par conséquent, les CEE maximales au 50e centile du scénario de fabrication de pneus et d’autres produits en caoutchouc ont été choisies (en d’autres mots, on a choisi ces valeurs plutôt que la valeur maximale au 90e centile de la plage des valeurs indiquée au 90e centile). Comme la valeur maximale au 50e centile de 19 µg/L se situe à l’intérieur de la plage des valeurs de CEE au 90e centile, variant de 0,66 à 32 µg/L, elle devrait représenter une valeur estimative élevée de l’exposition de l’eau potable. Ce scénario est jugé plus réaliste pour évaluer l’exposition de l’eau potable, tout en étant prudent. L’utilisation d’une CEE maximale au 50e centile de 19 µg/L donne une DJMDV de 9,5 × 10‑4 mg/kg p.c./j dans l’eau potable.
Ailleurs dans le monde, les substances du sous‑groupe des benzothiazoles ont été détectées dans l’eau. Par exemple, le MBT a été trouvé dans les eaux de surface de divers pays européens à une concentration maximale de 0,019 µg/L (EMPODAT 2013), le MBT a été mesuré dans les eaux usées aux États‑Unis à des concentrations atteignant 4,2 mg/L (concentration moyenne) dans les effluents d’un producteur de MBTS (CMA 1985 cité dans EC 2008) (Carpinteiro et al. 2012; EC 2008; EMPODAT 2013; Kloepfer et al. 2005; Liao et al. 2006), et le DCBS a été mesuré dans les eaux côtières suédoises à des concentrations comprises entre 0,20 et 0,43 ng/L (Gustavsson et al. 2017).
L’exposition potentielle, le cas échéant, aux substances du sous‑groupe des benzothiazoles en raison de leur utilisation dans les matériaux d’emballage alimentaire et comme additifs indirects a été jugée négligeable (communication personnelle, courriels de la Direction des aliments, Santé Canada, au BERSE, Santé Canada, 2017, 2018; sans référence). Toutefois, en raison de leurs diverses autres utilisations industrielles, certains benzothiazoles peuvent pénétrer dans l’environnement et ont été détectés dans certains poissons et autres organismes aquatiques. Des données limitées étaient disponibles sur les concentrations de benzothiazoles dans les aliments. Des données sur la présence de certaines de ces substances ont été trouvées pour certains poissons et fruits de mer seulement. Dans le monde, on a signalé des concentrations de 2 benzothiazoles dans le poisson et les fruits de mer en Suède (Brorström‑Lundén et al. 2011). On a estimé de manière prudente l’exposition par le régime alimentaire aux benzothiazoles individuels des consommateurs qui ont déclaré avoir consommé du poisson ou des fruits de mer (base « mangeurs seulement ») en multipliant la concentration maximale de chaque substance (annexe F) par la quantité totale de poisson et de fruits de mer consommée par chaque répondant à l’Enquête sur la santé dans les collectivités canadiennes (Statistique Canada 2015). Cette approche a permis d’obtenir une série d’estimations de l’exposition aux benzothiazoles pour différentes tranches d’âge (tableau 3‑14). L’exposition par le régime alimentaire n’a pas été estimée pour les nourrissons de moins d’un an, car seulement 2 % des répondants à l’enquête ont déclaré avoir consommé du poisson ou des fruits de mer (communication personnelle, courriels de la Direction des aliments, Santé Canada, au BERSE, Santé Canada, 2019; sans référence).
| Substance | Exposition moyenne | Exposition au 90e centile |
|---|---|---|
| CBS | 1,8 x 10‑4 à 5,4 x 10‑4 | 3,5 x 10‑4 à 1,1 x 10‑3 |
| MBT | 6,2 x 10‑6 à 1,9 x 10‑5 | 1,2 x 10‑5 à 4,0 x 10‑5 |
a L’exposition estimée par le régime alimentaire a été prise en compte pour les personnes de 1 an et plus, les estimations pour toutes les substances étant les plus élevées d’après le poids corporel pour les tout‑petits de 1 an.
Biosurveillance
On a trouvé des données de biosurveillance pour le MBT dans certains pays (par exemple, la concentration maximale de 10,8 µg/L de MBT dans l’urine des humains non exposés au MBT en Allemagne (Gries et al. 2015)). Étant donné que l’origine du composé dans l’urine n’est pas claire, ces données de biosurveillance n’ont pas été utilisées pour estimer l’exposition.
Produits disponibles aux consommateurs
La présence de TBBS, de CBS, de MBTS, de MBT et de DCBS dans les matériaux en caoutchouc a été déclarée au Canada, d’après les renseignements fournis en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Canada 2017), et on sait qu’ils sont utilisés comme agents accélérateurs à l’étape de vulcanisation dans la production de caoutchouc (Danish EPA 2003; EC 2008; ECHA 2014a; OCDE 2003, 2004a, 2008). Cependant, l’OCDE (2003) a indiqué que les produits finis en caoutchouc ne devraient contenir que de faibles quantités de TBBS, étant donné la transformation chimique au cours de la vulcanisation, et que toute utilisation du DCBS comme accélérateur de vulcanisation devrait entraîner sa réaction complète pendant le procédé de vulcanisation (OCDE 2004a).
Compte tenu des pressions de vapeur faibles à très faibles des substances du sous‑groupe des benzothiazoles et de leurs profils d’emploi, l’exposition par inhalation devrait être nulle.
Au Canada, les pneus recyclés peuvent être utilisés pour le rembourrage ou le revêtement des surfaces des terrains de sport et des terrains de jeu (AR 2017, 2018; Cantin 2009). Étant donné leur utilisation dans la fabrication de produits en caoutchouc (y compris les pneus) et leur présence dans les granulés de caoutchouc des surfaces de gazon synthétique en Europe (RIVM 2017), on a évalué l’exposition au MBT, au MBTS et au CBS des surfaces de gazon synthétique au Canada qui contiennent du caoutchouc fabriqué à partir de pneus recyclés. Comme aucune donnée n’a été trouvée sur les concentrations de MBT, de MBTS et de CBS dans le gazon synthétique au Canada, il est jugé approprié d’utiliser l’étude menée par RIVM (2017) comme étude de substitution. La mise à la bouche, par un tout petit, de granulés de caoutchouc provenant d’un gazon synthétique et l’exposition cutanée à la suite des jeux d’enfants sur un gazon synthétique ont été sélectionnées comme scénarios sentinelles par voies orale et cutanée, respectivement. L’exposition possible par voie orale au MBT dans des granulés de caoutchouc fabriqués à partir de pneus recyclés est estimée à 9,8 × 10‑5 mg/kg p.c./j et l’exposition par voie cutanée est estimée à 2,5 × 10‑3 mg/kg p.c./j d’après la concentration maximale rapportée de 7,6 mg/kg de MBT d’une surface en gazon synthétique aux Pays‑Bas (ECHA 2017; RIVM 2017). L’exposition par voie orale découlant de l’ingestion fortuite de granulés de caoutchouc fabriqués à partir de pneus recyclés contenant du MBTS est estimée à 3,9 × 10‑6 mg/kg p.c./j, et l’exposition par voie cutanée à cette substance est estimée à 9,7 × 10‑5 mg/kg p.c./j, d’après la concentration maximale de 0,3 mg/kg de MBTS (ECHA 2017; RIVM 2017). EC (2008) a indiqué qu’il n’y a pas de CBS dans les produits disponibles aux consommateurs, étant donné que la substance est utilisée comme accélérateur de vulcanisation dans la fabrication des produits en caoutchouc, mais force est d’admettre qu’il est difficile de déterminer l’identité des accélérateurs employés dans un produit en caoutchouc donné. Puisque le RIVM (2017) a détecté une concentration maximale de 0,04 mg/kg de CBS (la concentration médiane étant 0,02 mg/kg), cette source potentielle d’exposition a également été prise en considération avec la concentration maximale. L’exposition orale due à l’ingestion fortuite de granulés de caoutchouc fabriqués à partir de pneus recyclés contenant du CBS est négligeable, et l’exposition cutanée est estimée à 1,3 × 10‑5 mg/kg p.c./j (ECHA 2017; RIVM 2017).
Le risque que le MBT soit présent dans les sucettes pour bébé disponibles au Canada a été examiné et les 20 échantillons testés présentaient une concentration inférieure à la LQ de 10 mg/kg (communication personnelle, courriels de la Direction de la Sécurité des produits de consommation et des produits dangereux, Santé Canada, au BERSE, Santé Canada, 2017‑2018; sans référence). Bien que le MBT n’ait pas été détecté dans les sucettes pour bébé au Canada, sa présence dans ces produits à des concentrations atteignant la LQ de 10 mg/kg de caoutchouc entraînerait une DJMDV estimée de 1,7 × 10‑3 mg/kg p.c./j.
Du SMBT a été trouvé dans un lubrifiant pour pompe à eau de radiateur automobile à une concentration de 5 % (SDS 2011). L’exposition cutanée d’un adulte utilisant le produit a été estimée à 0,13 mg/kg p.c. par événement. Compte tenu des pressions de vapeur faibles à très faibles des substances du sous‑groupe des benzothiazoles et de leurs profils d’emploi, on ne prévoit aucune exposition par inhalation.
Afin d’estimer le risque de cancer dû à l’exposition de la population générale au Canada aux substances du sous‑groupe des benzothiazoles, les DJMDV ont été calculées pour estimer l’exposition journalière par l’eau potable (9,5 × 10‑4 mg/kg p.c./j pour le TBBS, le MBTS, le SMBT ou le DCBS), l’eau potable plus les aliments (1,9 × 10‑3 mg/kg p.c./j pour le CBS et 9,8 × 10‑4 mg/kg p.c./j pour le MBT), l’exposition par voie orale et/ou cutanée aux granulés de caoutchouc (jusqu’à 1,9 × 10‑3 mg/kg p.c./j pour le MBT, le MBTS et le CBS), et les sucettes pour bébés (1,7 × 10‑3 mg/kg p.c./j pour le MBT) (voir l’annexe C). Étant donné que la présence concomitante du MBT, du MBTS et du CBS dans les granulés de caoutchouc a été démontrée (RIVM 2017), il est raisonnable de croire qu’une coexposition puisse avoir lieu. Ainsi, l’exposition cumulative pour la durée de la vie (voie orale ou cutanée) au MBT, au MBTS et au CBS dans les granulés de caoutchouc a été estimée à 2,0 × 10‑3 mg/kg p.c./j.
Prise en compte des sous‑groupes de la population pouvant être plus exposés
Dans l’évaluation du risque pour la santé humaine, on a pris en compte les groupes de personnes au sein de la population canadienne qui, en raison d’une plus grande sensibilité ou d’une plus grande exposition, peuvent être davantage vulnérables aux effets nocifs pour la santé découlant de l’exposition à certaines substances. Le potentiel d’exposition élevée pendant le développement et la période au cours de laquelle les personnes sont en âge de procréer a été évalué. L’exposition a été systématiquement évaluée en fonction de l’âge afin de tenir compte des différences physiques et comportementales aux différentes périodes de la vie. Dans l’évaluation de l’exposition aux concentrations de fond dans les milieux naturels, les jeunes enfants (c’est-à-dire âgés de 1 an) étaient plus exposés par l’air ambiant que les adultes.
3.7.2 Évaluation des effets sur la santé
TBBS
Le TBBS a été évalué par le Programme coopératif d’évaluation des produits chimiques de l’OCDE dans un document SIAR dans le cadre de l’EDD (OCDE 2003). Cette évaluation permet de caractériser les effets du TBBS sur la santé. Des recherches ont été menées dans la littérature scientifique jusqu’en août 2018. On n’a trouvé aucune étude sur les effets sur la santé qui aurait une incidence sur la caractérisation des risques (en d’autres mots, des études qui donneraient des critères d’effet critiques différents ou des points de départ plus faibles que ceux qui figurent dans le rapport de l’OCDE de 2003).
L’OCDE a trouvé une étude de toxicité à doses répétées combinée à une évaluation préalable de la toxicité pour la reproduction ou le développement (OCDE TG 422), comme étude clé pour caractériser les effets des doses répétées. Dans cette étude, des rats SD ont reçu du TBBS par gavage à des doses de 0, 40, 200 ou 1 000 mg/kg p.c./j pendant 42 jours ou 38 jours pour les mâles ou les femelles, respectivement. Diverses modifications rénales pathologiques ont été observées chez les animaux exposés, notamment une augmentation des corps granulaires éosinophiles et une dégénérescence vacuolaire des tubules proximaux, ainsi qu’une augmentation du poids relatif des reins chez les 2 sexes dans les groupes ayant reçu 200 ou 1 000 mg/kg p.c./j. Une augmentation des corps éosinophiles a également été observée chez les mâles à la dose de 40 mg/kg p.c./j. Des effets hépatiques, tels que l’hypertrophie des hépatocytes et l’augmentation du poids du foie, ont été observés chez les mâles et les femelles dans les groupes ayant reçu 200 mg/kg p.c./j ou 1 000 mg/kg p.c./j. Chez les mâles, on a observé une anémie hémolytique et une augmentation des dépôts d’hémosidérine dans la rate des animaux ayant reçu 200 mg/kg p.c./j ou 1 000 mg/kg p.c./j. Le nombre de rats mâles ayant présenté des corps éosinophiles dans les reins a augmenté dans tous les groupes ayant reçu la substance. En outre, à la dose de 1 000 mg/kg p.c./j, la prise de poids corporel a ralenti chez les mâles et ralenti légèrement chez les femelles. Une DMENO de 40 mg/kg p.c./j a été établie d’après l’augmentation des corps éosinophiles constatée chez les mâles (OCDE 2003).
Dans une étude de 90 jours à doses répétées, des rats D ont reçu par gavage du TBBS à des doses de 0, 100, 300 ou 1 000 mg/kg p.c./j. Une DSENO de 100 mg/kg p.c./j a été établie d’après une diminution du poids corporel chez les mâles. Les femelles du groupe ayant reçu la dose la plus élevée (1 000 mg/kg p.c./j) ont présenté une augmentation du poids du foie et des reins, une augmentation du cholestérol dans le sérum et une augmentation de la densité des urines (OCDE 2003). Toutefois, le rapport de l’OCDE (2003) a indiqué que cette étude ne pouvait être validée.
Dans l’étude susmentionnée de l’OCDE [Essai 422], aucun effet sur la reproduction ou le développement n’a été observé chez les rats exposés. Le TBBS n’a eu aucun effet sur la capacité d’accouplement, la durée de l’œstrus ou la durée de la gestation et de la mise bas chez les rats exposés. Des changements dans l’indice de fertilité ont été observés à 40 mg/kg p.c./j et à 1 000 mg/kg p.c./j, mais non à 200 mg/kg p.c./j. Le poids corporel des descendants n’a pas été touché par le TBBS et aucune anomalie n’a été observée lors de l’examen externe à la naissance. Les tissus reproducteurs des mâles et des femelles ont été bien examinés et aucune anomalie n’a été observée (OCDE 2003).
Une étude de toxicité pour le développement a également été trouvée. Un nombre non précisé de femelles ont reçu du TBBS par gavage à des doses de 0, 50, 150 ou 500 mg/kg p.c./j entre les jours 6 et 15 de la gestation. Aucun effet n’a été noté chez les femelles ou les descendants à quelque dose que ce soit. En 2003, l’OCDE a déterminé une DSENO de 500 mg/kg p.c./j, soit la dose maximale d’essai, pour les effets sur la mère et le développement.
Le TBBS n’était pas mutagène dans les essais de mutation bactérienne ni dans plusieurs essais in vitro de mutation génique chez les mammifères. Il a cependant induit des aberrations chromosomiques dans les cellules de mammifères in vitro avec activation métabolique. Des réponses positives ont été observées dans les cellules de lymphomes de souris avec activation métabolique et, d’après les résultats des études in vitro antérieures, on suppose que ces réponses sont dues à des aberrations chromosomiques. Le TBBS n’était pas génotoxique dans un essai in vivo du micronoyau de la souris (OCDE 2003).
Aucune étude de toxicité chronique ou de cancérogénicité n’a été trouvée. En l’absence de telles études et compte tenu de sa similarité structurelle avec MBT, cette dernière substance a été choisie comme analogue pour éclairer les critères d’effet pour la toxicité chronique et la cancérogénicité du TBBS.
CBS
Le CBS a été évalué par l’Union européenne en 2008 (EU RAR 2008). Cette évaluation sert à éclairer la caractérisation des effets du CBS sur la santé. En outre, comme le CBS peut être hydrolysé en MBT et en cyclohexylamine (CHA) (EU RAR 2008), les données concernant les effets du MBT et de la CHA sur la santé ont également été utilisées pour éclairer la caractérisation des effets de cette substance sur la santé en l’absence de données propres à celle‑ci pour certains critères d’effet. Les critères d’effet critiques et les doses correspondantes pour le MBT et la CHA qui sont utilisés pour caractériser les risques du CBS et les résumés des données pertinentes sur les effets sur la santé figurent à l’annexe A aux fins de comparaison.
Les données propres au CBS concernant ses effets sur la santé étaient généralement peu nombreuses. Deux études sur l’administration orale à doses répétées ont été trouvées. Dans une étude à court terme par gavage, des rats (6/sexe/groupe) ont reçu du CBS à des doses de 0, 25, 80, 250 ou 800 mg/kg p.c./j pendant 28 jours consécutifs. Six autres animaux par sexe et par groupe du groupe témoin et du groupe ayant reçu la dose élevée ont été exposés pendant 28 jours, puis ont eu 14 jours de récupération avant le sacrifice. Des signes de coagulopathie chez les mâles et les femelles et des effets rénaux chez les rats mâles ont été observés à la dose de 250 mg/kg p.c./j et à la dose supérieure. Aucun effet nocif pertinent lié à l’exposition n’a été observé chez les animaux des 2 sexes à la dose de 80 mg/kg p.c./j. Par conséquent, une DSENO de 80 mg/kg p.c./j a été établie d’après les effets généralisés constatés chez les rats exposés à des doses élevées (EU RAR 2008).
Dans une étude par le régime alimentaire de 28 jours chez le rat, l’auteur a obtenu une DSENO de 250 mg/kg p.c./j d’après la diminution de la consommation alimentaire et du poids corporel aux doses plus élevées. Cependant, il a été indiqué dans le rapport EU RAR (2008) que le manque de données sur la biochimie sanguine, l’hématologie et l’histopathologie diminuait la validité de cette DSENO, bien que les données sur la consommation alimentaire et le poids corporel soient généralement reconnues comme des indicateurs sensibles de la toxicité générale (EU RAR 2008).
Aucune étude adéquate de toxicité chronique ou de cancérogénicité à doses répétées n’a été trouvée pour le CBS. Toutefois, des données pertinentes sur les effets de ses produits d’hydrolyse (MBT et CHA) sur la santé sont disponibles et ont été utilisées aux fins de lecture croisée pour le CBS. Comme le MBT est l’un des benzothiazoles de ce sous‑groupe, les renseignements sur la toxicité chronique à doses répétées et la cancérogénicité se trouvent sous la rubrique MBT, à la section 3.7.2.
La CHA a été évaluée par ECCC et Santé Canada dans le cadre du PGPC (ECCC, SC 2019), et a été utilisé comme analogue dans l’évaluation du CBS dans le rapport EU RAR (2008). L’administration orale de CHA à différentes doses et durées d’exposition chez plusieurs souches de rats et de souris a révélé que les testicules sont l’organe le plus sensible aux effets toxicologiques de la CHA. Dans une étude combinée de toxicité chronique et de cancérogénicité à doses répétées de 2 ans, une DSENO de 60 mg/kg p.c./j a été établie d’après l’augmentation significative des changements au niveau testiculaire (atrophie, tubules avec peu de spermatides, dépôts de calcium dans les tubules) observée à 219 mg/kg p.c./j (ECCC, SC 2019; EU RAR 2008).
Le CBS a donné des résultats négatifs dans les essais de mutation génique avec différentes souches de Salmonella et une souche de Saccharomyces. Il a également donné des résultats négatifs dans un essai de lymphome de souris. Dans un essai d’aberration chromosomique in vitro, cette substance a montré un faible potentiel clastogène. Le seul essai in vivo disponible (mortalité embryonnaire) n’a pu être évalué de manière adéquate, car les données rapportées étaient insuffisantes. Il n’y a donc pas suffisamment de preuves pour proposer de conclure que le CBS est mutagène. Cette conclusion est étayée par les données de génotoxicité disponibles pour les produits d’hydrolyse MBT et CHA (EU RAR 2008).
Aucune étude sur l’effet du CBS sur la reproduction n’a été répertoriée. Cependant, des études de toxicité pour la reproduction étaient disponibles pour les produits d’hydrolyse MBT et CHA. En ce qui concerne le MBT, on n’a observé aucun effet sur la reproduction dans une étude chez le rat jusqu’à la dose maximale d’essai (15 000 ppm dans le régime alimentaire, soit environ 745 à 1 328 mg/kg p.c./j). Des renseignements plus détaillés sur cette étude figurent dans la partie du présent rapport consacrée au MBT.
La CHA a été classée comme substance toxique pour la reproduction (Repr 2) par la Commission européenne (EU 2008). Plusieurs études des effets de la CHA sur la reproduction ont été trouvées. Dans plusieurs études menées sur des rats à doses répétées, on a observé des effets sur les testicules en termes de poids et de modifications morphologiques. Les mêmes études clés ont été relevées dans les évaluations d’ECCC, de SC (2019) et dans le rapport EU RAR (2008). Dans une étude par le régime alimentaire de 13 semaines qui a porté expressément sur les effets testiculaires, des rats mâles ont reçu 0, 68,5, 137, 274 ou 411 mg/kg p.c./j de CHA HCl dans leur régime alimentaire, soit 0, 50, 100, 200 ou 300 mg/kg p.c./j de CHA. Des effets sur l’histopathologie ont été observés dans les testicules (modifications dégénératives des tubules, formation de cellules géantes, atrophie testiculaire chez certains animaux), parmi celles‑ci les changements dans les tubules étaient statistiquement significatifs aux doses de 200 et 300 mg/kg p.c./j par rapport aux groupes témoins dans lesquels les animaux s’alimentaient librement ou ayant la même quantité de nourriture que le groupe traité. Le poids des testicules était également réduit de manière significative dans les groupes ayant reçu 200 ou 300 mg/kg p.c./j, par rapport au groupe témoin dans lequel les animaux s’alimentaient librement. Cependant, un effet significatif n’a été observé qu’à la dose maximale par rapport au groupe témoin nourri avec la même quantité de nourriture que le groupe traité. La DSENO a été établie à 100 mg/kg p.c./j CHA d’après les effets testiculaires observés aux doses plus élevées (ECCC, SC 2019).
Plusieurs études sur les effets du CBS sur le développement chez le rat ont été trouvées. Ces études ont systématiquement démontré que le CBS induit une toxicité chez les mères d’après une variation de la prise de poids pendant la gestation et de signes de retard de la croissance fœtale se manifestant par une réduction du poids corporel moyen des fœtus. Toutefois, l’effet sur le poids corporel des fœtus a été exclusivement observé à des doses orales associées à un ralentissement significatif de la prise de poids de 15 % à 30 % chez les mères. Par conséquent, il n’a pas été possible de déterminer un potentiel embryotoxique ou tératogène propre à la substance (EU RAR 2008).
MBTS
Le MBTS a été évalué par le Comité consultatif allemand sur les substances chimiques existantes (Beratergremium für umweltrelevante altstoffe, BUA) en 1993. Le rapport indiquait que le MBTS était en équilibre redox avec le MBT, et par conséquent si les effets toxiques du MBTS correspondaient à ceux du MBT (BUA 1993).
L’Agence européenne des produits chimiques a publié une Décision de vérification de la conformité pour le MBTS (ECHA 2016a) et a convenu que le MBT est un analogue approprié du MBTS pour la lecture croisée, d’après le raisonnement suivant : le MBTS comporte 2 groupements MBT et est facilement converti en MBT, les métabolites du MBTS et du MBT sont les mêmes et les profils de toxicité, par exemple la génotoxicité et les effets des 2 substances sur le développement et les effets génotoxiques sont similaires. L’ECHA (2016a) a également fait référence à l’étude du BUA (1993) en ce qui concerne l’équilibre redox du MBTS avec le MBT. Par conséquent, le MBT a été utilisé comme analogue pour caractériser les effets du MBTS sur la santé en l’absence de données propres à la substance. Les critères d’effet critiques et les doses correspondantes pour le MBT qui ont été utilisés pour caractériser les risques du MBTS et les résumés des données pertinentes sur les effets sur la santé figurent à l’annexe A aux fins de comparaison (aucune étude additionnelle n’est décrite dans le présent document).
Les études disponibles sur l’exposition de rats et de cobayes au MBTS à doses répétées ont montré des effets sur le foie et les reins. Toutefois, ces études étaient insuffisantes pour établir une concentration critique (BUA 1993).
L’unique étude à long terme disponible sur le MBTS n’indiquait pas de potentiel cancérogène. Cependant, cette étude ne respectait pas suffisamment les lignes directrices actuelles pour les essais de produits chimiques, car la taille de l’échantillon était insuffisante et les doses et les durées d’exposition étaient inappropriées. Par conséquent, le MBT est utilisé comme analogue pour éclairer les effets critères d’effet pour la toxicité chronique et la cancérogénicité pour cette substance. Les renseignements pertinents sur les effets sur la santé figurent dans la section consacrée au MBT dans le présent rapport.
Aucune étude adéquate sur la reproduction n’a été trouvée.
Dans une étude de toxicité pour le développement, des rats Wistar ont reçu du MBTS à des doses de 0, 0,04, 0,2 ou 1 % dans leur régime alimentaire (soit approximativement 0, 26, 127 ou 596 mg/kg p.c./j) entre les jours 0 et 20 de la gestation. La prise de poids corporel chez les mères entre les jours 0 et 14 de la gestation dans le groupe ayant reçu 1 % a été sensiblement réduite, mais on n’a observé aucun changement significatif induit par le MBTS dans les autres paramètres maternels, par exemple la consommation alimentaire et les signes cliniques de toxicité. Une DSEO de 127 mg/kg p.c./j a été établie (BUA 1993). On n’a pas constaté d’effet significatif lié à l’exposition sur la fréquence des pertes avant et après l’implantation ni sur le nombre, le rapport des sexes ou le poids corporel des fœtus vivants. Les examens morphologiques des fœtus n’ont révélé aucun signe de tératogenèse. Pour ce qui est du développement postnatal des descendants des mères ayant reçu du MBTS, on a observé un taux de survie élevé et une bonne croissance des descendants. L’auteur de l’étude a conclu que le MBTS n’a aucun effet nocif sur le développement prénatal et postnatal des descendants des rats aux doses employées (EMA et al. 1989).
En l’absence d’une étude adéquate à doses répétées pour caractériser l’exposition ponctuelle au MBTS, on a utilisé le MBT comme analogue pour éclairer les effets subchroniques à court terme, ainsi que les critères d’effet toxicologiques pour la reproduction. Par extension, on a également utilisé le SMBT comme analogue pour caractériser le risque d’exposition cutanée potentiel au MBTS par lecture croisée.
Le MBTS s’est avéré négatif dans la plupart des résultats de tests d’Ames trouvés. Le MBTS n’a pas induit de mutation génique dans les cellules de mammifères sans activation métabolique, mais on a constaté un taux de mutation accru dans l’essai du lymphome de souris avec activation métabolique. Le MBTS n’a pas induit de dommages chromosomiques dans les cellules CHO avec ou sans activation métabolique (BUA 1993). Aucune étude de génotoxicité in vivo n’a été trouvée.
MBT
Le CIRC a classé le MBT dans le groupe 2A des substances cancérogènes (« probablement cancérogène pour les humains ») et a publié une monographie sur cette substance en 2018 (CIRC 2018). La substance a également été examinée par l’ECHA en 2014, par l’EPA danoise en 2014 et par l’EPA américaine en 2010. La monographie du CIRC (2018) et l’évaluation de l’ECHA (2014a) concernant le MBT ont été utilisées pour éclairer la caractérisation des effets de cette substance sur la santé. Des recherches ont été menées dans la littérature scientifique jusqu’en août 2018. On n’a trouvé aucune étude traitant des effets sur la santé qui aurait eu une incidence sur la caractérisation des risques (en d’autres mots, des études qui donneraient des critères d’effet critiques différents ou des points de départ plus faibles que ceux qui figurent ou des points de départ plus faibles que ceux indiqués dans CIRC 2018 ou ECHA 2014a).
La toxicocinétique du MBT a été évaluée dans plusieurs études chez des rats et des cobayes. Le MBT administré par voie orale était facilement absorbé et éliminé. L’élimination se faisait principalement par l’urine, et en petites quantités par les matières fécales. Les données sur la récupération, après administration orale ou intraveineuse de MBT, n’indiquaient pas que des quantités importantes de radioactivité dues à du MBT marqué au 14C étaient retenues dans les tissus autres que le sang. Des études sur le métabolisme ont révélé la présence d’un glucuronide, d’un conjugué du glutathion, de l’acide mercapturique ainsi que de sulfate et de disulfure de di(benzothiazol‑2‑yle comme métabolites du MBT dans l’urine (ECHA 2014a). Dans une étude de cancérogénicité par voie orale de 2 ans, des groupes de 50 rats et de 50 rats femelles F344/N et de 50 souris mâles et 50 souris femelles B6C3F1 ont été exposés au MBT dans de l’huile de maïs, par gavage, 5 jours par semaine pendant 103 semaines. Les femelles ont reçu des doses de 0, 188 ou 375 mg/kg p.c./j, tandis que les rats mâles et les souris mâles et femelles ont reçu des doses de 0, 375 ou 750 mg/kg p.c./j. Chez les rats, on a observé une fréquence accrue de la leucémie à cellules mononucléées, des adénomes à cellules acineuses du pancréas, des phéochromocytomes des glandes surrénales ou des phéochromocytomes malins (combinés), et des adénomes ou des carcinomes des glandes préputiales (combinés) chez les mâles exposés, et une augmentation de la fréquence des phéochromocytomes des glandes surrénales et des adénomes ou des carcinomes de l’hypophyse (combinés) chez les femelles exposées. On a rapporté une faible fréquence de papillomes à cellules transitoires du bassinet du rein et des carcinomes à cellules transitoires du bassinet du rein chez les rats mâles exposés. On n’a trouvé aucun signe d’effets cancérogènes du MBT chez les souris mâles ayant reçu une dose de 375 ou 750 mg/kg p.c./j. Des signes d’effets cancérogènes chez les souris femelles, indiqués par une augmentation de la fréquence des adénomes ou des carcinomes hépatocellulaires (combinés) (NTP 1988), ont été constatés.
Par ailleurs, on disposait d’études sur la cancérogénicité du MBT chez les humains. Une étude a été menée sur une cohorte de 2 160 travailleurs masculins d’une usine de production chimique dans le nord du Pays de Galles, au Royaume‑Uni. La comparaison des données pour les travailleurs exposés avec les populations nationales de l’Angleterre et du Pays de Galles a montré un excès significatif de la fréquence du cancer de la vessie. Après des comparaisons internes avec d’autres expositions professionnelles, on a constaté une tendance non significative à la hausse de la fréquence du cancer de la vessie, avec une augmentation de l’exposition cumulative au MBT. Un excès de risque unitaire non significatif, multiplié par 2, a été observé dans le groupe le plus exposé. Dans une autre étude, une cohorte de 1 059 travailleurs mâles dans une usine de production chimique à Nitro, en Virginie occidentale (États‑Unis) a été exposé au MBT et au 4‑aminobiphényle (substance classée dans le Groupe 1 du CIRC comme cause du cancer de la vessie). Parmi les 511 travailleurs exposés au MBT sans exposition documentée au 4‑aminobiphényle, on a constaté une surmortalité statistiquement significative d’un facteur de 4 due au cancer de la vessie. On a également observé une tendance statistiquement significative de la mortalité due au cancer de la vessie, avec une exposition cumulative croissante au MBT. Le manque de données disponibles sur le tabagisme a constitué une limite pour ces 2 études. Cependant, il est peu probable que le facteur de confusion dû au tabagisme explique les profils exposition–réponse observés dans ces études (CIRC 2018).
Le MBT a été testé dans le cadre de divers essais de génotoxicité. Le MBT a induit des aberrations chromosomiques et des échanges de chromatides sœurs dans des cellules d’ovaires de hamsters chinois en présence d’une activation métabolique, et a provoqué des mutations au niveau du locus Tk dans des cellules de lymphomes L5178Y de souris. Cependant, il n’était pas mutagène dans les systèmes d’essai des bactéries ou dans les lignées cellulaires de carcinome gastrique et pulmonaire humain. Il ne s’était pas lié à l’ADN du rat in vivo. Par conséquent, le CIRC (2018) a conclu qu’il y a peu de preuves indiquant que le MBT est génotoxique.
Whittaker et al. (2004) ont examiné l’ensemble des données épidémiologiques et toxicologiques pour le MBT, et ont conclu que l’induction de tumeurs à cellules transitoires du bassinet du rein est le critère d’effet le plus pertinent traduisant la plus grande sensibilité, aux fins de l’évaluation quantitative des risques. Bien que les tumeurs à cellules transitoires ne soient pas statistiquement significatives chez les rats mâles, on les juge particulièrement pertinentes pour une évaluation des effets du MBT sur la santé en raison de l’accroissement apparent du risque de décès par cancer de la vessie chez les humains exposés en milieu de travail. Utilisant les résultats de l’étude sur le cancer de 2 ans du NTP (1988) et des résultats d’essais de génotoxicité, les auteurs ont employé un modèle à stades multiples pour extrapoler les expositions à faible dose au MBT. Ce modèle à stades multiples a permis de calculer une plus faible dose efficace (LED10), qui est définie comme la limite inférieure de confiance à 95 % pour une dose associée à un risque supplémentaire de 10 %, à partir des données sur les tumeurs à cellules transitoires du bassinet du rein chez les rats mâles, dans l’étude NTP. Un coefficient de pente de 6,34 x 10‑4 (mg/kg j)‑1 a ensuite été calculé à partir de la LED10 (Whittaker et. al 2004). Ce coefficient de pente est utilisé pour caractériser le risque de cancer lié à l’exposition au MBT pour la population générale au Canada.
D’après l’étude du NTP susmentionnée chez le rat et la souris (gavage, 2 ans), une DMENO de 188 mg/kg p.c./j pour les femelles et une DMENO de 375 mg/kg p.c./j pour les rats mâles et pour les souris mâles et femelles ont été établies par l’ECHA, d’après une réduction du taux de survie et une la léthargie, ou une réduction du poids corporel observée chez les rats ou les souris exposés, respectivement. Le NTP a également mené une étude par gavage de 13 semaines chez le rat et la souris. L’ECHA (2014a) a établi une DMENO de 188 mg/kg p.c./j pour les rats mâles et femelles, d’après une augmentation du poids relatif du foie, et une DSENO de 188 mg/kg p.c./j pour les souris mâles et femelles, d’après une léthargie et la fourrure ébouriffée observées à la dose suivante de 375 mg/kg p.c./j.
On n’a trouvé aucune étude à doses répétées pour le MBT par voie cutanée. Cependant, on a trouvé une étude de 91 jours sur l’administration à doses répétées, par voie cutanée, de SMBT, le sel de sodium du MBT. Une DSENO de 200 mg/kg p.c./j a été établie d’après une augmentation statistiquement significative dans le poids du foie observée chez les rats femelles exposés à des doses plus élevées (US EPA 2010). On utilise cette DSENO pour caractériser les risques d’exposition par voie cutanée au MBT, au lieu de faire une extrapolation de voie à voie à partir d’une étude de toxicité orale menée avec du MBT, car on s’attend à ce que le SMBT soit facilement hydrolysé en MBT au contact de la peau.
Dans une étude de toxicité pour la reproduction sur 2 générations de rats Sprague‑Dawley, on n’a constaté aucun signe d’effet sur la reproduction jusqu’à la dose maximale d’essai. L’auteur a établi une DSENO de 15 000 ppm dans le régime alimentaire (soit environ 745 à 1 328 mg/kg p.c./j) (ECHA 2014a).
Deux études de toxicité prénatale pour le développement chez des rats SD et des lapins néo‑zélandais ont été trouvées. Il n’y a eu aucune preuve de toxicité pour le développement prénatal chez les 2 espèces jusqu’aux doses maximales d’essai de 300 mg/kg p.c./j (ECHA 2014a).
Les renseignements concernant le MBT et les effets induits par la réduction des taux d’hormones thyroïdiennes dans les organismes aquatiques ont été présentés dans l’évaluation des risques pour l’environnement (section 3.6), et il a été montré que le MBT inhibe la TPO chez le rat et le porc in vitro (CIRC 2018; Friedman et al. 2016).
SMBT
Le SMBT est le sel de sodium du MBT. L’EPA a évalué le MBT et le SMBT en 2010 et a utilisé le MBT comme analogue pour combler les lacunes dans les données sur les effets du SMBT sur la santé par lecture croisée (US EPA 2010). Par conséquent, en l’absence de données propres à la substance, on emploie les effets pertinents sur la santé et d’autres effets du MBT pour éclairer la caractérisation des effets du SMBT sur la santé. Les critères d’effet critiques et les doses correspondantes pour le MBT qui sont utilisés pour caractériser les risques du SMBT et les résumés des données pertinentes sur les effets sur la santé figurent à l’annexe A aux fins de comparaison (aucune étude additionnelle n’est décrite dans le présent document).
Une seule étude des effets du SMBT sur la santé a été trouvée, soit une étude de toxicité subchronique par voie cutanée à doses répétées chez le rat, décrite dans le rapport de 2010 de l’EPA. Des rats SD (nombre et sexe non indiqués) ont reçu du SMBT par voie cutanée à raison de 0, 200, 1 000 ou 2 000 mg/kg p.c./j pendant 91 jours. Une augmentation statistiquement significative du poids du foie a été observée chez les rats femelles à 1 000 et 2 000 mg/kg p.c./j. Aucun autre effet notable lié au traitement n’a été constaté. Ce rapport (US EPA 2010) a fait état d’une DMENO de 1 000 mg/kg p.c./j (établie d’après l’augmentation du poids du foie chez les femelles) et d’une DSENO de 200 mg/kg p.c./j.
DCBS
Le DCBS a été évalué par l’OCDE en 2004 (OCDE 2004a). Cette évaluation sert à éclairer la caractérisation des effets du DCBS sur la santé dans le présent rapport.
Dans une étude de toxicité à doses répétées combinée à une évaluation préalable de la toxicité pour la reproduction ou le développement [OCDE TG 422], on a administré à des rats du DCBS par gavage des doses de 0, 6, 25, 100 ou 400 mg/kg p.c./j pendant 44 jours, ou 40 à 51 jours pour les mâles et les femelles, respectivement. Des critères d’effet critiques ont été constatés lors de l’observation clinique et de l’examen histopathologique des reins. On a observé une salivation chez les mâles à la dose de 400 mg/kg p.c./j et une diminution de l’activité locomotrice chez les femelles aux doses de 100 et 400 mg/kg p.c./j. L’examen histopathologique a révélé la présence de gouttelettes hyalines dans l’épithélium tubulaire rénal chez les mâles et une dégénérescence lipidique de l’épithélium tubulaire rénal chez les femelles à 100 et 400 mg/kg p.c./j. En outre, on a observé une hypertrophie des surrénales avec une vacuolisation à cellules corticosurrénales et une atrophie de la rate chez les femelles à 100 et 400 mg/kg p.c./j. L’auteur a établi une DSENO pour la toxicité à doses répétées, soit 25 mg/kg p.c./j pour les 2 sexes (OCDE 2004a).
Dans l’étude mentionnée ci‑dessus, réalisée selon l’Essai 422 de l’OCDE, les effets toxiques ont été observés chez les femelles et les petits à la dose de 400 mg/kg p.c./j. On a observé une diminution du nombre de corps jaunes accompagnée d’une diminution du nombre de sites d’implantation et de la taille des portées. Trois mères sont mortes le jour prévu de la mise bas ou le lendemain. Toutes les mères ayant reçu une dose de 400 mg/kg p.c./j ont perdu leur portée à la naissance ou au plus tard le 4e jour de lactation. On n’a constaté aucun effet sur l’accouplement, la fertilité et la morphogénèse des petits à une dose inférieure ou égale à 100 mg/kg p.c./j. L’auteur de l’étude a établi une DSENO pour la toxicité pour la reproduction et le développement, soit 100 mg/kg p.c./j (OCDE 2004a).
On a obtenu des résultats négatifs avec le DCBS dans des essais de mutation bactérienne avec et sans activation métabolique. Les résultats ont également été négatifs dans des essais sur cellules de mammifères, à l’exception des effets cytogénétiques observés dans un essai du micronoyau dans à cellules CHL sans activation métabolique. Cependant, aucun effet cytogénétique n’a été observé dans un essai in vivo sur des chromosomes de la moelle osseuse. Selon l’OCDE, le poids de la preuve semble indiquer que cette substance pourrait ne pas être génotoxique in vivo.
Aucune étude de chronicité ou de cancérogénicité pour le DCBS n’a été trouvée. Toutefois, l’OCDE (2004a) a jugé que le CBS présente une structure apparentée à celle du DCBS, car les 2 substances peuvent s’hydrolyser en MBT. Bien qu’il n’existe aucune donnée de toxicocinétique empirique pour le DCBS et que la substance ne semble pas être génotoxique, le MBT a été sélectionné comme analogue pour caractériser le potentiel cancérogène du DCBS dans la présente évaluation, à titre d’approche prudente.
Prise en compte des sous‑groupes de la population qui pourraient être plus sensibles
Des groupes de personnes au sein de la population canadienne pourraient, en raison d’une plus grande sensibilité ou d’une plus grande exposition, être davantage vulnérables aux effets nocifs pour la santé en raison de l’exposition à certaines substances. On a pris en compte le potentiel de sensibilité pendant les différentes périodes de la vie ou selon les sexes, provenant des études disponibles. Les différences entre les sexes ont été examinées dans des études figurant dans la base de données sur les dangers. Dans la présente évaluation, les études prises en compte comprenaient des études sur des animaux de laboratoire, dans lesquelles les auteurs ont examiné les effets sur la reproduction et le développement chez les jeunes, et la toxicité chez les femelles gravides.
3.7.3 Caractérisation des risques pour la santé humaine
En l’absence de données sur les effets sur la santé propres à la voie d’exposition, on a utilisé des études de toxicité par voie orale comme études de substitution pour caractériser les risques liés à l’exposition cutanée. Les tableaux 3‑16 et 3‑17 présentent toutes les estimations pertinentes de l’exposition et les points de départ (PD) pour les risques associés aux substances du sous‑groupe des benzothiazoles, ainsi que les ME résultantes.
Le CIRC (2018) a classé le MBT comme un cancérogène du groupe 2A (« probablement cancérogène pour les humains »). Par conséquent, pour estimer le risque de cancer lié à l’exposition quotidienne au MBT, on a utilisé un excès de risque unitaire (ERU = 6,34 × 10‑4 (mg/kg j)‑1), calculé par Whittaker et al. (2004) qui ont employé la même étude de 2 ans du NTP sur le cancer chez le rat et qui a été relevée par le CIRC (2018). En l’absence de données de toxicité chronique/cancérogénicité propres à la substance pour le TBBS, le SMBT, le CBS, le MBTS et le DCBS, et compte tenu des similarités structurelles et/ou de considérations métaboliques, on a sélectionné le MBT comme analogue de lecture croisée pour caractériser le potentiel cancérogène de ces substances.
Bien qu’aucun signe indiquant la présence de TBBS et de DCBS dans les granulés de caoutchouc n’ait été trouvé, on s’attend à ce que l’exposition potentielle à ces substances à partir des granulés de caoutchouc soit similaire ou inférieure à l’exposition au MBT, au MBTS et au CBS.
L’application de l’excès de risque unitaire (6,34 × 10‑4 (mg/kg-j)‑1) à l’exposition estimée au TBBS, au MBTS, au SMBT ou au DCBS au cours de la vie, par l’eau potable (9,5 × 10‑4 mg/kg p.c./j), donne un risque de cancer d’environ 6,0 × 10‑7 pour chaque substance. De plus, l’application de l’excès de risque unitaire à l’exposition estimée pendant la durée de vie au CBS et au MBT, par l’eau potable et les aliments (1,9 × 10‑3 mg/kg p.c./j et 9,8 × 10‑4 mg/kg p.c./j, respectivement) donne lieu à un risque de cancer d’environ 1,2 × 10‑6 et 6,2 × 10‑7, respectivement. De même, en appliquant l’excès de risque unitaire à l’exposition estimée pendant la durée de vie (des tout‑petits à l’âge adulte) au MBT, au MBTS et au CBS (exposition par voie orale et/ou cutanée) par les granulés de caoutchouc (jusqu’à 1,9 × 10‑3 mg/kg p.c./j), on obtient un risque de cancer compris entre 6,2 × 10‑9 et 1,2 × 10‑6. La co‑occurrence du MBT, du MBTS et du CBS a été démontrée dans les benzothiazoles mesurés dans des échantillons de granulés de caoutchouc fabriqués à partir de caoutchouc recyclé (RIVM 2017). Puisqu’une coexposition orale et cutanée au MBT, au MBTS et au CBS par les granulés de caoutchouc est probable, l’exposition cumulative pour toute la durée de la vie à ces substances a été estimée à 32,0 × 10‑3 mg/kg p.c./j, d’où un risque de cancer approximatif de 1,3 × 10‑6.
Le MBT n’a pas été détecté dans les sucettes en caoutchouc pour bébé au Canada (voir la section 3.7.1). Toutefois, le risque de cancer lié à la mise à la bouche quotidienne d’une sucette en caoutchouc, si elle contenait du MBT à la LQ de 10 mg/kg de caoutchouc selon l’étude de Santé Canada, se traduirait par un risque de cancer de 1,1 × 10‑6.
En ce qui concerne le MBT, la DJMDV résultant de l’exposition à des sucettes pour bébé en caoutchouc contenant du MBT, à une concentration équivalant à la LQ de 10 mg/kg de caoutchouc, couplée à l’exposition au MBT dans les granulés de caoutchouc, a été estimée à 4,9 × 10‑3, ce qui donne un risque de cancer de 3,1 × 10‑6.
En ce qui concerne la présence de ces substances dans l’environnement, les CEE sont jugées suffisamment prudentes pour tenir compte de l’incertitude liée à une éventuelle coexposition à plusieurs substances du sous‑groupe des benzothiazoles. De même, les hypothèses utilisées pour calculer les estimations de l’exposition pour ces substances dans les aliments sont suffisamment prudentes pour tenir compte de cette incertitude.
| Scénario d’exposition | DJMDV (mg/kg p.c./j) | Concentration critique | Effet critique sur la santé | Risque de cancer |
|---|---|---|---|---|
| Milieu environnemental, voie orale, exposition quotidienne, MBTS, SMBT, TBBS et DCBS | 9,5 × 10‑4 | ERU = 6,34 × 10‑4 (mg/kg j)‑1 | Augmentation des tumeurs à cellules transitoires du bassinet du rein | 6,0 × 10‑7 |
| Milieu environnemental, voie orale, exposition quotidienne par les aliments, MBT | 9,8 × 10‑4 | ERU = 6,34 × 10‑4 (mg/kg j)‑1 | Augmentation des tumeurs à cellules transitoires du bassinet du rein | 6,2 × 10‑7 |
| Milieu environnemental, voie orale, exposition quotidienne par les aliments, CBS | 1,9 × 10‑3 | ERU = 6,34 × 10‑4 (mg/kg j)‑1 | Augmentation des tumeurs à cellules transitoires du bassinet du rein | 1,2 × 10‑6 |
| Granulés de caoutchouc, exposition cutanée et quotidienne, CBSa | 9,8 × 10‑6 | ERU = 6,34 × 10‑4 (mg/kg j)‑1 | Augmentation des tumeurs à cellules transitoires du bassinet du rein | 6,2 × 10‑9 |
| Granulés de caoutchouc, exposition orale et cutanée, quotidienne, MBTS | 7,6 × 10‑5 | ERU = 6,34 × 10‑4 (mg/kg j)‑1 | Augmentation des tumeurs à cellules transitoires du bassinet du rein | 4,8 × 10‑8 |
| Granulés de caoutchouc, exposition orale et cutanée, quotidienne, MBT | 1,9 × 10‑3 | ERU = 6,34 × 10‑4 (mg/kg j)‑1 | Augmentation des tumeurs à cellules transitoires du bassinet du rein | 1,2 × 10‑6 |
| Sucettes pour bébé en caoutchoucb, exposition orale et quotidienne, MBT | 1,7 × 10‑3 | ERU = 6,34 × 10‑4 (mg/kg j)‑1 | Augmentation des tumeurs à cellules transitoires du bassinet du rein | 1,1 × 10‑6 |
Abréviations : DJMDV = dose journalière moyenne pour la durée de la vie; ERU = excès de risque unitaire.
a Les expositions par les voies orale et cutanée ne se cumulent pas nécessairement, car l’exposition par voie orale est négligeable.
b On fait l’hypothèse que le MBT est présent dans les sucettes pour bébé en caoutchouc à la LQ de l’étude, soit 10 mg/kg de caoutchouc (communication personnelle, courriels de la Direction de la Sécurité des produits de consommation et des produits dangereux, Santé Canada, au BERSE, Santé Canada, 2017, 2018; sans référence).
Compte tenu des renseignements ci‑dessus et des incertitudes liées à la co‑occurrence et à la coexposition possibles, le risque de cancer résultant de l’exposition orale et cutanée aux substances du sous‑groupe des benzothiazoles est jugé faible aux niveaux actuels d’exposition.
En ce qui concerne les effets non cancérogènes systémiques, on a utilisé les concentrations entraînant des effets critiques sur la santé, d’après des études de toxicité chronique ou subchronique, pour caractériser le risque lié aux expositions ponctuelles pour la plupart des substances du sous‑groupe des benzothiazoles. L’utilisation d’études de toxicité chronique ou subchronique pour caractériser les risques liés aux expositions ponctuelles ou intermittentes a été jugée prudente.
Pour l’exposition cutanée ponctuelle au CBS, une DSENO de 80 mg/kg p.c./j a été établie à partir d’une étude de 28 jours sur l’exposition orale à doses répétées. La comparaison de cette DSENO avec l’exposition cutanée ponctuelle estimée au CBS due à des granulés de caoutchouc (1,3 x 10‑5 mg/kg p.c./j) donne une marge d’exposition d’environ 6 000 000. Cette marge est jugée suffisante pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé, et on estime qu’elle assure une protection contre les effets potentiels sur la reproduction ou le développement qui se produisent à une dose plus élevée.
Pour ce qui est des effets systémiques non cancérogènes du MBT, une DMENO de 188 mg/kg p.c./j a été établie d’après l’augmentation du poids relatif du foie observée chez les rats dans une étude à doses répétées administrées par voie orale de 13 semaines. Cette DMENO est utilisée pour caractériser le risque associé à une exposition ponctuelle par voie orale au MBT, ainsi que le risque associé à une exposition ponctuelle par voie orale au MBTS, selon une approche de lecture croisée. La comparaison de la DMENO avec la valeur estimative de l’exposition ponctuelle par voie orale aux granulés de caoutchouc contenant du MBT (9,8 x 10‑5 mg/kg p.c./j) ou du MBTS (3,9 x 10‑6 mg/kg p.c./j) donne des marges d’exposition d’environ 1 920 000 ou 48 200 000, respectivement. Ces marges sont jugées suffisantes pour réduire les incertitudes relatives aux bases de données sur l’exposition et les effets sur la santé.
En ce qui concerne l’exposition ponctuelle par voie cutanée, une DSENO de 200 mg/kg p.c./j a été établie d’après l’augmentation du poids du foie observée chez les rats exposés au SMBT dans une étude de toxicité subchronique par voie cutanée. Cette DSENO est également utilisée pour caractériser le risque lié à l’exposition cutanée au MBT et au MBTS, selon une approche par lecture croisée. La comparaison de la DSENO avec l’exposition estimée à un lubrifiant de pompe à eau de radiateur automobile contenant du SMBT (0,13 mg/kg p.c./j) ou à des granulés de caoutchouc contenant du MBT (2,5 × 10‑3 mg/kg p.c./j) ou du MBTS (2,1 x 10‑5 mg/kg p.c./j) donne des marges d’exposition d’environ 1 500, 80 000 et 9 500 000, respectivement. Ces marges jugées adéquates pour compenser les incertitudes concernant les bases de données sur l’exposition et les effets sur la santé.
Pour ce qui est des effets non cancérogènes dus à des expositions par voies orale et cutanée, les marges ont été jugées adéquates, même en tenant compte de l’incertitude associée à la co‑occurrence possible de ces substances dans les granulés de caoutchouc.
| Scénario d’exposition | Exposition quotidienne estimée (mg/kg p.c./j) | Dose critique (mg/kg p.c./j) | Effet critique sur la santé | ME |
|---|---|---|---|---|
| Granulés de caoutchouc, exposition cutanée ponctuelle, enfant, CBSa | 1,3 × 10‑5 | DSENO = 80 | Effets sur les reins | 6 000 000b |
| Granulés de caoutchouc, exposition orale ponctuelle, tout‑petit, MBTSa | 3,9 × 10‑6 | DMENO = 188 | Augmentation du poids relatif du foie | 48 200 000c |
| Granulés de caoutchouc, exposition cutanée ponctuelle, enfant, MBTSa | 9,7 × 10‑5 | DSENO = 200 | Augmentation du poids du foie | 2 100 000b |
| Granulés de caoutchouc, exposition orale ponctuelle, tout‑petit, MBTa | 9,8 × 10‑5 | DMENO = 188 | Augmentation du poids relatif du foie | 1 920 000c |
| Granulés de caoutchouc, exposition cutanée ponctuelle, enfant, MBTa | 2,5 × 10‑3 | DSENO = 200 | Augmentation du poids du foie | 80 000b |
| Lubrifiant de pompe à eau de radiateur automobile, exposition cutanée ponctuelle, adulte, SMBT | 0,13 | DSENO = 200 | Augmentation du poids du foie | 1 500b |
Abréviations : DMENO = dose minimale entraînant un effet nocif observé; ME = marge d’exposition; DSENO = dose sans effet nocif observé; PdD = point de départ.
a Bien qu’il n’y ait pas de preuve directe (par exemple, données sur les concentrations) indiquant la présence de TBBS et de DCBS dans les granulés de caoutchouc, on s’attend à ce que l’exposition potentielle à ces substances entraîne une exposition similaire ou inférieure par rapport au MBT, au MBTS et au CBS. Par conséquent, la ME potentielle serait similaire ou supérieure à ce qui est présenté ici.
b ME cible = 100 (x10 pour la variation interspécifique; x10 pour la variation intraspécifique).
c ME cible = 300 (x10 pour la variation interspécifique; x10 pour la variation intraspécifique; x3 pour l’utilisation d’une DMENO).
Bien que l’exposition de la population générale au TBBS, au CBS, au MBTS, au MBT, au SMBT et au DCBS ne soit pas préoccupante aux niveaux actuels, on estime néanmoins que ces substances sont préoccupantes pour la santé en raison de leurs effets cancérogènes potentiels. Par conséquent, si l’exposition à ces substances devait augmenter, cela pourrait devenir préoccupant pour la santé humaine. De plus, on juge que le CBS est davantage préoccupant pour la santé en raison de ses effets possibles sur la reproduction.
3.7.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Le tableau 3‑17 présente les principales sources d’incertitude.
| Principale source d’incertitude | Incidence |
|---|---|
| Absence de données de surveillance pour les substances du sous‑groupe des benzothiazoles dans les milieux naturels ambiants au Canada (par exemple, eau de surface, air), l’eau potable ou le lait maternel. | +/‑ |
| Comme les données canadiennes sur l’occurrence de ces substances étaient limitées, les concentrations de benzothiazole utilisées dans l’évaluation de l’exposition par le régime alimentaire provenaient d’études réalisées à l’étranger. | +/‑ |
| Absence d’étude de toxicité chronique ou subchronique chez les animaux par voie cutanée, et il y a peu d’études de toxicité chronique chez les animaux par voie orale pour la plupart des substances du sous‑groupe des benzothiazoles. | +/‑ |
| Il y a peu ou pas d’études de toxicité pour la reproduction ou le développement ou de cancérogénicité pour certaines substances du sous‑groupe des benzothiazoles. | +/‑ |
| Il n’existe pas ou peu de données empiriques sur les dangers propres à certaines substances du sous‑groupe des benzothiazoles. | +/‑ |
+ = incertitude quant au potentiel de surestimation de l’exposition/risque; – = incertitude quant au potentiel de sous‑estimation du risque d’exposition; +/ – = potentiel inconnu de surestimation ou de sous‑estimation du risque.
4. Conclusion
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation, les substances du sous-groupe des benzotriazoles présentent un faible risque d’effets nocifs pour l’environnement. Il a été conclu que les substances du sous-groupe des benzotriazoles ne satisfont pas aux critères énoncés aux alinéas 64a) et b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation, le MBT et ses précurseurs présentent un risque d’effets nocifs pour l’environnement. Il a été conclu que le MBT et ses précurseurs, y compris les substances du sous-groupe des benzothiazoles, satisfont aux critères énoncés à l’alinéa 64a) de la LCPE, car ils pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique. Toutefois, il a été conclu que les substances du sous-groupe des benzothiazoles ne satisfont pas au critère énoncé à l’alinéa 64b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à mettre en danger l’environnement essentiel pour la vie.
À la lumière des renseignements contenus dans la présente évaluation, il a été conclu que les substances du groupe des benzotriazoles et des benzothiazoles ne satisfont pas aux critères de l’alinéa 64c) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou une concentration ou des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaine
Il a été conclu que les 9 substances du sous-groupe des benzotriazoles ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE et que le MBT et ses précurseurs, y compris les 6 substances du sous-groupe des benzothiazoles, satisfont à un ou plusieurs des critères énoncés à l’article 64 de la LCPE. Il a également été établi que certaines substances du groupe du MBT et de ses précurseurs répondent aux critères de persistance, mais que le MBT et ses précurseurs ne répondent pas aux critères de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation pris en vertu de la LCPE.
Bibliographie
[ACC] American Chemistry Council. 2001. Benzothiazole-based thiazoles category justification and testing rationale. 12 pages. Test plan for benzothiazoles submitted to the US EPA’s HPV Chemical Challenge Program. (Disponible en anglais seulement)
ACD/Percepta [module prévisionnel]. c 1997-2012. Toronto (ON): Advanced Chemistry Development, Inc. (Disponible en anglais seulement)
[AR] Alberta Recycling. 2017. Annual report 2016/17 [PDF]. Edmonton (AB): AR. [Consulté le 14 août 2016]. (Disponible en anglais seulement)
[AR] Alberta Recycling. 2018. Annual report 2017/2018 [PDF]. Edmonton (AB): AR. [Consulté le 14 août 2016]. (Disponible en anglais seulement)
Arnot JA, Mackay D, Bonnell M. 2008a. Estimating metabolic biotransformation rates in fish from laboratory data. Environ Toxicol Chem. 27(2):341–351. (Disponible en anglais seulement)
Arnot JA, Mackay D, Parkerton TF, Bonnell, M. 2008b. A database of fish biotransformation rates for organic chemicals. Environ Toxicol Chem. 27(11):2263-2270. (Disponible en anglais seulement)
Ash M. 2001. Handbook of textile processing chemicals. Synapse Information Resources, Inc. (Disponible en anglais seulement)
Asheim J, Vike-Jonas K, Gonzalez SV, Lierhagen S, Venkatraman V, Veivåg IL, Snilsberg B, Flaten TP, Asimakopoulos AG. 2019. Benzotriazoles, benzothiazoles and trace elements in an urban road setting in Trondheim, Norway: Re-visiting the chemical markers of traffic pollution. Sci Total Environ. 649:703-11. (Disponible en anglais seulement)
Asimakopoulos AG, Ajibola A, Kannan K, Thomaidis NS. 2013a. Occurrence and removal efficiencies of benzotriazoles and benzothiazoles in a wastewater treatment plant in Greece. Sci Total Environ. 452:163-171. (Disponible en anglais seulement)
Asimakopoulos AG, Wang L, Thomaidis NS, Kannan K. 2013b. Benzotriazoles and benzothiazoles in human urine from several countries: a perspective on occurrence, biotransformation, and human exposure. Environ Int. 59:274-281. (Disponible en anglais seulement)
Avagyan R, Sadiktsis I, Bergvall C, Westerholm R. 2014. Tire tread wear particles in ambient air—a previously unknown source of human exposure to the biocide 2-mercaptobenzothiazole. Environ Sci Pollut Res. 21(19):11580-6. (Disponible en anglais seulement)
Badila AB. 2013. Scrap tire weight and characteristics study passenger light truck (PLT). Final Report. Winnipeg (MB): TSM. [Consulté le 23 août 2018]. (Disponible en anglais seulement)
[BCFBAF] Bioaccumulation Program for Microsoft Windows [estimation model]. 2010. Ver. 3.01. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. (Disponible en anglais seulement)
[BDIPSN] Base de données sur les ingrédients de produits de santé naturels. [Modifié le 24 mars 2023]. Ottawa (Ont.) : Santé Canada. [Consulté le 19 avril 2023].
[BDPSNH] Base de données des produits de santé naturels homologués. [Modifié le 17 avril 2017]. Ottawa (Ont.) : Santé Canada. [Consulté le 19 avril 2023].
[BIOWIN] Biodegradation Probability Program for Microsoft Windows [estimation model]. 2010. Ver. 4.10. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. (Disponible en anglais seulement)
Boethling RS, Howard PH, Beauman JA, Larosche ME. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere. 30(4):741-752. (Disponible en anglais seulement)
Bouma K, Nab FM, Schothorst RC. 2003. Migration of N-nitrosamines, N-nitrosatable substances and 2-mercaptobenzthiazol from baby bottle teats and soothers: A Dutch retail survey. Food Addit Contam. 20(9):853-858. (Disponible en anglais seulement)
Breedveld GD, Roseth R, Sparrevik M, Hartnik T, Hem LJ. 2003. Persistence of the de-icing additive benzotriazole at an abandoned airport. Water Air Soil Pollut. Focus 3(3):91-101. (Disponible en anglais seulement)
Brinksmeier ED, Meyer D, Huesmann-Cordes AG, Herrmann C. 2015. Metalworking fluids – mechanisms and performance. CIRP Ann Manuf Technol. 64(2):605-628. (Disponible en anglais seulement)
Brorström-Lundén E, Hansson K, Remberger M, Kaj L, Magner J, Andersson H, Haglund P, Andersson R, Liljelind P, Grabic R. 2011. Screening of benzothiazoles, benzenediamines, dicyclohexylamine and benzotriazoles. IVL Swedish Environmental Research Institute Ltd. IVL Report B2023. (Disponible en anglais seulement)
Brownlee BG, Carey JH, MacInnis GA, Pelizzari IT. 1992. Aquatic environmental chemistry of 2-(thiocyanomethylthio)benzothiazole and related benzothiazoles. Environ Toxicol Chem. 11:1153-1168. (Disponible en anglais seulement)
[BUA] Beratergremium fur Umweltrelevant Altstoffe. 1993. 2,2’-Dithio-bis-benzothiazole BUA report 126. (Disponible en anglais seulement)
Canada. 1978. Règlement sur les aliments et drogues. C.R.C., ch. 870.
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L. C. 1999, ch. 33. Gazette du Canada , Partie III, vol. 22, n° 3.
Canada, ministère de l’Environnement. 2017. Loi canadienne sur la protection de l’environnement (1999) : avis concernant les substances visées par la mise à jour de l’inventaire de 2017. Gazette du Canada, Partie I, vol. 151, no 2, p. 89-161.
Cancilla DA, Martinez J, Van Aggelen GC. 1998. Detection of aircraft deicing/antiicing fluid additives in a perched water monitoring well at an international airport. Environ Sci Technol. 32(23):3834-3835. (Disponible en anglais seulement)
Cancilla DA, Baird JC, Geis SW, Corsi SR. 2003. Studies of the environmental fate and effect of aircraft deicing fluids: Detection of 5‐methyl‐1H‐benzotriazole in the fathead minnow (Pimephales promelas). Environ Toxicol Chem. 22(1):134-140. (Disponible en anglais seulement)
Cantin S. 2009. Les pneus hors d’usage [PDF]. Information Sheet. Recyc-Québec. [Consulté le 13 août 2018].
Carpinteiro I, Abuin B, Ramil M, Rodríguez I, Cela R. 2012. Simultaneous determination of benzotriazole and benzothiazole derivatives in aqueous matrices by mixed-mode solid-phase extraction followed by liquid chromatography–tandem mass spectrometry. Anal Bioanal Chem. 402(7):2471-8. (Disponible en anglais seulement)
CATALOGIC [environmental fate and ecotoxicity model]. 2014. Ver. 5.12.1. Bourgas (BG): University “Prof. Dr. Assen Zlatarov”, Laboratory of Mathematical Chemistry. (Disponible en anglais seulement)
ChemCAN [level III fugacity model of 24 regions of Canada]. 2003. Version 6.00. Peterborough (ON): Trent University, Canadian Centre for Environmental Modelling and Chemistry. (Disponible en anglais seulement)
[Cheminfo] Cheminfo Services Inc. 2012. Tire manufacturing and tire retreading sector study: sector overview and profile along with responses to questionnaire. Préparé pour la Division de la production des produits chimiques, Direction des secteurs des produits chimiques, Direction générale de l’intendance environnementale, Environnement Canada, Gatineau, Québec. Rapport confidentiel. (Disponible en anglais seulement)
ChemRisk LLC. 2010. Tyre and general rubber good generic exposure scenario: Emission factor guidance for formulation and industrial use. Final report prepared for ETRMA. Pittsburgh (PA): ChemRisk LLC. 33 pages. (Disponible en anglais seulement)
Choi T, Kim J, Ko DH, Kim C, Hwang J, Ahn S, Kim SY, Kim C, Lee J, Yoon T. 2007. Zebrafish as a new model for phenotype‐based screening of melanogenic regulatory compounds. Pigment Cell Res. 20(2):120-127. (Disponible en anglais seulement)
Ciba-Geigy Corp. 1968. Short-term (49-day) and sub-chronic (90-day) toxicity studies with “tinuvin 320” in rats with cover letter date 083088. U.S. NTIS Microfiche No. OTS051661O. Cover letter plus 24 p. Étude datée de janvier. (Disponible en anglais seulement)
[CompTox] US EPA Chemistry Dashboard. 2018. Search results for CAS RN 120-78-5; 149-30-4; 2492-26-4; 4979-32-2; 95-31-8; 95-33-0. [Consulté en juillet 2018]. (Disponible en anglais seulement)
[ConsExpo Web] Consumer Exposure Web Model. 2016. Bilthoven (NL): Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement]. (Disponible en anglais seulement)
Craine L, Raban M. 1989. The chemistry of sulfenamides. Chem Rev. 89(4):689-712. (Disponible en anglais seulement)
[Danish EPA] Danish Environmental Protection Agency. 2003. Liberation of MBT in natural rubber. Survey of Chemical Substances in Consumer Products, Survey No. 22. Danish Technological Institute. (Disponible en anglais seulement)
[Danish EPA] Danish Environmental Protection Agency. 2013. Benzotriazole and Tolyltriazole. Evaluation of health hazards and proposal of health based quality criteria for soil and drinking water. Environmental Project No. 1526, 2013. (Disponible en anglais seulement)
[Danish EPA] Danish Environmental Protection Agency. 2014. 2-Mercaptobenzothiazole (MBT). Evaluation of health hazards and proposal of health-based quality criterion for ambient air. Environmental Project No. 1530, 2014. (Disponible en anglais seulement)
De Wever H, De Moor K, Verachtert H. 1994. Toxicity of 2-mercaptobenzothiazole towards bacterial growth and respiration. Appl. Microbiol. Biotechnol. 42(4):631-635. (Disponible en anglais seulement)
De Wever H, Verachtert H. 1997. Biodegradation and toxicity of benzothiazoles. Water Res. 31(11): 2673-2684. (Disponible en anglais seulement)
Diaz-Cruz MS, Molins-Delgado D, Serra-Roig M, Kalogianni E, Skoulikidis NT, Barcelo D. 2019. Personal care products reconnaissance in EVROTAS river (Greece): Water-sediment partition and bioaccumulation in fish. Sci Total Environ. 651:3079-3089. (Disponible en anglais seulement)
[EC] European Commission. 2005. Scientific committee on consumer products sccp opinion on 2-mercaptobenzothiazole (MBT) (sensitisation only). [Consulté le 17 décembre 2018]. (Disponible en anglais seulement)
[EC] European Commission. 2008. European Union risk assessment report: N-cyclohexylbenzothiazol-2-sulphenamide [PDF]. Germany: Bundesanstalt für Arbeitsschutz und Arbeitsmedizin. [Consulté le 17 décembre 2018]. (Disponible en anglais seulement)
[EC] European Commission. 2018. European Union substance evaluation report: N,N-dicyclohexylbenzothiazole-2-sulphenamide. CAS No. 4979-32-2, EC No. 225-625-8 [PDF]. Germany: Federal Institute for Occupational Health and Safety. [Consulté en février 2019]. (Disponible en anglais seulement)
[ECB] European Chemicals Bureau, Institute for Health and Consumer Protection. 2003. Technical guidance document on risk assessment, part II. Luxembourg City (LU): European Chemicals Bureau. 337 p. (Disponible en anglais seulement)
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l’approche scientifique : classification du risque écologique des substances organiques. Ottawa (Ont.), gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016b. Supporting documentation: data used to create substance-specific hazard and exposure profiles and assign risk classifications. Gatineau (QC): ECCC. Information in support of the science approach document: ecological risk classification of organic substances. Disponible sur demande à substances@ec.gc.ca (Disponible en anglais seulement)
[ECCC] Environnement et Changement climatique Canada. 2018. Données collectées lors de la mise à jour de l’inventaire de la LIS en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances de la Liste intérieure. Données préparées par : Environnement Canada et Santé Canada : Programme des substances existantes.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2015. Identification des priorités d’évaluation des risques : résultats de l’examen de 2015. Ottawa (Ont.), gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2016a. Évaluation préalable rapide : polymères identifiés lors de la deuxième phase de la mise à jour de la Liste intérieure des substances. Ottawa (Ont.), gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2016b. Rapport d'évaluation préalable sur 2-(2H-Benzotriazol-2-yl)-4,6-di-tert-pentylphénol (BDTP) : numéro de registre du Chemical Abstracts Service 25973-55-1. Ottawa (Ont.), gouvernement du Canada. [Consulté le 21 septembre 2017].
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. [Modifié le 20 avril 2017]. Catégorisation de substances chimiques. Ottawa (Ont.) : gouvernement du Canada. [Consulté le 25 novembre 2016].
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2018a. Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée. Ottawa (Ont.), gouvernement du Canada
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2018b. Évaluation préalable substances jugées comme étant peu préoccupantes au moyen de l’approche de la Classification du risque écologique des substances organiques et de l’approche fondée sur le seuil de préoccupation toxicologique (SPT). Ottawa (Ont.), gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2019. Ébauche d’évaluation préalable – N-Cyclohexylsulfamate de sodium et cyclohexanamine. Ottawa (Ont.), gouvernement du Canada.
ECHA] European Chemicals Agency. c2007-2019 Registered substances database; search results for CAS RN 120-78-5; 149-30-4; 2492-26-4; 4979-32-2; 95-31-8; 95-33-0; 3147-75-9; 29385-43-1; 70321-86-7. Helsinki (FI): ECHA. [Consulté en juillet 2019]. (Disponible en anglais seulement)
[ECHA] European Chemicals Agency. 2014a. Substance Evaluation Report: Benzothiazole-2-thiol (2-MBT) [PDF]. [Consulté le 17 décembre 2018]. (Disponible en anglais seulement)
[ECHA] European Chemicals Agency. 2014b. Annex XV report: Proposal for identification of a substance of very high concern on the basis of the criteria set out in REACH article 57 [PDF]. [Consulté le 3 mai 2024]. (Disponible en anglais seulement)
[ECHA] European Chemicals Agency. 2016a. Decision on a compliance check [PDF]. Helsinki (FI): ECHA. 11 p. (Disponible en anglais seulement)
[ECHA] European Chemicals Agency. 2016b. Guidance on information requirements and chemical safety assessment, chapter R.16: Environmental exposure assessment [PDF]. Version 3.0. Helsinki (FI): ECHA. 178 p. (Disponible en anglais seulement)
[ECHA] European Chemicals Agency. 2017. An evaluation of the possible health risks of recycled rubber granules used as infill in synthetic turf sports fields. [Consulté le 7 janvier 2019]. (Disponible en anglais seulement)
[EFSA] European Food Safety Authority. 2015. Scientific Opinion on the risks to public health related to the presence of bisphenol A (BPA) in foodstuffs: Executive summary. EFSA Journal 2015. 13(1):3978. (Disponible en anglais seulement)
Ema M, Sakamoto J, Murai T, Kawasaki H. 1989. Evaluation of the teratogenic potential of the rubber accelerator dibenzthiazyl disulphide in rats. J App Toxicol. 9(6):413-417. (Disponible en anglais seulement)
EMPODAT. 2013. EMPODAT Database. [Consulté le 17 décembre 2018]. (Disponible en anglais seulement)
Environnement Canada, Santé Canada. 2014. Approche d’identification des substances chimiques et des polymères jugés prioritaires pour l’évaluation des risques en vertu de la Partie 5 de la Loi canadienne sur la protection de l’environnement de 1999 [LCPE (1999)]. Ottawa (Ont.), gouvernement du Canada.
[EPI Suite] Estimation Program Interface Suite for Microsoft Windows [estimation model]. c 2000-2012. Ver. 4.11. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. Esteban S, Gorga M, Petrovic M, González-Alonso S, Barceló D, Valcárcel Y. 2014a. Analysis and occurrence of endocrine-disrupting compounds and estrogenic activity in the surface waters of Central Spain. Sci Total Environ. 466:939-951. (Disponible en anglais seulement)
Esteban S, Gorga M, González-Alonso S, Petrovic M, Barceló D, Valcárcel Y. 2014b. Monitoring endocrine disrupting compounds and estrogenic activity in tap water from Central Spain. Environ Sci Pollut Res. 21(15): 9297-9310. (Disponible en anglais seulement)
Esteban S, Moreno-Merino L, Matellanes R, Catalá M, Gorga M, Petrovic M, López de Alda M, Barceló D, Silva A, Durán JJ, López-Martínez J, Valcárcel Y. 2016. Presence of endocrine disruptors in freshwater in the northern Antarctic Peninsula region. Environ Res. 147:179-192. (Disponible en anglais seulement)
[EU] European Union. 2008. Regulation (EC) No 1272/2008 of the European Parliament and of the Council of 16 December 2008 on classification, labelling and packaging of substances and mixtures, amending and repealing Directives 67/548/EEC and 1999/45/EC, and amending Regulation (EC) No 1907/2006. Off J Eur Union L 353:1-1355. (Disponible en anglais seulement)
[EU RAR] European Union Risk Assessment Report. 2008. N-Cyclohexylbenzothiazol-2-sulphenamide. CAS No: 95-33-0. EINECS No:202-411-2. (Disponible en anglais seulement)
[FCEN] Fichier canadien sur les éléments nutritifs. 2015. Santé Canada.
Ficheux AS, Wesolek N, Chevillotte G, Roudot AC. 2015. Consumption of cosmetic products by the French population. First part: Frequency data. Food Chem Toxicol. 78:159-169. (Disponible en anglais seulement)
Ficheux AS, Chevillotte G, Wesolek N, Morisset T, Dornic N, Bernard A, Bertho A, Romanet A, Leroy L, Mercat AC, et al. 2016. Consumption of cosmetic products by the French population second part: Amount data. Food Chem Toxicol. 90:130-141. (Disponible en anglais seulement)
Focazio MJ, Kolpin DW, Barnes KK, Furlong ET, Meyer MT, Zaugg SD, Barber LB, Thurman ME. 2008. A national reconnaissance for pharmaceuticals and other organic wastewater contaminants in the United States—II) Untreated drinking water sources. Sci Total Environ. 402(2-3):201-216. (Disponible en anglais seulement)
Foundation Animal Bio Science Safety Research Institute. 2011. 2-(2H-benzotriazol-2-yl)-4- (tert-butyl)-6- (sec-pentyl) phenol Repeated oral administration toxicity using rats Reproductive and developmental toxicity combined test. Trial #: 07 – 112. Ministry of Health, Labor and Welfare, Pharmaceutical Foods Division, Review & Administration Division, Tokyo. Chemical Safety Division. (Disponible en japonais seulement)
Friedman PK, Watt ED, Hornung MW, Hedge JM, Judson RS, Crofton KM, Simmons SO. 2016. Tiered high-throughput screening approach to identify thyroperoxidase inhibitors within the ToxCast Phase I and II chemical libraries. Toxicol Sci. 151(1):160-180. (Disponible en anglais seulement)
Giger W, Schaffner C, Kohler HPE. 2006. Benzotriazole and tolyltriazole as aquatic contaminants. 1. Input and occurrence in rivers and lakes. Environ Sci Technol. 40(23):7186-7192. (Disponible en anglais seulement)
Glassmeyer ST, Furlong ET, Kolpin DW, Cahill JD, Zaugg SD, Werner SL, Meyer MT, Kryak DD. 2005. Transport of chemical and microbial compounds from known wastewater discharges: potential for use as indicators of human fecal contamination. Environ Sci Technol. 39:5157-5169. (Disponible en anglais seulement)
Glassmeyer ST, Furlong ET, Kolpin DW, Batt AL, Benson R, Boone JS, Conerly O, Donohue MJ, King DN, Kostich MS, et al. 2017. Nationwide reconnaissance of contaminants of emerging concern in source and treated drinking waters of the United States. Sci Total Environ. 581:909-922. (Disponible en anglais seulement)
Gorga M, Insa S, Petrovic M, Barceló D. 2015. Occurrence and spatial distribution of EDCs and related compounds in waters and sediments of Iberian rivers. Sci Total Environ. 503:69-86. (Disponible en anglais seulement)
Gries W, Kupper K, Long G. 2015. Rapid and sensitive LC–MS–MS determination of 2-mercaptobenzothiazole, a rubber additive, in human urine. Anal Bioanal Chem. 407:3417–3423. (Disponible en anglais seulement)
[GSBL] GSBL Webapplikation 3.0. Federal information system on chemical substances; search results for CAS RN 36437-37-3. Germany. [Consulté le 30 mai 2018]. (Disponible en anglais seulement)
Gustavsson BM, Magnér J, Almroth BC, Eriksson MK, Sturve J, Backhaus T. 2017. Chemical monitoring of Swedish coastal waters indicates common exceedances of environmental thresholds, both for individual substances as well as their mixtures. Mar Pollut Bull. 122(1-2):409-19. (Disponible en anglais seulement)
Hansen P, Tønning K, Malmgren-Hansen B. 2008. Survey and health assessment of chemical substances in hobby products for children. Danish Ministry of the Environment, Environmental Protection Agency (Danish EPA). Survey of Chemical Substances in Consumer Products, No. 93. (Disponible en anglais seulement)
Hansson C, Agrup G. 1993. Stability of the mercaptobenzothiazole compounds. Contact Dermatitis 28:29-34. (Disponible en anglais seulement)
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport non publié. Ottawa (ON): Santé Canada, Environmental Health Directorate. (Disponible en anglais seulement)
[HENRYWIN] Henry’s Law Constant Program for Microsoft Windows [estimation model]. 2008. Ver. 3.20. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. (Disponible en anglais seulement)
Herzog B, Lemmer H, Horn H, Müller E. 2015. A note on benzotriazole concentrations in the receiving waters of different sewage treatment plants. Asian Pacific J Microbiol Res. 3(1):1-3. (Disponible en anglais seulement)
Hirata-Koizumi M, Watari N, Mukai D, Imai T, Hirose A, Kamata E, Ema M. 2007. A 28-day repeated dose toxicity study of ultraviolet absorber 2-(2′-hydroxy-3′,5′-di-tert-butylphenyl) benzotriazole in rats. Drug Chem Toxicol. 30(4):327-341. (Disponible en anglais seulement)
Hirata-Koizumi M, Ogata H, Imai T, Hirose A, Kamata E, Ema M. 2008a. A 52-week repeated dose toxicity study of ultraviolet absorber 2-(2′-hydroxy-3′,5′-di-tert-butylphenyl)benzotriazole in rats. Drug Chem Toxicol. 31(1):81-96. (Disponible en anglais seulement)
Hirata-Koizumi M, Matsuyama T, Imai T, Hirose A, Kamata E, Ema M. 2008b. Lack of gender-related difference in the toxicity of 2-(2′- hydroxy-3′,5′-di-tert-butylphenyl)benzotriazole in preweaning rats. Drug Chem Toxicol. 31(2):275-287. (Disponible en anglais seulement)
Hirata Koizumi M, Matsuyama T, Imai T, Hirose A, Kamata E, Ema M. 2008c. Gonadal influence on the toxicity of 2-(2′-Hydroxy-3′,5′- di-tert-butylphenyl) benzotriazole in rats. Drug Chem Toxicol. 31(1): 115-126. (Disponible en anglais seulement)
[HPVIS] High Production Volume Information System. c 1998-2017. OPPT: US EPA. Search Results for 149-30-04. [Consulté en décembre 2017]. (Disponible en anglais seulement)
[HSDB] Hazardous Substances Data Bank [database]. 1983-2017. Bethesda (MD): National Library of Medicine (US). [Consulté le 12 décembre 2017]. (Disponible en anglais seulement)
[IARC] International Agency for Research on Cancer. 2018. IARC Monographs, volume 115, 2-Mercaptobenzothiazole. (Disponible en anglais seulement)
Jakimska A, Huerta B, Bargańska Ż, Kot-Wasik A, Rodríguez-Mozaz S, Barceló D. 2013. Development of a liquid chromatography–tandem mass spectrometry procedure for determination of endocrine disrupting compounds in fish from Mediterranean rivers. J Chromatogr A. 1306:44-58. (Disponible en anglais seulement)
Janna H, Scrimshaw MD, Williams RJ, Churchley J, Sumpter JP. 2011. From dishwasher to tap? Xenobiotic substances benzotriazole and tolyltriazole in the environment. Environ Sci Technol. 45(9):3858-3864. (Disponible en anglais seulement)
Japan Bioassay Research Center. 2006. 2- (2 1 "-pentotriazole-2-yl) -4- (candy" -butyl) -6- (sec-butyl) phenol repeated oral administration using rats toxicity reproductive and developmental toxicity combination test. Test number 0632. Central Labor Accident Prevention Association. (Disponible en japonais seulement)
Japan Bioassay Research Center. 2007. 1,2,3-Benzotriazole [CAS No. 95-14-7]. National Institute of Technology and Evaluation, Japan. (Disponible en japonais seulement)
Johannessen C, Liggio J, Zhang X, Saini A, Harner T. 2022a. Composition and transformation chemistry of tire-wear derived organic chemicals and implications for air pollution. Atmos Pollut Res 13(9): 101533. (Disponible en anglais seulement)
Johannessen C, Saini A, Zhang X, Harner T. 2022b. Air monitoring of tire-derived chemicals in global megacities using passive samplers. Environ Pollut 314: 120206. (Disponible en anglais seulement)
Jover E, Matamoros V, Bayona JM. 2009. Characterization of benzothiazoles, benzotriazoles and benzosulfonamides in aqueous matrixes by solid-phase extraction followed by comprehensive two-dimensional gas chromatography coupled to time-of-flight mass spectrometry. J Chromatogr A. 1216(18):4013-4019. (Disponible en anglais seulement)
Kase R, Eggen RIL, Junghans M, Gotz C, Hollender J. 2011. Assessment of micropollutants from municipal wastewater-Combination of exposure and ecotoxicological effect data for Switzerland. In Waste Water-Eval Manage. IntechOpen. (Disponible en anglais seulement)
Kazner C. 2011. Advanced wastewater treatment by nanofiltration and activated carbon for high quality water reuse (Doctoral dissertation, Hochschulbibliothek der Rheinisch-Westfälischen Technischen Hochschule Aachen). (Disponible en anglais seulement)
Kim J-W, Chang K-H, Prudente M, Viet PH, Takahashi S, Tanabe S, Kunisue T, Isobe T. 2019. Occurrence of benzotriazole ultraviolet stabilizers (BUVSs) in human breast milk from three Asian countries. Sci Total Env. 655: 1081-1088. (Disponible en anglais seulement)
Kiss, A, Fries, E. 2009. Occurrence of benzotriazoles in the rivers Main, Hengstbach, and Hegbach (Germany). Environ Sci Pollut Res Int. 16(6):702-710. (Disponible en anglais seulement)
Kloepfer A, Jekel M, Reemtsma T. 2005. Occurrence, sources, and fate of benzothiazoles in municipal wastewater treatment plants. Environ Sci Technol. 39(10):3792-3798. (Disponible en anglais seulement)
[KOAWIN] Octanol-Air Partition Coefficient Program for Microsoft Windows [estimation model]. 2010. Ver. 1.10. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. (Disponible en anglais seulement)
[KOCWIN] Organic Carbon Partition Coefficient Program for Microsoft Windows [estimation model]. 2010. Ver. 2.00. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. (Disponible en anglais seulement)
Kolpin DW, Furlong ET, Meyer MT, Thurman EM, Zaugg SD, Barber LB, Buxton HT. 2002. Pharmaceuticals, hormones, and other organic wastewater contaminants in US streams, 1999− 2000: A national reconnaissance. Environ Sci Technol. 36(6):1202-1211. (Disponible en anglais seulement)
Koval IV. 1996. Synthesis and application of sulfenamides. Russian Chem. Rev. 65(5): 421-440. (Disponible en anglais seulement)
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [estimation model]. 2010. Ver. 1.68. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. (Disponible en anglais seulement)
Lai W, Lin YC, Wang YH, Guo YL, Lin A. 2018. Occurrence of emerging contaminants in aquaculture waters: cross-contamination between aquaculture systems and surrounding waters. Water, Air, Soil Pollut. 229(8):249. (Disponible en anglais seulement)
Lee S, Kim S, Park J, Kim H-J, Lee JJ, Choi G, Choi S, Kim S, Kim SY, Choi K, et al. 2015. Synthetic musk compounds and benzotriazole ultraviolet stabilizers in breast milk: Occurrence, time-course variation and infant health risk. Environ Res. 140: 466-473. (Disponible en anglais seulement)
Li Y, Zhai JL, Liu YS, Zhang QQ, Jiang YX, Liu Shan, Liu, WR, Yang YY, Ying GG. 2018. Personal care products in wild fish in two main Chinese rivers: Bioaccumulation potential and human health risks. Sci Total Environ. 621:1093-1102. (Disponible en anglais seulement)
Liao C, Kim UJ, Kannan K. 2018. A review of environmental occurrence, fate, exposure, and toxicity of benzothiazoles. Environ Sci Technol. 52:5007-5026. (Disponible en anglais seulement)
Liu W, Xue J, Kannan K. 2017. Occurrence of and exposure to benzotriazoles and benzothiazoles from textiles and infant clothing. Sci Total Environ. 592:91–96. (Disponible en anglais seulement)
Loos R, Gawlik BM, Locoro G, Rimaviciute E, Contini S, Bidoglio G. 2009. EU-wide survey of polar organic persistent pollutants in European river waters. Environ Pollut. 157(2):561-568. (Disponible en anglais seulement)
Loos R, Locoro G, Comero S, Contini S, Schwesig D, Werres F, Balsaa P, Oliver G, Weiss S, Blaha L, et al. 2010. Pan-European survey on the occurrence of selected polar organic persistent pollutants in ground water. Water Res. 44(14):4115-4126. (Disponible en anglais seulement)
Loos R, Tavazzi S, Paracchini B, Canuti E, Weissteiner C. 2013. Analysis of polar organic contaminants in surface water of the northern Adriatic Sea by solid-phase extraction followed by ultrahigh-pressure liquid chromatography–QTRAP® MS using a hybrid triple-quadrupole linear ion trap instrument. Anal bioanal chem. 405(18):5875-5885. (Disponible en anglais seulement)
Loretz LG, Api AM, Barraj LM, Burdick J, Dressler WE, Gettings SD, Han Hsu H, Pan YHL, Re TA, Renskers KJ, et al. 2005. Exposure data for cosmetic products: lipstick, body lotion, and face cream. Food Chem Toxicol. 43:279-291. (Disponible en anglais seulement)
Löwenberg J, Zenker A, Baggenstos M, Koch G, Kazner C, & Wintgens T. 2014. Comparison of two PAC/UF processes for the removal of micropollutants from wastewater treatment plant effluent: process performance and removal efficiency. Water Res. 56:26-36. (Disponible en anglais seulement)
Lu Z, De Silva AO, Peart TE, Cook CJ, Tetreault GR, Servos MR, Muir DCG. 2016a. Distribution, partitioning and bioaccumulation of substituted diphenylamine antioxidants and benzotriazole UV stabilizers in an urban creek in Canada. Environ Sci Technol. 50:9089−9097. (Disponible en anglais seulement)
Lu Z, Peart TE, Cook CJ, De Silva AO. 2016b. Simultaneous determination of substituted diphenylamine antioxidants and benzotriazole ultra violet stabilizers in blood plasma and fish homogenates by ultra-high performance liquid chromatography-electrospray tandem mass spectrometry. J Chromatogr A. 1461:51-58. (Disponible en anglais seulement)
Lu Z, Smyth SA, Peart TE, De Silva AO. 2017. Occurrence and fate of substituted diphenyl amine antioxidants and benzotriazole UV stabilizers in various Canadian wastewater treatment processes. Water Res. 123:158-166. (Disponible en anglais seulement)
Luecken JJ, Sullivan AB. 1981. Stability of benzothiazole sulfonamide accelerators. Elastomerics. 113(8):34-38,44. (Disponible en anglais seulement)
Luongo G, Avagyan R, Hongyu R, Ostman C. 2016. The washout effect during laundry on benzothiazole, benzotriazole, quinolone, and their derivatives in clothing textiles. Environ Sci Pollut Res. 23:2537-2548. (Disponible en anglais seulement)
Mackay D, Hughes DM, Romano ML, Bonnell M. 2014. The role of persistence in chemical evaluations. Integr Environ Assess. 10(4):588-594. (Disponible en anglais seulement)
Mandaric L, Diamantini E, Stella E, Cano-Paoli K, Valle-Sistac J, Molins-Delgado D, Bellin A, Chiogna G, Majone B, Silvia Diaz-Cruz M, et al. 2017. Contamination sources and distribution patterns of pharmaceuticals and personal care products in Alpine rivers strongly affected by tourism. Sci Total Environ. 590-591:484-494. (Disponible en anglais seulement)
Mansouri K, Grulke CM, Judson RS, Williams AJ. 2018. OPERA models for predicting physicochemical properties and environmental fate endpoints. J Cheminform. 10:10. (Disponible en anglais seulement)
Miyata K, Ose K. 2012. Thyroid hormone-disrupting effects and the amphibian metamorphosis assay. J Toxicol Pathol. 25(1):1-9. (Disponible en anglais seulement)
Molins-Delgado D, Diaz-Cruz MS, Barcelo D. 2015. Removal of polar UV stabilizers in biological wastewater treatments and ecotoxicological implications. Chemosphere. 119:S51-S57. (Disponible en anglais seulement)
Molins-Delgado D, Tavora J, Diaz-Cruz MS, Barcelo D. 2017. UV filters and benzotriazoles in urban aquatic ecosystems: The footprint of daily use products. Sci Total Environ. 601-602:975-986. (Disponible en anglais seulement)
Molins-Delgado D, Olmo-Campos MdM, Valeta-Juan G, Pleguezuelos-Hernandez V, Barcelo D, Diaz-Cruz MS. 2018. Determination of UV filters in human breast milk using turbulent flow chromatography and babies’ daily intake estimation. Environ Res. 161: 532-539. (Disponible en anglais seulement)
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [estimation model]. 2010. Ver. 1.43. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. (Disponible en anglais seulement)
Muller K, Hubner D, Huppertsberg S, Knepper TP, Zahn D. 2022. Probing the chemical complexity of tires: identification of potential tire-borne water contaminants with high-resolution mass spectrometry. Sci Total Environ. 802 (2022) 149799. (Disponible en anglais seulement)
Nawrocki ST, Drake KD, Watson CF, Foster GD, Maier KJ. 2005. Comparative aquatic toxicity evaluation of 2-(Thiocyanomethylthio)benzothiazole and selected degradation products using Ceriodaphnia dubia. Arch Environ Contam Toxicol. 48:344-350. (Disponible en anglais seulement)
[NCI] National Cancer Institute. 1978. Bioassay Of 1h-Benzotriazole For Possible Carcinogenicity CAS No. 95-14-7. Washington (DC): US Department of Health, Education and Welfare, National Institutes of Health. Technical Report Series No. 88; DHEW Publication No. (NIH) 78-1338. (Disponible en anglais seulement)
Nelson KR, Schroeder AL, Ankley GT, Blackwell BR, Blanksma C, Degitz SJ, Flynn KM, Jensen KM, Johnson RD, Kahl MD, et al. 2016. Impaired anterior swim bladder inflation following exposure to the thyroid peroxidase inhibitor 2-mercaptobenzothiazole part I: Fathead minnow. Aquat Toxicol. 173:192-203. (Disponible en anglais seulement)
[New EQC] New Equilibrium Criterion Model. 2011. Ver. 1.00 (Beta). Peterborough (ON): Trent University, Canadian Centre for Environmental Modelling and Chemistry. (Disponible en anglais seulement)
Ni HG, Lu FH, Luo XL, Trian HY, Zeng Y. 2008. Occurrence, phase distribution, and mass loadings of benzothiazoles in riverine runoff of the Pearl River Delta, China. Environ Sci Technol. 42(6):1892-1897. (Disponible en anglais seulement)
[NOCIL] Nocil Limited. [Date unknown]. Technical note on vulcanization [PDF]. Mumbai (IN): NOCIL. [Consulté le 28 janvier 2019]. (Disponible en anglais seulement)
Nödler K, Voutsa D, Licha T. 2014. Polar organic micropollutants in the coastal environment of different marine systems. Mar Pollut Bull. 85(1):50-59. (Disponible en anglais seulement)
[NPRI] National Pollutant Release Inventory. NPRI Datasets: 1) Release, 2) Disposal, and 3) Recycling. Ottawa (ON): gouvernement du Canada. Search results for CAS RN 149-30-4. [Consulté le 30 mai 2018]. (Disponible en anglais seulement)
[NTP] National Toxicology Program (US). 1988. Toxicology and carcinogenesis studies of 2-mercaptobenzothiazole (CAS No. 149-30-4) in F344/Nrats and B6C3F1 mice (gavage studies). Research Triangle Park (NC): US Department of Health and Human Services, National Toxicology Program. (Disponible en anglais seulement)
[NTP] National Toxicology Program (US). 2011. Chemical information review document for phenolic benzotriazoles. Research Triangle Park (NC): US Department of Health and Human Services, National Toxicology Program. (Disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2003. SIDS initial assessment report: N-tert-butylbenzothiazole-2-sulphenamide: CAS No. 95-31-8 [PDF]. SIAM [SIDS Initial Assessment Meeting]: 18: 2004 April: Paris, France. [Consulté le 31 août 2017]. (Disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2004a. SIDS initial assessment report: N,N-dicyclohexyl-2-benzothiazolessulfenamide: CAS No. 4979-32-2 [PDF]. SIAM [SIDS Initial Assessment Meeting]: 16: 2003 May: Paris, France. [Consulté le 31 mai 2018]. (Disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2004b. Emissions scenario document on additives in the rubber industry [PDF]. Paris (FR): OECD, Environment Directorate. (Series on Emission Scenario Documents No. 6; Report No. ENV/JM/MONO(2004)11, JT00166668). [Consulté en novembre 2018]. (Disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2008. SIDS initial assessment report (SIAR): N-cyclohexylbenzothiazole-2-sulphenamide [PDF]. SIAM 27, 14-16 October 2008 [Consulté le 17 décembre 2018]. (Disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2009a. SIDS initial assessment report (SIAR): 2-tert-Butyl-6-(5-chloro-2H-benzotriazol-2-yl)-4-methylphenol. SIAM 28, 14-17 April 2009 [Consulté le 15 décembre 2018]. (Disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2009b. OECD ESD #3 Emission Scenario Document on Plastic Additives. ENV/JM/MONO (2004)8/REV 1. 9 juillet 2009. (Disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2009c. SIDS initial assessment report (SIAR): N,N-Dicyclohexyl-2-benzothiazolesulfenamide [PDF]. SIAM 18, 20-23 April 2004 [Consulté le 17 décembre 2018]. (Disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2011. Emission scenario document on the use of metalworking fluids [PDF]. Paris (FR): OECD, Environment Directorate. (Series on Emission Scenario Documents No. 28; Report No. ENV/JM/MONO(2011)18, JT03304938). [Consulté en novembre 2018]. (Disponible en anglais seulement)
OCDE QSAR Toolbox [outil de lecture croisée]. 2016. Ver. 4.2 Paris (FR): Organisation for Economic Co-operation and Development, Laboratory of Mathematical Chemistry. (Disponible en anglais seulement)
Okonski AI, MacDonald DB, Potter K, Bonnell M. 2021. Deriving predicted no-effect concentrations (PNECs) using a novel assessment factor method. Hum Ecol Risk Assess. DOI:10.1080/10807039.2020.1865788. (Disponible en anglais seulement)
Orwig BA. 1971. The chemistry of sulfenimides. Thesis submitted to McGill University Department of Chemistry. 97 p. (Disponible en anglais seulement)
Östman M, Lindber, RH, Fick J, Björn E, Tysklind M. 2017. Screening of biocides, metals and antibiotics in Swedish sewage sludge and wastewater. Water Res. 115:318-328. (Disponible en anglais seulement)
Peng Y, Fang W, Krauss M, Brack W, Wang Z, Li F, Zhang X. 2018. Screening hundreds of emerging organic pollutants (EOPs) in surface water from the Yangtze River Delta (YRD): Occurrence, distribution, ecological risk. Environ Pollut. 241:484-493. (Disponible en anglais seulement)
Peter B. 2013. Combined 28-day repeated dose toxicity study with the reproduction/developmental toxicity screening test of irgamet 39 in rats by oral gavage. [Submission to Santé Canada]. (Disponible en anglais seulement)
Reemtsma T, Weiss S, Mueller J, Petrovic M, González S, Barcelo D, Ventura F, Knepper TP. 2006. Polar pollutants entry into the water cycle by municipal wastewater: A European perspective. Enviro Sci Technol. 40(17):5451-8. (Disponible en anglais seulement)
Reemtsma T, Miehe U, Duennbier U, Jekel M. 2010. Polar pollutants in municipal wastewater and the water cycle: occurrence and removal of benzotriazoles. Water Res. 44(2):596-604. (Disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment (NL)]. 2007. Do-it-yourself products fact sheet: To assess the risks for the consumer: updated version for ConsExpo 4 [PDF]. Bilthoven (NL): DOI: 10.21945/RIVM-2017-0016. (Disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment (NL)]. 2017. Evaluation of health risks of playing sports on synthetic turf pitches with rubber granulate [PDF]. Bilthoven (NL): RIVM. Report No.: 612810012/2002. (Disponible en anglais seulement)
Rodriguez DM, Wrobel K, Jimenez MGG. 2004. Determination of 2-mercaptobenzothiazole (MBT) in tannery wastewater by high performance liquid chromatography with amperometric detection. Bull Environ Contam Toxicol. 73:818-824. (Disponible en anglais seulement)
Rotterdam Convention. 2008. Japan – Final Regulatory Action. [Consulté le 2 janvier 2019]. (Disponible en anglais seulement)
Rotterdam Convention. c2010. Database of notifications of final regulatory action: for non-annex III chemicals. [Consulté le 10 mai 2019]. (Disponible en anglais seulement)
Rovira J, Domingo JL. 2019. Human health risks due to exposure to inorganic and organic chemicals from textiles: A review. Environ Res. 168:62-69. (Disponible en anglais seulement)
Ryu J, Oh J, Snyder SA, Yoon Y. 2014. Determination of micropollutants in combined sewer overflows and their removal in a wastewater treatment plant (Seoul, South Korea). Environ Monit Assess. 186(5): 3239-3251. (Disponible en anglais seulement)
Santé Canada. 2013. Document d’orientation provisoire sur l’évaluation des risques pour la santé humaine associés à une exposition de courte durée aux substances cancérogènes présentes dans les sites contaminés Ottawa (Ont.) : Santé Canada.
Santé Canada. 2014. Document de principes SPN2014-01, Paramètres des facteurs d’exposition généraux utilisés pour les évaluations de l’exposition alimentaire, professionnelle et résidentielle Ottawa (Ont.) : gouvernement du Canada.
Santé Canada. 2016. Document sur l’approche scientifique : Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances . Ottawa (Ont.) : gouvernement du Canada.
Schriks M, Heringa MB, van der Kooi MM, de Voogt P, van Wezel AP. 2010. Toxicological relevance of emerging contaminants for drinking water quality. Water Res. 44(2):461-476. (Disponible en anglais seulement)
SDA [Soap and Detergent Association]. 2010. Appendix II-A-1 & Appendix II-B-1: Dermal exposure parameters to estimate screening exposures to consumer products – North America. IN: Consumer product ingredient safety: Exposure and Risk Screening Methods for Consumer Product Ingredients, 2nd edition. Section on dermal parameters. Washington (DC): The Soap and Detergent Association. (Disponible en anglais seulement)
[SDS] Safety Data Sheet. 2008. Hyspin Spindle Oil HS. Castrol. [Consulté le 17 décembre 2018]. (Disponible en anglais seulement)
[SDS] Safety Data Sheet. 2011. Revive Radiator Water Pump Lube. Shrader Canada. [Consulté le 17 décembre 2018]. [restricted access]. (Disponible en anglais seulement)
[SDS] Safety Data Sheet. 2013. Cooling System Repair Right Side. Rislone. [Consulté le 17 décembre 2018]. (Disponible en anglais seulement)
[SDS] Safety Data Sheet. 2016a. Protect_DIP Aerosol. Protect_DIP. [Consulté le 17 décembre 2018]. (Disponible en anglais seulement)
[SDS] Safety Data Sheet. 2016b. SWEPCO 715 Power Steering/Hydraulic Oil. Southwestern Petroleum Corporation. [Consulté le 17 décembre 2018]. (Disponible en anglais seulement)
[SDS] Safety Data Sheet. 2016c. Brayco 885. Castrol. [Consulté le 17 décembre 2018]. (Disponible en anglais seulement)
[SDS] Safety Data Sheet. 2017. Liquid Impression Pen. Skilcraft. [Consulté le 17 décembre 2018]. (Disponible en anglais seulement)
[SDS] Safety Data Sheet. 2018. Cooling System Repair Left Side. Rislone. [Consulté le 17 décembre 2018]. (Disponible en anglais seulement)
SimpleTreat [sewage treatment plant removal model]. 2003. Ver. 3.1. Bilthoven (NL): Rijksinstituut voor Volksgezondheid en Milieu (RIVM) [National Institute for Public Health and the Environment]. RIVM, Laboratory for Ecological Risk Assessment, PO Box 1, 3720 BA Bilthoven, The Netherlands. (Disponible en anglais seulement)
Søndergaard M. 2009. Organic compounds: redox potential. In: Likens GE, editor. Encyclopedia of inland waters. Vol. 1. Millbrook (NY): Elsevier. p. 852-859. (Disponible en anglais seulement)
Stackelberg PE, Furlong ET, Meyer MT, Zaugg SD, Henderson AK, Reissman DB. 2004. Persistence of pharmaceutical compounds and other organic wastewater contaminants in a conventional drinking-water-treatment plant. Sci Total Environ. 329(1-3):99-113. (Disponible en anglais seulement)
Statistique Canada. 2015. Canadian Community Health Survey (CCHS) 2015 Share File. Ottawa (ON): gouvernement du Canada. Estimates generated using SAS 9.3 [GRID] through SAS EG 5.1. (Disponible en anglais seulement)
Stephensen E, Adolfsson-Erici M, Hulander M, Parkkonen J, Förlin L. 2005. Rubber additives induce oxidative stress in rainbow trout. Aquat Toxicol. 75(2):126-143. (Disponible en anglais seulement)
Stinckens E, Vergauwen L, Schroeder AL, Maho W, Blackwell BR, Witters H, Blust R, Ankley GT, Covaci A, Villeneuve DL, et al. 2016. Impaired anterior swim bladder inflation following exposure to the thyroid peroxidase inhibitor 2-mercaptobenzothiazole part II: Zebrafish. Aquat Toxicol. 173:204-217. (Disponible en anglais seulement)
[TaPL3] Long Range Transport and Persistence Level III Model. 2003. Ver. 3.00. Peterborough (ON): Trent University, Canadian Centre for Environmental Modelling and Chemistry. (Disponible en anglais seulement)
[TEST] Toxicity Estimation Software Tool. 2016. Ver. 4.21. Washington (DC): US Environmental Protection Agency. (Disponible en anglais seulement)
Tietge JE, Degitz SJ, Haselman JT, Butterworth BC, Korte JJ, Kosian PA, Lindberg-Livingston AJ, Burgess EM, Blackshear PE, Hornung MW. 2013. Inhibition of the thyroid hormone pathway in Xenopus laevis by 2-mercaptobenzothiazole. Aquat Toxicol. 126:128-136. (Disponible en anglais seulement)
Unice KM, Bare JL, Kreider ML, Panko JM. 2015. Experimental methodology for assessing the environmental fate of organic chemicals in polymer matrices using column leaching studies and OECD 308 water/sediment systems: Application to tire and road wear particles. Sci Total Environ. 533:476-487. (Disponible en anglais seulement)
[US EPA] US Environmental Protection Agency. 2009. Screening-Level Hazard, sponsored chemicals: phenolic benzotriazoles category. Washington (DC): US EPA. 20 p. (Disponible en anglais seulement)
[US EPA] US Environmental Protection Agency. 2010. Screening-level hazard characterization of high production volume chemicals: Benzothiazole and morpholine-based thiazoles category. Hazard Characterization Document. Washington (DC): US EPA. 45 p. (Disponible en anglais seulement)
[US NTP] U.S. National Toxicology Program, U.S. Department of Health and Human Services. 2011. Chemical information review document for phenolic benzotriazoles. Supporting Nomination for Toxicological Evaluation by the National Toxicology Program. (Disponible en anglais seulement)
Valcárcel Y, Valdehíta A, Becerra E, de Alda ML, Gil A, Gorga M, Navas JM. 2018. Determining the presence of chemicals with suspected endocrine activity in drinking water from the Madrid region (Spain) and assessment of their estrogenic, androgenic and thyroidal activities. Chemosphere. 201:388-398. (Disponible en anglais seulement)
Valls-Cantenys C, Scheurer M, Iglesias M, Sacher F, Brauch HJ, Salvadó V. 2016. A sensitive multi-residue method for the determination of 35 micropollutants including pharmaceuticals, iodinated contrast media and pesticides in water. Anal Bioanal Chem. 408(22):6189-6200. (Disponible en anglais seulement)
Van Leerdam JA, Hogenboom AC, van der Kooi MM, de Voogt P. 2009. Determination of polar 1H-benzotriazoles and benzothiazoles in water by solid-phase extraction and liquid chromatography LTQ FT Orbitrap mass spectrometry. Int J Mass Spectrom. 282(3):99-107. (Disponible en anglais seulement)
Versar. 1986. Standard scenarios for estimating exposure to chemical substances during use of consumer products. Prepared for U.S.EPA Office of Toxic Substances Exposure Evaluation Division. (Disponible en anglais seulement)
Vetter W, Lorenz J. 2013. Determination of benzotriazoles in dishwasher tabs from Germany and estimation of the discharge into German waters. Environ Sci Pollut Res. 20(7):4435-40. (Disponible en anglais seulement)
Vimalkumar K, Arun E, Krishna-Kuma S, Poopal RK, Nikhil NP, Subramanian A, Babu-Rajendran R. 2018. Occurrence of triclocarban and benzotriazole ultraviolet stabilizers in water, sediment, and fish from Indian rivers. Sci Total Environ. 625:1351-1360. (Disponible en anglais seulement)
Voutsa D, Hartmann P, Schaffner C, Giger W. 2006. Benzotriazoles, alkylphenols and bisphenol A in municipal wastewaters and in the Glatt River, Switzerland. Environ Sci Pollut Res. 13(5):333-341. (Disponible en anglais seulement)
Wagner S, Huffer T, Klockner P, Wehrhahn M, Hofmann T, Reemtsma T. 2018. Tire wear particles in the aquatic environment- A review on generation, analysis, occurrence, fate and effects. Water Res. 139:83-100. (Disponible en anglais seulement)
Wagner S, Klockner P, Reemtsma, T. 2022. Aging of tire and road wear particles in terrestrial and freshwater environments – A review on processes, testing, analysis, and impact. Chemosphere. 288(2):132467. (Disponible en anglais seulement)
Wang L, Asimakopoulos AG, Moon HB, Nakata H, Kannan K. 2013. Benzotriazole, benzothiazole, and benzophenone compounds in indoor dust from the United States and East Asian countries. Environ Sci Technol. 47(9):4752-4759. (Disponible en anglais seulement)
Wang L, Zhang J, Sun H, Zhou Q. 2016. Widespread occurrence of benzotriazoles and benzothiazoles in tap water: influencing factors and contribution to human exposure. Environ Sci Technol. 50(5):2709-2717. (Disponible en anglais seulement)
[WATERNT] Water Solubility Program [estimation model]. 2010. Ver. 1.01. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. (Disponible en anglais seulement)
Weiss S, Reemtsma T. 2005. Determination of benzotriazole corrosion inhibitors from aqueous environmental samples by liquid chromatography-electrospray ionization-tandem mass spectrometry. Anal Chem. 77(22):7415-7420. (Disponible en anglais seulement)
Whittaker MH, Gebhart AM, Miller TC, Hammer F. 2004. Human health risk assessment of 2-mercaptobenzothiazole in drinking water. Toxicol Ind Health. 20:149-163. (Disponible en anglais seulement)
Wolschke H, Xie Z, Möller A, Sturm R, Ebinghaus R. 2011. Occurrence, distribution and fluxes of benzotriazoles along the German large river basins into the North Sea. Water Res. 45(18):6259-6266. (Disponible en anglais seulement)
[WSKOWWIN] Water Solubility Program [estimation model]. 2010. Ver. 1.42. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation.Xue J, Wan Y, Kannan K. 2017. Occurrence of benzotriazoles (BTRs) in indoor air from Albany, New York, USA, and its implications for inhalation exposure. Toxicol Environ Chem. 99(3):402-14. (Disponible en anglais seulement)
Yoo J, Graf TA, Kuruvilla DJ, D’Mello SR, Salem AK, Bowden NB. 2013. New biodegradable polymers based on previously unknown functional groups for drug and gene delivery. In: TechConnect Briefs. Technical proceedings from nanotech conference and expo 2013, Volume 1: Advanced materials, CNTs, particles, films and composites. p. 577-580. (Disponible en anglais seulement)
Zarfl C, Scheringer M, Matthies M. 2011. Screening criteria for long-range transport potential of organic substances in water. Environ Sci Technol. 45(23):10075-10081. (Disponible en anglais seulement)
Zeng F, Sherry JP, Bols NC. 2016. Evaluating the toxic potential of benzothiazoles with the rainbow trout cell lines RTgill-W1 and RTL-W1. Chemosphere 155:308-318. (Disponible en anglais seulement)
Zhang Z, Ren N, Li YF, Kunisue T, Gao D, Kannan K. 2011. Determination of benzotriazole and benzophenone UV filters in sediment and sewage sludge. Environ Sci Technol. 45(9):3909-3916. (Disponible en anglais seulement)
Zhou Y, Liu H, Li J, Xu S, Li Y, Zhao H, Jin H, Liu W, Chung AC, Hong Y, et al. 2018. Profiles, variability, and predictors of urinary benzotriazoles and benzothiazoles in pregnant women from Wuhan, China. Environ Int. 121(2): 1279-1288. (Disponible en anglais seulement)
Annexe A. Méthode de la lecture croisée pour l’évaluation des effets des benzotriazoles et des benzothiazoles sur la santé humaine
| Facteur | Justification |
|---|---|
| Structure chimique. L’accent a été mis sur les analogues qui contiennent un groupement benzotriazole. | On s’attend à ce que les analogues qui ont une structure chimique similaire ou qui sont métabolisés par des voies similaires en des produits de dégradation similaires présentent des profils de toxicité similaires. Les analogues qui comportent des métabolites toxiques connus, mais qui ne devraient pas découler du métabolisme de l’organisme cible n’ont pas été étudiés. |
| Métabolites similaires (prévus ou observés). | On s’attend à ce que les analogues qui ont une structure chimique similaire ou qui sont métabolisés par des voies similaires en des produits de dégradation similaires présentent des profils de toxicité similaires. Les analogues qui comportent des métabolites toxiques connus, mais qui ne devraient pas découler du métabolisme de l’organisme cible n’ont pas été étudiés. |
| Alertes de structures communes | Des analogues présentant des alertes de structures similaires devraient avoir plus de similarités sur le plan de la toxicité. |
| Propriétés physico‑chimiques similaires. L’accent a été mis sur les structures chimiques ayant des valeurs similaires de masse moléculaire, de solubilité dans l’eau, de pression de vapeur et de log Koe. | Des analogues présentant des priorités physico‑chimiques semblables pourraient partager des profils toxicologiques et une biodisponibilité semblable. |
| Disponibilité des données sur les effets sur la santé | Seuls des analogues dont les données sur les dangers présentaient une qualité suffisante et qui couvraient des voies et des durées d’exposition pertinentes pour les scénarios d’exposition ont été jugés utilisables pour les besoins de la lecture croisée. |
| Choix et utilisation d’un analogue basé sur une évaluation internationale fiable. | L’EPA danoise a sélectionné le benzotriazole afin de procéder à une lecture croisée des données avec le tolyltriazole dans son évaluation (Danish EPA 2013). |
| Nom commun ou no CAS | Dro-métrizole 2440‑22‑4 |
UV‑329 3147‑75‑9 |
UV‑320 3846‑71‑7 |
UV‑326 3896‑11‑5 |
UV‑350 36437‑37‑3 |
UV‑234 70321‑86‑7 |
|---|---|---|---|---|---|---|
| Structure |  |
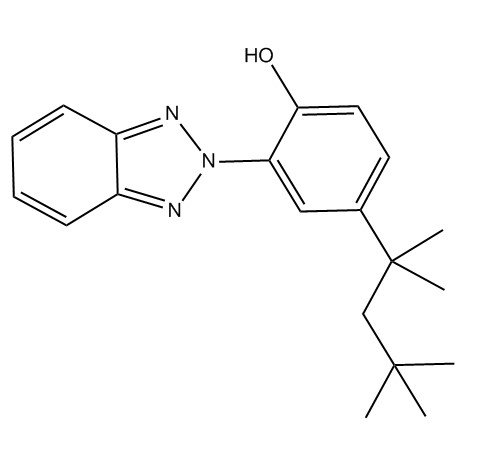 |
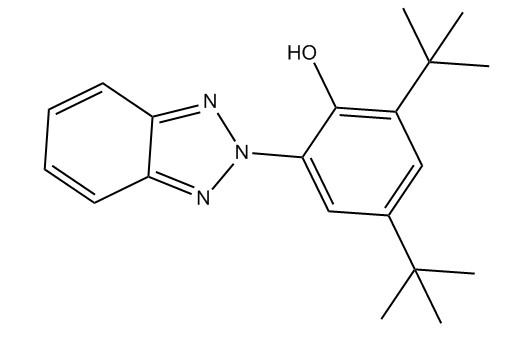 |
 |
C](/content/dam/eccc/images/pded/benzotriazoles-benzothiazoles/20210126-ta2e.jpg) |
 |
| MM (g/mol) | 225c | 323,43 | 323,43 | 315,80 | 323,44 | 447,58 |
| Pression de vapeur (Pa) | 1,46 x 10‑6 | 4,1 x 10‑6 | 1,47 x 10‑7 | 7,5 x 10‑7 | 1,04 x 10‑7 | < 1,0 x 10‑4 |
| Solubilité dans l’eau (mg/L) | 0,173c | 0,002 | 0,150 | 0,004 | 3,106 | < 0,005 |
| Log Koe | 4,2‑4,3c | > 6,5 | 6,3 | > 6,5 | 6,3 | > 6,5 |
| Toxicité à court terme/ subchro-nique (mg/kg p.c./j) | S.O. | DSENO = 5 685 mg/kg p.c./j établie d’après l’absence d’effet à la dose maximale d’essai chez les rats LC, d’après l’UV‑320 |
DMENO = 0,5, 2,5 mg/kg p.c./j établie d’après les effets sur le sang et le foie chez les rats mâles | DSENO = 29,6, 32,2 mg/ kg p.c./j (mâles, femelles) établie d’après la perte de poids chez les chiens femelles à la dose suivante | S.O. | DSENO = 3 000 mg/kg p.c./j établie d’après l’absence d’effet à la dose maximale d’essai chez les rats DMENO = 26 mg/kg p.c./j établie d’après les variations de poids du foie chez les rats DSENO = 2.5 mg/kg p.c./j établie d’après les variations de poids du foie et les lésions histopathologiques à 15 mg/kg p.c./j dans le foie chez les rats |
| Toxicité chronique (mg/kg p.c./j) | Voir pour la cancérogénicité | S.O. LC d’après l’UV‑320 |
DSENO = 0,1, 2,5 mg/ kg p.c./j (mâle, femelle), établie d’après les effets sur le sang et le foie chez les rats mâles | Voir pour la cancérogénicité | S.O. | S.O. |
| Cancérogénicité | DSENO = 62, 64 mg/kg p.c./j (femelles, mâles) établie d’après l’absence d’effet jusqu’à la dose maximale d’essai chez les souris DMENO = 142, 169 mg/kg p.c./j (mâles, femelles) établie d’après le ralentissement de la prise de poids corporel (mâles) et la diminution de la consommation alimentaire (femelles) chez les rats |
S.O. LC basée sur le drométrizole et l’UV‑326 |
S.O. LC basée sur le drométrizole et l’UV‑326 |
DSENO = 59, 62 mg/kg p.c./j (femelles, mâles) établie d’après l’absence d’effet jusqu’à la dose maximale d’essai chez les souris | S.O. | S.O. LC basée sur le drométrizole et l’UV‑326 |
| Génotoxicité | Test d’Ames, érythrocytes micronucléés, AC: (‑) | Test d’Ames, AC, E. coli, de mutation génique sur cellules de mammifères: (‑) |
Test d’Ames (bactéries et E. coli), AC: (‑) | Test d’Ames, AC, comète, micronoyau, anomalies du noyau : (‑) Inhibition de la synthèse de l’ARN : (+) |
S.O. | Test d’Ames, réparation de l’ADN, par autoradiographie, anomalies du noyau, ECS, AC: (‑) |
| Toxicité pour la reproduction ou le développement (mg/kg p.c./j) | DSENO pour le développement = 1 000 établie d’après l’absence d’effet à la dose maximale d’essai chez les rats et les souris DSENO pour la reproduction et le développement = 300 mg/kg p.c./j établie d’après l’absence d’effet à la dose maximale d’essai chez les rats |
S.O. LC d’après le drométrizole, l’UV‑326, l’UV‑350 et l’UV‑234 |
S.O. LC d’après le drométrizole, l’UV‑326, l’UV‑350 et l’UV‑234 |
DSENO pour le développement = 3 000 mg/kg p.c./j établie d’après l’absence d’effets à la dose maximale d’essai chez les rats DSENO pour le développement = 1 000 mg/kg p.c./j établie d’après l’ossification incomplète chez les souris DSENO pour la reproduction =1 000 mg/kg p.c./j établie d’après l’absence d’effets à la dose maximale d’essai chez les rats |
Reproduction/ développement DSENO = 12,5 mg/kg p.c./j établie d’après l’absence d’effet à la dose maximale d’essai chez les rats DSENO = 100 mg/kg p.c./j, établie d’après l’absence d’effet à la dose maximale d’essai chez les rats |
DSENO pour le développement = 300 mg/kg p.c./j établie d’après une diminution du poids corporel et un retard accru de la maturation squelettique chez les fœtus en l’absence de toxicité maternelle, chez les rats, à la DMENO de 1 000 mg/kg p.c./j LC d’après le drométrizole, l’UV‑326 et l’UV‑350 |
Abréviations : AC = aberrations chromosomiques; DMENO = dose minimale entraînant un effet nocif observé; DSENO = dose sans effet nocif observé; S.O. = sans objet; LC = lecture croisée; ECS = échange entre chromatides sœurs.
a Sauf indication contraire, les données sont tirées de l’ECHA (2017), de l’EPI Suite (c2000‑2012) ou de sections précédentes du présent rapport.
b Les données présentées dans ce tableau servent à combler les lacunes dans les données pour les substances pour lesquelles il y a peu de données. Ce tableau est présenté pour permettre la comparaison des données disponibles pour chaque substance, par critère d’effet.
c Comme il est indiqué dans l’évaluation préalable du BDTP (ECCC, SC 2016b).
| Nom commun ou no CAS | Benzotriazole 95‑14‑7 |
Tolyltriazole 29385‑43‑1 |
80595‑74‑0 | 94270‑86‑7 |
|---|---|---|---|---|
| Structure | ![c12c(nn[nH]1)cccc2](/content/dam/eccc/images/pded/benzotriazoles-benzothiazoles/20210126-ta3a.jpg) |
![c1cc2c(cc1)[nH]nn2.[*]C](/content/dam/eccc/images/pded/benzotriazoles-benzothiazoles/20210126-ta3b.jpg) |
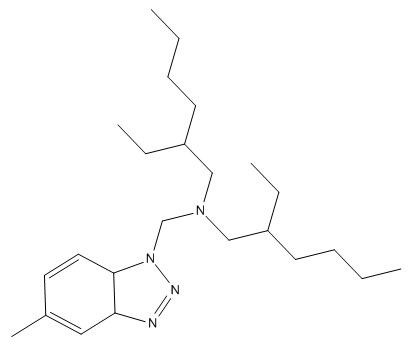 |
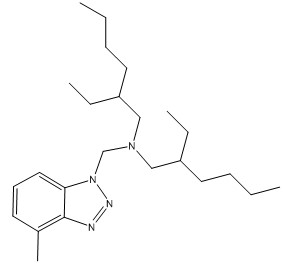 |
| MM (g/mol) | 119,13 | 133,15 | 386,63 | 386,63 |
| Pression de vapeur (Pa) | 0,00328 | 14 | 4,34 x 10‑7 | 4,34 x 10‑7 |
| Solubilité dans l’eau (mg/L) | 19 800 | 4 049 | 0,01175 | 0,01175 |
| Log Koe | 1,44 | 1,71 | 7,62 | 7,62 |
| Toxicité subchronique ou à court terme (mg/kg p.c./j) | DSENO = 30 mg/kg p.c./j établie d’après des effets sur les reins, chez les rats femelles, à la DMENO de 100 mg/kg p.c./j | DSENO = 150 mg/kg p.c./j établie d’après la diminution de la numération des érythrocytes, du taux d’hémoglobine et de l’hématocrite, chez les rats mâles, une diminution des protéines plasmatiques et une augmentation de l’activité de l’ALT et de l’AST, chez les rats mâles et femelles, à la DMENO de 450 mg/kg p.c./j | S.O. LC basée sur 94270‑86‑7 |
DSENO = 45 mg/kg p.c./j établie d’après des changements dans les organes du système lymphatique, chez les rats, à la DMENO de 150 mg/kg p.c./j |
| Toxicité chronique (mg/kg p.c./j) | DMENO = 335 mg/kg p.c./j établie d’après des effets non cancérogènes observés dans divers organes et tissus, chez les rats | S.O. LC basée sur le benzotriazole |
S.O. | S.O. |
| Cancérogénicité | DMENO = 335 mg/kg p.c./j établie d’après des néoplasmes observés dans divers organes et tissus, chez les rats | S.O. LC basée sur le benzotriazole |
S.O. | S.O. |
| Génotoxicité | Test d’Ames, microsome, AC, ECS: (+) Dommages à l’ADN, chromotest SOSc, micronoyau: (‑) |
Test d’Ames : (‑, +) Micronoyau : (‑) Lymphomes de souris : (+) |
S.O. | S.O. |
| Toxicité pour la reproduction ou le développement (mg/kg p.c./j) | DSENO = 300 mg/kg p.c./j établie d’après l’absence d’effet à la dose maximale d’essai chez les rats | S.O. LC basée sur le benzotriazole |
S.O. LC basée sur 94270‑86‑7 |
DSENO pour le développement = 45 mg/kg p.c./j établie d’après une diminution de la taille des portées chez les rats à la DMENO de 150 mg/kg p.c./j DSENO pour la reproduction = 150 mg/kg p.c./j établie d’après l’absence d’effet à la dose maximale d’essai chez les rats |
Abréviations : ALT = alanine aminotransférase; AST = aspartate aminotransférase; AC = aberrations chromosomiques; DMENO = dose minimale entraînant un effet nocif observé; DSENO = dose sans effet nocif observé; S.O. = sans objet; LC = lecture croisée; ECS = échange entre chromatides sœurs.
a Sauf indication contraire, les données sont tirées de l’ECHA (2017), de l’EPI Suite (c2000‑2012) ou de sections précédentes du présent rapport.
b Les données présentées dans ce tableau servent à combler les lacunes dans les données pour les substances pour lesquelles il y a peu de données. Ce tableau est présenté pour permettre la comparaison des données disponibles pour chaque substance, par critère d’effet.
c Essai colorimétrique qui mesure l’activation de la réponse SOS chez Escherichia coli, qui se produit lorsque l’ADN est endommagé.
| Nom commun et no CAS | TBBS 95‑31‑8 |
CBS 95‑33‑0 |
MBTS 120‑78‑5 |
MBT 149‑30‑4 |
SMBT 2492‑26‑4 |
DCBS 4979‑32‑2 |
|---|---|---|---|---|---|---|
| Structure | 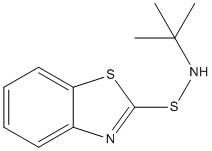 |
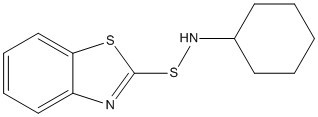 |
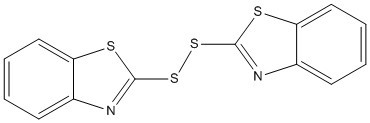 |
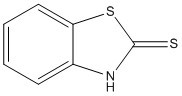 |
![Structure chimique représentative de la 2(3H)-Benzothiazolethione, sel de sodium, avec notation SMILES : [S-]C1=NC2=CC=CC=C2S1.[Na+]](/content/dam/eccc/images/pded/benzotriazoles-benzothiazoles/20210126-ta4e.jpg) |
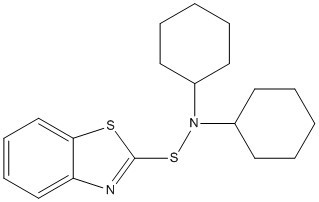 |
| MM (g/mol) | 238,37 | 264,41 | 332,47 | 167,24 | 189,23 | 346,59 |
| Pression de vapeur (Pa) | 6,12 x 10‑5 | < 4,53 x 10‑5 | 8,28 × 10‑8 | 2,60 × 10‑8 | 2,60 × 10‑8 | < 1 x 10‑5 |
| Solubilité dans l’eau (mg/L) | 1,23 | 0,32 | < 0,05 | 118 | 118 | 0,0019 |
| log Koe | 4,67 | 5,0 | 4,21 | 2,41 | ‑0,48 | 5,5 |
| Toxicité subchronique ou à court terme (mg/kg p.c./j) | DMENO = 40 mg/kg p.c./j établie d’après une augmentation des corps éosinophiles chez les rats mâles | DSENO = 80 mg/kg p.c. /j établie d’après des effets sur les reins chez les rats, à la dose élevée (250 mg/kg p.c./j) | S.O. LC basée sur le MBT (toxicité chronique/ subchronique) par voie orale LC basée sur le SMBT pour l’exposition par voie cutanée |
DMENO = 188 mg/ kg p.c./j établie d’après une augmentation du poids relatif du foie chez les rats LC basée sur le SMBT pour l’exposition par voie cutanée | DSENO (cutanée)= 200 mg/kg p.c./j établie d’après une augmentation du poids du foie à la dose élevée chez les rats | DSENO = 25 mg/kg p.c./j établie d’après une diminution de l’activité locomotrice chez les rats femelles, des gouttelettes hyalines dans l’épithélium tubulaire du rein, chez les rats mâles, et une dégénérescence graisseuse de l’épithélium tubulaire du rein, chez les rats femelles, à la dose élevée |
| Toxicité chronique (mg/kg p.c./j) | S.O. | S.O. | S.O. | DMENO = 188 mg/ kg p.c./j établie d’après une augmentation du poids relatif du foie chez les rats | S.O. | S.O. |
| Cancérogénicité | LC basée sur le MBT | LC basée sur le MBT | LC basée sur le MBT | Cancérogène – groupe 2A du CIRC; effets cancérogènes observés chez les rats, mais non chez les souris mâles, résultats ambigus chez les souris femelles; cancer de la vessie chez les travailleurs masculins exposés. Excès de risque unitaire : 6,34 × 10‑4 (mg/kg‑j)‑1 | LC basée sur le MBT | LC basée sur le MBT |
| Génotoxicité | In vitro Test d’Ames, mutation génique sur cellules de mammifères (‑) AC sur cellules de mammifères avec activation métabolique (+) Essai sur lymphomes de souris avec activation métabolique (+) |
In vitro : Test d’Ames, lymphomes de souris: (‑) AC: (+) In vivo : pas de données |
In vitro : Test d’Ames, aberrations chromosomiques, mutation génique sur cellules de mammifères : (‑); Essai sur lymphomes de souris avec activation métabolique : (+) In vivo : pas de données |
In vitro : Aberrations chromosomiques, ECS, lymphomes de souris: (+) Test d’Ames, mutation génique sur lignée cellulaire de carcinomes gastriques et pulmonaires, chez les humains : (‑) In vivo : fixation d’ADN chez le rat : (‑) |
S.O. | In vitro : Test d’Ames : (‑) Effets cytogénétiques dans des cellules CHL (+) In vivo : Effets cytogénétiques dans la moelle osseuse des rats : (‑) |
| Toxicité pour la reproduction ou le développement (mg/kg p.c./j) | Aucun effet sur la reproduction et le développement n’a été constaté avec le TBBS | DSENO pour la reproduction = 60 mg/kg p.c./j établie d’après des effets sur les testicules chez les rats exposés à 219 mg/kg p.c./j CHA, qui est le produit de l’hydrolyse du CBS Aucun effet sur le développement n’a été constaté avec le CBS. | DSEO maternelle = 127 mg/kg p.c./j, établie d’après une diminution de la prise de poids corporel chez les mères (femelles) Aucune toxicité pour le développement n’a été constatée LC basée sur le MBT pour la toxicité pour la reproduction |
DSENO pour la reproduction = 745, 1 328 mg/kg p.c./j (mâles, femelles) établie d’après l’absence d’effets à la dose maximale d’essai chez les rats DSENO pour le développement = 300 mg/kg p.c./j établie d’après l’absence d’effet à la dose maximale d’essai chez les rats et les lapins |
S.O. | DSENO pour la reproduction / développement = 100 mg/kg p.c./j établie d’après une diminution du nombre de corps jaunes, accompagnée d’une diminution du nombre de sites d’implantation et de la taille des portées à la dose plus élevée |
Abréviations : AC = aberrations chromosomiques; CHA = cyclohexylamine; DMENO = dose minimale entraînant un effet nocif observé; DSENO = dose sans effet nocif observé; S.O. = sans objet, LC = lecture croisée; ECS = échange entre chromatides sœurs.
a Sauf indication contraire, les données sont tirées de l’ECHA (2017), de l’EPI Suite (c2000‑2012) ou de sections précédentes du présent rapport.
b Les données présentées dans ce tableau servent à combler les lacunes dans les données pour les substances pour lesquelles il y a peu de données. Ce tableau est présenté pour permettre la comparaison des données disponibles pour chaque substance, par critère d’effet.
Annexe B. Approche de classification du risque écologique (CRE) des substances organiques
La classification du risque écologique (CRE) des substances organiques est une approche permettant de classer les risques en tenant compte de plusieurs paramètres de danger et d’exposition, tout en pondérant les multiples éléments de preuve. Elle combine les divers éléments de preuve pour différentier les substances plus ou moins dangereuses et celles présentant un potentiel d’exposition plus ou moins élevé dans divers milieux. Cette approche permet de réduire l’incertitude associée à la caractérisation des risques, contrairement à une approche qui serait basée sur un seul paramètre mesuré dans un seul milieu (par exemple, la concentration létale médiane). L’approche, décrite en détail dans ECCC (2016a), est résumée ci‑dessous.
Les données sur les propriétés physico‑chimiques, le devenir (demi‑vies chimiques dans divers milieux et biotes, coefficients de partage et bioconcentration dans les poissons), l’écotoxicité aiguë pour les poissons et les volumes de produits chimiques importés et fabriqués au Canada proviennent de la littérature scientifique, de bases de données empiriques accessibles (par exemple, la boîte à outils QSAR de l’OCDE, 2016), et des réponses fournies aux enquêtes menées conformément à l’article 71 de la LCPE. Certaines de ces données sont obtenues par le choix de certaines relations quantitatives structure-activité (QSAR) ou par modélisation du devenir du bilan massique ou de la bioaccumulation. Ces données ont été utilisées comme intrants dans d’autres modèles de bilan massique ou pour compléter les profils de danger et d’exposition des substances.
Les profils de danger reposent principalement sur les paramètres suivants : le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dans le réseau trophique, la biodisponibilité et l’activité chimique et biologique. Les profils d’exposition sont également fondés sur de nombreux paramètres, dont les taux d’émission potentiels, la persistance globale et le potentiel de transport à grande distance. On a comparé les profils de danger et d’exposition aux critères de décision afin de classer les potentiels de danger et d’exposition pour chaque substance organique selon trois niveaux : faible, moyen ou élevé. Des règles supplémentaires ont été appliquées (par exemple, cohérence de la classification, marge d’exposition) pour améliorer les classifications préliminaires de danger et d’exposition.
Une matrice de risques a été utilisée pour classer le risque associé à chaque substance comme étant faible, modéré ou élevé, suivant la classification du danger et de l’exposition. Les classifications du risque obtenues par l’approche de la CRE ont fait l’objet d’une vérification en deux étapes. La première étape consistait à modifier à la baisse la classification du risque (qui passe du niveau modéré ou élevé à faible) des substances présentant une faible estimation du taux d’émission dans l’eau après le traitement des eaux usées, ce qui représente un faible risque d’exposition. La deuxième étape consistait à revoir les résultats de classification faibles à la lumière de scénarios de risque relativement prudents à l’échelle locale (c’est-à-dire dans la zone proche du point de rejet), conçus pour protéger l’environnement, afin de déterminer si la classification du risque devrait être reclassée à un niveau supérieur.
La CRE s’appuie sur une approche pondérée afin de réduire au minimum le risque de sur-classement ou de sous-classement du danger, de l’exposition et du risque subséquent. La démarche équilibrée du traitement des incertitudes est décrite en détail dans ECCC (2016a). Voici une description de deux des domaines d’incertitude les plus importants. Les erreurs dans les valeurs de toxicité aiguë empiriques ou modélisées pourraient conduire à des changements du classement du risque, en particulier en ce qui a trait aux paramètres reposant sur des valeurs de résidus dans les tissus (c’est-à-dire le mode d’action toxique), dont bon nombre sont des valeurs prévues à partir de modèles QSAR. Cependant, la conséquence de cette erreur est atténuée par le fait que la surestimation de la létalité médiane donnera, pour les résidus dans les tissus, une valeur prudente (protectrice) utilisée dans l’analyse des résidus corporels critiques. L’erreur due à une sous‑estimation de la toxicité aiguë sera atténuée grâce à l’utilisation d’autres paramètres de danger tels que le profil structurel du mode d’action, la réactivité ou l’affinité de liaison à l’estrogène. Toute modification ou erreur dans les quantités d’une substance chimique peut modifier le classement de l’exposition, puisque la classification de l’exposition et du risque est extrêmement sensible au taux d’émission et à la quantité utilisée. Le classement obtenu par l’approche de CRE représente donc l’exposition et le risque au Canada établis d’après ce qu’on estime être les quantités utilisées actuellement, et pourrait ne pas refléter les tendances futures.
Annexe C. Estimation de l’exposition humaine aux substances du groupe des benzotriazoles et des benzothiazoles
Les estimations de l’exposition aux produits disponibles aux consommateurs ont été établies d’après des poids corporels par défaut, c’est-à-dire 7,5 kg pour un nourrisson, 15,5 kg pour un tout‑petit, 31,0 kg pour un enfant, 59,4 kg pour un adolescent, 70,9 kg pour un adulte et 72,0 kg pour une personne âgée (Santé Canada 1998), et des profils d’emploi prévus. Les valeurs de la masse moléculaire et de la pression de vapeur ont été utilisées pour générer des estimations de l’inhalation. Une valeur prudente d’absorption cutanée de 100 % est présumée.
Dose journalière moyenne pour la durée de la vie (DJMDV) et facteurs d’ajustement en fonction de l’âge (FAFA) :
La DJMDV a été calculée afin d’estimer le risque de cancer dû à une exposition quotidienne au MBT, au MBTS, au SMBT, au DCBS et au CBS par les milieux naturels, les aliments, les granulés de caoutchouc et les sucettes de bébés. Les hypothèses et l’équation sont présentées ci‑dessous (Santé Canada 2013):
EGQ: exposition générale quotidienne
Durée moyenne de la vie (DMV) : 78 ans (Santé Canada 2014)
Durée du groupe d’âge (DGA) : 0,5 an pour les nourrissons (0 à 6 mois), 4,5 ans pour les tout‑petits (0,5 à 4 ans), 7 ans pour les enfants (5 à 11 ans), 8 ans pour les adolescents (12 à 19 ans) et 60 ans pour les adultes (20 ans et plus) (Santé Canada 1998).
Les facteurs d’ajustement dépendants de l’âge, ci‑dessous, ont été appliqués aux estimations de l’exposition en vue de déterminer le risque de cancer pour chaque groupe d’âge :
10 pour les nourrissons (0 à 6 mois), 5 pour les tout‑petits (0,5 à 4 ans), 3 pour les enfants (5 à 11 ans), 2 pour les adolescents (12 à 19 ans) et 1 pour les adultes (20 ans et plus) (Santé Canada 2013).
DJMDV = [(EGQnourrissons × DGAnourrissons) + (EGQtout‑petits × DGAtout‑petits) + (EGQenfants × DGAenfants) + (EGQadolescents × DGAadolescents) + (EGQadultes × DGAadultes)] / [DMV]
| Scénario d’utilisation | Hypothèses |
|---|---|
| Peinture protectrice non permanente en aérosol pour automobiles | Pour l’estimation de l’exposition par voie cutanée : Taux de contact : 100 mg/min (RIVM 2007) Durée du jet d’aérosol : 15 minutes (RIVM 2007) Absorption cutanée : 100 % Concentration × taux de contact × durée du rejet x absorption cutanée (100 %) / poids corporel × facteur de conversion d’unité Pour les estimations de l’exposition par inhalation par événement, nous avons utilisé les valeurs par défaut (ConsExpo Web 2016) pour le modèle de pulvérisation, le produit en aérosol et l’utilisation d’une bombe aérosol, sauf indication contraire : Durée du jet d’aérosol : 15 minutes (RIVM 2007) Durée de l’exposition : 20 minutes (RIVM 2007) Volume de la pièce : 34 m³ (RIVM 2007) Hauteur de la pièce : 2,25 m (RIVM 2007) Taux de renouvellement de l’air : 1,5 renouvellement par heure (RIVM 2007) Débit d’inhalation : 16,2 m³/jour (Santé Canada 1998) Taux de génération de masse : 0,45 g/s (RIVM 2007) Fraction dans l’air : 0,7 (RIVM 2007) Masse volumique des matières non volatiles : 1,5 g/cm³ (RIVM 2007) Diamètre de coupure pour l’inhalation : 15 µm (RIVM 2007) |
| Pompe à eau de radiateur automobile, réparation du système de refroidissement, huile hydraulique et de servodirection | Pour l’estimation de l’exposition par voie cutanée : Épaisseur du film retenu sur la peau : 0,01588 cm (Versar 1986) Superficie : 12 cm2 (Cela représente la superficie de 2 doigts et de 2 pouces chez un adulte.) Fraction absorbée : 1 (On suppose qu’il y a absorption complète du produit.) Absorption cutanée : 100 % Concentration × épaisseur du film retenu sur la peau × superficie × masse volumique x absorption cutanée (100 %) / poids corporel × facteur de conversion d’unité |
| Barre de savon | Pour l’estimation de l’exposition par voie cutanée : Quantité de produit : 1,1 g (adultes), 0,92 g (adolescents), 0,53 g (enfants), 0,31 g (tout‑petits), 0,19 g (nourrissons) (Ficheux et al. 2016) Facteur de rétention global : 0,01 (SDA, 2010) Fréquence : 1,2/jour (pour adultes, adolescents, enfants et tout‑petits), 1,1/jour (nourrissons) (Ficheux et al. 2015) Absorption cutanée : 100 % Concentration × quantité de produit × facteur de rétention × (fréquence)* x absorption cutanée (100 %) / poids corporel × facteur de conversion d’unité La fréquence est incluse dans l’estimation de l’exposition quotidienne, mais non dans l’estimation de l’exposition ponctuelle. |
| Teintures pour les lèvres et les joues | Contact avec les lèvres : Quantité de produit : 0,01 g pour adolescents et adultes (Loretz et al. 2005) Fréquence : 2,35/jour pour adolescents et adultes (Loretz et al. 2005) Concentration × quantité de produit × (fréquence)* / poids corporel × facteur de conversion d’unité Contact avec les joues : Quantité de produit : 0,54 g pour adolescents et adultes (d’après les valeurs par défaut pour le maquillage du visage) (Loretz et al. 2005) Fréquence : 1,24/jour pour adolescents et adultes (d’après les valeurs par défaut pour le maquillage du visage) (Loretz 2006) Absorption cutanée : 100 % Concentration × quantité de produit × (fréquence)* x absorption cutanée (100 %) / poids corporel × facteur de conversion d’unité Estimation de l’exposition totale = estimation de l’exposition due au contact avec les lèvres + estimation de l’exposition due au contact avec les joues La fréquence est incluse dans l’estimation de l’exposition quotidienne, mais non dans l’estimation de l’exposition ponctuelle. |
| Brillant à lèvres | Pour l’estimation de l’exposition par voie orale : Quantité de produit : 0,01 g pour tout‑petits, enfants, adolescents et adultes (Loretz et al. 2005) Fréquence : 2,35/jour pour adolescents et adultes, 0,89/jour pour enfants et 0,58/jour pour tout‑petits (Loretz et al. 2005) Concentration × quantité de produit × (fréquence)* / poids corporel × facteur de conversion d’unité La fréquence est incluse dans l’estimation de l’exposition quotidienne lorsqu’elle est supérieure à 1, et la fréquence n’est pas incluse dans l’estimation de l’exposition ponctuelle. |
| Stylo à encre liquidea | Pour l’estimation de l’exposition par voie orale ou cutanée : Pour les calculs de l’exposition ponctuelle b, la quantité estimée d’encre par exposition est de 50 mg (Hansen et al. 2008). La fraction absorbée est fixée à 1, par prudence. Concentration × quantité d’encre par exposition × fraction absorbée / poids corporel Pour les calculs de l’exposition quotidienne c, on suppose un taux de dépôt d’encre de 100 µg/cm et de 25 cm de ligne d’encre par jour (communication personnelle de l’Art & Creative Materials Institute (ACMI), Université Duke, à Santé Canada, 2009; sans référence). La mise à la bouche de la main et l’exposition due à la mise à la bouche d’objets sont prises en compte dans l’estimation de l’exposition quotidienne. Concentration × taux de dépôt d’encre × ligne d’encre par jour / poids corporel × facteur de conversion d’unité |
| Produits pour les ongles (produit de renforcement des ongles, poli, gel et colle à ongles) | Pour l’estimation de l’exposition par voie cutanée : Quantité de produit : 0,16 g pour adolescents et adultes, 0,06 g pour tout‑petits et enfants Absorption cutanée : 100 % Concentration × quantité de produit x absorption cutanée (100 %) / poids corporel × facteur de conversion d’unité |
| Granulés en caoutchouc | Pour l’estimation de l’exposition par voie orale : Quantité ingérée par événement : 0,2 g pour les tout‑petits, les enfants, les adolescents et les adultes (RIVM 2017) Concentration × quantité ingérée* par événement / poids corporel × facteur de conversion d’unité Pour l’estimation de l’exposition par voie cutanée : Contact ponctuel avec la peau : 1 g pour les tout‑petits; 10 g pour les enfants, les adolescents et les adultes (ECHA 2017; RIVM 2017) Absorption cutanée : 100 % Concentration × contact ponctuel avec la peau* x absorption cutanée (100 %) / poids corporel × facteur de conversion d’unité On suppose que toute la substance entre en contact avec la peau ou pénètre dans les fluides gastro-intestinaux (RIVM 2017) Pour les calculs de l’exposition quotidienne, on présume de façon prudente que l’exposition ponctuelle se produit chaque jour. |
| Sucette pour bébé en caoutchouc | Pour l’estimation de l’exposition par voie orale : Poids du produit : 0,045 kg d Fraction de la surface du produit qui est porté à la bouche : 0,5 (Lassen et al. 2011, cité dans EFSA 2015) Fraction de la journée pendant laquelle le produit est mâchonné : 0,2 pour les nourrissons; 0,32 pour les tout‑petits (Juberg et al. 2001, cité dans EFSA 2015) Concentration × quantité ingérée par jour × fraction de la surface du produit qui est porté à la bouche × fraction de la journée pendant laquelle le produit est mâchonné / poids corporel × facteur de conversion d’unité |
a Le produit en question (SDS 2017) ne semble pas être commercialisé auprès des enfants. Cependant, par prudence, il n’a pas été possible d’exclure une utilisation non ciblée par les tout‑petits.
b L’exposition ponctuelle est représentative des scénarios qui pourraient se produire en une journée (par exemple, les tout‑petits dessinant sur leur peau ou mettant un stylo dans la bouche), mais pas nécessairement chaque jour. Par conséquent, l’exposition ponctuelle estimée est plus élevée que l’exposition quotidienne estimée.
c Selon l’ACMI, une personne peut être exposée à une ligne d’encre d’environ 25 cm par jour, par contact avec la peau ou par la bouche.
d Poids des sucettes pour bébé obtenu par examen du poids des produits, d’après les étiquettes des produits.
Annexe D. Estimations de l’absorption quotidienne par groupe d’âge au sein de la population générale du Canada
Hypothèses formulées pour différents groupes d’âge au sein de la population générale au Canada :
0 à 6 mois : poids de 7,5 kg, volume inhalé de 2,1 m³ d’air par jour, consommation de 0,8 L d’eau par jour (dans une préparation pour nourrissons) ou de 0,3 L/j (sans préparation pour nourrissons), respectivement (Santé Canada 1998).
Pour les enfants nourris au lait maternel :
Consommation : 0,742 L de lait maternel par jour (Santé Canada 1998), et on présume que le lait maternel est la seule source d’alimentation.
Ajustement relatif aux lipides : 4 % de lipides (concentration moyenne de lipides dans le lait maternel).
Masse volumique : 1,03 g/ml (masse volumique du lait maternel)
Exposition orale par le lait maternel = concentration (ng/g de préparation pour nourrisson) × consommation × ajustement relatif aux lipides × masse volumique / poids corporel × facteur de conversion d’unité
0,5 à 4 ans : Tout‑petits – poids de 15,5 kg, volume inhalé de 9,3 m³ d’air par jour, consommation de 0,7 L d’eau par jour (Santé Canada 1998).
5 à 11 ans : Enfants – poids de 31,0 kg, volume inhalé de 14,5 m³ d’air par jour, consommation de 1,1 L d’eau par jour (Santé Canada 1998).
12 à 19 ans : Adolescents – poids de 59,4 kg, volume inhalé de 15,8 m³ d’air par jour, consommation de 1,2 L d’eau par jour (Santé Canada 1998).
20 à 59 ans : Adultes – poids de 70,9 kg, volume inhalé de 16,2 m³ d’air par jour, consommation de 1,5 L d’eau par jour (Santé Canada 1998).
60 ans et plus : Personnes âgées – poids de 72,0 kg, volume inhalé de 14,3 m³ d’air par jour, consommation de 1,6 L d’eau par jour (Santé Canada 1998).
| Voie d’exposition | 0 à 6 mois (nourris au lait maternel) | 0 à 6 mois (préparation pour nourrisson) | 0 à 6 mois (sans préparation pour nourrisson) | 0,5 à 4 ans | 5 à 11 ans | 12 à 19 ans | 20 à 59 ans | 60 ans et plus |
|---|---|---|---|---|---|---|---|---|
| Air | 4,1 × 10‑6 | 4,1 × 10‑6 | 4,1 × 10‑6 | 8,7 × 10‑6 | 6,8 × 10‑6 | 3,9 × 10‑6 | 3,3 × 10‑6 | 2,9 × 10‑6 |
| Aliments | S.O. | S.O. | S.O. | 2,8 × 10‑5 | 2,6 × 10‑5 | 1,1 × 10‑5 | 8,6 × 10‑6 | 8,6 × 10‑6 |
| Absorption totale | 4,1 × 10‑6 | 4,1 × 10‑6 | 4,1 × 10‑6 | 3,7 × 10‑5 | 3,3 × 10‑5 | 1,5 × 10‑5 | 1,2 × 10‑5 | 1,2 × 10‑5 |
Abréviations : S.O. = sans objet.
| Voie d’exposition | 0 à 6 mois (nourris au lait maternel) | 0 à 6 mois (préparation pour nourrisson) | 0 à 6 mois (sans préparation pour nourrisson) | 0,5 à 4 ans | 5 à 11 ans | 12 à 19 ans | 20 à 59 ans | 60 ans et plus |
|---|---|---|---|---|---|---|---|---|
| Aliments | 1,8 × 10‑5 | S.O. | S.O. | 2,50 × 10‑4 | 2,32 × 10‑4 | 9,65 × 10‑5 | 7,71 × 10‑5 | 7,71 × 10‑5 |
| Absorption totale | 1,8 × 10‑5 | S.O. | S.O. | 2,50 × 10‑4 | 2,32 × 10‑4 | 9,65 × 10‑5 | 7,71 × 10‑5 | 7,71 × 10‑5 |
Abréviations : S.O. = sans objet.
| Voie d’exposition | 0 à 6 mois (nourris au lait maternel) | 0 à 6 mois (préparation pour nourrisson) | 0 à 6 mois (sans préparation pour nourrisson) | 0,5 à 4 ans | 5 à 11 ans | 12 à 19 ans | 20 à 59 ans | 60 ans et plus |
|---|---|---|---|---|---|---|---|---|
| Eau potable | S.O. | 9,0 × 10‑6 | 9,0 × 10‑6 | 3,8 × 10‑6 | 3,0 × 10‑6 | 1,7 × 10‑6 | 1,8 × 10‑6 | 1,9 × 10‑6 |
| Aliments | 9,4 × 10‑5 | S.O. | S.O. | 6,17 × 10‑5 | 5,72 × 10‑5 | 2,38 × 10‑5 | 1,90 × 10‑5 | 1,90 × 10‑5 |
| Absorption totale | 9,4 × 10‑5 | 9,0 × 10‑6 | 9,0 × 10‑6 | 6,6 × 10‑5 | 6,0 × 10‑5 | 2,6 × 10‑5 | 2,1 × 10‑5 | 2,1 × 10‑5 |
Abréviations : S.O. = sans objet.
| Voie d’exposition | 0 à 6 mois (nourris au lait maternel) | 0 à 6 mois (préparation pour nourrisson) | 0 à 6 mois (sans préparation pour nourrisson) | 0,5 à 4 ans | 5 à 11 ans | 12 à 19 ans | 20 à 59 ans | 60 ans et plus |
|---|---|---|---|---|---|---|---|---|
| Air | 2,8 × 10‑6 | 2,8 × 10‑6 | 2,8 × 10‑6 | 6,0 × 10‑6 | 4,7 × 10‑6 | 2,7 × 10‑6 | 2,3 × 10‑6 | Négligeable |
| Aliments | S.O. | S.O. | S.O. | 3,0 × 10‑5 | 2,8 × 10‑5 | 1,1 × 10‑5 | 9,2 × 10‑6 | 9,2 × 10‑6 |
| Absorption totale | 2,8 × 10‑6 | 2,8 × 10‑6 | 2,8 × 10‑6 | 3,6 × 10‑5 | 3,3 × 10‑5 | 1,4 × 10‑5 | 1,2 × 10‑5 | 9,2 × 10‑6 |
Abréviations : S.O. = sans objet.
| Voie d’exposition | 0 à 6 mois (nourris au lait maternel) | 0 à 6 mois (préparation pour nourrisson) | 0 à 6 mois (sans préparation pour nourrisson) | 0,5 à 4 ans | 5 à 11 ans | 12 à 19 ans | 20 à 59 ans | 60 ans et plus |
|---|---|---|---|---|---|---|---|---|
| Aliments | Négligeable | S.O. | S.O. | 4,9 × 10‑4 | 4,5 × 10‑4 | 1,9 × 10‑4 | 1,5 × 10‑4 | 1,5 × 10‑4 |
| Absorption totale | Négligeable | S.O. | S.O. | 4,9 × 10‑4 | 4,5 × 10‑4 | 1,9 × 10‑4 | 1,5 × 10‑4 | 1,5 × 10‑4 |
Abréviations : S.O. = sans objet.
| Voie d’exposition | 0 à 6 mois (nourris au lait maternel) | 0 à 6 mois (préparation pour nourrisson) | 0 à 6 mois (sans préparation pour nourrisson) | 0,5 à 4 ans | 5 à 11 ans | 12 à 19 ans | 20 à 59 ans | 60 ans et plus |
|---|---|---|---|---|---|---|---|---|
| Eau potable | S.O. | 2,0 × 10‑3 | 2,0 × 10‑3 | 8,7 × 10‑4 | 6,8 × 10‑4 | 3,9 × 10‑4 | 4,1 × 10‑4 | 4,3 × 10‑4 |
| Absorption totale | S.O. | 2,0 × 10‑3 | 2,0 × 10‑3 | 8,7 × 10‑4 | 6,8 × 10‑4 | 3,9 × 10‑4 | 4,1 × 10‑4 | 4,3 × 10‑4 |
Abréviations : S.O. = sans objet.
| Voie d’exposition | 0 à 6 mois (nourris au lait maternel) | 0 à 6 mois (préparation pour nourrisson) | 0 à 6 mois (sans préparation pour nourrisson) | 0,5 à 4 ans | 5 à 11 ans | 12 à 19 ans | 20 à 59 ans | 60 ans et plus |
|---|---|---|---|---|---|---|---|---|
| Eau potable | S.O. | 2,0 × 10‑3 | 2,0 × 10‑3 | 8,7 × 10‑4 | 6,8 × 10‑4 | 3,9 × 10‑4 | 4,1 × 10‑4 | 4,3 × 10‑4 |
| Aliments | S.O. | S.O. | S.O. | 1,1 × 10‑3 | 1,0 × 10‑3 | 4,4 × 10‑4 | 3,5 × 10‑4 | 3,5 × 10‑4 |
| Absorption totale | S.O. | 2,0 × 10‑3 | 2,0 × 10‑3 | 2,0 × 10‑3 | 1,7 × 10‑3 | 8,3 × 10‑4 | 7,6 × 10‑4 | 7,8 × 10‑4 |
Abréviations : S.O. = sans objet.
| Voie d’exposition | 0 à 6 mois (nourris au lait maternel) | 0 à 6 mois (préparation pour nourrisson) | 0 à 6 mois (sans préparation pour nourrisson) | 0,5 à 4 ans | 5 à 11 ans | 12 à 19 ans | 20 à 59 ans | 60 ans et plus |
|---|---|---|---|---|---|---|---|---|
| Eau potable | S.O. | 2,0 × 10‑3 | 2,0 × 10‑3 | 8,7 × 10‑4 | 6,8 × 10‑4 | 3,9 × 10‑4 | 4,1 × 10‑4 | 4,3 × 10‑4 |
| Aliments | S.O. | S.O. | S.O. | 1,1 × 10‑3 | 1,0 × 10‑3 | 4,4 × 10‑4 | 3,5 × 10‑4 | 3,5 × 10‑4 |
| Absorption totale | S.O. | 2,0 × 10‑3 | 2,0 × 10‑3 | 2,0 × 10‑3 | 1,7 × 10‑3 | 8,3 × 10‑4 | 7,6 × 10‑4 | 7,8 × 10‑4 |
Abréviations : S.O. = sans objet.
Annexe E. Concentrations mesurées des substances du sous‑groupe des benzotriazoles dans l’eau
| Référence (pays) | Concentration minimale | Concentration maximale | Concentration moyenne ou médiane | Type d’eau |
|---|---|---|---|---|
| Breedveld et al. 2003 (Norvège) | 1,2 | 1 100 | N.R. | Eau souterraine |
| Cancilla et al. 1998 (États‑Unis) | N.R. | 126 000 | N.R. | Eau souterraine |
| Carpinteiro et al. 2012 (Espagne) | N.R. | 0,74 | 1,02 | Eaux usées |
| Diaz‑Cruz et al. 2019 (Grèce) | Environ 0,025 | Environ 0,7 | N.R. | Eau de surface |
| EMPODAT 2013 (Pays‑Bas) | 0,03 | 5,3 | N.R. | Eau de surface |
| Esteban et al. 2014a (Espagne) | 0,097 | 1,184 | N.R. | Eau de surface |
| Esteban et al. 2014b (Espagne) | 0,0004 | 0,02 | N.R. | Eau potable |
| Esteban et al. 2016 (Antarctique) | < 0,00007 | 0,01171 | N.R. | Eau de surface |
| Esteban et al. 2016 (Antarctique) | 0 | 0,172 | N.R. | Eaux usées |
| EU Waterbase‑ rivers (Suisse) | 0,005 | 0,405 | N.R. | Eau de surface |
| Giger et al. 2006 (Suisse) | 0,16 | 5,44 | N.R. | Eau de surface |
| Giger et al. 2006 (Suisse) | 0,22 | 0,4 | N.R. | Eau de surface |
| Giger et al. 2006 (Suisse) | 0,21 | 0,45 | 0,37 | Eau de surface |
| Giger et al. 2006 (Suisse) | 0,73 | 1,47 | 1,12 | Eau de surface |
| Giger et al. 2006 (Suisse) | 0,32 | 2,86 | 1,36 | Eau de surface |
| Giger et al. 2006 (Suisse) | 0,06 | 1,38 | 0,23 | Eau de surface |
| Giger et al. 2006 (Suisse) | 0,12 | 0,51 | N.R. | Eau de surface |
| Herzog et al. 2015 (Allemagne) | 0,64 | 3,57 | N.R. | Eaux usées |
| Janna et al. 2011 (Royaume‑Uni) | N.R. | N.R. | 0,224 | Eau de surface |
| Janna et al. 2011 (Royaume‑Uni) | 0,0006 | 0,0794 | 0,0309 | Eau potable |
| Janna et al. 2011 (Royaume‑Uni) | 0,84 | 3,605 | N.R. | Eaux usées |
| Jover et al. 2009 (Espagne) | N.R. | 0,131 | N.R. | Eaux usées |
| Jover et al. 2009 (Espagne) | N.R. | 0,24 | N.R. | Eau de surface |
| Kazner 2011 (Allemagne) | N.R. | 9,03 | N.R. | Eaux usées |
| Kiss et Fries 2009 (Allemagne) | 0,038 | 1,474 | N.R. | Eau de surface |
| Loos et al. 2009 (Italie) | N.R. | 7,997 | 0,493 | Eau de surface |
| Loos et al. 2013 (Italie) | 0,002927 | 0,009203 | N.R. | Eau de surface |
| Loos et al. 2013 (Italie) | N.R. | 0,00375 | N.R. | Eau de surface |
| Lowenberg et al. 2014 (Suisse) | 2 700 | 6 000 | N.R. | Eaux usées |
| Mandaric et al. 2017 (Italie) | 0,02205 | 0,0847 | N.R. | Eau de surface |
| Molins‑Delgado et al. 2015 (Espagne) | 0,0267 | 4,38 | N.R. | Effluents d’eaux usées |
| Molins‑Delgado et al. 2017 (Espagne) | 0,025 | 8,5298 | N.R. | Eau de surface |
| Molins‑Delgado et al. 2017 (Espagne) | 1,0841 | 16,9331 | N.R. | Eaux usées |
| Ostman et al. 2017 (Suède) | 0,19 | 24,61 | 2,28 | Eaux usées |
| Ostman et al. 2017 (Suède) | 0,037 | 13 | 0,29 | Eaux usées |
| Peng et al. 2018 (Chine) | 0,0738 | 18,3026 | 2,4747 | Eau de surface |
| Reemtsma et al. 2006 (Europe) | N.R. | N.R. | 7,3 | Eaux usées |
| Reemtsma et al. 2010 (Allemagne) | < 0,05 | 1,57 | N.R. | Eau de surface |
| Reemtsma et al. 2010 (Allemagne) | 17 | 44 | N.R. | Eaux usées |
| Rapport du RIVM, annexe 3 (Europe) | N.R. | 1,4 | 0,49 | Eau de surface |
| Rapport du RIVM, annexe 3 (Pays‑Bas) | 0,097 | 0,54 | N.R. | Eau de surface |
| Rapport du RIVM, annexe 3 (Pays‑Bas) | 0,041 | 1,1 | N.R. | Eau de surface |
| Rapport du RIVM, annexe 3 (Pays‑Bas) | 0,15 | 0,97 | N.R. | Eau de surface |
| Rapport du RIVM, annexe 3 (Pays‑Bas) | 0,29 | 0,81 | N.R. | Eau de surface |
| Kase et al. 2011 (Suisse) | N.R. | 2,99 | 1,23 | Eau de surface |
| Kase et al. 2011 (Suisse) | N.R. | 17,3 | 12,881 | Eaux usées |
| Ryu et al. 2014 (Corée du Sud) | N.R. | 0,088 | N.R. | Eaux usées |
| Schriks et al. 2010 (Pays‑Bas) | N.R. | 0,54 | N.R. | Eau de surface |
| Schriks et al. 2010 (Pays‑Bas) | N.R. | 0,2 | N.R. | Eau potable |
| Valcarcel et al. 2018 (Espagne) | ≤ 0,00247 | 0,01503 | N.R. | Eau potable |
| Valls‑Cantenys et al. 2016 (Allemagne) | 0,045 | 25,3 | 1,715 | Eau de surface |
| Valls‑Cantenys et al. 2016 (Allemagne) | 0,506 | 57,9 | 16,8 | Eaux usées |
| Valls‑Cantenys et al. 2016 (Allemagne) | 1,338 | 21,5 | 8,7 | Eaux usées |
| van Leerdam et al. 2009 (Pays‑Bas) | N.R. | 0,2 | N.R. | Eau potable |
| van Leerdam et al. 2009 (Pays‑Bas) | N.R. | 8 | N.R. | Eaux usées |
| Voutsa et al. 2006 (Suisse) | 11 | 100 | N.R. | Eaux usées |
| Voutsa et al. 2006 (Suisse) | 0,636 | 3,69 | N.R. | Eau de surface |
| Wang et al. 2016 (Chine) | N.R. | 0,227 | N.R. | Eau potable |
| Wang et al. 2016 (Chine) | N.R. | 0,227 | N.R. | Eau de surface |
| Wang et al. 2016 (Chine) | N.R. | 0,0138 | N.R. | Eau souterraine |
| Weiss et Reemtsma 2005 (Allemagne) | N.R. | N.R. | 11,9 | Eaux usées |
| Weiss et Reemtsma 2005 (Allemagne) | N.R. | N.R. | 9,6 | Eaux usées |
| Weiss et Reemtsma 2005 (Allemagne) | N.R. | N.R. | 0,9 | Eau de surface |
| Weiss et Reemtsma 2005 (Allemagne) | N.R. | N.R. | 3,4 | Eau de surface |
| Weiss et Reemtsma 2005 (Allemagne) | N.R. | N.R. | 0,2 | Eau souterraine |
| Weiss et Reemtsma 2005 (Allemagne) | N.R. | N.R. | < 0,01 | Eau souterraine |
| Weiss et al. 2006 (Allemagne) | 4 | 22 | 12 | Eaux usées |
| Wolschke et al. 2011 (Allemagne) | 0,024 | 0,39 | N.R. | Eau de surface |
Abréviation: N.R. = valeur non rapportée.
| Référence (pays) | Concentration minimale | Concentration maximale | Concentration moyenne ou médiane | Description de la substance | Type d’eau |
|---|---|---|---|---|---|
| Asimakopoulos et al. 2013a (Grèce) | 0,106 | 15,841 | N.R. | Tolyltriazole | Eaux usées |
| Breedveld et al. 2003 (Norvège) | N.R. | N.R. | < 1, sauf un échantillon provenant d’une zone humide | Tolyltriazole | Eau souterraine |
| Cancilla et al. 1998 (États‑Unis) | N.R. | N.R. | 17 000 | 5‑ Tolyltriazole | Eau souterraine |
| Cancilla et al. 2003 (États‑Unis) | N.R. | 2160 | N.R. | 5‑Tolyltriazole | Ruissellement d’aéroport |
| Cancilla et al. 2003 (États‑Unis) | N.R. | 1 670 | N.R. | 4‑Tolyltriazole | Ruissellement d’aéroport |
| Cancilla et al. 2003 (États‑Unis) | N.R. | < 80 | N.R. | 4‑Tolyltriazole | Site en amont et cours d’eau récepteurs |
| Cancilla et al. 2003 (États‑Unis) | N.R. | < 80 | N.R. | 5‑Tolyltriazole | Site en amont et cours d’eau récepteurs |
| Carpinteiro et al. 2012 (Espagne) | N.R. | 0,21 | N.R. | Tolyltriazole | Eau de rivière |
| Danish EPA 2013 (Pays‑Bas) | 160 | 180 | N.R. | Tolyltriazole | Eau souterraine |
| Diaz‑Cruz et al. 2019 (Grèce) | Environ 0,025 | Environ 0,8 | N.R. | 5‑Tolyltriazole | Eau de surface |
| EMPODAT 2013 (Pays‑Bas) | 0,01 | 0,5 | N.R. | Tolyltriazole | Eau de surface |
| EMPODAT 2013 (Pays‑Bas) | 0,01 | 0,66 | N.R. | Tolyltriazole | Eau souterraine |
| EMPODAT 2013 (Pays‑Bas) | 0,006 | 2,59 | N.R. | olyltriazole | Eaux usées |
| EMPODAT 2013 (Pays‑Bas) | < LQ | 0,37 | N.R. | 5‑Tolyltriazole | Eau de surface |
| EMPODAT 2013 (Pays‑Bas) | 1,06 | 4,9 | N.R. | 5‑Tolyltriazole | Eaux usées |
| EMPODAT 2013 (Pays‑Bas) | 0,08 | 0,66 | N.R. | 4‑Tolyltriazole | Eau de surface |
| Esteban et al. 2014a (Espagne) | 0,272 | 1,052 | N.R. | Tolyltriazole | Eau de rivière |
| Esteban et al. 2014b (Espagne) | 0,0037 | 0,0125 | N.R. | Tolyltriazole | Eau du robinet |
| Esteban et al. 2016 (Antarctique) | < 0,00001 | 0,01468 | 0,01003 | Tolyltriazole | Cours d’eau |
| Esteban et al. 2016 (Antarctique) | < 0,00001 | 0,00745 | N.R. | Tolyltriazole | Étangs |
| Esteban et al. 2016 (Antarctique) | 4,64761 | N.R. | N.R. | Tolyltriazole | Eaux usées |
| Focazio et al. 2008 (États‑Unis) | N.R. | Concentration rapportée | N.R. | 5‑Tolyltriazole | Eau potable non traitée |
| Giger et al. 2006 (Suisse) | 0,01 | 0,91 | N.R. | Tolyltriazole | Eau de rivière |
| Glassmeyer et al. 2017 (États‑Unis) | N.R. | 1,2 | 0,27 | 5‑Tolyltriazole | Eau de source |
| Glassmeyer et al. 2005 (États‑Unis) | N.R. | 1,7 | N.R. | 5‑Tolyltriazole | Eaux usées |
| Glassmeyer et al. 2017 (États‑Unis) | N.R. | 0,247 | 0,134 | 5‑Tolyltriazole | Eau potable |
| Gorga et al. 2015 (Espagne) | N.D. | 7,018 | N.R. | Tolyltriazole | Eau de rivière |
| Janna et al. 2011 (Royaume‑Uni) | < 0,0005 | 0,0698 | 0,0151 | Tolyltriazole | Eau du robinet |
| Jover et al. 2009 (Espagne) | N.R. | N.R. | 0,925 | 5‑Tolyltriazole | Eau de rivière |
| Jover et al. 2009 (Espagne) | N.R. | N.R. | 1,561 | 5‑Tolyltriazole | Eau de rivière |
| Jover et al. 2009 (Espagne) | N.R. | N.R. | N.D. | 5‑Tolyltriazole et 4‑Tolyltriazole | Eaux usées |
| Kiss et Fries 2009 (Allemagne) | 0,025 | 0,281 | 0,063 (principale et 0,095 (Hengstbach) | 5‑Tolyltriazole | Eau de rivière |
| Kiss et Fries 2009 (Allemagne) | 0,025 | 0,952 | 0,099 (principale et 0,476 (Hengstbach) | 4‑Tolyltriazole | Eau de rivière |
| Kolpin et al. 2002 (États‑Unis) | N.R. | 2,4 | 0,39 | 5‑Tolyltriazole | Cours d’eau |
| Lai et al. 2018 (Taiwan) | 0,0004 | 0,0119 | N.R. | Tolyltriazole | Aquaculture |
| Loos et al. 2010 (Italie) | N.R. | 0,516 | 0,02 | Tolyltriazole | Eau souterraine |
| Loos et al. 2013a (Italie) | N.R. | 24,3 | 2,9 | Tolyltriazole | Eaux usées |
| Loos et al. 2013b (Italie) | 0,003112 | 0,0185 | N.R. | Tolyltriazole | Eau de mer |
| Molins‑Delgado et al. 2015 (Espagne) | 0,7787 | 47,1429 | 3,1764 | 5‑Tolyltriazole | Influents d’eaux usées |
| Molins‑Delgado et al. 2015 (Espagne) | 0,5871 | 10,5412 | 1,7941 | 5‑Tolyltriazole | Effluents d’eaux usées |
| Molins‑Delgado et al. 2017 (Espagne) | 0,0669 | 7,1814 | N.R. | 5‑Tolyltriazole | Eau de surface |
| Molins‑Delgado et al. 2017 (Espagne) | 3,7285 | 6,3662 | N.R. | 5‑Tolyltriazole | Eaux usées |
| Noedler et al. 2014 (Europe et États‑Unis) | 0,01 | 0,177 | N.R. | Tolyltriazole | Eau de mer |
| Ostman et al. 2017 (Suède) | 0,941 | 6,106 | 3,202 | 5‑Tolyltriazole et 4‑Tolyltriazole | Eaux d’égout |
| Ostman et al. 2017 (Suède) | 0,095 | 2,3 | 0,921 | 5‑Tolyltriazole et 4‑Tolyltriazole | Effluents traités |
| Peng et al. 2018 (Chine) | 0,033843 | 1,465068 | 0,33308 | 5‑Tolyltriazole | Eau de surface |
| Reemtsma et al. 2006 (Europe) | N.R. | N.R. | 2,2 | Tolyltriazole | Eaux usées |
| Reemtsma et al. 2010 (Allemagne) | < 0,05 | 2,14 | N.R. | 4‑Tolyltriazole | Eau de surface |
| Reemtsma et al. 2010 (Allemagne) | < 0,05 | 0,34 | N.R. | 5‑Tolyltriazole | Eau de surface |
| Kase et al. 2011 (Suisse) | N.R. | 0,516 | 0,249 | 5‑Tolyltriazole | Eau de surface |
| Kase et al. 2011 (Suisse) | N.R. | 1,95 | 1,14 | 5‑Tolyltriazole | Eaux usées |
| Schriks et al. 2010 (Pays‑Bas) | N.R. | 0,29 | N.R. | Tolyltriazole | Eau de surface |
| Stackelberg et al. 2004 (États‑Unis) | N.R. | N.D. | N.R. | 5‑Tolyltriazole | Eau de cours d’eau, eau brute et eau finie |
| Valcarcel et al. 2018 (Espagne) | 0,00136 | 0,05458 | N.R. | Tolyltriazole | Eau potable |
| Valls‑Cantenys et al. 2016 (Allemagne) | < LD | 12,5 | 0,437 | 5‑Tolyltriazole et 4‑Tolyltriazole | Eau de rivière |
| Valls‑Cantenys et al. 2016 (Allemagne) | 0,566 | 11,8 | 2,98 | 5‑Tolyltriazole et 4‑Tolyltriazole | Eaux usées |
| Valls‑Cantenys et al. 2016 (Allemagne) | 0,89 | 6,15 | 1,615 | 5‑Tolyltriazole et 4‑Tolyltriazole | Eaux usées |
| Voutsa et al. 2006 (Suisse) | 0,122 | 0,628 | N.R. | Tolyltriazole | Eau de rivière |
| Voutsa et al. 2006 (Suisse) | 0,1 | 5,6 | N.R. | Tolyltriazole | Eaux usées |
| Wang et al. 2016 (Chine) | < LQ | 0,0702 | 0,0016 | Tolyltriazole | Eau du robinet |
| Wang et al. 2016 (Chine) | < 0,0004 | 0,0214 | < 0,0004 | Tolyltriazole | Eau du robinet |
| Weiss et Reemtsma 2005 (Allemagne) | N.R. | N.R. | 0,2 | 4‑Tolyltriazole | Eau de canal |
| Weiss et Reemtsma 2005 (Allemagne) | N.R. | N.R. | 0,05 | 4‑Tolyltriazole | Filtrat de berges |
| Weiss et Reemtsma 2005 (Allemagne) | N.R. | N.R. | < 0,01 | 4‑Tolyltriazole | Eau souterraine |
| Weiss et Reemtsma 2005 (Allemagne) | N.R. | N.R. | 2,2 | 4‑Tolyltriazole | Eaux usées |
| Weiss et Reemtsma 2005 (Allemagne) | N.R. | N.R. | 2,1 | 4‑Tolyltriazole | Eaux usées |
| Weiss et Reemtsma 2005 (Allemagne) | N.R. | N.R. | 0,2 | Tolyltriazole | Eau de lac |
| Weiss et Reemtsma 2005 (Allemagne) | N.R. | N.R. | 0,1 | 5‑Tolyltriazole | Eau de canal |
| Weiss et Reemtsma 2005 (Allemagne) | N.R. | N.R. | < 0,01 | 5‑Tolyltriazole | Filtrat de berges |
| Weiss et Reemtsma 2005 (Allemagne) | N.R. | N.R. | < 0,01 | 5‑Tolyltriazole | Eau souterraine |
| Weiss et Reemtsma 2005 (Allemagne) | N.R. | N.R. | 2,5 | 5‑Tolyltriazole | Eaux usées |
| Weiss et Reemtsma 2005 (Allemagne) | N.R. | N.R. | 2 | 5‑Tolyltriazole | Eaux usées |
| Weiss et al. 2006 (Allemagne) | N.R. | N.R. | 2,1 | 5‑Tolyltriazole | Eaux usées |
| Weiss et al. 2006 (Allemagne) | N.R. | N.R. | 1,3 | 5‑Tolyltriazole | Eaux usées |
| Wolschke et al. 2011 (Allemagne) | 0,021 | 0,454 | N.R. | Tolyltriazole | Eau de surface |
Abréviations : N.R. = valeur non rapportée; LD = limite de détection; LQ = limite de quantification; N.D. = valeur non détectée.
| Référence (pays) | Concentration minimale | Concentration maximale | Concentration moyenne | Description de la substance | Type d’eau |
|---|---|---|---|---|---|
| Lu et al. 2016a (Canada) | N.R. | < 0,00058 | N.R. | UV‑329 | Eau de surface |
| Lu et al. 2017 (Canada) | N.R. | 0,00854 | N.R. | UV‑329 | Effluents d’eaux usées |
| ECHA 2014b (Europe) | 0,00055 | 0,00094 | N.R. | UV‑320 | Eau de surface |
| ECHA 2014b (Europe) | N.R. | 0,024 | N.R. | UV‑320 | Eaux usées |
| ECHA 2014b (Europe) | N.R. | 0,004 | N.R. | UV‑320 | Effluents de station de traitement d’eaux usées |
| ECHA 2014b (Europe) | N.R. | 0,001 | N.R. | UV‑320 | Eaux de tempête |
| ECHA 2014b (Europe) | N.R. | 0,023 | N.R. | UV‑320 | Effluents de site d’enfouissement |
| Lu et al. 2016a (Canada) | < 0,0015 | 0,0843 | N.R. | UV‑326 | Eau de surface |
| Lu et al. 2017 (Canada) | N.R. | 0,034 | N.R. | UV‑326 | Effluents d’eaux usées |
| Lu et al. 2016a (Canada) | < 0,00005 | 0,00032 | N.R. | UV‑234 | Eau de surface |
| Lu et al. 2017 (Canada) | N.R. | 0,0409 | 0,00225 | UV‑234 | Effluents d’eaux usées |
Abréviations : N.R. = valeur non rapportée.
Annexe F. Exposition par le régime alimentaire aux substances du groupe des benzotriazoles et des benzothiazoles
Toutes les données disponibles sur les concentrations de benzothiazoles et de benzotriazoles signalées dans le poisson et les fruits de mer ont été prises en compte pour l’évaluation de l’exposition par le régime alimentaire. Nous avons exclu les échantillons qui ne seraient pas représentatifs des concentrations de fond puisqu’ils ont été prélevés en aval des sources de pollution probables (par exemple, en zones urbaines, dans les sites industriels), et ne seraient donc probablement pas représentatifs du contexte canadien. Les concentrations rapportées sur la base des lipides ou du poids sec ont été converties en poids humide en utilisant la teneur en lipides ou en humidité telle que rapportée dans les études ou, en l’absence de ces données, à partir d’espèces de poissons et de fruits de mer comparables incluses dans le Fichier canadien sur les éléments nutritifs (FCEN 2015). Parmi les autres données disponibles sur leur occurrence, on a présumé, de manière prudente, que la concentration maximale trouvée pour chaque benzothiazole et composé de benzotriazole dans les tissus comestibles du poisson ou des fruits de mer représentait la concentration dans tous les poissons et fruits de mer consommés par la population générale au Canada. Les concentrations de chaque benzotriazole et benzothiazole, pour lesquels on a estimé l’exposition alimentaire par les poissons et les fruits de mer, sont résumées dans le tableau F‑1.
| Substance | Plage des concentrations (ng/g) | Concentration maximale utilisée dans l’évaluation (ng/g) | Aliments présentant la concentration maximale | Référence (pays) |
|---|---|---|---|---|
| Benzotriazole | < 0,40 – 3,14 | 3,14 | Poissona | Li et al. 2018 (Chine) |
| UV‑329 | 0,009 – 521,75 | 28 | Poissona | Vimalkumar et al. 2018 (Inde) |
| UV‑326 | 0,04 – 10,6 | 6,9 | Poissona | Vimalkumar et al. 2018 (Inde) |
| Tolyltriazole | 0,23 – 3,35 | 3,35 | Carpe | Jakimska et al. 2013 (Espagne) |
| UV‑234 | 0,01 – 54,26 | 54,26 | « Surtout de la perche » | Brorström‑Lundén et al. 2011 (Suède) |
| CBS | 1,0 – 202,0 | 126,2 | Moules bleues | Brorström‑Lundén et al. 2011 (Suède) |
| MBT | 0,8 – 11,5 | 4,5 | Moules bleues | Brorström‑Lundén et al. 2011 (Suède) |
a Espèces de poissons non indiquées.
Annexe G. Informations additionnelles sur l’hydrolyse des substances du sous‑groupe des benzothiazoles
Les sulfénamides ont une liaison soufre-azote très labile qui peut être homolysée et clivée, relativement facilement (Koval 1996). Vu la polarisation de cette liaison et la capacité du soufre et de l’azote à être des centres actifs (pour les attaques électrophile et nucléophile, respectivement), les sulfénamides peuvent être oxydés sur l’un ou l’autre des centres actifs et la liaison peut également être clivée par réduction (Craine et Raban 1989). Les sulfénamides purs dérivés d’amines primaires (CBS, TBBS) sont plus sensibles à l’hydrolyse que les sulfénamides qui sont dérivés d’amines secondaires (DCBS) (Luecken et Sullivan 1980).
Selon Orwig (1971), l’hydrolyse des sulfénamides se produit facilement dans les solutions aqueuses ou éthérées en présence d’acides, mais dans les solutions alcalines, la liaison S‑N est plus stable à l’hydrolyse. Ceci est également confirmé par les données de Yoo et al. (2013) qui indiquent que l’hydrolyse se produit en quelques minutes dans les conditions acides et en quelques heures dans des conditions neutres.
L’approche adoptée pour cette évaluation des risques pour l’environnement correspond aux données mentionnées ci‑dessous. Le Rapport d’évaluation initiale de l’OCDE pour le TBBS cite une étude du METI (2000) dans laquelle le TBBS subit une dégradation abiotique rapide par hydrolyse à un pH inférieur ou égal à 7 (OCDE 2003). Selon des renseignements additionnels, le TBBS s’hydrolyse rapidement en MBT avec une demi‑vie de 7,76 à 9,53 heures dans l’eau à un pH de 7 et à 25 °C (ECHA c2007‑2019). Le rapport d’évaluation initiale de l’OCDE pour le DCBS cite une étude du CERI (2001) dans laquelle le produit chimique a été hydrolysé dans l’eau à 25 °C avec des demi‑vies de 4,92 jours à un pH de 4,0, de 18,6 jours à un pH de 7,0 et de 112 jours à un pH de 9,0 (OCDE 2009c). Cela confirme les données rapportées par Orwig (1971) et Yoo et al. (2013) concernant la dépendance au pH de l’hydrolyse des sulfénamides. Dans un rapport d’évaluation du DCBS publié par l’Union européenne, on a recalculé les demi‑vies à partir d’une étude soumise par l’industrie, et qui donnait des demi‑vies moyennes de 77 heures à un pH de 4, de 81,5 heures à un pH de 7, et de 58 heures à un pH de 9 (CE 2018). Dans le présent rapport, on reconnaît que même si la réaction d’hydrolyse se produit, elle n’est pas assez rapide pour empêcher l’adsorption du DCBS sur les matières en suspension. Dans le pire des cas, on présume, aux fins des scénarios d’exposition par l’environnement dans la présente évaluation, que l’hydrolyse en MBT se produira avant que les composés d’origine ne soient adsorbés sur les matières en suspension.
Une étude d’Unice et al. (2015) confirme que le MBT est un produit de transformation du CBS. Dans une étude de Hansson et Agrup (1993) citée dans EU RAR (2008), le CBS a montré une instabilité dans la solution tampon à un pH de 6,5. Toutefois, l’hydrolyse en MBTS et en MBT a été lente jusqu’à l’ajout d’un agent réducteur, tel que le glutathion ou la cystéine. Après l’ajout de glutathion, tout le CBS avait disparu en une heure et seul le MBT était présent, ce qui confirme le clivage réducteur indiqué par Craine et Raban (1989). Une étude de Monsanto décrite par l’ECHA (c2007‑2019) et les données présentées dans ChemRisk LLC (2010) montrent également une hydrolyse complète du CBS après 24,9 heures. Toutefois, les produits d’hydrolyse les plus abondants étaient le benzothiazole et le 2‑benzothiazolone, plutôt que le MBT. Nous avons pris en compte l’incertitude concernant les taux d’hydrolyse du CBS et des produits qui en découlent aux fins des scénarios d’exposition écologique en supposant que seulement 50 % du CBS s’hydrolyse en MBT.
Contrairement aux autres composés d’origine, le MBTS contient une liaison disulfure qui, pour être clivée, devra se trouver dans un milieu réducteur. Les conditions environnementales varient entre l’oxydation et l’anoxie, les conditions anoxiques (par exemple celles que l’on trouve dans les sédiments profonds) créant un environnement fortement réducteur (Søndergaard 2009). Par conséquent, le clivage des liaisons disulfure peut se produire dans ces conditions. En outre, les résultats d’une étude de Monsanto (1980), cités dans EU RAR (2008), indique que dans des conditions environnementales, le MBTS en solution aqueuse est hydrolysé en quelques jours. Par conséquent, aux fins de la présente évaluation, on suppose que le MBTS sera réduit en MBT.
Outre les substances du sous‑groupe des benzothiazoles, on a dressé une liste d’autres précurseurs potentiels du MBT figurant sur la Liste intérieure des substances (LIS, voir l’annexe I), et elle comprend 14 substances susceptibles de contribuer aux rejets de MBT. Trois substances comprennent le groupement MBT lié par une liaison sulfénamide et peuvent produire du MBT, en raison de la labilité de la liaison (Koval 1996). Ces substances comprennent les nos CAS 95‑29‑4, 102‑77‑2 et 3741‑80‑8. Les cinq substances suivantes sont des sels que le MBT forme avec des amines (nos CAS 38456‑45‑0, 65605‑47‑2, 65605‑48‑3, 68911‑68‑2, 117920‑00‑0). On s’attend donc à ce que le MBT soit biodisponible lorsque ces substances se dissocient dans l’eau. Trois autres précurseurs du MBT comprennent les sels que le MBT forme avec le zinc, le potassium et le cuivre (nos CAS 155‑04‑4, 7778‑70‑3, 32510‑27‑3), et qui devraient se dissocier pour donner du MBT. Il existe également deux substances contenant le groupement MBT (nos CAS 95‑32‑9, 22405‑83‑0) qui peuvent produire du MBT par l’hydrolyse d’une liaison disulfure, ce qui peut se survenir dans des conditions environnementales réductrices (Søndergaard 2009). Un autre précurseur du MBT est le n° CAS 21564‑17‑0, dont le MBT est le principal produit d’hydrolyse (Brownlee et al. 1992; Reemsta et al. 1995; Rodriguez et al.
Annexe H. Données additionnelles sur les effets sur l’environnement
| Nom commun | Organisme d’essai | Critère d’effet | Valeur (mg/L) | Référence |
|---|---|---|---|---|
| MBT | Poisson-zèbre (D. rerio) |
CE50 (éclosion différée) |
0,6 | Stinckens et al. 2016 |
| MBT | Poisson-zèbre (D. rerio) |
CL50 120 hpf | 6,9 | Stinckens et al. 2016 |
| MBT | Poisson-zèbre (D. rerio) |
CE50 168 hpf (gonflement des chambres postérieures) |
3,2 | Stinckens et al. 2016 |
| MBT | Poisson-zèbre (D. rerio) |
CL50 120 hpf | 4,2 | Stinckens et al. 2016 |
| MBT | Poisson-zèbre (D. rerio) |
CE50 168 hpf (réduction des pigments oculaires) |
0,66 | Stinckens et al. 2016 |
| MBT | Poisson-zèbre (D. rerio) |
CE50 120 hpf (réduction des pigments corporels) | 0,56 | Stinckens et al. 2016 |
| MBT | Poisson-zèbre (D. rerio) |
CE50 120 hpf (malformation de la bouche) | 0,61 | Stinckens et al. 2016 |
| MBT | Poisson-zèbre (D. rerio) |
CSEO 120 hpf (éclosion altérée) | 0,35 | Stinckens et al. 2016 |
| MBT | Algues (S. capricornutum) |
CE50 96 h (chlorophylle) | 0,23 | EC 2008 |
| MBT | Algues (S. capricornutum) |
CE50 96 h (croissance) |
0,25 | EC 2008 |
| MBT | Amphibiens (X. laevis) |
CMEO 21 j (développement métamorphique) | 0,11 | Tietge et al. 2013 |
| MBT | Amphibiens (X. laevis) |
CSEO 21 j (développement métamorphique) | 0,047 | Tietge et al. 2013 |
Abréviations : CSEO = concentration sans effet observé; CLx = concentration létale pour x % de la population; CEx = concentration entraînant un effet pour x % de la population; hpf = heures après fécondation.
| Nom commun | Organisme d’essai | Critère d’effet | Valeur (mg/kg) |
|---|---|---|---|
| MBTS | Éphémère (Hexagenia spp.) |
CSEO 3 semaines (survie) | > 100 |
| MBTS | Éphémère (Hexagenia spp.) |
CSEO 3 semaines (croissance) | > 100 |
| MBTS | Amphipode (Hyalella azteca) |
CSEO 3 semaines (survie) | > 100 |
| MBTS | Amphipode (Hyalella azteca) | CSEO 3 semaines (croissance) | > 100 |
| MBTS | Ver de boue (Tubifex tubifex) |
CSEO 3 semaines (survie) | > 100 |
| MBTS | Ver de boue (Tubifex tubifex) |
CSEO 4 semaines (production de cocons) | > 100 |
| MBTS | Ver de boue (Tubifex tubifex) |
CSEO 4 semaines (cocons éclos) | > 100 |
Abréviations : CSEO = concentration sans effet observé.
a Communication personnelle; données de recherche non publiées sur le benzothiazole fournies par la Division de la recherche sur les contaminants aquatiques, ECCC, à la Division de l’évaluation des risques pour l’environnement, ECCC, avril 2018; sans référence.
Annexe I. Liste non exhaustive des substances qui sont des précurseurs du 2‑mercaptobenzothiazole (MBT)
Six substances du sous‑groupe des benzothiazoles ont été jugées prioritaires en vue de mesures ultérieures au cours de la phase de catégorisation. Étant donné que l’évaluation porte sur un groupement préoccupant commun (MBT), toutes les substances figurant sur la LIS qui comprennent le groupement MBT ont ensuite été évaluées pour déterminer si elles pouvaient être des précurseurs du MBT. Le tableau I‑1 présente la liste non exhaustive de 14 substances qui ont été considérées comme des précurseurs potentiels, en plus des substances du sous‑groupe des benzothiazoles. Un examen plus poussé de la LIS permettrait de trouver d’autres précurseurs du MBT. En outre, il peut y avoir d’autres substances contenant le groupement MBT qui sont nouvelles au Canada (et qui ne sont donc pas indiquées).
Par conséquent, le MBT et ses précurseurs (c’est-à-dire les six substances du sous‑groupe des benzothiazoles et les 14 précurseurs potentiels énumérés dans le tableau I‑1) comprennent le MBT, ses sels, et les composés qui contiennent du MBT lié à tout groupement chimique par des liaisons disulfure ou sulfénamide ou lié au thiocyanate de méthyle. La conclusion de la présente évaluation pour l’environnement s’appuie sur celle concernant le groupement MBT, lorsque les autres composants de ces substances pourraient être préoccupants ou non.
| No CAS | Nom dans la LIS |
|---|---|
| 95‑29‑4 | N,N‑Diisopropylbenzothiazole‑2‑sulfénamide |
| 95‑32‑9 | 2‑(Morpholinodithio)benzothiazole |
| 102‑77‑2 | 2‑(Morpholinothio)benzothiazole |
| 155‑04‑4 | Disulfure de zinc et de di(benzothiazol‑2‑yle) |
| 3741‑80‑8 | N‑(2‑Benzothiazolylthio)‑N‑(tert‑butyl)‑2‑benzothiazolsulfénamide |
| 7778‑70‑3 | Benzothiazole‑2(3H)‑thione, sel de potassium |
| 21564‑17‑0 | Thiocyanate de (benzothiazol‑2‑ylthio)méthyle |
| 22405‑83‑0 | Dichloro[2,2’‑dithiobis[benzothiazole]]zinc |
| 32510‑27‑3 | Benzothiazole‑2(3H)‑thione, sel de cuivre |
| 38456‑45‑0 | Benzothiazole‑2(3H)‑thione, composé avec la diéthylamine (1:1) |
| 65605‑47‑2 | Benzothiazole‑2(3H)‑thione, composé avec la dibutylamine (1:1) |
| 65605‑48‑3 | Benzothiazole‑2(3H)‑thione, composé avec la triéthylamine (1:1) |
| 68911‑68‑2 | tert‑Alkylamines en C 12‑14, composés avec la benzothiazole‑2(3H)‑thione |
| 117920‑00‑0 | tert‑Alkylamines en C 16‑22, composés (1:1) avec la benzothiazole‑2(3H)‑thione |
