Évaluation préalable arènes
Titre officiel : Évaluation préalable arènes
Numéros d’enregistrement du Chemical Abstracts Service 57-97-6, 98-82-8
Environnement et Changement climatique Canada
Santé Canada
Mars 2019
No de cat. : En14-362/2019F-PDF
ISBN 978-0-660-29637-1
Résumé
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement, 1999 (LCPE), la ministre de l’Environnement et du Changement climatique et la ministre de la Santé ont réalisé une évaluation préalable portant sur deux des neuf substances appelées collectivement le « groupe des arènes » conformément au Plan de gestion des produits chimiques. Ces deux substances figurent parmi celles qui ont été désignées comme devant être évaluées en priorité, car elles satisfont aux critères de catégorisation au sens du paragraphe 73(1) de la LCPE. Par la suite, il a été établi par d’autres approches que sept substances sur neuf étaient peu préoccupantes, et les décisions relatives à ces substances sont fournies dans des rapports distinctsNote de bas de page 12. En conséquence, la présente évaluation préalable porte sur les deux substances énumérées dans le tableau ci-dessous. Les deux substances visées dans la présente évaluation préalable seront ci-après appelées substances du groupe des arènes.
NE CASa |
Nom dans la liste intérieure |
Nom commun |
98-82-8 |
Cumène |
Cumène; isopropylbenzène |
57-97-6 |
Benz[a]anthracene, 7,12-dimethyl- |
7,12-Diméthylbenzo[a]anthracène (DMBA) |
a Le numéro de registre du Chemical Abstracts Service (no CAS) est la propriété de l’American Chemical Society et toute utilisation ou redistribution, sauf quand cela est requis pour des exigences réglementaires et/ou pour des rapports au gouvernement du Canada quand l’information et les rapports sont requis en vertu d’une loi ou d’une politique administrative, est interdite sans autorisation écrite préalable de l’American Chemical Society.
En 2011, environ 100 000 à 1 000 000 kg de cumène (no CAS 98-82-8) ont été déclarés comme étant fabriqués au Canada, et la même quantité a été importée au Canada. Il n’y a eu aucune déclaration de fabrication ou d’importation de 7,12‑diméthylbenzo[a]anthracène (DMBA, no CAS 57-97-6) au-delà du seuil de déclaration de 100 kg pour la même année. Au Canada, le cumène est utilisé principalement comme produit chimique intermédiaire, mais il est également utilisé dans des produits disponibles au consommateur, y compris les adhésifs, les peintures, les produits reliés à l’automobile et les lubrifiants. Au Canada, le DMBA est utilisé comme produit chimique de recherche dans les laboratoires. Il peut également être produit involontairement lors de procédés industriels en tant que sous-produit.
Les risques écologiques du cumène et du DMBA ont été caractérisés au moyen de la classification du risque écologique des substances organiques (CRE). La CRE est une approche basée sur les risques, qui tient compte de plusieurs paramètres liés au danger et à l’exposition et basés sur une pondération des éléments de preuve. Les profils de danger sont établis principalement en se basant sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Parmi les paramètres pris en compte pour les profils d’exposition, on retrouve la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Une matrice de risques est utilisée pour assigner aux substances un potentiel faible, moyen ou élevé, basé sur leurs profils de danger et d’exposition. La CRE a déterminé que le cumène et le DMBA sont des substances peu susceptibles de causer des effets nocifs à l’environnement.
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation préalable, le cumène et le DMBA présentent un faible risque d’effets nocifs sur l’environnement. Il a été conclu que le cumène et le DMBA ne satisfont pas aux critères énoncés à l’alinéa 64a) ou b) de la Loi canadienne sur la protection de l’environnement (1999), car ils ne pénètrent pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ni à mettre en danger l’environnement essentiel pour la vie.
Les risques pour la santé humaine que présentent le cumène et le DMBA ont été caractérisés sur la base de renseignements disponibles sur l’exposition et sur les effets sur la santé.
Dans le cas du cumène, les études en laboratoire ont déterminé que la cancérogénicité est un effet critique sur la santé après une exposition de longue durée par inhalation. En outre, après l’administration par voie orale pendant 6 mois ou par inhalation pendant 3 mois, des effets autres que le cancer ont été observés dans des études en laboratoire sur les reins (étude de 6 mois par voie orale) et le foie (étude de 3 mois par inhalation). Aucun effet néfaste systémique n’a été observé dans des études en laboratoire portant sur l’exposition aiguë et à court terme par inhalation ou voie cutanée. L’exposition de la population générale au cumène, à partir de l’environnement et en raison de sa présence possible dans les aliments, a été caractérisée à l’aide de concentrations mesurées. La source principale d’exposition était l’air intérieur. Sur la base de la comparaison des estimations de l’exposition et des niveaux d’effet critique constatés dans les études concernant les effets sur la santé, on a estimé que les marges d’exposition sont adéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé humaine. Les estimations de l’exposition au cumène due à l’utilisation de divers produits disponibles aux consommateurs ont été déterminées et n’ont pas été jugées préoccupantes pour la santé humaine, car les études en laboratoire disponibles n’ont pas indiqué que les expositions aiguës et à court terme sont préoccupantes.
Le DMBA est génotoxique, et les études en laboratoire ont indiqué que la cancérogénicité pour plusieurs organes est un effet critique pour la santé, après l’administration par les voies orale et cutanée. Cette substance est considérée pouvoir être cancérogène par inhalation, et les estimations de sa puissance ont été dérivées sur la base des valeurs de puissance propres aux différentes voies pour un hydrocarbure aromatique polycyclique bien étudié. L’exposition de la population générale au DMBA a été caractérisée à l’aide de concentrations mesurées dans l’air ambiant au Canada. Sur la base de la comparaison des estimations de l’exposition et des niveaux d’effet critique constatés dans les études concernant les effets sur la santé, on a estimé que les marges d’exposition sont adéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé humaine.
Sur la base des renseignements présentés dans la présente évaluation préalable, il a été conclu que le cumène et le DMBA ne satisfont au critère de l’alinéa 64(c) [D[1] de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Par conséquent, il a été conclu que le cumène et le DMBA ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
1. Introduction
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement, 1999 (LCPE), la ministre de l’Environnement et la ministre de la Santé ont réalisé une évaluation préalable portant sur deux des neuf substances (cumène et DMBA) appelées collectivement le « groupe des arènes » conformément au Plan de gestion des produits chimiques afin de déterminer si ces deux substances présentent ou peuvent présenter un risque pour l’environnement ou la santé humaine. Ces deux substances figurent parmi celles qui ont été désignées comme devant être évaluées en priorité, car elles satisfont aux critères de catégorisation au sens du paragraphe 73(1) de la LCPE (ECCC, SC [modifié 2017]).
Les sept autres substances (énumérées dans le tableau 1-1, ci-dessous) ont été prises en compte dans le document sur l’approche scientifique intitulé Classification du risque écologique des substances organiques (CRE) et, soit le document sur l’approche scientifique intitulé Approche fondée sur le seuil de préoccupation toxicologique (SPT) (Santé Canada 2016a) ou par l’intermédiaire de l’approche dite Méthode d’examen préalable rapide (ECCC, SC, 2017a), et nous avons jugé qu’elles sont peu préoccupantes pour la santé humaine et l’environnement. Par conséquent, la suite du rapport n’en traite pas. Les conclusions proposées pour ces sept substances sont présentées dans l’évaluation préalable des substances jugées peu préoccupantes compte tenu de la Classification du risque écologique des substances organiques et de l’Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances (ECCC, SC, 2017b) et l’Examen préalable rapide des substances auxquelles la population générale est peu exposée (ECCC, SC, 2017a).
| No CASa | Nom figurant sur la liste intérieure des substances | Approche utilisée pour la substance | Références |
|---|---|---|---|
| 632-51-9 | Tétraphényléthylène | CRE/SPT | ECCC, SC 2017b |
| 29036-02-0 | Quaterphényle | CRE/SPT | ECCC, SC 2017b |
| 38640-62-9 | Bis(isopropyl)naphtalène | CRE/SPT | ECCC, SC 2017b |
| 64800-83-5 | Éthylphénéthylbenzène | CRE/SPT | ECCC, SC 2017b |
| 68398-19-6 | Éthyl(phénéthyl)benzène, dérivé mono-ar-éthylique | CRE/SPT | ECCC, SC 2017b |
| 68953-80-0 | Benzène, mélangé à du toluène, produit de désalkylation | CRE/Méthode d’examen préalable rapide | ECCC, SC 2017a |
| 68987-42-8 | Benzène comprenant des groupements éthylène, résidus | CRE/Méthode d’examen préalable rapide | ECCC, SC 2017a |
a. Le numéro de registre du Chemical Abstracts Service (no CAS) est la propriété de l’American Chemical Societyet toute utilisation ou redistribution, sauf quand cela est requis pour des exigences réglementaires et/ou pour des rapports au gouvernement du Canada quand l’information et les rapports sont requis en vertu d’une loi ou d’une politique administrative, est interdite sans autorisation écrite préalable de l’American Chemical Society.
La présente évaluation préalable traite donc uniquement des deux autres substances (cumène et DMBA).
Les risques écologiques du cumène et du DMBA ont été caractérisés selon l’approche CRE (ECCC 2016a). La CRE décrit les dangers d’une substance à l’aide de paramètres clés, y compris le mode d’action, la réactivité chimique, le seuil de toxicité interne dérivé d’après le réseau trophique, la biodisponibilité, ainsi que l’activité chimique et biologique, et elle tient compte de l’exposition possible des organismes dans les milieux aquatique et terrestre, sur la base de facteurs comprenant les taux d’émission, la persistance globale et le potentiel de transport à grande distance des polluants atmosphériques. Les divers éléments de preuve sont combinés afin d’identifier les substances nécessitant une évaluation plus poussée de leur potentiel d’effets nocifs sur l’environnement ou présentant une faible probabilité d’effets nocifs sur l’environnement.
La présente ébauche d’évaluation préalable tient compte des renseignements sur les propriétés chimiques des substances visées, leur devenir dans l’environnement, leurs dangers, leurs utilisations et leur exposition ainsi que des renseignements supplémentaires fournis par des parties intéressées. Des données pertinentes ont été relevées jusqu’en juillet 2016. Des demandes d’éclaircissements additionnels et des activités de suivi auprès des parties intéressées ont eu lieu jusqu’en octobre 2016. Nous avons utilisé des données empiriques tirées d’études clés, ainsi que certains résultats de modélisation, pour établir nos conclusions. Lorsqu’ils étaient disponibles et pertinents, les renseignements contenus dans les évaluations effectuées par d’autres instances ont été utilisés.
De plus, la présente évaluation préalable a été préparée par le personnel des programmes d’évaluation des risques de la LCPE travaillant à Santé Canada et à Environnement et Changement climatique Canada. Elle inclut des observations provenant d’autres programmes de ces ministères. La partie Évaluation des effets sur l’environnement de la présente évaluation est établie à partir de la CRE (document publié le 30 juillet 2016), qui a fait l’objet d’un examen par les pairs et d’une période de consultation publique de 60 jours. La partie portant sur la santé humaine a fait l’objet d’un examen externe par des pairs et/ou d’une consultation de ces derniers. Des commentaires concernant les parties techniques pertinentes pour la santé humaine ont été reçus de Tetra Tech Inc. (Theresa Lopez, Jennifer Flippin, Katherine Super et Gary Drendel). De plus, l’ébauche de la présente évaluation préalable (publiée le 21 juillet 2017) a fait l’objet d’une période de consultation publique de 60 jours. Bien que des commentaires de l’extérieur aient été pris en compte, Santé Canada et Environnement et Changement climatique Canada restent responsables du contenu final et des conclusions de la présente évaluation préalable.
La présente ébauche d’évaluation préalable repose sur des renseignements permettant de déterminer si les substances satisfont aux critères énoncés à l’article 64 de la LCPE. Pour ce faire, les renseignements scientifiques ont été étudiés et intégrés à une approche basée sur le poids de la preuve et le principe de précautionNote de bas de page 3 . Nous présentons dans la présente évaluation préalable les renseignements critiques et les considérations à partir desquels les conclusions ont été tirées.
2. Caractérisation du risque écologique
Les risques écologiques du cumène et du DMBA ont été caractérisés selon l’approche dite de « classification du risque écologique des substances organiques » (CRE) (ECCC 2016a). La CRE est une approche basée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition basés sur la pondération de plusieurs éléments de preuve. Les divers éléments de preuve sont combinés afin de faire la différence entre des substances présentant une puissance plus ou moins élevée et un potentiel d’exposition plus ou moins élevé dans divers milieux. Cette approche réduit l’incertitude globale de la caractérisation des risques comparativement à une approche qui reposerait sur un seul paramètre dans un seul milieu (p. ex. CL50). Les paragraphes suivants résument l’approche, qui est décrite en détail dans ECCC (2016a).
Les données sur les propriétés physico-chimiques, sur le devenir (demi-vies chimiques dans divers milieux et biote, coefficients de partage, bioconcentration dans les poissons), sur l’écotoxicité aiguë pour les poissons, et sur les volumes de produits chimiques importés et fabriqués au Canada proviennent de diverses sources : la littérature scientifique, les bases de données empiriques disponibles (p. ex. boîte à outils QSAR de l’OCDE), et les réponses aux enquêtes réalisées en vertu de l’article 71 de la LCPE, ou obtenues de relations structure-activité quantitative (QSAR) sélectionnées ou de modèles de devenir et de bioaccumulation par bilan massique. Ces données ont été utilisées comme intrants dans d’autres modèles de bilan massique ou pour compléter les profils d’exposition et de danger de la substance.
Les profils de danger ont été établis en se basant principalement sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Les profils d’exposition étaient basés sur de nombreux paramètres, dont les taux d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Les profils de danger et d’exposition ont été comparés aux critères de décision afin de classer les potentiels de risque et d’exposition de chaque substance comme faible, moyen ou élevé. D’autres règles ont été appliquées (p. ex. constance de la classification, marge d’exposition) afin de raffiner les classifications préliminaires du danger et de l’exposition.
Une matrice de risques a été utilisée pour assigner à chaque substance un risque potentiel faible, moyen ou élevé, basé sur la classification de son danger et de son exposition. Les classifications du risque potentiel au moyen de la CRE ont été vérifiées en suivant une approche en deux étapes. La première étape servait à ajuster les résultats de la classification du risque de moyen ou élevé à faible pour les substances présentant une faible vitesse d’émission estimée dans l’eau après traitement des eaux usées, représentant un faible potentiel d’exposition. La deuxième étape servait à examiner les résultats de la classification du risque potentiel faible ou moyen selon des scénarios de risque relativement prudents, à l’échelle locale (c.-à-d. dans la zone à proximité du point de rejet) et conçue pour protéger l’environnement, afin de déterminer si la classification du risque potentiel devrait être accrue.
La CRE s’appuie sur une approche pondérée afin de minimiser le potentiel de sous-classification et de surclassification des dangers, de l’exposition et des risques subséquents. Les approches équilibrées pour tenir compte des incertitudes sont décrites dans plus de détails dans le document ECCC 2016a. Nous décrivons ci-après deux des zones d’incertitude les plus importantes. Les erreurs dans les valeurs de toxicité aiguë empiriques ou modélisées pourraient conduire à des changements de la classification du danger, en particulier en ce qui a trait aux paramètres reposant sur des valeurs de résidus dans les tissus (c.-à-d. mode d’action toxique), dont de nombreux sont des valeurs prédites à partir de modèles QSAR. Cependant, l’impact de cette erreur est atténué par le fait qu’une surestimation de la létalité médiane conduira à une valeur prudente (protectrice) pour les résidus dans les tissus utilisée pour l’analyse des résidus corporels critiques (RCC). L’erreur dans la sous-estimation d’une toxicité aiguë sera atténuée par l’utilisation d’autres paramètres de danger, comme le profilage structural du mode d’action, la réactivité et/ou l’affinité de liaison à l’œstrogène. Les changements dans les quantités chimiques ou les erreurs dans ces quantités pourraient conduire à des classifications différentes de l’exposition, car la classification de l’exposition et du risque dépendant grandement du taux d’émission et des quantités utilisées. Les résultats de la CRE reflètent donc l’exposition et le risque au Canada basés sur les quantités actuellement utilisées et pourraient ne pas refléter des tendances futures.
3. Cumène
3.1 Identité de la substance
L’identité de la substance est décrite dans le tableau 3-1, y compris son numéro CAS, son nom dans la Liste intérieure des substances (LIS), sa structure et sa masse moléculaire. Cette substance est communément connue sous le nom de cumène ou isopropylbenzène.
| No CAS | Nom dans la LIS (nom commun) |
Structure chimique et formule moléculaire | Masse moléculaire (Da) |
|---|---|---|---|
| 98-82-8 | Cumène (isopropylbenzène) | 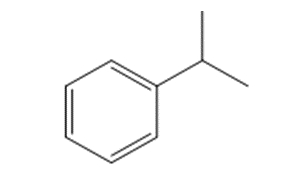 C9H12 C9H12 |
120 |
3.2 Propriétés physiques et chimiques
| Propriété | Valeur empirique | Référence(s) pour les valeurs empiriques |
|---|---|---|
| État physique | Liquide | (ECB 2001; Lide 2016) |
| Point de fusion (°C) | -96,01 | (ECB 2001; Lide 2016) |
| Point d’ébullition (°C) | 152,4 | (ECB 2001; Lide 2016) |
| Pression de vapeur (Pa) |
600 | (Daubert et Danner 1985, cité dans PhysProp 2006) |
| Constante de la loi d’Henry (Pa· m3/mol) |
1,46 x 103 | (Lide 2016) |
| Solubilité dans l’eau (mg/L) |
50 61,3 |
(ECB 2001; Lide 2016) (Sanemasa et coll. 1982, cité dans PhysProp 2006) |
| Log Koe (sans dimension) |
3,66 | (Hansch et coll. 1995, cité dans PhysProp 2006) |
D’autres propriétés physiques et chimiques sont présentées dans ECCC (2016b).
3.3 Sources et utilisations
Le cumène est principalement produit par l’alkylation du benzène avec du propène ou par la distillation du goudron de houille (ECB 2001). Selon les renseignements présentés dans le cadre d’une enquête réalisée en vertu de l’article 71 de la LCPE, il a été déclaré que la quantité totale de cumène fabriquée au Canada en 2011 se situait entre 100 000 et 1 000 000 kg, et la quantité importée était du même ordreNote de bas de page 4 . Aux États-Unis, la quantité totale de cumène fabriquée en 2012 était supérieure à 10 millions de tonnes (US EPA 2013).
Selon les données de l’inventaire national des rejets de polluants (INRP) pour 2014, les industries ont déclaré moins de 50 tonnes de cumène rejetées, éliminées et transférées. Parmi les secteurs déclarants figuraient les usines de pâtes et papier, l’extraction du pétrole et du gaz et la fabrication de produits chimiques.
Le cumène est présent dans le pétrole brut, les plantes, le foin des marais et les aliments (WHO 1999; ECB 2001; IARC 2012). On ignore pour le moment si sa présence dans les aliments est naturelle ou résulte de sa présence dans les milieux environnementaux (p. ex. le sol). Le cumène a été détecté dans les aliments, tels que les fruits, les légumes, les aliments cuits et les produits laitiers (ECB 2001; Hiatt et Pia 2004; FDA 2006). Le cumène est également présent dans la fumée de cigarette et les émissions de véhicules (WHO 1999; IARC 2012).
Le cumène est principalement utilisé dans les applications industrielles, mais il est également présent dans les produits disponibles aux consommateurs. Il est utilisé comme intermédiaire dans la production de phénol et d’acétone, et est présent comme composant mineur dans l’essence et comme solvant pétrolier (ECB 2001; IARC 2012). Selon les renseignements présentés dans le cadre d’une enquête réalisée en vertu de l’article 71 de la LCPE (Environnement Canada 2013), les utilisations liées aux produits de consommation au Canada comprennent les peintures et les revêtements, les lubrifiants et les graisses, les carburants et les produits automobiles, les adhésifs et les produits d’étanchéité. Une recherche supplémentaire dans la littérature a également révélé que le cumène peut être utilisé dans des produits de nettoyage spécialisés, comme les nettoyants pour injecteur de carburant et comme nettoyeur de surfaces en béton (UGL 2005; Prestone 2013) et comme agent antigel pour le diesel (Power Service 2014). Tous ces produits sont disponibles sur les marchés canadiens.
Au Canada, le cumène a été relevé comme composant dans la fabrication de certains matériaux d’emballage alimentaires. La contribution de cette utilisation à l’exposition globale pour les humains devrait être négligeable (communication personnelle de la Direction des aliments de Santé Canada au Bureau d’évaluation du risque des substances existantes, mai 2016; sans référence). En outre, on trouve du cumène dans les produits antiparasitaires, où il est utilisé comme produit de formulation autorisé (communication personnelle avec l’Agence de réglementation de la lutte antiparasitaire de Santé Canada, mai 2016; sans référence). Le cumène ne figure pas dans la Base de données sur les produits pharmaceutiques (BDPP) de la Direction des produits thérapeutiques comme ingrédient médicinal ou non médicinal dans les produits pharmaceutiques, désinfectants ou vétérinaires finaux au Canada. Le cumène ne figure pas dans la Base de données sur les ingrédients des produits de santé naturels (BDIPSN), ni dans la Base de données des produits de santé naturels homologués (BDPSNH), comme ingrédient médicinal ou non médicinal dans les produits de santé naturels au Canada (BDPP 2016; BDIPSN 2017; BDPSNH 2016; communication personnelle, mai 2016). Le United States Pharmacopoeia (USP 2016) et l’Agence européenne des médicaments (EMA 2016) classent le cumène comme solvant résiduel de classe 2 avec un niveau d’exposition quotidienne (PDE) de 0,7 mg/j, et par conséquent, on s’attendrait à ce que l’exposition due à son utilisation potentielle comme solvant ou intermédiaire dans le traitement ou la fabrication de ces produits ou de leurs ingrédients, ou leur présence résiduelle subséquente, serait inférieure à la plus faible des valeurs PDE de l’USP ou de l’EMA. La valeur PDE de 0,7 mg/j est également adoptée par Santé Canada (2016b). Le cumène ne figure pas comme ingrédient prohibé ou restreint dans la Liste critique des ingrédients des cosmétiques, et ne fait pas l’objet d’un avis indiquant sa présence dans les cosmétiques, établi d’après les notifications soumises en vertu du Règlement sur les cosmétiques à Santé Canada (communication personnelle de la Direction de la sécurité des produits de consommation au Bureau d’évaluation du risque des substances existantes, juillet 2016).
3.4 Potentiel de causer des effets nocifs sur l’environnement
Les données essentielles et les considérations utilisées dans la CRE pour élaborer les profils spécifiques du cumène, ainsi que les résultats de la classification des dangers, de l’exposition et des risques figurent dans ECCC (2016b).
Étant donné que les classifications établies par la méthode CRE pour le cumène indiquent un faible danger et une faible exposition, on estime que cette substance présente un faible potentiel de risque pour l’environnement. Il est donc improbable qu’elle soit préoccupante pour l’environnement au Canada.
3.5 Potentiel d’effets nocifs sur la santé humaine
Évaluation de l’exposition
En raison de sa volatilité, l’inhalation du cumène est considérée comme la principale voie d’exposition.
Milieux environnementaux et aliments
Le cumène peut être présent dans l’air ambiant, l’air intérieur et les aliments. Depuis 2000, sa présence est contrôlée dans l’eau potable de trois municipalités canadiennes. Aucune information n’a été trouvée sur la présence de cumène dans la poussière ou le sol.
Le cumène a été mesuré dans plusieurs études sur l’air ambiant au Canada. Il a été mesuré à diverses stations du Réseau national de surveillance de la pollution atmosphérique (RNSPA) et les concentrations moyennes en 2010-2013 étaient inférieures à 0,02 μg/m3 (RNSPA 2016). Sa présence a également été mesurée dans l’air extérieur et l’air intérieur des villes de Windsor (2005, 2006), Regina (2007), Halifax (2009) et Edmonton (2010) au cours de l’été et de l’hiver selon quatre études différentes; les concentrations moyennes arithmétiques dans l’air extérieur allaient de moins de 0,011 μg/m3 à 0,048 μg/m3 d’après les données recueillies au cours des périodes d’étude dans les quatre régions (Santé Canada 2010a, 2010b, 2012 et 2013a). Compte tenu de la couverture des stations de surveillance dans tout le Canada et de la date des données, la limite supérieure des données du RNSPA en 2010-2013, soit 0,02 μg/m3, a été utilisée pour caractériser l’exposition de la population générale au cumène par l’air ambiant, dans le présent rapport d’évaluation (tableau 3-4).
Les concentrations de cumène mesurées dans l’air intérieur sont généralement plus élevées que celles détectées dans l’air extérieur. Dans le cadre de l’Enquête canadienne sur les mesures de la santé (ECMS) de 2009-2011, Zhu et coll. (2013) ont réalisé une enquête nationale sur l’air intérieur dans plus de 3 800 logements (p. ex. maisons, appartements) partout au Canada. Avec une fréquence de détection de près de 80 %, le cumène a été mesuré à des concentrations de 0,25 μg/m3 (moyenne arithmétique), 0,08 μg/m3 (valeur médiane) et 2,52 μg/m3 (99e centile). Les quatre études différentes réalisées sur l’air intérieur à Windsor (2005, 2006), Regina (2007), Halifax (2009) et Edmonton (2010) ont donné des moyennes arithmétiques de 0,092 à 0,564 μg/m3 et des moyennes géométriques de 0,061 à 0,239 μg/m3 d’après les données recueillies au cours des périodes d’étude dans les quatre régions (Santé Canada 2010a, 2010b, 2012 et 2013a). À titre de mesure prudente, nous avons sélectionné, pour caractériser l’exposition de la population générale au cumène par l’air intérieur (tableau 3-4), la moyenne géométrique la plus élevée, soit 0,239 μg/m3 et la moyenne arithmétique de0,564 μg/m3, tirées de l’étude menée à Windsor (45 logements au cours de l’été 2005) (Santé Canada 2010a) (tableau 3-4).
Le cumène a été détecté dans l’eau potable aux États-Unis (EWG 2016), au Japon (Shiraishi et coll. 1985) et en Europe (IRAC 2012). Depuis 2000, on contrôle les concentrations de cumène dans les réseaux municipaux d’eau potable dans certaines villes du Canada, dont Montréal, Regina et Toronto, mais il n’a pas été détecté dans ces systèmes d’eau aux limites de détection de 0,03 à 0,2 μg/L (Ville de Montréal 2000-2012; City of Regina 2008-2013; City of Toronto 2003-2012).
Il n’existe pas de données canadiennes spécifiques sur les concentrations de cumène dans les aliments. Selon un résumé des analyses des produits chimiques industriels dans les aliments et des pesticides trouvés dans les États-Unis, réalisées par le Total Diet Study (TDS) Program de la FDA des États-Unis (1991-2003), le cumène a été détecté dans 36 aliments différents, y compris les légumes (p. ex. les carottes), les fruits (p. ex. les oranges), les produits laitiers (p. ex. le fromage à la crème) et les aliments transformés (p. ex. le pain de viande, les pépites de poulet) (FDA 2006). Les concentrations moyennes variaient de 0,00005 ppm à 0,0031 ppm, et les concentrations maximales variaient de 0,002 ppm à 0,063 ppm. Cependant, pour un type d’aliments donné, le nombre d’échantillons soumis à l’analyse était limité (c.-à-d. 4 à 44), et plus de 90 % des résultats analytiques étaient inférieurs à la limite de quantification.
L’absorption totale de cumène provenant des milieux environnementaux et des aliments a été estimée entre 0,10 et 0,31 μg/kg p.c./j, les enfants de 6 mois à 4 ans présentant le taux d’absorption le plus élevé (0,31 μg/kg p.c./j) (annexe A-1). Les estimations d’absorption par le régime alimentaire, calculées à partir des données du programme TDS de la FDA, sont jugées très prudentes. Même si cet ensemble de données contenait des données empiriques sur la présence de cumène dans les aliments, le cumène a été détecté dans un nombre limité d’aliments, et également dans un nombre limité d’échantillons d’un type d’aliments donné. De plus, le cumène a été présenté comme concentrations quantifiables dans quelques aliments de base. Par rapport à l’absorption potentielle par les aliments ou l’eau potable, l’exposition par inhalation, par l’air (surtout l’air intérieur) représente plus de 95 % de l’absorption totale, et elle est donc considérée comme la principale voie d’exposition.
L’Union européenne a publié une évaluation des risques posés par le cumène (ECB 2001), et a présenté des estimations de l’absorption totale par l’air, l’eau potable et les aliments, sur la base de concentrations modélisées dans chaque compartiment environnemental associé au rejet de cumène dans l’environnement. L’évaluation de l’ECB a également conclu que la source principale d’exposition humaine (représentant environ 97 % de l’absorption totale) est l’air, ce qui corrobore les résultats du présent rapport d’évaluation.
Produits disponibles aux consommateurs
Le cumène est présent dans divers produits disponibles aux consommateurs, y compris les adhésifs, les peintures et les revêtements (liquides ou pulvérisés), les nettoyants liés à l’automobile et les lubrifiants. Des scénarios d’exposition sentinelle ont été sélectionnés. Étant donné que le cumène est un composant volatil, l’inhalation et, dans une moindre mesure, le contact cutané, sont les principales voies d’exposition au cumène contenu dans les produits disponibles aux consommateurs.
Les expositions ont été modélisées à l’aide du logiciel ConsExpo version 4.1 (ConsExpo 2006) et ont été considérées comme une exposition aiguë ou à court terme. Les estimations prudentes sont résumées dans le tableau 3-3. Les paramètres détaillés des intrants pour chaque scénario d’exposition sentinelle sont présentés dans le tableau A-2 de l’annexe A.
| Catégorie de produit | Scénario d’exposition sentinelle | Concentration de cumène (poids %)a |
Inhalation, concentration moyenne le jour de l’exposition (mg/m3) |
Exposition par voie cutanée (mg/kg p.c./événement) |
|---|---|---|---|---|
| Adhésif | Agent d’étanchéité pour brides et filets | 1 | 0,96 | 0,21 |
| Peintures et revêtements | Peintures liquides (pinceaux et rouleaux) | 3 | 35 | 1,52 |
| Peintures et revêtements | Peinture en bombe aérosol | 1 | 0,55 | 0,21 |
| Peintures et revêtements | Peinture pour bricolage, bombe aérosol | 0,2 | 0,19 | 0,097 |
| Peintures et revêtements | Revêtement de carreaux | 5 | 0,0087 (préapplication); 11,8 (application) |
0,035 (préapplication); 1,27 |
| Produits liés à l’automobile | Nettoyant d’injecteur de carburant | 5 | 0,24 | 0,007 |
| Lubrifiants et graisses | Lubrifiant pour porte de garage, verrou, charnières, en bombe aérosol | 1 | 0,44 | 0,0024 |
a Basée sur les concentrations déclarées ou, dans les cas où il s’agissait d’une plage, on a utilisé la limite supérieure.
Évaluation des effets sur la santé
Les effets du cumène sur la santé ont été examinés par le Integrated Risk Information System (US EPA 1997) et évalués conjointement par des organisations internationales (WHO 1999) et le Centre commun de recherche de la Commission européenne (ECB 2001). Aucune donnée sur la cancérogénicité du cumène pour les animaux n’était disponible à l’époque où ces évaluations ont été réalisées. En 2009, le programme National Toxicology Program (NTP) a publié des études sur la cancérogénicité du cumène chez des animaux de laboratoire (NTP 2009). Sur la base de ces études, le Centre international de recherche sur le cancer (CIRC) (IARC 2012) a classé le cumène comme « agent peut être cancérogène pour l’homme » (groupe 2B), en raison de « preuves inadéquates chez les humains » et de « preuves suffisantes chez les animaux de laboratoire ». De plus, le programme NTP a jugé que le cumène est « une substance dont on peut raisonnablement présumer qu’elle est cancérogène pour les humains » d’après un nombre suffisant de données probantes de cancérogénicité obtenues dans des études sur des animaux de laboratoire (NTP 2012).
Une étude de deux ans sur le cancer par inhalation, réalisée chez des souris et des rats mâles et femelles, a démontré la cancérogénicité du cumène (NTP 2009). Dans cette étude, des groupes de souris B6C3F1 (50/sexe/groupe) ont été exposés au cumène à des concentrations de 0, 125 (femelles seulement), 250, 500 ou 1 000 ppm (mâles seulement) (0, 614, 1 229, 2 458, 4 916 mg/m3) à raison de 6 heures par jour, 5 jours par semaine, pendant 105 semaines. À la fin de l’étude, des nécropsies et des examens microscopiques complets ont été réalisés le jour suivant la dernière exposition. On a constaté que le nombre d’adénomes et de carcinomes bronchio-alvéolaires augmentait d’une manière dépendante de la dose chez les souris mâles et femelles, à partir de la plus faible dose de traitement (DMENO = 614 mg/m3). À la concentration de 2 458 mg/m3, le cumène présentait également une augmentation significative du nombre d’adénomes ou de carcinomes hépatocellulaires chez les souris femelles. Le développement des adénomes et carcinomes bronchio-alvéolaires chez les souris femelles a été établi comme critère d’effet critique et a été jugé pertinent pour les humains. Cette étude a été utilisée pour établir une dose de référence (DR) dans le présent rapport d’évaluation. Une DR pour un niveau de risque supplémentaire de 10 % (DR10) de 17,1 ppm, et la limite inférieure de confiance de la dose de référence (LICDR10) de 14,1 ppm (équivalente à 12,4 mg/m3 en exposition continue) ont été calculées à l’aide du modèle multi-échelle de cancer, lequel fait l’hypothèse d’une linéarité à faible dose (figure B-1 de l’annexe B).
Dans la même étude de deux ans sur l’exposition par inhalation (NTP 2009), des groupes de rats F344 (50/sexe/groupe) ont été exposés à de la vapeur de cumène en concentrations de 0, 250, 500 ou 1 000 ppm (0, 1 229, 2 458, 4 916 mg/m3) à raison de 6 heures par jour, 5 jours par semaine, pendant 105 semaines. Le traitement a entraîné une augmentation significative du nombre d’adénomes de l’épithélium nasal dans tous les groupes de doses chez les mâles, et seulement à la dose de 1 229 mg/m3 chez les femelles, ainsi que des tumeurs rénales (adénomes ou carcinomes des tubules rénaux) pour tous les groupes de doses chez les mâles. Les tumeurs rénales étaient associées à une protéine spécifique du rat, l’alpha 2u-globuline, qui n’est pas pertinente pour les humains (NTP 2012).
Sur la base des données disponibles, le cumène, en tant que produit chimique parent, est généralement considéré comme non génotoxique. Le cumène a donné des résultats négatifs dans la plupart des essais de génotoxicité in vitro et in vivo, y compris le test d’Ames (Florin et coll. 1980; NTP 2009, 2012), le test des micronoyaux (NTP 2012), le test d’aberration chromosomique (Putman DL 1987; Yang LL 1987), le test de synthèse d’ADN non programmée (Curren RD 1987), et le test de transformation cellulaire (NTP 2009). Cependant, même si le résultat du test des comètes avec le cumène était négatif dans les tissus ciblés (les reins et les poumons chez les rats mâles, et le foie chez les rats femelles), il y avait également des données probantes révélant des dommages à l’ADN induits par le cumène dans les cellules hépatiques des rats mâles et les cellules pulmonaires des souris femelles in vivo (NTP 2012).
Bien que le cumène ne soit pas considéré comme génotoxique, l’oxyde d’a-méthylstyrène, un métabolite du cumène, l’est. L’oxyde d’a-méthylstyrène s’est révélé mutagène chez Salmonella (Rosman et coll., 1986). Des études chez des animaux ont fourni des preuves suffisantes de cancérogénicité de l’a-méthylstyrène (NTP 2007). Une augmentation de la fréquence des mutations de K-ras et du gène Tp53 dans un cancer des poumons induit par le cumène a été observée (Hong et coll. 2008) et pourrait être attribuable à la conversion du cumène en son métabolite génotoxique. Par conséquent, comme l’a suggéré le CIRC (IARC 2012), un mécanisme mutationnel est probablement un mode d’action par lequel le cumène pourrait produire des tumeurs pulmonaires chez les rongeurs. Certaines organisations ont proposé un mode d’action non génotoxique (Bolt, 2016; Jahnke, 2016).
Les critères d’effet autres que le cancer, ont été examinés dans des études à doses répétées à la fois par voie orale et par inhalation. Dans une étude subchronique par voie orale (Wolf et coll. 1956), des rats Wistar femelles (20 dans le groupe témoin et 10 dans chacun des groupes traités) ont reçu du cumène par gavage à raison de 0, 154, 462 ou 769 mg/kg p.c./j à raison de 5 jours par semaine pendant 6 mois. Une augmentation dépendante de la dose du poids du rein a été observée chez les groupes traités à 462 et 769 mg/kg p.c./j (le poids relatif ou absolu n’a pas été indiqué dans l’étude). Aucune modification biochimique ou histopathologique associée au composé n’a été constatée à quelque dose que ce soit. En ajustant la dose continue, on a obtenu une DSENO et une DMENO de 110 mg/kg-j et de 330 mg/kg-j, respectivement.
Dans une étude de trois mois par inhalation (NTP 2009), des groupes de rats F344 et de souris B6C3F1 (10 mâles et 10 femelles) ont été exposés à de la vapeur de cumène à des concentrations de 0, 62,5, 125, 250, 500 ou 1 000 ppm (0, 307, 615, 1 229, 2 458, 4 916 mg/m3) à raison de 6 heures par jour, 5 jours par semaine, pendant 14 semaines. Les poids absolu et relatif des organes (reins et foie) ont augmenté d’une manière dépendante de la dose. On a observé également une augmentation biologiquement (supérieure à 10 %) et statistiquement (p inférieur(e) à 0,05) significative du poids absolu et relatif du foie à la dose de 1 229 mg/m3 ou plus chez les rats mâles (NTP 2009). De même, une augmentation relative et absolue du poids du foie a été observée chez les souris mâles et femelles exposées à du cumène à 2 458 mg/m3 ou plus. Les données de biochimie clinique ont montré que les concentrations d’acide biliaire total dans le sérum avaient augmenté de façon irréversible à 2 458 et 4 916 mg/m3 chez les mâles, ce qui permet de croire que les fonctions hépatiques ont été touchées par la perturbation dans l’absorption ou l’excrétion d’acide biliaire (NTP 2009). Un examen histopathologique complet (cœur, rein droit, foie, poumons, testicules et thymus) a été réalisé sur tous les animaux des groupes témoins (souris et rats) et chez les groupes traités à 2 458 mg/m3 (souris femelles seulement) et à 4 916 mg/m3 (souris et rats, mâles et femelles). Aucune lésion macroscopique liée à l’exposition ou modification histopathologique liée aux tumeurs dans les poumons ou d’autres organes n’ont été observées après 3 mois d’exposition. La CSENO et la CMENO ont été établies à 615 et 1 229 mg/m3, respectivement, sur la base d’une augmentation du poids du foie dans cette évaluation, et ont été utilisées pour la caractérisation des risques.
Dans une étude concernant le développement, un groupe de rats SD femelles a été exposé à du cumène à raison de 6 heures par jour pendant les jours de gestation (JG) 6 à 15 à des concentrations de 0, 100, 500 ou 1 200 ppm (0, 492, 2 458, 5 899 mg/m3). Les mères enceintes ont été sacrifiées et les petits ont été examinés au JG 21 (Bushy Run Research Center 1989). Aucun effet sur le développement n’a été observé dans aucun des groupes traités.
Dans une étude d’exposition aiguë par inhalation, des groupes de rats F344 (10/sexe/groupe) ont été exposés à du cumène à 100, 500 ou 1 200 ppm (492, 2 458, 5 899 mg/m3) pendant 6 heures (Cushman et coll. 1995). Une batterie d’observations fonctionnelles a été réalisée avant l’exposition aiguë et 1, 6 et 24 heures après l’exposition. Aucun effet irréversible n’a été observé dans cette étude, malgré une ataxie transitoire qui a été observée 1 heure après l’exposition. L’auteur a conclu que la vapeur de cumène n’était pas neurotoxique ni ototoxique chez les rats. Dans une étude d’exposition par voie cutanée, du cumène (quantité non indiquée) a été appliqué de façon régulière sur l’oreille et l’abdomen rasé de lapins (nombre d’animaux non indiqué) sur une période de 2 à 4 semaines (Wolf et coll. 1956). Une légère irritation cutanée et le développement transitoire de tissus minces dévitalisés ont été signalés. Cependant, aucun effet toxicologique systémique n’a été observé. Ces résultats sont corroborés par des données non publiées de Procter and Gamble (1985), qui indiquaient qu’aucun signe de toxicité systémique n’avait été observé chez les lapins sur le dos desquels on avait appliqué 500 mg/kg p.c./j de cumène à raison de 5 jours par semaine pendant 4 semaines.
Caractérisation des risques pour la santé humaine
Sur la base des études et des évaluations rapportées par plusieurs agences internationales et nationales (IARC 2012; NTP 2009, 2012, 2013), la cancérogénicité a été identifiée comme l’effet critique à utiliser pour caractériser les risques pour la santé humaine. L’effet cancérogène le plus sensible est le développement d’adénomes et de carcinomes bronchio-alvéolaires chez les souris femelles dans une étude de deux ans sur le cancer (NTP 2009). Sur la base de cet effet, une valeur LICDR10 a été établie (14,1 ppm; équivalant à 1,24 x 104 μg/m3 en exposition continue).
Les données disponibles suggèrent un mode d’action génotoxique possible pour le cancer du poumon induit par le cumène.
Le tableau 3-4 ci-dessous présente les expositions et les valeurs de risque pertinentes, ainsi que la marge d’exposition (ME) qui en résulte, pour la caractérisation des risques pour la santé humaine liée à l’exposition au cumène.
| Scénario d’exposition | Concentrations d’exposition | Niveau d’effet critique | Paramètre d’effet critique pour la santé | ME |
|---|---|---|---|---|
| Inhalation d’air intérieur | 0,239 μg/m3 (moyenne géométrique la plus élevée)a 0,564 μg/m3 (moyenne arithmétique la plus élevée)a |
LICDR10=1,24 x 104 μg/m3 | Cancérogénicité (nombre accru d’adénomes et de carcinomes bronchio-alvéolaires, selon une étude de deux ans par inhalation chez la souris) |
22 000 - 51 800 |
| Inhalation d’air intérieur | 0,239 μg/m3 (moyenne géométrique la plus élevée)a 0,564 μg/m3 (moyenne arithmétique la plus élevée) |
CSENO = 110 mg/m3 b | Augmentation du poids du foie | 190 000 - 460 000 |
| Apport total provenant des milieux naturels (air, nourriture et eau potable) | 0,31 μg/kg p.c./j c | DSENO = 110 mg/kg p.c./j | Augmentation du poids des reins | 355 000 |
Abréviation : ME = marge d’exposition.
a D’après les concentrations de cumène dans des échantillons prélevés dans 45 logements à Windsor (Santé Canada 2010a).
b La CSENO à 110 mg/m3 en exposition continue a été convertie à partir de la concentration de 125 ppm (615 mg/m3) pour une exposition à raison de 6 heures par jour pendant 5 jours par semaine.
c Voir le tableau A-1 de l’annexe; valeurs basées sur le groupe d’âge de 6 mois à 4 ans, qui est le plus exposé, selon les estimations.
Les ME ci-dessus sont jugées satisfaisantes pour tenir compte des incertitudes dans les bases de données sur les effets sur la santé et l’exposition.
Pour ce qui est des produits disponibles aux consommateurs (voir le tableau 3-3), les estimations les plus élevées de l’exposition à court terme, basées sur l’utilisation de produits de peinture liquides contenant une concentration maximale de 3 % de cumène, étaient de 35 mg/m3 pour l’inhalation (dans les 24 heures suivant l’application) et de 1,52 mg/kg p.c./événement pour l’exposition par voie cutanée. Les concentrations pertinentes des effets néfastes critiques n’ont pas été indiquées, en raison du faible degré de danger dû au cumène à la suite d’une exposition à court terme chez les animaux de laboratoire. En particulier, aucun effet néfaste critique n’a été observé chez les rats après une exposition aiguë par inhalation à de la vapeur de cumène à des concentrations atteignant 1 200 ppm (5 899 mg/m3) pendant 6 heures. On n’a pas observé de lésion macroscopique liée à l’exposition ou de modification histopathologique liée aux tumeurs dans une étude de trois mois par inhalation chez la souris et le rat (NTP 2009). Pour ce qui est de l’exposition par voie cutanée, aucun effet nocif sur la santé n’a été observé à la suite d’applications multiples de cumène sur le dos de lapins (500 mg/kg p.c./j) (Procter and Gamble 1985). Par conséquent, le risque que représente pour la santé de la population générale une exposition au cumène à court terme devrait être faible.
Même si l’exposition de la population générale au cumène n’est pas préoccupante aux niveaux actuels, on considère que cette substance a un effet préoccupant sur la santé en raison de sa cancérogénicité potentielle. Elle pourrait devenir préoccupante pour la santé humaine si l’exposition au cumène venait à augmenter.
Incertitudes de l’évaluation des risques pour la santé humaine
Bien que l’absence d’études de toxicité chronique et de cancérogénicité pour le cumène concernant l’exposition par les voies orale et cutanée constitue une incertitude, l’inhalation est la principale voie d’exposition.
4. 7,12-Diméthylbenzo[a]anthracène (DMBA)
4.1 Identité de la substance
Le DMBA est un hydrocarbure aromatique polycyclique (HAP). L’identité de la substance est décrite dans le tableau 4-1, y compris son numéro CAS, son nom dans la LIS et sa structure.
| No CAS | Nom dans la LIS (nom commun) |
Structure chimique et formule moléculaire | Masse moléculaire (Da) |
|---|---|---|---|
| 57-97-6 | 7,12-Diméthylbenzo[a]anthracène | 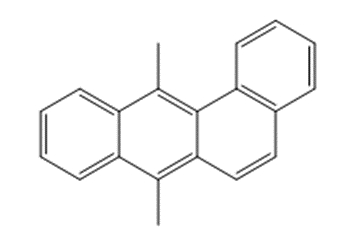 C20H16 C20H16 |
256 |
4.2 Propriétés physiques et chimiques
| Propriété | Valeur empirique | Référence(s) pour les valeurs empiriques | Valeur modélisée | Référence du modèle |
|---|---|---|---|---|
| État physique | poudre | (Sigma Aldrich 2016a) | s.o. | s.o. |
| Point de fusion (°C) |
123 | (Lide 2016) | 153,88 | (MPBPVP 2010) |
| Point d’ébullition (°C) |
s.o. | s.o. | 422,39 | (MPBPVP 2010) |
| Pression de vapeur (Pa) |
s.o. | s.o. | 3 x 10-5 | (MPBPVP 2010) |
| Constante de la loi d’Henry (Pa·m3/mol) |
s.o. | s.o. | 0,206 | (HENRYWIN 2010) |
| Solubilité dans l’eau (mg/L) |
0,061 | (Mackay et Shiu 1977, cité dans PhysProp 2006) | 0,019 | (WSKOWWIN 2010) |
| Log Koe (sans dimension) |
5,8 | (Hansch et coll, 1995, cité dans PhysProp 2006) | 6,62 | (KOWWIN 2010) |
D’autres propriétés physiques et chimiques sont présentées dans ECCC (2016b).
4.3 Sources et utilisations
Sur la base des renseignements disponibles, les quantités de DMBA fabriquées et importées au Canada sont limitées. Selon les informations soumises à la suite d’une enquête réalisée en vertu de l’article 71 de la LCPE, il n’y a eu aucune déclaration de fabrication ou d’importation de DMBA supérieure au seuil de déclaration de 100 kg en 2011Note de bas de page 5 . Aux États-Unis, il n’y a eu aucune déclaration de fabrication ou d’importation de DMBA supérieure au seuil de déclaration de 25 000 lb (11 340 kg) en 2011 en vertu du programme américain Chemical Data Reporting (US EPA 2012).
Le DMBA provient principalement d’activités anthropiques. Selon les renseignements soumis à une enquête réalisée en vertu de l’article 71 de la LCPE, le DMBA peut être produit involontairement au cours de procédés industriels sous forme de sous-produit (Environnement Canada 2013). Il peut être présent dans les produits contenant du noir de carbone (no CAS 1333-86-4) ou du noir au four. Selon l’évaluation du noir de carbone réalisée en vertu du Plan de gestion des produits chimiques (PGPC) (Environnement Canada, Santé Canada 2013), la présence des HAP (p. ex. le DMBA) sur les particules de noir de carbone n’est pas jugée pertinente en termes de cancérogénicité, en raison de sa biodisponibilité limitée. Plus précisément, on a observé peu ou pas d’élution d’HAP depuis la surface du noir de carbone par des fluides biologiques, et l’exposition au noir de carbone ne semble pas être le résultat de la formation d’adduits HAP-ADN (JECFA 1987; Borm et coll. 2005; OCDE 2006). Par conséquent, l’exposition potentielle au DMBA par l’utilisation du noir de carbone n’est pas traitée dans la suite de la présente évaluation.
Le DMBA est utilisé principalement comme agent chimique expérimental ou de recherche. Une recherche dans la littérature et la consultation des divers programmes de Santé Canada n’ont pas permis de relever d’utilisations liées à des produits de consommation.
4.4 Potentiel de causer des effets nocifs sur l’environnement
Les données et les considérations essentielles utilisées pour établir le profil propre du DMBA et les résultats de la classification sur le plan du danger, de l’exposition et des risques sont présentés dans le document d’ECCC (2016b).
D’après la CRE, le DMBA est peu dangereux et présente un potentiel faible d’exposition accrue. Cependant, des alertes sur la structure provenant de la boîte à outils de l’OCDE ont révélé que cette substance pourrait se lier à l’ADN. Les effets potentiels et la façon dont ils pourraient se manifester dans l’environnement n’ont pas été étudiés davantage, en raison de la faible exposition à cette substance. Compte tenu de son profil d’emploi actuel, il est peu probable que cette substance entraîne des préoccupations pour l’environnement au Canada.
4.5 Potentiel d’effets nocifs sur la santé humaine
Évaluation de l’exposition
Aucune utilisation liée aux produits de consommation n’a été relevée pour le DMBA.
Milieux environnementaux
Au Canada, on disposait d’études de surveillance du DMBA dans l’air ambiant en Alberta. Hsu et coll. (2015) ont signalé qu’en 2012-2013, des concentrations moyennes de DMBA de 0,19 à 0,30 ng/m3 avaient été détectées à quatre stations de surveillance de la qualité de l’air dans la région des sables bitumineux d’Athabasca, dans le nord-est de l’Alberta, au Canada. Les stations de surveillance se trouvaient dans des secteurs résidentiels ou commerciaux de trois collectivités d’environ 560, 61 300 et 580 habitants en 2011. Ces collectivités se trouvent entre 6 et 35 km du secteur des activités industrielles. L’échantillonnage a été réalisé 24 heures par jour, tous les 6 jours entre janvier 2012 et décembre 2013. En tout, quelque 120 échantillons ont été prélevés à chaque station de surveillance au cours de cette période. Les concentrations de DMBA aux mêmes stations de surveillance, décrites par Hsu et coll. (2015), ont également été déclarées sur une base annuelle par la Wood Buffalo Environmental Association (WBEA 2010–2014), avec des concentrations moyennes de 0,09 à 0,42 ng/m3. Plus récemment, Zielinska et coll. (2014) ont signalé des concentrations moyennes moindres de DMBA, soit 0,022 à 0,058 ng/m3, dans l’air ambiant de secteurs résidentiels adjacents à des sites de production de gaz naturel dans la zone de schiste de Barnett, aux États-Unis. L’entrepôt de données sur la qualité de l’air ambiant en Alberta contient des rapports faisant état de concentrations de DMBA de 0,3 ng/m3 pour la période de janvier 2010 à décembre 2015 (Alberta Government 2016). Étant donné le manque de données sur la surveillance du DMBA au Canada, nous avons sélectionné la concentration moyenne maximale de 0,3 ng/m3, rapportée par Hsu et coll. (2015), pour caractériser l’exposition chronique de la population générale au DMBA par l’air ambiant.
Selon les données de l’INRP pour 2011 à 2015, la présence du DMBA a été signalée dans des rejets atmosphériques à une quantité totale de 2 à 4 kg/année par quelques secteurs industriels, notamment les aciéries, les usines d’aluminium, l’extraction du pétrole et du gaz, les usines de pâtes et les usines de traitement de déchets (NPRI 2011–2015). La quantité rejetée de DMBA est au moins 1 000 fois plus faible que celle des autres rejets de HAP signalés dans le cadre de l’INRP. Selon les données de l’INRP (c.-à-d. environ 2 kg/année/site de DMBA sont rejetés dans l’air), les concentrations de DMBA dans l’air ambiant, prévues par un modèle prudent de dispersion atmosphérique, sont de l’ordre du ng/m3 à proximité d’une installation (100 à 3 000 m). Ces résultats modélisés sont comparables aux données de surveillance décrites ci-dessus.
Évaluation des effets sur la santé
Les effets du DMBA sur la santé n’ont pas été examinés ou évalués par aucun gouvernement. Le gouvernement du Canada a déjà réalisé une évaluation des risques pour la santé humaine que présentent certains HAP (benzo[a]pyrène, benzo[b]fluoranthène, benzo[j]fluoranthène, benzo[k]fluoranthène et indeno[1,2,3-cd]pyrène), dans le cadre du programme de la Liste des substances d’intérêt prioritaire (Environnement Canada, Santé Canada 1994). Les HAP ont été ajoutés à la Liste des substances toxiques figurant à l’annexe 1 de la Loi canadienne sur la protection de l’environnement. Les HAP ont également été classés comme substances cancérogènes par le CIRC (IARC 2010). Cependant, le DMBA n’était pas inclus dans cette classification.
On a signalé que le DMBA est un agent cancérogène puissant chez les animaux, causant l’induction de cancers dans de multiples systèmes par de nombreuses voies (Medina et coll. 1980; Currier et coll. 2005). Des groupes de 10 rats SD femelles ont reçu une dose unique de DMBA (0, 6,7, 16,7, 33,3, 66,7, 100 ou 133 mg/kg p.c.) dans de l’huile de sésame par gavage, et ont fait l’objet d’examens fréquents afin de détecter des tumeurs palpables pendant 150 jours (Huggins et coll. 1961a). Le nombre de tumeurs mammaires était de 1/10, 2/10, 5/10, 8/10, 10/10 et 10/10 après l’exposition à une dose unique de 6,7, 16,7, 33,3, 66,7, 100 et 133 mg/kg p.c. de DMBA, respectivement. La DMENO a été établie à 6,7 mg/kg p.c., la dose minimale d’essai. Les données indiquent que l’administration unique de DMBA peut avoir un fort effet d’induction de tumeurs mammaires chez les rates.
Plusieurs études à court terme et à doses répétées ont été réalisées afin d’établir la cancérogénicité du DMBA. Des souris ayant reçu 1,0 mg de DMBA par gavage chaque semaine pendant 6 semaines ont vu se développer des tumeurs mammaires à un taux d’incidence de 69 % (24 sur 35), par rapport à zéro (0 sur 43) chez des souris non traitées (Medina et coll. 1980). Dans une autre étude par Currier et coll. (2003), 20 souris FVB/N femelles vierges avaient reçu 1,0 mg de DMBA par gavage oral chaque semaine pendant 6 semaines. Vingt-trois semaines après la dose finale, une ou plusieurs tumeurs étaient apparues chez toutes les souris (75 % avaient des tumeurs mammaires, 15 % des tumeurs pulmonaires, 10 % des lymphomes et 5 % des tumeurs cutanées) (Currier et coll. 2003). Dans une étude d’exposition par voie cutanée, par Iversen (1991), une dose unique de 51,2 mg de DMBA avait induit un taux de tumeurs d’environ 40 %, et la même dose divisée en 50 doses quotidiennes de 1 mg avait induit un taux de tumeurs de presque 100 % (Iversen 1991).
Dans une étude de 14 mois sur le cancer à doses répétées par voie orale, par Chouroulinkov et coll. (1967), 144 souris femelles avaient reçu du DMBA par le régime alimentaire, dissous dans l’huile d’olive (15 μg de DMBA/j). Des tumeurs gastriques et mésentériques avaient été observées chez 41 (28,4 %) et 99 (68,7 %) des souris traitées avec le DMBA, respectivement. À titre de comparaison, aucune tumeur n’est apparue chez aucune des 117 souris ayant consommé les aliments sans DMBA (groupe témoin 1), et une seule tumeur mésentérique a été observée parmi les 158 souris ayant consommé le régime avec l’huile d’olive (groupe témoin 2). À partir de ces données, Collins et coll. (1998) ont établi un facteur de pente de cancer de 250 (mg/kg-j)-1 pour l’exposition au DMBA par voie orale.
Comme aucune étude sur le cancer attribuable au DMBA par inhalation n’a été relevée, on a procédé à l’extrapolation des doses de la voie orale à la voie par inhalation, sur la base d’une équivalence de puissance par rapport au benzo[a]pyrène (BaP). Cette approche est couramment utilisée pour l’évaluation des risques de cancer pour les HAP (Collins et coll. 1998; OEHHA 1994). On a estimé une concentration tumorigène, pour l’exposition au DMBA par inhalation associée à une augmentation de 5 % des cas de mortalité par tumeurs (CT05), en tenant compte de sa puissance relative par rapport au BaP, et de la CT05 établie pour l’exposition au BaP par inhalation. Collins et coll. (1988) ont déterminé que la puissance relative du DMBA par rapport au BaP était de 22. Cette valeur a été obtenue en comparant le facteur de puissance de cancer buccal de 250 (mg/kg-j)-1 pour le DMBA par rapport à un facteur de puissance de cancer buccal de 11,5 (mg/kg p.c./j)-1 pour le BaP, rapporté par Neal et Rigdoon (1967). La CT05 pour l’exposition au BaP par inhalation a été établie à 1,57 mg/m3 par Santé Canada (1994), sur la base d’une étude sur le cancer par Thyseen et coll. (1981), portant sur l’exposition au BaP par inhalation. Par conséquent, la CT05 estimée pour l’exposition au DMBA par inhalation a été établie à 0,071 mg/m3 (1,57 mg/m3 /22), en supposant que la puissance relative du DMBA par rapport au BaP par inhalation est la même que pour l’exposition par voie orale (c.-à-d. 22).
Les données disponibles indiquent que le DMBA est génotoxique. Un test d’Ames a été réalisé avec la souche TA100 de Salmonella typhimurium en présence de S9 isolé chez la souris, le rat, le hamster, le porc et l’humain. À l’exception des rats et des porcs, toutes les espèces animales avaient activé le DMBA en substance mutagène (Phillipson et Loannides 1989). Le DMBA avait induit l’échange des chromatides sœurs dans les lymphocytes de porcs femelles (McFee et Sherrill 1983) et les cellules de moelle osseuse chez des rats (van Kesteren-van Leeuwen et Natarajan 1980). Des adduits DMBA-ADN ont été constamment observés jusqu’à 42 semaines dans l’épiderme et le derme de souris qui avaient reçu une dose unique de 1,2 µmol de DMBA sur la peau rasée du dos (Randerath et coll. 1985). Une induction de la synthèse d’ADN non programmée, dépendante de la dose, a été observée chez des souris ayant reçu une application cutanée de DMBA, et ce, à toutes les doses appliquées (0, 0,24, 0,5 ou 1 %) (Mori et coll. 1999).
Pour les critères d’effet autres que le cancer, les études portant sur des rongeurs ayant reçu une dose unique de DMBA ont révélé que cette substance induisait des effets néfastes sur la glande surrénale chez les rats à 120 mg/kg p.c. par gavage (Huggins et coll. 1961b), sur les testicules à 8,6 mg/kg p.c. par injection intraveineuse (Ford et Huggins 1963), sur les ovaires chez les souris à 0,1 mg/kg p.c. par injection intrapéritonéale (Weitzman et coll. 1992) et dans la moelle osseuse chez les souris à 19 mg/kg p.c. par voie orale ou par injection intrapéritonéale (N’jai et coll. 2010). Dans une étude de deux semaines avec doses répétées, des souris B6CF31 (4 par groupe) ont reçu du DMBA chaque jour par gavage à raison de 0,1, 1,0 et 10 mg/kg p.c./j pendant 14 jours. Sur la base de l’inhibition de l’activation des lymphocytes, la DMENO a été établie à 0,1 mg/kg p.c./j, soit la dose minimale d’essai (Burchiel et coll. 1990).
Dans une étude sur le développement (Sanyal et coll. 2007) de rats traités par voie intrapéritonéale avec du DMBA, on a montré que cette substance est toxique pour les tissus placentaires et pour la différenciation du système sanguin fœtal, et donnait lieu à une restriction significative de la croissance fœtale.
La clairance du DMBA chez les souris a été examinée après l’administration d’une dose unique par gavage oral (N’jai et coll. 2010). L’étude a montré que les concentrations de DMBA dans le sang atteignaient un sommet entre 1,5 et 3 heures après l’administration par voie orale, puis diminuaient considérablement après 6 heures et n’étaient plus détectables après 24 heures. Il y a un manque d’études pharmacocinétiques sur l’inhalation du DMBA.
Caractérisation des risques pour la santé humaine
Sur la base des renseignements actuellement disponibles, l’exposition de la population générale canadienne au DMBA devrait être limitée à des concentrations de l’ordre du ng/m3 dans l’air ambiant. Dans les renseignements soumis à la suite d’une enquête réalisée en vertu de l’article 71 de la LCPE, il n’y avait eu aucune déclaration de fabrication ou d’importation de DMBA supérieure au seuil de déclaration de 100 kg en 2011. On n’a pas signalé la présence de DMBA dans les produits de consommation.
Le DMBA est un cancérogène puissant, d’après les études sur les animaux. La comparaison de la concentration moyenne de DMBA (c.-à-d. 0,3 ng/m3) dans l’air ambiant, rapportée par Hsu et coll. (2015), et les estimations de la CT05 de 0,071 mg/m3 de DMBA donne une marge d’exposition (ME) de 2,4 x 105. Étant donné la faible quantité totale de DMBA rejetée dans l’air, c’est-à-dire de 2 à 4 kg/année (NPRI 2011-2015), de sa faible volatilité et de sa solubilité dans l’eau, il est peu probable que la ME réelle soit supérieure à ce qu’indiquent les données sur l’exposition par inhalation. La ME dérivée pour l’exposition par inhalation est donc jugée suffisante pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
Bien que l’exposition de la population générale au DMBA ne soit pas préoccupante aux niveaux actuels, on considère que cette substance a des effets préoccupants sur la santé, en raison de sa cancérogénicité potentielle. Elle pourrait devenir préoccupante pour la santé humaine si l’exposition au DMBA venait à augmenter.
Incertitudes de l’évaluation des risques pour la santé humaine
Il subsiste une incertitude au sujet de la représentativité des données de surveillance obtenues en Alberta pour ce qui est de la population générale du Canada. Néanmoins, ces données de surveillance correspondent aux résultats prudents obtenus par modélisation, basés sur les renseignements sur les rejets dans l’INRP.
Pour ce qui est de la base de données sur les effets sur la santé, il subsiste une incertitude relative au manque d’information exhaustive sur les effets potentiels sur la santé dus à l’exposition au DMBA par inhalation, car les études sur le cancer ont été réalisées avec d’autres voies orale, cutanée ou injection sous-cutanée.
5. Conclusions
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation préalable, le cumène et le DMBA présentent un faible risque d’effets nocifs pour l’environnement. Il est proposé de conclure que le cumène et le DMBA ne répondent pas aux critères énoncés à l’alinéa 64(a) ou (b) de la Loi canadienne sur la protection de l’environnement (1999), car ils ne pénètrent pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ni à mettre en danger l’environnement essentiel pour la vie.
À la lumière des renseignements présentés dans la présente évaluation préalable, il a été conclu que le cumène et le DMBA ne satisfont à aucun des critères de l’alinéa 64(c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger pour la santé ou la vie humaine au Canada.
Par conséquent, il a été conclu que le cumène et le DMBA ne répondent à aucun des critères énoncés à l’article 64 de la LCPE.
Références
Alberta Government. 2016. Alberta's ambient air quality data warehouse. [base de données dans Internet]. Data reports [consulté : octobre 2016]. [En anglais seulement]
[BDIPSN] Base de données d’ingrédients de produits de santé naturels [base de données]. [Modifiée le 10 janvier 2017]. Ottawa (Ont.), gouvernement du Canada. [Consultée le 24 janvier 2018].
[BDPSNH] Base de données des produits de santé naturels homologués. [base de données] [modifiée le 10 août 2016] Ottawa (Ont.), gouvernement du Canada. [Consultée le 24 janvier 2018].
Bolt HM, Nielsen GD, Papameletiou C, Klein CL. 2016. 2-Phenylpropane (Cumene): Recommendation from the Scientific Committee on Occupational Exposure Limits (SCOEL/REC/029). [En anglais seulement]
Borm P, Cakmak G, Jermann E, Weishaupt C, Kempers P, van Schooten FJ, Oberdörster G, Schins RP. 2005. Formation of PAH-DNA adducts after in vivo and in vitro exposure of rats and lung cells to different commercial carbon blacks. Toxicol Appl. Pharmacol. 205:157–167. [En anglais seulement]
Brugnone F, Perbellini L, Faccini GB, Pasini F, Maranelli G, Romeo L, Gobbi M, Zedde A. 1989. Breath and blood levels of benzene, toluene, cumene and styrene in non-occupational exposure. Int. Arch. Occup. Environ. Health. 61: 303-311. [En anglais seulement]
Burchiel SW, Davis DA, Gomez MP, Montano RM, Barton SL, Seamer LC 1990. Inhibition of lymphocyte activation in splenic and gut-associated lymphoid tissues following oral exposure of mice to 7, 12-dimethylbenz[a]anthracene. Toxicol. Appl. Pharmacol. 105, 434-442. [En anglais seulement]
Bushy Run Research Center. 1989. Developmental toxicity study of inhaled cumene vapor in CD (Sprague-Dawley) rats. Final project report 52-621. TSCATS/0522881;EPA/OTS Doc. No. 40-8992172. [En anglais seulement]
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L.C. 1999, ch. 33. Gazette du Canada, Partie III, vol. 22, no 3.
Chouroulinkov, I., Gentil, A., and Guerin, M. (1967). Study of the carcinogenic action of orally administered 9, 10-dimethylbenzanthracene and 3,4-benzopyrene. Bull. Cancer 54, 67-78. [En anglais seulement]
City of Regina. 2008-2013. Buffalo Pound water administration board annual reports [En anglais seulement]
City of Toronto, 2003-2012. Annual drinking water quality analysis summary [En anglais seulement]
Collins, J.F., Brown, J.P., Alexeeff, G.V., and Salmon, A.G. (1998). Potency equivalency factors for some polycyclic aromatic hydrocarbons and polycyclic aromatic hydrocarbon derivatives. Regul. Toxicol. Pharmacol. 28, 45-54. [En anglais seulement]
Conkle JP, Camp BJ, Welch BE. 1975. Trace composition of human respiratory gas. Arch. Environ. Health 30: 290-295. [Cité dans ECB 2001] [En anglais seulement]
[ConsExpo] Consumer Exposure Model. 2006. Version 4.1. Bilthoven (NL): Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment]. [cité le 22 juillet 2016] [En anglais seulement]
Currier N, Solomon SE, Demicco EG, Chang DL, Farago M, Ying H, Dominguez I, Sonenshein GE, Cardiff RD, Xiao ZX, Sherr DH, Seldin DC. 2005. Oncogenic signaling pathways activated in DMBA-induced mouse mammary tumors. Toxicol. Pathol. 33, 726-737. [En anglais seulement]
Cushman JR, Norris JC, Dodd DE, Darmer KI, Morris CR. 1995. Subchronic Inhalation Toxicity and Neurotoxicity Assessment of Cumene in Fischer 344 Rats. Journal of the American College of Toxicology 14, 129-147. [En anglais seulement]
[ECB] European Chemicals Bureau. 2001. European Union Risk assessment report: Cumene. [En anglais seulement]
[ECCC] Environnement et Changement climatique Canada. 2016a. Documents sur l’approche scientifique : Classification du risque écologique des substances organiques. Ottawa (Ont.) : gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016b. Data used to create substance-specific hazard and exposure profiles and assign risk classifications in the Ecological Risk Classification of organic substances. Gatineau (Qc). Disponible sur demande : substances@ec.gc.ca.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. [modifié le 12 mars 2017]. Catégorisation. Ottawa (Ont.), gouvernement du Canada. [consulté le 20 décembre 2017].
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2017a. Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée Ottawa (Ont.) : gouvernement du Canada
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2017b. Ébauche d’évaluation préalable – Substances jugées comme étant peu préoccupantes au moyen de l’approche de la Classification du risque écologique des substances organiques et de l’approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances.
[EMA] European Medicines Agency. 2015. ICH guideline Q3C (R5) on impurities: Guideline for residual solvents. (disponible en anglais seulement)
Environnement Canada. 2013. Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu du de l’article 71 de la Loi canadienne sur la protection de l’environnement de 1999 : Avis modifiant l’Avis concernant certaines substances de la Liste intérieure. Données préparées par Environnement Canada et Santé Canada, Programme des substances existantes.
Environnement Canada, Santé Canada. 2013. Évaluation préalable pour le Défi concernant le noir de carbone. Ottawa (Ont.), Environnement Canada; Santé Canada. [cité en juillet 2016].
[ESIS] European Chemical Substances Information System [base de données accessible par Internet]. 2008. Base de données élaborée par l’European Chemicals Bureau (ECB). [Cité le 29 août 2011]. (disponible en anglais seulement)
[EWG] Environmental Working Group. National drinking water database on isopropylbenzene. [Consulté le 21 juillet 2016]. (disponible en anglais seulement)
[FDA] Food and Drug Administration. 2006. Total diet study market baskets 1991-3 through 2003-4. [En anglais seulement]
Florin I, Rutberg L, Curvall M, Enzell CR. 1980. Screening of Tobacco Smoke Constituents for Mutagenicity using the Ames' Test. Toxicology 15, 219-232. [En anglais seulement]
Ford E, Huggins C. 1963. Selective destruction in testis induced by 7, 12-dimethylbenz [a] anthracene. J. Exp. Med. 118, 27-40. [En anglais seulement]
[HENRYWIN] Henry's Law Constant Program for Microsoft Windows [estimation model]. 2008. Ver. 3.20. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. [En anglais seulement]
Hiatt MH, Pia JH. 2004. Screening processed milk for volatile organic compounds using vacuum distillation/gas chromatography/mass spectrometry. Arch. Environ. Contam. Toxicol. 46, 189-196. [En anglais seulement]
Hong HH, Ton TV, Kim Y, Wakamatsu N, Clayton NP, Chan PC, Sills RC, Lahousse SA. 2008. Genetic alterations in K-ras and p53 cancer genes in lung neoplasms from B6C3F1 mice exposed to cumene. Toxicol. Pathol. 36, 720-726. [En anglais seulement]
Hsu Y, Harner T, Li H, Fellin P. 2015. PAH measurements in Air in the Athabasca Oil Sands Region. Environ. Sci. Tech. 49: 5584-5592. [En anglais seulement]
Huggins C, Grand LC, Brillantes FP. 1961a. Mammary cancer induced by a single feeding of polymucular hydrocarbons, and its suppression. Nature 189, 204-207. [En anglais seulement]
Huggins C, Morii S. 1961b. Selective adrenal necrosis and apoplexy induced by 7, 12-dimethylbenz(a)anthracene. J. Exp. Med. 114, 741-760. [En anglais seulement]
Huggins CB, Yoshida H, Bird CC. 1974. Hormone-dependent stem-cell rat leukemia evoked by a series of feedings of 7, 12-dimethylbenz(a)anthracene. J. Natl. Cancer Inst. 52, 1301-1305. [En anglais seulement]
[IARC] International Agency for Research on Cancer. 2010. Some non-heterocyclic polycyclic aromatic hydrocarbons and some related exposures. IARC Monogr. Eval. Carcinog. Risks Hum. 92, 1-853(disponible en anglais seulement)
[IARC] International Agency for Research on Cancer. 2012. Cumene. In Some Chemicals in Industrial and Consumer Products, Food Contaminants and Flavourings, and Water Chlorination By-Products. IARC Monographs on the Evaluation of Carcinogenic Risk to Humans 101. (disponible en anglais seulement)
[IARC] International Agency for Research on Cancer. 2013. Cumene. In: Some chemicals present in industrial and consumer products, food and drinking-water. [PDF, 6.49 Mo] IARC Monogr Eval Carcinog Risks Hum. 101. p. 325-348. [En anglais seulement]
[INRP] Inventaire national des rejets de polluants [base de données dans Internet]. 2011-2015. Gatineau (Québec), Environnement et Changement climatique Canada. [consulté en octobre 2016].
Iversen OH. 1991. The skin tumorigenic and carcinogenic effects of different doses, numbers of dose fractions and concentrations of 7, 12-dimethylbenz[a]anthracene in acetone applied on hairless mouse epidermis. Possible implications for human carcinogenesis. Carcinogenesis 12, 493-502. (disponible en anglais seulement)
Jahnke G, Hamann I, Laube B, Greim H, Hartwig A, Commission MAK 2016. Isopropyl benzene (cumene) [MAK Value Documentations, 2013]. In The MAK-Collection for Occupational Health and Safety. Wiley-VCH Verlag GmbH & Co. KGaA [En anglais seulement]
[JECFA] Comité mixte FAO/OMS d’experts des additifs alimentaires. 1987. Évaluation de certains additifs alimentaires et contaminants. Organisation mondiale de la Santé, Série de Rapports techniques 759. Genève (Suisse), Organisation mondiale de la Santé.
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [estimation model]. 2010. Ver. 1.68. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. [En anglais seulement]
Krotoszynski B, Gabriel G. O’Neill H. 1977. Characterisation of human expired air: a promising investigative and diagnostic technique. J. Chrom. Sci. 15: 239-244. [En anglais seulement]
Lide DR, editor. 2016. CRC handbook of chemistry and physics. 96thed. Boca Raton (FL): CRC Press. [Consulté le 3 juin 2016] [En anglais seulement]
Lillie MA, Ambrus CM, Pickren JW, Akhter S, Islam A, Ambrus JL. 2004. Breast cancer in intraductal carcinogen-treated non-human primates. J. Med. 35, 271-275. [En anglais seulement]
McFee AF, Sherrill MN. 1983. Sister-chromatid exchanges induced in swine lymphocytes by chronic oral doses of dimethylbenzanthracene. Mutat. Res. 116, 349-359. [En anglais seulement]
Medina D, Butel JS, Socher SH, Miller FL. 1980. Mammary tumorigenesis in 7, 12-dimethybenzanthracene-treated C57BL x DBA/2f F1 mice. Cancer Res. 40, 368-373. [En anglais seulement]
Mori M, Kobayashi H, Sugiyama C, Katsumura Y, Furihata C. 1999. Induction of unscheduled DNA synthesis in hairless mouse epidermis by skin carcinogens. J. Toxicol. Sci. 24, 217-226. [En anglais seulement]
[MPBPVP] Melting Point Boiling Point Program for Microsoft Windows [estimation model]. 2010. Ver. 1.43. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation [En anglais seulement]
[NCI] National Chemical Inventories. Issue 1. Columbus (OH): American Chemical Society, Chemical Abstracts Service. [Consulté en juillet 2016]. [En anglais seulement]
Neal, J., et Rigdon, R.H. (1967). Gastric tumors in mice fed benzo(a)pyrene: a quantitative study. Tex. Rep. Biol. Med. 25, 553-557. [En anglais seulement]
N’jai AU, Larsen M, Shi L, Jefcoate CR Czuprynski CJ. 2010. Bone marrow lymphoid and myeloid progenitor cells are suppressed in 7, 12-dimethylbenz(a)anthracene (DMBA) treated mice. Toxicology 271, 27-35. [En anglais seulement]
[NTP] National Toxicology Program. 2009. Toxicology and carcinogenesis studies of cumene (CAS No. 98-82-8) in F344/N rats and B6C3F1 mice (inhalation studies). Natl. Toxicol. Program. Tech. Rep. Ser. (542), 1-200. [En anglais seulement]
[NTP] National Toxicology Program. 2007. Toxicology and carcinogenesis studies of alpha-methylstyrene (Cas No. 98-83-9) in F344/N rats and B6C3F1 mice (inhalation studies). Natl. Toxicol. Program. Tech. Rep. Ser. (543), 1-210. [En anglais seulement]
[NTP] National Toxicology Program. 2012. Final Report on the Cumene (CASRN 98-82-8) Genotoxicity Studies. Research Triangle Park, NC: National Toxicology Program. [En anglais seulement]
[NTP] National Toxicology Program. 2013. Report on carcinogens monograph on cumene. Rep. Carcinog. Monogr. (13-5983), 1-166. [En anglais seulement]
[OECD] Organisation for Economic Co-operation and Development. 2006. Carbon black, CAS 1333-86-4; SIDS initial assessment report for carbon black; CAS No. 1333-86-4. SIDS initial assessment meeting 21, Washington (DC), 18–21 October 2005 (includes SIDS Initial Assessment Profile, SIDS Initial Assessment Report, and IUCLID Data Set) [Internet]. Geneva (CH): United Nations Environment Programme. [Dernière mise à jour le 6 juin 2006]. [En anglais seulement]
[OEHHA] California Air Resrouces Board and the Office of Enviormental Health Hazard-Assessment. 1994. Benzo[a]pyrene as a toxic air contaminant. Executive summary. [En anglais seulement]
Phillipson CE, Loannides C. 1989. Metabolic activation of polycyclic aromatic hydrocarbons to mutagens in the Ames test by various animal species including man. Mutat. Res. 211, 147-151. [En anglais seulement]
[PhysProp] Interactive PhysProp Database [base de données]. c2013. Syracuse (NY): SRC, Inc. [Consulté le 3 juin 2016]. (disponible en anglais seulement)
Power Service. 2014. Material Safety Data Sheet for Diesel fuel supplement+ cetane boost. [En anglais seulement]
Prestone. 2013. Safety Data Sheet Prestone® Fuel System Cleaner. (disponible en anglais seulement)
Procter & Gamble Company. (1985) 28-day subacute percutaneous toxicity with cover letter. OTS 0206749, Doc ID 878215029 [En anglais seulement]
Putman DL. 1987. Chromosome Aberrations in Chinese Hamster Ovary (CHO) Cells. NTIS/OTS 0522852. Microbiological Associates, Inc. (cité dans EC 2001). [En anglais seulement]
Randerath E, Agrawal HP, Weaver JA, Bordelon CB, Randerath K. 1985. 32P-postlabeling analysis of DNA adducts persisting for up to 42 weeks in the skin, epidermis and dermis of mice treated topically with 7, 12-dimethylbenz[a]anthracene. Carcinogenesis 6, 1117-1126. [En anglais seulement]
[RNSPA] Réseau national de surveillance de la pollution atmosphérique. 2016. RNSPA – données annuelles brutes pour 2010, 2011, 2012, 2013. Ottawa (Ont.), Environnement et Changement climatique Canada. [Consulté en juillet 2016].
Rosman LB, Beylin VG, Gaddamidi V, Hooberman BH, Sinsheimer JE. 1986. Mutagenicity of para-substituted alpha-methylstyrene oxide derivatives with Salmonella. Mutat. Res. 171, 63-70. [En anglais seulement]
Santé Canada. 1994. Hydrocarbures aromatiques polycycliques : Loi canadienne sur la protection de l’environnement, Liste des substances d’intérêt prioritaire : rapport d’évaluation. Environnement Canada et Santé Canada: Ottawa (Ont.)
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Environmental Health Directorate, Health Canada: Ottawa (ON). [En anglais seulement]
Santé Canada. 2009. Recommandations pour la qualité de l’eau potable au Canada : document technique : benzène, Santé Canada, Ottawa.
Santé Canada. 2010a. Étude d’évaluation de l’exposition à Windsor (2005-2006) : sommaire des données d’échantillonnage des composés organiques volatiles. Bureau de l’eau, de l’air et du changement climatique, Direction générale de la santé environnementale et de la sécurité des consommateurs. Ottawa (Ont.), Health Draft Screening Assessment Liquefied Petroleum Gases 53 Canada. 84 p. [cité en février 2014]
Santé Canada. 2010b. Étude de la qualité de l’air intérieur à Regina (2007) [PDF, 1.87 Mo] : sommaire des données d’échantillonnage des composés organiques volatiles. Bureau de l’eau, de l’air et du changement climatique, Direction générale de la santé environnementale et de la sécurité des consommateurs. Ottawa (Ont.), Santé Canada. 163 p. [cité en février 2014]
Santé Canada. 2012. Étude de la qualité de l’air intérieur à Halifax (2009) : sommaire des données d’échantillonnage des composés organiques volatiles. Bureau de l’eau, de l’air et du changement climatique, Direction générale de la santé environnementale et de la sécurité des consommateurs. Ottawa (Ont.), Santé Canada. 48 p.
Santé Canada 2013a. Étude sur la qualité de l’air intérieur à Edmonton (2010) : sommaire des données des composés organiques volatiles (COV) (rapport provisoire. Ottawa (Ont.), Santé Canada, Bureau de la qualité de l’eau et de l’air, Direction générale de la santé environnementale et de la sécurité des consommateurs. (En préparation).
Santé Canada. 2013b. Document de conseils sur le benzène dans l’air intérieur résidentiel, Santé Canada, Ottawa.
Santé Canada. 2016a. Document d’évaluation scientifique : Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances. Septembre 2016. 59 p.
Santé Canada. 2016b. Ligne directrice : Impuretés : directive sur les solvants résiduels ICH thème Q3C(R5). [cité en 2017].
Sanyal, M.K., and Li, Y.L. (2007). Deleterious effects of polynuclear aromatic hydrocarbon on blood vascular system of the rat fetus. Birth Defects Res. B. Dev. Reprod. Toxicol. 80, 367-373. [En anglais seulement] [En anglais seulement]
Schneider K, Roller M, Kalberlah F, Schuhmacher-Wolz U. 2002. Cancer risk assessment for oral exposure to PAH mixtures. J. Appl. Toxicol. 22, 73-83. [En anglais seulement]
[SCREEN3] Screening Tool Program for Windows [Screening Model]. 1996. Version 4.10. Research Triangle Park (NC): US Environmental Protection Agency, Office of Air Quality Planning and Standards Emissions, Monitoring, and Analysis Division. [En anglais seulement]
Shiraishi H. Pilkington NH, Otsukl A. Fuwa K. 1985. Occurrence of chlorinated polynuclear aromatic hydrocarbons in tap water. Environ. Sci. Technol. 19(7): 585-590. [En anglais seulement]
Thyssen, J., Althoff, J., Kimmerle, G., and Mohr, U. (1981). Inhalation studies with benzo[a]pyrene in Syrian golden hamsters. J. Natl. Cancer Inst. 66, 575-577. [En anglais seulement]
[UGL] United Gilsonite Laboratories. 2005. Material Safety Data Sheet for Concrete Cleaner and Degreaser. [En anglais seulement]
[US EPA] U.S. Environmental Protection Agency. 1997. Toxicological Review of Cumene (CAS No. 98-82-8). In Support of Summary Information on the Integrated Risk Information System. Washington, D.C.: U.S. Environmental Protection Agency. [En anglais seulement]
[US EPA] U.S. Environmental Protection Agency. 2011. Exposure factors handbook. Chapter 17. (dispnible en anglais seulement)
[US EPA] U.S. Environmental Protection Agency. 2012 Chemical Data Reporting Results. [Consulté en avril 2013] [En anglais seulement]
[USP] United States Pharmacopoeia. 2016. The United States Pharmacopeia and the National Formulary, published by United States Pharmacopoeial Convention. [En anglais seulement]
van Kesteren-van Leeuwen, AC, Natarajan AT. 1980. Localisation of 7-12-dimethylbenz(a)anthracene induced chromatid breaks and sister chromatid exchanges in chromosomes 1 and 2 of bone marrow cells of rat in vivo. Chromosoma 81, 473-481. [En anglais seulement]
Ville de Montréal. 2000-2009. Rapports annuels sur la qualité de l’eau potable à Montréal. [En anglais seulement]
[WEBA] Wood Buffalo Environmental Association. Annual reports. 2010-2014. [En anglais seulement]
Weitzman GA, Miller MM, London SN, Mattison DR. (1992). Morphometric assessment of the murine ovarian toxicity of 7, 12-dimethylbenz(a)anthracene. Reprod Toxicol. 1992; 6(2):137-41. [En anglais seulement]
[WHO] World Health Organization. 1999. Concise international chemical assessment document 18: Cumene. [En anglais seulement]
Wolf MA, Rowe VK, Mccollister DD, Hollingsworth RL, Oyen F.. 1956. Toxicological studies of certain alkylated benzenes and benzene; experiments on laboratory animals. AMA Arch. Ind. Health. 14, 387-398. [En anglais seulement]
[WSKOWWIN] Water Solubility for Organic Compounds Program for Microsoft Windows [estimation model]. 2010. Ver. 1.42. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. [En anglais seulement]
Yang LL. 1987. CHO/HGPRT Mutation Assay. NTIS/OTS 0522853. Microbiological Associates, Inc. [En anglais seulement]
Zhu J, Wong SL, Cakmak S. 2013. Nationally representative level of selected volatile organic compounds in Canadian residential indoor air: population-based survey. Environ. Sci. Tech. 47: 13276-13283. [En anglais seulement]
Zielinska B, Campbell D, Samburova V. 2014. Impact of emission from natural gas production facilities on ambient air quality in the Barnett Shale area: a pilot study. J. Air & Waste Manage. 64: 1369-1383. [En anglais seulement]
Annexes
Annexe A. Estimations de l’exposition de la population générale au cumène
| Milieux environnementaux | 0-0,5 ana | 0,5 à 4 ansb | 5 à 11 ansc | 12 à 19 ansd | 20 à 59 anse | 60 ans et plusf |
|---|---|---|---|---|---|---|
| Air ambiant (μg/m3)g |
0,02 | 0,02 | 0,02 | 0,02 | 0,02 | 0,02 |
| Air intérieur (μg/m3)g |
0,564 | 0,564 | 0,564 | 0,564 | 0,564 | 0,564 |
| Absorption d’eau potable (μg/kg p.c./j)h |
0,0032 (avec PN), 0,0012 (sans PN) |
0,0014 | 0,0011 | 6,06 x 10-4 | 6,35 x 10-4 | 6,67 x 10-4 |
| Absorption totale d’aliments (μg/kg p.c./j)i |
0,0057 | 0,0105 | 0,0087 | 0,0055 | 0,0032 | 0,0027 |
| Absorption totale par voie orale (eau potable et aliments) (μg/kg p.c./j) |
0,0032 (avec PN), 0,0069 (sans PN) |
0,012 | 0,0098 | 0,0061 | 0,0039 | 0,0034 |
| Absorption totale (air, eau potable et aliments) (μg/kg p.c./j) |
0,14 | 0,31 | 0,24 | 0,14 | 0,12 | 0,10 |
Abréviations : PN = Préparation pour nourrissons.
a Poids présumé : 7,5 kg; volume respiré : 2,1 m3/j. On présume que les nourrissons alimentés par préparation consomment exclusivement 0,8 L/j de préparation liquide pour nourrissons reconstituée avec de l’eau potable. Pour ce qui est des nourrissons ne consommant pas de préparation, on présume qu’ils consomment 0,3 L/j d’eau potable.
b Poids présumé : 15,5 kg; volume respiré : 9,3 m3/j; consommation d’eau potable : 0,7 L/j.
c Poids présumé : 31,0 kg; volume respiré : 14,5 m3/j; consommation d’eau potable : 1,1 L/j.
d Poids présumé : 59,4 kg; volume respiré : 15,8 m3/j; consommation d’eau potable : 1,2 L/j.
e Poids présumé : 70,9 kg; volume respiré : 16,2 m3/j; consommation d’eau potable : 1,5 L/j.
f Poids présumé : 72,0 kg; volume respiré : 14,3 m3/j; consommation d’eau potable : 1,6 L/j.
g Pour calculer la dose inhalée, on présume que l’air intérieur est inhalé pendant 21 heures à 0,564 μg/m3 et que l’air extérieur est inhalé pendant 3 heures à 0,02 μg/m3, et on multiplie ces valeurs par le taux d’inhalation et on divise par le poids corporel pour chaque groupe d’âge, comme l’indique Santé Canada (1998).
h La valeur d’absorption quotidienne de cumène par l’eau potable a été déterminée en multipliant la concentration de 0,03 μg/L par la valeur du taux de consommation quotidienne d’eau, publiée par Santé Canada (1998).
i Les estimations maximales d’absorption quotidienne de cumène ont été calculées à partir des concentrations moyennes publiées dans l’ensemble de données du programme TDS de la FDA (2006) pour 36 aliments, et multipliées par les valeurs correspondantes de consommation de ces aliments, d’après l’Enquête Nutrition au Canada 1970-1972, comme l’indique Santé Canada (1998). Les estimations maximales d’absorption ont ensuite été calculées par agrégation des estimations de l’absorption pour tous ces 36 aliments.
| Scénario pour le produit | Paramètres du modèle | Exposition estimée |
|---|---|---|
| Agent d’étanchéité pour bride/filet, basé sur le scénario d’étanchéification des joints décrit dans ConsExpo (2006) | Fréquence d’utilisation : 8,9/année (US EPA 2011) Durée de l’exposition : 45 min Durée de l’application : 30 min Quantité de produit : 75 g Fraction en poids : 0,01 Module d’inhalation : évaporation depuis une superficie croissante Taux de transfert massique : méthode de Langmuir Matrice de masse moléculaire : 3 000 g/mol Volume de la pièce : 10 m3 Ventilation : 2 renouvellements d’air/h Superficie de rejet : 250 cm2 Taux de contact : 50 mg/min Fraction d’absorption : 1 |
Inhalation : Concentration moyenne pour l’événement : 30,6 mg/m3 Concentration moyenne le jour de l’événement : 0,956 mg/m3 Voie cutanée : Aiguë, par événement : 0,212 mg/kg p.c. |
| Peinture (liquide), valeur basée sur le scénario d’une utilisation d’une peinture riche en solvant, avec pinceaux/rouleaux, décrit dans ConsExpo (2006) | Fréquence d’utilisation : 1/an Durée de l’exposition : 132 min Durée de l’application : 120 min Quantité de produit : 1 000 g Fraction en poids : 0,03 Module d’inhalation : évaporation depuis une superficie croissante Taux de transfert massique : méthode de Langmuir Matrice de masse moléculaire : 300 g/mol Volume de la pièce : 20 m3 Taux de renouvellement d’air : 0,6/h Superficie de rejet : 10 m2 Taux de contact : 30 mg/min Fraction d’absorption : 1 |
Inhalation : Concentration moyenne pour l’événement : 382 mg/m3 Concentration moyenne le jour de l’événement : 35 mg/m3 Voie cutanée : Aiguë, par événement : 1,52 mg/kg p.c. |
| Peinture en bombe aérosol, valeur basée sur le scénario de peinture avec bombe en aérosol décrit dans ConsExpo (2006) | Fréquence d’utilisation : 2/an Durée de l’exposition : 20 min Durée de l’application : 15min Quantité de produit : 280 g (en supposant qu’un contenant de 10 oz est utilisé) Fraction en poids : 0,01 Module d’inhalation : évaporation depuis une superficie croissante Taux de transfert massique : méthode de Langmuir Matrice de masse moléculaire : 300 g/mol Volume de la pièce : 34 m3 (en supposant que le travail est fait dans un garage) Taux de renouvellement d’air : 1,5/h Superficie de rejet : 1,5 m2 Taux de contact : 100 mg/min Fraction d’absorption : 1 |
Inhalation : Concentration moyenne pour l’événement : 39,4 mg/m3 Concentration moyenne le jour de l’événement : 0,547 mg/m3 Voie cutanée : Aiguë, par événement : 0,212 mg/kg p.c. |
| Peinture en bombe aérosol utilisée par les enfants de 5 à 11 ans, valeur basée sur un scénario de peinture avec bombe aérosol, décrit dans ConsExpo (2006) | Fréquence d’utilisation : 2/an Durée de l’exposition : 20 min Durée de l’application : 15 min Quantité de produit : 280 g (en supposant qu’un contenant de 10 oz est utilisé) Fraction en poids : 0,002 Module d’inhalation : évaporation depuis une superficie croissante Taux de transfert massique : méthode de Langmuir Matrice de masse moléculaire : 300 g/mol Volume de la pièce : 20 m3 Taux de renouvellement d’air : 0,6/h Superficie de rejet : 1,5 m2 Taux de contact : 100 mg/min Fraction d’absorption : 1 |
Inhalation : Concentration moyenne pour l’événement : 13,7 mg/m3 Concentration moyenne le jour de l’événement : 0,19 mg/m3 Voie cutanée : Aiguë, par événement : 0,0968 mg/kg p.c. |
| Revêtement de baignoire et de carrelage, basé sur un scénario d’utilisation de « peintures à deux composants » pour la préapplication, et scénario d’application de peintures à base d’eau (pinceaux et rouleaux). Les deux scénarios sont décrits dans ConsExpo (2006). | Préapplication, mélange et chargement: Fréquence d’utilisation : 0,33/an Durée de l’exposition : 5 min Durée de l’application : 5 min Quantité de produit : 12 700 g (en supposant que l’on utilise une trousse de re-finition avec 1 pinte) Fraction en poids : 0,05 Module d’inhalation : évaporation à partir d’une superficie à émission constante Taux de transfert massique : méthode de Thibodeaux Matrice de masse moléculaire : 45 g/mol Volume de la pièce : 1 m3 (espace personnel) Taux de renouvellement d’air : 0,6/h Superficie de rejet : 95 cm2 Quantité de produit déversée : 50 mg/événement Fraction d’absorption : 1 Application : Fréquence d’utilisation : 0,33/an Durée de l’exposition : 70 min Durée de l’application : 60 min Quantité de produit : 12 700 g Fraction en poids : 0,05 Module d’inhalation : évaporation depuis une superficie croissante Taux de transfert massique : méthode de Thibodeaux Matrice de masse moléculaire : 45 g/mol Volume de la pièce : 10 m3 Taux de renouvellement d’air : 2/h Superficie de rejet : 3 m2 Taux de contact : 30 mg/min Fraction d’absorption : 1 |
Préapplication: Inhalation : Concentration moyenne pour l’événement : 2,52 mg/m3 Concentration moyenne le jour de l’événement : 0,00874 mg/m3 Voie cutanée : Aiguë, par événement : 0,0353 mg/kg p.c. Catégorie : Inhalation : Concentration moyenne pour l’événement : 243 mg/m3 Concentration moyenne le jour de l’événement : 11,8 mg/m3 Voie cutanée : Aiguë, par événement : 1,27 mg/kg p.c. |
a Hypothèse : poids corporel de 70,9 kg et taux d’inhalation de 16,2 m3/j pour un adulte; poids corporel de 31 kg et taux d’inhalation de 14,5 m3/j pour les enfants de 5 à 11 ans.
b En raison de la volatilité du cumène, l’exposition par inhalation est basée sur le module « évaporation depuis une superficie croissante » dans ConsExpo (2006).
Annexe B. Estimation de la valeur DR du cumène

Figure B-1. Nombre de cas d’adénomes ou de carcinomes bronchio-alvéolaires en réponse à des concentrations de cumène absorbées par inhalation par des souris femelles (NTP 2009)
La courbe dose-réponse a été tracée selon le modèle multi-échelle de cancer, en utilisant le programme BMD2.5 (US EPA), pour déterminer la valeur DR10/LICDR10. Les valeurs DR10 et LICDR10 ont été établies à 17,1 et 14,1 ppm, respectivement. Dans la présente étude, la valeur LICDR10 basée sur une durée d’exposition (6 heures/j et 5 jours/semaine) a été convertie en exposition continue avec l’unité mg/m3, à l’aide de l’équation suivante :
LICDR10 = 14,1 ppm x (120,2 g/mol /24,45 L/mol) x (6/24) x (5/7) = 12,4 mg/m3
(où 120,2 est la masse moléculaire du cumène; 24,45 est le volume de 1 mol de substance en phase gazeuse à 25 °C).
