Évaluation préalable concernant les diisocyanates de méthylènediphényle et les méthylènediphényldiamines Numéros de registre du Chemical Abstracts Service 101-68-8; 2536-05-2, 5873-54-1; 9016-87-9; 26447-40-5; 101-77-9; 25214-70-4
Table des matières
- Sommaire
- 1. Introduction
- 2. Identité des substances
- 3. Propriétés physiques et chimiques
- 4. Sources et utilisations
- 5. Rejets dans l'environnement
- 6. Devenir dans l'environnement
- 7. Potentiel d'effets nocifs sur l'environnement
- 8. Potentiel d'effets nocifs sur la santé humaine
- 9. Conclusion
- Références
- Annexes
- Annexe A. Justification d'une approche de comparaison (lecture croisée) pour l'évaluation des effets des DMD sur la santé humaine et l'environnement
- Annexe B. Propriétés physiques et chimiques des substances MDD faisant partie du groupe de substances DMD/MDD
- Annexe C. Propriétés physiques et chimiques des substances DMD faisant partie du groupe de substances DMD/MDD
- Annexe D. Concentrations dans l'environnement de substances faisant partie du groupe des DMD/MDD
- Annexe E. Données d'entrée et résultats sommaires du modèle SCREEN3 dans le cadre d'une évaluation écologique de l'exposition par inhalation découlant de l'air ambiant près des sources de pollution ponctuelle industrielles génériques
- Annexe F. Concentrations dans l'air mesurées après l'application d'une mousse de polyuréthane giclé à deux composants à faible pression
- Annexe G. Valeurs estimatives de la limite supérieure de l'exposition aux DMD découlant de l'utilisation de produits de bricolage de type adhésif ou produit d'étanchéité, d'après Consexpo
- Annexe H. Justification de l'utilisation des diisocyanates de toluène (TDI) en tant qu'analogues
Liste des tableaux
- Tableau 1-1. N° CAS et noms dans la LIS des substances du groupe de substances DMD/MDD
- Tableau 2-1. Identité des substances 4,4'-MDD et pMDD
- Tableau 2-2. Identité des DMD faisant partie du groupe des DMD/MDD
- Tableau 6-1. Résumé de la modélisation de la fugacité de niveau III (New EQC 2011) pour le 4,4'-MDD et les composants du pMDD, indiquant le pourcentage de substance ou de composant de substance réparti dans chaque milieu
- Tableau 6-2. Résumé des données empiriques clés relativement à la biodégradation du 4,4'-MDD
- Tableau 6-3. Résumé des données modélisées liées à la dégradation du 4,4'-MDD et des composants oligomères du pMDD
- Tableau 6-4. Résumé des données empiriques sur la dégradation dans l'environnement du pDMD
- Tableau 6-5. Résumé des facteurs de bioconcentration (FBC) empiriques pour le 4,4'-MDD
- Tableau 6-6. Facteurs de bioconcentration empiriques (FBC) du 4,4'-DMD
- Tableau 7-1. Résumé des données empiriques sur la toxicité aquatique du 4,4'-MDD provenant des études
- Tableau 7-2. Résumé des données empiriques sur la toxicité aquatique du pMDD provenant des études
- Tableau 7-3. Résumé des données empiriques sur la toxicité pour le sol du 4,4'-MDD provenant des études
- Tableau 7-4. Résumé des données empiriques liées à la toxicité des sédiments pour les invertébrés découlant du 4,4'-MDD
- Tableau 7-5. Données empiriques sur la toxicité du 4,4'-MDD chez les oiseaux
- Tableau 7-6. Résumé des données empiriques sur la toxicité aquatique du 4,4'-DMD
- Tableau 7-7. Résumé des données empiriques sur la toxicité aquatique du pDMD
- Tableau 7-8. Résumé des données empiriques sur la toxicité pour le sol du pDMD
- Tableau 7-9. Résumé des quotients de risque obtenus pour différents milieux et des scénarios d'expositions pour les substances DMD et MDD dans le groupe
- Tableau 8-1. Concentrations de 4,4'-DMD dans les produits de bricolage
- Tableau 8-2. Concentrations de pDMD dans les produits de bricolage
- Tableau 8-3. Concentrations de DMD mélangés dans les produits de bricolage
- Tableau 8-4. Concentrations individuelles maximales de DMD après l'application d'un produit de polyuréthane à deux composants giclé à faible pression entre les solives (c. à d. « remplissage complet de cavité »)
- Tableau 8-5. Concentrations individuelles maximales de DMD attribuables à l'application de polyuréthane giclé à deux composants à faible pression le long de solives, dans des coins et dans les fissures
- Tableau 8-6. Résultats des mesures de concentrations dans l'air pendant l'application de produits de polyuréthane giclé à un composant expansible
- Tableau 8-7. Limite supérieure des estimations des concentrations atmosphériques de DMD découlant du type de produits de bricolage (adhésif ou produit d'étanchéité)
- Tableau 8-8. Estimations de la limite supérieure de l'exposition cutanée aux DMD par les produits de bricolage
- Tableau 8-9. Résumé des études épidémiologiques sur les DMD
- Tableau 8-10. Résumé des études réalisées sur des volontaires humains avec des TDI
- Tableau 8.11 Marges d'exposition par inhalation découlant de l'utilisation de produits de bricolage contenant des DMD
Sommaire
Conformément aux articles 68 et 74 de la Loi canadienne sur la protection de l'environnement (1999) [LCPE (1999)], la ministre de l'Environnement et la ministre de la Santé ont procédé à une évaluation préalable de sept substances collectivement appelées le groupe de substances de diisocyanates de méthylènediphényle et de méthylènediphényldiamines (DMD/MDD). Le groupe de substances DMD/MDD comprend cinq substances DMD, dont trois substances monomères (diisocyanate de 4,4'-méthylènediphényle, diisocyanate de méthylène -2,2'-diphényle et isocyanate de o-(p-isocyanatobenzyl)phényle), une substance polymère (diisocyanate de polyméthylènepolyphénylène) et un mélange d'isomères (diisocyanate de méthylènediphényle). Le groupe de substances DMD/MDD comprend également deux substances MDD : une substance monomère (4,4'-méthylènedianiline) et une substance polymère (formaldéhyde polymérisé avec l'aniline). Leurs numéros de registre du Chemical Abstracts Service (no CAS), leurs noms dans la Liste intérieure des substances (LIS) et leurs acronymes sont présentés dans le tableau 1 ci-dessous.
| N° CASa | Nom dans la LIS | Acronyme |
|---|---|---|
| 101-68-8 | Diisocyanate de 4,4'-méthylènediphényle | 4,4-DMD |
| 2536-05-2b | Diisocyanate de méthylène -2,2'-diphényle | 2,2-DMD |
| 5873-54-1b | Isocyanate de o-(p-isocyanatobenzyl)phényle | 2,4-DMD |
| 26447-40-5 | Diisocyanate de méthylènediphényle | Mélange d'isomères des DMD |
| 9016-87-9 | Diisocyanate de polyméthylènepolyphénylène | DMD polymère (pDMD) |
| 101-77-9b | 4,4'-Méthylènedianiline | 4,4'-MDD |
| 25214-70-4c | Formaldéhyde polymérisé avec l'aniline | MDD polymère (pMDD) |
a. Le numéro de registre du Chemical Abstracts Service (no CAS) est la propriété de l'American Chemical Society. Toute utilisation ou redistribution, sauf si elle sert à répondre aux besoins législatifs ou si elle est nécessaire pour les rapports destinés au gouvernement du Canada lorsque des renseignements et des rapports sont exigés par la loi ou une politique administrative, est interdite sans l'autorisation écrite préalable de l'American Chemical Society.
b. Cette substance n'a pas été désignée en vertu du paragraphe 73(1) de la LCPE, mais a été incluse dans cette évaluation, car elle était considérée comme prioritaire, en raison d'autres préoccupations relatives à la santé humaine.
c. Cette substance n'a pas été désignée en vertu du paragraphe 73(1) de la LCPE, mais a été incluse dans cette évaluation en raison de sa similarité avec le 4,4'-MDD.
Les substances DMD et le 4,4'-MDD du groupe de substances DMD/MDD ont été désignées comme étant d'intérêt prioritaire pour la prise de mesures, car elles répondaient aux critères de catégorisation en vertu de l'article 73 de la LCPE ou étaient considérées comme prioritaires pour une évaluation, en raison de préoccupations relatives à la santé humaine. Le pMDD ne répondait pas aux critères de catégorisation, mais elle a été ajoutée au groupe de substances DMD/MDD en raison de sa similarité avec le 4,4'-MDD (c.-à-d. qu'elle est en grande partie composée de 4,4'-MDD).
Les substances de DMD et MDD se caractérisent par une structure de base similaire, mais diffèrent sur le plan de leurs groupes fonctionnels, avec la présence de groupes fonctionnels isocyanates dans les DMD et de groupes fonctionnels aminés dans les MDD. Les DMD sont très réactifs en raison de la présence des groupes isocyanates.
D'après des renseignements fournis en vertu de l'article 71 de la LCPE pour 2011, les DMD importés et utilisés au Canada en 2011 comprenaient de 10 à 100 millions kg chacun de 4,4'-DMD et de pDMD, et entre 1 et 10 millions kg de mélange d'isomères des DMD. Au Canada, entre 1000 et 10 000 kg de 4,4'-MDD et entre 100 et 1000 kg de pMDD ont été importés. Le 4,4-DMD, le pDMD et le mélange d'isomères des DMD sont principalement utilisés dans la production de produits de polyuréthane, tels que les adhésifs, les revêtements, les mousses d'isolation, le stratifié d'emballage souple et les blocs de mousse utilisés dans les meubles. Les substances DMD sont également utilisées comme adhésifs dans la production de produits de bois d'ingénierie, tels que les panneaux de copeaux orientés. Les substances 4,4'-MDD et pMDD sont principalement utilisées comme intermédiaires dans la production des DMD.
Les substances DMD ont un potentiel de rejet dans l'environnement, principalement dans l'air pendant leur utilisation industrielle, comme lors de la production de produits de bois d'ingénierie et de produits de polyuréthane. Des rejets dans l'air de substances DMD ont été déclarés à l'INRP pour les années 2008 à 2013. On considère que les installations de fabrication de panneaux de copeaux orientés émettent plus de rejets que les autres types d'installations utilisant des DMD, en ce qui concerne les quantités de substance utilisées et les rejets proportionnels qui y sont associés. Les quantités de substances DMD rejetées dans l'air peuvent en plus contribuer aux dépôts au sol ou dans les eaux de surface des environs.
Lorsqu'elles sont rejetées dans l'environnement, en raison de la nature très réactive des groupes isocyanates dans les substances DMD, ces substances s'hydrolysent rapidement dans l'eau et dans le sol où un degré d'humidité est généralement fréquent. La réaction d'hydrolyse des substances DMD génère des polyurées inertes et de petites quantités de MDD comme principaux produits de réaction. Dans l'air, les substances DMD vont réagir facilement avec les radicaux hydroxyles ou vont se condenser ou se déposer au sol ou dans les eaux de surface des environs.
Aucune concentration de 4,4'-MDD et de pMDD dans l'environnement au Canada n'a été relevée. Le 4,4'-MDD figure sur la liste des substances à déclarer en vertu de l'Inventaire national des rejets de polluants (INRP); toutefois, aucun rejet n'a été déclaré. Le 4,4'-MDD peut être rejeté dans l'environnement à cause des utilisations industrielles, comme la fabrication de polyuréthane, mais, en raison des faibles quantités sur le marché de cette substance au Canada, ces rejets devraient être négligeables.
D'après ses propriétés physiques et chimiques, le 4,4'-MDD se dégrade rapidement dans l'air. La substance ne s'hydrolyse pas dans l'eau, et des essais de biodégradation avec des boues activées suggèrent des vitesses intermédiaires de biodégradation dans les conditions environnementales. Dans le sol, le 4,4'-MDD se lie par covalence aux substances humiques, réduisant ainsi sa biodisponibilité et sa bioaccessibilité. Des taux de biodégradation plus rapides dans le sol ont été observés en présence de substances organiques dégradables mélangées avec le substrat du sol. Il existe des données disponibles limitées sur le potentiel de dégradation des MDD dans les sédiments, et on prévoit que la majorité du 4,4'-MDD dans un environnement sédiments-eau se liera aux sédiments et ne sera pas disponible pour la biodégradation. La dégradation du pMDD devrait être semblable à celle du 4,4'-MDD.
Les substances MDD et DMD sont reconnues pour avoir un faible potentiel de bioaccumulation. Elles sont caractérisées par de faibles facteurs de bioconcentration chez les poissons. On s'attend à ce que d'infimes quantités de substances DMD soient disponibles et absorbées par les organismes à partir des milieux naturels. Chez les mammifères, le 4,4'-MDD a tendance à être facilement métabolisé et éliminé de l'organisme, et il n'est pas susceptible de se bioamplifier dans les réseaux trophiques terrestres.
Les résultats des études de toxicité en milieu aquatique semblent indiquer que tant le 4,4-DMD que le pDMD ne sont pas sensiblement toxiques pour les espèces aquatiques d'après les données sur l'exposition aiguë. Les substances DMD ont également une faible toxicité pour les espèces d'invertébrés vivant dans le sol et les plantes ayant fait l'objet d'essais. On a observé des effets modérés des DMD sur les petits mammifères à la suite d'une exposition par inhalation. En général, l'exposition aux DMD des organismes dans l'environnement sera inférieure aux niveaux d'exposition susceptibles d'avoir des effets nocifs.
Les organismes aquatiques sont sensibles à l'exposition à court terme et à long terme au 4,4'-MDD. On a observé que le 4,4'-MDD était modérément à très toxique pour divers organismes aquatiques ayant fait l'objet d'essais, comme les algues, les micro-organismes, les invertébrés et les poissons. Le 4,4'-MDD présente une toxicité faible à modérée pour les organismes vivant dans le sol et pour les plantes, et elle est modérément toxique pour les organismes vivant dans les sédiments et les oiseaux.
Le risque d'exposition des organismes aquatiques au 4,4'-MDD est plus susceptible de résulter des rejets de substances DMD dans l'air, de leurs dépôts dans le sol ou les eaux de surface, et de leur conversion subséquente en 4,4'-MDD. Les volumes d'importation élevés de substances DMD au Canada, ainsi que les renseignements sur leurs utilisations, indiquent que l'on trouvera principalement ces substances dans l'air et près des sources ponctuelles d'émissions. Il a été déterminé que des effets nocifs sur les organismes aquatiques et les organismes vivant dans le sol par suite de l'exposition actuelle au 4,4'-MDD découlant des dépôts de DMD dans les eaux de surface et le sol sont peu probables au Canada. En outre, il a été déterminé que des effets nocifs sur les mammifères terrestres dus à l'exposition par inhalation à des DMD sont peu probables.
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation préalable, les substances du groupe de substances DMD/MDD présentent un faible risque d'effets nocifs sur les organismes et sur l'intégrité globale de l'environnement. Nous concluons que les cinq substances DMD et les substances 4,4'-MDD et pMDD ne satisfont pas aux critères énoncés aux alinéas 64a) ou b) de la LCPE (1999), car elles ne pénètrent pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique, ou à mettre en danger l'environnement essentiel à la vie.
D'après l'ensemble des classifications et des renseignements établis par d'autres organismes de réglementation internationaux, les effets critiques pour la caractérisation des risques pour la santé humaine découlant de l'exposition aux substances DMD sont la cancérogénicité, des effets respiratoires, notamment la sensibilisation, et une sensibilisation cutanée. Des incidences de tumeurs pulmonaires ont été observées chez les rats exposés à des concentrations élevées de substances DMD dans le cadre d'études d'exposition par inhalation de deux ans. L'ensemble des preuves découlant des études sur la génotoxicité semble indiquer que les substances DMD ne sont probablement pas mutagènes. Les renseignements disponibles provenant d'études sur des animaux de laboratoire, d'études de cas humains et de données épidémiologiques ont été utilisés afin d'établir des concentrations associées à un effet critique pour la caractérisation des risques.
Les marges d'exposition entre la tranche supérieure des estimations des concentrations environnementales des émissions de DMD aux environs de sites industriels et les concentrations associées à un effet critique pour les effets respiratoires sont jugées adéquates pour tenir compte des incertitudes dans les bases de données sur l'exposition et sur les effets sur la santé. Les marges entre les estimations de l'exposition découlant de l'utilisation de certains produits de bricolage, plus particulièrement les mousses en polyuréthane giclé à deux constituants à faible pression, et les concentrations associées à un effet critique pour les effets respiratoires sont jugées inadéquates pour tenir compte des incertitudes dans les bases de données sur l'exposition et sur les effets sur la santé.
À la lumière, principalement, de l'examen des évaluations réalisées par des organismes internationaux et de l'ensemble des données disponibles, la cancérogénicité représente un effet critique pour la caractérisation des risques pour la santé humaine du 4,4'-MDD. Aucune donnée relative aux effets sur la santé n'a été relevée pour le pMDD. Puisque le 4,4'-MDD est le principal composant du pMDD, l'évaluation des effets sur la santé du 4,4'-MDD a été utilisée pour représenter ceux du pMDD. La population générale ne devrait pas être exposée aux substances 4,4'-MDD et pMDD dans les milieux naturels, étant donné qu'elles ne sont pas fabriquées au Canada et que leurs utilisations sont limitées à un nombre très restreint d'activités industrielles. De plus, il ne devrait y avoir aucune exposition à ces substances découlant de l'utilisation de produits de consommation. Puisque la population générale ne devrait pas être exposée aux substances 4,4'-MDD et pMDD, les risques pour la santé humaine devraient être faibles.
À la lumière des renseignements contenus dans la présente évaluation préalable, on conclut que les substances DMD satisfont aux critères énoncés à l'alinéa 64c) de la LCPE (1999), car elles pénètrent dans l'environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines. On conclut également que les substances 4,4'-MDD et pMDD ne satisfont pas aux critères énoncés à l'alinéa 64c) de la LCPE, car elles ne pénètrent pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Conclusion générale
On conclut que les cinq substances DMD (nosCAS 101-68-8, 2536-05-2, 5873-54-1, 9016-87-9 et 26447-40-5) du groupe de substances DMD/MDD satisfont à un ou à plusieurs des critères énoncés à l'article 64 de la LCPE. Cependant, on a déterminé que ces cinq substances DMD ne répondent pas aux critères de persistance ou de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation de la LCPE. On conclut également que les substances 4,4'-MDD (noCAS 101-77-9) et pMDD (no CAS 25214-70-4) ne satisfont à aucun des critères énoncés à l'article 64 de la LCPE
1. Introduction
Conformément aux articles 68 et 74 de la Loi canadienne sur la protection de l'environnement (1999) [LCPE] (Canada 1999), la ministre de l'Environnement et du Changement climatique et la ministre de la Santé ont procédé à une évaluation préalable des substances afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l'environnement ou la santé humaine.
L'Initiative des groupes de substances constitue un élément clé du Plan de gestion des produits chimiques (PGPC) du gouvernement du Canada (Environnement Canada et Santé Canada 2013). Le groupe des diisocyanates de méthylènediphényle (DMD) et des méthylènediphényldiamines (MDD) (groupe des substances DMD/MDD) est composé de cinq substances DMD et de deux substances MDD. Le 4,4'-MDD ne répondait pas aux critères de catégorisation en vertu de l'article 73 de la LCPE, mais était considéré comme une substance d'intérêt prioritaire au moment de la catégorisation d'après sa classification de substance à risque élevé par d'autres organismes internationaux. Le pMDD ne répondait pas aux critères de catégorisation, mais a été ajoutée au groupe des DMD/MDD d'après sa similarité avec le 4,4'-MDD. Les substances 4,4'-DMD, pDMD et DMD mélangés répondaient aux critères de catégorisation aux termes de l'article 73 de la LCPE. Les substances 2,2'-DMD et 2,4'-DMD ne répondaient pas répondu aux critères de catégorisation, mais ont été ajoutées à ce groupe en post-catégorisation d'après de nouvelles classifications de substances à risque élevé par d'autres organismes internationaux. Aucune des substances dans le groupe des substances DMD/MDD ne répondait aux critères de catégorisation relativement à la persistance, à la bioaccumulation ou à la toxicité intrinsèque pour les organismes aquatiques.
Les évaluations préalables effectuées aux termes de la LCPE (1999) mettent l'accent sur les renseignements jugés essentiels pour déterminer si une substance répond aux critères de toxicité des substances chimiques au sens de l'article 64 de la Loi. Les évaluations préalables visent à étudier les renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudenceNote de bas de page1.
L'évaluation des risques pour la santé humaine suppose la prise en compte des données utiles à l'évaluation de l'exposition (non professionnelle) de la population dans son ensemble et de l'information sur les dangers et les risques pour la santé (principalement d'après la prise en compte des évaluations effectuées par d'autres organismes, qui ont servi à déterminer le caractère prioritaire de la substance). Les décisions concernant la santé humaine reposent sur la nature de l'effet critique retenu ou sur la marge entre les valeurs prudentes de concentration donnant lieu à des effets et les estimations de l'exposition, en tenant compte de la confiance accordée au caractère exhaustif des bases de données sur l'exposition et les effets, et ce, dans le contexte d'une évaluation préalable. L'évaluation préalable présente les renseignements essentiels et les examens sur lesquels s'appuie la conclusion.
La présente évaluation tient compte des renseignements sur les propriétés chimiques, le devenir environnemental, les dangers, les utilisations et l'exposition, notamment les renseignements supplémentaires soumis par les parties intéressées. Les données pertinentes pour l'évaluation préalable de ces substances sont tirées de publications disponibles jusqu'en février 2015 pour les sections qui portent sur les aspects écologiques et disponibles jusqu'en avril 2015 pour les sections qui portent sur la santé humaine du document. Les données empiriques obtenues dans des études clés, ainsi que certains résultats provenant de modèles ont servi à établir les conclusions. Lorsqu'ils étaient disponibles et pertinents, les renseignements présentés dans des évaluations réalisées par d'autres gouvernements ont également été pris en compte.
La présente évaluation préalable a été préparée par le personnel du Programme des substances existantes de Santé Canada et d'Environnement et Changement climatique Canada et elle intègre les résultats d'autres programmes réalisés par ces ministères. Les parties de la présente évaluation préalable qui portent sur la santé humaine et l'écologie ont fait l'objet d'une étude consignée par des pairs ou d'une consultation de ces derniers. Raili Moldov (Department of Chemical Safety, Conseil de la santé, Estonie) et Robert J. West (Dow Chemical Company, États-Unis) ont fourni des commentaires sur les parties techniques concernant l'environnement. Des commentaires sur les parties techniques concernant la santé humaine ont été reçus de la part d'experts scientifiques désignés et réalisés par la Toxicology Excellence for Risk Assessment (TERA), notamment Andrew Maier (TERA), Leena Nylander-French (Université de la Caroline du Nord à Chapel Hill), Mark Utell (University School of Medicine de Rochester), Paul Siegel (National Institute for Occupational Safety and Health [NIOSH]), Naomi Hudson (NIOSH) et Kathleen Ernst (NIOSH). De plus, l'ébauche de la présente évaluation préalable avait fait l'objet d'une période de consultations publiques de 60 jours. Bien que les commentaires externes aient été pris en considération, Santé Canada et Environnement et Changement climatique Canada assument la responsabilité du contenu final et des résultats de l'évaluation préalable.
Les principales données et considérations sur lesquelles repose la présente évaluation sont résumées ci-après.
2. Identité des substances
La présente évaluation préalable cible cinq diisocyanates de méthylènediphényle (DMD) et deux méthylènediphényldiamines (MDD) dans le groupe des substances DMD/MDD. Les substances DMD et MDD se caractérisent par des structures de base similaires et diffèrent par la présence de groupes fonctionnels; en effet, les DMD contiennent des groupes isocyanates et les MDD sont caractérisés par des groupes fonctionnels amines. Les MDD sont généralement utilisés pour la fabrication de DMD et sont formés au fur et à mesure que les DMD se dégradent.
2.1 MDD
L'évaluation préalable porte sur une substance MDD monomère, le 4,4'-MDD (CAS RN 101-77-9), et sur une substance de MDD de composition inconnue ou variable, produits de réaction complexes ou matières biologiques (UVCB) polymères, le pMDA (CAS RN 25214-70-4), qui est surtout composée de MDD monomère, probablement du 4,4'-MDD (Allport et coll. 2003).
La production de substances MDD est généralement réalisée par la réaction de condensation en présence d'un catalyseur acide de l'aniline avec le formaldéhyde pour former le pMDD, qui est composé de mélanges de substances monomères MDD et d'homologues à cycles supérieurs (Amini et Lowenkron 2003; Lowenkron 2000). La composition isomérique, ainsi que la quantité relative de monomères par rapport aux homologues à cycles supérieurs dans le pMDD, peut varier en fonction des besoins de l'utilisateur final. Par conséquent, les MDD peuvent présenter une grande variété de compositions; toutefois, la composition typique est de 50 % d'isomères à deux cycles (dont la majorité sont des 4,4'-MDD), de 25 % d'isomères à trois cycles, de 12 % d'isomères à quatre cycles, de 6 % d'isomères à cinq cycles et de 7 % d'isomères comportant six cycles ou plus ou des matières indéfinies (Allport et coll. 2003).
Ailleurs, les rapports indiquent que la composition des MDD utilisés dans une étude de toxicité environnementale est de 60 % environ pour le 4,4'-MDD, de moins de 3 % pour le 2,4'-MDD et de moins de 0,1 % pour le 2,2'-MDD. Les concentrations approximatives d'oligomères étaient de 21 % d'isomères à trois cycles, de 8 % d'isomères à quatre cycles, de 3 % d'isomères à cinq cycles et de 4 % d'isomères comportant six cycles ou plus (ECHA, c2007-2013b). Lorsqu'un rapport plus élevé entre l'aniline et le formaldéhyde est utilisé, la proportion relative de structures à deux cycles augmente par rapport aux structures à cycles supérieurs (c.-à-d. plus de deux) (Lowenkron 2000). L'aniline inaltérée est recyclée au début de la réaction. Par ailleurs, des réactions secondaires pouvant se produire lors de la production de substances MDD entraînent généralement une certaine production de dérivés N-méthyl et quinazoline de l'aniline et des MDD. Toutefois, on a réussi à minimiser ces réactions secondaires dans les procédés (elles représenteraient généralement moins de 7 % du pMDD d'après la composition présentée précédemment) (Lowenkron 2000).
Les identités structurelles des substances MDD incluses dans le groupe des DMD/MDD sont présentées dans le tableau 2.1.
| No CAS | Nom dans la LIS (sigle) |
Structure chimique | Masse moléculaire (g/mol) |
Formule chimique |
|---|---|---|---|---|
| 101-77-9 | 4,4'-Méthylène-dianiline (4,4'-MDD) |
|
198,3 | C13H14N2 |
| 25214-70-4a | Formaldéhyde polymérisé avec l'aniline (pMDD) |
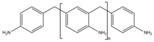 Structure représentative n = 0-4 |
198,3-618,8 | C13H14N2[C7H7N]n |
Abréviations : N° CAS, numéro de registre du Chemical Abstracts Service; LIS, Liste intérieure des substances.
a. Ce numéro CAS RN est un UVCB (substance de composition inconnue ou variable, produits de réactions complexes ou matières biologiques).
2.2 DMD
Les substances DMD incluses dans le groupe des substances DMD/MDD seront collectivement appelées les substances DMD, tout simplement les DMD. Elles comportent trois substances monomères, à savoir le 4,4'-DMD, le 2,4'-DMD et le 2,2'-DMD (nosCAS 101-68-8, 2536-05-2 et 5873-54-1, respectivement), un mélange d'isomères monomères (no CAS 26447-40-5) et une substance DMD polymère (UVCB) (no CAS 9016-87-9) (voir le tableau 2.2 pour connaître les structures ou les structures représentatives de ces substances). On note que la substance DMD (no CAS 9016-87-9) contient principalement des composants monomères et oligomères, c.-à-d. des composants qui contiennent un nombre relativement faible de chaînes carbonées (Yakabe et coll. 1999). Étant donné les ressemblances structurelles des DMD, une approche de comparaison des analogues a été utilisée pour évaluer ces cinq substances. Aux fins de l'évaluation des effets sur la santé et sur l'environnement, une justification de la lecture croisée des DMD est présentée à l'annexe A.
Les diisocyanates (c.-à-d. DMD) sont produits par la réaction du pMDD avec le phosgène, un réactif chimique. Les diisocyanates polymères (pDMD) qui en résultent sont vendus dans le commerce ou purifiés pour isoler les isomères DMD individuellement (c.-à-d. 4,4'-DMD, 2,4'-DMD ou 2,2'-DMD) ou en tant qu'isomères mélangés (c.-à-d. composition variable d'isomères 4,4'-DMD, 2,4'-DMD et 2,2'-DMD) (Amini et Lowenkron 2003). La composition typique des pDMD est habituellement identique à celle que le pMDD correspondant utilisé pour sa fabrication. Toutefois, tous les groupes d'amines seraient convertis en isocyanates correspondants après la phosgénation. Les isomères DMD mélangés (no CAS 26447-40-5) peuvent être composés principalement de 4,4'-DMD et de 2,4'-DMD (Bayer Material Science 2005; Yakabe et coll. 2000).
Les DMD monomères inclus dans le groupe sont généralement constitués d'un petit pourcentage de résidus ou d'impuretés (Allport et coll. 2003). Le 4,4'-DMD pur est habituellement composé de 95 % de 4,4'-DMD au minimum, et les 2 à 5 % restants correspondaient aux résidus ou aux impuretés du 2,4'-DMD et, dans une moindre mesure, du 2,2'-DMD et des homologues à cycles supérieurs (Allport et coll. 2003). De faibles quantités d'isomères avec différents modèles de substitution (c.-à-d. 2,4'- ou 2,2'-) ne devraient pas d'avoir d'impact considérable sur le devenir général dans l'environnement, sur le comportement ou sur les propriétés toxicologiques du 4,4'-DMD « pur ». Par conséquent, ces résidus ou ces impuretés ne seront pas examinés davantage dans l'évaluation du 4,4'-DMD. Cependant, les isomères individuels 2,2'-DMD et 2,4'-DMD ont été intégrés à la présente évaluation dans leur forme « pure », car on a signalé que certaines demandes portaient sur l'utilisation individuelle de ces isomères spécifiques. Comme pour le 4,4'-DMD, les impuretés résiduelles de ces substances ne devraient pas avoir de graves répercussions sur le devenir général dans l'environnement, sur le comportement ou sur les propriétés toxicologiques et, par conséquent, elles ne seront pas examinées davantage dans la présente évaluation préalable.
En raison du besoin industriel de substances DMD ayant des exigences différentes en matière de viscosité, de fonctionnalités, de réactivité et de propriété particulière pour les produits finaux, on procède couramment à la modification des isomères DMD « purs » et des pDMD. La modification entraîne généralement la production de « variantes » ou de « prépolymères » DMD qui présentent une teneur réduite en isocyanate, mais de meilleures propriétés de manutention (Allport et coll. 2003). Parmi les exemples les plus importants de DMD modifiés, on compte les dimères DMD (noCAS 17589-24-1) et les trimères (no CAS 31107-36-5) (Dieterich et coll. 1993). De plus, le « blocage » chimique des DMD se fait généralement à l'aide de phénols, de caprolactame et de composés du β-dicarbonyl tels que l'acétoacétate et le malonate d'éthyle, de certains alcools, d'oximes et de triazoles, pour former une liaison thermiquement faible (Dieterich et coll. 1993). L'isocyanate peut être régénéré à des températures élevées; par conséquent, les DMD modifiés peuvent devenir une source de 4,4'-DMD dans certaines conditions. Les dimères et les trimères DMD sont chimiquement différents du 4,4'-DMD et ne feront donc pas partie de la présente évaluation.
Des homologues de DMD à cycles supérieurs (plus de deux) (p. ex., nos CAS 25686-28-6, 39310-05-9) peuvent être commercialisés individuellement et la structure de ces substances peut être semblable à celle de la fraction de l'homologue à cycles supérieurs présente dans le pDMD; toutefois, comme nous l'indiquerons ultérieurement dans la présente évaluation préalable, le composant de 4,4'-DMD présent dans le pDMD soulève une plus grande préoccupation que les composants d'homologues à cycles supérieurs.
Les identités structurelles des DMD incluses dans le groupe des DMD/MDD sont présentées dans le tableau 2b.
| No CAS | Nom dans la LIS (sigle) |
Structure chimique | Masse moléculaire (g/mol) |
Formule chimique |
|---|---|---|---|---|
| 101-68-8 | Diisocyanate de 4,4'-méthylènediphényle (4,4'-DMD) |
|
250,3 | C15H10N2O2 |
| 2536-05-2 | Diisocyanate de méthylène -2,2'-diphényle (2,2'-DMD) |
|
250,3 | C15H10N2O2 |
| 5873-54-1 | Isocyanate de o-(p-isocyanatobenzyl)phé-nyle (2,4'-DMD) |
|
250,3 | C15H10N2O2 |
| 26447-40-5 | Diisocyanate de méthylènediphényle (Mélange d'isomères des DMD) |
(Structure représentative) |
250,3 |
C15H10N2O2 |
| 9016-87-9a | Diisocyanate de polyméthylène-polyphénylène (pDMD) |
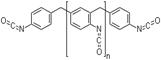 Structure représentative n = 0-4 |
250,3-774,8 | C15H10N2O2•[C8H5NO]n |
Abréviations : No CAS, numéro de registre du Chemical Abstracts Service; LIS, Liste intérieure des substances.
a. Ce numéro CAS RN est un UVCB (substance de composition inconnue ou variable, produits de réactions complexes ou matières biologiques).
3. Propriétés physiques et chimiques
Les propriétés physiques et chimiques détaillées (valeurs expérimentales et modélisées) des substances du groupe DMD/MDD qui sont pertinentes pour déterminer leur devenir dans l'environnement et leur écotoxicité sont présentées à l'annexe B pour les substances MDD et à l'annexe C pour les substances DMD.
Les modèles fondés sur des relations quantitatives structure-activité (RQSA) ont été utilisés pour produire des données pour certaines des propriétés physiques et chimiques des substances des sous-groupes des MDD et des DMD. Ces modèles sont fondés principalement sur des méthodes d'addition de fragments, c.-à-d. qu'ils additionnent les contributions des fragments sous-structuraux d'une molécule pour effectuer des prévisions concernant une propriété ou un paramètre. La plupart de ces modèles s'appuient sur la forme neutre d'un produit chimique comme donnée d'entrée. Par conséquent, sauf dans les cas indiqués, les valeurs modélisées concernent les formes neutres des substances.
Le 4,4'-MDD purifié est un solide de couleur brun clair à blanc cristallin avec une légère odeur rappelant l'amine. Le 4,4'-DMD présente une faible pression de vapeur (inférieure ou égale à 0,01 Pa à température ambiante) (MacNab 1999) et une très faible constante de la loi d'Henry (moins de 10-5 Pa·m3/mol) (HENRYWIN 2008), d'après les calculs de modélisation. Le log Koe du 4,4'-MDD a été déterminé, de façon expérimentale, comme étant faible (inférieur à 2). Le log Kco a également été déterminé de façon expérimentale dans différents types de sol et sa valeur était de modérée à élevée, entre 3,6 et 4,0 (Cowen et coll. 1998). La valeur modélisée de 3,4 pour le log Kco fondée sur la méthode d'indice de connectivité moléculaire était semblable aux valeurs déterminées de façon empirique; cependant, lorsqu'on le calcule à l'aide du log Koe, le log Kco modélisé se révélait plus faible à 1,7 (EPI Suite 2012) L'écart entre les valeurs empiriques et modélisées du log Kco est vraisemblablement dû aux interactions hydrophobes moléculaires des MDD qui peuvent ne pas être prises en compte par la méthode du modèle KOCWIN (2010) pour le log Koe. On a déterminé que la solubilité du 4,4'-MDD dans l'eau était de modérée à élevée (~ 1000 mg/L) (Moore 1978; MacNab 1999). Enfin, les valeurs de pKa de l'ion phénylammonium laisseraient entendre que le 4,4'-MDD existerait principalement sous la forme ionisée 1+ et 2+ à un pH inférieur à 5 environ (MacNab 1999).
Les substances monomères présentes dans le sous-groupe des DMD (nos CAS 101-68-8, 2536-05-2, 5873-54-1, 26447-40-5) sont généralement solides à température ambiante et existent sous forme de poudres; elles présentent généralement une faible pression de vapeur (inférieure ou égale à 0,01 Pa à température ambiante). On a déterminé expérimentalement par CLHP les valeurs modérées à élevées du log Koe des monomères DMD (environ 4,5) (Yakabe et coll. 2000). Toutefois, puisque la réactivité des monomères DMD dans l'eau est très élevée, il se peut que le log Koe ait une faible pertinence environnementale pour les substances DMD. Aucune valeur concernant le log Kco, la constante de la loi d'Henry ou l'hydrosolubilité n'a pu être déterminée pour les monomères DMD en raison de la réactivité élevée de ces substances avec l'eau. Enfin, des valeurs modélisées élevées de log Koa (environ 9) sont associées aux monomères DMD (KOAWIN 2008). Ces substances devraient réagir rapidement dans les eaux de surface ainsi qu'avec l'eau présente dans le sol et aucune ionisation ne devrait se produire.
Les pMDD et pDMD sont liquides à température ambiante en raison de la présence dans ces substances d'homologues ayant des masses moléculaires plus élevées. Dans le cas du pMDD, les composants des homologues ayant une masse moléculaire plus élevée auront des pressions de vapeur et des constantes de la loi d'Henry plus faibles, ainsi que des valeurs de log Koe, Kco et Koa plus élevées par rapport à la substance monomère 4,4'-MDD. On a mesuré une hydrosolubilité modérée à élevée (environ 360 à 1500 mg/L) concernant le pMDD; par ailleurs, une bonne partie des composants du pMDD existeraient principalement sous la forme ionisée 1+ ou n+ à un pH inférieur à 5, environ. Comme pour le pDMD, les composants des homologues ayant une masse moléculaire plus élevée auront des valeurs de pression de vapeur et de log Koa plus faibles par rapport à la substance monomère purifiée 4,4'-DMD. En raison du taux de réaction rapide des groupes isocyanates avec l'eau, on a estimé que d'autres paramètres (c.-à-d. constante de la loi d'Henry, log Koe, log Kco, hydrosolubilité, pKa) ne pouvaient pas être mesurés de façon pratique ou qu'ils ne présentaient pas de pertinence au point de vue environnemental.
4. Sources et utilisations
4.1 Sources
4.1.1 MDD
Les méthylènediphényldiamines (MDD) ne sont pas présents de façon naturelle dans l'environnement. D'après les renseignements recueillis dans le cadre d'une enquête réalisée en vertu de l'article 71 de la LCPE (Environnement et Changement climatique Canada 2012a), on n'a signalé aucune fabrication de 4,4'-MDD (n° CAS 101-77-9) au-dessus du seuil de déclaration de 100 kg au Canada en 2011. Toutefois, les déclarants ont indiqué qu'entre 1000 et 10 000 kg de 4,4'-MDD ont été importés au Canada en 2011 (Environnement Canada 2012a). La substance pMDD (n° CAS 25214-70-4), qui a aussi été incluse dans l'enquête, a été importée au Canada dans une quantité comprise entre 100 et 1000 kg pour l'année de déclaration 2011 (Environnement Canada 2012a).
Les rejets de MDD dans l'environnement peuvent résulter des procédés industriels qui utilisent ces substances. Malgré cela, les MDD sont principalement utilisés dans des systèmes fermés, ce qui permet de minimiser les rejets en cours de fabrication. Les MDD pourraient provenir de la dégradation des DMD rejetés dans l'environnement. Une autre source potentielle de MDD peut découler du clivage réducteur des colorants azoïques (Centre commun de recherche de la Commission européenne 2001).
4.1.2 DMD
Les diisocyanates de méthylènediphényle ne sont pas présents de façon naturelle dans l'environnement. D'après les renseignements recueillis dans le cadre d'une enquête réalisée en vertu de l'article 71 de la LCPE (Environnement et Changement climatique Canada 2012a), on n'a signalé aucune fabrication au-dessus du seuil de déclaration de 100 kg pour le 4,4'-DMD (n° CAS 101-68-8), le pDMD (n° CAS 9016-87-9) et les DMD mélangés (n° CAS 26447-40-5) en 2011. La quantité de DMD importés au Canada en 2011 a été déterminée être dans la plage de 10 à 100 millions kg (Environnement et Changement climatique Canada 2012a). Les quantités importées de 4,4'-DMD (n° CAS 101-68-8) et de pDMD (n° CAS 9016-87-9) étaient comprises dans la plage de 10 à 100 millions kg chacune et la quantité importée de DMD mélangés (n° CAS 26447-40-5) variait de 1 à 10 millions kg (Environnement et Changement climatique Canada 2012a). On a déclaré de plus faibles quantités de 2,4'-DMD (n° CAS 5873-54-1) et de 2,2'-DMD (n° CAS 2536-05-2) (entre 100 000 et 1 million kg, et entre 100 et 1000 kg, respectivement) importées au Canada, ce qui indique que ces isomères peuvent être dans le commerce individuellement et intégrés au 4,4'-DMD, au pDMD ou aux DMD mélangés (Environnement et Changement climatique Canada 2012a).
Ailleurs, les DMD ont été désignés comme substances chimiques produites en grande quantité par l'Environmental Protection Agency des États-Unis et l'Organisation de coopération et de développement économiques (OCDE) (OCDE 2003, USEPA 2011).
4.2 Utilisations
4.2.1 MDD
D'une manière générale, les méthylènediphényldiamines sont principalement utilisés comme produits intermédiaires dans les procédés de fabrication. Globalement, plus de 98 % de tous les pMDD produits sont utilisés comme produits intermédiaires dans la production en système fermé de pDMD et, par la suite, d'autres isomères des DMD (NTP 2011; Amini et Lowenkron 2003; Centre commun de recherche de la Commission européenne 2001). Moins de 2 % des MDD sont utilisés en tant qu'autres produits intermédiaires chimiques et produits de traitement dans la production de polymères à haute performance et d'élastomères au polyuréthane, de mousses, de revêtements, d'adhésifs et de résines (NTP 2011; Centre commun de recherche de la Commission européenne 2001). Les MDD sont utilisés à diverses fins, notamment comme réactifs analytiques pour l'analyse des métaux et du sulfate, inhibiteur de la corrosion et antioxydant, agent de finition pour le soudage, et produit de traitement dans le caoutchouc (NTP 2011). Ils peuvent être utilisés comme produit intermédiaire dans la production de colorants azoïques. Aux États-Unis, les MDD sont utilisés comme agent de réticulation dans les résines époxydes (NTP 2011). La Food and Drug Administration des États-Unis a approuvé l'utilisation de résines époxydes pour revêtir des conteneurs de grande capacité (plus de 1000 gallons) prévus pour contenir de façon répétée des boissons dont la teneur en alcool est de 8 % (NTP 2011).
Au Canada, les renseignements sur les utilisations industrielles et de consommation des MDD ont été déclarés en réponse à une enquête réalisée aux termes de l'article 71 de la LCPE (Environnement et Changement climatique Canada 2012a). Le 4,4'-MDD est mélangé à un produit utilisé comme catalyseur pour les procédés industriels et le pMDD est mélangé à un produit servant à enduire les machines. Les renseignements obtenus dans le cadre de cette enquête n'indiquent pas d'utilisations dans les produits de consommation qui entraîneraient une exposition de la population générale (Environnement Canada 2012a). Par ailleurs, on a signalé que le 4,4'-MDD était utilisé comme congénère intermédiaire dans la production de colorants azoïques, en particulier le Cartasol jaune et les colorants acides à base de benzidine (Environnement et Changement climatique Canada 2012a).
Au Canada, les MDD ne sont pas inscrits dans la Base de données sur les produits pharmaceutiques (BDPP) ou dans la Base de données interne sur les ingrédients non médicinaux de la Direction des produits thérapeutiques à titre d'ingrédient médicinal ou non médicinal présent dans des produits pharmaceutiques ou des médicaments vétérinaires (BDPP 2010; courriels adressés en 2011 par la Direction des produits thérapeutiques de Santé Canada au Bureau de gestion du risque de Santé Canada, source non citée). Les MDD ne sont pas répertoriés dans la Base de données sur les ingrédients des produits de santé naturels (BDIPSN) (BDIPSN 2013) comme ingrédients des produits de santé naturels et ne figurent pas dans la Base de données sur les produits de santé naturels homologués (BDPSNH) comme étant présents dans les produits de santé naturels actuellement autorisés (BDPSNH 2013). Aucun produit agricole ou pesticide contenant du 4,4'-MDD n'a été déterminé par l'Agence de réglementation de la lutte antiparasitaire (ARLA) (courriels de 2013 de l'ARLA, Santé Canada, au Bureau de gestion du risque, Santé Canada; source non citée). Les MDD ne figurent pas sur les Listes des additifs alimentaires autorisés en tant qu'additif alimentaire approuvé en vertu de la Loi sur les aliments et drogues (Canada 1978) et des autorisations de mise en marché connexes. D'après les renseignements disponibles soumis au Programme des cosmétiques de Santé Canda en vertu du Règlement sur les cosmétiques, les MDD ne devraient pas être utilisés dans les produits cosmétiques au Canada (courriels de 2013 de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau de l'évaluation des risques des substances existantes de Santé Canada; source non citée).
4.2.2 DMD
D'une manière générale, les DMD sont largement utilisés dans la production de polyuréthanes et en tant qu'adhésifs dans la production de produits du bois d'ingénierie. Les DMD remplacent de plus en plus les diisocyanates de toluène (TDI) dans la production de mousses flexibles et rigides, les panneaux de particules et les liants pour bois, les peintures et les revêtements, les adhésifs, les produits d'étanchéité, les élastomères, matériaux de plâtrage et les fibres spandex (Centre commun de recherche de la Commission européenne 2005; USEPA 2011; Björkner et coll. 2001, Methner et coll. 2000). De plus en plus, les DMD sont utilisés pour remplacer le formaldéhyde comme liant à base de résine dans la fabrication de panneaux à copeaux orientés (Environnement et Changement climatique Canada 2012a).
Dans le cas de la mousse flexible, on fait réagir les DMD avec des polyéthérols ou polyestérols en milieu industriel pour former des feuilles de mousse souple ou des pièces moulées qui sont ensuite utilisées pour fabriquer du mobilier, comme des canapés et des matelas, des mousses de rembourrage dans le secteur de l'automobile, des sous-tapis de plancher et d'autres mousses d'emballage (Centre commun de recherche de la Commission européenne 2005; Hoffman et Schupp 2009).
La mousse rigide et les produits CASE (revêtements, colles, bouche-pores et élastomères [Coatings, Adhesives, Sealants, Elastomers]) en polyuréthane sont également fabriqués à partir de DMD, qui sont ensuite utilisés dans les secteurs de la construction, du transport, des machines, de l'emballage et du mobilier (Centre commun de recherche de la Commission européenne 2005). Les articles manufacturés représentent une vaste utilisation commerciale des DMD. Ces types de produits existent également sous la forme de produits de bricolage utilisés par les consommateurs pour les projets d'amélioration de la maison, c.-à-d. des produits dans lesquels les DMD réagissent avec les polyols pour former une mousse rigide ou des produits CASE dès leur application, comme les produits d'étanchéité autour des fenêtres ou des portes, les isolants à l'intérieur des murs ou les adhésifs pour le sol (Centre commun de recherche de la Commission européenne 2005).
Les textiles et les pistes de sport constituent également des utilisations mineures de polyuréthanes faits à partir de DMD (Booth et coll. 2009; Björkner et coll. 2001).
Au Canada, des utilisations industrielles et de consommation de DMD ont été déclarées dans le cadre d'une enquête réalisée en vertu de l'article 71 de la LCPE (Environnement Canada 2012a). Une utilisation de 10 à 100 millions kg a été déclarée au Canada, dont une partie était disponible pour une utilisation par les consommateurs (Environnement et Changement climatique Canada 2012a).
Au Canada, l'utilisation de DMD a été déclarée pour la fabrication de mousse souple et rigide en polyuréthane, d'élastomères, de revêtements, d'adhésifs et de produits d'étanchéité, qui sont ensuite utilisés dans d'autres secteurs tels que le mobilier, la construction et l'automobile. D'autres articles manufacturés, tels que les panneaux à copeaux orientés, les panneaux de particules et d'autres produits du bois, sont fabriqués au Canada pour être ensuite utilisés en construction (Environnement Canada 2012a). Plusieurs sites industriels canadiens utilisent les pDMD et les DMD pour les produits du bois d'ingénierie, souvent conjointement, dans des quantités combinées qui varient de 400 000 kg par an à près de 6 millions kg par an et par site (Environnement et Changement climatique Canada 2012a). Les DMD sont également utilisés dans les matériaux de plâtrage par les professionnels à des fins médicales (3M 2010, 2011). De plus, les articles manufacturés contenant des DMD (comme les stratifiés d'emballage souple) sont importés aux fins d'utilisation (Environnement et Changement climatique Canada 2012a).
Des renseignements sur les produits de consommation sont également recueillis dans le domaine public par l'intermédiaire des points de vente au détail et des sites Web canadiens et sont pris en compte dans le présent rapport. Les utilisations de produits de consommation comportent plusieurs produits de bricolage tels que les adhésifs, la mousse isolante et les produits d'étanchéité (HPD 2013; HSDB 1983-2003).
Les DMD présents dans ce groupe ne figurent pas en tant qu'additifs alimentaires approuvés sur les Listes des additifs alimentaires autorisés, incorporées par renvoi dans les Autorisations de mise en marché d'additifs alimentaires, délivrées en vertu de la Loi sur les aliments et drogues (Canada 1985). D'après une présentation en vertu de l'article 71, les DMD figurent comme composant des adhésifs utilisés dans les emballages alimentaires disponibles sur le marché (Environnement et Changement climatique Canada 2012a); cependant, leur migration dans les aliments ne devrait pas se produire. Les DMD sont également utilisés dans la fabrication d'un fil de polyuréthane, qui peut être utilisé dans les emballages alimentaires au Canada (courriels de 2012 de la Direction des aliments de Santé Canada au Bureau de gestion du risque de Santé Canada; source non citée).
Au Canada, les DMD présents dans ce groupe ne sont pas inscrits dans la Base de données sur les produits pharmaceutiques (BDPP) ou dans la Base de données interne sur les ingrédients non médicinaux de la Direction des produits thérapeutiques à titre d'ingrédient médicinal ou non médicinal présent dans des produits pharmaceutiques ou des médicaments vétérinaires (BDPP 2010; courriels adressés en 2011 par la Direction des produits thérapeutiques de Santé Canada au Bureau de gestion du risque de Santé Canada, source non citée). Les DMD ne sont pas répertoriés dans la BDIPSN comme ingrédients de produits de santé naturels et ne figurent pas dans la BDPSNH comme étant présents dans les produits de santé naturels autorisés actuellement (BDIPSN 2013; BDPSNH 2013). D'après les renseignements disponibles soumis au Programme des cosmétiques de Santé Canada en vertu du Règlement sur les cosmétiques, les substances DMD ne devraient pas être utilisées dans les produits cosmétiques au Canada (courriels de 2013 de la Direction de la sécurité des produits de consommation (DSPC) de Santé Canada au Bureau d'évaluation du risque des substances existantes (BERSE); source non citée). Aucun produit agricole ou pesticide contenant des DMD n'a été déterminé par l'Agence de réglementation de la lutte antiparasitaire (ARLA) (courriels de 2013 de l'ARLA, Santé Canada, au Bureau de gestion du risque, Santé Canada; source non citée).
5. Rejets dans l'environnement
Les rejets anthropiques d'une substance dans l'environnement dépendent de différentes pertes qui surviennent pendant la fabrication, l'utilisation industrielle, l'utilisation commerciale et par les consommateurs, ainsi que l'élimination d'une substance. Afin d'estimer les rejets potentiels dans l'environnement à différentes étapes du cycle de vie d'une substance, Environnement et Changement climatique Canada compile des renseignements sur les secteurs pertinents et les gammes de produits ainsi que sur les facteurs d'émissionNote de bas de page2dans les eaux usées, le sol et l'air à différentes étapes du cycle de vie, en vue de déterminer celles qui contribuent le plus aux concentrations environnementales. Nous avons également tenu compte des activités de recyclage et de transfert vers les sites d'élimination des déchets (sites d'enfouissement, incinération).
Cette information est utilisée pour développer davantage les scénarios de caractérisation de l'exposition afin d'estimer les concentrations environnementales qui en découlent.
Les rejets de substances MDD et DMD faisant partie de ce groupe sont présentés dans les deux sections suivantes. Des résumés sur les rejets de substances du groupe des DMD et MDD dus aux activités industrielles et aux utilisations commerciales et de consommation sont également présentés. L'élimination en fin de vie utile est présentée collectivement pour les substances MDD et DMD puisqu'on peut s'attendre à une conversion des DMD en MDD.
5.1 Rejets de substances MDD
Le 4,4'-MDD figure sur la liste des substances à déclarer en vertu de l'Inventaire national des rejets de polluants (INRP); toutefois, aucun rejet n'a été signalé pour les années 2008-2013 (INRP 1995a). Le pMDD ne figure pas sur la liste de l'Inventaire national des rejets de polluants (INRP 1995b). On n'a recensé aucune donnée de surveillance pour la substance MDD au Canada.
En raison des faibles quantités de cette substance sur le marché au Canada (Environnement et Changement climatique Canada 2012a), les rejets dans l'environnement découlant des utilisations industrielles devraient être négligeables. Une forme de 4,4'-MDD est importée au Canada pour être transformée en un produit destiné à une utilisation industrielle au Canada. À la fin du cycle de vie, les préparations consommées sont éliminées à une installation de matières dangereuses en raison de la présence d'autres matières dangereuses. D'après les renseignements obtenus par l'enquête réalisée en vertu de l'article 71, le 4,4'-MDD ne devrait pas être présent dans les produits industriels ou de consommation (Environnement et Changement climatique Canada 2012a).
5.2 Rejets de substances DMD
5.2.1 Rejets de substances DMD dus à des activités industrielles
Des rejets de pDMD et de 4,4-DMD dans l'air, ainsi que les rejets totaux sur place ont été déclarés pour les années 2008 à 2013 (INRP 1995c). Le résumé de l'INRP concernant les rejets de 4,4'-DMD dans l'air provenant des installations industrielles au Canada pour 2013 indiquait 3,4 tonnes, avec des rejets totaux sur place de 6,7 tonnes (INRP 1995c). Les rejets déclarés de 4,4'-DMD dans l'air étaient de 14, 15, 4,8, 1,5 et 1,4 tonnes pour les années 2008, 2009, 2010, 2011 et 2012, respectivement (INRP 1995c)Note de bas de page3. Les rejets totaux sur place de 4,4'-DMD pour ces années étaient identiques (pas de rejet additionnel sur la terre ou dans les eaux de surface) (INRP 1995c). Le résumé de l'INRP concernant les rejets de pDMD dans l'air par des installations industrielles au Canada pour 2013 indiquait 0,13 tonne, avec des rejets totaux sur place de 1,8 tonne (INRP 1995c). Pour les années précédentes, les rejets de pDMD déclarés dans l'air étaient de 8, 4, 6, 1,5 et 0,3 tonnes respectivement pour 2008, 2009, 2010, 2011 et 2012, (INRP 1995c). Les rejets totaux correspondants de pDMD sur place étaient identiques (pas de rejet additionnel sur la terre ou dans les eaux de surface). Aucun rejet dans les eaux de surface n'a été signalé au cours de l'une ou l'autre des périodes de déclaration de l'INRP, que ce soit pour le 4,4'-DMD ou le pDMD.
Selon les renseignements reçus de l'industrie canadienne, les substances DMD ne sont pas fabriquées ou préparées au Canada (Environnement et Changement climatique Canada 2012a). Les pertes estimées indiquent que les substances dans le sous-groupe des DMD peuvent être rejetées dans l'environnement, principalement dans l'air pendant l'utilisation industrielle, telle que la production de produits de bois d'ingénierie et de polyuréthane.
Selon les données de surveillance internationales (voir la section 5.3, Concentrations environnementales mesurées) et les renseignements présentés à Environnement Canada (2012a), on estime que les installations de fabrication de panneaux à copeaux orientés entraînent des rejets plus élevés que d'autres types d'installations utilisant des DMD, aussi bien en termes de quantité de substance utilisée que de leurs rejets proportionnels connexes.
Dans les installations de fabrication de panneaux à copeaux orientés, les DMD (transformés en produits) sont ajoutés aux copeaux de bois pour assurer l'adhésion au bois. Les matériaux mélangés sont ensuite pressés et chauffés pour réaliser des panneaux à copeaux orientés thermodurcis. Enfin, les produits sont taillés, sciés et peints (USEPA 2002). Les retailles de coupe et la sciure de ponçage provenant des panneaux à copeaux orientés finis sont souvent utilisées comme combustible pour les brûleurs (NCASI 2012). D'après le NCASI (2012), certains DMD inaltérés peuvent être présents dans les retailles de coupe et la sciure de ponçage. Toutefois, les facteurs d'émission fournis par le NCASI (2012) n'indiquent pas un potentiel de rejet important lorsque les retailles de coupe sont brûlées. Les rejets potentiels de substances DMD peuvent se produire entre l'ajout de la résine aux copeaux de bois à l'étape de mélange et le thermofixage dans la presse à panneaux à copeaux orientés. Une fois traitées, les substances DMD n'existent plus en tant que telles. L'eau de traitement n'est pas rejetée par la presse, mais des DMD peuvent être rejetés dans l'air. Selon le National Council for Air and Stream Improvement (NCASI 2012), le rejet le plus élevé d'une seule installation au Canada est de 920 kg de DMD par an et est attribuable à la production de 300 millions de pieds carrés de panneaux à copeaux orientés par an, qui nécessiterait 3 450 000 kg (3450 tonnes) de DMD. À partir de cette information, un facteur d'émission pour les rejets de DMD dans l'air a été estimé à 0,027 % et constitue un facteur d'émission prudent.
Selon les renseignements de l'industrie et la littérature, les substances DMD peuvent aussi être rejetées dans l'air pendant la production de mousse ou d'adhésifs. Toutefois, on s'attend à ce que les quantités émises soient inférieures à celles des installations de fabrication de panneaux à copeaux orientés (Environnement et Changement climatique Canada 2012a; ACC 2012). Les données de surveillance et les lignes directrices liées à la déclaration des émissions indiquent que l'ampleur des rejets dans l'air découlant de ces types de production industrielle est inférieure à celle des rejets issus de la fabrication de panneaux à copeaux orientés (Allport et coll. 2003; Acton 2001; ACC 2012a). Les DMD sont également utilisés pour la préparation et l'application des adhésifs par les industries ou d'autres utilisateurs. Toutefois, la méthode typique d'application des adhésifs contenant des DMD n'est pas bien comprise, d'après les renseignements reçus des industries (Environnement et Changement climatique Canada 2012a). Néanmoins, on pense que le potentiel de rejets dans l'air pendant l'application industrielle d'adhésifs est négligeable étant donné que la pression de vapeur du produit chimique est inférieure à 0,13 Pa (OCDE 2011).
Les quantités de DMD rejetés dans l'air par des sources industrielles peuvent davantage contribuer au dépôt dans le sol ou les eaux de surface des environs.
5.2.2 Rejets de substances DMD au cours d’utilisations commerciales et de consommation
Deux types principaux de produits sont fabriqués à l'aide des DMD : les panneaux de copeaux orientés et les produits en mousse de polyuréthane (PU) souple ou rigide. Dans l'industrie, on emploie les DMD comme réactifs intermédiaires pour permettre la formation du polyuréthane. D'après les renseignements fournis par l'industrie (Environnement et Changement climatique Canada 2012a), on suppose que les substances DMD réagiront presque entièrement pendant le processus de traitement. Par conséquent, les panneaux à copeaux orientés et les produits de polyuréthane ne devraient pas contenir de DMD résiduel ou, le cas échéant, dans une très faible concentration.
En théorie, les rejets de DMD dans l'air dus aux panneaux à copeaux orientés sont possibles, mais la migration de tout DMD résiduel dans la matrice solide des matériaux est jugée difficile. En outre, beaucoup de ces produits sont conçus pour une utilisation à l'intérieur ou seront protégés contre les agents atmosphériques, et donc des rejets dans l'eau ne sont donc pas prévus (Environnement et Changement climatique Canada 2012a).
5.2.3 Rejets de substances MDD et DMD découlant de l'élimination en fin de vie utile
En raison de la nature des produits et des matériaux contenant des DMD, de grandes quantités de ces matériaux et produits qui ont été formés à partir de substances DMD comme matériaux de départ sont éliminées dans les sites d'enfouissement. Sachant que la mousse de polyuréthane sera largement éliminée dans les sites d'enfouissement à la fin du cycle de vie, Brown (source non citée) [tel que le décrit DeGaspari (1999)] a évalué la dégradation potentielle de la mousse de polyuréthane dans des conditions de site d'enfouissement. Après 700 jours dans des conditions de site d'enfouissement, aucune preuve de rejet des MDD ou de biodégradation de produits de mousse contenant des DMD n'a été observée. La substance MDD n'a pas été détectée dans le lixiviat des sites d'enfouissement. Selon DeGaspari (1999) et Brown (source non citée), les mousses en polyuréthane standard sont essentiellement inertes dans des conditions de site d'enfouissement et ne devraient pas rejeter d'amine aromatique dans l'environnement. Un rapport préparé par Environnement et Changement climatique Canada précise également que les substances DMD et MDD ne devraient pas se retrouver dans le lixiviat des sites d'enfouissement (CRA 2012).
5.2.4 Rejets de substances DMD à la suite de déversements dans l'environnement
Au Canada, deux déversements dans l'environnement de DMD ont été documentés ces dernières années, en 1999 et 2001 [communication personnelle, division des urgences environnementales (Environnement et Changement climatique Canada) à la Division des évaluations écologiques (Environnement et Changement climatique Canada), en date du 23 septembre 2013; source non citée]. La nature de ces déversements était considérée comme mineure à modérée. Dans l'un des cas, environ 200 litres de DMD ont été déversés sur le sol en raison de la fuite d'un conteneur pendant son transport en Ontario et la substance a été confinée sur place. L'autre déversement s'est produit en Colombie-Britannique à la suite d'une élimination inadéquate, dans un conteneur à ordures, de contenants renfermant environ 160 litres de 4,4'-DMD. Une certaine quantité de la substance a donc coulé du conteneur au sol. Dans les deux cas, les déversements ont été confinés et n'ont pas entraîné la contamination des milieux aquatiques.
5.3 Concentrations environnementales mesurées
Les données de surveillance environnementales pour les substances MDD et DMD dans le groupe n'étaient pas disponibles pour les sites au Canada. Toutefois, le 4,4'-MDD et certains DMD ont été décelés ailleurs. Les concentrations environnementales disponibles et les détails pertinents relatifs aux méthodes d'échantillonnage en Europe, aux États-Unis et au Japon sont résumés ci-dessous. Certains DMD ont été mesurés dans l'air dans des emplacements situés près des sources (Ecoff et Lambach 2012) et des MDD ont été mesurés dans les effluents d'eaux usées rejetées directement dans les eaux de surface (CHRIP 2008; Agence environnementale du Japon 2000), dans les eaux usées (OCDE 2002) et dans les sédiments (CHRIP 2008). Aucune recommandation environnementale n'était disponible dans le cas des échantillons dans le sol, que ce soit pour les MDD ou pour les DMD faisant partie du groupe. L'annexe D fournit une liste des sites d'échantillonnage ainsi que les concentrations décelées de substances MDD et DMD dans le groupe. L'annexe D contient une liste des sites d'échantillonnage et des concentrations de substances MDD et de DMD détectées.
5.3.1 Air
D'après les déclarations dans l'ensemble de données de dépistage (SIDS) de l'OCDE pour le 4,4'-méthylènedianiline (n° CAS 101-77-9), les concentrations atmosphériques de 4,4'-MDD, associées aux rejets de la substance en Europe étaient négligeables (OCDE 2002). Les détails portant sur les procédures d'échantillonnage et les sites géographiques n'ont pas été fournis.
Des DMD monomères et des types de substance DMD à trois cycles ont été détectés dans l'air à une variété d'emplacements situés près de la source, notamment près d'installations commerciales de mousse en polyuréthane giclé et d'installations de fabrication des panneaux à copeaux orientés. Bien que les filtres imprégnés d'un réactif de dérivatisation ou d'impacteurs contenant des réactifs de dérivatisation aient été utilisés pour recueillir des espèces de DMD, y compris la fraction aérosol, les particules d'aérosols de moins de 2 μm ne sont pas recueillies efficacement par un impacteur et les espèces de DMD présentes dans les grosses particules ne sont pas dérivatisées efficacement lorsqu'elles sont recueillies sur les filtres imprégnés d'un réactif de dérivatisation (Streicher et coll. 1994). Par conséquent, l'utilisation des méthodes d'échantillonnage permettant de recueillir la phase gazeuse et la phase aérosol éviterait la sous-estimation des concentrations totales présentes.
Les concentrations dans l'air de « DMD libres » et, dans certains cas, d'oligomères à cycles supérieurs (3 et plus) provenant des pDMD généralement mesurés à l'aide d'impacteurs ou de filtres dans divers sites industriels et commerciaux aux États-Unis et en Europe, ont été rapportées dans les publications avec comité de lecture, les rapports techniques et les comptes rendus de conférence, dont une bonne partie a été résumée dans Allport et coll. (2003). Les concentrations de DMD dues à la fabrication de mousse, à la fabrication de moulage de mousse, au laminage à la flamme et à la fabrication de produits forestiers (panneaux à copeaux orientés, panneaux de fibres) variaient de moins de 0,1 μg/m3 à plus de 1000 μg/m3 dans les émissions de cheminée ou d'évent sans technologie de réduction en place (le tableau D1 de l'annexe D présente des valeurs précises pour chaque type d'installation échantillonné). Des échantillons de surveillance de zone ont été prélevés en combinant des échantillonneurs d'impacteurs et de filtres à 25 pieds à gauche, à droite et derrière l'application, et à 50 pieds sous le vent de l'application à quatre sites de travail spécialisés dans la mousse en polyuréthane giclé (Ecoff et Lambach 2012). Des monomères DMD (2,4'- et 4,4'-DMD uniquement) ont été détectés dans 11 des 18 échantillons de zone prélevés sur les quatre sites à 25 pieds à des concentrations totales comprises entre 1,0 et 23,9 μg/m3, avec une concentration moyenne de 9,5 μg/m3 (les oligomères supérieurs n'ont été décelés que dans 4 des 18 échantillons à 25 pieds). À 50 pieds en aval du site d'application, des concentrations détectables de monomères DMD ont été mesurées à deux des trois sites de travail à des valeurs comprises entre 1,0 et 3,9 μg/m3 (aucun oligomère supérieur n'a été détecté à cette distance).
5.3.2 Eau
Dans une enquête portant sur plusieurs substances chimiques pertinentes sur le plan commercial et réalisée par l'Agence environnementale du Japon, le 4,4'-MDD a été surveillé dans des échantillons prélevés dans diverses eaux de surface (provenant de la mer, de lacs, de marais et de rivières de partout au Japon) entre 1985 et 2008, avec une augmentation générale dans la concentration observée avec le temps (CHRIP 2008; Agence environnementale du Japon 2000). Les sites d'échantillonnage surveillés ont été choisis pour étudier de la meilleure façon possible la persistance des produits chimiques dans l'environnement. Les sites où les substances chimiques étudiées pourraient être rejetées (p. ex., point de rejet des usines de traitement des eaux usées ou installations industrielles où l'importation ou la fabrication était connue) ont été volontairement omis. Par conséquent, cette enquête ne tient pas compte des sites environnants; on note également que les résultats de l'enquête ne reflètent pas les concentrations potentielles environnantes de MDD.
Au Japon, le 4,4'-MDD n'a pas été décelé dans les échantillons d'eau de surface prélevés en 1985, en 1995 ou en 1998 (CHRIP 2008). Dans les échantillons d'eau de surface prélevés dans 28 sites d'échantillonnage de partout au Japon en 2008, 11 sites affichaient des concentrations détectables de 4,4'-MDD, dont les valeurs variaient de la limite de détection de 0,001 μg/L à 0,016 μg/L (CHRIP 2008). Pour 1989, le 4,4'-MDD a été détecté, selon les déclarations, dans un site d'échantillonnage sur 24 à une très faible concentration comprise entre 0,00001 et 0,0001 μg/L (CHRIP 2008). Cette concentration est environ 100 fois plus faible que la limite de détection disponible en 2008, et il est probable qu'elle ne soit pas fiable. Les données disponibles pour les eaux de surface et les eaux usées sont présentées au tableau D2 de l'annexe D.
En Europe, les données de surveillance de l'industrie provenant des usines de traitement des eaux usées affichaient des niveaux de 4,4'-MDD inférieurs à 500 μg/L (OCDE 2002; communication personnelle, courriel de l'Agence fédérale allemande pour l'Environnement à Environnement et Changement climatique Canada, en date du 8 janvier 2013; source non citée). Cette information a été reprise dans l'ensemble de données de dépistage (SIDS) de l'OCDE pour le 4,4'-méthylènedianiline (n° CAS 101-77-9) (OCDE 2002); toutefois, on ne disposait pas de données individuelles et de sites d'échantillonnage.
En raison du taux rapide d'hydrolyse des DMD faisant partie du groupe des DMD/MDD, on ne devrait pas les trouver dans les milieux aquatiques.
5.3.3 Sols
D'après les déclarations dans l'ensemble de données de dépistage (SIDS) de l'OCDE pour le 4,4'-méthylènedianiline (n° CAS 101-77-9), les concentrations dans le sol de 4,4'-MDD étaient négligeables (OCDE 2002). Les détails portant sur les procédures d'échantillonnage et les sites n'ont pas été fournis.
Les concentrations dans le sol de DMD faisant partie du groupe des DMD/MDD n'ont pas été déterminées. Les substances DMD devraient s'hydrolyser en contact avec l'eau présente dans le sol, ce qui ne devrait donc pas conduire à des concentrations importantes dans ce milieu naturel.
5.3.4 Sédiments
Tout comme les substances chimiques pertinentes au plan commercial ont été surveillées dans les eaux de surface par l'Agence environnementale du Japon, les sédiments ont fait l'objet d'une étude entre 1985 et 1998. Les sites d'échantillonnage des sédiments ont été choisis d'après les mêmes critères que pour les eaux de surface, c.-à-d. les sites connus pour subir des rejets de produits chimiques ont été omis.
Dans cette enquête, des concentrations de 4,4'-MDD ont été déclarées dans les sédiments benthiques recueillis dans plusieurs sites de partout au Japon (CHRIP 2008). Les niveaux de 4,4'-MDD variaient de la limite de détection de 0,02 μg/g poids sec à 2,1 μg/g poids sec en 1998 (détecté à 15 des 33 sites d'échantillonnage) et de 0,036 à 0,88 μg/g poids sec en 1995 (détecté à 6 des 23 sites d'échantillonnage) (CHRIP 2008). Les données disponibles pour les sédiments figurent à l'annexe D (tableau D3).
Étant donné qu'il est peu probable que les substances DMD s'accumulent jusqu'à atteindre des concentrations importantes dans l'eau en raison de leur hydrolyse rapide, les concentrations dans les sédiments devraient être négligeables.
6. Devenir dans l'environnement
6.1 Distribution dans l'environnement
6.1.1 MDD
Le modèle de fugacité de niveau III (New EQC 2011) simule la distribution d'une substance dans un environnement d'évaluation hypothétique appelé « monde unitaire ». Le modèle EQC simule la distribution dans l'environnement d'une substance chimique à l'échelle régionale (à savoir, 100 000 km2) et permet d'obtenir la fraction de la masse totale dans chaque milieu provenant d'une émission dans le monde unitaire et les concentrations qui en résultent dans chaque milieu. Environnement et Changement climatique Canada utilise seulement les résultats de la distribution masse-fraction comme renseignements généraux sur le devenir dans l'environnement d'une substance et n'utilise habituellement pas les résultats des concentrations compartimentales pour la concentration prévue dans l'environnement (CPE) dans l'évaluation d'une substance. Il peut y avoir quelques exceptions, par exemple lorsqu'un rejet grandement dispersif d'une substance permet de croire que les concentrations à l'échelle régionale sont appropriées pour la CPE.
La distribution masse-fraction pour le 4,4'-MDD et les composants du pMDD est présentée dans le tableau 6.1 à l'aide des émissions constantes uniques dans l'atmosphère, l'eau et le sol. Le modèle EQC de niveau III prend pour hypothèse des conditions hors de l'équilibre entre les milieux naturels, mais des conditions à l'équilibre au sein de chaque milieu. Les résultats du tableau 6.1 représentent les effets nets du partage chimique, du transport entre divers milieux et de la perte tant par le processus d'advection (hors de la région modélisée) que par ceux de la dégradation ou de la transformation.
Les résultats de la modélisation de la fugacité de niveau III semblent indiquer que le 4,4'-MDD devrait demeurer principalement dans le sol (en raison des dépôts atmosphériques ou en raison de la pénétration directe dans le sol), l'eau ou les sédiments, tandis que des oligomères supérieurs demeureront principalement dans le sol ou les sédiments et en quantités faibles uniquement dans l'eau, selon le milieu de rejet dans chaque cas.
Tableau 6-1. Résumé de la modélisation de la fugacité de niveau III (New EQC 2011) pour le 4,4'-MDD et les composants du pMDD, indiquant le pourcentage de substance ou de composant de substance réparti dans chaque milieu
| Rejet de la substance dans : | Air | Eau | Sol | Sédiment |
|---|---|---|---|---|
| Air (100%) | 0,0 | 1,7-2,5 | 96,7-97,7 | 0,6-0,8 |
| Eau (100%) | 0,0 | 71,3-76,7 | 0,0 | 23,3-28,7 |
| Sol (100%) | 0,0 | 0,2 | 99,7-99,8 | 0,0-0,1 |
Données d'entrée du modèle : Demi-vies dans l'eau, le sol et les sédiments de 2400 à 4368 heures, de 2400 à 4368 heures et de 9600 à 17 472 heures, respectivement et log Kco de 3,7 (moyenne de la plage de valeurs présentées à l'annexe A).
| Rejet de la substance dans : | Air | Eau | Sol | Sédiment |
|---|---|---|---|---|
| Air (100%) | 0,0 | 0,8 | 88,0 | 11,2 |
| Eau (100%) | 0,0 | 6,5 | 0,0 | 93,5 |
| Soil (100%) | 0,0 | 0,0 | 99,9 | 0,1 |
Données d'entrée du modèle : Demi-vies dans l'eau, le sol et les sédiments de 4368 heures, de 4368 heures et de 17 472 heures, respectivement et log Kco de 5,3 (valeur présentée à l'annexe A).
| Rejet de la substance dans : | Air | Eau | Sol | Sédiment |
|---|---|---|---|---|
| Air (100%) | 0,0-0,4 | 0,3 | 80,9-81,3 | 18,4 |
| Eau (100%) | 0,0 | 1,6 | 0,0 | 98,4 |
| Soil (100%) | 0,0 | 0,0 | 99,9 | 0,1 |
Données d'entrée du modèle : Demi-vies dans l'eau, le sol et les sédiments de 4368 heures, de 4368 heures et de 17 472 heures, respectivement, log Kco de 7,4 (MDD à quatre cycles) et log Kco de 9,4 (MDD à cinq cycles) (valeur présentée à l'annexe A).
Étant donné la faible pression de vapeur et le taux relativement élevé de dégradation atmosphérique prévu concernant le 4,4'-MDD et les oligomères pMDD supérieurs (MDD à trois, quatre et cinq cycles), ni le 4,4'-MDD ni le pMDD ne devraient être présents en grandes quantités dans l'atmosphère [moins de 1 % prévu par le nouveau modèle EQC (2011)]. Dans une atmosphère d'essai générée par vaporisation de résine époxyde contenant un durcisseur de 4,4'-MDD, aucune différence dans l'efficacité de prélèvement des échantillons concernant le 4,4'-MDD n'a été observée lorsque des filtres tapissés de fibre de verre et revêtus d'acide ainsi que des filtres simples en Téflon ont été utilisés, ce qui indique que le 4,4'-MDD existe principalement sous forme d'aérosol dans l'atmosphère et qu'il serait donc susceptible d'être éliminé de l'atmosphère par la pluie ou la neige et par les dépôts secs (Gunderson et Anderson 1988; Bidleman 1988).
Il a été déterminé que les amines, y compris l'aniline, formaient des liaisons covalentes avec les groupes quinone dans les substances humiques (Thorn et coll. 1996) généralement présentes dans le sol et les sédiments. En outre, Cowen et coll. (1998) ont indiqué que le 4,4'-MMD est adsorbé dans le sol de façon légèrement plus importante dans des conditions aérobies que dans des conditions anaérobies. Les valeurs élevées de log Kco comprises entre 3,6 et 3,8 pour le 4,4'-MDD et les valeurs très élevées variant de 5,3 à 9,4 pour les oligomères pMDD laissaient entendre que les substances MDD avaient tendance à se répartir facilement dans la matière organique dans les sédiments et dans le sol. Cette tendance a également été prévue par la modélisation EQC (New EQC 2011). Selon les données de surveillance environnementales obtenues au Japon (décrites précédemment dans le présent rapport; CHRIP 2008), le 4,4'-MDD a été détecté dans les échantillons d'eau et de sédiments provenant de plusieurs sites. Ces données de surveillance corroborent la prévision du modèle EQC selon laquelle les rejets dans l'eau entraîneront probablement une répartition dans les sédiments, tandis qu'une certaine quantité de 4,4'-MDD demeurera dans l'eau. Selon les résultats d'une étude sur la transformation aérobie et anaérobie dans des systèmes de sédiments aquatiques (OECD 308) avec du 4,4'-MDD, il semble que la majeure partie (54 à 90 %) du 4,4'-MDD demeure liée aux sédiments (en particulier dans les milieux aérobies, dans lesquels les groupes quinones sont abondants) (Schaefer et Ponizovsky 2013). La liaison covalente du 4,4'-MDD aux substances humiques ne serait pas prévue par la modélisation EQC, et par conséquent, les résultats du modèle donnent probablement des prévisions inférieures à la véritable répartition du 4,4'-MDD dans les sédiments.
D'après la faible pression de vapeur et les valeurs modérées à élevées du log Kco, lorsqu'ils sont rejetés dans l'air, le 4,4'-MDD et le pMDD devraient se déposer principalement dans le sol où ils devraient être immobiles; on s'attend également, dans une moindre mesure, à ce qu'ils se répartissent dans l'eau, puis dans les sédiments. De même, lorsqu'elles sont rejetées directement dans le sol, les substances MDD resteront principalement dans ce milieu, comme le prévoit le modèle EQC (voir le tableau 6.1). Le modèle de transport et de persistance de niveau III (TaPL3) (TaPL3 2000) et la version 2.2 modèle de dépistage des POP de l'OCDE (OPST) (Scheringer et coll. 2009) ont été utilisés pour estimer la distance de parcours caractéristique (DTC) dans l'air du 4,4'-MDD et du pMDD (en fonction de ses composants). La DTC calculée dans l'air pour le 4,4'-MDD et les oligomères pMDD à trois, quatre et cinq cycles était comprise entre 2 et 110 km à l'aide du modèle TaPL3, et entre 5 et 250 km avec le modèle OPST. Les deux modèles semblent donc indiquer que le 4,4'-MDD et le pMDD ne devraient pas être transportés à longue distance dans l'air.
6.1.2 DMD
Les groupes isocyanates présentent généralement des taux de réactivité élevés avec les composés d'hydrogène actif, tels que les groupes amine et hydroxyle (en particulier les groupes isocyanates dans la position para, comme dans les 4,4'-MDD qui sont soumis à un encombrement stérique moins important que ceux dans la position ortho, comme dans les isomères 2,2'- et 2,4'-) (Arnold et coll. 1956). Par conséquent, le devenir et le comportement des substances dans le sous-groupe des DMD seront fortement touchés par leur réactivité dans les milieux naturels et les propriétés, telles que l'hydrosolubilité, les coefficients de partage basés sur l'eau (c.-à-d. constante de la loi d'Henry, Koe et Kco) et le pKa, n'ont pas de valeur réelle et ne peuvent généralement pas être déterminées avec précision. En conséquence, la modélisation de la fugacité de niveau III (New EQC 2011) n'a pas été établie pour le sous-groupe des DMD.
Les isomères DMD et les composants oligomères en particulier sont hydrophobes et faiblement solubles dans l'eau. Par conséquent, la réaction hétérogène avec l'eau peut être plus lente que pour les substances isocyanates de phényle associées (TDI) évaluées dans le lot 1 du Défi (Canada 2008). Toutefois, Sendijarevic et coll. (2004) ont découvert que même si la réaction du pDMD avec l'eau semblait se produire plus lentement que celle des TDI, après avoir brassé pendant 7 jours (300 rotations par minute) une quantité allant jusqu'à 50 000 mg de TDI et de pDMD (dans des conteneurs séparés) par litre d'eau à température ambiante, la teneur en isocyanate a été mesurée à plus de 8 % pour les TDI et à seulement 0,53 % pour les pDMD. Néanmoins, le produit principal d'une telle réaction est généralement les polyurées, qui ont tendance à se former rapidement en commençant par les bords et en formant une croûte pouvant restreindre la pénétration de l'eau et l'évacuation des amines (p. ex., MDD) (Gilbert 1988; Heimbach et coll. 1996; Brochhagen et Grieveson 1984). Dans des conditions de pénétration très dispersées dans l'environnement, les polyurées devraient également se former, ainsi que des quantités résiduelles d'amines correspondantes (p. ex., le 4,4'-DMD produirait certains 4,4'-MDD résiduels). Pendant plus de 100 jours, Heimbach et coll. (1996) ont ajouté du pDMD (composé de 45 % du monomère 4,4'-DMD) à des concentrations élevées de 1000 mg/L (1 g/L) et de 10 000 mg/L (10 g/L), dans à deux petits étangs artificiels (mésocosmes de réseaux d'eau douce permanents dans une situation représentative d'un déversement). Ils ont constaté que le pDMD avait réagi pour former des polyurées; par ailleurs, ils n'ont décelé aucun monomère DMD ni MDD dans l'eau des étangs (les limites de détection variaient de 4 à 10 μg/L) ou dans les poissons (les limites de détection étaient inférieures à 0,5 mg/kg pour les DMD et inférieures à 1,4 mg/kg pour les MDD). S'inspirant des résultats d'une étude semblable (Heimbach 1993), le Centre commun de recherche de la Commission européenne (2005) a également déterminé que le pDMD se dégradait relativement rapidement dans les sédiments des étangs artificiels, sa demie-vie s'étendant jusqu'à 80 jours. Yakabe et coll. (1999) ont déterminé que l'hydrolyse du pDMD (composé de 55 % du monomère DMD) entraînait la formation du 4,4'-MDD à des concentrations de 1,9, 2,0 et 2,5 mg/L pour des charges de pDMD de 400, de 1000 et de 10 000 mg/L (0,4, 1,0 et 10 g/L). Cela semble indiquer que les quantités résiduelles de MDD peuvent se former à une valeur inférieure à 1 % à ces fortes concentrations de pDMD. Par conséquent, dans l'étude sur le mésocosme de Heimbach et coll. (1996), des MDD résiduels ont également pu se former et se répartir dans les sédiments ou étaient présents sous la limite de détection dans l'eau. Il est noté que les taux de réaction d'hydrolyse des DMD, ainsi que les proportions relatives des produits de réaction, peuvent varier selon les conditions expérimentales, y compris les concentrations de départ des DMD. Il est possible que des concentrations de départ plus faibles de DMD puissent effectivement entraîner une production plus élevée de MDD résiduels, car la réaction de polymérisation visant à former des polyurées se produirait ensuite moins efficacement.
Heimbach et coll. (1996) ont également indiqué qu'une extraction des sédiments en vue de l'analyse des MDD avait été effectuée; ces résultats n'étaient toutefois pas disponibles. Il convient également de noter qu'à des températures aquatiques de moins de 10 °C, le pDMD se solidifie et forme des cristaux, ce qui peut fortement altérer sa dispersion ainsi que sa répartition ultérieure par hydrolyse; néanmoins, cet effet serait plus important si les concentrations de rejets étaient relativement élevées.
Si elles sont rejetées dans le sol, les substances DMD devraient réagir avec l'eau présente et former des polyurées solides. De plus, si des amines résiduelles se formaient à la suite de la réaction, il se pourrait qu'elles restent immobiles dans le sol, comme nous l'avons indiqué dans la section sur le devenir concernant les MDD. On n'a trouvé aucune étude portant sur les DMD dans les sols; toutefois, les résultats des expériences menées avec les TDI dans le sable humide non perturbé ont révélé que cette substance est convertie en polyurées, dans lesquelles 5,5 % des TDI d'origine n'avaient pas réagi après 24 heures et seulement 3,5 % étaient encore présents après 8 jours, tandis qu'aucune substance de toluène diamine (TDA) n'a été décelée au-dessus de la limite de détection de 0,01 ppm (Gilbert 1988).
Pour résumer, si elles sont rejetées dans l'eau ou le sol, les substances DMD devraient réagir pour former des polyurées, avec des quantités résiduelles de MDD (consulter la section précédente concernant le devenir des substances présentes dans le sous-groupe des MDD, notamment le 4,4'-MDD et les composants du pMDD).
En raison des pressions de vapeur relativement faibles (inférieures ou égales à 0,01 Pa, voir l'annexe C), les émissions atmosphériques de la substance DMD peuvent être minimes en l'absence de sources thermiques importantes ou de formation d'aérosols pendant la pulvérisation. Les substances DMD aéroportées sont habituellement présentes (quoique dans des quantités relativement faibles) dans les phases gazeuse et de condensation en aérosol (Karoly et coll. 2004). Dans les expériences effectuées avec des TDI monomères, qui, en général, s'hydrolysent plus facilement que les DMD dans l'eau, on n'a trouvé aucune preuve de réaction en phase gazeuse avec la vapeur d'eau dans une atmosphère d'essai [7 %-70 % d'humidité relative (HR)] et aucun TDA ni urée n'a été détecté (Holdren et coll. 1984). La limite de détection pour l'analyse des TDA était comprise entre 0,1 % et 1 %, environ, de la concentration atmosphérique des TDI (0,05-0,6 ppm). Toutefois, il convient de noter qu'au cours d'une série d'expériences, des TDA ont été observés à un taux de conversion de 0,1 % (bien que cela puisse être un artéfact, on ne peut ignorer que ce résultat peut vouloir dire qu'une très faible conversion de TDI en TDA est possible dans l'atmosphère dans certaines conditions). Duff (1985) a effectué une série d'expériences pour évaluer l'importance des divers mécanismes de dégradation atmosphérique (p. ex., photolytique, radicaux OH, O3, autres catalyseurs potentiels présents dans les émissions de TDI) à 28 °C et à une HR de 60 %; aucun TDA n'a été mesuré dans l'une ou l'autre des expériences au-dessus de la limite de détection, qui aurait mesuré un taux de conversion des TDI en TDA ³ 0,05 %. Cependant, en présence de phases condensées (p. ex., gouttes de pluie, brouillard ou nuages), on pourrait s'attendre à ce que les TDI et les DMD réagissent pour former de la polyurée et un résidu de TDA ou de MDD, respectivement (comme dans Yakabe et coll. 1999), et qu'ils soient ensuite transportés avec la phase condensée ou qu'ils se déposent dans le sol ou les eaux de surface.
Lorsque les substances DMD sont rejetées dans l'air, on peut s'attendre, en raison d'une demi-vie relativement courte dans ce milieu (13 heures pour le 4,4'-DMD; Becker et coll. 1988), d'une faible pression de vapeur et d'une tendance à se transformer en aérosols, à ce qu'elles se condensent sur les matières adjacentes, y compris les structures et l'équipement des installations, ainsi que sur les sols et les eaux de surface situés à proximité. En Europe et aux États-Unis, on a surveillé les concentrations de DMD monomères dans les émissions issues des évents et des cheminées et, parfois, dans l'air ambiant extérieur à certains sites industriels (p. ex., installations de fabrication de la mousse, panneaux à copeaux orientés) et commerciaux (p. ex., applications de mousse en polyuréthane giclé), et on a obtenu des concentrations variant de moins de 0,1 à 1320 μg/m3 (voir l'annexe D pour avoir toutes les données).
6.2 Persistance dans l'environnement
Cette section résume les renseignements disponibles séparément pour les substances MDD et DMD. Dans ces sections, les renseignements sont présentés en sous-sections en fonction du milieu naturel et portent sur les réactions qui se produisent dans l'atmosphère, dans l'eau, les milieux solides (dont les boues) et le sol. Plus particulièrement, la sous-section sur le milieu aquatique décrit la réaction d'hydrolyse et aborde les études disponibles sur la biodégradation immédiate et intrinsèque réalisées selon les protocoles acceptés de l'OCDE ou du MITI, qui mettent en avant l'eau en tant que milieu d'essai dans la conception expérimentale. Les données modélisées sont également présentées pour les substances MDD et fournissent un autre point à considérer pour le potentiel de biodégradation de ces substances.
6.2.1 MDD
Il convient de noter que les essais de dégradation ont tendance à être menés à l'aide du monomère 4,4'-MDD. Le 4,4'-MDD est le principal composant du pMDD; d'après les déclarations, la composition du pMDD est un mélange d'environ 50 % de 4,4'-MDD, avec une faible quantité de 2,4'-MDD, le reste étant composé d'oligomères (Cowen et coll. 1998). Généralement, la position des groupes amines sur les anneaux de carbone des isomères MDD, du 4,4'-MDD et du 2,4'-MDD peut influer sur la réactivité générale du pMDD en raison de l'encombrement stérique et des effets électroniques. Certaines différences dans la réactivité peuvent également se produire entre les oligomères du pMDD et le monomère 4,4'-MDD. Néanmoins, on peut considérer que les résultats de dégradation empirique pour le 4,4'-MDD sont appropriés au pMDD. De plus, il est indiqué que le terme générique MDD est souvent utilisé dans la littérature pour faire référence au mélange industriel pMDD.
6.2.1.1 Dans l'atmosphère
La réaction des radicaux OH avec le 4,4'-MDD vaporisé dans des conditions atmosphériques simulées a été étudiée par Becker et coll. (1988). La constante du taux de 30 (± 10) × 10-12 cm3/molécule/sec a été déterminée pour le 4,4'-MDD. En supposant une concentration moyenne de radicaux hydroxyles troposphériques de 1 × 106 OH/cm3, la demi-vie pour le 4,4'-MDD a été établie à 6,4 heures. Cette demi-vie laisse entendre une dégradation relativement rapide du 4,4'-MDD dans l'air.
6.2.1.2 Dans l'eau
Hydrolyse
Les MDD ne devraient pas s'hydrolyser dans des conditions environnementales d'après les caractéristiques de sa structure moléculaire (voir le tableau 2.1). Aucune étude sur l'hydrolyse des MDD ne se trouve dans la littérature disponible. De plus, les données modélisées liées à l'hydrolyse n'ont pu être obtenues pour les MDD puisque le modèle généralement utilisé, EPI Suite (2012), ne produit pas de résultat relatif à l'hydrolyse pour ce type de structure chimique.
Études sur la biodégradation rapide et intrinsèque
Des études sur la biodégradation rapide et intrinsèque ont été réalisées pour le 4,4'-MDD (Étude présentée 2012a-d; Kim et coll. 2002).
En général, les essais de biodégradabilité rapide comprennent les tests de dépistage modifiés de l'OCDE, le test d'évolution du CO2, l'essai manométrique de respirométrie, le test d'élimination du carbone organique dissous (COD), l'essai en flacon fermé et l'essai MITI(I) ainsi que la mesure de la minéralisation sur une période de 28 jours à l'aide d'un inoculum à base de boues activées à faibles concentrations et d'une concentration élevée du composé d'essai (2 à 100 mg/L). Les essais de biodégradabilité intrinsèque comprennent l'essai de Zahn-Wellens, l'essai de boues activées semi-instantanées et l'essai MITI(II), et sont traditionnellement menés avec des densités de population microbienne élevées ainsi qu'à l'aide d'un inoculum à base de boues activées. En général, on estime qu'une substance se biodégrade rapidement (c.-à-d. subit une biodégradation ultime) si au moins 60 % de la biodégradation se produit en 28 jours dans un essai de biodégradation rapide et qu'elle se biodégrade de façon intrinsèque si 70 % ou plus de la biodégradation se produit en 28 jours dans le cadre d'un essai sur la biodégradabilité intrinsèque (Aronson et Howard 1999). Une biodégradation supérieure à 20 % peut être considérée comme une preuve de biodégradabilité intrinsèque (Environnement Canada 2009).
Les conditions expérimentales, y compris les concentrations de la substance d'essai et de l'inoculum, ainsi que la composition de l'inoculum et le degré d'acclimatation de l'inoculum, variaient entre les essais disponibles. Ces différences dans la conception et les conditions expérimentales ont produit une variété de résultats liés à la biodégradation. Cependant, dans l'ensemble, les résultats des essais de biodégradation rapide et inhérente, disponibles pour le 4,4'-MDD, indiquent que cette substance présente des vitesses de biodégradation intermédiaires, compte tenu de la grande plage de résultats de dégradation observée dans la base de données empiriques. D'après les résultats de l'essai d'inhibition de la respiration dans des boues activées OECD 209, les valeurs CE0 et CE50 pour les boues activées étaient supérieures à 100 mg/L de 4,4'-MDD (Caspers et coll. 1986). De même, dans une étude d'exposition chronique sur 10 jours portant sur le taux de croissance d'E. coli, une concentration sans effet observé (CSEO) supérieure à 100 mg/L a été établie et aucun effet important sur la croissance d'E. coli après 10 jours d'exposition au 4,4'-MDD n'a été observé (ECHA, c2007-2013a). Par conséquent, d'après ces résultats, il est peu probable que les concentrations de 4,4'-MDD jusqu'à 100 mg/L aient un effet inhibiteur important sur les populations microbiennes utilisées dans les essais de biodégradation.
Un essai de biodégradabilité du 4,4'-MDD à 100 mg/L a été réalisé selon la ligne directrice de l'OCDE no 301F, pour tester les produits chimiques en 1994 (Étude présentée 2012a). Les résultats de l'étude n'étaient pas uniformes : deux des trois échantillons répétés de 4,4'-MDD ont présenté une biodégradation de 0 % après 28 jours par les trois méthodes d'estimation. Cependant, dans le troisième échantillon répété, la biodégradabilité du 4,4'-MDD était de 19 % pour ce qui est de la demande biochimique en oxygène, de 34 % pour ce qui est du carbone organique dissous et de 37 % après 28 jours pour ce qui est de l'analyse des résidus. La biodégradation rapide du 4,4'-MDD à 0,5 mg/L a également été testée dans un essai d'évolution du CO2 selon la ligne directrice de l'OCDE n° 301B en 2009 (Étude présentée 2012b). Les résultats de l'étude ont indiqué que le 4,4'-MDD se biodégradait dans une certaine mesure; on a pu observer une biodégradation de 46 % à la suite d'une exposition de 28 jours, ainsi qu'une biodégradation de 53 % après 63 jours. Dans une autre étude, la biodégradation aérobie du 4,4'-MDD à diverses concentrations a été examinée par Kim et coll. (2002) à l'aide d'un essai de Sturm modifié (biodégradation rapide) avec des boues activées selon le protocole D5209-92 de l'American Society for Testing and Materials (qui est semblable aux lignes directrices de l'OCDE nos 301 et 301B). Il a été déterminé que la biodégradation du 4,4'-MDD à une concentration d'essai de 30 mg/L était d'environ 62 % et 72 % après respectivement 28 jours et 36 jours d'incubation. La biodégradation de 4,4'-MDD par une souche bactérienne Ochrobactarum anthropi présente dans les boues a été testée à quatre concentrations. Les résultats ont démontré un niveau varié de dégradation en fonction de la concentration de la substance d'essai. À la concentration la plus faible de 30 mg/L, on a déterminé que la biodégradation du 4,4'-MDD était d'environ 62 % et 72 % après respectivement 28 et 36 jours; elle est semblable à celle qui a été déterminée dans l'expérience avec les boues activées, réalisée à la même concentration de substance d'essai. Toutefois, à des concentrations d'essai plus importantes de 4,4'-MDD, on a pu observer une réduction du niveau de biodégradation de la substance. Après 28 jours d'incubation, environ 40 % de la biodégradation avait été atteinte à 50 mg/L, 15 % à 100 mg/L et moins de 5 % à 300 mg/L.
Mei et coll. (2015) ont comparé les résultats de plusieurs protocoles d'essai de biodégradation rapide (lignes directrices 301A, B, D et F de l'OCDE) pour la biodégradation du 4,4'-MDD couvrant une plage de concentrations de 2,0 à 40 mg/L, selon la ligne directrice suivie pour les essais. Les concentrations de biodégradation sur 28 jours étaient de 94,8 %, 29,5 %, 0 % et 100 % pour les lignes directrices 301A, B, D et F de l'OCDE, respectivement. En dernière analyse, les auteurs de cette étude ont suggéré que le 4,4'-MDD présente une biodégradation intermédiaire et que la grande variation constatée dans les échantillons répétés est représentative des substances dont la biodégradabilité est partielle. Enfin, on a réalisé en 1986 un essai sur le 4,4'-MDD à 30 mg/L dans le cadre de l'essai MITI modifié (II) no 302C portant sur la biodégradation intrinsèque (Caspers et coll. 1986). La biodégradabilité de la substance d'essai a été mesurée à l'aide d'un respiromètre. On a pu observer que 43 % du 4,4'-MDD s'était biodégradé après 28 jours. En utilisant l'essai de Zahn-Wellens et les protocoles 302 et 302B de l'OCDE, ainsi qu'un inoculum provenant de boues activées produites par des usines de traitement d'eaux usées industrielles, jugées préadaptées (étude présentée 2012c et 2012d), on a constaté que la biodégradation du 4,4'-MDD était de 95 % après 14 jours et de 97 % après 21 jours, à une concentration d'essai de 389 mg/L.
Dans l'ensemble, les preuves empiriques découlant d'études disponibles sur la biodégradation rapide et intrinsèque dans l'eau indiquent que la vitesse de biodégradation du 4,4'-MDD varie probablement selon la biodisponibilité du 4,4'-MDD et la capacité des microorganismes de biodégrader cette substance. Cependant, les résultats indiquent également que le 4,4'-MDD peut subir une dégradation intrinsèque et primaire. Dans les milieux naturels dépourvus de conditions renforcées, telles que la présence d'inoculum préadapté, et en tenant compte de la tendance des MDD à s'adsorber sur les particules solides, la biodégradation de la substance peut se dérouler à une vitesse modérée à lente.
Essai de simulation de la biodégradation
Schaefer et Carpenter (2013) ont examiné la biodégradation du 4,4'-MDD à une concentration nominale de 100 μg/L dans des eaux de surface, en suivant les procédures de la ligne directrice de l'OCDE n° 309 (Minéralisation aérobie dans les eaux superficielles - Essai de simulation de la biodégradation). Selon la ligne directrice n° 309 de l'OCDE, l'objectif principal de cet essai de simulation vise à déterminer la minéralisation (biodégradation ultime) de la substance d'essai (indiquée par l'évolution du 14CO2), ces vitesses de dégradation tenant compte de la biodégradation primaire et ultime, mais également des réactions d'oxydation ou de réduction potentiellement abiotiques. À la fin des essais (92 jours), seulement 11 à 26 % de la radioactivité était associée avec le 14CO2 évolué. De plus, les critères de validité de la ligne directrice n° 309 de l'OCDE précisent qu'une substance de référence doit être utilisée (p. ex., aniline ou benzoate de sodium), afin de s'assurer que l'activité microbienne de l'eau d'essai est à l'intérieur de certaines limites, bien qu'aucune substance de référence ne semble avoir été utilisée dans cette étude (et par conséquent, le critère de validité n'est pas respecté). Les essais de biodégradation par simulation ou les essais de biodégradation par élimination du carbone organique dissous peuvent être plus réalistes d'un point de vue environnemental que les études de biodégradation classiques, mais qui ne sont pas couramment utilisées pour les produits chimiques connus à ce jour, et conséquemment, il est important de comparer les résultats par rapport à une substance dont la biodégradation est bien caractérisée. En définitive, cet essai nous permet de conclure que dans les conditions assez réalistes d'un point de vue environnemental, la biodégradation totale peut représenter jusqu'à ~ 20 %, et la biodégradation primaire jusqu'à inférieur(e) à 60 % (comme il a été déterminé dans des essais avec des eaux de surface, dans lesquels le taux de récupération le plus élevé était de 81-83 %) au cours d'une période de 28 jours (aux fins de comparaison avec les durées habituelles utilisées dans les études normalisées de biodégradation rapide et intrinsèque).
6.2.1.3 Dans le sol
Cowen et coll. (1998) ont étudié la biodégradation du 4,4'-MDD radiomarqué au 14C dans le sol de surface composé de loam limoneux et dans le sol limoneux-sableux dans des conditions aérobie et anaérobie. Du 4,4'-MDD a été testé à six concentrations comprises entre 0,5 et 53 mg/L. La biodégradation aérobie du 4,4'-MDD a été calculée à 11 % seulement après 28 jours (Cowen et coll. 1998) d'après la récupération du 14CO2. Dans des conditions anaérobies, la biodégradation du 4,4'-MDD n'a pas été observée au cours de la durée de l'expérience de 71 jours.
En résumé, des renseignements empiriques disponibles concernant le potentiel de dégradation du 4,4'-MDD dans le sol laissent supposer que la substance ne se biodégrade pas rapidement dans ce milieu et qu'elle se lie aux substances humiques, réduisant ainsi sa biodisponibilité et sa bioaccessibilité. Toutefois, la substance peut se biodégrader plus rapidement en présence de substances organiques dégradables mélangées avec le substrat du sol.
6.2.1.4 Dans le sédiments
Schaefer et Ponizovsky (2013) ont étudié la transformation du 4,4'-MDD dans les sédiments, dans le cadre d'une étude réalisée selon la ligne directrice de l'OCDE no 308 (Transformation aérobie et anaérobie dans les sédiments aquatiques). L'étude a été réalisée à l'aide de 4,4'-MDD radiomarqué au 14C, à une concentration de 1,38 à 1,41 mg/kg (poids sec) dans des systèmes aérobies et anaérobies sur deux types de sédiments (estuariens et dulcicoles). Après 100 jours d'incubation, la répartition de la radioactivité dans les sédiments aérobies était comme suit : de 54 % à 90 % « non extractible » des sédiments; de 8 à 33 %, « extractible » des sédiments; de 6 à 12 %, des métabolites non identifiés dans l'eau (uniquement pour les essais en milieu aérobie); et de 3 à 6 % de 14CO2 (minéralisation; uniquement pour les essais en milieu aérobie). En dernière analyse, la sorption des particules tend à dominer la dissipation des MDD dans les systèmes eau-sédiments, comme l'indique la forte proportion de MDD qui demeure liée aux sédiments (54 %-90 % « non extractible » plus 8-33 % « extractible »). Les conditions d'extraction, qui comprenaient l'extraction d'échantillons en triple à l'acétonitrile (et 1 % de NH4OH) et avec sonication, ont été jugées de modérées à intenses dans l'analyse des résidus liés (ECETOC 2009). Selon ce résultat, de concert avec la grande proportion de résidus liés constatée dans cette étude, il est probable que la majeure partie des MDD dans un milieu eau-sédiments ne serait pas disponible pour être dégradée ou être absorbée par des organismes.
6.2.1.5 Résumé des données empiriques liées au MDD concernant la persistance
Un résumé des données empiriques sur la biodégradation produites par les essais de biodégradation rapide du 4,4'-MDD pendant 28 jours est présenté dans le tableau 6.2 ci-dessous. En tenant compte des preuves de biodégradation du 4,4'-MDD obtenues grâce aux études dans l'eau, le sol et les sédiments, la biodégradation de la substance semble dépendre de sa biodisponibilité. Dans l'eau, le 4,4'-MDD subissait une biodégradation intrinsèque uniquement lorsque des populations microbiennes préadaptées étaient utilisées. Dans le sol et les sédiments, où les MDD tendent à se lier et à avoir une moins grande biodisponibilité, on a observé que les vitesses de biodégradation des MDD étaient lentes. Le 4,4'-MDD affiche une valeur élevée pour log Kco, ce qui signifie qu'il s'adsorbe facilement dans les particules. Par conséquent, dans l'environnement, y compris le milieu aquatique, on considère que cette tendance à s'adsorber constitue un processus dominant qui peut limiter sa biodisponibilité pour les micro-organismes qui contribueraient à sa biodégradation. D'après les données disponibles, on estime que le 4,4'-MDD se biodégradera dans l'environnement à une vitesse de modérée à faible.
| Milieu | Processus de devenir | Concentration de la substance d'essai (mg/L) |
% de biodégradationa | Référence |
|---|---|---|---|---|
| Boues activées | Biodégradation rapide | 100 | 0 | Étude présentée 2012a |
| Boues activées | Biodégradation rapide | 100 | 19 | Étude présentée 2012a |
| Boues activées | Biodégradation rapide | 0,5 | 46 | Étude présentée 2012b |
| Boues activées | Biodégradation rapide | 30 | 62 | Kim et coll. |
| Boues activées | Biodégradation rapide | 50 | 40 | Kim et coll. |
| Boues activées | Biodégradation rapide | 100 | 15 | Kim et coll. |
| Boues activées | Biodégradation rapide | 300 | inférieur(e) à 5 | Kim et coll. |
| Boues activées | Biodégradation rapide | 40 | 94,8 | Mei et coll. 2015 |
| Boues activées | Biodégradation rapide | 15,8 | 29,5 | Mei et coll. 2015 |
| Boues activées | Biodégradation rapide | 2,0 | 0 | Mei et coll. 2015 |
| Boues activées | Biodégradation rapide | 22,5 | 100 | Mei et coll. 2015 |
| Boues activées | Biodégradation intrinsèque | 30 | 43 | Caspers et coll. 1986 |
| Boues activées | Biodégradation intrinsèque | 389 | supérieur(e) à 95 - 97b | Étude présentée 2012d,e |
| Sol | Dégradation microbienne | 0,5 - 53 | 11 | Cowen et coll. 1998 |
a. Les résultats de la biodégradation sont résumés pour la période d'essai inférieure ou égale à 28 jours.
b. Un inoculum préadapté a été utilisé.
6.2.1.6 Modélisation de la persistance du 4,4'-MDD et du pMDD
Bien que des données expérimentales sur la dégradation du 4,4'-MSS soient disponibles, une méthode du poids de la preuve reposant sur des relations quantitatives structure-activité (RQSA) a aussi été utilisée avec les modèles de dégradation présentés au tableau 6.3 ci-après. Des données modélisées ont été produites pour confirmer les données empiriques relatives aux 4,4'-MDD et pour établir des renseignements sur les composants oligomères du pMDD. La dégradation dans l'air et dans l'eau a été étudiée à l'aide des relations quantitatives structure-activité (RQSA). Les substances MDD ne contiennent pas de groupements fonctionnels pouvant subir une hydrolyse.
| Processus de devenir | Modèle et base du modèle | Substance | Résultat et prévision du modèle | Demi-vie extrapolée (jours) |
|---|---|---|---|---|
| Air : Oxydation atmosphérique |
AOPWIN 2010b | 4,4'-MDD pMDD (n = 3 - 5) |
t½ = 0,05 jour | inférieur(e) u égal(e) à 2 |
| Air : Réaction avec l'ozone |
AOPWIN 2010b | 4,4'-MDD pMDD (n = 3 - 5) |
s.o.c | s.o. |
| Eau : Hydrolyse |
HYDROWIN 2010b | 4,4'-MDD pMDD (n = 3 - 5) |
s.o.c | s.o. |
| s.o. Biodégradation aérobie primaire : Sous-modèle 4 : enquête d'expert (résultats qualitatifs) |
BIOWIN 2010b | 4,4'-MDD pMDD (n = 3 - 5) |
[2,3-3,3]d « biodégradation lente à rapide » |
supérieur(e) u égal(e) à 182 |
| Biodégradation aérobie ultime : Sous-modèle 3 : enquête d'expert (résultats qualitatifs) |
BIOWIN 2010b | 4,4'-MDD pMDD (n = 3 - 5) |
[1,1-2,4]d « des mois et plus » |
supérieur(e) u égal(e) à 182 |
| Biodégradation aérobie ultime : Sous-modèle 5 : Probabilité linéaire MITI |
BIOWIN 2010b | 4,4'-MDD pMDD (n = 3 - 5) |
[-1,69-0,18]e « biodégradation très lente » |
supérieur(e) u égal(e) à 182 |
| Biodégradation aérobie ultime : Sous-modèle 6 : Probabilité non linéaire MITI |
BIOWIN 2010b | 4,4'-MDD pMDD (n = 3 - 5) |
[0]e « biodégradation très lente » |
supérieur(e) u égal(e) à 182 |
| Biodégradation aérobie ultime : Probabilité |
DS TOPKAT, c2005-2009 | 4,4'-MDD pMDD (n = 3) (pMDD n = 4, 5 ne faisaient pas partie du domaine d'applicabilité) |
[0]e « biodégradation très lente » |
supérieur(e) u égal(e) à 182 |
| Biodégradation aérobie ultime : % DBO (demande biochimique en oxygène) |
CATALOGIC 2012 | 4,4'-MDD pMDD (n = 3 - 5) |
% DBO = 0 « biodégradation très lente » |
supérieur(e) u égal(e) à 182 |
a. Les substances utilisées dans le résumé incluent les nos CAS suivants : 101-77-9 et 25214-70-4.
b. EPI Suite (2008).
c. Le modèle ne précise pas d'estimation pour ce type de structure.
d. Le résultat s'exprime par une valeur numérique de 0 à 5.
e. Le résultat s'exprime par un taux de probabilité.
Les résultats modélisés présentés dans le tableau 6.3 ci-dessus fournissent d'autres données relativement uniformes concernant le potentiel de dégradation des MDD et des composants oligomères du pMDD dans l'air et dans l'eau.
Les résultats de dégradation modélisés pour le 4,4'-MDD dans l'air, établis à l'aide du modèle AOPWIN (2010), correspondaient aux données empiriques disponibles pour cette substance. Dans l'ensemble, les résultats modélisés dans l'air indiquaient une dégradation relativement rapide, avec des demi-vies inférieures à deux jours pour le 4,4'-MDD et le pMDD.
Dans le milieu aquatique, les résultats modélisés pour la biodégradation ultime, repris dans le tableau 6.3 ci-dessus, indiquaient collectivement que les substances 4,4'-MDD et pMDD (d'après ses oligomères) ne présentent pas de potentiel de biodégradation rapide. Le modèle de biodégradation aérobie primaire [sous-modèles BIOWIN 4 (2010)] affichait certains écarts dans le potentiel de biodégradation du 4,4'-MDD et du pMDD. Selon ce modèle, la biodégradation du 4,4'-MDD devrait se produire relativement rapidement (semaines) et un peu plus lentement (mois) dans le cas du pMDD. Néanmoins, étudiés de façon collective, les résultats modélisés indiquent que le 4,4'-MDD et le pMDD devraient se biodégrader lentement dans l'eau. Ces résultats sont assez conformes aux études empiriques disponibles pour le 4,4'-MDD, qui démontrent une vitesse modérée de biodégradation dans l'eau.
Les données d'entrée du modèle EPI Suite (2012), consistant en renseignements sur les compositions chimiques du 4,4'-MDD et des oligomères du pMDD constitués de trois, quatre et cinq anneaux de carbone, s'inscrivaient dans le domaine d'applicabilité du modèle AOPWIN (2010) et des modèles BIOWIN (2010) présentés dans le tableau 6.3. De même, toutes les données d'entrée du modèle étaient situées dans le domaine d'applicabilité du modèle de biodégradation CATALOGIC (2012). Enfin, les conditions liées au domaine d'applicabilité du modèle DS TOPKAT (c2005-2009) n'ont pas été respectées pour les oligomères du pMDD composés de quatre et cinq anneaux de carbone. Toutefois, les résultats du modèle DS TOPKAT pour ces deux oligomères n'indiquaient aucun potentiel de biodégradation et étaient conformes à toutes les autres données modélisées obtenues grâce aux modèles EPI Suite (2012) et CATALOGIC (2012).
6.2.1.7 Conclusion sur la persistance des MDD
Dans l'ensemble, les données empiriques ont indiqué que la vitesse de biodégradation du 4,4'-MDD dans le milieu aquatique était de modérée à lente, une bonne partie des résultats relatifs à la biodégradation rapide démontrant une biodégradation inférieure à 60 % et une biodégradation intrinsèque inférieure à 70 %. Cependant, comme il a été mentionné précédemment, la substance peut subir une dégradation primaire intrinsèque, et il a été démontré qu'elle peut être intrinsèquement biodégradable dans une situation de préadaptation. Étant donné que le pMDD est composé à 50 % environ de 4,4'-MDD (Cowen et coll. 1998), ces résultats s'appliquent également au pMDD. Les résultats de biodégradation ultime modélisée ont également révélé un potentiel de biodégradation très lente, alors qu'un certain écart a été observé dans les résultats de biodégradation primaire modélisée. Dans le sol, on a observé des vitesses lentes de biodégradation. On peut conclure que le 4,4'-MDD, ainsi que le pMDA se dégraderont probablement à une vitesse modérée dans l'environnement, et que leur liaison covalente avec les sédiments ou le sol les rendra moins disponibles pour une éventuelle biodégradation. Dans l'air, la réaction rapide des radicaux OH avec le 4,4'-MDD permet de croire que cette substance ne sera pas présente longtemps dans l'air.
6.2.2 DMD
Les substances DMD appartiennent à une classe de produits chimiques généralement connus sous le nom d'isocyanates aromatiques. Il s'agit de composés extrêmement réactifs, qui réagissent immédiatement avec les molécules nucléophiles, telles que NH2, NH, OH, SH ou COOH (Mormann et coll. 2006). En raison de la réactivité versatile du groupe isocyanate, les substances DMD peuvent servir à produire une grande variété de matériaux utilisés dans les coussins et l'isolation en mousse, les adhésifs, les produits d'étanchéité, les revêtements et les élastomères. Par exemple, la réaction d'un isocyanate avec un alcool produit un uréthane; avec une amine, il produit une urée substituée et avec de l'eau, il produit un acide carbamique, qui, ensuite, se dégrade rapidement en amines primaires et en dioxyde de carbone correspondants (Groupe d'experts en diisocyanates de l'ACC 2005).
La plupart des études sur la réactivité chimique ont été consacrées au 4,4'-DMD (Mormann et coll. 2006), bien que la réaction d'hydrolyse ait été bien caractérisée à l'aide du pDMD (Yakabe et coll. 1999; Heimbach et coll. 1996; Sendijarevic et coll. 2004). Dans l'ensemble, la réactivité des deux groupes isocyanates dans les DMD est égale (Mormann et coll. 2006). Dans le cas du 4,4'-DMD, on n'observe aucun encombrement stérique des groupes isocyanates et aucun effet électronique d'un groupe sur l'autre en raison du groupe méthylène central (Mormann et coll. 2006). Concernant les autres monomères DMD dans le groupe de substances DMD/MDD, avec les groupes isocyanates dans la position ortho, le 2,2'-DMD et le 2,4'-DMD, l'encombrement stérique ainsi que l'effet électronique peuvent influer sur la réactivité de ces substances (Arnold et coll. 1956). Néanmoins, on considère que les données disponibles pour le 4,4'-DMD sont pertinentes et s'appliquent aux 2,2'-DMD et 2,4'-DMD.
6.2.2.1 Dans l'atmosphère
Selon les déclarations, les DMD se dégradent rapidement par réaction avec les radicaux OH (Carter et coll. 1999; Tury et coll. 2003). La réactivité atmosphérique du 4,4'-DMD a été étudiée par Carter et coll. (1999) par l'intermédiaire d'études de photoréaction en utilisant une substance analogue structurale appropriée. En raison de la difficulté technique pour produire de la vapeur à partir de produits chimiques ayant une pression de vapeur faible, tels que les DMD, une substance analogue, l'isocyanate de toluène en position para (PTI), a été utilisée dans l'étude. La pertinence du PTI en tant que substance analogue pour les DMD a été traitée; les auteurs ont expliqué que la molécule de DMD peut être perçue comme deux molécules de PTI ajoutées au groupe de méthylène et qu'il est raisonnable de penser que des réactions devraient se produire au noyau aromatique et avec un mécanisme de réaction semblable après l'ajout de radicaux OH. Les résultats de l'étude ont indiqué que les DMD ont tendance à réagir relativement rapidement dans l'atmosphère. La constante de vitesse de deuxième ordre de 5,9 × 10-12 cm3/molécule/sec a été établie pour les PTI et a été doublée pour estimer la constante de vitesse de deuxième ordre pour la substance DMD à doubles anneaux, à savoir 1,2 × 10-11cm3/molécule/sec. La demi-vie atmosphérique des DMD qui en résulte a été estimée à 11 heures (Groupe d'experts en diisocyanates de l'ACC 2005) et à 15 heures (Tury et coll. 2003), d'après les hypothèses liées la concentration moyenne de radicaux hydroxyles de 1,1 × 106 molécules/cm3 et de 1,5 × 106 molécules/cm3, respectivement.
En présence de phases condensées (p. ex., gouttes de pluie, brouillard ou nuages), on pourrait s'attendre à ce que les TDI et les DMD dans l'atmosphère réagissent pour former une certaine quantité de polyurée et un résidu de TDA et de MDD, respectivement (comme dans Yakabe et coll. 1999), et qu'ils soient ensuite transportés avec la phase condensée ou qu'ils se déposent dans le sol ou les eaux de surface.
6.2.2.2 Dans l'eau
Réaction d'hydrolyse
Les isocyanates aromatiques sont des espèces réactives sur le plan chimique, qui réagissent avec l'eau (Shkapenko et coll. 1960; Yakabe et coll.1999). Dans une description simplifiée, l'hydrolyse d'un isocyanate d'aryle avec l'eau forme tout d'abord un acide carbamique, puis, après un rejet rapide de dioxyde de carbone, elle forme une amine primaire (p. ex., MDD). L'amine primaire peut ensuite réagir avec l'isocyanate pour former une urée (Yakabe et coll. 1999).
Concernant les diisocyanates, tels que le pDMD (substance hydrophobe dense et visqueuse), la réaction avec l'eau a tendance à se produire plus lentement que la réaction homogène pour les isocyanates simples. En raison de ses propriétés physiques, lorsqu'elle est versée dans l'eau, la substance DMD a tendance à couler; par ailleurs, l'hydrolyse se produit de façon hétérogène au niveau ou au-dessous de l'interface diisocyanate-eau. Dans les réactions hétérogènes, la vitesse d'hydrolyse peut dépendre de la granulométrie et de la surface, ainsi que de l'efficacité du mélange (Sendijarevic et coll. 2004). Les observations ont démontré que les taux de réaction d'hydrolyse étaient rapides et proches de ceux prévus pour une réaction homogène, lorsque les DMD étaient finement divisés et dispersés par une agitation vigoureuse. Les composants isocyanates oligomériques de l'échantillon de pDMD ont disparu à peu près à la même vitesse que le monomère 4,4'-DMD. On a mesuré que la demi-vie de réaction du 4,4'-DMD était d'environ 25 heures dans des conditions expérimentales avec agitation et avec un taux de charge de 400 mg/L (Yakabe et coll. 1999). En revanche, dans des expériences statiques, lorsque la diffusion et l'évolution du gaz étaient l'unique source de mélange, on a pu observer la présence de pDMD dans le mélange pendant plus de 20 jours, avec environ 25 % de substance inaltérée restante (Yakabe et coll. 1999). Dans une autre étude (Étude présentée 2012a) portant sur la réaction du pDMD avec l'eau dans des conditions sans agitation, on a pu également observer que les concentrations des produits solubles formés étaient plus faibles que celles des produits formés pendant des expériences avec agitation. On a déterminé que les demi-vies pour la formation du 4,4'-MDD à partir des DMD étaient 3,8, 4,5 et 6,2 jours, respectivement, pour des aires surfaciques de pDMD de 18,1, 13,2 et 5,7 cm2. Concernant la réactivité générale dans l'eau, il est noté que les différences structurelles dues à la substitution du groupe isocyanate des monomères DMD, c.-à-d. le 2,2'-DMD, le 2,4'-DMD et le 4,4'-DMD ainsi que la présence des trois monomères (comme dans les DMD mélangés) ne devraient pas influer fortement sur la voie de pénétration générale des produits chimiques et les taux de réaction associés. Les données modélisées (EPI Suite 2012) pointent vers des demi-vies pour l'hydrolyse, inférieures à 10 minutes pour toutes les substances DMD du groupe [c.-à-d. 2,2'-DMD; 2,4'-DMD; 4,4'-DMD; structure représentative des DMD mélangés et composants individuels du pDMD (n = 2 - 5)]. Ces résultats ont indiqué que les taux d'hydrolyse de toutes les substances DMD dans le groupe ont tendance à être semblables. Toutefois, on note que les données d'hydrolyse modélisées peuvent sous-estimer l'influence de l'encombrement stérique, des propriétés physiques telles que la viscosité, ainsi que des répercussions d'une réaction hétérogène sur les taux d'hydrolyse individuels pour la substance DMD dans le groupe. Par conséquent, les taux de réaction d'hydrolyse empiriques pour ces substances DMD devraient être quelque peu plus lents que les taux modélisés.
La réaction du pDMD dans l'eau a produit des polyurées solides, insolubles et non réactives en tant que produit principal, une petite proportion de 4,4'-méthylènedianiline (4,4'-MDD) à partir du 4,4'-DMD présent dans le pDMD ainsi que du carbone organique dissous (Yakabe et coll. 1999). La quantité de 4,4'-MDD produit a été mesurée à 1 % dans des conditions expérimentales avec agitation, et à 0,005 % dans des conditions expérimentales statiques, ce qui indique que l'efficacité du mélange a eu une incidence sur le taux de réaction.
Les produits découlant de la réaction d'hydrolyse du pDMD ont fait l'objet d'une étude plus poussée par Sendijarevic et coll. (2004). Cette étude est axée sur le potentiel de rejet des MDD dans l'environnement en raison du rejet dans l'environnement du pDMD et de son hydrolyse ultérieure en polyurées. Les auteurs ont caractérisé l'hydrolyse et la réaction cinétique associée des polyurées obtenues à partir de l'hydrolyse du pDMD. Les échantillons de polyurées ont été préparés par une agitation vigoureuse du pDMD avec de l'eau pour obtenir des polyurées dont la masse moléculaire est plus faible; on pense que ces dernières sont soumises à une hydrolyse plus rapidement que les polyurées de masse moléculaire plus faible qui se sont formées dans des conditions statiques. Cette étude a été réalisée avec un échantillon de pDMD industriel, connu sur le marché sous le nom de Lupranate M-205, et avec une composition décrite comprenant des congénères de l'isocyanate de polyméthylène-polyphényle, du 4,4'-DMD (39,4 %), du 2,4'-DMD (3,4 %) et du 2,4-bis(p-isocyanatobenzyl)phényl isocyanate. Les résultats d'étude ont indiqué que les polyurées formées à la suite du contact du pDMD avec l'eau ne devraient pas être réactives, pour la plupart, dans l'environnement, et ce, pendant des milliers d'années. On a déterminé que les demi-vies de réaction dans le cas de rejets de MDD à partir de composés pDMD-polyurée couvrent l'échelle des temps géologiques, ce qui indique que les polyurées sont extrêmement stables dans l'environnement (Sendijarevic et coll. 2004).
Études sur la biodégradation rapide et intrinsèque
Le pDMD a été testé dans une étude de biodégradation intrinsèque en 1986 selon l'essai MITI modifié (II) dans le cadre du protocole d'essai no 302C (Caspers et coll. 1986). D'après les auteurs de l'étude, l'essai de biodégradation intrinsèque a été appliqué, car le pDMD était connu pour ne pas se biodégrader facilement. Cette étude était également composée d'essais sur le 4,4'-MDD et, par conséquent, le protocole d'étude est décrit plus en détail dans la section sur la persistance des MDD ci-dessus. En résumé, le protocole d'étude concernant le pDMD a aussi été modifié en fonction de la source d'inoculum; le pDMD a été testé à la même concentration de 30 mg/L et l'aniline a été utilisée en tant que substance de référence dans l'étude. On a décrit la substance d'essai pDMD comme étant composée d'isomères et d'oligomères, comprenant environ 50 % d'un DMD monomère. Après 28 jours, une biodégradation de 0 % a été observée pour le pDMD. Par conséquent, le pDMD ne subit pas de biodégradation intrinsèque dans les conditions de cet essai. En utilisant le protocole no 209, on n'a constaté aucune inhibition de la respiration à n'importe laquelle des concentrations d'essai du pDMD utilisées (c.-à-d. 1, 10 ou 100 mg/L), ce qui indique que la substance d'essai n'est pas grandement toxique pour les microorganismes présents dans les boues.
6.2.2.3 Dans le sol
Les DMD sont des substances fortement réactives, en particulier en contact avec l'eau. On s'attend à ce que dans le sol, où un degré d'humidité est prédominant, les substances DMD subissent principalement une hydrolyse (Martens et Domsch 1981; Allport et coll. 2003). Comme pour la réaction d'hydrolyse dans le milieu aquatique, la même réaction hétérogène est prévue dans le sol, entraînant ainsi des produits de réaction tels que les MDD et les polyurées. Durant le processus de réaction, le diisocyanate est piégé au sein d'une croûte de polyurées solides et insolubles (Allport et coll. 2003). Les MDD ont tendance à se former en quantités relativement faibles et les polyurées constituent les produits de réaction principaux.
La dégradation des polyurées préparées à partir des DMD radiomarqués au 14 C et formées par interaction des DMD avec l'eau, a été étudiée dans différents sols agricoles allant du sable à l'argile (Martens et Domsch 1981). Cette étude visait à aborder le devenir d'une forte teneur en polyurées découlant des MDD après le déversement d'isocyanates monomères. Dans cette étude, la dégradation n'était pas détectée après quatre mois, comme a pu le démontrer l'absence d'évolution détectable du 14CO2 ou le manque de formation de produits radiomarqués solubles, tels que les diamines et les oligo-urées (Martends et Domsch 1981).
6.2.2.4 Dans les sédiments
Des mesures des concentrations de pDMD dans les sédiments ont été effectuées dans une étude non publiée par Heimbach (1993), où de fortes concentrations de la substance (1000 et 10 000 mg/L) ont été ajoutées aux étangs artificiels pour évaluer les effets dans une situation de déversement. Selon la description de l'étude d'Heimbach (1993) dans l'étude du Centre commun de recherche de la Commission européenne (2005), la vitesse de dégradation du pDMD était considérable, mais elle n'était pas uniforme au cours de l'étude. Les concentrations de pDMD ont diminué tout au long de l'étude de 7,6 à une valeur inférieure ou égale à 0,7 mg/kg dans l'étang ayant reçu une faible dose (1000 mg/L) et de 20 à 0,8 mg/kg dans l'étang qui comporte une forte dose (10 000 mg/L). Les demi-vies de pDMD dans les résidus d'urée présents dans les sédiments variaient de 7 à 80 jours dans l'étang ayant reçu une faible dose et de 14 à 28 jours dans l'étang ayant reçu une forte dose. Cette étude semblait indiquer que le pDMD a tendance à se répartir relativement rapidement dans les sédiments, mais que les taux de réaction tendent à augmenter plus rapidement à des concentrations de pDMD plus élevées.
6.2.2.5 Résumé des données empiriques liées au DMD concernant la persistance
Les substances DMD du groupe de substances DMD/MDD appartiennent à une classe très réactive de produits chimiques. Dans l'atmosphère, on sait que les DMD réagissent rapidement et des demi-vies relativement rapides ont été établies en fonction de la réaction des radicaux OH à l'aide d'une substance analogue (Groupe d'experts en diisocyanates de l'ACC 2005; Tury et coll. 2003) (voir le tableau 6.4 ci-dessous). On sait également que les substances s'hydrolysent rapidement; néanmoins, la vitesse d'hydrolyse dépend des conditions de mélange (Yakabe et coll. 1999). Dans les expériences au cours desquelles les DMD avaient été dispersés par agitation vigoureuse, on a pu observer des taux d'hydrolyse rapides, alors que dans des conditions statiques, jusqu'à 75 % de la substance d'essai avait réagi après 20 jours; toutefois, certaines quantités de la substance d'essai inaltérée semblaient rester dans la solution (Yakabe et coll. 1999) (voir le tableau 6.4). Un essai de biodégradation intrinsèque a été mené et les résultats ont révélé que le pDMD ne se biodégrade pas dans les conditions de l'essai. Puisque l'hydrolyse est un mode important de dégradation relativement rapide de substances contenant des DMD dans l'environnement, il est peu probable que ceux-ci persistent très longtemps dans un milieu aquatique et sédimentaire. Les études sur l'hydrolyse des DMD ont démontré que la demi-vie dans l'eau ne devrait pas être supérieure à 182 jours (6 mois) et que, en conséquence, la substance ne devrait pas être persistante dans ce milieu naturel. De plus, puisqu'un certain degré d'humidité est généralement présent dans le sol, l'hydrolyse devrait être également la réaction de dégradation prédominante dans ce compartiment environnemental.
Étant donné l'abondance des données empiriques sur la biodégradation des DMD du groupe dans l'air et dans l'eau, et le fait que ces substances réagissent fortement dans ces milieux naturels, la modélisation de la biodégradation dans l'air et dans l'eau n'a pas été réalisée pour ces substances.
| No CAS | Milieu | Processus de devenir | Valeur pour la dégradation | Paramètre et unités de la dégradation | Référence |
|---|---|---|---|---|---|
| DMD générique | Air | Oxydation | 11-15 | Demi-vie (en heures) |
Groupe d'experts en diisocyanates de l'ACC 2005; Tury et coll. 2003 |
| 9016-87-9 | Eau | Hydrolyse | 75a | Biodégradation (%) |
Yakabe et coll. 1999 |
| 9016-87-9 | Eau | Biodégradation intrinsèque | 0b | Biodégradation (%) |
Caspers et coll. 1986 |
a. Après 20 jours;
b. Après 28 jours.
6.2.2.6 Conclusion sur la persistance des DMD dans le groupe des DMD/MDD
D'après les données empiriques disponibles (tableau 6.4), les DMD du groupe de substances DMD/MDD ne devraient pas persister dans l'air, l'eau, le sol et les sédiments.
6.3 Potentiel de bioaccumulation
Afin de s'appuyer sur plusieurs éléments de preuve pour établir le potentiel de bioaccumulation des substances faisant partie du groupe de substances DMD/MDD, les données empiriques et modélisées ont été prises en compte. Cette section est divisée en deux sous-sections dans lesquelles les renseignements disponibles sur les substances MDD et ceux relatifs aux DMD sont traités séparément.
Les données expérimentales et modélisées disponibles, y compris les facteurs de bioconcentration (FBC), ainsi que les renseignements déduits des coefficients de partage constituent des facteurs à considérer supplémentaires pour déterminer le potentiel de bioaccumulation des substances MDD et DMD.
6.3.1 MDD
Dans le cas des MDD, les facteurs de bioconcentration expérimentaux et modélisés, les renseignements déduits des données sur les coefficients de partage ainsi que les données déduites d'analogues pour le pMDD, ont été pris en compte dans la détermination du potentiel de bioaccumulation. On considère que les facteurs de bioconcentration pour les poissons déterminés de façon expérimentale (FBC) constituent les principaux éléments de preuve concernant le potentiel de bioaccumulation de la substance. Ces résultats empiriques sont également appuyés par les données modélisées.
6.3.1.1 Facteur de bioconcentration (FBC) aquatique
Une étude examinant le potentiel de bioaccumulation du 4,4'-MDD dans les poissons a été réalisée en 1992 par le ministère du Commerce international et de l'Industrie du Japon (MITI) (MITI 1992). Selon le rapport d'étude, le 4,4'-MDD a été testé sur des carpes (Cyprinus carpio) aux concentrations nominales de 0,02 mg/L et de 0,2 mg/L et conformément à la ligne directrice de l'OCDE n° 305C (Bioaccumulation : essai pour le niveau de bioconcentration chez le poisson). Des poissons mesurant environ 10 cm et pesant 30 grammes ont été utilisés dans l'étude. La teneur en lipides des poissons a été établie en moyenne à 4,5 %. Le FBC a été mesuré pour la substance à l'équilibre après une période d'essai de 6 semaines (MITI 1992).
D'après les calculs, les facteurs de bioconcentration (FBC) variaient de moins de 3,1 à 15 après une exposition à la concentration de 0,02 mg/L du 4,4'-MDD et de 3 à 14 après une exposition à la concentration la plus élevée de 0,2 mg/L du 4,4'-MDD. Les résultats expérimentaux ont indiqué que la différence par un facteur de 10 dans la concentration de la substance d'essai utilisée dans l'étude n'avait pas d'influence sur les valeurs du FBC. Dans l'ensemble, les résultats liés au FBC inférieur ou égal à 15 révèlent un faible potentiel de bioaccumulation. Les résultats de cette étude sont présentés ci-dessous dans le tableau 6.5.
| Organisme d'essai | Valeur du FBC (L/kg)a |
Référence |
|---|---|---|
| Carpe (Cyprinus carpio) |
inférieur(e) à 3,1-15 (0,02 mg/L) 3-14 (0,2 mg/L) |
ECHA, c2007-2013aNDE |
a. Les valeurs entre parenthèses représentent les concentrations d'essai utilisées pour déterminer les FBC.
b. NDE : non disponible pour examen.
Pour corroborer les résultats des facteurs de bioconcentration expérimentaux, les résultats du modèle ont également été produits grâce au modèle BCFBAF (EPI Suite 2012) et à l'aide de la valeur expérimentale de log Koe de 1,6 en tant que données d'entrée du modèle. Les valeurs FBC et FBA prévues pour le poisson du niveau trophique intermédiaire représentatif des eaux canadiennes, d'après une modification du modèle de bilan massique d'Arnot et Gobas (2003), étaient toutes deux de 3,2 L/kg. Les valeurs prévues étaient conformes aux valeurs expérimentales obtenues dans l'étude.
De plus, les valeurs FBC et FBA prévues pour les oligomères à trois cycles du pMDD concernant le poisson de niveau trophique intermédiaire, d'après le log Koe modélisé de 3,29, étaient toutes deux de 51 L/kg environ.
6.3.1.2 Potentiel de bioaccumulation dans les organismes terrestres
D'après les modèles de rejet connus, les MDD ont tendance à se déposer à la surface du sol, en conséquence principalement des émissions de substances DMD et de leur conversion rapide qui s'ensuit en une certaine quantité de MDD (Yakabe et coll. 1999). Par conséquent, l'exposition des organismes terrestres au MDD et aux amines connexes due à la conversion des isocyanates correspondants dans l'environnement est théoriquement possible.
Les valeurs expérimentales du log Koe variaient de 1,55 à 1,64 pour le 4,4'-MDD et de 1,3 à 2,5 pour le pMDD (voir l'annexe B : tableaux B1 et B2) laissent penser que ces produits chimiques ont un faible potentiel de bioaccumulation dans le biote. Toutefois, avec la combinaison de valeurs modérées de log Koe supérieures ou égales à 2 et d'une valeur élevée de log Koa (le log Koa pour le 4,4'-MDD est de 9,5; voir le tableau B1 de l'annexe B), et compte tenu de l'exposition alimentaire des organismes terrestres, les substances chimiques peuvent subir une bioamplification dans les réseaux trophiques terrestres, tel que l'indiquent Gobas et coll. (2003) et Kelly et coll. (2007).
On a pu observer que les substances ayant un log Koe inférieur ou égal à 2 sont généralement métabolisées ou éliminées par des voies telles que les sécrétions urinaires par les animaux exposés (Kelly et coll. 2007). Dans le cas du 4,4'-MDD, les études chez les rats, les souris, les cobayes, les lapins et les singes ont démontré qu'après une injection par voie intrapéritonéale ou intraveineuse ou après une administration orale de 4,4'-MDD, la substance est en grande partie éliminée dans l'urine et les matières fécales (OCDE 2002). Aussi bien les métabolites acétylés du 4,4'-MDD que du 4,4'-MDD libre ont été détectés dans l'urine des animaux exposés (OCDE 2002). Par conséquent, d'après cette information, on considère que le 4,4'-MDD a tendance à être facilement métabolisé ou éliminé du corps par de petits mammifères; par conséquent, il est peu probable qu'il subisse une bioamplification dans les réseaux trophiques terrestres. De plus, le facteur de bioamplification (FBA) modélisé, établi d'après les valeurs de log Koe et de log Koa concernant le 4,4'-MDD dans le cas du prédateur au sommet de la chaîne alimentaire (le loup), n'a indiqué aucun potentiel de bioamplification (FBA du 4,4'-MDDloup = 4 × 10-4) [les prévisions relatives au FBA concernant les loups ont été déterminées à l'aide de la feuille de calcul de Gobas et coll. (2003)].
6.3.1.3 Conclusion sur le potentiel de bioaccumulation des MDD
Le 4,4'-MDD et le pMDD présentent des valeurs expérimentales de log Koe faibles à modérées et des valeurs modélisées de log Koa élevées. Un faible log Koe indique généralement un faible potentiel de bioaccumulation, mais puisqu'il ne s'agit que d'un coefficient de partage, il ne tient pas compte des processus physiologiques tels que le métabolisme. Environnement et Changement climatique Canada ne considère pas de façon isolée l'utilisation du log Koe comme une donnée suffisante pour déterminer le potentiel de bioaccumulation. Des valeurs faibles à modérées de log Koe, ainsi qu'une valeur élevée de log Koa indiquent un potentiel de bioamplification dans les réseaux trophiques terrestres, étant donné que l'alimentation constitue la voie d'exposition à la substance (Kelly et coll. 2007). Concernant le 4,4'-MDD, les données expérimentales semblent indiquer que cette substance est facilement métabolisée et secrétée par de petits mammifères (OCDE 2002); il est donc peu probable que cette substance ait un potentiel de bioamplification dans les réseaux trophiques terrestres. Ce fait a été confirmé par le très faible FBA prévu chez les prédateurs terrestres au sommet de la chaîne alimentaire (calculs du FBA concernant le loup effectués d'après Gobas et coll. 2003). Un FBC expérimental chez les poissons a été déterminé comme étant très faible (MITI 1992), ce qui indique que le 4,4'-MDD ne se bioaccumule pas dans les poissons. Les résultats liés au FBC empirique chez les poissons étaient conformes aux valeurs de FBC prévues par le modèle (EPI Suite 2012). Enfin, le FBC modélisé pour l'oligomère prédominant à trois cycles dans le pMDD était également très faible (EPI Suite 2012); une bioaccumulation dans le biote est donc peu probable.
6.3.2 DMD
Les DMD sont très réactifs en raison des propriétés des groupes isocyanates (Yakabe 1999). En conséquence, ils ne devraient pas s'accumuler jusqu'à atteindre des concentrations importantes dans l'eau et dans le sol, où un certain degré d'humidité prédomine et favoriserait l'hydrolyse. Cette caractéristique a été précédemment décrite plus en détail dans les sections sur le devenir et la persistance de la présente évaluation préalable. En effet, on s'attend à ce que d'infimes quantités de DMD soient disponibles et absorbées par les organismes à partir des milieux naturels. De plus, les deux principaux produits découlant de la réaction d'hydrolyse des DMD (polyurées et MDD) se bioaccumulent dans les organismes à des niveaux très faibles uniquement. Les polyurées obtenues à partir des DMD sont des matières inertes, insolubles et solides et ont tendance à former des couches ou des croûtes (Yakabe 1999); on a également pu observer qu'elles entraînaient des effets écotoxicologiques indirects chez les populations d'organismes benthiques (Heimbach et coll. 1996). Comme nous l'avons décrit ci-dessus, les substances MDD ont un faible potentiel de bioaccumulation.
Les valeurs de log Koedéterminées pour les monomères DMD dans le groupe de substances DMD/MDD étaient de 4,5 environ et les valeurs modélisées du log Koa étaient de 8,95 (voir l'annexe C). Dans le cas du pDMD, le log Koe n'a pas été déterminé, alors que les valeurs modélisées du log Koa variaient de 8,95 (pour l'oligomère avec n = 2) à 24,8 (n = 5) (voir l'annexe C). Pour les substances ayant un faible potentiel de métabolisation, ces valeurs de log Koe et de log Koa pourraient indiquer une bioamplification probable dans les réseaux terrestres (Kelly et coll. 2007). Toutefois, étant donné la réactivité connue des DMD, il est très peu probable que ces substances soient disponibles dans l'environnement où elles seraient absorbées par les organismes. Par conséquent, compte tenu de la forte réactivité, de la dégradation rapide et du manque de persistance des DMD du groupe de substances DMD/MDD dans les milieux naturels, notamment l'air et le sol, l'estimation du potentiel de bioaccumulation dans les réseaux trophiques terrestres n'a pas été prise en compte dans la présente évaluation préalable.
6.3.2.1 Facteur de bioconcentration (FBC) aquatique
Une étude de bioconcentration dans les poissons concernant le 4,4'-MDD a été réalisée en 2002 chez la carpe par le Chemicals Evaluation and Research Institute du Japon (Cyprinus carpio) (Étude présentée 2012e). L'étude a été réalisée conformément à la ligne directrice de l'OCDE n° 305 (Bioconcentration : essai avec renouvellement continu sur les poissons). Il a été observé que la substance réagissait rapidement avec l'eau; par conséquent, un solvant de support a été utilisé pour stabiliser le produit chimique. Il convient de noter que l'utilisation d'un solvant de support n'est pas représentative des conditions naturellement présentes dans l'environnement; toutefois, aux fins de l'essai d'une substance hautement réactive, elle est jugée acceptable. La solution mère a été préparée en procédant par dissolution du 4,4'-MDD radiomarqué au 14C (substance radiomarquée positionnée aux deux anneaux de carbone) dans l'acétone. La stabilité relative de cette préparation a pu être observée (95 % du 4,4'-DMD étaient encore présents dans la solution d'acétone après quatre jours). L'étude de détermination de doses sur 96 heures chez le médaka japonais (Oryzias latipes) a indiqué une faible CL50 de 0,5 mg/L découlant de l'exposition au 4,4'-DMD dans l'acétone. Par conséquent, dans le cas de l'étude de bioconcentration sur 28 jours, une carpe mesurant entre 5,8 et 7,4 cm a été exposée au mélange 4,4'-DMD/acétone à deux concentrations (0,8 μg/L et 0,08 μg/L). Les solutions mères de 4,4'-DMD dans l'acétone pour les deux expositions ont été préparées à des concentrations de 8,0 mg/L et de 0,8 mg/L et les solutions d'essai ont été renouvelées tous les deux à trois jours. Des mesures de la substance d'essai dans les solutions d'essai ont été réalisées tout au long de l'étude et les concentrations mesurées affichaient un écart qui ne dépassait pas 20 % par rapport aux concentrations nominales. On a estimé que l'état stable était atteint au cours des 28 jours d'après les observations relatives à l'écart minimal (moins de 20 %) pour au moins trois mesures consécutives du FBC. La teneur en lipides des poissons a été établie à partir des poissons témoins uniquement et a été déclarée à 2,8 % avant le début de l'étude et à 4,5 % à la fin. D'après l'exposition sur 28 jours de la substance d'essai, il a été déterminé que les FBC dans le groupe exposé à la dose de 0,8 μg/L étaient compris entre 61 et 150 et entre 120 et 330 dans le groupe exposé à la dose de 0,08 μg/L. Les FBC moyens ont été calculés et établis à 92 lorsque la concentration d'exposition était de 0,08 μg/L et à 200 avec la concentration d'essai 10 fois inférieure de 0,08 μg/L. Les FBC moyens sont résumés dans le tableau 6.6 ci-dessous.
| Organisme d'essai | Valeur cinétique et en régime stationnaire(L/kg)a | Référence |
|---|---|---|
| Carp (Cyprinus carpio) |
92 (0,8 μg/L) 200 (0,08 μg/L) |
Étude présentée 2012e; ECHA, c2007-2013c |
a. Les valeurs entre parenthèses représentent les concentrations d'essai utilisées pour déterminer les FBC.
Les résultats de l'étude précisent que le 4,4'-DMD a un faible potentiel de bioaccumulation. Il convient de noter que sans l'utilisation d'un solvant de support, la substance d'essai serait rapidement hydrolysée; elle ne pourrait maintenir la concentration d'essai nominale et, finalement, ne serait pas biodisponible pour les organismes d'essai. On ne sait pas si la substance d'essai a réagi dans l'eau, puisque les mesures des concentrations de la substance d'essai n'étaient pas particulièrement axées sur la présence des groupes isocyanates; elles étaient plutôt fondées sur le radiomarquage placé sur les anneaux de carbone du 4,4'-DMD. Toutefois, étant donné que la réaction hétérogène des DMD dans l'eau et que la formation de polyurées n'ont pas été reconnues dans le rapport d'étude, on peut conclure que les concentrations de 4,4'-DMD sont restées stables dans les solutions d'essai.
On considère également que les résultats de cette étude s'appliquent à d'autres substances DMD dans le groupe. La structure du 4,4'-DMD est très semblable aux monomères 2,2'-DMD et 2,4'-DMD, ainsi qu'aux DMD mélangés, composés des trois monomères (consulter la section sur l'identité de la substance). Par ailleurs, le pDMD est composé à 50 % environ de 4,4'-DMD qui constitue donc le principal composant de cette substance (consulter la section sur l'identité de la substance).
Concernant la méthodologie utilisée dans l'étude disponible sur la bioaccumulation, il est reconnu que les procédures expérimentales adoptées dans cette étude ont créé des conditions artificielles pour l'exposition au DMD. Étant donné que le pDMD est une substance très réactive, elle ne devrait pas être disponible dans les milieux environnants d'où les organismes aquatiques pourraient l'absorber. Dans des conditions environnementales, où la réaction d'hydrolyse des DMD devrait se produire rapidement, les organismes seraient principalement exposés aux polyurées et aux MDD plutôt qu'aux DMD. Comme les DMD, les polyurées et les MDD ont un faible potentiel de bioaccumulation.
Enfin, étant donné l'applicabilité des données de bioaccumulation empiriques fiables pour les substances DMD du groupe et le fait que ces substances sont très réactives dans l'eau, la modélisation de la bioaccumulation n'a pas été effectuée pour ces substances.
6.3.2.2 Conclusion sur le potentiel de bioaccumulation des DMD dans le groupe de substances DMD/MDD
Les substances DMD du groupe des DMD/MDD appartiennent à une classe très réactive de produits chimiques. Elles sont connues pour s'hydrolyser rapidement et, en conséquence, ne se retrouvent que transitoirement dans les milieux naturels tels que l'eau ou sol, où un certain degré d'humidité est généralement prédominant (Yakabe 1999). Pour cette raison, on considère que les substances DMD ont tendance à ne pas être présentes dans des concentrations importantes dans l'environnement pendant de longues périodes; elles ne sont donc pas disponibles pour être absorbées par les organismes et il est très peu probable qu'elles subissent une bioamplification dans les réseaux trophiques aquatiques ou terrestres. Les données empiriques disponibles chez les poissons découlant de l'exposition au 4,4'-DMD stabilisé par solvant sur une période de 28 jours laissent entendre que cette substance ne se bioaccumule pas dans les poissons. Les résultats liés au FBC issus de cette étude sur la bioconcentration sont considérés comme des données déduites à partir d'analogues pour les DMD monomères restant dans le groupe de substances DMD/MDD, à savoir le 2,2'-DMD et le 2,4'-DMD ainsi que pour les DMD mélangés. Par ailleurs, puisque le 4,4'-DMD est un composant majeur du pDMD, les résultats de l'étude concernant le 4,4'-DMD sont jugés représentatifs du pDMD également.
Par conséquent, compte tenu des données empiriques disponibles au sujet du potentiel de bioaccumulation, de leurs propriétés physico-chimiques et de leur devenir dans l'environnement, il est peu probable que les substances DMD du groupe de substances DMD/MDD se bioaccumulent grandement.
7. Potentiel d'effets nocifs sur l'environnement
7.1 Évaluation des effets sur l'environnement
Les renseignements disponibles sur l'écotoxicité des substances MDD et DMD dans le groupe de substances MDD/DMD sont repris dans les sous-sections ci-dessous.
Dans le cas du 4,4'-MDD, les études empiriques disponibles pour les organismes dans l'eau, le sol et les sédiments sont résumées dans les sous-sections pour chaque milieu naturel et dans les tableaux correspondants 7.1, 7.2 et 7.4. Étant donné que le pMDD est composé à plus de 50 % du 4,4'-MDD (Allport et coll. 2003), les données sur la toxicité disponibles pour le pMDD sont également présentées en tant que données potentielles déduites à partir d'analogues (tableau 7.2). Il n'est pas surprenant que les niveaux de toxicité chez les espèces aquatiques, telles que les algues, le cladocère et les microorganismes dans les boues activées, établis à partir de l'exposition expérimentale au pMDD, soient semblables à ceux déterminés pour le 4,4'-MDD (voir les tableaux 7.1 et 7.2).
De même, les données empiriques disponibles pour les substances dans le groupe de substances DMD/MMD sont résumées dans les sous-sections pour chaque milieu naturel et dans les tableaux 7.6, 7.7 et 7.8. Puisque les études écologiques ont été réalisées pour seulement deux substances du sous-groupe (le 4,4'-DMD et le pDMD), les résultats de ces études ont été jugés des données déduites à partir d'analogues pour éclairer les effets écologiques découlant de l'exposition potentielle au 2,4'-DMD, au 2,2'-DMD et au DMD mélangé. Le 2,4'-DMD et le 2,2'DMD sont des isomères très semblables du 4,4'-MDD et les DMD est un mélange des trois monomères des DMD. Par conséquent, les effets écologiques découlant de l'exposition à ces substances DMD devraient être comparables.
7.1.1 MDD
7.1.1.1 Études empiriques pour le milieu aquatique
D'après les propriétés physiques et chimiques des MDD et leur devenir prévu dans l'environnement (consulter la section sur le devenir dans l'environnement, tableau 6.1), une fois rejetées dans l'eau, une bonne partie des substances, en particulier le monomère, devraient rester dans l'eau et se répartir ultérieurement dans les sédiments (jusqu'à 30 %) (voir le tableau 6.1). Toutefois, le sol et les sédiments devraient être le principal milieu récepteur lorsque des rejets de MDD se produisent dans l'air et le sol. Par conséquent, la voie d'exposition potentielle pour les organismes aquatiques au MDD résulterait principalement des rejets directs des substances MDD dans l'eau.
Les effets du 4,4'-MDD chez les espèces aquatiques ont fait l'objet d'une étude approfondie, notamment chez les micro-organismes (bactéries marines et d'eau douce et boues activées), les algues vertes, les invertébrés (Daphnia magna) et les poissons. Des effets semblables ont été établis pour le pMDD chez les micro-organismes [algues vertes et invertébrés (D. magna)], bien que les études effectuées étaient moins nombreuses. D'une manière générale, les niveaux de toxicité observés chez différentes espèces aquatiques mesurés sous forme de paramètres écologiques étaient comparables entre le 4,4'-MDD et le pMDD.
Les effets écologiques du 4,4'-MDD ont été étudiés chez trois espèces de micro-organismes : une bactérie marine Gram négatif Photobacterium phosphoreum, une bactérie Escherichia coli à Gram négatif et des micro-organismes non identifiés présents dans les boues activées.
Un essai de toxicité des bactéries photoluminescentes, l'essai Microtox, a été effectué avec une bactérie marine P. phosphoreum pour produire un indice des données de toxicité pour plus de 1300 produits chimiques (Kaiser et Palabrica 1991).Le 4,4'-MDD était l'un des produits chimiques testés dans la présente étude. La valeur de la CE50 aiguë sur 30 minutes déterminée pour le 4,4'-MDD dans l'essai biologique Microtox était de 6,6 mg/L (Kaiser et Palabrica 1991), ce qui indique un potentiel de toxicité modérée de la substance d'essai.
Dans les deux autres études sur les bactéries disponibles pour le 4,4'-MDD, les observations ont démontré que la substance n'était pas sensiblement toxique pour les organismes d'essai aux expositions aiguës et chroniques (ECHA, c2007-2013a). Dans le cadre d'une étude sur la toxicité aiguë sur 3 heures menée en 1986, des boues activées provenant d'une usine de traitement d'eaux usées à l'échelle du laboratoire ont été testées selon la ligne directrice de l'OCDE n° 209 (Boue activée, essai d'inhibition de la respiration) à des concentrations allant jusqu'à 100 mg/L. On a déterminé que la CE50 pour l'inhibition de la respiration est supérieure à 100 mg/L après une exposition de 3 heures au 4,4'-MDD (Caspers et coll. 1986). De même, dans une étude d'exposition chronique sur 10 jours mettant à l'essai le taux de croissance d'E. coli, une concentration sans effet observé (CSEO) supérieure à 100 mg/L a été établie et aucun effet important sur la croissance d'E. coli après 10 jours d'exposition au 4,4'-MDD n'a été observé (ECHA, c2007-2013a).
Les effets écotoxicologiques du 4,4'-MDD et du pMDD ont également été déterminés chez les algues. Le 4,4'-MDD a été testé chez deux espèces, Selenastrum capricornutum et Desmodesmus subspicatus, dans une étude de 2002 et de 1985, respectivement. Les deux études ont été effectuées selon la ligne directrice de l'OCDE n° 201 (essai d'inhibition de croissance des algues) et des résumés des rapports d'étude sont disponibles sur le site Web de l'Agence européenne des produits chimiques (ECHA, c2007-2013a). Dans l'étude de 2002, l'algue S. capricornutum a été exposée au 4,4'-MDD à des concentrations nominales variant de 0,2 à 20 mg/L sur 48 et 72 heures. À 72 heures, la CE50 pour le taux de croissance était de 14,4 mg/L et pour le calcul de la surface sous la courbe de croissance, les paramètres déclarés comprenaient une CSEO de 0,93 mg/L et une CE50 sur 72 heures de 5,34 mg/L. Dans l'étude de 1985, l'algue D. subspicatus a été exposée au 4,4'-MDD aux concentrations nominales variant de 10 à 160 mg/L pour 72 heures. Selon les déclarations, une CE50 pour le taux de croissance était de 21 mg/L (ECHA, c2007-2013a). En résumé, les deux espèces d'algues, S. capricornutum et D. subspicatus, semblent avoir des sensibilités semblables à l'exposition du 4,4'-MDD jusqu'à 72 heures, avec des CE50 pour l'inhibition du taux de croissance variant de 13,5 à 21 mg/L.
Un résumé d'une étude semblable concernant le pMDD, effectuée en 1992 conformément à la norme d'essai industrielle DIN 38 412, partie 9, est également disponible sur le site Web de l'Agence européenne des produits chimiques (ECHA, c2007-2013a). Dans cette étude, l'algue verte, D. subspicatus, a été exposée au pMDD pendant 72 heures et deux paramètres écotoxicologiques (inhibition du taux de croissance et augmentation de la biomasse) ont été pris en compte. Les CE10 ont été établies à 0,3 et 2,4 mg/L et les CE50 ont été établies à 11 et 9,8 mg/L pour l'inhibition du taux de croissance et l'augmentation de la biomasse, respectivement (voir le tableau 6b). D'après les études disponibles, les effets écotoxicologiques du 4,4'-MDD et du pMDD sur l'algue semblent être similaires. Selon les déclarations, le pMDD utilisé dans l'étude était composé du 4,4'-MDD (près de 60 %), du 2,4'-MDD (moins de 3 %), du 2,2'-MDD (moins de 0,1 %) et des oligomères à des concentrations d'environ 21 % pour trois oligomères, 8 % pour quatre oligomères, 3 % pour cinq oligomères et 4 % pour un nombre d'oligomères supérieur ou égal à six (ECHA, c2007-2013a).
Plusieurs paramètres écotoxicologiques à court terme et à long terme ont été établis pour le cladocère, Daphnia magna, en raison de nombreuses études testant le 4,4'-MDD (ECHA, c2007-2013a; Salinas 2011; Mitsubishi Chemical Safety Institute 2002a, 2002b). De même, deux études sur l'écotoxicité aiguë, qui examinent les effets du pMDD sur les daphnies, ont été menées récemment (Étude présentée 2012; ECHA, c2007-2013a). En général, les substances 4,4'-MDD et pMDA sont très toxiques pour l'espèce D. magna, avec des paramètres de CE50 ou de CL50 atteignant une valeur inférieure à 1 mg/L en raison des expositions aiguës et chroniques. Les études disponibles sont résumées dans les tableaux 7.1 et 7.2.
Les effets écotoxiques incluant l'inhibition de la reproduction chez l'espèce D. magna découlant d'une exposition à long terme de 21 jours au 4,4'-MDD, ont été déterminés dans une étude effectuée par le Mitsubishi Chemical Safety Institute (2002b). L'étude a été réalisée conformément à la ligne directrice de l'OCDE no 211 (Daphnia magna, essai de reproduction). Les daphnies ont été exposées à la substance d'essai dont la concentration varie de 0,006 à 0,6 mg/L. La valeur de CL50 aiguë a été déclarée comme étant de 0,0291 mg/L; la CSEO, la CMEO et la CE50 concernant l'inhibition de la croissance étaient de 0,00525, 0,0182 et 0,0149 mg/L, respectivement. Cette étude démontre les effets de toxicité les plus faibles observés à la suite de l'exposition d'une espèce aquatique au 4,4'-MDD.
Deux études non publiées examinant les effets aigus de l'exposition du pMDD à l'espèce D. magna étaient disponibles aux fins d'examen (Étude présentée 2012f, 2012h; ECHA, c2007-2013b; voir le tableau 7.2). Les valeurs CSEO, CE50 et CE100 sur 48 heures concernant l'immobilisation ont été déterminées à 0,273, 0,57 et 1,24 mg/L, respectivement, d'après les concentrations moyennes mesurées. Une autre étude similaire non publiée, réalisée en 2010, a également porté sur les effets du pMDD sur l'immobilisation de l'espèce D. magna après une exposition à court terme de 48 heures. Les valeurs CSEO, CE50 et CE100 concernant l'espèce D. magna étaient de 0,1 mg/L, entre 0,1 et 1 mg/L et de 1 mg/L, respectivement, d'après les concentrations d'essai nominales. Les résultats des deux études sont conformes et indiquent un degré similaire de toxicité pour les organismes d'essai.
Chez les espèces de poissons, la toxicité à court terme du 4,4'-MDD a été établie par l'intermédiaire d'une série d'études non publiées réalisées entre 1985 et 2002. Des résumés de ces études sont disponibles sur le site Web de l'Agence européenne des produits chimiques (ECHA, c2007-2013a). Les paramètres disponibles découlant des études de toxicité chez les poissons sont présentés dans le tableau 7.1. Des études à court terme sur 96 heures ont été réalisées chez quatre espèces de poissons, à savoir le médaka (Oryzias latipes), la truite arc-en-ciel (Oncorhynchus mykiss), l'ide mélanote (Leuciscus idus) et le poisson zèbre (Brachydanio rerio). Les niveaux d'effet étaient comparables entre les différentes espèces de poissons et s'inscrivaient dans le même ordre de grandeur (voir le tableau 7.1) avec des CL50 sur 96 heures variant de 20,6 mg/L pour le médaka à 65 mg/L pour le poisson zèbre. Les données de toxicité empiriques disponibles pour les poissons indiquent que l'exposition à court terme (jusqu'à 96 heures) au 4,4'-MDD entraîne des effets toxiques modérés. Des valeurs de concentration létales établies pour différentes espèces de poissons dans ces études sont semblables et s'inscrivent dans le même ordre de grandeur. On n'a pas trouvé d'études de toxicité chronique à long terme chez les poissons dans la littérature publiée ni dans les sources non publiées. Toutefois, les effets écotoxicologiques du 4,4'-MDD chez les poissons devraient être plus prononcés par suite d'une exposition plus longue à la substance par rapport aux effets établis dans les études à court terme. Aucune étude sur les poissons n'a été relevée pour le pMDD. Les effets du pMDD devraient toutefois être semblables à ceux du 4,4'-MDD, étant donné les similarités structurelles entre les deux substances.
En conclusion, les organismes aquatiques sont sensibles à l'exposition à court terme et à long terme aux substances MDD, avec des effets toxiques observés intensifiés par l'exposition chronique, un phénomène typique des substances chimiques narcotiques neutres. On a observé que les substances 4,4'-MDD et pMDD présentaient une toxicité forte à modérée pour divers organismes aquatiques ayant fait l'objet d'essais, y compris les algues, les micro-organismes, l'invertébré Daphnia magna, et les poissons. Le cladocère, D. magna, présentait la plus forte sensibilité à l'exposition aux substances MDD et pMDD, avec plusieurs paramètres écotoxicologiques aigus et chroniques déterminés à moins de 1 mg/L. De plus, les paramètres écotoxicologiques déterminés pour les substances 4,4'-MDD et pMDD dans les algues et l'espèce D. magna étaient très semblables, ce qui permet de confirmer que les résultats découlant des études liées au pMDD peuvent être utilisés en tant que données déduites à partir d'analogues pour le 4,4'-MDD.
| Organisme d'essai | Durée de l'essai | Paramètre | Valeur (mg/L) |
Référence |
|---|---|---|---|---|
| Bactérie marine (Photobacterium phosphoreum) |
30 minutes | CE50 (essai Microtox) |
6,6 | Kaiser et Palabrica 1991 |
| Boues activées | 3 heures | CE50 (respiration) |
supérieur(e) à 100 | Caspers et coll. 1986 |
| Bactéries (Escherichia coli) |
10 jours | CSEO (taux de croissance) |
supérieur(e) à 100 | ECHA, c2007-2013aNDE |
| Algue (Selenastrum capricornutum) |
48 heures | CE50 NDE (taux de croissance) |
13,5 | ECHA, c2007-2013a |
| Algue (Selenastrum capricornutum) |
72 heures | CE50 NDE (taux de croissance) |
14,4 | ECHA, c2007-2013a |
| Algue (Desmodesmus subspicatus) |
72 heures | CE50 NDE (taux de croissance) |
21 | ECHA, c2007-2013a |
| Cladocère (Daphnia magna) |
24 heures | CE50 (immobilisation) |
2,3 | ECHA, c2007-2013a |
| Cladocère (Daphnia magna) |
24 heures | CSEO (immobilisation) |
0,41 | Salinas 2011 |
| Cladocère (Daphnia magna) |
48 heures | CSEO (immobilisation) |
0,19 | Salinas 2011 |
| Cladocère (Daphnia magna) |
24 heures | CE50 (immobilisation) |
1,5 | Salinas 2011 |
| Cladocère (Daphnia magna) |
48 heures | CE50 (immobilisation) |
0,40 | Salinas 2011 |
| Cladocère (Daphnia magna) |
24 heures | CE100 (immobilisation) |
supérieur(e) à 4,3 | Salinas 2011 |
| Cladocère (Daphnia magna) |
48 heures | CE100 (immobilisation) |
2,0 | Salinas 2011 |
| Cladocère (Daphnia magna) |
24 heures | CSEO (immobilisation) |
0,63 | Mitsubishi Chemical Safety Institute 2002a |
| Cladocère (Daphnia magna) |
48 heures | CSEO (immobilisation) |
0,2 | Mitsubishi Chemical Safety Institute 2002a |
| Cladocère (Daphnia magna) |
24 heures | CE50 (immobilisation) |
8,08 | Mitsubishi Chemical Safety Institute 2002a |
| Cladocère (Daphnia magna) |
48 heures | CE50 (immobilisation) |
2,47 | Mitsubishi Chemical Safety Institute 2002a |
| Cladocère (Daphnia magna) |
48 heures | CE100 (immobilisation) |
200 | Mitsubishi Chemical Safety Institute 2002a |
| Cladocère (Daphnia magna) |
14 jours | CSEO (reproduction) |
0,15 | ECHA, c2007-2013a |
| Cladocère (Daphnia magna) |
21 jours | CL50 (inhibition de la reproduction) |
0,0291 | Mitsubishi Chemical Safety Institute 2002b |
| Cladocère (Daphnia magna) |
21 jours | CE50 (inhibition de la reproduction) |
0,0149* | Mitsubishi Chemical Safety Institute 2002b |
| Cladocère (Daphnia magna) |
21 jours | CSEO (inhibition de la reproduction) |
0,00525 | Mitsubishi Chemical Safety Institute 2002b |
| Cladocère (Daphnia magna) |
21 jours | CMEO (inhibition de la reproduction) |
0,0182 | Mitsubishi Chemical Safety Institute 2002b |
| Médaka (Oryzias latipes) |
48 heures | CL50 | 321 | ECHA, c2007-2013aNDE |
| Médaka (Oryzias latipes) |
96 heures | CL50 | 20,6 | ECHA, c2007-2013aNDE |
| Truite arc-en-ciel (Oncorhynchus mykiss) |
96 heures | CL50 | 39 | ECHA, c2007-2013aNDE |
| Ide mélanote (Leuciscus idus) |
96 heures | CL50 | 53 | ECHA, c2007-2013aNDE |
| Poisson zèbre (Brachydanio rerio) |
96 heures | CL50 | 42 | ECHA, c2007-2013aNDE |
| Poisson zèbre (Brachydanio rerio) |
96 heures | CL50 | 65 | ECHA, c2007-2013aNDE |
Abréviations : NDE, non disponible pour examen; CE50, concentration d'une substance qu'on estime susceptible de causer un effet chez 50 % des organismes d'essai; CL50, concentration d'une substance qu'on estime susceptible de causer un décès chez 50 % des organismes d'essai; CSEO, concentration sans effet observé (concentration la plus élevée ne causant pas d'effet statistiquement significatif par rapport aux témoins dans un essai de toxicité; CMEO, concentration minimale entraînant un effet observé (concentration la plus faible mesurée lors d'un essai de toxicité qui a un effet statistiquement significatif par comparaison avec les témoins.
*Ce paramètre a été choisi en tant que valeur critique de toxicité (VCT). Il a été estimé que l'étude était fiable d'après un sommaire de rigueur d'études (Environnement Canada 2013).
| Organisme d'essai | Durée de l'essai | Paramètre | Valeur (mg/L) |
Référence |
|---|---|---|---|---|
| Algues vertes (Desmodesmus subspicatus) |
72 heures | CE50 (taux de croissance) |
11 | ECHA, c2007-2013aNDE |
| Algues vertes (Desmodesmus subspicatus) |
72 heures | CE50 (augmentation de la biomasse) |
9,8 | ECHA, c2007-2013aNDE |
| Cladocère (Daphnia magna) |
48 heures | CSEO (immobilisation) |
0,273 | Étude présentée 2012f; ECHA, c2007-2013b |
| Cladocère (Daphnia magna) |
48 heures | CE50 (immobilisation) |
0,570 | Étude présentée 2012f; ECHA, c2007-2013b |
| Cladocère (Daphnia magna) |
48 heures | CE100 (immobilisation) |
1,24 | Étude présentée 2012f; ECHA, c2007-2013b |
| Cladocère (Daphnia magna) |
48 heures | CSEO (mortalité) |
0,1 | Étude présentée 2012g; ECHA, c2007-2013b |
| Cladocère (Daphnia magna) |
48 heures | CE50 (mortalité) |
supérieur(e) à 0,1 inférieur(e) à 1 | Étude présentée 2012g; ECHA, c2007-2013b |
| Cladocère (Daphnia magna) |
48 heures | CE100 (mortalité) |
1 | Étude présentée 2012g; ECHA, c2007-2013b |
Abréviations : NDE, non disponible pour examen; CE50 : concentration d'une substance qu'on estime susceptible de causer un effet chez 50 % des organismes d'essai; CSEO : concentration sans effet observé, soit la concentration la plus élevée ne causant pas d'effet statistiquement significatif par rapport au groupe témoin dans un essai de toxicité.
7.1.1.2 Études empiriques concernant d'autres milieux naturels
Dans le sol
Le sol constitue un milieu récepteur pour les substances MDD. Le dépôt des DMD dans le sol, et leur conversion ultérieure en polyurées et en MDD, est considéré comme étant la principale source de MDD dans ce milieu naturel. D'après les propriétés physiques et chimiques et le devenir dans l'environnement modélisé, les MDD pourraient être présents dans le sol s'il était rejeté directement dans l'environnement. Les résultats obtenus avec le modèle EQC présentés dans le tableau 6.1 dans la section sur le devenir dans l'environnement indiquent que lorsque les MDD sont rejetés dans l'air, une bonne partie de ces derniers seront ensuite déposés dans le sol. En outre, lorsque les substances MDD sont rejetées dans le sol, presque la totalité des substances devrait rester dans ce milieu.
Des études empiriques pour le monomère 4,4'-MDD ont été réalisées chez les micro-organismes et les invertébrés du sol et deux espèces de plantes. Aucune étude similaire évaluant les effets écotoxicologiques dans les organismes du sol n'a été révélée pour le pMDD. Les études disponibles sur la toxicité pour le sol relativement au 4,4'-MDD sont résumées dans le tableau 7.3.
Les effets écotoxiques du 4,4'-MDD sur les bactéries fixatrices d'azote ont été étudiés dans une étude de 2013 réalisée selon la ligne directrice de l'OCDE n° 216 (Micro-organismes du sol : essai de transformation de l'azote) (Schwarz 2013) sur 28 jours. Des échantillons du sol étaient composés de sable loameux et ont été prélevés sur un site qui n'avait pas été cultivé au cours des quatre dernières années et qui n'avait pas subi d'application d'engrais, de pesticides ou d'herbicides pendant ces années. L'effet de la réduction d'ammonium n'a pas été observé aux concentrations de 4,4'-MDD testées; en conséquence, une CSEO supérieure à 1000 mg/kg de sol a été attribuée. Les auteurs ont conclu que les résultats de cette étude semblaient indiquer que les bactéries nitrifiantes n'étaient pas inhibées par la substance d'essai (Schwarz 2013).
Les effets écotoxicologiques du 4,4'-MDD ont été déterminés pour un arthropode terricole, le collembole nivicole (Folsomia candida) (Moser 2011). Dans une étude de 2011, réalisée selon ligne directrice de l'OCDE no 232, les effets de l'exposition à long terme du 4,4'-MDD sur la reproduction ont été déterminés. Selon les déclarations, les valeurs de la CSEO et de la CE50 sur 28 jours sont de 562 et de 909,9 mg/kg de sol (poids sec), respectivement. Selon les résultats de cette étude, le 4,4,-MDD présenterait une faible toxicité pour le collembole nivicole, d'après la période d'exposition et le paramètre pris en compte dans l'étude.
Des effets écotoxicologiques liés au 4,4'-MDD ont été déterminés dans un invertébré du sol, le ver de terre, Eisenia fetida, pour la première fois en 1992 conformément à la ligne directrice de l'OCDE no 207 (Vers de terre, essais de toxicité aiguë) (Étude présentée 2012h), et plus récemment en 2012, conformément à la ligne directrice de l'OCDE no 222 (Essai de reproduction chez le lombric) (Hamberger et Moser 2012). Dans l'étude de toxicité aiguë, les vers de terre ont été exposés à la substance d'essai mélangée à du sol artificiel pendant 14 jours (Étude présentée 2012h). Les résultats déclarés indiquaient une CL50 de 444 mg/kg de sol, ainsi que des CSEO pour le comportement ou l'apparence, pour l'augmentation ou la diminution du poids et pour la mortalité de 56, 32 et 180 mg/kg de sol, respectivement. Dans l'étude à long terme sur 56 jours, qui utilise également du sol artificiel, les valeurs de la CSEO et de la CE10 liées aux effets sur la production ont été déterminées comme étant inférieures à 18 mg/kg de sol (poids sec) et de 11,2 mg/kg de sol (poids sec), respectivement. Les résultats de ces deux études ont indiqué que le 4,4'-MDD présente une toxicité modérée pour les vers de terre.
Les effets sur la levée, la croissance et la survie des plantules ont été étudiés chez deux espèces de plantes, représentatives des groupes de plantes monocotylédones et dicotylédones : l'avoine, Avena sativa, et la laitue, Lactuca sativa (van der Hoeven et coll. 1992).
Dans l'étude réalisée avec l'avoine, la CSEO concernant la levée des plantules a été déclarée à 320 mg/kg de sol (poids sec) après 17 jours d'exposition. Les valeurs de la CSEO et de la CE50 sur 14 jours pour le taux de croissance ont été déterminées à 100 et 353 mg/kg de sol (poids sec), respectivement. Enfin, la CSEO sur 14 jours concernant la survie dépassait la concentration testée la plus élevée et était supérieure ou égale à 1000 mg/kg de sol (poids sec). Dans l'étude réalisée avec la laitue, la CSEO concernant la levée des plantules a été déclarée à 100 mg/kg de sol (poids sec) après 17 jours d'exposition. La CSEO et la CE50 sur 14 jours pour le taux de croissance ont été déterminées à 10 et 128 mg/kg de sol (poids sec), respectivement, après 14 jours d'exposition. Comme pour l'étude réalisée avec l'avoine, la CSEO sur 14 jours concernant la survie dépassait également la concentration testée la plus élevée et était supérieure ou égale à 1000 mg/kg de sol (poids sec). Les deux études sur les plantes indiquent que le 4,4'-MDD présente une toxicité modérée pour le sol, d'après une période d'exposition de deux semaines.
En résumé, le 4,4'-MDD semble exercer une toxicité faible à modérée sur les organismes du sol et les plantes. Le ver de terre était l'espèce la plus sensible au 4,4'-MDD, en particulier à la suite d'une exposition à long terme. De plus, deux espèces végétales, l'avoine et la laitue, ont été soumises à un essai et les résultats de ces études semblaient indiquer une sensibilité similaire chez les deux espèces végétales à l'exposition au 4,4'-MDD.
| Organisme d'essai | Durée de l'essai | Paramètre | Valeur (mg/kg de sol sec) |
Référence |
|---|---|---|---|---|
| Inoculum du sol (bactéries fixatrices d'azote) |
8 jours | CSEO (réduction de l'ammonium) |
supérieur(e) à 1000 | Schwarz 2013 |
| Collembole Folsomia candida |
28 jours | CSEO; CE50 (reproduction) |
562 | Moser 2011 |
| Collembole Folsomia candida |
28 jours | CSEO; CE50 (reproduction) |
909,9 | Moser 2011 |
| Ver de terre (Eisenia fetida) |
14 jours | CSEO (augmentation du poids) |
32 | Hamberger et Moser 2012 |
| Ver de terre (Eisenia fetida) |
14 jours | CSEO (comportement/apparence) |
56 | Hamberger et Moser 2012 |
| Ver de terre (Eisenia fetida) |
14 jours | CSEO (mortalité) |
180 | Hamberger et Moser 2012 |
| Ver de terre (Eisenia fetida) |
14 jours | CL50 | 444 | Hamberger et Moser 2012 |
| Ver de terre (Eisenia fetida) |
56 jours | CSEO (reproduction) |
inférieur(e) à 18 | Hamberger et Moser 2012 |
| Ver de terre (Eisenia fetida) |
56 jours | CE (reproduction) |
11,2* | Hamberger et Moser 2012 |
| Avoine (Avena sativa) |
14 jours | CSEO (croissance) |
100 | van der Hoeven et coll. 1992 |
| Avoine (Avena sativa) |
14 jours | CE50 (croissance) |
353 | van der Hoeven et coll. 1992 |
| Avoine (Avena sativa) |
14 jours | CSEO (survie) |
supérieur(e) à 1000 | van der Hoeven et coll. 1992 |
| Avoine (Avena sativa) |
17 jours | CSEO (levée des plantules) |
320 | van der Hoeven et coll. 1992 |
| Laitue (Lactuca sativa) |
14 jours | CSEO (croissance) |
10 | van der Hoeven et coll. 1992 |
| Laitue (Lactuca sativa) |
14 jours | CE50 (croissance) |
128 | van der Hoeven et coll. 1992 |
| Laitue (Lactuca sativa) |
14 jours | CSEO (survie) | supérieur(e) à 1000 | van der Hoeven et coll. 1992 |
| Laitue (Lactuca sativa) |
17 jours | CSEO (levée des plantules) |
100 | van der Hoeven et coll. 1992 |
Abréviations : NDE, non disponible pour examen; CE50, concentration d'une substance qu'on estime susceptible de causer un effet chez 50 % des organismes d'essai; CL50, concentration d'une substance qu'on estime susceptible de causer un décès chez 50 % des organismes d'essai; CSEO, concentration sans effet observé (concentration la plus élevée ne causant pas d'effet statistiquement significatif par rapport aux témoins dans un essai de toxicité; CMEO, concentration minimale entraînant un effet observé (concentration la plus faible mesurée lors d'un essai de toxicité qui a un effet statistiquement significatif par comparaison avec les témoins.
*Ce paramètre a été choisi en tant que valeur critique de toxicité (VCT).
Dans les sédiments
D'après les caractéristiques physiques et chimiques des MDD et le devenir prévu dans l'environnement, les sédiments pourraient être un milieu récepteur de la substance dès son rejet dans l'environnement. Les composants oligomères du pMDD présentent une plus grande affinité pour les sédiments que les MDD monomère. D'après la modélisation EQC (2011) (tableau 6.1), près de 30 % du 4,4'-MDD et plus de 90 % des oligomères des MDD devraient se répartir dans les sédiments lors des rejets de 4,4'-MDD ou de pMDD dans l'eau. La répartition dans les sédiments à partir de l'air devrait également se produire, en particulier pour les oligomères du pMDD ayant un nombre d'anneaux de carbone plus importants (supérieur à 3).
La toxicité du 4,4'-MDD a été établie chez un certain nombre d'espèces vivant dans les sédiments, notamment les invertébrés et les crustacés. Des rapports non publiés sur des études écotoxicologiques, réalisées entre 2000 et 2005, ont porté sur la toxicité du 4,4'-MDD pour les moucherons non piqueurs (Chironomus riparius), les vers noirs (Lumbriculus variegatus) et un crustacé(Hyalella azteca) (Egeler et Ginzburg 2001; Egeler 2002; Egeler et Gilberg 2005). Les paramètres écotoxicologiques principaux pour les espèces vivant dans les sédiments soumises à des essais sont résumés dans le tableau 7.4. Le profil de toxicité du 4,4'-MDD dans les sédiments d'après l'exposition chronique sur 28 jours des différentes espèces laisse penser que cette substance présente une toxicité modérée pour les organismes benthiques.
Deux études testant les effets chroniques du 4,4'-MDD chez le ver noir, L. variegatus ont été réalisées en 2001 et 2002 (Egeler and Ginzburg 2001; Egeler 2002). Les paramètres étudiés comportaient la mortalité, la reproduction et la biomasse. Il convient de noter que les résultats des études de 2001 et 2002 ont démontré une sensibilité variée du ver noir à l'exposition du 4,4'-MDD, avec une différence dans le niveau de toxicité multipliée par 10, environ, dans les paramètres parallèles. Ce manque de correspondance dans les résultats de l'étude pourrait être attribué aux différences observées dans les protocoles expérimentaux de chaque étude; les deux études s'appuyaient sur la méthode de Phipps et coll. (1993), mais l'étude de 2002 a également suivi la ligne directrice de l'OCDE n° 218 (Essai de toxicité sur les chironomes dans un système eau-sédiment chargé). Le profil de toxicité du 4,4'-MDD dans les sédiments d'après l'exposition chronique sur 28 jours des différentes espèces laisse penser que cette substance présente une toxicité modérée pour les organismes benthiques. Cependant, dans l'ensemble, le ver noir (L. variegatus) était l'espèce la plus sensible à l'exposition au 4,4'-MDD, et le critère d'effet le plus sensible était la CMEO de 3,75 mg/kg sédiments (poids sec) en raison de ses effets sur la biomasse (Egeler 2002). La teneur en tourbe des sédiments utilisés dans l'essai d'Egeler (2002) était de 5 % (poids sec). L'analyse de la matière d'essai n'a pas été jugée nécessaire, de sorte que les résultats sont basés sur les concentrations nominales. La biomasse, basée sur le poids sec des tissus des vers et sur le poids sec libre de cendre, était grandement réduite dans tous les traitements, par rapport aux témoins, comme l'indiquait l'analyse de variance (ANOVA) et le test T de Dunnett subséquent (p inférieur(e) u égal(e) à 0,05).
| Organisme d'essai | Durée de l'essai | Paramètre | Valeur (mg/kg) |
Référence |
|---|---|---|---|---|
| Moucheron non piqueur (Chironomus riparius) |
28 jours | CSEO (taux d'émergence) |
500 | Egeler et Gilberg 2005 |
| Moucheron non piqueur (Chironomus riparius) |
28 jours | CMEO (taux d'émergence) |
1000 | Egeler et Gilberg 2005 |
| Moucheron non piqueur (Chironomus riparius) |
28 jours | CE50 (taux d'émergence) |
849 | Egeler et Gilberg 2005 |
| Moucheron non piqueur (Chironomus riparius) |
28 jours | CSEO (taux de développement) |
supérieur(e) à 1000 | Egeler et Gilberg 2005 |
| Moucheron non piqueur (Chironomus riparius) |
28 jours | CMEO (taux de développement) |
supérieur(e) à 1000 | Egeler et Gilberg 2005 |
| Ver noir (Lumbriculus variegatus) |
28 jours | CSEO (mortalité) |
supérieur(e) à 60 | Egeler 2002 |
| Ver noir (Lumbriculus variegatus) |
28 jours | CSEO (reproduction) |
3,75 | Egeler 2002 |
| Ver noir (Lumbriculus variegatus) |
28 jours | CE50 (reproduction) |
14,1 | Egeler 2002 |
| Ver noir (Lumbriculus variegatus) |
28 jours | CSEO (biomasse) |
inférieur(e) à 3,75 | Egeler 2002 |
| Ver noir (Lumbriculus variegatus) |
28 jours | CMEO (biomasse) |
3,75* | Egeler 2002 |
| Ver noir (Lumbriculus variegatus) |
28 jours | CE50 (biomasse) |
42,6 | Egeler 2002 |
| Ver noir (Lumbriculus variegatus) |
28 jours | CSEO (reproduction) |
25,2 | Egeler et Ginzburg 2001 |
| Ver noir (Lumbriculus variegatus) |
28 jours | CMEO (reproduction) |
50,3 | Egeler et Ginzburg 2001 |
| Ver noir (Lumbriculus variegatus) |
28 jours | CSEO (biomasse) |
50,3 | Egeler et Ginzburg 2001 |
| Ver noir (Lumbriculus variegatus) |
28 jours | CMEO (biomasse) |
100,7 | Egeler et Ginzburg 2001 |
| Ver noir (Lumbriculus variegatus) |
28 jours | CE50 (biomasse) |
81 | Egeler et Ginzburg 2001 |
| Crustacé amphipode (Hyalella azteca) |
28 jours | CSEO (mortalité) |
41,3 | Egeler et Gilbert 2005 |
| Crustacé amphipode (Hyalella azteca) |
28 jours | CMEO (mortalité) |
90,9 | Egeler et Gilbert 2005 |
| Crustacé amphipode (Hyalella azteca) |
28 jours | CE50 (mortalité) |
117,9 | Egeler et Gilbert 2005 |
| Crustacé amphipode (Hyalella azteca) |
28 jours | CSEO (longueur de l'amphipode) |
90,9 | Egeler et Gilbert 2005 |
| Crustacé amphipode (Hyalella azteca) |
28 jours | CMEO (longueur de l'amphipode) |
200 | Egeler et Gilbert 2005 |
| Crustacé amphipode (Hyalella azteca) |
28 jours | CSEO (biomasse totale) |
90,9 | Egeler et Gilbert 2005 |
| Crustacé amphipode (Hyalella azteca) |
28 jours | CMEO (biomasse totale) |
200 | Egeler et Gilbert 2005 |
| Crustacé amphipode (Hyalella azteca) |
28 jours | CE50 (biomasse totale) |
134,8 | Egeler et Gilbert 2005 |
Abréviations : NDE, non disponible pour examen; CE50, concentration d'une substance qu'on estime susceptible de causer un effet chez 50 % des organismes d'essai; CL50, concentration d'une substance qu'on estime susceptible de causer un décès chez 50 % des organismes d'essai; CSEO, concentration sans effet observé (concentration la plus élevée ne causant pas d'effet statistiquement significatif par rapport aux témoins dans un essai de toxicité; CMEO, concentration minimale entraînant un effet observé (concentration la plus faible mesurée lors d'un essai de toxicité qui a un effet statistiquement significatif par comparaison avec les témoins).
* Ce paramètre a été choisi en tant que valeur critique de toxicité (VCT).
Faune
Mammifères
On n'a pas trouvé de rapports d'étude portant sur la toxicité des MDD et du pMDD pour les mammifères terrestres dans la littérature publiée ni dans les sources non publiées. Toutefois, les espèces élevées en laboratoire généralement utilisées dans les modèles expérimentaux pour étudier la santé humaine, telles que les rats et les souris, sont pertinentes pour les espèces sauvages. De nombreuses études portant sur les effets des DMD chez les souris et les rats sont décrites dans la section sur l'évaluation des effets sur la santé et dans Santé Canada (2013). On considère que ces études et les paramètres établis sont applicables à certaines espèces de mammifères sauvages, telles que les musaraignes, les mulots et d'autres petits mammifères, ainsi qu'à d'autres espèces sauvages, en appliquant les corrections de classement appropriées.
Oiseaux
La toxicité du 4,4'-MDD découlant d'une exposition à court terme à la substance dans les aliments a été établie chez la Carouge à épaulettes (Agelaius phoeniceus). Dans l'étude, les oiseaux sauvages piégés ont été préconditionnés à une captivité pendant deux à six semaines et recevaient généralement des doses par gavage avec des solutions ou des suspensions de la substance chimique d'essai dans le propylèneglycol, ou, parfois, par d'autres méthodes d'administration orale comme les boulettes de régurgitation ou les capsules de gélatine. Puisque cette publication est une compilation des résultats pour plusieurs centaines de produits chimiques, les protocoles expérimentaux liés au 4,4'-MDD n'ont pas été fournis. La durée d'exposition était de 18 heures (ECHA, c2007-2013a). Les paramètres déterminés dans l'étude comportaient la DL50 pour une toxicité orale aiguë et la valeur liée à la répulsion aviaire R50. De plus, l'indice de risque aviaire aigu (aussi connu sous le nom indice de répulsion/toxicité) a également été calculé pour de nombreux produits chimiques, dans le but d'indiquer la probabilité d'un empoisonnement par voie orale dans la nature. La DL50concernant le 4,4'-MDD a été déclarée à 148 mg/kg, ce qui indique une toxicité modérée de la substance d'essai. La valeur R50 a été déterminée comme étant supérieure à 1,00 %. Le facteur de risque n'a pas été calculé pour le 4,4'-MDD, puisque les valeurs DL50 et R50n'ont pas été établies pour d'autres espèces d'oiseaux soumises à des essais dans l'étude, un aspect clé dans la détermination d'une valeur ou tendance significative par l'indice. Les résultats clés de l'étude sur le 4,4'-MDD sont résumés dans le tableau 7.5 ci-dessous.
| Organisme d'essai | Durée de l'essai | Paramètre | Valeur (mg/kg) |
Référence |
|---|---|---|---|---|
| Carouge à épaulette (Agelaius phoeniceus) |
18 heures | DL50 | 148 | Schafer et coll. 1983; ECHA, c2007-2013a |
Abréviations : DL50, dose ou concentration d'une substance qu'on estime létale pour 50 % des organismes d'essai.
Dans l'ensemble, les résultats de cette étude ont indiqué que le 4,4'-MDD est modérément toxique pour les oiseaux, d'après l'exposition à court terme par ingestion.
7.1.1.3 Calcul de la CESE
On considère que le sol est le principal milieu naturel récepteur des MDD au Canada selon les sources et les utilisations connues de ces substances. Concernant le sol, la CE10 à long terme sur 56 jours pour la reproduction du ver de terre (Eisenia fetida), établie à 11,2 mg/kg (sol sec), était la valeur de toxicité expérimentale valide la plus sensible et a donc été choisie en tant que valeur critique de toxicité (VCT). La concentration estimée sans effet (CESE) a été déterminée en divisant cette valeur par un facteur d'évaluation de 10 (pour tenir compte de la variabilité interspécifique et intraspécifique de la vulnérabilité et pour donner une valeur de 1,1 mg/kg (sol sec).
Au Canada, l'eau ne devrait pas être un milieu récepteur important pour le 4,4'-MDD ou le pMDD d'après leurs modèles d'utilisation et de rejets connus; en conséquence, l'exposition aux organismes aquatiques ne devrait pas se produire. Toutefois, étant donné l'importance du milieu aquatique dans l'environnement et les observations de toxicité élevée pour certains organismes aquatiques découlant de l'exposition au MDD, une CESE aquatique a également été calculée. La CE50 sur 21 jours de 0,0149 mg/L déterminée chez l'espèce D. magna (Mitsubishi Chemical Safety Institute 2002b) est considérée comme étant la VCT pour les MDD dans le milieu aquatique. Un facteur d'application de 10 a été appliqué à cette VCT (pour tenir compte de la variabilité interspécifique et intraspécifique de la vulnérabilité), entraînant une CESE aquatique de 0,0015 mg/L.
De même, une CESE a également été calculée pour les sédiments, compte tenu du fait que les MDD présentent une toxicité faible à modérée pour certains organismes benthiques. On considère que la VCT pour les MDD dans les sédiments représente la CMEO de 3,75 mg/kg (sédiment sec) pour le ver noir (Lumbriculus variegatus) (ECHA, c2007-2013a). Une CESE pour les sédiments a été calculée en divisant cette VCT par un facteur d'application de 10 (pour tenir compte de la variabilité interspécifique et intraspécifique de la vulnérabilité), ce qui donne une valeur de 0,375 mg/kg.
Les CESE calculées dans cette section s'appliquent à la fois au 4,4'-MDD et au pMDA.
Une CESE pour la faune n'a pas été établie. Le 4,4'-MDD et le pMDA ne se retrouvent habituellement pas dans l'air; par conséquent, on ne prévoit pas que l'inhalation constitue une voie d'exposition pour la faune. Ces substances sont connues pour leur faible potentiel de bioaccumulation de sorte que l'exposition de la faune par le régime alimentaire est peu probable.
7.1.1.4 Résumé des effets écologiques des MDD
Le 4,4'-MDD et le pMDD exerçaient une toxicité élevée à modérée sur les organismes aquatiques dans le cadre des expositions expérimentales aiguës et chroniques. Les études de toxicité aiguë et chronique ont permis d'observer une toxicité faible à modérée sur les oiseaux, les plantes terrestres, les invertébrés du sol et la faune terrestre.
7.1.2 DMD
Les DMD faisant parti du groupe de substance DMD/MDD comprennent trois monomères (4,4'-DMD, 2,4'-DMD et 2,2'-DMD) ainsi que deux mélanges (DMD mélangé et DMD oligomérique [pDMD]). Des études empiriques portant sur la toxicité des DMD pour les espèces aquatiques, terrestres ou vivant dans les sédiments ont été réalisées pour deux substances dans le groupe de substance DMD/MDD : le 4,4'-DMD et le pDMD. On n'a pas trouvé d'études empiriques liées aux substances 2,4'-DMD, 2,2'-DMD et MDD mélangé dans la littérature publiée ni dans les sources non publiées. Toutefois, étant donné que le 2,4'-DMD et le 2,2'-DMD sont des isomères très semblables du 4,4'-DMD (ils ne diffèrent que par le positionnement d'un ou deux groupes isocyanates de la position para à ortho sur les anneaux de carbone), les données empiriques pour le 4,4'-DMD peuvent être utilisées en tant que données déduites à partir d'analogues pour le 2,4'-DMD et le 2,2'-DMD. Une approche semblable peut être suivie pour les DMD mélangés, puisqu'il s'agit d'un mélange comportant les trois monomères DMD, à savoir le 2,2'-DMD, le 2,4'-DMD et le 4,4'-DMD.
Au contact avec l'eau, les substances DMD s'hydrolysent immédiatement et forment des polyurées, du dioxyde de carbone et une certaine quantité de MDD. Dans les nombreuses études portant sur le devenir et les effets du pDMD dans l'eau, les polyurées sont décrites comme étant des composantes inertes et biologiquement inactives (Sendijarevic et coll. 2004). Les effets toxiques associés aux polyurées sur les organismes aquatiques et benthiques étaient indirects et résultaient de la formation des couches de polyurées qui recouvraient les sédiments (consulter la section relative aux études empiriques pour d'autres milieux naturels).
Les polyurées ont des masses moléculaires élevées et une solubilité très faible dans l'eau; par conséquent, leur biodisponibilité pour les organismes aquatiques devrait être limitée. Des effets écotoxiques découlant des expositions aux composants oligomériques du pDMD ou aux produits polymères issus de la réaction d'hydrolyse devraient être inférieurs aux effets des composants monomères et ne pas les dépasser.
Les effets toxiques du 4,4'-MDD et du pMDD (c.-à-d. les produits résiduels de l'hydrolyse du 4,4'-DMD et du pDMD), déterminés par des études empiriques sur les organismes aquatiques, sont traités dans la section sur les MDD ci-dessus. L'évolution du dioxyde de carbone découlant de la réaction de grandes quantités de pDMD, vraisemblablement dans une situation de déversement, a démontré qu'elle pouvait éventuellement créer des microhabitats toxiques résultant des effets écotoxiques, en particulier chez les espèces benthiques immobiles. Ces effets sont traités plus en détail dans la section relative aux études empiriques dans d'autres milieux naturels ci-dessous.
7.1.2.1 Études empiriques pour le milieu aquatique
Les substances DMD sont très réactives lorsqu'elles sont en contact avec de l'eau en raison de la présence des groupes isocyanates. Le pDMD est connu pour subir rapidement une hydrolyse et pour former des polyurées, de petites quantités de MDD et du dioxyde de carbone; toutefois, dans les essais de laboratoire, on a observé une variation des taux d'hydrolyse en fonction des conditions expérimentales (Yakabe et coll. 1999). D'une manière générale, les substances DMD devraient réagir rapidement dans l'eau et ne devraient se retrouver que de façon transitoire dans le milieu aquatique, sans s'accumuler jusqu'à atteindre des concentrations importantes dans le milieu environnant.
Le 4,4'-DMD et le pDMD ont été soumis à des essais expérimentaux avec plusieurs espèces aquatiques comme les algues vertes, les micro-organismes, les invertébrés aquatiques et les poissons. Moins d'études étaient disponibles pour le 4,4'-DMD, étant donné que le pDMD semble avoir été testé plus souvent dans les études écotoxicologiques (les résultats de l'étude concernant le 4,4'-DMD et le pDMD sont résumés dans les tableaux 7.6 et 7.7, respectivement). Puisque le 4,4'-DMD représente environ 50 % de la composition du pDMD (consulter la section sur l'identité de la substance), les résultats des études testant le pDMD peuvent également être utilisés en tant que données déduites à partir d'analogues pour le 4,4'-DMD. Les effets du pDMD issus d'un événement de pollution accidentelle simulé ont aussi été étudiés à l'aide d'étangs artificiels ou de mésocosmes qui contenaient des organismes provenant de différents niveaux trophiques, notamment le phytoplancton, le zooplancton, le macrobenthos, les poissons et les macrophytes (Heimbach et coll. 1996).
Trois études portant sur le 4,4'-DMD, réalisées en 1977, sont résumées sur le site Web de l'Agence européenne des produits chimiques (ECHA, c2007-2013c). Les espèces étudiées comportaient deux invertébrés : le cladocère (D. magna) et l'escargot (Limnea stagnalis), ainsi que le poisson zèbre (B. rerio). Les résumés d'étude disponibles manquaient de détails expérimentaux et les concentrations d'essai du 4,4'-DMD ainsi que les protocoles expérimentaux n'étaient pas décrits (ECHA, c2007-2013c). Dans les trois études, on a pu déterminer que les préparations de la substance d'essai subissaient une réaction hétérogène, avec la précipitation d'un produit de réaction hydrolysé insoluble. Le 4,4'-MDD a été détecté dans l'eau d'essai à une concentration d'environ 4 mg/L après l'essai. La CSEO sur 24 heures était la seule valeur déclarée dans les trois études et elle était la même pour les trois espèces soumises à des essais à une concentration supérieure ou égale à 500 mg/L (ECHA, c2007-2013) (voir le tableau 7.6).
Des effets toxiques de pDMD ont été établis dans les algues vertes (D. subspicatus), dans une étude réalisée en 1994 selon la ligne directrice de l'OCDE no 201 (Essai d'inhibition de croissance des algues). Cette étude est résumée sur le site Web de l'Agence européenne des produits chimiques (ECHA, c2007-2013c). Le pDMD a été testé à une concentration unique de 1640 mg/L et, après trois jours d'exposition, aucune inhibition de la croissance des algues n'a été observée. La CSEO et la CE50 ont donc été attribuées en tant que valeurs supérieures ou égales à 1640 mg/L et supérieures à 1640 mg/L, respectivement (voir le tableau 6g). Les renseignements sur la composition du pDMD n'ont pas été fournis dans le résumé de l'étude (ECHA, c2007-2013c).
Une étude non publiée de 1986 portant sur les effets du pDMD chez les micro-organismes (provenant des boues activées), chez le cladocère (D. magna) et chez le poisson zèbre (B. rerio) a été présentée à Environnement et Changement climatique Canada (Caspers et coll. 1986). Outre les effets écotoxicologiques du pDMD, l'influence de la dispersion du pMDD dans le milieu d'essai sur son comportement toxique a été démontrée dans l'étude avec l'espèce D. magna. D'une manière générale, dans tous les essais, le pDMD ne pouvait se disperser de façon suffisante et uniforme dans l'eau, en raison probablement de sa tendance à s'hydrolyser et à former des polyurées solides (Caspers et coll. 1986). Lorsqu'il est dispersé à l'aide d'une méthode de cisaillement à haute vitesse, la toxicité du pDMD pour l'espèce D. magna était plus importante d'au moins un ordre de grandeur que lorsqu'il est dispersé à l'aide d'un agitateur magnétique. Par conséquent, l'efficacité de la dispersion du pDMD dans l'eau semblait influer sur son potentiel à causer des effets nocifs chez les organismes exposés. Toutefois, il convient de noter que le cisaillement à haute vitesse n'est pas représentatif des conditions environnementales typiques ou des situations pratiques.
Les effets sur le taux de respiration des micro-organismes présents dans les boues activées ont été déterminés à la suite d'une exposition au pDMD à des concentrations de 1, 10 et 100 mg/L pendant trois heures (Caspers et coll. 1986). Il a été déterminé que le pDMD n'était pas très toxique pour les micro-organismes dans les boues activées, étant donné qu'une inhibition de 0 % de la respiration a été observée à la plus forte concentration testée. Une valeur CE50 supérieure à 100 mg/L a donc été attribuée à l'inhibition de la respiration (Caspers et coll. 1986) (voir le tableau 7.7).
On a également constaté des effets toxiques aigus et chroniques sur le cladocère (D. magna) (Caspers et coll. 1986). Dans l'étude de toxicité aiguë, le pDMD a été testé à l'aide de deux méthodes de dispersion de la substance d'essai dans le milieu d'essai. Dans un essai, le pDMD a été dispersé dans l'eau à l'aide d'un cisaillement à haute vitesse pendant une minute à des concentrations allant de 0,5 à 500 mg/L. Dans un deuxième essai, le pDMD a été dispersé dans l'eau à l'aide d'un agitateur magnétique pendant 30 minutes et à des concentrations allant de 20 à 1000 mg/L. La CE50 sur 96 heures de 129,7 mg/L pour l'immobilisation a été calculée à partir du premier ensemble de données lorsque la substance d'essai a été dispersée par une méthode de cisaillement à haute vitesse. On n'a pas pu déterminer de valeur CE50 à partir du deuxième essai, car aucun effet nocif n'a été observé chez l'espèce D. magna à la concentration testée la plus élevée. Comme nous l'avons mentionné ci-dessus, ce résultat semble indiquer que l'efficacité de la dispersion du pDMD dans le milieu d'essai a une influence sur son potentiel à causer des effets nocifs dans l'organisme d'essai.
Dans l'étude de toxicité chronique, les effets du pDMD sur la reproduction ont été étudiés chez l'espèce D. magna à des concentrations de la substance d'essai allant jusqu'à 10 m/L (Caspers et coll. 1986). La substance a été dispersée dans l'eau par une légère agitation avec une tige en verre et un agitateur magnétique pendant une heure. Aucun effet négatif sur la reproduction n'a été détecté après 21 jours d'exposition à la plus forte concentration de pDMD testée de 10 mg/L. En conséquence, une CSEO supérieure à 10 mg/L a été attribuée pour la reproduction.
Enfin, des effets de toxicité aiguë du pDMD chez le poisson zèbre ont également été déterminés dans cette étude (Caspers et coll. 1986). Le pDMD a été testé à des concentrations allant jusqu'à 1000 mg/L et a été dispersé dans le milieu d'essai par agitation. La formation de gouttelettes solides, que les auteurs de l'étude estiment être des matières d'essai non dissoutes, a été observée et a éveillé la curiosité des poissons. On n'a pas observé de mortalité à la plus forte concentration de pDMD testée de 1000 mg/L après 96 heures d'exposition. Par conséquent, la CSEO a été déclarée comme étant supérieure à 1000 mg/L. Toutefois, on note généralement que les effets nocifs sur les poissons provoqués par une ingestion orale ou par dommages mécaniques des tissus corporels sensibles (p. ex., branchies) n'ont pas pu être exclus. Des exemples précis de ces effets et le nombre de poissons touchés n'ont pas été présentés dans le rapport d'étude (Caspers et coll. 1986).
La toxicité aiguë du pDMD a été précédemment déterminée dans une étude de 1982 qui étudie le médaka japonais (O. Latipes). Cette étude est résumée sur le site Web de l'Agence européenne des produits chimiques (ECHA, c2007-2013c). Dans cette étude, le pDMD a été testé selon le protocole japonais, Nichi-Nou-Sei B2735, dans des conditions semi-statiques. Le pDMD a été testé à une concentration de 3000 mg/L (déclaré en ppm); la substance d'essai a été dispersée dans l'eau par agitation et une précipitation au fond du récipient d'essai a été observée. Il a également été noté que deux heures après l'ajout du pDMD dans le milieu d'essai, de la poudre blanche est apparue à la surface de l'eau et s'est fixée aux nageoires des poissons. Aucune mortalité n'a été observée chez les poissons d'essai; une CSEO supérieure à 3000 mg/L a été déclarée après 48, 72 et 96 heures d'exposition au pDMD (ECHA, c2007-2013c).
Dans l'ensemble, les résultats des études de toxicité pour les organismes aquatiques, présentés dans les tableaux 7.6 et 7.7, semblent indiquer que les deux substances 4,4'-DMD et pDMD ne sont pas sensiblement toxiques pour les espèces aquatiques d'après une exposition aiguë. Les effets toxiques augmentent lorsque le pDMD se disperse efficacement dans le milieu d'essai, comme l'a démontré l'utilisation des différentes méthodes de dispersion dans l'étude de toxicité aiguë menée chez D. magna (Caspers et coll. 1986). Enfin, des résultats uniformes liés à la toxicité aiguë ont été observés chez les deux espèces de poissons testées, le poisson zèbre et le médaka japonais, ce qui indique un niveau semblable de sensibilité à la substance d'essai chez les deux espèces de poissons.
Ces observations devraient également s'appliquer aux autres substances DMD dans le groupe de substance DMD/MDD, au DMD mélangé et aux monomères (2,2'-DMD et 2,4'-DMD), étant donné les ressemblances structurelles des substances dans le groupe.
| Organisme d'essai | Durée de l'essai | Paramètre | Valeur (mg/L) |
Référence |
|---|---|---|---|---|
| Cladocère (Daphnia magna) |
24 heures | CSEO | supérieur(e) u égal(e) à 500 | Caspers et coll. 1986 |
| Escargot (Limnea stagnalis) |
24 heures | CSEO | supérieur(e) u égal(e) à 500 | ECHA, c2007-2013cNDE |
| Poisson zèbre (Brachydanio rerio) |
24 heures | CSEO | supérieur(e) u égal(e) à 500 | Caspers et coll. 1986 |
Abréviations : NDE, non disponible pour examen; CSEO, la concentration sans effet observé, est la concentration la plus élevée ne causant pas d'effet statistiquement significatif par rapport aux témoins dans un essai de toxicité.
| Organisme d'essai | Durée de l'essai | Paramètre | Value (mg/L) |
Référence |
|---|---|---|---|---|
| Boues activées | 3 heures | CE50 (inhibition de la respiration) |
supérieur(e) à 100 | Caspers et coll. 1986, ECHA c2007-2013c |
| Algues vertes (Desmodesmus subspicatus) |
3 jours | CSEO; CE50 (taux de croissance) |
1640; supérieur(e) à 1640 |
ECHA, c2007-2013cNDE |
| Cladocère (Daphnia magna) |
96 heures | CE50 (immobilisation) |
129,7* | Caspers et coll. 1986, ECHA c2007-2013c |
| Cladocère (Daphnia magna) |
21 jours | CSEO (reproduction) |
supérieur(e) à 10 | Caspers et coll. 1986 |
| Médaka japonais (Oryzias latipes) |
48 96 heures | CSEO (mortalité) |
supérieur(e) à 3000 | ECHA, c2007-2013cNDE |
| Poisson zèbre (Brachydanio rerio) |
96 heures | CSEO (mortalité) |
supérieur(e) à 1000 | Caspers et coll. 1986 |
Abréviations : NDE, non disponible pour examen; CE50 : concentration d'une substance qu'on estime susceptible de causer un effet chez 50 % des organismes d'essai; CSEO : concentration sans effet observé, soit la concentration la plus élevée ne causant pas d'effet statistiquement significatif par rapport au groupe témoin dans un essai de toxicité.
* Ce paramètre a été choisi en tant que valeur critique de toxicité (VCT).
Une série d'études sur l'exposition aiguë des mollusques, des crustacés et des poissons au pDMD ont été brièvement décrites dans Brochhagen et Grieveson (1984). Les résultats de ces études ne sont pas présentés dans le tableau 7.7, car la publication contenait peu de détails expérimentaux. Les escargots, les daphnies et les poissons ont été exposés au pDMD à une concentration unique de 500 mg/L pendant 24 heures. Concernant les trois espèces, les valeurs de CL50 ont été déclarées comme étant supérieures à 500 mg/L. Les carpes ont également été exposées à une plus faible concentration de pDMD établie à 10 mg/L (représentant 0,001 % de pDMD) pendant 35 jours. Il a été déclaré que les poissons d'essai présentaient des signes de perturbation du comportement; en outre, sept poissons sont morts et un poisson a été sacrifié au cours de l'étude. Lors d'un examen histologique, aucun effet systémique sur le foie et les reins n'a été observé; toutefois, les poissons ont présenté des signes d'irritation du tégument qui, d'après ce qu'on pense, favorise la pénétration des agents pathogènes (Brochhagen et Grieveson 1984). Il convient de noter que les effets observés chez la carpe d'après l'exposition à long terme de 35 jours au pDMD sont plus intenses que ceux observés dans les études à court terme chez les poissons exposés à des concentrations bien plus élevées de pDMD (voir le tableau 7.7 ci-dessus).
Outre les études de laboratoire menées pour étudier les effets du pDMD sur les espèces aquatiques individuelles (voir le tableau 7.7), des études plus générales qui ont porté sur les effets du pDMD sur les écosystèmes aquatiques ont été effectuées. Ces études visaient à évaluer les effets du pDMD découlant des déversements dans l'environnement (Heimbach et coll. 1996; Brochhagen et Grieveson 1984).
Une série d'études a été brièvement décrite dans Brochhagen et Grieveson (1984). Selon les auteurs, des expériences ont été réalisées dans le cadre desquelles le pDMD (composé d'un mélange de DMD monomères avec des oligomères) a été ajouté à la concentration de 50 mg/L (représentant 0,005 % de DMD) dans des systèmes modélisant l'eau salée et l'eau de rivière. On a pu observer que les DMD se convertissaient rapidement en polyurées. Les concentrations de DMD et les amines correspondantes ont été surveillées pendant 30 jours; la concentration de DMD est tombée à 5 % de la valeur initiale en une journée et les concentrations d'amines étaient généralement inférieures de 0,4 % à la quantité théorique d'après l'hydrolyse totale du diisocyanate en diamine. Il a été déclaré que le nombre de toutes les formes de zooplancton et de phytoplancton était réduit, à l'exception de la chlorophyte photosynthétique. La diminution maximale de ce nombre a atteint 75 % et s'est produite environ 10 jours après les traitements à base de DMD (Brochhagen et Grieveson 1984).
Dans une étude plus récente, les effets d'un événement de pollution accidentelle simulé avec du pDMD dans le milieu aquatique ont été étudiés grâce à des étangs artificiels (Heimbach et coll. 1996). Les étangs artificiels ont été conçus pour modéliser les écosystèmes d'eau douce permanents et comportaient des sédiments de lac naturels.
Les étangs ont été peuplés avec un certain nombre d'espèces benthiques et de plancton, un nombre limité de poissons (conservés en cages afin de maintenir l'équilibre entre les proies et les prédateurs) et de macrophytes pour établir des communautés naturelles avec des conditions de proies et de prédateurs. Deux étangs ont été traités avec du pDMD à des concentrations de 1000 et 10 000 mg/L et le troisième étang n'a pas été traité afin de servir d'étang témoin. Les étangs ont été étudiés pendant une période de 112 jours. Selon les déclarations, le pMDD était composé d'environ 45 % de 4,4'-DMD, ainsi que d'homologues et d'isomères supérieurs et semblait être un liquide visqueux qui, une fois appliqué aux étangs, réagissait avec l'eau pour produire des polyurées et du dioxyde de carbone et pour former une couche uniforme sur le dessus des sédiments (Heimbach et coll. 1996). À la fin de l'étude, les mesures de DMD et de MDD dans les eaux de l'étang étaient inférieures au niveau de détection analytique compris entre 0,004 et 0,01 mg/L (4-10 µg/L). Les effets sur les organismes présents dans les mésocosmes, notamment les communautés de phytoplancton et de zooplancton, et sur une variété d'espèces de poissons et de macrophytes ont été observés. On a constaté que l'application de pDMD à des concentrations atteignant 10 000 mg/L, ce qui est représentatif d'un scénario de déversement, entraînait des effets biologiques modérés, mais temporaires, sur les espèces aquatiques exposées. L'hydrolyse du pDMD a entraîné des changements la composition chimique de l'eau de l'étang et les nouvelles conditions ont renforcé la croissance de certains groupes de phytoplancton et de macrophytes qui, en retour, ont accru la production d'oxygène dans les étangs. Toutefois, à la plus forte concentration testée, un déséquilibre dans le rapport proie-prédateur dans l'écosystème a été noté lorsque des changements dans la composition chimique de l'eau et les populations de phytoplancton ont eu une incidence sur le zooplancton, qui, à son tour, a eu des effets nuisibles sur le prédateur du niveau trophique supérieur, la truite arc-en-ciel. De manière générale, un système aquatique touché devrait se rétablir rapidement, même si un déversement pourrait entraîner une certaine modification de la composition des espèces sur une aire limitée (Brochhagen et Grieveson 1984).
On a également constaté des effets sur les organismes benthiques, et ces effets sont décrits dans la sous-section suivante, 7.1.2.2, qui traite des sédiments.
7.1.2.2 Études empiriques concernant d'autres milieux naturels
Dans le sol
Étant donné que les substances DMD réagissent fortement dans l'eau, on s'attend à ce que dans le sol, où un certain degré d'humidité prédomine, elles subissent une réaction d'hydrolyse et forment des polyurées, certains MDD et du dioxyde de carbone. Par conséquent, comme pour le milieu aquatique, les substances DMD ne devraient se retrouver que de façon transitoire dans le sol sans s'accumuler jusqu'à atteindre des concentrations importantes.
Les effets du pDMD ont été déterminés pour le ver de terre, Eisenia fetida, dans une étude de 1992 menée conformément à la ligne directrice de l'OCDE n° 207 (Vers de terre, essais de toxicité aiguë) (Étude présentée 2012h). La substance d'essai comporte entre 40 et 50 % de 4,4'-DMD, entre 2 et 4 % de 2,4'-DMD et entre 40 et 60 % d'isomères à trois cycles, ainsi que des traces d'impuretés. Cette étude est également résumée sur le site Web de l'Agence européenne des produits chimiques (ECHA, c2007-2013c) et elle est associée au no CAS 9016-87-9. Des vers de terre ont été exposés à la substance d'essai à la concentration de 1000 mg/kg (sol sec) pendant 14 jours dans des sols artificiels. Les valeurs de CSEO ont été estimées en comparant les effets sur la mortalité et le poids, ainsi que l'évaluation visuelle du comportement et de l'apparence des animaux exposés avec ceux des animaux témoins. Aucun effet sur la mortalité, sur l'augmentation du poids ou sur le comportement et l'apparence n'a été observé après 14 jours d'exposition au pDMD à la concentration d'essai de 1000 mg/kg de sol sec. Par conséquent, des valeurs de CSEO supérieures ou égales à 1000 mg/kg de sol sec ont été attribuées pour les paramètres écotoxicologiques (voir le tableau 7.8). Dans l'étude, il a été noté que, puisque les DMD réagissent avec l'eau, l'absence de tout effet est due à sa disparition du milieu d'essai (Étude présentée 2012h).
Les effets écotoxiques du pDMD ont également été étudiés chez deux espèces de plantes, à savoir l'avoine, Avena sativa, et la laitue, Lactuca sativa (van der Hoeven et coll. 1992). L'étude a été réalisée conformément à la ligne directrice de l'OCDE no 208 (Essai sur plante terrestre : essai d'émergence de plantules et de croissance de plantules) et les effets sur l'émergence, la croissance et la survie des plantules ont été étudiés sur 14 jours. Le pMDD utilisé dans l'étude était composé de 40 à 50 % de 4,4'-DMD, de 2 à 4 % de 2,4'-DMD et de 40 à 60 % d'isomères à trois cycles. La substance d'essai a été appliquée à une concentration unique de 1000 mg par kg de sol sec. Les échantillons d'essai ont été préparés par étapes, selon lesquelles du sable grossier a tout d'abord été revêtu de pDMD préalablement mélangé à de l'acétone; l'acétone a ensuite été retirée par séchage pendant deux jours dans la hotte, puis le pDMD contenant du sable a été mélangé (ratio 1:1) à du sol agricole pour atteindre la concentration d'échantillon souhaitée de 1000 mg/kg poids sec. De l'eau déminéralisée a été ajoutée (ratio 1:1 en fonction du poids) et la teneur finale en eau était de 50 %. Le pH du sol s'est maintenu entre 6,3 et 6,4 tout au long de l'étude. Les résultats des essais ont indiqué que l'exposition de l'avoine et de la laitue au pDMD à la concentration d'essai de 1000 mg/kg poids sec n'a pas entraîné d'effets importants dans les paramètres étudiés. Une CE50 et une CSEO supérieures ou égales à 1000 mg/kg (sol sec) ont été attribuées à la croissance, à l'émergence et à la survie des plantules. Par conséquent, cette étude laisse entendre qu'après une exposition subchronique de deux semaines, le pDMD devrait présenter une faible toxicité pour les plantes.
| Organisme d'essai | Durée de l'essai | Paramètre | Valeur (mg/kg de sol sec) |
Référence |
|---|---|---|---|---|
| Ver de terre (Eisenia fetida) |
14 jours | CSEO (mortalité, augmentation du poids, comportement et apparence) | supérieur(e) u égal(e) à 1000 | Étude présentée 2012h, ECHA, c2007-2013c |
| Avoine (Avena sativa) |
14 jours | CSEO, CE50 (croissance); CSEO (émergence des plantules); CSEO (survie) |
supérieur(e) u égal(e) à 1000 | van der Hoeven et coll. 1992 |
| Laitue (Lactuca sativa) |
14 jours | CSEO, CE50 (croissance); CSEO (émergence des plantules); CSEO (survie) |
supérieur(e) u égal(e) à 1000 | van der Hoeven et coll. 1992 |
Abréviations : CSEO, la concentration sans effet observé, est la concentration la plus élevée ne causant pas d'effet statistiquement significatif par rapport aux témoins dans un essai de toxicité; CE50, la concentration d'une substance qu'on estime susceptible de causer un effet chez 50 % des organismes d'essai.
En résumé, des études d'écotoxicité ont été réalisées pour un invertébré du sol, le ver de terre, et pour deux espèces de plantes. Une très faible toxicité a été observée dans toutes les études d'après la période d'exposition à court terme de deux semaines. Puisque le pDMD est une substance très réactive, le manque d'effet dans le sol pourrait être le résultat d'une dégradation rapide et du fait que le pDMD disparaît ensuite des échantillons d'essai. Rien n'indique dans les résumés d'étude disponibles que la concentration de la substance d'essai se soit maintenue tout au long des deux études. Par ailleurs, les concentrations de la substance d'essai pendant et à la fin de l'étude n'ont pas été indiquées.
Dans les sédiments
Les effets de l'exposition au pDMD sur les organismes benthiques ont été étudiés dans le contexte d'un événement de pollution accidentelle (Heimbach et coll. 1996). Dans l'étude, les étangs artificiels, composés de sédiments et peuplés d'organismes aquatiques et benthiques, ont été traités avec de fortes concentrations de pDMD de 1000 mg/L et de 10 000 mg/L et ont été étudiés pendant 112 jours.
L'application de pDMD aux étangs artificiels, en particulier à la dose élevée de 10 000 mg/L, a eu un grave effet sur les populations d'organismes benthiques et a eu une incidence sur les zones traitées et non traitées, étant donné que la substance d'essai se déplaçait continuellement à travers les sédiments. Les effets écotoxiques du pDMD étaient indirects; une couche de DMD qui s'est formée sur des sections de sédiment a créé des microhabitats où les organismes sont morts de faim en raison de l'obstruction physique ou sont morts en raison du manque d'oxygène ou des niveaux toxiques de dioxyde de carbone. Le pDMD réactif a provoqué l'élimination quasi totale des populations benthiques les plus abondantes, à savoir les oligochètes (espèces Tubificidae et Naididae), les bivalves et les diptères, dans l'étang exposé à une forte dose entre 7 et 14 jours après le traitement. Un certain rétablissement des populations de Tubificidae, de Naididae et de diptères a été observé; toutefois, la population de bivalves, dont le cycle de vie est plus long que ceux d'autres espèces benthiques, n'a pas pu se rétablir et n'a pas été détectée dans l'étang exposé à une forte dose à la fin de l'étude. Il a également été noté que les gastéropodes mobiles n'ont pas été touchés par le traitement au pDMD. Dans l'étang ayant reçu une faible dose, les organismes benthiques présents dans la partie non traitée de l'étang n'ont pas été touchés puisqu'une petite fraction seulement de la substance d'essai et de ses produits de réaction a atteint cette zone. Les effets potentiels résultant de l'exposition au pDMD dans les sections traitées des étangs n'ont pas été décrits par Heimbach et coll. (1996). Toutefois, la couche de DMD était plus grande dans la section traitée de l'étang et couvrait environ 30 % de sédiments en plus que dans les sections non traitées. Les effets observés dans les sections traitées devraient donc être semblables et probablement plus graves que ceux qui ont pu être observés dans les sections non traitées des étangs.
En résumé, lorsqu'il est ajouté aux étangs artificiels à de fortes concentrations reflétant une situation de diversement, on a pu observer que le pDMD formait une couche de polyurées durcies inertes sur le dessus des sédiments. Ce phénomène a eu de graves répercussions sur les organismes benthiques exposés présents dans les étangs artificiels, où les obstructions physiques provoquées par la couche de polyurées, le manque d'oxygène et les concentrations de dioxyde de carbone créées par la réaction d'hydrolyse du pDMD, ont entraîné la diminution de plusieurs des populations benthiques résidentes. Il est noté qu'au Canada, les déversements de substances DMD dans l'environnement se sont rarement produits au cours des dernières années (un en 1999 et un en 2001); la nature de ces derniers était considérée comme mineure à modérée et ils n'ont pas entraîné la contamination des systèmes aquatiques [communication personnelle de la Division des urgences environnementales (Environnement et Changement climatique Canada) à la Division des évaluations écologiques (Environnement et Changement climatique Canada), en date du 23 septembre 2013; source non citée]. Par conséquent, d'après ces renseignements, l'exposition des organismes benthiques aux DMD à la suite d'un déversement accidentel est improbable au Canada.
Faune
Mammifères
On n'a pas trouvé de rapports d'étude portant sur la toxicité des DMD pour les organismes terrestres sauvage, notamment les mammifères, dans la littérature publiée ni dans les sources non publiées. Toutefois, les espèces élevées en laboratoire utilisées dans les modèles expérimentaux pour étudier la santé humaine, telles que les rats et les souris, sont pertinentes pour les espèces sauvages. On considère que ces données sont applicables à certaines espèces de mammifères sauvages, telles que les musaraignes, les mulots et d'autres petits mammifères, ainsi qu'à d'autres espèces sauvages, en appliquant les critères de classement appropriés.
En raison de la toxicité observée des DMD découlant de l'exposition dans l'air, les études de toxicité subchronique et chronique par inhalation réalisées chez de petits mammifères, tels que les rats, présentent un intérêt particulier. Ces études et les effets établis sont décrits dans la section sur l'évaluation des effets sur la santé et dans Santé Canada (2013). Plus particulièrement, dans les études réalisées par Reuzel et coll. (1990 et 1994a), la valeur de la concentration minimale avec effet nocif observé (CMENO) de 1 mg/m3a été établie en fonction d'une exposition chronique par inhalation des rats au pDMD. Les effets observés à cette concentration d'exposition comprenaient des effets sur les voies respiratoires (augmentation de l'hyperplasie) dans les régions pulmonaires et extrathoraciques (Santé Canada 2013).
7.1.2.3 Calcul de la CESE
L'exposition potentielle découlant de l'inhalation des DMD dans le groupe de substance DMD/MDD peut être estimée d'après l'utilisation et les modèles de rejets connus de ces substances au Canada. Par conséquent, une CESE a été calculée à partir de la CMENO chronique de 1 mg/m3 [en tant que CMENO expérimentale valide la plus sensible pour un animal exposé au pDMD (no CAS 9016-87-9) (Reuzel et coll. 1990 et 1994a) dans le cas des rats], en divisant cette valeur par un facteur d'évaluation de 10 (pour tenir compte de la variabilité interspécifique et intraspécifique de la vulnérabilité) pour donner une valeur de 0,1 mg/m3. Il convient de noter que dans les nombreuses études sur les rats, des effets nocifs irréversibles ont été observés à la suite des expositions à long terme à des concentrations d'inhalation comprises entre 1 et 10 mg/m3 environ (Hoymann et coll. 1995; Reuzel et coll. 1990, 1994a; Buschmann et coll. 1996; Waalkens-Berendsen et coll. 1992) (consulter Santé Canada 2013).
Des données de toxicité limitées sur les substances pDMD dans le groupe étaient disponibles pour l'eau et le sol. Dans l'eau, seule une valeur CE50 de 129,7 mg/L pour les daphnies (voir le tableau 7.7), et d'autres études n'ont révélé aucun effet aux concentrations testées. Une réaction d'hydrolyse rapide des DMD devrait se produire au contact de l'eau; les pDMD ne se retrouveraient donc que de façon transitoire dans le milieu aquatique. Il est reconnu que les effets écotoxiques liés à l'exposition aux DMD dans l'eau peuvent être le résultat de la contribution des MDD formés par hydrolyse. Néanmoins, en tenant compte de la CE50 de 129,7 mg/L en tant que VCT des DMD pour le milieu aquatique et en appliquant un facteur d'évaluation de 10 (pour extrapoler des valeurs liées aux effets médians à court terme à des valeurs sans effet à long terme), une valeur CESE de 13 mg/L est obtenue. Dans le sol, aucune étude n'a démontré d'effet aux concentrations testées (voir le tableau 7.8). Par conséquent, on n'a pas obtenu de CESE pour ce milieu.
Les CESE calculées dans cette section s'appliquent autant aux monomères DMD qu'au pDMD.
7.1.2.4 Résumé des effets écologiques des DMD
Dans l'ensemble, les résultats des études de toxicité pour les organismes aquatiques, présentés dans les tableaux 7.6 et 7.7, semblent indiquer que les deux substances 4,4'-DMD et pDMD ne sont pas grandement toxiques pour les espèces aquatiques d'après une exposition aiguë et chronique. De même, une toxicité modérée découlant de l'exposition au 4,4'-DMD et pDMD a été observée dans les études sur les mammifères considérés comme espèces substitutives aux petits mammifères terrestres. Une faible toxicité liée à l'exposition au pDMD pour un organisme du sol (le ver de terre) a été observée. Par contre, on a pu observer que le pDMD avait des répercussions indirectes sur certaines populations d'organismes benthiques dans les études sur l'exposition simulant des conditions de déversement accidentel. Malgré la gravité de ces répercussions sur certains groupes d'organismes tels que les bivalves immobiles, elles peuvent être considérées comme étant temporaires, étant donné que, d'une manière générale, les populations ont présenté des signes de rétablissement avec le temps.
Ces observations sur le niveau de toxicité devraient être semblables pour les autres substances dans le sous-groupe des DMD (DMD mélangés et monomères : 2,2'-DMD et 2,4'-DMD), étant donné les ressemblances structurelles de ces substances dans le groupe.
7.2 Évaluation de l'exposition de l'environnement
Les données de surveillance environnementales pour les substances MDD et DMD dans le groupe n'ont pas été déterminées au Canada. Par conséquent, les concentrations environnementales canadiennes des substances MDD et DMD dans le groupe ont été estimées d'après les renseignements pertinents disponibles.
Les données liées aux concentrations de certaines des substances du groupe de substance DMD/MDD dans l'air, l'eau et le sol dans l'environnement ont été déterminées dans d'autres pays (voir l'annexe D).
La caractérisation de l'exposition des substances MDD et DMD dans le groupe est axée sur les scénarios d'exposition clés qui découlent des principaux rejets dans l'environnement de ces substances. En général, l'ampleur des rejets est directement liée à la quantité d'une substance fabriquée ou utilisée, ainsi qu'à ses facteurs d'émission applicables. Dans les cas où les rejets industriels sont semblables sur le plan des quantités aux rejets des consommateurs ou aux rejets commerciaux, ils engendrent normalement des niveaux plus élevés d'exposition environnementale que ces derniers. Cela est dû au fait que les rejets industriels se concentrent dans un nombre limité de sites, alors que les rejets des consommateurs ou les rejets commerciaux sont dispersés dans tout le pays.
7.2.1 MDD
Au Canada, quelques entreprises sont connues pour effectuer le mélange d'un produit industriel contenant du 4,4'-MDD ou du pMDD, qui est ensuite envoyé aux fins d'utilisation dans différents secteurs industriels. Le mélange contenant du 4,4'-MDD est utilisé uniquement en tant que catalyseur et n'est pas présent dans le produit final. Après avoir utilisé le produit contenant du 4,4'-MDD, la solution utilisée est récupérée puis envoyée aux fins de traitement des déchets (Environnement et Changement climatique Canada 2012a). Les rejets de 4,4'-MDD dans l'environnement sont donc jugés minimes : les mélanges contenant du pMDD sont utilisés en tant que revêtement pour les pièces de machines pour les applications industrielles (Environnement et Changement climatique Canada 2012a). Les pièces de machine enduites de pMDD devraient être utilisées dans un milieu industriel pendant de nombreuses décennies, avec des rejets négligeables de pMDD dans l'environnement (Environnement et Changement climatique Canada 2012a). Par conséquent, le potentiel de rejets de MDD ou de produits des MDD dans l'environnement pendant leur traitement et leur application est minimal. D'après cette information, et en tenant compte du potentiel très limité de rejets environnementaux dans ce cas, on considère qu'un scénario d'exposition quantitative n'est pas nécessaire.
7.2.2 DMD
L'exposition aux substances DMD (et aux MDD créés à la suite de la conversion des DMD) a été estimée sous la forme de concentrations environnementales estimées (CPE) issues de l'utilisation des DMD dans l'industrie du bois d'ingénierie, tel que le décrivent les sections suivantes. Le potentiel d'exposition découlant de l'industrie du bois d'ingénierie est représentatif d'une industrie produisant des rejets élevés. Les substances DMD peuvent aussi être rejetées dans l'air pendant la production de mousse ou d'adhésifs. La documentation et les lignes directrices liées à la déclaration d'émissions indiquent que les rejets dans l'air provenant de ces types de production industrielle sont inférieurs d'un ordre de grandeur par rapport aux rejets issus de l'industrie du bois d'ingénierie (Allport et coll. 2003; Acton 2001; ACC 2012a).
On considère que les installations qui utilisent des DMD pour fabriquer des panneaux à copeaux orientés représentent un haut niveau d'exposition environnementale, car les DMD sont utilisés dans de grandes quantités à un nombre limité d'installations. L'air constitue le principal milieu de rejet provenant de cette industrie, avec le facteur d'émission estimé le plus élevé s'élevant à 0,027 % (NCASI 2012). Les concentrations dans l'environnement ont été estimées à l'aide de SCREEN3 (1995); les données d'entrée et les résultats sont décrits dans le passage ci-dessous.
Bien qu'une grande quantité d'entreprises canadiennes soient concernées par l'industrie du polyuréthane, ce scénario n'a pas été choisi pour déterminer une estimation d'exposition quantitative. La quantité de DMD utilisés par une installation de polyuréthane unique varie de quelques kilos à plus de deux millions de kilogrammes. On peut présumer que plus de 60 utilisateurs canadiens de DMD utiliseront entre 50 000 kg et 2 000 000 kg de DMD en un même endroit. Toutefois, la quantité de DMD présumée être rejetée par chaque installation utilisant du polyuréthane devrait être inférieure aux quantités rejetées par les grandes installations de fabrication de panneaux à copeaux orientés au Canada (Environnement et Changement climatique Canada 2012a).
Les CPE sont fondées sur les renseignements disponibles concernant l'utilisation des DMD/MDD dans le groupe, sur les facteurs d'émission sectoriels et les caractéristiques du milieu récepteur.
Par conséquent, les CPE ont été estimées pour l'air et le sol uniquement. Les substances DMD sont principalement rejetées dans l'air. Dans le sol, les dépôts atmosphériques de DMD à proximité des émetteurs et la transformation chimique ultérieure en MDD peuvent entraîner une exposition dans le sol au MDD. Aucun rejet direct n'est prévu dans le milieu aquatique d'après les modèles d'utilisation connus des substances MDD et DMD dans le groupe. Les dépôts atmosphériques de substances DMD dans les plans d'eau devraient également être très limités; par ailleurs, au contact de l'eau, les DMD devraient se répartir rapidement.
Au Canada, les utilisations directes par le consommateur ou commerciales de MDD ou DMD devraient entraîner des rejets diffus et, en conséquence, de faibles concentrations de la substance dans l'environnement. Par conséquent, des scénarios de rejets pour ces utilisations n'ont pas été étudiés davantage.
7.2.2.1 Air
Puisque les substances DMD peuvent être utilisées par des installations industrielles et que, d'après les déclarations, elles sont rejetées dans l'air, le modèle SCREEN3 de l'Environmental Protection Agency des États-Unis a été choisi pour estimer une concentration maximale générique d'une heure autour d'une installation hypothétique (SCREEN3 1995). SCREEN3 est un outil d'évaluation qui requiert des données d'entrée moins nombreuses et moins perfectionnées que d'autres modèles plus complexes; toutefois, pour s'assurer que l'utilisation de SCREEN3 convient aux DMD, des particularités techniques de l'industrie ont été prises en compte dans les entrées du modèle. Le scénario choisi est conçu pour fournir une estimation basée sur des hypothèses prudentes concernant la quantité de la substance utilisée et rejetée par l'installation, ainsi que l'installation et le cadre environnemental dans lesquels ces rejets se produisent. Les données d'entrées utilisées pour calculer la concentration prévue dans l'environnement (CPE) autour de l'installation et les données de sortie du modèle sont présentées à l'annexe E. En supposant un taux de rejet maximal de 0,31 kg/h [d'après NCASI (2012)] provenant d'une installation hypothétique de panneaux à copeaux orientés qui utilise 10 millions de kg de substances DMD (fourchette supérieure des quantités déclarées utilisées par toute installation individuelle au Canada; Environnement et Changement climatique Canada 2012a), les estimations de SCREEN3 concernant la concentration maximale d'une heure à une distance de 100, 200 et 1000 m à partir de la source étaient de 11,44, 12,76 et 5,618 μg/m3, respectivement. La concentration de 12,76 μg/m3 à 200 m est utilisée en tant que CPE dans l'évaluation de l'exposition de l'environnement et devrait être plus élevée que les concentrations atmosphériques réelles provenant de toute installation canadienne qui utilise actuellement des DMD. Par conséquent, cette CPE constitue une estimation très prudente. Néanmoins, les estimations du modèle SCREEN3 sont comparables aux concentrations de DMD mesurées dans les émissions de cheminée dans des installations non canadiennes (figurant à l'annexe D).
7.2.2.2 Dépôts dans le sol et l'eau
Dans le cas des installations industrielles qui utilisent des substances présentes dans le sous-groupe des DMD, les rejets dans l'air sont fondés sur la volatilisation dans des conditions de pression et de température élevées. Bien que toutes les substances DMD présentent de faibles pressions de vapeur, les DMD monomères constitueraient l'espèce prédominante rejetée dans l'air, car ils ont les pressions de vapeur relatives les plus élevées de toutes les substances DMD et de tous les composants de la substance. Le taux de dépôt des monomères DMD autour d'une installation industrielle a été estimé en fonction du calcul présenté dans Tury et coll. (2003). La concentration dans l'air ambiant et le flux de dépôts de substances gazeuses et liées aux aérosols dans le sol qui en découle ont été modélisés par Tury et coll. (2003) à l'aide du modèle OPS (Operational Priority Substances) au sein du modèle EUSES (European Union System for the Evaluation of Substances). Le modèle présume que les rejets proviennent d'une construction basse sans cheminée. Une estimation d'exposition normalisée fondée sur le modèle de panache gaussien OPS a été utilisée par Tury et coll. (2003) pour effectuer un calcul par défaut de la concentration de DMD et de TDI dans l'air ainsi que du flux de dépôt dans le sol près d'une source ponctuelle selon une force de source donnée. Ils ont obtenu un taux de dépôt annuel moyen de 9 μg/m2 par an pour les DMD sur une zone de 1 km² provenant de l'émetteur, pour une usine produisant un rejet continu de DMD de 8,8 kg par an. L'utilisation de ce calcul par défaut, en l'adaptant de façon linéaire à un site hypothétique qui devrait utiliser 10 millions kg par an et ayant un facteur d'émission de 0,027 % dans l'air, se traduit par un taux de dépôt annuel moyen estimé de 2,8 mg/m2 par an de monomère DMD. On estime qu'il s'agit d'un scénario canadien de la pire éventualité. Le dépôt des fractions de vapeur et d'aérosols, tel qu'il est pris en compte par le modèle, serait provoqué par des processus de dépôt humide (p. ex., eau de pluie) ou sec, qui peuvent être propres aux conditions locales. Le modèle OPS est basé sur des conditions atmosphériques moyennes réalistes établies d'après un ensemble de données couvrant 10 années de conditions météorologiques aux Pays-Bas. En outre, le dépôt de DMD, particulièrement dans des conditions humides (c.-à-d. en présence de phases condensées comme les gouttes de pluie, le brouillard ou les nuages), entraînerait une certaine conversion en amines correspondants (c.-à-d. MDD). Toutefois, puisque le taux de dépôt est relativement faible et limité à une zone située à proximité de l'usine, les concentrations de MDD dans le sol qui en résultent ne devraient pas être supérieures à 0,023 mg/kg de sol dans les 10 premiers centimètres du sol, en tenant compte de toutes les pertes normales en raison de la dégradation et de la diffusion dans le sol (modèle de sol 2005). Cette estimation de la concentration dans le sol à l'état stable est basée sur un taux de dépôt hypothétique de 2,8 mg/m2 par an sur plus de 10 000 mètres carrés de sol. De plus, elle vise à représenter un scénario de la pire éventualité en supposant que 100 % des DMD sera converti en MDD au contact de l'humidité. On s'attend à ce que les flux à court terme dans le sol varient par rapport à cette moyenne en raison de facteurs tels que les cycles de production, la hauteur de la cheminée de l'usine, la topographie locale et les conditions météorologiques, notamment le vent et les précipitations qui contrôlent les processus de dépôt. On note également que les concentrations atmosphériques de DMD estimées grâce à une modélisation par le modèle OPS d'après Tury et coll. (2003) sont semblables et comparables aux estimations obtenues par l'entremise de SCREEN3. Toutefois, les calculs basés sur Tury et coll. (2003) ont été jugés plus appropriés que le modèle SCREEN3 pour estimer les concentrations de MDD dans l'air qui pourraient se déposer dans le sol, car ils comportaient les taux de dépôt. Les résultats de SCREEN3 ne sont pas pris en compte dans le calcul des concentrations de sol obtenues et ont été effectués simplement pour valider la modélisation par le modèle OPS.
Les dépôts de DMD dans les plans d'eau issus des rejets en suspension devraient être limités. Cependant, si l'émetteur était situé près une source d'eau comme un lac ou une rivière, il serait possible que les DMD rejetés dans l'air se déposent ou se répartissent dans les eaux de surface. Étant donné que les DMD sont rapidement soumis à une hydrolyse, ils sont de courte durée dans le milieu aquatique et, par conséquent, ne devraient pas s'accumuler jusqu'à atteindre des concentrations importantes. Au contact de l'eau, les DMD se convertissent généralement en polyurées et en amines résiduelles. Les concentrations de MDD résiduels obtenues dans les eaux de surface seraient probablement faibles étant donné la capacité de dilution élevée dans les eaux de surface typiques par rapport au taux de dépôt d'une substance. À l'heure actuelle, les modèles qui estimeraient les concentrations d'une substance dans l'eau provenant des dépôts de MDD ne sont pas disponibles. En conséquence, la plage supérieure des concentrations mesurées dans les eaux japonaises en 2008 (CHRIP 2008) (voir le tableau D2 de l'annexe D), en l'occurrence 0,02 µg/L, est utilisée en tant qu'estimation prudente d'une CPE dans les eaux canadiennes.
7.2.3 Résumé de l'exposition de l'environnement
En résumé, le potentiel d'exposition environnementale aux MDD par leur utilisation directe est très limité. L'exposition aux MDD devrait plutôt découler d'une conversion des DMD rejetés dans l'environnement. Les DMD sont principalement rejetés dans l'air à la suite d'une utilisation industrielle dans la fabrication du polyuréthane ou de produits du bois d'ingénierie tels que les panneaux à copeaux orientés. Les analyses de l'exposition étaient fondées sur des usines de panneaux à copeaux orientés, car ces dernières devraient présenter les plus forts rejets de toutes les utilisations industrielles. À l'aide d'une modélisation par le modèle SCREEN3, une CPE pour la concentration de DMD dans l'air à 200 m d'une installation de panneaux à copeaux orientés a été estimée à 0,013 mg/m3 (12,76 μg/m3). Les dépôts de DMD en suspension dans le sol ont été estimés à l'aide du modèle OPS et, d'après les calculs, se produisent à un taux de 2,8 mg/m2 par an. En supposant de façon prudente un taux de conversion de 100 % des DMD en MDD au contact de l'humidité du sol, une CPE pour les MDD dans le sol de 0,023 mg/kg a été déterminée. On n'a pas pu modéliser de CPE pour les concentrations de MDD dans l'eau ou les sédiments découlant des dépôts et de la conversion des DMD. La plage supérieure des concentrations mesurées dans les eaux de surface japonaises de 0,02 µg/L a plutôt été utilisée en tant qu'estimation prudente d'une CPE dans les eaux canadiennes.
7.3 Caractérisation du risque écologique
7.3.1 Analyse des quotients de risque
Les faibles volumes d'importation de MDD au Canada et les renseignements qui mentionnent des utilisations généralement restreintes à un petit nombre d'exploitations industrielles au Canada indiquent que les possibilités de grands rejets dans l'environnement au Canada sont limitées. Étant donné que les modèles d'utilisation et de rejets connus des MDD au Canada démontrent un faible potentiel de rejets directs de MDD dans l'air, le sol ou l'eau, les quotients de risque n'ont pas été calculés pour les rejets directs de MDD dans tous les milieux naturels. Il existe toutefois une possibilité de rejet et de conversion des DMD qui constitueraient une source indirecte de MDD dans l'environnement canadien.
Une analyse du quotient de risque, fondée sur des estimations réalistes et prudentes de la pire éventualité de l'exposition et sur les renseignements liés à l'écotoxicité, a été réalisée pour les DMD dans l'air afin de déterminer si cette substance pourrait avoir des effets nocifs sur l'environnement au Canada. Le scénario industriel propre au site a tenu compte des sources d'émissions réelles découlant de la fabrication de panneaux à copeaux orientés (présenté précédemment dans la section sur l'évaluation de l'exposition de l'environnement). Cela a permis d'obtenir une concentration prévue dans l'environnement (CPE) pour les DMD dans l'air de 0,013 mg/mg3. Une concentration estimée sans effet (CESE) pour les DMD a été calculée à partir de la valeur de toxicité chronique par inhalation pour les petits mammifères de 0,1 mg/m3 (consulter la section sur les effets écologiques). Le quotient de risque qui en résulte (CPE/CESE) est de 0,13. Par conséquent, les effets nocifs pour les mammifères terrestres découlant de l'exposition par inhalation sont peu probables à ce site industriel.
Les DMD rejetés dans l'air peuvent se déposer sur les sols où ils subiront rapidement une hydrolyse et formeront des polyurées et de petites quantités de MDD. Comme les MDD peuvent être présents longtemps dans le sol, il est possible que des organismes terrestres y soient exposés. Une analyse du quotient de risque, fondée sur des estimations réalistes et prudentes de la pire éventualité de l'exposition et sur les renseignements liés à l'écotoxicité, a été réalisée pour le milieu terrestre et le sol afin de déterminer si cette substance pourrait avoir des effets nocifs sur l'environnement au Canada. Le scénario industriel propre au site a tenu compte des sources d'émissions réelles découlant de la fabrication de panneaux à copeaux orientés (présenté précédemment dans la section sur l'évaluation de l'exposition de l'environnement) puis a estimé les concentrations de MDD dans le sol qui résultent de la conversion des DMD déposés. Les calculs concernant ce scénario ont produit une concentration prévue dans l'environnement (CPE) maximale de MDD dans le sol de 0,023 mg/kg. Une concentration estimée sans effet (CESE) pour les MDD de 1,1 mg/kg poids sec a été calculée à partir de la valeur de toxicité à long terme pour le ver de terre (consulter la section sur les effets écologiques). Le quotient de risque qui en résulte (CPE/CESE) est de 0,02. Par conséquent, les effets nocifs pour les organismes terrestres découlant de l'exposition dans le sol aux MDD sont peu probables à ce site industriel.
Comme pour les sols, il existe un risque de rejets indirects de MDD dans les eaux de surface en raison du dépôt de substances DMD rejetées dans l'air et de leur hydrolyse qui s'ensuit. Comme les MDD peuvent être présents dans l'eau assez longtemps, il est possible que les organismes aquatiques y soient exposés. Par conséquent, une analyse du quotient de risque, fondée sur des estimations réalistes et prudentes de la pire éventualité de l'exposition et sur les renseignements liés à l'écotoxicité, a été réalisée pour le milieu aquatique fin de déterminer si cette substance pourrait avoir des effets nocifs sur l'environnement au Canada. La concentration mesurée de DMD dans les eaux de surface japonaises de 0,02 µg/L, ou 0,00002 mg/L (tableau D2 de l'annexe D), a été considérée comme une concentration prévue dans l'environnement (CPE) prudente pour l'environnement au Canada. On a supposé de façon prudente également que le taux de conversion des DMD en MDD était de 100 %. Le 4,4'-MDD exerçait une toxicité faible à modérée et aiguë à subchronique chez les organismes aquatiques soumis à des essais et présentait une forte toxicité dans les essais de toxicité chronique réalisés chez l'invertébré aquatique D. magna. Une concentration estimée sans effet (CESE) de 1,5 µg/L, ou 0,0015 mg/L, pour les MDD a été calculée à partir d'une valeur de toxicité chronique de 0,015 mg/L pour les daphnies (consulter la section sur les effets écologiques). Le quotient de risque qui en résulte (CPE/CESE) est de 0,01. Par conséquent, les effets nocifs sur les organismes aquatiques à la suite de l'exposition à la substance MDD découlant des dépôts de DMD dans les eaux de surface sont peu probables au Canada.
| Médias | Substance | Scénario | CESE | CPE | QR |
|---|---|---|---|---|---|
| Air | DMD | Rejets industriels propres au site de substances DMD dans l'air issus de la fabrication de panneaux à copeaux orientés et prise en compte de l'exposition par inhalation de la faune aux DMD | 0,1 mg/m3 | 0,013 mg/m3 | 0,13 |
| Soil | MDD | Rejets industriels propres au site de substances DMD dans l'air issus de la fabrication de panneaux à copeaux orientés, des dépôts dans le sol et de la conversion en MDD | 1,1 mg/kg (poids sec) | 0,023 mg/kg | 0,02 |
| Water | MDD | Scénario général tenant compte des dépôts atmosphériques de DMD dans les eaux de surface et de la conversion en MDD | 0,0015 mg/L | 0,00002 mg/L | 0,01 |
7.3.2 Examen des données probantes et conclusion
La démarche utilisée dans le cadre de cette évaluation écologique préalable visait à examiner les divers renseignements pertinents afin de tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence, conformément aux dispositions de la LCPE. Les éléments de preuve pris en compte comprennent les résultats d'un calcul prudent du quotient de risque ainsi que des renseignements sur la persistance, la bioaccumulation, la toxicité, les sources, le devenir, la présence et la répartition des substances dans l'environnement.
D'après les renseignements sur les sources et les utilisations disponibles pour les MDD au Canada, aucun rejet direct de la substance dans l'eau, l'air et le sol n'a été déterminé, alors que les rejets de DMD ont été déterminés principalement dans l'air. Les MDD peuvent être présents dans l'eau et le sol en raison des rejets de DMD dans l'air, de leur dépôt dans les eaux de surface et le sol et de leur conversion ultérieure en MDD dans ces milieux naturels. Les risques écologiques, dont une analyse des quotients de risque pour les MDD et les DMD consécutif aux utilisations industrielles des DMD, ont été présentés plus haut, à la section 7.3.1, pour l'air, le sol et l'eau. Ces quotients de risque sont tous inférieurs à 1.
Les substances DMD sont des substances très réactives et devraient rapidement se transformer en polyurées inertes et en faibles quantités de MDD lors du contact avec l'eau, y compris l'eau présente dans les sols. On prévoit que les MDD demeureront longtemps dans les sols et les sédiments, et demeureront seulement un certain temps dans l'eau, mais leur potentiel de bioaccumulation devrait être faible. Les polyurées devraient également présenter un faible potentiel de bioaccumulation. Les quantités élevées de substances DMD qui sont importées au Canada et leurs utilisations indiquent un risque important de rejet généralisé dans l'environnement au Canada, principalement dans l'air au cours d'une utilisation industrielle. Une fois rejetés dans l'environnement, ils seront présents principalement sous forme de vapeur ou d'aérosols dans l'air près des sources d'émissions ponctuelles, avec des produits de transformation incluant des polyurées et, vraisemblablement, des MDD formés lors du contact avec l'eau, y compris des phases condensées dans l'air et dans les sols.
Enfin, l'utilisation de DMD dans les produits de consommation et commerciaux ne devrait pas conduire à d'importantes émissions dans l'environnement en raison de la faible quantité des émissions résultantes dans l'air et de leur nature dispersée. En outre, la plupart des utilisations de substances DMD (p. ex., adhésifs et produits d'étanchéité pour le bricolage, produits en polyuréthane giclé) ne s'accompagneraient pas de déchets liquides. Par conséquent, les quotients de risque pour l'air et l'eau n'ont pas été calculés, car les rejets de DMD découlant des utilisations par les consommateurs sont jugés négligeables.
De nombreux éléments de preuve ont été pris en compte dans la caractérisation des risques écologiques posés par les substances MDD et DMD et comportaient des données expérimentales écotoxicologiques fiables, des modèles d'utilisation et de rejets connus des substances MDD et DMD au Canada, des concentrations estimées dans l'environnement fondées sur des scénarios d'expositions généraux et industriels et la prise en compte de la conversion potentielle des DMD en MDD dans le milieu naturel. Il ressort de cette information que le risque d'effets nocifs pour les organismes et l'intégrité générale de l'environnement au Canada découlant des substances dans le groupe des DMD et des MDD est faible.
Bien que les profils d'emploi et les quantités de MDD dans le commerce ne sont pas préoccupants aux concentrations actuelles, ils pourraient l'être si les quantités devaient augmenter au Canada, étant donné les effets sur l'écologie associés à ces substances.
7.3.3 Incertitudes dans l'évaluation des risques pour l'environnement
Des incertitudes ont été observées quant à la quantité de DMD convertis en espèces de MDD correspondantes lorsque la substance se dépose dans les sols ou dans l'eau. La concentration de DMD dans l'atmosphère et la concentration obtenue dans les sols de surface, ainsi que les caractéristiques du sol, telles que l'humidité et le degré de saturation, peuvent influer sur cette conversion. L'hypothèse selon laquelle 100 % des DMD sont convertis en MDD est considérée comme étant très prudente; par conséquent, elle conduirait vraisemblablement à une surestimation du risque.
On ne sait pas non plus si des proportions plus importantes de MDD se formeraient lors de l'hydrolyse des DMD à des concentrations plus faibles et dispersées (p. ex., à partir du dépôt atmosphérique de DMD) et lorsqu'il n'y a peut-être pas assez de molécules de DMD pour subir une polymérisation en polyurées. À ce jour, les études portant sur la réaction d'hydrolyse des DMD sont axées sur des concentrations de DMD plus importantes simulant une situation de déversement.
On note également des incertitudes à l'égard des taux de réaction relatifs à la réaction d'hydrolyse hétérogène des DMD. Les renseignements disponibles semblent indiquer que cette réaction dépend des conditions de mélange et étant donné l'écart naturel observé dans différents environnements aquatiques (p. ex., rivière à débit rapide ou marais stagnant), on pourrait s'attendre à des taux variés d'hydrolyse des DMD ou à une hydrolyse incomplète dans certaines conditions.
L'utilisation des divers types et sources de diols ou polyols (p. ex., polyester-polyol, éthylèneglycol, huile caterol) pour la production de mousse de polyuréthane peut modifier le potentiel de dégradation et des produits qui en résultent, y compris les MDD, créant ainsi une incertitude au sujet de la quantité de MDD pouvant être libérée pendant la dégradation des mousses de polyuréthane dans les sites d'enfouissement. Toutefois, les MDD ne devraient pas constituer un produit de dégradation important dans des conditions typiques des sites d'enfouissement. Les facteurs d'atténuation, notamment la sorption aux matières organiques au sein des sites d'enfouissement et l'élimination pendant la décantation des matières organiques pendant le traitement des eaux usées, minimiseraient le potentiel de rejets de MDD découlant de la dégradation des mousses de polyuréthane dans les sites d'enfouissement.
Les MDD ont présenté une toxicité élevée pour les invertébrés aquatiques (c.-à-d. d'après les essais de toxicité chronique avec des daphnies). Les modèles d'utilisation actuels des MDD au Canada n'indiquent aucun rejet dans l'eau et aucune estimation liée aux concentrations dans l'eau des MDD provenant du dépôt atmosphérique dans les eaux de surface n'a pu être déterminée. Toutefois, en raison de leur grande capacité de dilution, de leur apport diffus dans les eaux de surface résultant du dépôt atmosphérique, ainsi que du faible taux de conversion en MDD observé dans les expériences de laboratoire avec les DMD, on s'attend à ce que les concentrations aquatiques obtenues de MDD soient très faibles. Les données de surveillance pourraient être utilisées pour confirmer cet aspect.
Aucune information n'était disponible sur les effets potentiels des émissions atmosphériques des DMD sur la végétation, qui peuvent provoquer la formation d'un film polymère pouvant causer des effets secondaires physiques chez les plantes. D'après les estimations relatives aux concentrations atmosphériques de DMD provenant des installations rejetant le plus d'émissions, on a déterminé qu'elles n'entraînaient pas d'effets respiratoires chez les espèces sauvages sensibles et, par conséquent, les effets secondaires chez les plantes à ces concentrations sont peu probables.
8. Potentiel d'effets nocifs sur la santé humaine
8.1 Évaluation de l'exposition
8.1.1 Milieux naturels et aliments
8.1.1.1 MDD
Aucun rapport sur les concentrations mesurées de 4,4'-MDD ou de pMDD dans les milieux naturels ou les aliments au Canada n'a été trouvé. Selon les déclarations, le 4,4'-MDD et le pMDD ne sont pas fabriqués au Canada ni utilisés pour la fabrication de DMD au Canada (Environment Canada 2012a). Les utilisations industrielles de 4,4'-MDD et de pMDD sont restreintes à un petit nombre d'opérations, ce qui indique un faible potentiel de rejets dans l'environnement au Canada. Étant donné la faible pression de vapeur et le taux élevé de dégradation atmosphérique du 4,4'-MDD et du pMDD, aucun des deux ne devrait être présent dans l'air ambiant. D'après la modélisation de la fugacité de niveau III, les résultats laissent entendre que les MDD ne se répartiront pas dans l'air et, s'ils sont présents, ils demeureront dans le sol, l'eau ou les sédiments. La surveillance environnementale au Japon indique la présence de 4,4'-MDD dans les eaux de surface au-dessus de la limite de détection de 0,001 µg/L (c.-à-d. jusqu'à 0,02 µg/L) dans 11 des 28 sites. Le 4,4'-MDD a également été détecté dans les sédiments au Japon avec une moyenne géométrique de 0,015 mg/kg (CHRIP 2008; Agence environnementale du Japon 2000).
Les DMD rejetés dans l'environnement peuvent se transformer en MDD. Aucun MDD ne devrait se retrouver dans l'air lors du rejet de DMD, étant donné le faible taux de transformation dans l'air. Le taux de dépôt de DMD dans le sol est relativement faible et restreint aux zones situées à proximité du point de rejet. Dans un scénario de la pire éventualité avec une transformation de 100 % des DMD déposés en MDD dans l'environnement et avec une source de rejet d'un rayon de 10 km, la concernant estimée dans le sol ne devrait pas être supérieure à 0,023 mg/kg (voir la section sur l'évaluation de l'exposition de l'environnement). En outre, les MDD ou les DMD ne sont pas fabriqués au Canada et la quantité de MDD directement rejetée dans l'environnement devrait être minimale. Lorsque les données de surveillance des eaux japonaises et les valeurs de concentration estimée dans le sol ont été utilisées pour calculer la limite supérieure prudente de l'absorption journalière de MDD, ces estimations étaient inférieures à un nanogramme par kilogramme de poids corporel (kg p.c.) par jour. Par conséquent, l'environnement ne devrait pas être une source d'exposition pour les humains.
Vu ces données, on ne s'attend pas à une exposition de la population générale au 4,4'-MDD et au pMDD par l'environnement.
8.1.1.2 DMD
Les DMD ne sont pas naturellement présents dans les milieux naturels au Canada. Aucune donnée empirique sur les concentrations des DMD dans les milieux naturels au Canada ou ailleurs n'a été retracée. La chimie des DMD empêche la présence de fortes concentrations dans l'environnement. Les DMD ne sont pas persistants dans l'eau ou le sol, avec une dégradation se produisant principalement par hydrolyse (EPI Suite 2008). En général, la demi-vie des DMD peut être rapide et être de moins d'une minute lorsque les eaux sont en mouvement. Les DMD formeront des produits de dégradation, à savoir des polyurées solides et insolubles et, dans une moindre mesure, des MDD (Yakabe et coll. 1999). En raison de la réactivité des DMD, la majorité de la substance restera et se dégradera dans le milieu dans lequel elle a été émise.
Avec de faibles pressions de vapeur pour les isomères, les DMD ne devraient pas être présents en grandes quantités dans l'air sous forme de vapeur. À l'aide du modèle SCREEN3, les concentrations dans l'air autour des sources ponctuelles, telles que les installations utilisant des DMD dans la production, ont été estimées (SCREEN3 1995). L'estimation de la concentration atmosphérique d'une heure établie par SCREEN3 pour une installation hypothétique mentionnée dans la section sur l'évaluation de l'exposition de l'environnement (annexe E) a été approfondie afin de tenir compte des considérations relatives à la santé humaine (USEPA 2004). Une petite partie de la population générale peut être exposée aux DMD si elle réside dans les environs des installations de panneaux à copeaux orientés. D'après une distance réaliste à partir de l'installation déclarante où la zone peuplée la plus proche devrait se situer, la limite supérieure de l'estimation modélisée pour la concentration atmosphérique de DMD est de 0,543 µg/m3pendant 8 heures. Cette estimation est jugée prudente étant donné qu'on ne tient pas compte de la vitesse ou de la direction du vent; un panache d'émission constant est supposé et les propriétés physiques et chimiques des DMD, telles que la faible pression de vapeur, ne sont pas prises en compte par ce modèle.
Il peut également y avoir un risque d'exposition par l'alimentation en raison de l'utilisation d'un film laminé pour l'emballage des produits alimentaires, tel qu'il est déclaré dans l'enquête menée aux termes de l'article 71 en vertu de la LCPE (Environment Canada 2012a). Un adhésif de polyuréthane est utilisé pour maintenir ensemble plusieurs couches de polymère afin de former des matériaux d'emballage alimentaire laminés. Les couches de polymère sont des barrières fonctionnelles entre l'adhésif et les aliments; par conséquent, les DMD présents dans la couche d'adhésif ne devraient pas migrer dans les aliments (communication personnelle, Direction des aliments de Santé Canada au Bureau de la gestion du risque de Santé Canada 2013; source non citée). Les concentrations de 4,4'-DMD dans l'adhésif de polyuréthane utilisé dans les emballages alimentaires sont faibles et varient de 0,005 à 0,5 % (Environment et Changement climatique Canada 2012a). On considère que le potentiel d'exposition découlant de l'adhésif est négligeable. Aucune donnée révélant la présence de DMD dans les aliments au Canada n'a été déterminée.
D'après les renseignements généraux, l'exposition potentielle de la population aux DMD présents dans les milieux naturels et dans l'alimentation au Canada devrait être négligeable.
8.1.2 Produits de consommation
8.1.2.1 MDD
Les MDD sont principalement utilisés pour produire des DMD dans des milieux fermés et une petite fraction est utilisée comme agent de réticulation des polyuréthanes, comme antioxydant pour les huiles lubrifiantes, comme produit de traitement dans le caoutchouc et comme produit intermédiaire dans les fibres élastomères et dans la préparation de colorants azoïques (Mortensen et coll. 2005; HSDB 1983-2003). Aucun rapport sur l'utilisation de 4,4'-MDD ou de pMDD dans les produits de consommation au Canada n'a été trouvé. Il peut y avoir un risque d'exposition au 4,4'-MDD libre résiduel découlant des produits faits de polyuréthane. Toutefois, les MDD ne sont pas présents à l'état libre après la production de polyuréthanes (NTO 2011; ISSC 2005; Centre commun de recherche de la Commission européenne 2005, 2001).
On sait que le 4,4'-MDD est utilisé dans la production de colorants azoïques (Cartasol jaune) pouvant être employés dans les encres, le papier, le cuir et d'autres produits du textile (Centre commun de recherche de la Commission européenne 2001). Sous un clivage réducteur, le 4,4'-MDD peut se libérer fortuitement; toutefois, on ne dispose d'aucun renseignement sur le taux de libération (PISSC 2005; Centre commun de recherche de la Commission européenne 2001). Une étude a révélé une migration potentielle de faibles niveaux de 4,4'-MDD dans les aliments lorsqu'ils sont cuisinés à l'aide d'ustensiles de cuisson en plastique contenant des colorants azoïques dans des conditions réalistes de préparation des aliments. Parmi les 11 ustensiles soumis à des essais, six ont montré un rejet de 4,4'-MDD dans le simulant d'aliments, avec des concentrations comprises entre 1,4 et 2,5 µg d'équivalents d'aniline par kilogramme de simulant d'aliments, ce qui entraînerait une très faible absorption estimée de nanogrammes par kilogramme de poids corporel (Mortensen et coll. 2005). On n'a déclaré aucune utilisation par le consommateur de MDD au Canada. D'après les renseignements généraux, une exposition potentielle de la population générale canadienne aux MDD en raison de leur présente sous forme de résidus dans les produits de consommation est jugée négligeable.
8.1.2.2 DMD
L'utilisation des DMD dans le commerce et les produits de consommation est répandue. Le 4,4'-DMD, le pDMD et les DMD mélangés sont principalement utilisés dans la production de mousse de polyuréthane souple ou rigide. Le 2,2'-DMD et le 2,4'-DMD peuvent également être utilisés en tant qu'ingrédients dans la production de polyuréthane.
Le polyuréthane est produit par réaction entre des DMD et des polyéthérols ou polyesters (Allport et coll. 2003; Harper et coll. 2001). Le produit de polyuréthane est ensuite traité, durcissant ainsi le polyuréthane et réduisant le groupe d'isocyanates libres (NCO).
La mousse de polyuréthane flexible est produite de façon commerciale en tant que blocs de mousse qui sont disponibles pour les consommateurs, après traitement, sous la forme de divers articles manufacturés tels que le mobilier, les matelas ou les sous-tapis de plancher. La possibilité qu'il subsiste des DMD résiduels dans le polyuréthane flexible a été étudiée (Hoffmann et Schupp 2009; Krone et Klingner 2005). Dans une étude sur les réservoirs d'air par Hoffmann et Schupp (2009), le potentiel de migration des DMD à partir de la mousse traitée a été évalué. Dans un réservoir d'air fermé, un échantillonnage continu de l'air relativement à un nouveau matelas en mousse contenant 5 ppb de DMD extractibles a permis d'établir que les DMD n'étaient pas émis au-dessus de la limite de détection de 5,4 ng/m3. En utilisant des filtres tapissés de fibres de verre entre les couches de mousse, une migration continue sur cinq jours a été surveillée et on a déterminé qu'elle était très faible, à 9 ng/mg3 (Hoffman et Schupp 2009). Ces données indiquent que si des DMD résiduels subsistent dans la mousse au moment de l'achat, les résidus demeureront probablement dans la matrice polymère.
Par conséquent, compte tenu des renseignements disponibles (y compris la faible pression de vapeur des DMD), l'exposition de la population générale par inhalation et par voie cutanée aux DMD résiduels potentiels présents dans les produits de mousse souple est jugée négligeable.
D'autres produits de polyuréthane contenant des DMD comprennent les panneaux de particules ou les panneaux à copeaux orientés (Harper et coll. 2001; Centre commun de recherche de la Commission européenne 2005). Les DMD constituent un ingrédient dans la résine qui est ajoutée aux particules de bois. En raison de la température élevée et de l'humidité, la résine (contenant des DMD) traite et durcit les particules de bois dans les panneaux de particules ou les panneaux à copeaux orientés. Einbrodt conclut dans un exposé de position (cité dans un rapport du Centre commun de recherche de la Commission européenne 2005) que les panneaux de particules auxquels sont liées des polyurées n'émettent pas de « niveaux dangereux » de DMD. En outre, aucune donnée n'indiquait la présence de MDD, un produit de décomposition potentiel, dans les panneaux de particules. Dans des conditions thermiques accrues, où l'on peut s'attendre à des émissions de DMD issues des liants ou des revêtements pour bois, les panneaux de particules n'ont émis aucun DMD (Centre commun de recherche de la Commission européenne 2005). Cela a également été observé par Harper et coll. (2001) qui ont déclaré que le taux de durcissement maximal augmente avec la température de durcissement isotherme.
Les DMD sont également utilisés pour produire de la mousse de polyuréthane servant dans les produits de scellement, d'isolation et d'adhésion. Ces produits peuvent être « à deux composants » ou « à un composant ». Les produits « à deux composants » sont habituellement conditionnés sous forme de contenant comportant deux chambres séparées, l'une renfermant des DMD à l'état libre, sans réaction, et l'autre des polyols. Pendant l'application, les DMD et les polyols sont pulvérisés ou projetés au moyen d'une buse ou d'un pistolet pulvérisateur simultanément pour réagir et former une mousse de polyuréthane au point d'application (Crespo et Galán 1999; Lesage et coll. 2007; Methner et coll. 2010). Les trousses ou les produits en polyuréthane giclé à deux composants sont offerts aux bricoleurs et ils produisent habituellement la mousse sous faible pression (U.S. EPA 2015). Le polyuréthane giclé peut également être appliqué au moyen de systèmes de pulvérisation haute pression; cependant, ces systèmes ne sont utilisés que par les applicateurs professionnels (U.S. EPA 2015).
Les produits de bricolage « à un composant » contiennent un prépolymère isocyanate préparé à partir à partir de polyols et diisocyanates prémélangés qui, une fois libéré, réagit avec l'humidité dans l'air pour acquérir sa résistance mécanique par réticulation (Cui et coll. 2002; RAPRA 2000). Ces produits peuvent avoir des fonctions différentes, à savoir comme produit d'étanchéité, adhésif de construction, adhésif pour revêtement de sol, adhésif thermofusible et colle de bricolage. Les produits à un composant qui donnent une mousse expansible sont habituellement utilisés comme produits d'étanchéité, et les produits à un composant qui ne sont pas expansibles sont habituellement utilisés comme adhésifs.
Les tableaux 8.1, 8.2 et 8-3 présentent une description de la durée de durcissement et des plages de concentrations pour chaque substance DMD dans différents types de produits de bricolage (HPD 2013; HSDB 1983-2003).
| Produit | Concentration (% p/p) |
Durée de durcissement |
|---|---|---|
| Mousse de polyuréthane giclé (trousse à deux composants à faible pression) |
30-60 | Séchage non collant : 0,1 - 1 min Durcissement complet : 1 h |
| Produit d'étanchéité en mousse à un composant | 5-20 | Séchage non collant : 5 - 30 min Durcissement complet : 1 - 24 h |
| Adhésif de polyuréthane/produit d'étanchéité pour les assemblages | 1-30 | Séchage non collant : 15 min Durcissement complet : 1 - 24 h |
| Adhésif pour le sol ou le mur | 1-5 | Séchage non collant : 60 - 90 min Durcissement complet : 8 - 10 h |
| Adhésif pour la construction | 7-50 | Séchage non collant : 20 - 30 min Durcissement complet : 1 - 24 h |
| Adhésif général/colle de bricolage | 10-56 | Durcissement complet : 1 - 4 h |
| Colle Super Glue | 30-50 | Durcissement complet : 1 - 4 h |
| Adhésif thermofusible | 2-3 | Durcissement complet : 0,5 - 2 min |
| Produit | Concentration (% p/p) |
Durée de durcissement |
|---|---|---|
| Polyuréthane giclé (trousse à deux composants à faible pression) |
30-60 | Séchage non collant : 0,1 - 1 min Durcissement complet : 1 h |
| Scellant en mousse à un composant | 5-55 | Séchage non collant : 5 - 30 min Durcissement complet : 1 - 24 h |
| Adhésif de polyuréthane/produit d'étanchéité pour les assemblages | 1-10 | Séchage non collant : 15 min Durcissement complet : 1 - 24 h |
| Adhésif pour la construction | 10-25 | Séchage non collant : 20 - 30 min Durcissement complet : 1 - 24 h |
| Colle générique ou de bricolage | 30-56 | Durcissement complet : 1 - 4 h |
| Colle Super Glue | 30-50 | Durcissement complet : 1 - 4 h |
| Produit | Concentration (% p/p) |
Durée de durcissement |
|---|---|---|
| Polyuréthane giclé (trousse à deux composants à faible pression) |
5-10 | Séchage non collant : 0,1 - 1 min Durcissement complet : 1 h |
| Adhésif de polyuréthane/produit d'étanchéité pour les assemblages | 1-5 | Séchage non collant : 15 min Durcissement complet : 1 - 24 h |
| Adhésif pour la construction | 1-5 | Séchage non collant : 20 - 30 min Durcissement complet : 1 - 24 h |
| Adhésif pour le sol | 1-5 | Séchage non collant : 60 - 90 min Durcissement complet : 8 - 10 h |
| Colle générique ou de bricolage | 32-56 | Durcissement complet : 1 - 4 h |
| Adhésif thermofusible | inférieur(e) à 3 | Durcissement complet : 0,5 - 2 min |
L'exposition aux DMD découlant de l'utilisation de ces produits de bricolage dépend en partie de leur taux de « durcissement » ainsi que de l'humidité et de la température de la pièce dans laquelle ils sont appliqués. Les « taux de durcissement » constituent des mesures du taux de réaction des DMD pour former du polyuréthane et du durcissement ultérieur qui se fait grâce à la réticulation. Le durcissement commence généralement au moment de l'application et va de l'extérieur vers l'intérieur; une « peau » ou un film non collant se forme sur la surface (Cao et coll. 2012; Lesage et coll. 2007) avant la phase de durcissement. Le produit entraîne le durcissement du polyuréthane et la réduction des groupes NCO libres (Allport et coll. 2003). Dans les études mesurant le taux de traitement des diisocyanates, on a déterminé qu'avec une humidité et une température plus élevées, le temps de réaction est plus long (Wirts et coll. 2003; Wirts et Salthammer 2002). Les renseignements sur le produit fournissent une plage prévue concernant la durée nécessaire pour atteindre un durcissement complet ainsi qu'un temps de séchage non collant ou d'arrêt dans certains cas (tableaux 8.1 à 8.3).
L'exposition par inhalation et par voie cutanée aux DMD a été estimée pour les particuliers qui utilisent des produits de bricolage contenant des DMD. Les produits peuvent contenir un isomère DMD principal ou un mélange de plusieurs DMD. Les estimations de l'exposition sont fondées sur la concentration connue de DMD globalement dans chaque produit, tel qu'il est déclaré aux termes de l'article 71 et confirmé par les renseignements techniques des fabricants du produit. En fonction de l'utilisation prévue de ces produits, la voie orale d'exposition n'a pas été jugée pertinente.
Bien que les étiquettes de ces produits prescrivent des mesures de protection individuelle, comme le port de gants ou une protection respiratoire, les estimations calculées de l'exposition ne tiennent pas compte des particuliers qui porteraient un équipement de protection individuelle, car les consommateurs ne disposent pas nécessairement d'un tel équipement ni ne savent pas nécessairement comment l'utiliser.
Exposition par inhalation
Les produits de polyuréthane giclé à deux composants à faible pression peuvent être achetés dans le commerce en contenants de diverses tailles, les deux tailles les plus courantes étant de 13 et 20 kg (la plus grande masse commercialisée). La concentration de chaque substance DMD contenue dans ce type de produit peut varier de 5 à 60 % p/p, entraînant avant que le mélange soit fait avec le polyol pour former la mousse (tableaux 8.1 à 8.3). La mousse fabriquée à partir d'un contenant de 20 kg devrait couvrir 600 pieds-planches ou 300 pi2 (28 m²) pour une épaisseur de mousse de 2 po (courriel de 2013 de CUCFA au Bureau des substances existantes de Santé Canada; source non citée; Lesage et coll. 2007).
On n'a trouvé aucune étude dans laquelle les concentrations de DMD dans l'air avaient été mesurées pendant l'utilisation par un particulier d'un produit de polyuréthane giclé à deux composants à faible pression. Cependant, il existe plusieurs études dans lesquelles les concentrations de DMD dans l'air ont été mesurées pendant l'application de produits de polyuréthane giclé à deux composants par des applicateurs professionnels qui utilisaient un système de pulvérisation à faible pression ou à haute pression (Lesage et coll. 2007; Roberge et coll. 2009; Fomo Products 2005, 2010; ACC 2012b; Convenience Products 2012, 2014 a,b; Dow Chemical Company 2013).
Les études dans lesquelles on avait mesuré les concentrations de DMD dans l'air pendant l'application de produits de polyuréthane giclé à faible pression ont été utilisées aux fins de la présente évaluation, car elles sont jugées les plus représentatives d'un scénario d'utilisation par les particuliers.
Les parties intéressées ont présenté plusieurs études dans lesquelles les concentrations de DMD dans l'air avaient été contrôlées pendant l'application de produits de polyuréthane giclé à deux composants à faible pression. Dans ces études, les produits contenant des DMD avaient été appliqués par des professionnels soit sous forme de produit d'étanchéité (pour remplir des trous et des fissures dans les murs et les plafonds (p. ex., des écarts entre les solives et le mur), ou sous forme d'isolant (pour couvrir ou remplir toute une partie de mur entre des solives). Les résultats sont présentés à l'annexe F et résumés dans les tableaux 8.4 et 8.5 ci-dessous. Les études présentées avaient été réalisées dans des maisons aux États-Unis (Fomo Products 2005; Dow Chemical 2013; Convenience Products 2014a,b) ou dans des enceintes de pulvérisation spécialisées (Fomo Products 2010; ACC 2012b; Convenience Products 2012).
Les parties intéressées ont présenté trois études dans lesquelles un produit de polyuréthane giclé à deux composants avait été appliqué à faible pression entre les solives (c.-à-d. pour remplir entièrement une cavité) (Fomo Products 2005; Convenience Products 2012; Dow Chemical 2013). Dans ces études, il s'agissait de mesurer l'exposition attribuable à des applications d'une durée d'une heure ou moins. Il ressort de ces études qu'il faudrait environ 1 heure pour appliquer 20 kg de produit. Les études ont été réalisées dans divers régimes de ventilation, dont certains étaient jugés moins représentatifs d'un scénario d'application par un particulier (p. ex., un particulier n'investirait pas nécessairement dans l'achat de deux ventilateurs carrés à l'occasion d'une unique utilisation d'une trousse de polyuréthane giclé). Les concentrations maximales globales étaient de 0,16 mg/m3 (pour une durée de pulvérisation de 13 minutes, la ventilation étant assurée soit par un ventilateur carré ou par un ventilateur de qualité industrielle) (Dow Chemical 2013); de 0,078 mg/m3(pendant une application de 60 minutes, deux ventilateurs carrés étant installés dans les fenêtres, mais réglés à la valeur « FERMÉ », ce qui équivaut à des fenêtres ouvertes); de 0,053 mg/m3 (pendant une application de 60 minutes, avec deux ventilateurs carrés réglés au maximum) (Convenience Products 2012); ou de 0,082 mg/m3 (après une application de 60 minutes, avec ventilation naturelle, c.-à-d. avec les fenêtres et les portes ouvertes) (Fomo Products 2005). (Voir l'annexe F pour plus de détails). Il a été jugé que l'étude de Dow était entachée d'incertitudes (les concentrations d'air mesurées étaient identiques, même si elles étaient basées sur 2 régimes de ventilation passablement différents). La concentration de 0,082 mg/m3 (Fomo Products 2005) est jugée représentative d'un scénario dans lequel un particulier utilise un produit de polyuréthane giclé à deux composants à faible pression (sous forme de trousse) pendant une heure.
| Étude de référence | Ventilation (changements d'air/heure) |
Temps d'échantillonnage (min) |
Air [ ] pendant la pulvérisation (mg/m 3) |
|---|---|---|---|
| 1993. | 44 (ventilateur de qualité industrielle) |
13 | 0,16 |
| 1993. | 16 (1 ventilateur carré) |
13 | 0,16 |
| Convenience Products 2012 | 6 (fenêtres ouvertes) |
60 | Total DMD* : 0,078 |
| Convenience Products 2012 | 102 (2 ventilateurs carrés) |
60 | Total DMD* : 0,053 |
| Fomo Products 2005 | Fenêtres ouvertes | 18-20 | 0,082 |
*Ces valeurs ont été obtenues en additionnant les concentrations de DMD monomères et de pDMD; la concentration de pDMD était inférieure à la limite de détection (LD) de 0,02 mg/m3; on a supposé que la concentration était la moitié de la LD.
Les parties intéressées ont présenté trois études dans lesquelles un produit de polyuréthane giclé à deux composants avait été appliqué à faible pression le long de solives et de coins et dans des fissures (ACC 2012b; Convenience Products 2014a,b). Ces études étaient basées sur la mesure de l'exposition pendant des applications d'une durée de 30 minutes. D'après ces études, il semble qu'il faudrait environ 30 minutes pour appliquer 13 kg de polyuréthane giclé. Ces études avaient été réalisées avec un large éventail de taux de ventilation, dont certains sont moins représentatifs d'un scénario type d'application par un particulier. Les concentrations maximales mesurées pendant l'application du polyuréthane giclé étaient de 0,01 mg/m3 (avec deux ventilateurs carrés insérés dans les fenêtres), de 0,04 mg/m3(ventilation naturelle) et de 0,1 mg/m3(10,4 renouvellements d'air par heure dans une enceinte d'essai, ventilation perpendiculaire au sujet de pulvérisation). (Voir l'annexe F pour plus de détails). La concentration de 0,1 mg/m3 était entachée d'incertitudes, car la limite de détection pour l'une des concentrations de DMD mesurées (pDMD) était élevée (supérieur(e) à 0,1 mg/m3), et par conséquent la contribution réelle des pDMD à la concentration totale de DMD est inconnue. Par conséquent, une plage de concentrations maximales de 0,04 à 0,1 mg/m3 est jugée représentative d'un scénario d'exposition correspondant à l'application d'une trousse de 13 kg de polyuréthane giclé à deux composants à faible pression.
| Étude de référence | Ventilation (changements d'air/heure) |
Temps d'échantillonnage (min) |
Air [ ] pendant la pulvérisation (mg/m3) |
|---|---|---|---|
| Convenience Products 2014a | 4,7 (2 ventilateurs carrés) |
15 | 0,01 |
| Convenience Products 2014b | 0,2 (ventilation naturelle) |
15 | 0,04 |
| ACC 2012b | 10,4 (enceinte d'essai) |
24-29 | 0,1* |
*Cette valeur est basée sur l'addition des concentrations de 2,4'-DMD, de 4,4'-DMD et de pDMD; la concentration de pDMD était inférieure à la limite de détection (LD) de 0,102 mg/m3; on a supposé que la concentration était la moitié de la LD.
Ces concentrations sont entachées d'incertitudes, car il est fort probable que les professionnels qui appliquent le produit dans les diverses études ont reçu une formation et ont de l'expérience avec ces produits, et donc ils effectuent une application « plus propre » qu'un particulier non formé.
Les personnes présentes dans une habitation peuvent également être exposées aux DMD en raison de leur présence dans les aérosols dans l'air pendant l'utilisation d'un produit de polyuréthane giclé à deux composants à faible pression. Dans le cas de l'application du polyuréthane giclé par un professionnel, on demandera habituellement aux occupants de l'habitation de quitter celle-ci pendant l'application du produit et de revenir au moins 1 heure plus tard afin de réduire au minimum l'exposition aux DMD (NRC 2011). Les données disponibles indiquent que la concentration dans l'air baisse rapidement lorsque la mousse commence à durcir. Dans les études décrites aux tableaux 8.4 et 8.5 et à l'annexe F, toutes les mesures post-pulvérisation (prises entre 30 minutes et 1 heure après l'application [ACC 2012b]) ont donné des concentrations de DMD qui étaient inférieures à la limite de détection de l'étude (Fomo Products 2005; ACC 2012b; Convenience Products 2012, 2014 a,b; Dow Chemical Company 2013). De plus, dans le cas des scénarios d'application de polyuréthane giclé à deux composants à pression élevée, on a trouvé que les concentrations diminuaient en deçà de la limite de quantification avec la distance de la zone de pulvérisation et avec le moment de l'application (Lesage et coll. 2007; Roberge et coll. 2009).
En plus des produits de polyuréthane giclé à deux composants à faible pression, les produits de bricolage contenant des DMD comprennent les produits à un composant de mousse expansible, également utilisés comme produits d'étanchéité. Ces produits contiennent un pré-mélange de DMD et de polyol, c.-à-d. un prépolymère terminé par un isocyanate, et ils sont habituellement appliqués à partir d'une bonbonne munie d'une buse constituée d'un tube étroit, contre la surface d'un mur afin de sceller de petites fissures. Au point d'utilisation du produit, lorsque le prépolymère est évacué, le groupe isocyanate présent dans le prépolymère réagit avec l'humidité dans l'air et forme un intermédiaire aminé qui réagit ensuite avec le prépolymère contenant des isocyanates; la mousse expansible est alors formée. Le tableau 8.6 présente les résultats des études présentées par les parties intéressées, et dans lesquelles les concentrations de DMD dans l'air ont été mesurées pendant l'application de produits de polyuréthane giclé à un composant.
| Étude de référence | Quantité appliquée | Ventilation | Durée de l'application (min) |
Concentrations dans l'air pendant l'application (mg/m3) |
Scénario d'application |
|---|---|---|---|---|---|
| Fomo Products 2010 | 1.5 bonbonne (taille des bonbonnes non indiquée) |
None - ventilation was turned off | 15 | inférieur(e) à LD (0.001) |
Appliqué sur un carton dans une enceinte de pulvérisation sous humidité |
| Convenience Products 2009 | n.i. | n.i. | 15 | inférieur(e) à LD (0.0065) |
Appliqué autour d'une grande fenêtre fabriquée, avec endos en panneau de particules |
| Lars Rosell et Marcus Vestergren 2012 | 524-550 g | n.i. | inférieur(e) à 20 | inférieur(e) à LD (0.00025) |
Appliqué autour d'une grande fenêtre fabriquée, avec endos en panneau de particules |
LD : Limite de détection; n.i. : non indiqué
Les concentrations de DMD indiquées dans le tableau 8.6 étaient toutes inférieures à la limite de détection de l'étude (les limites de détection étaient comprises entre 0,00025 et 0,0065 mg/m3). Dans l'évaluation des risques du DMD par l'Union européenne (Centre commun de recherche de la Commission européenne 2005), on présentait également des données soumises par l'industrie et indiquant que les concentrations de DMD étaient inférieures à la limite de détection de 0,0061 mg/m3 lorsque des particuliers utilisaient les produits de mousse giclée à un composant. L'UE a utilisé cette valeur comme scénario de la pire éventualité pour l'inhalation à court terme, en indiquant que ces données de surveillance reflètent la situation en milieu professionnel, mais s'appliquent également à l'utilisation de ce produit par les consommateurs (Centre commun de recherche de la Commission européenne 2005). D'après toute l'information obtenue, la limite de détection de 0,0065 mg/m3 est considérée comme la limite supérieure de l'estimation pour l'exposition de la population générale aux DMD en raison de l'utilisation d'un produit d'étanchéité en mousse à un composant.
D'autres produits de bricolage contenant des DMD ne sont pas expansibles, mais ils sont utilisés pour boucher les trous ou coller les morceaux ensemble pendant l'assemblage du bois, du métal ou des cloisons sèches. On n'a pas déterminé de données de surveillance de ces types de produits et les estimations de l'exposition par inhalation découlant de l'utilisation de ces produits ont été calculées à l'aide du logiciel ConsExpo v.4.1 (RIVM 2006).
Un produit (adhésif/produit d'étanchéité de polyuréthane ou produit d'étanchéité pour les assemblages) est utilisé pour lier et remplir l'espace entre les matériaux en bois, soit pour le mobilier soit pour les murs de séparation. Ce produit agit comme un produit de calfeutrage et peut être appliqué en tant que couche épaisse entre deux surfaces. En supposant qu'une cartouche pleine (390 g) d'un produit d'étanchéité pour les assemblages est utilisée pour une tâche d'une durée de 30 minutes, la concentration de DMD en suspension pendant l'utilisation de ce produit est estimée par le modèle ConsExpo entre 0,00063 et 0,0010 mg/m3 (voir le tableau 8.7 ou l'annexe G pour avoir plus de détails).
L'exposition se produisant au cours de petits et grands projets nécessitent des adhésifs a été estimée à l'aide du modèle ConsExpo, d'après l'utilisation d'un adhésif pour revêtement de sol, de colle de construction ou de colle de bricolage. L'adhésif pour revêtement de sol peut être utilisé pour un projet de grande envergure, comme un salon, dans lequel l'installation prendrait plusieurs heures. Si l'on se base sur une journée de 8 heures pour poser le plancher, la concentration de DMD pendant l'utilisation de ce type de produit est estimée entre 0,00013 et 0,00047 mg/m3 (tableau 8.7, annexe G). De la colle de construction peut être utilisée pour une variété de projets dans la maison. Les concentrations de DMD pendant l'utilisation de colle de construction, en supposant un projet de moyenne envergure autour de la maison, ont été estimées entre 0,0014 et 0,0021 mg/m3 selon une application de 30 minutes et un temps de séchage non collant de 30 minutes sur une surface de 1 m² (tableau 8.7, annexe G). Les adhésifs utilisés dans les produits de bricolage sont destinés aux petits projets, comme la confection de modèles et l'artisanat. D'après l'utilisation de 6 g de produit pendant 20 minutes sur une surface de 400 cm², une plage de concentrations de DMD variant de 25 à 56 % p/p (tableau 8.7) dans le produit, les concentrations atmosphériques sont estimées entre 1,0 × 10-5 et 1,2 × 10-5 mg/m3, pendant l'utilisation de ce produit (tableau 8.7, annexe G). Ces niveaux sont conformes à ceux déclarés dans l'étude sur la colle Gorilla réalisée par McCoy et coll. (2013); l'utilisation par le consommateur d'une colle de bricolage a été simulée en appliquant de petites quantités de colle (1, 2 et 30 g) à des surfaces plates avant de les coller ensemble. L'étude a indiqué des concentrations atmosphériques de DMD et de pDMD de moins de 0,0005 mg/m3.
D'autres adhésifs, de la colle Super Glue et des adhésifs thermofusibles ont été jugés associés à de faibles concentrations atmosphériques de DMD. Par exemple, la réparation d'une poignée cassée d'une tasse nécessiterait peu de colle Super Glue (0,5 g), serait rapidement terminée et prendrait quelques heures pour durcir. Par l'intermédiaire de ces hypothèses, la concentration de DMD découlant de la colle Super Glue a été estimée à moins de 4,1 × 10-8 mg/m3. La concentration de DMD pendant l'utilisation d'adhésifs thermofusibles est estimée à moins de 7,9 × 10-8 mg/m3 (tableau 8.7, annexe G).
| Scénario modélisé pour produit de consommationa | Durée d'exposition et de durcissement | Plage des concentrations moyennes par événement pendant la durée d'application et de durcissement (mg/m3) |
|---|---|---|
| Adhésif de polyuréthane/produit d'étanchéité pour les assemblages | 30 + 15 min | 0,00063-0,0010 |
| Adhésif pour le sol ou le mur | 8 h + 1.5 h | 0,00013-0,00047 |
| Adhésif pour la construction | 30 + 30 min | 0,0014-0,0021 |
| Adhésif général/colle de bricolage | 4 h | 1,0 × 10-5 to 1,2 × 10-5 |
| Colle Super Glue | 4 h | inférieur(e) à 4,1× 10-8 |
| Adhésif thermofusible | 25 + 2 min | inférieur(e) à 7,9 × 10-8 |
a. Les taux de ventilation pour ces scénarios étaient de 0,5 ou 0,6 renouvellement/h (voir l'annexe G pour plus de détails).
On considère que les estimations de l'exposition basées sur le modèle ConsExpo sont prudentes en raison des limites du modèle. Lorsque les produits de bricolage sont appliqués, la quantité de DMD inaltérés devrait diminuer en raison de la production de polyuréthane et de son durcissement. Toutefois, le modèle ConsExpo ne tient pas compte de la transformation physique d'une substance et il a été supposé que tous les DMD présents dans le produit avant l'application se volatilisent (communication personnelle, RIVM 2013). La quantité de DMD libres rejetés dans l'air pendant l'application devraient plus faibles que la quantité estimée par le modèle ConsExpo, compte tenu du développement d'un film sur la surface du produit qui réduit potentiellement la migration et le rejet des DMD inaltérés (Lesage et coll. 2007). Les estimations du modèle ConsExpo de la concentration atmosphérique sont basées sur les propriétés physiques et chimiques des DMD, mais pas sur la transformation physique des DMD en polyuréthane lorsque le produit est appliqué (communication personnelle, RIVM 2013). Le taux de transfert de masse selon la théorie de la couche limite de 0,18 m/min (Spark et coll. 1996) présenté par RIVM a été proposé pour tenir compte de la couche durcie entre l'air ambiant et le polyuréthane non durci. Étant donné que les données expérimentales ont été basées sur une moyenne de substances volatiles, l'étude de Sparks et coll. (1996) n'a pas été prise en compte. Plus récemment, Wirts et Salthammer (2002) ont déterminé un débit massique expérimental de 0,013 m/min en fonction du taux d'émissions relatif au 4,4'-DMD pur. Les données de Wirts et Salthammer (2002) ont été utilisées dans le cadre des estimations modélisées des produits de bricolage (adhésif ou produit d'étanchéité).
Un produit de bricolage qui contient des DMD est destiné aux caisses de camionnettes (Dominion Sure Seal 2014). Ce produit, disponible dans les quincailleries, peut être appliqué au rouleau, au pinceau, par bonbonne d'aérosol ou par pistolet pulvérisateur. Bien que les instructions sur l'étiquette indiquent que le produit peut être utilisé sur les patios ou les planchers de sous-sol ou de garage, on l'utilise habituellement pour enduire l'intérieur des caisses de camionnettes afin d'assurer une protection contre la rouille. Le revêtement des caisses de camionnettes peut être fait par des professionnels, ou par les propriétaires de camionnette. Si un particulier utilise un produit pour caisse de camionnette, ce sera probablement à l'extérieur ou dans un garage ouvert, et cela nécessitera l'utilisation d'au plus 1 gallon (3,7 L) de produit seulement (contenant maximal disponible dans le détail). Les concentrations de DMD dans l'air pendant l'application dans une caisse de camionnette ont été présentées dans un contexte d'utilisation professionnelle à l'intérieur (Myers and Cummings 2005), ce qui n'est pas représentatif du scénario d'utilisation par un propriétaire de camionnette. Bien qu'aucune étude ne soit disponible pour ce scénario spécifique, l'exposition potentielle par inhalation, associée à l'utilisation de produits de revêtement de caisse de camionnette, devrait être beaucoup plus faible que l'exposition due à l'utilisation de produits de bricolage à l'intérieur.
Exposition par voie cutanée
L'exposition cutanée aux DMD découlant de l'utilisation des produits de bricolage a été calculée en tant que quantité du produit par surface de contact avec la peau. Une série d'études de sensibilisation de la peau humaine indiquent que la sensibilisation cutanée dépendait de la dose par surface unitaire de contact avec la peau, plutôt que de la quantité globale de substance appliquée à la peau (Kimber et coll. 2008; Robinson et coll. 2000). Les estimations supposent également que tout produit séché restant sur la peau ne constitue pas une barrière contre l'application continue.
Les étiquettes des produits d'étanchéité en mousse de polyuréthane suggèrent des mesures de sécurité, car le produit pulvérisé peut adhérer à de grandes surfaces des bras et des mains pendant l'utilisation. Dans le cas du scénario d'application à faible pression de mousse de polyuréthane giclé à deux composants, on a estimé l'exposition cutanée aux DMD en posant que l'application par pistolet pulvérisateur donnait une couverture (0,25 g) (RIVM 2006) au dos de chaque main et avant-bras (2185 cm²), ce qui constitue une charge cutanée de 0,068 mg/cm2. On a estimé que l'application de produits d'étanchéité en mousse à un composant, à l'aide d'une bonbonne à long embout de pulvérisation près du corps, rejetant potentiellement 0,004 g de produit sur l'extrémité des doigts touchant l'embout (10 cm2), impliquait une charge cutanée estimée être entre 0,02 et 0,22 mg/cm2(tableau 8.8).
Les produits d'étanchéité pour les emballages sont généralement appliqués comme de la colle de calfeutrage, directement sur la surface de travail. Dans ce scénario, les deux surfaces collées ensemble sont maintenues en place pour que la colle commence à prendre. On suppose que pendant cette période, 20 % de la paume ou des doigts d'une main (46 cm²) peuvent être exposés aux gouttes de colle, ce qui donne une limite supérieure estimative de 4,9 mg/cm2 aux DMD (tableau 8.8).
L'exposition cutanée potentielle a été estimée pour les adhésifs de construction, la colle pour le sol et la colle de bricolage. En raison de la nature de leur application pratique, on suppose que les mains sont en contact avec des adhésifs pour le sol pendant toute la durée de l'installation du sol, avec un taux de contact de 30 mg/min pendant 8 heures. On prévoit une exposition de 50 % des mains, ce qui entraînerait une estimation de la charge cutanée de 3,2 mg/cm2. Durant l'utilisation des adhésifs de construction, c.-à-d. en maintenant ensemble deux composants pendant que la colle prend, on présume que 20 % des deux paumes ou tous les doigts (91 cm2) seraient en contact avec la colle, ce qui entraînerait une charge cutanée potentielle de DMD de 2,2 mg/cm2. Pendant l'application de 0,08 g de colle de bricolage contenant 56 % de 4,4'-DMD, on suppose que les bouts des doigts (2 cm2) seraient exposés lors d'un travail de précision, ce qui entraînerait une charge cutanée estimée de DMD de 22 mg/cm² (tableau 8.8).
Tout contact avec la peau lors de l'utilisation d'adhésifs thermofusibles et de colle Super Glue est généralement évité afin de protéger la couche du derme contre toute lésion physique liée aux brûlures et au déchirement. De même, le contact de la peau avec le produit appliqué au pinceau ou au rouleau, par exemple un produit de revêtement de caisse de camionnettes, serait généralement évité. En cas de contact accidentel avec la colle Super Glue, un bout de doigt peut être exposé à 5 % de la colle utilisée, entraînant ainsi une charge cutanée potentielle de DMD de 13 mg/cm2. La manipulation d'une barre de colle thermofusible n'entraînerait pas d'exposition en l'insérant dans un pistolet à colle, car les DMD sont durcis pour former une barre solide. Contrairement aux autres produits de bricolage, qui peuvent contenir des isocyanates libres avant l'utilisation, les adhésifs thermofusibles nécessitent de fortes températures pour rejeter des DMD. Le contact avec la peau serait évité pendant l'application de colle chauffée, limitant ainsi toute exposition cutanée aux DMD.
| Scénario modélisé relatif au produit de consommation | Surface de contact (cm 2) |
Charge cutanée (mg/cm 2) |
|---|---|---|
| Polyuréthane giclé (faible pression, trousse à deux composants) |
2185 | 0,068 |
| Produit d'étanchéité en mousse | 10 | 0,22 |
| Adhésifs/produit d'étanchéité de polyuréthane | 46 | 4,9 |
| Adhésif pour le sol ou le mur | 455 | 3,2 |
| Adhésif pour la construction | 91 | 2,2 |
| Adhésif général/colle de bricolage | 2 | 22 |
| Colle Super Glue | 1 | 13 |
8.2 Évaluation des effets sur la santé
8.2.1 MDD
Le pMDD est un mélange contenant en grande partie du 4,4'-MDD. On n'a trouvé aucun renseignement sur les effets du pDMD sur la santé. En Union européenne (UE), au sens du Règlement sur l'enregistrement, l'évaluation, l'autorisation et la restriction des substances chimiques (règlement REACH), le 4,4'-MDD et le pMDD apparaissent sur la Liste des substances extrêmement préoccupantes candidates en vue d'une autorisation (SVHC) en raison de la nature des effets sur la santé associés au 4,4'-MDD, qui a été classé comme cancérogène de catégorie 1B par la Commission européenne (ECHA 2011). En tenant compte du fait que le 4,4'-MDD constitue le principal composant du pMDD et parce qu'aucune donnée sur les effets sur la santé n'a été déterminée pour le pMDD, l'évaluation suivante des effets du 4,4'-MDD sur la santé s'appliquera aussi au pMDD.
8.2.1.1 Cancérogénicité et génotoxicité
Le Centre international de recherche sur le cancer (CIRC) a classé le 4,4'-MDD comme substance cancérogène du groupe 2B (« substances pouvant être cancérogènes pour l'homme ») (CIRC 1986) et la Commission européenne a classé la substance chimique en tant que substance cancérogène de catégorie 1B (« substances présumées cancérogènes pour l'être humain ») (Commission européenne 2015a). En outre, le National Toxicology Program (NTP) des États-Unis a donc conclu de classer le 4,4'-MDD parmi les substances dont on peut « raisonnablement présumer qu'elles sont cancérogènes pour l'homme » (NTP 1983). Ces classifications de danger nationales et internationales et conclusions sont surtout fondées sur l'observation d'une hausse du nombre de tumeurs chez les animaux de laboratoire.
Des tumeurs ont été observées en de multiples sites chez les rats et les souris traités avec du 4,4'-MDD. Dans une étude de deux ans réalisée sur des animaux, des rats F344 et des souris B6C3F1 ont été exposés au 4,4'-MDD dans de l'eau potable à des doses de 0, 150 ou 300 ppm (correspondant environ à 0/0, 9/10 ou 16/19 [mâle/femelle] pour les rats et à 0/0, 25/19 ou 57/43 [mâle/femelle] mg/kg p.c. par jour pour les souris) pendant 103 semaines. Une augmentation statistiquement importante des carcinomes dans les cellules folliculaires de thyroïde a été observée chez les rats mâles ayant reçu une forte dose, ainsi que des augmentations statistiquement importantes des adénomes du follicule thyroïdien chez les rates ayant reçu une dose élevée et les souris mâles et femelles auxquelles on a administré une forte dose. L'augmentation des adénomes des cellules C de la thyroïde a été observée chez les rates en fonction de la dose. L'augmentation des adénomes des cellules C a été constatée chez les rates, d'une façon associée à la dose. On a pu observer des nodules néoplasiques dans le foie des rats mâles ayant reçu des doses faibles et élevées. De plus, des tumeurs inhabituelles à faibles incidences ont été observées chez les rats exposés et comportaient des cholangiadénomes chez les mâles, ainsi que des papillomes transitionnels de la vessie et des tumeurs de la granulosa des ovaires chez les femelles. L'incidence des tumeurs rares peut avoir une importance toxicologique, car leur incidence de valeur historique est très faible. Chez les souris, une augmentation statistiquement importante du carcinome hépatocellulaire a été observée chez les mâles et les femelles exposés, ainsi qu'une augmentation statistiquement importante de l'adénome hépatocellulaire chez les souris femelles ayant reçu une dose élevée. Parmi les autres tumeurs qui ont augmenté chez les souris exposées, on compte les phéochromocytomes surrénaliens chez les mâles, les adénomes alvéolaires/bronchiolaires et les lymphomes malins chez les femelles (NTP 1983).
Les études ayant évalué les issues liées au cancer chez les humains ont été déterminées. Liss et Chrostek (1983) ont indiqué qu'il y avait un lien entre le cancer de la vessie et le travail dans des zones subissant une exposition potentielle passée ou présente au 4,4'-MDD. Il s'agissait d'une enquête de suivi concernant le décès de 179 hommes blancs parmi des employés qui avaient travaillé plus d'un mois dans des zones soumises à une exposition aux résines époxydes et aux durcisseurs d'amines contenant du 4,4'-MDD. Il a été observé que le ratio standardisé lié au cancer avait fortement augmenté par rapport à l'ensemble de la population. Toutefois, une analyse de la mortalité proportionnelle liée au cancer a indiqué que seule la surabondance des cancers de la vessie était élevée de façon significative. Contrairement aux résultats de Liss et Chrostek (1983), aucune donnée indiquant une augmentation du risque de cancer général ou de la vessie n'a été observée dans une étude rétrospective de cohorte menée chez 595 travailleurs (550 hommes et 45 femmes) employés dans une centrale électrique en Suède entre 1963 et 1986. Des ratios d'incidence normalisés (RIN) ont été obtenus à partir du ratio du nombre de cas observés sur le nombre de cas prévus. Le ratio RIN global de 0,52 était basé sur 5 cas observés. Les auteurs ont indiqué que les résultats devraient être interprétés avec prudence, car la majeure partie des sujets étaient relativement jeunes et n'avaient pas encore atteint un âge où les cancers sont plus fréquents, et la période de suivi était courte et n'a peut-être pas englobé la période de latence pour le cancer de la vessie (Selden et coll. 1992).
La Commission européenne (2015a) a classé le 4,4'-MDD comme mutagène de catégorie 2, « substances préoccupantes pour l'homme en raison de la possibilité qu'elles puissent produire des mutations héréditaires dans les cellules germinales humaines ». Les données expérimentales sont résumées ci-dessous.
Le 4,4'-MDD a produit des effets positifs dans des essais de mutation bactériologiques. Il a également causé des mutations génétiques dans les cellules de lymphomes de souris L5178Ytk+/-. Le 4,4'-MDD a provoqué des aberrations chromosomiques dans des cellules pulmonaires des hamsters de Chine, mais l'effet était équivoque dans des cellules ovariennes (CHO) de hamsters de Chine. Il a également entraîné l'échange de chromatides sœurs dans des cellules ovariennes. Dans un essai visant à évaluer les dommages à l'ADN, le 4,4'-MDD a clairement démontré le déclenchement d'une synthèse d'ADN non programmée dans les hépatocytes des rats.
Le potentiel génotoxique du 4,4'-MDD a été confirmé dans une série d'essais in vivo. On a pu observer une mutation létale récessive associée au sexe chez le mâle adulte Drosophila melanogaster après une exposition au 4,4'-MDD par l'alimentation; le résultat était cependant négatif lorsqu'il était exposé par injection à dose plus faible. Dans des tests du micronoyau, le 4,4'-MDD a indiqué des résultats positifs ou équivoques chez les souris exposées, mais négatifs chez les rats exposés. Un effet faiblement positif a été observé chez les souris exposées dans l'essai d'échange de chromatides sœurs. Dans l'essai de synthèse d'ADN non programmée, des résultats négatifs ont été constatés chez les souris et les rats exposés. Néanmoins, le 4,4'-MDD a causé une fragmentation de l'ADN et la formation d'adduits à l'ADN chez les rats exposés.
8.2.1.2 Autres effets non cancérogènes
Aucun effet non cancérogène du 4,4'-MDD n'a été observé dans divers organes et tissus, principalement le foie et la thyroïde. Dans une étude de toxicité orale de deux ans menée chez les rats et les souris (NTP 1983), des kystes folliculaires de la thyroïde et une hyperplasie des cellules folliculaires ont été observés à des doses de 9 ou 10 mg/kg p.c. par jour et à des groupes de doses plus élevés chez les rats mâles ou femelles respectivement; on a également pu observer une métamorphose graisseuse du foie et les changements cellulaires focaux chez les rats mâles et femelles à des doses faibles et élevées. Cependant une dilatation non spécifiée du foie n'a été observée que chez les rats mâles à des doses faibles et élevées. Chez les souris, l'hyperplasie des cellules folliculaires de la thyroïde et la dégénérescence des cellules hépatiques ont été observées chez les mâles à 25 mg/kg p.c. par jour; toutefois, chez les femelles, ces effets n'ont été observés que dans le groupe de dose élevée (43 mg/kg p.c. par jour) (NTP 1983).
Plusieurs études de toxicité orale subchronique ont été examinées. Dans une étude réalisée par Ciba-Geigy (1982), l'hyperplasie ou l'hypertrophie des cellules folliculaires et l'hyperplasie des cellules glandulaires diffuse avec un épuisement des colloïdes dans la thyroïde ont été observés chez les rats mâles et femelles exposés au 4,4'-MDD dans l'eau potable à une dose de 8 mg/kg p.c. par jour et plus pendant trois mois. À la dose plus élevée (23 mg/kg p.c. par jour pour les mâles et 22 mg/mg p.c. par jour pour les femelles), on a observé une anémie, un niveau élevé d'enzymes, un poids des organes modifié, une hyperplasie du canal cholédoque, des lésions hépatiques et des lésions de la thyroïde chez les mâles et les femelles, mais la minéralisation des reins n'a été observée que chez les rats mâles. En outre, un nombre élevé de leucocytes et un pourcentage élevé de neutrophiles, ainsi qu'une prolongation du temps de Quick, ont été observés dans les groupes soumis aux doses les plus élevées (31 mg/kg p.c. par jour pour les mâles et 32 mg/kg p.c. par jour pour les femelles) concernant les deux sexes. Des pourcentages réduits de lymphocytes ont été observés chez les rates, ainsi qu'une hyperplasie nodulaire focale de la thyroïde chez les rats mâles (Ciba-Geigy 1982). Le NTP des États-Unis a également réalisé une étude de 13 semaines chez des rats et des souris traités avec du 4,4'-MDD dans de l'eau potable. Chez les rats, une réduction liée à la dose dans la consommation d'eau a été observée chez les mâles et les femelles à 13 mg/kg p.c. par jour et à des doses plus élevées. Chez les souris, une réduction du gain de poids a été observée chez les mâles à 27 mg/kg p.c. par jour et à des doses plus élevées. À la dose la plus élevée (55 mg/kg p.c. par jour pour les mâles et 52 mg/kg p.c. par jour pour les femelles), on a pu constater une hyperplasie du canal cholédoque, des goitres adénomateux et une réduction du gain de poids chez les souris mâles et femelles (NTP 1983). D'autres études de toxicité subchronique par voie orale ont permis d'obtenir des DMENO comprises entre 84 et 97 mg/kg p.c. par jour (Kiasa et coll. 1984, Fukushima et coll. 1979 et 1981, Tsuda et coll. 1987). Aucune étude d'exposition subchronique par inhalation ou par voie cutanée n'a été recensée.
Un certain nombre d'études à court terme réalisées sur diverses espèces, avec différentes voies d'exposition, ont été réalisées. Dans une étude de 14 jours dans l'eau potable réalisée sur les rats et les souris, des réductions dans la consommation d'eau et le gain de poids ont été observées chez les rats exposés au 4,4'-MDD à 17 mg/kg p.c. par jour et à des doses plus élevées, ainsi que chez les souris exposées à 102 mg/kg p.c. par jour pour les femelles et à 136 mg/kg p.c. pour les mâles, et à des doses plus élevées (NTP 1983). La BASF (1977) a réalisé une étude d'exposition par voie orale sur 14 jours chez les rats. Une diminution des niveaux de lipide sérique total et une augmentation des niveaux de la phosphatase alcaline sérique ont été constatées dans un groupe des deux sexes auquel on a administré une faible dose (25 mg/kg p.c. par jour); par ailleurs, un poids élevé concernant le foie a été noté uniquement chez les femelles ayant reçu une faible dose. À la dose élevée (50 mg/kg p.c. par jour), on a pu remarquer une anémie avec une réduction du nombre de globules rouges, une diminution des niveaux d'hémoglobine et des hématocrites, ainsi qu'une augmentation du nombre de leucocytes chez les mâles et les femelles. Une augmentation des enzymes sériques (alanineaminotransférase [ALAT], phosphatase alcaline), des protéines totales (mâles uniquement), du total des lipides et de la bilirubine totale, ainsi que des poids d'organes élevés concernant le foie, les reins, la rate et la thyroïde a été observée chez les animaux exposés à la dose élevée. Par ailleurs, l'analyse d'urine a révélé des effets nocifs chez les deux groupes exposés. Des cellules rénales isolées et la présence de protéines dans les sédiments urinaires étaient évidentes. L'histopathologie a indiqué des lésions légères à modérées liées à la dose chez les deux groupes exposés et se traduisaient par une prolifération des conduits biliaires avec une fibrose initiale et des réactions inflammatoires du foie, un élargissement de la rate en raison de l'hématopoïèse extramédulaire et une hyperplasie de l'épithélium thyroïdien (BASF 1977). Deux autres études sur l'exposition par voie orale chez les rats a permis d'obtenir des DMENO de 84 et 100 mg/kg p.c. par jour d'après les effets nocifs observés dans le foie et la thyroïde des animaux exposés (Miyamoto et coll. 1977 et Hagiwara et coll. 1993).
Une étude d'exposition par inhalation à court terme chez les cobayes mâles albinos et les cobayes mâles pigmentés a été effectuée par Leong et coll. (1987). Une dégénérescence des segments intérieurs et extérieurs des cellules photoréceptrices et une couche cellulaire épithéliale pigmentée des rétines ont été observées dans les deux souches de cobayes exposés au 4,4'-MDD à 440 mg/m3 pendant deux semaines. Un granulome pulmonaire insignifiant ou une légère pneumonie granulomateuse ont été observés chez les animaux exposés (Leong et coll. 1987).
Le 4,4'-MDD a également provoqué des effets systémiques chez les animaux exposés par application cutanée. Dans une étude d'exposition par voie cutanée de deux semaines chez les souris, une augmentation du poids du foie et de la rate a été observée chez les mâles et les femelles à 168 mg/kg p.c. par jour. Des décès ont été déclarés chez les mâles et les femelles (Holland et coll. 1987). Dans une autre étude d'exposition par voie cutanée, des lapins ont été exposés au 4,4'-MDD à 700 mg/kg p.c. par jour pendant 10 jours. On a remarqué une prolifération des conduits biliaires, une cirrhose de Laennec, une nécrose parenchymateuse focale, une légère glomérulonéphrite aiguë, une dermatite nécrosante aiguë et une réduction du poids corporel final (15 %) (DuPont 1976a).
8.2.1.3 Toxicocinétique
The evaluation of available toxicokinetic information shows that 4,4'-MDA is absorbed by oral, dermal, and inhalation routes of exposure in humans and animals. Information from a number of case reports indicated that 4,4'-MDA can distribute to various organs after accidental ingestion of the chemical. There is no evidence for accumulation in the body. N-acetylation of 4,4'-MDA apparently represents the detoxification metabolic pathway. 4,4'-MDA and its metabolites are mainly excreted in the urine.
8.2.2 DMD
Health effects data on any MDI isomer or mixture of isomers of the MDI subgroup were taken into consideration in this section, and health effect levels established for substances within the subgroup were selected to characterize the overall health effects associated with the DMD subgroup. The rationale for this read-across is presented in Appendix A.
8.2.2.1 Cancérogénicité et génotoxicité
La Commission européenne a classé les DMD (nos CAS 101-68-8, 5873-54-1, 2536-05-2, 26447-40-5, 9016-87-9) comme cancérogènes de catégorie 2 (cancérogène présumé pour l'homme) (Commission européenne 2009, 2015b). Le CIRC a classé les DMD (nos CAS 101-68-8, 26447-40-5) comme cancérogènes du groupe 3 (inclassable quant à la cancérogénicité pour l'homme) d'après des données inadéquates concernant sa cancérogénicité pour l'homme et des données limitées relativement à la cancérogénicité chez les animaux de laboratoire (CIRC 1999). L'écart entre les deux classifications pourrait être attribuable au fait que des études additionnelles ont été prises en compte par l'Union européenne, y compris un examen par Feron et coll. (2001) des résultats des études de Reuzel et coll. (1990, 1994a) et de Hoymann et coll. (1995).
Deux études de toxicité chronique chez les animaux effectuées avec des DMD ont été recensées.
Dans une étude d'exposition par inhalation réalisée par Reuzel et coll. (1990, 1994a), des rats Wistar mâles et femelles (60 par sexe et par groupe) ont été exposés au pDMD à des concentrations de 0, 0,2, 1,0 ou 6,0 mg/m3, six heures par jour, cinq jours par semaine, pendant deux ans. Les concentrations de pDMD étaient sous forme d'aérosols produits à partir de pDMD liquide, au moyen d'air comprimé. Huit adénomes pulmonaires (6/60 chez les mâles, 2/60 chez les femelles) et un adénocarcinome pulmonaire (1/60 chez les mâles, 0/60 chez les femelles) ont été observés dans le groupe d'exposition de 6,0 mg/m3. On n'a pas détecté de tumeurs aux poumons dans les autres groupes d'exposition. Les tumeurs décelées dans les autres organes n'ont pas été considérées comme étant liées au traitement. Les effets non néoplasiques de cette étude sont décrits dans la sous-section « Autres effets non cancérogènes ».
Hoymann et coll. (1995) ont réalisé une étude de cancérogénicité par inhalation chez les rats Wistar femelles. Les animaux (80 par groupe) ont été exposés au 4,4'-MDD sous forme d'un aérosol à des concentrations de 0, 0,23, 0,70 ou 2,05 mg/m3, 17 heures par jour, cinq jours par semaine, pendant deux ans. Des données liées à l'incidence des tumeurs étaient disponibles pour le groupe présentant la plus forte exposition uniquement. Un animal (1/80) faisant partie du groupe le plus exposé a développé un adénome bronchioalvéolaire unique.
Une grande étude rétrospective de cohorte a été définie pour étudier les effets potentiels sur la santé associés à l'exposition aux diisocyanates (Sorahan et Nichols 1993, 2002). L'étude incluait la surveillance de 5824 hommes et de 2464 femmes employés dans 11 usines fabriquant des mousses de polyuréthane flexible. Sur les 11 usines, 4 utilisaient des diisocyanates de toluène (TDI) et 7 usines utilisaient des TDI et des DMD. Les niveaux d'exposition n'étaient pas disponibles. Les données sur la mortalité et sur la morbidité par cancer ont été recueillies de 1958 à 1998. Aucune tendance positive importante entre le risque de cancer des poumons ou le risque de maladies bénignes du système respiratoire (sans fournir plus de détails) et la durée d'exposition aux diisocyanates n'a été relevée chez l'humain. Chez les femmes, on a noté une augmentation importante du ratio standardisé de mortalité (RSM) dans le cas du cancer des poumons, mais les auteurs ont conclu que le développement de ce type de cancer n'était probablement pas dû à l'exposition aux diisocyanates (aucune explication pour cette conclusion n'a été fournie). En se basant sur les limites de l'étude, le tabagisme et les facteurs alimentaires n'ont pas été pris en compte. Les effets de la sensibilisation n'ont pas été examinés dans cette étude.
Dans les essais de mutation in vitro, l'utilisation de DMD a permis d'aboutir à des résultats variés en fonction du type de solvant utilisé.
Dans les essais d'Ames, les résultats étaient différents lorsque les DMD étaient dissous dans du diméthylsulfoxyde (DMSO), dans de l'acétone ou dans de l'éther diméthylique du diéthylèneglycol (EGDE). Lorsque les DMD étaient dissous dans le DMSO, des réactions positives ont été observées dans les souches de Salmonella typhimurium TA 98 et TA 100 en présence d'une activation métabolique (S9). Des réactions négatives ont été observées dans d'autres souches (TA 1535, TA 1537 et TA 1538) en présence ou en l'absence de S9. Des réactions négatives ont été observées dans les souches TA 98 et TA 100 en l'absence de S9 (Andersen et coll. 1980; Herbold 1980a, 1980b; Woolrich 1982; Shimizu et coll. 1985; Herbold et coll. 1998; Zeiger et coll. 1987; Seel et coll. 1999). Lorsque les DMD étaient dissous dans l'acétone, les résultats avec la souche Salmonella typhimurium TA 100 étaient faiblement positifs avec l'activation S9 et négatifs sans l'activation S9 (Herbold 1980c). Lorsque les DMD étaient dissous dans l'EGDE, des réactions négatives ont été observées dans les souches TA 1535, TA 1537, TA 1538, TA 100 et TA 98 en l'absence ou en présence de S9 (Herbold 1990a,b; Herbold et coll. 1998; Seel et coll. 1999). Les études ont indiqué que des traces de teneur en eau dans le DMSO commercial peuvent hydrolyser les groupes isocyanates des DMD en un certain nombre de produits, notamment les méthylènediphényldiamines (MDD), les urées, les polyurées et le dioxyde de carbone, et ce, en très peu de temps. De même, le DMSO peut agir comme catalyseur dans la réaction d'hydrolyse, indiquée dans la spectroscopie infrarouge et l'analyse par chromatographie en phase liquide à haute performance (Herbold et coll. 1998; Seel et coll. 1999). Par contre, les DMD sont plus stables dans l'EDGD même si des traces d'eau sont présentes. Herbold et coll. (1998) ont examiné la stabilité des DMD dans le DMSO et dans l'EGDE en présence de traces d'eau. Dans le cas des DMD dissous dans le DMSO avec une teneur en eau de 0,04 %, l'analyse par chromatographie en phase liquide à haute performance a indiqué que la teneur en DMD était de 86,5 % au début, de 22,1 % après 15 minutes, de 1 % après 30 minutes et qu'on ne les détectait plus après 45 minutes. Dans le cas des DMD dissous dans l'EGDE avec une teneur en eau de 0,07 %, 99,1 % des DMD étaient encore présents après quatre heures. Lorsque la teneur en eau passait à 0,47 %, 93,3 % des DMD étaient détectés après une heure et 78,9 % étaient encore présents après quatre heures.
Dans les cellules mammaliennes, on a observé l'induction de mutations géniques dans les cellules de lymphomes L5178Y TK+/- de souris uniquement dans le DMSO à une concentration de DMD élevée en présence de S9 (McGregor et coll. 1981a, 1981b). Ces résultats peuvent avoir été influencés par la stabilité des DMD dans le DMSO. On n'a pas constaté de dommages à l'ADN chez les cellules humaines exposées au 4,4'-DMD dissous dans l'EGDE (Vock et coll. 1998). Dans l'essai portant sur l'aberration chromosomique, des résultats positifs ont été notés dans les lymphocytes de sang entier humain traités avec du 4,4'-DMD dissous dans de l'acétone. Toutefois, la présence de « fibres à effets polymères » a été observée sur des lamelles de microscope et laisse entendre que les DMD pourraient ne pas être stables dans l'acétone (Maki-Paakkanen et coll. 1987). Des résultats positifs ont été notés dans les essais sur la transformation des cellules lorsque des cellules de hamster ont été traitées avec des DMD dissous dans du DMSO en présence et en l'absence de S9 (Pool et Harris 1980a, 1980b).
Les essais in vivo concernant les DMD incluaient plusieurs essais sur les adduits à l'ADN et des essais sur l'induction de micronoyaux. Des résultats faiblement positifs ont été observés pour les adduits à l'ADN chez les rats exposés au 4,4'-DMD, par voie cutanée ou par inhalation (Vock et Lutz 1995a, 1997; Vock et coll. 1995b, 1996). Dans certains cas, la radioactivité de l'ADN était trop faible pour subir une analyse des nucléotides et l'indice de liaison covalente était très faible par rapport aux groupes témoins positifs. Vock et coll. (1995b) ont estimé que le 4,4'-DMD est 1000 fois moins puissant que le cancérogène pour la peau connu, à savoir le 7,12-diméthylbenz[a]anthracène (DMBA), pour former des adduits à l'ADN dans l'épiderme. Une bonne partie des résultats négatifs ont été déterminés dans les essais sur l'induction de micronoyaux menés chez les souris et les rats par injection intrapéritonéale ou par inhalation (JETOC 1982; Zhong et Siegel 2000; Pauluhn et coll. 2001; Lindberg et coll. 2011).
Des études limitées et non concluantes sur la génotoxicité ont été recensées chez les humains exposés au DMD. Marczynski et coll. (1994a, 1994b, 2005) ont réalisé plusieurs études relatives à l'effet des DMD sur les dommages à l'ADN chez les travailleurs exposés au DMD, chez les volontaires en bonne santé et chez les volontaires souffrant légèrement d'asthme. Les volontaires en bonne santé et asthmatiques n'avaient pas déjà été exposés aux DMD. Des échantillons sanguins ont été prélevés avant et après l'exposition par inhalation au DMD (0,05 - 0,31 mg/m3 pendant une durée allant jusqu'à deux heures). Les dommages à l'ADN ont été analysés dans les lymphocytes. Aucune augmentation importante dans la fréquence des ruptures de brins d'ADN n'a été observée. Dans l'étude de Marczynski et coll. (2005) réalisée chez des volontaires en bonne santé et asthmatiques, les auteurs ont noté la présence d'un petit groupe sensible (10 %) qui affichait des fréquences de ruptures de brins d'ADN plus élevées, bien qu'il n'ait pas atteint une importance statistique. Les DMD utilisés dans ces études étaient composés d'un mélange de DMD (60 %), de divers triisocyanates (30 %) et de diisocyanates non définis (10 %).
Le mode d'action pour les tumeurs des voies respiratoires observées chez les rongeurs n'a pas été totalement éclairci. Le CIRC (1999) a noté que l'incidence des tumeurs des voies respiratoires observées par Reuzel et coll. (1994a) ne pouvait « pas être attribuée avec confiance à un effet de petites particules non spécifiques inhalées ou à la composition chimique des particules ». Il existe deux mécanismes postulés décrits par le Centre commun de recherche de la Commission européenne (2005) : l'un est lié à une réaction inflammatoire soutenue et l'autre à un mécanisme génotoxique par l'entremise du métabolite potentiel des MDD. Cependant, on n'a pas identifié de MDD dans les études toxicocinétiques des DMD, et on a suggéré que les MDD ne constituent pas des métabolites importants chez les rats exposés aux DMD (voir la section 8.2.2.5).
8.2.2.2 Toxicité pour la reproduction et le développement
Aucune étude de toxicité pour la reproduction n'a été recensée. Dans une étude de toxicité à doses répétées par inhalation réalisée par Reuzel et coll. (1994a), des rats ont été exposés au pDMD à des concentrations de 0, 0,2, 1,0 ou 6,0 mg/m3, six heures par jour, cinq jours par semaine, pendant 24 heures. Des renseignements relatifs à la pathologie clinique et à l'histopathologie des essais étaient disponibles et n'ont indiqué aucune toxicité liée à l'exposition. Chez les rates, les poids des ovaires n'ont pas été mesurés.
En termes de toxicité pour le développement, Buschmann et coll. (1996) ont déclaré une CSENO pour le développement de 3 mg/m3. Une augmentation statistiquement significative de la sternèbre asymétrique dans les fœtus des rats a été observée à la dose de 9 mg/m3; toutefois, on ne sait pas exactement si cette anomalie, jugée mineure, est un effet lié au traitement. Les rates gravides ont été exposées par inhalation au 4,4'-DMD à des concentrations de 0, 1, 3 ou 9 mg/m3, six heures par jour, du 6e au 15e jour de gestation. Les fœtus ont été examinés au 20e jour de gestation. Parmi les effets maternels, on observe une diminution dans la consommation des aliments dans tous les groupes exposés au cours de l'exposition, une diminution rétablie à des valeurs témoins après la dernière exposition au 15e jour de gestation. Une augmentation significative des poids relatif et absolu des poumons a été observée chez les rates gravides à la dose d'exposition de 9 mg/m3. La présence d'une sternèbre asymétrique est une variante commune chez cette souche et chez les rats. L'incidence observée s'inscrit dans les limites de la variabilité biologique de la souche de rat utilisée. En outre, le nombre accru de cas se manifestait aux doses qui provoquaient une toxicité maternelle (c.-à-d. diminution de la consommation d'aliments, augmentation du poids des poumons). Aucun autre effet sur la reproduction ou le fœtus n'a été observé; les paramètres mesurés incluaient le nombre de corps jaunes, les sites d'implantation, la perte observée avant et après l'implantation, les poids des fœtus et du placenta, les anomalies importantes et viscérales et le degré d'ossification.
8.2.2.3 Sensibilisation
La Commission européenne a classé les DMD (nos CAS 101-68-8, 5873-54-1, 2536-05-2, 26447-40-5, 9016-87-9) comme sensibilisateurs des voies respiratoires de catégorie 1 et comme sensibilisateurs de la peau (Commission européenne 2015b).
Sensibilisation des voies respiratoires
L'essai lié à l'hypersensibilité des cobayes est l'un des essais non standard les plus courants utilisés pour étudier le potentiel de sensibilisation. D'après cet essai, l'hypersensibilité respiratoire a été induite chez les cobayes qui ont démontré une sensibilisation après une exposition aiguë à une concentration élevée (135 mg/m3 ou plus) de DMD (Pauluhn et Mohr 1994; Pauluhn 1995). L'hypersensibilité respiratoire a été induite chez les cobayes qui ont démontré une sensibilisation après une exposition à des concentrations plus faibles de DMD pendant cinq jours consécutifs (17 - 22 mg/m3, trois heures par jour pendant cinq jours) (Thorne et coll. 1986; Karol et Thorne 1988; Griffith-Johnson et coll. 1990). On a indiqué que les animaux ayant démontré une sensibilisation aux DMD ont développé une sensibilisation croisée à d'autres composés d'isocyanates (McDonnell 1971).
Un modèle d'asthme chez les rongeurs a été proposé d'après les réactions inflammatoires allergiques des voies respiratoires chez les rats surmulots mesurés en tant que niveaux des éosinophiles, des neutrophiles et des lymphocytes dans le liquide de lavage bronchioloalvéolaire (Pauluhn 2008a, Pauluhn et Poole 2011). Pauluhn et coll. (2008a, 2011) ont établi un seuil de déclenchement de 5 mg/m3 de pDMD d'après l'induction suscitée par une exposition au pDMD de 936 mg/m3 par inhalation par le nez uniquement pendant 10 minutes par jour et pendant cinq jours. Ce modèle est précieux pour démontrer certains aspects critiques de l'asthme et sa pathogenèse. Toutefois, ce seuil de déclenchement n'est pas recommandé comme point de départ pour une caractérisation des risques, conformément aux lignes directrices relatives à l'évaluation des risques d'immunotoxicité pour les produits chimiques (Guidance for Immunotoxicity Risk Assessment for Chemicals) (PISSC 2012).
Chez les humains, les effets déclarés sur la santé associés à l'exposition aux DMD peuvent varier d'individus ne présentant aucun symptôme à des personnes démontrant d'importantes réactions, telles qu'une pneumopathie d'hypersensibilité ou de graves symptômes d'asthme.
Sur le lieu de travail, des anticorps de l'immunoglobuline E et G propres aux DMD ont été détectés chez les travailleurs exposés aux DMD (Zeiss et coll. 1980; Pezzini et coll. 1984; Tse et coll. 1985; Liss et coll. 1988; Cartier et coll. 1989). Toutefois, ces anticorps spécifiques ne constituent pas de bons indicateurs des risques liés aux effets sur la santé (USEPA 1998; PISSC 2000). Par exemple, un niveau élevé d'immunoglobuline G propre aux DMD peut être décelé chez les travailleurs asymptomatiques exposés et chez les personnes souffrant d'asthme professionnel (Lushniak et coll. 1988; Baur et coll. 1994).
Des cas d'asthme mortels pouvant être liés à la sensibilisation aux DMD en raison de l'exposition dans les milieux professionnels ont été déclarés (NIOSH 1996; Carino et coll. 1997; MIFACE 2003; MIOSHA 2004; Chester et coll. 2005). Une étude après incident a souvent permis de déterminer des mécanismes de contrôle de l'exposition (p. ex., ventilation d'évacuation) et des concentrations de DMD mesurées inappropriés.
Des cas d'asthme professionnel lié aux DMD, avec une co-exposition à d'autres substances, ont été déclarés dans divers milieux professionnels notamment les installations de fabrication, les ateliers de carrosserie et les hôpitaux (Liden 1980; Leroyer et coll. 1998; Dietemann-Morland et coll. 1991; Sommer et coll. 2000; Lemière et coll. 2002; Perfetti et coll. 2003; Bonauto et Lofgren 2004; Chester et coll. 2005; Suojalehto et coll. 2011). Dans certains cas, les travailleurs ont développé une sensibilisation des voies respiratoires et de la peau (Kanerva et coll. 2001; Donnelly et coll. 2003; Valks et coll. 2003; Stingeni et coll. 2008). Des cas de pneumopathie d'hypersensibilité professionnelle liée à l'exposition aux DMD ont également été déclarés (Malo et coll. 1982; Baur et coll. 1984; Bascom et coll. 1985; Walker et coll. 1989; Schreiber et coll. 2008). La concentration de DMD qui induit l'effet de sensibilisation n'est pas toujours connue. Dans certains cas, des déversements de DMD ont été déterminés.
On a recensé un certain nombre d'études épidémiologiques qui ont porté sur les effets respiratoires, notamment l'asthme professionnel dans les usines de fabrication où les travailleurs manipulaient des DMD. De la même manière que les rapports de cas, dans la plupart des cas, les concentrations atmosphériques de DMD sur le lieu de travail n'ont pas été déclarées (Diller et Derbert 1983; Pham et coll. 1988; Petsonk et coll. 2000; Wang et Petsonk 2004).
L'American Conference of Governmental Industrial Hygienists (ACGIH), l'Occupational Safety and Health Administration (OSHA) des États-Unis et le NIOSH disposent de limites standard professionnelles identiques concernant les niveaux élevés de DMD dans l'air : 0,05 mg/m3 comme moyenne pondérée dans le temps sur 8 heures et 0,2 mg/m3 (valeur plafond de 10 minutes). (ACGIH 1996; CDC 2012; OSHA 2012). Dans certaines usines où les niveaux DMD dans l'air étaient surveillés, il a été déclaré que les niveaux dépassaient parfois la limite standard professionnelle (Vandenplas et coll. 1993a; Pham et coll. 1978). Toutefois, dans les usines où les concentrations atmosphériques de DMD étaient surveillées, le potentiel d'exposition cutanée et le degré de conformité avec les mesures de protection n'ont pas été clairement décrits.
Dans une étude de cohorte longitudinale, on n'a constaté aucun changement important dans la fonction respiratoire des travailleurs exposés à des niveaux allant jusqu'à 0,01 mg/m3 de DMD dans l'air dans une usine de mousse de polyuréthane (Sulotto et coll. 1990). Le niveau d'exposition était basé sur une semaine de surveillance en continu sur bande magnétique et les travailleurs avaient travaillé dans l'usine pendant 14 ans en moyenne. Les fonctions respiratoires [capacité vitale forcée (CVF), volume expiratoire forcé, volume expiratoire maximal par seconde (VEMS), pourcentage de VEMS/CVF, débit expiratoire forcé compris entre 25 et 75 %] ont été mesurées.
Dans une étude transversale, des travailleurs ont été exposés aux DMD durant les processus consistant à fixer et à coller des fenêtres dans une entreprise de fabrication automobile (Kakooei et coll. 2006). D'après des mesures d'échantillonnage personnel prélevées trois fois, le niveau d'exposition moyen au DMD était de 0,03453 mg/m3 durant le processus de fixation des fenêtres et de 0,02727 mg/m3 pendant le processus consistant à coller les fenêtres. Une diminution importante a été observée dans les fonctions respiratoires [capacité pulmonaire réduite, pourcentage de VEMS/CVF et pourcentage du débit maximal expiratoire (pourcentage de DME)] chez les travailleurs par rapport aux groupes témoins. Toutefois, les travailleurs peuvent avoir démontré une sensibilisation au fil des ans puisqu'ils avaient travaillé dans la même usine pendant six ans en moyenne. L'étude a été réalisée au cours de l'été où les fenêtres de l'usine ont été ouvertes pour assurer la ventilation. Les travailleurs ont déclaré que les fenêtres étaient maintenues partiellement ou entièrement fermées pendant l'hiver, ce qui laisse entendre des concentrations atmosphériques accrues de DMD durant les mois d'hiver.
Lors d'une étude transversale, les niveaux de DMD étaient surveillés 24 heures par jour chaque jour dans une usine de trois ans qui fabriquait des moules en uréthane et qui était conçue pour minimiser l'exposition humaine aux DMD (Bernstein et coll. 1993). Des moniteurs de zones ont été installés à plusieurs endroits dans l'usine afin d'exécuter une surveillance continue des DMD. Même si des concentrations atmosphériques précises de DMD n'étaient pas disponibles dans le rapport d'étude, il a été indiqué que les niveaux mesurés avaient toujours été inférieurs à la limite standard professionnelle de 0,05 mg/m3. La totalité de la main-d'œuvre (243 travailleurs) a participé à cette étude et trois cas d'asthme professionnel ont été diagnostiqués par les médecins. Ces travailleurs ayant reçu le diagnostic travaillaient tous dans les zones où ils ont pu être exposés de manière accidentelle à des niveaux élevés de DMD présents sous la forme de liquides ou de fumées. L'un des travailleurs s'est rappelé l'apparition des symptômes liés à l'asthme deux semaines après une exposition accidentelle à un déversement important de DMD. L'un des travailleurs était un sujet témoin choisi au hasard parmi les travailleurs qui disaient ne pas avoir de symptômes, mais à qui les médecins ont diagnostiqué un problème d'asthme professionnel potentiel d'après les essais réalisés sur la fonction pulmonaire. Les trois travailleurs ont été transférés dans un environnement de travail sans diisocyanate et ont été réévalués après un an. La fonction pulmonaire des trois travailleurs s'est améliorée. Les médecins ont confirmé que l'asthme professionnel de ces travailleurs avait cessé d'être actif. Le travailleur témoin qui disait ne pas avoir de symptôme a également démontré une amélioration de la fonction pulmonaire après avoir travaillé dans un environnement sans isocyanates, il a donc été confirmé qu'il avait souffert d'asthme.
Dans une étude longitudinale de cinq ans réalisée par Musk et coll. (1982, 1985), 94 travailleurs provenant de deux usines exposés aux DMD et aux TDI ont fait l'objet d'un suivi. Des niveaux de TDI ont été mesurés sur quatre ans avec un niveau maximal de 0,05 mg/m3 et des niveaux de DMD ont été mesurés pendant un à deux ans avec un niveau maximal de 0,04 mg/m3. Au cours des cinq années de l'étude, 2573 échantillons environnementaux ont été prélevés. Les travailleurs ont été divisés en 4 groupes d'exposition (aucune exposition, TDI uniquement, DMD uniquement et co-exposition au TDI et DMD) en fonction des mesures environnementales recueillies et des antécédents professionnels. L'usage du tabac a également été pris en compte. Aucun changement important dans les fonctions pulmonaires d'après les valeurs de VEMS n'a été observé dans les groupes exposés par rapport au groupe non exposé. Les sujets exposés ont démontré un taux de déclin normal du VEMS en fonction de l'âge et de l'usage du tabac, qui n'a pas été considéré comme étant lié à l'exposition aux isocyanates (Musk et coll. 1982, 1985).
Gee et Morgan (1985) ont examiné la capacité ventilatoire de 68 travailleurs exposés aux DMD et aux TDI. L'étude incluait 42 travailleurs qui avaient fait l'objet d'une étude en 1971 par Musk et coll. (1982, 1985) en tant qu'étude de suivi réalisée après 10 ans. Les concentrations annuelles moyennes de TDI et de DMD étaient disponibles de 1973 à 1980 et de 1975 à 1981, respectivement. Les concentrations annuelles moyennes les plus élevées de TDI et de DMD étaient de 0,024 mg/m3 et de 0,05 mg/m3, respectivement. Aucun changement important dans les valeurs de spirométrie (CVF et VEMS) des groupes exposés n'a été observé par rapport aux valeurs de CVF et de VEMS prévues.
Des DMD ont été introduits dans une usine de fabrication de panneaux de copeaux qui n'avait jamais utilisé d'isocyanates auparavant, tel qu'il est déclaré dans une étude réalisée par Vandenplas et coll. (1993a) et un certain nombre de travailleurs ont commencé à se plaindre de l'apparition de symptômes respiratoire dès deux semaines après la première utilisation des DMD. Après trois mois, on a diagnostiqué une pneumopathie d'hypersensibilité associée aux DMD à 8 des 167 travailleurs employés dans l'usine. La pneumopathie d'hypersensibilité a été diagnostiquée par provocation bronchique. Ces travailleurs ont développé des anticorps d'immunoglobine G et E propres aux conjugués de sérum-albumine humaine. Le niveau d'exposition était d'environ 0,06 mg/m3 d'après deux enquêtes menées deux mois après l'utilisation initiale des DMD.
Dans d'autres études épidémiologiques où les niveaux de DMD dans l'air étaient plus élevés (entre 0,1 et 0,87 mg/m3), des cas d'asthme professionnel et des effets respiratoires et pulmonaires ont été observés chez les travailleurs exposés (Pham et coll. 1978; Kolmodin-Hedman et coll. 1980; Diller et Herbert 1982; Diller et Derbert 1983; Martin et coll. 1982; Meredith et coll. 2000).
D'après les renseignements généraux disponibles issus des études épidémiologiques traitées ci-dessus, il semblerait qu'aucun effet important n'ait été observé à 0,05 mg/m3 concernant les individus en bonne santé exposés aux diisocyanates dans un milieu professionnel. Des incertitudes existent à ce niveau d'effet en raison des incertitudes dans la base de données épidémiologique. Un résumé des études épidémiologiques est présenté dans le tableau 8.9.
| Concentration d'isocyanate | Durée de l'exposition (Moyenne) |
Nombre de sujets exposés (témoins) |
Durée de l'étude/effets sur la santé | Référence |
|---|---|---|---|---|
| 0,01 mg/m3 (niveau maximal de DMD, mesures effectuées sur une semaine) |
14 ans | 27 (27) |
Suivi effectué pendant une semaine/aucun effet respiratoire important (CVF, VEMS, pourcentage de VEMS/CVF, débit expiratoire forcé entre 25 et 75 %) |
Sulotto et coll. 1990 |
| Moyenne de 0,03 mg/m3 de DMD (échantillonnage personnel effectué sur une journée, N = 3 par personne) |
6 ans | 39 (117) |
Diminution des fonctions respiratoires par rapport aux sujets témoins (capacité pulmonaire, pourcentage de VEMS/CVF, pourcentage de débit maximal expiratoire) |
Kakooei et coll. 2006 |
| Valeur inférieure à la limite standard professionnelle de 0,05 mg/m3 de DMD (surveillance effectuée 24 heures par jour étant donné que l'usine est en exploitation) |
18,2 mois | 243 travailleurs (totalité de l'usine) |
3/243 pour lesquels l'asthme professionnel a été confirmé | Bernstein et coll. 1993 |
| 0,04 mg/m3(DMD) 0,05 mg/m3 (TDI) (niveaux maximums mesurés) |
2 ans (DMD) et 4 ans (TDI) |
94 (provenant de deux usines) |
Suivi effectué pendant cinq ans/aucun changement important observé dans les fonctions pulmonaires (VEMS) | Musk et coll. 1982, 1985 |
| 0,05 mg/m3 (DMD) 0,024 mg/m3(TDI) (concentration annuelle moyenne la plus élevée) |
7 à 8 ans (DMD), 9 ans (TDI) |
68 (12) provenant de 2 usines | 42 travailleurs ont fait l'objet d'une étude dans Musk et coll. (1982, 1985) et d'un suivi pendant 10 ans/Aucun changement n'a été observé dans les fonctions respiratoires et pulmonaires (CVF/VEMS) | Gee et Morgan 1985 |
| 0,06 mg/m3 de DMD (d'après deux enquêtes) |
2 semaines à 3 mois | 167 travailleurs (totalité de l'usine) |
8 travailleurs pour lesquels une pneumopathie d'hypersensibilité a été confirmée | Vandenplas et coll. 1993 |
| 0,1 - 0,87 mg/m3 de DMD | 1 à 7 ans | divers | Asthme professionnel, diminution de la fonction pulmonaire | Pham et coll. 1978; Kolmodin-Hedman et coll. 1980; Diller et Herbert 1982; Diller et Derbert 1983; Martin et coll. 1982; Meredith et coll. 2000 |
Utilisation des diisocyanates de toluène en tant qu'analogues
Les effets des DMD à la suite d'une exposition aiguë ou à court terme n'ont pas été étudiés de façon systématique dans les études réalisées sur les volontaires humains, même si les cohortes professionnelles ont pu subir des expositions aiguës. Il existe un degré d'incertitude dans les estimations d'exposition découlant des études sur l'épidémiologie. Pour faciliter l'évaluation des effets sur la santé humaine, une recherche a été réalisée pour déterminer les analogues chimiques appropriés qui sont semblables sur le plan structurel, physiochimique et toxicologique aux fins de collecte de données déduites à partir d'analogues. On a déterminé que des TDI constituaient des analogues appropriés dans cette évaluation afin de calculer les niveaux d'effets dans le cas des effets sur la respiration, y compris la sensibilisation, issus d'une exposition aiguë aux DMD. La justification de ces données déduites à partir d'analogues est présentée à l'annexe H. Les études principales réalisées sur des volontaires humains et qui étudient les effets d'une exposition aiguë ou à court terme des TDI sont décrites ci-dessous et résumées dans le tableau 8.10.
Il existait plusieurs études d'exposition par inhalation aux TDI réalisée sur des volontaires humains, qui n'avaient pas déjà été exposés à des isocyanates. Aucun effet respiratoire n'a été observé lorsque 17 humains en bonne santé ont été exposés à des doses de 0,030 mg/m3 de TDI pendant six heures, puis à une dose de 0,14 mg/m3 de TDI pendant 20 minutes (Vandenplas et coll. 1999). Aucun effet respiratoire n'a été observé lorsque des volontaires en bonne santé ou asthmatiques ont été exposés à des TDI à une dose de 0,14 mg/m3 pendant 15 à 30 minutes dans le cadre de trois études indépendantes réalisées par Fabbri et coll. (1987), Moller et coll. (1986)) et Chester et coll. (1979). Lorsque 10 volontaires en bonne santé ont été exposés à des TDI à une dose de 0,14 mg/m3 pendant deux heures, un volontaire a démontré une réaction des voies respiratoires positive (Vogelmeier et coll. 1991). Chez les volontaires asthmatiques, c.-à-d. les personnes dont les voies respiratoires ont pu démontrer une sensibilisation aux multiples allergènes, des réactions positives des voies respiratoires ont été observées à un niveau d'exposition aussi bas que 0,071 mg/m3 pendant une durée d'exposition d'une à deux heures (Vogelmeier et coll. 1991; Baur 1985).
| Conditions de l'exposition | Nbre de sujets | Effets sur la santé | Références |
|---|---|---|---|
| 0,030 mg/m3 pendant six heures, puis 0,140 mg/m3 pendant 20 minutes | 17 volontaires en bonne santé (fumeurs et non-fumeurs) |
Aucun effet nocif pour la santé | Vandenplas et coll. 1999 |
| 0,14 mg/m3 pendant 15 à 30 min | 6 à 10 volontaires en bonne santé dans chaque étude; 10 volontaires asthmatiques dans une étude |
Aucun effet nocif pour la santé | Fabbri et coll. 1987; Moller et coll. 1986; Chester et coll. 1979 |
| 0,071 mg/m3 pendant une heure, repos pendant 45 minutes, 0,14 mg/m3 pendant une heure | 10 volontaires en bonne santé; 15 volontaires asthmatiques (13 sujets ont poursuivi à la dose de 0,14 mg/m3) |
Volontaires en bonne santé : aucune réaction asthmatique (définie comme une augmentation de 100 % de la résistance aérienne) Volontaires asthmatiques : À 0,071 mg/m3, un sujet a développé une réaction asthmatique grave; à 0,14 mg/m3, un sujet a développé une réaction asthmatique |
Baur et coll. 1994 |
| Volontaires en bonne santé : 0,14 mg/m3 pendant deux heures; Volontaires asthmatiques : 0,071 mg/m3 pendant une heure, repos pendant 45 minutes, 0,14 mg/m3 pendant une heure |
10 volontaires en bonne santé; 15 volontaires asthmatiques |
Volontaires en bonne santé : l'augmentation initiale de la résistance aérienne est revenue à la normale après 30 minutes d'exposition, 3 sujets ont déclaré une irritation des yeux ou une toux Volontaires asthmatiques : Aucun effet important comme groupe; 4 sujets ont développé une obstruction bronchique importante avec une augmentation aérienne spécifique supérieure à 50 %. Les 4 sujets ont également déclaré ce qui suit : serrement de poitrine, rhinites, toux, dyspnée, irritation de la gorge ou maux de tête |
Baur 1985 |
| Volontaires en bonne santé : 0,14 mg/m3 pendant deux heures Volontaires asthmatiques : 0,071 mg/m3 pendant une heure, puis 0,14 mg/m3 pendant une heure |
10 volontaires en bonne santé; 14 volontaires asthmatiques |
Volontaires en bonne santé : un sujet a développé une réaction positive des voies respiratoires. Volontaires asthmatiques : un sujet a développé une réaction positive des voies respiratoires à 0,071 mg/m3, 2 sujets ont développé une réaction positive des voies respiratoires à 0,14 mg/m3. |
Vogelmeier et coll. 1991 |
D'après les renseignements disponibles issus des études contrôlées réalisées sur les humains avec des TDI et dont il est question ci-dessus, un niveau d'effet respiratoire aigu chez les personnes asthmatiques a été établi à 0,071 mg/m3 pour les volontaires asthmatiques et à 0,14 mg/m3 pour les volontaires en bonne santé.
Chez les personnes ayant démontré une sensibilisation, une très faible concentration de DMD, appelée concentration de déclenchement, peut entraîner des réactions de sensibilisation telles que des effets respiratoires et de l'asthme. La concentration de déclenchement déterminée la plus faible figurant dans la littérature est établie à 0,00051 mg/m3, chez une infirmière ayant démontré une sensibilisation cutanée et qui a parfois appliqué des appareils plâtrés orthopédiques contenant des DMD aux patients (Suojalehto et coll. 2011). D'autres concentrations de déclenchement déterminées dans la littérature publiée, comprises entre 0,01024 et 0,0026 mg/m3 (Suojalehto et coll. 2011; Lemière et coll. 2002), ont indiqué qu'un seuil de déclenchement peut être exceptionnellement faible chez les personnes ayant démontré une sensibilisation. Dans le cas d'autres personnes, des concentrations de déclenchement allant de 0,05 à 0,1 mg/m3 de DMD ont été déterminées (Karol 1986; Talini et coll. 2010; Carino et coll. 1997). Par conséquent, la concentration pouvant déclencher une réaction parmi les personnes sensibilisées est extrêmement variable.
Sensibilisation cutanée
Les données démontrent de manière constante que les DMD sont des sensibilisateurs cutanés. Des essais sur la sensibilisation cutanée dans les essais sur les ganglions lymphatiques locaux chez la souris indiquent que les DMD constituent de puissants sensibilisateurs cutanés. Cinq études indépendantes sur les ganglions lymphatiques locaux chez la souris ont donné des résultats positifs (Dearman et coll. 1992; Plitnick et coll. 2005; Selgrade et coll. 2006; USEPA 2006; Étude présentée 2012l). Une valeur de carbone élémentaire 3 (la dose d'un produit chimique nécessaire pour déclencher une augmentation trois fois supérieure de l'activité de prolifération dans les essais sur les ganglions lymphatiques locaux chez la souris par rapport aux témoins simultanés ayant reçu le véhicule) établie à 0,08 % a été déterminée dans Selgrade et coll. (2006). Dans deux autres études, des valeurs de carbone élémentaire 3 de 0,07 % et de 0,28 % ont été estimées par Santé Canada en fonction d'un modèle de régression linéaire décrit dans Basketter et coll. (2005) (Dearman et coll. 1992; Plitnick et coll. 2005). Des valeurs de carbone élémentaire 3 n'ont pas pu être déterminées ni calculées dans les deux autres études (USEPA 2006; Étude présentée 2012l).
D'après la comparaison des valeurs de carbone élémentaire 3 issues des essais sur les ganglions lymphatiques locaux chez la souris et des essais sur la sensibilisation humaine figurant dans d'importants ensembles de données regroupant divers produits chimiques, on a constaté que les valeurs de carbone élémentaire 3 sont directement liées aux seuils de sensibilisation humaine (Griem et coll. 2003; Basketter et coll. 2005; Api et coll. 2009). Par conséquent, les valeurs de carbone élémentaire 3 ont été suggérées comme valeurs appropriées pour déterminer un niveau d'induction de la sensibilisation non prévue ou pour servir de DSEO de remplacement dans l'évaluation quantitative des risques (Api et coll. 2008; Loveless et coll. 2010; PISSC 2012; Peiser et coll. 2012).
Selon le PISSC (2012), la mesure de la dose recommandée aux fins d'utilisation dans une évaluation des risques liés à la sensibilisation cutanée correspond à la quantité d'un produit chimique appliqué par surface de peau. À partir des études sur les ganglions lymphatiques locaux chez la souris réalisées par Plitnick et coll. (2005), Selgrade et coll. (2006) et Dearman et coll. (1992), des valeurs de carbone élémentaire 3 ont été converties à 0,0175 mg/cm², 0,02 mg/cm²et 0,070 mg/cm², respectivementNote de bas de page4. La valeur de carbone élémentaire de 0,02 mg/cm² provenant de Selgrade et coll. (2006) est jugée la valeur la plus appropriée puisque l'étude a été réalisée selon les lignes directrices de l'OCDE sur les essais standards.
Outre les études sur les ganglions lymphatiques locaux chez la souris, d'autres modèles expérimentaux évaluant le potentiel de sensibilisation cutanée ont également présenté des résultats uniformes. Trois essais concernant l'enflure des oreilles de souris réalisés sur deux souches différentes de souris ont révélé des résultats positifs (Thorne et coll. 1987; Ishizu et Goto 1980; Tanaka et coll. 1987). Des résultats variés ont été observés dans deux études de maximisation chez les cobayes. 1976; Tanaka et coll. 1987).
Deux volontaires en bonne santé ont développé une sensibilisation de la peau sept à 10 jours après une exposition cutanée aiguë au 4,4'-DMD (Hamada et coll. 2012). Les volontaires, qui n'avaient pas d'antécédents en matière d'allergie aux isocyanates, ont été exposés par voie cutanée au 4,4'-DMD (concentration de surface de 0,800 mg/cm²), la zone exposée a été recouverte après 8 heures. La concentration de surface de 0,800 mg/cm²est basée sur une dose d'essai épicutané régulière de 20 mg de 2,0 % vt/vol d'une préparation commerciale d'essai épicutané disponible. Après une période variant de 7 à 10 jours après l'exposition, des réactions de dermatite de contact allergique se sont produites. Des essais épicutanés réalisés grâce à des dilutions en série avec du 4,4'-DMD, du 4,4'-MDD, du p-phénylènediamine (PPD) ou du dicyclohexylméthane-4,4'-diisocyanate (DMD) ont été réalisés. Les essais épicutanés ont indiqué que les deux volontaires ont été sensibilisés au 4,4'-MDD. L'un des volontaires a démontré une sensibilisation au 4,4'-DMD. Certaines études ont proposé de définir les MDD comme marqueur pour la sensibilisation cutanée des DMD (Estlander et coll. 1992; Goossens et coll. 2002; Frick-Engfeldt et coll. 2007). Les essais épicutanés chez les patients ayant des dermatites ont permis d'établir que ceux qui ont démontré une réaction positive au 4,4'-DMD et au pDMD ont aussi démontré des réactions positives au 4,4'-MDD. Toutefois, les auteurs ont également noté que les résultats de l'étude ne répondent pas aux critères mentionnés dans la définition traditionnelle de la sensibilisation active. Il a été considéré que l'étude était limitée en raison de la très petite taille de l'échantillon.
Plusieurs études de cas ont décrit les travailleurs qui avaient acquis une sensibilisation cutanée après une exposition en milieu professionnel aux DMD (Liden 1980; Estlander et coll. 1992; Hannu et coll. 2005; Engfeldt et coll. 2013; Engfeldt and Ponten 2013; Kiec-Swierczynska et coll. 2014). De plus, une réaction croisée avec d'autres isocyanates a été observée. Stingeni et coll. (2008) ont déclaré qu'un travailleur exposé au 4,4'-DMD dans le cadre du travail pendant un an a développé une immunoglobine E propre à l'isocyanate positive aux DMD, aux HDI et aux TDI, même s'il n'avait jamais été exposé aux HDI ou aux TDI. Dans les études réalisées sur des animaux, les essais concernant l'enflure des oreilles des souris ont également révélé une réactivité croisée avec d'autres isocyanates (Thorne et coll. 1987).
Certaines données laissent entendre que les réactions de sensibilisation cutanée et respiratoire sont liées, puisque la sensibilisation est une réaction systématique; par ailleurs, l'exposition cutanée aux DMD peut conduire à une sensibilisation respiratoire ultérieure.
Dans une étude menée par Rattray et coll. (1994), les cobayes ont été exposés de façon aiguë à des concentrations de DMD variant de 19,4 à 24,7 mg/m3. On n'a pas observé d'hypersensibilité respiratoire à la suite de la provocation bronchique; toutefois, certains animaux ont développé une hypersensibilité cutanée. Dans une autre étude, lorsque des cobayes ont été exposés une fois ou de façon répétée aux DMD par injection intradermique, une hypersensibilité respiratoire a été observée à la suite de la provocation bronchique avec des DMD (Pauluhn et Mohr 1994). Dans un modèle d'asthme chez les souris, des animaux ont d'abord subi une sensibilisation cutanée, suivie d'une période de repos et d'une provocation bronchique de 30 minutes avec des conjugués DMD-albumine (Wisnewski et coll. 2011b). Ces souris ont développé une hyperréactivité des voies respiratoires non spécifique semblable à des réactions observées dans le cas de l'asthme. Des effets semblables ont été démontrés dans les modèles d'asthme concernant les rats par Pauluhn (2008b) et Selgrade et coll. (2006). Dans l'ensemble, les études réalisées sur des animaux ont montré des résultats uniformes quant au fait de démontrer que l'induction par l'exposition cutanée peut conduire à des réactions ressemblant à de l'asthme avec des expositions par inhalation ultérieures.
Dans les usines de fabrication où les niveaux atmosphériques de DMD sont continuellement mesurés et maintenus en dessous de la limite d'exposition sur le lieu de travail, de nouveaux cas de sensibilisation respiratoire induite par les isocyanates continuent d'être déterminés (Petsonk et coll. 2000; Bernstein et coll. 1993; Wang et Petsonk 2004). Les données laissent entendre que l'exposition cutanée pourrait être un domaine qui a pu être négligé (Bello et coll. 2007b; Redlich 2010). Les niveaux d'exposition cutanée dans les milieux professionnels ont rarement été mesurés. Dans un cas, un travailleur a développé une urticaire de contact allergique et de l'asthme après un contact des mains direct et prolongé avec une grande quantité de colle contenant des DMD pendant une longue période (Valks et coll. 2003). Le niveau d'exposition cutanée n'était pas connu et il a pu y avoir une exposition par inhalation. Il existe un certain nombre de cas documentés dans lesquels les travailleurs qui ont appliqué des appareils plâtrés orthopédiques contenant des DMD ont développé ce que l'on pense être une sensibilisation liée aux DMD (Donnelly et coll. 2003; Sommer et coll. 2000; Suojalehto et coll. 2011). Toutefois, les niveaux d'exposition par inhalation ou cutanée n'étaient pas connus. Suojalehto et coll.(2011) ont estimé les niveaux d'exposition dans le milieu hospitalier en mesurant les concentrations de diisocyanates dans l'air pendant une simulation de moulage (le boîtier en plâtre synthétique a été enroulé autour d'un morceau de bois) et pendant un travail de moulage normal dans deux hôpitaux. Les concentrations de diisocyanate dans l'air ont été mesurées dans la zone de respiration, près du point de moulage (15 cm au-dessus) et près du point de couture (lorsque le moulage est retiré); les niveaux variaient de 0,02 à 2,5 µg de NCO/m3. Les niveaux mesurés étaient inférieurs à la limite d'exposition professionnelle de la Finlande établie à 35 µg de NCO/m3, qui correspond à environ 100 µg/m3de DMD monomères. La période d'échantillonnage dans la zone de respiration dans deux hôpitaux comprend des phases sans travail de moulage.
8.2.2.4 Autres effets non cancérogènes
Des effets respiratoires autres que les effets liés à la sensibilisation après avoir inhalé des DMD ont été déclarés chez des animaux de laboratoire.
Des changements transitoires dans le liquide de lavage bronchioalvéolaire des rats exposés (par le nez uniquement) aux DMD à des doses de 0, 0,7, 2,4, 8 ou 20 mg/m3 pendant six heures (Pauluhn 2000) ont été observés. Les animaux ont été observés et du fluide de lavage broncho-alvéolaire a été prélevé après 3 heures, 1 journée, 3 jours et 7 jours, après l'exposition. D'après les changements transitoires dans le liquide de lavage bronchioalvéolaire (les changements relatifs à la lacticodéshydrogénase, aux protéines totales, à l'enzyme de conversion de l'angiotensine et aux phospholipides observés 3 heures et une journée après l'exposition sont revenus à des niveaux de contrôle au troisième jour après l'exposition) à 0,7 mg/m3, l'auteur a conclu qu'un dysfonctionnement transitoire de la barrière épithéliale pulmonaire a été observé, ce qui est révélateur d'un dysfonctionnement du surfactant pulmonaire. Dans une publication ultérieure par Pauluhn (2002) basée sur l'étude de Pauluhn (2000) et d'autres études, une concentration seuil d'irritation aiguë de 0,5 mg/m3 a été estimée. Des changements histologiques minimes dans les poumons ont été observés à une concentration de 10 mg/m3 chez les rats exposés au pDMD à une concentration de 0, 10, 30 ou 100 mg/m3pendant six heures (Kilgour et coll. 2002).
Dans une étude de toxicité à court terme, une CMEO de 1mg/m3 a été déterminée. Ce niveau d'effet était basé sur une hausse transitoire des niveaux surfactants dans les macrophages et la lumière alvéolaires chez les rats exposés au pDMD à des concentrations de 0, 1, 4 ou 10 mg/m3, six heures par jour, cinq jours par semaine, pendant quatre semaines (Kilgour et coll. 2002). Dans la même étude, on a pu observer des changements histologiques minimes, une bronchiolite ainsi qu'un épaississement des régions acineuses centrales à la dose de 4 mg/m3. Les effets ont été rétablis dès 30 jours après l'exposition.
Dans le cas d'une exposition subchronique, une CMEO de 1,0 mg/m3 a été déterminée d'après les changements histologiques dans les poumons observés chez les rates. Dans l'étude, les animaux ont été exposés au 4,4'-DMD à des concentrations de 0,3, 1,0 ou 3,0 mg/m3 pendant 18 heures par jour, cinq jours par semaine, pendant 90 jours (Heinrich et coll. 1991). Toutefois, seul un extrait de l'étude était disponible. Une CMEO plus appropriée pour l'exposition subchronique était établie à 4,1 mg/m3 d'après l'accumulation des macrophages alvéolaires dans les poumons, l'accumulation des macrophages dans les ganglions lymphatiques médiastinaux et les changements histopathologiques dans la cavité nasale des rats exposés au pDMD à des concentrations de 0, 4,1, 8,4 ou 12,3 mg/m3, six heures par jour, cinq jours par semaine, pendant 13 semaines (Reuzel et coll. 1994b).
Dans les études réalisées par Reuzel et coll. (1990, 1994a), on a établi une CSENO chronique de 0,2 mg/m3, basée sur une augmentation importante de l'hyperplasie des cellules basales dans l'épithélium olfactif et une augmentation importante de l'hyperplasie de la glande de Bowman chez les rats mâles à la dose suivante de 1,0 mg/mg3. Les rats mâles et femelles ont été exposés au pDMD à 0, 0,2, 1,0 ou 6,0 mg/m3, six heures par jour, cinq jours par semaine, pendant 24 mois (Reuzel et coll. 1990, 1994a). Chez les deux sexes, on a constaté une forte augmentation des macrophages avec un pigment jaune dans les poumons et les ganglions lymphatiques médiastinaux où l'effet était considéré comme étant minime à une concentration de 1,0 mg/m3 et modéré à une dose de 6,0 mg/m3. Une fibrose localisée entourant l'épithélialisation du canal alvéolaire a été observée à 1,0 mg/m3 ou plus.
Dans l'ensemble, les voies respiratoires constituaient l'organe cible le plus touché dans les études d'exposition par inhalation, avec des réactions inflammatoires initiales suivies d'une augmentation dans la prolifération des cellules. Avec une exposition prolongée, des changements histologiques se sont produits et ont fini par entraîner une hyperplasie.
8.2.2.5 Toxicocinétique
Les DMD peuvent former des adduits de protéines dans le corps. Généralement, les adduits à l'albumine liés aux DMD et les adduits à l'hémoglobine ont été mesurés à partir d'échantillons de sang ou d'urine à l'aide d'une méthode d'hydrolyse rigoureuse en laboratoire. Après l'hydrolyse, tout DMD sera hydrolysé en MDD. Par conséquent, le niveau d'adduits de protéine est mesuré en fonction du niveau de 4,4'-MDD dans les échantillons. Cette méthode d'hydrolyse ne peut distinguer les adduits liés aux DMD ou tout adduit potentiel lié aux MDD. Bien que cela soit théoriquement possible, peu de données sont disponibles pour soutenir le fait que les DMD subiraient une transformation biologique en MDD libre dans le corps. Il est possible que les DMD forment des adduits de protéine par l'intermédiaire de mécanismes sans la formation de MDD. Dans le cas des TDI, on a découvert qu'ils pouvaient former des adduits avec le glutathion (GSH) dans les voies respiratoires inférieures (Wisnewski et coll. 2011a). Les TDI liés au GSH peuvent se déplacer dans d'autres parties du corps pour former des adduits plus stables.
Selon une étude non publiée qui a porté sur la toxicocinétique des DMD chez les rates Wistar, des animaux ont été exposés aux DMD à une dose de 20 mg/m³ pendant six heures par inhalation au 19e jour de gestation. Des échantillons sanguins ont été prélevés chez les animaux. Les niveaux de MDD, après une hydrolyse acide avec les DMD, ont été mesurés dans le sang maternel, le fluide amniotique, le fœtus et le placenta immédiatement après l'exposition. Le niveau le plus élevé de MDD a été observé dans le sang maternel, puis le placenta, le fœtus et le liquide amniotique (Bartsch et coll. 1996).
Dans une étude sur l'absorption cutanée in vitro réalisée sur de la peau de cobaye, de rat et humaine, environ 58 à 91 % de la dose ont été retenus dans la peau (Clowes 1997). Dans une autre étude sur l'absorption cutanée in vitro effectuée sur la peau de cobayes, l'absorption de DMD (mesurée à l'aide de la spectrophotométrie infrarouge à transformée de Fourrier [IRTF] en mode réflexion totale atténuée [ATR]) à partir de la surface de la peau était rapide (85 % ont été absorbés en 30 minutes) (Bello et coll. 2006). On a découvert que les DMD se propageaient dans des couches plus profondes de la peau.
Dans des études in vivo réalisées sur des rats, l'absorption cutanée systémique de 14C-4,4'-DMD était faible et correspondait à 1 %, voire moins, de la dose appliquée (Leibold et coll. 1998; Hoffmann et coll. 2010). Lorsque les DMD étaient administrés par injection intradermique, l'absorption cutanée était de 26 %. On s'est aperçu qu'un savon doux et de l'eau étaient inefficaces pour enlever les DMD de la peau (Wester et coll. 1999).
Dans une étude d'absorption cutanée pilote, deux femmes en bonne santé, qui n'avaient pas d'antécédents d'allergie de contact avec des isocyanates ou qui ne présentaient pas de symptômes respiratoires pouvant être liés aux isocyanates, ont subi une exposition cutanée au 4,4'-DMD (Hamada et coll. 2012). Des quantités de 10 mg ou de 25 mg de 4,4'-DMD ont été appliquées sur la peau de volontaires, ce qui correspond à une concentration de surface de 0,8 mg/cm²; la zone traitée était recouverte après 8 heures. Soixante-dix pour cent du 4,4'-DMD ont pu être récupérés à partir de la surface de la peau, ce qui indique que la quantité maximale qui peut être absorbée était de 30 %. Toutefois, l'étude n'a pas permis de calculer un pourcentage de l'absorption cutanée.
Liljelind et coll. (2010) ont effectué une comparaison estimée de la charge corporelle découlant de l'exposition cutanée par rapport à l'exposition par inhalation aux DMD en fonction des hypothèses, notamment une absorption cutanée de 1 %, un volume de respiration de 10 m³ pendant un quart de travail de 8 heures et une absorption de 70 % à partir de l'air respiré. Liljelind et coll. (2010) ont estimé que la contribution à la charge corporelle découlant de l'exposition cutanée serait environ 20 fois moins élevée que dans le cas de l'exposition par inhalation dans le cadre d'un scénario d'exposition estimée.
8.3 Caractérisation du risque pour la santé humaine
8.3.1 MDD
Aucun rapport sur les concentrations mesurées de 4,4'-MDD ou de pMDD dans les milieux naturels ou les aliments au Canada n'a été trouvé. Étant donné la faible pression de vapeur et le taux élevé de dégradation atmosphérique du 4,4'-MDD et du pMDD, aucun des deux ne devrait être présent dans l'air ambiant. Les MDD ne sont pas fabriqués au Canada, et ne sont pas utilisés pour fabriquer des DMD. Selon les renseignements disponibles, les utilisations industrielles des substances MDD et pMDD sont limitées à un petit nombre d'opérations au Canada. Par conséquent, l'exposition de la population dans les milieux naturels est peu probable. Selon les déclarations, le 4,4'-MDD et le pMDD ne sont pas utilisés dans les produits de consommation au Canada. D'après ces faits, on ne s'attend pas à une exposition de la population générale au 4,4'-MDD et au pMDD par l'environnement.
En s'appuyant principalement sur l'étude d'évaluations réalisées par des organismes internationaux et d'autres organismes nationaux (CIRC, Commission européenne et OCDE), ainsi que sur les données disponibles, la cancérogénicité représente un effet critique de 4,4'-MDD pour la caractérisation des risques pour la santé humaine. Au cours d'une étude de deux ans sur des rats et des souris portant sur l'absorption par voie orale, on a observé une augmentation de l'incidence des tumeurs de la thyroïde et du foie. Quelques tumeurs rares à faibles incidences ont également été observées chez les rats exposés : phéochromocytomes surrénaliens observés chez les souris mâles; adénomes alvéolaires/bronchiolaires et lymphomes malins observés chez les souris femelles. De plus, l'application cutanée du 4,4'-MDD a entraîné une augmentation de l'incidence des tumeurs hépatiques chez les souris femelles en fonction de la dose. Les études épidémiologiques ont également fourni quelques indications de cancer de la vessie chez les humains exposés dans le cadre du travail.
Puisque l'exposition de la population générale aux substances 4,4'-MDD et pMDD ne devrait pas avoir lieu, les risques pour la santé humaine devraient être faibles. Même si l'exposition de la population générale au 4,4'-MDD et au pMDD n'est pas préoccupante aux concentrations actuelles, ces substances pourraient avoir un effet préoccupant sur la santé si l'exposition augmentait.
8.3.2 DMD
D'après les évaluations faites par plusieurs organismes de réglementation internationaux (USEPA 1998; PISSC 2000; Centre commun de recherche de la Commission européenne 2005) et les renseignements disponibles, les effets critiques associés à l'exposition aux DMD sont une cancérogénicité due à une exposition par inhalation et à une sensibilisation respiratoire et cutanée. Des tumeurs aux poumons ont été observées chez les rats exposés à de fortes concentrations de DMD par inhalation pendant deux ans, mais pas à des concentrations plus faibles. Les éléments de preuve réunis à partir des études sur la génotoxicité semblent indiquer que les DMD ne sont probablement pas mutagènes. Quelques résultats positifs de génotoxicité ont été observés, mais étaient associés aux incertitudes dans le choix des solvants dans les études in vitro. La formation d'adduit à l'ADN est caractérisée comme étant faiblement positive in vivo.
La Commission européenne a classé les DMD comme sensibilisateurs respiratoires de catégorie 1 et comme sensibilisateurs cutanés de catégorie 1. Les études expérimentales sur les animaux, des rapports de cas sur les humains et les études épidémiologiques indiquent tous que les DMD sont associés à la sensibilisation des voies respiratoires. Une réactivité croisée avec d'autres isocyanates a été observée chez les humains et chez les animaux. À l'heure actuelle, aucun modèle d'essais sur les animaux ayant été validé n'est disponible pour caractériser la sensibilisation des voies respiratoires. Il n'est pas clair comment on peut extrapoler les relations dose-réponse des animaux aux humains pour le paramètre du système immunitaire (PISSC 2012). Dans le rapport d'une évaluation des risques de l'Union européenne menée sur les DMD, un certain nombre d'études réalisées sur des animaux ont été décrites pour caractériser le paramètre de sensibilisation des voies respiratoires, mais « aucune n'est jugée un essai validé pour évaluer le potentiel de sensibilisation des voies respiratoires ou de l'asthme chez les humains » (Centre commun de recherche de la Commission européenne 2005).
Dans deux études de cohortes longitudinales dans lesquelles les travailleurs exposés dans le cadre de leur travail aux DMD et aux TDI ont fait l'objet d'un suivi pendant cinq ou 10 ans, aucun changement important dans les fonctions respiratoires ou pulmonaires n'a été observé lorsque des concentrations atmosphériques d'isocyanates atteignaient jusqu'à 0,05 mg/m³ (Musk et coll. 1982, 1985; Gee et Morgan 1985). Trois cas d'asthme professionnel (parmi les 243 travailleurs) ont été constatés dans une étude réalisée par Bernstein et coll. (1993), dans laquelle les niveaux de DMD dans l'air n'avaient jamais dépassé 0,05 mg/m³ dans le cadre d'une surveillance de 24 heures par jour, chaque jour, dans une usine de fabrication de trois ans. Toutefois, cette incidence est jugée faible; on ne sait pas si les trois travailleurs avaient déjà démontré une sensibilisation. Par ailleurs, l'asthme n'était plus actif et les fonctions pulmonaires s'étaient améliorées chez les travailleurs après leur transfert dans un environnement sans isocyanate pendant un an. Une autre étude épidémiologique a déclaré que des travailleurs développaient une pneumopathie d'hypersensibilité après une période d'exposition allant de deux semaines à trois mois à une concentration de DMD d'environ 0,06 mg/m³ (Vendenplas et coll. 1993a). Une incertitude persiste quant au niveau d'exposition réel provoquant un effet, puisque la surveillance s'est déroulée deux mois après l'utilisation initiale des DMD.
D'après les données collectives tirées des études épidémiologiques liées aux DMD dans les milieux professionnels, en tenant compte des limites des études, on a considéré qu'il était raisonnable d'établir un niveau d'effet à 0,050 mg/m³ au-dessous duquel aucun effet respiratoire important n'a été observé chez les humains exposés aux DMD en suspension de façon répétée. Le même niveau d'effet a été sélectionné dans le rapport sur la sécurité chimique du 4,4'-MDD présenté à l'Agence européenne des produits chimiques en vertu du règlement REACH (Consortium des DMD 2012). Dans ce rapport, un niveau dérivé sans effet (DNEL) aigu par inhalation de 0,05 mg/m³ a été utilisé pour caractériser le risque lié à l'exposition aux DMD pour la population générale, d'après la valeur plafond de la MAK Commission en Allemagne de 0,1 mg/m³ ajustée pour tenir compte des différences entre les travailleurs et la population générale.
Des études sur les humains impliquant une exposition aiguë aux isocyanates (TDI) ont été recensées. On estime que les TDI sont des analogues appropriés pour les DMD d'après la ressemblance des sous-structures chimiques et des effets respiratoires et de sensibilisation observés chez les humains et les animaux. Un niveau d'effet respiratoire aigu a été déterminé à 0,14 mg/m³ selon une augmentation transitoire possible observée dans la résistance aérienne chez un volontaire en bonne santé sur 10 exposés aux TDI pendant deux heures (Vogelmeier et coll. 1991). Il y a lieu de noter que cette concentration n'est pas très différente de la valeur plafond de 10 minutes en milieu professionnel de 0,2 mg/m² pour les DMD dans l'air (ACGIH 1996; CDC 2012; OSHA 2012).
L'inhalation de l'air ambiant par la population générale résidant à proximité des sites industriels constitue une source potentielle d'exposition aux DMD (p. ex., usine de fabrication de produits du bois à l'aide de DMD). La comparaison de la limite supérieure estimative de la concentration dans l'environnement des DMD de 5,4 × 104 mg/m³ dans l'air près d'un site industriel au niveau d'effet de 0,05 mg/m³, d'après des effets respiratoires sans importance observés chez les humains dans des études épidémiologiques liées aux DMD, donne lieu à une marge d'exposition de 90. On obtient une marge d'exposition (ME) de 400 en comparant cette limite supérieure estimative de la concentration atmosphérique au niveau auquel aucune tumeur n'a été observée ou auquel tout effet néfaste a été observé dans une étude d'exposition chronique par inhalation de deux ans réalisée sur des animaux de laboratoire (CSENO de 0,2 mg/m³, d'après une augmentation importante de l'hyperplasie des cellules basales dans l'épithélium olfactif et une augmentation importante de l'hyperplasie des glandes de Bowman chez les rats mâles à la dose suivante testée) (Reuzel et coll. 1990, 1994a). On obtient une marge d'exposition (ME) de 11 000 en comparant la limite supérieure estimative de la concentration atmosphérique au niveau associé aux incidences des tumeurs aux poumons dans la même étude d'exposition par inhalation de deux ans (c.-à-d. 6,0 mg/m³). Ces ME sont jugées adéquates pour rendre compte des incertitudes liées aux bases de données concernant les effets sur la santé et l'exposition.
Une autre source potentielle d'exposition de la population générale du Canada aux DMD serait l'utilisation de produits de bricolage. L'exposition à ces produits serait à court terme et peut se produire par inhalation ou voix cutanée. Les marges d'exposition pour ces scénarios ont été calculées d'après un niveau d'effet de 0,05 mg/m³ déterminé à partir des études épidémiologiques sur les DMD. L'utilisation de ce niveau d'effet comme paramètre critique pour caractériser le risque découlant de l'utilisation de produits de consommation est jugé prudent, étant donné qu'il est basé sur l'observation des effets chez les travailleurs exposés en continu tout au long d'un quart de travail de 8 heures et qu'il peut être répété sur une longue période (de plusieurs semaines à plusieurs années), une durée d'exposition plus longue que dans le cas des utilisateurs de produits de bricolage. Par conséquent, des ME par inhalation ont également été estimées à l'aide d'un niveau d'effet respiratoire aigu de 0,14 mg/m³ déterminé à partir des études menées sur des volontaires en bonne santé exposés aux TDI pendant une courte durée (jusqu'à deux heures). On doit noter que les deux niveaux d'effet critiques sont pris en compte dans la caractérisation des risques, en raison des incertitudes associées à la base de données sur les effets sanitaires, en raison de la gravité de ces effets (effets nocifs à long terme et persistant après la sensibilisation) et à la complexité du critère d'effet sanitaire (sensibilisation respiratoire), dont le mécanisme d'action est en grande partie inconnu. Le tableau 8.11 présente les valeurs ME pour l'inhalation basées sur les deux niveaux d'effet critique, pour chaque scénario lié aux produits de consommation, ainsi que les niveaux d'exposition estimés connexes.
Les valeurs ME pour l'inhalation pour tous les produits de bricolage disponibles pour les consommateurs, à l'exception des produits en mousse de polyuréthane giclé à deux composants à faible pression, sont jugées adéquates pour rendre compte des incertitudes dans les bases de données sur l'exposition et les effets sur la santé.
Dans le cas du produit de polyuréthane giclé à deux composants à faible pression par les particuliers, les plages des ME pour l'inhalation allaient de 0,6 à 1,7 lorsque le produit était utilisé pour des travaux d'isolation, et de 0,5 à 3,5 lorsque le produit était utilisé pour des travaux de scellement. Ces ME sont jugées inadéquates.
Dans l'évaluation des risques liés aux DMD réalisée par l'Union européenne, une CSENO de 0,5 mg/m³, d'après une concentration seuil d'irritation pour les rats (Pauluhn 2000; 2002), a été choisie pour la caractérisation des risques pour les consommateurs qui découlent d'une exposition par inhalation à court terme aux DMD (Centre commun de recherche de la Commission européenne 2005). La comparaison de la CSENO établie par l'Union européenne avec le niveau d'exposition choisi dans cette évaluation (tableau 8.1) pour représenter l'exposition pendant l'application par un particulier d'un produit en mousse de polyuréthane giclé à deux composants, entraînerait des ME qui seraient considérées comme inappropriée pour tenir compte des incertitudes dans les bases de données sur l'exposition et les effets sur la santé. L'EPA de la Californie (2015) a proposé un niveau d'exposition de référence aiguë (REL - reference exposition level) DMD/pDMD de 12 µg/m³ basé sur une CMENO de 0,7 mg/m³ pour les rats (Pauluhn 2002). Bien que le rapport ne soit qu'une ébauche, l'EPA de la Californie estime que ce niveau REL assure une protection raisonnable contre la sensibilisation dans un scénario d'expositions aiguës rarement répétées. Les concentrations d'exposition représentaient une application particulière d'un produit de polyuréthane giclé à deux composants à faible pression (pour isoler ou pour sceller) dans cette évaluation étaient supérieures au niveau REL de l'EPA de Californie; par conséquent, le risque pour la santé humaine ne serait pas jugé acceptable.
| Produit | Niveau d'exposition (mg/m3) |
ME (d'après un niveau d'effet critique de 0.05 mg/m3 de DMD tiré d'une étude sur les humains) |
ME (d'après un niveau d'effet critique de 0.14 mg/m3 de DMD tiré d'une étude sur les humains) |
|---|---|---|---|
| Polyuréthane giclé à deux composants à faible pression (entre les solives, pour isoler) |
0,082a | 0,6 | 1.7 |
| Polyuréthane giclé à deux composants à faible pression (entre les solives, dans les coins et dans les fissures, pour sceller) |
0,04 - 0,1b | 0,5 - 1 | 1,4 - 3,5 |
| Scellant en mousse de polyuréthane à un composant | 0,0065c | 8 | 22 |
| Produit d'étanchéité de polyuréthane | 0,00063 - 0,0010d | 50 - 80 | 140 - 220 |
| Adhésif pour le sol ou le mur | 0.00013 - 0.00047d | 100 - 400 | 300 - 1100 |
| Colle de construction | 0,0014 - 0,0021d | 20 - 40 | 67 - 100 |
| Colle générique ou de bricolage | 1,0 × 10-5 - 1,2 × 10-4d | 400 - 5000 | 1200-14 000 |
| Colle Super Glue | 4,1 × 10-8d | supérieur(e) à 10 000 | supérieur(e) à 10 000 |
| Adhésif thermofusible | 7,9 × 10-8d | supérieur(e) à 10 000 | supérieur(e) à 10 000 |
a. Concentration d'air mesurée (voir le tableau 8-4, annexe F);
b. Concentration d'air mesurée (voir le tableau 8 5, annexe F);
c. Concentration d'air mesurée (voir le tableau 8-6);
d. Concentrations d'air modélisées (voir le tableau 8-7, annexe G).
Les DMD constituent de forts sensibilisateurs cutanés comme l'indiquent les données collectives tirées des études de cas sur les animaux de laboratoire et les humains, ainsi que les données épidémiologiques. En outre, les preuves obtenues chez les animaux de laboratoire permettent de croire que l'exposition cutanée avant l'exposition par inhalation pourrait déclencher une hypersensibilité respiratoire, ce qui souligne l'importance de minimiser le contact cutané.
8.4 Incertitudes de l'évaluation des risques pour la santé humaine
8.4.1 MDD
Bien qu'il manque de données de surveillance environnementale canadiennes au sujet des MDD, on peut faire confiance à l'information selon laquelle la présence de substances de MDD dans l'environnement sera probablement faible. La confiance indiquant que la présence des 4,4'-MDD dans les aliments (découlant de l'utilisation d'ustensiles de cuisson contenant des colorants azoïques) est minimale est jugée modérée à élevée.
On n'a trouvé aucune donnée sur les effets du pMDD sur la santé. Par conséquent, l'évaluation des effets sur la santé concernant le 4,4'-MDD a été appliquée au pMDD. Par conséquent, la présente évaluation préalable ne présente pas d'analyse complète du mode d'induction des effets, y compris des effets cancéreux, associés à l'exposition du 4,4'-MDD.
8.4.2 DMD
Des incertitudes persistent quant à l'évaluation de l'exposition humaine aux DMD à partir des milieux naturels. On n'a pas trouvé de données empiriques sur la concentration de DMD dans les milieux environnementaux comme l'eau ou le sol. Cependant, en raison de sa réactivité, on ne prévoit pas que la substance sera présente ou persistera dans ces médias. On constate des incertitudes liées aux estimations environnementales déterminées à l'aide d'un modèle de panache gaussien à source unique et à la proximité exacte des installations aux zones peuplées. Cependant, l'estimation de l'exposition dans l'air était basée sur des hypothèses prudentes. Pour ce qui est de l'exposition aux produits de consommation, il subsiste des incertitudes associées à l'utilisation d'études ayant mesuré des concentrations de DMD dans l'air lors de son application par des professionnels, pour déterminer l'exposition de la population générale. La formation et l'expérience des applicateurs, ainsi que les niveaux de ventilation, ne sont pas nécessairement représentatives d'un scénario d'utilisation par un particulier (il peut y avoir surestimation ou sous-estimation de l'exposition du particulier en fonction du paramètre). Pour certaines de ces études, il subsiste également une incertitude pour ce qui est d'assigner la valeur de la moitié de la limite de détection (LD) aux concentrations de DMD que l'on avait indiqué être inférieures à la LD. Cependant, on peut avoir une confiance modérée à élevée dans l'évaluation de l'exposition, car des données empiriques ont été utilisées, les concentrations d'exposition maximales mesurées dans ces études ont été utilisées, et les produits de polyuréthane giclé à deux composants à faible pression utilisés dans ces études sont similaires à ceux qui sont habituellement employés pour le bricolage.
Des incertitudes persistent au sujet de l'estimation de l'exposition au produit ConsExpo. Cependant, ces hypothèses sont jugées prudentes; par exemple, les estimations cutanées modélisées ne tiennent pas compte de l'épaisseur de la couche de peau et font l'hypothèse que 100 % du DMD dans le produit entreront en contact avec la peau.
Les données empiriques sur les effets sur la santé concernant les DMD sont disponibles pour les humains et les animaux. Une incertitude existe dans les études épidémiologiques sur les humains relativement à l'exposition professionnelle. Dans les études où une sensibilisation a été déterminée, des renseignements insuffisants ont été fournis pour confirmer que les travailleurs n'avaient pas déjà démontré une sensibilisation découlant d'une exposition à des concentrations plus élevées à la même usine qui se serait produite avant les mesures, ou découlant de l'exposition aux DMD dans des milieux autres que le lieu de travail. L'effet chez le « travailleur en bonne santé » peut avoir faussé les résultats des études épidémiologiques transversales et à long terme (Le Moual et coll. 2008). Une incertitude persiste quant à la précision des niveaux d'exposition des DMD déclarés dans les milieux professionnels. Les niveaux de DMD déclarés dans l'air varient en fonction de la méthodologie utilisée. Les concentrations de DMD mesurées dans l'air, en milieu professionnel, dépendent de l'emplacement des dispositifs de surveillance de l'air, de l'heure de la journée à laquelle ces mesures sont prises, et du type de travail réalisé pendant ces mesures. Les niveaux d'exposition mesurés pourraient ne pas avoir pris en compte le déversement accidentel et l'exposition aux DMD chauffés. Il était probable que les travailleurs soient exposés aux DMD par inhalation ou par voie cutanée. Toutefois, les niveaux d'exposition cutanée n'ont pas été mesurés. De plus, les travailleurs ont tendance à être exposés à des concentrations intermittentes plus élevées de DMD et de façon continue à de faibles concentrations de DMD sur le lieu de travail, ce qui constitue un modèle d'exposition différent de celui de la population générale exposée par les produits de consommation. L'utilisation d'un niveau d'effet critique basé sur les études épidémiologiques associé aux DMD en milieu professionnel, afin de comparer des scénarios d'exposition à court terme pour des produits de bricolage de consommation, est jugée prudente. Cependant, elle est jugée appropriée en raison des incertitudes associées à la base de données sur les effets sanitaires, et aussi de la gravité de ces effets et de la complexité des critères d'effet sanitaires. Quelques incertitudes sont associées à l'utilisation d'un analogue structurel pour la caractérisation des effets sur la santé humaine. Cela dit, les TDI et les DMD sont néanmoins tous des isocyanates et ont les mêmes effets sur la santé des humains et des animaux. L'utilisation du niveau d'effet sur la santé, basé sur une étude des TDI pour caractériser les risques associés aux DMD, présente également des incertitudes, car elle est basée sur des effets résultant de l'inhalation de vapeurs, tandis que les produits de consommation contenant des DMD peuvent donner lieu à une exposition par les vapeurs et les aérosols. Des cas de tumeurs pulmonaires ont été observés dans une étude d'inhalation de deux ans (Reuzel et coll. 1990, 1994a), pendant laquelle des animaux avaient été exposés à une concentration élevée de pDMD (c.-à-d. 6,0 mg/m³). Cette concentration élevée a été générée de façon artificielle dans des études expérimentales, et on n'est pas certain que cette concentration puisse être associée normalement avec des produits de consommation contenant des DMD. Il subsiste des incertitudes quant au mode d'action des tumeurs. Deux mécanismes postulés ont été déterminés, mais ils n'ont pas été totalement éclaircis.
9. Conclusion
9.1 MDD
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation préalable, le 4,4'-MDD et le pMDD présentent un faible risque d'effets nocifs sur les organismes et sur l'intégrité globale de l'environnement. Il est conclu que le 4,4'-MDD et le pMDD ne répondent pas aux critères énoncés à l'alinéa 64a) ou b) de la LCPE (1999), car elles ne pénètrent pas dans l'environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique, ni à mettre en danger l'environnement essentiel pour la vie.
Sur la base de l'exposition négligeable de la population générale au 4,4'-MDD et au pMDD, il est conclu que ces substances ne répondent pas aux critères énoncés à l'alinéa 64c) de la LCPE (1999), car elles ne pénètrent pas dans l'environnement en une quantité, à une concentration ou dans des conditions de nature à mettre en danger la vie et la santé humaines au Canada.
La conclusion est donc que le 4,4'-MDD et le pMDD ne répondent à aucun des critères énoncés à l'article 64 de la LCPE (1999).
9.2 DMD
Compte tenu de tous les éléments de preuve disponibles présentés dans la présente évaluation préalable, le risque que les cinq substances DMD du groupe des DMD/MDD nuisent aux organismes et à l'intégrité générale de l'environnement est faible. Il est conclu que les substances DMD ne répondent pas aux critères énoncés à l'alinéa 64a) ou b) de la LCPE, car elles ne pénètrent pas dans l'environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique, ni à mettre en danger l'environnement essentiel pour la vie.
D'après le caractère inadéquat possible des marges d'exposition entre l'estimation de l'exposition aux substances DMD découlant de l'utilisation de certains produits de bricolage et des niveaux d'effet critique, nous concluons que les cinq substances DMD du groupe des DMD/MDD répondent aux critères énoncés à l'alinéa 64c) de la LCPE, car la substance pénètre dans l'environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
On conclut donc donc que les cinq substances DMD du groupe des DMD/ MDD (nos CAS 101-68-8; 2536-05-2, 5873-54-1; 9016-87-9 et 26447-40-5) répondent à un ou plusieurs des critères énoncés à l'article 64 de la LCPE.
Les cinq substances DMD du groupe des DMD/ MDD ne répondent pas aux critères de persistance ou de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
Références
3M Company. 2010. Material Safety Data Sheet: 3M Scotchcast Poly Plus [Internet]. St. Paul (Minnesota): 3M Company. [Consulté en janvier 2014].
3M Company. 2011. Material Safety Data Sheet: 3M Primacast Splint [Internet]. St Paul (Minnesota): 3M Company. [Consulté en janvier 2014].
3M Company. 2012. Material Safety Data Sheet: 3M Scotch-Weld Polyurethane Reactive Easy 250 Adhesive[Internet]. St. Paul (Minnesota): 3M Company. [Consulté en févr. 2013].
[ACC] American Chemistry Council. 2012a. MDI emissions reporting guidelines for polyurethane industry. Report : AX186. Washington (DC): ACC, Center for the Polyurethanes Industry.
[ACC] American Chemistry Council. 2012b. Spray polyurethane foam ventilation research project - phase 2, American Chemistry Council's Center for the Polyurethanes Industry, Rapport daté du 19 décembre 2012, Rapport déposé à Environnement Canada le 31 octobre 2014.
[ACC Diisocyanates Panel] American Chemistry Council's Diisocyanates Panel. 2005. An Assessment of persistence, bioaccumulation, and inherent ecotoxicity of aromatic diisocyanate substances on the Canadian Domestic Substances List (DSL). Rapport non publié, déposé à Environnement Canada. 21 p.
ACD/Percepta [Prediction Module]. c1997-2012. Toronto (ON): Advanced Chemistry Development.
[ACGIH] American Conference of Governmental Industrial Hygienists. 1996. TLVs and BEIs. Threshold limit values for chemical substances and physical agents and biological exposure indices. Cincinnati (Ohio.) [cité par NIOSH 2004].
Acton BC. 2001. Stack emissions from a continuous polyurethane panel production line. Great Britain : International Isocyanate Industry. 33 p. III Report No.: 11441.
Agrup G. 1968. Sensitization induced by patch testing. Br J Dermatol 80(10): 631-4.
Allport DC, Gilbert DS, Outterside SM, editors. 2003. MDI and TDI: Safety, health and the environment: a source book and practical guide. Chichester (GB).
Amini B, Lowenkron S. 2003. Aniline and its derivatives. Kirk-Othmer Encyclopedia of Chemical Technology. New York (NY): John Wiley & Sons Inc. p. 783-809.
Anderson. 2012. Fiche signalétique. Gorilla Glue. [Internet] Colombus (Ohio) [consulté en févr. 2013].
Andersen M, Binderup ML, Kiel P, Larsen H, Maxild J. 1980. Mutagenic action of isocyanates used in the production of polyurethanes. Scand J Work Environ Health 6(3) : 221-226.
Angelini G, Vena GA, Giglo G, Fiordalisi F, Meneghini CL. 1985. Contact dermatitis due to cosmetics. J Appl Cosmetol 3 : 223-236.
Api AM, Basketter DA, Cadby PA, Cano MF, Ellis G, Gerberick GF, Griem P, McNamee PM, Ryan CA, Scfford R. 2008. Dermal sensitization quantitative risk assessment (QRA) for fragrance ingredients. Regul Toxicol Pharmacol 52(1) : 3-23.
Api AM, Lalko J, Politano V. 2009. The use of human data when conducting dermal sensitization quantitative risk assessments for fragrance ingredients; how well does the LLNA predict human NOELs? The Toxicologist, Supplement to Toxicol Sci 108(1): 26 (Résumé #133) [cité par Loveless et coll. 2010].
Arnold RG, Nelson JA, Verbanc JJ. 1956. Recent advances in isocyanate chemistry. Chem. Rev. 57(1): 47-76.
Aronson D, Howard PH. 1999. Evaluating potential POP/PBT compounds for environmental persistence. North Syracuse (NY): Syracuse Research Corporation, Environmental Science Center. Report No. SRC-TR-99-020.
Arnot JA, Gobas FAPC. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb Sci 22(3) : 337-345.
Asakura S. 1986. Report to the International Isocyanate Institute, Project FE-E-39-1 [rapport non publié]. Université nationale de Yokohama, Département du génie de la sécurité, Japon. dans: Cowen et coll. 1998, European Commission 2000.
[ASTM] American Society for Testing and Materials International. c1996-2012. Standards; ASTM D5209-92. West Conshohocken (PA) : ASTM International. [Consulté le 6 décembre 2012].
[ATSDR] Agency for Toxic Substances & Disease Registry. 1998. Toxicological profile for methylenedianiline. U.S. Department of Health and Human Services, Public Health Service.
Bartsch W, Buschmann J, Hoymann HG, Heinrich U. 1996. Étude sur la toxicité chronique et la cancérogénicité du DMD (en allemand) Hanovre, Fraunhofer-Institut für Toxikologie und Experimentelle Medizin (non publié) [cité par IPCS 2000].
Bascom R, Kennedy TP, Levitz D, Zeiss CR. 1985. Specific bronchoalveolar lavage IgG antibody in hypersensitivity pneumonitis from diphenylmethane diisocyanate. Am Rev Respir Dis 131(3) : 463-465.
BASF AG. 1977. Abt. Toxikologie; unveroffenlichte Untersuchung XXIII/539 (07.01.1977.) [Cité par ECJRC 2001; OECD 2002].
Basketter DA, Clapp C, Jefferies D, Safford B, Ryan CA, Gerberick F, Dearman RJ, Kimber I. 2005. Predictive identification of human skin sensitization thresholds. Contact Dermatitis 53(5) : 260-267.
[BDPSNH] Base de données des produits de santé naturels homologués[database on the Internet]. 2013. Santé Canada. [Consulté en avril 201302 12].
Baur X, Dewair M, Römmelt H. 1984. Acute airway obstruction followed by hypersensitivity pneumonitis in an isocyanate (MDI) worker. J Occup Med 26(4) : 285-287.
Baur X. 1985. Isocyanate hypersensitivity. Final report to the International Isocyanate Institute. III File No. 10349; III Project E-AB-19. [Cité par National Research Council of the National Academies des États-Unis 2004].
Baur X, Marek W. Ammon J, Czuppon AB, Marczynski B, Raulf-Heimsoth M, Roemmelt H, Fruhmann G. 1994. Respiratory and other hazards of isocyanates. Int Arch Occup Environ Health 66(3): 141-152. [Cité par US EPA 1998].
Bayer Material Science. 2005. Material Safety Data Sheet : MONDUR ML [Internet]. Pittsburgh, Pennsylvanie: Bayer Material Science LLC. [Consulté en janvier 2013].
[BCFBAF] Bioaccumulation Program for Windows [Estimation Model]. [2000-2010]. Version 4.10. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (New-York): Syracuse Research Corporation.
Becker KH, Bastian V, Klein Th. 1988. The reactions of OH radicals with toluene diisocyanate, toluenediamine and methylenedianiline under simulated atomospheric conditions. J Photochem Photobio, A. 45(2): 195-205
Bello D, Smith TJ, Woskie SR, Streicher RP, Boeniger MF, Redlich CA, Liu Y. 2006. An FTIR investigation of isocyanate skin absorption using in vitro guinea pig skin. J Environ Monit 8(5): 523-529.
Bello D, Sparer J, Redlich CA, Ibrahim K, Stowe MH, Liu Y. 2007a. Slow curing of aliphatic polyisocyanate paints in automotive refinishing: a potential source for skin exposure. J Occup Enviro Hyg 4(6): 406-411.
Bello D, Herrick CA, Smith TJ, Woskie SR, Streicher RP, Cullen MR, Liu Y, Redlich CA. 2007b. Skin exposure to isocyanates: reasons for concern. Environ Health Perspect 115(3): 328-335.
Bernstein DI, Korbee L, Staudee T, Bernstein JA, Scinto J, Herd ZL, Bernstein IL. 1993. The low prevalence of occupational asthma and antibody-dependent sensitization to diphenylmethane diisocyanate in a plant engineered for minimal exposure to diisocyanates. J Allergy Clin Immunol 92(3): 387-396.
Best DH, Coleman WB. 2007. Bile duct destruction by 4,4'-diaminodiphenylmethane does not block the small hepatocyte-like progenitor cell response in retrorsine-exposed rats. Hepatology 46(5): 1611-1619.
Bidleman TF. 1988. Atmospheric processes. Environ Sci Technol 22(4): 361-367.
Björkner B, Frick-Engfeldt M, Pontén A, Zimerson E. 2001. Plastic Materials. Contact Dermatitis (eds. JD Johansen et coll.) pp. 696.
Boethling RS, Howard PH, Beauman JA, Larosche ME. 1995. Factors for intermedia extrapolation in biodegradability assessment. Chemosphere. 30(4): 741−752.
Bonauto D, Lofgren D. 2004. Review of three asthma cases and MDI exposure data associated with the spray-on truck bed lining industry. Olympia (Washington), Washington State Department of Labor and Industries, State of Washington, Safety and Health Assessment and Research for Prevention (SHARP) Program, Technical Report No. 42-5-2004. [Cité par NIOSH 2006].
Booth K, Cummings B, Karoly WJ, Mullina S, Robert WP, Spence M, Lichtenberg FW, Banta J. 2009. Measurements of airborne methylene diphenyl diisocyanate (MDI) concentration in the U.S. workplace. J Occup Environ Hyg 6(4): 228-238.
Boutin M, Dufresne A, Ostiguy C, Lesage J. 2006. Determination of airborne isocyanates generated during the thermal degradation of car paint in body repair shops. Ann Occup Hyg 50(4): 385-393.
Brochhagen FK, Grieveson BM. 1984. Environmental aspects of isocyanates in water and soil. Cell Polym 3: 11-17.
Brochhagen FK, Schal HP. 1986. Diphenylmethane diisocyanate: the concentration of its saturated vapor. Am Ind Hyg Assoc J 47(4) : 225-228.
Brouwer DH, Semple S, Marquart J, Cherrie JW. 2001. A dermal model for spray painters. Part 1: subjective exposure modelling of spray paint deposition. Ann Occup Hyg 45(1): 15-23.
Buschmann J, Koch W, Fuhst R, Heinrich U. 1996. Embryotoxicity study of monomeric 4,4'-methylenediphenyl diisocyanate (MDI) aerosol after inhalation exposure in Wistar rats. Fundam Appl Toxicol 32(1) :96-101.
[EPA de la Californie] California Environmental Protection Agency. 2015. Methylene Diphenyl Disocyanate (Monomer and Polymeric Forms) Reference Exposure Levels. Technical support document for the derivation of noncancer reference exposure levels. Appendix D1. SRP Review Draft, mai 2015. Air, Community, and Environmental Research Branch, Office of Environmental Health Hazard Assessment.
Canada. 1978. Règlement sur les aliments et drogues, C.R.C., ch. 870.
Canada. 1985. Loi sur les aliments et drogues, L.R.C. 1985, ch. F-27.
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999), ch. 33, Gazette du Canada. Partie III, vol. 22, n° 3.
Canada. 2000. Loi canadienne sur la protection de l'environnement (1999) - Règlement sur la persistance et la bioaccumulation, C.P. 2000-348, 23 mars 2000, DORS/2000-107, Gazette du Canada. Partie III, vol. 134, n° 7, p. 607−612.
Canada. 2008. Rapport d'évaluation préalable pour le Défi - Diisocyanate de toluène (n° CAS 584-84-9; n° CAS 91-08-7; n° CAS 26471-62-5) [Internet]. Ottawa, Ontario : Environnement Canada et Santé Canada. [Consulté en jan. 2013].
Canada. 2010. Règlement sur les aliments et drogues, C.R.C., ch. 870 modifié le 9 juin 2010.
Canada. 2011. Ministère de l'Environnement. Loi canadienne sur la protection de l'environnement (1999) - Avis concernant certaines amines aromatiques et certaines substances azoïques aromatiques et à base de benzidines aromatiques. Gazette du Canada. Partie I, vol. 145, n° 51, 17 décembre 2011.
Canada. 2012. Ministère de l'environnement. Loi canadienne sur la protection de l'environnement (1999) - Avis concernant certains diisocyanates de méthylènediphényle et méthylènediphényldiamines, et les crésols. Gazette du Canada. Partie I, vol. 146, n° 24, 16 juin 2012, p. 1561-1584.
Cangemi JM, Dos Santos AM, Neto SC, Cherice GO. 2008. Biodegradation of polyurethane derived from castor oil. Polímeros 18(3) : 201-206.
Cao LC, Cheng J, Liu XD, Wang R, Zhang JY, Qu J, Jaeger U. 2012. Study of Properties of One-Component Moisture-Curable Polyurethane and Silane Modified Polyurethane Adhesives. J Adhes Sci Technol 26(10-11) : 1395-1405.
Carino M, Aliani M, Licitra C, Sarno N, Ioli F. 1997. Death due to asthma at workplace in a diphenylmethane diisocyanate-sensitized subject. Respiration 64(1) : 111-113.
Carter WPL, Luo D, Malkina IL. 1999. Investigation of the atmospheric ozone formation potential of para toluene isocyanate and methylene diphenylene diisocyante. Riverside (Californie) : College of Engineering, Center for Environmental Research and Technology University of California. Rapport final au « Diisocyanates Panel » de la Chemical Manufacturers Association.
Cartier A, Gammer L, Malo J-L, Lagier F, Ghezzo H, Harris K, Patterson R. 1989. Specific serum antibodies against isocyanates : Association with occupational asthma. J Allergy Clin Immunol 84 (4 Pt 1) : 507-514. [Cité par US EPA 1998].
Caspers N, Hamburger B, Kanne R, Klebert W. 1986. Ecotoxicity of toluenediisocyanate (TDI), diphenylmethanediisocyanate (MDI), toluene diamine (TDA), diphyenylmethanediamine (MDA.) International Isocyanate Institute Project No. E-CE-41. [Accès limité].
Castro EA, Moodie RB, Sansom PJ. 1985. The kinetics of methyl and phenyl isocyanates. J Chem Soc Perkin Trans 2 5 :737-742.
[CDC] Centers for Disease Control and prevention. 2012. The national institute for occupational safety and health (NIOSH) pocket guide to chemical hazards. [Internet] [consulté le 16 août 2012].
Ceballos DM, Yost MG, Whittaker SG, Reeb-Whitaker C, Camp J, Dills R. 2011. Development of a permeation panel to test dermal protective clothing against sprayed coatings. Ann Occup Hyg 55(2): 214-227.
CH2M HILL Canada Limited. The city of Calgary : industrial commercial institutional waste diversion progress update. UE2011-11, Document connexe 3, mai 2011. Préparé pour la ville de Calgary par CH2M HILL Canada Limited. [Consulté le 10 avril 2013].
Chester DA, Hanna EA, Pickelman BG, Rosenman KD. 2005. Asthma death after spraying polyurethane truck bedliner. Am J Ind Med 48(1) :78-84.
Chester EH, Martinez-Catinchi FL, Schwartz HJ, Horowitz J, Fleming GM, Gerblich AA, McDonald EW, Brethauer R. 1979. Patterns of airway reactivity to asthma produced by exposure to toluene di-isocyanate. Chest 75(2 Suppl) : 229-231.
Chemical Industry Directory. Global Chemical Network. Zhejiang NetSun Co., Ltd. [Consulté le 29 janvier 2015].
[CHRIP] Chemical Risk Information Platform [database on the Internet]. Anonymous. Tokyo (JP): National Institute of Technology and Evaluation, Chemical Management Centre (CMC). 2008. [Consulté le 14 mars 2013].
CIBA-GEIGY. 1982. 3 Month Toxicity Study in Rats (Drinking Water); TK 10504, GU Project No. 791743; GU 2. Toxicology (25.06.1982.) [Cité par ECJRC 2001; OECD 2002].
Clowes HM. 1997. In vitro absorption from various doses of MDI through guinea pig, rat and human skin. Central toxicology laboratory, Alderley Park Macclesfield, Cheshire UK, Report No. CTL/P/5348, III Project 125, 3 novembre 1997. [Cité par ECJRC 2005].
Convenience Products. (Clayton Corporation.) 2009. MDI emissions study of one component polyurethane foam sealant products. Test report conducted by John A. Jurgiel & Associates and submitted to Center for the Polyurethanes Industry. Rapport déposé à Environnement Canada le 31 octobre 2014.
Convenience Products (Clayton Corporation.) 2012. MDI emissions study of full cavity insulation application using low pressure spray foam. Unpublished test report conducted by Certified Safety Consulting. 23 p. Rapport déposé à Environnement Canada le 30 octobre 2014.
Convenience Products (Clayton Corporation.) 2014a. MDI emissions study of low pressure bead applied polyurethane foam sealant applied in a residential basement with ventilation. Unpublished test report conducted by Certified Safety Consulting. 19 p. Rapport déposé à Environnement Canada le 30 octobre 2014.
Convenience Products (Clayton Corporation.) 2014b. MDI emissions study of low pressure bead applied polyurethane foam sealant applied in a residential basement without ventilation. Unpublished test report conducted by Certified Safety Consulting. 18 p. Rapport déposé à Environnement Canada le 30 octobre 2014.
Cowen WF, Gastinger AM, Spanier CE, Buckel JR, Bailey RE. 1998. Sorption and microbial degradation of toluenediamines and methylenedianiline in soil under aerobic and anaerobic conditions. Environ Sci Technol 32(5) : 598-603.
[CRA] Conestoga-Rovers & Associates (Waterloo, Ontario.) 2012. Potential presence and releases of five substances grouping to the environment from the waste sector.
[CRA] Conestoga-Rovers & Associates (Waterloo, Ontario.) 2012. Potential presence and releases of five substances grouping to the environment from the waste sector. Rapport produit pour Environnement Canada, Gatineau (Québec): Environnement Canada. Demande de rapport no K2A82-11-0029. Numéro de référence : 077785(2.) 418 p.
Crespo J, Galán J. 1999. Exposure to MDI during the process of insulating buildings with sprayed polyurethane foam. Ann Occup Hyg 43(6): 415-419.
Cui Y, Chen D, Wang X, Tang X. 2002. Crystalline structure in isocyanate reactive hot melt adhesives. Inter J Adhesion Adhesives 22(4): 317-322.
Dalene M, Skarping G, Brunmark P. 1995. Assessment of occupational exposure to 4,4'-methylenedianiline by the analysis of urine and blood samples. Int Arch Occup Environ Health 67(2): 67-72.
De Agostini F et coll. 1987. Considerazioni epidemiologiche sulla dermatite allergica da contatto da diaminodifenilmethano. Dermatologia LXXX(34-38.) [Cité par ECJRC 2001; OECD 2002].
Dearman RJ, Spence LM, Kimber I. 1992. Characterization of murine immune responses to allergenic diisocyanates. Toxicol Appl Pharmacol 112(2): 190-197.
DeGaspari J. 1999. From trash to cash: a new process reclaims former unrecoverables in residue of scrapped vehicles. Mechanical Engineering-CIME 121(6): 48-51.
Dietemann-Molard A, Kopfershmitt-Kubler MC, Meyer PD, Tomb R, Pauli G. 1991. Allergic asthma due to domestic use of insulating polyurethane foam. Lancet 338(8772) :953.
Dieterich D, Grigat E, Hahn W, Hespe H, Schmelzer HG. 1993. Principles of polyurethane chemistry and special applications. [In: Oertel, G. Polurethane Handbook: chemistry, raw materials, processing, application, properties. 2nd ed. Munich (Allemagne): Hanser Gardner Publications. p. 12-53].
Diller WF, Herbert E. 1982. Lungenfunktion und andere gesundheitliche Parameter bei Beschäftigten in einem Isocyanatbetrieb (MDI-Herstellung) [Fonction pulmonaire et autres paramètres de santé chez les employés d'une usine d'isocyananure (MDI production.)] Zentralbl Arbeitsmed Arbeitsschutz Prophyl Ergonomie 32(4) : 128-137. [Article en allemand, cité par DFG 1997].
Diller WF, Derbert E. 1983. Lung function and other health parameters in workers in an isocyanate factory (MDI production). Abs Hyg Communicable Diseases 58(8) : 524-525. [Cité par ECJRC 2005].
Dominion Sure Seal. 2014. Material Safety Data Sheet. EZ Liner BEZLG, Part A.
Dow Chemical Company. [MSDSonline] Material Safety Data Sheets [Internet]. c1998 − 2011. Chicago (Illinois) : MSDSonline. [Consulté le 1er févr. 2012]. [accès limité].
Dow Chemical Company. février 2012. Low Pressure Spray Foam Products. [Cité par USEPA, dossier EPA-HQ-OPPT-2011-0182]
Dow Chemical Company. 1954. Results of Skin Sensitization Tests with Methylene Dianiline, Biochemical Research Department(17.12.1954.) (Travaux non publiés) [Cité par ECJRC 2001; OECD 2002].
Dow Chemical Company. 2013. Residential Home Re-Occupancy and Ventilation After Crawl Space Sprayed with Low Pressure Polyurethane Foam. Non publié. Présenté au départ à l'American Chemistry Council Polyurethanes Technical Conference, Phoenix (Arizona.)
[BDPP] Base de données sur les produits pharmaceutiques [database on the Internet]. 2010. Santé Canada. [Consulté le 12 mars 2013].
Duff, PB. 1985. Fate of Toluene Diisocyanate in Air, Phase II Study, Proceedings of the SPI 29th Annual Technical/Marketing Conference, 23 au 25 octobre, Reno (Nevada).
Dunn BJ. 1978. Dunn, B.J. (1978) Guinea Pig Skin Hypersensitization Test, Methylene Dianiline. Allied Chemical Corporation (18.09.1978). [Cité par ECJRC 2001; OECD 2002].
DuPont. 1975. Ten-day subacute exposure of rabbit to methylene dianiline. Dot ID. 878220288. (Travaux non publiés). [Cité par ATSDR 1998].
DuPont. 1976a. Skin absorption studies in rabbits treated with 4,4´-diaminodiphenylmethane (MDA). A. pathological and clinical effects of a lo-day subacute study. Dot ID. 878220289. (Travaux non publiés.) [Cité par ATSDR 1998].
Duprat P, Gradiski D, Marignac B. 1976. The irritant and allergenic action of two isocyanates: toluene diisocyanate (TDI) and diphenylmethane diisocyanate (MDI). Eur J Toxicol Environ Hyg. 9(1) : 43-53. Article en français. [Cité par ECJRC 2005].
[ECETOC] European Centre for Ecotoxicology and Toxicology of Chemicals. 2003. Contact Sensitisation : Classification according to potency. Technical Report No. 87.
[ECETOC] European Centre for Ecotoxicology and Toxicology of Chemicals. 2009. Workshop : Significance of Bound Residues in Environmental Risk Assessment, 14 au 15 octobre 2009, Bruxelles. Workshop Report No. 17.
[ECJRC] European Commission Joint Research Centre. 2001. Risk Assessment Report: 4-4'-methylenedianiline (CAS No. 101-77-9). Luxembourg : Office for Official Publications of the European Communities. Vol. 9.
[ECJRC] European Commission Joint Research Centre. 2005. European Union Risk Assessment Report. Methylenediphenyl diisocyanate (MDI) CAS No. 26447-40-5. Luxembourg : Office for Official Publications of the European Communities. Vol. 59.
[ECHA] European Chemicals Agency. c2007-2013a. Registered substances : Chemical substances search. Résultats de recherche pour le numéro CAS 101-77-9. Helsinki (Finlande) : ECHA. [Consulté en févr. 2013].
[ECHA] European Chemicals Agency. c2007-2013b. Registered substances : Chemical substances search. Résultats de recherche pour le numéro CAS 25214-70-4. Helsinki (Finlande) : ECHA. [Consulté en févr. 2013].
[ECHA] European Chemicals Agency. c2007-2013c. Registered substances : Chemical substances search. Résultats de recherche pour le numéro CAS 101-68-8. Helsinki (Finlande) : ECHA. [Consulté en janv. 2013].
[ECHA] European Chemicals Agency. c2007-2013d. Registered substances : Chemical substances search. Résultats de recherche pour le numéro CAS 2536-05-2. Helsinki (Finlande) : ECHA. [Consulté en févr. 2013].
[ECHA] European Chemicals Agency. c2007-2013e. Registered substances : Chemical substances search. Résultats de recherche pour le numéro CAS 5873-54-1. Helsinki (Finlande) : ECHA. [Consulté en févr. 2013] Agency.
[ECHA] European Chemicals Agency. 2011. SVHC Support Document - Formaldehyde,oligomeric Reaction products with aniline.
Ecoff S, Lambach J. 2012. A proposed methodology for establishing a save work zone around a SPF application to exterior walls of a commercial structure. Article présenté à la Polyurethanes Technical Conference de 2012, 24 au 26 septembre, Atlanta (Georgie.)
Egeler Ph., Ginzburg N. 2001. A study on the toxicity of 4,4'-Methylenedianiline to the aquatic oligochaete Lumbriculus variegatus. ECT Oekotoxikologie GmbH, Allemagne, Study Number : P1LA. [Accès limité].
Egeler Ph. 2002. A study on the toxicity of 4,4'-Methylenedianiline to the aquatic oligochaet Lumbriculus variegatus. ECT Oekotoxikologie GmbH, Allemagne, Study Number : P2LA. [Accès limité].
Egeler Ph, Gilberg D. 2005. 4,4'-Methylenedianiline: A Study on the toxicity to the sediment dweller Chironomus riparius. ECT Oekotoxikologie GmbH, Allemagne, Study Number : AD2ME. [Accès limité].
Elmer's. 2012. Material Safety Data Sheet. Elmer's Ultimate Glue. [Internet]. Colombus (Ohio) [consulté en févr. 2013].
Emmett EA. 1976. Allergic contact dermatitis in polyurethane plastic moulders. J Occup Med 18(12) :802-804.
Engfeldt M, Isaksson M, Zimerson E, Bruze M. 2013. Several cases of work-related allergic contact dermatitis caused by isocyanates at a company manufacturing heat exchangers. Contact Dermatitis 68(3) : 175-180.
Engfeldt M, Pontén A. 2013. Contact allergy to isocyanates after accidental spillage. Contact Dermatitis 69(2) : 122-124.
Agence de l'Environnemet du Japon. 2000. Chemicals in the Environment : Report on the environmental survey and wildlife monitoring of chemicals in F.Y. Environment Health and Safety Division, Environment Agency (Japan), septembre 2000.
Environnement Canada. 2009. Guidance for Conducting Ecological Assessments under CEPA, 1999, Science Resource Technical Series, Mini Guidance Module : Determining the persistence of a chemical from biodegradation data. Gatineau (Québec) : Environnement Canada, Division de l'évaluation écologique.
Environnement Canada. 2010. Données recueillies conformément à l'article 71 de la Loi canadienne sur la protection de l'environnement (1999) et à l'« Avis concernant certaines substances inscrites sur la Liste intérieure de substances (LIS) », Gazette du Canada, vol. 135, n° 46. Données produites par Environnement Canada et Santé Canada, Programme des substances existantes.
Environnement Canada. 2011. Données recueillies conformément à l'article 71 de la Loi canadienne sur la protection de l'environnement (1999) et à l'« Avis concernant certaines amines aromatiques et certaines substances azoïques aromatiques et à base de benzidines aromatiques », Gazette du Canada. Partie I, vol. 145, n° 51, 17 décembre 2011. Données produites par Environnement Canada et Santé Canada, Programme des substances existantes.
Environnement Canada. 2012a. Données recueillies conformément à l'article 71 de la Loi canadienne sur la protection de l'environnement (1999) et à l'« Avis concernant certains diisocyanates de méthylènediphényle et méthylènediphényldiamines, et les crésols», Gazette du Canada. Partie I, vol. 146, n° 24, 16 juin 2012. Données produites par Environnement Canada et Santé Canada, Programme des substances existantes.
Environnement Canada. 2012b. Ensemble des bases de données téléchargeables des installations de l'Inventaire national des rejets de polluants [INRP]. Ottawa, Ontario : Environnement Canada. (1) Facility data, Year 1993-2010 (en format Microsoft Access, version du 27 mars 2012.) [Consulté en mars 2013].
Environnement Canada. 2013. Sommaire de rigueur d'études - Toxicité aquatique. Gatineau, Québec : Environnement Canada. Developed for a daphnid reproduction study by Mitsubishi Chemical Safety Institute (2002b). Disponible sur demande.
Environnement Canada et Santé Canada. 2008. Rapport provisoire d'évaluation préalable des TDI - Diisocyanate de toluène - Diisocyanate de 4-méthyl-m-phénylène (2,4-TDI), n° CAS 584-84-9; Diisocyanate de 2-méthyl-m-phénylène (2,6-TDI), n° CAS 91-08-7; Diisocyanate de 2-méthyl-m-tolidène (mélanges d'isomères du TDI), n° CAS 26471-62-5.
Environnement Canada et Santé Canada. 2013. Substances chimiques : Catégorisation [Internet]. Ottawa, Ontario : Gouvernement du Canada. [mise à jour le 25 mai 2013; consulté le 21 juillet 2013].
[EPI Suite] Estimation Programs Interface Suite for Microsoft Windows [Estimation Model]. 2012. Version 4.1. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [Consulté en janv. 2013].
Estlander T, Keskinen H, Jolanki R, Kanerva L. 1992. Occupational dermatitis from exposure to polyurethane chemicals. Contact Dermatitis 27(3) : 161-165.
Commission européenne. 2000. IUCLID Dataset, 4,4'-methylenedianiline, CAS No. 101-77-9 [Internet]. Édition 2000 en format CD-ROM. [s.l]. : Agence européenne des produits chimiques, Commission européenne.
Commission européenne. 2009. Règlement (CE) no 790/2009 de la Commission du 10 août 2009 modifiant, aux fins de son adaptation au progrès technique et scientifique, le règlement (CE) no 1272/2008 du Parlement européen et du Conseil relatif à la classification, à l'étiquetage et à l'emballage des substances et des mélanges.
Commission européenne. 2015a. Details on Substances Classified in Annex VI to Regulation (EC) No 1272/2008. Index Number : 612-051-00-1. [Internet]. [Consulté le 26 octobre 2015].
Commission européenne. 2015b. Details on Substances Classified in Annex VI to Regulation (EC) No 1272/2008. Index Number : 615-005-00-9. [Internet]. [Consulté le 26 octobre 2015].
Fabbri LM, Boschetto P, Zocca E, Milani G, Pivirotto F, Plebani M, Burlina A, Licata B, Mapp CE. 1987. Bronchoalveolar neutrophilia during late asthmatic reactions induced by toluene diisocyanate. Am Rev Respir Dis 136(1) : 36-42.
Feron VJ, Kittel B, Kuper CF, Ernst H, Rittinghausen S, Muhle H, Koch W, Gamer A, Mallett AK, Hoffmann HD. 2001. Chronic pulmonary effects of respirable methylene diphenyl diisocyanate (MDI) aerosol in rats : combination of findings from two bioassays. Arch Toxicol 75(3) : 159-175.
Fomo Products. 2010. An evaluation of airborne methylene diphenyl diisocyanate (MDI.) Rapport daté du 9 mars 2010. Rapport déposé à Environnement Canada, le 31 octobre 2014.
Fomo Products. 2005. MDI air monitoring report-Fomo products wall stud case study. Rapport déposé à Environnement Canada le 31 octobre 2014.
Foureman P, Mason JM, Valencia R, Zimmering S. 1994. Chemical mutagenesis testing in Drosophila. X. Results of 70 coded chemicals tested for the National Toxicology Program. Environ Mol Mutagen 23(3) : 208-227.
Franklin International. 2010. Material Safety Data Sheet. Titebond 811 Advantage. [Internet]. Colombus (Ohio) [consulté en févr. 2013].
Frick-Engfeldt M, Isaksson M, Zimerson E, Bruze M. 2007. How to optimize patch testing with diphenylmethane diisocyanate. Contact Dermatitis 57 : 138-151.
Fukushima S, Hirose M, Hagiwara A, Hasegawa R, Ito N. 1981. Inhibitory effect of 4,4'-diaminodiphenylmethane on liver, kidney and bladder carcinogenesis in rats ingesting N-ethyl-N-hydroxyethylnitrosamine or N-butyl-N-(4-hydroxybutyl) nitros-amine. Carcinogenesis 2(10) : 1033-1037. [Cité par ATSDR 1998].
Fukushima S, Shibata M, Hibino T, Yoshimura T, Hirose M, Ito N. 1979. Intrahepatic bile duct proliferation induced by 4,4'-diaminodiphenylmethane in rats. Toxicol Appl Pharmacol 48(1 Pt 1) : 145-155. [Cité par ATSDR 1998].
Gailhofer G, Ludvan M. 1987. [Changement dans les spectres allergènes de l'eczéma par contact de 1975 à 1984 [Trad]. Derm Beruf Umwelt 35(1) : 12-16. [Article en allemand]
Gee JB, Morgan WKC. 1985. A 10-year follow-up study of a group of workers exposed to isocyanates. J Occup Med 27(1): 15-18.
Gilbert DS. 1988. Fate of TDI and MDI in air, soil and water. J Cell Plast 24(2): 178-192.
Gledhill A, Wake A, Hext P, Leibold E, Shiotsuka R. 2005. Absorption, distribution, metabolism and excretion of an inhalation dose of [14C] 4,4'-methylenediphenyl diisocyanate in the male rat. Xenobiotica 35(3): 273-292.
Gobas FAPC, Kelly BC, Arnot JA. 2003. Quantitative Structure Activity Relationships for predicting the bioaccumulation of POPs in terrestrial food-webs. QSAR Comb Sci 22(3): 329-336.
Goossens A, Detienne T, Bruze M. 2002. Occupational allergic contact dermatitis caused by isocyanates. Contact Dermatitis 47(5): 304-308.
Griem P, Goebel C, Scheffler H. 2003. Proposal for a risk assessment methodology for skin sensitization based on sensitization potency data. Regul Toxicol Pharmacol 38(3): 269-290.
Griffiths-Johnson D, Spear K, Jin R, Karol MH. 1990. Late-onset pulmonary responses in guinea pigs sensitized by inhalation of diphenylmethane 4,4'-diisocyanate (MDI). Toxicologist 10(1) : 222 (abstract.)
Grimalt R, Vilaplana J, Romaguera C. 2009. Three cases of allergic contact dermatitis to 4,4'-diaminodiphenylmethane. Contact Dermatitis 60(6) : 346-347.
Gulati DK, Witt K, Anderson B, Zeiger E, Shelby MD. 1989. Chromosome aberration and sister chromatid exchange tests in Chinese hamster ovary cells in vitro. III. Results with 27 chemicals. Environ Mol Mutagen 13(2) : 133-193.
Gunderson EC, Anderson CC. 1988. A sampling and analytical method for airborne m-Phenylenediamine (MPDA) and 4,4'-Methylenedianiline (MDA). Am Ind Hyg Assoc J 49(10) : 531-538.
Hagiwara A, Tiwawech D, Imaida K, Tamano S, Shibata MA, Fukushima S, Ito N. 1993. Modifying influence of prior treatment with toxic agents on induction of preneoplastic and neoplastic lesions in a medium-term multi-organ carcinogenesis bioassay. Teratog Carcinog Mutagen 13(6) : 277-287. [Cité par ATSDR 1998].
Hall AJ, Harrington JM, Waterhouse JA. 1992. The Epping jaundice outbreak : a 24 year follow up. J Epidemiol Community Health 46(4) : 327-328.
Hamada H, Isaksson M, Bruze M, Engfeldt M, Liljelind I, Axelsson S, Jönsson B, Tinnerberg H, Zimerson E. 2012. Dermal uptake study with 4,4'-diphenylmethane diisocyanate led to active sensitization. Contact Dermatitis66(2) : 101-105.
Hamberger R, Moser Th. 2012. 4,4'-MDA: reproduction toxicity to the earthworm Eisenia fetida. ECT Oekotoxikologie GmbH and CIP - Chemisches Institut Pforzheim GmbH. Study number 1AD1RR. [Accès limité].
Hansch C., Leo A., Hoekman D. 1995. Exploring QSAR: Hydrophobic, Electronic, and Steric Constants. Washington (DC) : American Chemical Society (ACS).
Hannu T, Estlander T, Jolanki R. 2005. Allergic contact dermatitis due to MDI and MDA from accidental occupational exposure. Contact Dermatitis 52(2) : 108-109.
Harkema JR, Carey SA, Wagner JG. 2006. The nose revisited: a brief review of the comparative structure, function, and toxicologic pathology of the nasal epithelium. Toxicol Pathol 34(3) : 252-269.
Harper DP, Wolcott MP, Rials TG. 2001. Evaluating cure of a pMDI-wood bondline using spectroscopic calorimetric and mechanical methods. J Adhesion 76(1) : 55-74.
Santé Canada. 2013. Documents d'appui : Summary tables of health effects information for methylenediphenyl diisocyanates and diamines. Ottawa (ON) : Santé Canada. Disponible sur demande.
Health Council of the Netherlands. 2008. Prevention of work-related airway allergies. Recommended occupational exposure limits and periodic screening. The Hague, Health Council of the Netherlands, Publication No. 2008/03.
Heimbach F. 1993. Biological effects and fate of Desmodur 44 V 20 (polymeric MDI) in artificial ponds by simulating an accidental pollution. Project 101-EU-ENV for the International Isocyanate Institute [rapport non publié]. Dans : ECJRC 2005.
Heimbach F, Jaeger K, Sporenberg W. 1996. Fate and biological effects of polymeric MDI (4,4'-diphenylmethane diisocyanate and homologs) in small artificial ponds. Ecotoxicol Environ Saf 33(2) : 143-153.
Heinrich U, Koch W, Schiiler T, Creutzenberg O, Rittinghausen S, Klingebiel R, Hoymann HG, Bartsch W, Preiss A. 1991. Inhalation exposure of rats to 4',4-methylenediphenyl-diisocyanate (MDI). In Proceedings, BOHS VIIIth International Symposium on InhaledParticles, Edinburgh, 1991, p. 6.8. [Cité par ECJRC 2005].
Henkel Corporation. 2010. Material Safety Data Sheet. 1-component-polyurethane adhesive. Rocky Hill(Connecticut) [consulté en févr. 2013].
[HENRYWIN] Henry's Law Constant Program for Microsoft Windows [Estimation Model]. 2008. Version 3.20. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation.
Herbold B. 1980a. Desmodur 44M (MDI), Salmonella/Microsomen Test zur Untersuchung auf Punkmutagene Wirkung, Bayer Institute fur Toxikologie, Report No.9341, 1.8.1980. [Cité par ECJRC 2005].
Herbold B. 1980b. Desmodur 44V20 (MDI), Salmonella/Microsomen Test zur Untersuchung auf Punmutagene Wirkung, Bayer Institute fur Toxikologie, Report No.9341, 1.8.1980. [Cité par ECJRC 2005].
Herbold B. 1980c. Desmodur 44M (MDI), Erganzung zum Bericht 9130 vom 9 May 1980, Salmonella/Microsomen Test zur Untersuchung auf punkmutagene Wirkung, Bayer Institute fur Toxikologie, Report No. 9303, 17 juillet 1980. [Cité par ECJRC 2005].
Herbold BA. 1990a. Special study, Salmonella/Microsome Test with Desmodur 44M (4,4'-MDI) using TA100, Bayer AG, Fachbereich Toxicology, Report No. 19570, 27 septembre 1990 [cité par ECJRC 2005].
Herbold BA. 1990b. Special study, Salmonella/Microsome Test with Desmodur 44M (4,4'-MDI) using TA100, Bayer AG, Fachbereich Toxicology, Report No. 19570, 27 septembre1990. [Cité par ECJRC 2005].
Herbold B, Haas P, Seel K, Walber U. 1998. Studies on the effect of the solvents dimethylsulfoxide and ethyleneglycoldimethylether on the mutagenicity of four types of diisocyanates in the Salmonella/microsome test. Mut Res 412 : 167-175.
Hiasa Y, Kitahori Y, Enoki N, Konishi N, Shimoyama T. 1984. 4,4'-Diaminodiphenylmethane : promoting effect on the development of thyroid tumors in rats treated with N-bis(2-hydroxypropyl)nitrosamine. J Natl Cancer Inst 72(2) : 471-6. [Cité par ATSDR 1998].
Hoffmann HD, Leibold E, Ehnes C, Fabian E, Landsiedel R, Gamer A, Poole A. 2010. Dermal uptake and excretion of 14C-toluene diisocyanate (TDI) and 14C-methylene diphenyl diisocyanate (MDI) in male rats. Clinical signs and histopathology following dermal exposure of male rats to TDI. Toxicol Lett 199(3) : 364-371.
Hoffmann HD, Schupp T. 2009. Evaluation of consumer risk resulting from exposure against diphenylmethane-4,4'-diisocyanate (MDI) from polyurethane foam. EXCLI J 8 : 58-65.
Holdren MW, Spicer CW, Riggin RM. 1984. Reaction of toluene diisocyanate with water vapour. Am Ind Hyg Assoc J 45(9) :626-633.
Holland JM, Smith LH, Frome E et coll. 1987. Test of Carcinogenicity in Mouse Skin: Methylenedianiline, gamma Glycidyloxytrimethyloxysilane, gamma Aminopropyltriethoxysilane and a mixture of M-phenylenediamine, methylenedianiline, and diglycidylether of Bisphenol-A. Govt Reports Announcements & Index (GRA&I)(23.) [Cité par ATSDR 1998].
Hoymann HG, Buschmann J, Heinrich U. 1995. Examinations about the chronic toxicity/carcinogenicity of 4,4'-mehtylene diphenyl diisocyanate (MDI). Fraunhofer-Institut fur Toxikologie and Aerosolforschung, Hannover, Allemagne. Report No. 116-06-084. [Cité par US EPA 1998; Feron et coll. 2001; ECJRC 2005]
[HPD] Household Products Database. 2013. Methylene bisphenyl diisocyanate (MDI) [Internet]. Washington (DC): US National Library of Medicine, National Institutes of Health. [Consulté en juin 2012].
[HSDB] Hazardous Substances Data Bank [base de données Internet]. 1983-2003. Résultats de recherche pour le numéro CAS 101-77-9. Bethesda (MD) : National Library of Medicine (US.) [consulté en juillet 2013].
[IARC] International Agency For Research On Cancer. 1986. WHO monographs on the evaluation of carcinogenic risks to humans. Volume 39: Some chemicals used in plastics and elastomers. IARC Working Group on the Evaluation of Carcinogenic Risk of Chemicals to Humans. [Consulté le 13 août 2012].
[IARC] International Agency For Research On Cancer. 1999. WHO monographs on the evaluation of carcinogenic risks to humans. Volume 71: re-evaluation of some organic chemicals, hydrazine and hydrogen peroxide 71 : 1049-1058. IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. [consulté le 7 août 2012].
[IBTL] Industrial BIO-TEST Laboratories Inc. 1973. Report to CIBA-GEIGY Corporation. Acute Toxicity Studies with FA-56 and FA-57. Unpublished report Nr. IBT No. 601-03110 (24.04.1993.) (Travaux non publiés.) [Cité par ECJRC 2001;OECD 2002].
International Isocyanate Institute Inc. (III.) 1978a. Unpublished report Nr. MA-12-77-5 (08.09.1978.) (Travaux non publiés.) [Cité par ECJRC 2001;OECD 2002].
International Isocyanate Institute Inc. (III.) 1978b. Unpublished report Nr. MA-12-77-6 (14.09.1978.) (Travaux non publiés.) [Cité par ECJRC 2001;OECD 2002].
[IPCS] International Programme on Chemical Safety. 1999. Environmental Health Criteria 212: Principles and methods for assessing allergic hypersensitization associated with exposure to chemicals.
[IPCS] International Programme on Chemical Safety. 2000. Concise International Chemical Assessment. Document 27: Diphenylmethane diisocyanate (MDI).
[IPCS] International Programme on Chemical Safety. 2005. OECD SIDS 4,4' Methylenedianiline. UNEP: World Health Organization. (Environmental Health Criteria 75). Sous leparrainage conjoint du Programme des Nations Unies sur l'Environnement, l'Organisation internationale du trvail et l'Organisation mondiale de la Santé.
[IPCS] International Programme on Chemical Safety. 2012. Harmonization Project Document No. 10: Guidance for immunotoxicity risk assessment for chemicals.
Ishizu S, Goto T. 1980. Preliminary study on skin sensitisation caused by MDI solution, Report to the International Isocyanate Institute. [Cité par ECJRC 2005].
[ISOPA]. European Diisocyanate and Polyol Producers Association. 2013. GPS Safety Summary. Avenue E. Van Nieuwenhuyse Laan 4, 1160 Brussels Belgium.
[JETOC] Japan Chemical Industry Ecology-Toxicology and Information Center. 1982. Micronucleus test, report of the Japan Chemical Industry Ecology, Toxicology and Information Centre. [Cité par ECJRC 2005].
Johnson BT. 2005. Microtox® acute toxicity test. In : Small-scale freshwater toxicity investigations. Vol. 1: Toxicity test methods. Blaise C, Férard J-F, editors. p. 69-105. Dordrecht, Netherlands : Springer Netherlands.
Kaiser KLE, Palabrica VS. 1991. Photobacterium phosphoreum toxicity data index. Water Poll Res J Can 26(3) : 361-431.
Kakooei H, Shahtaheri SJ, Karbasi HA. 2006. Evaluation of workers' exposure to methylene diphenyl diisocyanate (MDI) in an automobile manufacturing company, Iran. Int J Occup Saf Ergon 12(4) : 443-449.
Kanerva L, Estlander T, Jolanki R, Keskinen H. 2001. Asthma from diisocyanates is not mediated through a Type IV, patch-test-positive mechanism. Contact Dermatitis 44(4): 246-263.
Karol MH. 1986. Respiratory effects of inhaled isocyanates. CRC Cr Rev Toxicol 16(4) : 349-379.
Karol MH, Thorne PS. 1988. Respiratory hypersensitivity and hyper-reactivity : implications for assessing allergic responses. In : Gardner DE, Carpo JD, Massaro EJ (Eds), Toxicology of the Lung, Raven Press, New York, p. 427 [cité par Pauluhn and Mohr 1994].
Karoly WJ, Flatley JJ, Stevenson RD, Bowers JD. 2004. Airborne concentrations of methylene diphenyl diisocyanate (MDI) in North American wood mills during the manufacturing of oriented strand board (OSB). J Occup Environ Hyg 1(12) :789-798.
Kelly BC, Ikonomou MG, Blair JD, Morin AE, Gobas FAPC. 2007. Food web-specific biomagnification of persistent organic pollutants. Science 317(5835) : 236-239.
Kennedy AL, Brown WE. 1998. Biochemical and histoautoradiographic characterization of the distribution of radioactivity following exposure to 14C-MDI aerosol, Project 103-AM-MTX, International Isocyanate Institute, 20 novembre 1998. [Cité par ECJRC 2005].
Kieć-Świerczyńska M, Swierczyńska-Machura D, Chomiczewska-Skóra D, Nowakowska-Świrta E, Kręcisz B. 2014. Occupational allergic and irritant contact dermatitis in workers exposed to polyurethane foam. Int J Occup Med Environ Health 27(2) : 196-205.
Kilgour JD, Rattray NJ, Foster J, Soames A, Hext PM. 2002. Pulmonary responses and recovery following single and repeated inhalation exposure of rats to polymeric methylene diphenyl diisocyanate aerosols. J Appl Toxicol 22(6) : 371-385.
Kim M, Jang J, Lee I, Le H, Yoon J. 2002. Toxicity and biodegradation of diamines. J Environ Sci Health B 37(1) : 53-64.
Kimber I, Derman RJ, Basketter DA, Ryan CA, Gerberick GF, McNamee P, Lalko J, Api AM. 2008. Dose metrics in the acquisition of skin sensitization : thresholds and importance of dose per unit area. Regul Toxicol Pharmacol 52(1) : 39-45.
[KOAWIN] Octanol Air Partition Coefficient Program for Microsoft Windows [Estimation Model]. 2008. Version 1.10. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.
[KOCWIN] Organic Carbon Partition Coefficient Program for Windows [Estimation Model]. 2010. Version 2.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [Consulté le 22 mars 2013].
Kolmodin-Hedman B, Alexanderrson R, Hedenstierna G. 1980. Diisocyanater - MDI: Lungfysiologiska undersökningar på personal i plastindustri [Diisocyanates - études de la physiologie du poumon sur le personnel de l'industrie des plastiques]. Arbete och hälsa 10 : 4. [Cité par DFG 1997]. [Article en suédois]
Kopelman H, Robertson MH, Sanders PG, Ash I. 1966a. The Epping jaundice. Br Med J 1(5486) : 514-516.
Kopelman H, Scheuer PJ, Williams R. 1966b. The Liver Lesion of the Epping Jaundice. Q J Med New Series 35: 553-564.
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [Estimation Model]. 2010. Version 1.68. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.
Krone CA, Ely JTA, Klingner T, Rando RJ. 2003. Isocyanates in flexible polyurethane foams. Bull Environ Contam Toxicol 70(2) : 328-335.
Krone CA, Klingner TD. 2005. Isocyanates, polyurethane and childhood asthma. Pediatr allergy immunol 16(5) : 368-379.
Laboratoire d'Études du Métabolisme des Médicaments. 1977. Pharmokinetics of MDI after inhalation exposure of rats to labelle MDI. Rapport présenté à l'International Isocyanate Institute, septembre 1977, par le Laboratoire d'Études du Métabolisme des Médicaments (LEMM), Commissariat à l'énergie atomique, France. [Cité par ECJRC 2005].
Rosell L, Vestergren M. 2012. Selena straw foams MDI emission report from one-component foam. EPA-HQ-OPPT-2011-0182. Le rapport a également été déposé par l'American Chemistry Council's Center for the Polyurethanes Industry à Environnement Canada le 31 octobre 2014.
Le Moual N, Kauffmann F, Eisen EA, Kennedy SM. 2008. The healthy worker effect in asthma : work may cause asthma, but asthma may also influence work. Am J Respir Crit Care Med 177(1) : 4-10.
Leibold E, Hoffmann HD, Hildebrand B. 1998. 14C-Methylenbisphenylisocyanate (14C-MDI) - Study of the absorption after single dermal and intradermal administration in rats. BASF Aktiengesellschaft Toxicology, Ludwigshafen/Rhein, Draft report project no. 01B0431/946010, III project no. 126-EU-MTX, 1998. [Cité par ECJRC 2005].
Lemière C, Romeo P, Chaboillez S, Tremblay C, Malo JL. 2002. Airway inflammation and functional changes after exposure to different concentrations of isocyanates. J Allergy Clin Immunol 110(4) :641-646.
Leong BK, Lund JE, Groehn JA, Coombs JK, Sabaitis CP, Weaver RJ, Griffin RL. 1987. Retinopathy from inhaling 4,4'-methylenedianiline aerosols. Fundam Appl Toxicol 9(4) :645-658.
Leroyer C, Perfetti L, Cartier A, Malo JL. 1998. Can reactive airways dysfunction syndrome (RADS) transform into occupational asthma due to "sensitisation" to isocyanates? Thorax 53(2): 152-153.
Lesage J, Stanley J, Karoly WJ, Lichtenberg FW. 2007. Airborne methylene diphenyl diisocyanate (MDI) concentrations associated with the application of polyurethane spray foam in residential construction. J Occup Environ Hyg 4(2) : 145-155.
Lide DR, editor. 2003. CRC Handbook of Chemistry and Physics. 84th Edition. Boca Raton, FL : CRC Press.
Lidén C. 1980. Allergic contact dermatitis from 4,4'diisocyanato-diphenyl methane (MDI) in a molder. Contact Dermatitis 6(4) : 301-302.
Lindberg HK, Korpi A, Santonen T, Säkkinen K, Järvelä M, Tornaeus J, Ahonen N, Järventaus H, Pasanen AL, Rosenberg C, Norppa H. 2011. Micronuclei, hemoglobin adducts and respiratory tract irritation in mice after inhalation of toluene diisocyanate (TDI) and 4,4'-methylenediphenyl diisocyanate (MDI). Mutat Res 723(1) : 1-10.
Liss, GM, Bernstein, DI, Moller, DR, Gallagher, JS, Stephenson, RL, Bernstein, IL. 1988. Pulmonary and immunologic evaluation of foundry workers exposed to methylene diphenyldiisocyanate (MDI). J Allergy Clin Immunol 82(1) : 55-61. [Cité par US EPA 1998].
Liss, G.M., Chrostek, W. 1983. NIOSH Health Hazard Evaluation Report, HETA 82-146-1388, Boeing Vertol Company (Cité par OECD 2002).
Liu Q, Wisnewski AV. 2003. Recent developments in diisocyanate asthma. Ann Allergy Asthma Immunol 90(5 Suppl 2) : 35-41.
Liu Y, Sparer J, Woskie SR, Cullen MR, Chung JS, Holm CT, Redlich CA. 2000. Qualitative assessment of isocyanate skin exposure in auto body shops: a pilot study. Amer J Ind Med 37(3) : 265-274.
Loveless SE, Api AM, Crevel RWR, Debruyne E, Gamer A, Jowsey IR, Kern P, Kimber I, Lea L, Lloyd P, Mehmood Z, Steiling W, Veenstra G, Woolhiser M, Hennes C. 2010. Potency values from the local lymph node assay: Application to classification, labelling and risk assessment. Regul Toxicol Pharmacol 56(1) : 54-66.
Lowenkron S. 2000. Amines, aromatic, methylenedianiline. In : Kirk-Othmer Encyclopedia of Chemical Technology. New York (NY) : John Wiley & Sons, Inc. p. 1-11.
[LSAS] Least-Squares Adjustment Spreadsheet (version 1.1). 2005. Zurich (CH): Safety and Environmental Technology Group.
Lushniak BD, Reh CM, Bernstein DI, Gallagher JS. 1998. Indirect assessment of 4,4'-diphenylmethane diisocyanate (MDI) exposure by evaluation of specific humoral immune responses to MDI conjugated human serum albumin. Am J Ind Med 33(5) : 471-477.
MacNab, JI. 1999. Determination of Physical Properties of 4,4'-MDA. International Isocyanate Institute Inc. Project 146. [Accès limité].
Maddison P, Merckx EMB. 1996. Responsible care programmes. Forestry & Forest Prod Int p. 107-110.
Mäki-Paakkanen J, Norppa H. 1987. Chromosome aberrations and sister-chromatid exchanges induced by technical grade toluene diisocyanate and methylenediphenyl diisocyanate in cultured human lymphocytes. Toxicol Lett 36(1): 37-43.
Malo JL, Zeiss CR. 1982. Occupational hypersensitivity pneumonitis after exposure to diphenylmethane diisocyanate. Am Rev Respir Dis 125(1) : 113-116.
Marczynski B, Ammon J, Seemann U, Zimmermann B, Marek W, Baur X. 1994a. Untersuchungen zur gentoxizität und apoptose im blut von diisocynat-exponierten arbeitern. [En allemand] Atemw Lungen Kr 20 : 456-457. [Cité par ECJRC 2005]
Marczynski B, Seemann U, Ammon J, Broding H, Marek W, Baur X. 1994b. Analysis of DNA fragmentation in white blood cell debris of workers exposed to diisocyanates. Book of Abstracts-Eurotox'94. Toxicol Letters 74(s1): 53.
Marczynski B, Merget R, Mensing T, Rabstein S, Kappler M, Bracht A, Haufs MG, Käfferlein HU, Brüning T. 2005. DNA strand breaks in the lymphocytes of workers exposed to diisocyanates : indications of individual differences in susceptibility after low-dose and short-term exposure. Arch Toxicol 79(6) : 355-362.
Martin F, Fichet D, Arsanian G, Leloup MC. 1982. Enquête épidémiologique sur la toxicité des isocyanates en milieu industriel. Arch Mal Prof 43 : 481 [cité par DFG 1997].
Massone L, Anonide A, Borghi S, Isola V. 1990. Significato clinico di test epicutanei positivi al diaminodifenilmetano. Folia Allergol Immunol Clin 37 : 259-262.
Matsuoka A, Haishima Y, Hasegawa C, Matsuda Y, Tsuchiya T. 2008. Organic-solvent extraction of model biomaterials for use in the in vitro chromosome aberration test. J Biomed Mater Res A 86(1) : 13-22.
McCoy M, Anderson K, Boyd C. 2013. Inhalation study of Gorilla Glue. GZA GeoEnvironmental Inc. Study presentation at Isocyanates and Health Conference, Potomac, (Maryland).
McGill DB, Motto JD. 1974. An industrial outbreak of toxic hepatitis due to methylenedianiline. N Engl J Med 291(6) : 278-82. [Cité par ATSDR 1998; ECJRC 2001; OECD 2002].
McGregor DB. 1981a. Testing the mutagenic potential of HE1003 in the mouse lymphoma assay, Inveresk Research International Report No. 1906, janvier 1981, to Bayer AG Institut fur Toxikologie. [Cité par ECJRC 2005].
McGregor DB. 1981b. Testing the mutagenic potential of HE1003 in the mouse lymphoma assay, Inveresk Research International Report No. 1883, janvier 1981, to Bayer AG Institut fur Toxikologie. [Cité par ECJRC 2005].
McGregor DB, Brown A, Cattanach P, Edwards I, McBride D, Riach C, Caspary WJ. 1988. Responses of the L5178Y tk+/tk- mouse lymphoma cell forward mutation assay: III. 72 coded chemicals. Environ Mol Mutagen 12(1) :85-154. [Cité par ATSDR 1998; ECJRC 2001; OECD 2002.
McDonnell ME. 1971. Production of skin sensitization by inhalation of isocyanates. Haskell Laboratory Report No. 161-71. Sponsored by E.I. du Pont Nemours and Company. OTS No. 86910000460.
MDI Consortium. 2012. Chemical Safety Report on 4,4'-methylenediphenyl diisocyanate CAS No. 101-68-8. Rapport produit pour l'Agence européenne des produits chimiques (ECHA).
Mei CF, Liu YZ, Long WN, Sun GP, Zeng GQ, Xu MY, Luan TG. 2015. A comparative study of biodegradability of carcinogenic aromatic amine (4,4'-Diaminodiphenylmethane) with OECD 301 test methods. Ecotoxicol Environ Saf 111 : 123-130.
Meredith SK, Bugler J, Clark RL. 2000. Isocyanate exposure and occupational asthma: a case-referent study. Occup Environ Med 57(12) :830-836.
Methner MM, McKernan JL, Dennison JL. 2010. Occupational health and safety surveillance task-based exposure assessment of hazards associated with new residential construction. Appl Occup Environ Hyg 15(11) :811-819.
Michalopoulos GK, Barua L, Bowen WC. 2005. Transdifferentiation of rat hepatocytes into biliary cells after bile duct ligation and toxic biliary injury. Hepatology 41(3) : 535-544.
[MIFACE] Michigan Fatality and Control Evaluation. 2003. Manager of after-market truck bed liner store dies of asthmatic attack after spraying van with isocyanate-based truck bed liner. Lansing (Michigan) : Michigan State University, Occupational and Environmental Medicine, Michigan Fatality and Control Evaluation, MIFACE Investigation 03M1018. [Cité par NIOSH 2006].
[MIOSHA] Michigan Occupational Safety and Health Administration. 2004. MIOSHA isocyanate alert: spray-on truck-bed liner operation proves fatal. Lansing, (Michigan): Michigan Occupational Safety and Health Administration, Department of Labor and Economic Growth. [Cité par NIOSH 2006].
Mirsalis J, Tyson K, Beck J et coll. 1983. Induction of unscheduled DNA synthesis (UDS) in hepatocytes following in vitro and in vivo treatment. Environ Mutagen 5 : 482.
Mirsalis JC, Tyson CK, Steinmetz KL, Loh EK, Hamilton CM, Bakke JP, Spalding JW. 1989. Measurement of unscheduled DNA synthesis and S-phase synthesis in rodent hepatocytes following in vivo treatment : testing of 24 compounds. Environ Mol Mutagen 14(3) : 155-164.
[MITI] Ministry of International Trade & Industry Japan. 1992. Biodegradataion and bioaccumulation data of existing chemicals based on the CSCL Japan. Japan Chemical Industry Ecology-Toxicology & Information Center, octobre 1992. [Accès limité].
Mitsubishi Chemical Safety Institute. 2002a. Final report of acute immobility test against Daphnia magna by 4,4-methylene bis benzene amine (test number : A010459-2). Rapport non publié au ministère de l'Environnement du Japon. Traduction vers l'anglais réalisée pour l'International Isocyanate Institute c2008. 32 p.
Mitsubishi Chemical Safety Institute. 2002b.Final report of reproduction inhibition test against Daphnia magna by 4,4-methylene bis benzene amine (test number: A010459-3). Rapport non publié au ministère de l'Environnement du Japon. Traduction vers l'anglais réalisée pour l'International Isocyanate Institute c2008. 41 p.
Miyamoto J, Okuno Y, Kadota T, Mihara, K. 1977. Experimental hepatic lesions and drug metabolizing enzymes in rats. J Pestic Sci (Nihon Noyakugaku Kaishi) 2(3) : 257-270.
Moore WM. 1978. Methylenedianiline. In : Kirk-Othmer Encyclopedia of Chemical Technology, edited by Mark HF, Othmer DF, Overberger CG, and Seaborg GT, New York (NY) : John Wiley & Sons, p. 338-348.
Mori H, Yoshimi N, Sugie S, Iwata H, Kawai K, Mashizu N, Shimizu H. 1988. Genotoxicity of epoxy resin hardeners in the hepatocyte primary culture/DNA repair test. Mutat Res 204(4) :683-688. [Cité par ATSDR 1998; ECJRC 2001; OECD 2002].
Mormann W, Vaquero RL, Seel K. 2006. Interactions of aromatic isocyanates with N-acetyl-L-cysteine under physiological conditions : formation of conjugates, ureas and amines. EXCLI J 5 : 191-208.
Mortensen SK, Trier XT, Foverskov A, Peterson JH. 2005. Specific determination of 20 primary aromatic amines in aqueous food simulants by liquid chromatography-electrospray ionization-tandem mass spectrometry. J Chromatography A 1091(1-2) : 40-50.
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [Estimation Model]. 2010. Version 1.43. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [Consulté le 22 mars 2013].
Moser Th, Schott C. 2011. 4,4'-MDA : toxicity to the collembolan species Folsomia candida, Chemisches Institut Pforzheim Gmhb ECT Oekotoxikologie GmbH project# 11AD1CR. [Accès limité].
Musk AW, Peters JM, DiBerardinis L, Murphy RL. 1982. Absence of respiratory effects in subjects exposed to low concentrations of TDI and MDI. J Occup Med 24(10) :746-750.
Musk AW, Peters JM, Berstein L. 1985. Absence of respiratory effects in subjects exposed to low concentrations of TDI and MDI : a reevaluation. J Occup Med 27(12) :917-920.
Myer HE, Cummings BJ. 2005. Safety considerations for Application of Spary-On Truck Bed Liners.
[NCASI] National Council of Air and Stream Improvements. 2012. Draft forest product industry methylene diphenyl diisocyanate (MDI) fact sheet. Ébauche datée du 19 mars 2012. Déposé à la Division de la mobilisation et de l'élaboration de programmes d'Environnement Canada, par l'Association des produits forestiers du Canada (APFC) et la NCASI le 5 octobre 2012. 5 p.
[New EQC] Equilibrium Criterion Model. 2011. Version 1.0 (Beta.) Peterborough (Ontario): Canadian Environmental Modelling Centre de l'université Trent. [2013-03-14].
[BDIPSN] Base de données sur les ingrédients des produits de santé naturels [database on the Internet]. 2013. Santé Canada. [Consulté en avril 201302 12].
[NIOSH] National Institute for Occupational Safety and Health. 1996. Preventing asthma and death from diisocyanate exposure DHHS. DHHS (NIOSH) publication number 96-111. Department of Health and Human Services, Centers for Disease Control and Prevention, National Institute for Occupational Safety and Health. [Consulté le 8 août 2012].
[NIOSH] National Institute for Occupational Safety and Health. 2006. Preventing asthma and death from MDI exposure during spray-on truck bed liner and related applications. DHHS (NIOSH) publication number 2006-149. [Consulté le 15 août 2012].
[INRP] Inventaire national des rejets de polluants [database on the Internet]. 1995a. Recherche de données dans L'INRP pour 4,4'-MDA (CAS RN 101-77-9) pour la période 2008-2013. Gatineau, Québec : Environnement Canada. [Consulté en févr. 2015].
[INRP] Inventaire national des rejets de polluants [database on the Internet]. 1995b. Recherche de données dans L'INRP pour pMDA (CAS RN 25214-70-4) pour la période 2008-2013. Gatineau, Québec : Environnement Canada. [Consulté en févr. 2015].
[INRP] Inventaire national des rejets de polluants [database on the Internet]. 1995c. Recherche de données dans L'INRP pour 4,4'-MDI (CAS RN 101-68-8) et pMDI (CAS RN 9016-87-9). Gatineau, Québec : Environnement Canada. [Consulté en févr. 2015].
[NRC] National Research Council. 2011. Evaluation Listing CCMC 13447-L. [Consulté en novembre 2015].
[NTP] National Toxicology Program. 1983. Technical Report on the Carcinogenesis Studies of 4,4'-Methylenedianiline Dihydrochloride (CAS No. 13552-44-8) in F344/N Rats and B6C3FI Mice (Drinking Water Studies.) U.S. Department of Health and Human Services. NTP-81-143, NIH Publication No. 83-2504, NTP TR 248.
[NTP] National Toxicology Program. US Department of Health and Health Services. 2005. Report on Carcinogens, Eleventh Edition. 4,4'-Methylenedianiline and Its Dihydrochloride Salt. CAS Nos. 101-77-9 and 13552-44-8.
[NTP] National Toxicology Program. US Department of Health and Health Services. 2011. 4,4' Methylenedianiline and its dihydrochloride. Report on Carcinogens, Twelfth Edition. Research Triangle Park, (North-Carolina): U.S. Department of Health and Human Services, Public Health Service, National Toxicology Program. pp. 265.
O'Brien IM, Harries MG, Burge PS, Pepys J. 1979. Toluene di-isocyanate-induced asthma. I. Reactions to TDI, MDI, HDI and histamine. Clin Allergy 9(1) : 1-6.
[OCDE] Organisation de coopération et de développement économiques. 2002. Summary risk assessment report : 4,4'-Methylenedianiline(MDA): (1st Priority List): CAS no. 101-77-9: EINECS no. 202-974-4 [Internet]. Genève (Suisse): Programme des produits chimiques du PNUE [Consulté en janvier 2013].
[OCDE] Organisation de coopération et de développement économiques. 2003. SIDS Initial Assessment Profile from SIAM 17, 11 au 14 novembre 2003. CAS No. 26447-40-5. Methylenediphenyl diisocyanate [consulté le 15 août 2012].
[OCDE] Organisation de coopération et de développement économiques. 2004. The 2004 OECD list of high production volume chemicals. Paris (France) : OECD, Environment Directorate, Environment, Helath and Safety Division. 143 p.
[OCDE] Organisation de coopération et de développement économiques. 2011. Emission scenario document on radiation curable coating, inks and adhesives. Series on Emission scenario documents number 27 [Internet]. Paris (FR) : OECD Environmental Directorate, Environmental Health and Safety Division. ENV/JM/MONO(2011)17, JT03304942.[consulté en mars 2013].
O'Neil, MJ et coll. 2006. The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. 14th ed. Whitehouse Station (New-Jersey): Merck. 2564 p.
Oprea S. 2011. Degradation of crosslinked poly(ester-urethanes) elastomers in distilled water: influence of hard segment. J Appl Polym Sci 124(2) : 1059-1066.
[OSHA] Occupational Safety and Health Administration. 2012. Permissible exposure limit: Table Z-1 Limits for Air Contaminants. 29 CFR 1910.1000. [Internet]. [Consulté le 16 août 2012].
Parodi S, Taningher M, Russo P, Pala M, Tamaro M, Monti-Bragadin C. 1981. DNA-damaging activity in vivo and bacterial mutagenicity of sixteen aromatic amines and azo-derivatives, as related quantitatively to their carcinogenicity. Carcinogenesis (LOND) 2(12) : 1317-1326.
Parodi S, Zunino A, Ottaggio L, De Ferrari M, Santi L. 1983. Lack of correlation between the capability of inducing sister-chromatid exchanges in vivo and carcinogenic potency, for 16 aromatic amines and azo derivatives. Mutat Res 108(1-3) : 225-238.
Pauluhn J. 1995. Diphenylmethane-4,4'-diisocyanate (MDI-monomer) Evaluation of respiratory sensitization in guinea-pigs following brief high-level inhalation induction exposure and challenge with ramped MDI concentrations. Bayer Study No. T1058323, III-Project 121-EU-MTX, 30 mai 1995.[cité par ECJRC 2005].
Pauluhn J. 2000. Acute inhalation toxicity of polymeric diphenyl-methane 4,4'-diisocyanate in rats : time course of changes in bronchoalveolar lavage. Arch Toxicol 74(4-5) : 257-269.
Pauluhn J. 2002. Short-term inhalation toxicity of polyisocyanate aerosols in rats : comparative assessment of irritant-threshold concentrations by bronchoalveolar lavage. Inhal Toxicol 14(3): 287-301.
Pauluhn J. 2008a. Brown Norway rat asthma model of diphenylmethane-4,4'-diisocyanate (MDI) : Analysis of the elicitation dose-response relationship. Toxicol Sci 104(2) : 320-331.
Pauluhn J. 2008b. Brown Norway rat asthma model of diphenylmethane-4,4'-diisocyanate (MDI) : impact of vehicle for topical induction. Regul Toxicol Pharmacol 50(1) : 144-154.
Pauluhn J, Mohr U. 1994. Assessment of respiratory hypersensitivity in guinea-pigs sensitized to diphenylmethane-4,4'-diisocyanate (MDI) and challenged with MDI, acetylcholine or MDI-albumin conjugate. Toxicology 92(1-3) : 53-74.
Pauluhn J, Gollapudi B, Hammond T, Linscombe A, Thiel A, Zischka-Kuhbier D. 2001. Bone marrow micronucleus assay in Brown-Norway rats exposed to diphenyl-methane-4,4'-diisocyanate. Arch Toxicol 75(4) : 234-242.
Pauluhn J, Poole A. 2011. Brown Norway rat asthma model of diphenylmethane-4,4'-diisocyanate (MDI) : Determination of the elicitation threshold concentration of after inhalation sensitization. Toxicol 281 : 15-24.
Peiser M, Tralau T, Heidler J, Api AM, Arts JH, Basketter DA, English J, Diepgen TL, Fuhlbrigge RC, Gaspari AA, Johansen JD, Karlberg AT, Kimber I, Lepoittevin JP, Liebsch M, Maibach HI, Martin SF, Merk HF, Platzek T, Rustemeyer T, Schnuch A, Vandebriel RJ, White IR, Luch A. 2012. Allergic contact dermatitis : epidemiology, molecular mechanisms, in vitro methods and regulatory aspects. Current knowledge assembled at an international workshop at BfR, Allemagne. Cell Mol Life Sci 69(5) :763-781.
Perfetti L, Bramé B, Ferrari M, Moscato G. 2003. Occupational asthma (OA) with sensitization to diphenylmethane diisocyanate (MDI) presenting at the onset like a reactive airways dysfunction syndrome (RADS). Am J Ind Med 44(3) : 325-328.
Petsonk EL, Wang ML, Lewis DM, Siegel PD, Husberg BJ. 2000. Asthma-like symptoms in wood product plant workers exposed to methylene diphenyl diisocyanate. Chest 118(4) : 1183-1193.
Pezzini A, Riviera A, Paggiaro P, Spiazzi A, Gerosa F, Filieri M, Toma G, Tridente G. 1984. Specific IgE antibodies in twenty-eight workers with diisocyanate-induced bronchial asthma. Clin Allergy 14(5) : 453-461. [Cité par US EPA 1998].
Pham QT, Cavelier C, Mereau P, Mur JM, Cicollella A. 1978. Isocyanates and respiratory function: A study of workers producing polyurethane foam moulding. Ann Occ Hyg 21(2) : 121-129.
Pham QT, Teculescu D, Meyer-Bisch C, Mur JM. 1988. Effects of chronic exposure to diisocyanates. Bull Eur Physiopathol Respir 23(6) : 561-564.
Phipps GL, Ankley GT, Benoit DA, Mattson VR. 1993. Use of the aquatic oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ Toxicol Chem 12(2) : 269-279.
Plitnick LM, Loveless SE, Ladics GS, Holsapple MP, Smialowicz RJ, Woolhiser MR, Anderson PK, Smith C, Selgrade MJK. 2005. Cytokine mRNA profiles for isocyanates with known and unknown potential to induce respiratory sensitization. Toxicology 207(3) : 487-499.
Pludro G, Karlowski K, Mańkowska M, Woggon H, Uhde WJ. 1969. [Toxicological and chemical studies of some epoxy resins and hardeners. I. Study of acute and subacute toxicity of phthalic acid anhydride, 4,4'diaminodiphenylmethane and epoxy resin Epilox EG-34]. Acta Pol Pharm 26(4) : 353-358. [Article en polonais] [Cité par ATSDR 1998].
Poole A, Harris WJ. 1980a. Testing of the cell transformation activity of HE1002, Inveresk Research International, Report No. 1862, novembre 1980, to Bayer AG Institut für Toxicologie. [Cité par ECJRC 2005].
Poole A, Harris WJ. 1980b. Testing of the cell transformation activity of HE1003, Inveresk Research International, Report No. 1863, novembre 1980, to Bayer AG Institut für Toxicologie. [Cité par ECJRC 2005].
Rattray NJ, Botham PA, Hext PM, Woodcock DR, Fielding I, Dearman RJ, Kimber I. 1994. Induction of respiratory hypersensitivity to diphenylmethane-4,4'-diisocyanate (MDI) in guinea pigs. Influence of route of exposure. Toxicology 88(1-3) : 15-30.
Redlich CA. 2010. Skin exposure and asthma: is there a connection? Proc Am Thorac Soc 7(2): 134-137.
Reuzel PGJ, Arts JHE, Kuijpers MHM, Kuper CF. 1990. Chronic toxicity/carcinogenicity inhalation study of polymeric methylenediphenyl diisocyanate aerosol in rats, TNO-CIVO Institutes Report No.V88.122, mars 1990, for the International Isocyanate Institute. [Cité par ECJRC 2005].
Reuzel PGJ, Arts JHE, Lomax LG, Kuijpers MHM, Kuper CF, Gembardt C, Feron VJ, Loser E. JP. 1994a. Chronic inhalation toxicity and carcinogenicity study of respirable polymeric methylene diphenyl diisocyanate (polmeric MDI) aerosol in rats. Fundam Appl Toxicol 22(2) : 195-210. [Cité par US EPA 1998].
Reuzel PGJ, Kuper CF, Feron VJ, Appelman LM, Löser E. 1994b. Acute, subacute and subchronic inhalation toxicity studies of respirable polymeric methylene diphenyl diisocyanate (Polymeric MDI) aerosol in rats. Fundam Appl Toxicol 22(2) : 186-194.
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2006. Consumer Exposure (ConsExpo) Model [Internet]. Version 4.1. The Netherlands : The National Institute for Public Health and the Environment (Rijksinstituut voor Volksgezondheid en Milieu).
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2007. Do-It-Yourself Products Fact Sheet: To assess the risks for the consumer [Internet]. The Netherlands : The National Institute for Public Health and the Environment (Rijksinstituut voor Volksgezondheid en Milieu).
Roberge B, Gravel R, Drolet D. 2009. Diisocyanate-4,4' de diphénylméthane (MDI) - Pratiques de sécurité et concentration lors de pulvérisation de mousse polyuréthane. Rapport R-606. Institut de recherche Robert-Sauvé en santé et en sécurité du travail (IRSST.)
Romaguera C, Garcia-Perez A, Martin-Pascual A, Miranda A. 1981. Diaminodiphenylmethane in standard patch tests. Contact Dermatitis 7(6) : 347-348.
Saclay R. 1977. Pharmacokinetics of MDI after inhalation exposure of rats to labeled MDI. In : Rapport par le Laboratoire d'Études du Métabolisme des Médicaments, Département de Biologie, à l'International Isocyanate Institute [cité par US EPA 1998]
Salinas PE. 2011. Report : 4,4'-MDA-acute toxicity (immobilisation) study in thewater flea Daphnia magna STRAUS. Unpublished report. Parsippany (NJ) : International Isocyanate Institute.
Schafer Jr EW, Bowles Jr WA, Hurlbut J. 1983. The acute oral toxicity, repellency, and hazard potential of 998 chemicals to one or more species of wild and domestic birds. Arch Environ Contam Toxicol 12(3) : 355-382.
Schaefer EC, Carpenter K. 2013. [14C] 4,4'-Methylenedianiline : aerobic mineralization in surface water (OECD Guidline 309.) Wildlife International ProjectNo. : 717E-101. [Accès limité].
Schaefer EC, Ponizovsky A. 2013. [14C] 4,4'-Methylenedianiline : aerobic and anaerobic transformation in aquatic sediment systems (OECD Guideline 308.) Wildlife International Project No. : 717E-102. [Accès limité].
Scheringer M, MacLeod M, Wegmann F. 2009. The OECD Pov and LRTP Screening Tool, Version 2.2, A manual for the OECD POV and LRTP Screening Tool 2.2 that is a follow-up version of the Software POPorNot 1.0 distributed at the OECD/UNEP Workshop on Application of Multimedia Models for Identification of Persistent Organic Pollutants, ETH Zurich (Suisse), avril 2009. Version 2.2
Schmidt P, Burck D, Weigmann HJ. 1974. [Acute toxicity of some for plastic processing industry important amines]. Z Gesamte Hyg 20(7) : 393-8. [Cité par ATSDR 1998]. [Article en allemand]
Schmidt P, Gohlke R, Just A, Rothe R, Burck D, Jager H. 1980. Combined action of hepatotoxic substances and increased environmental temperature on the liver of rats. J Hyg Epidemiol Microbiol Immunol 24(3): 271-276. [Cité par ATSDR 1998].
Schreiber J, Knolle J, Sennekamp J, Schulz KT, Hahn JU, Hering KG, Raulf-Heimsoth M, Merget R. 2008. Sub-acute occupational hypersensitivity pneumonitis due to low-level exposure to diisocyanates in a secretary. Eur Respir J 32(3): 807-811.
Schwarz H. 2013. 4,4'-MDA: effect on nitrification in soil. Experimental Toxicology and Ecology. International Isocyanate Institute Inc. Project # 37G0290/08G264. [Accès limité].
SCREEN3 [Computer Model]. 1995. Version 96043. Research Triangle Park (NC) : US Environmental Protection Agency, Office of Air Quality Planning and Standards, Emissions, Monitoring, and Analysis Division. [Consulté en 2013].
Seldén A, Berg P, Jakobsson R, de Laval J. 1992. Methylene dianiline : assessment of exposure and cancer morbidity in power generator workers. Int Arch Occup Environ Health 63(6) : 403-408.
Sendijarevic V, Sendijarevic A, Sendijarevic I, Bailey RB, Pemberton D, Reimann KA. 2004. Hydrolytic stability of toluene diisocyanate and polymeric methylenediphenyl diisocyanate based polyureas under environmental conditions. Environ Sci Technol 38(4) : 1066-1072.
Shaddock JG, Heflich RH, McMillan DC, Hinson JA, Casciano DA. 1989. Pretreatment with mixed-function oxidase inducers increases the sensitivity of the hepatocyte/DNA repair assay. Environ Mol Mutagen 13(4) : 281-288.
Shelby MD, Erexson GL, Hook GJ, Tice RR. 1993. Evaluation of a three-exposure mouse bone marrow micronucleus protocol: results with 49 chemicals. Environ Mol Mutagen 21(2) : 160-179.
Shkapenko G, Gmitter GT, Gruber EE.1960. Mechanism of the water-isocyanate reaction. Ind Eng Chem 52(7) :605-608.
Shimizu H, Susujki Y, Takemura N, Goto S, Matsushita H. 1985. The results of microbial mutation test for forty-three industrial chemicals. Japan J Ind Health (Sangyō Igaku) 27(6) : 400-419.
Seel K, Walber U, Herbold B, Kopp R. 1999. Chemical behaviour of seven aromatic diisocyanates (toluenediisocyanates and diphenylmethanediisocyanates) under in vitro conditions in relationship to their results in the Salmonella/microsome test. Mutat Res 438(2) : 109-123.
Selgrade M, Boykin EH, Haykal-Coates N, Woolhiser MR, Wiescinski C, Andrews DL, Farraj AK, Doerfler DL, Gavett SH. 2006. Inconsistencies between cytokine profiles, antibody responses, and respiratory hyperresponsiveness following dermal exposure to isocyanates. Toxicol Sci 94(1) : 108-117.
Soil Model. 2005. A model to calculate chemical behaviour in a surface soil layer including roots, version 3. Peterborough (ON) : université Trent, Canadian Environmental Modelling Centre. [Consulté en mai 2013].
Sommer B, Sherson D, Kjøller H, Hansen I, Clausen G, Jepsen J. 2000. [Asthma caused by methylene-diphenyl-diisocyanate cast in a nurse]. Ugeskr Laeger 162(4) : 505-506. [Cité par ECJRC 2005] [Article en danois].
Sorahan T, Nichols L. 2002. Mortality and cancer morbidity of production workers in the UK flexible polyurethane foam industry: updated findings, 1958-98. Occup Environ Med 59(11) :751-758.
Sorahan T, Pope D. 1993. Mortality and cancer morbidity of production workers in the United Kingdom flexible polyurethane foam industry. Br J Ind Med 50(6) : 528-536.
Stingeni L, Bellini V, Lisi P. 2008. Occupational airborne contact urticaria and asthma : simultaneous immediate and delayed allergy to diphenylmethane-4,4'-diisocyanate. Contact Dermatitis 58(2) : 112-113.
Streicher RP, Kennedy ER, and Lorberau CD.1994. Strategies for the simultaneous collection of vapours and aerosols with emphasis on isocyanate sampling. Analyst 119(1) :89-97.
Rapport d'étude. 2012a. Étude confidentielle non publiée, déposée à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Québec): Environnement Canada, Division de la mobilisation et de l'élaboration de programmes. Internal ID: Other_5_V2, p. 47.
Rapport d'étude. 2012b. Étude confidentielle non publiée, déposée à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Québec): Environnement Canada, Division de la mobilisation et de l'élaboration de programmes. Internal ID: Other_5_V2, p. 117.
Rapport d'étude. 2012c. Étude confidentielle non publiée, déposée à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Québec): Environnement Canada, Division de la mobilisation et de l'élaboration de programmes. Internal ID: #8 (original en allemand.)
Rapport d'étude. 2012d. Étude confidentielle non publiée, déposée à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Québec): Environnement Canada, Division de la mobilisation et de l'élaboration de programmes. Internal ID: #11 (original en allemand.)
Rapport d'étude. 2012e. Étude confidentielle non publiée, déposée à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Québec): Environnement Canada, Division de la mobilisation et de l'élaboration de programmes. Internal ID: Other_5_V2, p. 277.
Rapport d'étude. 2012f. Étude confidentielle non publiée, déposée à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Québec): Environnement Canada, Division de la mobilisation et de l'élaboration de programmes. Internal ID: Other_5_V2, p. 575.
Rapport d'étude. 2012g. Étude confidentielle non publiée, déposée à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Québec): Environnement Canada, Division de la mobilisation et de l'élaboration de programmes. Internal ID: Other_5_V2, p. 113.
Rapport d'étude. 2012h. Étude confidentielle non publiée, déposée à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Québec): Environnement Canada, Division de la mobilisation et de l'élaboration de programmes. Internal ID: Other_5_V2, p. 397.
Rapport d'étude. 2012i. Étude confidentielle non publiée, déposée à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Québec): Environnement Canada, Division de la mobilisation et de l'élaboration de programmes. Internal ID: Other_5_V2, p. 669.
Rapport d'étude. 2012j. Étude confidentielle non publiée, déposée à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Québec): Environnement Canada, Division de la mobilisation et de l'élaboration de programmes.
Rapport d'étude. 2012k. Étude confidentielle non publiée, déposée à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Québec): Environnement Canada, Division de la mobilisation et de l'élaboration de programmes. Internal ID: Other_5_V2, p. 17.
Rapport d'étude. 2012l. Étude confidentielle non publiée, déposée à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Québec): Environnement Canada, Division de la mobilisation et de l'élaboration de programmes.
Sulotto F, Romano C, Piolatto G, Coggiola M, Polizzi S, Ciacco C, Berra A. 1990. Short-term respiratory changes in polyurethane foam workers exposed to low MDI concentration. Int Arch Occup Environ Health 62(7): 521-524.
Suojalehto H, Linström I, Henriks-Eckerman ML, Jungewelter S, Suuronen K. 2011. Occupational asthma related to low levels of airborne methylene diphenyl diisocyanate (MDI) in orthopedic casting work. Am J Ind Med 54(12) :906-910.
Suzuki H, Ikeda N, Kobayashi K, Terashima Y, Shimada Y, Suzuki T, Hagiwara T, Hatakeyama S, Nagaoka K, Yoshida J, Saito Y, Tanaka J, Hayashi M. 2005. Evaluation of liver and peripheral blood micronucleus assays with 9 chemicals using young rats. A study by the Collaborative Study Group for the Micronucleus Test (CSGMT)/Japanese Environmental Mutagen Society (JEMS)-Mammalian Mutagenicity Study Group (MMS). Mutat Res 583(2) : 133-145.
[TaPL3] Long Range Transport and Persistence Level III model [Internet]. 2000. Version 2.10. Peterborough (ON) : Université Trent, Canadian Environmental Modelling Centre.
Talini D, Novelli F, Bacci E, de Santis M, Paggiaro PL. 2010. Sequential sensitization to different occupational compounds in a young woman. Med Lav 101(1) : 49-54.
Tanaka KI, Takeoka A, Nishimura F, Hanada S. 1987. Contact sensitivity induced in mice by methylene bisphenyl diisocyanate. Contact Dermatitis 17(4) : 199-204.
Thorgeirsson A. 1978. Sensitization capacity of epoxy resin hardeners in the guinea pig. Acta Derm Venereol (Stockholm) 58(4) : 323-326.
Thorn KA, Pettigrew PJ, Goldenberg WS. 1996. Covalent binding of aniline to humic substances. 2. 15N NMR studies of nucleophilic addition reactions. Environ Sci Technol 30(9): 2764-2775.
Thorne PS, Hillebrand JA, Karol MH. 1986. Pulmonary irritation and hypersensitivity in guinea pigs exposed to 4,4'-diphenylmethane diisocyanate (MDI) aerosol. Toxicologist 6(1): 15 (abstract.)
Thorne PS, Hillebrand JA, Lewis GR, Karol MH. 1987. Contact sensitivity by diisocyanates : Potencies and cross-reactivities. Toxicol Appl Pharmacol 87(1) : 155-165.
[TRI] Toxics Release Inventory [database on the Internet]. 2012. Washington (DC) : US Environmental Protection Agency [consulté en 2013].
Tillmann HL, van Pelt FN, Martz W, Luecke T, Welp H, Dörries F, Veuskens A, Fischer M, Manns MP. 1997. Accidental intoxication with methylene dianiline p,p'-diaminodiphenylmethane: acute liver damage after presumed ecstasy consumption. J Toxicol Clin Toxicol 35(1) : 35-40.
Titebond Inc. 2012. Material Safety Data Sheet. Titebond Polyurethane Glue. [Internet]. Colombus (Ohio) [consulté en févr. 2013].
Tse KS, Johnson A, Chan H, Chan-Yeung M. 1985. A study of serum antibody activity in workers with occupational exposure to diphenylmethane diisocyanate. Allergy 40(5) : 314-320. [Cité par US EPA 1998].
Tsuda H, Ogiso T, Hasegawa R, Imaida K, Masui T, Ito N. 1987. Inhibition of neoplastic development in rat liver, kidney, oesophagus and forestomach by 4,4'-diaminodiphenylmethane administration. Carcinogenesis 8(5) :719-722. [Cité par ATSDR 1998].
Tury B, Pemberton D, Bailey RE. 2003. Fate and potential environmental effects of methylenediphenyl diisocyanate and toluene diisocyanate released into the atmosphere. J Air Waste Manag Assoc 53(1): 61-66.
[US CPSC] US Consumer Product Safety Commission. 2012. Incident reports [Internet] [Consulté le 3 déc. 2012].
[USEPA] US Environmental Protection Agency. 1985. Risk Assessment for 4,4' Methylenedianiline [Internet]. Washington (DC): US EPA, Office of Toxic Substances. [Consulté en févr. 2013].
[USEPA] US Environmental Protection Agency. 1998. Toxicological review of methylene diphenyl diisocyanate (MDI): (CAS No. 101-68-8 and 9016-87-9): in support of summary information on the Intergrated Risk Information System (IRIS) [Internet] Washington (DC): US EPA. [Consulté en 2013].
[USEPA] US Environmental Protection Agency. 2002. AP 42, fifth edition volume 1; chapter 10: wood product industry. Washington (DC): US EPA. Section 10.6.1, Waferboard oriented strandboard. [Consulté en avril 2013].
[USEPA] US Environmental Protection Agency. 2006. Toxic Substances Control Act (TSCA) Section 8(e) submission. [Consulté le 6 décembre 2012].
[USEPA] US Environmental Protection Agency. 2011. Methylene diphenyl diisocyanate (MDI) and related compounds action plan. Washington (DC): US EPA, Office of Pollution Prevention and Toxics.
[USEPA] US Environmental Protection Agency. 2015. Information on the Various Types of Spray Polyurethane Foam Products. [consulté le 3 novembre 2015].
Valks R, Conde-Salazar L, Barrantes OL. 2003. Occupational allergic contact urticaria and asthma from diphenylmethane-4,4'-diisocyanatae. Contact Dermatitis49(3): 166-167.
Van der Hoeven N, Roza P, Henzen L. 1992. Determination of the effect of TDI, TDA, MDI, MDA on the emergence and growth of the plant species Avena sativa and Lactuca sativa according to OECD Guideline no. 208. TNO Institute of Environmental Sciences. Study numbers IMW-91-0032/33/34/36-02/03. [Accès limité].
Van Gheluwe P, Cole KC, Hébrard MJ, Leroux J. 1987. Attenuated total reflectance infrared spectroscopic analysis of high index foams. J Cell Plast 23(1): 73-85.
Van Joost T, Heule F, de Boer J. 1987. Sensitization to methylenedianiline and para-structures. Contact Dermatitis 16(5) : 246-248.
Vandenplas O, Malo JL, Dugas M, Cartier A, Desjardins A, Lévesque J, Shaughnessy MA, Grammer LC. 1993a. Hypersensitivity pneumonitis-like reaction among workers exposed to diphenylmethane [i.e. piphenylmethane] diisocyanate (MDI.) Am Rev Respir Dis 147(2): 338-346.
Vandenplas O, Delwiche JP, Staquet P, Jamart J, Bernard A, Boulanger J, Delaunois L, Sibille Y. 1999. Pulmonary effects of short-term exposure to low levels of toluene diisocyanate in asymptomatic subjects. Eur Respir J 13(5): 1144-1150.
Vock EH, Lutz WK. 1995a. Investigation of adduct formation of 4,4'-methylenediphenyldiisocyanate (MDI) or 4,4'-methylenedianiline (MDA) with DNA or chromatin protein in dermally-exposed rats, for International Isocyanate Institute, III-Projectnumber 123-EU-MTX, 28 novembre 1995. [Cité par ECJRC 2005].
Vock EH, Cantoreggi S, Gupta RC, Lutz WK. 1995b. 32P-postlabeling analysis of a DNA adducts formed in vitro and in rat skin by methylenediphenyl-4,4'-diisocyanate(MDI.) Toxicol Lett 76(1): 17-26.
Vock EH, Hoymann HG, Heinrich U, Lutz WK. 1996. 32P-postlabeling of a DNA adduct derived from 4,4'-methylenedianiline, in the olfactory epithelium of rats exposed by inhalation to 4,4'-methylenediphenyl diisocyanate. Carcinogenesis 17(5) : 1069-1073.
Vock EH, Lutz WK. 1997. Distribution and DNA adduct formation of radiolabeled methylenediphenyl-4,4'-diisocyanate (MDI) in the rat after topical treatment. Toxciol Lett 92(2): 93-100.
Vock EH, Vamvakas S, Gahlman R, Lutz WK. 1998. Investigation of the induction of DNA double-strand breaks by methylenediphenyl-4,4'-diisocyanate in cultured human lung epithelial cells. Toxcol Sci 46(1) :83-89.
Vogelmeier C, Baur X, Fruhmann G. 1991. Isocyanate-induced asthma: results of inhalation tests with TDI, MDI and methacholine. Int Arch Occup Environ Health 63(1): 9-13.
Waalkens-Berendsen DH, Arts JHE. 1992. Report of a developmental toxicity range-finding study of inhaled polymeric MDI aerosol in rats, TNO Nutrition and Food Research, TNO report V92.102, april 1992, to the International Isocyanate Institute. [Cité par ECJRC 2005].
Walker CL, Grammer LC, Shaughnessy MA, Duffy Michele, Stoltzfu VD, Patterson R. 1989. Diphenylmethane diisocyanate hypersensitivity pneumonitis: a serologic evaluation. J Occup Med 31(4) : 315-319.
Wang ML, Petsonk EL. 2004. Symptom onset in the first 2 years of employment at a wood products plant using diisocyanates : some observations relevant to occupational medical screening. Am J Ind Med 46(3) : 226-233.
[WATERNT] Water Solubility Program [Estimation Model]. 2010. Version 1.01. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [Consulté le 22 mars 2013].
Wester RC, Hui X, Landry T, Maibach HI. 1999. In Vivo skin decontamination of methylene bisphenyl isocyanate (MDI): soap and water ineffective compared to polypropylene glycol, polyglycol-based cleanser and corn oil. Toxicol Sci 48(1) : 1-4.
Wirts M, Salthammer T. 2002. Isocyanate emission from PUR adhesives: influence of temperature, monomer content, and curing mechanism. Environ Sci Technol 36(8) : 1827-1832.
Wirts M, Grunwalk D, Schulze D, Uhde E, Salthammer T. 2003. Time course of isocyanate emission from curing polyurethane adhesives. Atmos Environ 37(39-40) : 5467-5475.
Wisnewski AV, Hettick JM, Siegel PD. 2011a. Toluene diisocyanate reactivity with glutathione across a vapor/liquid interface and subsequent transcarbamoylation of human albumin. Chem Res Toxicol 24(10) : 1686-1693.
Wisnewski AV, Xu L, Robinson E, Liu J, Redlich CA, Herrick CA. 2011b. Immune sensitization to methylene diphenyl diisocyanate (MDI) resulting from skin exposure: albumin as a carrier protein connecting skin exposure to subsequent respiratory responses. J Occup Med Toxicol 6 :6.
Won D, Nong G, Lusztyk E, Schleibinger H. 2013. Emissions of MDI from Do-It-Yourself Products. Conseil national de recherches du Canada. Institute de recherches en construction. Ottawa (Ontario). [Tavaux non publiés]
Woolrich PF. 1982. Toxicology, industrial hygiene and medical control of TDI, MDI and PMPPI. Am Ind Hyg Assoc J 43(2) :89-97.
Yakabe Y, Henderson KM, Thompson WC, Pemberton D, Tury B, Bailey RE. 1999. Fate of methylenediphenyl diisocyanate and toluene diisocyanate in the aquatic environment. Environ Sci Technol 33(15) : 2579-2583.
Yakabe Y, Hiromatsu K, Kawahara K, Nakahara M. 2000. Determination of 1-octanol/water partition coefficients of isocyanate compounds by an HPLC method. Toxicol Environ Chem 77(3-4) : 199-206.
Zeiger E. 1987. Salmonella mutagenicity tests : III. Results from testing of 255 chemicals, Environ Mutagen 9 (Suppl 9) : 1-60.
Zeiger E, Anderson B, Haworth S, Lawlor T, Mortelmans K. 1988. Salmonella mutagenicity tests : IV. Results from the testing of 300 chemicals. Environ Mol Mutagen 11(Suppl 12) : 1-18.
Zeiss CR, Kanellakes TM, Bellone JD, Levitz D, Pruzansky JJ, Patterson R. 1980. Immunoglobulin E-mediated asthma and hypersensitivity pneumonitis with precipitating anti-hapten antibodies due to diphenylmethane diisocyanate (MDI) exposure. J Allergy Clin Immunol 65(5) : 347-352.
Zhong BZ, Siegel PD. 2000. Induction of micronuclei following exposure to methylene di-phenyl diisocyanate : potential genotoxic metabolites. Toxicol Sci 58(1) : 102-108.
Zosky GR, Sly PD. 2007. Animal models of asthma. Clin Exp Allergy 37(7):973-988.
Annexes
Annexe A. Justification d'une approche de comparaison (lecture croisée) pour l'évaluation des effets des DMD sur la santé humaine et l'environnement
Certains facteurs à considérer justifient l'utilisation d'une approche de comparaison des analogues entre les membres du sous-groupe des DMD. Les éléments pris en compte pour l'approche de comparaison des analogues sont abordés ci-dessous :
- Similarité structurelle : Comme nous l'avons indiqué dans la section sur l'identité de la substance, les substances DMD couvertes dans le groupe des DMD/MDD partagent des caractéristiques structurelles communes. Le 4,4'-, 2,2'- et 2,4'-DMD sont des isomères positionnels des DMD. Le DMD mélangé contient une composition variable d'isomères 4,4'-, 2,2'- et 2,4'-DMD. Le pDMD comprend principalement des composants monomères des DMD et des composants oligomériques (avec un nombre relativement faible de chaînes de carbone). La position variable du groupe fonctionnel des isocyanates de chaque substance ne devrait pas modifier fortement la toxicité prévue.
- Similarité des propriétés physico-chimiques : Les propriétés physico-chimiques déterminées ou modélisées des substances DMD couvertes dans le groupe des DMD/MDD ont été présentées dans la section sur les propriétés physiques et chimiques. Les isomères positionnels des DMD et du DMD mélangés comportent des masses moléculaires identiques; ils sont généralement solides à la température de la pièce et existent sous forme de poudre. Ces DMD présentent généralement une faible pression de vapeur, des valeurs élevées de log Koa et une très forte réactivité dans l'eau. En raison de la présence de composants homologues dont la masse moléculaire est plus élevée, le pDMD est liquide à la température de la pièce et présente une pression de vapeur et des valeurs de log Koa plus faibles par rapport au monomère DMD. En raison du taux de réaction rapide des groupes isocyanates avec l'eau, on a estimé que d'autres paramètres (c.-à-d. constante de la loi d'Henry, log Koe, log Kco, hydrosolubilité, pKa) ne pouvaient pas être mesurés de façon pratique ou qu'ils ne présentaient pas de pertinence du point de vue de l'environnement.
- Similarité toxicocinétique : Une analyse de la toxicocinétique des substances DMD est proposée dans la section sur la toxicocinétique. Lors d'une exposition par inhalation, les substances DMD se déposent principalement dans les poumons, le système gastro-intestinal et le sang, puis dans le foie et les reins. L'excrétion se fait principalement par les matières fécales et une plus petite quantité est éliminée dans l'urine. La voie métabolique sous-entend un processus d'acétylation suivi d'une oxydation. Les substances DMD comportent des groupes fonctionnels isocyanates, qui peuvent se lier aux protéines telles que le glutathion et l'albumine. Les études toxicocinétiques réalisées sur des animaux ont indiqué que l'absorption cutanée systémique des DMD est faible (Leibold et coll. 1998; Hoffmann et coll. 2010).
- Similarité de la toxicité pour les mammifères : L'examen des données existantes sur la toxicité pour les membres du groupe des DMD est abordé dans la section sur l'évaluation des effets sur la santé. Les données disponibles indiquent que les membres du groupe ont un comportement semblable.
Génotoxicité. Les données tirées des études de génotoxicité in vitro (p. ex., essais de mutation bactériologiques, essai sur les lymphomes de souris, échange de chromatides sœurs, essai sur l'aberration chromosomique, transformation des cellules, dommages à l'ADN) et les données extraites des études de génotoxicité in vivo (p. ex., adduit à l'ADN, induction de micronoyaux) ont été étudiées. Les résultats des études de génotoxicité sur les membres du groupe étaient semblables.
Toxicités critiques des mammifères. Les preuves indiquent que tous les membres du groupe des DMD présentent des effets respiratoires, une sensibilisation respiratoire et une sensibilisation cutanée semblables. Les études portant sur la cancérogénicité par inhalation réalisées sur des animaux révèlent quelques incidences des tumeurs aux poumons après avoir exposé les animaux à de fortes concentrations. La sensibilisation respiratoire et cutanée liée aux DMD a aussi été déclarée chez les humains. Le groupe fonctionnel isocyanate est responsable des effets de sensibilisation et sa présence est notée dans tous les membres du groupe des DMD. - Similarité de l'écotoxicité : ELes preuves indiquent que tous les membres du groupe des DMD présentent des effets respiratoires, une sensibilisation respiratoire et une sensibilisation cutanée semblables. Les études portant sur la cancérogénicité par inhalation réalisées sur des animaux révèlent quelques incidences des tumeurs aux poumons après avoir exposé les animaux à de fortes concentrations. La sensibilisation respiratoire et cutanée liée aux DMD a aussi été déclarée chez les humains. Le groupe fonctionnel isocyanate est responsable des effets de sensibilisation et sa présence est notée dans tous les membres du groupe des DMD.
- Autres renseignements à l'appui : L'Union européenne a publié un rapport d'évaluation des risques pour les DMD en 2005. La désignation générale des « DMD » définie par l'Union européenne incluait un certain nombre de composés isomériques avec la formule empirique C15H10N2O2, ainsi que des prépolymères et des polymères basés sur ces isomères (Centre commun de recherche de la Commission européenne 2005), qui ont tous été étudiés comme groupe. Les substances DMD présentes dans le groupe visé par le Plan de gestion des produits chimiques faisaient partie du groupe des « DMD » de l'Union européenne.
Annexe B. Propriétés physiques et chimiques des substances MDD faisant partie du groupe de substances DMD/MDD
| Propriétés physico-chimiques | Valeur | Référence |
|---|---|---|
| Point de fusion (°C) |
91,6 -92* | O'Neil 2006 |
| Point d'ébullition (°C) |
389* | HSDB 1983-2003 |
| Masse volumique (kg/m3) |
1150* (à 20 °C) | MacNab 1999 |
| Pression de vapeur (Pa) |
2,5 × 10-4* | MacNab 1999 |
| Pression de vapeur (Pa) |
2,7 × 10-5 (à 25 °C) | Amini et Lowenkron 2003 |
| Constante de la loi de Henry (Pa·m3/mol) |
6,1 × 10-6 | HENRYWIN 2008 (méthode d'estimation « Bond ») |
| Log Koe | 1,55 | MacNab 1999; |
| Log Koe | 1,59* | ECHA, c2007-2013a; Hansch et coll. 1995 et CHRIP 2008 |
| Log Kco | Empirique : 3,6 - 3,8* | Cowen et coll. 1998a; |
| Log Kco | Modélisé : 1,76 (d'après la méthode du log Koe) et 3,4 (d'après la méthode de l'ICM) |
Epi Suite 2012 |
| Log Koa | 9,5 | LSAS 2005 |
| Hydrosolubilité (mg/L) |
1000 | Moore 1978; |
| Hydrosolubilité (mg/L) |
1010* (à 25 °C) | MacNab 1999 |
| pKa | 4,96; | MacNab 1999; |
| pKa | 5,32; 4,23 | ACD/Percepta, c1997-2012 |
Abréviations : log Kco, coefficient de partage carbone organique-eau; log Koe, coefficient de partage octanol-eau; log Koa, coefficient de partage octanol-air; HS, hydrosolubilité; pKa, constante de dissociation acide;
a. Valeur calculée à partir d'isothermes de Freundlich sur 8 heures dans un loam sableux et un loam limoneux composé de 1,6 et 1,3 % de carbone organique respectivement.
*Valeur utilisée aux fins de modélisation (moyenne utilisée si une plage de valeurs était disponible).
| Propriétés physico-chimiques | Valeur | Référence |
|---|---|---|
| Point de fusion (°C) |
30-70 (composants à 2 cycles) | ECHA, c2007-2013b; MPBPWIN 2010 (valeur pondérée) |
| Point de fusion (°C) |
215 (composants à 3 cycles) | ECHA, c2007-2013b; MPBPWIN 2010 (valeur pondérée) |
| Point de fusion (°C) |
280 (composants à 4 cycles) | ECHA, c2007-2013b; MPBPWIN 2010 (valeur pondérée) |
| Point de fusion (°C) |
345 (composants à 5 cycles) | ECHA, c2007-2013b; MPBPWIN 2010 (valeur pondérée) |
| Point d'ébullition (°C) |
411 | ECHA, c2007-2013b |
| Point d'ébullition (°C) |
398 à 101 kPa | Amini et Lowenkron 2003 |
| Masse volumique (kg/m3) |
1150 à 20 °C; | ECHA, c2007-2013b; |
| Masse volumique (kg/m3) | 1070 à 70 °C | Amini et Lowenkron 2003 |
| Pression de vapeur (Pa) |
inférieur(e) à 0,0001 à 20 °C et 0,0016 à 50 °C (composants à 2 cycles) | Rapport d'étude 2010 |
| Pression de vapeur (Pa) |
1,3 à 100 °C (composants à 2 cycles) | Amini et Lowenkron 2003 |
| Pression de vapeur (Pa) |
1,9 × 10-10 (composants à 3 cycles) | MPBPWIN 2010 (méthode de Grain modifiée, à 25 °C) |
| Pression de vapeur (Pa) |
6,02 × 10-15 (composants à 4 cycles) | MPBPWIN 2010 (méthode de Grain modifiée, à 25 °C) |
| Pression de vapeur (Pa) |
1,9 × 10-19 (composants à 5 cycles) | MPBPWIN 2010 (méthode de Grain modifiée, à 25 °C) |
| Constante de la loi de Henry (Pa·m3/mol) |
6,1 × 10-6 (composants à 2 cycles) | HENRYWIN 2008 (méthode d'estimation « Bond ») |
| Constante de la loi de Henry (Pa·m3/mol) |
1,9 × 10-10 (composants à 3 cycles) - hors du domaine du modèle | HENRYWIN 2008 (méthode d'estimation « Bond ») |
| Constante de la loi de Henry (Pa·m3/mol) |
6,02 × 10-15 (composants à 4 cycles) - hors du domaine du modèle | HENRYWIN 2008 (méthode d'estimation « Bond ») |
| Constante de la loi de Henry (Pa·m3/mol) |
1,9 × 10-19 (composants à 5 cycles) - hors du domaine du modèle | HENRYWIN 2008 (méthode d'estimation « Bond ») |
| log Koe | Valeur empirique : 1,3 - 2,5 (1,5 pour les composants à 2 cycles) à 25 °C et à un pH de 6,2 | ECHA, c2007-2013b; |
| log Koe | Valeur modélisée : 2,61 (composants à 3 cycles) | KOWWIN 2010 (à l'aide d'un ajustement des valeurs expérimentales avec du 4,4'-MDD de 1,6) |
| log Koe | Valeur modélisée : 3,71 composants à 4 cycles) | KOWWIN 2010 (à l'aide d'un ajustement des valeurs expérimentales avec du 4,4'-MDD de 1,6) |
| log Koe | Valeur modélisée : 4,82 (composants à 5 cycles) | KOWWIN 2010 (à l'aide d'un ajustement des valeurs expérimentales avec du 4,4'-MDD de 1,6) |
| log Kco | 3,6 - 3,8 (composants à 2 cycles) | Cowen et coll. 1998a |
| log Kco | 5,3 (composants à 3 cycles) | KOCWIN 2010 |
| log Kco | 7,4 (composants à 4 cycles) | KOCWIN 2010 |
| log Kco | 9,4 (composants à 5 cycles) | KOCWIN 2010 |
| log Koa | 9,5 (composants à 2 cycles) | LSAS 2005; |
| log Koa | 16,4 (composants à 3 cycles) - hors du domaine du modèle | KOAWIN 2008 (Koe défini par l'utilisateur) |
| log Koa | 22,0 (composants à 4 cycles) - hors du domaine du modèle | KOAWIN 2008 (Koe défini par l'utilisateur) |
| log Koa | 27,6 (composants à 5 cycles) - hors du domaine du modèle | KOAWIN 2008 (Koe défini par l'utilisateur) |
| Hydrosolubilité (mg/L) |
360 - 1220; 1552 (composants à 2 cycles) à 20 °C | ECHA, c2007-2013b |
| Hydrosolubilité (mg/L) |
1,1 (composants à 3 cycles) | WATERNT 2010 |
| Hydrosolubilité (mg/L) |
0,001 (composants à 4 cycles) | WATERNT 2010 |
| Hydrosolubilité (mg/L) |
8,4 x 10-7 (composants à 5 cycles) | WATERNT 2010 |
| pKa | 4,96 (composants à 2 cycles) | ECHA, c2007-2013b; ACD/ Percepta, c1997-2012 |
| pKa | 4,23; 5,32 (composants à 2 cycles) | ECHA, c2007-2013b; ACD/ Percepta, c1997-2012 |
| pKa | 4,52; 4,65; 5,16 (composants à 3 cycles) | ECHA, c2007-2013b; ACD/ Percepta, c1997-2012 |
| pKa | 4,52; 4,65; 4,79; 5,16 (composants à 4 cycles) | ECHA, c2007-2013b; ACD/ Percepta, c1997-2012 |
| pKa | 4,52; 4,65; 4,69; 4,92; 5,16 (composants à 5 cycles) | ECHA, c2007-2013b; ACD/ Percepta, c1997-2012 |
Abréviations : log Kco, coefficient de partage carbone organique-eau; log Koe, coefficient de partage octanol-eau; log Koa, coefficient de partage octanol-air; HS, hydrosolubilité; pKa, constante de dissociation acide;
a. Valeur calculée à partir d'isothermes de Freundlich sur 8 heures dans un loam sableux et un loam limoneux composé de 1,6 et 1,3 % de carbone organique respectivement.
*Valeur utilisée aux fins de modélisation (moyenne utilisée si une plage de valeurs était disponible)
Annexe C. Propriétés physiques et chimiques des substances DMD faisant partie du groupe de substances DMD/MDD
| Propriétés physico-chimiques | Valeur | Référence |
|---|---|---|
| Point de fusion (°C) |
37; | Lide 2003 |
| Point de fusion (°C) |
39 - 43 | ECHA, c2007-2013c |
| Point d'ébullition (°C) |
supérieur(e) à 300* à 101 kPa; | ECHA, c2007-2013c |
| Point d'ébullition (°C) |
196 à 0,1 kPa | Lide 2003 |
| Masse volumique (kg/m3) |
1320* à 20 °C | ECHA, c2007-2013c |
| Pression de vapeur (Pa) |
0,0007*; inférieur(e) à 0,002; |
Chakrabarti 1989; |
| Pression de vapeur (Pa) |
0,00049 à 20 °C | Brochhagen et Schal 1986 |
| Constante de la loi de Henry (Pa·m3/mol) |
s.o. | s.o. |
| log Kow | 4,51* à 22 °C et à un pH de 7 environ | Yakabe et coll. 2000 |
| log Koc | s.o. | |
| log Koa | 8,95r | KOAWIN 2008 (Koe défini par l'utilisateur) |
| Hydrosolubilité (mg/L) |
s.o. | s.o. |
| pKa | s.o. | s.o. |
Abréviations : log Kco, coefficient de partage carbone organique-eau; log Koe, coefficient de partage octanol-eau; log inférieur(e) à Koa, coefficient de partage octanol-air; HS, hydrosolubilité; pKa, constante de dissociation acide; s.o., sans objet (c'est-à-dire que le paramètre physico-chimique ne s'appliquait pas à la substance)
*Valeur utilisée aux fins de modélisation (moyenne utilisée si une plage de valeurs était disponible)
| Propriétés physico-chimiques | Valeur | Référence |
|---|---|---|
| Point de fusion (°C) |
42,8 | ECHA, c2007-2013d |
| Point d'ébullition (°C) |
supérieur(e) à 270 (se décompose) | ECHA, c2007-2013d |
| Masse volumique (kg/m3) |
1130 | Chemical Industry Directory 2015 |
| Pression de vapeur (Pa) |
0,0081* à 20 °C et 0,012* à 25 °C | ECHA, c2007-2013d |
| Constante de la loi de Henry (Pa·m3/mol) |
s.o. | s.o. |
| log Kow | 4,51* | Yakabe et coll. 2000 |
| log Koc | s.o. | |
| log Koa | 8,95 | KOAWIN 2008 (Koe défini par l'utilisateur) |
| Hydrosolubilité (mg/L) |
s.o. | s.o. |
| pKa | s.o. | s.o. |
| Propriétés physico-chimiques | Valeur | Référence |
|---|---|---|
| Point de fusion (°C) |
34 - 38* | ECHA, c2007-2013e |
| Point d'ébullition (°C) |
supérieur(e) à 241 (se décompose) | |
| Masse volumique (kg/m3) |
1240 - 1320 à 20 °C | ISOPA 2013 |
| Pression de vapeur (Pa) |
0,0014* à 20 °C | ECHA, c2007-2013e |
| Constante de la loi de Henry (Pa·m3/mol) |
s.o. | s.o. |
| log Kow | 4,51* | Yakabe et coll. 2000 |
| log Koc | s.o. | s.o. |
| log Koa | 8,95 | KOAWIN 2008 (Koe défini par l'utilisateur) |
| Hydrosolubilité (mg/L) |
s.o. | s.o. |
| pKa | s.o. | s.o. |
| Propriétés physico-chimiques | Valeur | Référence |
|---|---|---|
| Point de fusion (°C) |
34 - 38 (donnée déduite à partir d'analogues par l'intermédiaire du no CAS 5873-54-1) |
ECHA, c2007-2013e |
| Point d'ébullition (°C) |
supérieur(e) à 241 (se décompose) (donnée déduite à partir d'analogues par l'intermédiaire du no CAS 5873-54-1) |
ECHA, c2007-2013e |
| Masse volumique (kg/m3) |
1240 - 1320 à 20 °C | ISOPA 2013 |
| Pression de vapeur (Pa) |
0,04 à 43 °C | Dow Chemical Company, c1998-2011 |
| Constante de la loi de Henry (Pa·m3/mol) |
s.o. | s.o. |
| log Kow | 4,51* | Yakabe et coll. 2000 |
| log Koc | s.o. | |
| log Koa | 8,95 | KOAWIN 2008 (Koe défini par l'utilisateur) |
| Hydrosolubilité (mg/L) |
s.o. | s.o. |
| pKa | s.o. | s.o. |
| Propriétés physico-chimiques | Valeur | Référence |
|---|---|---|
| Point de fusion (°C) |
Valeur modélisée : 181 (composants à 3 cycles); | MPBPWIN 2010 (valeur pondérée) |
| Point de fusion (°C) |
Valeur modélisée : 253 (composants à 4 cycles); | MPBPWIN 2010 (valeur pondérée) |
| Point de fusion (°C) |
Valeur modélisée : 311 (composants à 5 cycles) | MPBPWIN 201 (valeur pondérée); |
| Point de fusion (°C) |
Forme des cristaux inférieur(e) à 10 °C | Dow Chemical Company, c1998-2011 |
| Point d'ébullition (°C) |
supérieur(e) à 230 | Dow Chemical Company, c1998-2011 |
| Masse volumique (kg/m3) |
1240 à 20 ºC | Dow Chemical Company, c1998-2011 |
| Pression de vapeur (Pa) |
inférieur(e) à 0,0013 | Dow Chemical Company, c1998-2011; |
| Pression de vapeur (Pa) |
Valeur modélisée : 7,5 × 10-7 (composants à 3 cycles); | MPBPWIN 2010 (méthode de Grain modifiée) |
| Pression de vapeur (Pa) |
Valeur modélisée : 7,2 × 10-11 (composants à 4 cycles); | MPBPWIN 2010 (méthode de Grain modifiée) |
| Pression de vapeur (Pa) |
Valeur modélisée : inférieur(e) à 10-12(composants à 5 cycles) à 25 ºC | MPBPWIN 2010 (méthode de Grain modifiée) |
| Constante de la loi de Henry (Pa·m3/mol) |
s.o. | s.o. |
| log Kow | s.o. | s.o. |
| log Koc | s.o. | s.o. |
| log Koa | 8,95 (composants à 2 cycles) | KOAWIN 2008 (Koe défini par l'utilisateur) |
| log Koa | 14,7 (composants à 3 cycles) - hors du domaine du modèle | KOAWIN 2008 (Koe défini par l'utilisateur) |
| log Koa | 19,7 (composants à 4 cycles) - hors du domaine du modèle | KOAWIN 2008 (Koe défini par l'utilisateur) |
| log Koa | 24,8 (composants à 5 cycles) - hors du domaine du modèle | KOAWIN 2008 (Koe défini par l'utilisateur) |
| Hydrosolubilité (mg/L) |
s.o. | s.o. |
| pKa | s.o. | s.o. |
Annexe D. Concentrations dans l’environnement de substances faisant partie du groupe des DMD/MDD
| No CAS | Lieu | Type d'installation (point d'échantillonnage et nombre) |
Concentration (moyenne) mg/m3 |
Référence |
|---|---|---|---|---|
| 101-68-8, 2536-05-2, 5873-54-1, 26447-40-5 | Europe | Fabricant de mousse (5; cheminée)a,d |
inférieur(e) à 0,4-3,7c | Allport et coll. 2003 |
| 101-68-8, 2536-05-2, 5873-54-1, 26447-40-5 | s.o. | Fabricant de panneaux en mousse (1; cheminée)b,d |
inférieur(e) à 10-48c | Acton 2001 |
| 101-68-8, 2536-05-2, 5873-54-1, 26447-40-5 | Europe | Fabricant de panneaux de fibres (4; cheminée)e,d |
45-1,320c | Maddison et Merckx 1996 |
| 101-68-8, 2536-05-2, 5873-54-1, 26447-40-5 | Amérique du Nord | Fabricant de panneaux à copeaux orientésd (1; évacuation de presse) |
160-380f, 150-290c |
Allport et coll. 2003 |
| 101-68-8, 2536-05-2, 5873-54-1, 26447-40-5 | Europe | Moulage de mousse flexible (3; cheminée)d |
inférieur(e) à 0,1-12,5c | Allport et coll. 2003 |
| 101-68-8, 2536-05-2, 5873-54-1, 26447-40-5 | Europe | Laminage à la flamme de la mousse flexible (1; cheminée)d |
48c | Allport et coll. 2003 |
| 101-68-8, 5873-54-1 | États-Unis | Sites de travail spécialisés dans la mousse en polyuréthane giclé (4; 25 pieds à gauche, à droite et derrière) |
SSD - 23,9g | Ecoff et Lambach 2012 |
| 101-68-8, 5873-54-1 | États-Unis | Sites de travail spécialisés dans la mousse en polyuréthane giclé (4; 50 pieds sous le vent) |
SSD - 3,9g | Ecoff et Lambach 2012 |
Abréviations : s.o., sans objet; ps, poids sec; co, carbone organique; SSD, sous le seuil de détection
a. Installations fabriquant des panneaux (revêtements flexibles) (3) et bloc de mousse rigide (2);
b. Installation qui fabrique des panneaux en polyuréthane avec des revêtements en métaux;
c. Concentration estimée de monomère DMD calculée à partir de la mesure de groupes isocyanates libres (NCO);
d. Aucun équipement de contrôle n'a été utilisé dans ces cheminées;
e. Échantillons prélevés à partir de l'air d'évacuation dans les cheminées à trois moments différents dans le processus de fabrication des panneaux de fibres;
f. Mesuré à l'aide de la « méthode 207 » de l'Environmental Protection Agency des États-Unis (semble être la méthode OTM-14 de l'Environmental Protection Agency des États-Unis) qui mesure de façon sélective les isomères 2,4'-DMD et 4,4'-DMD.
g. Les méthodes d'échantillonnage et d'analyse de BMS 1.20.1 (solution avec impacteurs) et 1.7.7 (liquide de désorption du filtre) ont été utilisées pour évaluer les DMD et MDD d'après le résumé de conférence (on ne dispose pas d'autres renseignements).
| Lieu et année | Type d'échantillon (détection)* |
Concentration (seuil de détection) μg/L |
Référence |
|---|---|---|---|
| Japon 1985 | Eaux de surface (0/10) |
n.d. (5) |
Agence environnementale du Japon 2000; CHRIO 2008 |
| Japon 1989 | Eaux de surface (1/24) |
1,2 x 10-4 (10-5 - 0,1) |
CHRIP 2008 |
| Japon 1995 | Eaux de surface (0/23) |
n/d (inférieur(e) à 1) |
CHRIP 2008 |
| Japon 1998 | Eaux de surface (0/36) |
(inférieur(e) à 1) | CHRIP 2008 |
| Japon 2008 | Eaux de surface (11/28) |
0,001 - 0,02 (0,001) |
CHRIP 2008 |
| Europe | Effluents industriels | inférieur(e) à 500 | EURAR 2001 |
Abréviations : n.d., non détecté;
*Le nombre fait référence au nombre de stations d'échantillonnage distinctes sur le plan géographique qui possédaient des échantillons dont les valeurs déclarées étaient supérieures au seuil de détection.
| Lieu et année | Type d'échantillon (détection)* |
Concentration (seuil de détection) μg/g ps |
Référence |
|---|---|---|---|
| Japon 1985 | Sédiments (0/8) |
n.d. (1) |
CHRIP 2008 |
| Japon 1989 | Sédiments (1/24) |
2 x 10-4 (1 x 10-4 - 0,03) |
CHRIP 2008 |
| Japon 1995 | Sédiments benthiques (6/23) |
0,036 - 0,88 (0,03) |
CHRIP 2008 |
| Japon 1998 | Sédiments benthiques (15/33) |
0,02 - 2,1 (0,02) |
CHRIP 2008 |
Abréviations : ps, poids sec; n.d., non détecté;
*Le nombre fait référence au nombre de stations d'échantillonnage distinctes sur le plan géographique qui possédaient des échantillons dont les valeurs déclarées étaient supérieures au seuil de détection.
Annexe E. Données d'entrée et résultats sommaires du modèle SCREEN3 dans le cadre d'une évaluation écologique de l'exposition par inhalation découlant de l'air ambiant près des sources de pollution ponctuelle industrielles génériques
| Paramètre | Valeur | Remarques |
|---|---|---|
| Taux d'émission (g/s) | 0,0856 | Cette valeur a été fournie par le NCASI d'après l'hypothèse que 3450 tonnes métriques de DMD sont utilisées et que l'exploitation se fait en continu. |
| Hauteur des cheminées (m) | 10 | Fondé sur l'annexe technique E : Derivation of Stack Parameter Data de l'Environmental Protection Agency des États-Unis (2004). Version 2.1.2 du modèle RSEI, Economics, Exposure, and Technology Division; Office of Pollution Prevention and Toxics; Environmental Protection Agency des États-Unis; Washington (D.C.) 20460; août 2004 |
| Diamètre de la cheminée (m) | 0,6 | Système d'inventaire des rejets résiduels. 1995. Environnement et Changement climatique Canada, Direction des données sur la pollution, Division des principaux contaminants atmosphériques. |
| Vitesse d'échappement de gaz de la cheminée (m/s) | 9 | Annexe technique E : Derivation of Stack Parameter Data de l'Environmental Protection Agency des États-Unis (2004). Version 2.1.2 du modèle RSEI, Economics, Exposure, and Technology Division; Office of Pollution Prevention and Toxics; Environmental Protection Agency des États-Unis; Washington (D.C.) 20460; août 2004 |
| Température d'échappement de la cheminée (K) | 316 | Système d'inventaire des rejets résiduels. 1995. Environnement et Changement climatique Canada, Direction des données sur la pollution, Division des principaux contaminants atmosphériques. |
| Température de l'air ambiant (K) | 293 | Valeur par défaut du modèle |
| Hauteur du récepteur au-dessus du sol (m) | 2,5 | Valeur par défaut du modèle, représente la hauteur des petits organismes corticaux terrestres. |
| Option urbaine/rurale | Urbaine | Valeur par défaut du modèle, d'après l'hypothèse que l'installation est située près d'un milieu urbain. |
| Option de rabattement causé par le bâtiment | Sélectionnée | Valeur par défaut sélectionnée du modèle SCREEN3, |
| Hauteur du bâtiment (m) | 10 | Valeur par défaut, représente la hauteur des bâtiments dans lesquels la production, le traitement ou l'utilisation de la substance ont lieu (Commission européenne 2003). |
| Dimension horizontale minimale (m) | 20 | Valeur par défaut, représente les installations industrielles à basse hauteur typiques (Law et coll. 2004). |
| Dimension horizontale maximale (m) | 100 | Valeur par défaut, représente les installations industrielles à basse hauteur typiques (Law et coll. 2004). |
| Terrain simple | Sélectionnée | Valeur par défaut sélectionnée du modèle SCREEN3 (fournit un scénario plus prudent que pour un terrain complexe) |
| Conditions météorologiques complètes | Sélectionnée | Valeur par défaut sélectionnée du modèle SCREEN3 (indique les pires conditions). |
| Hauteur du terrain | 5 | Valeur par défaut, correspond à une moitié de la hauteur de la cheminée. |
| Concentration maximale (g/m3) | 1,276 E-5 | Valeur maximale obtenue à 200 m |
| Concentration à 100 m (g/m3) | 1,144 E-5 | La distance de 100 mètres correspond à la distance moyenne entre une source d'émission et la limite d'un site industriel |
| Concentration à 1000 m (g/m3) | 0,618 E-5 | Sans objet |
Aux fins de l'évaluation des effets de l'exposition sur la santé, des valeurs ont été précisées en fonction des renseignements fournis en réponse à une enquête menée en vertu de l'article 71 concernant les installations industrielles au Canada (Environnement et Changement climatique Canada 2012a). Ces modifications incluaient l'utilisation des quantités de substances et des paramètres exacts qui sont caractéristiques des installations canadiennes spécifiques.
Annexe F. Concentrations dans l'air mesurées après l'application d'une mousse de polyuréthane giclé à deux composants à faible pression
| Référence | Zone pulvérisée (pi) |
Quantité pulvérisée | Ventilation (ren. air/h) |
Moment de l'échantillonnage (min.) |
Type d'échantil-lonnage | Concentration dans l'air pendant la pulvérisation (mg/m3) |
|---|---|---|---|---|---|---|
| Dow Chemical 2013 | Vide sanitaire d'une résidence (25 pi × 23 pi × 40 po) |
11,8 pi3 | 44 (Ventilateur qualité industrielle, utilisé pour expulser l'air) |
13 | Personnel | 0,16 |
| Dow Chemical 2013 | Vide sanitaire d'une résidence (25 pi × 23 pi × 40 po) |
11,8 pi3 | 44 (Ventilateur qualité industrielle, utilisé pour expulser l'air) |
13 | Surface | 0,017 |
| Dow Chemical 2013 | Vide sanitaire d'une résidence (25 pi × 23 pi × 40 po) |
11,8 pi3 | 16 (Ventilateur carré pour alimenter en air le vide sanitaire) |
13 | Personnel | 0,16 |
| Dow Chemical 2013 | Vide sanitaire d'une résidence (25 pi × 23 pi × 40 po) |
11,8 pi3 | 16 (Ventilateur carré pour alimenter en air le vide sanitaire) |
13 | Surface | 0,022 |
| Convenience Products 2012 | Pièce simulée B (10 × 10 × 8) |
Trousse de 20 kg utilisée (nombre inconnu de trousses utilisées par pièce) |
6 (Ventilateur carré installé dans la fenêtre, mais à l'arrêt) |
Un jeu de 4 échantillons de 15 min prélevés pendant 3 séances de pulvérisation de 60 min. | Personnel | Applicateur 1 : monomère DMD : 0,013, 0,022, 0,03, 0,0099 pDMD : inférieur(e) à LD (0,02) Total DMD* : 0,0199-0,04 |
| Convenience Products 2012 | Pièce simulée B (10 × 10 × 8) |
Trousse de 20 kg utilisée (nombre inconnu de trousses utilisées par pièce) |
6 (Ventilateur carré installé dans la fenêtre, mais à l'arrêt) |
Un jeu de 4 échantillons de 15 min prélevés pendant 3 séances de pulvérisation de 60 min. | Personnel | Applicateur 2 : monomère DMD : 0,031, 0,024, 0,017, 0,016 pDMD : inférieur(e) à LD (0,02) Total DMD* : 0,026-0,041 |
| Convenience Products 2012 | Pièce simulée B (10 × 10 × 8) |
Trousse de 20 kg utilisée (nombre inconnu de trousses utilisées par pièce) |
6 (Ventilateur carré installé dans la fenêtre, mais à l'arrêt) |
Un jeu de 4 échantillons de 15 min prélevés pendant 3 séances de pulvérisation de 60 min. | Personnel | Applicateur 3 : monomère DMD : 0,039, 0,043, 0,059, 0,068 pDMD : inférieur(e) à LD (0,02) Total DMD* : 0,049-0,078 |
| Convenience Products 2012 | Pièce simulée B (10 × 10 × 8) |
Trousse de 20 kg utilisée (nombre inconnu de trousses utilisées par pièce) |
6 (Ventilateur carré installé dans la fenêtre, mais à l'arrêt) |
Un jeu de 4 échantillons de 15 min prélevés pendant 3 séances de pulvérisation de 60 min. | Surface | Monomère DMD : inférieur(e) à LD (0,002) pDMD : inférieur(e) à LD (0,02) Total DMD* : 0,011 |
| Convenience Products 2012 | Pièce simulée A (10 × 10 × 8) |
Trousse de 20 kg utilisée (nombre inconnu de trousses utilisées par pièce) |
102 (Ventilateur carré dans une fenêtre, réglé au maximum) |
Un jeu de 4 échantillons de 15 min prélevés pendant 3 séances de pulvérisation de 60 min. | Personnel | Applicateur 1 : monomère DMD : 0,015, 0,021, 0,015, 0,023 pDMD : inférieur(e) à LD (0,02) Total DMD* : 0,025-0,033 |
| Convenience Products 2012 | Pièce simulée A (10 × 10 × 8) |
Trousse de 20 kg utilisée (nombre inconnu de trousses utilisées par pièce) |
102 (Ventilateur carré dans une fenêtre, réglé au maximum) |
Un jeu de 4 échantillons de 15 min prélevés pendant 3 séances de pulvérisation de 60 min. | Personnel | Applicateur 2 : monomère DMD : 0,001, 0,023, 0,022, 0,022 pDMD : inférieur(e) à LD (0,02) Total DMD* : 0,011-0,033 |
| Convenience Products 2012 | Pièce simulée A (10 × 10 × 8) |
Trousse de 20 kg utilisée (nombre inconnu de trousses utilisées par pièce) |
102 (Ventilateur carré dans une fenêtre, réglé au maximum) |
Un jeu de 4 échantillons de 15 min prélevés pendant 3 séances de pulvérisation de 60 min. | Personnel | Applicateur 3 : monomère DMD : 0,038, 0,037, 0,035, 0,043 pDMD : inférieur(e) à LD (0,02) Total DMD* : 0,045-0,053 |
| Convenience Products 2012 | Pièce simulée A (10 × 10 × 8) |
Trousse de 20 kg utilisée (nombre inconnu de trousses utilisées par pièce) |
102 (Ventilateur carré dans une fenêtre, réglé au maximum) |
Un jeu de 4 échantillons de 15 min prélevés pendant 3 séances de pulvérisation de 60 min. | Surface | Monomère DMD : inférieur(e) à LD (0,002) pDMD : inférieur(e) à LD (0,02) Total DMD* : 0,011 |
| Fomo Products 2005 | n.i. | n.i. | Ventilation naturelle (portes et fenêtres ouvertes) |
6 échantillons aux 18-20 minutes prélevés pendant une séance de pulvérisation de 118 minutes en tout | Personnel | 0,016, 0,054, 0,082, 0,060, 0,057, 0,017 |
| Fomo Products 2005 | n.i. | n.i. | Ventilation naturelle (portes et fenêtres ouvertes) |
20-40 min. | Surface | 0,0041, inférieur(e) à LD (plage de 0,0022-0,0045) |
Abréviations : LD = limite de détection; n.i. = non indiqué.
*Ces valeurs ont été obtenues en additionnant la concentration de monomères DMD et de pDMD; lorsqu'une substance était en deçà de la limite de détection (LD), on présumait que sa concentration était la moitié de la LD.
| Référence | Zone pulvérisée (pi) |
Quantité pulvérisée | Ventilation (ren. air/h) |
Moment de l'échantillonnage (min.) |
Type d'échantil-lonnage | Concentration dans l'air pendant la pulvérisation (mg/m3) |
|---|---|---|---|---|---|---|
| Convenience Products 2014a | Sous-sol de résidence (24 × 45 × 7) |
2/3 de contenant (La13 kg utilisés) |
4,7 (2 ventilateurs carrés installés dans les fenêtres) |
2 échantillons de 15 min prélevés pendant une séance de pulvérisation de 30 min. | Personnel | 0,01, 0,01 |
| Convenience Products 2014a | Sous-sol de résidence (24 × 45 × 7) |
2/3 de contenant (La13 kg utilisés) |
4,7 (2 ventilateurs carrés installés dans les fenêtres) |
2 échantillons de 15 min prélevés pendant une séance de pulvérisation de 30 min. | Surface | inférieur(e) à LD (0,007) |
| Convenience Products 2014b | Sous-sol de résidence (8 × 30 × 9 + 8 × 30 × 45) |
Trousse de 13 kg utilisée (La20 lb de produit appliquées) |
0,2 (Ventilation naturelle, c.-à-d. fenêtres et porte coulissante ouvertes à une extrémité de la pièce) |
Échantillons de 15 min prélevés pendant une séance de pulvérisation de 30 min. | Personnel | 0,04, inférieur(e) à LD (0,007) |
| Convenience Products 2014b | Sous-sol de résidence (8 × 30 × 9 + 8 × 30 × 45) |
Trousse de 13 kg utilisée (La20 lb de produit appliquées) |
0,2 (Ventilation naturelle, c.-à-d. fenêtres et porte coulissante ouvertes à une extrémité de la pièce) |
Échantillons de 15 min prélevés pendant une séance de pulvérisation de 30 min. | Surface | inférieur(e) à LD (0,007) |
| ACC 2012b | Chambre d'essai (7,9 × 7,9 × 8,2) |
19 lb | 10,4 (La ventilation était perpendiculaire au jet) |
24-29 (temps de pulvérisation de 19 minutes); ceci est l'une des 4 applications répétées |
Personnel | Applicateur 1 : 2,4'-DMD : 0,008 4,4'-DMD : 0,04 pDMD : inférieur(e) à LD (0,102) Total DMD* : 0,1 |
| ACC 2012b | Chambre d'essai (7,9 × 7,9 × 8,2) |
19 lb | 10,4 (La ventilation était perpendiculaire au jet) |
24-29 (temps de pulvérisation de 19 minutes); ceci est l'une des 4 applications répétées |
Surface | Applicateur 1 : 2,4'-DMD : 0,006 4,4'-DMD : 0,003 pDMD : inférieur(e) à LD (0,088) Total DMD* : 0,053 |
| ACC 2012b | Chambre d'essai (7,9 × 7,9 × 8,2) |
19 lb | 10,4 (La ventilation était perpendiculaire au jet) |
24-29 (temps de pulvérisation de 15 minutes); ceci est l'une des 4 applications répétées |
Personnel | Applicateur 2 : aucun résultat déclaré |
| ACC 2012b | Chambre d'essai (7,9 × 7,9 × 8,2) |
19 lb | 10,4 (La ventilation était perpendiculaire au jet) |
24-29 (temps de pulvérisation de 15 minutes); ceci est l'une des 4 applications répétées |
Surface | Applicateur 2 : 2,4'-DMD : 0,009 4,4'-DMD : inférieur(e) à LD (0,0046) pDMD : inférieur(e) à LD (0,140) Total DMD* : 0,0813 |
| ACC 2012b | Chambre d'essai (7,9 × 7,9 × 8,2) |
19 lb | 10,4 (La ventilation était perpendiculaire au jet) |
24-29 (temps de pulvérisation de 18 minutes); ceci est l'une des 4 applications répétées |
Personnel | Applicateur 3 : 2,4'-DMD : 0,010 4,4'-DMD : 0,03 pDMD : inférieur(e) à LD (0,111) Total DMD* : 0,095 |
| ACC 2012b | Chambre d'essai (7,9 × 7,9 × 8,2) |
19 lb | 10,4 (La ventilation était perpendiculaire au jet) |
24-29 (temps de pulvérisation de 18 minutes); ceci est l'une des 4 applications répétées |
Surface | Applicateur 3 : 2,4'-DMD : 0,006 4,4'-DMD : 0,01 pDMD : inférieur(e) à LD (0,112) Total DMD* : 0,072 |
| ACC 2012b | Chambre d'essai (7,9 × 7,9 × 8,2) |
19 lb | 10,4 (La ventilation était perpendiculaire au jet) |
24-29 (temps de pulvérisation de 16 minutes); ceci est l'une des 4 applications répétées |
Personnel | Applicateur 4 : 2,4'-DMD : 0,005 4,4'-DMD : 0,01 pDMD : inférieur(e) à LD (0,118) Total DMD* : 0,074 |
| ACC 2012b | Chambre d'essai (7,9 × 7,9 × 8,2) |
19 lb | 10,4 (La ventilation était perpendiculaire au jet) |
24-29 (temps de pulvérisation de 16 minutes); ceci est l'une des 4 applications répétées |
Surface | Applicateur 4 : 2,4'-DMD : inférieur(e) à LD (0,0046) 4,4'-DMD : 0,01 pDMD : inférieur(e) à LD (0,138) Total DMD* : 0,0813 |
Abréviation : LD = limite de détection.
* Ces valeurs ont été obtenues en additionnant la concentration de 2,4'-DMD, 4,4'-DMD et pDMD; lorsqu'une substance était en deçà de la limite de détection (LD), on présumait que sa concentration était la moitié de la LD.
| Référence | Type d'application | Zone pulvérisée (pi) |
Quantité pulvérisée | Ventilation (ren. air/h) |
Moment de l'échantillonnage (min.) |
Type d'échantil-lonnage | Concentration dans l'air pendant la pulvérisation (mg/m3) |
|---|---|---|---|---|---|---|---|
| Fomo Products 2010 | Une trousse entière a été utilisée sur un carton placé sur le plancher d'un laboratoire de pulvérisation | n.i. | Trousse entière - taille inconnue | Aucune ventilation (portes fermées) |
15 | Personnel | 0,089 |
| Fomo Products 2010 | Deux pulvérisations de 10 secondes séparées par un intervalle de 10 min. | n.i. | n.i. | Aucune ventilation (portes fermées) |
15 | Personnel | inférieur(e) à LD (0,013) |
Abréviations : LD = limite de détection; n.i. = non indiqué..
Annexe G. Valeurs estimatives de la limite supérieure de l'exposition aux DMD découlant de l'utilisation de produits de bricolage de type adhésif ou produit d'étanchéité, d'après Consexpo
| Type de produit de consommation | Paramètres du modèlea | Estimation de l'exposition |
|---|---|---|
| Adhésif de polyuréthane/produit d'étanchéité pour les assemblages | Les hypothèses du scénario sont fondées sur un scénario par défaut Consexpo pour un produit d'étanchéité destiné aux assemblages (RIVM 2007)
|
concentration moyenne par événement (additif à base de 4,4'-DMD, pDMD et DMD mélangés) : 0,0010 mg/m3 |
| Adhésif de polyuréthane/produit d'étanchéité pour les assemblages | Scénario cutané basé sur une application instantanée :
|
Charge cutanée (additive - 4,4'-DMD, pDMD et DMD mélangés) : 4,9 mg/cm2 |
| Adhésif pour le sol ou le mur | Les hypothèses du scénario sont fondées sur un scénario par défaut Consexpo pour fixer le parquet en bois à la surface (RIVM 2007)
|
concentration moyenne par événement (additif à base de 4,4'-DMD et DMD mélangés) : 0,00047 mg/m³ |
| Adhésif pour le sol ou le mur | Scénario cutané basé sur une application constante :
|
Charge cutanée (additive - 4,4'-DMD, pDMD et DMD mélangés) : 3,16 mg/m2 |
| Adhésif pour la construction | Les hypothèses du scénario sont fondées sur un scénario par défaut Consexpo pour de la colle de construction en bouteille (RIVM 2007)
|
concentration moyenne par événement (additif à base de 4,4'-DMD, pDMD et DMD mélangés) : 0,0021 mg/m³ |
| Adhésif pour la construction | Scénario cutané basé sur une application instantanée :
|
Charge cutanée (additive - 4,4'-DMD, pDMD et DMD mélangés) : 2,2 mg/cm2 |
| Adhésif général/colle de bricolage | Les hypothèses du scénario sont fondées sur un scénario par défaut Consexpo pour une colle en bouteille générique (RIVM 2007)
|
concentration moyenne par événement (pour le 4,4'-DMD) : 1,2 × 10-5 mg/m3 |
| Adhésif général/colle de bricolage | Scénario cutané basé sur une application instantanée :
|
Charge cutanée : 22,4 mg/cm2 |
| Colle Super Glue | Les hypothèses du scénario sont fondées sur un scénario par défaut Consexpo pour la colle Super Glue (RIVM 2007)
|
concentration moyenne par événement (pour le pDMD) : 4,1 × 10-8 mg/m³ |
| Colle Super Glue | Scénario cutané basé sur une application instantanée :
|
Charge cutanée : 12,5 mg/cm2 |
| Adhésif thermofusible | Les hypothèses du scénario sont fondées sur un scénario par défaut Consexpo pour un adhésif thermofusible (RIVM 2007)
Le scénario d'exposition cutanée n'a pas été modélisé, étant donné que les DMD ne seraient rejetés que lors de températures accrues de l'adhésif solide. |
concentration moyenne par événement (additif à base de 4,4'-DMD et DMD mélangés) : 7,9 × 10-8 mg/m3 |
a. Le taux transfert de masse calculé d'après les études sur les émissions de Wirts et Salthammer (2002) pour le 4,4'-DMD pur a été utilisé au lieu de l'équation par défaut de Langmuir.
Annexe H. Justification de l'utilisation des diisocyanates de toluène (TDI) en tant qu'analogues
Un certain nombre de facteurs justifient l'utilisation des TDI comme analogues pour les effets respiratoires, notamment la sensibilisation dans l'évaluation des effets du DMD sur la santé. Les éléments pris en considération sont présentés ci-dessous :
- Structure : Les TDI et les DMD ont des structures similaires, qui sont composées de cycles aromatiques et de groupes fonctionnels isocyanates.
- Propriétés physico-chimiques : Les masses moléculaires des TDI sont plus faibles que celles des DMD. Les TDI devraient être plus réactifs que les DMD en raison de leur solubilité et de leur pression de vapeur plus élevées.
- Toxicité pour les mammifères : Les TDI et les DMD présentent des effets respiratoires et des effets de sensibilisation semblables, aussi bien dans les études épidémiologiques sur les humains que dans les études expérimentales sur les animaux. De façon mécanistique, les groupes fonctionnels isocyanates présents dans les TDI et les DMD sont responsables de la liaison aux protéines et de l'effet de sensibilisation potentielle du système immunitaire qui s'ensuit (Liu et Wisnewski 2003). Le potentiel relatif de sensibilisation cutanée est semblable entre les TDI et les DMD. D'après les essais sur les ganglions lymphatiques locaux chez la souris, les TDI présentent une valeur de carbone élémentaire 3 de 0,11 % (ECETOC 2003), qui est semblable à la valeur de carbone élémentaire 3 de 0,08 % des DMD (Selgrade et coll. 2006).