Évaluation préalable - dérivés de protéines et extraits de levure
Titre officiel : Évaluation préalable - dérivés de protéines et extraits de levure
Numéro de registre du Chemical Abstracts Service
- 8013-01-2
- 9015-54-7
- 92113-31-0
- 111174-63-1
Environnement et Changement climatique Canada
Santé Canada
Octobre 2022
No de cat. : En84-308/2022F-PDF
ISBN 978-0-660-45040-7
Sommaire
En vertu de l’article 68 ou 74 de la Loi canadienne sur la protection de l’environnement, 1999 (LCPE), les ministres de l’Environnement et de la Santé ont réalisé une évaluation préalable de quatre substances formant le groupe des dérivés de protéines et des extraits de levure. Leurs numéros de registre du Chemical Abstracts Service (no CASNote de bas de page 1 ), leurs noms sur la Liste intérieure des substances (LIS) et leurs noms communs sont indiqués dans le tableau ci-dessous.
| No CAS | Nom dans la LIS | Nom commun |
|---|---|---|
|
8013-01-2a |
Extraits de levure |
Extraits de levure |
|
9015-54-7a,b |
Hydrolysats de protéines |
S. o. |
|
92113-31-0a,b |
Collagène, hydrolysats |
Hydrolysats de collagène |
|
111174-63-1a |
Produits de réaction d’hydrolysats de protéines du cuir avec le chlorure d’isostéaroyle |
Collagène hydrolysé par l’isostéaroyle |
Abréviations : S. o. = sans objet
a La substance portant ce NE CAS est un UVCB (une substance de composition inconnue ou variable, un produit de réaction complexe ou une matière biologique).
b La substance n’est pas visée par le paragraphe 73(1) de la LCPE, mais fait l’objet de la présente évaluation, car elle est jugée d’intérêt prioritaire selon d’autres mécanismes.
Les substances du groupe des protéines et des extraits de levure sont dérivées de matières biologiques d’origine naturelle. La composition des extraits de levure, des hydrolysats de protéines, des hydrolysats de collagène et du collagène hydrolysé par l’isostéaroyle varie selon la source de la matière et les conditions de production. Les données sur ces quatre substances ont été obtenues dans le cadre d’une enquête menée en vertu de l’article 71 de la LCPE. Pendant l’année de déclaration de 2011, entre 100 000 et 1 000 000 kg des extraits de levure, entre 10 000 et 100 000 kg d’hydrolysats de protéines et 67 702 kg d’hydrolysats de collagène ont été importés au Canada. Pendant la même année, aucune importation de collagène hydrolysé par l’isostéaroyle et aucune production de ces quatre substances au-delà du seuil de déclaration de 100 kg n’ont été déclarées au Canada. Parmi les utilisations déclarées se comptent les matériaux de construction, les aliments et boissons, les produits nutritionnels utilisés dans les aliments pour animaux et les produits de soins personnels. Plus précisément, les substances de ce groupe peuvent être utilisées au Canada dans des aliments comme agents aromatisants, dans des produits alimentaires tels que des suppléments protéiques et des préparations pour nourrissons, ainsi que dans un certain nombre de produits de consommation comme des cosmétiques et des produits de santé naturels. De plus, les hydrolysats de collagène et les extraits de levure sont des agents de formulation dans des produits antiparasitaires.
Les risques pour l’environnement des substances du groupe des dérivés de protéines et des extraits de levure ont été caractérisés à l’aide de la Classification des risques écologiques (CRE) des substances organiques, une approche fondée sur le risque qui tient compte de multiples paramètres liés au danger et à l’exposition et d’une pondération des éléments de preuve pour classer le risque. Les profils de danger reposent principalement sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne induite par le réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Parmi les paramètres pris en compte dans les profils d’exposition figurent le taux d’émission potentielle, la persistance globale et le potentiel de transport sur de grandes distances. Une matrice des risques permet d’attribuer un niveau de risque faible, modéré ou élevé à ces substances, en fonction de leurs profils de danger et d’exposition. D’après les résultats de l’analyse de la CRE, il est peu probable que les substances du groupe des dérivés de protéines et des extraits de levure soient nocives pour l’environnement.
Compte tenu de tous les éléments de preuve avancés dans la présente évaluation préalable, les quatre substances du groupe des dérivés de protéines et des extraits de levure posent un faible risque d’effets nocifs sur l’environnement. Il est conclu que les extraits de levure, les hydrolysats de protéines, les hydrolysats de collagène et le collagène hydrolysé par l’isostéaroyle ne satisfont pas aux critères de l’alinéa 64a) ou 64b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur sa diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
Concernant la santé humaine, les profils de risque de différents hydrolysats de protéines d’origine végétale ou animale, qui sont représentatifs de la substance hydrolysats de protéines faisant partie du groupe des dérivés de protéines et des extraits de levure, indiquent qu’aucun effet nocif n’a été observé lors d’études de laboratoire réalisées avec des doses allant jusqu’à la dose limite de 1000 mg/kg pc/jour. De même, aucun effet nocif n’a été signalé lors de plusieurs études de laboratoire sur les extraits de levure et les hydrolysats de collagène. D’après les renseignements sur les composants de réaction du collagène hydrolysé par l’isostéaroyle, à savoir l’acide isostéarique et les hydrolysats de collagène, ainsi que sur d’autres alkylamides d’acides aminés de structure similaire, cette substance ne devrait pas avoir d’effets nocifs sur la santé. Par conséquent, compte tenu des renseignements toxicologiques disponibles sur un ensemble représentatif d’hydrolysats de protéines (notamment les dérivés de levure et de collagène) et de substances associées au collagène hydrolysé par l’isostéaroyle, il a été jugé que les substances du groupe des dérivés de protéines et des extraits de levure présentent un faible potentiel de danger et leur risque pour la santé humaine est donc faible.
Compte tenu des renseignements présentés dans la présente évaluation préalable, il est conclu que les extraits de levure, les hydrolysats de protéines, les hydrolysats de collagène et le collagène hydrolysé par l’isostéaroyle ne satisfont pas aux critères de l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaine.
Par conséquent, il est conclu que les extraits de levure, les hydrolysats de protéines, les hydrolysats de collagène et le collagène hydrolysé par l’isostéaroyle ne satisfont à aucun des critères de l’article 64 de la LCPE.
1. Introduction
En vertu de l’article 68 ou 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), les ministres de l’Environnement et de la Santé ont réalisé une évaluation préalable de quatre substances formant le groupe des dérivés de protéines et des extraits de levure afin de déterminer si ces substances posent ou peuvent poser des risques pour l’environnement ou la santé humaine. Il a été déterminé que l’évaluation des substances de ce groupe était prioritaire, car elles satisfont aux critères de catégorisation énoncés au paragraphe 73(1) de la LCPE ou sont considérées comme prioritaires en vertu d’autres mécanismes (ECCC, SC [2017a modifié]).
Les risques pour l’environnement associés aux substances du groupe des dérivés de protéines et des extraits de levure ont été caractérisés à l’aide de l’approche de classification des risques écologiques (CRE) des substances organiques (ECCC, 2016a). La CRE décrit le danger associé à une substance à l’aide de paramètres clés, dont le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne induite par le réseau trophique, la biodisponibilité et l’activité chimique et biologique. La CRE tient compte de la possible exposition des organismes dans des environnements aquatiques ou terrestres en se basant sur des paramètres tels que les taux d’émission potentielle, la persistance globale et le potentiel de transport atmosphérique sur de grandes distances. La combinaison des divers éléments de preuve permet de déterminer les substances dont le potentiel d’effets nocifs sur l’environnement doit être évalué en profondeur et celles qui présentent peu de risques pour l’environnement.
La présente évaluation préalable tient compte des renseignements sur les propriétés chimiques, le devenir environnemental, les dangers, les utilisations et l’exposition et des renseignements supplémentaires soumis par les intervenants. Des données pertinentes ont été recensées jusqu’en septembre 2019. Des données empiriques tirées d’études clés ainsi que des résultats de modélisations ont permis de tirer les conclusions de l’évaluation préalable. Quand ils étaient pertinents, les renseignements contenus dans des évaluations réalisées par d’autres administrations ont été pris en compte.
La présente évaluation préalable a été préparée par le personnel du Programme d’évaluation des risques de la LCPE de Santé Canada et d’Environnement et Changement climatique Canada et inclut des données provenant d’autres programmes de ces deux ministères. La partie concernant la santé humaine a quant à elle été soumise à un examen ou une consultation externe. Des commentaires sur les parties techniques sur la santé humaine ont été fournis par le Dr Supratik Kar (Interdisciplinary Center for Nanotoxicity, Jackson State University), le Dr Mustafa Al-Zoughool (Kuwait University), la Dre Judy S. Lakind (LaKind Associates; University of Maryland School of Medicine) et le Dr Joseph Caruso (Institute of Environmental Health Sciences, Wayne State University). La partie de la présente évaluation portant sur les risques pour l’environnement est basée sur le document de la CRE (publié le 30 juillet 2016), lequel a fait l’objet d’un examen externe par des pairs et d’une consultation publique de 60 jours. De plus, la version provisoire de la présente évaluation préalable (publiée le 5 février 2021) a été soumise à une consultation publique de 60 jours. Bien que les commentaires provenant de l’extérieur aient été pris en compte, Environnement et Changement climatique Canada et de Santé Canada restent responsables du contenu et des résultats définitifs de la présente évaluation préalable.
La présente évaluation préalable s’appuie sur des renseignements essentiels permettant de déterminer si les substances visées satisfont aux critères de l’article 64 de la LCPE grâce à l’examen de données scientifiques et à une approche basée sur le poids de la preuve et le principe de précaution.Note de bas de page 2 La présente évaluation préalable comporte des données et éléments essentiels sur lesquels ses conclusions sont fondées.
2. Identité des substances
Pour les différentes substances concernées, les numéros de registre du Chemical Abstracts Service (no CASNote de bas de page 3 ), les noms figurant dans la Liste intérieure des substances (LIS) et les noms communs sont indiqués dans le tableau 2-1.
| No CASa | Nom dans la LIS | Nom commun |
|---|---|---|
| 8013-01-2 | Extraits de levure | Extraits de levure |
| 9015-54-7b | Hydrolysats de protéines | Hydrolysats de protéines |
| 92113-31-0b | Collagène, hydrolysats | Hydrolysats de collagène |
| 111174-63-1 | Produits de réaction d’hydrolysats de protéines du cuir avec le chlorure d’isostéaroyle | Collagène hydrolysé par l’isostéaroyle |
a Toutes les substances du groupe des dérivés de protéines et des extraits de levure sont des UVCB (substances de composition inconnue ou variable, produits de réactions complexes ou matières biologiques). Ces matières proviennent de sources naturelles ou de réactions complexes et ne peuvent pas être synthétisées par simple combinaison de composants seuls. Les UVCB ne sont pas des mélanges de substances distinctes obtenus intentionnellement et sont considérées comme des substances simples. La complexité et la variabilité de leur composition peuvent les rendre difficiles à caractériser de manière complète et systématique.
b Cette substance n’a pas été identifiée en vertu du paragraphe 73(1) de la LCPE, mais a été prise en compte dans la présente évaluation, car elle a été considérée comme prioritaire en vertu d’autres mécanismes.
Selon la United States Food and Drug Administration (US FDA) (1978), les hydrolysats de protéines représentent un ensemble de sources de protéines traitées par des acides ou des enzymes et destinées à produire un mélange d’acides aminés ou de peptides. Il existe quatre principaux types d’hydrolysats de protéines qui se différencient normalement par leur mode de préparation : i) les protéines de source végétale ou animale hydrolysées par un acide; ii) les extraits de levure de bière ou de boulangerie autolysés; iii) les sauces de soja issues de la dégradation enzymatique de mélanges de blé et de soja; iv) la caséine hydrolysée par un enzyme (US FDA, 1978).
Bien que les extraits de levure se définissent de la même manière que les hydrolysats de protéines, les premiers seront abordés séparément dans le cadre de la présente évaluation (c.-à-d. comme une substance distincte). La United States’ Toxic Substances Control Act (TSCA) de 2018 définit la substance de no CAS 8013-01-2 (extrait de levure) comme des « extraits et leurs dérivés modifiés physiquement, par exemple les teintures, les essences concrètes, les essences absolues, les huiles essentielles, les oléorésines, les terpènes, les fractions sans terpènes, les distillats, les résidus, obtenus à partir de Saccharomyces » (US EPA, 2018). Bien que d’autres renseignements sur l’identité de la substance ne soient pas disponibles, d’autres éléments de preuve indiquent que cet organisme est Saccharomyces cerevisiae. Le no CAS ci-dessus est répertorié par l’US FDA comme « extrait de levure de boulangerie » connu comme étant un dérivé de S. cerevisiae (US FDA, 2019) et le Chemical Book de Sigma Aldrich indique également que l’extrait associé au no CAS 8013-01-2 provient de cette espèce (Chemical Book, 2017).
Les quatre substances du groupe des dérivés de protéines et des extraits de levure sont considérées comme des UVCB. La variation de la composition est généralement due à des différences dans la nature de la source de protéines et les conditions de production ou de transformation. Par exemple, les hydrolysats de protéines peuvent être préparés à partir de différentes sources animales ou végétales (p. ex., des sous-produits du cuir, des plumes de poulet ou des sous-produits végétaux) et les matières premières peuvent ne pas être constituées de protéines pures. La plupart du temps, la source de protéines contient également des lipides, de l’amidon ou d’autres hydrates de carbone et des contaminants potentiels. Les contaminants sont surveillés de près pour assurer qu’ils répondent aux normes industrielles et sont généralement éliminés lors des étapes de traitement thermique ou de purification (Petrova et coll., 2018). Des renseignements supplémentaires sur l’identité des composants de certains hydrolysats de protéines représentatifs sont présentés à l’annexe A.
Le procédé de production des hydrolysats de protéines commence généralement par une source de protéines (animale ou végétale) qui est soumise à un traitement mécanique de broyage ou de découpage suivi d’une extraction à l’eau et d’une étape de centrifugation au cours de laquelle le concentré de protéines est séparé des autres composés organiques (Colantoni et coll., 2017). La solution ainsi obtenue est ensuite soumise à une étape d’hydrolyse enzymatique ou acide pour décomposer les protéines en peptides plus petits ou en acides aminés libres. Enfin, les composés hydrosolubles sont soumis à une autre étape de centrifugation suivie d’une étape de concentration permettant de purifier davantage la protéine (par distillation, atomisation ou lyophilisation). Les différences de conditions de production et de transformation (telles que la température, le pH, la centrifugation, l’extraction, la purification) ont toutes un impact significatif sur la composition du mélange produit.
L’obtention du collagène hydrolysé par l’isostéaroyle nécessite notamment des étapes de production supplémentaires, qui vont plus loin que celles requises pour les hydrolysats de protéines. Cette substance est produite par une réaction de condensation entre le chlorure d’acide isostéarique et les acides aminés présents dans les hydrolysats de collagène (c.-à-d. dérivés de l’hydrolyse des sous-produits du cuir) qui produit un mélange correspondant d’amides isostéaroyliques d’acides aminés. C’est ce mélange d’amides isostéaroyliques d’acides aminés qui est connu sous le nom de « collagène hydrolysé par l’isostéaroyle ».
2.1 Choix des analogues et utilisation de modèles (Q)SAR
Une méthode par lecture croisée utilisant les données associées à des analogues et des résultats de modèles de relations (quantitatives) structure-activité ([Q]SAR), le cas échéant, a permis d’évaluer les effets sur la santé humaine du collagène hydrolysé par l’isostéaroyle. Comme cette substance est produite par la réaction de condensation entre le chlorure de l’acide isostéarique et le mélange des acides aminés présents dans les hydrolysats de collagène, les renseignements sur les effets sur la santé de l’acide isostéarique (qui est formé par l’hydrolyse du chlorure de l’acide isostéarique) et des hydrolysats de collagène (qui font partie du groupe des dérivés de protéines et des extraits de levure) ont permis de caractériser ses effets sur la santé. Outre les données sur les effets sur la santé de ces deux composants, les données relatives à une classe similaire de composés, les alkylamides d’acides aminés, ont été prises en considération. Ces substances sont des mélanges très similaires au collagène hydrolysé par l’isostéaroyle, car elles contiennent des chlorures d’acide et divers acides aminés. Les renseignements sur l’identité et la structure chimique des alkylamides d’acides aminés et de l’acide isostéarique sont utilisés dans le cadre de la présente évaluation et figurent dans le tableau 2-2.
| No CAS | Nom sur la LIS ou autre nom (nom commun) | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 2724-58-5 | Acide 16-méthyl-heptadécanoïque (acide isostéarique) | 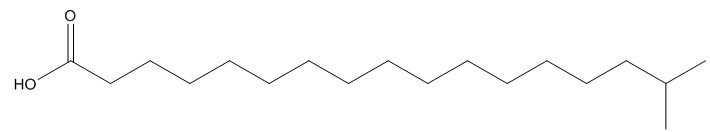 C18H36O2 C18H36O2 |
284,48 |
| 616-91-1 | N-acétyl-2-cystéine (acétylcystéine) |
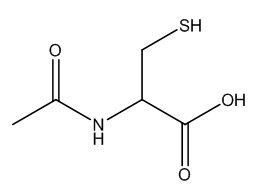 C5H9NO3S C5H9NO3S |
163,20 |
| 1188-37-0 | Acide N-acétylglutamique |  C7H11NO5 C7H11NO5 |
189,17 |
| 68-95-1 | N-Acétyl-L-proline (N-Acétylproline) |
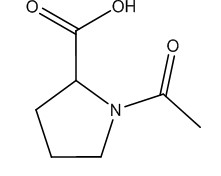 C7H11NO3 C7H11NO3 |
157,17 |
| 537-55-3 | N-Acétyl-2-tyrosine (N-Acétyl-L-tyrosine) |
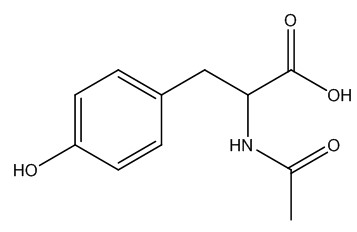 C11H13NO4 C11H13NO4 |
223,22 |
| 167888-81-5 | Capryloyl glutamate de disodium | ![CCCCCCCC(=O)NC(CCC(=O)[O-])C(=O)[O-].[Na+].[Na+]](/content/dam/eccc/images/pded/protein-derivatives-yeast-extract/20220809-t22f.jpg) C13H21NNa2O5 C13H21NNa2O5 |
317,29 |
| 68187-32-6 | Cocoyl glutamate de sodium | ![C(CC(=O)[O-])C(C(=O)O)N.[Na+]](/content/dam/eccc/images/pded/protein-derivatives-yeast-extract/20220809-t22g.jpg) C5H8NNaO4 C5H8NNaO4 |
169,11 |
| 29923-31-7 | Lauroyl glutamate de sodium | ![CCCCCCCCCCCC(=O)NC(CCC(=O)O)C(=O)[O-].[Na+]](/content/dam/eccc/images/pded/protein-derivatives-yeast-extract/20220809-t22h.jpg) C17H30NNaO5 C17H30NNaO5 |
351,42 |
3. Propriétés physiques et chimiques
Des données empiriques sur les propriétés physiques et chimiques des substances du groupe des dérivés de protéines et des extraits de levure n’étaient pas disponibles, mais elles peuvent généralement être estimées de façon approximative en utilisant leurs principaux composants (p. ex., acides aminés et chlorure d’isostéaroyle). Les propriétés physiques et chimiques des composants représentatifs de ces substances ont été rapportées dans le document d’ECCC (2016 b). Toutefois, en raison de la variabilité intrinsèque de la composition de ces substances et de l’approche adoptée pour caractériser le risque pour la santé humaine de ce groupe, il n’est pas nécessaire de dériver les propriétés physiques et chimiques approximatives de ces substances pour la partie de la présente évaluation consacrée à la santé humaine.
4. Sources et utilisations
Toutes les substances du groupe des dérivés de protéines et des extraits de levure ont fait l’objet d’une enquête menée en vertu de l’article 71 de la LCPE (Canada, 2012). Le tableau 4-1 résume les renseignements déclarés sur les quantités totales produites et importées des substances du groupe des dérivés de protéines et des extraits de levure pour l’année de déclaration 2011 (Environnement Canada, 2013).
| Nom commun | Quantité totale produitea (kg) | Quantité totale importéea (kg) |
|---|---|---|
| Extraits de levure | NDb | 100 000 – 1 000 000 |
| Hydrolysats de protéines | NDb | 10 000 – 100 000 |
| Hydrolysats de collagène | NDb | 67 702 |
| Collagène hydrolysé par l’isostéaroyle | NDb | NDb |
Abréviations : ND = non déclaré
a Les valeurs reflètent les quantités déclarées dans le cadre d’une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada, 2013). Consultez l’enquête pour en connaître les inclusions et exclusions particulières (annexes 2 et 3). Les valeurs exactes sont fournies lorsqu’elles ne sont pas confidentielles. Les quantités confidentielles sont présentées sous la forme d’une gamme de valeurs.
b Aucune quantité produite ou importée supérieure au seuil de déclaration de 100 kg n’a été déclarée pour cette substance pour l’année de déclaration 2011.
Le Tableau 4‑2 résume les principales utilisations des substances du groupe des dérivés de protéines et des extraits de levure à partir des renseignements obtenus dans le cadre d’une enquête réalisée en vertu de l’article 71 de la LCPE (Environnement Canada, 2013).
| Principales utilisationsa | Extraits de levure | Hydrolysats de protéines | Hydrolysats de collagène | Collagène hydrolysé par l’isostéaroyle |
|---|---|---|---|---|
| Matériaux de construction | N | O | N | N |
| Aliments et boissons | O | N | O | N |
| Biens intermédiaires | O | N | N | N |
| Produits alimentaires pour animaux | N | O | N | N |
| Produits de soins personnels | N | N | O | N |
Abréviations : O = oui, utilisation déclarée pour cette substance; N = non, utilisation non déclarée pour cette substance
a Utilisations non confidentielles déclarées dans le cadre d’une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada, 2013). Consultez l’enquête pour en connaître les inclusions et exclusions particulières (annexes 2 et 3).
Le tableau 4‑3 présente les autres utilisations des substances du groupe des dérivés de protéines et des extraits de levure recensées au Canada.
| Utilisation | Extraits de levure | Hydrolysats de protéines | Hydrolysats de collagène | Collagène hydrolysé par l’isostéaroyle |
|---|---|---|---|---|
| Ingrédient médicinal ou non médicinal dans des désinfectants ou des médicaments destinés aux humains ou aux animauxa | N | Ob | Oc | N |
| Ingrédients médicinaux ou non médicinaux dans des produits de santé naturelsd | O | O | O | N |
| Déclaré présent dans des produits cosmétiques en vertu du Règlement sur les cosmétiquese | Of | Og | Oh | Og |
| Ingrédient présent dans des produits antiparasitaires homologuési | Oj | N | Ok | N |
Abréviations : O = oui, utilisation déclarée pour cette substance; N = non, utilisation non déclarée pour cette substance
a Communication personnelle; courriels de la Direction des produits thérapeutiques (DPT) et de la Direction des produits de santé naturels et sans ordonnance (DPSNSO), Santé Canada, adressé au Bureau d’évaluation des risques des substances existantes (BERSE), Santé Canada, et datés de 2019 et 2020; non référencé
b Déclaré dans un médicament vétérinaire commercialisé en tant qu’ingrédient actif (communications personnelles; courriel de la DPT, Santé Canada, adressé au BERSE, Santé Canada, et daté de 2019; non référencé)
c Déclaré dans plusieurs médicaments en vente libre destinés à la consommation humaine en tant qu’ingrédient non médicinal (communications personnelles; courriel de la DPSNSO, Santé Canada, adressé au BERSE, Santé Canada, et daté de 2020; non référencé)
d Communications personnelles, courriel de la DPSNSO, Santé Canada, adressé au BERSE, Santé Canada, et daté de 2019; non référencé
e Communication personnelle; courriel de la Direction de la sécurité des produits de consommation et des produits dangereux (DSPCPD), Santé Canada, adressé au BERSE, Santé Canada, et daté de 2019; non référencé
f Présence déclarée dans des produits comme des nettoyants, des revitalisants, du maquillage, des hydratants, des shampoings et d’autres produits capillaires (communication personnelle; courriel de la DSPCPD, Santé Canada, adressé au BERSE, Santé Canada, et daté de 2019; non référencé)
g Présence déclarée dans des produits comme des hydratants pour le visage, des nettoyants, des démaquillants et des vernis à ongles (communication personnelle; courriel de la DSPCPD, Santé Canada, adressé au BERSE, Santé Canada, et daté de 2019; non référencé)
h Présence déclarée dans des produits comme des produits pour le bain, des nettoyants, des exfoliants, des colorants pour cheveux, des produits de maquillage, des produits de massage, des revitalisants et des vernis à ongles (communications personnelles; courriel de la DSPCPD, Santé Canada, adressé au BERSE, Santé Canada, et daté de 2019; non référencé)
i Communications personnelles, courriels de l’Agence de réglementation de la lutte antiparasitaire (ARLA), Santé Canada, adressés au BERSE, Santé Canada, et datés de 2019; non référencé; Santé Canada, 2010.
j Présence déclarée comme ingrédient présent dans des insecticides, des fongicides et des régulateurs de croissance des plantes (communications personnelles; courriel de l’ARLA, Santé Canada, adressé au BERSE, Santé Canada, et daté de 2020; non référencé)
k Présence déclarée comme ingrédient présent dans des acaricides, des insecticides et des régulateurs de croissance des insectes (communications personnelles; courriel de l’ARLA, Santé Canada, adressé au BERSE, Santé Canada, et daté de 2019; non référencé)
Les extraits de levure ne sont pas connus pour être utilisés dans la fabrication de matériaux d’emballage alimentaire. Cependant, ils peuvent entrer dans la composition d’additifs indirects (p. ex. dans des produits nettoyants) utilisés dans des installations de transformation d’aliments. Au Canada, les extraits de levure seraient considérés comme des ingrédients alimentaires autres que des additifs qui pourraient être ajoutés à tout aliment non standard (par exemple, marmite et végémite), ou à tout aliment standard auquel il est permis d’ajouter des extraits de levure. Il est également possible d’utiliser des extraits de levures comme agents aromatisants ou rehausseurs de saveur. Bien qu’aucun renseignement définitif ne soit disponible concernant l’utilisation d’extraits de levure comme agents aromatisants dans des aliments vendus au Canada, cette utilisation est probable puisqu’elle est autorisée aux États-Unis (communications personnelles; courriels de la Direction des aliments [DA], Santé Canada, adressé au Bureau de l’évaluation des risques des substances existantes [BERSE], Santé Canada, et daté de 2019; non référencé).
Au Canada, il est interdit d’utiliser des hydrolysats de protéines comme additifs alimentaires et ils ne sont pas non plus utilisés dans des matériaux d’emballage alimentaire ni dans des additifs indirects. Il est possible de les utiliser comme additifs non alimentaires dans des aliments vendus au Canada. Ces substances sont considérées comme ingrédients alimentaires lorsqu’elles sont utilisées dans des préparations pour nourrissons à base d’acides aminés isolés ou d’hydrolysats de protéines. Ces formules sont généralement conçues pour les nourrissons qui ne tolèrent pas les protéines entières alors que les hydrolysats de protéines de ces formules spécialisées peuvent être la principale source de protéines alimentaires du nourrisson (communications personnelles; courriels de la DA, Santé Canada, adressés au BERSE, Santé Canada, et datés de 2019; non référencé). Le Food Chemicals Codex (FCC) et l’US Food and Drug Administration (US FDA) indiquent que les hydrolysats de protéines sont notamment utilisés dans les aliments comme agents aromatisants et exhausteurs de goût (FCC USP, 2016; US FDA, 2019). Bien qu’il n’existe aucun renseignement solide concernant l’utilisation d’hydrolysats de protéines comme agents aromatisants dans des aliments vendus au Canada, cette utilisation est probable puisqu’elle est autorisée aux États-Unis (communications personnelles, courriels de la DA, Santé Canada, adressés au BERSE, Santé Canada, et datés de 2019; non référencé).
L’Agence canadienne d’inspection des aliments (ACIA) a inscrit les sources d’hydrolysats de protéines tels que les os d’animaux, les grains de maïs, les poils d’animaux et les plumes de volaille hydrolysés à la partie I de l’annexe IV du Règlement sur les aliments du bétail (Canada, 1983) (qui est une liste d’ingrédients qui ne nécessitent pas de déclaration s’ils sont utilisés conformément aux définitions des ingrédients des aliments pour animaux). Bien que cela concerne les aliments pour animaux, le processus d’évaluation de l’ACIA porte également sur l’impact sur la santé humaine lié au transfert potentiel de ces composés dans le lait, les œufs et la viande destinés à la consommation humaine, ainsi que sur tout contaminant éventuel associé à ces substances (ACIA, 2019).
En ce qui concerne les hydrolysats de collagène, il a été déclaré que des substances sont utilisées dans des produits de soins de plaies pour animaux (FDS, 2014). Les hydrolysats de collagène et le collagène hydrolysé par l’isostéaroyle ne sont pas des additifs alimentaires autorisés, et ils ne sont pas déclarés comme étant utilisés pour la fabrication de matériaux d’emballage alimentaire ou comme additifs indirects au Canada (communications personnelles; courriels de la DA, Santé Canada, adressés au BERSE, Santé Canada, et datés de 2019; non référencé).
5. Potentiel d’effets nocifs sur l’environnement
5.1 Caractérisation des risques pour l’environnement
Les risques pour l’environnement associés aux substances du groupe des dérivés de protéines et des extraits de levure ont été caractérisés à l’aide de l’approche de classification des risques écologiques (CRE) des substances organiques (ECCC, 2016a). La CRE est une approche basée sur les risques qui permet de classer ces derniers en tenant compte de plusieurs paramètres liés au danger et à l’exposition et en pondérant plusieurs éléments de preuve. Les divers éléments de preuve sont combinés et permettent ainsi de distinguer les substances présentant un pouvoir faible ou élevé et un potentiel d’exposition faible ou élevé dans divers milieux. Cette approche permet de réduire l’incertitude associée à la caractérisation des risques, contrairement à une méthode de caractérisation qui serait basée sur un seul paramètre mesuré dans un seul milieu (p. ex. la concentration létale médiane). Cette approche est résumée ci-dessous et décrite en détail dans un document d’ECCC (2016a).
Les données sur les propriétés physiques et chimiques, le devenir (demi-vies chimiques dans divers médias et biotes, coefficients de partage et bioconcentration dans les poissons), l’écotoxicité aiguë pour les poissons et les volumes de produits chimiques importés et produits au Canada ont été extraites de publications scientifiques, des bases de données empiriques existantes (p. ex., la boîte à outils [Q]SAR de l’OCDE, 2014) et des réponses aux enquêtes menées en vertu de l’article 71 de la LCPE ou produites à l’aide de modèles (Q)SAR (relation quantitative structure-activité) ou par modélisation du devenir du bilan massique ou de la bioaccumulation. Ces données ont été intégrées à d’autres modèles de bilan massique ou ont permis de définir les profils de danger et d’exposition de la substance.
Les profils de danger ont été principalement basés sur les paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne induite par le réseau trophique, à la biodisponibilité et à l’activité biologique et chimique. Les profils d’exposition ont été également basés sur plusieurs autres paramètres, dont le taux d’émission potentielle, la persistance globale et le potentiel de transport sur de grandes distances. La comparaison entre les profils de danger et d’exposition et les critères de décision a permis de classer les potentiels de danger et d’exposition de chaque substance comme faibles, moyens ou élevés. D’autres règles ont été appliquées (p. ex. en matière d’uniformité de la classification et de marges d’exposition) afin d’affiner la classification préalable des dangers ou des expositions.
Une matrice des risques a été utilisée pour assigner à chaque substance un niveau de risque, faible, moyen ou élevé, en fonction de la classification des dangers et des expositions propres à la substance. Les classifications des risques au moyen de la CRE ont été vérifiées selon une approche en deux étapes. La première étape a consisté à ajuster les résultats de la classification, en faisant passer le niveau de risque de moyen à élevé à faible pour les substances qui présentaient un faible taux d’émission estimé dans l’eau en sortie de traitement des eaux usées, le potentiel d’exposition à ces substances étant donc faible. La seconde étape a consisté à examiner les résultats de la classification des faibles niveaux de risque en se basant sur des scénarios de risque locaux (c.-à-d. dans la zone à proximité du point de rejet) relativement prudents et conçus pour protéger l’environnement, afin de déterminer si le niveau de classification des risques devait être augmenté.
La CRE utilise une approche pondérée permettant de réduire au minimum le risque de sous-classifier ou surclassifier les dangers et l’exposition et les risques qui en résultent. Les approches équilibrées tenant compte des incertitudes sont décrites en détail dans le document d’ECCC (2016a). Deux des domaines d’incertitude les plus importants sont décrits ci-dessous. Des erreurs dans les valeurs de toxicité aiguë empiriques ou modélisées pourraient entrainer des modifications de la classification des dangers, en particulier dans le cas des paramètres dépendant des valeurs liées aux résidus présents dans les tissus (c.-à-d. les paramètres liés au mode d’action toxique), nombre de ces valeurs étant prédites à l’aide de modèles (Q)SAR (Boîte à outils QSAR de l’OCDE, 2014). Toutefois, l’impact de ce type d’erreur est atténué par le fait qu’une surestimation de la létalité médiane conduira à une valeur prudente (protectrice) de résidus dans les tissus pour l’analyse des résidus corporels critiques. L’erreur due à une sous-estimation de la toxicité aiguë sera atténuée par le recours à d’autres paramètres du danger tels que la structure associée au mode d’action, la réactivité ou l’affinité de liaison aux œstrogènes. Les changements ou erreurs dans les quantités chimiques pourraient conduire à des différences de classification de l’exposition, les classifications de l’exposition et du risque étant très sensibles au taux d’émission et aux quantités utilisées. Les classifications au moyen de la CRE permettent donc de connaître l’exposition et le risque au Canada, basés sur les estimations des quantités actuellement utilisées, mais peut-être pas les tendances futures.
Les données et éléments essentiels pris en compte pour développer les profils spécifiques aux substances du groupe des dérivés de protéines et des extraits de levure, ainsi que les résultats de la classification du danger, de l’exposition et du risque sont présentés dans le document ECCC (2016 b).
Les résultats de la classification du danger et de l’exposition pour les quatre substances du groupe des dérivés de protéines et des extraits de levure sont présentés dans le tableau 5-1.
| Substance | Classification du danger selon la CRE | Classification de l’exposition selon la CRE | Classification du risque selon la CRE |
|---|---|---|---|
| Extraits de levure | Faible | Faible | Faible |
| Hydrolysats de protéines | Faible | Faible | Faible |
| Hydrolysats de collagène | Faible | Faible | Faible |
| Collagène hydrolysé par l’isostéaroyle | Fort | Faible | Faible |
Compte tenu des classements de faible danger et de faible exposition obtenus à l’aide des renseignements pris en compte pour la CRE, les extraits de levure, les hydrolysats de protéines et les hydrolysats de collagène ont été classés comme ayant un faible potentiel de risque pour l’environnement. Il est peu probable que ces substances présentent un risque pour l’environnement au Canada.
D’après les renseignements pris en compte pour la CRE, le potentiel d’exposition du collagène hydrolysé par l’isostéaroyle est classé faible. Le potentiel de danger de cette substance a été classé comme élevé en raison de l’accord entre son mode d’action réactif et son ratio d’écotoxicité élevé, tous les deux suggérant que cette substance a une puissance élevée. De même, d’après des alertes structurales provenant de la Boîte à outils (Q)SAR de l’OCDE (OCDE, 2014), cette substance pourrait se lier à l’ADN ou à des protéines. Cependant, les données utilisées pour la caractérisation selon la CRE ont été basées sur un seul modèle de marqueurs d’ADN, qui constitue une mesure conservatrice. Des analyses supplémentaires décrites à la section 6.2 ont permis d’attribuer un faible potentiel mutagène à l’acide isostéarique et aux autres substances associées au collagène hydrolysé par l’isostéaroyle. Le collagène hydrolysé par l’isostéaroyle a été initialement classé comme substance présentant un potentiel modéré de risque pour l’environnement. Cependant, la classification du risque a été revue à la baisse, passant à un potentiel faible de risque pour l’environnement à la suite de la correction effectuée en fonction des quantités actuelles utilisées (voir section 7.1.1 du document sur l’approche de la CRE, ECCC, 2016a). Les effets potentiels et la façon dont ils peuvent se manifester dans l’environnement n’ont pas été étudiés de manière approfondie en raison du faible risque d’exposition associé à cette substance. Étant donné son profil d’utilisation actuel, il est probable que cette substance présente des risques pour l’environnement au Canada.
6. Risque d’effets nocifs sur la santé humaine
6.1 Évaluation de l’exposition
La population générale du Canada peut être exposée aux substances du groupe des dérivés de protéines et des extraits de levure, car ces substances sont naturellement présentes dans l’environnement et peuvent également être rejetées dans l’environnement à la suite de l’utilisation de produits de consommation (p. ex. rejetées dans les égouts).
L’exposition de la population générale du Canada aux substances de ce groupe peut être due aux aliments et aux produits disponibles pour les consommateurs, dont des cosmétiques. L’exposition à ces substances peut survenir par voie orale lors de la consommation d’aliments, par voie cutanée lors de l’utilisation de cosmétiques comme les revitalisants capillaires et par inhalation lors de l’utilisation de cosmétiques en vaporisateur comme les hydratants pour le visage et les produits coiffants.
Étant donné le faible potentiel de danger des substances du groupe des dérivés de protéines et des extraits de levure (section 6.2), aucune estimation quantitative de l’exposition de la population générale n’a été réalisée.
6.2 Évaluation des effets sur la santé
Les substances du groupe des dérivés de protéines et des extraits de levure sont des mélanges complexes et il existe peu de renseignements sur les types précis (p. ex. méthodes de préparation) de substances de ce groupe et, dans le cas des hydrolysats de protéines, sur les sources (p. ex. végétaux, animaux ou levures) utilisées au Canada. Ainsi, la présente évaluation utilise des renseignements portant sur diverses substances représentatives (p. ex. des hydrolysats d’origine animale et végétale) pour caractériser les profils d’effets sur la santé des substances du groupe des dérivés de protéines et des extraits de levure.
Un examen de la littérature scientifique concernant les quatre substances évaluées a montré que dans la majorité des études aucun effet nocif n’avait été observé à des concentrations inférieures à 1000 mg/kg pc/jour. Dans les quelques cas où des effets négatifs ont été observés, il s’agissait de formulations de régime inappropriées dans lesquelles certaines déficiences en acides aminés n’ont pas été prises en compte. Aucun effet associé à une cancérogénicité, génotoxicité ou toxicité pour la reproduction/développement potentielle n’a été observé. Les détails importants sont présentés ci-dessous.
Extraits de levure
Une étude de toxicité subchronique à dose répétée administrée par voie orale a été réalisée avec des rats Wistar. Les animaux étudiés (10 animaux/sexe/dose) ont reçu 0, 200, 625 ou 2000 mg/kg pc/jour de MDA 11 (produit à base de S. cerevisiae, composé de 53 % de protéines, 11 % de sel, 3,6 % de graisse et d’autres solides) pendant 13 semaines. Une dose sans effet nocif observé (DSENO) de 2000 mg/kg pc/jour, la dose testée la plus élevée (HTD), a été établie sur la base de l’absence d’effets nocifs (ECHA, c2007-2019c).
Pour une autre étude de toxicité subchronique à dose répétée, des rats Charles River (10 animaux/sexe/groupe) ont été exposés pendant 90 jours à 0,2, 2 ou 20 g/kg pc/jour (soit 200, 2000 ou 20 000 mg/kg pc/jour) d’extrait de levure autolysé (40 % de protéines, 16,7 % de cendres et 15,8 % d’azote) par voie orale. Une DSENO de 2000 mg/kg pc/jour a été établie sur la base d’une néphrite, de dépôts minéraux dans les tubules du cortex interne et de la jonction corticomédullaire et de l’augmentation des rapports de poids rein-corps à la dose suivante (Hazleton Laboratories, 1970).
Une épreuve de mutation inverse bactérienne utilisant S. cerevisiae et réalisé avec et sans activation métabolique pendant 72 h a produit un résultat négatif pour les cinq souches de Salmonella typhimurium testées (ECHA, c2007-2019c).
Une épreuve in vivo de micronoyaux avec la poudre de Maxarome (obtenue à partir de la levure primaire) et la poudre de Gistex (extrait de levure autolysé) a permis de constater que les substances testées ne donnaient aucune indication de dommage chromosomique ni de dommage au fuseau mitotique dans les cellules de moelle osseuse de souris (ECHA, c2007-2019c).
D’après les résultats des épreuves in vitro et in vivo ci-dessus, l’extrait de levure ne devrait pas être génotoxique.
Un avis GRAS (Generally Regarded as Safe) a également été émis par l’US FDA (ECCC, SC, 2017 b) concernant plusieurs souches naturelles et génétiquement modifiées de S. cerevisiae. Selon l’Autorité européenne de sécurité des aliments (EFSA), S. cerevisiae est présumé sans risque pour l’utilisation dans les aliments pour animaux et tout au long de la chaîne alimentaire. Toutefois, leur publication sur la présomption qualifiée de sécurité (QPS) contient quelques conditions supplémentaires (EFSA, 2007, 2010, 2011).
Hydrolysats de protéines
Sources végétales
Dans une étude de toxicité subchronique à dose répétée, des rats Charles River (12 animaux/groupe) ont été nourris avec un régime composé de 20 % d’hydrolysats de protéines alimentaires (environ 3600 mg/jour) provenant de Lupinus albus, L. luteus ou de caséine (témoins) pendant 112 jours. L’alimentation a été complétée par de la DL-méthionine. Aucune différence n’a été observée entre le groupe testé et le groupe témoin quant à la consommation de nourriture, au taux de conversion des aliments, au rapport du poids des organes au poids corporel pour le foie, la rate, le cœur, aux résultats d’examen microscopique ou aux anomalies observées à l’autopsie (Ballester, 1980).
Une étude de toxicité subchronique à dose répétée par voie orale en trois parties a été réalisée avec des rats Wistar et des souris Colworth C57 BI. Pendant la première partie de cette étude, les animaux (19 rats/groupe) ont reçu pendant 21 semaines 2500 ou 5000 mg/kg pc/jour d’un aliment constitué de gluten de blé hydrolysé avec de l’acide et modifié avec de l’hydrochlorure de cystéine et du glucose ou du xylose. Une DSENO de 5000 mg/kg pc/jour (DEE) a été établie. Pendant la deuxième partie de l’étude, des rats Wistar ont reçu 5000 ou 9000 mg/kg pc/jour (40 animaux/sexe/groupe) des mêmes formules pendant deux ans. Une DSENO de 5000 mg/kg pc/jour a été établie sur la base de l’augmentation du poids des reins et du foie et une incidence plus élevée de télangiectasie à la dose de 9000 mg/kg pc/jour. Pendant la troisième partie de l’étude, un aliment à base de gluten de blé hydrolysé avec de l’acide et modifié avec du glucose a été donné à des souris Colworth (45 animaux/sexe/groupe) pendant 80 semaines à raison de 5000 ou 9000 mg/kg pc/jour. Une DSENO de 9000 mg/kg pc/jour (DEE) a été établie. Les DSENO établies au cours de cette étude n’ont été basées sur aucun effet observé sur le gain de poids corporel, la consommation de nourriture, l’hématologie, le poids des organes ou des résultats histologiques liés au traitement. Bien que l’incidence de nodules hépatiques chez les animaux traités avec les deux concentrations alimentaires ait été supérieure à celle observée chez les témoins, ces différences n’ont pas été jugées statistiquement significatives. De même, il n’y a eu aucun effet significatif sur l’incidence de la néoplasie, le type de néoplasie et le site ou l’âge de développement de cette dernière (Laboratoire de recherche d’Unilever, 1976).
Une autre étude de toxicité chronique à dose répétée par voie orale a été réalisée avec des souris ICR-JCL sevrées. Les animaux étudiés (40 animaux/sexe/groupe) ont été exposés pendant 18 mois à 0, 0,11, 1,1 ou 11 % (soit environ 8000 mg/kg pc/jour) de solides de sauce de soja (obtenus par hydrolyse enzymatique) et ont reçu un régime alimentaire de base contenant des quantités équivalentes de chlorure de sodium. Une DSENO de 8000 mg/kg pc/jour (DEE) a été établie sur la base de l’absence de différences dans la prise de poids corporel, la mortalité, le rapport entre le poids des organes et le poids corporel et l’histopathologie des animaux traités par rapport aux témoins recevant du chlorure de sodium. Aucun signe de cancérogénicité n’a été observé (Ohshita, 1977). Des résultats similaires ont été obtenus au cours d’une étude de six mois sur des rats Wistar (30 animaux/sexe/groupe) ayant reçu des régimes alimentaires contenant jusqu’à 7000 mg/kg pc/jour de solides de sauce de soja (Ohshita, 1977).
La protéine de soja hydrolysée à l’acide s’est avérée non mutagène lors d’une série d’épreuves microbiennes in vitro avec des souches de Salmonella typhimurium (Litton Bionetics, 1974). Les protéines de lupin hydrolysées (jusqu’à 26,7 %), les protéines de pois hydrolysées (jusqu’à 25 %), les protéines d’amandes douces hydrolysées (jusqu’à 3,3 %) et les protéines végétales hydrolysées (10,9 %) ne se sont pas avérées mutagènes lors de divers tests Ames (Personal Care Products Council, 2016a,b).
Une étude de toxicité pour la reproduction/développement a été réalisée avec des souris CD-1 et des rats Wistar avec des protéines de soja hydrolysées administrées par voie orale. Les animaux étudiés ont reçu des doses allant jusqu’à 1000 mg/kg pc/jour (souris) et 1400 mg/kg pc/jour) (rats) pendant 10 jours à partir du sixième jour de gestation. L’évaluation n’a révélé aucun effet sur le développement fœtal ni sur la survie maternelle ou fœtale chez les souris et les rats jusqu’à la dose maximale testée (Morgareidge, 1973).
Sources animales
D’après les renseignements soumis à l’ECHA dans un dossier REACH, une étude de toxicité subchronique à dose répétée par voie orale a été réalisée avec des rats Sprague-Dawley. Les animaux étudiés (40 animaux/sexe/dose) ont été exposés pendant 90 jours à 0, 30, 300 ou 1000 mg/kg pc/jour de cartilage hydrolysé de sternum de poulet (collagène). Aucun des groupes de traitement n’a présenté de mortalité, d’effets indésirables, ni de signes cliniques de toxicité. Un des mâles du groupe ayant reçu la dose intermédiaire a été euthanasié le 38e jour après avoir été trouvé moribond. L’analyse post-mortem a révélé un écoulement rouge des yeux de l’animal, des dents crochues et un contenu gastrique minimal, attribués à une blessure subie dans la cage et non liée au traitement. Une DSENO de 1000 mg/kg pc/jour (HTD) a été établie (ECHA, c2007-2019a).
Une épreuve de mutation inverse bactérienne avec des concentrations maximales de caséine hydrolysée de 5000 μg/plaque a produit des résultats négatifs pour toutes les souches de Salmonella typhimurium (avec ou sans activation métabolique S9). La même épreuve a également été effectuée avec de la kératine hydrolysée et des protéines de lait hydrolysées et a produit des résultats négatifs, indiquant ainsi le caractère non mutagène de ces substances. Une épreuve in vitro d’aberration chromosomique utilisant la fraction glycomacropeptide du lait de vache à des concentrations maximales de 5000 μg/plate a également montré que la substance n’est pas cytotoxique ni génotoxique (ECHA, c2007-2019b).
Aux États-Unis, les hydrolysats de protéines ont reçu le statut GRAS. Plus précisément, les protéines hydrolysées de plantes, de légumes, d’animaux et de lait sont considérées comme GRAS (US FDA, 1961, 1972). L’US FDA a également déterminé que l’utilisation de peptones (un mélange variable de polypeptides, d’oligopeptides et d’acides aminés produits par hydrolyse partielle de la caséine, de tissus animaux, de protéines de soja, de gélatine, d’ovalbumine et de protéines de lactosérum) comme substances alimentaires directes était GRAS dans certaines conditions d’utilisation (US eCFR, 2019).
Hydrolysats de collagène
Une étude de toxicité subchronique à dose répétée par gavage a été menée avec des rats Sprague-Dawley. Les animaux ont été exposés pendant 90 jours à 0, 30, 300 ou 1000 mg/kg pc/jour de BioCell Collagen IINote de bas de page 4 (10 animaux/sexe/groupe) dans 100 mL d’eau. Une DSENO de 1000 mg/kg pc/jour a été établie (HTD) sur la base de l’absence d’effets nocifs sur l’hématologie, la chimie clinique, les évaluations macroscopiques d’organes et de tissus et des signes cliniques (FDA 2017).
Aucun effet nocif n’a été observé lors d’une autre étude d’exposition par voie alimentaire de 90 jours pour laquelle des rats Sprague Dawley ont reçu une nourriture contenant du collagène, de la gélatine ou de la caséine en quantités comprises entre 2000 et 10 000 mg/kg pc/jour (Booth, 1970; Whitmore, 1975).
Une étude de toxicité à court terme par voie cutanée a été réalisée avec des lapins. Les animaux étudiés (2 animaux/sexe/groupe) ont reçu 100, 1000 ou 3200 mg/kg pc/jour d’un shampoing commercialisé contenant 2 % de collagène hydrolysé une fois par jour pendant 30 jours. La peau d’un mâle et d’une femelle de chaque groupe a été abrasée chaque semaine. Une DSENO de 3200 mg/kg (DEE) a été établie sur la base de l’absence de lésions macroscopiques et microscopiques, de comportement anormal et de décès (CTFA, 1979, comme mentionné dans Liebert M., 1985). Des résultats similaires ont été obtenus lors d’une autre étude de toxicité cutanée chez des porcs Yorkshire traités avec 0,5, 1 ou 2 mL/kg d’une solution de shampoing contenant 2 % de collagène hydrolysé (DSENO = 2 mL/kg DEE) (TPS 1978).
Une série d’études cliniques ont été réalisées chez des femmes ménopausées, des adultes souffrant de douleurs articulaires, d’arthrose, de diabète de type 2, d’hypertension légère ou de plaies de pression et d’autres adultes en bonne santé. Les patients ont consommé des produits principalement composés de collagène hydrolysé isolé à des doses maximales de 135 mg/kg pc/jourNote de bas de page 5 (seuls ou avec de faibles doses d’autres composés dérivés du cartilage, dont l’acide hyaluronique et le sulfate de chondroïtine) pendant une période maximale de 20 mois. Aucun effet indésirable lié au composé (par exemple, cicatrisation, douleur articulaire, inflammation) n’a été signalé jusqu’à la dose maximale testée de 135 mg/kg pc/jour (US FDA, 2017).
Collagène hydrolysé par l’isostéaroyle
Comme indiqué à la section 2, le collagène hydrolysé par l’isostéaroyle est produit par une réaction de condensation entre le chlorure d’acide isostéarique et les acides aminés présents dans les hydrolysats de collagène. Étant donné le manque de données sur les effets spécifiques de cette substance sur la santé, nous avons utilisé les renseignements sur les effets sur la santé de ces deux composants de la réaction pour déterminer les effets sur la santé du collagène hydrolysé par l’isostéaroyle. De plus, les renseignements sur les effets sur la santé d’alkylamides d’acides aminés de structure similaire ont été pris en compte.
Acide isostéarique
Au cours de trois études réalisées par incubation gastrique, des rats ayant reçu de l’acide isostéarique ont présenté une DL50 aiguë par voie orale comprise entre 32 et 64 mL/kg pc (Liebert, 1983).
Lors d’une étude « Test Guideline 401 » de l’OCDE, un groupe de cinq rats/sexe a reçu de l’acide isooctadécanoïque (également appelé acide isostéarique, no CAS 30399-84-9) à une dose de 2000 mg/kg pc. Il n’y a eu aucun signe clinique, aucun décès, ni aucun effet nocif observable à la nécropsie. La DL50 était > 2000 mg/kg pc (ECHA, c2007-2019d).
Une épreuve de mutation inverse bactérienne avec l’isomère structural, à savoir l’acide stéarique, à des concentrations maximales de 5000 μg/plate (avec ou sans activation métabolique) sur des souches de Salmonella typhimurium a donné des résultats négatifs dans tous les cas (ECHA, c2007-2019d).
Hydrolysats de collagène
Les renseignements sur cette substance sont fournis à la section ci-dessus sur les hydrolysats de collagène.
Alkylamides d’acides aminés
Divers autres alkylamides d’acides aminés présentant à divers degrés des similarités structurelles avec le collagène hydrolysé par l’isostéaroyle ont fait l’objet d’un examen par le panel du Cosmetic Ingredient Review (CIR) en tant que membres du groupe des alkylamides d’acides aminés. Un nombre limité d’études a été identifié.
Des études in vitro avec de l’acide acétylglutamique, l’acétylproline, l’acétyltyrosine, le capryloylglutamate disodique, le cocoylglutamate de sodium et le lauroylglutamate de sodium ont mis en évidence une absence de génotoxicité (Cosmetic Ingredient Review, 2013).
Une étude de toxicité pour la reproduction/développement de l’acétylcystéine administrée par voie orale a été menée chez le rat et le lapin. Les animaux étudiés ont reçu des doses maximales de 2000 mg/kg pc/jour (rats) et de 1000 mg/kg pc/jour (lapins). Selon les résultats d’une évaluation, aucun signe d’altération de la fertilité ni de toxicité pour les fœtus n’a été observé chez ces deux animaux jusqu’à la dose maximale testée. Lors d’une étude distincte de toxicité pour la reproduction, des rats mâles traités par voie orale avec 250 mg/kg pc/jour d’acétylcystéine pendant 15 semaines n’ont présenté aucun effet nocif sur la fertilité ni sur les performances de reproduction (US FDA, 2006).
6.3 Caractérisation du risque pour la santé humaine
Aucun effet nocif n’a été observé lors d’études en laboratoire réalisées avec des concentrations maximales de 1000 mg/kg pc/jour de divers hydrolysats de protéines de source végétale ou animale de structure similaire, représentatifs de la substance de no CAS 9015-54-7 (hydrolysats de protéines). De même, aucun effet nocif n’a été rapporté dans plusieurs études de laboratoire réalisées avec des doses maximales de 1000 mg/kg pc/jour d’hydrolysats de collagène et d’extrait de levure. Aucune donnée n’était disponible sur les effets sur la santé spécifiques du collagène hydrolysé par l’isostéaroyle. Compte tenu des renseignements sur les constituants individuels ayant réagi, à savoir l’acide isostéarique et les hydrolysats de collagène, ainsi que sur des alkylamides d’acides aminés de structure similaire, cette substance ne devrait pas avoir d’effets nocifs sur la santé. En conséquence, compte tenu des renseignements toxicologiques disponibles présentés dans la présente section, le potentiel de danger des substances du groupe des dérivés de protéines et des extraits de levure est jugé faible. Aucune estimation quantitative de l’exposition n’a donc été effectuée. Le risque posé à la santé humaine par les quatre substances du groupe des dérivés de protéines et des extraits de levure est jugé faible.
6.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Certaines lacunes et incertitudes existaient dans la base de données relatives aux effets sur la santé (p. ex., concernant l’utilisation d’un ensemble de données représentatives pour traiter la variabilité des mélanges complexes d’hydrolysats de protéines), mais elles n’étaient pas significatives et ne risquaient pas d’influer sur les résultats. Sur la base des renseignements disponibles, il a été jugé approprié pour la présente évaluation d’adopter une approche qualitative basée sur le danger pour la caractérisation des risques.
7. Conclusion
Compte tenu de tous les éléments de preuve avancés dans la présente évaluation préalable, les quatre substances du groupe des dérivés de protéines et des extraits de levure posent un faible risque d’effets nocifs sur l’environnement. Il est conclu que les extraits de levure, les hydrolysats de protéines, les hydrolysats de collagène et le collagène hydrolysé par l’isostéaroyle ne satisfont pas aux critères de l’alinéa 64a) ou 64b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur sa diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
Compte tenu des renseignements présentés dans la présente évaluation préalable, il est conclu que les extraits de levure, les hydrolysats de protéines, les hydrolysats de collagène, et le collagène hydrolysé par l’isostéaroyle ne satisfont pas aux critères de l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaine.
Par conséquent, il est conclu que les extraits de levure, les hydrolysats de protéines, les hydrolysats de collagène et le collagène hydrolysé par l’isostéaroyle ne satisfont à aucun des critères de l’article 64 de la LCPE.
Références
[ACIA] Agence canadienne d’inspection des aliments. 2019. Chapitre 2 – Exigences par rapport aux données pour l’enregistrement des ingrédients et des aliments du bétail : 2.6 Directives relatives à l’évaluation des aliments nouveaux du bétail : origine végétale. [Consulté le 31 octobre 2019].
Ballester D, Yáñez E, García R, Erazo S, López F, Haardt E, Cornejo S, López A, Pokniak J, and Chichester C. et al 1980. Chemical composition, nutritive value, and toxicological evaluation of two species of sweet lupine (Lupinus albus and Lupinus luteus). J Agric Food Chem. 28:402-405. (Disponible en anglais seulement)
Booth AL. 1970. US Department of Agriculture, Berkeley, CA. Memorandum with attachments, dated July 21, to R.A. Whitmore, US Department of Agriculture, Philadelphia. (Disponible en anglais seulement)
Calabrese EJ, Kenyon EM. 1991. Air toxics and risk assessment. Chelsea (MI): Lewis Publishers, Inc. (Disponible en anglais seulement)
Canada. [1983]. Règlement sur les aliments du bétail. DORS/83-593.
Canada, Ministère de l’Environnement. 2012. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances de la Liste intérieure [PDF]. Gazette du Canada, Partie I, vol. 146, no 48, supplément.
Chemical Book. 2017. Yeast Extract. [Consulté le 6 sept. 2019]. (Disponible en anglais seulement)
Colantoni A, Recchia L, Bernabei G, Cardarelli M, Rouphael Y, Colla G. 2017. Analyzing the Environmental Impact of Chemically-Produced Protein Hydrolysate from Leather Waste vs. Enzymatically-Produced Protein Hydrolysate from Legume Grains. Agriculture. 7(8):62. (Disponible en anglais seulement)
Cosmetic Ingredient Review. 2013. Safety Assessment of Amino Acid Alkyl Amides as Used in Cosmetics [PDF]. [Consulté le 6 septembre 2019]. (Disponible en anglais seulement)
CTFA (Cosmetic, Toiletry and Fragrance Association). 1979. Submission of unpublished data by CTFA. Subchronic dermal toxicity test (as cited in Liebert M. 1985). (Disponible en anglais seulement)
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l’approche scientifique : Classification du risque écologique des substances organiques. Ottawa, Ontario : gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada; 2016b; Supporting Documentation: data used to create substance-specific hazard and exposure profiles and assign risk classifications in the Ecological Risk Classification of organic substances; Gatineau (QC) : ECCC; renseignements sur le document sur l’approche scientifique : classification du risque écologique des substances organiques; disponible sur demande à substances@canada.ca. (Disponible en anglais seulement).
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. [Modifié le 12 mars 2017]. Catégorisation de substances chimiques. Ottawa, Ontario : gouvernement du Canada. [Consulté le 18 sept. 2019].
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2017b. Rapport final d’évaluation préalable de la souche F53 de la levure Saccharomyces cerevisiae. Ottawa, Ontario : gouvernement du Canada.
[ECHA] European Chemicals Agency. c2007-2019a. Registered substances database; search results for CAS RN 100085-61-8. Helsinki (FI): ECHA [mis à jour en 2006; consulté le 7 oct, 2019]. (Disponible en anglais seulement)
[ECHA] European Chemicals Agency. c2007-2019b. Registered substances database; search results for CAS RN 100085-61-8. Helsinki (FI): ECHA [mis à jour en 2008; consulté le 7 oct. 2019]. (Disponible en anglais seulement)
[ECHA] European Chemicals Agency. c2007-2019c. Registered substances database; search results for CAS RN 84604-16-0. Helsinki (FI): ECHA [mis à jour en 1999; consulté le 7 oct. 2019]. (Disponible en anglais seulement)
[ECHA] European Chemicals Agency. c2007-2019d. Registered substances database; search results for CAS RN 30399-84-9. Helsinki (FI): ECHA [mis à jour en 1999; consulté le 15 février 2022]. (Disponible en anglais seulement)
[EFSA] European Food Safety Authority. 2007. Introduction of a Qualified Presumption of Safety (QPS) approach for assessment of selected microorganisms referred to EFSA. EFSA Journal 587, 10-16. (Disponible en anglais seulement)
[EFSA] European Food Safety Authority. 2010. Scientific Opinion on the maintenance of the list of QPS biological agents intentionally added to food and feed (2010 update). EFSA Journal 8(12), 1-56. (Disponible en anglais seulement)
[EFSA] European Food Safety Authority. 2011. Scientific Opinion on the maintenance of the list of QPS biological agents intentionally added to food and feed (2011 update). EFSA Journal 9 (12), 1-82. (Disponible en anglais seulement)
Environnement Canada; 2013; Données de la Mise à jour de l’Inventaire de la LIS recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances de la Liste intérieure; Données préparées par Environnement Canada et Santé Canada, Programme des substances existantes.
[FCC USP] Food Chemicals Codex [base de données]. 016. Rockville (MD): US Pharmacopeial Convention. [Consulté en février 2019]. (Disponible en anglais seulement)
Hazleton Laboratories, Inc. 1970. 13 –week dietary administration - rats. Soup base mixture, compound FN; yeatex, yeast extract. Report submitted to Campbell Soup Company, Camden, N. J. Section II in comments by IHPC on SCOGS tentative report 37b "Protein hydrolyzates," Toxicology. 1977. International Hydrolyzed Protein Council, Washington, DC. (Disponible en anglais seulement)
Liebert MA. Inc Publishers. 1983. Final Report on the Safety Assessment of Isostearic Acid. J Am Coll Toxicol. 2(7):61-74. (Disponible en anglais seulement)
Liebert MA. Inc Publishers. 1985. Final Report on the Safety Assessment of Hydrolyzed Collagen. J Am Coll Toxicol. 4(5):199-221. (Disponible en anglais seulement)
Litton Bionetics Inc. 1974. Mutagenic evaluation of compound FDA 71-85, hydrolyzed vegetable protein (soy). Report prepared under DHEW Contract No. FDA 223-74-2104. Available from: NTIS, Springfield, VA; PB-245 432. (Disponible en anglais seulement)
Morgareidge K. 1973. Food and Drug Research Laboratories, Inc. Teratologic evaluation of FDA 71-85 (hydrolyzed vegetable protein) in mice and rats. Final report prepared under DHEW Contract No. FDA 71-260. Waverly, NY. [27 p.] (Disponible en anglais seulement)
OECD QSAR Toolbox [outil de lecture croisée]. 2014. Version 3.3. Paris (FR): Organisation for Economic Co-operation and Development, Laboratory of Mathematical Chemistry. (Disponible en anglais seulement)
Ohshita K, Nakashima Y, Sugiyama S, Takahashi R. [1977]. Appendix 3. Safety evaluation of shoyu. In: Scientific data and information for the Select Committee on GRAS Substances relating to fermented soy sauce. Kikkoman Foods, Inc., Walworth, WI. p.36-109. (Disponible en anglais seulement)
Personal Care Products Council. 2016a. Summary information Hydrolyzed Sweet Almond Protein and Hydrolyzed Lupine Protein. Unpublished data submitted by Personal Care Products Council. (Disponible en anglais seulement)
Personal Care Products Council. 2016b. Summary information Hydrolyzed Pea Protein. Unpublished data submitted by Personal Care Products Council. (Disponible en anglais seulement)
Petrova I, Tolstorebrov I, Eikevik TM. 2018. Production of fish protein hydrolysates step by step: technological aspects, equipment used, major energy costs and methods of their minimizing. Int Aquat Res. 10(3):223-241. (Disponible en anglais seulement)
Santé Canada. 2010. Liste des produits de formulation de l’ARLA [PDF]. Ottawa, Ontario : gouvernement du Canada. SC Pub. no : 100461, no de catalogue : H114-22/2010F. [Consulté le 7 oct. 2019].
[SDS] Safety Data Sheet. 2014. Lambert Kay EMT Gel [PDF]. Missouri (US): Lambert Kay. [Consulté le 16 oct. 2019]. (Disponible en anglais seulement)
TPS (Toxicology and Pathology Services) of the Cosmetic Ingredient Review. 1978. Subchronic dermal toxicity test (2-19-10). (Disponible en anglais seulement)
Unilever Research Laboratory. 1976. Biological evaluation of modified protein hydrolysates for use as meat flavors. Washington, DC. International Hydrolyzed Protein Council. (Disponible en anglais seulement)
[US eCFR] United States Electronic Code of Federal Regulations. 2019. Title 21, vol. 3, c. I, part 184.1553: Direct Food Substances Affirmed as Generally Recognized as Safe. Washington (DC): National Archives and Records Administration’s Office of the Federal Register (OFR); Government Publishing Office. [Consulté le 12 sept. 2019]. (Disponible en anglais seulement)
[US EPA] United States Environmental Protection Agency. 2018. Substance Registry Services (SRS). Yeast, ext. [Consulté le 25 oct. 2019]. (Disponible en anglais seulement)
[US FDA] United States Food and Drug Administration. 1961. Approval as GRAS (to Snyder, ChadwelL Keck, Kayser, and Ruggles, Chicago, Ill.) of hydrolyzed milk protein based on a letter, dated October 20, 1961 from E. T. W., Food and Drug Administration. (Disponible en anglais seulement)
[US FDA] United States Food and Drug Administration. 1972. Subcommittee on Review of the GRAS List (Phase II). 1972. A comprehensive survey of industry on the use of food chemicals generally recognized as safe (GRAS). Appendix A. Prepared under DHEW contract no. FDA 70-22, by Committee on Food Protection, Division of Biology and Agriculture, National Research Council. National Academy of Sciences, Washington, DC. (Disponible en anglais seulement)
[US FDA] United States Food and Drug Administration. 1978. Evaluation of the Health Aspects of Protein Hydrolyzates as Food Ingredients. Life Sciences Research Office. [Consulté le 7 oct. 2019]. (Disponible en anglais seulement)
[US FDA] United States Food and Drug Administration. 2006. Acetadote® (acetylcysteine) Injection [package insert] NDA21-539/S-004 [PDF]. Nashville (TN): Cumberland Pharmaceuticals. [Consulté le 7 oct. 2019]. (Disponible en anglais seulement)
[US FDA] United States Food and Drug Administration. 2017. GRAS Notice 713 for Hydrolyzed Procine Trachea Cartilage. Submitted by Rousselot BVBA on May 3, 2017. Washington (DC): US FDA. [Consulté le 7 oct. 2019]. (Disponible en anglais seulement)
[US FDA] United States Food and Drug Administration. 2019. Protein Hydrolysate, unspecified. Washington (DC) : US FDA. [Consulté le 7 oct. 2019]. (Disponible en anglais seulement)
Whitmore R, Booth A, Naghski J, Swift C. 1975. Digestibility and safety of limed hide collagen in rat feeding experiments. J Food Sci. 40:101-104. (Disponible en anglais seulement)
Annexe A. Principaux composants de certains hydrolysats de protéines
| Composant principal (% p/p poids sec) | Blé | Levure | Caséine |
|---|---|---|---|
| Protéines | 43,2 | 32,4 | 91,9 |
| Cendres | 41,1 | 54,2 | 0,9 |
| Hydrates de carbone | 0,12 | 0,14 | 0,04 |
| Acides organiques | 6,45 | 7,63 | Moins de 0,4 |
| NH4Cl | 4,82 | 1,44 | 4,0 |
| Humidité | 2,4 | 2,2 | 2,9 |
| Total | 99,2 | 99,4 | 99,7 |
a Exemples de compositions de produits commerciaux de protéines hydrolysées à l’acide (en poids sec).
