Évaluation préalable - Diacétate et hexakis(2-méthylpropanoate) de sucrose
Titre officiel : Évaluation préalable - Diacétate et hexakis(2-méthylpropanoate) de sucrose
6-Acétate et 2,3,4-tris(2-méthylpropanoate) de [6-O-acétyl-1,3,4-tris(O-(2-méthylpropanoyl)-β-D-fructofuranosyl-α-D-glucopyranoside
Numéro de registre du Chemical Abstracts Service
126-13-6
Environnement et Changement climatique Canada
Santé Canada
Juin 2022
No de cat. : En84-293/2022F-PDF
ISBN 978-0-660-43469-8
Synopsis
En vertu de l’article 68 de la Loi canadienne sur la protection de l’environnement 1999 (LCPE), les ministres de l’Environnement et de la Santé ont réalisé une évaluation préalable du 6-acétate et 2,3,4-tris(2-méthylpropanoate) de [6-O-acétyl-1,3,4-tris(O-(2-méthylpropanoyl)-β-D-fructofuranosyl-α-D-glucopyranoside, appelé ci-après diacétate et hexakis(2-méthylpropanoate) de sucrose (SAIB). Le numéro du registre du Chemical Abstracts Service (NE CASNote de bas de page 1 ) de cette substance est le 126‑13-6.
Le SAIB n’est pas présent naturellement dans l’environnement. D’après les renseignements soumis en réponse à une enquête menée en vertu de l’article 71 de la LCPE en 2011, aucune production de cette substance n’a été déclarée au Canada, mais 0,1 kg y a été importé. Le SAIB est utilisé comme adhésif et agent filmogène dans des cosmétiques. C’est un additif alimentaire autorisé, inscrit sur la Liste des additifs alimentaires autorisés ayant d’autres utilisations acceptées (Listes des additifs alimentaires autorisés), en tant qu’agent modificateur de la densité dans des boissons contenant des essences d’agrumes ou de sapin.
Les risques posés à l’environnement par le SAIB ont été caractérisés au moyen de la Classification du risque écologique des substances organiques (CRE). La CRE est une méthode basée sur les risques qui tient compte de plusieurs paramètres pour évaluer le danger et l’exposition et d’une pondération des divers éléments de preuve pour classer le risque. Les profils de danger sont établis principalement en se basant sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. La vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance font partie des paramètres pris en compte pour les profils d’exposition. Une matrice de risque est utilisée pour assigner un niveau de risque faible, modéré ou élevé, basé sur les profils de danger et d’exposition. D’après les résultats de la CRE, il est improbable que le SAIB ait des effets nocifs sur l’environnement.
Compte tenu de tous les éléments de preuve avancés dans la présente évaluation préalable, le SAIB présente un faible risque d’effets nocifs sur l’environnement. Il est conclu que le SAIB ne satisfait à aucun des critères de l’alinéa 64 a) ou 64 b) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ni dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou sa diversité biologique ou qui constituent ou peuvent constituer un danger pour l’environnement essentiel à la vie.
L’exposition de la population générale au SAIB due aux milieux de l’environnement ne devrait pas être importante. Pour la population générale du Canada, l’exposition potentielle au SAIB peut résulter de la consommation de certaines boissons alcooliques et non alcooliques aromatisées, de l’utilisation de produits cosmétiques tels que du vernis à ongles, du rouge à lèvres, de l’ombre à paupières, des autocollants pour le visage, des tatouages pour le corps et des produits à base de peau artificielle dans des formulations à pulvériser.
En 1993, le profil toxicologique du SAIB a fait l’objet d’un examen au niveau international par le Comité mixte d'experts des additifs alimentaires de l’Organisation des Nations Unies pour l’alimentation et l’agriculture et de l’Organisation mondiale de la Santé, auquel Santé Canada a activement participé. Le SAIB est considéré avoir un faible potentiel de danger. Lors d’études à court terme et sur la toxicité chronique (chez des animaux pertinents et par voie orale), aucun effet génotoxique ou carcinogène sur la reproduction ou le développement ni aucun autre effet nocif pertinent pour la santé humaine n’a été observé jusqu’à une dose de 2000 mg/kg pc/jour. Aucun effet nocif n’a été observé chez des humains ayant reçu une dose journalière de 20 mg/kg pc/jour. Le risque pour la santé humaine étant considéré faible, aucune estimation d’exposition au SAIB due à la consommation d’aliments ou à l’utilisation de cosmétiques n’est présentée.
Compte tenu de tous les renseignements présentés dans la présente évaluation préalable, il est conclu que le SAIB ne satisfait à aucun des critères de l’alinéa 64 c) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaine.
Il est donc conclu que le SAIB ne satisfait à aucun des critères de l’article 64 de la LCPE.
1. Introduction
En vertu de l’article 68 de la Loi canadienne sur la protection de l’environnement 1999 (LCPE) (Canada 1999), les ministres de l’Environnement et de la Santé ont réalisé une évaluation préalable du 6-acétate et 2,3,4-tris(2-méthylpropanoate) de [6-O-acétyl-1,3,4-tris(O-(2-méthylpropanoyl)-β-D-fructofuranosyl-α-D-glucopyranoside, appelé ci‑après di(acétate) et hexakis(2-méthylpropanoate) de sucrose ou SAIB, afin de déterminer si cette substance présente ou peut présenter un risque pour l’environnement ou la santé humaine. Cette substance a été jugée d’intérêt prioritaire en raison de préoccupations ayant trait à la santé humaine (ECCC, SC [modifié en 2017]).
Les risques posés à l’environnement par le SAIB ont été caractérisés au moyen de la Classification du risque écologique des substances organiques (CRE) (ECCC 2016a). La CRE est une méthode qui tient compte de plusieurs paramètres pour évaluer le danger dont le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité et l’activité chimique et biologique. Elle tient compte de l’exposition potentielle des organismes dans des environnements terrestres ou aquatiques en se basant sur des facteurs tels que les vitesses d’émission potentielles, la persistance globale et le potentiel de transport atmosphérique à grande distance. Les divers éléments de preuve sont combinés pour déterminer les substances pour lesquelles une évaluation plus poussée de leur potentiel d’effets nocifs sur l’environnement est nécessaire ou ayant une faible probabilité d’effets nocifs sur l’environnement.
La substance présentement visée a fait l’objet d’un examen au niveau international par le JECFA (Joint Expert Committee on Food Additives of the Food and Agriculture Organization of the United Nations/World Health Organization), examen auquel Santé Canada a participé. Ces évaluations sont soumises à un examen rigoureux (dont une évaluation par des pairs). De plus, le Comité scientifique de l’alimentation (CSA) de l’Union européenne et la Food and Drug Administration des États-Unis (FDA) ont évalué le profil de toxicité du SAIB. L’évaluation du JECFA a été utilisée pour étayer la caractérisation des effets sur la santé de la présente évaluation préalable (OMS 1993).
Pour la présente évaluation préalable, nous avons tenu compte de renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et les expositions, ainsi que de renseignements additionnels soumis par des parties intéressées. Des données pertinentes ont été identifiées jusqu’en septembre 2019. Des données empiriques tirées d’études clés ainsi que certains résultats de modélisation ont été utilisés pour tirer nos conclusions. Quand ils étaient pertinents, des renseignements présentés dans des évaluations faites par d’autres juridictions ont été pris en compte.
La présente évaluation préalable a été préparée par le personnel de la Direction de la sécurité des produits de consommation et des produits dangereux, avec le soutien technique du Bureau d’évaluation des risques des substances existantes, de Santé Canada et du Programme d’évaluation des risques de la LCPE d’Environnement et Changement climatique Canada. Elle incorpore des intrants d’autres programmes de ces ministères. La partie de la présente évaluation portant sur la santé humaine a fait l’objet d’un examen externe. Des commentaires sur les parties techniques pertinentes pour la santé humaine ont été reçus du Dr Mustafa Al-Zoughool de l’Universit du Koweit, du Dr Muhammad Sajid Arshad du Government College University de Faisalabad au Pakistan et du Dr Katalin Csáki de la Direction de l’évaluation des risques sanitaires des aliments de Budapest en Hongrie. La partie de la présente évaluation portant sur l’environnement est basée sur le document de la CRE (publié le 30 juillet 2016), qui a fait l’objet d’un examen externe et d’une période de commentaires du public de 60 jours. De plus, l’ébauche de la présente évaluation préalable (publiée le 14 novembre 2020) a fait l’objet d’une période de commentaires du public de 60 jours. Bien que des commentaires externes aient été pris en compte, Santé Canada et Environnement et Changement climatique Canada restent responsables du contenu final et des conclusions de la présente évaluation préalable.
La présente évaluation préalable est centrée sur des renseignements critiques afin de déterminer si cette substance satisfait aux critères de l’article 64 de la LCPE, en examinant les renseignements scientifiques et en suivant une approche basée sur le poids de la preuve et le principe de précautionNote de bas de page 2 . Nous y présentons les renseignements critiques et les éléments pris en compte à partir desquels nous avons tiré nos conclusions.
2. Identité de la substance
Nous donnons dans le Tableau 2‑1 le numéro de registre du Chemical Abstracts Service (NE CAS), le nom sur la Liste intérieure des substances (LIS), le nom commun et l’acronyme du SAIB.
|
NE CAS (abréviation) |
Nom sur la LIS (nom commun) |
Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
|
126-13-6 (SAIB) |
Di(acétate)-hexaisobutyrate de saccharose
(acétate et isobutyrate de sucrose) |
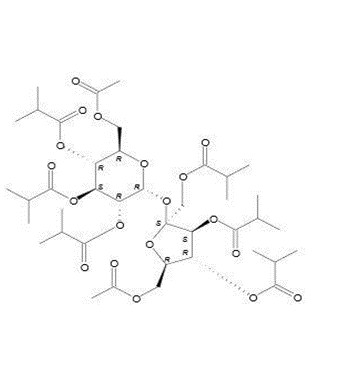 C40H62O19
C40H62O19
|
846,92 |
3. Propriétés physiques et chimiques
Le SAIB est un liquide très visqueux à 20 °C, légèrement jaune. Nous présentons dans le tableau 3-1 un résumé des données sur ses propriétés physiques et chimiques. D’autres propriétés physiques et chimiques ont été données dans un document d’ECCC (2016b).
| Propriété | Valeur | Référence clé |
|---|---|---|
| État physique | Liquide | PubChem 2022 |
| Point d’ébullition (°C) | 758,6b | SciFinder 2022 |
| Masse moléculaire (g/mL; 20 °C) | 1,12a | ECHA 2019 |
| Pression de vapeur (Pa, 25 °C) | 8,77E-21b | SciFinder 2022 |
| Solubilité dans l’eau (mg/L, 25 °C) | 5,5b | SciFinder 2022 |
| log Koe (sans dimension; 25 °C) | 6,62b | SciFinder 2022 |
| log Kco (sans dimension; 25 °C) | 4,98 (pH 1 à 10)b | SciFinder 2022 |
4. Sources et utilisations
Le SAIB n’est pas présent naturellement dans l’environnement. Il a été visé par une enquête menée en vertu de l’article 71 de la LCPE (Canada 2012). En 2011, aucune production de SAIB n’a été déclarée au Canada, alors qu’environ 0,1 kg y a été importé (Environnement Canada 2013).
Le SAIB est utilisé comme adhésif et agent filmogène dans des cosmétiques. En se basant sur les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, de 2016 à 2019, du SAIB a été utilisé dans 1262 produits cosmétiques, dont des autocollants pour le visage, des vernis à ongles, des rouges à lèvres et des tatouages pour le corps (données internes, Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada, 22 juillet 2019; non référencé). Actuellement, il n’y a pas de conditions spécifiques pour l’utilisation du SAIB dans des cosmétiques au Canada (Santé Canada 2018). Le SAIB peut être utilisé comme agent de modification de la densité dans des arômes utilisés dans des boissons alcooliques ou non alcooliques contenant des essences d’agrumes ou de sapin, à une concentration maximale permise de 300 parties par million (ppm) dans la boisson consommée (communication personnelle, de la Direction des aliments de Santé Canada à la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada, 26 septembre 2019; non référencé). Au niveau international, du SAIB est aussi utilisé pour la production d’encres, de revêtements et de papiers (Reynolds et Chappel 1998, Eastman 2019).
5. Potential d’effets nocifs sur l’environnement
5.1 Caractérisation des risques pour l’environnement
Les risques posés à l’environnement par le SAIB ont été caractérisés en suivant l’approche de Classification du risque écologique des substances organiques (CRE) (ECCC 2016a). La CRE est une approche basée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition et d’une pondération des éléments de preuve pour déterminer la classification du risque. Les divers éléments de preuve sont combinés pour différencier les substances plus ou moins dangereuses et les potentiels d’exposition plus ou moins grands dans divers milieux. Cette approche permet de réduire l’incertitude globale de la caractérisation du risque, comparativement à une approche basée sur un seul paramètre dans un seul milieu (p. ex. la concentration létale moyenne (CL50)).
Nous avons collecté des données sur les propriétés physico-chimiques, le devenir (demi-vie chimique dans divers milieux et biotes, coefficients de partition, bioconcentration dans les poissons), l’écotoxicité aiguë chez le poisson et sur les quantités importées ou produites de cette substance au Canada, à partir de la littérature scientifique, de bases de données empiriques (p. ex. Boîte à outils (Q)SAR de l’OCDE 2014) et de renseignements soumis lors d’enquêtes menées en vertu de l’article 71 de la LCPE. D’autres données ont été obtenues à l’aide de modèles (Q)SAR (relation quantitative structure-activité) ou de devenir du bilan massique et de bioaccumulation. Nous avons utilisé ces données comme intrants dans d’autres modèles de bilan massique ou pour compléter les profils de danger et d’exposition de cette substance.
Les profils de danger ont été établis principalement à partir de paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Les profils d’exposition ont aussi été basés sur plusieurs paramètres dont la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Les profils de danger et d’exposition ont été comparés aux critères de décision afin de les classer comme faibles, moyens ou élevés. D’autres règles ont été appliquées (p. ex., constance de la classification, marge d’exposition) pour améliorer les classifications préliminaires du danger et de l’exposition.
Une matrice de risque a été utilisée pour assigner un risque potentiel faible, modéré ou élevé à chaque substance, en se basant sur la classification du danger et de l’exposition. Les classifications du risque potentiel au moyen de la CRE ont été vérifiées en suivant une approche en deux étapes. La première étape consistait à ajuster la classification du risque de modéré ou élevé à faible pour les substances dont la vitesse d’émission dans l’eau après le traitement des eaux usées était estimée faible, représentant un faible potentiel d’exposition. La deuxième étape consistait à revoir les résultats de classification de faible potentiel de risque en utilisant des scénarios de risque relativement prudents à l’échelle locale (c.‑à‑d. dans la zone à proximité du point de rejet) conçus pour protéger l’environnement, afin de déterminer si la classification du risque devrait passée à un niveau supérieur.
La CRE est basée sur une approche pondérée afin de réduire au minimum le potentiel de surclassification ou de sous-classification du danger et de l’exposition, et du risque subséquent. Les approches équilibrées suivies pour traiter les incertitudes sont décrites en détail dans un document d’ECCC (2016a). Dans ce qui suit, nous décrivons deux des domaines d’incertitude les plus importants. Les erreurs dans les valeurs de toxicité aiguë empiriques ou modélisées pourraient conduire à des changements de la classification du danger, en particulier en ce qui a trait aux paramètres reposant sur les concentrations de résidus dans les tissus (c.-à-d. mode d’action toxique), dont de nombreux sont des valeurs prédites à partir de modèles (Q)SAR (Boîte à outils QSAR de l’OCDE 2014). Cependant, l’impact d’une telle erreur est atténué par le fait qu’une surestimation de la létalité médiane donnera une valeur prudente (protectrice) pour les résidus dans les tissus aux fins d’analyse des résidus corporels critiques. Une erreur de sous‑estimation de la toxicité aiguë sera atténuée par le recours à d’autres paramètres de danger, comme le profilage structural du mode d’action, la réactivité et/ou l’affinité de liaison aux œstrogènes. Les changements ou les erreurs dans les quantités chimiques pourraient entraîner des classifications différentes de l’exposition, la classification de l’exposition et du risque étant grandement dépendantes de la vitesse d’émission et des quantités utilisées. Les classifications obtenues à l’aide de la CRE reflètent donc l’exposition et le risque au Canada, sur la base de ce qui est connu au sujet des quantités actuellement utilisées, mais pourraient ne pas refléter de futures tendances.
Les données et éléments critiques utilisés pour développer les profils spécifiques au SAIB, ainsi que les résultats de la classification du danger, de l’exposition et du risque, sont présentés dans un document d’ECCC (2016b).
En se basant sur les classifications de faible danger et de faible exposition obtenues au moyen de la CRE, le SAIB a été classé comme présentant un faible potentiel de risque pour l’environnement. Il est improbable que cette substance entraîne des préoccupations pour l’environnement au Canada.
6. Potential d’effets nocifs sur la santé humaine
6.1 Évaluation de l’exposition
Le SAIB étant considéré avoir un faible potentiel de danger (voir l’évaluation des effets sur la santé ci-après), des estimations quantitatives de l’exposition de la population générale n’ont pas été faites. Dans la présente section, nous présentons des renseignements généraux sur l’exposition au SAIB.
Milieux de l’environnement et aliments
Nous n’avons trouvé aucune donnée sur des concentrations mesurées de SAIB dans des milieux de l’environnement au Canada. En raison de son KOE et de son KCO élevés, le SAIB devrait se retrouver dans les sols et les sédiments. En raison de sa faible pression de vapeur, il ne devrait pas se volatiliser à partir de la la surface d’eaux ou de sols.
Au Canada, le SAIB peut être utilisé comme agent de modification de la densité utilisé dans des arômes pour boissons (dont des boissons alcoolisées ou non alcoolisées) contenant des essences d’agrumes ou de sapin (communication personnelle de la Direction des aliments de Santé Canada à la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada, 26 septembre 2019, non référencé).
Produits disponibles pour les consommateurs
Une exposition par voie dermique devrait être la principale voir d’exposition au SAIB pour la population générale du Canada, due à l’utilisation de produits cosmétiques. Parmi ces derniers, du SAIB est utilisé dans des autocollants pour le visage, des tatouages pour le corps, des vernis à ongles, des rouges à lèvres et des ombres à paupières. Le SAIB a aussi été déclaré au Canada dans un produit simulant la peau qui pourrait être utilisé avec un pistolet pulvérisateur ou un aérographe (données internes, Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada; non référencé). En raison de sa faible volatilité et de sa faible concentration, l’exposition par voie dermique et par inhalation par événement due à l’utilisation de tels produits devrait être faible pour la population générale.
6.2 Évaluation des effets sur la santé
Le SAIB a fait l’objet d’un examen par le JECFA `(Joint FAO/WHO Expert Committee on Food Additives) (OMS 1975, 1978, 1982, 1993, 1997). Suite à sa 41ème rencontre, le JECFA a publié un profil de toxicité complet pour le SAIB (OMS 1993). Ce comité a établi une dose journalière acceptable (DJA) de 20 mg/kg pc/jour (OMS 1997). En accord avec le JECFA, le Comité scientifique de l’alimentation (CSA) de l’Union européenne et la FDA des États-Unis ont évalué le SAIB et établi une DJA de 20 mg/kg pc/jour (CSA 2016, FDA 1999).
Les profils toxicologiques susmentionnés ont été utilisés pour étayer la partie sur le danger de la présente évaluation, y compris la sélection des niveaux d’effet pour des paramètres critiques. Nous avons réalisé une recherche bibliographique jusqu’en septembre 2019, et aucune nouvelle étude sur les effets sur la santé pouvant conduire à des points de départ inférieurs à ceux mentionnés dans des évaluations internationales précédentes n’a été identifiée.
Les études de toxicocinétique réalisées avec des rats, des chiens ou des humains ont montré que le devenir et l’élimination du SAIB chez le chien étaient substantiellement différents de ceux observés chez le rat ou l’humain. Les chiens absorbaient environ 50 % de la dose de 14C-SAIB admistrée par voie orale, alors que les rats et les humains en absorbaient respectivement 73 et plus de 88 % (Reynolds et al. 1974, OMS 1993). Chez les rats et les humains, l’élimination du SAIB absorbé se faisait principalement dans le 14CO2 exhalé (entre 40 et 66 %), puis dans l’urine (entre 11 et 21 %) et les fèces (entre 10 et 27 %). Les chiens éliminaient le SAIB principalement dans leurs fèces (entre 46 et 53 %), puis dans l’exhalation de 14CO2 (environ 28 %) et l’urine (environ 7 %). De plus, les profils de chromatographie sur papier des extraits d’urine montraient la présence de sucrose acylé plus lourd comme métabolites principal chez le chien, alors que chez l’humain et le rat ces métabolites étaient absents (CSA 2016, CSA 1994, OMS 1993, FDA 1999). Aucune donnée sur l’absorption du SAIB par voie dermique ou par inhalation n’a été trouvée.
Les études sur la toxicité aiguë par voie orale réalisées avec des rats, des souris, des chiens et des singes montrent que le SAIB a une très faible toxicité. Aucune mortalité liée au traitement n’a été observée lors de ces études et la dose létale médiane rapportée dans toutes ces études corespondait à la dose testée la plus élevée, qui était typiquement supérieure à 5000 mg/kg pc (OMS 1993). Aucune étude sur la toxicité aiguë par inhalation n’a été trouvée.
Le SAIB était bien tolérée par les rats, les chiens et les singes lors d’études à court terme et de toxicité sub-chronique avec des doses par voie orale bien supérieure à 2000 mg/kg pc/j. Des effets liés à la suppression de la fonction hépatique, comme une activité moindre du glucose-6-phosphate, une augmentation des niveaux sérique de la phosphatase alcaline (SAP), une plus grande rétention de la bromosulfophtaléine (BSP) et du vert d’indocyanine (ICG), ont été observés lors de certaines études chez le rat et le singe, alors que ces effets étaient toujours observés chez le chien même à des doses aussi faibles que 130 mg/kg pc/jour. Les résultats de ces études montrent que le foie est un organe cible pour la toxicité (OMS 1993, FDA 1999, CSA 2016).
Le JECFA a conclu que les effets sur les fonctions hépatiques observés chez les chiens ne sont pas pertinents pour les humains en raison de différences substantielles dans le devenir et l’élimination du SAIB par ces deux espèces. Étant donné que certains effets liés à la fonction hépatique ont été observés lors d’études à court terme avec des rats et des singes, les données des études à long terme ont été évaluées pour s’assurer des effets du SAIB sur le foie.
Le JECFA a considéré qu’une étude sur la toxicité chronique chez le rat est l’étude clé pour évaluer la toxicité systémique du SAIB (MacKenzie et al. 1998a, OMS 1993). Pour cette étude, des rats F344 (20 par sexe et par groupe) ont reçu quotidiennement pendant un an 0, 500, 1000 ou 2000 mg/kg pc/jour de SAIB dans leur alimentation. Aucune diminution constante du poids corporel, du gain de poids corporel et de la consommation d’aliments n’a été observée. Aucune modification liée au traitement des paramètres hématologiques (globules rouges, globules blancs, hémoglobine, hématocrite, numération plaquettaire et numération des globules rouges nucléés) et de chimie clinique (glucose, bilirubine, cholestérol, aspartate aminotransférase, SAP, alanine aminotransférase, azote uréique sanguin, créatinine et électrolytes) n’a été observée. La vitesse d’élimination de la BSP a été mesurée chez les animaux témoins et ayant reçu la plus forte dose, et elle s’est avérée similaire. Aucune différence dans le poids des organes ni aucun changement à des niveaux microscopiques ou macropscopiques, en particuleir dans le foie, n’a été observé tant chez les animaux du groupe témoin que chez ceux des groupes traités avec le SAIB. Il a été conclu que la plus forte dose de 2000 mg/kg pc/jour) était la dose sans effet nocif observé (DSENO) pour le SAIB (MacKenzie et al. 1998a).
Blair et Chappel (1998) ont rapporté les résultats d’une étude d’un an sur la toxicité chronique par voir orale avec des macaques de Buffon. Quatre animaux par sexe et par groupe ont reçu quotidiennement 0, 500, 1450 ou 2400 mg/kg pc/jour de SAIB dans leur alimentation. Aucune mortalité ni aucune modification comportemantale, physique ou ophtalmoscopique n’a été observée. Aucune différence statistiquement significative dans les paramètres hématologiques et de chimie clinique, dont ceux liés aux fonctions hépatiques, à savoir les protéines sériques, les transaminases, l’ornithine carbamoyltransférase (OCT), le SAP, la bilirubine, les acides biliaires ou la rétention de la BSP, des animaux témoins et des animaux traités n’a été observée. Aucune modification de sections du foie des animaux ayant reçu la dose élevée, comparativement à celles du foie des animaux témoins, n’a été mise en évidence lors d’une analyse par microscopie électronique. La dose la plus élevée testée, 2400 mg/kg pc/jour, a été considérée être la DSENO (FDA 1999). De plus, ces études sur la toxicité chronique ont montré que le SAIB n’affecte pas la fonction hépatique des rats et des singes.
Des tests in-vitro avec Salmonella typhimurium, des cellules d’ovaire de hamster chinois et des hépatocytes primaires de rats ont montré que le SAIB n’est ni mutagène ni clastogène (Myhr et al. 1998, CIR 2016). Pour deux études sur la cancérogénicité, des rats F344 et des souris B6C3F1, 50 par sexe et par groupe, ont reçu quotidiennement pendant deux ans des aliments contenant du SAIB (Mackenzie et al. 1998a). Les doses pour les rats et les souris étaient respectivement de 500, 1000 ou 2000 mg/kg pc/jour et de 1250, 2500 ou 5000 mg/kg pc/jour. Deux groupes témoins, un pour les rats et un pour les souris, ont reçu des aliments exempts de SAIB pendant toute la durée de l’étude. Aucune différence liée au traitement dans les taux de survie, des modifications physiques ou comportementales, la consommation d’aliments et le poids corporel n’a été observée lors de ces deux études. Aucune modification statistiquement significative des paramètres hématologiques et de chimie clinique n’a été observée chez les rats et les souris traités. L’incidence de leucémie à cellules mononucléées dans plusieurs organes et de tumeurs cellulaires interstitielles était similaire chez les rats du groupe témoin et des groupes traités et n’était pas considérée liée au traitement. De même, aucune différence statistiquement significative n’a été observée dans l’incidence d’adénomes alvéolaires/bronchiolaires chez les souris du groupe témoin et des groupes traités. La DSENO a été considérée être la plus forte dose testée, 2000 mg/kg pc/jour pour le rat et de 5000 mg/kg pc/jour pour la souris.
Pour une étude sur la toxicité pour la reproduction sur 3 générations, des rats F344 (trente par sexe et par groupe) ont été exposés à 0, 500, 1000 ou 2000 mg/kg pc/jour de SAIB dans leur alimentation (MacKenzie et al. 1998b). Avant l’accouplement, les mâles et les femelles (génération F0) ont reçu des aliments contenant du SAIB pendant 10 et 2 semaines respectivement. Le traitement au SAIB des femelles F0 a continué pendant l’accouplement, la gestation et la lactation. Les petits F1 résultat de l’accouplement de mâles et de femelles F0 ont été exposés au SAIB in utero, durant l’accouplement, la gestation et la lactation. Les petits F1 ont été accouplés deux fois pour produire des petits F2a et F2b. Les petits F2 ont reçu le même traitement que les petits F1, jusqu’à ce que des petits F3 soient produits. Les petits F2b ont été utilisés à des fins d’examen tératologique.
Aucune mortalité ni aucune toxicité ante-mortem liée au traitement n’a été observée chez les générations F0, F1 ou F2. Des différences occasionnelles et non constantes dans la consommation d’aliments et le poids corporel ont été observées chez des animaux des générations F0, F1 et F2, à différentes doses. Aucune différence significative dans l’indice de fertilité ou d’autres paramètres liés au développement ou à la reproduction des animaux témoins et des animaux traités n’a été observée. L’examen des petits F2b n’a révélé aucune anormalité des tissus mous ou du squelette. Il a été conclu que la DSENO était de 2000 mg/kg pc/jour (MacKenzie et al. 1998b).
Lors d’une étude tératologique, des lapins blancs de Nouvelle-Zélande femelles, 16 par dose, ont été exposées par gavage à du SAIB à raison de 500, 850 et 1200 mg/kg pc/jour dans de l’huile de maïs, pendant les jours de gestation 7 à 19 (MacKenzie et al. 1998b). Un groupe témoin (32 animaux) n’a reçu que l’huile de maïs. Aucne mortalité ni aucun signe général de toxicité liée au traitement n’a été observé chez aucun des animaux. L’examen de malformations viscérales ches les petits n’a mis en évidence aucune anormalité liée au traitement. La plus forte dose testée (1200 mg/kg pc/jour) a été retenue comme DSENO.
Les résultats d’études sur la sensibilisation et l’irritation de la peau avec des cobayes et des humains ont montré qu’une solution à 20 % de SAIB ne provoquait pas de sensibilisation et ne causait qu’une irritation transitoire de la peau (Krasavage et al. 1973). Le comité d’experts du Cosmetic Ingredient Review (CIR) a examiné ces données et conclu que le SAIB n’est ni un irritant cutané ni un sensibilisant cutané chez l’humain (CIR 2016).
Les effets d’un seule dose journalière de SAIB allant jusqu’à 20 mg/kg pc sur les fonctions hépatobiliaires chez l’humain ont été évalués lors de trois études cliniques de 14 jours (FDA 1999). Aucune différence n’a été observée dans les paramètres hématologiques et de chimie clinique ni dans les vitesses d’élimination de la BSP à des points définis dans le temps avant ou après le traitement au SAIB. Il a été conclu que le SAIB n’induit pas de toxicité pour le foie chez l’humain jusqu’à une dose de 20 mg/kg pc/jour pendant 14 jours (FDA 1999).
6.3 Caractérisation du risque pour la santé humaine
En se basant sur les renseignements toxicologiques disponibles, le SAIB est considéré avoir un faible potentiel de danger. Le SAIB n’est ni mutagène ni cancérigène. De même, le SAIB n’a induit aucune anormalité liée à la reproduction ou au développement jusqu’à une dose orale de 2000 mg/kg pc/jour lors d’une étude de la toxicité pour le reproduction et le développement sur trois générations de rats (MacKenzie et al. 1998b). Une DSENO de 2000 mg/kg pc/jour a été établie à partir des résultats d’une étude sur la toxicité chronique par voie orale chez le rat (MacKenzie et al. 1998a). Toutes les évaluations faites au niveau international ont conclu que le SAIB a une faible toxicité et ont établi la DSENO à 2000 mg/kg pc/jour pour la caractérisation des risques.
En raison de son faible potentiel de danger, aucune estimation quantitative de l’exposition au SAIB de la population générale du Canada due aux aliments, aux cosmétiques, aux produits de santé naturels et aux milieux de l’environnement n’a été faite. Le risque pour la santé humaine dû à une exposition au SAIB provenant de diverses sources devrait être faible pour la population générale du Canada.
6.4 Incertitudes de l’évaluation du risque pour la santé humaine
Aucune incertitude significative n’a été identifiée. Certaines lacunes dans les données existent sur l’exposition dans la base de données sur l’exposition par voie dermique ou inhalation. Toutefois, il est improbable que la disponibilité d’autres effets sur la santé pour ces voies d’exposition ait un impact sur la détermination de faible potentiel de danger du SAIB.
7. Conclusion
Compte tenu de tous les éléments de preuve avancés dans la présente ébauche d’évaluation préalable, le risque d’effets nocifs du SAIB sur l’environnement est faible. Il est conclu que le SAIB ne satisfait pas aux critères de l’alinéa 64 a) ou 64 b) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ni dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou sa diversité biologique ou qui constituent ou peuvent constituer un danger pour l’environnement essentiel à la vie.
Compte tenu de tous les renseignements présentés dans la présente ébauche d’évaluation préalable, il est conclu que le SAIB ne satisfait pas aux critères de l’alinéa 64 c) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ni dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaine.
Il est donc conclu que le SAIB ne satisfait à aucun des critères de l’article 64 de la LCPE.
Références
Blair M. et Chappel C.I.; 1998; 4-week range-finding and 1-year oral toxicity studies of sucrose acetate isobutyrate (SAIB) in the cynomolgus monkey; Food and chemical toxicology, 36(2), p.121-126.
Boîte à outils QSAR de l’OCDE; 2014; ver. 3.3; Paris (France) : Organisation de coopération et de développement économiques, Laboratoire de chimie mathématique (disponible en anglais seulement).
Canada; 1999; Loi canadienne sur la protection de l’environnement, L.C. 1999, ch.33; Gazette du Canada, Partie III, vol. 22, no 3.
Canada, ministère de l’Environnement; 2012; Loi canadienne sur la protection de l’environnement (1999)- Avis concernant certaines substances de la Liste intérieure [PDF]; Gazette du Canada, Partie I, vol. 146, no 48, suppléments.
[CIR] Cosmetic Ingredient Review Expert Panel; 2016 [PDF]; Safety assessment of saccharide esters as used in cosmetics [consulté le 9 octobre 2019] (disponible en anglais seulement).
[CSA] Comité scientifique sur l’alimentation de la Commission européenne; 1994; 32ème série; The evaluation of sucrose acetate isobutyrate (SAIB); Luxembourg, Bruxelles.
[CSA] Comité scientifique sur l’alimentation de la Commission européenne; 2016; Re-evaluation of sucrose acetate isobutyrate (E 444) as a food additive; EFSA Panel on Food additives and Nutrient Sources added to Food (ANS); EFSA Journal, 14(5), p. 4489.
Eastman; 2019; SAIB-100 (Sucrose Acetate Isobutyrate); [consultée le 11 octobre 2019] (disponible en anglais seulement).
[ECCC] Environnement et Changement climatique Canada; 2016a; Document sur l’approche scientifique : Classification du risque écologique des substances organiques; Ottawa (ON) : gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada; 2016b; Supporting documentation: data used to create substance-specific hazard and exposure profiles and assign risk classifications; Gatineau (QC) : ECCC; Information en soutien au Document sur l’approche scientifique : Classification du risque écologique des substances organiques; disponible auprès de substances@ec.gc.ca.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada; [modifié le 12 mars 2017]; Catégorisation de substances chimiques;Ottawa (ON) : gouvernement du Canada [consulté le 10 janvier 2020].
[ECHA] Agence européenne des produits chimiques; c2007-2019; Registered substances database, search results for CAS RN 126-13-6; Helsinki (Finlande) : ECHA [mise à jour le 9 juillet 2019, consultée le 9 octobre 2019] (disponible en anglais seulement).
Environnement Canada; 2013; Données de la mise à jour de l’inventaire de la LIS recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement de 1999 : Avis concernant certaines substances de la Liste intérieure; données préparées par Environnement Canada et Santé Canada, Programme des substances existantes.
[FDA] Food and Drug Administration des États-Unis; 1999; Food Additives Permitted for Direct Addition to Food for Human Consumption; Sucrose Acetate Isobutyrate; Federal Register, 64 (107), p. 29949.
Krasavage W.J., DiVicenzo G.D., Astill B.D., Roudabush R.L. et Terhaar C.J.; 1973; Biological effects of sucrose acetate isobutyrate in rodents and dogs; J. Agric. Food Chem., 21(3), p. 473‑479.
Mackenzie K.M., Tisdel P.J., Hall R.L., Boysen B.G., Field W.E. et Chappel C.I.; 1998a; Oral toxicity and carcinogenicity studies of sucrose acetate isobutyrate (SAIB) in the Fischer 344 rat and B6C3F1 mouse; Food Chem. Toxicol., 36(2), p. 111-120.
Mackenzie K.M., Henwood S.M., Tisdel P.J., Boysen B.G., Palmer T.E., Schardein J.L., West A.J. et Chappel C.I.; 1998b; Sucrose acetate isobutyrate (SAIB): three-generation reproduction study in the rat and teratology studies in the rat and rabbit; Food Chem. Toxicol., 36(2), p. 135-140.
Myhr B.C., Cifone M.A., Ivett J.L., Lawlor T.E. et Young R.R.; 1998; Lack of genotoxic effects of sucrose acetate isobutyrate (SAIB); Food Chem. Toxicol., 36(2), p. 127-134.
[OMS] Joint FAO/WHO Expert Committee on Food Additives; 1975; Evaluation of certain food additives: some food colours, thickening agents, smoke condensates, and certain other substances; Nineteenth report of the Joint FAO/WHO Expert Committee on Food Additives; WHO Technical Report Series, No. 576.
[OMS] Joint FAO/WHO Expert Committee on Food Additives; 1978; Evaluation of certain food additives; Twenty-first report of the Joint FAO/WHO Expert Committee on Food Additives; WHO Technical Report Series, No. 617.
[OMS] Joint FAO/WHO Expert Committee on Food Additives; 1982; Evaluation of certain food additives and contaminants; Twenty-sixth report of the Joint FAO/WHO Expert Committee on Food Additives; WHO Technical Report Series, No. 683.
[OMS] Joint FAO/WHO Expert Committee on Food Additives; 1993; Toxicological evaluation of certain food additives and contaminants; WHO Food Additives Series, No. 32.
[OMS] Joint FAO/WHO Expert Committee on Food Additives; 1997; Evaluation of certain food additives and contaminants; Forty-sixth report of the Joint FAO/WHO Expert Committee on Food Additives; WHO Technical Report Series, No. 868.
PubChem [base de données]; 2004- ; Bethesda (MD): US National Library of Medicine, National Center for Biotechnology Information; PubChem Compound Summary for CID 31339, Sucrose acetate isobutyrate [consulté le 15 février 2022].
Reynolds R.C. et Chappel C.I.; 1998; Sucrose acetate isobutyrate (SAIB): historical aspects of its use in beverages and a review of toxicity studies prior to 1988; Food Chem. Toxicol., 36(2), p. 81-93.
Reynolds R.C., Astill B.D., Terhaar C.J. et Fassett D.W.; 1974; Fate and disposition of sucrose-U-14C acetate isobutyrate in humans, rats, and dogs; J. Agricult. Food Chem., 22(6), p. 1084‑1088.
Santé Canada; [modifié en 2018]; Liste des ingrédients dont l’usage est interdit ou restreint dans les cosmétiques; Ottawa (ON) : gouvernement du Canada [consulté le 16 octobre 2019].
SciFinder [base de données]; 2022; Columbus (OH): Chemical Abstract Services [consulté en février 2022](disponible en anglais seulement).
