Évaluation préalable - Groupe des époxydes et des éthers glycidyliques
Titre officiel : Évaluation préalable - Groupe des époxydes et des éthers glycidyliques
Numéros d’enregistrement du Chemical Abstracts Service
106-92-3, 1139-30-6, 2210-79-9, 2451-62-9, 120547-52-6
Environnement et Changement climatique Canada
Santé Canada
Août 2020
No de cat. : En14-415/2020F-PDF
ISBN 978-0-660-35322-7
Sommaire
En vertu des articles 68 et 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), les ministres de l’Environnement et de la Santé ont réalisé une évaluation préalable de cinq des 12 substances appelées collectivement « groupe des époxydes et des éthers glycidyliques » dans le cadre du Plan de gestion des produits chimiques (PGPC). L’évaluation de ces cinq substances a été jugée d’intérêt prioritaire, car elles satisfont aux critères de catégorisation du paragraphe 73(1) de la LCPE ou ont été déclarées d’intérêt prioritaire en raison d’autres préoccupations liées à la santé humaine. Les sept autres substances ont été déterminées peu préoccupantes en suivant d’autres approches, et les décisions à leur sujet sont présentées dans des rapports distinctsNote de bas de page 1Note de bas de page 2. En conséquence, la présente évaluation préalable porte sur les cinq substances indiquées dans le tableau ci-dessous. Les cinq substances examinées dans la présente évaluation préalable seront appelées dans ce qui suit groupe des époxydes et des éthers glycidyliques. Nous donnons dans le tableau ci-après le numéro du registre du Chemical Abstracts Service (no CASNote de bas de page 3 ), le nom sur la Liste intérieure des substances et l’acronyme de ces cinq substances.
| N° CAS | Nom dans la Liste intérieure des substances | Nom commun (abréviation) |
|---|---|---|
| 106-92-3a | Oxyde d’allyle et de 2,3-époxypropyle | Éther d’allyle et de glycidyle (AGE) |
| 1139-30-6 | [1R-(1R*,4R*,6R*,10S*)]-4,12,12-Triméthyl-9-méthylén-5-oxatricyclo[8.2.0.04,6]dodécane | Oxyde de bêta-caryophyllène (BCPO) |
| 2210-79-9a | Oxyde de 2,3-époxypropyle et de o-tolyle | Éther d’o-crésol et de glycidyle (o-CGE) |
| 2451-62-9a | 1,3,5-Tris(oxiranylméthyl)-1,3,5-triazine-2,4,6(1H,3H,5H)-trione | Isocyanurate de triglycidyle (TGIC) |
| 120547-52-6b | Dérivés mono[(C12-13-alkyloxy)méthyliques] de l’oxirane | Éther d’alkyle (C12-C13) et de glycidyle (AGE C12-C13) |
a Cette substance n’a pas été identifiée en vertu du paragraphe 73(1) de la LCPE, mais est visée par la présente évaluation, car elle est considérée d’intérêt prioritaire en raison d’autres préoccupations pour la santé humaine.
b Cette substance est un UVCB (sigle désignant les substances de composition inconnue ou variable, produits de réaction complexes ou matières biologiques).
À l’exception du BCPO, qui est naturellement présent dans certaines espèces de plantes et huiles essentielles, les substances du groupe des époxydes et des éthers glycidyliques ne sont pas présentes naturellement dans l’environnement. Toutes les substances de ce groupe ont été incluses dans des enquêtes menées en vertu de l’article 71 de la LCPE. En 2011, l’AGE, le BCPO, l’o-CGE et le TGIC n’ont pas été déclarées produits au Canada en quantités supérieures au seuil de déclaration de 100 kg. Les quantités importées d’AGE, de BCPO, d’o-CGE et de TGIC étaient respectivement de 100 à 10 000 kg, < 100 kg, de 79 000 kg et de 407 000 kg, pour les années de déclaration 2008 ou 2011. L’AGE C12-C13 n’a pas été déclaré produit ni importé en quantités supérieures au seuil de déclaration en 2011.
Les risques posés à l’environnement par les substances du groupe des époxydes et des éthers glycidyliques ont été caractérisés au moyen de la Classification du risque écologique des substances organiques (CRE). La CRE est une approche basée sur le risque, qui tient compte de plusieurs paramètres liés au danger et à l’exposition et d’une pondération des éléments de preuve. Les profils de danger sont établis principalement en se basant sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Parmi les paramètres pris en compte pour les profils d’exposition, mentionnons la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Une matrice de risque est utilisée pour assigner un niveau faible, modéré ou élevé de préoccupation potentielle, basé sur les profils de risque et d’exposition. D’après les résultats de la CRE, il est improbable que les substances du groupe des époxydes et des éthers glycidyliques aient des effets nocifs sur l’environnement.
Compte tenu de tous les éléments de preuve avancés dans la présente évaluation préalable, l’AGE, le BCPO, l’o-CGE, le TGIC et l’AGE C12-C13 présentent un faible risque d’effets nocifs sur l’environnement. Il a été conclu que l’AGE, le BCPO, l’o-CGE, le TGIC et l’AGE C12-C13 ne satisfont à aucun des critères de l’alinéa 64a) ou 64b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur sa diversité biologique, et à mettre en danger l’environnement essentiel pour la vie.
L’AGE est utilisé comme diluant réactif dans des systèmes de résines époxydes. Toutefois, il sert principalement d’intermédiaire industriel et aucun produit disponible pour les consommateurs en contenant n’a été identifié. L’exposition de la population générale à l’AGE due aux milieux de l’environnement devrait être minime en raison des faibles quantités déclarées dans le commerce et de sa dégradation rapide dans l’environnement. L’AGE est associé à des effets préoccupants pour la santé, étant donné qu’il a été classé comme substance suspectée de causer des défauts génétiques, de causer le cancer et de causer des dommages au niveau de la fertilité. Toutefois, puisque l’exposition de la population générale devrait être minimale, le risque pour la santé humaine dû à une telle exposition est faible.
Le BCPO est utilisé dans des produits cosmétiques comme ingrédient de parfum. Ce n’est pas d’un additif alimentaire homologué au Canada. Toutefois, cette substance peut être présente dans des aliments en tant qu’aromatisant, étant donné qu’elle serait utilisée à cette fin aux États-Unis et en Europe. L’exposition de la population générale au BCPO due aux milieux de l’environnement devrait être minime, en raison des faibles quantités déclarées dans le commerce. Des effets nocifs sur le foie et le système lymphatique mésentérique observés lors d’études de laboratoire ont été identifiés comme effets critiques pour la caractérisation du risque. La comparaison des estimations de l’exposition due à l’utilisation de produits cosmétiques contenant du BCPO et du niveau d’effet critique a permis de calculer des marges d’exposition jugées adéquates pour tenir compte des incertitudes des bases de données sur l’exposition et les effets sur la santé. Les absorptions estimées, établies par le Comité mixte d’experts des additifs alimentaires de la FAO/OMS (Organisation des Nations Unies pour l’alimentation et l’agriculture/Organisation mondiale de la Santé) et l’Autorité européenne de sécurité alimentaire, dues à l’utilisation du BCPO comme aromatisant sont inférieures de plusieurs ordres de grandeur au niveau d’effet critique de cette substance. Le risque pour la santé humaine dû à l’utilisation du BCPO comme aromatisant est donc jugé faible.
L’o-CGE est principalement utilisé comme diluant réactif pour la formulation de résines époxydes et a été identifié dans un nombre limité de produits de bricolage, dont un adhésif pour revêtement de sol, un revêtement de sol pour garage, une résine époxyde à deux composants et une résine pour l’art, l’artisanat et le bricolage. L’exposition de la population générale à l’o-CGE due aux milieux de l’environnement devrait être négligeable. La cancérogénicité observée lors d’études de laboratoire réalisées avec des substances de structure apparentée, ainsi que les effets non cancérogènes observés lors d’études à court terme avec l’o-CGE (p. ex, inflammation des muqueuses nasales), ont été identifiés comme effets critiques pour la caractérisation du risque. La comparaison des estimations d’exposition à l’o-CGE due à l’utilisation de certains produits de bricolage et des niveaux d’effet critique a permis de calculer des marges d’exposition jugées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et sur l’exposition.
Le TGIC est principalement utilisé comme agent de réticulation dans la formulation de résines de polyester utilisées pour la fabrication de revêtements en poudre de polyester. L’exposition de la population générale au TGIC due aux milieux de l’environnement devrait être minime, cette substance devant être rapidement hydrolysée après son rejet. Il ne devrait pas y avoir d’exposition par contact avec des articles manufacturés peints, car cette substance serait entièrement réticulée et durcie. Le TGIC est associé à des effets préoccupants pour la santé, étant donné qu’il a été classé comme pouvant causer des défauts génétiques. Toutefois, étant donné les niveaux actuels d’exposition de la population générale, le risque pour la santé humaine devrait être faible.
La présence d’AGE C12-C13 a été détectée dans un nombre limité de produits de bricolage, dont un adhésif époxyde à deux composants, une matière de charge époxyde vendue en tube et une résine époxyde multi-usage à faible viscosité, utilisés pour sceller et revêtir diverses surfaces. Il ne devrait pas y avoir d’exposition à l’AGE C12-C13 due aux milieux de l’environnement. Les effets critiques associés à une exposition cutanée à court terme se limitent à des effets réversibles au point de contact, et le risque pour la santé humaine dû à une exposition cutanée à l’AGE C12-C13 lors de l’utilisation de ces produits est jugé faible. La comparaison des estimations de l’exposition par inhalation à l’AGE C12-C13 et des niveaux associés à des effets nocifs chez les animaux de laboratoire a permis de calculer des marges d’exposition jugées adéquates pour tenir compte des incertitudes des bases de données sur l’exposition et les effets sur la santé.
En se basant sur les renseignements présentés dans la présente évaluation préalable, il est conclu que l’AGE, le BCPO, l’o-CGE, le TGIC et l’AGE C12-C13 ne satisfont pas aux critères de l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaine.
Il est donc conclu que l’AGE, le BCPO, l’o-CGE, le TGIC et l’AGE C12-C13 ne satisfont à aucun des critères de l’article 64 de la LCPE.
1. Introduction
En vertu des articles 68 et 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE) (Canada 1999), les ministres de l’Environnement et de la Santé ont réalisé une évaluation préalable de cinq des 12 substances appelées collectivement « groupe des époxydes et des éthers glycidyliques » dans la cadre du Plan de gestion des produits chimiques (PGPC), afin de déterminer si ces cinq substances présentent ou peuvent présenter un risque pour l’environnement ou la santé humaine. L’évaluation de ces cinq substances a été jugée d’intérêt prioritaire, car elles satisfont aux critères de catégorisation du paragraphe 73(1) de la LCPE ou ont été déclarées d’intérêt prioritaire en raison d’autres préoccupations liées à la santé humaine (ECCC et SC [modifié 2007]).
Les sept autres substances (énumérées dans le tableau 1-1) ont été prises en compte dans le document sur l’Approche de Classification du risque écologique des substances organiques (ECCC 2016a), et soit dans le document sur l’Approche scientifique pour l’Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances (Santé Canada 2016a), soit dans l’approche suivie dans le document intitulé Examen préalable rapide des substances avec une exposition limitée pour la population générale (ECCC, SC 2018a). Il a été estimé que ces sept substances sont peu préoccupantes pour la santé humaine ou pour l’environnement. En tant que telles, elles ne sont donc plus étudiées dans le présent rapport. Les conclusions pour ces sept substances sont présentées dans le document intitulé Substances jugées peu préoccupantes, établi selon la Classification du risque écologique des substances organiques, l’Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances (ECCC, SC, 2018b) et l’Examen préalable rapide des substances avec une exposition limitée pour la population générale (ECCC, SC 2018a).
| No CASa | Nom sur la Liste intérieure des substances (LIS) | Approche suivie pour l’évaluation de la substance | Référence |
|---|---|---|---|
| 101-90-6 | m-Bis(2,3-époxypropoxy)benzène | CRE/évaluation préalable rapide | ECCC, SC 2017b |
| 556-52-5 | 2,3-Époxypropan-1-ol | CRE/évaluation préalable rapide | ECCC, SC 2017b |
| 28768-32-3 | 4,4’-Méthylènebis[N,N-bis(2,3-époxypropyl)aniline] | CRE/évaluation préalable rapide | ECCC, SC 2017b |
| 61788-72-5 | Acides gras de tallöl époxydés, esters d’octyle | CRE/SPT | ECCC, SC 2017b |
| 61789-01-3 | Acides gras de tallöl époxydés, esters 2-éthylhexyliques | CRE/SPT | ECCC, SC 2017a |
| 66072-38-6 | 2,2’,2’’-[Méthylidynetris(phénylèneoxyméthylène)]tris(oxirane) | CRE/évaluation préalable rapide | ECCC, SC 2017a |
| 68082-35-9 | Acides gras de soja époxydés, esters de méthyle | CRE/SPT | ECCC, SC 2017b |
a Le numéro de registre du Chemical Abstracts Service (no CAS) est la propriété de l’American Chemical Society, et toute utilisation ou redistribution, sauf si elle est requise pour appuyer les exigences réglementaires ou pour les rapports au gouvernement du Canada lorsque les renseignements et les rapports sont exigés par la loi ou une politique administrative, est interdite sans l’autorisation écrite préalable de l’American Chemical Society.
Les cinq autres substances qui font l’objet de la présente évaluation préalable seront désignées ci-après sous le nom « groupe des époxydes et des éthers glycidyliques ».
Les risques pour l’environnement associés aux substances du groupe des époxydes et des éthers glycidyliques ont été caractérisés en suivant l’approche de CRE (ECCC 2016a). La CRE décrit le danger associé à une substance à l’aide de paramètres clés comme le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité et l’activité biologique et chimique, et tient compte de l’exposition possible des organismes dans des milieux terrestres ou aquatiques en fonction de facteurs tels que la vitesse d’émission potentielle, la persistance globale et le potentiel de transport atmosphérique à grande distance. Les divers éléments de preuve sont combinés afin de déterminer si les substances nécessitent une évaluation plus poussée de leur potentiel d’effets nocifs sur l’environnement ou si elles présentent un faible risque de tels effets.
La présente évaluation préalable tient compte de renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et l’exposition, ainsi que d’autres renseignements soumis par des parties intéressées. Nous avons identifié des données pertinentes jusqu’en juin 2017. Nous avons utilisé des données empiriques tirées d’études clés, ainsi que certains résultats de modélisation pour tirer nos conclusions. Lorsqu’ils étaient pertinents, des renseignements présentés dans des évaluations effectuées par d’autres juridictions ont été pris en compte.
La présente évaluation préalable a été préparée par le personnel du Programme d’évaluation des risques de la LCPE de Santé Canada et d’Environnement et Changement climatique Canada. Elle inclut des intrants d’autres programmes de ces deux ministères. Les parties de la présente évaluation ayant trait à la santé humaine ont fait l’objet d’un examen et/ou de consultations externes. Bernard Gadagbui, du Département de santé environnementale, Faculté de médecine, Université de Cincinnati, et Michael Jayjock, de Jayjock & Associates, ont fait des commentaires sur les parties techniques concernant la santé humaine. La partie de la présente évaluation ayant trait à l’environnement est basée sur le document de la CRE (publié le 30 juillet 2016), et a été l’objet d’un examen externe ainsi que d’une période de 60 jours de commentaires du public (publié le 24 novembre 2018). Bien que les commentaires externes aient été pris en compte, Santé Canada et Environnement et Changement climatique Canada restent responsables du contenu final et des conclusions de la présente évaluation préalable.
La présente évaluation préalable repose sur des renseignements critiques pour déterminer si les substances satisfont aux critères de l’article 64 de la LCPE. À cette fin, nous avons examiné les renseignements scientifiques et suivi une approche basée sur une pondération des éléments de preuve et le principe de précautionNote de bas de page 4 . Dans ce document, nous présentons les renseignements critiques et les éléments sur lesquels nos conclusions sont basées.
2. Identité des substances
Nous donnons dans les tableaux 2-1 et 2-2 le no CAS, le nom sur la Liste intérieure des substances (LIS), le nom commun et l’acronyme de chacune des substances du groupe des époxydes et des éthers glycidyliques.
| No CAS (acronyme) | Nom sur la LIS(nom commun) | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 106-92-3 (AGE) | Oxyde d’allyle et de 2,3-époxypropyle (éther d’allyle et de glycidyle) | 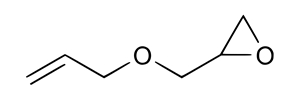 C6H10O2 C6H10O2 | 114,14 |
| 1139-30-6 (BCPO) | [1R-(1R*,4R*,6R*,10S*)]-4,12,12-Triméthyl-9-méthylén-5-oxatricyclo[8.2.0.04,6]dodécane (oxyde de bêta‑caryophyllène) | 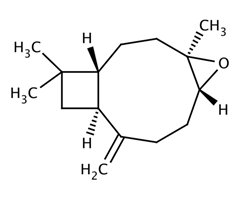 C15H24O C15H24O | 220,25 |
| 2210-79-9 (o-CGE) | Oxyde de 2,3-époxypropyle et de o-tolyle (éther d’o-crésol et de glycidyle) | 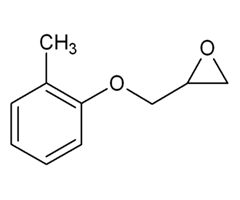 C10H12O2 C10H12O2 | 164,20 |
| 2451-62-9 (TGIC) | 1,3,5-Tris(oxiranylméthyl)-1,3,5-triazine-2,4,6(1H,3H,5H)-trione (isocyanurate de triglycidyle) | 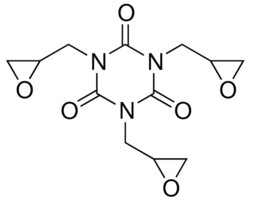 C12H15N3O6 C12H15N3O6 | 297,27 |
| No CAS | Nom sur la LIS | Structure chimique représentativea |
|---|---|---|
| 120547-52-6 (AGE C12-C13) | Dérivés mono[(C12-13-alkyloxy)méthyliques] de l’oxirane (éther d’alkyle (C12-C13) et de glycidyle) | 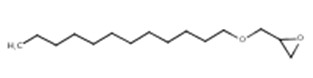 C15H30O2 C15H30O2 |
a UVCB = Substances de composition inconnue ou variable, produits de réaction complexes ou matières biologiques. Structure représentative, telle que décrite dans EPA (2010).
L’AGE C12-C13 est un UVCB (substance de composition inconnue ou variable, produits de reaction complexes ou matières biologiques). Une analyse par chromatographie en phase gazeuse avec détection par ionisation de flamme a montré qu’il est composé d’environ 49 % d’oxyde de n-dodécyle et d’oxiranylméthyle et de 39 % d’oxyde d’oxiranylméthyle et de n-tridécyle (Steidemann et al. 1996, cité dans Society of the Plastics Industry Inc 1997a). Le principal composant, celui en C12, a donc été considéré représentatif de la structure de cette substance. Ceci correspond à la structure représentative établie par l’EPA (2010).
2.1 Sélection d’analogues et utilisation de modèles (Q)SAR
Une approche de lecture croisée à partir de données sur des analogues a permis d’éclairer l’évaluation des effets sur la santé de l’o-CGE. Nous avons choisi des analogues ayant une structure et/ou une fonction similaires à celles de ces substances (p. ex. d’après leurs propriétés physico-chimiques, leur toxicocinétique, leur réactivité), et pour lesquelles il existait des données empiriques pertinentes pour la caractérisation du danger. Nous donnons à l’annexe A de plus amples détails sur les facteurs pris en compte pour l’identification des analogues. Une liste des analogues utilisés pour éclairer la présente évaluation est présentée dans le tableau 2‑3. Pour de plus amples renseignements sur les propriétés physico-chimiques des analogues de l’o-CGE, consulter l’annexe B. Les détails des données obtenues par lecture croisée pour éclairer l’évaluation des effets sur la santé humaine sont discutés dans les sections pertinentes du présent rapport.
| No CAS | Nom commun | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 26447-14-3 | Oxyde de méthylphényle et d’oxiranylméthyle (OMPOM) | 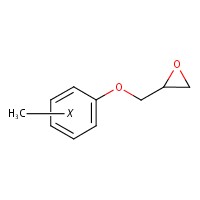 C10H12O2 C10H12O2 | 165,21 |
| 122-60-1 | Oxyde d’oxiranylméthyle et de phényle (AGE) | 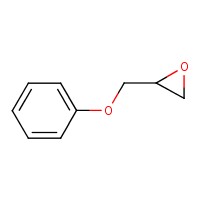 C9H10O2 C9H10O2 | 150,18 |
| 96-09-3 | Phényloxirane (PO) | 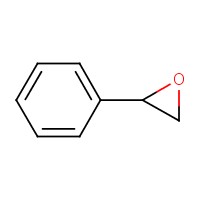 C8H8O C8H8O | 120,15 |
3. Propriétés physiques et chimiques
Nous donnons dans le tableau 3-1 un résumé des propriétés physiques et chimiques des substances du groupe des époxydes et des éthers glycidyliques, avec la gamme des valeurs indiquée pour chaque propriété. Quand les données expérimentales sur une propriété d’une substance étaient limitées ou indisponibles, nous avons utilisé la méthode de la lecture croisée à partir de données sur des analogues et/ou des modèles (Q)SAR pour générer des valeurs prédites pour la substance. D’autres propriétés physiques et chimiques sont données dans un document d’ECCC (2016b).
| Propriété | AGE | BCPO | o-CGE | TGIC | AGE C12-C13 |
|---|---|---|---|---|---|
| État physique | Liquide incolore | Cristaux incolores | Liquide incolore | Solide blanc | Liquide |
| Point de fusion (°C) | -100(ECHA 2017a) | 61-63(FSS 2014a) | -69(ECHA 2017b) | 92-95 (ECHA 2017c) | Non disponible |
| Point d’ébullition (°C) | 154(ECHA 2017a) | 263 (EpiSuite c2000-2012) | 260(ECHA 2017b) | 240 (ECHA 2017c) | Non disponible |
| Pression de vapeur (Pa) | 480(ECHA 2017a) | 1,3 (EpiSuite c2000-2012) | 0,82(ECHA 2017b) | <0,007 (ECHA 2017c) | 0,28 (EpiSuite c2000-2012) |
| Constante de Henry log(Pa·m3/mol) | -5,6 (EpiSuite c2000-2012) | -3,1 (EpiSuite c2000-2012) | -6,1 (EpiSuite c2000-2012) | < -7 (EpiSuite c2000-2012) | -1,6 (EpiSuite c2000-2012) |
| Solubilité dans l’eau (mg/L) | 140 000(ECHA 2017a) | 2,2-4,6 (EpiSuite c2000-2012) | 840(ECHA 2017b) | 9 000 – 10 000 (ECHA 2017c) | 0,027 (EpiSuite c2000-2012) |
| log Koe | 0,45(ECHA 2017a) | 4,9 (EpiSuite c2000-2012) | 2,5(ECHA 2017b) | -0,8 (ECHA 2017c) | 7,25 (EpiSuite c2000-2012) |
4. Sources et utilisations
4.1 Sources
À l’exception du BCPO, les substances du groupe des époxydes et des éthers glycidyliques ne sont pas présentes naturellement dans l’environnement. Le BCPO est présent naturellement sous forme du produit d’oxydation du composé parent, le bêta-caryophyllène, qui se retrouve dans des plantes comme le basilic, la cannelle, le poivre noir, le cannabis, la lavande, l’origan, le romarin, la sauge et le Syzgium cordatum. Le BCPO est le principal composant des huiles essentielles, telles que celles de géranium parfumée à la rose, de mélisse ou de feuille de goyave (Burdock 2009, Fidty et coll. 2016).
L’AGE est produit par condensation de l’alcool prop-2-èn-1-ol et du (chlorométhyl)oxirane, avec déchlorhydratation subséquente pour former le cycle époxy (Pottenger et coll. 2012). Dans l’Union européenne, l’AGE est produit au moyen de procédés en lots fermés (ECHA 2017a). L’o-CGE peut être produit par des réactions d’époxydation avec le chlorure de prop-2-èn-1-yle, ou avec du (chlorométhyl)oxirane par déchlorhydratation subséquente (Pottenger et coll. 2012). Le TGIC est produit industriellement par réaction de l’acide cyanurique avec un excès de (chlorométhyl)oxirane (OMS 1998).
Toutes les substances du groupe des époxydes et des éthers glycidyliques ont été visées par des enquêtes menées en vertu de l’article 71 de la LCPE (Environnement Canada 2009, Environnement Canada 2012). Nous donnons dans le tableau 4‑1 un résumé des quantités totales produites et importées déclarées des substances du groupe des époxydes et des éthers glycidyliques, pour les années 2008 ou 2011. L’AGE, le BCPO et le TGIC n’ont pas été produits au Canada en quantités supérieures au seuil de déclaration de 100 kg (Environnement Canada 2009, Environnement Canada 2013). En 2011, l’AGE C12-C13 n’a été ni produit ni importé au Canada en quantités supérieures au seuil de déclaration de 100 kg (Environnement Canada 2013).
| Nom commun(abréviation) | Quantité fabriquée totalea (kg) | Quantité importée totalea (kg) | Année de déclaration | Référence – Enquête |
|---|---|---|---|---|
| Éther d’allyle et de glycidyle (AGE) | - | 100 – 10 000 | 2008 | Environnement Canada 2009 |
| Oxyde de bêta‑caryophylle(BCPO) | - | < 100 | 2011 | Environnement Canada 2013 |
| Éther d’o-crésol et de glycidyle (o-CGE) | 100 – 1 000 | 79 000 | 2008 | Environnement Canada, 2009 |
| Isocyanurate de triglycidyle (TGIC) | - | 407 000 | 2008 | Environnement Canada, 2009 |
| Éther d’alkyle (C12-C13) et de glycidyle (AGE C12-C13) | - | - | 2011 | Environnement Canada 2013 |
a Les valeurs indiquées reflètent les quantités déclarées en réponse aux enquêtes menées en vertu de l’article 71 de la LCPE (Environnement Canada 2009, Environnement Canada 2013). Voir les enquêtes pour ce qui est des inclusions et des exclusions particulières (annexes 2 et 3).
« – » : Aucune quantité déclarée supérieure au seuil de déclaration de 100 kg.
Aux États-Unis, les quantités produites ou importées allaient d’environ 1 à 10 millions de livres (450 000 à 4 500 000 kg) pour l’AGE, l’o-CGE, le TGIC et l’AGE C12-C13 (ChemView 2016a,b,c,d). Dans l’Union européenne, les quantités produites ou importées d’AGE, d’o-CGE et de TGIC allaient de 100 000 à plus de 1 000 000 kg (ECHA 2017a,b,c).
4.2 Utilisations
L’AGE est principalement utilisé pour des applications commerciales comme intermédiaire de résine, et peut également l’être comme stabilisant pour d’autres substances chimiques, résines et caoutchoucs (Pottenger et coll. 2012). Aux États‑Unis, l’AGE est rapporté utilisé comme intermédiaire chimique industriel pour la production d’adhésifs et de produits d’étanchéité, de caoutchouc synthétique et de peintures et de revêtements. Toutefois, ces utilisations ont été rapportées en tant qu’utilisations industrielles ou commerciales (ChemView 2016a). Dans l’Union européenne, cette substance est utilisée sur des sites industriels et pour la production (ECHA 2017a).
La Commission européenne a inscrit cette substance à l’annexe II de la Liste des substances interdites dans les produits cosmétiques, en indiquant qu’elle ne doit pas entrer dans la composition d’un produit cosmétique disponible dans l’Union européenne. Au Canada, l’AGE n’a pas été rapporté comme ingrédient de cosmétique, et il ne figure pas sur la Liste critique des ingrédients cosmétiques de Santé Canada, qui mentionne les substances dont l’utilisation dans des produits cosmétiques est restreinte ou interdite au Canada (communication personnelle, courriels de la Direction de la sécurité des produits de consommation (DSPC) de Santé Canada au Bureau d’évaluation du risque des substances existantes (BERSE) de Santé Canada, mai 2016, non référencé; Santé Canada modifié 2015). L’AGE n’a pas été détecté dans des produits disponibles pour les consommateurs au Canada. Il ne figure pas dans la Base de données interne sur les produits pharmaceutiques (BDPP), dans la Base de données sur les ingrédients des produits de santé naturels (BDIPSN) ni dans la Base de données sur les produits de santé naturels homologués (BDPSNH) (BDPP modifiée 2015, BDIPSN modifiée 2015, BDPSNH modifiée 2014). Il n’est pas permis de l’utiliser comme additif alimentaire au Canada. Aucun renseignement définitif n’est disponible sur l’utilisation potentielle de l’AGE comme composant de matériaux d’emballage alimentaire ni comme additif fortuit au Canada. Toutefois, puisque cette substance est connue pour être utilisée dans des matériaux d’emballage alimentaire aux États-Unis, il est possible qu’elle puisse être utilisée dans des matériaux d’emballage d’aliments vendus au Canada (communication personnelle, courriels de la Direction des aliments de Santé Canada au BERSE de Santé Canada, août 2019, non référencé). L’AGE n’est pas utilisé dans des produits antiparasitaires au Canada (communication personnelle, courriels de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au BERSE de Santé Canada, mars 2016, non référencé).
Au Canada, le BCPO ne figure pas dans la BDPP, la BDIPSN ni la BDPSNH (BDPP modifiée 2015, BDIPSN modifiée 2015, BDPSNH modifiée 2014). Cette substance est utilisée comme produit de formulation dans des produits antiparasitaires homologués au Canada (communication personnelle, courriels de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au BERSE de Santé Canada, mars 2016, non référencé). D’après les renseignements soumis lors d’une enquête menée en vertu de l’article 71 de la LCPE (Canada 2012), le BCPO est utilisé comme ingrédient de parfum dans des produits cosmétiques tels que des lotions pour le corps, des gels pour la douche, des savons pour les mains et des produits parfumants, à une concentration finale inférieure à 0,2 ppm (ECCC 2016b).
Le BCPO n’est pas un additif alimentaire autorisé au Canada et n’a pas été rapporté être utilisé comme composant de matériaux d’emballage alimentaire ni comme additif indirect (communication personnelle, courriels de la Direction des aliments de Santé Canada au BERSE de Santé Canada, mars 2016, non référencé). Aux États-Unis, l’utilisation du BCPO est autorisée en vertu du règlement 21 CFR 172.515 comme arôme synthétique utilisé à la quantité minimale requise pour produire l’effet recherché et conformément aux bonnes pratiques de fabrication (BPF) (eCFR 2017). Cette substance est également autorisée dans l’Union européenne en tant qu’aromatisant en vertu du règlement UE no 872/2012 (EFSA 2014). Par conséquent, il est possible que cette substance soit présente comme aromatisant dans les aliments vendus au Canada.
L’o-CGE n’est pas autorisé au Canada comme additif alimentaire, et aucune utilisation de cette substance comme ingrédient de matériaux d’emballage alimentaire, additif indirect ou ingrédient de produits antiparasitaires n’a été rapportée au Canada (communication personnelle, courriels de la Direction des aliments de Santé Canada au BERSE de Santé Canada, mars 2016, non référencé; communication personnelle, courriels de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au BERSE de Santé Canada, mars 2016, non référencé). Au Canada, l’o-CGE ne figure pas dans la BDPP, la BDIPSN ni la BDPSNH (BDPP modifiée 2015, BDIPSN modifiée 2015, BDPSNH modifiée 2014). L’o-CGE n’a pas été déclaré comme ingrédient de cosmétiques au Canada. Toutefois, en tant que dérivé du méthylphénol, cette substance figure sur la « Liste critique des ingrédients de cosmétiques » et son utilisation est donc interdite dans des produits cosmétiques » (communication personnelle, courriels de la DSPC de Santé Canada au BERSE de Santé Canada, mai 2016, non référencé; Santé Canada modifié 2015).
L’o-CGE est principalement utilisé comme diluant réactif pour des résines époxydes liquides (Pottenger et coll. 2012). Les diluants réactifs permettent aux résines époxydes d’être moins visqueuses et plus faciles à manipuler à l’état non durci (Dow 2012). En raison de la présence du groupe fonctionnel époxyde, l’o-CGE prend part aux réactions de polymérisation et de réticulation et est donc lié de façon covalente à la matrice après durcissement (Bosch et coll. 1985, Lee 1989, Hamerton 1996 cité dans Environnement Canada, Santé Canada 2010).
D’après les renseignements soumis en réponse à une enquête menée en vertu de l’article 71 de la LCPE, l’o-CGE peut être utilisé au Canada comme intermédiaire chimique, adhésif et substance d’étanchéité ou comme agent d’ajustement de la viscosité pour diverses applications, comme la production d’adhésifs et agents d’étanchéité, de peintures et revêtements ou de matériaux de construction (Environnement Canada 2009). Dans la littérature accessible au public, l’o-CGE a été identifié dans un nombre limité de produits de bricolage disponibles pour les consommateurs au Canada. Il a été identifié dans un adhésif pour revêtement de sol, un composé époxyde pour revêtement de sol et une résine époxyde de finition pour assurer l’étanchéité de surfaces (FSS 2015a, 2015b, 2017). L’o-CGE a également été identifié dans une résine époxyde utilisée pour les arts et l’artisanat, pour la production de produits en résine à partir de moules (FSS 2014b).
Le TGIC n’est pas autorisé comme additif alimentaire au Canada. Aucun renseignement définitif n’est disponible quant à son utilisation potentielle comme composant de matériaux d’emballage alimentaire ou additif indirect au Canada. Toutefois, puisque cette substance est connue pour être utilisée aux États-Unis comme composant de matériaux d’emballage alimentaire, il est possible qu’il puisse être utilisé dans de matériaux d’emballage d’aliments vendus au Canada (communication personnelle, courriels de la Direction des aliments de Santé Canada au BERSE de Santé Canada, août 2019, non référencé). Le TGIC n’est pas non plus utilisé dans des produits antiparasitaires au Canada (communication personnelle, courriels de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au BERSE de Santé Canada, mars 2016, non référencé). Au Canada, le TGIC ne figure pas dans la BDPP, la BDIPSN ni la BDPSNH (BDPP modifiée 2015, BDIPSN modifiée 2015, BDPSNH modifiée 2014). Cette substance n’est pas déclarée comme ingrédient utilisé dans des cosmétiques au Canada (communication personnelle, courriels de la DSPC de Santé Canada au BERSE de Santé Canada, mai 2016, non référencé).
D’après les renseignements déclarés en réponse à une enquête menée en vertu de l’article 71 de la LCPE, le TGIC peut être utilisé comme substance adhésive et agent d’étanchéité, comme charge chimique ou additif pour la production de peintures et revêtements ou dans des articles métalliques formés, dont des pièces pour automobile (Environnement Canada 2009). À l’échelle mondiale, le TGIC est principalement utilisé comme agent de réticulation tridimensionnel ou agent de durcissement pour la production de peintures en poudre (OMS 1998). Les revêtements en poudre de polyester contenant du TGIC fabriqués à des fins d’utilisation industrielles semblent être disponibles en quantités destinées aux consommateurs. L’application de revêtements en poudre nécessite un équipement spécialisé et l’utilisation de tels produits par des consommateurs devrait être limitée.
L’AGE C12-C13 n’est pas autorisé comme additif alimentaire au Canada, et il n’a pas été rapporté être utilisé comme composant de matériaux d’emballage alimentaire, comme additif indirect ni dans les produits antiparasitaires au Canada (communication personnelle, courriels de la Direction des aliments de Santé Canada au BERSE de Santé Canada, mars 2016, non référencé; communication personnelle, courriels de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au BERSE de Santé Canada, mars 2016, non référencé). Au Canada, l’AGE C12-C13 ne figure pas dans la BDPP, la BDIPSN ni la BDPSNH (BDPP modifiée 2015, BDIPSN modifiée 2015, BDPSNH modifiée 2014). Cette substance n’est pas déclarée comme ingrédient de cosmétiques au Canada (communication personnelle, courriels de la DSPC de Santé Canada au BERSE de Santé Canada, mai 2016, non référencé).
Les utilisations de l’AGE C12-C13 sont principalement de nature industrielle, en tant qu’intermédiaire chimique pour des applications, comme des peintures et revêtements ou des adhésifs et agents d’étanchéité (ChemView 2016d). Cette substance a été identifiée dans un nombre limité de composés époxydes adhésifs disponibles pour les consommateurs au Canada (FSS 2013, FSS 2014c, FSS 2016).
5. Potentiel d’effets nocifs sur l’environnement
5.1 Caractérisation des risques pour l’environnement
Les risques posés à l’environnement par les substances du groupe des époxydes et des éthers glycidyliques ont été caractérisés au moyen de la Classification du risque écologique des substances organiques (ECCC 2016a). La CRE est une approche basée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition et d’une pondération des éléments de preuve pour déterminer la classification du risque. Les divers éléments de preuve sont combinés pour différencier les substances plus ou moins dangereuses et les potentiels d’exposition plus ou moins grands dans divers milieux. Cette approche permet de réduire l’incertitude globale de la caractérisation du risque, comparativement à une approche basée sur un seul paramètre dans un seul milieu (p. ex. la concentration létale moyenne (CL50)). Nous avons résumé dans ce qui suit cette approche, qui est d’autre part décrite en détail dans un document d’ECCC (2016a).
Nous avons collecté des données sur les propriétés physico-chimiques, le devenir (demi-vie chimique dans divers milieux et biotes, coefficients de partition, bioconcentration dans les poissons), l’écotoxicité aiguë chez le poisson et les quantités importées ou produites de ces substances au Canada, à partir de la littérature scientifique, des bases de données empiriques (p. ex. Boîte à outils (Q)RSA de l’OCDE 2014) et de renseignements soumis lors d’enquêtes menées en vertu de l’article 71 de la LCPE. D’autres données ont été obtenues à l’aide de modèles (Q)SAR (relation quantitative structure-activité) ou de devenir du bilan massique et de bioaccumulation. Nous avons utilisé ces données comme intrants dans d’autres modèles de bilan massique ou pour compléter les profils de danger et d’exposition de ces substances.
Les profils de danger ont été établis principalement à partir de paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Les profils d’exposition ont aussi été basés sur plusieurs paramètres dont la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Les profils de danger et d’exposition ont été comparés aux critères de décision afin de les classer comme faibles, moyens ou élevés. D’autres règles ont été appliquées (p. ex., constance de la classification, marge d’exposition) pour améliorer les classifications préliminaires du danger et de l’exposition.
Une matrice de risque a été utilisée pour assigner un risque potentiel faible, modéré ou élevé à chaque substance, en se basant sur la classification du danger et de l’exposition. Les classifications du risque potentiel au moyen de la CRE ont été vérifiées en suivant une approche en deux étapes. La première étape consistait à ajuster la classification du risque de modéré ou élevé à faible pour les substances dont la vitesse d’émission dans l’eau après le traitement des eaux usées était estimée faible, représentant un faible potentiel d’exposition. La deuxième étape consistait à revoir les résultats de classification de faible potentiel de risque en utilisant des scénarios de risque relativement prudents à l’échelle locale (c.‑à‑d. dans la zone à proximité du point de rejet) conçus pour protéger l’environnement, afin de déterminer si la classification du risque devrait passée à un niveau supérieur.
La CRE est basée sur une approche pondérée afin de réduire au minimum le potentiel de surclassification ou de sous-classification du danger et de l’exposition, et du risque subséquent. Les approches équilibrées suivies pour traiter les incertitudes sont décrites en détail dans un document d’ECCC (2016a). Dans ce qui suit, nous décrivons deux des domaines d’incertitude les plus importants. Les erreurs dans les valeurs de toxicité aiguë empiriques ou modélisées pourraient conduire à des changements de la classification du danger, en particulier en ce qui a trait aux paramètres reposant sur les concentrations de résidus dans les tissus (c.-à-d. mode d’action toxique), dont de nombreux sont des valeurs prédites à partir de modèles (Q)SAR (Boîte à outils QSAR de l’OCDE 2014). Cependant, l’impact d’une telle erreur est atténué par le fait qu’une surestimation de la létalité médiane donnera une valeur prudente (protectrice) pour les résidus dans les tissus aux fins d’analyse des résidus corporels critiques (RCC). Une erreur de sous-estimation de la toxicité aiguë sera atténuée par le recours à d’autres paramètres de danger, comme le profilage structural du mode d’action, la réactivité et/ou l’affinité de liaison aux œstrogènes. Les changements ou les erreurs dans les quantités chimiques pourraient entraîner des classifications différentes de l’exposition, la classification de l’exposition et du risque étant grandement dépendantes de la vitesse d’émission et des quantités utilisées. Les classifications obtenues à l’aide de la CRE reflètent donc l’exposition et le risque au Canada, sur la base de ce qui est connu au sujet des quantités actuellement utilisées, mais pourraient ne pas refléter de futures tendances.
Les données et éléments critiques utilisés pour développer les profils spécifiques aux substances du groupe des époxydes et des éthers glycidyliques, ainsi que les résultats de la classification du danger, de l’exposition et du risque, sont présentés dans un document d’ECCC (2016b).
Les résultats de la classification du danger et de l’exposition pour les substances du groupe des époxydes et des éthers glycidyliques sont présentés dans le tableau 5‑1.
| Substance | Classification CRE du danger | Classification CRE de l’exposition | Classification CRE du risque |
|---|---|---|---|
| AGE | Faible | Faible | Faible |
| BCPO | Modéré | Faible | Faible |
| o-CGE | Élevé | Faible | Modéré |
| TGIC | Modéré | Élevé | Modéré |
| AGE C12-C13 | Élevé | Faible | Faible |
D’après les renseignements pris en compte pour la CRE, l’AGE et le BCPO ont été classés comme substances présentant un faible potentiel d’exposition. L’AGE et le BCPO ont respectivement été classés comme substances présentant un potentiel de danger faible et modéré. Le BCPO a été identifié comme ayant un potentiel modéré d’effets nocifs sur les réseaux trophiques aquatiques, étant donné son potentiel de bioaccumulation modéré. L’AGE et le BCPO ont donc été classés comme substances ayant un faible potentiel de risque pour l’environnement. Compte tenu des profils d’utilisation actuels, il est improbable que ces substances soient préoccupantes pour l’environnement au Canada.
D’après les renseignements pris en compte pour la CRE, l’o-CGE a été classé comme substance ayant un faible potentiel d’exposition, bien que ce potentiel soit plus important à l’échelle locale. L’o-CGE a été classé comme ayant un potentiel de danger élevé, en se basant sur son mode d’action réactif et un rapport de toxicité élevé, les deux suggérant que cette substance est probablement très dangereuse, et en se basant sur des alertes structurales de la Boîte à outils QSAR de l’OCDE (2014), qui a permis d’identifier que cette substance est un liant potentiel à l’ADN et/ou aux protéines. L’o-CGE a été classé comme ayant un potentiel modéré de risque pour l’environnement. Toutefois, cette classification du risque a été réduite à faible potentiel suite à un ajustement basé sur les quantités actuellement utilisées (voir la section 7.1.1. du document sur l’Approche de CRE (ECCC 2016a)). Les effets potentiels et la façon dont ils se manifestent dans l’environnement n’ont pas été étudiés plus à fond, en raison de la faible exposition à cette substance. Compte tenu des profils d’utilisation actuels, il est improbable que cette substance soit préoccupante pour l’environnement au Canada.
D’après les renseignements pris en compte pour la CRE, le TGIC a été classé comme substance ayant un potentiel d’exposition élevé, basé sur une longue persistance globale et de grandes quantités utilisées rapportées lors d’une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Le TGIC a été classé comme substance ayant un potentiel de danger modéré, en se basant sur son mode d’action réactif avec des alertes structurales de la Boîte à outils QSAR de l’OCDE (2014), qui indiquent que cette substance est un liant potentiel à l’ADN et aux protéines. Le TGIC a été classé comme substance ayant un potentiel modéré de risque pour l’environnement. Étant donné sa classification globale de substance ayant un potentiel de risque pour l’environnement modéré, il est improbable que cette substance soit préoccupante pour l’environnement au Canada. Cette substance étant actuellement utilisée en grande quantité au Canada, il est improbable que des fluctuations de ses profils d’utilisation entraînent une augmentation significative du risque pour l’environnement. Les effets potentiels et la façon avec laquelle ils peuvent se manifester ne seront pas étudiés plus à fond.
D’après les renseignements pris en compte pour la CRE, l’AGE C12-C13 a été classé comme substance ayant un potentiel d’exposition faible. Il a aussi été classé comme ayant un potentiel de danger élevé, basé sur un mode d’action réactif et un rapport de toxicité élevé, les deux suggérant que cette substance est probablement très dangereuse. L’AGE C12-C13 a été classé comme substance ayant un potentiel modéré d’effets nocifs sur les réseaux trophiques aquatiques, étant donné son potentiel de bioaccumulation modéré. L’AGE C12-C13 a été classé comme substance ayant un potentiel modéré de risques pour l’environnement. Toutefois, la classification du risque a été réduite à faible suite à un ajustement basé sur les quantités actuellement utilisées (voir la section 7.1.1. du document décrivant l’approche CRE (ECCC 2016a)). Les effets potentiels et la façon dont ils se manifestent dans l’environnement n’ont pas été étudiés plus à fond, en raison de la faible exposition à cette substance. Compte tenu des profils d’utilisation actuels, il est improbable que cette substance soit préoccupante pour l’environnement au Canada.
6. Potentiel d’effets nocifs sur la santé humaine
6.1 Éther d’allyle et de glycidyle (AGE)
6.1.1 Évaluation de l’exposition
Nous n’avons trouvé aucune concentration mesurée d’AGE dans l’air, l’eau ou le sol. En se basant sur les utilisations de l’AGE comme intermédiaire pour la production d’autres substances chimiques et produits, des rejets dans l’eau et dans l’air peuvent avoir lieu, cette substance ayant une pression de vapeur et une solubilité dans l’eau élevées. L’AGE a une courte demi-vie par hydrolyse, d’environ 7-13 jours à des pH compris entre 4 et 9 (ECHA 2017a), et une courte demi-vie par photodégradation dans l’air, de moins de 5 heures (AOPWIN 2010). Compte tenu des quantités limitées (100 à 10 000 kg) déclarées pour l’AGE au Canada lors d’une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2009) et des propriétés physico-chimiques de cette substance (hydrolyse et photodégradation rapides), l’exposition à l’AGE due aux milieux de l’environnement devrait être minimale.
L’AGE peut être utilisé comme intermédiaire chimique pour la formulation de résines. Nous n’avons trouvé aucune étude sur l’exposition potentielle à l’AGE résiduel pouvant être présent dans des résines époxydes durcies. Le Centre international de recherche sur le cancer (CIRC) a noté que, lors de la production de résines, le groupe des époxyde et des éthers glycidyliques réagit pendant le processus de durcissement et, en conséquence, est généralement absent des produits complètement durcis (CIRC 1989). Cette substance peut également être utilisée pour la production d’adhésifs et produits d’étanchéité, de caoutchouc synthétique ou de peintures et revêtements. Toutefois, aucun produit disponible pour les consommateurs en contenant n’a été identifié.
6.1.2 Évaluation des effets sur la santé
Un résumé exhaustif des effets sur la santé associés à une exposition à l’AGE a fait l’objet d’un SIAP (SIDS Initial Assessment Profile) de l’OCDE (OCDE 2007). L’AGE a été classé par l’UE comme substance susceptible de causer des défauts génétiques (Muta 2), de causer le cancer (Carc 2) et de nuire à la fertilité (Repr 2) (ECHA 2017a).
Pour une étude par inhalation d’une durée de 2 ans, des rats Osborne-Mendel (n = 50/sexe/dose) et des souris B6C3F1 (n = 50/sexe/dose) ont été exposés à 0, 5 ou 10 ppm d’AGE (correspondant à environ 0, 23 ou 47 mg/m3), 5 jours/semaine pendant 102-103 semaines (NTP 1990). Des tumeurs nasales accompagnées d’effets non cancérogènes comme une inflammation, une métaplasie pavimenteuse, une métaplasie respiratoire et une dégénérescence de l’épithélium olfactif ont été observées. Bien qu’elles ne soient pas statistiquement significatives, ces tumeurs ont été considérées biologiquement significatives, les tumeurs nasales primaires étant rares chez les rongeurs. Les auteurs ont conclu qu’il y avait des preuves équivoques de cancérogénicité chez les rats mâles, aucune preuve chez les rats femelles, certaines preuves chez les souris mâles et des preuves équivoques chez les souris femelles.
L’AGE s’est révélé génotoxique lors de la plupart des tests in vitro réalisés (Ames, échange de chromatides sœurs, aberration chromosomique), et il a été rapporté qu’il provoque la formation de micronoyaux, de translocations réciproques et une létalité récessive liée au sexe in vivo (Wade et coll. 1979, Hemminki et coll. 1980, Allied Corporation 1982, Department of Health & Human Services 1984, NIH 1984, Shell Oil Company 1984, Yoon et coll. 1985, Canter et coll. 1986, NTP 1990, Von Der Hude et coll. 1990, Von Der Hude et coll. 1991). De plus, il a été observé que l’AGE forme des adduits à l’ADN in vivo après une administration cutanée et intrapéritonéale (Plna et Segerback 1997, Perez et Osterman-Golkar 2000).
Plusieurs tests de toxicité aiguë et à dose répétée par inhalation ont mis en évidence une irritation respiratoire et des effets sur le passage nasal chez des animaux de laboratoire, à des concentrations aussi faibles que 4 ppm (correspondant à environ 18,7 mg/m3) (Shell Chemical Company 1956, DOW Chemical Company 1978, Gagnaire et coll. 1987, NTP 1990, Zissu 1995).
6.1.3 Caractérisation des risques pour la santé humaine
En se basant sur les renseignements disponibles sur les sources et les utilisations de l’AGE, l’exposition de la population générale devrait être minimale. Aux niveaux actuels d’exposition, le risque pour la santé humaine est donc jugé faible.
Bien que l’exposition de la population générale à l’AGE ne soit pas préoccupante aux niveaux actuels, cette substance a été associée à des effets préoccupants pour la santé lors de sa classification par l’UE (Muta 2, Carc 2 et Repr 2) (ECHA 2017a). Par conséquent, il pourrait être préoccupant pour la santé humaine si l’exposition venait à augmenter.
6.2 Oxyde de bêta-caryophyllène (BCPO)
6.2.1 Évaluation de l’exposition
Milieux de l’environnement et aliments
Nous n’avons trouvé aucune concentration mesurée de BCPO dans l’air, l’eau ou le sol. Compte tenu des faibles quantités (< 100 kg) de cette substance déclarée être utilisée au Canada (ECCC 2016c) et du nombre limité d’espèces végétales dans lesquelles le BCPO peut être un composant majeur, l’exposition chronique au BCPO due aux milieux de l’environnement devrait être minimale.
Au Canada, l’exposition potentielle au BCPO peut être due à son utilisation comme aromatisant alimentaire. L’utilisation de cette substance en tant qu’aromatisant est autorisée aux États-Unis et en Europe.
Le Comité mixte d’experts des additifs alimentaires de la FAO/OMS (JECFA) a évalué un groupe d’aromatisants de type époxyde lors de sa 65e réunion (OMS 2006). Dans le cadre de son évaluation, le JECFA a estimé à 0,002 µg/kg pc/j l’absorption de BCPO par habitant due à son utilisation comme aromatisant, pour la population des États‑Unis. Cette estimation de l’absorption, basée sur une approche d’absorption quotidienne maximisée dérivée d’une enquête, a été calculée en assumant que la quantité de BCPO produite annuellement aux États-Unis était consommée par 10 % de sa population (« consommateurs d’aliments seulement ») et que seulement 80 % de la quantité produite annuellement de 0,9 kg était déclarée lors des enquêtes sur la quantité d’additifs utilisée au cours d’une année (National Academy of Science 1987, International Organization of the Flavour Industry 1995, Lucas et coll. 1999 cité dans JECFA 2006). Dans son évaluation, le JECFA a également rapporté que le BCPO pourrait être principalement consommé à partir d’aliments qui en contiennent naturellement, citant une quantité annuelle de 488 kg présente naturellement dans les aliments en 1987 (OMS 2006, Stofberg et Grundschober 1987). Le JECFA a conclu qu’« il n’y a aucune préoccupation en matière de sécurité aux niveaux d’absorption estimés» concernant le BCPO, lorsqu’il est utilisé comme aromatisant alimentaire.
Le comité d’experts de l’Autorité européenne de sécurité alimentaire (EFSA) a examiné cinq époxydes évalués par le JECFA (lors de sa 65e réunion), qui sont utilisés comme aromatisants alimentaires en Europe (EFSA 2014). Dans son rapport de 2014, l’EFSA a fourni des renseignements sur les niveaux d’utilisation du BCPO comme aromatisant alimentaire (aucun produit alimentaire spécifique n’a été mentionné). Le groupe d’experts de l’EFSA a calculé une absorption journalière maximale théorique ajoutée modifiée basée sur l’absence de données précises sur l’utilisation des substances du groupe évalué (EFSA 2014). Cette approche suivie pour estimer les absorptions assume que tous les aliments d’une catégorie entière d’aliments contiennent le niveau d’utilisation moyen de la substance et que toute la catégorie d’aliments est consommée quotidiennement (communication personnelle, courriels de la Direction des aliments de Santé Canada au BERSE de Santé Canada, mars 2016, non référencé). Ceci devrait conduire à une surestimation de l’absorption (communication personnelle, courriels de la Direction des aliments de Santé Canada au BERSE de Santé Canada, mars 2016, non référencé). Pour cette évaluation, le groupe d’experts de l’EFSA a repris la conclusion du JECFA à l’effet qu’« il n’y a aucune préoccupation en matière de sécurité aux niveaux estimés d’absorption de la substance comme aromatisant, basée sur une approche d’absorption journalière maximisée établie d’après les résultats d’une enquête » (ESFA 2014).
Cosmétiques
Au Canada, le BCPO est utilisé comme ingrédient de parfum dans des produits cosmétiques tels que des lotions pour le corps, des gels pour la douche, des savons pour les mains et des produits parfumés, à une concentration finale inférieure à 0,2 ppm (ECCC 2016c). L’utilisation des produits parfumants et des lotions pour le corps pouvant contenir du BCPO a été considérée être le scénario associé au plus grand potentiel d’exposition par inhalation et par voie cutanée, et des estimations de l’exposition ont été obtenues à l’aide d’algorithmes de ConsExpo Web (2016).
L’exposition par inhalation due à l’utilisation d’un vaporisateur de parfum contenant du BCPO a été estimée de l’ordre du nanogramme et donnerait lieu à une exposition négligeable. Il a été estimée que l’utilisation de lotions pour le corps contenant du BCPO conduirait à exposition par voie cutanée allant de 8,2 x 10‑6 à 3,8 x 10-5 mg/kg pc/j, les nourrissons représentant le groupe d’âge le plus exposé (voir l’annexe C pour de plus de détails).
6.2.2 Évaluation des effets sur la santé
Le Centre international de recherche sur le cancer (CIRC), l’Environmental Protection Agency des États-Unis (EPA) et l’Agence européenne des produits chimiques (ECHA) n’ont pour l’instant établie aucune classification du danger du BCPO.
Les effets à court terme du BCPO ont été étudiés dans le cadre d’une étude d’exposition par voie alimentaire de 14 jours, pour laquelle des rats Hsd:SD (n = 3/sexe/dose) ont reçu une dose de 0, 3000, 9000 ou 18 000 ppm de BCPO (correspondant à 0, 279,1, 788,8 ou 1558,1 mg/kg pc/j pour les mâles et à 0, 267,6, 815,7 ou 1586,0 mg/kg pc/j pour les femelles) (Product Safety Labs 2012). Des signes cliniques, des variations du poids corporel et des changements de comportement ont été étudiés chez ces animaux. Un examen macroscopique à l’autopsie a également été effectué sur tous les animaux à la fin de l’étude. Aucun effet indésirable lié au traitement et touchant les signes cliniques, le poids corporel, le gain de poids corporel, la consommation d’aliments, l’efficacité alimentaire ou d’autres paramètres n’a été observé. La dose sans effet nocif observé (DSENO) a été établie à 18 000 ppm (la dose maximale testée (correspondant à environ 1500 mg/kg pc/j). Aucune étude à court terme avec le BCPO par voie cutanée ou par inhalation n’a été identifiée.
Pour une étude d’exposition subchronique par voie alimentaire de 90 jours, des rats Sprague-Dawley (n = 10/sexe/dose) ont reçu 0, 1750, 10 500 ou 21 000 ppm (correspondant à 0, 109, 672 ou 1398 mg/kg pc/j pour les mâles et à 0, 137, 800 ou 1660 mg/kg pc/j pour les femelles) (Product Safety Labs 2013). Des signes cliniques, des variations du poids corporel et des changements de comportement ont été étudiés. Un examen macroscopique à l’autopsie, de tests histopathologiques, de tests de biochimie sanguine et d’analyses de l’urine ont également été faits. Une néphropathie et des gouttelettes cytoplasmiques tubulaires ainsi qu’une augmentation du poids absolu et relatif des reins ont été observées chez les mâles à toutes les doses. Les auteurs ont indiqué que ces résultats concordaient avec la présence du syndrome de néphropathie associée à l’α2u-globuline. Toutefois, comme il n’existe aucune preuve de production d’α2u-globuline chez les humains, les auteurs n’ont pas jugé ces résultats pertinents pour la santé humaine. Parmi d’autres effets indésirables liés à la dose, mentionnons ceux touchant le foie (p. ex. augmentation du poids absolu et relatif du foie, hypertrophie hépatocytaire) et les ganglions lymphatiques mésentériques (p. ex. présence d’érythrocytes dans les sinus) chez les groupes ayant reçu les doses moyennes et élevées. Aucun effet nocif sur les organes reproducteurs lié au traitement n’a été observé. Dans les conditions de l’étude, les auteurs ont indiqué que la DSENO était inférieure à 109 mg/kg pc/j chez les mâles, basée sur des effets nocifs sur les reins, tandis qu’elle était de 137 mg/kg pc/j chez les femelles, basée sur des preuves histologiques d’hypertrophie hépatocytaire. Toutefois, étant donné que les effets sur les reins chez les mâles ne sont pas pertinents pour les humains, une DSENO de 109 mg/kg pc/j a été jugée appropriée, d’après les observations des effets sur le foie et les ganglions lymphatiques mésentériques à la dose suivante. Ce niveau d’effet a été jugé conforme à celui qui a été adopté par l’EFSA pour l’utilisation du BCPO comme substance aromatisante (EFSA 2014). Aucune étude de toxicité subchronique du BCPO par voie cutanée ou par inhalation n’a été identifiée.
Aucune étude de toxicité chronique n’a été identifiée. Cependant, il existe certaines preuves in vitro suggérant que le BCPO pourrait être anti-tumorigène (Fidyt et coll. 2016). Plus précisément, il a été rapporté que le BCPO inhibe la prolifération des cellules CaCo-2 (dérivées du côlon humain) et augmente l’activité de la doxorubicine, un médicament anti-cancer (Ambroz et coll. 2015). De plus, il a été montré que le BCPO est cytotoxique pour diverses lignées de cellules cancéreuses telles que HepG2 (cellules cancéreuses de la leucémie humaine), AGS (cellules cancéreuses pulmonaires chez les humains), SNU-1 (cellules cancéreuses du système gastrique chez les humains) et SNU-16 (cellules cancéreuses de l’estomac chez les humains). Quant à la génotoxicité, le BCPO s’est toujours révélé non mutagène lors de tests sur des bactéries (Richold et coll. 1979 cité dans EFSA 2014, Di Sotto et coll. 2013) et n’a pas entraîné d’augmentation de la fréquence des micronoyaux dans les lymphocytes périphériques humains in vitro (Di Sotto et coll. 2013). Aucun test de génotoxicité in vivo n’a été identifié.
6.2.3 Caractérisation des risques pour la santé humaine
L’étude sur l’exposition subchronique de 90 jours par voie alimentaire chez le rat a été identifiée comme la plus pertinente pour la caractérisation du risque dû à une exposition au BCPO. Une DSENO de 109 mg/kg pc/j a été établie comme niveau d’effet critique, basée sur des effets observés sur le foie (p. ex. augmentation du poids absolu et relatif du foie, hypertrophie hépatocytaire) et les ganglions lymphatiques mésentériques (p. ex. présence d’érythrocytes dans les sinus) aux doses moyenne et élevée (Product Safety Labs 2013).
Nous donnons dans le tableau 6‑1 les estimations pertinentes de l’exposition au BCPO, les niveaux d’effet critique du BCPO, ainsi que les marges d’exposition (ME) résultantes.
| Scénario d’exposition | Exposition systémique | Niveau d’effet critique | ME |
|---|---|---|---|
| Exposition cutanée quotidienne due à l’utilisation de lotion pour le corps (nourrissons) | 3,8 x 10-5 mg/kg pc/j | DSENO = 109 mg/kg pc/jDes effets sur le foie et les ganglions lymphatiques mésentériques ont été observés à la dose suivante (672 mg/kg pc/j) au cours d’une étude par voie alimentaire de 90 jours chez le rat. | > 2 000 000 a |
a en assumant que l’absorption par voie cutanée est équivalente à l’absorption par voie orale.
La comparaison du niveau d’effet critique et de l’exposition cutanée estimée pour le BCPO, due à son utilisation dans les produits cosmétiques, a permis de calculer une ME > 2 000 000, jugée adéquate pour tenir compte des incertitudes des bases de données sur l’exposition et les effets sur la santé.
En ce qui concerne l’exposition potentielle au BCPO par voie alimentaire, due à son utilisation comme aromatisant, le JECFA et l’EFSA ont conclu que le BCPO ne présente aucun risque pour la sécurité. De plus, les absorptions estimées par le JECFA et l’ESFA pour l’utilisation du BCPO comme aromatisant alimentaire sont inférieurs de plusieurs ordres de grandeur au niveau d’effet critique pertinent. Le risque pour la santé humaine posé par une exposition au BCPO contenu naturellement dans des aliments ou utilisé comme aromatisant alimentaire est donc jugé faible.
6.2.4 Incertitudes de l’évaluation du risque pour la santé humaine
Bien que la base de données sur les effets du BCPO sur la santé soit limitée, étant donné que les marges d’exposition estimées sont suffisamment importantes (plusieurs ordres de grandeur), l’approche suivie pour la caractérisation des risques dus à cette substance est jugée fiable.
6.3 Éther d’o-crésol et de glycidyle (o-CGE)
6.3.1 Évaluation de l’exposition
Aucune concentration mesurée d’o-CGE dans l’air, l’eau ou le sol n’a été identifiée. L’o-CGE n’est pas stable dans l’eau, sa demi-vie d’hydrolyse étant très courte, de 10,5 à 8,9 heures à des pH de 4 à 9 (ECHA 2017b). Cette substance a une faible constante de Henry, indiquant qu’après son rejet dans l’environnement elle se retrouvera généralement dans l’eau où elle sera rapidement hydrolysée. Les estimations de l’exposition environnementale modélisées, basées sur la limite supérieure des quantités déclarées (79 000 kg) de cette substance au Canada (Environnement Canada, 2009) indiquent que les concentrations dans l’air, l’eau et le sol seraient de l’ordre du nanogramme et devraient donc entraîner une exposition négligeable pour la population générale.
Au Canada, l’o-CGE est utilisé comme intermédiaire chimique, adhésif et agent d’étanchéité ou régulateur de viscosité pour des applications telles que la production d’adhésifs et d’agents d’étanchéité, de peintures et revêtements ou de matériaux de construction (Environnement Canada 2009). L’o-CGE, comme d’autres éthers glycidyliques, est principalement utilisé comme diluant réactif pour la formulation des composés de résine époxyde (CIRC 1989). Nous n’avons trouvé aucune étude sur l’exposition potentielle à l’o-CGE résiduel présent dans des résines époxydes durcies. Toutefois, il est généralement assumé que l’oxyde oxiranylméthylique n’est plus présent dans le produit durci (CIRC 1989). De plus, le rapport d’évaluation de la sécurité des produits chimiques de Dow Chemical sur les diluants réactifs, y compris l’o-CGE, indique que même si les diluants réactifs peuvent être utilisés dans diverses applications de consommation, les concentrations de la matière n’ayant pas réagi restant dans des biens de consommation sont négligeables (Dow 2012).
Produits disponibles pour les consommateurs
Bien que l’o-CGE soit principalement utilisé comme diluant réactif pour des applications industrielles, cette substance a été détectée dans un nombre limité de produits de bricolage disponibles pour les consommateurs au Canada (dans un adhésif pour revêtement de sol à utiliser avant l’installation du revêtement, un produit époxyde pour revêtement de sol utilisé sur les planchers de garage, une résine époxyde employée comme produit de finition et agent d’étanchéité (p. ex., pour maquettes) et un composé époxyde utilisé pour la fabrication de moules et d’objets décoratifs) (FSS 2015a, b; FSS 2017).
L’adhésif pour revêtement de sol est un produit à deux composants, conçu pour des applications à l’intérieur ou à l’extérieur, et peut être utilisé dans les bâtiments résidentiels ou commerciaux (TDS 2010). Le produit est utilisé en mélangeant d’abord les deux composants qui sont ensuite appliqués à l’aide d’une truelle dans l’heure qui suit le mélange, avant la pose du revêtement de sol. Une exposition cutanée et par inhalation peut résulter du mélange et de l’application de ce produit. Après l’application, l’exposition à l’o-CGE devrait être minimale, car il aura réagi chimiquement avec d’autres ingrédients du produit une fois durci et le produit adhérera au revêtement de sol.
L’o-CGE a été détecté dans un autre produit de revêtement de sol pour planchers de garage. C’est un revêtement de sol époxydique à deux composants pour planchers de garage en béton (TDS 2012). Il est appliqué à la brosse ou au rouleau dans les 2 heures suivant le mélange. Après l’application, on laisse le revêtement durcir avant de pouvoir utiliser la surface. L’exposition à l’o-CGE peut se produire par inhalation et par voie cutanée pendant l’utilisation de ce produit. L’exposition potentielle à l’o-CGE après l’application de ce produit devrait être minimale, car la substance réagit chimiquement avec d’autres ingrédients du produit pour former l’époxyde durci une fois polymérisé.
L’o-CGE a été identifié comme ingrédient d’une résine époxyde à deux composants utilisée sur diverses surfaces pour donner un fini transparent. Le produit est destiné à être utilisé sur des surfaces en matière plastique et des surfaces dures de produits de bricolage et d’artisanat, comme des maquettes (avions, voitures, bateaux, etc.), et devrait être appliqué à la brosse ou au rouleau dans les deux heures suivant le mélange. Une exposition cutanée et par inhalation due à l’utilisation de ce produit peut se produire pendant le mélange, le chargement ou l’application des deux composants époxyde (résine et durcisseur). L’o-CGE a aussi été identifié comme ingrédient d’une résine époxyde pour travaux d’art, d’artisanat et de bricolage pour produire des pièces moulées en résine époxyde. Une exposition cutanée et par inhalation due à cette utilisation peut survenir pendant son mélange et son chargement dans le moule, et une exposition par inhalation peut être due à l’évaporation potentielle de l’o-CGE pendant le durcissement.
Les expositions à l’o-CGE par inhalation et par voie cutanée ont été estimées à l’aide de ConsExpo Web (ConsExpo 2016), et les valeurs obtenues sont considérées prudentes en raison des contraintes du modèle. Lorsque ces produits sont appliqués, il est prévu que la quantité d’o-CGE n’ayant pas réagi diminue suite au durcissement de la formulation époxyde. Toutefois, le modèle ConsExpo ne tient pas compte de la transformation physique d’une substance, et il a été assumé que tout l’o-CGE présent dans le produit avant l’application se volatilise. La quantité d’o-CGE libre libérée dans l’air pendant l’application serait probablement inférieure à celle estimée par ConsExpo. Les estimations de la concentration dans l’air faites à l’aide de ConsExpo sont basées sur les propriétés physico-chimiques de l’o-CGE et non sur la transformation physique de l’o-CGE lors de l’application du produit.
Le coefficient de transfert de masse est un paramètre clé pour le calcul de l’évaporation pour l’exposition par inhalation avec ConsExpo (McCready & Fontaine 2010). Une méthode développée par Sparks et coll. (1996) pour estimer les coefficients de transfert de masse a été utilisée pour caractériser l’exposition par inhalation à l’o-CGE en corrélation avec l’évaporation à intérieur, le débit d’air dans les pièces, la température et la diffusivité moléculaire.
L’exposition à l’o-CGE par inhalation due à l’utilisation d’un adhésif époxyde pour plancher, d’un revêtement époxyde pour plancher, d’un revêtement/scellant à deux composants ou d’une résine pour art, artisanat et bricolage a été estimée à l’aide de ConsExpo Web et du coefficient de transfert de masse calculé par Sparks et coll. (1996). L’exposition cutanée à l’o-CGE due à l’utilisation de ces produits a également été estimée et est présentée dans le tableau 6-2 (voir l’annexe C pour plus de détails).
| Scénario pour le produit | Exposition par inhalation (concentration moyenne par événement sur 24 h) | Exposition cutanée (par événement)a |
|---|---|---|
| Adhésif époxyde pour revêtement de sol | 0,061 mg/m3 | 0,79 mg/kg pc |
| Revêtement époxyde pour plancher | 0,25 mg/m3 | 1,37 mg/kg pc |
| Époxyde de revêtement/étanchéité à deux composants | 0,29 mg/m3 | 2,1 mg/kg pc |
| Résine pour art, artisanat et bricolage | 0,031 mg/m3 | 0,22 mg/kg pc |
a La valeur de l’exposition cutanée indiquée représente l’exposition due au mélange, au chargement et à l’application des produits, le cas échéant, selon le mode d’emploi.
L’utilisation de l’adhésif époxyde pour revêtement de sol, du revêtement d sol époxyde ou du produit à deux composants pour revêtement/étanchéité de sol devrait être peu fréquente (c.-à-d. surtout pour des travaux d’amélioration ou de réparation, à une fréquence inférieure ou égale à une fois par année) (ConsExpo 2007). La résine pour travaux d’art et d’artisanat peut être utilisée plus fréquemment. Une hypothèse prudente d’une utilisation par semaine a été faite dans le cas des résines utilisées pour l’art et l’artisanat (ConsExpo 2007). L’exposition due à l’utilisation de la résine pour travaux d’art, d’artisanat et de bricolage devrait être de longue durée et intermittente, et des estimations de l’exposition par inhalation et par voie cutanée amorties sur toute une vie (AQMV, exprimée en concentration par inhalation ou dose cutanée) ont également été calculées et sont présentées dans le tableau 6-3.
| Scénario pour le produit | AQMV – inhalationa (mg/m3) | AQMV – exposition cutanéea (mg/kg pc/j) |
|---|---|---|
| Résine pour art, artisanat et bricolage | 9,15 x10-3 | 1,12 x 10-2 |
a Les détails de ces calculs sont présentés à l’annexe C.
6.3.2 Évaluation des effets sur la santé
L’o-CGE est actuellement visé par le Plan d’action continu communautaire (CoRAP) de l’ECHA et est en cours d’évaluation par un état membre en Europe. Cette substance est classée comme susceptible de provoquer des défauts génétiques (Muta 2) selon la classification et l’étiquetage harmonisés approuvés par l’Union européenne (ECHA 2017b). Il n’y a pas de classification du danger par d’autres organisations.
Les effets à court terme de l’o-CGE ont été étudiés dans le cadre d’une étude par inhalation de 21 jours, au cours de laquelle des rats RAI f SPF (n = 10/sexe/dose) ont été exposés à 0, 53, 152 ou 305 mg/m3, 6 heures par jour, 5 jours par semaine, pendant 3 semaines (Ciba-Geigy Limited 1978). À la dose la plus faible (53 mg/m3), une réduction de la consommation alimentaire et du poids corporel chez les rats mâles a été observée entre les jours 3 et 10. D’autres signes observés comprenaient la dyspnée, l’exophtalmie et la fourrure ébouriffée, mais ces effets ont également été observés chez les animaux témoins. À la dose moyenne (152 mg/m3), outre les effets rapportés à la dose faible, une congestion et une inflammation purulente avec ulcération de la muqueuse nasale ont été observées pendant toute la période d’exposition. Ces changements nasaux étaient réversibles après une période de récupération de 21 jours. À la dose la plus élevée (305 mg/ m3), une diminution statistiquement significative du poids corporel et de la mortalité a été observée chez 75 % des animaux, à partir du jour 6. Des hémorragies occasionnelles dans le myocarde, les poumons, le foie, les reins, les surrénales, l’hypophyse, les ovaires et le cerveau ont également été constatées. De plus, les animaux présentaient une congestion marquée, une inflammation purulente avec ulcération de la muqueuse nasale et une déplétion des thymocytes, une atrophie du tissu lymphoïde et une réduction de la spermatogenèse. Les auteurs ont conclu que la CSEO était inférieure à 53 mg/ m3. Toutefois, comme les seuls effets liés au traitement observés à 53 mg/ m3 étaient une réduction de la consommation alimentaire et du poids corporel, une CSENO a été établie à 53 mg/m3.
Les résultats d’une autre étude à court terme par inhalation ont été rapportés dans un dossier d’enregistrement REACH. Pour cette étude, 344 rats Fischer (n = 5/sexe/dose) ont été exposés à 0, 0,6 ou 4 ppm (correspondant à environ 0, 4 et 27 mg/m3) d’o-CGE, 5 jours par semaine pendant 4 semaines. Le rapport n’indiquait « aucun effet observé » ou « aucun effet nocif observé », et la dose de 4 ppm (27 mg/m3, dose testée la plus élevée) a été retenue comme CSEO (Anonyme 1991 cité dans ECHA 2017d).
Aucune étude à court terme par voie cutanée ou orale sur l’o-CGE n’a été trouvée. Des renseignements sur les effets potentiels sur la santé d’analogues [oxyde de méthylphényle et d’oxiranylméthyle (OMPOM, n° CAS 26447-14-3), oxyde d’oxiranyle et de méthylphényle (AGE, n° CAS 122-60-1) et phényloxirane (PO, n° CAS 90-96-3) ont été pris en compte pour la caractérisation des effets de l’o-CGE sur la santé, en raison de leur similarité en termes de structure chimique, des propriétés physiques chimiques, de réactivité et de toxicocinétique. Les structures chimiques de ces analogues sont données dans le tableau 2 3.
Pour une étude par voie orale sur les effets à court terme du PO sur la prolifération cellulaire dans le préestomac, des rats F344 mâles (n = 5/dose) ont reçu des doses de 0, 137, 275 ou 550 mg/kg pc/j de PO par gavage, 3 fois par semaine pendant 4 semaines (Cantoreggi et coll. 1993). Des changements morphologiques marginaux (épaisseur de l’épithélium pavimenteux, kératinisation légèrement accrue du préestomac) et des augmentations statistiquement significatives de la prolifération cellulaire dans certaines sections de l’estomac et du haut de l’intestin grêle ont été observés. Une DMENO de 137 mg/kg pc a été établie, basée sur des augmentations significatives de prolifération cellulaire observées dans le préestomac.
Toxicité chronique / cancérogénicité
Il n’existe actuellement aucune étude de toxicité chronique ou à long terme sur les effets de l’o-CGE par voie orale, par voie cutanée ou par inhalation. Les renseignements sur les analogues AGE et PO ont été pris en compte. Ces deux analogues ont été classés par le Centre international de recherche sur le cancer (CIRC 1989, 1994, 1999). L’AGE a été classé dans le groupe 2B (agent possiblement cancérogène pour les humains) tandis que le PO a été classé dans le groupe 2A (substance probablement cancérogène pour les humains).
Pour une étude sur la cancérogénicité par voie orale (Conti et coll. 1988), des rats Sprague-Dawley (n = 40/sexe/dose) ont reçu des doses de 0, 50 ou 250 mg/kg pc/j de PO (dans de l’huile d’olive pure) par gavage, 4-5 jours par semaine pendant 52 semaines. Une augmentation de tumeurs totales et malignes liée à la dose a été observée chez les groupes traités (analyses statistiques non rapportées). En particulier, le PO a produit des carcinomes épidermoïdes, des papillomes, des acanthomes et des lésions (signes avant-coureurs) dans le préestomac.
Le potentiel cancérogène du PO a également été étudié dans le cadre d’une étude de 2 ans, au cours de laquelle des rats F344 (n = 52/sexe/dose) et des souris B6C3F1 (n = 52/sexe/dose) ont reçu du PO (dans de l’huile de maïs) par gavage oral, 3 fois par semaine pendant 104 semaines (Lijinsky 1986). Les rats ont reçu des doses de 0, 275 ou 550 mg/kg pc/j, tandis que les souris ont reçu des doses de 0, 375 ou 750 mg/kg pc/j. Chez le rat, les principales anomalies histopathologiques consistaient en une fréquence élevée de papillomes et de carcinomes épidermoïdes dans le préestomac. Chez la souris, une augmentation statistiquement significative des papillomes et des carcinomes épidermoïdes (combinés) a été observée dans le préestomac des animaux mâles et femelles, à toutes les doses. Une augmentation statistiquement significative de l’incidence des carcinomes et des adénomes du foie (combinés) a également été observée chez les souris mâles à la dose moyenne, mais pas chez les souris femelles. Dans l’ensemble, ces résultats suggèrent que chez les animaux de laboratoire l’organe cible après une exposition par voie orale au PO est le préestomac, suggérant un effet au point de contact.
Pour ce qui est de la voie cutanée, seulement deux études (Weil et coll. 1963, Van Duuren et coll. 1963) ont été trouvées, mais elles souffraient de limitations significatives (p. ex., dose unique, détails insuffisants sur la dose, choix du vecteur) et n’ont pas été jugées utiles pour la caractérisation des effets sur la santé.
En ce qui concerne l’exposition par inhalation, des études de toxicité chronique et de cancérogénicité ont été réalisées avec l’AGE. Pour une étude de 2 ans sur l’exposition par inhalation, des rats Sprague-Dawley (n = 100/sexe/groupe) ont été exposés à 0, 1 ou 12 ppm d’AGE 6 heures par jour, 5 jours par semaine, pendant 24 mois (Lee et coll. 1983). Cela correspondait à environ 0, 6,14 ou 73,68 mg/m3 (CIRC 1999). Des tumeurs nasales ont été observées chez les rats exposés à la dose élevée (11 % chez les mâles et 4,4 % chez les femelles), mais aucune n’a été observée à la dose faible. De plus, pour les animaux mâles et femelles, une augmentation liée à la dose des cas de rhinite et de métaplasie pavimenteuse ont été observées, corrélés aux tumeurs nasales. Bien qu’aucune analyse statistique n’ait été effectuée, les auteurs ont noté que les tumeurs nasales se développaient par contact direct et absorption de l’AGE par l’épithélium respiratoire de la cavité nasale.
L’o-CGE a été considéré comme une génotoxine faible par Gardiner et coll. (1992). Dans l’UE, l’o-CGE est classé comme « susceptible de causer des défauts génétiques » (ECHA 2017b). Compte tenu du profil des effets sur la santé de l’o-CGE, tout effet cancérogène résultant d’une exposition chronique devrait se produire au site de contact (comme pour les analogues AGE et PO).
Toxicité pour la reproduction et le développement
En ce qui concerne la toxicité pour la reproduction et le développement, aucune étude sur les effets de l’o-CGE dus à une exposition pertinente (c.-à-d. voie orale, voie cutanée et inhalation) n’a été trouvée. Les données sur les effets d’analogues sur la santé ont donc été prises en compte.
Pour la voie orale, les effets de l’analogue PO sur la reproduction et le développement ont été étudiés dans le cadre d’une étude pour laquelle des rats femelles BDIV (n = 14/groupe) ont reçu une dose unique de 200 mg/kg pc (dans de l’huile d’olive) par gavage le jour de la gestation (JG) 17 (Ponomarkov et coll. 1984). La progéniture de ces animaux a ensuite reçu de 100-150 mg/kg pc de PO, une fois par semaine pendant 96 semaines, du sevrage à la fin de l’étude. Aucun effet nocif lié au traitement n’a été rapporté chez les mères après l’administration d’une dose unique de 200 mg/kg pc (dose maximale testée). Chez les descendants, une augmentation statistiquement significative des carcinomes du préestomac a été observée. Les résultats de cette étude indiquent que l’organe cible au cours du développement serait le préestomac, en accord avec les résultats des études de cancérogénicité à long terme.
Pour une étude par voie cutanée portant sur les effets létaux dominants de l’analogue OMPOM, des souris B6D2F1 mâles (n = 10) ont reçu une dose de 1500 mg/kg pc/j, 3 fois par semaine pendant 8 semaines (Pullin 1977, Gardiner et coll. 1992). Après la période de traitement, les mâles ont été accouplés avec des femelles non traitées. Environ deux semaines après la période d’accouplement, les femelles ont été sacrifiées et examinées pour déterminer les taux de grossesse, le nombre total d’implantations et la mortalité fœtale par grossesse. Bien qu’il y ait eu une diminution statistiquement significative de la proportion de femelles gravides, les effets de l’OMPOM sur le nombre d’implantations/grossesses et leurs conséquences sur la létalité dominante n’étaient pas clairs.
Des études de toxicité par inhalation portant sur les paramètres de reproduction et de développement ont été faites avec l’analogue AGE. Pour une étude sur la reproduction et la létalité dominante sur 2 générations, des rats mâles (n = 8/groupe) ont été exposés à 0, 2, 6 ou 11 ppm (correspondant à environ 0, 12, 37 ou 68 mg/m3) d’AGE, 6 heures/jour pendant 19 jours consécutifs, puis accouplés avec des femelles non traitées (Terrill et coll. 1982). Aucun changement dans le poids corporel ou l’état de mortalité n’a été observé chez ces rats mâles. De plus, il a été observé que la fertilité des rats mâles était semblable à celle des témoins et que les petits avaient une croissance normale sans anomalie structurelle importante. Pour la partie de cette étude portant sur le développement, des femelles gravides (n = 25/groupe) ont également été exposées à 0, 2, 6 ou 11 ppm (correspondant à environ 0, 12, 37 ou 68 mg/m3) d’AGE, 6 heures/jour des JG 4 à 15. Aucun effet nocif lié au traitement n’a été observé chez les mères ni sur les fœtus traités. Les auteurs ont conclu que les rats exposés jusqu’à 11 ppm (correspondant à 68 mg/ m3) ne présentaient aucun signe significatif lié au développement ou à la reproduction (CSENO = 68 mg/m3, dose maximale testée).
Des études par inhalation sur les effets de l’analogue PO sur la reproduction et le développement ont également été prises en compte. Sikov et coll. (1986) ont exposé des rats Wistar femelles (n = 106/groupe) à des vapeurs de PO à raison de 0, 100 ou 300 ppm (correspondant à environ 0, 614, 1842 mg/m3), 7 heures par jour, 5 jours par semaine, pendant 3 semaines avant la gestation. En raison d’une toxicité grave, le groupe recevant 300 ppm a été retiré de l’étude. Les autres animaux ont ensuite été accouplés et exposés à 0 ou 100 ppm de PO 7 heures/jour, 5 jours/semaine, des JG 0 à 18. Les animaux ont été sacrifiés le JG 20 et autopsiés. À 100 ppm (614 mg/ m3), une augmentation significative de la mortalité, une réduction significative de la consommation alimentaire/gain de poids corporel et une augmentation significative du poids des poumons ont été observées chez les femelles exposées avant et pendant la gestation. La même dose pendant la gestation a entraîné une augmentation des pertes préimplantation. Les fœtus des mères exposées présentaient une fréquence significativement plus importante de défauts d’ossification des sternèbres et des os occipitaux. Les auteurs n’ont pu établir s’il s’agissait d’effets directs ou le résultat d’une toxicité maternelle. Une CMENO de 100 ppm (614 mg/ m3) a été établie pour les effets sur la reproduction et le développement chez le rat, basée sur les observations d’une mortalité maternelle accrue, d’un pourcentage accru de portées présentant des résorptions, d’une diminution du poids corporel des fœtus et d’effets accrus sur l’ossification des fœtus.
Au cours de la même étude, des lapins néo-zélandais blancs femelles (n = 24/groupe) ont été exposés au PO à des concentrations de 0, 15 ou 50 ppm (correspondant à environ 0, 92 ou 307 mg/m3), 7 heures par jour des JG 1 à 24. Les animaux ont été sacrifiés le JG 30 et autopsiés, les mêmes examens que ceux que nous avons décrits ci-dessus pour les rats ont été faits. L’exposition au PO a entraîné une augmentation statistiquement significative de la mortalité et une diminution significative du poids corporel moyen et de la consommation alimentaire. Une augmentation statistiquement significative, liée à la dose, du pourcentage de portées présentant des résorptions a également été observée. Il n’y avait pas de différences significatives dans le poids corporel des fœtus comparativement aux témoins, ni aucune indication d’une augmentation des malformations à la suite de l’exposition. Une CMENO de 15 ppm (92 mg/ m3) a été établie pour la toxicité maternelle et le succès de la reproduction chez le lapin, basée sur une mortalité maternelle accrue et un pourcentage accru de portées avec résorptions. Une CSENO de 50 ppm (307 mg/ m3) a été établie pour la toxicité pour le développement chez le lapin (dose maximale testée).
Autres effets
Les autres effets liés à une exposition à l’o-CGE comprennent une sensibilisation potentielle de la peau. Des rapports sur des tests de maximisation sur cobayes indiquent que l’o-CGE pourrait provoquer une sensibilisation cutanée chez les cobayes (Anonyme 1976 cité dans ECHA 2017d, Anonyme 1989 cité dans ECHA 2017d, Ullmann et coll. 1991 cité dans Gardiner et coll. 1992). Les données tirées d’études sur les humains et de rapports de cas en milieu de travail confirment également le risque de sensibilisation cutanée. Des volontaires ayant déjà reçu un diagnostic de dermatite de contact allergique ou d’autres affections cutanées ont présenté des tests épicutanés positifs lorsqu’ils ont été exposés à 0,25 % (p/p) d’o-CGE dans de la vaseline (Jolanki et coll. 1990, Jolanki et coll. 1991, Tosti et coll. 1993, Chieregato et coll. 1994, Angelini et coll. 1996).
6.3.3 Caractérisation des risques pour la santé humaine
D’après les données sur les effets sur la santé des analogues PO et AGE, l’effet critique associé à une exposition à l’o-CGE devrait être la cancérogénicité.
L’étude de 2 ans sur les effets cancérogènes d’une exposition par inhalation à l’AGE chez le rat (Lee et coll. 1983) a été jugée appropriée pour la caractérisation du risque d’effets cancérogènes dû à l’exposition à l’o-CGE. Une modélisation de la concentration de référence a été effectuée afin d’établir un point de départ pour les effets cancéreux critiques. La courbe dose-réponse a été utilisée pour calculer la limite inférieure de l’intervalle de confiance à 95 % de la concentration de référence (LCCR) qui devrait entraîner un taux de tumeurs de 10 % (LCCR10). Les niveaux de la LCCR10 ont été estimés pour les données sur les tumeurs au moyen de modèles dichotomiques disponibles dans le logiciel Benchmark Dose Software de l’EPA (BMDS, version 2.5). Un modèle a été choisi en fonction de l’ajustement (annexe E). Une analyse des données dose-réponse a produit une LCCR10 de 11,4 ppm (76,6 mg/ m3), basée sur des tumeurs nasales.
L’estimation de l’exposition de la population générale par inhalation due à la résine pour bricolage et artisanat a été corrigée pour tenir compte de la durée de vie afin de calculer une absorption quotidienne moyenne sur toute une vie (AQMV, exprimée en mg/m3). Elle a été établie à 9,15 x10-3. La comparaison du niveau d’effet critique (LCCR10 = 76,6 mg/m3) et de l’estimation de l’absorption quotidienne moyenne sur toute la durée de vie par inhalation à l’o-CGE due à l’utilisation d’une résine pour bricolage et artisanat a conduit à calculer une ME de 8372. Compte tenu de la nature prudente de l’évaluation (hypothèse d’utilisation du produit une fois par semaine pendant toute la vie) et du profil de la substance (cancérogénicité au point de contact), cette marge est jugée adéquate pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition.
Il n’existait aucune étude par voie cutanée sur les effets d’une exposition répétée à l’o-CGE. En ce qui concerne les analogues AGE et PO, les données sur les effets de l’exposition cutanée à long terme n’étaient pas suffisamment détaillées pour en déduire des niveaux d’effet permettant une caractérisation quantitative du risque chronique. Les ensembles de données sur les dangers associés aux analogues AGE et PO indiquent que l’exposition entraîne principalement des effets au point de contact, avec une toxicité générale limitée ou nulle. Bien que des tumeurs aient été observées au point de contact dans d’autres organes comme le préestomac et la cavité nasale, la peau représente généralement une barrière moins sensible que les voies gastro‑intestinales et les voies respiratoires (IGHRC 2006). Les effets au point de contact sont donc susceptibles de se produire à des doses plus élevées sur la peau que sur les muqueuses internes. D’après ces renseignements et en se basant sur la ME pour l’exposition chronique par inhalation à l’o-CGE, l’exposition cutanée due à l’utilisation de produits de bricolage et d’artisanat contenant de l’o-CGE ne devrait pas être préoccupante pour la santé humaine.
Une CSNEO de 53 mg/m3, basée sur des effets nocifs liés au traitement observés à la dose suivante (c.-à-d. congestion, inflammation purulente avec ulcération de la muqueuse nasale) chez les animaux de laboratoire, a été établie comme niveau d’effet critique pour la caractérisation des risques pour la santé humaine dus à une exposition à court terme par inhalation à l’o-CGE présent dans des produits disponibles pour les consommateurs. Nous donnons dans le tableau 6-4 toutes les estimations pertinentes de l’exposition par inhalation, le niveau d’effet critique et les ME résultantes pour la détermination du risque.
| Scénario d’exposition | Concentration moyenne par événement sur 24 h (mg/m3) | Niveau d’effet critique (CSENO, mg/m3)a | ME |
|---|---|---|---|
| Adhésif époxyde pour plancher a | 0,061 mg/m3 | 53 | 868 |
| Revêtement époxyde pour plancher | 0,25 mg/m3 | 53 | 212 |
| Revêtement/produit d’étanchéité à deux composantsa | 0,29 mg/m3 | 53 | 183 |
| Résine pour art, artisanat et bricolage | 0,031 mg/m3 | 53 | 1709 |
a Basé sur la congestion et l’inflammation purulente avec ulcération de la muqueuse nasale observées à la dose suivante (152 mg/m3) lors d’une étude d’inhalation de 21 jours chez le rat .
La comparaison du niveau d’effet critique et des estimations de l’exposition par inhalation à l’o-CGE due à l’utilisation d’un adhésif époxyde pour plancher, d’un revêtement époxyde pour plancher, d’un enduit/produit d’étanchéité à deux composants ou d’une résine pour art, artisanat et bricolage a conduit à calculer des ME allant de 183 à 1709, jugées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et sur l’exposition.
Aucune étude de toxicité associée à une exposition cutanée à court terme à l’o-CGE n’a été trouvée. Toutefois, les résultats de l’étude de 21 jours par inhalation indiquent que les effets au point de contact devraient être réversibles suite à une exposition à court terme.
Bien que l’exposition de la population générale à l’o-CGE ne soit pas préoccupante aux niveaux actuels, cette substance est jugée préoccupante pour la santé en raison d’effets mutagènes potentiels, et d’une classification Muta 2 dans l’UE. Par conséquent, elle pourrait devenir préoccupante pour la santé humaine si l’exposition venait à augmenter.
6.3.4 Incertitudes de l’évaluation des risques pour la santé humaine
Les sources clés d’incertitude sont présentées dans le tableau suivant.
| Source clé d’incertitude | Impact |
|---|---|
| Les estimations modélisées de l’utilisation des produits ne tiennent pas compte des réactions chimiques de l’o-CGE pendant le mélange et l’application du produit, ce qui surestime l’exposition. | + |
| Il n’existe aucune étude sur la toxicité chronique ou la cancérogénicité de l’o-CGE pour aucune des voies d’exposition pertinentes (c.-à-d. par voie cutanée ou par inhalation). Des données sur les analogues AGE et PO ont été utilisées. | +/- |
| Il n’existe aucune étude pertinente sur la toxicité cutanée à court terme. Comme les analogues AGE et PO induisent des effets locaux au point de contact, constatés lors des études par inhalation et par voie orale, nous avons estimé que l’o-CGE se comporterait de façon similaire. | +/- |
+ = incertitude quant au potentiel de surestimation de l’exposition/risque; – = incertitude quant au potentiel de sous-estimation du risque d’exposition; +/ – = potentiel inconnu de surestimation ou de sous-estimation du risque.
6.4 Isocyanurate de triglycidyle (TGIC)
6.4.1 Évaluation de l’exposition
Aucune concentration mesurée de TGIC dans l’air, l’eau ou le sol n’a été trouvée. Compte tenu des utilisations du TGIC comme agent de réticulation chimique pour la production de peinture/revêtement polyester, la plus grande partie du TGIC utilisé pour ces applications de revêtement en poudre serait immobilisée après réticulation et ne pourrait donc pas être rejetée dans l’environnement (AGDH 1994, 2001). L’exposition au TGIC dans l’environnement due à son utilisation pour des applications commerciales ou industrielles devrait être négligeable, la pulvérisation électrostatique étant une méthode d’application efficace et l’excès de poudre devrait être éliminé au moyen d’extracteurs de poussière (AGDH 1994, OCDE 2004). Du TGIC peut être rejeté dans l’eau des installations qui produisent, traitent ou utilisent cette substance. Toutefois, il devrait être rapidement hydrolysé suite à son rejet (OMS 1998, AGDH 1994). Il n’y a pas de rejets de TGIC dans l’eau dus aux applications commerciales ou industrielles de peinture en poudre (OCDE 2004).
Le TGIC est principalement utilisé comme agent de réticulation pour la formulation de résines de polyester utilisées pour la fabrication de revêtements en poudre. Au cours de la fabrication de tels revêtements, le TGIC peut être mélangé avec d’autres résines, pigments, charges et additifs à des concentrations comprises entre 4 et 10 % en poids du revêtement en poudre final (AGDH 1994). Les expositions au TGIC après son application sur des articles métalliques finis ne devraient pas avoir lieu, car pendant le processus d’application le TGIC est durci à des températures élevées et est entièrement réticulé et lié à une matrice solide (OMS 1998).
6.4.2 Évaluation des effets sur la santé
Étant donné que l’exposition actuelle de la population générale canadienne au TGIC devrait être minime, seul un bref aperçu des principaux effets du TGIC sur la santé humaine est présenté ci-après.
Le TGIC a été classé par l’UE comme « susceptible de provoquer des défauts génétiques » (classification « Muta 1B ») (ECHA 2017c). Des effets à court terme du TGIC ont été rapportés pour les voies d’exposition orale, cutanée et par inhalation. Un rapport sur une étude de toxicité par voie orale de 7 jours mentionne que des lésions des tubules rénaux et des modifications hémorragiques/dégénératives des muqueuses gastriques et duodénales ont été observées chez le rat (Shell 1971 cité dans OMS 1998). Dans un document soumis à l’EPA, une CSEO de 43/56 mg/kg pc (mâles/femelles) a été établie (Ciba-Geigy Corporation 1990a). Dans le même document, une DSEO de 130 mg/kg pc a été établie pour une étude par voie cutanée de 7 jours chez le rat. Pour une étude par inhalation de 5 jours, des souris CD-1 mâles (n = 12/dose) ont été exposées à 0, 10, 40 ou 140 mg/m3. Des signes cliniques nocifs, une perte accrue de poids corporel et une mortalité plus élevée ont été constatés aux doses moyenne et élevée (Nissan Chemical American Corporation 1992a). La DSENO a été établie à 10 mg/m3. Plusieurs études à court terme sur les effets de l’exposition par inhalation au TGIC sur des cellules spermatogoniales de souris ont été menées. La CSENO la plus faible établie était de 1,79 mg/m3, pour un test d’aberration chromosomique des spermatogonies au cours duquel des souris mâles Crl:CD-1 (ICR)BR (n = 10/dose) ont été exposées pendant 5 jours (Ciba-Geigy Corporation 1992a).
Le TGIC a fait l’objet d’une étude de toxicité et de fertilité combinée de 13 semaines avec des rats Sprague-Dawley mâles (n = 10/dose). Les rats ont reçu du TGIC quotidiennement dans leurs aliments à raison de 0, 10, 30 ou 100 ppm (correspondant à environ 0, 0,72, 2,08 ou 7,32 mg/kg pc/j). Une DSENO de 30 ppm (2,08 mg/kg pc/j) a été établie par les auteurs de l’étude, basée sur des effets observés dans les ganglions lymphatiques mésentériques (Fabreguettes 1995, Ciba-Geigy Corporation 1995). Selon le protocole de fertilité suivi pour cette étude, aucun effet nocif lié au traitement n’a été observé chez les animaux parents ni chez leur progéniture. Cependant, pour cette étude, le TGIC n’a été administré qu’à des mâles. Par conséquent, les effets sur la reproduction/développement découlant d’une exposition maternelle n’ont pas été étudiés.
Les effets d’une exposition chronique/long terme au TGIC ont été étudiés lors d’une épreuve biologique sur le cancer chez des rats Sprague-Dawley mâles (n = 50/dose), à des concentrations alimentaires de 0, 10, 30, 100 ou 300 ppm (correspondant à environ 0,, 0,43, 1,30, 4,36 et 13,6 mg/kg pc/j). Les auteurs ont conclu que le TGIC ne présentait pas de potentiel cancérogène (Fabreguettes 1999). Le TGIC n’a pas non plus été observé favoriser la formation de tumeurs cutanées lors d’une épreuve d’initiation-promotion cutanée (Shell 1971 cité dans AGDH 1994).
Le TGIC a exhibé un potentiel de sensibilisation cutanée et de sensibilisation respiratoire. En milieu de travail, des cas de dermatite de contact allergique ont été rapportés (Mathias 1988, Nishioka et coll. 1988, Foulds et Koh 1992, Munro et Lawrence 1992, McFadden et Rycroft 1993, Jolanki et coll. 1994, Pirilla et al. 1997, Wigger-Alberti et al. 1997, Craven et al. 1999, Meuleman et coll. 1999, Aalto-Korte et Suuronen 2016). L’asthme professionnel a également été rapporté dans une série d’étude de cas (Pirila et coll. 1997, McCoach et coll. 1998, Meuleman et coll. 1999, Quirce et coll. 2004, Anees et coll. 2011, Quirce et Sastre 2011, Sastre et coll. 2011).
6.4.3 Caractérisation des risques pour la santé humaine
D’après les renseignements sur l’exposition due à l’utilisation de TGIC, l’exposition de la population générale due aux milieux de l’environnement devrait être minime. L’exposition des consommateurs due à des articles peints finis ne devrait pas avoir lieu étant donné que le TGIC devrait être entièrement réticulé et durci. Sur la base de ces renseignements, le risque pour la santé humaine dû à l’exposition au TGIC devrait être faible pour la population générale.
Bien que l’exposition de la population générale au TGIC ne soit pas préoccupante aux niveaux actuels, cette substance est jugée préoccupante pour la santé en raison de son potentiel d’effets mutagènes, avec une classification « Muta 1B » dans l’UE (ECHA 2017c). Par conséquent, elle pourrait devenir préoccupante pour la santé humaine si l’exposition venait à augmenter.
6.4.4 Incertitudes de l’évaluation des risques pour la santé humaine
Bien qu’il y ait certaines incertitudes dans la base de données sur les effets sur la santé (données épidémiologiques insuffisantes d’après les doses entraînant un effet) et certaines limites dans les bases de données sur l’exposition (données sur la disponibilité des produits spécialisés nécessaires pour utiliser des revêtements en poudre contenant du TGIC), et étant donné que les sources, les utilisations et les propriétés du TGIC sont bien caractérisées, une approche qualitative pour la caractérisation des risques est jugée appropriée pour la présente évaluation.
6.5 Éther d’alkyle (C12-C13) et de glycidyle (AGE C12-C13)
6.5.1 Évaluation de l’exposition
Aucune concentration mesurée d’AGE C12-C13 dans l’air, l’eau ou le sol n’a été trouvée. D’après les renseignements soumis lors d’une enquête menée en vertu de l’article 71 de la LCPE, les quantités produites ou importées d’AGE C12-C13 au Canada étaient inférieures au seuil de déclaration de 100 kg (Environnement Canada 2013). Cette substance n’étant pas présente naturellement dans l’environnement, l’exposition indirecte à l’AGE C12-C13 due aux milieux de l’environnement devrait être minime, compte tenu des faibles quantités rapportées dans le commerce (Environnement Canada 2013).
L’AGE C12-C13 est principalement utilisé comme ingrédient dans des résines époxydes, dans lesquelles il agit probablement comme diluant réactif, de manière similaire à celle des autres éthers glycidyliques (CIRC 1989). Cette substance a été détectée dans un nombre limité de produits adhésifs époxydes à deux composants disponibles pour les consommateurs au Canada. Il a été détecté dans un adhésif époxyde à deux composants (FSS 2016) et dans une matière de charge époxyde en tube (FSS 2014c). L’AGE C12-C13 a aussi été identifié comme ingrédient d’une résine époxyde à faible viscosité multi-usage, pouvant être utilisée pour sceller et enduire diverses surfaces comme celles de meubles ou de bateaux (FSS 2013).
Une exposition aiguë par inhalation ou par voie cutanée à l’AGE C12-C13 peut se produire pendant le mélange, le chargement et l’application de certains adhésifs époxydes dans lesquels il est présent comme ingrédient. L’exposition après l’application ne devrait pas être significative, étant donné que cette substance aura réagi chimiquement avec d’autres ingrédients et devrait être réticulée dans une matrice solide après durcissement. À l’aide de ConsExpo Web, nous avons estimé les expositions par voie cutanée et par inhalation dues à l’utilisation de ces adhésifs époxydes. Les résultats sont présentés dans le tableau 6-6 ci-après. La méthode Sparks pour calculer le coefficient de transfert de masse de la substance a été utilisée pour estimer les expositions par inhalation (Sparks et coll. 1996 cité dans McCready & Fontaine 2010). Les estimations de l’exposition par inhalation à l’AGE C12-C13 due à ces utilisations sont jugées prudentes car, tout comme pour les estimations de l’exposition à l’o-CGE, le modèle ne tient pas compte du durcissement de la préparation époxyde après son application (des détails supplémentaires sont fournis à la section 6.3.1, ci-dessus). Des détails sur chaque scénario de produit figurent à l’annexe C.
| Scénario pour le produit | Exposition aiguë par inhalation (concentration moyenne par événement sur 24 h) | Exposition aiguë par voie cutanéea,b |
|---|---|---|
| Adhésif époxyde à deux composants | 0,0085 mg/m3 (0,0044 mg/kg pc) | 0,07 mg/kg pc |
| Matière de charge époxyde en tube | 0,0069 mg/m3 (0,0036 mg/kg pc) | 0,035 mg/kg pc |
| Revêtement avec résine faible viscosité | 0,069 mg/m3 (0,036 mg/kg pc) | 1,84 mg/kg pc |
a La valeur pour l’exposition cutanée indiquée représente l’exposition due au mélange, au chargement et à l’application des produits, le cas échéant, selon le mode d’emploi
b Exposition cutanée systématique en assumant une absorption cutanée de 100 %.
6.5.2 Évaluation des effets sur la santé
Les effets à court terme de l’AGE C12-C13 ont été étudiés dans le cadre d’une étude de toxicité par voie orale, pour laquelle des rats Fischer 344 (n = 10/sexe/groupe) ont reçu 0, 100, 500 ou 2500 mg/kg pc/j d’AGE C12-C13 par gavage, 7 jours par semaine pendant 4 semaines (Shell Oil Company 1991). À la fin de l’étude, tous les animaux ont été autopsiés et un examen histopathologique des tissus a été fait. Une hyperplasie diffuse ou focale de l’estomac non glandulaire liée au traitement a été observée chez les rats exposés à 500 ou 2500 mg/kg pc/j. La maturation des cellules était ordonnée et aucune atypie ou invasion cellulaire n’a été notée sous la muqueuse musculaire, suggérant que ces effets seraient probablement réversibles après arrêt de l’exposition. Aucun effet systémique n’a été observé. Les auteurs ont établi une DSENO de 100 mg/kg pc/j, basée sur l’hyperplasie gastrique (non glandulaire) observée aux doses plus élevées.
Pour l’exposition par voie cutanée, une étude de détermination des doses a été réalisée avec des rats Fischer 344 (n = 2/sexe/dose) pendant 2 semaines (Society of the Plastics Industry Inc 1997a). Les animaux ont été exposés par voie cutanée à 0, 10, 100 ou 1000 mg/kg pc/j d’AGE C12-C13 (dans de l’acétone), 5 jours/semaine pendant 2 semaines. L’irritation cutanée a été évaluée quotidiennement au niveau du site d’application. Un examen macroscopique à l’autopsie et une histopathologie limitée ont également été effectués. À la dose la plus faible, seule une légère desquamation a été observée. Aux doses moyenne et élevée, des effets histopathologiques de la peau liés au traitement (p. ex., érythème, escarre, œdème, desquamation et fissuration) ont été observés, associés à une perte d’intégrité cutanée à la dose la plus élevée. Les auteurs ont établi une DSENO de 10 mg/kg pc/j, basée sur des effets cutanés locaux constatés à la dose suivante. Cependant, aucun effet systémique n’a été identifié à aucune des doses testées. Aucune étude à court terme par inhalation n’a été trouvée.
En se basant sur l’étude susmentionnée, la toxicité subchronique due à une exposition cutanée à l’AGE C12-C13 a été étudiée dans le cadre d’une étude de 13 semaines, pour laquelle des rats Fischer 344 (n = 10/sexe/dose) ont été exposés à 0, 1, 10 ou 100 mg/kg pc/j (dans de l’acétone), 5 jours/semaine, pendant 13 semaines (Society of the Plastics Industry Inc 1997a). Le site sur la peau a été évalué chaque jour pendant la première semaine, puis hebdomadairement par la suite pour déterminer s’il y avait irritation cutanée. Des signes cliniques, l’hématologie et la biochimie clinique des animaux ont également été examinés. À la fin de l’étude, les animaux ont été autopsiés et un examen histopathologique a été réalisé. Il n’y a pas eu d’effet nocif apparent lié au traitement, autre que des effets locaux observés sur le site cutané. Les auteurs ont établi une DSENO de 1 mg/kg pc/j, basée sur les changements cutanés (c.-à-d. desquamation, épaississement de la peau, hyperplasie épidermique, hyperkératose et hyperplasie des glandes sébacées) observés aux doses moyenne et élevée. Toutefois, aucun effet systémique n’a été observé aux doses testées.
Pour une autre étude de neurotoxicité subchronique, des rats Fischer 344 (n = 12/sexe/dose) ont été exposés par voie cutanée à 0, 1, 10 ou 100 mg/kg pc/j d’AGE C12-C13 (dans de l’acétone), 5 jours/semaine pendant 13 semaines (Society of the Plastics Industry Inc 1997b). Des évaluations cutanées ont été effectuées quotidiennement pendant la première semaine, puis hebdomadairement par la suite. Une batterie d’observation fonctionnelle a été axée sur la force de la préhension, l’étalement des pattes arrière et l’activité motrice. Des tests d’électrodiagnostic ont été utilisés pour dépister des dysfonctionnements des nerfs périphériques, de la moelle épinière, du tronc cérébral, du cervelet et du cerveau en évaluant les potentiels évoqués de ces sites anatomiques. Une nécropsie et des examens histopathologiques ont été faits sur des tissus externes. Les animaux des groupes exposés à la dose moyenne et à la dose élevée présentaient un érythème, un œdème, une desquamation et une tavelure modérée. L’état de la peau des animaux du groupe ayant reçu la faible dose était comparable à celui des animaux du groupe témoin. En ce qui concerne les paramètres de neurotoxicité examinés, des effets significatifs n’ont été observés que pour les tests de la voie visuelle, exprimés en termes de potentiel évoqué visuel (PEV) par flash, bien que ces effets n’aient pas été associés aux effets histopathologiques. Aucune observation macroscopique ni aucun effet histopathologique n’a été relevé sur les systèmes nerveux central et périphérique. Sur la base de ces données, les auteurs ont calculé une CSEO de 1 mg/kg pc/j, basée sur des effets cutanés légers chez les rats exposés à la dose moyenne et de légères modifications du PEV par flash chez les rats mâles exposés à la dose moyenne. En raison de l’incertitude du mécanisme des différences de PEV par flash et parce que le traitement visuel précoce chez les rats albinos est différent de celui des animaux pigmentés, la signification toxicologique des différences observées sur le plan du PEV par flash dans cette étude est incertaine. Par conséquent, les modifications du PEV par flash ne seront pas jugées pertinentes pour la caractérisation des risques de l’AGE C12-C13 pour la santé humaine pour la présente évaluation. Aucune étude subchronique n’a été menée par voie orale ni par inhalation.
Toxicité chronique, cancérogénicité, génotoxicité
Il n’existe actuellement aucune étude à long terme sur les effets de l’AGE C12-C13 pour les voies d’exposition pertinentes (c.-à-d. orale, cutanée ou inhalation).
L’AGE C12-C13 a exhibé un potentiel génotoxique lors de tests de mutagénicité bactérienne. Il a donné des résultats positifs chez Salmonella typhimurium TA1535 avec et sans activation métabolique. Toutefois, il a donné des résultats négatifs pour la mutagénicité chez toutes les autres souches testées telles que TA98, TA100, TA1537 avec et sans activation métabolique. Il n’a pas non plus causé d’anomalies mutagènes chez E. coli WP2 (Society of the Plastics Industry Inc 1997c). Un test de mutation génétique in vitro sur des cellules de mammifères effectué sur des cellules ovariennes de hamster chinois (CHO) a donné des résultats négatifs (Society of the Plastics Industry Inc 1998). L’exposition intrapéritonéale in vivo à des doses de 0, 1000, 2000 ou 4000 mg/kg pc chez des souris ICR (n = 5/sexe/dose) n’a pas induit d’augmentation importante des érythrocytes polychromatiques micronucléés dans la moelle osseuse et a donné des résultats négatifs pour ce qui est de la génotoxicité (Society of the Plastics Industry Inc 1997d). En tenant compte des renseignements disponibles sur la génotoxicité, il est improbable que l’AGE C12-C13 soit génotoxique.
Toxicité pour la reproduction et le développement
En ce qui concerne la toxicité pour la reproduction et le développement, l’AGE C12-C13 ne devrait pas causer d’effets nocifs significatifs par voie cutanée. Pour une étude sur la toxicité pour le développement, des rats femelles Crl:CD(SD)BR (n = 8/groupe) ont été exposées par voie cutanée à 0, 1, 10, 50, 100 ou 200 mg/kg pc/j d’OAOM (dans de l’acétone), 6 heures/jour des JG 6 à15 (Epoxy Resin Systems Task Group 1997). Les signes cliniques, l’irritation cutanée, le poids corporel et la consommation alimentaire ont été enregistrés tout au long de l’étude. Au JG 20, on a procédé au sacrifice des animaux avec examen du contenu utérin, suivi d’un examen du contenu des cavités thoracique, abdominale et pelvienne. L’utérus et les ovaires ont été excisés et le nombre de corps jaunes a été compté. Tous les fœtus, les résorptions précoces et tardives et le nombre de foyers d’implantation ont été dénombrés. Un examen externe des fœtus a été effectué. Les effets nocifs liés au traitement chez les mères se limitaient à ceux constatés au point d’exposition par voie cutanée, et il n’y avait aucun signe de toxicité générale. Une irritation cutanée, caractérisée par un érythème, un œdème et une desquamation, a été observée chez les groupes exposés aux doses de 50, 100 et 200 mg/kg pc/j. À la dose de 10 mg/kg pc/j, deux femelles seulement présentaient un léger érythème. Toutefois, il ne s’agissait pas d’indications définitives d’une irritation cutanée liée au traitement. Aucune autre observation cutanée n’a été observée. Pour ce qui est des paramètres de reproduction, aucun effet nocif lié au traitement n’a été observé dans les organes reproducteurs féminins. Ce résultat concorde avec l’absence d’effets sur les organes reproducteurs dans les études de toxicité subchronique susmentionnées (Society of the Plastics Industry Inc 1997b). De plus, les pertes post-implantation, la croissance intra-utérine, la survie des petits, la taille viable de la portée, le rapport sexe/fœtus, le nombre de corps jaunes et les foyers d’implantation étaient comparables à ceux des témoins. En ce qui concerne les données sur la morphologie des fœtus, aucune malformation externe et aucune variation du développement externe n’ont été observées. Les auteurs ont indiqué que la CSEO pour l’irritation cutanée était de 10 mg/kg pc/j et que la CSEO pour la toxicité maternelle et la toxicité pour le développement était de 200 mg/kg pc/j (dose maximale testée).
6.5.3 Caractérisation des risques pour la santé humaine
L’exposition de la population générale à l’AGE C12-C13 peut se produire lors de l’utilisation de produits de bricolage disponibles pour les consommateurs (c.-à-d. un adhésif époxyde à deux composants, une matière charge époxyde en tube et un revêtement de résine à faible viscosité). L’exposition devrait se produire à court terme par inhalation et par voie cutanée.
En ce qui concerne les effets cancérogènes, bien qu’on ne puisse exclure la possibilité d’une réponse cancérogène, aucune étude à long terme sur cet effet n’a été trouvée. D’après les renseignements sur la génotoxicité, il est improbable que l’AGE C12-C13 soit génotoxique. Comme les scénarios d’exposition associés à l’utilisation de cette substance ne devraient être que de courte durée, la cancérogénicité n’est pas considérée comme un effet critique pour la caractérisation des risques pour la santé humaine associés à l’AGE C12-C13.
En ce qui concerne l’exposition à court terme par voie cutanée, seuls des effets locaux sur la peau ont été observés au point de contact après une exposition à l’AGE C12-C13. Des effets systémiques dus à une exposition par voie cutanée à l’AGE C12-C13 n’ont pas été observés lors d’une étude à court terme de détermination des doses chez le rat (Society of the Plastics Industry Inc 1997a), lors d’études de toxicité subchronique subséquentes (Society of the Plastics Industry Inc 1997a,b) ni lors d’une étude de toxicité pour la reproduction et le développement (Epoxy Resin Systems Task Group 1997) à des doses pouvant atteindre 1000 mg/kg pc/j. D’après les renseignements disponibles, cette substance est associée à des effets locaux réversibles et non nocifs suite à une exposition à court terme par voie cutanée, et le risque pour la santé humaine associé à une exposition à l’AGE C12-C13 par voie cutanée est faible.
Aucune étude sur les effets de l’AGE C12-C13 par inhalation n’a été trouvée. Par conséquent, une DSENO de 100 mg/kg pc/j, basée sur les effets au point de contact sur le préestomac observés lors d’une étude de toxicité par voie orale chez le rat à la dose suivante (c.-à-d. 500 mg/kg pc/j), a été utilisée comme niveau d’effet critique pour la caractérisation des risques liés à une exposition par inhalation à court terme à l’AGE C12-C13 (Shell Oil Company 1991).
| Scénario d’exposition | Concentration d’exposition (convertie en dose externe, mg/kg pc) | Niveau d’effet critique (mg/kg pc/j)a | ME |
|---|---|---|---|
| Adhésif époxyde à deux composants | 0,0044 | 100 | 22 727 |
| Matière de charge époxyde en tube | 0,0036 | 100 | 27 778 |
| Revêtement avec résine faible viscosité | 0,036 | 100 | 2 778 |
La comparaison du niveau d’effet critique et des estimations de l’exposition par inhalation due à l’utilisation de produits de bricolage contenant de l’AGE C12-C13 a permis de calculer des ME allant de 2778 à 27 778. Ces ME sont jugées adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition. Bien qu’il y ait une incertitude quant à l’utilisation d’un effet critique provenant d’une étude de toxicité par voie orale pour caractériser le risque d’inhalation, d’après le profil toxicologique global de l’AGE C12-C13, les effets dus à l’inhalation devraient probablement se limiter à une irritation au point de contact. De plus, cette évaluation est jugée prudente, car elle compare un niveau d’effet (irritation de la muqueuse du préestomac par contact avec le site) qui se produit après 28 jours d’exposition chez des animaux de laboratoire, avec une exposition due à l’utilisation des produits à court terme.
6.5.4 Incertitudes de l’évaluation des risques pour la santé humaine
Les sources clés d’incertitude sont présentées dans le tableau suivant.
| Sources clés d’incertitude | Impact |
|---|---|
| Extrapolation de l’étude de toxicité par voie orale pour l’exposition par inhalation. | +/- |
| Les estimations modélisées pour l’utilisation des produits ne tiennent pas compte des réactions chimiques de l’AGE C12-C13 pendant le mélange et l’application du produit, ce qui surestime l’exposition. | + |
| Il n’existe aucune étude sur la toxicité chronique ou la cancérogénicité de l’AGE C12-C13 pour aucune des voies d’exposition pertinentes (voie cutanée ou inhalation). Comme les scénarios d’exposition associés à l’utilisation de cette substance ne devraient être que de courte durée, la cancérogénicité n’est pas considérée comme un effet critique pour la caractérisation des risques pour la santé humaine associés à l’AGE C12-C13. | +/- |
| Il n’existe pas d’études sur le danger par inhalation dû aux effets d’une exposition à court terme à l’AGE C12-C13 ou à ses analogues. Les effets de l’exposition orale à court terme à l’AGE C12-C13 ont été utilisés pour éclairer la caractérisation du risque dû à une exposition par inhalation à court terme. | +/- |
+ = incertitude quant au potentiel de surestimation de l’exposition/risque; – = incertitude quant au potentiel de sous-estimation du risque d’exposition; +/ – = potentiel inconnu de surestimation ou de sous-estimation du risque.
7. Conclusion
Compte tenu de tous les éléments de preuve avancés dans la présente évaluation préalable, l’AGE, le BCPO, l’o-CGE, le TGIC et l’AGE C12-C13 présentent un faible risque d’effets nocifs sur l’environnement. Il est conclu que ces cinq substances ne satisfont à aucun des critères de l’alinéa 64a) ou 64b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur sa diversité biologique, et à mettre en danger l’environnement essentiel pour la vie.
En se basant sur les renseignements présentés dans la présente évaluation préalable, il est conclu que l’AGE, le BCPO, l’o-CGE, le TGIC et l’AGE C12-C13 ne satisfont à aucun des critères de l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaine.
Il est donc conclu que l’AGE, le BCPO, l’o-CGE, le TGIC et l’AGE C12-C13 ne satisfont à aucun des critères de l’article 64 de la LCPE.
Références
Aalto-Korte K. et Suuronen K.; 2016; Occupational contact allergy to components of polyester resin systems; Contact Dermatitis, 75(1), p. 14-19 (en anglais seulement).
[AGDH] Ministère de la Santé du gouvernement de l’Australie; 1994; Triglycidylisocyanurate (TGIC) [Word]; Sydney (AU): Department of Health, National Industrial Chemicals Notification and Assessment Scheme (NICNAS); Priority Existing Chemical (PEC) Assessment Report No. 1 (en anglais seulement).
Allied Corporation; 1982; Evaluation of allyl glycidyl ether for enzyme mediated mutagenicity in salmonella typhimurium with cover letter; Microfiche No. 215156, Doc ID: 878221062, Old Doc ID: 8DS (en anglais seulement).
Ambroz M., Bousova I., Skarka A., Hanusova V., Kralova V., Matouskova P., Szotakova B. et Skalova L.; 2015; The influence of sesquiterpenes from Myrica rubra on the antiproliferative and pro-oxidative effects of doxorubicin and its accumulation in cancer cells; Molecules, 20(8), p. 15343-15358 (en anglais seulement).
Anees W., Moore V.C., Croft J.S., Robertson A.S. et Burge P.S.; 2011; Occupational asthma caused by heated triglycidyl isocyanurate; Occupational Medicine, 61(1), p. 65-67 (en anglais seulement).
Angelini G., Rigano L., Foti C., Grandolfo M., Vena G.A., Bonamonte D., Soleo L. et Scorpiniti A.A.; 1996; Occupational sensitization to epoxy resin and reactive diluents in marble workers; Contact Dermatitis, 35(1), p. 11-16 (en anglais seulement).
[AOPWIN] Atmospheric Oxidation Program for Microsoft Windows [modèle d’estimation]; 2010; ver. 1.92a; Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation (en anglais seulement).
Asakawa Y., Taira Z. et Takemoto T.; 1981; X-ray crystal structure analysis of 14-hydroxycarylophyllene oxide, a new metaboilite of (-)-caryophyllene, in rabbits; Journal of Pharmaceutical Sciences, 70(6), p. 710-711 (en anglais seulement).
Asakawa Y., Ishida T., Toyota M. et Takemoto T.; 1986; Terpenoid biotransformation in mammals IV biotransformation of (+)-longifolene, (-)-carylophyllene, (-)-caryophyllene oxide, (-)-cyclocolorenone, (+)-nootkatone, (-)-elemol, (-)-abietic acid and (+)-dehydroabietic acid in rabbits; Xenobiotica, 16(8), p. 753‑767 (en anglais seulement).
[BDPP] Base de données sur les produits pharmaceutiques; 2015; Ottawa (ON) : Santé Canada [mise à jour le 17 juillet 2017, consultee le 2 avril 2017].
[BDIPSN] Base de données d'ingrédients de produits de santé naturels [base de données]; [modifiée le 23 novembre 2015]; Ottawa (ON), Santé Canada [consultée le 2 avril 2017].
[BDPSNH] Base de données des produits de santé naturels homologués [base de données]; [modifiée le 27 février 2014]; Ottawa (ON), Santé Canada [consultée le 2 avril 2017].
Burdock; 2009; Fenaroli’s Handbook of Flavour Ingredients, 6ème edition, Boca Raton (FL), CRC Press (en anglais seulement).
Canada; 1978; Règlement sur les aliments et drogues, C.R.C., ch. 870.
Canada; 1999; Loi canadienne sur la protection de l’environnement (1999), L.C. 1999, ch. 33, Gazette du Canada Partie III, vol. 22, no 3.
Canter D.A., Zeiger E., Haworth S., Lawlor T., Mortelmans K. et Speck W.; 1986; Comparative mutagenicity of aliphatic epoxides in salmonella; Mutation Research, 172(2), p. 105-138 (en anglais seulement).
Cantoreggi S., Dietrich D.R. et Lutz W.K.; 1993; Induction of cell proliferation in the forestomach of F344 rats following subchronic administration of styrene 7,8-oxide and butylated hydroxyanisole; Cancer Research, 53(15), p. 3505-3508 (en anglais seulement).
ChemCAN, Level III fugacity model of 24 regions of Canada; 2003; ver. 6.00; Peterborough (ON) : Université Trent, Canadian Centre for Environmental Modelling and Chemistry (en anglais seulement)..
ChemIDplus [base de données]; 1993- ; Bethesda (MD): US National Library of Medicine (en anglais seulement).
[ChemView] ChemView [base de données]; 2016a; Search results for CAS RN 106-92-3; Washington (DC): EPA Office of Pollution Prevention and Toxics [mis à jour le 17 décembre 2016, consulté le 29 mai 2017] (en anglais seulement).
[ChemView] ChemView [base de données]; 2016b; Search results for CAS RN 2210-79-9; Washington (DC): EPA Office of Pollution Prevention and Toxics [mis à jour le 17 décembre 2016, consulté le 29 mai 2017] (en anglais seulement).
[ChemView] ChemView [base de données]; 2016c; Search results for CAS RN 2451-62-9; Washington (DC): EPA Office of Pollution Prevention and Toxics [mis à jour le 17 décembre 2016, consulté le 29 mai 2017] (en anglais seulement).
[ChemView] ChemView [base de données]; 2016d; Search results for CAS RN 120547-52-6; Washington (DC): EPA Office of Pollution Prevention and Toxics [mis à jour le 17 décembre 2016, consulté le 29 mai 2017] (en anglais seulement).
Chieregato C., Vincenzi C., Guerra L. et Farina P.; 1994; Occupational allergic contact dermatitis due to ethylenediamine dihydrochloride and cresyl glycidyl ether in epoxy resin systems; Contact Dermatitis, 30, p. 120 (en anglais seulement).
Ciba-Geigy Corporation; 1990a; Initial submission: summary of toxicology data of Araldite PT 810 with cover letter dated 101992; Microfiche No: OTS0571432, New Doc ID: 88-920009782, Old Doc ID: 8EHQ-1092-11501 (en anglais seulement).
Ciba-Geigy Corporation; 1992a; Support: 1,3,5-triglycidylisocyanurate: chromosomal aberrations assay in mouse spermatogonial cells with cover letter dated 112592; Microfiche No: OTS0503914-15, New Doc ID: 89-930000035, Old Doc ID: 8EHQ-1292-0490 (en anglais seulement).
Ciba-Geigy Corporation; 1995; Support: 13-week toxicity study and fertility study of Araldite PT-810 by oral route (dietary admixture) in male rats, with cover letter dated 4/26/96; Microfiche No: OTS0503914-17, New Doc ID: 000811668U, Old Doc ID: 8EHQ-0596-0490 (en anglais seulement).
Ciba-Geigy Limited; 1978; TK 10’410, 21-day aerosol inhalation study in rats; Document No: 8EHQ-92-0530. 08930000012 (en anglais seulement).
[CIRC] Centre international de recherche sur le cancer; 1989; Working Group on the Evaluation of Carcinogenic Risks to Humans; Some organic solvents, resin monomers and related compounds, pigments and occupational exposures in paint manufacture and painting; IARC Monogr. Eval. Carcinog. Risks Hum. 47 (en anglais seulement).
[CIRC] Centre international de recherche sur le cancer; IARC Working Group on the Evaluation of Carcinogenic Risks to Humans; 1994; Styrene-7,8-oxide; IARC Monogr. Eval. Carcinog. Risks Hum., 60, p. 321-346 (en anglais seulement).
[CIRC] Centre international de recherché sur le cancer; IARC Working Group on the Evaluation of Carcinogenic Risks to Humans; 1999; Phenyl glycidyl ether; IARC Monogr. Eval. Carcinog. Risks Hum., 71, p. 1525-1527 (en anglais seulement).
[ConsExpo Web] Consumer Exposure Web Model; 2016; Bilthoven (Pays-Bas) : Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement] (en anglais seulement).
Conti B., Maltoni C., Perino G. et Ciliberti A.; 1988; Long-term carcinogenicity bioassays on styrene administered by inhalation, ingestion and injection and styrene oxide administered by ingestion in Sprague-Dawley rats, and para-methylstyrene administered by ingestion in Sprague-Dawley rats and Swiss mice; Annals New York Academy of Sciences, 534(1), p. 203-234 (en anglais seulement).
[CosIng] Cosmetic Ingredients and Substances [base de données]; 2017; ver. 2; Search results for CAS RN 106-92-3; Bruxelles (Belgique) : DG Internal Market, Industry, Entrepreneurship and SMEs [consulté le 29 mai 2017].
Craven N.M., Bhushan M. et Beck M.H.; 1999; Sensitization to triglycidyl isocyanurate, epoxy resins and acrylates in a developmental chemist; Contact Dermatitis, 40(1), p. 54 (en anglais seulement).
De Rooij B.M., Commandeur J.N.M., Hommes J.W., Aalbers T., Groot E.J. et Vermeulen N.P.E.; 1998; Urinary metabolite profile of phenyl and o-cresyl glycidyl ether in rats : identification of a novel pathway leading to n-acetylserine o-conjugates; Chemical Research in Toxicology, 11(2), p. 111-118 (en anglais seulement).
Department of Health & Human Services; 1984; The salmonella/microsome mutagenicity test system with cover letter dated 060484; Microfiche No. OTS0522514, New Doc ID: 40-8440544, Old Doc ID: 42051 B3-267 (en anglais seulement).
Di Sotto A., Maffei F., Hrelia P., Castelli F., Sarpietro M.G. et Mazzanti G.; 2013; Genotoxicity assessment of β-caryophyllene oxide; Regulatory Toxicology and Pharmacology, 66(3), p. 264-268 (en anglais seulement).
DOW Chemical Company; 1978; Acute oral, acute percutaneous absorption, and acute inhalation toxicity of allyl glycidyl ether; Microfiche No: OTS0206671, Doc ID: 878214853, Old Doc ID: 8DS (en anglais seulement).
DOW Chemical Company; 2012; Product safety assessment: DOW reactive diluents [révisé le 2 mai 2012, consulté le 30 mai 2017]; disponible sur demande (en anglais seulement).
[ECCC] Environnement et Changement climatique Canada; 2016a; Document sur l’approche scientifique : Classification du risque écologique des substances organiques; Ottawa (ON), gouvernement du Canada.
[ECCC] Environment and Climate Change Canada; 2016b; Supporting documentation: data used to create substance-specific hazard and exposure profiles and assign risk classifications; Gatineau (QC) : ECCC; Information in support of the science approach document: ecological risk classification of organic substances; disponible à : substances@ec.gc.ca (en anglais seulement)
[ECCC] Environnement et Changement climatique Canada; 2016c; données soumises en vertu de la Loi canadienne sur la protection de l’environnement, 1999, article 70; Données préparées par ECCC, Santé Canada, Programme des substances existantes.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada; [modifié le 20 avril 2007]; Catégorisation; Ottawa (ON), gouvernement du Canada [consulté le 1 avril 2017].
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada; 2015; Identification des priorités d’évaluation des risques : résultats de l’examen de 2015; Ottawa (ON), gouvernement du Canada [consulté le 1 avril 2017].
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada; 2018; Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée; Ottawa (ON), gouvernement du Canada [consulté le 1 avril 2017].
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada; 2018; Ébauche d'évaluation préalable : Substances jugées comme étant peu préoccupantes au moyen de l'approche de la Classification du risque écologique des substances organiques et de l'approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances; Ottawa (ON), gouvernement du Canada.
[eCFR] Code of Federal Regulations desÉtats-Unis, Title 21 [base de données]; 2017; Search Results for beta-caryophyllene oxide [mise à jour le 1er avril 2016; consulté le 29 mai 2017] (en anglais seulement).
[ECHA] Agence européenne des produits chimiques; 2017a; Brief profile: Allyl 2,3-epoxypropyl ether; CAS RN 106-92-3; Helsinki (Finlande) : ECHA [mis à jour le 5 mai 2017, consulté de 24 mai 2017] (en anglais seulement).
[ECHA] Agence européenne des produits chimiques; 2017b; Brief profile: 2,3-epoxypropyl o-tolyl ether; CAS RN 2210-79-9; Helsinki (Finlande) : ECHA [mis à jour le 5 mai 2017, consulté de 24 mai 2017] (en anglais seulement).
[ECHA] Agence européenne des produits chimiques; 2017c; Brief profile: 1,3,5-tris(oxiranylmethyl)-1,3,5-triazine-2,4,6(1H,3H,5H)-trione; CAS RN 2451-62-9; Helsinki (Finlande) : ECHA [mis à jour le 5 mai 2017; consulté de 24 mai 2017] (en anglais seulement).
[ECHA] Agence européenne des produits chimiques; 2017d; Guidance on safe use: 2,3-epoxypropyl o-tolyl ether; CAS RN 2210-79-9; Helsinki (Finlande) : ECHA [mis à jour le 26 mai 2017; consulté le 19 juin 2017] (en anglais seulement).
[EFSA] Autorité européenne pour la sécurité des aliments; 2014; Scientific opinion: scientific opinion on flavouring group evaluation 82, Revision 1 (FGE.82Rev1): consideration of epoxides evaluated by the JECFA (65th meeting); EFSA Journal, 12(6), p. 3708 (en anglais seulement).
Environnement Canada, Santé Canada; 2010; Évaluation préalable pour le Défi concernant le l'oxyde de butyle et de 2,3-époxypropyle : Numéro de registre du Chemical Abstracts Service 2426-08-6; Ottawa (ON), gouvernement du Canada [consulté le 30 mai 2017].
Environnement Canada; 2009; Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu du de l’article 71 de la Loi canadienne sur la protection de l’environnement de 1999 : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure; Données préparées par Environnement Canada et Santé Canada, Programme des substances existantes.
Environnement Canada; 2012; Phase 2 de la mise à jour de l’inventaire de la Liste intérieure – Guide d’orientation pour répondre à l’Avis concernant certaines substances sur la Liste intérieure (l’avis); publié dans la Gazette du Canada, Partie I, le 1er décembre 2012.
Environnement Canada; 2013; Données de la Mise à jour de l'inventaire de la LIS recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l'environnement, 1999: Avis concernant certaines substances de la Liste intérieure; Données préparées par Environnement Canada et Santé Canada, Programme des substances existantes.
[EPA] Environmental Protection Agency des États-Unis; 2005; Guidelines for carcinogen risk assessment [PDF]; Washington (DC): US EPA, Risk Assessment Forum [consulté le 19 juin 2017] (en anglais seulement).
[EPA] Environmental Protection Agency des États-Unis; 2010; Screening-level hazard characterization. Sponsored chemical: Alkyl (C12-C14) glycidyl ether (CAS RN 68609-97-2). Supporting chemical: Alkyl (C12-C13) glycidyl ether (CAS RN 120547-52-6) [PDF]; Washington (DC): US EPA, Office of Pollution Prevention and Toxics [consulté le 19 juin 2017] (en anglais seulement).
[EPI Suite] Estimation Program Interface Suite for Microsoft Windows [modèle d’estimation]; c2000-2012; ver. 4.11; Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation (en anglais seulement).
Epoxy Resin Systems Task Group; 1997; Final report, a dermal developmental toxicity screening study of alkyl glycidyl ethers in rats, with cover letter dated 10/19/97; Microfiche No: OTS0558897, New Doc ID: 44645, Old Doc ID: 42185 F1-17 44645 (en anglais seulement).
Fabreguettes C.; 1995; 13-week toxicity study and fertility study by oral route (dietary mixture) in male rats; CIT/Study No. 11099 TCR/PT 810 (TGIC)/Ciba-Geigy and Nissan; Microfiche No: OTS0503914-17, New Doc ID: 000811668U, Old Doc ID: 8EHQ-0596-0490 (en anglais seulement).
Fabreguettes C.; 1999; Carcinogenicity study in male rats; CIT/Study No. 11117 TCR; Microfiche No: OTS0573828-1, New Doc ID: 89990000269, Old Doc ID: 8EHQ-0799-14351 (en anglais seulement).
[FSS] Fiche signalétique de sécurité; 2013; MAS Epoxies Low Viscosity Epoxy Resin [PDF]; South Saint Paul (MN) : Endurance Technologies Inc. [consulté le 1er juin 2017] (en anglais seulement).
[FSS] Fiche signalétique de sécurité; 2014a; (−)-Caryophyllene oxide; Oakville (ON), Sigma-Aldrich Canada Co. [consulté le 1er juin 2017] (en anglais seulement).
[FSS] Fiche signalétique de sécurité; 2014b; EASYCAST EPOXY RESIN PART A; Fields Landing (CA), Environmental Technology Inc. [consulté le 30 mai 2017] (en anglais seulement).
[FSS] Fiche signalétique de sécurité; 2015a; EPOXY 1-GLK 2PK GARAGE FLOOR GRAY Kit Part A [PDF]; Concord (ON), Rust-Oleum Consumer brands Canada (RCBC) [consulté le 30 mai 2017] (en anglais seulement).
[FSS] Fiche signalétique de sécurité; 2015b; Z-POXY FINISHING RESIN KIT – RESIN; Ontario (CA), Pacer Technology [consulté le 30 mai 2017] (en anglais seulement).
[FSS] Fiche signalétique de sécurité; 2016; PC-SUPEREPOXY, Part A [PDF]; Allentown (PA), Protective Coating Company [consulté le 30 mai 2017] (en anglais seulement).
[FSS] Fiche signalétique de sécurité; 2017; ULTRABOND G-21 PART A [PDF]; Laval (Qué.), Mapei Inc. [consulté le 30 mai 2017].
Fidyt K., Fiedorowicz A., Strzadala L. et Szummy A.; 2016; βcaryophyllene and β-caryophyllene oxide—natural compounds of anticancer and analgesic properties; Cancer Medicine, 5(10), p. 3007-3017 (en anglais seulement)
Foulds I.S. et Koh D.; 1992; Allergic contact dermatitis from resin hardeners during the manufacture of thermosetting coating paints; Contact Dermatitis, 26(2), p. 87-90 (en anglais seulement).
Gagnaire F., Zissu D., Bonnet P. et De Ceaurriz J.; 1987; Nasal and pulmonary toxicity of allyl glycidyl ether in mice; Toxicology Letters, 39(2), p. 139-145 (en anglais seulement).
Gardiner T.H., Waechter J.M., Wiedow M.A. et Solomon W.T.; 1992; Glycidyloxy compounds used in epoxy resin systems: a toxicology review; Regulatory Toxicology and Pharmacology, 15(2), p. S1-S77 (en anglais seulement).
Hemminki K., Falck K. et Vainio H.; 1980; Comparison of alkylation rates and mutagenicity of directly acting industrial and laboratory chemicals: epoxides, glycidyl ethers, methylating and ethylating agents, halogenated hydrocarbons, hydrazine derivatives, aldehydes, thiuram and dithiocarbamate derivatives; Arc. Toxicol., 46(3-4), p. 277-285 (en anglais seulement).
[IGHRC] The Interdepartmental Group on Health Risks from Chemicals; 2006; Guidelines on route-to-route extrapolation of toxicity data when assessing health risks of chemicals; Bedfordshire (R.-U.) : Institute of Environment and Health (en anglais seulement).
Jolanki R.; 1991; Occupational skin diseases from epoxy compounds; Acta Dermato-Venereologica, Supplementum, 159, p. 1-80 (en anglais seulement).
Jolanki R., Estlander T. et Kanerva L.; 1987; Occupational contact dermatitis and contact urticaria caused by epoxy resins; Acta Derm. Venereol. Stockholm., 134(supplementum), p. 90-94 (en anglais seulement).
Jolanki R., Kanerva L., Estlander T. et Tarvainen K.; 1994; Concomitant sensitization to triglycidyl isocyanurate, diaminodiphenylmethane and 2-hydroxyethyl methacrylate from silk-screen printing coatings in the manufacture of circuit boards; Contact Dermatitis, 30(1), p. 12-15 (en anglais seulement).
Jolanki R., Kanerva L., Estlander T., Tarvainen K., Keskinen H. et Henriks-Eckerman M.L.; 1990; Occupational dermatoses from epoxy resin compounds; Contact Dermatitis, 23(3), p. 172-183 (en anglais seulement).
Langmuir I.; 1913; The vapor pressure of metallic tungsten; Phys. Rev., 2(329), p. 42 (en anglais seulement).
Lee K.P., Schneider P.W. et Trochimowicz H.J.; 1983; Morphologic expression of glandular differentiation in the epidermoid nasal carcinomas induced by phenylglycidyl ether inhalation; American Journal of Pathology, 111(2), p. 140-148 (en anglais seulement).
Lijinsky W.; 1986; Rat and mouse forestomach tumors induced by chronic oral administration of styrene oxide; JNCI, 77(2), p. 471-476 (en anglais seulement).
Loretz L.G., Api A.M., Barraj L.M., Burdick J., Dressler W.E., Gettings S.D., Han Hsu H., Pan Y.H.L., Re T.A., Renskers K.J., Rothenstein A., Scrafford C.G. et Sewall C.; 2005; Exposure data for cosmetic products: lipstick, body lotion, and face cream; Food Chem. Toxicol., 43, p. 279-291 (en anglais seulement).
Loretz L.G., Api A.M., Babcock L., Barraj L.M., Burdick J., Cater K.C., Jarrett G., Mann S., Pan Y.H.L., Re T.A. et al.; 2008; Exposure data for cosmetic products: Facial cleanser, hair conditioner, and eye shadow; Food Chem. Toxicol., 46, p. 1516-1524 (en anglais seulement).
Mathias C.G.T.; 1988; Allergic contact dermatitis from triglycidyl isocyanurate in polyester paint pigments; Contact Dermatitis, 19(1), p. 67-68 (en anglais seulement).
McCready D. et Fontaine D.; 2010; Refining ConsExpo evaporation and human exposure calculations for REACH; Human and Ecological Risk Assessment, 16(4), p. 783-800 (en anglais seulement).
McCoach J.S. et Burge P.S.; 1997; Occupational asthma due to triglycidyl isocyanurate (TGIC); Thorax, 52(Suppl 6), P173 (en anglais seulement).
McCoach J.S., Robertson A.S. et Burge P.S.; 1998; Occupational asthma due to triglycidyl isocyanurate TGIC; Annual Meeting of the European Academy of Allergology and Clinical Immunology, Birmingham (R.-U.), 21-26 juin 1998; Allergy (Copenhage), 53(SUPPL. 43), 218 (en anglais seulement).
McFadden J.P., Rycroft R.J.G.; 1993; Occupational contact dermatitis from triglycidyl isocyanurate in a powder paint sprayer; Contact Dermatitis, 28(4), p. 251 (en anglais seulement).
Meuleman L., Goossens A., Linders C., Rochette F. et Nemery B.; 1999; Case report: sensitization to triglycidylisocyanurate (TGIC) with cutaneous and respiratory manifestations; Allergy, 54(7), p. 752-756 (en anglais seulement).
Munro C.S. et Lawrence C.M.; Short communications: occupational contact dermatitis from triglycidyl isocyanurate in a powder paint factory; Contact Dermatitis, 26(1), p. 59 (en anglais seulement).
[NIH] National Institutes of Health; 1984; Comparative mutagenicity of aliphatic diesters in salmonella; Microfiche No: OTS0522514, New Doc ID: 40-8440414, Old Doc ID: 42051 B3-266 (en anglais seulement).
Nishioka K., Ogasawara M. et Asagami C.; 1988; Short communications: occupational contact allergy to triglycidyl isocyanurate (TGIC, Tepic); Contact Dermatitis, 19(5), p. 379-380 (en anglais seulement).
Nissan Chemical American Corporation; 1992a; Supplemental information from Nissan Chemical America Corp to USEPA concerning triglycidyl isocyanurate: 5-day repeat exposure inhalation toxicity study in the male mouse w—attach; Microfich No: OTS0503914-13, New Doc ID: 89-920000049, Old Doc ID: 8EHQ-0292-0490 (en anglais seulement).
Nissan Chemical American Corporation; 1992b; Supplement: Triglycidyl isocyanurate: chromosome analysis in mouse spermatogonial cells, comparative inhalation study with cover letter dated 091892; Microfiche No: OTS0503914-14, New Doc ID: 89-920000133, Old Doc ID: 8EHQ-0992-0490 (en anglais seulement).
[NTP] National Toxicology Program; 1990; NTP technical report on the toxicology and carcinogensis studies of allyl glycidyl ether (CAS No. 106-92-3) in Osborne-mendel rats and B6C3F1 mice (inhalation studies); Research Triangle Park (NC): US Department of Health and Human Services, National Toxicology Program. Report No.: 376 (en anglais seulement).
[NTP] National Toxicology Program; 2000; Report on carcinogens background document for Styrene-7,8-oxide; Research Triangle Park [PDF] (NC): US Department of Health and Human Services, National Toxicology Program, Public Health Service (en anglais seulement)
[NTP] National Toxicology Program; 2010; o-Cresyl glycidyl ether. Salmonella: Study Summary. Study ID: 141757 (en anglais seulement).
[OCDE] Organisation de coopération et de développement économiques; 2004; Emission scenario document on metal finishing [PDF]; Paris (France) : OCDE, Direction de l’environnement; Series on Emission Scenario Documents No. 12; Report No.: ENV/JM/MONO(2004)23, JT03263583) [consulté le 15 juillet 2017] (en anglais seulement).
[OCDE] Organisation de coopération et de développement économiques; 2007; SIDS Initial Assessment Profile (SIAP): Allyl 2,3-epoxypropyl ether [PDF] [SIDS Initial Assessment Meeting] 25; octobre 2007; Paris, France [consulté le 19 juin 2017] (en anglais seulement).
[OCDE] Organisation de coopération et de développement économiques; 2014; Boîte à outils QSAR de l’OCDE [outil de lecture croisée; ver. 3.3; Paris (France) : Organisation de coopération et de développement économiques, Laboratoire de chimie mathématique (en anglais seulement).
[OMS] Organisation mondiale de la Santé; 1998; Concise International Chemical Assessment Document 8: Triglycidyl Isocyanurate [PDF]; Genève (Suisse) : Organisation mondiale de la Santé (en anglais seulement).
[OMS] Organisation mondiale de la Santé; 2006; Joint FAO/WHO Expert Committee on Food Additives [PDF]; Evaluation of certain food additives; Genève (Suisse) : Organisation mondiale de la Santé (WHO Technical Report Series 934), Sixty-fifth report of the JECFA (en anglais seulement).
Opdycke D.L.J et Letizia C.; 1983; Monographs on fragrance raw materials, Caryophyllene oxide; Food Chem. Toxicol., 21(5), p. 661-662 (en anglais seulement).
Pérez H.L. et Osterman-Golkar S.; 2000; Biotransformation of the double bond in allyl glycidyl ether to an epoxide ring. Evidence from hemoglobin adducts in mice; Chemico-Biological Interactions, 125(1), p. 17‑28 (en anglais seulement).
Piirila P., Eslander T., Keskinen H., Jolanki R., Laakkonen A., Pfaffli P., Tupasela O., Tuppurainen M. et Nordman H.; 1997; Occupational asthma caused by triglycidyl isocyanurate (TGIC); Clinical and Experimental Allergy, 27(5), p. 510-514 (en anglais seulement).
Plna K. Segerback; 1997; 32P-Postlabelling of DNA adducts formed by allyl glycidyl ether in vitro and in vivo; Carcinogenesis, 18(8), p. 1457-1462 (en anglais seulement).
Ponomarkov V., Cabral J.R.P., Wahrendorf J. et Galendo D.; 1984; A carcinogenicity study of styrene-7,8-oxide in rats; Cancer Letters, 24(1), p. 95-101 (en anglais seulement).
Pottenger L.H., Boverhof D.R. et Waechter J.M.; 2012; Epoxy Compounds—Olefin Oxides, Aliphatic Glycidyl Ethers, and Aromatic Monoglycidyl Ethers; Patty’s Toxicology, 82, p. 425-490 (en anglais seulement).
Product Safety Labs; 2012; Beta-caryophyllene epoxide: palatability/toxicity study: a 14-day dietary study in rats; Study Number: 31086 [accès restreint] (en anglais seulement).
Product Safety Labs; 2013; Beta-caryophyllene epoxide: a 90-day dietary study in rats; Study number: 33329 [accès restreint] (en anglais seulement).
Pullin T.G.; 1977; Report to the DOW Chemical Company. Integrated mutagenicity testing program on several epoxy compounds; Microfiche No: OTS0206671, Doc ID: 878214859, Old Doc IC: 8DS (en anglais seulement).
Quirce S., Fernandez-Nieto M., de Gorgolas M., Renedo G., Carnes J. et Sastre J.; 2004; Hypersensitivity pneumonitis caused by triglycidyl isocyanurate; Allergy, 59(10), p. 1128 (en anglais seulement).
Quirce S. et Sastre J.; 2011; New causes of occupational asthma; Current Opinion in Allergy and Clinical Immunology, 11(2), p. 80-85 (en anglais seulement).
Santé Canada; 1998; Exposure factors for assessing total daily intake of priority substances by the general population of Canada; rapport non publié; Ottawa (ON) : Santé Canada, Direction de l’hygiène du milieu (en Anglais seulement).
Santé Canada; 2013; Document d’orientation provisoire sur l’évaluation des risques pour la santé humaine associés à une exposition de courte durée aux substances cancérogènes présentes dans les sites contaminés [PDF]; Ottawa (ON), gouvernement du Canada [consulté le 19 juin 2017].
Santé Canada; [modifié le 14 décembre 2015]; Liste critique des ingrédients de cosmétiques : liste des ingrédients dont l'usage est interdit dans les cosmétiques; Ottawa (ON), Santé Canada, Direction de la sécurité des produits de consommation [consulté le 29 mai 2016].
Santé Canada; 2016; Document sur l’approche scientifique – Approche fondée sur le seuil de preoccupation toxicologique (SPT) pour certaines substances; Ottawa (ON) : gouvernement du Canada.
Sastre J., Carnes J., Garcia del Potro M., Manso L., Aguado E. et Fernandez-Nieto M.; 2011; Occupational asthma caused by triglycidyl isocyanurate; Int. Arch. Occup. Environ. Health, 84(5), p. 547‑549 (en anglais seulement).
Shell Chemical Company; 1956; The toxicology of glycidol and some glycidyl ethers; Microfiche No: OTS0523687, New Doc ID: 40-5640496, Old Doc ID: 42051 B3-206 (en anglais seulement).
Shell Oil Company; 1984; Toxicity of fine chemicals: genotoxicity studies with allyl glycidyl ether with cover letter dated 103086; Microfiche No. OTS0513375, New Doc ID: 86870000029 (en anglais seulement).
Shell Oil Company; 1991; Initial submission: histopathologic evaluation of tissues and organs from rats on a twenty-eight day oral toxicity evaluation of G23-09 (draft report) w-cover letter dated 102291; Microfiche No: OTS0535219, New Doc ID: 88-920000035, Old Doc ID: 8EHQ-1091-1389 (en anglais seulement).
Sikov M.R., Cannon W.C., Carr D.B. et Miller R.A.; 1986; Reproductive toxicology of inhaled styrene oxide in rats and rabbits; Journal of Applied Toxicology, 6(3), p. 155-164 (en anglais seulement).
Society of the Plastics Industry Inc.; 1997a; Alkyl glycidyl ether: 2-week range finding and 13-week repeated dose dermal toxicity study in fischer 344 rats, with cover letter dated 10/29/97; Microfiche No: OTS0558896, New Doc ID: 44645, Old Doc ID: 42185 F1-18 44645 (en anglais seulement).
Society of the Plastics Industry Inc.; 1997b; Alkyl glycidyl ether: 13-week neurotoxicity study in fischer 344 rats, with cover letter dated 2/12/1998; Microfiche No: OTS0559329, New Doc ID: 44647, Old Doc ID: 42185 F1-021 44647 (en anglais seulement).
Society of the Plastics Industry Inc.; 1997c; Final report, bacterial reverse mutation assay with an independent repeat assay of alkyl glycidyl ether, with cover letter dated 11/18/97; Microfiche: OTS0558898. New Doc ID: 44645. Old Doc ID: 42185 F1-19 44645. (en anglais seulement)
Society of the Plastics Industry Inc.; 1997d; Final report, micronucleus cytogenetic assay in mice of alkyl glycidyl ether, with cover letter dated 5/16/97; Microfiche No: OTS0558882, New Doc ID: 44641, Old Doc ID: 42185 F1-16 44641 (en anglais seulement).
Society of the Plastics Industry Inc.; 1998; Final report, in vitro mammalian cell gene mutation test with independent repeat assay (alkyl glycidyl ether), with cover letter dated 3/18/1998; Microfiche No: OTS0559330, New Doc ID: 44648, Old Doc ID: 42185 F1-022 44648 (en anglais seulement).
Sparks L.E., Tichenor B.A., Chang J. et Guo Z.; 1996; Gas-phase mass transfer model for predicting volatile organic compound (VOC) emission rates from indoor pollutant sources; Indoor Air, 6, p. 31-30 (en anglais seulement).
Stofberg J. et Grundschober F.; 1987; Consumption Ratio and Food Predominance of Flavouring Materials; Perfumer and Flavorist, 12 (4), p. 27 (en anglais seulement).
[TDS] Technical Data Sheet; 2010; ULTRABOND G21 [PDF]; Laval (QC) : Mapei Inc. [consulté le 30 mai 2017] (en anglais seulement).
[TDS] Technical Data Sheet; 2012; EPOXYSHIELD [PDF]; Vernon Hills (IL) : Rust-Oleum Corperation [consulté le 2 avril 2017] (en anglais seulement).
Terrill J.B., Lee K.P., Culik R. et Kennedy G.L.; 1982; The inhalation toxicity of phenylglycidyl ether: reproduction, mutagenic, teratogenic, and cytogenetic studies; Toxicology and Applied Pharmacology, 64(2), p. 204-212 (en anglais seulement).
Tosti A., Guerra L., Vincenzi C. et Peluso A.M.; 1993; Occupational skin hazards from synthetic plastics. Toxicology and Industrial Health, 9(3); p. 493-502 (en anglais seulement).
Van Duuren; 1967; Carcinogenic epoxides, lactones and halo-ethers and their mode of action; Annals of the New York Academy of Sciences, 163(2), p. 633-651 (en anglais seulement).
Van Duuren B.L., Nelson N., Orris L., Palmes E.D. et Schmitt F.L.; 1963; Carcinogenicity of epoxides, lactones and peroxy compounds; Journal of the National Cancer Institute, 31(1), p. 41-55 (en anglais seulement).
von der Hude W., Seelbach A. et Basler A.; 1990; Epoxides: comparison of the induction of SOS repair in Escherichia coli PQ37 and the bacterial mutagenicity in the Ames test; Mutation Research, 231(2), p. 205-218 (en anglais seulement).
von der Hude W., Carstensen S. et Obe G.; 1991; Structure-activity relationships of epoxides: induction of sister chromatid exchanges in Chinese hamster V79 cells; Mutation Research, 249(1), p. 55-70 (en anglais seulement).
Wade M.J., Moyer J.W. et Hine C.H.; 1979; Mutagenic action of a series of epoxides; Mutation Research, 66(4), p. 367-371 (en anglais seulement).
Weil C.S., Condra N., Haun C. et Striegel J.A.; 1963; Experimental carcinogenicity and acute toxicity of representative epoxides; American Industrial Hygiene Association Journal, 24(4), p. 305-325 (en anglais seulement).
Wormuth M., Scheringer M., Vollenweider M. et Hungerbuhler K.; 2006; What are the sources of exposure to eight frequently used pthalic acid esters in Europeans?; Risk Anal., 26(3), p. 803-824 (en anglais seulement).
Wigger-Alberti W., Hofmann M. et Elsner P.; 1997; Contact dermatitis caused by triglycidyl isocyanurate; American Journal of Contact Dermatitis, 8(2), p. 106-107 (en anglais seulement).
Yoon J.S., Mason J.M., Valencia R., Woodruff R.C. et Zimmering S.; 1985; Chemical mutagenesis testing in drosophila. IV. Results of 45 coded compounds tested for the National Toxicology Program; Environmental Mutagenesis, 7(3), p. 349-367 (en anglais seulement).
Zissu D.; 1995; Histopathological changes in the respiratory tract of mice exposed to ten families of airborne chemicals; Journal of Applied Toxicology, 15(3), p. 207-213 (en anglais seulement).
Annexe A. Facteurs pris en compte pour l’identification d’analogues pertinents
| Facteur | Justification |
|---|---|
| 1. Structure chimique. L’accent a été mis sur les analogues avec un cycle benzénique. Le cycle benzénique peut ou non être substitué par un groupe alkyle à chaîne courte, mais il doit être substitué par un groupe oxiranylméthoxy ou époxyde. | Les analogues qui ont une structure chimique similaire devraient avoir des profils de toxicité similaires. |
| 2. Métabolites similaires (prévus ou observés). La métabolisation de l’o-CGE se produit principalement par conjugaison GSH ou hydrolyse de l’époxyde. Chez le rat, le métabolite de la conjugaison GSH est l’acide mercapturique de l'éther d’o-crésol et de glycidyle. Le métabolite issu de l’hydrolyse de l’époxyde est un métabolite de type 1,2‑diol, qui subit ensuite des réactions d’oxydation. | Les analogues métabolisés par des voies similaires en des produits de dégradation similaires devraient avoir des profils de toxicité similaires. |
| 3. Alertes structurales communes | Les analogues présentant des alertes structurales similaires devraient avoir une plus grande similarité en termes de toxicité. |
| 4. Propriétés physico-chimiques similaires. L’accent a été mis sur les structures chimiques de masses moléculaires, de solubilité dans l’eau, de pression de vapeur et de log Koe similaires. | Les analogues ayant des propriétés physico-chimiques similaires peuvent potentiellement avoir des profils de toxicité similaires. |
Les analogues oxyde de méthylphényle et d’oxiranylméthyle (OMPOM, n° CAS 26447-14-3), oxyde de phényle et d’oxiranylméthyle (OPOM, n° CAS 122-60-1) et phényloxirane (PO, n° CAS 90-96-03) ont été retenus en raison de leur similarité avec l’o-CGE pour ce qui est de la structure chimique, des propriétés physicochimiques, de la réactivité et de la toxicocinétique. L’OMPOM a la plus grande similarité avec l’o-CGE et les données disponibles associées à cette substance ont été utilisées en premier. L’OMPOM est un mélange racémique de différents isomères de l’o-CGE, le groupe méthyl étant situé à différentes positions du noyau benzénique par rapport à l’entité oxiranylméthoxy. L’o-CGE était considéré comme l’isomère prédominant produit dans ces mélanges (Gardiner et coll. 1992). Toutefois, en l’absence de données sur l’OMPOM, les données sur la toxicité de l’analogue OPOM ont été prises en compte. L’OPOM et l’o-CGE ne diffèrent que par la présence ou l’absence d’un seul groupe méthyle sur le noyau benzénique. De plus, il existe des preuves indiquant que l’OPOM et l’o-CGE sont métabolisés par des voies similaires (de Rooij et coll. 1998). Lorsque des données sur l’OPOM n’étaient pas disponibles, des données sur l’analogue le plus proche suivant (c.-à-d. le PO) ont été utilisées pour combler le manque de données. Le PO et l’o-CGE diffèrent par la présence ou l’absence d’un groupe méthyle sur le noyau benzénique et d’un groupe oxyde séparant le noyau benzénique de l’entité époxyde.
Annexe B. Propriétés physico-chimiques de l’o-CGE et de ses analogues
| Paramètre | Phényloxirane n° CAS : 96-09-3 | Oxyde de phényle et d’oxiranylméthyle n° CAS : 122-60-1 | Éther d’o-crésol et de glycidyle n° CAS : 2210-79-9 | Oxyde de méthylphényle et d’oxiranylméthyle n° CAS : 26447-14-3 |
|---|---|---|---|---|
| MM (g/mol) | 120,15 | 150,18 | 164,20 | 165,21 |
| Pression de vapeur (mm Hg) | 0,58b | 4,36 x 10-4b | 6,2x10-3b | 0,13a |
| Constante de Henry (atm·m3/mol) | 1,78 x 10-5a | 2,16 x 10-5a | -6,1 | 5,29 x 10-4a |
| Solubilité dans l’eau (mg/L) | 3 000b | 3 172a | 840b | 5,64 x 10-3a |
| log Koe (sans dimension) | 1,59-1,61a | 1,61-1,74a | 2,5b | 3,37a |
a Valeur estimée par logiciel (p. ex., EpiSuite c2000-2012).
b Valeur expérimentale.
Annexe C. Exposition potentielle estimée des humains aux substances du groupe des époxydes et des éthers glycidyliques
Des scénarios d’exposition ont été utilisés pour estimer l’exposition potentielle aux substances du groupe des époxydes et des éthers glycidyliques. Les hypothèses faites pour ces scénarios sont résumées dans le tableau C-1. Les expositions ont été estimées en utilisant ConsExpo Web ou des algorithmes du modèle (ConsExpo 2006, ConsExpo Web 2016), sauf indication contraire. Un facteur de rétention (FR) global de 1 a été utilisé, sauf indication contraire.
Les expositions ont été estimées pour différents groupes d’âge basés sur le poids corporel (pc), tirés des facteurs d’exposition de Santé Canada pour la population générale du Canada (Santé Canada 1998).
Adultes (de 20 à 59 ans) : 70,9 kg
| Substance | Scénario d’exposition | Hypothèses |
|---|---|---|
o-CGE | Adhésif époxyde pour revêtement de sol | Modèle : ConsExpo Web (2016) Modèle d’inhalation : exposition à la vapeur, évaporation C : 2,5 % (FSS 2017) F : 0,25 par an Durée de l’exposition (min) : 75 Quantité de produit (kg) : 10 (TDS 2010) Volume de la pièce (m3) : 58 Taux de renouvellement (/heure) : 0,5 Vitesse d’inhalation; 1,0 m3/h Coefficient de transfert de masse (m/h) : 2,10a (Sparks et coll. 1996, cité dans McCready & Fontaine 2010) Matrice de la masse moléculaire : 3000 g/mol Surface de rejet (m2) : 4 Modèle cutané : Superficie exposée (cm2) : 110 Taux de contact (mg/min) : 30 Durée de l’application (min) : 75 Absorption cutanée : 1 |
o-CGE | Revêtement de sol époxyde | Modèle : ConsExpo Web (2016) Modèle d’inhalation : exposition à la vapeur, évaporation C : 2,5 % (FSS 2015a) F : 0,33/an Quantité de produit : 4850 g (TDS 2012) Durée de l’exposition : 135 min Quantité de produit (kg) : 4,85 Volume de la pièce : 34 m3 Taux de renouvellement : 2/heure Absorption par inhalation de 100 % Vitesse d’inhalation; 1,53 m3/h Coefficient de transfert de masse (m/h) : 1,55a (Sparks et coll. 1996, cité dans McCready & Fontaine 2010) Matrice de la masse moléculaire : 3000 g/mol Surface de rejet (m2) : 23 Modèle cutané : Surface exposée : 228 cm2 (moitié d’une main) Vitesse de contact : 30 mg/min Durée de l’application : 120 min Absorption cutanée : 1 |
o-CGE | Revêtement/scellant époxyde à deux composants | Modèle : ConsExpo Web (2016) Modèle d’inhalation : exposition à la vapeur, évaporation C : 15 % (FSS 2015b) F : 1/an Quantité de produit (g) : 400 Durée de l’exposition (min) : 132 (B) Volume de la pièce (m3) : 20 Taux de renouvellement : 0,6/heure Absorption par inhalation de 100 % Vitesse d’inhalation : 1,53 m3/h Coefficient de transfert de masse (m/h) : 2,64a (Sparks et coll. 1996, cité dans McCready & Fontaine 2010) Matrice de la masse moléculaire : 3000 g/mol Surface de rejet (m2) : 0,5 Modèle cutané : Surface exposée (cm2) : 228 Vitesse de contact (mg/min) : 30 Durée de l’application (min) : 30 Absorption cutanée : 1 |
o-CGE | Résine pour l’art, l’artisanat et le bricolage | Modèle : ConsExpo Web (2016) C : 15 % F : 52/an Quantité de produit : 205 g Modèle d’inhalation : exposition à la vapeur, évaporation Durée de l’exposition (min) : 240 Quantité de produit (g) : 205 Volume de la pièce (m3) : 20 Taux de renouvellement : 0,6/heure Absorption par inhalation de 100 % Vitesse d’inhalation : 1,53 m3/h Coefficient de transfert de masse (m/h) : 4,93a (Sparks et coll. 1996, cité dans McCready & Fontaine 2010) Matrice de la masse moléculaire : 3000 g/mol Surface de rejet (cm2) : 178 Modèle cutané : Surface exposée : 2 cm2 (extrémité des doigts) Quantité de produit (g) : 0,05 Absorption cutanée : 1 |
AGE C12-C13 | Adhésif époxyde à deux composants | Modèle : ConsExpo Web (2016) C : 2,5 % Quantité de produit (g) : 20 Modèle d’inhalation : exposition à la vapeur, évaporation Durée de l’exposition (min) : 240 Volume de la pièce (m3) : 20 Taux de renouvellement : 0,6/heure Absorption par inhalation de 100 % Vitesse d’inhalation : 1,53 m3/h Coefficient de transfert de masse (m/h) : 3,22a (Sparks et coll. 1996, cité dans McCready & Fontaine 2010) Matrice de la masse moléculaire : 3000 g/mol Surface de rejet (m2) : 0,05 Modèle cutané : Surface exposée (cm2) : 43 Quantité de produit (g) : 0,1 |
AGE C12-C13 | Matière de charge époxyde en tube | Modèle : ConsExpo Web (2016) C : 5 % Quantité de produit : 40 g Modèle d’inhalation : exposition à la vapeur, évaporation Durée de l’exposition (min) : 240 Volume de la pièce (m3) : 20 Taux de renouvellement : 0,6/heure Absorption par inhalation de 100 % Vitesse d’inhalation : 1,53 m3/h Coefficient de transfert de masse (m/h) : 3,79a (Sparks et coll. 1996, cité dans McCready & Fontaine 2010) Matrice de la masse moléculaire : 3000 g/mol Surface de rejet (m2) : 0,012 Modèle cutané : Superficie exposée : 228 cm2 (moitié d’une main) Quantité de produit (g) : 0,05 |
AGE C12-C13 | Revêtement avec résine de faible viscosité | Modèle : ConsExpo Web (2016) Modèle d’inhalation : exposition à la vapeur, évaporation C : 30 % F (par année) : 0,33 Quantité de produit (g) : 220 Durée de l’exposition (min) : 240 Volume de la pièce (m3) : 34 Taux de renouvellement : 0,6/heure Absorption par inhalation de 100 % Vitesse d’inhalation : 1,53 m3/h Coefficient de transfert de masse (m/h) : 1,78a (Sparks et coll. 1996, cité dans McCready & Fontaine 2010) Matrice de la masse moléculaire : 3000 g/mol Surface de rejet (m2) : 2 Modèle cutané : Superficie exposée : 228 cm2 Vitesse de contact (mg/min) : 30 Durée de l’application (min) : 30 Absorption cutanée : 1 |
BCPO | Exposition cutanée – lotion/crème/hydratant pour le corps | C : < 0,2 ppm (ECCC 2016b) F : 1,1/j pour les adultes (Loretz et coll. 2006), 1,7/j pour les nourrissons (Wormuth et coll. 2006) Quantité de produit par application (moyenne) : 4,4 g pour les adultes (Loretz et coll. 2005) et 1,4 g pour les nourrissons (Wormuth et coll. 2006) Absorption cutanée ( %) : 100 |
BCPO | Exposition par inhalation à un parfum en aérosol | Modèle : ConsExpo Web (2016) C : < 0,2 ppm (ECCC 2016b) Durée de l’exposition : 5 min Masse rejetée : 0,5 g Volume de la pièce : 10 m3 Vitesse d’inhalation : 1,53 m3/h Taux de renouvellement : 0 |
a Estimation basée sur une longueur caractéristique présumée égale à la racine carrée de la superficie du rejet pour chaque scénario.
Absorption journalière moyenne à vie (AJMV)
L’AJMV a été calculée pour estimer l’exposition à l’o-CGE pendant la vie due à son utilisation dans une résine pour l’art, l’artisanat ou le bricolage, tirée de Canada 2013. L’hypothèse que les adultes seront exposés au produit pendant 50 ans est considérée prudente, et la caractérisation du risque est considérée protectrice pour les expositions pouvant survenir chez des individus de moins de 20 ans.
L’équation est la suivante :
AJMV = [(ESJnourrissons × DAnourrissons) + (ESJtout-petits × DAtout-petits) + (ESJenfants × DAenfants) + (ESJadolescents × DAadolescents) + (ESJadultes × DAadultes)] / [DVM]
avec :
ESJ = exposition systémique journalière
Durée de vie moyenne (DVM) = 70 ans
Durée du groupe d’âge (DA) = 50 ans pour les adultes (de 20 ans et plus)
Annexe D. Modélisation de la concentration de référence à partir des données d’une étude de 2 ans sur les effets cancérogènes d’une exposition à l’AGE chez le rat (Lee et coll. 1983)
La modélisation de la concentration de référence (CR) a été réalisée au moyen du logiciel Benchmark Dose Software (BMDS, version 2.5) de l’EPA. Les résultats de 10 modèles disponibles dans le logiciel sont présentés dans le tableau D-1. Un modèle d’ajustement optimal a été choisi en fonction de la valeur p, de l’échelle des résidus, de la valeur du critère d’information d’Akaike (CIA) et de l’examen visuel de l’ajustement du modèle. Les modèles LogLogistic, LogProbit et Weibull ont donné un ajustement optimal avec des résidus à l’échelle de 0, des CIA comparables et un examen visuel. Par mesure de prudence, le modèle LogProbit a été choisi parce qu’il fournit l’estimation la plus basse de la CRL (11,4 ppm).
| Nom du modèle | CIA | Valeur P | CR | CRL | Résidus à l’échelle pour le groupe de concentrations près de la CR |
|---|---|---|---|---|---|
| Gamma | 112,146 | S.O. | 13,0155 | 11,5035 | 0,001 |
| Logistic | 110,451 | 0,266 | 13,2218 | 11,7009 | 0,014 |
| LogLogistic | 112,146 | S.O. | 12,6436 | 11,5315 | 0 |
| LogProbit | 112,146 | S.O. | 13,3094 | 11,4026 | 0 |
| Cancer – multistade | 112,186 | 0,1567 | 18,4445 | 11,8606 | 0,294 |
| Cancer – multistade | 110,323 | 0,3032 | 14,2987 | 11,4782 | 0,025 |
| Cancer – multistade | 110,161 | 0,3218 | 13,4565 | 11,5492 | 0,002 |
| Probit | 110,52 | 0,2562 | 13,5611 | 11,6255 | 0,022 |
| Weibull | 112,146 | S.O. | 12,6217 | 11,5511 | 0 |
| Quantal-Linear | 112,186 | 0,1567 | 18,4445 | 11,8606 | 0,294 |
S.O. = sans objet. Les valeurs P associées à ces modèles étaient égales à 1 ou proches.
