Évaluation préalable Oxydes d’éthane-1,2-dio
Numéros de registre du chemical abstracts service
110-71-4, 111-46-6, 111-90-0, 112-07-2, 112-27-6, 112-34-5, 112-60-7
Environnement et Changement climatique Canada
Santé Canada
Août 2018
No de cat. : En14-329/2018F-PDF
ISBN 978-0-660-27545-1
Table des matières
- Sommaire
- 1. Introduction
- 2. Identité des substances
- 3. Propriétés physiques et chimiques
- 4. Sources
- 5. Utilisations
- 6. Potentiel d'effets nocifs sur l'environnement
- 7. Potentiel d'effets nocifs sur la santé humaine
- 7.1 Évaluation de l'exposition
- 7.2 Évaluation des effets sur la santé
- 7.3 Caractérisation des risques pour la santé humaine
- 7.3.1 Caractérisation des risques pour la santé humaine posés par les substances du sous-groupe des éthane-1,2-diols
- 7.3.2 Caractérisation des risques pour la santé humaine posés par les substances du sous-groupe des oxydes d'éthane-1,2-diol
- 7.3.3 Caractérisation des risques pour la santé humaine posés par le 1,2 diméthoxyéthane
- 7.4 Incertitudes de l'évaluation des risques pour la santé humaine posés par les oxydes d'éthane-1,2-diol
- 8. Conclusion
- Références
- Annexes
Liste des tableaux
- Tableau 2-1. Identités des substances de type oxyde d'éthane-1,2-diol
- Tableau 2-2. Sous-groupes du groupe des substances de type oxyde d'éthane-1,2-diol
- Tableau 2-3. Identité des analogues et disponibilité des données croisées utilisées pour la présente évaluation
- Tableau 3-1. Gamme des propriétés physiques et chimiques des éthane-1,2-diols
- Tableau 3-2. Gamme des propriétés physiques et chimiques des oxydes d'éthane-1,2-diol
- Tableau 3-3. Gamme des propriétés physiques et chimiques du 1,2-diméthoxyéthane
- Tableau 4-1. Résumé des quantités des substances du groupe des oxydes d'éthane-1,2-diol produites ou importées au Canadaa
- Tableau 5-1. Résumé des renseignements non confidentiels sur les utilisations au Canada des substances des sous-groupe EG et EGE
- Tableau 6-1. Résultats de la classification des risques écologiques posés par les substances du groupe des oxydes d'éthane-1,2-diol
- Tableau 7-1. Résumé des valeurs de l'absorption dermale pour les substances du groupe des EGE
- Tableau 7-2. Résumé des estimations de l'exposition dermale d'un adulte aux éthane 1,2 diols et aux oxydes d'éthane-1,2-diol due à l'utilisation de cosmétiques, de produits de santé naturels ou de drogues sans ordonnance
- Tableau 7-3. Résumé des estimations des expositions dermales aiguës d'un adulta aux éthane-1,2-diols et aux oxydes d'éthane-1,2-diol dues à l'utilisationde cosmétiques
- Tableau 7-4. Résumé des estimations des expositions par voie dermale et atmosphérique d'un adulte aux éthane-1,2-diols et aux oxydes d'éthane-1,2-diol dues à l'utilisationnde peintures et revêtements
- Tableau 7-5. Expositions estimées au DEGEE et au DEGBE dues à la mise en bouche de jouets pains par des enfants (Hansen et Pederson 2005)
- Tableau 7-6. Concentrations dans l'air moyennes sur 24 heures et 6 heures dues à l'utilisation d'assainisseurs d'air
- Tableau 7-7. Exposition dermale estimée et concentration dans l'air des oxydes d'éthane 1,2-diol dues à l'utilisation de produits de mettoyage domestiques
- Tableau 7-8. Valeurs des paramètres critiques mises à jour pour le DEGBE
- Tableau 7-9. Exposition pertinente et danger pour le DEG, et ME résultante
- Tableau 7-10. Exposition pertinente et danger pour le TEG, et ME résultante
- Tableau 7-11. Exposition pertinente et danger pour le TTEG, et ME résultante
- Tableau 7-12. Exposition pertinente et danger pour le DEGEE, et ME résultante
- Tableau 7-13. Exposition pertinente et danger pour l'EGBEA, et ME résultante
- Tableau 7-14. Exposition pertinente et danger pour le DEGBE, et ME résultante
- Tableau 7-15. Exposition pertinente et danger pour le 1,2-diméthoxyéthane et son métabolite, le 2-ME, ainsi que la ME résultante
- Tableau 7-16. Sources d'incertitude de la caractérisation des risques
Liste des figures
Résumé
En vertu des articles 68 ou 74 de la Loi canadienne sur la protection de l’environnement 1999 (LCPE), les ministres de l’Environnement et de la Santé ont procédé à une évaluation préalable de sept des neuf substances désignées ci-après sous le terme « Groupe des oxydes d’éthane-1,2-diol » dans le cadre du Plan de gestion des produits chimiques. Ces sept substances font partie de celles identifiées comme d’intérêt prioritaire pour une évaluation, car elles satisfont aux critères de catégorisation du paragraphe 73(1) de la LCPE ou présentent d’autres préoccupations pour la santé humaine. Deux des neuf substances ont été déterminées peu préoccupantes en suivant d’autres approches, et les décisions proposées pour ces substances sont fournies dans des rapports distinctsNote de bas de page 1 . En conséquence, la présente évaluation préalable vise les sept substances mentionnées dans le tableau ci-après.
| N° CASa | Nom sur la Liste intérieure (LI) |
Nom(s) commun(s) | Acronyme |
|---|---|---|---|
| 110-71-4b | 1,2-Diméthoxyéthane | 1,2-Diméthoxyéthane | EGDME |
| 111-46-6 | 2,2'-Oxydiéthanol | 3-Oxapentane-1,5-diol ou 2,2'-oxybiséthanol | DEG |
| 112-27-6 | 2,2'-(Éthylènedioxy)diéthanol | 3,6-Dioxaoctane-1,8-diol ou 2,2'-(éthane-1,2-dioxy)biséthanol | TEG |
| 112-60-7 | 3,6,9-Trioxaundécane-1,11-diol | 3,6,9-Trioxaundécane-1,11-diol | TTEG |
| 111-90-0 | 2-(2-Éthoxyéthoxy)éthanol | 3,6-Dioxaoctane-1-ol ou 2-(2-éthoxyéthoxy)éthanol | DEGEE |
| 112-07-2 | Acétate de 2-butoxyéthyle | Acétate de 2-butoxyéthyle | EGBEA |
| 112-34-5 | 2-(2-Butoxyéthoxy)éthanol | 3,6-Dioxadécane-1-ol ou 2-(2-butoxyéthoxy)éthanol | DEGBE |
a Le numéro de registre Chemical Abstracts Service (no CAS) est la propriété de l’American Chemical Society et toute utilisation ou redistribution, sauf quand cela est requis pour des exigences réglementaires et/ou pour des rapports au gouvernement du Canada quand l’information et les rapports sont requis en vertu d’une loi ou d’une politique administrative, est interdite sans autorisation écrite préalable de l’American Chemical Society.
b Cette substance n’a pas été identifiée en vertu du paragraphe 73(1) de la LCPE, mais est visée par la présente évaluation préalable, car elle est considérée comme d’intérêt prioritaire en raison d’autres préoccupations ayant trait à la santé humaine.
Au Canada, les substances du groupe des oxydes d’éthane-1,2-diol sont utilisées dans une variété de produits, notamment dans les cosmétiques et les médicaments sans ordonnance, les peintures et les revêtements, les assainisseurs d’air, ainsi que dans les adhésifs, les piles et les textiles.
Toutes les substances de ce groupe sont importées au Canada en quantités allant de 100 à 10 000 000 kg/an. Quatre de ces sept substances (TTEG, DEGEE, EGBEA et DEGBE) sont produites au Canada en quantités allant de 1 000 à 10 000 000 kg/an. Aux États-Unis, les quantités produites de ces substances vont de 10 000 000 à 450 000 000 kg/an.
Les risques pour l’environnement posés par les sept substances du groupe des oxydes d’éthane-1,2-diol ont été caractérisés au moyen de la Classification des risques écologiques des substances organiques (CRE). La CRE est une approche basée sur les risques, qui tient compte de plusieurs paramètres liés au danger et à l’exposition et basés sur une pondération des plusieurs éléments de preuve pour déterminer la classification du risque. Les profils de danger sont établis principalement en se basant sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Parmi les paramètres pris en compte pour les profils d’exposition, on retrouve la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Une matrice de risques est utilisée pour assigner aux substances un potentiel de préoccupation faible, moyen ou élevé, basé sur leurs profils de danger et d’exposition. La CRE a permis de déterminer que les sept substances du groupe des oxydes d’éthane-1,2-diol ont un faible potentiel d’effets nocifs sur l’environnement.
En tenant compte de tous les éléments de preuve disponibles contenus dans la présente évaluation préalable, nous avons déterminé que les sept substances du groupe des oxydes d’éthane‑1,2-diol posent un faible risque d’effets nocifs sur l’environnement. Il a été conclu que les sept substances du groupe des oxydes d’éthane-1,2-diol ne satisfont à aucun des critères de l’alinéa 64a) ou 64b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique ou à mettre en danger l’environnement essentiel pour la vie.
Pour l’évaluation des risques pour la santé humaine, les sept substances de ce groupe ont été séparées en 3 sous-groupes : éthane-1,2-diols, oxydes d’éthane-1,2-diol et glymes. Nous avons déterminé que les milieux de l’environnement et les aliments ne représentent pas des sources significatives d’exposition pour les Canadiens. Pour les éthane-1,2-diols et les oxydes d’éthane-1,2-diols, les estimations d’exposition ont été faites en se basant sur les niveaux de ces substances dans des produits de consommation, comme les produits cosmétiques et les médicaments sans ordonnance, les peintures et les revêtements et des produits nettoyants domestiques. Pour le 1,2‑diméthoxyéthane, les estimations d’exposition sont basées sur les niveaux dans l’air intérieur et dans les assainisseurs d’air.
Les effets nocifs pour la santé humaine n’ont pas été observées lors des études de laboratoire mettant en cause de fortes doses d’oxydes d’éthane-1,2-diol, les organes cibles étant le foie et les reins. Pour certaines de ces substances (DEGEE, EGBEA et DEGBE), les effets hémolytiques observés dans des études de laboratoire ne sont pas utiles pour la santé humaine, les humains étant bien moins sensibles à de tels effets. Dans le cas du 1,2‑diméthoxyéthane, des effets sur le développement sont observés dans des études de laboratoire à des doses inférieures à celles des autres substances du groupe des oxydes d’éthane-1,2-diol, avec également des effets sur les testicules, le sang, le thymus et les surrénales.
Pour tous les sous-groupes, en se basant sur les estimations d’exposition à des produits utilisés par des consommateurs et les niveaux d’effet critique identifiés, nous avons déterminé que les marges sont adéquates pour tenir compte des incertitudes des bases de données sur l’exposition et les effets sur la santé
En nous basant sur les renseignements présentés dans la présente évaluation préalable, il est conclu que les sept substances du groupe des oxydes d’éthane-1,2-diol ne satisfont à aucun des critères de l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est conclu que les sept substances du groupe des oxydes d’éthane-1,2-diol visées par la présente évaluation préalable ne satisfont à aucun des critères de l’article 64 de la LCPE.
1. Introduction
En vertu des articles 68 et 74 de la Loi canadienne sur la protection de l’environnement 1999 (LCPE), les ministres de l’Environnement et de la Santé ont fait l’évaluation préalable de substances afin de déterminer si elles posent ou peuvent poser un risque pour l’environnement ou la santé humaine. Les sept substances visées par la présente évaluation préalable font partie d’un groupe de neuf substances dénommé groupe des oxydes d’éthane‑1,2‑diol. Elles ont été identifiées comme d’intérêt prioritaire pour une évaluation, car elles satisfont aux critères de catégorisation du paragraphe 73(1) de la LCPE (ECCC, SC [modifié en 2007]) ou ont été jugées prioritaires en raison d’autres préoccupations ayant trait à la santé humaine.
Deux autres substances, l’oxyde de bis(2-méthoxyéthyle) et le 1,2-bis(2‑méthoxyéthoxy)éthane (nos CASNote de bas de page 2 111-96-6 et 112-49-2 respectivement), ont été évaluées dans les documents d’évaluation scientifique intitulés Classification du risque écologique (CRE) des substances organiques et Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances (ECCC 2016a; Santé Canada 2016b) et ont été déclarées peu préoccupantes pour la santé humaine ou l’environnement. Par conséquent, ces substances ne seront donc plus prises en compte dans la présente évaluation. Les conclusions proposées pour ces deux substances sont données dans les documents intitulés Substances jugées peu préoccupantes compte tenu de l’ébauche d’évaluation préalable réalisée à l’aide de la Classification du risque écologique des substances organiques et Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances.
Les risques pour l’environnement posés par les sept substances du groupe des oxydes d’éthane-1,2-diol ont été caractérisés au moyen de la Classification des risques écologiques posés par les substances organiques (CRE) (ECCC 2016a). Pour la CRE, on décrit les risques posés par une substance en utilisant des paramètres clés parmi lesquels le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau alimentaire, la biodisponibilité et l’activité chimique et biologique. Elle tient compte de l’exposition possible des organismes dans des environnements terrestres ou aquatiques, basée sur des facteurs incluant les taux d’émission potentiels, la persistance globale et le potentiel de transport atmosphérique à grande distance. Les divers éléments de preuve sont combinés afin d’identifier les substances nécessitant une évaluation plus poussée de leur potentiel d’effets nocifs sur l’environnement ou présentant une faible probabilité d’effets nocifs sur l’environnement.
Les substances du groupe des oxydes d’éthane-1,2-diol ont fait l’objet d’examens au niveau international dans le cadre de différents programmes tels que le Programme coopératif d’évaluation des produits chimiques de l’Organisation pour la coopération et le développement économiques (OCDE) et de la Commission européenne (un certain nombre d’évaluations sont disponibles). Ces évaluations sont soumises à un processus d’examen et d’acceptation rigoureux par des autorités gouvernementales internationales. Environnement et Changement climatique Canada et Santé Canada sont des participants actifs à ce processus et considèrent que ces évaluations sont fiables. Les données de ces évaluations ont été utilisées pour étayer la caractérisation des effets sur la santé des substances du groupe des oxydes d’éthane-1,2-diol.
Pour la présente évaluation préalable, nous avons pris en compte des renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et l’exposition, y compris des renseignements soumis par des parties intéressées. Des données pertinentes ont été identifiées jusqu’en avril 2016. Toutefois, des études ou des renseignements plus récents obtenus auprès de pairs nationaux ou étrangers ou dans le cadre de la consultation publique qui a suivi l’ébauche de l’évaluation préalable (voir ci-dessous) peuvent aussi être cités. Nous avons utilisé des données empiriques tirées d’études clés ainsi que des résultats de modélisation pour tirer nos conclusions. Quand ils étaient disponibles et pertinents, nous avons tenu compte de renseignements présentés dans des évaluations faites par d’autres administrations.
La présente évaluation préalable a été préparée par le personnel des programmes d’évaluation des risques de la LCPE travaillant à Santé Canada et Environnement et Changement climatique Canada. Elle inclut des intrants d’autres programmes de ces ministères. Des commentaires sur l’approche de CRE et les résultats ont été soumis par la Dre Jon Arnot (ARC Arnot Research and Consulting) et M. Geoff Granville (GCGranville Consulting Corp.). Le volet environnemental de la présente évaluation d’appui sur le document a fait l’objet d’un examen externe par des pairs. De plus, le document sur la CRE a été publié le 30 juillet 2016 et a fait l’objet d’une période de consultation publique de 60 jours. Des parties de la présente évaluation préalable ont fait l’objet d’un examen et/ou de consultations externes par des pairs. Bien que des commentaires de l’extérieur aient été pris en compte, Environnement et Changement climatique Canada et Santé Canada restent responsables du contenu final et des conclusions de la présente évaluation préalable.
La présente évaluation préalable est centrée sur des renseignements critiques afin de déterminer si les substances visées satisfont aux critères de l’article 64 de la LCPE. Elle examine les renseignements scientifiques et formule une conclusion en intégrant une approche basée sur le poids de la preuve et le principe de précaution.Note de bas de page 3 Nous présentons dans la présente évaluation préalable les renseignements critiques et les considérations à partir desquelles notre conclusion a été tirée.
2. Identité des substances
Les sept substances visées par la présente évaluation préalable appartiennent à un groupe plus large de substances chimiques connu sous le nom d'oxydes d'alcane-1,2-diol. La formule générale de ces composés est donnée à la figure 2-1. Les oxydes d'alcane-1,2-diol peuvent être divisés en sous-groupes basés sur la nature des groupes fonctionnels (R1 ou R2), le nombre d'unités alcane-1,2-diol, le nombre d'atomes de carbone dans la chaîne latérale de l'oxyde (R1 ou R2) ou le degré de ramification de R3 et R4 (Mangelsdorf et al. 2016). Les esters d'alcane-1,2-diol et d'acide acétique, appelés acétates d'oxyde d'alcane-1,2-diyle, sont également inclus dans ce groupe chimique (Mangelsdorf et al. 2016).
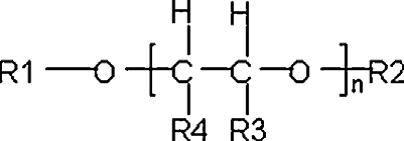
Longue description pour la figure 2-1
Formule générale des oxydes d'éthane1,2-diol, des esters d'éthane-1,2-diol et des dioxydes d'éthane-1,2-diol (tirée de Mangelsdorf et al. 2016)
Nous donnons dans le tableau 2-1 le numéro de registre du Chemical Abstracts Service (n° CASNote de bas de page 4), le nom sur la Liste intérieure (LI), le ou les noms communs et l'acronyme des substances individuelles du groupe des oxydes d'éthane-1,2-diol visées par la présente évaluation. Une liste d'autres noms chimiques (p. ex. noms commerciaux) est disponible auprès du National Chemical Inventories (NCI 2014).
Les sept substances visées par la présente évaluation préalable sont représentatives de trois sous-groupes différents : les éthane-1,2-diols (EG), les oxydes d'éthane-1,2-diol (EGE) et une substance du groupe des glymes (voir les tableaux 2-1 et 2-2).
| N° CAS (acronyme) |
Nom sur la LIS (nom commun)a |
Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 111-46-6 (DEG) |
2,2'-Oxydiéthanol (2,2'-oxybiséthanol) | 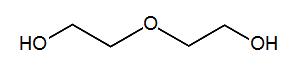 |
106,12 |
| 112-27-6 (TEG) |
2,2'-[Éthylènedioxy]diéthanol | ![2,2’-[Éthylènedioxy]diéthanol](/content/dam/eccc/migration/ese-ees/760C39A1-1144-4718-B8F7-29A31CC295A6/Triethylene-20Glycol.jpg.png) |
150,17 |
| 112-60-7 (TTEG) |
3,6,9-Trioxaundécane-1,11-diol | 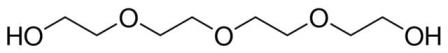 |
194,23 |
| 111-90-0 (DEGEE) |
2-(2-Éthoxyéthoxy)éthanol | 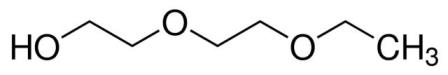 |
134,17 |
| 112-07-2 (EGBEA) |
Acétate de 2-butoxyéthyle | 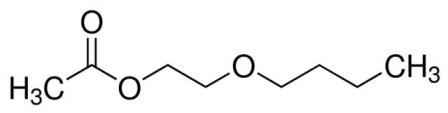 |
160,21 |
| 112-34-5 (DEGBE) |
2-(2-Butoxyéthoxy)éthanol |  |
162,23 |
| 110-71-4 (EGDME) |
1,2-Diméthoxyéthane | 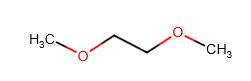 |
90,12 |
a ChemIDplus 1993 a,b,c,d,e,f,g
| Sousgroup | Composés chimiques | Groupes fonctionnels critiques | Gamme des masses moléculaires (g/mol) |
|---|---|---|---|
| Éthane-1,2-diols (n = 3) |
DEG, TEG, TTEG | Oxydes d'éthane-1,2-diol comportant 1, 2 ou 3 groupes oxyde d'alcane-1,2-diol avec deux groupes terminaux alcools | 106,12-194,23 |
| Oxydes d'éthane-1,2-diol (n = 3) |
DEGEE, EGBEA, DEGBE | Oxydes d'éthane-1,2-diol comportant 1 ou 2 groupes oxyde d'alcane-1,2-diol avec un groupe terminal alkyle à 2 ou 4 atomes de carbone et un groupe terminal alcool ou ester | 134,17-162,23 |
| Glymes (n=1) |
1,2-Diméthoxyéthane | Oxyde d'éthane-1,2-diol comportant deux unités dioxyde d'alcane-1,2-diol et deux groupes terminaux méthyles | 90,12 |
2.1 Sélection des analogues
Nous avons suivi une approche reposant sur des données croisées tirées d'analogues pour les évaluations ayant trait à la santé humaine. Les analogues ont été sélectionnés en fonction de similitudes structurelles et/ou fonctionnelles avec les substances du groupe visé (p. ex. basées sur des propriétés physico-chimiques ou de toxicocinétique), et pour lesquels on disposait de données empiriques pertinentes pouvant être utilisées pour obtenir des données croisées sur des substances pauvres en données. En plus de ces analogues, nous discutons de l'utilisation de données croisées d'une substance à une autre d'un même sous-groupe des éthane-1,2-diols dans les sections pertinentes du présent rapport (voir Évaluation des effets sur la santé du sous-groupe des éthane-1,2-diols). Nous donnons dans le tableau 2-3 ci-après une liste des analogues utilisés pour étayer notre évaluation, ainsi qu'une indication du potentiel des données croisées.
| No CAS de l’analogue | Nom sur la LIS/autre nom (nom commun) |
Structure chimique et formule moléculaire | Masse molé-culaire (g/mol) | Données sur la santé humaine | Substance cible pour l’analogue |
|---|---|---|---|---|---|
| 111-76-2a | 2-Butoxy-éthanol (EGBE: Ethylene glycol monobutyl ether) |
 C6H14O2 |
118,18 | Y | EGBEA (N° CAS 112-07-2)a |
| 109-86-4b | 2-Méthoxy-éthanol (2-ME) |
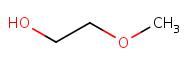 C3H8O2 |
76,09 | Yc | 1,2-Diméthoxyéthane (n° CAS 110-71-4)b |
a EGBE : structure chimique, formule moléculaire et masse moléculaire tirées de ChemIDplus 1993 h.
b 2-ME : structure chimique, formule moléculaire et masse moléculaire tirées de ChemIDplus 1993 i.
c Tel qu'indiqué dans la section Évaluation des effets sur la santé du 1,2-diméthoxyéthane, le 2-ME est en réalité un métabolite du 1,2-diméthoxyéthane chez des animaux de laboratoire.
3. Propriétés physiques et chimiques
Généralement, les oxydes d'alcane-1,2-diol sont des liquides semi-volatils à haut point d'ébullition, qui se comportent comme des solvants pour l'eau et de nombreux solvants organiques (Mangelsdorf et al. 2016). Les substances des sous-groupes EG, EGE et 1,2-diméthoxyéthane ont des points de fusion et d'ébullition, des densités, des masses moléculaires et des pressions de vapeur couvrant différentes gammes. De plus, le 1,2-diméthoxyéthane a une pression de vapeur plus élevée, un logarithme de coefficient de partage octanol-eau (Koe) et un point d'ébullition inférieurs à ceux des substances des deux autres sous-groupes, qui peuvent être dus en partie à sa masse moléculaire plus faible.
Nous donnons dans les tableaux 3-1, 3-2 et 3-3 un résumé des propriétés physiques et chimiques des substances du groupe des oxydes d'éthane-1,2-diol. On retrouvera les propriétés physico-chimiques des substances individuelles des sous-groupes EG et EGE dans le document de référence de Santé Canada (2016a). D'autres propriétés physiques et chimiques sont données dans le document ECCC 2016b.
| Propriété | Type de donnée | Valeur | Température (°C) | Référence |
|---|---|---|---|---|
| Forme physique | - | Liquide | 25 | - |
| Point de fusion (ºC) |
Expérimentale | -10 à -6,2 | s.o. |
Lide 2007 HSDB 2007b |
| Point d'ébullition (ºC) |
Expérimentale | 246 - 327,3 | s.o. |
Lide 2007 HSDB 2007b |
| Densité (sans dimension) |
Expérimentale | 11 197 - 11 285 | 25;15 | Lide 2007 HSDB 2007b |
| Masse moléculaire (kg/m3) |
Expérimentale | 1119,7 - 1128,5 | 25;15 | Lide 2007 HSDB 2007b |
| Pression de vapeur (mm Hg) |
Expérimentale | 4,65 x 10-5 - 5,7 x 10-3 | 26;25 | HSDB 1983c HSDB 2007a,b |
| Constante de Henry (atm.m3/mol) |
Estimée; Expérimentale |
2,61 x 10-10 - 2,0 x 10-9 | 25;s.o. | HSDB 2007a HSDB 2009a |
| logKoe (sans dimension) |
Modélisée; Estimée |
-2,02 -1,47 |
s.o. |
HSDB 2007b HSDB 2009a |
| Hydrosolubilité (mg/L) |
Expérimentale | 1 x 106 | 20 | HSDB 2007a,b HSDB 2009a |
| Propriété | Type de donnée | Valeur | Température (°C) | Référence |
|---|---|---|---|---|
| Forme physique | - | Liquide | 25 | - |
| Point de fusion (ºC) |
Expérimentale | -68,1 - -54 | NA | HSDB 2007c,d |
| Point d'ébullition (ºC) |
Expérimentale | 192 - 230,4 | NA | HSDB 2007b HSDB 2009b |
| Densité (sans dimension) |
Expérimentale | 0,942 2 - 0,988 5 | 20 | HSDB 2007c HSDB 2009b |
| Masse moléculaire (kg/m3) |
Expérimentale | 942,2 - 988,5 | 20 | HSDB 2007c HSDB 2009b |
| Pression de vapeur (mm Hg) |
Expérimentale | 0,021 9 - 0,375 | 25;20 | HSDB 2007d HSDB 2009b |
| Constante de Henry (atm.m3/mol) |
Expérimentale | 7,29 x 10-9 - 5,46 x 10-6 | 25 | HSDB 2007d HSDB 2009b |
| logKoe (sans dimension) |
Expérimentale; Estimée |
-0,54 - 1,57 | NA | HSDB 2007c HSDB 2009b |
| Hydrosolubilité (mg/L) |
Expérimentale | 9 x 103 - 1 x 106 | 20 | HSDB 2007c,d HSDB 2009b |
| Propriété | Type de donnée | Valeur | Température (°C) | Référence |
|---|---|---|---|---|
| Forme physique | - | Liquide | 25 | - |
| Point de fusion (ºC) |
Expérimentale | -71 à -58 | s.o. |
HSDB 2002 |
| Point d'ébullition (ºC) |
Expérimentale | 82-83 | s.o. |
HSDB 2002 |
| Densité (sans dimension) |
Expérimentale | 0,862 85 | 20; 4 | HSDB 2002 |
| Masse moléculaire (kg/m3) |
Expérimentale | 862,85 | 25; 15 | HSDB 2002 |
| Pression de vapeur (mm Hg) |
Expérimentale | 48 | 20 | HSDB 2002 |
| Constante de Henry (atm.m3/mol) |
Estimée | 1,1 x 10-6 | 25 | HSDD 2002 |
| logKoe (sans dimension) |
Modélisée; Estimée |
-0,21 | s.o. |
HSDS 2002 |
| Hydrosolubilité (mg/L) |
Expérimentale | 1 x 106 | 20 | HSDB 2002 |
s.o. = sans objet
4. Sources
Les sept substances de ce groupe sont produites commercialement et ne sont pas présentes naturellement dans l'environnement.
Trois enquêtes distinctes, réalisées en vertu de l'article 71 de la LCPE, ont été menées en 2001, 2008 et 2012 afin d'obtenir des renseignements sur les quantités de diverses substances dans le commerce au Canada (Environnement Canada 2001, 2009, 2014).
Ces enquêtes ont montré qu'une substance du sous-groupe EG, le TTEG, et que les trois substances du sous-groupe EGE étaient produites au Canada en quantités supérieures au seuil de déclaration. Les sept substances du groupe des oxydes d’éthane-1,2-diol ont été importées au Canada en quantités supérieures au seuil de déclaration (Environnement Canada 2001, 2009, 2014; voir le tableau 4-1).
| Sous-groupe | Nom Common | Production totale(kg)* | Importation totale(kg)* |
|---|---|---|---|
| Éthane-1,2-diols | DEG | - | 100 000-1 000 000 |
| Éthane-1,2-diols | TEG | - | 1 000 000-10 000 000 |
| Éthane-1,2-diols | TTEG | 1 000 000-10 000 000 | 100 000-1 000 000 |
| Oxydes d'éthane 1,2-diol | DEGEE | 10 000-100 000 | 100 000-1 000 000 |
| Oxydes d'éthane 1,2-diol | EGBEA | 1000-10 000 | 100 000-1 000 000 |
| Oxydes d'éthane 1,2-diol | DEGBE | 10 000-100 000 | 1 000 000-10 000 000 |
| Glymes | 1,2-Diméthoxyéthane | - | 100-100 000 |
a Valeurs qui reflètent les quantités déclarées en réponse à une enquête menée en vertu de l'article 71 de la LCPE (Environnement Canada 2001, 2009, 2014). Pour les inclusions et exclusions spécifiques, consulter l'enquête (annexes 2 et 3).
Aux États-Unis, en 2012, les quantités produites allaient de 10 000 000 à 450 000 000 de kg pour les substances de type EG et EGE (EPA 2012), alors que celles de 1,2‑diméthoxyéthane allaient de 453 600 à 4 536 000 en 2005 (ECHA 2012b).Note de bas de page 5 Dans l’Union européenne, les quantités produites ou importées de ces sept substances allaient de 100 000 à 1 000 000 000 de kg en 2015 (ECHA 2015).
5. Utilisations
Les renseignements obtenus lors de deux enquêtes menées en vertu de l'article 71 sur les utilisations au Canada des six substances des sous-groupes EG et EGE sont présentés dans le tableau 5-1 (Environnement Canada 2001, 2014).
| Principales utilisationsa | Éthane-1,2-diols | Oxydes d'éthane 1,2-diol |
|---|---|---|
| Adhésifs | TEG, TTEG | EGBEA, DEGBE |
| Automobile, aéronefs et transport | DEG, TEG, TTEG | DEGEE, EGBEA, DEGBE |
| Produits de nettoyageb | DEG, TEG | DEGEE, EGBEA, DEGBE |
| Produits de soins personnelsc, y compris les cosmétiques | - | DEGEE |
| Colorants et pigments | - | DEGEE, DEGBE |
| Produits de santé, médicaux et vétérinaires | - | DEGEE |
| Peinture et revêtementsb | DEG, TEG, TTEG | DEGEE, EGBEA, DEGBE |
| Matières platiques et plastifiants | TEG, TTEG | DEGEE, DEGBE |
| Produits pour l'impression et l'écriture et encres d'imprimerie | TEG, TTEG | DEGEE, DEGBE |
| Caoutchouc | TEG | DEGBE |
| Textile, cuir et tannage | - | DEGEE |
| Jouets, équipement pour les sports et équipement pour terrains de jeux | - | EGBEA |
a Renseignements obtenus lors d'enquêtes menées en vertu de l'article 71 de la LCPE (Environnement Canada 2001, 2014).
b Les données déclarées en vertu de l’article 71 ainsi que d’autres sources de données sur les concentrations (p. ex. données sur les concentrations rapportées dans les FS, communications personnelles d’autres directions générales de Santé Canada) ont été utilisées pour caractériser l’exposition à la section 7.
c Dans le présent document, un produit de soins personnels est un produit qui est généralement reconnu par le public à des fins d’hygiène personnelle ou de soins quotidiens. En fonction de la manière avec laquelle le produit est présenté à la vente et de sa composition, les produits de soins personnels peuvent être classés dans une des trois catégories réglementaires suivantes au Canada : cosmétiques, drogues ou produits de santé naturels.
Le DEG est interdit dans les produits cosmétiques utilisés par voie orale ou sans rinçageNote de bas de page 6 (Santé Canada [modifié en 2015]). D'après les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, du TEG, du DEGEE et du DEGBE ont été déclarés présents dans des produits cosmétiquesote de bas de page 7 (communication personnelle, courriels de la Direction de la sécurité des produits de consommation [DSPC] de Santé Canada au Bureau d'évaluation des substances existantes [BESE] de Santé Canada, septembre 2015; non référencé).
Le TEG et le DEGBE sont inscrits dans la Base de données sur les produits pharmaceutiques (BDPP) comme ingrédient actif dans des désinfectants assimilés aux drogues pour surfaces dures. Le DEG, le TEG, le DEGEE et le DEGBE sont inscrits dans la Base de données interne sur les ingrédients non médicaux de la Direction des produits thérapeutiques comme étant présents dans des désinfectants assimilés aux drogues et dans des drogues pour les humains.Note de bas de page 8 Le DEG est inscrit dans la Base de données d’ingrédients de produits de santé naturels (BDIPSN) uniquement pour des utilisations non médicinales, en tant qu’ingrédient de parfum, solvant ou agent de réduction de la viscosité dans des produits à rincer à application topique. Le DEG est interdit dans les produits d’hygiène buccale et les produits sans rinçage (BDIPSN, 2018, communication personnelle de la Direction des produits de santé naturels et sans ordonnance, DPSNSO, Santé Canada, au Bureau de l’évaluation des risques pour les substances existantes, BERSE, Santé Canada, datée du 3 août 2017). Le DEGBE est inscrit dans la BDIPSN pour des utilisations non médicinales topiques, en tant qu’ingrédient de parfum, solvant ou agent de réduction de la viscosité (BDIPSN, 2018). Le DEG et le DEGBE ne figurent pas dans la Base de données des produits de santé naturels homologués (BDPSNH) comme étant présents dans les produits de santé naturels actuellement homologués (BDPSNH 2018). Le DEGEE est inscrit dans la BDIPSN à titre de produit de santé non naturel, car il n’est pas une substance naturellement présente dans l’environnement visée par l’annexe 1 du Règlement sur les produits de santé naturels, tandis que le TEG et le DEGEE sont inscrits dans la BDIPSN, mais uniquement pour des utilisations topiques non médicinales en tant qu’ingrédient de parfum, de solvant ou d’agent de réduction de la viscosité (BDIPSN 2018), et ils sont inscrits dans la BDPSNH comme substances présentes dans des produits de santé naturels actuellement homologués (BDPSNH 2018).Note de bas de page 9
Au Canada, les six substances des sous-groupes EG et EGE sont utilisées pour de l'emballage alimentaire. Toutefois, seuls le DEG et l'EGBEA pourraient se retrouver en contact direct avec des aliments (communication personnelle, courriels de la Direction générale des aliments de Santé Canada au Bureau de la gestion du risque de Santé Canada, octobre 2015; non référencé). Aucune de ces substances n'est inscrite sur la Liste des additifs alimentaires autorisés en tant qu'additif alimentaire autorisé en vertu de la Loi sur les aliments et drogues et associé à des autorisations de commercialisation (communication personnelle, courriels de la Direction générale des aliments de Santé Canada au Bureau de la gestion du risque de Santé Canada, octobre 2015; non référencé).
Finalement, cinq des six substances des sous-groupes EG et EGE (DEG, TEG, DEGEE, EGBEA et DEGBE) ont été identifiées comme formulant dans des produits antiparasitaires. Seul le TEG est un ingrédient pesticide actif homologué, mais le produit homologué est seulement formulé au Canada et exporté (communication personnelle, courriels de l'Agence de la réglementation de la lutte antiparasitaire de Santé Canada au BERSE de Santé Canada, septembre 2015 et septembre 2016; non référencé).
Le 1,2-diméthoxyéthane est utilisé comme additif à des concentrations allant de 1 à 10 % p/p dans du lithium pour la production de tous types de piles, d'après les fiches signalétiques (FS) de produits au Canada. On retrouve aussi ce composé comme impureté dans des assainisseurs d'air et des produits de lessive à des concentrations inférieures à 0,01 % (Environnement Canada 2009). Le 1,2-diméthoxyéthane est identifié dans le Q3C(R5) : Impuretés : directive sur les solvants résiduels de la Direction des produits thérapeutiques en tant que solvant de classe 2 et, en conséquence, ne devrait pas être présent à plus de 100 ppm (soit une exposition quotidienne acceptable de 1,0 g/jour) dans des drogues (Santé Canada 2016a).
Pour les substances des sous-groupes EG et EGE, les principales utilisations identifiées au niveau international, en plus de celles mentionnées dans le tableau 5-1, comprennent des antigels, des matériaux de bricolage, des produits antiparasitaires, des additifs indirects dans des substances en contact avec des aliments, des additifs pour les polyuréthanes et les résines de polyester, des agents déshydratants pour les activités touchant le gaz naturel et des additifs pour des utilisations industrielles ou commerciales (JECFA 1995; Wagner 2006; Tønning et al. 2008; OCDE 2007, 2009a; Scorecard 2011; FDA 2011; GoodGuide 2014; CHSST 2015; DOW 2015; ECHA 2015; EWG 2015; NICNAS 2015; NYSDEC 2015; U.S. Government Publishing Office 2015). Pour le 1,2-diméthoxyéthane, ce sont des produits de nettoyage, des produits de santé, médicaux et vétérinaires, des peintures et revêtements, des produits pour l’impression ou l’écriture, des encres d’imprimerie et des utilisations industrielles ou commerciales (ECHA 2012b; NICNAS 2016a).
Les utilisations identifiées au Canada sont détaillées à la section 7.1.2. Brièvement, les expositions aux substances de ce groupe ont été caractérisées pour les peintures à l’eau, les produits d’étanchéité/teinture du bois, les cosmétiques, les médicaments sans ordonnance, les assainisseurs d’air, les produits de nettoyage domestiques et les jouets peints. Il existe aussi des expositions potentielles peu fréquentes dues à d’autres produits comme des adhésifs, des piles et des textiles (Environnement Canada 2001, 2009, 2014; voir le tableau 5-1).
Voici un résumé de l’approche, laquelle est décrite en détail dans le document d’ECCC (2016a).
6. Potentiel d'effets nocifs sur l'environnement
6.1 Caractérisation des risques pour l'environnement
Les risques posés à l'environnement par les sept substances du groupe des oxydes d'éthane-1,2-diol ont été caractérisés au moyen de la Classification des risques écologiques des substances organiques (CRE) (ECCC 2016a). La CRE est une approche basée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l'exposition basés sur la pondération de plusieurs éléments de preuve. Les divers éléments de preuve sont combinés afin de faire la différence entre des substances présentant une puissance plus ou moins élevée et un potentiel d'exposition plus ou moins élevé dans divers milieux. Cette approche réduit l'incertitude globale de la caractérisation des risques comparativement à une approche qui reposerait sur un seul paramètre dans un seul milieu (p. ex. CL50). Ci-dessous, nous résumons l'approche suivie, qui est décrite en détail dans le document ECCC 2016a.
Des données sur les propriétés physico-chimiques, le devenir (demi-vie chimique dans divers milieux et biotes, coefficients de partage et bioconcentration dans le poisson), l'écotoxicité aiguë pour le poisson et les quantités produites et importées au Canada ont été collectées dans la littérature scientifique, dans des bases de données empiriques (p. ex. boîte à outils QSAR de l'OCDE) et dans les réponses à des enquêtes menées en vertu de l'article 71 de la LCPE. D'autres données ont été obtenues en utilisant des modèles de type QSAR (Quantitative Structure-Activity Relationship) ou de bioaccumulation et de devenir du bilan massique. Ces données ont été utilisées comme intrants dans d'autres modèles de bilan massique ou pour compléter les profils d'exposition et de danger de la substance.
Les profils de danger ont été établis en se basant principalement sur des paramètres liés au mode d'action toxique, à la réactivité chimique, aux seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l'activité chimique et biologique. Les profils d'exposition ont aussi été élaborés à partir de plusieurs paramètres dont la vitesse d'émission potentielle, la persistance globale et le potentiel de transport à grande distance. Les profils de danger et d'exposition ont été comparés aux critères de décision afin de classer les potentiels de risque et d'exposition de chaque substance comme faibles, moyens ou élevés. D'autres règles ont été appliquées (p. ex. constance de la classification, marge d'exposition) afin de raffiner les classifications préliminaires du danger et de l'exposition.
Une matrice de risques a été utilisée pour assigner à chaque substance un risque potentiel faible, moyen ou élevé, basé sur la classification de son danger et de son exposition. Les classifications du risque potentiel au moyen de la CRE ont été vérifiées en suivant une approche en deux étapes. La première étape servait à ajuster les résultats de la classification du risque de moyen ou élevé à faible pour les substances présentant une faible vitesse d'émission estimée dans l'eau après traitement des eaux usées, représentant un faible potentiel d'exposition. La deuxième étape servait à revoir les résultats d'une classification du potentiel de risque faible ou moyen de scénarios de risque relativement prudents, d'échelle locale (c.-à-d. dans la zone à proximité du point de rejet), conçus pour protéger l'environnement, afin de déterminer si la classification du risque potentiel devrait être accrue.
La CRE est basée sur une approche pondérée afin de réduire au minimum toute sur-classification ou sous-classification du danger et de l'exposition et du risque subséquent. Les approches équilibrées pour tenir compte des incertitudes sont décrites en plus de détails dans le document ECCC 2016a. Nous décrivons ci-après deux des zones d'incertitude les plus importantes. Les erreurs dans les valeurs de toxicité aiguë empiriques ou modélisées pourraient conduire à des changements de la classification du danger, en particulier en ce qui a trait aux paramètres reposant sur des valeurs de résidus dans les tissus (c.-à-d. mode d'action toxique), dont de nombreux sont des valeurs prédites à partir de modèles QSAR. Cependant, l'impact de cette erreur est atténué par le fait qu'une surestimation de la létalité médiane conduira à une valeur prudente (protectrice) pour les résidus dans les tissus pour l'analyse des résidus corporels critiques (RCC). L'erreur de sous-estimation de la toxicité aiguë sera atténuée par l'utilisation d'autres paramètres de risque comme le profilage structurel du mode d'action, la réactivité et/ou l'affinité de liaison à l'estrogène. Les changements dans les quantités chimiques ou les erreurs dans ces quantités pourraient conduire à des classifications différentes de l'exposition, la classification de l'exposition et du risque étant hautement sensible à la vitesse d'émission et aux quantités utilisées. Les résultats de la CRE reflètent donc l'exposition et le risque au Canada basés sur les quantités actuellement utilisées et pourraient ne pas refléter des tendances futures.
Les données critiques et les paramètres pris en compte pour développer les profils spécifiques aux sept substances du groupe des oxydes d'éthane-1,2-diol et les résultats de la classification du danger, de l'exposition et du risque sont présentés dans le document ECCC 2016b.
Les classifications du danger et de l'exposition pour les sept substances du groupe des oxydes d'éthane-1,2-diol sont résumées dans le tableau 6.1.
| Substance (n° CAS) |
Classification CRE du danger | Classification CRE de l'exposition | Classification CRE du risque |
|---|---|---|---|
| DEG (111-46-6) | faible | faible | faible |
| TEG (112-27-6) | faible | faible | faible |
| TTEG (112-60-7) | faible | faible | faible |
| DEGEE (111-90-0) | faible | faible | faible |
| EGBEA (112-07-2) | faible | faible | faible |
| DEGBE (112-34-5) | faible | faible | faible |
| [EGDME] (110-71-4) | faible | faible | faible |
En se basant sur les classifications de faible danger et de faible exposition obtenues au moyen de la CRE, les sept substances du groupe des oxydes d'éthane-1,2-diol ont été classées comme ayant un faible potentiel de risque pour l'environnement. Il est donc improbable que ces substances soient inquiétantes pour les organismes ou l'intégrité plus globale de l'environnement au Canada.
7. Potentiel d'effets nocifs sur la santé humaine
7.1 Évaluation de l'exposition
7.1.1 Milieux de l'environnement et aliments
Aucune concentration mesurée dans l'air ambiant, l'eau ou les aliments au CanadaNote de bas de page 10 n'a été identifiée pour les sept substances de ce groupe.
Deux substances, le DEGBE et l'EGBEA, ont été rapportées comme étant rejetées dans l'air au Canada, respectivement à raison de 20 389 et 10 876 tonnes/an, en 2013 (INRP 1993 - 2013). En se basant sur ces données et en utilisant les quantités dans le commerce au Canada des six substances des sous-groupes EG et EGE et du 1,2-diméthoxyéthane, la modélisation des concentrations (au moyen de ChemCAN, version 6.0) dans les milieux de l'environnement après rejet dans l'atmosphère conduit à des expositions minimales ou de l'ordre du nanogramme (absorptions inférieur(e) à 1 à 45 ng/kg pc/jour, selon la substance) (Santé Canada 2016a).
Au Canada, les sept substances de ce groupe sont utilisées dans de l'emballage alimentaire. Toutefois, seuls le DEG et l'EGBEA pourraient potentiellement entrer en contact avec des aliments (communication personnelle, courriels de la Direction générale des aliments et des produits de santé de Santé Canada au BGR de Santé Canada, ocotbre 2015; non référencé). Les expositions probables au DEG et à l'EGBEA ont été estimées respectivement à 0,3 et 0,03 μg/kg pc/jour.
Le DEGEE a fait l'objet d'une étude exhaustive dans l'air intérieur dans 18 villes à travers le Canada (2009 à 2011). Il a été détecté dans 3 % des 3857 résidences, avec une moyenne géométrique de 0,54 μg/m3 et une gamme allant de 0,4 à 6,93 μg/m3 (Zhu et al. 2013a, 2013b). Du 1,2-diméthoxyéthane a été rapporté dans l'air intérieur, en Allemagne, à une concentration maximale de 13 μg/m3(95e centile : 0,5 μg/m3), basée sur 12 des 500 mesures (ECHA 2012b).Note de bas de page 11
Le DEG a été rapporté présent dans le sol de sites ou d'installations de déchets dangereux aux É.-U. Toutefois, la valeur rapportée n'était pas pertinente pour la présente évaluation (ASTDR 2013).
7.1.2 Produits de consommation
Absorption cutanée
Du DEG appliqué sur la peau de rats in vivo a été absorbé rapidement et, 15 minutes après l’application, environ 50 % de la dose (basé sur la radioactivité) se retrouvait dans la peau.Note de bas de page 12 À tous les moments d’observation (15 min, 8 h et 24 h), le site cutané d’essai de chaque animal a été frotté à l’aide d’un cure-oreille, les animaux ont été sacrifiés et le site cutané a été retiré et congelé avant l’analyse. Huit et vingt-quatre heures après l’application, 12 et 32 % de la radioactivité étaient respectivement détectés dans l’urine, indiquant une absorption cutanée et une exposition systémique (DOW 1981). D’après ces données cutanées non publiées sur le DEG soumises à Santé Canada, l’absorption cutanée du TEG et du TTEG a été considérée être de 50 % (DOW 2016a).
Pour le DEGEE, lors de trois études sérieuses in vitro sur l’absorption cutanée au travers de la peau humaine, une formulation de shampooing contenant 5 ou 10 % de DEGEE, une formulation hydroalcoolique (sans rinçage) contenant 15 % de DEGEE et des formulations émulsifiées (sans rinçage) contenant 2, 5 ou 10 % de DEGEE ont été testées. L’absorption totale était de 21,6 et 17,5 %, de 51,5 % et de 43,2 à 56 % respectivement lors de ces trois études (SCCP 2006a). En se basant sur ces études, une absorption cutanée du DEGEE a été établie à 50 %.
Pour le DEGBE, aucune des études disponibles sur l’absorption cutanée par la peau humaine ou de rat ne convenait au calcul d’une absorption. Toutefois, en se basant sur ces mêmes expériences et sur les études d’absorption cutanée sur le DEGEE et l’EGBE, le SCCP (2006b) a indiqué qu’il est improbable que l’absorption cutanée soit supérieure à 50 %.
Tel qu’indiqué au paragraphe 7.2.2, une fois absorbée l’EGBEA est rapidement hydrolysé dans le sang en EGBE et acétate, et tous les effets systémiques observés avec l’EGBEA sont aussi typiquement observés avec l’EGBE. En se basant sur des études chez le rat, le porc ou l’humain, une gamme de valeurs d’absorption a été déterminée, généralement l’absorption cutanée de l’EGBE liquide variait entre 20 et 30 % chez le rat. La CE (2006-2008a) a indiqué que pour la voie cutanée, la valeur extrapolée est probablement égale ou inférieure à celle pour l’EGBE. Il peut être anticipé que la pénétration cutanée de l’EGBEA liquide serait d’environ 30 % et celle de la vapeur d’EGBEA d’environ 39 %. En se basant sur les renseignements disponibles sur l’EGBE, une absorption cutanée de 30 % a été retenue pour l’EGBEA.
Nous donnons dans le tableau 7-1 un résumé des valeurs de l’absorption cutanée.
| Substance (n° CAS) |
Absorption cutanée |
Référence |
|---|---|---|
| DEG (111-46-6) | 50 % | DOW 1981, 2016a |
| TEG (112-27-6) | 50 %a | DOW 2016a |
| TTEG (112-60-7) | 50 %a | DOW 2016a |
| DEGEE (111-90-0) | 50 % | SCCP 2006a |
| EGBEA (112-07-2) | 30 % | EC 2006-2008a |
| DEGBE(112-34-5) | 50 % | SCCP 2006b |
a En utilisant l'absorption cutané rapportée pour le DEG comme analogue.
Cosmétiques, produits de santé naturels, produits de soins personnels et médicaments en vente libreNote de bas de page 13
D'après des déclarations faites à Santé Canada, trois substances de ce groupe (TEG DEGEE, DEGBE) se retrouvent dans des produits cosmétiques vendus au CanadaNote de bas de page 14 (communication personnelle, courriels de la DSPC de Santé Canada au BERSE de Santé Canada, septembre 2015; non référencé). Du TEG et du DEGEE sont aussi présents en tant qu'ingrédient non médicinal dans des produits de santé naturels vendus au Canada (BDPSNH 2018).Note de bas de page 15 Des sources de renseignements internes à Santé Canada ont indiqué que le DEG, le TEG et le DEGEE sont aussi utilisés comme ingrédients non médicinaux dans des médicaments sans ordonnance (communication personnelle, courriels de la Direction générale des aliments et des produits de santé de Santé Canada au Bureau de la gestion du risque de Santé Canada, octobre 2015; non référencé).
En se basant sur les renseignements susmentionnés, les expositions au DEG, au TEG, au DEGEE ou au DEGBE dues à l’utilisation de certains types de produits ont été caractérisées et les scénarios présentés dans la présente section sont des scénarios d’exposition sentinelle englobant d’autres types de produits comme les produits de santé naturels et les produits de soins personnels. Les valeurs pour l’absorption cutanée sont données dans le tableau 7-1 et les estimations de l’exposition cutanée à chaque substance sont données dans les tableaux 7-2 et 7-3 (voir aussi l’annexe A pour les paramètres utilisés avec le modèle élaboré pour ces scénarios).
| Substance (n° CAS) |
Scénario pour le produit | Concentration (% p/p) |
Exposition quotidienne estimée (mg/kg pc/jour) |
|---|---|---|---|
| DEG (111-46-6) |
Shampooing antibactérien | 3a | 0,027 (interne)b 0,054 (externe)b |
| TEG (112-27-6) |
Crème pour le corps | inférieur(e) u égal(e) à 0.3c | inférieur(e) u égal(e) à 0,10 (interne) inférieur(e) u égal(e) à 0,20 (externe) |
| DEGEE (111-90-0) |
Déodorant/antisudorifique | 10-30c | 0,55-1,7 (interne) 1,1-3,4 (externe) |
| DEGEE (111-90-0) |
Crème pour le corps | 1-3c | 0,34-1,0 (interne) 0,68-2,0 (externe) |
| DEGBE (112-34-5) |
Maquillage pour le visage | 10-30c | 0,47-1,4 (interne) 0,94-2,8 (externe) |
a Ingrédient non médicinal dans du shampooing antibactérien (communication personnelle, courriels de la Direction générale des aliments et produits de santé de Santé Canada au Bureau de la gestion du risque de Santé Canada, octobre 2015; non référencé).
b Les estimations de l'exposition externe sont des estimations du dépôt cutané. Les estimations de l'exposition interne sont des estimations de l'exposition systémique basée sur les valeurs d'absorption cutanée de chaque substance.
c Les concentrations sont basées sur des déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques (communication personnelle, courriels de la DSPC de santé Canada au BERSE de Santé Canada, septembre 2015; non référencé).
| Substance (n° CAS) |
Scénario | Concentration (% p/p)a |
Exposition estimée par application (mg/kg pc) |
|---|---|---|---|
| DEGEE (111-90-0) |
Colorant capillaire | 3-10b | 4,2-14,0 (externe)c 2,1-7,0 (interne) |
| DEGBE (112-34-5) |
Colorant capillaire | 1-3 | 1,4-4,2 (externe) 0,71-2,1 (interne) |
a Les concentrations sont basées sur des déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques (communication personnelle, courriels de la DSPC de santé Canada au BERSE de Santé Canada, septembre 2015; non référencé).
b 97,5 % des produits contiennent 3-10 % de DEGEE; seulement 2,5 % en contiennent supérieur(e) à 10 % (communication, personnelle, courriels de la DSPC de santé Canada au BERSE de Santé Canada, septembre 2015; non référencé).
c Les estimations de l'exposition externe sont des estimations du dépôt cutané. Les estimations de l'exposition interne sont des estimations de l'exposition systémique basée sur les valeurs d'absorption cutanée de chaque substance.
Peintures et revêtements
Au Canada, certaines de ces substances sont aussi utilisées dans des peintures ou des revêtements (Environnement Canada 2001; Environnement Canada 2014) et, à l'échelle mondiale, les substances de ce groupe peuvent être présentes dans une variété de peintures ou de revêtements, dans des produits de construction ou des matériaux pour le bricolage (Household Products Database 1993-2015; DOW 2007a, 2007b; DOW 2014a).
Les expositions cutanées ou par inhalation aux substances de ce groupe dues à l'utilisation de peintures murales à l'eau à appliquer au rouleau ou à des produits d'étanchéité/de finition pour revêtement de sol ont été estimées au moyen de ConsExpo v4.1 (ConsExpo 2006). Elles sont présentées dans le tableau 7-4.Note de bas de page 16 Les scénarios ont été établis afin de simuler la peinture soit d'un mur soit d'un plancher et comprennent les voies d'exposition par inhalation et par voie cutanée occasionnelle (les estimations cutanées internes ont été calculées en utilisant les valeurs d'absorption cutanée du tableau 7-1). Aucune donnée sur les concentrations de TTEG dans les peintures n'était disponible. Nous avons donc utilisé celles de TEG dans la peinture en remplacement et les expositions devraient donc être similaires.
| Substance (n° CAS) |
Scénarioa | Concentration (% p/p) |
Exposition cutanée estimée par application (mg/kg pc)b |
Concentration moyenne instantanée dans l'air par événement lors de l'utilisation (mg/m3) |
|---|---|---|---|---|
| DEG (111-46-6) |
Water-borne roller wall paints | 1c | 0.254 interne; 0.51 externe |
0,27 |
| TEG (112-27-6) |
Water-borne roller wall paints | 0,1-4 %d | 1.02 interne; 2.04 externe |
0,25 |
| TTEG (112-60-7) |
Water-borne roller wall paints | 0,1-4 %d | 1.02 interne; 2.04 externe |
0,25 |
| DEGEE (111-90-0) |
Floor sealant | 1-10e | 0.176 interne; 0.353 externe |
20,1 |
| EGBEA (112-07-2) |
Wood sealant | 1-5f | 0.053 interne; 0.176 externe |
58,4 |
| DEGBE (112-34-5) |
Water-borne roller wall paints | 2g | 0.51 interne; 1.02 externe |
0,5 |
a Tous les scénarios ont été modélisés en utilisant ConsExpo (Santé Canada 2016a; voir aussi l'Annexe A).
b Les estimations de l'exposition externe sont des estimations du dépôt cutané. Les estimations de l'exposition interne sont des estimations de l'exposition systémique basée sur les valeurs d'absorption cutanée de chaque substance.
c FS 2012c.
d Les données de l'industrie soumises en vertu de l'article 71 de la LCPE 1999 ont indiqué que du TEG est présent à des concentrations allant de 0,1 à 4 %. Aucune donnée n'était disponible sur les concentrations de TTEG dans les peintures; toutefois, les déclarations de l'industrie indiquent sa présence potentielle dans des peintures ou des revêtements. La concentration de TEG dans la peinture a donc été utilisée en remplacement pour le TTEG et l'exposition devrait donc être similaire.
e FS 2012d.
f FS 2010d.
g FS 2015u.
Les concentrations moyennes instantanées par événement susmentionnées peuvent surestimer l'exposition à ces substances, qui ont des pressions de vapeur allant de faible à modérée (voir la section sur les Propriétés physiques et chimiques).
Jouets peints portés à la bouche par des enfants
Au Canada, certaines de ces substances peuvent être présentes dans des jouets et des articles pour enfants (Environnement Canada 2001; Environnement Canada 2014). Au niveau international, la présence de substances de ce groupe a aussi été rapportée dans des jouets peints (Hansen et Pederson 2005).
Le ministère danois de l'Environnement a rapporté la migration de certaines substances de ce groupe de jouets en bois peints vers de la salive simulée (Hansen et Pederson 2005). Ces auteurs ont analysé les six substances des sous-groupes EG et EGE. Quatre de celles-ci (TEG, EGBEA, DEG, TTEG) ont été détectées à de faibles concentrations dans de la salive simulée, provenant de moins de cinq produits. L'exposition à ces 4 substances par cette voie ne devrait donc pas être significative.
Deux des substances (DEGEE et DEGBE) ont été détectées dans de la salive simulée, provenant de quatre produits ou plus (n=15), à des concentrations allant de modérée à élevée. Les expositions potentielles à ces substances dues à la mise en bouche ont été estimées. L'évaluation de l'exposition orale due à la mise en bouche de jouets faite par le ministère danois de l'Environnement a été adoptée pour la présente évaluation. Les absorptions orales rapportées les plus élevées de ces deux substances sont données dans le tableau 7-5.Note de bas de page 17
| Substance (n° CAS) |
Vitesse de migration (μg/10 cm2/h |
Absorption orale rapportée la plus élevée (μg/kg bw/jour)a |
Référence |
|---|---|---|---|
| DEGEE (111-90-0) |
12,6 | 18,9 | Hansen et Pederson 2005 |
| DEGBE (112-34-5) |
55,7 | 16,7 | Hansen et Pederson 2005 |
a Le taux d'absorption a été supposé à 100 %, exposition de 3 heures, poids corporel de 10 kg.
Assainisseurs d'air
Des assainisseurs d'air en aérosol contenant des concentrations jusqu'à 1 % de DEG, 10 % de TEG et 30 % de DEGEE sont vendus au Canada (FS 2009b, 2014d, 2014e, Environnement Canada 2009). De plus, du 1,2-diméthoxyéthane a été détecté comme impureté potentielle (à des concentrations inférieur(e) à 0,01 %, Environnement Canada 2009) des EGE utilisés dans les assainisseurs d'air. Toutefois, on ne pense pas que ce composé soit présent dans une large part des produits de consommation.
Les concentrations moyennes dans l’air sur 24 heures résultant de l’utilisation d’assainisseurs d’air contenant du DEGEE, du TEG et du 1,2-diméthoxyéthane ont été estimées au moyen de ConsExpo v4.1 (ConsExpo 2006).Note de bas de page 18 Nous les présentons dans le tableau 7-6 ci-après. De plus, dans le cas du 1,2-diméthoxyéthane, une concentration moyenne sur une durée plus courte (6 heures) correspondant à la durée d’exposition quotidienne de l’étude critique pour la caractérisation des risques a aussi été estimée.
| Substance (n° CAS) |
Concentration (% p/p) |
Concentration dans l'air 24 h (6-h |
|---|---|---|
| DEG (111-46-6) |
1 | 0,187 mg/m3 |
| TEG (112-27-6) |
10 | 1,87 mg/m3 |
| DEGEE (111-90-0) |
30 | 5,62 mg/m3 |
| 1,2-Diméthoxyéthane (110-71-4) |
0,01 | 0,0019 mg/m3 (0,007 3 mg/m3) |
Produits de nettoyage domestiques
Au Canada, la présence d'une majorité des EGE a aussi été rapportée dans des produits de nettoyage et de désinfection utilisés dans des environnements domestiques ou professionnels, comme les hôpitaux et les cuisines (Environnement Canada 2001; Environnement Canada 2014; communication personnelle, courriels de la Direction générale des aliments et des produits de santé de Santé Canada au Bureau de la gestion du risque de Santé Canada, octobre 2015; non référencé). Globalement, les substances de ce groupe peuvent aussi être présentes dans des produits de nettoyage, dont des savons à vaisselle, des nettoyants tout usage et des nettoyants pour le four (Household Products Database 1993-2015).
Des nettoyants pour salle de bains et des nettoyants tout usage pour vitres à pulvériser contenant des concentrations de DEG, DEGEE, EGBEA ou DEGBE peuvent être disponibles au Canada (communication personnelle, courriels de la Direction générale des aliments et des produits de santé de Santé Canada au Bureau de la gestion du risque de Santé Canada, octobre 2015; non référencé; FS 2013f; FS 2015v; OCDE 2007). Des concentrations moyennes sur 24 heures et des estimations de l'exposition cutanée (les estimations cutanées internes ont été calculées au moyen des valeurs de l'absorption cutanées données dans le tableau 7-1) ont été estimées au moyen de ConsExpo v4.1 (ConsExpo 2006) et sont présentées dans le tableau 7-7 (voir aussi l'annexe A pour les paramètres utilisés avec ConsExp v4.1).
| Substance (n° CAS) |
Produit | Concentration (% p/p) |
Exposition cutanée estimée (mg/kg pc/événement; mg/kg bw/jour) |
Concentration moyenne sur 24 h (mg/m3) |
|---|---|---|---|---|
| DEG (111-46-6) |
Nettoyant pour salle de bains | 4a | 0,10 interne; 0,20 externe |
2,92 |
| DEGEE (111-90-0) |
Nettoyant pour vitres | 8b | 0,19 interne; 0,38 externe |
3,14 |
| EGBEA (112-07-2) |
Nettoyant pour vitres | 5c | 0,070 interne; 0,23 externe |
1,96 |
| DEGBE (112-34-5) |
Nettoyant pour salle de bains | 10d | 0,26 interne; 0,52 externe |
7,31 |
a Communication personnelle, courriels de la Direction générale des aliments et des produits de santé de Santé Canada au Bureau de la gestion du risque de Santé Canada, octobre 2015; non référencé.
b OCDE (2007 : p. 61).
c FS (2015v).
d FS (2013f).
Les concentrations moyennes sur 24 heures sont comparables aux concentrations maximales dans l'air (10,8 mg/m3) et aux concentrations dans la zone de respiration (5,4 mg/m3) rapportées pour l'utilisation d'un nettoyant pour salle de bains à pulvériser contenant du DEGBE, mesuré par l'HERA (2005). Toutefois, les concentrations modélisées susmentionnées sont des estimations sur 24 heures (pendant et après l'utilisation) et soulignent la prudence de ce modèle pour cet ensemble spécifique de substances.
Autres produits
Les expositions à d’autres produits, comme des adhésifs, des piles ou des textiles, n’ont pas été évaluées, car celles des produits sentinelles présentés ci-avant (cosmétiques et médicaments sans ordonnance, peintures et revêtements, assainisseurs d’air, nettoyants domestiques) devraient couvrir les expositions par inhalation et les expositions cutanées dues à d’autres produits utilisés moins fréquemment.
7.2 Évaluation des effets sur la santé
7.2.1 Évaluation des effets sur la santé des substances du sous-groupe des éthane-1,2-diols
Pour ce sous-groupe, la majorité des renseignements sur les effets sur la santé est basée sur les rapports d'évaluation initiale SIDS (Screening Information Data Set) de l'OCDE pour la catégorie de l'éthane-1,2-diol et les éthane-1,2-diols spécifiques, à savoir le 3-oxapentane-1,5-diol (DEG), le 3,6-dioxaoctane-1,8-diol (TEG) et le 3,6,9-trioxaundécane-1,11-diol (TTEG) (OCDE 2009a, 2009b, 2009c, 2009d). La littérature scientifique pour ces documents a été mise à jour par le pays promoteur de l'OCDE (Canada). Les renseignements les plus récents, basés sur une recherche bibliographique pour la période allant de janvier 2003 à septembre 2015, ont mis en évidence de nouvelles études sur les effets sur la santé et ont conduit à utiliser pour la présente évaluation préalable des paramètres critiques différents de ceux mentionnés dans le document OCDE 2009a.
Données sur les effets sur la santé spécifique d'une substance pour la caractérisation des risques
Le sous-groupe des éthane-1,2-diols comprend le 3-oxapentane-1,5-diol (DEG), le 3,6-dioxaoctane-1,8-diol (TEG) et le 3,6,9-trioxaundécane-1,11-diol (TTEG). Dans la présente section, nous donnons les paramètres critiques et les niveaux d'effet correspondants relatifs à ces composés à utiliser pour la caractérisation des risques, tels que directement tirés des documents OCDE 2009a, 2009b, 2009c et 2009d ou de publications plus récentes s'il y a lieu.
3-Oxapentane-1,5-diol (DEG)
La toxicocinétique du DEG a été résumée dans le document OCDE 2009b, de la manière suivante : d’après des études avec des rats et/ou des chiens, la principale voie métabolique est l’oxydation par l’intermédiaire des alcool-déhydrogénases et des aldéhyde-déhydrogénases (ADH/ALD). Le DEG et ses métabolites ne s’accumulent pas de manière significative dans les tissus. Le DEG est principalement éliminé dans l’urine sous forme de DEG et d’acide 2-(hydroxyéthoxy)acétique [AHEA]. Il est aussi éliminé sous forme de CO2 exhalé. Le DEG est facilement absorbé par voie orale, mais l’absorption cutanée est limitée (9 % basée sur une dose de 200 mg/kg pc chez le rat).Note de bas de page 19 Bien que cela ne soit pas mentionné dans les documents OCDE 2009a et 2009b, lors d’une autre étude réalisée par DOW (1981), l’absorption cutanée chez le rat était supérieure à 9 % à une dose inférieure appliquée dans le 24 heures suivant la première dose. Ces données sont décrites dans la section Évaluation de l’exposition.
Pour le DEG, une étude à court terme par voie orale a été réalisée chez le rat. Les animaux testés ont été exposés à 0, 11, 46, 180 ou 850 mg/kg pc/jour dans leur alimentation pendant 32 jours. La dose sans effet nocif observé (DSENO) était de 850 mg/kg/ p.c./jour. Bien que cette valeur soit considérée comme une dose minimale avec effet nocif observé (DMENO) (dans OCDE, 2009b) de nouvelles données confirment que la DSENO devrait être établie à 850 mg/kg/ p.c./jour.Note de bas de page 20 Une étude à court terme par inhalation a aussi été réalisée chez le rat, exposé à 0, 530, 3 000 ou 5 000 mg/m3 de DEG 6 h/jour pendant 9 jours. La DSENO et la DMENO étaient respectivement de 3 000 et 5 000 mg/m3, basées sur des modifications mineures des paramètres hématologiques et de chimie clinique (OCDE 2009a, 2009b). Aucune étude à court terme par voie cutanée n’a été trouvée pour le DEG.
Deux études subchroniques par voie orale à dose répétée ont été réalisées avec des rats. Ces études de 13 et 32 semaines sont décrites plus en détail dans le document de référence de Santé Canada (2016a). Deux études chroniques à dose répétée ont été réalisées avec des rats. Pour l’une d’elles, les animaux ont été exposés à 0, 1 200 ou 2 300 mg/kg pc/jour de DEG dans l’alimentation pendant 3 à 24 mois. Une DMENO orale de 2 300 mg/kg pc/jour a été déterminée, basée sur l’observation de calculs rénaux chez les mâles à 24 mois. La DSENO était de 1 200 mg/kg pc/jour. Lors de l’autre étude, au contraire, aucun effet n’a été observé chez des rats exposés à 25 000 ppm (équivalent à 3 500 mg/kg pc/jour) dans l’eau potable pendant 2 ans (OCDE 2009b).
Une toxicité à court terme a aussi été observée chez des humains, basée sur une étude cas/témoins réalisée chez 63 enfants âgés d’un mois à 13 ans, qui avaient été exposés à du sirop à l’acétaminophène contaminé par du DEG. Ces enfants ont exhibé une anurie idiopathique et une oligurie sévère pendant 24 heures ou plus avec, quelques fois, d’autres effets observés (hépatite, pancréatite et manifestations neurologiques sévères) en moyenne 6 jours après l’absorption de la première dose. Le nombre moyen d’administrations (doses) était de 4 à 5 chez les patients atteints d’insuffisance rénale et de 2 chez les témoins. En se basant sur les 32 enfants touchés et les 17 enfants témoins sans insuffisance rénale, pour laquelle les doses maximales de DEG pouvaient être estimées, une dose médiane de 1 500 mg/kg pc (fourchette de 246-4 942 mg/kg pc) a été déterminée comme niveau d’effet probable pour une insuffisance rénale chez des enfants âgés d’un mois à 13 ans. L’ingestion estimée de DEG chez les 17 enfants témoins (sans insuffisance rénale) était de 56,0 à 2 773 mg/kg pc. Il est bon de noter qu’il existe un grand chevauchement des doses estimées de DEG toxiques et non toxiques chez les enfants (O’Brien et al. 1998; OCDE 2009b). À cause de ce grand chevauchement, cette étude n’est pas considérée comme utile dans le calcul des points de référence pour la caractérisation du risque associé au DEG.
Pour de plus amples renseignements sur les études décrites ci-dessus et les résumés d’autres études (études de toxicité par voie orale de 13 et de 32 semaines chez le rat, étude continue de toxicité par voie orale sur la reproduction chez la souris et études de toxicité par voie orale sur le développement chez le rat, la souris et le lapin, autres études sur l’humain), veuillez consulter le document de référence (Santé Canada 2017).
3,6-Dioxaoctane-1,8-diol (TEG)
La toxicocinétique du TEG a été résumée dans les documents OCDE 2009a et 2009c. D’après des études chez le rat et/ou le lapin, la principale voie métabolique est l’oxydation par l’intermédiaire d’ADH/ALD. Le TEG était principalement éliminé dans l’urine sous forme de TEG et d’acide (éthane-1,2-diyldioxy)diacétique, et seulement 1 % était dégradé et éliminé sous forme de CO2 exhalé (OCDE 2009c; DOW 2016a). L’OCDE (2009a, 2009c) n’a pas fourni de valeur pour l’absorption cutanée du TEG. Toutefois, en se basant sur des données non publiées soumises à Santé Canada, l’absorption cutanée du TEG a été établie à 50 % (voir la section 7.1.2).
Lors d’une étude à court terme par voie orale réalisée avec des rats, les animaux étaient exposés à 0, 1 132-1 177, 2 311-2 411 ou 5 916-6 209 mg/kg p.c./jour de TEG dans l’alimentation pendant 14 jours. La DSENO était de 5 916 mg/kg p.c./jour. Bien que des variations aient été observées à la dose élevée dans les paramètres urinaires (augmentation du volume d’urine, baisse du pH urinaire et présence de cristaux de phosphite), ces effets n’ont pas été jugés nocifs (Ballantyne et Snellings 2007). Aucune étude cutanée à court terme n’a été trouvée pour le TEG. Deux études de 9 jours par inhalation ont été réalisées chez le rat, un niveau d’effet nocif a été déterminé dans l’une d’elles. Lors de celle-ci, les animaux étaient exposés, par le nez uniquement, à 0, 102, 517 ou 1 036 mg/m3 à raison de 6 h/jour pendant 9 jours. La concentration sans effet nocif observé (CSENO) était de 1 036 mg/m3, et reposait sur l’absence d’effets significatifs à chacune des concentrations (Ballantyne et al. 2006; OCDE 2009a, 2009c). La concentration sans effet nocif observé (CSENO) était de 1 036 mg/m3, basée sur l’absence d’effet significatif à chacune des concentrations (Ballantyne et al. 2006; OCDE 2009a, 2009c).
Une étude subchronique à dose répétée par voie orale a été réalisée avec des rats, qui ont été exposés à 0, 748-848, 1 522-1 699 ou 3 849-4 360 mg/kg pc/jour de TEG dans l’alimentation pendant 13 semaines. Une DSENO et une DMENO respectivement de 1 699 et 3 489 mg/kg pc/jour ont été déterminées, basées sur une diminution du poids corporel chez les deux sexes et un gain de poids corporel moindre chez les femelles (Ballantyne et Snellings 2007; OCDE 2009c). Lors de deux études par inhalation réalisées avec des singes pendant des périodes allant jusqu’à 13 mois, aucun effet nocif n’a été observé à des concentrations allant jusqu’à 6,14 mg/m3 (durée de l’exposition/jour non donnée) (Ballantyne et Snellings 2007; EPA 2005).
Des résumés des études chroniques par voie orale à dose répétée chez des rats ou des singes, d’une étude par voie orale continue sur la reproduction chez des souris et d’une étude sur la toxicité par voie orale du TEG pour le développement chez des rats et des souris sont fournis dans le document de référence de Santé Canada (Santé Canada 2017).
Pour les humains, aucun document sur l’ingestion orale de TEG pur n’a été trouvé. Dans les quelques cas rapportés d’ingestion, toute interprétation des effets était compliquée en raison de la présence d’autres substances (Ballantyne et Snellings 2007).
3,6,9-Trioxaundécane-1,11-diol (TTEG)
Aucune étude de toxicocinétique in vivo avec le TTEG n’a été trouvée. Tel qu’indiqué dans les documents de l’OCDE (2009a, 2009d), on peut supposer que le TTEG est métabolisé principalement par l’intermédiaire d’ADH/ALD in vivo. Bien que l’OCDE (2009a, 2009c) ne fournisse pas de valeur pour l’absorption cutanée pour le TTEG, en se basant sur des données cutanées sur le DEG non publiées soumises à Santé Canada, l’absorption cutanée du TTEG a été établie à 50 % (voir la section 7.1.2).
Pour le TTEG, trois études à court terme par voie orale (une de 14 jours et deux de 4 semaines) ont été réalisées avec des rats. Des effets liés au traitement ont été observés lors d’une seule de ces études; volume et densité de l’urine accrus chez les deux sexes et pH de l’urine moindre chez les femelles à la dose de 4 500 mg/kg pc/jour lors d’une des deux études de 4 semaines. La DSENO déterminée lors de cette étude d’exposition par gavage de 28 à 32 jours était de 3 380 mg/kg pc/jour (Healing et al. 2016).
Une étude subchronique à dose répétée par voie cutanée a été réalisée avec des rats. Les animaux étaient exposés à 0 ou environ 3 360 mg/kg pc/jour 6 h/jour, 5 jours/semaine pendant 13 semaines. Cette étude a été réalisée en suivant les directives de l’OCDE et de l’Environmental Protection Agency des États-Unis (EPA) et une large gamme de paramètres ont été étudiés. La DSENO était de 3 360 mg/kg pc/jour (OCDE 2009d).
Bien que les études de génotoxicité disponibles pour le DEG et le TEG aient mis en évidence des résultats négatifs, des tests similaires (épreuves d’aberration chromosomique in vitro et d’échange de chromatides sœurs, épreuves in vivo des niveaux de chromosome) réalisés avec le TTEG ont conduit à des résultats positifs ou équivoques. Toutefois, en se basant sur la base de données sur la génotoxicité globale et des études de type QSAR (quantitative structure-activity relationship) de la génotoxicité du TTEG, ainsi que sur des études de deux ans sur le DEG ou l’EG réalisées avec des rats et/ou des souris, l’OCDE (2009a) a conclu que les membres de type EG [EG, DEG, TEG, TTEG et pentaEG] ne sont pas considérés comme carcinogènes.
Bien qu'aucune étude standard sur la toxicité pour la reproduction ou sur la toxicité pour le développement n'ait été trouvée dans le cas du TTEG, l'OCDE (2009a) a conclu que le TTEG présente un faible potentiel de toxicité pour la reproduction, basé sur l'absence de modifications histopathologiques dans les testicules et les épididymes de rats auxquels on avait administré du TTEG pendant 14 jours ou 4 semaines.
Données sur le danger d'analogues utilisées pour la caractérisation des risques
Tel que susmentionné, en raison du manque de données sur l’absorption cutanée pour le TEG et le TTEG, les données sur l’absorption cutanée du DEG (50 %) ont été utilisées pour estimer l’absorption cutanée du TEG et du TTEG. Il n’existait pas non plus de données sur la toxicité par inhalation pour le TTEG. Toutefois, puisque ces substances ont été évaluées en tant que groupe par l’OCDE (2009a), les données sur l’inhalation pour le TEG ont été jugées appropriées pour le TTEG. Tel qu’indiqué dans le document de l’OCDE (2009a), les données sur cinq substances de type EG montrent que, au fur et à mesure que la masse moléculaire des composés de la série d’homologues augmente, le potentiel de toxicité systémique pour la reproduction ou le développement diminue. Cette tendance correspond à une décroissance probable de l’absorption lorsque la masse moléculaire augmente, bien que les données disponibles pour une comparaison directe soient limitées et non concluantes.
Bien que la seule étude par voie cutanée à dose répétée soit une étude de 13 semaines sur le TTEG avec des rats, le TTEG n’a pas été jugé adéquat pour l’obtention de données croisées pour le DEG et le TEG, car la DL50 cutanée pour le lapin augmente de 12 500 mg/kg pc pour le DEG à 22 600 mg/kg pc pour le TTEG et la base de données sur la toxicité orale montre que la sévérité des effets toxicologiques diminue quand on passe du DEG au TEG puis au TTEG pour des doses similaires.Note de bas de page 21 Les études par voie orale spécifiques d’une substance mettant en évidence des niveaux d’effets critiques (DSENO et DMENO) pour cette substance (DEG ou TEG) seront utilisées comme études de remplacement pour la toxicité cutanée lors de la caractérisation des risques posés par ces substances.
À l’opposé, bien que la toxicité aiguë et à dose répétée indique une diminution de la sévérité des effets toxicologiques quand on passe du DEG au TEG puis au TTEG, cette tendance n’est pas apparente dans le cas de la toxicité pour le développement, tel qu’indiqué dans le document de référence de Santé Canada (2017).
7.2.2 Évaluation des effets sur la santé des substances du sous-groupe des oxydes d'éthane-1,2-diol
Différents organismes internationaux (p. ex. l'OCDE et l'Agence européenne des produits chimiques [ECHA]) ont analysé et résumé les renseignements sur les effets sur la santé des substances du sous-groupe des oxydes d'éthane-1,2-diol, et ont caractérisé les risques posés par ces substances. Ces documents ont donc été utilisés pour étayer notre évaluation des effets sur la santé de ces substances, y compris le choix des niveaux d'effets pour les paramètres critiques ainsi que les DSENO/DMENO.
Données sur les effets sur la santé spécifique de la substance utilisées pour la caractérisation des risques
Ce sous-groupe comprend un monoester d'acide acétique et d'éthane-1,2-diol et deux oxydes de 3-oxapentane-1,5-diol. Dans la présente section, nous donnons les paramètres critiques et les niveaux d'effet correspondants pour le DEGEE, l'EGBEA et le DEGBE, à utiliser pour la caractérisation des risques.
2-(2-Éthoxyéthoxy)éthanol (DEGEE)
L'OCDE (2007) et le SCCP (2006a) ont fait un résumé de la littérature disponible sur les effets sur la santé du DEGEE. Nous avons fait une recherche bibliographique couvrant la période allant de l'année précédant le SIAMNote de bas de page 22 de l'OCDE (octobre 2004) à avril 2016. Nous n'avons trouvé aucune étude sur les effets sur la santé qui aurait pu conduire à des niveaux d'effet critique inférieurs à ceux identifiés par l'OCDE (2007).
Les études disponibles sur le métabolisme animal des substances du groupe des oxydes de di(éthane-1,2-diol) indiquent que la principale voie d'élimination est l'urine. On ne retrouve que de petites quantités ou des traces des métabolites dans l'air expiré ou les excréments. Les deux principaux métabolites urinaires du DEGEE, l'acide éthoxyéthoxyacétique et le DEG, sont excrétés dans les 24 premières heures. En se basant sur des données limitées, un métabolisme similaire du DEGEE devrait prendre place chez les humains (OCDE 2007).
Les données disponibles, in vitro et in vivo, suggèrent que le DEGEE n’est pas considéré comme génotoxique. Lors de deux études sur la carcinogénicité du DEGEE, aucune augmentation de la présence de tumeurs n’a été rapportée, toutefois ces études avaient des limites (voir Santé Canada 2017). La biodisponibilité orale du DEGEE chez des animaux de laboratoire a été rapportée à 79-95 % (DOW 2016b).
Le DEGEE a une faible toxicité aiguë par inhalation étant donné qu'à la concentration maximale de vapeur possible (560 mg/m3) aucun rat n'est mort après une exposition de 7 heures (OCDE 2007).
Lors d'une étude à court terme par voie orale, des rats ont été exposés à 0, 1340, 2680 ou 5360 mg/kg pc/jour de DEGEE par gavage, 5 jours/semaine pendant 6 semaines. De la mortalité a été observée à la dose la plus élevée, ainsi que la présence de sang dans l'urine. À 2680 mg/kg pc/jour, aucun effet significatif n'a été observé. Toutefois, les poids relatifs du foie, du cœur et des reins (mais pas le poids absolu de ces organes) étaient aussi plus élevés par rapport à ceux de témoins. Les modifications pathologiques incluaient une hyperkératose de l'estomac et une congestion splénique. La DSENO pour cette étude était de 1340 mg/kg pc/jour (Krasavage et Vlaovic 1982, cité dans OCDE 2007).
Lors d’une étude de 90 jours par voie orale, des porcs ont reçu 0, 167, 500 ou 1500 mg/kg pc/jour de DEGEE dans leur alimentation.Note de bas de page 23 Une grande variété de paramètres, incluant le poids corporel et des organes, des paramètres hématologiques et urinaires et une histopathologie des tissus, ont été étudiés. Une dégénérescence hydropique du foie et des tubules proximaux des reins a été observée chez une des deux femelles traitées avec 500 mg/kg pc/jour et chez tous les animaux traités avec 1 000-1 500 mg/kg pc/jour14. Le poids relatif des reins était plus élevé et la numération des globules rouges était moindre chez les mâles traités avec 1 500 mg/kg pc/jour. La DSENO a été établie à 167 mg/kg pc/jour (Gaunt et al. 1968, cité dans OCDE 2007).
Lors d’une étude de 28 jours par voie cutanée, on a administré 0, 100, 300 ou 1 000 mg/kg pc/jour de DEGEE à des lapins. Aucun signe de toxicité importante, d’effet nocif sur la santé ou de comportement anormal dû au traitement n’a été observé. La DSEO pour la toxicité systémique a été établie à 1 000 mg/kg pc/jour (Gattefosse 1994, cité dans SCCP 2006a).
En ce qui concerne l'exposition subchronique, on a administré par voie cutanée à des lapins du DEGEE à raison de 0, 99, 296, 986 ou 2957 mg/kg pc/jour, cinq jours/semaine pendant 12 semaines. Des niveaux d'azote uréique sanguin plus importants et des blessures graves aux reins ont été rapportés à 2957 mg/kg pc/jour chez un des 4 animaux ayant survécu. Des modifications mineures des reins ont aussi été observées chez 3 des 4 animaux ayant survécu, à la dose de 986 mg/kg pc/jour. En se basant sur ces effets, une DSENO a été établie à 296 mg/kg pc/jour. Toutefois, cette étude a été réalisée avec un petit nombre d'animaux et ne donnait que des renseignements limités sur les effets spécifiques. Sa fiabilité peut donc être faible (Dow Chemical Company 1950, cité dans OCDE 2007).
Une étude chronique par voie orale (DEGEE dans l’eau potable) a été réalisée avec des rats, sur trois générations (deux groupes chacun avec 8/sexe/dose : DEGEE avec 29,5 % d’éthane-1,2-diol ou DEGEE avec moins de 0,2 % d’éthane-1,2-diol – haute pureté). On a administré à ces groupes l’équivalent de 0, 10, 40, 200 ou 950 mg/kg pc/jour de DEGEE de haute pureté ou de basse pureté pendant une période allant jusqu’à 718 jours. Seuls le foie et les reins de tous les animaux ont été examinés au microscope. Des dommages aux reins et des pierres au niveau de la vessie ont été observés chez 2 des 28 animaux ayant reçu une dose de 950 mg/kg pc/jour de DEGEE de haute pureté. La DSENO pour le DEGEE de grande pureté a été établie à 200 mg/kg pc/jour. La DSENO pour le DEGEE de piètre pureté était de 10 mg/kg pc/jour, basée sur 4, 11 et 39 % de rats avec des modifications pathologiques aux doses respectives de 40, 200 et 950 mg/kg pc/jour. Bien que les effets n’aient pas été spécifiés à la dose de 40 mg/kg pc/jour, dans des sources secondaires, des dommages aux reins, des pierres dans la vessie et un gonflement trouble du foie ont été observés à 200 et 950 mg/kg pc/jour (Smyth et al. 1944, cité dans SCCP 2006a; Smyth et al. 1944, cité dans OCDE 2007). Aucune étude chronique ou subchronique par inhalation n’a été trouvée pour le DEGEE.
Dans le document de référence de Santé Canada (2017), on fournit des résumés d'une étude par voie orale des effets sur la reproduction chez des souris sur deux générations et d'études limitées sur la toxicité pour le développement chez des rats et des souris, ainsi que des résumés d'une étude de 28 jours par inhalation chez le rat et d'une étude par exposition quotidienne de souris, de lapins, de chats et de cobayes soumis à une atmosphère saturée en DEGEE.
Les études à dose répétée et les études sur la toxicité pour la reproduction et le développement réalisées avec du DEGEE (administré pendant une période allant jusqu'à deux ans) indiquent que les organes cibles (quand des effets sont observés) sont les reins et le foie.Note de bas de page 24 De plus, ces effets ont aussi été observés chez plusieurs espèces, par des voies d'exposition différentes et à des doses similaires (entre 1 000 et 2 700 mg/kg pc/jour), indiquant que des effets systémiques ont lieu principalement à des doses supérieures à 1 000 mg/kg pc/jour.
Une étude épidémiologique récente a été menée sur 204 couples mère-enfant en France en vue d’examiner l’association entre les concentrations de métabolites de l’éther de glycol dans l’urine des mères recueillie avant 19 semaines de grossesse et les capacités neurocognitives de leurs enfants 6 ans après leur naissance. Cinq métabolites ont été dosés dans l’urine. Les valeurs médianes de deux métabolites potentiels du DEGEE étaient de 0,016 mg/L pour l’acide éthoxyacétique [EAA] et de 0,028 mg/L pour l’acide éthoxyéthoxyacétique [EEAA]. Une association entre la concentration urinaire chez les mères et la note des enfants de 6 ans a été établie pour un seul des deux métabolites potentiels du DEGEE (EAA) et cette association a été observée dans un seul des quatre tests neurocognitifs administrés aux enfants de 6 ans (Béranger et al. 2017). Par conséquent, les résultats indiquant que le DEGEE peut affecter les capacités neurocognitives sont équivoques et ont une utilité limitée pour la caractérisation du risque.
Acétate de 2-butoxyéthyle (EGBEA)
L’OCDE (2006) et la CE (2006-2008a) ont fait des résumés de la littérature disponible sur les effets sur la santé de l’EGBEA, et une recherche bibliographique réalisée pour la période allant de l’année avant la parution du document de l’OCDE 2006 (août 2005) à avril 2016 n’a pas permis d’identifier de nouveaux renseignements sur les effets sur la santé. Seules des données limitées sont disponibles sur la toxicité par inhalation et la toxicité à dose répétée par voie orale ou cutanée.
La CL50 par inhalation pour l’EGBEA était supérieure à 2 660 mg/m3 chez le rat et le lapin (CE 2006-2008a). Les études à dose répétée par inhalation ont indiqué des signes d’hématotoxicité et de lésions associées chez toutes les espèces, sauf chez le cobaye, à une concentration dans l’air de 400 ppm = 2 621 mg/m3 (seule concentration testée). Toutefois, ces études comportent d’importantes limites et n’ont pas été considérées par la Commission européenne comme fiables pour une évaluation des risques (CE 2006-2008a).
Les données disponibles montrent que l’EGBEA est rapidement hydrolysé en 2‑butoxyéthanol (no CAS 111-76-2) par des estérases présentes dans le sang mammalien et d’autres tissus (Environnement Canada et Santé Canada 2002a; OCDE 2006a).Note de bas de page 25 En raison des limites des études réalisées avec l’EGBEA et puisque l’EGBEA est rapidement hydrolysé en 2-butoxyéthanol, les données sur la toxicité du 2‑butoxyéthanol ont donc été utilisées pour caractériser les risques posés par l’EGBEA.
Données sur les effets sur la santé d'analogues pour la caractérisation des risques
La CE (2006-2008b) a résumé la littérature disponible sur les effets sur la santé du 2-butoxyéthanol. Une recherche bibliographique a été faite pour la période allant de l'année avant la publication du document de la CE (2006-2008b) (août 2007) à avril 2016. Aucune nouvelle étude sur les effets sur la santé qui aurait pu conduire à des niveaux d'effet critique plus bas n'a été trouvée.
Le 2-butoxyéthanol est classé comme substance du groupe 3 (preuve inadéquate de carcinogénicité chez les humains et preuve limitée de carcinogénicité chez des animaux) par le Centre international de recherches sur le cancer (CIRC 2006). Cependant, « comme l’espèce humaine est moins sensible que les rongeurs à cette toxicité, le 2-butoxyéthanol ne devrait pas représenter un danger cancérogène dans les conditions normales de manipulation et d’utilisation » (OCDE 2006b). Les épreuves de génotoxicité in vivo et la plupart de celles in vitro suggèrent que le 2-butoxyéthanol n’est pas génotoxique.
Deux études étaient disponibles pour évaluer la toxicité cutanée à court terme du 2‑butoxyéthanol. Lors d’une étude de 9 jours, des signes de toxicité ont été observés et étaient limités à des signes transitoires d’hémolyse chez le lapin après une exposition de 9 jours à 900 mg/kg pc/jour de 2-butoxyéthanol (doses de 0, 45, 225, 450 ou 900 mg/kg pc/jour). La DSENO de 450 mg/kg pc/jour pour cette étude était basée sur des effets hématologiques (Bushy Run Research Center 1980, cité dans CE, 2006‑2008b). Afin d’évaluer les effets sur le système immunitaire, du 2-butoxyéthanol a été administré par voie cutanée à des souris, à raison de 0, 100, 500, 1 000 ou 1 500 mg/kg pc/jour pendant 4 jours. À la dose de 1 500 mg/kg pc/jour, une augmentation du poids relatif de la rate et une augmentation de la cellularité de la rate ont été observées. Aucune diminution de la prolifération de cellules B n’a été observée, alors que les lymphocytes T exhibaient une diminution statistiquement significative de la prolifération lymphocytaire aux doses de 500 et 1 000 mg/kg pc/jour. Lors de l’épreuve mixte de réponse lymphocytaire, les cellules tueuses naturelles, l’activité cytotoxique des lymphocytes T et la réponse des cellules T-dépendantes à plaques étaient inchangées après le traitement. Une DSENO de 1 000 mg/kg pc/jour a été établie, basée sur l’augmentation relative du poids de la rate à 1500 mg/kg pc/jour (Singh et al. 2001, cité dans CE 2006-2008b).
Lors d’une étude de 13 semaines, des lapins ont reçu des doses cutanées de 0, 10, 50 ou 150 mg/kg pc/jour, 5 jours/semaine. Aucun effet n’a été observé jusqu’à la dose la plus élevée (Wil Research laboratories Inc. 1983, cité dans CE 2006-2008b).
Lors d’une étude par inhalation à dose répétée de 2-butoxyéthanol (études de 1‑3 semaines, de 14 semaines et de 2 ans chez le rat et étude de 2 ans chez la souris), le principal effet constamment observé était l’hémolyse, qui a été associée occasionnellement à des effets hépatiques secondaires (pigmentation des cellules de Kupffer et augmentations absolue et relative du poids du foie) (voir Santé Canada 2017).
Lors d’une étude sur la toxicité pour le développement par gavage oral, des rates en gestation ont reçu des doses de 2-butoxyéthanol de 0, 30, 100 ou 200 mg/kg pc/jour pendant les jours de gestation (JG) 9-11 ou de 0, 30, 100 ou 300 mg/kg pc/jour durant les JG 11-13. La DSENO et la DMENO maternelles étaient respectivement de 30 et 100 mg/kg pc/jour, basées sur un poids corporel et/ou un gain de poids moindres, des poids accrus des reins et de la rate et une hématotoxicité sévère typique d’une anémie hémolytique. Tel qu’indiqué dans le document de la CE (2006-2008b), une DSENO et une DMENO ont respectivement été établies à 100 et 200 mg/kg pc/jour, basées sur une létalité fœtale accrue sans malformation. Toutefois, ces effets n’ont été observés qu’en présence de toxicité maternelle.
Lors d’une autre étude sur la toxicité pour le développement par voie orale, on a rapporté des effets sur la reproduction (nombre inférieur de femelles fertiles, diminution des portées/paires fertiles) et des effets maternels (augmentation de la mortalité des femelles, poids corporels moindres, etc.) à des doses supérieures à celles susmentionnées (CE 2006-2008b).
Bien que les niveaux d’effet les plus bas pour l’administration de 2-butoxyéthanol induisent une toxicité hémolytique chez des rongeurs, les études mécanistiques et sur la mode d’action ont montré que le métabolite du 2-butoxyéthanol, l’acide 2‑butoxyacétique, est responsable de l’hématoxicité chez les rongeurs et que les humains sont 30 fois moins sensibles que les rats à cet effet hémotoxique (CE 2006‑2008b). Des analyses complexes du mode d’action ont aussi montré que les globules rouges humains sont 40 à 150 fois moins sensibles à l’hématoxicité que ceux des rats et que, dans des conditions de susceptibilité différentes (maladies physiologiques ou sanguines), les humains sont encore résistants à la toxicité hémolytique de l’acide 2‑butoxyacétique (EPA 2010). Ceci est évident, car suite à des doses orales élevées de 2-butoxyéthanol (jusqu’à 4 500 mg/kg pc/jour) chez les humains, le principal effet toxique était une acidose métabolique et une dépression du système nerveux central, accompagnées d’une hématotoxicité (hématurie) dans certains cas (basé sur des rapports de cas chez des humains adultes ayant ingéré des produits contenant 10-35 % de 2-butoxyéthanol). La dose aiguë la plus faible conduisant à une acidose métabolique chez des humains était de 400 mg/kg pc (DMENO) (CE 2006-2008b).
Pour de plus amples renseignements sur les études décrites ci-dessus et les résumés d’autres études (études de toxicité par inhalation sur le développement chez le rat et le lapin), veuillez consulter le document de référence (Santé Canada 2017).
2-(2-Butoxyéthoxy)éthanol (DEGBE)
La CE (2000) a résumé la littérature sur les effets sur la santé du DEGBE. Nous avons réalisé une recherche bibliographique couvrant la période allant de l'année précédant la finalisation du document de la CE (2000) (juillet 1998) à avril 2016. Une seule étude potentiellement pertinente pour la caractérisation des risques a été trouvée et les renseignements sur celle-ci sont donnés ci-après.
Le DEGBE a une faible toxicité aiguë par inhalation étant donné la concentration de vapeur maximale possible (120 mg/m3 de DEGBE). Aucun rat n'est mort après une exposition de 7 heures.
Les données in vitro et in vivo disponibles suggèrent que le DEGBE n’est pas mutagène ni génotoxique (voir Santé Canada 2017).
La recherche bibliographique a permis d’identifier une étude subchronique en 2005, pour laquelle on a administré du DEGBE à des rats pendant 13 semaines à raison de 0, 50, 250 ou 1 000 mg/kg pc/jour dans l’eau potable (voir le tableau 7-8 pour des détails).
| Paramètre | Détails de l'étude | Niveau d'effet critique et paramètre pour les effets sur la santé | Référence |
|---|---|---|---|
| Exposition à dose répétée; toxicité subchronique (13 semaines) |
Espèce : rat (10/sexe/dose) Voie : orale (eau potable) Concentration et durée : 50, 250 ou 1 000 mg/kg pc/jour pendant 13 semaines |
DSENO = 250 mg/kg pc/jour DMENO = 1 000 mg/kg pc/jour Modifications de l'hématologie et des paramètres de chimie clinique. Modifications du poids du foie et des reins. Lésions histopathologiques dans le foie des femelles |
Johnson et al. 2005 |
La CE (2000) a rapporté une étude de 6 semaines et une étude de 13 semaines par voie orale (gavage) chez des rats, mais aucune DSENO n’a été établie lors de ces deux études. Pour l’étude de 6 semaines, on a utilisé de fortes doses (891 à 3564 mg/kg pc/jour) et, bien que pour l’étude de 13 semaines on ait utilisé des doses plus faibles (51 à 1630 mg/kg pc/jour), elle a été considérée de qualité limitée, car les effets observés ne correspondaient pas au profil de toxicité connu des oxydes d’éthane‑1,2‑diol (p. ex. hyperkératose de l’estomac, mortalité élevée non élucidée aux doses de 254 à 1630 mg/kg pc/jour). Nous avons donc utilisé l’étude de Johnson et al. (2005) décrite ci-dessus (tableau 7-8) pour la caractérisation des risques dus à une exposition orale.
Lors d’une étude de 13 semaines de toxicité par voie cutanée, des rats ont été exposés à 0, 200, 600 ou 2 000 mg/kg pc/jour de DEGBE, 5 jours/semaine et 6 h/jour (occlusion). Aucune mortalité ni aucun effet sur le poids corporel, le poids des organes, la pathologie ou la chimie clinique n’a été observé aux doses testées, ni effet observé dans l’analyse des paramètres neurologiques. Le DEGBE a eu des effets locaux tels qu’un érythème dont la sévérité et le déclenchement dépendaient de la concentration. La DSENO pour des effets systémiques a été établie à 2 000 mg/kg pc/jour (Auletta et al. 1993 et Beyrouty et al. 1993, cité dans CE 2000).
Le DEGBE n’est pas considéré comme dangereux par inhalation, possiblement en raison de sa faible pression de vapeur et de sa faible volatilité (Patty 1994, cité dans CE 2000). Ceci a été confirmé lors d’études par inhalation de 2 semaines, 5 semaines et 90 jours réalisées avec des rats, chez lesquels des effets ont été observés à des concentrations de vapeur ≥ 100 mg/m3 (effets sur les poumons, la rate et le foie observés lors des études de 2 et 5 semaines; lors de l’étude de 90 jours, une DSENO a été établie à 94 mg/m3, la concentration la plus élevée testée) (voir Santé Canada 2017).
Lors d’une étude sur la toxicité pour le développement par voie cutanée, on a administré à des lapines en gestation 0, 100, 300 ou 1 000 mg/kg pc/jour de DEGBE, 4 heures par jour, de la journée de gestation (JG) 7 à la JG 18 (12 jours, sans occlusion). Les animaux étaient sacrifiés le JG 29. Le poids corporel de la mère était légèrement moindre aux deux doses les plus élevées, sans toutefois que cette perte de poids soit statistiquement significative. La DSENO pour la toxicité systémique a été établie à 1000 mg/kg pc/jour (Nolen et al. 1985; CE 2000).
Lors d’une étude sur la toxicité pour la reproduction par voie cutanée sur une génération, réalisée avec des rats, aucune toxicité systémique ou pour la reproduction n’a été observée à la seule dose testée de 2 000 mg/kg pc/jour (CE 2000).
Une étude de 30 jours par voie orale et une étude sur la toxicité pour la reproduction par voie orale sur une génération chez le rat, ainsi qu’une étude de toxicité pour le développement par voie orale chez la souris sont résumées dans le document de référence (Santé Canada 2017).
Lors des études par voie orale à dose répétée chez le rat susmentionné, le DEGBE a exhibé une toxicité hémolytique à des doses ≥ 250 mg/kg pc/jour. Des études in vitro de métabolites présumés du DEGBE ont mis en évidence que les globules rouges humains sont bien moins sensibles à une hématoxicité que ceux du rat (SCCP 2006b; OCDE 2007). En se basant sur l’interprétation de la voie métabolique proposée dans SCCP (2006b), les humains sont considérés plus résistants que les rats à la toxicité hémolytique des métabolites du DEGBE (l’acide 2-butoxyacétique et l’acide butoxyéthoxyacétique).
7.2.3 Évaluation des effets sur la santé du 1,2-diméthoxyéthane
Le 1,2-diméthoxyéthane est classé dans la Classification et étiquetage harmonisés de l’Union européenne comme substance qui peut nuire à la fertilité et causer des dommages au fœtus (Repr. 1B : H360FD) et par le règlement REACH de la Commission européenne comme substance pouvant nuire à la fertilité ou au fœtus, et qu’on soupçonne être cancérogène (Union européenne 2016).
L'ECHA (2012b) a évalué le 1,2-diméthoxyéthane et a retenu la toxicité pour la reproduction ou le développement comme les effets nocifs les plus robustes et les plus sensibles pour une analyse dose-réponse. L'évaluation faite dans le cadre du NICNAS (2016a) a aussi été utilisée comme source de renseignements supplémentaires sur le 1,2-diméthoxyéthane. Le 1,2-diméthoxyéthane est métabolisé en 2-méthoxyéthanol (2-ME), puis en acide 2-méthyoxyacétique. La toxicité du 1,2-diméthoxyéthane est attribuée à ces deux métabolites (ECHA 2012b; NICNAS 2016a). Aucune étude sur la toxicocinétique du 1,2-diméthoxyéthane n'a été trouvée mais, d'après NICNAS (2016a) et ECHA (2012b), le 1,2-diméthoxyéthane et l'oxyde de bis(2-méthoxyéthyle) (no CAS 111-96-6), dont la toxicocinétique a été étudiée, sont considérés être métabolisés en suivant la même voie métabolique enzymatique et ont exhibé des produits métaboliques similaires tels que le 2-ME et l'acide 2-méthoxyacétique, seulement 2 % de la dose administrée restant dans la carcasse de la souris. Le 2-ME a été précédemment évalué par Environnement Canada et Santé Canada (2002b), et on discute des données pertinentes à la section Données sur les risques posés par des analogues pour la caractérisation des risques.
Les effets potentiels sur la santé associés au 1,2‑diméthoxyéthane sont basés sur les résultats d’études à dose répétée (effets sur le sang, le thymus, les glandes surrénales et dégénérescence des testicules) et d’études sur la toxicité pour le développement (mort fœtale et effets sur le squelette accrus et poids corporel du fœtus moindre) à des doses relativement faibles. Les données in vitro disponibles suggèrent aussi que le 1,2‑diméthoxyéthane n’est pas génotoxique. Toutefois, aucune donnée in vivo sur la génotoxicité n’était disponible (NICNAS 2016a).
Le 1,2‑diméthoxyéthane a une faible toxicité aiguë par voies orale et cutanée (DL50 > 2 000 mg/kg pc chez le lapin). Il a une toxicité aiguë faible à modérée par inhalation (CL50 entre 2 000 et 6 300 mg/m3). Aucune donnée sur la toxicité à dose répétée par voie orale ou cutanée n’a été trouvée pour le 1,2‑diméthoxyéthane.
Lors d’une étude à dose répétée par inhalation, des rats (corps complet) ont été exposés par inhalation à des vapeurs de 1,2‑diméthoxyéthane, six heures/jour, cinq jours/semaine pendant deux semaines. La DSENO et la DMENO pour cette étude ont respectivement été établies à 50 et 250 ppm (187 et 935 mg/m3), basées sur une réduction réversible des couches de cellules de l’épithélium séminifère chez les mâles. À l’opposé, lors d’une étude similaire avec des lapins exposés (corps complet) par inhalation, des modifications irréversibles de l’épithélium séminifère des testicules avaient lieu à la dose de 935 mg/m3 (ECHA 1986a, 1986b, 2012a, 2012b).
Lors d’une étude sur la toxicité pour le développement, des rates en gestation ont été exposées par gavage oral à du 1,2‑diméthoxyéthane pendant les JG 8 à 18. Aux doses supérieures à 120 mg/kg pc/jour, une mortalité fœtale de 100 % a été observée. Aux doses de 30 et 60 mg/kg pc/jour, des effets fœtotoxiques ont aussi été observés. Une DMENO de 30 mg/kg pc/jour a donc été établie, basée sur une fréquence accrue des petits mort-nés et d’œdèmes fœtaux et sur une durée de gestation plus longue. Une DSENO maternelle a été établie à 60 mg/kg pc/jour, basée sur des gains de poids corporel moindres (en partie dus à des décès prématurés) aux doses de 120 à 1000 mg/kg pc/jour (Leonhardt et al. 1991, cité dans ECHA 2012b).
Lors d’une étude plus ancienne sur la toxicité pour le développement, des rates en gestation ont été exposées à du 1,2‑diméthoxyéthane par inhalation (corps complet) 6 h/jour pendant le JG 7 à 16 (10 jours). Des résorptions fœtales ainsi qu’une ossification retardée et d’autres effets sur le fœtus (vertèbres thoraciques et lombaires fragmentées, malformations des côtes, urètre plus large, sang dans le péricarde, etc.) ont été observés à 32 et 100 ppm (120 et 374 mg/m3). Une mort fœtale ainsi que d’autres effets sur le fœtus (malformations des extrémités, poids corporel moindre, etc.) ont été observés à la dose la plus élevée de 100 ppm (374 mg/m3). La DSENO et la DMENO pour la toxicité pour le développement ont été établies respectivement 10 et 32 ppm (37 et 120 mg/m3), basées sur un développement retardé et une incidence accrue de malformations. Une DSENO maternelle de 100 ppm (374 mg/m3) a aussi été établie (ECHA 1988a, 2012b). Lors d’une étude similaire réalisée au même moment, des lapines en gestation ont été exposées à du 1,2‑diméthoxyéthane par inhalation (corps complet) 6 h/jour pendant les JG 6 à 18 (13 jours), avec une période de récupération de 10 jours. À la dose la plus élevée de 50 ppm (187 mg/m3), la vitalité des portées dans les 24 premières heures suivant une césarienne était considérablement réduite et des anomalies chez plusieurs fœtus ont été notées (orientation anormale des avant-pattes, malformations du crâne et irrégularités de l’ossification, taches aux bords rouges sur la peau). Une DSENO et une DMENO pour la toxicité pour le développement ont respectivement été établies à 16 et 50 ppm (60 et 187 mg/m3), basées sur une vitalité moindre des petits et des anomalies du fœtus. Une DSENO et une DMENO maternelles ont respectivement aussi été établies à 16 et 50 ppm (60 et 187 mg/m3), basées sur une consommation alimentaire légèrement moindre aux deux concentrations (ECHA 1988a, 1988b; ECHA 2012b). Bien que cette étude par inhalation avec des lapins suggère que les effets sur le fœtus et sur la mère sont observés aux mêmes doses, des effets sur le fœtus (incidence accrue de malformations et ossification retardée) ont été observés à 120 mg/m3 en l’absence d’effet sur la mère lors de l’étude par inhalation avec des rats.
Données sur les effets sur la santé d'analogues pour la caractérisation des risques
Comme susmentionné, le 1,2-diméthoxyéthane est métabolisé en 2-ME, puis en acide 2-méthoxyacétique, et sa toxicité est attribuée à ces deux métabolites (ECHA 2012b; NICNAS 2016a). Ceci appuie l'utilisation du 2-ME comme analogue pour l'évaluation de la toxicité du 1,2-diméthoxyéthane et est aussi appuyé par des soumissions faites à l'EPA (Ferro Corporation 2002.Note de bas de page 26 Le 2-ME a été précédemment évalué par Environnement Canada et Santé Canada (2002b) et NICNAS (2016b).
Comme indiqué dans le document du NICNAS (2016b), le 2-ME et d’autres composés chimiques du groupe des alcoxyéthanols et des acétatesNote de bas de page 27 sont bien absorbés par toutes les voies d’exposition. L’absorption par la peau exposée est considérée être une source importante d’exposition chez les humains exposés aux vapeurs. Une fois absorbés, ces composés chimiques sont distribués dans tout le corps, y compris dans le fœtus en développement. Ceci peut potentiellement conduire à des niveaux de métabolites plus élevés dans le fœtus que ceux observés chez des femmes en gestation.Note de bas de page 28 Les alcoxyéthanols et les acétates sont très largement métabolisés, la majorité étant excrétée dans l’urine.
Le 2-ME n’est pas mutagène in vitro, mais il existe des preuves qu’il peut être clastogène, et des preuves convergentes que le métabolite initial, le 2‑méthoxyacétaldehyde, est génotoxique pour plusieurs lignées de cellules. De même, le principal métabolite, l’acide 2-méthoxyacétique, n’était pas mutagène in vitro, mais conduisait la plupart du temps à des résultats positifs lors de différentes épreuves de clastogénicité. Des études in vivo suggèrent que le 2-ME n’est pas génotoxique pour des cellules somatiques, mais il existe des preuves qu’il provoque des dommages génétiques aux cellules germinales mâles chez le rat à des doses supérieures à 500 mg/kg pc/jour (Environnement Canada, Santé Canada 2002b).
Un certain nombre d’études sur la toxicité à dose répétée avec le métabolite, le 2-ME, sont disponibles. Il a été montré que le 2-ME cause des effets nocifs sur le système reproducteur mâle chez plusieurs espèces, par toutes les voies d’exposition. Des effets sur le système reproducteur femelle ont aussi été rapportés (modifications du cycle d’ovulation et des niveaux d’hormones ainsi que des modifications histopathologiques des ovaires) (Environnement Canada, Santé Canada 2002b). Lors des deux études de 13 semaines par inhalation réalisées avec des rats ou des lapins, une DMENO de 93 mg/m3 a été établie pour celle avec les lapins, basée sur des effets sur les testicules (dégénérescence liée à la dose des testicules et poids des testicules), alors qu’une DMENO de 933 mg/m3 a été établie pour celle avec les rats, basée sur des effets dégénératifs sur les testicules, mais la DSENO et la DMENO globales étaient respectivement de 93 et 311 mg/m3, basées sur des poids corporels moindres des femelles (Miller et al. 1983; Environnement Canada, Santé Canada 2002b). Ces études indiquent que le lapin était plus sensible que le rat à la toxicité testiculaire du 2-ME.
Tel qu’indiqué ci-après, le 2-ME provoque des effets nocifs sur le développement en l’absence de toxicité pour la mère, chez plusieurs espèces et par toutes les voies d’exposition. Des effets sur le développement ont généralement été observés à des doses inférieures à celles observées pour d’autres effets hématologiques et sur la reproduction. De plus, le lapin est plus sensible que les espèces de rongeurs à la toxicité pour le développement du 2-ME (Environnement Canada, Santé Canada 2002b).
Lors d’une étude sur la toxicité pour le développement, des lapines en gestation ont été exposées quotidiennement par inhalation (corps complet) pendant les JG 6 à 18 (13 jours), puis sacrifiées au JG 29. Des effets tératologiques importants (malformations externes, viscérales et du squelette) et un poids corporel du fœtus moindre ont été observés à la dose de 156 mg/m3. Les variations du squelette (ossification retardée du sternum) étaient nettement accrues chez les fœtus des animaux exposés à 31 et 156 mg/m3. La DSENO et la DMENO pour une ossification retardée étaient respectivement de 9 et 31 mg/m³. La DMENO, basée sur des malformations du fœtus, était de 156 mg/m3 (Hanley et al. 1984a, 1984b; Environnement Canada, Santé Canada 2002b).
Hanley et al. (1984a, 1984b) ont aussi réalisé des études sur la toxicité pour le développement par inhalation avec des rats et des souris, en utilisant les mêmes concentrations de 2-ME que celles utilisées pour l’étude avec les lapins. Lors de l’étude avec les rats (corps complet des femelles en gestation exposé), une augmentation des variations du squelette (aiguillons lombaires et ossification retardée des vertèbres) a été observée chez les fœtus des animaux exposés à 156 mg/m3. Lors de l’étude avec les souris (corps complet des femelles en gestation exposé), une augmentation de l’hypoplasie testiculaire et des variations du squelette (côtes lombaires supplémentaires) ont été observées chez les fœtus des animaux exposés à 156 mg/m3. Des diminutions transitoires du gain de poids corporel maternel chez les rats, les souris et les lapins exposés à la dose la plus élevée (156 mg/m3) étaient les seuls signes cohérents d’effets sur la mère (Hanley et al. 1984a, 1984b; Environnement Canada, Santé Canada 2002b).
Lors d’une étude réalisée par Nelson et al. (1984), des rats mâles ont été exposés à 0 ou 78 mg/m3 de 2-ME, 7 h/jour, 7 jours/semaine pendant 6 semaines, alors que des femelles ont été exposées durant les JG 7-13 ou 14-20. Les mâles exposés étaient ensuite accouplés avec des femelles non exposées et on a laissé toutes les femelles mettre bas normalement. Des groupes choisis de petits/portées ont subi des tests de comportement neuromoteur et des analyses neurochimiques de leurs cerveaux. Aucun signe de toxicité n’a été observé chez les parents mâles ou femelles exposés. Chez les petits exposés à 78 mg/m3, des modifications neurochimiques (différences significatives des niveaux d’acétylcholine, de dopamine, de norépinéphrine et de 5-hydroxytryptamine dans les cerveaux des petits âgés de 21 jours) et des effets comportementaux ont été observés (Environnement Canada, Santé Canada 2002b).
Les études de toxicité pour le développement par inhalation susmentionnées conduisent à une DMENO de 31 mg/m3 (et une CSEO correspondante de 9 mg/m3) pour une incidence accrue de variations du squelette chez les fœtus de lapin, qui est aussi mentionnée dans le document d’Environnement Canada et Santé Canada (2002b). Cette incidence accrue des variations du squelette survenait en l’absence de toxicité maternelle. Des incidences accrues de variations du squelette ont été observées à 156 mg/m3 lors d’études sur la toxicité pour le développement par inhalation réalisées avec des rats ou des souris, mais pas à 31 mg/m3. En ce qui concerne les malformations du fœtus, des incidences accrues de cet effet ont été observées à 156 mg/m3 chez des lapins et des souris. Bien que le 2-ME ne semble pas faire augmenter l’incidence de malformations du fœtus à 156 mg/m3 chez le rat, lors d’une étude indépendante sur la toxicité sur le développement par inhalation de 1,2-diméthoxyéthane, une incidence accrue de malformations (urètre plus grand et malformations du squelette) et une ossification retardée ont été observées à 120 mg/m3 chez des fœtus de rat. Ces effets survenaient en l’absence de toxicité maternelle.
Les études sur la toxicité pour le développement par inhalation étaient basées sur des protocoles d’exposition de femelles en gestation à la substance 6 h/jour pendant 10 ou 13 jours au cours de la gestation. Toutefois, tel que susmentionné, des effets ont aussi observés chez des petits de rates exposées à une seule concentration de 2-ME pendant une période plus courte, 7 jours à raison de 7 h/jour, à une concentration de 78 mg/m3. Bien que les paramètres de nécropsie et histopathologiques n’aient pas été étudiés lors de cette étude, les renseignements limités suggèrent qu’une courte exposition du fœtus in utero pendant la gestation (7 jours) peut conduire à des effets neurochimiques sur le cerveau.
Pour de plus amples renseignements sur les études décrites ci-dessus et les résumés d’autres études (étude de toxicité de 13 semaines par l’eau de boisson chez le rat, étude de toxicité cutanée de 28 jours chez le rat, étude de toxicité cutanée de 13 semaines chez le cobaye), veuillez consulter le document de référence (Santé Canada 2017).
Études avec des humains - 2-ME
Des effets sur le sang, la moelle osseuse et le sperme ont été observés chez des travailleurs exposés à du 2-ME par inhalation ou contact cutané. Ces effets incluaient une prévalence d’anémie, une incidence accrue de leucopénie et une hypoplasie de la moelle osseuse. Des données indiquant une association entre les expositions au composé chimique et des effets nocifs sur la reproduction et le développement (production de sperme réduite, modifications de la morphologie du sperme, avortement spontané et malformations congénitales) étaient aussi disponibles. Alors que des facteurs de confusion comme une exposition à d’autres composés chimiques ne peuvent pas être éliminés (toutes les populations étudiées étaient aussi exposées à d’autres solvants de type oxyde d’éthane-1,2-diol), ces observations correspondent à celles faites lors d’expériences avec des animaux (Environnement Canada, Santé Canada 2002b).
Une étude épidémiologique récente a été menée sur 204 couples mère-enfant en France en vue de déterminer l’association entre les concentrations de métabolites d’éther de glycol dans l’urine des mères recueillie avant la 19e semaine de gestation et les capacités neurocognitives de leurs enfants de 6 ans. Cinq métabolites ont été dosés dans l’urine et la valeur médiane obtenue pour le métabolite potentiel de 2-ME était de 0,062 mg/L pour l’acide méthoxyacétique [MAA]. Aucune association n’a été établie entre la concentration de ce métabolite dans l’urine des mères et les notes des enfants de 6 ans aux quatre tests neurocognitifs (Béranger et al. 2017).
7.3 Caractérisation des risques pour la santé humaine
7.3.1 Caractérisation des risques pour la santé humaine posés par les substances du sous-groupe des éthane-1,2-diols
Comme mentionné à la section 7.1, les milieux de l’environnement et les aliments ne devraient pas être des sources significatives d’exposition aux substances de ce sous‑groupe. L’exposition devrait survenir principalement à partir de peintures et revêtements, de cosmétiques et de produits sans ordonnance, d’assainisseurs d’air et de produits de nettoyage domestiques. Les études par voie cutanée ou par inhalation disponibles, bien que limitées, ont été utilisées pour caractériser les risques quand cela était possible. Toutefois, des niveaux d’effets critiques subchroniques et à court terme par voie orale ont aussi été utilisés pour caractériser les risques par voie cutanée.
Dans les tableaux ci-après, nous donnons toutes les expositions pertinentes (scénarios pour les produits sentinelles) pour toutes les voies et toutes les durées, ainsi que les valeurs d’effet critique pour les substances du sous-groupe des EG, ainsi que les marges d’exposition (ME) en découlant.
| Scénario d'exposition | Concentration d’exposition | Niveau d'effet critique | Paramètre critique de danger | Marge d'exposition (ME) |
|---|---|---|---|---|
| Exposition cutanée aiguë due à de la peinture à l'eau à appliquer au rouleau | Exposition cutanée aiguë (interne) = 0,25 mg/kg pc | DSENO = 850 mg/kg pc/jour, basée sur une étude de 32 jours par gavage de rats | Aucun effet significatif (à la dose la plus élevée) | 3 400 |
| Exposition cutanée quotidienne due à du shampooing antibactérien | Exposition cutanée interne quotidienne = 0,027 mg/kg pc/jour | DSENO = 1 200 mg/kg pc/jour, basée sur une étude de 90 jours à 2 ans par gavage de rats | Calculs de la vésicule biliaire chez les mâles à 2 300 mg/kg pc/jour | 44 450 |
| Exposition aiguë par inhalation par de la peinture à l’eau à appliquer au rouleau | Exposition aiguë par inhalation = 0,269 mg/m3 | CSEO = 3 000 mg/m3 (étude de 9 jours par inhalation avec des rats) | Modifications des paramètres hématologiques et de chimie clinique à 5 000 mg/m3 | 11 150 |
| Concentration moyenne sur 24 heures par le DEG dans du nettoyant pour salle de bains | Concentration moyenne sur 24 heures = 2,92 mg/m3 | CSEO = 3 000 mg/m3 basée sur une étude de 9 jours par inhalation avec des rats | Modifications des paramètres hématologiques et de chimie clinique à 5 000 mg/m3 | 1 000 |
| Scénario d'exposition | Concentration d’exposition | Niveau d'effet critique | Paramètre critique de danger | Marge d'exposition (ME) |
|---|---|---|---|---|
| Exposition cutanée aiguë due à de la peinture à l'eau à appliquer au rouleaua | Exposition cutanée aiguë (interne) = 1,02 mg/kg pc | DSENO = 5 916 mg/kg pc/jour, basée sur une étude de 14 jours par gavage de rats | Aucun effet significatif à la dose la plus élevé | 5 800 |
| Exposition aiguë par inhalation due à de la peinture à l'eau à appliquer au rouleau | Exposition aiguë par inhalation = 0,269 mg/m3 | CSENO = 1 036 mg/m3 de TEG, basée sur une étude de 9 jours par inhalation avec des rats | Aucun effet significatif à la concentration la plus élevée | 3 850 |
| Exposition cutanée quotidienne due à de la crème pour le corps | Exposition cutanée quotidienne (interne) = 0,1 mg/kg pc/jour | DSENO = 1 699 mg/kg pc/jour, basée sur une étude de 13 semaines par gavage avec des rats | Poids corporels moindres, pH de l'urine plus bas et poids des reins accru à 3 489 mg/kg pc/jour | 16 990 |
| Concentration moyenne sur 24 heures due à un assainisseur d'air (pulvérisation) | 1,87 mg/m3 | DSENO = 1 036 mg/m3 basée sur une étude de 9 jours par inhalation avec des rats | Aucun effet significatif à la concentration la plus élevée | 550 |
| Scénario d'exposition | Concentration d'exposition | Niveau d'effet critique | Paramètre critique de danger | Marge d'exposition (ME) |
|---|---|---|---|---|
| Exposition cutanée aiguë due à de la peinture à l'eau à appliquer au rouleaua | Exposition cutanée aiguë (interne) = 1,02 mg/kg pc | DSENO = 3 380 mg/kg pc/jour, basée sur une étude de 28-32 jours avec des rats alimentés par gavage | Volume et densité de l'urine accrus et pH de l'urine plus bas à 4 500 mg/kg pc/jour | 3 310 |
| Exposition aiguë par inhalation due à de la peinture à l'eau à appliquer au rouleaua | Exposition aiguë par inhalation = 0,269 mg/m3 | DSENO = 1 036 mg/m3 de TEGb basée sur une étude de 9 jours par inhalation avec des rats | Aucun effet significatif à la concentration la plus élevée. Donnée croisée tirée de la CSENO pour le TEG chez le rat | 3 850 |
a En utilisant la concentration maximale de TEG (4 %) en remplacement.
b L’étude de 9 jours par inhalation avec des rats et l’étude de 13 semaines par voie orale avec des rats, en utilisant du TEG, ont aussi été utilisées en remplacement pour contribuer à déterminer les risques posés par le TTEG dus à des expositions par inhalation à des peintures et revêtements.
Les ME susmentionnées sont considérées adéquates pour tenir compte des incertitudes des bases de données sur l’exposition et les effets sur la santé.
Pour le scénario de peinture (voir les tableaux 7-9 à 7-11), une comparaison entre les DSENO et CSE(N)O pertinentes et les estimations des expositions par inhalation ou par voie cutanée conduit à des ME d’environ 3 400 à 11 150 pour les substances de ce sous‑groupe.
Pour les cosmétiques et les produits sans ordonnance (crème pour le corps et shampooing antibactérien; voir les tableaux 7-9 et 7-10), la comparaison entre les DSENO pertinentes et les estimations d’exposition cutanée conduit à des ME de 16 990 à 44 450 pour les substances de ce sous-groupe. Pour les produits de nettoyage domestiques (assainisseurs d’air et nettoyants pour salle de bains; voir les tableaux 7-9 et 7-10), une comparaison entre les DSENO et les estimations d’exposition par inhalation conduit à des ME de 550 à 1 000. Une ME de 550 a été déterminée pour le scénario d’exposition aiguë à un assainisseur d’air en utilisant le TEG quand la concentration moyenne sur 24 heures était comparée à la CSENO de 1 036 mg/m3 tirée de l’étude de 9 jours par inhalation (par le nez uniquement) avec des rats. Cette CSENO par inhalation résultant d’expositions pendant 9 jours conduit à une ME prudente et protectrice quand elle est comparée à la concentration moyenne de 1,87 mg/m3 (basée sur la concentration maximale de TEG dans les assainisseurs d’air).
Pour tous les autres produits et tous les autres scénarios d’exposition étudiés, les ME déterminées étaient supérieures à celles présentées dans les tableaux ci-dessus et sont donc considérées adéquates pour tenir compte des incertitudes des bases de données sur l’exposition et les effets sur la santé.
7.3.2 Caractérisation des risques pour la santé humaine posés par les substances du sous-groupe des oxydes d'éthane-1,2-diol
Comme mentionné à la section 7.1, les milieux de l’environnement et les aliments ne devraient pas être des sources significatives d’exposition aux substances de ce sous‑groupe. L’exposition devrait principalement être due à des cosmétiques, à des produits pour le bricolage (produit d’étanchéité pour les planchers, peinture à l’eau à appliquer au rouleau) et à des produits de nettoyage domestiques. L’exposition due à la mise en bouche de jouets a aussi été prise en compte pour la caractérisation des risques. Des études par voie cutanée, orale ou par inhalation ont été utilisées pour caractériser les risques. Pour l’exposition cutanée, des études par voie orale ont aussi été utilisées dans certains cas.
Dans les tableaux ci-après, nous donnons toutes les expositions pertinentes (produits conduisant à l’exposition la plus élevée par différentes voies et pour différentes durées) et les valeurs de danger pour les substances du sous-groupe des EGE, ainsi que les ME en découlant.
| Scénario d'exposition | Concentration d'exposition | Niveau d'effet critique | Paramètre critique de danger | Marge d'exposition (ME) |
|---|---|---|---|---|
| Exposition quotidienne par voie orale due à la mise en bouche de jouets | 0,018 9 mg/kg pc/jour | DSENO = 167 mg/kg pc/jour (étude de 90 jours par voie orale avec des porcs) |
Effets sur le foie et les reins chez les femelles à 500 mg/kg pc/jour | 8 840 |
| Exposition aiguë par voie cutanée due à du colorant capillaire | 4,2-14,0 mg/kg pc (exposition externe) 2,1 - 7,0 mg/kg pc/jour (exposition interne) |
DSEO = 1 000 mg/kg pc/jour (étude de 28 jours par voie cutanée avec des lapins) DSENO = 1 340 mg/kg pc/jour (étude de 6 semaines par voie orale avec des rats |
Aucun effet Modifications pathologiques limitées et modifications du poids des organes à 2 680 mg/kg pc/jour | Aucune ME déterminée 191-638 |
| Exposition cutanée quotidienne due à du déodorant/anti-sudorifique | 1,1-3,4 mg/kg pc/jour [exposition externe] 0,55-1,7 mg/kg pc/jour [exposition interne] |
DSENO = 296 mg/kg pc/jour [étude de 12 semaines par voie cutanée avec des lapins] DSENO = 200 mg/kg pc/jour [étude de 2 ans par voie orale avec des rats] |
Effets sur le foie et les reins à 986 mg/kg pc/jour Effets sur la vessie et les reins à 950 mg/kg pc/jour |
87-269 118-364 |
| Scénario d'exposition | Concentration d’exposition | Niveau d'effet critique | Paramètre critique de danger | Marge d'exposition (ME) |
|---|---|---|---|---|
| Exposition cutanée aiguë due à du nettoyant pour vitres | 0,23 mg/kg pc
|
DSENO = 1 000 mg/kg pc/jour DSENO maternelle = 30 mg/kg pc/jour |
Augmentation relative du poids de la rate à 1 500 mg/kg pc/jour
Poids et/ou gain de poids corporel moindre, poids des reins et de la rate accrus, sévère hématotoxicité chez les rates à 100 mg/kg pc/jour |
4 350
|
| Scénario d'exposition | Concentration d’exposition | Niveau d'effet critique | Paramètre critique de danger | Marge d'exposition [ME] |
|---|---|---|---|---|
| Exposition orale quotidienne due à la mise en bouche de jouets | 0,016 7 mg/kg pc/jour | DSENO = 250 mg/kg pc/jour [étude de 13 semaines par voie orale avec des rats] |
Effets sur le foie et les reins à 1 000 mg/kg pc/jour | 14 970 |
| Exposition cutanée aiguë due à du colorant capillaire | 4,2 mg/kg pc/jour (exposition externe) |
DSENO = 1000 mg/kg pc/jour [étude de 12 jours par voie dermale de la toxicité pour le développement avec des lapins] |
Aucun effet | 238 |
| Exposition cutanée quotidienne due à du maquillage pour le visage | 2,8 mg/kg pc/jour (exposition externe) |
DSENO = 2 000 mg/kg pc/jour [étude de 13 semaines par voie cutanée avec des rats] |
Aucun effet | 714 |
Pour le scénario avec des jouets [voir les tableaux 7-12 et 7-14], une comparaison entre les DSENO pertinentes et les estimations les plus élevées d'exposition par voie orale conduit à une ME d'environ 8 840 à 14 970 pour ce sous-groupe.
Pour les scénarios avec des cosmétiques [colorant capillaire, antisudorifique/déodorant et maquillage pour le visage; voir les tableaux 7-12 et 7-14], une comparaison entre les DSENO pertinentes et les estimations de l’exposition cutanée conduit à des ME allant de 87 à 714. Les ME inférieures à 100 concernent des produits contenant du DEGEE uniquement. Toutefois, ces marges d’exposition sont considérées acceptables pour trois raisons : 1) les études par voir cutanée ou orale utilisées pour le scénario d’exposition quotidienne à du déodorant/antisudorifique ont toutes deux mis en évidence des effets à des doses proches de 1 000 mg/kg pc/jour, indiquant que les ME basées sur des DSENO bien plus faibles établies lors de ces études (200 et 296 mg/kg pc/jour) sont prudentes; 2) tel qu’indiqué dans la section Effets sur la santé, les effets systémiques observés chez plusieurs espèces et pour différentes voies d’exposition ont lieu principalement à des doses supérieures à la dose limite de 1 000 mg/kg pc/jour de DEGEE; 3) pour le scénario d’exposition aiguë par voie cutanée à du colorant capillaire, la CSEO de 1 000 mg/kg pc/jour établie lors de l’étude à court terme par voie cutanée avec des lapins correspondait à la dose la plus élevée testée, c’est-à-dire la dose limite, et aucune DSENO n’a donc été établie. Quand on a utilisé des données d’une étude à court terme par voie orale avec des rats et des expositions internes qui tenaient compte de l’absorption cutanée pour un tel scénario, la ME était ≥ 191. Les faits indiquent donc que les risques d’exposition aiguë et cutanée quotidienne sont faibles pour le DEGEE.
Pour les produits de nettoyage domestiques (voir le tableau 7-13), une comparaison entre les DSENO pertinentes et les estimations de l’exposition cutanée conduit à des ME allant de 429 à 4 350 pour l’EGBEA.
Tous les autres produits et tous les autres scénarios conduisent à des ME acceptables, supérieures aux ME (comparable au niveau durée et voie d’exposition) présentées dans les tableaux ci-dessus.
En ce qui concerne les concentrations dans l’air modélisées et les expositions par inhalation, les nettoyants pour salle de bains, les nettoyants pour vitres et les produits d’étanchéité pour le plancher ne se sont pas utilisés fréquemment et leur étiquetage comporte toujours des directives claires (en particulier dans le cas des produits d’étanchéité pour le plancher).
De plus, comme mentionnées dans la section Évaluation de l’exposition, les concentrations pics mesurées dans l’air (juste après l’utilisation d’un nettoyant pour salle de bains) sont comparables aux concentrations moyennes sur 24 heures modélisées, indiquant la prudence du modèle d’inhalation ConsExpo pour cet ensemble spécifique de substances. Toutefois, les EGE ne sont pas considérés dangereux par inhalation, en raison en partie de leur faible volatilité et de leur faible pression de vapeur (Patty 1994, cité dans CE 2000). De plus, aucun effet nocif n’ayant été observé lors d’études sur la toxicité aiguë et des effets limités ayant été observés lors d’études à plus long terme tendent aussi à indiquer une faible toxicité du DEGEE et du DEGBE aux concentrations de vapeur maximales atteignables. Pour l’EGBE (le métabolite de l’EGBEA), des effets maternels et sur le développement ont été observés à 483 mg/m3 (CSENO = 242 mg/m3). Il existe une faible probabilité que la population générale soit exposée à la concentration de vapeur maximale atteignable pendant une longue période. Étant donné ces remarques, le risque posé par l’inhalation devrait donc être faible, et des ME n’ont pas été établies pour ces produits.
Toutes les expositions présentées ci-dessus sont donc considérées avoir des ME adéquates pour tenir compte des incertitudes des bases de données sur l’exposition et les effets sur la santé.
7.3.3 Caractérisation des risques pour la santé humaine posés par le 1,2 diméthoxyéthane
Tel que mentionné dans ECHA (2012b), la toxicité pour la reproduction du 1,2-diméthoxyéthane est considérée être le résultat de la présence de ses métabolites, le 2-ME puis l'acide 2-méthoxyacétique.
Comme mentionné à la section 7.1, l'air intérieur et l'utilisation d'assainisseurs d'air constituent les principales sources d'exposition. Dans les tableaux ci-après, nous fournissons toutes les expositions pertinentes (produits responsables des expositions les plus importantes par différentes voies et pour différentes durées) et les valeurs des risques associés au 1,2-diméthoxyéthane et au 2-ME, ainsi que les ME en découlant.
Comme mentionné à la section 7.2.3, une ossification retardée a été observée après administration d’une dose de 31 mg/m3 de 2-ME à des fœtus de lapins. D’un autre côté, des malformations du foetus ont été observées après administration de 1,2-diméthoxyéthane et de 2-ME à des rats, des souris ou des lapins à des doses plus élevées, 120-156 mg/m3. Étant donné que l’ossification retardée (à la dose plus faible) n’a été observée que chez le lapin et que les malformations ont été observées chez trois espèces (à des doses plus élevées), des ME ont été déterminées pour les deux effets.
| Scénario d'exposition | Concentration d'exposition | Niveau d'effet critique | Paramètre critique de danger | Marge d'exposition (ME) |
|---|---|---|---|---|
| Air intérieur | 0,013 mg/m3 (1,2-diméthoxy-éthane) |
CSEO = 9 mg/m3 DSENO = 37 mg/m3 |
Variations du squelette (ossification retardée du sternum) chez le fœtus à 31 mg/m3 lors d'une étude sur la toxicité pour le développement avec des lapins
|
823
2 850 |
a Note: les malformations du fœtus ont été observées à 156 mg/m3 après administration de 2-ME. Sur une base molaire, 31 mg/m3de 2-ME équivalent à 37 mg/m3 de 1,2-diméthoxyéthane :
0,037 g/90,12 g/mol ≈ 0,000 41 mol = 0,41 mmol ≈ 10 ppm.
0,031 g/76,09 g/mol ≈ 0,000 41 mol = 0,41 mmol ≈ 10 ppm.
Pour évaluer les risques posés par le 1,2‑diméthoxyéthane et son métabolite, le 2-ME, nous avons pris en compte les CSE(N)O observées lors d’études sur la toxicité pour le développement avec du 2-ME (9 mg/m3) et du 1,2‑diméthoxyéthane (37 mg/m3). Cette approche est considérée protectrice pour les sous-populations susceptibles (femmes en gestation, fœtus et nouveaux-nés) et rendre compte des effets sur le système reproducteur mâle observés lors de différentes études avec des animaux (CSENO = 93 mg/m3 pour le 2-ME; CSENO = 935 mg/m3 pour le 1,2‑diméthoxyéthane). En se basant sur les concentrations de 1,2‑diméthoxyéthane dans l’air intérieur, une comparaison avec les CSE(N)O pertinentes conduit à des ME de 823 à 2 850. Toutefois, il est bon de noter que l’étude sur la toxicité pour le développement par inhalation avec des lapins a mis en évidence des effets sur le fœtus à 156 mg/m3, alors que les variations du squelette observées à 31 mg/m3 de 2-ME sont d’une importance biologique inconnue. Comme susmentionnée, l’utilisation d’une CSEO (9 mg/m3) pour cette étude est considérée protectrice des populations susceptibles. L’étude sur la toxicité pour le développement par inhalation avec des rats réalisée avec du 1,2‑diméthoxyéthane a mis en évidence des effets sur le squelette et les viscères du fœtus à 120 mg/m3, et la ME résultante pour le scénario avec l’air intérieur basée la CSENO de cette étude était supérieure à 2 800. Les ME établies sont donc très prudentes.
Les concentrations des produits modélisées (voir la section Évaluation de l'exposition) étaient inférieures aux concentrations dans l'air intérieur rapportées. Des ME pour ces scénarios n'ont donc pas été établies. En se basant sur les CSE(N)O les plus faibles pour le 1,2-diméthoxyéthane et le 2-ME, toutes les ME calculées sont considérées adéquates pour tenir compte des incertitudes des bases de données sur l'exposition et les effets sur la santé.
Un des métabolites du 1,2-diméthoxyéthane, le 2-ME, a déjà fait l’objet d’une évaluation par Environnement Canada et Santé Canada (2002b), et il a été déterminé qu’il présente un potentiel de risque élevé en raison de la gamme d’effets nocifs observés lors d’études avec des animaux, y compris de toxicité pour le développement. En conséquence, il est actuellement inscrit à l’Annexe 1 (Liste des substances toxiques) de la LCPE 1999. Bien que l’exposition de la population générale au 1,2-diméthoxyéthane ne soit pas inquiétante aux niveaux actuels, elle pourrait potentiellement avoir des effets préoccupants sur la santé au cas où les concentrations de son métabolite, le 2-ME, venaient à augmenter.
7.4 Incertitudes de l'évaluation des risques pour la santé humaine posés par les oxydes d'éthane-1,2-diol
Les sources clés d'incertitude sont présentées dans le tableau suivant.
| Source clé d'incertitude | Impact |
|---|---|
| Extrapolation d'une voie à une autre des études sur la toxicité par voie orale pour les expositions cutanées |
+ |
| Utilisation d'études subchroniques pour les expositions à long terme (en raison du manque d’études de toxicité chronique) | - |
| Importance des variations du squelette comme paramètre pour les effets nocifs sur le développement dans le cas du 1,2-diméthoxyéthane | + |
+ = incertitude sur le potentiel à causer une surestimation de l'exposition/risque; - = incertitude sur le potentiel à causer une sous-estimation de l'exposition/risque; +/- = potentiel inconnu à causer une surestimation ou une sous-estimation du risque
Dans la base de données sur les effets sur la santé, il n’y avait aucune étude chronique pour la plupart des oxydes d’éthane-1,2-diol. L’extrapolation d’études subchroniques ou avec une seule voie d’exposition à une autre voie d’exposition en raison du manque d’étude appropriée par voie cutanée et/ou par inhalation peut aussi contribuer à une certaine incertitude. Toutefois, dans le cas des études sur la toxicité par voie cutanée, il n’y avait aucune preuve d’effet sur la santé aux doses inférieures à la dose limite de 1000 mg/kg pc/jour pour les éthane-1,2-diols et les oxydes d’éthane‑1,2-diol (TTEG, DEGEE, DEGBE, EGBEA).
Dans le cas du 1,2-méthoxyéthane, des effets sur le développement dus à une exposition par inhalation de 1,2-méthoxyéthane ou de 2-ME surviennent à des concentrations de 120 à 156 mg/m3 chez trois espèces différentes. Une incidence accrue de variations du squelette a été observée chez seulement une de ces trois espèces (lapin) à des concentrations plus faibles. L’importance biologique de ces variations du squelette à ces concentrations plus faibles n’est pas certaine.
Des données limitées étaient disponibles sur les profils d’exposition des consommateurs (durée de l’exposition) associés aux assainisseurs d’air, aux nettoyants pour vitres et aux produits de bronzage. De plus, il y a des incertitudes quant à la part de marché et à la prévalence des produits cosmétiques contenant des concentrations plus élevées d’oxyde d’éthane-1,2-diol au Canada. En outre, bien que certains oxydes d’éthane-1,2-diol puissent être présents dans des cosmétiques (p. ex. du DEGEE), les expositions combinées aux substances individuelles n’ont pas été estimées, car elles ne devraient pas représenter une part significative du marché au Canada. De plus, il peut y avoir une incertitude liée à la proportion de produits utilisés par les consommateurs dans lesquels du 1,2-méthoxyéthane se retrouve comme impureté.
8. Conclusion
En tenant compte de tous les éléments de preuve avancés dans la présente évaluation préalable, il existe un faible risque d’effets nocifs pour les organismes et l’intégrité globale de l’environnement dû aux sept substances du groupe des oxydes d’éthane‑1,2-diol. Il est conclu que les sept substances du groupe des oxydes d’éthane‑1,2-diol ne satisfont pas aux critères de l’alinéa 64a) ou 64b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique ou à mettre en danger l’environnement essentiel pour la vie.
À la lumière des renseignements présentés dans la présente évaluation préalable, il est conclu que les sept substances du groupe des oxydes d’éthane‑1,2-diol ne satisfont pas aux critères de l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Par conséquent, il est conclu que les sept substances du groupe des oxydes d’éthane‑1,2-diol ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
RéférencesNote de bas de page 29
Auletta CS, Schroeder RE, Krasavage WJ, Stack CR.; 1993; Toxicology of diethylene glycol butyl ether, 4. Dermal subchronic/reproduction study in rats. J Am Coll Toxicol. 12(2):161-168.
Akuse R.M., Eke F.U., Ademola A.D., Fajolu I.B., Gbelee H.O., Ihejiahi U., Bugaje M.A., Anochie I.C., Asinobi A.O., Okafor H.U. et al.; 2012; Diagnosing renal failure due to diethylene glycol in children in a resource-constrained setting; Pediatr. Nephrol., 27(6), p. 1021-1028.
[ATSDR] Agency for Toxic Substances & Disease Registry [Internet]; 2013; SUMMARY DATA FOR 2013 PRIORITY LIST OF HAZARDOUS SUBSTANCES; Atlanta (GA) : Agency for Toxic Substances & Disease Registry, 19 pages. (en anglais seulement)
Ballantyne B. et Snellings W.M.; 2005a; Developmental toxicity study with diethylene glycol dosed by gavage to CD rats and CD-1 mice; Food Chem. Toxicol., 43, p. 1637-46.
Ballantyne B. et Snellings W.M.; 2005b; Developmental toxicity study with triethylene glycol given by gavage to CD rats and CD-1 mice; J. Appl. Toxicol., 25, p. 418-426.
Ballantyne B. et Snellings W.M.; 2007; Triethylene glycol HO(CH2CH2O)3H - Toxicology update; J. Appl. Toxicol., 27, p. 291–299.
Ballantyne B., Snellings W.M. et Norris J.C.; 2006; Respiratory peripheral chemosensory irritation, acute and repeated exposure toxicity studies with aerosols of triethylene glycol; J. Appl. Toxicol., 26, p. 387‑396.
[BDIPSN] Base de données d’ingrédients de produits de santé naturels; [modifiée le 21 février 2018]; Ottawa (ON) : Santé Canada.
[BDPP] Base de données sur les produits pharmaceutiques; [modifiée le 27 septembre 2016]; Ottawa (ON) : Santé Canada.
[BDPSNH] Base de données sur les produits de santé naturels homologués; [modifiée le 6 février 2018]; Ottawa (ON) : Santé Canada.
Belgaqua; 23 mars 2010; Annex to the HYDROCHECK procedure for acceptance of Materials in contact with Drinking Water [Internet]; Bruxelles, 13 pages. (en anglais seulement)
Béranger R, Garlantézec R. Le Maner-Idrissi G, Lacroix A, Rouget F, Trowbridge J, Warembourg C, Monfort C, Le Gléau F, Jourdin M, et al. 2017. Prenatal exposure to glycol ethers and neurocognitive abilities in 6-year-old children: The PELAGIE cohort study. Environmental Health Perspectives 125(4): 684-690.
Besenhofer L.M., McLaren M.C., Latimer B., Bartels M., Filary M.J., Perala A.W. et McMartin K.E.; 2011; Role of Tissue Metabolite Accumulation in the Renal Toxicity of Diethylene Glycol; Toxicological Sciences, 123(2), p. 374–383.
Beyrouty P., Broxop B., Losos G., Robinson K., Maurissen J.P.J., Gill M.W. et Stack C.R.; 1993; Toxicology of diethylene glycol butyl ether - 5. Dermal subchronic neurotoxicity study in rats; J. Am. Coll. Toxicol., 12, p. 169-174.
[Cal. EPA] Environmental Protection Agency de la Californie; 2016; Ethylene glycol mono‐n‐butyl ether reference exposure levels; Technical support document for the derivation of noncancer reference exposure levels. Appendix D1: Scientific Review Panel Review Draft, January 2016; Air Toxics Hot Spots Program; Air, Community, and Environmental Research Branch; 43 pages.
Canada; 1978; Règlement sur les aliments et drogues, C.R.C., ch. 870.
Canada; 1999; Loi canadienne sur la protection de l’environnement, 1999; L.C. 1999, ch. 33; Gazette du Canada, Partie III, vol. 22, no 3.
Canada, ministère de l’Environnement; 2001; Loi canadienne sur la protection de l’environnement, 1999 : Avis concernant certaines sunstances inscrites sur la Liste intérieure des substances (LIS); Gazette du Canada, Partie I, vol. 135, no 46, p. 4194-4210.
Canada, ministère de l’Environnement; 2009; Loi canadienne sur la protection de l’environnement, 1999 : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure; Gazette du Canada, Partie I, vol. 143, no 40, p. 2945-2956.
[CCHST] Centre canadien d’hygiène et de sécurité au Travail; 2006; CHEMINFO Search [base de données sur l’Internet]; Hamilton (ON); [consulté le 3 décembre 2015].
[CE] Commission européenne; 2000; European Union Risk Assessment Report, CAS RN 112-34-5: 2‑(2‑Butoxyethoxy)ethanol; Luxembourg : Office des publications officielles des Communautés européennes, rapport no : EUR 18998 EN,114 pp.
[CE] Commission européenne; 2006-2008a; European Union Risk Assessment Report, CAS RN 112-07-2: 2-Butoxyethyl acetate (EGBEA) Part I – Environment; rapport no EUR 22475 EN, 2006; et Part II Human Health, final approved version, août 2008, 204 p.
[CE] Commission européenne; 2006-2008b; European Union Risk Assessment Report, CAS RN 111-76-2: 2-Butoxyethanol (EGBE);Luxembourg : Office des publications officielles des Communautés européennes, volume 68 Part I – Environment; rapport no EUR 22501 EN, 2006; et Part II Human Health, final approved version, août 2008, 418 p.
[CEDI] Cumulative Estimated Daily Intakes Database [base de données sur l’Internet]; 2015; Silver Spring (Maryland), U.S. Food and Drug Administration [mise à jour le 31 août 2015, consultée en décembre 2015].
ChemCAN; 2003; Modèle de fugacité de niveau III pour 24 régions du Canada; ver. 6,00; Peterborough (ON) : Trent University, Canadian Centre for Environmental Modelling and Chemistry.
ChemIDplus [base de données]; 1993- a; No. CAS 111-46-6; Bethesda (MD): US National Library of Medicine [mise à jour NS; consultée le 15 mars 2016].
ChemIDplus [base de données]; 1993- b; No. CAS 112-27-6; Bethesda (MD): US National Library of Medicine [mise à jour NS; consultée le 15 mars 2016].
ChemIDplus [base de données]; 1993- c; No. CAS 112-60-7; Bethesda (MD): US National Library of Medicine [mise à jour NS; consultée le 15 mars 2016].
ChemIDplus [base de données]; 1993- d; No. CAS 111-90-0;Bethesda (MD): US National Library of Medicine [mise à jour NS; consultée le 15 mars 2016].
ChemIDplus [base de données]; 1993- e; No. CAS 112-07-2; Bethesda (MD): US National Library of Medicine [mise à jour NS; consultée le 15 mars 2016].
ChemIDplus [base de données]; 1993- f; No. CAS 112-34-5; Bethesda (MD): US National Library of Medicine [mise à jour NS; consultée le 15 mars 2016].
ChemIDplus [base de données]; 1993- g; No. CAS 110-71-4; Bethesda (MD): US National Library of Medicine [mise à jour NS; consultée le 15 mars 2016].
ChemIDplus [base de données]; 1993- h; No. CAS 111-76-2; Bethesda (MD): US National Library of Medicine [mise à jour NS; consultée le 15 mars 2016].
ChemIDplus [base de données]; 1993- i; No. CAS 109-86-4; Bethesda (MD): US National Library of Medicine [mise à jour NS; consultée le 15 mars 2016].
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 2006. IARC Monographs on the evaluation of carcinogenic Volume 88: Formaldehyde, 2-butoxyethanol and 1-tert-butoxypropan-2-ol. Summary of data reported and evaluation. Technical Publication no. 39. Lyon, France.
Conrad T., Landry G.M., Yee A.W.T., Nichols R. et McMartin K.E.; 2016; Diglycolic acid, the toxic metabolite of diethylene glycol, chelates calcium and produces renal mitochondrial dysfunction in vitro; Clinical Toxicology, 54(6), p. 501-511.
[ConsExpo] Consumer Exposure Model [Internet]; 2006; version 4.1; Bilthoven (NL) : Rijksinstituut voor Volksgezondheid en Milieu (Institut national pour la santé publique et l’environnement).
Devoti E., Marta E., Belotti E., Bregoli L., Liut F., Maiorca P., Mazzucotelli V. et Cancarini G.; 2015; Diethylene glycol poisoning from transcutaneous absorption; Am. J. Kidney Dis., 65(4), p. 603-606.
[DOW] The DOW Chemical Company; 1981; DEG: Method Development for Skin Penetration Study in Rats (using diethylene glycol); rapport non publié de la Dow Chemical Company (Midland, MI 48674, É.-U.); soumis à Santé Canada, mars 2016 [Pour de plus amples renseignements, voir le document de référence (Santé Canada 2017)].
[DOW] The DOW Chemical Company; 2007a; Product Safety Assessment, Diethylene Glycol Butyl Ether Acetate; Form No. 233-00340-MM-1207. [créé le 15 décembre 2007]. (en anglais seulement)
[DOW] The DOW Chemical Company; 2007b; Product Safety Assessment, Diethylene Glycol Monoethyl Ether; Form No. 233-00344-MM-0907 [créé le 24 septembre 2007]. (en anglais seulement)
[DOW] The DOW Chemical Company; 2014a; Product Safety Assessment, Diethylene Glycol Butyl Ether; Form No. 233-00262-MM-1214X [révisé le 23 décembre 2014]; (en anglais seulement)
[DOW] The DOW Chemical Company; 2014b; Triethylene glycol mouse developmental toxicity study: Developmental toxicity is secondary to maternal toxicity; mise à jour non publiée soumise à Santé Canada en mars 2016, 3 p. [Pour de plus amples renseignements, voir le document de référence (Santé Canada 2017)].
[DOW] The DOW Chemical Company; 2015; Product Safety Assessment Finder [base de données sur l’Internet]; [consultée le 3 décembre 2015]. (en anglais seulement) (en anglais seulement)
[DOW] The DOW Chemical Company; 2016a; Response to data gaps request on ethylene glycols to Health Canada; reçue le 8 mars 2016 [Pour de plus amples renseignements, voir le document de référence (Santé Canada 2017)].
[DOW] The DOW Chemical Company; 2016b; Updated response to data gaps request on ethylene glycol ethers to Health Canada; reçue le 7 avril 2016 [Pour de plus amples renseignements, voir le document de référence (Santé Canada 2017)].
[ECCC] Environnement et Changement climatique Canada; 2016a; Document sur l’approche scientifique : Classification du risque écologique des substances organiques.
[ECCC] Environnement et Changement climatique Canada; 2016b; Gatineau (QC) : données utilisées pour créer des profils d’exposition et de danger spécifiques des substances et assigner des classifications des risques pour la Classification des risques écologiques des substances organiques; disponible à l’adresse suivante : substances@ec.gc.ca.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2017. Ébauche d’évaluation préalable Substances jugées comme étant peu préoccupantes au moyen de l’approche de la Classification du risque écologique des substances organiques et de l’approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances. Ottawa (Ont.) : ECCC, SC.
[ECETOC] European Centre for Ecotoxicology and Toxicology of Chemicals; 2005; The toxicology of glycol ethers and its relevance to man (4e édition); volume 1; ECETOC Technical Report No. 95; Bruxelles, Belgique, 202 p.
[ECHA] Agence européenne des produits chimiques; 1986a; 1,2-Dimethoxyethane, CAS RN 110-71-4; Exp Key Repeated dose toxicity:inhalation.002; Industry Submission to ECHA, mise à jour le 6 janvier 2016; [consultée en mars 2016].
[ECHA] Agence européenne des produits chimiques; 1986b; 1,2-Dimethoxyethane, CAS RN 110-71-4; Exp Supporting Repeated dose toxicity:inhalation.004; Industry Submission to ECHA, mise à jour le 6 janvier 2016; [consultée en mars 2016].
[ECHA] Agence européenne des produits chimiques; 1988a; 1,2-Dimethoxyethane, CAS RN 110-71-4; Exp Supporting Developmental toxicity / teratogenicity.001; Industry Submission to ECHA, mise à jour le 6 janvier 2016; [consultée en mars 2016].
[ECHA] Agence européenne des produits chimiques; 1988b; 1,2-Dimethoxyethane, CAS RN 110-71-4; Exp Key Developmental toxicity / teratogenicity.002; Industry Submission to ECHA, mise à jour le 6 janvier 2016; [consultée le 6 janvier 2016].
[ECHA] Agence européenne des produits chimiques; 2012a; Support document for identification of 1,2-Dimethyoxyethane (EGDME) as substance of very high concern because of its CMR properties, 21 p.
[ECHA] Agence européenne des produits chimiques; 2012b; Annex XV dossier. Proposal for identification of a Substance as a Category 1A OR 1B CMR, PBT, vPvB or a substance of an equivalent level of concern; Public version, 1,2-dimethoxyethane (EGDME) CAS RN 110-71-4; CE numéro 203-794-9. (en anglais seulement)
[ECHA] Agence européenne des produits chimiques; 2015; Dossier for 2-(2-ethoxyethoxy)ethanol, CAS RN 111-90-0; [consulté en septembre 2015].
Environnement Canada; 2001; Données sur certaines substances collectées en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement 1999 : Avis concernant certaines substances inscrites sur la Liste intérieure des substances (LIS); données préparées par : Environnement Canada, Santé Canada, Programme des substances existantes.
Environnement Canada; 2009; données pour la mise à jour de l’inventaire de la LIS collectées en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement 1999 : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure; données préparées par : Environnement Canada, Santé Canada, Programme des substances existantes.
Environnement Canada; 2014; Résultats de l’examen préalable rapide des substances identifiées à la Phase 2 de la mise à jour de la Liste intérieure des substances – Chiffrier détaillé; Division de l’évaluation environnementale, Environnement Canada, Gatineau, QC, Canada.
Environnement Canada, Santé Canada; 2002a; Loi canadienne sur la protection de l’environnement : Liste des substances d’intérêt prioritaire – Rapport d’évaluation pour le 2-butoxyéthanol; Ottawa (ON).
Environnement Canada, Santé Canada; 2002b; Loi canadienne sur la protection de l’environnement : Liste des substances d’intérêt prioritaire – Rapport d’évaluation pour le 2-méthoxyéthanol; Ottawa (ON).
Environnement Canada, Santé Canada; modifié le 20 avril 2007; Catégorisation; Ottawa (ON) : gouvernement du Canada [consulté date].
Environnement Canada, Santé Canada; 2015; Rapport sur l’état des connaissances scientifiques : groupe des phtalates : phtalate de diisononyle, phtalates de dialkyle en C8-10 ramifié, riches en C9, (phtalate de diisononyle PDIN); Ottawa (ON) : Environnement Canada, Santé Canada.
[EPA] Environmental Protection Agency des États-Unis. 1996. Health Effects Test Guidelines: OPPTS 870.3250, Subchronic Dermal Toxicity—90 days. "Public draft". Report number EPA 712–C–96–202, June 1996. 13 pp. (en anglais seulement)
[EPA] Environmental Protection Agency des États-Unis; 2005; Triethylene glycol - Revised report of the Antimicrobials Division; Toxicology Endpoint Selection Committee, 13 pp. November 21, 2005 [cité dans HSDB. 2007a; Triethylene glycol; CASRN: 112-27-6].
[EPA] Environmental Protection Agency des États-Unis; 2008; Supporting Documents for Initial Risk-Based Prioritization of High Production Volume Chemicals; Chemical/Category : CAS No. 110-71-4, Ethane, 1,2-dimethoxy- (also known as 1,2-Dimethyoxyethane, or Monoglyme), 18 March 2008, 24 pp. [cité dans ECHA ca 2012]; Note : le site Web cité dans ECHA (2012b) n’est plus accessible.
[EPA] Environmental Protection Agency des États-Unis; 2010; Toxicological review of ethylene glycol monobutyl ether (EGBE) (CAS No. 111-76-2): In support of summary information on the Integrated Risk Information System (IRIS); Report No. EPA/635/R-08/006F, Washington, D.C. 206 p.
[EPA] Environmental Protection Agency des États-Unis; 2012; Chemical Data Access Tool (CDAT) [base de données sur l’Internet]; [mise à jour le 5 avril 2016; consultée le 15 avril 2016]. (en anglais seulement)
[EWG] Environmental Working Group; 2015; EWG’s Skin Deep Cosmetics Database [base de données sur l’Internet]; Washington (DC) : EWG; [consulté le 3 décembre 2015].
[FDA] Food and Drug Administration des États-Unis; 2011; List of Indirect Additives Used in Food Contact Substances [base de données sur l’Internet]; Silver Spring (Maryland) [mis à jour le 14 novembre 2011; consulté le 7 décembre 2015]. (en anglais seulement)
Federal Register des États-Unis; 2011; Glymes; Proposed Significant New Use Rule; United States Environmental Protection Agency, 76 FR 40850, July 12, 2011. (en anglais seulement)
Federal Register des États-Unis; 2014; Ethylene Glycol Ethers: Significant New Use Rule; United States Environmental Protection Agency, 79 FR 74639, December 16, 2014. (en anglais seulement)
Ferrari L.A. et Giannuzzi L.; 2005; Clinical parameters, postmortem analysis and estimation of lethal dose in victims of a massive intoxication with diethylene glycol; Forensic Sci. Int., 53(1), p. 45-51.
Ferro Corporation; 2002; 1,2-dimethoxyethane : CAS Number 110-71-4; US EPA HPV Challenge Program Submission; décembre 2001, révisé en août 2002, pages 1-21 de 93.
[FS] Fiche signalétique; 9 septembre 2007; FUTURE PREMIUM FLOOR FINISH; Racine, WI: S.C. Johnson & Son, Inc.; [consultée le 3 décembre 2015].
[FS] Fiche signalétique; 2009a, 30 avril; Shell Flushing Oil D 22; Bangkok, THA: The Shell Company of Thailand Ltd.; [consultée le 3 décembre ].
[FS] Fiche signalétique; 2009b, 1er décembre; GLADE® TOUGH ODOR SOLUTIONS SURFACE DISINFECTANT & AIR SANITIZER - CLEAR SPRINGS; S.C. Johnson & Son, Inc., Racine WI.; [consultée le 3 décembre 2015].
[FS] Fiche signalétique; 2010a, 25 février; FROTH-PAK(TM) 620BF HFC CLASS A POLYOL Spray Polyurethane Foam; Midland, MI : The Dow Chemical Company; [consultée le 14 décembre 2015].
[FS] Fiche signalétique; 2010b, 9 mars; RT201504 - RT-2015-2.0-W; El Segundo, CA : Henry Company; [consultée le 2 décembre 2015].
[FS] Fiche signalétique; 2010c, 6 octobre; PROFIN 1GL 4PK WB 275VOC SANDING SEALER; Vernon Hills, IL : Rust-Oleum Corporation; [consultée le 3 décembre 2015].
[FS] Fiche signalétique; 2010d; 27X37, CLEAR WOOD FINISH GLOSS; Irvine, CA: Deft, Inc.; [consultée le 22 février 2016].
[FS] Fiche signalétique; 2010e, avril; Tetra-ThinTM; Tetra-Etch Products Ltd, Whitburn West Lothian, Scotland; [consultée le 13 mars 2016].
[FS] Fiche signalétique; 2011a, 15 mars; Driveway, Concrete & Masonry Cleaner Concentrate; Atlanta, GA : Zep.; [consultée le 3 décembre 2015].
[FS] Fiche signalétique; 2011b, 10 mai; Artisan Anti-Graffiti Protectant; Moorestown, NJ : Chemique, Inc. [consultée le 2 décembre 2015].
[FS] Fiche signalétique; 2011c, 26 mai; CLASSIC WHITE FINISH LINE IND.; MENOMONEE FALLS, WI: RAABE COMPANY; [consultée le 3 décembre 2015].
[FS] Fiche signalétique; 2012b, 24 août; Shell Irus Fluid C-NA; Houston, TX : SOPUS Products; [consultée le 3 décembre 2015].
[FS] Fiche signalétique; 2012c; Dynamic PTC Pro Tint; Mississauga, ON : Dynamic Paint Products Inc.; [consultée le le 22 février 2016].
[FS] Fiche signalétique; 2012d; Wet-Look Floor Finish; Atlanta, GA: Zep Commercial Sales and Service [consultée le le 22 février 2016].
[FS] Fiche signalétique; 2012e, 25 octobre; GLADE® SENSE & SPRAY® AUTOMATIC ROOM SPRAY - CLEAR SPRINGS®; S.C. Johnson & Son, Inc., Racine WI.; [consultée le le 3 décembre 2015].
[FS] Fiche signalétique; 2013a, 09 janvier; SN214 - PREMIUM ALL SEASON CONCRETE ACCELERATOR; El Segundo, CA: Henry Company; [ consultée le 2 décembre 2015]..[FS] Fiche signalétique; 2013b, 30 avril; GRANITE GOLD DAILY CLEANER; San Diego, CA: Granite Gold, Inc.; [consultée le 2 décembre 2015].
[FS] Fiche signalétique; 2013c, 15 août; ULTRACOAT POLISH REMOVER; Laval, QC : Mapei; [consultée le 2 décembre 2015].
[FS] Fiche signalétique; 2013d, 9 septembre; SimpleGrout Premixed Grout; Seal Beach, CA: Custom Building Products; [consultée le 2 décembre 2015].
[FS] Fiche signalétique; 2013e, 18 novembre; Energel X; Tokyo, Jpn : Pentel Co., LTD [consultée le 3 décembre 2015].
[FS] Fiche signalétique; 2013f, 1er mai; DISINFECTANT SCRUBBING BUBBLES® BATHROOM CLEANER - FRESH CITRUS SCENT; [consultée le 30 septembre 2015].
[FS] Fiche signalétique; 2013g, 4 avril; AIR CARE air conditioner hygienizer; Electrolux code 9 029 794 261; Mariel refrigeration and air conditioning, Busto Arsizio, Italy (traduit de l’allemand) [consultée en février 2016].
[FS] Fiche signalétique; 2014a, 21 novembre; EPOXY 2-GL BLACKTOP COATING; Vernon Hills, IL : Rust-Oleum Corporation [consultée le 3 décembre 2015].
[FS] Fiche signalétique; 2014b, 17 novembre; TB 670 LVT Flooring Adhesive; Columbus, OH : Franklin International [consultée le 11 décembre 2015].
[FS] Fiche signalétique; 2014c, 22 décembre; TractionCote Anti-Slip Coating; Maplewood, NJ: Surface Solutions, LLC [consultée le 3 décembre 2015].
[FS] Fiche signalétique; 2014d, 14 janvier; Mulberry Air Freshener/Air Delights Air Neutralizer 9000; K-G Spray-Pak Inc., Concord, Ontario, Canada. http://msds.kgpackaging.com/ [consultée le 18 mars 2016].
[FS] Fiche signalétique; 2014e, 21 janvier; Air Freshener 70 %; Air Guard Control (Canada) Ltd. Concord, Ontario, Canada [consultée le 18 mars 2016].
[FS] Fiche signalétique; 2014f, 21 janvier; Vectair V-Air Air Freshener. K-G Spray-Pak Inc., Concord, Ontario, Canada [consultée le 18 mars 2016].
[FS] Fiche signalétique; 2015a, 9 mars; Glance HC 1 Glass & Multi-Surface Cleaner; Sturtevant, WI : Diversey, Inc. [consultée le 3 décembre 2015].
[FS] Fiche signalétique; 2015b, 18 mars; Citrus II Hospital Germicidal Deodorizing Cleaner; Kennesaw, GA : Beaumont Products, Inc. [consultée le 2 décembre 2015].
[FS] Fiche signalétique; 2015c, 11 avril; ARMOR ALL Extreme Wheel and Tire Cleaner; Danbury, CT: The Armor All/STP Products Company [consultée le 2 décembre 2015].
[FS] Fiche signalétique; 2015d, 29 avril; Liquid Wrench White Lithium Grease; Indian Trail, NC: RSC Chemical Solutions [consultée le 3 décembre 2015].
[FS] Fiche signalétique; 2015e, 8 mai; MAPEI-ACTIVE DP02-S; Milan, IT: Mapei. [consultée le 3 décembre 2015]. (en anglais seulement)
[FS] Fiche signalétique; 2015f, 8 mai; MAPEFLOOR WAX REMOVER; Castanheira do Ribatejo, Prt: Mapei [consultée le 3 décembre 2015].
[FS] Fiche signalétique; 2015g, 14 mai; DIF 22-OZ 12 WALLPAPER STRIPPER CONC.; Vernon Hills, IL : Rust-Oleum Corporation [consultée le 3 décembre 2015].
[FS] Fiche signalétique; 2015h, 15 mai; MAPEGROUT SVT DF GRAVIER; Milan, IT: Mapei. [consultée le 3 décembre 2015].
[FS] Fiche signalétique; 2015i, 15 mai; WDCARE 1-GL 2PK VARA UNIVSL SAND SEALER; Vernon Hills, IL: Rust-Oleum Corporation [consultée le 3 décembre 2015].
[FS] Fiche signalétique; 2015j, 17 mai; SILANCOLOR CLEANER PLUS; Milan, IT: Mapei [consultée le 3 décembre 2015].
[FS] Fiche signalétique; 2015k, 3 juin; StoneSpecific Polished Granite Sealer; Atlanta, GA: Custom Building Products [consultée le 2 décembre 2015].
[FS] Fiche signalétique; 2015l, 15 juin; ELIMINATOR III ENGINE DEGREASER 15 OZ; Hartford, CT, USA: Permatex, Inc. [consultée le 3 décembre 2015].
[FS] Fiche signalétique; 2015m, 8 juillet; ROCK SOLID 1GL 4PK WOODSTRIPPER128; Vernon Hills, IL : Rust-Oleum Corporation [consultée le 3 décembre 2015].
[FS] Fiche signalétique; 2015n, 5 août; ULTRACOAT TOP DECK OIL; Milan, IT: Mapei [consultée le 2 décembre 2015].
[FS] Fiche signalétique; 2015o, 7 août; ACCENT SSPR 6PK MICA STONE TRAVERTINE; Vernon Hills, IL: Rust-Oleum Corporation [consultée le 3 décembre 2015].
[FS] Fiche signalétique; 2015p, 4 septembre; ADHESION PROMOTER; Hickory, NC : RPM Wood Finishes group [consultée le 3 décembre 2015].
[FS] Fiche signalétique; 2015q, 4 septembre; CSL850 Heat Sink Compound; Guelph, ON: CSL Silicones Inc. [consultée le 2 décembre 2015].
[FS] Fiche signalétique; 2015r, 5 septembre; VIBROMIX E; Budaörs, Hun : Mapei [consultée le 3 décembre 2015].
[FS] Fiche signalétique; 2015s, 15 septembre; ULTRA PENETRATING STAIN MEDIUM MAHOGANY GAL; Hickory, NC: MOHAWK Finishing Products [consultée le 17 décembre 2015].
[FS] Fiche signalétique; 2015t, 27 novembre; MINWAX Water-Based HELMSMAN Urethane; Upper Saddle River, NJ: Minwax [consultée le 3 décembre 2015].
[FS] Fiche signalétique; 2015u; COLOR ACCENTS™ Interior Latex Satin Paint, Ultradeep Base; Cleveland, OH: THE SHERWIN-WILLIAMS COMPANY [consultée le 22 février 2016].
[FS] Fiche signalétique; 2015v; KLEAN STRIP MULTI-SURFACE CLEANER AEROSOL; [consultée le 29 avril 2016].
[FS] Fiche signalétique; 2015w, juin; Tetra-Etch® Etchant; Tetra-Etch Products Ltd, Whitburn West Lothian, Scotland [consultée le 13 mars 2016].
GoodGuide [base de données sur l’Internet]; 2014; [consultée le 3 décembre 2015].
Hanley T.R. Jr, Young J.T., John J.A. et Rao K.S.; 1984a; Ethylene glycol monomethyl ether (EGME) and propylene glycol monomethyl ether (PGME): Inhalation fertility and teratogenicity studies in rats, mice and rabbits; Environ. Health Perspect., 57, p. 7–12.
Hanley T.R. Jr, Yano B.L., Nitschke K.D. et John J.A.; 1984b; Comparison of the teratogenic potential of inhaled ethylene glycol monomethyl ether in rats, mice, and rabbits; Toxicol. Appl. Pharmacol., 75, p. 409–422.
Hansen O. et Pedersen E.; 2005; Migration and health assessment of chemical substances in surface treated wooden toys; ministère danois de l’Environnement.
Healing G., Sulemann T., Cotton P., Harris J., Hargreaves A., Finney R., Kirk S., Schramm C., Garner C., Pivette P. et Burdett L.; 2016; Safety data on 19 vehicles for use in 1 month oral rodent pre-clinical studies: administration of hydroxypropyl-ß-cyclodextrin causes renal toxicity; J. Appl. Toxicol., 36, p. 140‑150.¶
Heilmair R., Lenk W. et Löhr D.; 1993; Toxicokinetics of diethylene glycol (DEG) in the rat; Arch. Toxicol., 67, p. 655-666.
[HERA] Human and Environmental Risk Assessment on ingredients of household cleaning products; 2005; 2-(2-Butoxyethoxy)ethanol, CAS No: 112-34-5; édition 1.0, août 2005; 12 p.
Household Products Database [base de données sur l’Internet]; 1993—2015; Bethesda (MD): US National Library of Medicine; [mise à jour en août 2015; consultée le 7 décembre 2015].
[HSDB] Hazardous Substances Data Bank [base de données]; 2002; No. CAS 110-71-4; Bethesda (MD): National Library of Medicine (US) [mises à jour en février 2007 et décembre 2014; consultée le 9 mars 2016].
[HSDB] Hazardous Substances Data Bank [base de données]; 2007a; No. CAS 112-27-6; Bethesda (MD): National Library of Medicine (US) [mise à jour en octobre 2007; consultée le 8 mars 2016].
[HSDB] Hazardous Substances Data Bank [base de données]; 2007b; No. CAS 112-60-7; Bethesda (MD): National Library of Medicine (US) [mise à jour en octobre 2007, consultée le 8 mars 2016].
[HSDB] Hazardous Substances Data Bank [base de données]; 2007c; No. CAS 111-90-0; Bethesda (MD): National Library of Medicine (US) [mise à jour en octobre 2007; consultée le 9 mars 2016].
[HSDB ] Hazardous Substances Data Bank [base de données]; 2007d; No. CAS 112-34-5; Bethesda (MD): National Library of Medicine (US) [mise à jour en octobre 2007; consultée le 9 mars 2016].
[HSDB] Hazardous Substances Data Bank [base de données]; 2009a; No. CAS 111-46-6; Bethesda (MD): National Library of Medicine (US) [mise à jour en décembre 2009; consultée le 7 mars 2016].
[HSDB ] Hazardous Substances Data Bank [base de données]; 2009b; No. CAS 112-07-6; Bethesda (MD): National Library of Medicine (US) [mise à jour en avril 2012; consultée le 9 mars 2016].
[IFRA] International Fragrance Association; 2012; REACH exposure scenarios for fragrance substances; IFRA Operations, Bruxelles, Belgique, 19 April 2012, 126 p.
[INRP] Inventaire national des rejets de polluants [base de données]; 1993-2013; Gatineau (QC) : Environnement Canada [mis à jour le 4 janvier 2016; consulté en novembre 2015].
[JECFA] Joint FAO/WHO Expert Committee on Food Additives; 1995; Evaluation of Certain Food Additives and Contaminants; Genève : Organisation mondiale de la santé; 54 pages; Fourty-fourth report.
Johnson K.A., Baker P.C., Kan H.L., Maurissen J.P., Spencer P.J. et Marty M.S.; 2005; Diethylene glycol monobutyl ether (DGBE): two- and thirteen-week oral toxicity studies in Fischer 344 rats; Food and Chemical Toxicology, 43, p. 467–481.
Kassotis CD, Tillitt DE, Wade Davis J, Hormann AM, et Nagel SC. 2014. Estrogen and androgen receptor activities of hydraulic fracturing chemicals and surface and ground water in a drilling-dense region. Endocrinology 155(3):897-907.
Kassotis CD, Klemp KC, Vu DC, Lin C-H, Meng C-X, Besch-Williford CL, Pinatti, Thomas Zoeller R, Drobnis EZ, Balise VD, et al. 2015. Endocrine-disrupting activity of hydraulic fracturing chemicals and adverse health outcomes after prenatal exposure in male mice. Endocrinology 156(12):4458-4473.
Kenyon M.O., Coffing S.L., Ackerman J.I., Gunther W.C., Dertinger S.D., Criswell K. et Dobo K.L.; 2015; Compensatory erythropoiesis has no impact on the outcome of the in vivo Pig-a mutation assay in rats following treatment with the haemolytic agent 2-butoxyethanol; Mutagenesis, 30(3), p. 325-334.
Kraut J.A.; 2015; Diagnosis of toxic alcohols: limitations of present methods; Clinical Toxicology, 53, p. 589-595.
Landry G.M., Dunning C.L., Abreo F., Latimer B., Orchard E. et McMartin K.E.; 2015; Diethylene glycol-induced toxicities show marked threshold dose response in rats; Tox. Appl. Pharm., 282, p. 244-251.
Lide D.R., éditeur; 2007; CRC handbook of chemistry and physics, 88th ed., Boca Raton (FL): CRC Press.
Loretz L.G., Api A.M., Barraj L.M., Burdick J., Dressler W.E., Gettings S.D., Han Hsu H., Pan Y.H.L., Re T.A., Renskers K.J., Rothenstein A., Scrafford C.G. et Sewall C.; 2005; Exposure data for cosmetic products: lipstick, body lotion, and face cream; Food Chem. Toxicol., 43, p. 279-291.
Loretz L., Api A.M., Barraj L., Burdick J., Davis D.A., Dressler W., Gilberti E., Jarrett G., Mann S., Pan Y.H.L. et al.; 2006; Exposure data for personal care products: Hairspray, spray perfume, liquid foundation, shampoo, body wash, and solid antiperspirant; Food Chem. Toxicol., 44, p. 2008-2018.
Loretz L.G., Api A.M., Babcock L., Barraj L.M., Burdick J., Cater K.C., Jarrett G., Mann S., Pan Y.H.L., Re T.A., Renskers K.J. et Scrafford C.G.; 2008; Exposure data for cosmetic products: Facial cleanser, hair conditioner, and eye shadow; Food Chem. Toxicol., 46, p. 1516-1524.
Mangelsdorf I., Kleppe S.N., Heinzow B. et Sagunski H.; 2016; Indoor air guide values for glycol ethers and glycol esters—A category approach; Int. J. Hyg. Environ. Health, 219(4-5), p. 419-436.
Miller R.R., Ayres J.A., Young J.T. et McKenna M.J.; 1983; Ethylene glycol monomethyl ether. I. Subchronic vapor inhalation study with rats and rabbits; Fundam. Appl. Toxicol., 3, p. 49–54.
Nagano K., Nakayama E., Oobayashi H., Nishizawa T., Okudat H. et Yamazaki K.; 1984; Experimental studies of ethylene glycol ethers in Japan; Environ. Health Perspectives, 57, p. 75-84.
Neeper-Bradley T.L., Tyl R.W., Fisher L.C., Kubena M.F., Vrbanic M.A. et Losco P.E.; 1995; Determination of a no-observed-effect level for developmental toxicity of ethylene glycol administered by gavage to CD rats and CD-1 mice; Fundam. Appl. Toxicol., 27, p. 121-130 [cité dans OCDE 2009a].
Nelson B.K., Brightwell W.S., Burg J.R. et Massari V.J.; 1984; Behavioral and neurochemical alterations in the offspring of rats after maternal or paternal inhalation exposure to the industrial solvent 2‑methoxyethanol; Pharmacol. Biochem. Behav., 20, p. 269–279.
[NCI] National Chemical Inventories [base de données sur CD-ROM]. 2014. Columbus (OH): American Chemical Society, Chemical Abstracts Service; [consultée en 2014].
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme; 2015; HUMAN HEALTH TIER II ASSESSMENT FOR Ethanol, 2,2'-oxybis- . Ministère de la Santé du gouvernement de l’Australie. [Mis à jour le 31 juillet 2015; consulté le 14 décembre 2015].
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme; 2016a; Human Health Tier II Assessment for Ethane, 1,2-dimethoxy- CAS RN 110-71-4; Inventory multi-tiered assessment and prioritisation (IMAP); Australian Government Department of Health and Ageing [consulté en mars 2016].
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme; 2016b; Human Health Tier II Assessment for Alkoxyethanols (C1-C2) and their acetates; Inventory multi-tiered assessment and prioritisation (IMAP); Australian Government Department of Health and Ageing [consulté en avril 2016].
Nolen G.A., Gibson W.B., Benedict J.H., Briggs D.W. et Schardein J.L.; 1985; Fertility and teratogenic studies of diethylene glycol monobutyl ether in rats and rabbits; Fund. Appl. Toxicol., 5, p. 1137-1143.
[NTP] National Toxicology Program des États‑Unis. 1993. NTP technical report on toxicity studies of ethylene glycol ethers 2-methoxyethanol, 2-ethoxyethanol, 2-butoxyethanol (CAS Nos. 109-86-4, 110-80-5, 111-76-2) administered in drinking water to F344/N rats and B6C3F1 mice. U.S. Department of Health and Human Services. 122 pp. + appendices. (NTP Toxicity Report Series No. 26; NIH Publication No. 93-3349).
[NTP] National Toxicology Program des États-Unis; 2000; Toxicology and Carcinogenesis Studies of 2‑Butoxyethanol (CAS No. 111-76-2) in F344/N rats and B6C3F1 mice (Inhalation studies); NTP Technical Report Series No.484; NIH Publication No. 00-3974.
[NYSDEC] New York State Department of Environmental Conservation; 2015; Final Supplemental Generic Environmental Impact Statement On The Oil, Gas and Solution Mining Regulatory Program [Internet]; 12 décembre 2011; Revised Draft, Albany, NY: NYSDEC, 1537 [cité le 3 décembre 2015].
O’Brien K.L., Selanikio J.D., Hecdivert C., Placide M.-F., Louis M., Barr J.R., Hospendales C.J., Lewis M.J., Schawartz B., Philen R.M. et al.; 1998; Epidemic of pediatric deaths from acute renal failure caused by diethylene glycol poisoning; Journal of the American Medical Association, 279, p. 1175-1180.
[OCDE] Organisation pour la coopération et le développement économiques. 1981. Lignes directrices de l'OCDE pour les essais de produits chimiques. Essai n° 411: Toxicité cutanée subchronique: 90 jours. Adopté le 12 mai 1981. 9 p.
[OCDE] Organisation pour la coopération et le développement économiques; 2006a; SIDS Initial Assessment Report for: Monoethylene glycol ethers category (Mono EGEs); CAS RN 2807-30-9, 111-76-2(surrogate only), 112-07-2, 112-25-4; SIDS Initial Assessment Meeting 19, 19-22 octobre 2004; [NOTE : il s’agit d’un résumé de CE 2006-2008a].
[OCDE] Organisation pour la coopération et le développement économiques. 2006b. SIDS Initial Assessment Profile for: 2-butoxyethanol (Ethylene Glycol Butyl Ether = EGBE); CAS RN 111-76-2. SIDS Initial Assessment Meeting 23; 17-20 October 2006 [NOTE : il s’agit d’un résumé de CE 2006-2008b].
[OCDE] Organisation pour la coopération et le développement économiques; 2007; SIDS Initial Assessment Report for: Diethylene glycol ethers category (Di EGEs); CAS RN 111-90-0, 112-15-2, 6881-94-3, 124-17-4, 112-59-4; SIDS Initial Assessment Meeting, 21 October 2005.
[OCDE] Organisation pour la coopération et le développement économiques; 2009a; SIDS Initial Assessment Report for: Ethylene Glycol Category; SIDS Initial Assessment Meeting, 18 April 2004; Chercher « all records », puis « ethylene glycol » à l’adresse suivante : http://webnet.oecd.org/hpv/ui/Publications.aspx
[OCDE] Organisation pour la coopération et le développement économiques; 2009b; SIDS Dossier on the HPV chemical Diethylene Glycol; CAS No. : 111-46-6; Sponsor Country : Canada, 89 p.
[OCDE] Organisation pour la coopération et le développement économiques; 2009c; SIDS Dossier on the HPV chemical Triethylene Glycol; CAS No. : 112-27-6; Sponsor Country : Canada, 65 p.
[OCDE] Organisation pour la coopération et le développement économiques; 2009d; SIDS Dossier on the HPV chemical Tetraethylene Glycol; CAS No. : 112-60-7; Sponsor Country: Canada, 72 p.
Pomierny B., Krzyzanowska W., Niedzielska E., Broniowska Z. et Budziszewska B.; 2016; Ethylene glycol ethers induce apoptosis and disturb glucose metabolism in the rat brain; Pharmacological Reports, 68, p. 162-171.
Rentz E.D., Lewis L., Mujica O.J., Barr D.B., Schier J.G., Weerasekera G., Kuklenyik P., McGeehin M., Osterloh J., Wamsley J. et al.; 2008; Outbreak of acute renal failure in Panama in 2006: a case-control study; Bull World Health Organ., 86, p. 749–756.
Renwick J.H. et Cameron K.M.; 1992; Fetal detriment used as an index of effects of diethylene glycol on Syrian hamster fetuses; J. Toxicol. Environ. Health, 36, p. 377-400.
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement]; 2005; Consumer Exposure and Uptake Models Program Manual; Bilthoven (NL) : RIVM. Report No. : 320 104 004/2005 [consultée le 2 mars 2016].
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement]; 2006a; Cleaning products fact sheet: to assess the risks for the consumer; Bilthoven (NL): RIVM. Report No. : 320 104 003/2006 [consulté le 22 février 2016].
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement]; 2006b; Pest control products fact sheet: to assess the risks for the consumer; Bilthoven (NL) : RIVM. Report No. : 320 005 002/2006 [consulté le 11 mars 2016].
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement]; 2007a; Paint products fact sheet: to assess the risks for the consumer: updated version for ConsExpo 4; Bilthoven (NL): RIVM. Report No. : 320 104 008/2007 [consulté le 22 février 2016].
[RIVM] Rijksinstituut voor Volksgezondheid en [Institut national pour la santé publique et l’environnement]; 2007b; Do-it-yourself products fact sheet: to assess the risks for the consumer; Bilthoven (NL): RIVM. Report No.: 320104007/2007 [consulté le 22 février 2016].
Santé Canada; 1994; L’évaluation du risque à la santé humaine des substances d’intérêt prioritaire; Ottawa (ON) : ministère des Approvisionnements et Services Canada; no cat. : En40-215/41F. Disponible sur demande : substances@ec.gc.ca.
Santé Canada; 1998; Exposure factors for assessing total daily intake of priority substances by the general population of Canada; rapport non publié; Ottawa (ON) : Santé Canada, Direction de l’Hygiène du milieu.
Santé Canada; 1999; Loi canadienne sur la protection de l’environnement : Priority Substances List Supporting documentation: Health-related sections - 2-methoxyethanol; 157 p. [accès restreint].
Santé Canada [modifié le 14 décembre 2015]; Liste critique des ingrédients de cosmétiques : liste des ingrédients dont l’usage est interdit dans les cosmétiques; Ottawa (ON) : Santé Canada, Direction de la sécurité des produits de consommation. [consultée en janvier 2016]..
Santé Canada; 2016a; Impurities: Guideline for Residual Solvents. ICH Topic Q3C(R5). Adoption of International Conference on Harmonisation of Technical Requirements for the Registration of Pharmaceuticals for Human Use (ICH) Guidance Document: Q3C(R5): Guideline for Residual Solvents. 25 p.
Santé Canada; 2016b; Document sur l’approche scientifique : Seuil de préoccupation toxicologique (SPT) pour certaines substances; septembre 2016; 54 p.
Santé Canada. 2017. Documentation de référence : Physical and chemical properties, exposure estimate methods, and human health effects. Gatineau (QC) : SC. Renseignements à l’appui de l’évaluation préalable des oxydes d’éthane-1,2-diol. Disponible sur demande : substances@ec.gc.ca.
[SCCP] Scientific Committee on Consumer Products; 2006a; 19 December 2006, Opinion on diethylene glycol monoethyl ether (DEGEE) [publié en 2007], 27 p.
[SCCP] Scientific Committee on Consumer Products; 2006b; 19 December 2006, Opinion on diethylene glycol monobutyl ether (DEGBE) [publié en 2007], 22 p.
[SCCP] Scientific Committee on Consumer Products. 2008. Opinion on diethylene glycol (DEG). 25 p.
[SCCS] Scientific Committee on Consumer Safety; 2012; The SCCS’s Notes of Guidance for the Testing of Cosmetic Ingredients and their Safety Evaluation, 8th Revision.
Schep L.J. et Slaughter R.J.; 2005; Comments on diethylene glycol concentrations (Letter to the editor); Forensic Sci. Int., 155, p. 233.
Schep, LJ, Slaughter RJ, Temple WA et Beasley DMG. 2009. Diethylene glycol poisoning. Clinical Toxicology 47: 525-535.
Schier J.G., Hunt D.R., Peralas A., McMartin K.E., Bartels M.J., Lewis L.S., McGeehin M.A. et Flanders W.D.; 2013; Characterizing concentrations of diethylene glycol and suspected metabolites in human serum, urine, and cerebrospinal fluid samples from the Panama DEG mass poisoning; Clin. Toxicol., 51(10), p. 923-929.
Scorecard [base de données sur l’Internet]; 2011; [consulté le 17 décembre 2015].
Sitarek K., Gromadzinska J., Lutz P., Stetkiewicz J., Śweircz J. et Wasowicz W.; 2012; Fertility and developmental toxicity studies of diethylene glycol monobutyl ether (DGBE) in rats; Int. J. Occup. Environ. Med., 25(4), p. 404-417.
Snellings WM, McMartin KE, Banton MI, Reitman F, Klapacz J. 2017. Human health assessment for long-term oral ingestion of diethylene glycol. Reg Tox Pharm. 87:Si-S20.
Starek-Świechowicz B., Miranowicz-Dzierżawska K., Budziszewska B. et Starek A.; 2015; The effects of 2-methoxyethanol and 2-ethoxyethanol on hematological changes induced by 2-butoxyethanol; Medycyna Pracy, 66(3), p. 303–315.
Statistique Canada; 2012; Enquête canadienne sur les mesures de santé (ECMS), cycle 2, 2009-2011.
Tønning K., Pedersen E., Drøjdahl Lomholt A., Malmgren-Hansen B., Woin P., Møller L. et Bernth N.; 2008; Survey, emission and health assessment of chemical substances in baby products [Internet]; Copenhagen: Danish Environmental Protection Agency. 98. No. 90.: [2015 déc.c 04]. (en anglais seulement)
Uemura K.; 1980; The teratogenic effects of ethylene glycol dimethyl ether on mouse; Acta Obst. Gynaec. Jpn., 32, p. 113-121.
Union Carbide [BRRC] Bushy Run Research Center; 1983; 1,2-Dimethoxyethane (Ethylene Glycol Dimethylether) In Vitro Mutagenesis Studies: 3-Test Battery. Final report with cover letter; U.S. NTIS Record OTS0534903. 2/10/1983, Part 1.
Union européenne; 2016; 1,2-dimethoxyethane - Brief Profile - ECHA; [consulté en avril 2016].
Vale A.; 2007; Ethylene and diethylene glycol; Medicine, 35(11), p. 617-618.
Wagner P.; 2006; Reassessment of 3 Tolerance Exemptions for Ethylene Glycol, Diethylene Glycol, and the Combination of Diethylene Glycol Monomethyl Ether, Diethylene Glycol Monoethyl Ether, and Diethylene Glycol Monobutyl Ether [Internet]; 2006; Washington : United States Environmental Protection Agency, 17 pages; [consulté le 7 décembre 2015].
Zhu J., Wong S.L. et Cakmak S.; 2013a; Nationally representative levels of selected volatile organic compounds in Canadian residential indoor air: Population-based survey; Env. Sci. Tech., 47, p. 13276‑13283.
Zhu J., Wong S.L. et Cakmak S.; 2013b; Supporting information : Nationally representative levels of selected volatile organic compounds in Canadian residential indoor air: Population-based survey; 8 p. [cité dans Env. Sci. Tech., 47, p. 13276-13283].
Annexes
Annexe A. Paramètres pour estimer l'exposition aux oxydes d'éthane-1,2-diol due à l'utilisation de produits
Les expositions ont été estimées en se basant sur le poids présumé d'un adulte, 70,9 kg, (Santé Canada 1998), la vitesse d'inhalation d'un adulte, 16,2 m3/jour et en utilisant des comportements d'adulte, sauf indication contraire. Les expositions ont été estimées au moyen de ConsExpo, version 4.1, ou d'algorithmes de ce modèle (ConsExpo 2006).
| Type de produit et scénario | Substances | Paramètre du modèle |
|---|---|---|
| Produits de soins personnels Colorant capillaire permanent |
DEGEE; DEGBE |
Concentration de DEGEE = 3-10 %f; DEGBE = 1-3% (communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau de l'évaluation du risque des substances existantes de Santé Canada, septembre 2015; non référencé) Quantité de produit = 100 g par application (RIVM 2006a) Fréquence = 3,57 fois par an (Statistique Canada 2012) Facteur de rétention = 0,10 (SCCS 2012) |
| Produits de soins personnels Produit de bronzage |
DEGEE | Concentration de DEGEE = 3-10 % (communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau de l'évaluation du risque des substances existantes de Santé Canada, septembre 2015; non référencé) Quantité de produit = 4,4 g par jour (application) (Loretz et al. 2005) Fréquence = 1 application par jour (jugement expert) |
| Produits de soins personnels Crème pour le corps |
TEG; DEGEE |
Concentration de TEG inférieur(e) u égal(e) à 0,3 %; DEGEE = 1-3 % (communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau de l'évaluation du risque des substances existantes de Santé Canada, septembre 2015; non référencé) Quantité de produit = 4,4 g par application (Loretz et al. 2005) Fréquence = 1,1 fois par jour (Loretz et al. 2005) |
| Produits de soins personnels Maquillage pour le visage |
DEGBE | Concentration de DEGBE = 10-30 % (communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau de l'évaluation du risque des substances existantes de Santé Canada, septembre 2015; non référencé) Quantité de produit = 1,2 g par application (Loretz et al. 2006) Fréquence = 1,8 fois par jour (Loretz et al. 2006) |
| Produits de soins personnels Shampooing antibactérien |
DEG | Concentration de DEG = 3 % (communication personnelle, courriels de la Direction générale des aliments et produits de santé de Santé Canada au Bureau de la gestion du risque de Santé Canada, octobre 2015; non référencé) Quantité de produit = 11,8 g par application (Loretz et al. 2006) Fréquence = 1,1 fois par jour (Loretz et al. 2006) |
| Produits de soins personnels Déodorant/antisudorifique |
DEGEE | Concentration de DEGEE = 10-30 % (communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau de l'évaluation du risque des substances existantes de Santé Canada, septembre 2015; non référencé) Quantité de produit = 0,6 g par application (Loretz et al. 2006) Fréquence = 1,3 fois par jour (Loretz et al. 2006) |
| Peintures et revêtements Peinture murale à l'eau à appliquer au rouleaua |
DEG | Concentration de DEG dans le colorant à peinture = 13 % (FS 2012c) Pigment dans la peinture murale = 8 % (RIVM 2007a) Donc, concentration maximale prévue de DEG dans la peinture = 1 % Taux d'absorption cutanée = 50 % (DOW 2016a) |
| Peintures et revêtements Peinture murale à l'eau à appliquer au rouleaua |
TEG; TTEG |
Les données de l'industrie soumises en vertu de l'article 71 de la LCPE 1999 ont indiqué que du TEG est présent à des concentrations allant de 0,1 à 4 %. Aucune donnée disponible sur les concentrations de TTEG dans les peintures. Toutefois, les soumissions de l'industrie indiquent une présence potentielle dans des peintures et des revêtements. La concentration de TEG dans la peinture a donc été utilisée en remplacement pour le TTEG et l'exposition devrait être similaire. |
| Peintures et revêtements Peinture murale à l'eau à appliquer au rouleaua |
DEGBE | Concentration maximale de DEGBE = 2 % (FS 2015u) Taux d'absorption cutanée = 50 % (SCCP 2006a) Vitesse de transfert de masse = 353 m/s (Thibodeaux; calculé à partir de RIVM 2005, p. 41) Matrice MM = 20,5 m/s (calculé à partir de RIVM 2005, p. 41) |
| Peintures et revêtements Sol/béton/produit d'étanchéité pour roche/finib | DEGEE | Concentration de DEGEE = 1-10 % (FS 2012d) Taux d'absorption cutanée = 50 % (SCCP 2006a) Vitesse de transfert de masse = 22 m/s (Thibodeaux; calculé à partir de RIVM 2005, p. 41) Matrice MM = 27,6 m/s (calculé à partir de RIVM 2005, p. 41) |
| Peintures et revêtements Teinture pour bois/plancherb |
EGBEA | Concentration d'EGBEA = 1-5 % (FS 2010d) Taux d'absorption cutanée = 30 % (CE 2006-2008a) Vitesse de transfert de masse = 22 m/s (Thibodeaux; calculé à partir de RIVM 2005, p. 41) Matrice MM = 27,6 m/s (calculé à partir de RIVM 2005, p. 41) |
| Produits de nettoyage et assainisseurs d'air Nettotant pour les vitresc |
DEGEE; EGBEA |
Concentration de DEGEE = 8 % (OCDE 2007, p. 61) Concentration d'EGBEA = 5 % (FS 2015v) Durée de l'exposition = 24 h (jugement expert) Estimation cutanée = application instantanée et valeurs des constantes de vitesse ajoutées (jugement expert) |
| Produits de nettoyage et assainisseurs d'air Nettoyant pour salle de baind |
DEG; DEGBE |
Concentration de DEGBE = 10 % (FS 2013f) Concentration de DEG = 4% (communication personnelle, courriels de la Direction générale des aliments et produits de santé de Santé Canada au Bureau de la gestion du risque de Santé Canada, octobre 2015; non référencé) Durée de l'exposition = 24 h (jugement expert) Estimation cutanée = application instantanée et valeurs des constantes de vitesse ajoutées (jugement expert) |
| Produits de nettoyage et assainisseurs d'air Assainisseur d'aire |
TEG; DEGEE; 1,2-déméthoxyéthane |
Concentration de DEGEE = 10-30 % (FS 2014d, 2014e) Concentration de TEG = 5-10 % (FS 2009b) Concentration de 1,2-diméthoxyéthane (en tant qu'impureté d'autres EGE utilisés dans les assainisseurs d'air) = 0,01 % (Environnement Canada 2009). Assainisseur d'air en aérosol (non aqueux) : vitesse de décharge = 0,9 g/s; fréquence d'utilisation = 1/jour; durée de la pulvérisation = 6 s (IFRA 2012) Durée d'exposition chronique (pour les assainisseurs d'air contenant du DEGEE, du TEG ou du 1,2-diméthoxyéthane) = 24 h (jugement expert) Durée d'exposition aiguë (pour les assainisseurs d'air contenant du 1,2-diméthoxyéthane) = 6 h (basé sur des expositions d'une journée lors d'études sur la toxicité pour le développement chez des lapins exposés à 2-ME ou des rats exposés à du 1,2-diméthoxyéthane Volume de la pièce = 20 min 3 s (IFRA 2012; RIVM 2006b) Taux de ventilation = 0,6/h (RIVM 2006b) |
a Les expositions ont été estimées en utilisant le scénario ConsExpo pour la peinture murale à l'eau à appliquer au pinceau/rouleau [RIVM 2007a]. Toutes les valeurs par défaut recommandées pour ce scénario ont été utilisées, sauf pour les paramètres mentionnées ci-après.
b Le revêtement général d'un sol (RIVM 2007b) correspond le mieux aux scénarios de produit pour un sol/béton/fini en roche/produit d'étanchéité et teinture de bois/plancher. Toutes les valeurs par défaut recommandées pour ce scénario ont été utilisées, sauf pour les paramètres mentionnés présentement.
c Les expositions ont été estimées en utilisant le scénario de ConsExpo pour les nettoyants pour vitres [RIVM 2006a]. Toutes les valeurs par défaut recommandées pour ce scénario ont été utilisées, sauf pour les paramètres mentionnés présentement.
d Les expositions ont été estimées en utilisant le scénario de ConsExpo pour les nettoyants pour salle de bains [RIVM 2006a]. Toutes les valeurs par défaut recommandées pour ce scénario ont été utilisées, sauf pour les paramètres mentionnés présentement.
e Il n'y a pas présentement de scénario dans ConsExpo pour les assainisseurs d'air. Toutefois, en se basant sur IFRA [2012] et des consultations internes, les paramètres utilisés dans ConsExpo v4.1 sont mentionnés sous Paramètre du modèle.
f 97,5 % des colorants capillaires au Canada contiennent 3-10 % de DEGEE; seulement 2,5 % en contiennent supérieur(e) à 10 %.
