Évaluation préalable triclocarban
Titre officiel : Évaluation préalable - 3-(4-chlorophényl)-1-(3,4-dichlorophényl)urée (triclocarban)
Numéro de registre du Chemical Abstracts Service : 101-20-2
Environnement et Changement climatique Canada
Santé Canada
Mars 2023
No de cat. : En84-317/2022F-PDF
ISBN 978-0-660-45319-4
Résumé
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), le ministre de l’Environnement et le ministre de la Santé ont réalisé une évaluation préalable de la substance 3-(4-chlorophényl)-1-(3,4-dichlorophényl)urée, ci-après appelée triclocarban. Le numéro de registre du Chemical Abstracts Service (no CASNote de bas de page 1) pour le triclocarban est 101-20-2.
Selon les renseignements soumis dans le cadre d’enquêtes menées en vertu de l’article 71 de la LCPE, le triclocarban a été importé au Canada dans des quantités respectivement comprises entre 10 000 et 100 000 kg et entre 1 000 et 10 000 kg en 2008 et 2015, mais les quantités fabriquées au Canada n’ont pas dépassé le seuil de déclaration de 100 kg. Le triclocarban est utilisé au Canada dans des produits de consommation, notamment dans un petit nombre de cosmétiques tels que les pains de savon et les nettoyants pour le visage.
Le risque pour l’environnement associé au triclocarban a été caractérisé à l’aide de l’approche de classification des risques écologiques des substances organiques (CRE), une approche basée sur les risques qui tient compte de plusieurs paramètres de danger et d’exposition et pondère de multiples éléments de preuve pour obtenir un classement du risque. Les profils de danger reposent principalement sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne induite par le réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Parmi les paramètres pris en compte dans les profils d’exposition figurent le taux d’émission potentielle, la persistance globale et le potentiel de transport sur de grandes distances. Une matrice des risques permet d’attribuer un niveau de risque faible, modéré ou élevé aux substances, en fonction de leurs profils de danger et d’exposition. L’approche de la CRE a permis de classer l’exposition au triclocarban comme étant faible, d’après les profils d’emploi déclarés, et le danger comme étant modéré. Comme cette substance est connue pour ses propriétés antibactériennes, la classification de sa dangerosité a été revue à l’aide d’un ensemble de données plus large que celui pris en compte dans la CRE initiale. À la suite de cette analyse supplémentaire, le triclocarban a été considéré comme présentant un danger élevé en raison de sa toxicité intrinsèque pour les organismes aquatiques et de son potentiel élevé de bioaccumulation chez les invertébrés. Cependant, en raison de son faible potentiel d’exposition, le triclocarban est considéré comme peu susceptible de causer des effets nocifs sur l’environnement.
Compte tenu de tous les éléments de preuve exposés dans la présente évaluation préalable, le triclocarban présente un faible risque d’effets nocifs pour l’environnement. Il est conclu que le triclocarban ne répond pas aux critères énoncés aux alinéas 64a) ou b) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
Il a été déterminé, dans des études sur des animaux, que l’effet critique du triclocarban sur la santé était une réduction du poids absolu et relatif des organes (rate, reins, foie, surrénales, cœur et hypophyse) accompagnée de modifications histologiques au niveau des organes. En outre, l’exposition au triclocarban dans le cadre d’études à doses répétées a entraîné des effets sur la diversité microbienne dans les excréments, le poids corporel et le poids des organes. Des effets sur les tissus des organes reproducteurs mâles, la reproduction et la viabilité des petits aux naissances vivantes et une réduction du poids corporel des petits des rats et de la survie de ces derniers ont été observés dans des études sur des animaux. L’exposition de la population canadienne au triclocarban est principalement associée à l’utilisation de cosmétiques ainsi qu’à des sources alimentaires et environnementales (eau potable, sol et poussière domestique). Les données de biosurveillance au Canada ont montré que la majeure partie de la population est faiblement exposée au triclocarban. Les marges d’exposition ont été jugées adéquates pour rendre compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
Compte tenu de tous les renseignements exposés dans la présente évaluation préalable, il est conclu que le triclocarban ne satisfait pas au critère énoncé à l’alinéa 64c) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est donc conclu que le triclocarban ne satisfait à aucun des critères de l’article 64 de la LCPE.
1. Introduction
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE) (Canada, 1999), les ministres de l’Environnement et de la Santé ont réalisé une évaluation préalable du triclocarban afin de déterminer si cette substance présente ou peut présenter des risques pour l’environnement ou la santé humaine. Il a été déterminé que l’évaluation de cette substance dans le cadre du Plan de gestion des produits chimiques (PGPC) était prioritaire, car elle satisfait aux critères de catégorisation du paragraphe 73(1) de la LCPE (ECCC, SC [modifié en 2007]).
Les risques pour l’environnement associés au triclocarban ont été caractérisés au moyen de l’approche de classification des risques écologiques (CRE) des substances organiques (ECCC 2016a). La CRE décrit la dangerosité d’une substance à l’aide de paramètres clés, dont le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne induite par le réseau trophique, la biodisponibilité et l’activité chimique et biologique. La CRE tient compte de la possible exposition des organismes dans les milieux aquatiques et terrestres en se basant sur des facteurs tels que les taux d’émission potentielle, la persistance globale et le potentiel de transport atmosphérique sur de grandes distances. La combinaison des divers éléments de preuve permet de déterminer les substances dont le potentiel d’effets nocifs sur l’environnement doit être évalué en profondeur et celles qui présentent peu de risques pour l’environnement.
La présente évaluation préalable tient compte des renseignements sur les propriétés chimiques, le devenir environnemental, les dangers, les utilisations et l’exposition et des renseignements supplémentaires soumis par les intervenants. Des recherches dans la littérature scientifique menées jusqu’en octobre et des recherches ciblées jusqu’en novembre 2020 ont permis de trouver des données pertinentes. Des données empiriques tirées d’études clés ainsi que des résultats de modélisations ont permis de tirer des conclusions. Quand ils étaient pertinents, les renseignements contenus dans des évaluations réalisées par d’autres administrations ont été pris en compte.
La présente évaluation préalable a été rédigée par le personnel du Programme d’évaluation des risques de la LCPE de Santé Canada et d’Environnement et Changement climatique Canada et inclut des données provenant d’autres programmes de ces deux ministères. La partie de la présente évaluation préalable portant sur la santé humaine a quant à elle été soumise à un examen ou une consultation externe. Des commentaires sur les parties techniques consacrées à la santé humaine ont été soumis par le Dr R.S. Prosser (Université de Guelph, Canada), la Dre Hongbo Ma (Université du Wisconsin, États-Unis [É.-U.]), le Dr Ndeke Musee (Université de Pretoria, Afrique du Sud) et le Dr Rolf Halden (Université d’État de l’Arizona, É.-U.). La partie de la présente évaluation préalable portant sur les risques pour l’environnement est basée sur le document de la CRE (publié le 30 juillet 2016), lequel a fait l’objet d’un examen externe par des pairs et d’une consultation publique de 60 jours. Par ailleurs, l’ébauche de la présente évaluation préalable (publiée le 10 octobre 2020) a été soumise à une consultation publique de 60 jours. Bien que les commentaires externes aient été pris en compte, Environnement et Changement climatique Canada et Santé Canada restent responsables du contenu et des résultats définitifs de la présente évaluation préalable.
La présente évaluation préalable s’appuie sur des renseignements essentiels qui permettent de déterminer si cette substance satisfait aux critères de l’article 64 de la LCPE grâce à l’examen de données scientifiques et à une approche basée sur le poids de la preuve et le principe de précaution.Note de bas de page 2 La présente évaluation préalable expose les renseignements et éléments essentiels sur lesquels sa conclusion s’appuie.
2. Identité de la substance
Le numéro de registre du Chemical Abstracts Service (no CAS) pour le triclocarban, le nom de celui-ci dans la Liste intérieure (LI) et son nom commun figurent dans le Tableau 2‑1.
| No CAS | Nom sur la LI (nom commun) | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 101-20-2 | triclocarban | 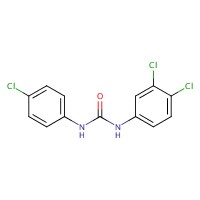 C13H9Cl3N2O C13H9Cl3N2O
|
315,59 |
Synonymes : 1-(3',4'-dichlorophényl)-3-(4'-chlorophényl)urée; 3,4,4'-trichlorocarbanilide; 3,4,4'-trichlorodiphénylurée; N-(3,4-dichlorophényl)-N’-(4-chlorophényl)urée; Trichlocarban; Triclocarbanum (ChemIDplus, 1993-).
Le triclocarban est un carbanilide composé de deux cycles benzéniques, l’un monochloré, l’autre dichloré, tous deux liés à une molécule d’urée (aussi appelée « carbamide »).
3. Propriétés physiques et chimiques
Les propriétés physiques et chimiques du triclocarban sont résumées au Tableau 3‑1. D’autres propriétés physiques et chimiques figurent dans un document d’ECCC (2016 b).
| Propriété | Valeur | Type de données | Référence clé |
|---|---|---|---|
| État physique | Solide | Expérimentale | O’Neil, 2013 |
| Point de fusion (°C) | 255,6 °C | Expérimentale | Bradley et coll., 2014 |
| Pression de vapeur (Pa, 25 °C) | 4,8 x 10-7 | Modélisée | PubChem, 2004- |
| Constante de Henry (Pa·m3/mol) | 4,6 x 10-6 | Modélisée | PubChem, 2004- |
| Solubilité dans l’eau (mg/L à 25 °C) | 0,62 | Expérimentale | ECHA, c2007-2017 |
| log Koe (sans dimension) | 3,63 | Expérimentale | ECHA, c2007-2017 |
| pKa (sans dimension, 20 °C) | 12,7 | Expérimentale | PubChem, 2004- |
Abréviations : Koe : coefficient de partage octanol-eau pKa : constante de dissociation acide
4. Sources et utilisations
Le triclocarban a été visé par des enquêtes menées en vertu de l’article 71 de la LCPE (Canada, 2009, 2017Note de bas de page 3). Aucune quantité produite de triclocarban dépassant le seuil de déclaration de 100 kg n’a été déclarée en 2008 et 2015. Les répondants ont déclaré avoir importé respectivement 10 000 à 100 000 kg et 1 000 à 10 000 kg de triclocarban au Canada en 2008 et 2015. Ils ont déclaré l’avoir utilisé comme agent antibactérien dans des produits de santé naturels vendus au Canada, pour prévenir les odeurs corporelles (Canada, 2009, 2017).
Le triclocarban figure dans la Base de données sur les ingrédients des produits de santé naturels comme produit de santé non naturel, car il ne s’agit pas d’une substance naturelle inscrite à l’annexe 1 du Règlement sur les produits de santé naturels, mais ne figure pas dans la Base de données sur les produits de santé naturels homologués, car il n’est pas présent dans les produits de santé naturels vendus au Canada (BDIPSN [modifiée en 2021]; BDPSNH [modifiée en 2021]). Le triclocarban n’est utilisé dans aucun médicament à usage humain actuellement commercialisé, selon la liste de la Base de données sur les produits pharmaceutiques (communication personnelle; courriel de la Direction des produits de santé naturels sans ordonnance, Santé Canada, adressé à la Direction de la sécurité des milieux, Santé Canada, et daté du 2 février 2022; source non citée). Le triclocarban n’est pas utilisé comme additif alimentaire ou indirect et n’entre pas dans la composition de matériaux d’emballage alimentaire (communication personnelle; courriel de la Direction des aliments, Santé Canada, adressé à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, et daté du 31 août 2018; source non citée). De plus, le triclocarban n’est pas utilisé comme principe actif ou ingrédient dans les produits antiparasitaires homologués (communication personnelle; courriel de l’Agence de réglementation de la lutte antiparasitaire, Santé Canada, adressé à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, et daté du 31 août 2018; source non citée).
Le triclocarban ne figure actuellement pas sur la Liste critique des ingrédients cosmétiques (Santé Canada [modifiée en 2019]). Selon les déclarations soumises à Santé Canada en vertu du Règlement sur les cosmétiques entre décembre 2015 et décembre 2018, le triclocarban est utilisé au Canada dans un petit nombre de produits cosmétiques, dont des pains de savon et des nettoyants pour le visage (données internes; Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, 7 janvier 2019; source non citée).
Le triclocarban est inscrit dans la base de données d’identification des ingrédients cosmétiques du Personal Care Products Council en raison de son utilisation comme biocide cosmétique, agent déodorant et agent de conservation. Il est également utilisé dans les huiles, comprimés et sels pour le bain, les savons et détergents pour le bain, les nettoyants pour le corps, les déodorants et les poudres (PCPC, 2018).
Il a été déterminé que le triclocarban était présent, en Europe, dans des catégories de produits telles que les produits d’entretien de l’air, les revêtements et peintures, les diluants, les décapants, les mastics, les plâtres, la pâte à modeler, les peintures à appliquer avec les doigts, les encres et toners, les produits pharmaceutiques et les produits de lavage et de nettoyage (CoRAP, 2018). En revanche, le triclocarban n’a pas été trouvé, au Canada, dans ces produits ou dans des produits de consommation autres que ceux énumérés ci-dessus.
En Europe, le pourcentage de triclocarban dans les cosmétiques rinçables est limité à moins de 1,5 % lorsqu’il est utilisé à d’autres fins que comme conservateur (Annexe III/100, EC, 2018a), et à 0,2 % maximum dans les cosmétiques lorsqu’il est utilisé comme conservateur (Annexe V/23, EC, 2018 b). L’United States Food and Drug Administration (US FDA) a publié une décision finale indiquant que l’utilisation du triclocarban (et de 18 autres ingrédients actifs) dans des produits de lavage antiseptique grand public (pour les mains et le corps) n’est pas généralement reconnue comme sûre ou efficace en raison d’un manque de données démontrant la sécurité et l’efficacité d’une telle utilisation (US FDA, 2016).
5. Potentiel d’effets nocifs sur l’environnement
5.1 Caractérisation des risques pour l’environnement
Les risques pour l’environnement associés au triclocarban ont été caractérisés au moyen de l’approche de CRE (ECCC, 2016a). La CRE est une méthode de hiérarchisation des risques qui permet de classer ces derniers en tenant compte de plusieurs paramètres liés au danger et à l’exposition et en pondérant plusieurs éléments de preuve. La combinaison des divers éléments de preuve permet de différencier les substances en fonction de leur potentiel de toxicité, faible ou élevé, et du risque d’exposition à celles-ci, faible ou élevé, dans divers milieux. Cette approche permet de réduire l’incertitude globale associée à la caractérisation des risques, contrairement à une méthode de caractérisation qui serait basée sur un seul paramètre mesuré dans un seul milieu (p. ex. la concentration létale médiane).
Les données sur les propriétés physiques et chimiques, le devenir (demi-vies chimiques dans divers milieux et biotes, coefficients de partage et bioconcentration dans les poissons), l’écotoxicité aiguë pour les poissons et les volumes de produits chimiques importés et fabriqués au Canada ont été extraites de publications scientifiques, de bases de données empiriques existantes (p. ex., la boîte à outils [Q]SAR de l’OCDE, 2014) et de résultats d’enquêtes menées en vertu de l’article 71 de la LCPE ou ont été générées à l’aide de modèles (Q)SAR (relation quantitative structure-activité) ou par modélisation du devenir du bilan massique ou de la bioaccumulation. Ces données ont été intégrées à d’autres modèles de bilan massique ou ont permis de définir les profils de danger et d’exposition de la substance.
Les profils de danger ont été principalement basés sur les paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne induite par le réseau trophique, à la biodisponibilité et à l’activité biologique et chimique. Les profils d’exposition ont été également basés sur plusieurs autres paramètres, dont le taux d’émission potentielle, la persistance globale et le potentiel de transport sur de grandes distances. La comparaison des profils de danger et d’exposition avec les critères de décision a permis de classifier les potentiels de dangerosité et risques d’exposition associés à chaque substance organique comme faibles, modérés ou élevés. L’application d’autres règles (p. ex. en matière de constance du classement et de marges d’exposition) a permis d’affiner la classification préliminaire du danger et du risque d’exposition.
Une matrice des risques a permis de déterminer un niveau de risque (faible, moyen ou élevé), en fonction de la classification du danger et de l’exposition pour chaque substance. Les classifications des risques déterminées au moyen de la CRE ont été vérifiées selon une approche en deux étapes. La première étape a consisté à ajuster les résultats de la classification des risques, de sorte que le niveau de risque moyen ou élevé devienne faible pour les substances qui présentaient un faible taux d’émission estimé dans l’eau en sortie de traitement des eaux usées, le risque d’exposition à ces substances étant donc faible. La deuxième étape a consisté à examiner les résultats de la classification des risques au moyen de scénarios locaux (c. à d. à proximité immédiate du point de rejet) de risque relativement prudents destinés à protéger l’environnement, afin de déterminer si le niveau de risque devait être augmenté.
La CRE utilise une approche pondérée permettant de réduire au minimum le risque de sous-classifier ou surclassifier les dangers et l’exposition et les risques qui en résultent. Un document d’ECCC (2016a) décrit en détail les approches équilibrées ayant permis de tenir compte des incertitudes. Deux des domaines d’incertitude les plus importants sont décrits ci-dessous. Des erreurs dans les valeurs de toxicité aiguë empiriques ou modélisées pourraient entraîner des modifications de la classification du danger, en particulier dans le cas des paramètres dépendant des valeurs liées aux résidus présents dans les tissus (c.-à-d. les paramètres liés au mode d’action toxique), nombre de ces valeurs étant prédites à l’aide de modèles (Q)SAR (Boîte à outils QSAR de l’OCDE, 2014). Toutefois, l’impact de telles erreurs est atténué par le fait qu’une surestimation de la létalité médiane conduira à une valeur prudente (conservative) concernant les résidus présents dans les tissus, laquelle sera utilisée pour l’analyse critique des résidus corporels. Les erreurs dues à une sous-estimation de la toxicité aiguë seront atténuées grâce à l’utilisation d’autres paramètres de danger tels que le profilage structurel du mode d’action, la réactivité ou l’affinité de la liaison à l’œstrogène. Les changements ou erreurs dans les quantités chimiques pourraient conduire à des différences de classification de l’exposition, les classifications de l’exposition et du risque étant très sensibles au taux d’émission et aux quantités utilisées. Les classifications déterminées au moyen de la CRE reflètent donc l’exposition et le risque au Canada en tenant compte des estimations des quantités actuellement utilisées, mais peut-être pas les tendances futures.
Les données et éléments essentiels ayant servi à dresser les profils propres au triclocarban et les résultats de la classification des dangers, de l’exposition et des risques sont présentés dans un document d’ECCC (2016 b).
Selon les renseignements pris en compte dans le cadre de la CRE, le triclocarban a été classé comme ayant un faible potentiel d’exposition. Cette substance a également été classée comme ayant un potentiel de dangerosité modéré en raison de sa capacité modérée à provoquer des effets nocifs dans les réseaux trophiques aquatiques, compte tenu de son potentiel de bioaccumulation et de sa toxicité élevée. D’après toutes ces données, le triclocarban a été classé comme présentant un faible risque pour l’environnement.
Les données existantes relatives au profil d’utilisation et à la surveillance environnementale confirment le faible potentiel d’exposition déterminé à l’aide de la CRE. Étant donné que le triclocarban est peu utilisé dans les secteurs des produits de consommation et du commerce (voir la section 4 - Sources et utilisations), le triclocarban issu de produits de consommation et rejeté dans les écosystèmes aquatiques d’eau douce au Canada par l’intermédiaire des eaux usées se disperse et les organismes aquatiques sont donc faiblement exposés à cette substance. Les mesures disponibles effectuées sur les eaux de surface canadiennes indiquent que les concentrations de triclocarban sont inférieures au seuil de détection déclaré de 0,006 µg/L (Garcia-Ac et coll., 2009), ce qui confirme le résultat de la classification, à savoir que le potentiel d’exposition à la faune aquatique est faible. Le triclocarban peut également être rejeté sur les sols agricoles canadiens sur lesquels des biosolides sont épandus. Les études existantes indiquent que le triclocarban pur épandu sur les sols se biodégrade lentement (Ying et coll., 2007), mais la dégradation pourrait être stimulée à l’aide de la bioaugmentation (une technique de bioremédiation qui améliore la dégradation des contaminants grâce à l’utilisation de cultures microbiennes) (Mulla et coll., 2016; Yun et coll., 2017; Sipahutar et Vangnai, 2017; Sipahutar et coll,. 2018). En outre, le triclocarban présent dans les biosolides se dégrade encore plus lentement (Lozano et coll., 2018; Snyder et coll., 2010), et la biodégradation peut être ralentie par une faible biodisponibilité lorsque ces biosolides sont épandus dans des champs (Kwon et Xia, 2012). Par ailleurs, les études existantes montrent que le triclocarban contenu dans les biosolides peut être faiblement biodisponible (Snyder et coll., 2010; Higgins et coll., 2011; Macherius et coll., 2014; Walters et coll., 2010) et peu bioaccumulable dans le réseau trophique des organismes terrestres, comme les vers de terre et les oiseaux (annexe A, tableau A-2).
Le potentiel de danger modéré du triclocarban a été déterminé grâce aux règles de classification appliquées dans le cadre de la CRE, notamment à celles associées au facteur d’évaluation du danger (FED)Note de bas de page 4 pour le milieu aquatique et à la biodisponibilité. Cependant, comme le triclocarban est connu pour ses propriétés antibactériennes et son profil de dangerosité potentiellement élevé, une caractérisation supplémentaire des dangers pour l’environnement a été effectuée à l’aide d’un ensemble de données plus large que celui pris en compte dans l’approche de CRE.
Les données empiriques de toxicité mettent en évidence un potentiel de danger élevé (plutôt que modéré) pour les espèces aquatiques, en particulier pour les invertébrés aquatiques (toxicité indiquée par des valeurs de la CL50 comprises entre 6,896 µg/L et 910 µg/L; la CE50 est comprise entre 0,209 µg/L et 295 µg/L; annexe A, tableau A-1). Les données empiriques de bioaccumulation mettent également en évidence un potentiel élevé de bioaccumulation chez les invertébrés aquatiques, en particulier chez les daphnies (facteur de bioconcentration/facteur de bioaccumulation [FBC/FBA] compris entre 1240 et 82 900) et les mollusques bivalves (FBC/FBA compris entre 7943 et 45 538) (annexe A, tableau A-2), deux catégories d’organismes qui n’ont pas été prises en compte dans les paramètres utilisés dans le cadre de la CRE.
Compte tenu de ces renseignements supplémentaires, le danger associé au triclocarban est probablement plus important que prévu selon les paramètres utilisés dans le cadre de la CRE. Bien qu’il soit peu probable que les niveaux actuels d’exposition au triclocarban dans l’environnement au Canada soient préoccupants, le triclocarban est considéré comme présentant un potentiel de danger élevé en raison de sa toxicité intrinsèque pour les espèces aquatiques et de son potentiel élevé de bioaccumulation chez les invertébrés. Par conséquent, le triclocarban pourrait présenter un risque pour l’environnement au Canada si les niveaux d’exposition augmentaient.
6. Potentiel d’effets nocifs sur la santé humaine
6.1 Évaluation de l’exposition
6.1.1 Milieux environnementaux et alimentation
Milieux environnementaux
Des études portant sur les milieux environnementaux ont consisté à mesurer les concentrations de triclocarban dans l’eau potable, le sol et la poussière domestique. Dans l’Enquête nationale sur les sous-produits de désinfection et certains nouveaux contaminants dans l’eau potable au Canada (2009-2010) (Tugulea, 2016), Santé Canada a analysé 65 systèmes de traitement de l’eau potable partout au Canada. Les concentrations de triclocarban dans l’eau traitée ou non traitée provenant de puits, de rivières ou de lacs étaient inférieures au seuil de détection minimal (4 ng/L) sur 92 % des sites d’échantillonnage existants. Lorsqu’ils étaient détectés (dans quatre échantillons), les concentrations mesurées dans l’eau de puits étaient comprises entre 9,2 et 29,3 ng/L dans les échantillons non traités et entre 109,9 et 160,5 ng/L dans les échantillons traités, 160,5 ng/L étant la concentration la plus élevée détectée dans tous les échantillons. Ces données montrent que les concentrations de triclocarban peuvent être plus élevées dans l’eau traitée que dans l’eau non traitée; les raisons de ce constat ne sont pas claires (Tugulea, 2016). Dans une étude portant sur l’eau potable de trois arrondissements de Montréal (Québec), la concentration de triclocarban était inférieure à la limite de détection (LD) (LD = 3 ng/L); Garcia-Ac et coll., 2009). Le triclocarban n’a pas été détecté dans l’eau potable dans une ancienne étude de surveillance menée dans 12 agglomérations des É.-U. (DL = 10 ng/L; Monsanto, 1980); Cependant, dans cette étude, probablement antérieure à la mise en place des pratiques modernes, la LD était plus élevée. Dans une étude plus récente réalisée en Espagne, du triclocarban a été détecté dans de l’eau minérale et de l’eau du robinet, à des concentrations respectives de 53 et 56 ng/L (limite de quantification [LQ] = 0,1 ng/L; Carmona et coll., 2014).
Le triclocarban a été mesuré dans des sols agricoles, après épandage de biosolides. Les concentrations observées varient considérablement d’un endroit à l’autre, probablement en raison de l’étendue de l’épandage antérieur de biosolides ou des niveaux de contamination de fond. Au Québec (Canada), des échantillons prélevés dans deux régions différentes dans des sols sur lesquels des biosolides municipaux avaient été épandus à 12 et 11 reprises entre 1991 et 2006 présentaient respectivement des concentrations moyennes de triclocarban de 53 et 13 ng/g (Viglino et coll., 2011). Dans la région des États du littoral médio-atlantique et en Virginie septentrionale (États-Unis), des champs sur lesquels avaient été dispersés des biosolides une seule fois au cours des 3 à 13 dernières années présentaient une concentration moyenne de triclocarban de 107,1 ng/g (en poids sec). Des champs sur lesquels avaient été épandus des biosolides à plusieurs reprises durant la même période présentaient une moyenne légèrement plus élevée de 131,9 ng/g (en poids sec) (Lozano et coll., 2018). Dans l’Illinois, des champs sur lesquels des biosolides avaient été épandus pendant 33 ans présentaient une concentration maximale de triclocarban de 1 251 ng/g (en poids sec) et le sol des parcelles témoins présentait une concentration maximale de 744 ng/g (en poids sec; Xin et coll., 2010).
Aucune donnée de surveillance environnementale au Canada n’a été trouvée pour le triclocarban dans la poussière domestique. Une concentration médiane de 200 ng/g de triclocarban a été mentionnée dans une étude portant sur des échantillons de poussière provenant d’une installation sportive et éducative à usage mixte située aux É.-U. (Hartmann et coll., 2016). Une étude portant sur des échantillons de poussière prélevés dans 19 installations sportives et 27 maisons individuelles situées dans l’Oregon a fait état d’une concentration moyenne de 497 ng/g et d’une concentration maximale de 9760 ng/g de triclocarban (Chen et coll., 2018).
Aucune étude de surveillance environnementale du triclocarban dans l’air intérieur ou extérieur n’a été trouvée. Étant donné que le triclocarban présente une faible pression de vapeur, il n’est pas censé se diffuser dans l’air.
Alimentation
Il a été signalé dans divers pays, dont le Canada et les États-Unis, que des biosolides municipaux et des eaux usées recyclées à usage agricole contenaient du triclocarban provenant de produits de consommation. Les biosolides et les eaux usées recyclées pourraient être à l’origine de la présence de triclocarban dans les aliments (AGDH, 2017; SCCP, 2005; US EPA, 2002, 2009).
Les études existantes issues de la littérature scientifique portent principalement sur des essais contrôlés visant à estimer l’absorption du triclocarban par des plantes comestibles cultivées à l’aide de sols amendés ou d’eaux usées recyclées ou sur des modélisations permettant d’estimer les concentrations prévues de triclocarban dans les produits issus d’animaux consommant ces mêmes plantes. Cependant, étant donné que ces études se limitent à des essais expérimentaux ou à des modélisations et qu’elles ne fournissent pas de mesures directes des concentrations dans les aliments vendus au détail, elles ont été jugées inappropriées pour servir à estimer l’exposition. Les seules mesures de concentrations de triclocarban dans des aliments vendus au détail, recensées au Canada ou ailleurs, avaient été effectuées sur des échantillons de légumes-feuilles et de légumes racines achetés sur un marché en Espagne (Aparicio et coll., 2018) et contenant tous des concentrations détectables de triclocarban. Dans le cadre de cette évaluation de l’exposition, la concentration maximale de triclocarban dans la laitue, indiquée par Aparicio et coll. (2018), soit 14,6 ppb (ng/g de matière sèche) et 0,79 ppb en poids humide (selon les calculs), a été appliquée de façon conservatrice aux aliments de la grande catégorie des « légumes ».
Le taux de consommation alimentaire des « consommateurs seulement » sur une seule journée pour la catégorie « légumes », selon le Tableau de consommation des aliments de Santé Canada basé sur l’Enquête sur la santé dans les collectivités canadiennes (ESCC) de 2004, a été utilisé pour les enfants âgés de 6 mois à 3 ans (Santé Canada, 2015), et les données de consommation du Tableau de consommation des aliments basées sur l’ESCC de 2015 ont été utilisées pour tous les autres groupes d’âgeNote de bas de page 5 (Santé Canada, 2018 b). L’estimation prudente de l’exposition au triclocarban par l’alimentation a consisté à multiplier la concentration maximale de triclocarban dans la laitue, indiquée ci-dessus, par les taux de consommation moyens et au 90e percentile issus des ESCC pour les légumes. Les estimations de l’exposition moyenne et au 90e percentile par l’alimentation variaient respectivement de 2,31 à 6,84 ng/kg pc/jour et de 4,69 à 13,71 ng/kg pc/jour (communication personnelle; courriel de la Direction des aliments, Santé Canada, adressé à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, et daté du 5 mars 2019; source non citée).
Le triclocarban n’a pas été détecté dans le lait humain (n = 56 et LD = 0,86 µg/L) dans une étude menée dans la région d’Ottawa dans le cadre de l’Étude sur l’utilisation des plastiques et des produits de santé personnels pendant la grossesse (étude P4) (Arbuckle et coll., 2015). L’estimation prudente des expositions dues à l’allaitement a été réalisée à l’aide de la LD issue de cette étude et intégrée à la valeur de la dose journalière chez l’humain, indiquée ci-dessous, pour les nourrissons allaités.
Compte tenu de toutes les sources d’exposition répertoriées dans les milieux environnementaux et l’alimentation, la dose journalière estimée chez l’humain varie de 7,8 ng/kg pc/jour pour les adolescents (âgés de 14 à 18 ans) à 113,8 ng/kg pc/jour pour les nourrissons (âgés de 0 à 5 mois) allaités.
Le Tableau B‑1 de l’annexe B résume les données d’absorption potentielle de triclocarban par l’intermédiaire des milieux environnementaux et de l’alimentation.
6.1.2 Biosurveillance
La concentration totale de triclocarban dans l’urine sert à mesurer l’exposition globale des personnes à une substance, quelle que soit la voie ou la source d’exposition (dont les milieux environnementaux, l’alimentation et les produits d’usage quotidien). Dans les études menées chez l’humain, 27 % de la dose ingérée était excrétée dans l’urine pendant les trois jours suivant l’exposition orale; Le triclocarban (sous forme libre ou de métabolites) peut être également détecté dans l’urine après une exposition cutanée (Hiles et Birch, 1978a; Scharpf et coll., 1975; Schebb et coll., 2011 b). L’élimination après une exposition orale est biphasique, avec des demi-vies de 2,4 et 20 heures (Hiles et Birch, 1978a). L’élimination après une exposition cutanée est monophasique, avec une demi-vie de 8 à 10 heures (Scharpf et coll., 1975). Les principaux métabolites du triclocarban détectés dans l’urine sont des dérivés glucuronidés du triclocarban ou du triclocarban hydroxylé (2'-hydroxytriclocarban ou 3'-hydroxytriclocarban). La concentration totale de triclocarban est mesurée après déconjugaison enzymatique et hydrolyse acide; le triclocarban libre est rarement détecté dans l’urine humaine (Birch et coll., 1978; Ye et coll., 2011; Zhou et coll., 2012). Consultez la section 6.2.1 pour en savoir davantage sur la métabolisation et l’excrétion du triclocarban.
Le triclocarban a été mesuré dans le cadre du cycle 2 (2009-2011) de l’Enquête canadienne sur les mesures de la santé (ECMS). Dans cette étude, la concentration totale de triclocarban a été mesurée dans l’urine après déconjugaison enzymatique et hydrolyse acide. Du triclocarban a été détecté dans moins de 4 % d’un échantillon national représentatif de 2549 Canadiens âgés de 3 à 79 ans (LD = 1 µg/L). Le 95e percentile était inférieur à la limite de détection dans tous les groupes d’âge, y compris chez les enfants, sauf dans le groupe des personnes âgées de 40 à 59 ans, qui n’a pas été inclus dans les résultats en raison d’une forte variation des données (Santé Canada, 2013). La concentration totale de triclocarban n’a été détectée que dans 4 % des échantillons d’urine (LD = 1,1 µg/L) provenant de femmes enceintes (n = 80) dans le cadre d’une étude menée dans la région d’Ottawa dans le cadre de l’étude P4 (Arbuckle et coll., 2015).
La concentration totale de triclocarban (après déconjugaison enzymatique et hydrolyse acide) a été détectée dans 37 % des échantillons d’urine (LD = 0,1 µg/L) prélevés dans la population générale âgée de 6 ans et plus lors de l’enquête nationale étatsunienne sur la santé et la nutrition (NHANES, n = 2686) en 2013-2014, avec une valeur au 95e percentile de 13,4 µg/L et une valeur maximale de 588 µg/L (Ye et coll., 2016). La différence de concentration au 95e percentile entre les populations étatsunienne et canadienne suggère une utilisation plus répandue ou plus importante du triclocarban aux É.-U. Cependant, la fréquence de détection plus faible observée au Canada pourrait être en partie due au fait que la LD était plus faible dans la NHANES que dans l’ECMS. Le taux de détection le plus élevé observé en ce qui concerne le triclocarban dans l’urine était > 99 % dans un groupe de 209 volontaires adultes en bonne santé vivant en Chine (LD = 0,005 µg/L). La valeur maximale indiquée dans cette étude était de 192 µg/L (Yin et coll., 2016).
Le triclocarban a été détecté dans 22 % des échantillons d’urine prélevés chez des enfants dans la NHANES en 2013-2014 et dans 37 % des échantillons provenant d’adultes, la concentration urinaire au 95e percentile étant égale à 0,9 µg/L chez les enfants (Ye et coll., 2016). Cependant, dans une étude étatsunienne de moindre envergure (n = 181), le triclocarban a été détecté dans 37 % des échantillons d’urine (LD = 0,1 µg/L) prélevés chez des enfants âgés de 3 à 6 ans, la valeur maximale observée étant égale à 8,5 µg/L (Hoffman et coll., 2018). À l’échelle mondiale, la fréquence de détection du triclocarban dans l’urine d’enfants était de 28 % au Danemark (6 à 11 ans, LD = 0,01 µg/L) et pouvait atteindre 70 % au Brésil (6 à 14 ans, LD = 0,004 µg/L) tandis que cette substance n’était pas détectée en Allemagne (LQ = 1,0 µg/L) (Frederiksen et coll., 2013; Moos et coll., 2014; Rocha et coll., 2018 a, 2018b). Les concentrations maximales mesurées étaient de 1,0 µg/L au Danemark et 0,94 µg/L au Brésil (Frederiksen et coll., 2013; Rocha et coll., 2018 a).
Le triclocarban a été détecté dans le sang du cordon ombilical dans 22 % des échantillons de 33 nouveau-nés aux É.-U. (LD non indiquée) et dans 65 % de 92 nouveau-nés en Chine (LD = 0,002 µg/L) (Pycke et coll., 2014; Wei et coll., 2017). La concentration maximale mentionnée dans cette dernière étude était de 0,82 µg/L. Le triclocarban n’a pas été détecté dans les échantillons de méconium (n = 54, LD = 0,53 ng/g) ou de lait humain (n = 56, LD = 0,86 µg/L) utilisés dans l’étude P4 ni dans les échantillons de lait humain (n = 20, LD = 1,2 µg/L) utilisés dans une étude menée aux É.-U. (Arbuckle et coll., 2015; Ye et coll., 2006).
Les doses journalières estimées de triclocarban ont été calculées à partir des données de biosurveillance issues de l’ECMS et de la NHANES (Santé Canada, 2013; Ye et coll., 2006). Dans une étude de la pharmacocinétique du triclocarban réalisée chez des sujets humains exposés par voie orale à cette substance, des volontaires (n = 6 mâles, âgés de 20 à 40 ans) ont reçu une dose unique de 2,2 µmol de triclocarban marqué au carbone 14 par kg de poids corporel (Hiles et Birch, 1978a). Le triclocarban a été absorbé rapidement et une concentration plasmatique maximale de 3,7 nmol/g a été atteinte en moins de trois heures. Vingt-sept pour cent de la dose administrée ont été excrétés dans l’urine en 80 heures. Étant donné que la métabolisation du triclocarban n’entraîne pas la rupture de sa structure de base, le carbone 14 retrouvé dans l’urine permet une estimation fiable de l’excrétion de la dose initiale par voie urinaire et peut être considéré comme un biomarqueur spécifique. Les études de biosurveillance que sont l’ECMS et la NHANES ont permis de déterminer la concentration totale de triclocarban dans l’urine après hydrolyse acide et déconjugaison enzymatique, cette mesure de la concentration de triclocarban étant considérée comme spécifique (Santé Canada, 2013; Ye et coll., 2006).
Les doses journalières estimées ont été calculées à partir des valeurs au 95e percentile issues de l’ECMS et de la NHANES, en utilisant une fraction d’excrétion urinaire de 27 %, d’après Hiles et Birch (1978a). Les concentrations au 95e percentile indiquées dans l’ECMS étaient inférieures à la LD et une valeur de 1,0 µg/L a été utilisée comme estimation prudente de la concentration urinaire. Consultez l’annexe C pour en savoir plus sur les valeurs par défaut et les modèles ayant servi à calculer les doses journalières estimées. Les doses journalières estimées à partir des données de biosurveillance canadiennes se situent entre 0,07 et 0,11 µg/kg pc/jour. Les doses absorbées figurent dans le Tableau 6‑1.
| Source | Groupe d’âge (ans) | CU ou CUCr, P95 | FEU |
Dose journalière estimée (mg/kg pc/jour) |
|---|---|---|---|---|
|
Cycle 2 de l’ECMS (2009-2011) (Santé Canada, 2013) |
De 3 à 5 | 1,0 µg/L | 0,27 | 0,00011 |
|
Cycle 2 de l’ECMS (2009-2011) (Santé Canada, 2013) |
De 6 à 11 | 1,0 µg/L | 0,27 | 0,000093 |
|
Cycle 2 de l’ECMS (2009-2011) (Santé Canada, 2013) |
De 12 à 19 | 1,0 µg/L | 0,27 | 0,000074 |
|
Cycle 2 de l’ECMS (2009-2011) (Santé Canada, 2013) |
De 20 à 39 | 1,0 µg/L | 0,27 | 0,000074 |
|
Cycle 2 de l’ECMS (2009-2011) (Santé Canada, 2013) |
De 40 à 59 | 1,0 µg/L | 0,27 | 0,000074 |
|
Cycle 2 de l’ECMS (2009-2011) (Santé Canada, 2013) |
De 60 à 79 | 1,0 µg/L | 0,27 | 0,000074 |
|
NHANES, 2013-2014 (Ye et coll., 2006) |
De 6 à 11 | 0,778 µg/g Cr | 0,27 | 0,000033 |
|
NHANES, 2013-2014 (Ye et coll., 2006) |
De 12 à 19 | 1,97 µg/g Cr | 0,27 | 0,00015 |
|
NHANES, 2013-2014 (Ye et coll., 2006) |
20 et plus | 17,6 µg/g Cr | 0,27 | 0,0012 |
|
NHANES, 2013-2014 (Ye et coll., 2006) |
Tous | 14,6 µg/g Cr | 0,27 | 0,0010 |
Abréviations : CU : concentration urinaire; CUCr : concentration urinaire ajustée en fonction de la créatinine; Cr, creatinine; FEU : fraction d’excrétion urinaire
6.1.3 Cosmétiques
Il a été signalé que le triclocarban était utilisé au Canada dans un petit nombre de cosmétiques tels que des pains de savon et des nettoyants pour le visage. Les concentrations déclarées de triclocarban dans ces produits varient de 0,1 % à 3 % (données internes de la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, datées du 7 janvier 2019; source non citée). Les niveaux d’exposition potentielle ont été estimés à partir d’hypothèses prudentes et de valeurs par défaut. Consultez l’annexe C pour en savoir davantage sur les valeurs par défaut et les modèles ayant servi à estimer les niveaux d’exposition. Les scénarios d’exposition sentinelles sont présentés dans le Tableau 6‑2.
Les valeurs d’absorption cutanée provenant de diverses études réalisées chez l’humain ont servi à déterminer une dose interne estimée. L’absorption cutanée a été évaluée à l’aide de cellules de diffusion statique ou dynamique avec de la peau humaine d’adultes et de nouveau-nés (Wester et coll., 1985). Une dose de 27 µg/cm2 de triclocarban a été appliquée sur la surface de la peau. À 37 °C, 0,26 % de la dose appliquée a été absorbéNote de bas de page 6 par la peau abdominale des nouveau-nés et 0,23 % par la peau abdominale des adultes dans une cellule de diffusion statique. Dans un modèle à flux constant, 6 % de la dose appliquée ont été absorbés par la peau abdominale d’un adulte. Lors d’un essai in vivo, une dose de 4 µg/cm2 de triclocarban radiomarqué au carbone 14 a été appliquée sur 500 cm2 de peau chez cinq hommes volontaires. Sur une période de sept jours, 7 % de la dose appliquée a pénétré dans la peau, d’après les données d’excrétion urinaire (Wester et coll., 1985). Dans deux études distinctes, l’absorption du triclocarban a été mesurée chez des volontaires humains après que les sujets se furent douchés avec du savon contenant du triclocarban. Dans la première étude, six sujets masculins adultes ont utilisé environ 7 g de savon contenant 2 % de triclocarban (ce qui équivaut à une dose appliquée d’environ 8 µg/cm2 avant rinçage, selon les valeurs par défaut applicables au groupe d’âge des 19 ans et plus). La quantité totale moyenne excrétée dans l’urine et les matières fécales équivalait à 0,39 % de la dose appliquée (dont 0,16 % dans l’urine sur deux jours et 0,23 % dans les matières fécales sur six jours) (Scharpf et coll., 1975). Dans la seconde étude, six volontaires adultes (cinq hommes et une femme) ont utilisé du savon contenant 0,6 % de triclocarban et en ont appliqué une dose maximale moyenne de 4 µg/cm2 sur leur peau. Après s’être savonnés, les volontaires ont laissé la mousse sur leur peau pendant 15 minutes avant de se rincer. La quantité moyenne excrétée dans l’urine sur 72 heures équivalait à 0,6 % de la dose appliquée, soit 0,5 mg par douche et par personne (Schebb et coll., 2011 b). Dans chacune de ces études, la dose indiquée était avant celle appliquée avant rinçage. D’après ces études, l’absorption par voie cutanée d’une dose de triclocarban > 8 µg/cm2 (avant le rinçage) par l’intermédiaire du savon peut être estimée de façon prudente à 0,39 % de la dose appliquée (d’après Scharpf et coll., 1975). L’absorption cutanée d’une dose de triclocarban de 4 µg/cm2 ou moins (avant le rinçage) contenue dans du savon peut être estimée à plus de 0,6 % de la dose appliquée selon Schebb et coll. (2011 b), car la quantité excrétée dans les matières fécales n’a pas été mentionnée. Pour obtenir une estimation prudente, un taux d’absorption de 1 % a été utilisé pour les scénarios où la dose appliquée de triclocarban était inférieure à 4 µg/cm2.
| Scénario | Limite supérieure de concentration (%) | Groupe d’âge | Dose appliquéea (µg/cm2) | Absorption cutanée (%) | Exposition systémique (mg/kg pc/jour) |
|---|---|---|---|---|---|
| Savon pour le corps (solide) | 3,0b | 19 ans et plus | 2,3 | 1,0 | 0,0053 |
| Savon pour le corps (solide) | 3,0b | De 9 à 13 ans | 2,2 | 1,0 | 0,0067 |
a Dose appliquée sur la peau avant rinçage.
b Données internes de la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, datées du 7 janvier 2019; source non citée.
6.2 Évaluation des effets sur la santé
Le triclocarban a fait l’objet d’examens par le Comité scientifique des produits de consommation (SCCP) de la Commission européenne, le National Industrial Chemicals Notification and Assessment Scheme du ministère australien de la Santé et l’US EPA, dans le cadre de son programme « High Production Volume Challenge » (SCCP, 2005; AGDH, 2017; US EPA, 2002). Certaines données issues de ces examens ont été prises en compte dans la présente évaluation des effets sur la santé.
6.2.1 Toxicocinétique
Le triclocarban est rapidement absorbé et métabolisé par voie orale ou intraveineuse chez l’humain, le rat et d’autres espèces. Cette substance est moins rapidement absorbée par voie cutanée, mais les doses absorbées par cette voie sont rapidement métabolisées et éliminées. Une fois le triclocarban absorbé, sa métabolisation n’entraîne pas de rupture de sa structure de base; il subit une hydroxylation suivie d’une conjugaison avec l’acide glucuronique et des sulfates dans des proportions variables, selon les tissus. La conjugaison a lieu avec le triclocarban ou des espèces hydroxylées. Une très faible partie de la dose absorbée (< 1 %) migre dans les tissus, selon des études menées chez l’animal (Hiles, 1977; Hiles et coll., 1978). Chez l’humain, les rats et les singes, plus de 90 % de la dose absorbée par voie orale sont excrétés dans l’urine et les matières fécales, mais en grande partie dans les matières fécales (Hiles, 1977; Hiles et Birch, 1978b; Hiles et coll., 1978). Le triclocarban est excrété dans l’urine sur une période pouvant atteindre 80 heures et dans les matières fécales pendant un maximum de 12 jours (Hiles, 1977; Hiles et Birch, 1978a; Scharpf et coll., 1975; Schebb et coll., 2011 b).
Études chez l’humain
Chez l’humain, le triclocarban a été rapidement absorbé après l’administration de doses orales, atteignant sa concentration plasmatique maximale après moins de trois heures (Hiles et Birch, 1978a). Après application cutanée sous la douche avec du savon contenant jusqu’à 2 % de triclocarban, les concentrations de triclocarban et des métabolites de ce dernier étaient inférieures au seuil de détection (10 ppb) dans le sang, quel que soit le moment de l’échantillonnage (Scharpf et coll., 1975; Taulli et coll., 1977). Après administration par voie intraveineuse, le triclocarban est passé par une très courte phase de diffusion dans le plasma, où sa demi-vie était inférieure à cinq minutes, suivie d’une phase d’élimination, où sa demi-vie était de 8,6 heures (Scharpf et coll., 1975). Après administration d’une dose unique par voie orale, deux tiers à trois quarts du triclocarban présent dans le sang ont été sulfonés en trois heures et moins de 10 % ont été glucuronoconjugués; au bout de 24 heures, plus de 95 % du triclocarban présent dans le plasma était sulfoné (Taulli et coll., 1977; Birch et coll., 1978). Les métabolites du triclocarban ont été éliminés du plasma en deux phases : élimination des glucuronides, avec une demi-vie de 1,8 heure, puis élimination des sulfates, avec une demi-vie de 20,2 heures (Hiles et Birch, 1978a). Très peu de données permettant de décrire la distribution organique du triclocarban chez l’humain ont été trouvées. Cependant, dans une étude de biosurveillance, du triclocarban a été trouvé dans l’hypothalamus, dans 1 échantillon sur 24, et dans la substance blanche, dans 2 échantillons sur 10, et il a été détecté dans le sang de cordon, dans des études supplémentaires (Van Der Meer, 2017; Wei et coll., 2017; Pycke et coll., 2014).
Après exposition cutanée sous la douche avec un savon contenant du triclocarban, les métabolites excrétés sont principalement des formes glucuronoconjuguées et une faible quantité de triclocarban parent est détectée dans l’urine. La concentration maximale de glucuronides de N-triclocarban dans l’urine a été observée 10 à 24 heures après utilisation sous la douche d’un savon contenant 0,6 % de triclocarban et elle variait considérablement d’un sujet à l’autre. La prise de douches quotidiennes répétées a entraîné une stabilisation des glucuronides de triclocarban dans l’urine (Schebb et coll., 2011 b; Scharpf et coll., 1975). Après une seule exposition par voie cutanée, la majeure partie du triclocarban, soit jusqu’à 0,6 % de la dose appliquée, a été excrétée sur une période allant jusqu’à 36 heures et 0,24 % de cette même dose l’a été dans les matières fécales (Scharpf et coll., 1975; Schebb et coll., 2011 b). Après administration d’une dose par voie intraveineuse, 18 % de celle-ci ont été éliminés dans l’urine après 24 heures et 20 % au bout de quatre jours. Environ 10 % de cette dose ont été excrétés dans les matières fécales au cours des deux premiers jours et 55 % après 14 jours (Scharpf et coll., 1975). Après une administration d’une dose par voie orale, 27 % de cette dernière ont été éliminés dans l’urine en 80 heures et 70 % dans les fèces au bout de 120 heures, ce qui mettrait en évidence de possibles différences selon la voie d’administration (Hiles et Birch, 1978a).
Études chez les animaux
Chez des singes rhésus adultes, les concentrations plasmatiques ont augmenté rapidement jusqu’à 12 heures après l’injection intraveineuse puis relativement lentement entre 12 et 24 heures après celle-ci, ce qui correspondrait à une cinétique de premier ordre (Hiles et coll., 1978). Chez des rats Sprague-Dawley mâles, 43 % d’une dose de 14C-triclocarban administrée par gavage a été retrouvée dans l’urine, la bile et les tissus après 72 heures (Hiles, 1977). Dans cette même étude, 7,8 % de cette dose ont été détectés dans les matières fécales, la bile, l’urine et les tissus 72 heures après exposition à du 14C-triclocarban par voie cutanée par l’intermédiaire d’une solution de savon concentrée à 10 % (Hiles, 1977). Après administration de cette substance par voie intraveineuse, orale ou cutanée chez des rats mâles, les seuls tissus contenant plus de 0,01 % du 14C administré étaient, dans l’ordre d’accumulation relative, le foie, les reins, les testicules et les poumons. Cependant, les quantités étaient très faibles, soit respectivement 0,072 % et 0,04 % de la dose administrée dans le foie et les poumons (Hiles, 1977). Dans une étude sur les effets de doses ad libitum administrées par l’intermédiaire d’eau potable à des souris CD-1 femelles pendant les périodes de reproduction et postnatale, le triclocarban a traversé le placenta et s’est retrouvé dans le lait maternel. Des composés apparentés au triclocarban, dans une proportion de 7 à 18 % de la dose absorbée, ont été détectés dans les gonades femelles, le cerveau, le cœur et la graisse de la progéniture, alors que des concentrations beaucoup plus faibles (< 1 à 7 % de la dose absorbée) ont été observées dans le cerveau, les muscles et le cœur des mères (Enright et coll., 2017).
Comme chez l’humain, les principaux métabolites détectés dans le plasma après administration intraveineuse et orale chez l’animal (singes rhésus adultes) étaient des formes sulfonées du triclocarban; dans la bile, la majorité des espèces dérivées du triclocarban étaient glucuronidées (Hiles et coll., 1978; Taulli et coll., 1977; Birch et coll., 1978). Après exposition cutanée chez le rat, des dérivés glucuronoconjugués n’ont été détectés dans le plasma que dans les groupes exposés aux doses les plus élevées (Schebb et coll., 2011 b). Chez les singes, les métabolites du triclocarban ont été éliminés du plasma en deux phases : élimination rapide des espèces dérivées du glucuronide, puis élimination plus lente des espèces conjuguées sulfatées (Hiles et coll., 1978). Après administration d’une dose par voie orale ou intraveineuse à des rats, environ 90 % de cette dose ont été excrétés dans les matières fécales ou la bile et 4,3 % dans l’urine (Hiles, 1977). Après administration cutanée, 15,6 % et 77 % de la dose absorbée ont été respectivement excrétés dans l’urine et la bile de façon constante sur une période de 72 heures (Hiles, 1977). Chez les singes rhésus, environ 20 % de la dose absorbée ont été éliminés dans l’urine après administration de celle-ci par voie intraveineuse, le reste ayant été éliminé dans les matières fécales (Hiles et coll., 1978).
6.2.2 Études de la toxicité aiguë, irritation et sensibilisation
Le triclocarban présente une faible toxicité aiguë lorsqu’il est administré par voie orale ou cutanée (SCCP, 2005). Aucune étude sur l’exposition par inhalation n’a été trouvée; Cependant, cette voie d’exposition est peu probable en raison de la faible pression de vapeur du triclocarban. Ce dernier n’est pas une substance irritante ou sensibilisante selon les études menées chez l’animal et l’humain (SCCP, 2005).
6.2.3 Génotoxicité
Le triclocarban a donné des résultats négatifs, avec et sans activation métabolique, lors de tests d’Ames effectués sur des souches TA98, TA100, TA1535, TA1537 et TA1538 de Salmonella typhimurium avec des doses pouvant atteindre 5 000 µg/plaque (Bayer, 1992; Bonin et coll., 1982; ECHA, c2007-2017). Le triclocarban a également donné des résultats négatifs lors d’un test d’aberration chromosomique in vitro réalisé avec et sans activation métabolique sur des cellules d’ovaires de hamsters chinois avec des concentrations pouvant atteindre 2 000 µg/mL (Soap and Detergent Association, 2002). Dans des essais réalisés dans le cadre du programme Tox21, le triclocarban s’est révélé génotoxique dans les lignées de cellules dont les mécanismes de réparation de l’ADN étaient déficients (Kim et coll., 2019).
6.2.4 Études à doses répétées
Dans une étude à doses répétées, des rates Sprague-Dawley sevrées au bout du 22e jour postnatal (JPN) (quatre par groupe) ont été exposées par voie alimentaire à 0 %, 0,2 % (soit environ à 103 mg/kg pc/jour) ou 0,5 % (soit environ 257 mg/kg pc/jour) de triclocarban pendant une durée de 28 jours, puis observées pendant une période d’élimination de 28 jours (Kennedy et coll., 2018). Aucune différence importante n’a été observée dans le poids corporel ou la prise de poids corporel. Le prélèvement d’échantillons fécaux tout au long de l’étude et le séquençage de l’ARNr 16 S à partir de l’ADN total extrait des matières fécales ont permis de déterminer la diversité du microbiote. La diversité phylogénétique a beaucoup diminué au fil du temps dans les deux groupes exposés pendant la phase de traitement (par rapport au jour 0) sur l’ensemble de la période de traitement. La tendance à la baisse de la diversité phylogénétique (par rapport au jour 0) était statistiquement significative dans le groupe ayant reçu une faible dose au 28e jour de traitement et aux 5e, 12e et 28e jours dans le groupe ayant reçu une dose élevée. La diversité phylogénétique a augmenté pendant la période d’élimination, et au jour d’élimination 8 (et par la suite) elle était significativement différente dans les deux groupes par rapport au jour 2. Une évolution statistiquement significative de la communauté microbienne, par rapport aux groupes témoins, s’est produite dans les deux groupes de traitement le deuxième jour du traitement et s’est poursuivie tout au long de la phase de traitement. Pendant la phase d’élimination, les communautés microbiennes étaient de plus en plus similaires au microbiote témoin au fil du temps. Dans le groupe ayant reçu une faible dose, les différences étaient statistiquement significatives au jour 2 de la période d’élimination, mais ne l’étaient plus au jour 8 et par la suite; dans le groupe ayant reçu une dose élevée, les différences étaient statistiquement significatives jusqu’au jour 11, mais ne l’étaient plus au jour 28. Aucune différence significative entre les groupes traités dans l’une ou l’autre des phases de l’étude n’a été observée en matière de diversité phylogénétique ou de communautés microbiennes. Au cours de la phase de traitement, les Firmicutes constituaient le phylum dominant dans les deux groupes traités et les Bacteroidetes le phylum dominant dans les groupes traités (au jour 0) et dans le groupe témoin. Durant la phase d’élimination, la quantité relativement importante de Bacteroidetes et Firmicutes dans les groupes de traitement est revenue à des niveaux qui n’étaient pas significativement différents de ceux du groupe de contrôle (Kennedy et coll., 2018).
Des groupes de 12 souris C57BL/6 mâles adultes ont été exposés à des doses de triclocarban de 0, 3, 10, 30 et 90 mg/kg pc/jour par intubation intragastrique pendant 35 jours dans une étude des effets à court terme sur la fonction cardiaque (Xie et coll., 2018). Les animaux ont été sacrifiés au jour 35 et leurs cœurs ont été prélevés pour subir des analyses histologiques et métabolomiques. Une diminution statistiquement significative du poids corporel par rapport aux témoins a été observée à 10, 30 et 90 mg/kg pc/jour. Une diminution statistiquement significative du poids absolu du cœur a été observée à 30 et 90 mg/kg pc/jour, et une diminution statistiquement significative du poids du cœur par rapport au poids corporel a été observée dans tous les groupes étudiés. Un examen histopathologique a révélé que les fibres cardiaques étaient plus épaisses et présentaient une plus faible coloration chez les animaux des groupes ayant reçu les deux doses maximales. Les données métabolomiques ont mis en évidence de multiples effets sur le métabolisme cardiaque, notamment des variations de la concentration des métabolites endogènes et de celle des enzymes cardiaques intervenant dans la synthèse et le métabolisme des acides gras (Xie et coll., 2018). L’importance des effets métaboliques du point de vue biologique n’a pas été clairement démontrée. Les modifications métaboliques induites par le triclocarban font intervenir le récepteur constitutif des androstanes (CAR), dont le triclocarban est un activateur avéré. Ce récepteur joue un rôle central dans l’induction des cytochromes P450 et des enzymes de phase II, ainsi que dans le métabolisme des lipides et du glucose et dans d’autres mécanismes. Cependant, les CAR varient considérablement d’une espèce à l’autre pour ce qui est des séquences d’ADN ou ARN qui codent pour ces derniers et de leur capacité à se lier à des substances chimiques qui les activent (Omiecinski et coll.,2011). Par conséquent, les observations de Xie et coll. (2018), selon lesquelles les modifications métaboliques induites par le CAR et les modifications de la physiologie cardiaque qui en résultent, ne sont probablement pas pertinentes pour les humains.
Dans une étude de toxicité chronique réalisée sur deux ans selon un protocole approuvé par l’US FDA, des groupes de 80 rats Sprague-Dawley ont été exposés à des doses de triclocarban de 0, 25, 75 et 250 mg/kg pc/jour par l’alimentation (Monsanto, 1981). Les signes cliniques, le poids corporel et l’alimentation ont été surveillés tout au long de l’étude. Des examens ophtalmoscopiques ont été régulièrement effectués, et des analyses cliniques hématologiques, biochimiques et d’urine ont été réalisées aux 6e, 12e, 20e, 23e mois chez les mâles et au 25e mois chez les femelles. Des autopsies et des examens pathologiques ont été effectués sur les animaux morts. Un examen des lésions macroscopiques au microscope a permis de détecter les éventuelles modifications néoplasiques. Aucun signe clinique et aucune mortalité liés au traitement n’ont été observés tout au long de l’étude. Aucune différence n’a été constatée en ce qui concerne les observations ophtalmologiques, la consommation alimentaire ou les analyses d’urine. Des signes de respiration difficile, une émaciation, des râles et des cas de mortalité ont été respectivement observés chez les mâles témoins et traités entre les semaines 64 et 86 et entre les semaines 70 et 83, en raison d’infections respiratoires. Le poids corporel moyen des mâles (à 250 mg/kg pc/jour) et des femelles (à 75 et 250 mg/kg pc/jour) était légèrement inférieur à celui des témoins. Une anémie a été observée à 75 et 250 mg/kg pc/jour chez les mâles et à 250 mg/kg chez les femelles pc/jour. Une légère augmentation des taux de phosphatase alcaline sérique, d’azote uréique sanguin, de glucose et de bilirubine totale a été observée à différents moments chez les mâles ayant reçu une dose élevée. Les modifications statistiquement significatives du poids des organes comprenaient une augmentation du poids du foie chez les deux sexes à 75 et 250 mg/kg pc/jour, une augmentation du poids de la rate à 75 mg/kg pc/jour chez les mâles et à 250 mg/kg pc/jour chez les deux sexes et une augmentation du poids des testicules et du cœur chez les mâles à 250 mg/kg pc/jour. Les auteurs n’ont observé aucun changement microscopique pouvant expliquer l’augmentation du poids des organes et ont indiqué que les variations de ce dernier pourraient donc ne pas être significatives d’un point de vue biologique. Une augmentation du nombre de cas de testicules petits et flasques a été observée chez les mâles (250 mg/kg pc/jour) morts spontanément ou abattus dans un état moribond entre 12 et 23 mois. Une telle augmentation liée au traitement n’a pas été observée au moment de l’abattage des animaux. Aucune augmentation de l’apparition de tumeurs liée à la dose n’a été mise en évidence, quel que soit le site (Monsanto, 1981). Une dose sans effet nocif observé (DSENO) de 25 mg/kg pc/jour a été choisie par le SCCP (2005) pour cette étude après observation de cas d’anémie et de modifications du poids des organes et du poids corporel à 75 mg/kg pc/jour.
6.2.5 Études in vitro
Dans des cellules cancéreuses de la prostate, un traitement associant des androgènes et le triclocarban a stimulé l’activation d’un gène rapporteur codant pour la luciférase combiné à un promoteur de l’élément de réponse aux androgènes par rapport à un traitement utilisant seulement des androgènes. Cet effet a été annulé par le bicalutamide, un inhibiteur de la liaison au récepteur des androgènes (Duleba et coll., 2011). L’exposition simultanée au triclocarban, d’une part, et à l’œstrogène ou à la dihydrotestostérone, d’autre part, augmente l’activation, par les œstrogènes ou les androgènes, du gène rapporteur codant pour la luciférase dans les lignées cellulaires comme HeLa 9908 et MDA-2kb (Tarnow et coll., 2013; Huang et coll., 2014; Christen et coll., 2010; Chen et coll., 2008; Blake et coll., 2010; Ahn et coll., 2008). Dans les cellules de cancer du sein MCF-7, le triclocarban favorise la prolifération cellulaire, réduit l’expression de la protéine ERα et de son ARN et stimule l’expression du AhR en cas de co-expression avec les œstrogènes (Huang et coll., 2014; Tarnow et coll., 2013). Dans des cellules mammaires non cancéreuses (MCF10A), le triclocarban a induit des caractéristiques de type lésion précancéreuse, y compris une dépendance réduite aux facteurs de croissance, une capacité de croissance en l’absence du support et une prolifération cellulaire accrue (Sood et coll., 2013). L’exposition au triclocarban a entraîné des modifications significatives de la quantité de brins d’ARN transcrit sensibles aux hormones thyroïdiennes dans les cellules GH3 de rat et a inhibé l’absorption d’iodure et l’activité de la peroxydase thyroïdienne dans des modèles de thyroïde cellulaire (Hinther et coll., 2011; Wu et coll., 2016).
Le triclocarban a entraîné une déplétion de l’adénosine triphosphate à des concentrations non cytotoxiques et d’importantes arythmies dans des cardiomyocytes dérivés de cellules souches pluripotentes humaines (Chaudhari et coll., 2018). Le triclocarban a été détecté dans le cadre d’un dépistage in vitro développé par Tox21 visant à déceler les substances chimiques ayant des effets sur la fonction mitochondriale (Xia et coll., 2018).
6.2.6 Études de la toxicité pour la reproduction et le développement
Dans une étude de la toxicité pour la reproduction sur trois générations, des doses de 0, 250, 500, 1 000 et 3 000 ppm (soit respectivement 0, 23, 50, 95 et 280 mg/kg pc/jour) de triclocarban ont été administrées par l’alimentation à des groupes de 12 mâles et 24 femelles de rats Charles River CD (Monsanto, 1983). Le triclocarban a été administré au moins 60 jours avant l’accouplement, puis de façon continue après ce dernier. Les animaux de chaque génération parentale ont été accouplés pour produire deux portées et certains animaux de la génération F2 ont été pour produire une troisième portée. Les descendants de la deuxième portée des parents des générations F0 et F1 ont été sélectionnés pour être les parents des générations suivantes. Les générations F2 et F3 ont reçu la substance étudiée pendant une période de croissance de 80 jours précédant l’accouplement, puis de façon continue après ce dernier. Tout au long de l’étude, aucun signe clinique lié au traitement et aucun effet sur le poids corporel ou la consommation alimentaire n’ont été observés dans les générations adultes pendant la croissance ou entre les périodes d’accouplement. Aucune tendance constante n’a été observée en ce qui concerne les effets sur le poids corporel ou la consommation alimentaire des parents pendant les phases de gestation ou de lactation de l’étude. Les indices d’accouplement et la fertilité des mâles n’ont été affectés négativement par le traitement dans aucune des générations sauf dans la génération F1. Le taux de gestation a été exceptionnellement faible dans le groupe ayant reçu 3 000 ppm pour la deuxième portée de la génération F1. Dans une petite étude annexe, parmi les animaux du groupe ayant reçu 3 000 ppm et se révélant inféconds, un mâle sur trois et trois femelles sur dix étaient infertiles. Le nombre moyen de petits vivants à la naissance était inférieur à celui observé chez les témoins pour les deux portées du groupe ayant reçu la dose maximale dans la génération F0; aucun effet similaire n’a été observé dans les générations F1 et F2. Le poids moyen des petits était fortement réduit au JPN 21 dans les deux portées du groupe de la génération F0 ayant reçu la dose maximale. Une diminution du poids de la rate et du foie par rapport aux témoins a été observée chez les petits de la deuxième portée de la génération F3 à 1000 ppm et au-delà et le rapport du poids des reins sur celui du corps était inférieur à celui du témoin dans le groupe ayant reçu 3000 ppm. Des effets histologiques ont été observés dans les reins des petits de la première portée de la génération F1 à 500 ppm et au-delà. Une congestion splénique a été observée chez les petits des femelles de la génération F3 à 3 000 ppm. Dans la génération adulte, des différences de poids absolu et relatif de la rate, des reins, du foie, des surrénales, du cœur ou de l’hypophyse ont été constatées à 500 ppm et plus. Un examen histopathologique de certains tissus d’animaux adultes ayant reçu 3 000 ppm a révélé des effets sur la rate, le foie, les reins et la moelle osseuse (Monsanto, 1983). Le SCCP (2005) a déterminé une DSENO de 250 ppm (23 mg/kg pc/jour) en ce qui concerne les effets systémiques dans la génération parentale après avoir observé une variation du poids absolu et relatif des organes chez les animaux ayant reçu 500 ppm, valeur confirmée par l’observation de modifications histologiques à la dose de 3 000 ppm (Monsanto, 1983). Le SCCP (2005) a établi une DSENO de 1 000 ppm (95 mg/kg pc/jour) en ce qui concerne la toxicité pour la reproduction et le développement après avoir constaté une réduction du taux de gestation, du nombre de petits vivants à la naissance et du poids des petits au JPN 21 à 3 000 ppm (280 mg/kg pc/jour).
Dans une étude modifiée des effets sur le développement, des rates Sprague-Dawley gestantes et allaitantes ont été exposées, par l’alimentation, à des doses de triclocarban de 0 %, 0,2 % ou 0,5 % (soit, respectivement, environ 0, 103 et 257 mg/kg pc/jour) pendant une certaine période au cours de la gestation seulement, durant la gestation et la lactation ou l’allaitement ou pendant la lactation ou l’allaitement seulement (Kennedy et coll., 2015). Dans la première partie de l’étude, les rates gestantes ont reçu des doses de triclocarban de 0 % (n = 4), 0,2 % (n = 5) ou 0,5 % (n = 5) par leur alimentation entre les jours de gestation (JG) 5 et 19. Les mères ont été abattues au JG 19. Du triclocarban a été détecté dans le sérum maternel et le liquide amniotique. Une diminution statistiquement significative du gain de poids corporel et du taux de triiodothyronine (T3) sérique a été observée chez les mères du groupe ayant reçu une dose de 0,5 % de triclocarban. Aucun effet n’a été observé sur la survie, le nombre d’implantations, le poids du corps ou des organes sexuels, les résultats de l’observation macroscopique physiologique ou histologique des organes (foie, reins, surrénales et ovaires) et le taux sanguin d’œstradiol, de testostérone, de progestérone, de thyroxine et de thyréostimuline. Le deuxième volet de l’étude a été divisé en deux parties, A et B, dans lesquelles des rates gestantes ont été respectivement exposées au triclocarban par l’alimentation entre le JG 5 et le JPN 21 (sevrage) et entre le JG 5 et le JPN 14 (sevrage). Dans la partie A de l’étude, les rates gestantes ont été exposées à 0 % (n = 5) ou 0,5 % (n = 5) entre le JG 5 et le JPN 21. Les mères ont été abattues au JPN 21 ou le jour où les petits restants sont morts. À la naissance, il n’y avait aucune différence entre les groupes dans le nombre de naissances vivantes ou le poids à la naissance. Les nouveau-nés des mères du groupe ayant reçu une dose de triclocarban de 0,5 % et allaités par celles-ci n’ont pas survécu au-delà du JPN 8. Tous les nouveau-nés des animaux témoins et allaités par ceux-ci ont survécu après le sevrage. Des bandes laiteuses ont été observées à travers la peau du ventre des petits du groupe ayant reçu 0,5 % de triclocarban (indiquant une consommation de lait); cependant, les glandes mammaires prélevées sur les mères du groupe ayant reçu cette même dose présentaient des signes d’involution. Dans la partie B du deuxième volet de l’étude, les femelles gestantes ont été exposées à 0 % (n = 5) ou 0,5 % (n = 5) entre le JG 5 et le JPN 14. Dans cette partie de l’étude, les portées des mères du groupe ayant reçu 0,5 % ont été réduites à six petits au JPN 0 et trois petits ont été remplacés par des petits témoins. Au JPN 3, les petits témoins ont été remplacés par de nouveaux petits en bonne santé et au JPN 6, tous les petits nés de mères traitées ont été remplacés par de nouveaux petits témoins. Au JPN 9, les petits témoins ajoutés à la portée au JPN 3 ont été remplacés par des petits en bonne santé. Les bandes laiteuses étaient similaires dans les groupes témoins et dans ceux traités au JPN 1 et au JPN 3, mais étaient absentes au JPN 6 chez les petits nés de mères ayant reçu 0,5 % de triclocarban et élevés par celles-ci. Les glandes mammaires des mères traitées au JPN 14 ne présentaient pas de signes d’involution lorsque de nouveaux petits en santé étaient allaités par leurs mères de manière continue et normale. Dans le troisième volet de l’étude, des rates gestantes ont reçu 0 % (n = 5), 0,2 % (n = 5) ou 0,5 % (n = 5) de triclocarban par l’alimentation entre le JG 5 et le JPN 21. Les portées ont été réduites à six petits et croisées : chaque mère a allaité deux petits de sa propre portée et deux autres provenant de chacun des autres groupes traités. Tous les groupes de mères (n = 5) ont élevé 30 petits : dix nés de mères ayant reçu 0,5 % de triclocarban, dix nés de mères ayant reçu 0,2 % de cette substance et dix nés de mères témoins. À la naissance, aucune différence n’a été constatée dans le nombre de nouveau-nés vivants ou le poids moyen par portée. Au JPN 3, le poids corporel moyen était respectivement 16 et 25 % inférieur à celui des témoins chez les petits élevés par les mères ayant reçu 0,2 % et 0,5 % de triclocarban. Dans chaque groupe de mères, aucune différence n’a été observée entre les poids corporels des petits exposés in utero à des doses de triclocarban différentes. Aucun petit élevé par les mères ayant reçu 0,5 % de triclocarban n’a survécu au-delà du JPN 5, quelles que soient les conditions d’exposition in utero (n = 30). Vingt-sept des 30 petits élevés par les mères ayant reçu 0,2 % de triclocarban ont survécu jusqu’au JPN 6, mais seulement quatre animaux de ce groupe ont survécu au-delà du jour de sevrage. Tous les petits élevés par les mères témoins ont survécu au-delà de la période d’étude, quelle que soit l’exposition in utero. Au moment du sevrage, le poids corporel moyen des quatre petits survivants élevés par la mère traitée avec 0,2 % de triclocarban était environ égal à la moitié de celui des petits élevés par les mères témoins (une analyse statistique était impossible, car les autres petits avaient été élevés par la même mère). Les abdomens de tous les petits élevés par les mères exposées à l’une ou l’autre des doses de triclocarban étaient distendus et tous les petits avaient la diarrhée. Aux JPN 4 et 5, un examen pathologique macroscopique des petits élevés par les mères ayant été traitées avec 0,5 % de triclocarban a révélé la présence de petits ulcères gastriques graves et de vacuoles lipidiques dans les hépatocytes. Les conditions d’exposition in utero n’ont eu aucun effet sur la distance anogénitale, la date de l’ouverture du vagin, la date de début du premier œstrus après l’ouverture du vagin ou le poids des organes. Le fait d’avoir été élevé ou non par une mère n’a eu aucun effet sur la distance anogénitale (Kennedy, 2015). La dose minimale avec effet nocif observé (DMENO) sélectionnée pour cette étude est de 0,2 % de triclocarban (soit 103 mg/kg pc/jour, la dose testée la plus faible) compte tenu de la diminution du poids corporel et du nombre de survivants chez les petits allaités par des mères à cette dose et au-delà.
Dans une étude de toxicité pour la reproduction et de tératogénicité, des lapines de Nouvelle-Zélande (n = 20/groupe) ont reçu par voie cutanée, entre les JG 7 et 18, une dose de 0 (pas de traitement), 0 (excipient seulement), 250, 500 ou 1 000 mg/kg pc/jour d’un mélange contenant du triclocarban et du 3-trifluorométhyl-4,4’-dichlorocarbanilide (TFC) dans des proportions de deux pour un (Nolan et Dierckman, 1979). Ce mélange a été administré par l’intermédiaire d’une solution savonneuse concentrée à 1 % et appliquée au niveau du dos sur une surface de 14 × 24 cm préalablement débarrassée de ses poils, puis rincée au bout de 4 heures. Les animaux ont été abattus au 29e jour et les fœtus ont été extraits des mères par césarienne. Aucune différence significative n’a été relevée en ce qui concerne le nombre de fœtus vivants ou morts, les résorptions, les implantations, les corps jaunes, le poids du fœtus ou les malformations (lors des examens macroscopiques et de l’observation des tissus mous et du squelette). Aucune toxicité pour les mères n’a été observée, mais une légère irritation cutanée a été constatée chez tous les animaux traités (Nolan et Dierckman, 1979).
Des rats mâles Sprague-Dawley castrés ont reçu du triclocarban par l’alimentation ou par injection de propionate de testostérone pendant 10 jours (Chen et coll., 2008). Les animaux ont été divisés en quatre groupes (n = 12/groupe) en fonction du traitement reçu. Le groupe 1 a reçu une injection de solution saline et a été nourri normalement, le groupe 2 a reçu une injection de 0,2 mg/kg pc/jour de propionate de testostérone et a été également nourri normalement, le groupe 3 a reçu une injection de solution saline et 0,25 % de triclocarban par son alimentation (soit une dose de 123 mg/kg pc/jour) et le groupe 4 a reçu une injection de 0,2 mg/kg pc/jour de propionate de testostérone et 0,25 % de triclocarban par son alimentation. Aucune différence significative entre les groupes n’a été détectée dans le poids corporel total et le poids des reins ou du foie. Aucune différence significative entre les rats témoins (groupe 1) et les rats ayant seulement reçu du triclocarban (groupe 3) n’a été observée pour ce qui est du poids des vésicules séminales, de la glande de Cowper, des muscles élévateurs de l’anus et bulbo-spongieux (MEABS) et du gland du pénis. Une augmentation du poids de la prostate ventrale a été constatée chez les rats traités uniquement avec du triclocarban (groupe 3) par rapport aux rats témoins (groupe 1). Le traitement avec le propionate de testostérone seulement (groupe 2) a entraîné une importante augmentation du poids des organes sexuels secondaires par rapport aux témoins (groupe 1) et aux animaux ayant uniquement reçu du triclocarban (groupe 3). Le traitement à base de propionate de testostérone et de triclocarban a entraîné une importante augmentation du poids de tous les organes sexuels secondaires, par rapport au traitement utilisant seulement le propionate de testostérone, ce qui met en évidence une possible synergie in vivo entre ces deux substances (Chen et coll., 2008).
Dans une étude de la toxicité pour la fonction reproductive des mâles, des rats mâles Sprague-Dawley (âgés de 48 à 52 jours) ont été répartis en groupes de 12 et traités avec 0 ou 0,25 % de triclocarban (soit une dose de 129 mg/kg pc/jour) par l’alimentation pendant 10 jours (Duleba et coll., 2011). Les animaux du groupe traité ont pris beaucoup plus de poids (5,1 % de poids final en plus) que ceux du groupe témoin. Le poids absolu et relatif du foie était également plus élevé chez les animaux traités que chez les témoins, mais le poids des reins, des surrénales et des testicules demeurait inchangé. Les poids absolu et relatif des vésicules séminales (+42 %), de la prostate ventrale (+42 %), des MEABS (+136 %) et du gland du pénis (+35 %) étaient également nettement plus élevés chez les animaux traités. En outre, les poids secs des vésicules séminales, des MEABS et du gland du pénis étaient nettement plus élevés chez les animaux traités, bien qu’aucune anomalie visible ou modification histologique n’ait été constatée dans les glandes sexuelles accessoires, le pénis ou les testicules. Une hyperplasie a été observée dans les glandes vésiculaires, qui étaient plus ou moins distendues sous l’effet de l’accumulation de liquide et formaient de nombreux plis complexes; ces derniers s’étendaient jusque dans le lumen et les acini de la prostate, eux-mêmes également distendus par rapport à ceux de la prostate des témoins. Une teneur en protéines et en ADN beaucoup plus élevée chez les animaux traités que chez les témoins a été observée dans la prostate ventrale, les MEABS et le gland du pénis. Les concentrations sériques de testostérone et d’hormone lutéinisante n’ont pas beaucoup varié sous l’effet de l’administration de triclocarban (Duleba coll., 2011).
6.2.7 Épidémiologie
Dans des études épidémiologiques, de possibles associations entre les concentrations urinaires de triclocarban et les taux hormonaux pendant la grossesse, d’une part, et la diminution de l’âge gestationnel à la naissance, d’autre part (Aker et coll., 2018; Geer et coll., 2017). Dans un échantillon de cas-témoin (inclus dans une étude de cohorte) constitué de 439 femmes enceintes, une diminution faible, mais statistiquement significative, du taux de T3 sérique totale (selon les mesures effectuées sur des échantillons prélevés à un maximum de quatre moments de la grossesse) a été observée, en lien avec une augmentation de l’écart interquartile des concentrations urinaires de triclocarban (mesurées sous forme de variable binaire, supérieure ou inférieure à la LD). Une augmentation non significative de la thyréostimuline a également été associée à des concentrations de triclocarban supérieures à la LD. Cependant, l’association avec le taux de T3 n’était plus significative dans une analyse de sensibilité réalisée chez des femmes ayant accouché à terme (soit après plus de 37 semaines de gestation) (Aker et coll., 2018). Dans un groupe de 34 nouveau-nés, la concentration de triclocarban dans le sang du cordon ombilical a été associée à une forte probabilité de diminution de l’âge gestationnel à la naissance. Dans une analyse de sensibilité, le 2’-hydroxytriclocarban a été associé de manière marginalement significative à une diminution de la longueur du corps à la naissance, mais le triclocarban dans le sang du cordon n’était plus associé à l’âge gestationnel à la naissance (Geer et coll., 2017).
Aucune association entre les concentrations urinaires de triclocarban et la croissance fœtale, les malformations fœtales, les lésions de l’ADN chez les enfants, la fréquence du diabète, la fécondité (délai avant la grossesse) et les paramètres de qualité du sperme adulte n’a été mentionnée (Ferguson et coll., 2018; Wei et coll., 2017; Rocha et coll., 2018a; Li et coll., 2018; Smarr et coll., 2017, 2018).
6.3 Caractérisation des risques pour la santé humaine
Selon des études de toxicité aiguë, le triclocarban présente une faible toxicité pour les mammifères, est peu irritant pour les yeux et la peau et n’est pas sensibilisant. Dans une étude de deux ans sur les effets d’une exposition par voie alimentaire, une anémie, une réduction du poids corporel et une augmentation du poids des organes ont été constatées chez le rat à des doses supérieures ou égales à 75 mg/kg pc/jour et la DSENO a été fixée à 25 mg/kg pc/jour (Monsanto, 1981). Cette DSENO a été choisie comme point de départ (PD) par le SCCP de la Commission européenne (2005) dans son avis sur le triclocarban. Dans une étude menée sur trois générations et portant sur les effets d’une exposition par voie alimentaire sur la reproduction, une réduction du taux de grossesse dans la génération F1, une réduction du nombre de petits vivants à la naissance dans la génération F0, une réduction du poids corporel des petits de la génération F0 et une réduction du poids des organes des petits de la génération F3 ont été observées à 280 mg/kg pc/jour (bien qu’aucun de ces effets n’ait été présent dans toutes les générations), ce qui a permis au SCCP (2005) de fixer la DSENO à 95 mg/kg pc/jour en ce qui concerne les effets sur la reproduction (Monsanto, 1983). Dans cette même étude, une DSENO de 23 mg/kg pc/jour a été mentionnée par le SCCP (2005) pour ce qui est des variations du poids absolu et relatif des organes (rate, reins, foie, surrénales, cœur et hypophyse) chez les parents, lesquelles ont été confirmées par l’observation de modifications histologiques. Toutefois, aucun effet significatif sur la reproduction, la tératogénicité ou la toxicité maternelle chez les lapins n’était relevé lorsque des doses pouvant atteindre 1 000 mg/kg pc/jour d’un mélange contenant du triclocarban et du TFC dans des proportions de deux pour un étaient administrées par voie cutanée pendant la gestation (Nolen et Dierckman, 1979).
De plus, des effets ont été observés à la plus faible dose orale testée (soit 103 à 129 mg/kg pc/jour) dans une étude à doses répétées et trois études de courte durée sur la toxicité pour la reproduction et le développement. Dans une étude de 28 jours sur les effets d’une exposition par l’alimentation, des changements significatifs de la diversité microbienne dans les matières fécales ont été observés à des doses supérieures ou égales à 103 mg/kg pc/jour (soit la plus faible dose testée (Kennedy et coll., 2018). Dans une étude modifiée sur le développement, une réduction du poids corporel et du taux de survie a été observée chez les petits (rats) allaités par des mères ayant reçu des doses supérieures ou égales à 103 mg/kg pc/jour (soit la plus faible dose testée) par leur alimentation (Kennedy et coll., 2015). Une forte augmentation du poids de plusieurs organes sexuels accessoires a été observée chez des rats mâles castrés lorsqu’une dose de 123 mg/kg pc/jour de triclocarban était administrée par l’alimentation en même temps que de la testostérone (Chen et coll., 2008). Dans une étude connexe sur la toxicité pour la fonction reproductrice des mâles, une hyperplasie des organes sexuels accessoires, une augmentation de leur poids absolu et relatif et une modification de leur morphologie ont été observées chez des rats mâles exposés à 129 mg/kg pc/jour de triclocarban par l’alimentation (Duleba et coll., 2011). Les effets sur le système reproducteur des mâles coïncident avec les résultats des études in vitro, qui mettent en évidence une amplification de la signalisation stimulant la production de testostérone en présence de triclocarban.
Les scénarios d’exposition sentinelles concernant le triclocarban sont basés sur l’utilisation quotidienne de produits cosmétiques topiques et l’exposition par les milieux naturels et l’alimentation. Compte tenu des effets critiques et de la longue durée des scénarios d’exposition sentinelles, une DSENO de 23 mg/kg pc/jour liée à la toxicité systémique a été choisie comme PD dans une étude portant sur les effets pour la reproduction d’une exposition par l’alimentation et menée sur trois générations. Les marges d’exposition (ME) résultantes sont censées permettre une protection contre d’autres effets systémiques et sur la reproduction mentionnés dans des études de courte durée et dans une étude de toxicité chronique réalisée sur deux ans.
La population canadienne est exposée au triclocarban par l’intermédiaire des milieux environnementaux (notamment de l’eau potable et de la poussière), des produits alimentaires et des cosmétiques. Les données de biosurveillance montrent que plus de 96 % de la population canadienne présente une concentration urinaire de moins de 1 µg/L de triclocarban. Dans une étude canadienne, le triclocarban n’a pas été détecté dans le lait humain ou le méconium. Pour tenir compte des risques associés à l’exposition au triclocarban par les milieux environnementaux, les produits alimentaires et les cosmétiques, les ME obtenues grâce à la modélisation des expositions dans le cadre de scénarios sentinelles sont présentées dans le Tableau 6‑3.
| Scénario d’exposition | Exposition systémique (mg/kg pc/jour) | Dose critique (mg/kg pc/jour) | Paramètre d’effet critique pour la santé | ME |
|---|---|---|---|---|
| Milieux environnementaux et alimentation (nourrissons âgés de 0 à 5 mois et allaités) | 1,1 x 10-4 | DSENO = 23 | Diminution du poids absolu et relatif des organes; modifications histologiques des organes | 200 000 |
| Savon pour le corps (solide; enfants âgés de 9 à 13 ans) | 0,0067 | DSENO = 23 | Diminution du poids absolu et relatif des organes; modifications histologiques des organes | 3430 |
Abréviations : ME : marge d’exposition DSENO : dose sans effet nocif observé.
Compte tenu des paramètres prudents utilisés dans la modélisation des expositions, les ME calculées sont considérées comme adéquates, car elles permettent de prendre en compte les incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
6.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les plus importantes sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principales sources d’incertitudes | Impact |
|---|---|
| Aucune donnée canadienne ou nord-américaine concernant le triclocarban présent dans les aliments vendus au détail n’a été trouvée. La concentration maximale de triclocarban mentionnée dans la littérature scientifique en ce qui concerne la laitue a été utilisée pour représenter tous les légumes dans le cadre de l’évaluation de la consommation alimentaire. | +/- |
| Peu d’études à doses répétées administrées par voie cutanée sont consacrées au triclocarban. | +/- |
+ = incertitude quant au potentiel de surestimation de l’exposition ou du risque; - = incertitude quant au potentiel de sous-estimation de l’exposition ou du risque; +/ – = potentiel inconnu de surestimation ou de sous-estimation du risque.
7. Conclusion
Compte tenu de tous les éléments de preuve exposés dans la présente d’évaluation préalable, le triclocarban présente un faible risque d’effets nocifs pour l’environnement. Il est conclu que le triclocarban ne répond pas aux critères énoncés aux alinéas 64a) et b) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel à la vie.
Compte tenu de tous les renseignements exposés dans la présente évaluation préalable, il est conclu que le triclocarban ne satisfait pas aux critères énoncés à l’alinéa 64c) de la LCPE, car il ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger pour la vie ou la santé humaines au Canada.
Il est donc conclu que le triclocarban ne satisfait à aucun des critères de l’article 64 de la LCPE.
Bibliographie
[AGDH] Australian Government Department of Health. 2017. Urea, N-(4-chlorophenyl)-N'-(3,4-dichlorophenyl)-: Environment tier II assessment [PDF]. Sydney (AU): Department of Health, National Industrial Chemicals Notification and Assessment Scheme (NICNAS). [consulté le 31 janvier 2019]. (Disponible en anglais seulement).
Ahn KC, Zhao B, Chen J, Cherednichenko G, Sanmarti E, Denison MS, Lasley B, Pessah IN, Kültz D, Chang DPY, Gee SJ, Hammock BD. 2008. In vitro biologic activities of the antimicrobials triclocarban, its analogs, and triclosan in bioassay screens: receptor-based bioassay screens. Environ Health Perspect. 116(9):1203-1210. (Disponible en anglais seulement).
Aker AM, Johns L, McElrath TF, Cantonwine DE, Mukherjee B, Meeker JD. 2018. Associations between maternal phenol and paraben urinary biomarkers and maternal hormones during pregnancy: A repeated measures study. Environ Int. 113:341-349. (Disponible en anglais seulement).
Albanese KA, Lanno RP, Hadad CM, Chin Y-P. 2017. Photolysis- and dissolved organic matter-induced toxicity of triclocarban to Daphnia magna. Environ Sci Technol Lett. 4(11):457-462. (Disponible en anglais seulement).
Aparicio I, Martín J, Abril C, Santos JL, Alonso E. 2018. Determination of household and industrial chemicals, personal care products and hormones in leafy and root vegetables by liquid chromatography-tandem mass spectrometry. J Chromatogr A. 1533:49-56. (Disponible en anglais seulement).
Arbuckle TE, Weiss L, Fisher M, Hauser R, Dumas P, Bérubé R, Neisa A, LeBlanc A, Lang C, Ayotte P, et al. 2015. Maternal and infant exposure to environmental phenols as measured in multiple biological matrices. Sci Total Environ. 508:575-584. (Disponible en anglais seulement).
Arnot JA, Mackay D. 2008. Policies for chemical hazard and risk priority setting: Can persistence, bioaccumulation, toxicity, and quantity information be combined? Environ Sci Technol. 42(13):4648-4654. (Disponible en anglais seulement).
Aylward LL, Hays SM, Vezina A, Deveau M, St-Amand A, Nong A. 2015. Biomonitoring Equivalents for interpretation of urinary fluoride. Regul Toxicol Pharmacol. 72(1):158-167. (Disponible en anglais seulement).
Barros S, Montes R, Quintana JB, Rodil R, Oliveira JMA, Santos MM, Neuparth T. 2017. Chronic effects of triclocarban in the amphipod Gammarus locusta: Behavioural and biochemical impairment. Ecotoxicol Environ Saf. 135:276-283. (Disponible en anglais seulement).
Bayer AG. 1992. Preventol SB - Salmonella/microsome test. Report no. 21078. [Cité dans SCCP, 2005]. (Disponible en anglais seulement).
[BDIPSN] Base de données d’ingrédients de produits de santé naturels [base de donnée]. [Modifié le 13 oct. 2021]. Ottawa (Ont.), gouvernement du Canada. [Consulté le 25 nov. 2021].
[BDPSNH] Base de données sur les produits de santé naturels homologués [base de données]. [Modifié le 8 sept. 2021]. Ottawa (Ont.), gouvernement du Canada. [Consulté le 25 nov. 2021].
Birch CG, Hiles RA, Eichhold TH, Jeffcoat AR, Handy RW, Hill JM, Willis SL, Hess TR, Wall ME. 1978. Biotransformation products of 3,4,4'-trichlorocarbanilide in rat, monkey, and man. Drug Metab Dispos. 6(2): 169-76. (Disponible en anglais seulement).
Blake LS, Martinović D, Gray LE, Wilson VS, Regal RR, Villeneuve DL, Ankley GT. 2010. Characterization of the androgen-sensitive MDA-kb2 cell line for assessing complex environmental mixtures. Environ Toxicol Chem. 29(6):1367-1376. (Disponible en anglais seulement).
Bonin AM, Arlauskas AP, Angus DS, Baker RSU, Gallagher CH, Greenoak G, Lane Brown MM, Meher-Homji KM, Reeve V. 1982. UV-absorbing and other sun-protecting substances: genotoxicity of 2-ethylhexyl P-methoxycinnamate. Mutat Res. 105(5):303-308. [Cité dans SCCP, 2005]. (Disponible en anglais seulement).
Bradley JC, Lang A, Williams A. 2014. Jean-Claude Bradley Double Plus Good (Highly Curated and Validated) Melting Point Dataset. figshare. Dataset. (Disponible en anglais seulement).
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L.C. 1999, ch. 33. Gazette du Canada, Partie III, vol. 22, no 3.
Canada, ministère de l’Environnement. 2009. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure [PDF]. Gazette du Canada, Partie I, vol. 143, no 40, p. 2945-2956.
Canada, ministère de l’Environnement. 2017. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant les substances visées par la mise à jour de l’inventaire de 2017. Gazette du Canada, Partie I, vol. 151, no 2.
Carmona E, Andreu V, Picó Y. 2014. Occurrence of acidic pharmaceuticals and personal care products in Turia River Basin: From waste to drinking water. Sci Total Environ. 484(1):53-63. (Disponible en anglais seulement).
[CE] Commission européenne. 2018a. Annex III: List of substances which cosmetic products must not contain except subject to the restrictions laid down. [Mis à jour le 24 oct. 2018; consulté le 31 mai 2019]. (Disponible en anglais seulement).
[CE] Commission européenne. 2018b. Annex V: List of preservatives allowed in cosmetic products. [mis à jour le 23 nov. 2018; consulté le 31 mai 2019].
Cha J, Cupples AM. 2010. Triclocarban and triclosan biodegradation at field concentrations and the resulting leaching potentials in three agricultural soils. Chemosphere. 81(4):494-499. (Disponible en anglais seulement).
Chaudhari U, Nemade H, Sureshkumar P, Vinken M, Ates G, Rogiers V, Hescheler J, Hengstler JG, Sachinidis A. 2018. Functional cardiotoxicity assessment of cosmetic compounds using human-induced pluripotent stem cell-derived cardiomyocytes. Arch Toxicol. 92(1):371-381. (Disponible en anglais seulement).
ChemIDplus [base de données]. 1993-. Bethesda (MD): US National Library of Medicine. [Mis à jour le 20 juil. 2016; consulté le 5 mars 2019]. (Disponible en anglais seulement).
Chen J, Ahn KC, Gee NA, Ahmed MI, Duleba AJ, Zhao L, Gee SJ, Hammock BD, Lasley BL. 2008. Triclocarban enhances testosterone action: a new type of endocrine disruptor? Endocrinology. 149(3):1173-1179. (Disponible en anglais seulement).
Chen J, Hartmann EM, Kline J, Van Den Wymelenberg K, Halden RU. 2018. Assessment of human exposure to triclocarban, triclosan and five parabens in U.S. indoor dust using dispersive solid phase extraction followed by liquid chromatography tandem mass spectrometry. J Hazard Mater. 360:623-630. (Disponible en anglais seulement).
Chiaia-Hernandez AC, Ashauer R, Moest M, Hollinghaus T, Jeon J, Spaak P, Hollender J. 2013. Bioconcentration of organic contaminants in Daphnia resting eggs. Environ Sci Technol. 47(18):10667-10675. (Disponible en anglais seulement).
Christen V, Crettaz P, Oberli-Schrämmli A, Fent K. 2010. Some flame retardants and the antimicrobials triclosan and triclocarban enhance the androgenic activity in vitro. Chemosphere. 81(10):1245-1252. (Disponible en anglais seulement).
Coogan MA, Edziyie RE, La Point TW, Venables BJ. 2007. Algal bioaccumulation of triclocarban, triclosan, and methyl-triclosan in a North Texas wastewater treatment plant receiving stream. Chemosphere. 67(10):1911-1918. (Disponible en anglais seulement).
Coogan MA, La Point TW. 2008. Snail bioaccumulation of triclocarban, triclosan, and methyltriclosan in a north Texas, USA, stream affected by wastewater treatment plant runoff. Environ Toxicol Chem. 27(8):1788-1793. (Disponible en anglais seulement).
[CoRAP] ECHA Community Rolling Action Plan. 2018. Justification Document for the Selection of a CoRAP Substance: Triclocarban. March 20, 2018. EC 202-924-1. (Disponible en anglais seulement).
de Solla SR, Gilroy EAM, Klinck JS, King LE, McInnis R, Struger J, Backus SM, Gillis PL. 2016. Bioaccumulation of pharmaceuticals and personal care products in the unionid mussel Lasmigona costata in a river receiving wastewater effluent. Chemosphere. 146:486-496. (Disponible en anglais seulement).
Dong X, Xu H, Wu X, Yang L. 2018. Multiple bioanalytical method to reveal developmental biological responses in zebrafish embryos exposed to triclocarban. Chemosphere. 193:251-258. (Disponible en anglais seulement).
Duleba AJ, Ahmed MI, Sun M, Gao AC, Villanueva J, Conley AJ, Turgeon JL, Benirschke K, Gee NA, Chen J, Green PG, Lasley BL. 2011. Effects of triclocarban on intact immature male rat: augmentation of androgen action. Reprod Sci. 18(2):119-127. (Disponible en anglais seulement).
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l’approche scientifique : Classification du risque écologique des substances organiques. Ottawa (Ont.), gouvernement du Canada. (Disponible en anglais seulement).
[ECCC] Environnement et Changement climatique Canada. 2016b. Supporting documentation: data used to create substance-specific hazard and exposure profiles and assign risk classifications. Gatineau (Qué.), ECCC. Information complémentaire liée au Document sur l’approche scientifique : Classification du risque écologique des substances organiques. Accessible sur demande à substances@ec.gc.ca.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. [Modifié le 12 mars 2017]. Catégorisation. Ottawa (Ont.), gouvernement du Canada. [Consulté le 12 mars 2017].
EG&G Bionomics. 1976. Acute toxicity of TCC-QM-769 to bluegill (Lepomis macrochirus) and rainbow trout (Salmo gairdneri). Report no. 88-920008326. (Disponible en anglais seulement).
EG&G Bionomics. 1978a. Acute toxicity of TCC (1218033) to bluegill (Lepomis macrochirus) in dilution water with a total hardness (as calcium carbonate) of 100 milligrams per liter. Report no. 88-920008503. (Disponible en anglais seulement).
EG&G Bionomics. 1978b. Acute toxicity of TCC (1218033) in a pH 6.0 dilution water to bluegill (Lepomis macrochirus). Report no. 88-920007553. (Disponible en anglais seulement).
EG&G Bionomics. 1978c. The chronic toxicity of 1218033 to the water flea (Daphnia magna). Report no. 88-920007397. (Disponible en anglais seulement).
EG&G Bionomics. 1978d. Acute toxicity of TCC (1218033) to bluegill (Lepomis macrochirus). Report no. 88-920008331. (Disponible en anglais seulement).
EG&G Bionomics. 1978e. Acute toxicity of TCC (1218033) to bluegill (Lepomis macrochirus) in dilution water with a total hardness (as calcium carbonate) of 250 milligrams per liter. Report no. 88-920008507. (Disponible en anglais seulement).
EG&G Bionomics. 1978f. Acute toxicity of TCC (1218033) to bluegill (Lepomis macrochirus) in dilution water with a pH of 8.0. Report no. 88-920008508. (Disponible en anglais seulement).
EG&G Bionomics. 1978g. Acute toxicity of TCC (1218033) to bluegill (Lepomis macrochirus) at 30 °C. Report no. 88-920008606. (Disponible en anglais seulement).
EG&G Bionomics. 1979. Chronic toxicity of sediment-sorbed TCC to the midge (Paratanytarsus parthenogenica). Report no. 88-920007763. (Disponible en anglais seulement).
EG&G Bionomics. 1980. Acute and chronic toxicity of TCC to mysid shrimp (Mysidopsis bahia) in flow-through tests. Report no. 88-920007499. (Disponible en anglais seulement).
[ECHA] European Chemicals Agency. c2007-2017. Registered substances database; search results for CAS RN 101-20-2. Helsinki (FI): ECHA. [Consulté le 20 avril 2021].
Enright HA, Falso MJS, Malfatti MA, Lao V, Kuhn EA, Hum N, Shi Y, Sales AP, Haack KW, Kulp KS, et al. 2017. Maternal exposure to an environmentally relevant dose of triclocarban results in perinatal exposure and potential alterations in offspring development in the mouse model. PLoS ONE. 12(8):e0181996. (Disponible en anglais seulement).
Fan B, Li J, Wang X, Gao X, Chen J, Ai S, Li W, Huang Y, Liu Z. 2019. Study of aquatic life criteria and ecological risk assessment for triclocarban (TCC). Environ Pollut. 254:112956. (Disponible en anglais seulement).
Ferguson KK, Meeker JD, Cantonwine DE, Mukherjee B, Pace GG, Weller D, McElrath TF. 2018. Environmental phenol associations with ultrasound and delivery measures of fetal growth. Environ Int. 112:243-250. (Disponible en anglais seulement).
Ficheux AS, Chevillotte G, Wesolek N, Morisset T, Dornic N, Bernard A, Bertho A, Romanet A, Leroy L, Mercat AC, et al. 2016. Consumption of cosmetic products by the French population second part: Amount data. Food Chem Toxicol. 90:130-141. (Disponible en anglais seulement).
Ficheux AS, Wesolek N, Chevillotte G, Roudot AC. 2015. Consumption of cosmetic products by the French population. First part: Frequency data. Food Chem Toxicol. 78:159-169. (Disponible en anglais seulement).
Frederiksen H, Nielsen JKS, Mørck TA, Hansen PW, Jensen JF, Nielsen O, Andersson, A-M, Knudsen LE. 2013. Urinary excretion of phthalate metabolites, phenols and parabens in rural and urban Danish mother-child pairs. Int J Hyg Environ Health. 216(6):772-783. (Disponible en anglais seulement).
Fu Q, Sanganyado E, Ye Q, Gan J. 2016. Meta-analysis of biosolid effects on persistence of triclosan and triclocarban in soil. Environ Pollut. 210:137-144. (Disponible en anglais seulement).
Gao L, Yuan T, Cheng P, Bai Q, Zhou C, Ao J, Wang W, Zhang H. 2015. Effects of triclosan and triclocarban on the growth inhibition, cell viability, genotoxicity and multixenobiotic resistance responses of Tetrahymena thermophila. Chemosphere. 139:434-440. (Disponible en anglais seulement).
Garcia-Ac A, Segura PA, Viglino L, Fϋrtös A, Gagnon C, Prévost M, Sauvé S. 2009. On-line solid-phase extraction of large-volume injections coupled to liquid chromatography-tandem mass spectrometry for the quantitation and confirmation of 14 selected trace organic contaminants in drinking and surface water. J Chromatogr A. 1216(48):8518-8527. (Disponible en anglais seulement).
Geer LA, Pycke BFG, Waxenbaum J, Sherer DM, Abulafia O, Halden RU. 2017. Association of birth outcomes with fetal exposure to parabens, triclosan and triclocarban in an immigrant population in Brooklyn, New York. J Hazard Mater. 323(Pt A):177-183. (Disponible en anglais seulement).
Geiss C, Ruppert K, Heidelbach T, Oehlmann J. 2016. The antimicrobial agents triclocarban and triclosan as potent modulators of reproduction in Potamopyrgus antipodarum (Mollusca: Hydrobiidae). J Environ Sci Health A Tox Hazard Subst Environ Eng. 51(13):1173-1179. (Disponible en anglais seulement).
Giudice BD, Young TM. 2010. The antimicrobial triclocarban stimulates embryo production in the freshwater mudsnail Potamopyrgus antipodarium. Environ Toxicol Chem. 29(4):966-970. (Disponible en anglais seulement).
Gomes MF, de Carvalho Soares de Paula V, Martins LRR, Garcia JRE, Yanamoto FY, de Freitas AM. 2020. Sublethal effects of triclosan and triclocarban at environmental concentrations in silver catfish (Rhamdia quelen) embryos. Chemosphere. 263(2):127985. (Disponible en anglais seulement).
Han J, Won E-J, Hwang U-K, Kim I-C, Yim J-H, Lee J-S. 2016. Triclosan (TCS) and Triclocarban (TCC) cause lifespan reduction and reproductive impairment through oxidative stress-mediated expression of the defensome in the monogonont rotifer (Brachionus koreanus). Comp Biochem Physiol C Toxicol Pharmacol. 185-186:131-137. (Disponible en anglais seulement).
Hartmann EM, Hickey R, Hsu T, Román CMB, Chen J, Schwager R, Kline J, Brown GZ, Halden RU, Huttenhower C, Green JL. 2016. Antimicrobial Chemicals Are Associated with Elevated Antibiotic Resistance Genes in the Indoor Dust Microbiome. Environ Sci Technol. 50(18):9807-9815. (Disponible en anglais seulement).
Higgins CP, Paesani ZJ, Abbot Chalew TE, Halden RU. 2009. Bioaccumulation of triclocarban in Lumbriculus variegatus. Environ Toxicol Chem. 28(12):2580-2586. (Disponible en anglais seulement).
Higgins CP, Paesani ZJ, Abbot Chalew TE, Halden RU. 2011. Persistence of triclocarban and triclosan in soils after land application of biosolids and bioaccumulation in Eisenia foetida. Environ Toxicol Chem. 30 (3):556-563. (Disponible en anglais seulement).
Hiles RA. 1977. Metabolism and toxicity of halogenated carbanilides: Absorption, distribution and excretion of radioactivity from 3,4,4'-trichloro[14C]carbanilide (TCC) and 3-trifluoromethyl-4,4'-dichloro[14C]carbanilide (TFC) in rats. Food Cosmet Toxicol. 15(3):205-211. (Disponible en anglais seulement).
Hiles RA, Birch CG. 1978a. The absorption, excretion, and biotransformation of 3,4,4'-trichlorocarbanilide in humans. Drug Metabol Dispos. 6(2):177-183. (Disponible en anglais seulement).
Hiles RA, Birch CG. 1978b. Nonlinear metabolism and disposition of 3,4,4'-trichlorocarbanilde in the rat. Toxicol Appl Pharmacol. 46(2):323-337. (Disponible en anglais seulement).
Hiles RA, Caudill D, Birch CG, Eichhold T. 1978. The Metabolism and Disposition of 3,4,4’-Trichlorocarbanilide in the Intact and Bile Duct-Cannulated Adult and in the Newborn Rhesus Monkey (M. mulatfa). Toxicol Appl Pharmacol. 46(3):593-608. (Disponible en anglais seulement).
Hinther A., Bromba CM, Wulff JE, Helbing CC. 2011. Effects of triclocarban, triclosan, and methyl triclosan on thyroid hormone action and stress in frog and mammalian culture systems. Environ Sci Technol. 45(12):5395-5402. (Disponible en anglais seulement).
Hoffman K, Hammel SC, Phillips AL, Lorenzo AM, Chen A, Calafat AM, Ye X, Webster TF, Stapleton HM. 2018. Biomarkers of exposure to SVOCs in children and their demographic associations: The TESIE Study. Environ Int. 119:26-36. (Disponible en anglais seulement).
Huang H, Du G, Zhang W, Hu J, Wu D, Song L, Xia Y, Wang X. 2014. The in vitro estrogenic activities of triclosan and triclocarban. J Appl Toxicol. 34(9):1060-1067. (Disponible en anglais seulement).
Hyland KC, Blaine AC, Higgins CP. 2015. Accumulation of contaminants of emerging concern in food crops — part 2: Plant distribution. Environ Toxicol Chem. 34(10):2222-2230. (Disponible en anglais seulement).
Ismail NS, Müller CE, Morgan RR, Luthy RG. 2014. Uptake of contaminants of emerging concern by the bivalves Anodonta californiensis and Corbicula fluminea. Environ Sci Technol. 48(16):9211-9219. (Disponible en anglais seulement).
Kennedy RC, Fling RR, Robeson MS, Saxton AM, Schneider LG, Darcy JL, Bemis DA, Zhao L, Chen J. 2018. Temporal dynamics of gut microbiota in triclocarban-exposed weaned rats. Environ Sci Pollut Res Int. 25(15):14743-14751. (Disponible en anglais seulement).
Kennedy RCM, Menn FM, Healy L, Fecteau KA, Hu P, Bae J, Gee NA, Lasley BL, Zhao L, Chen J. 2015. Early life triclocarban exposure during lactation affects neonate rat survival. Reprod Sci. 22(1):75-89. (Disponible en anglais seulement).
Kim S, Chen J, Cheng T, Gindulyte A, He J, He S, Li Q, Shoemaker BA, Thiessen PA, Yu B, Zaslavsky L, Zhang J, Bolton EE. 2019. PubChem 2019 update: improved access to chemical data. Nucleic Acids Res. 47(D1):D1102-1109. (Disponible en anglais seulement).
Kwon J-W, Xia K. 2012. Fate of triclosan and triclocarban in soil columns with and without biosolids surface application. Environ Toxicol Chem. 31(2):262-269. (Disponible en anglais seulement).
Lawrence JR, Zhu B, Swerhone GDW, Roy J, Wassenaar LI, Topp E, Korber DR. 2009. Comparative microscale analysis of the effects of triclosan and triclocarban on the structure and function of river biofilm communities. Sci Total Environ. 407(10):3307-3316. (Disponible en anglais seulement).
Lenz KA, Pattison C, Ma H. 2017. Triclosan (TCS) and triclocarban (TCC) induce systemic toxic effects in a model organism in the nematode Caenorhabditis elegans. Environ Pollut. 231(Pt 1):462-470. (Disponible en anglais seulement).
Li AJ, Xue J, Lin S, Al-Malki AL, Al-Ghamdi MA, Kumosani TA, Kannan K. 2018. Urinary concentrations of environmental phenols and their association with type 2 diabetes in a population in Jeddah, Saudi Arabia. Environ Res. 166: 544-552. (Disponible en anglais seulement).
Loretz LJ, Api AM, Babcock L, Barraj LM, Burdick J, Cater KC, Jarrett G, Mann S, Pan YHL, Re TA, et al. 2008. Exposure data for cosmetic products: Facial cleanser, hair conditioner, and eye shadow. Food Chem Toxicol. 46(5):1516-1524. (Disponible en anglais seulement).
Lozano N, Rice CP, Ramirez M, Torrents A. 2018. Fate of triclocarban in agricultural soils after biosolid applications. Environ Sci Pollut Res. 25(1):222-232. (Disponible en anglais seulement).
Lu Y, Jin H, Shao B, Xu H, Xu X. 2019. Physiological and biochemical effects of triclocarban stress on freshwater algae. SN Applied Sciences. 1(12):1685. (Disponible en anglais seulement).
Macherius A, Lapen DR, Reemtsma T, Römbke J, Topp E, Coors A. 2014. Triclocarban, triclosan and its transformation product methyl triclosan in native earthworm species four years after a commercial-scale biosolids application. Sci Total Environ. 472:235-238. (Disponible en anglais seulement).
Monsanto. 1980. The chronic toxicity of TCC to the midge (Paratanytarsus parthenogenetica) via water, food and sediment exposure. Report no. 88-920007067. (Disponible en anglais seulement).
Monsanto. 1980. Study # MSL-1264 (9/22/1980) TCC Environmental Monitoring-Surface Waters and Drinking Waters. [Cité par EPA HPVIS [PDF]]. (Disponible en anglais seulement).
Monsanto. 1981. A twenty-four month dietary toxicity/carcinogenicity study of TCC in rats. Report no. BDN-77-280. [Cité dans SCCP, 2005]. (Disponible en anglais seulement).
Monsanto. 1983. A three-generation reproduction study with TCC rats. Report no. BD-79-058. [Cité dans SCCP, 2005]. (Disponible en anglais seulement).
Moos RK, Angerer J, Wittsiepe J, Wilhelm M, Brüning T, Koch HM. 2014. Rapid determination of nine parabens and seven other environmental phenols in urine samples of German children and adults. Int J Hyg Environ Health 217(8):845-853. (Disponible en anglais seulement).
Mulla SI, Hu A, Wang Y, Sun Q, Huang S-L, Wang H, Chang-Ping Y. 2016. Degradation of triclocarban by a triclosan-degrading Sphingomonas sp. Strain YL-JM2C. Chemosphere. 144:292-296. (Disponible en anglais seulement).
Nolen GA, Dierckman TA. 1979. Reproduction and teratogenic studies of a 2:1 mixture of 3,4,4'-trichlorocarbanilide and 3-trifluoromethyl-4,4'-dichlorocarbanilide in rats and rabbits. Toxicol Appl Pharmacol. 51(3):417-425. (Disponible en anglais seulement).
[OCDE] OECD QSAR Toolbox [outil de lecture croisée]. 2014. Version 3.3. Paris (FR): Organisation de coopération et de développement économiques, Laboratoire de chimie mathématique. (Disponible en anglais seulement).
Omiecinski CJ, Coslo DM, Chen T, Laurenzana EM, Peffer RC. 2011. Multi-species Analyses of Direct Activators of the Constitutive Androstane Receptor. Toxicol Sci. 123(2):550-562. (Disponible en anglais seulement).
O’Neil, MJ, editor. 2013. The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. 15th ed. Cambridge, UK: Royal Society of Chemistry. (Disponible en anglais seulement).
[PCPC] Personal Care Products Council. 2018. Cosmetic Ingredient Identification Database (International Cosmetic Ingredient Dictionary [INCI]). [Consulté le 30 jan. 2019]. (Disponible en anglais seulement).
Prosser RS, Lissemore L, Shahmohamadloo RS, Sibley PK. 2015. Effect of biosolids-derived triclosan and triclocarban on the colonization of plant roots by arbuscular mycorrhizal fungi. Sci Total Environ. 508: 427-434. (Disponible en anglais seulement).
Prosser RS, Lissemore L, Solomon KR, Sibley PK. 2014. Toxicity of biosolids-derived triclosan and triclocarban to six crop species. Environ Toxicol Chem. 33(8):1840-1848. (Disponible en anglais seulement).
PubChem [database]. 2004—. Bethesda (MD): US National Library of Medicine, National Center for Biotechnology Information. [Consulté le 5 mar. 2019]. (Disponible en anglais seulement).
Pycke BFG, Geer LA, Dalloul M, Abulafia O, Jenck AM, Halden RU. 2014. Human fetal exposure to triclosan and triclocarban in an urban population from Brooklyn, New York. Environ Sci Technol. 48(15):8831-8838. (Disponible en anglais seulement).
Rocha BA, Asimakopoulos AG, Honda M, da Costa NL, Barbosa RM, Barbosa F, Kannan K. 2018a. Advanced data mining approaches in the assessment of urinary concentrations of bisphenols, chlorophenols, parabens and benzophenones in Brazilian children and their association to DNA damage. Environ Int. 116:269-277. (Disponible en anglais seulement).
Rocha BA, de Oliveira ARM, Barbosa F. 2018b, A fast and simple air-assisted liquid-liquid microextraction procedure for the simultaneous determination of bisphenols, parabens, benzophenones, triclosan, and triclocarban in human urine by liquid chromatography-tandem mass spectrometry. Talanta. 183:94-101. (Disponible en anglais seulement).
Sabourin L, Duenk P, Bonte-Gelok S, Payne M, Lapen DR, Topp E. 2012. Uptake of pharmaceuticals, hormones and parabens into vegetables grown in soil fertilized with municipal biosolids. Sci Total Environ. 431:233-236. (Disponible en anglais seulement).
Sales Junior SF, Vallerie Q, de Farias Araujo G, Soares LOS, da Silva EO, Correia FV, Saggioro EM. 2020. Triclocarban affects earthworms during long-term exposure: Behavior, cytotoxicity, oxidative stress and genotoxicity assessments. Environ Pollut. 267:115570. (Disponible en anglais seulement).
Santé Canada. 2013. Deuxième rapport sur la biosurveillance humaine des substances chimiques de l’environnement au Canada. Résultats de l’Enquête canadienne sur les mesures de la santé Cycle 2 (2009 à 2011). Ottawa (Ont.), gouvernement du Canada. [Consulté le 17 avril 2019].
Santé Canada. 2015. Tableau de la consommation des aliments obtenu à l’aide de Statistique Canada, Enquête sur la santé dans les collectivités canadiennes, cycle 2.2, Nutrition (2004). Fichier partagé. Ottawa.
Santé Canada. 2017. Tableau de la consommation d’eau obtenu à l’aide de Statistique Canada, Enquête sur la santé dans les collectivités canadiennes, cycle 2.2, Nutrition (2004). Fichier partagé. Ottawa.
Santé Canada. 2018a. Draft backgrounder document on default values for breast milk and formula intakes. Rapport inédit. Ottawa (Ont.), gouvernement du Canada.
Santé Canada. 2018b. Tableau de la consommation des aliments obtenu à l’aide de Statistique Canada, Enquête sur la santé dans les collectivités canadienne, Nutrition. Fichier de partage. Ottawa. Santé Canada. [Modifié le 3 déc. 2019]. Liste critique des ingrédients des cosmétiques : ingrédients interdits et d’usage restreint. Ottawa (Ont.), gouvernement du Canada. [Consulté le 16 avril 2021].
Saravanabhavan G, Walker M, Guay M, Aylward L. 2014. Urinary excretion and daily intake rates of diethyl phthalate in the general Canadian population. Sci Total Environ. 500-501:191-198. (Disponible en anglais seulement).
Satyro S, Saggioro EM, Veríssimo F, Buss DF, de Paiva Magalhães D, Oliviera A. 2017. Triclocarban: UV photolysis, wastewater disinfection, and ecotoxicity assessment using molecular biomarkers. Environ Sci Pollut Res. 24(19):16077-16085. (Disponible en anglais seulement).
[SCCP] European Commission Scientific Committee on Consumer Products. 2005. Opinion on Triclocarban for uses other than as a preservative [PDF]. Colipa no. P29. SCCP/0851/04. (Disponible en anglais seulement).
Scharpf LGJ, Hill ID, Maibach HI. 1975. Percutaneous penetration and disposition of triclocarban in man: body showering. Arch Environ Health. 30(1):7-14. (Disponible en anglais seulement).
Schebb NH, Flores I, Kurobe T, Franze B, Ranganathan A, Hammock BD, Teh, SJ. 2011a. Bioconcentration, metabolism and excretion of triclocarban in larval Qurt medaka (Oryzias latipes). Aquat Toxicol. 105(3-4):448-454. (Disponible en anglais seulement).
Schebb NH, Inceoglu B, Ahn KC, Morisseau C, Gee SJ, Hammock BD. 2011b. Investigation of human exposure to triclocarban after showering and preliminary evaluation of its biological effects. Environ Sci Technol. 45(7):3109-3115. (Disponible en anglais seulement).
Schultz MM, Bartell SE, Schoenfuss HL. 2012. Effects of triclosan and triclocarban, two ubiquitous environmental contaminants, on anatomy, physiology, and behaviour of the fathead minnow (Pimephales promelas). Arch Environ Contam Toxicol. 63(1):114-124. (Disponible en anglais seulement).
Sherburne JJ, Anaya AM, Fernie KJ, Forbey JS, Furlong ET, Kolpin DW, Dufty AM, Kinney CA. 2016. Occurrence of triclocarban and triclosan in an agro-ecosystem following application of biosolids. Environ Sci Technol. 50(24):13206-13214. (Disponible en anglais seulement).
Shi Q, Zhuang Y, Hu T, Lu C, Wang X, Huang H, Du G. 2019. Developmental toxicity of triclocarban in zebrafish (Danio rerio) embryos. J Biochem Mol Toxicol. 33(5):e22289. (Disponible en anglais seulement).
Sipahutar MK, Piapukiew J, Vangnai AS. 2018. Efficiency of the formulated plant-growth promoting Pseudomonas fluorescens MC46 inoculant on triclocarban treatment in soil and its effect on Vigna radiata growth and soil enzyme activities. J Hazard Mater. 344:883-892. (Disponible en anglais seulement).
Sipahutar MK, Vangnai AS. 2017. Role of plant growth-promoting Ochrobactrum sp. MC 22 on triclocarban degradation and toxicity mitigation to legume plants. J Hazard Mater. 329:38-48. (Disponible en anglais seulement).
Smarr MM, Honda M, Kannan K, Chen Z, Kim S, Buck Louis GM. 2018. Male urinary biomarkers of antimicrobial exposure and bi-directional associations with semen quality parameters. Reprod Toxicol. 77:103-108. (Disponible en anglais seulement).
Smarr MM, Sundaram R, Honda M, Kannan K, Buck Louis GM. 2017. Urinary concentrations of parabens and other antimicrobial chemicals and their association with couples’ fecundity. Environ Health Perspect. 125(4):730-736. (Disponible en anglais seulement).
Snyder EH, O’Connor GA, McAvoy DC. 2010. Fate of 14-C triclocarban in biosolids-amended soils. Sci Total Environ. 408(13):2726-2732. (Disponible en anglais seulement).
Snyder EH, O’Connor GA, McAvoy DC. 2011. Toxicity and bioaccumulation of biosolids-borne triclocarban (TCC) in terrestrial organisms. Chemosphere. 82(3):460-467. (Disponible en anglais seulement).
Soap and Detergent Association. 2002. In vitro mammalian chromosome aberration test. Report no. 2002-01-TCC. [Cité dans SCCP, 2005]. (Disponible en anglais seulement).
Sood S, Choudhary S, Wang H-CR. 2013. Induction of human breast cell carcinogenesis by triclocarban and intervention by curcumin. Biochem Biophys Res Commun. 438(4):600-606. (Disponible en anglais seulement).
Springborn Life Sciences Inc. 1987. Acute toxicity of 3,4,4’ Trichlorocarbanilide to amphipods (Gammarus fasciatus). Report no. 88-920008374. (Disponible en anglais seulement).
Springborn Life Sciences Inc. 1988a. Static acute toxicity of TCC to ceriodaphnids. Report no. 88-920008511. (Disponible en anglais seulement).
Springborn Life Sciences Inc. 1988b. Static acute toxicity of 3,4,4’ Trichlorocarbanilide to channel catfish (Ictalurus punctatus). Report no. 88-920008550. (Disponible en anglais seulement).
Springborn Life Sciences Inc. 1988c. Static acute toxicity of 3,4,4’ Trichlorocarbanilide to fathead minnow (Pimephales promelas). Report no. 88-920008373. (Disponible en anglais seulement).
Statistique Canada. 2004. Enquête sur la santé dans les collectivités canadiennes – Nutrition (ESCC). Information détaillée pour 2004 (Cycle 2.2). Ottawa (Ont.), Statistique Canada.
Tamura I, Kagota K, Yasuda Y, Yoneda S, Morita J, Nakada N, Kameda Y, Kimura K, Tatarazako N, Yamamoto H. 2013a. Ecotoxicity and screening level ecotoxicological risk assessment of five antimicrobial agents: triclosan, triclocarban, resorcinol, phenoxyethanol and p-thymol. J Appl Toxicol. 33(11):1222-1229. (Disponible en anglais seulement).
Tamura I, Kimura K, Kameda Y, Nakada N, Yamamoto H. 2013b. Ecological risk assessment of urban creek sediments contaminated by untreated domestic wastewater: potential contribution of antimicrobials and a musk fragrance. Environ Technol. 34(9-12):1567-1575. (Disponible en anglais seulement).
Tanoue R, Nomiyama K, Nakamura H, Kim J-W, Isobe T, Shinohara R, Kunisue T, Tanabe S. 2015. Uptake and tissue distribution of pharmaceuticals and personal care products in wild fish from treated-wastewater-impacted streams. Environ Sci Technol. 49(19):11649-11658. (Disponible en anglais seulement).
Tarnow P, Tralau T, Hunecke D, Luch A. 2013. Effects of triclocarban on the transcription of estrogen, androgen and aryl hydrocarbon receptor responsive genes in human breast cancer cells. Toxicol In Vitro. 27(5):1467-1475. (Disponible en anglais seulement).
Taulli TA, Hill JT, Pounds GW. 1977. High-pressure liquid chromatographic studies of TCC and metabolites in experimental animals and man. J Chromatogr Sci. 15(3-4):111-118. (Disponible en anglais seulement).
TCC Consortium. 2002. High Production Volume (HPV) Chemical Challenge Program data availability and screening level assessment for triclocarban CAS No. 101-20-2. Report No. 201-14186A. (Disponible en anglais seulement).
Torres T, Cunha I, Martins R, Santos MM. 2016. Screening the toxicity of selected personal care products using embryo bioassays: 4-MBC, propylparaben and triclocarban. Int J Mol Sci. 17(10):1762. (Disponible en anglais seulement).
Tugulea 2016. A national survey of disinfection by-products and selected drinking water contaminants in Canadian drinking water (2009-2010). Base de données non publiée. Ottawa (Ont.), Division de l’exposition et de la biosurveillance, Santé Canada. (Disponible en anglais seulement).
[US EPA] United States Environmental Protection Agency. 2002. High Production Volume (HPV) Chemical Challenge Program Data Availability and Screening Level Assessment for Triclocarban [PDF]. 201-14186A. Prepared for the HPV Challenge Program by the Triclocarban Consortium. (Disponible en anglais seulement).
[US EPA] United States Environmental Protection Agency. 2009. Targeted National Sewage Sludge Survey Statistical Analysis Report. Office of Water (4301T), Washington, DC. EPA-822-R-08-018. (Disponible en anglais seulement).
[US EPA] United States Environmental Protection Agency. 2011. Exposure Factors Handbook: 2011 Edition. Washington (DC): US EPA, National Center for Environmental Assessment, Office of Research and Development. [Consulté le 31 mai 2019]. (Disponible en anglais seulement).
[US FDA] United States Food and Drug Administration. 2016. Safety and Effectiveness of Consumer Antiseptics; Topical Antimicrobial Drug Products for Over-the-Counter Human Use. 21 CFR Part 310. (Disponible en anglais seulement).
Viglino L, Prévost M, Suavé S. 2011. High throughput analysis of solid-bound endocrine disruptors by LDTD-APCI-MS/MS. J Environ Monit. 13(3):583-590. (Disponible en anglais seulement).
Villeneuve DL, Jensen KM, Cavallin JE, Durhan EJ, Garcia-Reyero N, Kahl MD, Leino RL, Makynen EA, Wehmas LC, Perkins EJ, et al. 2017. Effects of the antimicrobial contaminant triclocarban, and co-exposure with the androgen 17β-trenbolone, on reproductive function and ovarian transcriptome of the fathead minnow (Pimephales promelas). Environ Toxicol Chem. 36(1):231-242. (Disponible en anglais seulement).
Vingskes AK, Spann N. 2018. The toxicity of a mixture of two antiseptics, triclosan and triclocarban, on reproduction and growth of the nematode Caenorhabditis elegans. Ecotoxicology. 27(4):420-429. (Disponible en anglais seulement).
Walters E, McClellan K, Halden RU. 2010. Occurrence and loss over three years of 72 pharmaceuticals and personal care products from biosolids-soil mixtures in outdoor mesocosms. Water Res. 44(20):6011-6020. (Disponible en anglais seulement).
Wei L, Qiao P, Shi Y, Ruan Y, Yin J, Wu Q, Shao B. 2017. Triclosan/triclocarban levels in maternal and umbilical blood samples and their association with fetal malformation. Clin Chim Acta. 466:133-137. (Disponible en anglais seulement).
Wester RC, Maibach HI, Surinchak J, Bucks DAW. 1985. Predictability of In Vitro Diffusion Systems: Effect of Skin Types and Ages on Percutaneous Absorption of Triclocarban. Dermatology. 6:223-226. [Cité dans SCCP, 2005]. (Disponible en anglais seulement).
[Wilson and Meridian] Wilson Scientific Consulting Inc. and Meridian Environmental Inc. 2015 [modifié]. Critical review of soil ingestion rates for use in contaminated site human health risk assessments in Canada. Rapport d’entrepreneur préparé pour la Division des lieux contaminés, Programme de la sécurité des milieux, Santé Canada, Ottawa (Ont.). (Disponible en anglais seulement).
Wu Y, Beland FA, Fang JL. 2016. Effect of triclosan, triclocarban, 2,2',4,4'-tetrabromodiphenyl ether, and bisphenol A on the iodide uptake, thyroid peroxidase activity, and expression of genes involved in thyroid hormone synthesis. Toxicol In Vitro. 32:310-319. (Disponible en anglais seulement).
Xia K, Hundal LS, Kumar K, Armbrust K, Cox AE, Granato TC. 2010. Triclocarban, triclosan, polybrominated diphenyl ethers, and 4-nonylphenol in biosolids and in soil receiving 33-year biosolids application. Environ Toxicol Chem. 29(3):597-605. (Disponible en anglais seulement).
Xia M, Huang R, Shi Q, Boyd WA, Zhao J, Sun N, Rice JR, Dunlap PE, Hackstadt AJ, Bridge MF, et al. 2018. Comprehensive Analyses and Prioritization of Tox21 10K Chemicals Affecting Mitochondrial Function by in-Depth Mechanistic Studies. Environ Health Perspect. 126(7):077010. (Disponible en anglais seulement).
Xie W, Zhang W, Ren J, Li W, Zhou L, Cui Y, Chen H, Yu W, Zhuang X, Zhang Z, et al. 2018. Metabonomics Indicates Inhibition of Fatty Acid Synthesis, β-Oxidation, and Tricarboxylic Acid Cycle in Triclocarban-Induced Cardiac Metabolic Alterations in Male Mice. J Agric Food Chem. 66(6):1533-1542. (Disponible en anglais seulement).
Xu X, Lu Y, Zhang D, Wang Y, Zhou X, Xu H, Mei Y. 2015. Toxic assessment of triclosan and triclocarban on Artemia salina. Bull Environ Contam Toxicol. 95(6):728-733. (Disponible en anglais seulement).
Yang L-H, Ying G-G, Su H-C, Stauber JL, Adams MS, Binet MT. 2008. Growth-inhibiting effects of 12 antibacterial agents and their mixtures on the freshwater microalga Pseudokirchneriella subcaptiata. Environ Toxicol Chem. 27(5):1201-1208. (Disponible en anglais seulement).
Ye X, Kuklenyik Z, Needham LL, Calafat AM. 2006. Measuring environmental phenols and chlorinated organic chemicals in breast milk using automated on-line column-switching-high performance liquid chromatography-isotope dilution tandem mass spectrometry. J Chromatogr B Analyt Technol Biomed Life Sci. 831(1-2):110-115. (Disponible en anglais seulement).
Ye X, Wong L-Y, Dwivedi P, Zhou X, Jia T, Calafat AM. 2016. Urinary Concentrations of the Antibacterial Agent Triclocarban in United States Residents: 2013−2014 National Health and Nutrition Examination Survey. Environ Sci Technol. 50(24):13548-13554. (Disponible en anglais seulement).
Ye X, Zhou X, Furr J, Ahn KC, Hammock BD, Gray EL, Calafat AM. 2011. Biomarkers of exposure to triclocarban in urine and serum. Toxicology. 286(1-3):69-74. (Disponible en anglais seulement).
Yin J, Wei L, Shi Y, Zhang J, Wu Q, Shao B. 2016. Chinese population exposure to triclosan and triclocarban as measured via human urine and nails. Environ Geochem Health. 38(5):1125-1135. (Disponible en anglais seulement).
Ying G-G, Yu X-Y, Kookana RS. 2007. Biological degradation of triclocarban and triclosan in a soil under aerobic and anaerobic conditions and comparison with environmental fate modelling. Environ Pollut. 150(3):300-305. (Disponible en anglais seulement).
Yun H, Liang DK, Li Z, Qi G, Wang A. 2017. Enhanced biotransformation of triclocarban by Ochrobactrum sp. TCC-1 under anoxic nitrate respirate conditions. Curr Microbiol. 74(4):491-498. (Disponible en anglais seulement).
Zhou X, Ye X, Calafat AM. 2012. Automated on-line column-switching HPLC-MS/MS method for the quantification of triclocarban and its oxidative metabolites in human urine and serum. J Chromatogr B Analyt Technol Biomed Life Sci. 881-882:27-33. (Disponible en anglais seulement).
Annexes
Annexe A. Résumé des données relatives aux effets du triclocarban sur l’environnement
| Organisme étudié | Paramètre | Valeur (en µg/L ou en µg/g en poids sec, sauf indication contraire) | Observations | Référence |
|---|---|---|---|---|
| Puce d’eau (Daphnia magna) | CL50 après 48 h | 13 | S. o. | EG&G Bionomics, 1978c |
| Puce d’eau (Daphnia magna) | CL50 après 96 h | 27,4 | S. o. | Albanese et coll., 2017 |
| Puce d’eau (Daphnia magna) | CL50 après 48 h | De 10 à 20 | S. o. | TCC Consortium, 2002 |
| Puce d’eau (Daphnia magna) | CE50 après 48 h (immobilisation) | 10 | S. o. | Tamura et coll., 2013a |
| Puce d’eau (Daphnia magna) | CSEO après 42 jours (reproduction) | 0,25 | S. o. | Fan et coll., 2019 |
| Puce d’eau (Daphnia magna) | CSEO après 21 jours (reproduction) | > 0,25, mais < 0,50 | S. o. | EG&G Bionomics, 1978c |
| Puce d’eau (Daphnia magna) |
CMEO après 21 jours (mortalité et reproduction) CSEO après 21 jours (mortalité et reproduction) |
4,7 (CMEO) 2,9 (CSEO) |
S. o. | TCC Consortium, 2002 |
| Puce d’eau (Daphnia similis) | CE50 après 48 h | 14 | S. o. | Satyro et coll., 2017 |
| Puce d’eau (Ceriodaphnia dubia) | CE50 après 48 h | 3,1 | S. o. | TCC Consortium, 2002 |
| Puce d’eau (Ceriodaphnia dubia) | CL50 après 48 h (survie) | 6,896 | S. o. | Fan et coll., 2019 |
| Puce d’eau (Ceriodaphnia dubia) | CSEO après 8 jours (croissance) | 1,9 | S. o. | Tamura et coll., 2013a |
| Puce d’eau (Ceriodaphnia dubia) | CSEO après 7 jours (mortalité et reproduction) | 1,46 | S. o. | TCC Consortium, 2002 |
| Puce d’eau (Ceriodaphnia dubia) |
CE50 après 48 h CSEO après 48 h |
3,1 (CE50) 1,9 (CSEO) |
S. o. | Springborn Life Sciences Inc., 1988a |
| Crevette d’eau douce (Macrobrachium nipponense) | CL50 après 96 h (survie) | 261,6 | S. o. | Fan et coll., 2019 |
| Artémie (Artemia salina) | CL50 après 24 h | 17,8 | S. o. | Xu et coll., 2015 |
| Mysidacé (Mysidopsis bahia) |
CL50 après 96 h CTMA après 28 jours |
15 De 0,06 à 0,12 |
S. o. | EG&G Bionomics, 1980 |
| Mysidacé (Mysidopsis bahia) |
CL50 après 24 h CL50 après 48 h CL50 après 72 h CL50 après 96 h |
42 30 21 De 13 à 15 |
S. o. | TCC Consortium, 2002 |
| Mysidacé (Mysidopsis bahia) | Ce50 après 28 jours (reproduction) | 0,209 | S. o. | TCC Consortium, 2002 |
| Mysidacé (Mysidopsis bahia) |
CMEO après 28 jours (mortalité et reproduction) CSEO après 28 jours (mortalité et reproduction) |
0,12 (CMEO) 0,06 (CSEO) |
S. o. | TCC Consortium, 2002 |
| Mysidacé (Mysidopsis bahia) |
CMEO après 28 jours (reproduction) CSEO après 28 jours (reproduction) |
0,125 (CMEO) 0,062 (CSEO) |
S. o. | TCC Consortium, 2002 |
| Mysidacé (Mysidopsis bahia) |
CMEO après 28 jours (croissance) CSEO après 28 jours (croissance) |
0,500 (CMEO) 0,250 (CSEO) |
S. o. | TCC Consortium, 2002 |
| Rotifère (Brachionus koreanus) | CL50 après 24 h | 388 |
200 µg/L : croissance réduite de la population 100 µg/L : stress oxydatif Régulation transcriptionnelle des protéines de détoxification, antioxydantes et de choc thermique entraînant des changements dans la durée de vie et la fécondité |
Han et coll., 2016 |
| Amphipode d’eau douce (Gammarus fasciatus) |
CL50 après 96 h CSEO |
13 (CL50) 7,9 (CSEO) |
S. o. | Springborn Life Sciences, 1987 |
| Nématode (Caenorhabditis elegans) | CL50 après 24 h | 910 | 10 µg/L : réduction de la taille du couvain et éclosion retardée | Lenz et coll., 2017 |
| Larves de moucherons (Chironomidae) | CL50 après 48 h | De 60 à 100 | S. o. | TCC Consortium, 2002 |
| Protozoaire d’eau douce (Tetrahymena thermophila) | CE50 après 24 h (croissance) | 295 |
1,0 µg/L : dommages causés à l’ADN 0,316 µg/L : régulation négative de l’expression du gène MXR 0,79 µg/L : inhibition de l’activité des pompes d’efflux |
Gao et coll., 2015 |
| Invertébré benthique (Paratanytarsus parthenogenetica) | CL50 après 48 h (mortalité) | 96 | S. o. | Monsanto, 1980 |
| Invertébré benthique (Paratanytarsus parthenogenetica) | CL50 après 48 h | 67 | S. o. | EG&G Bionomics, 1979 |
| Nématode (Caenorhabditis elegans) | CE50 après 96 h (reproduction et croissance) | 119 | S. o. | Vingskes et Spann, 2018 |
| Amphipode marin (Gammarus locusta) | CMEO après 60 jours (marqueurs biochimiques) | 2,5 |
Aucun effet constaté sur la survie, la croissance ou la reproduction, quelle que soit la concentration; réponse monotonique 0,1 µg/L : taux de PL plus élevés chez les femelles que chez les mâles 0,1 et 0,5 µg/L : activité importante de la Cat et de la GST 2,5 µg/L : concentrations de Cat et de GST similaires ou plus faibles par rapport aux témoins; 65 % d’augmentation de la concentration de l’AChE chez les mâles et les femelles |
Barros et coll., 2017 |
| Invertébré benthique (Paratanytarsus parthenogenetica) | CSEO après exposition par l’eau durant tout le cycle de vie | De 1,3 à 3,0 | S. o. | Monsanto, 1980 |
| Invertébré benthique (Paratanytarsus parthenogenetica) | CSEO après 28 jours d’exposition par les sédiments | De 2,76 à 5,9 | S. o. | Monsanto, 1980 |
| Invertébré benthique (Paratanytarsus parthenogenetica) | CSEO après exposition par l’alimentation durant tout le cycle de vie (croissance, émergence, reproduction et éclosabilité) | > 85,5 | S. o. | Monsanto, 1980 |
| Organisme benthique (Chironomus yoshimatsui) | CSEO après 20 jours (émergence) | 2,5 µg/g | S. o. | Tamura et coll., 2013 b |
| Chironome plumeux (Chironomus plumosus) | CE50 après 48 h (immobilisation) | 97,44 | S. o. | Fan et coll., 2019 |
| Ver noir (Lumbriculus variegatus) | CSEO après 10 jours (mortalité) | 100 (µg/g en poids sec) | Aucune mortalité constatée | Higgins et coll., 2009 |
| Loche baromètre (Misgurnus anguillicaudatus) | CL50 après 96 h (survie) | 471,7 | S. o. | Fan et coll., 2019 |
| Médaka (Oryzias latipes sinensis) | CL50 après 96 h (survie) | 1189 | S. o. | Fan et coll., 2019 |
| Médaka (Oryzias latipes) | CL50 après 96 h | 85 | S. o. | Tamura et coll., 2013a |
| Médaka (Oryzias latipes sinensis) | CL10 après 28 jours (survie) | 32,73 | S. o. | Fan et coll., 2019 |
| Poisson-zèbre (Danio rerio) | CSEO après 9 jours (survie) | 24 | S. o. | Tamura et coll., 2013a |
| Poisson-zèbre (Danio rerio) | CMEO 32 et 80 h après fertilisation (mortalité) | 350 | S. o. | Torres et coll., 2016 |
| Poisson zèbre (Danio rerio) |
CL10 après 96 h CL50 après 96 h |
147,5 (CL10) 215,8 (CL50) |
Observations effectuées à d’autres concentrations : 133,3 µg/L : inhibition de l’hormone thyroïdienne, modification de l’expression des gènes sensibles aux hormones thyroïdiennes 6,7 µg/L : modification de l’expression des protéines associées aux mécanismes de liaison, au métabolisme, au développement des muscles squelettiques, au développement du système nerveux et à la réponse immunitaire |
Dong et coll., 2018 |
| Poisson zèbre (Danio rerio) | CMEO 4 et 120 h après fertilisation | De 0,3 à 300 |
Augmentation de la mortalité et du nombre de malformations, éclosion retardée et réduction de la longueur du corps Effet sur la fréquence cardiaque et l’expression des gènes liés au développement du cœur et modification de l’expression des gènes associés aux mécanismes hormonaux |
Shi et coll., 2019 |
| Poisson-chat argenté (Rhamdia quelen) | 96 h après fécondation (anomalies du développement et marqueurs biochimiques liés à la réponse au stress oxydatif) | 0,1 6,3 |
Des anomalies du développement ont été observées à 0,1 et 6,3 µg/L, notamment des anomalies faciales, crâniennes, spinales et caudales. Des altérations biochimiques liées au stress oxydatif ont été observées à 0,1 µg/L. |
Gomes et coll., 2020 |
| Barbue de rivière (Ictalurus punctatus) | CL50 après 96 h CSEO | 140 120 | S. o. | Springborn Life Sciences Inc., 1988b |
| Truite arc-en-ciel (Oncorhynchus mykiss) | CL50 après 96 h | 120 | S. o. | TCC Consortium, 2002 |
| Truite arc-en-ciel (Oncorhynchus mykiss) | CL50 après 96 h | 120 | S. o. | EG&G Bionomics, 1976 |
| Crapet arlequin (Lepomis macrochirus) | CL50 après 96 h | De 12 à 77 | S. o. | TCC Consortium, 2002 |
| Crapet arlequin (Lepomis macrochirus) | CL50 après 96 h (dureté totale de l’eau de dilution : 100 µg/L CaCO3) | 77 | S. o. | EG&G Bionomics, 1978a |
| Crapet arlequin (Lepomis macrochirus) | CL50 après 96 h (eau de dilution de pH = 6,0) | 40 | S. o. | EG&G Bionomics, 1978b |
| Crapet arlequin (Lepomis macrochirus) | CL50 après 96 h | 70 | S. o. | EG&G Bionomics, 1978d |
| Crapet arlequin (Lepomis macrochirus) | CL50 après 96 h (dureté totale de l’eau de dilution : 250 µg/L CaCO3) | 78 | S. o. | EG&G Bionomics, 1978e |
| Crapet arlequin (Lepomis macrochirus) | CL50 après 96 h (eau de dilution de pH = 8,0) | 100 | S. o. | EG&G Bionomics, 1978f |
| Crapet arlequin (Lepomis macrochirus) | CL50 après 96 h (à 30 °C) | 47 | S. o. | EG&G Bionomics, 1978 g |
| Crapet arlequin (Lepomis macrochirus) | CL50 après 96 h | 97 | S. o. | EG&G Bionomics, 1976 |
| Tête-de-boule (Pimephales promelas) |
CL50 après 96 h CSEO |
92 54 |
S. o. | Springborn Life Sciences Inc., 1988c |
| Tête-de-boule (Pimephales promelas) |
CSEO après 22 jours CMEO après 22 jours (reproduction) |
1 (CSEO) 5 (CMEO) |
1 µg/L : aucun effet sur la reproduction 5 µg/L : diminution de la fécondité Aucun effet sur la masse corporelle ou le rapport gonadosomatique |
Villeneuve et coll., 2017 |
| Tête-de-boule (Pimephales promelas) |
CMEO après 12 jours (larves fraîchement écloses) CMEO après 21 jours (poisson mature) |
1,6 1,6 |
Larves fraîchement écloses : modifications mineures des paramètres de croissance et de la capacité de fuite des larves Poisson mature : moins grande propension à défendre le nid |
Schultz et coll., 2012 |
| Vairon rare (Gobiocypris rarus) | CL50 après 96 h (survie) | 110,3 | S. o. | Fan et coll., 2019 |
| Vairon rare (Gobiocypris rarus) | CSEO après 28 jours (survie) | 41,24 | S. o. | Fan et coll., 2019 |
| Algues vertes (Selenastrum) |
CMEO après 5 jours CSEO après 5 jours |
36 (CMEO) 30 (CSEO) |
Concentration algistatique minimale | TCC Consortium, 2002 |
| Cyanobactéries (Microcystis) |
CMEO après 5 jours CSEO après 5 jours |
> 32 (CMEO) > 32 (CSEO) |
Concentration algistatique minimale | TCC Consortium, 2002 |
| Algues vertes (Pseudokirchneriella subcapitata) |
CI50 après 72 h CSEO CMEO |
17 (CI50) < 10 (CSEO) 10 (CMEO) |
Inhibition de la croissance | Yang et coll., 2008 |
| Algues vertes (Pseudokirchneriella subcapitata) | CE50 après 72 h | 29 | S. o. | Tamura et coll., 2013 |
| Algues vertes (Pseudokirchneriella subcapitata) | CSEO après 72 h | 5,7 | S. o. | Tamura et coll., 2013 |
| Algues vertes (Pseudokirchneriella subcapitata) | CI50 après 72 h | 319 | S. o. | Satyro et coll., 2017 |
| Algues vertes (Scenedesmus obliquus) | CE50 après 96 h (inhibition de la croissance des algues) | 9,11 mg/L | S. o. | Lu et coll., 2019 |
| Algues vertes (Chlorella pyrenoidosa) | CE50 après 96 h (inhibition de la croissance des algues) | 8,76 mg/L | S. o. | Lu et coll., 2019 |
| Algues vertes (Chlorella vulgaris) | CE50 après 96 h (inhibition de la croissance des algues) | 8,474 mg/L | S. o. | Lu et coll., 2019 |
| Communauté microbienne de biofilm de rivière | Huit semaines (biomasse, architecture et activité des algues et composition de la communauté microbienne) | 10 |
Réduction significative de la biomasse d’algues Arrêt de l’utilisation du carbone La communauté passe de l’autotrophie à l’hétérotrophie Changements importants dans la composition des communautés et les communautés bactériennes |
Lawrence et coll., 2009 |
| Oursin violet (Paracentrotus lividus) |
8 et 80 h après fertilisation CMEO (longueur des larves) |
0,64 | Diminution de la longueur des larves et anomalies morphologiques | Torres et coll., 2016 |
| Hydrobie des antipodes (Potamopyrgus antipodarum) | CSEO et CMEO après 28 jours (reproduction) |
0,1 (CSEO) 10 (CMEO) |
0,082 0,287 |
Geiss et coll., 2016 |
| Hydrobie des antipodes (Potamopyrgus antipodarum) | CSEO, CMEO, CE10 et CE50 après 2 à 4 semaines |
0,5 (CSEO) 0,2 (CMEO) 0,5 (CE10) 2,5 (CE50) |
2,5 µg/L : stimulation de la production d’embryons | Giudice et Young, 2010 |
| Rana chensinensis | CL50 après 96 h (survie) | 23,84 | S. o. | Fan et coll., 2019 |
| Grenouille-taureau (Rana catesbeiana) | Essai biologique 48 h sur la nageoire caudale de têtards de grenouilles d’élevage (régulation du gène des hormones thyroïdiennes) | De 0,316 à 316 (de 10 nM à 1000 nM) |
Aucun effet sur les niveaux de transcription de TRβ, quelle que soit la dose d’exposition Diminution des niveaux de transcription de RLK1 à 316 µg/L Augmentation des niveaux de transcription de IHSP30 et CAT à 316 µg/L Réduction des niveaux de transcription de Gh et Dio 1 à 316 µg/L Réduction du niveau de transcription de Hsp70 entre 0,316 et 316 µg/L |
Hinther et coll., 2011 |
| Lombric (Eisenia foetida) | CL50 après 31 jours (sols amendés avec des biosolides) | 40 000 µg/kg (40 mg/kg) | Aucun effet comportemental (p. ex., remontée à la surface du sol, tortillement, raidissement, élongation, battements, posture immobile en boule) ou pathologique (p. ex. lésions superficielles, gonflement des segments médians, zones ulcérées) sur les vers n’a été observé, quelle que soit la dose administrée; la perte de poids et les effets sur la reproduction n’ont pas été surveillés. | Snyder et coll., 2011 |
| Lombric (Eisenia andrei) |
CL50 après 72 h (toxicité aiguë par contact) CE50 après 48 h (test d’évitement) |
3,3 mg/cm2 (CL50) 1,92 mg/kg (CE50) |
S. o. | Sales Junior et coll., 2020 |
| Lombric (Eisenia andrei) |
viabilité des cellules après 45 jours Ajout de 200 g de sol à 10 réplications avec 30 mL de solution de triclocarban à 1, 10, 50 et 100 mg/kg |
1 et 10 mg/kg |
Une diminution de la viabilité des cellules de lombric de 44 % a été observée après 14 jours d’exposition à 10 mg/kg. Une augmentation du pourcentage d’amoebocytes a également été constatée. L’exposition chronique a entraîné une réduction des activités de la Cat et de la GST, une diminution des taux de GSH et une augmentation de la PL dans les organismes exposés. Des dommages causés à l’ADN par une dose de 1 mg/kg ont été observés après 45 jours. |
Sales Junior et coll., 2020 |
| Limnodrilus hoffmeisteri | CL50 après 96 h (survie) | 10 622 | S. o. | Fan et coll., 2019 |
|
Laitue Maïs |
65 jours (symbiose entre les champignons mycorhiziens à arbuscules et les racines des plantes) | De 0 à 0,304 (µg/g en poids sec) | Aucune inhibition de la colonisation des racines des plantes par les champignons mycorhiziens à arbuscules | Prosser et coll., 2015 |
|
Soja Laitue Blé |
Environ 39 à 85 jours (selon les espèces; sol amendé avec des biosolides) (germination des graines et croissance) | De 3,6 à 304 (µg/g en poids sec) | Effets négligeables | Prosser et coll., 2014 |
| Communauté microbienne du sol | 31 jours (respiration, ammonification et nitrification dans les communautés microbiennes du sol) | De 6 à 717 (µg/g en poids sec) | Effets négligeables | Snyder et coll., 2011 |
Abréviations : S. o. : sans objet CL50 : concentration estimée comme étant létale pour 50 % des organismes traités; CMEO : concentration minimale avec effet observé, c.-à-d. concentration la plus faible, utilisée lors d’un essai de toxicité et causant un effet statistiquement significatif si l’on effectue une comparaison avec les témoins; CSEO : concentration sans effet observé, c.-à-d. concentration maximale utilisée lors d’un essai de toxicité et ne provoquant pas d’effet statistiquement significatif si l’on effectue une comparaison avec les témoins; CE50 : concentration dont on estime qu’elle cause un effet sur 50 % des organismes traités; CE10 : concentration dont on estime qu’elle cause un effet sur 10 % des organismes traités; Cat : catalase; GST : glutathion S-transférase; PL : peroxydation lipidique; AChE : acétylcholinestérase CTMA : concentration toxique maximale acceptable; CI50 : concentration inhibitrice provoquant un effet sur 50 % des organismes traités.
| Organisme traité | Concentration de triclocarban (durée, le cas échéant) | Paramètre de bioaccumulation (en L/kg, sauf indication contraire) | Référence |
|---|---|---|---|
| Médaka (Oryzias latipes) |
Eau reconstituée en laboratoire (24 h) |
FBC : 724 (le TCC a été métabolisé par oxydation en dérivés sulfoconjugués ou glucuronoconjugués) | Schebb et coll., 2011a |
| Carassin commun (Carassius carassius) |
Effluents d’une STEU De 0,000023 à 0,000044 µg/mL |
FBA dans le plasma : < 0,1 – 8,6 | Tanoue et coll., 2015 |
| Algues vertes (Cladophora) |
Effluents d’une STEU 0,191 µg/L |
FBA : 1900 | Coogan et La Point, 2008 |
| Algues vertes (Cladophora) |
Effluents d’une STEU De 0,08 à 0,03 mg/L |
FBA : De 1600 à 2700 | Coogan et coll., 2007 |
| Daphnie (œufs « vrais » ou éphippies de Daphnia longispina et Daphnia galeata) |
Sédiments du lac Greifensee (Suisse) (120 h) |
FBC : de 1240 à 82 900 | Chiaia-Hernandez et coll., 2013 |
| Ver noir (Lumbriculus variegatus) |
Sédiments enrichis en laboratoire (22,4 µg/g ps) (56 jours) |
FBA (poids humide) : de 1600 à 2200 | Higgins et coll., 2009 |
| Lombric (Eisenia foetida) |
Biosolides (31 jours) |
FBA (poids sec; gsol/gtissu): de 5,2 à 18 | Snyder et coll., 2011 |
| Lombric (Eisenia foetida) |
Biosolides (de 7,6 à 10,8 µg/g ps) (28 jours) |
FABS (état stable; gco/glip) : de 0,22 à 0,71 | Higgins et coll., 2011 |
| Lombric (Eisenia foetida) | Biosolides (4,94 µg/g ps) | FABS (poids sec; gco/glip) : de 0,1 à 1,6 | Macherius et coll., 2014 |
| Hélisome commun de l’Est (Helisoma trivolvis) |
Effluents d’une STEU (deux semaines) |
FBA : 1600 | Coogan et La Point, 2008 |
| Moule d’eau douce (Lasmigona costata) | Effluents d’une STEU S. o. | FBA (en cage) : de 9 975 à 45 538 | de Solla et coll., 2016 |
| Palourde (Corbicula fluminea) |
Effluents d’une STEU enrichis (14 jours) |
FBC : 7943 | Ismail et coll., 2014 |
| Moule (Anodonta californiensis) |
Effluents d’une STEU enrichis (14 jours) |
FBC : 7943 | Ismail et coll., 2014 |
| Laitue (Lactuca sativa) |
Eau d’irrigation 0,35 µg/L |
FCR < 10 (récolte à maturité) | Hyland et coll., 2015 |
| Fraise (Fragaria ananassa) |
Eau d’irrigation 0,35 µg/L |
FCR < 100 (récolte à maturité) |
Hyland et coll., 2015 |
|
Maïs sucré (Zea mays) Carotte (Daucus carota) Tomate (Solanum lycopersicum) Pomme de terre (Solanum tuberosum) |
Biosolides 6,03 µg/g ps |
Aucune absorption détectée à la récolte | Sabourin et coll., 2012 |
| biosolides → sol → lombrics → souris sylvestre (Peromyscus maniculatus) → œufs d’étourneau sansonnet (Sturnus vulgaris) → œufs de crécelle d’Amérique (Falco sparverius) |
Biosolides 1,25 µg/g p/p |
FABS (poids humide; ngco/nglip) : lombric : 0,79 (valeur estimée, car les lombrics n’ont pas été dépurés) FABS dans le foie de la souris sylvestre : 0,20 FABS dans les œufs d’étourneau : 0,25 FABS dans les œufs de crécelle : 0,05 | Sherburne et coll., 2016 |
Abréviations : S. o. : sans objet; ps : poids sec; FCR : facteur de concentration dans les racines; FCP : facteur de concentration dans les pousses; FABS : facteur d’accumulation du biote-sol ou biote-sédiments; FBA : facteur de bioaccumulation; FBC : facteur de bioconcentration; STEU : station de traitement des eaux usées; gco/glip : grammes dans le carbone organique/grammes dans les lipides; ngco/nglip : nanogrammes dans le carbone organique/nanogrammes dans les lipides;
Annexe B. Exposition humaine par les milieux naturels et l’alimentation
| Voie d’exposition | De 0 à 5 moisa (lait humain)b | De 0 à 5 moisa (lait maternisé)c | De 6 à 11 moisd | 1 ane | De 2 à 3 ansf | De 4 à 8 ansg | De 9 à 13 ansh | De 14 à 18 ansi | 19 ans et plusj |
|---|---|---|---|---|---|---|---|---|---|
| Air ambiantk | AD | AD | AD | AD | AD | AD | AD | AD | AD |
| Air intérieurl | AD | AD | AD | AD | AD | AD | AD | AD | AD |
| Eau potablem | S. o. | 21,0 | 13,5 | 5,3 | 4,6 | 3,7 | 2,8 | 2,8 | 3,3 |
| Aliments et boissonsn | 80,3 | AD | 53,6 | 13,7 | 12,5 | 11,9 | 6,7 | 4,7 | 5,1 |
| Solo | S. o. | S. o. | 0,05 | 0,05 | 0,02 | 0,02 | 0,01 | 0,001 | 0,001 |
| Poussièrep | 33,5 | 33,5 | 29,0 | 31,1 | 13,9 | 10,4 | 5,5 | 0,33 | 0,34 |
| Absorption totale | 113,8 | 54,5 | 96,0 | 50,1 | 31,1 | 26,0 | 15,1 | 7,8 | 8,7 |
Abréviations : S. o. : sans objet; AD = aucune donnée trouvée dans la littérature scientifique.
a À supposer que l’enfant pèse 6,3 kg (Santé Canada, 2015), respire 3,7 m³ d’air par jour (US EPA, 2011 [modifié]) et ingère 21,6 mg de poussière par jour (Wilson et Meridian, 2015 [modifié]); il est supposé qu’il n’y a pas d’ingestion de sol en raison des pratiques habituelles des personnes prenant soin des nourrissons.
b Concerne uniquement les nourrissons allaités, à supposer qu’ils consomment 0,744 L de lait humain par jour (Santé Canada, 2018a) et que ce dernier est leur seule source alimentaire; le triclocarban n’a pas été détecté dans les échantillons de lait humain de 80 Canadiennes deux à trois mois après l’accouchement (Arbuckle et coll., 2015); la LD de 0,68 µg/L mentionnée dans cette étude a servi à estimer la limite supérieure du niveau d’exposition.
c Concerne uniquement les nourrissons nourris au lait maternisé, à supposer qu’ils consomment 0,826 L d’eau par jour (Santé Canada, 2018a) et que cette eau sert à préparer le lait maternisé; voir la note de bas de page sur l’eau potable pour en savoir plus.
d À supposer que le nourrisson pèse 9,1 kg (Santé Canada, 2015), respire 5,4 m³ d’air par jour (US EPA, 2011 [modifié]), boive 0 L d’eau par jour (Santé Canada, 2017) et ingère 7,3 mg de sol et 27,0 mg de poussière par jour (Wilson et Meridian 2015 [modifié]); les nourrissons nourris au lait humain sont supposés consommer 0,632 L de lait humain par jour (Santé Canada, 2018a); il est supposé que les nourrissons nourris au lait maternisé boivent 0,764 L d’eau par jour (Santé Canada, 2018a) et que cette eau sert à préparer le lait maternisé; voir la note de bas de page sur l’eau potable pour en savoir plus.
e À supposer que l’enfant pèse 11,0 kg (Santé Canada, 2015), respire 8,0 m³ d’air par jour (US EPA, 2011 [modifié]), boive 0,36 L d’eau par jour (Santé Canada, 2017) et ingère 8,8 mg de sol et 35,0 mg de poussière par jour (Wilson et Meridian, 2015 [modifié]).
f À supposer que l’enfant pèse 15 kg (Santé Canada, 2015), respire 9,2 m³ d’air par jour (US EPA, 2011 [modifié]), boive 0,43 L d’eau par jour (Santé Canada, 2017) et ingère 6,2 mg de sol et 21,4 mg de poussière par jour (Wilson et Meridian, 2015 [modifié]).
g À supposer que l’enfant pèse 23 kg (Santé Canada, 2015), respire 11,1 m³ d’air par jour (US EPA, 2011 [modifié]), boive 0,53 L d’eau par jour (Santé Canada, 2017) et ingère 8,7 mg de sol et 24,4 mg de poussière par jour (Wilson et Meridian, 2015 [modifié]).
h À supposer que l’enfant pèse 42 kg (Santé Canada, 2015), respire 13,9 m³ d’air par jour (US EPA, 2011 [modifié]), boive 0,74 L d’eau par jour (Santé Canada, 2017) et ingère 6,9 mg de sol et 23,8 mg de poussière par jour (Wilson et Meridian, 2015 [modifié]).
i À supposer que l’enfant pèse 62 kg (Santé Canada, 2015), respire 15,9 m³ d’air par jour (US EPA, 2011 [modifié]), boive 1,09 L d’eau par jour (Santé Canada, 2017) et ingère 1,4 mg de sol et 2,1 mg de poussière par jour (Wilson et Meridian, 2015 [modifié]).
j À supposer que l’enfant pèse 74 kg (Santé Canada, 2015), respire 15,1 m³ d’air par jour (US EPA, 2011 [modifié]), boive 1,53 L d’eau par jour (Santé Canada, 2017) et ingère 1,6 mg de sol et 2,6 mg de poussière par jour (Wilson et Meridian, 2015 [modifié]).
k Aucune donnée de surveillance concernant le triclocarban présent dans l’air ambiant (air extérieur) n’a été trouvée au Canada ou ailleurs.
Aucune donnée de surveillance pour le triclocarban dans l’air intérieur n’a été trouvée, au Canada ou ailleurs.
m Une valeur maximale de 160,5 ng/L de triclocarban dans l’eau traitée provenant de stations de traitement de l’eau situées au Canada a été mentionnée (communication personnelle; courriel de la Direction des sciences de la santé environnementale et de la radioprotection, Santé Canada, adressé à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, et daté du 20 septembre 2018; source non citée).
n Les taux de consommation alimentaire sont décrits dans un document de Santé Canada (2015); les valeurs au 90e percentile fournies par la Direction des aliments ont été utilisées, sauf pour la tranche d’âge des nourrissons de 0 à 5 mois nourris avec du lait maternisé, laquelle a été supprimée en raison de la faible taille de l’échantillon, et pour la tranche d’âge des nourrissons de 6 à 11 mois, qui prenait en compte l’exposition par l’allaitement et la valeur au 90e percentile relative à l’exposition par les aliments; les sources et valeurs de l’exposition au triclocarban par les aliments sont décrites à la section 6.1.1 et ont été fournies par la Direction des aliments de Santé Canada (communication personnelle; courriel de la Direction des aliments, Santé Canada, adressé à la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, et daté du 5 mars 2019; source non citée).
o Une valeur moyenne de 53 ng/g de triclocarban dans une terre agricole située au Québec a été indiquée (Viglino et coll., 2011).
p Aucune donnée de surveillance de la poussière domestique n’a été trouvée au Canada. Une valeur maximale de 9 760 ng/g de triclocarban a été mentionnée dans une étude portant sur de la poussière recueillie dans des installations sportives et des maisons individuelles situées en Oregon (Chen et coll., 2018).
