Évaluation préalable pour le Défi concernant
Archivée
Cette page Web a été archivée dans le Web
L'information dont il est indiqué qu'elle est archivée est fournie à des fins de référence, de recherche ou de tenue de documents. Elle n'est pas assujettie aux normes Web du gouvernement du Canada et elle n'a pas été modifiée ou mise à jour depuis son archivage. Pour obtenir cette information dans un autre format, veuillez communiquer avec nous.
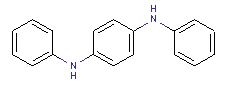
le mélange de N,N’-(phényl(s) et tolyl(s))benzène-1,4-diamines
et
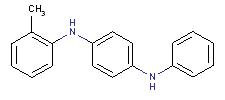
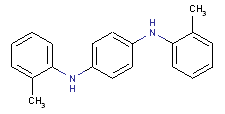
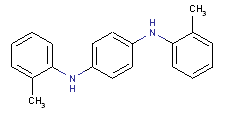
le mélange de N,N’-(tolyl(s) et xylyl(s))benzène-1,4-diamines
Numéro de registre du Chemical Abstracts Service
68953-84-4
et
68478-45-5
Environnement Canada
Santé Canada
September 2011
Table des matières
- Sommaire
- Introduction
- Identité de la substance
- Propriétés physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe I : Sommaires de rigueur d'étude
- Annexe II : Table de résumé des données du modèle PBT
- Annexe III : Quantités de pertes pour le BENTAX et le BENPAT et concentrations environnementales estimées d'après ces quantités
- Annexe IV : Tranche supérieure des estimations de l'absorption quotidienne de BENPAT pour divers groupes d'âge
- Annexe V : Résumé des données relatives aux effets du BENPAT, du BENTAX et de l'analogue, le BENTAPAX
- Annexe VI : Résumé des marges d'exposition pour le BENPAT
Conformément à l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)], les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable du Benzène-1,4-diamine, dérivés mixtes de N,N’-(phényle et tolyle) (BENPAT) dont le numéro de registre du Chemical Abstracts Service est 68953-84-4[1] ainsi que du Benzène-1,4-diamine, dérivés N,N’-(tolylés et de xylylés) mixtes (BENTAX) dont le numéro de registre du Chemical Abstracts Service est 68478-45-5.
Une priorité élevée a été accordée à l’évaluation préalable de ces substances inscrites au Défi dans le cadre du Plan de gestion des produits chimiques, car elles répondent aux critères de la catégorisation écologique relatifs à la persistance, au potentiel de bioaccumulation et à la toxicité intrinsèque pour les organismes non humains et elles semblent être commercialisées au Canada.
L’évaluation des risques que présentent ces substances pour la santé humaine n’a pas été jugée hautement prioritaire à la lumière des résultats fournis par les outils simples de détermination du risque d’exposition et du risque pour la santé élaborés aux fins de la catégorisation des substances de la Liste intérieure des substances.
Le BENPAT et le BENTAX sont classés comme des substances de composition inconnue ou variable, produits de réactions complexes ou matières biologiques (UVCBs) utilisés au Canada et ailleurs dans le cadre de la fabrication de produits à base de caoutchouc. Le BENPAT et le BENTAX agissent en tant qu’agents protecteurs (antiozonants et antioxydants) dans les produits à base de caoutchouc. Ces substances ne sont pas naturellement produites dans l’environnement. De 100 à 1 000 kg de BENTAX et de 1 000 000 à 10 000 000 kg de BENPAT ont été importés au Canada en 2006. Les quantités de BENTAX et de BENPAT importées au Canada ainsi que les utilisations potentiellement dispersives de ces substances indiquent qu’elles pourraient être rejetées dans l’environnement canadien.
Les composants du BENPAT et du BENTAX, d’après les données expérimentales sur leur dégradation et d’après leurs propriétés physiques et chimiques, ne devraient pas se dégrader rapidement dans l’environnement. Elles sont persistantes dans l’eau, le sol et les sédiments. Les principaux composants du BENPAT et du BENTAX ont également le potentiel de s’accumuler dans les organismes, mais l’accumulation devrait être modérée. Il a été déterminé que ces substances remplissent les critères de persistance, mais non les critères de bioaccumulation définis dans le Règlement sur la persistance et la bioaccumulation. En outre, les valeurs expérimentales sur la toxicité révèlent que ces substances représentent un risque pour les organismes aquatiques.
Les données expérimentales recueillies sur la toxicité en milieu aquatique du BENPAT et d’un analogue chimique indiquent que le BENPAT et le BENTAX peuvent tous deux avoir des effets nocifs sur les organismes aquatiques.
Dans cette évaluation préalable, l’estimation de l’exposition dans le pire des scénarios plausibles a été effectuée en supposant des situations où des usines (utilisatrices de la substance) rejettent du BENPAT dans le milieu aquatique. Dans les scénarios de rejets examinés, la concentration environnementale estimée (CEE) dans l’eau dépassait généralement les concentrations estimées sans effet (CESE) calculées pour les algues. Lorsqu’une approche semblable a été appliquée au BENTAX, la CEE dans l’eau était inférieure aux CESE calculées pour les algues, dans un scénario d’exposition plus prudent.
Selon les renseignements disponibles, il a été conclu que le BENPAT pénètre dans l’environnement en une quantité, à une concentration ou dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou la diversité biologique. Par contre, il a été conclu que le BENTAX ne pénètre pas dans l’environnement en une quantité, à une concentration ou dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou la diversité biologique.
Les études chroniques concernant le BENPAT et une substance analogue n’ont apporté aucune preuve de cancérogénicité chez des animaux de laboratoire. En outre, les renseignements disponibles sur la génotoxicité indiquent qu’il est peu probable que le BENPAT et le BENTAX soient génotoxiques. Puisque l’exposition de la population générale au BENTAX a été jugée négligeable, le risque pour la santé humaine a été considéré comme faible. Les marges d’exposition entre l’estimation de la limite supérieure d’exposition au BENPAT dans les milieux naturels et les niveaux critiques produisant un effet chez les animaux de laboratoire sont considérées comme adéquates pour tenir compte des incertitudes dans les bases de données des effets sur la santé et de l’exposition.
À la lumière des renseignements présentés dans cette évaluation préalable, il a été conclu que le BENTAX et le BENPAT ne pénètrent pas dans l’environnement en quantité, à des concentrations ou dans des conditions qui constituent ou peuvent constituer un danger pour la vie ou la santé humaine.
D’après les renseignements disponibles, il a été conclu que le BENPAT remplit au moins un des critères de l’article 64 de la Loi canadienne sur la protection de l’environnement (1999).
D’après les renseignements disponibles, il a été conclu que le BENTAX ne remplit aucun des critères de l’article 64 de la Loi canadienne sur la protection de l’environnement (1999).
De plus, il a été conclu que les composants du BENTAX et du BENPAT remplissent les critères de persistance, mais non ceux du potentiel de bioaccumulation au sens du Règlement sur la persistance et la bioaccumulation.
Comme le BENTAX figure sur la Liste intérieure, son importation et sa fabrication au Canada ne sont pas visées par les dispositions du paragraphe 81(1). Vu les dangers écologiques que peut présenter cette substance, on craint qu’en raison de nouvelles activités qui n’ont pas été mentionnées ou évaluées, elle en vienne à remplir les critères énoncés à l’article 64 de la Loi. Par conséquent, il est recommandé de modifier la Liste intérieure, en application des dispositions du paragraphe 87(3) de la Loi, pour indiquer que les dispositions du paragraphe 81(3) de la Loi s’appliquent à cette substance de telle sorte qu’une nouvelle activité de fabrication, d’importation ou d’utilisation du BENTAX soit annoncée dans un avis et fasse l’objet d’évaluations des risques écologiques et des risques pour la santé humaine.
La Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)] (Canada, 1999) exige que les ministres de l’Environnement et de la Santé procèdent à une évaluation préalable des substances qui répondent aux critères de catégorisation énoncés dans la Loi afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l’environnement ou la santé humaine.
Selon l’information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu’une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères environnementaux de catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque pour les organismes aquatiques (Ti), et que l’on croit être commercialisées au Canada;
- celles qui répondent aux critères de catégorisation pour le plus fort risque d’exposition (PFRE) ou qui présentent un risque d’exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine, compte tenu des classifications qui ont été établies par d’autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont donc publié un avis d’intention dans la Partie I de la Gazette du Canada (Canada, 2006) dans lequel ils priaient l’industrie et les autres intervenants de fournir, selon un calendrier déterminé, des renseignements précis qui pourraient servir à étayer l’évaluation des risques, ainsi qu’à élaborer et à évaluer les meilleures pratiques de gestion des risques et de bonne gestion des produits pour ces substances jugées hautement prioritaires.
On a décidé d’accorder une attention hautement prioritaire à l’évaluation des risques pour l’environnement du mélange de N,N’-(phényl(s) et tolyl(s))benzène-1,4-diamines et du mélange de N,N’-(tolyl(s) et xylyl(s))benzène-1,4-diamines, car ces substances ont été jugées persistantes, bioaccumulables et intrinsèquement toxiques pour les organismes aquatiques et il semble qu’elles sont commercialisées au Canada. Il a été décidé d’évaluer ces deux substances ensemble étant donné les similitudes qui existent dans leur composition, leur structure et leurs propriétés.
Le volet du Défi portant sur ces substances a été publié dans la Gazette du Canada le 26 septembre 2009 (Canada, 2009a et 2009b). En même temps ont été publiés les profils de ces substances, qui présentaient l’information technique (obtenue avant décembre 2005) sur laquelle a reposé leur catégorisation. Des renseignements relatifs aux propriétés chimiques, à la persistance et aux utilisations du mélange de N,N’-(phényl(s) et tolyl(s))benzène-1,4-diamines (BENPAT) ainsi qu’aux utilisations du mélange de N,N’-(tolyl(s) et xylyl(s))benzène-1,4-diamines (BENTAX) ont été communiqués en réponse au Défi (Présentation de projet d’études, 2010a, 2010b).
Bien que l’évaluation des risques que présentent le BENTAX et le BENPAT soit jugée hautement prioritaire pour l’environnement, ces substances ne répondent pas aux critères pour le PFRE ou le REI ni aux critères définissant un risque élevé pour la santé humaine compte tenu de leur classement par d’autres organismes nationaux ou internationaux en ce qui a trait à la cancérogénicité, à la génotoxicité ou à la toxicité pour le développement ou la reproduction. Dès lors, la présente évaluation est axée principalement sur les renseignements pertinents à l’évaluation des risques écologiques.
Les évaluations préalables effectuées aux termes de la LCPE (1999) mettent l’accent sur les renseignements jugés essentiels pour déterminer si une substance répond aux critères au sens de l’article 64 de la Loi. Les évaluations préalables visent à examiner les renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence.[2]
La présente évaluation préalable prend en considération les renseignements sur les propriétés chimiques, les dangers, les utilisations de la substance en question et l’exposition à celle-ci, y compris l’information supplémentaire fournie dans le cadre du Défi. Les données pertinentes pour l’évaluation préalable de ces substances sont tirées de publications originales, de rapports de synthèse et d’évaluation, de rapports de recherche de parties intéressées et d’autres documents consultés au cours de recherches documentaires menées récemment, jusqu’en janvier 2011 (sections du document concernant la santé humaine et les aspects écologiques). Les études les plus importantes ont fait l’objet d’une évaluation critique. Il est possible que les résultats de modélisation aient servi à formuler des conclusions. Lorsqu’ils étaient disponibles et pertinents, les renseignements contenus dans les évaluations des dangers effectués par d’autres instances ont été utilisés. La présente ébauche d’évaluation préalable ne constitue pas un examen exhaustif ou critique de toutes les données disponibles. Il s’agit plutôt d’un sommaire des renseignements essentiels qui appuient la conclusion proposée.
La présente évaluation préalable a été préparée par le personnel du Programme des substances existantes de Santé Canada et d’Environnement Canada et elle intègre les résultats d’autres programmes exécutés par ces ministères. La partie portant sur l’écologie a fait l’objet d’une étude consignée par des pairs ou de consultations de ces derniers. De plus, l’ébauche de l’évaluation a fait l’objet d’une période de commentaires de 60 jours par le public. Bien que les commentaires reçus de l’extérieur aient été pris en considération, Santé Canada et Environnement Canada sont seuls responsables du contenu final et des résultats de l’évaluation préalable. Les approches suivies pour les évaluations préalables dans le cadre du Défi ont été examinées par un groupe indépendant, soit le Groupe consultatif du Défi.
Les principales données et considérations sur lesquelles repose la présente évaluation sont résumées ci-après.
Nom des substances
Aux fins de la présente évaluation, la substance « mélange de N,N’-(phényl(s) et tolyl(s))benzène-1,4-diamines » (no CAS 68953-84-4) sera appelée BENPAT, d’après le nom anglais de la Liste intérieure des substances (LIS) (voir le tableau 1). De la même façon, la substance « mélange de N,N’-(tolyl(s) et xylyl(s))benzène-1,4-diamines » (no CAS 68478-45-5) sera appelée BENTAX, également d’après le nom anglais de la LIS.
Ces substances sont considérées comme des substances de composition inconnue ou variable, des produits de réaction complexes ou des matières biologiques (UVCB). Aux fins de la présente évaluation, une autre substance UVCB, le mélange de N,N’-(phényl(s), tolyl(s) et xylyl(s))benzène-1,4-diamines[3] (no CAS 68953-84-3), est utilisée en tant que substance analogue en raison de ses similitudes structurelles. Cet analogue sera appelé BENPATAX, d’après le nom du National Chemical Inventory.
Le BENPAT est un mélange de dérivés de phényle et de tolyle; le BENTAX est quant à lui un mélange de dérivés de tolyle et de xylyle. La substance analogue, le BENPATAX, existe sous la forme d’un mélange de trois dérivés (phényle, tolyle et xylyle) fixés à la structure d’amine aromatique commune aux trois substances (BENPAT, BENTAX et BENPATAX) (NICNAS, 2001). Le BENPATAX renferme tous les principaux composants du BENPAT et du BENTAX; il peut donc être utilisé comme analogue du BENPAT comme du BENTAX. Cependant, comme de nombreuses études existent sur le BENPAT, alors que les données sur le BENTAX sont rares, les renseignements sur le BENPATAX sont employés pour la caractérisation du BENTAX seulement.
Les données caractérisant le BENPAT, le BENTAX et l’analogue BENPATAX sont décrites ci-dessous aux tableaux 1a, 1b et 1c, respectivement.
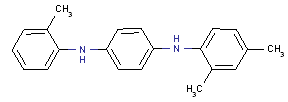
Les combinaisons de dérivés existantes se chevauchent pour les trois substances (BENPAT, BENTAX et BENPATAX) et comprennent les constituants possibles suivants : deux phényles (structure 1), un phényle et un tolyle (structure 2), deux tolyles (structure 3), un tolyle et un xylyle (structure 4) et deux xylyles (structure 5). Une seule combinaison possible de dérivés pour la substance analogue BENPATAX ne l’est pas pour le BENPAT ou le BENTAX : il s’agit d’une combinaison formée de phényle et de xylyle.
En outre, des numéros CAS ont été attribués à la plupart des constituants uniques formant les substances BENPAT, BENTAX et BENPATAX. Ainsi, la structure 1 est connue sous le nom de N,N’-diphényl-p-phénylènediamine (DPPD), no CAS 74-31-7; la structure 2 (avec un groupe méthyle en position ortho sur le noyau aryle) est connue sous le nom de N-phényl-N’-(o-tolyle)-p-phénylènediamine, no CAS 27173-16-6; la structure 3 (avec des groupes méthyles en position ortho sur les noyaux aryles) est quant à elle connue sous le nom de N,N’-di(o-tolyl)-p-phénylènediamine, no CAS 15017-02-4.
Tableau 1a. Identité de la substance – BENPAT
| Numéro de registre du Chemical Abstracts Service (no CAS) | 68953-84-4 |
| Nom dans la LIS | Benzène-1,4-diamine, dérivés mixtes de N,N’-(phényle et tolyle) |
| Noms relevés dans les National Chemical Inventories (NCI)[1] | 1,4-Benzenediamine, N,N’-mixed Ph and tolyl derivs. (en anglais) (TSCA, DSL, REACH, EINECS, ENCS, PICCS, ASIA-PAC, NZIoC); 1,4-Benzenediamine, N,N’-mixed Phenyl and tolyl derivatives (en anglais) (LIS); benzènediamine-1,4, mélange de N,N’-dérivés phényles et tolyles (EINECS); 1,4-Benzoldiamin, N,N’-gemischte Phenyl und Tolylderivate (en allemand) (EINECS); 1,4-bencenodiamina, N,N’-mezcla de fenil y tolil derivados (en espagnol) (EINECS); 1,4-Benzenediamine, N,N’-mixed phenyl and tolyl derivatives (en anglais) (AICS); 1,4-Benzenediamine, N,N’-mixed phenyl and tolyl derivs. (en anglais)(ECL); DERIVATIVES, BENZENE-1,4-DIAMINE, N,N’-MIXED PHENYL AND TOLYL (en anglais) (PICCS); MIXED PHENYL AND TOLYL P-PHENYLENEDIAMINE (en anglais) (PICCS) |
| Autres noms | Hydroquinone, o-toluidine, aniline condensate; N,N’-Diphenyl-p-phenylenediamine, methylated; Amines (catégorie chimique); Wingstay 100 (Huntink et al., 2006; IUCLID Data Set, 2003); Polystay 100AZ (MSDS, 2002a); Accinox 100, blend of phenyl and tolyl p-phenylenediamines, DAPD, mixed diaryl-p-phenylenediamines, mixed di-aryl-p-phenylenediamines, diaryl-p-phenylenediamines, Naugard 496, Vulkanox 3100,Polystay 100, WTR Number 4a, Nailax (Nailax B)(IUCLID Data Set, 2003), DTPD (XingChun Chemical Corporation, c2006; Kirk-Othmer, c2010) |
Groupe chimique (groupe de la LIS) |
Substances organiques de composition inconnue ou variable, produits de réaction complexes et matières biologiques (UVCB) |
| Principale classe chimique ou utilisation | Amines |
| Principale sous-classe chimique | Amines aromatiques |
| Formule chimique | Produit de réaction complexe comprenant ce qui suit : Structure 1 = C18H16N2 Structure 2 = C19H18N2 Structure 3 = C20H20N2 |
| Structures chimiques représentatives utilisées dans les modèles d’estimation[2] | Structure 1 Structure 2 Structure 3 |
| SMILES représentatif utilisé dans les modèles d’estimation[3] | Structure 1 Structure 2 Structure 3 |
| Masse moléculaire (/mol) | Structure 1 = 260,33 Structure 2 = 274,36 Structure 3 = 288,39 |
[2] Comme elle fait partie de la catégorie des UVCB (substances de composition inconnue ou variable, produits de réactions complexes ou matières biologiques), cette substance n’est pas un composé chimique défini et elle peut donc être représentée par différentes structures. Aux fins de la modélisation, la structure et le SMILES correspondant présentés ici ont été choisis pour la représenter.
[3] Simplified Molecular Input Line Entry System.
Tableau 1b. Identité de la substance – BENTAX
| Numéro de registre du Chemical Abstracts Service (no CAS) | 68478-45-5 |
| Nom dans la LIS | Benzène-1,4-diamine, dérivés N,N’-(tolylés et de xylylés) mixtes |
| Noms relevés dans les National Chemical Inventories (NCI)[1] | 1,4-Benzenediamine, N,N’-mixed tolyl and xylyl derivs. (en anglais) (TSCA, DSL, REACH, EINECS, PICCS, ASIA-PAC) 1,4-Benzenediamine, N,N’-mixedTolyl and xylyl derivatives (en anglais) (LIS) benzènediamine-1,4, dérivés N,N’-(mélange de tolyle et de xylyle) (EINECS) 1,4-Benzoldiamin, N,N’-gemischte Tolyl und Xylylderivate (en allemand) (EINECS) 1,4-bencenodiamina, N,N’-mezcla de tolil y xilil derivados (en espagnol) (EINECS) 1,4-Benzenediamine, N,N’-mixed tolyl and xylyl derivs. (en anglais) (ECL) DERIVATIVE, BENZENE-1,4-DIAMINE, N,N’-MIXED TOLYL AND XYLYL (en anglais) (PICCS) |
| Autres noms | Hydroquinone, o-toludine, xylidine condensate p-Phenylenediamine, diaryl-Benzene-1,4-diamine, dérivés N,N’-(tolyles et de xylyles) mixtes Amines (catégorie chimique) |
Groupe chimique (groupe de la LIS) |
Substances organiques de composition inconnue ou variable, produits de réaction complexes et matières biologiques (UVCB) |
| Principale classe chimique ou utilisation | Amines |
| Principale sous-classe chimique | Amines aromatiques |
| Formule chimique | Produit de réaction complexe comprenant ce qui suit : Structure 3 = C20H20N2 Structure 4 = C21H22N2 Structure 5 = C22H24N2 |
| Structures chimiques représentatives utilisées dans les modèles d’estimation[2] | Structure 3 Structure 4 Structure 5 |
| SMILES représentatif utilisé dans les modèles d’estimation[3] | Structure 3 Structure 4 Structure 5 |
| Masse moléculaire (g/mol) |
Structure 3 = 288,39 Structure 4 = 302,41 Structure 5 = 316,44 |
[2] Comme elle fait partie de la catégorie des UVCB (substances de composition inconnue ou variable, produits de réactions complexes ou matières biologiques), cette substance n’est pas un composé chimique défini et elle peut donc être représentée par différentes structures. Aux fins de la modélisation, la structure et le SMILES correspondant présentés ici ont été choisis pour la représenter.
[3] Simplified Molecular Input Line Entry System.
Tableau 1c. Identité de la substance – BENPATAX (substance analogue)
| Numéro de registre du Chemical Abstracts Service (no CAS) | 68953-83-3 |
| Nom dans la LIS | Benzène-1,4-diamine, dérivés mixtes de N,N’-(phényle, tolyle et xylyle) |
| Noms relevés dans les National Chemical Inventories (NCI)[1] | 1,4-Benzenediamine, N,N’-mixed Ph and tolyl and xylyl derivs. (en anglais) (TSCA, DSL, REACH, EINECS, ASIA-PAC) 1,4-Benzenediamine, N,N’-mixed Phenyl and tolyl and xylyl derivatives (en anglais) (LIS) benzènediamine-1,4, mélange de N,N’-dérivés phényles, tolyles et xylyles (EINECS) 1,4-Benzoldiamin, N,N’-gemischte Phenyl und Tolyl und Xylylderivate (en allemand) (EINECS) 1,4-bencenodiamina, N,N’-mezcla de fenil, tolil y xilil derivados (en espagnol) (EINECS) 1,4-Benzenediamine, N,N’-mixed phenyl and tolyl and xylyl derivs. (en anglais) (AICS) 1,4-Benzenediamine, N,N’-mixed Ph and tolyl and xylyl derivs. (en anglais) (ECL) |
| Autres noms | Diaryl-p-phenylenediamines Hydroquinone, o-toluidine, xylidine, aniline condensate Amines (catégorie chimique) Wingstay 200 (NICNAS, 2001) Polystay 200 (MSDS, 2002b) |
Groupe chimique (groupe de la LIS) |
Substances organiques de composition inconnue ou variable, produits de réaction complexes et matières biologiques (UVCB)[2] |
| Principale classe chimique ou utilisation | Amines |
| Principale sous-classe chimique | Amines aromatiques |
| Formule chimique | Produits de réaction complexe : C18H16N2 –C22H24N2 |
| Structure chimique représentative |  où : R = H (phényle) R = CH3 (tolyle) R = 2 CH3 (xylyle) |
| Masse moléculaire (g/mol) |
260,33 – 316,44 (d’après les structures individuelles) 302 (NICNAS, 2001) |
[2] Comme elle fait partie de la catégorie des UVCB (substances de composition inconnue ou variable, produits de réactions complexes ou matières biologiques), cette substance n’est pas un composé chimique défini et elle peut donc être représentée par différentes structures. Aux fins de la modélisation, la structure et le SMILES correspondant présentés ici ont été choisis pour la représenter.
Les substances BENPAT et BENTAX sont produites par le processus de condensation de 1 mole d’hydroquinone avec 2 à 2,5 moles d’un mélange d’arylamines composé, à parts égales, d’aniline et d’o-toluidine ou d’o-toluidine et de xylidine (Goodyear Tire and Rubber Company, 1965; Fernandes et McCormack, 1971; Kirk-Othmer, c2010). Le réactif de xylidine utilisé dans la production de BENTAX peut être soit du 2,4-diméthylaniline, soit un mélange d’isomères de xylidine (Goodyear Tire and Rubber Company, 1965).
Étant donné que les arylamines sont présentes dans des proportions égales dans les réactions, une répartition aléatoire des produits doit être obtenue. En conséquence, il a été rapporté que la composition du BENPAT était la suivante : 25 % de N,N’-diphényl-p-phénylènediamine (structure 1; no CAS 74-31-7); 50 % de N-phényle-N’-(o-tolyle)-p-phénylènediamine (structure 2; no CAS 27173-16-6); et 25 % de N,N’-di(o-tolyl)-p-phénylènediamine (structure 3; no CAS 15017-02-4) (Huntlink et al., 2006; IUCLID Data Set, 2003).
D’après les renseignements concernant la composition du BENPAT et les ratios entre l’o-toluidine et la xylidine dans le mélange réactif, on suppose que la composition du BENPAX est approximativement la suivante : 25 % de N,N’-di(o-tolyl)-p-phénylènediamine (structure 3; no CAS 15017-02-4); 50 % deN-(o-tolyl)-N’-xylyl-p-phénylènediamine; et 25 % de N,N’-dixylyl-p-phénylène (no CAS 28726-30-9). Même si le N-(o-tolyl)-N’-xylyl-p-phénylènediamine et leN,N’-dixylyl-p-phénylène, composés du BENTAX, sont potentiellement composés de plusieurs isomères distincts, ils sont représentés dans cette évaluation par les isomères N-(o-tolyl)-N’-(2,4-diméthylphényl)-p-phénylènediamine (structure 4) et N,N’-(2,4-diméthylphényl)-p-phénylènediamine (structure 5), respectivement. Il faut remarquer que le BENTAX pourrait se composer de combinaisons additionnelles d’isomères résultant de variations des modèles de substitution des substituants méthyles dans les dérivés de tolyle et de xylyle. Toutefois, ses propriétés physico-chimiques ne varieraient pas de façon importante avec ces légères différences en matière de substitution. Une telle variabilité n’est pas attendue dans la composition du BENPAT étant donné que les réactifs précis ainsi que leurs modèles de substitution du méthyle sont connus pour cette substance (Goodyear Tire and Rubber Company, 1965; Fernandes et McCormack, 1971; Kirk-Othmer, c2010; Huntink et al., 2006; IUCLID Data Set, 2003).
Enfin, les impuretés trouvées dans le BENPAT comprennent deux réactifs résiduels (o-toluidine [< 0,1 %] et aniline [< 0,1 %]) et des produits de réaction supplémentaires comme la méthyldiphénylamine (< 0,1 %) et la diphénylamine (1 à 5 %) (IUCLID Data Set, 2003). De même, il a été rapporté que l’o-toluidine était un composé résiduel que l’on retrouvait dans le BENTAX à une concentration inférieure à 0,1 % (MSDS, 2002a). Étant donné que ces impuretés ne sont présentes qu’en quantités très faibles dans la composition globale du BENPAT et du BENTAX, il n’en sera pas davantage question dans la présente évaluation.
Le BENPAT et le BENTAX sont des substances UVCB caractérisées par un mélange de dérivés de phényle et de tolyle, et par un mélange de dérivés de tolyle et de xylyle, respectivement. La substance analogue, le BENTAPAX, est une substance UVCB composée d’un mélange de dérivés de phényle, de tolyle et de xylyle.
Certaines propriétés physicochimiques étaient disponibles concernant les produits offerts sur le marché pour les trois substances (IUCLID Data Set, 2003; Commission européenne, 2000; Goodyear Tire and Rubber Company, 1965; NICNAS, 2001; Présentation de projet d’études, 1998). Toutefois, dans certains cas, la composition exacte des constituants des produits commerciaux n’était pas précisée, ou les propriétés physicochimiques étaient estimées d’après des mesures effectuées pour des constituants uniques. Par conséquent, les propriétés physicochimiques expérimentales et modélisées pour les substances BENPAT, BENTAX et la substance analogue BENPATAX sont décrites dans les deux tableaux ci-dessous. Le tableau 2a présente les données disponibles pour les produits commerciaux tandis que le tableau 2b présente les données disponibles pour les structures représentatives 1 à 5 (voir les tableaux 1a, 1b et 1c pour obtenir une description de ces structures représentatives). Les données expérimentales et modélisées (tout comme les renseignements généraux) disponibles pour les structures représentatives 1 à 3 sont jugées pertinentes et utilisées en tant que « lecture croisée » pour le BENPAT, alors que les données concernant les structures représentatives 3 à 5 sont jugées pertinentes pour le BENTAX.
Les propriétés physico-chimiques décrites aux tableaux 2a et 2b sont pertinentes concernant le devenir environnemental des substances. En outre, des modèles basés sur les relations quantitatives structure-activité (RQSA) ont servi à produire des données pour déterminer quelques propriétés physiques et chimiques des cinq structures représentatives du BENPAT et du BENTAX (voir le tableau 2b). Ces modèles (sauf WSKOWWIN, 2008) s’appuient principalement sur des méthodes d’ajout de fragments, c’est-à-dire qu’elles reposent sur la structure d’un produit chimique. Seules les formes neutres d’un produit chimique peuvent être fournies comme données d’entrée à ces modèles (formes SMILES); par conséquent, les valeurs modélisées figurant au tableau 2b concernent la forme neutre des structures représentatives.
Tableau 2a. Propriétés physiques et chimiques des formes de BENPAT, de BENTAX et de BENPATAX disponibles dans le commerce
| Propriété | Substance (no CAS) |
Type | Valeur | Température (°C) | Référence |
|---|---|---|---|---|---|
| Point de fusion (ºC) |
BENPAT (68953-84-4) | Expérimental | 90[*] à 105[*] | IUCLID Data Set, 2003; Commission européenne, 2000 | |
| BENTAX (68478-45-5) | Expérimental | 60[*] à 70[a] | Goodyear Tire and Rubber Company, 1965 | ||
| Point d’ébullition (ºC) |
BENPATAX (68953-83-3) | Expérimental | > 300 | NICNAS, 2001; Présentation de projet d’études, 1998 | |
| Pression de vapeur (Pa) |
BENPATAX (68953-83-3) | Modélisé | < 1 x 10-5[*] (1 x 10-8 kPa)[b] | 25 | NICNAS, 2001; Présentation de projet d’études, 1998 |
| Log Koe [c] (coefficient de partage octanol-eau) (sans dimension) |
BENPAT (68953-84-4) | Expérimental | 3,4 à 4,3 | IUCLID Data Set, 2003 Présentation de projet d’études, 2010c MSDS, 2002b |
|
| 3,4 à 4,3 | |||||
| BENPATAX (68953-83-3) | 3,3* à 4,6[*] | ||||
| 3,5 à 4,56 | NICNAS, 2001; Présentation de projet d’études, 1998 | ||||
| Log Koc[d] (coefficient de partage carbone organique-eau) (sans dimension) |
BENPAT (68953-84-4) | Expérimental | 4,39 à 4,95 | Présentation de projet d’études, 2010c | |
| Solubilité dans l’eau (mg/L) |
BENPAT (68953-84-4) | Estimée d’après les données expérimentales | ~ 2,2[e], [*] | Présentation de projet d’études, 2010a | |
| BENTAX (68478-45-5) | Expérimental | insoluble | FS, 2002a | ||
| BENPATAX (68953-83-3) | Expérimental | insoluble | FS, 2002b | ||
| 1,02 | ~20 | NICNAS, 2001; Présentation de projet d’études, 1998 | |||
| Solubilité dans le pentane (g/mL) |
BENPAT (68953-84-4) | Expérimental | 0,0025 | Goodyear Tire and Rubber Company, 1965 | |
| BENTAX (68478-45-5) | 0031 | ||||
| BENPATAX (68953-83-3) | 0,013 à 0,027 |
[a] Le point de fusion des diphényl-p-phénylènediamines alkyl-substitués préparés en utilisant un mélange aminé de toluidines mixtes et de xylidines mixtes est inférieur à 60 oC. Le point de fusion des diphényl-p-phénylènediamines alkyl-substitués préparés en utilisant un mélange aminé de 2,4-diméthylaniline et d’o-toluidine est compris entre 65 et 70 oC (Goodyear Tire and Rubber Company, 1965).
[b] La valeur entre parenthèses est la valeur indiquée à l’origine.
[c] Les intervalles de valeurs de log Koe ont été établis par chromatographie liquide haute performance (CLHP) pour les principaux composants isolément.
[d] L’intervalle de valeurs de log Koc ont été établis par CLHP pour les principaux composants isolément.
[e] Il était indiqué dans la Présentation de projet d’études (2010a) que cette valeur avait été obtenue à partir de la solubilité mesurée des composés principaux du BENPAT comprise entre 0,045 et 0,013 mg/L et à partir d’une solubilité combinée des composés mineurs de 1,9 mg/L. Aucune précision supplémentaire sur la façon dont cette valeur a été calculée n’a été fournie.
[*] Indique la valeur choisie pour la modélisation.
Le tableau 2b ci-dessous décrit les propriétés empiriques et modélisées des structures représentatives 1 à 5 pour les substances BENPAT et BENTAX (voir les tableaux 1a et 1b pour obtenir une description des structures représentatives).
Tableau 2b. Propriétés physiques et chimiques des structures représentatives du BENPAT[1] (structures 1 à 3) et du BENTAX[2] (structures 3 à 5)
| Propriété | Structure | Type | Valeur[1] | Température (oC) |
Référence |
|---|---|---|---|---|---|
| Point de fusion (ºC) |
1 | Expérimental | 154[*] | Lorenz et Parks, 1962 | |
| 150 à 151 | Merck Index, V.12:2, dans CHRIP, c2008 | ||||
| 144 à 153 | Kirk-Othmer, c2010 | ||||
| Modélisé | 143 | MPBPWIN, 2008 | |||
| 2 | Expérimental | 130[*] | Lorenz et Parks, 1962 | ||
| Modélisé | 154 | MPBPWIN, 2008 | |||
| 3 | Expérimental | 135[*] à 136[*] | Lorenz et Parks, 1962 | ||
| Modélisé | 159 | MPBPWIN, 2008 | |||
| 4 | Modélisé | 169[*] | |||
| 5 | 179[*] | ||||
| Point d’ébullition (ºC) |
1 | Expérimental | 220 à 225 (à 0,5 mmHg) | Merck Index, v.12:2, dans CHRIP, c2008 | |
| Modélisé | 398 | MPBPWIN, 2008 | |||
| 2 | Modélisé | 410 | |||
| 3 | Expérimental | 420 | CHRIP, c2008 | ||
| Modélisé | 421 | MPBPWIN, 2008 | |||
| 4 | Modélisé | 433 | |||
| 5 | Modélisé | 445 | |||
| Pression de vapeur (Pa) |
1 | Expérimental | 8,47 × 10-7 (valeur extrapolée) | 25 | |
| Modélisé | 7,65 × 10-5[*] | MPBPWIN, 2008 | |||
| 2 | Modélisé | 3,06 × 10-5[*] | 25 | MPBPWIN, 2008 | |
| 3 | 1,42 × 10-5[*] | ||||
| 4 | 5,65 × 10-6[*] | ||||
| 5 | 2,23 × 10-6[*] | ||||
| Constante de la loi de Henry (Pa·m3/mol) |
1 | Modélisé | 2,08 × 10-5 | 25 | HENRYWIN, 2008 |
| 2 | Modélisé | 2,29 × 10-5 | 25 | ||
| 3 | Modélisé | 2,53 × 10-5 | 25 | ||
| 4 | Modélisé | 2,79 × 10-5 | 25 | ||
| 5 | Modélisé | 3,08 × 10-5 | 25 | ||
| Log Koe (coefficient de partage octanol-eau) (sans dimension) |
1 | Expérimental | > 3,7 | 22,8 | IUCLID Data Set, 2003 |
| 3,4 | Présentation de projet d’études, 2010b; IUCLID Data Set, 2003 | ||||
| 3,3[*] | Présentation de projet d’études, 2010c | ||||
| 3,5 | Présentation de projet d’études, 1998 | ||||
| Modélisé | 4,04 | KOWWIN, 2008 | |||
| 2 | Expérimental | > 4,3 | 22,8 | IUCLID Data Set, 2003 | |
| 3,82 | Présentation de projet d’études, 2010b; IUCLID Data Set, 2003 | ||||
| 3,92 | Présentation de projet d’études, 1998 | ||||
| 3,9[*] | Présentation de projet d’études, 2010c | ||||
| Modélisé | 4,59 | KOWWIN, 2008 | |||
| 3 | Expérimental | > 4,6 | 22,8 | IUCLID Data Set, 2003 | |
| 4,28 | Présentation de projet d’études, 2010b; IUCLID Data Set, 2003 | ||||
| 4,6[*] | Présentation de projet d’études, 2010c | ||||
| 4,17 à 4,21 | Présentation de projet d’études, 1998 | ||||
| Modélisé | 5,13 | KOWWIN, 2008 | |||
| 4 | Expérimental | 4,39 à 4,42 | Présentation de projet d’études, 1998 | ||
| Modélisé | 5,68 | KOWWIN, 2008 | |||
| 5 | Expérimental | 4,51 à 4,56 | Présentation de projet d’études, 1998 | ||
| Modélisé | 6,23 | KOWWIN, 2008 | |||
| Log Kco (coefficient de partage carbone organique-eau) (sans dimension) |
1 | Expérimental | 4,39 | Présentation de projet d’études, 2010c | |
| Modélisé | 4,7151 (à partir de l’ICM[**]) |
KOCWIN, 2008 | |||
| 3,1165 (à partir du log Koe) |
|||||
| 2 | Expérimental | 4,66 | Présentation de projet d’études, 2010c | ||
| Modélisé | 4,92 (à partir de l’ICM) |
KOCWIN, 2008 | |||
| 3,42 (à partir du log Koe) |
|||||
| 3 | Expérimental | 4,95 | Présentation de projet d’études, 2010c | ||
| Modélisé | 5,14 (à partir de l’ICM) |
KOCWIN, 2008 | |||
| 3,72 (à partir du log Koe) |
|||||
| 4 | Modélisé | 5,35 (à partir de l’ICM) |
KOCWIN, 2008 | ||
| 4,02 (à partir du log Koe) |
|||||
| 5 | Modélisé | 5,55 (à partir de l’ICM) |
KOCWIN, 2008 | ||
| 4,33 (à partir du log Koe) |
|||||
| Solubilité dans l’eau (mg/L) |
1 | Expérimental | 0,13[*] | Présentation de projet d’études, 2010a | |
| Modélisé | 7,353 | 25 | WSKOWWIN, 2008 | ||
| 1,5867 | WATERNT, 2008 | ||||
| 2 | Expérimental | 0,11[*] | Présentation de projet d’études, 2010a | ||
| Modélisé | 2,09 | 25 | WSKOWWIN, 2008 | ||
| Modélisé | 0,50 | WATERNT, 2008 | |||
| 3 | Expérimental | 0,045 | Présentation de projet d’études, 2010a | ||
| Modélisé | 0,59 | 25 | WSKOWWIN, 2008 | ||
| Modélisé | 0,16 | WATERNT, 2008 | |||
| 4 | Modélisé | 0,17 | 25 | WSKOWWIN, 2008 | |
| Modélisé | 0,05[*] | WATERNT, 2008 | |||
| 5 | Modélisé | 0,05 | 25 | WSKOWWIN, 2008 | |
| Modélisé | 0,02[*] | WATERNT, 2008 | |||
| pKa | 2[3] | Modélisé | pKa1 = 1,91 | ACD/pKaDB, 2005 | |
| pKa2 = -1,29 | |||||
| 3[3] | pKa1 = 2,24 | ||||
| pKa2 = -1,22 |
[2] Le BENTAX est composé des structures représentatives 3 à 5. Voir le tableau 1b pour obtenir une description des structures représentatives.
[3] Dans l’eau, le BENPAT et le BENTAX (représentés par les structures 2 et 3 aux fins de l’ACD/pKaDB (2005) se comportent comme des bases attirant les protons et, par conséquent, les valeurs des pKa secondaires décroissent (contrairement à ce qui se passe dans le cas d’un acide).
[*] Indique la valeur choisie pour la modélisation.
[**] ICM : indice de connectivité moléculaire.
Les données expérimentales et modélisées pour les propriétés physico-chimiques des structures représentatives 1 à 5 indiquent les qualités générales suivantes pour lesdites structures : faible solubilité dans l’eau, pression de vapeur et constante de la loi de Henry très faible à négligeable, log Kco modéré à très élevé et log Koe modéré à élevé. De plus, d’après les résultats obtenus à partir du programme de modélisation pKa DB d’ACD (2005) utilisant les structures 2 et 3 comme des structures représentatives du BENPAT et du BENTAX, respectivement, il est conclu que les deux substances s’ionisent très peu dans l’eau et qu’elles doivent par conséquent être considérées comme des substances non ionisantes.
La solubilité d’une substance influence sa mobilité dans l’environnement. Aussi s’agit-il de l’un des paramètres clés permettant la caractérisation du devenir d’une substance chimique lorsque cette dernière est rejetée dans l’environnement.
Les solubilités aqueuses du BENPAT et de la substance analogue, le BENPATAX, ont été déterminées de manière expérimentale. Une étude complète a été soumise à Environnement Canada pour le BENPATAX (Présentation de projet d’études, 1998) alors qu’un résumé d’une étude de IUCLID a été soumis pour le BENPAT (Résumé d’étude, 2010a). Ces deux études ont été menées conformément à la Ligne directrice no 105 de l’Organisation de coopération et de développement économiques (OCDE) relative à la détermination de la solubilité dans l’eau. Le BENPATAX a été testé en suivant le protocole original de la ligne directrice adoptée en 1981. La Ligne directrice no 105 de l’OCDE a depuis été révisée puis adoptée en 1995. Les changements apportés concernent principalement la forme (OCDE, 1995). Cette ligne directrice comporte une méthode par élution sur colonne avec chromatographie en phase liquide à haute résolution (CLHR) (détection des UV).
Pour le BENPAT, il a été déterminé expérimentalement que les structures représentatives 1 à 3 (composés principaux) avaient des solubilités dans l’eau comprises entre 0,045 et 0,13 mg/L et que les composés mineurs avaient une solubilité dans l’eau d’environ 1,9 mg/L. En outre, il a été déterminé que la solubilité globale du BENPAT dans l’eau était d’environ 2,2 mg/L. Étant donné qu’aucun détail de l’expérience n’a été fourni, la façon dont cette solubilité plus élevée dans l’eau a été établie n’est pas claire. Il n’a pas non plus été expliqué pourquoi la solubilité globale du BENPAT dans l’eau, substance constituée de multiples composés, était supérieure à celle des composés uniques la constituant. La solubilité globale moyenne du BENPATAX dans l’eau a été estimée à 1,02 mg/L (Présentation de projet d’études, 1998). Étant donné que le BENPATAX est constitué de composés majeurs davantage substitués par le méthyle et moins solubles que ceux que l’on retrouve dans le BENPAT, il a été considéré que, tant pour le BENPAT que pour le BENPATAX, les solubilités globales dans l’eau étaient supérieures à celles de leurs composés uniques. Aucune précision quant à la façon dont la solubilité globale du BENTAPAX dans l’eau a été établie à partir des pics de CLHR observés pour les composés uniques n’a été fournie dans l’étude complète (Présentation de projet d’études, 1998).
L’étude de solubilité du BENPATAX dans l’eau a fait l’objet d’un examen critique afin d’en assurer la validité. Cette étude (sommaire de rigueur d’étude) se trouve à l’annexe 1.
Enfin, il existe des différences entre les valeurs expérimentales et les valeurs modélisées disponibles concernant la solubilité dans l’eau des structures 1 à 3 : les valeurs expérimentales sont globalement moins élevées que les valeurs modélisées. Les valeurs expérimentales ont été utilisées comme intrants du modèle pour les structures représentatives 1 à 3 et les valeurs modélisées (provenant du modèle WATERNT, 2008) ont été utilisées pour les structures représentatives 4 et 5. Par conséquent, les solubilités dans l’eau pour les structures 4 et 5 pourraient être surestimées; toutefois, ces valeurs sont égales ou inférieures aux valeurs de solubilité dans l’eau obtenues pour les structures représentatives 1 à 3 et conformes à la tendance générale voulant que plus les composés sont substitués par le méthyle, moins la solubilité dans l’eau est importante.
BENPAT
Cette substance n’est pas produite naturellement dans l’environnement. Selon les données recueillies lors d’une enquête menée conformément à l’article 71 de la LCPE (1999) (Canada, 2009b), sept déclarants ont indiqué que des quantités comprises entre 1 000 000 et 10 000 000 kg de BENPAT ont été importées au Canada en 2006 et aucune fabrication de ladite substance n’a été signalée au Canada. De plus, une entreprise a manifesté son intérêt pour le BENPAT.
Ailleurs, le BENPAT a été reconnu comme substance chimique produite en grande quantité par les organismes suivants : l’Environmental Protection Agency des États-Unis (US EPA) (US EPA, 2009), le Centre commun de recherche de la Commission européenne (ESIS) (ESIS, c1995-2009), et l’Organisation de coopération et de développement économiques (OCDE) (OCDE, 2004a).
Par le passé, les données reçues en provenance de la Liste intérieure des substances (1984-1986) indiquaient que la quantité totale de BENPAT importée, fabriquée ou proposée sur le marché canadien au cours de l’année 1986 se situait entre 100 000 et 1 000 000 de kilogrammes (Environnement Canada, 1988). Le nombre de déclarants pour les années civiles 1984 à 1986 était de 4.
BENTAX
Le BENTAX n’est pas non plus produit naturellement dans l’environnement. Selon l’ enquête menée conformément à l’article 71 de la LCPE (1999) (Canada, 2009b), de 100 à 1 000 kg de BENTAX ont été importés au Canada en 2006. Aucune fabrication de cette substance n’a été signalée au Canada. Moins de quatre déclarants ont répondu à cette enquête et une entreprise a montré son intérêt pour le BENTAX.
Selon une enquête menée en 2005 conformément à l’article 71 de la LCPE (1999) (Environnement Canada, 2005), de 1001 à 100 000 kg de BENTAX ont été importés au Canada la même année.
Le BENTAX n’a pas été reconnu par l’industrie de l’Union européenne comme substance chimique produite en grandes ou en petites quantités (ESIS, c1995-2009). De façon identique, cette substance ne figure pas sur les listes de substances chimiques produites en grandes quantités d’autres organismes tels que l’US EPA ou l’OCDE.
Enfin, par le passé, la quantité que les entreprises ont déclaré avoir fabriquée, importée ou commercialisée au Canada durant l’année civile 1986 se situait entre 100 000 kg et 1 000 000 kg (Environnement Canada, 1988). Le nombre de déclarants pour les années civiles 1984 à 1986 était inférieur à 4.
Au Canada, les utilisations industrielles du BENPAT et du BENTAX ont été déterminées dans le cadre de l’enquête menée en application de l’article 71 de la LCPE (1999) (Canada, 2009b); la plupart de ces utilisations sont considérées comme des renseignements commerciaux confidentiels et ne peuvent être divulguées. Cependant, toutes les utilisations ont été prises en compte dans la présente évaluation.
Une entreprise a signalé que le BENPAT était utilisé dans la fabrication de produits à base de caoutchouc à des concentrations comprises entre 0,29 et 2,17 % (Environnement Canada, 2010c). L’une des utilisations déclarées du BENTAX consiste à agir en tant qu’agent protecteur dans la composition du caoutchouc afin d’offrir à ce dernier une protection contre le vieillissement en retardant les dégradations liées aux expositions à la chaleur, à l’oxygène, à l’ozone, au rayonnement ultraviolet ou à l’humidité dans les produits finis.
En général, le BENTAX et le BENPAT sont utilisés en tant qu’additifs permettant de protéger les élastomères contre la détérioration liée à l’ozone (Kirk-Othmer, c2010). On les appelle communément des antiozonants ou des antioxydants, car leur effet protecteur sur les produits à base de caoutchouc découle d’une réaction entre l’additif chimique et l’ozone.
Le BENPAT et le BENTAX appartiennent à une catégorie d’antiozonants chimiques commerciaux dérivés de N,N’-diaryl-p-phénylènediamine (N,N’-diaryl-p-PDA), où le groupe aryle peut être le phényle, le méthylphényle ou le naphtalényle (Miller et al., 1985). Il s’agit d’antiozonants moyennement actifs utilisés à de faibles concentrations en raison de leur faible solubilité dans l’eau (Kirk-Othmer, c2010). Il a été reconnu que leur principal avantage consistait en une résistance élevée aux pertes liées à la consommation et à la vaporisation (Ambelang et al., 1963). Ainsi, conjuguées à des antiozonants plus réactifs, ces substances offrent une plus grande protection dans le cadre d’utilisations à long terme telles que dans les pneus radiaux pour les voitures de tourisme (Miller et al., 1985).
On sait que le BENPAT est utilisé comme antioxydant/antiozonant dans des produits à base de caoutchouc présentant une durée de vie élevée, comme les pneus et les tuyaux (Iatropoulos et al., 1997). Il convient de noter que les agents protecteurs du caoutchouc (c.-à-d., les antioxydants et les antiozonants) sont généralement ajoutés pour représenter environ 1 % (% en poids) de la composition d’un pneu normal (Wik et Dave, 2009). Toutefois, étant donné que diverses substances chimiques peuvent être utilisées comme agents protecteurs ou additifs, la composition des différents pneus varie (Wik et Dave, 2009).
Le BENTAX et le BENPAT ne sont pas des ingrédients utilisés dans des produits cosmétiques au Canada (SDC, 2010) et ne figurent pas sur la Liste critique des ingrédients dont l’utilisation est restreinte ou interdite dans les cosmétiques (Santé Canada, 2009). À l’heure actuelle, le BENTAX et le BENPAT ne sont pas utilisés comme principes actifs, ni comme produits de formulation, dans les pesticides dont l’utilisation est homologuée au Canada (ARLA, 2007). Ils ne sont pas répertoriés comme additifs alimentaires au titre 16 du Règlement sur les aliments et drogues (Canada, 1978). Le BENTAX et le BENPAT ne sont pas utilisés dans les emballages alimentaires ni comme additifs indirects (courriel de la Direction des aliments de Santé Canada adressé au Bureau de gestion du risque de Santé Canada en avril 2010; source non citée).
De plus, le BENTAX et le BENPAT ne sont inscrits ni dans la Base de données sur les produits pharmaceutiques, ni dans la Base de données sur les ingrédients non médicinaux interne de la Direction des produits thérapeutiques, ni dans la Base de données sur les ingrédients des produits de santé naturels (BDIPSN), ni dans la Base de données sur les produits de santé naturels homologués (BDPSNH) en tant qu’ingrédient médicinal ou non médicinal dans les produits pharmaceutiques finaux, les produits de santé naturels ou les médicaments vétérinaires (BDPP, 2010; BDIPSN, 2010; BDPSNH, 2010; courriel de la Direction des produits thérapeutiques de Santé Canada adressé au Bureau de gestion du risque de Santé Canada en avril 2010; source non citée).
Par le passé, les codes d’utilisation pour le BENPAT et le BENTAX étaient indiqués dans les données de sélection de la Liste intérieure des substances (Environnement Canada, 1988). Ces codes comprenaient les utilisations suivantes (qui peuvent encore s’avérer pertinentes) : « Antioxydant/inhibiteur de corrosion/inhibiteur de décoloration/décrassant/agent pour prévenir l’écaillement » et « Produits chimiques organiques, industriels »
Dans les pays nordiques, l’utilisation industrielle du BENPAT a été classée dans la catégorie « Fabrication de produits en caoutchouc et en plastique », tandis que sa catégorie d’utilisation était « antioxydants (antiozonants) » (SPIN, 2006).
Environnement Canada a mis au point une méthode pour estimer les pertes d’une substance pendant différentes étapes de son cycle de vie, y compris son devenir dans un produit ou un article fini (Environnement Canada, 2008). Cette méthode comprend une analyse du cycle de vie et un tableur (outil de débit massique) qui intègrent les renseignements sur la fabrication, l’importation et l’utilisation des données disponibles pour la substance. En commençant par une masse définie de la substance, chaque étape du cycle de vie est par la suite évaluée jusqu’à ce que toute la masse ait été prise en compte. Les facteurs pertinents sont étudiés, les incertitudes sont reconnues et des hypothèses peuvent être émises pendant chaque étape, selon les renseignements disponibles. Les pertes estimées représentent le bilan massique exhaustif de la substance au cours de son cycle de vie et elles comprennent les rejets dans les eaux usées et d’autres milieux récepteurs (sol, air), la transformation chimique, le transfert vers les activités de recyclage et le transfert vers les sites d’élimination des déchets (sites d’enfouissement, incinération). Toutefois, à moins de disposer de données précises sur le taux ou le potentiel de rejet de cette substance provenant des sites d’enfouissement et des incinérateurs, la méthode ne permet pas de quantifier les rejets dans l’environnement à partir de ces sources.
En général, les rejets d’une substance dans l’environnement peuvent découler de différentes pertes de la substance pendant sa fabrication, son utilisation industrielle ainsi que son utilisation commerciale et par les consommateurs. Ces pertes peuvent être regroupées en sept types : 1) déversements dans les eaux usées; 2) émissions atmosphériques; 3) pertes dans le sol; 4) transformation chimique; 5) élimination dans les sites d’enfouissement; 6) élimination par incinération; 7) élimination par recyclage (p. ex., le recyclage est jugé comme une perte et n’est plus pris en considération dans la présente évaluation). Elles sont estimées à partir de données issues d’enquêtes réglementaires, des industries, ainsi qu’en fonction des données publiées par différents organismes. Les pertes dans les eaux usées concernent les déversements des eaux usées brutes non traitées avant tout traitement, que ce soit un traitement des eaux usées industrielles sur place ou un traitement des eaux usées municipales hors site. De la même manière, les pertes par transformation chimique font référence aux modifications de l’identité de la substance qui ont lieu au cours des étapes de fabrication, d’utilisation industrielle ou d’utilisation commerciale et par les consommateurs, mais elles excluent celles qui ont lieu pendant les opérations de gestion des déchets telles que l’incinération et le traitement des eaux usées. La perte dans les terres inclut le transfert accidentel ou les rejets dans le sol ou les surfaces pavées ou non pavées pendant l’utilisation de la substance et sa durée de vie utile (p. ex. à partir de l’utilisation de machinerie agricole ou d’automobiles). La perte dans les terres n’inclut toutefois pas les autres transferts vers l’utilisation de la substance et sa durée de vie utile (p. ex. application au sol des biosolides et dépôts atmosphériques).
Les pertes estimées pour le BENPAT et le BENTAX au cours de leur cycle de vie (fondées sur des hypothèses prudentes) sont présentées au tableau 3 (Environnement Canada, 2010a, 2010b). Le BENPAT et le BENTAX ne sont pas fabriqués au Canada au-delà des seuils de déclaration; par conséquent, les pertes estimées sont fondées sur les quantités importées déclarées pour l’année 2006. Les volumes déclarés sur le marché canadien en 2006 étaient compris entre 1 000 000 et 10 000 000 kg/an pour le BENPAT et entre 100 et 1 000 kg/an pour le BENTAX (Canada, 2009b).
Tableau 3. Estimations des pertes de BENPAT et de BENTAX durant leur cycle de vie[1]
| Type de perte | BENPAT [Proportion (%)] |
BENTAX [Proportion (%)] |
||||
|---|---|---|---|---|---|---|
| Utilisation à des fins industrielles | Utilisation commerciale/ par les consommateurs |
Total | Utilisation à des fins industrielles | Utilisation commerciale/ par les consommateurs |
Total | |
| Eaux usées | 0,03 à 0,6 | 5,6 à 5,7[*] | 5,6 à 6,3 | 0,04 à 0,8 | 1,3 à 2,4 | 1,3 à 3,2 |
| Sol | - | 5,50 à 5,53[**] | 5,50 à 5,53 | - | - | - |
| Air | 0,004 à 0,1 | 0,004 à 0,1 | 0,04 à 0,1 | - | 0,04 à 0,1 | |
| Transformation chimique[***] | Non nulle | Non nulle | Non nulle | Non nulle | ||
| Incinération | 0,001 à 0,004 | 8,28 à 8,33 | 8,28 à 8,33 | 0,002 à 0,02 | 2,9 à 3 | 2,9 à 3 |
| Sites d’enfouissement | 0,5 à 0,6 | 12,3 à 12,5 | 12,8 à 13,1 | 0,08 à 1,5 | 92,3 à 95,6 | 93,8 à 95,7 |
| Recyclage | - | 67,0 à 67,4 | 67,0 à 67,4 | - | - | - |
| Exportation | Inconnue | Inconnue | Inconnue | Inconnue | ||
[*] Pour le scénario d’utilisation commerciale et de consommation développé pour le BENPAT, il est attendu qu’à certains endroits à travers le Canada, les eaux de ruissellement provenant des routes peuvent être recueillies par les usines de traitement des eaux usées mais qu’à d’autres endroits ce ruissellement peut être déversé directement sans être traité dans les eaux ambiantes.
[**] Pour le scénario d’utilisation commerciale et de consommation développé pour le BENPAT, le type de perte identifié comme « sol » se réfère généralement aux rues, routes et le sol qui leur est associé.
[***] On reconnaît la possibilité de transformation chimique des antiozonants BENPAT et BENTAX par oxydation; cependant, à l’heure actuelle, la mesure dans laquelle ce phénomène se produit n’est pas adéquatement documentée dans la littérature disponible.
La majeure partie du BENPAT se trouvant dans les produits commerciaux et de consommation est recyclée (approximativement 67 %). Le BENPAT est aussi rejeté dans le sol et dans les eaux de ruissellement provenant de routes en des proportions approximativement égales de 5,5 et 5,7 %, respectivement, ceci résultant d’utilisation commerciale et de consommation de produits contenant cette substance. Il est important de noter que pour le scénario d’utilisation commerciale et de consommation développé pour le BENPAT, le type de perte identifié comme « sol » se réfère généralement aux rues, routes et le sol qui leur est associé. De plus, dans le scénario de rejets commerciaux et de consommation, environ 13 % du BENPAT est estimé être éliminé dans les sites d’enfouissement, et à peu près 8 %, incinéré. Les rejets globaux de BENPAT estimés provenant d’activités ou d’utilisations industrielles sont de moins de 1 % dans les eaux usées et les sites d’enfouissement, respectivement, et d’au plus 0,1 % dans l’air.
Le BENTAX est estimé comme étant rejeté vers les eaux usées en une quantité représentant 1,3 à 3,2 % de la quantité totale utilisée dans le commerce canadien. En contraste avec le BENPAT, le BENTAX se trouvant dans les produits commerciaux et de consommation est estimé comme aboutissant principalement dans des installations d’élimination des déchets (incinération : environ 3 %; sites d’enfouissement : 93,8 à 95,7 %). Finalement, les rejets de BENTAX provenant d’utilisations industrielles sont estimés à au plus 0,8 % vers les eaux usées et, semblablement au BENPAT, les émissions vers l’air sont estimées à au plus 0,1 %.
Les pertes estimées pour le BENPAT et le BENTAX indiquent que ces substances présentent un potentiel de rejets dans l’environnement. En général, les eaux usées constituent une source courante de rejets d’une substance dans l’eau et le sol par les installations de traitement des eaux usées et la gestion des déchets subséquente des boues. Des particules de caoutchouc de pneu contenant du BENPAT peuvent se déposer sur les bords de la route et pénétrer dans les égouts. Une fois que les particules de caoutchouc sont entrées en contact avec l’eau, le BENPAT peut se lixivier (Wik, 2007). Une petite fraction des particules de caoutchouc de pneu peut être transférée par le vent ou la pluie vers le sol proche. Toutefois, les concentrations de ces particules tendent à décroître en même temps que la distance par rapport aux routes; des réductions supérieures à 80 % ont ainsi pu être signalées à 30 m des routes (Wik et Dave, 2009). Lors d’activités de recyclage, une substance peut être acheminée dans l’eau ou le sol, selon les caractéristiques opérationnelles des installations. Enfin, les sites d’enfouissement peuvent entraîner la lixiviation de substances dans les eaux souterraines, et cela est d’autant plus probable dans les cas où le site d’enfouissement ne dispose pas d’un système de collecte ou de traitement de lixiviat. Toutefois, on prévoit que les dégagements gazeux ou la migration de BENPAT et de BENTAX en provenance des sites d’enfouissement ne représentent pas une source importante de rejet étant donné que ces deux substances présentent une faible volatilité et s’adsorbent facilement dans les sols.
Même s’il est possible que d’autres produits commerciaux et de consommation contenant du BENPAT ou du BENTAX soient importés au Canada en plus de ceux déclarés au cours des enquêtes menées auprès de l’industrie réalisées conformément à l’article 71 de la LCPE (1999), aucun renseignement n’est disponible sur la quantité de ces importations. On prévoit que les étapes du cycle de vie et les pertes proportionnelles découlant de l’utilisation de ces autres produits ne seront pas énormément différentes de celles prises en considération et estimées ci-dessus. Toutefois, la masse réelle de la perte de substance au cours de chaque étape du cycle de vie peut être supérieure aux estimations susmentionnées, si ces données étaient disponibles aux fins de considération.
Le modèle de fugacité de niveau III (EQC 2003) simule la distribution d’une substance dans un environnement d’évaluation hypothétique selon les processus de partage chimique, de réactivité et de transport entre divers milieux. Les valeurs de fraction en masse présentées dans les tableaux 4a, 4b, 4c et 4d représentent les effets nets de ces processus dans des conditions de rejets continus lorsqu’un « état stable » hors de l’équilibre est atteint (p. ex. niveau III). Les intrants utilisés pour le modèle EQC (2003) sont présentés à l’annexe II. Étant donné que de nombreuses données concernant les produits commerciaux et les structures représentatives du BENPAT et du BENTAX étaient disponibles, le modèle a été exécuté plusieurs fois afin de comprendre les variations du comportement et du devenir probables de ces substances.
En général, les résultats de la modélisation de la fugacité de niveau III indiquent une faible variation et laissent entendre que le BENPAT et le BENTAX devraient demeurer principalement dans l’eau, le sol et les sédiments, selon le milieu dans lequel ces substances sont rejetées.
Les résultats de la modélisation EQC pour le BENPAT figurant aux tableaux 4a et 4b ainsi que les résultats pour le BENTAX figurant aux tableaux 4c et 4d sont décrits ensemble ci-dessous.
Le tableau 4a décrit les résultats du modèle de fugacité pour le BENPAT d’après les propriétés physico-chimiques disponibles pour le produit commercial; le tableau 4b décrit quant à lui les résultats du modèle de fugacité pour les structures représentatives 1 à 3 du BENPAT (présentés sous forme de fourchettes). De façon identique, le tableau 4c décrit les résultats du modèle de fugacité pour le BENTAX d’après les propriétés physicochimiques disponibles pour le produit commercial, alors que les résultats du modèle de fugacité pour les structures représentatives 3 à 5 du BENTAX sont résumés au tableau 4d.
Tableau 4a. Résultats de la modélisation de la fugacité de niveau III pour le BENPAT (présentés sous forme de fourchettes)[*] (EQC, 2003)
| Substance rejetée dans : | Pourcentage de la substance répartie dans chaque milieu | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| l’air (100 %) | 0,2 | 1,4 à 2,7 | 97 | < 1,4 |
| l’eau (100 %) | négligeable | 67 à 94 | négligeable | 6 à 33 |
| le sol (100 %) | négligeable | négligeable | 100 | négligeable |
Tableau 4b. Résultats de la modélisation de la fugacité de niveau III pour les structures représentatives 1 à 3 du BENPAT (présentés sous forme de fourchettes)[*] (EQC, 2003)
| Substance rejetée dans : | Pourcentage de la substance répartie dans chaque milieu | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| l’air (100 %) | 1,2 à 4,6 | 1,7 à 4,2 | 91 à 96 | 0,2 à 1,6 |
| l’eau (100 %) | négligeable | 50 à 95 | 0,7 | 4 à 49 |
| le sol (100 %) | négligeable | < 1 | 100 | négligeable |
Tableau 4c. Résultats de la modélisation de la fugacité de niveau III pour le BENTAX (EQC, 2003)
| Substance rejetée dans : | Pourcentage de la substance répartie dans chaque milieu | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| l’air (100 %) | 0,4 | 1,4 | 97 | 1,2 |
| l’eau (100 %) | négligeable | 52,5 | négligeable | 47,5 |
| le sol (100 %) | négligeable | négligeable | 100 | négligeable |
Tableau 4d. Résultats de la modélisation de la fugacité de niveau III pour les structures représentatives 3 à 5 du BENTAX (présentés sous forme de fourchettes)[*] (EQC, 2003)
| Substance rejetée dans : | Pourcentage de la substance répartie dans chaque milieu | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| l’air (100 %) | < 1,2 | 1,6 | 96 | < 1,6 |
| l’eau (100 %) | négligeable | 50 à 60 | < 1 | 40 – 50 |
| le sol (100 %) | négligeable | négligeable | 100 | négligeable |
En cas de rejet dans l’air, des quantités faibles ou négligeables de BENPAT et de BENTAX demeureraient dans ce milieu (voir les tableaux 4a et 4d). D’après des pressions de vapeur modélisées négligeables à faibles pour les structures représentatives 1 à 5 comprises entre 0,2 × 10-5 et 8 × 10-5 Pa et des constantes de la loi de Henry comprises entre 2 x 10-5 et 3 x× 10-5 Pa·m3/mol, le BENPAT et le BENTAX sont considérés comme des substances non volatiles. Par conséquent, s’ils n’étaient rejetés que dans l’air, le BENPAT et le BENTAX ne demeureraient dans ce milieu qu’en fractions très réduites. On estime que le sol est le milieu principal dans lequel ces substances se répartissent (> 90 %, voir les tableaux 4a à 4d) lorsqu’elles sont rejetées dans l’air.
En cas de rejet dans l’eau, le BENPAT et le BENTAX devraient fortement s’adsorber sur les matières en suspension et les sédiments étant donné les valeurs modérées à élevées du log Kco estimées entre 3,1 et 4,3 (obtenues à partir du log Koe) et entre 4,7 et 5,5 (obtenues à partir de l’ICM) pour les structures représentatives 1 à 5. Les valeurs expérimentales de log Koe, soit 4,39 à 4,95, pour les structures 1 à 3 du BENPAT corroborent également cette tendance. En cas de rejet dans l’eau, on estime également que ces substances demeureront dans le milieu aquatique à un état stable. D’après les constantes de la loi de Henry attribuées au BENPAT et au BENTAX, la volatilisation à partir de la surface de l’eau ne devrait pas être un processus de devenir important de ces substances. Par conséquent, si l’eau est le milieu récepteur, le BENTAX et le BENPAT devraient surtout demeurer dans l’eau et dans les sédiments, tandis que des fractions négligeables se retrouveront dans l’air et dans le sol (voir les tableaux 4a à 4d). Toutefois, le BENPAT serait plus soluble dans l’eau que le BENTAX en raison du niveau plus faible de substitution du méthyle de ses composés qui entraîne des valeurs de log Koe et Kco moins élevées. Cette différence est illustrée par les résultats du modèle de fugacité de niveau III (voir les tableaux 4a et 4b), dans lequel on prévoit qu’en cas de rejet dans l’eau, le BENPAT tendrait à demeurer davantage dans ce milieu (50 à 95 %) et qu’une fraction plus faible se retrouvera dans les sédiments (jusqu’à 49 %) alors que le BENTAX aurait tendance à demeurer dans l’eau et dans les sédiments selon des fractions approximativement égales (de 50 à 60 % et de 40 à 50 %, respectivement).
En cas de rejet dans le sol, l’adsorption sur place du BENPAT et du BENTAX devrait être élevée à modérée (la substance devrait être relativement immobile), d’après les valeurs estimées du log Kco. La volatilisation à partir des surfaces de sol humides serait un processus peu important dans le devenir de ces substances d’après les constantes estimées de la loi de Henry de leurs structures représentatives. En outre, le BENPAT et le BENTAX ne devraient pas se volatiliser à partir des surfaces de sol sèches d’après les pressions de vapeur de leurs structures représentatives et de la substance analogue, le BENPATAX. Par conséquent, en cas de rejet dans le sol, le BENPAT et le BENTAX demeureront principalement dans le milieu des sols, comme le montrent les résultats de la modélisation de la fugacité de niveau III (voir les tableaux 4a à 4d).
Persistance dans l’environnement
Eau
Des données empiriques sur la dégradation du BENPAT étaient disponibles, en revanche, aucune ne l’était pour le BENTAX. Des données empiriques concernant les structures représentatives, soit la structure 1 et la structure 3, étaient également disponibles. Ces structures sont partiellement représentatives du BENPAT et la structure 3 est également partiellement représentative du BENTAX. En outre, les données empiriques sur la dégradation de la substance analogue (le BENPATAX) sont incluses. Ces données sont jugées appropriées pour le BENPAT et le BENTAX; cependant, elles seront utilisées pour le BENTAX seulement, car le même type d’études existe sur le BENPAT.
Le tableau 5 présente les données empiriques sur la dégradation du BENPAT, du BENPATAX et des structures représentatives 1 et 3.
Pour le BENPAT, un taux de biodégradation compris entre 0 et 0,64 % sur 28 jours lors d’un test de biodégradation immédiate a été rapporté (IUCLID Data Set, Résumé d’étude, 2010b). Pour le BENTAX, les données disponibles concernant la substance analogue, le BENPATAX, ont été utilisées en s’appuyant sur la similitude structurelle des substances, matérialisée par la présence de dérivés de xylyle et de tolyle. Un taux de biodégradation de 1,72 % sur 28 jours a été rapporté pour le BENPATAX (NICNAS, 2001). Toutes les études sur la biodégradation dans l’eau ont été menées conformément à la Ligne directrice no 301 de l’OCDE.
Des données empiriques sur la biodégradation de la structure représentative 1 ainsi que des données sur la photodégradation de la structure représentative 3 étaient également disponibles. Il a été démontré que la structure 1 se dégradait lentement, avec un taux de dégradation de 0,2 % sur deux semaines lors d’un test effectué conformément à la Ligne directrice LD 301C de l’OCDE (CHRIP, c2008). La conclusion de ce test était : « non-biodégradabilité ».
Une étude de photodégradation effectuée dans l’eau était disponible pour la structure représentative 3, une composante importante du BENPAT comme du BENTAX (Présentation de projet d’études, 2010a). Des demi-vies relativement courtes de 2,5 et 4,7 jours ont été obtenues dans deux types de conditions aquatiques caractérisées respectivement par des pH de 6 et de 8. Toutefois, ce mode de dégradation ne serait applicable qu’à la fraction de la substance se trouvant dans la partie supérieure de la colonne d’eau exposée à la lumière du soleil. Si l’on tient compte des propriétés physico-chimiques de la structure 3 (voir le tableau 2), et notamment de sa faible solubilité dans l’eau ainsi que du devenir environnemental en résultant prévu par le modèle EQC (voir le tableau 4c), lorsqu’une répartition dans les sédiments est attendue en cas de rejet de cette substance dans l’eau, on prévoit qu’une quantité limitée de ladite substance pourra être soumise à une photodégradation dans la colonne d’eau. En outre, aucun produit de transformation de la substance n’a été identifié dans cette étude.
Tableau 5a. Données empiriques concernant la dégradation du BENPAT, de la substance analogue, le BENPATAX, et des structures représentatives 1 et 3[1]
| Substance | Milieu | Processus du devenir | Valeur de dégradation | Résultat de dégradation/unités | Référence |
|---|---|---|---|---|---|
| BENPAT | Eau | Biodégradation[2] | 0,64 | Biodégradation 28 jours/ % |
IUCLID Data Set, 2003; Présentation de projet d’études, 2010b |
| Eau | Biodégradation | 0 | Biodégradation 28 jours/ % |
IUCLID Data Set, 2003 | |
| BENPATAX | Eau | Biodégradation | 1,72 | Biodégradation 28 jours/ % |
NICNAS, 2001 |
| Structure 1 | Eau | Biodégradation | 0,2 | Biodégradation 14 jours/ % |
CHRIP, c2008 |
| Structure 3 | Eau | Photodégradation | 2,5, 4,5[3] | Demi-vie/jours | Présentation de projet d’études, 2010a |
[2] La biodégradation a été évaluée en utilisant la méthode respiratoire no 301F de l’OCDE. Un inoculum a été prélevé dans des boues activées provenant d’une usine de traitement des eaux usées.
[3] Demi-vies observées à des pH de 6 et de 8, respectivement.
Une étude sur l’hydrolyse du BENPAT a été effectuée sur une période de 28 jours (Présentation de projet d’études, 2010c). L’analyse de la solution aqueuse de BENPAT a révélé une diminution des concentrations initiales des structures représentatives 1 à 3 du BENPAT, diminution de l’ordre de 34 à 39 %, dans les 7 premiers jours de l’étude, puis un déclin subséquent plus lent pendant les jours suivants. Cependant, aucun produit de dégradation n’a été détecté dans la solution aqueuse à mesure que le BENPAT en disparaissait. On a plutôt trouvé des précipitats des trois structures représentatives à la surface de la verrerie utilisée dans l’étude. Les résultats indiquent qu’il ne s’est pas produit de réactions chimiques entre le BENPAT et l’eau dans les conditions expérimentales; au lieu de cela, c’est une précipitation physique de la substance qui a eu lieu. Comme le BENPAT ne comporte pas de groupements fonctionnels hydrolysables, l’hydrolyse de cette substance est improbable.
En raison du nombre relativement faible de données expérimentales sur la dégradation du BENPAT et du BENTAX, une méthode du poids de la preuve reposant sur des RQSA (Environnement Canada, 2007) a aussi été utilisée avec les modèles de la dégradation indiqués dans le tableau 5b ci-dessous. Étant donné l’importance écologique du milieu aquatique, le fait que la plupart des modèles disponibles s’appliquent à l’eau et que le BENPAT et le BENTAX devraient être libérés dans ce milieu, la biodégradation dans l’eau est la biodégradation qui a surtout été étudiée. Le BENPAT comme le BENTAX ne contiennent pas de groupements fonctionnels pouvant subir une hydrolyse. De plus subsiste un manque général d’information sur la dégradation de ces substances dans les sédiments.
Le tableau 5b résume les résultats des modèles de prédiction RQSA disponibles sur la dégradation dans l’eau et dans l’air. Étant donné que le BENTAX et le BENPAT existent sous forme de mélanges, chaque composé desdits mélanges (soit les structures représentatives 1 à 5) a été examiné avec les modèles de prédiction RQSA.
Tableau 5b. Données modélisées sur la dégradation des structures représentatives 1 à 5
| Processus du devenir | Modèle et base du modèle | Structure représentative | Résultat des modèles | Prédiction des modèles | Demi-vie extrapolée (jours) | ||
|---|---|---|---|---|---|---|---|
| Air | |||||||
| Oxydation atmosphérique | AOPWIN, 2008[1] | Structures 1 à 3 | t 1/2 = 0,053 jour (ou 0,64 heure) |
≤ 2 | |||
| Structures 3 à 5 | |||||||
| Réaction avec l’ozone | AOPWIN, 2008[1] | Structures 1 à 3 | s. o.[2] | s.o. | |||
| Structures 3 à 5 | |||||||
| Eau | |||||||
| Hydrolyse | HYDROWIN, 2008[1] | s. o.[2] | s.o. | ||||
| Biodégradation primaire | |||||||
| Biodégradation (aérobie)[3] | BIOWIN, 2008[1] Sous-modèle 4 : enquête d’expert (résultats qualitatifs) |
Structures 1 à 3 | 3,07 à 3,26 | « se biodégrade lentement » | < 182 | ||
| Structures 3 à 5 | 2,9 à 3,07 | ||||||
| Biodégradation ultime | |||||||
| Biodégradation (aérobie)[3] | BIOWIN, 2008[1] Sous-modèle 3 : enquête d’expert (résultats qualitatifs) |
Structures 1 à 3 | 2,1423 à 2,3980 | « se biodégrade lentement » | ≥ 182 | ||
| Structures 3 à 5 | 1,93 à 2,14 | ||||||
| Biodégradation (aérobie)[4] | BIOWIN, 2008[1] Sous-modèle 5 : Probabilité linéaire MITI |
Structures 1 à 3 | -0,2797 à -0,2627 | « se biodégrade très lentement » | ≥ 182 | ||
| Structures 3 à 5 | -0,27 à -0,29 | ||||||
| Biodégradation (aérobie)[4] | BIOWIN, 2008[1] Sous-modèle 6 : Probabilité non linéaire MITI |
Structures 1 à 3 | 0,002 à 0,003 | « se biodégrade très lentement » | ≥ 182 | ||
| Structures 3 à 5 | 0,001 à 0,002 | ||||||
| Biodégradation (aérobie)[4] | TOPKAT, 2004 Probabilité[*] |
Structures 1 et 2 | 0 | « se biodégrade lentement » | ≥ 182 | ||
| Structures 4 et 5 | |||||||
| Biodégradation (aérobie) | CATABOL, c2004-2008 % DBO (demande biochimique en oxygène) |
Structures 1 à 3 | 0,0038 à 0,007 | « se biodégrade très lentement » | ≥ 182 | ||
| Structures 3 à 5 | 0,0036 à 0,0038 | ||||||
[2] Le modèle ne donne pas d’estimation pour ce type de structure.
[3] Le résultat s’exprime par une valeur numérique de 0 à 5.
[4] Le résultat s’exprime par un taux de probabilité.
[*] La prévision du modèle TOPKAT (2004) pour la structure 3 a été jugée non fiable et a donc été écartée. Il était impossible de prévoir la demi-vie par hydrolyse dans l’eau pour les structures représentatives du BENPAT et du BENTAX étant donné que le modèle HYDROWIN (2008) n’estime pas les constantes du taux d’hydrolyse pour ce type de structures (pas de groupements fonctionnels hydrolysables présents).
Les résultats de la modélisation de la biodégradation ultime issus des sous-modèles 3, 5 et 6 de BIOWIN (2008), de TOPKAT (2004) et de CATABOL (c2004 à 2008) pour les structures représentatives du BENPAT et du BENTAX sont très uniformes et indiquent que la biodégradation dans l’eau serait lente ou très lente, et que la demi-vie de minéralisation complète serait supérieure à 182 jours dans ce même milieu. Les résultats du sous-modèle BIOWIN 4 (modèle de prévision de dégradation primaire) semblent indiquer que la substance a une demi-vie primaire inférieure à 182 jours; toutefois, l’identité des produits de dégradation est inconnue. Le taux de biodégradation primaire est relativement faible et, lorsqu’on l’extrapole à une minéralisation complète, on estime que la demi-vie est supérieure à 182 jours.
D’après un ratio d’extrapolation 1:1:4 de la demi-vie de biodégradation dans l’eau, le sol et les sédiments (Boethling et al., 1995), la demi-vie dans le sol est également supérieure à 182 jours, alors que celle dans les sédiments est supérieure à 365 jours. Ceci indique que le BENPAT et le BENTAX devraient être persistants dans le sol et les sédiments.
Dans l’ensemble, les données expérimentales et modélisées sur la biodégradation concernant le BENPAT, la substance analogue (le BENPATAX) ainsi que certaines des données sur les structures représentatives 1 et 3 (tableau 5a) indiquent que la demi-vie de biodégradation ultime dans l’eau des composants du BENPAT et du BENTAX serait supérieure à 182 jours (6 mois).
Autres milieux
Air
Dans l’air, la valeur de demi-vie de l’oxydation atmosphérique prévue de 0,053 jour pour les cinq structures représentatives (voir le tableau 5b) démontre que les composants du BENPAT et du BENTAX sont susceptibles de s’oxyder rapidement. Même si la réaction avec l’ozone n’a pas pu être estimée pour les structures représentatives en utilisant le modèle AOPWIN, d’après leur mode d’action en tant qu’antiozonants et antioxydants dans les produits à base de caoutchouc, on estime que ces substances réagissent avec d’autres espèces photooxydantes dans l’atmosphère, comme l’O3. De plus, d’après les résultats obtenus à partir d’expériences de photolyse dans l’eau sur la structure représentative 3, les composants du BENPAT et du BENTAX sont susceptibles de se dégrader par photolyse directe. Ces processus de dégradation réduiront encore la demi-vie du BENPAT et du BENTAX dans l’atmosphère. Avec une demi-vie inférieure à 0,053 jour résultant de réactions avec les radicaux hydroxyles et potentiellement de la photolyse et de réactions avec l’ozone, on considère que les composants du BENPAT et du BENTAX ne sont pas persistants dans l’air.
Sol
Le comportement de la structure représentative 3, composante majeure du BENPAT comme du BENTAX, dans le sol a été examiné dans le cadre d’une étude sur la dissipation dans le sol, réalisée dans des conditions de terrain en Caroline du Sud (États-Unis) conformément à la ligne directrice 164-1 de l’US EPA (Springborn Laboratories, 2004). La substance d’essai a été radiomarquée au carbone 14 et appliquée à la surface d’échantillons de sol de loam sableux à une concentration nominale de 165 mg de substance/kg de sol (poids sec). La radioactivité totale a été mesurée dans les échantillons de sol à une profondeur de 0 à 3 pouces, et de 3 à 6 pouces, cela sur 362 jours (aux jours 0, 7, 14, 32, 61, 90, 180 et 362). On n’a pas relevé les concentrations à une profondeur supérieure à 6 pouces. L’échantillonnage du sol sur 362 jours a monté que la plus grande partie (98 %) des matières radiomarquées demeurait dans les 3 premiers pouces de sol. La radioactivité appliquée s’est rapidement liée dans une large mesure (à plus de 95 %) aux particules de sol, devenant impossible à extraire. La substance radiomarquée non liée, extractible, se dissipait rapidement 5 % de la quantité demeurant au bout de 32 %, 3 %, au bout de 180 jours, et moins de 1 %, au bout de 362 jours. Les concentrations de la structure représentative 3 radiomarquée extractible dans les 3 premiers pouces de sol ont été utilisées pour calculer les taux de dissipation ainsi que les demi-vies correspondantes de dissipation, en supposant une cinétique de pseudo-premier ordre. Le taux de dissipation initial, du jour 0 au jour 32 de l’étude, était de 0,064 jour-1, et la demi-vie correspondante pour la dissipation était de 10,8 jours. Du jour 32 au jour 362, le taux de dissipation était de 0,00788 jour-1, et la demi-vie correspondante pour la dissipation était de 88 jours. Le taux de dissipation de 0 à 362 jours a été établi à 0,0104 jour-1, et la demi-vie correspondante pour la dissipation étant de 66,5 jours. On a fait remarquer que le taux de dissipation diminuait du jour 32 au jour 180 de l’étude, la demi-vie pour la dissipation nette étant de 217 jours, puis augmentait du jour 180 au jour 362, avec une demi-vie pour la dissipation nette de 58 jours. Ce ralentissement et cette accélération de la dissipation de la structure représentative 3 ont été en partie attribués aux changements saisonniers de la température, puisque ces périodes d’étude correspondaient au printemps et à l’automne.
À la fin de l’étude, 46 % de la radioactivité initiale demeurait dans les 3 premiers pouces de sol, et moins de 2 % dans la couche de 3 à 6 pouces de profondeur. Plus de 95 % de la radioactivité restée dans les 3 premiers pouces de sol n’était pas extractible. Dans l’ensemble, on n’a constaté aucune accumulation des produits de dégradation extractibles; on a supposé qu’il y avait des pertes vers l’atmosphère sous forme de dioxyde de carbone et de produits de dégradation organiques volatils. Cependant, on n’a pas exercé de surveillance à l’égard de ces composés.
En bref, l’étude sur la dissipation de la structure représentative 3 a montré que cette substance a un fort potentiel de liaison aux particules de sol, qu’elle est probablement plutôt immobile dans la colonne de sol et que les changements des conditions environnementales, par exemple les variations de température, peuvent avoir une incidence sur son taux de dissipation. Les valeurs de Kco élevée pour les structures représentatives 1 à 5 permettent de prévoir une forte adsorptivité aux particules de sol pour le BENPAT comme pour le BENTAX. Enfin, les résultats de cette étude donnent un aperçu du bilan massique en ce qui concerne le devenir de la structure représentative 3 du BENPAT dans le sol. L’étude comme telle n’indique pas la capacité intrinsèque de la structure représentative 3 à se dégrader dans ce milieu.
Oxydation
Les agents protecteurs du caoutchouc comme les antiozonants et les antioxydants fonctionnent par l’intermédiaire d’une migration séquentielle vers la surface amorcée par une rupture de l’équilibre au sein du mélange de caoutchouc elle-même causée par la réaction de la substance chimique à la surface du caoutchouc (Ignatz-Hoover et al., 2003). Plusieurs théories expliquent l’action protectrice des antiozonants à la surface du caoutchouc (Kirk-Othmer, c2010). La théorie de l’agent capteur laisse entendre que l’antiozonant se répartit à la surface du caoutchouc et que l’ozone réagit plus volontiers avec l’antiozonant qu’avec le caoutchouc. La théorie de la pellicule protectrice laisse entendre quant à elle que les produits de la réaction ozone-antiozonant, générés comme le décrit la théorie de l’agent capteur, forment une pellicule à la surface du caoutchouc, ce qui empêche encore davantage l’attaque du caoutchouc par l’ozone. La théorie de la reliaison laisse entendre que l’antiozonant peut éviter la scission des liaisons du caoutchouc ozonisé ou recombiner les liaisons doubles endommagées dans le caoutchouc. Enfin, la théorie de l’autoréparation laisse entendre que l’antiozonant peut réagir avec le caoutchouc ozonisé ou d’autres produits de réaction permettant d’obtenir une pellicule autoréparatrice d’une faible masse moléculaire et inerte sur la surface du caoutchouc (Kirk-Othmer, c2010).
Parmi ces mécanismes proposés, plusieurs pourraient contribuer à la protection du caoutchouc; toutefois, les preuves à notre disposition laissent entendre que la théorie de l’agent capteur est le mode d’action le plus important (Kirk-Othmer, c2010). Des preuves visuelles et microscopiques viennent également appuyer la théorie de formation d’une pellicule à la surface du caoutchouc. Après caractérisation par spectroscopie, il s’est avéré que la composition de cette pellicule contenait certains antiozonants inaltérés ainsi que certains produits de réaction observés dans l’antiozonant ozonisé liquide (Lattimer et al., 1980; Andries et al., 1975; Andries et al., 1979). Les théories de reliaison et d’autoréparation sont moins établies que les théories de l’agent capteur et de pellicule protectrice, car il n’existe que peu de preuves d’une réaction entre l’antiozonant et le caoutchouc ozonisé ou de la possibilité d’une fixation des antiozonants aux chaînes de caoutchouc après une attaque d’ozone (Lorenz et Parks, 1963a; 1963b).
Le mécanisme de l’activité antiozone de la structure représentative 1 (ou DPPD) a été étudié, et ses produits de transformation ont été caractérisés (Rotschová et Pospíšil, 1981). Le BENPAT et le BENTAX sont utilisés comme antiozonants dans le caoutchouc (Kirk-Othmer, c2010) et, dans le cadre de leur rôle principal en tant qu’agents protecteurs, sont oxydés par l’ozone à la place de l’ozone (Rapta et al., 2009), de la même façon que la théorie d’agent capteur décrite ci-dessus. Comme le laissent supposer les conclusions concernant la structure 1, cette oxydation entraîne la formation de dérivés de 1,4benzoquinone-diimine qui se sont révélés stables à l’oxydation sur une période d’un an, sans changement subséquent dans leur composition (Rotschová et Pospíšil, 1981). En outre, il a été découvert que la structure 1 formait du N,N’-diphényl-p-quinondiimine lorsqu’elle réagissait avec des radicaux peroxyles (Kochi, 1973; Boozer et al., 1955).
Potentiel de transport à grande distance
On a utilisé le modèle de transport et de persistance de niveau III (TaPL3) (TaPL3, 2000) pour estimer la distance de transport caractéristique (DTC), définie comme la distance maximale parcourue dans l’air par 63 % de la substance. Beyer et al. (2000) ont proposé que des DTC de plus de 2 000 km représentent le potentiel élevé de transport atmosphérique à grande distance, celles de 700 km à 2 000 km le modéré, et de celles de moins de 700 km le faible. D’après une estimation de la DTC de 60 km pour le BENTAX et de 28 km pour le BENPAT, le potentiel de transport atmosphérique à grande distance de ces deux substances est considéré comme faible. Cela signifie que le BENTAX et le BENPAT ne devraient pas être transportés dans l’atmosphère à une grande distance à partir de leurs sources d’émission.
Conclusion
D’après les données empiriques, qui comprennent celles sur les structures représentatives 1 et 3 ainsi que les données sur l’analogue, et d’après les données modélisées (voir les tableaux 5a et 5b), des indications concordantes et fiables montrent que le BENPAT et le BENTAX renferment des quantités significatives des composés répondant aux critères de persistance dans l’eau, le sol et les sédiments (demi-vies dans le sol et l’eau supérieures ou égales à 182 jours et demi-vie dans les sédiments supérieure ou égale à 365 jours) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000), mais non aux critères de persistance dans l’air (demivie supérieure ou égale à 2 jours.)
Potentiel de bioaccumulation
En milieu aquatique
Les valeurs modélisées et expérimentales du log Koe pour les structures représentatives 1 à 3 du BENPAT et les structures représentatives 3 à 5 du BENTAX donnent à penser que ces substances chimiques présentent un potentiel modéré à élevé de bioaccumulation dans le biote (voir les tableaux 2a et 2b; valeurs expérimentales et modélisées du log Koe comprises entre 3,4 et 6,23).
Les données expérimentales sur la bioaccumulation du BENPAT sont décrites cidessous, alors qu’aucune étude sur la bioaccumulation n’a été trouvée pour le BENTAX. Les valeurs modélisées du facteur de bioconcentration (FBC) et du facteur de bioaccumulation pour le BENPAT et le BENTAX sont fournies par la suite.
Données expérimentales sur la bioaccumulation du BENPAT
La bioaccumulation du BENPAT a été étudiée chez la carpe (Cyprinus carpio) (Présentation de projet d’études, 2010b) et résumée dans IUCLID Data Set (2003). La méthode du MITI pour tester le niveau d’accumulation des substances chimiques dans le corps des poissons (similaire à la méthode 305C de l’OCDE) a été utilisée pour mesurer des valeurs du FBC pour le BENPAT à deux concentrations d’essai, 0,05 et 0,005 mg/L, sur une période de 8 semaines (IUCLID Data Set, 2003; Présentation de projet d’études, 2010b). Dix poissons ont été exposés pour chaque concentration d’essai et cinq ont été utilisés dans le groupe témoin. La concentration de BENPAT dans l’eau a été mesurée deux fois par semaine pendant toute la durée de l’étude; la concentration de BENPAT dans le poisson a quant à elle été analysée aux semaines 1, 2, 4, 6 et 8, chaque fois sur deux poissons, en utilisant une chromatographie en phase liquide à haute résolution. Deux poissons témoins ont été analysés au début et à la fin de l’exposition. De plus, un test de dépuration a été réalisé après l’essai de bioaccumulation : des poissons supplémentaires ont été soumis à des analyses aux jours 1, 5 et 8 après la fin de l’exposition afin de clarifier le processus d’élimination de la substance d’essai concentrée dans le corps des poissons testés (Présentation de projet d’études, 2010b).
D’après le résumé du IUCLID Data Set (2003), maintenir des concentrations nominales de BENPAT dans le milieu d’essai tout au long de l’étude s’est avéré difficile (les concentrations d’essai étaient comprises entre 60 et 100 %) probablement en raison de l’absorption rapide de la substance par le poisson et de sa répartition sur les surfaces de l’aquarium. De plus, étant donné que la substance d’essai, le BENPAT, est un produit de réaction complexe, une grande variabilité a pu être constatée dans les données, ce qui a entraîné l’obtention de fourchettes de valeurs de FBC pour les différents composés du produit. Dans le rapport détaillé de l’étude (Présentation de projet d’études, 2010b), il était indiqué qu’en général, la concentration des substances d’essai dans l’eau d’essai diminuait lorsque ces substances présentaient un potentiel de bioconcentration, vraisemblablement en raison d’une absorption et d’un métabolisme rapides.
Cinq pics (« a » à « e ») ont été déterminés par CLHR : les pics « a » et « b » ont été définis comme les composés mineurs et les pics « c » à « e » ont été définis comme les composés majeurs. De plus, le pic « c » a été défini comme la structure représentative 1, le pic « d » comme la structure représentative 2 et le pic « e » comme la structure représentative 3 (Présentation de projet d’études, 2010b).
Dans l’ensemble, les fourchettes de valeurs du FBC obtenues pour chaque pic étaient équivalentes aux deux concentrations expérimentales d’exposition, 0,05 et 0,005 mg/L. Par conséquent, la manière la plus efficace de caractériser le FBC pour chaque structure représentative consiste à présenter la moyenne des valeurs de FBC obtenues à partir des deux concentrations d’exposition.
Pour la structure représentative 1, le FBC moyen était de 1 363 ± 573, pour la structure représentative 2, le FBC moyen était de 2 472 ± 890 et pour la structure représentative 3, le FBC moyen était de 6 250 ± 2 548. Ces chiffres ont été obtenus à partir de 20 valeurs de FBC comprises entre 269 et 2 630 pour le pic « c », entre 776 et 3 790 pour le pic « d » et entre 1 420 et 11 300 pour le pic « e », respectivement.
Un test de dépuration a été réalisé sur le BENPAT afin de clarifier le processus d’élimination de la substance d’essai concentrée dans le corps des poissons testés, à des concentrations d’exposition de 0,05 et de 0,005 mg/L (Présentation de projet d’études, 2010b). Les les demi-vies pour la dépuration obtenues se situaient, aux concentrations d’exposition de 0,05 et de 0,005 mg/L, respectivement à 0,7 jour et 3 jours, pour la structure représentative 1; respectivement à 3,6 et 5,7 jours, pour la structure représentative 2; respectivement à 44,4 et et 193 jours, pour la structure représentative 3 (Présentation de projet d’études, 2010b).
Les résultats relatifs à la dépuration du BENPAT étaient aussi résumés dans IUCLID Data Set (2003). Cependant, la demi-vie de 193 jours pour la structure représentative 3, à une concentration d’exposition de 0,005 mg/L, a été exclue de ce résumé dans IUCLID Data Set, et l’on y indiquait plutôt que cette demi-vie était inférieure à 6 jours pour les pics « a » à « e » à une concentration d’exposition de 0,005 mg/L et inférieure à 4 jours pour les pics « a » à « d » à une concentration d’exposition de 0,05 mg/L. Cependant, il a été indiqué que la demi-vie de dépuration pour le pic « e » à une concentration d’exposition de 0,05 mg/L était de 44 jours. Cette valeur de demi-vie pour le pic « e » a été jugée suspecte dans le résumé d’IUCLID Data Set (2003) étant donné qu’elle était bien plus élevée que la demi-vie de dépuration obtenue pour le même pic à un niveau de concentration de 0,005 mg/L et qu’elle ne concordait pas avec la tendance générale en matière de demi-vie de dépuration observée pour les pics « a » à « d » (moins de 5 jours) aux deux concentrations d’exposition (IUCLID Data Set, 2003). Cependant, la demi-vie de 44 jours (de même que celle de 193 jours) concordait avec les FBC élevés signalés pour la structure représentative 3 dans la Présentation de projet d’études (2010b).
Pour s’occuper des variations importantes observées dans les valeurs du FBC pour chacun des pics et pour appliquer les méthodes statistiques appropriées en vue de former une base pour l’interprétation des résultats, un projet supplémentaire intitulé « Statistical Calculations of Data from a Bioaccumulation Study with Wingstay 100 in Carp » (Calculs statistiques des données provenant d’une étude sur la bioaccumulation du Wingstay 100 chez la carpe) a été entrepris et résumé dans IUCLID Data Set (2003). Cette analyse employait la méthode d’analyse de l’incertitude de Monte Carlo. Les résultats ont permis d’obtenir une valeur maximale du FBC de 6 600 pour le pic « e » et les données relatives à la dépuration ont confirmé l’atteinte d’un état stable dans les tissus des composés du BENPAT après trois semaines, avec des demi-vies de dépuration inférieures à 5 jours pour tous les composés. Il a également été remarqué que, tandis que la substitution du méthyle de la substance d’essai augmentait, il en allait de même pour la bioaccumulation chez la carpe; cette tendance était cohérente avec l’augmentation des valeurs du log Koe. Par conséquent, les résultats de l’étude sur la bioaccumulation indiquent que la structure représentative 3, soit l’un des composés principaux du BENPAT (constituant au moins 20 % du BENPAT [Huntlink et al., 2006; IUCLID Data Set, 2003]), présente un potentiel de bioaccumulation chez la carpe, avec une valeur de FBC supérieure à 5 000.
De plus, des valeurs expérimentales de FBC étaient disponibles pour la structure représentative 1. Des carpes, Cyprinus carpio, ont fait l’objet d’essais à deux concentrations (0,1 mg/L et 0,01 mg/L) pour lesquelles les valeurs de FBC les plus élevées étaient respectivement de 1 420 et 2 150. La conclusion tirée concernant la structure 1 était « bioconcentration modérée » (CHRIP, c2008). Dans l’ensemble, ces résultats concernant la structure 1 sont cohérents avec l’étude sur la bioconcentration chez la carpe décrite ci-dessus (IUCLID, 2003; Résumé d’étude, 2010b), c’est-à-dire qu’étant donné que la structure 1 constitue le composé le moins substitué du BENPAT, les valeurs du FBC devraient être modérées.
Le tableau 6a présente les valeurs empiriques du FBC pour le BENPAT chez les poissons.
Tableau 6a. Données empiriques sur la bioaccumulation du BENPAT et de la structure représentative 1
| Substance | Organisme d’essai | Paramètre | Valeur (poids humide en L/kg) | Référence |
|---|---|---|---|---|
| BENPAT | Carpe commune (Cyprinus carpio) |
FBC moyen[1] | Structure représentative 1 1 36 3± 573 Structure représentative 2 2 472 ± 890 Structure représentative 3[2] 6 250 ± 2 548 |
IUCLID Data Set, 2003; Présentation de projet d’études, 2010b |
| Structure 1 | Carpe commune (Cyprinus carpio) |
FBC | 260 – 1 420[3] 500 – 2 150[4] |
CHRIP, c2008 |
[2] Un FBC d’environ 7 000 a été obtenu en appliquant une estimation basée sur la méthode de Monte Carlo à la fourchette de valeurs du FBC obtenue pour le composé « e » (IUCLID Data Set, 2003).
[3] FBC mesuré pour une concentration d’essai de 0,1 mg/L (ppm).
[4] FBC mesuré pour une concentration d’essai de 0,01 mg/L (ppm).
Données sur la bioconcentration et la bioamplification pour les structures représentatives du BENPAT (structures 1 à 3) et du BENTAX (structures 3 à 5)
Puisque peu de données sur le FBC étaient disponibles pour le BENPAT et qu’aucune donnée sur la bioaccumulation n’était disponible pour le BENTAX, une méthode prédictive a été appliquée au moyen de modèles des facteurs de bioaccumulation (FBA) et de bioconcentration (FBC). Selon le Règlement sur la persistance et la bioaccumulation (Canada, 2000), une substance est bioaccumulable si ses facteurs de bioaccumulation et de bioconcentration sont égaux ou supérieurs à 5 000. Toutefois, le calcul des facteurs de bioaccumulation est la mesure préconisée pour évaluer le potentiel de bioaccumulation des substances. En effet, le facteur de bioconcentration ne prend pas en compte de manière adéquate le potentiel de bioaccumulation des substances par l’alimentation, lequel est un facteur majeur pour les substances dont le log Koe est supérieur à ~ 4,0 (Arnot et Gobas, 2003).
Vu les similarités structurelles entre les structures représentatives du BENPAT et du BENTAX, et vu leurs valeurs de log Koe comparables, des prédictions ont été générées pour toutes les structures représentatives de ces deux produits commerciaux. Pour ce faire, on a utilisé une version modifiée du modèle de la cinétique du bilan massique élaborée par Arnot et Gobas (2003). Les constantes de la vitesse de métabolisation ont été calculées d’après des données empiriques tirées d’études, cela en normalisant en fonction du poids, de la teneur en lipides des poissons et de la température de l’eau dans l’étude, conformément à ce qu’indiquent Arnot et al. (2008a), lorsque le FBC est connu. On juge que cette modélisation est « à l’intérieur du domaine » parce qu’elle est fondée sur les principes premiers et, dans la mesure où les conditions du domaine mécanistique (diffusion passive), du domaine global des paramètres (gamme des valeurs empiriques de log Koe et de la masse moléculaire) et du domaine du métabolisme (constantes de kM corrigées) sont remplies, les prévisions sont considérées comme valides (Arnot et Gobas, 2003; Arnot et Gobas, 2006).
La moyenne des valeurs du FBC pour le corps entier indiquées pour les structures au tableau 6a a été employée pour dériver les constantes de la vitesse de métabolisation. La métabolisation dans l’intestin et dans les tissus n’est généralement pas un mécanisme d’élimination important pour les produits chimiques dont le log Koe est inférieur à environ 4,5 (Arnot et al., 2008a, 2008b; Arnot et Gobas, 2006), mais ce mécanisme peut varier en fonction de la taille et de la teneur en lipides des poissons utilisés pour les essais.
On voit au tableau 6b que les constantes du taux d’élimination total (taux de dépuration), obtenues d’après le modèle cinétique du bilan massique normalisé pour correspondre aux données empiriques tirées d’études, sont surestimées si on les compare avec les taux de dépuration empiriques indiqués pour les structures représentatives 1 à 3 du BENPAT (Présentation de projet d’études, 2010b). Cependant, une estimation du kM doit être inférieure à la constante du taux de dépuration. Par conséquent, une fois corrigée en fonction du poids, la kM[4] des structures représentatives 1 à 3, d’après les conditions de l’étude, devrait être d’approximativement 0,094 jour-1. L’estimation des kM d’après les RQSA, pour les structures représentatives du BENPAT et du BENTAX à l’aide du modèle BCFBAFWIN (Arnot et al., 2009), qui ne tient compte que de la structure et du log Koe pour produire des estimations, se situe entre 2,3 et 0,17 jour-1, ce qui corrobore l’hypothèse d’une vitesse de transformation métabolique relativement élevée (métabolisation relativement rapide). Vu l’étroite similarité des structures, le log Koe et le mécanisme de biotransformation probable (oxydation arénique de phase I), la constante d’origine empirique de 0,094 jour-1 est employée pour toutes les structures du BENPAT et du BENTAX afin de traduire le potentiel de biotransformation chez les poissons dans les études empiriques.
Comme un lien peut être établi entre le potentiel de métabolisation, et par le fait même l’élimination, et le poids corporel ainsi que la température (Hu et Layton, 2001; Nicholas et al., 2007), les FBC et FBA prévus ont été normalisés pour les poissons du niveau trophique intermédiaire dans le modèle d’Arnot et Gobas, conformément à la procédure décrite dans Arnot et al. (2008b). Les poissons du niveau trophique intermédiaire ont été désignés représentatifs des résultats globaux du modèle, d’après le concepteur du modèle. En outre, il s’agit de la taille de poissons susceptible d’être consommée par les piscivores aviaires et terrestres.
Les résultats de la modélisation du bilan massique sont présentés au tableau 6c. Ces résultats indiquent que, à une kM d’approximativement 0,05 jour-1, soit la constante de la vitesse de métabolisation normalisée pour les poissons du niveau trophique intermédiaire, dans le modèle, aucune des structures représentatives du BENPAT et du BENTAX n’a un FBC ou un FBA supérieur à 5 000. Même lorsque la constante de la vitesse de métabolisation est fixée à 0 (c’est-à-dire, kM = 0 jour-1), les FBC et FBA prévus pour les poissons du niveau trophique intermédiaire sont proches de 5 000, mais demeurent inférieurs à cette valeur.
Tableau 6b. Constantes cinétiques ainsi que FBC et FBA calculés pour le BENPAT, le BENTAX et le BENPATAX d’après les données disponibles sur les FBC, normalisées pour les conditions de l’étude
| Substance | Para- mètre d’étude[b] |
Cons- tante de la vitesse d’absorp-tion en j-1 (k1)[a] |
Cons- tante de la vitesse d’élimi- nation totale en j-1 (kT)[a], [d] |
Cons- tante de la vitesse d’élimi- nation bran- chiale en j-1 (k2)[a] |
Cons- tante de la vitesse de méta- boli-sation en j-1 (kM)[a] |
Cons- tante de la vitesse de crois- sance en j-1(kG)[a] |
Cons- tante de la vitesse d’excré- tion fécale en j -1 (kE)[a] |
FBC (condi- tions de l’étude)[a] |
FBA (condi- tions de l’étude)[a] |
Référence |
|---|---|---|---|---|---|---|---|---|---|---|
| BENPAT : structure repré- sentative 1 |
FBC ( 1363) | 431 | 6,01 | 6,00 | -5,700 | 0,001 | 0,010 | 72 | 81 | IUCLID Data Set, 2003; Présentation de projet d’études,2010b |
| BENPAT : structure repré- sentative 1 |
FBC (1 747) | 387 | 4,12 | 4,12 | -3,916 | 0,001 | 0,008 | 95 | 105 | CHRIP, c2008 |
| BENPAT : structure repré- sentative 2 |
FBC (2 472) | 451 | 0,401 | 0,397 | -0,226 | 0,001 | 0,010 | 1 096 | 2 344 | IUCLID Data Set, 2003; Présentation de projet d’études, 2010b |
| BENPAT : structure repré- sentative 3 |
FBC (6 250) | 452 | 0,326 | 0,315 | -0,255 | 0,001 | 0,010 | 1 380 | 5 888 | IUCLID Data Set, 2003; Présentation de projet d’études, 2010b |
| BENPAT (structures repré- sentatives 1, 2 et 3) |
Test de dépu- ration |
429 | 0,139[c] | inconnue[h] | ~ 0,094[i] | 0,035[e] | 0,01 | 2 258[f] | Présentation de projet d’études, 2010b |
[b] D’après les données disponibles (moyenne géométrique utilisée, le cas échéant).
[c] D’après une moyenne des demi-vies indiquées pour la dépuration dans la Présentation de projet d’études (2010b) (= 5 jours).
[d] kT = somme de toutes les constantes du taux d’élimination, ou k2 + kG, lorsqu’on les connaît.
[e] La vitesse de croissance n’est pas indiquée. Elle a été estimée d’après les données présentées dans le cadre du Défi sur des poissons cobayes de poids similaire, nourris à raison de 2 à 3 % de leur poids.
[f] Calculée en termes de k1/k2 (c’est-à-dire FBC cinétique).
[h] Cette valeur ne peut être calculée de manière exacte parce que les estimations sont supérieures à la constante de dépuration indiquée dans la Présentation de projet d’études (2010a).
[i] Il s’agit d’une valeur correspondant à la fourchette supérieure des constantes de la vitesse de métabolisation pour le BENPAT puisque la valeur doit être inférieure à 0,139 et qu’elle ne prend pas en compte l’élimination par les branchies.
Tableau 6c. FBC et FBA prévus pour les structures représentatives du BENPAT (structures représentatives 1 à 3) et du BENTAX (structures représentatives 3 à 5), cela chez des poissons représentatifs du niveau trophique intermédiaire (NTI)
| Substance | Log Koe | Constante de la vitesse de métabolisation en j-1 (kM) [a] | FBC NTI[b] | FBA NTI[b] | Référence |
|---|---|---|---|---|---|
| BENPAT : structure représentative 1 |
3,3 | 0,05 | 130 | 135 | Arnot et Gobas, 2003 |
| BENPAT : structure représentative 2 |
3,9 | 0,05 | 501 | 537 | Arnot et Gobas, 2003 |
| BENPAT et BENTAX : structure représentative 3 |
4,6 | 0,05 | 1 621 | 1 905 | Arnot et Gobas, 2003 |
| BENTAX : structure représentative 4 |
4,4 | 0,05 | 1 202 | 1 584 | Arnot et Gobas, 2003 |
| BENTAX : structure représentative 5 |
4,5 | 0,05 | 1 412 | 1 584 | Arnot et Gobas, 2003 |
[b] Calculée à l’aide d’un modèle modifié du bilan massique sur trois niveaux trophiques tiré d’Arnot et Gobas (2003), normalisé pour des poissons du niveau trophique intermédiaire (Pds = 184 g, Lip. = 6,8 %, Temp. = 10).
Vérification de la base de données empiriques sur les FBC et la métabolisation
Arnot et Gobas (2006) ont procédé à une évaluation critique des données disponibles sur la bioaccumulation (FBC et FBA) chez les poissons et d’autres organismes. Cette entreprise a été déterminée en partie par les activités de catégorisation au début des années 2000, et a généré une base de données empiriques de qualité sur les FBC et les FBA que l’administration publique canadienne a utilisée aux fins de la catégorisation et utilise maintenant dans le cadre du Défi (Arnot et Gobas, 2003b). Dans la base de données empiriques sur les FBC, à un log Koe de 4,5 à 4,6 (c’est-à-dire pour les structures représentatives 3 à 5), la distribution des données empiriques « acceptables » pour les FBC chez les poissons montre que seuls deux produits chimiques (le tétrachlorobenzène et le trichlorotoluène) ont des valeurs de FBC chez les poissons qui dépassent le critère fixé au Canada, soit ≥ 5 000 (un grand nombre de substances chimiques ont des FBC inférieurs à cette valeur de 5 000 à un tel log Koe). Certains des FBC indiqués pour ces deux composés halogénés sont inférieurs à 5 000, ce qui illustre la variabilité des essais relatifs aux FBC. On s’attend à ce que la transformation métabolique de ces deux composés soit beaucoup plus lente que celle des composants du BENPAT et du BENTAX. En effet, l’examen de la base de données sur les kM tirée d’Arnot et al. (2008b) pour 10 g de poisson à 15 ºC montre que les deux composés halogénés en question ont des constantes de la vitesse de métabolisation empiriques (kM) surtout de l’ordre de 10-3, et les valeurs de kM prédites par les RQSA pour 10 g de poisson à 15 ºC se situent entre 10-2 et 10-1. Après normalisation pour des poissons de niveau trophique intermédiaire pesant 184 g à 10 ºC, les kM étaient encore plus faibles, allant alors de 10-4 à 10-2. En conséquence, comme leurs log Koe sont comparables à ceux des composés halogénés, mais comme les kM empiriques (et estimées) sont beaucoup plus élevées pour le BENPAT et le BENTAX, aucun résultat empirique ne laisse supposer que le BENPAT ou le BENTAX auraient des FBC supérieurs à 5 000.
Études du bilan massique chez les mammifères
Des études ont été effectuées chez des lapins et des rats pour caractériser le devenir biologique des structures représentatives 1 à 3 du BENPAT, notamment son absorption, sa métabolisation et son excrétion (Umeniwa et al., 1985; Research Triangle Institute, 1998a, 1998b). Pour résumer, les études sur la métabolisation de ces structures chez les mammifères ont révélé que, après ingestion, ces substances sont excrétées surtout dans les matières fécales et la bile. Les substances sont aussi métabolisées rapidement, et les métabolites sont excrétés de manière comparable aux composés d’origine. L’information qui précède ne peut pas être facilement utilisée pour expliquer le bilan massique chez des organismes respirant dans l’eau, comme les poissons, car dans leur cas, l’échange par les branchies constitue également un mécanisme d’élimination important pour le BENPAT et le BENTAX. Les vitesses de transformation métabolique devraient aussi être quelque peu moins élevées chez les poissons que chez les mammifères. Cependant, l’information dont on dispose confirme que ces structures sont métabolisées in vivo et que l’élimination par l’excrétion de matières fécales et d’urine pourrait être plus grande que les valeurs calculées par le modèle cinétique de FBC fondé sur le bilan massique, ce qui laisse supposer que ces facteurs atténuent le potentiel de bioaccumulation.
Conclusion
BENPAT et BENTAX
Les valeurs du FBC et du FBA modélisées pour les structures représentatives 1 à 3 du BENPAT sont comprises entre 130 et 1 905. Les valeurs de FBC et de FBA prédites pour le BENPAT sont pour ainsi dire égales, ce qui laisse supposer que l’absorption par la nourriture n’est pas un facteur, pour cette UVCB, et que le FBC est le meilleur paramètre pour évaluer la bioaccumulation. En effet, vu les valeurs de log Koe faibles à modérées du BENPAT, la fraction biodisponible dans l’eau prévue avec le modèle d’Arnot et Gobas est de 99 à 100 % pour toutes les structures représentatives.
Les données dont on dispose sur les FBC empiriques à l’équilibre pour le BENPAT indiquent que le principal composant, soit la structure représentative 3, est susceptible de se bioaccumuler, avec un FBC > 5 000. Cependant, ce résultat empirique ne concorde pas avec les constantes du taux de dépuration global enregistrées pour les structures représentatives du BENPAT dans l’étude sur la dépuration menée subséquemment (Présentation de projet d’études, 2010b). Ce résultat ne concorde pas non plus avec le FBC empirique moyen d’environ 2 500 pour la structure représentative 2, qui se distingue de la structure représentative 3 seulement par un groupement méthyle, et par une différence de log Koe de moins d’une demi-unité logarithmique. Lorsqu’on appliquait la constante du taux de dépuration de cette étude pour corriger le modèle cinétique du bilan massique d’Arnot et Gobas, les FBC et les FBA prévus pour les structures représentatives 1 à 3 du BENPAT devenaient inférieurs à 5 000. Il existe certaines incohérences dans les données disponibles sur la bioconcentration du BENPAT. Elles sont probablement attribuables aux variations des concentrations d’exposition, qui n’étaient pas bien maintenues durant la période d’exposition (on signalait des variations de l’ordre de 60 à 100 % des concentrations nominales d’essai). Le FBC obtenu pour la structure représentative 3 est donc douteux, à la lumière des autres éléments de preuve, surtout toutes les indications empiriques acceptables selon lesquelles la bioconcentration est faible à modérée, à un log Koe de ~ 4,5 à 4,6.
Ainsi, on conclut qu’il existe suffisamment de données sur les propriétés chimiques et physiques, le log Koe et la biotransformation, de données modélisées et de résultats in vivo qui concordent pour supposer qu’aucune des structures représentatives du BENPAT ou du BENTAX ne répond au critère de bioaccumulation (FBC ou FBA supérieur à 5 000) énoncé dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Évaluation des effets sur l’environnement
A – Dans le milieu aquatique
Il existe des preuves expérimentales et modélisées confirmant que le BENTAX et le BENPAT nuisent aux organismes aquatiques après une exposition à court terme (aiguë) et une exposition à plus long terme (chronique) à des concentrations relativement faibles. Les données empiriques concernant les organismes aquatiques disponibles pour le BENPAT, la substance analogue BENPATAX et la structure représentative 1 sont présentées au tableau 7. Bien que des prévisions modélisées aient été générées afin d’estimer la toxicité du BENPAT et du BENTAX pour les organismes aquatiques, elles n’ont pas été incluses dans le présent rapport en raison des nombreuses données expérimentales qui étaient disponibles pour lesdites substances et la substance analogue, le BENPATAX (voir le tableau 7a).
En outre, on note que pour les UVCB, les valeurs de CE50 ou de CL50 représentent en fait le « taux de charge » du composé et que la concentration dissoute réelle des divers composés peut être différente. Les renseignements toxicologiques disponibles sont néanmoins acceptables.
Les effets écotoxicologiques du BENPAT ont été étudiés chez plusieurs espèces aquatiques et notamment les algues, les crustacés, les bactéries et les poissons d’eau douce. Toutes les études ont été réalisées conformément aux lignes directrices de l’OCDE et ont été jugées fiables par leurs auteurs (IUCLID Data Set, 2003; Présentation de projet d’études, 2010b). Comme la substance d’essai était tout d’abord dissoute dans l’acétone avant d’être versée dans l’eau d’essai, des solvants témoins ont été inclus dans le modèle d’étude.
Pour une espèce d’algues, Selenastrum capricornutum, les valeurs de CE50 pour l’inhibition de la production de biomasse et de la vitesse de croissance ont été déterminées après une exposition de 72 heures au BENPAT. Les valeurs de CE50 pour la substance d’essai étaient de 0,018 mg/L pour l’inhibition de la production de biomasse et supérieures à 0,079 mg/L pour l’inhibition de la vitesse de croissance. En outre, il a été déterminé que la CE10 et la concentration sans effet observé (CSEO) étaient respectivement de 0,0043 mg/L et de 0,013 mg/L pour l’inhibition de la production de biomasse et de la vitesse de croissance. Il est nécessaire de remarquer que, étant donné que des effets statistiquement significatifs ont été observés à toutes les concentrations d’essai pour le paramètre concernant la production de biomasse, la valeur calculée de CE10 a été utilisée pour proposer une estimation de la CSEO.
Des Daphnia magna ont été exposées au BENPAT dans le cadre d’un test d’immobilisation aiguë. Les résultats ont indiqué que les valeurs de CE50 et de CSEO pour la substance d’essai étaient respectivement de 1,8 mg/L et de 0,36 mg/L. On a en outre constaté que des particules brunes, dont on a présumé qu’il s’agissait de la substance d’essai, adhéraient aux daphnies d’essai dans une telle mesure que certains organismes d’essai étaient maintenus à la surface de l’aquarium (effet de bouée).
Dans une étude plus récente sur la toxicité (Présentation de projet d’études, 2010c), D. magna s’est montré plus sensible au BENPAT. D’après la CE50 aiguë de 1,8 mg/L, les concentrations d’exposition dans les solutions d’essai ont été fixées au départ entre 0,26 et 10 mg/L. Cependant, après 2 jours d’exposition, ces concentrations d’essai avaient entraîné une mortalité élevée chez D. magna; il a donc été décidé d’employer une gamme de concentrations d’exposition plus faibles (0,02 à 0,32 mg/L). La durée de l’étude a été de 21 jours. D’après le paramètre d’évaluation de la fécondité (c’est-à-dire le nombre de descendants vivants par parent à la fin de la période d’essai), la CE50 sur 21 jours pour les effets sur la reproduction a été estimée à 0,033 mg/L, la concentration minimale avec effet observé (CMEO), à 0,007 mg/L, et la CSEO, à une valeur inférieure à la plus faible concentration d’essai. La CE10 comme la CE20 ont été projetées à partir des données générées; elles étaient respectivement de 0,0045 mg/L et de 0,0090 mg/L. De plus, on a calculé, d’après la survie des D. magna de la génération parentale, une CL50 sur 21 jours de 0,048 mg/L, une CMEO de 0,036 mg/L, et une CSEO de 0,016 mg/L (Présentation de projet d’études, 2010c).
Des poissons d’eau douce, des truites arc-en-ciel et des carpes, ont été exposés au BENPAT dans le cadre d’un essai se déroulant sur 14 jours. Les valeurs de CL50 et de CSEO obtenues pour la truite arc-en-ciel étaient de 0,26 mg/L et 0,14 mg/L, respectivement. Des effets supplémentaires ont été observés chez la truite arc-en-ciel à des concentrations de la substance d’essai supérieures à la CL50 : une coloration plus foncée du poisson, expliquée par la probable adsorption de la substance d’essai, un comportement léthargique, une perte de l’équilibre ainsi que des effets sur la longueur et le poids du corps. Les valeurs de CL50 et de CSEO obtenues pour la carpe étaient de 0,43 mg/L et 0,28 mg/L, respectivement. Des effets supplémentaires ont également été observés chez la carpe à des concentrations supérieures à la CL50 : une coloration plus foncée du poisson, un comportement léthargique et une perte de l’équilibre.
Enfin, la toxicité du BENPAT pour les microorganismes (comme les bactéries) a été étudiée lors d’un essai d’inhibition de la consommation d’oxygène par des boues activées. La valeur de CE50 après une exposition de 30 minutes à la substance d’essai était supérieure à 10 000 mg/L.
En outre, la cytotoxicité de plusieurs antioxydants, dont la structure représentative 1 (ou DPPD) a été définie chez un cilié, le Tetrahymena pyriformis, dans le cadre d’un essai photodynamique de 48 heures (Epstein et al., 1967). La solution mère de la substance a été préparée dans l’acétone. Les cultures ont été incubées dans l’obscurité à une température de 28 oC; la cytotoxicité a été établie par l’entremise d’un examen microscopique des aliquotes des cultures. Il a été déterminé que la CL50 de la structure représentative 1 chez le T. pyriformis était de 0,010 mg/L (Epstein et al., 1967). Dans la même publication, les valeurs de CL50 provenant d’études sur la toxicité aiguë des substances antioxydantes administrées par voie orale à des rats étaient présentées. La CL50 de la structure représentative 1 chez les rats obtenue à partir d’une étude sur la toxicité aiguë par voie orale était comprise entre 800 et 1 600 mg/kg de poids corporel (Epstein et al., 1967). Les auteurs ont montré l’existence d’une association positive entre la toxicité des antioxydants dans le cadre des études utilisant le T. pyriformis et celles utilisant les rats.
L’écotoxicité du BENTAX a été caractérisée dans une fiche signalétique (FS, 2002a) signalant des valeurs de CL50 et de CE50 pour plusieurs espèces aquatiques. Toutefois, il a été déterminé que les paramètres d’écotoxicité concernaient en fait une substance similaire, vraisemblablement le BENPAT, car les espèces d’essai, le type d’essai et les valeurs de CL50 et de CE50 étaient les mêmes que ceux rapportés pour le BENPAT dans IUCLID Data Set (2003). Par conséquent, les renseignements sur la toxicité concernant la substance analogue, le BENPATAX (voir le tableau 7), sont utilisés pour le BENTAX étant donné que cet analogue contient des dérivés de xylyle qui ne se trouvent pas dans le BENPAT (voir les tableaux 1a, 1b et 1c pour obtenir des renseignements sur la composition des substances).
La toxicité de la substance analogue BENPATAX pour les organismes aquatiques a été caractérisée chez plusieurs espèces et notamment les algues, les crustacés et les poissons d’eau douce (Présentation de projet d’études, 1998). Les études ont été menées conformément aux lignes directrices de l’OCDE. Des solvants témoins ont été inclus dans le concept expérimental.
La toxicité du BENPATAX chez les algues S. capricornutum a été établie dans le cadre d’un essai sur la toxicité chronique analysant les effets de cette substance sur la vitesse de croissance et la production de biomasse. D’après les vitesses de croissance des algues constatés dans cette étude, les valeurs de CE50 et de CSEO après 72 heures concernant le BENPATAX se chiffraient respectivement à 0,11 mg/L et 0,0020 mg/L. En outre, la CE50 après 72 heures concernant la production de biomasse était de 0,0094 mg/L. De la même manière, il a été déterminé que la CE10 était de 0,00075 mg/L et, étant donné que des effets statistiquement significatifs ont été observés sur la biomasse à tous les niveaux de traitement testés, cette valeur a été utilisée comme une estimation de la CSEO pour la production de biomasse.
Les effets du BENPATAX sur la D. magna ont été étudiés dans le cadre d’un essai de toxicité aiguë à renouvellement continu. Les valeurs de CE50 après 24 et 48 heures obtenues associées à l’immobilisation constatée des organismes d’essai étaient respectivement de > 0,81 mg/L et 0,59 mg/L. Il a été établi que la CSEO était de 0,18 mg/L, d’après l’absence d’immobilisation et d’effets nocifs chez les daphnies après l’exposition à la substance d’essai. Des effets nocifs tels qu’une léthargie ont été notés chez les daphnies exposées à des concentrations d’essai inférieures aux valeurs de CE50 signalées. Enfin, des carpes communes ont été exposées au BENPATAX dans le cadre d’un essai de 14 jours à renouvellement continu. Il a été établi que les valeurs de CL50 et de CSEO étaient respectivement de 0,35 mg/L et 0,17 mg/L. En outre, des effets sublétaux comprenant une léthargie et une perte de l’équilibre ont été constatés chez les poissons exposés à une concentration de 0,35 mg/L de la substance.
Tableau 7. Données empiriques sur la toxicité pour les organismes aquatiques
| Substance | Organisme d’essai | Type d’essai | Paramètre | Valeur (mg/L) | Référence | ||||
|---|---|---|---|---|---|---|---|---|---|
| BENPAT | |||||||||
| Algues (Selenastrum capricornutum) |
Toxicité chronique (72 heures) |
CE50[1] (augmentation de la biomasse) |
0,018 (18 µg/L) |
Présentation de projet d’études, 2010b; IUCLID Data Set, 2003 | |||||
| CE50 (vitesse de croissance) |
> 0,079 (> 79 µg/L) |
||||||||
| CE10 (CSEO[2]) (augmentation de la biomasse) |
0,0043 (43 µg/L) |
||||||||
| CSEO[2] (vitesse de croissance) |
0,013 | ||||||||
| Cladocère (Daphnia magna) |
Toxicité aiguë (48 heures) |
CE50 (immobilisation) |
1,8 | Présentation de projet d’études, 2010b; IUCLID Data Set, 2003 Présentation de projet d’études, 2010b Présentation de projet d’études, 2010b; IUCLID Data Set, 2003 |
|||||
| CSEO | 0,36 | ||||||||
| Toxicité chronique (21 jours) | CE50 (fécondité) | 0,033 | |||||||
| CE20 (fécondité) |
0,0090 | ||||||||
| CE10[*] (fécondité) |
0,0045 | ||||||||
| CMEO (fécondité) |
0,007 | ||||||||
| CL50[3] (fécondité) |
0,048 | ||||||||
| CMEO (survie) |
0,036 | ||||||||
| CSEO (survie) |
0,016 | ||||||||
| Carpe commune (Cyprinus carpio) |
Toxicité aiguë (14 jours) |
CL50 | 0,43 | ||||||
| CSEO | 0,28 | ||||||||
| Truite arc-en-ciel (Oncorhynchus mykiss) |
Toxicité aiguë (14 jours) |
CL50 | 0,26 | ||||||
| CSEO | 0,14 | ||||||||
| Boues activées (microorga-nismes comme les bactéries) | Toxicité aiguë (30 minutes) |
CE50 | > 10 000 | IUCLID Data Set, 2003 | |||||
| Structure 1 | |||||||||
| Cilié (Tetrahymena pyriformis) |
Toxicité aiguë (48 heures) |
CI50[4] | 0,010 (10 µg/L) | Epstein et al., 1967 | |||||
| BENPATAX | |||||||||
| Algues (Selenastrum capricornutum) |
Toxicité chronique (72 heures) |
CE50 (augmentation de la biomasse) |
0,0094 | Présentation de projet d’études, 1998 | |||||
| CE50 (vitesse de croissance) |
0,11 | ||||||||
| CE10[*] (augmentation de la biomasse) |
0,00075 | ||||||||
| CSEO (vitesse de croissance) |
0,0020 | ||||||||
| Cladocère (Daphnia magna) |
Toxicité aiguë (24 heures) |
CE50 | > 81 | ||||||
| Toxicité aiguë (48 heures) |
CE50 | 0,59 | |||||||
| CSEO | 0,18 | ||||||||
| Carpe commune (Cyprinus carpio) |
Toxicité aiguë (14 jours) |
CL50 | 0,35 | ||||||
| CSEO | 0,17 | ||||||||
[2] CSEO – Concentration sans effet observé, soit la concentration la plus élevée ne causant pas d’effet statistiquement significatif par rapport au groupe témoin dans un essai de toxicité.
[3] CL50 – Concentration d’une substance qu’on estime létale pour 50 % des organismes d’essai.
[4] CI50 – Concentration inhibitrice pour un pourcentage donné d’un effet. Estimation ponctuelle de la concentration d’une substance d’essai causant une réduction de 50 % d’une mesure biologique quantitative comme la vitesse de croissance.
[*] Ces valeurs de CE10 ont été choisies comme valeurs critiques de toxicité (VCT) pour les besoins de la caractérisation du risque écologique. Les études sur la toxicité du BENPAT et du BENTAPAX pour les algues de l’espèce S. capricornutum (Présentation de projet d’études, 2010b, 1998) ont été soumises à une évaluation critique et elles ont été jugées fiables.
En résumé, des études caractérisant la toxicité du BENPAT et de la substance analogue, le BENPATAX, chez plusieurs espèces aquatiques sont disponibles. Bien que l’on puisse considérer qu’il est possible de déduire les données pour le BENTAX à partir de celles relatives au BENPAT, ce dernier ne comprend pas les dérivés de xylyle qui sont davantage substitués par le méthyle. Par conséquent, les renseignements disponibles concernant le BENPATAX ont été jugés plus pertinents et appliqués au BENTAX en s’appuyant la similitude structurelle des substances, matérialisée par la présence de dérivés de xylyle et de tolyle. De plus, l’analogue BENPATAX contient également des dérivés de phényle qui ne sont pas présents dans le BENTAX.
Le poids de la preuve, en ce qui concerne les données expérimentales, indique que le BENPAT et le BENTAX entraîneraient des effets nocifs aigus chez les organismes aquatiques à des concentrations faibles (CL50 aiguës inférieures à 1,0 mg/L).
En outre, les études concernant la toxicité des lixiviats de pneus ont été passées en revue et il a été découvert que les agents protecteurs du caoutchouc, y compris le BENPAT ainsi que les composés de ce dernier et possiblement du BENTAX, pouvaient être détectés dans les lixiviats et contribuer à la toxicité globale de ces derniers dans le milieu aquatique (Wik, 2007; MEEO, 1994). Le ministère de l’Environnement et de l’Énergie de l’Ontario (MEEO, 1994) a réalisé des analyses chimiques et des essais sur la toxicité aquatique sur des lixiviats de pneus en utilisant diverses espèces comme la Daphnia magna, la Ceriodaphnia dubia, la truite arc-en-ciel et la tête-de-boule. Une évaluation des données sur la toxicité a également été menée pour identifier les substances contribuant à la toxicité des lixiviats. Des échantillons d’eau d’essai ont été préparés par lots en submergeant un pneu entier d’automobile dans de l’eau. Un lot d’eau dans laquelle aucun pneu n’a été submergé a été utilisé en tant que témoin négatif. Tous les lots d’eau d’essai ont présenté une toxicité aiguë pour la truite arc-en-ciel, alors qu’aucune toxicité n’a pu être constatée chez les autres espèces testées. Les valeurs de CL50 après 24 et 96 heures calculées pour les truites arc-en-ciel exposées au premier lot d’eau (dans laquelle a été submergée un pneu) se chiffraient respectivement à 58 et 34 % vol/vol, et à 83 et 52 % vol/vol pour le deuxième lot (MEEO, 1994).
Pour l’évaluation des données sur la toxicité, des essais sur des truites ont été menés en utilisant des échantillons d’eau exposée au pneu non dilués, et le temps létal moyen (TL50) a été utilisé afin de mesurer la toxicité. Les additifs chimiques (tels que l’acide chlorhydrique et l’hydroxyde de sodium pour déterminer la sensibilité au pH ainsi que l’acide éthylènediaminetétracétique et le thiosulfate de sodium pour déterminer si les métaux contribuaient à la toxicité observée) ont été utilisés pour déterminer les caractéristiques des substances toxiques se trouvant dans les lixiviats de pneu. La photosensibilité et la persistance des substances toxiques ont également été étudiées. Enfin, l’ajout du charbon actif aux échantillons d’essai a permis d’éliminer la toxicité du lixiviat de pneu pour la truite, ce qui indique que les composés responsables de ladite toxicité de l’eau dans laquelle a été submergé un pneu sont très vraisemblablement des composés organiques polaires non volatils (MEEO, 1994).
Les échantillons d’eau ont également été analysés en vue d’en déterminer les paramètres généraux de qualité de l’eau (comme la dureté, les concentrations de carbone organique et inorganique, de composés azotés et de métaux), les composés organiques cibles (y compris les pesticides, les hydrocarbures chlorés, les hydrocarbures aromatiques polycycliques, les phtalates, les amines, etc.) ainsi que les substances chimiques non ciblées, dont la plusieurs étaient des arylamines et des alkylphénols, que l’on considérait comme des produits de dégradation des additifs antioxydants et antiozonants. Ces derniers comprenaient la structure 1 (ou DPPD), l’aniline, la p-benzoquinone, le 2-méthyl-N-phényl-aniline et le N-phényl-aniline (MEEO, 1994). Ces composés pourraient être responsables de la toxicité observée étant donné qu’il s’agit de composés organiques non volatils; toutefois, plusieurs autres additifs du caoutchouc entrent dans cette catégorie de produits chimiques, et aucun lien n’a pu être établi entre les concentrations d’agents protecteurs dans le lixiviat et la toxicité observée chez la truite.
Dans une étude plus récente, la toxicité aiguë du BENPAT (appelé DTPD dans ladite étude) dans les lixiviats du caoutchouc pour la Daphnia magna a été évaluée par Wik (2007). Dans cette étude, la toxicité des lixiviats produits à partir d’échantillons de caoutchouc contenant divers additifs du caoutchouc (huiles de mise en œuvre et d’extension, antioxydants et antiozonants, accélérateurs de vulcanisation et produits de remplissage/agents de renforcement) a été évaluée.
Une semelle typique de pneus a été préparée en utilisant un nombre minimal de composés et a été testée en tant qu’échantillon de référence. Des échantillons de caoutchouc ont été préparés en ajoutant individuellement les différents additifs à la composition du caoutchouc de référence (ajout de 1,9 % de BENPAT). Des essais ont été menés en ajoutant des morceaux des échantillons de caoutchouc dans de l’eau dans des quantités allant de 0,31 à 10 grammes de caoutchouc par litre d’eau de dilution. Les organismes d’essai ont été exposés à ce mélange après une période de stabilisation de ce dernier de 72 heures. Un témoin positif (K2Cr2O7) et un témoin négatif (eau de dilution) ont été utilisés; les pourcentages de daphnies immobilisées et les valeurs de CE50 ont été calculés pour des périodes d’exposition de 24 et de 48 heures. Les lixiviats contenant les organismes d’essai survivants ont ensuite été irradiés aux rayons ultraviolets (UV) pendant 2 heures et le pourcentage de daphnies immobilisées a été consigné une heure après (Wik, 2007).
Après des expositions de 24 et de 48 heures aux échantillons de caoutchouc contenant du BENPAT, les pourcentages de daphnies immobilisées étaient significativement plus élevés (de 37 à 42 % et de 54 à 56 %) que ceux observés avec l’échantillon de référence (6,3 % et 20,6 %). L’immobilité après l’irradiation aux UV était également significativement plus élevée dans les échantillons contenant du BENPAT que dans tous les autres échantillons. Les valeurs de CE50 après 24 et 48 heures obtenues avec les échantillons de caoutchouc contenant du BENPAT étaient respectivement comprises entre 2,5 et 3,3 et 1,4 et 1,5 grammes de caoutchouc par litre d’eau de dilution. Il convient de noter que la toxicité signalée pour les différents échantillons représente la toxicité d’un additif donné ajoutée à la toxicité de fond de l’échantillon de référence (Wik, 2007). Les valeurs CE50 n’ont pas été calculées pour les échantillons de caoutchouc de référence en raison des faibles relations concentration-réponse.
La toxicité la plus élevée pour la Daphnia magna a été observée dans les échantillons de caoutchouc contenant des agents protecteurs, parmi lesquels du BENPAT. Il est possible que la toxicité élevée constatée ait été causée par la migration séquentielle des agents protecteurs vers la surface du caoutchouc, à partir de laquelle ils pourraient se libérer plus facilement. De plus, la toxicité des échantillons de caoutchouc contenant du BENPAT a augmenté après l’irradiation aux UV, ce qui laisse entendre que le BENPAT pourrait se photodégrader pour produire des composés plus toxiques (Wik, 2007). L’irradiation aux UV pourrait également avoir entraîné la dégradation des échantillons de caoutchouc, ce qui à son tour aurait augmenté la lixiviabilité du BENPAT. Néanmoins, l’étude ne comprenait pas d’échantillons non irradiés qui auraient pu être utilisés comme témoins pour vérifier les possibles augmentations de la toxicité causées par une lixiviation supplémentaire de la substance qui aurait eu lieu au cours des trois dernières heures de l’essai.
Dans l’ensemble, l’étude de Wik (2007) a indiqué que les lixiviats provenant de caoutchouc contenant des agents protecteurs tels que le BENPAT entraînaient des effets toxiques chez la Daphnia magna, ce qui laisse entendre que ces substances pourraient se libérer du caoutchouc et avoir des effets toxiques sur les organismes aquatiques.
En résumé, les conclusions tirées à partir des études sur les lixiviats du caoutchouc effectuées par le MEEO (1994) et Wik (2007) laissent entendre que les agents protecteurs, y compris le BENPAT et les composés du BENPAT et du BENTAX (comme la structure 1, l’aniline, la p-benzoquinone, le 2-méthyl-N-phényl-aniline et le N-phényl-aniline) peuvent se libérer par lixiviation du caoutchouc lorsqu’ils sont exposés à l’eau, et avoir des effets toxiques sur le milieu aquatique à des concentrations relativement faibles.
B – Dans d’autres milieux
La toxicité du BENPAT pour les organismes vivant dans les sols et les sédiments a été étudiée en laboratoire (Présentation de projet d’études, 2010c). On n’a trouvé aucune étude sur les effets du BENTAX dans les sols et les sédiments.
Sol
On a déterminé les effets du BENPAT sur la survie, la croissance et la capacité de reproduction des lombrics adultes de l’espèce Eisenia fetida. L’étude a porté sur 4 concentrations d’essai : 125, 250, 500 et 1 000 mg de BENPAT/kg de sol (poids sec), et comportait des témoins traités au solvant (acétone) et des témoins non traités. Les lombrics adultes ont été placés dans un sol traité pendant 28 jours, et leur progéniture en développement a été laissée dans ce sol pendant 28 jours de plus. Les paramètres mesurés étaient la survie et la variation du poids corporel des lombrics adultes au bout de 28 jours d’exposition, et l’on a aussi évalué le nombre de juvéniles s’étant développés au bout de 56 jours.
Au terme de la période d’exposition de 28 jours, le BENPAT n’avait pas entraîné de mortalité significative chez les lombrics adultes aux concentrations d’essai (c’est-à-dire 125 à 1 000 mg de BENPAT/kg de sol [poids sec]). On n’a pas observé d’effets sur le comportement, la santé ou la biomasse des lombrics après une exposition au BENPAT. De plus, aucun effet notable sur la capacité de reproduction des lombrics n’a été constaté. Par conséquent, la CSEO sur la mortalité, la biomasse, le comportement et la capacité de reproduction des lombrics adultes a été fixée, pour le BENPAT, à la concentration maximale d’essai, soit 1 000 mg de BENPAT/kg de sol (poids sec) (Présentation de projet d’études, 2010c).
Sédiments
Les effets du BENPAT dans les sédiments ont été étudiés dans le cadre d’une étude fondée sur la ligne directrice 218 de l’OCDE, intitulée Essai de toxicité sur les chironomes dans un système eau-sédiment chargé (Présentation de projet d’études, 2010c). Le moucheron de l’espèce Chironomus riparius a été utilisé comme animal modèle. Les larves de C. riparius sont des organismes tubulaires vivant en suspension; dépositivores, ils se nourrissent de la matière organique dans les sédiments. Par conséquent, ils sont susceptibles d’entrer en contact avec tout contaminant lié aux sédiments. Des chironomes au premier stade larvaire (c’est-à-dire de moins de 3 jours) ont été utilisés dans cette étude. Le BENPAT a été testé à cinq concentrations d’essai, soit 25, 64, 160, 400 et 1 000 mg/kg sédiments secs, avec un groupe de témoins traités au solvant (acétone) et un groupe de témoins non traités, sur 28 jours. Des échantillons des sédiments ont été préparés comme suit : des solutions d’essai de BENPAT ont été ajoutées à du sable sec, mélangées, puis l’acétone en a été évaporée, après quoi le sable sec chargé a été mélangé avec les sédiments humides préparés.
On a enregistré la durée de développement ainsi que le nombre total de moucherons mâles et femelles entièrement émergés. La valeur de la CE50 sur 28 j du BENPAT pour C. riparius a été estimée à plus de 615,2 mg/kg (soit une concentration nominale de 1 000 mg/kg). Les valeurs de CSEO pour le ratio d’émergence et pour le taux de développement, au bout de 28 jours, ont toutes deux été établies à 615,2 mg/kg (soit une concentration nominale de 1 000 mg/kg).
Sommaire
Les études menées dans les sols et dans les sédiments sur les lombrics et les chironomes, respectivement, n’ont révélé aucun effet associé à l’exposition au BENPAT aux concentrations maximales d’essai.
Il est possible que, vu son potentiel d’adsorption élevé, le BENPAT soit fortement lié aux particules de sol ou de sédiments et que, par conséquent, il ne soit pas biodisponible pour les organismes vivant dans les sols ou les sédiments. Cependant, comme une seule espèce a été soumise à des essais dans chacun de ces milieux jusqu’ici, il est également possible que ces organismes en particulier, c’est-à-dire le lombric E. fetida et le chironome C. riparius, ne soient pas très sensibles au BENPAT.
Évaluation de l’exposition de l’environnement
Aucune donnée concernant les concentrations de BENPAT et de BENTAX dans l’environnement au Canada n’a été relevée. Par conséquent, on a estimé les concentrations dans l’environnement à partir des renseignements dont on disposait, notamment les quantités estimées de substance, les taux de rejet et la taille des plans ou cours d’eau récepteurs. Les renseignements concernant la présence d’agents protecteurs tels que le BENPAT dans l’environnement à cause de l’usure des pneus sont également résumés.
A – Rejets industriels
L’exposition aquatique au BENPAT et au BENTAX est prévue lorsque ces substances sont rejetées par les utilisations industrielles vers une usine de traitement des eaux usées et que l’usine évacue son effluent dans des eaux réceptrices. La concentration de la substance dans les eaux réceptrices près du point de rejet de l’usine de traitement des eaux usées est utilisée comme la concentration environnementale estimée (CEE) dans l’évaluation du risque que présente la substance en milieu aquatique. On peut la calculer à l’aide de l’équation suivante :
Ceau-ind = [1000 × Q × L × (1 - R)] / [N × F × D]
où
Ceau-ind : concentration en milieu aquatique due aux rejets industriels, en mg/L
Q : quantité de substance totale utilisée chaque année sur un site industriel, en kg/an
L : pertes dans les eaux usées, fraction
R : taux d’élimination de l’usine de traitement des eaux usées, fraction
N : nombre de jours de rejets annuels, en jour/an
F : débit de l’effluent de l’usine de traitement des eaux usées, en m3/jour
D : facteur de dilution dans l’eau réceptrice, sans dimension
BENPAT
Une analyse de l’exposition propre au site en milieu aquatique a été effectuée à un total de trois sites où le BENPAT était utilisé comme antiozonant dans la fabrication de produits en caoutchouc de haute qualité. La quantité réelle de la substance employée à chaque site allait de 10 000 à 500 000 kg/année. Deux scénarios de rejet, le scénario 1 et le scénario 2, sont présentés pour chaque site; ils illustrent l’intervalle d’estimations des pertes de la substance dans les eaux usées attribuables aux processus de production selon deux sources d’information différentes.
Dans le scénario de rejet 1, la fraction que l’on estime perdue dans les eaux usées des processus de production est de 1 %, d’après l’OCDE (2004c). Dans le scénario de rejet 2, la fraction que l’on estime perdue dans les eaux usées des processus de production est de 0,05 %, d’après l’information présentée dans la Présentation de projet d’études (2010b). Les eaux usées contenant la substance subissent ensuite un traitement secondaire et tertiaire hors site (pour les sites 2 et 3) dans des usines de traitement des eaux usées, avec un taux d’élimination modélisé de 48 %. Ce taux a été estimé à l’aide du modèle ASTreat (2006) concernant l’élimination par les usines de traitement des eaux usées, pour la structure représentative 2, l’un des principaux composants du BENPAT, qui compose la substance à approximativement 50 % (Huntink et al. 2006). Les effluents de ces usines de traitement sont ensuite rejetés dans des cours d’eau ou des lacs, et un facteur de dilution d’au plus 10 est appliqué pour dériver les CEE produites par les concentrations dans les effluents. On suppose également une fréquence de rejet de 350 jours/année pour les 3 sites aux fins de l’estimation. Les CEE estimées pour les 3 sites sont de l’ordre de 0,8 à 64,82 µg/L pour le scénario 1, et de 0,04 à 3,24 µg/L pour le scénario 2 (Environnement Canada, 2011a). Ces valeurs de CEE représentent le degré d’exposition dans les eaux réceptrices à proximité du point de rejet de l’usine de traitement des eaux usées à chaque site.
Les variables relatives à l’exposition utilisées pour définir les rejets de BENPAT à 3 sites industriels ainsi que les CEE pour les scénarios de rejet 1 et 2 sont présentées au tableau 8a ci-dessous.
Tableau 8a. Sommaire des rejets industriels de BENPAT
| Paramètre | Site 1 | Site 2 | Site 3 | |||
|---|---|---|---|---|---|---|
| Scénario 1 | Scénario 2 | Scénario 1 | Scénario 2 | Scénario 1 | Scénario 2 | |
| CEE (µg/L) | 12,22 | 0,61 | 0,8 | 0,04 | 64,82 | 3,24 |
BENTAX
Une analyse de l’exposition propre au site en milieu aquatique a été effectuée à un site où le BENTAX était utilisé de manière industrielle comme antiozonant dans la fabrication de produits en caoutchouc (Environnement Canada, 2011b). La quantité de BENTAX déclarée être importée pour être utilisée à ce site est de 100 à 1 000 kg (Environnement Canada, 2010c).
Dans cette analyse de l’exposition propre au site, le site industriel comprend une installation, des usines de traitement primaire et secondaire des eaux usées et un plan d’eau récepteur. La CEE dans les eaux réceptrices a été estimée d’après la concentration dans les effluents d’eaux usées, avec un facteur de dilution de 10 dans les eaux réceptrices. La fraction rejetée dans les eaux usées a été évaluée, de manière prudente, à approximativement 2 %; elle provient de la manipulation des contenants de produits chimiques et des procédés industriels employés dans les installations visées. On a aussi supposé une fréquence de rejet de 24 jours/année aux fins de l’estimation. Cette hypothèse est fondée sur des estimations des activités en lien avec la quantité totale de produits générée et sur l’utilisation connexe de la substance dans des modes de production par lots peu fréquents. Le taux d’élimination par une usine locale de traitement des eaux usées a été estimé, par modélisation informatique, à 46,4 % (SimpleTreat, 1997), pour la structure représentative 4, l’un des principaux composants du BENTAX, qui devrait composer la substance à approximativement 50 %, comme la structure 2 dans le BENPAT (Huntink et al. 2006).
D’après les hypothèses décrites ci-dessus, la CEE est estimée à 0,02 mg/L pour le site industriel considéré.
Comme seulement le plus gros utilisateur a été pris en compte dans cette analyse propre au site, avec certaines hypothèses de la fourchette supérieure des estimations, on considère que la CEE obtenue correspond au degré d’exposition pour un scénario de rejet prudent dans les eaux réceptrices à proximité du point de rejet de l’usine de traitement des eaux usées d’un site industriel au Canada.
B – Rejets par les consommateurs
Utilisation de BENPAT dans les pneus
Comme le BENPAT est présent dans des produits de consommation, notamment dans les pneus, et pourrait être rejeté dans l’eau, Mega Flush, le tableur d’Environnement Canada, a été utilisé pour estimer la concentration de la substance dans divers plans d’eau recevant des effluents d’usines de traitement des eaux usées dans lesquelles des produits de consommation contenant du BENPAT pourraient avoir été rejetés (Environnement Canada, 2009).
Ce scénario de rejet associé aux produits de consommation n’a pas été appliqué au BENTAX, car on s’attend à ce que les rejets de cette substance en provenance de produits de consommation soient très faibles vu les quantités utilisées déclarées pour cette substance (Environnement Canada, 2005, 2010c).
Le tableur Mega Flush fournit des estimations fondées sur des hypothèses réalistes pour environ 1 000 sites de rejet au Canada. Deux scénarios de rejet de Mega Flush, les scénarios 1 et 2, ont été étudiés pour le BENPAT, et ce, pour prendre en compte les différences dans les estimations des rejets dans l’eau et le sol. Pour le scénario de rejet 1, on a utilisé des hypothèses fondées sur ChemRisk LLC (2009), selon lesquelles les rejets se font à 66 % dans l’eau et à 33 % dans le sol, avec 50 % des 66 % rejetés dans l’eau étant libérés dans le réseau d’égouts, et 50 %, dans les eaux réceptrices. Pour le scénario de rejet 2, une distribution moitié-moitié dans l’eau et le sol a été supposée d’après les hypothèses employées dans l’outil de détermination du débit massique (voir le tableau 3, Environnement Canada, 2010a).
Les hypothèses réalistes employées comprennent ce qui suit :
- pertes dans les eaux usées : 0,378 % pour le scénario de rejet 1, et de 0,252 % pour le scénario de rejet 2;
- taux d’élimination par l’usine de traitement des eaux usées estimé à 0,0 % en l’absence de traitement, à 17 % avec un traitement primaire seulement, et à 48 % avec une combinaison de traitement primaire et secondaire;
- nombre de jours de rejet par année : 365;
- facteur de dilution dans les eaux réceptrices : 1 à 10;
- 12 % de caoutchouc libéré à partir de particules de caoutchouc en raison de l’abrasion (ChemRisk LLC, 2009)
- 6,3% du BENPAT lessivé dans l’eau à partir des particules de caoutchouc[5]
On a estimé que la CEE de BENPAT dans les eaux réceptrices était de l’ordre de 7,4 × 10-6 à 2,2 × 10-3 mg/L. L’estimation est fondée sur la quantité totale de la substance présumée être utilisée dans les pneus. L’équation et les données d’entrée employées pour calculer la CEE sont présentées dans Environnement Canada (2011c, 2011d).
Autres renseignements sur l’usure des pneus
On présenté ci-dessous des renseignements additionnels sur la présence d’agents protecteurs du caoutchouc tels que le BENPAT dans l’environnement à cause de l’usure des pneus.
Des particules provenant de l’usure des pneus sont libérées par la semelle des pneus en raison de l’interaction entre les pneus et la chaussée (ChemRisk, 2008). La majeure partie du caoutchouc abrasé est rejetée sous la forme de particules relativement grosses sur les bords de routes, alors que moins de 5 % de ces particules sont aéroportées et moins de 1 % sont rejetées sous forme d’émissions gazeuses. Les particules déposées sur le bord de la route peuvent ensuite se retrouver dans les milieux aquatiques par l’intermédiaire de l’eau de ruissellement des routes (Wik et Dave, 2009). Selon des estimations fondées sur des données des années 1970, environ 30 % de la gomme des pneus s’use et est rejetée dans l’environnement (Wik et Dave, 2009). Des estimations plus récentes indiquent des rejets plus faibles à partir de la semelle, de l’ordre de 10 à 12 % (Camatini et al., 2001; Blok, 2005; OCDE, 2004c; ChemRisk LLC, 2009). Les estimations plus anciennes des rejets de gomme, dans les années 1970, sont plus élevées parce que les pneus radiaux modernes se caractérisent par un taux d’usure plus faible que celui des pneus diagonaux utilisés auparavant (Veith, 1992). La teneur en antiozonants est habituellement de 1 % dans la gomme des pneus (Wik et Dave, 2009). Ailleurs, on indique que la teneur en antiozonants dans le caoutchouc peut se situer entre 0,25 et 4 % et atteindre 8 % en poids (Goodyear Tire and Rubber Company, 1965).
Un programme de recherche pluriannuel sur les possibles effets des particules provenant de l’usure des pneus sur l’environnement, la santé et les composantes écologiques a été entrepris par le Tire Industry Project Group (TIPG), par l’intermédiaire du World Business Council on Sustainable Development; plusieurs membres de l’industrie y participent (ChemRisk, 2008). Les données recueillies jusqu’ici comprennent des études sur la composition des particules sur le bord des routes, y compris la composition en substance organiques et inorganiques, et sur leur possible lessivage dans l’environnement. Les résultats obtenus ont été résumés dans des rapports (ChemRisk, 2008; ChemRisk et DIK, 2008) parus dans les publications à comité de lecture (Kreider et al., 2010) et présentés à une conférence (MacAfee et al., 2010).
Trois types de particules provenant de l’usure des pneus ont été identifiés, et leur composition ainsi que leurs propriétés physiques ont été analysées dans une étude du TIPG (ChemRisk 2008). Les particules en bordure des routes (PR) sont composées d’un mélange d’éléments provenant des pneus, de la chaussée, des carburants, des freins et de la poussière des routes. Les particules provenant de l’usure des pneus (PUP) sont produites par l’interaction entre les pneus et la chaussée. Les particules de pneus (PP) sont composées de gomme de pneus pure. La composition chimique globale varie pour ces trois types de particules, qui se distinguent aussi par leur taille et leur forme (ChemRisk, 2008; Kreider et al., 2010). Par exemple, les PR et les PUP générées en laboratoire ont toutes deux une forme allongée de cigare, tandis que les PP sont plus grosses, avec des bords plus dentelés.
Pour cette étude, des PP ont été produites en laboratoire et recueillies sur des pneus usuels de véhicules de promenade et de camions à l’aide d’un dispositif de collecte sur route spécialement conçu à cet effet. Les particules prélevées sur la route et les particules générées en laboratoire étaient semblables en termes de composition, et elles renfermaient une quantité comparable de caoutchouc.
L’analyse des composants organiques des PR et des PUP générées en laboratoire a révélé la présence d’antioxydants, dont du BENPAT (appelé DTPD dans le rapport), en concentrations de l’ordre des parties par million (ppm) (ChemRisk, 2008). De plus, on a procédé à une extraction à l’acétone afin de déterminer quels composants des PR et des PP avaient le potentiel d’être lessivés. On a trouvé plusieurs antioxydants dans les extraits de PR et de PP obtenus à l’acétone, ainsi que plusieurs autres produits organiques comme des composants d’huiles et de cires de même que des phtalates (ChemRisk, 2008). On a détecté du BENPAT dans les extraits de PP obtenus à l’acétone (MacAfee et al., 2010).
Le potentiel de lessivage des produits chimiques recensés dans les extraits à l’acétone a été étudié, et les PR et les PP ont été soumises à des essais de lessivage par une imitation d’eau de pluie. On a laissé de l’eau de pluie à pH 7,5 s’égoutter pendant 16 heures sur des colonnes renfermant des PR ou des PP. L’eau a ensuite été recueillie, et l’on a analysé sa teneur en produits organiques et en métaux. On n’a pas détecté de produits chimiques dans le lessivat d’eau après 16 heures, sauf du formaldéhyde (ChemRisk, 2008). Le lessivat des produits chimiques provenant des PR a été mélangé avec des particules de sol représentatives de celles qu’on peut trouver le long des routes, et l’on a soumis le mélange à une expérience semblable à celle des études sur colonne avec l’eau, pendant 16 heures. L’eau de lessivage du sol a été recueillie et analysée. On n’a pas trouvé de produits chimiques, y compris des antiozonants, dans le lessivat.
Ces études sur 16 heures, qui simulaient un épisode de précipitations unique, sur le potentiel de lessivage des additifs organiques entrant dans la composition des pneus, dont le BENPAT, ont montré l’absence de telles substances dans les lessivats (ChemRisk, 2008). Cependant, vu la durée très courte de ces études, l’absence de variation dans les conditions expérimentales ainsi que le fort potentiel d’adsorptivité du BENPAT, le potentiel de lessivage de cette substance pourrait ne pas avoir été entièrement caractérisé. En effet, ces études n’illustrent pas les conditions environnementales à plus long terme ainsi que les effets connexes sur le potentiel de lessivage des antiozonants tels que le BENPAT à partir des particules provenant de l’usure des pneus.
Dans d’autres études remontant aux années 1970, des estimations concernant les émissions de gomme provenant des pneus fondées sur différents marqueurs chimiques des pneus ont été rapportées (Wik et Dave, 2009). Les marqueurs des pneus constituent un moyen pratique de surveiller les concentrations en particules provenant de l’usure des pneus dans l’environnement. Les fractions de particules provenant de l’usure des pneus dans le sol, les sédiments et l’air ne peuvent être déterminées à partir des taux d’usure mesurés ou dérivés de manière théorique (ChemRisk, 2008). Les concentrations de particules de caoutchouc dans l’environnement ont été estimées d’après les marqueurs chimiques des pneus, soit les concentrations mesurées des composés et additifs courants du caoutchouc, y compris le butadiène-styrène (SBR), le caoutchouc naturel (CN), les benzothiazoles (HOBT et 24MoBT) et le zinc organique (Wik et Dave, 2009). On n’a trouvé aucune documentation attestant l’utilisation d’antiozonants comme marqueurs chimiques des pneus, probablement parce que les antiozonants sont des additifs chimiques réactifs du caoutchouc (ChemRisk et DIK, 2008). Cependant, l’analyse chimique des particules de la semelle des pneus a montré qu’elles contiennent des agents protecteurs (ChemRisk, 2008).
Il faut souligner que l’utilisation de marqueurs chimiques peut être à l’origine de surestimations ou de sous-estimations des concentrations de particules de pneus étant donné que les marqueurs utilisés pourraient être soumis à une dégradation dans l’environnement ou que d’autres sources que les pneus pourraient être à l’origine de leur rejet dans l’environnement (Wik et Dave, 2009). Le rapport de ChemRisk et DIK (2008) présente une description plus approfondie de la fiabilité des différents marqueurs chimiques des pneus, dont différents marqueurs à base de polymères, le benzothiazole (BT), le 2-(4-morpholinyl)benzothiazole (24MoBT), la N-cyclohexyl-2-benzothiazolimine (NCBA), des marqueurs à base de zinc ainsi que les marqueurs à base d’additifs à point d’ébullition élevé présents dans le butadiène-styrène. Il en a été conclu que les marqueurs de pneus les plus prometteurs étaient les marqueurs de pyrolyse à base de polymères (isoprène, butadiène et thiophène) ainsi que le zinc organique.
Les CEE de particules de pneus provenant de l’étude de Wik et Dave (2009) ont été résumées pour les États-Unis uniquement et sont présentées au tableau 8b. Aux États-Unis, les rejets annuels de particules de pneus en caoutchouc dans l’environnement se chiffrent environ à 500 millions de kg. Les concentrations de particules de pneus dans la poussière des routes ont été estimées entre 0,7 et 210 g/kg de poids sec d’après les concentrations mesurées les plus élevées des différents marqueurs chimiques des pneus. Dans les sols longeant les routes, des concentrations de 0,6 à 117 g/kg de poids sec ont été estimées d’après les concentrations mesurées les plus élevées des différents marqueurs chimiques des pneus. Les concentrations des particules de pneus dans la poussière des routes et dans les sols diminuaient en fonction de la distance qui séparait ces derniers des routes. Des particules de pneus peuvent également avoir été épandues sur des terres agricoles en tant que composés de boues provenant d’usines de traitement des eaux usées (UTEE). On a estimé qu’environ 16 % du zinc se retrouvant dans les UTEE provenait de l’usure des pneus. Les concentrations de zinc dans les boues d’UTEE ont été mesurées à hauteur de 4 g/kg de poids sec. En considérant que la gomme des pneus est constituée à environ 1,5 % de zinc, la concentration de particules de caoutchouc de pneus dans les boues d’UTEE a été estimée à 42,7 g/kg de poids sec (Wik et Dave, 2009).
D’après les concentrations de benzothiazoles, les concentrations de particules liées à l’usure des pneus dans les eaux de ruissellement des routes ont été estimées entre 0,3 et 197 mg/L. En comparaison, de faibles concentrations de particules de pneus ont été estimées dans les eaux réceptrices. D’après les valeurs concernant les eaux de ruissellement des routes, il a été estimé que des concentrations de particules de pneus comprises entre 0,03 et 17,9 mg/L se retrouvaient dans les eaux réceptrices. Des concentrations comprises entre 0,09 et 6,4 mg/L seulement ont été obtenues sur la base des concentrations mesurées de benzothiazoles (Wik et Dave, 2009). Les concentrations de particules de pneus dans les sédiments ont été estimées entre 0,3 et 155 g/kg de poids sec d’après les concentrations mesurées de benzothiazoles et de zinc. Cependant, étant donné que les composés benzothiazoles sont solubles dans l’eau et qu’ils n’ont pas tendance à s’accumuler dans les sédiments, ce marqueur sous-estime vraisemblablement la concentration des particules de pneus se trouvant dans les sédiments (Wik et Dave, 2009). Les concentrations de particules de pneus dans l’air ambiant le long des routes sont estimées entre 0,4 et 11 µg/m3.
Tableau 8b. Concentrations environnementales estimées pour les particules de pneus
| Milieu | Lieu; année | Marqueurs des pneus | Références[1] | Concentrations environnementales estimées pour les particules de pneus[2] |
|---|---|---|---|---|
| Air | Route expresse d’Akron, Ohio, É.-U. – 1973; tunnel des montagnes Allegheny, Pennsylvanie, É.-U. – 1973 | SBR[4] | Cardina, 1974; Pierson et Brachaczek, 1974 | 6 à 11 µg/m3 |
| Autoroute de la rivière San Gabriel, Californie, É.-U. – 1974 | SBR[4]/CN[5] | Cadle et Williams, 1978 | 0,5 µg/m3 | |
| Eaux de ruisselle-ment des routes | Rivières Pawtuxet, Woonasquatucket et Moshassuck, Rhode Island, É.-U. – 1995 | HOBT[6] | Reddy et Quinn, 1997 | 87 mg/L |
| Ruisseau Ballona et rivière Santa Ana, Californie, É.-U. – 1997-1998 | 24MoBT[7] | Zeng et al., 2004 | 92 mg/L | |
| Eau de rivière | Bassin de décantation d’autoroute (à l’intersection des routes 102 et 4 du Rhode Island) et rivière Pawtuxet, Rhode Island, É.-U. – 1995 | 24MoBT | Reddy et Quinn, 1997 | 1,6 mg/L |
| Sédiments | Baie de San Francisco, Californie, É.-U. | 24MoBT | Spies et al., 1987 | 155 000 mg/kg p.s. |
| Bassin de décantation d’autoroute, rivière Pawtuxet et baie Narragansett, Rhode Island, É.-U. – 1995 | HOBT | Reddy et Quinn, 1997 | 400 mg/kg p.s. | |
| Sol | Autoroute de la rivière San Gabriel, Californie, É.-U. – 1974; Rotunda Drive, Michigan, É.-U. – 1973 (à 0 m de la route) |
SBR | Cadle et Williams, 1978; Pierson et Brachaczek, 1974 | 4 500 à 24 000 mg/kg p.s. |
| Route 80, Berkeley, Californie, É.-U. (à 0 m de la route) | 24MoBT | Spies et al., 1987 | 117 000 mg/kg p.s. | |
| Rotunda Drive, Michigan, É.-U. – 1973 (à 8 m de la route) |
SBR | Pierson et Brachaczek, 1974 | 1 000 mg/kg p.s. | |
| Autoroute de la rivière San Gabriel, Californie, É.-U. – 1974 (à 30 m de la route) |
SBR | Cadle et Williams, 1978 | 0 mg/kg p.s. |
[1] Études rapportant des concentrations environnementales mesurées pour le marqueur de pneu utilisées par Wik et Dave (2009) dans l’estimation des particules de pneus dans l’environnement
[2] Concentrations estimées par Wik et Dave (2009)
[3] Concentrations de l’agent protecteur calculées d’après les estimations signalées de particules de pneus, en supposant que le caoutchouc de la gomme de pneus est constitué à 1 % de l’agent protecteur (Wik et Dave, 2009)
[4] SBR : butadiène-styrène
[5] CN : caoutchouc naturel
[6] HOBT : 2-hydroxybenzothiazole
[7] 24MoBT : 2-(4-morpholinyl)benzothiazole
En résumé, l’étude de Wik et Dave (2009) a permis de démontrer que des particules provenant de la gomme des pneus sont rejetées dans l’environnement. Ces particules contiennent des agents protecteurs tels que le BENPAT; ces substances sont ajoutées dans le caoutchouc des pneus en tant qu’agents protecteurs (Kirk-Othmer, c2010; Iatropoulos et al., 1997).
Enfin, la biodisponibilité des antiozonants des particules de pneus n’est pas bien caractérisée à l’heure actuelle. On n’a pas relevé d’études fiables sur la biodisponibilité des antioxydants provenant des particules de pneus usés; toutefois, la biodisponibilité des agents protecteurs provenant des lixiviats de pneus entiers a été démontrée dans une étude de Stephensen et al. (2003). Dans l’étude de Stephensen et al. (2003), quatre agents protecteurs ou métabolites d’agents protecteurs autres que le BENPAT ont été mesurés dans la bile de truites arc-en-ciel après leur exposition à de l’eau contenant le lixiviat d’un pneu entier. Il est possible que le BENPAT n’ait pas été présent dans les échantillons de caoutchouc testés par Stephensen et al. (2003); cependant, certains des composés antiozonants lui étaient semblables d’un point de vue structurel. Par exemple, l’un des composés mesurés, le N-(1-méthyléthyl)-N’-phényl-1,4-benzènediamine (IPPD), ne se distinguait de la structure représentative 1 du BENPAT que par la présence d’un groupe alkyle au lieu d’un groupe aryle.
Enfin, plusieurs études sur la biodisponibilité des particules de pneus usés ont été résumées dans Wik et Dave (2009) et, dans l’ensemble, les résultats indiquaient que les particules de pneus usés pouvaient être biodisponibles pour les organismes pélagiques qui filtrent l’eau, les organismes benthiques et les plantes.
Caractérisation des risques pour l’environnement
La démarche choisie dans la présente évaluation préalable des risques pour l’environnement consistait à examiner différents éléments probants et de formuler des conclusions en se fondant sur la méthode du poids de la preuve, tout en respectant le principe de la prudence, comme l’exige la LCPE (1999). Les éléments de preuve considérés comprenaient les résultats du calcul des quotients de risque ainsi que les renseignements sur la persistance, la bioaccumulation, la toxicité, les sources et le devenir de la substance.
On s’attend à ce que les composants du BENPAT et du BENTAX soient persistants dans l’eau, le sol et les sédiments; certains des principaux composants du BENPAT comme du BENTAX sont également susceptibles d’avoir un potentiel de bioaccumulation modéré à élevé. Des composants du BENPAT et du BENTAX répondent aux critères de persistance, mais pas à celui de bioaccumulation au sens du Règlement sur la persistance et la bioaccumulation de la LCPE (1999) (Canada, 2000). Une fois rejetés dans l’environnement, tant le BENPAT que le BENTAX peuvent se retrouver dans l’eau, le sol et les sédiments.Le BENPAT et le BENTAX ont également montré un fort potentiel de toxicité pour les organismes aquatiques.
Les substances persistantes demeurent longtemps dans l’environnement après y avoir été rejetées, ce qui accroît l’ampleur et la durée possibles de l’exposition. Celles dont la demi-vie dans les milieux mobiles (comme l’eau) est longue et qui sont sujettes à se répartir en proportions appréciables dans ces milieux peuvent causer une contamination étendue. Par ailleurs, le rejet de faibles quantités de substances bioaccumulables peut donner lieu à des concentrations élevées de ces substances dans les organismes exposés.
BENPAT
Une analyse du quotient de risque couplant des estimations de l’exposition avec des données sur la toxicité a été effectuée pour le milieu aquatique afin de déterminer s’il existait un risque pour l’environnement au Canada. Les scénarios industriels propres aux sites (fondés sur des plans d’eau récepteurs réels) présentés précédemment ont généré une CEE de l’ordre de 0,8 à 64,82 mg/L pour le scénario 1, et de 0,04 à 3,24 mg/L pour le scénario 2 (Environnement Canada, 2011a). Une CESE pour le BENPAT a été dérivée à partir d’une valeur de toxicité chronique de 0,0043 mg/L (valeur expérimentale traduisant la plus grande sensibilité dans l’environnement; voir le tableau 7) pour l’algue de l’espèce S. capricornutum, cela en divisant cette valeur par un facteur d’évaluation de 10 (traduisant la variation intraspécifique et interspécifique en matière de sensibilité ainsi que l’extrapolation de résultats obtenus en laboratoire à des conditions de terrain); cela a donné une valeur de 0,00043 mg/L (soit 0,43 mg/L). Les quotients de risque (CEE/CESE) découlant du scénario 1 sont de l’ordre de 1,9 à 150,7, tandis qu’ils se situent entre 0,1 et 7,5 pour le scénario 2. Ils sont résumés au tableau 8c ci-dessous.
Tableau 8c. Quotients de risque pour le BENPAT obtenus à partir des scénarios de rejet industriels
| Paramètre | Site 1 | Site 2 | Site 3 | |||
|---|---|---|---|---|---|---|
| Scénario 1 | Scénario 2 | Scénario 1 | Scénario 2 | Scénario 1 | Scénario 2 | |
| CEE (µg/L) | 12,22 | 0,61 | 0,8 | 0,04 | 64,82 | 3,24 |
| QR | 28,4 | 1,4 | 1,9 | 0,1 | 150,7 | 7,5 |
Suivant une méthodologie similaire à l’approche du rapport CEE/CESE, le tableur des rejets associés aux produits de consommation Mega Flush a prévu, pour le premier scénario considéré (scénario 1), que les CEE pour le BENPAT pourraient excéder la CESE dans environ 4 % des plans d’eau recevant des eaux usées au Canada en conditions de faible débit (10e centile) (Environnement Canada, 2011c). Les prévisions pour le second scénario (scénario 2) étaient plus élevées : cette fois, il s’agissait d’environ 11 % des plans d’eau recevant des eaux usées au Canada en conditions de faible débit (10e centile (Environnement Canada, 2011d). Le rapport CEE/CESE maximal calculé pour le scénario de rejet 1 de Mega Flush était de 3,7, et le QR maximal pour le scénario de rejet 2 de Mega Flush était de 5,1 (Environnement Canada, 2011c, 2011d).
L’information indique que le BENPAT est susceptible de représenter un danger pour l’environnement au Canada.
BENTAX
Une analyse du quotient de risque couplant des estimations prudentes de l’exposition avec des données sur la toxicité a été effectuée pour le milieu aquatique afin de déterminer s’il existait un risque pour l’environnement au Canada. Le scénario industriel propre au site (fondé sur un plan d’eau récepteur réel) a généré une CEE de l’ordre de 0,0036 mg/L (Environnement Canada, 2011a). Une CESE a été dérivée à partir d’une valeur de toxicité aiguë de 0,00075 mg/L (valeur expérimentale valide traduisant la plus grande sensibilité dont on dispose pour l’analogue BENTAPAX; voir le tableau 7) pour l’algue de l’espèce S. capricornutum, cela en divisant cette valeur par un facteur d’évaluation de 10 (traduisant la variation intraspécifique et interspécifique en matière de sensibilité ainsi que l’extrapolation de résultats obtenus en laboratoire à des conditions de terrain); cela a donné une valeur de 0,000075 mg/L (soit 0,075 mg/L). Le quotient de risque (CEE/CESE) associé est de 0,047. Par conséquent, il est peu probable que la substance présente un danger pour les organismes aquatiques vu son utilisation limitée dans l’industrie et les faibles quantités qui sont rejetées.
Dans l’ensemble, l’information indique que le BENTAX n’est pas susceptible de représenter un danger pour l’environnement au Canada.
Incertitudes dans l’évaluation des risques pour l’environnement
Toute modélisation des propriétés physiques et chimiques d’une substance ainsi que des caractéristiques de persistance et de bioaccumulation est fondée sur les structures chimiques. Étant donné que le BENPAT et le BENTAX font partie de la catégorie des UVCB (substances de composition inconnue ou variable, produits de réactions complexes ou matières biologiques), elles ne peuvent être présentées par une seule structure chimique distincte. Par conséquent, aux fins de la modélisation, des « structures représentatives » (les structures représentatives 1 à 5) ont été déterminées en vue de fournir des estimations prudentes. Ces structures représentent les composés principaux constituant le BENPAT et le BENTAX. Étant donné que plusieurs structures représentatives peuvent être choisies pour la même substance UVCB, il est reconnu que des incertitudes liées à la structure existent pour ces substances. Par exemple, alors que la part des diverses structures représentatives peut être estimée ou mesurée, cette part peut varier selon les lots de la substance importés. De plus, les composés mineurs du BENPAT et du BENTAX présents dans les mélanges à des concentrations inférieures à 5 % n’ont pas été pris en considération dans la présente évaluation.
Certaines des propriétés physico-chimiques expérimentales du BENPAT dont on dispose ont été exprimées sous forme de fourchettes (voir les tableaux 2a et 2b), ce qui entraîne par conséquent une certaine variabilité des résultats. Lorsque de telles propriétés ont été utilisées comme intrants dans les modèles, cette variabilité se traduit potentiellement par une surestimation ou une sous-estimation des valeurs réelles dans les résultats desdits modèles. Lorsque des fourchettes de valeurs étaient disponibles pour les paramètres physico-chimiques, les modèles étaient exécutés pour les valeurs supérieures et inférieures des fourchettes afin de déduire toute l’étendue possible des résultats.
Des incertitudes existent quant à l’évaluation expérimentale de la solubilité dans l’eau du BENPAT et de la substance analogue, le BENPATAX. Les solubilités dans l’eau de chacun des composés principaux et mineurs du BENPAT et du BENPATAX ont été établies de manière expérimentale. Les composés principaux affichaient une solubilité dans l’eau moins importante que les composés mineurs, et également moins importante que les solubilités dans l’eau établies pour chaque substance dans son ensemble. La façon dont les valeurs de solubilité dans l’eau du BENPAT et du BENTAX ont été estimées reste obscure et il en va donc de même pour la précision desdites valeurs. Étant donné que la solubilité dans l’eau est l’un des paramètres clés pour comprendre le comportement et le devenir d’une substance dans l’environnement ainsi que pour réaliser la modélisation de la fugacité, il est essentiel de disposer d’estimations fiables à ce sujet.
Il faut souligner que l’exposition environnementale associée au BENPAT présent dans les produits en caoutchouc recyclé, y compris ceux qui sont utilisés dans les zones récréatives comme les terrains de jeu et les terrains de sport, n’a pas prise en compte dans la présente évaluation préalable. À l’heure actuelle, on ne trouve pas, dans les sources publiées ou inédites, d’information sur les rejets possibles dans l’environnement à partir des produits recyclés contenant du BENPAT et peut-être du BENTAX. Les rejets possibles dans l’environnement sont donc inconnus pour l’instant.
En ce qui concerne les données sur la bioaccumulation relatives à la structure représentative 3 du BENPAT et du BENTAX, des incertitudes sont associées aux résultats empiriques dont on dispose. D’après une analyse minutieuse des vitesses de métabolisation, des taux de dépuration et de la variabilité constatée dans l’étude existante sur les poissons, on pense que les résultats obtenus pour la structure représentative 3 du BENPAT ne constituent pas des preuves suffisantes et cohérentes permettant de dire que la substance répond au critère relatif à la bioaccumulation (FBC ou FBA > 5 000) énoncé dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000); cependant, on croit que ce composant principal du BENPAT a un potentiel significatif de bioaccumulation. Il serait donc souhaitable d’avoir d’autres données expérimentales sur la bioaccumulation pour confirmer l’analyse du potentiel de bioaccumulation. La structure 3 est également en partie représentative du BENTAX, sa distribution étant susceptible d’être similaire à celle du BENPAT à approximativement 25 %. On ne dispose pas, à l’heure actuelle, de données expérimentales sur la bioaccumulation du BENTAX, par exemple une étude in vivo sur la bioaccumulation en milieu aquatique. De telles données, en particulier des valeurs de FBC chez les poissons pour les structures représentatives 4 et 5 du BENTAX, analogues à celles concernant les structures représentatives 1, 2 et 3 du BENPAT, seraient importantes et précieuses. Ces données pourraient également être employées pour corroborer et évaluer les résultats expérimentaux obtenus pour le BENPAT et sa structure représentative 3.
Lorsque le BENPAT est rejeté dans un plan d’eau, il a tendance à se loger dans les particules en suspension et dans les sédiments au fond de l’eau, où les organismes vivant dans les sédiments pourraient ainsi lui être exposés. Aucune donnée de surveillance environnementale n’existe à l’heure actuelle sur cette substance. Les données écotoxicologiques sur un organisme vivant dans les sédiments, le chironome C. riparius, n’ont révélé aucune toxicité (Présentation de projet, d’études 2010c). D’après les données dont on dispose, on ne sait pas exactement si la biodisponibilité du BENPAT adsorbé sur les sédiments est limitée ou si c’est plutôt le chironome qui est peu sensible à cette substance. Vu la forte toxicité de la substance pour un certain nombre des espèces aquatiques testées (voir le tableau 7), il est difficile d’affirmer avec certitude qu’elle est peu susceptible de présenter un danger pour les organismes vivant dans les sédiments au Canada.
Étant donné que le BENTAX, comme le BENPAT, tend à s’associer aux particules en suspension et aux sédiments au fond de l’eau, les organismes vivant dans les sédiments pourraient lui être exposés. On ne disposait pas de données écotoxicologiques sur la toxicité du BENTAX pour des organismes vivant dans les sédiments; cependant, les données concernant le BENPAT (Présentation de projet d’études, 2010c) peuvent être utilisées comme substituts pour le BENTAX, vu la similarité de structure et de propriétés des deux produits. Compte tenu des incertitudes associées au fait qu’on dispose du profil de toxicité pour une seule espèce, le chironome C. riparius, il est difficile de prévoir le degré des effets chez d’autres organismes vivant dans les sédiments. À la lumière de l’analyse des quotients de risque pour le site industriel où l’on utilise du BENTAX, et en supposant que le degré de sensibilité à la substance est similaire à celui de l’espèce aquatique susmentionnée, il est peu probable que la substance présente un danger pour les organismes vivant dans les sédiments.
Évaluation de l’exposition
Milieux naturels et aliments
D’après leurs profils d’utilisation, le BENTAX et le BENPAT ne devraient pas se retrouver dans les aliments et les boissons au Canada.
Aucune donnée empirique sur les concentrations de BENTAX et de BENPAT dans les milieux naturels au Canada n’a été relevée. Les concentrations environnementales ont été estimées en utilisant la version 6.00 de ChemCAN, un modèle régional de fugacité de niveau III en champ lointain propre au Canada qui permet d’estimer les concentrations environnementales sur une échelle régionale par rapport aux rejets annuels d’une substance (ChemCAN, 2003). Les rejets annuels de BENTAX et de BENPAT ont été estimés de façon prudente en utilisant la limite supérieure des quantités totales sur le marché en 2006, soit 1 000 kg de BENTAX et 10 000 000 kg de BENPAT, ainsi que les pourcentages de pertes prévus par l’outil de débit massique pour les utilisations commerciales, industrielles et par les consommateurs (voir le tableau 3) (Environnement Canada, 2010a, b, c). On considère que les pourcentages de pertes ne sont pas rejetés dans l’environnement, mais ils sont toutefois utilisés en tant qu’estimations du pire cas aux fins de modélisation. Les estimations des quantités de pertes sont fournies en annexe III.
Les concentrations environnementales estimées par ChemCAN, v. 6.00, sont présentées à l’annexe III. On a obtenu une tranche supérieure de l’absorption quotidienne de BENTAX et de BENPAT pour la population au Canada sur la base des concentrations environnementales estimées. Une exposition environnementale au BENTAX négligeable, de l’ordre du dixième de nanogramme (10-10 de gramme) par kg p.c. (kilogramme de poids corporel) par jour a été estimée. L’exposition environnementale totale estimée au BENPAT était comprise entre 0,06 et 0,63 µg/kg p.c. par jour pour différents groupes d’âge, et était la plus élevée pour les nourrissons nourris au lait maternel (de 0 à 6 mois) (voir annexe IV).
Le BENPAT et le BENTAX sont utilisés comme additifs afin de prévenir la dégradation dans le caoutchouc de haute qualité. Le BENPAT en particulier peut entrer dans la composition du caoutchouc utilisé pour les pneus. Les rejets de particules provenant de pneus résultant de l’usure peuvent alors représenter une source d’exposition potentielle pour la population générale, spécialement pour celle proche des couloirs de transport. Toutefois, le potentiel d’exposition par inhalation au BENPAT devrait être faible, car presque toutes les particules routières (contenant approximativement 15% de matériaux provenant de pneus), générées sous des conditions de conduite extérieure réalistes, sont plus large que le diamètre limite inhalable (10 µm) (Kreider et al., 2010). De plus, il pourrait y avoir une certaine dispersion de ces particules au sol adjacent, mais la tendance à la dispersion est estimée minime, car une diminution des concentrations en particules de pneus de plus de 80 % a été enregistrée à l’intérieur d’une zone de 30 mètres des routes (Wik et Dave, 2009).
Produits de consommation
Tel qu’il a déjà été précisé, le BENTAX et le BENPAT sont utilisés comme additifs afin de prévenir la dégradation des caoutchoucs de haute qualité. Dans la classe des diaryl-p-phénylènediamines, ces substances peuvent être utilisées comme antiozonants et antioxydants du caoutchouc (TradingChem, 2008; PCP, 2008).
Le BENPAT est présent comme antiozonant dans certains composés du caoutchouc à des concentrations déclarées comprises entre 0,29 et 2,17 % en poids (Environnement Canada, 2010c). Dans la gomme de pneus, la concentration normale d’antiozonants est de 1 % en poids (Wik et Dave, 2009). Ailleurs, il a été signalé que les antiozonants étaient présents dans le caoutchouc à hauteur de 0,25 à 4 %, et jusqu’à 8 % en poids (Goodyear Tire and Rubber Company, 1965). En général, le BENPAT est utilisé comme antioxydant dans le polychloroprène ainsi que dans les industries des pneus et des courroies (PCP, 2008). Étant donné que le BENPAT est un additif du caoutchouc mélangé dans la matrice polymérique du caoutchouc à de faibles concentrations, tout contact cutané fortuit avec des pneus par des consommateurs ne devrait pas entraîner d’exposition cutanée.
Les utilisations déclarées pour le BENTAX en réponse à un avis émis en application de l’article 71 de la LCPE (1999) ont été déclarées comme des renseignements commerciaux confidentiels et ne peuvent être divulguées. Toutefois, d’après son utilisation en tant qu’antiozonant moyennement actif présentant de faibles concentrations et une faible solubilité dans l’eau, toute exposition à des produits de caoutchouc devrait être fortuite ou négligeable (Kirk-Othmer, c2010).
Évaluation des effets sur la santé
Les renseignements disponibles quant aux effets sur la santé du BENPAT et du BENTAX sont résumés à l’annexe V. Les données concernant les effets sur la santé de la substance analogue, le BENPATAX, ont également été prises en compte pour éclairer davantage l’évaluation des effets sur la santé du BENPAT et sont résumées à l’annexe V. La structure et l’identité de ces substances sont présentées au tableau 1 de la section « Identité de la substance ».
Le National Industrial Chemicals Notification and Assessment Scheme (NICNAS) d’Australie a mené une évaluation des risques concernant le BENTAPAX (NICNAS, 2001). Aucune évaluation nationale ou internationale n’a été recensée dans le cas du BENPAT ou du BENTAX particulièrement.
Aucun effet de cancérogénicité n’a été observé dans le cadre d’une étude de 52 semaines sur des rats Fischer 344 exposés à du BENPAT par voie orale à des doses pouvant atteindre 95 mg/kg p.c. par jour (AHF, 1996c; Iatropoulos et al., 1997). Bien que des augmentations importantes de l’hyperplasie et de la prolifération des cellules urothéliales aient été observées chez tous les groupes exposés au BENPAT, aucune néoplasie n’a pu être constatée. L’absence d’activités entraînant la formation de tumeurs ou favorisant le développement de ces dernières dans le foie et la vessie de rats Fischer 344 mâles a également été confirmée dans le cadre d’un essai biologique accéléré de 38 semaines (à des doses de 95 mg/kg p.c. par jour) (AHF, 1996b; Iatropoulos et al., 1997). De façon similaire, aucun effet cancérogène n’a été signalé dans le cadre d’une étude sur la toxicité de 52 semaines sur des rats exposés par voie orale à l’analogue BENPATAX et à des doses pouvant atteindre 100 mg/kg par jours (Iatropoulos et al., 2000).
La génotoxicité potentielle du BENPAT, du BENTAX et du BENPATAX a été évaluée dans le cadre de plusieurs essais in vitro et in vivo. Aucun signe de génotoxicité n’a été décelé dans les essais in vivo, qui comprenait un test du micronoyau sur la moelle osseuse de la souris ainsi que deux essais pour mutagénicité chez la Drosophila spp.(AHF, 1995; BESC, 2003; Goodyear Tire and Rubber Company, 1992a, c; Litton Bionetics, 1979; Pharmakon, 1993a). La plupart des essais in vitro sur des systèmes cellulaires de bactéries ou de mammifères se sont avérés négatifs (AHF, 1999, Crebelli et al., 1985; BESC, 2000, 2003; Jeffrey, 1999; SanSebastian, 1994). Des réponses positives faibles ont été observées avec les trois composés sur certaines souches de Salmonella, avec activation métabolique (BESC, 2003; Stankowski, 1998; Goodyear Tire and Rubber Company, 1992 a, c, d). Des résultats positifs ont également été constatés dans des essais d’altération et de réparation de l’ADN chez Escherichia coli pour le BENPAT et le BENTAX, sans activation métabolique (les essais n’ont pas été menés avec une activation métabolique) (BESC, 2003; Goodyear Tire and Rubber Company, 1992a, c, d). Les renseignements disponibles susmentionnés indiquent que le BENPAT et le BENTAX ne sont vraisemblablement pas génotoxiques.
Lors d’une étude de toxicité sur la reproduction sur deux générations, des rats Sprague-Dawley ont été exposés à du BENPAT par voie orale à une dose de 0 à 75 mg/kg p.c. par jour à partir de la période précédant l’accouplement (10 semaines) jusqu’au sevrage des petits (à l’âge de 21 jours). Des périodes de gestation significativement prolongées ont été constatées chez les mères à des doses de 20 et 75 mg/kg p.c. par jour pour les mères F0 et à toutes les doses pour les mères F1. Une augmentation importante des pertes postimplantation ainsi qu’une diminution du nombre total de petits et de petits vivants ont pu être observées dans les portées F1 et F2 à des doses de 20 et de 75 mg/kg p.c. par jour. Des dystocies et des mises bas tardives également été observées auxdites doses au cours de l’étude. Des lésions polykystiques rénales avec une incidence et une gravité liées à la dose ont été relevées à toutes les doses (6, 20 et 75 mg/kg p.c. par jour) chez les parents F0 et F1 ainsi que chez les rats sevrés F1 et F2. Cependant, aucune preuve de toxicité pour la reproduction chez les mâles n’a été signalée (Goodyear Tire and Rubber Company, 2001). Une étude mécaniste a également été réalisée chez la même souche de rats à des doses de 125 mg/kg p.c. jour administrées par voie orale afin d’approfondir l’analyse de l’association entre les stades d’exposition et les effets sur la santé observés dans l’étude sur deux générations susmentionnée. Les résultats de cette étude ont permis de confirmer que l’exposition au BENPAT au cours de la période de gestation entraînait des dystocies ainsi que des mises bas tardives et qu’elle entraînait également la présence de reins polykystiques chez les descendants F1. L’exposition précédant la gestation n’a pas accru les effets attribués à l’ingestion de BENPAT pendant la période de gestation (Goodyear Tire and Rubber Company, 2001).
Dans deux études sur la toxicité pour le développement, des rats Sprague-Dawley femelles ont été exposés au BENPAT et au BENPATAX par gavage pendant 10 jours au cours de la gestation. Une réduction du poids corporel des fœtus et des mères (liée à une baisse de la consommation d’aliments) a été observée à des doses de 200 mg/kg p.c. de BENPAT par jour (la dose testée la plus élevée) et à des doses de 70 et 200 mg/kg p.c. de BENPATAX par jour. Aucune anomalie (malformations ou variations) liée au composé n’a été constatée chez les descendants (BESC, 2003; Tyl, 1996).
En ce qui concerne les effets non cancéreux, une augmentation importante de l’hyperplasie et de la prolifération des cellules urothéliales a été relevée à toutes les doses testées chez des rats Fischer 344 mâles et femelles exposés par voie orale à des doses de 0 à 95 mg/kg p.c. de BENPAT par jour pendant 52 semaines (Iatropoulos, 1997). Des augmentations du poids relatif des organes (foie, rate, cœur et rein) et des baisses du gain de poids corporel et de la consommation d’aliments ont également été observées chez les rats exposés à la dose élevée. De la même manière, une augmentation de la prolifération cellulaire dans la vessie, une baisse du poids corporel et une augmentation du poids des organes (à des doses de 30 et de 125 mg/kg p.c. par jour) ont aussi été relevées chez la même souche de rats dans le cadre d’une étude de 28 jours sur l’exposition au BENPAT par voie orale (AHF, 1996a). L’administration par voie orale de BENPATAX pendant 4 semaines a entraîné une hyperplasie de l’urothélium ainsi qu’une augmentation de la prolifération des cellules urothéliales chez des rats Fischer 344 exposés à la dose élevée (100 mg/kg p.c. par jour) (Iatropoulos et al, 1998; NICNAS, 2001).
Des effets hématologiques liés à une exposition par voie orale au BENPAT ont aussi été constatés dans le cadre de plusieurs études sur la toxicité à court et à long terme chez des rats Fischer 344. Des signes d’anémies macrocytaires, y compris des augmentations réversibles du volume corpusculaire moyen, des diminutions de la teneur corpusculaire moyenne en hémoglobine ainsi que des modifications des valeurs de chimie clinique (augmentation des taux de cholestérol et de bilirubine dans le sang) ont été observées chez des rats des deux sexes exposés à la dose élevée de BENPAT (120 mg/kg p.c.) au cours d’une étude de 28 jours (AHF, 1996a). Une augmentation importante du volume corpusculaire moyen, une diminution de la teneur corpusculaire moyenne et du nombre de globules rouges accompagnées de preuves microscopiques d’une érythropoïèse extramédullaire dans la rate et le foie ont également été relevées à une dose de 95 mg/kg p.c. par jour (la dose testée la plus élevée) dans le cadre d’une étude sur 52 semaines. Une augmentation des taux de cholestérol et de bilirubine ainsi qu’une baisse des niveaux de protéine totale ont également été signalées chez des rats exposés à la dose élevée (AHF, 1996c; Iatropoulos et al., 1997). Les mêmes résultats ont été confirmés par un essai biologique accéléré de 38 semaines chez des rats exposés par voie orale à des doses de 95 mg/kg p.c. de BENPAT par jour (Iatropoulos et al., 1997). Des effets hématopoïétiques similaires ont également été observés dans le cadre d’une étude de 52 semaines sur des rats exposés à la substance analogue, le BENPATAX. À des doses de 20 et de 100 mg/kg p.c. par jour, des modifications histopathologiques dans la rate, le foie, les reins et la vessie chez les animaux exposés à la dose élevée ont apporté une preuve supplémentaire de la présence d’anémies macrocytaires (Iatropoulos et al., 2000; NICNAS, 2001). Des signes d’anémies macrocytaires ont aussi été relevés dans l’étude de 28 jours chez des rats exposés à des doses de 120 mg/kg p.c. de BENPATAX par jour (Iatropoulos et al., 1998).
La dose minimale avec effet nocif observé (DMENO) concernant l’exposition chronique par voie orale était comprise entre 2,7 mg/kg p.c. par jour (dose testée la plus faible) pour le BENPAT chez les rats, d’après l’augmentation importante de l’hyperplasie et de la prolifération des cellules urothéliales (AHF, 1996c), et 20 mg/kg p.c. par jour pour le BENPATAX chez les rats, d’après la présence d’une anémie macrocytaire (Iatropoulos et al., 2000). La DMENO concernant l’exposition à court terme par voie orale était comprise entre 30 mg/kg p.c. par jour pour le BENPAT chez les rats, d’après l’augmentation de la prolifération des cellules urothéliales dans la vessie (AHF, 1996a), et 120 mg/kg p.c. par jour pour le BENPAT et le BENPATAX chez les rats, d’après la présence d’une anémie macrocytaire (AHF, 1996a; Iatropoulos et al., 1998). Dans le cadre d’une étude sur la toxicité pour le développement chez des rats exposés par voie orale, une DMENO pour le développement de 20 mg/kg p.c. par jour, d’après l’allongement de la durée de gestation, l’augmentation des pertes postimplantation et la baisse du nombre total de petits et de petits vivants a été déterminée, tout comme une DMENO systémique de 6 mg/kg p.c. par jour, d’après les lésions polykystiques sur les reins (Goodyear Tire and Rubber Company, 2001).
Les résultats provenant des études sur la toxicité aiguë indiquaient que les valeurs de DL50 chez des rats exposés par voie orale au BENPAT, au BENTAX et à l’analogue BENPATAX ainsi que les valeurs de DL50 chez des lapins exposés par voie cutanée au BENPAT et au BENPATAX étaient toutes supérieures à 2 000 mg/kg p.c. après une exposition unique (Bayer, 1990; BESC, 2003; Pharmakon, 1993b; Goodyear Tire and Rubber Company, 1992b; WARF, 1959; Merriman, 1995a, b; Springborn Laboratories, 1995a). Aucune étude sur la toxicité aiguë par inhalation n’a été recensée. Des résultats contrastés ont été observés dans des études sur l’irritation de la peau et des yeux chez des lapins exposés au BENPAT (Bayer, 1991; Springborn Laboratories, 1995b; WARF, 1959). On a estimé que le BENPAT était un sensibilisant cutané d’après les faibles réactions de sensibilisation constatées dans le cadre de tests de maximalisation réalisés sur des cochons d’Inde (Springborn Laboratories, 1995c). Des réactions de sensibilisation similaires ont été observées chez des cochons d’Inde exposés à l’analogue, le BENPATAX (Merriman, 1995d). Il a également été démontré que le BENPATAX entraînait une irritation légère à modérée de la peau chez des lapins (Merriman, 1995b, c).
Niveau de confiance à l’égard de la base de données sur les effets sur la santé
Le niveau de confiance à l’égard de la base de données sur la toxicité dans le cas du BENPAT est jugé modéré, car des données empiriques ont été recensées. Cependant, aucune étude de toxicité par inhalation ou par voie cutanée à doses répétées n’a été recensée pour le BENPAT ou le BENTAX (ou encore le BENPATAX). Bien qu’aucune étude de toxicité pour la reproduction et le développement ni aucune étude sur l’exposition par voie orale à doses répétées n’ait été recensée pour le BENTAX précisément, les données déduites à partir de la base de données sur le BENPAT et le BENPATAX ont permis d’atteindre un niveau de confiance plus élevé afin de déterminer les effets potentiels du BENTAX sur la santé. Par conséquent, le niveau de confiance à l’égard de la base de données sur la toxicité dans le cas du BENTAX est jugé faible à modéré.
Caractérisation des risques pour la santé humaine
Aucune preuve de cancérogénicité n’a été observée dans plusieurs études de toxicité chronique chez des rats exposés par voie orale au BENPAT et à la substance analogue, le BENPATAX. Les renseignements dont on dispose indiquent que le BENPAT, le BENTAX et le BENPATAX ne sont vraisemblablement pas génotoxiques. Dès lors, la caractérisation des risques dans cette évaluation est fondée sur les effets non cancérogènes du BENPAT et du BENTAX.
Les données empiriques sur les effets sur la santé du BENPAT, du BENTAX et du BENPATAX indiquent un faible potentiel de risque aigu par voie orale et par voie cutanée. Les organes ciblés après une exposition par voie orale répétée au BENPAT et au BENPATAX concernaient toujours les systèmes urinaire et hématopoïétique. La dose minimale avec effet nocif observé a été détermine comme étant de 2,7 mg/kg p.c. de BENPAT par jour, d’après une augmentation importante de l’hyperplasie et de la prolifération des cellules urothéliales chez les rats. La concentration minimale à laquelle des modifications hématologiques ont été observées (augmentation du volume corpusculaire moyen, diminution de la teneur corpusculaire moyenne et du nombre de globules rouges) se chiffrait à 20 mg/kg p.c. par jour avec le BENPATAX administré par voie orale chez les rats; ces effets ont aussi été signalés pour le BENPAT et le BENPATAX à des doses de 95 et de 120 mg/kg p.c. par jour dans d’autres études sur la toxicité à court terme et la toxicité chronique.
Parmi les effets critiques figuraient des effets sur le plan de la reproduction et du développement. Un allongement de la durée de gestation chez les mères F1 et des lésions polykystiques dans les reins de rats sevrés F1 et F2 ont été observés chez des rats exposés à des doses de 6 mg/kg p.c. de BENPAT par jour (DMENO) dans le cadre d’une étude de toxicité pour la reproduction et le développement. L’exposition par voie orale à doses répétées de 20 mg/kg p.c. de BENPAT par jour a entraîné une diminution des capacités reproductives chez les mères, y compris des dystocies, une augmentation des pertes postimplantation, une baisse du nombre total de petits et de petits vivants et des mises bas tardives.
Il a été estimé que l’exposition environnementale au BENTAX était de l’ordre du nanogramme (10-9 mg)/kg p.c. par jour et qu’elle était par conséquent négligeable. L’exposition environnementale maximale estimée au BENPAT était de 0,63 µg/kg p.c. par jour (voir l’annexe IV). Le risque d’exposition de la population générale au BENPAT et au BENTAX par l’intermédiaire des produits de consommation est jugé négligeable étant donné qu’on ne ne s’attend pas à ce qu’une exposition fortuite par contact cutané avec des produits en caoutchouc ait lieu.
Une comparaison entre les concentrations associées à un effet critique pour les expositions à des doses répétées par voie orale (2,7, 6 et 20 mg/kg p.c. par jour) et la tranche supérieure des estimations de l’exposition à partir de toutes les sources d’exposition environnementale au BENPAT (de 0,06 à 0,63 µg/kg p.c. par jour) permet d’obtenir des marges d’exposition comprises entre 4 285 et 333 300 environ (voir l’annexe VI). Ces marges d’exposition sont jugées adéquates pour rendre compte des incertitudes liées aux bases de données concernant les effets sur la santé et l’exposition.
Incertitudes de l’évaluation des risques pour la santé humaine
Le niveau de confiance dans les estimations de l’exposition de la population générale au BENPAT et au BENTAX à partir des milieux naturels est faible. Aucune donnée concernant les concentrations de ces substances dans les milieux naturels n’a été relevée dans la littérature. Les valeurs maximales des quantités commercialisées ont été combinées aux pourcentages de l’outil de débit massique pour le modèle ChemCAN; ainsi, il est vraisemblable que les estimations modélisées de l’exposition environnementale soient prudentes. Les utilisations commerciales recensées pour le BENTAX et le BENPAT dans les recherches documentaires et en réponse à un avis publié en application de l’article 71 de la LCPE (1999), soit en tant qu’agents antiozonants et antioxydants dans les produits à base de caoutchouc, ne devraient pas être à l’origine d’une exposition de la population générale.
Certaines incertitudes existent quant à l’exposition au BENPAT et au BENTAX à partir des produits de consommation. Toutefois, les renseignements disponibles indiquent que l’exposition de la population générale à partir desdits produits de consommation est peu probable. Il y a aussi certaines incertitudes liées au potentiel d’utilisation secondaire de pneus, toutefois il n’y a pas suffisamment de données disponibles afin de caractériser le potentiel d’exposition associé à cette source.
Bien que des incertitudes subsistent concernant l’évaluation des effets sur la santé et de l’exposition pour le BENPAT et le BENTAX en raison des lacunes de la base de données, les marges entre la tranche supérieure des estimations de l’exposition dans les milieux naturels et les concentrations avec effet relevées chez les animaux de laboratoire sont adéquates pour tenir compte des incertitudes dans les bases de données des effets sur la santé et de l’exposition.
Selon les renseignements dont on dispose, le BENPAT pénètre ou peut pénétrer dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique. D’après les renseignements dont on dispose, le BENTAX ne pénètre pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique. De plus, les composants du BENPAT et du BENTAX répondent aux critères relatifs à la persistance énoncés dans le Règlement sur la persistance et la bioaccumulation, mais pas à ceux qui concernent le potentiel de bioaccumulation (Canada, 2000).
Selon les renseignements dont on dispose, le BENPAT et le BENTAX ne pénètrent pas en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur la vie et la santé humaines.
Sur la base des renseignements dont on dispose, il est conclu que le BENPAT satisfait à au moins un des critèresénoncés à l’article 64 de la LCPE (1999).
Comme le BENTAX figure sur la Liste intérieure des substances, son importation et sa fabrication au Canada ne sont pas visées par les dispositions du paragraphe 81(1). Vu les dangers écologiques que peut présenter cette substance, on craint qu’en raison de nouvelles activités qui n’ont pas été relevées ou évaluées, elle en vienne à remplir les critères énoncés à l’article 64 de la Loi. Par conséquent, il est recommandé de modifier la Liste intérieure, en application des dispositions du paragraphe 87(3) de la Loi, pour indiquer que les dispositions du paragraphe 81(3) de ladite Loi s’appliquent à cette substance de telle sorte qu’une nouvelle activité (fabrication, importation ou utilisation) relative au BENTAX soit annoncée dans un avis et fasse l’objet d’évaluations des risques pour l’environnement et des risques pour la santé humaine.
ACD/pKaDB [module de prévision]. 2005. Version 9.04. Toronto (Ont.) : Advanced Chemistry Development [consulté en janvier 2010]. [réserve de consultation].
[AHF] American Health Foundation. 1994. Preliminary Oral 3-Week Range-Finding Study for Administration of WINGSTAY 100 and R-59 in Male and Female Fischer 344 Rats, AHF Study R-1626 to The Goodyear Tire and Rubber Company. In : US EPA 2010.
[AHF] American Health Foundation. 1995. 32P Postlabeling Assay for Detection of Adduct Formation by WINGSTAY 100 and R-59 in Rat Liver and Urinary Bladder DNA, AHF Study No. 93-63 to The Goodyear Tire and Rubber Company. In : US EPA 2010.
[AHF] American Health Foundation. 1996a. Four-Week Dietary Study of WINGSTAY 100 in Fischer 344 Rats, rapport no AHF R1664. In : US EPA 2010.
[AHF] American Health Foundation. 1996b. 38-Week Accelerated Bioassay (ABA) of WINGSTAY 100 in Rats. In : US EPA 2010.
[AHF] American Health Foundation. 1996c. 52-Week Chronic Feeding Study of WINGSTAY 100 in Rats with 12-Week Recovery. Rapport no HF R1695. In : US EPA 2010.
[AHF] American Health Foundation. 1999. Unscheduled DNA Synthesis Assays (UDS) with Rat Hepatocytes on Wingstay 100 Condensation Products RWC-7703, RWX-7704, and RWC-7706. In : US EPA 2010.
Ambeland, J.C., et al. 1963. Rubber Chem. Technol. 36:1497. In : Kirk-Othmer Encyclopedia of Chemical Technology c.2010.
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d’estimation]. 2008. Version 1.92a. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
Andries, J.C., et al. 1979. Rubber Chem. Technol. 52:823. In : Kirk-Othmer Encyclopedia of Chemical Technology c.2010.
Andries, J.C., Ross, D.B., Diem, H.E. 1975. Rubber Chem. Technol. 48:41 (1975). In :Kirk-Othmer Encyclopedia of Chemical Technology c.2010.
[ARLA] Agence de réglementation de la lutte antiparasitaire. 2007. Note réglementaire REG 2007-04 : liste des produits de formulation de l’ARLA. Ottawa (Ont.) : Santé Canada, ARLA. [consultée le 17 mai 2010].
Arnot, J.A., Gobas, F.A.P.C. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb. Sci. 22(3):337-345.
Arnot JA et Gobas FAPC. 2006. A review of bioconcentration factor (BCF) and bioaccumulation factor (BAF) assessments for organic chemicals in aquatic organisms. Environ. Rev. 14:257-297.
Arnot, J.A., Mackay, D., Bonnell, M. 2008a. Estimating metabolic biotransformation rates in fish from laboratory data. Environ. Toxicol. Chem. 27(2):341–351.
Arnot, J.A., Mackay, D., Parkerton, T.F., Bonnell, M. 2008b. A database of fish biotransformation rates for organic chemicals. Environ. Toxicol. Chem. 27(11):2263-2270.
Arnot, J.A., Meylan, W., Tunkel, J., Howard, P.H., Mackay, D., Bonnell, M,. Boethling, R.S. 2009. A quantitative structure-activity relationship for predicting metabolic biotransformation rates for organic chemicals in fish. Environ. Toxicol. Chem. 28(6):1168-1177.
ASTreat Model [modèle d’élimination par les usines de traitement des eaux usées]. 2006. Version 1.0. Cincinnati (États-Unis) : Procter & Gamble Company. Disponible auprès de la Procter & Gamble Company, C.P. 538707, Cincinnati, Ohio, 45253-8707, États-Unis.
[BIOWIN] Biodegradation Probability Program for Windows [modèle d’estimation]. 2008. Version 4.10. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
Bayer, A.G. 1990. Rapport no 19778. In : US EPA 2010.
Bayer, A.G. 1991. Rapport no 19940. In : US EPA 2010.
[BDIM DPT] Base de données sur les ingrédients non médicinaux de la Direction des produits thérapeutiques [base de données exclusive]. 2010 [consultée en avril 2010]. Disponible auprès de Santé Canada, Division des produits thérapeutiques.
[BDIPSNH]. Base de données d’ingrédients de produits de santé naturels homologués [base de données sur Internet]. 2010. Ottawa (Ont.) : Santé Canada, Direction des produits de santé naturels. [consultée en avril 2010].
[BDPP] Base de données sur les produits pharmaceutiques [base de données sur Internet]. 2010. Ottawa (Ont.) : Santé Canada [consultée en avril 2010]. Recherche de produits pharmaceutiques en ligne.
[BESC] Bureau européen des substances chimiques. 2000. IUCLID Dataset for 1,4-Benzenediamine, N,N’-mixed Ph and tolyl derivs. Commission européenne.
[BESC] Bureau Européen des Substances Chimiques. 2003. IUCLID Dataset for 1,4-Benzenediamine, N,N’-mixed Ph and tolyl derivs. Commission européenne.
Beyer, A., Mackay, D., Matthies, M., Wania, F., Webster, E. 2000. Assessing long-range transport potential of persistent organic pollutants. Environ. Sci. Technol. 34(4):699-703.
Boethling, R.S., Howard, P.H., Beauman, J.A., Larosche, M.E. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere 30(4):741-752.
Boozer, C.E., Hammond, G.S., Sen, J.N. 1955. Air oxidation of hydrocarbons. II. The stoichiometry and fate of inhibitiors in benzene and chlorobenzene. J. Am. Chem. Soc. 77:3233-3237. In : Rapta, et al., 2009.
Cadle, S.H., Williams, R.L. 1978. Gas and particle emissions from automobile tires in laboratory and field studies. Rubber Chemistry and Technology 52:146-158.
Camatini, M., Crosta, G.F., Dolukhanyan, T., Sung, C, Guiliani, G., Corbetta, G.M., Cencetti, S., Regazzoni, C. 2001. Microcharacterization and identification of tyre debris in heterogeneouslaboratory and environmental specimens. Materials Characterization 46: 271-283. In : ChemRisk LLC 2009.
Canada. 1978. Règlement sur les aliments et drogues, C.R.C., ch. 870. Règlement sur les aliments et drogues.
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999), L.C. 1999, ch. 33, Gazette du Canada, Partie III, vol. 22, n° 3.
Canada. 2000. Loi canadienne sur la protection de l’environnement (1999) : Règlement sur la persistance et la bioaccumulation. C.P. 2000-348, 23 mars 2000, DORS/2000-107. Gazette du Canada, Partie II, vol. 134, n° 7.
Canada. Ministère de l’Environnement, ministère de la Santé. 2006. Loi canadienne sur la protection de l’environnement (1999) : Avis d’intention d’élaborer et de mettre en œuvre des mesures d’évaluation et de gestion des risques que certaines substances présentent pour la santé des Canadiens et leur environnement, Canada Gazette, Gazette du Canada, Partie I, vol. 140, n° 49.
Canada. Ministère de l’Environnement, ministère de la Santé. 2009a. Loi canadienne sur la protection de l’environnement (1999) : Avis de dixième divulgation d’information technique concernant les substances identifiées dans le Défi, Gazette du Canada, Partie I, vol. 143, n° 25.
Canada. Ministère de l’Environnement. 2009b. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant les substances du groupe 11 du Défi. Gazette du Canada, Partie I, vol. 143, n° 5.
Cardina, J.A. 1974. Particle size determination of tire-tread rubber in atmospheric dusts. Rubber Chemistry and Technology 47:1005-1010.
[CATABOL] Probabilistic assessment of biodegradability and metabolic pathways [modèle informatique]. c2004-2008. Version 5.10.2. Bourgas (Bulgarie) : Bourgas Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. CATALOGIC.
ChemCAN [Level III fugacity model of 24 regions of Canada]. 2003. Version 6.00. Peterborough (Ont.) : Trent University, Le centre canadien de modélisation et de chimie environnementales [consulté en mai 2010].
ChemRisk. 2008 Interim report of tire wear particle research. Pittsburgh (PA), San Francisco (CA) : ChemRisk Inc. 7 p.
ChemRisk, DIK. 2008. State of knowledge report for tire materials and tire wear particles. Pittsburgh (PA), San Francisco (CA) : ChemRisk Inc.; Hanovre (Allemagne) : DIK Inc. 41 p.
ChemRisk LLC. 2009. Tyre generic exposure scenario; Service life guidance. Version 1. Bruxelles (Belgique) : [ETRMA]. 14 p.
ChemRisk LLC. 2010. Tyre and general rubber goods generic exposure scenario; Emission factor guidance for formulation and industrial use. Version 2. Bruxelles (Belgique) : European Tyre and Rubber Manufacturers' Association [ETRMA]. 33 p. L'évaluation des risques.
[CHRIP] Chemical Risk Information Platform [base de données sur Internet]. c2008. Tokyo (Japon) : National Institute of Technology and Evaluation, Chemical Managemet Centre (CMC) [consulté en avril 2010]. Plate-forme d'information chimique sur les risques.
Commission européenne. 2000. IUCLID Dataset [1,4-Benzenediamine, N,N’-mixed Ph and tolyl derives]. No CAS 68953-84-4 [en ligne]. Year 2000 CD-ROM edition. Ispra (Italie) : Commission européenne, Centre commun de recherche, Institut pour la santé et la protection des consommateurs, Bureau Européen des Substances Chimiques [consulté en avril 2010].
Crebelli, R., Paoletti, A., Falcone, E., Aquilina, G., Fabri, G., Carere, A. 1985. Mutagenicity studies in a tyre plant: in vitro activity of workers’ urinary concentrates and raw materials. Br. J. Ind. Med. 42(7):481-7.
[ECOSAR] Ecological Structural Activity Relationships [en ligne]. 2008. Version 1.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
Environnement Canada. 1988. Données de la Liste intérieure des substances (LIS), 1984-1986, recueillies en vertu du paragraphe 25(1) de la LCPE, 1988, et conformément au guide de déclaration à la Liste intérieure des substances. Données produites par Environnement Canada.
Environnement Canada. 2005. Données pour certaines substances recueillies en vertu de la Loi canadienne sur la protection de l’environnement (1999), article 71 : Avis concernant certaines substances considérées comme priorités pour suivi. Gazette du Canada, Partie I, vol. 140, n° 9. Données recueillies par : Environnement Canada, Division de la mobilisation et de l’élaboration des programmes.
Environnement Canada. 2007. Guidance for Conducting Ecological Assessments under CEPA, 1999, Science Resource Technical Series, Technical Guidance Module: QSARs. Document de travail préliminaire révisé. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique.
Environnement Canada. 2008. Guidance for Conducting Ecological Assessments under CEPA, 1999, Science Resource Technical Series, Technical Guidance Module: Mass Flow Tool. Document de travail. Gatineau (Qc) : Environnement Canada, Division des substances existantes.
Environment Canada. 2009. Guidance for Conducting Ecological Assessments under CEPA, 1999, Science Resource Technical Series, Technical Guidance Module: Mega Flush Consumer Release Scenario. Document de travail. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique.
Environnement Canada. 2010a. Assumptions, limitations and uncertainties of the Mass Flow Tool for BENPAT. Document provisoire interne. No CAS 68953-84-4. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique.
Environnement Canada. 2010b. Assumptions, limitations and uncertainties of the Mass Flow Tool for BENTAX. Document provisoire interne. No CAS 68478-45-5. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique.
Environnement Canada. 2010c. Données sur les substances du lot 11 recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances identifiées dans le neuvième lot du Défi. Données recueillies par Environnement Canada, Division de la mobilisation et de l’élaboration des programmes.
Environnement Canada. 2011a. Site Specific Analysis Report: CAS RN 68953-84-4, 2011-02-18. Rapport inédit. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique.
Environnement Canada. 2011b. IGETA report: CAS RN 68478-45-5, 2011-02-18. Rapport inédit. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique.
Environnement Canada. 2011c. Mega Flush report: CAS RN 68953-84-4, 2011-02-18. Scenario 1. Rapport inédit. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique.
Environnement Canada. 2011d. Mega Flush report: CAS RN 68953-84-4, 2011-02-18. Scenario 2. Rapport inédit. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique.
[EPIsuite] Estimation Programs Interface Suite for Microsoft Windows [modèle d’estimation]. 2008. Version 4.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
[EQC] Equilibrium Criterion Model. 2003. Version 2.02. Peterborough (Ont.) : Trent University, Canadian Environmental Modelling Centre. Le centre canadien de modélisation et de chimie environnementales.
[ESIS] European Chemical Substances Information System [base de données sur Internet]. c1995-2009. Bureau Européen des Substances Chimiques (BESC) [consultée en avril 2010].
Fernandes et McCormack, inventeurs; E.I du Pont de Nemours and Company, cessionnaire. Le 14 décembre 1971. Diaryl-p-phenylenediamine stabilizers for peroxide-cured polyethelene. United States Patent 3,627,728.
[FS] Fiche signalétique. 2002a. Polystay 100AZ. Akron (OH) : Goodyear Tire and Rubber Company. MSDS Online [réserve de consultation].
[FS] Fiche signalétique. 2002b. Polystay 200. Akron (OH) : Goodyear Tire and Rubber Company. MSDS Online [réserve de consultation].
Goodyear Tire and Rubber Company. Le 15 décembre 1965. Complete specification: antiozonants for diene rubbers. Great Britain patent GB 1,012,945.
Goodyear Tire and Rubber Company. 1992a. Support: Initial Submission: Letter from Goodyear Tire and Rubber Co Submitting a Battery of Mutagenicity Studies with Nailax in Animals and Bacteria with Attachments. Doc.#88920005217, OTS0544191. Litton Bionetics Inc.
Goodyear Tire and Rubber Company. 1992b. Support: Initial Submission: Acute oral LD50 Assay in Rats (EPA-FIFRA). [Rapport définitif comprenant annexes et lettre d’accompagnement daté du 5 février 1992.] Doc.#88-920000842, OTS0535348. Food & Drug Res Labs.
Goodyear Tire and Rubber Company. 1992c. Initial Submission: Letter from Goodyear Tire and Rubber Co Submitting Three Mutagenicity Studies with Wingstay 100 AZ in Salmonella, Drosophila, and E. Coli. Doc #88-920005219, OTS0544193.
Goodyear Tire and Rubber Company. 1992d. Initial Submission: Letter from Goodyear Tire and Rubber Co Submitting a Battery of Mutagenicity Studies with Wingstay 200 in Salmonella Typhimurium and E. Coli with Attachments. Doc #88-920005220, OTS0544194.
Goodyear Tire and Rubber Company. 1996a. Support: Initial Submission: Letter from Goodyear Tire and Rubber Co to US EPA Re Pilot Study for Reproductive Toxicity Test in Rats, with Attachments & Dated 02/05/96. Doc# 88960000053, OTS0558447. Research Triangle Institute.
Goodyear Tire and Rubber Company. 2001. Support: Letter from Goodyear Tire and Rubber Co. to US EPA Submitting Two-Generation Reproductive Toxicity Evaluation and Mechanistic Study of Wingstay 100, w/Attchmts & Dated 1/10/01. Doc #89010000088, OTS05584472. Research Triangle Institute.
[HENRYWIN] Henry’s Law Constant Program for Microsoft Windows [modèle d’estimation]. 2008. Version 3.20. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
Hu, T.-M., Layton, W.L. 2001. Allometric scaling of xenobiotic clearance: uncertainty versus universality. AAPS PharmSci. 3(4) Article 29.
Huntink, N.M., Datta, R.N., Talma, A., Noordermeer, J.M.M. 2006. Ozonolysis of model olefins – efficiency of antiozonants. J. App. Polymer Sci. 100:853-866.
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [modèle d’estimation]. 2008. Version 2.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
Iatropoulos, M.J., Williams, G.M., Wang, C.X., Brunnemann, K.D., Leber, A.P. 1997. Assessment of chronic toxicity and carcinogenicity in rats of Wingstay®100, a rubber antioxidant/antiozonant. Experimental Toxicology and Pathology 49:153-165.
Iatropoulos, M.J., Wang, C.X., Brunnemann, K.D., Pittman, B.P, Hosey, J. 1998. Four week dietary study of Wingstay 200 in Fischer 344 rats. AHF Study R-1708. American Health Foundation, États-Unis. In :NICNAS, 2001.
Iatropoulos, M.J., Wang, C.X., Brunnemann, K.D., Hosey, J., Pittman, B.P. 2000. 52-Week chronic feeding toxicity study of Wingstay 200 in rats with a 12-week recovery, AHF Study R-1778. American Health Foundation, États-Unis. In :NICNAS, 2001.
Ignatz-Hoover, F., Byron, H.T., Datta, R.N., Arie J., de Hoog, Hutnik, N.M., Talma, A.G. 2003. Chemical additives migration in rubber. Rubber Chem. Toxicol. 76(3):747-767.
IUCLID Data Set [en ligne]. 2003. 1,4-benzenediamine, N,N’-mixed Ph and tolyl derivs. Washington (DC) : US Environmental Protection Agency. Fiche technique.
Jeffrey, A.M. 1999. Unscheduled DNA synthesis assays (UDS) with rat hepatocytes on Wingstay 200 and its components R-59, R-898 and R-6304. AHF Study No. 97-79B. American Health Foundation, États-Unis. In : NICNAS, 2001.
Kirk-Othmer Encyclopedia of Chemical Technology [en ligne]. c2010 [consulté le 22 avril 2010; mis à jour le 19 avril 2010]. Hoboken (NJ) : John Wiley & Sons, Inc. Kirk-Othmer l'encyclopédie des technologie chimique.
Kochi, J.K. (éditeur). 1973. Free radicals. Vol 2. New York (NY) : Wiley. p.51. In : Rapta, et al., 2009.
[KOCWIN] Organic carbon sorption coefficient program for soil and sediment [modèle d’estimation]. 2008. Version 2.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
Kollig, H.P. 1988. Criteria for evaluating the reliability of literature data on environmental process constants. Toxicol. Environ. Chem. 17:287-311.
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.67. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
Kreider, M.L., Panko, J.M., McAtee, B.L., Sweet, L.I., Finley, B.L. 2010. Physical and chemical characterization of tire-related particles: Comparison of particles generated using different methodologies. Science of the Total Environment 408: 652-659.
Lattimer, R.P., et al. 1980. Rubber Chem. Technol. 53:1170. In : Kirk-Othmer Encyclopedia of Chemical Technology, c2010.
Litton Bionetics Inc. 1979. Drosophila SLRL Assay with Nailax to The Goodyear Tire and Rubber Company. In : US EPA, 2010.
Lorenz, O., Parks, C.R. 1962. Titrimetric determination of N, ”-disubstituted p-Phenylenediamines. Anal. Chem. 34(3):394–396.
Lorenz, O., Parks, C.R. 1963a. Rubber Chem. Technol 36:194. In :Kirk-Othmer Encyclopedia of Chemical Technology, c2010.
Lorenz, O., Parks, C.R. 1963b. Rubber Chem. Technol. 36:201. In :Kirk-Othmer Encyclopedia of Chemical Technology, c2010.
MacAtee, B., Kreider, M., Panko, J., Sweet, L., Finley, B. ChemRisk. 2010. Evaluation of chemical leaching potential from roadway particles. Présenté à : Bridging Science and Communities, 31e réunion annuelle nord-américaine de la SETAC, du 7 novembre au 1er décembre, Portland (OR).
[MEEO] Ministère de l’Environnement et de l’Énergie de l’Ontario. 1994. The acute lethality to rainbow trout of water contaminated by an automobile tire. Toronto (Ont.) : Ministère de l’Environnement et de l’Énergie, Direction de l’élaboration des normes, Aquatic Toxicology Section. 32 p.
Merriman, T.H. 1995a. An acute oral toxicity study in rats with Wingstay 200. SLS Study No 3097.20. Springborn Laboratories, États-Unis. In :NICNAS, 2001.
Merriman, T.H. 1995b. An acute dermal toxicity study in rabbits with Wingstay 200. SLS Study No 3097.24. Springborn Laboratories, États-Unis. In :NICNAS, 2001.
Merriman, T.H. 1995c. A primary skin irritation study in rabbits with Wingstay 200. SLS Study No 3097.21. Springborn Laboratories, États-Unis. In :NICNAS, 2001.
Merriman, T.H. 1995d. A dermal sensitisation study in guinea pigs with Wingstay 200. SLS Study No 3097.25. Springborn Laboratories, États-Unis. In :NICNAS, 2001.
Miller, D.E., Dessent, R.W., Kuczkowski, J.L. 1985. Rubber World 193(1):39. In : Kirk-Othmer Encyclopedia of Chemical Technology, c2010.
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.43. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
[NCI] National Chemical Inventories [base de données sur CD-ROM]. 2009. Issue 2. Columbus (OH) : American Chemical Society [consultée le 21 avril 2010]. Inventaires chimiques nationaux.
Nichols, J.W., Fitzsimmons, P.N., Burkhard, L.P. 2007. In vitro – in vivo extrapolation of quantitative hepatic biotransformation data for fish. II. Modeled effects on chemical bioaccumulation. Environ. Toxicol. Chem. 26:1304-1319.
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme. 2001. Rapport complet public: 1,4-Benzenediamine, N,N’-Mixed phenyl et tolyl et dérivés d'xylyl (Wingstay 200) [en ligne]. Sydney (Australie) : Dept. of Health and Aged Care, NICNAS. 33 p.
[OASIS Forecast] Optimized Approach based on Structural Indices Set [en ligne]. 2005. Version 1.20. Bourgas (Bulgarie) : Bourgas Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. Logiciels OASIS.
[OCDE] Organisation de coopération et de développement économiques. 1995. Lignes directrices de l’OCDE pour les essais de produits chimiques : Méthode 105 – Hydrosolubilité. Adoptée le 27 juillet 1995.
[OCDE] Organisation de coopération et de développement économiques. 2004a. The 2004 list of high production volume chemicals. Paris (France) : OCDE, Division de l’environnement, de la santé et de la sécurité.
[OCDE] Organisation de coopération et de développement économiques. 2004b. Emission Scenario Document on textile manufacturing wool mills [en ligne]. Paris (France) : OCDE, Direction de l’environnement, Division de l’environnement, de la santé et de la sécurité. ENV/JM/EEA(2004)8, JT00175156.
[OCDE] Organisation de coopération et de développement économiques. 2004c. Emission Scenario Document on additives in Rubber industry [en ligne]. Paris (France) : OCDE, Direction de l’environnement, Division de l’environnement, de la santé et de la sécurité. ENV/JM/EEA(2004)11, JT00166913. Recherche de documents officiels de l'OECD.
[OCDE] Organisation de coopération et de développement économiques. 2004d. Emission Scenario Document on Plastics Additives [en ligne]. Paris (France) : OCDE, Direction de l’environnement, Division de l’environnement, de la santé et de la sécurité. ENV/JM/MONO(2004)8, JT00166678. Recherche de documents officiels de l'OECD.
Oser, B.L., Oser, M. 1956. Inhibitory effect of feed grade diphenyI-p-phenylenediamine (DPPD) on parturition in rats. Agric. Food Chem. 4(9):796–797.
[PCP] Power Chemical Corporation. 2008. Produits chimiques pour le caoutchouc : Antioxydant PA100. Jiangsu (Chine) : Power Chemical Corporation [consulté le 17 mai 2010].
Pharmakon USA. 1993a. Report # Ph309-GY-001-93 to The Goodyear Tire and Rubber Company. In : US EPA, 2010.
Pharmakon USA. 1993b. Report # Ph402-GY-001-93 to The Goodyear Tire and Rubber Company. In : US EPA, 2010.
Pierson, W.R., Brachaczek, W.W. 1974. Airborne particulate debris from rubber tires. Rubber Chemistry and Technology 47:1275-1299.
Présentation de projet d’études. 1998. Projet non publié et confidentiel (no CAS 68953-83-3) présenté à Environnement Canada, selon la Loi canadienne sur la protection de l’environnement (1999) : Règlement sur les renseignements concernant les substances nouvelles. Gatineau (Qc) : Environnement Canada.
Présentation de projet d’études. 2010a. Résumé de projet non publié et confidentiel (no CAS 68953-84-4) présenté à Environnement Canada, selon le Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l’élaboration de programmes. 25 p.
Présentation de projet d’études. 2010b. Projet non publié et confidentiel (no CAS 68953-84-4) présenté à Environnement Canada, selon le Plan de gestion des produits chimiques. Gatineau (Qc) : Environment Canada, Division de la mobilisation et de l’élaboration des programmes. Présentation datée du 8 juin 2010.
Présentation de projet d’études. 2010c. Projet non publié et confidentiel (no CAS RN 68953-84-4) présenté à Environnement Canada, selon le Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l’élaboration des programmes. Présentation datée du 22 juillet 2010.
Rapta, P., Vargová , A., Polovková , J., Gatial, A., Omelka, L., Majzlik, Breza, M. 2009. A variety of oxidation products of antioxidants based on N,N’-substituted p-phenylenediamines. Polym. Degrad. Stab. 94:1457-1466.
Reddy, C.M., Quinn, J.G. 1997. Environmental chemistry of benzothiazoles derived from rubber. Environ. Sci. Technol. 31:2847–2853.
Research Triangle Institute. 1998a. Metabolism and excretion of [14C]R-1679 (as a major component of Wingstay 100) in bile of male rats after a single oral dose. Research Triangle Park (NC) : Research Triangle Institute.
Research Triangle Institute. 1998b. Metabolism and excretion of [14C]R-898 (as a major component of Wingstay 100) in urine, feces and bile of male rats after a single oral dose. Research Triangle Park (NC) : Research Triangle Institute.
Rotschová , J., Pospíšil, J. 1981. New aspects of the mechanism of action of arylamine stabilizers. Chemistry and Industy 11:393-394.
SanSebastian, J.R. 1994. In vitro chromosomal aberration analysis of Wingstay 200 in Chinese hamster ovary (CHO) cells, Pharmakon Study No. PH 302-GY-002-93. Pharmakon (É.-U.) In :NICNAS, 2001.
Santé Canada. 1994. L’évaluation du risque à la santé humaine des substances d’intérêt prioritaire. Ottawa (Ont.) : Santé Canada, Direction de l’hygiène du milieu.
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Ottawa (Ont.) : Santé Canada, Direction de l’hygiène du milieu.
Santé Canada. 2009. Liste critique des ingrédients dont l’utilisation est restreinte ou interdite dans les cosmétiques – septembre 2009 [en ligne]. Ottawa (Ont.) : Santé Canada, Sécurité des produits de consommation [consultée le 14 mai 2010].
[SBSC] Santé et Bien-être social Canada. 1990. L’allaitement maternel au Canada : pratiques et tendances. No de catalogue H39-199/1990F; ISBN 0-662-18397-5. Ottawa (Ont.) : Santé et Bien-être social Canada. 9 p. In : Santé Canada, 1998.
[SDC] Système de déclaration des cosmétiques [base de données exclusive]. 2010. Disponible auprès de Santé Canada, Division des cosmétiques.
SimpleTreat [modèle d’élimination par les usines de traitement des eaux usées]. 1997. Version 3.0. Bilthoven (Pays-Bas) : National Institute for Public Health and the Environment (RIVM). Disponible auprès du : National Institute for Public Health and the Environment (RIVM), Laboratory for Ecological Risk Assessment, C.P. 1, 3720 BA Bilthoven (Pays-Bas).
Spies, R.B., Andresen, B.D., Rice, D.W. 1987. Benzthiazoles in estuarine sediments as indicators of street runoff. Nature 327:697-699.
[SPIN] Substances in Preparations in Nordic Countries [base de données sur Internet]. 2006. Copenhague (Danemark) : Conseil des ministres des pays nordiques [consultée en avril 2010]. Substances dans les préparations dans les pays nordiques.
Springborn Laboratories. 1995a. An Acute Toxicity Study in Rabbits with WINGSTAY 100 (Limit Test), rapport no S94-001-3097.29 to The Goodyear Tire and Rubber Company. In : US EPA, 2010.
Springborn Laboratories. 1995b. A Primary Eye Irritation Study in Rabbits with WINGSTAY 100, rapport no 3097.27 to The Goodyear Tire and Rubber Company. In : US EPA, 2010.
Springborn Laboratories. 1995c. A Dermal Sensitization Study in Guinea Pigs with WINGSTAY 100 – Maximization Design, rapport no 3097.30 to The Goodyear Tire and Rubber Company. In : US EPA, 2010.
Springborn Laboratories. 2004. Terrestrial field soil dissipation study with [14C]R-898, component of Wingstay® 100. Rapport final. Wareham (MA) : Springborn Laboratories, Inc. 160 p. Présenté à Environnement Canada, selon le Plan de gestion des produits chimiques, 15 novembre 2010.
Stankowski, L.F. 1998. Ames/Salmonella-E. coli liquid pre-incubation assay on Wingstay 200. Pharmakon Study No. PH 301-GY-005-93. Pharmakon (É.-U.) In :NICNAS, 2001.
Stephensen, E., Adolfsson-Erici, M., Celander, M., Hulander, M., Parkkonen, J., Hegelund, T., Sturve, J., Hasselberg, L., Bengtsson, M., Förlin, L. 2003. Biomarker responses and chemical analyses in fish indicate leakage of polycyclic aromatic hydrocarbons and other compounds from car tire rubber. Environ. Toxicol. Chem. 22:2926–2931.
[TaPL3] Long Range Transport and Persistence Level III model [en ligne]. 2000. Version 2.10. Peterborough (Ont.) : Trent University, Canadian Environmental Modelling Centre. Le centre canadien de modélisation et de chimie environnementales.
[TOPKAT] TOxicity Prediction by Komputer Assisted Technology [en ligne]. 2004. Version 6.2. San Diego (CA) : Accelrys Software Inc.
[TradingChem] TradingChem Group Ltd. 2008. R.T. Vanderbilt Co. Inc. [consulté le 17 mai 2010].
Tyl, R.W. 1996. Developmental toxicity evaluation of Wingstay 200 administered by gavage to CD rats. RTI No 65C-6429-100/300. Research Triangle Institute (É.-U.) In :NICNAS, 2001.
Umeniwa, K., Matsuda, T., Maeda, M., Miyazaki, K., Arita, T. 1985. Biological fate of N,N’-diphenyl –p-phynylenediamine. Yakugaku Zasshi – J Pharm Soc Jpn 105(1):65 – 76.
[US EPA] United States Environmental Protection Agency. 2007. Emission scenario document on adhesive formulation [Internet]. Rapport final. Paris (France) : OCDE, Direction de l’environnement (Series on Emission Scenario Documents).
[US EPA] United States Environmental Protection Agency. 2009. High Production Volume Information System (HPVIS) [en ligne]. Washington (DC) : US EPA, Office of Pollution Prevention and Toxics. Système d'information sur la production à volume élevé [consulté en avril 2010].
[US EPA] United States Environmental Protection Agency. 2010. High Production Volume Information System (HPVIS). Detailed Chemical Results for 1,4-Benzenediamine, N,N’-mixed Ph and tolyl derivs. Système d'information sur la production à volume élevé .
Veith, A.G. 1992. A review of important factors affecting tread wear. Rubber Chem Technol 65: 601-658. In : ChemRisk LLC, 2009.
[WARF] Wisconsin Alumni Research Foundation. 1959. Acute Toxicity of WINGSTAY 100 to the Goodyear Tire and Rubber Company. In : US EPA, 2010.
[WATERNT] Water Solubility Program [modèle d’estimation]. 2008. Version 1.01. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
Wik, A. 2007. Toxic components leaching from tire rubber. Bull. Environ. Contam. Toxicol. 79:114-119.
Wik, A., Dave, G. 2009. Occurrence and effects of tire wear particles in the environment – A critical review and an initial risk assessment. Environmental Pollution 157:1-11.
[WSKOWWIN] Water Solubility for Organic Compounds Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.41. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
XingChun Chemical Corporation. c2006. Antioxidant DTPD (3100) [fiche sur le produit en ligne]. Jurong Chuncheng Town (Chine) : Xcchem [consultée le 2 juin 2010].
Zeng, E.Y., Tran, K., Young, D. 2004. Evaluation of potential molecular markers for urban stormwater runoff. Environmental Monitoring and Assessment 90:23-43.
Sommaire de rigueur d’étude : Évaluation du potentiel de bioaccumulation aquatique
| No | Article | Poids | Oui/Non | Préciser |
|---|---|---|---|---|
| 1 | Référence : Présentation de projet d’études. 2010b. Projet non publié et confidentiel (no CAS 68953-84-4) présenté à Environnement Canada, selon le Plan de gestion des produits chimiques. Gatineau (Qc) : Environment Canada, Division de la mobilisation et de l’élaboration des programmes. Présentation datée du 8 juin 2010. Essai de bioaccumulation chez la carpe – Rapport final |
|||
| 2 | Identité de la substance : no CAS | s.o. | ||
| 3 | Identité de la substance : nom(s) chimique(s) | s.o. | ||
| 4 | Composition chimique de la substance | 2 | O | |
| 5 | Pureté chimique | 1 | O | 100 % |
| 6 | Indication de la persistance/stabilité de la substance en milieu aqueux? | 1 | O | On a confirmé que la substance d’essai était stable dans ces conditions d’essai et de stockage. |
| 7 | Si le matériel d’essai est radiomarqué, est-ce que la ou les positions précises du ou des atomes marqués ainsi que le pourcentage de radioactivité associé aux impuretés ont été rapportés? | 2 | s.o. | |
| Méthode | ||||
| 8 | Référence | 1 | O | Norme industrielle japonaise : Méthode pour tester le niveau d’accumulation des substances chimiques dans le corps des poissons (méthode pour l’essentiel identique aux Lignes directrices de l’OCDE pour les essais de produits chimiques et la bioaccumulation (Ligne directrice no 305C) |
| 9 | Méthode normalisée (OCDE, UE, nationale, ou autre)? | 3 | O | Méthode de la norme industrielle japonaise |
| 10 | Justification de la méthode ou du protocole non normalisé employé, le cas échéant | 2 | s.o. | |
| 11 | BPL (bonnes pratiques de laboratoire) | 3 | O | |
| Organisme d’essai | ||||
| 12 | Identité de l’organisme : nom | s.o. | carpe | |
| 13 | Indication du nom latin ou des deux noms (latin et commun)? | 1 | O | Cyprinus carpio |
| 14 | Âge ou stade biologique de l’organisme d’essai | 1 | O | D’après la longueur et le poids des poissons ainsi que leur alimentation, on peut déduire qu’il s’agissait de poissons juvéniles. |
| 15 | Longueur et/ou poids | 1 | O | poids = 22,9 g longueur moyenne = 9,7 cm |
| 16 | Sexe | 1 | s.o. | |
| 17 | Nombre d’organismes par répétition | 1 | O | 20 poissons par niveau pour les niveaux 1 et 2, 5 pour le groupe témoin |
| 18 | Charge en organismes | 1 | N | |
| 19 | Type de nourriture et périodes d’alimentation pendant la période d’acclimatation | 1 | O | |
| Conception et conditions des essais | ||||
| 20 | Type d’expérience (en laboratoire ou sur le terrain) | s.o. | Laboratoire | |
| 21 | Voies d’exposition (nourriture, eau, les deux) | s.o. | Eau | |
| 22 | Durée de l’exposition | s.o. | 8 semaines | |
| 23 | Nombre de répétitions (y compris les témoins) | 1 | O | Deux concentrations testées, 20 poissons par concentration, 5 poissons dans le groupe témoin |
| 24 | Concentrations | 1 | 0,05 mg/L et 0,005 mg/L | |
| 25 | Type/composition de la nourriture et périodes d’alimentation (pendant l’essai) | 1 | O | |
| 26 | Si le rapport FBC/FBA a été utilisé comme dérivé de la concentration du produit chimique dans l’organisme et dans l’eau, estce que la durée de l’expérimentation était égale ou plus longue que le temps requis pour que la concentration du produit chimique atteigne un état stable? | 3 | O | La durée de dépuration pour le composé « e » était de 5,7 jours pour l’exposition de niveau 1 et de 44,4 jours pour l’exposition de niveau 2 |
| 27 | Si le rapport FBC/FBA a été déterminé comme correspondant au rapport de la concentration du produit chimique dans l’organisme sur sa concentration dans l’eau, est-ce que les concentrations mesurées dans l’organisme et dans l’eau étaient mentionnées? | 3 | ||
| 28 | Les concentrations dans les eaux d’essai ont-elles été mesurées périodiquement? | 1 | O | Une fois par semaine (tableau 1) |
| 29 | Les conditions du milieu d’exposition pertinentes pour la substance sont-elles indiquées? (p. ex. : pour la toxicité des métaux – pH, COD/COT, dureté de l’eau, température) | 3 | O | |
| 30 | Photopériode et intensité de l’éclairage | 1 | O | |
| 31 | Préparation de solutions mères et de solutions d’essai | 1 | O | |
| 32 | Intervalles des contrôles analytiques | 1 | O | |
| 33 | Méthodes statistiques utilisées | 1 | Y | |
| 34 | Un agent émulsionnant ou stabilisant a-t-il été employé si la substance était peu soluble ou instable? | s.o. | O | tétrahydrofurane (20 fois la quantité de la substance d’essai) |
| Renseignements d’intérêt pour la qualité des données | ||||
| 35 | L’organisme d’essai correspondait-il à l’environnement canadien? | 3 | O | |
| 36 | Les conditions d’essai (pH, température, OD, etc.) sont-elles typiques pour l’organisme d’essai? | 1 | O | |
| 37 | Le type et la conception du système (statique, semi-statique, dynamique; ouvert ou fermé; etc.) correspondent-ils aux propriétés de la substance et à la nature ou aux habitudes de l’organisme? | 2 | O | |
| 38 | Le pH de l’eau d’essai était-il dans la plage des valeurs typiques de l’environnement au Canada (6 à 9)? | 1 | O | 7,9 à 8 |
| 39 | La température de l’eau d’essai était-elle dans la plage des valeurs typiques de l’environnement au Canada (5 à 27 oC)? | 1 | O | 25 +/- 2 |
| 40 | Est-ce que le contenu en lipides (ou FBA/FBC normalisé par rapport aux lipides) a été indiqué? | 2 | O | 3,6 % en moyenne |
| 41 | Est-ce que les concentrations mesurées d’un produit chimique dans les eaux d’essai étaient plus basses que la solubilité du produit? | 3 | O | |
| 42 | Si une substance radiomarquée a été utilisée, est-ce que le FBC a été déterminé d’après le composé d’origine (et non d’après les résidus radiomarqués)? | 3 | s.o. | |
| Résultats | ||||
| 43 | Les paramètres déterminés (FBA, FBC) et leurs valeurs | s.o. | s.o. | FBC |
| 44 | FBA ou FBC déterminés comme : 1) le rapport de la concentration en produit chimique produit dans l’organisme, ou 2) le rapport entre les constantes d’incorporation de produit chimique et du taux d’élimination | s.o. | s.o. | (2) |
| 45 | Le FBA/FBC a-t-il été déterminé d’après un 1) échantillon de tissu ou 2) l’organisme entier? | s.o. | s.o. | (2) |
| 46 | Le FBA/FBC utilisé était-elle la valeur 1) moyenne ou 2) maximale? | s.o. | s.o. | Les valeurs maximales (des fourchettes sont présentées). |
| 47 | Note : % | 97,7 | ||
| 48 | Code de fiabilité d’Environnement Canada : | 1 | ||
| 49 | Catégorie de fiabilité (élevée, satisfaisante, faible) : | Confiance élevée | ||
Sommaire de rigueur d’étude : Évaluation des données expérimentales sur la solubilité dans l’eau selon la méthode de Kollig[*]
| Élément | Pondération | Réponse | Note |
|---|---|---|---|
| Référence : Présentation de projet d’études. 1998. Projet non publié et confidentiel (no CAS 68953-83-3) présenté à Environnement Canada, selon la Loi canadienne sur la protection de l’environnement (1999) : Règlement sur les renseignements concernant les substances nouvelles. Gatineau (Qc) : Environnement Canada. Détermination de la solubilité dans l’eau |
|||
| Substance d’essai : No CAS : 68953-83-3 | |||
| Pourriez-vous répéter l’expérience avec les renseignements disponibles? | 5 | Assez bien | 2,5 |
| Un objectif clair est-il énoncé? | 1 | Oui | 1 |
| La qualité de l’eau est-elle caractérisée ou définie (distillée ou désionisée)? | 2 | Oui (eau à réactifs obtenue à l’aide d’un dispositif Sybron/Barnstead NANOpure II) |
2 |
| Les résultats sont-ils présentés de façon détaillée, claire et compréhensible? | 3 | Passable Les détails concernant les calculs utilisés pour établir la solubilité générale dans l’eau de la substance (à partir des composés principaux et mineurs) ne sont pas fournis. |
1,5 |
| Les données proviennent-elles d’une source principale et non d’un article cité? | 3 | Source principale | 3 |
| La substance chimique a-t-elle été testée à des concentrations inférieures à sa limite de solubilité dans l’eau? | 5 | s.o. | s.o. |
| Y avait-il absence de particules? | 2 | Non indiqué (la taille des pores du filtre n’était pas indiquée) |
0 |
| A-t-on fait un essai avec une substance de référence ayant une constante connue? | 3 | Deux séries de substances de références ont été analysées par CLHR et UV avec les échantillons | 3 |
| D’autres processus intervenant dans le devenir ont-ils été pris en considération? | 5 | s.o. | s.o. |
| A-t-on fait un essai témoin (à blanc)? | 3 | s.o. | s.o. |
| La température a-t-elle été maintenue constante? | 5 | Oui (à environ 20 oC) | 5 |
| L’expérience a-t-elle été réalisée à une température presque ambiante (15 à 30 oC)? | 3 | Oui | 3 |
| La pureté de la substance est-elle précisée (> 98 %)? | 3 | Oui (100 %) |
3 |
| L’identité de la substance a-t-elle été attestée? | 3 | Oui | 3 |
| La source de la substance est-elle indiquée? | 1 | Oui | 1 |
| Résultats : (X±SE) | |||
| Solubilité (dans l’eau) : la solubilité moyenne dans l’eau était de 1,02 mg/L. | |||
| Note globale : | 82 % | ||
| Degré de fiabilité[**] | Confiance élevée | ||
[**] Le code de fiabilité pour les études écotoxicologiques de la catégorisation dans la LIS est utilisé.
Annexe II : Tableau sommaire des intrants des modèles de la persistance, de la bioaccumulation et de la toxicité
Devenir et propriétés physiques et chimiques
Intrants d’EPIsuite (2008) (tous les modèles, notamment AOPWIN, KOCWIN, BCFWIN, BIOWIN et ECOSAR)
| Structure | Code SMILES |
|---|---|
| Structure 1 | N(C1=CC=CC=C1)C1=CC=C(NC2=CC=CC=C2)C=C1 |
| Structure 2 | CC1=C(NC2=CC=C(NC3=CC=CC=C3)C=C2)C=CC=C1 |
| Structure 3 | CC1=CC=CC=C1NC1=CC=C(NC2=CC=CC=C2C)C=C1 |
| Structure 4 | CC1=CC=C(NC2=CC=C(NC3=CC=CC=C3C)C=C2)C(C)=C1 |
| Structure 5 | CC1=CC=C(NC2=CC=C(NC3=CC=C(C)C=C3C)C=C2)C(C)=C1 |
Devenir
EQC (2003) (intrants de type I)
| Paramètre | BENPAT | BENTAX | Structure 1 | Structure 2 | Structure 3 | Structure 4 | Structure 5 |
|---|---|---|---|---|---|---|---|
| Masse moléculaire (g/mol) | 274,35 | 302[1] | 260,31 | 274,36 | 288,39 | 302,41 | 316,44 |
| Point de fusion (oC) | 90 à 105 | 60 | 154 | 130 | 135,5 | 168,91 | 179,02 |
| Température (en oC) | 25 | 20[1] | 22,8 | 25 | 25 | 25 | 25 |
| Pression de vapeur (Pa) | 1 x 10-5 | 1 x 10-5 | 7,65 x 10-5 | 3,06 x 10-5 | 1,42 x 10-5 | 5,65 x 10-6 | 2,23 x 10-6 |
| Log Koe | 3,3 à 4,6 | 4,56[1] | 3,3 | 3,9 | 4,6 | 4,42 | 4,56 |
| Solubilité dans l’eau (mg/L) | 2,2 | 1,021 | 0,13 | 0,11 | 0,045 | 0,0489 | 0,0153 |
TaPL3 (2000)
| Paramètre | BENPAT | BENTAX |
|---|---|---|
| Type de substance chimique | 1 | 1 |
| Masse moléculaire (g/mol) | 288,39 | 316,44 |
| Point de fusion (oC) | 105 | 60 |
| Température (oC) | 20 | 20 |
| Pression de vapeur (Pa) | 1 x 10-5 | 1 x 10-5 |
| Log Koe | 4,6 | 4,56 |
| Solubilité dans l’eau (mg/L) | 2,2 | 1,02 |
| Demi-vie de réaction dans l’air (h) | 0,6 | 0,6 |
| Demi-vie de réaction dans l’eau (h) | 4 368 | 4 368 |
| Demi-vie de réaction dans le sol (h) | 4 368 | 4 368 |
| Demi-vie de réaction dans les sédiments (h) | 8 760 | 8 760 |
| Demi-vie de réaction dans les sédiments en suspension (h) | 4 368 | 4368 |
| Demi-vie de réaction dans le poisson (h) | 4 368 | 4 368 |
| Demi-vie de réaction dans les aérosols (h) | 1 x 1011 | 1 x 1011 |
Annexe III : Quantités de pertes pour le BENTAX et le BENPAT et concentrations environnementales estimées d’après ces quantités
Pertes de BENTAX et de BENPAT d’après les valeurs intermédiaires de la gamme générée par l’outil de détermination du débit massique
| Substance | Forme de pertes | Milieu récepteur | Volume (kg/année) |
|---|---|---|---|
| BENTAX | Eaux usées | Eau | 22,5 |
| Émissions atmosphériques | Air | 0,5 | |
| Décharges | Sol | 947,5 | |
| BENPAT | Eaux usées | Eau | 600 000 |
| Sols | Sol | 550 000 | |
| Émissions atmosphériques | Air | 5 000 | |
| Décharges | Sol | 1 295 000 |
Estimation des concentrations de BENTAX et de BENPAT dans les milieux naturels à l’aide du modèle ChemCAN, v. 6.00 (ChemCAN, 2003)[1]
| Substance | Milieu | Concentration |
|---|---|---|
| BENTAX | Air[2] | 0,0622 ng/m3 |
| Eau[3] | 3,05 ng/L | |
| Sol[3] | 55,2 ng/g de solides | |
| Sédiments[3] | 104 ng/g de solides | |
| BENPAT | Air[2] | 0,0635 ng/m3 |
| Eau[3] | 5 361 ng/L | |
| Sol[3] | 14 694 ng/g de solides | |
| Sédiments[3] | 16 838 ng/g de solides |
[2] Les demi-vies par oxydation atmosphérique ont été estimées en utilisant AOPWIN v1.92 (AOPWIN, 2008).
[3] En raison de la persistance dans l’eau, le sol et les sédiments, la dégradation dans ces milieux environnementaux a été jugée négligeable.
Annexe IV : Tranche supérieure des estimations de l’absorption quotidienne de BENPAT pour divers groupes d’âge (µg/kg p.c. par jour
Tranche supérieure des estimations de l’absorption quotidienne de BENPAT pour divers groupes d’âge
| Voie d’exposition | 0 à 0,5 an[1], [2], [3] | 0,5 à 4 ans[4] | 5 à 11 ans[5] | 12 à 19 ans[6] | 20 à 59 ans[7] | 60 ans et plus[8] | ||
|---|---|---|---|---|---|---|---|---|
| Nourris au lait maternel | Nourris au lait maternisé | Pas nourris au lait maternisé | ||||||
| Air[9] | 1,78 × 10-5 | 1,78 × 10-5 | 1,78 × 10-5 | 3,81 × 10-5 | 2,97 × 10-5 | 1,69 × 10-5 | 1,45 × 10-5 | 1,26 × 10-5 |
| Eau potable[10] | s.o. | 5,72 × 10-1 | 2,14 × 10-1 | 2,42 × 10-1 | 1,90 × 10-1 | 1,08 × 10-1 | 1,13 × 10-1 | 1,19 × 10-1 |
| Aliments et boissons[11] | s.o. | s.o. | s.o. | s.o. | s.o. | s.o. | s.o. | s.o. |
| Sol[12] | 5,88 × 10-2 | 5,88× 10-2 | 5,88 × 10-2 | 9,48 × 10-2 | 3,08 × 10-2 | 7,42 × 10-3 | 6,22 × 10-3 | 6,12 × 10-3 |
| Absorption totale | 5,88 × 10-2 | 6,31× 10-1 | 2,73 × 10-1 | 3,37 × 10-1 | 2,21 × 10-1 | 1,16 × 10-1 | 1,20 × 10-1 | 1,25 × 10-1 |
[1] Aucune donnée n’a été déterminée pour les concentrations de BENPAT dans le lait maternel.
[2] On présume que le nourrisson pèse 7,5 kg, respire 2,1 m3 d’air par jour, boit 0,8 L d’eau par jour (lait maternisé) ou 0,3 L d’eau par jour (lait non maternisé) et ingère 30 mg de sol par jour (Santé Canada, 1998).
[3] Dans le cas des enfants uniquement nourris au lait maternisé, l’absorption par l’eau correspond à l’absorption par la nourriture. On n’a répertorié aucune donnée sur les concentrations de BENPAT dans l’eau potable ou le lait maternisé pour le Canada. La concentration de BENPAT dans l’eau potable a été estimée à l’aide du modèle ChemCAN v6.00 à 5 361 ng/L (ChemCAN, 2003). En ce qui concerne les enfants non nourris au lait maternisé, 50 % d’entre eux ont commencé à manger des aliments solides à 4 mois et 90 % ont commencé à 6 mois (SBSC, 1990).
[4] En supposant que l’enfant pèse 15,5 kg, qu’il respire 9,3 m3 d’air par jour, qu’il boive 0,7 L d’eau par jour et qu’il ingère 100 mg de sol par jour (Santé Canada, 1998).
[5] En supposant que l’enfant pèse 31 kg, qu’il respire 14,5 m3 d’air par jour, qu’il boive 1,1 L d’eau par jour et qu’il ingère 65 mg de sol par jour (Santé Canada, 1998).
[6] En supposant que le jeune pèse 59,4 kg, qu’il respire 15,8 m3 d’air par jour, qu’il boive 1,2 L d’eau par jour et qu’il ingère 30 mg de sol par jour (Santé Canada, 1998).
[7] En supposant que la personne pèse 70,9 kg, qu’elle respire 16,2 m3 d’air par jour, qu’elle boive 1,5 L d’eau par jour et qu’elle ingère 30 mg de sol par jour (Santé Canada, 1998).
[8] En supposant que la personne pèse 72,0 kg, qu’elle respire 14,3 m3 par jour, qu’elle boive 1,6 L d’eau par jour et qu’elle ingère 30 mg de sol par jour (Santé Canada, 1998).
[9]Aucune donnée n’a été déterminée pour les concentrations de BENPAT dans l’air. La concentration de BENPAT dans l’air a été estimée à l’aide du modèle ChemCAN, v.6.00, à 0,0635 ng/m3 (ChemCAN, 2003).
[10] Aucune donnée n’a été déterminée pour les concentrations de BENPAT dans l’eau potable. La concentration de BENPAT dans l’eau potable a été estimée à l’aide du modèle ChemCAN, v. 6.00, à 5 361 ng/L (ChemCAN, 2003).
[11] Aucune donnée n’a été déterminée pour les concentrations de BENPAT dans les aliments ou les boissons.
[12] Aucune donnée n’a été déterminée pour les concentrations de BENPAT dans le sol. La concentration de BENPAT dans le sol a été estimée à l’aide du modèle ChemCAN, v.6.00, à 14 694ng/g de solides (ChemCAN, 2003)
Annexe V : Résumé des données relatives aux effets du BENPAT, du BENTAX et de l’analogue, le BENTAPAX
| Paramètre | Doses ou concentrations minimales avec effet1/Résultats |
|---|---|
| Toxicité aiguë | BENPAT (n° CAS 68953-84-4) DL50 minimale par voie orale (rat) > 2 000 mg/kg p.c. (Bayer AG, 1990; BESC, 2003) Autre DL50 par voie orale (rat) > 4 000 à 5 000 mg/kg p.c. (Pharmakon, 1993b; WARF, 1959) DL50 par voie cutanée (lapin) > 2 000 mg/kg p.c. (Springborn Laboratories, 1995a; BESC, 2003) BENTAX (n° CAS 68478-45-5) DL50 minimale par voie orale (rat) > 6 130 mg/kg p.c. (Goodyear Tire and Rubber Company, 1992b) BENPATAX (analogue, n° CAS 68953-83-3) DL50 par voie orale (rat) = entre 2 000 mg/kg p.c. et 5 000 mg/kg p.c. (Merriman, 1995a) DL50 par voie cutanée (lapin) > 2 000 mg/kg p.c. (Merriman, 1995b) Aucune étude d’exposition par inhalation n’a été recensée. |
| Toxicité court terme en doses répétées | BENPAT (n° CAS 68953-84-4) DMEO la plus faible par voie orale = 7,5 mg/kg p.c. par jour d’après l’augmentation de la prolifération des cellules urothéliales de la vessie chez des rats Fischer 344 (14 rats/sexe/groupe) des deux sexes exposés dans leur alimentation à des doses de 0, 7,5, 30 ou 120 mg/kg p.c. pendant 4 semaines. Une augmentation du poids du foie et des reins a pu être constatée chez les femelles exposées à la dose moyenne et les mâles exposés à la dose élevée, tout comme une augmentation du poids du cœur et de la rate ainsi qu’une diminution du poids corporel chez les femelles exposées à la dose élevée (accompagnée d’une baisse de la consommation d’aliments). Une augmentation de la division cellulaire dans le foie et une diminution de cette dernière dans les reins ont également pu être observées (mâles exposés à la dose moyenne et mâles et femelles exposés à la dose élevée). Des signes hématologiques réversibles (y compris une augmentation du volume corpusculaire moyen et une baisse de la teneur corpusculaire moyenne en hémoglobine) et des modifications des valeurs de chimie clinique (y compris une augmentation des taux de bilirubine et de cholestérol dans le sang) sont apparus chez les groupes exposés à la dose élevée. Les auteurs de cette étude ont jugé que la DMNEO pour cette étude était de 30 mg/kg p.c., d’après l’augmentation de la prolifération des cellules urothéliales dans la vessie chez les deux sexes et l’augmentation du poids du foie et des reins chez les femelles exposées à la dose moyenne (AHF, 1996a). Autre DMEO par voie orale = 100 mg/kg p.c. par jour, d’après la diminution fortement liée à la dose du poids corporel, l’augmentation du poids du foie et de l’indice de marquage hépatocellulaire (0,1 g/kg) chez des rats Fischer 344/N TacfBR des deux sexes exposés par gavage à des doses de BENPAT de 0, 100, 300, 1 000 ou 3 000 mg/kg p.c. par jour pendant 21 jours. Les doses 1 000 et 3 000 mg/kg p.c. se sont avérées létales pour les rats mâles et femelles après 6 jours d’exposition (AHF, 1994). BENPATAX (analogue, n° CAS 68953-83-3) DMEO la plus faible par voie orale = 120 mg/kg p.c. par jour, d’après l’anémie macrocytaire [augmentation du volume corpusculaire moyen et baisse de la teneur corpusculaire moyenne en hémoglobine], l’érythropoïèse extramédullaire compensatoire, la réduction du gain de poids corporel, l’augmentation du poids relatif du foie, des reins et du cerveau, l’augmentation des taux de cholestérol, de birilubine, d’albumine et de protéine totale observées chez des rats Fischer 344 mâles et femelles (6 à 8 rats/sexe/groupe) exposés dans leur alimentation à des doses de 0, 7,5, 30 ou 120 mg/kg p.c. de Wingstay 200 (appellation commerciale du BENPATAX) pendant 28 jours. Une hyperplasie de l’urothélium et une augmentation de la prolifération des cellules urothéliales (uniquement liées à la dose chez les femelles) ont également été constatées dans les groupes exposés à la dose élevée (Iatropoulos et al., 1998). Aucune étude à court terme n’a été recensée pour le BENTAX et aucune étude concernant l’exposition par voie cutanée ou par inhalation n’a été recensée pour les trois composés. |
| Toxicité subchronique | BENPAT (n° CAS 68953-84-4) DMENO : Des groupes de rats Fischer 344 mâles (nombre non précisé) ont été exposés dans leur alimentation à des doses de 1 900 ppm (soit 95 mg/kg p.c. par jour, d’après la méthode de conversion des doses de Santé Canada, 1994) de BENPAT pendant 38 semaines (essai biologique accéléré conçu pour évaluer le potentiel d’induction et de promotion des tumeurs dans les organes cibles [foie et vessie]). La substance a entraîné une anémie chronique accompagnée d’une baisse du poids corporel, d’une érythropoïèse extramédullaire compensatoire dans le foie et la rate, d’une augmentation du poids des reins et du cœur, d’une augmentation du taux de bilirubine ainsi que d’une baisse des taux de protéine totale, d’albumine, et de biliprotéine (bilirubine plus albumine). Aucune activité d’induction ou de promotion des tumeurs n’a été observée (AHF, 1996b; Iatropoulos et al., 1997). Aucune étude sur la toxicité subschronique n’a été recensée pour le BENTAX et le BENPATAX et aucune étude concernant l’exposition par voie cutanée ou par inhalation n’a été recensée pour les trois composés. |
| Toxicité chronique et cancérogénicité | BENPAT (n° CAS 68953-84-4) DMENO par voie orale (non néoplasique) = 2,7 mg/kg p.c. par jour, d’après une augmentation importante de l’hyperplasie et de la prolifération des cellules urothéliales observée à toutes les doses testées chez des rats Fischer 344 des deux sexes exposés dans leur alimentation à des doses de 0, 53, 310 et 1 900 ppm (soit 0, 2,7, 15,5 et 95 mg/kg p.c. par jour, d’après la méthode de conversion des doses de Santé Canada, 1994) de BENPAT pendant 52 semaines (suivies par une période de rétablissement de 12 semaines). Des augmentations du poids du foie, de la rate, du cœur et des reins ainsi que des baisses du gain de poids corporel et de la consommation d’aliments ont également été signalées chez les groupes exposés à la dose élevée. Une augmentation importante du volume corpusculaire moyen, une diminution de la teneur corpusculaire moyenne et du nombre de globules rouges accompagnées de preuves microscopiques d’une érythropoïèse extramédullaire dans la rate et le foie ont également été constatées. Une augmentation des taux de cholestérol et de bilirubine dans le sang ainsi qu’une baisse des niveaux de protéine totale ont également été remarquées chez les animaux exposés à la dose élevée. Aucune preuve d’activité cancérogène liée à l’exposition n’a été décelée (AHF, 1996c; Iatropoulos et al., 1997). BENPATAX (analogue, n° CAS 68953-83-3) DMENO par voie orale (non néoplasique) = 20 mg/kg p.c., d’après la présence d’une anémie macrocytaire observée dans le cadre d’une étude de 52 semaines à doses répétées chez des rats Fischer 344 (20 rats/sexe/groupe) exposés dans leur alimentation à des doses de 0, 4, 20 et 100 mg/kg p.c. de BENPATAX par jour pendant 52 semaines suivies d’une période de rétablissement de 12 semaines. Les effets observés incluaient une augmentation de la méthémoglobine chez les rats des deux sexes ainsi qu’une augmentation de la numération plaquettaire et réticulocytaire et une baisse du nombre de globules rouges dans le sang, de l’hémoglobine et de l’hématocrite chez les rats mâles. D’autres effets, comme l’augmentation du volume corpusculaire moyen, la diminution de la teneur corpusculaire moyenne et la baisse des concentrations sériques de folates, d’acide folique et de fer ont également été observés chez les rats exposés à la dose élevée. Une réduction du poids corporel, une augmentation du poids relatif du foie, des reins et de la thyroïde, une congestion importante de la rate et une augmentation de la prolifération cellulaire dans la vessie ont permis d’apporter des preuves supplémentaires d’anémie macrocytaire principalement chez les rats exposés à la dose élevée (Iatropoulos et al., 2000). Aucune étude à long terme n’a été recensée pour le BENTAX et aucune étude concernant l’exposition par voie cutanée ou par inhalation n’a été recensée pour les trois composés. |
| Toxicité pour le développement et la reproduction | BENPAT (n° CAS 68953-84-4) Dans le cadre d’une étude sur deux générations, des groupes de 30 rats SpragueDawley mâles et femelles ont été exposés dans leur alimentation à des doses de BENPAT de 0, 120, 400 et 1 500 ppm (soit 0, 6, 20 et 75 mg/kg p.c. par jour, d’après la méthode de conversion des doses de Santé Canada, 1994) pendant des périodes de 10 semaines précédant l’accouplement, 2 semaines au moment de l’accouplement, 3 semaines de gestation et jusqu’à la période de sevrage des petits (21 jours). DMENO par voie orale concernant la toxicité pour le développement et la reproduction = 6 mg/kg p.c. par jour d’après l’allongement de la durée de gestation chez les mères F1 et les lésions polykystiques observées dans les reins des rats sevrés F1 et F2. On a estimé que les lésions dans les reins étaient liées à la dose. L’allongement de durée de gestation et l’augmentation du poids des petits ont également pu être constatés à des doses de 20 et de 75 mg/kg p.c. par jour pour les mères F0 avec des portées de rats F1. Des dystocies et des mises bas tardives ont été relevées chez les mères F0 et F1 tandis que les pertes postimplantation par portée augmentaient de façon importante à des doses de 20 et de 75 mg/kg p.c. par jour pour les portées F1 et à des doses de 75 mg/kg p.c. par jour pour les portées F2. Le nombre de petits et de petits vivants par portée baissait considérablement à des doses de 20 et de 75 mg/kg p.c. pour les portées F1 et à des doses de 75 mg/kg p.c. pour les portées F2. À des doses de 75 mg/kg p.c., une augmentation importante du nombre de petits morts et une réduction de l’indice des naissances vivantes ont été signalées pour les mères F0 et F1. Aucune preuve de toxicité pour la reproduction n’a été relevée chez les mâles F0 et F1. DMENO par voie orale concernant la toxicité systémique = 6 mg/kg p.c. par jour d’après la présence de lésions dans les reins observée à toutes les doses chez les femelles F0 et les parents F1. Une mortalité au cours de la gestation/lactation a pu être observée chez les groupes F0 et F1 exposés aux doses moyenne (3/24; 1/22) et élevée (4/25; 1/24). Des baisses du poids corporel ont été constatées chez les femelles exposées à la dose élevée (Goodyear Tire and Rubber Company, 2001). Autre étude : Une étude mécaniste a permis de confirmer les résultats de l’étude sur la toxicité pour la reproduction sur deux générations de rats ci-dessus; elle a démontré que l’exposition par voie orale au BENPAT à une dose de 2 500 ppm (soit 125 mg/kg p.c., d’après la méthode de conversion des doses de Santé Canada, 1994) entraînait l’apparition de dystocies, de mises bas retardées et d’une diminution connexe de la survie des petits à la naissance. L’étude indiquait qu’une exposition au cours de la gestation était nécessaire et suffisante pour entraîner une dystocie. Il est aussi nécessaire et suffisant d’exposer les mères F0 pendant leur gestation ou lactation pour entraîner le développement de reins polykystiques chez les descendants F1. Toutefois, il n’est pas certain que l’exposition pendant la gestation puisse induire à elle seule le développement de reins polykystiques. L’exposition précédant la gestation n’a pas accru les effets attribués à l’ingestion de BENPAT pendant la période de gestation (Goodyear Tire and Rubber Company, 2001). Autre étude : Des rates Sprague-Dawley (25/groupe) inséminées ont été exposées par gavage à des doses de 0, 20, 70 et 200 mg/kg p.c. de BENPAT par jour pendant 10 jours (jours de gestation 6 à 15). DMEO par voie orale concernant la toxicité pour le développement = 200 mg/kg p. c., d’après l’augmentation du poids corporel des fœtus. Le taux de grossesse, la taille des portées, le nombre de fœtus vivants, l’implantation dans l’utérus ni aucun des autres paramètres ayant trait à la gestation n’a été touché par l’exposition à la substance chimique. DMEO par voie orale concernant la toxicité systémique = 200 mg/kg p. c., d’après la baisse du poids corporel de la mère et de la consommation d’aliments à la dose la plus élevée uniquement. Pour cette étude, la DSEO était de 70 mg/kg p.c. DSEO par voie orale (effets tératogènes) = ≥ 200 mg/kg p.c. par jour, d’après l’absence d’anomalies (malformations ou variations) liées à l’exposition dans le cadre de cette étude (BESC, 2003). BENPATAX (analogue, n° CAS 68953-83-3) Des rats Sprague-Dawley (25/groupe) ont été exposés par gavage à des doses de 0, 20, 70 et 200 mg/kg p.c. par jour pendant 10 jours (1 seul groupe à la dose élevée) ou 14 jours (3 groupes) au cours de la gestation. DMENO par voie orale concernant la toxicité pour le développement = 70 mg/kg p.c. par jour d’après la réduction du poids corporel des fœtus observée chez les groupes de rats F1 exposés aux doses moyenne et élevée. DMEO par voie orale concernant la toxicité systémique = 70 mg/kg p. c., d’après la baisse du poids corporel, du gain de poids corporel et de la consommation d’aliments chez des femelles F0. Une DSEO de 20 mg/kg p.c. pour la toxicité maternelle et pour le développement et une DSEO ≥ 200 mg/kg p.c. pour la toxicité tératogène ont été établies pour cette étude (Tyl, 1996). Aucune étude sur la toxicité pour le développement et la reproduction n’a été relevée pour le BENTAX (n° CAS 68478-45-5) |
| Génotoxicité et paramètres connexes : in vivo | Essai du micronoyau BENPAT (n° CAS 68953-84-4) Résultats négatifs : Dans la moelle osseuse de souris CD-1 ayant reçu des doses uniques de 0, 1 250 et 2 500 mg/kg p.c. par voie intrapéritonéale (Pharmakon, 1993a). Analyse des produits d’addition de l’ADN (postétiquetage P32) BENPAT (n° CAS 68953-84-4) Résultats négatifs : Dans les cellules du foie et de la vessie de rats Fischer 344/N TacfBR exposés par voie orale (gavage) à des doses de 0, 300, 1 000 et 3 000 mg/kg p.c. par jour pendant 7 jours (AHF, 1995) Mutation génique (test de mutation létale récessive associée au sexe chez la drosophile) BENPAT (n° CAS 68953-84-4) Résultats négatifs : Chez des Drosophila melanogaster exposées dans leur alimentation à des doses de 0,01 et 0,05 mg/mL pendant 24 heures (BESC, 2003; Goodyear Tire and Rubber Company, 1992a) Résultats négatifs : Chez des Drosophila melanogaster exposées dans leur alimentation à des doses de 0,05 et 0,63 mg/mL pendant 24 heures (BESC, 2003; Litton Bionetics, 1979; Goodyear Tire and Rubber Company, 1992a) BENTAX (n° CAS 68478-45-5) Résultats négatifs : Chez des Drosophila melanogaster sauvages et Muller-s (mutation de l’œil liée au gène bar sur le chromosome X) exposées par voie orale à des doses de 0,01, 0,001 et 0,0001 mg/mL pendant 16 heures (Goodyear Tire and Rubber Company, 1992c) |
| Génotoxicité et paramètres connexes : in vitro | Mutation génique BENPAT (n° CAS 68953-84-4) Résultats positifs : Chez des Salmonella typhimurium de souche TA98, TA 1537 et TA1538 avec activation métabolique Résultats négatifs : Chez des S. typhimurium de souche TA98 et TA1538 et des Escherichia coli WP2 sans activation métabolique; des S. typhimurium de souche TA100, TA1535, TA1537 et des Escherichia coli de souche WP2 uvrA avec et sans activation métabolique (BESC, 2003; Goodyear Tire and Rubber Company, 1992a) BENTAX (n° CAS 68478-45-5) Résultats positifs : Chez des Salmonella typhimurium de souche TA98, TA 1537 et TA1538 avec activation métabolique Résulats négatifs : Chez des Salmonella typhimurium de souche TA100 et TA1535 avec et sans activation métabolique (Goodyear Tire and Rubber Company, 1992c) Résultats positifs : Chez des Salmonella typhimurium de souche TA98, TA100, TA1535 et TA1538 avec activation métabolique (Goodyear Tire and Rubber Company, 1992d) BENPATAX (analogue, n° CAS 68953-83-3) Résultats positifs : Chez des Salmonella typhimurium de souche TA98, TA 1537 et TA1538 avec activation métabolique Résultats négatifs : Chez des Salmonella typhimurium de souche TA100 et TA1535 et des E. coli de souche WP2uvrA avec et sans activation métabolique (Stankowski, 1998) Aberration chromosomique (essai cytogénétique) BENPAT (n° CAS 68953-84-4) Résultats négatifs : Dans des cellules ovariennes de hamster chinois, avec ou sans activation métabolique (BESC, 2000, 2003). BENPATAX (analogue, n° CAS 68953-83-3) Résultats négatifs : Dans des cellules ovariennes de hamster chinois avec ou sans activation métabolique (SanSebastian, 1994). Dommages à l’ADN et réparation de l’ADN BENPAT (n° CAS 68953-84-4) Résultats positifs : Chez des Escherichia coli Pol A1 et des Escherichia coli Pol A1 de souche W 3110 (Pol A+) et p 3478 (Pol A-) sans activation métabolique (BESC, 2003; Goodyear Tire and Rubber Company, 1992a) BENTAX (n° CAS 68478-45-5) Résultats positifs : Chez des Escherichia coli (Pol A1- ) sans activation métabolique (Goodyear Tire and Rubber Company, 1992c,d) Essai de transformation in vitro BENPAT (n° CAS 68953-84-4) Résultats négatifs : Dans des cellules de souris Balb/3T3 sans activation métabolique (BESC, 2003; Goodyear Tire and Rubber Company, 1992a) Essais sur la synthèse de l’ADN non programmée BENPAT (n° CAS 68953-84-4) Résultats négatifs : Sur des hépatocytes de rat sans activation métabolique (hépatocytes capables d’activation métabolique) (AHF, 1999). BENPATAX (analogue, n° CAS 68953-83-3) Résultats négatifs : Sur des hépatocytes de rat sans activation métabolique (Jeffrey, 1999). |
| Irritation/ sensibilisation | Irritation cutanée BENPAT (n° CAS 68953-84-4) Aucune irritation n’a été observée chez des rats exposés au BENPAT pendant 4 heures et des lapins albinos exposés à des solutions de 20 % de BENPAT en suspension (WARF, 1959). Dans le cadre d’un test de Draize, une légère irritation (faible rougeur) a été relevée sur la zone testée chez des lapins albinos exposés à une dose de 500 mg de BENPAT pendant une durée pouvant atteindre 72 heures (WARF, 1959). BENPATAX (analogue, n° CAS 68953-83-3) Une légère irritation de la peau a été constatée chez des lapins néo-zélandais blancs exposés au BENPATAX pendant 4 heures (la période d’observation a duré jusqu’à 10 jours). Les observations supplémentaires comprenaient une desquamation et des taches brunes sur la zone testée (Merriman, 1995c). Dans le cadre d’un test de Draize, une irritation légère à modérée a été signalée chez des lapins néo-zélandais blancs (5/sexe) après qu’ils ont été exposés au BENPATAX à une dose de 2 000 mg/kg répartie sur 10 % de la surface du corps pendant 24 heures (la période d’observation a duré jusqu’à 14 jours) (Merriman, 1995b). Aucune étude sur l’irritation de la peau n’a été recensée pour le BENTAX (n° CAS 68478-45-5) Irritation oculaire BENPAT (n° CAS 68953-84-4) Aucune irritation oculaire n’a été signalée chez le lapin après 24 heures (aucune précision fournie, Bayer, 1991). Une irritation légère et réversible a été constatée chez des lapins (test de Draize) exposés à des doses de 0,06 g (0,1 mL) de BENPAT pour une durée pouvant atteindre 72 heures. La substance d’essai est jugée « légèrement irritante » pour les yeux (Springborn Laboratories, 1995b). Aucune étude sur l’irritation oculaire n’a été recensée pour le BENTAX (n° CAS 68478-45-5) et le BENPATAX (analogue, n° CAS 68953-83-3) Sensibilisation BENPAT (n° CAS 68953-84-4) Dans le cadre d’un test de maximalisation, des cochons d’Inde albinos ont été exposés à deux reprises (la deuxième fois 7 jours plus tard) à des doses de 25 % et de 100 % de BENPAT après induction intracutanée de 5 et 100 % de BENPAT. De faibles réactions cutanées (érythèmes et œdèmes) ont été observées. La substance d’essai est considérée comme un allergène de contact (Springborn Laboratories, 1995c). BENPATAX (analogue, n° CAS 68953-83-3) Dans le cadre d’un test de maximalisation chez des cochons d’Inde, de faibles réactions cutanées (érythèmes et œdèmes) ont été constatées lorsque les animaux de laboratoire étaient exposés à des doses de 40 % de BENPATAX après induction intracutanée de 5 et 100 % de la substance active. Le BENPATAX était un allergène pour la peau des cochons d’Inde (Merriman, 1995d). Aucune étude sur la sensibilisation n’a été recensée pour le BENTAX (n° CAS 68478-45-5) |
Études sur les humains - génotoxicité in vitro (mélanges de diaryl-p-phénylènedia-mines) |
Une étude sur la mutagénicité dans les voies urinaires pour analyser les expositions professionnelles dans l’industrie du caoutchouc comprenant 72 ouvriers (44 fumeurs) employés dans une usine de pneus a permis de démontrer que le tabagisme, mais pas la profession, était fortement lié à l’apparition d’une activité mutagène positive dans les voies urinaires chez des Salmonella typhimurium de souche TA98. Un effet synergique possible entre la profession et le tabagisme a été observé chez les ouvriers qui fabriquaient des pneus et qui étaient également fumeurs. L’analyse des matières premières a montré que les mélanges de diaryl-p-phénylènediamines étaient faiblement actifs en tant que mutagènes dans la souche TA98 en présence d’une activation métabolique (Crebelli et al., 1985). |
| Scénario d’exposition | Concentration ou absorption | Dose avec effet critique | Effet critique | Marge d’exposition |
|---|---|---|---|---|
| Absorption journalière estimée provenant du milieu environnemental[1] | de 0,06 à 0,67 µg/kg p.c. par jour (BENPAT) | 2,7 mg/kg p.c. par jour | Concentration d’exposition à long terme par voie orale et à doses répétées (DMENO) pour assister à une augmentation de l’hyperplasie et de la prolifération des cellules urothéliales relevée à toutes les doses testées chez des rats des deux sexes exposés au BENPAT (n° CAS 68953-84-4) dans le cadre d’une étude de 52 semaines (AHF, 1996b; Iatropoulos et al., 1997). |
4 285 – 45 000 |
| 6 mg/kg p.c. par jour | Concentration d’exposition par voie orale et à doses répétées (DMENO) pour assister à l’apparition de lésions polykystiques dans les reins liées au traitement observées à toutes les doses chez des parents F1 et des rats sevrés F1 et F2, et d’un allongement de la gestation chez les mères F1, dans le cadre d’une étude portant sur deux générations de rats exposés au BENPAT (n° CAS 68953-84-4) (Goodyear Tire and Rubber Company, 2001). | 9 520 – 100 000 | ||
| 20 mg/kg p.c. par jour | Concentration d’exposition à long terme par voie orale et à doses répétées (DMENO) pour assister à l’apparition d’une anémie macrocytaire liée au traitement dans le cadre d’une étude de 52 semaines avec du BENPATAX (n° CAS 68953-84-4) (Iatropoulos et al., 2000). | 31 745 – 333 300 |
Notes de bas de page
[2] La détermination de la conformité à l’un ou à plusieurs des critères énoncés à l’article 64 repose sur une évaluation des risques pour l’environnement et/ou la santé humaine associés aux expositions dans l’environnement en général. Pour les humains, ceci comprend, sans toutefois s’y limiter, les expositions par l’air ambiant et intérieur, l’eau potable, les produits alimentaires et l’utilisation de produits de consommation. Une conclusion établie en vertu de la LCPE (1999) portant sur les substances des lots 1 à 12 du Défi, énumérées dans le Plan de gestion des produits chimiques, n’est pas pertinente, ni ne prévient une évaluation en fonction des critères de danger définis dans le Règlement sur les produits contrôlés, qui fait partie du cadre réglementaire applicable au Système d’information sur les matières dangereuses au travail pour les produits destinés à être utilisés au travail. De manière similaire, une conclusion fondée sur les critères définis à l’article 64 de la LCPE (1999) n’empêche pas d’intervenir en vertu d’autres articles de cette loi ou d’autres lois.
[3] Dans les documents publiés dans la Partie I de la Gazette du Canada le 2 octobre 2010 et rendus publics sur le site Web portant sur les substances chimiques (Substances chimiques du onzième lot du Défi), le nom donné à la substance portant le no CAS 68953-84-3, soit « benzène-1,4-diamine, dérivés mixtes de N,N'-(phényle, tolyle et xylyle) », était erroné.
[4] Vu les valeurs de log Koe pour les structures représentatives 1 à 3 du BENPAT et les structures représentatives 3 à 5 du BENTAX, l’élimination par la métabolisation pourrait être moins importante que l’élimination par les branchies, comme le laisse supposer le modèle du bilan massique. Cependant, comme cela n’est pas certain, une kM de 0,094 jour-1 a été utilisée pour les autres prévisions par modélisation.
[5] Les calculs sont fondés sur les données suivantes :
- CE50 sur 48 heures = 1,5 g caoutchouc /L pour D.magna lorsque les organismes ont été exposés au lessivat dans l’eau obtenu en immergeant des échantillons de caoutchouc composés à 1,9 % de BENPAT dans l’eau pendant 72 heures (Wik, 2007).
- CE50 sur 48 heures = 1,8 mg/L pour les D. magna exposées au BENPAT (voir le tableau 7; Présentation de projet, 2010b; IUCLID Data Set, 2003).
- Par conséquent, on suppose que la concentration de BENPAT dans l’eau est, dans l’étude de Wik (2007), de 1,8 mg/L. Ainsi, 1,5 g/L × 1,9 % = 0,0285g/L de BENPAT, et 1,8 mg/L/28,5 mg/L = 6,3 %
- Dans ce calcul, on suppose que la toxicité pour D. magna observée dans Wik (2007) est attribuable au BENPAT.
Cette page Web a été archivée dans le Web
L'information dont il est indiqué qu'elle est archivée est fournie à des fins de référence, de recherche ou de tenue de documents. Elle n'est pas assujettie aux normes Web du gouvernement du Canada et elle n'a pas été modifiée ou mise à jour depuis son archivage. Pour obtenir cette information dans un autre format, veuillez communiquer avec nous.
Archivée
le mélange de N,N’-(phényl(s) et tolyl(s))benzène-1,4-diamines
et
le mélange de N,N’-(tolyl(s) et xylyl(s))benzène-1,4-diamines
Numéro de registre du Chemical Abstracts Service
68953-84-4
et
68478-45-5
Environnement Canada
Santé Canada
September 2011
Table des matières
- Sommaire
- Introduction
- Identité de la substance
- Propriétés physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe I : Sommaires de rigueur d'étude
- Annexe II : Table de résumé des données du modèle PBT
- Annexe III : Quantités de pertes pour le BENTAX et le BENPAT et concentrations environnementales estimées d'après ces quantités
- Annexe IV : Tranche supérieure des estimations de l'absorption quotidienne de BENPAT pour divers groupes d'âge
- Annexe V : Résumé des données relatives aux effets du BENPAT, du BENTAX et de l'analogue, le BENTAPAX
- Annexe VI : Résumé des marges d'exposition pour le BENPAT
Conformément à l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)], les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable du Benzène-1,4-diamine, dérivés mixtes de N,N’-(phényle et tolyle) (BENPAT) dont le numéro de registre du Chemical Abstracts Service est 68953-84-4[1] ainsi que du Benzène-1,4-diamine, dérivés N,N’-(tolylés et de xylylés) mixtes (BENTAX) dont le numéro de registre du Chemical Abstracts Service est 68478-45-5.
Une priorité élevée a été accordée à l’évaluation préalable de ces substances inscrites au Défi dans le cadre du Plan de gestion des produits chimiques, car elles répondent aux critères de la catégorisation écologique relatifs à la persistance, au potentiel de bioaccumulation et à la toxicité intrinsèque pour les organismes non humains et elles semblent être commercialisées au Canada.
L’évaluation des risques que présentent ces substances pour la santé humaine n’a pas été jugée hautement prioritaire à la lumière des résultats fournis par les outils simples de détermination du risque d’exposition et du risque pour la santé élaborés aux fins de la catégorisation des substances de la Liste intérieure des substances.
Le BENPAT et le BENTAX sont classés comme des substances de composition inconnue ou variable, produits de réactions complexes ou matières biologiques (UVCBs) utilisés au Canada et ailleurs dans le cadre de la fabrication de produits à base de caoutchouc. Le BENPAT et le BENTAX agissent en tant qu’agents protecteurs (antiozonants et antioxydants) dans les produits à base de caoutchouc. Ces substances ne sont pas naturellement produites dans l’environnement. De 100 à 1 000 kg de BENTAX et de 1 000 000 à 10 000 000 kg de BENPAT ont été importés au Canada en 2006. Les quantités de BENTAX et de BENPAT importées au Canada ainsi que les utilisations potentiellement dispersives de ces substances indiquent qu’elles pourraient être rejetées dans l’environnement canadien.
Les composants du BENPAT et du BENTAX, d’après les données expérimentales sur leur dégradation et d’après leurs propriétés physiques et chimiques, ne devraient pas se dégrader rapidement dans l’environnement. Elles sont persistantes dans l’eau, le sol et les sédiments. Les principaux composants du BENPAT et du BENTAX ont également le potentiel de s’accumuler dans les organismes, mais l’accumulation devrait être modérée. Il a été déterminé que ces substances remplissent les critères de persistance, mais non les critères de bioaccumulation définis dans le Règlement sur la persistance et la bioaccumulation. En outre, les valeurs expérimentales sur la toxicité révèlent que ces substances représentent un risque pour les organismes aquatiques.
Les données expérimentales recueillies sur la toxicité en milieu aquatique du BENPAT et d’un analogue chimique indiquent que le BENPAT et le BENTAX peuvent tous deux avoir des effets nocifs sur les organismes aquatiques.
Dans cette évaluation préalable, l’estimation de l’exposition dans le pire des scénarios plausibles a été effectuée en supposant des situations où des usines (utilisatrices de la substance) rejettent du BENPAT dans le milieu aquatique. Dans les scénarios de rejets examinés, la concentration environnementale estimée (CEE) dans l’eau dépassait généralement les concentrations estimées sans effet (CESE) calculées pour les algues. Lorsqu’une approche semblable a été appliquée au BENTAX, la CEE dans l’eau était inférieure aux CESE calculées pour les algues, dans un scénario d’exposition plus prudent.
Selon les renseignements disponibles, il a été conclu que le BENPAT pénètre dans l’environnement en une quantité, à une concentration ou dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou la diversité biologique. Par contre, il a été conclu que le BENTAX ne pénètre pas dans l’environnement en une quantité, à une concentration ou dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou la diversité biologique.
Les études chroniques concernant le BENPAT et une substance analogue n’ont apporté aucune preuve de cancérogénicité chez des animaux de laboratoire. En outre, les renseignements disponibles sur la génotoxicité indiquent qu’il est peu probable que le BENPAT et le BENTAX soient génotoxiques. Puisque l’exposition de la population générale au BENTAX a été jugée négligeable, le risque pour la santé humaine a été considéré comme faible. Les marges d’exposition entre l’estimation de la limite supérieure d’exposition au BENPAT dans les milieux naturels et les niveaux critiques produisant un effet chez les animaux de laboratoire sont considérées comme adéquates pour tenir compte des incertitudes dans les bases de données des effets sur la santé et de l’exposition.
À la lumière des renseignements présentés dans cette évaluation préalable, il a été conclu que le BENTAX et le BENPAT ne pénètrent pas dans l’environnement en quantité, à des concentrations ou dans des conditions qui constituent ou peuvent constituer un danger pour la vie ou la santé humaine.
D’après les renseignements disponibles, il a été conclu que le BENPAT remplit au moins un des critères de l’article 64 de la Loi canadienne sur la protection de l’environnement (1999).
D’après les renseignements disponibles, il a été conclu que le BENTAX ne remplit aucun des critères de l’article 64 de la Loi canadienne sur la protection de l’environnement (1999).
De plus, il a été conclu que les composants du BENTAX et du BENPAT remplissent les critères de persistance, mais non ceux du potentiel de bioaccumulation au sens du Règlement sur la persistance et la bioaccumulation.
Comme le BENTAX figure sur la Liste intérieure, son importation et sa fabrication au Canada ne sont pas visées par les dispositions du paragraphe 81(1). Vu les dangers écologiques que peut présenter cette substance, on craint qu’en raison de nouvelles activités qui n’ont pas été mentionnées ou évaluées, elle en vienne à remplir les critères énoncés à l’article 64 de la Loi. Par conséquent, il est recommandé de modifier la Liste intérieure, en application des dispositions du paragraphe 87(3) de la Loi, pour indiquer que les dispositions du paragraphe 81(3) de la Loi s’appliquent à cette substance de telle sorte qu’une nouvelle activité de fabrication, d’importation ou d’utilisation du BENTAX soit annoncée dans un avis et fasse l’objet d’évaluations des risques écologiques et des risques pour la santé humaine.
La Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)] (Canada, 1999) exige que les ministres de l’Environnement et de la Santé procèdent à une évaluation préalable des substances qui répondent aux critères de catégorisation énoncés dans la Loi afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l’environnement ou la santé humaine.
Selon l’information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu’une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères environnementaux de catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque pour les organismes aquatiques (Ti), et que l’on croit être commercialisées au Canada;
- celles qui répondent aux critères de catégorisation pour le plus fort risque d’exposition (PFRE) ou qui présentent un risque d’exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine, compte tenu des classifications qui ont été établies par d’autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont donc publié un avis d’intention dans la Partie I de la Gazette du Canada (Canada, 2006) dans lequel ils priaient l’industrie et les autres intervenants de fournir, selon un calendrier déterminé, des renseignements précis qui pourraient servir à étayer l’évaluation des risques, ainsi qu’à élaborer et à évaluer les meilleures pratiques de gestion des risques et de bonne gestion des produits pour ces substances jugées hautement prioritaires.
On a décidé d’accorder une attention hautement prioritaire à l’évaluation des risques pour l’environnement du mélange de N,N’-(phényl(s) et tolyl(s))benzène-1,4-diamines et du mélange de N,N’-(tolyl(s) et xylyl(s))benzène-1,4-diamines, car ces substances ont été jugées persistantes, bioaccumulables et intrinsèquement toxiques pour les organismes aquatiques et il semble qu’elles sont commercialisées au Canada. Il a été décidé d’évaluer ces deux substances ensemble étant donné les similitudes qui existent dans leur composition, leur structure et leurs propriétés.
Le volet du Défi portant sur ces substances a été publié dans la Gazette du Canada le 26 septembre 2009 (Canada, 2009a et 2009b). En même temps ont été publiés les profils de ces substances, qui présentaient l’information technique (obtenue avant décembre 2005) sur laquelle a reposé leur catégorisation. Des renseignements relatifs aux propriétés chimiques, à la persistance et aux utilisations du mélange de N,N’-(phényl(s) et tolyl(s))benzène-1,4-diamines (BENPAT) ainsi qu’aux utilisations du mélange de N,N’-(tolyl(s) et xylyl(s))benzène-1,4-diamines (BENTAX) ont été communiqués en réponse au Défi (Présentation de projet d’études, 2010a, 2010b).
Bien que l’évaluation des risques que présentent le BENTAX et le BENPAT soit jugée hautement prioritaire pour l’environnement, ces substances ne répondent pas aux critères pour le PFRE ou le REI ni aux critères définissant un risque élevé pour la santé humaine compte tenu de leur classement par d’autres organismes nationaux ou internationaux en ce qui a trait à la cancérogénicité, à la génotoxicité ou à la toxicité pour le développement ou la reproduction. Dès lors, la présente évaluation est axée principalement sur les renseignements pertinents à l’évaluation des risques écologiques.
Les évaluations préalables effectuées aux termes de la LCPE (1999) mettent l’accent sur les renseignements jugés essentiels pour déterminer si une substance répond aux critères au sens de l’article 64 de la Loi. Les évaluations préalables visent à examiner les renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence.[2]
La présente évaluation préalable prend en considération les renseignements sur les propriétés chimiques, les dangers, les utilisations de la substance en question et l’exposition à celle-ci, y compris l’information supplémentaire fournie dans le cadre du Défi. Les données pertinentes pour l’évaluation préalable de ces substances sont tirées de publications originales, de rapports de synthèse et d’évaluation, de rapports de recherche de parties intéressées et d’autres documents consultés au cours de recherches documentaires menées récemment, jusqu’en janvier 2011 (sections du document concernant la santé humaine et les aspects écologiques). Les études les plus importantes ont fait l’objet d’une évaluation critique. Il est possible que les résultats de modélisation aient servi à formuler des conclusions. Lorsqu’ils étaient disponibles et pertinents, les renseignements contenus dans les évaluations des dangers effectués par d’autres instances ont été utilisés. La présente ébauche d’évaluation préalable ne constitue pas un examen exhaustif ou critique de toutes les données disponibles. Il s’agit plutôt d’un sommaire des renseignements essentiels qui appuient la conclusion proposée.
La présente évaluation préalable a été préparée par le personnel du Programme des substances existantes de Santé Canada et d’Environnement Canada et elle intègre les résultats d’autres programmes exécutés par ces ministères. La partie portant sur l’écologie a fait l’objet d’une étude consignée par des pairs ou de consultations de ces derniers. De plus, l’ébauche de l’évaluation a fait l’objet d’une période de commentaires de 60 jours par le public. Bien que les commentaires reçus de l’extérieur aient été pris en considération, Santé Canada et Environnement Canada sont seuls responsables du contenu final et des résultats de l’évaluation préalable. Les approches suivies pour les évaluations préalables dans le cadre du Défi ont été examinées par un groupe indépendant, soit le Groupe consultatif du Défi.
Les principales données et considérations sur lesquelles repose la présente évaluation sont résumées ci-après.
Nom des substances
Aux fins de la présente évaluation, la substance « mélange de N,N’-(phényl(s) et tolyl(s))benzène-1,4-diamines » (no CAS 68953-84-4) sera appelée BENPAT, d’après le nom anglais de la Liste intérieure des substances (LIS) (voir le tableau 1). De la même façon, la substance « mélange de N,N’-(tolyl(s) et xylyl(s))benzène-1,4-diamines » (no CAS 68478-45-5) sera appelée BENTAX, également d’après le nom anglais de la LIS.
Ces substances sont considérées comme des substances de composition inconnue ou variable, des produits de réaction complexes ou des matières biologiques (UVCB). Aux fins de la présente évaluation, une autre substance UVCB, le mélange de N,N’-(phényl(s), tolyl(s) et xylyl(s))benzène-1,4-diamines[3] (no CAS 68953-84-3), est utilisée en tant que substance analogue en raison de ses similitudes structurelles. Cet analogue sera appelé BENPATAX, d’après le nom du National Chemical Inventory.
Le BENPAT est un mélange de dérivés de phényle et de tolyle; le BENTAX est quant à lui un mélange de dérivés de tolyle et de xylyle. La substance analogue, le BENPATAX, existe sous la forme d’un mélange de trois dérivés (phényle, tolyle et xylyle) fixés à la structure d’amine aromatique commune aux trois substances (BENPAT, BENTAX et BENPATAX) (NICNAS, 2001). Le BENPATAX renferme tous les principaux composants du BENPAT et du BENTAX; il peut donc être utilisé comme analogue du BENPAT comme du BENTAX. Cependant, comme de nombreuses études existent sur le BENPAT, alors que les données sur le BENTAX sont rares, les renseignements sur le BENPATAX sont employés pour la caractérisation du BENTAX seulement.
Les données caractérisant le BENPAT, le BENTAX et l’analogue BENPATAX sont décrites ci-dessous aux tableaux 1a, 1b et 1c, respectivement.
Les combinaisons de dérivés existantes se chevauchent pour les trois substances (BENPAT, BENTAX et BENPATAX) et comprennent les constituants possibles suivants : deux phényles (structure 1), un phényle et un tolyle (structure 2), deux tolyles (structure 3), un tolyle et un xylyle (structure 4) et deux xylyles (structure 5). Une seule combinaison possible de dérivés pour la substance analogue BENPATAX ne l’est pas pour le BENPAT ou le BENTAX : il s’agit d’une combinaison formée de phényle et de xylyle.
En outre, des numéros CAS ont été attribués à la plupart des constituants uniques formant les substances BENPAT, BENTAX et BENPATAX. Ainsi, la structure 1 est connue sous le nom de N,N’-diphényl-p-phénylènediamine (DPPD), no CAS 74-31-7; la structure 2 (avec un groupe méthyle en position ortho sur le noyau aryle) est connue sous le nom de N-phényl-N’-(o-tolyle)-p-phénylènediamine, no CAS 27173-16-6; la structure 3 (avec des groupes méthyles en position ortho sur les noyaux aryles) est quant à elle connue sous le nom de N,N’-di(o-tolyl)-p-phénylènediamine, no CAS 15017-02-4.
Tableau 1a. Identité de la substance – BENPAT
| Numéro de registre du Chemical Abstracts Service (no CAS) | 68953-84-4 |
| Nom dans la LIS | Benzène-1,4-diamine, dérivés mixtes de N,N’-(phényle et tolyle) |
| Noms relevés dans les National Chemical Inventories (NCI)[1] | 1,4-Benzenediamine, N,N’-mixed Ph and tolyl derivs. (en anglais) (TSCA, DSL, REACH, EINECS, ENCS, PICCS, ASIA-PAC, NZIoC); 1,4-Benzenediamine, N,N’-mixed Phenyl and tolyl derivatives (en anglais) (LIS); benzènediamine-1,4, mélange de N,N’-dérivés phényles et tolyles (EINECS); 1,4-Benzoldiamin, N,N’-gemischte Phenyl und Tolylderivate (en allemand) (EINECS); 1,4-bencenodiamina, N,N’-mezcla de fenil y tolil derivados (en espagnol) (EINECS); 1,4-Benzenediamine, N,N’-mixed phenyl and tolyl derivatives (en anglais) (AICS); 1,4-Benzenediamine, N,N’-mixed phenyl and tolyl derivs. (en anglais)(ECL); DERIVATIVES, BENZENE-1,4-DIAMINE, N,N’-MIXED PHENYL AND TOLYL (en anglais) (PICCS); MIXED PHENYL AND TOLYL P-PHENYLENEDIAMINE (en anglais) (PICCS) |
| Autres noms | Hydroquinone, o-toluidine, aniline condensate; N,N’-Diphenyl-p-phenylenediamine, methylated; Amines (catégorie chimique); Wingstay 100 (Huntink et al., 2006; IUCLID Data Set, 2003); Polystay 100AZ (MSDS, 2002a); Accinox 100, blend of phenyl and tolyl p-phenylenediamines, DAPD, mixed diaryl-p-phenylenediamines, mixed di-aryl-p-phenylenediamines, diaryl-p-phenylenediamines, Naugard 496, Vulkanox 3100,Polystay 100, WTR Number 4a, Nailax (Nailax B)(IUCLID Data Set, 2003), DTPD (XingChun Chemical Corporation, c2006; Kirk-Othmer, c2010) |
Groupe chimique (groupe de la LIS) |
Substances organiques de composition inconnue ou variable, produits de réaction complexes et matières biologiques (UVCB) |
| Principale classe chimique ou utilisation | Amines |
| Principale sous-classe chimique | Amines aromatiques |
| Formule chimique | Produit de réaction complexe comprenant ce qui suit : Structure 1 = C18H16N2 Structure 2 = C19H18N2 Structure 3 = C20H20N2 |
| Structures chimiques représentatives utilisées dans les modèles d’estimation[2] | Structure 1 Structure 2 Structure 3 |
| SMILES représentatif utilisé dans les modèles d’estimation[3] | Structure 1 Structure 2 Structure 3 |
| Masse moléculaire (/mol) | Structure 1 = 260,33 Structure 2 = 274,36 Structure 3 = 288,39 |
[2] Comme elle fait partie de la catégorie des UVCB (substances de composition inconnue ou variable, produits de réactions complexes ou matières biologiques), cette substance n’est pas un composé chimique défini et elle peut donc être représentée par différentes structures. Aux fins de la modélisation, la structure et le SMILES correspondant présentés ici ont été choisis pour la représenter.
[3] Simplified Molecular Input Line Entry System.
Tableau 1b. Identité de la substance – BENTAX
| Numéro de registre du Chemical Abstracts Service (no CAS) | 68478-45-5 |
| Nom dans la LIS | Benzène-1,4-diamine, dérivés N,N’-(tolylés et de xylylés) mixtes |
| Noms relevés dans les National Chemical Inventories (NCI)[1] | 1,4-Benzenediamine, N,N’-mixed tolyl and xylyl derivs. (en anglais) (TSCA, DSL, REACH, EINECS, PICCS, ASIA-PAC) 1,4-Benzenediamine, N,N’-mixedTolyl and xylyl derivatives (en anglais) (LIS) benzènediamine-1,4, dérivés N,N’-(mélange de tolyle et de xylyle) (EINECS) 1,4-Benzoldiamin, N,N’-gemischte Tolyl und Xylylderivate (en allemand) (EINECS) 1,4-bencenodiamina, N,N’-mezcla de tolil y xilil derivados (en espagnol) (EINECS) 1,4-Benzenediamine, N,N’-mixed tolyl and xylyl derivs. (en anglais) (ECL) DERIVATIVE, BENZENE-1,4-DIAMINE, N,N’-MIXED TOLYL AND XYLYL (en anglais) (PICCS) |
| Autres noms | Hydroquinone, o-toludine, xylidine condensate p-Phenylenediamine, diaryl-Benzene-1,4-diamine, dérivés N,N’-(tolyles et de xylyles) mixtes Amines (catégorie chimique) |
Groupe chimique (groupe de la LIS) |
Substances organiques de composition inconnue ou variable, produits de réaction complexes et matières biologiques (UVCB) |
| Principale classe chimique ou utilisation | Amines |
| Principale sous-classe chimique | Amines aromatiques |
| Formule chimique | Produit de réaction complexe comprenant ce qui suit : Structure 3 = C20H20N2 Structure 4 = C21H22N2 Structure 5 = C22H24N2 |
| Structures chimiques représentatives utilisées dans les modèles d’estimation[2] | Structure 3 Structure 4 Structure 5 |
| SMILES représentatif utilisé dans les modèles d’estimation[3] | Structure 3 Structure 4 Structure 5 |
| Masse moléculaire (g/mol) |
Structure 3 = 288,39 Structure 4 = 302,41 Structure 5 = 316,44 |
[2] Comme elle fait partie de la catégorie des UVCB (substances de composition inconnue ou variable, produits de réactions complexes ou matières biologiques), cette substance n’est pas un composé chimique défini et elle peut donc être représentée par différentes structures. Aux fins de la modélisation, la structure et le SMILES correspondant présentés ici ont été choisis pour la représenter.
[3] Simplified Molecular Input Line Entry System.
Tableau 1c. Identité de la substance – BENPATAX (substance analogue)
| Numéro de registre du Chemical Abstracts Service (no CAS) | 68953-83-3 |
| Nom dans la LIS | Benzène-1,4-diamine, dérivés mixtes de N,N’-(phényle, tolyle et xylyle) |
| Noms relevés dans les National Chemical Inventories (NCI)[1] | 1,4-Benzenediamine, N,N’-mixed Ph and tolyl and xylyl derivs. (en anglais) (TSCA, DSL, REACH, EINECS, ASIA-PAC) 1,4-Benzenediamine, N,N’-mixed Phenyl and tolyl and xylyl derivatives (en anglais) (LIS) benzènediamine-1,4, mélange de N,N’-dérivés phényles, tolyles et xylyles (EINECS) 1,4-Benzoldiamin, N,N’-gemischte Phenyl und Tolyl und Xylylderivate (en allemand) (EINECS) 1,4-bencenodiamina, N,N’-mezcla de fenil, tolil y xilil derivados (en espagnol) (EINECS) 1,4-Benzenediamine, N,N’-mixed phenyl and tolyl and xylyl derivs. (en anglais) (AICS) 1,4-Benzenediamine, N,N’-mixed Ph and tolyl and xylyl derivs. (en anglais) (ECL) |
| Autres noms | Diaryl-p-phenylenediamines Hydroquinone, o-toluidine, xylidine, aniline condensate Amines (catégorie chimique) Wingstay 200 (NICNAS, 2001) Polystay 200 (MSDS, 2002b) |
Groupe chimique (groupe de la LIS) |
Substances organiques de composition inconnue ou variable, produits de réaction complexes et matières biologiques (UVCB)[2] |
| Principale classe chimique ou utilisation | Amines |
| Principale sous-classe chimique | Amines aromatiques |
| Formule chimique | Produits de réaction complexe : C18H16N2 –C22H24N2 |
| Structure chimique représentative | 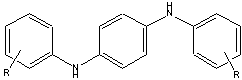 où : R = H (phényle) R = CH3 (tolyle) R = 2 CH3 (xylyle) |
| Masse moléculaire (g/mol) |
260,33 – 316,44 (d’après les structures individuelles) 302 (NICNAS, 2001) |
[2] Comme elle fait partie de la catégorie des UVCB (substances de composition inconnue ou variable, produits de réactions complexes ou matières biologiques), cette substance n’est pas un composé chimique défini et elle peut donc être représentée par différentes structures. Aux fins de la modélisation, la structure et le SMILES correspondant présentés ici ont été choisis pour la représenter.
Les substances BENPAT et BENTAX sont produites par le processus de condensation de 1 mole d’hydroquinone avec 2 à 2,5 moles d’un mélange d’arylamines composé, à parts égales, d’aniline et d’o-toluidine ou d’o-toluidine et de xylidine (Goodyear Tire and Rubber Company, 1965; Fernandes et McCormack, 1971; Kirk-Othmer, c2010). Le réactif de xylidine utilisé dans la production de BENTAX peut être soit du 2,4-diméthylaniline, soit un mélange d’isomères de xylidine (Goodyear Tire and Rubber Company, 1965).
Étant donné que les arylamines sont présentes dans des proportions égales dans les réactions, une répartition aléatoire des produits doit être obtenue. En conséquence, il a été rapporté que la composition du BENPAT était la suivante : 25 % de N,N’-diphényl-p-phénylènediamine (structure 1; no CAS 74-31-7); 50 % de N-phényle-N’-(o-tolyle)-p-phénylènediamine (structure 2; no CAS 27173-16-6); et 25 % de N,N’-di(o-tolyl)-p-phénylènediamine (structure 3; no CAS 15017-02-4) (Huntlink et al., 2006; IUCLID Data Set, 2003).
D’après les renseignements concernant la composition du BENPAT et les ratios entre l’o-toluidine et la xylidine dans le mélange réactif, on suppose que la composition du BENPAX est approximativement la suivante : 25 % de N,N’-di(o-tolyl)-p-phénylènediamine (structure 3; no CAS 15017-02-4); 50 % deN-(o-tolyl)-N’-xylyl-p-phénylènediamine; et 25 % de N,N’-dixylyl-p-phénylène (no CAS 28726-30-9). Même si le N-(o-tolyl)-N’-xylyl-p-phénylènediamine et leN,N’-dixylyl-p-phénylène, composés du BENTAX, sont potentiellement composés de plusieurs isomères distincts, ils sont représentés dans cette évaluation par les isomères N-(o-tolyl)-N’-(2,4-diméthylphényl)-p-phénylènediamine (structure 4) et N,N’-(2,4-diméthylphényl)-p-phénylènediamine (structure 5), respectivement. Il faut remarquer que le BENTAX pourrait se composer de combinaisons additionnelles d’isomères résultant de variations des modèles de substitution des substituants méthyles dans les dérivés de tolyle et de xylyle. Toutefois, ses propriétés physico-chimiques ne varieraient pas de façon importante avec ces légères différences en matière de substitution. Une telle variabilité n’est pas attendue dans la composition du BENPAT étant donné que les réactifs précis ainsi que leurs modèles de substitution du méthyle sont connus pour cette substance (Goodyear Tire and Rubber Company, 1965; Fernandes et McCormack, 1971; Kirk-Othmer, c2010; Huntink et al., 2006; IUCLID Data Set, 2003).
Enfin, les impuretés trouvées dans le BENPAT comprennent deux réactifs résiduels (o-toluidine [< 0,1 %] et aniline [< 0,1 %]) et des produits de réaction supplémentaires comme la méthyldiphénylamine (< 0,1 %) et la diphénylamine (1 à 5 %) (IUCLID Data Set, 2003). De même, il a été rapporté que l’o-toluidine était un composé résiduel que l’on retrouvait dans le BENTAX à une concentration inférieure à 0,1 % (MSDS, 2002a). Étant donné que ces impuretés ne sont présentes qu’en quantités très faibles dans la composition globale du BENPAT et du BENTAX, il n’en sera pas davantage question dans la présente évaluation.
Le BENPAT et le BENTAX sont des substances UVCB caractérisées par un mélange de dérivés de phényle et de tolyle, et par un mélange de dérivés de tolyle et de xylyle, respectivement. La substance analogue, le BENTAPAX, est une substance UVCB composée d’un mélange de dérivés de phényle, de tolyle et de xylyle.
Certaines propriétés physicochimiques étaient disponibles concernant les produits offerts sur le marché pour les trois substances (IUCLID Data Set, 2003; Commission européenne, 2000; Goodyear Tire and Rubber Company, 1965; NICNAS, 2001; Présentation de projet d’études, 1998). Toutefois, dans certains cas, la composition exacte des constituants des produits commerciaux n’était pas précisée, ou les propriétés physicochimiques étaient estimées d’après des mesures effectuées pour des constituants uniques. Par conséquent, les propriétés physicochimiques expérimentales et modélisées pour les substances BENPAT, BENTAX et la substance analogue BENPATAX sont décrites dans les deux tableaux ci-dessous. Le tableau 2a présente les données disponibles pour les produits commerciaux tandis que le tableau 2b présente les données disponibles pour les structures représentatives 1 à 5 (voir les tableaux 1a, 1b et 1c pour obtenir une description de ces structures représentatives). Les données expérimentales et modélisées (tout comme les renseignements généraux) disponibles pour les structures représentatives 1 à 3 sont jugées pertinentes et utilisées en tant que « lecture croisée » pour le BENPAT, alors que les données concernant les structures représentatives 3 à 5 sont jugées pertinentes pour le BENTAX.
Les propriétés physico-chimiques décrites aux tableaux 2a et 2b sont pertinentes concernant le devenir environnemental des substances. En outre, des modèles basés sur les relations quantitatives structure-activité (RQSA) ont servi à produire des données pour déterminer quelques propriétés physiques et chimiques des cinq structures représentatives du BENPAT et du BENTAX (voir le tableau 2b). Ces modèles (sauf WSKOWWIN, 2008) s’appuient principalement sur des méthodes d’ajout de fragments, c’est-à-dire qu’elles reposent sur la structure d’un produit chimique. Seules les formes neutres d’un produit chimique peuvent être fournies comme données d’entrée à ces modèles (formes SMILES); par conséquent, les valeurs modélisées figurant au tableau 2b concernent la forme neutre des structures représentatives.
Tableau 2a. Propriétés physiques et chimiques des formes de BENPAT, de BENTAX et de BENPATAX disponibles dans le commerce
| Propriété | Substance (no CAS) |
Type | Valeur | Température (°C) | Référence |
|---|---|---|---|---|---|
| Point de fusion (ºC) |
BENPAT (68953-84-4) | Expérimental | 90[*] à 105[*] | IUCLID Data Set, 2003; Commission européenne, 2000 | |
| BENTAX (68478-45-5) | Expérimental | 60[*] à 70[a] | Goodyear Tire and Rubber Company, 1965 | ||
| Point d’ébullition (ºC) |
BENPATAX (68953-83-3) | Expérimental | > 300 | NICNAS, 2001; Présentation de projet d’études, 1998 | |
| Pression de vapeur (Pa) |
BENPATAX (68953-83-3) | Modélisé | < 1 x 10-5[*] (1 x 10-8 kPa)[b] | 25 | NICNAS, 2001; Présentation de projet d’études, 1998 |
| Log Koe [c] (coefficient de partage octanol-eau) (sans dimension) |
BENPAT (68953-84-4) | Expérimental | 3,4 à 4,3 | IUCLID Data Set, 2003 Présentation de projet d’études, 2010c MSDS, 2002b |
|
| 3,4 à 4,3 | |||||
| BENPATAX (68953-83-3) | 3,3* à 4,6[*] | ||||
| 3,5 à 4,56 | NICNAS, 2001; Présentation de projet d’études, 1998 | ||||
| Log Koc[d] (coefficient de partage carbone organique-eau) (sans dimension) |
BENPAT (68953-84-4) | Expérimental | 4,39 à 4,95 | Présentation de projet d’études, 2010c | |
| Solubilité dans l’eau (mg/L) |
BENPAT (68953-84-4) | Estimée d’après les données expérimentales | ~ 2,2[e], [*] | Présentation de projet d’études, 2010a | |
| BENTAX (68478-45-5) | Expérimental | insoluble | FS, 2002a | ||
| BENPATAX (68953-83-3) | Expérimental | insoluble | FS, 2002b | ||
| 1,02 | ~20 | NICNAS, 2001; Présentation de projet d’études, 1998 | |||
| Solubilité dans le pentane (g/mL) |
BENPAT (68953-84-4) | Expérimental | 0,0025 | Goodyear Tire and Rubber Company, 1965 | |
| BENTAX (68478-45-5) | 0031 | ||||
| BENPATAX (68953-83-3) | 0,013 à 0,027 |
[a] Le point de fusion des diphényl-p-phénylènediamines alkyl-substitués préparés en utilisant un mélange aminé de toluidines mixtes et de xylidines mixtes est inférieur à 60 oC. Le point de fusion des diphényl-p-phénylènediamines alkyl-substitués préparés en utilisant un mélange aminé de 2,4-diméthylaniline et d’o-toluidine est compris entre 65 et 70 oC (Goodyear Tire and Rubber Company, 1965).
[b] La valeur entre parenthèses est la valeur indiquée à l’origine.
[c] Les intervalles de valeurs de log Koe ont été établis par chromatographie liquide haute performance (CLHP) pour les principaux composants isolément.
[d] L’intervalle de valeurs de log Koc ont été établis par CLHP pour les principaux composants isolément.
[e] Il était indiqué dans la Présentation de projet d’études (2010a) que cette valeur avait été obtenue à partir de la solubilité mesurée des composés principaux du BENPAT comprise entre 0,045 et 0,013 mg/L et à partir d’une solubilité combinée des composés mineurs de 1,9 mg/L. Aucune précision supplémentaire sur la façon dont cette valeur a été calculée n’a été fournie.
[*] Indique la valeur choisie pour la modélisation.
Le tableau 2b ci-dessous décrit les propriétés empiriques et modélisées des structures représentatives 1 à 5 pour les substances BENPAT et BENTAX (voir les tableaux 1a et 1b pour obtenir une description des structures représentatives).
Tableau 2b. Propriétés physiques et chimiques des structures représentatives du BENPAT[1] (structures 1 à 3) et du BENTAX[2] (structures 3 à 5)
| Propriété | Structure | Type | Valeur[1] | Température (oC) |
Référence |
|---|---|---|---|---|---|
| Point de fusion (ºC) |
1 | Expérimental | 154[*] | Lorenz et Parks, 1962 | |
| 150 à 151 | Merck Index, V.12:2, dans CHRIP, c2008 | ||||
| 144 à 153 | Kirk-Othmer, c2010 | ||||
| Modélisé | 143 | MPBPWIN, 2008 | |||
| 2 | Expérimental | 130[*] | Lorenz et Parks, 1962 | ||
| Modélisé | 154 | MPBPWIN, 2008 | |||
| 3 | Expérimental | 135[*] à 136[*] | Lorenz et Parks, 1962 | ||
| Modélisé | 159 | MPBPWIN, 2008 | |||
| 4 | Modélisé | 169[*] | |||
| 5 | 179[*] | ||||
| Point d’ébullition (ºC) |
1 | Expérimental | 220 à 225 (à 0,5 mmHg) | Merck Index, v.12:2, dans CHRIP, c2008 | |
| Modélisé | 398 | MPBPWIN, 2008 | |||
| 2 | Modélisé | 410 | |||
| 3 | Expérimental | 420 | CHRIP, c2008 | ||
| Modélisé | 421 | MPBPWIN, 2008 | |||
| 4 | Modélisé | 433 | |||
| 5 | Modélisé | 445 | |||
| Pression de vapeur (Pa) |
1 | Expérimental | 8,47 × 10-7 (valeur extrapolée) | 25 | |
| Modélisé | 7,65 × 10-5[*] | MPBPWIN, 2008 | |||
| 2 | Modélisé | 3,06 × 10-5[*] | 25 | MPBPWIN, 2008 | |
| 3 | 1,42 × 10-5[*] | ||||
| 4 | 5,65 × 10-6[*] | ||||
| 5 | 2,23 × 10-6[*] | ||||
| Constante de la loi de Henry (Pa·m3/mol) |
1 | Modélisé | 2,08 × 10-5 | 25 | HENRYWIN, 2008 |
| 2 | Modélisé | 2,29 × 10-5 | 25 | ||
| 3 | Modélisé | 2,53 × 10-5 | 25 | ||
| 4 | Modélisé | 2,79 × 10-5 | 25 | ||
| 5 | Modélisé | 3,08 × 10-5 | 25 | ||
| Log Koe (coefficient de partage octanol-eau) (sans dimension) |
1 | Expérimental | > 3,7 | 22,8 | IUCLID Data Set, 2003 |
| 3,4 | Présentation de projet d’études, 2010b; IUCLID Data Set, 2003 | ||||
| 3,3[*] | Présentation de projet d’études, 2010c | ||||
| 3,5 | Présentation de projet d’études, 1998 | ||||
| Modélisé | 4,04 | KOWWIN, 2008 | |||
| 2 | Expérimental | > 4,3 | 22,8 | IUCLID Data Set, 2003 | |
| 3,82 | Présentation de projet d’études, 2010b; IUCLID Data Set, 2003 | ||||
| 3,92 | Présentation de projet d’études, 1998 | ||||
| 3,9[*] | Présentation de projet d’études, 2010c | ||||
| Modélisé | 4,59 | KOWWIN, 2008 | |||
| 3 | Expérimental | > 4,6 | 22,8 | IUCLID Data Set, 2003 | |
| 4,28 | Présentation de projet d’études, 2010b; IUCLID Data Set, 2003 | ||||
| 4,6[*] | Présentation de projet d’études, 2010c | ||||
| 4,17 à 4,21 | Présentation de projet d’études, 1998 | ||||
| Modélisé | 5,13 | KOWWIN, 2008 | |||
| 4 | Expérimental | 4,39 à 4,42 | Présentation de projet d’études, 1998 | ||
| Modélisé | 5,68 | KOWWIN, 2008 | |||
| 5 | Expérimental | 4,51 à 4,56 | Présentation de projet d’études, 1998 | ||
| Modélisé | 6,23 | KOWWIN, 2008 | |||
| Log Kco (coefficient de partage carbone organique-eau) (sans dimension) |
1 | Expérimental | 4,39 | Présentation de projet d’études, 2010c | |
| Modélisé | 4,7151 (à partir de l’ICM[**]) |
KOCWIN, 2008 | |||
| 3,1165 (à partir du log Koe) |
|||||
| 2 | Expérimental | 4,66 | Présentation de projet d’études, 2010c | ||
| Modélisé | 4,92 (à partir de l’ICM) |
KOCWIN, 2008 | |||
| 3,42 (à partir du log Koe) |
|||||
| 3 | Expérimental | 4,95 | Présentation de projet d’études, 2010c | ||
| Modélisé | 5,14 (à partir de l’ICM) |
KOCWIN, 2008 | |||
| 3,72 (à partir du log Koe) |
|||||
| 4 | Modélisé | 5,35 (à partir de l’ICM) |
KOCWIN, 2008 | ||
| 4,02 (à partir du log Koe) |
|||||
| 5 | Modélisé | 5,55 (à partir de l’ICM) |
KOCWIN, 2008 | ||
| 4,33 (à partir du log Koe) |
|||||
| Solubilité dans l’eau (mg/L) |
1 | Expérimental | 0,13[*] | Présentation de projet d’études, 2010a | |
| Modélisé | 7,353 | 25 | WSKOWWIN, 2008 | ||
| 1,5867 | WATERNT, 2008 | ||||
| 2 | Expérimental | 0,11[*] | Présentation de projet d’études, 2010a | ||
| Modélisé | 2,09 | 25 | WSKOWWIN, 2008 | ||
| Modélisé | 0,50 | WATERNT, 2008 | |||
| 3 | Expérimental | 0,045 | Présentation de projet d’études, 2010a | ||
| Modélisé | 0,59 | 25 | WSKOWWIN, 2008 | ||
| Modélisé | 0,16 | WATERNT, 2008 | |||
| 4 | Modélisé | 0,17 | 25 | WSKOWWIN, 2008 | |
| Modélisé | 0,05[*] | WATERNT, 2008 | |||
| 5 | Modélisé | 0,05 | 25 | WSKOWWIN, 2008 | |
| Modélisé | 0,02[*] | WATERNT, 2008 | |||
| pKa | 2[3] | Modélisé | pKa1 = 1,91 | ACD/pKaDB, 2005 | |
| pKa2 = -1,29 | |||||
| 3[3] | pKa1 = 2,24 | ||||
| pKa2 = -1,22 |
[2] Le BENTAX est composé des structures représentatives 3 à 5. Voir le tableau 1b pour obtenir une description des structures représentatives.
[3] Dans l’eau, le BENPAT et le BENTAX (représentés par les structures 2 et 3 aux fins de l’ACD/pKaDB (2005) se comportent comme des bases attirant les protons et, par conséquent, les valeurs des pKa secondaires décroissent (contrairement à ce qui se passe dans le cas d’un acide).
[*] Indique la valeur choisie pour la modélisation.
[**] ICM : indice de connectivité moléculaire.
Les données expérimentales et modélisées pour les propriétés physico-chimiques des structures représentatives 1 à 5 indiquent les qualités générales suivantes pour lesdites structures : faible solubilité dans l’eau, pression de vapeur et constante de la loi de Henry très faible à négligeable, log Kco modéré à très élevé et log Koe modéré à élevé. De plus, d’après les résultats obtenus à partir du programme de modélisation pKa DB d’ACD (2005) utilisant les structures 2 et 3 comme des structures représentatives du BENPAT et du BENTAX, respectivement, il est conclu que les deux substances s’ionisent très peu dans l’eau et qu’elles doivent par conséquent être considérées comme des substances non ionisantes.
La solubilité d’une substance influence sa mobilité dans l’environnement. Aussi s’agit-il de l’un des paramètres clés permettant la caractérisation du devenir d’une substance chimique lorsque cette dernière est rejetée dans l’environnement.
Les solubilités aqueuses du BENPAT et de la substance analogue, le BENPATAX, ont été déterminées de manière expérimentale. Une étude complète a été soumise à Environnement Canada pour le BENPATAX (Présentation de projet d’études, 1998) alors qu’un résumé d’une étude de IUCLID a été soumis pour le BENPAT (Résumé d’étude, 2010a). Ces deux études ont été menées conformément à la Ligne directrice no 105 de l’Organisation de coopération et de développement économiques (OCDE) relative à la détermination de la solubilité dans l’eau. Le BENPATAX a été testé en suivant le protocole original de la ligne directrice adoptée en 1981. La Ligne directrice no 105 de l’OCDE a depuis été révisée puis adoptée en 1995. Les changements apportés concernent principalement la forme (OCDE, 1995). Cette ligne directrice comporte une méthode par élution sur colonne avec chromatographie en phase liquide à haute résolution (CLHR) (détection des UV).
Pour le BENPAT, il a été déterminé expérimentalement que les structures représentatives 1 à 3 (composés principaux) avaient des solubilités dans l’eau comprises entre 0,045 et 0,13 mg/L et que les composés mineurs avaient une solubilité dans l’eau d’environ 1,9 mg/L. En outre, il a été déterminé que la solubilité globale du BENPAT dans l’eau était d’environ 2,2 mg/L. Étant donné qu’aucun détail de l’expérience n’a été fourni, la façon dont cette solubilité plus élevée dans l’eau a été établie n’est pas claire. Il n’a pas non plus été expliqué pourquoi la solubilité globale du BENPAT dans l’eau, substance constituée de multiples composés, était supérieure à celle des composés uniques la constituant. La solubilité globale moyenne du BENPATAX dans l’eau a été estimée à 1,02 mg/L (Présentation de projet d’études, 1998). Étant donné que le BENPATAX est constitué de composés majeurs davantage substitués par le méthyle et moins solubles que ceux que l’on retrouve dans le BENPAT, il a été considéré que, tant pour le BENPAT que pour le BENPATAX, les solubilités globales dans l’eau étaient supérieures à celles de leurs composés uniques. Aucune précision quant à la façon dont la solubilité globale du BENTAPAX dans l’eau a été établie à partir des pics de CLHR observés pour les composés uniques n’a été fournie dans l’étude complète (Présentation de projet d’études, 1998).
L’étude de solubilité du BENPATAX dans l’eau a fait l’objet d’un examen critique afin d’en assurer la validité. Cette étude (sommaire de rigueur d’étude) se trouve à l’annexe 1.
Enfin, il existe des différences entre les valeurs expérimentales et les valeurs modélisées disponibles concernant la solubilité dans l’eau des structures 1 à 3 : les valeurs expérimentales sont globalement moins élevées que les valeurs modélisées. Les valeurs expérimentales ont été utilisées comme intrants du modèle pour les structures représentatives 1 à 3 et les valeurs modélisées (provenant du modèle WATERNT, 2008) ont été utilisées pour les structures représentatives 4 et 5. Par conséquent, les solubilités dans l’eau pour les structures 4 et 5 pourraient être surestimées; toutefois, ces valeurs sont égales ou inférieures aux valeurs de solubilité dans l’eau obtenues pour les structures représentatives 1 à 3 et conformes à la tendance générale voulant que plus les composés sont substitués par le méthyle, moins la solubilité dans l’eau est importante.
BENPAT
Cette substance n’est pas produite naturellement dans l’environnement. Selon les données recueillies lors d’une enquête menée conformément à l’article 71 de la LCPE (1999) (Canada, 2009b), sept déclarants ont indiqué que des quantités comprises entre 1 000 000 et 10 000 000 kg de BENPAT ont été importées au Canada en 2006 et aucune fabrication de ladite substance n’a été signalée au Canada. De plus, une entreprise a manifesté son intérêt pour le BENPAT.
Ailleurs, le BENPAT a été reconnu comme substance chimique produite en grande quantité par les organismes suivants : l’Environmental Protection Agency des États-Unis (US EPA) (US EPA, 2009), le Centre commun de recherche de la Commission européenne (ESIS) (ESIS, c1995-2009), et l’Organisation de coopération et de développement économiques (OCDE) (OCDE, 2004a).
Par le passé, les données reçues en provenance de la Liste intérieure des substances (1984-1986) indiquaient que la quantité totale de BENPAT importée, fabriquée ou proposée sur le marché canadien au cours de l’année 1986 se situait entre 100 000 et 1 000 000 de kilogrammes (Environnement Canada, 1988). Le nombre de déclarants pour les années civiles 1984 à 1986 était de 4.
BENTAX
Le BENTAX n’est pas non plus produit naturellement dans l’environnement. Selon l’ enquête menée conformément à l’article 71 de la LCPE (1999) (Canada, 2009b), de 100 à 1 000 kg de BENTAX ont été importés au Canada en 2006. Aucune fabrication de cette substance n’a été signalée au Canada. Moins de quatre déclarants ont répondu à cette enquête et une entreprise a montré son intérêt pour le BENTAX.
Selon une enquête menée en 2005 conformément à l’article 71 de la LCPE (1999) (Environnement Canada, 2005), de 1001 à 100 000 kg de BENTAX ont été importés au Canada la même année.
Le BENTAX n’a pas été reconnu par l’industrie de l’Union européenne comme substance chimique produite en grandes ou en petites quantités (ESIS, c1995-2009). De façon identique, cette substance ne figure pas sur les listes de substances chimiques produites en grandes quantités d’autres organismes tels que l’US EPA ou l’OCDE.
Enfin, par le passé, la quantité que les entreprises ont déclaré avoir fabriquée, importée ou commercialisée au Canada durant l’année civile 1986 se situait entre 100 000 kg et 1 000 000 kg (Environnement Canada, 1988). Le nombre de déclarants pour les années civiles 1984 à 1986 était inférieur à 4.
Au Canada, les utilisations industrielles du BENPAT et du BENTAX ont été déterminées dans le cadre de l’enquête menée en application de l’article 71 de la LCPE (1999) (Canada, 2009b); la plupart de ces utilisations sont considérées comme des renseignements commerciaux confidentiels et ne peuvent être divulguées. Cependant, toutes les utilisations ont été prises en compte dans la présente évaluation.
Une entreprise a signalé que le BENPAT était utilisé dans la fabrication de produits à base de caoutchouc à des concentrations comprises entre 0,29 et 2,17 % (Environnement Canada, 2010c). L’une des utilisations déclarées du BENTAX consiste à agir en tant qu’agent protecteur dans la composition du caoutchouc afin d’offrir à ce dernier une protection contre le vieillissement en retardant les dégradations liées aux expositions à la chaleur, à l’oxygène, à l’ozone, au rayonnement ultraviolet ou à l’humidité dans les produits finis.
En général, le BENTAX et le BENPAT sont utilisés en tant qu’additifs permettant de protéger les élastomères contre la détérioration liée à l’ozone (Kirk-Othmer, c2010). On les appelle communément des antiozonants ou des antioxydants, car leur effet protecteur sur les produits à base de caoutchouc découle d’une réaction entre l’additif chimique et l’ozone.
Le BENPAT et le BENTAX appartiennent à une catégorie d’antiozonants chimiques commerciaux dérivés de N,N’-diaryl-p-phénylènediamine (N,N’-diaryl-p-PDA), où le groupe aryle peut être le phényle, le méthylphényle ou le naphtalényle (Miller et al., 1985). Il s’agit d’antiozonants moyennement actifs utilisés à de faibles concentrations en raison de leur faible solubilité dans l’eau (Kirk-Othmer, c2010). Il a été reconnu que leur principal avantage consistait en une résistance élevée aux pertes liées à la consommation et à la vaporisation (Ambelang et al., 1963). Ainsi, conjuguées à des antiozonants plus réactifs, ces substances offrent une plus grande protection dans le cadre d’utilisations à long terme telles que dans les pneus radiaux pour les voitures de tourisme (Miller et al., 1985).
On sait que le BENPAT est utilisé comme antioxydant/antiozonant dans des produits à base de caoutchouc présentant une durée de vie élevée, comme les pneus et les tuyaux (Iatropoulos et al., 1997). Il convient de noter que les agents protecteurs du caoutchouc (c.-à-d., les antioxydants et les antiozonants) sont généralement ajoutés pour représenter environ 1 % (% en poids) de la composition d’un pneu normal (Wik et Dave, 2009). Toutefois, étant donné que diverses substances chimiques peuvent être utilisées comme agents protecteurs ou additifs, la composition des différents pneus varie (Wik et Dave, 2009).
Le BENTAX et le BENPAT ne sont pas des ingrédients utilisés dans des produits cosmétiques au Canada (SDC, 2010) et ne figurent pas sur la Liste critique des ingrédients dont l’utilisation est restreinte ou interdite dans les cosmétiques (Santé Canada, 2009). À l’heure actuelle, le BENTAX et le BENPAT ne sont pas utilisés comme principes actifs, ni comme produits de formulation, dans les pesticides dont l’utilisation est homologuée au Canada (ARLA, 2007). Ils ne sont pas répertoriés comme additifs alimentaires au titre 16 du Règlement sur les aliments et drogues (Canada, 1978). Le BENTAX et le BENPAT ne sont pas utilisés dans les emballages alimentaires ni comme additifs indirects (courriel de la Direction des aliments de Santé Canada adressé au Bureau de gestion du risque de Santé Canada en avril 2010; source non citée).
De plus, le BENTAX et le BENPAT ne sont inscrits ni dans la Base de données sur les produits pharmaceutiques, ni dans la Base de données sur les ingrédients non médicinaux interne de la Direction des produits thérapeutiques, ni dans la Base de données sur les ingrédients des produits de santé naturels (BDIPSN), ni dans la Base de données sur les produits de santé naturels homologués (BDPSNH) en tant qu’ingrédient médicinal ou non médicinal dans les produits pharmaceutiques finaux, les produits de santé naturels ou les médicaments vétérinaires (BDPP, 2010; BDIPSN, 2010; BDPSNH, 2010; courriel de la Direction des produits thérapeutiques de Santé Canada adressé au Bureau de gestion du risque de Santé Canada en avril 2010; source non citée).
Par le passé, les codes d’utilisation pour le BENPAT et le BENTAX étaient indiqués dans les données de sélection de la Liste intérieure des substances (Environnement Canada, 1988). Ces codes comprenaient les utilisations suivantes (qui peuvent encore s’avérer pertinentes) : « Antioxydant/inhibiteur de corrosion/inhibiteur de décoloration/décrassant/agent pour prévenir l’écaillement » et « Produits chimiques organiques, industriels »
Dans les pays nordiques, l’utilisation industrielle du BENPAT a été classée dans la catégorie « Fabrication de produits en caoutchouc et en plastique », tandis que sa catégorie d’utilisation était « antioxydants (antiozonants) » (SPIN, 2006).
Environnement Canada a mis au point une méthode pour estimer les pertes d’une substance pendant différentes étapes de son cycle de vie, y compris son devenir dans un produit ou un article fini (Environnement Canada, 2008). Cette méthode comprend une analyse du cycle de vie et un tableur (outil de débit massique) qui intègrent les renseignements sur la fabrication, l’importation et l’utilisation des données disponibles pour la substance. En commençant par une masse définie de la substance, chaque étape du cycle de vie est par la suite évaluée jusqu’à ce que toute la masse ait été prise en compte. Les facteurs pertinents sont étudiés, les incertitudes sont reconnues et des hypothèses peuvent être émises pendant chaque étape, selon les renseignements disponibles. Les pertes estimées représentent le bilan massique exhaustif de la substance au cours de son cycle de vie et elles comprennent les rejets dans les eaux usées et d’autres milieux récepteurs (sol, air), la transformation chimique, le transfert vers les activités de recyclage et le transfert vers les sites d’élimination des déchets (sites d’enfouissement, incinération). Toutefois, à moins de disposer de données précises sur le taux ou le potentiel de rejet de cette substance provenant des sites d’enfouissement et des incinérateurs, la méthode ne permet pas de quantifier les rejets dans l’environnement à partir de ces sources.
En général, les rejets d’une substance dans l’environnement peuvent découler de différentes pertes de la substance pendant sa fabrication, son utilisation industrielle ainsi que son utilisation commerciale et par les consommateurs. Ces pertes peuvent être regroupées en sept types : 1) déversements dans les eaux usées; 2) émissions atmosphériques; 3) pertes dans le sol; 4) transformation chimique; 5) élimination dans les sites d’enfouissement; 6) élimination par incinération; 7) élimination par recyclage (p. ex., le recyclage est jugé comme une perte et n’est plus pris en considération dans la présente évaluation). Elles sont estimées à partir de données issues d’enquêtes réglementaires, des industries, ainsi qu’en fonction des données publiées par différents organismes. Les pertes dans les eaux usées concernent les déversements des eaux usées brutes non traitées avant tout traitement, que ce soit un traitement des eaux usées industrielles sur place ou un traitement des eaux usées municipales hors site. De la même manière, les pertes par transformation chimique font référence aux modifications de l’identité de la substance qui ont lieu au cours des étapes de fabrication, d’utilisation industrielle ou d’utilisation commerciale et par les consommateurs, mais elles excluent celles qui ont lieu pendant les opérations de gestion des déchets telles que l’incinération et le traitement des eaux usées. La perte dans les terres inclut le transfert accidentel ou les rejets dans le sol ou les surfaces pavées ou non pavées pendant l’utilisation de la substance et sa durée de vie utile (p. ex. à partir de l’utilisation de machinerie agricole ou d’automobiles). La perte dans les terres n’inclut toutefois pas les autres transferts vers l’utilisation de la substance et sa durée de vie utile (p. ex. application au sol des biosolides et dépôts atmosphériques).
Les pertes estimées pour le BENPAT et le BENTAX au cours de leur cycle de vie (fondées sur des hypothèses prudentes) sont présentées au tableau 3 (Environnement Canada, 2010a, 2010b). Le BENPAT et le BENTAX ne sont pas fabriqués au Canada au-delà des seuils de déclaration; par conséquent, les pertes estimées sont fondées sur les quantités importées déclarées pour l’année 2006. Les volumes déclarés sur le marché canadien en 2006 étaient compris entre 1 000 000 et 10 000 000 kg/an pour le BENPAT et entre 100 et 1 000 kg/an pour le BENTAX (Canada, 2009b).
Tableau 3. Estimations des pertes de BENPAT et de BENTAX durant leur cycle de vie[1]
| Type de perte | BENPAT [Proportion (%)] |
BENTAX [Proportion (%)] |
||||
|---|---|---|---|---|---|---|
| Utilisation à des fins industrielles | Utilisation commerciale/ par les consommateurs |
Total | Utilisation à des fins industrielles | Utilisation commerciale/ par les consommateurs |
Total | |
| Eaux usées | 0,03 à 0,6 | 5,6 à 5,7[*] | 5,6 à 6,3 | 0,04 à 0,8 | 1,3 à 2,4 | 1,3 à 3,2 |
| Sol | - | 5,50 à 5,53[**] | 5,50 à 5,53 | - | - | - |
| Air | 0,004 à 0,1 | 0,004 à 0,1 | 0,04 à 0,1 | - | 0,04 à 0,1 | |
| Transformation chimique[***] | Non nulle | Non nulle | Non nulle | Non nulle | ||
| Incinération | 0,001 à 0,004 | 8,28 à 8,33 | 8,28 à 8,33 | 0,002 à 0,02 | 2,9 à 3 | 2,9 à 3 |
| Sites d’enfouissement | 0,5 à 0,6 | 12,3 à 12,5 | 12,8 à 13,1 | 0,08 à 1,5 | 92,3 à 95,6 | 93,8 à 95,7 |
| Recyclage | - | 67,0 à 67,4 | 67,0 à 67,4 | - | - | - |
| Exportation | Inconnue | Inconnue | Inconnue | Inconnue | ||
[*] Pour le scénario d’utilisation commerciale et de consommation développé pour le BENPAT, il est attendu qu’à certains endroits à travers le Canada, les eaux de ruissellement provenant des routes peuvent être recueillies par les usines de traitement des eaux usées mais qu’à d’autres endroits ce ruissellement peut être déversé directement sans être traité dans les eaux ambiantes.
[**] Pour le scénario d’utilisation commerciale et de consommation développé pour le BENPAT, le type de perte identifié comme « sol » se réfère généralement aux rues, routes et le sol qui leur est associé.
[***] On reconnaît la possibilité de transformation chimique des antiozonants BENPAT et BENTAX par oxydation; cependant, à l’heure actuelle, la mesure dans laquelle ce phénomène se produit n’est pas adéquatement documentée dans la littérature disponible.
La majeure partie du BENPAT se trouvant dans les produits commerciaux et de consommation est recyclée (approximativement 67 %). Le BENPAT est aussi rejeté dans le sol et dans les eaux de ruissellement provenant de routes en des proportions approximativement égales de 5,5 et 5,7 %, respectivement, ceci résultant d’utilisation commerciale et de consommation de produits contenant cette substance. Il est important de noter que pour le scénario d’utilisation commerciale et de consommation développé pour le BENPAT, le type de perte identifié comme « sol » se réfère généralement aux rues, routes et le sol qui leur est associé. De plus, dans le scénario de rejets commerciaux et de consommation, environ 13 % du BENPAT est estimé être éliminé dans les sites d’enfouissement, et à peu près 8 %, incinéré. Les rejets globaux de BENPAT estimés provenant d’activités ou d’utilisations industrielles sont de moins de 1 % dans les eaux usées et les sites d’enfouissement, respectivement, et d’au plus 0,1 % dans l’air.
Le BENTAX est estimé comme étant rejeté vers les eaux usées en une quantité représentant 1,3 à 3,2 % de la quantité totale utilisée dans le commerce canadien. En contraste avec le BENPAT, le BENTAX se trouvant dans les produits commerciaux et de consommation est estimé comme aboutissant principalement dans des installations d’élimination des déchets (incinération : environ 3 %; sites d’enfouissement : 93,8 à 95,7 %). Finalement, les rejets de BENTAX provenant d’utilisations industrielles sont estimés à au plus 0,8 % vers les eaux usées et, semblablement au BENPAT, les émissions vers l’air sont estimées à au plus 0,1 %.
Les pertes estimées pour le BENPAT et le BENTAX indiquent que ces substances présentent un potentiel de rejets dans l’environnement. En général, les eaux usées constituent une source courante de rejets d’une substance dans l’eau et le sol par les installations de traitement des eaux usées et la gestion des déchets subséquente des boues. Des particules de caoutchouc de pneu contenant du BENPAT peuvent se déposer sur les bords de la route et pénétrer dans les égouts. Une fois que les particules de caoutchouc sont entrées en contact avec l’eau, le BENPAT peut se lixivier (Wik, 2007). Une petite fraction des particules de caoutchouc de pneu peut être transférée par le vent ou la pluie vers le sol proche. Toutefois, les concentrations de ces particules tendent à décroître en même temps que la distance par rapport aux routes; des réductions supérieures à 80 % ont ainsi pu être signalées à 30 m des routes (Wik et Dave, 2009). Lors d’activités de recyclage, une substance peut être acheminée dans l’eau ou le sol, selon les caractéristiques opérationnelles des installations. Enfin, les sites d’enfouissement peuvent entraîner la lixiviation de substances dans les eaux souterraines, et cela est d’autant plus probable dans les cas où le site d’enfouissement ne dispose pas d’un système de collecte ou de traitement de lixiviat. Toutefois, on prévoit que les dégagements gazeux ou la migration de BENPAT et de BENTAX en provenance des sites d’enfouissement ne représentent pas une source importante de rejet étant donné que ces deux substances présentent une faible volatilité et s’adsorbent facilement dans les sols.
Même s’il est possible que d’autres produits commerciaux et de consommation contenant du BENPAT ou du BENTAX soient importés au Canada en plus de ceux déclarés au cours des enquêtes menées auprès de l’industrie réalisées conformément à l’article 71 de la LCPE (1999), aucun renseignement n’est disponible sur la quantité de ces importations. On prévoit que les étapes du cycle de vie et les pertes proportionnelles découlant de l’utilisation de ces autres produits ne seront pas énormément différentes de celles prises en considération et estimées ci-dessus. Toutefois, la masse réelle de la perte de substance au cours de chaque étape du cycle de vie peut être supérieure aux estimations susmentionnées, si ces données étaient disponibles aux fins de considération.
Le modèle de fugacité de niveau III (EQC 2003) simule la distribution d’une substance dans un environnement d’évaluation hypothétique selon les processus de partage chimique, de réactivité et de transport entre divers milieux. Les valeurs de fraction en masse présentées dans les tableaux 4a, 4b, 4c et 4d représentent les effets nets de ces processus dans des conditions de rejets continus lorsqu’un « état stable » hors de l’équilibre est atteint (p. ex. niveau III). Les intrants utilisés pour le modèle EQC (2003) sont présentés à l’annexe II. Étant donné que de nombreuses données concernant les produits commerciaux et les structures représentatives du BENPAT et du BENTAX étaient disponibles, le modèle a été exécuté plusieurs fois afin de comprendre les variations du comportement et du devenir probables de ces substances.
En général, les résultats de la modélisation de la fugacité de niveau III indiquent une faible variation et laissent entendre que le BENPAT et le BENTAX devraient demeurer principalement dans l’eau, le sol et les sédiments, selon le milieu dans lequel ces substances sont rejetées.
Les résultats de la modélisation EQC pour le BENPAT figurant aux tableaux 4a et 4b ainsi que les résultats pour le BENTAX figurant aux tableaux 4c et 4d sont décrits ensemble ci-dessous.
Le tableau 4a décrit les résultats du modèle de fugacité pour le BENPAT d’après les propriétés physico-chimiques disponibles pour le produit commercial; le tableau 4b décrit quant à lui les résultats du modèle de fugacité pour les structures représentatives 1 à 3 du BENPAT (présentés sous forme de fourchettes). De façon identique, le tableau 4c décrit les résultats du modèle de fugacité pour le BENTAX d’après les propriétés physicochimiques disponibles pour le produit commercial, alors que les résultats du modèle de fugacité pour les structures représentatives 3 à 5 du BENTAX sont résumés au tableau 4d.
Tableau 4a. Résultats de la modélisation de la fugacité de niveau III pour le BENPAT (présentés sous forme de fourchettes)[*] (EQC, 2003)
| Substance rejetée dans : | Pourcentage de la substance répartie dans chaque milieu | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| l’air (100 %) | 0,2 | 1,4 à 2,7 | 97 | < 1,4 |
| l’eau (100 %) | négligeable | 67 à 94 | négligeable | 6 à 33 |
| le sol (100 %) | négligeable | négligeable | 100 | négligeable |
Tableau 4b. Résultats de la modélisation de la fugacité de niveau III pour les structures représentatives 1 à 3 du BENPAT (présentés sous forme de fourchettes)[*] (EQC, 2003)
| Substance rejetée dans : | Pourcentage de la substance répartie dans chaque milieu | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| l’air (100 %) | 1,2 à 4,6 | 1,7 à 4,2 | 91 à 96 | 0,2 à 1,6 |
| l’eau (100 %) | négligeable | 50 à 95 | 0,7 | 4 à 49 |
| le sol (100 %) | négligeable | < 1 | 100 | négligeable |
Tableau 4c. Résultats de la modélisation de la fugacité de niveau III pour le BENTAX (EQC, 2003)
| Substance rejetée dans : | Pourcentage de la substance répartie dans chaque milieu | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| l’air (100 %) | 0,4 | 1,4 | 97 | 1,2 |
| l’eau (100 %) | négligeable | 52,5 | négligeable | 47,5 |
| le sol (100 %) | négligeable | négligeable | 100 | négligeable |
Tableau 4d. Résultats de la modélisation de la fugacité de niveau III pour les structures représentatives 3 à 5 du BENTAX (présentés sous forme de fourchettes)[*] (EQC, 2003)
| Substance rejetée dans : | Pourcentage de la substance répartie dans chaque milieu | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| l’air (100 %) | < 1,2 | 1,6 | 96 | < 1,6 |
| l’eau (100 %) | négligeable | 50 à 60 | < 1 | 40 – 50 |
| le sol (100 %) | négligeable | négligeable | 100 | négligeable |
En cas de rejet dans l’air, des quantités faibles ou négligeables de BENPAT et de BENTAX demeureraient dans ce milieu (voir les tableaux 4a et 4d). D’après des pressions de vapeur modélisées négligeables à faibles pour les structures représentatives 1 à 5 comprises entre 0,2 × 10-5 et 8 × 10-5 Pa et des constantes de la loi de Henry comprises entre 2 x 10-5 et 3 x× 10-5 Pa·m3/mol, le BENPAT et le BENTAX sont considérés comme des substances non volatiles. Par conséquent, s’ils n’étaient rejetés que dans l’air, le BENPAT et le BENTAX ne demeureraient dans ce milieu qu’en fractions très réduites. On estime que le sol est le milieu principal dans lequel ces substances se répartissent (> 90 %, voir les tableaux 4a à 4d) lorsqu’elles sont rejetées dans l’air.
En cas de rejet dans l’eau, le BENPAT et le BENTAX devraient fortement s’adsorber sur les matières en suspension et les sédiments étant donné les valeurs modérées à élevées du log Kco estimées entre 3,1 et 4,3 (obtenues à partir du log Koe) et entre 4,7 et 5,5 (obtenues à partir de l’ICM) pour les structures représentatives 1 à 5. Les valeurs expérimentales de log Koe, soit 4,39 à 4,95, pour les structures 1 à 3 du BENPAT corroborent également cette tendance. En cas de rejet dans l’eau, on estime également que ces substances demeureront dans le milieu aquatique à un état stable. D’après les constantes de la loi de Henry attribuées au BENPAT et au BENTAX, la volatilisation à partir de la surface de l’eau ne devrait pas être un processus de devenir important de ces substances. Par conséquent, si l’eau est le milieu récepteur, le BENTAX et le BENPAT devraient surtout demeurer dans l’eau et dans les sédiments, tandis que des fractions négligeables se retrouveront dans l’air et dans le sol (voir les tableaux 4a à 4d). Toutefois, le BENPAT serait plus soluble dans l’eau que le BENTAX en raison du niveau plus faible de substitution du méthyle de ses composés qui entraîne des valeurs de log Koe et Kco moins élevées. Cette différence est illustrée par les résultats du modèle de fugacité de niveau III (voir les tableaux 4a et 4b), dans lequel on prévoit qu’en cas de rejet dans l’eau, le BENPAT tendrait à demeurer davantage dans ce milieu (50 à 95 %) et qu’une fraction plus faible se retrouvera dans les sédiments (jusqu’à 49 %) alors que le BENTAX aurait tendance à demeurer dans l’eau et dans les sédiments selon des fractions approximativement égales (de 50 à 60 % et de 40 à 50 %, respectivement).
En cas de rejet dans le sol, l’adsorption sur place du BENPAT et du BENTAX devrait être élevée à modérée (la substance devrait être relativement immobile), d’après les valeurs estimées du log Kco. La volatilisation à partir des surfaces de sol humides serait un processus peu important dans le devenir de ces substances d’après les constantes estimées de la loi de Henry de leurs structures représentatives. En outre, le BENPAT et le BENTAX ne devraient pas se volatiliser à partir des surfaces de sol sèches d’après les pressions de vapeur de leurs structures représentatives et de la substance analogue, le BENPATAX. Par conséquent, en cas de rejet dans le sol, le BENPAT et le BENTAX demeureront principalement dans le milieu des sols, comme le montrent les résultats de la modélisation de la fugacité de niveau III (voir les tableaux 4a à 4d).
Persistance dans l’environnement
Eau
Des données empiriques sur la dégradation du BENPAT étaient disponibles, en revanche, aucune ne l’était pour le BENTAX. Des données empiriques concernant les structures représentatives, soit la structure 1 et la structure 3, étaient également disponibles. Ces structures sont partiellement représentatives du BENPAT et la structure 3 est également partiellement représentative du BENTAX. En outre, les données empiriques sur la dégradation de la substance analogue (le BENPATAX) sont incluses. Ces données sont jugées appropriées pour le BENPAT et le BENTAX; cependant, elles seront utilisées pour le BENTAX seulement, car le même type d’études existe sur le BENPAT.
Le tableau 5 présente les données empiriques sur la dégradation du BENPAT, du BENPATAX et des structures représentatives 1 et 3.
Pour le BENPAT, un taux de biodégradation compris entre 0 et 0,64 % sur 28 jours lors d’un test de biodégradation immédiate a été rapporté (IUCLID Data Set, Résumé d’étude, 2010b). Pour le BENTAX, les données disponibles concernant la substance analogue, le BENPATAX, ont été utilisées en s’appuyant sur la similitude structurelle des substances, matérialisée par la présence de dérivés de xylyle et de tolyle. Un taux de biodégradation de 1,72 % sur 28 jours a été rapporté pour le BENPATAX (NICNAS, 2001). Toutes les études sur la biodégradation dans l’eau ont été menées conformément à la Ligne directrice no 301 de l’OCDE.
Des données empiriques sur la biodégradation de la structure représentative 1 ainsi que des données sur la photodégradation de la structure représentative 3 étaient également disponibles. Il a été démontré que la structure 1 se dégradait lentement, avec un taux de dégradation de 0,2 % sur deux semaines lors d’un test effectué conformément à la Ligne directrice LD 301C de l’OCDE (CHRIP, c2008). La conclusion de ce test était : « non-biodégradabilité ».
Une étude de photodégradation effectuée dans l’eau était disponible pour la structure représentative 3, une composante importante du BENPAT comme du BENTAX (Présentation de projet d’études, 2010a). Des demi-vies relativement courtes de 2,5 et 4,7 jours ont été obtenues dans deux types de conditions aquatiques caractérisées respectivement par des pH de 6 et de 8. Toutefois, ce mode de dégradation ne serait applicable qu’à la fraction de la substance se trouvant dans la partie supérieure de la colonne d’eau exposée à la lumière du soleil. Si l’on tient compte des propriétés physico-chimiques de la structure 3 (voir le tableau 2), et notamment de sa faible solubilité dans l’eau ainsi que du devenir environnemental en résultant prévu par le modèle EQC (voir le tableau 4c), lorsqu’une répartition dans les sédiments est attendue en cas de rejet de cette substance dans l’eau, on prévoit qu’une quantité limitée de ladite substance pourra être soumise à une photodégradation dans la colonne d’eau. En outre, aucun produit de transformation de la substance n’a été identifié dans cette étude.
Tableau 5a. Données empiriques concernant la dégradation du BENPAT, de la substance analogue, le BENPATAX, et des structures représentatives 1 et 3[1]
| Substance | Milieu | Processus du devenir | Valeur de dégradation | Résultat de dégradation/unités | Référence |
|---|---|---|---|---|---|
| BENPAT | Eau | Biodégradation[2] | 0,64 | Biodégradation 28 jours/ % |
IUCLID Data Set, 2003; Présentation de projet d’études, 2010b |
| Eau | Biodégradation | 0 | Biodégradation 28 jours/ % |
IUCLID Data Set, 2003 | |
| BENPATAX | Eau | Biodégradation | 1,72 | Biodégradation 28 jours/ % |
NICNAS, 2001 |
| Structure 1 | Eau | Biodégradation | 0,2 | Biodégradation 14 jours/ % |
CHRIP, c2008 |
| Structure 3 | Eau | Photodégradation | 2,5, 4,5[3] | Demi-vie/jours | Présentation de projet d’études, 2010a |
[2] La biodégradation a été évaluée en utilisant la méthode respiratoire no 301F de l’OCDE. Un inoculum a été prélevé dans des boues activées provenant d’une usine de traitement des eaux usées.
[3] Demi-vies observées à des pH de 6 et de 8, respectivement.
Une étude sur l’hydrolyse du BENPAT a été effectuée sur une période de 28 jours (Présentation de projet d’études, 2010c). L’analyse de la solution aqueuse de BENPAT a révélé une diminution des concentrations initiales des structures représentatives 1 à 3 du BENPAT, diminution de l’ordre de 34 à 39 %, dans les 7 premiers jours de l’étude, puis un déclin subséquent plus lent pendant les jours suivants. Cependant, aucun produit de dégradation n’a été détecté dans la solution aqueuse à mesure que le BENPAT en disparaissait. On a plutôt trouvé des précipitats des trois structures représentatives à la surface de la verrerie utilisée dans l’étude. Les résultats indiquent qu’il ne s’est pas produit de réactions chimiques entre le BENPAT et l’eau dans les conditions expérimentales; au lieu de cela, c’est une précipitation physique de la substance qui a eu lieu. Comme le BENPAT ne comporte pas de groupements fonctionnels hydrolysables, l’hydrolyse de cette substance est improbable.
En raison du nombre relativement faible de données expérimentales sur la dégradation du BENPAT et du BENTAX, une méthode du poids de la preuve reposant sur des RQSA (Environnement Canada, 2007) a aussi été utilisée avec les modèles de la dégradation indiqués dans le tableau 5b ci-dessous. Étant donné l’importance écologique du milieu aquatique, le fait que la plupart des modèles disponibles s’appliquent à l’eau et que le BENPAT et le BENTAX devraient être libérés dans ce milieu, la biodégradation dans l’eau est la biodégradation qui a surtout été étudiée. Le BENPAT comme le BENTAX ne contiennent pas de groupements fonctionnels pouvant subir une hydrolyse. De plus subsiste un manque général d’information sur la dégradation de ces substances dans les sédiments.
Le tableau 5b résume les résultats des modèles de prédiction RQSA disponibles sur la dégradation dans l’eau et dans l’air. Étant donné que le BENTAX et le BENPAT existent sous forme de mélanges, chaque composé desdits mélanges (soit les structures représentatives 1 à 5) a été examiné avec les modèles de prédiction RQSA.
Tableau 5b. Données modélisées sur la dégradation des structures représentatives 1 à 5
| Processus du devenir | Modèle et base du modèle | Structure représentative | Résultat des modèles | Prédiction des modèles | Demi-vie extrapolée (jours) | ||
|---|---|---|---|---|---|---|---|
| Air | |||||||
| Oxydation atmosphérique | AOPWIN, 2008[1] | Structures 1 à 3 | t 1/2 = 0,053 jour (ou 0,64 heure) |
≤ 2 | |||
| Structures 3 à 5 | |||||||
| Réaction avec l’ozone | AOPWIN, 2008[1] | Structures 1 à 3 | s. o.[2] | s.o. | |||
| Structures 3 à 5 | |||||||
| Eau | |||||||
| Hydrolyse | HYDROWIN, 2008[1] | s. o.[2] | s.o. | ||||
| Biodégradation primaire | |||||||
| Biodégradation (aérobie)[3] | BIOWIN, 2008[1] Sous-modèle 4 : enquête d’expert (résultats qualitatifs) |
Structures 1 à 3 | 3,07 à 3,26 | « se biodégrade lentement » | < 182 | ||
| Structures 3 à 5 | 2,9 à 3,07 | ||||||
| Biodégradation ultime | |||||||
| Biodégradation (aérobie)[3] | BIOWIN, 2008[1] Sous-modèle 3 : enquête d’expert (résultats qualitatifs) |
Structures 1 à 3 | 2,1423 à 2,3980 | « se biodégrade lentement » | ≥ 182 | ||
| Structures 3 à 5 | 1,93 à 2,14 | ||||||
| Biodégradation (aérobie)[4] | BIOWIN, 2008[1] Sous-modèle 5 : Probabilité linéaire MITI |
Structures 1 à 3 | -0,2797 à -0,2627 | « se biodégrade très lentement » | ≥ 182 | ||
| Structures 3 à 5 | -0,27 à -0,29 | ||||||
| Biodégradation (aérobie)[4] | BIOWIN, 2008[1] Sous-modèle 6 : Probabilité non linéaire MITI |
Structures 1 à 3 | 0,002 à 0,003 | « se biodégrade très lentement » | ≥ 182 | ||
| Structures 3 à 5 | 0,001 à 0,002 | ||||||
| Biodégradation (aérobie)[4] | TOPKAT, 2004 Probabilité[*] |
Structures 1 et 2 | 0 | « se biodégrade lentement » | ≥ 182 | ||
| Structures 4 et 5 | |||||||
| Biodégradation (aérobie) | CATABOL, c2004-2008 % DBO (demande biochimique en oxygène) |
Structures 1 à 3 | 0,0038 à 0,007 | « se biodégrade très lentement » | ≥ 182 | ||
| Structures 3 à 5 | 0,0036 à 0,0038 | ||||||
[2] Le modèle ne donne pas d’estimation pour ce type de structure.
[3] Le résultat s’exprime par une valeur numérique de 0 à 5.
[4] Le résultat s’exprime par un taux de probabilité.
[*] La prévision du modèle TOPKAT (2004) pour la structure 3 a été jugée non fiable et a donc été écartée. Il était impossible de prévoir la demi-vie par hydrolyse dans l’eau pour les structures représentatives du BENPAT et du BENTAX étant donné que le modèle HYDROWIN (2008) n’estime pas les constantes du taux d’hydrolyse pour ce type de structures (pas de groupements fonctionnels hydrolysables présents).
Les résultats de la modélisation de la biodégradation ultime issus des sous-modèles 3, 5 et 6 de BIOWIN (2008), de TOPKAT (2004) et de CATABOL (c2004 à 2008) pour les structures représentatives du BENPAT et du BENTAX sont très uniformes et indiquent que la biodégradation dans l’eau serait lente ou très lente, et que la demi-vie de minéralisation complète serait supérieure à 182 jours dans ce même milieu. Les résultats du sous-modèle BIOWIN 4 (modèle de prévision de dégradation primaire) semblent indiquer que la substance a une demi-vie primaire inférieure à 182 jours; toutefois, l’identité des produits de dégradation est inconnue. Le taux de biodégradation primaire est relativement faible et, lorsqu’on l’extrapole à une minéralisation complète, on estime que la demi-vie est supérieure à 182 jours.
D’après un ratio d’extrapolation 1:1:4 de la demi-vie de biodégradation dans l’eau, le sol et les sédiments (Boethling et al., 1995), la demi-vie dans le sol est également supérieure à 182 jours, alors que celle dans les sédiments est supérieure à 365 jours. Ceci indique que le BENPAT et le BENTAX devraient être persistants dans le sol et les sédiments.
Dans l’ensemble, les données expérimentales et modélisées sur la biodégradation concernant le BENPAT, la substance analogue (le BENPATAX) ainsi que certaines des données sur les structures représentatives 1 et 3 (tableau 5a) indiquent que la demi-vie de biodégradation ultime dans l’eau des composants du BENPAT et du BENTAX serait supérieure à 182 jours (6 mois).
Autres milieux
Air
Dans l’air, la valeur de demi-vie de l’oxydation atmosphérique prévue de 0,053 jour pour les cinq structures représentatives (voir le tableau 5b) démontre que les composants du BENPAT et du BENTAX sont susceptibles de s’oxyder rapidement. Même si la réaction avec l’ozone n’a pas pu être estimée pour les structures représentatives en utilisant le modèle AOPWIN, d’après leur mode d’action en tant qu’antiozonants et antioxydants dans les produits à base de caoutchouc, on estime que ces substances réagissent avec d’autres espèces photooxydantes dans l’atmosphère, comme l’O3. De plus, d’après les résultats obtenus à partir d’expériences de photolyse dans l’eau sur la structure représentative 3, les composants du BENPAT et du BENTAX sont susceptibles de se dégrader par photolyse directe. Ces processus de dégradation réduiront encore la demi-vie du BENPAT et du BENTAX dans l’atmosphère. Avec une demi-vie inférieure à 0,053 jour résultant de réactions avec les radicaux hydroxyles et potentiellement de la photolyse et de réactions avec l’ozone, on considère que les composants du BENPAT et du BENTAX ne sont pas persistants dans l’air.
Sol
Le comportement de la structure représentative 3, composante majeure du BENPAT comme du BENTAX, dans le sol a été examiné dans le cadre d’une étude sur la dissipation dans le sol, réalisée dans des conditions de terrain en Caroline du Sud (États-Unis) conformément à la ligne directrice 164-1 de l’US EPA (Springborn Laboratories, 2004). La substance d’essai a été radiomarquée au carbone 14 et appliquée à la surface d’échantillons de sol de loam sableux à une concentration nominale de 165 mg de substance/kg de sol (poids sec). La radioactivité totale a été mesurée dans les échantillons de sol à une profondeur de 0 à 3 pouces, et de 3 à 6 pouces, cela sur 362 jours (aux jours 0, 7, 14, 32, 61, 90, 180 et 362). On n’a pas relevé les concentrations à une profondeur supérieure à 6 pouces. L’échantillonnage du sol sur 362 jours a monté que la plus grande partie (98 %) des matières radiomarquées demeurait dans les 3 premiers pouces de sol. La radioactivité appliquée s’est rapidement liée dans une large mesure (à plus de 95 %) aux particules de sol, devenant impossible à extraire. La substance radiomarquée non liée, extractible, se dissipait rapidement 5 % de la quantité demeurant au bout de 32 %, 3 %, au bout de 180 jours, et moins de 1 %, au bout de 362 jours. Les concentrations de la structure représentative 3 radiomarquée extractible dans les 3 premiers pouces de sol ont été utilisées pour calculer les taux de dissipation ainsi que les demi-vies correspondantes de dissipation, en supposant une cinétique de pseudo-premier ordre. Le taux de dissipation initial, du jour 0 au jour 32 de l’étude, était de 0,064 jour-1, et la demi-vie correspondante pour la dissipation était de 10,8 jours. Du jour 32 au jour 362, le taux de dissipation était de 0,00788 jour-1, et la demi-vie correspondante pour la dissipation était de 88 jours. Le taux de dissipation de 0 à 362 jours a été établi à 0,0104 jour-1, et la demi-vie correspondante pour la dissipation étant de 66,5 jours. On a fait remarquer que le taux de dissipation diminuait du jour 32 au jour 180 de l’étude, la demi-vie pour la dissipation nette étant de 217 jours, puis augmentait du jour 180 au jour 362, avec une demi-vie pour la dissipation nette de 58 jours. Ce ralentissement et cette accélération de la dissipation de la structure représentative 3 ont été en partie attribués aux changements saisonniers de la température, puisque ces périodes d’étude correspondaient au printemps et à l’automne.
À la fin de l’étude, 46 % de la radioactivité initiale demeurait dans les 3 premiers pouces de sol, et moins de 2 % dans la couche de 3 à 6 pouces de profondeur. Plus de 95 % de la radioactivité restée dans les 3 premiers pouces de sol n’était pas extractible. Dans l’ensemble, on n’a constaté aucune accumulation des produits de dégradation extractibles; on a supposé qu’il y avait des pertes vers l’atmosphère sous forme de dioxyde de carbone et de produits de dégradation organiques volatils. Cependant, on n’a pas exercé de surveillance à l’égard de ces composés.
En bref, l’étude sur la dissipation de la structure représentative 3 a montré que cette substance a un fort potentiel de liaison aux particules de sol, qu’elle est probablement plutôt immobile dans la colonne de sol et que les changements des conditions environnementales, par exemple les variations de température, peuvent avoir une incidence sur son taux de dissipation. Les valeurs de Kco élevée pour les structures représentatives 1 à 5 permettent de prévoir une forte adsorptivité aux particules de sol pour le BENPAT comme pour le BENTAX. Enfin, les résultats de cette étude donnent un aperçu du bilan massique en ce qui concerne le devenir de la structure représentative 3 du BENPAT dans le sol. L’étude comme telle n’indique pas la capacité intrinsèque de la structure représentative 3 à se dégrader dans ce milieu.
Oxydation
Les agents protecteurs du caoutchouc comme les antiozonants et les antioxydants fonctionnent par l’intermédiaire d’une migration séquentielle vers la surface amorcée par une rupture de l’équilibre au sein du mélange de caoutchouc elle-même causée par la réaction de la substance chimique à la surface du caoutchouc (Ignatz-Hoover et al., 2003). Plusieurs théories expliquent l’action protectrice des antiozonants à la surface du caoutchouc (Kirk-Othmer, c2010). La théorie de l’agent capteur laisse entendre que l’antiozonant se répartit à la surface du caoutchouc et que l’ozone réagit plus volontiers avec l’antiozonant qu’avec le caoutchouc. La théorie de la pellicule protectrice laisse entendre quant à elle que les produits de la réaction ozone-antiozonant, générés comme le décrit la théorie de l’agent capteur, forment une pellicule à la surface du caoutchouc, ce qui empêche encore davantage l’attaque du caoutchouc par l’ozone. La théorie de la reliaison laisse entendre que l’antiozonant peut éviter la scission des liaisons du caoutchouc ozonisé ou recombiner les liaisons doubles endommagées dans le caoutchouc. Enfin, la théorie de l’autoréparation laisse entendre que l’antiozonant peut réagir avec le caoutchouc ozonisé ou d’autres produits de réaction permettant d’obtenir une pellicule autoréparatrice d’une faible masse moléculaire et inerte sur la surface du caoutchouc (Kirk-Othmer, c2010).
Parmi ces mécanismes proposés, plusieurs pourraient contribuer à la protection du caoutchouc; toutefois, les preuves à notre disposition laissent entendre que la théorie de l’agent capteur est le mode d’action le plus important (Kirk-Othmer, c2010). Des preuves visuelles et microscopiques viennent également appuyer la théorie de formation d’une pellicule à la surface du caoutchouc. Après caractérisation par spectroscopie, il s’est avéré que la composition de cette pellicule contenait certains antiozonants inaltérés ainsi que certains produits de réaction observés dans l’antiozonant ozonisé liquide (Lattimer et al., 1980; Andries et al., 1975; Andries et al., 1979). Les théories de reliaison et d’autoréparation sont moins établies que les théories de l’agent capteur et de pellicule protectrice, car il n’existe que peu de preuves d’une réaction entre l’antiozonant et le caoutchouc ozonisé ou de la possibilité d’une fixation des antiozonants aux chaînes de caoutchouc après une attaque d’ozone (Lorenz et Parks, 1963a; 1963b).
Le mécanisme de l’activité antiozone de la structure représentative 1 (ou DPPD) a été étudié, et ses produits de transformation ont été caractérisés (Rotschová et Pospíšil, 1981). Le BENPAT et le BENTAX sont utilisés comme antiozonants dans le caoutchouc (Kirk-Othmer, c2010) et, dans le cadre de leur rôle principal en tant qu’agents protecteurs, sont oxydés par l’ozone à la place de l’ozone (Rapta et al., 2009), de la même façon que la théorie d’agent capteur décrite ci-dessus. Comme le laissent supposer les conclusions concernant la structure 1, cette oxydation entraîne la formation de dérivés de 1,4benzoquinone-diimine qui se sont révélés stables à l’oxydation sur une période d’un an, sans changement subséquent dans leur composition (Rotschová et Pospíšil, 1981). En outre, il a été découvert que la structure 1 formait du N,N’-diphényl-p-quinondiimine lorsqu’elle réagissait avec des radicaux peroxyles (Kochi, 1973; Boozer et al., 1955).
Potentiel de transport à grande distance
On a utilisé le modèle de transport et de persistance de niveau III (TaPL3) (TaPL3, 2000) pour estimer la distance de transport caractéristique (DTC), définie comme la distance maximale parcourue dans l’air par 63 % de la substance. Beyer et al. (2000) ont proposé que des DTC de plus de 2 000 km représentent le potentiel élevé de transport atmosphérique à grande distance, celles de 700 km à 2 000 km le modéré, et de celles de moins de 700 km le faible. D’après une estimation de la DTC de 60 km pour le BENTAX et de 28 km pour le BENPAT, le potentiel de transport atmosphérique à grande distance de ces deux substances est considéré comme faible. Cela signifie que le BENTAX et le BENPAT ne devraient pas être transportés dans l’atmosphère à une grande distance à partir de leurs sources d’émission.
Conclusion
D’après les données empiriques, qui comprennent celles sur les structures représentatives 1 et 3 ainsi que les données sur l’analogue, et d’après les données modélisées (voir les tableaux 5a et 5b), des indications concordantes et fiables montrent que le BENPAT et le BENTAX renferment des quantités significatives des composés répondant aux critères de persistance dans l’eau, le sol et les sédiments (demi-vies dans le sol et l’eau supérieures ou égales à 182 jours et demi-vie dans les sédiments supérieure ou égale à 365 jours) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000), mais non aux critères de persistance dans l’air (demivie supérieure ou égale à 2 jours.)
Potentiel de bioaccumulation
En milieu aquatique
Les valeurs modélisées et expérimentales du log Koe pour les structures représentatives 1 à 3 du BENPAT et les structures représentatives 3 à 5 du BENTAX donnent à penser que ces substances chimiques présentent un potentiel modéré à élevé de bioaccumulation dans le biote (voir les tableaux 2a et 2b; valeurs expérimentales et modélisées du log Koe comprises entre 3,4 et 6,23).
Les données expérimentales sur la bioaccumulation du BENPAT sont décrites cidessous, alors qu’aucune étude sur la bioaccumulation n’a été trouvée pour le BENTAX. Les valeurs modélisées du facteur de bioconcentration (FBC) et du facteur de bioaccumulation pour le BENPAT et le BENTAX sont fournies par la suite.
Données expérimentales sur la bioaccumulation du BENPAT
La bioaccumulation du BENPAT a été étudiée chez la carpe (Cyprinus carpio) (Présentation de projet d’études, 2010b) et résumée dans IUCLID Data Set (2003). La méthode du MITI pour tester le niveau d’accumulation des substances chimiques dans le corps des poissons (similaire à la méthode 305C de l’OCDE) a été utilisée pour mesurer des valeurs du FBC pour le BENPAT à deux concentrations d’essai, 0,05 et 0,005 mg/L, sur une période de 8 semaines (IUCLID Data Set, 2003; Présentation de projet d’études, 2010b). Dix poissons ont été exposés pour chaque concentration d’essai et cinq ont été utilisés dans le groupe témoin. La concentration de BENPAT dans l’eau a été mesurée deux fois par semaine pendant toute la durée de l’étude; la concentration de BENPAT dans le poisson a quant à elle été analysée aux semaines 1, 2, 4, 6 et 8, chaque fois sur deux poissons, en utilisant une chromatographie en phase liquide à haute résolution. Deux poissons témoins ont été analysés au début et à la fin de l’exposition. De plus, un test de dépuration a été réalisé après l’essai de bioaccumulation : des poissons supplémentaires ont été soumis à des analyses aux jours 1, 5 et 8 après la fin de l’exposition afin de clarifier le processus d’élimination de la substance d’essai concentrée dans le corps des poissons testés (Présentation de projet d’études, 2010b).
D’après le résumé du IUCLID Data Set (2003), maintenir des concentrations nominales de BENPAT dans le milieu d’essai tout au long de l’étude s’est avéré difficile (les concentrations d’essai étaient comprises entre 60 et 100 %) probablement en raison de l’absorption rapide de la substance par le poisson et de sa répartition sur les surfaces de l’aquarium. De plus, étant donné que la substance d’essai, le BENPAT, est un produit de réaction complexe, une grande variabilité a pu être constatée dans les données, ce qui a entraîné l’obtention de fourchettes de valeurs de FBC pour les différents composés du produit. Dans le rapport détaillé de l’étude (Présentation de projet d’études, 2010b), il était indiqué qu’en général, la concentration des substances d’essai dans l’eau d’essai diminuait lorsque ces substances présentaient un potentiel de bioconcentration, vraisemblablement en raison d’une absorption et d’un métabolisme rapides.
Cinq pics (« a » à « e ») ont été déterminés par CLHR : les pics « a » et « b » ont été définis comme les composés mineurs et les pics « c » à « e » ont été définis comme les composés majeurs. De plus, le pic « c » a été défini comme la structure représentative 1, le pic « d » comme la structure représentative 2 et le pic « e » comme la structure représentative 3 (Présentation de projet d’études, 2010b).
Dans l’ensemble, les fourchettes de valeurs du FBC obtenues pour chaque pic étaient équivalentes aux deux concentrations expérimentales d’exposition, 0,05 et 0,005 mg/L. Par conséquent, la manière la plus efficace de caractériser le FBC pour chaque structure représentative consiste à présenter la moyenne des valeurs de FBC obtenues à partir des deux concentrations d’exposition.
Pour la structure représentative 1, le FBC moyen était de 1 363 ± 573, pour la structure représentative 2, le FBC moyen était de 2 472 ± 890 et pour la structure représentative 3, le FBC moyen était de 6 250 ± 2 548. Ces chiffres ont été obtenus à partir de 20 valeurs de FBC comprises entre 269 et 2 630 pour le pic « c », entre 776 et 3 790 pour le pic « d » et entre 1 420 et 11 300 pour le pic « e », respectivement.
Un test de dépuration a été réalisé sur le BENPAT afin de clarifier le processus d’élimination de la substance d’essai concentrée dans le corps des poissons testés, à des concentrations d’exposition de 0,05 et de 0,005 mg/L (Présentation de projet d’études, 2010b). Les les demi-vies pour la dépuration obtenues se situaient, aux concentrations d’exposition de 0,05 et de 0,005 mg/L, respectivement à 0,7 jour et 3 jours, pour la structure représentative 1; respectivement à 3,6 et 5,7 jours, pour la structure représentative 2; respectivement à 44,4 et et 193 jours, pour la structure représentative 3 (Présentation de projet d’études, 2010b).
Les résultats relatifs à la dépuration du BENPAT étaient aussi résumés dans IUCLID Data Set (2003). Cependant, la demi-vie de 193 jours pour la structure représentative 3, à une concentration d’exposition de 0,005 mg/L, a été exclue de ce résumé dans IUCLID Data Set, et l’on y indiquait plutôt que cette demi-vie était inférieure à 6 jours pour les pics « a » à « e » à une concentration d’exposition de 0,005 mg/L et inférieure à 4 jours pour les pics « a » à « d » à une concentration d’exposition de 0,05 mg/L. Cependant, il a été indiqué que la demi-vie de dépuration pour le pic « e » à une concentration d’exposition de 0,05 mg/L était de 44 jours. Cette valeur de demi-vie pour le pic « e » a été jugée suspecte dans le résumé d’IUCLID Data Set (2003) étant donné qu’elle était bien plus élevée que la demi-vie de dépuration obtenue pour le même pic à un niveau de concentration de 0,005 mg/L et qu’elle ne concordait pas avec la tendance générale en matière de demi-vie de dépuration observée pour les pics « a » à « d » (moins de 5 jours) aux deux concentrations d’exposition (IUCLID Data Set, 2003). Cependant, la demi-vie de 44 jours (de même que celle de 193 jours) concordait avec les FBC élevés signalés pour la structure représentative 3 dans la Présentation de projet d’études (2010b).
Pour s’occuper des variations importantes observées dans les valeurs du FBC pour chacun des pics et pour appliquer les méthodes statistiques appropriées en vue de former une base pour l’interprétation des résultats, un projet supplémentaire intitulé « Statistical Calculations of Data from a Bioaccumulation Study with Wingstay 100 in Carp » (Calculs statistiques des données provenant d’une étude sur la bioaccumulation du Wingstay 100 chez la carpe) a été entrepris et résumé dans IUCLID Data Set (2003). Cette analyse employait la méthode d’analyse de l’incertitude de Monte Carlo. Les résultats ont permis d’obtenir une valeur maximale du FBC de 6 600 pour le pic « e » et les données relatives à la dépuration ont confirmé l’atteinte d’un état stable dans les tissus des composés du BENPAT après trois semaines, avec des demi-vies de dépuration inférieures à 5 jours pour tous les composés. Il a également été remarqué que, tandis que la substitution du méthyle de la substance d’essai augmentait, il en allait de même pour la bioaccumulation chez la carpe; cette tendance était cohérente avec l’augmentation des valeurs du log Koe. Par conséquent, les résultats de l’étude sur la bioaccumulation indiquent que la structure représentative 3, soit l’un des composés principaux du BENPAT (constituant au moins 20 % du BENPAT [Huntlink et al., 2006; IUCLID Data Set, 2003]), présente un potentiel de bioaccumulation chez la carpe, avec une valeur de FBC supérieure à 5 000.
De plus, des valeurs expérimentales de FBC étaient disponibles pour la structure représentative 1. Des carpes, Cyprinus carpio, ont fait l’objet d’essais à deux concentrations (0,1 mg/L et 0,01 mg/L) pour lesquelles les valeurs de FBC les plus élevées étaient respectivement de 1 420 et 2 150. La conclusion tirée concernant la structure 1 était « bioconcentration modérée » (CHRIP, c2008). Dans l’ensemble, ces résultats concernant la structure 1 sont cohérents avec l’étude sur la bioconcentration chez la carpe décrite ci-dessus (IUCLID, 2003; Résumé d’étude, 2010b), c’est-à-dire qu’étant donné que la structure 1 constitue le composé le moins substitué du BENPAT, les valeurs du FBC devraient être modérées.
Le tableau 6a présente les valeurs empiriques du FBC pour le BENPAT chez les poissons.
Tableau 6a. Données empiriques sur la bioaccumulation du BENPAT et de la structure représentative 1
| Substance | Organisme d’essai | Paramètre | Valeur (poids humide en L/kg) | Référence |
|---|---|---|---|---|
| BENPAT | Carpe commune (Cyprinus carpio) |
FBC moyen[1] | Structure représentative 1 1 36 3± 573 Structure représentative 2 2 472 ± 890 Structure représentative 3[2] 6 250 ± 2 548 |
IUCLID Data Set, 2003; Présentation de projet d’études, 2010b |
| Structure 1 | Carpe commune (Cyprinus carpio) |
FBC | 260 – 1 420[3] 500 – 2 150[4] |
CHRIP, c2008 |
[2] Un FBC d’environ 7 000 a été obtenu en appliquant une estimation basée sur la méthode de Monte Carlo à la fourchette de valeurs du FBC obtenue pour le composé « e » (IUCLID Data Set, 2003).
[3] FBC mesuré pour une concentration d’essai de 0,1 mg/L (ppm).
[4] FBC mesuré pour une concentration d’essai de 0,01 mg/L (ppm).
Données sur la bioconcentration et la bioamplification pour les structures représentatives du BENPAT (structures 1 à 3) et du BENTAX (structures 3 à 5)
Puisque peu de données sur le FBC étaient disponibles pour le BENPAT et qu’aucune donnée sur la bioaccumulation n’était disponible pour le BENTAX, une méthode prédictive a été appliquée au moyen de modèles des facteurs de bioaccumulation (FBA) et de bioconcentration (FBC). Selon le Règlement sur la persistance et la bioaccumulation (Canada, 2000), une substance est bioaccumulable si ses facteurs de bioaccumulation et de bioconcentration sont égaux ou supérieurs à 5 000. Toutefois, le calcul des facteurs de bioaccumulation est la mesure préconisée pour évaluer le potentiel de bioaccumulation des substances. En effet, le facteur de bioconcentration ne prend pas en compte de manière adéquate le potentiel de bioaccumulation des substances par l’alimentation, lequel est un facteur majeur pour les substances dont le log Koe est supérieur à ~ 4,0 (Arnot et Gobas, 2003).
Vu les similarités structurelles entre les structures représentatives du BENPAT et du BENTAX, et vu leurs valeurs de log Koe comparables, des prédictions ont été générées pour toutes les structures représentatives de ces deux produits commerciaux. Pour ce faire, on a utilisé une version modifiée du modèle de la cinétique du bilan massique élaborée par Arnot et Gobas (2003). Les constantes de la vitesse de métabolisation ont été calculées d’après des données empiriques tirées d’études, cela en normalisant en fonction du poids, de la teneur en lipides des poissons et de la température de l’eau dans l’étude, conformément à ce qu’indiquent Arnot et al. (2008a), lorsque le FBC est connu. On juge que cette modélisation est « à l’intérieur du domaine » parce qu’elle est fondée sur les principes premiers et, dans la mesure où les conditions du domaine mécanistique (diffusion passive), du domaine global des paramètres (gamme des valeurs empiriques de log Koe et de la masse moléculaire) et du domaine du métabolisme (constantes de kM corrigées) sont remplies, les prévisions sont considérées comme valides (Arnot et Gobas, 2003; Arnot et Gobas, 2006).
La moyenne des valeurs du FBC pour le corps entier indiquées pour les structures au tableau 6a a été employée pour dériver les constantes de la vitesse de métabolisation. La métabolisation dans l’intestin et dans les tissus n’est généralement pas un mécanisme d’élimination important pour les produits chimiques dont le log Koe est inférieur à environ 4,5 (Arnot et al., 2008a, 2008b; Arnot et Gobas, 2006), mais ce mécanisme peut varier en fonction de la taille et de la teneur en lipides des poissons utilisés pour les essais.
On voit au tableau 6b que les constantes du taux d’élimination total (taux de dépuration), obtenues d’après le modèle cinétique du bilan massique normalisé pour correspondre aux données empiriques tirées d’études, sont surestimées si on les compare avec les taux de dépuration empiriques indiqués pour les structures représentatives 1 à 3 du BENPAT (Présentation de projet d’études, 2010b). Cependant, une estimation du kM doit être inférieure à la constante du taux de dépuration. Par conséquent, une fois corrigée en fonction du poids, la kM[4] des structures représentatives 1 à 3, d’après les conditions de l’étude, devrait être d’approximativement 0,094 jour-1. L’estimation des kM d’après les RQSA, pour les structures représentatives du BENPAT et du BENTAX à l’aide du modèle BCFBAFWIN (Arnot et al., 2009), qui ne tient compte que de la structure et du log Koe pour produire des estimations, se situe entre 2,3 et 0,17 jour-1, ce qui corrobore l’hypothèse d’une vitesse de transformation métabolique relativement élevée (métabolisation relativement rapide). Vu l’étroite similarité des structures, le log Koe et le mécanisme de biotransformation probable (oxydation arénique de phase I), la constante d’origine empirique de 0,094 jour-1 est employée pour toutes les structures du BENPAT et du BENTAX afin de traduire le potentiel de biotransformation chez les poissons dans les études empiriques.
Comme un lien peut être établi entre le potentiel de métabolisation, et par le fait même l’élimination, et le poids corporel ainsi que la température (Hu et Layton, 2001; Nicholas et al., 2007), les FBC et FBA prévus ont été normalisés pour les poissons du niveau trophique intermédiaire dans le modèle d’Arnot et Gobas, conformément à la procédure décrite dans Arnot et al. (2008b). Les poissons du niveau trophique intermédiaire ont été désignés représentatifs des résultats globaux du modèle, d’après le concepteur du modèle. En outre, il s’agit de la taille de poissons susceptible d’être consommée par les piscivores aviaires et terrestres.
Les résultats de la modélisation du bilan massique sont présentés au tableau 6c. Ces résultats indiquent que, à une kM d’approximativement 0,05 jour-1, soit la constante de la vitesse de métabolisation normalisée pour les poissons du niveau trophique intermédiaire, dans le modèle, aucune des structures représentatives du BENPAT et du BENTAX n’a un FBC ou un FBA supérieur à 5 000. Même lorsque la constante de la vitesse de métabolisation est fixée à 0 (c’est-à-dire, kM = 0 jour-1), les FBC et FBA prévus pour les poissons du niveau trophique intermédiaire sont proches de 5 000, mais demeurent inférieurs à cette valeur.
Tableau 6b. Constantes cinétiques ainsi que FBC et FBA calculés pour le BENPAT, le BENTAX et le BENPATAX d’après les données disponibles sur les FBC, normalisées pour les conditions de l’étude
| Substance | Para- mètre d’étude[b] |
Cons- tante de la vitesse d’absorp-tion en j-1 (k1)[a] |
Cons- tante de la vitesse d’élimi- nation totale en j-1 (kT)[a], [d] |
Cons- tante de la vitesse d’élimi- nation bran- chiale en j-1 (k2)[a] |
Cons- tante de la vitesse de méta- boli-sation en j-1 (kM)[a] |
Cons- tante de la vitesse de crois- sance en j-1(kG)[a] |
Cons- tante de la vitesse d’excré- tion fécale en j -1 (kE)[a] |
FBC (condi- tions de l’étude)[a] |
FBA (condi- tions de l’étude)[a] |
Référence |
|---|---|---|---|---|---|---|---|---|---|---|
| BENPAT : structure repré- sentative 1 |
FBC ( 1363) | 431 | 6,01 | 6,00 | -5,700 | 0,001 | 0,010 | 72 | 81 | IUCLID Data Set, 2003; Présentation de projet d’études,2010b |
| BENPAT : structure repré- sentative 1 |
FBC (1 747) | 387 | 4,12 | 4,12 | -3,916 | 0,001 | 0,008 | 95 | 105 | CHRIP, c2008 |
| BENPAT : structure repré- sentative 2 |
FBC (2 472) | 451 | 0,401 | 0,397 | -0,226 | 0,001 | 0,010 | 1 096 | 2 344 | IUCLID Data Set, 2003; Présentation de projet d’études, 2010b |
| BENPAT : structure repré- sentative 3 |
FBC (6 250) | 452 | 0,326 | 0,315 | -0,255 | 0,001 | 0,010 | 1 380 | 5 888 | IUCLID Data Set, 2003; Présentation de projet d’études, 2010b |
| BENPAT (structures repré- sentatives 1, 2 et 3) |
Test de dépu- ration |
429 | 0,139[c] | inconnue[h] | ~ 0,094[i] | 0,035[e] | 0,01 | 2 258[f] | Présentation de projet d’études, 2010b |
[b] D’après les données disponibles (moyenne géométrique utilisée, le cas échéant).
[c] D’après une moyenne des demi-vies indiquées pour la dépuration dans la Présentation de projet d’études (2010b) (= 5 jours).
[d] kT = somme de toutes les constantes du taux d’élimination, ou k2 + kG, lorsqu’on les connaît.
[e] La vitesse de croissance n’est pas indiquée. Elle a été estimée d’après les données présentées dans le cadre du Défi sur des poissons cobayes de poids similaire, nourris à raison de 2 à 3 % de leur poids.
[f] Calculée en termes de k1/k2 (c’est-à-dire FBC cinétique).
[h] Cette valeur ne peut être calculée de manière exacte parce que les estimations sont supérieures à la constante de dépuration indiquée dans la Présentation de projet d’études (2010a).
[i] Il s’agit d’une valeur correspondant à la fourchette supérieure des constantes de la vitesse de métabolisation pour le BENPAT puisque la valeur doit être inférieure à 0,139 et qu’elle ne prend pas en compte l’élimination par les branchies.
Tableau 6c. FBC et FBA prévus pour les structures représentatives du BENPAT (structures représentatives 1 à 3) et du BENTAX (structures représentatives 3 à 5), cela chez des poissons représentatifs du niveau trophique intermédiaire (NTI)
| Substance | Log Koe | Constante de la vitesse de métabolisation en j-1 (kM) [a] | FBC NTI[b] | FBA NTI[b] | Référence |
|---|---|---|---|---|---|
| BENPAT : structure représentative 1 |
3,3 | 0,05 | 130 | 135 | Arnot et Gobas, 2003 |
| BENPAT : structure représentative 2 |
3,9 | 0,05 | 501 | 537 | Arnot et Gobas, 2003 |
| BENPAT et BENTAX : structure représentative 3 |
4,6 | 0,05 | 1 621 | 1 905 | Arnot et Gobas, 2003 |
| BENTAX : structure représentative 4 |
4,4 | 0,05 | 1 202 | 1 584 | Arnot et Gobas, 2003 |
| BENTAX : structure représentative 5 |
4,5 | 0,05 | 1 412 | 1 584 | Arnot et Gobas, 2003 |
[b] Calculée à l’aide d’un modèle modifié du bilan massique sur trois niveaux trophiques tiré d’Arnot et Gobas (2003), normalisé pour des poissons du niveau trophique intermédiaire (Pds = 184 g, Lip. = 6,8 %, Temp. = 10).
Vérification de la base de données empiriques sur les FBC et la métabolisation
Arnot et Gobas (2006) ont procédé à une évaluation critique des données disponibles sur la bioaccumulation (FBC et FBA) chez les poissons et d’autres organismes. Cette entreprise a été déterminée en partie par les activités de catégorisation au début des années 2000, et a généré une base de données empiriques de qualité sur les FBC et les FBA que l’administration publique canadienne a utilisée aux fins de la catégorisation et utilise maintenant dans le cadre du Défi (Arnot et Gobas, 2003b). Dans la base de données empiriques sur les FBC, à un log Koe de 4,5 à 4,6 (c’est-à-dire pour les structures représentatives 3 à 5), la distribution des données empiriques « acceptables » pour les FBC chez les poissons montre que seuls deux produits chimiques (le tétrachlorobenzène et le trichlorotoluène) ont des valeurs de FBC chez les poissons qui dépassent le critère fixé au Canada, soit ≥ 5 000 (un grand nombre de substances chimiques ont des FBC inférieurs à cette valeur de 5 000 à un tel log Koe). Certains des FBC indiqués pour ces deux composés halogénés sont inférieurs à 5 000, ce qui illustre la variabilité des essais relatifs aux FBC. On s’attend à ce que la transformation métabolique de ces deux composés soit beaucoup plus lente que celle des composants du BENPAT et du BENTAX. En effet, l’examen de la base de données sur les kM tirée d’Arnot et al. (2008b) pour 10 g de poisson à 15 ºC montre que les deux composés halogénés en question ont des constantes de la vitesse de métabolisation empiriques (kM) surtout de l’ordre de 10-3, et les valeurs de kM prédites par les RQSA pour 10 g de poisson à 15 ºC se situent entre 10-2 et 10-1. Après normalisation pour des poissons de niveau trophique intermédiaire pesant 184 g à 10 ºC, les kM étaient encore plus faibles, allant alors de 10-4 à 10-2. En conséquence, comme leurs log Koe sont comparables à ceux des composés halogénés, mais comme les kM empiriques (et estimées) sont beaucoup plus élevées pour le BENPAT et le BENTAX, aucun résultat empirique ne laisse supposer que le BENPAT ou le BENTAX auraient des FBC supérieurs à 5 000.
Études du bilan massique chez les mammifères
Des études ont été effectuées chez des lapins et des rats pour caractériser le devenir biologique des structures représentatives 1 à 3 du BENPAT, notamment son absorption, sa métabolisation et son excrétion (Umeniwa et al., 1985; Research Triangle Institute, 1998a, 1998b). Pour résumer, les études sur la métabolisation de ces structures chez les mammifères ont révélé que, après ingestion, ces substances sont excrétées surtout dans les matières fécales et la bile. Les substances sont aussi métabolisées rapidement, et les métabolites sont excrétés de manière comparable aux composés d’origine. L’information qui précède ne peut pas être facilement utilisée pour expliquer le bilan massique chez des organismes respirant dans l’eau, comme les poissons, car dans leur cas, l’échange par les branchies constitue également un mécanisme d’élimination important pour le BENPAT et le BENTAX. Les vitesses de transformation métabolique devraient aussi être quelque peu moins élevées chez les poissons que chez les mammifères. Cependant, l’information dont on dispose confirme que ces structures sont métabolisées in vivo et que l’élimination par l’excrétion de matières fécales et d’urine pourrait être plus grande que les valeurs calculées par le modèle cinétique de FBC fondé sur le bilan massique, ce qui laisse supposer que ces facteurs atténuent le potentiel de bioaccumulation.
Conclusion
BENPAT et BENTAX
Les valeurs du FBC et du FBA modélisées pour les structures représentatives 1 à 3 du BENPAT sont comprises entre 130 et 1 905. Les valeurs de FBC et de FBA prédites pour le BENPAT sont pour ainsi dire égales, ce qui laisse supposer que l’absorption par la nourriture n’est pas un facteur, pour cette UVCB, et que le FBC est le meilleur paramètre pour évaluer la bioaccumulation. En effet, vu les valeurs de log Koe faibles à modérées du BENPAT, la fraction biodisponible dans l’eau prévue avec le modèle d’Arnot et Gobas est de 99 à 100 % pour toutes les structures représentatives.
Les données dont on dispose sur les FBC empiriques à l’équilibre pour le BENPAT indiquent que le principal composant, soit la structure représentative 3, est susceptible de se bioaccumuler, avec un FBC > 5 000. Cependant, ce résultat empirique ne concorde pas avec les constantes du taux de dépuration global enregistrées pour les structures représentatives du BENPAT dans l’étude sur la dépuration menée subséquemment (Présentation de projet d’études, 2010b). Ce résultat ne concorde pas non plus avec le FBC empirique moyen d’environ 2 500 pour la structure représentative 2, qui se distingue de la structure représentative 3 seulement par un groupement méthyle, et par une différence de log Koe de moins d’une demi-unité logarithmique. Lorsqu’on appliquait la constante du taux de dépuration de cette étude pour corriger le modèle cinétique du bilan massique d’Arnot et Gobas, les FBC et les FBA prévus pour les structures représentatives 1 à 3 du BENPAT devenaient inférieurs à 5 000. Il existe certaines incohérences dans les données disponibles sur la bioconcentration du BENPAT. Elles sont probablement attribuables aux variations des concentrations d’exposition, qui n’étaient pas bien maintenues durant la période d’exposition (on signalait des variations de l’ordre de 60 à 100 % des concentrations nominales d’essai). Le FBC obtenu pour la structure représentative 3 est donc douteux, à la lumière des autres éléments de preuve, surtout toutes les indications empiriques acceptables selon lesquelles la bioconcentration est faible à modérée, à un log Koe de ~ 4,5 à 4,6.
Ainsi, on conclut qu’il existe suffisamment de données sur les propriétés chimiques et physiques, le log Koe et la biotransformation, de données modélisées et de résultats in vivo qui concordent pour supposer qu’aucune des structures représentatives du BENPAT ou du BENTAX ne répond au critère de bioaccumulation (FBC ou FBA supérieur à 5 000) énoncé dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Évaluation des effets sur l’environnement
A – Dans le milieu aquatique
Il existe des preuves expérimentales et modélisées confirmant que le BENTAX et le BENPAT nuisent aux organismes aquatiques après une exposition à court terme (aiguë) et une exposition à plus long terme (chronique) à des concentrations relativement faibles. Les données empiriques concernant les organismes aquatiques disponibles pour le BENPAT, la substance analogue BENPATAX et la structure représentative 1 sont présentées au tableau 7. Bien que des prévisions modélisées aient été générées afin d’estimer la toxicité du BENPAT et du BENTAX pour les organismes aquatiques, elles n’ont pas été incluses dans le présent rapport en raison des nombreuses données expérimentales qui étaient disponibles pour lesdites substances et la substance analogue, le BENPATAX (voir le tableau 7a).
En outre, on note que pour les UVCB, les valeurs de CE50 ou de CL50 représentent en fait le « taux de charge » du composé et que la concentration dissoute réelle des divers composés peut être différente. Les renseignements toxicologiques disponibles sont néanmoins acceptables.
Les effets écotoxicologiques du BENPAT ont été étudiés chez plusieurs espèces aquatiques et notamment les algues, les crustacés, les bactéries et les poissons d’eau douce. Toutes les études ont été réalisées conformément aux lignes directrices de l’OCDE et ont été jugées fiables par leurs auteurs (IUCLID Data Set, 2003; Présentation de projet d’études, 2010b). Comme la substance d’essai était tout d’abord dissoute dans l’acétone avant d’être versée dans l’eau d’essai, des solvants témoins ont été inclus dans le modèle d’étude.
Pour une espèce d’algues, Selenastrum capricornutum, les valeurs de CE50 pour l’inhibition de la production de biomasse et de la vitesse de croissance ont été déterminées après une exposition de 72 heures au BENPAT. Les valeurs de CE50 pour la substance d’essai étaient de 0,018 mg/L pour l’inhibition de la production de biomasse et supérieures à 0,079 mg/L pour l’inhibition de la vitesse de croissance. En outre, il a été déterminé que la CE10 et la concentration sans effet observé (CSEO) étaient respectivement de 0,0043 mg/L et de 0,013 mg/L pour l’inhibition de la production de biomasse et de la vitesse de croissance. Il est nécessaire de remarquer que, étant donné que des effets statistiquement significatifs ont été observés à toutes les concentrations d’essai pour le paramètre concernant la production de biomasse, la valeur calculée de CE10 a été utilisée pour proposer une estimation de la CSEO.
Des Daphnia magna ont été exposées au BENPAT dans le cadre d’un test d’immobilisation aiguë. Les résultats ont indiqué que les valeurs de CE50 et de CSEO pour la substance d’essai étaient respectivement de 1,8 mg/L et de 0,36 mg/L. On a en outre constaté que des particules brunes, dont on a présumé qu’il s’agissait de la substance d’essai, adhéraient aux daphnies d’essai dans une telle mesure que certains organismes d’essai étaient maintenus à la surface de l’aquarium (effet de bouée).
Dans une étude plus récente sur la toxicité (Présentation de projet d’études, 2010c), D. magna s’est montré plus sensible au BENPAT. D’après la CE50 aiguë de 1,8 mg/L, les concentrations d’exposition dans les solutions d’essai ont été fixées au départ entre 0,26 et 10 mg/L. Cependant, après 2 jours d’exposition, ces concentrations d’essai avaient entraîné une mortalité élevée chez D. magna; il a donc été décidé d’employer une gamme de concentrations d’exposition plus faibles (0,02 à 0,32 mg/L). La durée de l’étude a été de 21 jours. D’après le paramètre d’évaluation de la fécondité (c’est-à-dire le nombre de descendants vivants par parent à la fin de la période d’essai), la CE50 sur 21 jours pour les effets sur la reproduction a été estimée à 0,033 mg/L, la concentration minimale avec effet observé (CMEO), à 0,007 mg/L, et la CSEO, à une valeur inférieure à la plus faible concentration d’essai. La CE10 comme la CE20 ont été projetées à partir des données générées; elles étaient respectivement de 0,0045 mg/L et de 0,0090 mg/L. De plus, on a calculé, d’après la survie des D. magna de la génération parentale, une CL50 sur 21 jours de 0,048 mg/L, une CMEO de 0,036 mg/L, et une CSEO de 0,016 mg/L (Présentation de projet d’études, 2010c).
Des poissons d’eau douce, des truites arc-en-ciel et des carpes, ont été exposés au BENPAT dans le cadre d’un essai se déroulant sur 14 jours. Les valeurs de CL50 et de CSEO obtenues pour la truite arc-en-ciel étaient de 0,26 mg/L et 0,14 mg/L, respectivement. Des effets supplémentaires ont été observés chez la truite arc-en-ciel à des concentrations de la substance d’essai supérieures à la CL50 : une coloration plus foncée du poisson, expliquée par la probable adsorption de la substance d’essai, un comportement léthargique, une perte de l’équilibre ainsi que des effets sur la longueur et le poids du corps. Les valeurs de CL50 et de CSEO obtenues pour la carpe étaient de 0,43 mg/L et 0,28 mg/L, respectivement. Des effets supplémentaires ont également été observés chez la carpe à des concentrations supérieures à la CL50 : une coloration plus foncée du poisson, un comportement léthargique et une perte de l’équilibre.
Enfin, la toxicité du BENPAT pour les microorganismes (comme les bactéries) a été étudiée lors d’un essai d’inhibition de la consommation d’oxygène par des boues activées. La valeur de CE50 après une exposition de 30 minutes à la substance d’essai était supérieure à 10 000 mg/L.
En outre, la cytotoxicité de plusieurs antioxydants, dont la structure représentative 1 (ou DPPD) a été définie chez un cilié, le Tetrahymena pyriformis, dans le cadre d’un essai photodynamique de 48 heures (Epstein et al., 1967). La solution mère de la substance a été préparée dans l’acétone. Les cultures ont été incubées dans l’obscurité à une température de 28 oC; la cytotoxicité a été établie par l’entremise d’un examen microscopique des aliquotes des cultures. Il a été déterminé que la CL50 de la structure représentative 1 chez le T. pyriformis était de 0,010 mg/L (Epstein et al., 1967). Dans la même publication, les valeurs de CL50 provenant d’études sur la toxicité aiguë des substances antioxydantes administrées par voie orale à des rats étaient présentées. La CL50 de la structure représentative 1 chez les rats obtenue à partir d’une étude sur la toxicité aiguë par voie orale était comprise entre 800 et 1 600 mg/kg de poids corporel (Epstein et al., 1967). Les auteurs ont montré l’existence d’une association positive entre la toxicité des antioxydants dans le cadre des études utilisant le T. pyriformis et celles utilisant les rats.
L’écotoxicité du BENTAX a été caractérisée dans une fiche signalétique (FS, 2002a) signalant des valeurs de CL50 et de CE50 pour plusieurs espèces aquatiques. Toutefois, il a été déterminé que les paramètres d’écotoxicité concernaient en fait une substance similaire, vraisemblablement le BENPAT, car les espèces d’essai, le type d’essai et les valeurs de CL50 et de CE50 étaient les mêmes que ceux rapportés pour le BENPAT dans IUCLID Data Set (2003). Par conséquent, les renseignements sur la toxicité concernant la substance analogue, le BENPATAX (voir le tableau 7), sont utilisés pour le BENTAX étant donné que cet analogue contient des dérivés de xylyle qui ne se trouvent pas dans le BENPAT (voir les tableaux 1a, 1b et 1c pour obtenir des renseignements sur la composition des substances).
La toxicité de la substance analogue BENPATAX pour les organismes aquatiques a été caractérisée chez plusieurs espèces et notamment les algues, les crustacés et les poissons d’eau douce (Présentation de projet d’études, 1998). Les études ont été menées conformément aux lignes directrices de l’OCDE. Des solvants témoins ont été inclus dans le concept expérimental.
La toxicité du BENPATAX chez les algues S. capricornutum a été établie dans le cadre d’un essai sur la toxicité chronique analysant les effets de cette substance sur la vitesse de croissance et la production de biomasse. D’après les vitesses de croissance des algues constatés dans cette étude, les valeurs de CE50 et de CSEO après 72 heures concernant le BENPATAX se chiffraient respectivement à 0,11 mg/L et 0,0020 mg/L. En outre, la CE50 après 72 heures concernant la production de biomasse était de 0,0094 mg/L. De la même manière, il a été déterminé que la CE10 était de 0,00075 mg/L et, étant donné que des effets statistiquement significatifs ont été observés sur la biomasse à tous les niveaux de traitement testés, cette valeur a été utilisée comme une estimation de la CSEO pour la production de biomasse.
Les effets du BENPATAX sur la D. magna ont été étudiés dans le cadre d’un essai de toxicité aiguë à renouvellement continu. Les valeurs de CE50 après 24 et 48 heures obtenues associées à l’immobilisation constatée des organismes d’essai étaient respectivement de > 0,81 mg/L et 0,59 mg/L. Il a été établi que la CSEO était de 0,18 mg/L, d’après l’absence d’immobilisation et d’effets nocifs chez les daphnies après l’exposition à la substance d’essai. Des effets nocifs tels qu’une léthargie ont été notés chez les daphnies exposées à des concentrations d’essai inférieures aux valeurs de CE50 signalées. Enfin, des carpes communes ont été exposées au BENPATAX dans le cadre d’un essai de 14 jours à renouvellement continu. Il a été établi que les valeurs de CL50 et de CSEO étaient respectivement de 0,35 mg/L et 0,17 mg/L. En outre, des effets sublétaux comprenant une léthargie et une perte de l’équilibre ont été constatés chez les poissons exposés à une concentration de 0,35 mg/L de la substance.
Tableau 7. Données empiriques sur la toxicité pour les organismes aquatiques
| Substance | Organisme d’essai | Type d’essai | Paramètre | Valeur (mg/L) | Référence | ||||
|---|---|---|---|---|---|---|---|---|---|
| BENPAT | |||||||||
| Algues (Selenastrum capricornutum) |
Toxicité chronique (72 heures) |
CE50[1] (augmentation de la biomasse) |
0,018 (18 µg/L) |
Présentation de projet d’études, 2010b; IUCLID Data Set, 2003 | |||||
| CE50 (vitesse de croissance) |
> 0,079 (> 79 µg/L) |
||||||||
| CE10 (CSEO[2]) (augmentation de la biomasse) |
0,0043 (43 µg/L) |
||||||||
| CSEO[2] (vitesse de croissance) |
0,013 | ||||||||
| Cladocère (Daphnia magna) |
Toxicité aiguë (48 heures) |
CE50 (immobilisation) |
1,8 | Présentation de projet d’études, 2010b; IUCLID Data Set, 2003 Présentation de projet d’études, 2010b Présentation de projet d’études, 2010b; IUCLID Data Set, 2003 |
|||||
| CSEO | 0,36 | ||||||||
| Toxicité chronique (21 jours) | CE50 (fécondité) | 0,033 | |||||||
| CE20 (fécondité) |
0,0090 | ||||||||
| CE10[*] (fécondité) |
0,0045 | ||||||||
| CMEO (fécondité) |
0,007 | ||||||||
| CL50[3] (fécondité) |
0,048 | ||||||||
| CMEO (survie) |
0,036 | ||||||||
| CSEO (survie) |
0,016 | ||||||||
| Carpe commune (Cyprinus carpio) |
Toxicité aiguë (14 jours) |
CL50 | 0,43 | ||||||
| CSEO | 0,28 | ||||||||
| Truite arc-en-ciel (Oncorhynchus mykiss) |
Toxicité aiguë (14 jours) |
CL50 | 0,26 | ||||||
| CSEO | 0,14 | ||||||||
| Boues activées (microorga-nismes comme les bactéries) | Toxicité aiguë (30 minutes) |
CE50 | > 10 000 | IUCLID Data Set, 2003 | |||||
| Structure 1 | |||||||||
| Cilié (Tetrahymena pyriformis) |
Toxicité aiguë (48 heures) |
CI50[4] | 0,010 (10 µg/L) | Epstein et al., 1967 | |||||
| BENPATAX | |||||||||
| Algues (Selenastrum capricornutum) |
Toxicité chronique (72 heures) |
CE50 (augmentation de la biomasse) |
0,0094 | Présentation de projet d’études, 1998 | |||||
| CE50 (vitesse de croissance) |
0,11 | ||||||||
| CE10[*] (augmentation de la biomasse) |
0,00075 | ||||||||
| CSEO (vitesse de croissance) |
0,0020 | ||||||||
| Cladocère (Daphnia magna) |
Toxicité aiguë (24 heures) |
CE50 | > 81 | ||||||
| Toxicité aiguë (48 heures) |
CE50 | 0,59 | |||||||
| CSEO | 0,18 | ||||||||
| Carpe commune (Cyprinus carpio) |
Toxicité aiguë (14 jours) |
CL50 | 0,35 | ||||||
| CSEO | 0,17 | ||||||||
[2] CSEO – Concentration sans effet observé, soit la concentration la plus élevée ne causant pas d’effet statistiquement significatif par rapport au groupe témoin dans un essai de toxicité.
[3] CL50 – Concentration d’une substance qu’on estime létale pour 50 % des organismes d’essai.
[4] CI50 – Concentration inhibitrice pour un pourcentage donné d’un effet. Estimation ponctuelle de la concentration d’une substance d’essai causant une réduction de 50 % d’une mesure biologique quantitative comme la vitesse de croissance.
[*] Ces valeurs de CE10 ont été choisies comme valeurs critiques de toxicité (VCT) pour les besoins de la caractérisation du risque écologique. Les études sur la toxicité du BENPAT et du BENTAPAX pour les algues de l’espèce S. capricornutum (Présentation de projet d’études, 2010b, 1998) ont été soumises à une évaluation critique et elles ont été jugées fiables.
En résumé, des études caractérisant la toxicité du BENPAT et de la substance analogue, le BENPATAX, chez plusieurs espèces aquatiques sont disponibles. Bien que l’on puisse considérer qu’il est possible de déduire les données pour le BENTAX à partir de celles relatives au BENPAT, ce dernier ne comprend pas les dérivés de xylyle qui sont davantage substitués par le méthyle. Par conséquent, les renseignements disponibles concernant le BENPATAX ont été jugés plus pertinents et appliqués au BENTAX en s’appuyant la similitude structurelle des substances, matérialisée par la présence de dérivés de xylyle et de tolyle. De plus, l’analogue BENPATAX contient également des dérivés de phényle qui ne sont pas présents dans le BENTAX.
Le poids de la preuve, en ce qui concerne les données expérimentales, indique que le BENPAT et le BENTAX entraîneraient des effets nocifs aigus chez les organismes aquatiques à des concentrations faibles (CL50 aiguës inférieures à 1,0 mg/L).
En outre, les études concernant la toxicité des lixiviats de pneus ont été passées en revue et il a été découvert que les agents protecteurs du caoutchouc, y compris le BENPAT ainsi que les composés de ce dernier et possiblement du BENTAX, pouvaient être détectés dans les lixiviats et contribuer à la toxicité globale de ces derniers dans le milieu aquatique (Wik, 2007; MEEO, 1994). Le ministère de l’Environnement et de l’Énergie de l’Ontario (MEEO, 1994) a réalisé des analyses chimiques et des essais sur la toxicité aquatique sur des lixiviats de pneus en utilisant diverses espèces comme la Daphnia magna, la Ceriodaphnia dubia, la truite arc-en-ciel et la tête-de-boule. Une évaluation des données sur la toxicité a également été menée pour identifier les substances contribuant à la toxicité des lixiviats. Des échantillons d’eau d’essai ont été préparés par lots en submergeant un pneu entier d’automobile dans de l’eau. Un lot d’eau dans laquelle aucun pneu n’a été submergé a été utilisé en tant que témoin négatif. Tous les lots d’eau d’essai ont présenté une toxicité aiguë pour la truite arc-en-ciel, alors qu’aucune toxicité n’a pu être constatée chez les autres espèces testées. Les valeurs de CL50 après 24 et 96 heures calculées pour les truites arc-en-ciel exposées au premier lot d’eau (dans laquelle a été submergée un pneu) se chiffraient respectivement à 58 et 34 % vol/vol, et à 83 et 52 % vol/vol pour le deuxième lot (MEEO, 1994).
Pour l’évaluation des données sur la toxicité, des essais sur des truites ont été menés en utilisant des échantillons d’eau exposée au pneu non dilués, et le temps létal moyen (TL50) a été utilisé afin de mesurer la toxicité. Les additifs chimiques (tels que l’acide chlorhydrique et l’hydroxyde de sodium pour déterminer la sensibilité au pH ainsi que l’acide éthylènediaminetétracétique et le thiosulfate de sodium pour déterminer si les métaux contribuaient à la toxicité observée) ont été utilisés pour déterminer les caractéristiques des substances toxiques se trouvant dans les lixiviats de pneu. La photosensibilité et la persistance des substances toxiques ont également été étudiées. Enfin, l’ajout du charbon actif aux échantillons d’essai a permis d’éliminer la toxicité du lixiviat de pneu pour la truite, ce qui indique que les composés responsables de ladite toxicité de l’eau dans laquelle a été submergé un pneu sont très vraisemblablement des composés organiques polaires non volatils (MEEO, 1994).
Les échantillons d’eau ont également été analysés en vue d’en déterminer les paramètres généraux de qualité de l’eau (comme la dureté, les concentrations de carbone organique et inorganique, de composés azotés et de métaux), les composés organiques cibles (y compris les pesticides, les hydrocarbures chlorés, les hydrocarbures aromatiques polycycliques, les phtalates, les amines, etc.) ainsi que les substances chimiques non ciblées, dont la plusieurs étaient des arylamines et des alkylphénols, que l’on considérait comme des produits de dégradation des additifs antioxydants et antiozonants. Ces derniers comprenaient la structure 1 (ou DPPD), l’aniline, la p-benzoquinone, le 2-méthyl-N-phényl-aniline et le N-phényl-aniline (MEEO, 1994). Ces composés pourraient être responsables de la toxicité observée étant donné qu’il s’agit de composés organiques non volatils; toutefois, plusieurs autres additifs du caoutchouc entrent dans cette catégorie de produits chimiques, et aucun lien n’a pu être établi entre les concentrations d’agents protecteurs dans le lixiviat et la toxicité observée chez la truite.
Dans une étude plus récente, la toxicité aiguë du BENPAT (appelé DTPD dans ladite étude) dans les lixiviats du caoutchouc pour la Daphnia magna a été évaluée par Wik (2007). Dans cette étude, la toxicité des lixiviats produits à partir d’échantillons de caoutchouc contenant divers additifs du caoutchouc (huiles de mise en œuvre et d’extension, antioxydants et antiozonants, accélérateurs de vulcanisation et produits de remplissage/agents de renforcement) a été évaluée.
Une semelle typique de pneus a été préparée en utilisant un nombre minimal de composés et a été testée en tant qu’échantillon de référence. Des échantillons de caoutchouc ont été préparés en ajoutant individuellement les différents additifs à la composition du caoutchouc de référence (ajout de 1,9 % de BENPAT). Des essais ont été menés en ajoutant des morceaux des échantillons de caoutchouc dans de l’eau dans des quantités allant de 0,31 à 10 grammes de caoutchouc par litre d’eau de dilution. Les organismes d’essai ont été exposés à ce mélange après une période de stabilisation de ce dernier de 72 heures. Un témoin positif (K2Cr2O7) et un témoin négatif (eau de dilution) ont été utilisés; les pourcentages de daphnies immobilisées et les valeurs de CE50 ont été calculés pour des périodes d’exposition de 24 et de 48 heures. Les lixiviats contenant les organismes d’essai survivants ont ensuite été irradiés aux rayons ultraviolets (UV) pendant 2 heures et le pourcentage de daphnies immobilisées a été consigné une heure après (Wik, 2007).
Après des expositions de 24 et de 48 heures aux échantillons de caoutchouc contenant du BENPAT, les pourcentages de daphnies immobilisées étaient significativement plus élevés (de 37 à 42 % et de 54 à 56 %) que ceux observés avec l’échantillon de référence (6,3 % et 20,6 %). L’immobilité après l’irradiation aux UV était également significativement plus élevée dans les échantillons contenant du BENPAT que dans tous les autres échantillons. Les valeurs de CE50 après 24 et 48 heures obtenues avec les échantillons de caoutchouc contenant du BENPAT étaient respectivement comprises entre 2,5 et 3,3 et 1,4 et 1,5 grammes de caoutchouc par litre d’eau de dilution. Il convient de noter que la toxicité signalée pour les différents échantillons représente la toxicité d’un additif donné ajoutée à la toxicité de fond de l’échantillon de référence (Wik, 2007). Les valeurs CE50 n’ont pas été calculées pour les échantillons de caoutchouc de référence en raison des faibles relations concentration-réponse.
La toxicité la plus élevée pour la Daphnia magna a été observée dans les échantillons de caoutchouc contenant des agents protecteurs, parmi lesquels du BENPAT. Il est possible que la toxicité élevée constatée ait été causée par la migration séquentielle des agents protecteurs vers la surface du caoutchouc, à partir de laquelle ils pourraient se libérer plus facilement. De plus, la toxicité des échantillons de caoutchouc contenant du BENPAT a augmenté après l’irradiation aux UV, ce qui laisse entendre que le BENPAT pourrait se photodégrader pour produire des composés plus toxiques (Wik, 2007). L’irradiation aux UV pourrait également avoir entraîné la dégradation des échantillons de caoutchouc, ce qui à son tour aurait augmenté la lixiviabilité du BENPAT. Néanmoins, l’étude ne comprenait pas d’échantillons non irradiés qui auraient pu être utilisés comme témoins pour vérifier les possibles augmentations de la toxicité causées par une lixiviation supplémentaire de la substance qui aurait eu lieu au cours des trois dernières heures de l’essai.
Dans l’ensemble, l’étude de Wik (2007) a indiqué que les lixiviats provenant de caoutchouc contenant des agents protecteurs tels que le BENPAT entraînaient des effets toxiques chez la Daphnia magna, ce qui laisse entendre que ces substances pourraient se libérer du caoutchouc et avoir des effets toxiques sur les organismes aquatiques.
En résumé, les conclusions tirées à partir des études sur les lixiviats du caoutchouc effectuées par le MEEO (1994) et Wik (2007) laissent entendre que les agents protecteurs, y compris le BENPAT et les composés du BENPAT et du BENTAX (comme la structure 1, l’aniline, la p-benzoquinone, le 2-méthyl-N-phényl-aniline et le N-phényl-aniline) peuvent se libérer par lixiviation du caoutchouc lorsqu’ils sont exposés à l’eau, et avoir des effets toxiques sur le milieu aquatique à des concentrations relativement faibles.
B – Dans d’autres milieux
La toxicité du BENPAT pour les organismes vivant dans les sols et les sédiments a été étudiée en laboratoire (Présentation de projet d’études, 2010c). On n’a trouvé aucune étude sur les effets du BENTAX dans les sols et les sédiments.
Sol
On a déterminé les effets du BENPAT sur la survie, la croissance et la capacité de reproduction des lombrics adultes de l’espèce Eisenia fetida. L’étude a porté sur 4 concentrations d’essai : 125, 250, 500 et 1 000 mg de BENPAT/kg de sol (poids sec), et comportait des témoins traités au solvant (acétone) et des témoins non traités. Les lombrics adultes ont été placés dans un sol traité pendant 28 jours, et leur progéniture en développement a été laissée dans ce sol pendant 28 jours de plus. Les paramètres mesurés étaient la survie et la variation du poids corporel des lombrics adultes au bout de 28 jours d’exposition, et l’on a aussi évalué le nombre de juvéniles s’étant développés au bout de 56 jours.
Au terme de la période d’exposition de 28 jours, le BENPAT n’avait pas entraîné de mortalité significative chez les lombrics adultes aux concentrations d’essai (c’est-à-dire 125 à 1 000 mg de BENPAT/kg de sol [poids sec]). On n’a pas observé d’effets sur le comportement, la santé ou la biomasse des lombrics après une exposition au BENPAT. De plus, aucun effet notable sur la capacité de reproduction des lombrics n’a été constaté. Par conséquent, la CSEO sur la mortalité, la biomasse, le comportement et la capacité de reproduction des lombrics adultes a été fixée, pour le BENPAT, à la concentration maximale d’essai, soit 1 000 mg de BENPAT/kg de sol (poids sec) (Présentation de projet d’études, 2010c).
Sédiments
Les effets du BENPAT dans les sédiments ont été étudiés dans le cadre d’une étude fondée sur la ligne directrice 218 de l’OCDE, intitulée Essai de toxicité sur les chironomes dans un système eau-sédiment chargé (Présentation de projet d’études, 2010c). Le moucheron de l’espèce Chironomus riparius a été utilisé comme animal modèle. Les larves de C. riparius sont des organismes tubulaires vivant en suspension; dépositivores, ils se nourrissent de la matière organique dans les sédiments. Par conséquent, ils sont susceptibles d’entrer en contact avec tout contaminant lié aux sédiments. Des chironomes au premier stade larvaire (c’est-à-dire de moins de 3 jours) ont été utilisés dans cette étude. Le BENPAT a été testé à cinq concentrations d’essai, soit 25, 64, 160, 400 et 1 000 mg/kg sédiments secs, avec un groupe de témoins traités au solvant (acétone) et un groupe de témoins non traités, sur 28 jours. Des échantillons des sédiments ont été préparés comme suit : des solutions d’essai de BENPAT ont été ajoutées à du sable sec, mélangées, puis l’acétone en a été évaporée, après quoi le sable sec chargé a été mélangé avec les sédiments humides préparés.
On a enregistré la durée de développement ainsi que le nombre total de moucherons mâles et femelles entièrement émergés. La valeur de la CE50 sur 28 j du BENPAT pour C. riparius a été estimée à plus de 615,2 mg/kg (soit une concentration nominale de 1 000 mg/kg). Les valeurs de CSEO pour le ratio d’émergence et pour le taux de développement, au bout de 28 jours, ont toutes deux été établies à 615,2 mg/kg (soit une concentration nominale de 1 000 mg/kg).
Sommaire
Les études menées dans les sols et dans les sédiments sur les lombrics et les chironomes, respectivement, n’ont révélé aucun effet associé à l’exposition au BENPAT aux concentrations maximales d’essai.
Il est possible que, vu son potentiel d’adsorption élevé, le BENPAT soit fortement lié aux particules de sol ou de sédiments et que, par conséquent, il ne soit pas biodisponible pour les organismes vivant dans les sols ou les sédiments. Cependant, comme une seule espèce a été soumise à des essais dans chacun de ces milieux jusqu’ici, il est également possible que ces organismes en particulier, c’est-à-dire le lombric E. fetida et le chironome C. riparius, ne soient pas très sensibles au BENPAT.
Évaluation de l’exposition de l’environnement
Aucune donnée concernant les concentrations de BENPAT et de BENTAX dans l’environnement au Canada n’a été relevée. Par conséquent, on a estimé les concentrations dans l’environnement à partir des renseignements dont on disposait, notamment les quantités estimées de substance, les taux de rejet et la taille des plans ou cours d’eau récepteurs. Les renseignements concernant la présence d’agents protecteurs tels que le BENPAT dans l’environnement à cause de l’usure des pneus sont également résumés.
A – Rejets industriels
L’exposition aquatique au BENPAT et au BENTAX est prévue lorsque ces substances sont rejetées par les utilisations industrielles vers une usine de traitement des eaux usées et que l’usine évacue son effluent dans des eaux réceptrices. La concentration de la substance dans les eaux réceptrices près du point de rejet de l’usine de traitement des eaux usées est utilisée comme la concentration environnementale estimée (CEE) dans l’évaluation du risque que présente la substance en milieu aquatique. On peut la calculer à l’aide de l’équation suivante :
Ceau-ind = [1000 × Q × L × (1 - R)] / [N × F × D]
où
Ceau-ind : concentration en milieu aquatique due aux rejets industriels, en mg/L
Q : quantité de substance totale utilisée chaque année sur un site industriel, en kg/an
L : pertes dans les eaux usées, fraction
R : taux d’élimination de l’usine de traitement des eaux usées, fraction
N : nombre de jours de rejets annuels, en jour/an
F : débit de l’effluent de l’usine de traitement des eaux usées, en m3/jour
D : facteur de dilution dans l’eau réceptrice, sans dimension
BENPAT
Une analyse de l’exposition propre au site en milieu aquatique a été effectuée à un total de trois sites où le BENPAT était utilisé comme antiozonant dans la fabrication de produits en caoutchouc de haute qualité. La quantité réelle de la substance employée à chaque site allait de 10 000 à 500 000 kg/année. Deux scénarios de rejet, le scénario 1 et le scénario 2, sont présentés pour chaque site; ils illustrent l’intervalle d’estimations des pertes de la substance dans les eaux usées attribuables aux processus de production selon deux sources d’information différentes.
Dans le scénario de rejet 1, la fraction que l’on estime perdue dans les eaux usées des processus de production est de 1 %, d’après l’OCDE (2004c). Dans le scénario de rejet 2, la fraction que l’on estime perdue dans les eaux usées des processus de production est de 0,05 %, d’après l’information présentée dans la Présentation de projet d’études (2010b). Les eaux usées contenant la substance subissent ensuite un traitement secondaire et tertiaire hors site (pour les sites 2 et 3) dans des usines de traitement des eaux usées, avec un taux d’élimination modélisé de 48 %. Ce taux a été estimé à l’aide du modèle ASTreat (2006) concernant l’élimination par les usines de traitement des eaux usées, pour la structure représentative 2, l’un des principaux composants du BENPAT, qui compose la substance à approximativement 50 % (Huntink et al. 2006). Les effluents de ces usines de traitement sont ensuite rejetés dans des cours d’eau ou des lacs, et un facteur de dilution d’au plus 10 est appliqué pour dériver les CEE produites par les concentrations dans les effluents. On suppose également une fréquence de rejet de 350 jours/année pour les 3 sites aux fins de l’estimation. Les CEE estimées pour les 3 sites sont de l’ordre de 0,8 à 64,82 µg/L pour le scénario 1, et de 0,04 à 3,24 µg/L pour le scénario 2 (Environnement Canada, 2011a). Ces valeurs de CEE représentent le degré d’exposition dans les eaux réceptrices à proximité du point de rejet de l’usine de traitement des eaux usées à chaque site.
Les variables relatives à l’exposition utilisées pour définir les rejets de BENPAT à 3 sites industriels ainsi que les CEE pour les scénarios de rejet 1 et 2 sont présentées au tableau 8a ci-dessous.
Tableau 8a. Sommaire des rejets industriels de BENPAT
| Paramètre | Site 1 | Site 2 | Site 3 | |||
|---|---|---|---|---|---|---|
| Scénario 1 | Scénario 2 | Scénario 1 | Scénario 2 | Scénario 1 | Scénario 2 | |
| CEE (µg/L) | 12,22 | 0,61 | 0,8 | 0,04 | 64,82 | 3,24 |
BENTAX
Une analyse de l’exposition propre au site en milieu aquatique a été effectuée à un site où le BENTAX était utilisé de manière industrielle comme antiozonant dans la fabrication de produits en caoutchouc (Environnement Canada, 2011b). La quantité de BENTAX déclarée être importée pour être utilisée à ce site est de 100 à 1 000 kg (Environnement Canada, 2010c).
Dans cette analyse de l’exposition propre au site, le site industriel comprend une installation, des usines de traitement primaire et secondaire des eaux usées et un plan d’eau récepteur. La CEE dans les eaux réceptrices a été estimée d’après la concentration dans les effluents d’eaux usées, avec un facteur de dilution de 10 dans les eaux réceptrices. La fraction rejetée dans les eaux usées a été évaluée, de manière prudente, à approximativement 2 %; elle provient de la manipulation des contenants de produits chimiques et des procédés industriels employés dans les installations visées. On a aussi supposé une fréquence de rejet de 24 jours/année aux fins de l’estimation. Cette hypothèse est fondée sur des estimations des activités en lien avec la quantité totale de produits générée et sur l’utilisation connexe de la substance dans des modes de production par lots peu fréquents. Le taux d’élimination par une usine locale de traitement des eaux usées a été estimé, par modélisation informatique, à 46,4 % (SimpleTreat, 1997), pour la structure représentative 4, l’un des principaux composants du BENTAX, qui devrait composer la substance à approximativement 50 %, comme la structure 2 dans le BENPAT (Huntink et al. 2006).
D’après les hypothèses décrites ci-dessus, la CEE est estimée à 0,02 mg/L pour le site industriel considéré.
Comme seulement le plus gros utilisateur a été pris en compte dans cette analyse propre au site, avec certaines hypothèses de la fourchette supérieure des estimations, on considère que la CEE obtenue correspond au degré d’exposition pour un scénario de rejet prudent dans les eaux réceptrices à proximité du point de rejet de l’usine de traitement des eaux usées d’un site industriel au Canada.
B – Rejets par les consommateurs
Utilisation de BENPAT dans les pneus
Comme le BENPAT est présent dans des produits de consommation, notamment dans les pneus, et pourrait être rejeté dans l’eau, Mega Flush, le tableur d’Environnement Canada, a été utilisé pour estimer la concentration de la substance dans divers plans d’eau recevant des effluents d’usines de traitement des eaux usées dans lesquelles des produits de consommation contenant du BENPAT pourraient avoir été rejetés (Environnement Canada, 2009).
Ce scénario de rejet associé aux produits de consommation n’a pas été appliqué au BENTAX, car on s’attend à ce que les rejets de cette substance en provenance de produits de consommation soient très faibles vu les quantités utilisées déclarées pour cette substance (Environnement Canada, 2005, 2010c).
Le tableur Mega Flush fournit des estimations fondées sur des hypothèses réalistes pour environ 1 000 sites de rejet au Canada. Deux scénarios de rejet de Mega Flush, les scénarios 1 et 2, ont été étudiés pour le BENPAT, et ce, pour prendre en compte les différences dans les estimations des rejets dans l’eau et le sol. Pour le scénario de rejet 1, on a utilisé des hypothèses fondées sur ChemRisk LLC (2009), selon lesquelles les rejets se font à 66 % dans l’eau et à 33 % dans le sol, avec 50 % des 66 % rejetés dans l’eau étant libérés dans le réseau d’égouts, et 50 %, dans les eaux réceptrices. Pour le scénario de rejet 2, une distribution moitié-moitié dans l’eau et le sol a été supposée d’après les hypothèses employées dans l’outil de détermination du débit massique (voir le tableau 3, Environnement Canada, 2010a).
Les hypothèses réalistes employées comprennent ce qui suit :
- pertes dans les eaux usées : 0,378 % pour le scénario de rejet 1, et de 0,252 % pour le scénario de rejet 2;
- taux d’élimination par l’usine de traitement des eaux usées estimé à 0,0 % en l’absence de traitement, à 17 % avec un traitement primaire seulement, et à 48 % avec une combinaison de traitement primaire et secondaire;
- nombre de jours de rejet par année : 365;
- facteur de dilution dans les eaux réceptrices : 1 à 10;
- 12 % de caoutchouc libéré à partir de particules de caoutchouc en raison de l’abrasion (ChemRisk LLC, 2009)
- 6,3% du BENPAT lessivé dans l’eau à partir des particules de caoutchouc[5]
On a estimé que la CEE de BENPAT dans les eaux réceptrices était de l’ordre de 7,4 × 10-6 à 2,2 × 10-3 mg/L. L’estimation est fondée sur la quantité totale de la substance présumée être utilisée dans les pneus. L’équation et les données d’entrée employées pour calculer la CEE sont présentées dans Environnement Canada (2011c, 2011d).
Autres renseignements sur l’usure des pneus
On présenté ci-dessous des renseignements additionnels sur la présence d’agents protecteurs du caoutchouc tels que le BENPAT dans l’environnement à cause de l’usure des pneus.
Des particules provenant de l’usure des pneus sont libérées par la semelle des pneus en raison de l’interaction entre les pneus et la chaussée (ChemRisk, 2008). La majeure partie du caoutchouc abrasé est rejetée sous la forme de particules relativement grosses sur les bords de routes, alors que moins de 5 % de ces particules sont aéroportées et moins de 1 % sont rejetées sous forme d’émissions gazeuses. Les particules déposées sur le bord de la route peuvent ensuite se retrouver dans les milieux aquatiques par l’intermédiaire de l’eau de ruissellement des routes (Wik et Dave, 2009). Selon des estimations fondées sur des données des années 1970, environ 30 % de la gomme des pneus s’use et est rejetée dans l’environnement (Wik et Dave, 2009). Des estimations plus récentes indiquent des rejets plus faibles à partir de la semelle, de l’ordre de 10 à 12 % (Camatini et al., 2001; Blok, 2005; OCDE, 2004c; ChemRisk LLC, 2009). Les estimations plus anciennes des rejets de gomme, dans les années 1970, sont plus élevées parce que les pneus radiaux modernes se caractérisent par un taux d’usure plus faible que celui des pneus diagonaux utilisés auparavant (Veith, 1992). La teneur en antiozonants est habituellement de 1 % dans la gomme des pneus (Wik et Dave, 2009). Ailleurs, on indique que la teneur en antiozonants dans le caoutchouc peut se situer entre 0,25 et 4 % et atteindre 8 % en poids (Goodyear Tire and Rubber Company, 1965).
Un programme de recherche pluriannuel sur les possibles effets des particules provenant de l’usure des pneus sur l’environnement, la santé et les composantes écologiques a été entrepris par le Tire Industry Project Group (TIPG), par l’intermédiaire du World Business Council on Sustainable Development; plusieurs membres de l’industrie y participent (ChemRisk, 2008). Les données recueillies jusqu’ici comprennent des études sur la composition des particules sur le bord des routes, y compris la composition en substance organiques et inorganiques, et sur leur possible lessivage dans l’environnement. Les résultats obtenus ont été résumés dans des rapports (ChemRisk, 2008; ChemRisk et DIK, 2008) parus dans les publications à comité de lecture (Kreider et al., 2010) et présentés à une conférence (MacAfee et al., 2010).
Trois types de particules provenant de l’usure des pneus ont été identifiés, et leur composition ainsi que leurs propriétés physiques ont été analysées dans une étude du TIPG (ChemRisk 2008). Les particules en bordure des routes (PR) sont composées d’un mélange d’éléments provenant des pneus, de la chaussée, des carburants, des freins et de la poussière des routes. Les particules provenant de l’usure des pneus (PUP) sont produites par l’interaction entre les pneus et la chaussée. Les particules de pneus (PP) sont composées de gomme de pneus pure. La composition chimique globale varie pour ces trois types de particules, qui se distinguent aussi par leur taille et leur forme (ChemRisk, 2008; Kreider et al., 2010). Par exemple, les PR et les PUP générées en laboratoire ont toutes deux une forme allongée de cigare, tandis que les PP sont plus grosses, avec des bords plus dentelés.
Pour cette étude, des PP ont été produites en laboratoire et recueillies sur des pneus usuels de véhicules de promenade et de camions à l’aide d’un dispositif de collecte sur route spécialement conçu à cet effet. Les particules prélevées sur la route et les particules générées en laboratoire étaient semblables en termes de composition, et elles renfermaient une quantité comparable de caoutchouc.
L’analyse des composants organiques des PR et des PUP générées en laboratoire a révélé la présence d’antioxydants, dont du BENPAT (appelé DTPD dans le rapport), en concentrations de l’ordre des parties par million (ppm) (ChemRisk, 2008). De plus, on a procédé à une extraction à l’acétone afin de déterminer quels composants des PR et des PP avaient le potentiel d’être lessivés. On a trouvé plusieurs antioxydants dans les extraits de PR et de PP obtenus à l’acétone, ainsi que plusieurs autres produits organiques comme des composants d’huiles et de cires de même que des phtalates (ChemRisk, 2008). On a détecté du BENPAT dans les extraits de PP obtenus à l’acétone (MacAfee et al., 2010).
Le potentiel de lessivage des produits chimiques recensés dans les extraits à l’acétone a été étudié, et les PR et les PP ont été soumises à des essais de lessivage par une imitation d’eau de pluie. On a laissé de l’eau de pluie à pH 7,5 s’égoutter pendant 16 heures sur des colonnes renfermant des PR ou des PP. L’eau a ensuite été recueillie, et l’on a analysé sa teneur en produits organiques et en métaux. On n’a pas détecté de produits chimiques dans le lessivat d’eau après 16 heures, sauf du formaldéhyde (ChemRisk, 2008). Le lessivat des produits chimiques provenant des PR a été mélangé avec des particules de sol représentatives de celles qu’on peut trouver le long des routes, et l’on a soumis le mélange à une expérience semblable à celle des études sur colonne avec l’eau, pendant 16 heures. L’eau de lessivage du sol a été recueillie et analysée. On n’a pas trouvé de produits chimiques, y compris des antiozonants, dans le lessivat.
Ces études sur 16 heures, qui simulaient un épisode de précipitations unique, sur le potentiel de lessivage des additifs organiques entrant dans la composition des pneus, dont le BENPAT, ont montré l’absence de telles substances dans les lessivats (ChemRisk, 2008). Cependant, vu la durée très courte de ces études, l’absence de variation dans les conditions expérimentales ainsi que le fort potentiel d’adsorptivité du BENPAT, le potentiel de lessivage de cette substance pourrait ne pas avoir été entièrement caractérisé. En effet, ces études n’illustrent pas les conditions environnementales à plus long terme ainsi que les effets connexes sur le potentiel de lessivage des antiozonants tels que le BENPAT à partir des particules provenant de l’usure des pneus.
Dans d’autres études remontant aux années 1970, des estimations concernant les émissions de gomme provenant des pneus fondées sur différents marqueurs chimiques des pneus ont été rapportées (Wik et Dave, 2009). Les marqueurs des pneus constituent un moyen pratique de surveiller les concentrations en particules provenant de l’usure des pneus dans l’environnement. Les fractions de particules provenant de l’usure des pneus dans le sol, les sédiments et l’air ne peuvent être déterminées à partir des taux d’usure mesurés ou dérivés de manière théorique (ChemRisk, 2008). Les concentrations de particules de caoutchouc dans l’environnement ont été estimées d’après les marqueurs chimiques des pneus, soit les concentrations mesurées des composés et additifs courants du caoutchouc, y compris le butadiène-styrène (SBR), le caoutchouc naturel (CN), les benzothiazoles (HOBT et 24MoBT) et le zinc organique (Wik et Dave, 2009). On n’a trouvé aucune documentation attestant l’utilisation d’antiozonants comme marqueurs chimiques des pneus, probablement parce que les antiozonants sont des additifs chimiques réactifs du caoutchouc (ChemRisk et DIK, 2008). Cependant, l’analyse chimique des particules de la semelle des pneus a montré qu’elles contiennent des agents protecteurs (ChemRisk, 2008).
Il faut souligner que l’utilisation de marqueurs chimiques peut être à l’origine de surestimations ou de sous-estimations des concentrations de particules de pneus étant donné que les marqueurs utilisés pourraient être soumis à une dégradation dans l’environnement ou que d’autres sources que les pneus pourraient être à l’origine de leur rejet dans l’environnement (Wik et Dave, 2009). Le rapport de ChemRisk et DIK (2008) présente une description plus approfondie de la fiabilité des différents marqueurs chimiques des pneus, dont différents marqueurs à base de polymères, le benzothiazole (BT), le 2-(4-morpholinyl)benzothiazole (24MoBT), la N-cyclohexyl-2-benzothiazolimine (NCBA), des marqueurs à base de zinc ainsi que les marqueurs à base d’additifs à point d’ébullition élevé présents dans le butadiène-styrène. Il en a été conclu que les marqueurs de pneus les plus prometteurs étaient les marqueurs de pyrolyse à base de polymères (isoprène, butadiène et thiophène) ainsi que le zinc organique.
Les CEE de particules de pneus provenant de l’étude de Wik et Dave (2009) ont été résumées pour les États-Unis uniquement et sont présentées au tableau 8b. Aux États-Unis, les rejets annuels de particules de pneus en caoutchouc dans l’environnement se chiffrent environ à 500 millions de kg. Les concentrations de particules de pneus dans la poussière des routes ont été estimées entre 0,7 et 210 g/kg de poids sec d’après les concentrations mesurées les plus élevées des différents marqueurs chimiques des pneus. Dans les sols longeant les routes, des concentrations de 0,6 à 117 g/kg de poids sec ont été estimées d’après les concentrations mesurées les plus élevées des différents marqueurs chimiques des pneus. Les concentrations des particules de pneus dans la poussière des routes et dans les sols diminuaient en fonction de la distance qui séparait ces derniers des routes. Des particules de pneus peuvent également avoir été épandues sur des terres agricoles en tant que composés de boues provenant d’usines de traitement des eaux usées (UTEE). On a estimé qu’environ 16 % du zinc se retrouvant dans les UTEE provenait de l’usure des pneus. Les concentrations de zinc dans les boues d’UTEE ont été mesurées à hauteur de 4 g/kg de poids sec. En considérant que la gomme des pneus est constituée à environ 1,5 % de zinc, la concentration de particules de caoutchouc de pneus dans les boues d’UTEE a été estimée à 42,7 g/kg de poids sec (Wik et Dave, 2009).
D’après les concentrations de benzothiazoles, les concentrations de particules liées à l’usure des pneus dans les eaux de ruissellement des routes ont été estimées entre 0,3 et 197 mg/L. En comparaison, de faibles concentrations de particules de pneus ont été estimées dans les eaux réceptrices. D’après les valeurs concernant les eaux de ruissellement des routes, il a été estimé que des concentrations de particules de pneus comprises entre 0,03 et 17,9 mg/L se retrouvaient dans les eaux réceptrices. Des concentrations comprises entre 0,09 et 6,4 mg/L seulement ont été obtenues sur la base des concentrations mesurées de benzothiazoles (Wik et Dave, 2009). Les concentrations de particules de pneus dans les sédiments ont été estimées entre 0,3 et 155 g/kg de poids sec d’après les concentrations mesurées de benzothiazoles et de zinc. Cependant, étant donné que les composés benzothiazoles sont solubles dans l’eau et qu’ils n’ont pas tendance à s’accumuler dans les sédiments, ce marqueur sous-estime vraisemblablement la concentration des particules de pneus se trouvant dans les sédiments (Wik et Dave, 2009). Les concentrations de particules de pneus dans l’air ambiant le long des routes sont estimées entre 0,4 et 11 µg/m3.
Tableau 8b. Concentrations environnementales estimées pour les particules de pneus
| Milieu | Lieu; année | Marqueurs des pneus | Références[1] | Concentrations environnementales estimées pour les particules de pneus[2] |
|---|---|---|---|---|
| Air | Route expresse d’Akron, Ohio, É.-U. – 1973; tunnel des montagnes Allegheny, Pennsylvanie, É.-U. – 1973 | SBR[4] | Cardina, 1974; Pierson et Brachaczek, 1974 | 6 à 11 µg/m3 |
| Autoroute de la rivière San Gabriel, Californie, É.-U. – 1974 | SBR[4]/CN[5] | Cadle et Williams, 1978 | 0,5 µg/m3 | |
| Eaux de ruisselle-ment des routes | Rivières Pawtuxet, Woonasquatucket et Moshassuck, Rhode Island, É.-U. – 1995 | HOBT[6] | Reddy et Quinn, 1997 | 87 mg/L |
| Ruisseau Ballona et rivière Santa Ana, Californie, É.-U. – 1997-1998 | 24MoBT[7] | Zeng et al., 2004 | 92 mg/L | |
| Eau de rivière | Bassin de décantation d’autoroute (à l’intersection des routes 102 et 4 du Rhode Island) et rivière Pawtuxet, Rhode Island, É.-U. – 1995 | 24MoBT | Reddy et Quinn, 1997 | 1,6 mg/L |
| Sédiments | Baie de San Francisco, Californie, É.-U. | 24MoBT | Spies et al., 1987 | 155 000 mg/kg p.s. |
| Bassin de décantation d’autoroute, rivière Pawtuxet et baie Narragansett, Rhode Island, É.-U. – 1995 | HOBT | Reddy et Quinn, 1997 | 400 mg/kg p.s. | |
| Sol | Autoroute de la rivière San Gabriel, Californie, É.-U. – 1974; Rotunda Drive, Michigan, É.-U. – 1973 (à 0 m de la route) |
SBR | Cadle et Williams, 1978; Pierson et Brachaczek, 1974 | 4 500 à 24 000 mg/kg p.s. |
| Route 80, Berkeley, Californie, É.-U. (à 0 m de la route) | 24MoBT | Spies et al., 1987 | 117 000 mg/kg p.s. | |
| Rotunda Drive, Michigan, É.-U. – 1973 (à 8 m de la route) |
SBR | Pierson et Brachaczek, 1974 | 1 000 mg/kg p.s. | |
| Autoroute de la rivière San Gabriel, Californie, É.-U. – 1974 (à 30 m de la route) |
SBR | Cadle et Williams, 1978 | 0 mg/kg p.s. |
[1] Études rapportant des concentrations environnementales mesurées pour le marqueur de pneu utilisées par Wik et Dave (2009) dans l’estimation des particules de pneus dans l’environnement
[2] Concentrations estimées par Wik et Dave (2009)
[3] Concentrations de l’agent protecteur calculées d’après les estimations signalées de particules de pneus, en supposant que le caoutchouc de la gomme de pneus est constitué à 1 % de l’agent protecteur (Wik et Dave, 2009)
[4] SBR : butadiène-styrène
[5] CN : caoutchouc naturel
[6] HOBT : 2-hydroxybenzothiazole
[7] 24MoBT : 2-(4-morpholinyl)benzothiazole
En résumé, l’étude de Wik et Dave (2009) a permis de démontrer que des particules provenant de la gomme des pneus sont rejetées dans l’environnement. Ces particules contiennent des agents protecteurs tels que le BENPAT; ces substances sont ajoutées dans le caoutchouc des pneus en tant qu’agents protecteurs (Kirk-Othmer, c2010; Iatropoulos et al., 1997).
Enfin, la biodisponibilité des antiozonants des particules de pneus n’est pas bien caractérisée à l’heure actuelle. On n’a pas relevé d’études fiables sur la biodisponibilité des antioxydants provenant des particules de pneus usés; toutefois, la biodisponibilité des agents protecteurs provenant des lixiviats de pneus entiers a été démontrée dans une étude de Stephensen et al. (2003). Dans l’étude de Stephensen et al. (2003), quatre agents protecteurs ou métabolites d’agents protecteurs autres que le BENPAT ont été mesurés dans la bile de truites arc-en-ciel après leur exposition à de l’eau contenant le lixiviat d’un pneu entier. Il est possible que le BENPAT n’ait pas été présent dans les échantillons de caoutchouc testés par Stephensen et al. (2003); cependant, certains des composés antiozonants lui étaient semblables d’un point de vue structurel. Par exemple, l’un des composés mesurés, le N-(1-méthyléthyl)-N’-phényl-1,4-benzènediamine (IPPD), ne se distinguait de la structure représentative 1 du BENPAT que par la présence d’un groupe alkyle au lieu d’un groupe aryle.
Enfin, plusieurs études sur la biodisponibilité des particules de pneus usés ont été résumées dans Wik et Dave (2009) et, dans l’ensemble, les résultats indiquaient que les particules de pneus usés pouvaient être biodisponibles pour les organismes pélagiques qui filtrent l’eau, les organismes benthiques et les plantes.
Caractérisation des risques pour l’environnement
La démarche choisie dans la présente évaluation préalable des risques pour l’environnement consistait à examiner différents éléments probants et de formuler des conclusions en se fondant sur la méthode du poids de la preuve, tout en respectant le principe de la prudence, comme l’exige la LCPE (1999). Les éléments de preuve considérés comprenaient les résultats du calcul des quotients de risque ainsi que les renseignements sur la persistance, la bioaccumulation, la toxicité, les sources et le devenir de la substance.
On s’attend à ce que les composants du BENPAT et du BENTAX soient persistants dans l’eau, le sol et les sédiments; certains des principaux composants du BENPAT comme du BENTAX sont également susceptibles d’avoir un potentiel de bioaccumulation modéré à élevé. Des composants du BENPAT et du BENTAX répondent aux critères de persistance, mais pas à celui de bioaccumulation au sens du Règlement sur la persistance et la bioaccumulation de la LCPE (1999) (Canada, 2000). Une fois rejetés dans l’environnement, tant le BENPAT que le BENTAX peuvent se retrouver dans l’eau, le sol et les sédiments.Le BENPAT et le BENTAX ont également montré un fort potentiel de toxicité pour les organismes aquatiques.
Les substances persistantes demeurent longtemps dans l’environnement après y avoir été rejetées, ce qui accroît l’ampleur et la durée possibles de l’exposition. Celles dont la demi-vie dans les milieux mobiles (comme l’eau) est longue et qui sont sujettes à se répartir en proportions appréciables dans ces milieux peuvent causer une contamination étendue. Par ailleurs, le rejet de faibles quantités de substances bioaccumulables peut donner lieu à des concentrations élevées de ces substances dans les organismes exposés.
BENPAT
Une analyse du quotient de risque couplant des estimations de l’exposition avec des données sur la toxicité a été effectuée pour le milieu aquatique afin de déterminer s’il existait un risque pour l’environnement au Canada. Les scénarios industriels propres aux sites (fondés sur des plans d’eau récepteurs réels) présentés précédemment ont généré une CEE de l’ordre de 0,8 à 64,82 mg/L pour le scénario 1, et de 0,04 à 3,24 mg/L pour le scénario 2 (Environnement Canada, 2011a). Une CESE pour le BENPAT a été dérivée à partir d’une valeur de toxicité chronique de 0,0043 mg/L (valeur expérimentale traduisant la plus grande sensibilité dans l’environnement; voir le tableau 7) pour l’algue de l’espèce S. capricornutum, cela en divisant cette valeur par un facteur d’évaluation de 10 (traduisant la variation intraspécifique et interspécifique en matière de sensibilité ainsi que l’extrapolation de résultats obtenus en laboratoire à des conditions de terrain); cela a donné une valeur de 0,00043 mg/L (soit 0,43 mg/L). Les quotients de risque (CEE/CESE) découlant du scénario 1 sont de l’ordre de 1,9 à 150,7, tandis qu’ils se situent entre 0,1 et 7,5 pour le scénario 2. Ils sont résumés au tableau 8c ci-dessous.
Tableau 8c. Quotients de risque pour le BENPAT obtenus à partir des scénarios de rejet industriels
| Paramètre | Site 1 | Site 2 | Site 3 | |||
|---|---|---|---|---|---|---|
| Scénario 1 | Scénario 2 | Scénario 1 | Scénario 2 | Scénario 1 | Scénario 2 | |
| CEE (µg/L) | 12,22 | 0,61 | 0,8 | 0,04 | 64,82 | 3,24 |
| QR | 28,4 | 1,4 | 1,9 | 0,1 | 150,7 | 7,5 |
Suivant une méthodologie similaire à l’approche du rapport CEE/CESE, le tableur des rejets associés aux produits de consommation Mega Flush a prévu, pour le premier scénario considéré (scénario 1), que les CEE pour le BENPAT pourraient excéder la CESE dans environ 4 % des plans d’eau recevant des eaux usées au Canada en conditions de faible débit (10e centile) (Environnement Canada, 2011c). Les prévisions pour le second scénario (scénario 2) étaient plus élevées : cette fois, il s’agissait d’environ 11 % des plans d’eau recevant des eaux usées au Canada en conditions de faible débit (10e centile (Environnement Canada, 2011d). Le rapport CEE/CESE maximal calculé pour le scénario de rejet 1 de Mega Flush était de 3,7, et le QR maximal pour le scénario de rejet 2 de Mega Flush était de 5,1 (Environnement Canada, 2011c, 2011d).
L’information indique que le BENPAT est susceptible de représenter un danger pour l’environnement au Canada.
BENTAX
Une analyse du quotient de risque couplant des estimations prudentes de l’exposition avec des données sur la toxicité a été effectuée pour le milieu aquatique afin de déterminer s’il existait un risque pour l’environnement au Canada. Le scénario industriel propre au site (fondé sur un plan d’eau récepteur réel) a généré une CEE de l’ordre de 0,0036 mg/L (Environnement Canada, 2011a). Une CESE a été dérivée à partir d’une valeur de toxicité aiguë de 0,00075 mg/L (valeur expérimentale valide traduisant la plus grande sensibilité dont on dispose pour l’analogue BENTAPAX; voir le tableau 7) pour l’algue de l’espèce S. capricornutum, cela en divisant cette valeur par un facteur d’évaluation de 10 (traduisant la variation intraspécifique et interspécifique en matière de sensibilité ainsi que l’extrapolation de résultats obtenus en laboratoire à des conditions de terrain); cela a donné une valeur de 0,000075 mg/L (soit 0,075 mg/L). Le quotient de risque (CEE/CESE) associé est de 0,047. Par conséquent, il est peu probable que la substance présente un danger pour les organismes aquatiques vu son utilisation limitée dans l’industrie et les faibles quantités qui sont rejetées.
Dans l’ensemble, l’information indique que le BENTAX n’est pas susceptible de représenter un danger pour l’environnement au Canada.
Incertitudes dans l’évaluation des risques pour l’environnement
Toute modélisation des propriétés physiques et chimiques d’une substance ainsi que des caractéristiques de persistance et de bioaccumulation est fondée sur les structures chimiques. Étant donné que le BENPAT et le BENTAX font partie de la catégorie des UVCB (substances de composition inconnue ou variable, produits de réactions complexes ou matières biologiques), elles ne peuvent être présentées par une seule structure chimique distincte. Par conséquent, aux fins de la modélisation, des « structures représentatives » (les structures représentatives 1 à 5) ont été déterminées en vue de fournir des estimations prudentes. Ces structures représentent les composés principaux constituant le BENPAT et le BENTAX. Étant donné que plusieurs structures représentatives peuvent être choisies pour la même substance UVCB, il est reconnu que des incertitudes liées à la structure existent pour ces substances. Par exemple, alors que la part des diverses structures représentatives peut être estimée ou mesurée, cette part peut varier selon les lots de la substance importés. De plus, les composés mineurs du BENPAT et du BENTAX présents dans les mélanges à des concentrations inférieures à 5 % n’ont pas été pris en considération dans la présente évaluation.
Certaines des propriétés physico-chimiques expérimentales du BENPAT dont on dispose ont été exprimées sous forme de fourchettes (voir les tableaux 2a et 2b), ce qui entraîne par conséquent une certaine variabilité des résultats. Lorsque de telles propriétés ont été utilisées comme intrants dans les modèles, cette variabilité se traduit potentiellement par une surestimation ou une sous-estimation des valeurs réelles dans les résultats desdits modèles. Lorsque des fourchettes de valeurs étaient disponibles pour les paramètres physico-chimiques, les modèles étaient exécutés pour les valeurs supérieures et inférieures des fourchettes afin de déduire toute l’étendue possible des résultats.
Des incertitudes existent quant à l’évaluation expérimentale de la solubilité dans l’eau du BENPAT et de la substance analogue, le BENPATAX. Les solubilités dans l’eau de chacun des composés principaux et mineurs du BENPAT et du BENPATAX ont été établies de manière expérimentale. Les composés principaux affichaient une solubilité dans l’eau moins importante que les composés mineurs, et également moins importante que les solubilités dans l’eau établies pour chaque substance dans son ensemble. La façon dont les valeurs de solubilité dans l’eau du BENPAT et du BENTAX ont été estimées reste obscure et il en va donc de même pour la précision desdites valeurs. Étant donné que la solubilité dans l’eau est l’un des paramètres clés pour comprendre le comportement et le devenir d’une substance dans l’environnement ainsi que pour réaliser la modélisation de la fugacité, il est essentiel de disposer d’estimations fiables à ce sujet.
Il faut souligner que l’exposition environnementale associée au BENPAT présent dans les produits en caoutchouc recyclé, y compris ceux qui sont utilisés dans les zones récréatives comme les terrains de jeu et les terrains de sport, n’a pas prise en compte dans la présente évaluation préalable. À l’heure actuelle, on ne trouve pas, dans les sources publiées ou inédites, d’information sur les rejets possibles dans l’environnement à partir des produits recyclés contenant du BENPAT et peut-être du BENTAX. Les rejets possibles dans l’environnement sont donc inconnus pour l’instant.
En ce qui concerne les données sur la bioaccumulation relatives à la structure représentative 3 du BENPAT et du BENTAX, des incertitudes sont associées aux résultats empiriques dont on dispose. D’après une analyse minutieuse des vitesses de métabolisation, des taux de dépuration et de la variabilité constatée dans l’étude existante sur les poissons, on pense que les résultats obtenus pour la structure représentative 3 du BENPAT ne constituent pas des preuves suffisantes et cohérentes permettant de dire que la substance répond au critère relatif à la bioaccumulation (FBC ou FBA > 5 000) énoncé dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000); cependant, on croit que ce composant principal du BENPAT a un potentiel significatif de bioaccumulation. Il serait donc souhaitable d’avoir d’autres données expérimentales sur la bioaccumulation pour confirmer l’analyse du potentiel de bioaccumulation. La structure 3 est également en partie représentative du BENTAX, sa distribution étant susceptible d’être similaire à celle du BENPAT à approximativement 25 %. On ne dispose pas, à l’heure actuelle, de données expérimentales sur la bioaccumulation du BENTAX, par exemple une étude in vivo sur la bioaccumulation en milieu aquatique. De telles données, en particulier des valeurs de FBC chez les poissons pour les structures représentatives 4 et 5 du BENTAX, analogues à celles concernant les structures représentatives 1, 2 et 3 du BENPAT, seraient importantes et précieuses. Ces données pourraient également être employées pour corroborer et évaluer les résultats expérimentaux obtenus pour le BENPAT et sa structure représentative 3.
Lorsque le BENPAT est rejeté dans un plan d’eau, il a tendance à se loger dans les particules en suspension et dans les sédiments au fond de l’eau, où les organismes vivant dans les sédiments pourraient ainsi lui être exposés. Aucune donnée de surveillance environnementale n’existe à l’heure actuelle sur cette substance. Les données écotoxicologiques sur un organisme vivant dans les sédiments, le chironome C. riparius, n’ont révélé aucune toxicité (Présentation de projet, d’études 2010c). D’après les données dont on dispose, on ne sait pas exactement si la biodisponibilité du BENPAT adsorbé sur les sédiments est limitée ou si c’est plutôt le chironome qui est peu sensible à cette substance. Vu la forte toxicité de la substance pour un certain nombre des espèces aquatiques testées (voir le tableau 7), il est difficile d’affirmer avec certitude qu’elle est peu susceptible de présenter un danger pour les organismes vivant dans les sédiments au Canada.
Étant donné que le BENTAX, comme le BENPAT, tend à s’associer aux particules en suspension et aux sédiments au fond de l’eau, les organismes vivant dans les sédiments pourraient lui être exposés. On ne disposait pas de données écotoxicologiques sur la toxicité du BENTAX pour des organismes vivant dans les sédiments; cependant, les données concernant le BENPAT (Présentation de projet d’études, 2010c) peuvent être utilisées comme substituts pour le BENTAX, vu la similarité de structure et de propriétés des deux produits. Compte tenu des incertitudes associées au fait qu’on dispose du profil de toxicité pour une seule espèce, le chironome C. riparius, il est difficile de prévoir le degré des effets chez d’autres organismes vivant dans les sédiments. À la lumière de l’analyse des quotients de risque pour le site industriel où l’on utilise du BENTAX, et en supposant que le degré de sensibilité à la substance est similaire à celui de l’espèce aquatique susmentionnée, il est peu probable que la substance présente un danger pour les organismes vivant dans les sédiments.
Évaluation de l’exposition
Milieux naturels et aliments
D’après leurs profils d’utilisation, le BENTAX et le BENPAT ne devraient pas se retrouver dans les aliments et les boissons au Canada.
Aucune donnée empirique sur les concentrations de BENTAX et de BENPAT dans les milieux naturels au Canada n’a été relevée. Les concentrations environnementales ont été estimées en utilisant la version 6.00 de ChemCAN, un modèle régional de fugacité de niveau III en champ lointain propre au Canada qui permet d’estimer les concentrations environnementales sur une échelle régionale par rapport aux rejets annuels d’une substance (ChemCAN, 2003). Les rejets annuels de BENTAX et de BENPAT ont été estimés de façon prudente en utilisant la limite supérieure des quantités totales sur le marché en 2006, soit 1 000 kg de BENTAX et 10 000 000 kg de BENPAT, ainsi que les pourcentages de pertes prévus par l’outil de débit massique pour les utilisations commerciales, industrielles et par les consommateurs (voir le tableau 3) (Environnement Canada, 2010a, b, c). On considère que les pourcentages de pertes ne sont pas rejetés dans l’environnement, mais ils sont toutefois utilisés en tant qu’estimations du pire cas aux fins de modélisation. Les estimations des quantités de pertes sont fournies en annexe III.
Les concentrations environnementales estimées par ChemCAN, v. 6.00, sont présentées à l’annexe III. On a obtenu une tranche supérieure de l’absorption quotidienne de BENTAX et de BENPAT pour la population au Canada sur la base des concentrations environnementales estimées. Une exposition environnementale au BENTAX négligeable, de l’ordre du dixième de nanogramme (10-10 de gramme) par kg p.c. (kilogramme de poids corporel) par jour a été estimée. L’exposition environnementale totale estimée au BENPAT était comprise entre 0,06 et 0,63 µg/kg p.c. par jour pour différents groupes d’âge, et était la plus élevée pour les nourrissons nourris au lait maternel (de 0 à 6 mois) (voir annexe IV).
Le BENPAT et le BENTAX sont utilisés comme additifs afin de prévenir la dégradation dans le caoutchouc de haute qualité. Le BENPAT en particulier peut entrer dans la composition du caoutchouc utilisé pour les pneus. Les rejets de particules provenant de pneus résultant de l’usure peuvent alors représenter une source d’exposition potentielle pour la population générale, spécialement pour celle proche des couloirs de transport. Toutefois, le potentiel d’exposition par inhalation au BENPAT devrait être faible, car presque toutes les particules routières (contenant approximativement 15% de matériaux provenant de pneus), générées sous des conditions de conduite extérieure réalistes, sont plus large que le diamètre limite inhalable (10 µm) (Kreider et al., 2010). De plus, il pourrait y avoir une certaine dispersion de ces particules au sol adjacent, mais la tendance à la dispersion est estimée minime, car une diminution des concentrations en particules de pneus de plus de 80 % a été enregistrée à l’intérieur d’une zone de 30 mètres des routes (Wik et Dave, 2009).
Produits de consommation
Tel qu’il a déjà été précisé, le BENTAX et le BENPAT sont utilisés comme additifs afin de prévenir la dégradation des caoutchoucs de haute qualité. Dans la classe des diaryl-p-phénylènediamines, ces substances peuvent être utilisées comme antiozonants et antioxydants du caoutchouc (TradingChem, 2008; PCP, 2008).
Le BENPAT est présent comme antiozonant dans certains composés du caoutchouc à des concentrations déclarées comprises entre 0,29 et 2,17 % en poids (Environnement Canada, 2010c). Dans la gomme de pneus, la concentration normale d’antiozonants est de 1 % en poids (Wik et Dave, 2009). Ailleurs, il a été signalé que les antiozonants étaient présents dans le caoutchouc à hauteur de 0,25 à 4 %, et jusqu’à 8 % en poids (Goodyear Tire and Rubber Company, 1965). En général, le BENPAT est utilisé comme antioxydant dans le polychloroprène ainsi que dans les industries des pneus et des courroies (PCP, 2008). Étant donné que le BENPAT est un additif du caoutchouc mélangé dans la matrice polymérique du caoutchouc à de faibles concentrations, tout contact cutané fortuit avec des pneus par des consommateurs ne devrait pas entraîner d’exposition cutanée.
Les utilisations déclarées pour le BENTAX en réponse à un avis émis en application de l’article 71 de la LCPE (1999) ont été déclarées comme des renseignements commerciaux confidentiels et ne peuvent être divulguées. Toutefois, d’après son utilisation en tant qu’antiozonant moyennement actif présentant de faibles concentrations et une faible solubilité dans l’eau, toute exposition à des produits de caoutchouc devrait être fortuite ou négligeable (Kirk-Othmer, c2010).
Évaluation des effets sur la santé
Les renseignements disponibles quant aux effets sur la santé du BENPAT et du BENTAX sont résumés à l’annexe V. Les données concernant les effets sur la santé de la substance analogue, le BENPATAX, ont également été prises en compte pour éclairer davantage l’évaluation des effets sur la santé du BENPAT et sont résumées à l’annexe V. La structure et l’identité de ces substances sont présentées au tableau 1 de la section « Identité de la substance ».
Le National Industrial Chemicals Notification and Assessment Scheme (NICNAS) d’Australie a mené une évaluation des risques concernant le BENTAPAX (NICNAS, 2001). Aucune évaluation nationale ou internationale n’a été recensée dans le cas du BENPAT ou du BENTAX particulièrement.
Aucun effet de cancérogénicité n’a été observé dans le cadre d’une étude de 52 semaines sur des rats Fischer 344 exposés à du BENPAT par voie orale à des doses pouvant atteindre 95 mg/kg p.c. par jour (AHF, 1996c; Iatropoulos et al., 1997). Bien que des augmentations importantes de l’hyperplasie et de la prolifération des cellules urothéliales aient été observées chez tous les groupes exposés au BENPAT, aucune néoplasie n’a pu être constatée. L’absence d’activités entraînant la formation de tumeurs ou favorisant le développement de ces dernières dans le foie et la vessie de rats Fischer 344 mâles a également été confirmée dans le cadre d’un essai biologique accéléré de 38 semaines (à des doses de 95 mg/kg p.c. par jour) (AHF, 1996b; Iatropoulos et al., 1997). De façon similaire, aucun effet cancérogène n’a été signalé dans le cadre d’une étude sur la toxicité de 52 semaines sur des rats exposés par voie orale à l’analogue BENPATAX et à des doses pouvant atteindre 100 mg/kg par jours (Iatropoulos et al., 2000).
La génotoxicité potentielle du BENPAT, du BENTAX et du BENPATAX a été évaluée dans le cadre de plusieurs essais in vitro et in vivo. Aucun signe de génotoxicité n’a été décelé dans les essais in vivo, qui comprenait un test du micronoyau sur la moelle osseuse de la souris ainsi que deux essais pour mutagénicité chez la Drosophila spp.(AHF, 1995; BESC, 2003; Goodyear Tire and Rubber Company, 1992a, c; Litton Bionetics, 1979; Pharmakon, 1993a). La plupart des essais in vitro sur des systèmes cellulaires de bactéries ou de mammifères se sont avérés négatifs (AHF, 1999, Crebelli et al., 1985; BESC, 2000, 2003; Jeffrey, 1999; SanSebastian, 1994). Des réponses positives faibles ont été observées avec les trois composés sur certaines souches de Salmonella, avec activation métabolique (BESC, 2003; Stankowski, 1998; Goodyear Tire and Rubber Company, 1992 a, c, d). Des résultats positifs ont également été constatés dans des essais d’altération et de réparation de l’ADN chez Escherichia coli pour le BENPAT et le BENTAX, sans activation métabolique (les essais n’ont pas été menés avec une activation métabolique) (BESC, 2003; Goodyear Tire and Rubber Company, 1992a, c, d). Les renseignements disponibles susmentionnés indiquent que le BENPAT et le BENTAX ne sont vraisemblablement pas génotoxiques.
Lors d’une étude de toxicité sur la reproduction sur deux générations, des rats Sprague-Dawley ont été exposés à du BENPAT par voie orale à une dose de 0 à 75 mg/kg p.c. par jour à partir de la période précédant l’accouplement (10 semaines) jusqu’au sevrage des petits (à l’âge de 21 jours). Des périodes de gestation significativement prolongées ont été constatées chez les mères à des doses de 20 et 75 mg/kg p.c. par jour pour les mères F0 et à toutes les doses pour les mères F1. Une augmentation importante des pertes postimplantation ainsi qu’une diminution du nombre total de petits et de petits vivants ont pu être observées dans les portées F1 et F2 à des doses de 20 et de 75 mg/kg p.c. par jour. Des dystocies et des mises bas tardives également été observées auxdites doses au cours de l’étude. Des lésions polykystiques rénales avec une incidence et une gravité liées à la dose ont été relevées à toutes les doses (6, 20 et 75 mg/kg p.c. par jour) chez les parents F0 et F1 ainsi que chez les rats sevrés F1 et F2. Cependant, aucune preuve de toxicité pour la reproduction chez les mâles n’a été signalée (Goodyear Tire and Rubber Company, 2001). Une étude mécaniste a également été réalisée chez la même souche de rats à des doses de 125 mg/kg p.c. jour administrées par voie orale afin d’approfondir l’analyse de l’association entre les stades d’exposition et les effets sur la santé observés dans l’étude sur deux générations susmentionnée. Les résultats de cette étude ont permis de confirmer que l’exposition au BENPAT au cours de la période de gestation entraînait des dystocies ainsi que des mises bas tardives et qu’elle entraînait également la présence de reins polykystiques chez les descendants F1. L’exposition précédant la gestation n’a pas accru les effets attribués à l’ingestion de BENPAT pendant la période de gestation (Goodyear Tire and Rubber Company, 2001).
Dans deux études sur la toxicité pour le développement, des rats Sprague-Dawley femelles ont été exposés au BENPAT et au BENPATAX par gavage pendant 10 jours au cours de la gestation. Une réduction du poids corporel des fœtus et des mères (liée à une baisse de la consommation d’aliments) a été observée à des doses de 200 mg/kg p.c. de BENPAT par jour (la dose testée la plus élevée) et à des doses de 70 et 200 mg/kg p.c. de BENPATAX par jour. Aucune anomalie (malformations ou variations) liée au composé n’a été constatée chez les descendants (BESC, 2003; Tyl, 1996).
En ce qui concerne les effets non cancéreux, une augmentation importante de l’hyperplasie et de la prolifération des cellules urothéliales a été relevée à toutes les doses testées chez des rats Fischer 344 mâles et femelles exposés par voie orale à des doses de 0 à 95 mg/kg p.c. de BENPAT par jour pendant 52 semaines (Iatropoulos, 1997). Des augmentations du poids relatif des organes (foie, rate, cœur et rein) et des baisses du gain de poids corporel et de la consommation d’aliments ont également été observées chez les rats exposés à la dose élevée. De la même manière, une augmentation de la prolifération cellulaire dans la vessie, une baisse du poids corporel et une augmentation du poids des organes (à des doses de 30 et de 125 mg/kg p.c. par jour) ont aussi été relevées chez la même souche de rats dans le cadre d’une étude de 28 jours sur l’exposition au BENPAT par voie orale (AHF, 1996a). L’administration par voie orale de BENPATAX pendant 4 semaines a entraîné une hyperplasie de l’urothélium ainsi qu’une augmentation de la prolifération des cellules urothéliales chez des rats Fischer 344 exposés à la dose élevée (100 mg/kg p.c. par jour) (Iatropoulos et al, 1998; NICNAS, 2001).
Des effets hématologiques liés à une exposition par voie orale au BENPAT ont aussi été constatés dans le cadre de plusieurs études sur la toxicité à court et à long terme chez des rats Fischer 344. Des signes d’anémies macrocytaires, y compris des augmentations réversibles du volume corpusculaire moyen, des diminutions de la teneur corpusculaire moyenne en hémoglobine ainsi que des modifications des valeurs de chimie clinique (augmentation des taux de cholestérol et de bilirubine dans le sang) ont été observées chez des rats des deux sexes exposés à la dose élevée de BENPAT (120 mg/kg p.c.) au cours d’une étude de 28 jours (AHF, 1996a). Une augmentation importante du volume corpusculaire moyen, une diminution de la teneur corpusculaire moyenne et du nombre de globules rouges accompagnées de preuves microscopiques d’une érythropoïèse extramédullaire dans la rate et le foie ont également été relevées à une dose de 95 mg/kg p.c. par jour (la dose testée la plus élevée) dans le cadre d’une étude sur 52 semaines. Une augmentation des taux de cholestérol et de bilirubine ainsi qu’une baisse des niveaux de protéine totale ont également été signalées chez des rats exposés à la dose élevée (AHF, 1996c; Iatropoulos et al., 1997). Les mêmes résultats ont été confirmés par un essai biologique accéléré de 38 semaines chez des rats exposés par voie orale à des doses de 95 mg/kg p.c. de BENPAT par jour (Iatropoulos et al., 1997). Des effets hématopoïétiques similaires ont également été observés dans le cadre d’une étude de 52 semaines sur des rats exposés à la substance analogue, le BENPATAX. À des doses de 20 et de 100 mg/kg p.c. par jour, des modifications histopathologiques dans la rate, le foie, les reins et la vessie chez les animaux exposés à la dose élevée ont apporté une preuve supplémentaire de la présence d’anémies macrocytaires (Iatropoulos et al., 2000; NICNAS, 2001). Des signes d’anémies macrocytaires ont aussi été relevés dans l’étude de 28 jours chez des rats exposés à des doses de 120 mg/kg p.c. de BENPATAX par jour (Iatropoulos et al., 1998).
La dose minimale avec effet nocif observé (DMENO) concernant l’exposition chronique par voie orale était comprise entre 2,7 mg/kg p.c. par jour (dose testée la plus faible) pour le BENPAT chez les rats, d’après l’augmentation importante de l’hyperplasie et de la prolifération des cellules urothéliales (AHF, 1996c), et 20 mg/kg p.c. par jour pour le BENPATAX chez les rats, d’après la présence d’une anémie macrocytaire (Iatropoulos et al., 2000). La DMENO concernant l’exposition à court terme par voie orale était comprise entre 30 mg/kg p.c. par jour pour le BENPAT chez les rats, d’après l’augmentation de la prolifération des cellules urothéliales dans la vessie (AHF, 1996a), et 120 mg/kg p.c. par jour pour le BENPAT et le BENPATAX chez les rats, d’après la présence d’une anémie macrocytaire (AHF, 1996a; Iatropoulos et al., 1998). Dans le cadre d’une étude sur la toxicité pour le développement chez des rats exposés par voie orale, une DMENO pour le développement de 20 mg/kg p.c. par jour, d’après l’allongement de la durée de gestation, l’augmentation des pertes postimplantation et la baisse du nombre total de petits et de petits vivants a été déterminée, tout comme une DMENO systémique de 6 mg/kg p.c. par jour, d’après les lésions polykystiques sur les reins (Goodyear Tire and Rubber Company, 2001).
Les résultats provenant des études sur la toxicité aiguë indiquaient que les valeurs de DL50 chez des rats exposés par voie orale au BENPAT, au BENTAX et à l’analogue BENPATAX ainsi que les valeurs de DL50 chez des lapins exposés par voie cutanée au BENPAT et au BENPATAX étaient toutes supérieures à 2 000 mg/kg p.c. après une exposition unique (Bayer, 1990; BESC, 2003; Pharmakon, 1993b; Goodyear Tire and Rubber Company, 1992b; WARF, 1959; Merriman, 1995a, b; Springborn Laboratories, 1995a). Aucune étude sur la toxicité aiguë par inhalation n’a été recensée. Des résultats contrastés ont été observés dans des études sur l’irritation de la peau et des yeux chez des lapins exposés au BENPAT (Bayer, 1991; Springborn Laboratories, 1995b; WARF, 1959). On a estimé que le BENPAT était un sensibilisant cutané d’après les faibles réactions de sensibilisation constatées dans le cadre de tests de maximalisation réalisés sur des cochons d’Inde (Springborn Laboratories, 1995c). Des réactions de sensibilisation similaires ont été observées chez des cochons d’Inde exposés à l’analogue, le BENPATAX (Merriman, 1995d). Il a également été démontré que le BENPATAX entraînait une irritation légère à modérée de la peau chez des lapins (Merriman, 1995b, c).
Niveau de confiance à l’égard de la base de données sur les effets sur la santé
Le niveau de confiance à l’égard de la base de données sur la toxicité dans le cas du BENPAT est jugé modéré, car des données empiriques ont été recensées. Cependant, aucune étude de toxicité par inhalation ou par voie cutanée à doses répétées n’a été recensée pour le BENPAT ou le BENTAX (ou encore le BENPATAX). Bien qu’aucune étude de toxicité pour la reproduction et le développement ni aucune étude sur l’exposition par voie orale à doses répétées n’ait été recensée pour le BENTAX précisément, les données déduites à partir de la base de données sur le BENPAT et le BENPATAX ont permis d’atteindre un niveau de confiance plus élevé afin de déterminer les effets potentiels du BENTAX sur la santé. Par conséquent, le niveau de confiance à l’égard de la base de données sur la toxicité dans le cas du BENTAX est jugé faible à modéré.
Caractérisation des risques pour la santé humaine
Aucune preuve de cancérogénicité n’a été observée dans plusieurs études de toxicité chronique chez des rats exposés par voie orale au BENPAT et à la substance analogue, le BENPATAX. Les renseignements dont on dispose indiquent que le BENPAT, le BENTAX et le BENPATAX ne sont vraisemblablement pas génotoxiques. Dès lors, la caractérisation des risques dans cette évaluation est fondée sur les effets non cancérogènes du BENPAT et du BENTAX.
Les données empiriques sur les effets sur la santé du BENPAT, du BENTAX et du BENPATAX indiquent un faible potentiel de risque aigu par voie orale et par voie cutanée. Les organes ciblés après une exposition par voie orale répétée au BENPAT et au BENPATAX concernaient toujours les systèmes urinaire et hématopoïétique. La dose minimale avec effet nocif observé a été détermine comme étant de 2,7 mg/kg p.c. de BENPAT par jour, d’après une augmentation importante de l’hyperplasie et de la prolifération des cellules urothéliales chez les rats. La concentration minimale à laquelle des modifications hématologiques ont été observées (augmentation du volume corpusculaire moyen, diminution de la teneur corpusculaire moyenne et du nombre de globules rouges) se chiffrait à 20 mg/kg p.c. par jour avec le BENPATAX administré par voie orale chez les rats; ces effets ont aussi été signalés pour le BENPAT et le BENPATAX à des doses de 95 et de 120 mg/kg p.c. par jour dans d’autres études sur la toxicité à court terme et la toxicité chronique.
Parmi les effets critiques figuraient des effets sur le plan de la reproduction et du développement. Un allongement de la durée de gestation chez les mères F1 et des lésions polykystiques dans les reins de rats sevrés F1 et F2 ont été observés chez des rats exposés à des doses de 6 mg/kg p.c. de BENPAT par jour (DMENO) dans le cadre d’une étude de toxicité pour la reproduction et le développement. L’exposition par voie orale à doses répétées de 20 mg/kg p.c. de BENPAT par jour a entraîné une diminution des capacités reproductives chez les mères, y compris des dystocies, une augmentation des pertes postimplantation, une baisse du nombre total de petits et de petits vivants et des mises bas tardives.
Il a été estimé que l’exposition environnementale au BENTAX était de l’ordre du nanogramme (10-9 mg)/kg p.c. par jour et qu’elle était par conséquent négligeable. L’exposition environnementale maximale estimée au BENPAT était de 0,63 µg/kg p.c. par jour (voir l’annexe IV). Le risque d’exposition de la population générale au BENPAT et au BENTAX par l’intermédiaire des produits de consommation est jugé négligeable étant donné qu’on ne ne s’attend pas à ce qu’une exposition fortuite par contact cutané avec des produits en caoutchouc ait lieu.
Une comparaison entre les concentrations associées à un effet critique pour les expositions à des doses répétées par voie orale (2,7, 6 et 20 mg/kg p.c. par jour) et la tranche supérieure des estimations de l’exposition à partir de toutes les sources d’exposition environnementale au BENPAT (de 0,06 à 0,63 µg/kg p.c. par jour) permet d’obtenir des marges d’exposition comprises entre 4 285 et 333 300 environ (voir l’annexe VI). Ces marges d’exposition sont jugées adéquates pour rendre compte des incertitudes liées aux bases de données concernant les effets sur la santé et l’exposition.
Incertitudes de l’évaluation des risques pour la santé humaine
Le niveau de confiance dans les estimations de l’exposition de la population générale au BENPAT et au BENTAX à partir des milieux naturels est faible. Aucune donnée concernant les concentrations de ces substances dans les milieux naturels n’a été relevée dans la littérature. Les valeurs maximales des quantités commercialisées ont été combinées aux pourcentages de l’outil de débit massique pour le modèle ChemCAN; ainsi, il est vraisemblable que les estimations modélisées de l’exposition environnementale soient prudentes. Les utilisations commerciales recensées pour le BENTAX et le BENPAT dans les recherches documentaires et en réponse à un avis publié en application de l’article 71 de la LCPE (1999), soit en tant qu’agents antiozonants et antioxydants dans les produits à base de caoutchouc, ne devraient pas être à l’origine d’une exposition de la population générale.
Certaines incertitudes existent quant à l’exposition au BENPAT et au BENTAX à partir des produits de consommation. Toutefois, les renseignements disponibles indiquent que l’exposition de la population générale à partir desdits produits de consommation est peu probable. Il y a aussi certaines incertitudes liées au potentiel d’utilisation secondaire de pneus, toutefois il n’y a pas suffisamment de données disponibles afin de caractériser le potentiel d’exposition associé à cette source.
Bien que des incertitudes subsistent concernant l’évaluation des effets sur la santé et de l’exposition pour le BENPAT et le BENTAX en raison des lacunes de la base de données, les marges entre la tranche supérieure des estimations de l’exposition dans les milieux naturels et les concentrations avec effet relevées chez les animaux de laboratoire sont adéquates pour tenir compte des incertitudes dans les bases de données des effets sur la santé et de l’exposition.
Selon les renseignements dont on dispose, le BENPAT pénètre ou peut pénétrer dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique. D’après les renseignements dont on dispose, le BENTAX ne pénètre pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique. De plus, les composants du BENPAT et du BENTAX répondent aux critères relatifs à la persistance énoncés dans le Règlement sur la persistance et la bioaccumulation, mais pas à ceux qui concernent le potentiel de bioaccumulation (Canada, 2000).
Selon les renseignements dont on dispose, le BENPAT et le BENTAX ne pénètrent pas en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur la vie et la santé humaines.
Sur la base des renseignements dont on dispose, il est conclu que le BENPAT satisfait à au moins un des critèresénoncés à l’article 64 de la LCPE (1999).
Comme le BENTAX figure sur la Liste intérieure des substances, son importation et sa fabrication au Canada ne sont pas visées par les dispositions du paragraphe 81(1). Vu les dangers écologiques que peut présenter cette substance, on craint qu’en raison de nouvelles activités qui n’ont pas été relevées ou évaluées, elle en vienne à remplir les critères énoncés à l’article 64 de la Loi. Par conséquent, il est recommandé de modifier la Liste intérieure, en application des dispositions du paragraphe 87(3) de la Loi, pour indiquer que les dispositions du paragraphe 81(3) de ladite Loi s’appliquent à cette substance de telle sorte qu’une nouvelle activité (fabrication, importation ou utilisation) relative au BENTAX soit annoncée dans un avis et fasse l’objet d’évaluations des risques pour l’environnement et des risques pour la santé humaine.
ACD/pKaDB [module de prévision]. 2005. Version 9.04. Toronto (Ont.) : Advanced Chemistry Development [consulté en janvier 2010]. [réserve de consultation].
[AHF] American Health Foundation. 1994. Preliminary Oral 3-Week Range-Finding Study for Administration of WINGSTAY 100 and R-59 in Male and Female Fischer 344 Rats, AHF Study R-1626 to The Goodyear Tire and Rubber Company. In : US EPA 2010.
[AHF] American Health Foundation. 1995. 32P Postlabeling Assay for Detection of Adduct Formation by WINGSTAY 100 and R-59 in Rat Liver and Urinary Bladder DNA, AHF Study No. 93-63 to The Goodyear Tire and Rubber Company. In : US EPA 2010.
[AHF] American Health Foundation. 1996a. Four-Week Dietary Study of WINGSTAY 100 in Fischer 344 Rats, rapport no AHF R1664. In : US EPA 2010.
[AHF] American Health Foundation. 1996b. 38-Week Accelerated Bioassay (ABA) of WINGSTAY 100 in Rats. In : US EPA 2010.
[AHF] American Health Foundation. 1996c. 52-Week Chronic Feeding Study of WINGSTAY 100 in Rats with 12-Week Recovery. Rapport no HF R1695. In : US EPA 2010.
[AHF] American Health Foundation. 1999. Unscheduled DNA Synthesis Assays (UDS) with Rat Hepatocytes on Wingstay 100 Condensation Products RWC-7703, RWX-7704, and RWC-7706. In : US EPA 2010.
Ambeland, J.C., et al. 1963. Rubber Chem. Technol. 36:1497. In : Kirk-Othmer Encyclopedia of Chemical Technology c.2010.
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d’estimation]. 2008. Version 1.92a. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
Andries, J.C., et al. 1979. Rubber Chem. Technol. 52:823. In : Kirk-Othmer Encyclopedia of Chemical Technology c.2010.
Andries, J.C., Ross, D.B., Diem, H.E. 1975. Rubber Chem. Technol. 48:41 (1975). In :Kirk-Othmer Encyclopedia of Chemical Technology c.2010.
[ARLA] Agence de réglementation de la lutte antiparasitaire. 2007. Note réglementaire REG 2007-04 : liste des produits de formulation de l’ARLA. Ottawa (Ont.) : Santé Canada, ARLA. [consultée le 17 mai 2010].
Arnot, J.A., Gobas, F.A.P.C. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb. Sci. 22(3):337-345.
Arnot JA et Gobas FAPC. 2006. A review of bioconcentration factor (BCF) and bioaccumulation factor (BAF) assessments for organic chemicals in aquatic organisms. Environ. Rev. 14:257-297.
Arnot, J.A., Mackay, D., Bonnell, M. 2008a. Estimating metabolic biotransformation rates in fish from laboratory data. Environ. Toxicol. Chem. 27(2):341–351.
Arnot, J.A., Mackay, D., Parkerton, T.F., Bonnell, M. 2008b. A database of fish biotransformation rates for organic chemicals. Environ. Toxicol. Chem. 27(11):2263-2270.
Arnot, J.A., Meylan, W., Tunkel, J., Howard, P.H., Mackay, D., Bonnell, M,. Boethling, R.S. 2009. A quantitative structure-activity relationship for predicting metabolic biotransformation rates for organic chemicals in fish. Environ. Toxicol. Chem. 28(6):1168-1177.
ASTreat Model [modèle d’élimination par les usines de traitement des eaux usées]. 2006. Version 1.0. Cincinnati (États-Unis) : Procter & Gamble Company. Disponible auprès de la Procter & Gamble Company, C.P. 538707, Cincinnati, Ohio, 45253-8707, États-Unis.
[BIOWIN] Biodegradation Probability Program for Windows [modèle d’estimation]. 2008. Version 4.10. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
Bayer, A.G. 1990. Rapport no 19778. In : US EPA 2010.
Bayer, A.G. 1991. Rapport no 19940. In : US EPA 2010.
[BDIM DPT] Base de données sur les ingrédients non médicinaux de la Direction des produits thérapeutiques [base de données exclusive]. 2010 [consultée en avril 2010]. Disponible auprès de Santé Canada, Division des produits thérapeutiques.
[BDIPSNH]. Base de données d’ingrédients de produits de santé naturels homologués [base de données sur Internet]. 2010. Ottawa (Ont.) : Santé Canada, Direction des produits de santé naturels. [consultée en avril 2010].
[BDPP] Base de données sur les produits pharmaceutiques [base de données sur Internet]. 2010. Ottawa (Ont.) : Santé Canada [consultée en avril 2010]. Recherche de produits pharmaceutiques en ligne.
[BESC] Bureau européen des substances chimiques. 2000. IUCLID Dataset for 1,4-Benzenediamine, N,N’-mixed Ph and tolyl derivs. Commission européenne.
[BESC] Bureau Européen des Substances Chimiques. 2003. IUCLID Dataset for 1,4-Benzenediamine, N,N’-mixed Ph and tolyl derivs. Commission européenne.
Beyer, A., Mackay, D., Matthies, M., Wania, F., Webster, E. 2000. Assessing long-range transport potential of persistent organic pollutants. Environ. Sci. Technol. 34(4):699-703.
Boethling, R.S., Howard, P.H., Beauman, J.A., Larosche, M.E. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere 30(4):741-752.
Boozer, C.E., Hammond, G.S., Sen, J.N. 1955. Air oxidation of hydrocarbons. II. The stoichiometry and fate of inhibitiors in benzene and chlorobenzene. J. Am. Chem. Soc. 77:3233-3237. In : Rapta, et al., 2009.
Cadle, S.H., Williams, R.L. 1978. Gas and particle emissions from automobile tires in laboratory and field studies. Rubber Chemistry and Technology 52:146-158.
Camatini, M., Crosta, G.F., Dolukhanyan, T., Sung, C, Guiliani, G., Corbetta, G.M., Cencetti, S., Regazzoni, C. 2001. Microcharacterization and identification of tyre debris in heterogeneouslaboratory and environmental specimens. Materials Characterization 46: 271-283. In : ChemRisk LLC 2009.
Canada. 1978. Règlement sur les aliments et drogues, C.R.C., ch. 870. Règlement sur les aliments et drogues.
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999), L.C. 1999, ch. 33, Gazette du Canada, Partie III, vol. 22, n° 3.
Canada. 2000. Loi canadienne sur la protection de l’environnement (1999) : Règlement sur la persistance et la bioaccumulation. C.P. 2000-348, 23 mars 2000, DORS/2000-107. Gazette du Canada, Partie II, vol. 134, n° 7.
Canada. Ministère de l’Environnement, ministère de la Santé. 2006. Loi canadienne sur la protection de l’environnement (1999) : Avis d’intention d’élaborer et de mettre en œuvre des mesures d’évaluation et de gestion des risques que certaines substances présentent pour la santé des Canadiens et leur environnement, Canada Gazette, Gazette du Canada, Partie I, vol. 140, n° 49.
Canada. Ministère de l’Environnement, ministère de la Santé. 2009a. Loi canadienne sur la protection de l’environnement (1999) : Avis de dixième divulgation d’information technique concernant les substances identifiées dans le Défi, Gazette du Canada, Partie I, vol. 143, n° 25.
Canada. Ministère de l’Environnement. 2009b. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant les substances du groupe 11 du Défi. Gazette du Canada, Partie I, vol. 143, n° 5.
Cardina, J.A. 1974. Particle size determination of tire-tread rubber in atmospheric dusts. Rubber Chemistry and Technology 47:1005-1010.
[CATABOL] Probabilistic assessment of biodegradability and metabolic pathways [modèle informatique]. c2004-2008. Version 5.10.2. Bourgas (Bulgarie) : Bourgas Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. CATALOGIC.
ChemCAN [Level III fugacity model of 24 regions of Canada]. 2003. Version 6.00. Peterborough (Ont.) : Trent University, Le centre canadien de modélisation et de chimie environnementales [consulté en mai 2010].
ChemRisk. 2008 Interim report of tire wear particle research. Pittsburgh (PA), San Francisco (CA) : ChemRisk Inc. 7 p.
ChemRisk, DIK. 2008. State of knowledge report for tire materials and tire wear particles. Pittsburgh (PA), San Francisco (CA) : ChemRisk Inc.; Hanovre (Allemagne) : DIK Inc. 41 p.
ChemRisk LLC. 2009. Tyre generic exposure scenario; Service life guidance. Version 1. Bruxelles (Belgique) : [ETRMA]. 14 p.
ChemRisk LLC. 2010. Tyre and general rubber goods generic exposure scenario; Emission factor guidance for formulation and industrial use. Version 2. Bruxelles (Belgique) : European Tyre and Rubber Manufacturers' Association [ETRMA]. 33 p. L'évaluation des risques.
[CHRIP] Chemical Risk Information Platform [base de données sur Internet]. c2008. Tokyo (Japon) : National Institute of Technology and Evaluation, Chemical Managemet Centre (CMC) [consulté en avril 2010]. Plate-forme d'information chimique sur les risques.
Commission européenne. 2000. IUCLID Dataset [1,4-Benzenediamine, N,N’-mixed Ph and tolyl derives]. No CAS 68953-84-4 [en ligne]. Year 2000 CD-ROM edition. Ispra (Italie) : Commission européenne, Centre commun de recherche, Institut pour la santé et la protection des consommateurs, Bureau Européen des Substances Chimiques [consulté en avril 2010].
Crebelli, R., Paoletti, A., Falcone, E., Aquilina, G., Fabri, G., Carere, A. 1985. Mutagenicity studies in a tyre plant: in vitro activity of workers’ urinary concentrates and raw materials. Br. J. Ind. Med. 42(7):481-7.
[ECOSAR] Ecological Structural Activity Relationships [en ligne]. 2008. Version 1.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
Environnement Canada. 1988. Données de la Liste intérieure des substances (LIS), 1984-1986, recueillies en vertu du paragraphe 25(1) de la LCPE, 1988, et conformément au guide de déclaration à la Liste intérieure des substances. Données produites par Environnement Canada.
Environnement Canada. 2005. Données pour certaines substances recueillies en vertu de la Loi canadienne sur la protection de l’environnement (1999), article 71 : Avis concernant certaines substances considérées comme priorités pour suivi. Gazette du Canada, Partie I, vol. 140, n° 9. Données recueillies par : Environnement Canada, Division de la mobilisation et de l’élaboration des programmes.
Environnement Canada. 2007. Guidance for Conducting Ecological Assessments under CEPA, 1999, Science Resource Technical Series, Technical Guidance Module: QSARs. Document de travail préliminaire révisé. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique.
Environnement Canada. 2008. Guidance for Conducting Ecological Assessments under CEPA, 1999, Science Resource Technical Series, Technical Guidance Module: Mass Flow Tool. Document de travail. Gatineau (Qc) : Environnement Canada, Division des substances existantes.
Environment Canada. 2009. Guidance for Conducting Ecological Assessments under CEPA, 1999, Science Resource Technical Series, Technical Guidance Module: Mega Flush Consumer Release Scenario. Document de travail. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique.
Environnement Canada. 2010a. Assumptions, limitations and uncertainties of the Mass Flow Tool for BENPAT. Document provisoire interne. No CAS 68953-84-4. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique.
Environnement Canada. 2010b. Assumptions, limitations and uncertainties of the Mass Flow Tool for BENTAX. Document provisoire interne. No CAS 68478-45-5. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique.
Environnement Canada. 2010c. Données sur les substances du lot 11 recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances identifiées dans le neuvième lot du Défi. Données recueillies par Environnement Canada, Division de la mobilisation et de l’élaboration des programmes.
Environnement Canada. 2011a. Site Specific Analysis Report: CAS RN 68953-84-4, 2011-02-18. Rapport inédit. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique.
Environnement Canada. 2011b. IGETA report: CAS RN 68478-45-5, 2011-02-18. Rapport inédit. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique.
Environnement Canada. 2011c. Mega Flush report: CAS RN 68953-84-4, 2011-02-18. Scenario 1. Rapport inédit. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique.
Environnement Canada. 2011d. Mega Flush report: CAS RN 68953-84-4, 2011-02-18. Scenario 2. Rapport inédit. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique.
[EPIsuite] Estimation Programs Interface Suite for Microsoft Windows [modèle d’estimation]. 2008. Version 4.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
[EQC] Equilibrium Criterion Model. 2003. Version 2.02. Peterborough (Ont.) : Trent University, Canadian Environmental Modelling Centre. Le centre canadien de modélisation et de chimie environnementales.
[ESIS] European Chemical Substances Information System [base de données sur Internet]. c1995-2009. Bureau Européen des Substances Chimiques (BESC) [consultée en avril 2010].
Fernandes et McCormack, inventeurs; E.I du Pont de Nemours and Company, cessionnaire. Le 14 décembre 1971. Diaryl-p-phenylenediamine stabilizers for peroxide-cured polyethelene. United States Patent 3,627,728.
[FS] Fiche signalétique. 2002a. Polystay 100AZ. Akron (OH) : Goodyear Tire and Rubber Company. MSDS Online [réserve de consultation].
[FS] Fiche signalétique. 2002b. Polystay 200. Akron (OH) : Goodyear Tire and Rubber Company. MSDS Online [réserve de consultation].
Goodyear Tire and Rubber Company. Le 15 décembre 1965. Complete specification: antiozonants for diene rubbers. Great Britain patent GB 1,012,945.
Goodyear Tire and Rubber Company. 1992a. Support: Initial Submission: Letter from Goodyear Tire and Rubber Co Submitting a Battery of Mutagenicity Studies with Nailax in Animals and Bacteria with Attachments. Doc.#88920005217, OTS0544191. Litton Bionetics Inc.
Goodyear Tire and Rubber Company. 1992b. Support: Initial Submission: Acute oral LD50 Assay in Rats (EPA-FIFRA). [Rapport définitif comprenant annexes et lettre d’accompagnement daté du 5 février 1992.] Doc.#88-920000842, OTS0535348. Food & Drug Res Labs.
Goodyear Tire and Rubber Company. 1992c. Initial Submission: Letter from Goodyear Tire and Rubber Co Submitting Three Mutagenicity Studies with Wingstay 100 AZ in Salmonella, Drosophila, and E. Coli. Doc #88-920005219, OTS0544193.
Goodyear Tire and Rubber Company. 1992d. Initial Submission: Letter from Goodyear Tire and Rubber Co Submitting a Battery of Mutagenicity Studies with Wingstay 200 in Salmonella Typhimurium and E. Coli with Attachments. Doc #88-920005220, OTS0544194.
Goodyear Tire and Rubber Company. 1996a. Support: Initial Submission: Letter from Goodyear Tire and Rubber Co to US EPA Re Pilot Study for Reproductive Toxicity Test in Rats, with Attachments & Dated 02/05/96. Doc# 88960000053, OTS0558447. Research Triangle Institute.
Goodyear Tire and Rubber Company. 2001. Support: Letter from Goodyear Tire and Rubber Co. to US EPA Submitting Two-Generation Reproductive Toxicity Evaluation and Mechanistic Study of Wingstay 100, w/Attchmts & Dated 1/10/01. Doc #89010000088, OTS05584472. Research Triangle Institute.
[HENRYWIN] Henry’s Law Constant Program for Microsoft Windows [modèle d’estimation]. 2008. Version 3.20. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
Hu, T.-M., Layton, W.L. 2001. Allometric scaling of xenobiotic clearance: uncertainty versus universality. AAPS PharmSci. 3(4) Article 29.
Huntink, N.M., Datta, R.N., Talma, A., Noordermeer, J.M.M. 2006. Ozonolysis of model olefins – efficiency of antiozonants. J. App. Polymer Sci. 100:853-866.
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [modèle d’estimation]. 2008. Version 2.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
Iatropoulos, M.J., Williams, G.M., Wang, C.X., Brunnemann, K.D., Leber, A.P. 1997. Assessment of chronic toxicity and carcinogenicity in rats of Wingstay®100, a rubber antioxidant/antiozonant. Experimental Toxicology and Pathology 49:153-165.
Iatropoulos, M.J., Wang, C.X., Brunnemann, K.D., Pittman, B.P, Hosey, J. 1998. Four week dietary study of Wingstay 200 in Fischer 344 rats. AHF Study R-1708. American Health Foundation, États-Unis. In :NICNAS, 2001.
Iatropoulos, M.J., Wang, C.X., Brunnemann, K.D., Hosey, J., Pittman, B.P. 2000. 52-Week chronic feeding toxicity study of Wingstay 200 in rats with a 12-week recovery, AHF Study R-1778. American Health Foundation, États-Unis. In :NICNAS, 2001.
Ignatz-Hoover, F., Byron, H.T., Datta, R.N., Arie J., de Hoog, Hutnik, N.M., Talma, A.G. 2003. Chemical additives migration in rubber. Rubber Chem. Toxicol. 76(3):747-767.
IUCLID Data Set [en ligne]. 2003. 1,4-benzenediamine, N,N’-mixed Ph and tolyl derivs. Washington (DC) : US Environmental Protection Agency. Fiche technique.
Jeffrey, A.M. 1999. Unscheduled DNA synthesis assays (UDS) with rat hepatocytes on Wingstay 200 and its components R-59, R-898 and R-6304. AHF Study No. 97-79B. American Health Foundation, États-Unis. In : NICNAS, 2001.
Kirk-Othmer Encyclopedia of Chemical Technology [en ligne]. c2010 [consulté le 22 avril 2010; mis à jour le 19 avril 2010]. Hoboken (NJ) : John Wiley & Sons, Inc. Kirk-Othmer l'encyclopédie des technologie chimique.
Kochi, J.K. (éditeur). 1973. Free radicals. Vol 2. New York (NY) : Wiley. p.51. In : Rapta, et al., 2009.
[KOCWIN] Organic carbon sorption coefficient program for soil and sediment [modèle d’estimation]. 2008. Version 2.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
Kollig, H.P. 1988. Criteria for evaluating the reliability of literature data on environmental process constants. Toxicol. Environ. Chem. 17:287-311.
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.67. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
Kreider, M.L., Panko, J.M., McAtee, B.L., Sweet, L.I., Finley, B.L. 2010. Physical and chemical characterization of tire-related particles: Comparison of particles generated using different methodologies. Science of the Total Environment 408: 652-659.
Lattimer, R.P., et al. 1980. Rubber Chem. Technol. 53:1170. In : Kirk-Othmer Encyclopedia of Chemical Technology, c2010.
Litton Bionetics Inc. 1979. Drosophila SLRL Assay with Nailax to The Goodyear Tire and Rubber Company. In : US EPA, 2010.
Lorenz, O., Parks, C.R. 1962. Titrimetric determination of N, ”-disubstituted p-Phenylenediamines. Anal. Chem. 34(3):394–396.
Lorenz, O., Parks, C.R. 1963a. Rubber Chem. Technol 36:194. In :Kirk-Othmer Encyclopedia of Chemical Technology, c2010.
Lorenz, O., Parks, C.R. 1963b. Rubber Chem. Technol. 36:201. In :Kirk-Othmer Encyclopedia of Chemical Technology, c2010.
MacAtee, B., Kreider, M., Panko, J., Sweet, L., Finley, B. ChemRisk. 2010. Evaluation of chemical leaching potential from roadway particles. Présenté à : Bridging Science and Communities, 31e réunion annuelle nord-américaine de la SETAC, du 7 novembre au 1er décembre, Portland (OR).
[MEEO] Ministère de l’Environnement et de l’Énergie de l’Ontario. 1994. The acute lethality to rainbow trout of water contaminated by an automobile tire. Toronto (Ont.) : Ministère de l’Environnement et de l’Énergie, Direction de l’élaboration des normes, Aquatic Toxicology Section. 32 p.
Merriman, T.H. 1995a. An acute oral toxicity study in rats with Wingstay 200. SLS Study No 3097.20. Springborn Laboratories, États-Unis. In :NICNAS, 2001.
Merriman, T.H. 1995b. An acute dermal toxicity study in rabbits with Wingstay 200. SLS Study No 3097.24. Springborn Laboratories, États-Unis. In :NICNAS, 2001.
Merriman, T.H. 1995c. A primary skin irritation study in rabbits with Wingstay 200. SLS Study No 3097.21. Springborn Laboratories, États-Unis. In :NICNAS, 2001.
Merriman, T.H. 1995d. A dermal sensitisation study in guinea pigs with Wingstay 200. SLS Study No 3097.25. Springborn Laboratories, États-Unis. In :NICNAS, 2001.
Miller, D.E., Dessent, R.W., Kuczkowski, J.L. 1985. Rubber World 193(1):39. In : Kirk-Othmer Encyclopedia of Chemical Technology, c2010.
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.43. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
[NCI] National Chemical Inventories [base de données sur CD-ROM]. 2009. Issue 2. Columbus (OH) : American Chemical Society [consultée le 21 avril 2010]. Inventaires chimiques nationaux.
Nichols, J.W., Fitzsimmons, P.N., Burkhard, L.P. 2007. In vitro – in vivo extrapolation of quantitative hepatic biotransformation data for fish. II. Modeled effects on chemical bioaccumulation. Environ. Toxicol. Chem. 26:1304-1319.
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme. 2001. Rapport complet public: 1,4-Benzenediamine, N,N’-Mixed phenyl et tolyl et dérivés d'xylyl (Wingstay 200) [en ligne]. Sydney (Australie) : Dept. of Health and Aged Care, NICNAS. 33 p.
[OASIS Forecast] Optimized Approach based on Structural Indices Set [en ligne]. 2005. Version 1.20. Bourgas (Bulgarie) : Bourgas Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. Logiciels OASIS.
[OCDE] Organisation de coopération et de développement économiques. 1995. Lignes directrices de l’OCDE pour les essais de produits chimiques : Méthode 105 – Hydrosolubilité. Adoptée le 27 juillet 1995.
[OCDE] Organisation de coopération et de développement économiques. 2004a. The 2004 list of high production volume chemicals. Paris (France) : OCDE, Division de l’environnement, de la santé et de la sécurité.
[OCDE] Organisation de coopération et de développement économiques. 2004b. Emission Scenario Document on textile manufacturing wool mills [en ligne]. Paris (France) : OCDE, Direction de l’environnement, Division de l’environnement, de la santé et de la sécurité. ENV/JM/EEA(2004)8, JT00175156.
[OCDE] Organisation de coopération et de développement économiques. 2004c. Emission Scenario Document on additives in Rubber industry [en ligne]. Paris (France) : OCDE, Direction de l’environnement, Division de l’environnement, de la santé et de la sécurité. ENV/JM/EEA(2004)11, JT00166913. Recherche de documents officiels de l'OECD.
[OCDE] Organisation de coopération et de développement économiques. 2004d. Emission Scenario Document on Plastics Additives [en ligne]. Paris (France) : OCDE, Direction de l’environnement, Division de l’environnement, de la santé et de la sécurité. ENV/JM/MONO(2004)8, JT00166678. Recherche de documents officiels de l'OECD.
Oser, B.L., Oser, M. 1956. Inhibitory effect of feed grade diphenyI-p-phenylenediamine (DPPD) on parturition in rats. Agric. Food Chem. 4(9):796–797.
[PCP] Power Chemical Corporation. 2008. Produits chimiques pour le caoutchouc : Antioxydant PA100. Jiangsu (Chine) : Power Chemical Corporation [consulté le 17 mai 2010].
Pharmakon USA. 1993a. Report # Ph309-GY-001-93 to The Goodyear Tire and Rubber Company. In : US EPA, 2010.
Pharmakon USA. 1993b. Report # Ph402-GY-001-93 to The Goodyear Tire and Rubber Company. In : US EPA, 2010.
Pierson, W.R., Brachaczek, W.W. 1974. Airborne particulate debris from rubber tires. Rubber Chemistry and Technology 47:1275-1299.
Présentation de projet d’études. 1998. Projet non publié et confidentiel (no CAS 68953-83-3) présenté à Environnement Canada, selon la Loi canadienne sur la protection de l’environnement (1999) : Règlement sur les renseignements concernant les substances nouvelles. Gatineau (Qc) : Environnement Canada.
Présentation de projet d’études. 2010a. Résumé de projet non publié et confidentiel (no CAS 68953-84-4) présenté à Environnement Canada, selon le Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l’élaboration de programmes. 25 p.
Présentation de projet d’études. 2010b. Projet non publié et confidentiel (no CAS 68953-84-4) présenté à Environnement Canada, selon le Plan de gestion des produits chimiques. Gatineau (Qc) : Environment Canada, Division de la mobilisation et de l’élaboration des programmes. Présentation datée du 8 juin 2010.
Présentation de projet d’études. 2010c. Projet non publié et confidentiel (no CAS RN 68953-84-4) présenté à Environnement Canada, selon le Plan de gestion des produits chimiques. Gatineau (Qc) : Environnement Canada, Division de la mobilisation et de l’élaboration des programmes. Présentation datée du 22 juillet 2010.
Rapta, P., Vargová , A., Polovková , J., Gatial, A., Omelka, L., Majzlik, Breza, M. 2009. A variety of oxidation products of antioxidants based on N,N’-substituted p-phenylenediamines. Polym. Degrad. Stab. 94:1457-1466.
Reddy, C.M., Quinn, J.G. 1997. Environmental chemistry of benzothiazoles derived from rubber. Environ. Sci. Technol. 31:2847–2853.
Research Triangle Institute. 1998a. Metabolism and excretion of [14C]R-1679 (as a major component of Wingstay 100) in bile of male rats after a single oral dose. Research Triangle Park (NC) : Research Triangle Institute.
Research Triangle Institute. 1998b. Metabolism and excretion of [14C]R-898 (as a major component of Wingstay 100) in urine, feces and bile of male rats after a single oral dose. Research Triangle Park (NC) : Research Triangle Institute.
Rotschová , J., Pospíšil, J. 1981. New aspects of the mechanism of action of arylamine stabilizers. Chemistry and Industy 11:393-394.
SanSebastian, J.R. 1994. In vitro chromosomal aberration analysis of Wingstay 200 in Chinese hamster ovary (CHO) cells, Pharmakon Study No. PH 302-GY-002-93. Pharmakon (É.-U.) In :NICNAS, 2001.
Santé Canada. 1994. L’évaluation du risque à la santé humaine des substances d’intérêt prioritaire. Ottawa (Ont.) : Santé Canada, Direction de l’hygiène du milieu.
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Ottawa (Ont.) : Santé Canada, Direction de l’hygiène du milieu.
Santé Canada. 2009. Liste critique des ingrédients dont l’utilisation est restreinte ou interdite dans les cosmétiques – septembre 2009 [en ligne]. Ottawa (Ont.) : Santé Canada, Sécurité des produits de consommation [consultée le 14 mai 2010].
[SBSC] Santé et Bien-être social Canada. 1990. L’allaitement maternel au Canada : pratiques et tendances. No de catalogue H39-199/1990F; ISBN 0-662-18397-5. Ottawa (Ont.) : Santé et Bien-être social Canada. 9 p. In : Santé Canada, 1998.
[SDC] Système de déclaration des cosmétiques [base de données exclusive]. 2010. Disponible auprès de Santé Canada, Division des cosmétiques.
SimpleTreat [modèle d’élimination par les usines de traitement des eaux usées]. 1997. Version 3.0. Bilthoven (Pays-Bas) : National Institute for Public Health and the Environment (RIVM). Disponible auprès du : National Institute for Public Health and the Environment (RIVM), Laboratory for Ecological Risk Assessment, C.P. 1, 3720 BA Bilthoven (Pays-Bas).
Spies, R.B., Andresen, B.D., Rice, D.W. 1987. Benzthiazoles in estuarine sediments as indicators of street runoff. Nature 327:697-699.
[SPIN] Substances in Preparations in Nordic Countries [base de données sur Internet]. 2006. Copenhague (Danemark) : Conseil des ministres des pays nordiques [consultée en avril 2010]. Substances dans les préparations dans les pays nordiques.
Springborn Laboratories. 1995a. An Acute Toxicity Study in Rabbits with WINGSTAY 100 (Limit Test), rapport no S94-001-3097.29 to The Goodyear Tire and Rubber Company. In : US EPA, 2010.
Springborn Laboratories. 1995b. A Primary Eye Irritation Study in Rabbits with WINGSTAY 100, rapport no 3097.27 to The Goodyear Tire and Rubber Company. In : US EPA, 2010.
Springborn Laboratories. 1995c. A Dermal Sensitization Study in Guinea Pigs with WINGSTAY 100 – Maximization Design, rapport no 3097.30 to The Goodyear Tire and Rubber Company. In : US EPA, 2010.
Springborn Laboratories. 2004. Terrestrial field soil dissipation study with [14C]R-898, component of Wingstay® 100. Rapport final. Wareham (MA) : Springborn Laboratories, Inc. 160 p. Présenté à Environnement Canada, selon le Plan de gestion des produits chimiques, 15 novembre 2010.
Stankowski, L.F. 1998. Ames/Salmonella-E. coli liquid pre-incubation assay on Wingstay 200. Pharmakon Study No. PH 301-GY-005-93. Pharmakon (É.-U.) In :NICNAS, 2001.
Stephensen, E., Adolfsson-Erici, M., Celander, M., Hulander, M., Parkkonen, J., Hegelund, T., Sturve, J., Hasselberg, L., Bengtsson, M., Förlin, L. 2003. Biomarker responses and chemical analyses in fish indicate leakage of polycyclic aromatic hydrocarbons and other compounds from car tire rubber. Environ. Toxicol. Chem. 22:2926–2931.
[TaPL3] Long Range Transport and Persistence Level III model [en ligne]. 2000. Version 2.10. Peterborough (Ont.) : Trent University, Canadian Environmental Modelling Centre. Le centre canadien de modélisation et de chimie environnementales.
[TOPKAT] TOxicity Prediction by Komputer Assisted Technology [en ligne]. 2004. Version 6.2. San Diego (CA) : Accelrys Software Inc.
[TradingChem] TradingChem Group Ltd. 2008. R.T. Vanderbilt Co. Inc. [consulté le 17 mai 2010].
Tyl, R.W. 1996. Developmental toxicity evaluation of Wingstay 200 administered by gavage to CD rats. RTI No 65C-6429-100/300. Research Triangle Institute (É.-U.) In :NICNAS, 2001.
Umeniwa, K., Matsuda, T., Maeda, M., Miyazaki, K., Arita, T. 1985. Biological fate of N,N’-diphenyl –p-phynylenediamine. Yakugaku Zasshi – J Pharm Soc Jpn 105(1):65 – 76.
[US EPA] United States Environmental Protection Agency. 2007. Emission scenario document on adhesive formulation [Internet]. Rapport final. Paris (France) : OCDE, Direction de l’environnement (Series on Emission Scenario Documents).
[US EPA] United States Environmental Protection Agency. 2009. High Production Volume Information System (HPVIS) [en ligne]. Washington (DC) : US EPA, Office of Pollution Prevention and Toxics. Système d'information sur la production à volume élevé [consulté en avril 2010].
[US EPA] United States Environmental Protection Agency. 2010. High Production Volume Information System (HPVIS). Detailed Chemical Results for 1,4-Benzenediamine, N,N’-mixed Ph and tolyl derivs. Système d'information sur la production à volume élevé .
Veith, A.G. 1992. A review of important factors affecting tread wear. Rubber Chem Technol 65: 601-658. In : ChemRisk LLC, 2009.
[WARF] Wisconsin Alumni Research Foundation. 1959. Acute Toxicity of WINGSTAY 100 to the Goodyear Tire and Rubber Company. In : US EPA, 2010.
[WATERNT] Water Solubility Program [modèle d’estimation]. 2008. Version 1.01. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
Wik, A. 2007. Toxic components leaching from tire rubber. Bull. Environ. Contam. Toxicol. 79:114-119.
Wik, A., Dave, G. 2009. Occurrence and effects of tire wear particles in the environment – A critical review and an initial risk assessment. Environmental Pollution 157:1-11.
[WSKOWWIN] Water Solubility for Organic Compounds Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.41. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
XingChun Chemical Corporation. c2006. Antioxidant DTPD (3100) [fiche sur le produit en ligne]. Jurong Chuncheng Town (Chine) : Xcchem [consultée le 2 juin 2010].
Zeng, E.Y., Tran, K., Young, D. 2004. Evaluation of potential molecular markers for urban stormwater runoff. Environmental Monitoring and Assessment 90:23-43.
Sommaire de rigueur d’étude : Évaluation du potentiel de bioaccumulation aquatique
| No | Article | Poids | Oui/Non | Préciser |
|---|---|---|---|---|
| 1 | Référence : Présentation de projet d’études. 2010b. Projet non publié et confidentiel (no CAS 68953-84-4) présenté à Environnement Canada, selon le Plan de gestion des produits chimiques. Gatineau (Qc) : Environment Canada, Division de la mobilisation et de l’élaboration des programmes. Présentation datée du 8 juin 2010. Essai de bioaccumulation chez la carpe – Rapport final |
|||
| 2 | Identité de la substance : no CAS | s.o. | ||
| 3 | Identité de la substance : nom(s) chimique(s) | s.o. | ||
| 4 | Composition chimique de la substance | 2 | O | |
| 5 | Pureté chimique | 1 | O | 100 % |
| 6 | Indication de la persistance/stabilité de la substance en milieu aqueux? | 1 | O | On a confirmé que la substance d’essai était stable dans ces conditions d’essai et de stockage. |
| 7 | Si le matériel d’essai est radiomarqué, est-ce que la ou les positions précises du ou des atomes marqués ainsi que le pourcentage de radioactivité associé aux impuretés ont été rapportés? | 2 | s.o. | |
| Méthode | ||||
| 8 | Référence | 1 | O | Norme industrielle japonaise : Méthode pour tester le niveau d’accumulation des substances chimiques dans le corps des poissons (méthode pour l’essentiel identique aux Lignes directrices de l’OCDE pour les essais de produits chimiques et la bioaccumulation (Ligne directrice no 305C) |
| 9 | Méthode normalisée (OCDE, UE, nationale, ou autre)? | 3 | O | Méthode de la norme industrielle japonaise |
| 10 | Justification de la méthode ou du protocole non normalisé employé, le cas échéant | 2 | s.o. | |
| 11 | BPL (bonnes pratiques de laboratoire) | 3 | O | |
| Organisme d’essai | ||||
| 12 | Identité de l’organisme : nom | s.o. | carpe | |
| 13 | Indication du nom latin ou des deux noms (latin et commun)? | 1 | O | Cyprinus carpio |
| 14 | Âge ou stade biologique de l’organisme d’essai | 1 | O | D’après la longueur et le poids des poissons ainsi que leur alimentation, on peut déduire qu’il s’agissait de poissons juvéniles. |
| 15 | Longueur et/ou poids | 1 | O | poids = 22,9 g longueur moyenne = 9,7 cm |
| 16 | Sexe | 1 | s.o. | |
| 17 | Nombre d’organismes par répétition | 1 | O | 20 poissons par niveau pour les niveaux 1 et 2, 5 pour le groupe témoin |
| 18 | Charge en organismes | 1 | N | |
| 19 | Type de nourriture et périodes d’alimentation pendant la période d’acclimatation | 1 | O | |
| Conception et conditions des essais | ||||
| 20 | Type d’expérience (en laboratoire ou sur le terrain) | s.o. | Laboratoire | |
| 21 | Voies d’exposition (nourriture, eau, les deux) | s.o. | Eau | |
| 22 | Durée de l’exposition | s.o. | 8 semaines | |
| 23 | Nombre de répétitions (y compris les témoins) | 1 | O | Deux concentrations testées, 20 poissons par concentration, 5 poissons dans le groupe témoin |
| 24 | Concentrations | 1 | 0,05 mg/L et 0,005 mg/L | |
| 25 | Type/composition de la nourriture et périodes d’alimentation (pendant l’essai) | 1 | O | |
| 26 | Si le rapport FBC/FBA a été utilisé comme dérivé de la concentration du produit chimique dans l’organisme et dans l’eau, estce que la durée de l’expérimentation était égale ou plus longue que le temps requis pour que la concentration du produit chimique atteigne un état stable? | 3 | O | La durée de dépuration pour le composé « e » était de 5,7 jours pour l’exposition de niveau 1 et de 44,4 jours pour l’exposition de niveau 2 |
| 27 | Si le rapport FBC/FBA a été déterminé comme correspondant au rapport de la concentration du produit chimique dans l’organisme sur sa concentration dans l’eau, est-ce que les concentrations mesurées dans l’organisme et dans l’eau étaient mentionnées? | 3 | ||
| 28 | Les concentrations dans les eaux d’essai ont-elles été mesurées périodiquement? | 1 | O | Une fois par semaine (tableau 1) |
| 29 | Les conditions du milieu d’exposition pertinentes pour la substance sont-elles indiquées? (p. ex. : pour la toxicité des métaux – pH, COD/COT, dureté de l’eau, température) | 3 | O | |
| 30 | Photopériode et intensité de l’éclairage | 1 | O | |
| 31 | Préparation de solutions mères et de solutions d’essai | 1 | O | |
| 32 | Intervalles des contrôles analytiques | 1 | O | |
| 33 | Méthodes statistiques utilisées | 1 | Y | |
| 34 | Un agent émulsionnant ou stabilisant a-t-il été employé si la substance était peu soluble ou instable? | s.o. | O | tétrahydrofurane (20 fois la quantité de la substance d’essai) |
| Renseignements d’intérêt pour la qualité des données | ||||
| 35 | L’organisme d’essai correspondait-il à l’environnement canadien? | 3 | O | |
| 36 | Les conditions d’essai (pH, température, OD, etc.) sont-elles typiques pour l’organisme d’essai? | 1 | O | |
| 37 | Le type et la conception du système (statique, semi-statique, dynamique; ouvert ou fermé; etc.) correspondent-ils aux propriétés de la substance et à la nature ou aux habitudes de l’organisme? | 2 | O | |
| 38 | Le pH de l’eau d’essai était-il dans la plage des valeurs typiques de l’environnement au Canada (6 à 9)? | 1 | O | 7,9 à 8 |
| 39 | La température de l’eau d’essai était-elle dans la plage des valeurs typiques de l’environnement au Canada (5 à 27 oC)? | 1 | O | 25 +/- 2 |
| 40 | Est-ce que le contenu en lipides (ou FBA/FBC normalisé par rapport aux lipides) a été indiqué? | 2 | O | 3,6 % en moyenne |
| 41 | Est-ce que les concentrations mesurées d’un produit chimique dans les eaux d’essai étaient plus basses que la solubilité du produit? | 3 | O | |
| 42 | Si une substance radiomarquée a été utilisée, est-ce que le FBC a été déterminé d’après le composé d’origine (et non d’après les résidus radiomarqués)? | 3 | s.o. | |
| Résultats | ||||
| 43 | Les paramètres déterminés (FBA, FBC) et leurs valeurs | s.o. | s.o. | FBC |
| 44 | FBA ou FBC déterminés comme : 1) le rapport de la concentration en produit chimique produit dans l’organisme, ou 2) le rapport entre les constantes d’incorporation de produit chimique et du taux d’élimination | s.o. | s.o. | (2) |
| 45 | Le FBA/FBC a-t-il été déterminé d’après un 1) échantillon de tissu ou 2) l’organisme entier? | s.o. | s.o. | (2) |
| 46 | Le FBA/FBC utilisé était-elle la valeur 1) moyenne ou 2) maximale? | s.o. | s.o. | Les valeurs maximales (des fourchettes sont présentées). |
| 47 | Note : % | 97,7 | ||
| 48 | Code de fiabilité d’Environnement Canada : | 1 | ||
| 49 | Catégorie de fiabilité (élevée, satisfaisante, faible) : | Confiance élevée | ||
Sommaire de rigueur d’étude : Évaluation des données expérimentales sur la solubilité dans l’eau selon la méthode de Kollig[*]
| Élément | Pondération | Réponse | Note |
|---|---|---|---|
| Référence : Présentation de projet d’études. 1998. Projet non publié et confidentiel (no CAS 68953-83-3) présenté à Environnement Canada, selon la Loi canadienne sur la protection de l’environnement (1999) : Règlement sur les renseignements concernant les substances nouvelles. Gatineau (Qc) : Environnement Canada. Détermination de la solubilité dans l’eau |
|||
| Substance d’essai : No CAS : 68953-83-3 | |||
| Pourriez-vous répéter l’expérience avec les renseignements disponibles? | 5 | Assez bien | 2,5 |
| Un objectif clair est-il énoncé? | 1 | Oui | 1 |
| La qualité de l’eau est-elle caractérisée ou définie (distillée ou désionisée)? | 2 | Oui (eau à réactifs obtenue à l’aide d’un dispositif Sybron/Barnstead NANOpure II) |
2 |
| Les résultats sont-ils présentés de façon détaillée, claire et compréhensible? | 3 | Passable Les détails concernant les calculs utilisés pour établir la solubilité générale dans l’eau de la substance (à partir des composés principaux et mineurs) ne sont pas fournis. |
1,5 |
| Les données proviennent-elles d’une source principale et non d’un article cité? | 3 | Source principale | 3 |
| La substance chimique a-t-elle été testée à des concentrations inférieures à sa limite de solubilité dans l’eau? | 5 | s.o. | s.o. |
| Y avait-il absence de particules? | 2 | Non indiqué (la taille des pores du filtre n’était pas indiquée) |
0 |
| A-t-on fait un essai avec une substance de référence ayant une constante connue? | 3 | Deux séries de substances de références ont été analysées par CLHR et UV avec les échantillons | 3 |
| D’autres processus intervenant dans le devenir ont-ils été pris en considération? | 5 | s.o. | s.o. |
| A-t-on fait un essai témoin (à blanc)? | 3 | s.o. | s.o. |
| La température a-t-elle été maintenue constante? | 5 | Oui (à environ 20 oC) | 5 |
| L’expérience a-t-elle été réalisée à une température presque ambiante (15 à 30 oC)? | 3 | Oui | 3 |
| La pureté de la substance est-elle précisée (> 98 %)? | 3 | Oui (100 %) |
3 |
| L’identité de la substance a-t-elle été attestée? | 3 | Oui | 3 |
| La source de la substance est-elle indiquée? | 1 | Oui | 1 |
| Résultats : (X±SE) | |||
| Solubilité (dans l’eau) : la solubilité moyenne dans l’eau était de 1,02 mg/L. | |||
| Note globale : | 82 % | ||
| Degré de fiabilité[**] | Confiance élevée | ||
[**] Le code de fiabilité pour les études écotoxicologiques de la catégorisation dans la LIS est utilisé.
Annexe II : Tableau sommaire des intrants des modèles de la persistance, de la bioaccumulation et de la toxicité
Devenir et propriétés physiques et chimiques
Intrants d’EPIsuite (2008) (tous les modèles, notamment AOPWIN, KOCWIN, BCFWIN, BIOWIN et ECOSAR)
| Structure | Code SMILES |
|---|---|
| Structure 1 | N(C1=CC=CC=C1)C1=CC=C(NC2=CC=CC=C2)C=C1 |
| Structure 2 | CC1=C(NC2=CC=C(NC3=CC=CC=C3)C=C2)C=CC=C1 |
| Structure 3 | CC1=CC=CC=C1NC1=CC=C(NC2=CC=CC=C2C)C=C1 |
| Structure 4 | CC1=CC=C(NC2=CC=C(NC3=CC=CC=C3C)C=C2)C(C)=C1 |
| Structure 5 | CC1=CC=C(NC2=CC=C(NC3=CC=C(C)C=C3C)C=C2)C(C)=C1 |
Devenir
EQC (2003) (intrants de type I)
| Paramètre | BENPAT | BENTAX | Structure 1 | Structure 2 | Structure 3 | Structure 4 | Structure 5 |
|---|---|---|---|---|---|---|---|
| Masse moléculaire (g/mol) | 274,35 | 302[1] | 260,31 | 274,36 | 288,39 | 302,41 | 316,44 |
| Point de fusion (oC) | 90 à 105 | 60 | 154 | 130 | 135,5 | 168,91 | 179,02 |
| Température (en oC) | 25 | 20[1] | 22,8 | 25 | 25 | 25 | 25 |
| Pression de vapeur (Pa) | 1 x 10-5 | 1 x 10-5 | 7,65 x 10-5 | 3,06 x 10-5 | 1,42 x 10-5 | 5,65 x 10-6 | 2,23 x 10-6 |
| Log Koe | 3,3 à 4,6 | 4,56[1] | 3,3 | 3,9 | 4,6 | 4,42 | 4,56 |
| Solubilité dans l’eau (mg/L) | 2,2 | 1,021 | 0,13 | 0,11 | 0,045 | 0,0489 | 0,0153 |
TaPL3 (2000)
| Paramètre | BENPAT | BENTAX |
|---|---|---|
| Type de substance chimique | 1 | 1 |
| Masse moléculaire (g/mol) | 288,39 | 316,44 |
| Point de fusion (oC) | 105 | 60 |
| Température (oC) | 20 | 20 |
| Pression de vapeur (Pa) | 1 x 10-5 | 1 x 10-5 |
| Log Koe | 4,6 | 4,56 |
| Solubilité dans l’eau (mg/L) | 2,2 | 1,02 |
| Demi-vie de réaction dans l’air (h) | 0,6 | 0,6 |
| Demi-vie de réaction dans l’eau (h) | 4 368 | 4 368 |
| Demi-vie de réaction dans le sol (h) | 4 368 | 4 368 |
| Demi-vie de réaction dans les sédiments (h) | 8 760 | 8 760 |
| Demi-vie de réaction dans les sédiments en suspension (h) | 4 368 | 4368 |
| Demi-vie de réaction dans le poisson (h) | 4 368 | 4 368 |
| Demi-vie de réaction dans les aérosols (h) | 1 x 1011 | 1 x 1011 |
Annexe III : Quantités de pertes pour le BENTAX et le BENPAT et concentrations environnementales estimées d’après ces quantités
Pertes de BENTAX et de BENPAT d’après les valeurs intermédiaires de la gamme générée par l’outil de détermination du débit massique
| Substance | Forme de pertes | Milieu récepteur | Volume (kg/année) |
|---|---|---|---|
| BENTAX | Eaux usées | Eau | 22,5 |
| Émissions atmosphériques | Air | 0,5 | |
| Décharges | Sol | 947,5 | |
| BENPAT | Eaux usées | Eau | 600 000 |
| Sols | Sol | 550 000 | |
| Émissions atmosphériques | Air | 5 000 | |
| Décharges | Sol | 1 295 000 |
Estimation des concentrations de BENTAX et de BENPAT dans les milieux naturels à l’aide du modèle ChemCAN, v. 6.00 (ChemCAN, 2003)[1]
| Substance | Milieu | Concentration |
|---|---|---|
| BENTAX | Air[2] | 0,0622 ng/m3 |
| Eau[3] | 3,05 ng/L | |
| Sol[3] | 55,2 ng/g de solides | |
| Sédiments[3] | 104 ng/g de solides | |
| BENPAT | Air[2] | 0,0635 ng/m3 |
| Eau[3] | 5 361 ng/L | |
| Sol[3] | 14 694 ng/g de solides | |
| Sédiments[3] | 16 838 ng/g de solides |
[2] Les demi-vies par oxydation atmosphérique ont été estimées en utilisant AOPWIN v1.92 (AOPWIN, 2008).
[3] En raison de la persistance dans l’eau, le sol et les sédiments, la dégradation dans ces milieux environnementaux a été jugée négligeable.
Annexe IV : Tranche supérieure des estimations de l’absorption quotidienne de BENPAT pour divers groupes d’âge (µg/kg p.c. par jour
Tranche supérieure des estimations de l’absorption quotidienne de BENPAT pour divers groupes d’âge
| Voie d’exposition | 0 à 0,5 an[1], [2], [3] | 0,5 à 4 ans[4] | 5 à 11 ans[5] | 12 à 19 ans[6] | 20 à 59 ans[7] | 60 ans et plus[8] | ||
|---|---|---|---|---|---|---|---|---|
| Nourris au lait maternel | Nourris au lait maternisé | Pas nourris au lait maternisé | ||||||
| Air[9] | 1,78 × 10-5 | 1,78 × 10-5 | 1,78 × 10-5 | 3,81 × 10-5 | 2,97 × 10-5 | 1,69 × 10-5 | 1,45 × 10-5 | 1,26 × 10-5 |
| Eau potable[10] | s.o. | 5,72 × 10-1 | 2,14 × 10-1 | 2,42 × 10-1 | 1,90 × 10-1 | 1,08 × 10-1 | 1,13 × 10-1 | 1,19 × 10-1 |
| Aliments et boissons[11] | s.o. | s.o. | s.o. | s.o. | s.o. | s.o. | s.o. | s.o. |
| Sol[12] | 5,88 × 10-2 | 5,88× 10-2 | 5,88 × 10-2 | 9,48 × 10-2 | 3,08 × 10-2 | 7,42 × 10-3 | 6,22 × 10-3 | 6,12 × 10-3 |
| Absorption totale | 5,88 × 10-2 | 6,31× 10-1 | 2,73 × 10-1 | 3,37 × 10-1 | 2,21 × 10-1 | 1,16 × 10-1 | 1,20 × 10-1 | 1,25 × 10-1 |
[1] Aucune donnée n’a été déterminée pour les concentrations de BENPAT dans le lait maternel.
[2] On présume que le nourrisson pèse 7,5 kg, respire 2,1 m3 d’air par jour, boit 0,8 L d’eau par jour (lait maternisé) ou 0,3 L d’eau par jour (lait non maternisé) et ingère 30 mg de sol par jour (Santé Canada, 1998).
[3] Dans le cas des enfants uniquement nourris au lait maternisé, l’absorption par l’eau correspond à l’absorption par la nourriture. On n’a répertorié aucune donnée sur les concentrations de BENPAT dans l’eau potable ou le lait maternisé pour le Canada. La concentration de BENPAT dans l’eau potable a été estimée à l’aide du modèle ChemCAN v6.00 à 5 361 ng/L (ChemCAN, 2003). En ce qui concerne les enfants non nourris au lait maternisé, 50 % d’entre eux ont commencé à manger des aliments solides à 4 mois et 90 % ont commencé à 6 mois (SBSC, 1990).
[4] En supposant que l’enfant pèse 15,5 kg, qu’il respire 9,3 m3 d’air par jour, qu’il boive 0,7 L d’eau par jour et qu’il ingère 100 mg de sol par jour (Santé Canada, 1998).
[5] En supposant que l’enfant pèse 31 kg, qu’il respire 14,5 m3 d’air par jour, qu’il boive 1,1 L d’eau par jour et qu’il ingère 65 mg de sol par jour (Santé Canada, 1998).
[6] En supposant que le jeune pèse 59,4 kg, qu’il respire 15,8 m3 d’air par jour, qu’il boive 1,2 L d’eau par jour et qu’il ingère 30 mg de sol par jour (Santé Canada, 1998).
[7] En supposant que la personne pèse 70,9 kg, qu’elle respire 16,2 m3 d’air par jour, qu’elle boive 1,5 L d’eau par jour et qu’elle ingère 30 mg de sol par jour (Santé Canada, 1998).
[8] En supposant que la personne pèse 72,0 kg, qu’elle respire 14,3 m3 par jour, qu’elle boive 1,6 L d’eau par jour et qu’elle ingère 30 mg de sol par jour (Santé Canada, 1998).
[9]Aucune donnée n’a été déterminée pour les concentrations de BENPAT dans l’air. La concentration de BENPAT dans l’air a été estimée à l’aide du modèle ChemCAN, v.6.00, à 0,0635 ng/m3 (ChemCAN, 2003).
[10] Aucune donnée n’a été déterminée pour les concentrations de BENPAT dans l’eau potable. La concentration de BENPAT dans l’eau potable a été estimée à l’aide du modèle ChemCAN, v. 6.00, à 5 361 ng/L (ChemCAN, 2003).
[11] Aucune donnée n’a été déterminée pour les concentrations de BENPAT dans les aliments ou les boissons.
[12] Aucune donnée n’a été déterminée pour les concentrations de BENPAT dans le sol. La concentration de BENPAT dans le sol a été estimée à l’aide du modèle ChemCAN, v.6.00, à 14 694ng/g de solides (ChemCAN, 2003)
Annexe V : Résumé des données relatives aux effets du BENPAT, du BENTAX et de l’analogue, le BENTAPAX
| Paramètre | Doses ou concentrations minimales avec effet1/Résultats |
|---|---|
| Toxicité aiguë | BENPAT (n° CAS 68953-84-4) DL50 minimale par voie orale (rat) > 2 000 mg/kg p.c. (Bayer AG, 1990; BESC, 2003) Autre DL50 par voie orale (rat) > 4 000 à 5 000 mg/kg p.c. (Pharmakon, 1993b; WARF, 1959) DL50 par voie cutanée (lapin) > 2 000 mg/kg p.c. (Springborn Laboratories, 1995a; BESC, 2003) BENTAX (n° CAS 68478-45-5) DL50 minimale par voie orale (rat) > 6 130 mg/kg p.c. (Goodyear Tire and Rubber Company, 1992b) BENPATAX (analogue, n° CAS 68953-83-3) DL50 par voie orale (rat) = entre 2 000 mg/kg p.c. et 5 000 mg/kg p.c. (Merriman, 1995a) DL50 par voie cutanée (lapin) > 2 000 mg/kg p.c. (Merriman, 1995b) Aucune étude d’exposition par inhalation n’a été recensée. |
| Toxicité court terme en doses répétées | BENPAT (n° CAS 68953-84-4) DMEO la plus faible par voie orale = 7,5 mg/kg p.c. par jour d’après l’augmentation de la prolifération des cellules urothéliales de la vessie chez des rats Fischer 344 (14 rats/sexe/groupe) des deux sexes exposés dans leur alimentation à des doses de 0, 7,5, 30 ou 120 mg/kg p.c. pendant 4 semaines. Une augmentation du poids du foie et des reins a pu être constatée chez les femelles exposées à la dose moyenne et les mâles exposés à la dose élevée, tout comme une augmentation du poids du cœur et de la rate ainsi qu’une diminution du poids corporel chez les femelles exposées à la dose élevée (accompagnée d’une baisse de la consommation d’aliments). Une augmentation de la division cellulaire dans le foie et une diminution de cette dernière dans les reins ont également pu être observées (mâles exposés à la dose moyenne et mâles et femelles exposés à la dose élevée). Des signes hématologiques réversibles (y compris une augmentation du volume corpusculaire moyen et une baisse de la teneur corpusculaire moyenne en hémoglobine) et des modifications des valeurs de chimie clinique (y compris une augmentation des taux de bilirubine et de cholestérol dans le sang) sont apparus chez les groupes exposés à la dose élevée. Les auteurs de cette étude ont jugé que la DMNEO pour cette étude était de 30 mg/kg p.c., d’après l’augmentation de la prolifération des cellules urothéliales dans la vessie chez les deux sexes et l’augmentation du poids du foie et des reins chez les femelles exposées à la dose moyenne (AHF, 1996a). Autre DMEO par voie orale = 100 mg/kg p.c. par jour, d’après la diminution fortement liée à la dose du poids corporel, l’augmentation du poids du foie et de l’indice de marquage hépatocellulaire (0,1 g/kg) chez des rats Fischer 344/N TacfBR des deux sexes exposés par gavage à des doses de BENPAT de 0, 100, 300, 1 000 ou 3 000 mg/kg p.c. par jour pendant 21 jours. Les doses 1 000 et 3 000 mg/kg p.c. se sont avérées létales pour les rats mâles et femelles après 6 jours d’exposition (AHF, 1994). BENPATAX (analogue, n° CAS 68953-83-3) DMEO la plus faible par voie orale = 120 mg/kg p.c. par jour, d’après l’anémie macrocytaire [augmentation du volume corpusculaire moyen et baisse de la teneur corpusculaire moyenne en hémoglobine], l’érythropoïèse extramédullaire compensatoire, la réduction du gain de poids corporel, l’augmentation du poids relatif du foie, des reins et du cerveau, l’augmentation des taux de cholestérol, de birilubine, d’albumine et de protéine totale observées chez des rats Fischer 344 mâles et femelles (6 à 8 rats/sexe/groupe) exposés dans leur alimentation à des doses de 0, 7,5, 30 ou 120 mg/kg p.c. de Wingstay 200 (appellation commerciale du BENPATAX) pendant 28 jours. Une hyperplasie de l’urothélium et une augmentation de la prolifération des cellules urothéliales (uniquement liées à la dose chez les femelles) ont également été constatées dans les groupes exposés à la dose élevée (Iatropoulos et al., 1998). Aucune étude à court terme n’a été recensée pour le BENTAX et aucune étude concernant l’exposition par voie cutanée ou par inhalation n’a été recensée pour les trois composés. |
| Toxicité subchronique | BENPAT (n° CAS 68953-84-4) DMENO : Des groupes de rats Fischer 344 mâles (nombre non précisé) ont été exposés dans leur alimentation à des doses de 1 900 ppm (soit 95 mg/kg p.c. par jour, d’après la méthode de conversion des doses de Santé Canada, 1994) de BENPAT pendant 38 semaines (essai biologique accéléré conçu pour évaluer le potentiel d’induction et de promotion des tumeurs dans les organes cibles [foie et vessie]). La substance a entraîné une anémie chronique accompagnée d’une baisse du poids corporel, d’une érythropoïèse extramédullaire compensatoire dans le foie et la rate, d’une augmentation du poids des reins et du cœur, d’une augmentation du taux de bilirubine ainsi que d’une baisse des taux de protéine totale, d’albumine, et de biliprotéine (bilirubine plus albumine). Aucune activité d’induction ou de promotion des tumeurs n’a été observée (AHF, 1996b; Iatropoulos et al., 1997). Aucune étude sur la toxicité subschronique n’a été recensée pour le BENTAX et le BENPATAX et aucune étude concernant l’exposition par voie cutanée ou par inhalation n’a été recensée pour les trois composés. |
| Toxicité chronique et cancérogénicité | BENPAT (n° CAS 68953-84-4) DMENO par voie orale (non néoplasique) = 2,7 mg/kg p.c. par jour, d’après une augmentation importante de l’hyperplasie et de la prolifération des cellules urothéliales observée à toutes les doses testées chez des rats Fischer 344 des deux sexes exposés dans leur alimentation à des doses de 0, 53, 310 et 1 900 ppm (soit 0, 2,7, 15,5 et 95 mg/kg p.c. par jour, d’après la méthode de conversion des doses de Santé Canada, 1994) de BENPAT pendant 52 semaines (suivies par une période de rétablissement de 12 semaines). Des augmentations du poids du foie, de la rate, du cœur et des reins ainsi que des baisses du gain de poids corporel et de la consommation d’aliments ont également été signalées chez les groupes exposés à la dose élevée. Une augmentation importante du volume corpusculaire moyen, une diminution de la teneur corpusculaire moyenne et du nombre de globules rouges accompagnées de preuves microscopiques d’une érythropoïèse extramédullaire dans la rate et le foie ont également été constatées. Une augmentation des taux de cholestérol et de bilirubine dans le sang ainsi qu’une baisse des niveaux de protéine totale ont également été remarquées chez les animaux exposés à la dose élevée. Aucune preuve d’activité cancérogène liée à l’exposition n’a été décelée (AHF, 1996c; Iatropoulos et al., 1997). BENPATAX (analogue, n° CAS 68953-83-3) DMENO par voie orale (non néoplasique) = 20 mg/kg p.c., d’après la présence d’une anémie macrocytaire observée dans le cadre d’une étude de 52 semaines à doses répétées chez des rats Fischer 344 (20 rats/sexe/groupe) exposés dans leur alimentation à des doses de 0, 4, 20 et 100 mg/kg p.c. de BENPATAX par jour pendant 52 semaines suivies d’une période de rétablissement de 12 semaines. Les effets observés incluaient une augmentation de la méthémoglobine chez les rats des deux sexes ainsi qu’une augmentation de la numération plaquettaire et réticulocytaire et une baisse du nombre de globules rouges dans le sang, de l’hémoglobine et de l’hématocrite chez les rats mâles. D’autres effets, comme l’augmentation du volume corpusculaire moyen, la diminution de la teneur corpusculaire moyenne et la baisse des concentrations sériques de folates, d’acide folique et de fer ont également été observés chez les rats exposés à la dose élevée. Une réduction du poids corporel, une augmentation du poids relatif du foie, des reins et de la thyroïde, une congestion importante de la rate et une augmentation de la prolifération cellulaire dans la vessie ont permis d’apporter des preuves supplémentaires d’anémie macrocytaire principalement chez les rats exposés à la dose élevée (Iatropoulos et al., 2000). Aucune étude à long terme n’a été recensée pour le BENTAX et aucune étude concernant l’exposition par voie cutanée ou par inhalation n’a été recensée pour les trois composés. |
| Toxicité pour le développement et la reproduction | BENPAT (n° CAS 68953-84-4) Dans le cadre d’une étude sur deux générations, des groupes de 30 rats SpragueDawley mâles et femelles ont été exposés dans leur alimentation à des doses de BENPAT de 0, 120, 400 et 1 500 ppm (soit 0, 6, 20 et 75 mg/kg p.c. par jour, d’après la méthode de conversion des doses de Santé Canada, 1994) pendant des périodes de 10 semaines précédant l’accouplement, 2 semaines au moment de l’accouplement, 3 semaines de gestation et jusqu’à la période de sevrage des petits (21 jours). DMENO par voie orale concernant la toxicité pour le développement et la reproduction = 6 mg/kg p.c. par jour d’après l’allongement de la durée de gestation chez les mères F1 et les lésions polykystiques observées dans les reins des rats sevrés F1 et F2. On a estimé que les lésions dans les reins étaient liées à la dose. L’allongement de durée de gestation et l’augmentation du poids des petits ont également pu être constatés à des doses de 20 et de 75 mg/kg p.c. par jour pour les mères F0 avec des portées de rats F1. Des dystocies et des mises bas tardives ont été relevées chez les mères F0 et F1 tandis que les pertes postimplantation par portée augmentaient de façon importante à des doses de 20 et de 75 mg/kg p.c. par jour pour les portées F1 et à des doses de 75 mg/kg p.c. par jour pour les portées F2. Le nombre de petits et de petits vivants par portée baissait considérablement à des doses de 20 et de 75 mg/kg p.c. pour les portées F1 et à des doses de 75 mg/kg p.c. pour les portées F2. À des doses de 75 mg/kg p.c., une augmentation importante du nombre de petits morts et une réduction de l’indice des naissances vivantes ont été signalées pour les mères F0 et F1. Aucune preuve de toxicité pour la reproduction n’a été relevée chez les mâles F0 et F1. DMENO par voie orale concernant la toxicité systémique = 6 mg/kg p.c. par jour d’après la présence de lésions dans les reins observée à toutes les doses chez les femelles F0 et les parents F1. Une mortalité au cours de la gestation/lactation a pu être observée chez les groupes F0 et F1 exposés aux doses moyenne (3/24; 1/22) et élevée (4/25; 1/24). Des baisses du poids corporel ont été constatées chez les femelles exposées à la dose élevée (Goodyear Tire and Rubber Company, 2001). Autre étude : Une étude mécaniste a permis de confirmer les résultats de l’étude sur la toxicité pour la reproduction sur deux générations de rats ci-dessus; elle a démontré que l’exposition par voie orale au BENPAT à une dose de 2 500 ppm (soit 125 mg/kg p.c., d’après la méthode de conversion des doses de Santé Canada, 1994) entraînait l’apparition de dystocies, de mises bas retardées et d’une diminution connexe de la survie des petits à la naissance. L’étude indiquait qu’une exposition au cours de la gestation était nécessaire et suffisante pour entraîner une dystocie. Il est aussi nécessaire et suffisant d’exposer les mères F0 pendant leur gestation ou lactation pour entraîner le développement de reins polykystiques chez les descendants F1. Toutefois, il n’est pas certain que l’exposition pendant la gestation puisse induire à elle seule le développement de reins polykystiques. L’exposition précédant la gestation n’a pas accru les effets attribués à l’ingestion de BENPAT pendant la période de gestation (Goodyear Tire and Rubber Company, 2001). Autre étude : Des rates Sprague-Dawley (25/groupe) inséminées ont été exposées par gavage à des doses de 0, 20, 70 et 200 mg/kg p.c. de BENPAT par jour pendant 10 jours (jours de gestation 6 à 15). DMEO par voie orale concernant la toxicité pour le développement = 200 mg/kg p. c., d’après l’augmentation du poids corporel des fœtus. Le taux de grossesse, la taille des portées, le nombre de fœtus vivants, l’implantation dans l’utérus ni aucun des autres paramètres ayant trait à la gestation n’a été touché par l’exposition à la substance chimique. DMEO par voie orale concernant la toxicité systémique = 200 mg/kg p. c., d’après la baisse du poids corporel de la mère et de la consommation d’aliments à la dose la plus élevée uniquement. Pour cette étude, la DSEO était de 70 mg/kg p.c. DSEO par voie orale (effets tératogènes) = ≥ 200 mg/kg p.c. par jour, d’après l’absence d’anomalies (malformations ou variations) liées à l’exposition dans le cadre de cette étude (BESC, 2003). BENPATAX (analogue, n° CAS 68953-83-3) Des rats Sprague-Dawley (25/groupe) ont été exposés par gavage à des doses de 0, 20, 70 et 200 mg/kg p.c. par jour pendant 10 jours (1 seul groupe à la dose élevée) ou 14 jours (3 groupes) au cours de la gestation. DMENO par voie orale concernant la toxicité pour le développement = 70 mg/kg p.c. par jour d’après la réduction du poids corporel des fœtus observée chez les groupes de rats F1 exposés aux doses moyenne et élevée. DMEO par voie orale concernant la toxicité systémique = 70 mg/kg p. c., d’après la baisse du poids corporel, du gain de poids corporel et de la consommation d’aliments chez des femelles F0. Une DSEO de 20 mg/kg p.c. pour la toxicité maternelle et pour le développement et une DSEO ≥ 200 mg/kg p.c. pour la toxicité tératogène ont été établies pour cette étude (Tyl, 1996). Aucune étude sur la toxicité pour le développement et la reproduction n’a été relevée pour le BENTAX (n° CAS 68478-45-5) |
| Génotoxicité et paramètres connexes : in vivo | Essai du micronoyau BENPAT (n° CAS 68953-84-4) Résultats négatifs : Dans la moelle osseuse de souris CD-1 ayant reçu des doses uniques de 0, 1 250 et 2 500 mg/kg p.c. par voie intrapéritonéale (Pharmakon, 1993a). Analyse des produits d’addition de l’ADN (postétiquetage P32) BENPAT (n° CAS 68953-84-4) Résultats négatifs : Dans les cellules du foie et de la vessie de rats Fischer 344/N TacfBR exposés par voie orale (gavage) à des doses de 0, 300, 1 000 et 3 000 mg/kg p.c. par jour pendant 7 jours (AHF, 1995) Mutation génique (test de mutation létale récessive associée au sexe chez la drosophile) BENPAT (n° CAS 68953-84-4) Résultats négatifs : Chez des Drosophila melanogaster exposées dans leur alimentation à des doses de 0,01 et 0,05 mg/mL pendant 24 heures (BESC, 2003; Goodyear Tire and Rubber Company, 1992a) Résultats négatifs : Chez des Drosophila melanogaster exposées dans leur alimentation à des doses de 0,05 et 0,63 mg/mL pendant 24 heures (BESC, 2003; Litton Bionetics, 1979; Goodyear Tire and Rubber Company, 1992a) BENTAX (n° CAS 68478-45-5) Résultats négatifs : Chez des Drosophila melanogaster sauvages et Muller-s (mutation de l’œil liée au gène bar sur le chromosome X) exposées par voie orale à des doses de 0,01, 0,001 et 0,0001 mg/mL pendant 16 heures (Goodyear Tire and Rubber Company, 1992c) |
| Génotoxicité et paramètres connexes : in vitro | Mutation génique BENPAT (n° CAS 68953-84-4) Résultats positifs : Chez des Salmonella typhimurium de souche TA98, TA 1537 et TA1538 avec activation métabolique Résultats négatifs : Chez des S. typhimurium de souche TA98 et TA1538 et des Escherichia coli WP2 sans activation métabolique; des S. typhimurium de souche TA100, TA1535, TA1537 et des Escherichia coli de souche WP2 uvrA avec et sans activation métabolique (BESC, 2003; Goodyear Tire and Rubber Company, 1992a) BENTAX (n° CAS 68478-45-5) Résultats positifs : Chez des Salmonella typhimurium de souche TA98, TA 1537 et TA1538 avec activation métabolique Résulats négatifs : Chez des Salmonella typhimurium de souche TA100 et TA1535 avec et sans activation métabolique (Goodyear Tire and Rubber Company, 1992c) Résultats positifs : Chez des Salmonella typhimurium de souche TA98, TA100, TA1535 et TA1538 avec activation métabolique (Goodyear Tire and Rubber Company, 1992d) BENPATAX (analogue, n° CAS 68953-83-3) Résultats positifs : Chez des Salmonella typhimurium de souche TA98, TA 1537 et TA1538 avec activation métabolique Résultats négatifs : Chez des Salmonella typhimurium de souche TA100 et TA1535 et des E. coli de souche WP2uvrA avec et sans activation métabolique (Stankowski, 1998) Aberration chromosomique (essai cytogénétique) BENPAT (n° CAS 68953-84-4) Résultats négatifs : Dans des cellules ovariennes de hamster chinois, avec ou sans activation métabolique (BESC, 2000, 2003). BENPATAX (analogue, n° CAS 68953-83-3) Résultats négatifs : Dans des cellules ovariennes de hamster chinois avec ou sans activation métabolique (SanSebastian, 1994). Dommages à l’ADN et réparation de l’ADN BENPAT (n° CAS 68953-84-4) Résultats positifs : Chez des Escherichia coli Pol A1 et des Escherichia coli Pol A1 de souche W 3110 (Pol A+) et p 3478 (Pol A-) sans activation métabolique (BESC, 2003; Goodyear Tire and Rubber Company, 1992a) BENTAX (n° CAS 68478-45-5) Résultats positifs : Chez des Escherichia coli (Pol A1- ) sans activation métabolique (Goodyear Tire and Rubber Company, 1992c,d) Essai de transformation in vitro BENPAT (n° CAS 68953-84-4) Résultats négatifs : Dans des cellules de souris Balb/3T3 sans activation métabolique (BESC, 2003; Goodyear Tire and Rubber Company, 1992a) Essais sur la synthèse de l’ADN non programmée BENPAT (n° CAS 68953-84-4) Résultats négatifs : Sur des hépatocytes de rat sans activation métabolique (hépatocytes capables d’activation métabolique) (AHF, 1999). BENPATAX (analogue, n° CAS 68953-83-3) Résultats négatifs : Sur des hépatocytes de rat sans activation métabolique (Jeffrey, 1999). |
| Irritation/ sensibilisation | Irritation cutanée BENPAT (n° CAS 68953-84-4) Aucune irritation n’a été observée chez des rats exposés au BENPAT pendant 4 heures et des lapins albinos exposés à des solutions de 20 % de BENPAT en suspension (WARF, 1959). Dans le cadre d’un test de Draize, une légère irritation (faible rougeur) a été relevée sur la zone testée chez des lapins albinos exposés à une dose de 500 mg de BENPAT pendant une durée pouvant atteindre 72 heures (WARF, 1959). BENPATAX (analogue, n° CAS 68953-83-3) Une légère irritation de la peau a été constatée chez des lapins néo-zélandais blancs exposés au BENPATAX pendant 4 heures (la période d’observation a duré jusqu’à 10 jours). Les observations supplémentaires comprenaient une desquamation et des taches brunes sur la zone testée (Merriman, 1995c). Dans le cadre d’un test de Draize, une irritation légère à modérée a été signalée chez des lapins néo-zélandais blancs (5/sexe) après qu’ils ont été exposés au BENPATAX à une dose de 2 000 mg/kg répartie sur 10 % de la surface du corps pendant 24 heures (la période d’observation a duré jusqu’à 14 jours) (Merriman, 1995b). Aucune étude sur l’irritation de la peau n’a été recensée pour le BENTAX (n° CAS 68478-45-5) Irritation oculaire BENPAT (n° CAS 68953-84-4) Aucune irritation oculaire n’a été signalée chez le lapin après 24 heures (aucune précision fournie, Bayer, 1991). Une irritation légère et réversible a été constatée chez des lapins (test de Draize) exposés à des doses de 0,06 g (0,1 mL) de BENPAT pour une durée pouvant atteindre 72 heures. La substance d’essai est jugée « légèrement irritante » pour les yeux (Springborn Laboratories, 1995b). Aucune étude sur l’irritation oculaire n’a été recensée pour le BENTAX (n° CAS 68478-45-5) et le BENPATAX (analogue, n° CAS 68953-83-3) Sensibilisation BENPAT (n° CAS 68953-84-4) Dans le cadre d’un test de maximalisation, des cochons d’Inde albinos ont été exposés à deux reprises (la deuxième fois 7 jours plus tard) à des doses de 25 % et de 100 % de BENPAT après induction intracutanée de 5 et 100 % de BENPAT. De faibles réactions cutanées (érythèmes et œdèmes) ont été observées. La substance d’essai est considérée comme un allergène de contact (Springborn Laboratories, 1995c). BENPATAX (analogue, n° CAS 68953-83-3) Dans le cadre d’un test de maximalisation chez des cochons d’Inde, de faibles réactions cutanées (érythèmes et œdèmes) ont été constatées lorsque les animaux de laboratoire étaient exposés à des doses de 40 % de BENPATAX après induction intracutanée de 5 et 100 % de la substance active. Le BENPATAX était un allergène pour la peau des cochons d’Inde (Merriman, 1995d). Aucune étude sur la sensibilisation n’a été recensée pour le BENTAX (n° CAS 68478-45-5) |
Études sur les humains - génotoxicité in vitro (mélanges de diaryl-p-phénylènedia-mines) |
Une étude sur la mutagénicité dans les voies urinaires pour analyser les expositions professionnelles dans l’industrie du caoutchouc comprenant 72 ouvriers (44 fumeurs) employés dans une usine de pneus a permis de démontrer que le tabagisme, mais pas la profession, était fortement lié à l’apparition d’une activité mutagène positive dans les voies urinaires chez des Salmonella typhimurium de souche TA98. Un effet synergique possible entre la profession et le tabagisme a été observé chez les ouvriers qui fabriquaient des pneus et qui étaient également fumeurs. L’analyse des matières premières a montré que les mélanges de diaryl-p-phénylènediamines étaient faiblement actifs en tant que mutagènes dans la souche TA98 en présence d’une activation métabolique (Crebelli et al., 1985). |
| Scénario d’exposition | Concentration ou absorption | Dose avec effet critique | Effet critique | Marge d’exposition |
|---|---|---|---|---|
| Absorption journalière estimée provenant du milieu environnemental[1] | de 0,06 à 0,67 µg/kg p.c. par jour (BENPAT) | 2,7 mg/kg p.c. par jour | Concentration d’exposition à long terme par voie orale et à doses répétées (DMENO) pour assister à une augmentation de l’hyperplasie et de la prolifération des cellules urothéliales relevée à toutes les doses testées chez des rats des deux sexes exposés au BENPAT (n° CAS 68953-84-4) dans le cadre d’une étude de 52 semaines (AHF, 1996b; Iatropoulos et al., 1997). |
4 285 – 45 000 |
| 6 mg/kg p.c. par jour | Concentration d’exposition par voie orale et à doses répétées (DMENO) pour assister à l’apparition de lésions polykystiques dans les reins liées au traitement observées à toutes les doses chez des parents F1 et des rats sevrés F1 et F2, et d’un allongement de la gestation chez les mères F1, dans le cadre d’une étude portant sur deux générations de rats exposés au BENPAT (n° CAS 68953-84-4) (Goodyear Tire and Rubber Company, 2001). | 9 520 – 100 000 | ||
| 20 mg/kg p.c. par jour | Concentration d’exposition à long terme par voie orale et à doses répétées (DMENO) pour assister à l’apparition d’une anémie macrocytaire liée au traitement dans le cadre d’une étude de 52 semaines avec du BENPATAX (n° CAS 68953-84-4) (Iatropoulos et al., 2000). | 31 745 – 333 300 |
Notes de bas de page
[2] La détermination de la conformité à l’un ou à plusieurs des critères énoncés à l’article 64 repose sur une évaluation des risques pour l’environnement et/ou la santé humaine associés aux expositions dans l’environnement en général. Pour les humains, ceci comprend, sans toutefois s’y limiter, les expositions par l’air ambiant et intérieur, l’eau potable, les produits alimentaires et l’utilisation de produits de consommation. Une conclusion établie en vertu de la LCPE (1999) portant sur les substances des lots 1 à 12 du Défi, énumérées dans le Plan de gestion des produits chimiques, n’est pas pertinente, ni ne prévient une évaluation en fonction des critères de danger définis dans le Règlement sur les produits contrôlés, qui fait partie du cadre réglementaire applicable au Système d’information sur les matières dangereuses au travail pour les produits destinés à être utilisés au travail. De manière similaire, une conclusion fondée sur les critères définis à l’article 64 de la LCPE (1999) n’empêche pas d’intervenir en vertu d’autres articles de cette loi ou d’autres lois.
[3] Dans les documents publiés dans la Partie I de la Gazette du Canada le 2 octobre 2010 et rendus publics sur le site Web portant sur les substances chimiques (Substances chimiques du onzième lot du Défi), le nom donné à la substance portant le no CAS 68953-84-3, soit « benzène-1,4-diamine, dérivés mixtes de N,N'-(phényle, tolyle et xylyle) », était erroné.
[4] Vu les valeurs de log Koe pour les structures représentatives 1 à 3 du BENPAT et les structures représentatives 3 à 5 du BENTAX, l’élimination par la métabolisation pourrait être moins importante que l’élimination par les branchies, comme le laisse supposer le modèle du bilan massique. Cependant, comme cela n’est pas certain, une kM de 0,094 jour-1 a été utilisée pour les autres prévisions par modélisation.
[5] Les calculs sont fondés sur les données suivantes :
- CE50 sur 48 heures = 1,5 g caoutchouc /L pour D.magna lorsque les organismes ont été exposés au lessivat dans l’eau obtenu en immergeant des échantillons de caoutchouc composés à 1,9 % de BENPAT dans l’eau pendant 72 heures (Wik, 2007).
- CE50 sur 48 heures = 1,8 mg/L pour les D. magna exposées au BENPAT (voir le tableau 7; Présentation de projet, 2010b; IUCLID Data Set, 2003).
- Par conséquent, on suppose que la concentration de BENPAT dans l’eau est, dans l’étude de Wik (2007), de 1,8 mg/L. Ainsi, 1,5 g/L × 1,9 % = 0,0285g/L de BENPAT, et 1,8 mg/L/28,5 mg/L = 6,3 %
- Dans ce calcul, on suppose que la toxicité pour D. magna observée dans Wik (2007) est attribuable au BENPAT.