Évaluation préalable pour le Défi concernant
Archivée
l’acrylate d’éthyle
Numéro de registre du Chemical Abstracts Service :
140-88-5
Environnement Canada
Santé Canada
Septembre 2011
Table des matières
- Sommaire
- Introduction
- Identité de la substance
- Propriétés physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe 1 : Limite supérieure estimée de l'exposition de la population générale au Canada à l'acrylate d'éthyle à partir des milieux naturels
- Annexe 2 : Limite supérieure estimée de l'exposition à l'acrylate d'éthyle à partir des produits de consommation
- Annexe 3 : Résumé des données relatives aux effets de l'acrylate d'éthyle sur la santé
- Annexe 4 : Sommaire de rigueur d'études : toxicité pour les organismes aquatiques
Conformément à l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)], les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable de l’acrylate d’éthyle dont le numéro de registre du Chemical Abstracts Service[1] est 140-88-5. Une priorité élevée a été accordée à la prise de mesures à l’égard de la substance d’acrylate d’éthyle lors de la catégorisation visant la Liste intérieure des substances dans le cadre du Défi. On a déterminé que l’acrylate d’éthyle constitue une substance d’importance prioritaire parce qu’il a été considéré comme présentant le plus fort risque d’exposition (PFRE) à la population canadienne et qu’il a été inscrit sur une liste de produits cancérigènes par d’autres organismes. La substance n’a pas satisfait aux critères de catégorisation écologique relatifs à la persistance, au potentiel de bioaccumulation ou à la toxicité intrinsèque pour les organismes aquatiques.
Selon les renseignements soumis en application de l’article 71 de la LCPE (1999), aucune entreprise du Canada n’a fabriqué d’acrylate d’éthyle au cours de l’année civile 2006 en quantité supérieure au seuil de déclaration de 100 kg. On a toutefois signalé que 1 000 000 à 10 000 000 kg d’acrylate d’éthyle ont été importés en 2006. L’acrylate d’éthyle est principalement utilisé dans la fabrication de polymères et de copolymères. Même si des rejets d’acrylate d’éthyle provenant de ces sources se produisent dans l’environnement, on ne s’attend pas à ce que la population canadienne en général soit exposée à un degré appréciable à l’acrylate d’éthyle.
Comme l’acrylate d’éthyle a été classé par les organismes de réglementation internationaux sur la base de sa cancérogénicité, la présente évaluation préalable a porté principalement sur cette capacité de la substance. On a observé la formation de tumeurs du secteur gastrique antérieur chez des rats et des souris auxquels on avait administré de l’acrylate d’éthyle par gavage oral pendant deux ans. On n’a toutefois pas observé de formation de tumeurs lorsque l’administration de la substance s’est faite par d’autres voies telles que l’absorption d’eau potable par la bouche, l’inhalation et le contact cutané. L’ensemble de preuves issu des études de génotoxicité laisse entendre que l’acrylate d’éthyle n’est pas susceptible d’être mutagène, mais qu’il pourrait manifester des effets clastogènes in vitro. Bien que le mode de formation des tumeurs n’ait pas été entièrement élucidé, on a laissé entendre que l’hyperplasie prolongée du secteur gastrique antérieur pourrait constituer un facteur précurseur. En conséquence, on a utilisé une approche fondée sur le seuil d’innocuité pour caractériser le risque de la substance pour la santé humaine.
Les marges entre l’estimation de la limite supérieure d’exposition à l’acrylate d’éthyle dans les milieux naturels, les aliments ou l’utilisation de produits de consommation et les niveaux associés aux effets sur les animaux de laboratoire sont considérées comme adéquates pour tenir compte des incertitudes dans les bases de données concernant les effets sur la santé et l’exposition.
À la lumière des renseignements présentés dans le présent document, il est conclu que l’acrylate d’éthyle ne pénètre pas dans l’environnement en quantité, à des concentrations ou dans des conditions qui constituent ou peuvent constituer un risque pour la vie ou la santé humaines.
D’après les données empiriques disponibles, lesquelles proviennent de modèles, l’acrylate d’éthyle ne devrait pas être persistant, ni se bioaccumuler dans l’environnement. Cette substance ne répond donc pas aux critères de persistance ou de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation. En outre, les données empiriques disponibles indiquent que cette substance présente un risque modéré à élevé de se révéler toxique pour les organismes aquatiques. Après comparaison de la concentration estimée sans effet toxique et de la concentration estimée raisonnable de la pire exposition dans l’environnement, on estime peu probable que l’acrylate d’éthyle ait des effets écologiques nocifs au Canada.
Selon les renseignements disponibles, on conclut que l’acrylate d’éthyle ne pénètre pas dans l’environnement en une quantité, à une concentration ou dans des conditions ayant ou pouvant avoir un effet nocif immédiat ou à long terme sur l’environnement ou sur sa diversité biologique, ou qui constitue ou peut constituer un danger pour l’environnement essentiel pour la vie.
D’après les renseignements disponibles, il est conclu que l’acrylate d’éthyle ne satisfait à aucun des critères de l’article 64 de la Loi canadienne sur la protection de l’environnement (1999).
L’inclusion de cette substance sera considérée dans la prochaine mise à jour de l’inventaire de la Liste intérieure. De plus, des activités de recherche et de surveillance viendront, le cas échéant, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable.
La Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)] (Canada, 1999) exige que les ministres de l’Environnement et de la Santé procèdent à une évaluation préalable des substances qui répondent aux critères de catégorisation énoncés dans la Loi, afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l’environnement ou la santé humaine.
En se fondant sur l’information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu’une attention prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères environnementaux de catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque pour les organismes aquatiques (Ti), et que l’on croit être commercialisées au Canada;
- celles qui répondent aux critères de catégorisation pour le plus fort risque d’exposition (PFRE) ou qui présentent un risque d’exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine, compte tenu des classifications établies par d’autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont donc publié un avis d’intention dans la Partie I de la Gazette du Canada(Canada, 2006) dans lequel ils priaient l’industrie et les autres parties intéressées de fournir, selon un calendrier déterminé, des renseignements précis qui pourraient servir à étayer l’évaluation des risques, ainsi qu’à élaborer et à évaluer les meilleures pratiques de gestion des risques et de bonne gestion des produits pour ces substances jugées hautement prioritaires.
On a jugé que l’acrylate d’éthyle est une substance dont l’évaluation des risques pour la santé humaine est hautement prioritaire, car on considère qu’elle présente le risque d’exposition le plus fort et elle a été classée par d’autres organismes en fonction de sa cancérogénicité. Le volet du Défi portant sur cette substance a été publié dans la Gazette du Canada le 26 septembre 2009 (Canada, 2009). En même temps a été publié le profil de cette substance qui présentait l’information technique (obtenue avant décembre 2005) sur laquelle a reposé sa catégorisation.Des renseignements sur les utilisations de la substance ont été reçus en réponse au Défi.
Même s’il a été jugé hautement prioritaire d’évaluer les risques que présente l’acrylate d’éthyle pour la santé humaine, cette substance ne répond pas aux critères de catégorisation applicables à la persistance et à la bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation, ni aux critères de toxicité pour les organismes aquatiques.
Les évaluations préalables effectuées aux termes de la LCPE (1999) mettent l’accent sur les renseignements jugés essentiels pour déterminer si une substance répond aux critères de toxicité des substances chimiques au sens de l’article 64 de laLoi. Les évaluations préalables visent à examiner des renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence[2].
La présente évaluation préalable prend en considération les renseignements sur les propriétés chimiques, les dangers, les utilisations et l’exposition, y compris l’information supplémentaire fournie dans le cadre du Défi. Les données pertinentes pour l’évaluation préalable de l’acrylate d’éthyle sont tirées de publications originales, de rapports de synthèse et d’évaluation, de rapports de recherche de parties intéressées et d’autres documents consultés au cours de recherches documentaires menées récemment jusqu’en avril 2010 (sections du document concernant les aspects humains et écologiques).Les études les plus importantes ont fait l’objet d’une évaluation critique; il est possible que les résultats de modélisation aient servi à formuler des conclusions.
L’évaluation des risques pour la santé humaine suppose la prise en compte des données utiles à l’évaluation de l’exposition (non professionnelle) de la population dans son ensemble, ainsi que de l’information sur les dangers pour la santé (principalement d’après les évaluations s’appuyant sur la méthode du poids de la preuve effectuées par d’autres organismes, lesquelles ont servi à déterminer le caractère prioritaire de la substance). Dans le contexte d’une évaluation préalable, les décisions concernant la santé humaine reposent sur la nature de l’effet critique retenu ou sur l’écart entre les valeurs prudentes donnant lieu à des effets et les estimations de l’exposition, compte tenu de la confiance accordée au caractère exhaustif des bases de données sur l’exposition et les effets.L’évaluation préalable ne constitue pas un examen exhaustif ou critique de toutes les données disponibles.Il s’agit plutôt d’un sommaire des renseignements essentiels qui appuient la conclusion.
La présente évaluation préalable a été préparée par le personnel du Programme des substances existantes de Santé Canada et d’Environnement Canada et elle intègre les résultats d’autres programmes exécutés par ces ministères.
Les parties de la présente évaluation préalable qui portent sur la santé humaine et l’écologie ont fait l’objet d’une étude rédigée par des pairs ou d’une consultation de ces derniers. Des commentaires sur les parties techniques concernant la santé humaine ont été fournis par des experts scientifiques désignés et dirigés par la Toxicology Excellence for Risk Assessment (TERA), notamment M. Bernard Gadagbui. (TERA), M. Michael Jayjock (The LifeLine Group) et M. Chris Bevans (CJB Consulting).
En outre, le public a eu 60 jours pour formuler des commentaires sur l’ébauche de la présente évaluation préalable. Même si les commentaires venant de l’extérieur ont été pris en considération, Santé Canada et Environnement Canada sont seuls responsables du contenu final et des résultats de l’évaluation préalable. Les approches suivies pour les évaluations préalables dans le cadre du Défi ont été examinées par un groupe indépendant, soit le Groupe consultatif du Défi.
Les principales données et considérations sur lesquelles repose la présente évaluation sont résumées ci-après.
Aux fins du présent document, la substance est désignée sous le nom d’« acrylate d’éthyle », son appellation la plus courante.
Tableau 1. Identité de la substance - acrylate d’éthyle
| Numéro de registre du Chemical Abstracts Service (n° CAS) | 140-88-5 |
| Nom dans la LIS | Acrylate d’éthyle |
| Noms relevés dans les National Chemical Inventories (NCI)[1] | Ethyl acrylate (ENCS) Acrylate d’éthyle (EINECS) 2-Propenoic acid, ethyl ester (TSCA, AICS, SWISS, PICCS, ASIA-PAC, NZIoC) 2-propenoic acid, ethyl ester (ECL) Acrylic acid, ethyl ester (PICCS) Acrylate, ethyl (PICCS) |
| Autres noms | Ethyl 2-propenoate; Acrylic acid ethyl ester; Ethyl 2propenoate; Ethyl acrylic ester; Ethyl propenoate; NSC 8263; UN 1917 |
Groupe chimique (groupe de la LIS) |
Produits chimiques organiques définis |
| Principale classe chimique ou utilisation | Esters |
| Principale sous-classe chimique | Acrylates |
| Formule chimique | C5H8O2 |
| Structure chimique |  |
| SMILES[2] | O=C(OCC)C=C |
| Masse moléculaire | 100,116 g/mol |
[2] Simplified Molecular Input Line Entry Specification
Le tableau 2 présente les propriétés physiques et chimiques (données expérimentales et modélisées) de l’acrylate d’éthyle qui se rapportent à son devenir dans l’environnement.
Les modèles fondés sur les relations quantitatives structure-activité (RQSA) ont été utilisés pour générer des données pour certaines des propriétés physiques et chimiques de l’acrylate d’éthyle.
Tableau 2. Propriétés physiques et chimiques de l’acrylate d’éthyle
| Propriété | Type | Valeur[1] | Température (°C) | Référence |
|---|---|---|---|---|
| Point de fusion (ºC) |
Expérimental | -72[2] | BASF AG, 2000 | |
| Modélisé | -70,73 | MPBPWIN, 2008 | ||
| Point d’ébullition (ºC) |
Expérimental | 100 | BASF AG, 2000 | |
| Expérimental | 99,4[2] | O’Neil et al., 2001 | ||
| Modélisé | 100,51 | MPBPWIN, 2008 | ||
| Densité (kg/m3) |
Expérimental | 922 (0,922 g/cm3) |
20 | BASF AG, 2000 |
| Pression de vapeur (Pa) |
Expérimental | 3 800 | 20 | BASF AG, 2000 |
| Expérimental | 3 900 (29,3 mm Hg) |
20 | PISSC, 2004 | |
| 3 800[2] (28,5 mm Hg) |
CEDRE, 2006 | |||
| 5 147 (38,6 mm Hg) |
25 | Daubert et Danner, 1989 | ||
| Modélisé | 5 120 (38,6 mm Hg) |
20 | MPBPWIN, 2008 | |
| Constante de la loi de Henry (Pa·m3/mol) |
Expérimental | 25,3[2] | BASF AG, 2000 | |
| Calculé | 25,3 | 20 | ECETOC, 1994 | |
| Modélisé | 6,37 (6,29 × 10-5 •m3/mol) |
25 | HENRYWIN, 2008 (méthode d’estimation de groupe) | |
| 12,46 (1,23 × 10-4 atm•m3/mol) |
25 | HENRYWIN, 2008 (méthode d’estimation des liaisons) | ||
| Log Koe (coefficient de partage octanoleau) (sans dimension) |
Expérimental | 1,18[2] | 25 | BASF AG, 2000 |
| Modélisé | 1,22 | 25 | KOWWIN, 2008 | |
| Log Kco (coefficient de partage carbone organique-eau) (sans dimension) |
Expérimental | 1.34 | IUCLID, 2000 | |
| Modélisé | 1,07 | PCKOCWIN, 2008 | ||
| Log Koa (coefficient de partage carbone organique-air) |
Modélisé | 3,5 | KOAWIN, 2008 | |
| Solubilité dans l’eau (mg/L) |
Expérimental | 15 000[2] | 25 | BASF AG, 2000 |
| 20 000 | Tyler et Smock, 1993 | |||
| 20 000 | 20 | O’Neil et al., 2001 | ||
| 15 000 | Riddick et al., 1986 | |||
| Modélisé | 17 630 éthode Koe) |
25 | WSKOWWIN, 2008 | |
| pKa (constante de dissociation) (sans dimension) |
Modélisé | Ne s’ionise pas dans l’eau | zzACD/pKaDB, 2005 |
[1] Les valeurs entre parenthèses représentent les valeurs originales signalées par les auteurs ou estimées à l’aide des modèles.
[2] Valeur utilisée pour la modélisation.
L’acrylate d’éthyle se trouve naturellement dans les mûres, les framboises, les ananas, le fruit de la passion jaune et le durian (NTP, 1998; Burdock, 1997).
En plus des expositions naturelles, l’exposition humaine à l’acrylate d’éthyle au Canada peut découler de rejets provenant de sources ponctuelles associées à des installations industrielles de traitement par exemple, ainsi que de sources non ponctuelles telles que les aliments, l’emballage de produits alimentaires rejetant de l’acrylate d’éthyle résiduel et les produits commerciaux ou industriels présents sur le marché canadien, notamment par dégagement de gaz ou par migration.
D’après les renseignements recueillis dans le cadre d’une enquête effectuée en application de l’article 71 de la LCPE (1999), entre 1 000 000 et 10 000 000 kg d’acrylate d’éthyle ont été importés au Canada en 2006. Aucune fabrication n’a été signalée au Canada (Environnement Canada, 2010a).
Des données antérieures provenant de la Liste intérieure des substances (LIS) (19841986) ont montré que la quantité totale d’acrylate d’éthyle déclarée comme ayant été importée, fabriquée ou commercialisée au Canada au cours de l’année civile 1986 s’élevait à 12 100 000 kg (Environnement Canada, 1988).À l’extérieur du Canada, l’acrylate d’éthyle a été reconnu par l’Organisation de coopération et de développement économiques (OCDE) comme une substance chimique à haut volume de production, ce volume étant estimé à 50 000 à 100 000 tonnes par an en Europe et à 250 000 à 500 000 tonnes par an en Amérique du Nord (OCDE, 2005).
Procédé de production industrielle de l’acrylate d’éthyle : La majeure partie de l’acrylate d’éthyle est préparée commercialement par l’estérification catalysée d’acide acrylique et d’éthanol (McLaughlin et al., 1993). L’acrylate d’éthyle se polymérise facilement sous l’influence de la chaleur, de la lumière ou des peroxydes (O’Neil, 2006). Pour empêcher la polymérisation prématurée de la substance, l’acrylate d’éthyle est habituellement inhibé à l’aide de 10 à 20 ppm d’éther monométhylique de l’hydroquinone (OCDE, 2005). Pour que l’inhibiteur soit efficace, une certaine quantité d’oxygène dissous doit être présente dans le liquide (OCDE, 2005). Le monomère d’acrylate d’éthyle pur peut être entreposé à une température inférieure à 10 °C sans subir de polymérisation (O’Neil, 2006).
Pendant la fabrication et le transport, l’acrylate d’éthyle est principalement utilisé dans des systèmes fermés en raison de sa volatilité et de son inflammabilité (McLaughlinet al., 1993). Cette substance dégage une odeur désagréable et irritante et présente un faible seuil de détection (0,0012 ppm) (Amoore, 1983). Les concentrations dans l’air supérieures à 0,05 ppm seraient intolérables pour la plupart des personnes (McLaughlin et al., 1993).
Au Canada, l’acrylate d’éthyle entre dans la synthèse des polymères et des copolymères aux fins d’utilisation dans les formulations de produits industriels et de produits de consommation. Il n’existe pas de produit de consommation finale directement issu de l’acrylate d’éthyle, mais on peut trouver de l’acrylate d’éthyle dans des produits comme résidu issu du processus de polymérisation. L’acrylate d’éthyle apporte de la souplesse aux films résistants (O’Neil, 2006).
Les polymères en émulsion (à base d’eau) issus de l’acrylate d’éthyle sont utilisés dans les peintures au latex, les revêtements, les produits de calfeutrage et les produits de construction; dans les liants de pigments et les vernis employés pour les encres de gravure; dans les couches de base servant au traitement du cuir naturel ainsi que dans les adhésifs (McLaughlin et al., 1993). Les polymères en émulsion faisant intervenir l’acrylate d’éthyle sont utilisés dans les encaustiques pour planchers, les scellants, de même que dans les procédés de traitement des textiles tels que la liaison des fibres de rembourrage et des textiles non tissés, le laminage, le flocage, l’enduction d’envers et le finissage des tissus (McLaughlin et al., 1993). Parmi les polymères (à base de solvant) issus de l’acrylate d’éthyle figurent les laques, les peintures-émail et les améliorants de l’indice de viscosité des huiles (McLaughlin et al., 1993). Les polymères solides incluent les feuilles de plastique acrylique et les modificateurs de la résistance des matières plastiques aux chocs (McLaughlin et al., 1993).
Selon les renseignements fournis en application de l’article 71 de la LCPE (1999) et les réponses apportées au questionnaire dans le cadre du Défi, 1 000 000 à 10 000 000 kg d’acrylate d’éthyle ont été utilisés au Canada en 2006 (Environnement Canada, 2010a). La totalité de l’acrylate d’éthyle utilisé ne reste pas nécessairement au Canada, car une partie est exportée dans des produits finis (Environnement Canada, 2010b).
L’acrylate d’éthyle ne figure pas parmi les additifs alimentaires approuvés dans le Règlement sur les aliments et drogues (Canada, 1978), mais il est peut-être utilisé comme aromatisant dans des aliments vendus au Canada. Les aromatisants alimentaires ne font pas partie des additifs alimentaires visés par le Règlement. La Flavor and Extract Manufacturers Association (FEMA) des États-Unis a signalé une tendance à la baisse de la quantité d’acrylate d’éthyle utilisée comme aromatisant pour aliments aux États-Unis, soit au total 11 livres (4,98 kg) en 1995 (Lucas et al., 1999) et 3 livres (1,36 kg) en 2005 (Gavin et al., 2008).
L’acrylate d’éthyle est aussi utilisé dans les matériaux d’emballage d’aliments à titre de monomère de départ servant à la fabrication de polymères et de copolymères acryliques (courriels adressés en 2010 par la Direction des aliments de Santé Canada au Bureau de gestion du risque de Santé Canada; source non citée). Dans la Base de données sur les ingrédients des produits de santé naturels, l’acrylate d’éthyle est présenté comme un ingrédient non médicinal acceptable pouvant servir de renforçateur de goût dans les produits de santé naturels (BDIPSN, 2010). Comme l’acrylate d’éthyle se trouve dans la Base de données des produits de santé naturels homologués, il fait actuellement partie des produits de santé naturels homologués (BDPSNH, 2010).
Au Canada, l’acrylate d’éthyle n’est pas inscrit dans la Base de données sur les produits pharmaceutiques (BDPP) ni dans la Base de données interne sur les ingrédients non médicinaux de la Direction des produits thérapeutiques à titre d’ingrédient médicinal ou non médicinal présent dans des produits pharmaceutiques ou des médicaments vétérinaires (BDPP, 2010; courriels adressés en 2010 par la Direction des produits thérapeutiques de Santé Canada au Bureau de gestion du risque de Santé Canada, source non citée).
Selon les renseignements recueillis dans le cadre d’un sondage exécuté en application de l’article 71 de la LCPE (1999), 306 kg d’acrylate d’éthyle ont été rejetés dans l’air et 1 954 kg ont été transportés dans des installations de gestion des déchets hors site au Canada en 2006 (Environnement Canada, 2010a). Aucun rejet dans l’eau ou le sol n’a été déclaré (Environnement Canada, 2010a). Selon les déclarations faites dans le cadre de l’Inventaire national des rejets de polluants (INRP), 476 kg d’acrylate d’éthyle ont été rejetés en 2006 dans l’environnement par des sources ponctuelles situées en Ontario et au Québec; 72 kg au total ont été rejetés dans l’air ambiant et 3 kg ont été déposés dans des installations extérieures de gestion des déchets (INRP, 2008). Le sort réservé aux 401 kg restants n’a toutefois pas été spécifié (air, eau, sol). En 2008, les rejets déclarés à l’INRP avaient baissé à 133 kg rejetés dans l’air et à 8 kg déposés dans des installations extérieures de gestion des déchets (INRP, 2008). Selon le Toxic Release Inventory (TRI), au total 31 000 kg d’acrylate d’éthyle ont été rejetés aux États-Unis (TRI, 2008).
Selon les rejets déclarés à l’INRP, la plupart des rejets d’acrylate d’éthyle dans l’environnement s’effectuent dans l’air ambiant (Environnement Canada, 2008). Il se peut toutefois que les déclarations à l’INRP soient incomplètes et n’incluent pas certains rejets industriels dans l’eau. La présente évaluation suppose certains rejets d’acrylate d’éthyle dans les eaux de surface lorsqu’elle estime les concentrations environnementales estimées dans l’eau.
Tableau 3. Données de l’INRP sur l’acrylate d’éthyle (Environnement Canada, 2008)
| Année | Rejets sur place (tonnes) |
Élimination (tonnes) |
||||
|---|---|---|---|---|---|---|
| Air | Eau | Sol | Total | Sur place | Hors site | |
| 2008 | 0,133 | 0,133 | 0,008 | |||
| 2007 | 0,555 | 0,555 | 0,006 | |||
| 2006 | 0,072 | 0,476[1] | 0,003 | |||
| 2005 | 0,059 | 0,115[2] | 0,024 | |||
| 2004 | 0,044 | 0,116[3] | ||||
| 2003 | 0,015 | 0,114[4] | ||||
| 2002 | 0,048 | 0,156[5] | 0,004 | |||
| 2001 | 1,5 | 1,7[6] | 9,2 | |||
| 2000 | 1,8 | 1,9[7] | 15 | |||
| 1999 | 0,322 | |||||
[2] Un rejet total de 0,056 tonne a été déclaré, sans toutefois préciser dans quels milieux.
[3] Un rejet total de 0,073 tonne a été déclaré, sans toutefois préciser dans quels milieux.
[4] Un rejet total de 0,099 tonne a été déclaré, sans toutefois préciser dans quels milieux.
[5] Un rejet total de 0,108 tonne a été déclaré, sans toutefois préciser dans quels milieux.
[6] Un rejet total de 0,21 tonne a été déclaré, sans toutefois préciser dans quels milieux.
[7] Un rejet total de 0,128 tonne a été déclaré, sans toutefois préciser dans quels milieux.
D’après les propriétés physiques et chimiques de l’acrylate d’éthyle (tableau 2), les résultats de la modélisation de la fugacité de niveau III (tableau 4) semblent indiquer que cette substance demeure principalement dans l’air, l’eau et le sol, selon le milieu où elle est rejetée. Le programme de modélisation pKadB (ACD, 2005) indique que la substance ne s’ionise pas dans l’eau (absence de groupes ionisables).
Tableau 4. Résultats de la modélisation de la fugacité de niveau III (EQC, 2003)
| Substance rejetée dans : | Pourcentage de la substance se répartissant dans chaque milieu | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| l’air (100 %) | 93,8 | 5,6 | 0,7 | 0,0 |
| l’eau (100 %) | 1,8 | 97,9 | 0,0 | 0,2 |
| le sol (100 %) | 3,2 | 11,4 | 85,3 | 0,0 |
Lorsque la substance est rejetée dans l’air, des quantités élevées devraient s’y répartir (voir le tableau 4 ci-dessus). Si on se fonde sur la pression de vapeur expérimentale élevée de 3 900 Pa et sur la constante de la loi de Henry modérée à élevée de 25,3 Pa m3/mol, l’acrylate d’éthyle est considéré comme volatil. En conséquence, s’il est rejeté uniquement dans l’air, il tend à demeurer dans ce milieu même si une faible quantité se dépose aussi dans l’eau (~6 %, voir le tableau 4).
Si l’acrylate d’éthyle est rejeté dans l’eau, il tend à s’adsorber faiblement aux solides en suspension et aux sédiments en se fondant sur une faible valeur de 1,34 du log Kco. Si on se fonde sur la constante de la loi de Henry de ce composé et sur sa rapide dégradation dans l’eau qui limite son transport dans l’air, on peut s’attendre à ce que la volatilisation de l’acrylate d’éthyle à partir des plans d’eau joue un rôle peu important dans le devenir de cette substance. Même s’il peut arriver qu’une polymérisation de l’acrylate d’éthyle par le biais du rayonnement ultraviolet s’amorce dans le réseau hydrographique, celle-ci ne produira que des oligomères de faible masse moléculaire (< 4 unités) qui devraient se biodégrader. Par conséquent, si l’eau est un milieu récepteur, l’acrylate d’éthyle devrait surtout demeurer dans l’eau et, dans une très faible mesure, se répartir dans l’air (voir le tableau 4).
S’il est rejeté dans le sol, l’acrylate d’éthyle ne devrait pas présenter une forte adsorption au sol (c’est-à-dire qu’il devrait être mobile compte tenu de son faible log Kco. La volatilisation à partir des surfaces de sol humides semble un processus peu important dans le devenir de cette substance d’après sa constante de la loi de Henry.Sa pression de vapeur peut l’amener à se volatiliser légèrement à partir des surfaces de sol sèches. En cas de rejet de l’acrylate d’éthyle dans le sol, on s’attend donc à ce qu’il demeure en majeure partie dans ce milieu, même si une faible partie risque d’être transportée dans l’eau de surface par le ruissellement, de se diffuser dans les eaux souterraines et de se volatiliser dans l’air.
Persistance dans l’environnement
Le tableau 5a présente les données empiriques sur la biodégradation. Selon ces données, la demi-vie de l’acrylate d’éthyle dans l’air devrait être inférieure à deux jours et sa demivie dans l’eau, inférieure à 182 jours (6 mois); en conséquence la substance ne devrait pas se révéler persistante dans ces milieux.
Le tableau 5a présente des données empiriques sur la biodégradation tirées d’un essai de biodégradation immédiate (MITI, 1992) qui indiquent une biodégradation ultime de 52 % sur une période de 14 jours. Le résultat de cet essai laisse entendre que la demi-vie de l’acrylate d’éthyle dans l’eau serait d’environ 13 jours (en supposant une cinétique du premier ordre) - donc nettement inférieure à 182 jours (6 mois), ce qui indique que cette substance risque peu de persister dans ce milieu. Utilisant les méthodes de l’OCDE (méthode 301D) (OCDE, 1992), Staples et al. (2000) ont conclu à une dégradation de 57 % en 28 jours indiquant que l’acrylate d’éthyle est intrinsèquement biodégradable. Les auteurs ont aussi soumis la substance à l’essai de demande biochimique en oxygène de cinq jours (DBO5) et conclu que l’acrylate d’éthyle se dégrade facilement (77 %). La norme ISO (14593) identique à la méthode 310 de l’OCDE (OCDE, 2005; OCDE, 2003) a montré que l’acrylate d’éthyle est facilement biodégradable (80 à 90 % après 28 jours).
Tableau 5a. Données empiriques sur la dégradation de l’acrylate d’éthyle
| Milieu | Processus du devenir | Valeur de dégradation | Paramètre de dégradation | Référence |
|---|---|---|---|---|
| Air | Réaction avec l’ozone | 2,01 | Demi-vie, jours | Atkinson, 1989 |
| Air | Oxydation atmosphérique | 0,67 | Demi-vie, jours | Atkinson, 1989 |
| Eau | Hydrolyse | 1 277,5 | Demi-vie, jours (pH 7) |
Mabey et Mill, 1978 |
| Eau | Biodégradation | 52 | Biodégradation, % après 14 jours (DBO) | MITI, 1992 |
| Eau | Biodégradation | 92,6 à 100 | Biodégradation, % après 14 jours (analyse du composé d’origine) | MITI, 1992 |
| Eau | Biodégradation | 57 | Biodégradation, % après 28 jours | Staples et al., 2000 |
| Eau | Biodégradation | 80 à 90 | Biodégradation, % après 28 jours | OCDE, 2005 |
Bien que des données expérimentales sur la dégradation de l’acrylate d’éthyle soient disponibles, une méthode du poids de la preuve reposant sur des relations quantitatives structure-activité (RQSA) (Environnement Canada, 2007) a aussi été utilisée avec les modèles de dégradation présentés au tableau 5b ci-après. Compte tenu de l’importance écologique du milieu aquatique ainsi que du fait que la plupart des modèles disponibles s’appliquent à l’eau et que l’acrylate d’éthyle peut être libéré dans ce milieu, les études ont surtout porté sur la biodégradation dans l’eau.
Le tableau 5b résume les résultats des modèles prévisionnels RQSA disponibles sur la biodégradation dans l’eau et dans l’air.
Tableau 5b. Données modélisées sur la dégradation de l’acrylate d’éthyle
| Processus du devenir | Modèle et base du modèle |
Résultat et prévision du modèle | Demi-vie extrapolée (jours) |
|---|---|---|---|
| Air | |||
| Oxydation atmosphérique | AOPWIN, 2008[1] | t1/2 = 11,8 heures | ≤ 2 |
| Réaction avec l’ozone | AOPWIN, 2008[1] | t1/2 = 6,5 jours | ≥ 2 |
| Eau | |||
| Hydrolyse | HYDROWIN, 2008[1] | t1/2 = 9 ans (pH 7) t1/2 = 329 jours (pH 8) |
≥ 182 |
| Biodégradation primaire | |||
| Biodégradation (aérobie) | BIOWIN, 2008[1] Sous-modèle 4 : enquête d’expert (résultats qualitatifs) |
3,9[2] (se biodégrade rapidement) |
≤ 182 |
| Biodégradation ultime | |||
| Biodégradation (aérobie) | BIOWIN, 2008[1] Sous-modèle 3 : enquête d’expert (résultats qualitatifs) |
3,1[2] (se biodégrade rapidement) |
≤ 182 |
| Biodégradation (aérobie) | BIOWIN, 2008[1] Sous-modèle 5 : MITI, probabilité linéaire |
0,8[3] (se biodégrade rapidement) |
≤ 182 |
| Biodégradation (aérobie) | BIOWIN, 2008 Sous-modèle 6 : MITI, probabilité non linéaire MITI |
0,9[3] (se biodégrade rapidement) |
≤ 182 |
| Biodégradation (aérobie) | TOPKAT, 2004 Probabilité |
1,0[3] (se biodégrade très rapidement ) |
≤ 182 |
| Biodégradation (aérobie) | CATABOL, ©2004-2008 % DBO (demande biochimique en oxygène) |
% DBO = 52 (se biodégrade rapidement) |
≤ 182 |
[2] Le modèle ne fournit pas d’estimation pour ce type de structure.
[3] Le résultat s’exprime par une valeur numérique de 0 à 5.
[4] Le résultat s’exprime par un taux de probabilité.
Dans l’air, la valeur prévue de 11,8 heures pour la demi-vie liée à l’oxydation atmosphérique (voir le tableau 5b) démontre que l’acrylate d’éthyle est susceptible de s’oxyder rapidement.Il devrait réagir avec d’autres espèces comme l’O3 par photooxydation dans l’atmosphère, mais à un débit beaucoup plus lent. La demi-vie dans l’atmosphère résultant de la photolyse indirecte a de plus été estimée à 6,5 heures (OCDE, 2005). Des réactions avec des radicaux hydroxyles devraient donc constituer le plus important processus du devenir de l’acrylate d’éthyle dans l’atmosphère. Compte tenu de sa demi-vie de 0,67 jour (~ 16 heures; tableau 5a) fondée sur des données empiriques et de sa demi-vie estimée de 11,8 heures en raison des réactions avec des radicaux hydroxyles, l’acrylate d’éthyle est considéré comme non persistant dans l’air.
Dans l’eau, une demi-vie prévue de neuf ans par hydrolyse à pH 7 (voir le tableau 5b) démontre que ce produit chimique est susceptible d’être hydrolysé lentement. D’autres processus régissant son devenir dans l’eau doivent toutefois être pris en compte pour déterminer sa persistance dans ce milieu.
Les cinq modèles de biodégradation ultime laissent entendre que la biodégradation est rapide et que la demi-vie dans l’eau est nettement inférieure à 182 jours. Le résultat du sous-modèle 4 BIOWIN (programme de prédiction de biodégradation primaire) laisse penser que la substance possède une demi-vie primaire nettement inférieure à 182 jours, tandis que les sous-modèles de biodégradation ultime BIOWIN indiquent que la minéralisation complète se produirait dans un délai de 182 jours. De leur côté, les prévisions de CATABOL et TOPKAT se situent dans les domaines d’applicabilité des deux modèles. Elles sont donc considérées comme fiables et laissent supposer un taux rapide de biodégradation.
En utilisant un ratio d’extrapolation de 1:1:4 pour la demi-vie associée à la biodégradation dans l’eau, le sol et les sédiments (Boethling et al., 1995) et une demi-vie de biodégradation ultime inférieure à 90 jours dans l’eau, on obtient également une demivie inférieure à 90 jours dans le sol et une demi-vie inférieure ou égale à 365 jours dans les sédiments. L’acrylate d’éthyle ne devrait donc pas être persistant dans le sol et les sédiments.
D’après les données empiriques et modélisées (voir les tableaux 5a et 5b), l’acrylate d’éthyle ne répond pas aux critères de persistance dans l’air, l’eau, le sol ou les sédiments (demi-vie dans l’air égale ou supérieure à 2 jours, demi-vie dans le sol et l’eau égale ou supérieure à 182 jours, et demi-vie dans les sédiments égale ou supérieure à 365 jours) prévus dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Potentiel de bioaccumulation
Les valeurs expérimentales du log Koe de l’acrylate d’éthyle laissent entendre que cette substance chimique est peu bioaccumulable dans le biote (voir le tableau 2 ci-dessus). Bien que le log Koe soit axé principalement sur les critères relatifs au milieu aquatique et qu’il n’évalue pas les incidences possibles sur l’environnement et les organismes terrestres, les organismes terrestres ne seront pas exposés à cette substance chimique par voie alimentaire et le potentiel de bioamplification chez les animaux terrestres sera faible.
Tableau 6 : Données modélisées sur la bioaccumulation d’acrylate d’éthyle
| Organisme d’essai | Log Koe | Paramètre | Valeur en L/kg (poids humide) | Référence |
|---|---|---|---|---|
| Poisson | 1,18 | FBA | 1,59 | Gobas BAF T2MTL (Arnot et Gobas, 2003) |
| Poisson | 1,18 | FBC | 1,59 | Gobas BCF T2LTL (Arnot et Gobas, 2003) |
| Poisson | 1,22 | FBC | 0,91 | OASIS Forecast, 2005 |
| Poisson | 1,18 | FBC | 2,79 | BCFWIN, 2000 |
| Poisson | 1,33 | FBC | 6,0 | Tyler et Smock, 1993[1] |
Les preuves disponibles indiquent que l’acrylate d’éthyle devrait présenter un faible potentiel de bioaccumulation en raison de sa valeur expérimentale faible du log Koe. L’estimation modélisée des valeurs du facteur de bioconcentration (FBC) et du facteur de bioaccumulation (FBA) est largement inférieure à 5 000 (tableau 6). Un FBA et un FBC de 1,593 L/kg qui résultent de l’utilisation d’une constante de vitesse de métabolisation estimée afin de corriger la prévision de la bioaccumulation (Arnot et Gobas, 2003). Si l’on se fonde sur les valeurs obtenues par modélisation cinétique et les autres valeurs modélisées, l’acrylate d’éthyle ne répond pas au critère de bioaccumulation (FBC ou FBA ≥ 5 000) énoncé dans le Règlement sur la persistance et la bioaccumulation(Canada, 2000).
Comme il a été indiqué précédemment, l’acrylate d’éthyle ne répond pas aux critères de persistance et de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Évaluation des effets sur l’environnement
Une étude sur la toxicité chronique en milieu aquatique de l’acrylate d’éthyle chez Daphnia magna a conclu à une CMEO de 0,45 mg/L et à une CE50de 0,5 mg/L (tableau 7a). On estime que ces valeurs indiquent un potentiel de toxicité chronique modérée à élevée pour les organismes aquatiques. Les auteurs ont conclu que les faibles résultats relatifs à la concentration mesurés lors de l’enquête peuvent avoir résulté de plusieurs facteurs, notamment de la volatilité, de l’adsorption à l’aquarium en verre, de l’adsorption à des matières particulaires et de la biodégradabilité de l’acrylate d’éthyle.
Tableau 7a. Données empiriques sur la toxicité pour les organismes aquatiques
| Organisme d’essai | Type d’essai | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|
| Algues (Selenastrum capricornutum) | Toxicité aiguë (96 heures) |
CE50 | 5,5 | OCDE, 2005 |
| Daphnia magna | Toxicité aiguë (48 heures) |
CE50[1] | 7,9 | OCDE, 2005 |
| Daphnia magna | Toxicité chronique (21 jours) | CSEO[2] | 0,19 | OCDE, 2005 |
| Daphnia magna | Toxicité chronique (21 jours) | CMEO[3] | 0,45 | OCDE, 2005 |
| Daphnia magna | Toxicité chronique (21 jours) | CE50 | 0,5 | OCDE, 2005 |
| Poisson (Cyprinodon variegatus) | Toxicité aiguë (96 heures) |
CL50[4] | 2,0 | IUCLID, 2000 |
| Poisson (Pimephales promelas) | Toxicité aiguë (96 heures) |
CL50[4] | 2,5 | Geiger et al., 1990 |
| Poisson (Oncorhynchus mykiss) | Toxicité aiguë (96 heures) |
CL50[4] | 4,6 | OCDE, 2005 |
[2] CSEO - Concentration sans effet observé.
[3] CMEO - Concentration minimale avec effet observé
[4] CL50 - Concentration d’une substance qu’on estime létale pour 50 % des organismes d’essai.
Tableau 7b. Données modélisées sur la toxicité pour les organismes aquatiques
| Organisme d’essai | Type d’essai | Paramètre | Valeur (mg/L) |
Référence |
|---|---|---|---|---|
| Poisson | Toxicité aiguë (96 heures) |
CL50[1] | 2,2 | ECOSAR, 2008 |
| 2,06 | OASIS Forecast, 2005 | |||
| 18,79 | AIES, 2003-2005 | |||
| 8,0 | TOPKAT, 2004 | |||
| Poisson | Toxicité chronique (30 jours) |
Vtc[2] | 0,16 | ECOSAR, 2008 |
| Daphnia | Toxicité aiguë (96 heures) |
CE50[3] | 6,8 | ECOSAR, 2008 |
| Toxicité aiguë | 36,4 | TOPKAT, 2004 | ||
| Toxicité aiguë (48 heures) | < 221,9 | OASIS, 2004 | ||
| Algues | Toxicité aiguë (96 heures) |
CE50 | 1,07 | ECOSAR, 2008 |
[2] Vtc - Valeur de la toxicité chronique.
[3] CL50 - Concentration d’une substance qu’on estime létale pour 50 % des organismes d’essai.
Les résultats sur la toxicité issus des données expérimentales et modélisées sont comparables et indiquent que l’acrylate d’éthyle a le potentiel de présenter une toxicité modérée à élevée pour les organismes aquatiques. L’acrylate d’éthyle est un produit chimique réactif, mais le mode d’action n’est pas connu.
On n’a pas trouvé d’étude acceptable concernant les effets de l’acrylate d’éthyle sur l’environnement dans les milieux autres que l’eau.
Évaluation de l’exposition de l’environnement
Comme on n’a relevé aucune donnée relative aux concentrations de cette substance dans l’eau au Canada, on estime les concentrations dans l’environnement d’après les renseignements disponibles, notamment les estimations des quantités de la substance, les taux de rejet et la dimension des plans d’eau récepteurs.
A - Rejets industriels
Étant donné que l’acrylate d’éthyle est utilisé à des fins industrielles (voir la section « Utilisations ») et qu’on prévoit des rejets de cette substance dans l’eau, on a utilisé le pire scénario raisonnable de rejets industriels pour estimer la concentration de la substance dans l’eau à l’aide de l’outil d’exposition générique industriel - milieu aquatique (IGETA) d’Environnement Canada (2009a). On a exécuté une analyse de l’exposition propre au site pour le milieu aquatique dans deux sites industriels distincts où on utilise de l’acrylate d’éthyle (Environnement Canada, 2010c). Ces deux sites avaient été déterminés d’après les réponses données à l’enquête menée en application de l’article 71 de la LCPE (Environnement Canada, 2010a). Comme chaque utilisateur avait déclaré une consommation annuelle d’acrylate d’éthyle de l’ordre de 10 000 à 200 000 kg, le choix de ces sites devait représenter la pire éventualité réaliste au Canada, si on se fonde sur l’hypothèse générale voulant que la quantité rejetée soit proportionnelle à la quantité consommée.
Dans cette analyse de l’exposition propre au site, chaque site comprenait une installation, une usine de traitement des eaux usées et un plan d’eau récepteur. La concentration environnementale estimée (CEE) dans le plan d’eau récepteur a été estimée à partir de la concentration de la substance dans les effluents de l’usine de traitement des eaux usées et de l’application d’un facteur de dilution égal à 10. La concentration des effluents de l’usine de traitement des eaux usées a été estimée à partir d’une fraction de l’acrylate d’éthyle considéré comme sorti de l’installation pour se diriger vers une station municipale locale d’épuration des eaux, du taux présumé d’élimination dans l’usine de traitement des eaux usées et du taux d’écoulement de ses effluents. La fraction de perte, estimée de façon prudente à 5 %, découlait des opérations de manutention des contenants de produit chimique et des procédés industriels pertinents aux installations à l’étude. Il convient de noter que cette valeur est censée représenter la limite supérieure de la substance rejetée dans les eaux usées et qu’on s’attend à ce que le rejet provenant d’une installation réelle soit inférieur à cette limite. De façon prudente, on a supposé que l’élimination à la station locale d’épuration des eaux était nulle. L’écoulement des effluents provenant de la station locale d’épuration des eaux, considéré comme proportionnel à la population desservie, se situait entre 100 000 et plus de 1 000 000 m3 par jour pour les sites examinés. On a également supposé une fréquence de rejet de 250 jours par an pour les utilisateurs industriels (installations petites ou moyennes).
Selon les hypothèses susmentionnées, la CEE aux deux sites industriels distincts qui utilisent de l’acrylate d’éthyle a été estimée respectivement à 0,0002 mg/L et à 0,0305 mg/L. Les valeurs de la CEE obtenues sont considérées comme représentant le niveau d’exposition dans un scénario réaliste du pire cas de rejet dans les eaux réceptrices situées à proximité de l’émissaire d’évacuation des usines de traitement des eaux usées situées dans les sites industriels du Canada.
B - Rejets par les consommateurs
Comme on peut trouver de l’acrylate d’éthyle dans les produits de consommation et que cette substance peut être rejetée dans l’eau, on a utilisé Mega Flush, le tableur d’Environnement Canada, pour estimer la concentration de la substance dans différents plans d’eau récepteurs d’effluents d’usines de traitement des eaux usées où des produits de consommation contenant de l’acrylate d’éthyle peuvent avoir été rejetés (Environnement Canada, 2009b). Le tableur s’appuie sur des hypothèses réalistes pour fournir des estimations concernant environ 1 000 sites de rejet dans tout le Canada. Même si l’acrylate d’éthyle se trouve dans des produits de consommation, on estime que la quantité de cette substance évacuée dans les égouts est très faible (1 %), car elle est transformée au stade industriel.
Les hypothèses réalistes incluent :
- les pertes dans les égouts établies à 100 %;
- le taux d’élimination des usines de traitement des eaux usées estimé à 0,0 % en cas d’absence de traitement;
- 3,1 % en cas de traitement primaire seulement et 68 % en cas de traitements primaire et secondaire combinés;
- un nombre de jours de rejet égal à 365 jours par an;
- un facteur de dilution dans l’eau réceptrice de l’ordre de 1 à 10.
La concentration environnementale estimée (CEE) d’acrylate d’éthyle dans les plans d’eau récepteurs a été estimée à 0,0065 mg/L en se fondant sur une fourchette de 10 000 à 100 000 kg/an pour la quantité de substance utilisée par les consommateurs. L’équation et les entrées utilisées pour calculer la CEE sont décrites dans le rapport d’Environnement Canada (2010d).
Caractérisation des risques pour l’environnement
La démarche suivie dans la présente évaluation des risques écologiques consistait à examiner les divers renseignements à l’appui et à tirer des conclusions selon la méthode du poids de la preuve et le principe de prudence requis par la LCPE (1999). Les éléments de preuve pris en compte comprenaient les résultats d’un calcul prudent du quotient de risque ainsi que des renseignements sur la persistance, la bioaccumulation, la toxicité, les sources et le devenir de la substance.
Selon les prévisions, l’acrylate d’éthyle ne devrait pas être persistant dans l’air, l’eau, le sol ou les sédiments, et il devrait présenter un faible potentiel de bioaccumulation. De grandes quantités d’acrylate d’éthyle sont importées au Canada, mais une fois que celuici est rejeté dans l’environnement, on le retrouve principalement dans l’eau même si on peut prévoir certains rejets dans l’atmosphère en raison de la volatilité et du mode d’émission de la substance. Il a aussi été démontré que l’acrylate d’éthyle présente un potentiel moyen à élevé de toxicité pour les organismes aquatiques.
Une analyse du quotient de risque, incluant des estimations prudentes de l’exposition et les renseignements sur la toxicité de la substance, a été réalisée pour le milieu aquatique afin de déterminer si la substance pourrait avoir des effets nocifs sur l’environnement au Canada. Les deux scénarios présentés ci-dessus relativement à deux sites industriels distincts (tenant compte des plans d’eau récepteurs réels) ont révélé des concentrations environnementales estimées (CEE) de 0,0002 mg/L et de 0,0305 mg/L (Environnement Canada, 2010c). En divisant la valeur de la toxicité chronique (CMEO) de 0,45mg/L (valeur expérimentale valable la plus sensible) pour Daphnia magna par un facteur d’évaluation de 10 (afin de tenir compte des variations de sensibilité intraspécifiques et interspécifiques), on obtient une concentration estimée sans effet (CESE) de 0,045 mg/L. Comme les quotients de risque prudents (CEE/CESE) pour les deux scénarios industriels sont de 0,0047 et de 0,68, il est peu probable que l’acrylate d’éthyle ait des effets nocifs chez les organismes aquatiques.
Quand on divise la CEE de 0,0065 mg/L relative à l’acrylate d’éthyle prévue dans le scénario concernant les produits de consommation par la CESE de 0,045 mg/L, on obtient un quotient prudent de risque (CEE/CESE) de 0,14. Comme dans le scénario touchant les rejets industriels, il est peu probable que l’acrylate d’éthyle lié à l’utilisation de produits de consommation ait des effets nocifs chez les organismes aquatiques.
Ces renseignements portent à croire que l’acrylate d’éthyle risque peu d’avoir des effets nocifs sur l’environnement au Canada.
Incertitudes dans l’évaluation des risques pour l’environnement
Une certaine incertitude est liée à l’utilisation des prévisions RQSA. Toutefois, compte tenu de la structure limitée et relativement simple de l’acrylate d’éthyle, la majeure partie des résultats modélisés sont jugés fiables et inclus dans le domaine d’applicabilité des modèles, ce qui diminue l’incertitude globale.
De plus, une certaine incertitude entoure les effets de l’eau sur l’acrylate d’éthyle, car, même si la substance est censée se dégrader rapidement dans l’eau, une polymérisation est aussi possible. On a seulement tenu compte des données valables mesurées concernant les effets aquatiques.
Malgré la relative incertitude de l’estimation des niveaux d’exposition environnementale faute de données de surveillance canadiennes, on a utilisé deux scénarios de rejet prudents pour combler le manque de données.
Évaluation de l’exposition
Milieux naturels et aliments
La limite supérieure estimée de l’absorption d’acrylate d’éthyle provenant de l’air ambiant, de l’air intérieur, du sol, de l’eau potable ainsi que des aliments et boissons au Canada est de 0,00581 mg/kg p.c. par jour (annexe 1). Même si l’air intérieur est désigné comme la principale source d’exposition environnementale, cette estimation est considérée comme extrêmement prudente puisqu’on n’a pas décelé d’acrylate d’éthyle dans les 757 logements surveillés dans le cadre d’une étude canadienne alors que la limite de détection (10 µg/m3) avait été établie en calculant les concentrations dans l’air intérieur (Otson et al., 1994). Des concentrations d’acrylate d’éthyle de 0,04 à 2,1 mg/m3 dans l’air intérieur ont été signalées dans un immeuble à bureaux des États-Unis (aucun renseignement fourni sur l’emplacement ou sur l’échantillon, BUA, 1992).
On a signalé la présence naturelle d’acrylate d’éthyle dans les ananas frais (CIRC, 1986), les framboises, les mûres, les fruits de la passion jaune et les durians (NTP, 1998; Burdock, 1997). Le Comité mixte d’experts FAO/OMS sur les additifs alimentaires rapporte une dose quotidienne estimée d’acrylate d’éthyle absorbée sous forme d’assaisonnement de nourriture d’après les volumes annuels de production d’acrylate éthylique utilisés comme aromatisant (JECFA, 2006). L’absorption a été estimée à 1,1 × 10-5 mg/kg p. c. par jour et à 2,6 × 10-5 mg/kg p. c. par jour aux États-Unis et en Europe, respectivement. (JECFA, 2006). Selon l’information disponible, les aliments ne sont pas les éléments qui contribuent le plus à l’exposition globale à l’acrylate d’éthyle (annexe 1).
Même si les emballages d’aliments utilisent des matières à base d’acrylate d’éthyle, ces emballages contiennent peu d’acrylate d’éthyle sous forme résiduelle et la migration de la substance dans les aliments est négligeable (courriels adressés en 2010 par la Direction des aliments de Santé Canada au Bureau de gestion du risque de Santé Canada; source non citée). L’absorption journalière possible d’acrylate d’éthyle présent sous forme résiduelle dans les emballages d’aliments est très peu importante comparativement à l’exposition causée par sa présence naturelle dans certains fruits et à son utilisation à titre d’aromatisant alimentaire.
Il se peut aussi que de l’acrylate d’éthyle soit présent sous forme résiduelle dans des emballages de produits pharmaceutiques, mais cela n’est pas considéré comme une source d’exposition importante pour la population en général.
La concentration dans l’air ambiant s’appuie sur une étude de surveillance de la qualité de l’air exécutée à Houston et à Boston (États-Unis), comprenant la collecte de 22 échantillons dans chaque ville entre août 1990 et août 1991 (Kelly et al., 1993). Comme on n’a pas décelé d’acrylate d’éthyle dans les échantillons, on a utilisé la limite de détection de 0,2 ppb (0,82 µg/m3) dans l’air ambiant à titre d’entrée prudente pour la modélisation. Aucune donnée canadienne n’était disponible. On a aussi décelé la présence d’acrylate d’éthyle dans l’air ambiant (0,6 à1,8 ng/m3) dans 3 des 15 échantillons recueillis dans un 1 lieu de collecte sur 5 au Japon en 2001 (NITE, 2010).
De l’acrylate d’éthyle a aussi été décelé qualitativement dans l’air ambiant d’un site d’enfouissement américain (aucun renseignement fourni sur l’emplacement ou sur l’échantillon; BUA, 1992) ainsi que dans l’air évacué d’usines de production des ÉtatsUnis (12 500 et 25 000 mg/m3), de Nouvelle-Zélande (11 à 622 mg/m3) et du Japon (BUA, 1992), mais ces sources ponctuelles ne représentent pas l’exposition de la population en général.
Comme on n’a pas décelé d’acrylate d’éthyle dans les quelque 250 échantillons d’eau souterraine prélevés à l’intérieur ou autour de cinq usines produisant cette substance, on a fondé la concentration dans l’eau potable utilisée pour modéliser l’exposition sur la limite de détection située entre 1 et 10 ppb (McLaughlin et al.,1993). N’ayant pas trouvé d’études de surveillance du sol, on s’est servi d’un modèle d’exposition environnementale propre au Canada pour évaluer les concentrations prudentes dans le sol d’après la quantité de substance rejetée au Canada (ChemCAN, 2003).
Voici quelques résultats d’autres études de surveillance de l’acrylate d’éthyle dans l’eau et les sédiments : on n’a pas décelé d’acrylate d’éthyle dans 51 échantillons d’eaux de surface et de sédiments de fond recueillis à 17 endroits du Japon en 1980 (la limite de détection était de 0,3 à 50 µg/L, NITE. 2010). Parmi 100 échantillons de sol, d’eaux usées et d’eau de surface analysés, seuls deux échantillons de sédiments ont révélé des niveaux décelables d’acrylate d’éthyle atteignant 2,1 et 2,2 mg/kg (aucune limite de détection n’a été signalée, McLaughlin et al., 1993). On n’a pas décelé d’acrylate d’éthyle dans une usine de traitement des eaux usées située en Allemagne (la limite de détection était de 0,02 mg/L; BUA, 1992). On a décelé de l’acrylate d’éthyle, sans toutefois le quantifier, dans un des 17 échantillons d’eau souterraine recueillis aux États-Unis (lieu non cité; BUA, 1992).
Produits de consommation
En se fondant sur les renseignements reçus dans le cadre de l’enquête exécutée en application de l’article 71, on a utilisé la version 4.1 du logiciel néerlandais ConsExpo du RIVM (ConsExpo, 2006) pour modéliser l’exposition des consommateurs dans le cadre de scénarios concernant les produits de consommation et les produits de soins personnels (tableau 3, annexe 2).
Il peut arriver qu’on trouve de l’acrylate d’éthyle sous forme résiduelle dans les produits de consommation. Aux fins de la modélisation à l’aide de la version 4.1 de ConsExpo, on a utilisé 100 % de l’absorption par inhalation et par voie cutanée, mais la voie orale ne convenait pas, vu le type de produits où l’acrylate d’éthyle est utilisé. Ces taux prudents d’absorption pourraient entraîner des expositions modélisées légèrement plus élevées que celles qui peuvent se produire réellement.
En plus de ConsExpo (ConsExpo, 2006), on a également utilisé le logiciel Wall Paint Exposure Model (WPEM) de l’Environmental Protection Agency des États-Unis (USEPA, 2001) pour modéliser l’exposition des consommateurs pendant l’exécution de travaux de peinture dans leur logement. Comme les résultats fournis par le WPEM étaient uniformément inférieurs, on a estimé que les résultats obtenus à l’aide du modèle de ConsExpo fournissaient une estimation plus prudente de l’exposition.
Les polymères acryliques susceptibles de contenir de l’acrylate d’éthyle se trouvent habituellement dans les peintures extérieures plus coûteuses, car l’ajout d’un polymère acrylique à la peinture augmente sa durabilité et sa résistance aux frottements, de même que dans les peintures semi-lustrées utilisées pour peindre les boiseries intérieures (Frederick, 1998). Une petite étude du panier de consommation (Frederick, 1998) a permis d’analyser la présence d’acrylate d’éthyle dans 30 échantillons de peintures diverses destinées au grand public. Les auteurs ont signalé entre 1,26 et 4,49 ppm (moyenne de 1,28 ppm) d’acrylate d’éthyle dans la peinture murale mate au latex et entre 1,61 et 13,02 ppm (moyenne de 4,06 ppm) dans la peinture pour boiseries intérieures (Frederick, 1998).
Dans une étude en laboratoire, on a préparé et utilisé deux échantillons de peinture présentant des concentrations résiduelles d’acrylate d’éthyle (940 ppm et 2000 ppm p/p) pour peindre une chambre d’essai ne comprenant pas de ventilation (McLaughlin et al., 1993). Les concentrations maximales d’acrylate d’éthyle signalées dans l’air de la chambre en provenance des échantillons de peinture de 940 ppm et de 2000 ppm étaient respectivement de 2,5 ppm et de 8,0 ppm (McLaughlin et al., 1993). Le rapport précise en outre qu’aucune quantité d’acrylate d’éthyle (limite de détection de 0,2 ppm) n’a été decelée lorsqu’on a répété les scénarios de peinture en présence d’une ventilation adéquate (McLaughlin et al., 1993).
Il peut arriver que de l’acrylate d’éthyle soit présent sous forme résiduelle dans divers produits de bricolage. Le tableau 3 donne une estimation de l’exposition de personnes utilisant des produits de calfeutrage. On a supposé une concentration inférieure à 0,1 % en se fondant sur un produit de jointoiement peinturable indiqué dans la base de données sur les produits ménagers (Household Products Database, 2009).
L’acrylate d’éthyle peut être utilisé dans la fabrication de lingettes non tissées et dans d’autres matières non tisées à usage médical ou hospitalier en concentration maximale de 28 ppm[3], [4](Environnement Canada, 2010b).
D’autres produits pouvant contenir de l’acrylate d’éthyle sous forme résiduelle ont été recensés : produits pour toiture et autres liants et revêtements industriels renfermant une concentration maximale estimée de 29 ppm[4] de la substance (Environnement Canada, 2010b). De l’acrylate d’éthyle peut également être présent dans la colle à bois à une concentration maximale de 40 ppm[3](Environnement Canada, 2010b). Comme ces produits sont rarement utilisés, ils ne sont pas considérés comme une source importante d’exposition pour la population en général et aucune estimation de l’exposition n’a été calculée.
Les produits cosmétiques qui contenaient antérieurement des polymères acryliques susceptibles d’inclure de l’acrylate d’éthyle ont été reformulés et n’utilisent plus d’acrylate d’éthyle. Ils ne sont plus disponibles sur le marché canadien (courriels adressés en 2010 par le Bureau de la sécurité des produits de consommation de Santé Canada à la Division des substances existantes de Santé Canada; source non citée).
Dans la littérature, l’acrylate d’éthyle a été décrit comme un additif aux adhésifs (McLaughlin et al., 1993), tels que les bandages autocollants. La quantité d’acrylate d’éthyle présente sous forme résiduelle dans ces bandages est considérée comme très faible. Comme ces bandages autocollants ne sont pas souvent utilisés et que, par conséquent, ils ne sont pas considérés comme une source importante d’exposition pour la population en général, on n’a pas calculé d’estimations de l’exposition.
L’acrylate d’éthyle est utilisé dans diverses parties de véhicules motorisés, notamment dans la peinture extérieure, les scellants et les composants en plastique. Les renseignements reçus dans le cadre de l’enquête menée en application de l’article 71 indiquent que la concentration totale estimée d’acrylate d’éthyle dans un véhicule fini est inférieure à 0,031 kg par véhicule (Environnement Canada, 2010a). Puisque ces composants ne se trouvent pas dans l’espace occupé par les passagers, ils ne sont pas considérés comme une source importante d’exposition pour la population en général.
D’autres produits[4] (Environnement Canada, 2010 b) utilisés uniquement en milieu industriel peuvent contenir de l’acrylate d’éthyle sous forme résiduelle, mais ils ne sont pas considérés comme une source d’exposition pour la population en général.
Tableau 8. Modèles établis avec la version 4.1 de ConsExpo (voir l’annexe 2)
| Produit de consommation modélisé à un niveau spécifié | Exposition aiguë par voie cutanée (mg/kg) |
Exposition chronique par voie cutanée (mg/kg par jour) | Concentration moyenne d’inhalation par événement (mg/m3) |
|---|---|---|---|
| Peinture au latex mate (4,5 ppm) |
2,54 × 10-4 | 1,39 × 10-6 | 0,225 |
| Peintre semilustrée pour boiseries (13,2 ppm) | 3,6 × 10-4 | 1,99 × 10-6 | 0,108 |
| Produits de calfeutrage (< 0,1 %) | 2,12 × 10-3 | 1,74 × 10-5 | 0,427 |
| Lingettes pour nourrissons (28 ppm) |
7,47 × 10-5 | 3,73 × 10-4 | - |
| Lingettes pour adultes (28 ppm) |
7,9 × 10-6 | 7,89 × 10-6 | - |
Évaluation des effets sur la santé
L’annexe 3 comprend un résumé des renseignements disponibles sur les effets de l’acrylate d’éthyle sur la santé.
Le Centre International de Recherche sur le Cancer (CIRC) a classé l’acrylate d’éthyle comme substance cancérogène du groupe 2B (peut-être cancérogène pour l’homme) parce qu’il existait des indications de carcinogénicité suffisantes chez les animaux de laboratoire, mais aucune donnée épidémiologique pertinente sur la cancérogénicité chez les humains (CIRC, 1986, 1999). L’Environmental Protection Agency des États-Unis a classé l’acrylate d’éthyle comme un cancérogène possible chez les humains (Groupe B2) (USEPA, 2005, 2009). D’abord mentionné dans le cinquième rapport annuel sur les substances cancérogènes du National Toxicology Program (NTP) comme une substance dont on peut raisonnablement présumer qu’elle est cancérogène, l’acrylate d’éthyle a plus tard été retiré du neuvième rapport annuel du NTP sur les substances cancérogènes à la suite d’une réévaluation n’indiquant pas de potentiel cancérogène (NTP, 1989, 2000).
Selon des études expérimentales sur la toxicité chez les animaux, des incidences accrues de tumeurs du préestomac ont été observées chez les souris et les rats auxquels on avait administré de l’acrylate d’éthyle par gavage. Les rats Fischer 344 et les souris B6C3F1 traités avec de l’acrylate d’éthyle par gavage à raison de 0,100 ou 200 mg/kg p.c. par jour, 5 jours par semaine pendant 103 semaines présentaient une incidence beaucoup plus forte de tumeurs du préestomac (NTP, 1986a). Ces tumeurs (papillomes et carninomes malpighiens) ont été observées après gavage de 100 et 200 mg/kg p.c. par jour chez les deux sexes des deux espèces. Dans une étude de suivi, des rats Fischer 344 mâles se sont vu administrer par gavage de l’acrylate d’éthyle à raison de 0 ou 200 mg/kg p.c. par jour, 5 jours par semaine pendant 6 ou 12 mois suivis de périodes de récupération pouvant atteindre 15 mois (Ghanayemet al., 1993, 1994). Aucun effet néoplasique n’a été observé chez les animaux ayant reçu 200 mg/kg p.c. d’acrylate d’éthyle par jour pendant 6 mois, suivis de 0, 2 ou 15 mois de récupération, ni chez les animaux sacrifiés juste après 12 mois. On a observé le développement de tumeurs du préestomac pendant les périodes de récupération de 2 à 9 mois chez les animaux traités avec de l’acrylate d’éthyle pendant 12 mois.
Contrairement aux études concernant le gavage, on n’a pas observé d’effets néoplasiques chez les animaux de laboratoire auxquels on a administré de l’acrylate d’éthyle par d’autres voies. Dans une étude sur l’eau potable, des rats Wistar se sont vu administrer 0, 6 à 7, 60 à 70 ou 2 000 ppm d’acrylate d’éthyle (environ 0, 0,84 à 0,98, 9,4 à 9,8 et 280 mg/kg p.c. respectivement) pendant deux ans (Borzelleca et al., 1964). Les résultats histopathologiques n’ont pas révélé de lésions liées au traitement. Borzelleca et al. (1964) ont aussi exécuté une étude de la toxicité chronique sur des chiens. Des chiens beagle ont reçu de l’acrylate d’éthyle par voie orale dans des gélules à raison de 0, 10, 100 ou 1 000 ppm (approximativement 0, 0,3, 3 et 30 mg/kg p.c. par jour respectivement) pendant deux ans sans qu’on observe d’effets néoplasiques.
Dans les études sur la carcinogénicité due à l’inhalation, on n’a pas observé de lésions néoplasiques liées au traitement chez les rats Fischer 344 ni chez les souris B6C3F1 exposés à l’acrylate d’éthyle à un dosage de 0,25 ou 75 ppm (approximativement 0, 100 et 310 mg/m3respectivement) pendant 6 heures par jour, 5 jours par semaine durant 27 mois (Miller et al., 1985). Dans une autre étude effectuée par Miller et al., (1985), des rats Fischer 344 et des souris B6C3F1 ont été exposés à 0 ou 5 ppm d’acrylate d’éthyle (approximativement 20 mg/m3) pendant 24 mois sans qu’on observe d’effets néoplasiques.
Dans une étude sur la carcinogénicité par voie cutanée, 800 mg/kg p.c. par jour d’acrylate d’éthyle ont été administrés trois fois par semaine pendant toute leur vie à des souris C3H/HeJ mâles (DePass et al., 1984) sans qu’on observe de tumeurs épidermiques.
Dans des études épidémiologiques, les résultats d’études de cohortes en milieu de travail se sont révélés contradictoires. Les expositions à l’acrylate d’éthyle n’étaient pas bien quantifiées et les travailleurs étaient aussi exposés à d’autres produits chimiques. Dans une étude de cohorte menée de 1933 à 1945, les ouvriers d’une usine de fabrication de feuilles d’acrylique de Bristol (Pennsylvanie) étaient exposés à de l’acrylate d’éthyle, mais aussi à du méthacrylate de méthyle, à du plomb, à du dichlorure d’éthylène, à du chlorure de méthylène et à de l’acrylonitrile. Vingt ans après l’équivalent de trois ans d’emploi, on a observé une surmortalité due au cancer du côlon et du rectum chez les travailleurs exposés (Walker et al., 1991). Pourtant, deux autres études de cohorte similaires décrites par Walker et al. (1991) n’ont pas signalé de surmortalité due à une cause quelconque.
Un potentiel mutagène limité a été observé dans des essais de mutation in vitro. Les résultats d’un certain nombre de tests d’Ames exécutés sur différentes souches deSalmonella typhimurium avec et sans activation métabolique se sont révélés négatifs (Rohm et Haas, 1977, 1981; Ishidate et al., 1981; Haworth et al., 1983; Waegemaekers et Bensink, 1984; NTP, 1986a; Brusick, 1977; Zeiger et al., 1992; ECETOC, 1994; Emmert et al., 2006). Le résultat d’un test umu exécuté à l’aide de Salmonella typhimurium s’est montré lui aussi négatif (Yasunaga et al., 2004), alors que l’induction d’une recombinaison mitotique dans Saccharomyces cerevisiae s’est avérée positive (Zimmermann et Mohr, 1992). Dans des cellules de mammifères, on a observé l’induction de mutations géniques, de même que dans les cellules de lymphomes L5178Y TK+/- de souris (Myhr, 1980; McGregor et al., 1988; More et al.,1988; Dearfield et al., 1991), mais non dans les essais HGPRT exécutés sur des cellules d’ovaire de hamster chinois (Mooreet al., 1989). Pour ce qui est des effets clastogènes, les essais d’aberrations chromosomiques se sont la plupart du temps révélés positifs dans les cellules de lymphome de souris, dans les cellules d’ovaire de hamster chinois, dans les splénocytes de souris et dans les cellules de poumon de hamster chinois (NTP, 1986b; Moore et al., 1988; Ishidate et al.,1981; Loveday et al.,1990; Kligerman et al., 1991). On a obtenu des résultats mitigés pour les essais d’échange de chromatides sœurs dans des cellules d’ovaire de hamster chinois et dans des splénocytes de souris (NTP, 1986b; Loveday et al., 1990; Kligerman et al., 1991).
Dans les essais in vivo, les résultats concernant la génotoxicité se sont surtout révélés négatifs. On n’a pas observé d’aberrations chromosomiques chez les souris auxquelles on avait administré de l’acrylate d’éthyle par voie intrapéritonéale (Kligerman et al., 1991). Des essais d’induction de micronoyaux exécutés sur différentes souches de souris ayant reçu de l’acrylate d’éthyle par voie intrapéritonéale, orale ou cutanée se sont pour la plupart avérés négatifs (Przybojewska et al., 1984; Basler et van der Hude, 1987; Ashby et al. 1989; Kligerman et al.,1991; Hara et al.,1994; Morita et al.,1997; Tice et al., 1997). Les essais d’échange de chromatides sœurs exécutés sur des souris ayant reçu de l’acrylate d’éthyle par voie intrapéritonéale ont été négatifs (Kligerman et al., 1991). Dans les cellules germinales, les résultats d’essais de mutations létales récessives liées au sexe exécutés sur Drosophilia melanogaster par voie orale ou par injection se sont révélés négatifs (Valencia et al., 1985).
La première réunion d’évaluation du Screening Information Dataset (SIDS) de l’Organisation de coopération et de développement économiques (OCDE) tenue en 2004 a conclu que l’acrylate d’éthyle ne causait pas de préoccupations quant au risque mutagène (OCDE, 2004).
Le mode proposé d’induction de tumeurs du préestomac par l’acrylate d’éthyle chez le rat n’a pas été entièrement élucidé. Chez les rongeurs, le préestomac est un organe non glandulaire de stockage des aliments relié à l’œsophage et tapissé d’épithélium pavimenteux kératinisé et stratifié, alors que l’estomac glandulaire, qui se déverse dans le duodénum, est tapissé d’un épithélium glandulaire spécial. Chez les humains, en revanche, la totalité de l’estomac est glandulaire, mais on trouve des tissus épithéliaux pavimenteux comparables dans la cavité buccale et les deux tiers supérieurs de l’œsophage. À la différence des rongeurs, aucun de ces endroits ne joue un rôle dans le stockage des aliments. En 2003, le CIRC a publié un rapport qui étudiait la valeur prédictive des tumeurs du préestomac chez les rongeurs pour évaluer les risques cancérogènes de plusieurs produits chimiques, dont l’acrylate d’éthyle, pour les humains. Même si le CIRC (2003) n’a pas proposé de mode d’action pour les tumeurs du préestomac causées par l’acrylate d’éthyle, le groupe de travail a laissé entendre qu’une certaine période d’hyperplasie soutenue est nécessaire pour entraîner réellement une tumorigenèse (Boorman et Sills, 2003). Des études sur le gavage chez les rongeurs ont souligné que l’hyperplasie du préestomac causée par l’acrylate d’éthyle se prolonge tant que dure l’administration de cette substance. On a constaté une guérison complète de l’hyperplasie du préestomac chez des animaux traités pendant six mois, mais la persistance de cette hyperplasie chez les rats traités pendant 12 mois (Ghanayem et al., 1993, 1994). De plus, le développement de tumeurs du préestomac n’a pas été observé immédiatement, mais seulement pendant les périodes de récupération chez les rats traités durant 12 mois.
Williams et Iatropoulos (2009) ont avancé que l’induction de tumeurs du préestomac par l’acrylate d’éthyle dépend de la voie empruntée. Selon ces auteurs, une longue période de transit allant d’une demi-journée à deux ou trois jours et la présence de pH moins acide dans le préestomac permettent la prolifération de bactéries; de plus, la progression de l’irritation locale des tissus, de l’inflammation et de l’hyperkératose vers l’hyperplasie soutenue est un événement précurseur important qui mène à la néoplasie du préestomac causée par l’acrylate d’éthyle. On reconnaît depuis longtemps que l’hyperplasie (ou prolifération des cellules) constitue un facteur important dans la carcinogenèse. Certains auteurs ont laissé entendre que la prolifération des cellules doit être soutenue, et non seulement normale, pour favoriser la carcinogenèse (Preston-Martin et al., 1990; Melnick et al.,1993; Huff, 1995). Proctoret al. (2007) ont en outre souligné que les tumeurs du préestomac associées à l’irritation chronique de l’épithélium préstomacal, en particulier les tumeurs causées par un gavage répété, peuvent entraîner dans les tissus une dose qui n’est pas représentative de l’exposition humaine.
Aucune classification de la toxicité pour le développement ou la reproduction n’a pu être obtenue auprès d’organismes de réglementation nationaux et internationaux. La dose minimale avec effet observé (DMEO) administrée par voie orale et identifiée comme source de toxicité pour le développement était de 25 mg/kg p.c. par jour. Cette dose a été déterminée d’après le retard de l’ossification causé par l’administration à des rats d’acrylate d’éthyle par gavage à des doses de 0, 25, 50, 100, 200 ou 400 mg/kg p.c. par jour pendant les jours de gestation 7 à 16 (Pietrowicz et al.; 1980). Pour toutes les doses, on a également observé une diminution du gain de poids corporel chez les mères. Pour ce qui est de la voie d’administration par inhalation, la CMEO de 200 ppm (800 mg/m3) a été établie d’après une diminution importante du poids fœtal chez des rats SpragueDawley exposés à l’acrylate d’éthyle à des doses de 0, 25, 50, 100 ou 200 ppm (approximativement 0, 100, 200, 400 et 800 mg/m3 respectivement), six heures par jour pendant les jours de gestation 6 à 20 (Saillenfait et al., 1999). On a aussi observé une diminution importante du gain de poids corporel maternel et du gain de poids absolu pour la dose de 200 ppm. Dans une étude de cas limitée, une femme qui avait été exposée à des polymères contenant de l’acrylate d’éthyle disait que son enfant avait reçu un diagnostic d’anomalies cogénitales, mais l’étude ne donnait pas de précisions complémentaires (Sherman, 1985). On n’a pas recensé d’études sur la toxicité pour la reproduction, ni d’études sur la toxicité pour le développement en cas d’exposition cutanée.
Chez les rongeurs, la prise répétée de doses d’acrylate d’éthyle par voie orale affecte généralement le préestomac. La dose minimale avec effet nocif observé (DMENO) de 20 mg/kg p.c. par jour a été déterminée d’après une augmentation du poids de l’estomac et une augmentation de l’hyperplasie et de l’hyperkératose épithéliales du préestomac chez des rats Fischer 344 mâles auxquels on avait administré de l’acrylate d’éthyle par gavage dans le cadre de plusieurs études exécutées de 14 jours à 13 semaines (Rohm et Haas, 1986 b, 1987; Frederick et al., 1990). Dans une étude similaire, Frederick et al. (1990) ont déterminé une DMENO de 1 000 ppm (99 mg/kg p.c. par jour) correspondant à une irritation minimale et à une hyperplasie épithéliale diffuse du préestomac à la suite de l’administration à des rats Fischer 344 mâles d’acrylate d’éthyle dans de l’eau potable à des doses de 0, 200, 1 000, 2 000 ou 4 000 ppm (correspondant à 0, 23, 99, 197 et 369 mg/kg p.c. par jour respectivement), 5 jours par semaine pendant 14 jours. Une étude de deux ans sur des rats ayant reçu de l’acrylate d’éthyle dans de l’eau potable n’a toutefois pas permis d’observer de modifications histopathologiques (Borzelleca et al., 1964).
Les études sur la toxicité de l’acrylate d’éthyle absorbé par inhalation par des rongeurs ont généralement conclu à des effets sur les voies nasales. La plus faible CMENO après exposition aiguë a été établie à 25 ppm (100 mg/m3) d’après des lésions réversibles de l’épithélium olfactif chez des rats mâles dont seul le nez avait été exposé à de l’acrylate d’éthyle pendant trois heures (Frederick et al., 2002). On doit noter que, chez les rongeurs, l’anatomie nasale et l’écoulement de l’air inhalé diffèrent substantiellement de ceux des humains (Frederick et al., 1998, 2002). Des simulations effectuées à l’aide de modèles informatiques d’inhalation ont laissé entendre que l’épithélium olfactif humain est censé retenir des concentrations de vapeur d’acide organique inhalé tel que l’acrylate d’éthyle au moins deux à trois fois plus faibles que celui des rongeurs (Frederick et al., 1998, 2002). Une CMENO plus élevée de 75 ppm (310 mg/m3) due à une exposition aiguë a été établie d’après des lésions de l’épithélium olfactif (dégénérescence focale, nécrose, exfoliation et légère inflammation) observées chez des singes exposés à l’acrylate d’éthyle pendant trois heures (Rohm et Haas, 1994; Harkemaet al., 1997). L’Environmental Protection Agency des États-Unis a utilisé l’étude effectuée sur des rats par Frederick et al. en 2002 ainsi que l’étude menée sur des singes par Rohm et Haas en1994 et par Harkema et al. en 1997 comme points de départ pour le calcul de l’Acute Exposure Guideline Level1 (AEGL-1) et de l’Acute Exposure Guideline Level-2 (AEGL-2) (USEPA, 2007). La CMENO critique de 300 ppm (1 200 mg/m3) pour une exposition à court terme a été déterminée d’après une inflammation, une dégénérescence, une nécrose focale et une métaplasie malpighienne des cornets nasaux chez des rats et des souris exposés à l’acrylate d’éthyle pendant 30 jours (Milleret al., 1979). La CMENO critique de 25 ppm (100 mg/m3) pour une exposition à long terme par inhalation a été établie d’après des lésions néoplasiques des muqueuses olfactives incluant une dégénérescence, une inflammation et une hyperplasie chez des rats et des souris exposés à l’acrylate d’éthyle pendant 6 à 27 mois (Jerseyet al., 1978; Dow Chemical, 1979a; Miller et al., 1985).
Pour ce qui est de la voie cutanée, la DMENO la plus faible identifiée a été de 800 mg/kg p.c. par jour après observation d’une dermatite, d’une fibrose cutanée, d’une nécrose épidermique et d’une hyperkératose chez des souris C3H/HeJ mâles ayant reçu approximativement 800 mg/kg p.c. d’acrylate d’éthyle par jour, trois fois par semaine pendant toute leur vie (DePass et al., 1984).
Chez les humains, une étude de cohorte en milieu de travail a présumé une corrélation entre l’exposition à l’acrylate d’éthyle et une perturbation du système nerveux central. L’utilité de cette étude pour caractériser les effets sur la santé associés à l’exposition à l’acrylate d’éthyle est toutefois limitée puisque les sujets de l’étude étaient en même temps exposés à des niveaux importants d’autres produits chimiques (acrylate de butyle et acrylonitrile) (Kuzelova et al., 1981).
Chez les animaux de laboratoire, l’acrylate d’éthyle est un puissant irritant de la peau et des yeux (Haskell Laboratories, 1945; Pozzani et al., 1949; Treon et al., 1949; Oettel et Zeller, 1958; Celanese Chem Co., 1972; BASF AG, 1978; Lomonova et Klimova, 1979; Poole, 1980; Potokar et al., 1985; Rohm et Haas, 1986a, 1986c, 1986d, 1991; Union Carbide Corp, 1989; BAMM, 1994; BASF, 2005). Une étude de cas humains a indiqué que l’exposition accidentelle à l’acrylate d’éthyle a causé une grave irritation des yeux (Dow Chemical, 1964). Certaines preuves laissent en outre entendre que l’acrylate d’éthyle est un sensibilisant et que, chez les animaux, l’exposition à cette substance peut entraîner une sensibilisation croisée avec d’autres acrylates (Van der Walleet al., 1982). Les résultats d’essais concernant l’enflure des oreilles et les ganglions lymphatiques locaux se sont toutefois révélés négatifs (Kimber, 1992; NTP, 1994; Hayes et Meade, 1999). Pour ce qui est des humains, on a observé une sensibilisation chez des volontaires (Epstein, 1974) et chez des patients présentant une dermatite de contact présumée d’origine allergique (Foulger et Fleming, 1945; Jordan, 1975; Fregert, 1978; Bjorkner et Dahlquist, 1979; Malten et al., 1984; Conde-Salazar et al.,1988; Kanerva et al.,1988, 1989, 1992, 1995; Stenman et Bergman, 1989; Skoglund et Egelrud, 1991; Koppula et al., 1995; Marks et al., 1995; Rustemeyer et Frosch, 1996; Tucker et Beck, 1999; Lazarov, 2007; AaltoKorte et al., 2007). Certains des patients atteints de dermatite avaient été exposés à des acrylates ou avaient contracté une dermatite professionnelle au contact de matériaux dentaires, de scellants acryliques ou d’ongles artificiels.
Des études toxicocinétiques menées sur des animaux de laboratoire montrent que l’acrylate d’éthyle est absorbé et métabolisé rapidement après l’exposition par voie orale ou par inhalation (Stott et McKenna, 1984; Ghanayem et al., 1987). Les deux principales voies métaboliques sont l’hydrolyse de la liaison ester et la conjugaison avec le glutathion (GSH). L’acrylate d’éthyle est hydrolysé par les carboxylestérases, ce qui entraîne la production d’éthanol et d’acide acrylique (Miller et al., 1981; Frederick et al.,1994a). L’éthanol est ensuite métabolisé en vertu d’un procédé catabolique et l’acide acrylique emprunte la voie de dégradation du propionate par le métabolisme cellulaire, ce qui entraîne dans les deux cas la formation de dioxyde de carbone. Une conjugaison avec le GSH peut se produire spontanément par une addition de Michael ou par l’intermédiaire de la glutathion transférase (Ghanayem et al. 1987; Potter et Tran, 1992). L’inhalation d’acrylate d’éthyle par des rats a entraîné la déplétion du sulfhydryle non protéique principalement dans le foie, puis dans le sang, le cerveau et les poumons (Vodicka et al., 1990). Dans des études sur la toxicité de l’acrylate d’éthyle administré par gavage à des rongeurs, on a observé une réduction importante du sulfhydryle non protéique dans le préestomac et dans l’estomac glandulaire, ce qui laisse penser que la conjugaison au point de contact peut donner lieu à un important processus de détoxification (De Bethizy et al. 1987). Après la conjugaison avec le GSH, l’acrylate d’éthyle est rapidement éliminé dans l’urine (De Bethizy et al., 1987). Même si c’est théoriquement possible, on ne dispose pas de preuves de la génération de produits d’époxydation dans le métabolisme de l’acrylate d’éthyle (Delbressine et al., 1982; De Bethizy et al., 1987). Des chercheurs ont élaboré un modèle pharmacocinétique et pharmacodynamique fondé sur des données physiologiques concernant les rats qui décrit l’absorption, la diffusion et le métabolisme de doses d’acrylate d’éthyle administrées par voie orale (Frederick et Chang-Mateu, 1990; Frederick et al., 1992). Des modèles de dosimétrie interspécifiques similaires basés sur des données biologiques ont aussi été élaborés relativement à l’inhalation d’acrylate d’éthyle (Frederick et al., 1994 b, 2002; Sweeney et al., 2004).
Le niveau de confiance à l’égard des renseignements fournis dans la base de données sur la toxicité pour l’acrylate d’éthyle est jugé modéré à élevé. Des données ont été recensées sur la cancérogénicité, la génotoxicité, la toxicité pour le développement, la toxicité aiguë et la toxicité liée à l’administration de doses répétées chez des animaux de laboratoire. Mais on ne dispose pas d’études sur la toxicité pour la reproduction, ni d’études épidémiologiques concluantes.
Caractérisation du risque pour la santé humaine
Selon les classifications établies par d’autres organismes de réglementation nationaux et internationaux, la cancérogénicité constitue un effet critique pour la caractérisation du risque que présente l’acrylate d’éthyle pour la santé humaine. Des tumeurs du préestomac sont apparues chez des souris et des rats des deux sexes auxquels on avait administré de l’acrylate d’éthyle par gavage pendant deux ans. On n’a toutefois pas observé d’incidence de tumeurs quand l’acrylate d’éthyle était administré par d’autres voies, notamment par voie orale dans l’eau potable, par inhalation et par voie cutanée. L’ensemble des preuves issues des études sur la génotoxicité laisse entendre que l’acrylate d’éthyle n’est pas susceptible d’être mutagène, mais qu’il pourrait avoir certains effets clastogènes in vitro. La réunion initiale d’évaluation 18 du Screening Information Data Set (SIDS) de l’OCDE a conclu que l’acrylate d’éthyle ne suscitait pas de préoccupations quant au « risque mutagène » (OCDE, 2004). Même si le mode d’induction des tumeurs du préestomac observées chez les rongeurs n’a pas été complètement élucidé, il est quand même proposé que des doses aigües de bols gastriques d’acrylate d’éthyle dans le préestomac induisent l’irritation et l’hyperplasie soutenues comme précurseur pour le développement des tumeurs (OCDE, 2004; NTP, 2000; Williams et Iatropoulos, 2009).
En conséquence, une approche fondée sur le seuil d’innocuité a été utilisée pour évaluer le risque pour la santé humaine.
Pour ce qui est des effets non cancérogènes, on n’a pas recensé d’études sur la toxicité pour la reproduction. Les effets sur le développement étaient accompagnés d’une toxicité chez la mère, ce qui laissait croire à un effet secondaire. Les marges d’exposition sont basées sur des estimations prudentes de la limite supérieure de l’exposition de la population en général, ainsi que sur la CMENO et de la DMENO critiques pour les effets non cancérogènes. Pour la voie orale, la DMENO critique de 20 mg/kg p.c. par jour a été établie en fonction d’une augmentation du poids de l’estomac, d’une hyperplasie et d’une hyperkératose du préestomac chez des rats traités par gavage de 14 jours à 13 semaines (Rohm et Haas, 1986 b, 1987; Frederick et al., 1990). Même si on a établi une DMENO plus élevée de 99 mg/kg p.c. par jour dotée d’effets similaires sur la santé à la suite de la consommation d’eau potable, on s’est servi de la DMENO plus prudente issue des études sur le gavage pour calculer les marges d’exposition.
Les CMENO critiques de 25 ppm (100 mg/m3) et de 75 ppm (310 mg/m3) pour l’exposition aiguë à l’inhalation ont été déterminées d’après des lésions de l’épithélium olfactif chez des rats (Frederick et al., 2002) et chez des singes (Rohm et Haas, 1994; Harkema et al., 1997) exposés à l’acrylate d’éthyle pendant trois heures. En raison de différences substantielles de l’anatomie nasale et de l’écoulement de l’air inhalé, l’épithélium olfactif humain est censé retenir des concentrations d’acrylate d’éthyle au moins deux à trois fois plus faibles que celui des rongeurs (Frederick et al., 1998, 2002). L’Environmental Protection Agency des États-Unis a adopté ces études pour calculer les niveaux d’AEGL-1 et d’AEGL-2 (USEPA, 2007). La CMENO critique pour une exposition à court terme par inhalation a été déterminée en fonction d’une inflammation, d’une dégénérescence, d’une nécrose focale et d’une métaplasie malpighienne des cornets nasaux observées chez des rats et des souris exposés à 300 ppm (1 200 mg/m3) d’acrylate d’éthyle pendant 30 jours (Miller et al., 1979). La CMENO critique pour l’inhalation à long terme est de 25 ppm (100 mg/m3) déterminée d’après des lésions des muqueuses olfactives chez des rats et des souris exposés à l’acrylate d’éthyle pendant 6 à 27 mois. Pour la voie cutanée, la DMENO critique établie d’après l’induction de dermatite observée dans une étude sur l’exposition chronique chez des souris est de 800 mg/kg p.c. par jour.
Pour la population générale au Canada, les principales voies d’exposition à l’acrylate d’éthyle devraient être l’inhalation à court terme d’air intérieur et l’utilisation de produits de consommation tels que la peinture et d’autres produits de bricolage. Les propriétés de polymérisation, de photodégradation et de volatilisation spontanées de l’acrylate d’éthyle (OCDE, 2004) devraient réduire au minimum l’exposition à long terme de la population générale à l’inhalation.
La comparaison de la dose associée à un effet critique pour les doses répétées reçues par voie orale (20 mg/kg p.c. par jour) et de la limite supérieure estimée pour l’absorption quotidienne totale d’acrylate d’éthyle dans les milieux environnementaux et dans les aliments par la population générale au Canada (0,00199 à 0,00581 mg/kg p.c. par jour) donne une marge d’exposition variant de 3 500 à 10 000.
Si l’on se fonde sur des modèles utilisant des scénarios concernant les produits de consommation, la concentration d’acrylate d’éthyle dans l’air résultant de l’utilisation de produits de calfeutrage pour des travaux de bricolage est de 0,427 mg/m3. La comparaison de cette limite supérieure et de la fourchette de concentrations associée à un effet critique pour l’inhalation aiguë allant de 100 à 310 mg/m3 donne une marge d’exposition de 230 à 700. L’exposition cutanée à l’acrylate d’éthyle résultant de l’utilisation de lingettes pour nourrissons est de 3,73 × 104 mg/kg p.c. par jour. La comparaison de ce niveau d’exposition et de la concentration associée à un effet critique de 800 mg/kg p.c. par jour pour la voie cutanée provenant d’une étude chronique d’exposition chez la souris donne une marge d’exposition de 2,14 × 106. Cette marge d’exposition est prudente parce que l’exposition provenant de l’utilisation de lingettes personnelles a été comparée à la concentration associée à un effet critique tirée d’une étude de l’exposition chronique par voie cutanée. Cette marge d’exposition est jugée adéquate pour la sensibilisation cutanée et l’irritation cutanée.
Il est aussi important de considérer que 14 à 24 volontaires humains dont la peau a été exposée à l’acrylate d’éthyle (4 % d’acrylate d’éthyle dans de la gelée de pétrole) pendant un test de maximisation de 48 heures n’a montré ni sensibilité ou irritation dermale (Epstein [1974], cité dans Opdyke [1975]).
Les marges d’exposition tiennent adéquatement compte des incertitudes présentes dans les bases de données sur l’exposition et les effets sur la santé.
Incertitudes dans l’évaluation des risques pour la santé humaine
La détermination des marges d’exposition dans le cadre de la présente évaluation préalable ne tient pas compte des différences possibles entre les humains et les animaux de laboratoire en ce qui concerne la sensibilité aux effets de l’acrylate d’éthyle. Les tumeurs du préestomac chez les rongeurs ne sont pas considérées comme pertinentes pour évaluer le risque de cancer chez les humains puisque ceux-ci ne possèdent pas de préestomac même s’ils possèdent des organes similaires sur le plan histologique. De plus, la dose présente dans les tissus du préestomac des rongeurs ayant reçu de l’acrylate d’éthyle par gavage n’est pas représentative de la nature de l’exposition des humains à cette substance. Même si le fait que la toxicité pour le développement s’accompagne d’une toxicité maternelle laisse croire à un effet secondaire, on ne dispose pas d’information sur la toxicité pour la reproduction. La pureté de l’acrylate d’éthyle est généralement supérieure à 99 % et certaines études indiquent que cette substance contient un inhibiteur de polymérisation comme l’éther monométhylique de la tert-butylhydroquinone ou le p-méthoxyphénol. La présence d’un inhibiteur de polymérisation, même en quantité minimale, peut susciter une confusion dans les résultats expérimentaux. La polymérisation, la photodégradation et la volatilisation spontanées de l’acrylate d’éthyle pourraient aussi influer sur les doses réelles utilisées dans les études expérimentales.
En ce qui concerne la population générale, on a déterminé que l’inhalation constitue la voie d’exposition principale aux milieux environnementaux et aux produits de consommation, étant donné la nature volatile et la pression de vapeur de l’acrylate d’éthyle. Même si les données canadiennes disponibles au sujet de l’air intérieur n’indiquaient pas de niveaux quantifiables, on a utilisé la limite de détection employée dans la méthode analytique pour calculer les limites supérieures d’exposition estimées. Les limites supérieures d’exposition à l’acrylate d’éthyle par l’utilisation de produits de consommation suscitent une confiance modérée en raison de l’incertitude qui subsiste au sujet des concentrations d’acrylate d’éthyle résiduel dans les produits de consommation offerts sur le marché. Cependant, l’acrylate d’éthyle se polymérise quand il est exposé à la lumière et, par conséquent, il ne devrait pas être disponible sous forme de monomère.
Compte tenu de l’adéquation des marges d’exposition entre les limites supérieures d’exposition estimées à l’acrylate d’éthyle et les doses associées à un effet critique, il est conclu que l’acrylate d’éthyle ne pénètre pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
D’après les renseignements contenus dans la présente évaluation préalable, il est conclu que l’acrylate d’éthyle ne pénètre pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie. De plus, l’acrylate d’éthyle ne répond pas aux critères de persistance et de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Par conséquent, il est conclu que l’acrylate d’éthyle ne répond pas aux critères énoncés à l’article 64 de la LCPE (1999).
On envisagera d’inclure cette substance dans la mise à jour de la Liste intérieure des substances. De plus, des activités de recherche et de surveillance viendront, le cas échéant, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable.
Aalto-Korte, K., Alanko, K., Kuuliala, O., Jolanki, R. 2007. Methacrylate and acrylate allergy in dental personnel. Contact Derm. 57(5):324330.
ACD/pKaDB [module de prévision]. 2005. Version 9.04. Toronto (Ont.) : Advanced Chemistry Development. Accès :ACD/Labs [consulté le 18 mai 2010 - réserve de consultation].
[AIES] Artificial Intelligence Expert System. 2003-2005. Version 1.25. Ottawa (Ont.) : Environnement Canada. Modèle élaboré par Stephen Niculescu. Disponible auprès de la Division des substances nouvelles, Division des substances existantes, Environnement Canada
Amoore, J.E., Hautala, E. 1983. Odor as an aid to chemical safety: Odor thresholds compared with threshold limit values and volatilities for 214 industrial chemicals in air and water dilution. Journal of Applied Toxicology 3:272-290.
Arnot JA, Gobas FAPC. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb Sci 22(3):337–345.
Ashby, J., Richardson, C.R., Tinwell, H. 1989. Inactivity of ethyl acrylate in the mouse bone marrow micronucleus assay.Mutagenesis 4:283-285.
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d’estimation]. 2008. Version 1.92a. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles
Atkinson, R. 1989. Kinetics and Mechanisms of the Gas-Phase Reactions of the Hydroxyl Radical with Organic Compounds.Journal of Physical and Chemical Reference Data. Monograph No. 1.
BASF AG. 1958. Department of Toxicology, Report of toxicity studies with different acrylates, unpublished studies (VII/309). [cité dans OCDE, 2004].
BASF AG. 1978. Department of Toxicology, Report on the acute skin irritation of methyl acrylate, ethyl acrylate, butyl acrylate and ethyl hexyl acrylate, unpublished study, (XXV/218). Le 20 janvier 1978. [cité dans OCDE, 2004].
BASF AG. 2000. Ethyl Acrylate. In : IUCLID Dataset for ethyl acrylate. Commission européenne. Bureau Européen des Substances Chimiques. Le 18 février 2000.
BASF. 2005. Acute dermal irritation / corrosion in rabbits. M. Remmele (Study Director). BASF Aktiengesellschaft. Laboratory Project No.: 18H0651/042267. Le 15 août. [cité dans OCDE, 2004].
[BAMM] Basic Acrylic Monomer Manufacturers. 1994. Japanese Acrylic Ester Manufacturers: “Japanese Studies on Acrylic Esters and Acrylic Acid”. Le 15 novembre 1994. [cité dans Commission européenne, 2000].
Basler, A., van der Hude, W. 1987. Erbgutveraendernde Gefahrstoffe bga-Schriften 3/87, MMV Muenchen. [cité dans OCDE, 2004]
[BCFWIN] BioConcentration Factor Program for Windows [Estimation Model]. 2000. Version 2.15. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
[BDIPSN] Base de données sur les ingrédients des produits de santé naturels. 2010.
[BDPSNH] Base de données des produits de santé naturels homologués. 2010.
[BIOWIN] Biodegradation Probability Program for Windows [modèle d’estimation]. 2008. Version 4.10. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles
Bjorkner, B., Dahlquist, I. 1979. Contact allergy caused by UV-cured acrylates. Contact Dermatitis 5:403404.
Boethling, R.S., Howard, P.H., Beauman, J.A., Larosche, M.E. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere 30(4):741752.
Boorman, G.A., Sills, R.C. 2003. Ethyl acrylate. In: IARC monographs on the predictive value of rodent forestomach and gastric neuroendocrine tumours in evaluating carcinogenic risks to humans. Publication technique du CIRC n° 39. p. 5764.
Borzelleca, J.F., Larson, P.S., Hennigar, G.R. Jr., Huf, E.G., Crawford, E.M., Smith, R.B. Jr. 1964. Studies on the chronic oral toxicity of monomeric ethyl acrylate and methyl methacrylate.Toxicology and Applied Pharmacology 6:29-36.
Brusick, D. 1977. Ethyl acrylate. Mutagenicity evaluation. Washington (DC) : Litton Bionetics, BAMM. [cité dans ECETOC, 1994].
[BUA] Advisory Committee on Existing Chemicals of Environmental Relevance. 1992. Ethyl acrylate. BUA report 128. Stuttgart (Allemagne) : BUA.
Burdock, G.A. 1997. Fenaroli’s handbook of flavor ingredients. 6e éd. New York (NY) : CRC Press.
Canada. 1978. Règlement sur les aliments et drogues. C.R.C., c. 870.
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999), L.C. 1999, ch. 33, Gazette du Canada. Partie III, vol. 22, n° 3.
Canada. 2000. Loi canadienne sur la protection de l’environnement (1999) : Règlement sur la persistance et la bioaccumulation. C.P. 2000-348, 23 mars 2000, DORS/2000-107.Gazette du Canada. Partie II, vol. 134, n° 7
Canada. Ministère de l’Environnement, ministère de la Santé. 2006. Loi canadienne sur la protection de l’environnement (1999) : Avis d’intention d’élaborer et de mettre en œuvre des mesures d’évaluation et de gestion des risques que certaines substances présentent pour la santé des Canadiens et leur environnement. Gazette du Canada, Partie I, vol. 140, n° 49
Canada. Ministère de l’Environnement, ministère de la Santé. 2009. Loi canadienne sur la protection de l’environnement (1999) : Avis de onzième divulgation d’information technique concernant les substances identifiées dans le Défi. Gazette du Canada, Partie I, vol. 143, n° 39.
[CATABOL] Probabilistic assessment of biodegradability and metabolic pathways [modèle informatique]. c2004-2008. Version 5.10.2. Bourgas (Bulgarie) : Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. CATALOGIC.
[Cedre] Centre de documentation, de recherche et d’expérimentations sur les pollutions accidentelles des eaux. 2006. Acrylate d’éthyle : guide d’interventation chimique.
Celanese Chem. Co. 1972. Primary Skin Irritation Tests with Eighteen Materials in Albino Rabbits with Cover Letter dated July 28, 1972. OTS0206028 Doc ID 878212151. [cité dans Commission européenne, 2000]
[ChemCAN]. 2003. ChemCAN: level III. fugacity model of regional fate of chemicals [en ligne]. Version 6.00. Peterborough (Ont.) : Canadian Environmental Modelling Centre, Trent University. Modèle ChemCAN.
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 1986. Ethyl acrylate. IARC Monogr. Eval. Carcinog. Risks Hum. 39:8198.
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 1999. Ethyl acrylate. IARC Monogr. Eval. Carcinog. Risks Hum. 71(3):1447-57.
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 2003. Predictive value of rodent forestomach and gastric neuroendocrine tumours in evaluating carcinogenic risks to humans. Views and expert opinions of an IARC working group. Lyon, du 29 novembre au 1er décembre 1999. Publication technique du CIRC n° 39.
Commission européenne. 2000. IUCLID Dataset: Ethyl acrylate, CAS No. 140-88-5 [en ligne]. Ispra (Italie) : Commission européenne, Centre conjoint de recherche, Institut pour la santé et la protection des consommateurs, Bureau Européen des Substances Chimiques. [consulté le 18 janvier 2010].
Conde-Salazar L, Guimaraens D, Romero LV. 1988. Occupational allergic contact dermatitis from anaerobic acrylic sealants.Contact Dermatitis 18:129-132.
[ConsExpo] Consumer Exposure Model [en ligne]. 2006. Version 4.1. Bilthoven (Pays-Bas) : Rijksinstituut voor Volksgezondheid en Milieu (Institut national néérlandais de la santé publique et de l’environnement). ConsExpo 4.1.
Daubert, T.E.,Danner, R.P. 1991. Physical and thermodynamic properties of pure chemicals: Data compilation. Design Inst. Phys. Prop. Data., Amer. Inst. Chem. Eng. NY. NY : Hemisphere Pub. Corp. 5 Vol.
Dearfield, K.L., Harrington-Brock, K., Doerr, C.L., Rabinowitz, J.R., Moore, M.M. 1991. Genotoxicity in mouse lymphoma cells of chemicals capable of Michael addition. Mutagenesis6(6):519525.
De Bethizy, J.D., Udinsky, J.R., Scribner, H.E., Frederick, C.B. 1987. The disposition and metabolism of acrylic acid in male Sprague-Dawley rats. Fund. Appl. Toxicol. 8:549561.
Delbressine, L.P.C., Van Balen, H.C.J.G., Seutter-Berlage, F. 1982. Isolation and identification of mercapturic acid metabolites of phenyl substituted acrylate esters from urine of female rats.Arch. Toxicol. 49:321-330.
De Ceaurriz, J.C., Micillino, J.C., Bonnet, P., Guenier, J.P. 1981. Sensory irritation caused by various industrial airborne chemicals. Toxicol. Lett. 9(2):137-143.
DePass, L.R., Fowler, E.H., Meckley, D.R., Weil, C.S. 1984. Dermal oncogenicity bioassays of acrylic acid, ethyl acrylate, and butyl acrylate. Journal of Toxicology and Environmental Health 14:115-120.
Dow Chemical Co. 1957. Results of range finding toxicological tests on ethyl acrylate. TSCATS, Doc. I.D. 90001181S (1989). [cité dans BUA, 1992]
Dow Chemical Co. 1964. Preliminary toxicology information on ethyl acrylate. TSCATS, Doc. I.D. 86-90001182S (1989). [cité dans BUA, 1992]
Dow Chemical Co. 1979a. Pathologic findings in rats exposed by inhalation to vapors for 12 months including a group which was exposed to 225 ppm for 6 months & then held for a recovery period of 6 months. OTS0520802, Doc ID 86-890001298.
Dow Chemical Co. 1979b. Pathologic findings in mice exposed by inhalation to 225 ppm ethyl acrylate for 6 months and subsequently held for a recovery period of three months with cover letter dated 061589. OTS0520788, Doc ID 86-890001282.
[ECETOC] European Centre for Ecotoxicology and Toxicology of Chemicals. 1994. Ethyl acrylate (CAS No. 140-88-5). Joint Assessment of Commodity Chemicals (JACC). Rapport n° 28.
[ECOSAR] Ecological Structural Activity Relationships [en ligne]. 2008. Version 1.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles
Emmert, B., Bunger, J., Keuch, K., Muller, M., Emmert, S., Hallier, E., Westphal, G.A. 2006. Mutagenicity of cytochrome P450 2E1 substrates in the Ames test with the metabolic competent S. typhimurium strain YG7108pin3ERb5. Toxicology228:6676.
Environnement Canada. 1988. Données de la Liste intérieure des substances (LIS), 1984-1986, recueillies en vertu du paragraphe 25(1) de la Loi canadienne sur la protection de l’environnement (1988) et conformément à la Liste intérieure des substances : guide du déclarant. Données produites par Environnement Canada.
Environnement Canada. 2007. Guidance for Conducting Ecological Assessments under CEPA, 1999, Science Resource Technical Series, Technical Guidance Module: QSARs. Document de travail préliminaire révisé. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique. Disponible sur demande.
Environnement Canada. 2008. Inventaire national des rejets de polluants [base de données en ligne]. Gatineau (Qc) : Environnement Canada. [consultée le 20 juin 2010].
Environnement Canada. 2009a. Guidance for Conducting Ecological Assessments under CEPA, 1999, Science Resource Technical Series, Technical Guidance Module: The Industrial Generic Exposure Tool - Aquatic (IGETA). Document de travail. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique. Disponible sur demande.
Environnement Canada. 2009b. Guidance for conducting ecological assessments under CEPA 1999: science resource technical series, technical guidance module: Mega Flush consumer release scenario. Document de travail. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique. Disponible sur demande.
Environnement Canada. 2010a. Données sur les substances du lot 11 recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances identifiées dans le onzième lot du Défi. Données préparées par Environnement Canada, Programme des substances existantes.
Environnement Canada. 2010b. Données tirées des questionnaires volontaires relatifs aux substances contenues dans le lot 11 du Plan de gestion des produits chimiques. Préparé par Environnement Canada, Division des substances existantes.
Environnement Canada. 2010c. IGETA Report: CAS No. 140-88-5. Le 11 mars 2010. Rapport inédit. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique. Ecological Assessment. Disponible sur demande.
Environnement Canada. 2010d. Mega Flush Report: CAS No. 140-88-5. Le 9 avril 2010. Version 1. Rapport inédit. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique. Disponible sur demande.
[EPIsuite] Estimation Programs Interface Suite for Microsoft Windows [modèle d’estimation]. 2008. Version 4.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
Epstein, W.L. 1974. Report to Research Institute for Fragrance Materials (RIFM). Le 7 octobre 1974. [cité dans Opdyke, 1975]
[EQC] Equilibrium Criterion Model. 2003. Version 2.02. Peterborough (Ont.) : Trent University, Canadian Environmental Modelling Centre. Modèle EQC.
Foulger, J.H., Fleming, A.J. 1945. Toxicity of ethyl acrylate monomer. TSCATS, Doc. I.D. 86-890000837, DuPont de Nemours and Co. [cité dans BUA, 1992].
Frederick, C.B., Hazelton, G.A., Frantz, J.D. 1990. The histopathological and biochemical response of the stomach of male F344/N rats following two weeks of oral dosing with ethyl acrylate.Toxicol. Pathol. 18(2):247-56.
Frederick, C.B., Chang-Mateu, L.M. 1990. Contact site carcinogenicity: estimation of an upper limit for risk of dermal dosing site tumors based on oral dosing site carcinogenicity.In : Gerrity, T.R., Henry, C.J. (éd.). Principles of Route-to-Route Extrapolation for Risk Assessment. p. 237-270. New York (NY) : Elsevier.
Frederick, C.B., Potter, D.W., Chang-Mateu, M.J., Andersen, M.E. 1992. A physiologically based pharmacokinetic and pharmacodynamic model to describe oral dosing of rats with ethyl acrylate and its implications for risk assessment. Toxicol. Appl. Pharmacol. 114:246260.
Frederick, C.B., Udinsky, J.R., Finch, L. 1994a. The regional hydrolysis of ethyl acrylate to acrylic acid in the rat nasal cavity. Toxicol. Lett. 70:4956.
Frederick, C.B., Morris, J.R., Kimbell, J.S., Morgan, K.T., Scherer, P.W. 1994b. Comparison of four biologically-based dosimetry models for the deposition of rapidly metabolized vapors in the rodent nasal cavity. Inhalation Toxicology 6 (supp.):135-157.
Frederick, C.B. 1998. Potential for inhalation exposure to residual ethyl acrylate monomer from latex paints. Rohm and Haas Company, Toxicology Department, Report Number 98R-1107.
Frederick, C.B., Bush, M.L., Lomax, L.G., Black, K.A., Finch, L., Kimbell, J.S., Morgan, K.T., Subramaniam, R.P., Morris, J.B., Ultman, J.S. 1998. Application of a hybrid computational fluid dynamics and physiologically based inhalation model for interspecies dosimetry extrapolation of acidic vapors in the upper airways. Toxicol. Appl. Pharmacol. 152(1):211-31.
Frederick, C.B., Lomax, L.G., Black, K.A., Finch, L., Scribner, H.E., Kimbell, J.S., Morgan, K.T., Subramaniam, R.P., Morris, J.B. 2002. Use of a hybrid computational fluid dynamics and physiologically based inhalation model for interspecies dosimetry comparisons of ester vapors. Toxicol. Appl. Pharmacol. 183(1):2340.
Fregert, S. 1978. Allergic contact dermatitis from ethylacrylate in a window sealant. Contact dermatitis 4:56.
Gabor, S., Anca, L., Ivanov, L., Borda, M., Bozac, L. 1965. The chronic effect of inhalation of low methyl methacrylate and ethyl acrylate concentrations as shown by experiments on animals.Igiena 14:593-600 [en roumain]. [cité dans ECETOC, 1994]
Gavin, C.L, Williams, M.C., Hallagan, J.B. 2008. Flavor and Extract Manufacturers Association of the United States 2005 Poundage and Technical Effects Update Survey. Washington (DC) : Flavor and Extract Manufacturers Association of the United States.
Geiger, D.L., Brooke, L.T., Call, D.J. 1990. Acute Toxicities of Organic Chemicals to Fathead Minnows (Pimephales promelas). Vol. 5. Center for Lake Superior Environmental Studies. Superior (WI) :University of Wisconsin. 332 p.
Ghanayem, B.I., Maronpot, R.R., Matthews, H.B. 1985. Ethyl acrylate-induced gastric toxicity I. Effect of single and repetitive dosing. Tox. Appl. Pharmacol. 80:323335.
Ghanayem, B.I., Maronpot, R.R., Matthews, H.B. 1986. Ethyl acrylate-induced gastric toxicity III. Development and recovery of lesions. Toxicol. Appl. Pharm. 83:576-583.
Ghanayem, B.I., Burka, L.T., Matthews, H.B. 1987. Ethyl acrylate distribution, macromolecular binding, excretion, and metabolism in male Fisher 344 rats. Fund. Appl. Toxicol. 9:389-397.
Ghanayem, B.I., Matthews, H.B., Maronpot, R.R. 1991. Sustainability of forestomach hyperplasia in rats treated with ethyl acrylate for 13 weeks and regression after cessation of dosing. Tox. Pathol. 19:273-279.
Ghanayem, B.I., Sanchez, I.M., Maronpot, R.R., Elwell, M.R., Matthews, H.B. 1993. Relationship between the time of sustained ethyl acrylate forestomach hyperplasia and carcinogenicity.Environ. Health Perspect. 101:277-280.
Ghanayem, B.I., Sanchez, I.M., Matthews, H.B., Elwell, M.R. 1994. Demonstration of a temporal relationship between ethyl acrylate-induced forestomach cell proliferation and carcinogenicity. Toxicol. Pathol. 22(5):497-509.
Harkema, J.R., Lee, J.K., Morgan, K.T., Frederick, C.B. 1997. Olfactory epithelial injury in monkeys after acute inhalation exposure to acrylic monomers. Toxicologist 36:113 [cité dans USEPA, 2007]
Haskell Laboratories for Dupont de Nemours. 1945. Toxicity of ethyl acrylate monomer with cover sheet dated 061289. OTS0520953 Doc ID 86-890000837. [cité dans Commission européenne, 2000]
Hara, T., Katoh, M., Horiya, N., Shibuya, T. 1994. Ethyl acrylate is negative in the bone marrow micronucleus test using BDF1 male mice. Environ. Mut. Res. Commun. 16:211215.
Haworth, S., Lawlor, T., Mortelmans, K., Speck, W., Zeiger, E. 1983. Salmonella mutagenicity test results for 250 chemicals.Environ. Mutagen. Vol. 5 (Suppl 1):3-142.
Hayes, B.B., Meade, B.J. 1999. Contact sensitivity to selected acrylate compounds in B6C3F1 mice: relative potency, cross reactivity, and comparison of test methods. Drug Chem. Toxicol. 22:491-506.
[HENRYWIN] Henry’s Law Constant Program for Microsoft Windows [modèle d’estimation]. 2008. Version 3.20. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
Base de données de produits ménagers [base de données en ligne]. 2009. Septembre 2009. Bethesda (MD) : US Department of Health and Human Services.
Huff, J. 1995. Mechanisms, chemical carcinogenesis, and risk assessment: cell proliferation and cancer. Am. J. Ind. Med. 27(2):293-300.
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [modèle d’estimation]. 2008. Version 2.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.Outils d'évaluation de l'exposition et des modèles.
[INRP] Inventaire national des rejets de polluants [base de données en ligne]. 2008. Gatineau (Qc) : Environnement Canada. [consultée le 21 mars 2009].
Institute of Biological Research. 1983. Comparative histopathologic evaluation of changes in the nasal cavity of the rat after exposure to methyl, ethyl and butyl acrylate with cover letter dated 071289. OTS0520801, Doc ID 86-890001297.
Ishidate, M., Sofuni, T. Jr., Yoshikawa, K. 1981. Chromosomal aberration tests in vitro as a primary screening tool for environmental mutagens and/or carcinogens. Gann Monograph on Cancer Research 27:95-108.
[IUCLID]. International Uniform Chemical Information Database. 2000. IUCLID Dataset. Ethyl acrylate. Commission européenne. Bureau européen des substances chimiques. Le 18 février 2000.
Japon. Résumé du rapport d'évaluation du risque initial. Ethyl acrylate. CAS No. 140-88-5. PRTR No. 4. R0074. Accès: .
[JECFA] Comité mixte d’experts FAO/OMS sur les additifs alimentaires. 2006. Évaluation de la sécurité de certains les additifs alimentaires, (WHO food additives series: 54) [en ligne]. Genève (Suisse). [2010-07-07].
Jersey, G.C., Keyes, D.G., Battjes, J.E. 1978. Pathologic findings in rats exposed by inhalation to vapors of ethyl acrylate for 6 months. Midland (MI) : Health and Environmental Research, Toxicology Research Laboratory, Dow Chemical. TSCATS: OTS0520180, Doc-ID: 86-890001037
Jordan, W.P. Jr. 1975. Cross-sensitization patterns in acrylate allergies. Contact Dermatitis 1(1):13-5.
Kanerva, L., Estlander, T., Jolanki, R. 1988. Sensitization to patch test acrylates. Contact Dermatitis 18(1):10-15.
Kanerva, L., Estlander, T., Jolanki, R. 1989. Allergic contact dermatitis from dental composite resins due to aromatic epoxy acrylates and aliphatic acrylates. Contact Dermatitis20(3):201-11.
Kanerva, L., Estlander, T., Jolanki, R. 1992. Double active sensitization caused by acrylics. Am. J. Contact Derm. 3:23-26.
Kanerva, L., Estlander, T., Jolanki, R., Tarvainen, K. 1995. Statistics on allergic patch test reactions caused by acrylate compounds, including data on ethyl methacrylate. Am. J. Contact Derm. 6:75.
Kelly, T.J., Callahan, P.J., Pleil, J., Evans, G.F. 1993. Method development and field measurements for polar volatile organic compounds in ambient air. Environ. Sci. Technol. 27:11461153.
Kimber, I. 1992. Skin sensitization [EA negative in murine local lymph node assay]. Communication personnelle avec Mackay, J.M. le 12 novembre 1992. ICI CTL, Macclesfield. [cité dans ECETOC, 1994].
Kligerman, A.D., Atwater, A.L., Bryant, M.F., Erexson, G.L., Kwanyuen, P.K., Dearfield, K.L. 1991. Cytogenetic studies of ethyl acrylate using C57BL/6 mice. Mutagenesis 6(2):137-141.
[KOAWIN] Octanol Air Partition Coefficient Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.10. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles
Koppula, S.V., Fellman, J.H., Storrs, F.J. 1995. Screening allergens for acrylate dermatitis associated with artificial nails.Am. J. Contact Derm. 6:78-85.
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.67. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : Outils d'évaluation de l'exposition et des modèles
Kuzelova, M., Kovarik, J., Fiedlerova, D., Popler, A. 1981. Acrylic compounds and general health of the exposed persons.Pracov Lék 33:95-99 (en tchèque) [Doc Occup Health 8:1612; Chem. Abstr. 96:24169v]. [cité dans ECETOC, 1994].
Lazarov A. 2007. Sensitization to acrylates is a common adverse reaction to artificial fingernails. Journal of the European Academy of Dermatology and Venereology 21(2):169-174.
Lomonova, G.V., Klimova, E.I. 1979. Data on the toxicology of acrylic acid methyl and ethyl esters. Gig. Tr. Prof. Zabol9:5556 [cité dans ECETOC, 1994; Commission européenne, 2000].
Loveday, K.S., Anderson, B.E., Resnick, M.A., Zeiger, E. 1990. Chromosome aberration and sister chromatid exchange tests in Chinese hamster ovary cells in vitro. V: results with 46 chemicals.Environ. Mol. Mutagen. 16:272-303.
Lucas, C.D., Putnam, J.M., Hallagan, J.B. 1999. 1995 Poundage and Technical Effects Update Survey. Washington (DC) : Flavor and Extract Manufacturers Association (FEMA) of the United States.
Mabey, W., Mill, T. 1978. Critical Review of Hydrolysis of Organic Compounds in Water Under Environmental Conditions. J. Phys. Chem. Ref. Data. 7:383-415.
Malten, K.E., van Ketel, W.G., Nater, J.P., Liem, D.H. 1984. Reactions in selected patients to 22 fragrance materials.Contact Dermatitis 11:1-10.
Marks, J.G., Belsito, D.V. Jr., DeLeo, V.A., Fowler, J.F., Fransway, A.F. Jr., Maibach, H.I., Mathias, C.G.T., Nethercott, J.R., Rietschel, R.L., Rosenthal, L.E., et al. 1995. North American Contact Dermatitis Group standard tray patch test results (1992 to 1994). Am. J. Contact Derm. 6:160-165.
Matthews, E.J., Spalding, J.W., Tennant, R.W. 1993. Transformation of BALB/c-3T3 cells: V. Transformation responses of 168 chemicals compared with mutagenicity in Salmonella and carcinogenicity in rodent bioassays. Environ. Health Perspect. 101(Suppl 2):347-482.
McCarthy, T.J., Hayes, E.P., Schwartz, C.S., Witz, G. 1994. The reactivity of selected acrylate esters toward glutathione and deoxyribonucleosides in vitro: structure-activity relationships. Fund. Appl. Toxic. 22:543-548.
McGregor, D.B., Brown, A., Cattanach, P., Edwards, I., McBride, D.M., Riach, C., Caspary, W.J. 1988. Responses of the L5178Y tk+/tk- mouse lymphoma cell forward mutation assay: III. 72 coded chemicals. Environ. Molec. Mutagen. 12:85-154.
McLaughlin, J.E., Baldwin, R.C., Smith, J.M. 1993. Ethyl Acrylate Health Effects Overview. In: Tyler, T.R., Reiss Murphy, S., Hunt, E.K. (éditeurs). Health Effect Assessments of the Basic Acrylates. Ann Arbor (MI) : CRC Press.
Melnick, R.L., Huff, J., Barrett, J.C., Maronpot, R.R., Lucier, G., Portier, C.J. 1993. Cell proliferation and chemical carcinogenesis: symposium overview. Environ. Health Perspect. 101(Suppl 5):3-7.
Miller, R.R., Jersey, G.A., Betso, J.E., Rampy, L.W. 1979. 30-day ethyl acrylate vapor inhalation study with rats and mice, final report. Midland (MI) : Dow Chemical USA. [cité dans ECETOC, 1994].
Miller, R.R., Ayres, J.A., Rampy, L.W., McKenna, M.J. 1981. Metabolism of acrylate esters in rat tissue homogenates.Fundam. Appl. Toxicol. 1:410-414.
Miller, R.R., Young, J.T., Kociba, R.J., Keyes, D.G., Bodner, K.M., Calhoun, L.L., Ayres, J.A. 1985. Chronic toxicity and oncogenicity bioassay of inhaled ethyl acrylate in Fischer 344 rats and B6C3F1 mice. Drug and Chemical Toxicology 8:1-42.
[MITI] Ministry of International Trade & Industry (Japon), Basic Industries Bureau, Chemical Products Safety Division. 1992. Biodegradation and bioaccumulation data of existing chemicals based on the CSCL Japan. Tokyo (Japon) : Japan Chemical Industry Ecology-Toxicology & Information Center.
Moore, M.M., Amtower, A., Doerr, C.L., Brock, K.H., Dearfield, K.L. 1988. Genotoxicity of acrylic acid, methyl acrylate, ethyl acrylate, methyl methacrylate, and ethyl methacrylate in L5178Y mouse lymphoma cells. Environmental and Molecular Mutagenesis 11:49-63.
Moore, M.M., Harrington-Brock, K., Doerr, C.L., Dearfield, K.L. 1989. Differential mutant quantitation at the mouse lymphoma tk and CHO hgprt loci. Mutagenesis 4:394-403.
Morita, T., Asano, N., Awogi, T., Sasaki, Y.F., Sato, S., Shimada, H., Sutou, S., Suzuki, T., Wakata, A., Sofuni, T. et al. 1997. Evaluation of the rodent micronucleus assay in the screening of IARC carcinogens (groups 1, 2A and 2B) the summary report of the 6th collaborative study by CSGMT/JEMS MMS. Collaborative Study of the Micronucleus Group Test. Mammalian Mutagenicity Study Group (published erratum). Mutat. Res.391(3):259-67; 389:3-122.
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.43. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles
Murray, J.S., Miller, R.R., Deacon, M.M., Hanley, T.R., Hayes, W.C., Rao, K.S., John, J.A. 1981. Teratological evaluation of inhaled ethyl acrylate in rats. Tox. Appl. Pharmacol.60:106-111.
Myhr, B.C. 1980. Mutagenicity evaluation of ethyl acrylate monomer in the mouse lymphoma forward mutation assay. Washington (DC) : Litton Bionetics, Basic Acrylic Monomer Manufacturers, Inc (BAMM). [cité dans ECETOC, 1994]
[NCI] National Chemical Inventories [base de données sur CD-ROM]. 2006. Issue 1. Columbus (OH) : American Chemical Society, Chemical Abstracts Service. [consultée en janvier 2010]
[NITE] National Institute of Technology and Evaluation [en ligne]. c2008. Japan: Ethyl Acrylate; [consulté le 19 mars 2010].Carte du site
[NTP] National Toxicology Program. 1986a. Études de cancérogenèse d'acrylate d'éthyle (n° CAS 140-88-5) sur des rats F344/N et des souris B6C3F1 (études de gavage) . Research Triangle Park (NC) : U.S. Department of Health and Human Services, National Toxicology Program. Report No.: TR 259.
[NTP] National Toxicology Program. 1986b. In vitro cytogenetics chromosome aberration and sister chromatid exchange studies of ethyl acrylate (CAS # 140-88-5). Research Triangle Park (NC) : U.S. Department of Health and Human Services, National Toxicology Program. Étude ID: 550589.
[NTP] National Toxicology Program. 1989. Rapport sur les cancérogènes, 5th ed., Carcinogen Profiles. Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program.
[NTP] National Toxicology Program. 1994. Assessment of contact hypersensitivity to ethyl acrylate in female B6C3F1 mice. Report to National Toxicology Program, Medical College of Virginia. Protocol No. EAC-3-1-TO [cité dans OCDE, 2004]
[NTP] National Toxicology Program. 1998. Rapport sur les cancérogènes document de base pour l'acrylate d'éthyle. Research Triangle Park (NC) : US Department of Health Services, National Toxicology Program.
[NTP] National Toxicology Program. 2000. Rapport sur les cancérogènes, 9th ed., Carcinogen Profiles. Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program.
Nylander-French, L.A., French, J.E. 1998. Tripropylene glycol diacrylate but not ethyl acrylate induces skin tumors in a twenty-week short-term tumorigenesis study in Tg.AC (v-Ha-ras) mice. Toxicologic Pathology 26(4):476-483.
[OASIS Forecast] Optimized Approach based on Structural Indices Set [en ligne]. 2005. Version 1.20. Bourgas (Bulgarie) : Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry.Logiciels OASIS
Oberly, R., Tansy, M.F. 1985. LC50 Values for rats acutely exposed to vapors of acrylic and methacrylic acid esters.Journal of Toxicology and Environmental Health16:811-822.
[OCDE] Organisation de coopération et de développement économiques. 1992. Lignes directrices de l’OCDE pour les essais de produits chimiques. Essai 301D - Biodégradabilité facile : essai en flacon fermé.
[OCDE] Organisation de coopération et de développement économiques. 2003. Lignes directrices de l’OCDE pour les essais de produits chimiques. Essai 310 - Biodégradabilité facile : dégagement de CO2 dans des flacons hermétiquement clos (essai de l'espace libre au-dessus du liquide).
[OCDE] Organisation de coopération et de développement économiques. 2004. Ethyl Acrylate. CAS No. 140-88-5. SIDS initial assessment report for SIAM 18 [en ligne]. Genève (Suisse) : Programme des Nations Unies pour l’environnement (PNUE). [consulté le 3 février 2010].
[OCDE] Organisation de coopération et de développement économiques. 2005. Ethyl Acrylate d’éthyle. CAS No. 140-88-5. SIDS Dossier [en ligne]. Genève (Suisse) : Programme des Nations Unies pour l’environnement. [consulté le 19 août 2009].
Oettel, H., Zeller, H. 1958. Bericht über die Prüfung der Haut- und Schleimhautreizwirkung verschiedener Acrylsäureester. Ludwigshafen (Allemagne) : BASF. [cité dans ECETOC, 1994].
Oettel, H., Hofmann, H.T. 1960. Bericht über die toxikologische Prüfung verschiedener Acrylsäureester an Kaninchen and Katzen. Ludwigshafen (Allemagne) : BASF. [cité dans ECETOC, 1994].
O’Neil, M.J. (éd.) 2006. The Merck index--An encyclopedia of chemicals, drugs and biologicals. 14e éd. Whitehouse Station (NJ) : Merck & Co.
O’Neil, M.J, Smith, A., Heckleman, P.E., Obenchain Jr, J.R., Gallipeau, J.R., D’Arecca, M.A., Budavari, S. (éd.). 2001. The Merck Index.Ethyl acrylate.
Opdyke, D.L.J. 1975. Ethyl acrylate, monograph on raw materials 17. Food Cosmet. Toxicol. suppl 13:801802.
Otson, R., Fellin, P., Tran, Q. 1994. VOCs in representative Canadian residences. Atmospheric Environment28:3563-3569
Paulet, G., Vidal, M. 1975. De la toxicité de quelques esters acryliques et méthacryliques, de l’acrylamide et des polyacrylamdies. Arch. Mal. Prof. Med. Trav. Secur. Soc. 36:5860. [cité dans OCDE, 2004].
[PCKOCWIN] Organic Carbon Partition Coefficient Program for Windows [modèle d’estimation]. 2008. Version 1.66. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles
Pietrowicz, D., Owecka, A., Baranski, B. 1980. Disturbances in rats embryonal development due to ethylacrylate. Zwierzeta Laboratoryine 17:67-72. [cité dans CIRC, 1986; OCDE, 2004]
[PISSC] Programme international sur la sécurité des substances chimiques. 2004. Ethyl acrylate. ICSC: 0267.
Poole, L.J. 1980. Acrylate d’éthyle (AE) : Irritation studies in the rabbit. Report Cl80:66:2031. Consultox Laboratories Limited. Rapport rédigé pour Norsolor. [cité dans OCDE, 2004]
Potokar, M., Grundler, O.J., Heusener, A., Jung, R., Mürmann, P., Schöbel, C., Suberg, H., Zechel, H.J. 1985. Studies on the design of animal tests for the corrosiveness of industrial chemicals. Fd Chem. Toxic. 23:615617.
Potter, D.W., Tran, T.B. 1992. Rates of ethyl acrylate binding to glutathione and protein. Toxicol. Lett. 62:275285.
Pozzani, U.C., Weil, C.S., Carpenter, C.P. 1949. Subacute vapor toxicity and range-finding data for ethyl acrylate. J. Industrial Hyg. Toxicol. 31(6):311-316.
Preston-Martin, S., Pike, M.C., Ross, R.K., Jones, P.A., Henderson, B.E. 1990. Increased cell division as a cause of human cancer. Cancer Res. 50(23):7415-21.
Proctor, D.M., Gatto, N.M., Hong, S.J., Allamneni, K.P. 2007. Mode-of-action framework for evaluating the relevance of rodent forestomach tumors in cancer risk assessment. Toxicol. Sci. 98(2):313326.
Przybojewska, B., Dziubaltowska, E., Kowalski, Z. 1984. Genotoxic effects of ethyl acrylate and methyl acrylate in the mouse evaluated by the micronucleus test. Mutation Research 135:189-191.
Riddick, J.A., Bunger, W.B., Sakano, T.K. 1986. Ethyl acrylate. Techniques of Chemistry. Volume II. Organic solvents. Physical properties and methods of purification. Quatrième édition. Toronto (Ont.) : John Wiley & Sons.
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2006. Cosmetics fact sheet: To assess the risks for the consumer. Version mise à jour pour ConsExpo 4 [en ligne]. Bilthoven (Pays-Bas) : RIVM (Institut national néérlandais de la santé publique et de l’environnement). Rapport n° 320104001/2006.
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2007a. Do-it-yourself products fact sheet: To assess the risks for the consumer [en ligne]. Bilthoven (Pays-Bas) : RIVM (Institut national néérlandais de la santé publique et de l’environnement). Rapport n° 320104007/2007.
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2007b. Paint products fact sheet: To assess the risks for the consumer. Version mise à jour pour la version 4 de ConsExpo [en ligne]. Bilthoven (Pays-Bas) : RIVM (Institut national néérlandais de la santé publique et de l’environnement). Rapport n° 320104008/2007.
Rohm and Haas Company. 1950a. Munch Research Laboratories, Inc. (Testing Facility). Acute oral toxicity in mice. Spring House (PA) : Rohm and Haas Toxicology Department. Rapport n° 50RC-1003. Rapport inédit. [cité dans OCDE, 2004].
Rohm and Haas Company. 1950b. Acute toxicity studies, group III: methyl acrylate and ethyl acrylate. Document rédigé par Munch Res. Lab. Spring House (PA) : Rohm and Haas. [cité dans ECETOC. 1994].
Rohm and Haas Company. 1977. Mutagenicity evaluation of ethyl acrylate. Litton Bionetics, Inc. (Testing Facility). LBI Project No. 2683. Spring House (PA) : Rohm and Haas Toxicology Department. Rapport n° 77RC-1024. Rapport inédit. [cité dans OCDE, 2004].
Rohm and Haas Company. 1981. Ethyl acrylate: microbial mutagen test. Spring House (PA) : Rohm and Haas Toxicology Department. Rapport n° 80R-212. Rapport inédit. [cité dans OCDE, 2004].
Rohm and Haas Company. 1983. Situation and results of recent investigations into the toxicity of acrylic acid and its esters and a NTP technical report on the carcinogenesis bioassay of ethyl acrylate W-attachments. OTS0520798, Doc ID 86-890001294. [cité dans Commission européenne, 2000].
Rohm and Haas.Company. 1984. Acute definitive oral LD50 in rats- ethyl acrylate monomer. Spring House (PA) : Rohm and Haas Toxicology Department. Rapport n° 84R-0208. Rapport inédit. [cité dans OCDE, 2004].
Rohm and Haas Company. 1986a. Acute definitive dermal LD50 in rats (occluded) - ethyl acrylate monomer. Spring House (PA) : Rohm and Haas Toxicology Department. Rapport n° 86R-017A. Rapport inédit [cité OCDE, 2004].
Rohm and Haas Company. 1986b. Ethyl acrylate: 2-week oral (gavage) study in rats. Spring House (PA) : Rohm and Haas Toxicology Department. Rapport n° 86R-063. Rapport inédit. [cité dans OCDE, 2004].
Rohm and Haas Company. 1986c. Toxicity report, acute dermal LD50 definitive, rats (unoccluded). Document rédigé par Morrison, R.D., Hazelton, G.A. Spring House (PA) : Rohm and Haas. [cité dans ECETOC, 1994].
Rohm and Haas Company. 1986d. Toxicity report, acute dermal LD50 definitive, mice (occluded). Document rédigé par Morrison, R.D., Hazelton, G.A. Spring House (PA) : Rohm and Haas. [cité dans ECETOC, 1994].
Rohm and Haas Company. 1987. Ethyl acrylate: three month oral gavage study in rats. Spring House (PA) : Rohm and Haas. Rapport n° 86R-153. Rapport inédit. [cité dans OCDE, 2004].
Rohm and Hass Company. 1991. Ethyl acrylate (15 ppm MEHQ) skin irritation study in rabbits. Spring House (PA) : Rohm and Hass. Rapport n° 90R-268. Rapport inédit. [cité dans OCDE, 2004].
Rohm and Haas Company. 1994. Single dose inhalation toxicity study of ethyl acrylate (EA) and acrylic acid (AA) in monkeys. Rapport intermédiaire d’une étude pharmacocinétique, avec lettre d’accompagnement datée du 8 décembre 1994. Doc. ED 86-950000051 OTS0557564.
Rustemeyer, T., Frosch, P.J. 1996. Occupational skin diseases in dental laboratory technicians: (I). Clinical picture and causative factors. Contact Dermatitis 34:125-133.
Saillenfait, A., Bonnet, P., Gallissot, F., Protois, J.C., Peltier, A., Fabries, J.F. 1999. Relative developmental toxicities of acrylates in rats following inhalation exposure.Toxicological Sciences 48:240245.
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Ottawa (Ont.) : Santé Canada, Direction de l’hygiène du milieu.
Schwartz, B.S., Doty, R.L., Monroe, C., Frye, R., Barker, S. 1989. Olfactory function in chemical workers exposed to acrylate and methacrylate vapors. Am. J. Public Health79:613-618.
Sherman, J. 1985. Case study re: birth defects reported in a baby of mother exposed to SK-131-A and SK131-B with attachments and cover letter dated 081685. TSCATS, FYI-OTS-0885-0402. Document présenté par Sherman J., Michigan. [cité dans BUA, 1992].
Silver, E.H., Murphy, S.D. 1981. Potentiation of acrylate ester toxicity by prior treatment with the carboxylesterase inhibitor triorthotolyl phosphate (TOTP). Tox. Appl. Pharmacol. 57:208-219.
Shimizu, M., et al. 1994. Annual Report of Osaka City Institute of Public Health and Environmental Sciences 51, 11-17 (1988). In : Basic Acrylic Monomer Manufacturers, Japanese Acrylic Ester Manufacturers: “Japanese Studies on Acrylic Esters and Acrylic Acid”, 11-15-94. [cité dans Commission européenne, 2000].
Skoglund, A., Egelrud, T. 1991. Hypersensitivity reactions to dental materials in patients with lichenoid oral mucosal lesions and in patients with burning mouth syndrome. Scand. J. dent. Res. 99:320.
Staples, CA, Murphy, S.R., McLaughlin, J.E., Leung, H.-W., Cascieri, T.C., Farr, C.H. 2000. Determination of selected fate and aquatic toxicity charactericstics of acrylic acid and a series of acrylic ester. Chemosphere 40:29-38.
Steele, V.E., Arnold, J.T., Van Arnold, J., Mass, M.J. 1989. Evaluation of a rat tracheal epithelial cell culture assay system to identify respiratory carcinogens. Environ. Mol. Mutagen. 14:48-54.
Stenman, E., Bergman, M. 1989. Hypersensitivity reactions to dental materials in a referred group of patients. Scand. J. dent. Res. 97:76.
Stott, W.T., McKenna, M.J. 1984. The comparative absorption and excretion of chemical vapors by the upper, lower and intact respiratory tract of rats. Fund. Applied Tox. 4:594-602.
Sweeney, L.M., Andersen, M.E., Gargas, M.L. 2004. Ethyl acrylate risk assessment with a hybrid computational fluid dynamics and physiologically based nasal dosimetry model.Toxicol. Sci. 9(2):394403.
Tanii, H., Hashimoto, K. 1982. Structure-toxicity relationship of acrylates and methacrylates.Toxicol. Letters 11:125-129.
Tennant, R.W., Spaldinig, J., French, J.E. 1996. Evaluation of transgenic mouse bioassays for identifying carcinogens and noncarcinogens. Mutat. Res. 365:119-127.
Tice, R.R., Nylander-French, L.A., French, J.E. 1997. Absence of systemic in vivo genotoxicity after dermal exposure to ethyl acrylate and tripropylene glycol diacrylate in Tg.AC (v-Ha-ras) mice. Environ. Mol. Mutagen. 29:240-249.
[TOPKAT] TOxicity Prediction Program by Komputer Assisted Technology [en ligne]. 2004. Version 6.2. San Diego (CA) : Accelrys Software Inc.
Treon, J.F., Sigmon, H., Wright, H., Kitzmiller, K. 1949. The toxicity of methyl and ethyl acrylate. J. Ind. Hyg. Tox. 31:317325.
[TRI] Toxics Release Inventory Program [en ligne]. 2008. TRI Explorer. Version 4.7. Washington (DC) : US Environmental Protection Agency. Rapports publiés [consulté le 21 mars 2010].
Tucker, S.C., Beck, M.H. 1999. A 15-year study of patch testing to (meth)acrylates. Contact Dermatitis 40(5):278279.
Tyler et Smock. 1993. Overview. In : Tyler, T.R., Murphy, S.R., Hunt, E.K. (éd.). Health Effect Assessments of the Basic Acrylates. p. 131. Boca Raton (FL) : CRC Press.
Union Carbide Corp. 1971. Toxicology studies-ethyl acrylate. New York (NY) : Industrial Medicine and Toxicology Department. [cité dans CIRC, 1986].
Union Carbide Corp. 1989. Attachments: letter from US EPA to Union Carbide Corporation, listing of items in attachment Iii, part i - Brc studies & part Ii external toxicology reports with cover letter 071489. TSCATS: OTS0520180, Doc-ID: 86-890001037. [cité dans Commission européenne, 2000].
[USEPA] United States Environmental Protection Agency. 2005. Effets sur la santé de l'information utilisées dans le cancer et la caractérisation des risques non cancérogènes pour 1999 évaluations à l'échelle nationale.
[USEPA] United States Environmental Protection Agency 2007. Acute Exposure Guideline Levels (AEGLs) for ethyl acrylate (CAS Reg. No. 140-88-5) (interim). Washington (DC) : National Advisory Committee for AEGLs for Hazardous Substances, USEPA.
[USEPA] United States Environmental Protection Agency. 2009.Ethyl acrylate. [en ligne] Washington (DC) : Air Toxics, Technology Transfer Network. [le 3 février 2010].
Valencia, R., Mason, J.M., Woodruff, R.C., Zimmering, S. 1985. Chemical mutagenesis testing in drosophila. III. Results of 48 coded compounds tested for the National Toxicology Program.Environmental Mutagenesis 7:325-348.
Van der Walle, H.B., Klecak, G., Geleick, H., Bensink, T. 1982. Sensitizing potential of 14 mono-(meth)acrylates in the guinea pig.Contact Dermatitis 8:223-235.
Vodicka, P., Gut, I., Frantik, E. 1990. Effects of inhaled acrylic acid derivatives in rats. Toxicology65(12):209-21.
Waegemaekers, T.H.J.M., Bensink, M.P.M. 1984. Non-mutagenicity of 27 aliphatic acrylate esters in the Salmonella-microsome test.Mutation Res. 137:95-102.
Walker, A.M., Cohen, A.J., Loughlin, J.E., Rothman, K.J., DeFonso, L.R. 1991. Mortality from cancer of the colon or rectum among workers exposed to ethyl acrylate and methyl methacrylate.Scand. J. Work Environ. Health 17:719.
[WPEM] Wall Paint Expoure Assessment Model [en ligne]. 2001. Version 3.2. Washington (DC) : US EPA Office of Pollution Prevention and Toxics and National Paint and Coatings Association. Outils d'évaluation de l'exposition et des modèles.
Williams, G.M., Iatropoulos, M.J. 2009. Evaluation of potential human carcinogenicity of the synthetic monomer ethyl acrylate.Regul. Toxicol. Pharmacol. 53(1):6-15.
[WSKOWWIN] Water Solubility for Organic Compounds Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.41. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles
Yasunaga, K., Kiyonari, A., Oikawa, T., Abe, N., Yoshikawa, K. 2004. Evaluation of the Salmonella umu test with 83 NTP chemicals.Environmental and Molecular Mutagenesis 44:329-345.
Zeiger, E., Anderson, B., Haworth, S., Lawlor, T., Mortelmans, K. 1992. Salmonella mutagenicity tests: V. Results from the testing of 311 chemicals. Environ. Mol. Mutagen. 19 (Supplement 21):2-141.
Zimmermann, F.K., Mohr, A. 1992. Formaldehyde, glyoxal, urethane, methyl carbamate, 2,3-butanedione, 2,3-hexanedione, ethyl acrylate, dibromoacetonitrile and 2-hydroxypropionitrile induce chromosome loss in Saccharomyces cerevisiae. Mutat. Res. 270:151-166
Annexe 1 : Limite supérieure estimée de l’exposition de la population générale au Canada à l’acrylate d’éthyle à partir des milieux naturels
| Voie d’exposition | 0-6 mois[1], [2], [3] | 0,5 à 4 ans[4] |
5 à 11 ans[5] |
12 à 19 ans[6] |
20 à 59 ans[7] |
60 ans et plus[8] | ||
|---|---|---|---|---|---|---|---|---|
| Allaités | Lait mater-nisé | Sans lait mater-nisé | ||||||
| Air ambiant[9] | 0-2,87 x 10-2 | 0-6,15 x 10-2 | 0-4,79 x 10-2 | 0-2,73 x 10-2 | 0-2,34 x 10-2 | 0-2,04 x 10-2 | ||
| Air intérieur[10] | 0-2,45 | 0-5,25 | 0-4,09 | 0-2,33 | 0-2,00 | 0-1,74 | ||
| Eau potable[11] | 0,00 | 0-1,07 | 0-0,400 | 0-0,452 | 0-0,355 | 0-0,202 | 0,212 | 0-0,222 |
| Aliments et boissons[12] | 0,00 | 0,00 | 0,00 | 4,93 x 10-2 | 1,82 x 10-2 | 1,26 x 10-2 | 9,12 x 10-3 | 1,35 x 10-2 |
| Sol[13] | 3,22 x 10-10 | 5,19 x 10-10 | 1,69 x 10-10 | 4,07 x 10-11 | 3,41 x 10-11 | 3,35 x 10-11 | ||
| Absorption totale | 2,48 | 3,55 | 2,88 | 5,81 | 4,51 | 2,57 | 2,24 | 1,99 |
[2] Hypothèse : poids de 7,5 kg, inhalation de 2,1 m3 d’air par jour, consommation de 0,8 L d’eau par jour (lait maternisé) ou de 0,3 L d’eau par jour (autre que lait maternisé), ingestion de 30 mg de particules de sol par jour (Santé Canada, 1998).
[3] Dans le cas des enfants nourris exclusivement au lait maternisé, l’absorption par l’eau correspond à l’absorption par la nourriture. Aucune donnée n’a été obtenue sur la concentration d’acrylate d’éthyle dans le lait maternisé au Canada.
[4] Hypothèse : poids de 15,5 kg, inhalation de 9,3 m3 d’air par jour, consommation de 0,7 L d’eau par jour et ingestion de 100 mg de particules de sol par jour (Santé Canada, 1998).
[5] Hypothèse : poids de 31 kg, inhalation de 14,5 m3 d’air par jour, consommation de 1,1 L d’eau par jour et ingestion de 65 mg de particules de sol par jour (Santé Canada, 1998).
[6] Hypothèse : poids de 59,4 kg, inhalation de 15,8 m3 d’air par jour, consommation de 1,2 L d’eau par jour et ingestion de 30 mg de particules de sol par jour (Santé Canada, 1998).
[7] Hypothèse : poids de 70,9 kg, inhalation de 16,2 m3 d’air par jour, consommation de 1,5 L d’eau par jour et ingestion de 30 mg de particules de sol par jour (Santé Canada, 1998).
[8] Hypothèse : poids de 72,0 kg, inhalation de 14,3 m3 d’air par jour, consommation de 1,6 L d’eau par jour et ingestion de 30 mg de particules de sol par jour (Santé Canada, 1998).
[9] Aucune donnée canadienne n’a été recensée. Pour pallier cette absence, on a utilisé la limite de détection de 0,2 ppb (0,82 µg/m3) signalée par Kelly et al., 1993 pour la concentration d’acrylate d’éthyle dans l’air ambiant (extérieur) afin de calculer la limite supérieure de l’exposition estimée. La surveillance de l’air a eu lieu à Houston et à Boston (États-Unis) : 22 échantillons ont été prélevés dans chaque ville entre août 1990 et août 1991. On n’a pas décelé d’acrylate d’éthyle dans tous ces échantillons. Ce résultat n’a pas eu d’incidence sur les limites supérieures estimées de l’absorption quotidienne.
[10] Les estimations de l’absorption à partir de l’air intérieur sont fondées sur la limite de détection estimée de 10 µg/m3 de l’acrylate d’éthyle dans l’air intérieur signalé par Otson et al., 1994; 757 logements canadiens ont été surveillés et on n’a pas décelé d’acrylate d’éthyle dans tous ces échantillons. On présume que les Canadiens passent 21 heures par jour à l’intérieur (Santé Canada, 1998).
[11] Aucune donnée canadienne n’a été recensée. Pour pallier cette absence, on a utilisé la limite de détection la plus élevée signalée (10 ppb) pour la concentration d’acrylate d’éthyle dans l’eau potable (McLaughlin et al., 1993). Les auteurs ont signalé qu’on n’avait pas décelé d’acrylate d’éthyle dans les quelque 250 échantillons d’eau souterraine prélevés à l’intérieur ou autour de cinq usines produisant cette substance et que la limite de détection se situait entre 1 et 10 ppb (McLaughlin et al., 1993).
[12] Aucune donnée n’a été relevée sur la concentration d’acrylate d’éthyle dans les aliments au Canada. La seule concentration d’acrylate d’éthyle dans les fruits signalée (0,77 mg/kg) se trouvait dans l’ananas frais (CIRC, 1986). Faute de données canadiennes, cette valeur a été utilisée pour tous les autres fruits contenant l’acrylate d’éthyle dans les études provenant des États-Unis et d’Europe (mûres, framboises, fruits de la passion jaune et durians) la concentration signalée dans l’ananas (CIRC, 1986) aux fins du calcul de la limite supérieure estimée d’exposition à partir des aliments. La quantité quotidienne d’aliments consommés par chaque groupe d’âge est décrite par Santé Canada (1998). Le Comité mixte d’experts FAO/OMS sur les additifs alimentaires rapporte une dose quotidienne d’acrylate d’éthyle absorbée sous forme d’assaisonnement de nourriture d’après les volumes annuels de production d’acrylate éthylique utilisés comme aromatisant (JECFA, 2006). La quantité absorbée a été estimée à 1,1 × 10-5 mg/kg p. c. par jour et 2,6 × 10-5 mg/kg p. c. par jour aux États-Unis et en Europe, respectivement. (JECFA, 2006). Ces estimations n’ont pas été incluses dans le calcul de l’estimation de la limite supérieure d’exposition provenant des aliments.
[13] Aucune donnée n’a été relevée sur la concentration d’acrylate d’éthyle dans le sol. Une modélisation a été effectuée à l’aide de la version 6.0 de ChemCan (2003) pour les 306 kg de rejets dans l’air signalés en application de l’article 71 au Québec (Environnement Canada, 2010a). La concentration modélisée estimée s’élevait à 8,05 × 10-5 µg/L. Ce résultat n’a pas eu d’incidence sur les estimations de la limite supérieure d’absorption journalière.
Annexe 2 : Limite supérieure estimée de l’exposition à l’acrylate d’éthyle à partir des produits de consommation[*]
| N° | Type de produit de consommation | Paramètres du modèle | Estimation de l’exposition |
|---|---|---|---|
| 1a | Peinture latex mate | Masse moléculaire : 100 g/mol Pression de vapeur : 28,5 mm Hg Koe : 1,18 10Log Fréquence d’exposition : 2x/an (RIVM, 2007) Poids d’un adulte : 70,9 kg (Santé Canada, 1998) Fraction de poids : 4,5 x 10-6 ou 4,5 ppm (Frederick, 1998) Durée d’exposition : 132 min (RIVM, 2006, 2007b) Volume de la pièce : 20 m3 (RIVM, 2006, 2007b) Taux de renouvellement de l’air : 0,6x/heure (RIVM, 2006, 2007b) Quantité appliquée : 3,75 x 103 g (RIVM, 2006, 2007b) Surface de rejet : 15 m2 (RIVM, 2006, 2007b) Durée d’application : 120 min (RIVM, 2006, 2007b) Matrice d’une masse moléculaire : 120 g/mol (RIVM, 2006, 2007b) Vitesse de transfert de masse : 0,282 m/min (RIVM, 2006, 2007b) Fraction absorbée : 100 %[1] Taux d’inhalation : 16,2 m3/jour (Santé Canada, 1998) Modèle d’inhalation : exposition à la vapeur par évaporation avec une surface de rejet augmentant avec le temps Le scénario décrit la peinture au pinceau ou au rouleau de deux murs d’une petite pièce peu aérée. Densité de la peinture murale à base d’eau : 1,5 g/cm3 |
Inhalation - concentration moyenne par événement : 0,225 mg/m3 |
Masse moléculaire : 100 g/mol Pression de vapeur : 28,5 mm Hg Koe : 01,18 10Log Poids d’un adulte : 70,9 kg (Santé Canada, 1998) Fraction de poids : 4,5 x 10-6 ou 4,5 ppm (Frederick, 1998) Surface exposée : 0,367 m2 (RIVM, 2006, 2007b, surface des mains et des bras donnée dans la fiche d’information générale) Taux de contact : 30 mg/min (RIVM, 2006, 2007b) Durée de rejet : 120 min (RIVM, 2006, 2007b) Absorption cutanée : 100 %[1] Modèle cutané : contact cutané direct avec le produit à un taux constant. |
Dose cutanée aiguë (interne) : 2,54 x 10-4 mg/kg Dose cutanée chronique (interne) : 1,39 x 10-6 mg/kg par jour |
||
| 1 b | Peinture semilustrée pour boiseries | Masse moléculaire : 100 g/mol Pression de vapeur : 28,5 mm Hg Koe : 1,18 10 Log Fréquence d’exposition : 2 x/an (RIVM, 2006, 2007b) Poids d’un adulte : 70,9 kg (Santé Canada, 1998) Fraction de poids : 1,3 x 10-5 ou 13,2 ppm (Frederick, 1998) Durée d’exposition : 66 min Volume de la pièce : 20 m3 (RIVM 2006, 2007b) Taux de renouvellement de l’air : 0,6 x /heure (RIVM, 2006, 2007b) Quantité appliquée : 450 g Surface de rejet : 1,82 m2 Durée d’application : 60 min Matrice d’une masse moléculaire : 120 g/mol (RIVM, 2006, 2007b) Vitesse de transfert de masse : 0,282 m/min (RIVM, 2006, 2007b) Fraction absorbée : 100 %[1] Taux d’inhalation : 16,2 m3/jour (Santé Canada, 1998) Modèle d’inhalation : exposition à la vapeur par évaporation avec une surface de rejet augmentant avec le temps Le scénario décrit la peinture au pinceau ou au rouleau de deux murs d’une petite pièce peu aérée. Densité de la peinture à l’eau : 1,5 g/cm3 |
Inhalation - concentration moyenne par événement : 0,108 mg/m3 |
Masse moléculaire : 100 g/mol Pression de vapeur : 28,5 mm Hg Koe : 1,18 10Log Poids d’un adulte : 70,9 kg (Santé Canada, 1998) Fraction de poids : 1,32 x 10-5 ou 13,2 ppm (Frederick, 1998) Surface exposée : 0,367 m2 (RIVM, 2006, 2007b, surface des mains et des bras donnée dans la fiche d’information générale) Taux de contact : 30 mg/min (RIVM, 2006, 2007b) Durée de rejet : 120 min (RIVM, 2006, 2007b) Absorption cutanée : 100 %[1] Modèle cutané : contact cutané direct avec le produit à un taux constant |
Dose cutanée aiguë (interne) : 6,6 x 10-4 mg/kg Dose cutanée chronique (interne) : 3,61 x 10-6 mg/kg par jour |
||
| 2 | Produit de calfeutrage | Masse moléculaire : 100 g/mol Pression de vapeur : 28,5 mm Hg Koe : 1,18 10 Log Fréquence d’exposition au produit de calfeutrage : 3x/an (RIVM, 2006, 2007) Poids d’un adulte : 70,9 kg (Santé Canada, 1998) Fraction de poids : 0,01 % (Household Products Database, 2009) Durée d’exposition : 45 min (RIVM, 2006, 2007a) Volume de la pièce : 10 m3 (RIVM, 2006, 2007a) Taux de renouvellement de l’air : 0,6x/heure (RIVM, 2006, 2007a) Quantité appliquée : 75 g (RIVM, 2006, 2007a) Surface de rejet : 250 cm2 (RIVM, 2006, 2007a) Durée d’application : 30 min (RIVM, 2006, 2007a) Matrice d’une masse moléculaire : 3 x 103 g/mol (RIVM 2006, 2007a) Vitesse de transfert de masse : 3,73 x 103 m/min (RIVM, 2006, 2007a) Fraction absorbée : 100 %[1] Taux d’inhalation : 16,2 m3/jour (Santé Canada, 1998) Modèle d’inhalation : exposition à la vapeur par évaporation avec une surface de rejet augmentant avec le temps |
Inhalation - concentration moyenne par événement : 0,427 mg/m3 |
Masse moléculaire : 100 g/mol Pression de vapeur : 28,5 mm Hg Koe : 0,7 10 Log Poids d’un adulte : 70,9 kg (Santé Canada, 1998) Fraction de poids : 0,01 % (Household Products Database, 2009) Surface exposée : 2 cm2 (RIVM, 2006, 2007a) Taux de contact : 50 mg/min Durée de rejet : 30 min Modèle cutané : contact cutané direct avec le produit à un taux constant |
Dose cutanée aiguë (interne) : 0,00212 mg/kg Dose cutanée chronique (interne) : 1,74 x 10-5 mg/kg par jour |
||
| 3a | Lingettes pour nourrissons | Masse moléculaire : 100 g/mol Pression de vapeur : 28,5 mm Hg Koe : 1,18 10 Log Fréquence d’exposition : 5x/jour Poids d’un nourrisson : 7,5 kg (Santé Canada, 1998) Fraction de poids : 2,8 x 10-5 ou 28 ppm (Environnement Canada, 2010b) Surface exposée : 199 cm2 (RIVM, 2006) Quantité appliquée : 0,02 g (RIVM, 2006) Fraction absorbée : 100 %[1] Modèle cutané : contact cutané direct avec le produit, application instantanée |
Dose cutanée aiguë (interne) : 7,47 x 10-5 mg/kg Dose cutanée chronique (interne) : 3,73 x 10-4 mg/kg par jour |
| 3 b | Lingettes pour adultes | Masse moléculaire : 100 g/mol Pression de vapeur : 28,5 mm Hg Koe : 1,18 10 Log Fréquence d’exposition : 365x/an (RIVM, 2006, 2007) Poids d’un adulte : 70,9 kg (Santé Canada, 1998) Fraction de poids : 2,8 x 10-5 ou 28 ppm (Environnement Canada, 2010b) Surface exposée : 215 cm2 (RIVM, 2006) Quantité appliquée : 0,02 g (RIVM, 2006) Fraction absorbée : 100 %[1] Modèle cutané : contact cutané direct avec le produit, application instantanée |
Dose cutanée aiguë (interne) : 7,9 x 10-6 mg/kg Dose cutanée chronique (interne) : 7,89 x 10-6 mg/kg par jour |
[1] La fraction absorbée de 100 % est supposée.
| Paramètre | Doses ou concentrations minimales avec effet[i] / Résultats | ||||
|---|---|---|---|---|---|
| Animaux de laboratoire et in vitro | |||||
| Toxicité aiguë | DL50 par voie orale (rat) = 550-2 000 mg/kg p.c. (Pozzani et al., 1949; BASF AG, 1958; Oettel et Hofmann, 1960; Union Carbide Corp., 1971, 1989; Paulet et Vidal, 1975; Rohm et Haas, 1984; Ghanayem et al., 1985). DL50 par voie orale (souris) = 1 300-1 800 mg/kg p.c. (Rohm et Haas, 1950a,b; Tanii et Hashimoto, 1982). DL50 par voie orale (lapin) = 280-370 mg/kg p.c. (Treon et al., 1949; Oettel et Hofmann, 1960). CL50 par inhalation (rat) = 1 414-2 180 ppm (5 790-8 930 mg/m3) (Pozzani et al., 1949; Lomonova et Klimova, 1979; Silver et Murphy, 1981; Oberly et Tansy, 1985; Union Carbide Corp., 1989). CL50 par inhalation (souris) = 3 950 ppm (16 200 mg/m3) (Lomonova et Klimova, 1979). CL50 par inhalation (lapin) = <1 204 ppm (4 930 mg/m3) (Treon et al., 1949). Toxicité aiguë par inhalation Plus faible CMENO par inhalation : 25 ppm (100 mg/m3) selon des lésions de l’épithélium olfactif chez les rats F344/N mâles (5 par groupe) dont le nez seulement avait été exposé à l’acrylate d’éthyle à une concentration de 0, 5, 25 ou 75 ppm (approximativement 0, 20, 100, 310 mg/m3 respectivement) pendant 1, 3 ou 6 heures. Aucun effet n’a été observé chez les animaux exposés à 5 ppm pendant au plus 6 heures, ni chez les animaux exposés pendant une heure à toutes les concentrations. Des lésions de l’épithélium olfactif (nécrose unilatérale des cellules sustentaculaires, dégénérescence des neurones olfactifs et desquamation) ont été observées aux concentrations de 25 et 75 ppm chez les animaux exposés pendant 3 et 6 heures; récupération presque complète après une période de récupération de 6 semaines (Frederick et al., 2002) Autre CMENO par inhalation : 75 ppm (310 mg/m3) selon des lésions olfactives chez les singes Cynomolgus (mâles et femelles répartis au hasard, 3 par groupe) dont seule la tête avait été exposée à une concentration d’acrylate d’éthyle de 0 ou 75 ppm (approximativement 0 et 310 mg/m3 respectivement) pendant 3 ou 6 heures. L’examen de la cavité nasale a révélé des lésions comprenant une dégénérescence focale, une nécrose et une exfoliation accompagnées d’une légère inflammation limitée à l’épithélium olfactif. Environ 15 % et 50 % de l’épithélium olfactif avaient subi des dommages après 3 et 6 heures d’exposition à l’acrylate d’éthyle respectivement (Rohm et Haas, 1994; Harkema et al., 1997). FR50 (souris) = 315 ppm (approximativement 1290 mg/m3) chez les souris Swiss (n=6) dont seule la tête avait été exposée à l’acrylate d’éthyle (De Ceaurriz et al., 1981). DL50 par voie cutanée (rat) = 470-5 000 mg/kg p.c. (Rohm et Haas, 1986a, 1986c, 1986d; Union Carbide Corp., 1971, 1989). DL50 par voie cutanée (souris) = 2 000-5 000 mg/kg p.c. (Rohm et Haas, 1986d, 10986e). DL50 par voie cutanée (lapin) = 126-1 950 mg/kg p.c. (Pozzani et al., 1949; Dow Chemical Co., 1957). |
||||
| Toxicité à court terme en doses répétées | Plus faible DMENO par voie orale : 20 mg/kg p.c. par jour selon une augmentation du poids de l’estomac liée à la dose, ainsi qu’une hyperplasie et une hyperkératose des cellules squameuses de l’estomac chez des rats Fischer 344 mâles (10 par groupe) ayant reçu de l’acrylate d’éthyle par gavage à des concentrations de 0, 20, 100 ou 200 mg/kg p.c. par jour, 5 jours par semaine pendant 28 jours. On a observé une augmentation du poids de l’estomac par rapport au groupe témoin pour toutes les doses. Un autre groupe ayant reçu 200 mg/kg p.c. par jour (10 rats) a complètement guéri après une période de récupération de 9 semaines (Rohm et Haas, 1987). Plus faible DMENO par voie orale : 20 mg/kg p.c. par jour selon une augmentation de l’hyperplasie et de l’hyperkératose épithéliale du préestomac liée à la dose chez des rats Fischer 344 mâles (10 par groupe) ayant reçu de l’acrylate d’éthyle par gavage à des concentrations de 0, 2, 10, 20, 50, 100 ou 200 mg/kg p.c. par jour, 5 jours par semaine pendant 5 ou 12 jours. On a observé une augmentation du poids absolu et relatif de l’estomac à la concentration de 20 mg/kg p.c. ou plus après une période de 5 jours et à la concentration de 50 mg/kg p.c. ou plus après une période de 12 jours. Une irritation du préestomac, incluant une gastrite, un œdème de la sous-muqueuse et la formation d’ulcères, d’érosion ou d’escarres, s’est manifestée aux doses de 50 mg/kg p.c. ou plus après une période de 5 jours et de 100 mg/kg p.c. ou plus après une période de 12 jours. L’hyperplasie et l’hyperkératose épithéliales se sont manifestées à une dose de 20 mg/kg p.c. ou plus après une période de 5 à 12 jours (Rohm et Haas, 1986b). Plus faible DMENO par voie orale : 20 mg/kg p.c. par jour selon une hyperkératose du préestomac chez des rats Fischer 344 mâles (10 par groupe) ayant reçu de l’acrylate d’éthyle (pureté >99 %) par gavage à des doses de 0, 2, 10, 20, 50, 100 ou 200 mg/kg p.c. par jour, 5 jours par semaine pendant 14 jours. Les modifications histopathologiques du préestomac comprenaient une hyperkératose à la dose de 20 mg/kg p.c. ou plus, une inflammation subaiguë à chronique de la sous-muqueuse à la dose de 100 mg/kg p.c. ou plus, une hyperplasie focale des cellules épithéliales, un œdème ainsi qu’une ulcération ou une érosion de la sous-muqueuse à la dose de 200 mg/kg p.c. Les modifications histopathologiques de l’estomac glandulaire incluaient une inflammation et un œdème de la sous-muqueuse à la concentration de 100 mg/kg p.c. ou plus (Frederick et al., 1990). Autre DMENO par voie orale : 1 000 ppm (99 mg/kg p.c. par jour) selon une irritation minimale et une hyperplasie épithéliale diffuse du préestomac chez des rats Fischer 344 mâles (10 par groupe) ayant reçu de l’acrylate d’éthyle (pureté > 99 %) par voie orale dans de l’eau potable à des concentrations de 0, 200,1 000, 2 000 ou 4 000 ppm (correspondant à 0, 23, 99, 197 et 369 mg/kg p.c. par jour respectivement), 5 jours par semaine pendant 14 jours. On a observé une hyperplasie épithéliale diffuse du préestomac à la concentration de 1 000 ppm ou plus. On a constaté une légère inflammation chronique de la sous-muqueuse et/ou une hémorragie focale épithéliale à la concentration de 2 000 ppm ou plus. L’auteur a noté que, pour empêcher l’acrylate d’éthyle de se dégrader dans l’eau, on a changé les bouteilles d’eau deux fois par semaine sans déceler de perte importante (supérieure à 1 %) du composé d’origine (Fredericket al., 1990). [Autres études : Treon et al., 1949; Ghanayem et al.,1986; NTP, 1986a) |
||||
Plus faible CMENO par inhalation : 70 ppm (290 mg/m3) selon une augmentation du poids relatif des reins chez des rats mâles lors du traitement de rats albinos Sherman (15/sexe/groupe) avec de l’acrylate d’éthyle à des concentrations de 0, 70 ou 300 ppm (approximativement 0, 290 et 1 200 mg/m3 respectivement), 7 heures par jour, 5 jours par semaine pendant 30 jours. À la concentration de 70 ppm, on a observé une augmentation du poids des reins des rats mâles, mais aucun autre effet ou aucune anomalie histopathologique. Dans le groupe exposé à la concentration de 300 ppm, on a constaté une augmentation importante du poids relatif des reins chez les deux sexes. Deux animaux ont succombé à une infection pulmonaire tant dans le groupe recevant 70 ppm que dans son groupe témoin. Au total, 18 animaux sur 30 exposés à 300 ppm sont morts durant l’exposition comparativement à aucun décès dans le groupe témoin. La plupart des décès révélaient un trouble « catarrhal et pulmonaire » alors que 10 animaux sur 18 présentaient des dommages aux poumons, aux reins et au foie. (Pozzani et al., 1949). Autre CMENO par inhalation : 300 ppm (1 200 mg/m3) d’après l’observation d’inflammation, de dégénérescence, de nécrose focale et de métaplasie malpighienne des cornets nasaux chez des rats F344 et des souris B6C3F1 mâles (10/sexe/groupe/espèce) exposés à l’acrylate d’éthyle à des concentrations de 0, 75, 150 ou 300 ppm (approximativement 0, 310, 610 et 1 200 mg/m3 respectivement), 6 heures par jour, 5 jours par semaine pendant 30 jours. Seuls les groupes recevant 0 et 300 ppm ont été soumis à un examen histopathologique. On a observé une diminution du gain de poids corporel chez les deux sexes et chez les deux espèces aux concentrations de 150 et 300 ppm. On a constaté une inflammation, une dégénérescence, une nécrose focale et une métaplasie malpighienne des cornets nasaux chez les mâles des deux espèces à la concentration de 300 ppm. L’alternance du poids relatif des reins et du foie n’a pas révélé de résultats histologiques correspondants selon ECETOC (1994) (Miller et al., 1979). [Autres études : Pozzani et al., 1949; Treon et al., 1949] Aucune étude concernant l’absorption cutanée n’a été recensée. |
|||||
| Toxicité subchronique | Plus faible DMENO par voie orale : 20 mg/kg p.c. par jour selon une augmentation du poids de l’estomac ainsi qu’une hyperplasie et une hyperkératose de l’épithélium squameux de l’estomac de rats Fischer 344 mâles (10 par groupe) ayant reçu de l’acrylate d’éthyle par gavage à raison de 0, 20, 100 ou 200 mg/kg p.c. par jour, 5 jours par semaine pendant 13 semaines. On a observé une augmentation du poids de l’estomac dans tous les groupes ayant reçu ces diverses doses comparativement aux groupes témoins. On a constaté une hyperplasie et une hyperkératose de l’épithélium squameux du préestomac pour les doses de 20 mg/kg p.c. ou plus. Une baisse du poids corporel a été observée à la dose de 200 mg/kg p.c. (Rohm et Haas, 1987). | ||||
Autre DMENO : 100 mg/kg p.c. par jour selon une grave hyperplasie épithéliale du préestomac chez des rats Fisher 344 mâles (25 par groupe) ayant reçu de l’acrylate d’éthyle (pureté de 99 %) par gavage à une concentration de 0, 100 ou 200 mg/kg p.c. par jour, 5 jours par semaine pendant 13 semaines. On a observé une grave hyperplasie épithéliale du préestomac aux concentrations de 100 mg/kg p.c. ou plus. On n’a pas constaté de lésions dans l’estomac glandulaire ou le foie. On a observé une diminution importante de l’incidence et une aggravation de l’hyperplasie de la muqueuse du préestomac après 8 semaines et 19 mois de récupération. Aucune augmentation de l’incidence des papillomes ou des carcinomes du préestomac n’a été observée (Ghanayem et al., 1991). [Autres études : NTP, 1986a] Plus faible CMENO par inhalation :100 mg/m3 (25 ppm) selon des lésions histopathologiques de la muqueuse nasale chez des rats Fischer 344 (510/sexe/groupe) exposés à l’acrylate d’éthyle (pureté non précisée) à une concentration de 0, 25, 75 ou 225 ppm (approximativement 0, 100, 310 et 920 mg/m3), 6 heures par jour, 5 jours par semaine pendant 6 mois. On a limité les examens histopathologiques à la muqueuse nasale pour les concentrations de 25 et 75 ppm, alors qu’on a examiné un vaste éventail de tissus chez les groupes témoins et les groupes exposés à 225 ppm. On a observé une très légère dégénérescence focale de la partie olfactive de la muqueuse nasale à 25 ppm, une dégénérescence et une inflammation légères de la muqueuse nasale à 75 ppm et des effets moyennement graves sur la muqueuse nasale, notamment une dégénérescence, une inflammation et une nécrose, à 225 ppm. Aucune lésion pathologique marquée n’a été observée dans un groupe exposé. Pour la concentration de 225 ppm, on a signalé une diminution des tissus adipeux chez les mâles et les femelles; l’auteur a noté que cette observation correspondait aux données sur le poids corporel, même si aucune de ces données n’était indiquée (Jersey et al., 1978). Plus faible CMENO par inhalation :100 mg/m3 (25 ppm) d’après des lésions histopathologiques de la muqueuse nasale chez des rats Fischer 344 (5/sexe/groupe) exposés à l’acrylate d’éthyle (pureté non précisée) à des concentrations de 0, 25 ou 75 ppm (approximativement 0, 100 et 310 mg/m3), 6 heures par jour, 5 jours par semaine pendant 12 mois. Aucune altération facilement visible liée au traitement n’a été observée. L’examen histopathologique a révélé des lésions de la région olfactive de la muqueuse nasale dans tous les groupes traités. Les lésions incluaient une dégénérescence focale de l’épithélium olfactif, une hyperplasie focale des cellules basales de l’épithélium olfactif et une inflammation de la muqueuse et de la sousmuqueuse dont la gravité allait de très légère à la concentration de 25 ppm à légère à modérée pour la concentration de 75 ppm (Dow Chemical, 1979a). [Autres études : Treon et al., 1949; Gabor et al., 1965; Dow Chemical, 1979a,b; Institute of Biological Research, 1983; Miller et al., 1985] Plus faible CMENO par voie cutanée : 2 000 mg/kg p.c. par jour selon une diminution du poids corporel observée chez des souris transgéniques Tg.AC (vHaras) femelles (10 par groupe) ayant reçu par voie cutanée de l’acrylate d’éthyle (pureté de 99 %) à raison de 0, 60, 300 ou 600 µmoles/dose (approximativement 0, 200, 1000 et 2000 mg/kg p.c. par dose respectivement), 3 fois par semaine pendant 20 semaines. Aucune induction de papillomes n’a été observée à l’endroit de l’application (Tennant et al., 1996; Nylander-French et French, 1998). Le NTP (1998) a souligné que l’utilisation de modèles transgéniques pour la détection d’effets cancérogènes en est au stade expérimental et que les résultats de ces études sont indicatifs, mais ne doivent pas être considérés comme des preuves concluantes. [Aucune autre étude n’a été recensée.] |
|||||
| Toxicité chronique/ cancérogénicité | Cancérogénicité par voie orale chez les rats Des rats Fischer 344 (50 par sexe par groupe) ont reçu de l’acrylate d’éthyle (pureté de 99 à 99,5 %) par gavage à raison de 0, 100 ou 200 mg/kg p.c. par jour, 5 jours par semaine pendant 103 semaines. On a noté une augmentation importante de l’incidence de papillomes et de carcinomes des cellules squameuses chez les mâles soumis aux concentrations de 100 et 200 mg/kg p.c., ainsi qu’une augmentation importante de l’incidence de papillomes des cellules squameuses chez les femelles soumises aux concentrations de 100 et 200 mg/kg p.c. Chez les mâles, l’incidence des papillomes des cellules squameuses était de 1/50, 15/50, 29/50; celle des carcinomes des cellules squameuses, de 0/50, 5/50, 12/50 et l’incidence des papillomes et des carcinomes des cellules squameuses, de 1/50, 18/50, 36/50 pour les concentrations de 0, 100, 200 mg/kg p.c. par jour respectivement. Chez les femelles, l’incidence des papillomes des cellules squameuses était de 1/50, 65/50, 9/50; celle des carcinomes des cellules squameuses, de 0/50, 0/50, 2/50 et l’incidence des papillomes et des carcinomes des cellules squameuses, de 1/50, 6/50, 11/50 pour les concentrations de 0, 100, 200 mg/kg p.c. par jour respectivement. La CMENO était de 100 mg/kg p.c. par jour selon une augmentation de l’hyperkératose, de l’hyperplasie et de l’inflammation du préestomac observée à la concentration de 100 mg/kg p.c. et plus. Aucun effet sur le poids corporel moyen, les signes cliniques et la survie n’a été observé (NTP, 1986a). Des rats Fischer 344 mâles âgés d’environ 3 mois (5 à 16/groupe) ont reçu de l’acrylate d’éthyle (pureté de 99 %) par gavage à raison de 0 ou 200 mg/kg p.c. par jour, 5 jours par semaine pendant 6 à 12 mois suivis de périodes de récupération pouvant atteindre 15 mois. Des tumeurs du préestomac se sont développées au bout de 2 à 9 mois de la période de récupération chez les rats traités pendant 12 mois. On a observé des papillomes des cellules squameuses (2/5) du préestomac après 2 mois de récupération, ainsi que des carcinomes (3/13) et des papillomes (1/13) des cellules squameuses du préestomac après 9 mois de récupération. Aucun néoplasme n’a été observé dans les groupes témoins, dans les groupes traités pendant 6 mois avec ou sans période de récupération, ni chez les animaux sacrifiés juste après 12 mois de traitement. Aucune lésion néoplasique facilement visible n’a été observée dans le foie ou les autres organes des groupes traités. La CMENO était de 200 mg/kg p.c. par jour selon une hyperplasie du préestomac. Chez les animaux traités pendant 6 mois, on a observé le développement d’hyperplasie du préestomac (5/5), puis une récupération après 2 mois (0/5) et 15 mois (1/18). Chez les animaux traités pendant 12 mois, on a constaté une hyperplasie du préestomac (5/5) qui a persisté après 2 mois (5/5) et 9 mois (10/13) de récupération (Ghanayemet al., 1993, 1994). Le CIRC (1999) a souligné que, dans l’étude de Ghanayem (1993), l’évaluation histopathologique se limitait à l’estomac. Des rats Wistar (25/sexe/groupe) ont reçu de l’acrylate d’éthyle (pureté non précisée) par voie orale dans de l’eau potable à des concentrations de 0, 6 à 7, 60 à70 ou 2000 ppm (approximativement 0, 0,84 à 0,98, 9,4 à 9,8 et 280 mg/kg p.c. respectivement) pendant 2 ans (nombre de jours par semaine non précisé). Aucun effet néoplasique n’a été observé. La DMEO a été de 2 000 ppm (280 mg/kg p.c. par jour) selon une diminution importante de la consommation de liquide chez les deux sexes, ainsi que du poids corporel et de la consommation de nourriture chez les femelles. On n’a pas noté de changements dans la mortalité, l’hématologie, la pathologie clinique ou l’histopathologie. Les bouteilles d’eau étaient changées deux fois par semaine et aucune perte importante d’acrylate d’éthyle n’a été observée dans l’eau soumise à des essais après 72 heures (Borzelleca et al., 1964). Cancérogénicité par voie orale chez les souris Des souris B6C3F1 (50/sexe/groupe) ont reçu de l’acrylate d’éthyle (pureté de 99 à 99,5 %) par gavage à raison de 0, 100 ou 200 mg/kg p.c. par jour, 5 jours par semaine pendant 103 semaines. On a noté une augmentation importante de l’incidence des carcinomes et des papillomes des cellules squameuses du préestomac à la concentration de 200 mg/kg p.c. Chez les mâles, l’incidence des papillomes des cellules squameuses a été de 0/48, 4/47, 9/50, tandis que l’incidence des carcinomes des cellules squameuses a été de 0/48, 2/47, 5/50 et celle des papillomes et des carcinomes des cellules squameuses, de 0/48, 5/47, 12,50 pour les concentrations de 0, 100, 200 mg/kg p.c. par jour respectivement. Chez les femelles, l’incidence des papillomes des cellules squameuses a été de 1/50, 4/49, 5/48, alors que l’incidence des carcinomes des cellules squameuses a été de 0/50, 1/49, 2/48, et celle des carcinomes et des papillomes des cellules squameuses, de 1/50, 5/49 et 7/48 pour les concentrations de 0, 100, 200 mg/kg p.c. par jour respectivement. La CMENO a été de 100 mg/kg p.c. par jour selon une augmentation de l’hyperkératose, de l’hyperplasie et de l’inflammation du préestomac observée à 100 mg/kg p.c. et plus. Aucun effet n’a été observé sur le poids corporel moyen, les signes cliniques et la survie (NTP, 1986a). Cancérogénicité par voie orale chez les chiens Des chiens Beagle (2/sexe/groupe) ont reçu par voie orale, dans des capsules de gélatine mêlées à de l’huile de maïs, de l’acrylate d’éthyle à des concentrations de 0, 10, 100 ou 1000 ppm (approximativement 0, 0,3, 3 et 30 mg/kg p.c. par jour respectivement) pendant 2 ans (nombre de jours par semaine non précisé). Une DSEO de 1000 ppm a été déterminée. Au départ, les animaux recevant 1000 ppm (30 mg/kg p.c. par jour) présentaient des vomissements si la dose était réduite à 300 ppm (9 mg/kg p.c. par jour), puis progressivement augmentée à 1000 ppm (30 mg/kg p.c. par jour) sur une période de 16 semaines. Aucun effet toxique systémique n’a été observé. La diminution du gain de poids corporel et de la consommation de nourriture à la concentration de 1 000 ppm (30 mg/kg p.c. par jour) comparativement au groupe témoin n’était pas statistiquement significative. Aucun changement de l’histopathologie, des valeurs hématologiques, des concentrations de protéines dans l’urine et des substances réductrices n’a été observé (Borzelleca et al., 1964). Cancérogénicité par inhalation chez les rats et les souris Des rats Fischer 344 (75/sexe/groupe exposé et 60/sexe/groupe témoin) et des souris B6C3F1 ont été exposés à de l’acrylate d’éthyle (pureté (> 99,5 %) à des concentrations de 0, 25 ou 75 ppm (approximativement 0, 100 et 310 mg/m3 respectivement), 6 heures par jour, 5 jours par semaine pendant 27 mois. Des sousgroupes d’animaux ont été sacrifiés après 3, 6, 12 et 18 mois d’exposition. Aucune lésion néoplasique liée au traitement n’a été observée. L’incidence d’adénomes folliculaires de la thyroïde chez les souris mâles à la concentration de 225 ppm (7/69) s’est révélée nettement plus élevée que dans les groupes témoins examinés dans la même étude (2/121), mais pas plus marquée que dans les groupes témoins étudiés antérieurement. La CMENO était de 25 ppm (100 mg/m3) selon des lésions non néoplasiques de la muqueuse olfactive (hyperplasie des cellules glandulaires et des cellules basales, augmentation des glandes intraépithéliales et métaplasie respiratoire). On a observé une diminution importante du gain moyen de poids corporel chez les deux sexes à la dose de 310 mg/m3. Aucun effet sur la survie, le poids des organes, l’hématologie, la chimie clinique et les analyses d’urine n’a été observé (Miller et al., 1985). Des rats Fischer 344 et des souris B6C3F1 (90/sexe/groupe exposé et 80/sexe/groupe témoin) ont été exposés à de l’acrylate d’éthyle (pureté > 99,5 %) à une concentration de 0 ou 5 ppm (approximativement 20 mg/m3), 6 heures par jour, 5 jours par semaine pendant 24 mois. Des sous-groupes d’animaux ont été sacrifiés après 6, 12 et 18 mois d’exposition. L’examen histopathologique s’est limité aux cornets nasaux et n’a pas montré d’effets liés au traitement. La CSEO était de 5 ppm (20 mg/m3) (Miller et al., 1985). Cancérogénicité par voie cutanée chez les souris Des souris C3H/HeJ mâles (40/groupe) se sont vu administrer par voie cutanée de l’acétone (groupe témoin) ou 25 µL d’acrylate d’éthyle (pureté de 99 %) par animal (approximativement 23 mg/application, 800 mg/kg p.c. par jour), 3 fois par semaine pendant toute leur vie. Au départ, les animaux étaient logés par groupes de cinq. Selon les auteurs, après 13 mois d’étude, l’augmentation de la mortalité précoce a obligé à loger individuellement les animaux faisant partie du groupe traité à l’acrylate d’éthyle afin de réduire la propagation de la maladie infectieuse qui a peut-être contribué à cette mortalité précoce. Aucune tumeur épidermique n’a été observée. La DMENO était de 800 mg/kg p.c. selon le développement de dermatite, de fibrose dermique, de nécrose épidermique et d’hyperkératose. On n’a pas observé d’effet statistiquement significatif sur la survie; la durée moyenne de survie des souris exposées à l’acrylate d’éthyle a été de 408 jours, tandis que le groupe témoin exposé à l’acétone a survécu 484 jours (DePass et al. 1984). Le CIRC (1986) a noté que l’étude ne mentionne pas de vérification de la perte éventuelle de composé d’origine par volatilisation ou par polymérisation. Aucune étude supplémentaire n’a été recensée. |
||||
| Toxicité pour la reproduction | Aucune étude n’a été recensée. | ||||
| Toxicité pour le développement | Plus faible DMENO par voie orale chez les rats : 25 mg/kg p.c. par jour selon un retard de l’ossification des fœtus lorsque des rats Wistar femelles (10 à 23/groupe) recevaient de l’acrylate d’éthyle (pureté non précisée dans CIRC, 1986) par gavage à des concentrations de 0, 25, 50, 100, 200 ou 400 mg/kg p.c. par jour pendant les jours de gestation 7 à 16. On a observé une réduction du poids corporel des mères à la concentration de 25 mg/kg p.c. ou plus. Le nombre total de résorptions a fortement augmenté à la concentration de 100 mg/kg p.c. ou plus, mais on n’a pas constaté d’effets sur le nombre de fœtus vivants par portée. Après avoir examiné 50 % des fœtus afin de déceler de possibles anomalies du squelette, on a constaté une augmentation de l’incidence globale des retards de l’ossification dans tous les groupes traités (Pietrowicz et al., 1980). Autre DSEO par voie orale chez les rats :400 mg/kg p.c. par jour chez des rats Wistar femelles (nombre non précisé dans l’étude de la Commission européenne, 2000) ayant reçu par voie orale de l’acrylate d’éthyle (pureté non précisée) à des concentrations de 44, 133 ou 400 mg/kg p.c. par jour pendant les jours de gestation 0 à 19. Aucune donnée précisée sur l’inclusion d’un groupe témoin. On a observé une augmentation légère, mais non statistiquement significative, du nombre de fœtus morts ou résorbés. On n’a pas relevé d’induction d’anomalies externes, ni d’anomalies du squelette et des viscères. On n’a pas noté de changements défavorables dans le développement postnatal des petits (Shimizu et al., 1994). Plus faible CMENO par inhalation chez les rats : 200 ppm (800 mg/m3) selon une diminution importante du poids du fœtus chez des rats Sprague-Dawley femelles (17 à 19/groupe) exposés à l’acrylate d’éthyle à raison de 0, 25, 50, 100 ou 200 ppm (approximativement 0, 100, 200, 400 et 800 mg/m3respectivement) 6 heures par jour pendant les jours de gestation 6 à 20. On a observé une importante diminution du gain de poids maternel et du gain de poids absolu à la concentration de 200 ppm. Aucune différence importante n’a été observée en ce qui concerne le nombre de sites d’implantation et les fœtus vivants, l’incidence des implants non vivants et des résorptions ou le ratio du sexe des fœtus. À la concentration de 200 ppm, le poids des fœtus avait diminué considérablement de 7 à 8 % par rapport à ceux du groupe témoin. Pour aucune dose, on n’a observé d’augmentation de la létalité des embryons ou des fœtus, ni de malformations fœtales liées au traitement. L’incidence des variations externes et des variations du squelette et des viscères ont été similaires à celle des groupes témoins (Saillenfait et al., 1999). Autre CSEO par inhalation chez les rats : 150 ppm (610 mg/m3) chez des rats Sprague-Dawley femelles (33/groupe) exposés à l’acrylate d’éthyle à des concentrations de 0, 50 ou 150 ppm (approximativement 0, 200, 610 mg/m3respectivement), 6 heures par jour, pendant les jours de gestation 6 à 15. On a observé une réduction du poids maternel et de la consommation de nourriture par les mères, ainsi qu’une augmentation de la consommation d’eau à la concentration de 150 ppm. Aucun effet sur la taille moyenne des portées, le corps jaune, les sites d’implantation, les fœtus vivants, l’incidence des résorptions, le ratio du sexe des fœtus, la longueur vertex-coccyx des fœtus n’a été observé. Les auteurs ont jugé que l’augmentation importante du poids moyen du fœtus à la concentration de 150 ppm n’était pas significative sur le plan de la toxicité. À cette concentration, 3/308 petits ont montré des malformations fœtales (queue hypoplasique, petit orifice anal) ou des variations du squelette (retard de l’ossification, côtes ou vertèbres manquantes, côtes fusionnées), mais ces incidences ne se sont pas révélées statistiquement significatives comparativement aux groupes témoins actuellement à l’étude ou étudiés antérieurement. Aucun effet défavorable sur le poids ou la survie des fœtus n’a été observé (Murray et al., 1981). Aucune étude sur l’absorption cutanée n’a été recensée. |
||||
| Génotoxicité et paramètres connexes in vivo | Aberrations chromosomiques Résultats négatifs : Souris C57BL/6 mâles (5/groupe) ayant reçu de l’acrylate d’éthyle par voie intrapéritonéale à des concentrations de 0, 125, 250, 500 ou 1 000 mg/kg p.c. (aiguë) (Kligerman et al., 1991). Mutation létale récessive liée au sexe Résultats négatifs : Drosophilia melanogaster, administration par voie orale d’a plus 40 000 ppm d’acrylate d’éthyle (pureté de 99,7 % ) dans une solution de saccharose aqueuse à 5 % (Valencia et al., 1985). Résultats négatifs : Drosophilia melanogaster, administration d’au plus 20 000 ppm d’acrylate d’éthyle (pureté de 99,7 %) par injection dans une solution aqueuse de NaCl à 0,7 % (Valencia et al., 1985). Liaison à l’ADN Résultats négatifs : Rats Fischer 344 mâles (3/groupe) ayant reçu par gavage de l’acrylate d’éthyle 2,3-[14C] (pureté de 90 à 92 %) à des concentrations de 0, 100, 200 ou 400 mg/kg p.c. (Ghanayemet al,. 1987). Le CIRC (1999) a noté que la méthode utilisée pour déterminer la liaison à l’ADN était inadéquate. Induction de micronoyaux Résultats négatifs : Souris C57B16J (5 à 10/sexe/groupe) ayant reçu de l’acrylate d’éthyle par voie intrapéritonéale (pureté de 98,5 %) à des concentrations de 0, 461 ou de 738 mg/kg p.c. (aiguë) et de 0 ou 738 mg/kg p.c. par jour (2 jours consécutifs) (Ashby et al., 1989). Résultats négatifs : Souris BDF1 mâles (6 à 9/groupe) ayant reçu de l’acrylate d’éthyle par voie intrapéritonéale (pureté de 99 %) à des concentrations de 0, 375, 500, 750, 1 000 ou 1 500 mg/kg p.c. (aiguë). Tous les animaux ayant reçu des concentrations de 1 000 et 1 500 mg/kg p.c. et un animal ayant reçu 750 mg/kg p.c. sont morts (Hara et al., 1994). Résultats négatifs : Souris C57BL/6 mâles (5/groupe) ayant reçu de l’acrylate d’éthyle par voie intrapéritonéale (pureté de 99 %) à des concentrations de 0, 125, 250, 500 ou 1 000 mg/kg p.c. (aiguë) (Kligermanet al.; 1991). Résultats négatifs : Souris BDF1 mâles (6/groupe) ayant reçu de l’acrylate d’éthyle par voie intrapéritonéale (pureté de 99 %) à des concentrations de 0, 375, 500, 750 ou 1 000 mg/kg p.c. (aiguë) (Morita et al,. 1997). Résultats négatifs : Souris BDF1 mâles (6/groupe) ayant reçu de l’acrylate d’éthyle (pureté (> 99 % ) par voie orale à des concentrations de 0, 188, 375 ou 750 mg/kg p.c. par jour au stade aigu et pendant deux jours consécutifs (Hara et al., 1994). Résultats négatifs : Souris BDF1 mâles (6/groupe) ayant reçu de l’acrylate d’éthyle par voie orale à des concentrations de 0, 188, 375, 750 ou 1 000 mg/kg p.c. (aiguë) (Morita et al., 1997). Résultats négatifs : Souris Tg.AC mâles (7 à 9/groupe) ayant reçu de l’acrylate d’éthyle (pureté (99 %) par voie cutanée à des concentrations de 0, 200, 1 000 ou 2 000 mg/kg p.c. par jour, 3 fois par semaine pendant 20 semaines (Tice et al. 1997). Le NTP (1998) a souligné que l’utilisation de modèles transgéniques pour l’identification des effets cancérogènes en est au stade expérimental et que, même si les résultats de ces études sont indicatifs, ils ne doivent pas être considérés comme des preuves concluantes. Résultats positifs : Souris Balb/c mâles (4/groupe) ayant reçu de l’acrylate d’éthyle par voie intrapéritonéale pendant deux jours consécutifs à des concentrations de 0, 112,5, 225, 450, 900 ou 1 800 mg/kg p.c. par jour. Deux animaux ayant reçu des doses de 1 800 mg/kg p.c. sont morts (Przybojewska et al,. 1984; Basler et van der Hude, 1987). Résultats incertains ou variables : Souris C7B16J (5 à 10/sexe/groupe) ayant reçu de l’acrylate d’éthyle par voie intrapéritonéale pendant deux jours consécutifs à des concentrations de 0 ou 812 mg/kg p.c. par jour. Des expériences identiques répétées deux fois ont donné des résultats contradictoires (Ashby, 1989). Échange de chromatides sœurs Résultats négatifs : Souris C57BL/6 (5/groupe) ayant reçu de l’acrylate d’éthyle par voie intrapéritonéale à des concentrations de 0, 125, 250, 500 ou 1 000 mg/kg p.c. (aiguë) (Kligerman et al., 1991). |
||||
| Paramètre | Mutagénicité | |||
|---|---|---|---|---|
| Essai, espèce, souche | Résultats | Activation métabolique | Références | |
| Animaux de laboratoire etin vitro | ||||
| Génotoxicité et paramètres connexes in vitro | Essai sur des lymphomes de souris; cellules L51784TK+/- | Positifs | +/- | Darfield et al., 1991 |
| Positifs | - | Myhr, 1980; McGregor et al., 1988; Moore et al., 1988 | ||
| Essai HGPRT, cellules d’ovaire de hamster chinois (OHC) | Négatifs | - | Moore et al., 1989 | |
| Test d’Ames, Salmonella typhimurium TA98 | Négatifs | +/- | Rohm et Hass, 1977, 1981; Ishidate et al,. 1981; Haworth et al., 1983; Waegemaekers et Bensink, 1984; NTP, 1986a | |
| Négatifs | - | Brusick, 1977; ECETOC, 1994 | ||
| Négatifs | + | Zeiger et al., 1992 | ||
| Test d’Ames, Salmonella typhimurium TA100 | Négatifs | +/- | Rohm et Hass, 1977, 1981; Ishidate et al., 1981; Haworth et al., 1983; Waegermaekers et Bensink, 1984; NTP, 1986a | |
| Négatifs | - | Brunsick, 1977; ECETOC, 1994 | ||
| Négatifs | + | Zeiger et al,. 1992 | ||
| Test d’Ames, Salmonella typhimurium TA1535 | Négatifs | +/- | Rohm et Hass, 1977, 1981; Haworth et al., 1983; Waegemaekers et Bensink, 1984; NTP, 1986a | |
| Négatifs | - | Brusick, 1977; ECETOC, 1994 | ||
| Négatifs | + | Zeiger et al,. 1992 | ||
| Test d’Ames, Salmonella typhimurium TA1537 | Négatifs | +/- | Rohm et Hass, 1977, 1981; Ishidate et al., 1981; Haworth et al., 1983; Waegemaekers et Bensink, 1984; NTP, 1986a | |
| Négatifs | - | Brusick 1977; ECETOC 1994 | ||
| Test d’Ames, Salmonella typhimurium TA1538 | Négatifs | +/- | Rohm et Hass, 1977; Waegemaekers et Bensink, 1984 | |
| Négatifs | - | Brusick, 1977 | ||
| Test d’Ames, Salmonella typhimuriumYG7108pin3ERb5 | Négatifs | - | Emmert et al., 2006 | |
| Test umu, Salmonella typhimurium TA1535/pSK1002 | Négatifs | +/- | Yasunaga et al., 2004 | |
| Test cytogénétique sur levure, Saccharomyces cerevisiae D61.M | Positifs | _ | Zimmermann et Mohr, 1992 | |
| Test cytogénétique sur levure, Saccharomyces cerevisiae, souche D4 | Négatifs | +/- | Rohm et Haas, 1983 | |
| Paramètre | Doses ou concentrations minimales avec effet[i]/Résultats | ||||
|---|---|---|---|---|---|
| Animaux de laboratoire et in vitro | |||||
| Génotoxicité et paramètres connexesin vitro | Aberrations chromosomiques Résultats positifs : Cellules d’ovaire de hamster chinois (CHO) avec et sans activation métabolique S9 (NTP, 1986b). Résultats positifs : Cellules CHO avec activation métabolique S9 (Loveday et al., 1990). Résultats positifs : Cellules de lymphome de souris L5178Y/TK+/- sans activation métabolique S9 (Moore et al., 1988). Résultats positifs : Cellules de poumon de hamster chinois (CHL-Zellen) avec et sans activation métabolique S9 (Ishidate et al., 1981). Résultats positifs : Splénocytes isolés de souris sans S9 à la phase G1-S (Kligerman et al., 1991). Résultats négatifs : Cellules CHO sans activation métabolique S9 (Loveday et al., 1990). Résultats négatifs : Splénocytes isolés de souris traitées sans S9 à la phase G0 (Kligermanet al., 1991). Échange de chromatides sœurs Résultats positifs : Cellules CHO avec activation métabolique S9 (Loveday et al., 1990). Résultats positifs : Cellules CHO sans activation métabolique S9 (NTP, 1986b). Résultats négatifs : Cellules CHO sans activation métabolique S9 (Loveday et al., 1990). Résultats négatifs : Splénocytes isolés de souris sans S9 aux phases G0 et G1-S (Kligerman et al., 1991). Alkylation de l’ADN Résultats négatifs : Incubation de l’acrylate d’éthyle avec les désoxyribonucléosides pendant une période pouvant aller jusqu’à 24 heures à un pH de 6,7 ou 7,4 à 37 °C ou pendant une période pouvant aller jusqu’à 8 heures à 50 °C (McCarthy et al., 1994). Essai de transformation cellulaire Résultats positifs : Cellules A-31-1-13 BALB/c-3T3 (Matthews et al., 1993). Résultats positifs : Cellules épithéliales trachéales de rats Fischer 344 (Steele et al., 1989). Le BUA (1992) a souligné que la méthode n’est pas valide. |
||||
| Sensibilisation | Résultats positifs : Test d’adjuvant complet de Freund chez les cobayes et sensibilisation croisée aux provocations par plusieurs autres acrylates (Van der Walle et al., 1982). Résultats négatifs : Test de maximisation chez des cobayes (Van der Walle et al., 1982). Résultats négatifs : Test d’enflure des oreilles de souris afin de déceler l’hypersensibilité de contact (NTP, 1994; Hayes et Meade, 1999). Résultats négatifs : Essai des ganglions lymphatiques locaux murins (Kimber, 1992; NTP, 1994; Hayes et Meade, 1999). |
||||
| Irritation | Irritation cutanée Inflammation cutanée, érythème et œdème modérés à graves lors d’essais sur des lapins (Pozzani et al., 1994; Treon et al., 1949; Oettel et Zeller, 1958; BASF AG, 1978; Poole, 1980; Potokar et al., 1985; Rohm et Haas, 1991; BASF, 2005). Substance déclaré irritante chez les lapins, mais gravité non précisée (Celanese Chem Co., 1972; Lomonova et Klimova, 1979; Union Carbide Corp, 1989; BAMM 1994). Substance déclarée non irritante; aucune irritation constatée chez les lapins (pas d’information supplémentaire) (Union Carbide Corp, 1989). Léger érythème transitoire dans des conditions non occlusives; érythème et œdème graves dans des conditions occlusives chez les rats (Rohm et Haas, 1986a, 1986c). Aucune irritation dans des conditions non occlusives; érythème grave et œdème modéré dans des conditions occlusives chez les souris (Rohm et Haas, 1986d). |
||||
Irritation oculaire Rougeur et inflammation de la conjonctive et obscurcissement de la cornée lors d’essais sur des lapins (Pozzani et al., 1949; BASF AG, 1958; Oettel et Zeller, 1958; Poole, 1980). Irritant chez les cobayes; pas d’information supplémentaire (Haskell Laboratories, 1945). |
|||||
| Humains | |||||
| Études de sensibilisation | Vingt-quatre volontaires (aucun renseignement complémentaire précisé dans Opdyke, 1975) ont été traités pendant 48 heures au moyen d’acrylate d’éthyle à 4 % mêlé à de la gelée de pétrole dans le cadre d’un test de maximisation. On a constaté une sensibilisation chez dix volontaires. Aucune irritation n’a été observée (Epstein, 1974). Cinq hommes qui avaient réagi antérieurement à l’acrylate de bis (2-éthylhexyl) (2EHA) ou à l’acideN-tert-butyl maléamique ont été soumis pendant 48 heures à des tests épicutanés recouverts faisant intervenir de l’acrylate d’éthyle à 5 % mêlé à de l’huile d’olive. On a constaté de l’irritation chez une personne. Trois personnes ont fait preuve de sensibilisation croisée à l’acrylate d’éthyle (Jordan, 1975). Cent vingt-quatre personnes ayant des antécédents de dermatite en présence d’acrylate d’éthyle (aucun renseignement complémentaire) ont été soumises pendant 24 ou 48 heures à des tests épicutanés recouverts faisant intervenir 0,1 à 0,5 % d’acrylate d’éthyle mêlé à de la gelée de pétrole; 9 patients sur 124 ont démontré une sensibilisation (Kanervaet al., 1995). Cinquante-cinq techniciens dentaires (aucun renseignement supplémentaire) présentant une dermatite professionnelle présumée ont été soumis pendant 24 heures à des tests épicutanés faisant intervenir 0,1 % d’acrylate d’éthyle mêlé à de la gelée de pétrole; 3/55 ont démontré une sensibilisation (Rustemeyer et Frosch, 1996). Vingt-trois patients présentant une dermatite de contact d’origine allergique aux acrylates (17 femmes et 6 hommes de 30 à 69 ans) ont été soumis à des tests épicutanés faisant intervenir 0,1 % d’acrylate d’éthyle; 72 % des patients ont démontré une sensibilisation à l’acrylate d’éthyle. Dix patients allergiques aux ongles artificiels sur 11 ont été sensibilisés à l’acrylate d’éthyle (Koppula et al., 1995). [Autres études : Foulger et Fleming, 1945; Fregert, 1978; Bjorkner et Dahlquist, 1979; Malten et al., 1984; Conde-Salazar et al.,1988; Kanerva et al., 1988, 1989, 1992; Stenman et Bergman, 1989; Skoglund et Egelrud, 1991; Marks et al., 1995; Tucker et Beck, 1999; Aalto-Korteet al., 2007; Lazarov, 2007] |
||||
| Études épidémiologiques | |||||
| Études de cas | Un homme exposé accidentellement à l’acrylate d’éthyle a subi une grave irritation des yeux. Aucune précision n’était disponible (Dow Chemical, 1964). Une femme enceinte exposée à des polymères SK-131-A (polymères issus de l’acrylate d’éthyle, de l’acrylonitrile et de l’acide 2-méthylidènebutanedioïque) et SK131-B (polymères provenant de l’acrylate d’éthyle, du méthylolacrylamide et de l’acide 2-méthylidènebutanedioïque) a eu un enfant chez qui on a diagnostiqué des anomalies congénitales. Aucune autre précision n’était disponible (Sherman, 1985). |
||||
| Études de cohorte | Dans une première étude de cohorte menée à Bristol de 1933 à 1945, 3924 hommes employés dans une usine de fabrication de feuilles d’acrylique de Bristol (Pennsylvanie) ont été exposés à de l’acrylate d’éthyle, à du méthacrylate de méthyle, à du plomb, à du dichlorure d’éthylène, à du chlorure de méthylène et à de l’acrylonitrile. Les concentrations auxquelles ils avaient été exposés n’ont pas été mesurées et on a fondé les données concernant l’exposition sur un énoncé des tâches reconstruit à partir de relevés de production et d’entrevues avec le personnel de l’usine. Vingt ans après l’équivalent de trois ans passés à des emplois nécessitant l’exposition la plus élevée à l’acrylate d’éthyle ou au méthacrylate de méthyle, on a observé chez les travailleurs exposés à l’acrylate d’éthyle ou au méthacrylate de méthyle une surmortalité due au cancer du côlon (14 cas observés contre 7,53 cas prévus) comparativement aux taux locaux. Vingt ans après l’équivalent de trois ans d’emploi, on a observé chez les travailleurs exposés une surmortalité due au cancer du rectum (10 cas observés contre 5,23 cas prévus) par rapport aux taux locaux (Walker et al., 1991). Dans une étude de cohorte ultérieure menée à Bristol de 1946 à 1986, 6 548 hommes employés dans une usine de fabrication de feuilles d’acrylique de Bristol (Pennsylvanie) ont été exposés à de l’acrylate d’éthyle, à du méthacrylate de méthyle, à du plomb, à du dichlorure d’éthylène, à du chlorure de méthylène et à de l’acrylonitrile. Pour le méthacrylate de méthyle et l’acrylate d’éthyle, les niveaux d’exposition, semi-quantitatifs, ont été répartis selon une échelle d’exposition ordinale à quatre niveaux (niveau 1 = pas d’exposition régulière, niveau 2 = 1-5 ppm, niveau 3 = 5-24 ppm, niveau 4 = > 25 ppm). L’étude ne distinguait pas les niveaux d’exposition pour le méthacrylate de méthyle et l’acrylate d’éthyle. Les données sur l’exposition ont été surveillées à partir de 1972 et les données antérieures concernant l’exposition ont été reconstruites à partir de relevés de production et d’entrevues avec le personnel de l’usine. On n’a pas observé de surmortalité provenant d’une cause quelconque (Walker et al., 1991). Dans une étude de cohorte menée à Knoxville de 1943 à 1982, 3 381 hommes employés dans une usine de fabrication de feuilles d’acrylique de Knoxville (Tennessee) ont été exposés à de l’acrylate d’éthyle, à du méthacrylate de méthyle, à du plomb, à du dichlorure d’éthylène, à du chlorure de méthylène et à de l’acrylonitrile. Pour la vapeur de méthacrylate de méthyle et d’acrylate d’éthyle, les niveaux d’exposition, semi-quantitatifs, ont été répartis selon une échelle d’exposition à quatre niveaux fondée sur les tâches professionnelles. L’étude ne distinguait pas les niveaux d’exposition au méthacrylate de méthyle et à l’acrylate d’éthyle. Les données sur l’exposition ont été surveillées à partir de 1972 et les données antérieures ont été reconstruites à partir de relevés de production et d’entrevues avec le personnel de l’usine. On n’a pas observé de surmortalité provenant d’une cause quelconque (Walker et al., 1991). Des travailleurs employés pendant 5 ans en moyenne (20 femmes et 13 hommes) ont été exposés aux concentrations suivantes : 4-58 mg/m3 (1-14 ppm) d’acrylate d’éthyle, jusqu’à 50 mg/m3 (9,4 ppm) d’acrylate de n-butyle et 0,11-2 mg/m3(0,05-0,9 ppm) d’acrylonitrile. Des troubles de la fonction neuro-autonome ou des troubles névrotiques du système nerveux central ont été diagnostiqués chez 14 personnes sur 33; un examen électroencéphalographique n’a pas montré de dysfonction organique (Kuzelova et al., 1981). Des travailleurs d’une usine de produits chimiques fabriquant des acrylates et des méthacrylates (618 hommes, 113 femmes de 17 à 69 ans, la moyenne d’âge étant de 42,9 ans) ont été exposés à un mélange d’acrylate d’éthyle et de butyle, d’acide acrylique et de méthacrylate de méthyle. La concentration de l’acrylate d’éthyle et de l’acide acrylique variait de 0,01 à 56 ppm. On a observé une réduction de la fonction olfactive, mais l’association ne s’est pas révélée statistiquement significative (Schwartz et al., 1989). |
||||
| N° | Méthode normalisée (OCDE, UE, nationale ou autre)? | Pondération | Oui/non | Précisions |
|---|---|---|---|---|
| 1 | Référence : OCDE. 2005. Acrylate d’éthyle. No CAS 140-88-5. Dossier SIDS. Genève (Suisse) : Programme des Nations Unies pour l’environnement. | |||
| 2 | Identité de la substance : n° CAS | n.d. | Oui | |
| 3 | Identité de la substance : nom(s) chimique(s) | n.d. | Oui | |
| 4 | Composition chimique de la substance | 2 | Oui | |
| 5 | Pureté chimique | 1 | Oui | |
| 6 | Indication de la persistance/stabilité de la substance en milieu aqueux? | 1 | Non | |
| Méthode | ||||
| 7 | Référence | 1 | Oui | |
| 8 | Méthode normalisée (OCDE, UE, nationale ou autre)? | 3 | Oui | |
| 9 | Justification de la méthode ou du protocole si une méthode normalisée n’a pas été employée | 2 | Oui | |
| 10 | Bonne pratique de laboratoire (BPL) | 3 | Oui | |
| Organisme d’essai | ||||
| 11 | Identité de l’organisme : nom | n.d. | Oui | |
| 12 | Indication du nom latin ou des deux noms (latin et commun)? | 1 | Oui | |
| 13 | Âge ou stade biologique de l’organisme d’essai | 1 | Non | |
| 14 | Longueur et/ou poids | 1 | Non | |
| 15 | Sexe | 1 | Non | |
| 16 | Nombre d’organismes par répétition | 1 | ||
| 17 | Charge en organismes | 1 | Non | |
| 18 | Type de nourriture et périodes d’alimentation pendant la période d’acclimatation | 1 | Oui | |
| Conception et conditions des essais | ||||
| 19 | Type d’essai (toxicité aiguë ou chronique) | n.d. | Oui | Chronique |
| 20 | Type d’expérience (en laboratoire ou sur le terrain) | n.d. | Oui | Laboratoire |
| 21 | Voies d’exposition (nourriture, eau, les deux) | n.d. | ||
| 22 | Durée de l’exposition | n.d. | Oui | 21 jours |
| 23 | Témoins négatifs ou positifs (préciser) | 1 | Oui | |
| 24 | Nombre de répétitions (y compris les témoins) | 1 | Oui | Cinq |
| 25 | Des concentrations nominales sont-elles indiquées? | 1 | Oui | Cinq |
| 26 | Des concentrations mesurées sont-elles indiquées? | 3 | Oui | |
| 27 | Type de nourriture et périodes d’alimentation durant les essais à long terme | 1 | Oui | |
| 28 | Les concentrations ont-elles été mesurées périodiquement (spécialement dans les essais de toxicité chronique)? | 1 | Oui | Cinq |
| 29 | Les conditions du milieu d’exposition pertinentes pour cette substance sont-elles indiquées? (p. ex., pour la toxicité des métaux – pH, COD/COT, dureté de l’eau, température) | 3 | Oui | |
| 30 | Photopériode et intensité de l’éclairage | 1 | Non | |
| 31 | Préparation de solutions mères et de solutions d’essai | 1 | Non | |
| 32 | Emploi d’un agent émulsionnant ou solubilisant si la substance était peu soluble ou instable? | 1 | Non | |
| 33 | Si un agent émulsionnant ou solubilisant a été employé, sa concentration est-elle indiquée? | 1 | Non | |
| 34 | Si un agent émulsionnant ou solubilisant a été utilisé, son écotoxicité est-elle signalée? | 1 | Non | |
| 35 | Les intervalles des contrôles (y compris les observations et les paramètres de la qualité de l’eau) sont-ils indiqués? | 1 | Oui | |
| 36 | Méthodes statistiques utilisées | 1 | Non | |
| Renseignements d’intérêt pour la qualité des données | ||||
| 37 | Le paramètre déterminé est-il directement attribuable à la toxicité de la substance, non à l’état de santé des organismes (p. ex., lorsque la mortalité des témoins est supérieure à 10 %) ou à des facteurs physiques (p. ex., « effet d’ombrage »)? | n.d. | Oui | |
| 38 | L’organisme d’essai correspondait-il à l’environnement au Canada? | 3 | Oui | |
| 39 | Les conditions d’essai (pH, température, OD, etc.) sont-elles typiques pour l’organisme d’essai? | 1 | Oui | |
| 40 | Le type et la conception du système (statique, semi-statique, dynamique, ouvert ou fermé, etc.) correspondent-ils aux propriétés de la substance et à la nature ou aux habitudes de l’organisme? | 2 | Oui | |
| 41 | Le pH de l’eau était-il dans la plage des valeurs typiques de l’environnement au Canada (de 6 à 9)? | 1 | Oui | |
| 42 | La température de l’eau d’essai était-elle dans la plage des valeurs typiques de l’environnement au Canada (5 à 27 ºC)? | 1 | Oui | |
| 43 | La valeur de la toxicité était-elle inférieure à celle de la solubilité de la substance dans l’eau? | 3 | Oui | |
| Résultats | ||||
| 44 | Valeurs de la toxicité (indiquer paramètres et valeurs) | n.d. | n/a | |
| 45 | Autres paramètres indiqués – p. ex., FBC/FBA, CMEO/CSEO (préciser)? | n.d. | Oui | CMEO/CSEO/CMAT/CE50 |
| 46 | Autres effets nocifs indiqués (p. ex., cancérogénicité, mutagénicité)? | n.d. | Non | |
| 47 | Note : ... % | 77,1 | ||
| 48 | Code de fiabilité d’Environnement Canada : | 2 | ||
| 49 | Catégorie de fiabilité (élevée, satisfaisante, faible) : | Confiance satisfaisante | ||
| 50 | Commentaires | |||
Notes de bas de page
[2] La détermination de la conformité à l’un ou plusieurs des critères énoncés à l’article 64 repose sur l’évaluation des risques pour l’environnement ou la santé humaine associés aux expositions dans l’environnement en général. Pour les humains, ceci inclut, sans toutefois s’y limiter, les expositions à l’acrylate d’éthyle par l’air ambiant et intérieur, l’eau potable, les produits alimentaires et l’utilisation de produits de consommation. Une conclusion établie en vertu de la LCPE (1999) sur les substances des lots 1 à 12 du Défi, énumérées dans le Plan de gestion des produits chimiques, n’est pas pertinente, ni n’empêche une évaluation en fonction des critères de danger définis dans leRèglement sur les produits contrôlés qui fait partie du cadre réglementaire applicable au Système d’information sur les matières dangereuses utilisées au travail pour les produits destinés à être utilisés au travail.
[3] Déclaration volontaire produite par la Basic Acrylic Monomer Manufacturers Association (BAMM)
[4] Déclaration volotaire produite par Rohm and Haas Canada.
Cette page Web a été archivée dans le Web
L'information dont il est indiqué qu'elle est archivée est fournie à des fins de référence, de recherche ou de tenue de documents. Elle n'est pas assujettie aux normes Web du gouvernement du Canada et elle n'a pas été modifiée ou mise à jour depuis son archivage. Pour obtenir cette information dans un autre format, veuillez communiquer avec nous.
Archivée
l’acrylate d’éthyle
Numéro de registre du Chemical Abstracts Service :
140-88-5
Environnement Canada
Santé Canada
Septembre 2011
Table des matières
- Sommaire
- Introduction
- Identité de la substance
- Propriétés physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe 1 : Limite supérieure estimée de l'exposition de la population générale au Canada à l'acrylate d'éthyle à partir des milieux naturels
- Annexe 2 : Limite supérieure estimée de l'exposition à l'acrylate d'éthyle à partir des produits de consommation
- Annexe 3 : Résumé des données relatives aux effets de l'acrylate d'éthyle sur la santé
- Annexe 4 : Sommaire de rigueur d'études : toxicité pour les organismes aquatiques
Conformément à l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)], les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable de l’acrylate d’éthyle dont le numéro de registre du Chemical Abstracts Service[1] est 140-88-5. Une priorité élevée a été accordée à la prise de mesures à l’égard de la substance d’acrylate d’éthyle lors de la catégorisation visant la Liste intérieure des substances dans le cadre du Défi. On a déterminé que l’acrylate d’éthyle constitue une substance d’importance prioritaire parce qu’il a été considéré comme présentant le plus fort risque d’exposition (PFRE) à la population canadienne et qu’il a été inscrit sur une liste de produits cancérigènes par d’autres organismes. La substance n’a pas satisfait aux critères de catégorisation écologique relatifs à la persistance, au potentiel de bioaccumulation ou à la toxicité intrinsèque pour les organismes aquatiques.
Selon les renseignements soumis en application de l’article 71 de la LCPE (1999), aucune entreprise du Canada n’a fabriqué d’acrylate d’éthyle au cours de l’année civile 2006 en quantité supérieure au seuil de déclaration de 100 kg. On a toutefois signalé que 1 000 000 à 10 000 000 kg d’acrylate d’éthyle ont été importés en 2006. L’acrylate d’éthyle est principalement utilisé dans la fabrication de polymères et de copolymères. Même si des rejets d’acrylate d’éthyle provenant de ces sources se produisent dans l’environnement, on ne s’attend pas à ce que la population canadienne en général soit exposée à un degré appréciable à l’acrylate d’éthyle.
Comme l’acrylate d’éthyle a été classé par les organismes de réglementation internationaux sur la base de sa cancérogénicité, la présente évaluation préalable a porté principalement sur cette capacité de la substance. On a observé la formation de tumeurs du secteur gastrique antérieur chez des rats et des souris auxquels on avait administré de l’acrylate d’éthyle par gavage oral pendant deux ans. On n’a toutefois pas observé de formation de tumeurs lorsque l’administration de la substance s’est faite par d’autres voies telles que l’absorption d’eau potable par la bouche, l’inhalation et le contact cutané. L’ensemble de preuves issu des études de génotoxicité laisse entendre que l’acrylate d’éthyle n’est pas susceptible d’être mutagène, mais qu’il pourrait manifester des effets clastogènes in vitro. Bien que le mode de formation des tumeurs n’ait pas été entièrement élucidé, on a laissé entendre que l’hyperplasie prolongée du secteur gastrique antérieur pourrait constituer un facteur précurseur. En conséquence, on a utilisé une approche fondée sur le seuil d’innocuité pour caractériser le risque de la substance pour la santé humaine.
Les marges entre l’estimation de la limite supérieure d’exposition à l’acrylate d’éthyle dans les milieux naturels, les aliments ou l’utilisation de produits de consommation et les niveaux associés aux effets sur les animaux de laboratoire sont considérées comme adéquates pour tenir compte des incertitudes dans les bases de données concernant les effets sur la santé et l’exposition.
À la lumière des renseignements présentés dans le présent document, il est conclu que l’acrylate d’éthyle ne pénètre pas dans l’environnement en quantité, à des concentrations ou dans des conditions qui constituent ou peuvent constituer un risque pour la vie ou la santé humaines.
D’après les données empiriques disponibles, lesquelles proviennent de modèles, l’acrylate d’éthyle ne devrait pas être persistant, ni se bioaccumuler dans l’environnement. Cette substance ne répond donc pas aux critères de persistance ou de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation. En outre, les données empiriques disponibles indiquent que cette substance présente un risque modéré à élevé de se révéler toxique pour les organismes aquatiques. Après comparaison de la concentration estimée sans effet toxique et de la concentration estimée raisonnable de la pire exposition dans l’environnement, on estime peu probable que l’acrylate d’éthyle ait des effets écologiques nocifs au Canada.
Selon les renseignements disponibles, on conclut que l’acrylate d’éthyle ne pénètre pas dans l’environnement en une quantité, à une concentration ou dans des conditions ayant ou pouvant avoir un effet nocif immédiat ou à long terme sur l’environnement ou sur sa diversité biologique, ou qui constitue ou peut constituer un danger pour l’environnement essentiel pour la vie.
D’après les renseignements disponibles, il est conclu que l’acrylate d’éthyle ne satisfait à aucun des critères de l’article 64 de la Loi canadienne sur la protection de l’environnement (1999).
L’inclusion de cette substance sera considérée dans la prochaine mise à jour de l’inventaire de la Liste intérieure. De plus, des activités de recherche et de surveillance viendront, le cas échéant, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable.
La Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)] (Canada, 1999) exige que les ministres de l’Environnement et de la Santé procèdent à une évaluation préalable des substances qui répondent aux critères de catégorisation énoncés dans la Loi, afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l’environnement ou la santé humaine.
En se fondant sur l’information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu’une attention prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères environnementaux de catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque pour les organismes aquatiques (Ti), et que l’on croit être commercialisées au Canada;
- celles qui répondent aux critères de catégorisation pour le plus fort risque d’exposition (PFRE) ou qui présentent un risque d’exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine, compte tenu des classifications établies par d’autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont donc publié un avis d’intention dans la Partie I de la Gazette du Canada(Canada, 2006) dans lequel ils priaient l’industrie et les autres parties intéressées de fournir, selon un calendrier déterminé, des renseignements précis qui pourraient servir à étayer l’évaluation des risques, ainsi qu’à élaborer et à évaluer les meilleures pratiques de gestion des risques et de bonne gestion des produits pour ces substances jugées hautement prioritaires.
On a jugé que l’acrylate d’éthyle est une substance dont l’évaluation des risques pour la santé humaine est hautement prioritaire, car on considère qu’elle présente le risque d’exposition le plus fort et elle a été classée par d’autres organismes en fonction de sa cancérogénicité. Le volet du Défi portant sur cette substance a été publié dans la Gazette du Canada le 26 septembre 2009 (Canada, 2009). En même temps a été publié le profil de cette substance qui présentait l’information technique (obtenue avant décembre 2005) sur laquelle a reposé sa catégorisation.Des renseignements sur les utilisations de la substance ont été reçus en réponse au Défi.
Même s’il a été jugé hautement prioritaire d’évaluer les risques que présente l’acrylate d’éthyle pour la santé humaine, cette substance ne répond pas aux critères de catégorisation applicables à la persistance et à la bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation, ni aux critères de toxicité pour les organismes aquatiques.
Les évaluations préalables effectuées aux termes de la LCPE (1999) mettent l’accent sur les renseignements jugés essentiels pour déterminer si une substance répond aux critères de toxicité des substances chimiques au sens de l’article 64 de laLoi. Les évaluations préalables visent à examiner des renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence[2].
La présente évaluation préalable prend en considération les renseignements sur les propriétés chimiques, les dangers, les utilisations et l’exposition, y compris l’information supplémentaire fournie dans le cadre du Défi. Les données pertinentes pour l’évaluation préalable de l’acrylate d’éthyle sont tirées de publications originales, de rapports de synthèse et d’évaluation, de rapports de recherche de parties intéressées et d’autres documents consultés au cours de recherches documentaires menées récemment jusqu’en avril 2010 (sections du document concernant les aspects humains et écologiques).Les études les plus importantes ont fait l’objet d’une évaluation critique; il est possible que les résultats de modélisation aient servi à formuler des conclusions.
L’évaluation des risques pour la santé humaine suppose la prise en compte des données utiles à l’évaluation de l’exposition (non professionnelle) de la population dans son ensemble, ainsi que de l’information sur les dangers pour la santé (principalement d’après les évaluations s’appuyant sur la méthode du poids de la preuve effectuées par d’autres organismes, lesquelles ont servi à déterminer le caractère prioritaire de la substance). Dans le contexte d’une évaluation préalable, les décisions concernant la santé humaine reposent sur la nature de l’effet critique retenu ou sur l’écart entre les valeurs prudentes donnant lieu à des effets et les estimations de l’exposition, compte tenu de la confiance accordée au caractère exhaustif des bases de données sur l’exposition et les effets.L’évaluation préalable ne constitue pas un examen exhaustif ou critique de toutes les données disponibles.Il s’agit plutôt d’un sommaire des renseignements essentiels qui appuient la conclusion.
La présente évaluation préalable a été préparée par le personnel du Programme des substances existantes de Santé Canada et d’Environnement Canada et elle intègre les résultats d’autres programmes exécutés par ces ministères.
Les parties de la présente évaluation préalable qui portent sur la santé humaine et l’écologie ont fait l’objet d’une étude rédigée par des pairs ou d’une consultation de ces derniers. Des commentaires sur les parties techniques concernant la santé humaine ont été fournis par des experts scientifiques désignés et dirigés par la Toxicology Excellence for Risk Assessment (TERA), notamment M. Bernard Gadagbui. (TERA), M. Michael Jayjock (The LifeLine Group) et M. Chris Bevans (CJB Consulting).
En outre, le public a eu 60 jours pour formuler des commentaires sur l’ébauche de la présente évaluation préalable. Même si les commentaires venant de l’extérieur ont été pris en considération, Santé Canada et Environnement Canada sont seuls responsables du contenu final et des résultats de l’évaluation préalable. Les approches suivies pour les évaluations préalables dans le cadre du Défi ont été examinées par un groupe indépendant, soit le Groupe consultatif du Défi.
Les principales données et considérations sur lesquelles repose la présente évaluation sont résumées ci-après.
Aux fins du présent document, la substance est désignée sous le nom d’« acrylate d’éthyle », son appellation la plus courante.
Tableau 1. Identité de la substance - acrylate d’éthyle
| Numéro de registre du Chemical Abstracts Service (n° CAS) | 140-88-5 |
| Nom dans la LIS | Acrylate d’éthyle |
| Noms relevés dans les National Chemical Inventories (NCI)[1] | Ethyl acrylate (ENCS) Acrylate d’éthyle (EINECS) 2-Propenoic acid, ethyl ester (TSCA, AICS, SWISS, PICCS, ASIA-PAC, NZIoC) 2-propenoic acid, ethyl ester (ECL) Acrylic acid, ethyl ester (PICCS) Acrylate, ethyl (PICCS) |
| Autres noms | Ethyl 2-propenoate; Acrylic acid ethyl ester; Ethyl 2propenoate; Ethyl acrylic ester; Ethyl propenoate; NSC 8263; UN 1917 |
Groupe chimique (groupe de la LIS) |
Produits chimiques organiques définis |
| Principale classe chimique ou utilisation | Esters |
| Principale sous-classe chimique | Acrylates |
| Formule chimique | C5H8O2 |
| Structure chimique | 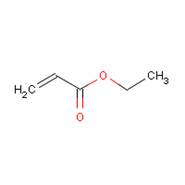 |
| SMILES[2] | O=C(OCC)C=C |
| Masse moléculaire | 100,116 g/mol |
[2] Simplified Molecular Input Line Entry Specification
Le tableau 2 présente les propriétés physiques et chimiques (données expérimentales et modélisées) de l’acrylate d’éthyle qui se rapportent à son devenir dans l’environnement.
Les modèles fondés sur les relations quantitatives structure-activité (RQSA) ont été utilisés pour générer des données pour certaines des propriétés physiques et chimiques de l’acrylate d’éthyle.
Tableau 2. Propriétés physiques et chimiques de l’acrylate d’éthyle
| Propriété | Type | Valeur[1] | Température (°C) | Référence |
|---|---|---|---|---|
| Point de fusion (ºC) |
Expérimental | -72[2] | BASF AG, 2000 | |
| Modélisé | -70,73 | MPBPWIN, 2008 | ||
| Point d’ébullition (ºC) |
Expérimental | 100 | BASF AG, 2000 | |
| Expérimental | 99,4[2] | O’Neil et al., 2001 | ||
| Modélisé | 100,51 | MPBPWIN, 2008 | ||
| Densité (kg/m3) |
Expérimental | 922 (0,922 g/cm3) |
20 | BASF AG, 2000 |
| Pression de vapeur (Pa) |
Expérimental | 3 800 | 20 | BASF AG, 2000 |
| Expérimental | 3 900 (29,3 mm Hg) |
20 | PISSC, 2004 | |
| 3 800[2] (28,5 mm Hg) |
CEDRE, 2006 | |||
| 5 147 (38,6 mm Hg) |
25 | Daubert et Danner, 1989 | ||
| Modélisé | 5 120 (38,6 mm Hg) |
20 | MPBPWIN, 2008 | |
| Constante de la loi de Henry (Pa·m3/mol) |
Expérimental | 25,3[2] | BASF AG, 2000 | |
| Calculé | 25,3 | 20 | ECETOC, 1994 | |
| Modélisé | 6,37 (6,29 × 10-5 •m3/mol) |
25 | HENRYWIN, 2008 (méthode d’estimation de groupe) | |
| 12,46 (1,23 × 10-4 atm•m3/mol) |
25 | HENRYWIN, 2008 (méthode d’estimation des liaisons) | ||
| Log Koe (coefficient de partage octanoleau) (sans dimension) |
Expérimental | 1,18[2] | 25 | BASF AG, 2000 |
| Modélisé | 1,22 | 25 | KOWWIN, 2008 | |
| Log Kco (coefficient de partage carbone organique-eau) (sans dimension) |
Expérimental | 1.34 | IUCLID, 2000 | |
| Modélisé | 1,07 | PCKOCWIN, 2008 | ||
| Log Koa (coefficient de partage carbone organique-air) |
Modélisé | 3,5 | KOAWIN, 2008 | |
| Solubilité dans l’eau (mg/L) |
Expérimental | 15 000[2] | 25 | BASF AG, 2000 |
| 20 000 | Tyler et Smock, 1993 | |||
| 20 000 | 20 | O’Neil et al., 2001 | ||
| 15 000 | Riddick et al., 1986 | |||
| Modélisé | 17 630 éthode Koe) |
25 | WSKOWWIN, 2008 | |
| pKa (constante de dissociation) (sans dimension) |
Modélisé | Ne s’ionise pas dans l’eau | zzACD/pKaDB, 2005 |
[1] Les valeurs entre parenthèses représentent les valeurs originales signalées par les auteurs ou estimées à l’aide des modèles.
[2] Valeur utilisée pour la modélisation.
L’acrylate d’éthyle se trouve naturellement dans les mûres, les framboises, les ananas, le fruit de la passion jaune et le durian (NTP, 1998; Burdock, 1997).
En plus des expositions naturelles, l’exposition humaine à l’acrylate d’éthyle au Canada peut découler de rejets provenant de sources ponctuelles associées à des installations industrielles de traitement par exemple, ainsi que de sources non ponctuelles telles que les aliments, l’emballage de produits alimentaires rejetant de l’acrylate d’éthyle résiduel et les produits commerciaux ou industriels présents sur le marché canadien, notamment par dégagement de gaz ou par migration.
D’après les renseignements recueillis dans le cadre d’une enquête effectuée en application de l’article 71 de la LCPE (1999), entre 1 000 000 et 10 000 000 kg d’acrylate d’éthyle ont été importés au Canada en 2006. Aucune fabrication n’a été signalée au Canada (Environnement Canada, 2010a).
Des données antérieures provenant de la Liste intérieure des substances (LIS) (19841986) ont montré que la quantité totale d’acrylate d’éthyle déclarée comme ayant été importée, fabriquée ou commercialisée au Canada au cours de l’année civile 1986 s’élevait à 12 100 000 kg (Environnement Canada, 1988).À l’extérieur du Canada, l’acrylate d’éthyle a été reconnu par l’Organisation de coopération et de développement économiques (OCDE) comme une substance chimique à haut volume de production, ce volume étant estimé à 50 000 à 100 000 tonnes par an en Europe et à 250 000 à 500 000 tonnes par an en Amérique du Nord (OCDE, 2005).
Procédé de production industrielle de l’acrylate d’éthyle : La majeure partie de l’acrylate d’éthyle est préparée commercialement par l’estérification catalysée d’acide acrylique et d’éthanol (McLaughlin et al., 1993). L’acrylate d’éthyle se polymérise facilement sous l’influence de la chaleur, de la lumière ou des peroxydes (O’Neil, 2006). Pour empêcher la polymérisation prématurée de la substance, l’acrylate d’éthyle est habituellement inhibé à l’aide de 10 à 20 ppm d’éther monométhylique de l’hydroquinone (OCDE, 2005). Pour que l’inhibiteur soit efficace, une certaine quantité d’oxygène dissous doit être présente dans le liquide (OCDE, 2005). Le monomère d’acrylate d’éthyle pur peut être entreposé à une température inférieure à 10 °C sans subir de polymérisation (O’Neil, 2006).
Pendant la fabrication et le transport, l’acrylate d’éthyle est principalement utilisé dans des systèmes fermés en raison de sa volatilité et de son inflammabilité (McLaughlinet al., 1993). Cette substance dégage une odeur désagréable et irritante et présente un faible seuil de détection (0,0012 ppm) (Amoore, 1983). Les concentrations dans l’air supérieures à 0,05 ppm seraient intolérables pour la plupart des personnes (McLaughlin et al., 1993).
Au Canada, l’acrylate d’éthyle entre dans la synthèse des polymères et des copolymères aux fins d’utilisation dans les formulations de produits industriels et de produits de consommation. Il n’existe pas de produit de consommation finale directement issu de l’acrylate d’éthyle, mais on peut trouver de l’acrylate d’éthyle dans des produits comme résidu issu du processus de polymérisation. L’acrylate d’éthyle apporte de la souplesse aux films résistants (O’Neil, 2006).
Les polymères en émulsion (à base d’eau) issus de l’acrylate d’éthyle sont utilisés dans les peintures au latex, les revêtements, les produits de calfeutrage et les produits de construction; dans les liants de pigments et les vernis employés pour les encres de gravure; dans les couches de base servant au traitement du cuir naturel ainsi que dans les adhésifs (McLaughlin et al., 1993). Les polymères en émulsion faisant intervenir l’acrylate d’éthyle sont utilisés dans les encaustiques pour planchers, les scellants, de même que dans les procédés de traitement des textiles tels que la liaison des fibres de rembourrage et des textiles non tissés, le laminage, le flocage, l’enduction d’envers et le finissage des tissus (McLaughlin et al., 1993). Parmi les polymères (à base de solvant) issus de l’acrylate d’éthyle figurent les laques, les peintures-émail et les améliorants de l’indice de viscosité des huiles (McLaughlin et al., 1993). Les polymères solides incluent les feuilles de plastique acrylique et les modificateurs de la résistance des matières plastiques aux chocs (McLaughlin et al., 1993).
Selon les renseignements fournis en application de l’article 71 de la LCPE (1999) et les réponses apportées au questionnaire dans le cadre du Défi, 1 000 000 à 10 000 000 kg d’acrylate d’éthyle ont été utilisés au Canada en 2006 (Environnement Canada, 2010a). La totalité de l’acrylate d’éthyle utilisé ne reste pas nécessairement au Canada, car une partie est exportée dans des produits finis (Environnement Canada, 2010b).
L’acrylate d’éthyle ne figure pas parmi les additifs alimentaires approuvés dans le Règlement sur les aliments et drogues (Canada, 1978), mais il est peut-être utilisé comme aromatisant dans des aliments vendus au Canada. Les aromatisants alimentaires ne font pas partie des additifs alimentaires visés par le Règlement. La Flavor and Extract Manufacturers Association (FEMA) des États-Unis a signalé une tendance à la baisse de la quantité d’acrylate d’éthyle utilisée comme aromatisant pour aliments aux États-Unis, soit au total 11 livres (4,98 kg) en 1995 (Lucas et al., 1999) et 3 livres (1,36 kg) en 2005 (Gavin et al., 2008).
L’acrylate d’éthyle est aussi utilisé dans les matériaux d’emballage d’aliments à titre de monomère de départ servant à la fabrication de polymères et de copolymères acryliques (courriels adressés en 2010 par la Direction des aliments de Santé Canada au Bureau de gestion du risque de Santé Canada; source non citée). Dans la Base de données sur les ingrédients des produits de santé naturels, l’acrylate d’éthyle est présenté comme un ingrédient non médicinal acceptable pouvant servir de renforçateur de goût dans les produits de santé naturels (BDIPSN, 2010). Comme l’acrylate d’éthyle se trouve dans la Base de données des produits de santé naturels homologués, il fait actuellement partie des produits de santé naturels homologués (BDPSNH, 2010).
Au Canada, l’acrylate d’éthyle n’est pas inscrit dans la Base de données sur les produits pharmaceutiques (BDPP) ni dans la Base de données interne sur les ingrédients non médicinaux de la Direction des produits thérapeutiques à titre d’ingrédient médicinal ou non médicinal présent dans des produits pharmaceutiques ou des médicaments vétérinaires (BDPP, 2010; courriels adressés en 2010 par la Direction des produits thérapeutiques de Santé Canada au Bureau de gestion du risque de Santé Canada, source non citée).
Selon les renseignements recueillis dans le cadre d’un sondage exécuté en application de l’article 71 de la LCPE (1999), 306 kg d’acrylate d’éthyle ont été rejetés dans l’air et 1 954 kg ont été transportés dans des installations de gestion des déchets hors site au Canada en 2006 (Environnement Canada, 2010a). Aucun rejet dans l’eau ou le sol n’a été déclaré (Environnement Canada, 2010a). Selon les déclarations faites dans le cadre de l’Inventaire national des rejets de polluants (INRP), 476 kg d’acrylate d’éthyle ont été rejetés en 2006 dans l’environnement par des sources ponctuelles situées en Ontario et au Québec; 72 kg au total ont été rejetés dans l’air ambiant et 3 kg ont été déposés dans des installations extérieures de gestion des déchets (INRP, 2008). Le sort réservé aux 401 kg restants n’a toutefois pas été spécifié (air, eau, sol). En 2008, les rejets déclarés à l’INRP avaient baissé à 133 kg rejetés dans l’air et à 8 kg déposés dans des installations extérieures de gestion des déchets (INRP, 2008). Selon le Toxic Release Inventory (TRI), au total 31 000 kg d’acrylate d’éthyle ont été rejetés aux États-Unis (TRI, 2008).
Selon les rejets déclarés à l’INRP, la plupart des rejets d’acrylate d’éthyle dans l’environnement s’effectuent dans l’air ambiant (Environnement Canada, 2008). Il se peut toutefois que les déclarations à l’INRP soient incomplètes et n’incluent pas certains rejets industriels dans l’eau. La présente évaluation suppose certains rejets d’acrylate d’éthyle dans les eaux de surface lorsqu’elle estime les concentrations environnementales estimées dans l’eau.
Tableau 3. Données de l’INRP sur l’acrylate d’éthyle (Environnement Canada, 2008)
| Année | Rejets sur place (tonnes) |
Élimination (tonnes) |
||||
|---|---|---|---|---|---|---|
| Air | Eau | Sol | Total | Sur place | Hors site | |
| 2008 | 0,133 | 0,133 | 0,008 | |||
| 2007 | 0,555 | 0,555 | 0,006 | |||
| 2006 | 0,072 | 0,476[1] | 0,003 | |||
| 2005 | 0,059 | 0,115[2] | 0,024 | |||
| 2004 | 0,044 | 0,116[3] | ||||
| 2003 | 0,015 | 0,114[4] | ||||
| 2002 | 0,048 | 0,156[5] | 0,004 | |||
| 2001 | 1,5 | 1,7[6] | 9,2 | |||
| 2000 | 1,8 | 1,9[7] | 15 | |||
| 1999 | 0,322 | |||||
[2] Un rejet total de 0,056 tonne a été déclaré, sans toutefois préciser dans quels milieux.
[3] Un rejet total de 0,073 tonne a été déclaré, sans toutefois préciser dans quels milieux.
[4] Un rejet total de 0,099 tonne a été déclaré, sans toutefois préciser dans quels milieux.
[5] Un rejet total de 0,108 tonne a été déclaré, sans toutefois préciser dans quels milieux.
[6] Un rejet total de 0,21 tonne a été déclaré, sans toutefois préciser dans quels milieux.
[7] Un rejet total de 0,128 tonne a été déclaré, sans toutefois préciser dans quels milieux.
D’après les propriétés physiques et chimiques de l’acrylate d’éthyle (tableau 2), les résultats de la modélisation de la fugacité de niveau III (tableau 4) semblent indiquer que cette substance demeure principalement dans l’air, l’eau et le sol, selon le milieu où elle est rejetée. Le programme de modélisation pKadB (ACD, 2005) indique que la substance ne s’ionise pas dans l’eau (absence de groupes ionisables).
Tableau 4. Résultats de la modélisation de la fugacité de niveau III (EQC, 2003)
| Substance rejetée dans : | Pourcentage de la substance se répartissant dans chaque milieu | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| l’air (100 %) | 93,8 | 5,6 | 0,7 | 0,0 |
| l’eau (100 %) | 1,8 | 97,9 | 0,0 | 0,2 |
| le sol (100 %) | 3,2 | 11,4 | 85,3 | 0,0 |
Lorsque la substance est rejetée dans l’air, des quantités élevées devraient s’y répartir (voir le tableau 4 ci-dessus). Si on se fonde sur la pression de vapeur expérimentale élevée de 3 900 Pa et sur la constante de la loi de Henry modérée à élevée de 25,3 Pa m3/mol, l’acrylate d’éthyle est considéré comme volatil. En conséquence, s’il est rejeté uniquement dans l’air, il tend à demeurer dans ce milieu même si une faible quantité se dépose aussi dans l’eau (~6 %, voir le tableau 4).
Si l’acrylate d’éthyle est rejeté dans l’eau, il tend à s’adsorber faiblement aux solides en suspension et aux sédiments en se fondant sur une faible valeur de 1,34 du log Kco. Si on se fonde sur la constante de la loi de Henry de ce composé et sur sa rapide dégradation dans l’eau qui limite son transport dans l’air, on peut s’attendre à ce que la volatilisation de l’acrylate d’éthyle à partir des plans d’eau joue un rôle peu important dans le devenir de cette substance. Même s’il peut arriver qu’une polymérisation de l’acrylate d’éthyle par le biais du rayonnement ultraviolet s’amorce dans le réseau hydrographique, celle-ci ne produira que des oligomères de faible masse moléculaire (< 4 unités) qui devraient se biodégrader. Par conséquent, si l’eau est un milieu récepteur, l’acrylate d’éthyle devrait surtout demeurer dans l’eau et, dans une très faible mesure, se répartir dans l’air (voir le tableau 4).
S’il est rejeté dans le sol, l’acrylate d’éthyle ne devrait pas présenter une forte adsorption au sol (c’est-à-dire qu’il devrait être mobile compte tenu de son faible log Kco. La volatilisation à partir des surfaces de sol humides semble un processus peu important dans le devenir de cette substance d’après sa constante de la loi de Henry.Sa pression de vapeur peut l’amener à se volatiliser légèrement à partir des surfaces de sol sèches. En cas de rejet de l’acrylate d’éthyle dans le sol, on s’attend donc à ce qu’il demeure en majeure partie dans ce milieu, même si une faible partie risque d’être transportée dans l’eau de surface par le ruissellement, de se diffuser dans les eaux souterraines et de se volatiliser dans l’air.
Persistance dans l’environnement
Le tableau 5a présente les données empiriques sur la biodégradation. Selon ces données, la demi-vie de l’acrylate d’éthyle dans l’air devrait être inférieure à deux jours et sa demivie dans l’eau, inférieure à 182 jours (6 mois); en conséquence la substance ne devrait pas se révéler persistante dans ces milieux.
Le tableau 5a présente des données empiriques sur la biodégradation tirées d’un essai de biodégradation immédiate (MITI, 1992) qui indiquent une biodégradation ultime de 52 % sur une période de 14 jours. Le résultat de cet essai laisse entendre que la demi-vie de l’acrylate d’éthyle dans l’eau serait d’environ 13 jours (en supposant une cinétique du premier ordre) - donc nettement inférieure à 182 jours (6 mois), ce qui indique que cette substance risque peu de persister dans ce milieu. Utilisant les méthodes de l’OCDE (méthode 301D) (OCDE, 1992), Staples et al. (2000) ont conclu à une dégradation de 57 % en 28 jours indiquant que l’acrylate d’éthyle est intrinsèquement biodégradable. Les auteurs ont aussi soumis la substance à l’essai de demande biochimique en oxygène de cinq jours (DBO5) et conclu que l’acrylate d’éthyle se dégrade facilement (77 %). La norme ISO (14593) identique à la méthode 310 de l’OCDE (OCDE, 2005; OCDE, 2003) a montré que l’acrylate d’éthyle est facilement biodégradable (80 à 90 % après 28 jours).
Tableau 5a. Données empiriques sur la dégradation de l’acrylate d’éthyle
| Milieu | Processus du devenir | Valeur de dégradation | Paramètre de dégradation | Référence |
|---|---|---|---|---|
| Air | Réaction avec l’ozone | 2,01 | Demi-vie, jours | Atkinson, 1989 |
| Air | Oxydation atmosphérique | 0,67 | Demi-vie, jours | Atkinson, 1989 |
| Eau | Hydrolyse | 1 277,5 | Demi-vie, jours (pH 7) |
Mabey et Mill, 1978 |
| Eau | Biodégradation | 52 | Biodégradation, % après 14 jours (DBO) | MITI, 1992 |
| Eau | Biodégradation | 92,6 à 100 | Biodégradation, % après 14 jours (analyse du composé d’origine) | MITI, 1992 |
| Eau | Biodégradation | 57 | Biodégradation, % après 28 jours | Staples et al., 2000 |
| Eau | Biodégradation | 80 à 90 | Biodégradation, % après 28 jours | OCDE, 2005 |
Bien que des données expérimentales sur la dégradation de l’acrylate d’éthyle soient disponibles, une méthode du poids de la preuve reposant sur des relations quantitatives structure-activité (RQSA) (Environnement Canada, 2007) a aussi été utilisée avec les modèles de dégradation présentés au tableau 5b ci-après. Compte tenu de l’importance écologique du milieu aquatique ainsi que du fait que la plupart des modèles disponibles s’appliquent à l’eau et que l’acrylate d’éthyle peut être libéré dans ce milieu, les études ont surtout porté sur la biodégradation dans l’eau.
Le tableau 5b résume les résultats des modèles prévisionnels RQSA disponibles sur la biodégradation dans l’eau et dans l’air.
Tableau 5b. Données modélisées sur la dégradation de l’acrylate d’éthyle
| Processus du devenir | Modèle et base du modèle |
Résultat et prévision du modèle | Demi-vie extrapolée (jours) |
|---|---|---|---|
| Air | |||
| Oxydation atmosphérique | AOPWIN, 2008[1] | t1/2 = 11,8 heures | ≤ 2 |
| Réaction avec l’ozone | AOPWIN, 2008[1] | t1/2 = 6,5 jours | ≥ 2 |
| Eau | |||
| Hydrolyse | HYDROWIN, 2008[1] | t1/2 = 9 ans (pH 7) t1/2 = 329 jours (pH 8) |
≥ 182 |
| Biodégradation primaire | |||
| Biodégradation (aérobie) | BIOWIN, 2008[1] Sous-modèle 4 : enquête d’expert (résultats qualitatifs) |
3,9[2] (se biodégrade rapidement) |
≤ 182 |
| Biodégradation ultime | |||
| Biodégradation (aérobie) | BIOWIN, 2008[1] Sous-modèle 3 : enquête d’expert (résultats qualitatifs) |
3,1[2] (se biodégrade rapidement) |
≤ 182 |
| Biodégradation (aérobie) | BIOWIN, 2008[1] Sous-modèle 5 : MITI, probabilité linéaire |
0,8[3] (se biodégrade rapidement) |
≤ 182 |
| Biodégradation (aérobie) | BIOWIN, 2008 Sous-modèle 6 : MITI, probabilité non linéaire MITI |
0,9[3] (se biodégrade rapidement) |
≤ 182 |
| Biodégradation (aérobie) | TOPKAT, 2004 Probabilité |
1,0[3] (se biodégrade très rapidement ) |
≤ 182 |
| Biodégradation (aérobie) | CATABOL, ©2004-2008 % DBO (demande biochimique en oxygène) |
% DBO = 52 (se biodégrade rapidement) |
≤ 182 |
[2] Le modèle ne fournit pas d’estimation pour ce type de structure.
[3] Le résultat s’exprime par une valeur numérique de 0 à 5.
[4] Le résultat s’exprime par un taux de probabilité.
Dans l’air, la valeur prévue de 11,8 heures pour la demi-vie liée à l’oxydation atmosphérique (voir le tableau 5b) démontre que l’acrylate d’éthyle est susceptible de s’oxyder rapidement.Il devrait réagir avec d’autres espèces comme l’O3 par photooxydation dans l’atmosphère, mais à un débit beaucoup plus lent. La demi-vie dans l’atmosphère résultant de la photolyse indirecte a de plus été estimée à 6,5 heures (OCDE, 2005). Des réactions avec des radicaux hydroxyles devraient donc constituer le plus important processus du devenir de l’acrylate d’éthyle dans l’atmosphère. Compte tenu de sa demi-vie de 0,67 jour (~ 16 heures; tableau 5a) fondée sur des données empiriques et de sa demi-vie estimée de 11,8 heures en raison des réactions avec des radicaux hydroxyles, l’acrylate d’éthyle est considéré comme non persistant dans l’air.
Dans l’eau, une demi-vie prévue de neuf ans par hydrolyse à pH 7 (voir le tableau 5b) démontre que ce produit chimique est susceptible d’être hydrolysé lentement. D’autres processus régissant son devenir dans l’eau doivent toutefois être pris en compte pour déterminer sa persistance dans ce milieu.
Les cinq modèles de biodégradation ultime laissent entendre que la biodégradation est rapide et que la demi-vie dans l’eau est nettement inférieure à 182 jours. Le résultat du sous-modèle 4 BIOWIN (programme de prédiction de biodégradation primaire) laisse penser que la substance possède une demi-vie primaire nettement inférieure à 182 jours, tandis que les sous-modèles de biodégradation ultime BIOWIN indiquent que la minéralisation complète se produirait dans un délai de 182 jours. De leur côté, les prévisions de CATABOL et TOPKAT se situent dans les domaines d’applicabilité des deux modèles. Elles sont donc considérées comme fiables et laissent supposer un taux rapide de biodégradation.
En utilisant un ratio d’extrapolation de 1:1:4 pour la demi-vie associée à la biodégradation dans l’eau, le sol et les sédiments (Boethling et al., 1995) et une demi-vie de biodégradation ultime inférieure à 90 jours dans l’eau, on obtient également une demivie inférieure à 90 jours dans le sol et une demi-vie inférieure ou égale à 365 jours dans les sédiments. L’acrylate d’éthyle ne devrait donc pas être persistant dans le sol et les sédiments.
D’après les données empiriques et modélisées (voir les tableaux 5a et 5b), l’acrylate d’éthyle ne répond pas aux critères de persistance dans l’air, l’eau, le sol ou les sédiments (demi-vie dans l’air égale ou supérieure à 2 jours, demi-vie dans le sol et l’eau égale ou supérieure à 182 jours, et demi-vie dans les sédiments égale ou supérieure à 365 jours) prévus dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Potentiel de bioaccumulation
Les valeurs expérimentales du log Koe de l’acrylate d’éthyle laissent entendre que cette substance chimique est peu bioaccumulable dans le biote (voir le tableau 2 ci-dessus). Bien que le log Koe soit axé principalement sur les critères relatifs au milieu aquatique et qu’il n’évalue pas les incidences possibles sur l’environnement et les organismes terrestres, les organismes terrestres ne seront pas exposés à cette substance chimique par voie alimentaire et le potentiel de bioamplification chez les animaux terrestres sera faible.
Tableau 6 : Données modélisées sur la bioaccumulation d’acrylate d’éthyle
| Organisme d’essai | Log Koe | Paramètre | Valeur en L/kg (poids humide) | Référence |
|---|---|---|---|---|
| Poisson | 1,18 | FBA | 1,59 | Gobas BAF T2MTL (Arnot et Gobas, 2003) |
| Poisson | 1,18 | FBC | 1,59 | Gobas BCF T2LTL (Arnot et Gobas, 2003) |
| Poisson | 1,22 | FBC | 0,91 | OASIS Forecast, 2005 |
| Poisson | 1,18 | FBC | 2,79 | BCFWIN, 2000 |
| Poisson | 1,33 | FBC | 6,0 | Tyler et Smock, 1993[1] |
Les preuves disponibles indiquent que l’acrylate d’éthyle devrait présenter un faible potentiel de bioaccumulation en raison de sa valeur expérimentale faible du log Koe. L’estimation modélisée des valeurs du facteur de bioconcentration (FBC) et du facteur de bioaccumulation (FBA) est largement inférieure à 5 000 (tableau 6). Un FBA et un FBC de 1,593 L/kg qui résultent de l’utilisation d’une constante de vitesse de métabolisation estimée afin de corriger la prévision de la bioaccumulation (Arnot et Gobas, 2003). Si l’on se fonde sur les valeurs obtenues par modélisation cinétique et les autres valeurs modélisées, l’acrylate d’éthyle ne répond pas au critère de bioaccumulation (FBC ou FBA ≥ 5 000) énoncé dans le Règlement sur la persistance et la bioaccumulation(Canada, 2000).
Comme il a été indiqué précédemment, l’acrylate d’éthyle ne répond pas aux critères de persistance et de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Évaluation des effets sur l’environnement
Une étude sur la toxicité chronique en milieu aquatique de l’acrylate d’éthyle chez Daphnia magna a conclu à une CMEO de 0,45 mg/L et à une CE50de 0,5 mg/L (tableau 7a). On estime que ces valeurs indiquent un potentiel de toxicité chronique modérée à élevée pour les organismes aquatiques. Les auteurs ont conclu que les faibles résultats relatifs à la concentration mesurés lors de l’enquête peuvent avoir résulté de plusieurs facteurs, notamment de la volatilité, de l’adsorption à l’aquarium en verre, de l’adsorption à des matières particulaires et de la biodégradabilité de l’acrylate d’éthyle.
Tableau 7a. Données empiriques sur la toxicité pour les organismes aquatiques
| Organisme d’essai | Type d’essai | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|
| Algues (Selenastrum capricornutum) | Toxicité aiguë (96 heures) |
CE50 | 5,5 | OCDE, 2005 |
| Daphnia magna | Toxicité aiguë (48 heures) |
CE50[1] | 7,9 | OCDE, 2005 |
| Daphnia magna | Toxicité chronique (21 jours) | CSEO[2] | 0,19 | OCDE, 2005 |
| Daphnia magna | Toxicité chronique (21 jours) | CMEO[3] | 0,45 | OCDE, 2005 |
| Daphnia magna | Toxicité chronique (21 jours) | CE50 | 0,5 | OCDE, 2005 |
| Poisson (Cyprinodon variegatus) | Toxicité aiguë (96 heures) |
CL50[4] | 2,0 | IUCLID, 2000 |
| Poisson (Pimephales promelas) | Toxicité aiguë (96 heures) |
CL50[4] | 2,5 | Geiger et al., 1990 |
| Poisson (Oncorhynchus mykiss) | Toxicité aiguë (96 heures) |
CL50[4] | 4,6 | OCDE, 2005 |
[2] CSEO - Concentration sans effet observé.
[3] CMEO - Concentration minimale avec effet observé
[4] CL50 - Concentration d’une substance qu’on estime létale pour 50 % des organismes d’essai.
Tableau 7b. Données modélisées sur la toxicité pour les organismes aquatiques
| Organisme d’essai | Type d’essai | Paramètre | Valeur (mg/L) |
Référence |
|---|---|---|---|---|
| Poisson | Toxicité aiguë (96 heures) |
CL50[1] | 2,2 | ECOSAR, 2008 |
| 2,06 | OASIS Forecast, 2005 | |||
| 18,79 | AIES, 2003-2005 | |||
| 8,0 | TOPKAT, 2004 | |||
| Poisson | Toxicité chronique (30 jours) |
Vtc[2] | 0,16 | ECOSAR, 2008 |
| Daphnia | Toxicité aiguë (96 heures) |
CE50[3] | 6,8 | ECOSAR, 2008 |
| Toxicité aiguë | 36,4 | TOPKAT, 2004 | ||
| Toxicité aiguë (48 heures) | < 221,9 | OASIS, 2004 | ||
| Algues | Toxicité aiguë (96 heures) |
CE50 | 1,07 | ECOSAR, 2008 |
[2] Vtc - Valeur de la toxicité chronique.
[3] CL50 - Concentration d’une substance qu’on estime létale pour 50 % des organismes d’essai.
Les résultats sur la toxicité issus des données expérimentales et modélisées sont comparables et indiquent que l’acrylate d’éthyle a le potentiel de présenter une toxicité modérée à élevée pour les organismes aquatiques. L’acrylate d’éthyle est un produit chimique réactif, mais le mode d’action n’est pas connu.
On n’a pas trouvé d’étude acceptable concernant les effets de l’acrylate d’éthyle sur l’environnement dans les milieux autres que l’eau.
Évaluation de l’exposition de l’environnement
Comme on n’a relevé aucune donnée relative aux concentrations de cette substance dans l’eau au Canada, on estime les concentrations dans l’environnement d’après les renseignements disponibles, notamment les estimations des quantités de la substance, les taux de rejet et la dimension des plans d’eau récepteurs.
A - Rejets industriels
Étant donné que l’acrylate d’éthyle est utilisé à des fins industrielles (voir la section « Utilisations ») et qu’on prévoit des rejets de cette substance dans l’eau, on a utilisé le pire scénario raisonnable de rejets industriels pour estimer la concentration de la substance dans l’eau à l’aide de l’outil d’exposition générique industriel - milieu aquatique (IGETA) d’Environnement Canada (2009a). On a exécuté une analyse de l’exposition propre au site pour le milieu aquatique dans deux sites industriels distincts où on utilise de l’acrylate d’éthyle (Environnement Canada, 2010c). Ces deux sites avaient été déterminés d’après les réponses données à l’enquête menée en application de l’article 71 de la LCPE (Environnement Canada, 2010a). Comme chaque utilisateur avait déclaré une consommation annuelle d’acrylate d’éthyle de l’ordre de 10 000 à 200 000 kg, le choix de ces sites devait représenter la pire éventualité réaliste au Canada, si on se fonde sur l’hypothèse générale voulant que la quantité rejetée soit proportionnelle à la quantité consommée.
Dans cette analyse de l’exposition propre au site, chaque site comprenait une installation, une usine de traitement des eaux usées et un plan d’eau récepteur. La concentration environnementale estimée (CEE) dans le plan d’eau récepteur a été estimée à partir de la concentration de la substance dans les effluents de l’usine de traitement des eaux usées et de l’application d’un facteur de dilution égal à 10. La concentration des effluents de l’usine de traitement des eaux usées a été estimée à partir d’une fraction de l’acrylate d’éthyle considéré comme sorti de l’installation pour se diriger vers une station municipale locale d’épuration des eaux, du taux présumé d’élimination dans l’usine de traitement des eaux usées et du taux d’écoulement de ses effluents. La fraction de perte, estimée de façon prudente à 5 %, découlait des opérations de manutention des contenants de produit chimique et des procédés industriels pertinents aux installations à l’étude. Il convient de noter que cette valeur est censée représenter la limite supérieure de la substance rejetée dans les eaux usées et qu’on s’attend à ce que le rejet provenant d’une installation réelle soit inférieur à cette limite. De façon prudente, on a supposé que l’élimination à la station locale d’épuration des eaux était nulle. L’écoulement des effluents provenant de la station locale d’épuration des eaux, considéré comme proportionnel à la population desservie, se situait entre 100 000 et plus de 1 000 000 m3 par jour pour les sites examinés. On a également supposé une fréquence de rejet de 250 jours par an pour les utilisateurs industriels (installations petites ou moyennes).
Selon les hypothèses susmentionnées, la CEE aux deux sites industriels distincts qui utilisent de l’acrylate d’éthyle a été estimée respectivement à 0,0002 mg/L et à 0,0305 mg/L. Les valeurs de la CEE obtenues sont considérées comme représentant le niveau d’exposition dans un scénario réaliste du pire cas de rejet dans les eaux réceptrices situées à proximité de l’émissaire d’évacuation des usines de traitement des eaux usées situées dans les sites industriels du Canada.
B - Rejets par les consommateurs
Comme on peut trouver de l’acrylate d’éthyle dans les produits de consommation et que cette substance peut être rejetée dans l’eau, on a utilisé Mega Flush, le tableur d’Environnement Canada, pour estimer la concentration de la substance dans différents plans d’eau récepteurs d’effluents d’usines de traitement des eaux usées où des produits de consommation contenant de l’acrylate d’éthyle peuvent avoir été rejetés (Environnement Canada, 2009b). Le tableur s’appuie sur des hypothèses réalistes pour fournir des estimations concernant environ 1 000 sites de rejet dans tout le Canada. Même si l’acrylate d’éthyle se trouve dans des produits de consommation, on estime que la quantité de cette substance évacuée dans les égouts est très faible (1 %), car elle est transformée au stade industriel.
Les hypothèses réalistes incluent :
- les pertes dans les égouts établies à 100 %;
- le taux d’élimination des usines de traitement des eaux usées estimé à 0,0 % en cas d’absence de traitement;
- 3,1 % en cas de traitement primaire seulement et 68 % en cas de traitements primaire et secondaire combinés;
- un nombre de jours de rejet égal à 365 jours par an;
- un facteur de dilution dans l’eau réceptrice de l’ordre de 1 à 10.
La concentration environnementale estimée (CEE) d’acrylate d’éthyle dans les plans d’eau récepteurs a été estimée à 0,0065 mg/L en se fondant sur une fourchette de 10 000 à 100 000 kg/an pour la quantité de substance utilisée par les consommateurs. L’équation et les entrées utilisées pour calculer la CEE sont décrites dans le rapport d’Environnement Canada (2010d).
Caractérisation des risques pour l’environnement
La démarche suivie dans la présente évaluation des risques écologiques consistait à examiner les divers renseignements à l’appui et à tirer des conclusions selon la méthode du poids de la preuve et le principe de prudence requis par la LCPE (1999). Les éléments de preuve pris en compte comprenaient les résultats d’un calcul prudent du quotient de risque ainsi que des renseignements sur la persistance, la bioaccumulation, la toxicité, les sources et le devenir de la substance.
Selon les prévisions, l’acrylate d’éthyle ne devrait pas être persistant dans l’air, l’eau, le sol ou les sédiments, et il devrait présenter un faible potentiel de bioaccumulation. De grandes quantités d’acrylate d’éthyle sont importées au Canada, mais une fois que celuici est rejeté dans l’environnement, on le retrouve principalement dans l’eau même si on peut prévoir certains rejets dans l’atmosphère en raison de la volatilité et du mode d’émission de la substance. Il a aussi été démontré que l’acrylate d’éthyle présente un potentiel moyen à élevé de toxicité pour les organismes aquatiques.
Une analyse du quotient de risque, incluant des estimations prudentes de l’exposition et les renseignements sur la toxicité de la substance, a été réalisée pour le milieu aquatique afin de déterminer si la substance pourrait avoir des effets nocifs sur l’environnement au Canada. Les deux scénarios présentés ci-dessus relativement à deux sites industriels distincts (tenant compte des plans d’eau récepteurs réels) ont révélé des concentrations environnementales estimées (CEE) de 0,0002 mg/L et de 0,0305 mg/L (Environnement Canada, 2010c). En divisant la valeur de la toxicité chronique (CMEO) de 0,45mg/L (valeur expérimentale valable la plus sensible) pour Daphnia magna par un facteur d’évaluation de 10 (afin de tenir compte des variations de sensibilité intraspécifiques et interspécifiques), on obtient une concentration estimée sans effet (CESE) de 0,045 mg/L. Comme les quotients de risque prudents (CEE/CESE) pour les deux scénarios industriels sont de 0,0047 et de 0,68, il est peu probable que l’acrylate d’éthyle ait des effets nocifs chez les organismes aquatiques.
Quand on divise la CEE de 0,0065 mg/L relative à l’acrylate d’éthyle prévue dans le scénario concernant les produits de consommation par la CESE de 0,045 mg/L, on obtient un quotient prudent de risque (CEE/CESE) de 0,14. Comme dans le scénario touchant les rejets industriels, il est peu probable que l’acrylate d’éthyle lié à l’utilisation de produits de consommation ait des effets nocifs chez les organismes aquatiques.
Ces renseignements portent à croire que l’acrylate d’éthyle risque peu d’avoir des effets nocifs sur l’environnement au Canada.
Incertitudes dans l’évaluation des risques pour l’environnement
Une certaine incertitude est liée à l’utilisation des prévisions RQSA. Toutefois, compte tenu de la structure limitée et relativement simple de l’acrylate d’éthyle, la majeure partie des résultats modélisés sont jugés fiables et inclus dans le domaine d’applicabilité des modèles, ce qui diminue l’incertitude globale.
De plus, une certaine incertitude entoure les effets de l’eau sur l’acrylate d’éthyle, car, même si la substance est censée se dégrader rapidement dans l’eau, une polymérisation est aussi possible. On a seulement tenu compte des données valables mesurées concernant les effets aquatiques.
Malgré la relative incertitude de l’estimation des niveaux d’exposition environnementale faute de données de surveillance canadiennes, on a utilisé deux scénarios de rejet prudents pour combler le manque de données.
Évaluation de l’exposition
Milieux naturels et aliments
La limite supérieure estimée de l’absorption d’acrylate d’éthyle provenant de l’air ambiant, de l’air intérieur, du sol, de l’eau potable ainsi que des aliments et boissons au Canada est de 0,00581 mg/kg p.c. par jour (annexe 1). Même si l’air intérieur est désigné comme la principale source d’exposition environnementale, cette estimation est considérée comme extrêmement prudente puisqu’on n’a pas décelé d’acrylate d’éthyle dans les 757 logements surveillés dans le cadre d’une étude canadienne alors que la limite de détection (10 µg/m3) avait été établie en calculant les concentrations dans l’air intérieur (Otson et al., 1994). Des concentrations d’acrylate d’éthyle de 0,04 à 2,1 mg/m3 dans l’air intérieur ont été signalées dans un immeuble à bureaux des États-Unis (aucun renseignement fourni sur l’emplacement ou sur l’échantillon, BUA, 1992).
On a signalé la présence naturelle d’acrylate d’éthyle dans les ananas frais (CIRC, 1986), les framboises, les mûres, les fruits de la passion jaune et les durians (NTP, 1998; Burdock, 1997). Le Comité mixte d’experts FAO/OMS sur les additifs alimentaires rapporte une dose quotidienne estimée d’acrylate d’éthyle absorbée sous forme d’assaisonnement de nourriture d’après les volumes annuels de production d’acrylate éthylique utilisés comme aromatisant (JECFA, 2006). L’absorption a été estimée à 1,1 × 10-5 mg/kg p. c. par jour et à 2,6 × 10-5 mg/kg p. c. par jour aux États-Unis et en Europe, respectivement. (JECFA, 2006). Selon l’information disponible, les aliments ne sont pas les éléments qui contribuent le plus à l’exposition globale à l’acrylate d’éthyle (annexe 1).
Même si les emballages d’aliments utilisent des matières à base d’acrylate d’éthyle, ces emballages contiennent peu d’acrylate d’éthyle sous forme résiduelle et la migration de la substance dans les aliments est négligeable (courriels adressés en 2010 par la Direction des aliments de Santé Canada au Bureau de gestion du risque de Santé Canada; source non citée). L’absorption journalière possible d’acrylate d’éthyle présent sous forme résiduelle dans les emballages d’aliments est très peu importante comparativement à l’exposition causée par sa présence naturelle dans certains fruits et à son utilisation à titre d’aromatisant alimentaire.
Il se peut aussi que de l’acrylate d’éthyle soit présent sous forme résiduelle dans des emballages de produits pharmaceutiques, mais cela n’est pas considéré comme une source d’exposition importante pour la population en général.
La concentration dans l’air ambiant s’appuie sur une étude de surveillance de la qualité de l’air exécutée à Houston et à Boston (États-Unis), comprenant la collecte de 22 échantillons dans chaque ville entre août 1990 et août 1991 (Kelly et al., 1993). Comme on n’a pas décelé d’acrylate d’éthyle dans les échantillons, on a utilisé la limite de détection de 0,2 ppb (0,82 µg/m3) dans l’air ambiant à titre d’entrée prudente pour la modélisation. Aucune donnée canadienne n’était disponible. On a aussi décelé la présence d’acrylate d’éthyle dans l’air ambiant (0,6 à1,8 ng/m3) dans 3 des 15 échantillons recueillis dans un 1 lieu de collecte sur 5 au Japon en 2001 (NITE, 2010).
De l’acrylate d’éthyle a aussi été décelé qualitativement dans l’air ambiant d’un site d’enfouissement américain (aucun renseignement fourni sur l’emplacement ou sur l’échantillon; BUA, 1992) ainsi que dans l’air évacué d’usines de production des ÉtatsUnis (12 500 et 25 000 mg/m3), de Nouvelle-Zélande (11 à 622 mg/m3) et du Japon (BUA, 1992), mais ces sources ponctuelles ne représentent pas l’exposition de la population en général.
Comme on n’a pas décelé d’acrylate d’éthyle dans les quelque 250 échantillons d’eau souterraine prélevés à l’intérieur ou autour de cinq usines produisant cette substance, on a fondé la concentration dans l’eau potable utilisée pour modéliser l’exposition sur la limite de détection située entre 1 et 10 ppb (McLaughlin et al.,1993). N’ayant pas trouvé d’études de surveillance du sol, on s’est servi d’un modèle d’exposition environnementale propre au Canada pour évaluer les concentrations prudentes dans le sol d’après la quantité de substance rejetée au Canada (ChemCAN, 2003).
Voici quelques résultats d’autres études de surveillance de l’acrylate d’éthyle dans l’eau et les sédiments : on n’a pas décelé d’acrylate d’éthyle dans 51 échantillons d’eaux de surface et de sédiments de fond recueillis à 17 endroits du Japon en 1980 (la limite de détection était de 0,3 à 50 µg/L, NITE. 2010). Parmi 100 échantillons de sol, d’eaux usées et d’eau de surface analysés, seuls deux échantillons de sédiments ont révélé des niveaux décelables d’acrylate d’éthyle atteignant 2,1 et 2,2 mg/kg (aucune limite de détection n’a été signalée, McLaughlin et al., 1993). On n’a pas décelé d’acrylate d’éthyle dans une usine de traitement des eaux usées située en Allemagne (la limite de détection était de 0,02 mg/L; BUA, 1992). On a décelé de l’acrylate d’éthyle, sans toutefois le quantifier, dans un des 17 échantillons d’eau souterraine recueillis aux États-Unis (lieu non cité; BUA, 1992).
Produits de consommation
En se fondant sur les renseignements reçus dans le cadre de l’enquête exécutée en application de l’article 71, on a utilisé la version 4.1 du logiciel néerlandais ConsExpo du RIVM (ConsExpo, 2006) pour modéliser l’exposition des consommateurs dans le cadre de scénarios concernant les produits de consommation et les produits de soins personnels (tableau 3, annexe 2).
Il peut arriver qu’on trouve de l’acrylate d’éthyle sous forme résiduelle dans les produits de consommation. Aux fins de la modélisation à l’aide de la version 4.1 de ConsExpo, on a utilisé 100 % de l’absorption par inhalation et par voie cutanée, mais la voie orale ne convenait pas, vu le type de produits où l’acrylate d’éthyle est utilisé. Ces taux prudents d’absorption pourraient entraîner des expositions modélisées légèrement plus élevées que celles qui peuvent se produire réellement.
En plus de ConsExpo (ConsExpo, 2006), on a également utilisé le logiciel Wall Paint Exposure Model (WPEM) de l’Environmental Protection Agency des États-Unis (USEPA, 2001) pour modéliser l’exposition des consommateurs pendant l’exécution de travaux de peinture dans leur logement. Comme les résultats fournis par le WPEM étaient uniformément inférieurs, on a estimé que les résultats obtenus à l’aide du modèle de ConsExpo fournissaient une estimation plus prudente de l’exposition.
Les polymères acryliques susceptibles de contenir de l’acrylate d’éthyle se trouvent habituellement dans les peintures extérieures plus coûteuses, car l’ajout d’un polymère acrylique à la peinture augmente sa durabilité et sa résistance aux frottements, de même que dans les peintures semi-lustrées utilisées pour peindre les boiseries intérieures (Frederick, 1998). Une petite étude du panier de consommation (Frederick, 1998) a permis d’analyser la présence d’acrylate d’éthyle dans 30 échantillons de peintures diverses destinées au grand public. Les auteurs ont signalé entre 1,26 et 4,49 ppm (moyenne de 1,28 ppm) d’acrylate d’éthyle dans la peinture murale mate au latex et entre 1,61 et 13,02 ppm (moyenne de 4,06 ppm) dans la peinture pour boiseries intérieures (Frederick, 1998).
Dans une étude en laboratoire, on a préparé et utilisé deux échantillons de peinture présentant des concentrations résiduelles d’acrylate d’éthyle (940 ppm et 2000 ppm p/p) pour peindre une chambre d’essai ne comprenant pas de ventilation (McLaughlin et al., 1993). Les concentrations maximales d’acrylate d’éthyle signalées dans l’air de la chambre en provenance des échantillons de peinture de 940 ppm et de 2000 ppm étaient respectivement de 2,5 ppm et de 8,0 ppm (McLaughlin et al., 1993). Le rapport précise en outre qu’aucune quantité d’acrylate d’éthyle (limite de détection de 0,2 ppm) n’a été decelée lorsqu’on a répété les scénarios de peinture en présence d’une ventilation adéquate (McLaughlin et al., 1993).
Il peut arriver que de l’acrylate d’éthyle soit présent sous forme résiduelle dans divers produits de bricolage. Le tableau 3 donne une estimation de l’exposition de personnes utilisant des produits de calfeutrage. On a supposé une concentration inférieure à 0,1 % en se fondant sur un produit de jointoiement peinturable indiqué dans la base de données sur les produits ménagers (Household Products Database, 2009).
L’acrylate d’éthyle peut être utilisé dans la fabrication de lingettes non tissées et dans d’autres matières non tisées à usage médical ou hospitalier en concentration maximale de 28 ppm[3], [4](Environnement Canada, 2010b).
D’autres produits pouvant contenir de l’acrylate d’éthyle sous forme résiduelle ont été recensés : produits pour toiture et autres liants et revêtements industriels renfermant une concentration maximale estimée de 29 ppm[4] de la substance (Environnement Canada, 2010b). De l’acrylate d’éthyle peut également être présent dans la colle à bois à une concentration maximale de 40 ppm[3](Environnement Canada, 2010b). Comme ces produits sont rarement utilisés, ils ne sont pas considérés comme une source importante d’exposition pour la population en général et aucune estimation de l’exposition n’a été calculée.
Les produits cosmétiques qui contenaient antérieurement des polymères acryliques susceptibles d’inclure de l’acrylate d’éthyle ont été reformulés et n’utilisent plus d’acrylate d’éthyle. Ils ne sont plus disponibles sur le marché canadien (courriels adressés en 2010 par le Bureau de la sécurité des produits de consommation de Santé Canada à la Division des substances existantes de Santé Canada; source non citée).
Dans la littérature, l’acrylate d’éthyle a été décrit comme un additif aux adhésifs (McLaughlin et al., 1993), tels que les bandages autocollants. La quantité d’acrylate d’éthyle présente sous forme résiduelle dans ces bandages est considérée comme très faible. Comme ces bandages autocollants ne sont pas souvent utilisés et que, par conséquent, ils ne sont pas considérés comme une source importante d’exposition pour la population en général, on n’a pas calculé d’estimations de l’exposition.
L’acrylate d’éthyle est utilisé dans diverses parties de véhicules motorisés, notamment dans la peinture extérieure, les scellants et les composants en plastique. Les renseignements reçus dans le cadre de l’enquête menée en application de l’article 71 indiquent que la concentration totale estimée d’acrylate d’éthyle dans un véhicule fini est inférieure à 0,031 kg par véhicule (Environnement Canada, 2010a). Puisque ces composants ne se trouvent pas dans l’espace occupé par les passagers, ils ne sont pas considérés comme une source importante d’exposition pour la population en général.
D’autres produits[4] (Environnement Canada, 2010 b) utilisés uniquement en milieu industriel peuvent contenir de l’acrylate d’éthyle sous forme résiduelle, mais ils ne sont pas considérés comme une source d’exposition pour la population en général.
Tableau 8. Modèles établis avec la version 4.1 de ConsExpo (voir l’annexe 2)
| Produit de consommation modélisé à un niveau spécifié | Exposition aiguë par voie cutanée (mg/kg) |
Exposition chronique par voie cutanée (mg/kg par jour) | Concentration moyenne d’inhalation par événement (mg/m3) |
|---|---|---|---|
| Peinture au latex mate (4,5 ppm) |
2,54 × 10-4 | 1,39 × 10-6 | 0,225 |
| Peintre semilustrée pour boiseries (13,2 ppm) | 3,6 × 10-4 | 1,99 × 10-6 | 0,108 |
| Produits de calfeutrage (< 0,1 %) | 2,12 × 10-3 | 1,74 × 10-5 | 0,427 |
| Lingettes pour nourrissons (28 ppm) |
7,47 × 10-5 | 3,73 × 10-4 | - |
| Lingettes pour adultes (28 ppm) |
7,9 × 10-6 | 7,89 × 10-6 | - |
Évaluation des effets sur la santé
L’annexe 3 comprend un résumé des renseignements disponibles sur les effets de l’acrylate d’éthyle sur la santé.
Le Centre International de Recherche sur le Cancer (CIRC) a classé l’acrylate d’éthyle comme substance cancérogène du groupe 2B (peut-être cancérogène pour l’homme) parce qu’il existait des indications de carcinogénicité suffisantes chez les animaux de laboratoire, mais aucune donnée épidémiologique pertinente sur la cancérogénicité chez les humains (CIRC, 1986, 1999). L’Environmental Protection Agency des États-Unis a classé l’acrylate d’éthyle comme un cancérogène possible chez les humains (Groupe B2) (USEPA, 2005, 2009). D’abord mentionné dans le cinquième rapport annuel sur les substances cancérogènes du National Toxicology Program (NTP) comme une substance dont on peut raisonnablement présumer qu’elle est cancérogène, l’acrylate d’éthyle a plus tard été retiré du neuvième rapport annuel du NTP sur les substances cancérogènes à la suite d’une réévaluation n’indiquant pas de potentiel cancérogène (NTP, 1989, 2000).
Selon des études expérimentales sur la toxicité chez les animaux, des incidences accrues de tumeurs du préestomac ont été observées chez les souris et les rats auxquels on avait administré de l’acrylate d’éthyle par gavage. Les rats Fischer 344 et les souris B6C3F1 traités avec de l’acrylate d’éthyle par gavage à raison de 0,100 ou 200 mg/kg p.c. par jour, 5 jours par semaine pendant 103 semaines présentaient une incidence beaucoup plus forte de tumeurs du préestomac (NTP, 1986a). Ces tumeurs (papillomes et carninomes malpighiens) ont été observées après gavage de 100 et 200 mg/kg p.c. par jour chez les deux sexes des deux espèces. Dans une étude de suivi, des rats Fischer 344 mâles se sont vu administrer par gavage de l’acrylate d’éthyle à raison de 0 ou 200 mg/kg p.c. par jour, 5 jours par semaine pendant 6 ou 12 mois suivis de périodes de récupération pouvant atteindre 15 mois (Ghanayemet al., 1993, 1994). Aucun effet néoplasique n’a été observé chez les animaux ayant reçu 200 mg/kg p.c. d’acrylate d’éthyle par jour pendant 6 mois, suivis de 0, 2 ou 15 mois de récupération, ni chez les animaux sacrifiés juste après 12 mois. On a observé le développement de tumeurs du préestomac pendant les périodes de récupération de 2 à 9 mois chez les animaux traités avec de l’acrylate d’éthyle pendant 12 mois.
Contrairement aux études concernant le gavage, on n’a pas observé d’effets néoplasiques chez les animaux de laboratoire auxquels on a administré de l’acrylate d’éthyle par d’autres voies. Dans une étude sur l’eau potable, des rats Wistar se sont vu administrer 0, 6 à 7, 60 à 70 ou 2 000 ppm d’acrylate d’éthyle (environ 0, 0,84 à 0,98, 9,4 à 9,8 et 280 mg/kg p.c. respectivement) pendant deux ans (Borzelleca et al., 1964). Les résultats histopathologiques n’ont pas révélé de lésions liées au traitement. Borzelleca et al. (1964) ont aussi exécuté une étude de la toxicité chronique sur des chiens. Des chiens beagle ont reçu de l’acrylate d’éthyle par voie orale dans des gélules à raison de 0, 10, 100 ou 1 000 ppm (approximativement 0, 0,3, 3 et 30 mg/kg p.c. par jour respectivement) pendant deux ans sans qu’on observe d’effets néoplasiques.
Dans les études sur la carcinogénicité due à l’inhalation, on n’a pas observé de lésions néoplasiques liées au traitement chez les rats Fischer 344 ni chez les souris B6C3F1 exposés à l’acrylate d’éthyle à un dosage de 0,25 ou 75 ppm (approximativement 0, 100 et 310 mg/m3respectivement) pendant 6 heures par jour, 5 jours par semaine durant 27 mois (Miller et al., 1985). Dans une autre étude effectuée par Miller et al., (1985), des rats Fischer 344 et des souris B6C3F1 ont été exposés à 0 ou 5 ppm d’acrylate d’éthyle (approximativement 20 mg/m3) pendant 24 mois sans qu’on observe d’effets néoplasiques.
Dans une étude sur la carcinogénicité par voie cutanée, 800 mg/kg p.c. par jour d’acrylate d’éthyle ont été administrés trois fois par semaine pendant toute leur vie à des souris C3H/HeJ mâles (DePass et al., 1984) sans qu’on observe de tumeurs épidermiques.
Dans des études épidémiologiques, les résultats d’études de cohortes en milieu de travail se sont révélés contradictoires. Les expositions à l’acrylate d’éthyle n’étaient pas bien quantifiées et les travailleurs étaient aussi exposés à d’autres produits chimiques. Dans une étude de cohorte menée de 1933 à 1945, les ouvriers d’une usine de fabrication de feuilles d’acrylique de Bristol (Pennsylvanie) étaient exposés à de l’acrylate d’éthyle, mais aussi à du méthacrylate de méthyle, à du plomb, à du dichlorure d’éthylène, à du chlorure de méthylène et à de l’acrylonitrile. Vingt ans après l’équivalent de trois ans d’emploi, on a observé une surmortalité due au cancer du côlon et du rectum chez les travailleurs exposés (Walker et al., 1991). Pourtant, deux autres études de cohorte similaires décrites par Walker et al. (1991) n’ont pas signalé de surmortalité due à une cause quelconque.
Un potentiel mutagène limité a été observé dans des essais de mutation in vitro. Les résultats d’un certain nombre de tests d’Ames exécutés sur différentes souches deSalmonella typhimurium avec et sans activation métabolique se sont révélés négatifs (Rohm et Haas, 1977, 1981; Ishidate et al., 1981; Haworth et al., 1983; Waegemaekers et Bensink, 1984; NTP, 1986a; Brusick, 1977; Zeiger et al., 1992; ECETOC, 1994; Emmert et al., 2006). Le résultat d’un test umu exécuté à l’aide de Salmonella typhimurium s’est montré lui aussi négatif (Yasunaga et al., 2004), alors que l’induction d’une recombinaison mitotique dans Saccharomyces cerevisiae s’est avérée positive (Zimmermann et Mohr, 1992). Dans des cellules de mammifères, on a observé l’induction de mutations géniques, de même que dans les cellules de lymphomes L5178Y TK+/- de souris (Myhr, 1980; McGregor et al., 1988; More et al.,1988; Dearfield et al., 1991), mais non dans les essais HGPRT exécutés sur des cellules d’ovaire de hamster chinois (Mooreet al., 1989). Pour ce qui est des effets clastogènes, les essais d’aberrations chromosomiques se sont la plupart du temps révélés positifs dans les cellules de lymphome de souris, dans les cellules d’ovaire de hamster chinois, dans les splénocytes de souris et dans les cellules de poumon de hamster chinois (NTP, 1986b; Moore et al., 1988; Ishidate et al.,1981; Loveday et al.,1990; Kligerman et al., 1991). On a obtenu des résultats mitigés pour les essais d’échange de chromatides sœurs dans des cellules d’ovaire de hamster chinois et dans des splénocytes de souris (NTP, 1986b; Loveday et al., 1990; Kligerman et al., 1991).
Dans les essais in vivo, les résultats concernant la génotoxicité se sont surtout révélés négatifs. On n’a pas observé d’aberrations chromosomiques chez les souris auxquelles on avait administré de l’acrylate d’éthyle par voie intrapéritonéale (Kligerman et al., 1991). Des essais d’induction de micronoyaux exécutés sur différentes souches de souris ayant reçu de l’acrylate d’éthyle par voie intrapéritonéale, orale ou cutanée se sont pour la plupart avérés négatifs (Przybojewska et al., 1984; Basler et van der Hude, 1987; Ashby et al. 1989; Kligerman et al.,1991; Hara et al.,1994; Morita et al.,1997; Tice et al., 1997). Les essais d’échange de chromatides sœurs exécutés sur des souris ayant reçu de l’acrylate d’éthyle par voie intrapéritonéale ont été négatifs (Kligerman et al., 1991). Dans les cellules germinales, les résultats d’essais de mutations létales récessives liées au sexe exécutés sur Drosophilia melanogaster par voie orale ou par injection se sont révélés négatifs (Valencia et al., 1985).
La première réunion d’évaluation du Screening Information Dataset (SIDS) de l’Organisation de coopération et de développement économiques (OCDE) tenue en 2004 a conclu que l’acrylate d’éthyle ne causait pas de préoccupations quant au risque mutagène (OCDE, 2004).
Le mode proposé d’induction de tumeurs du préestomac par l’acrylate d’éthyle chez le rat n’a pas été entièrement élucidé. Chez les rongeurs, le préestomac est un organe non glandulaire de stockage des aliments relié à l’œsophage et tapissé d’épithélium pavimenteux kératinisé et stratifié, alors que l’estomac glandulaire, qui se déverse dans le duodénum, est tapissé d’un épithélium glandulaire spécial. Chez les humains, en revanche, la totalité de l’estomac est glandulaire, mais on trouve des tissus épithéliaux pavimenteux comparables dans la cavité buccale et les deux tiers supérieurs de l’œsophage. À la différence des rongeurs, aucun de ces endroits ne joue un rôle dans le stockage des aliments. En 2003, le CIRC a publié un rapport qui étudiait la valeur prédictive des tumeurs du préestomac chez les rongeurs pour évaluer les risques cancérogènes de plusieurs produits chimiques, dont l’acrylate d’éthyle, pour les humains. Même si le CIRC (2003) n’a pas proposé de mode d’action pour les tumeurs du préestomac causées par l’acrylate d’éthyle, le groupe de travail a laissé entendre qu’une certaine période d’hyperplasie soutenue est nécessaire pour entraîner réellement une tumorigenèse (Boorman et Sills, 2003). Des études sur le gavage chez les rongeurs ont souligné que l’hyperplasie du préestomac causée par l’acrylate d’éthyle se prolonge tant que dure l’administration de cette substance. On a constaté une guérison complète de l’hyperplasie du préestomac chez des animaux traités pendant six mois, mais la persistance de cette hyperplasie chez les rats traités pendant 12 mois (Ghanayem et al., 1993, 1994). De plus, le développement de tumeurs du préestomac n’a pas été observé immédiatement, mais seulement pendant les périodes de récupération chez les rats traités durant 12 mois.
Williams et Iatropoulos (2009) ont avancé que l’induction de tumeurs du préestomac par l’acrylate d’éthyle dépend de la voie empruntée. Selon ces auteurs, une longue période de transit allant d’une demi-journée à deux ou trois jours et la présence de pH moins acide dans le préestomac permettent la prolifération de bactéries; de plus, la progression de l’irritation locale des tissus, de l’inflammation et de l’hyperkératose vers l’hyperplasie soutenue est un événement précurseur important qui mène à la néoplasie du préestomac causée par l’acrylate d’éthyle. On reconnaît depuis longtemps que l’hyperplasie (ou prolifération des cellules) constitue un facteur important dans la carcinogenèse. Certains auteurs ont laissé entendre que la prolifération des cellules doit être soutenue, et non seulement normale, pour favoriser la carcinogenèse (Preston-Martin et al., 1990; Melnick et al.,1993; Huff, 1995). Proctoret al. (2007) ont en outre souligné que les tumeurs du préestomac associées à l’irritation chronique de l’épithélium préstomacal, en particulier les tumeurs causées par un gavage répété, peuvent entraîner dans les tissus une dose qui n’est pas représentative de l’exposition humaine.
Aucune classification de la toxicité pour le développement ou la reproduction n’a pu être obtenue auprès d’organismes de réglementation nationaux et internationaux. La dose minimale avec effet observé (DMEO) administrée par voie orale et identifiée comme source de toxicité pour le développement était de 25 mg/kg p.c. par jour. Cette dose a été déterminée d’après le retard de l’ossification causé par l’administration à des rats d’acrylate d’éthyle par gavage à des doses de 0, 25, 50, 100, 200 ou 400 mg/kg p.c. par jour pendant les jours de gestation 7 à 16 (Pietrowicz et al.; 1980). Pour toutes les doses, on a également observé une diminution du gain de poids corporel chez les mères. Pour ce qui est de la voie d’administration par inhalation, la CMEO de 200 ppm (800 mg/m3) a été établie d’après une diminution importante du poids fœtal chez des rats SpragueDawley exposés à l’acrylate d’éthyle à des doses de 0, 25, 50, 100 ou 200 ppm (approximativement 0, 100, 200, 400 et 800 mg/m3 respectivement), six heures par jour pendant les jours de gestation 6 à 20 (Saillenfait et al., 1999). On a aussi observé une diminution importante du gain de poids corporel maternel et du gain de poids absolu pour la dose de 200 ppm. Dans une étude de cas limitée, une femme qui avait été exposée à des polymères contenant de l’acrylate d’éthyle disait que son enfant avait reçu un diagnostic d’anomalies cogénitales, mais l’étude ne donnait pas de précisions complémentaires (Sherman, 1985). On n’a pas recensé d’études sur la toxicité pour la reproduction, ni d’études sur la toxicité pour le développement en cas d’exposition cutanée.
Chez les rongeurs, la prise répétée de doses d’acrylate d’éthyle par voie orale affecte généralement le préestomac. La dose minimale avec effet nocif observé (DMENO) de 20 mg/kg p.c. par jour a été déterminée d’après une augmentation du poids de l’estomac et une augmentation de l’hyperplasie et de l’hyperkératose épithéliales du préestomac chez des rats Fischer 344 mâles auxquels on avait administré de l’acrylate d’éthyle par gavage dans le cadre de plusieurs études exécutées de 14 jours à 13 semaines (Rohm et Haas, 1986 b, 1987; Frederick et al., 1990). Dans une étude similaire, Frederick et al. (1990) ont déterminé une DMENO de 1 000 ppm (99 mg/kg p.c. par jour) correspondant à une irritation minimale et à une hyperplasie épithéliale diffuse du préestomac à la suite de l’administration à des rats Fischer 344 mâles d’acrylate d’éthyle dans de l’eau potable à des doses de 0, 200, 1 000, 2 000 ou 4 000 ppm (correspondant à 0, 23, 99, 197 et 369 mg/kg p.c. par jour respectivement), 5 jours par semaine pendant 14 jours. Une étude de deux ans sur des rats ayant reçu de l’acrylate d’éthyle dans de l’eau potable n’a toutefois pas permis d’observer de modifications histopathologiques (Borzelleca et al., 1964).
Les études sur la toxicité de l’acrylate d’éthyle absorbé par inhalation par des rongeurs ont généralement conclu à des effets sur les voies nasales. La plus faible CMENO après exposition aiguë a été établie à 25 ppm (100 mg/m3) d’après des lésions réversibles de l’épithélium olfactif chez des rats mâles dont seul le nez avait été exposé à de l’acrylate d’éthyle pendant trois heures (Frederick et al., 2002). On doit noter que, chez les rongeurs, l’anatomie nasale et l’écoulement de l’air inhalé diffèrent substantiellement de ceux des humains (Frederick et al., 1998, 2002). Des simulations effectuées à l’aide de modèles informatiques d’inhalation ont laissé entendre que l’épithélium olfactif humain est censé retenir des concentrations de vapeur d’acide organique inhalé tel que l’acrylate d’éthyle au moins deux à trois fois plus faibles que celui des rongeurs (Frederick et al., 1998, 2002). Une CMENO plus élevée de 75 ppm (310 mg/m3) due à une exposition aiguë a été établie d’après des lésions de l’épithélium olfactif (dégénérescence focale, nécrose, exfoliation et légère inflammation) observées chez des singes exposés à l’acrylate d’éthyle pendant trois heures (Rohm et Haas, 1994; Harkemaet al., 1997). L’Environmental Protection Agency des États-Unis a utilisé l’étude effectuée sur des rats par Frederick et al. en 2002 ainsi que l’étude menée sur des singes par Rohm et Haas en1994 et par Harkema et al. en 1997 comme points de départ pour le calcul de l’Acute Exposure Guideline Level1 (AEGL-1) et de l’Acute Exposure Guideline Level-2 (AEGL-2) (USEPA, 2007). La CMENO critique de 300 ppm (1 200 mg/m3) pour une exposition à court terme a été déterminée d’après une inflammation, une dégénérescence, une nécrose focale et une métaplasie malpighienne des cornets nasaux chez des rats et des souris exposés à l’acrylate d’éthyle pendant 30 jours (Milleret al., 1979). La CMENO critique de 25 ppm (100 mg/m3) pour une exposition à long terme par inhalation a été établie d’après des lésions néoplasiques des muqueuses olfactives incluant une dégénérescence, une inflammation et une hyperplasie chez des rats et des souris exposés à l’acrylate d’éthyle pendant 6 à 27 mois (Jerseyet al., 1978; Dow Chemical, 1979a; Miller et al., 1985).
Pour ce qui est de la voie cutanée, la DMENO la plus faible identifiée a été de 800 mg/kg p.c. par jour après observation d’une dermatite, d’une fibrose cutanée, d’une nécrose épidermique et d’une hyperkératose chez des souris C3H/HeJ mâles ayant reçu approximativement 800 mg/kg p.c. d’acrylate d’éthyle par jour, trois fois par semaine pendant toute leur vie (DePass et al., 1984).
Chez les humains, une étude de cohorte en milieu de travail a présumé une corrélation entre l’exposition à l’acrylate d’éthyle et une perturbation du système nerveux central. L’utilité de cette étude pour caractériser les effets sur la santé associés à l’exposition à l’acrylate d’éthyle est toutefois limitée puisque les sujets de l’étude étaient en même temps exposés à des niveaux importants d’autres produits chimiques (acrylate de butyle et acrylonitrile) (Kuzelova et al., 1981).
Chez les animaux de laboratoire, l’acrylate d’éthyle est un puissant irritant de la peau et des yeux (Haskell Laboratories, 1945; Pozzani et al., 1949; Treon et al., 1949; Oettel et Zeller, 1958; Celanese Chem Co., 1972; BASF AG, 1978; Lomonova et Klimova, 1979; Poole, 1980; Potokar et al., 1985; Rohm et Haas, 1986a, 1986c, 1986d, 1991; Union Carbide Corp, 1989; BAMM, 1994; BASF, 2005). Une étude de cas humains a indiqué que l’exposition accidentelle à l’acrylate d’éthyle a causé une grave irritation des yeux (Dow Chemical, 1964). Certaines preuves laissent en outre entendre que l’acrylate d’éthyle est un sensibilisant et que, chez les animaux, l’exposition à cette substance peut entraîner une sensibilisation croisée avec d’autres acrylates (Van der Walleet al., 1982). Les résultats d’essais concernant l’enflure des oreilles et les ganglions lymphatiques locaux se sont toutefois révélés négatifs (Kimber, 1992; NTP, 1994; Hayes et Meade, 1999). Pour ce qui est des humains, on a observé une sensibilisation chez des volontaires (Epstein, 1974) et chez des patients présentant une dermatite de contact présumée d’origine allergique (Foulger et Fleming, 1945; Jordan, 1975; Fregert, 1978; Bjorkner et Dahlquist, 1979; Malten et al., 1984; Conde-Salazar et al.,1988; Kanerva et al.,1988, 1989, 1992, 1995; Stenman et Bergman, 1989; Skoglund et Egelrud, 1991; Koppula et al., 1995; Marks et al., 1995; Rustemeyer et Frosch, 1996; Tucker et Beck, 1999; Lazarov, 2007; AaltoKorte et al., 2007). Certains des patients atteints de dermatite avaient été exposés à des acrylates ou avaient contracté une dermatite professionnelle au contact de matériaux dentaires, de scellants acryliques ou d’ongles artificiels.
Des études toxicocinétiques menées sur des animaux de laboratoire montrent que l’acrylate d’éthyle est absorbé et métabolisé rapidement après l’exposition par voie orale ou par inhalation (Stott et McKenna, 1984; Ghanayem et al., 1987). Les deux principales voies métaboliques sont l’hydrolyse de la liaison ester et la conjugaison avec le glutathion (GSH). L’acrylate d’éthyle est hydrolysé par les carboxylestérases, ce qui entraîne la production d’éthanol et d’acide acrylique (Miller et al., 1981; Frederick et al.,1994a). L’éthanol est ensuite métabolisé en vertu d’un procédé catabolique et l’acide acrylique emprunte la voie de dégradation du propionate par le métabolisme cellulaire, ce qui entraîne dans les deux cas la formation de dioxyde de carbone. Une conjugaison avec le GSH peut se produire spontanément par une addition de Michael ou par l’intermédiaire de la glutathion transférase (Ghanayem et al. 1987; Potter et Tran, 1992). L’inhalation d’acrylate d’éthyle par des rats a entraîné la déplétion du sulfhydryle non protéique principalement dans le foie, puis dans le sang, le cerveau et les poumons (Vodicka et al., 1990). Dans des études sur la toxicité de l’acrylate d’éthyle administré par gavage à des rongeurs, on a observé une réduction importante du sulfhydryle non protéique dans le préestomac et dans l’estomac glandulaire, ce qui laisse penser que la conjugaison au point de contact peut donner lieu à un important processus de détoxification (De Bethizy et al. 1987). Après la conjugaison avec le GSH, l’acrylate d’éthyle est rapidement éliminé dans l’urine (De Bethizy et al., 1987). Même si c’est théoriquement possible, on ne dispose pas de preuves de la génération de produits d’époxydation dans le métabolisme de l’acrylate d’éthyle (Delbressine et al., 1982; De Bethizy et al., 1987). Des chercheurs ont élaboré un modèle pharmacocinétique et pharmacodynamique fondé sur des données physiologiques concernant les rats qui décrit l’absorption, la diffusion et le métabolisme de doses d’acrylate d’éthyle administrées par voie orale (Frederick et Chang-Mateu, 1990; Frederick et al., 1992). Des modèles de dosimétrie interspécifiques similaires basés sur des données biologiques ont aussi été élaborés relativement à l’inhalation d’acrylate d’éthyle (Frederick et al., 1994 b, 2002; Sweeney et al., 2004).
Le niveau de confiance à l’égard des renseignements fournis dans la base de données sur la toxicité pour l’acrylate d’éthyle est jugé modéré à élevé. Des données ont été recensées sur la cancérogénicité, la génotoxicité, la toxicité pour le développement, la toxicité aiguë et la toxicité liée à l’administration de doses répétées chez des animaux de laboratoire. Mais on ne dispose pas d’études sur la toxicité pour la reproduction, ni d’études épidémiologiques concluantes.
Caractérisation du risque pour la santé humaine
Selon les classifications établies par d’autres organismes de réglementation nationaux et internationaux, la cancérogénicité constitue un effet critique pour la caractérisation du risque que présente l’acrylate d’éthyle pour la santé humaine. Des tumeurs du préestomac sont apparues chez des souris et des rats des deux sexes auxquels on avait administré de l’acrylate d’éthyle par gavage pendant deux ans. On n’a toutefois pas observé d’incidence de tumeurs quand l’acrylate d’éthyle était administré par d’autres voies, notamment par voie orale dans l’eau potable, par inhalation et par voie cutanée. L’ensemble des preuves issues des études sur la génotoxicité laisse entendre que l’acrylate d’éthyle n’est pas susceptible d’être mutagène, mais qu’il pourrait avoir certains effets clastogènes in vitro. La réunion initiale d’évaluation 18 du Screening Information Data Set (SIDS) de l’OCDE a conclu que l’acrylate d’éthyle ne suscitait pas de préoccupations quant au « risque mutagène » (OCDE, 2004). Même si le mode d’induction des tumeurs du préestomac observées chez les rongeurs n’a pas été complètement élucidé, il est quand même proposé que des doses aigües de bols gastriques d’acrylate d’éthyle dans le préestomac induisent l’irritation et l’hyperplasie soutenues comme précurseur pour le développement des tumeurs (OCDE, 2004; NTP, 2000; Williams et Iatropoulos, 2009).
En conséquence, une approche fondée sur le seuil d’innocuité a été utilisée pour évaluer le risque pour la santé humaine.
Pour ce qui est des effets non cancérogènes, on n’a pas recensé d’études sur la toxicité pour la reproduction. Les effets sur le développement étaient accompagnés d’une toxicité chez la mère, ce qui laissait croire à un effet secondaire. Les marges d’exposition sont basées sur des estimations prudentes de la limite supérieure de l’exposition de la population en général, ainsi que sur la CMENO et de la DMENO critiques pour les effets non cancérogènes. Pour la voie orale, la DMENO critique de 20 mg/kg p.c. par jour a été établie en fonction d’une augmentation du poids de l’estomac, d’une hyperplasie et d’une hyperkératose du préestomac chez des rats traités par gavage de 14 jours à 13 semaines (Rohm et Haas, 1986 b, 1987; Frederick et al., 1990). Même si on a établi une DMENO plus élevée de 99 mg/kg p.c. par jour dotée d’effets similaires sur la santé à la suite de la consommation d’eau potable, on s’est servi de la DMENO plus prudente issue des études sur le gavage pour calculer les marges d’exposition.
Les CMENO critiques de 25 ppm (100 mg/m3) et de 75 ppm (310 mg/m3) pour l’exposition aiguë à l’inhalation ont été déterminées d’après des lésions de l’épithélium olfactif chez des rats (Frederick et al., 2002) et chez des singes (Rohm et Haas, 1994; Harkema et al., 1997) exposés à l’acrylate d’éthyle pendant trois heures. En raison de différences substantielles de l’anatomie nasale et de l’écoulement de l’air inhalé, l’épithélium olfactif humain est censé retenir des concentrations d’acrylate d’éthyle au moins deux à trois fois plus faibles que celui des rongeurs (Frederick et al., 1998, 2002). L’Environmental Protection Agency des États-Unis a adopté ces études pour calculer les niveaux d’AEGL-1 et d’AEGL-2 (USEPA, 2007). La CMENO critique pour une exposition à court terme par inhalation a été déterminée en fonction d’une inflammation, d’une dégénérescence, d’une nécrose focale et d’une métaplasie malpighienne des cornets nasaux observées chez des rats et des souris exposés à 300 ppm (1 200 mg/m3) d’acrylate d’éthyle pendant 30 jours (Miller et al., 1979). La CMENO critique pour l’inhalation à long terme est de 25 ppm (100 mg/m3) déterminée d’après des lésions des muqueuses olfactives chez des rats et des souris exposés à l’acrylate d’éthyle pendant 6 à 27 mois. Pour la voie cutanée, la DMENO critique établie d’après l’induction de dermatite observée dans une étude sur l’exposition chronique chez des souris est de 800 mg/kg p.c. par jour.
Pour la population générale au Canada, les principales voies d’exposition à l’acrylate d’éthyle devraient être l’inhalation à court terme d’air intérieur et l’utilisation de produits de consommation tels que la peinture et d’autres produits de bricolage. Les propriétés de polymérisation, de photodégradation et de volatilisation spontanées de l’acrylate d’éthyle (OCDE, 2004) devraient réduire au minimum l’exposition à long terme de la population générale à l’inhalation.
La comparaison de la dose associée à un effet critique pour les doses répétées reçues par voie orale (20 mg/kg p.c. par jour) et de la limite supérieure estimée pour l’absorption quotidienne totale d’acrylate d’éthyle dans les milieux environnementaux et dans les aliments par la population générale au Canada (0,00199 à 0,00581 mg/kg p.c. par jour) donne une marge d’exposition variant de 3 500 à 10 000.
Si l’on se fonde sur des modèles utilisant des scénarios concernant les produits de consommation, la concentration d’acrylate d’éthyle dans l’air résultant de l’utilisation de produits de calfeutrage pour des travaux de bricolage est de 0,427 mg/m3. La comparaison de cette limite supérieure et de la fourchette de concentrations associée à un effet critique pour l’inhalation aiguë allant de 100 à 310 mg/m3 donne une marge d’exposition de 230 à 700. L’exposition cutanée à l’acrylate d’éthyle résultant de l’utilisation de lingettes pour nourrissons est de 3,73 × 104 mg/kg p.c. par jour. La comparaison de ce niveau d’exposition et de la concentration associée à un effet critique de 800 mg/kg p.c. par jour pour la voie cutanée provenant d’une étude chronique d’exposition chez la souris donne une marge d’exposition de 2,14 × 106. Cette marge d’exposition est prudente parce que l’exposition provenant de l’utilisation de lingettes personnelles a été comparée à la concentration associée à un effet critique tirée d’une étude de l’exposition chronique par voie cutanée. Cette marge d’exposition est jugée adéquate pour la sensibilisation cutanée et l’irritation cutanée.
Il est aussi important de considérer que 14 à 24 volontaires humains dont la peau a été exposée à l’acrylate d’éthyle (4 % d’acrylate d’éthyle dans de la gelée de pétrole) pendant un test de maximisation de 48 heures n’a montré ni sensibilité ou irritation dermale (Epstein [1974], cité dans Opdyke [1975]).
Les marges d’exposition tiennent adéquatement compte des incertitudes présentes dans les bases de données sur l’exposition et les effets sur la santé.
Incertitudes dans l’évaluation des risques pour la santé humaine
La détermination des marges d’exposition dans le cadre de la présente évaluation préalable ne tient pas compte des différences possibles entre les humains et les animaux de laboratoire en ce qui concerne la sensibilité aux effets de l’acrylate d’éthyle. Les tumeurs du préestomac chez les rongeurs ne sont pas considérées comme pertinentes pour évaluer le risque de cancer chez les humains puisque ceux-ci ne possèdent pas de préestomac même s’ils possèdent des organes similaires sur le plan histologique. De plus, la dose présente dans les tissus du préestomac des rongeurs ayant reçu de l’acrylate d’éthyle par gavage n’est pas représentative de la nature de l’exposition des humains à cette substance. Même si le fait que la toxicité pour le développement s’accompagne d’une toxicité maternelle laisse croire à un effet secondaire, on ne dispose pas d’information sur la toxicité pour la reproduction. La pureté de l’acrylate d’éthyle est généralement supérieure à 99 % et certaines études indiquent que cette substance contient un inhibiteur de polymérisation comme l’éther monométhylique de la tert-butylhydroquinone ou le p-méthoxyphénol. La présence d’un inhibiteur de polymérisation, même en quantité minimale, peut susciter une confusion dans les résultats expérimentaux. La polymérisation, la photodégradation et la volatilisation spontanées de l’acrylate d’éthyle pourraient aussi influer sur les doses réelles utilisées dans les études expérimentales.
En ce qui concerne la population générale, on a déterminé que l’inhalation constitue la voie d’exposition principale aux milieux environnementaux et aux produits de consommation, étant donné la nature volatile et la pression de vapeur de l’acrylate d’éthyle. Même si les données canadiennes disponibles au sujet de l’air intérieur n’indiquaient pas de niveaux quantifiables, on a utilisé la limite de détection employée dans la méthode analytique pour calculer les limites supérieures d’exposition estimées. Les limites supérieures d’exposition à l’acrylate d’éthyle par l’utilisation de produits de consommation suscitent une confiance modérée en raison de l’incertitude qui subsiste au sujet des concentrations d’acrylate d’éthyle résiduel dans les produits de consommation offerts sur le marché. Cependant, l’acrylate d’éthyle se polymérise quand il est exposé à la lumière et, par conséquent, il ne devrait pas être disponible sous forme de monomère.
Compte tenu de l’adéquation des marges d’exposition entre les limites supérieures d’exposition estimées à l’acrylate d’éthyle et les doses associées à un effet critique, il est conclu que l’acrylate d’éthyle ne pénètre pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
D’après les renseignements contenus dans la présente évaluation préalable, il est conclu que l’acrylate d’éthyle ne pénètre pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie. De plus, l’acrylate d’éthyle ne répond pas aux critères de persistance et de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Par conséquent, il est conclu que l’acrylate d’éthyle ne répond pas aux critères énoncés à l’article 64 de la LCPE (1999).
On envisagera d’inclure cette substance dans la mise à jour de la Liste intérieure des substances. De plus, des activités de recherche et de surveillance viendront, le cas échéant, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable.
Aalto-Korte, K., Alanko, K., Kuuliala, O., Jolanki, R. 2007. Methacrylate and acrylate allergy in dental personnel. Contact Derm. 57(5):324330.
ACD/pKaDB [module de prévision]. 2005. Version 9.04. Toronto (Ont.) : Advanced Chemistry Development. Accès :ACD/Labs [consulté le 18 mai 2010 - réserve de consultation].
[AIES] Artificial Intelligence Expert System. 2003-2005. Version 1.25. Ottawa (Ont.) : Environnement Canada. Modèle élaboré par Stephen Niculescu. Disponible auprès de la Division des substances nouvelles, Division des substances existantes, Environnement Canada
Amoore, J.E., Hautala, E. 1983. Odor as an aid to chemical safety: Odor thresholds compared with threshold limit values and volatilities for 214 industrial chemicals in air and water dilution. Journal of Applied Toxicology 3:272-290.
Arnot JA, Gobas FAPC. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb Sci 22(3):337–345.
Ashby, J., Richardson, C.R., Tinwell, H. 1989. Inactivity of ethyl acrylate in the mouse bone marrow micronucleus assay.Mutagenesis 4:283-285.
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d’estimation]. 2008. Version 1.92a. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles
Atkinson, R. 1989. Kinetics and Mechanisms of the Gas-Phase Reactions of the Hydroxyl Radical with Organic Compounds.Journal of Physical and Chemical Reference Data. Monograph No. 1.
BASF AG. 1958. Department of Toxicology, Report of toxicity studies with different acrylates, unpublished studies (VII/309). [cité dans OCDE, 2004].
BASF AG. 1978. Department of Toxicology, Report on the acute skin irritation of methyl acrylate, ethyl acrylate, butyl acrylate and ethyl hexyl acrylate, unpublished study, (XXV/218). Le 20 janvier 1978. [cité dans OCDE, 2004].
BASF AG. 2000. Ethyl Acrylate. In : IUCLID Dataset for ethyl acrylate. Commission européenne. Bureau Européen des Substances Chimiques. Le 18 février 2000.
BASF. 2005. Acute dermal irritation / corrosion in rabbits. M. Remmele (Study Director). BASF Aktiengesellschaft. Laboratory Project No.: 18H0651/042267. Le 15 août. [cité dans OCDE, 2004].
[BAMM] Basic Acrylic Monomer Manufacturers. 1994. Japanese Acrylic Ester Manufacturers: “Japanese Studies on Acrylic Esters and Acrylic Acid”. Le 15 novembre 1994. [cité dans Commission européenne, 2000].
Basler, A., van der Hude, W. 1987. Erbgutveraendernde Gefahrstoffe bga-Schriften 3/87, MMV Muenchen. [cité dans OCDE, 2004]
[BCFWIN] BioConcentration Factor Program for Windows [Estimation Model]. 2000. Version 2.15. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
[BDIPSN] Base de données sur les ingrédients des produits de santé naturels. 2010.
[BDPSNH] Base de données des produits de santé naturels homologués. 2010.
[BIOWIN] Biodegradation Probability Program for Windows [modèle d’estimation]. 2008. Version 4.10. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles
Bjorkner, B., Dahlquist, I. 1979. Contact allergy caused by UV-cured acrylates. Contact Dermatitis 5:403404.
Boethling, R.S., Howard, P.H., Beauman, J.A., Larosche, M.E. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere 30(4):741752.
Boorman, G.A., Sills, R.C. 2003. Ethyl acrylate. In: IARC monographs on the predictive value of rodent forestomach and gastric neuroendocrine tumours in evaluating carcinogenic risks to humans. Publication technique du CIRC n° 39. p. 5764.
Borzelleca, J.F., Larson, P.S., Hennigar, G.R. Jr., Huf, E.G., Crawford, E.M., Smith, R.B. Jr. 1964. Studies on the chronic oral toxicity of monomeric ethyl acrylate and methyl methacrylate.Toxicology and Applied Pharmacology 6:29-36.
Brusick, D. 1977. Ethyl acrylate. Mutagenicity evaluation. Washington (DC) : Litton Bionetics, BAMM. [cité dans ECETOC, 1994].
[BUA] Advisory Committee on Existing Chemicals of Environmental Relevance. 1992. Ethyl acrylate. BUA report 128. Stuttgart (Allemagne) : BUA.
Burdock, G.A. 1997. Fenaroli’s handbook of flavor ingredients. 6e éd. New York (NY) : CRC Press.
Canada. 1978. Règlement sur les aliments et drogues. C.R.C., c. 870.
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999), L.C. 1999, ch. 33, Gazette du Canada. Partie III, vol. 22, n° 3.
Canada. 2000. Loi canadienne sur la protection de l’environnement (1999) : Règlement sur la persistance et la bioaccumulation. C.P. 2000-348, 23 mars 2000, DORS/2000-107.Gazette du Canada. Partie II, vol. 134, n° 7
Canada. Ministère de l’Environnement, ministère de la Santé. 2006. Loi canadienne sur la protection de l’environnement (1999) : Avis d’intention d’élaborer et de mettre en œuvre des mesures d’évaluation et de gestion des risques que certaines substances présentent pour la santé des Canadiens et leur environnement. Gazette du Canada, Partie I, vol. 140, n° 49
Canada. Ministère de l’Environnement, ministère de la Santé. 2009. Loi canadienne sur la protection de l’environnement (1999) : Avis de onzième divulgation d’information technique concernant les substances identifiées dans le Défi. Gazette du Canada, Partie I, vol. 143, n° 39.
[CATABOL] Probabilistic assessment of biodegradability and metabolic pathways [modèle informatique]. c2004-2008. Version 5.10.2. Bourgas (Bulgarie) : Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. CATALOGIC.
[Cedre] Centre de documentation, de recherche et d’expérimentations sur les pollutions accidentelles des eaux. 2006. Acrylate d’éthyle : guide d’interventation chimique.
Celanese Chem. Co. 1972. Primary Skin Irritation Tests with Eighteen Materials in Albino Rabbits with Cover Letter dated July 28, 1972. OTS0206028 Doc ID 878212151. [cité dans Commission européenne, 2000]
[ChemCAN]. 2003. ChemCAN: level III. fugacity model of regional fate of chemicals [en ligne]. Version 6.00. Peterborough (Ont.) : Canadian Environmental Modelling Centre, Trent University. Modèle ChemCAN.
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 1986. Ethyl acrylate. IARC Monogr. Eval. Carcinog. Risks Hum. 39:8198.
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 1999. Ethyl acrylate. IARC Monogr. Eval. Carcinog. Risks Hum. 71(3):1447-57.
[CIRC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 2003. Predictive value of rodent forestomach and gastric neuroendocrine tumours in evaluating carcinogenic risks to humans. Views and expert opinions of an IARC working group. Lyon, du 29 novembre au 1er décembre 1999. Publication technique du CIRC n° 39.
Commission européenne. 2000. IUCLID Dataset: Ethyl acrylate, CAS No. 140-88-5 [en ligne]. Ispra (Italie) : Commission européenne, Centre conjoint de recherche, Institut pour la santé et la protection des consommateurs, Bureau Européen des Substances Chimiques. [consulté le 18 janvier 2010].
Conde-Salazar L, Guimaraens D, Romero LV. 1988. Occupational allergic contact dermatitis from anaerobic acrylic sealants.Contact Dermatitis 18:129-132.
[ConsExpo] Consumer Exposure Model [en ligne]. 2006. Version 4.1. Bilthoven (Pays-Bas) : Rijksinstituut voor Volksgezondheid en Milieu (Institut national néérlandais de la santé publique et de l’environnement). ConsExpo 4.1.
Daubert, T.E.,Danner, R.P. 1991. Physical and thermodynamic properties of pure chemicals: Data compilation. Design Inst. Phys. Prop. Data., Amer. Inst. Chem. Eng. NY. NY : Hemisphere Pub. Corp. 5 Vol.
Dearfield, K.L., Harrington-Brock, K., Doerr, C.L., Rabinowitz, J.R., Moore, M.M. 1991. Genotoxicity in mouse lymphoma cells of chemicals capable of Michael addition. Mutagenesis6(6):519525.
De Bethizy, J.D., Udinsky, J.R., Scribner, H.E., Frederick, C.B. 1987. The disposition and metabolism of acrylic acid in male Sprague-Dawley rats. Fund. Appl. Toxicol. 8:549561.
Delbressine, L.P.C., Van Balen, H.C.J.G., Seutter-Berlage, F. 1982. Isolation and identification of mercapturic acid metabolites of phenyl substituted acrylate esters from urine of female rats.Arch. Toxicol. 49:321-330.
De Ceaurriz, J.C., Micillino, J.C., Bonnet, P., Guenier, J.P. 1981. Sensory irritation caused by various industrial airborne chemicals. Toxicol. Lett. 9(2):137-143.
DePass, L.R., Fowler, E.H., Meckley, D.R., Weil, C.S. 1984. Dermal oncogenicity bioassays of acrylic acid, ethyl acrylate, and butyl acrylate. Journal of Toxicology and Environmental Health 14:115-120.
Dow Chemical Co. 1957. Results of range finding toxicological tests on ethyl acrylate. TSCATS, Doc. I.D. 90001181S (1989). [cité dans BUA, 1992]
Dow Chemical Co. 1964. Preliminary toxicology information on ethyl acrylate. TSCATS, Doc. I.D. 86-90001182S (1989). [cité dans BUA, 1992]
Dow Chemical Co. 1979a. Pathologic findings in rats exposed by inhalation to vapors for 12 months including a group which was exposed to 225 ppm for 6 months & then held for a recovery period of 6 months. OTS0520802, Doc ID 86-890001298.
Dow Chemical Co. 1979b. Pathologic findings in mice exposed by inhalation to 225 ppm ethyl acrylate for 6 months and subsequently held for a recovery period of three months with cover letter dated 061589. OTS0520788, Doc ID 86-890001282.
[ECETOC] European Centre for Ecotoxicology and Toxicology of Chemicals. 1994. Ethyl acrylate (CAS No. 140-88-5). Joint Assessment of Commodity Chemicals (JACC). Rapport n° 28.
[ECOSAR] Ecological Structural Activity Relationships [en ligne]. 2008. Version 1.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles
Emmert, B., Bunger, J., Keuch, K., Muller, M., Emmert, S., Hallier, E., Westphal, G.A. 2006. Mutagenicity of cytochrome P450 2E1 substrates in the Ames test with the metabolic competent S. typhimurium strain YG7108pin3ERb5. Toxicology228:6676.
Environnement Canada. 1988. Données de la Liste intérieure des substances (LIS), 1984-1986, recueillies en vertu du paragraphe 25(1) de la Loi canadienne sur la protection de l’environnement (1988) et conformément à la Liste intérieure des substances : guide du déclarant. Données produites par Environnement Canada.
Environnement Canada. 2007. Guidance for Conducting Ecological Assessments under CEPA, 1999, Science Resource Technical Series, Technical Guidance Module: QSARs. Document de travail préliminaire révisé. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique. Disponible sur demande.
Environnement Canada. 2008. Inventaire national des rejets de polluants [base de données en ligne]. Gatineau (Qc) : Environnement Canada. [consultée le 20 juin 2010].
Environnement Canada. 2009a. Guidance for Conducting Ecological Assessments under CEPA, 1999, Science Resource Technical Series, Technical Guidance Module: The Industrial Generic Exposure Tool - Aquatic (IGETA). Document de travail. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique. Disponible sur demande.
Environnement Canada. 2009b. Guidance for conducting ecological assessments under CEPA 1999: science resource technical series, technical guidance module: Mega Flush consumer release scenario. Document de travail. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique. Disponible sur demande.
Environnement Canada. 2010a. Données sur les substances du lot 11 recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances identifiées dans le onzième lot du Défi. Données préparées par Environnement Canada, Programme des substances existantes.
Environnement Canada. 2010b. Données tirées des questionnaires volontaires relatifs aux substances contenues dans le lot 11 du Plan de gestion des produits chimiques. Préparé par Environnement Canada, Division des substances existantes.
Environnement Canada. 2010c. IGETA Report: CAS No. 140-88-5. Le 11 mars 2010. Rapport inédit. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique. Ecological Assessment. Disponible sur demande.
Environnement Canada. 2010d. Mega Flush Report: CAS No. 140-88-5. Le 9 avril 2010. Version 1. Rapport inédit. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique. Disponible sur demande.
[EPIsuite] Estimation Programs Interface Suite for Microsoft Windows [modèle d’estimation]. 2008. Version 4.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
Epstein, W.L. 1974. Report to Research Institute for Fragrance Materials (RIFM). Le 7 octobre 1974. [cité dans Opdyke, 1975]
[EQC] Equilibrium Criterion Model. 2003. Version 2.02. Peterborough (Ont.) : Trent University, Canadian Environmental Modelling Centre. Modèle EQC.
Foulger, J.H., Fleming, A.J. 1945. Toxicity of ethyl acrylate monomer. TSCATS, Doc. I.D. 86-890000837, DuPont de Nemours and Co. [cité dans BUA, 1992].
Frederick, C.B., Hazelton, G.A., Frantz, J.D. 1990. The histopathological and biochemical response of the stomach of male F344/N rats following two weeks of oral dosing with ethyl acrylate.Toxicol. Pathol. 18(2):247-56.
Frederick, C.B., Chang-Mateu, L.M. 1990. Contact site carcinogenicity: estimation of an upper limit for risk of dermal dosing site tumors based on oral dosing site carcinogenicity.In : Gerrity, T.R., Henry, C.J. (éd.). Principles of Route-to-Route Extrapolation for Risk Assessment. p. 237-270. New York (NY) : Elsevier.
Frederick, C.B., Potter, D.W., Chang-Mateu, M.J., Andersen, M.E. 1992. A physiologically based pharmacokinetic and pharmacodynamic model to describe oral dosing of rats with ethyl acrylate and its implications for risk assessment. Toxicol. Appl. Pharmacol. 114:246260.
Frederick, C.B., Udinsky, J.R., Finch, L. 1994a. The regional hydrolysis of ethyl acrylate to acrylic acid in the rat nasal cavity. Toxicol. Lett. 70:4956.
Frederick, C.B., Morris, J.R., Kimbell, J.S., Morgan, K.T., Scherer, P.W. 1994b. Comparison of four biologically-based dosimetry models for the deposition of rapidly metabolized vapors in the rodent nasal cavity. Inhalation Toxicology 6 (supp.):135-157.
Frederick, C.B. 1998. Potential for inhalation exposure to residual ethyl acrylate monomer from latex paints. Rohm and Haas Company, Toxicology Department, Report Number 98R-1107.
Frederick, C.B., Bush, M.L., Lomax, L.G., Black, K.A., Finch, L., Kimbell, J.S., Morgan, K.T., Subramaniam, R.P., Morris, J.B., Ultman, J.S. 1998. Application of a hybrid computational fluid dynamics and physiologically based inhalation model for interspecies dosimetry extrapolation of acidic vapors in the upper airways. Toxicol. Appl. Pharmacol. 152(1):211-31.
Frederick, C.B., Lomax, L.G., Black, K.A., Finch, L., Scribner, H.E., Kimbell, J.S., Morgan, K.T., Subramaniam, R.P., Morris, J.B. 2002. Use of a hybrid computational fluid dynamics and physiologically based inhalation model for interspecies dosimetry comparisons of ester vapors. Toxicol. Appl. Pharmacol. 183(1):2340.
Fregert, S. 1978. Allergic contact dermatitis from ethylacrylate in a window sealant. Contact dermatitis 4:56.
Gabor, S., Anca, L., Ivanov, L., Borda, M., Bozac, L. 1965. The chronic effect of inhalation of low methyl methacrylate and ethyl acrylate concentrations as shown by experiments on animals.Igiena 14:593-600 [en roumain]. [cité dans ECETOC, 1994]
Gavin, C.L, Williams, M.C., Hallagan, J.B. 2008. Flavor and Extract Manufacturers Association of the United States 2005 Poundage and Technical Effects Update Survey. Washington (DC) : Flavor and Extract Manufacturers Association of the United States.
Geiger, D.L., Brooke, L.T., Call, D.J. 1990. Acute Toxicities of Organic Chemicals to Fathead Minnows (Pimephales promelas). Vol. 5. Center for Lake Superior Environmental Studies. Superior (WI) :University of Wisconsin. 332 p.
Ghanayem, B.I., Maronpot, R.R., Matthews, H.B. 1985. Ethyl acrylate-induced gastric toxicity I. Effect of single and repetitive dosing. Tox. Appl. Pharmacol. 80:323335.
Ghanayem, B.I., Maronpot, R.R., Matthews, H.B. 1986. Ethyl acrylate-induced gastric toxicity III. Development and recovery of lesions. Toxicol. Appl. Pharm. 83:576-583.
Ghanayem, B.I., Burka, L.T., Matthews, H.B. 1987. Ethyl acrylate distribution, macromolecular binding, excretion, and metabolism in male Fisher 344 rats. Fund. Appl. Toxicol. 9:389-397.
Ghanayem, B.I., Matthews, H.B., Maronpot, R.R. 1991. Sustainability of forestomach hyperplasia in rats treated with ethyl acrylate for 13 weeks and regression after cessation of dosing. Tox. Pathol. 19:273-279.
Ghanayem, B.I., Sanchez, I.M., Maronpot, R.R., Elwell, M.R., Matthews, H.B. 1993. Relationship between the time of sustained ethyl acrylate forestomach hyperplasia and carcinogenicity.Environ. Health Perspect. 101:277-280.
Ghanayem, B.I., Sanchez, I.M., Matthews, H.B., Elwell, M.R. 1994. Demonstration of a temporal relationship between ethyl acrylate-induced forestomach cell proliferation and carcinogenicity. Toxicol. Pathol. 22(5):497-509.
Harkema, J.R., Lee, J.K., Morgan, K.T., Frederick, C.B. 1997. Olfactory epithelial injury in monkeys after acute inhalation exposure to acrylic monomers. Toxicologist 36:113 [cité dans USEPA, 2007]
Haskell Laboratories for Dupont de Nemours. 1945. Toxicity of ethyl acrylate monomer with cover sheet dated 061289. OTS0520953 Doc ID 86-890000837. [cité dans Commission européenne, 2000]
Hara, T., Katoh, M., Horiya, N., Shibuya, T. 1994. Ethyl acrylate is negative in the bone marrow micronucleus test using BDF1 male mice. Environ. Mut. Res. Commun. 16:211215.
Haworth, S., Lawlor, T., Mortelmans, K., Speck, W., Zeiger, E. 1983. Salmonella mutagenicity test results for 250 chemicals.Environ. Mutagen. Vol. 5 (Suppl 1):3-142.
Hayes, B.B., Meade, B.J. 1999. Contact sensitivity to selected acrylate compounds in B6C3F1 mice: relative potency, cross reactivity, and comparison of test methods. Drug Chem. Toxicol. 22:491-506.
[HENRYWIN] Henry’s Law Constant Program for Microsoft Windows [modèle d’estimation]. 2008. Version 3.20. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
Base de données de produits ménagers [base de données en ligne]. 2009. Septembre 2009. Bethesda (MD) : US Department of Health and Human Services.
Huff, J. 1995. Mechanisms, chemical carcinogenesis, and risk assessment: cell proliferation and cancer. Am. J. Ind. Med. 27(2):293-300.
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [modèle d’estimation]. 2008. Version 2.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.Outils d'évaluation de l'exposition et des modèles.
[INRP] Inventaire national des rejets de polluants [base de données en ligne]. 2008. Gatineau (Qc) : Environnement Canada. [consultée le 21 mars 2009].
Institute of Biological Research. 1983. Comparative histopathologic evaluation of changes in the nasal cavity of the rat after exposure to methyl, ethyl and butyl acrylate with cover letter dated 071289. OTS0520801, Doc ID 86-890001297.
Ishidate, M., Sofuni, T. Jr., Yoshikawa, K. 1981. Chromosomal aberration tests in vitro as a primary screening tool for environmental mutagens and/or carcinogens. Gann Monograph on Cancer Research 27:95-108.
[IUCLID]. International Uniform Chemical Information Database. 2000. IUCLID Dataset. Ethyl acrylate. Commission européenne. Bureau européen des substances chimiques. Le 18 février 2000.
Japon. Résumé du rapport d'évaluation du risque initial. Ethyl acrylate. CAS No. 140-88-5. PRTR No. 4. R0074. Accès: .
[JECFA] Comité mixte d’experts FAO/OMS sur les additifs alimentaires. 2006. Évaluation de la sécurité de certains les additifs alimentaires, (WHO food additives series: 54) [en ligne]. Genève (Suisse). [2010-07-07].
Jersey, G.C., Keyes, D.G., Battjes, J.E. 1978. Pathologic findings in rats exposed by inhalation to vapors of ethyl acrylate for 6 months. Midland (MI) : Health and Environmental Research, Toxicology Research Laboratory, Dow Chemical. TSCATS: OTS0520180, Doc-ID: 86-890001037
Jordan, W.P. Jr. 1975. Cross-sensitization patterns in acrylate allergies. Contact Dermatitis 1(1):13-5.
Kanerva, L., Estlander, T., Jolanki, R. 1988. Sensitization to patch test acrylates. Contact Dermatitis 18(1):10-15.
Kanerva, L., Estlander, T., Jolanki, R. 1989. Allergic contact dermatitis from dental composite resins due to aromatic epoxy acrylates and aliphatic acrylates. Contact Dermatitis20(3):201-11.
Kanerva, L., Estlander, T., Jolanki, R. 1992. Double active sensitization caused by acrylics. Am. J. Contact Derm. 3:23-26.
Kanerva, L., Estlander, T., Jolanki, R., Tarvainen, K. 1995. Statistics on allergic patch test reactions caused by acrylate compounds, including data on ethyl methacrylate. Am. J. Contact Derm. 6:75.
Kelly, T.J., Callahan, P.J., Pleil, J., Evans, G.F. 1993. Method development and field measurements for polar volatile organic compounds in ambient air. Environ. Sci. Technol. 27:11461153.
Kimber, I. 1992. Skin sensitization [EA negative in murine local lymph node assay]. Communication personnelle avec Mackay, J.M. le 12 novembre 1992. ICI CTL, Macclesfield. [cité dans ECETOC, 1994].
Kligerman, A.D., Atwater, A.L., Bryant, M.F., Erexson, G.L., Kwanyuen, P.K., Dearfield, K.L. 1991. Cytogenetic studies of ethyl acrylate using C57BL/6 mice. Mutagenesis 6(2):137-141.
[KOAWIN] Octanol Air Partition Coefficient Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.10. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles
Koppula, S.V., Fellman, J.H., Storrs, F.J. 1995. Screening allergens for acrylate dermatitis associated with artificial nails.Am. J. Contact Derm. 6:78-85.
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.67. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : Outils d'évaluation de l'exposition et des modèles
Kuzelova, M., Kovarik, J., Fiedlerova, D., Popler, A. 1981. Acrylic compounds and general health of the exposed persons.Pracov Lék 33:95-99 (en tchèque) [Doc Occup Health 8:1612; Chem. Abstr. 96:24169v]. [cité dans ECETOC, 1994].
Lazarov A. 2007. Sensitization to acrylates is a common adverse reaction to artificial fingernails. Journal of the European Academy of Dermatology and Venereology 21(2):169-174.
Lomonova, G.V., Klimova, E.I. 1979. Data on the toxicology of acrylic acid methyl and ethyl esters. Gig. Tr. Prof. Zabol9:5556 [cité dans ECETOC, 1994; Commission européenne, 2000].
Loveday, K.S., Anderson, B.E., Resnick, M.A., Zeiger, E. 1990. Chromosome aberration and sister chromatid exchange tests in Chinese hamster ovary cells in vitro. V: results with 46 chemicals.Environ. Mol. Mutagen. 16:272-303.
Lucas, C.D., Putnam, J.M., Hallagan, J.B. 1999. 1995 Poundage and Technical Effects Update Survey. Washington (DC) : Flavor and Extract Manufacturers Association (FEMA) of the United States.
Mabey, W., Mill, T. 1978. Critical Review of Hydrolysis of Organic Compounds in Water Under Environmental Conditions. J. Phys. Chem. Ref. Data. 7:383-415.
Malten, K.E., van Ketel, W.G., Nater, J.P., Liem, D.H. 1984. Reactions in selected patients to 22 fragrance materials.Contact Dermatitis 11:1-10.
Marks, J.G., Belsito, D.V. Jr., DeLeo, V.A., Fowler, J.F., Fransway, A.F. Jr., Maibach, H.I., Mathias, C.G.T., Nethercott, J.R., Rietschel, R.L., Rosenthal, L.E., et al. 1995. North American Contact Dermatitis Group standard tray patch test results (1992 to 1994). Am. J. Contact Derm. 6:160-165.
Matthews, E.J., Spalding, J.W., Tennant, R.W. 1993. Transformation of BALB/c-3T3 cells: V. Transformation responses of 168 chemicals compared with mutagenicity in Salmonella and carcinogenicity in rodent bioassays. Environ. Health Perspect. 101(Suppl 2):347-482.
McCarthy, T.J., Hayes, E.P., Schwartz, C.S., Witz, G. 1994. The reactivity of selected acrylate esters toward glutathione and deoxyribonucleosides in vitro: structure-activity relationships. Fund. Appl. Toxic. 22:543-548.
McGregor, D.B., Brown, A., Cattanach, P., Edwards, I., McBride, D.M., Riach, C., Caspary, W.J. 1988. Responses of the L5178Y tk+/tk- mouse lymphoma cell forward mutation assay: III. 72 coded chemicals. Environ. Molec. Mutagen. 12:85-154.
McLaughlin, J.E., Baldwin, R.C., Smith, J.M. 1993. Ethyl Acrylate Health Effects Overview. In: Tyler, T.R., Reiss Murphy, S., Hunt, E.K. (éditeurs). Health Effect Assessments of the Basic Acrylates. Ann Arbor (MI) : CRC Press.
Melnick, R.L., Huff, J., Barrett, J.C., Maronpot, R.R., Lucier, G., Portier, C.J. 1993. Cell proliferation and chemical carcinogenesis: symposium overview. Environ. Health Perspect. 101(Suppl 5):3-7.
Miller, R.R., Jersey, G.A., Betso, J.E., Rampy, L.W. 1979. 30-day ethyl acrylate vapor inhalation study with rats and mice, final report. Midland (MI) : Dow Chemical USA. [cité dans ECETOC, 1994].
Miller, R.R., Ayres, J.A., Rampy, L.W., McKenna, M.J. 1981. Metabolism of acrylate esters in rat tissue homogenates.Fundam. Appl. Toxicol. 1:410-414.
Miller, R.R., Young, J.T., Kociba, R.J., Keyes, D.G., Bodner, K.M., Calhoun, L.L., Ayres, J.A. 1985. Chronic toxicity and oncogenicity bioassay of inhaled ethyl acrylate in Fischer 344 rats and B6C3F1 mice. Drug and Chemical Toxicology 8:1-42.
[MITI] Ministry of International Trade & Industry (Japon), Basic Industries Bureau, Chemical Products Safety Division. 1992. Biodegradation and bioaccumulation data of existing chemicals based on the CSCL Japan. Tokyo (Japon) : Japan Chemical Industry Ecology-Toxicology & Information Center.
Moore, M.M., Amtower, A., Doerr, C.L., Brock, K.H., Dearfield, K.L. 1988. Genotoxicity of acrylic acid, methyl acrylate, ethyl acrylate, methyl methacrylate, and ethyl methacrylate in L5178Y mouse lymphoma cells. Environmental and Molecular Mutagenesis 11:49-63.
Moore, M.M., Harrington-Brock, K., Doerr, C.L., Dearfield, K.L. 1989. Differential mutant quantitation at the mouse lymphoma tk and CHO hgprt loci. Mutagenesis 4:394-403.
Morita, T., Asano, N., Awogi, T., Sasaki, Y.F., Sato, S., Shimada, H., Sutou, S., Suzuki, T., Wakata, A., Sofuni, T. et al. 1997. Evaluation of the rodent micronucleus assay in the screening of IARC carcinogens (groups 1, 2A and 2B) the summary report of the 6th collaborative study by CSGMT/JEMS MMS. Collaborative Study of the Micronucleus Group Test. Mammalian Mutagenicity Study Group (published erratum). Mutat. Res.391(3):259-67; 389:3-122.
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.43. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles
Murray, J.S., Miller, R.R., Deacon, M.M., Hanley, T.R., Hayes, W.C., Rao, K.S., John, J.A. 1981. Teratological evaluation of inhaled ethyl acrylate in rats. Tox. Appl. Pharmacol.60:106-111.
Myhr, B.C. 1980. Mutagenicity evaluation of ethyl acrylate monomer in the mouse lymphoma forward mutation assay. Washington (DC) : Litton Bionetics, Basic Acrylic Monomer Manufacturers, Inc (BAMM). [cité dans ECETOC, 1994]
[NCI] National Chemical Inventories [base de données sur CD-ROM]. 2006. Issue 1. Columbus (OH) : American Chemical Society, Chemical Abstracts Service. [consultée en janvier 2010]
[NITE] National Institute of Technology and Evaluation [en ligne]. c2008. Japan: Ethyl Acrylate; [consulté le 19 mars 2010].Carte du site
[NTP] National Toxicology Program. 1986a. Études de cancérogenèse d'acrylate d'éthyle (n° CAS 140-88-5) sur des rats F344/N et des souris B6C3F1 (études de gavage) . Research Triangle Park (NC) : U.S. Department of Health and Human Services, National Toxicology Program. Report No.: TR 259.
[NTP] National Toxicology Program. 1986b. In vitro cytogenetics chromosome aberration and sister chromatid exchange studies of ethyl acrylate (CAS # 140-88-5). Research Triangle Park (NC) : U.S. Department of Health and Human Services, National Toxicology Program. Étude ID: 550589.
[NTP] National Toxicology Program. 1989. Rapport sur les cancérogènes, 5th ed., Carcinogen Profiles. Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program.
[NTP] National Toxicology Program. 1994. Assessment of contact hypersensitivity to ethyl acrylate in female B6C3F1 mice. Report to National Toxicology Program, Medical College of Virginia. Protocol No. EAC-3-1-TO [cité dans OCDE, 2004]
[NTP] National Toxicology Program. 1998. Rapport sur les cancérogènes document de base pour l'acrylate d'éthyle. Research Triangle Park (NC) : US Department of Health Services, National Toxicology Program.
[NTP] National Toxicology Program. 2000. Rapport sur les cancérogènes, 9th ed., Carcinogen Profiles. Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program.
Nylander-French, L.A., French, J.E. 1998. Tripropylene glycol diacrylate but not ethyl acrylate induces skin tumors in a twenty-week short-term tumorigenesis study in Tg.AC (v-Ha-ras) mice. Toxicologic Pathology 26(4):476-483.
[OASIS Forecast] Optimized Approach based on Structural Indices Set [en ligne]. 2005. Version 1.20. Bourgas (Bulgarie) : Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry.Logiciels OASIS
Oberly, R., Tansy, M.F. 1985. LC50 Values for rats acutely exposed to vapors of acrylic and methacrylic acid esters.Journal of Toxicology and Environmental Health16:811-822.
[OCDE] Organisation de coopération et de développement économiques. 1992. Lignes directrices de l’OCDE pour les essais de produits chimiques. Essai 301D - Biodégradabilité facile : essai en flacon fermé.
[OCDE] Organisation de coopération et de développement économiques. 2003. Lignes directrices de l’OCDE pour les essais de produits chimiques. Essai 310 - Biodégradabilité facile : dégagement de CO2 dans des flacons hermétiquement clos (essai de l'espace libre au-dessus du liquide).
[OCDE] Organisation de coopération et de développement économiques. 2004. Ethyl Acrylate. CAS No. 140-88-5. SIDS initial assessment report for SIAM 18 [en ligne]. Genève (Suisse) : Programme des Nations Unies pour l’environnement (PNUE). [consulté le 3 février 2010].
[OCDE] Organisation de coopération et de développement économiques. 2005. Ethyl Acrylate d’éthyle. CAS No. 140-88-5. SIDS Dossier [en ligne]. Genève (Suisse) : Programme des Nations Unies pour l’environnement. [consulté le 19 août 2009].
Oettel, H., Zeller, H. 1958. Bericht über die Prüfung der Haut- und Schleimhautreizwirkung verschiedener Acrylsäureester. Ludwigshafen (Allemagne) : BASF. [cité dans ECETOC, 1994].
Oettel, H., Hofmann, H.T. 1960. Bericht über die toxikologische Prüfung verschiedener Acrylsäureester an Kaninchen and Katzen. Ludwigshafen (Allemagne) : BASF. [cité dans ECETOC, 1994].
O’Neil, M.J. (éd.) 2006. The Merck index--An encyclopedia of chemicals, drugs and biologicals. 14e éd. Whitehouse Station (NJ) : Merck & Co.
O’Neil, M.J, Smith, A., Heckleman, P.E., Obenchain Jr, J.R., Gallipeau, J.R., D’Arecca, M.A., Budavari, S. (éd.). 2001. The Merck Index.Ethyl acrylate.
Opdyke, D.L.J. 1975. Ethyl acrylate, monograph on raw materials 17. Food Cosmet. Toxicol. suppl 13:801802.
Otson, R., Fellin, P., Tran, Q. 1994. VOCs in representative Canadian residences. Atmospheric Environment28:3563-3569
Paulet, G., Vidal, M. 1975. De la toxicité de quelques esters acryliques et méthacryliques, de l’acrylamide et des polyacrylamdies. Arch. Mal. Prof. Med. Trav. Secur. Soc. 36:5860. [cité dans OCDE, 2004].
[PCKOCWIN] Organic Carbon Partition Coefficient Program for Windows [modèle d’estimation]. 2008. Version 1.66. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles
Pietrowicz, D., Owecka, A., Baranski, B. 1980. Disturbances in rats embryonal development due to ethylacrylate. Zwierzeta Laboratoryine 17:67-72. [cité dans CIRC, 1986; OCDE, 2004]
[PISSC] Programme international sur la sécurité des substances chimiques. 2004. Ethyl acrylate. ICSC: 0267.
Poole, L.J. 1980. Acrylate d’éthyle (AE) : Irritation studies in the rabbit. Report Cl80:66:2031. Consultox Laboratories Limited. Rapport rédigé pour Norsolor. [cité dans OCDE, 2004]
Potokar, M., Grundler, O.J., Heusener, A., Jung, R., Mürmann, P., Schöbel, C., Suberg, H., Zechel, H.J. 1985. Studies on the design of animal tests for the corrosiveness of industrial chemicals. Fd Chem. Toxic. 23:615617.
Potter, D.W., Tran, T.B. 1992. Rates of ethyl acrylate binding to glutathione and protein. Toxicol. Lett. 62:275285.
Pozzani, U.C., Weil, C.S., Carpenter, C.P. 1949. Subacute vapor toxicity and range-finding data for ethyl acrylate. J. Industrial Hyg. Toxicol. 31(6):311-316.
Preston-Martin, S., Pike, M.C., Ross, R.K., Jones, P.A., Henderson, B.E. 1990. Increased cell division as a cause of human cancer. Cancer Res. 50(23):7415-21.
Proctor, D.M., Gatto, N.M., Hong, S.J., Allamneni, K.P. 2007. Mode-of-action framework for evaluating the relevance of rodent forestomach tumors in cancer risk assessment. Toxicol. Sci. 98(2):313326.
Przybojewska, B., Dziubaltowska, E., Kowalski, Z. 1984. Genotoxic effects of ethyl acrylate and methyl acrylate in the mouse evaluated by the micronucleus test. Mutation Research 135:189-191.
Riddick, J.A., Bunger, W.B., Sakano, T.K. 1986. Ethyl acrylate. Techniques of Chemistry. Volume II. Organic solvents. Physical properties and methods of purification. Quatrième édition. Toronto (Ont.) : John Wiley & Sons.
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2006. Cosmetics fact sheet: To assess the risks for the consumer. Version mise à jour pour ConsExpo 4 [en ligne]. Bilthoven (Pays-Bas) : RIVM (Institut national néérlandais de la santé publique et de l’environnement). Rapport n° 320104001/2006.
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2007a. Do-it-yourself products fact sheet: To assess the risks for the consumer [en ligne]. Bilthoven (Pays-Bas) : RIVM (Institut national néérlandais de la santé publique et de l’environnement). Rapport n° 320104007/2007.
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2007b. Paint products fact sheet: To assess the risks for the consumer. Version mise à jour pour la version 4 de ConsExpo [en ligne]. Bilthoven (Pays-Bas) : RIVM (Institut national néérlandais de la santé publique et de l’environnement). Rapport n° 320104008/2007.
Rohm and Haas Company. 1950a. Munch Research Laboratories, Inc. (Testing Facility). Acute oral toxicity in mice. Spring House (PA) : Rohm and Haas Toxicology Department. Rapport n° 50RC-1003. Rapport inédit. [cité dans OCDE, 2004].
Rohm and Haas Company. 1950b. Acute toxicity studies, group III: methyl acrylate and ethyl acrylate. Document rédigé par Munch Res. Lab. Spring House (PA) : Rohm and Haas. [cité dans ECETOC. 1994].
Rohm and Haas Company. 1977. Mutagenicity evaluation of ethyl acrylate. Litton Bionetics, Inc. (Testing Facility). LBI Project No. 2683. Spring House (PA) : Rohm and Haas Toxicology Department. Rapport n° 77RC-1024. Rapport inédit. [cité dans OCDE, 2004].
Rohm and Haas Company. 1981. Ethyl acrylate: microbial mutagen test. Spring House (PA) : Rohm and Haas Toxicology Department. Rapport n° 80R-212. Rapport inédit. [cité dans OCDE, 2004].
Rohm and Haas Company. 1983. Situation and results of recent investigations into the toxicity of acrylic acid and its esters and a NTP technical report on the carcinogenesis bioassay of ethyl acrylate W-attachments. OTS0520798, Doc ID 86-890001294. [cité dans Commission européenne, 2000].
Rohm and Haas.Company. 1984. Acute definitive oral LD50 in rats- ethyl acrylate monomer. Spring House (PA) : Rohm and Haas Toxicology Department. Rapport n° 84R-0208. Rapport inédit. [cité dans OCDE, 2004].
Rohm and Haas Company. 1986a. Acute definitive dermal LD50 in rats (occluded) - ethyl acrylate monomer. Spring House (PA) : Rohm and Haas Toxicology Department. Rapport n° 86R-017A. Rapport inédit [cité OCDE, 2004].
Rohm and Haas Company. 1986b. Ethyl acrylate: 2-week oral (gavage) study in rats. Spring House (PA) : Rohm and Haas Toxicology Department. Rapport n° 86R-063. Rapport inédit. [cité dans OCDE, 2004].
Rohm and Haas Company. 1986c. Toxicity report, acute dermal LD50 definitive, rats (unoccluded). Document rédigé par Morrison, R.D., Hazelton, G.A. Spring House (PA) : Rohm and Haas. [cité dans ECETOC, 1994].
Rohm and Haas Company. 1986d. Toxicity report, acute dermal LD50 definitive, mice (occluded). Document rédigé par Morrison, R.D., Hazelton, G.A. Spring House (PA) : Rohm and Haas. [cité dans ECETOC, 1994].
Rohm and Haas Company. 1987. Ethyl acrylate: three month oral gavage study in rats. Spring House (PA) : Rohm and Haas. Rapport n° 86R-153. Rapport inédit. [cité dans OCDE, 2004].
Rohm and Hass Company. 1991. Ethyl acrylate (15 ppm MEHQ) skin irritation study in rabbits. Spring House (PA) : Rohm and Hass. Rapport n° 90R-268. Rapport inédit. [cité dans OCDE, 2004].
Rohm and Haas Company. 1994. Single dose inhalation toxicity study of ethyl acrylate (EA) and acrylic acid (AA) in monkeys. Rapport intermédiaire d’une étude pharmacocinétique, avec lettre d’accompagnement datée du 8 décembre 1994. Doc. ED 86-950000051 OTS0557564.
Rustemeyer, T., Frosch, P.J. 1996. Occupational skin diseases in dental laboratory technicians: (I). Clinical picture and causative factors. Contact Dermatitis 34:125-133.
Saillenfait, A., Bonnet, P., Gallissot, F., Protois, J.C., Peltier, A., Fabries, J.F. 1999. Relative developmental toxicities of acrylates in rats following inhalation exposure.Toxicological Sciences 48:240245.
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Ottawa (Ont.) : Santé Canada, Direction de l’hygiène du milieu.
Schwartz, B.S., Doty, R.L., Monroe, C., Frye, R., Barker, S. 1989. Olfactory function in chemical workers exposed to acrylate and methacrylate vapors. Am. J. Public Health79:613-618.
Sherman, J. 1985. Case study re: birth defects reported in a baby of mother exposed to SK-131-A and SK131-B with attachments and cover letter dated 081685. TSCATS, FYI-OTS-0885-0402. Document présenté par Sherman J., Michigan. [cité dans BUA, 1992].
Silver, E.H., Murphy, S.D. 1981. Potentiation of acrylate ester toxicity by prior treatment with the carboxylesterase inhibitor triorthotolyl phosphate (TOTP). Tox. Appl. Pharmacol. 57:208-219.
Shimizu, M., et al. 1994. Annual Report of Osaka City Institute of Public Health and Environmental Sciences 51, 11-17 (1988). In : Basic Acrylic Monomer Manufacturers, Japanese Acrylic Ester Manufacturers: “Japanese Studies on Acrylic Esters and Acrylic Acid”, 11-15-94. [cité dans Commission européenne, 2000].
Skoglund, A., Egelrud, T. 1991. Hypersensitivity reactions to dental materials in patients with lichenoid oral mucosal lesions and in patients with burning mouth syndrome. Scand. J. dent. Res. 99:320.
Staples, CA, Murphy, S.R., McLaughlin, J.E., Leung, H.-W., Cascieri, T.C., Farr, C.H. 2000. Determination of selected fate and aquatic toxicity charactericstics of acrylic acid and a series of acrylic ester. Chemosphere 40:29-38.
Steele, V.E., Arnold, J.T., Van Arnold, J., Mass, M.J. 1989. Evaluation of a rat tracheal epithelial cell culture assay system to identify respiratory carcinogens. Environ. Mol. Mutagen. 14:48-54.
Stenman, E., Bergman, M. 1989. Hypersensitivity reactions to dental materials in a referred group of patients. Scand. J. dent. Res. 97:76.
Stott, W.T., McKenna, M.J. 1984. The comparative absorption and excretion of chemical vapors by the upper, lower and intact respiratory tract of rats. Fund. Applied Tox. 4:594-602.
Sweeney, L.M., Andersen, M.E., Gargas, M.L. 2004. Ethyl acrylate risk assessment with a hybrid computational fluid dynamics and physiologically based nasal dosimetry model.Toxicol. Sci. 9(2):394403.
Tanii, H., Hashimoto, K. 1982. Structure-toxicity relationship of acrylates and methacrylates.Toxicol. Letters 11:125-129.
Tennant, R.W., Spaldinig, J., French, J.E. 1996. Evaluation of transgenic mouse bioassays for identifying carcinogens and noncarcinogens. Mutat. Res. 365:119-127.
Tice, R.R., Nylander-French, L.A., French, J.E. 1997. Absence of systemic in vivo genotoxicity after dermal exposure to ethyl acrylate and tripropylene glycol diacrylate in Tg.AC (v-Ha-ras) mice. Environ. Mol. Mutagen. 29:240-249.
[TOPKAT] TOxicity Prediction Program by Komputer Assisted Technology [en ligne]. 2004. Version 6.2. San Diego (CA) : Accelrys Software Inc.
Treon, J.F., Sigmon, H., Wright, H., Kitzmiller, K. 1949. The toxicity of methyl and ethyl acrylate. J. Ind. Hyg. Tox. 31:317325.
[TRI] Toxics Release Inventory Program [en ligne]. 2008. TRI Explorer. Version 4.7. Washington (DC) : US Environmental Protection Agency. Rapports publiés [consulté le 21 mars 2010].
Tucker, S.C., Beck, M.H. 1999. A 15-year study of patch testing to (meth)acrylates. Contact Dermatitis 40(5):278279.
Tyler et Smock. 1993. Overview. In : Tyler, T.R., Murphy, S.R., Hunt, E.K. (éd.). Health Effect Assessments of the Basic Acrylates. p. 131. Boca Raton (FL) : CRC Press.
Union Carbide Corp. 1971. Toxicology studies-ethyl acrylate. New York (NY) : Industrial Medicine and Toxicology Department. [cité dans CIRC, 1986].
Union Carbide Corp. 1989. Attachments: letter from US EPA to Union Carbide Corporation, listing of items in attachment Iii, part i - Brc studies & part Ii external toxicology reports with cover letter 071489. TSCATS: OTS0520180, Doc-ID: 86-890001037. [cité dans Commission européenne, 2000].
[USEPA] United States Environmental Protection Agency. 2005. Effets sur la santé de l'information utilisées dans le cancer et la caractérisation des risques non cancérogènes pour 1999 évaluations à l'échelle nationale.
[USEPA] United States Environmental Protection Agency 2007. Acute Exposure Guideline Levels (AEGLs) for ethyl acrylate (CAS Reg. No. 140-88-5) (interim). Washington (DC) : National Advisory Committee for AEGLs for Hazardous Substances, USEPA.
[USEPA] United States Environmental Protection Agency. 2009.Ethyl acrylate. [en ligne] Washington (DC) : Air Toxics, Technology Transfer Network. [le 3 février 2010].
Valencia, R., Mason, J.M., Woodruff, R.C., Zimmering, S. 1985. Chemical mutagenesis testing in drosophila. III. Results of 48 coded compounds tested for the National Toxicology Program.Environmental Mutagenesis 7:325-348.
Van der Walle, H.B., Klecak, G., Geleick, H., Bensink, T. 1982. Sensitizing potential of 14 mono-(meth)acrylates in the guinea pig.Contact Dermatitis 8:223-235.
Vodicka, P., Gut, I., Frantik, E. 1990. Effects of inhaled acrylic acid derivatives in rats. Toxicology65(12):209-21.
Waegemaekers, T.H.J.M., Bensink, M.P.M. 1984. Non-mutagenicity of 27 aliphatic acrylate esters in the Salmonella-microsome test.Mutation Res. 137:95-102.
Walker, A.M., Cohen, A.J., Loughlin, J.E., Rothman, K.J., DeFonso, L.R. 1991. Mortality from cancer of the colon or rectum among workers exposed to ethyl acrylate and methyl methacrylate.Scand. J. Work Environ. Health 17:719.
[WPEM] Wall Paint Expoure Assessment Model [en ligne]. 2001. Version 3.2. Washington (DC) : US EPA Office of Pollution Prevention and Toxics and National Paint and Coatings Association. Outils d'évaluation de l'exposition et des modèles.
Williams, G.M., Iatropoulos, M.J. 2009. Evaluation of potential human carcinogenicity of the synthetic monomer ethyl acrylate.Regul. Toxicol. Pharmacol. 53(1):6-15.
[WSKOWWIN] Water Solubility for Organic Compounds Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.41. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles
Yasunaga, K., Kiyonari, A., Oikawa, T., Abe, N., Yoshikawa, K. 2004. Evaluation of the Salmonella umu test with 83 NTP chemicals.Environmental and Molecular Mutagenesis 44:329-345.
Zeiger, E., Anderson, B., Haworth, S., Lawlor, T., Mortelmans, K. 1992. Salmonella mutagenicity tests: V. Results from the testing of 311 chemicals. Environ. Mol. Mutagen. 19 (Supplement 21):2-141.
Zimmermann, F.K., Mohr, A. 1992. Formaldehyde, glyoxal, urethane, methyl carbamate, 2,3-butanedione, 2,3-hexanedione, ethyl acrylate, dibromoacetonitrile and 2-hydroxypropionitrile induce chromosome loss in Saccharomyces cerevisiae. Mutat. Res. 270:151-166
Annexe 1 : Limite supérieure estimée de l’exposition de la population générale au Canada à l’acrylate d’éthyle à partir des milieux naturels
| Voie d’exposition | 0-6 mois[1], [2], [3] | 0,5 à 4 ans[4] |
5 à 11 ans[5] |
12 à 19 ans[6] |
20 à 59 ans[7] |
60 ans et plus[8] | ||
|---|---|---|---|---|---|---|---|---|
| Allaités | Lait mater-nisé | Sans lait mater-nisé | ||||||
| Air ambiant[9] | 0-2,87 x 10-2 | 0-6,15 x 10-2 | 0-4,79 x 10-2 | 0-2,73 x 10-2 | 0-2,34 x 10-2 | 0-2,04 x 10-2 | ||
| Air intérieur[10] | 0-2,45 | 0-5,25 | 0-4,09 | 0-2,33 | 0-2,00 | 0-1,74 | ||
| Eau potable[11] | 0,00 | 0-1,07 | 0-0,400 | 0-0,452 | 0-0,355 | 0-0,202 | 0,212 | 0-0,222 |
| Aliments et boissons[12] | 0,00 | 0,00 | 0,00 | 4,93 x 10-2 | 1,82 x 10-2 | 1,26 x 10-2 | 9,12 x 10-3 | 1,35 x 10-2 |
| Sol[13] | 3,22 x 10-10 | 5,19 x 10-10 | 1,69 x 10-10 | 4,07 x 10-11 | 3,41 x 10-11 | 3,35 x 10-11 | ||
| Absorption totale | 2,48 | 3,55 | 2,88 | 5,81 | 4,51 | 2,57 | 2,24 | 1,99 |
[2] Hypothèse : poids de 7,5 kg, inhalation de 2,1 m3 d’air par jour, consommation de 0,8 L d’eau par jour (lait maternisé) ou de 0,3 L d’eau par jour (autre que lait maternisé), ingestion de 30 mg de particules de sol par jour (Santé Canada, 1998).
[3] Dans le cas des enfants nourris exclusivement au lait maternisé, l’absorption par l’eau correspond à l’absorption par la nourriture. Aucune donnée n’a été obtenue sur la concentration d’acrylate d’éthyle dans le lait maternisé au Canada.
[4] Hypothèse : poids de 15,5 kg, inhalation de 9,3 m3 d’air par jour, consommation de 0,7 L d’eau par jour et ingestion de 100 mg de particules de sol par jour (Santé Canada, 1998).
[5] Hypothèse : poids de 31 kg, inhalation de 14,5 m3 d’air par jour, consommation de 1,1 L d’eau par jour et ingestion de 65 mg de particules de sol par jour (Santé Canada, 1998).
[6] Hypothèse : poids de 59,4 kg, inhalation de 15,8 m3 d’air par jour, consommation de 1,2 L d’eau par jour et ingestion de 30 mg de particules de sol par jour (Santé Canada, 1998).
[7] Hypothèse : poids de 70,9 kg, inhalation de 16,2 m3 d’air par jour, consommation de 1,5 L d’eau par jour et ingestion de 30 mg de particules de sol par jour (Santé Canada, 1998).
[8] Hypothèse : poids de 72,0 kg, inhalation de 14,3 m3 d’air par jour, consommation de 1,6 L d’eau par jour et ingestion de 30 mg de particules de sol par jour (Santé Canada, 1998).
[9] Aucune donnée canadienne n’a été recensée. Pour pallier cette absence, on a utilisé la limite de détection de 0,2 ppb (0,82 µg/m3) signalée par Kelly et al., 1993 pour la concentration d’acrylate d’éthyle dans l’air ambiant (extérieur) afin de calculer la limite supérieure de l’exposition estimée. La surveillance de l’air a eu lieu à Houston et à Boston (États-Unis) : 22 échantillons ont été prélevés dans chaque ville entre août 1990 et août 1991. On n’a pas décelé d’acrylate d’éthyle dans tous ces échantillons. Ce résultat n’a pas eu d’incidence sur les limites supérieures estimées de l’absorption quotidienne.
[10] Les estimations de l’absorption à partir de l’air intérieur sont fondées sur la limite de détection estimée de 10 µg/m3 de l’acrylate d’éthyle dans l’air intérieur signalé par Otson et al., 1994; 757 logements canadiens ont été surveillés et on n’a pas décelé d’acrylate d’éthyle dans tous ces échantillons. On présume que les Canadiens passent 21 heures par jour à l’intérieur (Santé Canada, 1998).
[11] Aucune donnée canadienne n’a été recensée. Pour pallier cette absence, on a utilisé la limite de détection la plus élevée signalée (10 ppb) pour la concentration d’acrylate d’éthyle dans l’eau potable (McLaughlin et al., 1993). Les auteurs ont signalé qu’on n’avait pas décelé d’acrylate d’éthyle dans les quelque 250 échantillons d’eau souterraine prélevés à l’intérieur ou autour de cinq usines produisant cette substance et que la limite de détection se situait entre 1 et 10 ppb (McLaughlin et al., 1993).
[12] Aucune donnée n’a été relevée sur la concentration d’acrylate d’éthyle dans les aliments au Canada. La seule concentration d’acrylate d’éthyle dans les fruits signalée (0,77 mg/kg) se trouvait dans l’ananas frais (CIRC, 1986). Faute de données canadiennes, cette valeur a été utilisée pour tous les autres fruits contenant l’acrylate d’éthyle dans les études provenant des États-Unis et d’Europe (mûres, framboises, fruits de la passion jaune et durians) la concentration signalée dans l’ananas (CIRC, 1986) aux fins du calcul de la limite supérieure estimée d’exposition à partir des aliments. La quantité quotidienne d’aliments consommés par chaque groupe d’âge est décrite par Santé Canada (1998). Le Comité mixte d’experts FAO/OMS sur les additifs alimentaires rapporte une dose quotidienne d’acrylate d’éthyle absorbée sous forme d’assaisonnement de nourriture d’après les volumes annuels de production d’acrylate éthylique utilisés comme aromatisant (JECFA, 2006). La quantité absorbée a été estimée à 1,1 × 10-5 mg/kg p. c. par jour et 2,6 × 10-5 mg/kg p. c. par jour aux États-Unis et en Europe, respectivement. (JECFA, 2006). Ces estimations n’ont pas été incluses dans le calcul de l’estimation de la limite supérieure d’exposition provenant des aliments.
[13] Aucune donnée n’a été relevée sur la concentration d’acrylate d’éthyle dans le sol. Une modélisation a été effectuée à l’aide de la version 6.0 de ChemCan (2003) pour les 306 kg de rejets dans l’air signalés en application de l’article 71 au Québec (Environnement Canada, 2010a). La concentration modélisée estimée s’élevait à 8,05 × 10-5 µg/L. Ce résultat n’a pas eu d’incidence sur les estimations de la limite supérieure d’absorption journalière.
Annexe 2 : Limite supérieure estimée de l’exposition à l’acrylate d’éthyle à partir des produits de consommation[*]
| N° | Type de produit de consommation | Paramètres du modèle | Estimation de l’exposition |
|---|---|---|---|
| 1a | Peinture latex mate | Masse moléculaire : 100 g/mol Pression de vapeur : 28,5 mm Hg Koe : 1,18 10Log Fréquence d’exposition : 2x/an (RIVM, 2007) Poids d’un adulte : 70,9 kg (Santé Canada, 1998) Fraction de poids : 4,5 x 10-6 ou 4,5 ppm (Frederick, 1998) Durée d’exposition : 132 min (RIVM, 2006, 2007b) Volume de la pièce : 20 m3 (RIVM, 2006, 2007b) Taux de renouvellement de l’air : 0,6x/heure (RIVM, 2006, 2007b) Quantité appliquée : 3,75 x 103 g (RIVM, 2006, 2007b) Surface de rejet : 15 m2 (RIVM, 2006, 2007b) Durée d’application : 120 min (RIVM, 2006, 2007b) Matrice d’une masse moléculaire : 120 g/mol (RIVM, 2006, 2007b) Vitesse de transfert de masse : 0,282 m/min (RIVM, 2006, 2007b) Fraction absorbée : 100 %[1] Taux d’inhalation : 16,2 m3/jour (Santé Canada, 1998) Modèle d’inhalation : exposition à la vapeur par évaporation avec une surface de rejet augmentant avec le temps Le scénario décrit la peinture au pinceau ou au rouleau de deux murs d’une petite pièce peu aérée. Densité de la peinture murale à base d’eau : 1,5 g/cm3 |
Inhalation - concentration moyenne par événement : 0,225 mg/m3 |
Masse moléculaire : 100 g/mol Pression de vapeur : 28,5 mm Hg Koe : 01,18 10Log Poids d’un adulte : 70,9 kg (Santé Canada, 1998) Fraction de poids : 4,5 x 10-6 ou 4,5 ppm (Frederick, 1998) Surface exposée : 0,367 m2 (RIVM, 2006, 2007b, surface des mains et des bras donnée dans la fiche d’information générale) Taux de contact : 30 mg/min (RIVM, 2006, 2007b) Durée de rejet : 120 min (RIVM, 2006, 2007b) Absorption cutanée : 100 %[1] Modèle cutané : contact cutané direct avec le produit à un taux constant. |
Dose cutanée aiguë (interne) : 2,54 x 10-4 mg/kg Dose cutanée chronique (interne) : 1,39 x 10-6 mg/kg par jour |
||
| 1 b | Peinture semilustrée pour boiseries | Masse moléculaire : 100 g/mol Pression de vapeur : 28,5 mm Hg Koe : 1,18 10 Log Fréquence d’exposition : 2 x/an (RIVM, 2006, 2007b) Poids d’un adulte : 70,9 kg (Santé Canada, 1998) Fraction de poids : 1,3 x 10-5 ou 13,2 ppm (Frederick, 1998) Durée d’exposition : 66 min Volume de la pièce : 20 m3 (RIVM 2006, 2007b) Taux de renouvellement de l’air : 0,6 x /heure (RIVM, 2006, 2007b) Quantité appliquée : 450 g Surface de rejet : 1,82 m2 Durée d’application : 60 min Matrice d’une masse moléculaire : 120 g/mol (RIVM, 2006, 2007b) Vitesse de transfert de masse : 0,282 m/min (RIVM, 2006, 2007b) Fraction absorbée : 100 %[1] Taux d’inhalation : 16,2 m3/jour (Santé Canada, 1998) Modèle d’inhalation : exposition à la vapeur par évaporation avec une surface de rejet augmentant avec le temps Le scénario décrit la peinture au pinceau ou au rouleau de deux murs d’une petite pièce peu aérée. Densité de la peinture à l’eau : 1,5 g/cm3 |
Inhalation - concentration moyenne par événement : 0,108 mg/m3 |
Masse moléculaire : 100 g/mol Pression de vapeur : 28,5 mm Hg Koe : 1,18 10Log Poids d’un adulte : 70,9 kg (Santé Canada, 1998) Fraction de poids : 1,32 x 10-5 ou 13,2 ppm (Frederick, 1998) Surface exposée : 0,367 m2 (RIVM, 2006, 2007b, surface des mains et des bras donnée dans la fiche d’information générale) Taux de contact : 30 mg/min (RIVM, 2006, 2007b) Durée de rejet : 120 min (RIVM, 2006, 2007b) Absorption cutanée : 100 %[1] Modèle cutané : contact cutané direct avec le produit à un taux constant |
Dose cutanée aiguë (interne) : 6,6 x 10-4 mg/kg Dose cutanée chronique (interne) : 3,61 x 10-6 mg/kg par jour |
||
| 2 | Produit de calfeutrage | Masse moléculaire : 100 g/mol Pression de vapeur : 28,5 mm Hg Koe : 1,18 10 Log Fréquence d’exposition au produit de calfeutrage : 3x/an (RIVM, 2006, 2007) Poids d’un adulte : 70,9 kg (Santé Canada, 1998) Fraction de poids : 0,01 % (Household Products Database, 2009) Durée d’exposition : 45 min (RIVM, 2006, 2007a) Volume de la pièce : 10 m3 (RIVM, 2006, 2007a) Taux de renouvellement de l’air : 0,6x/heure (RIVM, 2006, 2007a) Quantité appliquée : 75 g (RIVM, 2006, 2007a) Surface de rejet : 250 cm2 (RIVM, 2006, 2007a) Durée d’application : 30 min (RIVM, 2006, 2007a) Matrice d’une masse moléculaire : 3 x 103 g/mol (RIVM 2006, 2007a) Vitesse de transfert de masse : 3,73 x 103 m/min (RIVM, 2006, 2007a) Fraction absorbée : 100 %[1] Taux d’inhalation : 16,2 m3/jour (Santé Canada, 1998) Modèle d’inhalation : exposition à la vapeur par évaporation avec une surface de rejet augmentant avec le temps |
Inhalation - concentration moyenne par événement : 0,427 mg/m3 |
Masse moléculaire : 100 g/mol Pression de vapeur : 28,5 mm Hg Koe : 0,7 10 Log Poids d’un adulte : 70,9 kg (Santé Canada, 1998) Fraction de poids : 0,01 % (Household Products Database, 2009) Surface exposée : 2 cm2 (RIVM, 2006, 2007a) Taux de contact : 50 mg/min Durée de rejet : 30 min Modèle cutané : contact cutané direct avec le produit à un taux constant |
Dose cutanée aiguë (interne) : 0,00212 mg/kg Dose cutanée chronique (interne) : 1,74 x 10-5 mg/kg par jour |
||
| 3a | Lingettes pour nourrissons | Masse moléculaire : 100 g/mol Pression de vapeur : 28,5 mm Hg Koe : 1,18 10 Log Fréquence d’exposition : 5x/jour Poids d’un nourrisson : 7,5 kg (Santé Canada, 1998) Fraction de poids : 2,8 x 10-5 ou 28 ppm (Environnement Canada, 2010b) Surface exposée : 199 cm2 (RIVM, 2006) Quantité appliquée : 0,02 g (RIVM, 2006) Fraction absorbée : 100 %[1] Modèle cutané : contact cutané direct avec le produit, application instantanée |
Dose cutanée aiguë (interne) : 7,47 x 10-5 mg/kg Dose cutanée chronique (interne) : 3,73 x 10-4 mg/kg par jour |
| 3 b | Lingettes pour adultes | Masse moléculaire : 100 g/mol Pression de vapeur : 28,5 mm Hg Koe : 1,18 10 Log Fréquence d’exposition : 365x/an (RIVM, 2006, 2007) Poids d’un adulte : 70,9 kg (Santé Canada, 1998) Fraction de poids : 2,8 x 10-5 ou 28 ppm (Environnement Canada, 2010b) Surface exposée : 215 cm2 (RIVM, 2006) Quantité appliquée : 0,02 g (RIVM, 2006) Fraction absorbée : 100 %[1] Modèle cutané : contact cutané direct avec le produit, application instantanée |
Dose cutanée aiguë (interne) : 7,9 x 10-6 mg/kg Dose cutanée chronique (interne) : 7,89 x 10-6 mg/kg par jour |
[1] La fraction absorbée de 100 % est supposée.
| Paramètre | Doses ou concentrations minimales avec effet[i] / Résultats | ||||
|---|---|---|---|---|---|
| Animaux de laboratoire et in vitro | |||||
| Toxicité aiguë | DL50 par voie orale (rat) = 550-2 000 mg/kg p.c. (Pozzani et al., 1949; BASF AG, 1958; Oettel et Hofmann, 1960; Union Carbide Corp., 1971, 1989; Paulet et Vidal, 1975; Rohm et Haas, 1984; Ghanayem et al., 1985). DL50 par voie orale (souris) = 1 300-1 800 mg/kg p.c. (Rohm et Haas, 1950a,b; Tanii et Hashimoto, 1982). DL50 par voie orale (lapin) = 280-370 mg/kg p.c. (Treon et al., 1949; Oettel et Hofmann, 1960). CL50 par inhalation (rat) = 1 414-2 180 ppm (5 790-8 930 mg/m3) (Pozzani et al., 1949; Lomonova et Klimova, 1979; Silver et Murphy, 1981; Oberly et Tansy, 1985; Union Carbide Corp., 1989). CL50 par inhalation (souris) = 3 950 ppm (16 200 mg/m3) (Lomonova et Klimova, 1979). CL50 par inhalation (lapin) = <1 204 ppm (4 930 mg/m3) (Treon et al., 1949). Toxicité aiguë par inhalation Plus faible CMENO par inhalation : 25 ppm (100 mg/m3) selon des lésions de l’épithélium olfactif chez les rats F344/N mâles (5 par groupe) dont le nez seulement avait été exposé à l’acrylate d’éthyle à une concentration de 0, 5, 25 ou 75 ppm (approximativement 0, 20, 100, 310 mg/m3 respectivement) pendant 1, 3 ou 6 heures. Aucun effet n’a été observé chez les animaux exposés à 5 ppm pendant au plus 6 heures, ni chez les animaux exposés pendant une heure à toutes les concentrations. Des lésions de l’épithélium olfactif (nécrose unilatérale des cellules sustentaculaires, dégénérescence des neurones olfactifs et desquamation) ont été observées aux concentrations de 25 et 75 ppm chez les animaux exposés pendant 3 et 6 heures; récupération presque complète après une période de récupération de 6 semaines (Frederick et al., 2002) Autre CMENO par inhalation : 75 ppm (310 mg/m3) selon des lésions olfactives chez les singes Cynomolgus (mâles et femelles répartis au hasard, 3 par groupe) dont seule la tête avait été exposée à une concentration d’acrylate d’éthyle de 0 ou 75 ppm (approximativement 0 et 310 mg/m3 respectivement) pendant 3 ou 6 heures. L’examen de la cavité nasale a révélé des lésions comprenant une dégénérescence focale, une nécrose et une exfoliation accompagnées d’une légère inflammation limitée à l’épithélium olfactif. Environ 15 % et 50 % de l’épithélium olfactif avaient subi des dommages après 3 et 6 heures d’exposition à l’acrylate d’éthyle respectivement (Rohm et Haas, 1994; Harkema et al., 1997). FR50 (souris) = 315 ppm (approximativement 1290 mg/m3) chez les souris Swiss (n=6) dont seule la tête avait été exposée à l’acrylate d’éthyle (De Ceaurriz et al., 1981). DL50 par voie cutanée (rat) = 470-5 000 mg/kg p.c. (Rohm et Haas, 1986a, 1986c, 1986d; Union Carbide Corp., 1971, 1989). DL50 par voie cutanée (souris) = 2 000-5 000 mg/kg p.c. (Rohm et Haas, 1986d, 10986e). DL50 par voie cutanée (lapin) = 126-1 950 mg/kg p.c. (Pozzani et al., 1949; Dow Chemical Co., 1957). |
||||
| Toxicité à court terme en doses répétées | Plus faible DMENO par voie orale : 20 mg/kg p.c. par jour selon une augmentation du poids de l’estomac liée à la dose, ainsi qu’une hyperplasie et une hyperkératose des cellules squameuses de l’estomac chez des rats Fischer 344 mâles (10 par groupe) ayant reçu de l’acrylate d’éthyle par gavage à des concentrations de 0, 20, 100 ou 200 mg/kg p.c. par jour, 5 jours par semaine pendant 28 jours. On a observé une augmentation du poids de l’estomac par rapport au groupe témoin pour toutes les doses. Un autre groupe ayant reçu 200 mg/kg p.c. par jour (10 rats) a complètement guéri après une période de récupération de 9 semaines (Rohm et Haas, 1987). Plus faible DMENO par voie orale : 20 mg/kg p.c. par jour selon une augmentation de l’hyperplasie et de l’hyperkératose épithéliale du préestomac liée à la dose chez des rats Fischer 344 mâles (10 par groupe) ayant reçu de l’acrylate d’éthyle par gavage à des concentrations de 0, 2, 10, 20, 50, 100 ou 200 mg/kg p.c. par jour, 5 jours par semaine pendant 5 ou 12 jours. On a observé une augmentation du poids absolu et relatif de l’estomac à la concentration de 20 mg/kg p.c. ou plus après une période de 5 jours et à la concentration de 50 mg/kg p.c. ou plus après une période de 12 jours. Une irritation du préestomac, incluant une gastrite, un œdème de la sous-muqueuse et la formation d’ulcères, d’érosion ou d’escarres, s’est manifestée aux doses de 50 mg/kg p.c. ou plus après une période de 5 jours et de 100 mg/kg p.c. ou plus après une période de 12 jours. L’hyperplasie et l’hyperkératose épithéliales se sont manifestées à une dose de 20 mg/kg p.c. ou plus après une période de 5 à 12 jours (Rohm et Haas, 1986b). Plus faible DMENO par voie orale : 20 mg/kg p.c. par jour selon une hyperkératose du préestomac chez des rats Fischer 344 mâles (10 par groupe) ayant reçu de l’acrylate d’éthyle (pureté >99 %) par gavage à des doses de 0, 2, 10, 20, 50, 100 ou 200 mg/kg p.c. par jour, 5 jours par semaine pendant 14 jours. Les modifications histopathologiques du préestomac comprenaient une hyperkératose à la dose de 20 mg/kg p.c. ou plus, une inflammation subaiguë à chronique de la sous-muqueuse à la dose de 100 mg/kg p.c. ou plus, une hyperplasie focale des cellules épithéliales, un œdème ainsi qu’une ulcération ou une érosion de la sous-muqueuse à la dose de 200 mg/kg p.c. Les modifications histopathologiques de l’estomac glandulaire incluaient une inflammation et un œdème de la sous-muqueuse à la concentration de 100 mg/kg p.c. ou plus (Frederick et al., 1990). Autre DMENO par voie orale : 1 000 ppm (99 mg/kg p.c. par jour) selon une irritation minimale et une hyperplasie épithéliale diffuse du préestomac chez des rats Fischer 344 mâles (10 par groupe) ayant reçu de l’acrylate d’éthyle (pureté > 99 %) par voie orale dans de l’eau potable à des concentrations de 0, 200,1 000, 2 000 ou 4 000 ppm (correspondant à 0, 23, 99, 197 et 369 mg/kg p.c. par jour respectivement), 5 jours par semaine pendant 14 jours. On a observé une hyperplasie épithéliale diffuse du préestomac à la concentration de 1 000 ppm ou plus. On a constaté une légère inflammation chronique de la sous-muqueuse et/ou une hémorragie focale épithéliale à la concentration de 2 000 ppm ou plus. L’auteur a noté que, pour empêcher l’acrylate d’éthyle de se dégrader dans l’eau, on a changé les bouteilles d’eau deux fois par semaine sans déceler de perte importante (supérieure à 1 %) du composé d’origine (Fredericket al., 1990). [Autres études : Treon et al., 1949; Ghanayem et al.,1986; NTP, 1986a) |
||||
Plus faible CMENO par inhalation : 70 ppm (290 mg/m3) selon une augmentation du poids relatif des reins chez des rats mâles lors du traitement de rats albinos Sherman (15/sexe/groupe) avec de l’acrylate d’éthyle à des concentrations de 0, 70 ou 300 ppm (approximativement 0, 290 et 1 200 mg/m3 respectivement), 7 heures par jour, 5 jours par semaine pendant 30 jours. À la concentration de 70 ppm, on a observé une augmentation du poids des reins des rats mâles, mais aucun autre effet ou aucune anomalie histopathologique. Dans le groupe exposé à la concentration de 300 ppm, on a constaté une augmentation importante du poids relatif des reins chez les deux sexes. Deux animaux ont succombé à une infection pulmonaire tant dans le groupe recevant 70 ppm que dans son groupe témoin. Au total, 18 animaux sur 30 exposés à 300 ppm sont morts durant l’exposition comparativement à aucun décès dans le groupe témoin. La plupart des décès révélaient un trouble « catarrhal et pulmonaire » alors que 10 animaux sur 18 présentaient des dommages aux poumons, aux reins et au foie. (Pozzani et al., 1949). Autre CMENO par inhalation : 300 ppm (1 200 mg/m3) d’après l’observation d’inflammation, de dégénérescence, de nécrose focale et de métaplasie malpighienne des cornets nasaux chez des rats F344 et des souris B6C3F1 mâles (10/sexe/groupe/espèce) exposés à l’acrylate d’éthyle à des concentrations de 0, 75, 150 ou 300 ppm (approximativement 0, 310, 610 et 1 200 mg/m3 respectivement), 6 heures par jour, 5 jours par semaine pendant 30 jours. Seuls les groupes recevant 0 et 300 ppm ont été soumis à un examen histopathologique. On a observé une diminution du gain de poids corporel chez les deux sexes et chez les deux espèces aux concentrations de 150 et 300 ppm. On a constaté une inflammation, une dégénérescence, une nécrose focale et une métaplasie malpighienne des cornets nasaux chez les mâles des deux espèces à la concentration de 300 ppm. L’alternance du poids relatif des reins et du foie n’a pas révélé de résultats histologiques correspondants selon ECETOC (1994) (Miller et al., 1979). [Autres études : Pozzani et al., 1949; Treon et al., 1949] Aucune étude concernant l’absorption cutanée n’a été recensée. |
|||||
| Toxicité subchronique | Plus faible DMENO par voie orale : 20 mg/kg p.c. par jour selon une augmentation du poids de l’estomac ainsi qu’une hyperplasie et une hyperkératose de l’épithélium squameux de l’estomac de rats Fischer 344 mâles (10 par groupe) ayant reçu de l’acrylate d’éthyle par gavage à raison de 0, 20, 100 ou 200 mg/kg p.c. par jour, 5 jours par semaine pendant 13 semaines. On a observé une augmentation du poids de l’estomac dans tous les groupes ayant reçu ces diverses doses comparativement aux groupes témoins. On a constaté une hyperplasie et une hyperkératose de l’épithélium squameux du préestomac pour les doses de 20 mg/kg p.c. ou plus. Une baisse du poids corporel a été observée à la dose de 200 mg/kg p.c. (Rohm et Haas, 1987). | ||||
Autre DMENO : 100 mg/kg p.c. par jour selon une grave hyperplasie épithéliale du préestomac chez des rats Fisher 344 mâles (25 par groupe) ayant reçu de l’acrylate d’éthyle (pureté de 99 %) par gavage à une concentration de 0, 100 ou 200 mg/kg p.c. par jour, 5 jours par semaine pendant 13 semaines. On a observé une grave hyperplasie épithéliale du préestomac aux concentrations de 100 mg/kg p.c. ou plus. On n’a pas constaté de lésions dans l’estomac glandulaire ou le foie. On a observé une diminution importante de l’incidence et une aggravation de l’hyperplasie de la muqueuse du préestomac après 8 semaines et 19 mois de récupération. Aucune augmentation de l’incidence des papillomes ou des carcinomes du préestomac n’a été observée (Ghanayem et al., 1991). [Autres études : NTP, 1986a] Plus faible CMENO par inhalation :100 mg/m3 (25 ppm) selon des lésions histopathologiques de la muqueuse nasale chez des rats Fischer 344 (510/sexe/groupe) exposés à l’acrylate d’éthyle (pureté non précisée) à une concentration de 0, 25, 75 ou 225 ppm (approximativement 0, 100, 310 et 920 mg/m3), 6 heures par jour, 5 jours par semaine pendant 6 mois. On a limité les examens histopathologiques à la muqueuse nasale pour les concentrations de 25 et 75 ppm, alors qu’on a examiné un vaste éventail de tissus chez les groupes témoins et les groupes exposés à 225 ppm. On a observé une très légère dégénérescence focale de la partie olfactive de la muqueuse nasale à 25 ppm, une dégénérescence et une inflammation légères de la muqueuse nasale à 75 ppm et des effets moyennement graves sur la muqueuse nasale, notamment une dégénérescence, une inflammation et une nécrose, à 225 ppm. Aucune lésion pathologique marquée n’a été observée dans un groupe exposé. Pour la concentration de 225 ppm, on a signalé une diminution des tissus adipeux chez les mâles et les femelles; l’auteur a noté que cette observation correspondait aux données sur le poids corporel, même si aucune de ces données n’était indiquée (Jersey et al., 1978). Plus faible CMENO par inhalation :100 mg/m3 (25 ppm) d’après des lésions histopathologiques de la muqueuse nasale chez des rats Fischer 344 (5/sexe/groupe) exposés à l’acrylate d’éthyle (pureté non précisée) à des concentrations de 0, 25 ou 75 ppm (approximativement 0, 100 et 310 mg/m3), 6 heures par jour, 5 jours par semaine pendant 12 mois. Aucune altération facilement visible liée au traitement n’a été observée. L’examen histopathologique a révélé des lésions de la région olfactive de la muqueuse nasale dans tous les groupes traités. Les lésions incluaient une dégénérescence focale de l’épithélium olfactif, une hyperplasie focale des cellules basales de l’épithélium olfactif et une inflammation de la muqueuse et de la sousmuqueuse dont la gravité allait de très légère à la concentration de 25 ppm à légère à modérée pour la concentration de 75 ppm (Dow Chemical, 1979a). [Autres études : Treon et al., 1949; Gabor et al., 1965; Dow Chemical, 1979a,b; Institute of Biological Research, 1983; Miller et al., 1985] Plus faible CMENO par voie cutanée : 2 000 mg/kg p.c. par jour selon une diminution du poids corporel observée chez des souris transgéniques Tg.AC (vHaras) femelles (10 par groupe) ayant reçu par voie cutanée de l’acrylate d’éthyle (pureté de 99 %) à raison de 0, 60, 300 ou 600 µmoles/dose (approximativement 0, 200, 1000 et 2000 mg/kg p.c. par dose respectivement), 3 fois par semaine pendant 20 semaines. Aucune induction de papillomes n’a été observée à l’endroit de l’application (Tennant et al., 1996; Nylander-French et French, 1998). Le NTP (1998) a souligné que l’utilisation de modèles transgéniques pour la détection d’effets cancérogènes en est au stade expérimental et que les résultats de ces études sont indicatifs, mais ne doivent pas être considérés comme des preuves concluantes. [Aucune autre étude n’a été recensée.] |
|||||
| Toxicité chronique/ cancérogénicité | Cancérogénicité par voie orale chez les rats Des rats Fischer 344 (50 par sexe par groupe) ont reçu de l’acrylate d’éthyle (pureté de 99 à 99,5 %) par gavage à raison de 0, 100 ou 200 mg/kg p.c. par jour, 5 jours par semaine pendant 103 semaines. On a noté une augmentation importante de l’incidence de papillomes et de carcinomes des cellules squameuses chez les mâles soumis aux concentrations de 100 et 200 mg/kg p.c., ainsi qu’une augmentation importante de l’incidence de papillomes des cellules squameuses chez les femelles soumises aux concentrations de 100 et 200 mg/kg p.c. Chez les mâles, l’incidence des papillomes des cellules squameuses était de 1/50, 15/50, 29/50; celle des carcinomes des cellules squameuses, de 0/50, 5/50, 12/50 et l’incidence des papillomes et des carcinomes des cellules squameuses, de 1/50, 18/50, 36/50 pour les concentrations de 0, 100, 200 mg/kg p.c. par jour respectivement. Chez les femelles, l’incidence des papillomes des cellules squameuses était de 1/50, 65/50, 9/50; celle des carcinomes des cellules squameuses, de 0/50, 0/50, 2/50 et l’incidence des papillomes et des carcinomes des cellules squameuses, de 1/50, 6/50, 11/50 pour les concentrations de 0, 100, 200 mg/kg p.c. par jour respectivement. La CMENO était de 100 mg/kg p.c. par jour selon une augmentation de l’hyperkératose, de l’hyperplasie et de l’inflammation du préestomac observée à la concentration de 100 mg/kg p.c. et plus. Aucun effet sur le poids corporel moyen, les signes cliniques et la survie n’a été observé (NTP, 1986a). Des rats Fischer 344 mâles âgés d’environ 3 mois (5 à 16/groupe) ont reçu de l’acrylate d’éthyle (pureté de 99 %) par gavage à raison de 0 ou 200 mg/kg p.c. par jour, 5 jours par semaine pendant 6 à 12 mois suivis de périodes de récupération pouvant atteindre 15 mois. Des tumeurs du préestomac se sont développées au bout de 2 à 9 mois de la période de récupération chez les rats traités pendant 12 mois. On a observé des papillomes des cellules squameuses (2/5) du préestomac après 2 mois de récupération, ainsi que des carcinomes (3/13) et des papillomes (1/13) des cellules squameuses du préestomac après 9 mois de récupération. Aucun néoplasme n’a été observé dans les groupes témoins, dans les groupes traités pendant 6 mois avec ou sans période de récupération, ni chez les animaux sacrifiés juste après 12 mois de traitement. Aucune lésion néoplasique facilement visible n’a été observée dans le foie ou les autres organes des groupes traités. La CMENO était de 200 mg/kg p.c. par jour selon une hyperplasie du préestomac. Chez les animaux traités pendant 6 mois, on a observé le développement d’hyperplasie du préestomac (5/5), puis une récupération après 2 mois (0/5) et 15 mois (1/18). Chez les animaux traités pendant 12 mois, on a constaté une hyperplasie du préestomac (5/5) qui a persisté après 2 mois (5/5) et 9 mois (10/13) de récupération (Ghanayemet al., 1993, 1994). Le CIRC (1999) a souligné que, dans l’étude de Ghanayem (1993), l’évaluation histopathologique se limitait à l’estomac. Des rats Wistar (25/sexe/groupe) ont reçu de l’acrylate d’éthyle (pureté non précisée) par voie orale dans de l’eau potable à des concentrations de 0, 6 à 7, 60 à70 ou 2000 ppm (approximativement 0, 0,84 à 0,98, 9,4 à 9,8 et 280 mg/kg p.c. respectivement) pendant 2 ans (nombre de jours par semaine non précisé). Aucun effet néoplasique n’a été observé. La DMEO a été de 2 000 ppm (280 mg/kg p.c. par jour) selon une diminution importante de la consommation de liquide chez les deux sexes, ainsi que du poids corporel et de la consommation de nourriture chez les femelles. On n’a pas noté de changements dans la mortalité, l’hématologie, la pathologie clinique ou l’histopathologie. Les bouteilles d’eau étaient changées deux fois par semaine et aucune perte importante d’acrylate d’éthyle n’a été observée dans l’eau soumise à des essais après 72 heures (Borzelleca et al., 1964). Cancérogénicité par voie orale chez les souris Des souris B6C3F1 (50/sexe/groupe) ont reçu de l’acrylate d’éthyle (pureté de 99 à 99,5 %) par gavage à raison de 0, 100 ou 200 mg/kg p.c. par jour, 5 jours par semaine pendant 103 semaines. On a noté une augmentation importante de l’incidence des carcinomes et des papillomes des cellules squameuses du préestomac à la concentration de 200 mg/kg p.c. Chez les mâles, l’incidence des papillomes des cellules squameuses a été de 0/48, 4/47, 9/50, tandis que l’incidence des carcinomes des cellules squameuses a été de 0/48, 2/47, 5/50 et celle des papillomes et des carcinomes des cellules squameuses, de 0/48, 5/47, 12,50 pour les concentrations de 0, 100, 200 mg/kg p.c. par jour respectivement. Chez les femelles, l’incidence des papillomes des cellules squameuses a été de 1/50, 4/49, 5/48, alors que l’incidence des carcinomes des cellules squameuses a été de 0/50, 1/49, 2/48, et celle des carcinomes et des papillomes des cellules squameuses, de 1/50, 5/49 et 7/48 pour les concentrations de 0, 100, 200 mg/kg p.c. par jour respectivement. La CMENO a été de 100 mg/kg p.c. par jour selon une augmentation de l’hyperkératose, de l’hyperplasie et de l’inflammation du préestomac observée à 100 mg/kg p.c. et plus. Aucun effet n’a été observé sur le poids corporel moyen, les signes cliniques et la survie (NTP, 1986a). Cancérogénicité par voie orale chez les chiens Des chiens Beagle (2/sexe/groupe) ont reçu par voie orale, dans des capsules de gélatine mêlées à de l’huile de maïs, de l’acrylate d’éthyle à des concentrations de 0, 10, 100 ou 1000 ppm (approximativement 0, 0,3, 3 et 30 mg/kg p.c. par jour respectivement) pendant 2 ans (nombre de jours par semaine non précisé). Une DSEO de 1000 ppm a été déterminée. Au départ, les animaux recevant 1000 ppm (30 mg/kg p.c. par jour) présentaient des vomissements si la dose était réduite à 300 ppm (9 mg/kg p.c. par jour), puis progressivement augmentée à 1000 ppm (30 mg/kg p.c. par jour) sur une période de 16 semaines. Aucun effet toxique systémique n’a été observé. La diminution du gain de poids corporel et de la consommation de nourriture à la concentration de 1 000 ppm (30 mg/kg p.c. par jour) comparativement au groupe témoin n’était pas statistiquement significative. Aucun changement de l’histopathologie, des valeurs hématologiques, des concentrations de protéines dans l’urine et des substances réductrices n’a été observé (Borzelleca et al., 1964). Cancérogénicité par inhalation chez les rats et les souris Des rats Fischer 344 (75/sexe/groupe exposé et 60/sexe/groupe témoin) et des souris B6C3F1 ont été exposés à de l’acrylate d’éthyle (pureté (> 99,5 %) à des concentrations de 0, 25 ou 75 ppm (approximativement 0, 100 et 310 mg/m3 respectivement), 6 heures par jour, 5 jours par semaine pendant 27 mois. Des sousgroupes d’animaux ont été sacrifiés après 3, 6, 12 et 18 mois d’exposition. Aucune lésion néoplasique liée au traitement n’a été observée. L’incidence d’adénomes folliculaires de la thyroïde chez les souris mâles à la concentration de 225 ppm (7/69) s’est révélée nettement plus élevée que dans les groupes témoins examinés dans la même étude (2/121), mais pas plus marquée que dans les groupes témoins étudiés antérieurement. La CMENO était de 25 ppm (100 mg/m3) selon des lésions non néoplasiques de la muqueuse olfactive (hyperplasie des cellules glandulaires et des cellules basales, augmentation des glandes intraépithéliales et métaplasie respiratoire). On a observé une diminution importante du gain moyen de poids corporel chez les deux sexes à la dose de 310 mg/m3. Aucun effet sur la survie, le poids des organes, l’hématologie, la chimie clinique et les analyses d’urine n’a été observé (Miller et al., 1985). Des rats Fischer 344 et des souris B6C3F1 (90/sexe/groupe exposé et 80/sexe/groupe témoin) ont été exposés à de l’acrylate d’éthyle (pureté > 99,5 %) à une concentration de 0 ou 5 ppm (approximativement 20 mg/m3), 6 heures par jour, 5 jours par semaine pendant 24 mois. Des sous-groupes d’animaux ont été sacrifiés après 6, 12 et 18 mois d’exposition. L’examen histopathologique s’est limité aux cornets nasaux et n’a pas montré d’effets liés au traitement. La CSEO était de 5 ppm (20 mg/m3) (Miller et al., 1985). Cancérogénicité par voie cutanée chez les souris Des souris C3H/HeJ mâles (40/groupe) se sont vu administrer par voie cutanée de l’acétone (groupe témoin) ou 25 µL d’acrylate d’éthyle (pureté de 99 %) par animal (approximativement 23 mg/application, 800 mg/kg p.c. par jour), 3 fois par semaine pendant toute leur vie. Au départ, les animaux étaient logés par groupes de cinq. Selon les auteurs, après 13 mois d’étude, l’augmentation de la mortalité précoce a obligé à loger individuellement les animaux faisant partie du groupe traité à l’acrylate d’éthyle afin de réduire la propagation de la maladie infectieuse qui a peut-être contribué à cette mortalité précoce. Aucune tumeur épidermique n’a été observée. La DMENO était de 800 mg/kg p.c. selon le développement de dermatite, de fibrose dermique, de nécrose épidermique et d’hyperkératose. On n’a pas observé d’effet statistiquement significatif sur la survie; la durée moyenne de survie des souris exposées à l’acrylate d’éthyle a été de 408 jours, tandis que le groupe témoin exposé à l’acétone a survécu 484 jours (DePass et al. 1984). Le CIRC (1986) a noté que l’étude ne mentionne pas de vérification de la perte éventuelle de composé d’origine par volatilisation ou par polymérisation. Aucune étude supplémentaire n’a été recensée. |
||||
| Toxicité pour la reproduction | Aucune étude n’a été recensée. | ||||
| Toxicité pour le développement | Plus faible DMENO par voie orale chez les rats : 25 mg/kg p.c. par jour selon un retard de l’ossification des fœtus lorsque des rats Wistar femelles (10 à 23/groupe) recevaient de l’acrylate d’éthyle (pureté non précisée dans CIRC, 1986) par gavage à des concentrations de 0, 25, 50, 100, 200 ou 400 mg/kg p.c. par jour pendant les jours de gestation 7 à 16. On a observé une réduction du poids corporel des mères à la concentration de 25 mg/kg p.c. ou plus. Le nombre total de résorptions a fortement augmenté à la concentration de 100 mg/kg p.c. ou plus, mais on n’a pas constaté d’effets sur le nombre de fœtus vivants par portée. Après avoir examiné 50 % des fœtus afin de déceler de possibles anomalies du squelette, on a constaté une augmentation de l’incidence globale des retards de l’ossification dans tous les groupes traités (Pietrowicz et al., 1980). Autre DSEO par voie orale chez les rats :400 mg/kg p.c. par jour chez des rats Wistar femelles (nombre non précisé dans l’étude de la Commission européenne, 2000) ayant reçu par voie orale de l’acrylate d’éthyle (pureté non précisée) à des concentrations de 44, 133 ou 400 mg/kg p.c. par jour pendant les jours de gestation 0 à 19. Aucune donnée précisée sur l’inclusion d’un groupe témoin. On a observé une augmentation légère, mais non statistiquement significative, du nombre de fœtus morts ou résorbés. On n’a pas relevé d’induction d’anomalies externes, ni d’anomalies du squelette et des viscères. On n’a pas noté de changements défavorables dans le développement postnatal des petits (Shimizu et al., 1994). Plus faible CMENO par inhalation chez les rats : 200 ppm (800 mg/m3) selon une diminution importante du poids du fœtus chez des rats Sprague-Dawley femelles (17 à 19/groupe) exposés à l’acrylate d’éthyle à raison de 0, 25, 50, 100 ou 200 ppm (approximativement 0, 100, 200, 400 et 800 mg/m3respectivement) 6 heures par jour pendant les jours de gestation 6 à 20. On a observé une importante diminution du gain de poids maternel et du gain de poids absolu à la concentration de 200 ppm. Aucune différence importante n’a été observée en ce qui concerne le nombre de sites d’implantation et les fœtus vivants, l’incidence des implants non vivants et des résorptions ou le ratio du sexe des fœtus. À la concentration de 200 ppm, le poids des fœtus avait diminué considérablement de 7 à 8 % par rapport à ceux du groupe témoin. Pour aucune dose, on n’a observé d’augmentation de la létalité des embryons ou des fœtus, ni de malformations fœtales liées au traitement. L’incidence des variations externes et des variations du squelette et des viscères ont été similaires à celle des groupes témoins (Saillenfait et al., 1999). Autre CSEO par inhalation chez les rats : 150 ppm (610 mg/m3) chez des rats Sprague-Dawley femelles (33/groupe) exposés à l’acrylate d’éthyle à des concentrations de 0, 50 ou 150 ppm (approximativement 0, 200, 610 mg/m3respectivement), 6 heures par jour, pendant les jours de gestation 6 à 15. On a observé une réduction du poids maternel et de la consommation de nourriture par les mères, ainsi qu’une augmentation de la consommation d’eau à la concentration de 150 ppm. Aucun effet sur la taille moyenne des portées, le corps jaune, les sites d’implantation, les fœtus vivants, l’incidence des résorptions, le ratio du sexe des fœtus, la longueur vertex-coccyx des fœtus n’a été observé. Les auteurs ont jugé que l’augmentation importante du poids moyen du fœtus à la concentration de 150 ppm n’était pas significative sur le plan de la toxicité. À cette concentration, 3/308 petits ont montré des malformations fœtales (queue hypoplasique, petit orifice anal) ou des variations du squelette (retard de l’ossification, côtes ou vertèbres manquantes, côtes fusionnées), mais ces incidences ne se sont pas révélées statistiquement significatives comparativement aux groupes témoins actuellement à l’étude ou étudiés antérieurement. Aucun effet défavorable sur le poids ou la survie des fœtus n’a été observé (Murray et al., 1981). Aucune étude sur l’absorption cutanée n’a été recensée. |
||||
| Génotoxicité et paramètres connexes in vivo | Aberrations chromosomiques Résultats négatifs : Souris C57BL/6 mâles (5/groupe) ayant reçu de l’acrylate d’éthyle par voie intrapéritonéale à des concentrations de 0, 125, 250, 500 ou 1 000 mg/kg p.c. (aiguë) (Kligerman et al., 1991). Mutation létale récessive liée au sexe Résultats négatifs : Drosophilia melanogaster, administration par voie orale d’a plus 40 000 ppm d’acrylate d’éthyle (pureté de 99,7 % ) dans une solution de saccharose aqueuse à 5 % (Valencia et al., 1985). Résultats négatifs : Drosophilia melanogaster, administration d’au plus 20 000 ppm d’acrylate d’éthyle (pureté de 99,7 %) par injection dans une solution aqueuse de NaCl à 0,7 % (Valencia et al., 1985). Liaison à l’ADN Résultats négatifs : Rats Fischer 344 mâles (3/groupe) ayant reçu par gavage de l’acrylate d’éthyle 2,3-[14C] (pureté de 90 à 92 %) à des concentrations de 0, 100, 200 ou 400 mg/kg p.c. (Ghanayemet al,. 1987). Le CIRC (1999) a noté que la méthode utilisée pour déterminer la liaison à l’ADN était inadéquate. Induction de micronoyaux Résultats négatifs : Souris C57B16J (5 à 10/sexe/groupe) ayant reçu de l’acrylate d’éthyle par voie intrapéritonéale (pureté de 98,5 %) à des concentrations de 0, 461 ou de 738 mg/kg p.c. (aiguë) et de 0 ou 738 mg/kg p.c. par jour (2 jours consécutifs) (Ashby et al., 1989). Résultats négatifs : Souris BDF1 mâles (6 à 9/groupe) ayant reçu de l’acrylate d’éthyle par voie intrapéritonéale (pureté de 99 %) à des concentrations de 0, 375, 500, 750, 1 000 ou 1 500 mg/kg p.c. (aiguë). Tous les animaux ayant reçu des concentrations de 1 000 et 1 500 mg/kg p.c. et un animal ayant reçu 750 mg/kg p.c. sont morts (Hara et al., 1994). Résultats négatifs : Souris C57BL/6 mâles (5/groupe) ayant reçu de l’acrylate d’éthyle par voie intrapéritonéale (pureté de 99 %) à des concentrations de 0, 125, 250, 500 ou 1 000 mg/kg p.c. (aiguë) (Kligermanet al.; 1991). Résultats négatifs : Souris BDF1 mâles (6/groupe) ayant reçu de l’acrylate d’éthyle par voie intrapéritonéale (pureté de 99 %) à des concentrations de 0, 375, 500, 750 ou 1 000 mg/kg p.c. (aiguë) (Morita et al,. 1997). Résultats négatifs : Souris BDF1 mâles (6/groupe) ayant reçu de l’acrylate d’éthyle (pureté (> 99 % ) par voie orale à des concentrations de 0, 188, 375 ou 750 mg/kg p.c. par jour au stade aigu et pendant deux jours consécutifs (Hara et al., 1994). Résultats négatifs : Souris BDF1 mâles (6/groupe) ayant reçu de l’acrylate d’éthyle par voie orale à des concentrations de 0, 188, 375, 750 ou 1 000 mg/kg p.c. (aiguë) (Morita et al., 1997). Résultats négatifs : Souris Tg.AC mâles (7 à 9/groupe) ayant reçu de l’acrylate d’éthyle (pureté (99 %) par voie cutanée à des concentrations de 0, 200, 1 000 ou 2 000 mg/kg p.c. par jour, 3 fois par semaine pendant 20 semaines (Tice et al. 1997). Le NTP (1998) a souligné que l’utilisation de modèles transgéniques pour l’identification des effets cancérogènes en est au stade expérimental et que, même si les résultats de ces études sont indicatifs, ils ne doivent pas être considérés comme des preuves concluantes. Résultats positifs : Souris Balb/c mâles (4/groupe) ayant reçu de l’acrylate d’éthyle par voie intrapéritonéale pendant deux jours consécutifs à des concentrations de 0, 112,5, 225, 450, 900 ou 1 800 mg/kg p.c. par jour. Deux animaux ayant reçu des doses de 1 800 mg/kg p.c. sont morts (Przybojewska et al,. 1984; Basler et van der Hude, 1987). Résultats incertains ou variables : Souris C7B16J (5 à 10/sexe/groupe) ayant reçu de l’acrylate d’éthyle par voie intrapéritonéale pendant deux jours consécutifs à des concentrations de 0 ou 812 mg/kg p.c. par jour. Des expériences identiques répétées deux fois ont donné des résultats contradictoires (Ashby, 1989). Échange de chromatides sœurs Résultats négatifs : Souris C57BL/6 (5/groupe) ayant reçu de l’acrylate d’éthyle par voie intrapéritonéale à des concentrations de 0, 125, 250, 500 ou 1 000 mg/kg p.c. (aiguë) (Kligerman et al., 1991). |
||||
| Paramètre | Mutagénicité | |||
|---|---|---|---|---|
| Essai, espèce, souche | Résultats | Activation métabolique | Références | |
| Animaux de laboratoire etin vitro | ||||
| Génotoxicité et paramètres connexes in vitro | Essai sur des lymphomes de souris; cellules L51784TK+/- | Positifs | +/- | Darfield et al., 1991 |
| Positifs | - | Myhr, 1980; McGregor et al., 1988; Moore et al., 1988 | ||
| Essai HGPRT, cellules d’ovaire de hamster chinois (OHC) | Négatifs | - | Moore et al., 1989 | |
| Test d’Ames, Salmonella typhimurium TA98 | Négatifs | +/- | Rohm et Hass, 1977, 1981; Ishidate et al,. 1981; Haworth et al., 1983; Waegemaekers et Bensink, 1984; NTP, 1986a | |
| Négatifs | - | Brusick, 1977; ECETOC, 1994 | ||
| Négatifs | + | Zeiger et al., 1992 | ||
| Test d’Ames, Salmonella typhimurium TA100 | Négatifs | +/- | Rohm et Hass, 1977, 1981; Ishidate et al., 1981; Haworth et al., 1983; Waegermaekers et Bensink, 1984; NTP, 1986a | |
| Négatifs | - | Brunsick, 1977; ECETOC, 1994 | ||
| Négatifs | + | Zeiger et al,. 1992 | ||
| Test d’Ames, Salmonella typhimurium TA1535 | Négatifs | +/- | Rohm et Hass, 1977, 1981; Haworth et al., 1983; Waegemaekers et Bensink, 1984; NTP, 1986a | |
| Négatifs | - | Brusick, 1977; ECETOC, 1994 | ||
| Négatifs | + | Zeiger et al,. 1992 | ||
| Test d’Ames, Salmonella typhimurium TA1537 | Négatifs | +/- | Rohm et Hass, 1977, 1981; Ishidate et al., 1981; Haworth et al., 1983; Waegemaekers et Bensink, 1984; NTP, 1986a | |
| Négatifs | - | Brusick 1977; ECETOC 1994 | ||
| Test d’Ames, Salmonella typhimurium TA1538 | Négatifs | +/- | Rohm et Hass, 1977; Waegemaekers et Bensink, 1984 | |
| Négatifs | - | Brusick, 1977 | ||
| Test d’Ames, Salmonella typhimuriumYG7108pin3ERb5 | Négatifs | - | Emmert et al., 2006 | |
| Test umu, Salmonella typhimurium TA1535/pSK1002 | Négatifs | +/- | Yasunaga et al., 2004 | |
| Test cytogénétique sur levure, Saccharomyces cerevisiae D61.M | Positifs | _ | Zimmermann et Mohr, 1992 | |
| Test cytogénétique sur levure, Saccharomyces cerevisiae, souche D4 | Négatifs | +/- | Rohm et Haas, 1983 | |
| Paramètre | Doses ou concentrations minimales avec effet[i]/Résultats | ||||
|---|---|---|---|---|---|
| Animaux de laboratoire et in vitro | |||||
| Génotoxicité et paramètres connexesin vitro | Aberrations chromosomiques Résultats positifs : Cellules d’ovaire de hamster chinois (CHO) avec et sans activation métabolique S9 (NTP, 1986b). Résultats positifs : Cellules CHO avec activation métabolique S9 (Loveday et al., 1990). Résultats positifs : Cellules de lymphome de souris L5178Y/TK+/- sans activation métabolique S9 (Moore et al., 1988). Résultats positifs : Cellules de poumon de hamster chinois (CHL-Zellen) avec et sans activation métabolique S9 (Ishidate et al., 1981). Résultats positifs : Splénocytes isolés de souris sans S9 à la phase G1-S (Kligerman et al., 1991). Résultats négatifs : Cellules CHO sans activation métabolique S9 (Loveday et al., 1990). Résultats négatifs : Splénocytes isolés de souris traitées sans S9 à la phase G0 (Kligermanet al., 1991). Échange de chromatides sœurs Résultats positifs : Cellules CHO avec activation métabolique S9 (Loveday et al., 1990). Résultats positifs : Cellules CHO sans activation métabolique S9 (NTP, 1986b). Résultats négatifs : Cellules CHO sans activation métabolique S9 (Loveday et al., 1990). Résultats négatifs : Splénocytes isolés de souris sans S9 aux phases G0 et G1-S (Kligerman et al., 1991). Alkylation de l’ADN Résultats négatifs : Incubation de l’acrylate d’éthyle avec les désoxyribonucléosides pendant une période pouvant aller jusqu’à 24 heures à un pH de 6,7 ou 7,4 à 37 °C ou pendant une période pouvant aller jusqu’à 8 heures à 50 °C (McCarthy et al., 1994). Essai de transformation cellulaire Résultats positifs : Cellules A-31-1-13 BALB/c-3T3 (Matthews et al., 1993). Résultats positifs : Cellules épithéliales trachéales de rats Fischer 344 (Steele et al., 1989). Le BUA (1992) a souligné que la méthode n’est pas valide. |
||||
| Sensibilisation | Résultats positifs : Test d’adjuvant complet de Freund chez les cobayes et sensibilisation croisée aux provocations par plusieurs autres acrylates (Van der Walle et al., 1982). Résultats négatifs : Test de maximisation chez des cobayes (Van der Walle et al., 1982). Résultats négatifs : Test d’enflure des oreilles de souris afin de déceler l’hypersensibilité de contact (NTP, 1994; Hayes et Meade, 1999). Résultats négatifs : Essai des ganglions lymphatiques locaux murins (Kimber, 1992; NTP, 1994; Hayes et Meade, 1999). |
||||
| Irritation | Irritation cutanée Inflammation cutanée, érythème et œdème modérés à graves lors d’essais sur des lapins (Pozzani et al., 1994; Treon et al., 1949; Oettel et Zeller, 1958; BASF AG, 1978; Poole, 1980; Potokar et al., 1985; Rohm et Haas, 1991; BASF, 2005). Substance déclaré irritante chez les lapins, mais gravité non précisée (Celanese Chem Co., 1972; Lomonova et Klimova, 1979; Union Carbide Corp, 1989; BAMM 1994). Substance déclarée non irritante; aucune irritation constatée chez les lapins (pas d’information supplémentaire) (Union Carbide Corp, 1989). Léger érythème transitoire dans des conditions non occlusives; érythème et œdème graves dans des conditions occlusives chez les rats (Rohm et Haas, 1986a, 1986c). Aucune irritation dans des conditions non occlusives; érythème grave et œdème modéré dans des conditions occlusives chez les souris (Rohm et Haas, 1986d). |
||||
Irritation oculaire Rougeur et inflammation de la conjonctive et obscurcissement de la cornée lors d’essais sur des lapins (Pozzani et al., 1949; BASF AG, 1958; Oettel et Zeller, 1958; Poole, 1980). Irritant chez les cobayes; pas d’information supplémentaire (Haskell Laboratories, 1945). |
|||||
| Humains | |||||
| Études de sensibilisation | Vingt-quatre volontaires (aucun renseignement complémentaire précisé dans Opdyke, 1975) ont été traités pendant 48 heures au moyen d’acrylate d’éthyle à 4 % mêlé à de la gelée de pétrole dans le cadre d’un test de maximisation. On a constaté une sensibilisation chez dix volontaires. Aucune irritation n’a été observée (Epstein, 1974). Cinq hommes qui avaient réagi antérieurement à l’acrylate de bis (2-éthylhexyl) (2EHA) ou à l’acideN-tert-butyl maléamique ont été soumis pendant 48 heures à des tests épicutanés recouverts faisant intervenir de l’acrylate d’éthyle à 5 % mêlé à de l’huile d’olive. On a constaté de l’irritation chez une personne. Trois personnes ont fait preuve de sensibilisation croisée à l’acrylate d’éthyle (Jordan, 1975). Cent vingt-quatre personnes ayant des antécédents de dermatite en présence d’acrylate d’éthyle (aucun renseignement complémentaire) ont été soumises pendant 24 ou 48 heures à des tests épicutanés recouverts faisant intervenir 0,1 à 0,5 % d’acrylate d’éthyle mêlé à de la gelée de pétrole; 9 patients sur 124 ont démontré une sensibilisation (Kanervaet al., 1995). Cinquante-cinq techniciens dentaires (aucun renseignement supplémentaire) présentant une dermatite professionnelle présumée ont été soumis pendant 24 heures à des tests épicutanés faisant intervenir 0,1 % d’acrylate d’éthyle mêlé à de la gelée de pétrole; 3/55 ont démontré une sensibilisation (Rustemeyer et Frosch, 1996). Vingt-trois patients présentant une dermatite de contact d’origine allergique aux acrylates (17 femmes et 6 hommes de 30 à 69 ans) ont été soumis à des tests épicutanés faisant intervenir 0,1 % d’acrylate d’éthyle; 72 % des patients ont démontré une sensibilisation à l’acrylate d’éthyle. Dix patients allergiques aux ongles artificiels sur 11 ont été sensibilisés à l’acrylate d’éthyle (Koppula et al., 1995). [Autres études : Foulger et Fleming, 1945; Fregert, 1978; Bjorkner et Dahlquist, 1979; Malten et al., 1984; Conde-Salazar et al.,1988; Kanerva et al., 1988, 1989, 1992; Stenman et Bergman, 1989; Skoglund et Egelrud, 1991; Marks et al., 1995; Tucker et Beck, 1999; Aalto-Korteet al., 2007; Lazarov, 2007] |
||||
| Études épidémiologiques | |||||
| Études de cas | Un homme exposé accidentellement à l’acrylate d’éthyle a subi une grave irritation des yeux. Aucune précision n’était disponible (Dow Chemical, 1964). Une femme enceinte exposée à des polymères SK-131-A (polymères issus de l’acrylate d’éthyle, de l’acrylonitrile et de l’acide 2-méthylidènebutanedioïque) et SK131-B (polymères provenant de l’acrylate d’éthyle, du méthylolacrylamide et de l’acide 2-méthylidènebutanedioïque) a eu un enfant chez qui on a diagnostiqué des anomalies congénitales. Aucune autre précision n’était disponible (Sherman, 1985). |
||||
| Études de cohorte | Dans une première étude de cohorte menée à Bristol de 1933 à 1945, 3924 hommes employés dans une usine de fabrication de feuilles d’acrylique de Bristol (Pennsylvanie) ont été exposés à de l’acrylate d’éthyle, à du méthacrylate de méthyle, à du plomb, à du dichlorure d’éthylène, à du chlorure de méthylène et à de l’acrylonitrile. Les concentrations auxquelles ils avaient été exposés n’ont pas été mesurées et on a fondé les données concernant l’exposition sur un énoncé des tâches reconstruit à partir de relevés de production et d’entrevues avec le personnel de l’usine. Vingt ans après l’équivalent de trois ans passés à des emplois nécessitant l’exposition la plus élevée à l’acrylate d’éthyle ou au méthacrylate de méthyle, on a observé chez les travailleurs exposés à l’acrylate d’éthyle ou au méthacrylate de méthyle une surmortalité due au cancer du côlon (14 cas observés contre 7,53 cas prévus) comparativement aux taux locaux. Vingt ans après l’équivalent de trois ans d’emploi, on a observé chez les travailleurs exposés une surmortalité due au cancer du rectum (10 cas observés contre 5,23 cas prévus) par rapport aux taux locaux (Walker et al., 1991). Dans une étude de cohorte ultérieure menée à Bristol de 1946 à 1986, 6 548 hommes employés dans une usine de fabrication de feuilles d’acrylique de Bristol (Pennsylvanie) ont été exposés à de l’acrylate d’éthyle, à du méthacrylate de méthyle, à du plomb, à du dichlorure d’éthylène, à du chlorure de méthylène et à de l’acrylonitrile. Pour le méthacrylate de méthyle et l’acrylate d’éthyle, les niveaux d’exposition, semi-quantitatifs, ont été répartis selon une échelle d’exposition ordinale à quatre niveaux (niveau 1 = pas d’exposition régulière, niveau 2 = 1-5 ppm, niveau 3 = 5-24 ppm, niveau 4 = > 25 ppm). L’étude ne distinguait pas les niveaux d’exposition pour le méthacrylate de méthyle et l’acrylate d’éthyle. Les données sur l’exposition ont été surveillées à partir de 1972 et les données antérieures concernant l’exposition ont été reconstruites à partir de relevés de production et d’entrevues avec le personnel de l’usine. On n’a pas observé de surmortalité provenant d’une cause quelconque (Walker et al., 1991). Dans une étude de cohorte menée à Knoxville de 1943 à 1982, 3 381 hommes employés dans une usine de fabrication de feuilles d’acrylique de Knoxville (Tennessee) ont été exposés à de l’acrylate d’éthyle, à du méthacrylate de méthyle, à du plomb, à du dichlorure d’éthylène, à du chlorure de méthylène et à de l’acrylonitrile. Pour la vapeur de méthacrylate de méthyle et d’acrylate d’éthyle, les niveaux d’exposition, semi-quantitatifs, ont été répartis selon une échelle d’exposition à quatre niveaux fondée sur les tâches professionnelles. L’étude ne distinguait pas les niveaux d’exposition au méthacrylate de méthyle et à l’acrylate d’éthyle. Les données sur l’exposition ont été surveillées à partir de 1972 et les données antérieures ont été reconstruites à partir de relevés de production et d’entrevues avec le personnel de l’usine. On n’a pas observé de surmortalité provenant d’une cause quelconque (Walker et al., 1991). Des travailleurs employés pendant 5 ans en moyenne (20 femmes et 13 hommes) ont été exposés aux concentrations suivantes : 4-58 mg/m3 (1-14 ppm) d’acrylate d’éthyle, jusqu’à 50 mg/m3 (9,4 ppm) d’acrylate de n-butyle et 0,11-2 mg/m3(0,05-0,9 ppm) d’acrylonitrile. Des troubles de la fonction neuro-autonome ou des troubles névrotiques du système nerveux central ont été diagnostiqués chez 14 personnes sur 33; un examen électroencéphalographique n’a pas montré de dysfonction organique (Kuzelova et al., 1981). Des travailleurs d’une usine de produits chimiques fabriquant des acrylates et des méthacrylates (618 hommes, 113 femmes de 17 à 69 ans, la moyenne d’âge étant de 42,9 ans) ont été exposés à un mélange d’acrylate d’éthyle et de butyle, d’acide acrylique et de méthacrylate de méthyle. La concentration de l’acrylate d’éthyle et de l’acide acrylique variait de 0,01 à 56 ppm. On a observé une réduction de la fonction olfactive, mais l’association ne s’est pas révélée statistiquement significative (Schwartz et al., 1989). |
||||
| N° | Méthode normalisée (OCDE, UE, nationale ou autre)? | Pondération | Oui/non | Précisions |
|---|---|---|---|---|
| 1 | Référence : OCDE. 2005. Acrylate d’éthyle. No CAS 140-88-5. Dossier SIDS. Genève (Suisse) : Programme des Nations Unies pour l’environnement. | |||
| 2 | Identité de la substance : n° CAS | n.d. | Oui | |
| 3 | Identité de la substance : nom(s) chimique(s) | n.d. | Oui | |
| 4 | Composition chimique de la substance | 2 | Oui | |
| 5 | Pureté chimique | 1 | Oui | |
| 6 | Indication de la persistance/stabilité de la substance en milieu aqueux? | 1 | Non | |
| Méthode | ||||
| 7 | Référence | 1 | Oui | |
| 8 | Méthode normalisée (OCDE, UE, nationale ou autre)? | 3 | Oui | |
| 9 | Justification de la méthode ou du protocole si une méthode normalisée n’a pas été employée | 2 | Oui | |
| 10 | Bonne pratique de laboratoire (BPL) | 3 | Oui | |
| Organisme d’essai | ||||
| 11 | Identité de l’organisme : nom | n.d. | Oui | |
| 12 | Indication du nom latin ou des deux noms (latin et commun)? | 1 | Oui | |
| 13 | Âge ou stade biologique de l’organisme d’essai | 1 | Non | |
| 14 | Longueur et/ou poids | 1 | Non | |
| 15 | Sexe | 1 | Non | |
| 16 | Nombre d’organismes par répétition | 1 | ||
| 17 | Charge en organismes | 1 | Non | |
| 18 | Type de nourriture et périodes d’alimentation pendant la période d’acclimatation | 1 | Oui | |
| Conception et conditions des essais | ||||
| 19 | Type d’essai (toxicité aiguë ou chronique) | n.d. | Oui | Chronique |
| 20 | Type d’expérience (en laboratoire ou sur le terrain) | n.d. | Oui | Laboratoire |
| 21 | Voies d’exposition (nourriture, eau, les deux) | n.d. | ||
| 22 | Durée de l’exposition | n.d. | Oui | 21 jours |
| 23 | Témoins négatifs ou positifs (préciser) | 1 | Oui | |
| 24 | Nombre de répétitions (y compris les témoins) | 1 | Oui | Cinq |
| 25 | Des concentrations nominales sont-elles indiquées? | 1 | Oui | Cinq |
| 26 | Des concentrations mesurées sont-elles indiquées? | 3 | Oui | |
| 27 | Type de nourriture et périodes d’alimentation durant les essais à long terme | 1 | Oui | |
| 28 | Les concentrations ont-elles été mesurées périodiquement (spécialement dans les essais de toxicité chronique)? | 1 | Oui | Cinq |
| 29 | Les conditions du milieu d’exposition pertinentes pour cette substance sont-elles indiquées? (p. ex., pour la toxicité des métaux – pH, COD/COT, dureté de l’eau, température) | 3 | Oui | |
| 30 | Photopériode et intensité de l’éclairage | 1 | Non | |
| 31 | Préparation de solutions mères et de solutions d’essai | 1 | Non | |
| 32 | Emploi d’un agent émulsionnant ou solubilisant si la substance était peu soluble ou instable? | 1 | Non | |
| 33 | Si un agent émulsionnant ou solubilisant a été employé, sa concentration est-elle indiquée? | 1 | Non | |
| 34 | Si un agent émulsionnant ou solubilisant a été utilisé, son écotoxicité est-elle signalée? | 1 | Non | |
| 35 | Les intervalles des contrôles (y compris les observations et les paramètres de la qualité de l’eau) sont-ils indiqués? | 1 | Oui | |
| 36 | Méthodes statistiques utilisées | 1 | Non | |
| Renseignements d’intérêt pour la qualité des données | ||||
| 37 | Le paramètre déterminé est-il directement attribuable à la toxicité de la substance, non à l’état de santé des organismes (p. ex., lorsque la mortalité des témoins est supérieure à 10 %) ou à des facteurs physiques (p. ex., « effet d’ombrage »)? | n.d. | Oui | |
| 38 | L’organisme d’essai correspondait-il à l’environnement au Canada? | 3 | Oui | |
| 39 | Les conditions d’essai (pH, température, OD, etc.) sont-elles typiques pour l’organisme d’essai? | 1 | Oui | |
| 40 | Le type et la conception du système (statique, semi-statique, dynamique, ouvert ou fermé, etc.) correspondent-ils aux propriétés de la substance et à la nature ou aux habitudes de l’organisme? | 2 | Oui | |
| 41 | Le pH de l’eau était-il dans la plage des valeurs typiques de l’environnement au Canada (de 6 à 9)? | 1 | Oui | |
| 42 | La température de l’eau d’essai était-elle dans la plage des valeurs typiques de l’environnement au Canada (5 à 27 ºC)? | 1 | Oui | |
| 43 | La valeur de la toxicité était-elle inférieure à celle de la solubilité de la substance dans l’eau? | 3 | Oui | |
| Résultats | ||||
| 44 | Valeurs de la toxicité (indiquer paramètres et valeurs) | n.d. | n/a | |
| 45 | Autres paramètres indiqués – p. ex., FBC/FBA, CMEO/CSEO (préciser)? | n.d. | Oui | CMEO/CSEO/CMAT/CE50 |
| 46 | Autres effets nocifs indiqués (p. ex., cancérogénicité, mutagénicité)? | n.d. | Non | |
| 47 | Note : ... % | 77,1 | ||
| 48 | Code de fiabilité d’Environnement Canada : | 2 | ||
| 49 | Catégorie de fiabilité (élevée, satisfaisante, faible) : | Confiance satisfaisante | ||
| 50 | Commentaires | |||
Notes de bas de page
[2] La détermination de la conformité à l’un ou plusieurs des critères énoncés à l’article 64 repose sur l’évaluation des risques pour l’environnement ou la santé humaine associés aux expositions dans l’environnement en général. Pour les humains, ceci inclut, sans toutefois s’y limiter, les expositions à l’acrylate d’éthyle par l’air ambiant et intérieur, l’eau potable, les produits alimentaires et l’utilisation de produits de consommation. Une conclusion établie en vertu de la LCPE (1999) sur les substances des lots 1 à 12 du Défi, énumérées dans le Plan de gestion des produits chimiques, n’est pas pertinente, ni n’empêche une évaluation en fonction des critères de danger définis dans leRèglement sur les produits contrôlés qui fait partie du cadre réglementaire applicable au Système d’information sur les matières dangereuses utilisées au travail pour les produits destinés à être utilisés au travail.
[3] Déclaration volontaire produite par la Basic Acrylic Monomer Manufacturers Association (BAMM)
[4] Déclaration volotaire produite par Rohm and Haas Canada.