Évaluation préalable pour le Défi concernant le Benzène, 1-chloro-2-[2,2-dichloro-1-(4-chlorophényl)éthyl]- (Mitotane) Numéro d'enregistrement du Chemical Abstracts Service 53-19-0
Table des matières
- Sommaire
- 1. Introduction
- 2. Identité de la substance
- 3. Propriétés physiques et chimiques
- 4. Sources
- 5. Utilisations
- 6. Rejets dans l'environnement
- 7. Devenir dans l'environnement
- 8. Potentiel d'effets nocifs sur l'environnement
- 9. Potentiel d'effets nocifs sur la santé humaine
- 10. Conclusion
- Références
- Annexes
- Annex A
- Annex B
- Annex C
Liste des tableaux et figures
- Tableau 2-1. Identité de la substance – mitotane
- Figure 3-1. Structure du p,p'-DDD
- Tableau 3-1. Propriétés physiques et chimiques du mitotane
- Tableau 4-1. Composants des formulations commerciales du DDT et leurs produits de dégradation
- Tableau 7-1. Résultats de la modélisation de la fugacité de niveau III (EQC 2003)
- Tableau 7-2. Données empiriques sur la dégradation du mitotane
- Tableau 7-3. Données de la modélisation de la dégradation du mitotane
- Tableau 7-4. Données empiriques sur le FBA et le FBC d'un analogue du mitotane (p,p'-DDD)
- Tableau 7-5. Autres données empiriques sur la bioaccumulation du mitotane et du p,p'-DDD
- Tableau 7-6. Données modélisées sur la bioaccumulation du mitotane (log Koe =5,9)
- Tableau 8-1. Données empiriques sur la toxicité du mitotane pour les organismes aquatiques
- Tableau 8-2. Données modélisées de la toxicité du mitotane
- Tableau 8-3. Données empiriques sur la toxicité du p,p'-DDD, un analogue du mitotane, pour les organismes aquatiques.
- Tableau 8-4. Données empiriques sur la toxicité sédimentairede l'analogue DDD du mitotane
- Tableau 8-5. Données empiriques sur la toxicité du mitotane et de son analogue DDD pour les organismes terrestres
- Tableau 8-6. Concentrations de mitotane dans l'air
- Tableau 8-7. Concentrations de mitotane dans le sol
- Tableau 8-8. Concentrations de mitotane dans les eaux de surface
- Tableau 8-9. Concentrations de mitotane dans les précipitations
- Tableau 8-10. Concentrations de mitotane dans les sédiments
- Tableau 8-11. Concentrations du mitotane dans le biote
Sommaire
En vertu de l'article 74 de la Loi canadienne sur la protection de l'environnement (1999) [LCPE], la ministre de l'Environnement et celle de la Santé ont procédé à l'évaluation préalable du benzène, 1-chloro-2-[2,2-dichloro-1-(4-chlorophényl)éthyl]- appelé mitotane dans le présent texte. Le numéro d'enregistrement du Chemical Abstracts ServiceNote de bas de page1 (NE CAS) est le 53-19-0. Une priorité a été accordée à l'évaluation préalable de cette substance puisqu'elle satisfait aux critères énoncés au paragraphe 73(1) de la LCPE.
Le mitotane peut être formé par la dégradation du dichlorodiphényltrichloro–éthane (DDT) et peut exister comme résidu du DDT et du dicofol, deux ingrédients actifs, trouvés auparavant dans des pesticides dont l'usage n'est plus homologué au Canada. On trouve encore du DDT et du dicofol dans le sol et les sédiments. Au Canada, le mitotane est aussi homologué comme agent chimiothérapeutique pour traiter le cancer des glandes surrénales. Cette substance n'existe pas naturellement au Canada, pas plus qu'elle n'y est fabriquée. En 2005, entre 100 et 1 000 kg de mitotane ont été importés. En 2006, on n'en a pas importé de quantité dépassant le seuil de déclaration de 100 kg, ni utilisé en quantité supérieure au seuil de déclaration de 1 000 kg. D'après les renseignements donnés par l'industrie pharmaceutique, entre 100 et 1 000 kg de mitotane sont importés et utilisés chaque année au Canada. Son utilisation en chimiothérapie laisse croire que le mitotane pourrait être rejeté dans l'environnement au Canada.
On s'attend à ce que la majorité du mitotane actuellement présent dans l'environnement provienne de l'utilisation passée du DDT et du dicofol. Étant donné son usage chimiothérapeutique, il est possible qu'il soit rejeté en petite quantité dans les systèmes de traitement d'eaux usées. Le mitotane est peu soluble dans l'eau et très peu volatil et, en raison de sa nature hydrophobe, il tend à se distribuer dans la phase particulaire et les tissus adipeux des organismes. Pour ces raisons, il se peut que l'on trouve le mitotane surtout dans le sol et, dans une moindre mesure, dans les sédiments. Il devrait en outre être présent en petites proportions dans l'eau et dans l'air.
Étant donné ses propriétés physiques et chimiques, on ne prévoit pas que le mitotane se dégradera rapidement dans l'environnement. Il devrait être persistant dans l'air, l'eau, le sol et les sédiments. Le mitotane peut également être bioaccumulable dans les organismes aquatiques et présenter un risque de bioamplification dans les chaînes alimentaires des animaux piscivores d'eau douce. Toutefois, une telle accumulation est peu probable chez les oiseaux ou les mammifères en raison de leur plus grande capacité métabolique. On a déterminé que cette substance répondait aux critères de persistance et de bioaccumulation définis dans le Règlement sur la persistance et la bioaccumulation. En outre, les données déduites à partir d'analogues et les données modélisées sur la toxicité en milieu aquatique indiquent que cette substance est très dangereuse pour les organismes aquatiques.
Il existe des risques à long terme associés aux substances persistantes et bioaccumulables qu'il est actuellement impossible de prévoir de façon fiable. Comme l'accumulation de telles substances peut être répandue et difficilement réversible, il est justifié de réagir de façon prudente. Toutefois, il est reconnu que le degré de préoccupation à l'égard d'une substance persistante et bioaccumulable dépend du taux et de la nature des rejets dans l'environnement.
Bien que de faibles quantités de mitotane soient consommées sous forme de produit pharmaceutique au Canada, une certaine proportion pourrait être rejetée, par excrétion, dans un petit nombre de sites de traitement des eaux usées. Or, la comparaison entre la concentration estimée de mitotane dans les lacs et les rivières recevant les effluents de ces sites et la concentration seuil pour les effets nocifs pour les organismes aquatiques sensibles indique un potentiel de nocivité pour l'environnement.
D'après les données empiriques concernant les effets sur la santé associés au mitotane, ces effets devraient se concentrer sur les glandes surrénales des humains. Toutefois, les marges entre la tranche supérieure des estimations prudentes de l'exposition au mitotane dans les milieux naturels et la dose minimale avec effet observé établie chez les animaux de laboratoire sont considérées comme adéquates pour tenir compte des incertitudes relevées dans les bases de données sur l'exposition et les effets sur la santé.
D'après les renseignements disponibles, il est conclu que le mitotane satisfait aux critères du paragraphe 64(a) de la LCPE, puisqu'il pénètre ou qu'il peut pénétrer dans l'environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique. Toutefois, le mitotane ne répond pas aux critères du paragraphe 64(b) de la LCPE, car il ne pénètre pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à mettre en danger l'environnement essentiel pour la vie. Il est aussi conclu que le mitotane ne répond pas aux critères du paragraphe 64(c) de la LCPE, car il ne pénètre pas dans l'environnement en une quantité, à une concentration, ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaine.
D'après les renseignements disponibles, il est proposé de conclure que le mitotane satisfait à un ou plusieurs des critères énoncés à l'article 64 de la LCPE. Il a été déterminé que le mitotane répond aux critères de la persistance et de la bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
1. Introduction
La Loi canadienne sur la protection de l'environnement (1999) [LCPE] exige que la ministre de l'Environnement et celle de la Santé procèdent à une évaluation préalable des substances qui répondent aux critères de catégorisation énoncés dans la LCPE afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l'environnement ou la santé humaine.
En se fondant sur l'information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu'une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères environnementaux de catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque pour les organismes aquatiques (Ti), et que l'on pense être commercialisées au Canada
- celles qui répondent aux critères de catégorisation pour le plus fort risque d'exposition (PFRE) ou qui présentent un risque d'exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine, compte tenu des classifications établies par d'autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont donc publié un avis d'intention dans la Partie I de la Gazette du Canada (Canada 2006a), dans lequel ils priaient l'industrie et les autres parties intéressées de fournir, selon un calendrier déterminé, des renseignements spécifiques qui pourraient servir à étayer l'évaluation des risques, ainsi qu'à développer des pratiques exemplaires de gestion des risques de référence et de bonne gestion des produits pour ces substances jugées hautement prioritaires.
On a estimé que l'on devait évaluer en priorité le mitotane (benzène, 1-chloro-2-[2,2-dichloro-1-(4-chlorophényl)éthyl]-), car cette substance satisfaisait aux critères du paragraphe 73(1) de la LCPE (ECCC et SC, 2007). Le volet du Défi portant sur cette substance a été publié dans la Gazette du Canada le 26 décembre 2009 (Canada, 2009a et 2009 b). Au même moment, on publiait une description de la substance présentant l'information technique obtenue avant décembre 2005 et sur laquelle a reposé sa catégorisation. Toutefois, aucun renseignement sur la substance n'a été communiqué en réponse au Défi.
Les évaluations préalables effectuées aux termes de la LCPE sont centrées sur les renseignements jugés essentiels pour déterminer si une substance répond aux critères énoncés dans l'article 64 de la LCPE. Les évaluations préalables visent à examiner les renseignements scientifiques et à tirer des conclusions fondées sur le poids de la preuve et le principe de prudenceNote de bas de page2 .
La présente évaluation préalable présente des renseignements sur les propriétés chimiques, les dangers, les utilisations et l'exposition. Les parties de la présente évaluation préalable de cette substance portant sur l'environnement et la santé humaine reposent sur les données pertinentes tirées des publications, des revues des écrits scientifiques, des documents d'évaluations originaux, ainsi que des rapports de recherche des parties intéressées et des recherches dans les écrits scientifiques parus avant septembre 2010. Une recherche rapide dans les écrits scientifiques réalisée en 2017 n'a pas révélé de nouveaux renseignements importants qui pourraient modifier les conclusions de la présente évaluation. Pour formuler nos conclusions, nous avons fait une évaluation critique des études les plus importantes et avons pu utiliser les résultats de modélisation.
Lorsqu'ils étaient disponibles et pertinents, les renseignements contenus dans les évaluations des dangers effectués par d'autres instances ont été utilisés.
Le personnel du Programme des substances existantes de Santé Canada et d'Environnement et Changement climatique Canada a rédigé la présente évaluation préalable qui intègre également les résultats obtenus par d'autres programmes de ces ministères. Les parties de l'évaluation portant sur l'environnement ont fait l'objet d'un d'examen ou d'une consultation écrits par des pairs externes. Les méthodes utilisées dans les évaluations préalables du Défi ont été examinées par un groupe indépendant, soit le Groupe consultatif du Défi. En outre, le public a disposé d'une période 60 jours pour émettre ses commentaires sur l'ébauche de l'Évaluation préalable. Nous n'avons reçu aucun commentaire de l'extérieur. La teneur et les conclusions finales de l'évaluation préalable demeurent la responsabilité de Santé Canada et d'Environnement et Changement climatique Canada.
Les principales données et considérations sur lesquelles repose l'ébauche d'évaluation sont résumées ci-après.
2. Identité de la substance
Dans le présent document, nous désignerons la substance sous son nom commun, le mitotane. Aussi appelée o,p'-DDD, elle peut être le résidu ou le produit de dégradation d'un composant de l'insecticide DDT (le dichlorodiphényltrichloroéthane). Les composants et leurs proportions dans le DDT sont énumérés au tableau 4-1. L'utilisation du DDT n'est plus homologuée au Canada depuis 1985. Les dérivés du DDT peuvent aussi être présents à de faibles concentrations en tant que résidus dans les produits contenant du dicofol (un acaricide).
La structure de l'isomère p,p'-DDD (no CAS 72-54-8) est similaire à celle de l'o,p'-DDD, mais elle est la substance la plus souvent retrouvée dans l'environnement. Dans les publications scientifiques, le nom DDD désigne habituellement l'isomère p,p'-DDD.
| Numéro d'enregistrement du Chemical Abstracts Service (NECAS) | 53-19-0 |
|---|---|
| Nom dans la LIS[a] | Benzène, 1-chloro-2-[2,2-dichloro-1-(4-chlorophényl)éthyl]- |
| Noms relevés dans les National Chemical Inventories (NCI)[b] |
Benzene 1-chloro-2-[2,2-dichloro-1-(4-chlorophenyl)ethyl]- (AICS, ASIA-PAC, NZIoC) mitotane (EINECS) |
| Autres noms | o,p'-DDD o,p'-TDE Lysodren® Mitotan 1,1-dichloro-2-(o-chlorophényl)-2-(p-chlorophényl)éthane 1-chloro-2-[2,2-dichloro-1-(4-chlorophényl)éthyl]benzène 2-(2-chlorophényl)-2-(4-chlorophényl)-1,1-dichloroéthane 2,2-bis(2-chlorophényl-4-chlorophényl)-1,1-dichloroéthane 2,4'-dichlorodiphényl dichloroéthane benzène, 1-chloro-2-(2,2-dichloro-1-(4-chlorophényl)éthyl) CB313 Chloditan Chlodithane éthane, 1,1-dichloro-2-(o-chlorophényl)-2-(p-chlorophényl)- NCI-C04933 NSC-38721 o,p'-dichlorodiphényldichloroéthane |
| Groupe chimique (groupe de la LIS) |
Produits chimiques organiques définis |
| Principale classe chimique ou utilisation | Organohalogénures |
| Principale sous-classe chimique | Chlorophényles |
| Formule chimique | C14H10Cl4 |
| Structure chimique | 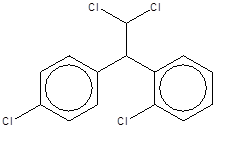 |
| SMILESI[c] | ClC(Cl)C(c1ccc(Cl)cc1)c2ccccc2Cl |
| Poids moléculaire | 320,05g/mol |
(a) LIS : Liste intérieure des substances.
(b) National Chemical Inventories (NCI) 2009 : AICS (inventaire des substances chimiques de l'Australie);ASIA-PAC (listes des substances de l'Asie-Pacifique); EINECS (inventaire européen des substances chimiques commercialisées existantes); NZIoC (inventaire des substances chimiques de la Nouvelle-Zélande).
(c) Simplified Molecular Input Line Entry System.
3. Propriétés physiques et chimiques
Le mitotane a deux formes optiquement actives (Konwick et coll. 2006) appelées énantiomères, la forme dextrogyre (+) et la forme lévogyre (-). Cette propriété d'une substance est appelée chiralité. Bien que les propriétés chimiques macroscopiques d'une molécule chirale soient les mêmes pour les deux énantiomères, l'activité biologique peut être propre à un énantiomère. Cette question est traitée de façon plus approfondie dans les sections du présent rapport touchant la bioaccumulation et les effets écologiques.
Le tableau 3-1 présente les propriétés physiques et chimiques (valeurs expérimentales et modélisées) du mitotane qui se rapportent à son devenir dans l'environnement. Les études clés qui sont à la source des données expérimentales (hydrosolubilité et Koe) ont fait l'objet d'un examen critique pour en assurer la validité.
Des modèles fondés sur les relations quantitatives structure-activité (RQSA) ont été utilisés afin de produire des données pour certaines des propriétés physiques et chimiques du mitotane. Ces modèles (sauf WSKOWWIN 2008) sont principalement fondés sur des méthodes d'addition de fragments, c'est-à-dire qu'ils s'appuient sur la structure d'un produit chimique donné.
En raison du manque de données empiriques sur le Koe, la bioaccumulation et l'écotoxicité du mitotane, nous avons utilisé une substance analogue, l'isomère p,p'-DDD (no CAS 72-54-8) [figure 3-1]. Le p,p'-DDD, a traditionnellement été utilisée comme insecticide, mais son utilisation n'est plus homologuée au Canada depuis 1978. La seule différence entre la structure chimique du p,p'-DDD et du mitotane est l'emplacement d'un des atomes de chlore sur les cycles benzéniques. Donc, les modèles générés par la suite EPI (2008) prédisent qu'en raison de leur structure similaire, le mitotane et le p,p'-DDD auront les mêmes propriétés physiques et chimiques, persistance, bioaccumulation dans les poissons et toxicité en milieu aquatique, en l'absence de nouvelles données expérimentales sur les données physiques et chimiques. Ainsi, la petite différence de structure chimique ne devrait pas avoir d'incidence sur les propriétés physiques et chimiques générales présentées au tableau 3-1. Par exemple, une preuve en est la similitude des valeurs expérimentales d'hydrosolubilité du mitotane et du p,p'-DDD, qui sont respectivement de 0,1 mg/L et 0,09 mg/L (Biggar et Riggs 1974). Toutefois, l'emplacement des atomes de chlore peut causer des différences dans la bioaccumulation et la toxicité de cette substance pour certains types d'organismes tels que les oiseaux et les mammifères, car il existe des preuves indiquant que les deux substances s'accumulent et sont métabolisées de façon différente par ces organismes. La pertinence d'utiliser le p,p'-DDD comme analogue pour évaluer la toxicité et la bioaccumulation est traitée, au besoin, dans les sections respectives.

Figure 3-1. Structure du p,p'-DDD
| Propriété | Type | Valeur[a] | Température (°C) | Référence |
|---|---|---|---|---|
| Point de fusion (°C) | Expérimentale | 77[*] | - | PhysProp 2006 |
| Point de fusion (°C) | Modélisée | 114,3 | - | MPBPWIN 2008 |
| Point d'ébullition (°C) | Modélisée | 366,75 | - | MPBPWIN 2008 |
| Masse volumique (kg/m3) | Aucune information disponible | Aucune information disponible | Aucune information disponible | Aucune information disponible |
| Pression de vapeur (Pa) | Modélisée | 2,253 × 10−3 (1,69 × 10−5 mm Hg) | 25 | MPBPWIN 2008 |
| Pression de vapeur (Pa) | Expérimentale | 2,586 × 10−4[*] (1,94 × 10−6 mm Hg) | 30 | Suntio et coll. 1988 |
| Pression de vapeur (Pa) | Expérimentale | 2,51 × 10−3[*] | 25 | Zhang et coll. 2009 |
| Constante de la loi de Henry (Pa m3/mol) | Calculée[b] | 8,035* | 25 | - |
| Constante de la loi de Henry (Pa m3/mol) | Calculée[b] | 7,93 × 10−5 | 25 | - |
| Constante de la loi de Henry (Pa m3/mol) | Modélisée | 4,40 | 25 | HENRYWIN 2008 |
| Constante de la loi de Henry (Pa m3/mol) | Modélisée | 4,341 × 10−5 | 25 | HENRYWIN 2008 |
| log Koe (coefficient de partage octanol-eau) [sans dimension] | Modélisée | 5,87 | - | KOWWIN 2008 |
| Log Koe (sans dimension) | Modélisée | 6,55 | - | Karickhoff et coll. 1991 (cité par Meadoret coll. 1997) |
| Log Koe (sans dimension) | Expérimentale (la valeur est pour l'analogue du mitotane, p,p'-DDD) | 6,02 | - | Sangster 1994 (cité par Physprop 2006) |
| Log Koe (sans dimension) | Expérimentale (la valeur est pour l'analogue du mitotane, p,p'-DDD) | 6,22 | 25 | De Bruijn et coll. 1989 |
| Log Koe (sans dimension) | S.O. | 5,69 | - | Hansch et Leo 1979 (cité par Gossett et coll. 1983) |
| Log Koe (coefficient de partage octanol-eau) [sans dimension] | Modélisé | 5,19 | - | ATSDR 2002 |
| Log Koe (sans dimension) | Modélisée (à partir de Koe) | 5,40[*] | - | KOCWIN 2008 |
| Log Koe (sans dimension) | Modélisée (à partir de MCI) | 5,08 | - | KOCWIN 2008 |
| Hydrosolubilité (mg/L) | Expérimentale | 0,1[*] | 25 | Biggar et Riggs 1974 |
| Hydrosolubilité (mg/L) | Modélisée | 0,1192 | Non précisé | WSKOWWIN 2008 |
| Solubilité dans d'autres solvants (g/L) | Expérimentale (alcool, isooctane, hexane et de tétrachlorure de carbone) | « Soluble » | Non précisé | USP 2008; O'Neil 2006 |
| pKa (constante de dissociation acide) [sans dimension] | La substance ne s'ionise pas dans des conditions environnementales. | S.O. | S.O. | S.O. |
(a) Les valeurs entre parenthèses sont les valeurs initiales publiées par les auteurs ou estimées à l'aide des modèles.
(b) Constante de la loi de Henry = pression de vapeur/solubilité dans l'eau. La pression de vapeur et l'hydrosolubilité sont toutes deux des valeurs expérimentales.
* Valeur choisie pour la modélisation.
« - » Données non disponibles.
4. Sources
Le mitotane n'est pas présent naturellement dans l'environnement.
Des renseignements ont été colligés en réponse à un avis publié en vertu de l'article 71 de la LCPE pour l'année civile 2005 (Canada, 2006). Les résultats indiquent que le mitotane n'a pas été fabriqué au Canada. Toutefois, deux entreprises en ont importé entre 100 et 1 000 kg/an.
En 2006, les résultats obtenus en réponse à l'avis publié en application de l'article 71 de la LCPE indiquent qu'au Canada l'on n'a pas fabriqué, importé ou utilisé du mitotane en des quantités dépassant les seuils de déclaration. Toutefois, une entreprise canadienne a exprimé son intérêt pour cette substance (Canada, 2009a).
Au Canada, le mitotane est une substance entrant dans la composition de produits réglementés par la Loi sur les aliments et les drogues (Canada 1985b). Les informations inscrites à la Liste des substances intérieure (LIS) -- qui sont fondées sur les activités tenues du 1er janvier 1984 au 31 décembre 1986 -- indiquent que ces produits étaient commercialisés. Au départ, cette substance avait été inscrite sur la Liste intérieure des substances sans renseignements connexes comme la quantité présente sur le marché ou le nombre de déclarants (Environnement Canada, 1988). Le mitotane figure dans la Base de données sur les produits pharmaceutiques de Santé Canada en tant qu'ingrédient d'un produit pharmaceutique homologué (BDPP 2010). Les détails fournis pendant la période de commentaire du public, après la publication de l'ébauche d'évaluation, indiquent qu'entre 100 et 1000 kg de mitotane étaient importés.
L'utilisation passée des pesticides DDT et dicofol constitue une autre source environnementale de mitotane. Ce dernier peut être présent sous forme de résidus (0,1 %) dans le DDT vendu comme pesticide (tableau 4-1; GDCh 1998). Le mitotane est également un produit de dégradation ou un métabolite d'un isomère du DDT (o,p'-DDT) que l'on trouve dans une proportion de 15 à 21 % dans l'insecticide DDT (ATSDR 2002). L'isomère du DDT, l'o,p'-DDT est présent à des niveaux détectables dans le dicofol (HSDB 2010). On utilisa largement dans le passé le DDT comme insecticide à large spectre. En 1970, le Canada limita l'utilisation de l'insecticide DDT et, en 1985, suspendit son homologation (CCME 1999, Canada 2002). En 1972, les États-Unis interdirent l'utilisation du DDT comme ingrédient actif dans les pesticides homologués. Toutefois, on l'utilise toujours dans certains pays (ATSDR 2002). Des organisations internationales telles que le Programme des Nations Unies pour l'environnement (PNUE) ont conclu qu'il était un polluant organique persistant nocif. La production mondiale de DDT a été largement réduite et elle est soumise à un contrôle international en vertu de la Convention de Stockholm sur les polluants organiques persistants (PNUE 2001).
| Composant du DDT | Formulation du DDT (%) (GDCh 1998) | Produits de dégradation (PISSC 1989) |
|---|---|---|
| p,p'-DDT | 77,1 | p,p'-DDE (aérobie), p,p'-DDD (anaérobie) |
| o,p'-DDT | 14,9 | o,p'-DDE (aérobie); mitotane (anaérobie) |
| p,p'-DDE | 4 | p,p'-DDMU; 4-chlorobenzaldéhyde |
| o,p'-DDE | 0,1 | Non disponible |
| p,p'-DDD | 0,3 | p,p'-DDMU |
| Mitotane (o,p'-DDD) | 0,1 | o,p'-DDA et hydroxylates |
Le DDT et ses dérivés peuvent également être présents dans les formulations de dicofol sous la forme d'impuretés (ATSDR 2002). La teneur en o,p'-DDT du volume total de dicofol est généralement inférieure à 0,1 % (HSDB 2010), tandis que celle du mitotane(o,p'-DDD) n'était pas détectable dans les formulations de dicofol (Turgut et coll., 2009; Qiu et coll., 2005). On a volontairement cessé la vente du dicofol au Canada en décembre 2008 et, depuis le 31 décembre 2011, toute utilisation de cette substance est interdite. On ne peut ni vendre ni utiliser légalement de produits contenant du dicofol au Canada (ARLA 2010).
De petites quantités de mitotane provenant de l'utilisation antérieure du DDT et du dicofol sont susceptibles de demeurer dans l'environnement ou de pénétrer dans l'environnement au Canada par le transport sur de grandes distances (p. ex. par l'air) depuis d'autres pays (voir section 8.2).
5. Utilisations
Au Canada, le mitotane est inscrit dans la Base de données sur les produits pharmaceutiques (BDPP) de Santé Canada en tant qu'ingrédient actif d'un produit pharmaceutique homologué (BDPP 2010). La sécurité, l'efficacité et la qualité de ce médicament ont déjà été évaluées en vertu de la Loi sur les aliments et drogues (LAD). Dans le présent document, l'évaluation de l'utilisation pharmaceutique du mitotane est axée sur l'exposition environnementale, un aspect que n'a pas couvert l'évaluation faite en vertu de la Loi sur les aliments et drogues.
Ce médicament sur ordonnance est un agent chimiothérapeutique oral utilisé dans le traitement du cancer de la glande surrénale (ATSDR 2002; Société canadienne du cancer, 2010; University of Michigan, 2010). Plus précisément, le mitotane est indiqué dans le traitement des cancers corticosurrénaliens inopérables, métastatiques et récurrents (Attivi, 2010; Bristol-Myers Squibb Company, 2010). La plupart des cliniciens considèrent le mitotane comme le médicament de choix pour le traitement des cancers corticosurrénaliens (AHFS, 2010). On estime que 93 kg, 100 kg et 60 kg ont respectivement été utilisés en 2007 2011 et 2012 au Canada (McLaughlin et Belknap 2008, IMS 2013). Les renseignements divulgués par l'industrie pharmaceutique indiquent qu'au Canada, l'utilisation varie d'une année à l'autre, mais se situe généralement entre 100 et 1 000 kg par année. Le distributeur recommande une dose moyenne de mitotane d'au moins 8 à 10 grammes par jour, mais celle-ci peut se situer entre 2 et 16 grammes par jour (Bristol-Myers Squibb Company, 2010).
Le mitotane figure dans la Base de données sur les ingrédients des produits de santé naturels avec un rôle comme produit de santé non naturel, à cause de sa présence dans la liste des médicaments d'ordonnance sous le nom de mitotane (BDIPSN, 2017). Il n'est pas répertorié dans la Base de données de produits de santé naturels homologués (BDPSNH, 2017). Donc, aucun produit de santé naturel actuellement homologué ne contient cette substance comme ingrédient médicinal ou non médicinal (BDPSNH, 2010). Le mitotane n'est pas répertorié dans les listes d'additifs alimentaires autorisés en vertu de la Loi sur les aliments et drogues (Canada, 1978) et des autorisations de commercialisation connexes (Santé Canada, 2013). On n'a pas recensé son utilisation ou sa présence dans les emballages alimentaires ou dans les préparations d'additifs indirects (communication personnelle de la Direction des aliments de Santé Canada adressée en 2010 au Bureau de la gestion du risque des substances existantes de Santé Canada, source non citée).
Dans d'autres pays, le mitotane est utilisé dans le traitement du syndrome de Cushing (hyperadrénocorticisme) chez les humains et les chiens (ATSDR, 2002; HSBD, 2010).
6. Rejets dans l'environnement
Aucune information précise sur les rejets industriels de mitotane n'a été relevée. Aucune information n'a été reçue des importateurs et des utilisateurs industriels en réponse à l'enquête menée pour 2006 en application de l'article 71 de la LCPE (Canada, 2009a), et la substance ne doit pas faire l'objet d'une déclaration à l'Inventaire national des rejets de polluants (INRP, 2006).
Le mitotane n'est pas produit par un processus naturel. Sa présence dans l'environnement peut découler de son utilisation antérieure dans les insecticides DDT et dicofol (ARLA 2007) ou de son utilisation actuelle comme médicament sur ordonnance. Le mitotane est un produit de dégradation de l'o,p'-DDT, dont on trouve des concentrations allant jusqu'à 21 % dans les formulations du DDT. La dégradation du o,p'-DDT contenu à moins de 1 % dans des formulations de dicofol peut se traduire par des rejets.
Ces pesticides étaient utilisés au Canada à des fins agricoles et forestières. Le mitotane fut donc surtout rejeté dans le sol et, par la dérive de pulvérisation, dans l'air. Le mitotane utilisé comme médicament sur ordonnance est rejeté dans les eaux usées et devrait ainsi se retrouver dans les sédiments, l'eau de surface et les biosolides.
Par conséquent, puisqu'il est un produit de la dégradation du DDT et du dicofol, on peut croire que le mitotane sera largement dispersé dans l'environnement en raison de son utilisation passée. Une très grande proportion du mitotane dans l'environnement devrait provenir de la dégradation de l'o,p'-DDT. Toutefois, la concentration près des points actuels de rejet dans l'eau pourrait être élevée en raison de l'utilisation récente de la substance comme médicament.
Le mitotane est homologué au Canada comme agent chimiothérapeutique et est administré sous forme de comprimés oraux. Selon la monographie du produit, récupérée dans la Base de données sur les produits pharmaceutiques (2010), le mitotane est absorbé dans le corps ou converti en métabolite hydrosoluble. La consommation de médicament contenant du mitotane cause l'ensemble des rejets de ce produit pharmaceutique.
Aucune forme inchangée de mitotane n'a été détectée dans de l'urine ou de la bile (voir l'information sur la métabolisation du mitotane dans la section portant sur l'évaluation des effets sur la santé) [FDA, 2009]. Le distributeur recommande une dose moyenne de 8 à 10 grammes par jour (Bristol-Myers Squibb Company, 2010). La capacité de l'intestin à dissoudre cette quantité de mitotane, nécessaire pour l'absorption, est limitée. Étant donné qu'il existe peu de renseignements fiables sur le devenir et la transformation possible du produit non absorbé, on suppose de façon prudente que 60 % de ce dernier est excrété sous forme inchangée dans les matières fécales (Moy, 1961).
La réponse des patients au mitotane est très variable (Attivi, 2010). Le patient demeure à l'hôpital jusqu'à l'obtention d'un régime stable, soit l'atteinte de la dose maximale tolérée (Bristol-Myers Squibb Company, 2010). La concentration recommandée de mitotane dans le plasma (de 14 à 20 mg/L) est généralement obtenue après deux à trois semaines (Moy, 1961). Le patient retourne ensuite à la maison pour le reste de son traitement, dont la durée variera entre 4 et 48 mois (Hutter et Kayhoe, 1966; Baudin et coll., 2001; Terzolo, Angeli et coll., 2007; Attivi, 2010; Brunton et coll., 2005, ASHP, 2010).
Une fois que le mitotane excrété atteint les systèmes de traitement des eaux usées, il se distribue en préférence dans les boues qui pourraient être transformées en biosolides. L'épandage de biosolides dans les champs agricoles constitue une source potentielle de mitotane dans les sols au Canada. Toutefois, cette voie de rejet devrait être négligeable comparativement aux quantités de mitotane produites par la dégradation in situ de l'o,p'-DDT.
7. Devenir dans l'environnement
Étant donné ses propriétés physiques et chimiques (tableau 3-1) et les résultats de la modélisation de la fugacité de niveau III (tableau 7-1), on peut penser que le mitotane demeurera surtout dans le sol et les sédiments, selon le milieu dans lequel il est rejeté. Actuellement, les seuls rejets de mitotane dans l'eau découlent de son utilisation comme médicament d'ordonnance et de son excrétion subséquente dans les eaux usées.
| Lieu du rejet de la substance | Pourcentage de substance répartie dans l'air | Pourcentage de substance répartie dans l'eau | Pourcentage de substance répartie dans le sol | Pourcentage de substance répartie dans les sédiments |
|---|---|---|---|---|
| Air (100 %) | 11,0 | 2,20 | 59,9 | 26,8 |
| Eau (100 %) | 0,16 | 7,50 | 0,87 | 91,5 |
| Sol (100 %) | 0,00 | 0,01 | 99,9 | 0,11 |
Ces résultats de la modélisation de la fugacité représentent la répartition de la substance entre les milieux dans un environnement d'évaluation hypothétique, ainsi que la perte tant par les processus de transport d'advection (à l'extérieur du milieu modélisé) que par ceux de dégradation ou de transformation. Les valeurs de répartition présentées dans le tableau 7-1représentent les effets nets de ces processus dans des conditions de rejets continus lorsqu'un « état stable » hors de l'équilibre est atteint.
Rejeté dans l'eau, le mitotane devrait s'adsorber fortement sur les matières solides en suspension et les sédiments en raison de la valeur élevée estimée du log Kco (~ 5,09). Étant donné la constante estimée de la loi de Henry, la volatilisation du mitotane depuis la surface de l'eau est possible mais, si l'eau est le milieu récepteur, il devrait surtout se répartir dans les sédiments (tableau 7-1).
Compte tenu de la valeur estimée du log Koc, le mitotane rejeté dans le sol devrait s'y adsorber fortement (il devrait donc être plutôt immobile). En raison de sa constante de la loi de Henry, la volatilisation depuis les surfaces de sol humides est possible. À cause de sa pression de vapeur, la substance pourrait également se volatiliser légèrement à partir des surfaces de sol sèches. En contexte agricole toutefois, l'érosion éolienne pourrait contribuer au retrait du mitotane du sol et son transfert dans l'air (Ressources naturelles Canada, 2010).
Une petite quantité de la substance devrait persister dans l'air (tableau 7-1 plus haut). On considère que le mitotaneest très légèrement volatil, étant donné la valeur expérimentale faible de sa pression de vapeur (2,51 × 10−3Pa) et la valeur modérée de sa constante de la loi de Henry(8,035 Pa m3/mol). Ainsi, s'il est rejeté uniquement dans l'air, il se répartira surtout dans le sol et les sédiments (59,9 % et 26,8 %, respectivement, voir le tableau 7-1), mais la proportion qui persistera dans l'air ne sera pas négligeable.
7.1 Persistance dans l'environnement
Le tableau 7-2 présente les données empiriques sur l'hydrolyse et la biodégradation du mitotane.
| Milieu | Processus du devenir | Paramètre | Nombre de jours pour la dégradation | Référence |
|---|---|---|---|---|
| Eau | Hydrolyse du DDD[a] | Demi-vie, pH 9 et 27 °C | 570[b] | Wolfe et coll.,1977 |
| Eau | Hydrolyse du DDD[a] | Demi-vie, pH 5 et 27 °C | 190[c] | Wolfe et coll., 1977 |
| Sédiments | Biodégradation primaire, anaérobie | Demi-vie, concentration > 19,2 mg/kg p.s. | < 100 | Huang et coll., 2001 |
| Sédiments | Biodégradation primaire, anaérobie | Demi-vie, concentrations de 9,6 à 19,2 mg/kg p.s. | Persistante (> 250 jours) |
Huang et coll., 2001 |
a Inclut l'o,p'-DDD (le mitotane) et le p,p'-DDD.
b Estimation fondée sur Cristol et coll. (1952).
c Estimation fondée sur Bensley et Kohnstam (1957).
Huang et coll. (2001) ont étudié la biodégradation anaérobie du DDT et de ses métabolites dans les boues de sédiments et l'eau sus-jacente (10 % p/v de solides) prélevées dans la rivière Keelung à Taiwan. La présence de p,p'-DDT et de son métabolite, le p,p'-DDD, avaient précédemment été signalée dans les sédiments de cette rivière. Elle découlait probablement de rejets survenus avant l'interdiction du DDT dans les années 1980, en Chine (Huang et coll., 2001). Une concentration initiale de mitotane de 39,5 μM -- ou 126,4 mg/kg p.s. de sédiments) -- est tombée à 6 μM -- soit 19,2 mg/kg p.s. de sédiments -- en 165 jours après une phase de latence de 25 jours (Huang et coll., 2001). Le taux d'élimination a augmenté après l'ajout de mitotane (134,4 mg/kg p.s.). Toutefois, le mitotane est demeuré persistant après que sa concentration eut diminué à 19,2 mg/kg p.s. Aucun changement dans la quantité de mitotane n'a été observé dans les échantillons témoins stériles au cours de la période d'échantillonnage. Les auteurs ont établi que le taux initial d'élimination du mitotane était de 1,33 mg/kg p.s. par jour. Ils n'ont cependant pas mentionné les produits de dégradation du mitotane dans leur étude.
Par ailleurs, Huang et coll. (2001) ont constaté une dépendance vis-à-vis du pH pour les taux de déchloration du p,p'-DDT (tableau 4-1) et les taux de formation et de transformation du p,p'-DDD (un analogue du mitotane dans la présente évaluation). Même si la dépendance de la transformation du mitotane en fonction du pH n'a pas été analysée, la voie de dégradation des isomères p,p' estsemblable à celle des isomères o,p'; et l'influence du pH est donc comparable. La plus forte activité de déchloration pour le p,p'-DDD a été observée à un pH de 6,7, tandis que l'on n'a observé qu'une faible voire aucune transformation à des pH de 5,9 et 9,0.
Huang et coll. (2001) ont aussi constaté qu'à des concentrations plus élevées (soit supérieures à 19,2 mg/kg p.s.), les demi-vies de transformation primaire des isomères o,p' et p,p' du DDT, du DDD et du DDE étaient inférieures à 100 jours, mais qu'il existait une phase de latence pour la transformation de mitotane (o,p'-DDD) qui n'a pas été observée pour aucun des résidus de DDT étudiés. Huang et coll. (2001) ont également constaté que tous les isomères du DDD et du DDE étaient persistants à des concentrations inférieures à la plage de 9,6 à 19,2 mg/kg p.s. Cette observation peut aider à expliquer la raison pour laquelle les concentrations de DDT et de ses métabolites mesurées dans l'environnement ont généralement diminué depuis les années 1970, tandis que ces composés sont toujours omniprésents à des concentrations entre 1 et 100 μg/kg dans le sol et les sédiments à travers les États-Unis et dans le monde entier (tableaux 8-7 et 8-10).
Kurt-Karakus et coll. (2006) ainsi que Meijer et coll. (2003) ont mesuré les concentrations de résidus de DDT, y compris le mitotane, dans des sols agricoles de la Muck Crops Research Station, une station de recherche de l'Université de Guelph située à Holland Marsh en Ontario. Toutefois, nous ne savons pas si les échantillons ont tous été prélevés dans le même champ. Dans les deux études, les concentrations de mitotane étaient respectivement de 400 et 1 200 μg/kg p.s., et celles d'o,p'-DDT de 3 200 et 3 000 μg/kg p.s. La date de la dernière application de DDT dans ce lieu est inconnue, mais elle est probablement proche de la période d'élimination progressive de l'utilisation du DDT au milieu des années 1970 (Kurt-Karakus et coll., 2006). Cela indique le potentiel de persistance du mitotane et de l'o,p'-DDT dans le sol, étant donné qu'ils étaient présents en concentrations relativement élevées environ 30 ans après la dernière application de DDT. Huang et coll. (2001) ont déterminé que les taux de dégradation de l'o,p'-DDT et du mitotane dans les boues de sédiments anoxiques de la rivière Keelung à Taiwan. Le mitotane a été dégradé 8,3 fois plus lentement que le p,p'-DDT et 5,5 fois plus lentement que l'o,p'-DDT dans les sédiments anoxiques.
En raison du peu de données sur la dégradation du mitotane, nous avons utilisé une méthode fondée sur le poids de la preuve, faisant appel à la RQSA (Environnement Canada, 2007) et basée sur les modèles de dégradation mentionnés au tableau 7-3. Étant donné l'importance écologique du milieu aquatique, le fait que la plupart des modèles disponibles s'appliquent au milieu aquatique et que le mitotane soit rejeté dans ce milieu du fait de son utilisation actuelle, c'est la biodégradation dans le milieu aquatique qui a été principalement étudiée.
| Processus du devenir | Modèle et base du modèle | Résultat et prévision du modèle | Demi-vie extrapolée (jours) |
|---|---|---|---|
| Oxydation atmosphérique | AOPWIN 2008[a] | t 1/2 = 2,5 jours | ≥ 2 |
| Réaction avec l'ozone | AOPWIN 2008[a] | s.o.[b] | s.o. |
| Hydrolyse | HYDROWIN 2008[a] | s.o.[b] | s.o. |
| Biodégradation (aérobie) | BIOWIN 2008[a] Sous-modèle 4 : enquête d'expert (résultats qualitatifs) |
2,8[c] « semaines » |
≤ 182 |
| Biodégradation (aérobie) | BIOWIN 2008[a] Sous-modèle 3 : enquête d'expert (résultats qualitatifs) |
1,7[c] « se biodégrade très lentement » |
≥ 182 |
| Biodégradation (aérobie) | BIOWIN 2008[a] Sous-modèle 5 : Probabilité linéaire MITI |
-0,22[d] « se biodégrade très lentement » |
≥ 182 |
| Biodégradation (aérobie) | BIOWIN 2008[a] Sous-modèle 6 : Probabilité non linéaire MITI |
0,0007[d] « se biodégrade très lentement » |
≥ 182 |
| Biodégradation (aérobie) | TOPKAT 2004 Probabilité |
0,003[d] « se biodégrade très lentement » |
≥ 182 |
| Biodégradation (aérobie) | CATABOL, C2004-2008 % DBO (demande biochimique en oxygène) |
% DBO = 0,003 « se biodégrade très lentement » |
≥ 182 |
a EPI Suite (2008)
b s.o. (sans objet) – le modèle ne précise pas d'estimation pour ce type de structure.
c Le résultat s'exprime par une valeur numérique de 0 à 5.
d Le résultat s'exprime par un taux de probabilité.
Les résultats du modèle BIOWIN (2008) sont jugés fiables, comme les caractéristiques structurelles pertinentes du mitotane sont incluses dans la bibliothèque de fragments structurels de ce modèle (p. ex. chlorure aliphatique, chlorure aromatique, substituant alkyle sur le noyau aromatique). Ainsi, le mitotane se trouve dans le domaine structurel du modèle CATABOL (c2004-2008) (correspondance structurelle = 94 %) et dans les limites OPS (Optimum Prediction Space) de TOPKAT (2004), tous les fragments structurels étant pris en compte.
Dans l'air, la demi-vie prévue par oxydation atmosphérique de 2,5 jours (tableau 7-3) indique que cette substance devrait s'oxyder lentement; elle est donc considérée comme étant persistante dans l'air (demi-vie > 2 jours). Le mitotane ne devrait pas se dégrader par photolyse directe.
Dans l'eau, les valeurs empiriques de demi-vie d'hydrolyse comprises entre 190 et 570 jours, selon le pH (tableau 7-2), montrent que cette substance est susceptible de s'hydrolyser lentement. D'autres processus régissant son devenir dans l'eau, comme la biodégradation, doivent toutefois être pris en compte pour déterminer sa persistance dans ce milieu.
Tous les modèles de biodégradation ultime (c.-à-d., dans lesquels la dégradation entraîne la minéralisation complète lorsque les produits finaux sont le CO2, le H2O et, de façon générale, des éléments du tableau périodique; tableau 7-3) concordent avec le fait que le mitotane se biodégrade très lentement; ainsi la substance est jugée comme étant persistante dans l'eau, même si la biodégradation primaire peut survenir plus rapidement.
Le mitotane possède également des caractéristiques structurelles associées aux produits chimiques qui ne se biodégradent pas facilement (p. ex. composés aliphatiques chlorés, structure aromatique chlorée à deux cycles, et log Koe > 2,2) [Arnot et coll., 2009]. En conséquence, sur la base de tous les résultats empiriques et des modèles ainsi que des caractéristiques structurelles, on dispose de preuves tangibles laissant entendre que la demi-vie de la biodégradation ultime du mitotane est supérieure à 182 jours dans l'eau.
En s'appuyant sur des rapports d'extrapolation de 1:1:4 pour les demi-vies de biodégradation eau:sol:sédiments (Boethling et coll., 1995), on peut déduire une demi-vie de dégradation ultime dans le sol dépassant 182 jours, et dans les sédiments dépassant 365 jours. Ainsi, le mitotane devrait être persistant dans le sol et les sédiments aérobies.
Certaines données laissent croire que le mitotane peut subir un transport atmosphérique à grande distance jusque dans des régions éloignées. Des concentrations de mitotane (o,p'-DDD) ont été mesurées dans l'air arctique au Canada et en Norvège. À Svalbard, en Norvège, les concentrations de la substance dans l'air étaient de 0,15 et 0,02 pg/m3 durant les étés de 2004 et 2005, respectivement (Becker et coll., 2009). À la station de recherche d'Alert, au Nunavut (Canada), les concentrations de mitotane dans l'air variaient de 0,09 à 1,15 pg/m3 en 2006-2007 (Hung et coll. 2010, communication personnelle : courriel du 27 août 2010 de la Division de la recherche sur la qualité de l'air à la Division d'Évaluation des risques pour l'environnement, toutes deux à Environnement Canada, non cité). Le mitotane a également été détecté dans des espèces de poissons de l'Arctique (Berg et coll., 1997; tableau 8-11). Toutefois, il est probable que le transport à grande distance de l'o,p'-DDT rejeté par le sol (par l'érosion éolienne) ait contribué à la présence du mitotane dans l'Arctique, étant donné qu'une portion de l'o,p'-DDT présent dans l'air qui a atteint l'Arctique finira par se dégrader, et que le produit de cette dégradation dans des conditions anaérobies sera le mitotane.
Nous avons utilisé le modèle de transport et de persistance de niveau III (TaPL3) [TaPL3 2000] pour estimer la distance de transport caractéristique (DTC), définie comme la distance maximale parcourue dans l'air par 63 % de la substance. Beyer et coll. (2000) ont proposé de classer le potentiel de transport atmosphérique à grande distance comme étant élevé si la DTC est supérieure à 2 000 km, modéré si elle est de 700 km à 2 000 km et faible si elle est inférieure à 700 km. L'estimation du potentiel de transport caractéristique de 1156 km du mitotane est donc modérée. Il pourra donc être transporté dans l'atmosphère dans des zones moyennement éloignées de ses sources d'émission.
Le modèle de dépistage (LTRP POP) de l'Organisation de coopération et de développement économiques (OCDE) peut être utilisé pour déterminer quels sont les produits chimiques à fort potentiel de persistance et de transport à grande distance (Scheringer et coll., 2006). Le modèle de l'OCDE est un modèle global qui compartimente la terre en air, eau et sol. Ce modèle est « orienté vers le transport » plutôt que vers une « cible », car il détermine simplement la DTC sans préciser le lieu où une substance pourra être transportée (Fenner et coll., 2005). Klasmeier et coll. (2006) ont proposé un seuil de 5 098 km, basé sur l'estimation de la DTC du modèle pour le PCB-180, permettrait de déterminer quelles substances présentent un fort potentiel de transport à grande distance. On sait de façon empirique que le PCB-180 est présent dans des régions éloignées. La DTC calculée pour le mitotane à l'aide du modèle de l'OCDE est de 1 047 km, ce qui indique que cette substance n'a pas un potentiel élevé de transport atmosphérique, puisque cette distance se situe sous la limite suggérée par Klasmeier et coll. (2006) pour les polluants mondiaux. Le modèle de dépistage de l'OCDE permet également de calculer l'efficacité du transfert (ET), qui correspond au pourcentage du flux des émissions vers l'atmosphère déposé à la surface (eau et sol) dans une région éloignée (% ET = D/E × 100, où E est le flux des émissions vers l'atmosphère et D, le flux du dépôt sur les milieux en surface dans une région cible). L'ET calculée pour le mitotane était de 0,000084 %, ce qui est supérieur à la limite de 0,00065 % (PCB-28) établie pour les substances de référence du modèle dont on sait de manière empirique qu'elles sont déposées de l'air sur le sol ou dans l'eau. La faible ET signifie que même si le mitotane a le potentiel de se déplacer sur une certaine distance dans l'atmosphère, il est peu probable qu'il se dépose sur la surface de la Terre dans quelque région éloignée que ce soit.
Le mitotane a été mesuré dans l'air et la faune arctiques, comme nous l'avons mentionné plus haut. Toutefois, il est probable que la majorité du mitotane mesuré dans l'air arctique résulte de la transformation de l'o,p'-DDT. En effet, on a été démontré (Wania, 2006; Environnement Canada, 2006b) que l'o,p'-DDT, beaucoup plus abondant dans l'atmosphère que le mitotane, voyage dans l'atmosphère sur de de grandes distances vers l'Arctique. De plus, les modèles de transport atmosphérique à grande distance ont évalué que le potentiel de transport du mitotane était modéré. Bidleman et Leone (2004) ont calculé la fugacité dans l'air de l'o,p'-DDT. La fraction d'o,p'-DDT dans l'air découlant de l'utilisation du DDT comme pesticide était évaluée à 0,42; la valeur moyenne dans l'air au–dessus des sols était de 0,49 et elle était de 0,43 à 0,45 dans l'air à l'échelle régionale. Il est raisonnable de présumer que le transport à grande distance et le dépôt d'o,p'-DDT suivi par la dégradation in situ en mitotane sont les seules sources de mitotane dans les écosystèmes touchés uniquement par les dépôts atmosphériques.
En se fondant sur les données empiriques et modélisées (tableaux 7-2 et 7-3), on peut conclure que le mitotane est persistant dans tous les milieux : l'air, l'eau, le sol et les sédiments.
7.2 Potentiel de bioaccumulation
7.2.1 Mesures empiriques de la bioaccumulation
Comme il a été indiqué précédemment, l'o,p'-DDD (le mitotane) et le p,p'-DDD devraient normalement avoir des propriétés physiques et chimiques semblables en raison de la similitude de leur structure. Toutefois, une petite différence dans leurs structures chimiques devrait se traduire par des potentiels de bioaccumulation différents dans certains organismes. Les cytochromes P450 sont des enzymes responsables du métabolisme de maintes différentes classes de composés xénobiotiques dans des organismes de niveau trophique supérieur (CYP2B) et ils peuvent être absents de la majorité des organismes aquatiques (Norstrom 1997). Dans le cas de composés aromatiques non fondus, l'exigence principale pour faciliter l'activité métabolique de ces enzymes est la présence de positions méta-para non substituées sur une structure circulaire (Norstrom 1997). Cette caractéristique structurelle est présente dans un noyau d'o,p'-DDD, mais pas dans un noyau de p,p'-DDD. Par conséquent, les mammifères terrestres et les oiseaux devraient métaboliser rapidement l'o,p'-DDD absorbé, réduisant son potentiel de bioaccumulation dans ces organismes par rapport à celui du p,p'-DDD. Toutefois, puisque les poissons et les invertébrés ne semblent pas avoir d'enzymes CYP2B, l'o,p'-DDD et le p,p'-DDD devraient présenter des potentiels de bioaccumulation semblables dans les organismes aquatiques.
Le tableau 7-4 présente les valeurs empiriques de la bioaccumulation pour l'analogue p,p'-DDD dans les poissons et les invertébrés aquatiques.
| Organisme d'essai, emplacement | Paramètre | Valeur (poids humide en L/kg) | Référence |
|---|---|---|---|
| Poisson (échantillon composite), lac Ontario | FBA (p,p'-DDD) |
892 473 | Oliver et Niimi 1988 |
| Hyalella azteca (amphipode) | FBC (p,p'-DDD) |
16 720 | Lotufo et coll. 2000 |
| Diporeia spp. (amphipode) | FBC (p,p'-DDD) |
436 000 | Lotufo et coll. 2000 |
FBA = facteur de bioaccumulation
FBC = facteur de bioconcentration
Lotufo et coll. (2000) ont réalisé des études sur les FBC avec des amphipodes d'eau douce et le p,p'-DDD. Le Hyallela azteca a été exposée à 0,178 μg/L de p,p'-DDD pendant 10 jours, et les Diporeia spp., à 0,174 μg/L pendant 28 jours. Les auteurs ont déterminé que le H. azteca était près de l'état d'équilibre ou l'avait atteint pendant la période d'exposition, comme l'indiquait l'inspection visuelle des courbes d'absorption et le fait que la période d'exposition correspondait à trois demi-vies ou plus d'élimination par cet organisme. En contrepartie, les Diporeia spp. n'ont pas atteint l'état d'équilibre pendant l'étude, une période de 623 jours aurait été nécessaire selon les calculs des auteurs. Le FBC présenté au tableau 7-4 pour les Diporeia spp. a été modifié afin de prendre en compte l'état d'équilibre et, par conséquent, les valeurs calculées du FBC.
Lotufo et coll. (2000) ont attribué certaines différences dans la bioaccumulation du p,p'–DDD entre le H. azteca et le Diporeia spp. à des facteurs comme les températures auxquelles les expériences ont été réalisées (la température ambiante pour le H. azteca et4 °Cpour les Diporeia spp.), la taille de l'organisme et la teneur en lipides des deux organismes.
En outre, Lotufo et coll. (2000) ont déterminé que le p,p'-DDD n'était pas biotransformé au cours d'une période d'exposition de 28 jours pour les Diporeia spp., ou d'une période d'exposition de 24 heures pour le H. azteca, étant donné qu'après ces périodes, la fraction de l'activité du 14C dans les tissus des organismes était supérieure à 98 %.
Comme nous l'avons indiqué plus haut, le mitotane possède deux formes optiquement actives appelées énantiomères, définies comme dextrogyre (+) ou lévogyre (-). Bien que les propriétés chimiques des deux énantiomères soient identiques, leur activité biologique pourrait différer. Par exemple, des résultats variables de la métabolisation énantiosélective du mitotane ont été obtenus chez des cochons miniatures, ce qui semble indiquer que des facteurs polymorphiques ont une incidence sur la chiralité de la métabolisation (Cantillana et coll., 2009). En revanche, Konwick et coll. (2006) n'ont relevé aucun signe de biotransformation propre à un énantiomère du mitotane dans la truite arc-en-ciel, leurs observations reposant sur des fractions énantiomériques constantes dans le poisson et une demi-vie diminuant selon la relation entre log Koe et log t½ établie pour les contaminants récalcitrants dans les poissons (Fisk et coll. 1998). Ainsi, bien que les données soient limitées, on peut considérer que l'activité métabolique propre à un énantiomère du mitotane est peu probable chez les organismes aquatiques.
Le FBA élevé de 892 473 L/kg (tableau 7-4) et le facteur de bioamplification (FBM) de 2,8 (tableau 7-5) qui ont été signalés pour le mitotane par Olivier et Niimi (1988) et Konwick et coll. (2006) respectivement, devraient être considérés comme des valeurs maximales puisque les poissons ont également été exposés à du DDT. L'absorption et la métabolisation du DDT ont probablement contribué à la concentration de DDD dans les poissons.
| Organisme d'essai, emplacement | Paramètre | Valeur[a] | Référence |
|---|---|---|---|
| Truite arc-en-ciel (Oncorhynchus mykiss) étude en laboratoire | FBM (depuis l'alimentation seulement; mitotane) | 2,8 | Konwick et coll. 2006 |
| Oligochètes exposés à 3 à 400 μg de p,p'-DDD/g de carbone organique | FABS (p,p'-DDD) | de 0,17 à 3,8 | Ingersoll et coll. 2005 |
| Amphipode (Rhepoxynius abronius) | FABS (mitotane) | 0,31 ± 0,10 | Meador et coll. 1997 |
| Polychète (Armandia brevis) | FABS (mitotane) | 2,4 ± 0,9 | Meador et coll. 1997 |
| Bivalves (couteaux, palourdes, moules et huîtres) | FABS (mitotane) | de 13,9 à 41,0 | Thompson et coll. 1999 |
(a) Normalisée aux [lipides]/[carbone organique].
FBAm = facteur de bioamplification
FABS = facteur d'accumulation biote-sédiments
Ingersoll et coll. (2005) ont mené une étude de 42 jours sur la colonisation par des invertébrés d'un étang comportant des plateaux sédimentaires enrichis en p,p'-DDD dont les concentrations se situaient entre 3 et 400 μg par gramme (g) de carbone organique (CO). Ils ont mesuré la bioaccumulation du p,p'-DDD par les oligochètes colonisant l'étang. Seules les deux concentrations les plus élevées (120 et 400 μg de p,p'-DDD/gco ) ont produit des FABS supérieurs à 1. La bioaccumulation du p,p'-DDD par les oligochètes a augmenté avec la hausse de la concentration du p,p'-DDD dans les sédiments. Toutefois, la plupart des concentrations testées sont plus élevées que celles qui ont été détectées dans la majorité des échantillons environnementaux. Par exemple, la concentration la plus élevée de mitotane décelée dans les sédiments, dans les provinces de l'Atlantique, était de 0,083 μg/kg p.s. (tableau 8-10).
Meador et coll. (1997) ont mené une étude du FABS pendant 10 jours sur l'amphipode marin Rhepoxynius abronius et le polychète Armandia brevis, collectés au large des côtes de l'état de Washington qu'ils ont exposés à des sédiments prélevés dans sept sites différents de la vaste étendue constituée par l'estuaire Hudson-Rarita de l'état de New York. Les sédiments de ces sites contenaient des concentrations entre 0,6 à 80 μg de mitotane par kg (poids sec). Les valeurs de FABS présentées dans le tableau 7-5 sont des valeurs moyennes, étant donné que les valeurs obtenues à chaque site ne sont pas présentées. La période d'absorption de 10 jours a été considérée comme étant suffisante pour que le A. brevis atteigne l'état d'équilibre; cependant le R. abronius était probablement loin d'être dans le même cas (Meador et coll. 1997), ce qui indique que la valeur du FABS serait encore plus élevée à l'état d'équilibre.
Thompson et coll. (1999) ont comparé les concentrations de résidus d'o,p'-DDT et de p,p'-DDT dans quatre espèces de bivalves et dans les sédiments d'une baie de l'océan Atlantique sur une côte de la France. Il est intéressant de noter que les habitants du milieu sédimentaire (couteau arqué [Solen marginatus] et palourde [Ruditapes philippinarum])ont principalement accumulé du mitotane (50 à 60 % de la totalité des résidus), même si le p,p'-DDD et le p,p'-DDT étaient les plus présents dans les sédiments, ce qui laisse entendre que la métabolisation du p,p'-DDD était rapide chez ces espèces. En revanche, la fraction de mitotane relative à la quantité totale de DDD dans les moules et les huîtres était semblable à celle des sédiments, ce qui semble indiquer une accumulation non sélective (ou une métabolisation s'il y a lieu) des isomères de DDE et de DDD. Les FABS déclarés dans cette étude étaient 13,9 pour les huîtres vivant dans les sédiments, 26,5 pour les couteaux arqués, 28,5 pour les moules, 30,7 pour les palourdes et 41,0 pour les huîtres vivant dans l'eau.
7.2.2 Modélisation du FBC et du FBA
Nous avons produit les estimations du FBC et du FBA pour le mitotane à l'aide de modèles fondés sur les relations quantitatives structure-activité (RQSA) et de modèles cinétiques de bilan massique. Les résultats de cette modélisation sont présentés au tableau 7-6 ci-dessous. Tous les modèles, à l'exception du modèle de régression linéaire du FBC, appliquaient une correction pour tenir compte de la vitesse de métabolisation (à taux constant kM). La valeur par défaut sans tenir compte de la métabolisation et la valeur corrigée pour tenir compte de la métabolisation sont toutes deux indiquées. Le modèle CPOP calcule la vitesse de métabolisation à partir de la probabilité que des réactions de biotransformation de la phase I et de la phase II se produisent en fonction de la structure du mitotane et en fonction du répertoire de voies de transformation du le modèle (Dimitrov et coll. 2005). La kM estimée avec cette méthode correspond à environ 0,01 d-1.
Les prévisions du bilan massique du FBC et du FBA ont été générées à l'aide du modèle BCFBAF (contenu dans la version 4.0 de l'application EPIWIN), lequel est fondé sur une version à trois niveaux trophiques du modèle de bilan massique de Arnot et Gobas (2003). Des constantes de vitesse de métabolisation peuvent être générées par le modèle BCFBAF d'EPIWIN à l'aide de la méthode fondée sur la RQSA (Arnot et coll., 2009) ou à l'aide de données empiriques de kM contenues dans les ensembles de données d'étalonnage ou de validation (Arnot et coll., 2008a et Arnot et coll., 2008b). La kM utilisée dans le modèle BCFBAF a été générée en se fondant sur l'étude de Konwick et coll. (2006) portant sur le FBAm de l'o,p'-DDD. Selon cette étude, la kM recommandée pour un poisson de 10 g à 15 °C est d'environ 0,015 d-1 (demi-vie de dépuration d'environ 45 jours). Les prévisions du FBC et du FBA obtenues à l'aide du modèle BCFBAF sont ensuite normalisées pour le poids (184 g) et la température (10 °C) d'un poisson de niveau trophique intermédiaire. Ces valeurs, qui sont présentées au tableau 7-6, représentent les conditions d'exposition moyennes au Canada. La routine de normalisation est décrite par Arnot et coll. (2008 b). Enfin, la valeur par défaut de l'efficacité d'assimilation alimentaire de 49 % n'a pas été corrigée en fonction de la valeur alpha de 42 ± 3 % signalée dans l'étude de Konwick et coll. (2006) sur le FBAm, car cela aurait peu d'effets sur le taux d'absorption alimentaire du mitotane et, par conséquent, peu d'incidence sur le FBA calculé. Dans tous les cas, le mitotane est pris en compte dans l'ensemble des domaines des modèles indiqués au tableau 7-6, ce qui comprend les domaines des paramètres globaux (log Koe et masse moléculaire) et de la métabolisation (kM) ainsi que les domaines mécaniste (diffusion passive) et structurelNote de bas de page3 (structure chimique).
| Organisme d'essai | Modèle (base du modèle) | Paramètre | Valeur (poids humide en L/kg) |
Référence |
|---|---|---|---|---|
| Poisson | BCFBAF (régression linéaire) | FBC, sans tenir compte de la métabolisation | 3 467 | BCFBAF 2008 |
| Poisson | BCFBAF (niveau trophique intermédiaire) | FBC, corrigé pour la métabolisation | 11 376 | BCFBAF 2008 |
| Poisson | BCFBAF (niveau trophique intermédiaire)' | FBA, corrigé pour la métabolisation | 148 936 | BCFBAF 2008 |
| Poisson | FBC (facteurs atténuants) | FBC, corrigé pour la métabolisation | 7 413 | CPOP 2008 |
À un log Koe d'environ 5,9, la fraction biodisponible prévue du mitotane dans la colonne d'eau, selon le modèle de bilan massique des poissons d'Arnot-Gobas, est d'environ 85 %, ce qui laisse entendre que l'absorption à partir de l'eau par les branchies est une exposition très appropriée dans le cas du mitotane. Si le log Kco de 5,4 est utilisé, la fraction biodisponible prévue est encore plus grande (environ 95 %). Ces données semblent indiquer que le FBC pourrait être la mesure la plus utile pour définir le potentiel de bioaccumulation du mitotane et que les voies alimentaires d'exposition contribueront de façon moins importante à la charge corporelle globale du mitotane dans les organismes pélagiques. En résumé, la majorité des valeurs modélisées du FBC et du FBA (tableau 7-6) ainsi que les valeurs empiriques du FBA et du FBAm (tableaux 7-4 et 7-5) indiquent que le mitotane est fortement bioaccumulable.
Les valeurs de FBC prévues laissent croire que le mitotane est très bioconcentré par les branchies à partir de la fraction biodisponible dans l'eau. Ces résultats correspondent aux valeurs de BFC observées chez les invertébrés aquatiques. Les valeurs de FBA estimées ci-dessus concordent assez bien avec les FBA mesurés sur le terrain pour le p,p'-DDD, dans le lac Ontario (Oliver et Niimi, 1988), ce qui semble indiquer que le FBA pour le mitotane est de l'ordre de 1 × 105 lorsque les concentrations dans les tissus sont comparées aux concentrations dans l'eau.
Arnot et Gobas (2006) ont fait une évaluation critique des données disponibles sur la bioaccumulation (FBC et FBA) des poissons et d'autres organismes. Ce travail, stimulé en partie par le processus de catégorisation réalisé par le gouvernement du Canada au début des années 2000, a donné lieu à la création d'une base de données comportant des valeurs empiriques de qualité du FBC et du FBA. Le Canada s'est servi de cette base de données pour la catégorisation et il l'utilise pour le Défi (Arnot et Gobas 2003). Dans Arnot et Gobas (2006), à une valeur de log Koe de 5,9 pour le mitotane et à une vitesse de transformation métabolique d'environ 0,01 à 0,02, la répartition empirique de données « acceptables » sur le FBC chez les poissons indique qu'il y a plusieurs produits chimiques dont les FBC chez les poissons répondent aux critères du Canada (FBA ou FBC ≥ à 5000). Nombre de ces produits sont également des composés organiques halogénés.
7.2.3 Conclusion
La très bonne concordance entre les différents éléments de preuve sur le mitotane laisse entendre que cette substance se bioaccumulera dans les organismes aquatiques à partir des voies d'exposition (eau et aliments) et que les réseaux trophiques la bioamplifieront. Cela correspond à de nombreux autres composés organiques halogénés ayant de faibles vitesses de biotransformation. Le log Koe et le log Kco pointent vers l'existence potentielle d'une importante fraction biodisponible de mitotane dans les eaux naturelles. Par conséquent, l'absorption par les branchies (que les tests de FBC permettent de mesurer) est suffisante pour s'attendre à ce que le FBC soit une donnée appropriée pour mesurer le potentiel de bioaccumulation du mitotane. Ce dernier a un log Koe, une vitesse de métabolisation et un FBC mesuré en laboratoire comparables à d'autres produits chimiques qui sont reconnus empiriquement pour se bioconcentrer par des facteurs excédant 5000 à partir de l'eau. De plus, les « faibles » vitesses de biotransformation calculées et observées dans les poissons laissent entendre que cette voie d'élimination ne sera pas vraiment importante chez les poissons et d'autres organismes aquatiques. Associé à un taux d'efficacité d'assimilation alimentaire relativement élevé, le mitotane devrait s'accumuler fortement dans les tissus des organismes aquatiques à partir du transfert alimentaire dans le tractus gastro-intestinal.
En tenant compte de la cohérence de la preuve susmentionnée et des hautes valeurs de FBA et FBC, mesurées et prédites, nous concluons donc au fort potentiel de bioaccumulation du mitotane et qu'il satisfait au critère de bioaccumulation au Canada avec un FBC dépassant 5000.
8. Potentiel d'effets nocifs sur l'environnement
8.1 Évaluation des effets écologiques
8.1.1 Milieu aquatique
Nous présentons les données empiriques (tableau 8-1) et modélisées (tableau 8-2) de la toxicité du mitotane sur les organismes aquatiques. Relativement peu de données expérimentales sont disponibles sur les effets macroscopiques ou touchant le corps entier (p. ex. développement anormal), mais il existe toutefois un certain nombre de résultats biochimiques. En raison de son utilisation comme médicament corticosurrénalien chez l'humain et le chien, la majorité de la recherche sur le mitotane est axée dans ce domaine. Il s'agit d'études biochimiques que l'on ne peut appliquer directement à tout l'organisme et l'absence de données quantitatives les élimine des considérations pour la production d'une valeur critique de toxicité pour l'analyse du quotient de risque. Les résultats de modélisation du tableau 8-2 présentent les effets du mitotane sur la croissance et la survie des organismes aquatiques. Des données empiriques sur la toxicité en milieu aquatique pour le corps entier sont également disponibles pour le p,p'-DDD, un analogue du mitotane (tableau 8-3).
Le p,p'-DDD est considéré comme un analogue convenant à l'évaluation de la toxicité chez les organismes aquatiques. En effet, selon ce qui est indiqué dans la section sur la bioaccumulation, la majorité des organismes aquatiques devraient avoir des capacités restreintes pour métaboliser le p,p'-DDD et l'o,p'-DDD. Toutefois, en raison de la susceptibilité accrue de l'o,p'-DDD à subir une transformation métabolique dans les mammifères et les oiseaux comparativement à celle du p,p'-DDD, le p,p'-DDD n'est pas considéré comme un analogue approprié pour l'étude de la toxicité chez les oiseaux et les mammifères.
Ensemble, ces résultats indiquent donc que le mitotane présente une toxicité élevée pour les organismes aquatiques après une exposition à court terme (aiguë) et une exposition à long terme (chronique) à des concentrations relativement faibles (c.-à-d. inférieures à 1 mg/L pour la toxicité aiguë).
| Organisme d'essai | Type d'essai | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|
| Mollusque : embryons de l'oursin violet (Strongylocentrotus purpuratus) | Développement anormal[a] (96 h) |
CE50[b] | 0,0676 | Roepke et coll. 2005 |
| Mollusque : embryons de l'oursin violet (Strongylocentrotus purpuratus) | Développement anormal[a] (51 h) |
CMEO[c] | 0,005 | Roepke et coll. 2005 |
| Poisson : truite arc-en-ciel (Oncorhynchus mykiss) |
Cortisol sécrété en réponse au stress (14 j) | CMEO[c] | 5 mg/kg p.c. (injection)[d] | Benguira et coll. 2002 |
| Poisson : Cellules interrénales de truite arc-en-ciel (Oncorhynchus mykiss) | Essai sur la viabilité des cellules (1 h) | CE50[b] | 123,37 | Leblond et Hontela 1999 |
| Poisson : Cellules interrénales de truite arc-en-ciel (Oncorhynchus mykiss) | Sécrétion de cortisol (1 h) | CE50[b] | 41,60 | Leblond et Hontela 1999 |
| Poisson : tilapia Tissu interrénal superfusé du Sarotherodon aureus | Sécrétion de cortisol (5 h) | CMEO[c] | 0,1 | Ilan et Yaron 1980 |
| Poisson omble chevalier (Salvelinus alpinus) | Réaction primaire de stress (23 h) | Aucune différence statistique avec le groupe témoin | 75 mg (voie orale) | Jorgenson et coll. 2001 |
| Insecte : larve de moustique | Mortalité (48 h) | CL50[e] | 0,015 | Deonier et coll. 1946 |
a Développement anormal incluant les larves retardées, anormales, allongées et naissantes.
b CE50 : Concentration d'une substance qu'on estime susceptible de causer un effet chez 50 % des organismes d'essai.
c CMEO : Concentration minimale avec effet observé, soit la concentration la plus faible d'une substance causant des effets statistiquement significatifs par rapport au groupe témoin dans un essai de toxicité.
d p.c. : poids corporel
e CL50 : Concentration d'une substance qu'on estime létale pour 50 % des organismes d'essai.
| Organisme d'essai | Type d'essai | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|
| Poisson | Toxicité aiguë (96 h) | CL50[a] | 0,096 | ECOSAR 2008 |
| Tête-de-boule | Toxicité aiguë (96 h) | CL50[a] | 0,023 | TOPKAT 2004 |
| Tête-de-boule | Toxicité aiguë (96 h) | CL50[a] | 0,087[b] | CPOP 2008 |
| Poisson | Toxicité chronique (30 j) | - | 0,013 | ECOSAR 2008 |
| Daphnie | Toxicité aiguë (48 h) |
CL50 | 0,096 | ECOSAR 2008 |
| Daphnie | Toxicité aiguë (48 h) |
CL50 | 0,063 | CPOP 2008 |
| Daphnie | Toxicité chronique[b] | -[e] | 0,021 | ECOSAR 2008 |
| Algues vertes | Toxicité aiguë (96 h) |
CE50[d] | 0,246[b] | ECOSAR 2008 |
| Algues vertes | Toxicité chronique[b] | - | 0,179[b] | ECOSAR 2008 |
| Ver de terre | Toxicité chronique (14 j) | CL50[a] | 220,7[b] | ECOSAR 2008 |
a CL50 : Concentration d'une substance qu'on estime létale pour 50 % des organismes d'essai.
b Étant donné que les concentrations pour la toxicité et l'hydrosolubilité sont souvent incertaines, seules les valeurs de toxicité ayant dépassé les estimations de la solubilité jusqu'à un facteur de 10 ont été jugées acceptables.
c La durée n'a pas été précisée.
d CE50 : Concentration d'une substance qu'on estime susceptible de causer un effet chez 50 % des organismes d'essai.
| Analogues | Organisme d'essai | Type d'essai | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|---|
| DDD[a] | Crustacé :Daphnia magna | Toxicité aiguë (26 h) | CL50[b] | 0,0046 | Frear et Boyd 1967 |
| DDD[a] | Crustacé : Hyalella azteca (dans l'eau interstitielle) | Toxicité chronique (10 j) | CL50 | 0,00077 | Lotufo et coll. 2000 |
| DDD[a] | Crustacés : Diporeia spp. | Toxicité chronique (10 j) | CL50 | 0,01168 | Lotufo et coll. 2000 |
| DDD[a] | Crustacés : Diporeia spp. | Toxicité chronique (10 j) | CE50[c] | 0,00287 | Lotufo et coll. 2000 |
| DDD[a] | Crustacés : Diporeia spp. | Toxicité chronique (28 j) | CL50 | 0,00196 | Lotufo et coll. 2000 |
| DDD[a] | Crustacé : Hyalella azteca | Toxicité chronique (28 j) | CE50 | < 0,00090 | Lotufo et coll. 2000 |
| p,p'-DDD | Crustacé :Hyalella azteca | Toxicité chronique (10 j) | CL50 | 0,00019 | Phipps et coll. 1995 |
| p,p'-DDD | Crustacé :Hyalella azteca (dans l'eau interstitielle) | Toxicité chronique (10 j) | CL50 | 0,00108 | Hoke et coll. 1994 |
| p,p'-DDD | Crustacé :Hyalella azteca | Toxicité chronique (10 j) | CL50 | 0,00019 | Hoke et coll. 1994 |
| p,p'-DDD | Insecte : Larves d'anophèles du paludisme (Anopheles quadrimaculatus) | Toxicité aiguë (48 h) | CL95[d] | 0,0025 | Deonier et Jones 1946 |
| p,p'-DDD | Insecte : Larves d'anophèles du paludisme (Anopheles quadrimaculatus) | Toxicité aiguë (48 h) | CL10CL100[e] | 0,005 | Deonier et Jones 1946 |
| p,p'-DDD | Insecte : Moucheron (Chironomus tentans) | Toxicité chronique (10 j) | CL50 | 0,00018 | Phipps et coll. 1995 |
| p,p'-DDD | Insecte : Plathelminthe (Phagocata gracilis) | Toxicité chronique (10 j) | CL50 | 0,6 | Bonner et Wells (1987) |
| p,p'-DDD | Insecte : Moucheron (Chironomus tentans) | Toxicité chronique (10 j) | CL50 | 0,00034 | Hoke et coll. 1997 |
| DDD[a] | Poisson : Truite arc-en-ciel | Toxicité aiguë (96 h) | CL50 | 0,07 | Mayer et Ellersieck1986 |
| DDD[a] | Poisson : Tête-de-boule | Toxicité aiguë (96 h) | CL50 | 4,4 | Mayer et Ellersieck1986 |
| DDD[a] | Poisson : Barbue de rivière | Toxicité aiguë (96 h) | CL50 | 1,5 | Mayer et Ellersieck1986 |
| DDD[a] | Poisson : Crapet arlequin | Toxicité aiguë (96 h) | CL50 | 0,042 | Mayer et Ellersieck1986 |
| DDD[a] | Poisson : Achigan à grande bouche | Toxicité aiguë (96 h) | CL50 | 0,042 | Mayer et Ellersieck1986 |
| DDD[a] | Poisson : Doré jaune | Toxicité aiguë (96 h) | CL50 | 0,014 | Mayer et Ellersieck1986 |
a Comprend le mitotane et le p,p'-DDD.
b CL50 : Concentration d'une substance qu'on estime létale pour 50 % des organismes d'essai.
c CE50 : Concentration d'une substance qu'on estime susceptible de causer un effet chez 50 % des organismes d'essai.
d CL95 : Concentration d'une substance qu'on estime létale pour 95 % des organismes d'essai.
e CL10CL100 : Concentration d'une substance qu'on estime létale pour 100 % des organismes d'essai.
Bien qu'il existe des preuves que le mitotane peut avoir une incidence sur la stéroïdogenèse et la sécrétion corticale chez les poissons, les oiseaux et les mammifères (Ilan et Yaron, 1980; Brandt et coll., 1992; Jönsson et coll., 1993; Jönsson et coll., 1994; Lund, 1994; Leblond et Hontela, 1999; Benguira et coll., 2002; Lacroix et Hontela, 2003), le paramètre empirique le plus sensible pour le mitotane était l'effet sur la croissance anormale chez l'embryon d'oursin violet, comme il est décrit ci-après.
Les effets du mitotane sur la physiologie, la reproduction et le développement de l'échinoderme ont été évalués pour déterminer s'ils peuvent empêcher le développement normal de deux espèces de larves d'oursins (Strongylocentrotus purpuratus et Lyyechinus anamesus) [Roepke et coll., 2005]. Le mitotane a été dissous dans du diméthylsulfoxyde (DMSO), puis ajouté aux flacons pour obtenir les concentrations de 0,005, 0,05 et 0,1 mg/L. À la suite d'un essai de 96 heures, les larves ont été divisées en cinq catégories (normales, retardées, anormales, allongées et naissantes) et elles ont été comparées (à l'aide d'un microscope) à la morphologie standard de larves « pluteus » dans le groupe témoin exposé à de l'eau de mer. Le bon développement au stade larvaire, comparativement aux organismes témoins, a été utilisé pour définir les relations concentration-réponse. La CE50 pour le mitotane a été estimée à 0,0676 mg/L chez S. purpuratus; des résultats similaires ont été constatés avec L. anamesus (données non présentées). Les concentrations plus élevées de mitotane ont entraîné une augmentation des pourcentages de larves retardées et morphologiquement anormales, et à 0,16 mg/L, les embryons non éclos constituaient 30 % de tous les embryons dénombrés (Roepke et coll., 2005).
En ce qui concerne les résultats des essais biochimiques, la capacité de susciter une réponse neuroendocrine au stress est une caractéristique fondamentale d'un écosystème sain, car elle permet à l'organisme de faire face aux situations de stress qui menacent l'homéostase. Des conditions de stress aigu activent l'axe hypothalamo-hypophyso-surrénalien des poissons téléostéens pour sécréter du cortisol (Benguira et coll., 2002). Les effets résultants peuvent inclure une perturbation de la croissance et de la fonction rénale, de même que des effets gonadosomatiques. Une altération de la capacité normale d'augmenter le niveau de cortisol plasmatique en réaction au stress aigu a été observée chez les poissons exposés de façon chronique à certains contaminants, y compris le mitotane (Benguira et coll., 2002).
On a étudié la sécrétion de cortisol en réponse au stress chez la truite arc-en-ciel (Oncorhynchus mykiss) exposée au mitotane en induisant le stress dans les conditions de confinement dans un espace réduit (Leblond et Hontela, 1999; Lacroix et Hontela, 2003; Benguira et coll., 2002). Une diminution liée à la dose du cortisol plasmatique a été constatée 14 jours après l'injection, ce qui indique que, contrairement au groupe témoin, les poissons traités avec le mitotane à des doses de 5 mg/kg avaient une capacité réduite d'augmentation des niveaux de cortisol plasmatique (Benguira et coll. 2002). Les effets du mitotane sur la viabilité des cellules interrénales de la truite arc-en-ciel (Oncorhynchus mykiss)et la sécrétion de cortisol par ces cellules ont également étéexaminés à l'aide d'un essai in vitro de 60 minutes (Leblond et Hontela, 1999). La CL50 et la CE50 pour le mitotane ont été calculées à 123,37 et 41,60 mg/L, respectivement (Leblond et Hontela, 1999).
Des effets semblables ont été observés par un autre groupe dans les tissus interrénaux du Sarotherodon aureus à la suite d'une exposition in vivo et in vitro au mitotane. Dans le cadre de cette étude, on a noté une inhibition de la sécrétion de cortisol par le mitotane in vitro par des cellules interrénales superfusées à de faibles concentrations comme 0,1 mg/L (Ilan et Yaron, 1980). Toutefois, dans une autre étude où l'on a administré une dose orale de 75 mg/kg de mitotane à des ombles chevaliers (Salvelinus alpinus), aucun effet sur la réaction au stress physiologique (mesurée par les niveaux de corticotrophine plasmatique et de cortisol post-stress) n'a été observé 28 jours après l'administration (Jorgensen et coll., 2001).
Les données de modélisation présentées au tableau 8-2 indiquent que le mitotane devrait avoir une toxicité aiguë et une toxicité chronique élevées chez les poissons, les daphnies et les algues. Dans le modèle ECOSAR (2008), le mitotane a été modélisé comme une substance organique neutre. Les poissons ont été identifiés comme étant les plus sensibles, une valeur de toxicité de 0,013 mg/L ayant été prévue par le modèle pour les poissons exposés pendant 30 jours. Le Koe utilisé pour la modélisation se situait dans le domaine d'applicabilité (log Koe < 8,00). Dans le modèle CPOP (2008), le mitotane a été modélisé en tant que « narcotique de surface de base », et il se situait à 89 % dans le domaine structurel du modèle des prévisions liées aux daphnies et à 94 % dans le domaine structurel des prévisions liées aux poissons.
Le mitotane et son isomère de position, le p,p'-DDD, ont fait l'objet d'essais sur des moustiques au début du quatrième stade larvaire (Anopheles quadrimaculatus) dans des suspensions d'eau et d'acétone pour que l'on évalue leurs effets. Le pourcentage de mortalité a été mesuré après 24 et 48 heures pour les concentrations de mitotane entre 0,0025 et 0,005 mg/L (Deonier et Jones, 1946). Après 24 heures, l'exposition à 0,005, 0,0033 et 0,0025 mg/L de mitotane a entraîné des taux de mortalité de 88 %, 68 % et 58 % chez les larves de moustique, respectivement. Des effets toxiques similaires ont été observés après 48 heures, des taux de mortalité de 100 %, 93 % et 95 % ayant été observés chez les larves de moustique aux concentrations de 0,005, 0,0033 et 0,0025 mg/L de mitotane, respectivement. On estime que les effets observés du p,p'-DDD sur les larves de moustique pourraient ne pas être représentatifs de la toxicité du mitotane. Ainsi, nous n'avons pas inclus ces valeurs dans l'évaluation quantitative des risques, bien que nous les présentons ici.
La toxicité en milieu aquatique du p,p'-DDD à l'égard du Chironomus tentans a été évaluée dans un autre essai de toxicité de 10 jours n'impliquant que de l'eau (Phipps et coll. 1995). La CL50 a été estimée à 0,00018 mg/L après l'ajustement en fonction du taux de mortalité dans le groupe témoin. Hoke et coll. (1997), qui ont effectué une étude semblable avec la même période d'exposition et le même organisme aquatique que Phipps et coll. (1995), ont obtenu une CL50 de 0,00034 mg/L. Bonner et Wells (1987) ont évalué la toxicité chronique en milieu aquatique du p,p'-DDD et d'autres dérivés du p,p'-DDT sur des plathelminthes (Phagocata gracilis). La CL50 au dixième jour était de 0,6 mg/L pour le p,p'-DDD. Il est intéressant de noter que la valeur de toxicité était inférieure à celles obtenues pour le même paramètre mesuré avec du p,p'-DDE (2,63 mg/L) et du p,p'-DDT (3,98 mg/L).
Le taux de survie chez le Daphnia magna à la suite d'une exposition de 26 heures au DDD a fait l'objet d'un essai. La concentration létale médiane (CL50) pour le DDD a été mesurée à 0,0046 mg/L (Frear et Boyd, 1967). La toxicité en milieu aquatique du p,p'-DDD à l'égard du H. azteca a été évaluée dans un autre essai de toxicité de 10 jours n'impliquant que de l'eau (Hoke et coll., 1994). La CL50 a été estimée à 0,00019 mg/L après l'ajustement en fonction du taux de mortalité dans le groupe témoin. Phipps et coll. (1995) ont obtenu le même résultat lors d'un essai de toxicité semblable. Hoke et coll. (1994) ont également mesuré la toxicité en milieu aquatique du p,p'-DDD pour Hyallela azteca dans un essai de toxicité de 10 jours dans de l'eau interstitielle. La CL50 obtenue était de 0,00108 mg/L. La toxicité chronique en milieu aquatique du DDD a été testée chez deux espèces d'amphipodes, soit à 10 jours et à 28 jours pour Diporeia spp.et à 10 jours seulement pour Hyallela azteca (Lotufo et coll. 2000). L'immobilisation s'avère l'effet observé chez les amphipodes; les organismes complètement immobiles étaient présumés morts. Les valeurs de CE50 et de CL50 après 10 jours pour le Diporeia spp. étaient de 0,00287 mg/L et 0,01168 mg/L, respectivement. L'essai de 10 jours sur Hyallela azteca effectué par Lutufo et coll. (2000) dans l'eau interstitielle a permis d'obtenir une CL50 de 0,00077 mg/L, valeur légèrement inférieure aux résultats obtenus par Hoke et coll. (1994) lors d'une étude semblable. La CE50 après 28 jours n'est pas concluante, mais la CL50 montre clairement, par rapport à une expérience similaire de 10 jours, que l'exposition pendant une période supplémentaire augmente l'effet sur les organismes. Cette étude vient appuyer l'hypothèse selon laquelle le mitotane pourrait avoir des effets à long terme importants.
Mayer et Ellersieck (1986) ont effectué une série de mesures de la toxicité aiguë du DDD sur six espèces de poisson (truite arc-en-ciel, tête-de-boule, barbue de rivière, crapet arlequin, barbue de rivière, achigan à grande bouche et doré jaune). Les CL50 après 96 h variaient entre 0,014 et 4,4 mg/L.
Comme il a été mentionné précédemment, la chiralité de la molécule de mitotane a indiqué qu'une métabolisation énantiosélective peut se produire. Une activité propre à un énantiomère n'a pas été décelée chez la truite arc-en-ciel (Konwick et coll., 2006), seulement chez des mammifères (Cantillana et coll., 2009). De plus, Konwick et coll. (2006) ont constaté que les taux de dépuration du mitotane et du p,p'-DDD étaient très similaires. Ces résultats laissent entendre que les analogues ont une activité métabolique semblable dans les poissons. Un métabolisme similaire peut être un indicateur d'une toxicité ou d'un comportement semblable chez les organismes aquatiques.
Pour résumer, les données expérimentales et modélisées sur le mitotane et son analogue indiquent la nocivité aiguë et la nocivité chronique du mitotane en faible concentration pour plusieurs espèces d'organismes aquatiques.
8.1.2 Autres milieux naturels
Aucune donnée empirique sur la toxicité du mitotane dans les sédiments pour les organismes benthiques n'a été recensée. Cependant, des données empiriques sur l'analogue p,p'-DDD étaient disponibles et elles sont résumées ci-dessous (tableau 8-4).
8.1.2.1 Toxicité des sédiments
| Analogue | Organisme d'essai | Type d'essai | Paramètre | Valeur (µg/gco) | Référence |
|---|---|---|---|---|---|
| p,p'-DDD | Nématodes | Toxicité chronique (12 sem.) | CI25[a] | 260 | Ingersoll et coll. 2005 |
| p,p'-DDD | Nématodes | Toxicité chronique (12 sem.) | CI50[b] | 400 | Ingersoll et coll. 2005 |
| p,p'-DDD | Oligochètes | Toxicité chronique (12 sem.) | CI25 | > 400 | Ingersoll et coll. 2005 |
| p,p'-DDD | Oligochètes | Toxicité chronique (12 sem.) | CI50 | > 400 | Ingersoll et coll. 2005 |
| p,p'-DDD | Chironomes | Toxicité chronique (12 sem.) | CI25 | 47 | Ingersoll et coll. 2005 |
| p,p'-DDD | Chironomes | Toxicité chronique (12 sem.) | CI50 | 85 | Ingersoll et coll. 2005 |
a CI25 : concentration dans les sédiments chargés en DDD entraînant une inhibition de 25 % de la colonisation des plateaux.
b CI50 : concentration dans les sédiments chargés en DDD entraînant une inhibition de 50 % de la colonisation des plateaux.
c gco : masse du carbone organique en grammes
Ingersoll et coll. (2005) ont évalué l'abondance de plusieurs taxons d'invertébrés dans une étude de 12 semaines sur la colonisation. Les sédiments ont été enrichis de p,p'-DDD (dissous dans l'acétone) à des concentrations variant de 3,0 à 400 µg de p,p'-DDD/gco (grammes de carbone organique). Des témoins négatifs et des solvants témoins ont été inclus. Aucune différence significative n'a été observée dans l'abondance des invertébrés entre les deux groupes témoins. L'abondance de nématodes était considérablement amoindrie à 400 µg de p,p'-DDD/gco , le nombre de chironomidés a considérablement diminué à 120 et à 400 µg de p,p'-DDD/gco . Les valeurs de CI25 variaient de 47 à plus de 400 µg de p,p'-DDD/gco , et celles de CI50 allaient de 85 à plus de 400 µg de p,p'-DDD/gco (Ingersoll et coll., 2005). Cette étude indique qu'un analogue proche du mitotane peut avoir une incidence sur l'abondance de plusieurs taxons d'invertébrés aquatiques exposés à des sédiments contaminés. Par conséquent, le mitotane devrait causer des effets semblables lorsqu'il est présent à des concentrations similaires dans les sédiments (tableau 8-4).
8.1.2.1.1. Toxicité terrestre pour les algues
Des données empiriques sur le mitotane et l'analogue p,p'-DDD dans le sol étaient disponibles (tableau 8-5). Les microalgues sont utilisées comme substituts pour détecter les substances chimiques dans les essais de toxicité aqueuse, car elles sont généralement plus sensibles que les plantes vasculaires (Chung et coll., 2007). Les algues vivent dans des sols humides et les milieux aquatiques (Wehr et Sheath 2002) et elles constituent un élément important de l'écosystème du sol (Chung et coll. 2007). Un essai de 4 jours sur des microalgues en phase solide a été élaboré pour détecter les effets phytotoxiques du DDD sur l'écosystème terrestre, à l'aide de trois espèces de microalgues (Selenastrum capricornutum, Chlorococcum hypnosporum et Chlorococcum meneghini, une microalgue du sol). Le milieu d'essai était de la silice fondue et lavée. Les effets du DDD sur les valeurs de fluorescence, la densité cellulaire des algues, et les concentrations de chlorophylle a ont été observés, et les valeurs de CE50 et de CE10 pour chaque espèce ont été obtenues à partir des relations dose-réponse. Le C.meneghini était l'espèce d'algue la plus sensible aux effets du DDD sur la densité cellulaire (CE50 = 179 mg/kg) et la teneur en chlorophylle a (CE50 = 150 mg/kg). La densité cellulaire est directement liée à la croissance et à la reproduction des algues. Par ailleurs, la densité cellulaire et les résultats de la fluorescence indiquent que l'efficacité du transfert d'énergie, des protéines collectrices de lumière au photosystème II, a été réduite sous l'influence du DDD. Les résultats de ces essais ont été comparés aux essais de l'EPA des États-Unis sur la germination de graines et l'élongation des racines sur le Lolium perenne : les CE50 obtenues avec du DDD pour la germination des graines et la longueur des racines étaient supérieures à 1 000 mg/kg(Chung et coll., 1997). Ainsi, on a découvert que les essais de microalgues étaient plus sensibles.
| Substance | Organisme d'essai | Type d'essai | Paramètre | Valeur (mg/kg) | Référence |
|---|---|---|---|---|---|
| DDD[a] | Selenastrum capricornutum | Toxicité chronique (4 jours) |
CE50[b] | 246 à > 500 | Chung et coll. 2007 |
| DDD[a] | Selenastrum capricornutum | Toxicité chronique (4 jours) |
CE10[c] | 0,77 à > 6,5 | Chung et coll. 2007 |
| DDD[a] | Chlorococcum hypnosporum | Toxicité chronique (4 jours) |
CE50 | 457 à > 1000 | Chung et coll. 2007 |
| DDD[a] | Chlorococcum hypnosporum | Toxicité chronique (4 jours) |
CE10 | 57 à > 1 000 | Chung et coll. 2007 |
| DDD[a] | Chlorococcum meneghini | Toxicité chronique (4 jours) |
CE50 | 150 à > 700 | Chung et coll. 2007 |
| DDD[a] | Chlorococcum meneghini | Toxicité chronique (4 jours) |
CE10 | 13 à > 35 | Chung et coll. 2007 |
| DDD[a] | Lolium perenne | Toxicité chronique (5 jours) | CE50 | > 1000 | Chung et coll. 2007 |
| DDD[a] | Lolium perenne | Toxicité chronique (5 jours) | CE10 | 114 à > 1000 | Chung et coll. 2007 |
a Inclut l'o,p'-DDD et le p,p'-DDD.
b CE50 : Concentration d'une substance qu'on estime susceptible de causer un effet chez 50 % des organismes d'essai.
c CE10 : Concentration d'une substance qu'on estime susceptible de causer un effet chez 10 % des organismes d'essai.
8.1.3 Conclusions sur la toxicité
Les résultats des essais de toxicité aiguë et chronique du mitotane et de son analogue, le p,p'-DDD, effectués sur des insectes, des poissons, des mollusques et des crustacés indiquent un potentiel d'effets à de faibles concentrations pour plusieurs organismes aquatiques. Les larves d'insectes constituaient la classe la plus sensible parmi les organismes aquatiques étudiés, des effets chroniques ayant été observés à des concentrations aussi faibles que 0,00018 mg/L chez les larves de moucheron. À cause de la présence d'indices suggérant que l'effet du mitotane sur les insectes pourrait être différent de celui de son analogue et bien que les larves d'insectes constituent la classe d'organisme la plus sensible, nous n'avons pas considéré que la valeur du p,p'-DDD produisant des effets sur cette classe était pertinente pour l'analyse du quotient de risque. Les crustacés constituaient une classe d'organismes très sensibles comme l'indique la concentration de 0,00019 mg/L produisant des effets chroniques sur Hyalella azteca. Des essais biochimiques menés sur des poissons indiquent que des cellules surrénales et hépatiques peuvent subir les effets du mitotane à des concentrations modérées.
8.2 Évaluation de l'exposition dans l'environnement
Nous avons recensé aux tableaux 8-6 à 8-11 des données sur les concentrations de mitotane dans l'environnement au Canada et ailleurs. Étant donné l'abondance de ces données, seuls les résultats des études plus récentes sont présentés pour montrer la répartition actuelle de cette substance dans l'environnement. Nous estimons que c'est son utilisation ancienne comme pesticide plutôt que son utilisation actuelle comme médicament sous ordonnance qui a contribué le plus aux concentrations mesurées de mitotane dans les sédiments, l'air et le sol.
| Lieu | Année | Seuil de détection (pg/m3) | Nombre et Pourcentage d'échantillons au–dessus du seuil de détection | Fourchette de concentration (pg/m3) |
Médiane (pg/m3) | Référence |
|---|---|---|---|---|---|---|
| Alert, Canada | 1992–1995 | 0,3 | 154 (6,9 %) | 0,024–1,707 | 0,051 | NatChem 2002 |
| Alert, Canada | 2002–2007 | 0,05-0,10 | 285 (14 %) | s.d. :1,599 | 0,061 | Hung et coll. 2010; comm. perso. sans référence |
| Burnt Island, Egbert et Point Petre, Canada | 2003 | N.D. | inconnu (N.D.) | s.d. : 1,354 | 0,248 | NatChem 2002 |
| Lethbridge, Lundbreck, Lacombe et Vegreville, (Canada) | 1999–2000 | 50 | 68 (0 %) | < s.d.. | N.D. | Kumar 2001 |
| Sept sites à proximité des Grands Lacs (Canada) | 1996–2003 | N.D. | Inconnu (N.D.) | 0,31–8,8 (phase gazeuse) | (moyenne) 2,08 | Sun et coll. 2006 |
| Pointe Pelée, Canada | 2004-2005 | 0,3-0,7 | 18 (N.D.) | 5 cm au–dessus du sol : 25-360 | (moyenne) 150 | Kurt-Karakus et coll. 2006 |
| Pointe Pelée, Canada | 2004-2005 | 0,3-0,7 | 18 (N.D.) | 20 cm cm au–dessus du sol : 20-230 | (moyenne) 120 | Kurt-Karakus et coll. 2006 |
| Pointe Pelée, Canada | 2004-2005 | 0,3-0,7 | 18 (N.D.) | 72 cm cm au–dessus du sol : 10-110 | (moyenne) 70 | Kurt-Karakus et coll. 2006 |
| Pointe Pelée, Canada | 2004-2005 | 0,3-0,7 | 18 (N.D.) | 200 cm au–dessus du sol : 7-90 | (moyenne) 40 | Kurt-Karakus et coll. 2006 |
ND : non disponible
| Lieu | Année | Seuil de détection (μg/kg) | Nombre d'échantillons | Pourcentage d'échantillons au–dessus du seuil de détection | Fourchette de concentration (pg/m3) |
Médiane (μg/kg) | Référence |
|---|---|---|---|---|---|---|---|
| Vallée de l'Okanagan et vallée du Fraser (Canada) | 2000–2001 | 1 | 11 | 73 | s.d : 250 | 36 | Bidleman et coll. 2006 |
| Marais Bradford-Holland (Canada) | 2004–2005 | 1,1 | inconnu | N.D. | N.D. | (moyenne) 400)(moyenne) 1200 | Kurt-Karakus et coll. 2006 Meijer et coll. (2003 |
| Pointe Pelée (Canada) | 1997–2006 | 0,58 | 275 | N.D. | s.d. : 11400[a] | moyenne géométrique : 40[a] | Crowe et Smith 2007 |
(a) Somme des o,p'-DDD et p,p'-DDD
N.D. : non disponible
| Lieu | Année | Seuil de détection | Nombre d'échantillons | Pourcentage d'échantillons au–dessus du seuil de détection | Fourchette de concentration (pg/m3) | Médiane (μg/kg) | Référence |
|---|---|---|---|---|---|---|---|
| Vallée de l'Okanagan et vallée du Fraser (C-B); | 2003–2005 | 0,001 ng/L | 27 | 37 | s.d. : 0,2 | N.D. | Environnement Canada 2009a |
| Bassin du ruisseau Johnson (Oregon) | 1998–2002 | 0,001 μg/L | 32 | 0 | s.d. | N.D. | Tanner et Lee 2004 |
N.D.; non disponible, .p.s. :poids sec, s.d. : seul de détection
| Lieu | Année | Seuil de détection | Nombre d'échantillons | Pourcentage d'échantillons au–dessus du seuil de détection | Fourchette de concentration | Médiane | Référence |
|---|---|---|---|---|---|---|---|
| Provinces de l'Atlantique (Canada); | 1995–2006 | S.O. | 26 | N.D. | s.d. : 25,5 ng/L | 8 ng/L | Environnement Canada 2010 |
N.D. : non disponible
| Lieu | années | Seuil de détection | Nombre d'échantillons | Pourcentage d'échantillons au–dessus du seuil de détection | Fourchette de concentration (μg/kg) | Médiane (μg/kg) | Référence |
|---|---|---|---|---|---|---|---|
| Provinces de l'Atlantique (Canada | 1995–2006 | N.D. | 55 | N.D. | s.d. : 0,08 p.s. | 0,003 | Environnement Canada 2010 |
| 20 États échantillonnés (États-Unis); | 1992–1995 | 1 μg/kg p.s | 350 | 11 % | s.d. :150 p.s. | N.D. | Wong et coll. 2000 |
p.s. : poids sec, s.d. : seuil de détection, N.D. : non disponible
L'o,p'-DDT n'a pas été mesuré dans les sédiments du fleuve Saint-Laurent (Pham et coll. 1993), mais du mitotane y a été détecté. L'o,p'-DDT était présent en tant que partie importante des dérivés du DDT dans la phase particulaire en suspension dans le fleuve Saint-Laurent (Pham et coll., 1993). On s'attend à ce que l'o,p'-DDT se dégrade rapidement en mitotane lorsqu'il se dépose dans les sédiments. Garrison et coll. (2000) ont démontré que l'o,p'-DDD est le principal métabolite produit par la dégradation de l'o,p'-DDT dans les sédiments marins, alors que l'o,p'-DDE, produit de dégradation de l'o,p'-DDT dans des conditions aérobies (voir le tableau 4-1), est présent en quantité plus importante dans les sédiments d'eau douce (Wandiga et coll., 2003).
En réalité, on ne détecte pas de mitotane dans une grande proportion d'échantillons prélevés dans tous les milieux naturels, ce qui pourrait être attribuable à des seuils de détection élevés, notamment dans l'air. De plus, même si de plus en plus de pays imposent des restrictions sur l'utilisation du DDT, aucun changement dans les concentrations de mitotane dans l'air n'a été observé entre 1992 et 1995 (NatChem, 2002) et entre 2002 et 2007 (Hung et coll., 2010). Le mitotane a été détecté dans les précipitations reçues dans les provinces du Canada atlantique, où les concentrations de mitotane étaient plus élevées que celles dans les eaux de surface (voir les tableaux 8.8 et 8-9). L'atmosphère semblerait être un important vecteur de transport lié à la contamination dans ce secteur.
Au Canada, des concentrations relativement élevées de mitotane ont été détectées dans le sol des zones agricoles intensives des vallées de l'Okanagan et du Fraser (Colombie-Britannique) ainsi que de la pointe Pelée (Ontario).
On a trouvé des données sur les concentrations d'isomères du mitotane et du DDD dans les organismes aquatiques au Canada, aux États-Unis et au Groenland (tableau 8-7). Les concentrations de mitotane mesurées chez les organismes variaient de 0,07 à 736 μg/kg poids humide. Les concentrations les plus élevées ont généralement été observées dans les lipides des organismes.
| Organisme | Lieu | Années | Tissus échantillonnés | Nombre d'échantillons | Plage de concentration (ph) μg/kg | Médiane (μg/kg) | Référence |
|---|---|---|---|---|---|---|---|
| Rorqual bleu | Fleuve Saint-Laurent (Canada) | 1992–1995 | Spécimen entier (lipide) | inconnu | 3,7–736[a] | 130[a] | Université Trent 2002 |
| Carpe commune (Cyprinus carpio) | Las Vegas Bay (É.-U.) | 1999–2000 | Spécimen entier | 129 | 5–122 | 7,9 | USGS 2000 |
| Achigan à grande bouche et orphie de la Floride | Hillsboro Canal (sud de la Floride, E.-U.) | 1995 | Spécimen entier | Inconnu | 5–34 | N.D. | USGS 2002 |
| Poisson (8 espèces) | Lac Michigan (E.-U.) | 1990 | Échantillons composites de poissons entiers | 23 | 0,13–81,70 | 5,83 | Giesy et coll. 2004 |
| Poissons | 20 états échantillonnés (É.-U) | 1992–1995 | Spécimen entier | 231 | 5–360 | N.D. | Wong et coll. 2000 |
| Bivalve | 20 états échantillonnés (É.-U) | 1992–1995 | Spécimen entier | 118 | 5–20 | N.D. | Wong et coll. 2000 |
| Saumon | Alaska (E.-U.) | 2001–2002 | Spécimen entier | Inconnu | 0.07–0,91 | N.D. | Alaska Department of Environmental Conservation 2010 |
| Poisson; flétan noir, chimère des profondeurs, tambour ocellé, poisson-loup, grenadier berglax, aiguillat noir, hoki et brosme | Détroit de Davis, ouest du Groenland, (Danemark) | 1992 | Spécimen entier | Inconnu | 0,8-28 | (moyenne)7,5 | Berg et coll. 1997 |
| Touladi | Lac Ontario, lac Michigan, lac Huron, lac Supérieur, Ontario, Canada et États-Unis | 1999-2000 | Échantillons composites de poissons | 74 | s.d. : 47,4 | 4,51 | Communication personnelle entre la Division de l'évaluation écologique d'Environnement Canada, le Bureau du programme national des Grands Lacs de l'Environmental Protection Agency des États-Unis et le Centre canadien des eaux intérieures d'Environnement Canada, source non citée[b] |
| Doré jaune | Lac Érié, Ontario, Canada et États-Unis | 1999-2000 | Échantillons composites de poissons | 13 | s.d. : 3,28 | 1,64 | Communication personnelle entre la Division de l'évaluation écologique d'Environnement Canada, le Bureau du programme national des Grands Lacs de l'Environmental Protection Agency des États-Unis et le Centre canadien des eaux intérieures d'Environnement Canada, source non citée[b] |
| Poisson (13 espèces) | Fleuve Saint-Laurent, Québec | 1995-1997 | Spécimen entier | 156 | <1–26[a] | 1,5[a] | Laliberté 2003 |
a Somme du o,p'-DDD et du p,p'-DDD.
b Avec la permission de l'Agence de protection de l'environnement des États-Unis, Bureau du programme national des Grands Lacs (Chicago, IL) et le Centre canadien pour les eaux intérieures (Burlington, ON)
s.d. : seuil de détection
8.2.1 Rejets provenant de l'utilisation du mitotane comme médicament d'ordonnance
La portion non métabolisée par les humains du mitotane présent dans un médicament sur ordonnance peut être excrétée dans les eaux usées. Le traitement des eaux usées n'en retire que partiellement le mitotane qui pourra ainsi être rejeté avec les effluents dans les eaux de surface. Nous avons prédit sa concentration dans les eaux de surface près du point de rejet des systèmes de traitement des eaux usées afin d'évaluer le risque encouru par les organismes aquatiques. Nous avons calculé les concentrations environnementales estimées (CEE) à l'aide de l'équation suivante :
CEE= (1000 × Q × L) × (1 – R) / (F × D)
où
CEE est la concentration estimée prédite de mitotane dans les eaux de surface près du point de rejet d'un système de traitement des eaux usées (mg/L) :
1000 est le facteur de conversion (mg/g)
Q est la masse de mitotane consommée quotidiennement par un patient (g/j)
L est le mitotane éliminé dans les eaux usées (fraction)
R est la proportion de mitotane retirée par le système de traitement des eaux usées (fraction)
F est le débit d'effluent hors du système de traitement des eaux usées (L/j)
D est le facteur de dilution dans l'eau de surface réceptrice (sans dimension)
Puisque le médicament est prescrit à un nombre limité de patients au Canada, le mitotane devrait être rejeté dans quelques sites seulement en tout temps. Comme l'on ne connaît pas l'emplacement des systèmes de traitement des eaux usées recevant du mitotane et parce que le nombre de patients qui en consomment est faible, la dose quotidienne de médicament administrée à un seul patient (moins la fraction métabolisée ou absorbée) a été utilisée comme masse rejetée à un système de traitement d'eaux donné pour trouver la proportion de points de rejets qui pourrait présenter un risque si le mitotane était utilisé et excrété par un résident dans la région visée. Nous avons calculé les concentrations dans l'environnement pour environ 1 000 points de rejet de systèmes de traitement d'eau à travers le Canada. Le calcul repose sur les données de départ et hypothèses suivantes :
- la dose quotidienne moyenne par patient est de 9 g selon la Bristol-Myers Squibb Company (2010)
- une perte dans les égouts de 60 % de la dose quotidienne recommandée soit la portion non absorbée ou non métabolisée par le patient
- un taux d'élimination dans les eaux usées par le système de traitement estimé à 87 % par l'entremise des lagunes aérées et facultatives (estimation de STP-EX, 2008), à 54,6 % en cas de traitement primaire seulement (estimé par ASTreat 1.0, 2006) et à 68,1 % en cas de traitements primaire et secondaire combinés (estimé par SimpleTreat 3.0, 1997)
- un facteur de dilution dans l'eau réceptrice entre 1 et 10.
Un traitement dure entre 4 et 48 mois (Hutter et Kayhoe, 1966; Baudin et coll., 2001; Terzolo, Angeli et coll., 2007; Attivi, 2010; Brunton et coll., 2005, ASHP, 2010). La durée d'administration de médicament sur ordonnance est variable, mais on estime que le traitement moyen s'étend sur toute une année. Chaque année, entre 100 et 1 000 kg de mitotane sont prescrits au Canada à une population constituée de 30 à 304 patients.
La concentration environnementale estimée (CEE) de mitotane dans les plans d'eau récepteurs à proximité des points de rejets de systèmes de traitement d'eau se situe entre 8,8 ×10−8 et 0,25 mg/L. Environnement Canada (2013) donne plus détails sur le calcul des CEE.
La concentration environnementale estimée (CEE) de mitotane dans les plans d’eau récepteurs à proximité des points de rejets de systèmes de traitement d’eau se situe entre 8,8 ×10−8 et 0,25 mg/L. Environnement Canada (2013) donne plus détails sur le calcul des CEE.
8.3 Caractérisation des risques pour l'environnement
La démarche suivie dans cette évaluation écologique préalable a consisté à étudier les informations scientifiques et techniques pertinents et d'en tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence, conformément à la LCPE. Les éléments de preuve pris en compte incluent des renseignements sur les sources et les quantités de rejet, la persistance, la bioaccumulation, l'écotoxicité et les résultats du calcul du quotient de risque.
8.3.1 Possibilité de rejet
Jusqu'aux années 1970, le DDT était appliqué en grandes quantités sur le sol et pulvérisé dans l'air au Canada. En conditions anaérobies dans le sol, l'eau et les sédiments, l'o,p'-DDT se dégrade en o,p'–DDD (mitotane). Les résultats de la modélisation de la fugacité (tableau 7-1) montrent que le mitotane rejeté dans l'air et sur le sol demeure finalement dans le sol ou les sédiments. L'utilisation passée de DDT et de dicofol a probablement donné lieu à de faibles concentrations répandues dans tous les milieux naturels. On considère que les résultats de surveillance du milieu ambiant des tableaux 8-6 à 8-11 reflètent surtout son utilisation passée comme pesticide plutôt que son utilisation actuelle comme médicament. Le mitotane a été détecté dans le biote pour de nombreuses espèces, ce qui laisse supposer une exposition environnementale au mitotane ou à l'un de ses composés d'origine liés au DDT.
Le mitotane est actuellement utilisé comme agent chimiothérapeutique. Conséquemment, il peut être rejeté dans les égouts, puis dans l'eau, après être passé par un système de traitement des eaux usées. À cause de sa solubilité faible, de sa volatilité plutôt faible et de sa forte valeur de log Koc, le mitotane une fois consommé comme médicament prescrit est rejeté dans l'environnement et devrait se retrouver dans l'eau, les biosolides des boues de systèmes de traitement des eaux usées et les sédiments près des points de rejet.
La présence de mitotane dans l'environnement ambiant (loin des points de rejets des systèmes de traitement des eaux usées) devrait largement résulter de son utilisation passée comme pesticide plutôt que son l'utilisation pharmaceutique actuelle.
8.3.2 Persistance
Dans les sédiments, la demi-vie de dégradation anaérobie primaire du mitotane a été estimée par Huang et coll. (2001) comme étant supérieure à 250 jours, après une période initiale d'élimination relativement rapide. Cette interprétation est cohérente avec les résultats de la modélisation (tableau 7-2). Tous les modèles de dégradation portent à croire que le mitotane se biodégrade très lentement dans le milieu aquatique. L'extrapolation des données aux sols et aux sédiments indiquent que la dégradation est aussi très lente dans les conditions aérobies de ces milieux. Par conséquent, les données disponibles appuient la conclusion selon laquelle le mitotane répond aux critères de persistance dans l'air, l'eau et le sol énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Les concentrations de mitotane mesurées dans différents milieux découlant probablement de son utilisation passée comme pesticide confirment sa présence et sa persistance dans l'environnement. Il y a aussi la possibilité de transport atmosphérique à grande distance comme le laissent entendre la modélisation et les données empiriques de la présence de mitotane dans l'Arctique canadien. Toutefois, cela peut être dû au transport de l'o,p'-DDT, suivi ultérieurement de sa dégradation.
8.3.3 Bioaccumulation
Des données empiriques sur le facteur de bioaccumulation et le facteur de bioconcentration ont été trouvées pour le p,p'-DDD (analogue du mitotane). Ces données et des estimations obtenues par modélisation indiquent que le mitotane est bioaccumulable dans les organismes aquatiques. Les calculs du facteur de bioamplification chez la truite arc-en-en ciel donne un résultat presque trois fois supérieur, démontrant ainsi que cette substance absorbée par voie alimentaire est susceptible d'être amplifiée dans la chaîne alimentaire des animaux piscivores en milieu aquatique, mais pas dans celle des oiseaux et des mammifères. De plus, les concentrations mesurées dans les prédateurs aquatiques de niveau trophique supérieur étaient généralement plus élevées que celles décelées dans les organismes situés à des niveaux inférieurs (tableau 8-7). Les valeurs de FABS calculées pour les organismes benthiques étaient généralement supérieures à 1, ce qui confirme que le mitotane peut être bioaccumulé dans les organismes benthiques. En qui concerne les FBC et les FBA, les valeurs empiriques pour le p,p'-DDD variaient de 16 720 à 892 473 L/kg et les valeurs modélisées, de 3467 à 148 936 L/kg. Conséquemment, le mitotane répond aux critères du potentiel de bioaccumulation (FBC ou FBA > 5000) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
8.3.4 Évaluation qualitative
Les substances qui sont très persistantes et bioaccumulables et intrinsèquement toxiques suscitent des préoccupations particulières, car le degré d'exposition à des substances comme le mitotane ou l'o,p'-DDD, ne peut pas être aisément quantifié et demeure incertain. Les substances persistantes demeurent longtemps dans l'environnement, ce qui accroît la probabilité et la durée de l'exposition. Cela est particulièrement préoccupant, puisque le rejet de petites quantités de substances persistantes et bioaccumulables peut, avec le temps, mener à des concentrations relativement élevées dans des organismes, ce qui peut se traduire par des effets qui ne sont pas actuellement mesurés pour le mitotane (par ex., la toxicité pour le développement des vertébrés). Certaines substances bioaccumulables et persistantes peuvent également présenter un risque de bioamplification dans la chaîne alimentaire et ainsi entraîner une exposition interne chez les prédateurs de niveau trophique supérieur. Étant donné qu'elles sont très répandues, plusieurs substances différentes qui sont persistantes et bioaccumulables peuvent être présentes simultanément dans les tissus d'organismes, augmentant ainsi la probabilité et la gravité possible des effets nocifs.
8.3.5 Analyse du quotient de risque
Nous avons réalisé une analyse du quotient de risque intégrant des estimations de l'exposition et les données sur la toxicité pour les eaux de surface près des points de rejet.
Le scénario d'utilisation pharmaceutique donne des CEE variant entre 8,8 × 10−5 et 0,25 mg/L (Environnement Canada, 2013). Nous avons obtenu une concentration estimée sans effet (CESE) à partir de la valeur de toxicité chronique de 0,00019 mg/L, soit la valeur expérimentale la plus sensible mesurée chez les crustacés(Hyallela azteca) pour l'analogue p,p'-DDD. Une CESE de 0,000019 mg/L est obtenue en divisant la valeur de toxicité chronique par un facteur de 10 pour tenir compte de l'extrapolation de la CL50 obtenue en laboratoire à une CESE obtenue sur le terrain pour les espèces sensibles. En raison de ses caractéristiques de persistance et de bioaccumulation, les calculs du quotient de risque du mitotane peuvent sous-estimer les risques à long terme actuels qui sont associés au transfert le long de la chaîne alimentaire.
À partir des données d'environ 1 000 systèmes de traitement des eaux usées, on a évalué que la concentration environnementale estimée (CEE) découlant de la prise de mitotane par un unique patient excéderait la concentration estimée sans effet (CESE), près du point de rejet des eaux usées dans environ 81 % des plans d'eau récepteurs à travers le Canada (Environnement Canada, 2009b). Toutefois, on admet que le nombre de patients auxquels on prescrit le mitotane à un temps ou un autre au Canada est peu élevé. Du point de vue statistique, dans 81 % des cas, le rejet de mitotane dans l'environnement dans les secteurs où habitent les 30 à 304 consommateurs pourrait se traduire par des effets nocifs sur les organismes aquatiques. Par conséquent, chaque année, la consommation prescrite de mitotane pourrait avoir des effets nocifs sur les organismes aquatiques de 25 à 250 plans d'eau près du point de rejet des effluents d'eaux.
Aucune donnée de surveillance propre aux organismes benthiques dans les secteurs avoisinant des sources de rejets n'est disponible pour cette substance. Pour le mitotane, un quotient de risque basé sur l'exposition dans l'eau interstitielle des sédiments n'a pu être calculé. Les preuves actuelles provenant d'essais sur des sédiments enrichis avec l'analogue du mitotane laissent croire que les macroinvertébrés endobenthiques pourraient être beaucoup moins sensibles que les organismes pélagiques ou bentho-pélagiques comme les crustacés épibenthiques.
8.3.6 Résumé
La présence de mitotane dans l'environnement est principalement liée à l'utilisation historique de pesticides. Toutefois, étant donné son utilisation comme médicament sur ordonnance, il est actuellement rejeté dans l'environnement au Canada. Entre 100 et 1 000 kg de mitotane par année sont utilisés au pays, dont 60 % seraient rejetés dans les égouts. Ces rejets n'ont probablement qu'une influence négligeable sur la charge globale du mitotane dans l'environnement. Toutefois, les calculs de la concentration environnementale estimée indiquent que, dans les eaux de surface qui reçoivent les effluents des systèmes de traitement des eaux usées contenant le mitotane rejeté par les patients, la teneur en mitotane excède fréquemment la concentration minimale estimée avec effet sur les organismes aquatiques. De plus, le mitotane est très persistant dans le sol, les sédiments, l'air et l'eau. Une fois rejeté dans l'environnement, il peut voyager sur des distances moyennes dans l'atmosphère jusqu'en des régions éloignées, comme l'Arctique, à cause de la migration du composé parent, le DDT, ou de son transport sur des particules en suspension. L'utilisation passée du DDT et du dicofol s'est traduite par une concentration généralement basse de mitotane dans l'environnement, toutefois cette substance persiste longtemps dans l'environnement. Puisque l'apparition d'effets dans les organismes aquatiques survient à de très basses concentrations, l'exposition continue à cette substance demeure préoccupante étant donné sa capacité de s'accumuler facilement dans les tissus d'organismes et sa très grande distribution géographique. L'exposition continuelle au mitotane et son accumulation progressive pourraient produire des effets chroniques sublétaux qui ne sont pas actuellement mesurés par les essais de toxicité.
La comparaison entre les concentrations sans effet et la concentration prédite dans les eaux de surface à proximité de points de rejets de systèmes de traitement des eaux usées semble indiquer que l'utilisation actuelle du mitotane comme médicament devrait être nocive pour l'environnement. Son utilisation passée comme pesticide occasionne aussi une exposition à long terme qui exige la prise en compte de précautions supplémentaires pour tenir compte de la possibilité d'effets inconnus et potentiellement irréversibles chez des organismes. En conséquence, le mitotane rejeté depuis différents points dans l'environnement au Canada peut potentiellement être nocif pour l'environnement, sur de vastes échelles spatiales et temporelles.
8.4 Incertitudes dans l'évaluation des risques pour l'environnement
Nous manquons d'information sur les sources de concentrations de mitotane dans l'environnement au Canada. La proportion des concentrations dans l'eau, les sédiments et le biote dans l'environnement ambiant (tableaux 8-6 et 8-7) résultant de son utilisation comme médicament sur ordonnance devrait être faible, par rapport à celle découlant de l'application passée du pesticide DDT. Puisque l'utilisation pharmaceutique de cette substance est locale, par rapport à la contamination extensive causée par l'utilisation passée du DDT, la concentration due aux utilisations actuelles devrait être plus élevée près des sources de rejet des eaux usées.
L'évaluation de la bioaccumulation est limitée par le volume disponible de données empiriques sur la bioaccumulation, ce qui a nécessité l'utilisation d'un analogue et du DDD (proportion de mitotane et de p,p'-DDD inconnue). La pertinence de recourir au p,p'-DDD en tant qu'analogue du mitotane pour l'étude de la bioaccumulation a été confirmée pour les invertébrés, les poissons et les cétacés, mais elle a été jugée inappropriée pour les mammifères terrestres et les oiseaux en raison des différences marquées relevées dans la métabolisation des substances. Par conséquent, la bioaccumulation du p,p'-DDD dans les mammifères et les oiseaux n'a pas été prise en compte dans le cadre de la présente évaluation. Des valeurs modélisées ont également été établies pour les facteurs de bioaccumulation et de bioconcentration et, bien que toutes les prévisions effectuées à l'aide de modèles comportent un certain degré d'erreur, les résultats des modèles corrigés pour tenir compte du métabolisme ont confirmé que le mitotane est susceptible de présenter un potentiel de bioaccumulation élevé en raison de ses caractéristiques structurelles. Les résultats empiriques sur l'analogue étaient en accord avec les données modélisées, ce qui vient confirmer davantage la validité des valeurs modélisées pour le mitotane.
En ce qui concerne l'écotoxicité, certains éléments de preuve de la nocivité sont liés aux paramètres biochimiques, tels que la viabilité des cellules et les effets endocriniens. Ces effets s'ajoutent aux données établissant que la substance peut être extrêmement nocive. La représentativité des effets du p,p'-DDD sur des organismes autres que les invertébrés et les poissons pour le mitotane comporte des incertitudes. Contrairement au p,p'-DDD, le mitotane a des effets endocriniens. De plus, ce dernier est métabolisé différemment de l'analogue par les mammifères et les oiseaux. Par conséquent, les données sur l'écotoxicité de l'analogue n'ont pas été utilisées pour les organismes terrestres.
La fraction de la substance qui est rejetée pendant son utilisation constitue une autre source d'incertitude. Moy (1961) a trouvé que 60 % du médicament demeurait sous forme inchangée dans les matières fécales humaines. Bien qu'aucune étude contestant cette conclusion n'ait été trouvée, la méthode utilisée par Moy (1961) pour déceler le mitotane dans les matières fécales n'était pas très spécifique à cette substance. Ces incertitudes ont été prises en compte en formulant des hypothèses prudentes fondées sur les meilleurs renseignements disponibles (c.-à-d. de 60 %). La dose quotidienne de mitotane utilisée pour traiter les carcinomes corticosurrénaux varie beaucoup. Elle dépend de la réponse du patient au médicament, l'objectif étant une concentration entre 14 et 20 mg/mL dans le plasma (c.-à-d., la dose maximale tolérée). La notice du médicament sur ordonnance (Bristol-Myers Squibb Company 2010) indique une dose moyenne entre 8 et 10 grammes par jour. De nombreuses études décrivent les méthodes utilisées pour améliorer l'absorption par le corps humain afin de réduire la dose requise et les effets indésirables (Attivi, 2010). Toutefois, aucune de ces méthodes ne semble être représentative de l'utilisation actuelle du mitotane, ou avoir réussi l'étape des essais cliniques. Par conséquent, une valeur type, estimée en fonction de la dose moyenne, a été utilisée pour la caractérisation quantitative des risques.
Nous ne pouvons pas utiliser de quantités discrètes pour l'évaluation quantitative, à cause du caractère confidentiel des renseignements communiqués par l'industrie pharmaceutique pendant la période de commentaires du public. Ainsi, il se peut que nous ayons surestimé la valeur supérieure de la fourchette du nombre de patients utilisant le médicament au Canada.
L'emplacement des sites de rejet varie selon le lieu de résidence des patients. Par conséquent, une approche statistique a été utilisée pour estimer le nombre de sites qui pourrait présenter un risque si un patient dans la région est desservi par le système de traitement des eaux usées. Dans les secteurs à forte densité de population, il est probable que plus d'un patient soit desservi par le même système de traitement des eaux usées. Si tel est le cas, le quotient de risque maximal calculé dans le cadre de la présente évaluation pourrait être sous-estimé, bien que le nombre de sites qui présentent un risque pour les organismes aquatiques devrait diminuer proportionnellement. À ce titre, les résultats quantitatifs ne constituent qu'un portrait général de l'ampleur du risque pour les organismes aquatiques.
9. Potentiel d'effets nocifs sur la santé humaine
9.1 Évaluation de l'exposition
9.1.1 Milieu naturel
Les limites supérieures des estimations de l'absorption quotidienne totale du mitotane par la population générale du Canada sont présentées à l'annexe B.
La population générale peut être indirectement exposée au mitotane par l'intermédiaire des milieux naturels. Les données empiriques sur les concentrations de mitotane dans les milieux naturels au Canada et ailleurs ont été recensées et présentées dans les tableaux 8-6 à 8-10 de la partie sur l'Évaluation de l'exposition dans l'environnement. La plupart des concentrations de mitotane mesurées et présentées dans les tableaux 8-6 à 8-10 sont susceptibles de provenir de l'utilisation historique de pesticides.
Le mitotane a été détecté dans l'air ambiant à divers sites échantillonnés autour dans les Grands Lacs entre 1996 et 2003 (Sun et coll., 2006). Les concentrations variaient de 0,31 à 8,8 pg/m3 en phase gazeuse (Sun et coll., 2006). La substance a également été décelée dans des échantillons d'air prélevés à diverses hauteurs au–dessus des sols agricoles dans le sud de l'Ontario (Kurt-Karakus et coll., 2006). Les concentrations maximales constatées à 5, 20, 72 et 200 cm au–dessus du sol étaient de 360, 230, 110 et 90 pg/m3, respectivement (Kurt-Karakus et coll., 2006). Toutefois, le mitotane n'a pas été détecté dans l'air ambiant à quatre sites dans une région agricole de l'Alberta (seuil de détection : 0,05 ng/m3; Kumar, 2001).
Du mitotane a été retrouvé dans de l'eau de surface dans la vallée de l'Okanagan et la vallée du Fraser en Colombie-Britannique à des concentrations entre 0,001 et 0,2 ng/L (Environnement Canada, 2009b). Pareillement, Pham et coll. (1996) ont signalé des concentrations de mitotane allant jusqu'à 0,232 ng/L dans les échantillons d'eau de surface du fleuve Saint-Laurent et de ses affluents. Toutefois, le mitotane n'a pas été détecté dans l'eau de surface à plusieurs sites dans le bassin du ruisseau Johnson, en Oregon, de 1988 à 2002 (seuil de détection : 0,001 μg/L; Tanner et Lee, 2004). La substance a aussi été décelée à une concentration allant jusqu'à 25,2 ng/L dans des échantillons de précipitations prélevés dans les provinces de l'Atlantique au Canada entre 1995 et 2006 (Environnement Canada, 2010).
Le mitotane a été détecté dans des sols agricoles et de vergers en Colombie-Britannique, à des concentrations allant de moins de 1 à 250 μg/kg (Bidleman et coll., 2006). La substance a également été décelée dans des sols agricoles au sud de l'Ontario, à une concentration de 400 ng/g (Kurt-Karakus et coll., 2006). Il y a eu également d'autres rapports déclarant la présence de DDD dans le sol, mais ils n'établissaient pas de distinction entre l'o,p'-DDD (mitotane) et le p,p'-DDD (un insecticide qui, depuis 1978, n'est plus homologué pour utilisation au Canada; communication personnelle adressée par l'Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau de l'évaluation du risque des substances existantes de Santé Canada en 2010, non citée). Par exemple, Crowe et Smith (2007) ont fait état d'une plage allant de moins 1 à 11,4 mg/kg pour le DDD dans le sol échantillonné dans la même région.
On n'a déclaré aucune présence de mitotane dans les aliments autres que le poisson au Canada. Par ailleurs, la substance a été détectée (3 à 78 μg/kg) dans du fromage en Espagne (Bentabol et Jodral, 1995). Dans une étude de l'alimentation totale en Espagne menée en 1990-1991, les concentrations de DDD étaient très faibles (de moins de 1 à 7 μg/kg) dans des échantillons de treize groupes alimentaires (Urieta et coll., 1996). On doit noter que les auteurs de l'étude n'ont pas distingué entre l'o,p'–DDD (mitotane) et le p,p'-DDD. Dans une autre étude de l'alimentation totale, également réalisée en Espagne, les concentrations maximales de DDT total (incluant l'o,p'-DDD) dans les poissons étaient de 9,9 μg/kg en poids humide (Lazara et coll., 1996).
Du mitotane a été retrouvé dans des baleines et des poissons à différents sites partout aux États-Unis et au Groenland (Danemark), de même qu'au Canada (voir l'Évaluation de l'exposition dans l'environnement, tableau 8-11). En outre, le mitotane a été signalé dans 11 espèces de poisson de consommation provenant du sud de la Chine, à une concentration moyenne de 4,4 μg/kg poids humide (Meng et coll. 2009). Les concentrations de mitotane dans les poissons déclarées par Giesy et coll. (1994) ont été jugées comme étant les plus pertinentes pour le Canada en raison de l'emplacement d'échantillonnage. Dans cette étude de 1990, le mitotane a été détecté dans une plage de concentrations allant de 0,13 à 81,70 μg/kg chez les poissons (Giesy et coll., 1994). Il convient de noter que les trois rivières à partir desquelles on a recueilli les poissons se situent dans le Michigan et sont influencées par les Grands Lacs (Giesy et coll., 1994).
La tranche supérieure des estimations de l'absorption du mitotane à partir de l'air ambiant, de l'air intérieur, de l'eau potable, de la nourriture et du sol ont été calculées d'après les concentrations environnementales rapportées dans la documentation. Elles sont résumées à l'annexe B. La tranche supérieure des valeurs estimatives totales varient entre 0,0016 μg/kg p.c. par jour (kilogramme de poids corporel par jour) pour les nourrissons (de 0 à 6 mois) et 0,022 μg/kg p.c. par jour pour les enfants âgés de 0,5 à 4 ans (voir l'annexe B).
9.1.2 Produits de consommation
Il n'y a eu aucune déclaration en vertu de l'article 71 pour l'utilisation du mitotane dans les produits de consommation au Canada (Canada, 2009a), ainsi, l'exposition de la population générale découlant de l'utilisation de produits de consommation n'est pas prévue. Le mitotane est homologué pour une utilisation au Canada en tant qu'agent chimiothérapeutique oral utilisé dans le traitement de certains cancers de la glande surrénale (BDPP, 2010). L'exposition directe à la suite de l'utilisation du mitotane en tant que produit thérapeutique est abordée dans le Règlement sur les aliments et drogues (Canada, 1978).
9.2 Évaluation des effets sur la santé
L'annexe C comporte un résumé des renseignements disponibles relativement aux effets du mitotane sur la santé.
On n'a relevé aucune classification ni évaluation des effets du mitotane sur la santé d'organismes de réglementation nationaux ou internationaux.
Le mitotane n'a pas provoqué de mutation chez la Salmonella typhimurium (Mortelmans et coll. 1986; Buselmaier et coll. 1972). Un isomère non précisé du mitotane n'a pas induit de synthèse non programmée de l'ADN dans des cultures primaires d'hépatocytes de rats, de souris et de hamster de Syrie (Maslansky et Williams, 1981). On a obtenu des résultats contrastés pour l'induction d'aberrations chromosomiques dans des cellules de rongeurs; toutefois, le mitotane n'a pas provoqué de transformation des cellules embryonnaires de souris ni d'échange de chromatides sœurs dans des cellules ovariennes de hamster chinois (Galloway et coll., 1987; Langenbach et Gingell, 1975; Palmer et coll., 1972). In vivo, le mitotane a entraîné une augmentation sélective de la synthèse de l'ADN des poumons, mais a donné des résultats négatifs dans le foie (Lund et coll. 1990). Selon les auteurs, ces effets peuvent être liés à la formation d'un métabolite réactif dans les poumons des souris. Les résultats globaux de la génotoxicité indiquent que le mitotane n'est pas une substance mutagène et qu'il n'est pas susceptible d'être génotoxique.
Les effets du mitotane sur des rats et des chiens ayant reçu la substance par voie orale ont été étudiés durant des périodes d'exposition allant de quatre jours à deux ans. Dans une étude de toxicité subchronique chez des rats exposés au mitotane par voie orale, des tumeurs à cellules de Leydig a été observées dans les testicules des rats mâles après un an d'exposition à une dose de 0,6 mg/kg p.c. par jour (Lacassagne, 1971). Ces résultats ont été déclarés comme n'étant pas conformes aux études précédentes, ce qui peut indiquer la participation d'un contaminant ou d'une variation de souche dans la réponse. Aucun autre détail sur cette étude n'a été déclaré (HBPTO 2001). En outre, plusieurs éléments de preuve qui laissent entendre que les cellules de Leydig humaines sont moins sensibles quantitativement aux tumeurs à cellules de Leydig induites par un produit que les cellules de rats (Shenker et coll., 1993; Quigley et coll., 1995; Clegg et coll., 1997).
La dose minimale avec effet nocif observé (DMENO) était de 4 mg/kg p.c. par jour, d'après l'atrophie grossière des glandes surrénales et la dégénérescence de cellules du cortex interne chez des chiens exposés par voie orale au mitotane pendant quatre jours (Cueto et Brown, 1958). Des expositions à long terme à 50 mg/kg p.c. par jour de mitotane ont entraîné une nécrose corticosurrénale chez des chiens (Kirk et Jensen, 1975; Lehman, 1951). On a, par ailleurs, observé des dommages dans la zone fasciculée et la zone réticulée chez des chiens exposés au mitotane pendant 10 jours (138 mg/kg p.c. par jour) (Kirk et coll., 1974). Une diminution de la force contractile du cœur et du volume du plasma a également été notée chez des chiens exposés à 50 mg/kg p.c. par jour de mitotane pendant 14 jours (Cueto, 1970). Chez les rats, une atrophie de la corticosurrénale et des organes thymolymphatiques a été constatée à la suite d'une exposition à 121 mg/kg p.c. par jour de mitotane pendant 16 jours (Hamid et coll., 1974). Enfin, on a noté des lésions dans des tissus des glandes surrénales (5 mg/kg p.c. par jour) ainsi qu'une hypertrophie du foie (20 mg/kg p.c. par jour) chez des rats nourris avec du mitotane pendant une période allant jusqu'à deux ans (Lehman, 1952).
L'exposition par voie cutanée à 200 mg/kg p.c. par jour de mitotane pendant 90 jours a entraîné de graves effets (aucun autre détail fourni) et était mortelle chez les lapins après 6 jours d'exposition à une dose de 400 mg/kg p.c. par jour (Lehman, 1951).
La toxicité du mitotane pour le développement a été étudiée chez des rats ayant reçu la substance dans leur alimentation pendant la gestation. On a observé un léger, mais important retard (de 2 jours) de l'ouverture vaginale chez la progéniture lorsque les mères Sprague-Dawley avaient reçu 28 mg/kg p.c. par jour de mitotane par gavage du 15e au 19e jour de la gestation. Les ratons issus de l'expérience précédente et exposés par voie sous-cutanée à 1 mg/kg p.c. de mitotane au cours de leur deuxième, troisième et quatrième jour de vie ont présenté un œstrus vaginal persistant et l'absence de corps jaunes durant leur vie adulte (Gellert et Heinrichs, 1975).
Les résultats issus des études sur la toxicité aiguë indiquaient que les valeurs de DL50 chez les rats, les souris et les cochons d'Inde exposés au mitotane étaient toutes supérieures à 4 000 mg/kg p.c. et que la valeur de DL50 par voie cutanée chez des lapins était supérieure à 1 200 mg/kg p.c. après une exposition unique (Gaines, 1969; Lehman, 1951; RTECS, 2009). Aucune étude sur la toxicité aiguë par inhalation n'a été recensée.
Le métabolisme du mitotane a été étudié chez les humains et chez une variété d'autres mammifères. L'absorption après l'ingestion du mitotane est évidente chez les humains, d'après les concentrations sériques et dans les tissus adipeux (ATSDR 2002). Quarante pour cent (40 %) de la dose de mitotane administrée est absorbée dans le tractus gastro-intestinal, peu importe la forme posologique (FDA 2009). Une partie de la fraction absorbée devrait être transformée en un métabolite hydrosoluble dans le foie, tandis qu'une autre fraction est stockée dans les tissus adipeux (Moy, 1961). Après l'administration d'une seule dose orale de 30 mg/kg p.c. à des porcs miniatures Göttingen, le mitotane a atteint une concentration maximale médiane en 8 heures avant de diminuer rapidement en raison de l'élimination et de la distribution dans les tissus corporels, les tissus adipeux étant les principaux sites de stockage. Un ratio élevé graisse/plasma au jour 30 révèle la lipophilie élevée de la substance (Hermansson et coll., 2008). Le mitotane inhibe la conversion du cholestérol en pregnénolone par les mitochondries de même que la conversion du 11-déoxycortisol en cortisol, et il entraîne une nécrose corticosurrénale sélective dans les tumeurs surrénales et les métastases chez les humains (De León et coll., 2002) (voir utilisation en tant que produit thérapeutique ci-dessous). Des essais par liaison compétitive ont également montré que le mitotane se lie au récepteur humain des œstrogènes (mais avec une bien plus faible affinité que l'estradiol) (ATSDR, 2002). Le mitotane est métabolisé par les mitochondries des glandes surrénales, par l'intermédiaire du cytochrome P450, en réactifs qui se lient par covalence aux macromolécules des mitochondries. On a établi une corrélation entre le métabolisme des glandes surrénales et les activités de liaison par covalence, et la sensibilité connue des espèces animales à l'effet corticosurrénal du mitotane (ATSDR, 2002). Par exemple, les mitochondries chez les chiens présentaient une métabolisation du mitotane et des activités de liaison par covalence bien plus importants que les mitochondries de rats, de lapins ou de cochons d'Inde (Martz et Straw, 1980).
Chez les humains, le mitotane a été utilisé pour traiter les carcinomes corticosurrénaux et le syndrome de CushingNote de bas de page4 pendant au moins 40 ans (Bergenstal et coll., 1960; Wooten et King, 1993). Le médicament est administré sous forme de comprimés de 500 mg dans lesquels le mitotane est intégré sous forme solide. Une dose moyenne de mitotane d'au moins 8 à 10 grammes par jour est recommandée par le distributeur, mais on peut en prescrire de 2 à 16 grammes par jour (BDPP, 2010). L'action thérapeutique est basée sur l'induction d'une nécrose sélective de la zone fasciculée etla zone fasciculairede la corticosurrénale ainsi que sur l'inhibition de la synthèse du cortisol (Hart et Straw, 1971; Hart et coll., 1971; Hart et coll., 1973). Les effets les plus importants associés au traitement par mitotane à des doses aussi élevées que 12 000 mg par jour pendant une période allant jusqu'à 34 mois étaient la fatigue, l'anorexie, la diarrhée, des nausées, et des vomissements chez des patients atteints du syndrome de Cushing et de carcinomes corticosurrénaux. Le composé n'a produit aucun effet observable dans le foie, les reins ou la moelle osseuse, et les effets indésirables se sont dissipés lorsque l'administration des doses a été interrompue (Bergenstal et coll., 1960; Hoffman et Mattox, 1972; Luton et coll., 1979; Perevodcikova et coll., 1972; Wallace et coll., 1961).
Nous jugeons que la confiance à l'égard de la base de données sur les effets sur la santé du mitotane est modérée, car la base contient peu de données empiriques.
9.3 Caractérisation des risques pour la santé humaine
On n'a pas retrouvé de classement ou d'évaluation des effets du mitotane sur la santé émis par des organismes de réglementation canadiens ou internationaux. L'information disponible indique que le mitotane ne devrait pas être génotoxique. Selon les données empiriques relatives aux effets du mitotane sur la santé, les glandes surrénales ont été définies comme un tissu cible.
La dose minimale avec effet signalée dans la base de données sur les effets du mitotane sur la santé est de 0,6 mg/kg p.c. par jour. Elle est associée à la présence de tumeurs à cellules de Leydig (TCL) dans les testicules des rats mâles après un an d'exposition. Ce constat ne concorde pas avec les résultats d'autres études (en raison d'une contamination possible du mitotane ou de la souche utilisée), et il existe une incertitude relative à l'interprétation de la pertinence des effets en raison d'une absence de données sur le mode d'action. Toutefois, les renseignements contenus dans la littérature laissent entendre que les cellules de Leydig humaines sont quantitativement moins sensibles que les cellules de rats aux TCL induites chimiquement. Par conséquent, la dose minimale avec effets nocifs observés était de 4 mg/kg p.c. par jour, et causait l'atrophie des surrénales chez des chiens.
Une comparaison entre la dose minimale avec effet nocif chez des animaux de laboratoire exposés à des doses répétées de mitotane (4 mg/kg p.c. par jour) par voie orale et l'extrémité de la limite supérieure des estimations de l'exposition de la population générale à des sources environnementales (0,022 µg/kg p.c.) donne une marge d'exposition d'environ 180 000. Cette marge est jugée suffisante pour tenir compte des incertitudes dans les bases de données sur les effets sur la santé et l'exposition.
Au Canada, le mitotane est seulement utilisé comme agent chimiothérapeutique oral pour traiter le cancer de la glande surrénale (BDPP, 2010). L'exposition directe découlant de l'utilisation du mitotane en chimiothérapie est abordée dans le Règlement sur les aliments et drogues (Canada 1978), et l'on ne prévoit pas d'exposition de la population générale attribuable à des produits de consommation.
9.4 Incertitudes dans l'évaluation des risques pour la santé humaine
La présente évaluation préalable ne présente pas d'analyse complète du mode d'induction des effets du mitotane. Les seules informations disponibles décrivent la toxicité potentielle du mitotane suivant une exposition par voie orale ou cutanée, et aucune étude sur l'exposition par inhalation n'a été recensée. Donc, les concentrations (ou doses) associées à un effet critique déterminées dans la présente évaluation préalable sont source d'incertitude en raison des limites de la base de données sur la toxicité. Il y a en outre des incertitudes liées à l'interprétation de l'importance biologique des effets, incluant les incertitudes liées à l'interprétation de la variation intraspécifique et interspécifique. Des données concernant les effets sur la santé ont, par ailleurs, été obtenues avec un isomère non précisé du mitotane, qui peut être représenté par le produit commercial contenant 90 % de l'isomère p,p'-DDD et seulement 5 à 8 % d'o,p'-DDD (mitotane).
En raison du nombre limité de données empiriques liées aux effets sur la santé et de l'utilisation restreinte de la modélisation, le niveau de confiance accordé à la détermination des effets critiques sur la santé est modéré.
L'incertitude liée à l'exposition au mitotane à partir des milieux naturels et de l'alimentation au Canada est modérée à élevée, car peu de données empiriques étaient disponibles pour calculer les estimations de l'exposition. Les produits de consommation ne devraient pas être une source d'exposition au mitotane. La seule utilisation rapportée du mitotane est en tant qu'agent chimiothérapeutique oral. Par conséquent, la population générale ne devrait pas être exposée au mitotane par l'intermédiaire de produits de consommation.
10. Conclusion
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation préalable, le mitotane présente un risque d'effets nocifs sur les organismes, mais pas sur l'intégrité globale de l'environnement. Il est conclu que le mitotane satisfait aux critères énoncés à l'alinéa 64a) de la LCPE, car il pénètre ou peut pénétrer dans l'environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique. Toutefois, il est conclu que le mitotane ne répond pas aux critères énoncés à l'alinéa 64b) de la LCPE, car il ne pénètre pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à mettre en danger l'environnement essentiel pour la vie.
À la lumière des renseignements contenus dans la présente évaluation préalable, il est aussi conclu que le mitotane ne satisfait pas aux critères énoncés à l'alinéa 64(c) de la LCPE, car il ne pénètre pas dans l'environnement en une quantité, à une concentration, ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaine.
Il est conclu que le mitotane satisfait à un ou plusieurs des critères énoncés à l'article 64 de la LCPE.
De plus, le mitotane répond aux critères de persistance et de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
11. Références
[ASHP] American Society of Health-System Pharmacists. 2010. AHFS drug information for mitotane. http://www.ahfsdruginformation.com/
[ASHP] American Society of Health-System Pharmacists. 2010. Mitotane AHSF Drug Monograph. Dans l'internet : http://www.ahfsdruginformation.com/.
[AIES] Artificial Intelligence Expert System. 2003-2005. Vers. 1.25. Ottawa (Ont.) : Environnement Canada. Modèle élaboré par Stephen Niculescu. Environnement Canada, Section de l'évaluation des substances chimiques nouvelles, Division de l'évaluation écologique.
Alaska Department of Environmental Conservation. 2010. Fish monitoring program: analysis of organic contaminants. http://www.dec.state.ak.us/eh/news.htm#fmp
[AOPWIN] Atmospheric Oxidation Program for Microsoft Windows [modèle d'estimation]. 2008. Version 1.92a. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. http://www.epa.gov/tsca-screening-tools/epi-suitetm-estimation-program-interface
[ARLA] Agence de réglementation de la lutte antiparasitaire. 2007. Note aux titulaires de pesticides - L'après-catégorisation des substances inscrites sur la Liste intérieure des substances : conséquences du Défi pour les titulaires de pesticides. Pièce jointe 1 : Matières actives, produits de formulation et impuretés contenues dans les produits de formulation inscrits sur la liste du Défi. Ottawa (Ont.) : Santé Canada, Agence de réglementation de la lutte antiparasitaire. [consultée le 30 août 2010]
[ARLA] Agence de réglementation de la lutte antiparasitaire. 2010. Note de réévaluation : Abandon de produits antiparasitaires agricoles et non agricoles homologués en cours de réévaluation et projet de modification des limites maximales de résidus : sixième mise à jour (27 septembre 2010). Ottawa (Ont.) : Santé Canada, ARLA. Dans l'internet : http://www.hc-sc.gc.ca/cps-spc/alt_formats/pdf/pubs/pest/decisions/rev2010-14/rev2010-14-fra.pdf [consultée le 27 octobre 2010]
Arnot, J.A., Gobas, F.A.P.C. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb. Sci. 22(3):337-345.
Arnot, J.A., Mackay, D., Bonnell, M. 2008a. Estimating metabolic biotransformation rates in fish from laboratory data. Environ. Toxicol. Chem. 27(2):341-351.
Arnot, J.A., Mackay, D., Parkerton, T.F., Bonnell, M. 2008 b. A database of fish biotransformation rates for organic chemicals. Environ. Toxicol. Chem. 27(11):2263-2270.
Arnot, J.A., Meylan, W., Tunkel, J., Howard, P.H., Mackay, D., Bonnell, M,. Boethling, R.S. 2009. A quantitative structure-activity relationship for predicting metabolic biotransformation rates for organic chemicals in fish. Environ. Toxicol. Chem. 28(6):1168-1177.
[ASTER] Assessment Tools for the Evaluation of Risk. 1999. Duluth (MN) : U.S. Environmental Protection Agency, Mid-Continent Ecology Division. http://cfpub.epa.gov/si/si_public_record_Report.cfm?dirEntryID=74887 [accès restreint]
ASTreat Model [sewage treatment plant removal model]. 2006. Version 1.0. Cincinnati (OH) : Procter & Gamble Company.
[ATSDR] Agency for Toxic Substances and Disease Registry. 2002. Draft toxicological profile for DDT, DDE, DDD. U.S. Department of Health and Human Services. Dans l'internet : http://www.atsdr.cdc.gov/substances/toxsubstance.asp?toxid=20
Attivi, D., Ajana, I., Astier, A., Demore, B., Gibaud, S. 2010. Development of microemulsion of mitotane for improvement of oral bioavailability. Drug Dev Ind Pharm 36(4):421-427.
Baudin, E., Pellegriti, G., Bonnay, M., Penfornis, A., Laplanche, A., Vassal, G., Schlumberger, M. 2001. Impact of monitoring plasma 1,1-dichlorodiphenildichloroethane (o,p'-DDD) levels on the treatment of patients with adrenocortical carcinoma. Cancer 92(6):1385-1392.
[BCFBAF] BioConcentration Factor Program for Microsoft Windows [modèle d'estimation]. 2008. Version 3.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. http://www.epa.gov/tsca-screening-tools/epi-suitetm-estimation-program-interface
[BDIPSN] Base de données sur les ingrédients des produits de santé naturels. 2010. Ottawa (Ont.) : Santé Canada. Dans l'internet : http://www.hc-sc.gc.ca/dhp-mps/prodnatur/applications/online-enligne/nhpid-bipsn-fra.php [consultée en septembre 2010].
[BDPP] Base de données sur les produits pharmaceutiques en ligne. 2010. Ottawa (Ontario), Santé Canada, https://produits-sante.canada.ca/dpd-bdpp/index-fra.jsp
[BDPSNH] Base de données des produits de santé naturels homologués [base de données]. 2010. Ottawa (Ontario) : Santé Canada. [consultée en septembre 2010] http://webprod.hc-sc.gc.ca/lnhpd-bdpsnh/language-langage.do?url=t.search.recherche&lang=fra
Becker, S., Halsall, C.J., Tych1, W., Kallenborn, R., Schlabach, M., Manø, S. 2009. Changing sources and environmental factors reduce the rates of decline of organochlorine pesticides in the Arctic Atmosphere. Atmos Chem Phys Discuss 9:515-540. Dans l'internet : www.atmos-chem-phys-discuss.net/9/515/2009/
Benguira, S., Leblond, V.S., Weber, J.P., Hontela, A. 2002. Loss of capacity to elevate plasma cortisol in rainbow trout (Oncorhynchus mykiss) treated with a single injection of o,p'–dichlorodiphenyldichloroethane. Environ. Toxicol. Chem. 21(8):1753-1756.
Bensley, B., Kohnstam, G. 1957. Nucleophilic substitution reactions of benzyl halides. Part 1. The reaction of benzyl chloride with partly aqueous solvents. J. Chem. Soc. 4747-4754 [cité dans Wolfe et coll. 1977]
Bentabol, A., Jodral, M. 1995. Occurrence of organochlorine agrochemical residues in Spanish cheeses. Pestic. Sci. 44:177-182.
Berg, V., Ugland, K.I., Hareide, N.R., Aspholm, P.E., Polder, A., Skaared, J.U. 1997. Organochlorine contamination in deep-sea fish from the Davis Strait.Mar. Environ. Res. 44(2):135-148.
Bergenstal, D., Hertz, R., Lipsett M. Moy R. 1960. Chemotherapy of adrenocortical cancer with o,p'-DDD. Ann. Intern. Med. 53(4):672-682 [cité dans ATSDR 2002 et CHE 1979]
Beyer, A., Mackay, D., Matthies, M., Wania, F., Webster, E. 2000. Assessing long-range transport potential of persistent organic pollutants. Environ. Sci. Technol. 34(4):699-703.
Bidleman, T.F., Leone, A.D. 2004. Soil-air exchange of organochlorine pesticides in the Southern United States. Environ. Pollut. 128:49-57.
Bidleman, T.F., Leone, A.D., Wong, F., van Vliet, L., Szeto, S., Ripley, B.D. 2006. Emission of legacy chlorinated pesticides from agricultural and orchard soils in British Columbia, Canada. Environ. Toxicol. Chem. 25:1488-1457.
Biggar, J.W., Riggs, R.L. 1974. Apparent solubility of organochlorine insecticides in water at various temperatures. Hilgardia 42(10):383-391.
[BIOWIN] Biodegradation Probability Program for Microsoft Windows [modèle d'estimation]. 2008. Version 4.10. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Dans l'internet : http://www.epa.gov/tsca-screening-tools/epi-suitetm-estimation-program-interface
Boethling, R.S., Howard, P.H., Beauman, J.A., Larosche, M.E. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere 30(4):741-752.
Bonner, J.C., Wells, M.R. 1987. Comparative acute toxicity of DDT metabolites among American and European species of planarians. Comp. Biochem. Physiol. C 87:43.
Brandt, I., Jönsson, C.J., Lund, B.O. 1992. Comparative studies on adrenocorticolytic DDT-metabolites. Ambio 21(8):602-605.
Bristol-Myers Squibb Company. 2010. Lysodren® (mitotane tablets, USP). Fiche signalétique. http://packageinserts.bms.com/pi/pi_lysodren.pdf
Brunton, L., Lazo, J., Parker, K. (éditeurs). 2005. Goodman & Gilman's The pharmacological basis of therapeutics, 11e éd. The McGraw-Hill Companies.
Bulger, W.H., Kupfer, D. 1978. Studies on the induction of rat uterine ornithine decarboxylase by DDT Analogs. I. Comparison with estradiol-17β activity. Pest. Biochem. Physiol. 8:253-262.
Buselmaier, W., Röhrborn, G., Propping, P. 1972. Mutagenicity investigations with pesticides in the host-mediated assay and the dominant lethal test in mice [en allemand]. Biol. Zbl. 91:310−325. [cité par le CIRC 1991]
Canada. 1978. Règlement sur les aliments et drogues. C.R.C., ch. 870. Dans l'internet : http://laws.justice.gc.ca/fra/C.R.C.-ch.870/index.html
Canada. 1985. Loi sur les aliments et drogues, L.R.C. 1985, ch. F-27. Dans l'internet : http://www.canlii.org/fr/ca/legis/lois/lrc-1985-c-f-27/derniere/lrc-1985-c-f-27.html
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999). L.C. 1999, ch. 33. Gazette du Canada, Partie III. vol. 22, no 3. Dans l'internet : http://www.gazette.gc.ca/archives/p3/1999/g3-02203.pdf
Canada. 2000. Loi canadienne sur la protection de l'environnement (1999): Règlement sur la persistance et la bioaccumulation, C.P. 2000-348, 29 mars 2000, DORS/2000-107. Dans l'internet : http://gazette.gc.ca/archives/p2/2000/2000-03-29/pdf/g2-13407.pdf
Canada. 2002. Loi sur les produits antiparasitaires. L.C. 2002, ch. 28. Gazette du Canada, Partie III, vol. 25, no 3.Dans l'internet : http://laws-lois.justice.gc.ca/fra/lois/P-9.01/.
Canada. Ministère de l'Environnement, ministère de la santé. 2006. Loi canadienne sur la protection de l'environnement (1999):Avis d'intention d'élaborer et de mettre en œuvre des mesures d'évaluation et de gestion des risques que certaines substances présentent pour la santé des Canadiens et leur environnement. Gazette du Canada, Partie I, vol. 140, no 49, p. 4109-4117. Dans l'internet : http://www.gazette.gc.ca/archives/p1/2006/2006-12-09/pdf/g1-14049.pdf
Canada. Ministère de l'Environnement, ministère de la Santé. 2009a. Loi canadienne sur la protection de l'environnement (1999) : Avis de douzième divulgation d'information technique concernant les substances identifiées dans le Défi. Gazette du Canada, Partie I, vol. 143, no 52, p. 3839-3847. Dans l'internet : http://www.gazette.gc.ca/rp-pr/p1/2009/2009-12-26/pdf/g1-14352.pdf#page=7
Canada. Ministère de l'Environnement, ministère de la Santé. 2009 b. Loi canadienne sur la protection de l'environnement (1999) : Avis de douzième divulgation d'information technique concernant les substances identifiées dans le Défi. Gazette du Canada, Partie I, vol. 143, no 52, p. 3813–3836. Dans l'internet : http://www.gazette.gc.ca/rp-pr/p1/2009/2009-12-26/pdf/g1-14352.pdf#page=33
Cantillana, T., Lindström, V., Eriksson, I., Brandt, I., Bergman, Å. 2009. Interindividual differences in o,p'-DDD enantiomer kinetics examined in Göttingen minipigs. Chemosphere 76:167-172.
[CATABOL] Probabilistic assessment of biodegradability and metabolic pathways [modèle informatique]. c2004-2008. Version 5.10.2. Bourgas (Bulgarie) : Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. http://oasis-lmc.org/?section=software&swid=1
[CCME] Conseil canadien des ministres de l'environnement. 1999. « DDT (total) ». Dans : Recommandations canadiennes pour la qualité des sols : Environnement et santé humaine 1999. Winnipeg *Manitoba). Feuilet d'information du CCME. Dans l'internet : http://www.ccme.ca/files/ceqg/fr/177.pdf
Chung, M.K., Hu, R., Wong, M.H., Cheung, K.C. 2007. Comparative toxicity of hydrophobic contaminants to microalgae and higher plants. Ecotoxicology 16:393-402.
[CIRC] Centre International de Recherche sur le Cancer. 1991. DDT and associated compounds. Programme international sur la sécurité des substances chimiques.
Clegg, E.D., Cook, J.C., Chapin, R.E., Foster, P.M.D., Daston, G.P. 1997. Leydig cell hyperplasia and adenoma formation: mechanisms and relevance to humans. Reprod. Toxicol. 11:107-121.
[CPOP] Canadian POPs Model. 2008. Gatineau (Qc) : Environnement Canada, Division de l'évaluation écologique; Bourgas (Bulgarie) : Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. [Modèle basé sur celui de Mekenyan et coll. 2005]. Disponible auprès de la Division de l'évaluation écologique d'Environnement Canada.
Cristol, S.J., Hause, N.L., Quant, A.J., Miller, H.W., Eilar, K.R., Meek, J.S. 1952. Mechanisms of elimination reactions. VI. The kinetics of dehydrochlorination of various 2,2-diarylchloroethanes. J. Am. Chem. Soc. 74(13):3333-3337. [cité dans Wolfe et coll. 1977]
[CHE] Critère d'hygiène de l'environnement 9. 1979. DDT and its derivatives. Genève (Suisse) : Organisation mondiale de la santé.
Crowe, A.S., Smith, J.E. 2007. Distribution and persistence of DDT in soil at a sand dune-marsh environment: Point Pelee, Ontario, Canada. Can. J. Soil Sci. 87:315-327.
Cueto, C., Brown, J. 1958. Biological studies on an adrenocorticolytic agent and the isolation of the active components. Endocrinology62:334-339. [cité dans HBPTO 2001]
Cueto, C. 1970. Cardiovascular effects of o,p'-DDD. Ind. Med. 39:55-56. [cité dans ATSDR 2002]
De Bruijn, J., Busser, F., Seinen, W., Hermens, J. 1989. Determination of octanol/water partition coefficients for hydrophobic organic chemicals with the "slow-stirring" method. Environ. Toxicol. Chem. 8:499-512.
De León, D.D., Lange, B.J., Walterhouse, D., Moshang, T. 2002. Clinical case seminar: Long-lerm (15 years) outcome in an infant with metastatic adrenocortical carcinoma. J. Clin. Endocrinol. Metab. 87(10):4452-4456.
Deonier, C.C., Jones, H.A. 1946. TDE, 1,1-Dichloro-2,2-bis(p-chlorophenyl) ethane, as a anopheline larvicide. Science 103(2662):13-14.
Deonier, C.C., Jones, H.A., Haller, H.L., Hinchey, E., Incho, H.H. 1946. Mosquito larvicide tests : A resume of tests of compounds related to DDT against larvae of Anopheles Quadrimaculatus. Soap and sanitary chemicals-Laboratory tests. J.Econ. Entomol. 39(459):118-119.
Dimitrov, S., Dimitrova, N., Parkerton, T., Comber, M., Bonnell, M., Mekenyan, O. 2005. Base-line model for identifying the bioaccumulation potential of chemicals. SAR QSAR Environ. Res. 16(6):531-554. Compris dans la Suite de modèles CPOP 2008.
Donahoe, R.M., Curtis, L.R. 1996. Estrogenic activity of chlordecone, o,p'-DDT and o,p'-DDE in juvenile rainbow trout: induction of vitellogenesis and interaction with hepatic estrogen binding sites. Aquat Toxicol. 36:31-52.
[ECCC et SC] Environnement et changement climatique Canada et Santé Canada. 2007 (modifié le 20 avril 2007) Catégorisation. Ottawa (Ontario), Gouvernement du Canada. Dans l'Internet : https://www.canada.ca/fr/sante-canada/services/substances-chimiques/approche-canada/categorisation-produits-chimiques.html
[ECOSAR] ECOlogical Structure-Activity Relationships Class Program [modèle d'estimation]. 2008. Version 1.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Dans l'internet : https://www.epa.gov/tsca-screening-tools/epi-suitetm-estimation-program-interface
Environnement Canada. 1988. Données de la Liste intérieure des substances (LIS) 1984-1986, recueillies en vertu du paragraphe 25(1) de la LCPE et conformément à la Liste intérieure des substances : guide du déclarant, 1988. Données préparées par Environnement Canada
Environnement Canada. 2005. Données recueillies en vertu de l'article 71 (LCPE, 1999) de la Loi canadienne sur la protection de l'environnement (1999) et à l'Avis concernant certaines substances considérées comme priorité pour suivi. Gazette du Canada, Partie 1, vol. 140, no 9. Données préparées par Environnement Canada
Environnement Canada. 2006. Plan national de mise en œuvre du Canada au titre de la Convention de Stockholm sur les polluants organiques persistants. May 2006. Ottawa (Ontario), Environnement Canada. http://chm.pops.int/Implementation/NIPs/NIPTransmission/tabid/253/Default.aspx
Environnement Canada. 2007. Guidance for Conducting Ecological Assessments under CEPA, 1999, Science Resource Technical Series, Technical Guidance Module : QSARs. Document de travail préliminaire révisé. Gatineau (Québec) : Environnement Canada, Division de l'évaluation écologique.
Environnement Canada. 2009a. Présence et concentrations des pesticides prioritaires dans certains écosystèmes aquatiques canadiens (2009). https://www.ec.gc.ca/eaudouce-freshwater/5EEF7087-5907-4E79-8EFE-37E6541E6FCF/PresenceEtConcentrationsDesPesticidesPrioritairesAquatiquesCanadiens%20FINAL-s.pdf (version de 2011).
Environnement Canada. 2009 b. Guidance for Conducting Ecological Assessments under CEPA, 1999, Science Resource Technical Series, Technical Guidance Module: Mega Flush Consumer Release Scenario. Document de travail. Gatineau (Québec) : Environnement Canada, Division de l'évaluation de écologique.
Environnement Canada. 2010. Envirodat Atlantique – Base de données de qualité d'eau. http://map.ns.ec.gc.ca/envirodat/root/main/fr/extraction_page_e.asp
Environnement Canada. 2013. Mega Flush Report : CAS RN53-19-0, 2013-05-29. Version 3.1.4. Rapport inédit. Gatineau (Qc) : Environnement Canada, Division de l'évaluation écologique.
[EPI Suite] Estimation Program Interface Suite for Microsoft Windows [modèle d'estimation]. 2008. Version 4.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Dans l'internet : https://www.epa.gov/tsca-screening-tools/epi-suitetm-estimation-program-interface.
[EQC] Equilibrium Criterion Model. 2003. Version 2.02. Peterborough (Ont.) : Trent University, Canadian Environmental Modelling Centre. http://www.trentu.ca/academic/aminss/envmodel/models/EQC2.html
Fenner, K., Scheringer, M., MacLeod, M., Matthies, M., McKone, T.E., Stroebe, M., Beyer, A., Bonnell, M., Le Gall, A., Klasmeier, J.et coll. 2005. Comparing estimates of persistence and long-range transport potential among multimedia models. Environ. Sci. Technol. 39:1932-1942.
Fisk, A.T., Norstrom, R.J., Cymbalisty, C.D., Muir, D.C.G. 1998. Dietary accumulation and depuration of hydrophobic organochlorines: bioaccumulation parameters and their relationship with the octanol/water partition coefficient. Environ. Toxicol. Chem. 17:951-961. [cité par Konwick et coll. 2006]
Frear, D.E.H., Boyd, J.E. 1967. Use of Daphnia magna for the microbioassay of pesticides. I. Development of standardized techniques for rearing Daphnia and preparation of dosage-mortality curves for pesticides. J. Econ. Entomol. 60(5):1228-1236.
Gaines, T.B. 1969. Acute toxicity of pesticides.Toxicol. Appl. Pharmacol. 14:515-534 [cité dans CHE 1979].
Galloway, S.M., Armstrong, M.J., Reuben, C., Colman, S., Brown, B., Cannon, C., Bloom, A.D., Nakamura, F., Ahmed, M., Duk, S.et coll. 1987. Chromosome aberrations and sister chromatid exchanges in Chinese hamster ovary cells: evaluations of 108 chemicals. Environ. Mol. Mutagen. 10(Suppl. 10):1-175.
Garrison, A.W., Nzengung, V.A., Avants, J.K., Ellington, J.J., Jones, W.J., Rennels, D., Wolfe, N.L. 2000. Phytodegradation of p,p'-DDT and the enantiomers of o,p'-DDT. Environ. Sci. Technol. 34:1663-1670.
[GdCh] German Chemical Society (Advisory committee on existing chemicals (BUA). 1998. DDT and its Derivatives. BUA report 216. Stuttgart (Allemagne) : S. Hirzel Wissenchaftliche Verlagsgesellschaft.
Gellert, R., Heinrichs, W. 1975. Effects of DDT homologs administered to female rats during the perinatal period. Biol. Neonate 26:283-290.
Giesy, J.P., Verbrugge, D.A., Othout, R.A., Bowerman, W.W., Mora, M.A., Jones, P.D., Newsted, J.L., Vandervoort, C., Heaton, S.N., Aulerich, R.J.et coll. 1994. Contaminants in fishes from Great Lakes-influenced sections and above dams of three Michigan Rivers. I: Concentrations of organo chlorine insecticides, polychlorinated biphenyls, dioxin equivalents, and mercury. Arch. Environ. Contam. Toxicol. 27:202-212.
Gilliom, R.J., Barbash, J.E., Crawford, C.G., Hamilton, P.A., Martin, J.D., Nakagaki, N., Nowell, L.H., Scott, J.C., Stackelberg, P.E., Thelin, G.P., Wolock, D.M. 2006. Pesticides in the nation's streams and ground water, 1992–2001. The quality of our nation's waters. Washington (DC) : United States Geological Survey.
Gossett, R.W., Brown, D.A., Young, D.R. 1983. Predicting the bioaccumulation of organic compounds in marine organisms using octanol/water partition coefficients. Mar. Pollut. Bull. 14(10):387-392.
Hamid, J., Sayeed, A., McFarlane, H. 1974. The effect of 1-(o-chlorophenyl)-1-(p-chlorophenyl)-2,2-dichloroethane (o,p'-DDD) on the immune response in malnutrition. Br. J. Exp. Pathol. 55:94.
Hansck, C., Leo, A. 1979. Substituent constants for correlation analysis in chemistry and biology. New York (NY) : Wiley Interscience. [cité dans Gossett et coll. 1983]
Hart, M., Straw, J.A. 1971. Studies on the site of action of o,p'-DDD in the dog adrenal cortex. 1. Inhibition of ACTH-mediated pregnenolone synthesis. Steroids 17(5):559-574.
Hart, M., Adamson, R., Fabro, S. 1971. Prematurity and intrauterine growth retardation induced by DDT in the rabbit. Arch. Int. Pharmacodyn. 192:286-290 [cité dans ATSDR 2002]
Hart, M.M., Regan, R.L., Adamson, R.H. 1973. The effect of isomers of DDD on the ACTH-induced steroid output, histology, and ultrastructure of the dog adrenal cortex. Toxicol. Appl. Pharmacol.24:101-113.
[HBPTO] Handbook of Pesticide Toxicology Agents, 2e édition. 2001. Robert Krieger (éd.) Academic Press 2:1332-1334.
Hebert, C.E., Weseloh, D.V., Kot, L., Glooschenko, V. 1994. Organochlorine contaminants in a terrestrial food web on the Niagara Peninsula, Ontario, Canada 1987-89. Arch. Environ. Contam. Toxicol. 26:356-366.
[HENRYWIN] Henry's Law Constant Program for Microsoft Windows [modèle d'estimation]. 2008. Version 3.20. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. http://www.epa.gov/tsca-screening-tools/epi-suitetm-estimation-program-interface.
Hermansson, V., Cantillana, T., Hovander, L., Bergman, A., Ljungvall, K., Magnusson, U., Törneke, K., Brandt, I. 2008. Pharmacokinetics of the adrenocorticolytic compounds 3-methylsulphonyl-DDE and o,p'-DDD (mitotane) in Minipigs. Cancer Chemother. Pharmacol. 61:267-274.
Himmelstein, M.W., Acquavella, J.F., Reccio, L., Medinsky, M.A., Bond, J.A. 1997. Toxicology and Epidemiology of 1,3-Butadiene. Crit. Rev. Toxicol. 27:1-108.
Hoffman, D.L., Mattox, V.R. 1972. Treatment of adrenocortical carcinoma with o,p'-DDD. Med. Clin. North Am. 56:999-1012. [cité dans CHE 1979]
Hoffman, D.L., Mattox, V.R. 1972. Treatment of adrenocortical carcinoma with . Med. Clin. North Am. 56:999-1012. [cité dans CHE 1979].
Hoke, R.A., Ankley, G.T., Cotter, A.M., Goldenstein, T., Kosian, P.A., Phipps, G.L., VanderMeiden, F.M. 1994. Evaluation of equilibrium partitioning theory for predicting acute toxicity of field-collected sediments contaminated with DDT, DDE and DDD to the amphipod Hyalella Azteca. Environ. Toxicol. Chem. 13:157-166.
[HSDB] Hazardous Substances Data Bank [base de données]. 2010. Mitotane. Bethesda (MD) : National Library of Medicine (U.S). http://toxnet.nlm.nih.gov/cgi-bin/sis/htmlgen?HSDB [consultée le 16 juillet 2010]
Hu, T.M., Layton, W.L. 2001. Allometric scaling of xenobiotic clearance: uncertainty versus universality. AAPS PharmSci 3(4):Article 29.
Huang, H.J., Liu, S.M., Kuo, C.E. 2001. Anaerobic biodegradation of DDT residues (DDT, DDD, AND DDE) in estuarine sediment. J. Environ. Sci. Health, Part B 36(3):273-288.
Hung, H., Kallenborn, R., Breivik, K., Su, Y., Brorstrøm-Lunden, E., Olafsdottir, K., Thorlacius, J.M., Leppanen, S., Bossi, R., Skov, H.et coll. 2010. Atmospheric monitoring of organic pollutants in the Arctic under the Arctic Monitoring and Assessment Programme (AMAP) : 1993-2006. Sci. Total Environ. 408:2854-2873.
Hutter, A.M., Kayhoe, D.E. 1966. Adrenal cortical carcinoma : Results of treatment with o,p'-DDD in 138 patients. A. J. Med. 41(4):581-592.
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [modèle d'estimation]. 2008. Version 2.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. http://www.epa.gov/tsca-screening-tools/epi-suitetm-estimation-program-interface.
Ilan, Z., Yaron, Z. 1980. Suppression by organochlorines of the response to adrenocorticotrophin of the interregnal tissue in Sarotherodon aureus (teleostei). J. Endocrinol. 87:185-193.
[IMS] IMS AG 2013. Multinational Integrated Data Analysis System (MIDAS) [base de données]. Cham (Suisse) : IMS AG.
Ingersoll, C.G., Wang, N., Hayward, J.M.R., Jones, J.R., Jones, S.B., Ireland, D.S. 2005. A field assessment of long-term laboratory sediment toxicity tests with the amphipod Hyalella azteca. Environ. Toxicol. Chem. 24(11):2853-2870.
[INRP] Inventaire national des rejets de polluants [base de données]. 2006. Gatineau (Qc) : Environnement Canada. http://www.ec.gc.ca/pdb/querysite/query_f.cfm [consultée le 22 août 2010]
Jönsson, C.J., Lund, B.O., Brandt, I. 1993. Adrenocorticolytic DDT-metabolites: studies in mink, Mustela vison and otter, Lutra lutra. Ecotoxicology 2:41-53.
Jönsson, C.J., Lund, B.O., Brunström, B., Brandt, I. 1994. Toxicity and irreversible binding of two DDT metabolites 3-methylsulfonyl-DDE and o,p'-DDD in adrenal interrenal cells in birds. Environ Toxicol Chem. 13(8):1303-1310.
Jorgensen, E.H., Balm, P.H.M., Christiansen, J.S., Plotitsyna, N., Ingebrigtsen, K. 2001. Influence of o,p'-DDD on the physiological response to stress in Arctic charr (Salvelinus alpinus). Aquat. Toxicol. 54:179-193.
Karickhoff, S.W., McDaniel, V.K., Melton, C., Vellino, A.N., Nute, D.E., Carreira, L.A. 1991. Predicting chemical reactivity by computer. Environ. Toxicol. Chem. 10:1405-1416. [cité dans Meador et coll. 1997]
Kirk,G., Boyer, S., Hutcheson, D. 1974. Effects of o,p'-DDD on plasma cortisol levels and histology of the adrenal gland in the normal dog. J. Am. Anim. Hosp. Assoc. 10:179-182.
Kirk, G., Jensen, H. 1975. Toxic effects of o,p'-DDD in the normal dog. J. Am. Anim. Hosp. Assoc. 11:765-768.
Klasmeier, J., Matthies, M., MacLeod, M., Fenner, K., Scheringer, M., Stroebe, M., Le Gall, A.C., McKone, T.E., van de Meent, D., Wania, F. 2006. Application of multimedia models for screening assessment of long-range transport potential and overall persistence. Environ. Sci. Technol. 40:53-60.
[KOCWIN] The Soil Adsorption Coefficient Program [modèle d'évaluation]. 2008. Version 2.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. www.epa.gov/oppt/exposure/pubs/episuite.htm
Kollig, H.P. 1988. Criteria for evaluating the reliability of literature data on environmental process constants. Toxicol. Environ. Chem. 17:287-311.
Konwick, B.J., Garrison, A.W., Black, M.C., Avants, J.K. et Fisk, A.T. 2006. Bioaccumulation, biotransformation and metabolite formation of fipronil and chiral legacy pesticides in rainbow trout. Environ. Sci. Technol. 40(9):2930-2936.
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [modèle d'estimation]. 2008. Version 1.67. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. http://www.epa.gov/tsca-screening-tools/epi-suitetm-estimation-program-interface.
Krieger R, editor. 2001. Handbook of Pesticide Toxicology : Agents. 2e éd. Academic Press 2:1332-1334.
Kumar, Y. 2001. Pesticides in ambient air in Alberta. Edmonton (Alberta) : ministère de l'Environnement de l'Alberta.
Kurt-Karakus, P.B., Bidleman, T.F., Staebler, R.M., Jones, K.C. 2006. Measurement of DDT fluxes from a historically treated agricultural soil in Canada. Environ. Sci. Technol. 40(15):4578-4585.
Lacassagne, A. 1971. Revue critique des tumeurs experimentales des cellules de Leydig plus particulièrement chez le rat. Bull. Cancer 58:236-276 [cité par Krieger 2001].
Lacroix, M., Hontela, A. 2003. The organochlorine o,p'-DDD disrupts the adrenal steroidogenic signaling pathway in rainbow trout (Oncorhynchus mykiss). Toxicol. Appl Pharmacol. 90:197-205.
Laliberté, D. 2003. Évolution des teneurs en mercure et en BPC de quatre espèces de poissons du Saint-Laurent, 1976-1997. Gouvernement du Québec, Ministère de l'Environnement, Direction du suivi de l'état de l'environnement. Bibliothèque nationale du Québec, Envirodoq : ENV/2003/0287.
Langenbach, R., Gingell, R. 1975. Cytotoxic and oncogenic activities of 1,1,1-trichloro-2,2-bis(p-chlorophenyl)-ethane and metabolites to mouse embryo cells in culture. J. Natl. Cancer Inst. 54:981-983.
Lazaro, R., Herrera, A., Arino, A., Conchello, M.P., Bayarri, S. 1996. Organochlorine pesticide residues in total diet samples from Aragon (Northeastern Spain). J. Agric. Food Chem. 44:2742-2747.
Leblond, V.S., Hontela, A. 1999. Effects of in vitro exposures to cadmium, mercury, zinc, and 1-(2-Chlorophenyl)-1-(4-chlorophenyl)-2,2-dichloroethane on steroidogenesis by dispersed interregnal cells of rainbow trout (Oncorhynchus mykiss). Toxicol. Appl. Pharmacol. 157:16-22.
Lehman, A.J. 1951. Chemicals in foods: A report to the Association of Food and Drug officials on current developments. Part II. Pesticides. Section I : Introduction. Q. Bull. Assoc. Food Drug Off. 15(1):122-125. [cité par Krieger 2001]
Lehman, A.J. 1952. Chemicals in foods: A report to the Association of Food and Drug officials on current developments. Part II. Pesticides. Section II : Dermal toxicity. Section III. Subacute and chronic toxicity. Section IV. Biochemistry. Section V. Pathology. Q. Bull. Assoc. Food Drug Off. 16(II):3-9; (III):47-53; (IV):85-91; (V):126-132. [cité par Krierger 2001]
Lotufo, G.R., Landrum, P.F., Gedeon, M.L., Tigue, E.A., Herche, L.R. 2000. Comparative toxicity and toxicokinetics of DDT and its major metabolites in freshwater amphipods. Environ. Toxicol. Chem. 19(2):368-379.
Lund, B.O. 1994. In vitro adrenal bioactivation and effects on steroid metabolism of DDT, PCBs and their metabolites in the gray seal (Halichoerus grypus). Environ Toxicol Chem13(6):913-917.
Lund, B.O., Busk, L., Brandt, I., Hellman, B. 1990. Effect of o,p'-DDD on the in vivo incorporation of 3H-thymidine into DNA: evidence for induced cell proliferation in the mouse lung. Pharmacol. Toxicol. 66(3):179-184.
Luton, J.P., Valcke, J.C., Remy, J.M., Mathieu de Fossey, B., Bricaire, H. 1972. Gynecomastia after long-term treatment of Cushing's diseases with o,p'-DDT. Ann. Endocrinol. 33:290-293. [cité dans CHE 1979]
Martz, F., Straw, J.A. 1980. Metabolism and covalent binding of 1-(o-chlorophenyl)-1-(pchlorophenyl)-2,2-dichloroethane (o,p'-DDD): Correlation between adrenocorticolytic activity and metabolic activation by adrenocortical mitochondria. Drug Metab Dispos. 8(3):127-130.
Maslansky, E.J., Williams, G.M. 1981. Evidence for an epigenetic mode of action in organochlorine pesticide hepatocarcinogenicity: a lack of genotoxicity in rat, mouse and hamster hepatocytes. J. Toxicol. Environ. Health 8:121-130.
Mayer, F.L., Ellersieck, M.R. 1986. Manual of acute toxicity: interpretation and data base for 410 chemicals and 66 species of freshwater organisms. Resource Publication 160. U.S. Fish and Wildlife Service, Washington (DC).
McLaughlin, A., Belknap, A. 2008. Annual kg quantity of medicinal ingredients distributed and dispensed in Canada: analysis of intercontinental medical statistics (IMS) data for 2007. Impact environnemental de l'initiative, DGPSA, Santé Canada. [Excel format data summary].
Meador, J.P., Adams, N.G., Casillas, E., Bolton, J.L. 1997. Comparative bioaccumulation of chlorinated hydrocarbons from sediment by two infaunal invertebrates. Arch. Environ. Contam. Toxicol. 33:388-400.
Meijer, S.N., Shoeib, M., Jantunen, L.M.M., Jones, K.C., Harner,T. 2003 Air-soil exchange of organochlorine pesticides in agricultural soils : 1. Field measurements using a novel in situ sampling device. Environ. Sci. Technol. 37:1292-1299. [cité dans Kurt-Karakus et coll. 2006]
Mekenyan, G., Dimitrov, S.D., Pavlov, T.S., Veith, G.D. 2005. POPs : A QSAR system for creating PBT profiles of chemicals and their metabolites. SAR QSAR Environ. Res. 16(1-2):103-133.
Mortelmans, K., Haworth, S., Lawlor, T., Speck, W., Tainer, B., Zeiger, E. 1986. Salmonella mutagenicity tests : II. Results from the testing of 270 chemicals. Environ. Mutagen. 8 (Suppl. 7):1-119.
Moy, R.H. 1961. Studies of the pharmacology of o,p'-DDD in man. J Lab. Clin. Med. 58(2):296-304
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [modèle d'estimation]. 2008. Version 1.43. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. http://www.epa.gov/tsca-screening-tools/epi-suitetm-estimation-program-interface
NatChem/Base de données sur les toxiques. 2002. Toronto (Ontario) : Environnement Canada. https://www.ec.gc.ca/natchem/default.asp?lang=Fr&n=F8BB758A-1. [Mise à jour en juillet 2004; consultée de 1992 à 2003].
[NCI] National Chemical Inventories [base de données]. 2009. Issue 1. Columbus (OH) : American Chemical Society. http://www.cas.org/products/cd/nci/index.html.
Nichols, J.W., Fitzsimmons, P.N., Burkhard, L.P. 2007. In vitro – in vivo extrapolation of quantitative hepatic biotransformation data for fish. II. Modeled effects on chemical bioaccumulation. Environ. Toxicol. Chem. 26:1304-1319.
Norstrom, R.J., Muir, D.C.G., Ford, C.A., Simon, M., Macdonald, C.R., Beland, P. 1992. Indications of P450 monooxygenase activities in beluga (Delphinapterus leucas) and narwhal (Monodon monoceros) from patterns of PCB, PCDD and PCDF accumulation. Marine Environ. Res. 34:267-272.
Oliver, B.G., Niimi, A.J. 1988. Trophodynamic analysis of polychlorinated biphenyl congeners and other chlorinated hydrocarbons in the Lake Ontario ecosystem. Environ. Sci. Technol. 22(4):388-397.
O'Neil MJ, directeur. 2006. The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. 14e éd., Merck Research Laboratories.
Palmer, K., Green, S., Legator, M. 1972. Cytogenetic effects of DDT and derivatives of DDT in a cultured mammalian cell line. Toxicol. Appl. Pharmacol. 22:355-364.
Perevodcikova, N.I., Platinskiy, L.V., Kerstman, V.I. 1972. [The treatment of inoperable forms of malignant tumors of the adrenal cortex with o,p'-DDD] (en russe). Vopr. Onkol. 18:24-29. [cité dans CHE 1979]
Pham, T., Lum, K., Lemieux, C. 1993. The occurrence, distribution and sources of DDT in the St-Lawrence River, Quebec (Canada). Chemosphere 26(9):1595-1606.
Pham, T., Lum, K., Lemieux, C. 1996. Seasonal variation of DDT and its metabolites in the St Lawrence River (Canada) and four of its tributaries. Sci Tot. Environ. 179:17-26.
Phipps, G.L., Mattson, V.R., Ankley, G.T. 1995. Relative sensitivity of three freshwater benthic macroinvertebrates to ten contaminants. Arch. Environ. Contam. Toxicol. 28:281-286.
[PhysProp] Interactive PhysProp Database [base de données en ligne]. 2006. Syracuse (NY) : Syr. Inc. http://www.syrres.com/esc/physdemo.htm [consultée le 16 août 2010]
[PISSC] Programme international sur la sécurité des substances chimiques. 1989. DDT and its derivatives - Environmental aspects. Genève (Suisse) : Organisation mondiale de la santé. (Critère d'hygiène de l'environnement 83). Financé conjointement par le Programme des Nations Unies pour l'environnement, l'Organisation internationale du travail et l'Organisation mondiale de la santé. http://www.inchem.org/documents/ehc/ehc/ehc83.htm
[PNUE] Programme des Nations Unies pour l'environnement. 2001. Convention de Stockholm sur les polluants organiques persistants (POP), telle qu'amendée en 2009 : Textes et Annexes. Secrétariat de la Convention de Stockholm sur les polluants organiques persistants. Genève (Suisse). http://chm.pops.int/Convention/tabid/54/Default.aspx
Qiu, X., Zhu, T., Yao, B., Hu, J., Hu, S. 2005. Contribution of dicofol to the current DDT pollution in China. Environ. Sci. Technol. 39:4385-4390.
Quigley, C.A., De Bellis, A., Marschke, K.B., El-Awady, M.K., Wilson, E.M., French, F.S. 1995. Androgen receptor defects: historical, clinical, and molecular perspectives. Endocr. Rev. 16:19-34.
Ressources naturelles Canada. 2010. L'Atlas du Canada – Risque d'érosion éolienne et sensibilité du climat. Ottawa (Ont.) : Ressources naturelles Canada. http://atlas.nrcan.gc.ca/site/francais/maps/climatechange/potentialimpacts/winderosionclimatesensitivity/interactivemap_view?map_web=TEMPLATE%20/home/atlas/mapdata/ajax.html&scale=42051275.911682&urlappend= .
Roepke, T.A., Snyder, M.J., Cherr, G.N. 2005. Estradiol and endocrine disrupting compounds adversely affect development of sea urchin embryos at environmentally relevant concentrations. Aquat. Toxicol. 71:155-173.
[RTECS] Registry of Toxic Effects of Chemical Substances. 2009. Record for ethane, 1,1-dichloro-2,2-bis(p-chlorophenyl)- (72-54-8). Hamilton (Ont.) : Centre canadien d'hygiène et de santé au travail, National Institute for Occupational Safety and Health. [mise à jour en novembre 2009; consulté en septembre 2010]
Sangster, J. 1994. LOGKOW Databank. A databank of evaluated octanol-water partition coefficients (log P) on microcomputer diskette. Montréal (Qc) : Sangster Research Laboratories [cité dans EPI Suite 2008; Phys-Prop References].
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Ottawa (Ontario) : Santé Canada, Direction de l'hygiène du milieu.
Santé Canada. 2013 [modifiée le 27 juin 2013]. Listes des additifs alimentaires autorisés. Ottawa (Ontario) : Santé Canada. https://www.canada.ca/fr/sante-canada/services/aliments-nutrition/salubrite-aliments/additifs-alimentaires/listes-autorises.html.
Scheringer, M., MacLeod, M., Wegmann, F. 2006. OECD POV and LRTP Screening Tool. Version 2.0. Paris (France) : Organisation de coopération et de développement économiques; Zurich (Suisse) : École polytechnique fédérale. Distribué lors de l'atelier OCDE-PNUE sur l'utilisation de modèles multimédias pour déterminer les polluants organiques persistants, tenu à Ottawa (Canada) du 31 mai au 2 juin 2006. www.sust-chem.ethz.ch/downloads/Tool2_0_Manual.pdf [consulté le 10 septembre 2010]
Schteingart, D.E. 2007. Adjuvant mitotane therapy of adrenal cancer – use and controversy. N. Engl. J. Med. 356:2415-2418.
Seth R, Webster E, Mackay D. 2008. Continued development of a mass balance model of chemical fate in a sewage treatment plant. Water Res. 42:595-604.
Shenker, A., Laue, L., Kosugi, S., Merendino, J.J., Minegishi, T., Cutler, G.B. 1993. A constitutively activating mutation of the luteinizing hormone receptor in familial male precocious puberty. Nature 265:652-654.
SimpleTreat [sewage treatment plant removal model]. 1997. Version 3.0. Bilthoven (Pays-Bas) : institut national pour la santé publique et l'enviornnement (RIVM) laboratoire d'évaluation des risques écologiques, laboratoire d'évaluation des risques écologiques, C.P. 1, 3720 BA Bilthoven (Pays-Bas).
Société canadienne du cancer. 2010. Qu'est-ce que le cancer de la glande surrénale? http://www.cancer.ca/fr-ca/cancer-information/cancer-type/adrenal-gland/adrenal-gland-cancer/?region=qc#ixzz4odEbx4DP.
[STP-EX] Sewage Treatment Plant Expanded Model. 2008. Windsor (Ontario) : Université de Windsor, département de génies civil et environnemental. [Modèle décrit par Seth et coll. 2008].
Sun, P., Blanchard, P., Brice, K., Hites, R.A. 2006. Atmospheric organochlorine pesticide concentrations near the great lakes: Temporal and spatial trends. Environ. Sci. Technol. 40:6587-6593.
Suntio, L.R., Shiu, W.Y., Mackay, D., Seiber, J.N., Glotfelty, D. 1988. Critical review of Henry's Law constants for pesticides. Rev. Environ. Contam. Toxicol. 103:1-59.
Tanner, D.Q., Lee, K.K. 2004. Organochlorine pesticides in the Johnson Creek Basin, Oregon, 1988-2002. Scientific Investigations Report 2004-5061. Denver (CO) : U.S. Geological Survey.
[TaPL3] Long Range Transport and Persistence Level III model. 2000. Version 2.10. Peterborough (Ont.) : Trent University, Canadian Center for Environmental Modelling and Chemistry. http://www.trentu.ca/academic/aminss/envmodel/models/TaPL3.html
Terzolo M, Angeli A, Fassnacht M, Daffara F, Tauchmanova L, Conton PA, Rossetto R, Buci L, Sperone P, Grossrubatscher E, Reimondo G, Bollito E, Papotti M, Saeger W, Hahner S, Koschker AC, Arvat E, Ambrosi B, Loli P, Lombardi G, Mannelli M, Bruzzi P, Mantero F, Allolio B, Dogliotti L, Berruti A. 2007. Adjuvant mitotane treatment for adrenocortical carcinoma. N Engl J Med. 356:2372–2380.
Terzolo M, Pia A, Berruti A, Osella G, Ali A, Carbone V, Testa E, Dogliotti L, Angeli A. 2007. Low-dose monitored mitotane treatment achieves the therapeutic range with manageable side effects in patients with adrenocortical cancer. J Clin Endocrinol Metab. 85(6) : 2234-2238.
Thompson, S., Budzinski, H., Garrigues, P., Narbonne, J.F. 1999. Comparison of PCB and DDT distribution between water-column and sediment-dwelling bivalves in Arcachon Bay, France. Mar. Pol. Bull. 38:655-662.
[TOPKAT] Toxicity Prediction by Komputer Assisted Technology [module de prévision]. 2004. Version 6.2. San Diego (CA) : Accelrys Software Inc. http://www.accelrys.com/products/topkat/index.html
Trent University. 2002. Biomagnification and bioaccumulation of organochlorine compounds in marine mammals Dans l'internet : http://www.biology.duke.edu/bio217/2002/pcb/DDT.htm
Turgut, C., Gokbulut, C., Cutright, T.J. 2009. Contents and sources of DDT impurities in dicofol formulations in Turkey. Environ. Sci. Pollut. Res. Int. 16:214-217.
[University of Michigan] University of Michigan – Comprehensive Cancer Center. 2010. Adrenal cancer. http://www.cancer.med.umich.edu/cancertreat/endocrine/adrenal_cancer.shtml
Urieta, I., Jalon, M., Eguileor, I. 1996. Food surveillance in the Basque Country (Spain). II. Estimation of the dietary intake of organochlorine pesticides, heavy metals, arsenic, aflatoxin M1, iron and zinc through the total diet study, 1990/91. Food Addit Contam Part A Chem Anal Control Expo Risk Assess. 13:29-52.
[USFDA] United States Food and Drug Administration. 2009. LYSODREN® (mitotane tablets, USP), Lysodren Label Information. Contenu de l'étiquette approuvé le 10 février 2009. NDA 16-885/S-023, p. 3-8. http://www.accessdata.fda.gov/drugsatfda_docs/label/2009/016885s023lbl.pdf. [consulté le 30 août 2010]
[USGS] United States Geological Survey. 2000. Organic chemical concentrations and reproductive biomarkers in common carp (Cyprinus carpio) collected from two areas in Lake Mead, Nevada. http://pubs.usgs.gov/ds/2007/286/pdf/ds286.pdf
[USGS] United States Geological Survey. 2002. The National Water Quality Assessment Program. Pesticides and organic compounds detected in composite samples (whole fish) of largemouth bass and Florida Gar at 15 sites in southern Florida, August through December 1995. http://sofia.usgs.gov/sfrsf/entdisplays/nawqa/
[USP] United States Pharmacopeia. Fiche signalétique : Mitotane. Rockville (MD) : United States Pharmacopeia. Base de données des fiches signalétiques du Centre canadien d'hygiène et de sécurité au travail. http://ccinfoweb2.ccohs.ca/ Action.lasso?-database=msds&-layout=Display&-response=detailframe.html&-recordID=13316850&-search [consultée le 8 août 2008]
Vaughan ED Jr. 2004. Diseases of the adrenal gland. Med Clin North Am. 88:443-466.
Wallace, E.Z., Silverstein, J.N., Villadolid, L.S., Weisenfeld, S. 1961. Cushing's syndrome due to adrenocortical hyperplasia. Treatment with an inhibitor of andrenocortical secretions. N Engl J Med265:1088-1093. [cité dans CHE 1979]
Wandiga, S.O., Jumba, I.O., Mutaaga, W.G., Lalah, J.O. 2003. The distribution, metabolism and toxicity of 14C-DDT in model aquarium tanks with fish and sediment simulating a tropical marine environment. Toxicol. Environ. Chem. 85(4-6):253-268.
Wania, F. 2006. Assessing the potential of persistent organic chemicals for long-range transport and accumulation in polar regions. Environ. Sci. Technol. 37(7):1344-1351.
Wehr, J.D., Sheath, R.G. 2002. Freshwater algae of North America ecology and classification. San Diego (CA) : Academic Press.
Wolfe, N.L., Zepp, R.G., Paris, D.F., Baughman, G.L., Hollis, R.C. 1977. Methoxychlor and DDT degradation in water: rates and products. Environ. Sci. Technol. 11(12):1077-1081.
Wong, C.S., Capel, P.D., Nowell, L.H. 2000. National-scale, field-based evaluation of the biota-sediment accumulation factor model. Environ. Sci. Technol. 35(9):1709-1715.
Wooten, M., King, D. 1993. Adrenal cortical carcinoma: Epidemiology and treatment with mitotane and a review of the literature. Cancer 72(11):3145-3155. [cité dans ATSDR 2002]
[WSKOWWIN] Water Solubility for Organic Compounds Program for Microsoft Windows [modèle d'estimation]. 2008. Version 1.41. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. http://www.epa.gov/tsca-screening-tools/epi-suitetm-estimation-program-interface.
Annexes
Annexe A : Tableau sommaire des intrants des modèles de persistance, de bioaccumulation et de toxicité (PBT)
| Paramètres d'entrée du modèle | Suite EPI (tous les modèles, dont AOPWIN, KOCWIN, BCFBAF, BIOWIN et ECOSAR) |
|---|---|
| Code SMILES | ClC(Cl)C(c1ccc(Cl)cc1)c2ccccc2Cl |
| Masse moléculaire (g/mol) | 320,05 |
| Point de fusion (°C) | 77 |
| Point d'ébullition (°C) | S.O. |
| Température (°C) | S.O. |
| Pression de vapeur (Pa) | 2,51 × 10−3 |
| Constante de la loi de Henry (Pa·m3/mol) | 8,035 |
| log Kae (sans dimension) | S.O. |
| log Koe (sans dimension) | 6,22 |
| Koe (sans dimension) | S.O. |
| log Kco(L/kg) | S.O. |
| Hydrosolubilité (mg/L) | 0,1 |
| log KoaKoa (sans dimension) | S.O. |
Abréviations : SMILES : simplified molecular input line entry system (système simplifié d'identification sur une seule ligne; S.O. : sans objet
Coefficients de partition K : Kae : air-eau, KoaKoa : octanol-air, Koc : carbone organique-eau, Koe : octanol-eau
| Paramètres d'entrée du modèle | STP (1), ASTreat (2), SimpleTreat (3) (différents intrants requis en fonction du modèle) | EQC (différents intrants requis pour comparaison entre produits chimiques de type I ou II) | Modèle FBC/FBA Arnot-Gobas |
|---|---|---|---|
| Code SMILES | S.O. | S.O. | S.O. |
| Masse moléculaire (g/mol) | 320,05 | 320,05 | S.O. |
| Point de fusion (°C) | S.O. | 77 | S.O. |
| Point d'ébullition (°C) | S.O. | S.O. | S.O. |
| Température (°C) | S.O. | 20 | S.O. |
| Pression de vapeur (Pa) | 2,51 × 10−3 | 2,51 × 10−3 | S.O. |
| Constante de la loi de Henry (Pa·m3/mol) | 8,035 | 8,035 | S.O. |
| log Kae (sans dimension) | S.O. | S.O. | S.O. |
| log Koe (sans dimension) | 6,22 | 6,22 | 6,22 |
| Koe (sans dimension) | S.O. | S.O. | S.O. |
| log Kco(L/kg) | S.O. | S.O. | S.O. |
| Hydrosolubilité (mg/L) | 0,1 | 0,1 | 0,1 |
| log KoaKoa (sans dimension) | S.O. | ||
| Coefficient de partition sol–eau (L/kg)[a] | S.O. | S.O. | S.O. |
| Coefficient de partition sédiments–eau (L/kg)[a] | S.O. | S.O. | S.O. |
| Coefficient de partition particule en suspension-eau (L/kg)[a] | S.O. | S.O. | S.O. |
| Coefficient de partition poisson-eau (L/kg)[b] | S.O. | S.O. | S.O. |
| Coefficient de partition aérosol–eau (sans dimension)[c] | S.O. | S.O. | S.O. |
| Coefficient de partition végétation-eau (sans dimension)[a] | S.O. | S.O. | S.O. |
| Enthalpie (Koe) | S.O. | S.O. | S.O. |
| Enthalpie (Kae) | S.O. | S.O. | S.O. |
| Demi-vie dans l'air (jours) | S.O. | 59,1 | S.O. |
| Demi-vie dans l'eau (jours) | S.O. | 4 320 | S.O. |
| Demi-vie dans les sédiments (jours) | S.O. | 38 900 | S.O. |
| Demi-vie dans le sol (jours) | S.O. | 4 320 | S.O. |
| Demi-vie dans la végétation (jours)[d] | S.O. | S.O. | S.O. |
| Constante du taux métabolique (1/jour) | S.O. | S.O. | 0,0155 |
| Constante du taux de biodégradation (1/jour ou 1/h) – précisez | 0,0001 h-1 | S.O. | S.O. |
| Demi-vie de biodégradation dans le décanteur primaire (t½-p) (h) | 10 000 | S.O. | S.O. |
| Demi-vie de biodégradation dans le bassin d'aération (t½-s) (h) | 10 000 | S.O. | S.O. |
| Demi-vie de biodégradation dans le bassin de décantation (t½-s) (h) | 10 000 | S.O. | S.O. |
Abréviations : FBC : facteur de bioconcentration, FBC : facteur de bioaccumulation, SMILES : simplified molecular input line entry system (système simplifié d'identification sur une seule ligne; S.O. : sans objet. Coefficients de partition K : Kae : air-eau, KoaKoa : octanol-air, Koc : carbone organique-eau, Koe : octanol-eau
a D'après le log Kco .
b D'après les données pour le FBC
c Valeur par défaut
d D'après la demi-vie dans l'eau.
Annexe B – Estimation de la limite supérieure de l'exposition de la population générale au mitotane présent dans les milieux environnementaux
| Absorption estimée (μg/kg p.c. par jour) | Air ambiant [i] | Air intérieur [j] | Eau potable [k] | Aliments et boissons [l] | Sol [m] | Absorption totale |
|---|---|---|---|---|---|---|
| 0−6 mois [a],[b],[c] – allaités | 3,85 × 10−5 | 2,70 × 10−5 | 0,00 | 0,00 | 1,6 × 10−3 | 1,63 × 10−3 |
| 0−6 mois [a],[b],[c] – lait maternisé | 3,85 × 10−5 | 2,70 × 10−5 | 2,13 × 10−5 | 0,00 | 1,6 × 10−3 | 1,65 × 10−3 |
| 0−6 mois [a],[b],[c] – sans lait maternisé | 3,85 × 10−5 | 2,70 × 10−5 | 1,64 × 10−3 | 0,00 | 1,6 × 10−3 | 1,64 × 10−3 |
| 0,5−4 ans [d] | 8,2 × 10−6 | 5,78 × 10−5 | 9,03 × 10−6 | 2,00 × 10−3 | 2,58 × 10−3 | 2,27 × 10−2 |
| 5-11 ans [e] | 6,43 × 10−6 | 4,50 × 10−5 | 7,10 × 10−6 | 1,52 × 10−2 | 8,39 × 10−4 | 1,61 × 10−2 |
| 12-19 ans [f] | 3,66 × 10−6 | 2,56 × 10−5 | 4,04 × 10−6 | 9,89 × 10−2 | 2,02 × 10−4 | 1,01 × 10−2 |
| 20−59 ans [g] | 3,14 × 10−6 | 2,20 × 10−5 | 4,04 × 10−6 | 6,69 × 10−3 | 2,02 × 10−4 | 6,89 × 10−3 |
| 60 ans et plus [h] | 2,73 × 10−6 | 1,91 × 10−5 | 4,44 × 10−5 | 4,06 × 10−3 | 1,67 × 10−4 | 4,25 × 10−3 |
a Aucune donnée sur le mitotane dans le lait maternel n'a été relevée.
b Hypothèses : poids de 7,5 kg, volume d'air respiré de 2,1 m3 par jour, consommation d'eau de 0,8 L/jour (enfants nourris au lait maternisé) ou de 0,3 L/jour (enfants non nourris au lait maternisé) et ingestion de 30 mg/jour de sol (Santé Canada, 1998).
c Pour les nourrissons exclusivement nourris au lait maternisé, l'absorption d'eau est synonyme d'apport alimentaire. On n'a répertorié aucune donnée sur les concentrations de mitotane dans le lait maternisé pour le Canada.
d En supposant que l'enfant pèse 15,5 kg, respire 9,3 m3 d'air par jour, qu'il boit 0,7 L d'eau par jouret qu'il ingère 100 mg de sol par jour (Santé Canada, 1998).
e En supposant que l'enfant pèse 31 kg, respire 14,5 m3 d'air par jour, qu'il boit 1,1 L d'eau par jouret qu'il ingère 65 mg de sol par jour (Santé Canada, 1998).
f En supposant que l'adolescent pèse 59,4 kg, respire 15,8 m3 d'air par jour, qu'il boit 1,2 L d'eau par jouret qu'il ingère 30 mg de sol par jour (Santé Canada, 1998).
g En supposant que l'adulte pèse 70,9 kg, respire 16,2 m3 d'air par jour, qu'elle boit 1,5 L d'eau par jouret qu'elle ingère 30 mg de sol par jour (Santé Canada, 1998).
h En supposant que l'aîné pèse 72 kg, respire 14,3 m3 d'air par jour, qu'elle boit 1,6 L d'eau par jouret qu'elle ingère 30 mg de sol par jour (Santé Canada, 1998).
i Valeur basée sur la concentration maximale de mitotane détecté (110 pg/m3) dans l'air à partir de 72 cm au–dessus des sols agricoles dans le sud de l'Ontario (Kurt-Karakus et coll., 2006). L'hypothèse selon laquelle les Canadiens passent 3 heures par jour à l'extérieur est utilisée (Santé Canada, 1998).
j Aucune donnée sur la concentration du mitotane dans l'air intérieur au Canada n'a été recensée. La concentration dans l'air ambiant (110 pg/m3) déclarée par Kurt-Karakus et coll. (2006) a été utilisée comme substitut pour les données relatives à l'air intérieur. On présume que les Canadiens passent 21 heures par jour à l'intérieur (Santé Canada 1998).
k Aucune donnée pour le mitotane dans l'eau potable n'a été recensée. On a utilisé, comme valeur de substitution, la concentration maximale de 0,0002 μg/L signalée dans le cas du mitotane dans l'eau de surface de la vallée de l'Okanagan et de la vallée du Fraser Valley au Canada, entre 2003 et 2005 (Environnement Canada, 2009b).
l Aucune donnée sur la concentration du mitotane dans les aliments au Canada. On a utilisé, comme substituts, la concentration maximale déclarée du mitotane prélevé dans les rivières influencées par les Grands Lacs aux États-Unis (81,7 μg/kg poids humide; Giesy et coll. (81,7 μg/kg poids humide; Giesy et coll., 1994) ainsi que la concentration maximale déclarée dans du fromage d'Espagne (78 μg/kg; Bentabol et Jodral, 1995). La quantité quotidienne d'aliments consommés par chaque groupe d'âge est décrite par Santé Canada (1998).
m Selon les concentrations déclarées de mitotane (400 ng/g) décelé dans les sols agricoles dans le sud de l'Ontario (Kurt-Karakus et coll., 2006).
Annexe C – Résumé des effets du mitotane sur la santé
Les acronymes suivant sont utilisées dans annexe C.
DL50 : dose létale médiane (50 %)
DMENO : dose minimale avec effet nocif observé
DMEO : dose minimale avec effet observé
Annexe C-1. Animaux de laboratoire et in vitro
Toxicité aiguë :
DL50 la plus faible (rat, souris) > 4 000 mg/kg p.c. (Gaines, 1969; RTECS, 2009).
Autre DL50 orale (cobaye) > 5 000 mg/kg p.c. (RTECS, 2009). DL50 minimale par voie cutanée (lapin) > 1 200 mg/kg p.c. (Lehman, 1951).
Toxicité à court terme des doses répétées :
Plus faible DMENO par voie orale = 4 mg/kg p.c. par jour, d'après l'atrophie des glandes surrénales observée à l'examen macroscopique et la dégénérescence de cellules du cortex interne chez des chiens exposés par voie alimentaire à l'o,p'-DDD pendant quatre jours (le nombre et le sexe des animaux ainsi que les autres doses utilisées ne sont pas indiqués dans la source secondaire) (Cueto et Brown, 1958).
Autre DMENO par voie orale = 50 mg/kg p.c. par jour, d'après la force contractile du cœur et du volume plasmasmatique chez les chiens exposés par voie orale à de l'o,p'-DDD pendant 14 jours (race et sexe non précisés; aucune information supplémentaire fournie). Selon l'auteur, la réduction du volume plasmatique peut avoir été causée par une perte de liquide du compartiment intravasculaire et non par une libération d'histamine (Cueto, 1970).
Autre DMENO par voie orale = 121 mg/kg p.c. par jour, d'après une atrophie de la corticosurrénale et des organes du système lymphatique (dont le thymus) chez des rats mâles Sprague-Dawley (20/groupe) exposés par voie alimentaire à une concentration de 0 à 121 mg/kg p.c. par jour d'o,p'-DDD pendant 16 jours. On a observé une perte du poids corporel ainsi que du poids du thymus, de la rate et des glandes surrénales. Il y a eu peu d'infiltration graisseuse du foie. Aucun changement n'a pu être décelé dans les reins, le cœur et les poumons. Le nombre de cellules formant des plages d'hémolyse et des cellules formant une rosette dans la rate et le thymus étaient inférieures par rapport au groupe témoin. Un groupe recevant un régime carencé en protéines (rats dénutris) a montré une diminution de la concentration de corticostéroïdes dans le plasma et une altération moindre de la réponse immunitaire. Le nombre de cellules formant des plages d'hémolyse et des cellules formant une rosette dans la rate et le thymus de rats dénutris traités avec de l'o,p'-DDD était presque égal à celui du groupe témoin (Hamid et coll., 1974).
Autre DMENO par voie orale = 138,5 mg/kg, d'après les lésions apparentes dans la zone fasciculée et la zone réticulée chez les chiens (4) exposés par voie orale à 138,5 mg/kg p.c. par jour (capsule) d'o,p'-DDD pendant 10 jours. Les niveaux plasmatiques de cortisol ont diminué, et on a également observé une baisse de la réponse à la stimulation à la corticotrophine. Un animal a présenté une hémorragie, une invasion par des lymphocytes et une nécrose de la corticosurrénale. Aucun changement dans la rate et le foie n'a été observé (Kirk et coll., 1974).
Toxicité subchronique
Plus faible DMENO par voie orale = 0,6 mg/kg p.c. par jour, d'après les tumeurs à cellules de Leydig constatées dans les testicules de rats exposés par voie orale à l'o,p'-DDD pendant une période allant de 285 à 348 jours (autres doses non précisées, aucune information supplémentaire fournie) (Lacassagne, 1971).
DMENO par voie orale = 50 mg/kg p.c. par jour, d'après une nécrose corticosurrénale chez les chiens bâtards (10 animaux; sexe non précisé) exposés par voie orale à 50 mg/kg p.c. par jour d'o,p'-DDD en comprimés pendant 36 à 150 jours. Une nécrose touchait principalement la zone fasciculée et la zone réticulée, bien que la zona glomerulosa ait été partiellement ou complètement touchée. Des foyers ressemblant à des lésions hémorragiques ont été constatés dans la rétine de cinq chiens traités; cependant aucune lésion de la rétine n'a été observée (Kirk et Jensen, 1975).
DMENO par voie cutanée = 200 mg/kg p.c. par jour, d'après les effets graves (mais aucun décès) chez les lapins exposés par voie cutanée à des doses de 0, 200 ou 400 mg/kg p.c. par jour de DDD (isomère non précisé) pendant 90 jours. La dose de 400 mg/kg p.c. a entraîné le décès de tous les lapins après six jours (Lehman, 1951).
Toxicité chronique et cancérogénicité
Plus faible DMENO par voie orale = 5 mg/kg p.c., d'après les lésions aux tissus chez les rats exposés par voie alimentaire à 0,5 ou 20 mg/kg p.c. par jour de DDD (isomère non précisé) pendant 104 jours. Une hypertrophie du foie a été observée à la dose la plus élevée (Lehman, 1952).
Autre DMENO par voie orale = 50 mg/kg p.c., d'après une atrophie de la corticosurrénale et une stéatose hépatique chez les chiens ayant reçu dans leur alimentation des doses de 0, 50, ou 80 mg/kg p.c. par jour de DDD (isomère non précisé) jusqu'au décès (dernier décès survenu au jour 990 pour la dose la plus élevée) (Lehman, 1952).
Toxicité pour le développement
Des groupes de 13 rates Sprague-Dawley ont été élevées et exposées par gavage à des doses de 0 ou 10 mg/kg p.c. par jour d'o,p'-DDD du 15e au 19e jour de gestation. Les ratons engendrés ont été utilisés dans deux expériences. Tous les animaux ont été sevrés à l'âge de 21 jours. La toxicité maternelle du mitotane n'a pas été évaluée dans le cadre de cette étude.
DMEO pour le développement = 10 mg/kg p.c. par jour, d'après un léger, mais important retard (de 2 jours) de l'ouverture vaginale chez la progéniture de mères Sprague-Dawley. Aucun effet significatif n'a été observé sur le poids corporel, le poids des ovaires ou de l'hypophyse, ou le cycle œstral à 49, 111 et 209 jours de vie.
À partir de la même étude, des rates issues de l'accouplement (12/groupe) ont été exposées par voie sous-cutanée à des doses de 0 ou 1 mg/kg p.c. d'o,p'-DDD au deuxième, troisième et quatrième jour de vie. Elles ont présenté un œstrus vaginal persistant avant l'âge de 209 jours et l'absence de corps jaune avant l'âge de 258 jours (Gellert et Heinrichs, 1975)
Toxicité pour la reproduction
Aucune étude de toxicité pour la reproduction n'a été recensée.
Génotoxicité et paramètres connexes : in vivo
Synthèse de l'ADN non programmée
Résultats positifs : dans les poumons de souris C57B1; une seule injection intrapéritonéale à des concentrations de 0, 100 ou 500 mg/kg p.c. Des résultats négatifs ont été observés dans le foie (Lund et coll., 1990).
Génotoxicité et paramètres connexes : in vitro
Mutation génique
Résultats négatifs : Salmonella typhimurium; souches TA98, TA100, TA1535, TA1537 avec et sans activation métabolique (Mortelmans et coll., 1986)
Résultats négatifs : Salmonella typhimurium; souches TA98 et TA100 avec activation métabolique par la fraction S9 des poumons et du foie de souris (Lund et coll., 1990).
Essai par passage sur hôte
Résultats négatifs : Salmonella typhimurium; souche G46 sans activation métabolique (isomère du DDD non précisé) (Buselmaier et coll., 1972)
Aberration chromosomique (essai cytogénétique)
Résultats négatifs : cellules ovariennes de hamster chinois, avec et sans activation métabolique (Galloway et coll., 1987).
Résultats positifs : cellules de rat-kangourou sans activation métabolique (non testées avec une activation métabolique) (Palmer et coll., 1972).
Essai de transformation in vitro
Résultats négatifs : cellules embryonnaires de souris sans activation métabolique (isomère de DDD non précisé) (Langenbach et Gingell, 1975)
Essais sur la synthèse de l'ADN non programmée
Résultats négatifs : hépatocytes de rat, de souris et de hamster sans activation métabolique (hépatocytes capables d'activation métabolique; isomère de DDD non précisé) (Maslansky et Williams, 1981).
Résultats négatifs : hépatocytes de rongeur sans activation métabolique (Lund et coll., 1990).
Échange de chromatides sœurs
Résultats négatifs : cellules de hamster chinois, avec et sans activation métabolique (Galloway et coll., 1987).
Sensibilisation et irritation
Aucune sensibilisation ou irritation de la peau n'a été relevée.
Études sur les humains – études cliniques
Des effets secondaires ont été observés chez les patients traités au mitotane, à des doses allant de 110 à 140 mg/kg p.c. Une anorexie et des nausées graves ainsi qu'une dépression du système nerveux variant de la léthargie à la somnolence ont été observées chez les patients traités avec le produit (le nombre et le sexe des patients n'ont pas été précisés dans la source secondaire). Le composé n'a entraîné aucune lésion détectable dans le foie, les reins ou la moelle osseuse. Les effets toxiques se sont dissipés lorsque le traitement a été interrompu. Les testicules (y compris les cellules de Leydig) n'ont pas été étudiés (Bergenstal et coll., 1960).
D'importantes doses de mitotane (1 000 à 12 000 mg/kg p.c. par jour) ont entraîné une fatigue, l'anorexie, des nausées, des vomissements et une diarrhée chez les patients atteints du syndrome de Cushing et présentant des carcinomes corticosurrénaux (sexe et nombre de patients non précisés dans la source secondaire) et exposés à des doses de 1 000 à 12 000 mg par jour pendant une période allant jusqu'à 34 mois. Les testicules (y compris les cellules de Leydig) n'ont pas été étudiés (Hoffman et Mattox, 1972; Luton et coll., 1979). Les symptômes ont disparu peu de temps après l'arrêt de l'administration du médicament ou lorsque le dosage avait été réduit (Perevodcikova et coll., 1972).