Évaluation préalable pour le Défi
Octaméthyltrisiloxane
(MDM)
Numéro de registre du Chemical Abstracts Service
107-51-7
Environnement Canada
Santé Canada
Mars 2015
Table des Matières
- Sommaire
- Introduction
- Identité de la substance
- Propriétés physiques et chimiques
- Sources
- Utilisations
- Rejets dans l’environnement
- Concentrations environnementales mesurées
- Devenir dans l’environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d’effets nocifs sur l’environnement
- Risque d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe I : Tableau sommaire des intrants des modèles
- Annexe II : Analyse de la fugacité et des résidus corporels critiques pour le MDM
- Annexe III : Limite supérieure des estimations de l’absorption quotidienne de MDM par la population générale du Canada
- Annexe IV : Limites supérieures des estimations d’exposition à l’octaméthyltrisiloxane dans les produits de soins personnels à l’aide du ConsExpo 4.1 (ConsExpo, 2007)
- Annexe V : Données sur la structure et les propriétés du MDM et des analogues pris en compte dans cette évaluation préalable
- Annexe VI : Résumé des données sur les effets pour la santé pour le MDM
- Annexe VII : Résumé des données sur les effets pour la santé pour les analogues de MDM
- Annexe VII : Résumé des données sur les effets pour la santé pour le MDM
Sommaire
Conformément à l'article 74 de la Loi canadienne sur la protection de l'environnement (1999) [LCPE (1999)], les ministres de l'Environnement et de la Santé ont effectué une évaluation préalable de l'octaméthyltrisiloxane. Cette substance, dont le numéro de registre du Chemical Abstracts ServiceNote de bas de page[1] est le 107-51-7, sera désignée par son acronyme commun, MDM, dans la présente évaluation. Une priorité élevée a été accordée à l'évaluation préalable de cette substance inscrite au Défi du Plan de gestion des produits chimiques, car elle répond aux critères de la catégorisation écologique relatifs à la persistance, au potentiel de bioaccumulation et à la toxicité intrinsèque pour les organismes non humains et qu'elle semblait être commercialisée au Canada.
L'évaluation des risques que présente le MDM pour la santé humaine n'a pas été jugée hautement prioritaire à la lumière des résultats fournis par les outils simples de détermination du risque d'exposition et du risque pour la santé élaborés par Santé Canada aux fins de la catégorisation des substances de la Liste intérieure des substances.
Le MDM est une substance organique principalement utilisée en tant qu'ingrédient dans des produits industriels, médicaux et de consommation tels que les produits de nettoyage et de dégraissage, les lubrifiants, les diluants et solvants, les produits de soins personnels et les cosmétiques. Cette substance n'est pas présente de façon naturelle dans l'environnementNote de bas de page[2]. Le MDM n'est pas fabriqué au Canada; toutefois, les importations des années civiles 2005 et 2006 étaient de l'ordre de 100 à 100 000 kg et de 10 000 à 100 000 kg/an respectivement.
Selon certaines hypothèses et les profils d'utilisations déclarés au Canada, la majorité du MDM importée au Canada devrait être exportée hors du pays dans des produits, recyclée pendant l'utilisation industrielle, ou présente dans des produits destinés aux sites d'enfouissement ou d'incinération. Près de la moitié du MDM utilisée au Canada devrait être rejetée dans l'environnement. De plus, on devrait observer la majorité des émissions dans l'air et une petite proportion (~ 1 %) dans les eaux usées avant traitement. La pression de vapeur élevée du MDM indique que, en cas de rejet dans des environnements autres que dans l'air, cette substance aura tendance à se volatiliser dans ces milieux et dans l'air.
Le MDM présent dans l'air aura une dégradation abiotique à la suite d'une réaction avec des radicaux hydroxyles produits photochimiquement, avec des demi-vies atmosphériques de 6 à 9 jours. La modélisation prévoit que le MDM aura un important potentiel de transport atmosphérique, mais il est peu probable que cette substance se dépose sur l'eau ou le sol dans les régions éloignées. Les processus abiotiques tels que la volatilisation et l'hydrolyse sont des processus de retrait efficaces du MDM dans l'eau et le sol ; la demi-vie de l'hydrolyse est de 0,12 à 60,9 jours et de 1,5 à 120 jours pour l'eau et le sol, respectivement. Aucune donnée n'était disponible sur la dégradation du MDM dans les sédiments, et une demi-vie de biodégradation calculée de 365 jours a été déterminée grâce à des données analogues. Cette demi-vie démontre que le MDM peut être présent dans les sédiments pour de longues périodes de temps. Cependant, le MDM a démontré un faible potentiel de biodégradation microbienne. En outre, d'après les preuves de dégradation abiotique active de la substance dans le sol et l'eau, il semble qu'une analyse de la persistance dans les sédiments reposant seulement sur les données de la biodégradation sous-estimerait le potentiel d'élimination dans ce milieu.
Le MDM a démontré une grande capacité de bioconcentration dans le cadre d'essais en laboratoire réalisés sur des poissons. Cette substance peut également avoir un grand potentiel d'accumulation dans des organismes grâce à l'exposition alimentaire. Un facteur de bioamplification empirique inférieur à 1 indique que cette substance ne devrait pas être transférée d'un niveau trophique au niveau supérieur dans le réseau alimentaire étudié.
Le MDM a démontré un faible potentiel de risques pour les espèces aquatiques, et aucun effet nocif n'a été observé après des expositions prolongées à des concentrations allant jusqu'au seuil de solubilité dans l'eau. Des effets nocifs ont été déclarés dans l'une des deux études en laboratoire menées sur des espèces vivant dans les sédiments, Lumbriculus variegatus. Cependant, aucun effet nocif n'a été observé dans une seconde étude réalisée sur les espèces Lumbriculus , ni sur des études en laboratoire menées sur deux autres espèces vivant dans des sédiments. La dose minimale avec effet déterminée dans le cadre des essais sur l'espèce Lumbriculus est nettement supérieure aux niveaux de MDM mesurés ou estimés dans l'environnement. On n'a trouvé aucune information sur les effets potentiels sur les espèces terrestres. Cependant, les résultats obtenus pour un composé semblable mécaniquement laissent entendre que le MDM ne devrait pas être dangereux pour les invertébrés terrestres ou les plantes.
Des données de surveillance indiquent que les niveaux d'exposition au MDM dans l'environnement sont très faibles. Les concentrations de la substance se trouvaient en dessous des seuils de détection dans les échantillons d'eau de surface, de sol et de sédiments, y compris ceux prélevés près de sources potentielles de rejet de MDM. De faibles concentrations de MDM ont été détectées dans certains échantillons d'air et on a également mesuré cette substance dans des influents et effluents d'usines de traitement des eaux usées, certaines eaux de procédés industriels avant traitement et des lixiviats de sites d'enfouissement. Cependant, les réductions substantielles des concentrations dans les effluents par rapport à celles que l'on retrouve dans les influents indiquent que le traitement des eaux usées réduit efficacement la quantité de MDM qui est prête à se mélanger aux eaux réceptrices. Les résultats des analyses du quotient de risque réalisées pour les eaux de surface et les sédiments ont déterminé que les plus fortes concentrations de MDM prévues dans l'environnement canadien sont nettement moins importantes que les concentrations expérimentales sans effet.
Des preuves relatives à la dégradation abiotique active du MDM, et les données sur le rejet direct limité de cette substance dans l'environnement et sur son élimination efficace des usines de traitement des eaux usées indiquent que le MDM aura un potentiel d'exposition faible dans l'environnement. D'après la présence limitée du MDM dans l'environnement, cette substance devrait présenter un faible risque d'effets nocifs pour les organismes exposés aux quantités présentes dans ce milieu. Les niveaux faibles d'exposition et de risque de danger indiquent que le MDM présenterait un faible risque d'effets nocifs pour les organismes ou pour l'intégrité globale de l'environnement. Il est donc proposé de conclure que le MDM ne satisfait pas aux critères énoncés aux alinéas 64a) et b) de la LCPE (1999), car il ne pénètre pas dans l'environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique, ou à mettre en danger l'environnement essentiel pour la vie.
En ce qui concerne la santé humaine, il est probable que la principale source d'exposition au MDM dans les milieux naturels ait lieu par l'intermédiaire de l'air intérieur. L'exposition de la population générale au MDM dans les produits de consommation peut avoir principalement lieu par l'utilisation de cosmétiques et de certains produits de soins personnels.
Les données empiriques disponibles étaient limitées relativement aux effets du MDM sur la santé. Des effets sur le foie, les reins et les poumons et une diminution du gain de poids corporel ont été observés chez les rats après une exposition à des doses répétées de MDM et de ses analogues. Les marges entre les estimations de la limite supérieure de l'exposition provenant des milieux environnementaux et de l'utilisation de produits de consommation contenant du MDM, et les niveaux d’effets critiques chez les animaux de laboratoire sont considérés comme adéquats pour tenir compte des incertitudes dans les bases de données concernant les effets sur la santé et l'exposition.
Compte tenu de l'adéquation des marges d'exposition entre les estimations supérieures de l'exposition au MDM et des niveaux d'effet critique chez les animaux de laboratoire, il est proposé de conclure que le MDM ne satisfait pas aux critères énoncés au paragraphe 64(c) de la LCPE (1999), car il ne pénètre pas l'environnement en quantités, à des concentrations ou dans des conditions qui constituent ou peuvent constituer un danger pour la vie ou la santé humaines au Canada. D'après les renseignements disponibles en ce qui concerne les considérations se rapportant à la santé humaine, il est conclu que le MDM ne constitue pas un danger au Canada pour la vie ou la santé humaine.
Par conséquent, d'après les renseignements disponibles, le MDM ne satisfait à aucun des critères de l'article 64 de la LCPE 1999.
Introduction
La Loi canadienne sur la protection de l'environnement (1999) [LCPE (1999)] (Canada, 1999) exige que les ministres de l'Environnement et de la Santé procèdent à une évaluation préalable des substances qui répondent aux critères de la catégorisation énoncés dans la Loi afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l'environnement ou la santé humaine.
En se fondant sur l'information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu'une attention prioritaire devait être accordée à un certain nombre de substances :
- celles qui répondent à tous les critères environnementaux de la catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque pour les organismes aquatiques (Ti), et que l'on croit être commercialisées au Canada;
- celles qui répondent aux critères de la catégorisation pour le plus fort risque d'exposition (PFRE) ou qui présentent un risque d'exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine, compte tenu des classifications qui ont été établies par d'autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont publié un avis d'intention dans la Partie I de la Gazette du Canada (Canada, 2006) dans lequel ils priaient l'industrie et les autres parties intéressées de fournir, selon un calendrier déterminé, des renseignements précis qui pourraient servir à étayer l'évaluation des risques, ainsi qu'à élaborer et à évaluer les meilleures pratiques de gestion des risques et de bonne gestion des produits pour ces substances jugées hautement prioritaires.
On a décidé d'accorder une attention hautement prioritaire à l'évaluation des risques pour l'environnement de l'octaméthyltrisiloxane, car il a été déterminé, lors de la catégorisation, que cette substance répondait aux critères relatifs à la persistance, au potentiel de bioaccumulation et à la toxicité intrinsèque pour les organismes aquatiques et il semble qu'elle est commercialisée au Canada. Le volet du Défi portant sur cette substance a été publié dans la Gazette du Canada le 26 décembre 2009 (Canada, 2009a, 2009b). En même temps a été publié le profil de la substance, qui présentait l'information technique (obtenue avant décembre 2005) sur laquelle a reposé sa catégorisation. Des renseignements relatifs aux propriétés chimiques, au potentiel de bioaccumulation, à la persistance, au danger et aux utilisations et au potentiel d'exposition de la substance ont été communiqués en réponse au Défi.
Même si l'évaluation des risques que présente l'octaméthyltrisiloxane pour l'environnement est jugée hautement prioritaire, cette substance ne répond pas aux critères de la catégorisation pour le PFRE ou le REI, ni aux critères définissant un grave risque pour la santé humaine, compte tenu du classement attribué par d'autres organismes nationaux ou internationaux quant à sa cancérogénicité, à sa génotoxicité ou à sa toxicité sur le plan du développement ou de la reproduction.
Les évaluations préalables effectuées portent une attention particulière aux renseignements jugés essentiels pour déterminer si une substance répond aux critères de l'article 64 de la LCPE (1999). Les évaluations préalables visent à étudier les renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudenceNote de bas de page[3]. L'utilisation du terme « prudence » dans l'ensemble de la présente évaluation se rapporte à l'approche protectrice adoptée.
La présente évaluation préalable tient compte des renseignements sur les propriétés chimiques, le devenir, les dangers, les utilisations et l'exposition, notamment les renseignements supplémentaires soumis par les intervenants. Nous avons relevé des données pertinentes jusqu'à septembre 2014. Les études les plus importantes, ainsi que les résultats modélisés, ont fait l'objet d'une évaluation critique en vue de formuler des conclusions. Lorsqu'ils étaient disponibles et pertinents, les renseignements contenus dans les évaluations des risques et des dangers effectuées par d'autres instances ont été utilisés. L'évaluation préalable ne présente pas un examen exhaustif ou critique de toutes les données disponibles; elle fait plutôt état des études et des éléments de preuve les plus importants pour appuyer la conclusion.
La présente évaluation préalable a été préparée par le personnel du Programme des substances existantes de Santé Canada et d'Environnement Canada et elle intègre les résultats d'autres programmes exécutés par ces ministères. Les parties de la présente évaluation préalable qui portent sur la santé humaine et l'écologie ont fait l'objet d'une étude consignée par des pairs et d'une consultation de ces derniers. L'ébauche originale de la présente évaluation préalable a été publiée en janvier 2011 et a fait l'objet d'une période de commentaires du public de 60 jours. Après la réception de nouveaux renseignements pertinents pour la présente évaluation, des révisions importantes ont été apportées à la partie écologique de la présente évaluation préalable et la mise à jour de l'ébauche a été publiée en mars 2014 pour une deuxième période de commentaires du public de 60 jours. D'autres commentaires ont été reçus au sujet de la mise à jour de l'ébauche au cours de la deuxième période de commentaires du public de 60 jours et ont été pris en considération au cours de la préparation de la version finale du rapport d'évaluation préalable.
Les méthodes utilisées dans les évaluations préalables menées dans le cadre du Défi ont été examinées par un Groupe consultatif du Défi indépendant. Bien que les commentaires externes aient été pris en considération, Santé Canada et Environnement Canada assument la responsabilité du contenu final et des résultats de l'évaluation préalable.
Les principales données et considérations sur lesquelles repose la présente évaluation sont résumées ci-après.
Identité de la substance
Nom de la substance
Aux fins du présent document, la substance octaméthyltrisiloxane est appelée MDM, appellation établie suivant les règles de nomenclature des polydiméthylsiloxanes présentées dans Fendinger et al. (1997), où M représente une unité de (CH3)3Si- et D, une unité de -Si(CH3)2-O-.
| Numéro de registre duChemical Abstracts Service(n° CAS) | 107-51-7 |
|---|---|
| Nom dans la LIS | Octaméthyltrisiloxane |
| Noms relevés dans lesNational Chemical Inventories(NCINote de bas de page Tableau 1[a]) | Trisiloxane, 1,1,1,3,3,5,5,5-octamethyl- (TSCA); Trisiloxane, octamethyl- (AICS, PICCS, ASIA-PAC, NZIoC); Octamethyltrisiloxane (EINECS, ECL) |
| Autres noms | Diméthylbis(triméthylsiloxy)silane Pentaméthyl(triméthylsiloxy)disiloxane Pentaméthyl(triméthylsilyloxy)disiloxane L3 Trisiloxane (INCI)Note de bas de page Tableau 1[b] |
| Groupe chimique (groupe de la LIS) |
Produits chimiques organiques définis |
| Principale classe chimique ou utilisation | Organosiliciums |
| Principale sous-classe chimique | Méthylsiloxanes volatils linéaire (VMS linéaires) |
| Formule chimique | C8H24O2Si3 |
| Structure chimique | 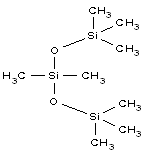 |
| SMILESNote de bas de page Tableau 1[c] | C[Si](C)(C)O[Si](C)(C)O[Si](C)(C)C |
| Masse moléculaire | 236,5 g/mol |
Propriétés physiques et chimiques
Le tableau 2 présente les données physiques et chimiques (valeurs expérimentales et modélisées) du MDM qui se rapportent à son devenir dans l'environnement.
| Propriété | Type | ValeurNote de bas de page Tableau 2[a].1 | Température (oC) | Référence |
|---|---|---|---|---|
| Point de fusion (oC) |
Expérimental | -82Note de bas de page Tableau 2[*] | s.o. | SEHSC, 2006 |
| Point de fusion (oC) |
Modélisé | -53 | s.o. | MPBPVPWIN, 2008 |
| Point d’ébullition (oC) |
Expérimental | 152,5[*] | s.o. | SEHSC, 2006 |
| Point d’ébullition (oC) |
Modélisé | 142 | s.o. | MPBPVPWIN, 2008 |
| Densité (kg/m3) |
Expérimental | 820 (0,820 g/cm3) |
20 | Mazzoni et al., 1997 |
| Pression de vapeur (Pa) |
Expérimental | 520[*] (3,9 mm Hg) |
s.o. | SEHSC, 2006 |
| Pression de vapeur (Pa) |
Modélisé | 465 (3,5 mm Hg) |
25 | MPBPVPWIN, 2008 |
| Constante de la loi de Henry (Pa·m3/mol) |
Expérimental | 3,0 × 105 (121 sans dimension) |
25 | SEHSC, 2006 |
| Constante de la loi de Henry (Pa·m3/mol) |
Expérimental | 2,9 × 106[*] | 25 | Xu et Kropscott, 2010 |
| Constante de la loi de Henry (Pa·m3/mol) |
Modélisé | 4,23 × 104 (0,418 atm·m3/mol; méthode d'estimation fondée sur les liaisons) |
25 | HENRYWIN, 2008 |
| Constante de la loi de Henry (Pa·m3/mol) |
Modélisé | 4,07 × 106 (40,2 atm·m3/mol; méthode d'estimation de la pression de vapeur et de l'hydrosolubilité)Note de bas de page Tableau 2[b] |
25 | HENRYWIN, 2008 |
| Constante de la loi de Henry (Pa·m3/mol) |
Modélisé | 3,62 × 106 (35,7 atm·m3/mol; méthode d'estimation de la pression de vapeur et de l'hydrosolubilité)Note de bas de page Tableau 2[c] |
25 | HENRYWIN, 2008 |
| Log Koe (coefficient de partage octanol-eau) (sans dimension) |
Expérimental | 4,8 | 25 | Bruggeman et al., 1984 |
| Log Koe (coefficient de partage octanol-eau) (sans dimension) |
Expérimental | 6,6[*] | 24,1 | SEHSC, 2010 |
| Log Koe (coefficient de partage octanol-eau) (sans dimension) |
Modélisé | 6,7 | 25 | KOWWIN, 2008 |
| Log Koa (coefficient de partage octanol-air) (sans dimension) |
Expérimental | 3,72[*] | 25 | Xu et Kropscott, 2010 |
| Log Koa (coefficient de partage octanol-air) (sans dimension) |
Modélisé | 4,5 | 25 | KOAWIN, 2008 |
| Log Kco (coefficient de partage carbone organique/eau) (sans dimension) |
Expérimental | 4,34[*] | 25 | Durham et Kozerski, 2010 |
| Log Kco (coefficient de partage carbone organique/eau) (sans dimension) |
Modélisé | 3,4 à 5,7 | 25 | KOCWIN, 2008 |
| Hydrosolubilité (mg/L) |
Expérimental | 0,034[*] | 23 | Varaprath et al., 1996 |
| Hydrosolubilité (mg/L) |
Modélisé | 0,027 | 25 | WSKOWWIN, 2008 |
Le MDM fait partie d'un groupe de composés organosiliciés (c.-à-d., des substances contenant une chaîne principale alternant silicium et oxygène) appelés méthylsiloxanes volatils (VMS) (Chandra, 1997). Les VMS sont des alkylsiloxanes oligomériques présentant une faible masse moléculaire (moins de 600 g/mol) et une pression de vapeur importante dans des conditions environnementales ambiantes (Allen et al., 1997; Hobson et al., 1997). Ce groupe de substances est également très hydrophobe et présente une faible solubilité dans l'eau. Le MDM est un VMS linéaire, ce qui indique que les composantes structurales de la molécule de siloxane sont disposées de façon linéaire plutôt que cyclique (tableau 1).
Sources
Il n'y a pas de sources naturelles connues du MDM.
Les résultats de l'enquête menée en réponse à l'avis publié en vertu de l'article 71 de la LCPE (1999) ont indiqué qu'au cours de l'année civile 2005, le MDM n'a pas été fabriqué au Canada en une quantité égale ou supérieure au seuil de déclaration de 100 kg. Toutefois, sept entreprises canadiennes ont déclaré avoir importé du MDM au Canada, l'une d'entre elles en une quantité inférieure au seuil de déclaration de 100 kg, deux entreprises en ayant importé entre 100 et 1 000 kg par année, et quatre entreprises ayant déclaré en avoir importé entre 1 001 et 100 000 kg par année (Environnement Canada, 2007a). De plus, deux entreprises canadiennes ont indiqué un intérêt pour cette substance.
Une autre enquête menée en vertu de l'article 71 pour l'année civile 2006 a indiqué que le MDM n'a pas été fabriqué au Canada en une quantité égale ou supérieure au seuil de déclaration de 100 kg. Les importations totales déclarées pour cette année étaient comprises entre 10 000 et 100 000 kg (Environnement Canada, 2010a). Le MDM a été importé au pays soit comme une substance pure, dans un mélange, en tant que composant des produits finis, ou en tant que résidu dans les polymères de silicone et les oligomères (Environnement Canada, 2010a).
Entre 2001 et 2010 (l'année de déclaration la plus récente), le MDM a été utilisé au Danemark, une utilisation totale de 400 kg ayant été signalée pour 2010 (SPIN, 2013). Les quantités totales utilisées en Norvège sont restées relativement constantes au cours de la période 2001-2010 et étaient comprises entre 300 et 600 kg par année. À l'exception d'une quantité utilisée de 300 kg signalée par la Finlande en 2010, aucune autre déclaration n'a été fournie à la base de données Substances in Preparations in Nordic Countries (SPIN) par les trois autres pays nordiques participants (Suède, Finlande et Norvège). À l'heure actuelle, le MDM ne figure pas sur les listes de substances chimiques produites en grandes ou en petites quantités de l'Union européenne (ESIS, c1995-2009) et n'est pas inclus dans le HPV Challenge Program de l'Environmental Protection Agency des États-Unis (HPVIS, 2012).
Utilisations
Les renseignements fournis dans les études menées en vertu de l'article 71 ont indiqué que pour les années civiles 2005 et 2006, les activités commerciales associées à l'utilisation du MDM au Canada relevaient des secteurs suivants : ceux des ventes en gros et de la distribution de produits chimiques (sauf les produits agricoles) et de produits analogues, et des magasins de produits de santé et de soins personnels (Environnement Canada, 2007a et 2010a). D'autres activités ont été signalées dans la fabrication de produits chimiques de base; de peintures, de revêtements et d'adhésifs; de savons, de produits de nettoyage et de produits de toilette; de produits plastiques et de semi-conducteurs et d'autres composants électroniques. Des activités ont également été signalées pour la construction de fondations, de structures et d'extérieurs d'immeubles.
Le MDM est principalement utilisé en tant qu'ingrédient dans la préparation de polymères, d'oligomères et de mélanges de polydiméthylsiloxane (PDMS) (Hobson et al., 1997; SEHSC, 2010; Environnement Canada, 2010a). Ces formulations de PDMS sont appliquées comme composants de formulation dans un éventail de produits industriels, médicaux et de consommation (Fendinger et al., 1997). Les formulations de PDMS contenant du MDM, appelées aussi diméticone, peuvent se trouver dans un éventail de produits de nettoyage et de dégraissage, de lubrifiants, de diluants et de solvants, ainsi que dans des cosmétiques et des produits de soins personnels (SEHSC, 2005; DowCorning Corporation, 2009d, 2009e, 2010a).
Dans les cosmétiques, les formulations de PDMS (polymères, oligomères, et mélanges) sont généralement appelées diméthicone. Le MDM peut être présent dans la diméthicone comme composante du mélange PDMS ou sous la forme d'une impureté (laissée par le traitement des polymères et des oligomères du PDMS) (Environnement Canada, 2010a). Le MDM peut être ajouté à des cosmétiques sous sa forme pure comme additif antimousse, ou comme agent revitalisant pour la peau (CosIng, 1976- ). La substance sert également de substrat et d'émollient dans les produits de soins pour la peau et les cheveux, ainsi que dans les produits antisudorifiques (DowCorning Corporation, 2009d). Le MDM ne figure pas à la Liste de Santé Canada sur les ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques (plus couramment appelée la liste critique des ingrédients des cosmétiques, ou simplement liste critique), un outil administratif dont se sert Santé Canada pour aviser les fabricants, parmi d'autres, que certaines substances, lorsqu'elles sont utilisées dans les cosmétiques, peuvent contrevenir à : a) l'interdiction générale qui se trouve à l'article 16 de la Loi sur les aliments et drogues ; b) une disposition du Règlement sur les cosmétiques) en tant que substance interdite ou restreinte et, par conséquent, peut être utilisé dans la formulation de produits cosmétiques (Santé Canada, 2014). Selon les notifications soumises aux termes du Règlement sur les cosmétiques à Santé Canada, le MDM est présent dans certains produits cosmétiques (se référer à la partie sur l'exposition relative aux types de produits) (courriel adressé en avril 2013 par la direction de la sécurité des produits de consommation de Santé Canada au Bureau de l'évaluation des risques des substances existantes de Santé Canada; source non citée).
Le MDM est répertorié dans la base de données sur les ingrédients des produits de santé naturels (BDIPSN) comme ingrédient non médicinal, agent antimousse et agent conditionnant pour la peau aux fins d'utilisation dans les produits de santé naturels topiques seulement (BDIPSN, 2014). Il figure dans la Base de données des produits de santé naturels homologués (BDPSNH) en tant qu'ingrédient non médicinal présent dans des produits de santé naturels actuellement homologués (BDPSNH, 2014).
Le MDM ne figure pas dans la Base de données sur les produits pharmaceutiques en tant qu'ingrédient médicinal présent dans les produits pharmaceutiques ou vétérinaires (BDPP, 2014). Toutefois, il est répertorié dans la Base de données interne des ingrédients non médicinaux de la Direction des produits thérapeutiques comme ingrédient non médicinal présent dans les produits thérapeutiques commercialisés utilisés comme écrans solaires, mais pas dans les médicaments vétérinaires (communication personnelle de la Direction des produits thérapeutiques de Santé Canada, 2014; source non citée).
Le MDM n'est pas répertorié comme additif alimentaire au titre 16 du Règlement sur les aliments et drogues (RAD) (Canada, 2010). Le MDM n'a pas été répertorié dans la formulation d'additifs indirects ou dans les matériaux d'emballage des aliments (communication personnelle de la Direction des aliments de Santé Canada, 2010; source non citée). Toutefois, le PDMS (no CAS 9006-65-9; USP, 2010) est un additif alimentaire autorisé conformément au point D.1 du tableau VIII, titre 16 du Règlement sur les aliments et drogues (Canada, 2010). Le PDMS est un composant courant des auxiliaires de transformation d'aliments utilisés pour maîtriser la mousse dans des applications alimentaires. Enfin, le MDM a été répertorié comme impureté dans un formulant de produit antiparasitaire herbicide (communication personnelle, Agence de réglementation de la lutte antiparasitaire, Santé Canada, 2013, source non citée).
Rejets dans l'environnement
En tant que composant de produits entrant dans un éventail d'applications du secteur industriel et pour le grand public, les rejets de MDM dans l'environnement canadien pourraient survenir lors d'opérations de transformation, notamment le transport et l'entreposage de matériaux, ainsi que pendant la durée de vie utile et l'élimination de produits contenant du MDM. En se fondant sur cette possibilité, tant des rejets dispersifs que non dispersifs de MDM dans l'environnement sont possibles. Les résultats de l'avis publié en application de l'article 71 pour l'année 2006 (Environnement Canada, 2010a) ont été utilisés pour estimer les rejets potentiels de MDM dans l'environnement canadien.
Environnement Canada a mis sur pied une méthode pour estimer les pertes d'une substance pendant les différentes étapes de son cycle de vie, y compris son devenir dans un produit ou un article fini (Environnement Canada, 2008). Cette méthode, appelée le débit massique, comprend une analyse du cycle de vie et un tableur (outil de débit massique) qui intègrent les renseignements sur la fabrication, l'importation et l'utilisation des produits disponibles pour la substance. En commençant par une masse définie de la substance, chaque étape du cycle de vie est par la suite évaluée jusqu'à ce qu'il n'y ait plus de masse. Les facteurs pertinents sont étudiés, les incertitudes sont reconnues et des hypothèses peuvent être émises pendant chaque étape, selon les renseignements disponibles. Les pertes estimées représentent le bilan massique exhaustif de la substance au cours de son cycle de vie et elles comprennent les rejets dans les eaux usées et d'autres milieux récepteurs (sol, air), la transformation chimique, le transfert vers les activités de recyclage et le transfert vers les sites d'élimination des déchets (site d'enfouissement, incinération). Toutefois, à moins de disposer de données précises sur le taux ou le potentiel de rejet de cette substance provenant des sites d'enfouissement et des incinérateurs, la méthode ne permet pas de quantifier les rejets dans l'environnement à partir de ces sources, pendant ou après leur élimination.
En règle générale, les rejets d'une substance dans l'environnement peuvent découler de différentes pertes de la substance pendant le processus de fabrication, son utilisation industrielle ainsi que son utilisation commerciale et par les consommateurs. Ces pertes peuvent être regroupées en sept types : (1) déversements dans les eaux usées; (2) émissions atmosphériques; (3) émissions dans les terres; (4) transformation chimique; (5) élimination sur les sites d'enfouissement; (6) élimination par incinération; et (7) élimination par recyclage (p. ex. le recyclage, jugé comme une perte, n'est pas pris en considération). Elles sont estimées à partir de données issues d'enquêtes réglementaires, des industries, ainsi qu'en fonction des données publiées par différents organismes. Les déversements dans les eaux usées font référence aux pertes dans les eaux usées brutes avant tout traitement, que ce soit un traitement des eaux usées industrielles sur place ou un traitement des eaux usées hors site. De la même manière, les pertes par transformation chimique font référence aux modifications de l'identité de la substance qui peuvent avoir lieu au cours des étapes de fabrication, d'utilisation industrielle ou d'utilisation commerciale et par les consommateurs, mais elles excluent celles qui ont lieu pendant les opérations de gestion des déchets telles que l'incinération et le traitement des eaux usées. La perte dans les terres inclut le transfert accidentel ou les rejets dans le sol ou les surfaces pavées ou non pavées pendant l'utilisation de la substance et sa durée de vie utile (p. ex. à partir de l'utilisation de machinerie agricole ou d'automobiles). La perte dans les terres n'inclut toutefois pas les autres transferts vers l'utilisation de la substance et sa durée de vie utile (p. ex. application au sol des biosolides et dépôts atmosphériques).
Les pertes estimées pour le MDM au cours de son cycle de vie (fondées sur des hypothèses prudentes) sont présentées au tableau 3 (Environnement Canada, 2010b). Étant donné qu'il n'y a pas eu de fabrication de MDM au Canada au-delà des seuils de déclaration, les pertes estimatives se fondent sur les quantités importées signalées pour 2006.
| Type de perte | Proportion (%) | Étapes pertinentes du cycle de vie |
|---|---|---|
| Eaux usées (avant le traitement des eaux usées) |
1,1 | Utilisation industrielle et utilisation commerciale ou par les consommateurs |
| Émissions atmosphériques | 45,4 | Utilisation industrielle et utilisation commerciale ou par les consommateurs |
| Émissions dans les terres | 0,0 | - |
| Transformation chimique | 0,0 | - |
| Sites d'enfouissement | 5,1 | Utilisation industrielle et utilisation commerciale ou par les consommateurs |
| Incinération | 1,3 | Utilisation industrielle et utilisation commerciale ou par les consommateurs |
| Recyclage | 16,1 | Utilisation à des fins industrielles |
| Exportation | 31,0 | Utilisation industrielle et utilisation commerciale ou par les consommateurs |
On s'attend à ce que la plus grande partie du MDM soit rejetée dans l'atmosphère pendant des applications commerciales et par les consommateurs ou des utilisations industrielles (45,4 %) ou qu'elle soit exportée dans des préparations commerciales (31 %). On s'attend également à un recyclage important (16,1 %) au cours de l'utilisation industrielle, et à des pertes plus petites dans les eaux usées (1,1 %) ou l'élimination dans les sites d'enfouissement (5,1 %) et les incinérateurs (1,3 %) dans le cadre d'applications dans le secteur industriel ou d'applications commerciales et par les consommateurs.
Concentrations environnementales mesurées
Les données relatives à la présence du MDM dans l'environnement sont présentées dans l'annexe II. De récentes données de surveillance canadiennes ont été obtenues pour l'air, les sédiments, les effluents des procédés et les eaux usées (à savoir, les influents et les effluents des usines de traitement des eaux usées, les lixiviats de sites d'enfouissement et les eaux industrielles), et le biote.
Air
Cheng et al. (2011) ont mesuré des concentrations de 0,97 à 2 ng/m3(valeur médiane de 1,53 ng/m3; n = 8) dans des échantillons d'air prélevés dans une station de traitement des eaux usées de l'Ontario entre juillet et septembre 2009. Les niveaux en aval et en amont de la station étaient de 0,66 à 0,77 ng/m3(valeur médiane de 0,73 ng/m3; n = 3) et de 1,41 ng/m3(n = 1), respectivement. Les concentrations dans deux échantillons d'air prélevés en novembre 2009 au-dessus d'un bassin d'aération d'une deuxième usine de traitement des eaux usées de l'Ontario étaient de 1,88 et de 2,64 ng/m3. La même étude a mesuré des concentrations d'air de 5,60 et de 6,14 ng/m3dans deux emplacements situés sous le vent par rapport à deux sites d'enfouissement de l'Ontario. Les concentrations en aval des sites étaient de 0,49 et de 0,87 ng/m3. L'échantillonnage pour les sites d'enfouissement s'est déroulé de juin à août 2009.
Genualdi et al. (2011) ont examiné la présence des VMS linéaires et cycliques sur 20 sites de la planète, y compris dans l'Arctique, dans des sites de référence éloignés et des zones urbaines (tableau 4). Le MDM a été détecté dans 4 des 12 sites de référence (Whistler [Colombie-Britannique]; Point Reyes [Californie]; Groton [Connecticut]; Hilo [Hawaï]) à des concentrations comprises entre 0,011 et 0,019 ng/m3, ainsi que dans 2 des 3 sites urbains (Downsview [Ontario] et Paris [France], mais pas à Sydney [Floride]) à des concentrations de 0,12 et 0,029 ng/m3. La substance n'a été détectée dans aucun des quatre échantillons de l'Arctique (seuil de détection de 0,011 ng/m3) et n'a pas été détectée dans l'un des échantillons agricoles (lac Bratt's [Saskatchewan]). Un seul des trois VMS linéaires examinés dans cette étude (MDM, L4, L5) était présent au-dessus du seuil de détection dans un échantillon de l'Arctique, le L4 présentant une concentration mesurée de 0,013 ng/m3au site polaire du lac Little Fox (Yukon). Les concentrations de VMS linéaires étaient jusqu'à trois ordres de grandeur inférieures à celles des VMS cycliques (D3, D4, D5, D6), avec des concentrations moyennes plus élevées pour la somme des VMS linéaires liés aux zones urbaines (0,63 ng/m3) par rapport aux sites de référence (0,03 ng/m3). Les faibles concentrations obtenues pour les sites de référence et dans l'Arctique ont été prises pour indiquer que le MDM et d'autres VMS linéaires ne subissaient pas d'important transport atmosphérique à grande distance, tandis que les concentrations plus élevées constatées dans des zones plus peuplées ont été attribuées à l'utilisation de produits de soins personnels et d'autres sources intérieures (Genualdi et al., 2011). Cependant, il est également possible que les faibles concentrations observées dans les régions nordiques et éloignées découlent de la dilution des substances à des niveaux inférieurs aux seuils de détection en raison de leur transport vers des régions éloignées de leurs sources.
Krogseth et al. (2013) ont signalé des concentrations de 0,39 à 6,43 ng/m3(valeur médiane de 1,8 ng/m3; n = 41) dans des échantillons d'air prélevés sur le campus de l'Université de Toronto, Scarborough dans une zone suburbaine de Toronto, en Ontario. Les échantillons ont été prélevés sur une période de quatre mois de mars à juin 2012.
Le MDM n'a pas été détecté (seuil de détection de 8 ng/m3) dans 24 échantillons d'air prélevés en 2004 et en 2005 à partir de divers sites dans 6 pays nordiques (Kaj et al., 2005b).
Milieu aquatique
Le MDM n'a pas été détecté (seuils de détection de 0,5 à 0,8 ng/L) dans des échantillons ponctuels en surface d'eau douce (n = 10) et d'eau de mer (n = 8) prélevés de 2004 à 2006 à divers endroits au Danemark, en Norvège, en Islande et en Suède (Kaj et al. , 2005b; Schlabach et al. , 2007). Un échantillon ponctuel est un échantillon dans lequel toute la substance d'essai de l'échantillon est prélevée en même temps; par conséquent, un échantillon ponctuel illustre les conditions propres à l'emplacement au moment auquel ledit échantillon a été prélevé.
Sédiments
Le MDM n'a pas été détecté (limites de détection de 0,2 à 7 ng/g p.s.) dans 93 échantillons ponctuels de sédiments prélevés en 2011 à divers endroits dans la région des Grands Lacs (Backus et al. , 2012), ni dans les échantillons ponctuels de sédiments prélevés la même année dans des sites sur le lac Ontario (n = 10) et le lac Pepin, dans le Minnesota (n = 24; limites de détection de 0,18 à 0,76 ng/g p.s.) (CES, 2012). Le MDM n'a pas non plus été détecté (seuil de détection de 20 ng/g poids sec) dans 126 échantillons ponctuels de sédiments prélevés en 2012 à Terre-Neuve (n = 1), en Nouvelle-Écosse (n = 3), au Nouveau-Brunswick (n = 2), au Québec (n = 78), en Ontario (n = 39) et en Colombie-Britannique (n = 3) (Pelletier et al. , 2012). Pour les trois études, les sites d'échantillonnage ont été sélectionnés près de sources ponctuelles, avérées ou potentielles, de MDM, et loin de sources potentielles, ponctuelles ou non ponctuelles (sites de référence).
Le MDM n'a pas été détecté (seuils de détection de 0,02 à 0,71 ng/g p.s.) dans 36 échantillons ponctuels de sédiments, dont 6 provenant de l'Arctique norvégien, prélevés de 2003 à 2008 en Norvège, au Danemark, en Finlande et aux Îles Féroé (Kaj et al. , 2005b; Schlabach et al. , 2007; Evenset et al. , 2009).
Effluents de traitement et eaux usées
Alaee (2012) ont analysé les échantillons ponctuels d'influents et d'effluents prélevés en 2011 et provenant de 15 usines de traitement des eaux usées en Ontario, au Québec et en Colombie-Britannique. le MDM était présent dans 10 des 16 échantillons d'influents à des concentrations de 6 à 96 ng/L, et dans 3 des 15 échantillons d'effluents à des concentrations de 3 à 10 ng/L (limites de détection de 1 à 13 ng/L).
Les données préliminaires de Alaee (2014) montrent des concentrations de 1 à 531 ng/L dans 16 échantillons d'influents, et de 0,4 à 114 ng/L dans neuf des 16 échantillons d'effluents prélevés en 2012 dans des usines de traitement des eaux usées en Ontario, au Québec et en Colombie-Britannique (seuil de détection de 1 ng/L).
Des mesures préliminaires menées par Khera (2014) ont décelé des MDM dans les 17 échantillons d'influents prélevés en 2012 dans des usines de traitement des eaux usées au Canada. Les concentrations dans les influents variaient de 14 à 531 ng/L, tandis que les échantillons d'effluent recueillis dans ces mêmes usines contenaient des concentrations comprises entre 0,5 et 115 ng/L (dans 12 échantillons sur 18, limite de détection de 0,4 ng/L). Des échantillons d'influents prélevés au cours de la première partie de 2013 contenaient des concentrations comprises entre 4,7 et 388 ng/L (dans 12 échantillons sur 16), tandis que les échantillons d'effluents contenaient des concentrations comprises entre 0,9 et 66 ng/L (dans 13 échantillons sur 16, limite de détection de 0,4 ng/L). En juillet 2013, la limite de détection pour les échantillons d'influents et d'effluents a été relevée à 53 ng/L. Le MDM n'a pas été détecté dans 24 échantillons d'influents et d'effluents prélevés sur le reste de l'année 2013 (seuil de détection de 53 ng/L). Le MDM était présent à des concentrations de 60 à 128 ng/L dans trois des 21 échantillons d'influents prélevés dans les usines de traitement des eaux usées en 2014, mais n'a pas été trouvée dans 21 échantillons d'effluents (limite de détection de 53 ng/L).
Des concentrations de 1 à 32 ng/L ont été mesurées dans 4 des 6 échantillons ponctuels d'influents prélevés dans des usines de traitement des eaux usées de 2004 à 2006 dans plusieurs pays nordiques (Kaj et al. , 2005b; Schlabach et al. , 2007). Le MDM n'a pas été détecté (seuils de détection de 0,3 à 1 ng/L) dans 11 échantillons ponctuels d'effluents provenant d'usines de traitement des eaux usées prélevés au cours de la même période et sur des sites semblables.
Le MDM n'a pas été détecté (seuil de détection de 13 ng/L) dans neuf échantillons ponctuels d'eau prélevés en 2011 et provenant des usines de traitement sur place de quatre installations industrielles en Ontario et au Québec (Alaee, 2012). La substance était présente à une concentration de 828 ng/L dans l'un des quatre échantillons ponctuels d'eau de procédé intermédiaire prélevés dans une cinquième installation, mais n'a pas été détectée (seuil de détection de 13 ng/L) dans l'effluent terminal de cette installation. Des concentrations comprises entre 17 et 15 300 ng/L ont été mesurées dans les quatre échantillons ponctuels d'eau prélevés dans une sixième installation, la concentration des effluents de ladite installation se chiffrant à 5 000 ng/L. Ces concentrations ont été relevées dans les eaux de procédés avant leur déversement dans une station publique de traitement des eaux usées.
Dans des données préliminaires tirées d'Alaee (2014), le MDM n'a pas été détecté (limite de détection : 2 ng/L) dans trois échantillons d'eau de procédés prélevés en 2012 d'une installation industrielle en Ontario.
Un échantillon ponctuel de lixiviat prélevé en 2011 dans un site d'enfouissement en Ontario contenait du MDM au niveau du seuil de détection de 1 ng/L (Alaee, 2012). Le MDM n'a pas été détecté (seuil de détection de 13 ng/L) dans des échantillons ponctuels de lixiviat prélevés la même année dans deux autres sites d'enfouissement en Ontario et au Québec.
Les données préliminaires provenant des sites d'enfouissement en Ontario, au Québec et en Colombie-Britannique indiquent la présence de MDM à des concentrations de 0,7 à 6,2 ng/L dans 9 des 15 échantillons de lixiviat prélevés en 2012 (Alaee, 2014).
Le MDM n'a pas été détecté (seuils de détection de 0,5-4 ng/L) dans 10 échantillons ponctuels d'eau prélevés dans des sites d'enfouissement des pays nordiques en 2004-2005 (Kaj et al. , 2005b).
Boues d'épuration d'usines de traitement des eaux usées
Aucune donnée canadienne n'a été relevée pour le MDM présent dans les boues des usines de traitement des eaux usées; cependant, des concentrations de 7 à 31 ng/g p.s. ont été signalées dans 23 échantillons ponctuels de boues sur 72 prélevés d'usines de traitement des eaux usées de pays nordiques entre 2004 et 2006 (Kaj et al. , 2005a,b; Schlabach et al. , 2007).
Sol
Aucune donnée sur le sol au Canada ou en Amérique du Nord n'a été trouvée pour le MDM.
Le MDM n'a pas été détecté (seuil de détection de 0,1 ng/g p.s.) dans des échantillons ponctuels prélevés en 2004 dans un site d'enfouissement abandonné et dans un site d'enfouissement en cours d'exploitation dans les Îles Féroé (Kaj et al., 2005b; ).
Biote
Des concentrations de MDM de 0,062 à 0,088 ng/g p.h. (valeur moyenne de 0,071 ng/g p.h.) ont été mesurées dans le sang prélevé en 2008 sur 3 petits de phoque commun du nord-ouest de l'Atlantique (Phoca vitulina) sur 5 dans une zone contaminée de l'estuaire du Saint-Laurent, mais cette substance n'a pas été détectée (seuil de détection de 0,034 ng/g p.h.) dans le sang de 10 petits de phoque commun se trouvant à proximité d'un site de référence dans le golfe du Saint-Laurent (Wang et al., 2012). De même, le MDM n'a pas été détecté dans les échantillons de sang de chélydres serpentines (Chelydra s. serpentina ; n = 32) ni dans les échantillons de sang de cormorans (Phalacrocorax auritus ; n = 22) prélevés dans les sites de référence et les sites contaminés dans la région des Grands Lacs du Canada. La contamination a été attribuée à la proximité des centres urbains et industriels, avec des sites de référence se trouvant en amont ou à une certaine distance des sources potentielles de MDM.
Le MDM n'a pas été détecté (seuil de détection de 0,42 ng/g de poids humide) dans des homogénats du corps entier de la truite grise (Salvelinus namaycush ; n = 60) et le doré jaune (Sander vitreus ; n = 17) prélevés dans les Grands Lacs, le lac Kusawa (Yukon), le lac Athabasca (Alberta) et le lac Winnipeg (Manitoba) (McGoldrick et al. , 2014).
Le MDM a été détecté dans l'un des sept échantillons du corps entier de grand brochet (Esox lucius) à une concentration de 0,3 ng/g de poids humide, et était également présent dans les quatre échantillons de corps entier du doré jaune (Sander vitreus) à des concentrations de 0,19 à 1,77 ng/g de poids humide (Pelletier, 2013). Il a également été mesuré à une concentration de 0,29 ng/g poids humide dans l'un des sept échantillons combinés de moules (Elliptio complanata ; les échantillons combinés contenaient cinq moules chacun). La substance était inférieure aux limites de détection dans deux échantillons de corps entiers de la perchaude (Perca flavescens) et quatre échantillons combinés du gobie à taches noires (Neogobius melanostomus ; chacun des échantillons combinés contenait 8 à 12 gobies à taches noires). Le seuil de détection pour toutes les espèces était de 0,17 ng/g poids sec. Les échantillons ont été prélevés en 2012 et en 2013 dans une zone du fleuve Saint-Laurent qui se situait dans le panache de dispersion immédiate des effluents provenant du centre urbain dense de Montréal, et reflètent, par conséquent, des conditions d'exposition proche de la source à la contamination urbaine.
Le MDM n'a pas été détecté dans des échantillons combinés de mysis (Mysis relicta ; n = 4), de gobie à taches noires (Neogobius melanostomus ; n = 12; total de 337 poissons), d'éperlan arc-en-ciel (Osmerus mordax ; n = 9; total de 54 poissons) et de gaspareau (Alosa pseudoharengus ; n = 5; total de 13 poissons) prélevés en 2011 dans le lac Ontario (CES, 2013). Le MDM n'a pas non plus été détecté chez 19 touladis (Salvelinus namaycush) prélevés au cours du même programme d'échantillonnage. Le seuil de détection pour tous les échantillons de l'étude était de 1,63 ng/g poids humide.
Le MDM n'a pas été détecté dans des échantillons combinés de zooplancton (n = 4), de larves d'éphémère (Hexagenia sp.; n = 5) et de jeunes d'alose noyer (Dorosoma cepedianum ; n = 11) prélevés en 2011 au lac Pepin, au Minnesota (CES, 2012). La substance n'a pas non plus été détectée dans 20 échantillons de doré noir (Sander canadensis) prélevés en même temps que les échantillons combinés. Les seuils de détection de l'étude étaient compris entre 0,18 et 0,76 ng/g p.h.
Le MDM n'a pas été détecté (seuil de détection de 0,3 ng/g p.h.) dans 45 échantillons de poissons, de mammifères marins et d'œufs d'oiseaux marins prélevés dans divers sites nordiques de 2004 à 2005 (Kaj et al. 2005b). Cette étude a examiné les échantillons de foie combinés provenant de 9 espèces de poisson marin et d'eau douce (lotte, limande à queue jaune, morue, chabot, plie rouge, omble chevalier, truite brune, brochet et corégone), ainsi que les échantillons de graisse combinés provenant de 4 types de mammifères marins (phoque, globicéphale, dauphins à flancs blancs et marsouin commun) et des œufs provenant de 3 espèces d'oiseaux marins (Fulmar, Marmette de Troïl et Goéland argenté). Le MDM n'a pas été détecté non plus (seuil de détection de 0,04 ng/g p.h.) dans des échantillons de moule (Mytilus edulis ; n = 3), de foie de limande à queue jaune (Platichthys flesus ; n = 2) et de contenu stomacal de morue franche (Gadus morhua ; n = 3) prélevés de 2004 à 2006 en Norvège (Schlabach et al. , 2007).
Cependant, une concentration de 0,1 ng/g p.h. de MDM a été mesurée dans 2 des 4 échantillons de foie de morue franche (Gadus morhua) prélevés dans les eaux norvégiennes entre 2004 et 2006 (Schlabach et al. , 2007). La substance était également présente à une concentration de 0,33 ng/g p.h. dans 1 échantillon de foie de morue franche sur 5, et à une concentration de 0,17 ng/g p.h. dans 1 échantillon de foie de morue polaire (Boreogadus saida) sur 11 prélevés dans l'Arctique norvégien en 2008 (Evenset et al., 2009). Le MDM n'a pas été détecté dans 14 oiseaux marins (Mouette tridactyle, Rissa tridactyla et Eider à duvet, Somateria mollissima), ni dans 6 échantillons de sédiments prélevés dans la même région (seuils de détection de 0,08 à 0,18 ng/g p.h. et de 0,19 à 0,3 ng/g p.s., respectivement) (Evenset et al. , 2009).
Devenir dans l'environnement
Le modèle de fugacité de niveau III (EQC, 2011) simule la distribution d'une substance dans un environnement d'évaluation hypothétique appelé « monde unitaire ». Le modèle EQC mis à jour en 2011 simule la distribution dans l'environnement d'une substance chimique à l'échelle régionale (à savoir, 100 000 km2) et permet d'obtenir la fraction de la masse totale dans chaque milieu provenant d'une émission dans le monde unitaire et les concentrations qui en résultent dans chaque milieu.
La distribution masse-fraction du MDM calculée à l'aide du modèle EQC figure au tableau 5 et utilise des émissions constantes uniques dans l'atmosphère, l'eau et le sol. Le modèle EQC de niveau III prend pour hypothèse des conditions hors de l'équilibre entre les milieux naturels, mais des conditions à l'équilibre au sein de chaque milieu. Les résultats du tableau 5 représentent les effets nets du partage chimique, du transport entre divers milieux, et de la perte tant par le processus d'advection (hors de la région modélisée) que par celui de la dégradation ou de la transformation.
Les résultats du modèle de fugacité de niveau III laissent entendre que le MDM devrait demeurer principalement dans l'air lorsque la substance est rejetée dans ce milieu ou dans le sol. Lorsqu'il est rejeté dans l'eau, le MDM devrait se répartir principalement dans l'eau ou dans les sédiments, avec une petite partie se répartissant dans l'air. Les valeurs d'entrée utilisées dans la modélisation sont fournies à l'annexe I.
| Substance rejetée dans | Air | Eau | Sol | Sédiments |
|---|---|---|---|---|
| l'air (100 %) | 100 | 0 | 0 | 0 |
| l'eau (100 %) | 7 | 40 | 0 | 53 |
| le sol (100 %) | 91 | 0 | 9 | 0 |
La pression de vapeur élevée (520 Pa) indique que le MDM est volatil. Par conséquent, si elle est rejetée dans l'air, on s'attend à ce que la substance demeure dans ce milieu et ait tendance à se déplacer dans d'autres milieux naturels. Le modèle EQC prévoit qu'environ 67 % des quantités émises dans l'air seront entraînées vers l'extérieur du monde unitaire et subiront d'autres transports atmosphériques, alors que les quantités restantes, soit 33 %, feront l'objet de réactions (d'une dégradation) dans l'atmosphère.
La faible hydrosolubilité de 0,034 mg/L (à 25 oC) et les valeurs élevées de log Kcode 3,4 à 5,7 (tableau 2) indiquent que le MDM rejeté dans l'eau aura tendance à s'adsorber sur les matières solides en suspension et les sédiments. Le modèle EQC prévoit que, dans des conditions d'état stable d'un rejet continu dans l'eau, environ 40 % de la substance demeurera dans l'eau et que la quantité restante se répartira dans les sédiments (53 %) ou s'échappera de la surface de l'eau pour arriver dans l'air (7 %). Même si la constante de la loi d'Henry calculée pour le MDM est élevée (2,9 × 106 Pa m3/mol 25 oC), la volatilisation à partir de la surface de l'eau ne devrait pas représenter un processus dominant dans le devenir de cette substance d'après le modèle de niveau III. Cependant, dans l'environnement, l'évaporation à partir de la surface de l'eau pourrait être favorisée dans certaines conditions environnementales (augmentation de la température et de la turbulence à la surface). De plus, d'autres facteurs influenceront l'importance relative de la sorption et de la volatilisation lors de la répartition du MDM dans l'eau. Ces facteurs comprennent la nature du plan d'eau récepteur, notamment les concentrations de sédiments et de matière organique en suspension, ainsi que la demi-vie plus longue prévue dans les sédiments que dans l'eau, ce qui se traduit par une plus grande fraction en masse retenue dans le milieu sédimentaire liée à des processus d'élimination plus lents.
En cas de rejet dans le sol, la pression de vapeur élevée laisse entendre que le MDM aura fortement tendance (91 %) à se volatiliser de la surface du sol dans l'air. Environ 9 % des quantités rejetées dans le sol devraient demeurer dans ce milieu (tableau 4); de ces 9 %, 30 % devraient se trouver dans l'air des pores du sol et 70 % devraient être adsorbées sur les solides. Cette capacité d'adsorption, conjuguée à la faible solubilité dans l'eau (0,034 mg/L; tableau 2), porte à croire que le MDM sera relativement immobile dans le sol.
Potentiel de transport à grande distance
On a utilisé le modèle de transport et de persistance de niveau III (TaPL3) (TaPL3, 2000) pour estimer la distance de transport caractéristique (DTC), définie comme la distance maximale parcourue dans l'air par 63 % de la substance. Beyer et al. (2000) ont proposé que des DTC de plus de 2 000 km représentent le potentiel élevé de transport atmosphérique à grande distance (PÉTGD), celles de 700 à 2 000 km représentent le modéré, et celles de moins de 700 km le potentiel faible. D'après une estimation de la DTC de 2 882 km par le modèle TaPL3, le potentiel de transport atmosphérique à grande distance du MDM est jugé élevé. Cela signifie qu'on estime que le MDM peut être transporté dans l'atmosphère vers des régions éloignées comme l'Arctique.
Le modèle de dépistage des polluants organiques persistants (POP) de l'OCDE peut également être utilisé pour identifier les produits chimiques à fort potentiel de persistance et de transport à grande distance (Scheringer et al., 2009). Le modèle de l'OCDE est un modèle global qui compartimente la terre en air, eau et sol. Ce modèle est « orienté vers le transport » plutôt que vers une « cible », car il cerne simplement la DTC sans préciser l'endroit où une substance peut être transportée en particulier (Fenner et al., 2005). Klasmeier et al. (2006) ont laissé entendre qu'un seuil de 5 098 km, basé sur l'estimation de la DTC du modèle pour le PCB-180, permettrait d'identifier des substances ayant un fort potentiel de transport à grande distance. Le PCB-180 a été détecté dans des régions éloignées. La DTC calculée pour le MDM à l'aide du modèle de l'OCDE est de 2 881 km, ce qui indique que le MDM présente un potentiel important de transport dans l'air, même s'il se situe sous la limite suggérée pour les polluants mondiaux par Klasmeier et al. (2006). Le modèle de dépistage des POP de l'OCDE permet également de calculer l'efficacité du transfert (ET), qui correspond au pourcentage du flux des émissions vers l'atmosphère déposé à la surface (eau et sol) dans une région éloignée (% ET = D/E × 100, où E est le flux des émissions vers l'atmosphère et D, le flux du dépôt sur les milieux en surface dans une région cible). L'efficacité du transfert calculée du MDM était de 1,3 × 10−6 %, ce qui est inférieur à la limite de 2,248 % (PCB-28) établie pour les substances de référence du modèle dont on sait de manière empirique qu'elles sont déposées de l'air sur le sol ou dans l'eau. La faible efficacité du transfert signifie que même si le MDM a le potentiel de se déplacer sur de grandes distances dans l'atmosphère, il est peu probable qu'il se dépose sur la surface de la Terre dans quelque région éloignée que ce soit, même lorsqu'il s'agit de milieux froids.
Les valeurs d'entrée utilisées pour modéliser le potentiel de transport à grande distance du MDM sont fournies à l'annexe I.
En outre, les valeurs du log Koaet du log Kae respectivement de 3,72 et de 3,06 (Xu et Kropscott, 2010) portent également à croire que le MDM présente un faible potentiel de contamination de l'Arctique (PCA) s'il est examiné à l'aide des parcelles de partage chimique décrites par Wania (2003, 2006). On dit souvent de ces produits chimiques que ce sont des « voiliers » en ce sens qu'ils ont un potentiel de transport atmosphérique à grande distance, mais qu'ils ne se retrouvent pas nécessairement dans d'autres milieux naturels en raison de leurs pressions de vapeur élevées.
Les estimations modélisées indiquent que le MDM a un potentiel de transport atmosphérique important et qu'il peut atteindre des lieux éloignés de ses sources d'émission. Bien qu'une analyse de l'efficacité du transfert et des parcelles de partage fondée sur le log Koaet le log Kae laisse entendre que le MDM présentera un faible potentiel de dépôt dans l'eau ou sur le sol dans des régions éloignées et un faible potentiel de contamination de l'Arctique, une étude récente réalisée dans l'Arctique norvégien (Evenset et al., 2009) a signalé la présence de MDM dans deux échantillons de foie de morue sur 16. La concentration de substance était inférieure aux limites de détection dans les échantillons de sédiments et d'oiseaux marins prélevés dans la même région. Étant donné qu'il n'existe aucune preuve de production naturelle de MDM, la détection de cette substance dans les échantillons de poisson est le signe d'une contamination liée à des sources anthropiques, bien que la nature de ces sources ne soit pas évidente. Une étude récente menée par Warner et al. (2010) a découvert que les niveaux de VMS cycliques mesurés dans les échantillons de poisson prélevés sur des sites dans l'Arctique européen étaient principalement influencés par la présence d'établissements humains à proximité. En outre, pour les espèces de poissons migrateurs comme la morue, les concentrations de VMS dans les tissus peuvent découler d'une exposition du poisson à des sources se trouvant dans des régions du Sud plus peuplées (Warner et al., 2010).
Persistance et potentiel de bioaccumulation
Persistance dans l'environnement
Milieux pertinents
D'après les résultats du modèle de fugacité de niveau III, l'air, l'eau et les sédiments sont considérés comme les milieux pertinents pour le MDM, en fonction du milieu dans lequel cette substance est rejetée. Le sol ne devrait pas être un milieu pertinent, même si la substance peut y demeurer, dans une certaine mesure, lorsqu'elle est rejetée directement dans ce milieu (se reporter au tableau 4).
Sources des données
Des données empiriques et modélisées ont été prises en compte dans l'analyse du potentiel de persistance dans l'environnement.
Données empiriques sur la persistance
Un résumé des données empiriques sur la dégradation du MDM figure au tableau 5a.
| Milieu | Processus du devenir | Valeur pour la dégradation | Paramètre et unités de la dégradation | Référence |
|---|---|---|---|---|
| Air | Photodégradation | 1,83 × 10−12 | Constante de vitesse / cm3/molécule·seconde demi-vie atmosphérique/jours |
Markgraf et Wells, 1997 |
| Air | Photodégradation | 6,3 | Temps de séjour dans l'atmosphère / jours | Markgraf et Wells, 1997 |
| Air | Photodégradation | 8,77 | Demi-vie de réaction atmosphérique/jours | Whelan et al., 2004 |
| Air | Photodégradation | 5,79 | Demi-vie/jours | SEHSC, 2011 |
| Eau | Hydrolyse | 60,9 (pH 7; 10 oC) |
Demi-vie / jours | Mosey et Kozerski, 2008 |
| Eau | Hydrolyse | 13,7 (pH 7; 25 oC) |
Demi-vie/jours | Mosey et Kozerski, 2008 |
| Eau | Hydrolyse | 0,12 (pH 9; 35 oC) |
Demi-vie/jours | Mosey et Kozerski, 2008 |
| Eau | Biodégradation | -3,7 | Biodégradation, % | Schaefer et Matthews, 2009 |
| Sol | Catalyse | 1,5 (32 % HR; 21 C) |
Demi-vie / jours | Xu et Doede 2010; Xu et al. , 2012 |
| Sol | Catalyse | 3,6 (42 % HR; 21 oC) |
Demi-vie/jours | Xu et Doede 2010; Xu et al. , 2012 |
| Sol | Catalyse | 6,2 (92 % HR; 21 oC) |
Demi-vie/jours | Xu et Doede 2010; Xu et al. , 2012 |
| Sol | Catalyse | 120 (100 % HR; 21 oC) |
Demi-vie/jours | Xu et Doede 2010; Xu et al. , 2012 |
| Sol | Catalyse | 4,54Note de bas de page Tableau 5a[a] | Demi-vie/jours | SEHSC, 2011 |
| Sol | Volatilisation | Aucune volatilisation importante (32 % HR; 21 oC) |
Demi-vie/jours | Xu et Doede 2010; Xu et al., 2012 |
| Sol | Volatilisation | 0,52 (100 % HR; 21 oC) |
Demi-vie/jours | Xu et Doede 2010; Xu et al., 2012 |
| Sédiments | Biodégradation | 365Note de bas de page Tableau 5a[b] | Demi-vie/jours | SEHSC, 2011 |
Biodégradation
Le MDM a affiché un faible potentiel de biodégradation microbienne dans un essai de biodégradabilité immédiate conformément à la Ligne directrice 310 de l'OCDE (OCDE, 2006), avec un pourcentage moyen de biodégradation de -3,7 % signalé dans les récipients d'essai à la fin de l'essai de 28 jours (Schaefer et Matthews, 2009).
Une demi-vie de biodégradation dans les sédiments de 365 jours (8 760 heures) a été calculée pour le MDM d'après les données fournies dans Xu (2009) pour le VMS cyclique octaméthylcyclotétrasiloxane (D4; n° CAS 556-67-2) dans les sédiments anaérobies d'un lac (SEHSC, 2011).
Dégradation abiotique
Une constante de la vitesse de réaction de 1,83 × 10−12 cm3/molécule·seconde a été déterminée pour la réaction en phase gazeuse du MDM avec des radicaux hydroxyles produits photochimiquement à une température d'environ 24 oC (Markgraf et Wells, 1997). En supposant une concentration de radicaux hydroxyles de 1 × 106 molécules/cm, les auteurs ont calculé un temps de séjour dans l'atmosphère du MDM de 6,3 jours. Les principaux produits de réaction observés ont été deux alcools de siloxane (silanols), tous deux considérés comme des produits de deuxième génération de la réaction de l'eau atmosphérique avec un produit d'ester de siloxane intermédiaire. De plus faibles quantités des deux siloxanes cycliques ont également été observées. À l'aide de cette constante de vitesse et d'une concentration de radicaux hydroxyles à l'état stable de 5 × 105 molécule/cm, Whelan et al. (2004) ont calculé une demi-vie de réaction atmosphérique approximative de 8,77 jours pour le MDM.
À l'aide de la constante du taux de réaction de 1,83 × 10−12 cm3/molécule·seconde fournie par Markgraf et Wells (1997) et d'une concentration moyenne de radicaux hydroxyles sur 12 heures de 1,5 × 106 molécules/cm, déterminée par Mount et Eisele (1992), SEHSC (2011) a calculé une valeur de demi-vie de 5,79 jours (139 heures) pour le MDM dans l'air.
Mosey et Kozerski (2008) ont fait état de demi-vies d'hydrolyse de 60,9 et 13,7 jours pour le MDM présent dans l'eau à un pH de 7 et à des températures de 10 et de 25 oC, respectivement. Une demi-vie de 0,12 jour a été mesurée dans une eau à un pH de 9 et à une température de 35 oC. Ces résultats indiquent que les taux d'hydrolyse pour le MDM dépendent du pH et de la température. Parmi les produits finaux de l'hydrolyse proposés, mentionnons le diméthylsilanediol (no CAS 1066-42-8) et le triméthylsilanol (no CAS 1066-40-6), le pentaméthyldisiloxanol (no CAS 56428-93-4) se formant comme espèce intermédiaire.
Xu et Doede (2010) ont étudié l'importance relative de la dégradation et de la volatilisation pour le devenir du MDM dans le sol. Le sol Londo du MichiganNote de bas de page[4] dopé de MDM marqué au C14 dans une concentration initiale approximative de 10 µg/g de poids sec (p.s.) a été incubé à une température de 21 °C dans des systèmes de tubes fermés et ouverts et quatre niveaux d'humidité constante du sol (32 %, 42 %, 92 % et 100 % d'humidité relative ou HR). Des extraits des systèmes de tests ont été analysés pour déterminer la présence de MDM et de produits de dégradation à l'aide d'une chromatographie en phase liquide à haute résolution avec détection radiométrique, et comptage par scintillation en milieu liquide. Pour l'estimation du bilan massique de la radioactivité validée par ajout connu, on a également déterminé les matériaux radioactifs résiduels non extractibles dans le sol par combustion à l'aide d'un comburant biologique. Les résultats des systèmes de tubes fermés ont indiqué que la dégradation semblait plus rapide à mesure que le sol s'asséchait avec des demi-vies de 1,5, 3,7, 6,2 et 120 jours à 32 %, 42 %, 92 % et 100 % d'humidité relative, respectivement. Dans les systèmes de tubes ouverts, la volatilisation n'était pas importante à la plus faible humidité relative de 32 %, mais elle constituait le principal mécanisme d'élimination à une humidité relative de 100 % (demi-vie de volatilisation de 0,52 jour). Les résultats ont indiqué que la transformation tout comme la volatilisation peuvent constituer des mécanismes d'élimination importants pour le MDM dans le sol, selon les conditions environnementales. Xu et al. (2012) ont confirmé l'importance de l'hydrolyse comme le mécanisme d'élimination principal du MDM dans les sols plus secs, la volatilisation devenant de plus en plus importante parallèlement à l'augmentation de l'humidité dans le sol.
Xu et Chandra (1999) ont suggéré que des sols plus secs pouvaient limiter les processus de biodégradation pour les VMS cycliques tout en favorisant les réactions abiotiques comme l'hydrolyse catalysée par des conditions acides et en surface. Si cela s'applique également aux VMS linéaires comme le MDM, alors la dégradation plus rapide observée par Xu et Doede (2010) à une humidité relative plus faible pourrait traduire des réactions catalytiques similaires survenant dans le substrat du sol. L'hydrolyse catalysée par des conditions acides et en surface ainsi que la volatilisation sont considérablement limitées dans les conditions hydriques et de récipient fermé de l'essai normalisé de biodégradation immédiate et cela pourrait être à l'origine de la lenteur importante de la dégradation observée par Schaefer et Matthews (2009).
En utilisant les résultats obtenus par Xu et Doede (2010) pour un sol présentant une humidité relative de 92 % et une température de 20,9 oC, SEHSC (2011) a estimé une demi-vie pour le MDM dans le sol d'environ 4,54 jours (109 heures).
Modélisation de la persistance
Bien que des données expérimentales sur la dégradation soient disponibles pour le MDM, des relations quantitatives structure-activité (RQSA) ont également été prises en compte dans le cadre d'une méthode du poids de la preuve comme le décrit Environnement Canada (2007b). Les résultats sont résumés dans le tableau 5b ci-dessous. Étant donné l'importance écologique du milieu aquatique et le fait que le MDM devrait être rejeté dans ce milieu, la biodégradation dans l'eau est la plus étudiée. En l'absence de modèles convenables de biodégradation pour le sol et les sédiments, les résultats obtenus pour l'eau ont été extrapolés de façon à obtenir des estimations du potentiel de biodégradation du MDM dans ces milieux.
| Processus du devenir | Modèle et base du modèle |
Résultat et prévision du modèle | Demi-vie extrapolée (jours) |
|---|---|---|---|
| Oxydation atmosphérique | AOPWIN, 2008Note de bas de page Tableau 5b[a] | t 1/2 = 8,9 jours | supérieur(e) à 2 |
| Réaction avec l'ozone | AOPWIN, 2008[a] | s.o.Note de bas de page Tableau 5b[b] | s.o. |
| Hydrolyse | HYDROWIN, 2008[a] | s.o.[b] | s.o. |
| Biodégradation primaire (aérobie) | BIOWIN, 2008[a] Sous-modèle 4 : enquête d'expert (résultats qualitatifs) |
3,5Note de bas de page Tableau 5b[c] « se biodégrade rapidement » |
inférieur(e) à 182 |
| Biodégradation ultime (aérobie) | BIOWIN, 2008[a] Sous-modèle 3 : enquête d'expert (résultats qualitatifs) |
2,7[c] « se biodégrade rapidement » |
inférieur(e) à 182 |
| Biodégradation ultime (aérobie) | BIOWIN, 2008[a] Sous-modèle 5 : Probabilité linéaire MITI |
0,01Note de bas de page Tableau 5b[d] « se biodégrade très lentement » |
supérieur(e) à 182 |
| Biodégradation ultime (aérobie) | BIOWIN, 2008[a] Sous-modèle 6 : Probabilité non linéaire MITI |
0,02[d] « se biodégrade très lentement » |
supérieur(e) à 182 |
| Biodégradation ultime (aérobie) | CATABOL, c2004-2008 Pourcentage de la DBO (demande biochimique en oxygène) |
% DBO = 8 « se biodégrade très lentement » |
supérieur(e) à 182 |
La demi-vie atmosphérique prévue de 8,9 jours (AOPWIN, 2008; tableau 5b) concorde bien avec les valeurs de demi-vies obtenues de façon empirique de 5,79 jours (SEHSC, 2011) et de 8,77 jours (Whelan et al., 2004; tableau 5a), ce qui vient soutenir une nouvelle fois le fait que le MDM devrait s'oxyder lentement dans l'air. Il n'y a pas d'estimation de la demi-vie de la réaction de cette substance avec d'autres espèces photooxydantes dans l'atmosphère, comme l'ozone. Toutefois, des réactions avec des radicaux hydroxyles devraient constituer le plus important processus de dégradation dans l'atmosphère pour le MDM en phase gazeuse
HYDROWIN (2008) ne fournit aucune estimation du potentiel d'hydrolyse du MDM, car les organosiliciums comme le MDM ne sont pas représentés dans l'ensemble d'étalonnage du modèle et sortent donc du domaine d'application du modèle.
Le sous-modèle BIOWIN 4, un modèle d'enquête sur la biodégradation primaire, estime que le MDM subira une biodégradation primaire dans l'eau avec une demi-vie de moins de 182 jours. Cette prévision varie de -3,7 % par rapport à la valeur calculée empiriquement pour la biodégradation sur 28 jours rapportée par Schaefer et Matthews (2009) dans un essai normalisé de biodégradation immédiate. Les résultats de trois des quatre modèles de biodégradation ultime (sous-modèles 5 et 6 de BIOWIN; CATABOL, c2004-2008; tableau 5b) laissent entendre que la demi-vie pour la biodégradation ultime du MDM dans l'eau dépassera probablement 182 jours.
Bien que les substances organosiliciées ne soient pas bien représentées dans les ensembles d'échantillonnage des modèles de biodégradation retenus, la lente biodégradation ultime prévue concorde avec les données empiriques pour l'eau et les sédiments, lesquelles signalent un faible potentiel de biodégradation microbienne. Pour cette raison, les résultats modélisés ont été pris en compte dans l'évaluation du poids de la preuve concernant le potentiel de persistance de la substance.
D'après un ratio d'extrapolation de 1:1:4 pour une demi-vie de biodégradation dans l'eau, le sol et les sédiments (Boethling et al., 1995), la demi-vie de biodégradation ultime du MDM dans le sol est, selon les modèles prédictifs, supérieure à 182 jours, et on estime que la demi-vie dans les sédiments se compte en années.
Résumé de la persistance potentielle
Le Règlement sur la persistance et la bioaccumulation (Canada, 2000) établit le critère utilisé pour déterminer si une substance est persistante en vertu de la LCPE (1999). D'après ce Règlement , une substance est persistante si sa demi-vie dans l'air est supérieure ou égale à deux jours, ou elle est soumise à un transport atmosphérique depuis sa source jusqu'à une région éloignée, si sa demi-vie dans l'eau ou le sol est supérieure ou égale à 182 jours ou si sa demi-vie dans les sédiments est supérieure ou égale à 365 jours.
Des demi-vies empiriques de 5,79 et de 8,77 jours, ainsi qu'une estimation modélisée de 8,9 jours, ont été obtenues pour la dégradation du MDM dans l'air. Par conséquent, le MDM répond aux critères sur la persistance dans l'air énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000). Toutefois, il a un faible potentiel de contamination de l'Arctique (voir la partie sur le devenir dans l'environnement), étant donné qu'il n'est pas susceptible de se déposer dans l'eau ou le sol dans des régions éloignées.
Bien que les résultats empiriques concernant la biodégradation immédiate et les estimations de la biodégradation modélisées semblent indiquer que le MDM se biodégradera lentement dans l'eau, des demi-vies allant jusqu'à 60,9 jours pour l'hydrolyse ont été signalées et cela laisse supposer que les processus abiotiques peuvent avoir une forte incidence sur la présence de cette substance dans la colonne d'eau. En outre, les résultats négatifs de biodégradation immédiate indiquent la nécessité de tests plus poussés, mais n'excluent pas la possibilité de biodégradabilité primaire. Les données empiriques sur la dégradation dans le sol obtenues pour le processus abiotique d'hydrolyse catalysée par des conditions acides et en surface permettent d'obtenir une demi-vie maximale de 120 jours dans les conditions de l'étude mentionnées. Ces données sont jugées suffisantes pour établir que les processus biotiques et les processus abiotiques peuvent constituer des mécanismes pertinents d'élimination du MDM dans l'eau et le sol. D'après ces renseignements, il est considéré que le MDM ne répond pas au critère de persistance d'une demivie supérieure ou égale à 182 jours dans ces milieux qui est énoncé dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
La demi-vie de biodégradation calculée de 365 jours fournie par SEHSC (2011) est la seule valeur disponible pour déterminer le potentiel de persistance du MDM dans les sédiments, et ladite valeur a été calculée pour le VMS cyclique D4. Il existe certaines incertitudes dans l'application des données sur le taux de biodégradation pour un VMS cyclique dans le cas d'un VMS linéaire comme le MDM, étant donné que les différences géométriques des molécules (c.àd., cycliques c. linéaires) influenceront vraisemblablement la disponibilité de la substance dans le cadre de la dégradation biologique. Toutefois, le MDM et le D4 sont des organosiliciums à faible masse moléculaire et devraient ainsi réagir de manière similaire à l'action microbienne. Pour cette raison, la valeur de la demi-vie de biodégradation dans les sédiments obtenue pour le D4 a été prise en compte pour fournir une estimation acceptable pour celle du MDM. D'après cette valeur de 365 jours, et d'après la valeur de demi-vie extrapolée supérieure à 365 jours obtenue par l'intermédiaire de la modélisation, le MDM répond au critère de persistance dans les sédiments (demi-vie supérieure ou égale à 365 jours) énoncé dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Potentiel de bioaccumulation
Collecte des données
Pour fournir le meilleur poids de la preuve possible pour le potentiel de bioaccumulation du MDM, des données empiriques et modélisées pour cette substance, ainsi que des données sur les propriétés des substances dont la structure et les mécanismes sont semblables, à savoir le L4, le L5 et le M4Q, ont été prises en compte. Les données relatives aux structures et aux propriétés physiques et chimiques de ces substances sont fournies à l'annexe VI aux fins de comparaison.
Les structures des analogues décrites à l'annexe VI présentent une comparabilité structurelle supérieure à 85 %, à l'aide du logiciel CHEMID (2010). D'après les données à l'annexe V, le MDM est considéré comme la substance la plus biodisponible des substances figurant à l'annexe VI. Le MDM est légèrement plus hydrosoluble et a le même log Kcoque le L4, mais présente des dimensions moléculaires inférieures, ce qui laisse entendre que l'absorption par les poissons au cours des essais en laboratoire sur le FBC sera moins limitée que celle du L4 (et, par conséquent, le FBC observé sera potentiellement plus élevé). La biodisponibilité du L5 et du M4Q pour l'absorption par l'intermédiaire de la colonne d'eau dans des conditions naturelles devrait être bien inférieure à celle du MDM (c.-à-d., hydrosolubilité mesurée, log Koeestimé, log Kco). Le MDM a généralement des dimensions moléculaires inférieures à celles du L5 et du M4Q (d'après l'analyse de conformères). Par conséquent, pour les raisons expliquées plus bas dans cette section, il est raisonnable de considérer le L4 comme l'analogue principal en matière de bioconcentration. Il est néanmoins raisonnable d'envisager l'ensemble de ces trois analogues pour l'absorption alimentaire (c.-à-d., le facteur de bioamplification) en ce qui concerne les expositions dans le monde réel. Les facteurs traitant de la biodisponibilité aqueuse par les branchies pourraient ne pas s'appliquer à l'absorption alimentaire. En outre, les dimensions moléculaires de ces substances chimiques sont généralement plus importantes que celles du MDM et le tractus gastro-intestinal (TGI) n'est pas soumis à une résistance moléculaire aussi importante que la surface des branchies (Arnot et al., 2010) (se reporter à l'analyse ci-dessous).
Facteur de bioconcentration (FBC)
Drottar (2006) a réalisé une étude de bioconcentration à renouvellement continu avec le MDM et le tête-de-boule, Pimephales promelas. Des poissons ont été exposés pendant 42 jours à des concentrations minimales de 0,034 et 0,0034 mg/L, la plus forte concentration d'essai étant près de la solubilité dans l'eau signalée pour la substance (tableau 2). En raison de la faible solubilité dans l'eau et de la forte volatilité du MDM, on a utilisé du diméthylformamide comme solvant et les concentrations d'essai ont été préparées à l'aide de pots à mélanger fermés. Malgré ces précautions, certaines pertes de la substance d'essai se sont produites et les concentrations d'essai médianes mesurées ont été de 0,021 et de 0,0017 mg/L pour les doses élevées et faibles, respectivement. Les valeurs du facteur de bioconcentration (FBC) à l'état stable déterminées en fonction des tissus des poissons et des concentrations dans l'eau étaient de 5 030 pour la concentration d'essai de 0,0017 mg/L et de 7 730 pour la concentration d'essai de 0,021 mg/L (tableau 6). De plus, les valeurs du FBC cinétique ont été calculées en fonction des taux de prise en charge et de dépuration et ces valeurs ont été de 3 610 et de 5 600 pour les doses de 0,0017 et de 0,021 mg/L, respectivement. Une dépuration de la substance d'essai s'est produite à un taux modéré, une élimination supérieure à 90 % se produisant dans les dix jours suivant la fin de l'exposition. Les constantes du taux cinétique provenant de cette étude figurent au tableau 8. Cependant, comme l'a remarqué le rapport de Drottar (2006), on a constaté un faible métabolisme du composé d'origine du MDM. Une caractérisation des métabolites a été effectuée sur des poissons prélevés à l'état stable apparent. Le pourcentage de radioactivité associé au MDM était en moyenne de 97,7 ± 1,6 %. Le pourcentage de radioactivité associé à un métabolite inconnu était en moyenne de 1,4 ± 1,9 %. Le pourcentage de radioactivité non extraite était en moyenne de 0,9 ± 0,3 %. Par conséquent, la majeure partie de la radioactivité trouvée dans les tissus des poissons était présente en tant que composé d'origine du MDM (Drottar, 2006).
Une étude de bioconcentration similaire a été menée pour le L4 (decaméthyltetrasiloxane; no CAS 141-62-8) (SEHSC, 2006). Des tête-de-boule ont été exposés pendant 35 jours à des concentrations nominales de 0,0067 et de 0,00067 mg/L dans un système expérimental en conditions dynamiques, suivi par une période de dépuration de 28 jours. L'hydrosolubilité du L4 est de 0,0067 mg/L. Comme avec le MDM, la volatilité élevée et la faible hydrosolubilité du L4 ont nécessité l'utilisation de procédures particulières pour limiter les pertes de substances provenant du système expérimental. Ces procédures comprenaient l'utilisation d'un solvant et de pots à mélanger fermés ainsi que l'optimisation du débit du diluteur afin de réduire les pertes liées à l'évaporation. Malgré ces précautions, certaines pertes de la substance d'essai se sont produites et les concentrations mesurées ont été de 0,0053 et de 0,00043 mg/L pour les doses élevées et faibles, respectivement. Des valeurs de FBC à l'état stable de 1 610 et 3 870, respectivement, ont été calculées pour les concentrations de 0,0053 et de 0,00043 mg/L tandis que les valeurs de FBC cinétiques calculées à partir des taux d'absorption et de dépuration se chiffraient à 1 760 et à 3 830, respectivement (tableau 6). Plus de 90 % de la substance d'essai était éliminée des tissus des poissons après la période de dépuration de 28 jours. Les constantes du taux cinétique provenant de cette étude figurent au tableau 8.
| Substance | Organisme d'essai | Paramètre | Valeurs cinétiques et à l'état stable (L/kg)Note de bas de page Tableau 6[a].4 | Référence |
|---|---|---|---|---|
| MDM | Tête-de-boule, Pimephales promelas | FBC | 5 600 à 7 730 (0,021 mg/L) 3 610 à 5 030 (0,0017 mg/L) |
Drottar, 2006Note de bas de page Tableau 6[*] |
| L4 | Tête-de-boule, Pimephales promelas | FBC | 1 610 à 1 760 (0,0053 mg/L) 3 830 à 3 870 (0,00043 mg/L) |
SEHSC, 2006 |
Les FBC du MDM et du L4 ont été estimés en utilisant un modèle cinétique du bilan massique basé sur Arnot et Gobas (2003a). Les résultats de cette modélisation, qui comprenaient les constantes du taux métabolique normalisées (comme l'explique l'analyse sur les constantes du taux cinétique ci-dessous), prévoient que les FBC du MDM et L4 pour les poissons utilisés dans les études empiriques seront respectivement de 7 762 et de 3 890 (99 % de précision pour la limite supérieure des FBC observés au tableau 6). Le FBC prévu à l'aide du même modèle pour un poisson du niveau trophique intermédiaire représentatif des eaux canadiennes se chiffre à 7 585. Le FBC prévu à l'aide du modèle de bilan massique d'Arnot-Gobas (v1.11) en se servant d'un kM de 0,02/jour pour un poisson de 10 g dont le contenu en lipides est de 5 % donne un FBC de 7 943, ce qui est également très comparable aux FBC à l'état stable signalés par Drottar (2006).
Arnot et Gobas (2006) ont mené une évaluation critique des données disponibles sur la bioaccumulation (FBC et FBA) chez le poisson et d'autres organismes et ont créé une base de données empirique de valeurs de FBC et de FBA de qualité (Arnot et Gobas, 2003b). Dans l'étude d'Arnot et Gobas (2006), à une valeur de log Koede 6,6 pour le MDM, la répartition empirique de données « acceptables » sur le FBC des poissons indique que plusieurs substances chimiques répondent au critère réglementaire canadien du FBC (supérieur ou égal à 5 000) et d'autres pas. C'est en grande partie une fonction de la biotransformation métabolique.
Les valeurs de FBC à l'état stable et cinétiques pour le L4 figurant au tableau 6 se situent dans la fourchette 1 610 à 3 870, alors que le FBC du MDM est généralement plus élevé; dans la gamme 3 610 à 7 730. Cela est vraisemblablement lié au taux d'absorption du L4 à partir de l'eau qui est atténué, dans une certaine mesure, par un encombrement stérique, permettant ainsi à un autre processus d'élimination de réduire la bioconcentration d'ensemble. Les données sur la taille moléculaire et les diamètres transversaux peuvent être utiles et sont couramment utilisées par des compétences internationales, comme l'Union européenne (ECHA, 2012), pour tirer des conclusions sur le potentiel de bioaccumulation suivant la méthode du poids de la preuve. De récentes études faisant le lien entre les données de FBC chez les poissons et les paramètres de taille moléculaire (Dimitrov et al., 2002 et 2005) laissent entendre que la probabilité qu'une molécule traverse la membrane cellulaire par diffusion passive diminue de façon importante à mesure qu'augmente le diamètre maximal (Dmax). La probabilité qu'une diffusion passive se produise diminue de façon notable lorsque le diamètre transversal est supérieur à environ 1,5 nm et de façon encore plus significative dans le cas des molécules ayant un diamètre transversal supérieur à 1,7 nm. Sakuratani et al. (2008) ont également étudié l'effet du diamètre transversal sur la diffusion passive dans un ensemble d'essais de FBC d'environ 1 200 substances chimiques nouvelles et existantes. Ils ont observé que les substances qui ne présentent pas un potentiel de bioconcentration très élevé (FBC inférieur à 5 000) ont souvent un Dmax supérieur à 2 nm et un diamètre effectif (Deff) supérieur à 1,1 nm.
Cependant, comme l'ont évoqué Arnot et al. (2010), il existe des incertitudes quant aux seuils proposés par Dimitrov et al. (2002, 2005) et Sakuratani et al. (2008), étant donné que les études sur le FBC utilisées pour calculer ces seuils n'ont pas fait l'objet d'évaluations critiques. Comme l'ont souligné Arnot et al. (2010), la taille moléculaire a un effet sur la solubilité et la capacité de diffusion dans les phases aqueuse et organique (membranes), et les plus grosses molécules peuvent avoir un taux d'absorption plus lent. Toutefois, ces mêmes contraintes liées aux cinétiques s'appliquent aux voies de diffusion de l'élimination chimique (c.-à-d. absorption lente = élimination lente). Un potentiel de bioaccumulation important peut donc s'appliquer aux substances qui sont soumises à un processus d'absorption lent, si elles sont biotransformées ou éliminées lentement par d'autres processus. Par conséquent, lorsqu'on évalue le potentiel de bioaccumulation, les données sur la taille moléculaire doivent être examinées avec discernement et de pair avec d'autres éléments de preuve pertinents.
D'après l'analyse tridimensionnelle de 30 conformères calculés à l'aide du modèle de bioaccumulation de base avec des facteurs d'atténuation (Dimitrov et al., 2005), le diamètre effectif et le diamètre maximal du MDM sont plus petits que ceux du L4. Cela semble indiquer que le MDM est moins susceptible de connaître une absorption limitée découlant d'effets stériques à la surface des branchies et cela permet d'expliquer en partie les FBC empiriques plus élevés.
Facteur de bioamplification (FBM)
Un facteur de bioamplification (FBM) cinétique à l'état stable corrigé pour la croissance de 0,26 et un FBML/L cinétique à l'état stable ajusté en fonction des lipides de 0,94 ont été signalés pour la truite arc-en-ciel juvénile, Oncorhynchus mykiss , exposée à du MDM radiomarqué au C14 sur les aliments aquacoles (environ 500 µg/g) pendant 35 jours, suivis d'une période de clairance de 28 jours avec une nourriture propre (SEHSC, 2010; tableau 7). La valeur du FBML/L ajusté en fonction des lipides a ensuite été peaufinée à 0,86 (SEHSC, 2011). Le FBM à l'état stable calculé sur la base des concentrations de MDM dans les tissus et dans la nourriture des poissons se chiffrait à 0,11 et la valeur normalisée par rapport aux lipides correspondante se chiffrait à 0,38 (Drottar, 2010). Le FBM normalisé par rapport aux lipides est considéré comme un paramètre plus pertinent pour évaluer le potentiel de bioamplification (Arnot et Gobas, 2006). L'efficacité de l'assimilation alimentaire dans les poissons exposés a été calculée à 32 %, et la demi-vie d'élimination ou de clairance était de 18 jours, en fonction d'une constante de vitesse de clairance de 0,0378 j-1. Les constantes du taux cinétique provenant de cette étude figurent au tableau 8.
Les valeurs du FBM décrivent le processus dans lequel la concentration d'un produit chimique dans un organisme atteint un niveau qui est supérieur à celui dans l'alimentation de l'organisme, en raison de l'absorption alimentaire (Gobas et Morrison, 2000). Un FBM supérieur à 1 indique qu'il y a bioamplification. Les données sur le FBM sont considérées comme des indicateurs du potentiel d'absorption et d'accumulation dans le biote par l'intermédiaire de l'alimentation. Concernant le réseau trophique examiné dans l'étude de SEHSC (2010, 2011), le FBM du MDM ne dépassait pas 1; toutefois, le FBM normalisé par rapport aux lipides était très proche de cette valeur, ce qui laisse supposer que les expositions alimentaires peuvent contribuer de façon importante aux charges corporelles dans l'environnement.
La comparaison entre les concentrations du composé d'origine du MDM et la radioactivité totale dans les échantillons de tissu et de tube digestif de poisson montre que la radioactivité présente est associée au composé d'origine du MDM. Cependant, la comparaison des concentrations du composé d'origine du MDM avec la radioactivité totale dans les extraits de foie prélevés au 1er jour de dépuration indique la présence d'un ou de plusieurs métabolites (Drottar, 2010). Bien que cela apporte la preuve d'un certain niveau de métabolisme du MDM par la truite arc-en-ciel, les résultats de cette étude laissent entendre qu'une faible biotransformation de cette substance s'est produite. En outre, la présence de métabolites inconnus ne permet pas d'établir que le MDM a été complètement métabolisé; de plus, on ne dispose d'aucune information sur le taux de métabolisme.
DowCorning Corporation (2010b) a rapporté un FBM à l'état stable apparent pour le VMS ramifié 1,1,1,5,5,5-Hexaméthyl-3,3-bis[(triméthylsilyl)oxy]trisiloxane (M4Q; no CAS 3555473) de 0,045 et un FBM normalisé par rapport aux lipides de 0,16 pour des alevins de truite arcenciel (Oncorhynchus mykiss), après une exposition à du M4Q radiomarqué au C14 dans la nourriture des poissons (environ 400 µg/kg) pour une période de 42 jours, suivie d'une période de clairance de 28 jours avec des aliments non contaminés (tableau 7). Les FBM cinétiques basés sur des taux d'absorption et de dépuration se chiffrant respectivement à 0,00252 g/g par jour et à 0,0245 j-1, étaient de 0,10 et de 0,37 (pour la valeur ajustée en fonction des lipides) et ont été estimés sans inclure la dilution liée au taux de croissance des poissons au cours de la période d'étude. Comme avec le MDM, le rapport de DowCorning Corporation (2010b) remarquait que la comparaison des concentrations du composé d'origine du M4Q avec la radioactivité totale relevée dans les tissus de poisson permettait de démontrer qu'elles étaient essentiellement semblables. Cela indiquait que la radioactivité présente dans les tissus de poisson provenait généralement du composé d'origine du M4Q. La comparaison des concentrations du composé d'origine du M4Q avec la radioactivité totale dans le tube digestif au fil du temps indique que la radioactivité présente dans le tube digestif se compose de M4Q inchangé. La comparaison entre les concentrations du composé d'origine du M4Q avec la radioactivité totale que l'on trouve dans le foie indique que la radioactivité présente dans le foie est aussi constituée principalement du composé d'origine du M4Q. Les constantes du taux cinétique provenant de cette étude figurent également au tableau 8.
| Substance | Organisme d'essai | Paramètre | Valeurs à l'état stable, cinétiques et normalisées par rapport aux lipides (/kg) | Référence |
|---|---|---|---|---|
| MDM | Truite arc-en-ciel Oncorhynchus mykiss |
FBM | De 0,11 à 0,86 | SEHSC, 2010, 2011; Drottar, 2010Note de bas de page Tableau 7[*] |
| M4Q | Truite arc-en-ciel Oncorhynchus mykiss |
FBM | De 0,045 à 0,37 | DowCorning Corporation, 2010b[*] |
L'efficacité d'assimilation alimentaire (EA) est également l'un des paramètres clés pour estimer le FBA à l'aide de modèles cinétiques à bilan massique comme ceux d'Arnot et Gobas (2003a, 2004), car elle est utilisée dans le calcul de la constante de vitesse d'absorption alimentaire (kD) et liée au log Koede la substance en question (Kelly et al., 2004). Comme le mentionne Arnot (2010), certains produits chimiques sont soumis à une dégradation dans les tissus épithéliaux de l'intestin et du tractus gastro-intestinal (TGI), ce qui peut réduire l'efficacité du transfert de la substance chimique dans l'organisme ainsi que la bioamplification en général. En théorie, une substance qui est fortement métabolisée dans le TGI devrait avoir une faible efficacité de l'assimilation alimentaire, tandis que les substances métabolisées lentement devraient présenter une assimilation potentiellement plus élevée et donc une bioamplification plus élevée.
L'efficacité de l'assimilation alimentaire du MDM rapportée par SEHSC (2010) est de 32 %, soit un niveau en deçà mais proche de la fourchette de 40 à 60 % signalée pour certains composés de biphényle polyhalogéné connus pour avoir un FBM supérieur à 1 (Kelly et al. 2004). Cela semble une nouvelle fois indiquer certaines limitations de l'absorption de MDM à partir du TGI, que ce soit en raison d'effets stériques, de résidus liés dans l'alimentation, ou les deux. Il faut remarquer qu'un FBM utilisant l'équation proposée dans la partie consacrée à l'alimentation de l'ébauche de révision de la Ligne directrice 305 de l'Organisation de coopération et de développement économiques (OCDE, 2011) ne peut pas être calculé pour le MDM, car le taux de croissance est plus élevé que la constante de vitesse de dépuration (par environ 0,005 j-1), ce qui entraîne une constante de vitesse de dépuration corrigée pour la croissance négative (c.-à-d., k2g). Cela montre l'effet du taux de croissance qui « surcharge » la cinétique de l'essai sur le FBM (se reporter au tableau 8). Des efforts sont mis en œuvre par l'intermédiaire de l'OCDE afin de gérer les influences du taux de croissance dans l'essai de toxicité par le régime alimentaire de la Ligne directrice 305 (OCDE, 2011).
Constantes du taux cinétique
Le modèle d'Arnot et Gobas a été employé à l'aide des constantes du taux métaboliques initialement normalisées par rapport au poids, à la température et à la teneur en lipides du poisson dans des études sur le FBC et le FBM. Cela a été effectué en utilisant l'approche décrite dans Arnot et al. (2008a), lorsque le FBC ou la constante de vitesse de dépuration sont connus. L'objectif est d'adapter le modèle cinétique pour qu'il corresponde aux données sur le FBC observées, fournissant ainsi des estimations raisonnables des constantes des taux. Les constantes du taux cinétique calculées et empiriques sont résumées selon un format de bilan massique au tableau 8 ci-dessous.
| Substance | Paramètre de l'étude | Constante du taux d'absorption jour-1 (k1) |
Constante de vitesse de dépuration jour -1 (kD)Note de bas de page Tableau 8a[a].5 |
Constante du taux d'élimination par les branchies jour-1 (k2) | Constante du taux métabolique jour-1 (kM) |
|---|---|---|---|---|---|
| MDM | FBCés (5 030 à 7 730) |
n.d. | n.d. | n.d. | n.d. |
| MDM | FBCcinétique (3 610 à 5 600) |
1 210 et 1 040[a] | 0,336 et 0,186[a] | n.d. | n.d. |
| MDM | FBCcinétique (7 762) |
1 427Note de bas de page Tableau 8a[b] | n.d. | 0,028[b] | 0,058[b] |
| MDM | FBMés (0,11 à 0,38) |
0,01[a] | 0,038[a] | 0,00Note de bas de page Tableau 8a[c] | 0,028[c] |
| MDM | FBMcinétique (0,26 à 0,86) |
s.o. | s.o. | s.o. | s.o. |
| L4 | FBCés (1 610 à 3 870) |
n.d. | n.d. | n.d. | n.d. |
| L4 | FBCcinétique (1 760 à 3 830) |
n.d. | n.d. | n.d. | n.d. |
| L4Note de bas de page Tableau 8a[*] | FBCcinétique (3 890) |
1 427[b] | n.d. | 0,007[b] | 0,066[b] |
| M4Q | FBMés (0,045 à 0,16) |
n.d. | n.d. | n.d. | n.d. |
| M4Q | FBMcinétique (0,10 à 0,37) |
0,0025[a] | 0,025[a] | 0,0000[c] | environ 0,02[c] |
| Substance | Paramètre de l'étude | Constante du taux de croissance jour-1 (kG) |
Constante de vitesse d'expulsion de la matière fécale jour-1 (kE) | Constante du taux d'élimination totale jour-1 (kT)Note de bas de page Tableau 8b[d].1 | Référence |
|---|---|---|---|---|---|
| MDM | FBCés (5 030 à 7 730) |
n.d. | n.d. | n.d. | Drottar, 2006 |
| MDM | FBCcinétique (3 610 à 5 600) |
n.d. | n.d. | n.d. | Drottar, 2006 |
| MDM | FBCcinétique (7 762) |
0,002Note de bas de page Tableau 8b[b] | 0,011[b] | 0,099 | Environnement Canada (voir le corps de texte) |
| MDM | FBMés (0,11 à 0,38) |
0,040Note de bas de page Tableau 8b[a] | 0,010Note de bas de page Tableau 8b[c] | 0,078[c] | Drottar, 2010 |
| MDM | FBMcinétique (0,26 à 0,86) |
s.o. | s.o. | s.o. | SEHSC, 2010; 2011 |
| L4 | FBCés (1 610 à 3 870) |
n.d. | n.d. | n.d. | SEHSC, 2006 |
| L4 | FBCcinétique (1 760 à 3 830) |
n.d. | n.d. | n.d. | SEHSC, 2006 |
| L4Note de bas de page Tableau 8b[*] | FBCcinétique (3 890) |
0,002[b] | 0,009[b] | 0,084[b] | Environnement Canada (voir le corps de texte) |
| M4Q | FBMés (0,045 à 0,16) |
n.d. | n.d. | n.d. | DowCorning Corporation, 2010b |
| M4Q | FBMcinétique (0,10 à 0,37) |
0,037[a] | 0,005[c] | 0,062[c] supérieur(e) à | Environnement Canada (voir le corps de texte) |
La méthode cinétique à bilan massique ajustée aux données sur le FBC de l'analogue prévoit des valeurs de FBC de 7 762 et de 3 890 pour le MDM et le L4, respectivement (cf. tableau 8), et ces valeurs concordent avec celles de 3 610 à 5 600 et de 1 760 à 3 830 obtenues de manière empirique pour le MDM et le L4 (tableau 6). Ainsi le niveau de confiance est bon concernant le fait que les constantes du taux cinétique se rapprochent de celles obtenues dans des conditions de laboratoire. Les constantes du taux d'élimination totale calculées sont très proches l'une de l'autre (0,06 à 0,1 j-1), qu'elles soient calculées à partir de données sur le FBC ou le FBM. Les constantes du taux métabolique sont aussi très proches et sont comprises entre 0,02 et 0,066 j-1, ce qui semble indiquer un taux de biotransformation lent et soutenir les observations rapportées dans les études empiriques indiquant une faible biotransformation des composés d'origine du MDM ou du L4. À titre de comparaison, des constantes de vitesse de dépuration de 0,035 et de 0,040 j-1ont été calculées pour le D4 et le D5, respectivement, chez la truite arc-en-ciel, Oncorhynchus mykiss (Woodburn et al., sous presse).
La capacité métabolique d'un organisme peut être liée au poids corporel et à la température (p. ex. Hu et Layton, 2001; Nichols et al., 2007). Pour fournir une constante du taux métabolique plus représentative, la moyenne géométrique des constantes aqueuses et alimentaires du taux métabolique (à savoir 0,038 j-1) a été déterminée pour tous les composés figurant au tableau 8. Cette constante de taux a ensuite fait l'objet d'une normalisation supplémentaire par rapport aux conditions du scénario du niveau trophique intermédiaire dans la version modifiée du modèle d'Arnot et Gobas (poids du poisson = 184 g, teneur en lipides = 6,8 %, température = 10 oC) conformément aux procédures décrites dans Arnot et al. (2008b). La valeur de kM qui en résulte, une fois arrondie, est de 0,010 j-1. Pour fournir un certain contexte au sein du groupe plus large des substances VMS, cette valeur de kM se trouve dans la fourchette de valeurs disponibles pour d'autres VMS présentant une faible masse moléculaire, soit de 0,008 à 0,08 (valeur médiane de 0,02) et de 0,001 à 0,01 (valeur médiane de 0,004) pour le D4 et le D5, respectivement (Environnement Canada, Santé Canada, 2008a, 2008b). On a utilisé des poissons de niveau trophique intermédiaire pour représenter les sorties globales du modèle, comme l'a laissé entendre le concepteur du modèle, et ce modèle est très représentatif du poids des poissons susceptibles d'être consommés par des piscivores aviaires ou terrestres; il prévoit aussi un contenu en lipides de 6,8 %, qui est jugé représentatif des conditions canadiennes. La valeur calculée de kM est conforme à l'analyse pour des métabolites réalisée dans des conditions d'état stable dans le cadre de l'étude sur la bioaccumulation de Drottar (2006) dans laquelle 98 % du matériel radiomarqué était présent en tant que MDM originel, ce qui appuie la notion de « faible dégradation métabolique » de cette substance.
La valeur de kM, d'après les données du tableau 8, pour le MDM et pour un poisson de 10 g à une température de 15 oC, a été estimée à 0,03 j-1à l'aide de la méthode d'Arnot et al. (2008b). Un examen de la base de données de kM mené par Arnot et al. (2008b) pour un poisson de 10 g à une température de 15 °C indique que les substances chimiques ayant un log Koed'environ 6,6 et un kM comparable au MDM, comme le 2,3,7,8-tétrachlorodibenzo-p-dioxine (no CAS 1746-01-6; – log Koe6,8, kM-normalisé de 0,01-0,02 j-1) le 2-Benzotriazol-2-yl-4,6-di-tert-butylphénol (no CAS 3846-71-7 – log Koe 6,3, kM-nornalisé de 0,04-0,05 j-1) et le DDE (no CAS 72-55-9 – log Koe 6,5, kM-normalisé de 0,02 j-1) ont des FBC calculés qui peuvent dépasser 5 000 (Gobas et al. , 1989; Gobas et Sharp, 1990; NITE, 2002).
Facteur d'amplification trophique (FAT)
Le facteur d'amplification trophique (FAT) est une mesure du potentiel de bioamplification d'une substance au sein d'un réseau trophique étudié dans des conditions naturelles. Ce facteur est estimé en mettant en corrélation des concentrations de substance normalisées dans le biote à différents niveaux trophiques. Une pente positive de la droite de régression des concentrations normalisées pour les lipides en fonction du niveau trophique indique que la concentration de la substance augmente sur plusieurs niveaux trophiques et qu'il y a bioamplification (Weisbrod et al., 2009). À l'inverse, un FAT inférieur à 1 est le signe d'une dilution trophique, qui est largement liée à une fonction du métabolisme.
Aucune valeur de FAT n'était disponible pour le MDM ou ses analogues au moment de la présente analyse. D'après une fourchette empirique de FBM comprise entre 0,11 et 0,86 (tableau 7), le MDM devrait présenter un faible potentiel de bioamplification par l'intermédiaire des réseaux trophiques et, par conséquent, présente vraisemblablement un FAT inférieur à 1.
Facteur de bioaccumulation (FBA)
Les facteurs de bioaccumulation sont mesurés dans des conditions naturelles en tant que rapport entre les charges de substance chimique absorbées dans le corps entier découlant de toutes les expositions et les concentrations se trouvant dans l'eau ambiante. Aucune donnée de terrain de ce type n'est disponible pour les VMS pris en compte dans la présente analyse de la bioaccumulation. Le calcul du FBA est la mesure préconisée pour évaluer le potentiel de bioaccumulation des substances, car il intègre toutes les expositions d'un organisme à la substance chimique, y compris l'exposition alimentaire qui prédomine pour les substances présentant un log Koesupérieur à 4, environ (Arnot et Gobas, 2003a).
À un log Koede 6,6, la fraction biodisponible prévue du MDM dans la colonne d'eau (à l'exclusion de la perte attribuable à la volatilisation), selon les modèles de bilan massique des poissons est d'environ 54 %, ce qui laisse entendre que l'absorption à partir de l'eau par les branchies est une exposition très pertinente pour le MDM. Cependant, si le log Kcode 4,3 est utilisé, la principale fraction (environ 99 %) du MDM se trouvera en phase dissoute dans l'eau. Cette analyse semble indiquer que l'absorption par les branchies est très pertinente pour cette substance chimique.
En l'absence de données empiriques, des estimations du FBA ont été générées en utilisant la version à trois niveaux trophiques du modèle de bilan massique cinétique mis au point par Arnot et Gobas (2003a) et en corrigeant l'efficacité de l'assimilation alimentaire de 46 % par défaut en fonction de la valeur alpha de 32 % rapportée dans l'étude sur le FBM du MDM par SEHSC (2010). Cette correction a une influence directe sur le taux d'absorption alimentaire par défaut (kD) utilisé comme hypothèse par le modèle. La prévision du FBA pour les poissons du niveau trophique intermédiaire à l'aide d'une constante du taux métabolique normalisée de 0,01 j-1et d'une valeur de ED de 32 % entraîne un FBA pour ces poissons du niveau trophique intermédiaire d'environ 288 400, soit un chiffre qui entre dans le domaine du modèleNote de bas de page[5].
Une surestimation possible du FBA pour les poissons du niveau trophique intermédiaire a été envisagée, étant donné le potentiel de bioamplification plus élevé calculé par le modèle. Cependant, le FBM utilisé dans le modèle pour le calcul du FBA concorde bien avec les résultats du FBM cinétique pour le MDM (FBM du modèle = 0,8 et FBM cinétique = environ 0,9). Le modèle du FBA calcule un « facteur d'amplification trophique réalisé »Note de bas de page[6] de 1,0, ce qui n'est pas une valeur extrême pour ce paramètre. Si cette valeur est fixée à moins de 1 (à l'aide d'une limite supérieure du FAT de 0,7), le FBA qui en résulte est d'environ 18 620. Même si l'on constate une certaine incertitude concernant la valeur absolue du FBA générée par le modèle, il est peu probable que le FBA soit de beaucoup inférieur à la valeur calculée, au vu des corrections apportées au modèle et des données cinétiques, et notamment de la lenteur du métabolisme, de la biodisponibilité aquatique relativement élevée et de l'efficacité de l'absorption alimentaire.
Analyse de la fugacité et des résidus corporels critiques
Le calcul des rapports et des capacités de fugacité d'après Burkhard et al. (2012), le calcul des résidus corporels critiques (McCarty et Mackay, 1993) pour les expositions dans l'eau, les sédiments et l'alimentation (c.-à-d., en utilisant les données relatives au FBC, au FABS et au FBM) ainsi que le calcul de la charge corporelle critique sont fournis à l'annexe III. Les données relatives au FABS pour le D4 ont été utilisées pour cette analyse, en raison de son hydrosolubilité, de son log Koeet de son log Kcosemblables à ceux du MDM, car aucune donnée n'était disponible pour le MDM. Les rapports de fugacité (Fbiote-eau, sédiment, régime alimentaire) dans le biote liés à l'exposition au MDM dans l'eau, les sédiments et le régime alimentaire sont tous inférieurs à 1 et n'atteignent que 0,05 au maximum. Ces valeurs sous-entendent un faible potentiel de bioamplification et une faible contribution de l'alimentation à la bioaccumulation globale du MDM. Ces résultats concordent avec les données relatives au FBM observées. L'analyse de la fugacité et des RCC semble indiquer que les résidus corporels critiques, qui sont compris entre moins de 1 mmol/kg et 1,4 mmol/kg, peuvent être atteints dans les organismes benthiques et pélagiques, au vu du potentiel global de bioaccumulation du MDM. La fourchette supérieure de ces valeurs dépasse la RCC chronique interne de 0,2-0,8 mmol/kg proposée par McCarty et MacKay (1993) pour les effets chroniques chez les poissons et les invertébrés et, même si des effets nocifs ont été observés chez un lombric d'essai vivant dans les sédiments, aucun n'a été rapporté chez les autres organismes d'essai pélagiques ou vivant dans les sédiments. Cette absence de corrélation avec les organismes pélagiques semble indiquer : 1) que le MDM peut se bioaccumuler sans agir comme d'autres substances narcotiques dans les sites visés (moins réactif que d'autres substances narcotiques); 2) qu'il pourrait y avoir une erreur dans le facteur de bioconcentration chez le poisson ou dans l'essai de toxicité dans les sédiments; 3) que l'accumulation dans les organismes ne résulte pas uniquement d'une répartition hydrophobe (p. ex. liaison hydrogène) et que, par conséquent, la répartition dans l'organisme n'entraîne pas de toxicité dans les sites visés; 4) que l'octanol n'est pas un bon substitut pour les lipides visés, ce qui entraîne des erreurs dans l'estimation des concentrations internes. Burkhard et al. (2012) analysent également les limites de l'analyse de la fugacité pour la bioaccumulation.
Résumé du potentiel de bioaccumulation
On observe une certaine concordance entre les éléments de preuve pour déduire que le MDM sera fortement bioaccumulé à partir de l'eau et du régime alimentaire, entraînant des facteurs de bioaccumulation dépassant les critères de bioaccumulation énoncés par le Règlement sur la persistance et la bioaccumulation (Canada, 2000). Cependant, il est peu probable que MDM se bioamplifie dans les réseaux trophiques. Les propriétés intrinsèques du MDM laissent entendre qu'il y a potentiellement une importante fraction biodisponible de MDM dans certaines eaux naturelles et que, par conséquent, l'eau reste un milieu d'exposition pertinent contribuant à la charge corporelle potentielle de MDM dans le biote, en plus de l'alimentation. Le MDM présente un log Koeet un faible taux métabolique comparables à ceux d'autres substances chimiques qui, d'après les observations empiriques, présentent une bioconcentration élevée à partir de l'eau. Une concordance très importante existe également entre les paramètres cinétiques calculés pour tous les VMS analysés dans la présente évaluation, ce qui semble indiquer que l'élimination du MDM pour le poisson ne résulte vraisemblablement pas d'un métabolisme important. Cela a des conséquences importantes sur les expositions à chaque niveau trophique des réseaux trophiques, mais peut-être pas sur l'ensemble du réseau trophique. Cette constatation concorde avec les rapports de fugacité calculés bien inférieurs à 1, laissant supposer que la bioamplification est peu probable pour le MDM.
Un potentiel de bioaccumulation élevé, quelle que soit la voie d'exposition, renseigne sur le potentiel d'effets nocifs à un niveau d'exposition donné, surtout lorsqu'un mode d'action narcotique est connu ou prévu. L'analyse de la fugacité et des RCC semble indiquer que les seuils narcotiques chroniques pourraient être atteints à des concentrations dans l'environnement suffisamment élevées (dans les sédiments ou dans l'eau). Il existe cependant certaines incertitudes sur l'analyse de la fugacité et des RCC ainsi que sur la capacité du MDM en tant que substance chimique narcotique. Des effets nocifs causés par le MDM n'ont été constatés que dans un essai sur les sédiments, et pas dans les autres essais sur les sédiments ni dans les essais sur les organismes pélagiques. Les résidus corporels critiques dépendent des niveaux d'exposition qui, s'ils sont bien inférieurs à la solubilité maximale, limiteront la concentration de résidus dans les tissus des organismes exposés, réduisant ainsi le potentiel d'effets nocifs. Le MDM a été décelé dans un petit nombre de poissons, de mammifères marins et d'invertébrés, mais à des niveaux bien inférieurs à ceux entraînant une narcose, et n'a pas été détecté dans d'autres espèces de poissons, d'invertébrés, de reptiles ou d'oiseaux.
Potentiel d'effets nocifs sur l'environnement
Évaluation des effets écologiques
Sources des données
La base de données empirique sur la toxicité du MDM pour les organismes aquatiques était suffisante pour évaluer le risque potentiel que représente cette substance dans ce milieu. Cependant, aucune donnée sur la toxicité pour les organismes terrestres n'a été recensée et les données empiriques relatives au VMS cyclique D5, un VMS à faible masse moléculaire pour lequel les données sont relativement nombreuses, ont été utilisées aux fins de comparaison dans l'examen des effets potentiels sur les organismes terrestres. Étant donné que le MDM et le D5 devraient tous les deux agir par narcose non polaire et qu'il s'agit de substances appartenant au même groupe général de substances VMS, l'examen des données sur la toxicité du D5 pour les organismes terrestres, en ce qui a trait à la toxicité potentielle du MDM pour les organismes terrestres, a été jugé pertinent.
Mode d'action
Drottar (2006) a rapporté une concentration tissulaire moyenne à l'état stable de 162,2 mg/kg, soit une concentration molaire de 0,69 mmol/kg, chez le tête-de-boule, Pimephales promelas , exposé pendant 42 jours à une dose de 0,021 mg/L de MDM. Cette valeur se trouve dans la plage du résidu corporel critique des poissons de 0,2 à 0,8 mmol/kg proposée par McCarty et al. (1992) comme étant attribuable aux effets chroniques liés à un mode d'action basé sur une narcose. D'après l'absence d'effets observés, comme une mortalité liée à la substance ou d'autres signes cliniques de toxicité à cette concentration tissulaire, on considère qu'une narcose non polaire est le mode d'action toxique le plus probable pour le MDM (SEHSC, 2006). Un mécanisme de toxicité par narcose non polaire et non spécifique a aussi été proposé pour certains VMS cycliques (Hobson et Silberhorn, 1995; Redman et al., 2012).
Études empiriques – Milieu aquatique/sédimentaire
Les données expérimentales sur les effets biologiques du MDM qui ont été utilisées pour évaluer le potentiel d'effets nocifs dans le milieu aquatique canadien sont résumées au tableau 9.
| Organisme d'essai | Type d'essai | Paramètre ultime | ValeurNote de bas de page Tableau 9[a].7 | Référence |
|---|---|---|---|---|
| Oncorhynchus mykiss , truite arc-en-ciel | Toxicité aiguë (96 heures) |
CL50Note de bas de page Tableau 9[b].6 | supérieur(e) à 0,019 mg/L | SEHSC, 2010 |
| Oncorhynchus mykiss , truite arc-en-ciel | Toxicité aiguë (96 heures) |
CSEONote de bas de page Tableau 9[c].5 | 0,019 mg/L | SEHSC, 2010 |
| Oncorhynchus mykiss , truite arc-en-ciel | Toxicité aiguë (96 heures) |
CSEONote de bas de page Tableau 9[d].2 | supérieur(e) à 0,019 mg/L | SEHSC, 2010 |
| Oncorhynchus mykiss , truite arc-en-ciel | Toxicité chronique (90 jours) |
CSEO | 0,027 mg/L | Lee, 2010Note de bas de page Tableau 9[*].5 |
| Oncorhynchus mykiss , truite arc-en-ciel | Toxicité chronique (90 jours) |
CMEO | supérieur(e) à 0,027 mg/L | Lee, 2010[*] |
| Daphnia magna , cladocère | Toxicité aiguë (48 heures) |
CE50Note de bas de page Tableau 9[e] | supérieur(e) à 0,02 mg/L | SEHSC, 2010 |
| Daphnia magna , cladocère | Toxicité chronique (21 jours) |
CE50 | supérieur(e) à 0,015 mg/L | |
| Daphnia magna , cladocère | Toxicité chronique (21 jours) |
CMEO | supérieur(e) à 0,015 mg/L | SEHSC, 2010 |
| Pseudokirchneriella subcapitata , algues vertes | Toxicité aiguë (72 heures) |
CSEO | supérieur(e) à 0,0094 mg/L | SEHSC, 2010 |
| Pseudokirchneriella subcapitata , algues vertes | Toxicité aiguë (72 heures) |
CSEO | 0,0094 mg/L | SEHSC, 2010 |
| Lumbriculus variegates , oligochète | Toxicité chronique (28 jours) |
CE50 | 17 mg/kg poids sec | Thomas et al., 2009b[*] |
| Lumbriculus variegates, oligochète | Toxicité chronique (28 jours) |
CSEO (survie, reproduction et biomasse) |
1,1 mg/kg (poids sec) | Thomas et al. , 2009b[*] |
| Lumbriculus variegates, oligochète | Toxicité chronique (28 jours) |
CMEO (survie et reproduction) |
1,6 mg/kg p.s. | Thomas et al. , 2009b[*] |
| Lumbriculus variegates, oligochète | Toxicité chronique (28 jours) |
CSEO (poids sec) |
17 mg/kg poids sec | Thomas et al. , 2009b[*] |
| Lumbriculus variegates, oligochète | Toxicité chronique (28 jours) |
CMEO (poids sec) |
17 mg/kg poids sec | Thomas et al. , 2009b[*] |
| Lumbriculus variegates, oligochète | Toxicité chronique (28 jours) |
CE50 | supérieur(e) à 38 mg/kg p.s. | Bradley, 2013 |
| Lumbriculus variegates, oligochète | Toxicité chronique (28 jours) |
CMEO (survie et reproduction) |
38 mg/kg p.s. | Bradley, 2013 |
| Lumbriculus variegates, oligochète | Toxicité chronique (28 jours) |
CMEO | supérieur(e) à 38 mg/kg p.s. | Bradley, 2013 |
| Chironomus riparius , moucheron | Toxicité chronique (28 jours) |
CL50 | 166 mg/kg poids sec | Thomas et al. , 2009a |
| Chironomus riparius , moucheron | Toxicité chronique (28 jours) |
CSEO (période de développement, émergence, taux d'émergence) |
84 mg/kg p.s. | Thomas et al., 2009a |
| Chironomus riparius , moucheron | Toxicité chronique (28 jours) |
CMEO (période de développement, émergence, taux d'émergence) |
210 mg/kg poids sec | Thomas et al., 2009a |
| Chironomus riparius , moucheron | Toxicité chronique (28 jours) |
CSEO (taux de développement) |
39 mg/kg p.s. | Thomas et al., 2009a |
| Chironomus riparius , moucheron | Toxicité chronique (28 jours) |
CMEO (taux de développement) |
84 mg/kg p.s. | Thomas et al., 2009a |
| Hyalella azteca , amphipode | Toxicité chronique (28 jours) |
CL50 | supérieur(e) à 70 mg/kg p.s. | Bradley, 2012 |
| Hyalella azteca , amphipode | Toxicité chronique (28 jours) |
CSEO (survie, croissance) |
70 mg/kg p.s. | Bradley, 2012 |
| Hyalella azteca , amphipode | Toxicité chronique (28 jours) |
CMEO (survie, croissance) |
supérieur(e) à 70 mg/kg p.s. | Bradley, 2012 |
Aucun effet nocif observable n'a été constaté aux concentrations d'essai jusqu'à concurrence de la solubilité dans l'eau signalée de 0,034 mg/L dans un essai de toxicité aiguë avec une truite arc-en-ciel, Oncorhynchus mykiss , le cladocère, Daphnia magna et les algues vertes, Pseudokirchneriella subcapitata , ainsi que dans un essai de toxicité chronique avec O. mykiss et D. magna (SEHSC, 2010; Lee, 2010). Des déterminations analytiques ont été effectuées dans toutes les études et les résultats présentés au tableau 9 sont exprimés sous forme de concentrations médianes mesurées.
Aucune toxicité reliée à la dose n'a été observée chez le tête-de-boule, Pimephales promelas , exposé pendant 42 jours à des concentrations d'essai de 0,0017 mg/L (0,0034 nominale) et de 0,021 mg/L (0,034 nominale) de MDM (Drottar, 2006; se reporter à la section relative au potentiel de bioaccumulation). Même s'il y a eu des décès occasionnels tout au long de l'étude (c.-à-d. de huit à dix décès dans chaque traitement de 120 poissons), tous les poissons qui ont survécu semblaient normaux et n'ont présenté de signe évident de toxicité.
Un essai de toxicité sur 28 jours avec des oligochètes d'eau douce, Lumbriculus variegates , et du MDM incorporé à une préparation de sédiments (teneur en carbone organique des sédiments de 1,9 %), a permis de constater une survie et une reproduction significativement réduites à la plus faible concentration d'essai mesurée (CMEO) de 1,6 mg/kg poids sec (p.s.) (Thomas et al., 2009b). La concentration sans effet observé (CSEO) pour l'étude était de 1,1 mg/kg p.s., également d'après les paramètres relatifs à la survie et à la reproduction. Le poids sec médian n'était pas significativement réduit à n'importe quelle concentration d'essai par rapport aux groupes témoins. La survie et la reproduction ont été rapportées sous la forme d'un paramètre unique, comme le précise la ligne directrice d'essai de toxicité pour Lumbriculus (OCDE, 2007), et ont été déterminées en fonction du nombre moyen de lombrics vivants dans les récipients d'essai à la fin de l'essai.
La charge saturante du MDM dans les sédiments peut être déterminée en utilisant la relation suivante :
Cs= Ce × Kco × foc
où :
- C s:
- charge saturante (mg/kg poids sec)
- Ce:
- solubilité dans l'eau du MDM (mg/L) = 0,034 mg/L (tableau 2)
- K co:
- coefficient de partage carbone organique-eau du MDM = 21 878 L/kg CO (log K co de 4,34; tableau 2)
- f oc:
- fraction de carbone organique (CO) dans les sédiments (sans unité)
La charge saturante représente la charge saturante thermodynamique théorique d'un composé dans un milieu donné à l'état stable. Selon les principes de la thermodynamique, cette valeur ne peut être dépassée. Cependant, dans les eaux de surface, la présence de cosolvants ou de surfactants peut créer des conditions qui permettent d'observer une « solubilité apparente » supérieure à la solubilité maximale. Dans les phases solides, comme les sédiments et les sols, la charge saturante est directement fonction de la quantité de carbone organique présente dans la matrice si l'on présume que seules des interactions hydrophobes se produisent avec la matière organique. La teneur en carbone organique des sédiments peut varier d'un emplacement à l'autre et, souvent, des teneurs en carbone moyennes sont utilisées pour calculer les charges saturantes dans les sédiments. La solubilité apparente dans l'eau et les charges saturantes dans les sédiments ou les sols peuvent faire augmenter ou diminuer la biodisponibilité d'un composé. Les valeurs calculées ci-dessus représentent par conséquent les charges de saturation théoriques qui, aux fins de la biodisponibilité, peuvent être dépassées dans certaines circonstances. Par exemple, il est difficile d'être sûr que seules des interactions hydrophobes sont à l'œuvre pour la définition de la charge saturante théorique dans les phases solides. Ces circonstances ne peuvent pas être facilement prévues en l'absence de données précises relatives à la nature du rejet et aux caractéristiques du milieu récepteur.
Pour un sédiment présentant une teneur en CO de 1,9 %, la charge saturante du MDM est de 14 mg/kg p.s. Comme les concentrations d'essai utilisées dans l'étude sont inférieures à cette valeur, la charge saturante du MDM n'a pas été dépassée.
Les essais suivants menés sur Lumbriculus à l'aide de sédiments naturels n'ont relevé aucun effet nocif statistiquement significatif pour la survie, la reproduction ou la biomasse (poids moyen) jusqu'à la concentration d'essai moyenne mesurée la plus élevée de 38 mg/kg p.s. de sédiment (Bradley, 2013). Par conséquent, la CSEO et la CMEO obtenues à partir de cette étude se chiffraient respectivement à 38 mg/kg p.s. et à plus de 38 mg/kg p.s. Étant donné que le sédiment d'essai présentait une teneur en CO de 3,1 %, la charge saturante du MDM était de 23 mg/kg p.s. La charge saturante a par conséquent été dépassée dans les conditions de l'étude, même si aucun effet nocif n'a été observé chez les organismes d'essai.
La survie, la période de développement et les taux d'émergence et de développement ont été examinés dans un essai de toxicité des sédiments de 28 jours (préparation de sédiments, teneur en CO de 2,2 %) avec le moucheron d'eau douce Chironomus riparius (Thomas et al., 2009a). Les taux de développement étaient les paramètres les plus sensibles, avec une CMEO de 84 mg/kg p.s. et une CSEO de 39 mg/kg p.s. La charge saturante du MDM dans des sédiments présentant une teneur en CO de 2,2 % est de 16 mg/kg p.s.; par conséquent, les valeurs terminales dépassaient la charge saturante du MDM dans ces sédiments. Cela semble indiquer que du MDM libre était présent dans le système expérimental et qu'il a pu participer aux effets observés par l'intermédiaire de facteurs comme l'obstruction physique des surfaces respiratoires.
Bradley (2012) n'a signalé aucun effet nocif sur la survie et la croissance chez des amphipodes d'eau douce, Hyalella azteca , exposés pendant 28 jours dans des sédiments à des concentrations moyennes de MDM mesurées de 6, 10, 19, 31 et 70 mg/kg p.s. de sédiment (sédiments naturels, teneur en CO de 3,7 %). La CSEO pour cette étude se chiffrait par conséquent à 70 mg/kg p.s. et la CMEO était supérieure à 70 mg/kg p.s. Ces deux valeurs dépassent la charge saturante de 27,5 mg/kg p.s. pour le MDM dans un sédiment présentant une telle teneur en CO. Cependant, aucun effet nocif n'a été constaté dans ce système expérimental.
En résumé, aucun effet nocif n'a été constaté dans les essais en laboratoire sur les individus de poisson, de Daphnia et d'algue exposés à des concentrations de MDM égales à la limite d'hydrosolubilité ou en dessous de cette dernière pour des périodes de 48 heures à 90 jours. Une série de valeurs terminales sur la toxicité a été observée dans des essais sur les sédiments avec le MDM, y compris deux études menées avec la même espèce (Lumbriculus variegatus); l'une de ces études a relevé des effets, mais pas l'autre. Les différences de réaction observées sont vraisemblablement le reflet d'un écart de sensibilité entre les trois espèces d'essai (Lumbriculus sp., Chironomus sp. et Hyalella sp.), mais peuvent également être liées aux écarts entre les conditions des études. Même si toutes les études sur la toxicité ont été menées conformément aux méthodologies standard internationalement admises et même si elles suivaient les bonnes pratiques de laboratoire (BPL), les différences (comme l'utilisation de sédiments naturels ou préparés, ou les légers écarts en matière de teneur en carbone organique des sédiments) peuvent avoir eu une influence sur les résultats des essais. Lumbriculus variegatus était l'espèce testée la plus sensible, avec une dose minimale avec effet de 1,6 mg/kg p.s. dans des sédiments préparés et présentant une teneur en CO de 1,9 %. Les résultats expérimentaux laissent entendre que des effets nocifs peuvent se produire chez certaines espèces vivant dans les sédiments exposées au MDM, en fonction des essais en laboratoire.
Études empiriques – Milieu terrestre
Aucune donnée sur les effets écologiques n'a été relevée pour le MDM sur les plantes terrestres, les organismes endogés (comme les lombrics) ou la faune. Des études en laboratoire ont été réalisées avec du MDM sur des rongeurs pour évaluer le potentiel de répercussions pour la santé humaine et les données pertinentes provenant de ces études sont présentées dans la section Effets pour la santé humaine de la présente évaluation.
Aucun renseignement sur les effets sur les organismes terrestres n'a été trouvé pour les autres VMS linéaires, comme le L4 et le L5. Cependant, des études de toxicité dans le sol sur le VMS cyclique D5 sont décrites dans la documentation scientifique et, d'après la similitude probable en matière de mode d'action, leurs résultats sont considérés comme pertinents pour le MDM. Une concentration inhibitrice médiane (CI50; concentration entraînant une réduction de 50 % dans une mesure biologique) de 767 mg/kg p.s. de sol a été signalée comme entraînant une réduction importante de la production de petits chez le collembole nivicole, Folsomia candida , exposé au D5 pendant 28 jours, tandis que la CI50à 56 jours pour le même paramètre chez le lombric, Eisenia fetida , était plus élevée que la concentration d'essai la plus élevée de 4 074 mg/kg p.s. (Environnement Canada, 2010c). Dans un essai de 14 jours sur le D5 et quatre espèces de plantes terrestres, l'espèce la plus sensible était l'orge, Hordeum vulgare , avec une CI50de 209 mg/kg p.s. de sol, d'après une réduction importante de la masse sèche des racines. Le même paramètre était plus élevé que la concentration d'essai la plus élevée de 3 533 à 4 306 mg/kg p.s. pour les trois autres espèces testées, le trèfle rouge (Trifolium pretense), le blé dur (Triticum durum) et le radis (Raphanus sativus) (Environnement Canada, 2010c). En comparaison, les niveaux de D5 mesurés dans les échantillons de sols amendés avec des biosolides prélevés dans des sites du sud de l'Ontario et au Québec étaient compris entre 0,006 et 0,221 mg/kg p.s. (Wang et al. , 2010). Même si les sols amendés avec des biosolides représentent un scénario de la pire éventualité pour le D5 dans ce milieu, la plage de valeurs mesurées est bien en dessous de la dose minimale avec effet de 209 mg/kg p.s. obtenue en laboratoire. La similitude proposée dans les modes d'action du D5 et du MDM laisse entendre que les valeurs terminales de toxicité pour les organismes terrestres seront semblables pour ces deux substances. En outre, le MDM devrait être présent dans les sols à des niveaux inférieurs à ceux du D5, au vu des quantités supérieures de D5 au Canada par rapport à celles du MDM (Environnement Canada, Santé Canada, 2008a). Ces éléments semblent indiquer que le MDM représente un faible risque pour les invertébrés et les plantes terrestres.
Calcul de la CESE
Milieu aquatique
Aucun effet nocif n'a été constaté dans les essais menés avec des espèces évoluant dans la colonne d'eau et une valeur critique de toxicité (VCT) pour le milieu aquatique a été calculée à l'aide d'une dose sans effet plutôt qu'avec une dose minimale avec effet. La CSEO la plus élevée de 0,027 mg/L, rapportée par Lee (2010) dans le cadre d'un essai de toxicité de 90 jours sur la truite arc-en-ciel, Oncorhynchus mykiss , a été choisie en tant que VCT. En plus de fournir les concentrations d'essai mesurées les plus élevées, la durée de l'étude (90 jours) permet de garantir que l'exposition à la substance d'essai a eu lieu sur une période prolongée. Étant donné que ce paramètre est déjà une valeur de toxicité sans effet, aucun facteur d'évaluation (FE) n'a été appliqué et la concentration estimée sans effet (CESE) se chiffre donc à 0,027 mg/L.
Sédiments
La plus faible valeur terminale obtenue dans les essais sur des espèces vivant dans les sédiments est une CMEO à 28 jours de 1,6 mg/kg p.s. rapportée pour une réduction de la survie et de la reproduction chez l'oligochète Lumbriculus variegates (Thomas et al., 2009b). Cette valeur représente le seuil de toxicité pour les organismes vivant dans les sédiments, d'après les données disponibles, et a par conséquent été choisie comme VCT pour les sédiments. Un facteur d'évaluation de 10 a été appliqué à la VCT de 1,6 mg/kg p.s. afin de tenir compte de la variabilité interspécifique et intraspécifique en matière de sensibilité au MDM, ce qui a permis d'obtenir une CESE de 0,16 mg/kg p.s. La CMEO de 1,6 mg/kg p.s. a été obtenue dans des sédiments présentant une teneur en carbone organique (CO) de 1,9 %. Cette valeur de CESE a été normalisée à une teneur en CO de 3 % pour faciliter la comparaison avec la concentration environnementale estimée (CEE) sur la base d'une teneur en CO équivalente (se reporter à la section sur l'évaluation de l'exposition de l'environnement). La CESE qui en résulte se chiffre donc à 2,5 mg/kg p.s.
Milieu terrestre
Aucune donnée sur les effets écologiques n'a été relevée pour le MDM sur les espèces de plantes terrestres, d'organismes endogés ou de faune; par conséquent, aucune CESE n'a pu être calculée pour le milieu terrestre.
Évaluation de l'exposition de l'environnement
Les propriétés chimiques et les utilisations déclarées de MDM indiquent que des rejets dans les eaux usées et les eaux réceptrices pourraient se produire lors d'applications de consommation et industrielles. Lorsqu'il est rejeté dans des eaux réceptrices, le MDM devrait se répartir dans la colonne d'eau et dans les sédiments, même si une partie se volatilisera également dans l'atmosphère. Les rejets de MDM en provenance des applications de consommation devraient être diffus et, pour cette raison, on estime que les sources industrielles présentent le potentiel le plus élevé de rejets plus concentrés dans l'environnement.
Le MDM se trouvait à des concentrations inférieures au seuil de détection dans les échantillons ponctuels d'eaux de surface et de sédiments prélevés en Amérique du Nord et en Europe, y compris dans des zones situées à proximité d'exutoires d'usines de traitement des eaux usées (cf. annexe II et section sur les concentrations environnementales mesurées). Les concentrations potentielles dans les eaux de surface à proximité des points de rejets des usines de traitement des eaux usées ont été estimées à l'aide d'une méthode de modélisation tenant compte des renseignements relatifs à l'importation de la substance, à son utilisation et ses quantités rejetées estimées, ainsi que des caractéristiques des milieux récepteurs canadiens.
La concentration de MDM calculée dans les eaux réceptrices à proximité du point de rejet d'une usine de traitement des eaux usées a été utilisée en tant que concentration environnementale estimée (CEE) dans l'évaluation des risques pour les eaux de surface canadiennes. Cette CEE pour les eaux de surface a été calculée à l'aide de l'équation suivante :
Ceau-ind= [1000 × Q × L × (1 - R)] / [N × F × D]
où :
- C eau-ind:
- concentration en milieu aquatique due aux rejets industriels, en mg/L
- Q :
- quantité de substance totale utilisée chaque année sur un site industriel, en kg/an
- L :
- pertes dans les eaux usées, fraction
- T :
- taux d'élimination de l'usine de traitement des eaux usées, fraction
- N :
- nombre de jours de rejets annuels, en jour/an
- D :
- débit de l'effluent de l'usine de traitement des eaux usées, en m 3par jour
- D :
- facteur de dilution dans l'eau réceptrice, sans dimension
Une analyse de l'exposition a été réalisée pour le milieu aquatique sur cinq sites où le MDM était utilisé à l'échelle industrielle en 2006 (Environnement Canada, 2010a). Ces sites ont été sélectionnés pour représenter des scénarios réalistes de pire éventualité pour les rejets dans tout le Canada fondés sur l'hypothèse générale selon laquelle la quantité d'une substance rejetée est proportionnelle à la quantité consommée ou produite. Dans cette analyse d'exposition propre au site, chaque scénario comprenait une installation, une usine de traitement des eaux usées et un plan d'eau récepteur. On a estimé la CEE dans les eaux réceptrices sur la base de la concentration dans les effluents des usines de traitement des eaux usées et de l'application d'un facteur de dilution dans le plan d'eau récepteur limité à une valeur maximale de 10. La concentration dans l'effluent de traitement des eaux usées a été déterminée d'après les données publiées et d'après un taux d'élimination secondaire allant de 87 à 90 % pour l'usine de traitement des eaux usées obtenu au moyen du modèle informatique ASTreat (2006). Le débit de l'effluent d'une usine locale de traitement des eaux usées est proportionnel à la population desservie et est compris, pour les sites étudiés, entre 4 000 et 200 000 m3par jour.
L'hypothèse du nombre de jours de rejet pour les utilisateurs industriels (installations de petite taille ou de taille moyenne) utilisée dans l'estimation était de 300 jours par an, pour un scénario de rejet continu. On considère que les valeurs de CEE obtenues représentent le niveau d'exposition à l'état stable dans le cadre d'un scénario de rejet réaliste de la pire éventualité dans des eaux réceptrices situées à proximité du point de rejet d'une usine de traitement des eaux usées au sein d'un site industriel au Canada. Pour mieux tenir compte de la différence de concentration liée à la volatilisation entre le point de rejet industriel dans l'égout et l'influent de l'usine de traitement des eaux usées, la fraction rejetée dans les eaux usées a été étalonnée en fonction des données de surveillance disponibles pour deux substances utilisées dans des processus industriels similaires (le D5 et le D6). Les concentrations mesurées de D5 et de D6 dans l'influent d'une station d'épuration dans une municipalité connue pour recevoir les concentrations les plus élevées de ces substances ont été utilisées pour calculer la charge totale. La fraction rejetée dans les eaux usées a ensuite été calculée en divisant la charge totale de l'influent entrant dans l'usine de traitement des eaux usées de la municipalité par la quantité connue de D5 et de D6 utilisée dans les sites industriels rejetant leurs effluents dans ladite usine de traitement; la fraction obtenue se chiffrait à 0,25 %.
D'après les valeurs d'entrée et les hypothèses susmentionnées, il est estimé que les CEE pour le MDM sont comprises entre 0,00001 et 0,00011 mg/L. La valeur de CEE la plus élevée de 110 ng/L (0,00011 mg/L) est proche de la concentration la plus élevée mesurée dans les effluents d'une usine canadienne de traitement des eaux usées, soit 115 ng/L (cf. annexe II).
Une relation de partage à l'équilibre (PEq) a été appliquée à la valeur de CEE dans les eaux de surface la plus élevée (0,00011 mg/L) afin de calculer une CEE estimée pour les sédiments. D'après les principes d'interactions hydrophobes,
CEEsédiments= CEEeau × Kcosédiments × foc
où :
- CEE sédiments:
- concentration environnementale estimée dans les sédiments (mg/kg p.s.)
- CEE eau:
- concentration environnementale estimée dans l'eau (mg/L) = 0,00011 mg/L
- K co:
- coefficient de partage carbone organique-eau (L/kg de CO) = 21 878 (se reporter au tableau 2)
- F co sédiments:
- fraction de carbone organique dans les sédiments (sans unité)
La fraction de carbone organique (CO) présente dans les sédiments (Fco sédiments) devrait varier considérablement entre les emplacements, et une valeur de moyenne de teneur en CO de 3 % a été utilisée pour représenter les sédiments au Canada.
La valeur de CEEsédimentsse chiffre alors à 0,072 mg/kg p.s. de sédiments.
Caractérisation des risques pour l'environnement
La présente évaluation préalable examine les renseignements essentiels en vue de déterminer si le MDM satisfait aux critères énoncés à l'article 64 de la LCPE (1999), et notamment si cette substance peut avoir des effets nocifs sur l'environnement au Canada. Les éléments de preuve examinés pour formuler une conclusion comprennent ceux relatifs aux modes d'utilisation et d'importation, aux rejets dans l'environnement et à leur répartition, au potentiel de persistance dans l'environnement, au potentiel de bioaccumulation, au potentiel de toxicité et de risque, aux résultats de la surveillance de l'environnement et aux résultats des analyses du quotient de risque d'après les données empiriques et modélisées relatives aux effets et à l'exposition.
Les renseignements obtenus pour l'année 2006 ont permis de déterminer que le MDM n'était pas fabriqué au Canada, mais qu'il était importé dans des quantités comprises entre 10 000 et 100 000 kg par an. Cette substance est principalement utilisée en tant qu'ingrédient de produits industriels, médicaux et de consommation tels que les produits de nettoyage et de dégraissage, les lubrifiants, les diluants et solvants, et les cosmétiques. Selon les profils d'utilisations déclarés au Canada, la majorité du MDM importée au Canada devrait être exportée hors du pays dans des produits (31 %), recyclée pendant l'utilisation industrielle (16 %), ou présente dans des produits destinés aux sites d'enfouissement (5 %) ou d'incinération (1 %). Près de la moitié du MDM utilisée au Canada (47 %) devrait être rejetée directement dans l'environnement. De plus, on devrait observer la majorité des émissions dans l'air (46 %) et la proportion restante (1 %) dans les eaux usées avant traitement. La pression de vapeur élevée du MDM indique que, en cas de rejet dans des environnements autres que dans l'air, cette substance aura tendance à se volatiliser dans ces milieux et dans l'air. Par conséquent, d'après la part plus importante de rejets directs dans l'air et la préférence du MDM pour se répartir dans ce milieu, l'air est considéré comme le principal milieu pertinent pour cette substance. On s'attend également à une certaine répartition dans l'eau et les sédiments lorsque la substance pénètre le milieu aquatique.
Le MDM présent dans l'air subira une dégradation abiotique à la suite d'une réaction avec des radicaux hydroxyles atmosphériques produits photochimiquement, ses demi-vies calculées étant de 6 à 9 jours. Ces résultats indiquent que le MDM n'est pas récalcitrant dans l'air, même si le temps de séjour dans l'atmosphère plus long laisse entendre que le MDM pourrait être en mesure de se déplacer avec les courants atmosphériques vers des régions situées à une certaine distance de son site d'émission. Cependant, le MDM est considéré comme ayant un faible potentiel de contamination de l'Arctique, étant donné qu'il ne devrait pas se déposer dans l'eau et le sol des régions éloignées. Le MDM n'a pas été détecté par les programmes de surveillance de l'air arctique menés en Amérique du Nord et en Europe, même s'il a été décelé à de faibles concentrations dans un petit nombre d'échantillons d'air prélevés dans des sites de référence nord-américains. Le MDM est plus susceptible d'être détecté dans des échantillons d'air prélevés à proximité des activités émettrices, comme les sites industriels, les installations de traitement des déchets et les centres urbains. La concentration atmosphérique la plus élevée, mesurée à 6,43 ng/m3, a été trouvée dans un échantillon prélevé dans une banlieue de Toronto, en Ontario, au Canada, et cette valeur est bien inférieure à la concentration minimale avec effet nocif observé (CMENO) de 7 740 mg/m3signalée pour ses effets par inhalation chez les rats (se reporter à l'évaluation des effets sur la santé humaine). Cela semble indiquer que les concentrations naturelles de MDM dans l'air se situent bien en dessous de celles qui entraîneraient des effets nocifs chez les organismes vivants.
Une petite part (environ 1 %) du MDM utilisée au Canada devrait être rejetée dans les eaux usées avant traitement. Les données empiriques indiquent que les processus abiotiques comme la volatilisation à l'interface air-eau et l'hydrolyse au sein de la colonne d'eau sont importants pour l'élimination du MDM dans le milieu aquatique, et ces deux processus contribueront à la réduction des niveaux de cette substance dans les usines de traitement des eaux usées et les eaux de surface. Les concentrations de MDM mesurées dans les effluents d'usine de traitement des eaux usées sont beaucoup plus faibles que celles que l'on constate dans les influents de ces mêmes usines, ce qui indique que les processus de traitement réussissent à réduire les quantités de MDM quittant les usines pour pénétrer dans les eaux de surface réceptrices. Les demi-vies empiriques pour l'hydrolyse de 0,12 à 60,9 jours indiquent que le MDM sera dégradé dans la colonne d'eau.
Les processus d'élimination comme la volatilisation à la surface de l'eau et l'hydrolyse dans la colonne d'eau devraient réduire de façon importante la quantité de MDM qui parvient au lit de sédiments. Cependant, aucune information n'a été relevée concernant la dégradation abiotique du MDM dans les sédiments, et une demi-vie de biodégradation de 365 jours, calculée en s'appuyant sur un analogue, a été utilisée pour déterminer son potentiel de persistance dans ce milieu. Le MDM a démontré un faible potentiel de biodégradation microbienne. En outre, d'après les preuves de dégradation abiotique active de la substance dans le sol et l'eau, il semble que la détermination de la persistance dans les sédiments reposant seulement sur les données de la biodégradation sous-estimerait le potentiel d'élimination dans ce milieu.
Le traitement des terres avec des biosolides (amendement avec des boues provenant d'usines de traitement des eaux usées) représente vraisemblablement la source potentielle la plus importante de MDM dans le sol. La pression de vapeur élevée de cette substance indique que le MDM présent dans les boues sera retiré par volatilisation au cours de la transformation des boues en biosolides, et qu'une certaine hydrolyse pourra également avoir lieu avant la déshydratation des boues. Ces processus devraient réduire la quantité totale de MDM présente dans les biosolides qui sont épandus sur les sols. En outre, il a été prouvé que l'hydrolyse catalysée par des conditions acides et la volatilisation étaient des processus d'élimination importants pour le MDM dans le sol.
Le MDM a démontré une grande capacité de bioconcentration dans le cadre d'essais en laboratoire réalisés sur des poissons. Les estimations du facteur de bioaccumulation (FBA) calculées à l'aide de données empiriques pour le MDM et plusieurs substances analogues pertinentes indiquent que cette substance peut également avoir un grand potentiel d'accumulation dans les organismes grâce à l'exposition alimentaire. La présence mesurée de MDM dans certains échantillons de biote aquatique confirme que cette substance est bien biodisponible. Cependant, le MDM n'est qu'occasionnellement détecté par les programmes de surveillance et aucune tendance claire ne se dégage en ce qui a trait aux caractéristiques régionales ou aux réseaux trophiques. Un facteur de bioamplification empirique inférieur à 1 indique que le MDM ne devrait pas passer d'un niveau trophique au niveau au-dessus du réseau trophique étudié.
D'après les données empiriques et modélisées, le MDM répond aux critères de persistance dans l'air et les sédiments, mais pas dans l'eau et le sol, conformément au Règlement sur la persistance et la bioaccumulation de la LCPE (1999) (demi-vie dans l'air supérieur(e) ou égal(e) à 2 jours; demi-vie dans l'eau et le sol supérieur(e) ou égal(e) à 182 jours; demi-vie dans les sédiments supérieur(e) ou égal(e) à 365 jours). D'après les valeurs empiriques et modélisées, le MDM satisfait au critère de bioaccumulation (FBA ou FBC supérieur ou égal à 5 000) énoncé dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Aucun lien n'a été établi entre l'accumulation de MDM dans les organismes et des effets potentiels. Aucun effet nocif n'a été observé dans les espèces de la colonne d'eau exposées pendant de longues périodes en laboratoire à des concentrations de MDM pouvant atteindre la limite d'hydrosolubilité. Des effets nocifs ont été déclarés dans l'une des deux études en laboratoire menées sur des espèces vivant dans les sédiments, Lumbriculus variegatus. Cependant, aucun effet nocif n'a été observé dans une seconde étude réalisée sur l'espèce Lumbriculus , ni dans des études en laboratoire menées sur deux autres espèces vivant dans les sédiments, l'amphipode d'eau douce Hyalella azteca et le moucheron à l'état larvaire Chironomus riparius. La dose minimale avec effet de 1,6 mg de MDM/kg p.s. de sédiment déterminée dans le cadre de l'essai sur l'espèce Lumbriculus est nettement supérieure aux niveaux de MDM qui ont été mesurés dans l'environnement. Les niveaux de MDM étaient inférieurs aux seuils de détection dans tous les échantillons de sédiments et d'eaux de surface prélevés dans les études de surveillance de l'environnement. Ces études comprenaient un total de 289 échantillons de sédiments, parmi lesquels certains avaient été prélevés dans des régions où la contamination industrielle et urbaine était connue. On n'a trouvé aucune information sur les effets potentiels sur les espèces terrestres. Cependant, les résultats obtenus pour un composé semblable mécaniquement laissent entendre que le MDM ne devrait pas être dangereux pour les invertébrés terrestres ou les plantes.
La présence de MDM dans l'environnement est étroitement liée aux activités urbaines et industrielles, ainsi qu'aux processus de traitement des déchets. Des concentrations de MDM ont été mesurées dans certains influents et effluents d'usines de traitement des eaux usées, dans certaines eaux de procédés industriels avant traitement et dans des lixiviats de sites d'enfouissement, confirmant le fait que cette substance peut être rejetée au cours de l'utilisation du produit et au moment de son élimination. Les concentrations dans les influents des usines canadiennes de traitement des eaux usées sont comprises entre 1 et 531 ng/L (dans 58 des 110 échantillons ponctuels), tandis qu'elles se situent entre 0,4 et 115 ng/L (dans 37 des 110 échantillons ponctuels) dans les effluents. La réduction notable des concentrations et de la fréquence de détection entre les influents et les effluents prélevés aux mêmes moments et aux mêmes usines de traitement des eaux usées indiquent que ce traitement réduit efficacement la quantité de MDM qui est prête à se mélanger aux eaux réceptrices. La volatilisation et l'hydrolyse sont vraisemblablement des processus d'élimination importants avant même l'entrée dans l'usine de traitement et au sein de cette dernière. En outre, la valeur élevée de log Kcocomprise entre 3 et 7 (valeur empirique de 4,34) semble indiquer que le MDM présent dans les influents aura tendance à s'adsorber aux particules en suspension, avec une élimination qui s'ensuit à partir de la phase aqueuse par décantation. Le MDM a été détecté dans 32 % des échantillons de boue d'usine de traitement des eaux usées (23 sur 72) prélevés dans des installations des pays nordiques et il est probable que cette substance soit également présente dans certaines boues canadiennes, bien qu'aucune donnée ne soit aujourd'hui disponible à ce sujet.
Une estimation quantitative du potentiel de risques pour l'environnement a été menée en comparant les concentrations environnementales estimées (CEE) dans le milieu aquatique canadien avec les concentrations estimées sans effet (CESE) dans le cadre d'une analyse du quotient de risque. Pour le milieu pélagique, une valeur de CEE dans les eaux de surface de 0,00011 mg/L a été déterminée comme la valeur la plus élevée parmi une série de concentrations provenant de cinq scénarios d'exposition industrielle. La comparaison de la valeur de la CEE avec une CESE de 0,027 mg/L, calculée à partir de la valeur sans effet provenant d'un essai sur la toxicité chronique de 90 jours sur la truite arc-en-ciel, Oncorhynchus mykiss , a permis d'obtenir un quotient de risque (CEE/CESE) de 0,004. Ce quotient de risque indique que le MDM n'est pas susceptible d'avoir des effets nocifs sur les organismes aquatiques.
Pour le milieu des sédiments, une CEE de 0,072 mg/kg p.s. fondée sur des sédiments présentant une teneur de CO à 3 % a été déterminée en appliquant les principes de relation de partage à l'équilibre (PEq) à la CEE la plus élevée prévue dans les eaux de surface (0,00011 mg/L). En comparaison, le MDM n'a été détecté dans aucun des 229 échantillons de sédiments prélevés dans six provinces canadiennes, avec des limites de détection comprises entre 0,0002 à 0,02 mg/kg p.s. de sédiment. La comparaison de la CEE avec une CESE de 2,5 mg/kg p.s. calculée à partir de la dose minimale avec effet provenant d'un essai sur la toxicité chronique sur l'oligochète, Lumbriculus variegates , a permis d'obtenir un quotient de risque (CEE/CESE) de 0,03. Par conséquent, d'après les hypothèses prudentes utilisées pour calculer les valeurs de CEE pour les eaux de surface et les sédiments, il est peu probable que le MDM ait des effets nocifs sur les organismes vivant dans les sédiments au Canada.
Des preuves relatives à la dégradation abiotique active du MDM dans l'eau et le sol, et les données sur le rejet direct limité de cette substance dans l'environnement et sur son élimination efficace des usines de traitement des eaux usées indiquent que le MDM aura un potentiel d'exposition faible dans l'environnement. Le MDM peut demeurer pendant des périodes plus longues dans l'air, même s'il n'est pas récalcitrant dans ce milieu, et peut également persister dans les sédiments. Cependant, étant donné la similitude, en matière de composition, entre le sol et les sédiments, et au vu de la capacité démontrée de la substance à se dégrader dans le sol, il semble probable qu'un certain niveau de dégradation abiotique se produise également dans les sédiments. De plus, l'hydrolyse dans la colonne d'eau devrait réduire la quantité de MDM parvenant au lit de sédiments. Même si les données de laboratoire et de modélisation indiquent que le MDM peut avoir un potentiel de bioaccumulation important, cette substance ne devrait pas se bioamplifier dans les réseaux trophiques. En outre, on constate une absence d'effets nocifs chez les organismes exposés pendant de longues périodes à des concentrations de MDM atteignant la limite de solubilité de cette substance. D'après la présence limitée du MDM dans l'environnement, cette substance devrait présenter un faible risque d'effets nocifs pour les organismes vivant dans le sol et les sédiments. Les niveaux faibles d'exposition et de risque de danger indiquent que le MDM présenterait un faible risque d'effets nocifs pour les organismes ou pour l'intégrité globale de l'environnement. On conclut que le MDM ne satisfait pas aux critères énoncés aux alinéas 64 a) ou b) de la LCPE (1999), car il ne pénètre pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique, ou à mettre en danger l'environnement essentiel pour la vie.
Incertitudes dans l'évaluation des risques pour l'environnement
Des quotients de risque ont été élaborés pour les milieux pélagiques et sédimentaires; cependant, ces deux quotients présentent des incertitudes. En ce qui concerne le milieu pélagique, aucune valeur de seuil de toxicité n'était disponible et la CESE s'est appuyée sur une dose sans effet plutôt que sur une dose minimale avec effet. Cela signifie que la CESE est non liée, l'hydrosolubilité fournissant le seul paramètre de limitation. Cette incertitude a été palliée en n'appliquant pas de facteur d'évaluation à la valeur critique de toxicité (VCT), étant donné que la VCT était déjà une valeur sans effet. Pour les sédiments, l'incertitude est liée au calcul d'une valeur de CEE pour le MDM en s'appuyant sur des hypothèses prudentes et des estimations modélisées alors que la substance n'est pas réellement détectée dans les échantillons de sédiments. La CEE calculée ne peut donc pas être comparée avec des niveaux environnementaux pour évaluer son niveau de réalisme.
Des prévisions modélisées ont été utilisées pour fournir des renseignements concernant la distribution, la persistance et le potentiel de bioaccumulation du MDM dans l'environnement. Cependant, les incertitudes pourraient être plus importantes concernant l'utilisation de modèles pour cette substance, car peu de données sur les siloxanes ont été intégrées dans les modèles. Les programmes comme EPI Suite et EQC ont récemment commencé à intégrer des données pour les VMS, principalement les VMS cycliques, dans les ensembles d'étalonnage des modèles et cela devrait permettre de réduire les incertitudes associées à l'application de ces modèles pour les organosiliciums comme le MDM. Les versions les plus récentes d'EPI et d'EQC ont été utilisées pour fournir des sorties du modèle dans la présente évaluation préalable, et elles tiennent toutes les deux en compte, dans une certaine mesure, des siloxanes. Par conséquent, les estimations calculées à partir de la modélisation ont été jugées suffisamment fiables pour être utilisées dans l'évaluation du potentiel d'effets nocifs sur l'environnement.
Risque d'effets nocifs sur la santé humaine
Évaluation de l'exposition
Milieux naturels et nourriture
On dispose de données empiriques limitées quant aux niveaux de MDM dans les milieux naturels. Au Canada, le MDM a été détecté dans l'air ambiant à des usines de traitement des eaux usées et des sites d'enfouissement en Ontario, ainsi qu'en aval et en amont de ces installations (0,66 à 6,14 ng/m3; cf. annexe II) (Cheng et al. , 2011). Étant donné que ces mesures de l'air ambiant ont été obtenues à la source, elles n'ont pas été jugées pertinentes pour les expositions de la population en général et on ne les a pas utilisées pour caractériser l'exposition à partir de l'air ambiant. On a également décelé du MDM dans l'environnement nordique (cf. annexe II). Plus précisément, il a été détecté dans les boues d'épuration et dans l'eau des sources ponctuelles et à proximité, mais il n'a pas été décelé dans le sol (moins de 0,1 µg/kg), les eaux de surface (moins de 0,5 à 0,8 ng/L), ou l'air ambiant (moins de 8 ng/m3) dans les échantillons prélevés dans les sources de fond (Kaj et al. , 2005a, 2005b). Dans des enquêtes de suivi, on a également décelé du MDM dans les boues et dans l'eau, mais encore une fois, on n'en a pas décelé dans les sédiments (moins de 0,19 à moins de 0,4 ng/g) ou dans l'eau de surface (moins de 0,3 ng/L) (Schlabach et al. , 2007; Evenset et al. , 2009). Dans une étude récente, le MDM a été détecté dans l'air ambiant (dans 6 endroits sur 20 à travers le monde) à des concentrations supérieures au seuil de détection comprises entre 0,011 et 0,12 ng/m3(Genualdi et al. , 2011).
Dans l'environnement intérieur, on a décelé des MDM dans 2 résidences suédoises sur 400 dans une plage de 2,5 à 12,3 µg/m3(Kaj et al. , 2005a). Les données préliminaires indiquent également des niveaux décelables de MDM (1,73 à 5,2 ng/m3, n = 6) dans un immeuble à bureaux de Toronto (communication personnelle d'Environnement Canada; 2010, source non citée). On a également décelé des siloxanes linéaires (décaméthyltétrasiloxane) et cycliques dans des chambres à coucher de résidences de Vancouver (Harner et al., 2010). Ces observations indiquent que le MDM peut être présent dans l'air intérieur.
On a également décelé du MDM dans 6 échantillons de lait maternel sur 39 dans une plage de concentration allant de 0,003 à 0,008 µg/L (Kaj et al. , 2005a).
Finalement, le MDM n'est pas répertorié comme un additif alimentaire approuvé et n'a pas été recensé comme étant présent dans la formulation d'additifs indirects ou dans les matériaux d'emballage d'aliments. Toutefois, le PDMS (no CAS 9006-65-9) est un additif alimentaire permis au Canada et Santé Canada ne dispose pas de données actuellement sur la quantité de MDM, le cas échéant, dans le PDMS utilisé dans les applications alimentaires. Par ailleurs, il faut souligner que le niveau maximal de PDMS quand on l'utilise comme additif alimentaire est de 10 ppm; tout MDM présent serait par conséquent considéré négligeable (communication personnelle de la Direction des aliments de Santé Canada, 2010; source non citée).
Les niveaux de MDM dans les tissus de poissons (p. ex. truite, doré jaune) et de fruits de mer (p. ex., moule) prélevés en eau de mer et en eau douce ont fait l'objet d'un suivi au Canada, aux États-Unis et en Europe du Nord (se reporter à l'annexe II et la section « Concentrations mesurées dans l'environnement »). La plupart des concentrations étaient inférieures à la limite de détection de la méthode ou près de sources ponctuelles urbaines (et, par conséquent, non représentatives des poissons susceptibles d'être consommés par la population); une étude a révélé des concentrations détectables (0,17 et 0,33 ng/g) à distance des sources ponctuelles, dans la morue franche de l'Arctique norvégien le foie de la morue polaire. Cependant, la prévalence était faible (1 sur 5 échantillons, et 1 sur 11) (Evenset et al. , 2009). D'après ces renseignements, l'exposition au MDM par la consommation de poisson devrait être faible pour l'ensemble de la population canadienne.
L'exposition dans les milieux naturels a été estimée au moyen des études réalisées dans les pays nordiques (Kaj et al. , 2005a, 2005b). L'absorption totale (6,5 µg/kg par jour) par toutes les voies d'exposition était la plus élevée dans le groupe d'âge de 0,5 à 4 ans (l'annexe IV contient plus de précisions).
L'incertitude quant aux estimations d'exposition est élevée, étant donné qu'on ne disposait d'aucune donnée empirique canadienne pour une majorité de sources environnementales. On a utilisé des données de suivi indiquant la présence de MDM dans l'environnement nordique en remplacement de données canadiennes. De plus, il subsiste une incertitude relativement à l'absence de données actuelles sur la quantité de MDM, le cas échéant, dans le PDMS utilisé dans les applications alimentaires. Toutefois, le niveau maximum de PDMS lorsqu'on l'utilise comme additif alimentaire est de 10 ppm; par conséquent, tout MDM présent serait considéré négligeable (communication personnelle de la Direction des aliments de Santé Canada, 2010; source non citée).
Selon des hypothèses prudentes (utilisation de limites de détection dans les calculs, concentrations maximales), il est évident que les estimations d'exposition des milieux naturels et du lait maternel sont des valeurs estimatives de la limite supérieure.
Les produits de consommation et les produits cosmétiques, y compris les produits de soins personnels
Les estimations d'exposition suite à l'utilisation de cosmétiques, y compris certains produits de soins personnels, ont été obtenues à l'aide du logiciel ConsExpo 4.1 (ConsExpo, 2007). Les fabricants de cosmétiques sont tenus d'informer Santé Canada des concentrations de siloxane, y compris les formulations de MDM et de PDMS (habituellement appelé diméthicone)Note de bas de page[7] dans ces types de produits. Selon les notifications soumises aux termes du Règlement sur les cosmétiques à Santé Canada, le MDM est présent dans 20 à 30 types de produits (cf. tableau 10), la plupart étant des produits « sans rinçage » (courriel adressé en avril 2013 par la direction de la sécurité des produits de consommation de Santé Canada au Bureau de l'évaluation des risques des substances existantes de Santé Canada; source non citée).
Le MDM présente une volatilité élevée (masse moléculaire de 236,54 g/mol, pression de vapeur de 3,9 mm Hg; tableau 2) et, par conséquent, la présente évaluation a pris en compte la voie par inhalation et la voie cutanée.
Dans l'évaluation d'un autre siloxane, le D4, réalisée par Santé Canada (Environnement Canada, Santé Canada, 2008b), on a supposé que 90 % de l'exposition aux cosmétiques et produits de soins personnels se produit par inhalation, 10 % survenant par la voie cutanée. Cette supposition était basée sur des données expérimentales qui indiquaient que 88 à 95 % du D4 s'évaporait de la peau (Zareba et al. , 2002; Jovanovic et al. , 2008; Environnement Canada, Santé Canada, 2008b). D'après la similitude dans le poids moléculaire et la pression de vapeur entre le MDM et le D4 (poids moléculaire du D4 : 296,62 g/mol, pression de vapeur de 1,05 mmHg), cette hypothèse a également servi à estimer l'exposition due à l'usage de cosmétiques contenant du MDM. En outre, selon le genre de produits (c.-à-d., la majorité sont des produits sont « sans rinçage »), on a supposé que l'exposition par inhalation et par voie cutanée se faisait sur une période de 12 heures.
On a calculé l'exposition quotidienne totale pour une personne qui utilise des produits contenant du MDM pendant une période de 12 heures. L'exposition a été estimée à 0,090–2,8 mg/kg p.c. (kilogramme de poids corporel) par jour pour la voie cutanée et à 6,8 × 10−3–0,42mg/kg p.c. par jour pour l'inhalation (se reporter au tableau 10). De plus, on a estimé une concentration médiane totale par événement de 0,05 à 4,2 mg/m3pour l'utilisation de ces produits sur une période de 12 heures.
Tableau 10. Estimation de l'exposition d'un adulte au MDM par l'utilisation de cosmétiques, y compris les produits de soins personnelsNote de bas de page Tableau 10[a].8
| Produit | Plage de concentration ( %)Note de bas de page Tableau 10[b].7 | Concentration moyenne par événement (mg/m3) | Inhalation (mg/kg p.c. par jour) | Dermique (mg/kg p.c. par jour) |
|---|---|---|---|---|
| Fond de teint | 1 – 3 | 4,6 × 10−3– 0,014 | 6,4 × 10−4– 1,9 × 10−3 | 9,1 × 10−3– 0,027 |
| Apprêt pour maquillage | 1 – 100 | 4,6 × 10−3– 0,18 | 6,4 × 10−4– 0,025 | 9,1 × 10−3– 0,35 |
| Cache-cernesNote de bas de page Tableau 10[d] | 1 – 30 | s.o. | s.o. | 2,1 × 10−3– 0,063 |
| Fard à joues[d] | 1 – 3 | s.o. | s.o. | 2,4 × 10−3– 7,1 × 10−3 |
| Fard à cils[d] | 0,3 – 30 | s.o. | s.o. | 7,1 × 10−5– 7,1 × 10−3 |
| Fard à paupières[d] | 3 – 100 | s.o. | s.o. | 4,6 × 10−4– 1,5 × 10−2 |
| Lotion pour les yeux[d] | 0,3 – 3 | s.o. | s.o. | 9,7 × 10−4– 0,010 |
| Crème pour le visage | 0,3 – 30 | 3,1 × 10−3– 0,31 | 6,4 × 10−4– 0,064 | 9,1 × 10−3– 0,91 |
| Crème corporelle | 0,3 – 10 | 0,011 – 0,38 | 1,4 × 10−3– 0,047 | 0,021 – 0,68 |
| Revitalisant sans rinçage | 0,1 – 30 | 0,011 – 3,2 | 8,7 × 10−4– 0,26 | 1,2 × 10−3– 0,37 |
| Shampooing[d] | 0,1 – 0,3 | s.o. | s.o. | 2,0 × 10−3– 6,0 × 10−3 |
| Revitalisant avec rinçage[d] | 0,1 – 0,3 | s.o. | s.o. | 7,2 × 10−4– 2,2 × 10−3 |
| Antisudorifique/ déodorantNote de bas de page Tableau 10[c] |
1 – 10 | s.o. | s.o. | 0,011 – 0,11 |
| Parfum | 3 – 30 | 8,5 × 10−3– 0,08 | 2,4 × 10−3– 0,024 | 0,024 – 0,24 |
| Total | s.o. | 0,050 – 4,2 | 6,8 × 10−3– 0,42 | 0,090 – 2,8 |
| Produit | Plage de concentration ( %)2 | Concentration moyenne par événement (mg/m3) | Inhalation (mg/kg p.c. par jour) | Dermique (mg/kg p.c. par jour) |
|---|---|---|---|---|
| Démêlant[c] | 5 | 0,27 | 0,14 | 0,20 |
| Shampooing[d] | 0,3 | s.o. | s.o. | 2,0 × 10−3 |
| Total | s.o. | 0,27 | 0,14 | 0,20 |
Outre les expositions par inhalation et par voie cutanée, on a aussi calculé l'exposition par voie orale provenant du rouge à lèvres, en supposant une absorption intégrale par la voie gastrointestinale. L'exposition a été estimée à3 – 8,9 µg/kg p.c. par jour. Ces estimations étaient faibles comparativement à l'exposition provenant d'autres produits « sans rinçage » et, par conséquent, n'ont pas été présentées dans les données sur l'exposition quotidienne totale provenant de cosmétiques, y compris les produits de soins personnels (tableau 10).
La population générale peut être exposée à des peintures contenant du MDM sous forme d'impureté (0,01 %); toutefois, cette exposition a été jugée nettement inférieure à celle provenant de cosmétiques et de produits de soins personnels.
Le MDM est également présent dans un nettoyant à base de silicone (Environnement Canada, 2010a) appliqué sur les automobiles pour éliminer les stries laissées par l'application d'une cire à base de silicone. Toutefois, les tendances actuelles du marché indiquent un emploi accru de cires sans strie. Étant donné que ce produit ne devrait pas être utilisé fréquemment par la population générale, il n'est pas considéré comme une source importante d'exposition.
Il subsiste une incertitude associée aux hypothèses employées pour estimer l'exposition par inhalation (disponibilité de 90 % pour l'exposition par inhalation). Toutefois, étant donné que le MDM et d'autres siloxanes linéaires et cycliques ont été observés dans l'air intérieur (Kaj et al., 2005a; Harner et al., 2010), il est certain que cette voie d'exposition est pertinente pour cette substance. Il subsiste également une incertitude concernant les concentrations et la présence de MDM dans divers produits (non déclarés en vertu de l'article 71 ou des notifications soumises en vertu du Règlement sur les cosmétiques à Santé Canada); toutefois, étant donné l'utilisation d'hypothèses prudentes (concentrations maximales, absorption intégrale par voie cutanée et inhalation, cooccurrence de l'utilisation de produits), il est plus que probable que ces estimations d'exposition sont à la limite supérieure.
Évaluation des effets sur la santé
La structure et l'identité des analogues pertinents du MDM sont présentées à l'annexe VI. Les renseignements disponibles quant aux effets du MDM sur la santé sont résumés à l'annexe VII. Les données sur les analogues du MDM sont présentées à l'annexe VIII.
Aucune évaluation ou classification des effets sur la santé par des organismes de réglementation nationaux ou internationaux n'a été recensée pour le MDM. Le MDM n'a pas produit de mutation génétique dans les cellules bactériennes (Salmonella typhimurium et Escherichia coli) et n'a pas produit d'aberrations chromosomiques dans des cellules ovariennes de hamster chinois, avec et sans activation métabolique (Seifried et al., 2006; BioReliance 2008, 2009). Dans un essai de mutation de cellules de mammifère, des résultats positifs ont été signalés dans les lymphomes de souris en l'absence d'activation métabolique, mais des résultats négatifs ont été signalés en présence d'activation métabolique (Seifried et al., 2006).
Dans le cadre d'un essai combiné de dépistage de la toxicité des doses répétées, pour la reproduction et pour le développement, des augmentations du cholestérol sérique et des augmentations des poids absolu et relatif du foie ont été observées chez des rats mâles et femelles exposés par inhalation au MDM pour une période allant jusqu'à 28 ou 29 jours à une concentration de 7 740 mg/m3et plus (DowCorning Corporation, 2007a). Une néphropathie produite par l'accumulation de gouttelettes d'hyaline a également été observée chez les rats mâles exposés à cette concentration, mais il est apparu qu'il s'agissait de lésions rénales caractéristiques induites par les globulines alpha-2 urinaires propres aux rats mâles. Étant donné que la globuline alpha-2 urinaire n'est synthétisée que dans le foie des rats matures sexuellement, on considère que ce mécanisme de toxicité n'est pas pertinent pour l'évaluation du risque pour la santé humaine. Aucun effet lié au traitement n'a été observé pour les paramètres liés à la reproduction ou au développement qui ont été évalués. Aucun effet sur la reproduction ou sur le développement n'a été constaté à la dose de 31 000 mg/m3, la concentration la plus élevée testée.
Dans une autre étude sur l'exposition par inhalation, des accumulations de protoporphyrine ainsi que des effets secondaires liés à une cholangite/péricholangite et à une prolifération des voies biliaires ont été observées chez des rats mâles et femelles après une exposition à une dose de 31 000 mg de MDM/m3pendant 90 jours (SEHSC, 2011).
Des rats ont été exposés au MDM par gavage dans le cadre d'une étude sur l'exposition par voie orale de 28 jours. Une augmentation importante des poids absolu et relatif du foie, accompagnée d'une hypertrophie hépatocellulaire et d'une accumulation de protoporphyrine associée à une prolifération des voies biliaires et à une inflammation chronique, a été observée chez les mâles aux doses de 250 mg/kg p.c. par jour et aux doses supérieures (Harland Laboratories Ltd, 2010).
Chez le lapin, le MDM n'irritait pas la peau après une exposition, mais produisait une irritation allant de minimale à modérée lorsqu'il était appliqué à la suite d'une exposition répétée (10 applications sur 14 jours) (DowCorning Corporation, 1994 et 1999a). Lors d'un test épicutané sur des humains, aucune sensibilisation ou irritation attribuable au MDM n'a été observée pendant une partie ou l'autre de l'étude. On a conclu que le MDM n'est pas un sensibilisant cutané (DowCorning Corporation, 1998).
Des prévisions de rapports constitution-activité quantitatifs (QSAR) ont été envisagées; toutefois, trois des quatre modèles (DEREK, 2008; CASETOX, 2008; Model Applier, 2008) habituellement utilisés à cette fin ne s'appliquaient pas à cette substance précise, et le résultat du quatrième modèle (TOPKAT, 2004) n'était pas concluant pour tous les paramètres (les prévisions n'étaient pas fiables), d'après les critères propres au modèle définis par l'utilisateur autres que le domaine d'applicabilité des modèles.
La base de données disponible quant aux effets sur la santé du MDM a été jugée limitée et des renseignements pertinents sur les analogues ont été pris en compte pour mieux éclairer l'évaluation des effets sur la santé humaine. Trois analogues pertinents ont été recensés selon leur similarité chimique et la disponibilité de données empiriques sur les effets sur la santé : no CAS 107-46-0 (héxaméthyldisiloxane [HMDS]), no CAS 141-62-8 (décaméthyltétrasiloxane [L4]) et no CAS 141-63-9 (dodécaméthylpentasiloxane [L5]). Le degré de similarité structurale est quantifié à l'aide du coefficient d'association de Tanimoto dans SciFinder; ce coefficient était de 67 %, 86 % et 73 % entre le MDM et le HMDS, le L4 et le L5, respectivement, et a été considéré comme adéquat. En outre, une propriété physique et chimique (c.-à-d., la solubilité dans l'eau) était dans une gamme comparable pour le MDM et ses analogues (se reporter à l'annexe VI pour les structures, les résultats sur la similarité et les valeurs d'hydrosolubilité).
Un résumé des données disponibles sur les effets sur la santé pour les trois analogues est présenté ci-dessous.
Dans des essais in vitro , le L5 n'a pas eu d'effets mutagènes dans des essais de mutation inverse sur des souches de S. typhimurium , avec et sans activation métabolique (DowCorning Corporation, 1979). Le HMDSa présenté des résultats négatifs dans des essais de mutation inverse sur des souches de Salmonella et d' Escherichia coli , dans des essais de recombinaison mutatique avec Saccharomyces , dans un essai de mutation du lymphome de souris, dans un essai d'échange de chromatides sœurs dans des cellules du lymphome de souris et dans deux essais de dommages à l'ADN (essais pol sur des souches d' Escherichia coli et essai d'élution alcaline du lymphome de souris), tous avec et sans activation métabolique (Isquith et al., 1988b; Shin-Etsu, 1994a). Des atteintes chromosomiques étaient évidentes dans les cellules L5178Y du lymphome de souris, mais cet effet n'était pas relié à la dose et a été observé uniquement en l'absence d'activation métabolique (Isquith et al., 1988a). Il n'y avait pas d'atteinte chromosomique dans les fibroblastes pulmonaires des hamsters chinois avec et sans activation métabolique (Shin-Etsu, 1994b).
Un essai in vivo a été recensé dans la documentation pour les analogues. Dans un essai d'aberrations chromosomiques avec le HMDS par injection intrapéritonéale, aucune atteinte chromosomique n'a été observée dans la moelle osseuse de rats mâles (Isquith et al., 1988b).
D'après l'ensemble des données sur la génotoxicité, on estime que les analogues du MDM, en particulier le HMDS, ne sont pas génotoxiques.
Dans une étude de toxicité chronique sur des rats exposés par inhalation au HMDS, il y a eu une augmentation liée à la dose de l'incidence de tumeurs à cellules de Leydig chez les mâles de tous les groupes traités après une année d'exposition (2/20, 10/20, 9/20, 12/20 et 15/20 à des concentrations de 0, 665, 2 660, 10 640 et 33 300 mg/m3, respectivement). Après 24 mois, on a observé des tumeurs à cellules de Leydig dans presque tous les mâles traités et du groupe témoin. De plus, des adénomes et des carcinomes des tubules rénaux sont apparus chez les mâles à une concentration de 10 640 mg/m3(chez 3 animaux sur 65) et à une concentration de 33 000 mg/m3(chez 6 des 65 animaux). Aucune preuve de lésions néoplasiques n'a été observée chez les femelles après 12 ou 24 mois. Les effets non néoplasiques observés chez les rats comprenaient une hyperplasie à cellules de Leydig et une incidence accrue d'inclusions éosinophiles dans l'épithélium oléofactif des mâles de tous les groupes exposés, une augmentation du poids du foie et une augmentation de l'incidence de minéralisation intraluminale dans les reins chez les mâles à des concentrations de 10 640 mg/m3et plus et une légère diminution du poids corporel des femelles à des concentrations de 10 640 mg/m3et plus, qui était probablement associée à une diminution de la consommation d'aliments (DowCorning Corporation, 1999b; Jovanovic et al., 2005). La plus faible concentration minimale avec effet nocif observé (CMENO) quant aux effets non néoplasiques a été de 665 mg/m3d'après une hyperplasie à cellules de Leydig et une incidence accrue d'inclusions éosinophiles dans l'épithélium olfactif chez les mâles.
Il a été démontré que les tumeurs à cellules de Leydig sont courantes chez les rats F344 d'un an et que ces tumeurs deviennent de plus en plus fréquentes avec l'âge (Boorman et al., 1990). Il existe plusieurs éléments de preuve qui laissent croire que les cellules de Leydig humaines sont quantitativement moins sensibles que les cellules des rats aux tumeurs à cellules de Leydig induites chimiquement (Shenker et al., 1993; Quigley et al., 1995; Clegg et al., 1997). D'autres études épidémiologiques disponibles sur plusieurs composés qui induisent des tumeurs à cellules de Leydig chez les rats n'ont pas établi une association entre l'exposition des humains à ces composés et l'induction d'hyperplasies à cellules de Leydig ou d'adénomes (Preston-Martin, 1991; Wilmer et al. , 1994; Longnecker, 1995; Himmelstein et al. , 1997). D'après ces résultats, on considère qu'il est peu probable que l'induction de tumeurs à cellules de Leydig soit pertinente à l'évaluation des risques pour les humains. Au sujet des adénomes et des carcinomes des tubules rénaux observés chez les rats mâles, la démonstration récente de liaisons réversibles de HMDS ou de métabolites à l'alpha-2-2μ-globuline dans les échantillons de rein de rats mâles provenant de rats traités au HMDS, en plus d'observations d'une formation accrue de gouttelettes d'hyaline chez les rats mâles, ont établi qu'une néphropathie attribuable à l'alpha 2μ, un mécanisme propre à l'espèce, est probablement responsable de la néoplasie rénale des rats observée (DowCorning Corporation, 2007b). Par conséquent, l'occurrence de tumeurs rénales chez les rats mâles à la suite de l'administration de HMDS est considérée propre à l'espèce et non pertinente pour l'évaluation des risques pour les humains.
Dans une étude sur deux semaines concernant l'exposition par inhalation au HMDS chez des rats, le seul effet nocif observé a été une augmentation reliée à la dose de la gravité de gouttelettes d'hyaline dans l'épithélium des tubules contournés proximaux des reins des rats mâles à une concentration de 3 319 mg/m3. Toutefois, ces lésions, décrites précédemment pour le MDM, correspondaient à une néphropathie de la globuline alpha-2 urinaire propre aux rats mâles et n'ont pas été considérées comme pertinentes pour l'évaluation des risques pour la santé humaine (DowCorning Corporation, 1992b). Dans une étude sur un mois de l'exposition par inhalation, on a observé une augmentation de l'incidence et de la gravité de la régénération des tubules rénaux, ce qui indique une augmentation des dommages aux reins, chez les mâles exposés au HMDS à des concentrations de 12 700 mg/m3et plus (DowCorning Corporation, 1997a). Dans une étude au cours de laquelle des rats ont été exposés par inhalation à du HMDS pendant trois mois, une inflammation associée à une agrégation du nacrophage alvéolaire a été observée dans les poumons des rates à la concentration la plus faible mise à l'essai (140 mg/m3) en montant (DowCorning Corporation, 1997b). La plus faible CMENO pour une exposition par inhalation à doses répétées a été de 140 mg/m3fondée sur une induction de réactions inflammatoires dans les poumons des rates.
Lorsque des rats ont reçu par gavage oral des doses de HMDS pendant 28 jours, on a observé des changements histopathologiques dans les reins (augmentation des corps éosinophiles) chez les mâles à une concentration de 40 mg/kg p.c. par jour (Shin-Etsu, 1994c). Dans le cadre d'une étude où des rats ont reçu par gavage oral des doses de L5 pendant 28 jours, une augmentation importante du poids absolu et du poids relatif du foie a été accompagnée de lésions hépatiques comme une vacuolisation hépatocellulaire périportale a été observée chez les femelles à des concentrations de 25 mg/kg p.c. par jour et plus (DowCorning Corporation, 2009c). Lorsque le L4 a été administré par gavage aux rats en fonction de la même concentration, l'incidence et la gravité du changement dans les lipides péribiliaires ont augmenté chez les rates à des concentrations de 25 mg/kg p.c. par jour et plus (DowCorning Corporation, 2009a). Toutefois, aucun effet relié au traitement n'a été observé chez les rats mâles et femelles exposés dans leur alimentation à une concentration de 500 mg de L4/kg p.c. par jour, la seule concentration mise à l'essai dans une étude sur un an (DowCorning Corporation, 1966). La plus faible dose minimale avec effet nocif observé (DMENO) pour une exposition par voie orale à doses répétées à ces analogues a été de 25 mg/kg p.c. par jour, fondée sur des effets nocifs dans le foie des rates exposées au L4 et au L5.
Des études sur une exposition cutanée à doses répétées ont été recensées pour deux des analogues du MDM. On n'a remarqué aucun effet nocif relié au traitement chez les rats mâles exposés à une concentration de 1 000 mg de L4/kg p.c. par jour par voie cutanée, une fois tous les jours pendant 28 jours (Hobbs et al., 1972). La DSENO pour une exposition par voie cutanée à doses répétées de HMDS a été chiffrée à 500 mg/kg p.c. par jour, d'après une diminution statistiquement significative du gain de poids corporel, de consommation d'aliments, du poids absolu du foie et des reins à la dose suivante testée (1 000 mg/kg p.c. par jour) chez les rats mâles exposés par voie cutanée pendant 28 jours (DowCorning Corporation, 1993).
Dans une étude sur la reproduction sur une génération de rats exposés par inhalation, le HMDS n'a pas entraîné d'effets sur la reproduction chez les mâles et les femelles à des concentrations allant jusqu'à 33 700 mg/m3, mais on a recensé une concentration minimale avec effet observé (CMEO) chez les parents en fonction d'une augmentation du poids des poumons et du foie chez les mâles, une baisse temporaire du gain de poids corporel chez les femelles et une baisse provisoire de consommation d'aliments chez les deux sexes (DowCorning Corporation, 2000). Ce résultat est conforme à l'absence d'effets observés sur la reproduction à la suite d'une exposition par inhalation à de fortes concentrations de MDM.
Dans une étude de toxicité aiguë par inhalation avec exposition au HMDS pendant quatre heures, la mortalité reliée au traitement et la congestion ou l'hémorragie de divers lobes des poumons chez les rats et les rates ont été signalées à une concentration de 93 500 mg/m3(DowCorning, 1996). Des études de toxicité aiguë par voie orale à l'aide de HMDS ont été recensées, mais aucune ne signalait de DMENO.
Le HMDS, tout comme le MDM, n'a pas produit de sensibilisation de la peau lors de tests épicutanés chez l'être humain (DowCorning Corporation, 1980 et 1992a). On n'a observé aucune incidence de la sensibilisation ou de l'irritation cutanée dans le cadre d'un test de Draize (DowCorning Corporation, 1992c). Une évaluation des propriétés irritantes de la peau avec du HDMS a donné des résultats semblables à ceux observés avec du MDM. À la suite d'une seule application de HDMS sur la peau de lapins, aucune irritation n'a été observée (DowCorning Corporation, 1978 et 1991). Lorsque le HDMS est appliqué après une exposition répétée, on n'a pas constaté, ou à peine, d'irritation sur la peau (DowCorning Corporation, 1976 et 1978).
On considère que la confiance dans la base de données des effets sur la santé du MDM va de faible à modérée, étant donné qu'on a recensé des données empiriques limitées, mais que des données sur les analogues (en particulier le HMDS) ont été utilisées pour déduire des données pour les paramètres manquants concernant le MDM.
Caractérisation des risques pour la santé humaine
Comme les données disponibles liées aux effets du MDM sur la santé étaient limitées, on a également pris en considération les données pertinentes relatives aux substances analogues. Aucune preuve de cancérogénicité pouvant être considérée comme pertinente pour l'évaluation des risques pour la santé humaine n'a été relevée dans le cadre d'une étude sur l'exposition chronique par inhalation chez des rats exposés à la substance analogue HMDS. La prise en compte des données disponibles sur la génotoxicité pour le MDM et ses analogues indique que le MDM est peu susceptible d'être génotoxique. Par conséquent, la caractérisation du risque pour la santé humaine est fondée sur les effets non cancérogènes.
D'après les estimations tirées du nombre limité de données sur les doses de MDM dans les milieux naturels, la source prédominante d'exposition au MDM est l'air intérieur. L'exposition provenant de l'air ambiant, de l'eau potable et du sol a été nettement inférieure en comparaison. On ne s'attend pas à une exposition attribuable aux aliments pour la majorité des groupes d'âge de la population générale. Toutefois, on a décelé du MDM dans des échantillons de lait maternel et, par conséquent, les nouveau-nés allaités pourraient être exposés à la substance.
La CMENO provenant d'une étude à court terme par inhalation menée avec du MDM a été jugée adéquate pour caractériser les risques pour la population générale d'une exposition à du MDM dans l'air intérieur. Cette CMENO (7 740 mg/m3, fondée sur des effets sur le foie) dépasse de plusieurs ordres de grandeur la concentration maximale d'air mesurée dans les maisons (12,3 μg/m3) et la marge d'exposition est jugée adéquate pour régler les incertitudes dans la base de données sur les expositions et les effets sur la santé.
La DMENO provenant d'une étude de 28 jours par voie orale menée avec du MDM a été jugée adéquate pour caractériser les risques liés à une exposition par voie orale. Bien qu'une DMENO plus faible ait été relevée pour les substances analogues L4 et L5 à partir d'une étude de 28 jours par voie orale, l'étude à court terme menée précisément avec du MDM a été jugée plus appropriée. Une comparaison de cette DMENO (250 mg/kg p.c. par jour, fondée sur des effets nocifs dans le foie des rats mâles et femelles) avec la valeur estimative de la limite supérieure de l'absorption quotidienne par voie orale de MDM pour les nouveau-nés allaités (7,9 × 10−4 μg/kg p. c. par jour; annexe V) donne une marge d'exposition de plusieurs ordres de grandeur. Cette marge est considérée comme adéquate pour rendre compte des incertitudes liées aux bases de données concernant les effets sur la santé et l'exposition.
L'exposition de la population générale en raison de l'utilisation de produits cosmétiques (y compris certains produits de soins personnels) devrait avoir lieu par inhalation, par voie cutanée et par voie orale.
La comparaison de l'estimation de la limite supérieure de l'exposition par voie orale découlant de l'utilisation d'un rouge à lèvres et de la DMENO à court terme par voie orale susmentionnée de 250 mg/kg p.c. par jour pour le MDM entraîne des marges d'exposition comprises entre 28 090 et 83 330. Ces marges d'exposition sont jugées adéquates pour tenir compte des incertitudes liées aux bases de données concernant les effets sur la santé et l'exposition.
En ce qui concerne l'exposition par voie cutanée liée à l'utilisation de cosmétiques, aucun effet n'a été observé chez des animaux de laboratoire à une dose de 500 mg/kg p.c. par jour dans une étude d'exposition par voie cutanée sur 28 jours chez les rats en utilisant du HMDS. Une DSENO de 500 mg/kg p.c. par jour et une DMENO de 1 000 mg/kg p.c. par jour a ainsi pu être obtenue à partir de cette étude (DowCorning Corporation, 1993). Dans une étude d'exposition par voie cutanée menée avec du L4, on n'a observé aucun effet nocif chez des lapins mâles albinos de Nouvelle-Zélande à une concentration de 1 000 mg/kg p.c. par jour (Hobbs et al., 1972). Une comparaison entre ces seuils critiques d'effet et la plage d'estimations de l'exposition quotidienne totale par voie cutanée au MDM à la suite de l'utilisation de cosmétiques (0,09 à 2,8 mg/kg p.c. par jour), donne des marges d'exposition comprises entre 180 et 5 560 lorsqu'on utilise la DSENO provenant de l'étude sur le HMDS, et de 360 à 11 110 lorsqu'on utilise la DSENO provenant de l'étude sur le L4. Si l'on tient compte du fait que les estimations d'exposition se fondaient sur des hypothèses prudentes (c.-à-d. concentrations maximales, utilisation de tous les types de produits le même jour, tous les produits contiennent du MDM) et étant donné que ces marges se fondent sur des doses sans effet nocif observé, ces marges d'exposition sont jugées adéquates pour tenir compte des incertitudes liées aux bases de données concernant les effets sur la santé et l'exposition.
En raison de la volatilité élevée du MDM et de son occurrence dans des produits « sans rinçage », on estime que l'inhalation est une voie d'exposition pertinente. Une comparaison de la plage estimative des concentrations moyennes par événement (0,05–4,2 mg/m3) découlant de l'utilisation de cosmétiques et de produits de soins personnels, avec la plus faible CMENO suivant une exposition par inhalation à court terme au MDM (7 740 mg/m3) donne des marges d'exposition allant de 1 840 à 154 800. Ces marges d'exposition sont jugées adéquates pour tenir compte des incertitudes liées aux bases de données concernant les effets sur la santé et l'exposition.
Incertitudes de l'évaluation des risques pour la santé humaine
Les données empiriques sur les effets pour la santé du MDM sont limitées et il subsiste une incertitude associée à l'utilisation d'analogues pour caractériser les effets pour la santé humaine. Il y a une incertitude concernant la cancérogénicité du MDM en raison de l'absence d'études à long terme, quoique les données disponibles provenant de tests de génotoxicité et d'études sur la cancérogénicité qui sont disponibles pour l'analogue HMDS n'indiquent pas de préoccupations. Il y a aussi une incertitude concernant les estimations d'exposition. Plus particulièrement, il y a une incertitude dans l'utilisation de concentrations dans l'environnement provenant de régions nordiques pour obtenir des estimations d'exposition (milieux naturels et lait maternel) dans la situation canadienne et une incertitude associée à la présence de MDM, le cas échéant, dans le PDMS (no CAS 9006-65-9) utilisé comme additif alimentaire.
En outre, il subsiste une incertitude associée aux hypothèses utilisées pour estimer l'exposition provenant de cosmétiques, y compris des produits de soins personnels. L'hypothèse selon laquelle une personne utiliserait tous les produits contenant du MDM le même jour est jugée très prudente. Il y a aussi une incertitude relativement aux hypothèses portant sur la caractérisation de l'exposition par inhalation à l'utilisation de cosmétiques. Toutefois, étant donné que le MDM a été décelé dans l'air intérieur, on estime qu'il s'agit d'une voie d'exposition pertinente pour le MDM. Finalement, il y a aussi une incertitude concernant les concentrations et la présence de MDM dans divers produits.
Conclusion
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation préalable, le MDM présente un faible risque d'effets nocifs sur les organismes et sur l'intégrité globale de l'environnement. On conclut que le MDM ne satisfait pas aux critères énoncés aux alinéas 64 a) ou b) de la LCPE (1999), car il ne pénètre pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique, ou à mettre en danger l'environnement essentiel pour la vie.
À la lumière des renseignements contenus dans la présente évaluation préalable, on conclut que le MDM ne satisfait pas aux critères énoncés à l'alinéa 64 c) de la LCPE (1999), car il ne pénètre pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
On conclut que le MDM ne satisfait à aucun des critères énoncés à l'article 64 de la LCPE (1999).
Références
Alaee, M. 2014. Données inédites de surveillance issues de la deuxième phase du Plan de gestion des produits chimiques. Présenté à la Division des évaluations écologiques d'Environnement Canada, Gatineau (Qc).
Alaee, et al. 2012.Linear and cyclic volatile methyl siloxanes in the leachate, influent, and effluent in various landfills, wastewater treatment plants, facilities from Canada.Rapport inédit. Burlington (Ont.) : Environnement Canada, Direction des sciences et de la technologie de l'eau.
Allen, R.B., Kochs, P., Chandra, G. 1997.Industrial organosilicon materials, their environmental entry and predicted fate. In :Chandra, G. (éd.)The handbook of environmental chemistry, Volume 3, Part H: Organosilicon materials.New York (NY) : Springer-Verlag. p. 181-223.
[AOPWIN]Atmospheric Oxidation Program for Windows[modèle d'évaluation]. 2008. Version 1.92a. Washington (DC) : Environmental Protection Agency des États-Unis,Office of Pollution Prevention and Toxics;Syracuse (NY) : Syracuse Research Corporation. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Arnot, J.A., Gobas, F.A.P.C. 2003.A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb. Sci. 22(3):337-345.
Arnot, J.A., Gobas, F.A.P.C. 2003b.Categorization of organic substances on the Domestic Substances List for bioaccumulation potential.Rapport présenté à Environnement Canada, Division des substances existantes. Juin 2003. Gatineau (Qc) : Environnement Canada.
Arnot, J.A., Gobas, F.A.P.C. 2004.A food web bioaccumulation model for organic chemicals in aquatic ecosystems. Environ. Toxicol. Chem. 23:2343-2355.
Arnot, J.A., Gobas, F.A.P.C. 2006.A review of bioconcentration factor (BCF) and bioaccumulation factor (BAF) assessments for organic chemicals in aquatic organisms. Environ. Rev. 14:257-297.
Arnot, J.A., Mackay, D., Bonnell, M. 2008a.Estimating metabolic biotransformation rates in fish from laboratory data. Environ. Toxicol. Chem. 27(2):341-351.
Arnot, J.A., Mackay, D., Parkerton, T.F., Bonnell, M. 2008b.A database of fish biotransformation rates for organic chemicals. Environ. Toxicol. Chem. 27(11):2263-2270.
Arnot, J.A. 2010.Estimating chemical absorption efficiency from dietary exposures and degradation rate constants in the gastro-intestinal tract.Rapport préliminaire. Préparé pour la Division des évaluations écologiques d'Environnement Canada. Mars 2010. Gatineau (Qc) : Environnement Canada.
Arnot, J.A., Arnot, M.I., Mackay, D., Couillard, Y., MacDonald, D., Bonnell, M., Doyle, P. 2010.Molecular size cutoff criteria for screening bioaccumulation potential: fact or fiction? Integr. Environ. Assess. Manag. 6(2):210-224.
ASTreat Model [modèle sur l'élimination des usines de traitement des eaux usées]. 2006. Version 1.0. Cincinnati (États-Unis) : Procter & Gamble Company. Disponible auprès de la Procter & Gamble Company, C.P. 538707, Cincinnati (OH), 45253-8707, États-Unis.
Backus, S., Moore, S., Pelletier, M. 2012. Données inédites de surveillance sur les sédiments issues de la deuxième phase du Plan de gestion des produits chimiques. Présenté à la Division des évaluations écologiques d'Environnement Canada, Gatineau (Qc).
[BDIPSN] Base de données sur les ingrédients des produits de santé naturels [base de données sur Internet]. 2014. Ottawa (Ont.) : Santé Canada [consulté en août 2014]. Accès : http://webprod.hc-sc.gc.ca/nhpid-bdipsn/search-rechercheReq.do?url=&lang=fra
[BDPP] Base de données sur les produits pharmaceutiques [base de données sur Internet]. 2011. Canada. Ministère de la Santé. [consulté en mars 2011]. Accès : http://www.hc-sc.gc.ca/dhp-mps/prodpharma/databasdon/index-fra.php
[BDPSNH] Base de données des produits de santé naturels homologués [base de données sur Internet]. 2011. Canada. Ministère de la Santé. [consulté en mars 2011]. Accès : http://webprod3.hc-sc.gc.ca/lnhpd-bdpsnh/language-langage.do?url=Search-Recherche&lang=fra
[BESC] Bureau européen des substances chimiques. 2010. IUCLID dataset: Octamethyltrisilixane, CAS No. 107-51-7 (document inédit).
Beyer, A., Mackay, D., Matthies, M., Wania, F., Webster, E. 2000.Assessing long-range transport potential of persistent organic pollutants. Environ. Sci. Technol. 34(4):699-703.
BioReliance. 2008.Bacterial reverse mutation assay with Octamethyltrisiloxane.Study No. AC09FV.503.BTL.
BioReliance. 2009. L3(Octamethyltrisiloxane; n° CAS 107-51-7): In vitro mammalian chromosome aberration test. Study NumberAC19VU.331.BTL.
[BIOWIN]Biodegradation Probability Program for Windows[modèle d'évaluation]. 2008. Version 4.10. Washington (DC) : Environmental Protection Agency des États-Unis,Office of Pollution Prevention and Toxics;Syracuse (NY) : Syracuse Research Corporation. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Boethling, R.S., Howard, P.H., Beauman, J.A., Larosche, M.E. 1995.Factors for intermedia extrapolations in biodegradability assessment. Chemosphere 30(4):741-752.
Boorman, G.A., Chapin, R.E., Mitsumori, K. 1990.Testis and epididymis in pathology of the Fisher rat.p. 405-418. San Diego (CA) : Academic Press.
Bradley, M.J. 2012.Octamethyltrisiloxane (L3): A 28-day toxicity test exposing freshwater amphipods (Hyalella azteca) to a test substance applied to sediment under static-renewal conditions following OPPTS draft guideline850.1735. HES Reference Number 12085-826. Revised draft III. Le 18 septembre 2012. Wareham (MA) : Smithers Viscient.
Bradley, M.J. 2013.Octamethyltrisiloxane (L3) – Sediment-water Lumbriculus toxicity test using spiked sediment, following OECD Guideline 225. Smithers Viscient Study No. 12023.6221. Wareham (MA) : Smithers Viscient.
[BRRC] Bushy Run Research Center. 1982. Rapport inédit présenté à Union Carbide Corporation.Silicone Fluid Y-4081. Acute toxicity and primary irritancy studies.BRRC Project Report 44-108.
Bruggeman, W.A., Weber-Fung, D., Opperhuizen, A., VanDerSteen, J., Wijbenga, A., Hutzinger, O. 1984.Absorption and retention of polydimethylsiloxanes (silicones) in fish: Preliminary experiments. Toxicol. Environ. Chem. 7(4):287-296.
Burkhard, L.P., Arnot, J.A., Embry, M.R., Farley, K.J., Hoke, R.A., Kitano, M., Leslie, H.A., Lotufo, G.R., Parkerton, T.F., Sappington, K.G., et al. 2012.Comparing laboratory and field measured bioaccumulation endpoints. Integ. Environ. Assess. Manag. 8(1):17-31.
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999) . L.C., 1999, ch. 33. Gazette du Canada , Partie III, vol. 22, no 3. Accès : www.gazette.gc.ca/archives/p3/1999/g3-02203.pdf
Canada. 2000. Loi canadienne sur la protection de l'environnement (1999) : Règlement sur la persistance et la bioaccumulation . C.P. 2000-348, 23 mars 2000, DORS/2000-107. Gazette du Canada , Partie II, vol. 134, no 7, p. 607-612. Accès : http://www.gazette.gc.ca/archives/p2/2000/2000-03-29/pdf/g2-13407.pdf
Canada. Ministère de la Santé nationale et du Bien-être social. 1990. L'allaitement maternel au Canada : pratiques et tendances. Ottawa (Ont.) : ministère de la Santé nationale et du Bien-être social. No de catalogue H39-199/1990F. [cité dans Santé Canada, 1998].
Canada. Ministère de l'Environnement, ministère de la Santé. 2008a. Évaluation préalable pour le Défi concernant le décaméthylcyclopentasiloxane (D5), Numéro de registre duChemical Abstracts Service541-02-6. Novembre 2008. Ottawa (Ont.) : Environnement Canada, Santé Canada.
Canada. Ministère de l'Environnement, ministère de la Santé. 2008b. Évaluation préalable pour le Défi concernant l'octaméthylcyclotétrasiloxane (D4). Numéro de registre duChemical Abstracts Service556-67-2. Novembre 2008. Ottawa (Ont.) : Environnement Canada, Santé Canada.
Canada. Ministère de l'Environnement, ministère de la Santé. 2013. Évaluation préalable pour le Défi concernant le 1,1,1,5,5,5-Hexaméthyl-3,3-bis[(triméthylsilyl)oxy]trisiloxane (M4Q) – mise à jour. Numéro de registre duChemical Abstracts Service3555-47-3. Ottawa (Ont.) : Environnement Canada, Santé Canada.
Canada. Ministère de l'Environnement, ministère de la Santé. 2006. Loi canadienne sur la protection de l'environnement (1999) : Avis d'intention d'élaborer et de mettre en œuvre des mesures d'évaluation et de gestion des risques que certaines substances présentent pour la santé des Canadiens et leur environnement. Gazette du Canada , Partie I, vol. 140, no 49, p. 4109-4117. Accès : http://www.gazette.gc.ca/archives/p1/2006/2006-12-09/pdf/g1-14049.pdf
Canada. Ministère de l'Environnement, ministère de la Santé. 2009a. Loi canadienne sur la protection de l'environnement (1999) : Avis de douzième divulgation d'information technique concernant les substances identifiées dans le Défi. Gazette du Canada , Partie I, vol. 143, no 52, p. 3839-3843. Accès :
http://www.gazette.gc.ca/rp-pr/p1/2009/2009-12-26/pdf/g1-14352.pdf#page=33
Canada. Ministère de l'Environnement. 2009b. Loi canadienne sur la protection de l'environnement (1999) : Avis concernant les substances du groupe 12 du Défi. Gazette du Canada , Partie I, vol. 143, no 52, p. 3813-3836. Accès : http://www.gazette.gc.ca/rp-pr/p1/2009/2009-12-26/pdf/g1-14352.pdf#page=7
Canada. 2014. Règlement sur les aliments et drogues. C.R.C., ch. 870 (modifié le 15 septembre 2010). Accès : http://laws-lois.justice.gc.ca/fra/reglements/C.R.C.%2C_ch._870/index.html
CASETOX [module de prévision]. 2008. Version 2.0. Beachwood (OH) : MultiCASE. [consulté le 6 août 2010]. Accès : http://www.multicase.com/products/prod03.htm [réserve de consultation].
Cassidy, S.L., Dotti, A., Kolesar, G.B., Dochterman, W., Meeks, R.G., Chevalier, H.J. 2001.Hexamethyldisiloxane: A 13-week subchronic whole-body vapor inhalation toxicity study in Fisher 344 rats. J. Toxicol. 20:391-399.
[CATABOL]Probabilistic assessment of biodegradability and metabolic pathways[modèle informatique]. c2004-2008. Version 5.10.2. Bourgas (Bulgarie) : Bourgas Prof. Assen Zlatarov University,Laboratory of Mathematical Chemistry.Accès : http://oasis-lmc.org/?section=software&swid=1
[CES] Centre Européen des Silicones. 2012.Preliminary assessment of octamethyltrisiloxane (L3) in sediments and biota in aquatic ecosystems.Rapport d'étape. Le 6 août 2012. Présenté à Environnement Canada en vertu du Plan de gestion des produits chimiques.
Chandra, G. 1997.Introduction. In :Chandra, G. (éd.)The handbook of environmental chemistry, Volume 3, Part H: Organosilicon materials.New York (NY) : Springer-Verlag. p. 181-223.
[ChemID] ChemIDplus Advanced [en ligne]. 2010. Bethesda (MD) : United StatesNational Library of Medicine. National Institutes of Health.Accès : http://chem.sis.nlm.nih.gov/chemidplus/
Cheng, Y., Shoeib, M., Ahrens, L., Harner, T., Ma, J. 2011.Wastewater treatment plants and landfills emit volatile methyl siloxanes (VMSs) to the atmosphere: Investigations using a new passive air sampler. Environ. Pollut. 159:2380-2386.
Clegg, E.D., Cook, J.C., Chapin, R.E., Foster, P.M.D., Daston, G.P. 1997.Leydig Cell hyperplasia and adenoma formation: mechanisms and relevance to humans. Reprod. Toxicol. 11:107-121.
[ConsExpo] Consumer Exposure Model [en ligne]. 2007. Version 4.1. Bilthoven (NL) :Rijksinstituut voor Volksgezondheid en Milieu(Institut national néérlandais de la santé publique et de l'environnement). Accès : http://www.ConsExpo.nl/en/healthanddisease/productsafety/ConsExpo.jsp#tcm:13-42840
[CosIng]Cosmetic Ingredients and Substances[base de données sur Internet]. 1976- . Bruxelles (Belgique) : Commission européenne, Enterprises et industrie. [mis à jour le 12 mars 2009; consulté le 7 juin 2010]. Accès : http://ec.europa.eu/enterprise/cosmetics/cosing/index.cfm?fuseaction=search.simple
[CPOP] Modèle canadien de POP. 2008. Gatineau (Qc) : Environnement Canada, Division des évaluations écologiques; Bourgas (Bulgarie) : Bourgas Prof. Assen Zlatarov University,Laboratory of Mathematical Chemistry.[modèle basé sur celui de Mekenyan et al. , 2005]. Disponible auprès de la Division des évaluations écologiques d'Environnement Canada.
[CTFA] Cosmetic, Toiletry and Fragrance Association. 1983.Summary for the results of surveys of the amount and frequency of use of cosmetic products by women.Rapport préparé par Pitkin, B., Rodericks, J.V., Turnbull, D. Washington (DC) : Environ Corporation.
[DEREK]Deducting Estimation from Existing Knowledge[module de prévision sur CD-ROM]. 2008. Version 10.0.2. Cambridge (MA) : Université Harvard, LHASA Group. [consulté le 6 août 2010]. Accès : http://lhasa.harvard.edu/?page=toxicology.htm [réserve de consultation].
Dimitrov, S., Dimitrova, N., Walker, J., Veith, G., Mekenyan, O. 2002.Predicting bioconcentration potential of highly hydrophobic chemicals. Effect of molecular size. Pure Appl. Chem. 74(10):1823-1830.
Dimitrov, S., Dimitrova, N., Parkerton, T., Comber, M., Bonnell, M., Mekenyan, O. 2005.Base-line model for identifying the bioaccumulation potential of chemicals. SAR QSAR Environ. Res. 16(6):531-554.
DowCorning Corporation. 1965.Chronic (8-month) feeding studies with methyl siloxanes in rabbits(avec lettre d'accompagnement datée du 20 avril 1994). TSCA OTS0556517, Document ID: 1965-I0065-1179-01.
DowCorning Corporation. 1966.Chronic (one-year) feeding studies with methyl siloxanes in rats(avec lettre d'accompagnement datée du 20 avril 1994). TSCA OTS0572253, Document ID: 1976-I0065-1010-04.
DowCorning Corporation. 1976.Skin contact irritation tests with 200 Fluid/0.65 cs.(avec lettre d'accompagnement datée du 20 avril 1994). TSCA OTS0590160, Document ID: 1976-I0065-1410Y03.
DowCorning Corporation. 1978.Comparison of primary skin irritation and effects of repeated prolonged skin exposure to various volatile experimental cosmetic fluids w/SD alcohol40W (avec lettre d'accompagnement datée du 20 avril 1994). TSCA OTS0572276, Document ID: 86940001270.
DowCorning Corporation. 1979.Mutagenicity evaluation of DowCorning 200 Fluid in the Ames Bacterial Assay(avec lettre d'accompagnement datée du 20 avril 1994). TSCA OTS0558128, Document ID: 86940001347.
DowCorning Corporation. 1980.Human repeated insult patch test with DowCorning Q2-1096 Fluid(avec lettre d'accompagnement datée du 20 avril 1994). TSCA OTS0558105, Document ID: 86940001324.
DowCorning Corporation. 1990.A 28-day subchronic oral gavage feasibility study of various low molecular weight silicone oligomers in rats(avec lettre d'accompagnement datée du 20 avril 1994). TSCA OTS0590105, Document ID: 1990-I0000-35105.
DowCorning Corporation. 1991.An acute skin irritation study of hexamethyldisiloxane in rabbits(avec lettre d'accompagnement datée du 20 avril 1994). TSCA OTS0572296, Document ID: 1991-I0000-36741.
DowCorning Corporation. 1992a.Human repeated insult patch test with hexamethylsiloxane(avec lettre d'accompagnement datée du 20 avril 1994). TSCA OTS0572322, Document ID: 1992-I0000-37036.
DowCorning Corporation. 1992b.A two-week repeated dose inhalation toxicity study of hexamethyldisiloxane in albino rats(avec lettre d'accompagnement datée du 20 avril 1994). TSCA OTS0572321, Document ID: 1992-I0000-37011.
DowCorning Corporation. 1992c.A skin sensitization study of hexamethyldisiloxane in guinea pigs(avec lettre d'accompagnement datée du 20 avril 1994). TSCA OTS0572320, Document ID: 86940001808.
DowCorning Corporation. 1993.A 28-day repeated dose dermal toxicity study of hexamethyldisiloxane in rats(avec lettre d'accompagnement datée du 20 avril 1994). TSCA OTS0572811, Document ID: 86940001823.
DowCorning Corporation. 1994.Skin contact irritation tests with Tx-1302 A, Tx-1302 B, Tx-1302 C, Tx-1302 D and Tx 1302 E in Albino rabbits(avec lettre d'accompagnement datée du 20 avril 1994). TSCA OTS0590160, Document ID: 1976-I0065-1410Y03.
DowCorning Corporation. 1996.An acute whole body inhalation study of HMDS in Albino rats. Reportno. 1996-I0000-41477.
DowCorning Corporation. 1997a. 1-month repeated dose inhalation toxicity study with hexamethyldisiloxane in rats(avec lettre d'accompagnement datée du 21 novembre 1997). TSCA OTS0559379, Document ID: 86-980000041.
DowCorning Corporation. 1997b. 3-month repeated dose inhalation toxicity study with hexamethyldisiloxane in rats with a 1-month recovery period(avec lettre d'accompagnement datée du 21 novembre 1997). TSCA OTS0559386, Document ID: 86-980000048.
DowCorning Corporation. 1998.Repeat insult patch test of six DowCorning materials in human subjects.Report no. 1998-I0000-45918.
DowCorning Corporation. 1999a.Skin irritation of DowCorning 200® Fluid, 1 cSt in the rabbit. Reportno. 1999-I0000-47455. [cité dans BESC, 2010].
DowCorning Corporation. 1999b.Initial submission: LTR FR DowCorning Corp to USEPA Re 24-mo combined chronic toxicity and oncogenicity vapor inhalation study of hexamethyldisiloxane in Fisher rats(document daté du 8 novembre 1999). TSCA OTS0559838, Document ID: 88000000031.
DowCorning Corporation. 2000.A one-generation inhalation reproductive toxicity study of hexamethyldisiloxane in rats(avec lettre d'accompagnement datée du 18 avril 2000). TSCA OTS0574055, Document ID: 86000000019.
DowCorning Corporation. 2004.An acute whole-body inhalation toxicity study of octamethyltrisiloxane in rats. Reportno. 2004-I0000-54030.
DowCorning Corporation. 2006.An acute oral toxicity study in rats with octamethyltrisiloxane. Reportno. 2004-I0000-53879.
DowCorning Corporation. 2007a.Combined repeated dose toxicity study with the reproductive/developmental toxicity screening test for octamethyltrisiloxane (L3) in Sprague-Dawley rats via inhalation exposure. HES Report number2007-I0000-58159. Le 11 avril 2008.
DowCorning Corporation. 2007b.Non-regulated study: hexamethyldisiloxane (HMDS): Determination of the reverse binding of HMDS/metabolites to Alpha 2u-Globulin in male Fischer 244 rats following oral gavage Administration. Report number2007-I0000-57893. Le 21 septembre 2007.
DowCorning Corporation. 2009a.Decamethyltetrasiloxane (L4): 28-day oral (gavage) toxicity study in the Sprague-Dawley rat with decamethyltetrasiloxane.Renseignements présentés à l'Environmental Protection Agency des États-Unis en vertu de la Toxic Substances Control Act. TSCA Document no. 8EHQ-09-17631B (daté du 10 septembre 2009).
DowCorning Corporation. 2009b.A 28-day subchronic oral gavage feasibility study of various low molecular weight silicone oligomers in rats.Renseignements présentés à l'Environmental Protection Agency des États-Unis en vertu de la Toxic Substances Control Act. TSCA Document no. 8EHQ-09-17732A (daté du 23 novembre 2009).
DowCorning Corporation. 2009c. 28-day oral (gavage) toxicity study in the Sprague-Dawley rat with dodecamethylpentasiloxane.Renseignements présentés à l'Environmental Protection Agency des États-Unis en vertu de la Toxic Substances Control Act. TSCA Document no. 8EHQ-09-17683A (daté du 14 octobre 2009).
DowCorning Corporation. 2009d.Environmental information. An overview of volatile methylsiloxane (VMS) fluids in the environment.Midland (MI) : DowCorning Corporation. Accès : https://www.xiameter.com/en/ExploreSilicones/Documents/95-724-01%20Overview%20of%20Volatile%20Methylsiloxane.pdf
DowCorning Corporation. 2009e.Xiameter® PMX-200 Silicone Fluid1CS. Fiche signalétique. Version 1.0. Le 20 janvier 2009. Midland (MI) : DowCorning Corporation. Accès : https: www.xiameter.com/EN/Products/
DowCorning Corporation. 2010a.DowCorning® Cleaner and Surface Prep Solvent.Fiche signalétique. Version 1.4. Le 22 avril 2010. Midland (MI) : DowCorning Corporation. Accès : http://www2.dowcorning.com/DataFiles/090007b2814676c0.pdf
DowCorning Corporation. 2010b. 14C-Tetrakis(trimethylsiloxy)silane (14C-M4Q): Dietary bioaccumulation in the rainbow trout (Oncorhynchus mykiss) under flow-through test conditions. DowCorning Corporation Health and Environmental Sciences Technical Report.Le 11 octobre 2010.
Drottar, K.R. 2006. 14C-Octamethyltrisiloxane (14C-L3): Bioconcentration in the fathead minnow (Pimephales promelas) under flow-through conditions. Silicones Environmental, Health and Safety Council(SEHSC). DowCorning Internal Report – 2006-10000-56380.
Drottar, K.R. 2010. 14C-Octamethyltrisiloxane (14C-L3): Dietary bioaccumulation in the rainbow trout (Oncorhynchus mykiss) under flow-through test conditions. Silicones Environmental, Health and Safety Council(SEHSC). HES Study Number 11245-102.
Durham, J., Kozerski, G.E. 2010.Soil-water distribution of 13C-Octamethyltrisiloxane (13C-L3) (107-51-7) and 13C-Decamethyltetrasiloxane (13C-L4) (141-62-8) using a batch equilibrium method. Rapport finalprésenté au Silicones Environmental,Health and Safety Council(SEHSC). DCC HES Study No. 10959-102. [cité dans SEHSC, 2011].
[ECHA] Agence européenne des produits chimiques. 2012. Guidance on information requirements and chemical safety assessment. Chapter R.11: PBT assessment. Novembre 2012. Version 1.1. Guidance for the implementation of REACH. Helsinki (Finlande) : Agence européenne des produits chimiques.
Environnement Canada. 2007a. Données sur les substances du groupe 6 recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances considérées comme priorités pour suivi. Données recueillies par Environnement Canada, Division de la mobilisation et de l'élaboration des programmes.
Environnement Canada. 2007b.Guidance for Conducting Ecological Assessments under CEPA, 1999, Science Resource Technical Series, Technical Guidance Module: QSARs.Document de travail préliminaire révisé. Gatineau (Qc) : Environnement Canada, Division des évaluations écologiques.
Environnement Canada. 2008.Guidance for Conducting Ecological Assessments under CEPA, 1999, Science Resource Technical Series, Technical Guidance Module: Mass Flow Tool.Document de travail. Gatineau (Qc) : Environnement Canada, Division des évaluations écologiques.
Environnement Canada. 2010a. Données sur les substances du lot 12 recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement (1999) : Avis concernant les substances du groupe 12 du Défi. Données recueillies par Environnement Canada, Division de la mobilisation et de l'élaboration des programmes.
Environnement Canada. 2010b.Mass Flow Tool report. Trisiloxane, octamethyl-(MDM). CAS No.: 107-51-7. Document interne de soutien technique. Gatineau (Qc) : Environnement Canada, Division des évaluations écologiques.
Environnement Canada. 2010c.Evaluation of the ecological effects of siloxane D5 in soil.Rapport inédit. Décembre 2010. Ottawa (Ont.) : Environnement Canada, Laboratoire de toxicologie des sols, Section de l'évaluation biologique et normalisation.
[EPI Suite]Estimation Programs Interface Suite for Microsoft Windows[modèle d'évaluation]. 2000-2008. Version 4.10. Washington (DC) : Environmental Protection Agency des États-Unis,Office of Pollution Prevention and Toxics;Syracuse (NY) : Syracuse Research Corporation. Accès : www.epa.gov/oppt/exposure/pubs/episuitedl.htm
[EQC] Equilibrium Criterion Model. 2011. Version 1.00. Lancé en août 2011. Peterborough (Ont.) : Université Trent,Canadian Environmental Modelling Centre.Accès : http://www.trentu.ca/academic/aminss/envmodel/models/NewEQCv100.html
[ESIS] European Chemical Substances Information System [base de données sur Internet]. c1995-2009. Bureau européen des substances chimiques (BESC). [consulté le 18 septembre 2012]. Accès : http://esis.jrc.ec.europa.eu/
Evenset, A., Leknes, H., Christensen, G.N., Warner, N., Remberger, M., Gabrielsen, G.W. 2009.Screening of new contaminants in samples from the Norwegian Arctic. SFT Report1049/2009 (TA-2510/2009). Oslo (Norvège) : Norwegian Pollution Control Authority (SFT), Akvaplan-niva, Norwegian Polar Institute, Norwegian Institute for Air Research (NILU).
Fendinger, N.J., Lehmann, R.G., Mihaich, E.M. 1997.Polydimethylsiloxane. In :Chandra, G. (éd.)The handbook of environmental chemistry, Volume 3, Part H: Organosilicon materials.New York (NY) : Springer-Verlag. p. 181-223.
Fenner, K., Scheringer, M., MacLeod, M., Matthies, M., McKone, T.E., Stroebe, M., Beyer, A., Bonnell, M., Le Gall, A., Klasmeier, J., et al. 2005.Comparing estimates of persistence and long-range transport potential among multimedia models. Environ. Sci. Technol. 39:1932-1942.
Genualdi, S., Harner, T., Cheng, Y., MacLeod, M., Hansen, K.M., van Egmond, R., Shoeib, M., Lee, S.C. 2011.Global distribution of linear and cyclic volatile methyl siloxanes in air. Environ. Sci. Technol. 45:3349-3354.
Gobas, F.A.C.P., Morrison, H.A. 2000.Bioconcentration and biomagnification in the aquatic environment. In :Boethling, R.S., Mackay, D. (éd.)Handbook of property estimation methods for chemicals, environmental and health sciences.Boca Raton (FL) : CRC Press. p. 189-231.
Gobas, F.A.P.C., Sharp, S.M. 1990.Bioaccumulation of some polychlorinated dibenzo-p-dioxins and octachlorodibenzofuran in the guppy (Poecilia reticulata). Chemosphere 20(5):495-512.
Gobas, F.A.P.C., Clark, K.E., Shiu, W.Y., Mackay, D. 1989.Bioconcentration of polybrominated benzenes and biphenyls and related superhydrophobic chemicals in fish: Role of bioavailability and elimination into the feces. Environ. Toxicol. Chem. 8:231-245.
Gobas, F.A.P.C., Hugget, D.B., Springer, T.A. 2011. D5bioaccumulation assessment.Rapport inédit présenté à Environnement Canada, Gatineau (Qc).
Harland Laboratories Ltd. 2010. 28-Day oral toxicity (gavage) study in the Sprague-Dawley rat with octamethyltrisiloxane(L3). Study number C53655.
Harner, T., Shoeib, M., Ahrens, L., Genualdi, S., Cheng, C., Lee, S.C., Lane, D., Smyth, S.A. 2010.Polyfluoroalkyl compounds (PF Cs) and siloxanes in air in support of the Chemicals Management Plan: new sampling and analysis methods, emissions from the waste sector and long-range transport– April 2008 to May 2010. Rapport inédit. Downsview (Ont.) : Direction de la science et de la technologie de l'atmosphère, Environnement Canada.
[HENRYWIN]Henry's Law Constant Program for Microsoft Windows[modèle d'évaluation]. 2008. Version 3.20. Washington (DC) : Environmental Protection Agency des États-Unis,Office of Pollution Prevention and Toxics;Syracuse (NY) : Syracuse Research Corporation. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Himmelstein, M.W., Acquavella, J.F., Reccio, L., Medinsky, M.A., Bond, J.A. 1997.Toxicology and epidemiology of 1,3-Butadiene. Crit. Rev. Toxicol. 27:1-108.
Hobbs, E.J., Fancher, O.E., Calandra, J.C. 1972.Effect of selected organopolysiloxanes on male rats and rabbits reproductive organs. Toxicol. Appl. Pharmacol. 21:45-54.
Hobson, J.F., Atkinson, R., Carter, W.P.L. 1997.Volatile methylsiloxanes. In :Chandra, G. (éd.)The handbook of environmental chemistry, Volume 3, Part H: Organosilicon materials.New York (NY) : Springer-Verlag. p. 137-180.
Hobson, J.F., Silberhorn, E.M. 1995.Octamethylcyclotetrasiloxane (OMCTS), a case study: Summary and aquatic risk assessment. Environ. Toxicol. Chem. 14(10):1667-1673.
[HPVIS] High Production Volume Information System [base de données sur Internet]. 2012. Environmental Protection Agency des États-Unis. [dernière mise à jour le 22 mars 2012; consulté le 18 septembre 2012]. Accès : http://www.epa.gov/chemrtk/hpvis/index.html
Hu, T.M., Layton, W.L. 2001.Allometric scaling of xenobiotic clearance: uncertainty versus universality. AAPS PharmSci. [en ligne]. Vol. 3(4) : article 29. [consulté le 25 mai 2010]. Accès : http://www.aapsj.org/view.asp?art=ps030429
[HYDROWIN]Hydrolysis Rates Program for Microsoft Windows[modèle d'évaluation]. 2008. Version 2.00. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Industrial Bio-Test Laboratories, Inc. 1964.Report to DowCorning Corporation irritation studies on seven samples(TX-46A, TX-46B, TX-46C, TX-46D, TX-46E, TX-47A, TX-47B) (avec lettre d'accompagnement datée du 20 avril 1994). TSCA OTS0556505, Document ID: 89940001051.
Industrial Bio-Test Laboratories, Inc. 1966.Report to DowCorning Corporation toxicity studies onTX-135A (avec lettre d'accompagnement datée du 20 avril 1994). TSCA OTS0556522, Document ID: 86940001068.
Industrial Bio-Test Laboratories, Inc. 1967a.Range finding eye irritation test onTX-212A (Hexamethyldisiloxane). TSCA OTS0572647, Document ID: 86940001612.
Industrial Bio-Test Laboratories, Inc. 1967b.Report to DowCorning Corporation range finding eye irritation test onTX-212B (avec lettre d'accompagnement datée du 20 avril 1994). TSCA OTS0556570, Document ID: 1967-I0065-1156-01.
Isquith, A., Matheson, D., Slesinski, R. 1988a.Genotoxicity studies on selected organosilicon compounds: in vitro assays. Food. Chem. Toxicol. 26:255-261.
Isquith, A., Slesinski, R., Matheson, D. 1988b.Genotoxicity studies on selected organosilicon compounds: in vivo assays. Food. Chem. Toxicol. 26:263-266.
Jovanovic, M.L., Crofoot, S.D., Crissman, J.W., Smith, P.A., Plotzke, K.P., Meeks, R.G. 2005.Chronic toxicity and oncogenicity study of hexamethyldisiloxane (HMDS) in Fisher-344 rats. Toxicol. Sci. 84:308.
Jovanovic, M.L., McMahaon, J.M., McNett, D.A., Tobin, J.M., Plotzke, K.P. 2008.In vitro and in vivo percutaneous absorption of 14C-octmethylcyclotetrasiloxane (14C-D4) and 14C decamethylcyclopentasiloxane(14C-D5). Regul. Toxicol. Pharmacol. 50:239-248.
Kaj, L., Andersson, J., Cousins, A.P., Remberger, M., Ekheden, Y., Dusan, B., Brorström-Lundén, E. 2005a.Results from the Swedish National Screening Programme 2004. Subreport 4: siloxanes. IVL ReportB1643. Stockholm (Suède) : IVL Swedish Environmental Research Institute Ltd.
Kaj, L., Schlabach, M., Andersson, J., Cousins, A.P., Schmidbauer, N., Brorström-Lundén, E. 2005b.Siloxanes in the Nordic environment. TemaNord 2005:593. Copenhague (Danemark) : Conseil des ministres des pays nordiques.
Kelly, B.C., Gobas, F.A.P.C., McLachlan, M.S. 2004.Intestinal absorption and biomagnification of organic contaminants in fish, wildlife, and humans. Environ. Toxicol. Chem. 23(10):2324-2336.
Khera, N. 2014. Données inédites de surveillance sur les eaux usées issues de la deuxième phase du Plan de gestion des produits chimiques. Présenté à la Division des évaluations écologiques d'Environnement Canada, Gatineau (Qc).
Klasmeier, J., Matthies, M., MacLeod, M., Fenner, K., Scheringer, M., Stroebe, M., Le Gall, A.C., McKone, T.E., van de Meent, D., Wania, F. 2006.Application of multimedia models for screening assessment of long-range transport potential and overall persistence. Environ. Sci. Technol. 40:53-60.
[KOAWIN]Octanol Air Partition Coefficient Program for Microsoft Windows[modèle d'évaluation]. 2008.
Version 1.10. Washington (DC) : Environmental Protection Agency des États-Unis,Office of Pollution Prevention and Toxics;Syracuse (NY) : Syracuse Research Corporation. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
[KOCWIN]The Soil Adsorption Coefficient Program[modèle d'évaluation]. 2008. Version 2.00. Washington (DC) : Environmental Protection Agency des États-Unis,Office of Pollution Prevention and Toxics;Syracuse (NY) : Syracuse Research Corporation. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
[KOWWIN]Octanol-Water Partition Coefficient Program for Microsoft Windows[modèle d'évaluation]. 2008. Version 1.68. Washington (DC) : Environmental Protection Agency des États-Unis,Office of Pollution Prevention and Toxics;Syracuse (NY) : Syracuse Research Corporation. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Krogseth, I.S., Zhang, X., Lei, Y.D., Wania, F., Breivik, K. 2013.Calibration and application of a passive air sampler (XAD-PAS) for volatile methyl siloxanes. Environ Sci Technol 47:4463-4470.
Lee, M.R. 2010.Early life-stage toxicity test with rainbow trout (Oncorhynchus mykiss) following OECD Guideline #210 with octamethyltrisiloxane(CAS No. 107-51-7). Springborn Smithers Laboratories Study No.: 12023.6205. [cité dans SEHSC, 2011].
Longnecker, M.P. 1995.Alcohol consumption and risk of cancer in humans: an overview. Alcohol 12:87-96.
Loretz, L.G., Api, A.M., Barraj, L.M., Burdick, J., Dressler, W.E., Gettings, S.D., Han Hsu, H., Pan, Y.H.L., Re, T.A., Renskers, K.J., et al. 2005.Exposure data for cosmetic products: lipstick, body lotion, and face cream. Food Chem. Toxicol. 43:279-291.
Loretz, L., Api, A.M., Barraj, L., Burdick, J., Davis, D.A., Dressler, W., Gilberti, E., Jarrett, G., Mann, S., Pan, Y.H.L., et al. 2006.Exposure data for personal care products: Hairspray, spray perfume, liquid foundation, shampoo, body wash, and solid antiperspirant. Food Chem. Toxicol. 44:2008-2018.
Loretz, L.G., Api, A.M., Babcock, L., Barraj, L.M., Burdick, J., Cater, K.C., Jarrett, G., Mann, S., Pan, Y.H.L., Re, T.A., et al. 2008.Exposure data for cosmetic products: Facial cleanser, hair conditioner, and eye shadow. Food Chem. Toxicol. 46:1516-1524.
Markgraf, S.J., Wells, J.R. 1997.The hydroxyl radical reaction rate constants and atmospheric reaction products of three siloxanes. Int. J. Chem. Kinet. 29:445-451.
Mazzoni, S.M., Roy, S., Grigoras, S. 1997.Eco-relevant properties of selected organosilicon materials. In :Chandra, G. (éd.)The handbook of environmental chemistry.Volume 3. Part H. New York (NY) : Springer-Verlag. p. 53-81.
McCarty, L.S., Mackay, D., Smith, A.D., Ozburn, G.W., Dixon, D.G. 1992.Residue-based interpretation of toxicity and bioconcentration QSARs from aquatic bioassays: neutral narcotic organics. Environ. Toxicol. Chem. 11(7):917-930.
McCarty, L.S., Mackay, D. 1993.Enhancing ecotoxicological modelling and assessment: Body residues and modes of toxic action. Environ. Sci. Technol. 27:1718-1728.
McGoldrick, D.J., Letcher, R.J., Barresi, E., Keir, M.J., Small, J., Clark, M.G., Sverko, E., Backus, S.M. 2014.Organophosphate flame retardants and organosiloxanes in predatory freshwater fish from locations across Canada. Environ Pollut 193:254-261.
McKim, J.M., Wilga, P.C., Breslin, W.J., Plotzke, K.P., Gallavan, R.H., Meeks, R.G. 2001.Potential estrogenic and antiestrogenic activity of the cyclic siloxane octamethylcyclotetrasiloxane (d4) and the linear siloxane hexamethyldisiloxane (HMDS) in immature rats using the uterotrophic assay. Toxicol. Sci. 63:37-46.
Mekenyan, G., Dimitrov, S.D., Pavlov, T.S., Veith, G.D. 2005.POPs: A QSAR system for creating PBT profiles of chemicals and their metabolites. SAR QSAR Environ. Res. 16(1-2):103-133.
[Model Applier]Leadscope FDA Model Applier[modèle de prévision sur CD-ROM]. 2008. Version 1.2.0-3. Columbus (OH) : Leadscope, Inc. [consulté le 6 août 2010]. Accès : http://www.leadscope.com/model_appliers/ [réserve de consultation].
Mosey, J.L., Kozerski, G.E. 2008.Hydrolysis of octamethyltrisiloxane (MDM). Silicones Environmental, Health and Safety Council (SEHSC). DowCorning Study No.10390-102. [cité dans SEHSC, 2010].
Mount, G.H., Eisele, F.L. 1992.An intercomparison of tropospheric OH measurements at Fritz Peak Observatory,Colorado. Science 256:1187. [cité dans SEHSC, 2011].
[MPBPVPWIN]Melting Point Boiling Point Program for Microsoft Windows[modèle d'évaluation]. 2008. Version 1.43. Washington (DC) : Environmental Protection Agency des États-Unis,Office of Pollution Prevention and Toxics;Syracuse (NY) : Syracuse Research Corporation. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
[NCI]National Chemical Inventories[base de données sur CD-ROM]. 2009. 1re éd. Columbus (OH) :American Chemical Society.[consulté le 15 mars 2010]. Accès : http://www.cas.org/products/cd/nci/index.html
Nichols, J.W., Fitzsimmons, P.N., Burkhard, L.P. 2007.In vitro - in vivo extrapolation of quantitative hepatic biotransformation data for fish. II. Modeled effects on chemical bioaccumulation. Environ. Toxicol. Chem. 26:1304-1319.
[NITE] National Institute of Technology and Evaluation. 2002. Tokyo (Japon) :National Institute of Technology and Evaluation, Chemical Management Centre.Accès : http://www.safe.nite.go.jp/data/hazkizon/pk_e_kizon_input_second.home_object
[OCDE] Organisation de coopération et de développement économiques. 2006. Lignes directrices de l'OCDE pour les essais de produits chimiques. Essai no 310. Biodégradation facile – dégagement de CO2 dans des flacons hermétiquement clos (essai de l'espace libre au-dessus du liquide). Adoptée le 23 mars 2006. Paris (France) : Organisation de coopération et de développement économiques, Direction de l'environnement.
[OCDE] Organisation de coopération et de développement économiques. 2007. Lignes directrices de l'OCDE pour les essais de produits chimiques. Essai no 225. Essai de toxicité sur Lumbriculus dans un système eau-sédiment chargé. Adoptée le 16 octobre 2007. Paris (France) : Organisation de coopération et de développement économiques, Direction de l'environnement.
[OCDE] Organisation de coopération et de développement économiques. 2011. Lignes directrices pour les essais de produits chimiques. Bioaccumulation chez le poisson : exposition via le milieu aquatique et via la voie alimentaire. Ébauche de document. V.10. Paris (France) : Organisation de coopération et de développement économiques, Direction de l'environnement.
Pelletier, M., Moore, S., Backus, S. 2012. Données inédites de surveillance sur les sédiments issues de la deuxième phase du Plan de gestion des produits chimiques. Présenté à la Division des évaluations écologiques d'Environnement Canada, Gatineau (Qc).
Preston-Martin, S.P. 1991.Evaluation of the evidence that tobacco-specific nitrosamines (TSNA) cause cancer in humans. Crit. Rev. Toxicol. 21:295-298.
Quigley, C.A., DE Bellis, A., Marschke, K.B., El-Awady, M.K., Wilson, E.M., French, F.S. 1995.Androgen receptor defects: historical, clinical, and molecular perspectives. Endocr. Rev. 16:19-34.
Redman, A.D., Mihaich, E., Woodburn, K., Paquin, P., Powell, D., McGrath, J.A., Di Toro, D.M. 2012.Tissue-based risk assessment of cyclic volatile methyl siloxanes. Environ. Toxicol. Chem. 31(8):1911-1919.
Rowe, V.K., Spencer, H.C., Bass, S.L. 1948.Toxicological studies on certain commercial silicones and hydrolyzable silane intermediates. J. Ind. Hyg. Toxicol. 30:332-352.
[RTECS] Registry of Toxic Effects of Chemical Substances. 2009.Record for Disiloxane, hexamethyl-(107-46-0). [mis à jour en novembre 2009]. Hamilton (Ont.) : Centre canadien d'hygiène et de santé au travail.
Santé Canada. 1994. L'évaluation du risque à la santé humaine des substances d'intérêt prioritaire. Ottawa (Ont.) : Santé Canada, Direction de l'hygiène du milieu. Accès : http://www.hc-sc.gc.ca/ewh-semt/pubs/contaminants/approach/index-fra.php
Santé Canada. 1995. Enquête sur l'exposition des êtres humains aux contaminants dans le milieu : Un guide pour les calculs de l'exposition. Ottawa (Ont.) : Santé Canada.
Santé Canada. 1998.Exposure factors for assessing total daily intake of priority substances by the general population of Canada.Rapport inédit. Ottawa (Ont.) : Santé Canada, Direction de l'hygiène du milieu.
Santé Canada. 2010. Liste critique des ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques – juin 2010 [en ligne]. Ottawa (Ont.) : Santé Canada, Direction de la sécurité des produits de consommation. [consulté en août 2014]. Accès : http://www.hc-sc.gc.ca/cps-spc/person/cosmet/info-ind-prof/_hot-list-critique/hotlist-liste-fra.php
Sakuratani, Y., Noguchi, Y., Kobayashi, K., Yamada, J., Nishihara, T. 2008.Molecular size as a limiting characteristic for bioconcentration in fish. J. Environ. Biol. 29(1):89-92.
Schaefer, E.C., Matthews, M.E. 2009. Octamethyltrisiloxane (L3; CAS No. 107-51-7):Ready biodegradability – CO2 in sealed vessels (headspace test). Silicones Environmental, Health and Safety Council(SEHSC). Wildlife International Ltd. Study No. – 570E-101. [cité dans SEHSC, 2010].
Scheringer, M., MacLeod, M., Wegmann, F. 2009.The OECD POV and LRTP Screening Tool[en ligne]. Version 2.2. Zurich (Suisse) : École polytechnique fédérale de Zurich. Accès : http://www.oecd.org/document/24/0,3746,en_2649_34373_45373336_1_1_1_1,00.html#download
Schlabach, M., Strand Andersen, M., Green, N., Schøyen, M., Kaj, L. 2007.Siloxanes in the environment of the Inner Oslofjord.SFT Report 986/2007 (TA-2269/2007). Oslo (Norvège) : Norwegian Pollution Control Authority (SFT), Norwegian Institute for Air Research (NILU), Norwegian Institute for Water Research (NIVA).
SciFinder [base de données sur CD-ROM]. 2007. Version 2007.3. Columbus (OH) :American Chemical Society.[consulté le 9 septembre 2010]. Accès : http://www.cas.org/products/scifindr/index.html
[SDC] Système de déclaration des cosmétiques [base de données exclusive]. Avril 2013. Disponible auprès de Santé Canada, Division des cosmétiques.
[SEHSC] Silicones Environmental, Health and Safety Council. 2005.Linear volatile methyl siloxanes group justification.CAS Nos. 107-51-7, 141-62-8, 141-63-9, and 1000-05-1. Le 31 août 2005. Présenté à Environnement Canada en vertu du Plan de gestion des produits chimiques.
[SEHSC] Silicones Environmental, Health and Safety Council. 2006.Linear volatile methyl siloxanes category.CAS Nos. 107-51-7, 141-62-8, 141-63-9, and 1000-05-1. Le 9 juin 2006. Présenté à Environnement Canada en vertu du Plan de gestion des produits chimiques.
[SEHSC] Silicones Environmental, Health and Safety Council. 2010.Octamethyltrisiloxane (L3). Background information.CAS No. 107-51-7. Le 23 juin 2010. Présenté à Environnement Canada en vertu du Plan de gestion des produits chimiques.
[SEHSC] Silicones Environmental, Health and Safety Council. 2011.Octamethyltrisiloxane(L3). Commentaires du Silicones Environmental, Health and Safety Council au sujet de l'ébauche d'évaluation préalable portant sur l'octaméthyltrisiloxane (MDM) réalisée par Santé Canada et Environnement Canada. Le 11 mars 2011. Présenté à Environnement Canada en vertu du Plan de gestion des produits chimiques.
Seifried, H.E., Seifried, R.M., Clarke, J.J., Junghans, T.B., San, R.H. 2006.A compilation of two decades of mutagenicity test results with the Ames Salmonella typhimurium and L5178Y mouse lymphoma cell mutation assays. Chem. Res. Toxicol. 19:627-644.
Shenker, A., Laue, L., Kosugi, S., Merendino, J.J., Minegishi, T., Cutler, G.B. 1993.A constitutively activating mutation of the luteinizing hormone receptor in familial male precocious puberty. Nature 265:652-654.
[Shin-Etsu] Shin-Etsu Silicones of America Inc. 1994a.Final Report, Bacterial reverse mutation test with LS-7130, Hexamethyldisiloxane(avec lettre de présentation datée du 29 juin 1995). TSCA OTS0557700, Document ID: 86950000188.
[Shin-Etsu] Shin-Etsu Silicones of America Inc. 1994b.Final Report, chromosomal aberration test with LS-7131, Hexamethyldisiloxane, using cultured mammalian cells(avec lettre de présentation datée du 29 juin 1995). TSCA OTS0557699, Document ID: 86950000187.
[Shin-Etsu] Shin-Etsu Silicones of America Inc. 1994c.Final Report, sub-acute oral toxicity study on LS-7131, Hexamethyldisiloxane, in rats(avec lettre de présentation datée du 29 juin 1995). TSCA OTS0557701, Document ID: 86950000189.
[SPIN] Substances in Preparations in Nordic Countries [base de données sur Internet]. 2013. Copenhague (Danemark) : Conseil des ministres des pays nordiques. [consulté le 18 septembre 2012]. Accès : http://90.184.2.100/DotNetNuke/default.aspx
[TaPL3] Long Range Transport and Persistence Level III model [en ligne]. 2000. Version 2.10. Peterborough (Ont.) : Université Trent,Canadian Environmental Modelling Centre.Accès : http://www.trentu.ca/academic/aminss/envmodel/models/TaPL3.html
Thomas, S.T., Krueger, H.O., Kendall, T.Z. 2009a.Octamethyltrisiloxane (L3; CAS No. 107-51-7): A prolonged sediment toxicity test with Chironomus riparius using spiked sediment. Wildlife International, Ltd. Project Number:570A-114. Rapport final. Easton (MD) : Wildlife International, Ltd.
Thomas, S.T., Krueger, H.O., Kendall, T.Z. 2009b.Octamethyltrisiloxane (L3; CAS No. 107-51-7): A prolonged sediment toxicity test with Lumbriculus variegatus using spiked sediment. Wildlife International, Ltd. Project Number:570A-115. Rapport final. Easton (MD) : Wildlife International, Ltd.
[TOPKAT] TOxicity Prediction by Komputer Assisted Technology [en ligne]. 2004. Version 6.2. San Diego (CA) : Accelrys Software Inc. [consulté le 6 août 2010]. Accès : http://www.accelrys.com/products/topkat/index.html
[USP] United States Pharmacopeia. 2010.Food Chemicals Codex.7e éd. Rockville (MD) : The United States Pharmacopeial Convention.
Varaprath, S., Frye, C.L., Hamelink, J. 1996.Aqueous solubility of permethylsiloxanes (silicones). Environ. Sci. Technol. 15(8):1263-1265.
Wang, D., Steer, H., Young, T., Tait, T., Williams, Z., Pacepavicius, G., Ng, T., Smyth, S.A., Kinsman, L., Sverko, E., et al. 2010.Concentrations of cyclic volatile methyl siloxanes (cVMS) in various environmental media from Southern Ontario and Southern Quebec.Rapport inédit. Burlington (Ont.) : Environnement Canada, Direction des sciences et de la technologie de l'eau.
Wang, D., de Solla, S.R., Lebeuf, M., Bisbicos, T., Barrett, G.C., Alaee, M. 2012.Determination of linear and cyclic volatile methylsiloxanes in blood of turtle, cormorant, and seal from Canada.Rapport inédit. Burlington (Ont.) : Environnement Canada, Direction des sciences et de la technologie de l'eau.
Wania, F. 2003.Assessing the potential of persistent organic chemicals for long-range transport and accumulation in polar regions. Environ. Sci. Technol. 37:1344-1351.
Wania, F. 2006.Potential of degradable organic chemicals for absolute and relative enrichment in the Arctic. Environ. Sci. Technol. 40:569-577.
Warner, N.A., Evenset, A., Christensen, G., Gabrielsen, G.W., Borgå, K., Leknes, H. 2010.Volatile siloxanes in the European Arctic: Assessment of sources and spatial distribution. Environ. Sci. Technol. 44:7705-7710.
Weisbrod, A.V., Woodburn, K.B., Koelmans, A.A., Parkerton, T.F., McElroy, A.E., Borgå, K. 2009.Evaluation of bioaccumulation using in vivo laboratory and field studies. Integr. Environ. Assess. Manag. 5(4):598-623.
Whelan, M.J., Estrada, E., van Egmond, R. 2004.A modelling assessment of the atmospheric fate of volatile methyl siloxanes and their reaction products. Chemosphere 57:1427-1437.
Wilmer, J., Bloeman, L., Farrar, D., Farny, V., Green, T., Millischer, R.J., Vrijhor, H. 1994.Trichloroethylene: Assessment of human carcinogenic hazard. Technical Report60. Mai 1994. Bruxelles (Belgique) : Centre d'écologie et de toxicologie de l'industrie chimique européenne.
Woodburn, K., Drottar, K., Domoradzki, J., Durham, J., McNett, D., Jezowski, R. [sous presse].Determination of the dietary biomagnification of octamethylcyclotetrasiloxane and decamethylcyclopentasiloxane with the rainbow trout(Oncorhynchus mykiss). Chemosphere (2012). Accès : http://dx.doi.org/10.1016/j.chemosphere.2012.10.049
[WSKOWWIN] Water Solubility for Organic Compounds Program for Microsoft Windows [modèle d'évaluation]. 2008. Version 1.42. Washington (DC) : Environmental Protection Agency des États-Unis,Office of Pollution Prevention and Toxics;Syracuse (NY) : Syracuse Research Corporation. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Wu, X., Bennett, D.H., Ritz, B., Cassady, D.L., Lee, K., Hertz-Picciotto, I. 2010.Usage pattern of personal care products in California households. Food Chem. Toxicol. 48:3109-3119.
Xu, S. 2009.Anaerobic transformation of octamethylcyclotetrasiloxane (14C-D4) in aquatic sediment systems. DowCorning Report No.2009-10000-61734. [cité dans SEHSC, 2011].
Xu, S., Chandra, G. 1999.Fate of cyclic methylsiloxanes in soils. 2. Rates of degradation and volatilization. Environ. Sci. Technol. 33:4034-4039.
Xu, S., Doede, K. 2010.Degradation octamethyltrisiloxane (L3) (CAS No. 107-51-7) in soils.Rapport final présenté au Silicones Environmental, Health and Safety Council (SEHSC). DCC HES Study No. 11297-102. [cité dans SEHSC, 2010, 2011].
Xu, S., Kropscott, B.E. 2010.Temperature dependence of air/water, 1-octanol/air, and 1-octanol/water partitioning coefficients of octamethyltrisiloxane(L3) (CAS 107-51-7). Rapport final présenté au Silicones Environmental, Health and Safety Council (SEHSC). DCC HES Study No. 10958-102. [cité dans SEHSC, 2011].
Xu, S., Doede, K., Staples, C. 2012.Degradation and volatilization of octamethyltrisiloxane (L3) in soils.Affiche présentée lors de la 33e réunion annuelle de la Society of Environmental Toxicology and Chemistry (SETAC), tenue à Long Beach (CA), du 11 au 15 novembre.
Zareba, G., Gelein, R., Morrow, P.E., Utell, M.J. 2002.Percutaneous absorption studies of octamethylcyclotetrasiloxane using the human skin/nude mouse model. Skin Pharmacol. Appl. Skin Physiol. 15:184-194.
Annexe I : Tableau sommaire des intrants des modèles
| Paramètres | Propriétés physico-chimiques et devenir |
Devenir |
Devenir |
Devenir |
Profils de persistance, bioaccumulation et toxicité |
|---|---|---|---|---|---|
| Modèle | EPI suite (tous les modèles) | EQC (substances chimiques de type II) | TaPL3 (substances chimiques de type II) | Pglob de l'OCDE – Outil de PTGD | Modèle canadien de POP (y compris le modèle CATABOL, le modèle de facteurs d'atténuation du FBC et le modèle OASIS) |
| Code SMILES | C[Si](C)(C)O[Si](C)(C)O[Si](C)(C)C | s.o. | s.o. | s.o. | C[Si](C)(C)O[Si](C)(C)O[Si](C)(C)C |
| Masse moléculaire (g/mol) | s.o. | 236,5 | 236,5 | 236,5 | s.o. |
| Point de fusion (oC) | -82 | -82 | -82 | s.o. | s.o. |
| Point d'ébullition (oC) | 152,5 | s.o. | s.o. | s.o. | s.o. |
| Température (oC) | s.o. | 25 | 20 | s.o. | s.o. |
| Pression de vapeur (Pa) | 520 | 520 | 520 | s.o. | s.o. |
| Hydrosolubilité (mg/L) | 0,034 | 0,034 | 0,034 | s.o. | s.o. |
| Constante de la loi de Henry (Pa·m3/mol) | 2,9 × 106 | 2,9 × 106 | s.o. | s.o. | s.o. |
| Log Kae (coefficient de partage air-eau; sans dimension) |
s.o. | 3,06Note de bas de page Annexe I Tableau 1[a] | s.o. | 3,06[a] | s.o. |
| Log Koe (coefficient de partage octanol-eau; sans dimension) |
6,6 | 6,6 | 6,6 | 6,6 | s.o. |
| Coefficient de partage sol-eau (L/kg) | s.o. | 438 | s.o. | s.o. | s.o. |
| Coefficient de partage sédiments-eau (L/kg) | s.o. | 876 | s.o. | s.o. | s.o. |
| Coefficient de partage particules en suspension-eau (L/kg) | s.o. | 4 380 | s.o. | s.o. | s.o. |
| Coefficient de partage poisson-eau (L/kg) | s.o. | 5 030 | s.o. | s.o. | s.o. |
| Demi-vie dans l'air (jours) | s.o. | 5,79Note de bas de page Annexe I Tableau 1[b] | 5,79b | 5,79b | s.o. |
| Demi-vie dans l'eau (jours) | s.o. | 13,7[b] | 13,7[b] | 13,7[b] | s.o. |
| Demi-vie dans les sédiments (jours) | s.o. | 365[b] | 365[b] | s.o. | s.o. |
| Demi-vie dans le sol (jours) | s.o. | 4,54[b] | 4,54[b] | 4,54[b] | s.o. |
| Demi-vie dans les sédiments en suspension (jours) | s.o. | s.o. | 13,7Note de bas de page Annexe I Tableau 1[c] | s.o. | s.o. |
| Demi-vie dans le poisson (jours) | s.o. | s.o. | 13,7[c] | s.o. | s.o. |
| Demi-vie dans les aérosols (jours) | s.o. | s.o. | 1 × 1011[c] | s.o. | s.o. |
Annexe II : Les concentrations environnementales
| Lieu et année | Concentration (ng/m3) |
Nombre d'échantillons | Référence |
|---|---|---|---|
| Ontario, Canada; 2009 Usine de traitement des eaux usées no 1 Clarificateur primaire |
1,84; 2 | 2 | Cheng et al. , 2011 |
| Ontario, Canada; 2009 Usine de traitement des eaux usées no 1 Cuve d'aération |
0,97; 1,17; 1,73; 1,84 | 4 | Cheng et al. , 2011 |
| Ontario, Canada; 2009 Usine de traitement des eaux usées no 1 Clarificateur secondaire |
1,28; 1,43 | 2 | Cheng et al. , 2011 |
| Ontario, Canada; 2009 Usine de traitement des eaux usées no 1 Contexte |
0,66; 0,76; 0,77; 1,41 | 4 | Cheng et al. , 2011 |
| Ontario, Canada; 2009 Usine de traitement des eaux usées no 2 Cuve d'aération |
1,88; 2,64 | 2 | Cheng et al. , 2011 |
| Ontario, Canada; 2009 Site d'enfouissement no 1 Amont |
0,49 | 1 | Cheng et al. , 2011 |
| Ontario, Canada; 2009 Site d'enfouissement no 1 Aval |
6,14 | 1 | Cheng et al. , 2011 |
| Ontario, Canada; 2009 Site d'enfouissement no 2 Amont |
0,87 | 1 | Cheng et al. , 2011 |
| Ontario, Canada; 2009 Site d'enfouissement no 2 Aval |
5,6 | 1 | Cheng et al. , 2011 |
| Région polaire/arctique; 2009 Barrow (Alaska) |
SSD LDM : 0,011 |
1 | Genualdi et al. , 2011 |
| Région polaire/arctique; 2009 Lac Little Fox (Yukon) |
SSD LDM : 0,011 |
1 | Genualdi et al. , 2011 |
| Région polaire/arctique; 2009 Alert (Nunavut) |
SSD LDM : 0,011 |
1 | Genualdi et al. , 2011 |
| Région polaire/arctique; 2009 Ny-Alesund (Norvège) |
SSD LDM : 0,011 |
1 | Genualdi et al. , 2011 |
| Canada; 2009 Ucluelet (Colombie-Britannique) |
SSD LDM : 0,011 |
1 | Genualdi et al. , 2011 |
| Canada; 2009 Whistler (Colombie-Britannique) |
0,016 LDM : 0,011 |
1 | Genualdi et al. , 2011 |
| Canada; 2009 Lac Bratt's (Saskatchewan) |
SSD LDM : 0,011 |
1 | Genualdi et al. , 2011 |
| Canada; 2009 Fraserdale (Ontario) |
SSD LDM : 0,011 |
1 | Genualdi et al. , 2011 |
| Canada; 2009 Downsview (Ontario) |
0,12 LDM : 0,011 |
1 | Genualdi et al. , 2011 |
| Canada; 2009 Île de Sable (Nouvelle-Écosse) |
SSD LDM : 0,011 |
1 | Genualdi et al. , 2011 |
| États-Unis; 2009 Point Reyes (Californie) |
0,011 LDM : 0,011 |
1 | Genualdi et al. , 2011 |
| États-Unis; 2009 Sydney (Floride) |
SSD LDM : 0,011 |
1 | Genualdi et al. , 2011 |
| États-Unis; 2009 Groton (Connecticut) |
0,013 LDM : 0,011 |
1 | Genualdi et al. , 2011 |
| États-Unis; 2009 Hilo (Hawaï) |
0,019 LDM : 0,011 |
1 | Genualdi et al. , 2011 |
| Europe; 2009 Storhofdi (Islande) |
SSD LDM : 0,011 |
1 | Genualdi et al. , 2011 |
| Europe; 2009 Malin Head (Irlande) |
SSD LDM : 0,011 |
1 | Genualdi et al. , 2011 |
| Europe; 2009 Paris (France) |
0,029 LDM : 0,011 |
1 | Genualdi et al. , 2011 |
| Europe; 2009 Kosetice (République tchèque) |
SSD LDM : 0,011 |
1 | Genualdi et al. , 2011 |
| Cape Grim (Australie); 2009 | SSD LDM : 0,011 |
1 | Genualdi et al. , 2011 |
| Tudor Hill (Bermudes); 2009 | SSD LDM : 0,011 |
1 | Genualdi et al. , 2011 |
| Toronto (Ontario); 2012 | 0,39 – 6,43 | 41 LDA = 0,39 |
Krogseth et al. , 2013 |
| Pays nordiquesNote de bas de page Annexe II Tableau 1[a]; 2004–2005 |
SSD LDM : 8 |
24 | Kaj et al. , 2005b |
| Lieu et année | Concentration (ng/L) |
Nombre d'échantillons | Référence |
|---|---|---|---|
| Pays nordiquesNote de bas de page Annexe II Tableau 2[a]; 2004–2005 Eau douce de surface |
SSD LDM : 0,5 – 0,8 |
10 | Kaj et al. , 2005b |
| Islande; 2005 Eau de mer |
SSD LDM : 0,5 |
4 | Kaj et al. , 2005b |
| Norvège; 2006 Eau de mer |
SSD LDM : 0,3 |
4 | Schlabach et al. , 2007 |
| Ontario, Québec, Colombie-Britannique, Canada; 2011 Influents d'usines de traitement des eaux usées |
6 – 96 LD : 13 |
dans 10 sur 16 | Alaee, 2012 |
| Ontario, Québec, Colombie-Britannique, Canada; 2011 Effluents d'usines de traitement des eaux usées |
3 – 10 LD : 1,13 |
dans 3 sur 15 | Alaee, 2012 |
| Ontario, Québec, Colombie-Britannique, Canada; 2012 Influents d'usines de traitement des eaux usées |
1 – 531 LD : 1 |
dans 16 sur 16 | Alaee, 2014 |
| Ontario, Québec, Colombie-Britannique, Canada; 2012 Effluents d'usines de traitement des eaux usées |
0,4 – 114 LD : 1 |
dans 9 sur 16 | Alaee, 2014 |
| Dans l'ensemble du Canada; 2012 Influents d'usines de traitement des eaux usées |
14,15 – 530,99 LD : 0,4 |
17 | Khera, 2014 |
| Dans l'ensemble du Canada; 2012 Effluents d'usines de traitement des eaux usées |
0,49 – 114,94 LD : 0,4 |
dans 12 sur 18 | Khera, 2014 |
| Dans l'ensemble du Canada; 2013 Influents d'usines de traitement des eaux usées |
4,73 – 388,18 LD : 0,4 |
dans 12 sur 16 | Khera, 2014 |
| Dans l'ensemble du Canada; 2013 Effluents d'usines de traitement des eaux usées |
0,9 – 65,42 LD : 0,4 |
dans 13 sur 16 | Khera, 2014 |
| Dans l'ensemble du Canada; 2013 Influents d'usines de traitement des eaux usées |
SSD LD : 53 |
24 | Khera, 2014 |
| Dans l'ensemble du Canada; 2013 Effluents d'usines de traitement des eaux usées |
SSD LD : 53 |
24 | Khera, 2014 |
| Dans l'ensemble du Canada; 2014 Influents d'usines de traitement des eaux usées |
60,1 – 128,19 LD : 53 |
dans 3 sur 21 | Khera, 2014 |
| Dans l'ensemble du Canada; 2014 Effluents d'usines de traitement des eaux usées |
SSD LD : 53 |
21 | Khera, 2014 |
| Ontario, Québec, Canada; 2011 Eaux industrielles |
17 – 15 300 LD : 13 |
dans 4 sur 13 | Alaee, 2012 |
| Ontario, Québec, Canada; 2011 Effluents industriels |
5000 LD : 13 |
dans 1 sur 5 | Alaee, 2012 |
| Ontario, Canada; 2012 Eaux industrielles |
SSD LD : 2 |
3 | Alaee, 2014 |
| Ontario ou Québec, Canada; 2011 Lixiviat s'écoulant du site d'enfouissement |
1 LD : 1 |
dans 1 sur 3 | Alaee, 2012 |
| Ontario, Québec, Colombie-Britannique, Canada; 2012 Lixiviat s'écoulant du site d'enfouissement |
0,7 – 6,2 LD : 0,3 – 3 |
dans 9 sur 15 | Alaee, 2014 |
| Pays nordiquesNote de bas de page Annexe II Tableau 2[b]; 2004–2005 Influents d'usines de traitement des eaux usées |
3,4; 14 LD : 0,5 – 1 |
dans 2 sur 4 | Kaj et al. , 2005b |
| Pays nordiques[b]; 2004–2005 Effluents d'usines de traitement des eaux usées |
SSD LD : 0,5 – 1 |
9 | Kaj et al. , 2005b |
| Norvège; 2006 Influents d'usines de traitement des eaux usées |
1; 32 LD : 0,3 |
2 | Schlabach et al. , 2007 |
| Norvège; 2006 Effluents d'usines de traitement des eaux usées |
SSD LD : 0,3 |
2 | Schlabach et al. , 2007 |
| Pays nordiques[b]; 2004–2005 Lixiviat s'écoulant du site d'enfouissement |
SSD LD : 0,5 – 4 |
10 | Kaj et al. , 2005b |
| Lieu et année | Concentration (ng/g poids sec) | Nombre d'échantillons | Référence |
|---|---|---|---|
| Région des Grands Lacs, Canada; 2011 | SSD LD : 0,2 – 7 |
93 | Backus et al. , 2012 |
| Lac Ontario (Canada); 2011 | SSD LD : 0,18 – 0,76 |
10 | CES, 2012 |
| Terre-Neuve-et-Labrador, Nouvelle-Écosse, Nouveau-Brunswick, Québec, Ontario, Colombie-Britannique; 2012 | SSD LD : 20 |
126 | Pelletier et al. , 2012 |
| Lac Pepin (Minnesota, États-Unis); 2011 | SSD LD : 0,18 – 0,76 ng/g p.h. |
24 | CES, 2012 |
| Pays nordiquesNote de bas de page Annexe II Tableau 3[a]; 2003–2005 |
SSD LD : 0,02 – 0,71 |
24 | Kaj et al. , 2005b |
| Norvège; 2006 | SSD LD : 0,2 – 0,4 |
6 | Schlabach et al. , 2007 |
| Arctique norvégien; 2008 | SSD LD : 0,19 – 0,3 |
6 | Evenset et al. , 2009 |
| Lieu et année | Concentration (ng/g poids sec) | Nombre d'échantillons | Référence |
|---|---|---|---|
| Suède; 2004–2005 Boues d'épuration d'usines de traitement des eaux usées |
(max.) 37 (médiane) 7 |
dans 12 sur 54 | Kaj et al. , 2005a |
| Pays nordiquesNote de bas de page Annexe II Tableau 4[a]; 2004–2005 Boues d'épuration d'usines de traitement des eaux usées |
1 – 64 (médiane) 12 |
dans 8 sur 14 | Kaj et al. , 2005b |
| Norvège; 2006 Boues d'épuration d'usines de traitement des eaux usées |
11 – 31 | dans 3 sur 4 | Schlabach et al. , 2007 |
| Îles Féroé; 2004 | SSD LD : 0,1 |
2 | Kaj et al. , 2005b |
| Lieu et année | Organisme | Concentration (ng/g poids humide) | Nombre d'échantillons | Référence |
|---|---|---|---|---|
| Ontario, Canada; 2008 | Chélydre serpentine (Chelydra s. serpentine) |
SSD LD : 0,034 |
32 | Wang, 2012 |
| Ontario, Canada; 2008 | Cormoran à aigrettes (Phalacrocorax auritus) |
SSD LD : 0,034 |
22 | Wang, 2012 |
| Ontario, Canada; 2008 | Phoque commun du nord-ouest de l'Atlantique (Phoca vitulina) |
0,062 – 0,088 LD : 0,026 |
dans 3 sur 15 | Wang, 2012 |
| Ontario, Manitoba, Alberta, Yukon, Canada; 2009–2010 |
Touladi (Salvelinus namaycush) |
SSD LD : 0,42 |
60 | McGoldrick et al. , 2014 |
| Ontario, Manitoba, Alberta, Yukon, Canada; 2009–2010 |
Doré jaune (Sander vitreus) |
SSD LD : 0,42 |
17 | McGoldrick et al. , 2014 |
| Lac Ontario (Canada); 2011 | Mysidacé (Mysis relicta) |
SSD LD : 1,63 |
4Note de bas de page Annexe II Tableau 5[a] | CES, 2013 |
| Lac Ontario (Canada); 2011 | Gobie à taches noires (Neogobius melanostomus) |
SSD LD : 1,63 |
12Note de bas de page Annexe II Tableau 5[b] | CES, 2013 |
| Lac Ontario (Canada); 2011 | Éperlan arc-en-ciel (Osmerus mordax) |
SSD LD : 1,63 |
9Note de bas de page Annexe II Tableau 5[c] | CES, 2013 |
| Lac Ontario (Canada); 2011 | Gaspareau (Alosa pseudoharengus) |
SSD LD : 1,63 |
5Note de bas de page Annexe II Tableau 5[d] | CES, 2013 |
| Lac Ontario (Canada); 2011 | Touladi (Salvelinus namaycush) |
SSD LD : 1,63 |
19 | CES, 2013 |
| Québec, Canada; 2012–2013 |
Grand brochet (Esox lucius) |
0,3 LD : 0,17 |
dans 1 sur 7 | Pelletier, 2013 |
| Québec, Canada; 2012–2013 |
Doré jaune (Sander vitreus) |
0,19 – 1,77 LD : 0,17 |
4 | Pelletier, 2013 |
| Québec, Canada; 2012–2013 |
Perchaude (Perca flavescens) |
SSD LD : 0,17 |
2 | Pelletier, 2013 |
| Québec, Canada; 2012–2013 |
Gobie à taches noires (Neogobius melanostomus) |
SSD LD : 0,17 |
4Note de bas de page Annexe II Tableau 5[e] | Pelletier, 2013 |
| Québec, Canada; 2012–2013 |
Elliptio de l'Est (Elliptio complanata) | 0,29 LD : 0,17 |
dans 1 sur 7Note de bas de page Annexe II Tableau 5[f] | Pelletier, 2013 |
| Lac Pepin (États-Unis); 2011 | Zooplancton | SSD LD : 0,18 – 0,76 |
4[a] | CES, 2012 |
| Lac Pepin (États-Unis); 2011 | Larve d'éphémère (Hexagenia sp.) |
SSD LD : 0,18 – 0,76 |
5[a] | CES, 2012 |
| Lac Pepin (États-Unis); 2011 | Alose noyer (JA) (Dorosoma cepedianum) | SSD LD : 0,18 – 0,76 |
11[a] | CES, 2012 |
| Lac Pepin (États-Unis); 2011 | Doré noir (Sander canadensis) |
SSD LD : 0,18 – 0,76 |
20 | CES, 2012 |
| Pays nordiquesNote de bas de page Annexe II Tableau 5[g]; 2004–2005 |
Poissons de mer et d'eau douce, mammifères marins, œufs d'oiseaux de mer. | SSD LD : 0,3 |
45 | Kaj et al. , 2005b |
| Norvège; 2004–2006 |
Moules (Mytilus edulis) |
SSD LD : 0,04 |
3 | Schlabach et al. , 2007 |
| Norvège; 2004–2006 |
Foie de limande à queue jaune (Platichthys flesus) |
SSD LD : 0,04 |
2 | Schlabach et al. , 2007 |
| Norvège; 2004–2006 |
Morue, estomac (Gadus morhua) |
SSD LD : 0,04 |
3 | Schlabach et al. , 2007 |
| Norvège; 2004–2006 |
Foie de morue (Gadus morhua) |
0,1 LD : 0,04 |
dans 2 sur 4 | Schlabach et al. , 2007 |
| Arctique norvégien; 2008 | Foie de morue franche (G. morhua) |
0,33 LD : 0,08 – 0,18 |
dans 1 sur 5 | Evenset et al. , 2009 |
| Arctique norvégien; 2008 | Foie de morue polaire (Boreogadus saida) |
0,17 LD : 0,08–0,18 |
dans 1 sur 5 | Evenset et al. , 2009 |
| Arctique norvégien; 2008 | Kittiwake (Rissa tridactyla) |
SSD LD : 0,08 – 0,18 |
9 | Evenset et al. , 2009 |
| Arctique norvégien; 2008 | Eider (Somateria collissima) | SSD LD : 0,08–0,18 |
5 | Evenset et al. , 2009 |
Annexe III : Analyse de la fugacité et des résidus corporels critiques pour le MDM
L'analyse ci-dessous s'est appuyée sur les équations présentées dans Burkhard et al. (2012) et dans Gobas et al. (2011).
Rapports de fugacité :
Les rapports de fugacité ont été calculés à l'aide des équations suivantes :
Fbiote-eau = FBC (L/kg) x dbiote (kg/L) × Zeau ÷ Zbiote
Fbiote-sédiment = FABS (kg/kg) × dbiote (kg/L) ÷ dsédiment (kg/L) × Zsédiment ÷ Zbiote
Fbiote-régime alimentaire = FBM (kg/kg) × dbiote (kg/L) ÷ drégime alimentaire (kg/L) × Zrégime alimentaire ÷ Zbiote
Les calculs sont décrits en détail dans le tableau suivant.
| Paramètre | Valeur calculée |
|---|---|
| Zeau = 1/H | 3,4E-07 |
| Zbiote = Kbiote-eau Zeau = Φlipides × (dbiote/dlipides) × Koe × Zeau | 0,07; 0,05 (invertébrés) |
| Zsédiments = Ksédiments-eau Zeau = ΦCO × dsédiments × Kco × Zeau | 0,0002 |
| Zrégime = c Zeau = Φlipides × (drégime/dlipides) × Koe × Zeau | 1,9E-08 |
| FBC = facteur de bioconcentration (L/kg) | 7730 |
| FBM = facteur de bioamplification (kg/kg) | 0,86 |
| FABS = facteur d'accumulation biote-sédiments (kg/kg) | 16 (valeur maximale du D4) |
| H = constante de la loi d'Henry (Pa·m3·mol-1) | 2 900 000 |
| Φlipides = teneur en lipides du biote (kg/kg) | 0,05; 0,02 (invertébrés) |
| ΦCO = teneur en carbone organique des sédiments (kg/kg) | 0,03 (étude sur le D4) |
| dbiote = densité du biote (kg/L) | 1 |
| dlipides = densité des lipides (kg/L) | 0,9 |
| dsédiments = densité des sédiments (kg/L) | 1,5 |
| Kco= coefficient de partage carbone organique-eau (L/kg de CO) | 21 878 |
| Koe= coefficient de partage octanol-eau (L/kg) | 3 981 072 |
| PV = pression de vapeur (Pa) | 520 |
| Fbiote-eau = | 0,035 |
| Fbiote-sédiments = | 0,05 |
| Fbiote-régime = | 2,2E-07 |
La capacité de fugacité dans un poisson présentant une teneur en lipides de 5 % a été calculée ainsi :
C = F × Z
où C est la capacité de fugacité maximale interne du MDM (mmol/kg), F est la fugacité (Pa) (en tant que PV × Frapport) et Z est Zbiote. Dans le poisson, en utilisant les données sur le FBC, une capacité maximale de 1,4 mmol/kg a été calculée, ce qui équivaut à une fugacité de 18,2 Pa. En utilisant les données déduites à partir de l'analogue D4 pour le FABS, une valeur de1,3 mmol/kg (25,9 Pa) a été calculée en tant que capacité maximale chez les invertébrés vivant dans les sédiments. En utilisant les données sur le FBM, une valeur de 8,6 E-06mmol/kg a été calculée.
Les résidus corporels critiques (RCC) pour un poisson présentant une teneur en lipides de 5 % (FBC du MDM déjà à une teneur en lipides de 5 %) ont également été calculés à l'aide d'une approche à l'état stable, où les RCC (en mmol/kg) ont été calculés comme suit :
RCC = HS × FBC ÷ MM
où :
HS = l'hydrosolubilité maximale (mg/L)
FBC = facteur de bioconcentration (L/kg)
MM = masse moléculaire (g/mol)
Lorsque les unités sont annulées dans l'équation ci-dessus, une valeur de 1,1 mmol/kg est calculée pour le MDM, une valeur très comparable à celle de 1,4 calculée avec l'approche sur la fugacité décrite ci-dessus pour le poisson.
Le seuil moyen de charge corporelle critique pour les substances chimiques avec un mode d'action narcotique citées dans McCarty et MacKay (1993) est d'environ 5 mmol/kg (fourchette de 2 à 8 mmol/kg). Les seuils narcotiques internes chroniques moyens de charge corporelle présentent approximativement un facteur 10 fois inférieur à celui des valeurs aiguës avec la même fourchette de valeurs (c.-à-d., 0,2 à 0,8 mmol/kg).
L'analyse de la fugacité et des résidus corporels critiques ci-dessus laisse entendre que les résidus corporels critiques peuvent être atteints pour des effets chroniques chez les poissons et les invertébrés et que, même si certains effets nocifs ont été observés chez des invertébrés vivant dans les sédiments, aucun n'a été rapporté chez des poissons ni d'autres organismes pélagiques. Cette absence de corrélation chez le poisson semble indiquer : 1) que le MDM peut se bioaccumuler sans agir comme d'autres substances narcotiques dans les sites visés (moins réactif que d'autres substances narcotiques); 2) qu'il pourrait y avoir une erreur dans le facteur de bioconcentration chez le poisson (trop élevé); 3) que l'accumulation dans les organismes ne résulte pas uniquement d'une répartition hydrophobe (p. ex. liaison hydrogène) et que, par conséquent, la répartition dans l'organisme n'entraîne pas de toxicité dans les sites visés; 4) que l'octanol n'est pas un bon substitut pour les lipides visés, ce qui entraîne des erreurs dans l'estimation des concentrations internes. Burkhard et al. (2012) abordent les limites de cette méthode.
Annexe IV : Limite supérieure des estimations de l'absorption quotidienne de MDM par la population générale du Canada
| Absorption estimée (µg/kg p.c. par jour) de MDM, par groupes d'âge | 0 à 6 moisNote de bas de page Annexe IV Tableau 1[a].10 allaités maternelNote de bas de page Annexe IV Tableau 1[b].9 |
0 à 6 mois[a] allaitement au biberon3Note de bas de page Annexe IV Tableau 1[c].8 |
0 à 6 mois[a] pas d'allaitement au biberon |
De 6 mois à 4 ansNote de bas de page Annexe IV Tableau 1[d].4 | De 5 à 11 ansNote de bas de page Annexe IV Tableau 1[e].1 | De 12 à 19 ansNote de bas de page Annexe IV Tableau 1[f] | De 20 à 59 ansNote de bas de page Annexe IV Tableau 1[g] | De 60 ans et plusNote de bas de page Annexe IV Tableau 1[h] |
|---|---|---|---|---|---|---|---|---|
| Air ambiantNote de bas de page Annexe IV Tableau 1[i] | 2,8 × 10−4 | 2,8 × 10−4 | 2,8 × 10−4 | 6,0 × 10−4 | 4,7 × 10−4 | 2,7 × 10−4 | 2,3 × 10−4 | 2,0 × 10−4 |
| Air intérieurNote de bas de page Annexe IV Tableau 1[j] | 3,0 | 3,0 | 3,0 | 6,5 | 5,0 | 2,9 | 2,5 | 2,1 |
| Eau potableNote de bas de page Annexe IV Tableau 1[k] | s.o. | 8,5 × 10−5 | 3,2 × 10−5 | 3,6 × 10−5 | 2,8 × 10−5 | 1,6 × 10−5 | 1,7 × 10−5 | 1,8 × 10−5 |
| Aliments et boissonsNote de bas de page Annexe IV Tableau 1[l] | 7,9 × 10−4 | S.O. | S.O. | S.O. | S.O. | S.O. | S.O. | S.O. |
| SolNote de bas de page Annexe IV Tableau 1[m] | 4,0 × 10−7 | 4,0 × 10−7 | 4,0 × 10−7 | 6,5 × 10−7 | 2,1 × 10−7 | 5,1 × 10−8 | 4,2 × 10−8 | 4,2 × 10−8 |
| Absorption totale | 3,0 | 3,0 | 3,0 | 6,5 | 5,0 | 2,9 | 2,5 | 2,1 |
Absorption maximale totale à partir de toutes les voies d'exposition :6,5 µg/kg p.c. par jour
Annexe V : Limites supérieures des estimations d'exposition à l'octaméthyltrisiloxane dans les produits de soins personnels à l'aide du ConsExpo 4.1 (ConsExpo, 2007)
| Produit | Scénario | HypothèsesNote de bas de page Annexe Va Tableau 1[a].11 | Dose externe appliquéeNote de bas de page Annexe Va Tableau 1[b].10 (mg/kg p.c. par jour) |
|---|---|---|---|
| Fond de teint | Maquillage pour le visage | Concentration de MDM = 1 à 3 % Fréquence d'exposition : 438 fois/an (Loretz et al., 2006) Surface exposée : 637 cm2(Santé Canada, 1995) Quantité de produit appliquée : 0,54 g (Loretz et al., 2006) (10 % de répartition, intrant du modèle 0,054 g) |
9,1 × 10−3– 0,027 |
| Apprêt pour maquillage | Maquillage pour le visage |
Concentration de MDM = 1 àà 100 % Fréquence d'exposition : 438 fois/an (Loretz et al., 2006) Surface exposée : 637 cm2(Santé Canada, 1995) Quantité de produit appliquée : 0,54 g (Loretz et al., 2006) (10 % de répartition, intrant du modèle 0,054 g) |
9,1 × 10−3– 0,35 |
| Cache-cernes (traitement localisé) | Maquillage pour le visage | Concentration de MDM = 1 à 30 % Fréquence d'exposition : 365 fois/an Superficie exposée : 50 cm2(estimation) Quantité de produit appliquée : 0,15 g (10 % de répartition, intrant du modèle 0,015 g) |
2,1 × 10−3– 0,063 |
| Fard à joues | Maquillage pour le visage | Concentration de MDM = 1 à 3 % Fréquence d'exposition : 438 fois/an (Loretz et al., 2006) Superficie exposée : 160 cm2(estimation ¼ du visage) Quantité de produit appliquée : 0,14 g (10 % de répartition, intrant du modèle 0,014 g) (Loretz et al., 2006) |
2,4 × 10−3– 7,1 × 10−3 |
| Fard à cils | Fard à cils | Concentration de MDM = 0,3 à 30 % Fréquence d'exposition : 244 fois/an (Wu et al., 2010) Superficie exposée : 1,6 cm2(ConsExpo, 2007) Quantité de produit appliquée : 0,025 g (10 % de répartition, intrant du modèle 0,0025 g) |
7,1 × 10−5– 7,1 × 10−3 |
| Fard à paupières couleur |
Fard à paupières | Concentration de MDM = 3 à 100 % Fréquence d'exposition : 438 fois/an (Loretz et al., 2008) Surface exposée : 24 cm2(ConsExpo, 2007) Quantité de produit appliquée : 0,009 g (10 % de répartition, intrant du modèle 0,0009 g) (Loretz et al., 2008) |
4,6 × 10−4– 1,5 × 10−2 |
| Lotion pour les yeux | Démaquillant pour les yeux | Concentration de MDM = 0,3 à 3 % Fréquence d'exposition : 166 fois/an (CTFA, 1983) Surface exposée : 50 cm2(Santé Canada, 1995) Quantité de produit appliquée : 0,5 g (10 % de répartition, intrant du modèle 0,05 g) |
9,7 × 10−4– 0,010 |
| Crème pour le visage | Crème pour le visage | Concentration de MDM = 0,3 à 30 % Fréquence d'exposition : 657 fois/an (Loretz et al., 2005) Surface exposée : 637 cm2(Santé Canada, 1995) Quantité de produit appliquée : 1,2 g (Loretz et al., 2005) (10 % de répartition, intrant du modèle 0,12 g) |
9,1 × 10−3– 0,91 |
| Crème corporelle | Crème corporelle | Concentration de MDM = 0,3 à 10 % Fréquence d'exposition : 402 fois/an (Loretz et al., 2005) Surface exposée : 16 925 cm2(Santé Canada, 1995) Quantité de produit appliquée : 4,4 g (Loretz et al., 2005) (10 % de répartition, intrant du modèle 0,44 g) |
0,021 – 0,68 |
| Revitalisant sans rinçage | Revitalisant (aucun facteur de rétention) | Concentration de MDM = 0,1 à 30 % Fréquence d'exposition : 260 fois/an Superficie exposée : 1 550 cm2(Santé Canada, 1995) Un facteur de dépôt de 10 % a été appliqué.Note de bas de page Annexe Va Tableau 1[d].5 Quantité de produit appliquée : 0,124 g (10 % de répartition, intrant du modèle 1,24 g) |
1,2 × 10−3– 0,37 |
| Shampooing | Shampooing | Concentration de MDM = 0,1 à 0,3 % Fréquence d'exposition: 260 fois/an Superficie exposée : 1 550 cm2(Santé Canada, 1995) Un facteur de rétention de 10 % a été appliqué.Note de bas de page Annexe Va Tableau 1[c].9 Quantité de produit appliquée : 20 g (10 % de répartition, intrant du modèle 2 g) |
2,0 × 10−3– 6,0 × 10−3 |
| Revitalisant avec rinçage | Revitalisant | Concentration de MDM = 0,1 à 0,3 % Fréquence d'exposition : 104 fois/an Superficie exposée : 1 550 cm2(Santé Canada, 1995) Un facteur de rétention de 10 % a été appliqué.[c] Quantité de produit appliquée : 18 g (10 % de répartition, intrant du modèle 1,8 g) |
7,2 × 10−4– 2,2 × 10−3 |
| Déodorant (en bâton) | Déodorant | Concentration de MDM = 1 à 10 % Fréquence d'exposition : 475 fois/an (Loretz et al., 2006) Surface exposée : 240 cm2(estimée) Quantité de produit appliquée : 0,6 g (Loretz et al., 2006) (10 % de répartition, intrant du modèle 0,06 g) |
0,011 – 0,11 |
| Parfum (quantité laissée sur la peau après vaporisation) | Parfum | Concentration de MDM = 3 à 30 % Fréquence d'exposition : 621 fois/an (Loretz et al., 2006) Superficie exposée : 200 cm2(ConsExpo, 2007) Quantité appliquée : 0,33 g (Loretz et al., 2006) (10 % de répartition, intrant du modèle 0,033 g) |
0,024 – 0,24 |
| Démêlant (enfants) |
Revitalisant sans rinçage | Concentration maximale de MDM = 5 % (Environnement Canada, 2010a) Fréquence : 365 (jugement professionnel) Superficie exposée : 785 cm2(Santé Canada, 1995) Un facteur de dépôt de 10 % a été appliqué.[d] Quantité de produit appliquée : 6,3 g (10 % de répartition, intrant du modèle 0,63 g), quantité de produit appliquée obtenue en corrigeant le revitalisant sans rinçage pour adultes pour les différences de superficie |
0,20 |
| Shampooing (enfants) | Shampooing | Concentration de MDM = 0,1 à 0,3 % Fréquence d'exposition : 164 fois/an (Wu et al., 2010) Superficie exposée : 785 cm2(Santé Canada, 1995) Un facteur de rétention de 10 % a été appliqué. Quantité de produit appliquée : 10 g (10 % de répartition, intrant du modèle 1 g); quantité de produit appliquée obtenue en corrigeant le shampooing pour adultes pour les différences de superficie |
2,0 × 10−3 |
| Produit | HypothèsesNote de bas de page Annexe Vb Tableau 2[a].12 | Estimation del'expositionpar voie orale externe chroniqueNote de bas de page Annexe Vb Tableau 2[b].11 (mg/kg p.c. par jour) |
|---|---|---|
| Rouge à lèvres | Concentration de MDM = 1 à 3 % Fréquence d'exposition : 767 fois/an (Loretz et al., 2005) Type d'exposition : absorption directe (ConsExpo, 2007) Quantité de produit ingérée : 0,01 g |
0030 – 0,0089 |
| Produit | Scénario | HypothèsesNote de bas de page Annexe Vc Tableau 3[a].13 | Estimation de l’exposition chronique (par application) |
|---|---|---|---|
| Fond de teint | Maquillage pour le visage | Concentration de MDM : 1 à 30 % Fréquence d'exposition : 438 fois/an (Loretz et al., 2006) Exposition à la vapeur, taux constant Durée d’exposition : 12 h Durée de l’émission : 12 h Volume de la pièce : 80 m3 Taux de ventilation : 1/h Quantité de produit appliquée : 0,54g (répartition à 90 %, intrant du modèle 0,49 g) (Loretz et al., 2006) Taux d’inhalation : 16,2 m3/jour Fraction absorbée : 1 |
Concentration moyenne par événement : Dose chronique interne : |
| Apprêt pour maquillage | Maquillage pour le visage | Concentration de MDM = 1 à 100 % Fréquence d'exposition : 438 fois/an (Loretz et al., 2006) Exposition à la vapeur, taux constant Durée d’exposition : 12 h Durée de l’émission : 12 h Volume de la pièce : 80 m3 Taux de ventilation : 1/h 0,54g (répartition à 90 %, intrant du modèle 0,49 g) (Loretz et al., 2006) Taux d’inhalation : 16,2 m3/jour Fraction absorbée : 1 |
Concentration moyenne par événement : Dose chronique interne : |
| Crème pour le visage | Crème pour le visage | Concentration de MDM = 0,3 à 30 % Fréquence d'exposition : 657 fois/an (Loretz et al., 2005) Exposition à la vapeur, taux constant Durée d’exposition : 12 h Durée de l’émission : 12 h Volume de la pièce : 80 m3 Taux de ventilation : 1/h Quantité de produit appliquée : 1,2 g (répartition à 90 %, intrant du modèle 1,1 g) (Loretz et al., 2005) Taux d’inhalation : 16,2 m3/jour Fraction absorbée : 1 |
Concentration moyenne par événement : Dose chronique interne : |
| Crème corporelle | Crème corporelle | Concentration de MDM = 0,3 à 10 % Fréquence d'exposition : 402 fois/an (Loretz et al., 2005) Exposition à la vapeur, taux constant Durée d’exposition : 12 h Durée de l’émission : 12 h Volume de la pièce : 80 m3 Taux de ventilation : 1/h Quantité de produit appliquée : 4,4 g (répartition à 90 %, intrant du modèle 4 g) (Loretz et al., 2005) Taux d’inhalation : 16,2 m3/jour Fraction absorbée : 1 |
Concentration moyenne par événement : Dose chronique interne : |
| Revitalisant sans rinçage | Revitalisant | Concentration de MDM = 0,1 à 30 % Fréquence d'exposition : 260 fois/an Exposition à la vapeur, taux constant Durée d’exposition : 12 h Durée de l’émission : 12 h Volume de la pièce : 80 m3 Taux de ventilation : 1/h Quantité appliquée : 12,4 g (répartition à 90 %, intrant du modèle à 11,2 g) Taux d’inhalation : 16,2 m3/jour Fraction absorbée : 1 |
Concentration moyenne par événement : Dose chronique interne : |
| Parfum | Quantité se volatilisant du dépôt sur la peau | Concentration de MDM : 3 à 30 % Fréquence d'exposition : 621 fois/an (Loretz et al., 2006) Durée d’exposition : 12 h Volume de la pièce : 80 m3 Taux de ventilation : 1/h Quantité appliquée : 0,33 g (Loretz et al., 2006) (répartition à 90 %, intrant du modèle à 0,30 g) Taux d’inhalation : 16,2 m3/jour Fraction absorbée : 1 |
Concentration moyenne par événement : Dose chronique externe appliquée : |
| Démêlant pour enfants | Revitalisant sans rinçage | Concentration de MDM = 5 % (Environnement Canada, 2010a) Fréquence : 365 (jugement professionnel) Concentration dans l’air limitée à la pression de vapeur de la substance pure Durée d’exposition : 12 h Volume de la pièce : 80 m3 Taux de ventilation : 1/h Quantité de produit appliquée : 6,3 g (répartition à 90 %, intrant du modèle à 5,67 g), quantité de produit appliquée obtenue en corrigeant le revitalisant sans rinçage pour adultes pour les différences de superficie Taux d’inhalation : 9,3 m3/jour Fraction absorbée : 1 |
Concentration moyenne par événement : Dose chronique interne : |
Annexe VI : Données sur la structure et les propriétés du MDM et des analogues pris en compte dans cette évaluation préalable
| Nom/n° CAS/nom abrégé | Structure | Formule moléculaire/masse moléculaire (g/mol)/propriétés chimiques | Méthode d'identifica-tion de l'analogue (% de similitudes) |
|---|---|---|---|
Octaméthyltrisiloxane 107-51-7 |
 |
C8H24O2Si3 Masse moléculaire : 236,5 Faible hydrosolubilité (34 μg/L)Note de bas de page Annexe VI Tableau 1[a] Log Koe : 6,6[a] Log Kco : 4,3[a] Dmax, Deff (nm)Note de bas de page Annexe VI Tableau 1[b] : 1,2; 0,9 |
s.o. |
| Hexaméthyl-disiloxane 107-46-0 HMDS |
 |
C6H18OSi2 Masse moléculaire : 162,62 Faible hydrosolubilité (964 μg/L) |
SciFinder : 67 % |
| Décaméthyl- tétrasiloxane 141-62-8 L4 |
 |
C10H30O3Si4 Masse moléculaire : 310,70 Faible hydrosolubilité (6,7 μg/L)Note de bas de page Annexe VI Tableau 1[c].10 Log Koe : 7,2Note de bas de page Annexe VI Tableau 1[d].6 Log Kco : 4,3Note de bas de page Annexe VI Tableau 1[e].2 Dmax, Deff (nm)b : 1,5; 1 |
SciFinder : 86 % ChemID : 89 % |
| Dodécaméthyl-pentasiloxane 141-63-9 L5 |
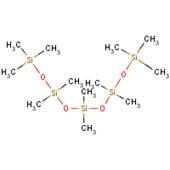 |
C12H36O4Si5 Masse moléculaire : 384,9 Faible hydrosolubilité (0,07 μg/L)[c] Log Koe : 7,8[d] Log Kco : 5,2[e] Dmax, Deff (nm)[b] : 1,7; 1,1 |
SciFinder : 73 % ChemID : 87 % |
| 1,1,1,5,5,5-Hexaméthyl-3,3-bis[(triméthylsilyl)oxy]trisiloxane 3555-47-3 M4Q |
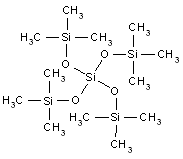 |
C12H36O4Si5 Masse moléculaire : 384,85 Faible hydrosolubilité (0,15 μg/L)Note de bas de page Annexe VI Tableau 1[f].1 Log Koe : 9,6[f] Log Kco : 5,2[e],[f] Dmax, Deff (nm)[b] : 1,3; 1,2 |
SciFinder : 73 % ChemID : 83 % |
Annexe VII : Résumé des données sur les effets pour la santé pour le MDM
| Paramètre | DL50ou CL50ou doses minimales sans effetNote de bas de page Annexe VII Tableau 1[a].15/résultats |
|---|---|
| Toxicité aiguë | DL50par voie orale(rat) = supérieur(e) à 2 000 mg/kg p.c. (DowCorning Corporation, 2006) CL50par inhalation(rat, 4 h) = supérieur(e) à 2 350 ppm (22 600 mg/m3) (DowCorning Corporation, 2004) DL50par voie cutanée(rat) = supérieur(e) à 2 000 mg/kg p.c. (DowCorning Corporation, 1999a) |
| Dose toxique à court terme pour l'exposition répétée | CMENO par inhalation =7 740 mg/m3, selon des augmentations importantes de cholestérol sérique chez les mâles, des augmentations importantes des poids absolu et relatif du foie chez les femelles, et une formation de gouttelettes d’hyaline entraînant une néphropathie, ce qui était conforme en apparence à une néphropathie alpha-2μ, chez les rats mâles Sprague-Dawley (10/sexe/groupe) ayant subi une exposition au corps entier à des concentrations de 0, 7,74, 15,5 ou 31,0 mg/L (équivalant à 0, 7 740, 15 500 ou 31 000 mg/m3), 6 heures par jour, 7 jours par semaine, pendant 28 ou 29 jours dans le cadre d’une étude de toxicité pour le développement et la reproduction à doses répétées. Des augmentations importantes du cholestérol sérique et des augmentations du poids relatif du foie ont également été observées respectivement à 15 500 mg/m3chez les femelles et à 31 000 mg/m3chez les mâles. Les autres observations comprenaient une hypertrophie centrolobulaire, qui était considérée comme un changement adaptatif, chez les femelles exposées à des concentrations de 7 740 mg/m3et plus, et chez les mâles exposés à la dose la plus élevée et protoporphyrine hépatique chez les mâles à des concentrations de 15 500 mg/m3et au-delà. On n’a remarqué aucun effet relié au traitement sur le poids corporel, la consommation d’aliments et les réactions neurocomportementales (DowCorning Corporation, 2007a). DMENO par voie orale= 250 mg/kg p.c. par jour, d'après une augmentation importante du poids du foie chez les rats Sprague-Dawley mâles et femelles (5 par groupe) auxquels on a administré par gavage des doses de 0, 5, 25, 250 et 1 000 mg/kg p.c. par jour pendant 28 jours. Cette augmentation s'accompagnait d'une hypertrophie hépatocellulaire et d'une accumulation de protoporphyrine associées à une prolifération des voies biliaires et à une inflammation périportale chronique chez les mâles soumis à des doses de 250 et de 1 000 mg/kg p.c. par jour et chez les femelles à la dose la plus élevée uniquement. Après une période de récupération de 14 jours, l'hypertrophie hépatocellulaire affichait une régression complète, tandis que l'accumulation de protoporphyrine et l'inflammation périportale chronique étaient toujours présentes chez les rats mâles et femelles soumis à la dose de 1 000 mg/kg p.c. par jour. Une incidence et une gravité accrues des gouttelettes d'hyaline ainsi que des niveaux plus élevés d'alpha-2μ-globuline ont été observés chez les mâles aux doses de 25 mg/kg p.c. par jour et aux doses supérieures, ainsi qu'à toutes les doses, respectivement. Néanmoins, les dépôts d'hyaline affichent une régression complète à la fin de la période de récupération. Une hypertrophie des cellules folliculaires dans les glandes thyroïdes d'une gravité minimale a été observée chez les deux sexes à 1 000 mg/kg p.c. par jour. Une réduction du gain de poids corporel a également été remarquée chez les mâles exposés à la dose la plus élevée à la fin de la période de traitement (Harland Laboratories Ltd, 2010). Aucune étude sur l'absorption cutanée n'a été recensée. |
| Toxicité subchronique | DMENO par inhalation = 31 000 mg/m3, d'après des accumulations de protoporphyrine ainsi que des effets secondaires liés à une cholangite/péricholangite et à une prolifération des voies biliaires chez des rats Sprague-Dawley mâles et femelles (nombre d'animaux par groupe inconnu) exposés par inhalation en milieu confiné à des doses de 0, 95, 400 ou 3 200 ppm (soit 0, 919, 3 870 ou 31 000 mg/m3), à raison de 6 h par jour, 7 jours par semaine pendant 90 jours. À la fin de la période de récupération de 28 jours, un rétablissement partiel a été observé. Une hypertrophie hépatocellulaire centro-lobulaire associée à un changement de poids des organes a également été observée chez les mâles à 3 870 mg/m3et chez les deux sexes à la concentration la plus élevée. Cette hypertrophie était réversible et on a estimé qu'il s'agissait d'un processus adaptatif lié à l'induction d'enzymes plutôt que d'un effet toxique. Dans le rein, des gouttelettes d'hyaline et des niveaux plus élevés d'alpha-2μ-globuline ont été observés chez les mâles. On a constaté des signes de rétablissement incomplet à la dose la plus élevée (SEHSC, 2011). Aucune étude par voie orale ou cutanée n'a été recensée. |
| Toxicité chronique et cancérogénicité | Aucune étude n'a été recensée. |
| Toxicité pour la reproduction | CSENO concernant la toxicité pour la reproduction =31 000 mg/m3d'après l'absence de toxicité pour la reproduction liée au traitement observée dans le cadre d'un essai combiné de dépistage de la toxicité des doses répétées, pour la reproduction et pour le développement où des rats (10/sexe/concentration) ont été exposés par inhalation à une dose de 0, 7,74, 15,5 ou 31,0 mg/L (soit 0, 7 740, 15 500 ou 31 000 mg/m3), 6 heures par jour, 7 jours par semaine pendant 28 ou 42 jours (les mâles ont été traités 14 jours avant l'accouplement et 14 jours après l'accouplement; les femelles ont été traitées 14 jours avant l'accouplement jusqu'au 19e jour de gestation). Une toxicité systémique chez les parents est signalée dans la section sur la toxicité à court terme (DowCorning Corporation, 2007a). Aucune autre étude de toxicité pour la reproduction n'a été recensée. |
| Toxicité pour le développement | CSENO concernant la toxicité pour le développement =31 000 mg/m3d'après l'absence de preuve de toxicité pour le développement liée au traitement observée chez des fœtus dans le cadre d'un essai combiné de dépistage de la toxicité à des doses répétées, pour la reproduction et pour le développement où des rats (10/sexe/concentration) ont été exposés par inhalation à une dose de 0, 7,74, 15,5 ou 31,0 mg/L (soit 0, 7 740, 15 500 ou 31 000 mg/m3), 6 heures par jour, 7 jours par semaine pendant 28 ou 42 jours (les mâles ont été traités 14 jours avant l'accouplement et 14 jours après l'accouplement; les femelles ont été traitées 14 jours avant l'accouplement jusqu'au 19e jour de gestation). CMEO pour la toxicité maternelle = 7 740 mg/m3, d'après des augmentations importantes du poids du foie accompagnées d'une hypertrophie centro-lobulaire (DowCorning Corporation, 2007a). Aucune autre étude de toxicité pour le développement n'a été recensée. |
| Génotoxicité et paramètres connexes : in vivo | Aucune étude n'a été recensée. |
| Génotoxicité et paramètres connexes : in vitro | Mutagénicité chez les bactéries Essai d'aberrations chromosomiques Essai de mutation de cellules de mammifères |
| Irritation | Irritation cutanée : Du Tx-1302 A (MDM) a été appliqué à trois lapins albinos (sexe non précisé) sur un tampon de coton de un pouce sur un pouce sur l’abdomen rasé et maintenu par un bandage en tissu. Dix applications ont été faites sur une période de 14 jours. On a constaté une irritation cutanée de minimale à modérée (DowCorning Corporation, 1994). |
| Études sur les humains | Dans le cadre d’un test épicutané sur des humains, 103 sujets (mâles et femelles) ont été exposés au matériel d’essai (MDM) pendant deux phases. La première phase (induction) consistait en neuf applications consécutives d’un timbre de 0,2 mL du matériel d’essai au même endroit toutes les 48 heures sous bandage semi-occlusif; les timbres étaient retirés après une exposition de 24 heures. Après une période de repos de 12 à 14 jours, la même dose a été appliquée sur un endroit non exposé (phase de défi) à l'aide de la même méthode et des bénévoles ont enlevé les timbres après 24 heures. Aucun des sujets n’a manifesté des signes d’irritation ou de sensibilisation au MDM pendant une partie quelconque de l’étude (DowCorning Corporation, 1998). |
Annexe VIII : Résumé des données sur les effets pour la santé pour les analogues de MDM
| Paramètre | Doses minimales sans effetNote de bas de page Annexe VIIIa Tableau 1[a].16/ résultats |
|---|---|
| Toxicité aiguë | Aucune étude n'a été recensée. |
| Dose toxique à court terme pour l'exposition répétée | DMENO par voie orale= 25 mg/kg p.c. par jour, d'après une augmentation de l'incidence et de la gravité de la modification graisseuse péribiliaire chez les rats Sprague-Dawley femelles (5 par groupe) auxquels on a administré par gavage des doses de 0, 25, 250 ou 1 000 mg/kg p.c. par jour pendant 28 jours. Cette augmentation de l'incidence et de la gravité était encore présente après une période de récupération de 14 jours pour les femelles exposées à la dose la plus élevée, par rapport au groupe témoin. De plus, une augmentation des poids absolus et relatifs du foie a été observée chez les mâles. Cette augmentation s’est accompagnée d’effets sur le foie comme un pigment brun dans le canal cholédoque intrahépatique à la dose la plus élevée et à la dose intermédiaire et d'une prolifération des canaux cholédoques, d'une inflammation chronique et d'une hypertrophie hépatocellulaire à la dose la plus élevée, qui n’étaient pas présents chez les mâles du groupe témoin. Bien que des augmentations des poids absolu et relatif du foie aient également été observées chez les femelles à une dose de 250 mg/kg p.c. par jour et plus, une augmentation de pigments dans les voies biliaires, de même que la prolifération des voies biliaires et l'inflammation chroniques connexes n'ont pas été observées chez les femelles à aucune des doses. Il n’y a pas eu non plus d'augmentation statistiquement significative dans l’activité locomotrice médiane du groupe (intervalles précoces ou séance totale) à la dose la plus élevée chez les mâles et les femelles (DowCorning Corporation, 2009a). DMEO par voie orale =1 500 mg/kg p.c. par jour, d’après une augmentation du poids relatif des reins chez les rats mâles Sprague-Dawley (six par groupe) auxquels on a administré par gavage des doses de 0 ou 1 500 mg/kg p.c. par jour, 5 jours/semaine, pendant quatre semaines consécutives. Aucune mortalité, aucun changement dans l’apparence générale, aucune anomalie de comportement et aucun autre signe de toxicité n’ont été observés tant chez les mâles et les femelles (DowCorning Corporation, 1990). DSENO par voie cutanée =1 000 mg/kg p.c. par jour d’après une absence d’effets nocifs significatifs en ce qui concerne le poids corporel, la mortalité et les réactions comportementales et aucune preuve d'atrophie testiculaire et de fonctions testiculaires réduites chez les lapins albinos mâles de Nouvelle-Zélande (10 par groupe) exposés par voie cutanée à des doses de 0 ou 1 000 mg/kg p.c. par jour, une fois par jour, pendant 28 jours consécutifs (Hobbs et al., 1972). Aucune autre étude sur l'exposition par voie cutanée n'a été recensée. Aucune étude sur l'exposition par inhalation n'a été recensée. |
| Toxicité subchronique | DSENO par voie orale =500 mg/kg p.c. par jour selon une absence d’effets reliés au traitement sur la croissance, l’état physiologique, le poids des organes ou l’apparence macroscopique et microscopique des tissus (tous les systèmes organiques) chez les rats sevrés albinos (5/sexe/dose) exposés par voie alimentaire à des doses de 0 ou 1 % de 200 Fluid 1.5 cs (décaméthyltétrasiloxane) (équivalant à 0 ou 500 mg/kg p.c. par jour, en utilisant une conversion posologique par Santé Canada, 1994) pendant un an (DowCorning Corporation, 1966). Autre DSENO par voie orale =500 mg/kg p.c. par jour, d'après l'absence d'effet lié au traitement sur les paramètres hématologiques et l'analyse d'urine, le poids des organes et l'apparence pathologique ou microscopique des tissus de tous les organes chez les lapins albinos (3 mâles et femelles par dose) exposés dans leur alimentation à des doses de 0 ou 1 % de 200 Fluid 1.5 cs (decaméthyltetrasiloxane) (soit l'équivalent de 0 ou 500 mg/kg p.c. par jour, en utilisant une méthode de conversion des doses de Santé Canada, 1994), pendant 8 mois (DowCorning Corporation, 1965). Aucune étude sur l'exposition par voie cutanée ou par inhalation n'a été recensée. |
| Toxicité chronique et cancérogénicité | Aucune étude n'a été recensée. |
| Toxicité pour la reproduction | Aucune étude n'a été recensée. |
| Toxicité pour le développement | Aucune étude n'a été recensée. |
| Génotoxicité et paramètres connexes : in vivo | Aucune étude n'a été recensée. |
| Génotoxicité et paramètres connexes : in vitro | Aucune étude n'a été recensée. |
| Sensibilisation | Aucune étude n'a été recensée. |
| Irritation | Irritation cutanée : Irritation oculaire : |
| Études sur les humains | Aucune étude n'a été recensée. |
| Paramètre | Doses minimales sans effetNote de bas de page Annexe VIIIb Tableau 2[a].17/ résultats |
|---|---|
| Toxicité aiguë | Aucune étude n'a été recensée. |
| Dose toxique à court terme pour l'exposition répétée | DMENO par voie orale= 25 mg/kg p.c. par jour, d'après l'augmentation importante des poids absolu et relatif du foie accompagnée de lésions hépatiques, comme une vacuolisation hépatocellulaire périportale chez des rats Sprague-Dawley femelles (5 par groupe) auxquels on a administré par gavage des doses de 0, 25, 250 ou 1 000 mg/kg p.c. par jour pendant 28 jours. Une augmentation du poids absolu et relatif du foie ainsi qu’une vacuolisation hépatocellulaire périportale ont été observées chez les mâles seulement à des concentrations de 250 et 1 000 mg/kg p.c. par jour. On a remarqué une prolifération des canaux cholédoques chez les mâles à une concentration de 1 000 mg/kg p.c. par jour et chez les femelles à des concentrations de 250 mg/kg p.c. par jour et plus. On a également remarqué un profil lobulaire accentué du foie des mâles traités à la dose la plus élevée (DowCorning Corporation, 2009c). DSENO par voie orale= 1 500 mg/kg p.c. par jour, selon l'absence d'effets liés au traitement observés sur la survie, le poids corporel, l'alimentation, le poids des organes (reins et foie), de même que selon l'absence de changements macroscopiques pathologiques et de changements de comportements chez les rats Sprague-Dawley mâles et femelles (six par sexe et par dose) ayant reçu par gavage une dose de 0 ou 1 500 mg/kg p.c. par jour, 5 jours par semaine pendant 4 semaines consécutives (DowCorning Corporation, 1990). Aucune étude sur l'exposition par voie cutanée ou par inhalation n'a été recensée. |
| Toxicité subchronique | Aucune étude n'a été recensée. |
| Toxicité chronique et cancérogénicité | Aucune étude n'a été recensée. |
| Toxicité pour la reproduction | Aucune étude n'a été recensée. |
| Toxicité pour le développement | Aucune étude n'a été recensée. |
| Génotoxicité et paramètres connexes : in vivo | Aucune étude n'a été recensée. |
| Génotoxicité et paramètres connexes : in vitro | Mutagénicité chez les bactéries Résultats négatifs : Salmonella typhimurium ,souches TA98, TA100, TA1535, TA1537 et TA1538, avec et sans activation métabolique (DowCorning Corporation, 1979). |
| Sensibilisation | Aucune étude n'a été recensée. |
| Irritation | Irritation cutanée : Irritation oculaire : |
| Études sur les humains | Aucune étude n'a été recensée. |
| Paramètre | Doses minimales avec effetNote de bas de page Annexe VIIIc Tableau 3[a].18/ résultats |
|---|---|
| Toxicité aiguë | DL50minimale par voie orale(rat) = supérieur(e) à 16 000 mg/kg p.c. (BRRC, 1982) CL50minimale par inhalation(rat, 4 h) = 15 956 ppm (1,06 × 105 mg/m3) (RTECS, 2009). Aucune étude sur l'absorption cutanée n'a été recensée. |
| Toxicité à court terme en doses répétées | DMENO la plus faible par voie orale =40 mg/kg p.c. par jour d’après des changements histopathologiques dans les reins (augmentation de corps éosinophiles) chez les rats mâles Crj:CD(SD) à qui on a administré par gavage par voie orale des doses de 0, 8, 40, 160 ou 640 g/kg p.c. par jour pendant 28 jours. Les autres effets observés comprennent des taches sur la surface des reins des mâles à des concentrations de 160 mg/kg p.c. par jour et plus et un changement brun foncé dans le foie et un grossissement du ganglion lymphatique hépatique chez les mâles à une concentration de 640 mg/kg p.c. par jour. Des changements histopathologiques dans le foie comme une stase de la bile, une infiltration de cellules autour de la stase de la bile et un gonflement des hépatocytes ont été remarqués chez les mâles et les femelles à la dose la plus élevée mise à l’essai. Une prolifération des canaux cholédoques, une nécrose cellulaire dans les hépatocytes et le dépôt d’un pigment brun ainsi qu’une augmentation des cellules histiocytaires dans le ganglion lymphatique hépatique ont été observés aussi à cette dose, mais seulement chez les mâles. Une diminution liée à la dose dans la consommation d’aliments et le gain de poids corporel et une augmentation du poids de la rate et du foie ont été constatées chez les mâles à la dose la plus élevée. Lors d’examens hématologiques, une augmentation des leucocytes a également été constatée chez les mâles à la même dose (Shin-Etsu, 1994c). DMENO =1 500 mg/kg p.c. par jour, d’après une protoporphyrine du foie (présence de pigments bruns foncés dans le canal cholédoque accompagnée d’une prolifération des canaux cholédoques et d’une inflammation chronique chez les rats mâles Sprague-Dawley (6 par groupe) auxquels on a administré par gavage des doses de 0 ou 1 500 mg/kg p.c. par jour, 5 jours/semaine pendant 4 semaines consécutives. Une augmentation du poids relatif des reins a également été observée chez les mâles. Aucune mortalité, aucun changement dans l’apparence générale, aucune anomalie de comportement et aucun autre signe de toxicité n’ont été signalés tant chez les mâles et les femelles (DowCorning Corporation, 1990 et 2009b). DSENO =1 200 mg/kg p.c. par jour, selon une absence d’anomalies cliniques liées au traitement, aucun changement relié à la dose dans le poids corporel et aucun effet sur le poids utérin des bébés rats Sprague Dawley (12 par groupe) à qui on a administré par gavage des concentrations de 0, 600 ou 1 200 mg/kg p.c. par jour, une fois par jour, pendant quatre jours consécutifs, à compter du 18e jour postnatal (McKim et al., 2001). CMENO la plus faible par inhalation =3 319 mg/m3, selon une gravité accrue reliée à la dose de gouttelettes d’hyaline dans l’épithélium des tubules contournés proximaux, ce qui est conforme en apparence avec une néphropathie attribuable à l’alpha2μ chez les rats mâles Sprague-Dawley (5 par groupe) exposés par inhalation au corps entier à des concentrations de 0, 499 ou 1 004 ppm (environ 0, 3 319 ou 6 678 mg/m3), 6 heures par jour, 5 jours par semaine, pendant 2 semaines. Des augmentations importantes du poids relatif des reins ont également été observées chez les mâles à la dose la plus élevée. Aucun effet toxique relié au traitement n’a été observé chez les rates (DowCorning Corporation, 1992b). Autre CMENO par inhalation =12 700 mg/m3, selon une augmentation de l’incidence et de la gravité de la régénération des tubules rénaux, ce qui indique une augmentation des dommages aux reins, chez les rats albinos Fischer 344 (10 par groupe) exposés par inhalation (nez seulement) à des concentrations de 0, 0,9, 3,4, 12,7 ou 59,2 mg/L (0, 900, 3 400, 12 700 ou 59 200 mg/m3) pendant 6 heures par jour, 5 jours par semaine, pendant un mois. Une augmentation de légère à modérée, en fonction de la dose, du poids du foie a été observée chez les mâles à toutes les doses mises à l’essai et chez les femelles exposées aux doses intermédiaire et maximale. Cette augmentation était accompagnée d’hypertrophie hépatocellulaire minimale chez les mâles à des concentrations de 12 700 et 59 200 mg/m3et chez une femelle à une concentration de 59 200 mg/m3et par une légère augmentation de l’accumulation des pigments dans les canaux cholédoques chez les mâles à la dose la plus élevée. On a également observé une accumulation de gouttelettes d’hyaline, des cylindres urinaires et des cylindres granuleux dans les reins de plusieurs mâles à la dose la plus élevée (DowCorning Corporation, 1997a). DMENO par voie cutanée= 1 000 mg/kg p.c. par jour, selon une réduction statistiquement significative du gain de poids corporel, de consommation d’aliments, de poids absolu du foie et du poids relatif du foie et des reins (ratio de l'organe au cerveau) chez les rats mâles Sprague-Dawley (10 par groupe) exposés à des concentrations de 0, 100, 500 ou 1 000 mg/kg p.c. par jour par voie cutanée, 6 heures par jour, 5 jours par semaine, pendant 28 jours. Ces effets n’ont pas été observés chez les rates. Aucun changement relié au traitement dans les paramètres hématologiques, histopathologiques ou de chimie clinique n’a été signalé chez les femelles et les mâles traités (DowCorning Corporation, 1993). DSENO par voie cutanée =200 mg/kg p.c. par jour, selon l’absence d’effets nocifs significatifs en ce qui concerne le poids corporel, la mortalité et les réactions comportementales et aucune preuve d’atrophie testiculaire et de fonction testiculaire réduite chez les lapins albinos mâles de Nouvelle-Zélande (10 par groupe) exposés à des concentrations de 0 ou 200 mg/kg p.c. par jour par voie cutanée, une fois par jour, pendant 28 jours consécutifs (Hobbs et al., 1972). |
| Toxicité subchronique | CMENO la plus faible par inhalation =140 mg/m3, d’après une légère, mais importante augmentation d’inflammation du tissu conjonctif multifocale, sous-pleurale subaiguë à chronique, associée à une agrégation du nécrophage alvéolaire, dans les poumons des rates albinos Fischer 344 (F344) (20 à 30 par groupe) exposées par inhalation (nez seulement) à des concentrations de 0, 0,14, 0,73, 3,42 ou 13,64 mg/L (0, 140, 730, 3 420 ou 13 640 mg/m3) pendant 6 heures par jour, 5 jours par semaine, pendant 3 mois. L’incidence de ces résultats était plus grande chez les mâles qui recevaient la dose la plus élevée seulement. Une incidence plus élevée de sang occulte dans l’urine et une augmentation minimale dans la gravité de l’atrophie tubulaire testiculaire ont été observées chez les mâles exposés à la dose la plus élevée. De faibles changements hématologiques et cliniques biochimiques ont été constatés, mais n’ont pas été considérés comme ayant une pertinence toxicologique. Aucun signe relié au traitement de toxicité ou mortalité clinique, aucun effet statistiquement significatif sur le gain de poids corporel ou la consommation d’aliments, aucun changement ophtalmoscopique, aucun résultat général d’autopsie macroscopique ni aucun changement de poids d’organe n’ont été constatés (DowCorning Corporation, 1997b). Autre CMENO par inhalation =3 944 mg/m3, d’après des lésions histologiques dans les reins, conforme en apparence avec une néphropathie de la globuline urinaire à l’alpha2 propre aux rats mâles, chez les rats mâles Fisher 344 (F344) (20 par groupe) exposés par inhalation au corps entier à des concentrations de 0, 50, 194, 593, 1 509 et 5 012 ppm (approximativement 0, 333, 1 290, 3 944, 10 037 et 33 335 mg/m3), 6 heures par jour, 5 jours par semaine, pendant 13 semaines. Ces lésions étaient accompagnées de concentrations légèrement accrues de créatinine et d’urée plasmatiques. De faibles changements hématologiques, cliniques biochimiques et d’analyse d’urine ont été observés, mais n’ont pas été considérés comme pertinents au plan toxicologique. Aucun signe relié au traitement de toxicité ou mortalité clinique, aucun effet statistiquement significatif sur le gain de poids corporel ou la consommation d’aliments, aucun changement ophtalmoscopique, aucun résultat général d’autopsie macroscopique ni aucun changement de poids d’organe n’ont été constatés (Cassidy et al., 2001). Aucune étude par voie orale ou cutanée n'a été recensée. |
| Toxicité chronique et cancérogénicité | Étude d’exposition par inhalation chez les rats : Des groupes de 20 rats F344 de chaque sexe ont été exposés à du HMDS par inhalation de vapeur à des concentrations de 0, 100, 400, 1 600 ou 5 000 ppm (approximativement 0, 665, 2 660, 10 640, 33 300 mg/m3), 6 heures par jour, 5 jours par semaine, pendant 1 ou 2 ans. Après 12 mois d’exposition, il y a eu une incidence accrue reliée à la dose de tumeurs à cellules de Leydig (TCL) chez les mâles à toutes les doses (2/20, 10/20, 9/20, 12/20 et 15/20 à des concentrations de 0, 665, 2 660, 10 640 et 33 300 mg/m3respectivement). Après 24 mois, on a observé des TCL chez presque tous les mâles. En outre, plusieurs adénomes et carcinomes des tubules rénaux sont survenus chez les mâles à une concentration de 10 640 mg/m3(chez 3 des 65 animaux) et à une concentration de 33 000 mg/m3(chez 6 des 65 animaux). Aucune preuve de lésions néoplasiques n’a été observée chez les femelles après 12 ou 24 mois. CMENO non néoplasique= 665 mg/m3d’après une hyperplasie à cellules de Leydig chez les mâles. Cet effet a été observé dans tous les groupes d’exposition, y compris les témoins, et avait tendance à augmenter en gravité à mesure que la concentration de l’exposition augmentait. Une incidence accrue d’inclusions éosinophiles dans l’épithélium olfactif chez les mâles à toutes les doses était conforme à l’inhalation chronique d’un irritant léger. On a également observé une augmentation du poids du foie et une augmentation de l’incidence de minéralisation intraluminale dans les reins chez les mâles à des concentrations de 10 640 mg/m3et plus. Une légère réduction du poids corporel des femelles à des concentrations de 10 640 mg/m3et plus était probablement associée à une réduction de la consommation d’aliments. Aucune étude par voie orale ou cutanée n'a été recensée. |
| Toxicité pour la reproduction | CSENO, toxicité pour la reproduction= 33 700 mg/m3selon une absence d’effets reliés au traitement sur les paramètres de reproduction chez les rats mâles et femelles Crl :CD (Sprague-Dawley) (24/sexe/groupe) exposés par inhalation à des concentrations de 0, 99, 1 030 ou 5 067 ppm (0, 658, 6 850 ou 33 700 mg/m3) dans une étude sur une génération (mâles traités 28 jours avant l’accouplement, pendant l’accouplement et jusqu’à y compris la veille de l’autopsie; les femelles traitées 28 jours avant l’accouplement, pendant l’accouplement et jusqu’à la fin du 20e jour de gestation. L’exposition des femelles a été reprise le 5e jour de la lactation et s’est poursuivie jusqu’à y compris la veille de l’autopsie).CMEO pour une toxicité systémique= 33 700 selon une augmentation du poids des poumons et du foie chez les mâles, diminution provisoire du gain de poids corporel chez les femelles et diminution provisoire de la consommation d’aliments chez les deux sexes (DowCorning Corporation, 2000). Aucune étude par voie orale ou cutanée n'a été recensée. |
| Toxicité pour le développement | Aucune étude n'a été recensée. |
| Génotoxicité et paramètres connexes : in vivo | Essai d'aberrations chromosomiques Résultats négatifs : Moelle osseuse; rats mâles Sprague-Dawley; injection intrapéritonéale (0, 255, 515 ou 1 030 mg/kg p.c., injection unique) (Isquith et al., 1988b). |
| Génotoxicité et paramètres connexes : in vitro | Mutagénicité chez les bactéries Essai de mutation de cellules de mammifères Dommages à l’ADN (essai d’élution alcaline de l’ADN) Essai d'aberrations chromosomiques Essai d'échange de chromatides sœurs |
| Sensibilisation | Dans le cadre d'un test de Draize, on n’a observé aucune incidence de la sensibilisation ou de l'irritation cutanée chez les animaux (10) exposés au HMDS à 24 ou 48 heures après provocation (DowCorning Corporation, 1992c) |
| Irritation | Irritation cutanée : Du HMDS a été appliqué à six lapins albinos (sexe non précisé) sur un tampon de coton de un pouce sur un pouce sur l’abdomen rasé et maintenu par un bandage en tissu. Dix applications ont été faites sur une période de 14 jours. On a constaté une irritation légère de la peau intacte (DowCorning Corporation, 1976). Un contact unique ou répété de HMDS avec la peau pendant plusieurs heures (jusqu’à 72 heures) ou jours (jusqu’à 16 jours) n’a pas causé d’irritation chez le lapin (DowCorning Corporation, 1978). Irritation oculaire :0,1 mL de HMDS non dilué a été instillé dans les yeux de deux lapins blancs albinos de la Nouvelle-Zélande. Après une minute, on a rincé l'œil gauche de chaque lapin à l'eau du robinet. On a examiné les deux yeux de chaque lapin 1 h, 24 h, 48 h, 72 h, 96 h et sept jours après l'instillation. Une grave irritation de l'iris et une irritation faible, voire aucune, de la conjonctive ont été observées tant dans les yeux rincés que non rincés une heure après l'instillation. Aucune irritation n'a été observée plus tard. On a conclu que le HMDS était légèrement irritant pour les yeux non rincés de lapins et à peine irritant pour les yeux de lapins rincés une minute après l'instillation (Industrial Bio-Test Laboratories, Inc., 1967a). |
| Études sur les humains | Dans le cadre d’un test épicutané sur des humains, 100 sujets (87 femmes blanches, 2 femmes hispaniques et 11 hommes blancs) ont été exposés au matériel d’essai (HMDS) pendant deux phases. La première phase (induction) consistait en neuf applications consécutives d’un timbre de 0,2 mL du matériel d’essai au même endroit toutes les 48 heures sous bandage occlusif et semi-occlusif; les timbres ont été retirés après une exposition de 24 heures. Après une période de repos de 14 jours, la même méthode (dose) a été utilisée sur un endroit non exposé auparavant (phase de provocation) et les volontaires ont retiré les timbres après 24 heures. Aucun signe de sensibilisation n’a été observé après cette application (DowCorning Corporation, 1992a). Dans le cadre d’un test épicutané sur des humains, 64 sujets (mâles et femelles) ont été exposés au matériel d’essai (HMDS) pendant deux phases. La première phase (induction) consistait en dix applications consécutives du matériel d’essai au même endroit toutes les 48 heures sous bandage non occlusif; les timbres ont été retirés après une exposition de 48 heures. Après une période de repos de 14 jours, la même méthode (dose) a été utilisée sur un endroit non exposé auparavant (phase de provocation) et les volontaires ont retiré les timbres après 48 heures. Il n’y a eu aucune réaction observable au timbre de provocation (DowCorning Corporation, 1980). |