Loi canadienne sur la protection de l'environnement (1999) Recommandations fédérales pour la qualité de l'environnement Cobalt
Tableau des matières
- Introduction
- Identité de la substance
- Utilisations
- Devenir, comportement et répartition dans l'environnement
- Concentrations mesurées
- Mode d'action
- Toxicité en milieu aquatique
- Détermination des Recommandations fédérales pour la qualité de l'environnement
- Références
- Liste des acronymes et des abréviations
Introduction
Les Recommandations fédérales pour la qualité de l'environnement (RFQE) offrent des points de référence relatifs à la qualité de l'environnement ambiant. Ces recommandations sont établies uniquement en fonction des effets ou des risques toxicologiques de substances ou de groupes de substances précis. En premier lieu, les Recommandations peuvent servir d'outil de prévention de la pollution en fournissant des objectifs acceptables pour la qualité de l'environnement. En deuxième lieu, elles peuvent aider à évaluer l'importance des concentrations des substances chimiques retrouvées actuellement dans l'environnement (surveillance des eaux, des sédiments et des tissus biologiques). Et en troisième lieu, elles peuvent servir de mesures de rendement des activités de gestion des risques. L'utilisation des RFQE est volontaire à moins d'être requise par un permis ou tout autre outil de réglementation. Donc, puisqu'elles s'appliquent au milieu ambiant, les RFQE ne sont pas des limites d'effluents à ne pas dépasser, mais peuvent être utilisées afin de déterminer ces limites. L'élaboration des RFQE relève de la responsabilité du ministre fédéral de l'Environnement, conformément à la Loi canadienne sur la protection de l'environnement (1999) (LCPE) (gouvernement du Canada (GC), 1999). L'objectif est d'élaborer des Recommandations pour appuyer l'évaluation et la gestion des risques des produits chimiques d'intérêt prioritaire recensés dans le Plan de gestion des produits chimiques (PGPC) ou d'autres initiatives fédérales. Des Recommandations fédérales pour la qualité des eaux douces visant le cobalt ont déjà été publiées (Environnement Canada, 2013) en se fondant sur l'évaluation de quatre substances contenant du cobalt (Canada, 2011). Cette évaluation a conclu que les quatre substances examinées n'étaient pas toxiques, permettant de calculer une concentration estimée sans effet (CESE) dans l'eau, qui a été adoptée subséquemment dans les Recommandations fédérales pour la qualité des eaux douces visant le cobalt (c.-à-d. 2,5 μg/L). Depuis ce temps, Canada (2017) a publié une évaluation sur le cobalt et les substances contenant du cobalt. Cette évaluation conclut que le cobalt et les composés solubles du cobalt satisfont à la définition de substance « toxique » pour l'environnement en vertu de la LCPE. En plus de cette conclusion différente en matière de toxicité, de nouvelles données scientifiques permettent le calcul d'une CESE dans l'eau qui tient compte de la dureté de l'eau, ce qui exige une révision des Recommandations fédérales pour la qualité des eaux visant le cobalt. La présente fiche d'information décrit les Recommandations fédérales pour la qualité des eaux, qui visent la protection de la vie aquatique contre le cobalt. Pour le moment, aucune RFQE n'a été élaborée pour les milieux naturels du sol, les sédiments ou les tissus biologiques
Les RFQE sont semblables aux recommandations du Conseil canadien des ministres de l’Environnement (CCME) en ce sens qu’elles sont des points de référence pour la qualité de l’environnement ambiant et sont fondées seulement sur des données relatives aux effets toxicologiques. Lorsque les données le permettent, les RFQE proviennent de méthodes du CCME. Les RFQE sont élaborées pour répondre à un besoin de recommandations au niveau fédéral (p. ex., pour soutenir des activités fédérales de gestion des risques ou de surveillance), mais seulement lorsque des recommandations du CCME pour la substance n’ont pas encore été rédigées, ou qu’il ne soit pas raisonnable de s’attendre à ce qu’elles soient mises à jour dans un avenir rapproché.
| Vie aquatique | Valeur des recommandations (µg/L)* |
|---|---|
| Eau douce | 1,0 |
* Les Recommandations fédérales pour la qualité des eaux sont utilisées lorsque les eaux ont une dureté de 100 mg/L. Dans le cas de valeurs de dureté de l'eau entre 52 et 396 mg/L, on peut faire le calcul pour les Recommandations à l'aide de l'équation suivante :
RFQ des eaux = exp{(0,414[ln(dureté)] – 1,887}
Identité de la substance
Le cobalt est un élément d'origine naturelle. Le cobalt est un oligo-élément essentiel nécessaire pour la formation de la vitamine B12 et pour sa fonction dans les processus enzymatiques (Gál et coll. 2008). Diverses sources anthropiques incluent les activités liées à la production de cobalt (c.-à-d., l'exploitation minière, la fonte et l'affinage); la fabrication, l'importation et l'utilisation de substances, de produits et d'articles manufacturés contenant du cobalt (p. ex., l'utilisation dans les procédés métallurgiques, les alliages et les carbures, les piles, les catalyseurs, le caoutchouc, les peintures et les enduits, le plastique, la fabrication d'automobiles, les cosmétiques, les pigments et les teintures, les encres d'imprimerie, les pesticides, les aliments du bétail, les engrais); la combustion de combustibles fossiles, et l'élimination et la gestion des déchets de produits et de résidus contenant du cobalt (Hodge et Dominey, 2001; PISSC, 2006; Canada 2017). Le Canada a effectué une évaluation préalable du cobalt et des substances contenant du cobalt (Canada 2017). L'évaluation a inclus les quatre composés du cobalt déjà évalués, pour lesquels des Recommandations fédérales pour la qualité des eaux avaient déjà été élaborées (Environnement Canada 2013). Une liste de substances contenant du cobalt visées par des mesures prioritaires, qui a été incluse dans l'évaluation, figure au rapport d'évaluation préalable du risque (Canada 2017). Cette fiche d'information a été élaborée en tenant compte de l'évaluation précitée qui était fondée sur des données et des renseignements recueillis jusqu'en septembre 2014. Certaines des données sur l'utilisation, les concentrations ambiantes et la toxicité, présentées ci-dessous, sont associées à cette évaluation et aux divers composés examinés dans le cadre de l'étude. Les Recommandations fédérales pour la qualité des eaux obtenues (voir la figure 1) visent l'ion de cobalt et peuvent être considérées comme pertinentes pour l'ion provenant de toutes les sources ou formes.
Utilisations
La forme élémentaire du cobalt est utilisée dans la fabrication de pigments, dans la production de produits chimiques et d'alliages (Environnement Canada, 2009; ATSDR, 2004), ainsi que dans la fabrication de piles rechargeables (CDI, 2006). Le chlorure de cobalt est employé comme catalyseur et déshydratant, alors que le sulfate de cobalt est couramment utilisé comme supplément nutritif dans l'alimentation du bétail (Environnement Canada, 2009). Les substances contenant du cobalt sont aussi utilisées dans la fonte et l'affinage de métaux non ferreux, comme intermédiaires dans les procédés métallurgiques ainsi que dans la fabrication de peintures et d'enduits, d'aimants, de caoutchouc, d'adhésifs et de scellants, d'automobiles, de plastique et d'emballages alimentaires (Canada 2017).
Devenir, comportement et répartition dans l'environnement
Le cobalt peut être présent sous diverses formes dans l'air ambiant, les eaux de surface, les sédiments, les sols et les eaux souterraines. Le cobalt est non volatil, exerçant une pression partielle nulle dans l'air (Diamond et coll. 1992). En conséquence, ses rejets dans l'air se font principalement sous forme de particules fines. Les activités anthropiques de combustion de combustibles fossiles et de déchets donnent lieu à des rejets de cobalt surtout sous forme d'oxydes. Le cobalt est également rejeté sous forme d'arséniure et de sulfure durant l'extraction et le raffinage des minerais (PISSC, 2006).
L'hydrosolubilité du cobalt et des substances contenant du cobalt varie considérablement, allant d'une très faible solubilité à des valeurs supérieures à 106 mg/L. Ainsi, si elles sont rejetées dans des plans d'eau, certaines substances libèreront plus d'ions de cobalt que d'autres lorsqu'elles se dissolvent ou se dissocient (Canada, 2017). Les poudres de cobalt élémentaire peuvent aussi libérer des ions de cobalt si elles sont rejetées dans les eaux de surface. Une certaine quantité de cobalt élémentaire non dissous peut se retrouver dans les sédiments et les sols humides lorsque le cobalt élémentaire a été libéré directement. Pour les ions de cobalt, l'état d'oxydation (II) est plus stable que l'état d'oxydation (III) (Cotton et Wilkinson, 1988), une condition qui favorise des complexes chimiques avec le cation bivalent dans les solutions aqueuses.
La distribution sol-eau du cobalt varie considérablement en fonction des propriétés du sol (Canada, 2011). Le cobalt se lie solidement aux sédiments et aux particules en suspension, et les coefficients élevés de distribution sédiments-eau laissent croire que la majeure partie du cobalt dans le milieu aquatique restera fixé aux sédiments du fond.
Les facteurs de bioaccumulation pour le cobalt varient de 7,4 à 3 110 L/kg chez les organismes aquatiques, et de 0,091 à 0,645 dans le biote et les sédiments (Canada 2017). Les études menées en laboratoire et sur le terrain ont conclu à l'absence de bioamplification du cobalt dans les réseaux trophiques. Il en est conclu que le potentiel de bioaccumulation du cobalt dans les écosystèmes naturels n'est pas élevé et que, même si le cobalt élémentaire et les composés contenant du cobalt satisfont au critère de persistance, ils ne respectent pas le critère de bioaccumulation défini dans le Règlement sur la persistance et la bioaccumulation de la LCPE (Gouvernement du Canada (GC), 2000).
À la lumière de l’information présentée dans le rapport d’évaluation préalable, le gouvernement du Canada (Canada, 2017) a conclu présentement que le cobalt et les composés solubles du cobalt satisfont aux critères définis à l’alinéa 64a) de la LCPE, c’est-à-dire qu’ils pénètrent dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir ou peut-être avoir, immédiatement ou à long terme, un effet nocif selon la LCPE sur l’environnement ou sur la diversité biologique, et, qu’en conséquence, des mesures de gestion du risque pourraient être requises.
Concentrations mesurées
À l'échelle mondiale, les concentrations de cobalt dans les zones relativement vierges varient selon le type de substrat rocheux et les conditions géologiques de surface. Elles sont habituellement de 20 à 25 mg/kg dans les sols, de moins de 1 μg/L dans les eaux douces de surface, de 0,3 à 1,7 μg/L dans les eaux de pluie et d'environ 1 ng/m3 dans l'atmosphère en régions éloignées (PISSC, 2006). Les concentrations dans des eaux de surface prélevées dans trois des sites les plus contaminés du Canada varient entre 0,025 et 2 028 μg/L (Percival et coll., 1996; Ressources naturelles Canada, 2001; Ville du Grand Sudbury, 2001, 2004). Une récente enquête de surveillance à l'échelle du Canada a révélé que les concentrations de cobalt dissous et de cobalt total se situent respectivement entre 0,002 et 64 μg/L, et entre 0,002 et 3,9 μg/L, dans les plans d'eau canadiens (Canada, 2017). Même si les émissions naturelles dépassent probablement les émissions anthropiques de cobalt dans l'environnement (Smith et Carson, 1981), une contamination anthropique restreinte peut quand même être importante et néfaste pour l'environnement, plus particulièrement dans les secteurs où l'activité industrielle a entraîné un accroissement des concentrations ambiantes.
Mode d'action
Tel que mentionné ci-dessus, le cobalt est un oligo-élément essentiel. Néanmoins, le mode d'action toxique du cobalt n'est pas encore parfaitement compris. On sait que cette substance inhibe diverses enzymes et que ceci entraîne une diminution de la respiration et du métabolisme tissulaire (Smith et Carson, 1981). Par exemple, le cobalt entrave notamment le cycle de l'acide citrique et peut aussi inhiber ou stimuler différentes enzymes du foie, y compris des enzymes qui métabolisent des médicaments. À son état 2+, l'ion de cobalt peut remplacer d'autres cations bivalents, réagissant avec le groupe thiol d'acides aminés, les protéines et autres coenzymes et cofacteurs, ce qui provoque une modification de l'activité enzymatique (Smith et Carson, 1981).
Toxicité aquatique
Il a été démontré que le cobalt est toxique pour les organismes aquatiques, parfois dans des concentrations observées dans les milieux contaminés. Il existe une multitude de données empiriques dans la documentation portant sur la toxicité aquatique à court et à long terme du chlorure de cobalt, du sulfate de cobalt et d'autres composés solubles du cobalt, qui, après leur rejet dans l'eau, se transforment, dans une plus ou moins grande mesure, en espèces biodisponibles de cobalt dissous, plus particulièrement, l'ion libre Co2+. Étant donné que la toxicité des métaux est souvent influencée par la dureté de l'eau, le pH, la force ionique et le carbone organique dissous (CDI, 2009; Canada, 2017), les données sur la toxicité sont normalisées en fonction des effets de ces facteurs, lorsque c'est possible, selon les besoins de l'évaluation. Au Canada (2017), il a été déterminé que la dureté était le facteur modifiant clé pour la toxicité du cobalt parmi les divers paramètres de qualité de l'eau qui pourraient potentiellement avoir une influence sur l'absorption et la toxicité du métal. Parmi les ensembles de données acceptables, une étude (Parametrix, 2010) a évalué l'influence de la dureté de l'eau sur la toxicité du cobalt pour Ceriodaphnia dubia et la tête-de-boule. D'après cette étude, une équation établissant un lien entre la toxicité du cobalt et la dureté de l'eau (allant de 52 à 396 mg/L) a été élaborée. Toutes les données acceptables sur la toxicité du cobalt ont été corrigées subséquemment pour adopter la valeur de 100 mg/L en utilisant cette équation dans le cadre du processus d'élaboration des Recommandations fédérales pour la qualité des eaux.
Parmi les études examinées aux fins du rapport d’évaluation préalable, sept études ont fourni des données acceptables sur la toxicité à long terme chez 13 espèces différentes, les valeurs corrigées en fonction de la dureté variant de 2,2 à 2 055 μg/L pour divers indicateurs de résultat (tableau 1). Même si les invertébrés sont plus sensibles au cobalt que les poissons, les sensibilités se chevauchent toutefois entre les taxons. Hyalella azteca était l’espèce la plus sensible, tandis que la truite arc-en-ciel (Oncorhynchus mykiss) était celle qui l’était le moins. L’espèce de poisson et l’espèce végétale les plus sensibles étaient respectivement le poisson zèbre (Brachydanio=Danio rerio) et la lenticule mineure (Lemna minor). L’espèce d’invertébré et l’espèce végétale les moins sensibles étaient respectivement l’oligochète Aeolosoma et l’algue verte (Chlamydomonas reinhardtii).
Élaboration des Recommandations fédérales pour la qualité des eaux
Les Recommandations fédérales pour la qualité des eaux, élaborées dans le présent document, définissent des points de référence fondés sur la dureté de l'eau pour les écosystèmes aquatiques, dont l'objectif est de protéger toutes les formes de vie aquatique durant des périodes d'exposition indéfinies. Une courbe de distribution de la sensibilité des espèces (DSE) a été établie à partir de données sur la toxicité à long terme (normalisées pour une dureté de l'eau de 100 mg/L) (tableau 2) pour treize espèces, soit trois espèces de poissons, six espèces d'invertébrés et quatre espèces de végétaux ou d'algues (figure 1). Chacune des espèces, pour lesquelles des données de toxicité appropriées étaient disponibles, a été classée selon son niveau de sensibilité, et sa position a été déterminée sur la courbe DSE. Les concentrations sont exprimées en microgrammes de cobalt par litre (μg Co/L). Par conséquent, les Recommandations fédérales pour la qualité des eaux dérivées de ces données s'appliquent au cobalt total plutôt qu'aux composés évalués (p. ex., CoCl2).
| Espèce | Groupe | Indicateur de résultat | Concentration (μg/L) |
Référence |
|---|---|---|---|---|
| Amphipode (Hyalella azteca) |
I | CI10 après 28 jours (croissance) |
2,2* | Norwood et coll., 2007; Heijerick et coll., 2007 |
| Puce d'eau (Daphnia magna) |
I | CE10 après 21 jours (reproduction) |
22,6 | Heijerick et coll., 2007 |
| Lenticule mineure (Lemna minor) |
P | CE10 après 7 jours (croissance) |
6,3 | Heijerick et coll., 2007 |
| Puce d'eau (Ceriodaphnia dubia) |
I | CE10 après 21 jours (reproduction) |
7,7 | Parametrix, 2010 |
| Escargot (Lymnea stagnalis) |
I | CE10 après 28 jours (croissance) |
8,36 | Heijerick et coll., 2007 |
| Algue verte (Pseudokirchneriella subcapitata) |
P | CE10 après 4 jours (croissance) |
31 | Heijerick et coll., 2007 |
| Moucheron (Chironomus tentans) |
I | CE10 après 20 jours (survie) |
202 | Pacific Ecorisk, 2005 |
| Spirodèle polyrhize (Spirodela polyrhiza) |
P | CE50 après 4 jours (croissance) |
257 | Gaur et coll., 1994 |
| Oligochète (Aeolosoma) |
I | CE10 après 14 jours (croissance) |
200 | Parametrix, 2010 |
| Poisson zèbre (Brachydanio rerio) |
F | CE10 après 16 jours (survie) |
348 | Dave et Xiu, 1991 |
| Tête-de-boule (Pimephales promelas) |
F | CE10 après 35 jours (survie) |
339 | Parametrix, 2010 |
| Algue verte (Chlamydomonas reinhardtii) |
P | CE30 après 5 jours (croissance) |
2 055 | Macfie et coll., 1994 |
| Truite arc-en-ciel (Oncorhynchus mykiss) |
F | CE10 après 81 jours (biomasse) |
2 049 | Parametrix, 2010 |
Légende :
F = Poisson;
I = Invertébré;
P = Plante;
*Moyenne géométrique
Remarque : CIx/CEx = Concentration inhibitrice / entraînant des effets sur X pour cent de la population;
Conformément au protocole du Conseil canadien des ministres de l'environnement (CCME, 2007), plusieurs fonctions de distribution cumulative ont été adaptées aux données à l'aide des méthodes de régression, et le choix du meilleur modèle s'est fondé sur l'examen de la validité de l'ajustement. Le modèle normal donne les meilleurs résultats lors d'une inspection visuelle, les plus faibles niveaux de variabilité statistique (résidus), une distribution équilibrée des résidus, le plus faible intervalle de confiance normalisé et la meilleure signification du test statistique de Anderson-Darling (A2) = 0,384 (p inférieur(e) à 0,05). Le 5e percentile (HC5), c.-à-d. la concentration dangereuse pour 5 % de l'espèce, de la courbe de DSE, est de 1,0 μg/L avec des limites de l'intervalle de confiance de 0,5 et 2,0 μg/L.
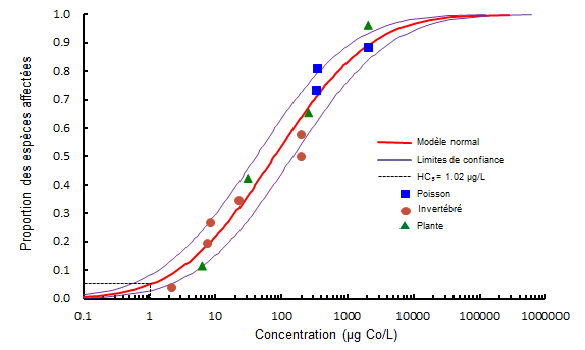
Longue description pour la figure 1
Distribution de la sensibilité des espèces (DSE) pour le cobalt dissous d'après les données de toxicité chroniques sélectionnées pour les organismes aquatiques d'eau douce. Le modèle Normal adapté aux données est présenté sur le graphique avec les intervalles de confiance de 95 %. Les données utilisées dans la DSE sont répertoriées à l'annexe 4. Cette figure montre que la sensibilité des organismes au cobalt dissous est répartie selon une courbe en S. Parmi les 14 points de données, trois sont en dehors des intervalles de confiance de 95 % de la courbe. Ils se trouvent aux deux extrémités de la forme ainsi qu'au milieu.
Étant donné que la dureté de l’eau était un facteur modifiant de toxicité significatif, les Recommandations fédérales pour la qualité des eaux sont exprimées sous forme d’équation où la dureté propre au site doit être entrée afin de calculer les recommandations propres à un site. Cette équation est fondée sur une valeur de courbe de toxicité-dureté de 0,414 et la valeur du 5e percentile de 1,0 μg/L est dérivée de la DSE lorsque la dureté est égale à 100 mg/L.
D’après la valeur de la courbe de toxicité-dureté et la DSE, l’équation pour obtenir les Recommandations fédérales pour la qualité des eaux visant Co est la suivante :
Point d’intersection avec l’axe y = ln(5epercentile) – [courbe de dureté × ln(dureté)]
= ln(1,02) – [0,414 × ln(100)]
= – 1,887
RFQ des eaux (μg/L) = e{(0,414[ln(dureté)] – 1,887}
Des Recommandations fédérales pour la qualité des eaux visant le cobalt à des concentrations de dureté de l’eau distinctes sont présentées au tableau 3. Étant donné que la courbe qui établit un lien entre la dureté et la toxicité était fondée sur une étude des niveaux de dureté allant de 52 à 396 mg/L, les Recommandations ne devraient pas être extrapolées au-delà de cette gamme de valeurs de dureté. En conséquence, les Recommandations minimales et maximales visant le cobalt, à des niveaux de dureté de l’eau de 52 et de 396 mg/L, sont respectivement de 0,78 et 1,80 µg/L.
| Dureté (mg/L) |
RFQ des eaux (μg/L) |
|---|---|
| 52 | 0,78 |
| 100 | 1,0 |
| 150 | 1,2 |
| 200 | 1,4 |
| 250 | 1,5 |
| 300 | 1,6 |
| 350 | 1,7 |
| 396 | 1,8 |
Références
ATSDR (Agency for Toxic Substances and Disease Registry). 2004. Toxicological Profile for Cobalt. Department of Health and Human Services, ATSDR. [consulté le 9 mars 2010].
Canada. 2000. Loi canadienne sur la protection de l'environnement : Règlement sur la persistance et la bioaccumulation, C.P. 2000-348, 23 mars 2000, DORS/2000-107.
Canada. Ministère de l'Environnement, ministère de la Santé. 2011. Évaluation préalable pour le Défi concernant le cobalt (cobalt élémentaire), Numéro de registre du Chemical Abstracts Service 7440-48-4; chlorure de cobalt, Numéro de registre du Chemical Abstracts Service 7646-79-9; acide sulfurique, sel (1:1) de cobalt (2+) (sulfate de cobalt), Numéro de registre du Chemical Abstracts Service 10124-43-3; acide sulfurique, sel de cobalt (sulfate de cobalt), Numéro de registre du Chemical Abstracts Service 10393-49-4. Rapport préparé par : Environnement Canada, Santé Canada, Programme des substances existantes. 124 pages. Gatineau (Québec).
Canada. Ministère de l'Environnement et ministère de la Santé 2017. Évaluation préalable du cobalt et des substances contenant du cobalt. Rapport préparé par Environnement Canada et Santé Canada, Programme des substances existantes. 157 pages. Gatineau (Québec).
CCME (Conseil canadien des ministres de l'environnement). 2007. Protocole d'élaboration des recommandations pour la qualité des eaux en vue de protéger la vie aquatique. Dans : Recommandations canadiennes pour la qualité de l'environnement, 1999, Conseil canadien des ministres de l'environnement, Winnipeg.
CDI (Cobalt Development Institute). 2006. Cobalt Fact Sheet 8: Electronics. Surrey (Royaume-Uni). [consulté le 5 février 2010].
CDI (Cobalt Development Institute). 2009. Development of Protective Water Quality Concentrations for Cobalt - Data in preparation. Aquatic Research Program. The Cobalt Development Institute. Guildford, Surrey (Royaume-Uni).
Ville du Grand Sudbury. 2001. City of Greater Sudbury's 2001 Lake Water Quality Initiative. Living with Lakes initiative.
Ville du Grand Sudbury. 2004. Programme de la qualité des eaux lacustres 2004. Rapport annuel. City of Lakes initiative.
Cotton, F.A., et Wilkinson, G. 1988. Advanced inorganic chemistry, 5e édition. Toronto (Ont.) : John Wiley and Sons. 1 455 p.
Dave, G., Xiu, R. 1991. Toxicity of Mercury, Nickel, Lead, and Cobalt to Embryos and Larvae of Zebrafish, Brachydanio rerio. Arch. Environ. Contam. Toxicol. 21:126-134.
Diamond, M.L., Mackay, D., Welbourn, P.M. 1992. Models of multi-media partitioning of multi-species chemicals: the fugacity/equivalence approach. Chemosphere 25: 91907-21.
Environnement Canada. 2009. Données sur les substances du lot 10 recueillies en vertu del'article71 de laLoi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances du lot 10 identifiées dans le Défi. Données préparées par : Environnement Canada, Programme des substances existantes.
Environnement Canada. 2013. Recommandations fédérales pour la qualité de l'environnement : Cobalt. Gatineau (Qc) : Environnement Canada, Bureau national des recommandations et des normes.
Gál, J., Hursthouse, A., Tatner, P., Stewart, F., Welton, R. 2008. Cobalt and secondary poisoning in the terrestrial food chain: Data review and research gaps to support risk assessment. Environ. Int. 34: 821-838.
Gaur, J.P., Noraho, N., Chauhan, Y.S. Chauhan. 1994. Relationship between heavy metal accumulation and toxicity in Spirodela polyrhiza (L.) Schleid and Azolla pinnata R. Br. Aquat. Bot. 49; 183-192.
[GC] Gouvernement du Canada. 1999. Loi canadienne sur la protection de l'environnement (1999). L.C., 1999, ch. 33. Gazette du Canada, Partie III, vol. 22, nº 3.
[GC] Gouvernement du Canada. 2000. Loi canadienne sur la protection de l'environnement (1999) : Règlement sur la persistance et la bioaccumulation, C.P. 2000-348, 29 mars, 2000, DORS/2000-107.
Heijerick, D., Ghekiere, A., Van Sprang, P., De Schamphelaere, K., Deleebeeck, N., Janssen, C. 2007. Effect of cobalt (CoCl2.6H2O) on freshwater organisms. Laboratoire d'essai : EURAS & Laboratory of Environmental Toxicology, Ghent University. Un rapport au Cobalt Development Institute. Guildford, Surrey (Royaume-Uni). CDI Study Number 20. Hodge, F.G., et Dominey, L. 2001. Cobalt and cobalt alloys. Kirk-Othmer Encyclopedia of Chemical Technology.
PISSC (Programme international sur la sécurité des substances chimiques) 2006. Cobalt and inorganic cobalt compounds. Genève (CH) : Organisation mondiale de la Santé. (Résumé succinct international no 69 sur l'évaluation des risques chimiques). Financé conjointement par le Programme des Nations Unies pour l'environnement, l'Organisation internationale du travail et l'Organisation mondiale de la santé, dans le cadre du Programme interorganisations pour la gestion rationnelle des produits chimiques.
Macfie, S.M., Tarmohamed, Y., Welbourn, P.M. 1994. Effects of cadmium, cobalt, copper, and nickel on growth of the green alga Chlamydomonas reinhardtii: the influences of the cell wall and pH. Arch. Environ. Contam. Toxicol. 27: 454-458.
Norwood, W.P., Borgmann, U., Dixon, D.G. 2007. Chronic toxicity of arsenic, cobalt, chromium and manganese to Hyalella azteca in relation to exposure and bioaccumulation. Environ. Pollut. 147: 262-272.
RNCan (Ressources naturelles Canada). 2001. Phase I : Lake sediment studies in the vicinity of the Horne smelter in Rouyn-Noranda, Quebec, CGC-Dossier public 2952.
Pacific Ecorisk. 2005. An Evaluation of the Acute Toxicity of Cobalt in Panther Creek Water to Three Resident Invertebrate Species (Brachycentrus americanus, Centroptilum conturbatum, and Serratella tibialis) and the Acute and Chronic Toxicity of Cobalt in Panther Creek Water to Chironomus tentans and Oncorhynchus mykiss. Laboratoire d'essai : Pacific Ecorisk, Martinez, CA. Un rapport au Blackbird Mine Site Group.
Parametrix. 2010. Acute and chronic toxicity of cobalt to freshwater organisms: Cobalt AWQC/PNEC development – Study 20. Laboratoire d'essai : Parametrix Environmental Research Laboratory. Un rapport au Cobalt Development Institute. Guildford, Surrey (Royaume-Uni). CDI Study Number 20. Percival, J.B., Dumaresq, C.G., Kwong, Y.T.J., Hendry, K.B., Michel, F.A. 1996. Arsenic in surface waters, Cobalt, Ontario. Current Research; Commission géologique du Canada. 137-146.
Smith, I.C., et Carson, B.L. 1981. Trace metals in the environment. Volume 6: Cobalt Ann Arbor Publishers: Ann Arbor (MI). 65-66, 1 202 p.
Liste des acronymes et des abréviations
- ATSDR
- Agency for Toxic Substances and Disease Registry
- CCME
- Conseil canadien des ministres de l’environnement
- CDI
- Cobalt Development Institute
- LCPE
- Loi canadienne sur la protection de l’environnement
- PGPC
- Plan de gestion des produits chimiques
- CE
- Concentration entraînant un effet
- RFQE
- Recommandations fédérales pour la qualité de l’environnement
- RFQ des eaux
- Recommandations fédérales pour la qualité des eaux
- CI
- Concentration inhibitrice
- PISSC
- Programme international sur la sécurité des substances chimiques
- RNCan
- Ressources naturelles Canada
- CESE
- Concentration estimée sans effet
- REP
- Rapport d’évaluation préalable
- DSE
- Distribution de la sensibilité des espèces