Rapport d'évaluation préalable pour le Défi
Archivée
Méthyloxirane
(oxyde de propylène)
Numéro de registre du Chemical Abstracts Service
75-56-9
Environnement Canada
Santé Canada
Juillet 2008
Table des matières
- Synopsis
- Introduction
- Identité de la substance
- Propriétés physiques et chimiques
- Sources
- Utilisations
- Rejets dans l’environnement
- Devenir dans l’environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d’effets nocifs sur l’environnement
- Potentiel d’effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe 1 : Valeurs estimées de la limite supérieure de l'absorption quotidienne de méthyloxirane (no CAS 75-56-9) par la population générale au Canada
- Annexe 2 : Concentrations prévues du méthyloxirane dans les milieux naturels
- Annexe 3 : Exposition estimée du méthyloxirane par les adultes à partir de produits de consommation
- Annexe 4 : Résumé des renseignements sur les effets sur la santé du méthyloxirane
Les ministres de l’Environnement et de la Santé ont réalisé une évaluation préalable du méthyloxirane dont le numéro de registre du Chemical Abstract Service (CAS) est 75 56 9. Une priorité élevée a été accordée à la prise de mesures à l’égard de cette substance lors de la catégorisation visant la Liste intérieure des substances dans le cadre du Défi lancé par les ministres, car on considère qu’elle présente le plus fort risque d’exposition (PFRE) pour les Canadiens et que d’autres organismes l’ont classé pour ses effets cancérogènes et génotoxiques. Comme cette substance répond au critère de catégorisation écologique de la persistance, mais non aux critères de la bioaccumulation ou de la toxicité intrinsèque pour les organismes aquatiques, la présente évaluation est donc axée sur les aspects relatifs à la santé humaine.
La quantité de méthyloxirane déclarée avoir été importée en 2006 est supérieure à 10 000 000 kg. Cette substance est surtout utilisée à titre de monomère dans la production de polymères de polyétherpolyols et une certaine quantité est destinée à la production de propylèneglycol.
L’exposition de la population canadienne au méthyloxirane devrait surtout se faire à partir de l’air, en se basant sur les rejets potentiels dans ce milieu ainsi que sa pression de vapeur élevée. Les renseignements, par ailleurs très limités, sur ses concentrations dans les milieux naturels et la modélisation de sa fugacité indiquent que l’exposition dans l’environnement général devrait être faible. L’exposition au méthyloxirane pourrait cependant être importante au cours de l’utilisation de produits qui en contiennent.
Sur la base essentiellement des évaluations fondées sur la méthode du poids de la preuve réalisées par plusieurs organismes internationaux et nationaux, le pouvoir cancérogène, déterminé par l’observation de tumeurs des fosses nasales chez le rat et la souris, est l’un des effets critiques permettant de caractériser le risque pour la santé humaine. Le méthyloxirane s’est aussi avéré génotoxique au cours de plusieurs essais in vitro et in vivo. Par conséquent, et en dépit du fait que le mode d’induction des tumeurs n’a pas été clairement élucidé, on ne peut exclure la possibilité que les tumeurs observées chez les animaux de laboratoire découlent d’une interaction directe avec le matériel génétique. En outre, la limite supérieure de l’exposition estimée par inhalation au cours de l’utilisation de produits de consommation contenant du méthyloxirane peut presque atteindre ou dépasser la concentration ayant un effet critique autre que le cancer dans les fosses nasales.
Compte tenu de la cancérogénicité du méthyloxirane, pour lequel il peut exister une probabilité d’effet nocif à tout niveau d’exposition et de l’inadéquation possible de la marge entre l’exposition estimée à partir des produits et du niveau critiques pour les effets autres que le cancer, il est conclu que le méthyloxirane est une substance qui peut pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
À la lumière des dangers écologiques et des rejets déclarés de méthyloxirane, il est conclu que cette substance ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique ni à mettre en danger l'environnement essentiel pour la vie. De plus, le méthyloxirane répond au critère de la persistance du Règlement sur la persistance et la bioaccumulation, mais non au critère qui y est énoncé sur le potentiel de bioaccumulation.
Cette substance s'inscrira dans la mise à jour de l’inventaire de la Liste intérieure des substances, qui débutera en 2009. De plus, des activités de recherche et de surveillance viendront, le cas échéant, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable et, le cas échéant, la performance des mesures de contrôle possibles déterminées à l'étape de la gestion des risques.
Compte tenu des renseignements disponibles, le méthyloxirane remplit un ou plusieurs critères de l’article 64 de la Loi canadienne sur la protection de l’environnement (1999).
La Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)] (Canada, 1999) impose aux ministres de l’Environnement et de la Santé de faire une évaluation préalable des substances qui répondent aux critères de la catégorisation énoncés dans la Loi, afin de déterminer si ces substances présentent ou sont susceptibles de présenter un risque pour l’environnement ou la santé humaine. À partir des résultats de l’évaluation préalable, les ministres peuvent proposer de ne rien faire à l’égard de la substance, de l’inscrire sur la Liste des substances d’intérêt prioritaire (LSIP) en vue d’une évaluation plus détaillée ou de recommander son inscription sur la Liste des substances toxiques de l’annexe 1 de la Loi et, s’il y a lieu, la quasi-élimination de ses rejets dans l’environnement.
En se fondant sur l’information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu’une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères de la catégorisation relatifs à l’environnement [persistance (P), potentiel de bioaccumulation (B) et toxicité intrinsèque (Ti) pour les organismes aquatiques] et que l’on croit être commercialisées au Canada;
- celles qui répondent aux critères de la catégorisation pour le plus fort risque d’exposition (PFRE) ou qui présentent un risque d’exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine à la lumière des classements effectués par d’autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont publié un avis d’intention dans la Partie I de la Gazette du Canada (Canada, 2006), dans lequel ils mettent au défi l’industrie et les autres intervenants intéressés de fournir, selon un calendrier déterminé, des renseignements particuliers sur les substances qui pourraient servir à étayer l’évaluation des risques. Ces renseignements pourraient aussi servir à élaborer et à évaluer comparativement les meilleures pratiques de gestion des risques et de gérance des produits pour ces substances jugées hautement prioritaires.
Le méthyloxirane a été jugé hautement prioritaire pour l’évaluation des risques qu’il comporte pour la santé humaine, car il a été jugé présenter un PFRE et a été classé par d’autres instances sur la base de sa cancérogénicité et de sa génotoxicité. Le volet du Défi portant sur cette substance a été lancé le 3 février 2007 au moyen d’un avis paru dans laGazette du Canada (Canada, 2007a). Le profil de cette substance a été publié en même temps. Ce profil présentait l’information technique, obtenue avant décembre 2005, sur laquelle a reposé la catégorisation de cette substance. En réponse au Défi, on a reçu des documents présentant des renseignements.
Même si l’évaluation des risques du méthyloxirane pour la santé humaine a été jugé hautement prioritaire et que la substance remplit le critère de la catégorisation écologique de la persistance, elle ne remplit pas celui du potentiel de bioaccumulation ou de la toxicité intrinsèque pour les organismes aquatiques. La présente évaluation est donc axée sur l’information pertinente à l’évaluation des risques pour la santé humaine.
Les évaluations préalables effectuées en vertu de la LCPE (1999) portent sur les renseignements essentiels pour établir si une substance répond ou non aux critères de toxicité des substances chimiques énoncés dans l’article 64 de la Loi, qui se lit comme suit :
64. « ...est toxique toute substance qui pénètre ou peut pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à :
- avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique;
- mettre en danger l’environnement essentiel pour la vie;
- constituer un danger au Canada pour la vie ou la santé humaine. »
Les évaluations préalables mettent en lumière les renseignements scientifiques et présentent les conclusions que l’on peut dégager en appliquant la méthode du poids de la preuve et la prudence.
Cette évaluation préalable inclue l’examen des renseignements sur les propriétés chimiques, les dangers, les utilisations et l’exposition, à l’inclusion des renseignements additionnels fournis dans le cadre du Défi. Des données pertinentes à l’évaluation préalable de cette substance ont été relevées dans des publications originales, des rapports de synthèse et d’évaluation, des rapports de recherche de parties intéressées et d’autres documents accessibles lors de recherches menées dernièrement, jusqu’en juillet 2007. Les études importantes ont fait l’objet d’évaluations critiques. Les études clés ont fait l’objet d’évaluation critique ; les résultats de la modélisation ont pu être utilisés dans la formulation de conclusions. L’évaluation des risques pour la santé humaine comprends l’examen de données pertinentes à l’évaluation de l’exposition (non professionnelle) de la population dans son ensemble et de l’information sur les dangers pour la santé (surtout fondée sur des évaluations réalisées par d’autres organismes selon la méthode du poids de la preuve et ayant servi à déterminer le caractère prioritaire de la substance). Les décisions reposent sur la nature de l’effet critique retenu ou sur l’écart entre les valeurs prudentes donnant lieu à des effets et les estimations de l’exposition tenant compte de la confiance accordée au caractère exhaustif des bases de données sur l’exposition et les effets, cela dans le contexte d’une évaluation préalable. Les évaluations préalables ne sont pas le résultat d’examens critiques ou exhaustifs de toutes les données disponibles. Elles présentent plutôt les informations critiques selon lesquelles la conclusion est basée.
La présente évaluation préalable a été effectuée par le personnel des Programme des substances existantes de Santé Canada et d’Environnement Canada et elle intègre des résultats provenant d’autres programmes appliqués par ces ministères. Cette évaluation préalable a fait l’objet d’une consultation indépendante par des pairs. Des commentaires sur les portions techniques concernant la santé humaine ont été reçus par des experts scientifiques qui y ont participé ont été choisis et dirigés par Toxicology Excellence for Risk Assessment (TERA) et comprenaient John Christopher (California Department of Toxic Substances Control), Michael Jayjock (The Lifeline Group), Donna Vorhees (The Science Collaborative) et Joan Strawson (TERA). Gradient Corporation a également donné son avis sur ces parties. Bien que les commentaires externes aient été pris en considération, Santé Canada assume la responsabilité du contenu final de l’évaluation préalable pour tout ce qui concerne la santé humaine. De plus, une version provisoire de la présente évaluation préalable a fait l’objet d’une consultation publique de 60 jours. Les considérations et les renseignements importants à la base du présent rapport sont présentés ci après.
Synonymes courants : oxyde de propylène, 1,2-époxypropane
Un résumé des propriétés physiques et chimiques les plus importantes du méthyloxirane est présenté dans le tableau 1. À la température ambiante, le méthyloxirane est un liquide incolore, très soluble dans l'eau et très volatil.
| Propriété | Valeur/unité | Référence |
|---|---|---|
| [*] Température de 20 à 25 °C [**] Valeurs initiales en unités autres que celles du Système international. |
||
| Structure chimique |  |
|
| Masse moléculaire | 58,08 g/mole | (PhysProp, 2003) |
| état physique (température et pression normales) | liquide incolore à odeur sucrée rappelant l'éther | (EURAR, 2000) |
| Masse volumique | 831 kg/m3(à 20 °C) | BASF, 1977a |
| Point d'ébullition (PE) | 33,9 – 35 °C | (American Chemical Society, 1952; Jefferson Chemical Company, 1960; Plunkett, 1987; BASF, 1995; PhysProp, 2003) |
| Point de fusion (PF) | -112,16 à -111 °C | (McDonald et al., 1959; Oetting, 1964; Howard, 1989; BASF, 1995; PhysProp, 2003) |
| Log Koe | 0,03; 0,08 ± 0,05 | (Deneer et al., 1988; Howard, 1989; Hansch et al., 1995) |
| Log Kco | 0,37 (est.) | (PCKOCWIN, 2000) |
| Constante de la loi de Henry (CLH) | 1,226×10 -4atm·m3/mole (est.) | (HENRYWIN, 2000) |
| Pression de vapeur (PV)[*] | 60,7 – 71,55 kPa; 59,2 kPa (8,59 PSI[**]); 70,9 – 71,7 kPa (532,1 - 538 mm Hg[**]) |
(American Chemical Society, 1952; BASF, 1967; Dow, 1977; Boubliket al., 1984; Howard, 1989; Aldrich Chemical Co., 2003) |
| Solubilité dans l'eau (SE)[*] | 400 – 590 g/L | (Bogyo et al., 1980; BASF, 1995) |
Le méthyloxirane n'existe pas à l'état naturel. Les deux principaux procédés utilisés pour sa fabrication en grandes quantités à partir du propylène sont la peroxydation et la chlorohydrination.
Selon les renseignements fournis conformément à l’avis concernant le méthyloxirane publié en vertu de l’article 71 de la LCPE (1999), aucune entreprise canadienne n’a déclaré avoir fabriqué cette substance en une quantité d’au moins 100 kg en 2006. Des entreprises canadiennes ont déclaré avoir importé du méthyloxirane en une quantité supérieure à 10 000 000 kg pendant l’année civile 2006 (Canada, 2007b).
Les présentations faites conformément à l’article 71 de la LCPE (1999), les réponses au questionnaire du Défi, des données communiquées volontairement (Canada, 2007b) et des publications scientifiques et techniques montrent que le méthyloxirane est surtout utilisé à titre de monomère dans la production de polymères de polyétherpolyols. Ces derniers servent à la fabrication de mousses de polyuréthane destinées aux industries de l’ameublement et de l’automobile. Le méthyloxirane peut aussi être utilisé pour la fabrication du propylèneglycol, comme agent de modification de l’amidon alimentaire, dans des applications où il peut y avoir contact avec des aliments, dans des cosmétiques et des produits d’hygiène personnelle, dans des résines, des encres et des lubrifiants synthétiques, comme additif détergent et inhibiteur de corrosion dans les carburants automobiles ainsi que dans les solvants pour le retrait de joints d’étanchéité, les nettoyants, les agents antimousses de produits pétroliers, les additifs de carburants et les adhésifs (Dow, 1981; Sack et al., 1992; Trent, 2001; Union européenne, 2002; Dow, 2007). Le propylèneglycol fabriqué à partir de méthyloxirane peut aussi servir à la production de résines de polyesters insaturées, notamment dans les industries du textile et des matières plastiques, et peut être utilisé dans des produits pharmaceutiques et des dégivrants pour avions (Dow, 1981; Trent, 2001; Union européenne, 2002; Dow, 2007). Le propylèneglycol sert aussi à la fabrication d’éthers de glycol utilisés comme solvants dans les peintures et les vernis (Trent, 2001). Le méthyloxirane en tant que tel n’a pas d’utilisations rapportées dans la base de données de déclaration des cosmétiques de Santé Canada (Santé Canada, Division des cosmétiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, communication personnelle, 9 juin 2008, non référencée). Cependant, le méthyloxirane se trouve dans les décapants (Henkel, 2008).
Le méthyloxirane est utilisé aux états-Unis pour la fumigation des fruits secs et la fumigation en vrac de plusieurs produits alimentaires comme le cacao, les épices, la chair de noix traitée, l'amidon et la gomme (Union européenne, 2002; US EPA, 2005). Cette substance n'est pas homologuée à titre de produit antiparasitaire au Canada et les produits traités aux états-Unis (ou ailleurs) et importés au Canada ne peuvent contenir plus de 0,1 ppm de méthyloxirane (ARLA, 2006).
Le méthyloxirane est un additif alimentaire autorisé par la Loi sur les aliments et drogues et le Règlement sur les aliments et drogues de Santé Canada (Justice Canada, 1985) et il est soumis aux conditions qui en assurent un usage limité, empêchant une exposition par la consommation de nourriture. Il figure comme substance de conservation (antimicrobienne) dans la liste des ingrédients non médicinaux des produits de santé naturels de Santé Canada (DGPSA, 2007).
Le méthyloxirane n’est pas fabriqué au Canada à des fins commerciales en quantités supérieures à 100 kg (Canada, 2007b). La demande nationale est satisfaite grâce à des importations en provenance des états-Unis. En 1999, l’approvisionnement et la consommation de méthyloxirane ont totalisé 51 500 tonnes au Canada, mais, en 2002, la quantité importée avait chuté à 38 000 tonnes (IPC, 2003). L’Inventaire national des rejets de polluants du Canada ne signalait qu’un seul émetteur en Ontario en 2005. Les rejets déclarés étaient tous atmosphériques et leur volume a diminué de façon constante pour passer de 10,4 tonnes en 1999 à 5,16 tonnes en 2002 et à 0,059 tonne en 2005 (INRP, 2006). Selon des renseignements récemment obtenus en vertu de la LCPE(1999) au moyen d’un avis concernant le méthyloxirane donné en application de l’article 71, des entreprises ont déclaré le rejet de cette substance en 2006 en une quantité inférieure à 50 kg, soit la valeur seuil de déclaration (Canada, 2007b).
La principale source de rejet dans l’environnement résulte de l’évaporation et de l’évacuation de gaz au cours de la production de substances pour lesquelles on utilise le méthyloxirane comme intermédiaire chimique, ainsi qu’au cours du stockage, de la manutention, du transport et de l’utilisation. L’évacuation des gaz de procédés semble être la plus importante source des rejets atmosphériques. Des rejets de méthyloxirane peuvent aussi avoir pour origine les gaz d’échappement des véhicules automobiles et les gaz de combustion de sources fixes utilisant des hydrocarbures. Les rejets présents dans les gaz sont souvent éliminés par lavage tandis que les déchets liquides sont incinérés (PISC, 1985; ME de l’Ontario, 2001).
À cause de sa pression de vapeur de 71,5 kPa, le méthyloxirane ne devrait exister que sous forme gazeuse dans l’atmosphère. étant donné sa très forte solubilité dans l’eau, il peut être entraîné de l’atmosphère par la pluie (PISC, 1985). Dans l’eau, il s’hydrolyse rapidement - entre 11 et 22 jours (tableau 3) - pour former du propylèneglycol. Cette dégradation est accélérée en présence des ions chlorure, de sorte que son élimination chimique sera plus rapide dans l’eau de mer que dans l’eau douce (Union européenne, 2002). La valeur de la constante de la loi de Henry du méthyloxirane, estimée à 1,23 × 10-4 atm·m3/mole, explique le fait que sa volatilisation à partir des surfaces humides devrait être moyenne. La valeur estimée de son log Kco (0,37) indique qu’il ne devrait pas s’adsorber sur les matières en suspension et les sédiments et qu’il devrait être très mobile dans ces milieux. Son évaporation à partir des surfaces des sols devrait donc être importante (Meylan et al., 1986).
Les résultats de l’application d’un modèle de la fugacité de niveau III, qui prévoit la répartition du méthyloxirane dans l’environnement, sont résumés dans le tableau 2. Il est à noter que les pourcentages élevés de répartition dans le sol pourraient être surestimés car le modèle ne prend pas en compte les processus du devenir, comme la volatilisation à partir d’un sol sec et la migration verticale dans le sol. étant donné les propriétés physiques et chimiques du méthyloxirane, ces processus devraient jouer un rôle important.
| Rejet de la substance dans | Fraction de la substance répartie dans chaque milieu (%) | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| l'air (100 %) | 88,0 | 10,3 | 1,6 | 0,02 |
| l'eau (100 %) | 4,5 | 95,3 | 0,1 | 0,18 |
| le sol (100 %) | 7,6 | 18,0 | 74,4 | 0,03 |
| l'air, l'eau et le sol (33 % chacun) | 15,4 | 44,0 | 40,6 | 0,08 |
Persistance
La demi-vie du méthyloxirane résultant de sa réaction dans l’air avec des radicaux hydroxyles d’origine photochimique se situe entre 7 et 32 jours environ (tableau 3), ce qui montre que cette substance satisfait au critère de la persistance dans l’air (demi-vie ≥ 2 jours) énoncé dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Le méthyloxirane peut être hydrolysé (demi-vie de 10,7 à 21,7 jours). Le méthyloxirane peut faire l’objet d’une biodégradation atteignant 100 % et n’être pas persistant dans l’eau (tableau 3). Une autre demi-vie modélisée (BIOWIN, 2000) par biodégradation dans l’eau de 15 jours a été obtenue et utilisée pour prévoir la demi-vie de cette substance dans le sol et les sédiments à l’aide des facteurs d'extrapolation de Boethling dont la formule est : t1/2 eau : t1/2 sol : t1/2 sédiments = 1: 1: 4 (Boethling, 1995). Ces valeurs permettent de conclure que cette substance ne satisfait pas aux critères de la persistance dans l’eau et le sol (demi-vie ≥ 182 jours) et les sédiments (demi-vie ≥ 365 jours) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
| Processus du devenir | Valeur pour la dégradation | Paramètre et unité pour la dégradation | Référence |
|---|---|---|---|
| Réaction avec le radical · OH dans l'air | 0,52 – 2,4 | constante cinétique(10 -12cm3/molécule s) | (Pitts, 1979; Winer et al., 1979 ; Zetsch et Stahl, 1981; Edney et al., 1986; Wallington et al., 1988; Atkinson, 1989) |
| 6,6 – 32,3 | demi-vie (jours) | ||
| Hydrolyse (à 20 – 25 °C) | 0,37 – 0,75 | constante cinétique (10-6· s-1) |
Nichols et Ingham, 1955; Koskikallio et Whalley, 1959; Mabey et Mill, 1978; Sato et al., 1985 |
| 10,7 – 21,7 | demi-vie (jours) | ||
| Biodégradation dans l'eau | 12 – 14; 67; 74; 93 – 98; 90 – 100 |
biodégradation (%) | Waggy et Payne, 1974; BASF, 1977b; Dow Deutschland, 1978; Miller et Watkinson, 1985; Chemicals Inspection and Testing Institute, 1992 |
Bioaccumulation
Les valeurs expérimentales et modélisées du log Koe, respectivement de 0,03 et 0,37, indiquent un potentiel de bioaccumulation probablement faible. Les facteurs modélisés de la bioaccumulation (FBA) et de la bioconcentration (FBC), qui varient entre 1 et 13 L/kg (tableau 4), montrent que le méthyloxirane ne satisfait pas aux critères de la bioaccumulation (FBC/FBA ≥ 5 000) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
| Organisme d'essai | Paramètre/unité | Valeur | Référence |
|---|---|---|---|
| Poisson | FBA (poids humide, L/kg) | 1 | Modified Gobas BAF T2MTL (Arnot et Gobas, 2003) |
| Poisson | FBC (poids humide, L/kg) | 1 - 13 | OASIS Forecast, 2005; Modified Gobas BCF 5 % T2LTL (Arnot et Gobas, 2003); BCFWIN, 2000) |
Comme il est indiqué précédemment, le méthyloxirane remplit le critère de persistance, mais ne remplit pas le critère du potentiel de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Selon les données écotoxicologiques (valeurs expérimentales et modélisées) sur le méthyloxirane, la toxicité pour les organismes aquatiques va de faible à modérée. Les valeurs expérimentales de toxicité aiguë (CL50) pour le poisson varient de 89 à 219 mg/L (Bridie et al., 1979; Crews, 1974). Aucune donnée de toxicité pour les organismes non aquatiques autres que des mammifères n’a été relevée.
L’INRP signale qu’un seul émetteur en Ontario a déclaré des rejets de 0,059 tonne de méthyloxirane dans l’air en 2005 (INRP, 2006). Selon les renseignements récemment obtenus en vertu de l’article 71 de la LCPE (1999), des entreprises ont déclaré le rejet de cette substance, en 2006, en une quantité inférieure à 50 kg, soit la valeur seuil de déclaration (Environnement Canada, 2007b). Les rejets de méthyloxirane peuvent aussi provenir des gaz d’échappement des véhicules automobiles et des gaz de combustion de sources fixes brûlant des hydrocarbures (PISC, 1985; ME de l’Ontario, 2001). étant donné la quantité et la nature de ces rejets, il est peu probable que ces derniers deviennent une source d’exposition importante pour les organismes dans l’environnement.
Évaluation de l'exposition
Il existe très peu d’informations sur les concentrations de méthyloxirane dans les milieux naturels qui pourraient servir à estimer quantitativement l’exposition de la population. Il est mentionné dans quelques études que le méthyloxirane n’a pas été décelé dans divers milieux, mais ces études font état de seuils de détection, soit une étude pilote américaine sur l’air intérieur et extérieur ainsi qu’une étude de surveillance japonaise présentant des données sur les eaux de surface et les sédiments (Sheldon et Jenkins, 1990; ME du Japon, 1995). Il apparaît inopportun d’estimer l’absorption en utilisant les seuils de détection de l’étude japonaise comme valeurs de remplacement pour l’eau potable et les sols au Canada. En effet, les modes d’utilisation et de rejet au Canada et les propriétés physiques et chimiques du méthyloxirane font que sa présence dans l’eau et le sol devrait être négligeable par rapport à sa concentration dans l’atmosphère, qui est sa principale source d’exposition. L’utilisation des seuils de détection pour l’air intérieur et extérieur, dans l’étude américaine, donne des estimations de limites supérieures de l’exposition au méthyloxirane de la population générale qui vont de 0,06 µg/kg par jour pour le groupe d’âge de 60 ans et plus à 0,18 µg/kg-m.c. par jour pour le groupe d’âge de 0,5 à 4 ans (annexe 1). La limite maximale de résidus de méthyloxirane de 0,1 ppm dans la chair de noix fumigée et importée a été utilisée pour estimer l’absorption à partir des noix et des graines car on ne disposait d’aucune autre donnée quantitative sur la concentration de cette substance dans les aliments. Les valeurs estimées de l’absorption à partir des aliments étaient négligeables comparativement à celles de l’absorption à partir de l’air. L’utilisation des seuils de détection comme valeurs de remplacement des concentrations dans l’air sont une source d’incertitude et les renseignements quantitatifs sur les concentrations dans l’eau et le sol au Canada font défaut. C’est pourquoi, les concentrations dans ces milieux ont été modélisées à l’aide de la version 6.0 du modèle ChemCan (CEMC, 2003) en supposant un rejet de 50 kg par an, qui est le seuil de déclaration indiqué dans le récent avis donné en conformité de l’article 71 de la LCPE (1999) (Canada, 2007b). Lorsque la modélisation porte sur le rejet dans l’air (principal milieu de rejet prévu), les concentrations dans l’air, l’eau et le sol (annexe 2) sont de beaucoup inférieures à celles utilisées pour estimer les quantités absorbées présentées dans l’annexe 1, ce qui souligne encore plus la nature prudente des estimations. Le seuil de rejet de 50 kg par an ne tient pas compte des rejets possibles à partir des produits contenant du méthyloxirane, mais ces rejets, si on se fonde sur les utilisations de cette substance au Canada, devraient surtout être des rejets atmosphériques. La contribution des rejets à partir des produits dans l’environnement général a sans doute été pris en compte au moment de l’utilisation des seuils de détection pour estimer les limites supérieures présentées précédemment. Le niveau de confiance accordé à la base de données sur l’exposition environnementale est très faible car on a utilisé les seuils de détection des méthodes et la modélisation pour estimer l’exposition, et les paramètres d’entrée des modèles reposent exclusivement sur des rejets théoriques.
Selon l’information disponible sur les utilisations du méthyloxirane au Canada, les produits de consommation peuvent constituer une autre source directe d’exposition pour les usagers. Afin d’évaluer le potentiel d’exposition accrue au méthyloxirane résultant de l’utilisation de ces produits contenant la substance, on a estimé les concentrations atmosphériques et l’absorption quotidienne par la population canadienne adulte (20 à 59 ans) pour les décapants et pour la peinture acrylique en aérosol (annexe 3). Ces produits ont été choisis parce qu’ils représentent d’importantes utilisations du méthyloxirane ou contiennent des substances dans lesquelles le méthyloxirane peut être présent comme résidu. La population canadienne adulte est considérée être la principale utilisatrice de ces produits. Selon ces estimations préalables, l’inhalation de décapant pourrait contribuer de façon appréciable à l’exposition, tandis que celle résultant de l’utilisation de la peinture acrylique en aérosol est plus faible. L’absorption par voie cutanée résultant de l’utilisation de ces produits est considérée comme négligeable selon la pression de vapeur élevée et le faible log Koe du méthyloxirane. Le niveau de confiance accordé à ces estimations de l’exposition à partir des produits de consommation est cependant faible, car les prévisions ont été faites en l’absence de données sur les émissions réelles.
évaluation des effets sur la santé
Des études réalisées chez des animaux de laboratoire ont fait classer le méthyloxirane dans le groupe 2B (cancérogène possible pour l’homme) du Centre international de recherche sur le cancer (CIRC), (CIRC, 1994), dans la catégorie 2 (substances devant être assimilées à des substances cancérogènes pour l’homme) de la Communauté européenne (Commission européenne, 1999; Commission européenne, 2001; Union européenne, 2002; ESIS, 2006), dans le groupe B2 (carcinogène probable pour les humains) de l’EPA américaine (US EPA, 1994) et comme « pouvant raisonnablement être considéré comme cancérogène pour les humains » par le National Toxicology Program (NTP, 2005). Ces classifications reposent sur l’observation de tumeurs épithéliales dans les fosses nasales chez des rats mâles et femelles et sur celle d’une faible incidence d’adénomes papillaires des fosses nasales de rats des deux sexes exposés par inhalation à 400 ppm (964 mg/m3) de méthyloxirane pendant 103 semaines (NTP, 1985; Renne et al., 1986) [voir l’annexe 4 pour un aperçu des bases de données toxicologiques]. On a noté, au cours d’une autre étude d’exposition par inhalation de rats mâles à 300 ppm (723 mg/m3) de méthyloxirane pendant 123 ou 124 semaines, une incidence accrue de carcinomes du tractus respiratoire et trois mâles exposés à 30 ou 300 ppm (72 ou 723 mg/m3) présentaient des tumeurs malignes des fosses nasales (Kuper et al., 1988). De façon semblable, des souris exposées par inhalation à 400 ppm (964 mg/m3) présentaient des incidences combinées accrues d’hémangiomes et d’hémangiosarcomes des fosses nasales (NTP, 1985; Renne et al., 1986). Des rats femelles exposés par voie orale à 15 ou 60 mg/kg-m.c. de méthyloxirane deux fois par semaine pendant 150 semaines ont présenté une augmentation liée à l’exposition de l’incidence de tumeurs stomacales (aucune analyse statistique) [Dunkelberg, 1982]. Des études réalisées par Dunkelberg (1979; 1981) et Walpole (1958) ont permis de démontrer que le méthyloxirane pouvait induire des sarcomes localisés au point d’injection sous-cutané chez des souris et des rats, respectivement. Même si pour certaines de ces études l’incidence des tumeurs des fosses nasales n’est pas statistiquement significative, ces tumeurs ont été considérées liées à l’exposition dans le contexte de leur rareté chez les animaux témoins, tant ceux de ces études que ceux d’études antérieures (NTP, 1985; Kuper et al., 1988; UE, 2002). Les seules données disponibles pour des études chez des humains sont insuffisantes pour évaluer la cancérogénicité du méthyloxirane chez les humains (CIRC, 1994; UE, 2002).
La Communauté européenne a classé le méthyloxirane dans la catégorie 2 des mutagènes (substances devant être assimilées à des substances mutagènes pour l’homme) [Commission européenne, 1999; Commission européenne, 2001; UE, 2002; ESIS, 2006]. Cette classification repose sur l’avis général d’un groupe d’experts selon lequel des faits démontrent clairement le pouvoir mutagène du méthyloxirane chez des cellules somatiques, tant in vitro qu’in vivo (Commission européenne, 1999). Le méthyloxirane s’est avéré génotoxique au cours de plusieurs essais in vitro dont certains ont donné lieu à des mutations génétiques chez des cellules mammaliennes et non mammaliennes ainsi qu’à des aberrations chromosomiques et à l’induction de micronoyaux chez des cellules mammaliennes (annexe 4). Il a aussi provoqué la césure de brins d’ADN et la formation d’adduits à l’ADN in vitro. Des effets ont aussi été notés in vivo chez des rongeurs et chez Drosophila. Parmi ceux-ci figurent l’induction de micronoyaux, des aberrations chromosomiques, des altérations de l’ADN ou la formation d’adduits à l’ADN; certains essais in vivo utilisant ces paramètres se sont toutefois avérés négatifs. Les résultats d’essais sur les effets dominants létaux chez des rongeurs ont été négatifs. Un examen (UE, 2002) de six études portant sur l’exposition professionnelle a montré qu’aucune conclusion ne pouvait être tirée en ce qui a trait au pouvoir mutagène du méthyloxirane chez les humains (Theiss et al., 1981; Pero et al., 1982 et 1985; Van Sittert et de Jong, 1985; de Jonget al., 1988; Hogstedt et al., 1990; Viktorovaet al., 1994). Une étude pilote récente, mais de peu d’ampleur, a montré une augmentation significative des concentrations sanguines d’adduits à l’ADN et d’échanges de chromatides sœurs chez des travailleurs exposés au méthyloxirane, mais on ne peut exclure la possibilité que des facteurs confusionnels aient contribué aux effets cytogénétiques (Czene et al., 2002).
Bien qu’une analyse complète du mode d’action de cette substance déborde le cadre du présent rapport, il apparaît qu’une prolifération cellulaire non néoplasique pourrait favoriser une tumorigenèse au-delà d’un certain seuil d’exposition. On ne peut toutefois ignorer le rôle éventuel des altérations génétiques dans le développement des tumeurs étant donné le nombre important d’éléments de preuve à l’appui de la génotoxicité. Diverses études ont récemment été effectuées afin d’examiner le rôle de l’appauvrissement en glutathion dans le contexte d’une tumorigenèse par le méthyloxirane chez le rat et la souris (Morris et al.,2004; Lee et al., 2005; Morris et Pottenger, 2006). Le mode d’action possible de l’induction de tumeurs par le méthyloxirane est actuellement évalué par l’Environmental Protection Agency des états-Unis (US EPA, 2005). Après un premier examen des données fournies par l’industrie, l’EPA américaine a indiqué qu’un mode d’action à l’origine des effets cancérogènes où interviendrait un seuil serait « fortement plausible », mais l’information obtenue fait actuellement l’objet d’un examen plus poussé (US EPA, 2006). De plus, Albertini et Sweeney (2007) ont étudié le profil de génotoxicité du méthyloxirane et conclu que sa génotoxicité donnant lieu à des réactions avec l’ADN peut être nécessaire mais non suffisante pour confirmer la cancérogénicité et qu’un mode d’action complexe est vraisemblable.
On a conclu, au cours d'une évaluation faite par l'Union européenne (UE, 2002), que la cancérogénicité du méthyloxirane se limitait surtout aux sites de premier contact, mais que l'apport relatif au processus cancérogène de l'irritation, de la réponse proliférative subséquente et de la génotoxicité demeurait incertain si l'on se fondait sur les connaissances scientifiques actuelles. L'UE a conclu, en se fondant sur le mode d'action direct et l'activité mutagène du méthyloxirane, que le risque d'effet cancérogène de cette substance exprimé chez l'animal s'avérait pertinent chez les humains.
Les effets non néoplasiques critiques induits par le méthyloxirane se produisent dans les fosses nasales. La concentration minimale avec effet (nocif) observé [CME(N)O] était de 71 mg/m3 chez des rats exposés par inhalation pendant 123 ou 124 semaines si l’on se fonde sur une légère augmentation de l’incidence de replis en forme de poches dans l’épithélium nasal des animaux exposés (Kuper et al., 1988). Le rapport de l’UE (2002) indique cette valeur comme la CMENO « minimale » pour les effets dans l’épithélium nasal. L’EPA américaine (US EPA, 1990) considère aussi cette concentration produisant un effet comme une CMENO pour obtenir sa concentration de référence concernant l’exposition chronique au méthyloxirane par inhalation. De même, dans le cadre d’une décision d’admissibilité à une nouvelle homologation du méthyloxirane à titre de pesticide, l’EPA a jugé que cette concentration produisant un effet serait utilisée comme une concentration sans effet nocif observé ou CSENO (US EPA, 2005). Des effets semblables ont été observés au cours d’études d’exposition chronique chez la souris où le niveau d’exposition était supérieur, soit 474 mg/m3 (NTP, 1985; Renne et al., 1986), et lorsque les rats et les souris étaient exposés pendant des périodes plus courtes à des concentrations de 5 à 15 fois supérieures, par exemple à 362 mg/m3 (Eldridge et al., 1995). Ces effets ont été observés aux plus faibles expositions utilisées au cours d’études d’exposition chronique chez les deux espèces.
Le niveau de confiance accordé à la base de données sur la toxicité est élevé car on dispose de données sur la toxicité aiguë, la cancérogénicité, la toxicité par doses répétées, la toxicité génétique et la toxicité pour la reproduction et le développement, mais il demeure une incertitude quant au mode d'induction des tumeurs.
Caractérisation du risque pour la santé humaine
En s’appuyant surtout sur des évaluations fondées sur le poids de la preuve et réalisées par plusieurs organismes nationaux et internationaux (CIRC, UE, US EPA et US NTP), on trouve que la cancérogénicité, pour laquelle un mode d’induction comportant une interaction directe avec du matériel génétique ne peut être exclu, constitue un effet critique permettant de caractériser le risque pour la santé humaine.
En ce qui a trait aux effets autres que le cancer, la comparaison de la dose ayant un effet critique non néoplasique chez des animaux de laboratoire exposés de façon chronique (71 mg/m3) avec la valeur limite supérieure d’exposition par inhalation (principale voie d’exposition prévue) chez la population générale (dont la valeur de 0,31 ug/m3 a été estimée à partir des seuils de détection d’une étude américaine), permet d’obtenir une marge d’exposition de 229 000 environ. Mais si on prend en compte la limite supérieure prudente de l’exposition estimée à partir de la concentration dans l’air résultant de l’utilisation de produits de consommation contenant du méthyloxirane (200 mg/m3 dans le décapant), on obtient une marge d’exposition inférieure à 1. Si l’exposition estimée résultant de ces produits est comparée à la concentration la plus faible ayant un effet à la suite d’une exposition à doses répétées à court terme (362 mg/m3), ce qui pourrait convenir davantage étant donné l’utilisation peu fréquente de ces produits, on obtient une marge d’exposition d’environ 2. Par conséquent, bien que la marge d’exposition pour les effets non néoplasiques soit adéquate pour l’exposition dans l’environnement général, celle des scénarios d’exposition par les produits de consommation (par ailleurs prudente) peut ne pas tenir compte de façon adéquate des incertitudes des bases de données sur l’exposition et les effets.
Incertitudes de l'évaluation du risque pour la santé humaine
Le présent rapport d’évaluation préalable du méthyloxirane ne prend pas en compte les écarts de la vulnérabilité à la substance pouvant exister entre les humains et les espèces de laboratoire, et cet aspect est accentué par le peu de données disponibles pour les humains. Mais les effets notés chez les deux espèces de rongeurs utilisées sont semblables. La modélisation de la toxicocinétique physiologique (Csandy et Filser, 2007) porte à croire à une toxicocinétique du méthyloxirane semblable chez l’humain et le rat. De plus, le mécanisme de l’induction des tumeurs n’a pas été complètement élucidé, mais les données indiquent la possibilité de mécanismes génotoxiques et non génotoxiques. Il demeure aussi des incertitudes appréciables quant à l’ampleur de l’exposition de la population générale à cette substance. Toutefois, comme les estimations de l’exposition présentées ici sont de nature prudente, le niveau de confiance à l’égard du fait que les niveaux d’exposition réels ne sont pas supérieurs à ces estimations est élevé.
Compte tenu de l’information disponible, il est conclu que le méthyloxirane ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique et à mettre en danger l'environnement essentiel pour la vie.
Compte tenu de la cancérogénicité du méthyloxirane, pour lequel il existe une probabilité d’effet nocif à toute valeur d’exposition, de la possibilité que la marge entre l’exposition estimée à partir des produits et du niveau critiques pour les effets autres que le cancer, il est conclu que le méthyloxirane est considéré comme une substance qui peut pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaine.
Il est donc conclu que le méthyloxirane ne satisfait pas aux critères énoncés aux alinéas 64a) et b) de la LCPE (1999), mais qu’il satisfait à ceux énoncés à l’alinéa 64c) de la Loi. De plus, cette substance satisfait au critère de la persistance, mais non à celui du potentiel de bioaccumulation du Règlement sur la persistance et la bioaccumulation.
[ACC] American Chemistry Council. 2005. Methyl oxirane: results of a 20-day repeated dose inhalation toxicity study in male mice and male rats. Rapport no TSCATS 8EHQ--05-16044B.
Agurell E, Cederberg H, Ehrenberg L, Lindahl-Kiessling K, Rannug U et Tornqvist M. 1991. Genotoxic effects of ethylene oxide and propylene oxide: a comparative study. Mutat. Res. 250(1-2):229-37 [cité dans CIRC, 1994; UE, 2002].
Albertini RJ, et Sweeney LM. 2007. Propylene Oxide: Genotoxicity Profile of a Rodent Nasal Carcinogen. Crit Rev Toxicol 37:489-520.
Aldrich Chemical Co. 2003. Material safety data sheet: propylene oxide. No de catalogue 240397.
American Chemical Society. 1952. Monograph series: Glycols. Curme GO Jr., Johnston F, editors. New York (NY) : Reinhold. [cité dans European Union Risk Assessment Report, 2000] .
[ARLA] Agence de réglementation de la lutte antiparasitaire. 2006. Document de travail de l’Agence de réglementation de la lutte antiparasitaire. Juin 2006 : Abrogation de la norme générale relative à la limite maximale de résidus de 0,1 ppm pour les résidus de pesticides dans les aliments [Règlement B.15.002(1)]
Arnot JA. et Gobas FA. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb Sci 22(3):337-345.
Atkinson R. 1989. Kinetics and mechanisms of the gas-phase reactions of the hydroxyl radical with organic compounds. J. Phys. Chem. Ref. Data Monograph 1. 246 pages.
Antonova V.I., Zommer E.A., Kuznetsova A.D. et Petrova NA. 1981. Toxicology of propylene oxide and regulation of its level in water. Gig. Sanit. 7:76-9 [cité dans UE, 2002; US EPA, 2005].
BASF AG. 1967. Analytisches Labor, unveroeffentlichte Untersuchung, TA/PV-Vg L 540 [cité dans European Union Risk Assessment Report, 2000] .
BASF AG. 1977a. Analytisches Labor, unveroeffentlichte Untersuchung, BRU 77.119 [cité dans European Union Risk Assessment Report, 2000] .
BASF AG. 1977b. Oekologielabor, rapport inédit de BASF AG, 6 mai 1977 [cité dans European Union Risk Assessment Report, 2000] .
BASF AG. 1995. Sicherheitsdatenblatt Propylenoxid [cité dans European Union Risk Assessment Report, 2000] .
[BCFWIN] BioConcentration Factor Program for Windows. 2000. Version 2.15. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.
[BIOWIN] Biodegradation Probability Program for Windows. 2000. Version 4.01. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.
Blair D. et Osborne GP. 1977. Acute toxicity studies on propylene oxide: acute inhalation toxicity and 10 day repeated exposure study. London : Shell Research. Report No.: TLGR.0032.77 [cité dans UE, 2002].
Boethling RS, Howard PH, Beauman JA et Larosche ME. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere 30(4):741-752.
Bogyo DA, Lande SS, Meylan WM, Howard PH et Santodonato J. 1980. Investigation of selected potential environmental contaminants: Epoxides. Report to U. S. Environmental Protection Agency, Office of Toxic Substances, Washington, DC. New Jersey (US): Syracuse Research Corporation.
Boogaard PJ, Rocchi PS et Van Sittert NJ. 1999. Biomonitoring of exposure to ethylene oxide and propylene oxide by determination of hemoglobin adducts: correlations between airborne exposure and adduct levels. Int Arch Occup Environ Health 72(3):142-50.
Bootman J, Lodge DC et Whalley HE. 1979. Mutagenic activity of propylene oxide in bacterial and mammalian systems. Mutat Res 67(2):101-12 [cité dans CIRC,1994; UE, 2002].
Boublik T, Fried V et Hala E. 1984. The vapor pressure of pure substances: selected values of the temperature dependence of the vapor pressures of some pure substances in the normal and low-pressure region. (Vol 17). 2nd rev. ed. Amsterdam (NL): Elsevier. 241 pages.
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). Lois du Canada. Ottawa : Travaux publics et Services gouvernementaux Canada. Gazette du Canada Partie III, vol. 22, n° 3.
Canada. 2000. Règlement sur la persistance et la bioaccumulation. Ottawa : Travaux publics et Services gouvernementaux Canada. Gazette du Canada, Partie II. vol. 134. [cité en août 2006].
[Canada]. Ministère de l’Environnement et ministère de la Santé. 2006. Loi canadienne sur la protection de l’environnement (1999) : Avis d’intention d’élaborer et de mettre en œuvre des mesures d’évaluation et de gestion des risques que certaines substances présentent pour la santé des Canadiens et leur environnement. Ottawa : Travaux publics et Services gouvernementaux Canada. Gazette du Canada Partie I, vol. 140, n° 49.
[Canada], Environnement Canada et Santé Canada. 2007a. Profil de substance pour le Défi : Méthyloxirane (oxyde de propylène) no CAS 75-56-9.
Canada. 2007b. Loi canadienne sur la protection de l'environnement (1999). Avis concernant certaines substances inscrites sur la Liste intérieure des substances (LIS). Ottawa : Travaux publics et Services gouvernementaux. Gazette du Canada Partie I, vol. 141, n° 5.
Canter DA, Zeiger E, Haworth S, Lawlor T, Mortelmans K et Speck W. 1986. Comparative mutagenicity of aliphatic epoxides in salmonella. Mutat Res 172(2):105-38 [cité dans CIRC, 1994; UE, 2002].
Castelain P, Criado B, Cornet M, Laib R, Rogiers V et Kirsch-Volders M. 1993. Comparative mutagenicity of structurally related aliphatic epoxides in a modified Salmonella/microsome assay. Mutagenesis 8(5):387-93 [cité dans CIRC, 1994].
Center for Chemical Hazards Assessment. Report No : (EPA-560/11-80-005). Disponible auprès de NTIS no PB80-183197.
ChemCAN. 2003. ChemCAN: level III fugacity model of regional fate of chemicals. Version 6.00. Peterborough (ON): Canadian Environmental Modelling Centre, Trent University.
Chemicals Inspection and Testing Institute. 1992. Biodegradation and bioaccumulation data of existing chemicals based on the CSCL Japan. Japan : Chemical Industry Ecology, Toxicology and Information Center.
Chovanec M, Naslund M, Spivak I, Dusinska M, Cedervall B et Kolman A. 1998. Rejoining of DNA strand breaks induced by propylene oxide and epichlorohydrin in human diploid fibroblasts. Environ Mol Mutagen 32(3):223-8.
CIRC (Centre international de recherche sur le cancer). 1994. Propylene oxide. IARC Monogr Eval Carcinog Risks Hum 60:181-213.
Commission européenne. 1999. Methyloxirane. Summary Record Meeting of the Commission Working Group on the Classification and Labelling of Dangerous Substances. ECB Ispra, 13 – 15 octobre, 1999. ECBI/61/99 - Rév. 3. 17.04.
Commission européenne. 2001. Methyloxirane. Directive de la Commission 2001/59/EC du 6 août 2001. Annexe 1B. Journal officiel des Communautés européennes 21.8.2001. L 225/26.
Cookson MJ, Sims P et Grover PL. 1971. Mutagenicity of expoxides of polycyclic hydrocarbons correlated with carcinogenicity of parent hydrocharbons. Nat New Biol 234:86-187.
Csanady GA et Filser JG. 2007. A physiological toxicokinetic model for inhaled propylene oxide in rat and human with special emphasis on the nose. Toxicol Sci 95(1):37-62.
Czene K, Osterman-Golkar S, Yun X., Li G, Zhao F, Perez HL, Li M, Natarajan AT et Segerback D. 2002. Analysis of DNA and hemoglobin adducts and sister chromatid exchanges in a human population occupationally exposed to propylene oxide: a pilot study. Cancer Epidemiol Biomarkers Prev 11(3):315-8.
de Jong G, Van Sittert NJ et Natarajan AT. 1988. Cytogenetic monitoring of industrial populations potentially exposed to genotoxic chemicals and of control populations. Mutat Res 204(3):451-64. [cité dans UE, 2002; CIRC, 1994]
Dean BJ, Brooks TM, Hodson-Walker G et Hutson DH. 1985. Genetic toxicology testing of 41 industrial chemicals. Mutat Res 153(1-2):57-77. [cité dans CIRC, 1994; UE, 2002].
Dean BJ et Hodson-Walker G. 1979. An in vitro chromosome assay using cultured rat-liver cells. Mutat Res 64(5):329-37. [cité dans CIRC, 1994; UE, 2002].
Deneer JW, Sinnige TL, Seinen W et Hermens JLM. 1988. Quantitative Structure-Activity Relationship for the Acute Toxicity of Some Epoxy Compounds to the Guppy. Aquatic Toxicology, 13, 195-204 [cité dans UE, 2002].
DGPSA (Direction générale des produits de santé et des aliments). 2007. Communication personnelle de Shahriar Khadem, Direction des produits de santé naturels, Direction générale des produits de santé et des aliments.
[DHM] Direction de l’hygiène du milieu. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Décembre 1998. Ottawa (ON) : Santé Canada, Direction de l’hygiène du milieu. Section des substances prioritaires.
Djuric Z, Hooberman BH, Rosman L et Sinsheimer JE. 1986. Reactivity of mutagenic propylene oxides with deoxynucleosides and DNA. Environ Mutagen 8(3):369-83. [cité dans CIRC,1994; UE, 2002].
[Dow] Dow Chemical Company. 2007. Technical data sheet [Internet]. Dow Chemical Company. [cité en septembre 2007].
[Dow] Dow Chemical Company. 1981. A guide to glycols. Midland (MI): Dow Chemical Company. Form No. 117-00991-89.
[Dow] Dow Chemical Company. 1977. Among the most versatile of intermediates...Alkylene oxides from Dow. Michigan (US): Dow Chemical Company [cité dans EURAR, 2000].
Dow Deutschland. 1978. NTIS/OTS 0509917 # 407875003 [cité dans IUCLID Data set, 2000] .
Dunkelberg H. 1981. Carcinogenic activity of ethylene oxide and its reaction products 2-chloroethanol, 2-bromoethanol, ethylene glycol and diethylene glycol: 1. Carcinogenicity of ethylene oxide in comparison with 1,2-propylene oxide after subcutaneous administration in mice. Zentralbl Bakteriol Mikrobiol Hyg [B] 174(5):383-404 [cité dans CIRC, 1994; UE, 2002]
Dunkelberg H. 1982. Carcinogenicity of ethylene oxide and 1,2-propylene oxide upon intragastric administration to rats. Br J Cancer 46(6):924-33.
Dunkelberg H. 1979. On the oncogenic activity of ethylene oxide and propylene oxide in mice. Br J Cancer 39(5):588-9.
[DHM] Direction de l'hygiène du milieu. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Décembre 1998. Ottawa (ON) : Santé Canada, Direction de l'hygiène du milieu. Section des substances prioritaires.
Edney EO, Kleindienst TE et Corse EW. 1986. Room temperature rate constants for the reactions of OH with selected chlorinated and oxygenated hydrocarbons. Int J Chem Kinet 18:1355-1371 [cité dans European Union Risk Assessment Report, 2000] .
Eldridge SR, Bogdanffy MS, Jokinen MP et Andrews LS. 1995. Effects of propylene oxide on nasal epithelial cell proliferation in F344 rats. Fundam Appl Toxicol 27(1):25-32 [cité dans CIRC, 1994]
Emmert B, Bunger J, Keuch K, Muller M, Emmert S, Hallier E et Westphal GA. 2006. Mutagenicity of cytochrome P450 2E1 substrates in the Ames test with the metabolic competent S. typhimurium strain YG7108pin3ERb5. Toxicology 228(1):66-76.
[EPIWIN] Estimation Programs Interface for Microsoft Windows. 2004. Version 3.12. Washington (DC): U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation.
[ESIS] European Chemical Substances Information System [base de données sur Internet]. 2006. Methyloxirane. CAS No. 75-56-9. Version 4.50. Bureau européen des substances chimiques (ECB). Commission européen.
[EURAR] European Union Risk Assessment Report. 2000. CAS No. 75-56-9.
Methyloxirane (propylene oxide). Bureau européen des substances chimiques, Substances existantes. Deuxième Liste des substances d’intérêt prioritaire, volume 23. Luxembourg : Office des publications officielles des Communautés européennes.
Farooqi Z, Tornqvist M, Ehrenberg L et Natarajan AT. 1993. Genotoxic effects of ethylene oxide and propylene oxide in mouse bone marrow cells. Mutat Res 288(2):223-8 [cité dans CIRC, 1994; UE, 2002].
Foureman P, Mason JM, Valencia R et Zimmering S. 1994. Chemical mutagenesis testing in Drosophila. X : results of 70 coded chemicals tested for the National Toxicology Program. Environ Mol Mutagen 23(3):208-27.
Gardner MJ, Coggon D, Pannett B et Harris EC. 1989. Workers exposed to ethylene oxide: a follow up study. Br J Ind Med 46(12):860-5 [cité dans CIRC, 1994].
Garro AJ et Phillips RA. 1980. Detection of mutagen-induced lesions in isolated DNA by marker rescue of Bacillus subtilis phage PHI105. Mutat Res 73 (1):1-14 [cité dans UE, 2002].
Gosselin RE, Smith RP, Hodge HC et Braddock JE, editors. 1984. Clinical toxicology of commercial products. 5th ed. Baltimore (MD): Williams & Wilkins; Section II Ingredients Index, Propylene oxide; p. 97-98 [cité dans UE, 2002].
Gulati DK, Witt K, Anderson B, Zeiger E et Shelby MD. 1989. Chromosome aberration and sister chromatid exchange tests in Chinese hamster ovary cells in-vitro. III. Results with 27 chemicals. Environ Mol Mutagen 13 (2):133-93 [cité dans CIRC,1994; UE, 2002].
Hackett PL, Brown MG, Buschbom RL, Clark ML, Miller RA, Music RL, Rowe SE, Schirmer RE et Sikov MR. 1982. Teratogenic study of ethylene and propylene oxide and n-Butyl Acetate. Cincinnati (OH): Department of Health and Human Services (US), Centers for Disease Control & Prevention; NIOSH (National Institute for Occupational Safety and Health). Contract No. 210-80-0013, PB83-258-038.127 pages. [cité dans CIRC, 1994].
Hansch C, Leo A et Hoekman D. 1995. Exploring QSAR: hydrophobic, electronic, and steric constants. Washington (DC): American Chemical Society.
Hardin BD, Niemeier RW, Sikov MR et Hackett PL. 1983a. Reproductive-toxicologic assessment of the epoxides ethylene oxide, propylene oxide, butylene oxide, and styrene oxide. Scand J Work Environ Health 9(2 Spec No):94-102.
Hardin BD, Schuler RL, Mcginnis PM, Niemeier RW et Smith RJ. 1983b. Evaluation of propylene oxide for mutagenic activity in 3 in vivo test systems. Mutat Res 117 (3-4):337-44 [cité dans CIRC, 1994; UE, 2002].
Harris SB, Schardein JL, Ulrich CE et Ridlon SA. 1989. Inhalation developmental toxicity study of propylene oxide in Fischer 344 rats. Fundam Appl Toxicol 13(2):323-31 [cité dans CIRC, 1994].
Hayes WC, Kirk HD, Gushow TS et Young JT. 1988. Effect of inhaled propylene oxide on reproductive parameters in Fischer 344 rats. Fundam Appl Toxicol 10(1):82-8 [cité dans CIRC 1994].
Hayes WC, Gushow TS, Kirk HD et Young JT. 1985. Propylene oxide: two-generation inhalation reproduction study in Fischer 344 rats. Midland (MI): Dow Chemical, Health and Environmental Sciences, Mammalian and Environmental Toxicology Research Laboratory. Report No.: D-1734 [cité dans UE, 2002].
Hemminki A, Vayrynen T et Hemminki K. 1994. Reaction kinetics of alkyl epoxides with DNA and other nucleophiles. Chem Biol Interact 93(1):51-8.
Hemminki K et Falck K. 1979. Correlation of Mutagenicity and 4-p Nitrobenzyl pyridine alkylation by epoxides. Toxicol Lett 4 (2):103-6 [cité dans CIRC, 1994; UE, 2002].
Hemminki K, Paasivirta J, Kurkirinne T et Virkki L. 1980. Alkylation products of DNA bases by simple epoxides. Chem Biol Interact 30(3):259-70 [cité dans UE, 2002].
Henkel Technologies 2008. Material Safety Data Sheet for Loctite Paint stripper.
[HENRYWIN] Henry's Law Constant Program for Microsoft Windows. 2000. Version 3.10. Washington (DC): U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation.
Hogstedt C, Aringer L et Gustavsson A. 1986. Epidemiologic support for ethylene oxide as a cancer-causing agent. JAMA 255(12):1575-8 [cité dans CIRC, 1994].
Hogstedt B, Bergmark E, Tornqvist M et Osterman-Golkar S. 1990. Chromosomal aberrations and micronuclei in lymphocytes in relation to alkylation of hemoglobin in workers exposed to ethylene oxide and propylene oxide. Hereditas 113(2):133-8 [cité dans UE, 2002; CIRC, 1994].
Hogstedt C, Rohlen O, Berndtsson BS, Axelson O et Ehrenberg L. 1979. A cohort study of mortality and cancer incidence in ethylene oxide production workers. Br J Ind Med 36(4):276-80 [cité dans CIRC,1994].
Hogstedt LC. 1988. Epidemiological studies on ethylene oxide and cancer: an updating. IARC Sci Publ (89):265-70 [cité dans CIRC, 1994].
Howard PH. 1989. Handbook of environmental fate and exposure data for organic chemicals: Vol. I, Large production and priority pollutants. Chelsea (MI): Lewis Publishers.
DGPSA (Direction générale des produits de santé et des aliments). 2007. Communication personnelle de Shahriar Khadem, Direction des produits de santé naturels, Direction générale des produits de santé et des aliments.
Hughes TJ, Simmons DM, Monteith LG et Claxton LD. 1987. Vaporization technique to measure mutagenic activity of volatile organic chemicals in the Amesalmonella assay. Environ Mol Mutagen 9(4):421-41 [cité dans CIRC,1994; UE, 2002].
[INRP] Inventaire national des rejets de polluants [base de données sur Internet]. 2006. Gatineau (QC): Environnement Canada. [cité en mars 2006].
[IPC] Indice des prix à la consommation. 2003. CPI Product Profiles. [Internet]. Toronto (ON): Camford Information Service.
Jacobson KH, Hackley WB et Feinsilver L. 1956. The toxicity of inhaled ethylene oxide and propylene oxide vapors; acute and chronic toxicity of ethylene oxide and acute toxicity of propylene oxide. AMA Arch Ind Health 13(3):237-44 [cité dans UE, 2002].
Japon, Gouvernement du Japon, Ministère de l'Environnement. 1995. Summary of the results of monitoring of water and bottom sediment: Report on environment survey and wildlife monitoring of chemicals in the environment. [cité en août 2007]. Disponible à : Japan Ministry of the Environment
Jefferson Chemical Company. 1960. Technische Broschuere Propylene Oxide [cité dans UE, 2002].
Jensen O. 1981. Contact allergy to propylene oxide and isopropyl alcohol in a skin disinfectant swab. Contact Dermatitis 7(3):148-50 [cité dans CIRC, 1994]
Jorritsma U, Cornet M, Van Hummelen P, Bolt HM, Vercruysse A, Kirsch-Volders M et Rogiers V. 1995. Comparative mutagenicity of 2-methylpropene (isobutene), its epoxide 2-methyl-1,2-epoxypropane and propylene oxide in the in vitro micronucleus test using human lymphocytes. Mutagenesis 10(2):101-4 [cité dans UE, 2002].
Justice Canada. 1985. Loi sur les aliments et drogues (L.R., 1985, ch. F-27) [cité en septembre 2007]
Kautiainen A et Tornqvist M. 1991. Monitoring exposure to simple epoxides and alkenes through gas chromatographic determination of hemoglobin adducts. Int Arch Occup Environ Health 63(1):27-31 [cité dans CIRC,1994; UE, 2002].
Kohda KH, Ninomiya S, Washizu K, Shiraki K, Ebie M et Kawazoe Y. 1987. Mutagenicity of a series of N-alkyl-, N-hydroxyalkyl-, N-haloalkyl- and N-carboxyalkyl-N-nitrosoureas in Escherichia coli tester strains: dependence on the uvrA DNA-repair system. Mutat Res 177(2):219-28 [cité dans CIRC, 1994].
Kolman A et Dusinska M. 1995. Comparison of propylene oxide and epichlorohydrin effects in two transformation tests (C3H/10T1/2 and SHE cells). Toxicol Lett 81(2-3):213-21 [cité dans UE, 2002].
Kolman A, Spivak I, Naslund M, Dusinska M et Cedervall B. 1997. Propylene oxide and epichlorohydrin induce DNA strand breaks in human diploid fibroblasts. Environ Mol Mutagen 30 (1):40-6.
Kolmark G et Giles NH. 1955. Comparative Studies of Monoepoxides as Inducers of Reverse Mutations in Neurospora. Genetics 40:890-902. [cité dans CIRC, 1994; UE, 2002].
Kumar R, Staffas J, Forsti A et Hemminki K. 1995. 32P-postlabelling method for the detection of 7-alkylguanine adducts formed by the reaction of different 1,2-alkyl epoxides with DNA. Carcinogenesis 16(9):483-9.
Kuper CF, Reuzel PG, Feron VJ et Verschuuren H. 1988. Chronic inhalation toxicity and carcinogenicity study of propylene oxide in Wistar rats. Food Chem Toxicol 26(2):159-67.
Koskikallio J et Whalley E. 1959. Effect of pressure on the spontaneous and the base-catalysed hydrolysis of epoxides. Can J Chem 37:783-787.
Lawley PD, Jarman M. 1972. Alkylation by propylene oxide of deoxyribonucleic acid, adenine, guanosine and deoxyguanylic acid. Biochem J 126:893-900
Lee MS, Faller TH, Kreuzer PE, Kessler W, Csanady GA, Putz C, Rios-Blanco MN, Pottenger LH, Segerback D, Osterman-Golkar S et al. 2005. Propylene oxide in blood and soluble nonprotein thiols in nasal mucosa and other tissues of male Fischer 344/N rats exposed to propylene oxide vapors--relevance of glutathione depletion for propylene oxide-induced rat nasal tumors. Toxicol Sci 83(1):177-89.
Lynch DW, Lewis TR, Moorman WJ, Burg JR, Groth DH, Khan A, Ackerman LJ et Cockrell BY. 1984a. Carcinogenic and toxicologic effects of inhaled ethylene oxide and propylene oxide in F344 rats. Toxicol Appl Pharmacol 76(1):69-84 [cité dans CIRC, 1994].
Lynch DW, Lewis TR, Moorman WJ, Burg JR, Gulati DK, Kaur P et Sabharwal PS. 1984b. Sister-chromatid exchanges and chromosome aberrations in lymphocytes from monkeys exposed to ethylene oxide and propylene oxide by inhalation. Toxicol Appl Pharmacol 76(1):85-95 [cité dans CIRC, 1994; UE, 2002].
Mabey W et Mill T. 1978. Critical review of hydrolysis of organic compounds in water under environmental conditions. J Phys Chem Ref Data. 7:383-415.
Matthews EJ, Spalding JW et Tennant RW. 1993. Transformation of BALB/c-3T3 cells: V. Transformation responses of 168 chemicals compared with mutagenicity in Salmonella and carcinogenicity in rodent bioassays. Environ Health Perspect 101(Suppl 2):347-482.
McDonald RA et Shrader SA Stull DR. 1959. Vapour pressure and freezing points of 30 organics. J Chem Eng Data 4 (4):311-313 [cité dans European Union Risk Assessment Report, 2000].
McGregor D, Brown AG, Cattanach P, Edwards I, Mcbride D, Riach C, Shepherd W et Caspary WJ. 1991. Responses of the L5178Y mouse lymphoma forward mutation assay: V. Gases and vapors. Environ Mol Mutagen 17(2):122-9 [cité dans CIRC, 1994; UE, 2002].
McMahon RE, Cline JC et Thompson CZ. 1979. Assay of 855 test chemicals in ten tester strains using a new modification of the Ames test for bacterial mutagens. Cancer Res 39 (3):682-93 [cité dans UE, 2002].
[ME de l’Ontario], Ministère de l’Environnement, Direction de l’élaboration des normes. Mars 2001. Ontario Air Standards for propylene oxide. Toronto (ON). Direction de l’élaboration des normes.
Meylan W, Papa L, De Rosa CT et Stara JF. 1986. Chemicals of current interest - propylene oxide : health and environmental effects profile. Toxicol Ind Health 2(3): 219-60
Migliore L, Rossi AM et Loprieno N. 1982. Mutagenic action of structurally related alkene oxides on Schizosaccharomyces pombe: the influence, 'in vitro', of mouse-liver metabolizing system. Mutat Res 102(4):425-37 [cité dans CIRC, 1994; UE, 2002].
Miller RC et Watkinson RJ. 1985. Propylene oxide: an assessment of ready biodegradability. Sittingbourne (GB): Shell Research, Sittingbourne Research Centre. Group Research Report SBGR.85.064. [cité dans UK IUCLID Dataset, 2000]
Morris AD, Ratcliffe J, Dalziel KL et English JSC. 1998. Allergic contact dermatitis from epoxy propane [abstract]. Contact Dermatitis 38(1):57.
Morris JB, Banton MI et Pottenger LH. 2004. Uptake of inspired propylene oxide in the upper respiratory tract of the F344 rat. Toxicol Sci 81(1):216-24.
Morris JB et Pottenger LH. 2006. Nasal NPSH depletion and propylene oxide uptake in the upper respiratory tract of the mouse. Toxicol Sci 92(1):228-34.
[NTP] National Toxicology Program. 1985. Toxicology and carcinogenesis studies of propylene oxide in F344/N rats and B6C3F1 mice (inhalation studies). Research Triangle Park (NC): National Toxicology Program. Technical Report Series 267.
[NTP] National Toxicology Program. 1989-1993. [database on the Internet]. Research Triangle Park (NC): National Toxicology Program. Study number 669217.
[NTP] National Toxicology Program. 2005. 11th Report on carcinogens. Substance profile: propylene oxide. Research Triangle Park (NC): National Toxicology Program.
Nichols PL Jr et Ingham JD. 1955. The inductive effect in ethylene oxide ring openings. Amer Chem Soc 77:6547-6551 [cité dans European Union Risk Assessment Report, 2000] .
Nivard MJ, Czene K, Segerback D et Vogel EW. 2003. Mutagenic activity of ethylene oxide and propylene oxide under XPG proficient and deficient conditions in relation to N-7-(2-hydroxyalkyl)guanine levels in Drosophila. Mutat Res 529(1-2):95-107.
[OASIS Forecast] Optimized Approach based on Structural Indices Set [Estimation Model]. 2005. Version 1.20. Bourgas, Bulgarie: Laboratory of Mathematical Chemistry.
Oetting FL.1964. Low-temperature heat capacity and related thermodynamic functions of propylene oxide. J Chem Physics 41(1):149-153 [cité dans European Union Risk Assessment Report, 2000] .
Ohnishi A, Hori H, Tanaka I, Yamamoto T et Murai Y. 1988. [Determination of the exposure concentration of propylene oxide to produce neuropathy in rats]. J UOEH 10(3):227-81.
Okuda H, Takeuchi T, Senoh H, Arito H, Nagano K, Yamamoto S et Matsushima T. 2006. Effects of inhalation exposure to propylene oxide on respiratory tract, reproduction and development in rats. J Occup Health 48(6):462-73.
Omura M, Tanaka A, Mori K, Hirata M, Zao M et Inoue N. 1994. Dose-dependent testicular toxicity of propylene oxide in rats induced by repeated intraperitoneal injections. Fukuoka Igaku Zasshi 85(7):204-10.
Ong T, Stewart J, Wen Y, Whong WZ. 1987. Application of SOS umu-test for the detection of genotoxic volatile chemicals and air pollutants. Environ Mutagen 9(2):171-6 [cité dans CIRC, 1994; UE, 2002].
[ME de l'Ontario], Ministère de l'Environnement, Direction de l'élaboration des normes. Mars 2001. Ontario Air Standards for propylene oxide. Toronto (ON). Direction de l'élaboration des normes.
Osterman-Golkar S, Bailey E, Farmer PB, Gorf SM et Lamb JH. 1984. Monitoring exposure to propylene oxide through the determination of hemoglobin alkylation. Scand J Work Environ Health 10(2):99-102 [cité dans CIRC, 1994].
Osterman-Golkar S, Czene K, Lee MS, Faller TH, Csanady GA, Kessler W, Perez HL, Filser JG et Segerback, D. 2003. Dosimetry by means of DNA and hemoglobin adducts in propylene oxide-exposed rats. Toxicol Appl Pharmacol 191(3):245-54.
Ott MG, Teta J et Greenberg HL. 1989. Lymphatic and hematopoietic tissue cancer in a chemical manufacturing environment. Am J Ind Med 16 (6):631-44 [cité dans CIRC, 1994].
[PCKOCWIN] Organic Carbon Partition Coefficient Program for Windows. 2000. Version 1.66. Washington (DC): U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics. Syracuse (NY): Syracuse Research Corporation.
Pero RW, Bryngelsson T, Widegren B, Hogstedt B et Welinder H. 1982. A reduced capacity for unscheduled DNA synthesis in lymphocytes from individuals exposed to propylene oxide and ethylene oxide. Mutat Res 104(1-3):193-200 [cité dans UE, 2002].
Pero RW, Osterman-Golkar S et Hogstedt B. 1985. Unscheduled DNA synthesis correlated to alkylation of hemoglobin in individuals occupationally exposed to propylene oxide. Cell Biol Toxicol 1(4):309-14 [cité dans UE, 2002].
Pfeiffer EH et Dunkelberg H. 1980. Mutagenicity of ethylene oxide and propylene oxide and of the glycols and halohydrins formed from them during the fumigation of foodstuffs. Food Cosmet Toxicol 18(2):115-8 [cité dans CIRC, 1994; UE, 2002].
[PhysProp] Interactive PhysProp Database [Internet]. 2003. Syracuse (NY): Syracuse Research Corporation [cité en mars 2003].
[PISC] Programme international sur la sécurité des substances chimiques. 1985. Environmental Health Criteria 56, Propylene oxide. Genève (CH) : Organisation mondiale de la santé, Programme des Nations Unies pour l'environnement, Organisation internationale du travail, Programme international sur la sécurité des substances chimiques.
Pitts JN. 1979. Chemical consequences of air quality standards and of control implementation programmes: roles of hydrocarbons, oxides of nitrogen, oxides of sulphur and aged smog in the production of photochemical oxidant and aerosol. California : CA State-wide Air Pollution Center. [cité dans IUCLID Dataset, 2000].
Plna K, Nilsson R, Koskinen M et Segerback D. 1999. 32P-postlabelling of propylene oxide 1- and N(6)-substituted adenine and 3-substituted cytosine/uracil: formation and persistence in vitro and in vivo. Carcinogenesis 20(10):2025-32.
Plunkett ER. 1987. Handbook of Industrial Toxicology. 3rd ed. New York (NY): Chemical Pub. Co.
Randerath K, Reddy MV et Gupta RC. 1981. 32P-labeling test for DNA damage. Proc Natl Acad Sci U S A 78(10):6126-9 [cité dans CIRC, 1994].
Renne RA, Giddens WE, Boorman GA, Kovatch R, Haseman JE et Clarke WJ. 1986. Nasal cavity neoplasia in F344/N rats and (C57BL/6 × C3H)F1 mice inhaling propylene oxide for up to two years. J Natl Cancer Inst 77(2):573-82 [cité dans CIRC, 1994].
Reuzel PGJ et Kuper CF. 1981. Subchronic (13 week) inhalation toxicity study of propylene oxide in rats. Zeist, NL: CIVO Institutes TNO. [cité dans UE, 2002].
Rios-Blanco MN, Ranasinghe A, Lee MS, Faller T, Filser JG et Swenberg JA. 2003a. Molecular dosimetry of N7-(2-hydroxypropyl)guanine in tissues of F344 rats after inhalation exposure to propylene oxide. Carcinogenesis 24(7):1233-8
Rios-Blanco MN, Yamaguchi S, Dhawan-Robl M, Kessler W, Schoonhoven R, Filser JG et Swenberg JA. 2003b. Effects of propylene oxide exposure on rat nasal respiratory cell proliferation. Toxicol Sci 75(2):279-88.
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2007a. Consumer Exposure (ConsExpo) Model [Internet]. Version 4.1. Pays-Bas : The National Institute for Public Health and the Environment (Rijksinstituut voor Volksgezondheid en Milieu).
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2007b. Do-it-yourself Products Fact Sheet: To assess the risks for the consumer [Internet]. Report 320104007/2007. RIVM. [cité en avril 2008].
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2007c. Paint Products fact Sheet : To assess the risks for the consumer [Internet]. Report 320104008/2007. RIVM. [cité en avril 2008]
Rowe VK, Hollingsworth RL, Oyen F, Mccollister DD et Spencer HC. 1956. Toxicity of propylene oxide determined on experimental animals. AMA Arch Ind Health 13(3):228-36 [cité dans CIRC, 1994].
Sack TM, Steele DH, Hammerstrom K et Remmers J. 1992. A survey of household products for volatile organic compounds. Atmos Environ 26A(6):1063-1070.
Sato H, Kidata T et Hori M. 1985. Sterilization of therapeutic immunoadsorbents with aqueous propylene oxide solutions. Int J Artif Organs 8 :109-114.
Segerback D, Osterman-Golkar S, Molholt B et Nilsson R. 1994. In vivo tissue dosimetry as a basis for cross-species extrapolation in cancer risk assessment of propylene oxide. Regul Toxicol Pharmacol 20(1 Pt 1):1-14 [cité dans CIRC, 1994].
Segerback D, Plna K, Faller T, Kreuzer PE, Hakansson K, Filser JG et Nilsson R. 1998. Tissue distribution of DNA adducts in male Fischer rats exposed to 500 ppm of propylene oxide: Quantitative analysis of 7-(2-hydroxypropyl)guanine by 32P-postlabelling. Chem Biol Interact 115 (3):229-46.
Shelby MD, Erexson GL, Hook GJ et Tice RR. 1993. Evaluation of a three-exposure mouse bone marrow micronucleus protocol: Results with 49 chemicals. Environ Mol Mutagen 21(2):160-79.
Sheldon LS. et Jenkins, P. 1990. Indoor pollutant concentrations and exposures for air toxics: a pilot study. Proceeding of the 5th International Conference on Indoor air Quality and Climate; Toronto, Canada ; p.759-764.
Simmon VF. 1981. Applications of the Salmonella/Microsome Assay. New York (NY): Springer-Verlag. p 120-6 [cité dans CIRC, 1994].
Sina JF, Bean CL, Dysart GR, Taylor VI et Bradley MO. 1983. Evaluation of the alkaline elution/rat hepatocyte assay as a predictor of carcinogenic/mutagenic potential. Mutat Res 113:357-91 [cité dans CIRC,1994; UE, 2002].
Smyth HF, Carpenter CP, Weil CS, Pozzani US, Striegel JA et Nycum JS. 1969. Range finding toxicity data. (List VII). AIHA J 30:470-6 [cité dans UE, 2002].
Smyth HF, Seaton J et Fischer L. 1941. The single dose toxicity of some glycols and derivatives. J Ind Hyg Toxicol 23:259-68 [cité dans UE, 2002]
[SNBES] Ministère de la Santé nationale et du Bien-être social (CA). 1990. L'allaitement maternel au Canada : pratiques et tendances actuelles. Ottawa : Canada, Ministère de la Santé nationale et du Bien-être social. SNBES no cat. H39-199/1990F. [cité dans DHM, 1998].
Snyder CA et Solomon JJ. 1993. The extent and persistence of binding to respiratory mucosal DNA by inhaled tritiated propylene oxide. Cancer Lett 72(3):157-61 [cité dans CIRC, 1994].
Solomon JJ, Mukai F, Fedyk J et Segal A. 1988. Reactions of propylene oxide with 2'-deoxynucleosides and in vitro with calf thymus DNA. Chem Biol Interact 67(3):275-94 [cité dans CIRC, 1994; UE, 2002].
Sprinz H, Matzke H et Carter J.(1982) Neuropathological evaluation of monkeys exposed to ethylene and propylene oxide. Kansas City (MI):Midwest Research Institute. (Préparé pour le NIOSH) [PB 83-134817].
Steinkraus V et Hausen BM. 1994. Contact allergy to propylene oxide. Contact Dermatitis 31(2):120.
Stocker WG et Thiess AM. 1979. Morbidity study on workers exposed to ethylene oxide/propylene oxide. In: The 7th Medichem Congress; 15 septembre; Gera ;1979. p. 534, 29.3.7.3.[cité dans UE, 2002].
Svensson K, Olofsson K et Osterman-Golkar S. 1991. Alkylation of DNA and hemoglobin in the mouse following exposure to propene and propylene oxide. Chem Biol Interact 78(1):55-66 [cité dans CIRC, 1994].
Thiess AM, Frentzel-Beyme R, Link R et Stocker WG. 1982. Mortality study on employees exposed to alkylene oxides (ethylene oxide/propylene oxide) and their derivatives. Dans : Prevention of Occupational Cancer International Symposium; avril 1981; Helsinki, Finlande. Bureau international du travail, Genève, Suisse : Occupational Safety and Health Series, No. 46. p. 249-259 [cité dans CIRC, 1994; UE, 2002].
Thiess AM, Schwegler H, Fleig I et Stocker WG. 1981. Mutagenicity study of workers exposed to alkylene oxides (ethylene oxide/propylene oxide) and derivatives. J Occup Med 23(5):343-7 [cité dans UE, 2002; CIRC 1994].
Trent DL. 2001. Propylene oxide [Internet]. Kirk-Othmer Encyclopedia of Chemical Technology, online version.
Tsuda S, Matsusaka N, Madarame H, Miyamae Y, Ishida K, Satoh M, Sekihashi K et Sasaki YF. 2000. The alkaline single cell electrophoresis assay with eight mouse organs: results with 22 mono-functional alkylating agents (including 9 dialkyl N-nitrosoamines) and 10 DNA crosslinkers. Mutat Res 467(1):83-98.
Tucker JD, Xu J, Stewart J, Baciu PC et Ong TM. 1986. Detection of sister chromatid exchanges induced by volatile genotoxicants. Teratog Carcinog Mutagen 6(1):15-21 [cité dans CIRC, 1994; UE, 2002].
Union européenne. 2002. Methyloxirane (Propylene Oxide). Commission européenne. Centre commun de recherche. Institut pour la protection et la sécurité des citoyens. Bureau européen des substances chimiques (ECB). European Union Risk Assessment Report. Deuxième liste des substances prioritaires. Rapport no EUR 20512 EN 23:1-149.
[US EPA] United States Environmental Protection Agency. 1986 Sept. Standard scenario for estimating exposure to chemical substances during use of consumer products Vol.1. (EPA contract No. 68-02-3968)
[US EPA] States Environmental Protection Agency. 1997 Aug. Exposure Factors Handbook Vol.3 Activity factors.(EPA/600/P-95/002Fc)
[US EPA] United States Environmental Protection Agency. 1994. Integrated Risk Information System (IRIS): Propylene oxide (CASRN 75-56-9).
[US EPA] United States Environmental Protection Agency. 2006 Aug. Reregistration Eligibility Decision (RED) for Propylene Oxide (EPA 738-R-06-029).
[US EPA] United States Environmental Protection Agency. 1990. Integrated Risk Information System (IRIS): Propylene oxide (CASRN 75-56-9).
[US EPA] United States Environmental Protection Agency. 2005 Sept 26. Propylene Oxide Revised HED Risk Assessment for Reregistration Eligibility Decision (RED) Document (PC Code: 042501, DP Barcode: D321759).
Van Ketel WG. 1979. Contact dermatitis from propylene oxide. Contact Dermatitis 5(3):191-2 [cité dans CIRC, 1994].
Van Sittert NJ et De Jong G. 1985. Biomonitoring of exposure to potential mutagens and carcinogens in industrial populations. Food Chem Toxicol 23(1):23-31. [cité dans UE, 2002].
Viktorova TV, Karimova LK, Khusnutdinova EK et Rafikov KH S. 1994. Assessment of chromosomal aberrations in workers of propylene and ethylene oxides production. Med Tr Prom Ekol 4:20-3 [cité dans UE, 2002].
Vogel EW et Nivard MJ. 1998. Genotoxic effects of inhaled ethylene oxide, propylene oxide and butylene oxide on germ cells: sensitivity of genetic endpoints in relation to dose and repair status. Mutat Res 405(2):259-71.
Vogel EW et Nivard MJ. 1997. The response of germ cells to ethylene oxide, propylene oxide, propylene imine and methyl methanesulfonate is a matter of cell stage-related DNA repair. Environ Mol Mutagen 29(2):124-35.
von der Hude W, Carstensen S, Gurtler R et Obe G. 1992. Structure-activity relationships of epoxides: induction of sister-chromatid exchanges in V79 Cells by enantiomeric epoxides. Mutat Res 278(4):289-97 [cité dans CIRC, 1994].
Von der Hude W, Carstensen S et Obe G. 1991. Structure-activity relationships of epoxides: Induction of sister-chromatid exchanges in Chinese hamster V79 cells. Mutat Res 249 (1):55-70 [cité dans UE, 2002].
von der Hude W, Seelbach A et Basler A. 1990. Epoxides: Comparison of the induction of SOS repair in Escherichia coli PQ37 and the bacterial mutagenicity in the Ames test. Mutat Res 231 (2):205-18 [cité dans UE, 2002].
Voogd CE, Van Der Stel JJ et Jacobs JJ. 1981. The mutagenic action of aliphatic epoxides. Mutat Res 89(4):269-82. [cité dans CIRC, 1994; UE, 2002].
Wade DR, Airy SC et Sinsheimer JE. 1978. Mutagenicity of aliphatic epoxides. Mutat Res 58 (2-3):217-24. [cité dans CIRC, 1994; UE, 2002].
Waggy GT et Payne JR. 1974. Environmental impact analysis, product biodegradability testing. Progress report. August 12, 1974. File No. 19751, Research and Development Department, Union Carbide Corporation [cité dans European Union Risk Assessment Report 2000] .
Wakata A, Miyamae Y, Sato SI, Suzuki T, Morita T, Asano N, Awogi T, Kondo K et Hayashi M. 1998. Evaluation of the rat micronucleus test with bone marrow and peripheral blood: Summary of the 9th collaborative study by CSGMT MMS. Environ Mol Mutagen 32 (1):84-100.
Walles SA. 1974. The influence of some alkylating agents on the structure of DNA in vitro. Chem Biol Interact 9(2):97-103 [cité dans UE, 2002].
Wallington TJ, Liu R., Dagaut P et Kurylo M.J. 1988. The gas phase reactions of hydroxyl radicals with a series of aliphatic ethers over the temperature range 240-440 K. Int J Chem Kinet 20:41-49 [cité dans European Union Risk Assessment Report, 2000] .
Walpole AL. 1958. Carcinogenic action of alkylating agents. Ann NY Acad Sci 68:750-61 [cité dans CIRC, 1994].
Weil CS, Condra N, Haun C et Streigel JA. 1963. Experimental carcinogenicity and acute toxicity of representative epoxides. Am Ind Hyg Assoc J 24:305-25 [cité dans UE, 2002].
Winer AM et al. 1979. Cité dans Atkinson R, Darnall KR, Lloyd AC, Winer AMand Pitts JN Jr. Kinetics and mechanisms of the reactions of the hydroxyl radical with organic compounds in the gas phase. Advances in Photochemistry, 11: 3741.
Yamaguchi T. 1982. Mutagenicity of trioses and methyl glyoxal on Salmonella typhimurium. Agric Biol Chem 46:849-51 [cité dans CIRC, 1994].
Yasunaga K, Kiyonari A, Oikawa T, Abe N et Yoshikawa K. 2004. Evaluation of the Salmonella umu test with 83 NTP chemicals. Environ Mol Mutagen 44(4):329-45.
Young JT, Mattsson JL, Albee RR et Schuetz DJ. 1985. Propylene oxide: Assessment of neurotoxic potential in male rats. Report (D-1831) of the Mammalian and Environmental Toxicology Research Laboratory. Midland (MI): Dow Chemical, Health and Environmental Sciences. [cité dans UE, 2002].
Zamora PO, Benson JM, Li AP et Brooks AL. 1983. Evaluation of an exposure system using cells grown on collagen gels for detecting highly volatile mutagens in the CHO mutation assay Environ Mutagen 5(6):795-801 [cité dans CIRC, 1994; UE, 2002].
Zeiger E, Anderson B, Haworth S, Lawlor T et Mortelmans K. 1988. Salmonella mutagenicity tests: IV. Results from the testing of 300 chemicals. Environ Mol Mutagen 11 Suppl 12:1-157 [cité dans CIRC, 1994].
Zetsch C et Stahl F. 1981. Rate constants for reactions of OH with partly oxidised hydrocarbons: carbonic acids and epoxides. Communication présentée au cours du « Discussion meeting of working party 2 », à Louvain, Belgique, les 11 et 12 février 1981, dans le cadre du COST 61A bis « Physicochemical behaviour of atmospheric pollutants » (Rapport préparé par RA Cox, AERE et Harwell) [cité dans European Union Risk Assessment Report, 2000).
| Voie d'exposition | Absorption estimée (µg/kg p.c. par jour) de naphtalène par groupes d'âge | ||||||
|---|---|---|---|---|---|---|---|
| 0-6 mois [1, 2, 3] | 0,5-4 ans[4] | 5-11 ans[5] | 12-19 ans[6] | 20-59 ans[7] | 60+ ans[8] | ||
| lait maternisé | sans lait maternisé | ||||||
| s.o. = sans objet a.d. = aucune donnée [1] Aucune donnée n'a été relevée sur la présence de méthyloxirane dans le lait maternel. [2] Valeurs présumées : masse corporelle de 7,5 kg, inhalation de 2,1 m 3 d'air par jour, ingestion de 0,8 L (lait maternisé) ou de 0,3 L (autre que le lait maternisé) d'eau par jour et ingestion de 30 mg de sol par jour (DHM, 1998). [3] L'absorption à partir de l'eau est synonyme de l'absorption à partir de la nourriture pour les nourrissons alimentés au lait maternisé. Aucune donnée sur les concentrations de mé thyloxirane dans le lait maternisé n'a été relevée. Aucune donnée sur le méthyloxirane dans l'eau au Canada n'a été relevée et le seuil de détection d'une étude de surveillance japonaise sur les eaux de surface (ME du Japon) a été jugé inadéquat sur la base du mode de rejet, des propriétés physicochimiques et des utilisations du méthyloxirane qui font que sa présence dans l'eau devrait être négligeable par comparaison à ses concentrations dans l'air. [4] Valeurs présumées : masse corporelle de 15,5 kg, inhalation de 9,3 m 3 d'air par jour et ingestion de 0,7 L d'eau, de 100 mg de sol et de 0,1 g de chair de noix par jour (DHM, 1998). [5] Valeurs présumées : masse corporelle de 31,0 kg, inhalation de 14,5 m 3 d'air par jour et ingestion de 1,1 L d'eau, de 65 mg de sol et de 0,4 g de chair de noix par jour (DHM, 1998). [6] Valeurs présumées : masse corporelle de 59,4 kg, inhalation de 15,8 m 3 d'air par jour et ingestion de 1,2 L d'eau, de 30 mg de sol et de 0,5 g de chair de noix par jour (DHM, 1998). [7] Valeurs présumées : masse corporelle de 70,9 kg, inhalation de 16,2 m 3 d'air par jour et ingestion de 1,5 L d'eau, de 30 mg de sol et de 0,8 g de chair de noix par jour (DHM, 1998). [8] Valeurs présumées : masse corporelle de 72,0 kg, inhalation de 14,3 m 3 d'air par jour et ingestion de 1,6 L d'eau, de 30 mg de sol et de 0,4 g de chair de noix par jour (DHM, 1998). [9] Aucune donnée n’a été relevée sur la présence du méthyloxirane dans l’air ambiant au Canada. Le seuil de détection de 0,31 µg/m3 pour l’air ambiant tiré d’une étude pilote portant sur quatre logements de Woodland, en Californie, a été utilisé pour le calcul de la limite supérieure de l’exposition estimée (Sheldon et al., 1990). Il est présumé que les Canadiens passent trois heures à l’extérieur à chaque jour (DHM, 1998). [10] Aucune donnée n’a été relevée sur la présence de méthyloxirane dans l’air intérieur au Canada. Le seuil de détection de 0,31 µg/m3 pour l’air intérieur, déterminé au cours d’une étude pilote portant sur deux logements de Woodland, en Californie, où le méthyloxirane n’a pas été décelé, a été utilisé pour le calcul de la limite supérieure de l’exposition estimée (Sheldonet al., 1990). Il est présumé que les Canadiens passent 21 heures à l’intérieur chaque jour (DHM, 1998). [11] Aucune donnée n’a été relevée sur la présence du méthyloxirane dans l’eau au Canada. Le seuil de détection maximal de 5 µg/L, d’une enquête de 1980 portant sur 36 sources japonaises d’eau de surface (ME du Japon, consultée en juillet 2007) a été jugé inadéquat pour l’estimation de la limite supérieure d’exposition ou des concentrations dans le lait maternisé reconstitué des nourrissons car le mode de rejet, les propriétés physiques et chimiques et les utilisations du méthyloxirane font que sa présence dans l’eau devrait être négligeable par comparaison à ses concentrations dans l’air. [12] La limite maximale générale de 0,1 ppm pour les résidus de méthyloxirane à l’intérieur ou à la surface de chairs de noix d’amandier, de noyer et de pacanier importées et fumigées a été utilisée pour estimer les limites supérieures d’exposition. Il s’agit des seules chairs de noix dont la fumigation par ce pesticide est connue, et aucune autre donnée sur la présence de méthyloxirane dans des aliments n’a été décelée (ARLA, 2006). Une étude portant sur les chairs de noix traitées présentée à l’EPA américaine fait état de résidus maximaux de méthyloxirane de 273 ppm dans des noix d’amandier, 28 jours après la fumigation. L’étiquetage actuel des produits aux états-Unis impose aux fumigateurs de retenir (de dégazer) les chairs de noix pendant 28 jours avant leur expédition (US EPA, 2005). Comme le Canada n’a pas imposé de limite maximale de résidus pour ce pesticide, les aliments traités aux états-Unis (ou ailleurs) importés au Canada ne peuvent contenir plus de 0,1 ppm de méthyloxirane sous peine d’infraction au Règlement sur les aliments et drogues(ARLA, 2006). La consommation de noix et de graines de ce groupe d’aliments – à l’exception du beurre d’arachide – a été utilisée car les chairs de noix d’amandier, de noyer et de pacanier sont les seules connues pour être fumigées. Aucune donnée n’a été décelée sur la présence du méthyloxirane dans d’autres aliments. [13] Aucune donnée sur la présence du méthyloxirane dans les sols au Canada n’a été relevée. Le seuil de détection de 2 µg/kg utilisé pour 12 échantillons de sédiments prélevés au cours d’une étude de surveillance japonaise réalisée en 1980 (ME du Japon) a été jugé inadéquat pour le calcul d’une estimation de la limite supérieure d’exposition (tel qu’il est mentionné ci-dessus pour l’eau) car le mode de rejet, les propriétés physiques et chimiques et les utilisations du méthyloxirane font que sa présence dans le sol devrait être négligeable par comparaison à ses concentrations dans l’air. |
|||||||
| Air ambiant [9] | 0,01 | 0,02 | 0,02 | 0,01 | 0,01 | 0,01 | |
| Air intérieur [10] | 0,08 | 0,16 | 0,13 | 0,07 | 0,06 | 0,05 | |
| Eau potable [11] | -- | -- | -- | -- | -- | -- | -- |
| Nourriture et boissons [12] | s.o. | 0,0007 | 0,001 | 0,0008 | 0,001 | 0,0006 | |
| Sol [13] | a.d. | a.d. | a.d. | a.d. | a.d. | a.d. | |
| Absorption totale | 0,09 | 0,09 | 0,18 | 0,15 | 0,08 | 0,07 | 0,06 |
| Milieu | Air | Eau | Sol |
|---|---|---|---|
| [1] Concentrations prévues à l'aide du modèle Chemcan (version 6.0) [CEMC, 2003]. [2] Les prévisions modélisées supposent un rejet à 100 % dans l'atmosphère du sud de l'Ontario d'une quantité de 50 kg par an, qui est le seuil de déclaration indiqué dans un avis récent donné en vertu de l'article 71 de la LCPE (1999) [Environnement Canada, 2007]. |
|||
| Concentration [2] | 5,4 x10 -7µg/m3 | 1,8 × 10 -5µg/L | 1,2 × 10 -9ng/g |
| Type de produits de consommation | Hypothèse | Exposition estimée |
|---|---|---|
| [a] Ces produits étant surtout utilisés par des adultes (personnes âgées de 20 à 59 ans), les expositions n’ont été estimées que pour ce groupe d’âge [b] Modèle ConsExpo (version 4.1), exposition aux vapeurs, débit constant comme mode de rejet (on suppose que la substance est rejetée à un débit constant durant un temps donné); estimation aux fins de comparaison; la concentration moyenne par événement est de 200 mg/m3. [c] La matrice de la masse moléculaire est calculée à partir de la masse moléculaire du solvant principal, le dichlorométhane présent dans le décapant. [d] La matrice de la masse moléculaire est calculée à partir de la masse moléculaire du solvant principal, le carbonate de propylène présent dans la peinture en aérosol. |
||
| Décapant | Inhalation
|
Concentration la moyenne par événement = 200 mg/m3 |
| Peinture acrylique en aérosol | Inhalation
|
Concentration la moyenne par événement = 1,3 mg/m3 |
| Paramètre | Résultat et référence | |||
|---|---|---|---|---|
| Espèce, souche | Résultat | Activation métabolique | Référence | |
| Génotoxicité et paramètres connexes : in vitro | ||||
| Mutation génique | Salmonella typhimurium TA 97 | positif | +/- | Canter et al., 1986 |
| négatif | +/- | Zeiger et al., 1988 | ||
| Salmonella typhimurium TA 98 | négatif | + | Bootman et al., 1979 Canter et al., 1986 Zeiger et al., 1988 |
|
| - | Bootman et al., 1979 McMahon et al., 1979 Pfeiffer et Dunkelberg, 1980 Canter et al., 1986 Zeiger et al., 1988 |
|||
| Salmonella typhimurium TA100 | positif | + | Bootman et al., 1979 Canter et al., 1986 Hughes, 1987 Castelain et al., 1993 |
|
| - | Wade et al., 1978 Bootman et al., 1979 McMahon et al., 1979 Pfeiffer et Dunkelberg, 1980 Simmon, 1981 Yamaguchi, 1982 Canter et al., 1986 Djuric et al., 1986 Agurell et al., 1991 Castelain et al., 1993 |
|||
| négatif | + | Zeiger et al., 1988 | ||
| - | Hemminki et Falck, 1979 Zeiger et al., 1988 |
|||
| Salmonella typhimurium TA1535 | positif | + | Bootman et al., 1979 Canter et al., 1986 Zeiger et al., 1988 Castelain et al., 1993 |
|
| - | Wade et al., 1978 Bootman et al., 1979 McMahon et al., 1979 Pfeiffer et Dunkelberg, 1980 Simmon, 1981 Canter et al., 1986 Djuric et al., 1986 Agurell et al., 1991 Castelain et al., 1993 |
|||
| négatif | - | Zeiger et al., 1988 | ||
| Salmonella typhimurium TA1537 | négatif | + | Bootman et al., 1979 Zeiger et al., 1988 |
|
| - | Bootman et al., 1979 McMahon et al., 1979 Pfeiffer et Dunkelberg, 1980 Zeiger et al., 1988 |
|||
| non concluant | +/- | Canter et al., 1986 | ||
| Salmonella typhimurium TA1538 | négatif | + | Dean et al., 1985 | |
| - | Dean et al., 1985 McMahon et al., 1979 |
|||
| Salmonella typhimurium YG7108 | positif | non précisé | Emmert et al., 2006 | |
| Salmonella typhimurium G46 | négatif | - | McMahon et al., 1979 | |
| Escherichia coli WP2 uvr A | positif | + | Dean et al., 1985 | |
| - | Dean et al., 1985 McMahon et al., 1979 |
|||
| négatif | - | Hemminki et Falck, 1979 | ||
| Escherichia coli WP2 | positif | + | Bootman et al., 1979 | |
| - | Bootman et al., 1979 McMahon et al., 1979 Dean et al., 1985 |
|||
| négatif | + | Dean et al., 1985 | ||
| Escherichia coli CM891 | positif | - | Bootman et al., 1979 | |
| Escherichia coli CM871 | positif | - | Bootman et al., 1979 | |
| Escherichia coli B (Arg-) Hs30R | positif | - | Kohda et al., 1987 | |
| Escherichia coli PQ37 | négatif | +/- | Von der Hude et al., 1990 | |
| Klebsiella pneumoniae | positif | - | Voogd et al., 1981 | |
| Saccharamyces cerevisiae | positif | - | Agurell et al., 1991 | |
| Schizosaccharomyces pombe p1 | positif | +/- | Migliore et al., 1982 | |
| Neurospora crassa | positif | - | Kolmark et Giles, 1955 | |
| Bactériophage | positif | non précisé | Garro et Phillips, 1980 | |
| négatif | - | Cookson et al., 1971 | ||
| Souris - cellules L5178Y | positif | - | McGregor et al., 1991 | |
| Hamster chinois - cellules ovariennes, locus hprt | positif | - | Zamora et al., 1983 | |
| Paramètre | Résultat et référence | |||
|---|---|---|---|---|
| Génotoxicité et paramètres connexes : in vitro | ||||
| échange de chromatides sœurs | Positif : hamster chinois CHO (+/-S9) [Gulati et al., 1989] hamster chinois, cellules V79 (-S9) [Von der Hude et al., 1991; Von der Hude et al., 1992] rat - cellules du foie in vitro (-S9) [Dean et Hodson-Walker, 1979] humain - lymphocytes in vitro (Tucker et al., 1986; Agurell et al., 1991) |
|||
| Aberrations chromosomiques | Positif : hamster chinois CHO (+/-S9) [Gulati et al., 1989] rat - cellules du foie in vitro (-S9) [Dean et Hodson-Walker, 1979; Dean et al., 1985] humain - lymphocytes in vitro (Bootman et al., 1979) |
|||
| Induction de micronoyaux | Positif : humain - lymphocytes in vitro (Jorritsma et al., 1995) |
|||
| Bris de brins d'ADN | Positif : rat - hépatocytes in vitro (-S9) [Sina et al., 1983] humain - fibroblastes diploïdes (Kolman et al., 1997; Chovanec et al., 1998) veau - ADN du thymus (Walles, 1974) |
|||
| Adduits à l'ADN | Positif : (Lawley et Jarman, 1972; Walles, 1974; Hemminki et al., 1980; Randerath et al., 1981; Djuric et al., 1986; Solomon et al., 1988; Hemminki et al., 1994; Kumar et al., 1995; Plna et al., 1999) |
|||
| Toxicité différentielle | Positif : autre bactérie (-S9) [Bootman et al., 1979] |
|||
| Induction de la réponse SOS | Positif : Salmonella typhimurium, TA1535/pSK1002 (+/-S9) [Ong et al., 1987] Salmonella typhimurium, TA1535/pSK1002 (-S9) [Yasunagaet al., 2004] |
|||
| Conversion génique | Positif : Saccharomyces cerevisiae (- S9) [Agurell et al., 1991] |
|||
| Transformation cellulaire | Positif : souris - fibroblastes d'embryon (Kolman et Duniska, 1995) hamster syrien - cellules d'embryons (Kolman et Duniska, 1995) BALB/c-3T3, cellules (-S9) (Matthews et al., 1993) |
|||
| Génotoxicité et paramètres connexes :in vivo | ||||
| Induction de micronoyaux (moelle osseuse) | Positif : Négatif : |
|||
| Induction de micronoyaux (sang périphérique) | Positif : Négatif : |
|||
| Aberrations chromosomiques (moelle osseuse) | Positif : souris (i.p.) [Farooqi et al., 1993; NTP Database, 1989-1993] |
|||
| échange de chromatides sœurs (moelle osseuse) | Positif : souris (i.p.) [Farooqi et al., 1993; NTP Database, 1989] |
|||
| échange de chromatides sœurs (sang périphérique) | Négatif : singe cynomolgus (inhalation) [Lynch et al., 1984b] |
|||
| Lésions de l'ADN dans la moelle osseuse, l'estomac et le colon | Positif : souris (i.p.) [Tsuda et al., 2000] |
|||
| Essai dominant létal | Négatif : rat (inhalation) [Hardin et al., 1983b] souris (orale) [Bootman et al., 1979] |
|||
| Mutation létale récessive liée au sexe | Positif : drosophile (vapeur) [Hardin et al., 1983b; Vogel et Nivard, 1997; Vogel et Nivard, 1998; Nivard et al., 2003] drosophile (orale) [Foureman et al., 1994] |
|||
| Translocations réciproques | Positif : drosophile (orale) [Foureman et al., 1994] |
|||
| Adduits à l'ADN | Positif : drosophile (vapeur) [Nivard et al., 2003] souris, rat ou chien (inhalation, i.p. ou i.v.) [Segerback et al., 1994] souris (i.p.) [Svensson et al., 1991] s rat (inhalation) [Snyder et Solomon, 1993; Segerback et al., 1998; Plna et al., 999; Osterman-Golkar et al., 2003; Rios-Blanco et al., 2003a] |
|||
| Perte de chromosomes | Positif : drosophile (vapeur) [Vogel et Nivard, 1998] |
|||
| Humains | ||||
| Toxicité chronique/ cancérogénicité | Le CIRC (1994) et l'UE (2002) ont examiné diverses études portant sur des cohortes de sujets subissant une exposition professionnelle et une étude témoin sans exposition professionnelle, et déterminé qu'il était impossible de formuler des conclusions sur la cancérogénicité du méthyloxirane (Stocker et Thiess, 1979; Thiess et al., 1982; Hogstedtet al., 1979, 1986; Hogstedt, 1988; Gardner et al., 1989; Ott et al., 1989). | |||
| Génotoxicité et paramètres connexes | L'UE (2002) a examiné six études portant sur l'exposition professionnelle et indiqué l'impossibilité de tirer des conclusions de ces études relativement à la mutagénicité du méthyloxirane chez les humains (Theiss et al., 1981; Peroet al., 1982, 1985; Van Sittert et de Jong, 1985; de Jonget al., 1988; Hogstedt et al., 1990; Viktorovaet al., 1994). Selon une étude pilote, huit travailleurs d’un groupe exposés au méthyloxirane pendant au moins deux ans (concentrations antérieures < 10 ppm et concentration mesurée pouvant atteindre 7 ppm le jour précédant le prélèvement sanguin) présentaient un accroissement significatif des concentrations sanguines d’adduits à l’ADN et d’échanges de chromatides sœurs, comparativement à huit témoins, mais on ne peut exclure la possibilité que des facteurs confusionnels aient contribué aux effets cytogénétiques (Czene et al.,2002). |
|||
| Sensibilisation, irritation et autres | Rapports de cas de dermatite allergique de contact (Van Ketel, 1979; Jensen, 1981; Steinkraus et Hausen, 1994; Morriset al., 1998) Rapport de cas de brûlure cornéenne (McLaughlin, 1946) Rapport de cas de symptômes, notamment ceux d’irritation du tractus respiratoire et de l’oeil (Gosselin et al.,1984) |
|||
| Adduits à l'hémoglobine | Niveaux accrus chez de petites populations échantillons (Osterman-Golkar et al., 1984; Kautiainen et Tornqvist, 1991; Boogaard et al., 1999; Czene et al., 2002) | |||
Cette page Web a été archivée dans le Web
L'information dont il est indiqué qu'elle est archivée est fournie à des fins de référence, de recherche ou de tenue de documents. Elle n'est pas assujettie aux normes Web du gouvernement du Canada et elle n'a pas été modifiée ou mise à jour depuis son archivage. Pour obtenir cette information dans un autre format, veuillez communiquer avec nous.
Archivée
Méthyloxirane
(oxyde de propylène)
Numéro de registre du Chemical Abstracts Service
75-56-9
Environnement Canada
Santé Canada
Juillet 2008
Table des matières
- Synopsis
- Introduction
- Identité de la substance
- Propriétés physiques et chimiques
- Sources
- Utilisations
- Rejets dans l’environnement
- Devenir dans l’environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d’effets nocifs sur l’environnement
- Potentiel d’effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe 1 : Valeurs estimées de la limite supérieure de l'absorption quotidienne de méthyloxirane (no CAS 75-56-9) par la population générale au Canada
- Annexe 2 : Concentrations prévues du méthyloxirane dans les milieux naturels
- Annexe 3 : Exposition estimée du méthyloxirane par les adultes à partir de produits de consommation
- Annexe 4 : Résumé des renseignements sur les effets sur la santé du méthyloxirane
Les ministres de l’Environnement et de la Santé ont réalisé une évaluation préalable du méthyloxirane dont le numéro de registre du Chemical Abstract Service (CAS) est 75 56 9. Une priorité élevée a été accordée à la prise de mesures à l’égard de cette substance lors de la catégorisation visant la Liste intérieure des substances dans le cadre du Défi lancé par les ministres, car on considère qu’elle présente le plus fort risque d’exposition (PFRE) pour les Canadiens et que d’autres organismes l’ont classé pour ses effets cancérogènes et génotoxiques. Comme cette substance répond au critère de catégorisation écologique de la persistance, mais non aux critères de la bioaccumulation ou de la toxicité intrinsèque pour les organismes aquatiques, la présente évaluation est donc axée sur les aspects relatifs à la santé humaine.
La quantité de méthyloxirane déclarée avoir été importée en 2006 est supérieure à 10 000 000 kg. Cette substance est surtout utilisée à titre de monomère dans la production de polymères de polyétherpolyols et une certaine quantité est destinée à la production de propylèneglycol.
L’exposition de la population canadienne au méthyloxirane devrait surtout se faire à partir de l’air, en se basant sur les rejets potentiels dans ce milieu ainsi que sa pression de vapeur élevée. Les renseignements, par ailleurs très limités, sur ses concentrations dans les milieux naturels et la modélisation de sa fugacité indiquent que l’exposition dans l’environnement général devrait être faible. L’exposition au méthyloxirane pourrait cependant être importante au cours de l’utilisation de produits qui en contiennent.
Sur la base essentiellement des évaluations fondées sur la méthode du poids de la preuve réalisées par plusieurs organismes internationaux et nationaux, le pouvoir cancérogène, déterminé par l’observation de tumeurs des fosses nasales chez le rat et la souris, est l’un des effets critiques permettant de caractériser le risque pour la santé humaine. Le méthyloxirane s’est aussi avéré génotoxique au cours de plusieurs essais in vitro et in vivo. Par conséquent, et en dépit du fait que le mode d’induction des tumeurs n’a pas été clairement élucidé, on ne peut exclure la possibilité que les tumeurs observées chez les animaux de laboratoire découlent d’une interaction directe avec le matériel génétique. En outre, la limite supérieure de l’exposition estimée par inhalation au cours de l’utilisation de produits de consommation contenant du méthyloxirane peut presque atteindre ou dépasser la concentration ayant un effet critique autre que le cancer dans les fosses nasales.
Compte tenu de la cancérogénicité du méthyloxirane, pour lequel il peut exister une probabilité d’effet nocif à tout niveau d’exposition et de l’inadéquation possible de la marge entre l’exposition estimée à partir des produits et du niveau critiques pour les effets autres que le cancer, il est conclu que le méthyloxirane est une substance qui peut pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
À la lumière des dangers écologiques et des rejets déclarés de méthyloxirane, il est conclu que cette substance ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique ni à mettre en danger l'environnement essentiel pour la vie. De plus, le méthyloxirane répond au critère de la persistance du Règlement sur la persistance et la bioaccumulation, mais non au critère qui y est énoncé sur le potentiel de bioaccumulation.
Cette substance s'inscrira dans la mise à jour de l’inventaire de la Liste intérieure des substances, qui débutera en 2009. De plus, des activités de recherche et de surveillance viendront, le cas échéant, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable et, le cas échéant, la performance des mesures de contrôle possibles déterminées à l'étape de la gestion des risques.
Compte tenu des renseignements disponibles, le méthyloxirane remplit un ou plusieurs critères de l’article 64 de la Loi canadienne sur la protection de l’environnement (1999).
La Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)] (Canada, 1999) impose aux ministres de l’Environnement et de la Santé de faire une évaluation préalable des substances qui répondent aux critères de la catégorisation énoncés dans la Loi, afin de déterminer si ces substances présentent ou sont susceptibles de présenter un risque pour l’environnement ou la santé humaine. À partir des résultats de l’évaluation préalable, les ministres peuvent proposer de ne rien faire à l’égard de la substance, de l’inscrire sur la Liste des substances d’intérêt prioritaire (LSIP) en vue d’une évaluation plus détaillée ou de recommander son inscription sur la Liste des substances toxiques de l’annexe 1 de la Loi et, s’il y a lieu, la quasi-élimination de ses rejets dans l’environnement.
En se fondant sur l’information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu’une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères de la catégorisation relatifs à l’environnement [persistance (P), potentiel de bioaccumulation (B) et toxicité intrinsèque (Ti) pour les organismes aquatiques] et que l’on croit être commercialisées au Canada;
- celles qui répondent aux critères de la catégorisation pour le plus fort risque d’exposition (PFRE) ou qui présentent un risque d’exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine à la lumière des classements effectués par d’autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont publié un avis d’intention dans la Partie I de la Gazette du Canada (Canada, 2006), dans lequel ils mettent au défi l’industrie et les autres intervenants intéressés de fournir, selon un calendrier déterminé, des renseignements particuliers sur les substances qui pourraient servir à étayer l’évaluation des risques. Ces renseignements pourraient aussi servir à élaborer et à évaluer comparativement les meilleures pratiques de gestion des risques et de gérance des produits pour ces substances jugées hautement prioritaires.
Le méthyloxirane a été jugé hautement prioritaire pour l’évaluation des risques qu’il comporte pour la santé humaine, car il a été jugé présenter un PFRE et a été classé par d’autres instances sur la base de sa cancérogénicité et de sa génotoxicité. Le volet du Défi portant sur cette substance a été lancé le 3 février 2007 au moyen d’un avis paru dans laGazette du Canada (Canada, 2007a). Le profil de cette substance a été publié en même temps. Ce profil présentait l’information technique, obtenue avant décembre 2005, sur laquelle a reposé la catégorisation de cette substance. En réponse au Défi, on a reçu des documents présentant des renseignements.
Même si l’évaluation des risques du méthyloxirane pour la santé humaine a été jugé hautement prioritaire et que la substance remplit le critère de la catégorisation écologique de la persistance, elle ne remplit pas celui du potentiel de bioaccumulation ou de la toxicité intrinsèque pour les organismes aquatiques. La présente évaluation est donc axée sur l’information pertinente à l’évaluation des risques pour la santé humaine.
Les évaluations préalables effectuées en vertu de la LCPE (1999) portent sur les renseignements essentiels pour établir si une substance répond ou non aux critères de toxicité des substances chimiques énoncés dans l’article 64 de la Loi, qui se lit comme suit :
64. « ...est toxique toute substance qui pénètre ou peut pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à :
- avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique;
- mettre en danger l’environnement essentiel pour la vie;
- constituer un danger au Canada pour la vie ou la santé humaine. »
Les évaluations préalables mettent en lumière les renseignements scientifiques et présentent les conclusions que l’on peut dégager en appliquant la méthode du poids de la preuve et la prudence.
Cette évaluation préalable inclue l’examen des renseignements sur les propriétés chimiques, les dangers, les utilisations et l’exposition, à l’inclusion des renseignements additionnels fournis dans le cadre du Défi. Des données pertinentes à l’évaluation préalable de cette substance ont été relevées dans des publications originales, des rapports de synthèse et d’évaluation, des rapports de recherche de parties intéressées et d’autres documents accessibles lors de recherches menées dernièrement, jusqu’en juillet 2007. Les études importantes ont fait l’objet d’évaluations critiques. Les études clés ont fait l’objet d’évaluation critique ; les résultats de la modélisation ont pu être utilisés dans la formulation de conclusions. L’évaluation des risques pour la santé humaine comprends l’examen de données pertinentes à l’évaluation de l’exposition (non professionnelle) de la population dans son ensemble et de l’information sur les dangers pour la santé (surtout fondée sur des évaluations réalisées par d’autres organismes selon la méthode du poids de la preuve et ayant servi à déterminer le caractère prioritaire de la substance). Les décisions reposent sur la nature de l’effet critique retenu ou sur l’écart entre les valeurs prudentes donnant lieu à des effets et les estimations de l’exposition tenant compte de la confiance accordée au caractère exhaustif des bases de données sur l’exposition et les effets, cela dans le contexte d’une évaluation préalable. Les évaluations préalables ne sont pas le résultat d’examens critiques ou exhaustifs de toutes les données disponibles. Elles présentent plutôt les informations critiques selon lesquelles la conclusion est basée.
La présente évaluation préalable a été effectuée par le personnel des Programme des substances existantes de Santé Canada et d’Environnement Canada et elle intègre des résultats provenant d’autres programmes appliqués par ces ministères. Cette évaluation préalable a fait l’objet d’une consultation indépendante par des pairs. Des commentaires sur les portions techniques concernant la santé humaine ont été reçus par des experts scientifiques qui y ont participé ont été choisis et dirigés par Toxicology Excellence for Risk Assessment (TERA) et comprenaient John Christopher (California Department of Toxic Substances Control), Michael Jayjock (The Lifeline Group), Donna Vorhees (The Science Collaborative) et Joan Strawson (TERA). Gradient Corporation a également donné son avis sur ces parties. Bien que les commentaires externes aient été pris en considération, Santé Canada assume la responsabilité du contenu final de l’évaluation préalable pour tout ce qui concerne la santé humaine. De plus, une version provisoire de la présente évaluation préalable a fait l’objet d’une consultation publique de 60 jours. Les considérations et les renseignements importants à la base du présent rapport sont présentés ci après.
Synonymes courants : oxyde de propylène, 1,2-époxypropane
Un résumé des propriétés physiques et chimiques les plus importantes du méthyloxirane est présenté dans le tableau 1. À la température ambiante, le méthyloxirane est un liquide incolore, très soluble dans l'eau et très volatil.
| Propriété | Valeur/unité | Référence |
|---|---|---|
| [*] Température de 20 à 25 °C [**] Valeurs initiales en unités autres que celles du Système international. |
||
| Structure chimique | 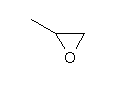 |
|
| Masse moléculaire | 58,08 g/mole | (PhysProp, 2003) |
| état physique (température et pression normales) | liquide incolore à odeur sucrée rappelant l'éther | (EURAR, 2000) |
| Masse volumique | 831 kg/m3(à 20 °C) | BASF, 1977a |
| Point d'ébullition (PE) | 33,9 – 35 °C | (American Chemical Society, 1952; Jefferson Chemical Company, 1960; Plunkett, 1987; BASF, 1995; PhysProp, 2003) |
| Point de fusion (PF) | -112,16 à -111 °C | (McDonald et al., 1959; Oetting, 1964; Howard, 1989; BASF, 1995; PhysProp, 2003) |
| Log Koe | 0,03; 0,08 ± 0,05 | (Deneer et al., 1988; Howard, 1989; Hansch et al., 1995) |
| Log Kco | 0,37 (est.) | (PCKOCWIN, 2000) |
| Constante de la loi de Henry (CLH) | 1,226×10 -4atm·m3/mole (est.) | (HENRYWIN, 2000) |
| Pression de vapeur (PV)[*] | 60,7 – 71,55 kPa; 59,2 kPa (8,59 PSI[**]); 70,9 – 71,7 kPa (532,1 - 538 mm Hg[**]) |
(American Chemical Society, 1952; BASF, 1967; Dow, 1977; Boubliket al., 1984; Howard, 1989; Aldrich Chemical Co., 2003) |
| Solubilité dans l'eau (SE)[*] | 400 – 590 g/L | (Bogyo et al., 1980; BASF, 1995) |
Le méthyloxirane n'existe pas à l'état naturel. Les deux principaux procédés utilisés pour sa fabrication en grandes quantités à partir du propylène sont la peroxydation et la chlorohydrination.
Selon les renseignements fournis conformément à l’avis concernant le méthyloxirane publié en vertu de l’article 71 de la LCPE (1999), aucune entreprise canadienne n’a déclaré avoir fabriqué cette substance en une quantité d’au moins 100 kg en 2006. Des entreprises canadiennes ont déclaré avoir importé du méthyloxirane en une quantité supérieure à 10 000 000 kg pendant l’année civile 2006 (Canada, 2007b).
Les présentations faites conformément à l’article 71 de la LCPE (1999), les réponses au questionnaire du Défi, des données communiquées volontairement (Canada, 2007b) et des publications scientifiques et techniques montrent que le méthyloxirane est surtout utilisé à titre de monomère dans la production de polymères de polyétherpolyols. Ces derniers servent à la fabrication de mousses de polyuréthane destinées aux industries de l’ameublement et de l’automobile. Le méthyloxirane peut aussi être utilisé pour la fabrication du propylèneglycol, comme agent de modification de l’amidon alimentaire, dans des applications où il peut y avoir contact avec des aliments, dans des cosmétiques et des produits d’hygiène personnelle, dans des résines, des encres et des lubrifiants synthétiques, comme additif détergent et inhibiteur de corrosion dans les carburants automobiles ainsi que dans les solvants pour le retrait de joints d’étanchéité, les nettoyants, les agents antimousses de produits pétroliers, les additifs de carburants et les adhésifs (Dow, 1981; Sack et al., 1992; Trent, 2001; Union européenne, 2002; Dow, 2007). Le propylèneglycol fabriqué à partir de méthyloxirane peut aussi servir à la production de résines de polyesters insaturées, notamment dans les industries du textile et des matières plastiques, et peut être utilisé dans des produits pharmaceutiques et des dégivrants pour avions (Dow, 1981; Trent, 2001; Union européenne, 2002; Dow, 2007). Le propylèneglycol sert aussi à la fabrication d’éthers de glycol utilisés comme solvants dans les peintures et les vernis (Trent, 2001). Le méthyloxirane en tant que tel n’a pas d’utilisations rapportées dans la base de données de déclaration des cosmétiques de Santé Canada (Santé Canada, Division des cosmétiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, communication personnelle, 9 juin 2008, non référencée). Cependant, le méthyloxirane se trouve dans les décapants (Henkel, 2008).
Le méthyloxirane est utilisé aux états-Unis pour la fumigation des fruits secs et la fumigation en vrac de plusieurs produits alimentaires comme le cacao, les épices, la chair de noix traitée, l'amidon et la gomme (Union européenne, 2002; US EPA, 2005). Cette substance n'est pas homologuée à titre de produit antiparasitaire au Canada et les produits traités aux états-Unis (ou ailleurs) et importés au Canada ne peuvent contenir plus de 0,1 ppm de méthyloxirane (ARLA, 2006).
Le méthyloxirane est un additif alimentaire autorisé par la Loi sur les aliments et drogues et le Règlement sur les aliments et drogues de Santé Canada (Justice Canada, 1985) et il est soumis aux conditions qui en assurent un usage limité, empêchant une exposition par la consommation de nourriture. Il figure comme substance de conservation (antimicrobienne) dans la liste des ingrédients non médicinaux des produits de santé naturels de Santé Canada (DGPSA, 2007).
Le méthyloxirane n’est pas fabriqué au Canada à des fins commerciales en quantités supérieures à 100 kg (Canada, 2007b). La demande nationale est satisfaite grâce à des importations en provenance des états-Unis. En 1999, l’approvisionnement et la consommation de méthyloxirane ont totalisé 51 500 tonnes au Canada, mais, en 2002, la quantité importée avait chuté à 38 000 tonnes (IPC, 2003). L’Inventaire national des rejets de polluants du Canada ne signalait qu’un seul émetteur en Ontario en 2005. Les rejets déclarés étaient tous atmosphériques et leur volume a diminué de façon constante pour passer de 10,4 tonnes en 1999 à 5,16 tonnes en 2002 et à 0,059 tonne en 2005 (INRP, 2006). Selon des renseignements récemment obtenus en vertu de la LCPE(1999) au moyen d’un avis concernant le méthyloxirane donné en application de l’article 71, des entreprises ont déclaré le rejet de cette substance en 2006 en une quantité inférieure à 50 kg, soit la valeur seuil de déclaration (Canada, 2007b).
La principale source de rejet dans l’environnement résulte de l’évaporation et de l’évacuation de gaz au cours de la production de substances pour lesquelles on utilise le méthyloxirane comme intermédiaire chimique, ainsi qu’au cours du stockage, de la manutention, du transport et de l’utilisation. L’évacuation des gaz de procédés semble être la plus importante source des rejets atmosphériques. Des rejets de méthyloxirane peuvent aussi avoir pour origine les gaz d’échappement des véhicules automobiles et les gaz de combustion de sources fixes utilisant des hydrocarbures. Les rejets présents dans les gaz sont souvent éliminés par lavage tandis que les déchets liquides sont incinérés (PISC, 1985; ME de l’Ontario, 2001).
À cause de sa pression de vapeur de 71,5 kPa, le méthyloxirane ne devrait exister que sous forme gazeuse dans l’atmosphère. étant donné sa très forte solubilité dans l’eau, il peut être entraîné de l’atmosphère par la pluie (PISC, 1985). Dans l’eau, il s’hydrolyse rapidement - entre 11 et 22 jours (tableau 3) - pour former du propylèneglycol. Cette dégradation est accélérée en présence des ions chlorure, de sorte que son élimination chimique sera plus rapide dans l’eau de mer que dans l’eau douce (Union européenne, 2002). La valeur de la constante de la loi de Henry du méthyloxirane, estimée à 1,23 × 10-4 atm·m3/mole, explique le fait que sa volatilisation à partir des surfaces humides devrait être moyenne. La valeur estimée de son log Kco (0,37) indique qu’il ne devrait pas s’adsorber sur les matières en suspension et les sédiments et qu’il devrait être très mobile dans ces milieux. Son évaporation à partir des surfaces des sols devrait donc être importante (Meylan et al., 1986).
Les résultats de l’application d’un modèle de la fugacité de niveau III, qui prévoit la répartition du méthyloxirane dans l’environnement, sont résumés dans le tableau 2. Il est à noter que les pourcentages élevés de répartition dans le sol pourraient être surestimés car le modèle ne prend pas en compte les processus du devenir, comme la volatilisation à partir d’un sol sec et la migration verticale dans le sol. étant donné les propriétés physiques et chimiques du méthyloxirane, ces processus devraient jouer un rôle important.
| Rejet de la substance dans | Fraction de la substance répartie dans chaque milieu (%) | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| l'air (100 %) | 88,0 | 10,3 | 1,6 | 0,02 |
| l'eau (100 %) | 4,5 | 95,3 | 0,1 | 0,18 |
| le sol (100 %) | 7,6 | 18,0 | 74,4 | 0,03 |
| l'air, l'eau et le sol (33 % chacun) | 15,4 | 44,0 | 40,6 | 0,08 |
Persistance
La demi-vie du méthyloxirane résultant de sa réaction dans l’air avec des radicaux hydroxyles d’origine photochimique se situe entre 7 et 32 jours environ (tableau 3), ce qui montre que cette substance satisfait au critère de la persistance dans l’air (demi-vie ≥ 2 jours) énoncé dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Le méthyloxirane peut être hydrolysé (demi-vie de 10,7 à 21,7 jours). Le méthyloxirane peut faire l’objet d’une biodégradation atteignant 100 % et n’être pas persistant dans l’eau (tableau 3). Une autre demi-vie modélisée (BIOWIN, 2000) par biodégradation dans l’eau de 15 jours a été obtenue et utilisée pour prévoir la demi-vie de cette substance dans le sol et les sédiments à l’aide des facteurs d'extrapolation de Boethling dont la formule est : t1/2 eau : t1/2 sol : t1/2 sédiments = 1: 1: 4 (Boethling, 1995). Ces valeurs permettent de conclure que cette substance ne satisfait pas aux critères de la persistance dans l’eau et le sol (demi-vie ≥ 182 jours) et les sédiments (demi-vie ≥ 365 jours) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
| Processus du devenir | Valeur pour la dégradation | Paramètre et unité pour la dégradation | Référence |
|---|---|---|---|
| Réaction avec le radical · OH dans l'air | 0,52 – 2,4 | constante cinétique(10 -12cm3/molécule s) | (Pitts, 1979; Winer et al., 1979 ; Zetsch et Stahl, 1981; Edney et al., 1986; Wallington et al., 1988; Atkinson, 1989) |
| 6,6 – 32,3 | demi-vie (jours) | ||
| Hydrolyse (à 20 – 25 °C) | 0,37 – 0,75 | constante cinétique (10-6· s-1) |
Nichols et Ingham, 1955; Koskikallio et Whalley, 1959; Mabey et Mill, 1978; Sato et al., 1985 |
| 10,7 – 21,7 | demi-vie (jours) | ||
| Biodégradation dans l'eau | 12 – 14; 67; 74; 93 – 98; 90 – 100 |
biodégradation (%) | Waggy et Payne, 1974; BASF, 1977b; Dow Deutschland, 1978; Miller et Watkinson, 1985; Chemicals Inspection and Testing Institute, 1992 |
Bioaccumulation
Les valeurs expérimentales et modélisées du log Koe, respectivement de 0,03 et 0,37, indiquent un potentiel de bioaccumulation probablement faible. Les facteurs modélisés de la bioaccumulation (FBA) et de la bioconcentration (FBC), qui varient entre 1 et 13 L/kg (tableau 4), montrent que le méthyloxirane ne satisfait pas aux critères de la bioaccumulation (FBC/FBA ≥ 5 000) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
| Organisme d'essai | Paramètre/unité | Valeur | Référence |
|---|---|---|---|
| Poisson | FBA (poids humide, L/kg) | 1 | Modified Gobas BAF T2MTL (Arnot et Gobas, 2003) |
| Poisson | FBC (poids humide, L/kg) | 1 - 13 | OASIS Forecast, 2005; Modified Gobas BCF 5 % T2LTL (Arnot et Gobas, 2003); BCFWIN, 2000) |
Comme il est indiqué précédemment, le méthyloxirane remplit le critère de persistance, mais ne remplit pas le critère du potentiel de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Selon les données écotoxicologiques (valeurs expérimentales et modélisées) sur le méthyloxirane, la toxicité pour les organismes aquatiques va de faible à modérée. Les valeurs expérimentales de toxicité aiguë (CL50) pour le poisson varient de 89 à 219 mg/L (Bridie et al., 1979; Crews, 1974). Aucune donnée de toxicité pour les organismes non aquatiques autres que des mammifères n’a été relevée.
L’INRP signale qu’un seul émetteur en Ontario a déclaré des rejets de 0,059 tonne de méthyloxirane dans l’air en 2005 (INRP, 2006). Selon les renseignements récemment obtenus en vertu de l’article 71 de la LCPE (1999), des entreprises ont déclaré le rejet de cette substance, en 2006, en une quantité inférieure à 50 kg, soit la valeur seuil de déclaration (Environnement Canada, 2007b). Les rejets de méthyloxirane peuvent aussi provenir des gaz d’échappement des véhicules automobiles et des gaz de combustion de sources fixes brûlant des hydrocarbures (PISC, 1985; ME de l’Ontario, 2001). étant donné la quantité et la nature de ces rejets, il est peu probable que ces derniers deviennent une source d’exposition importante pour les organismes dans l’environnement.
Évaluation de l'exposition
Il existe très peu d’informations sur les concentrations de méthyloxirane dans les milieux naturels qui pourraient servir à estimer quantitativement l’exposition de la population. Il est mentionné dans quelques études que le méthyloxirane n’a pas été décelé dans divers milieux, mais ces études font état de seuils de détection, soit une étude pilote américaine sur l’air intérieur et extérieur ainsi qu’une étude de surveillance japonaise présentant des données sur les eaux de surface et les sédiments (Sheldon et Jenkins, 1990; ME du Japon, 1995). Il apparaît inopportun d’estimer l’absorption en utilisant les seuils de détection de l’étude japonaise comme valeurs de remplacement pour l’eau potable et les sols au Canada. En effet, les modes d’utilisation et de rejet au Canada et les propriétés physiques et chimiques du méthyloxirane font que sa présence dans l’eau et le sol devrait être négligeable par rapport à sa concentration dans l’atmosphère, qui est sa principale source d’exposition. L’utilisation des seuils de détection pour l’air intérieur et extérieur, dans l’étude américaine, donne des estimations de limites supérieures de l’exposition au méthyloxirane de la population générale qui vont de 0,06 µg/kg par jour pour le groupe d’âge de 60 ans et plus à 0,18 µg/kg-m.c. par jour pour le groupe d’âge de 0,5 à 4 ans (annexe 1). La limite maximale de résidus de méthyloxirane de 0,1 ppm dans la chair de noix fumigée et importée a été utilisée pour estimer l’absorption à partir des noix et des graines car on ne disposait d’aucune autre donnée quantitative sur la concentration de cette substance dans les aliments. Les valeurs estimées de l’absorption à partir des aliments étaient négligeables comparativement à celles de l’absorption à partir de l’air. L’utilisation des seuils de détection comme valeurs de remplacement des concentrations dans l’air sont une source d’incertitude et les renseignements quantitatifs sur les concentrations dans l’eau et le sol au Canada font défaut. C’est pourquoi, les concentrations dans ces milieux ont été modélisées à l’aide de la version 6.0 du modèle ChemCan (CEMC, 2003) en supposant un rejet de 50 kg par an, qui est le seuil de déclaration indiqué dans le récent avis donné en conformité de l’article 71 de la LCPE (1999) (Canada, 2007b). Lorsque la modélisation porte sur le rejet dans l’air (principal milieu de rejet prévu), les concentrations dans l’air, l’eau et le sol (annexe 2) sont de beaucoup inférieures à celles utilisées pour estimer les quantités absorbées présentées dans l’annexe 1, ce qui souligne encore plus la nature prudente des estimations. Le seuil de rejet de 50 kg par an ne tient pas compte des rejets possibles à partir des produits contenant du méthyloxirane, mais ces rejets, si on se fonde sur les utilisations de cette substance au Canada, devraient surtout être des rejets atmosphériques. La contribution des rejets à partir des produits dans l’environnement général a sans doute été pris en compte au moment de l’utilisation des seuils de détection pour estimer les limites supérieures présentées précédemment. Le niveau de confiance accordé à la base de données sur l’exposition environnementale est très faible car on a utilisé les seuils de détection des méthodes et la modélisation pour estimer l’exposition, et les paramètres d’entrée des modèles reposent exclusivement sur des rejets théoriques.
Selon l’information disponible sur les utilisations du méthyloxirane au Canada, les produits de consommation peuvent constituer une autre source directe d’exposition pour les usagers. Afin d’évaluer le potentiel d’exposition accrue au méthyloxirane résultant de l’utilisation de ces produits contenant la substance, on a estimé les concentrations atmosphériques et l’absorption quotidienne par la population canadienne adulte (20 à 59 ans) pour les décapants et pour la peinture acrylique en aérosol (annexe 3). Ces produits ont été choisis parce qu’ils représentent d’importantes utilisations du méthyloxirane ou contiennent des substances dans lesquelles le méthyloxirane peut être présent comme résidu. La population canadienne adulte est considérée être la principale utilisatrice de ces produits. Selon ces estimations préalables, l’inhalation de décapant pourrait contribuer de façon appréciable à l’exposition, tandis que celle résultant de l’utilisation de la peinture acrylique en aérosol est plus faible. L’absorption par voie cutanée résultant de l’utilisation de ces produits est considérée comme négligeable selon la pression de vapeur élevée et le faible log Koe du méthyloxirane. Le niveau de confiance accordé à ces estimations de l’exposition à partir des produits de consommation est cependant faible, car les prévisions ont été faites en l’absence de données sur les émissions réelles.
évaluation des effets sur la santé
Des études réalisées chez des animaux de laboratoire ont fait classer le méthyloxirane dans le groupe 2B (cancérogène possible pour l’homme) du Centre international de recherche sur le cancer (CIRC), (CIRC, 1994), dans la catégorie 2 (substances devant être assimilées à des substances cancérogènes pour l’homme) de la Communauté européenne (Commission européenne, 1999; Commission européenne, 2001; Union européenne, 2002; ESIS, 2006), dans le groupe B2 (carcinogène probable pour les humains) de l’EPA américaine (US EPA, 1994) et comme « pouvant raisonnablement être considéré comme cancérogène pour les humains » par le National Toxicology Program (NTP, 2005). Ces classifications reposent sur l’observation de tumeurs épithéliales dans les fosses nasales chez des rats mâles et femelles et sur celle d’une faible incidence d’adénomes papillaires des fosses nasales de rats des deux sexes exposés par inhalation à 400 ppm (964 mg/m3) de méthyloxirane pendant 103 semaines (NTP, 1985; Renne et al., 1986) [voir l’annexe 4 pour un aperçu des bases de données toxicologiques]. On a noté, au cours d’une autre étude d’exposition par inhalation de rats mâles à 300 ppm (723 mg/m3) de méthyloxirane pendant 123 ou 124 semaines, une incidence accrue de carcinomes du tractus respiratoire et trois mâles exposés à 30 ou 300 ppm (72 ou 723 mg/m3) présentaient des tumeurs malignes des fosses nasales (Kuper et al., 1988). De façon semblable, des souris exposées par inhalation à 400 ppm (964 mg/m3) présentaient des incidences combinées accrues d’hémangiomes et d’hémangiosarcomes des fosses nasales (NTP, 1985; Renne et al., 1986). Des rats femelles exposés par voie orale à 15 ou 60 mg/kg-m.c. de méthyloxirane deux fois par semaine pendant 150 semaines ont présenté une augmentation liée à l’exposition de l’incidence de tumeurs stomacales (aucune analyse statistique) [Dunkelberg, 1982]. Des études réalisées par Dunkelberg (1979; 1981) et Walpole (1958) ont permis de démontrer que le méthyloxirane pouvait induire des sarcomes localisés au point d’injection sous-cutané chez des souris et des rats, respectivement. Même si pour certaines de ces études l’incidence des tumeurs des fosses nasales n’est pas statistiquement significative, ces tumeurs ont été considérées liées à l’exposition dans le contexte de leur rareté chez les animaux témoins, tant ceux de ces études que ceux d’études antérieures (NTP, 1985; Kuper et al., 1988; UE, 2002). Les seules données disponibles pour des études chez des humains sont insuffisantes pour évaluer la cancérogénicité du méthyloxirane chez les humains (CIRC, 1994; UE, 2002).
La Communauté européenne a classé le méthyloxirane dans la catégorie 2 des mutagènes (substances devant être assimilées à des substances mutagènes pour l’homme) [Commission européenne, 1999; Commission européenne, 2001; UE, 2002; ESIS, 2006]. Cette classification repose sur l’avis général d’un groupe d’experts selon lequel des faits démontrent clairement le pouvoir mutagène du méthyloxirane chez des cellules somatiques, tant in vitro qu’in vivo (Commission européenne, 1999). Le méthyloxirane s’est avéré génotoxique au cours de plusieurs essais in vitro dont certains ont donné lieu à des mutations génétiques chez des cellules mammaliennes et non mammaliennes ainsi qu’à des aberrations chromosomiques et à l’induction de micronoyaux chez des cellules mammaliennes (annexe 4). Il a aussi provoqué la césure de brins d’ADN et la formation d’adduits à l’ADN in vitro. Des effets ont aussi été notés in vivo chez des rongeurs et chez Drosophila. Parmi ceux-ci figurent l’induction de micronoyaux, des aberrations chromosomiques, des altérations de l’ADN ou la formation d’adduits à l’ADN; certains essais in vivo utilisant ces paramètres se sont toutefois avérés négatifs. Les résultats d’essais sur les effets dominants létaux chez des rongeurs ont été négatifs. Un examen (UE, 2002) de six études portant sur l’exposition professionnelle a montré qu’aucune conclusion ne pouvait être tirée en ce qui a trait au pouvoir mutagène du méthyloxirane chez les humains (Theiss et al., 1981; Pero et al., 1982 et 1985; Van Sittert et de Jong, 1985; de Jonget al., 1988; Hogstedt et al., 1990; Viktorovaet al., 1994). Une étude pilote récente, mais de peu d’ampleur, a montré une augmentation significative des concentrations sanguines d’adduits à l’ADN et d’échanges de chromatides sœurs chez des travailleurs exposés au méthyloxirane, mais on ne peut exclure la possibilité que des facteurs confusionnels aient contribué aux effets cytogénétiques (Czene et al., 2002).
Bien qu’une analyse complète du mode d’action de cette substance déborde le cadre du présent rapport, il apparaît qu’une prolifération cellulaire non néoplasique pourrait favoriser une tumorigenèse au-delà d’un certain seuil d’exposition. On ne peut toutefois ignorer le rôle éventuel des altérations génétiques dans le développement des tumeurs étant donné le nombre important d’éléments de preuve à l’appui de la génotoxicité. Diverses études ont récemment été effectuées afin d’examiner le rôle de l’appauvrissement en glutathion dans le contexte d’une tumorigenèse par le méthyloxirane chez le rat et la souris (Morris et al.,2004; Lee et al., 2005; Morris et Pottenger, 2006). Le mode d’action possible de l’induction de tumeurs par le méthyloxirane est actuellement évalué par l’Environmental Protection Agency des états-Unis (US EPA, 2005). Après un premier examen des données fournies par l’industrie, l’EPA américaine a indiqué qu’un mode d’action à l’origine des effets cancérogènes où interviendrait un seuil serait « fortement plausible », mais l’information obtenue fait actuellement l’objet d’un examen plus poussé (US EPA, 2006). De plus, Albertini et Sweeney (2007) ont étudié le profil de génotoxicité du méthyloxirane et conclu que sa génotoxicité donnant lieu à des réactions avec l’ADN peut être nécessaire mais non suffisante pour confirmer la cancérogénicité et qu’un mode d’action complexe est vraisemblable.
On a conclu, au cours d'une évaluation faite par l'Union européenne (UE, 2002), que la cancérogénicité du méthyloxirane se limitait surtout aux sites de premier contact, mais que l'apport relatif au processus cancérogène de l'irritation, de la réponse proliférative subséquente et de la génotoxicité demeurait incertain si l'on se fondait sur les connaissances scientifiques actuelles. L'UE a conclu, en se fondant sur le mode d'action direct et l'activité mutagène du méthyloxirane, que le risque d'effet cancérogène de cette substance exprimé chez l'animal s'avérait pertinent chez les humains.
Les effets non néoplasiques critiques induits par le méthyloxirane se produisent dans les fosses nasales. La concentration minimale avec effet (nocif) observé [CME(N)O] était de 71 mg/m3 chez des rats exposés par inhalation pendant 123 ou 124 semaines si l’on se fonde sur une légère augmentation de l’incidence de replis en forme de poches dans l’épithélium nasal des animaux exposés (Kuper et al., 1988). Le rapport de l’UE (2002) indique cette valeur comme la CMENO « minimale » pour les effets dans l’épithélium nasal. L’EPA américaine (US EPA, 1990) considère aussi cette concentration produisant un effet comme une CMENO pour obtenir sa concentration de référence concernant l’exposition chronique au méthyloxirane par inhalation. De même, dans le cadre d’une décision d’admissibilité à une nouvelle homologation du méthyloxirane à titre de pesticide, l’EPA a jugé que cette concentration produisant un effet serait utilisée comme une concentration sans effet nocif observé ou CSENO (US EPA, 2005). Des effets semblables ont été observés au cours d’études d’exposition chronique chez la souris où le niveau d’exposition était supérieur, soit 474 mg/m3 (NTP, 1985; Renne et al., 1986), et lorsque les rats et les souris étaient exposés pendant des périodes plus courtes à des concentrations de 5 à 15 fois supérieures, par exemple à 362 mg/m3 (Eldridge et al., 1995). Ces effets ont été observés aux plus faibles expositions utilisées au cours d’études d’exposition chronique chez les deux espèces.
Le niveau de confiance accordé à la base de données sur la toxicité est élevé car on dispose de données sur la toxicité aiguë, la cancérogénicité, la toxicité par doses répétées, la toxicité génétique et la toxicité pour la reproduction et le développement, mais il demeure une incertitude quant au mode d'induction des tumeurs.
Caractérisation du risque pour la santé humaine
En s’appuyant surtout sur des évaluations fondées sur le poids de la preuve et réalisées par plusieurs organismes nationaux et internationaux (CIRC, UE, US EPA et US NTP), on trouve que la cancérogénicité, pour laquelle un mode d’induction comportant une interaction directe avec du matériel génétique ne peut être exclu, constitue un effet critique permettant de caractériser le risque pour la santé humaine.
En ce qui a trait aux effets autres que le cancer, la comparaison de la dose ayant un effet critique non néoplasique chez des animaux de laboratoire exposés de façon chronique (71 mg/m3) avec la valeur limite supérieure d’exposition par inhalation (principale voie d’exposition prévue) chez la population générale (dont la valeur de 0,31 ug/m3 a été estimée à partir des seuils de détection d’une étude américaine), permet d’obtenir une marge d’exposition de 229 000 environ. Mais si on prend en compte la limite supérieure prudente de l’exposition estimée à partir de la concentration dans l’air résultant de l’utilisation de produits de consommation contenant du méthyloxirane (200 mg/m3 dans le décapant), on obtient une marge d’exposition inférieure à 1. Si l’exposition estimée résultant de ces produits est comparée à la concentration la plus faible ayant un effet à la suite d’une exposition à doses répétées à court terme (362 mg/m3), ce qui pourrait convenir davantage étant donné l’utilisation peu fréquente de ces produits, on obtient une marge d’exposition d’environ 2. Par conséquent, bien que la marge d’exposition pour les effets non néoplasiques soit adéquate pour l’exposition dans l’environnement général, celle des scénarios d’exposition par les produits de consommation (par ailleurs prudente) peut ne pas tenir compte de façon adéquate des incertitudes des bases de données sur l’exposition et les effets.
Incertitudes de l'évaluation du risque pour la santé humaine
Le présent rapport d’évaluation préalable du méthyloxirane ne prend pas en compte les écarts de la vulnérabilité à la substance pouvant exister entre les humains et les espèces de laboratoire, et cet aspect est accentué par le peu de données disponibles pour les humains. Mais les effets notés chez les deux espèces de rongeurs utilisées sont semblables. La modélisation de la toxicocinétique physiologique (Csandy et Filser, 2007) porte à croire à une toxicocinétique du méthyloxirane semblable chez l’humain et le rat. De plus, le mécanisme de l’induction des tumeurs n’a pas été complètement élucidé, mais les données indiquent la possibilité de mécanismes génotoxiques et non génotoxiques. Il demeure aussi des incertitudes appréciables quant à l’ampleur de l’exposition de la population générale à cette substance. Toutefois, comme les estimations de l’exposition présentées ici sont de nature prudente, le niveau de confiance à l’égard du fait que les niveaux d’exposition réels ne sont pas supérieurs à ces estimations est élevé.
Compte tenu de l’information disponible, il est conclu que le méthyloxirane ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique et à mettre en danger l'environnement essentiel pour la vie.
Compte tenu de la cancérogénicité du méthyloxirane, pour lequel il existe une probabilité d’effet nocif à toute valeur d’exposition, de la possibilité que la marge entre l’exposition estimée à partir des produits et du niveau critiques pour les effets autres que le cancer, il est conclu que le méthyloxirane est considéré comme une substance qui peut pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaine.
Il est donc conclu que le méthyloxirane ne satisfait pas aux critères énoncés aux alinéas 64a) et b) de la LCPE (1999), mais qu’il satisfait à ceux énoncés à l’alinéa 64c) de la Loi. De plus, cette substance satisfait au critère de la persistance, mais non à celui du potentiel de bioaccumulation du Règlement sur la persistance et la bioaccumulation.
[ACC] American Chemistry Council. 2005. Methyl oxirane: results of a 20-day repeated dose inhalation toxicity study in male mice and male rats. Rapport no TSCATS 8EHQ--05-16044B.
Agurell E, Cederberg H, Ehrenberg L, Lindahl-Kiessling K, Rannug U et Tornqvist M. 1991. Genotoxic effects of ethylene oxide and propylene oxide: a comparative study. Mutat. Res. 250(1-2):229-37 [cité dans CIRC, 1994; UE, 2002].
Albertini RJ, et Sweeney LM. 2007. Propylene Oxide: Genotoxicity Profile of a Rodent Nasal Carcinogen. Crit Rev Toxicol 37:489-520.
Aldrich Chemical Co. 2003. Material safety data sheet: propylene oxide. No de catalogue 240397.
American Chemical Society. 1952. Monograph series: Glycols. Curme GO Jr., Johnston F, editors. New York (NY) : Reinhold. [cité dans European Union Risk Assessment Report, 2000] .
[ARLA] Agence de réglementation de la lutte antiparasitaire. 2006. Document de travail de l’Agence de réglementation de la lutte antiparasitaire. Juin 2006 : Abrogation de la norme générale relative à la limite maximale de résidus de 0,1 ppm pour les résidus de pesticides dans les aliments [Règlement B.15.002(1)]
Arnot JA. et Gobas FA. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb Sci 22(3):337-345.
Atkinson R. 1989. Kinetics and mechanisms of the gas-phase reactions of the hydroxyl radical with organic compounds. J. Phys. Chem. Ref. Data Monograph 1. 246 pages.
Antonova V.I., Zommer E.A., Kuznetsova A.D. et Petrova NA. 1981. Toxicology of propylene oxide and regulation of its level in water. Gig. Sanit. 7:76-9 [cité dans UE, 2002; US EPA, 2005].
BASF AG. 1967. Analytisches Labor, unveroeffentlichte Untersuchung, TA/PV-Vg L 540 [cité dans European Union Risk Assessment Report, 2000] .
BASF AG. 1977a. Analytisches Labor, unveroeffentlichte Untersuchung, BRU 77.119 [cité dans European Union Risk Assessment Report, 2000] .
BASF AG. 1977b. Oekologielabor, rapport inédit de BASF AG, 6 mai 1977 [cité dans European Union Risk Assessment Report, 2000] .
BASF AG. 1995. Sicherheitsdatenblatt Propylenoxid [cité dans European Union Risk Assessment Report, 2000] .
[BCFWIN] BioConcentration Factor Program for Windows. 2000. Version 2.15. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.
[BIOWIN] Biodegradation Probability Program for Windows. 2000. Version 4.01. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.
Blair D. et Osborne GP. 1977. Acute toxicity studies on propylene oxide: acute inhalation toxicity and 10 day repeated exposure study. London : Shell Research. Report No.: TLGR.0032.77 [cité dans UE, 2002].
Boethling RS, Howard PH, Beauman JA et Larosche ME. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere 30(4):741-752.
Bogyo DA, Lande SS, Meylan WM, Howard PH et Santodonato J. 1980. Investigation of selected potential environmental contaminants: Epoxides. Report to U. S. Environmental Protection Agency, Office of Toxic Substances, Washington, DC. New Jersey (US): Syracuse Research Corporation.
Boogaard PJ, Rocchi PS et Van Sittert NJ. 1999. Biomonitoring of exposure to ethylene oxide and propylene oxide by determination of hemoglobin adducts: correlations between airborne exposure and adduct levels. Int Arch Occup Environ Health 72(3):142-50.
Bootman J, Lodge DC et Whalley HE. 1979. Mutagenic activity of propylene oxide in bacterial and mammalian systems. Mutat Res 67(2):101-12 [cité dans CIRC,1994; UE, 2002].
Boublik T, Fried V et Hala E. 1984. The vapor pressure of pure substances: selected values of the temperature dependence of the vapor pressures of some pure substances in the normal and low-pressure region. (Vol 17). 2nd rev. ed. Amsterdam (NL): Elsevier. 241 pages.
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). Lois du Canada. Ottawa : Travaux publics et Services gouvernementaux Canada. Gazette du Canada Partie III, vol. 22, n° 3.
Canada. 2000. Règlement sur la persistance et la bioaccumulation. Ottawa : Travaux publics et Services gouvernementaux Canada. Gazette du Canada, Partie II. vol. 134. [cité en août 2006].
[Canada]. Ministère de l’Environnement et ministère de la Santé. 2006. Loi canadienne sur la protection de l’environnement (1999) : Avis d’intention d’élaborer et de mettre en œuvre des mesures d’évaluation et de gestion des risques que certaines substances présentent pour la santé des Canadiens et leur environnement. Ottawa : Travaux publics et Services gouvernementaux Canada. Gazette du Canada Partie I, vol. 140, n° 49.
[Canada], Environnement Canada et Santé Canada. 2007a. Profil de substance pour le Défi : Méthyloxirane (oxyde de propylène) no CAS 75-56-9.
Canada. 2007b. Loi canadienne sur la protection de l'environnement (1999). Avis concernant certaines substances inscrites sur la Liste intérieure des substances (LIS). Ottawa : Travaux publics et Services gouvernementaux. Gazette du Canada Partie I, vol. 141, n° 5.
Canter DA, Zeiger E, Haworth S, Lawlor T, Mortelmans K et Speck W. 1986. Comparative mutagenicity of aliphatic epoxides in salmonella. Mutat Res 172(2):105-38 [cité dans CIRC, 1994; UE, 2002].
Castelain P, Criado B, Cornet M, Laib R, Rogiers V et Kirsch-Volders M. 1993. Comparative mutagenicity of structurally related aliphatic epoxides in a modified Salmonella/microsome assay. Mutagenesis 8(5):387-93 [cité dans CIRC, 1994].
Center for Chemical Hazards Assessment. Report No : (EPA-560/11-80-005). Disponible auprès de NTIS no PB80-183197.
ChemCAN. 2003. ChemCAN: level III fugacity model of regional fate of chemicals. Version 6.00. Peterborough (ON): Canadian Environmental Modelling Centre, Trent University.
Chemicals Inspection and Testing Institute. 1992. Biodegradation and bioaccumulation data of existing chemicals based on the CSCL Japan. Japan : Chemical Industry Ecology, Toxicology and Information Center.
Chovanec M, Naslund M, Spivak I, Dusinska M, Cedervall B et Kolman A. 1998. Rejoining of DNA strand breaks induced by propylene oxide and epichlorohydrin in human diploid fibroblasts. Environ Mol Mutagen 32(3):223-8.
CIRC (Centre international de recherche sur le cancer). 1994. Propylene oxide. IARC Monogr Eval Carcinog Risks Hum 60:181-213.
Commission européenne. 1999. Methyloxirane. Summary Record Meeting of the Commission Working Group on the Classification and Labelling of Dangerous Substances. ECB Ispra, 13 – 15 octobre, 1999. ECBI/61/99 - Rév. 3. 17.04.
Commission européenne. 2001. Methyloxirane. Directive de la Commission 2001/59/EC du 6 août 2001. Annexe 1B. Journal officiel des Communautés européennes 21.8.2001. L 225/26.
Cookson MJ, Sims P et Grover PL. 1971. Mutagenicity of expoxides of polycyclic hydrocarbons correlated with carcinogenicity of parent hydrocharbons. Nat New Biol 234:86-187.
Csanady GA et Filser JG. 2007. A physiological toxicokinetic model for inhaled propylene oxide in rat and human with special emphasis on the nose. Toxicol Sci 95(1):37-62.
Czene K, Osterman-Golkar S, Yun X., Li G, Zhao F, Perez HL, Li M, Natarajan AT et Segerback D. 2002. Analysis of DNA and hemoglobin adducts and sister chromatid exchanges in a human population occupationally exposed to propylene oxide: a pilot study. Cancer Epidemiol Biomarkers Prev 11(3):315-8.
de Jong G, Van Sittert NJ et Natarajan AT. 1988. Cytogenetic monitoring of industrial populations potentially exposed to genotoxic chemicals and of control populations. Mutat Res 204(3):451-64. [cité dans UE, 2002; CIRC, 1994]
Dean BJ, Brooks TM, Hodson-Walker G et Hutson DH. 1985. Genetic toxicology testing of 41 industrial chemicals. Mutat Res 153(1-2):57-77. [cité dans CIRC, 1994; UE, 2002].
Dean BJ et Hodson-Walker G. 1979. An in vitro chromosome assay using cultured rat-liver cells. Mutat Res 64(5):329-37. [cité dans CIRC, 1994; UE, 2002].
Deneer JW, Sinnige TL, Seinen W et Hermens JLM. 1988. Quantitative Structure-Activity Relationship for the Acute Toxicity of Some Epoxy Compounds to the Guppy. Aquatic Toxicology, 13, 195-204 [cité dans UE, 2002].
DGPSA (Direction générale des produits de santé et des aliments). 2007. Communication personnelle de Shahriar Khadem, Direction des produits de santé naturels, Direction générale des produits de santé et des aliments.
[DHM] Direction de l’hygiène du milieu. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Décembre 1998. Ottawa (ON) : Santé Canada, Direction de l’hygiène du milieu. Section des substances prioritaires.
Djuric Z, Hooberman BH, Rosman L et Sinsheimer JE. 1986. Reactivity of mutagenic propylene oxides with deoxynucleosides and DNA. Environ Mutagen 8(3):369-83. [cité dans CIRC,1994; UE, 2002].
[Dow] Dow Chemical Company. 2007. Technical data sheet [Internet]. Dow Chemical Company. [cité en septembre 2007].
[Dow] Dow Chemical Company. 1981. A guide to glycols. Midland (MI): Dow Chemical Company. Form No. 117-00991-89.
[Dow] Dow Chemical Company. 1977. Among the most versatile of intermediates...Alkylene oxides from Dow. Michigan (US): Dow Chemical Company [cité dans EURAR, 2000].
Dow Deutschland. 1978. NTIS/OTS 0509917 # 407875003 [cité dans IUCLID Data set, 2000] .
Dunkelberg H. 1981. Carcinogenic activity of ethylene oxide and its reaction products 2-chloroethanol, 2-bromoethanol, ethylene glycol and diethylene glycol: 1. Carcinogenicity of ethylene oxide in comparison with 1,2-propylene oxide after subcutaneous administration in mice. Zentralbl Bakteriol Mikrobiol Hyg [B] 174(5):383-404 [cité dans CIRC, 1994; UE, 2002]
Dunkelberg H. 1982. Carcinogenicity of ethylene oxide and 1,2-propylene oxide upon intragastric administration to rats. Br J Cancer 46(6):924-33.
Dunkelberg H. 1979. On the oncogenic activity of ethylene oxide and propylene oxide in mice. Br J Cancer 39(5):588-9.
[DHM] Direction de l'hygiène du milieu. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Décembre 1998. Ottawa (ON) : Santé Canada, Direction de l'hygiène du milieu. Section des substances prioritaires.
Edney EO, Kleindienst TE et Corse EW. 1986. Room temperature rate constants for the reactions of OH with selected chlorinated and oxygenated hydrocarbons. Int J Chem Kinet 18:1355-1371 [cité dans European Union Risk Assessment Report, 2000] .
Eldridge SR, Bogdanffy MS, Jokinen MP et Andrews LS. 1995. Effects of propylene oxide on nasal epithelial cell proliferation in F344 rats. Fundam Appl Toxicol 27(1):25-32 [cité dans CIRC, 1994]
Emmert B, Bunger J, Keuch K, Muller M, Emmert S, Hallier E et Westphal GA. 2006. Mutagenicity of cytochrome P450 2E1 substrates in the Ames test with the metabolic competent S. typhimurium strain YG7108pin3ERb5. Toxicology 228(1):66-76.
[EPIWIN] Estimation Programs Interface for Microsoft Windows. 2004. Version 3.12. Washington (DC): U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation.
[ESIS] European Chemical Substances Information System [base de données sur Internet]. 2006. Methyloxirane. CAS No. 75-56-9. Version 4.50. Bureau européen des substances chimiques (ECB). Commission européen.
[EURAR] European Union Risk Assessment Report. 2000. CAS No. 75-56-9.
Methyloxirane (propylene oxide). Bureau européen des substances chimiques, Substances existantes. Deuxième Liste des substances d’intérêt prioritaire, volume 23. Luxembourg : Office des publications officielles des Communautés européennes.
Farooqi Z, Tornqvist M, Ehrenberg L et Natarajan AT. 1993. Genotoxic effects of ethylene oxide and propylene oxide in mouse bone marrow cells. Mutat Res 288(2):223-8 [cité dans CIRC, 1994; UE, 2002].
Foureman P, Mason JM, Valencia R et Zimmering S. 1994. Chemical mutagenesis testing in Drosophila. X : results of 70 coded chemicals tested for the National Toxicology Program. Environ Mol Mutagen 23(3):208-27.
Gardner MJ, Coggon D, Pannett B et Harris EC. 1989. Workers exposed to ethylene oxide: a follow up study. Br J Ind Med 46(12):860-5 [cité dans CIRC, 1994].
Garro AJ et Phillips RA. 1980. Detection of mutagen-induced lesions in isolated DNA by marker rescue of Bacillus subtilis phage PHI105. Mutat Res 73 (1):1-14 [cité dans UE, 2002].
Gosselin RE, Smith RP, Hodge HC et Braddock JE, editors. 1984. Clinical toxicology of commercial products. 5th ed. Baltimore (MD): Williams & Wilkins; Section II Ingredients Index, Propylene oxide; p. 97-98 [cité dans UE, 2002].
Gulati DK, Witt K, Anderson B, Zeiger E et Shelby MD. 1989. Chromosome aberration and sister chromatid exchange tests in Chinese hamster ovary cells in-vitro. III. Results with 27 chemicals. Environ Mol Mutagen 13 (2):133-93 [cité dans CIRC,1994; UE, 2002].
Hackett PL, Brown MG, Buschbom RL, Clark ML, Miller RA, Music RL, Rowe SE, Schirmer RE et Sikov MR. 1982. Teratogenic study of ethylene and propylene oxide and n-Butyl Acetate. Cincinnati (OH): Department of Health and Human Services (US), Centers for Disease Control & Prevention; NIOSH (National Institute for Occupational Safety and Health). Contract No. 210-80-0013, PB83-258-038.127 pages. [cité dans CIRC, 1994].
Hansch C, Leo A et Hoekman D. 1995. Exploring QSAR: hydrophobic, electronic, and steric constants. Washington (DC): American Chemical Society.
Hardin BD, Niemeier RW, Sikov MR et Hackett PL. 1983a. Reproductive-toxicologic assessment of the epoxides ethylene oxide, propylene oxide, butylene oxide, and styrene oxide. Scand J Work Environ Health 9(2 Spec No):94-102.
Hardin BD, Schuler RL, Mcginnis PM, Niemeier RW et Smith RJ. 1983b. Evaluation of propylene oxide for mutagenic activity in 3 in vivo test systems. Mutat Res 117 (3-4):337-44 [cité dans CIRC, 1994; UE, 2002].
Harris SB, Schardein JL, Ulrich CE et Ridlon SA. 1989. Inhalation developmental toxicity study of propylene oxide in Fischer 344 rats. Fundam Appl Toxicol 13(2):323-31 [cité dans CIRC, 1994].
Hayes WC, Kirk HD, Gushow TS et Young JT. 1988. Effect of inhaled propylene oxide on reproductive parameters in Fischer 344 rats. Fundam Appl Toxicol 10(1):82-8 [cité dans CIRC 1994].
Hayes WC, Gushow TS, Kirk HD et Young JT. 1985. Propylene oxide: two-generation inhalation reproduction study in Fischer 344 rats. Midland (MI): Dow Chemical, Health and Environmental Sciences, Mammalian and Environmental Toxicology Research Laboratory. Report No.: D-1734 [cité dans UE, 2002].
Hemminki A, Vayrynen T et Hemminki K. 1994. Reaction kinetics of alkyl epoxides with DNA and other nucleophiles. Chem Biol Interact 93(1):51-8.
Hemminki K et Falck K. 1979. Correlation of Mutagenicity and 4-p Nitrobenzyl pyridine alkylation by epoxides. Toxicol Lett 4 (2):103-6 [cité dans CIRC, 1994; UE, 2002].
Hemminki K, Paasivirta J, Kurkirinne T et Virkki L. 1980. Alkylation products of DNA bases by simple epoxides. Chem Biol Interact 30(3):259-70 [cité dans UE, 2002].
Henkel Technologies 2008. Material Safety Data Sheet for Loctite Paint stripper.
[HENRYWIN] Henry's Law Constant Program for Microsoft Windows. 2000. Version 3.10. Washington (DC): U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation.
Hogstedt C, Aringer L et Gustavsson A. 1986. Epidemiologic support for ethylene oxide as a cancer-causing agent. JAMA 255(12):1575-8 [cité dans CIRC, 1994].
Hogstedt B, Bergmark E, Tornqvist M et Osterman-Golkar S. 1990. Chromosomal aberrations and micronuclei in lymphocytes in relation to alkylation of hemoglobin in workers exposed to ethylene oxide and propylene oxide. Hereditas 113(2):133-8 [cité dans UE, 2002; CIRC, 1994].
Hogstedt C, Rohlen O, Berndtsson BS, Axelson O et Ehrenberg L. 1979. A cohort study of mortality and cancer incidence in ethylene oxide production workers. Br J Ind Med 36(4):276-80 [cité dans CIRC,1994].
Hogstedt LC. 1988. Epidemiological studies on ethylene oxide and cancer: an updating. IARC Sci Publ (89):265-70 [cité dans CIRC, 1994].
Howard PH. 1989. Handbook of environmental fate and exposure data for organic chemicals: Vol. I, Large production and priority pollutants. Chelsea (MI): Lewis Publishers.
DGPSA (Direction générale des produits de santé et des aliments). 2007. Communication personnelle de Shahriar Khadem, Direction des produits de santé naturels, Direction générale des produits de santé et des aliments.
Hughes TJ, Simmons DM, Monteith LG et Claxton LD. 1987. Vaporization technique to measure mutagenic activity of volatile organic chemicals in the Amesalmonella assay. Environ Mol Mutagen 9(4):421-41 [cité dans CIRC,1994; UE, 2002].
[INRP] Inventaire national des rejets de polluants [base de données sur Internet]. 2006. Gatineau (QC): Environnement Canada. [cité en mars 2006].
[IPC] Indice des prix à la consommation. 2003. CPI Product Profiles. [Internet]. Toronto (ON): Camford Information Service.
Jacobson KH, Hackley WB et Feinsilver L. 1956. The toxicity of inhaled ethylene oxide and propylene oxide vapors; acute and chronic toxicity of ethylene oxide and acute toxicity of propylene oxide. AMA Arch Ind Health 13(3):237-44 [cité dans UE, 2002].
Japon, Gouvernement du Japon, Ministère de l'Environnement. 1995. Summary of the results of monitoring of water and bottom sediment: Report on environment survey and wildlife monitoring of chemicals in the environment. [cité en août 2007]. Disponible à : Japan Ministry of the Environment
Jefferson Chemical Company. 1960. Technische Broschuere Propylene Oxide [cité dans UE, 2002].
Jensen O. 1981. Contact allergy to propylene oxide and isopropyl alcohol in a skin disinfectant swab. Contact Dermatitis 7(3):148-50 [cité dans CIRC, 1994]
Jorritsma U, Cornet M, Van Hummelen P, Bolt HM, Vercruysse A, Kirsch-Volders M et Rogiers V. 1995. Comparative mutagenicity of 2-methylpropene (isobutene), its epoxide 2-methyl-1,2-epoxypropane and propylene oxide in the in vitro micronucleus test using human lymphocytes. Mutagenesis 10(2):101-4 [cité dans UE, 2002].
Justice Canada. 1985. Loi sur les aliments et drogues (L.R., 1985, ch. F-27) [cité en septembre 2007]
Kautiainen A et Tornqvist M. 1991. Monitoring exposure to simple epoxides and alkenes through gas chromatographic determination of hemoglobin adducts. Int Arch Occup Environ Health 63(1):27-31 [cité dans CIRC,1994; UE, 2002].
Kohda KH, Ninomiya S, Washizu K, Shiraki K, Ebie M et Kawazoe Y. 1987. Mutagenicity of a series of N-alkyl-, N-hydroxyalkyl-, N-haloalkyl- and N-carboxyalkyl-N-nitrosoureas in Escherichia coli tester strains: dependence on the uvrA DNA-repair system. Mutat Res 177(2):219-28 [cité dans CIRC, 1994].
Kolman A et Dusinska M. 1995. Comparison of propylene oxide and epichlorohydrin effects in two transformation tests (C3H/10T1/2 and SHE cells). Toxicol Lett 81(2-3):213-21 [cité dans UE, 2002].
Kolman A, Spivak I, Naslund M, Dusinska M et Cedervall B. 1997. Propylene oxide and epichlorohydrin induce DNA strand breaks in human diploid fibroblasts. Environ Mol Mutagen 30 (1):40-6.
Kolmark G et Giles NH. 1955. Comparative Studies of Monoepoxides as Inducers of Reverse Mutations in Neurospora. Genetics 40:890-902. [cité dans CIRC, 1994; UE, 2002].
Kumar R, Staffas J, Forsti A et Hemminki K. 1995. 32P-postlabelling method for the detection of 7-alkylguanine adducts formed by the reaction of different 1,2-alkyl epoxides with DNA. Carcinogenesis 16(9):483-9.
Kuper CF, Reuzel PG, Feron VJ et Verschuuren H. 1988. Chronic inhalation toxicity and carcinogenicity study of propylene oxide in Wistar rats. Food Chem Toxicol 26(2):159-67.
Koskikallio J et Whalley E. 1959. Effect of pressure on the spontaneous and the base-catalysed hydrolysis of epoxides. Can J Chem 37:783-787.
Lawley PD, Jarman M. 1972. Alkylation by propylene oxide of deoxyribonucleic acid, adenine, guanosine and deoxyguanylic acid. Biochem J 126:893-900
Lee MS, Faller TH, Kreuzer PE, Kessler W, Csanady GA, Putz C, Rios-Blanco MN, Pottenger LH, Segerback D, Osterman-Golkar S et al. 2005. Propylene oxide in blood and soluble nonprotein thiols in nasal mucosa and other tissues of male Fischer 344/N rats exposed to propylene oxide vapors--relevance of glutathione depletion for propylene oxide-induced rat nasal tumors. Toxicol Sci 83(1):177-89.
Lynch DW, Lewis TR, Moorman WJ, Burg JR, Groth DH, Khan A, Ackerman LJ et Cockrell BY. 1984a. Carcinogenic and toxicologic effects of inhaled ethylene oxide and propylene oxide in F344 rats. Toxicol Appl Pharmacol 76(1):69-84 [cité dans CIRC, 1994].
Lynch DW, Lewis TR, Moorman WJ, Burg JR, Gulati DK, Kaur P et Sabharwal PS. 1984b. Sister-chromatid exchanges and chromosome aberrations in lymphocytes from monkeys exposed to ethylene oxide and propylene oxide by inhalation. Toxicol Appl Pharmacol 76(1):85-95 [cité dans CIRC, 1994; UE, 2002].
Mabey W et Mill T. 1978. Critical review of hydrolysis of organic compounds in water under environmental conditions. J Phys Chem Ref Data. 7:383-415.
Matthews EJ, Spalding JW et Tennant RW. 1993. Transformation of BALB/c-3T3 cells: V. Transformation responses of 168 chemicals compared with mutagenicity in Salmonella and carcinogenicity in rodent bioassays. Environ Health Perspect 101(Suppl 2):347-482.
McDonald RA et Shrader SA Stull DR. 1959. Vapour pressure and freezing points of 30 organics. J Chem Eng Data 4 (4):311-313 [cité dans European Union Risk Assessment Report, 2000].
McGregor D, Brown AG, Cattanach P, Edwards I, Mcbride D, Riach C, Shepherd W et Caspary WJ. 1991. Responses of the L5178Y mouse lymphoma forward mutation assay: V. Gases and vapors. Environ Mol Mutagen 17(2):122-9 [cité dans CIRC, 1994; UE, 2002].
McMahon RE, Cline JC et Thompson CZ. 1979. Assay of 855 test chemicals in ten tester strains using a new modification of the Ames test for bacterial mutagens. Cancer Res 39 (3):682-93 [cité dans UE, 2002].
[ME de l’Ontario], Ministère de l’Environnement, Direction de l’élaboration des normes. Mars 2001. Ontario Air Standards for propylene oxide. Toronto (ON). Direction de l’élaboration des normes.
Meylan W, Papa L, De Rosa CT et Stara JF. 1986. Chemicals of current interest - propylene oxide : health and environmental effects profile. Toxicol Ind Health 2(3): 219-60
Migliore L, Rossi AM et Loprieno N. 1982. Mutagenic action of structurally related alkene oxides on Schizosaccharomyces pombe: the influence, 'in vitro', of mouse-liver metabolizing system. Mutat Res 102(4):425-37 [cité dans CIRC, 1994; UE, 2002].
Miller RC et Watkinson RJ. 1985. Propylene oxide: an assessment of ready biodegradability. Sittingbourne (GB): Shell Research, Sittingbourne Research Centre. Group Research Report SBGR.85.064. [cité dans UK IUCLID Dataset, 2000]
Morris AD, Ratcliffe J, Dalziel KL et English JSC. 1998. Allergic contact dermatitis from epoxy propane [abstract]. Contact Dermatitis 38(1):57.
Morris JB, Banton MI et Pottenger LH. 2004. Uptake of inspired propylene oxide in the upper respiratory tract of the F344 rat. Toxicol Sci 81(1):216-24.
Morris JB et Pottenger LH. 2006. Nasal NPSH depletion and propylene oxide uptake in the upper respiratory tract of the mouse. Toxicol Sci 92(1):228-34.
[NTP] National Toxicology Program. 1985. Toxicology and carcinogenesis studies of propylene oxide in F344/N rats and B6C3F1 mice (inhalation studies). Research Triangle Park (NC): National Toxicology Program. Technical Report Series 267.
[NTP] National Toxicology Program. 1989-1993. [database on the Internet]. Research Triangle Park (NC): National Toxicology Program. Study number 669217.
[NTP] National Toxicology Program. 2005. 11th Report on carcinogens. Substance profile: propylene oxide. Research Triangle Park (NC): National Toxicology Program.
Nichols PL Jr et Ingham JD. 1955. The inductive effect in ethylene oxide ring openings. Amer Chem Soc 77:6547-6551 [cité dans European Union Risk Assessment Report, 2000] .
Nivard MJ, Czene K, Segerback D et Vogel EW. 2003. Mutagenic activity of ethylene oxide and propylene oxide under XPG proficient and deficient conditions in relation to N-7-(2-hydroxyalkyl)guanine levels in Drosophila. Mutat Res 529(1-2):95-107.
[OASIS Forecast] Optimized Approach based on Structural Indices Set [Estimation Model]. 2005. Version 1.20. Bourgas, Bulgarie: Laboratory of Mathematical Chemistry.
Oetting FL.1964. Low-temperature heat capacity and related thermodynamic functions of propylene oxide. J Chem Physics 41(1):149-153 [cité dans European Union Risk Assessment Report, 2000] .
Ohnishi A, Hori H, Tanaka I, Yamamoto T et Murai Y. 1988. [Determination of the exposure concentration of propylene oxide to produce neuropathy in rats]. J UOEH 10(3):227-81.
Okuda H, Takeuchi T, Senoh H, Arito H, Nagano K, Yamamoto S et Matsushima T. 2006. Effects of inhalation exposure to propylene oxide on respiratory tract, reproduction and development in rats. J Occup Health 48(6):462-73.
Omura M, Tanaka A, Mori K, Hirata M, Zao M et Inoue N. 1994. Dose-dependent testicular toxicity of propylene oxide in rats induced by repeated intraperitoneal injections. Fukuoka Igaku Zasshi 85(7):204-10.
Ong T, Stewart J, Wen Y, Whong WZ. 1987. Application of SOS umu-test for the detection of genotoxic volatile chemicals and air pollutants. Environ Mutagen 9(2):171-6 [cité dans CIRC, 1994; UE, 2002].
[ME de l'Ontario], Ministère de l'Environnement, Direction de l'élaboration des normes. Mars 2001. Ontario Air Standards for propylene oxide. Toronto (ON). Direction de l'élaboration des normes.
Osterman-Golkar S, Bailey E, Farmer PB, Gorf SM et Lamb JH. 1984. Monitoring exposure to propylene oxide through the determination of hemoglobin alkylation. Scand J Work Environ Health 10(2):99-102 [cité dans CIRC, 1994].
Osterman-Golkar S, Czene K, Lee MS, Faller TH, Csanady GA, Kessler W, Perez HL, Filser JG et Segerback, D. 2003. Dosimetry by means of DNA and hemoglobin adducts in propylene oxide-exposed rats. Toxicol Appl Pharmacol 191(3):245-54.
Ott MG, Teta J et Greenberg HL. 1989. Lymphatic and hematopoietic tissue cancer in a chemical manufacturing environment. Am J Ind Med 16 (6):631-44 [cité dans CIRC, 1994].
[PCKOCWIN] Organic Carbon Partition Coefficient Program for Windows. 2000. Version 1.66. Washington (DC): U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics. Syracuse (NY): Syracuse Research Corporation.
Pero RW, Bryngelsson T, Widegren B, Hogstedt B et Welinder H. 1982. A reduced capacity for unscheduled DNA synthesis in lymphocytes from individuals exposed to propylene oxide and ethylene oxide. Mutat Res 104(1-3):193-200 [cité dans UE, 2002].
Pero RW, Osterman-Golkar S et Hogstedt B. 1985. Unscheduled DNA synthesis correlated to alkylation of hemoglobin in individuals occupationally exposed to propylene oxide. Cell Biol Toxicol 1(4):309-14 [cité dans UE, 2002].
Pfeiffer EH et Dunkelberg H. 1980. Mutagenicity of ethylene oxide and propylene oxide and of the glycols and halohydrins formed from them during the fumigation of foodstuffs. Food Cosmet Toxicol 18(2):115-8 [cité dans CIRC, 1994; UE, 2002].
[PhysProp] Interactive PhysProp Database [Internet]. 2003. Syracuse (NY): Syracuse Research Corporation [cité en mars 2003].
[PISC] Programme international sur la sécurité des substances chimiques. 1985. Environmental Health Criteria 56, Propylene oxide. Genève (CH) : Organisation mondiale de la santé, Programme des Nations Unies pour l'environnement, Organisation internationale du travail, Programme international sur la sécurité des substances chimiques.
Pitts JN. 1979. Chemical consequences of air quality standards and of control implementation programmes: roles of hydrocarbons, oxides of nitrogen, oxides of sulphur and aged smog in the production of photochemical oxidant and aerosol. California : CA State-wide Air Pollution Center. [cité dans IUCLID Dataset, 2000].
Plna K, Nilsson R, Koskinen M et Segerback D. 1999. 32P-postlabelling of propylene oxide 1- and N(6)-substituted adenine and 3-substituted cytosine/uracil: formation and persistence in vitro and in vivo. Carcinogenesis 20(10):2025-32.
Plunkett ER. 1987. Handbook of Industrial Toxicology. 3rd ed. New York (NY): Chemical Pub. Co.
Randerath K, Reddy MV et Gupta RC. 1981. 32P-labeling test for DNA damage. Proc Natl Acad Sci U S A 78(10):6126-9 [cité dans CIRC, 1994].
Renne RA, Giddens WE, Boorman GA, Kovatch R, Haseman JE et Clarke WJ. 1986. Nasal cavity neoplasia in F344/N rats and (C57BL/6 × C3H)F1 mice inhaling propylene oxide for up to two years. J Natl Cancer Inst 77(2):573-82 [cité dans CIRC, 1994].
Reuzel PGJ et Kuper CF. 1981. Subchronic (13 week) inhalation toxicity study of propylene oxide in rats. Zeist, NL: CIVO Institutes TNO. [cité dans UE, 2002].
Rios-Blanco MN, Ranasinghe A, Lee MS, Faller T, Filser JG et Swenberg JA. 2003a. Molecular dosimetry of N7-(2-hydroxypropyl)guanine in tissues of F344 rats after inhalation exposure to propylene oxide. Carcinogenesis 24(7):1233-8
Rios-Blanco MN, Yamaguchi S, Dhawan-Robl M, Kessler W, Schoonhoven R, Filser JG et Swenberg JA. 2003b. Effects of propylene oxide exposure on rat nasal respiratory cell proliferation. Toxicol Sci 75(2):279-88.
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2007a. Consumer Exposure (ConsExpo) Model [Internet]. Version 4.1. Pays-Bas : The National Institute for Public Health and the Environment (Rijksinstituut voor Volksgezondheid en Milieu).
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2007b. Do-it-yourself Products Fact Sheet: To assess the risks for the consumer [Internet]. Report 320104007/2007. RIVM. [cité en avril 2008].
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2007c. Paint Products fact Sheet : To assess the risks for the consumer [Internet]. Report 320104008/2007. RIVM. [cité en avril 2008]
Rowe VK, Hollingsworth RL, Oyen F, Mccollister DD et Spencer HC. 1956. Toxicity of propylene oxide determined on experimental animals. AMA Arch Ind Health 13(3):228-36 [cité dans CIRC, 1994].
Sack TM, Steele DH, Hammerstrom K et Remmers J. 1992. A survey of household products for volatile organic compounds. Atmos Environ 26A(6):1063-1070.
Sato H, Kidata T et Hori M. 1985. Sterilization of therapeutic immunoadsorbents with aqueous propylene oxide solutions. Int J Artif Organs 8 :109-114.
Segerback D, Osterman-Golkar S, Molholt B et Nilsson R. 1994. In vivo tissue dosimetry as a basis for cross-species extrapolation in cancer risk assessment of propylene oxide. Regul Toxicol Pharmacol 20(1 Pt 1):1-14 [cité dans CIRC, 1994].
Segerback D, Plna K, Faller T, Kreuzer PE, Hakansson K, Filser JG et Nilsson R. 1998. Tissue distribution of DNA adducts in male Fischer rats exposed to 500 ppm of propylene oxide: Quantitative analysis of 7-(2-hydroxypropyl)guanine by 32P-postlabelling. Chem Biol Interact 115 (3):229-46.
Shelby MD, Erexson GL, Hook GJ et Tice RR. 1993. Evaluation of a three-exposure mouse bone marrow micronucleus protocol: Results with 49 chemicals. Environ Mol Mutagen 21(2):160-79.
Sheldon LS. et Jenkins, P. 1990. Indoor pollutant concentrations and exposures for air toxics: a pilot study. Proceeding of the 5th International Conference on Indoor air Quality and Climate; Toronto, Canada ; p.759-764.
Simmon VF. 1981. Applications of the Salmonella/Microsome Assay. New York (NY): Springer-Verlag. p 120-6 [cité dans CIRC, 1994].
Sina JF, Bean CL, Dysart GR, Taylor VI et Bradley MO. 1983. Evaluation of the alkaline elution/rat hepatocyte assay as a predictor of carcinogenic/mutagenic potential. Mutat Res 113:357-91 [cité dans CIRC,1994; UE, 2002].
Smyth HF, Carpenter CP, Weil CS, Pozzani US, Striegel JA et Nycum JS. 1969. Range finding toxicity data. (List VII). AIHA J 30:470-6 [cité dans UE, 2002].
Smyth HF, Seaton J et Fischer L. 1941. The single dose toxicity of some glycols and derivatives. J Ind Hyg Toxicol 23:259-68 [cité dans UE, 2002]
[SNBES] Ministère de la Santé nationale et du Bien-être social (CA). 1990. L'allaitement maternel au Canada : pratiques et tendances actuelles. Ottawa : Canada, Ministère de la Santé nationale et du Bien-être social. SNBES no cat. H39-199/1990F. [cité dans DHM, 1998].
Snyder CA et Solomon JJ. 1993. The extent and persistence of binding to respiratory mucosal DNA by inhaled tritiated propylene oxide. Cancer Lett 72(3):157-61 [cité dans CIRC, 1994].
Solomon JJ, Mukai F, Fedyk J et Segal A. 1988. Reactions of propylene oxide with 2'-deoxynucleosides and in vitro with calf thymus DNA. Chem Biol Interact 67(3):275-94 [cité dans CIRC, 1994; UE, 2002].
Sprinz H, Matzke H et Carter J.(1982) Neuropathological evaluation of monkeys exposed to ethylene and propylene oxide. Kansas City (MI):Midwest Research Institute. (Préparé pour le NIOSH) [PB 83-134817].
Steinkraus V et Hausen BM. 1994. Contact allergy to propylene oxide. Contact Dermatitis 31(2):120.
Stocker WG et Thiess AM. 1979. Morbidity study on workers exposed to ethylene oxide/propylene oxide. In: The 7th Medichem Congress; 15 septembre; Gera ;1979. p. 534, 29.3.7.3.[cité dans UE, 2002].
Svensson K, Olofsson K et Osterman-Golkar S. 1991. Alkylation of DNA and hemoglobin in the mouse following exposure to propene and propylene oxide. Chem Biol Interact 78(1):55-66 [cité dans CIRC, 1994].
Thiess AM, Frentzel-Beyme R, Link R et Stocker WG. 1982. Mortality study on employees exposed to alkylene oxides (ethylene oxide/propylene oxide) and their derivatives. Dans : Prevention of Occupational Cancer International Symposium; avril 1981; Helsinki, Finlande. Bureau international du travail, Genève, Suisse : Occupational Safety and Health Series, No. 46. p. 249-259 [cité dans CIRC, 1994; UE, 2002].
Thiess AM, Schwegler H, Fleig I et Stocker WG. 1981. Mutagenicity study of workers exposed to alkylene oxides (ethylene oxide/propylene oxide) and derivatives. J Occup Med 23(5):343-7 [cité dans UE, 2002; CIRC 1994].
Trent DL. 2001. Propylene oxide [Internet]. Kirk-Othmer Encyclopedia of Chemical Technology, online version.
Tsuda S, Matsusaka N, Madarame H, Miyamae Y, Ishida K, Satoh M, Sekihashi K et Sasaki YF. 2000. The alkaline single cell electrophoresis assay with eight mouse organs: results with 22 mono-functional alkylating agents (including 9 dialkyl N-nitrosoamines) and 10 DNA crosslinkers. Mutat Res 467(1):83-98.
Tucker JD, Xu J, Stewart J, Baciu PC et Ong TM. 1986. Detection of sister chromatid exchanges induced by volatile genotoxicants. Teratog Carcinog Mutagen 6(1):15-21 [cité dans CIRC, 1994; UE, 2002].
Union européenne. 2002. Methyloxirane (Propylene Oxide). Commission européenne. Centre commun de recherche. Institut pour la protection et la sécurité des citoyens. Bureau européen des substances chimiques (ECB). European Union Risk Assessment Report. Deuxième liste des substances prioritaires. Rapport no EUR 20512 EN 23:1-149.
[US EPA] United States Environmental Protection Agency. 1986 Sept. Standard scenario for estimating exposure to chemical substances during use of consumer products Vol.1. (EPA contract No. 68-02-3968)
[US EPA] States Environmental Protection Agency. 1997 Aug. Exposure Factors Handbook Vol.3 Activity factors.(EPA/600/P-95/002Fc)
[US EPA] United States Environmental Protection Agency. 1994. Integrated Risk Information System (IRIS): Propylene oxide (CASRN 75-56-9).
[US EPA] United States Environmental Protection Agency. 2006 Aug. Reregistration Eligibility Decision (RED) for Propylene Oxide (EPA 738-R-06-029).
[US EPA] United States Environmental Protection Agency. 1990. Integrated Risk Information System (IRIS): Propylene oxide (CASRN 75-56-9).
[US EPA] United States Environmental Protection Agency. 2005 Sept 26. Propylene Oxide Revised HED Risk Assessment for Reregistration Eligibility Decision (RED) Document (PC Code: 042501, DP Barcode: D321759).
Van Ketel WG. 1979. Contact dermatitis from propylene oxide. Contact Dermatitis 5(3):191-2 [cité dans CIRC, 1994].
Van Sittert NJ et De Jong G. 1985. Biomonitoring of exposure to potential mutagens and carcinogens in industrial populations. Food Chem Toxicol 23(1):23-31. [cité dans UE, 2002].
Viktorova TV, Karimova LK, Khusnutdinova EK et Rafikov KH S. 1994. Assessment of chromosomal aberrations in workers of propylene and ethylene oxides production. Med Tr Prom Ekol 4:20-3 [cité dans UE, 2002].
Vogel EW et Nivard MJ. 1998. Genotoxic effects of inhaled ethylene oxide, propylene oxide and butylene oxide on germ cells: sensitivity of genetic endpoints in relation to dose and repair status. Mutat Res 405(2):259-71.
Vogel EW et Nivard MJ. 1997. The response of germ cells to ethylene oxide, propylene oxide, propylene imine and methyl methanesulfonate is a matter of cell stage-related DNA repair. Environ Mol Mutagen 29(2):124-35.
von der Hude W, Carstensen S, Gurtler R et Obe G. 1992. Structure-activity relationships of epoxides: induction of sister-chromatid exchanges in V79 Cells by enantiomeric epoxides. Mutat Res 278(4):289-97 [cité dans CIRC, 1994].
Von der Hude W, Carstensen S et Obe G. 1991. Structure-activity relationships of epoxides: Induction of sister-chromatid exchanges in Chinese hamster V79 cells. Mutat Res 249 (1):55-70 [cité dans UE, 2002].
von der Hude W, Seelbach A et Basler A. 1990. Epoxides: Comparison of the induction of SOS repair in Escherichia coli PQ37 and the bacterial mutagenicity in the Ames test. Mutat Res 231 (2):205-18 [cité dans UE, 2002].
Voogd CE, Van Der Stel JJ et Jacobs JJ. 1981. The mutagenic action of aliphatic epoxides. Mutat Res 89(4):269-82. [cité dans CIRC, 1994; UE, 2002].
Wade DR, Airy SC et Sinsheimer JE. 1978. Mutagenicity of aliphatic epoxides. Mutat Res 58 (2-3):217-24. [cité dans CIRC, 1994; UE, 2002].
Waggy GT et Payne JR. 1974. Environmental impact analysis, product biodegradability testing. Progress report. August 12, 1974. File No. 19751, Research and Development Department, Union Carbide Corporation [cité dans European Union Risk Assessment Report 2000] .
Wakata A, Miyamae Y, Sato SI, Suzuki T, Morita T, Asano N, Awogi T, Kondo K et Hayashi M. 1998. Evaluation of the rat micronucleus test with bone marrow and peripheral blood: Summary of the 9th collaborative study by CSGMT MMS. Environ Mol Mutagen 32 (1):84-100.
Walles SA. 1974. The influence of some alkylating agents on the structure of DNA in vitro. Chem Biol Interact 9(2):97-103 [cité dans UE, 2002].
Wallington TJ, Liu R., Dagaut P et Kurylo M.J. 1988. The gas phase reactions of hydroxyl radicals with a series of aliphatic ethers over the temperature range 240-440 K. Int J Chem Kinet 20:41-49 [cité dans European Union Risk Assessment Report, 2000] .
Walpole AL. 1958. Carcinogenic action of alkylating agents. Ann NY Acad Sci 68:750-61 [cité dans CIRC, 1994].
Weil CS, Condra N, Haun C et Streigel JA. 1963. Experimental carcinogenicity and acute toxicity of representative epoxides. Am Ind Hyg Assoc J 24:305-25 [cité dans UE, 2002].
Winer AM et al. 1979. Cité dans Atkinson R, Darnall KR, Lloyd AC, Winer AMand Pitts JN Jr. Kinetics and mechanisms of the reactions of the hydroxyl radical with organic compounds in the gas phase. Advances in Photochemistry, 11: 3741.
Yamaguchi T. 1982. Mutagenicity of trioses and methyl glyoxal on Salmonella typhimurium. Agric Biol Chem 46:849-51 [cité dans CIRC, 1994].
Yasunaga K, Kiyonari A, Oikawa T, Abe N et Yoshikawa K. 2004. Evaluation of the Salmonella umu test with 83 NTP chemicals. Environ Mol Mutagen 44(4):329-45.
Young JT, Mattsson JL, Albee RR et Schuetz DJ. 1985. Propylene oxide: Assessment of neurotoxic potential in male rats. Report (D-1831) of the Mammalian and Environmental Toxicology Research Laboratory. Midland (MI): Dow Chemical, Health and Environmental Sciences. [cité dans UE, 2002].
Zamora PO, Benson JM, Li AP et Brooks AL. 1983. Evaluation of an exposure system using cells grown on collagen gels for detecting highly volatile mutagens in the CHO mutation assay Environ Mutagen 5(6):795-801 [cité dans CIRC, 1994; UE, 2002].
Zeiger E, Anderson B, Haworth S, Lawlor T et Mortelmans K. 1988. Salmonella mutagenicity tests: IV. Results from the testing of 300 chemicals. Environ Mol Mutagen 11 Suppl 12:1-157 [cité dans CIRC, 1994].
Zetsch C et Stahl F. 1981. Rate constants for reactions of OH with partly oxidised hydrocarbons: carbonic acids and epoxides. Communication présentée au cours du « Discussion meeting of working party 2 », à Louvain, Belgique, les 11 et 12 février 1981, dans le cadre du COST 61A bis « Physicochemical behaviour of atmospheric pollutants » (Rapport préparé par RA Cox, AERE et Harwell) [cité dans European Union Risk Assessment Report, 2000).
| Voie d'exposition | Absorption estimée (µg/kg p.c. par jour) de naphtalène par groupes d'âge | ||||||
|---|---|---|---|---|---|---|---|
| 0-6 mois [1, 2, 3] | 0,5-4 ans[4] | 5-11 ans[5] | 12-19 ans[6] | 20-59 ans[7] | 60+ ans[8] | ||
| lait maternisé | sans lait maternisé | ||||||
| s.o. = sans objet a.d. = aucune donnée [1] Aucune donnée n'a été relevée sur la présence de méthyloxirane dans le lait maternel. [2] Valeurs présumées : masse corporelle de 7,5 kg, inhalation de 2,1 m 3 d'air par jour, ingestion de 0,8 L (lait maternisé) ou de 0,3 L (autre que le lait maternisé) d'eau par jour et ingestion de 30 mg de sol par jour (DHM, 1998). [3] L'absorption à partir de l'eau est synonyme de l'absorption à partir de la nourriture pour les nourrissons alimentés au lait maternisé. Aucune donnée sur les concentrations de mé thyloxirane dans le lait maternisé n'a été relevée. Aucune donnée sur le méthyloxirane dans l'eau au Canada n'a été relevée et le seuil de détection d'une étude de surveillance japonaise sur les eaux de surface (ME du Japon) a été jugé inadéquat sur la base du mode de rejet, des propriétés physicochimiques et des utilisations du méthyloxirane qui font que sa présence dans l'eau devrait être négligeable par comparaison à ses concentrations dans l'air. [4] Valeurs présumées : masse corporelle de 15,5 kg, inhalation de 9,3 m 3 d'air par jour et ingestion de 0,7 L d'eau, de 100 mg de sol et de 0,1 g de chair de noix par jour (DHM, 1998). [5] Valeurs présumées : masse corporelle de 31,0 kg, inhalation de 14,5 m 3 d'air par jour et ingestion de 1,1 L d'eau, de 65 mg de sol et de 0,4 g de chair de noix par jour (DHM, 1998). [6] Valeurs présumées : masse corporelle de 59,4 kg, inhalation de 15,8 m 3 d'air par jour et ingestion de 1,2 L d'eau, de 30 mg de sol et de 0,5 g de chair de noix par jour (DHM, 1998). [7] Valeurs présumées : masse corporelle de 70,9 kg, inhalation de 16,2 m 3 d'air par jour et ingestion de 1,5 L d'eau, de 30 mg de sol et de 0,8 g de chair de noix par jour (DHM, 1998). [8] Valeurs présumées : masse corporelle de 72,0 kg, inhalation de 14,3 m 3 d'air par jour et ingestion de 1,6 L d'eau, de 30 mg de sol et de 0,4 g de chair de noix par jour (DHM, 1998). [9] Aucune donnée n’a été relevée sur la présence du méthyloxirane dans l’air ambiant au Canada. Le seuil de détection de 0,31 µg/m3 pour l’air ambiant tiré d’une étude pilote portant sur quatre logements de Woodland, en Californie, a été utilisé pour le calcul de la limite supérieure de l’exposition estimée (Sheldon et al., 1990). Il est présumé que les Canadiens passent trois heures à l’extérieur à chaque jour (DHM, 1998). [10] Aucune donnée n’a été relevée sur la présence de méthyloxirane dans l’air intérieur au Canada. Le seuil de détection de 0,31 µg/m3 pour l’air intérieur, déterminé au cours d’une étude pilote portant sur deux logements de Woodland, en Californie, où le méthyloxirane n’a pas été décelé, a été utilisé pour le calcul de la limite supérieure de l’exposition estimée (Sheldonet al., 1990). Il est présumé que les Canadiens passent 21 heures à l’intérieur chaque jour (DHM, 1998). [11] Aucune donnée n’a été relevée sur la présence du méthyloxirane dans l’eau au Canada. Le seuil de détection maximal de 5 µg/L, d’une enquête de 1980 portant sur 36 sources japonaises d’eau de surface (ME du Japon, consultée en juillet 2007) a été jugé inadéquat pour l’estimation de la limite supérieure d’exposition ou des concentrations dans le lait maternisé reconstitué des nourrissons car le mode de rejet, les propriétés physiques et chimiques et les utilisations du méthyloxirane font que sa présence dans l’eau devrait être négligeable par comparaison à ses concentrations dans l’air. [12] La limite maximale générale de 0,1 ppm pour les résidus de méthyloxirane à l’intérieur ou à la surface de chairs de noix d’amandier, de noyer et de pacanier importées et fumigées a été utilisée pour estimer les limites supérieures d’exposition. Il s’agit des seules chairs de noix dont la fumigation par ce pesticide est connue, et aucune autre donnée sur la présence de méthyloxirane dans des aliments n’a été décelée (ARLA, 2006). Une étude portant sur les chairs de noix traitées présentée à l’EPA américaine fait état de résidus maximaux de méthyloxirane de 273 ppm dans des noix d’amandier, 28 jours après la fumigation. L’étiquetage actuel des produits aux états-Unis impose aux fumigateurs de retenir (de dégazer) les chairs de noix pendant 28 jours avant leur expédition (US EPA, 2005). Comme le Canada n’a pas imposé de limite maximale de résidus pour ce pesticide, les aliments traités aux états-Unis (ou ailleurs) importés au Canada ne peuvent contenir plus de 0,1 ppm de méthyloxirane sous peine d’infraction au Règlement sur les aliments et drogues(ARLA, 2006). La consommation de noix et de graines de ce groupe d’aliments – à l’exception du beurre d’arachide – a été utilisée car les chairs de noix d’amandier, de noyer et de pacanier sont les seules connues pour être fumigées. Aucune donnée n’a été décelée sur la présence du méthyloxirane dans d’autres aliments. [13] Aucune donnée sur la présence du méthyloxirane dans les sols au Canada n’a été relevée. Le seuil de détection de 2 µg/kg utilisé pour 12 échantillons de sédiments prélevés au cours d’une étude de surveillance japonaise réalisée en 1980 (ME du Japon) a été jugé inadéquat pour le calcul d’une estimation de la limite supérieure d’exposition (tel qu’il est mentionné ci-dessus pour l’eau) car le mode de rejet, les propriétés physiques et chimiques et les utilisations du méthyloxirane font que sa présence dans le sol devrait être négligeable par comparaison à ses concentrations dans l’air. |
|||||||
| Air ambiant [9] | 0,01 | 0,02 | 0,02 | 0,01 | 0,01 | 0,01 | |
| Air intérieur [10] | 0,08 | 0,16 | 0,13 | 0,07 | 0,06 | 0,05 | |
| Eau potable [11] | -- | -- | -- | -- | -- | -- | -- |
| Nourriture et boissons [12] | s.o. | 0,0007 | 0,001 | 0,0008 | 0,001 | 0,0006 | |
| Sol [13] | a.d. | a.d. | a.d. | a.d. | a.d. | a.d. | |
| Absorption totale | 0,09 | 0,09 | 0,18 | 0,15 | 0,08 | 0,07 | 0,06 |
| Milieu | Air | Eau | Sol |
|---|---|---|---|
| [1] Concentrations prévues à l'aide du modèle Chemcan (version 6.0) [CEMC, 2003]. [2] Les prévisions modélisées supposent un rejet à 100 % dans l'atmosphère du sud de l'Ontario d'une quantité de 50 kg par an, qui est le seuil de déclaration indiqué dans un avis récent donné en vertu de l'article 71 de la LCPE (1999) [Environnement Canada, 2007]. |
|||
| Concentration [2] | 5,4 x10 -7µg/m3 | 1,8 × 10 -5µg/L | 1,2 × 10 -9ng/g |
| Type de produits de consommation | Hypothèse | Exposition estimée |
|---|---|---|
| [a] Ces produits étant surtout utilisés par des adultes (personnes âgées de 20 à 59 ans), les expositions n’ont été estimées que pour ce groupe d’âge [b] Modèle ConsExpo (version 4.1), exposition aux vapeurs, débit constant comme mode de rejet (on suppose que la substance est rejetée à un débit constant durant un temps donné); estimation aux fins de comparaison; la concentration moyenne par événement est de 200 mg/m3. [c] La matrice de la masse moléculaire est calculée à partir de la masse moléculaire du solvant principal, le dichlorométhane présent dans le décapant. [d] La matrice de la masse moléculaire est calculée à partir de la masse moléculaire du solvant principal, le carbonate de propylène présent dans la peinture en aérosol. |
||
| Décapant | Inhalation
|
Concentration la moyenne par événement = 200 mg/m3 |
| Peinture acrylique en aérosol | Inhalation
|
Concentration la moyenne par événement = 1,3 mg/m3 |
| Paramètre | Résultat et référence | |||
|---|---|---|---|---|
| Espèce, souche | Résultat | Activation métabolique | Référence | |
| Génotoxicité et paramètres connexes : in vitro | ||||
| Mutation génique | Salmonella typhimurium TA 97 | positif | +/- | Canter et al., 1986 |
| négatif | +/- | Zeiger et al., 1988 | ||
| Salmonella typhimurium TA 98 | négatif | + | Bootman et al., 1979 Canter et al., 1986 Zeiger et al., 1988 |
|
| - | Bootman et al., 1979 McMahon et al., 1979 Pfeiffer et Dunkelberg, 1980 Canter et al., 1986 Zeiger et al., 1988 |
|||
| Salmonella typhimurium TA100 | positif | + | Bootman et al., 1979 Canter et al., 1986 Hughes, 1987 Castelain et al., 1993 |
|
| - | Wade et al., 1978 Bootman et al., 1979 McMahon et al., 1979 Pfeiffer et Dunkelberg, 1980 Simmon, 1981 Yamaguchi, 1982 Canter et al., 1986 Djuric et al., 1986 Agurell et al., 1991 Castelain et al., 1993 |
|||
| négatif | + | Zeiger et al., 1988 | ||
| - | Hemminki et Falck, 1979 Zeiger et al., 1988 |
|||
| Salmonella typhimurium TA1535 | positif | + | Bootman et al., 1979 Canter et al., 1986 Zeiger et al., 1988 Castelain et al., 1993 |
|
| - | Wade et al., 1978 Bootman et al., 1979 McMahon et al., 1979 Pfeiffer et Dunkelberg, 1980 Simmon, 1981 Canter et al., 1986 Djuric et al., 1986 Agurell et al., 1991 Castelain et al., 1993 |
|||
| négatif | - | Zeiger et al., 1988 | ||
| Salmonella typhimurium TA1537 | négatif | + | Bootman et al., 1979 Zeiger et al., 1988 |
|
| - | Bootman et al., 1979 McMahon et al., 1979 Pfeiffer et Dunkelberg, 1980 Zeiger et al., 1988 |
|||
| non concluant | +/- | Canter et al., 1986 | ||
| Salmonella typhimurium TA1538 | négatif | + | Dean et al., 1985 | |
| - | Dean et al., 1985 McMahon et al., 1979 |
|||
| Salmonella typhimurium YG7108 | positif | non précisé | Emmert et al., 2006 | |
| Salmonella typhimurium G46 | négatif | - | McMahon et al., 1979 | |
| Escherichia coli WP2 uvr A | positif | + | Dean et al., 1985 | |
| - | Dean et al., 1985 McMahon et al., 1979 |
|||
| négatif | - | Hemminki et Falck, 1979 | ||
| Escherichia coli WP2 | positif | + | Bootman et al., 1979 | |
| - | Bootman et al., 1979 McMahon et al., 1979 Dean et al., 1985 |
|||
| négatif | + | Dean et al., 1985 | ||
| Escherichia coli CM891 | positif | - | Bootman et al., 1979 | |
| Escherichia coli CM871 | positif | - | Bootman et al., 1979 | |
| Escherichia coli B (Arg-) Hs30R | positif | - | Kohda et al., 1987 | |
| Escherichia coli PQ37 | négatif | +/- | Von der Hude et al., 1990 | |
| Klebsiella pneumoniae | positif | - | Voogd et al., 1981 | |
| Saccharamyces cerevisiae | positif | - | Agurell et al., 1991 | |
| Schizosaccharomyces pombe p1 | positif | +/- | Migliore et al., 1982 | |
| Neurospora crassa | positif | - | Kolmark et Giles, 1955 | |
| Bactériophage | positif | non précisé | Garro et Phillips, 1980 | |
| négatif | - | Cookson et al., 1971 | ||
| Souris - cellules L5178Y | positif | - | McGregor et al., 1991 | |
| Hamster chinois - cellules ovariennes, locus hprt | positif | - | Zamora et al., 1983 | |
| Paramètre | Résultat et référence | |||
|---|---|---|---|---|
| Génotoxicité et paramètres connexes : in vitro | ||||
| échange de chromatides sœurs | Positif : hamster chinois CHO (+/-S9) [Gulati et al., 1989] hamster chinois, cellules V79 (-S9) [Von der Hude et al., 1991; Von der Hude et al., 1992] rat - cellules du foie in vitro (-S9) [Dean et Hodson-Walker, 1979] humain - lymphocytes in vitro (Tucker et al., 1986; Agurell et al., 1991) |
|||
| Aberrations chromosomiques | Positif : hamster chinois CHO (+/-S9) [Gulati et al., 1989] rat - cellules du foie in vitro (-S9) [Dean et Hodson-Walker, 1979; Dean et al., 1985] humain - lymphocytes in vitro (Bootman et al., 1979) |
|||
| Induction de micronoyaux | Positif : humain - lymphocytes in vitro (Jorritsma et al., 1995) |
|||
| Bris de brins d'ADN | Positif : rat - hépatocytes in vitro (-S9) [Sina et al., 1983] humain - fibroblastes diploïdes (Kolman et al., 1997; Chovanec et al., 1998) veau - ADN du thymus (Walles, 1974) |
|||
| Adduits à l'ADN | Positif : (Lawley et Jarman, 1972; Walles, 1974; Hemminki et al., 1980; Randerath et al., 1981; Djuric et al., 1986; Solomon et al., 1988; Hemminki et al., 1994; Kumar et al., 1995; Plna et al., 1999) |
|||
| Toxicité différentielle | Positif : autre bactérie (-S9) [Bootman et al., 1979] |
|||
| Induction de la réponse SOS | Positif : Salmonella typhimurium, TA1535/pSK1002 (+/-S9) [Ong et al., 1987] Salmonella typhimurium, TA1535/pSK1002 (-S9) [Yasunagaet al., 2004] |
|||
| Conversion génique | Positif : Saccharomyces cerevisiae (- S9) [Agurell et al., 1991] |
|||
| Transformation cellulaire | Positif : souris - fibroblastes d'embryon (Kolman et Duniska, 1995) hamster syrien - cellules d'embryons (Kolman et Duniska, 1995) BALB/c-3T3, cellules (-S9) (Matthews et al., 1993) |
|||
| Génotoxicité et paramètres connexes :in vivo | ||||
| Induction de micronoyaux (moelle osseuse) | Positif : Négatif : |
|||
| Induction de micronoyaux (sang périphérique) | Positif : Négatif : |
|||
| Aberrations chromosomiques (moelle osseuse) | Positif : souris (i.p.) [Farooqi et al., 1993; NTP Database, 1989-1993] |
|||
| échange de chromatides sœurs (moelle osseuse) | Positif : souris (i.p.) [Farooqi et al., 1993; NTP Database, 1989] |
|||
| échange de chromatides sœurs (sang périphérique) | Négatif : singe cynomolgus (inhalation) [Lynch et al., 1984b] |
|||
| Lésions de l'ADN dans la moelle osseuse, l'estomac et le colon | Positif : souris (i.p.) [Tsuda et al., 2000] |
|||
| Essai dominant létal | Négatif : rat (inhalation) [Hardin et al., 1983b] souris (orale) [Bootman et al., 1979] |
|||
| Mutation létale récessive liée au sexe | Positif : drosophile (vapeur) [Hardin et al., 1983b; Vogel et Nivard, 1997; Vogel et Nivard, 1998; Nivard et al., 2003] drosophile (orale) [Foureman et al., 1994] |
|||
| Translocations réciproques | Positif : drosophile (orale) [Foureman et al., 1994] |
|||
| Adduits à l'ADN | Positif : drosophile (vapeur) [Nivard et al., 2003] souris, rat ou chien (inhalation, i.p. ou i.v.) [Segerback et al., 1994] souris (i.p.) [Svensson et al., 1991] s rat (inhalation) [Snyder et Solomon, 1993; Segerback et al., 1998; Plna et al., 999; Osterman-Golkar et al., 2003; Rios-Blanco et al., 2003a] |
|||
| Perte de chromosomes | Positif : drosophile (vapeur) [Vogel et Nivard, 1998] |
|||
| Humains | ||||
| Toxicité chronique/ cancérogénicité | Le CIRC (1994) et l'UE (2002) ont examiné diverses études portant sur des cohortes de sujets subissant une exposition professionnelle et une étude témoin sans exposition professionnelle, et déterminé qu'il était impossible de formuler des conclusions sur la cancérogénicité du méthyloxirane (Stocker et Thiess, 1979; Thiess et al., 1982; Hogstedtet al., 1979, 1986; Hogstedt, 1988; Gardner et al., 1989; Ott et al., 1989). | |||
| Génotoxicité et paramètres connexes | L'UE (2002) a examiné six études portant sur l'exposition professionnelle et indiqué l'impossibilité de tirer des conclusions de ces études relativement à la mutagénicité du méthyloxirane chez les humains (Theiss et al., 1981; Peroet al., 1982, 1985; Van Sittert et de Jong, 1985; de Jonget al., 1988; Hogstedt et al., 1990; Viktorovaet al., 1994). Selon une étude pilote, huit travailleurs d’un groupe exposés au méthyloxirane pendant au moins deux ans (concentrations antérieures < 10 ppm et concentration mesurée pouvant atteindre 7 ppm le jour précédant le prélèvement sanguin) présentaient un accroissement significatif des concentrations sanguines d’adduits à l’ADN et d’échanges de chromatides sœurs, comparativement à huit témoins, mais on ne peut exclure la possibilité que des facteurs confusionnels aient contribué aux effets cytogénétiques (Czene et al.,2002). |
|||
| Sensibilisation, irritation et autres | Rapports de cas de dermatite allergique de contact (Van Ketel, 1979; Jensen, 1981; Steinkraus et Hausen, 1994; Morriset al., 1998) Rapport de cas de brûlure cornéenne (McLaughlin, 1946) Rapport de cas de symptômes, notamment ceux d’irritation du tractus respiratoire et de l’oeil (Gosselin et al.,1984) |
|||
| Adduits à l'hémoglobine | Niveaux accrus chez de petites populations échantillons (Osterman-Golkar et al., 1984; Kautiainen et Tornqvist, 1991; Boogaard et al., 1999; Czene et al., 2002) | |||