Atelier sur la recherche des causes : mines de métaux : chapitre 6
Séance 2 : Causes potentielles des effets
- Écotoxicologie des métaux traces dans le milieu aquatique
- Étude sur la toxicité du sélénium à l'aide des études de suivi des effets sur l'environnement
- Spéciation et devenir des cyanures dans les résidus de mines d'or : étude de cas
- Les réactifs miniers et les sous-produits (par exemple les sulfosels) comme substances toxiques potentielles dans les effluents miniers
Peter G.C. Campbell;
courriel : campbell@ete.inrs.ca
INRS, Centre Eau Terre Environnement
490, de la Couronne,Québec (Qc) G1K 9A9, Canada
Pour obtenir une réaction biologique d'un organisme cible et/ou pour s'accumuler à l'intérieur de cet organisme, un métal doit d'abord interagir avec une membrane cellulaire. Les métaux existent généralement dans le milieu aquatique sous des formes polaires et hydrophiles, qui sont fortement hydratées et incapables de traverser les membranes cellulaires par simple diffusion. À quelques exceptions près (p. ex., quelques complexes organométalliques et métalliques neutres - voir la figure 1, mécanisme [iii]; certains métaux complexes comprenant un ligand assimilable, comme le thiosulfate - figure 1, mécanisme [ii]), le transport des métaux à travers les membranes respiratoires ou digestives est habituellement facilité par des systèmes de transport précis ou des canaux à l'intérieur des membranes (figure 1, mécanisme [i]; Campbell, 1995). Ce transport est habituellement une fonction non pas des métaux dissous totaux, mais plutôt de la concentration d'ion métallique libre (figure 1, mécanisme [i]). Après que les métaux ont pénétré l'environnement intracellulaire, divers mécanismes existent pour assurer leur détoxication (Vijver et al., 2004; Luoma et Rainbow, 2008). Il s'ensuit que des prévisions simples de la toxicité associée aux métaux sur la base de quotas ou de charges de métaux, comme c'est souvent fait dans le cas des contaminants organiques, sont rarement applicables. Les métaux qui se lient à des protéines inductibles capables de liaison avec les métaux comme les métallothionéines, ou qui sont précipités dans des concrétions insolubles composées de granules riches en métaux, peuvent être considérés comme étant des métaux détoxiqués biologiquement, comparativement aux métaux dans des fractions sensibles aux métaux comme les organites et les protéines thermosensibles. Un corollaire de ce modèle d'accumulation des métaux est le suivant : la tolérance ou la résistance des métaux se rattachera à la capacité d'un organisme de prévenir la liaison de métaux « inappropriés » à des sites sensibles. La liaison d'un métal « inapproprié » à un site sensible aux métaux, souvent appelée « débordement », pourrait annoncer le début du stress induit par les métaux (Campbell et Hare, 2009).
Figure 1
La figure 1 illustre trois mécanismes de transport des métaux à travers la membrane cellulaire. Le premier mécanisme décrit le transport des espèces d'ions métalliques présents sous forme hydrophile, qui se fait par liaison ionique des ions métalliques à un ligand cellulaire sur la surface de la cellule. Le deuxième mécanisme illustre le transport de complexes métalliques nécessitant un ligand assimilable. Le troisième mécanisme illustre la diffusion passive d'espèces lipophiles.
Dans cette construction générale des interactions métaux-organismes, comment élaborer une directive en vue de déterminer si les métaux sont responsables des effets confirmés dans les milieux récepteurs des effluents des mines? Pour les métaux non essentiels, une approche hiérarchique pourrait comprendre les étapes suivantes :
- Déterminer les organismes bioindicateurs appropriés qui vivent dans le milieu récepteur et dans le milieu de contrôle ou de référence. Les critères pour la sélection des organismes
- Pour chaque espèce de bioindicateur, choisir l'organe cible approprié, p. ex. les branchies ou le foie (pour certaines petites espèces, il se peut qu'il soit impossible d'analyser les métaux à l'échelle de l'organe, auquel cas les concentrations dans l'ensemble de l'organisme peuvent être utilisées).
- Comparer les concentrations de métaux bioaccumulés dans les spécimens prélevés dans le milieu récepteur et le milieu de référence. L'observation de concentrations de métaux considérablement plus élevées chez les spécimens exposés représente une preuve suffisante à première vue qu'au moins un de ces métaux est responsable des effets observés dans le milieu récepteur. Il faut noter qu'en se fiant à la bioaccumulation des métaux (plutôt qu'à la détermination des concentrations de métaux et à la spéciation des métaux dans le milieu récepteur), cela pourrait permettre d'éviter de devoir estimer la biodisponibilité des métaux observés dans le plan d'eau recevant l'effluent minier.
- Pour améliorer l'interprétation des concentrations de métaux bioaccumulés, déterminer le partage cellulaire des métaux chez les organismes cibles (Campbell et Hare, 2009). Cependant, cette distinction entre les métaux détoxiqués du point de vue biologique et les métaux ayant « débordé » sur des sites sensibles aux métaux serait uniquement justifiée pour les espèces de bioindicateurs qui démontrent une réponse-seuil claire à une exposition accrue aux métaux - voir l'analyse dans Campbell et al. (2008) et Campbell et Hare (2009).
Dans le milieu récepteur, les métaux sont souvent observés sous forme de mélanges de métaux. Pour départager l'importance relative des différents métaux, la comparaison de la transcription génétique chez des organismes exposés et des organismes de référence semble prometteuse en tant qu'outil discriminateur de biosurveillance pour détecter et différencier les contaminants métalliques (Pierron et al., 2009; Walker et al., 2008).
Références
Campbell, P.G.C. 1995. « Interactions between trace metals and organisms: A critique of the free-ion activity model », dans A. Tessier et D. Turner (éd.), Metal Speciation and Bioavailability in Aquatic Systems. Chichester (UK), J. Wiley & Sons. Pp. 45-102.
Campbell, P.G.C., et L. Hare. 2009. « Metal detoxification in freshwater animals. Roles of metallothioneins », dans A. Sigel, H. Sigel et R.K.O. Sigel (éd.), Metallothioneins and Related Chelators. Cambridge (UK), Royal Society of Chemistry. Pp. 239-277.
Campbell, P.G.C., L.D. Kraemer, A. Giguère, L. Hare et A. Hontela. 2008. « Subcellular distribution of cadmium and nickel in chronically exposed wild fish: Inferences regarding metal detoxification strategies and implications for setting water quality guidelines for dissolved metals », Human Ecol. Risk Assess., 14 : 290-316.
Luoma, S.N., et P.S. Rainbow. 2008. Metal Contamination in Aquatic Environments: Science and Lateral Management. Cambridge (UK), Cambridge University Press.
Phillips, D.J.H., et P.S. Rainbow. 1993. Biomonitoring of Trace Aquatic Contaminants. London (UK), Elsevier Applied Science Publishers.
Pierron, F., V. Bourret, J. St-Cyr, P.G.C. Campbell, L. Bernatchez et P. Couture. 2009. « Transcriptional responses to environmental metal exposure in wild yellow perch (Perca flavescens) collected in lakes with differing environmental metal concentrations (Cd, Cu, Ni) », Ecotoxicol., 18 : 620-631.
Vijver, M.G., C.A.M. Van Gestel, R.P. Lanno, N.M. Van Straalen et W.J.G.M. Peijnenburg. 2004. « Internal metal sequestration and its ecotoxicological relevance: A review », Environ. Sci. Technol., 38 : 4705-4712.
Walker, P.A., P. Kille, A. Hurley, N.R. Bury et C. Hogstrand. 2008. « An in vitro method to assess toxicity of waterborne metals to fish », Toxicol. Appl. Pharmacol., 230 : 67-77.
Questions/Discussion
Q : Comment les déversements sont-ils estimés?
R : Dans ce cas, la centrifugation différentielle a été utilisée, mais d'autres méthodes sont aussi possibles.
Q : Peut-on comparer les résultats d'études sur l'acclimatation menées chez des crabes et des poissons?
R : La présente étude sur les poissons utilise l'exposition chronique, donc les résultats ne peuvent pas être comparés à ceux obtenus lors des études précédentes menées sur des crabes.
Q : Pourquoi les valeurs de toxicité sont-elles différentes des valeurs de référence pour les tissus?
R : Les données peuvent refléter la fraction de métal qui n'est pas biodisponible. L'information la plus pertinente porte sur l'identité des métaux qui sont absorbés par l'organisme, et pas nécessairement sur l'identité des métaux en suspension dans l'eau autour du poisson (qui ne sont pas absorbés par l'organisme).
V.P. Palace
Pêches et Océans Canada, Institut des eaux douces, Winnipeg (Manitoba) R3T 2N6
Introduction
Au Canada, plusieurs types d'activités minières mobilisent le sélénium (Se) en perturbant les sols. On trouve habituellement du sélénium dans les dépôts sulfurés de Cu, Pb, Hg, Ag, U et Zn, et les charges des bassins versants environnants peuvent augmenter durant l'extraction et la fusion de ces minerais (U.S. EPA, 2004; Wang et al., 1993). Le sélénium est habituellement présent dans les eaux non contaminées à une concentration de 0,1 à 1 µg/L, mais des concentrations mesurées dans l'eau en aval de sites d'exploitation ont atteint des dizaines, voire des centaines, de microgrammes par litre, et les concentrations mesurées dans les tissus des poissons résidants étaient également élevées (Palace et al., 2003, 2007).
Le sélénium est un nutriant essentiel, et il fait partie de plus de 30 familles de sélénoprotéines (Stewart et al., 2010). À des teneurs légèrement élevées, le sélénium peut s'accumuler dans les tissus de vertébrés ovipares, incluant les poissons, et induire une toxicité pour la reproduction en raison du dépôt de l'élément dans les oeufs. Au cours du développement, et juste après la fin de l'absorption du vitellus, les oeufs/embryons ayant des concentrations élevées de sélénium présentent des troubles de croissance (difformités), incluant des courbures rachidiennes, des oedèmes et des malformations craniofaciales (Holm et al., 2005). Les poissons adultes ne sont normalement pas touchés par une exposition au sélénium d'origines hydrique et alimentaire, et ce, même à une concentration élevée. L'aspect le plus remarquable de la toxicité du sélénium est l'intervalle restreint entre les concentrations requises dans l'alimentation (0,1 à 0,5 mg/kg pour les poissons) et les concentrations auxquelles des difformités commencent à apparaître chez la descendance (> 1-2 mg/kg) (Lemly, 1993).
Il est difficile d'examiner la toxicité potentielle du sélénium à l'aide de méthodes d'ESEE classiques. La géochimie de cet élément est complexe. De plus, les espèces de poissons les plus sensibles, et les plus souvent sélectionnées pour le suivi, sont très mobiles. Par conséquent, il y a des préoccupations voulant que les ESEE typiques puissent ne pas détecter adéquatement les cas de toxicité pour la reproduction en raison d'une exposition au sélénium au sein des populations de poissons résidants. Voici un bref aperçu de certaines préoccupations, ainsi que des recommandations pour l'examen des cas potentiels de toxicité pour la reproduction découlant d'une exposition au sélénium.
Préoccupations quant à la capacité des ESEE de détecter une toxicité au sélénium
a) La concentration hydrique de sélénium n'est pas un indicateur fiable de toxicité
Dans de nombreux cas, une toxicité potentielle découlant d'une exposition à un contaminant inorganique peut être efficacement dépistée à partir des concentrations de l'effluent ou des eaux réceptrices. En mai 2006, le comité scientifique des ESEE a entrepris un dépistage des rejets de sélénium en provenance des mines de métaux en recommandant une analyse pour cet élément dans le cadre de la caractérisation de l'effluent. Cependant, puisque les effets indésirables sont principalement liés à l'exposition d'origine alimentaire, la modélisation basée sur les expositions d'origine hydrique a une valeur limitée. En fait, la biogéochimie du sélénium et son incorporation dans les organismes des systèmes aquatiques sont extrêmement complexes. Pour décrire la relation entre le sélénium d'origine hydrique et les concentrations résultantes chez les poissons, il est important de calculer de façon empirique les facteurs d'enrichissement des algues présentes sur le site ainsi que la relation de transfert trophique pour chaque niveau dans un réseau trophique donné (Stewart et al., 2010). Par conséquent, les critères basés sur les tissus sont généralement acceptés comme étant les indicateurs les plus fiables de toxicité potentielle au sélénium chez les poissons (Lemly, 1993; Hamilton, 2002; U.S. EPA, 2004). Les recommandations pour l'organisme entier se situent entre 4 et 7,9 mg/kg (poids sec) (selon la revue de Chapman, 2007).
b) Différences entre les espèces sur le plan du partage et de la toxicité du sélénium
Les critères portant sur la concentration de sélénium dans les tissus (muscles ou organisme entier) sont préférables aux mesures de l'exposition hydrique pour l'évaluation du potentiel de toxicité du sélénium, mais il faut tenir compte des différences entre les espèces en matière de partage et de toxicité du sélénium. Par exemple, la mobilisation du sélénium des muscles vers les oeufs durant la synthèse du jaune varie d'une espèce à l'autre. Même parmi les espèces qui vivent dans des habitats naturels (p. ex., Truite arc-en-ciel et Omble de fontaine), la pente de la relation entre les concentrations de sélénium dans les muscles et la quantité de sélénium déposé dans les oeufs peut être assez différente (NAMC, 2008). Souvent, les muscles peuvent être utilisés comme substitut aux concentrations dans les oeufs/ovaires, car on signale fréquemment de fortes corrélations entre ces tissus. Cependant, les relations varient en fonction du moment où les échantillons ont été prélevés durant le cycle de reproduction, et pour de nombreuses espèces, cette information fondamentale n'est actuellement pas connue (NAMC, 2008). En raison de ces préoccupations, l'indicateur le plus fiable de toxicité potentielle au sélénium est la mesure de la concentration dans les oeufs ou les ovaires (Holm et al., 2005). Cependant, les seuils pour les difformités induites par le sélénium varient grandement entre les espèces de poissons, ce qui entraîne la nécessité de mesurer les courbes de toxicité propres aux espèces pour calculer des mesures exactes du risque (NAMC, 2008).
c) Mobilité des poissons
Chez les espèces de poissons très mobiles, une analyse de la toxicité potentielle pour la reproduction découlant d'une exposition au sélénium au sein d'un milieu aquatique donné peut donner lieu à de la confusion. De fait, l'incertitude liée au séjour dans l'aire étudiée et le degré de l'exposition à un effluent donné sont habituellement les principales préoccupations associées aux ESEE. Les principaux critères biologiques (taille corporelle, taille et structure de la population, taille des gonades et du foie) sont utilisés en tant qu'indicateurs de la santé globale d'un organisme chez les poissons sauvages capturés dans des zones recevant un effluent et dans des zones de référence. L'interprétation des données provenant de ce programme d'évaluation national est limitée par l'incertitude quant à l'exposition aux effluents, particulièrement dans les zones où les poissons peuvent se déplacer entre des zones exposées au sélénium et des zones de référence. Par exemple, nous avons observé simultanément un taux élevé de malformations larvaires dans un milieu présentant une population fonctionnelle de Truites arc-en-ciel adultes (Holm et al., 2005). Plus tard, nous avons démontré que des adultes actifs sur le plan de la reproduction avaient immigré en provenance d'autres zones non exposées au sélénium (Palace et al., 2007). Un transfert d'une structure communautaire composée principalement de Truites arc-en-ciel vers une structure communautaire composée d'Ombles de fontaine moins sensibles a seulement pu être montré après plusieurs décennies de suivi de la population (Rassmussen et al., 2008). La structure des ESEE pour le suivi biologique vise à détecter de telles perturbations en évaluant les proportions de jeunes de l'année, l'abondance des espèces et le recrutement (Environnement Canada, 2010). Cependant, le temps nécessaire pour réaliser une telle évaluation serait considérable si l'on suppose des cycles typiques d'ESEE de deux à trois ans. Pour les poissons associés à de courtes fenêtres temporelles de maturité sexuelle (les Truites arc-en-ciel vivant dans les eaux froides sont actives sur le plan de la reproduction pendant une période de deux à cinq ans [Nelson et Paetz, 1992]), dans les milieux associés à une faible reproductivité et au sein des populations comptant peu d'individus, ce délai nécessaire pourrait entraîner une chute de la population sous la limite de la capacité de peuplement durable avant que des mesures correctives soient prises.
Conclusion et recommandation
L'évaluation du potentiel du sélénium à induire une toxicité chez les poissons sauvages nécessite une analyse basée sur les tissus, en fonction de chaque espèce. Les oeufs et les ovaires sont les tissus à privilégier pour l'évaluation du risque, et en l'absence d'un seuil établi pour une espèce précise, une analyse de la concentration de sélénium dans l'un de ces tissus devrait être combinée à une analyse des malformations dans les embryons tout juste après l'absorption du vitellus.
Références
Chapman, P.M. 2007. « Selenium thresholds for fish from cold freshwaters », Human Ecol. Risk. Assess., 13 : 20-24.
Hamilton, S.J. 2002. « Rationale for a tissue based selenium criterion for aquatic life », Aquat. Toxicity, 57 : 85-100.
Holm, J., V.P. Palace, P. Siwik, G. Sterling, R.E. Evans, C.L. Baron, J. Werner et K. Wautier. 2005. « Developmental effects of bioaccumualted selenium in eggs and larvae of two salmonid species », Environ. Toxicol. Chem., 24 : 2373-2381.
Lemly, A.D. 1993. « Metabolic stress during winter increases the toxicity of selenium to fish », Aquat. Toxicol., 27 : 133-158.
NAMC - North America Metals Council. 2008. Selenium Tissue Thresholds: Tissue Selection Criteria, Threshold Development Endpoints, and Potential to Predict Population or Community Effects in the Field. 178 pages.
Nelson, J.S., et M.J. Paetz. 1992. Fishes of Alberta. Edmonton (Alb.), University of Alberta Press. 437 pages.
Palace, V.P., C.L. Baron, R.E. Evans, K. Wautier et J.F. Klaverkamp. 2003. « Metals, metalloids and metallothionein in tissues of fish from a canadian freshwater system receiving gold mining effluents and in fish from nearby reference areas », J. Physique IV, 107 : 1005-1008.
Palace, V.P., N.M. Halden, P. Yang, R.E. Evans et G. Sterling. 2007. « Determining residence patterns of rainbow trout using laser ablation inductively coupled plasma mass spectrometry (LA-ICP-MS) analysis of selenium in otoliths », Environ. Sci. Tech., 41 : 3679-3683.
Rassmussen, J.B., S. Peterson, S. Lele et J. Rosenfeld (éd.). 2008. Experts Workshop on Selenium Fish Science in the Athabasca River, Alberta. Workshop summary report. 55 pages.
Stewart, R., M. Grossell, D. Buchwalter, N. Fisher, S. Luoma, T. Mathews, P. Orr et W.-W. Wang. 2010. « Bioaccumulation and trophic transfer of selenium », dans P.M. Chapman, W.J. Adams, M.L. Brooks, C.G. Delos, S.N. Luoma, W.A. Maher, H.M. Ohlendorf, T.S. Presser et D.P. Shaw (éd.), Ecological Assessment of Selenium in the Aquatic Environment. Pensacola (FL), SETAC Press. Pp. 93-140.
U.S. EPA - United States Environmental Protection Agency. 2004. Draft Aquatic Life Water Quality Criteria for Selenium -- 2004. Washington, D.C. (É.-U.), Office of Water. EPA-822-D-04-001.
Wang, D., G. Alfthan et A. Aro. 1993. « Anthropogenic emissions of Se in Finland », Appl. Geochem., (Suppl. 2) : 87-93.
Questions/Discussion
Q : Selon les ESEE, des différences ont-elles été observées sur le terrain sur le plan de la croissance?
R : Oui, des différences ont été observées, mais les données devront être évaluées avec les régions pour déterminer s'il y a un effet généralisé.
Q : Les effets observés sur les oeufs étaient-ils reliés à la concentration de sélénium ou à des différences entre les espèces?
R : L'intervalle de variation entre les espèces est très faible. Donc, en général, la majorité de la variation notée dans les oeufs peut être attribuée à la concentration de sélénium. De plus, la sensibilité des espèces n'est pas pertinente, parce que la concentration de sélénium présente sur le terrain est très élevée.
Q : Comment les déviations rachidiennes surviennent-elles en raison du stress oxydatif?
R : Nous ne connaissons actuellement pas la réponse à cette question.
G.J. Zagury
Département des génies civil, géologique et des mines, École Polytechnique de Montréal
B.P. 6079, succ. Centre-Ville, Montréal (Qc), Canada H3C 3A7
Introduction
L'industrie des mines d'or est parmi les plus grands consommateurs de cyanures parce qu'ils ont une affinité très forte avec l'or. Après que le métal précieux a été extrait du minerai, les cyanures sont rejetés sous forme d'effluents ou de résidus solides contaminés. Les cyanures sont très toxiques, et leur toxicité est liée à leur spéciation. La forme de cyanures libres (HCN, CN-)est classée comme étant le contaminant le plus toxique, parce qu'elle est associée à un fort potentiel d'inhibition du métabolisme, alors que les cyanures complexés par les métaux (p. ex., Fe(CN)63-, Fe(CN)64-) sont considérés comme étant moins toxiques (Shifrin et al., 1996).
L'objectif de cette étude de cas était d'analyser la disponibilité et le devenir de cyanures dans des résidus miniers vieillis (six à neuf ans) et frais (trois mois), échantillonnés à des profondeurs de 0,2 et 1,0 m à deux sites d'extraction d'or dans le nord du Québec (Canada).
Matériel et méthodes
Premièrement, une caractérisation physicochimique détaillée des résidus a été effectuée (tableau 1), et des études de lixiviation ont été menées afin d'évaluer la fraction soluble des cyanures et leurs réactivités potentielles. La biodégradation des cyanures a également été étudiée. Les échantillons solides ont été caractérisés pour les cyanures totaux (CNT) et les cyanures dissociables par des acides faibles (CNDAF, Standard Methods). La fraction aqueuse de l'échantillon a été analysée pour déterminer les CNT, les CNDAF, le cyanate (CNO-) et le thiocyanate (SCN-) (tableau 2). Pour évaluer les populations bactériennes, le dénombrement de l'ensemble des bactéries hétérotrophes et résistantes aux cyanures a été réalisé dans les résidus vieillis [AO (0,2), AO (1), BO (0,2), BO (1)] et les résidus frais [BF (0,2), BF (1)]. Le dénombrement de l'ensemble des bactéries hétérotrophes et résistantes aux cyanures (six lectures) a été réalisé par la méthode du dénombrement sur plaques préparées par étalement (Zagury et al., 2004).
Résultats
La caractérisation physicochimique a montré que les concentrations de CNT étaient plus élevées et que le pH était plus alcalin dans les résidus frais comparativement aux résidus vieillis. De plus, des concentrations élevées de CNT, de CNDAF, de CNO- et de SCN- ont été mesurées dans la phase aqueuse des résidus frais plus réactifs, mais ces espèces ne sont pas détectables dans les résidus vieillis. En conséquence, des solubilisations de 70 % et 23 % de la teneur en cyanure total pour CNT et CNDAF, respectivement, ont été obtenues lors des tests de lixiviation sur les échantillons frais (Zagury et al., 2004). D'autre part, lorsque les essais de lixiviation ont été réalisés sur les résidus vieillis, CNT et CNDAF n'étaient pas décelables dans la phase aqueuse, ce qui suggère que CNSAD (complexes métal-cyanure forts) est la forme dominante dans les résidus vieillis (tableau 3). Le dénombrement de l'ensemble des bactéries hétérotrophes et résistantes aux cyanures dans les résidus vieillis a montré une population moyenne de 105 CFU/g, mais aucune croissance n'a été observée dans les résidus frais. Toutefois, les tests de minéralisation de cyanures ont indiqué la présence, dans les résidus frais et vieillis, d'une microflore dégradant le cyanure libre (Oudjehani et al., 2002).
Conclusion
Les résultats de cette étude ont révélé une différence quant aux propriétés physicochimiques (pH, capacité d'échange cationique et capacité tampon), aux concentrations et à la spéciation des cyanures, aux populations bactériennes viables et au comportement du cyanure en termes de lixiviation, et ce, entre des résidus solides frais et vieillis prélevés à deux sites d'extraction d'or. Les résultats indiquent que les espèces de cyanures les plus réactives initialement associées aux résidus solides se sont dégradées dans l'aire du bassin de résidus miniers. On croit que la diminution de la valeur de CNT au fil du temps (moyenne de 19,5 ± 2,0 mg/kg dans les résidus frais comparativement à 3,2 ± 0,7 mg/kg dans les résidus vieillis) découle principalement de la volatilisation (baisse du pH), de la lixiviation et de la dégradation bactérienne. Les résultats de cette étude ont aussi souligné le rôle de l'activité microbienne dans le devenir des cyanures contenus dans les résidus miniers. La plus grande proportion des espèces stables de cyanures observées dans les résidus vieillis découlent probablement de la dissociation précoce de complexes, allant de faibles à modérément forts. Il est aussi possible qu'une partie du cyanure libre libéré ait été transformée durant l'altération atmosphérique en formes plus stables, telles que les complexes de ferrocyanure ou de ferricyanure.
Tableau 1 : Propriétés physicochimiques des résidus solides vieillis et frais
Le tableau 1 présente diverses propriétés physicochimiques des résidus solides vieillis et frais. Les principales propriétés sont : les mesures du niveau d'acidité effectuées dans une solution aqueuse, les mesures du niveau d'acidité effectuées avec du CaCl2, les matières volatiles totales (% p/p), la teneur en eau (% p/p) et la capacité d'échange cationique (CEC) (mEq/100 g de poids sec). Les résultats sont présentés sous forme de « moyenne ± écart-type » (n = 3).
| Propriétés | AO (0,2) | AO (1) | BO (0,2) | BO (1) | BF (0,2) | BF (1) |
|---|---|---|---|---|---|---|
| pH (eau) |
7,6 ± 0,1
|
8,3 ± 0,1
|
7,3 ± 0,1
|
7,4 ± 0,1
|
10,5 ± 0,1
|
10,6 ± 0,1
|
| pH (CaCl2) |
7,2 ± 0,1
|
7,5 ± 0,1
|
7,1 ± 0,1
|
7,1 ± 0,1
|
10,1 ± 0,1
|
10,0 ± 0,1
|
| Matières volatiles totales (% p/p) |
2,1 ± 0,3
|
0,8 ± 0,3
|
3,2 ± 0,2
|
3,0 ± 0,2
|
2,4 ± 0,1
|
2,6 ± 0,2
|
| Teneur en eau (% p/p) |
23,1 ± 0,2
|
20,9 ± 1,1
|
26,9 ± 0,1
|
24,3 ± 0,3
|
20,8 ± 1,1
|
21,7 ± 0,2
|
| CEC (mEq/100 g de poids sec) |
34,9 ± 9,9
|
54,0 ± 5,8
|
35,4 ± 6,1
|
24,3 ± 1,8
|
2,9 ± 0,3
|
2,3 ± 0,6
|
Tableau 2: Concentrations des espèces de cyanures dans des résidus de mines d'or vieillis et frais
Le tableau 2 présente les concentrations des espèces cyanures dans des résidus de mines d'or vieillis et frais. Les échantillons de la phase solide ont été caractérisés pour les cyanures totaux (CNT) et les cyanures dissociables par des acides faibles (CNDAF) selon les méthodes du Standard Methods, alors que la portion liquide des échantillons (surnageant) a été analysée pour les CNT, les CNDAF, les cyanates (CNO-) et les thiocyanates (SCN-). Les résultats sont présentés sous forme de « moyenne ± écart-type » (n = 3).
| Phase solide | AO (0,2) (mg/kg) | AO (1) (mg/kg) | BO (0,2) (mg/kg) | BO (1) (mg/kg) | BF (0,2) (mg/kg) | BF (1) (mg/kg) |
|---|---|---|---|---|---|---|
| CNT CNDAF |
4,8 ± 0,5
< 0,5 |
2,4 ± 0,3
< 0,5 |
2,4 ± 0,3
< 0,5 |
3,4 ± 0,3
< 0,5 |
17,0 ± 1,7
3,1 ± 0,6 |
22,0 ± 1.0
2,8 ± 0,5 |
| Surnage |
AO (0,2)
(mg/L) |
AO (1)
(mg/L) |
BO (0,2)
(mg/L) |
BO (1)
(mg/L) |
BF (0,2)
(mg/L) |
BF (1)
(mg/L) |
| CNO- |
< 0,5
|
< 0,5
|
-
|
-
|
93
|
98
|
| SCN- |
< 0,5
|
41
|
-
|
-
|
300
|
270
|
| CNT |
< 0,01
|
0,94
|
-
|
-
|
110
|
130
|
| CNDAF |
< 0,01
|
< 0,01
|
-
|
-
|
23
|
110
|
[a] Les résultats sont présentés sous forme de « moyenne ± écart-type » (n = 3).
Tableau 3 : Comparaison entre la teneur en cyanure total des résidus solides, mesurée par la méthode standard 4500-CN C, et la teneur en cyanure toal libéré dans le NaOH
Le tableau 3 fournit une comparaison entre la teneur en cyanure total des résidus solides, mesurée par la méthode standard 4500-CN- C, et la teneur en cyanure total libéré dans le NaOH. Les échantillons analysés comportaient des résidus vieillis et des résidus frais. Des complexes cyanurés ont également été déterminés par catégorie : complexes faibles à modérés, et complexes très forts.
| Échantillons | CNT 4500-CN- C (mg/kg) |
CNT (NaOH, 10 % p/v) (mg/kg) |
Complexes cyanurés, faibles à modérés (a) (%) | Complexes cyanurés (b) (%) |
|---|---|---|---|---|
| AO (0,2) |
4,8
|
31,2
|
15,4
|
84,6
|
| AO (1) |
2,4
|
8,6
|
27,9
|
72,1
|
| BO (0,2) |
2,4
|
13,7
|
17,5
|
82,5
|
| BO (1) |
3,4
|
10,4
|
32,7
|
67,3
|
| BF (0,2) |
17
|
37,7
|
45,1
|
54,9
|
| BF (1) |
22
|
41,6
|
52,9
|
47,1
|
[a] Calculé comme suit : (CNT 4500-CN- C/CNT NaOH) × 100.
[b] Calculé comme suit : 100 - (CNT 4500-CN- C/CNT NaOH) × 100.
Références
Oudjehani, K., G.J. Zagury et L. Deschênes. 2002. « Natural attenuation potential of cyanide via microbial activity in mine tailings », Appl. Microbiol. Biotech., 58 : 409-415.
Shifrin, N.S., B.D. Beck, T.D. Gauthier, S.D. Chapnick et G. Goodman. 1996. « Chemistry, toxicology and human health risk of cyanide compounds in soils at former manufactured gas plant sites », Regul. Toxicol. Pharmacol., 23 : 106-116.
Zagury, G.J., K. Oudjehani et L. Deschênes. 2004. « Characterization and availability of cyanide in solid mine tailings from gold extraction plants », Sci. Total Environ., 320 : 211-224.
Questions/Discussion
Q : Y a-t-il une façon de connaître le rythme de la dégradation des cyanures?
R : Non, parce qu'actuellement, les périodes utilisées pour les études étaient de trois mois et six ans; étant donné cette période de temps, il était impossible de réaliser une interpolation linéaire.
Les réactifs miniers et les sous-produits (par exemple les sulfosels) comme substances toxiques potentielles dans les effluents miniers
B. Vigneault
Commission géologique du Canada, Ressources naturelles Canada
M. Desforges
Laboratoires des mines et des sciences minérales de CANMET, Ressources naturelles Canada
J. McGeer
Université Wilfrid Laurier
Introduction
En plus des substances nocives réglementées, les substances toxiques potentielles dans les effluents miniers comprennent souvent d'autres constituants inorganiques et organiques des effluents miniers. Les constituants non métalliques des effluents comprennent des réactifs de procédés et des produits chimiques de traitement des eaux usées ainsi que leurs sous-produits. Les réactifs de procédés comprennent les moussants et les collecteurs. Les xanthates sont souvent utilisés comme collecteurs durant le traitement des minerais sulfurés par flottation. La flottation de minerais sulfurés entraîne aussi la production de sulfosels, lesquels sont composés de plusieurs anions sulfures : thiosulfate de sulfosel, trithionate, tétrathionate et d'autres polythionates. Le procédé de traitement de l'eau le plus courant pour les mines de métaux est le chaulage, lequel est utilisé pour augmenter le pH et pour faire précipiter les métaux traces; cependant, ce processus génère des concentrations élevées de calcium et de sulfates. Il est aussi possible d'utiliser des réactifs polymériques conçus pour faire précipiter les métaux traces. Enfin, des floculants, comme des floculants polyacrylamides anioniques, peuvent aussi être utilisés dans certains cas pour éliminer les matières solides dans le traitement des eaux minières usées.
Il y a relativement très peu d'études publiées sur la contribution potentielle des constituants non métalliques des effluents miniers à la toxicité de l'effluent. De Rosemond et Liber (2004) ont déterminé qu'un floculant cationique représentait la principale source de toxicité pour l'invertébré Ceriodaphnia dubia dans l'effluent de la mine de diamants d'Ekati. Elphick et al. (2001) ont déterminé qu'un agent de flottation était la source de toxicité pour C. dubia dans l'effluent de la mine d'Eskay Creek. Enfin, Stekoll et al. (2009) ont laissé entendre que les concentrations élevées de calcium dans l'effluent de la mine de Red Dog pouvaient nuire au processus de fécondation chez les salmonidés.
Ainsi, des analyses ont été réalisées pour évaluer la toxicité des agents de flottation et de traitement pour les organismes aquatiques, et ce, à l'aide des espèces pouvant faire l'objet d'essais selon le Règlement sur les effluents des mines de métaux (REMM). Les paramètres de toxicité obtenus ont été comparés aux intervalles de concentrations attendues dans les effluents miniers afin de fournir des données sur le niveau de dépistage dans le contexte de la détermination, de l'évaluation, de la réduction et de la recherche des causes de la toxicité.
Matériel et méthodes
Différentes substances ont été mises à l'essai à l'aide des essais et des méthodes recommandées dans le REMM. Les essais de toxicité aiguë qui ont été réalisés comprennent la détermination de la létalité sur l'invertébré Daphnia magna (48 heures) et le poisson Oncorhynchus mykiss (Truite arc-en-ciel, 96 heures). Les essais de toxicité sublétale qui ont été réalisés comprennent la détermination de l'inhibition de la croissance sur l'algue Pseudokirchneriella subcapitata (anciennement Selenastrum capricornutum, 72 heures), sur la plante Lemna minor (sept jours) et sur une larve de poisson, Pimephales promelas (Méné à grosse tête, sept jours), ainsi que la détermination de l'inhibition de la reproduction pour l'invertébré Ceriodaphnia dubia (sept jours). Les variables de létalité (sept jours) pour C. dubia sont également consignées. Les substances mises à l'essai comprennent deux xanthates (isopropylxanthate de sodium [NAX] et amylxanthate de potassium [KAX]), deux espèces d'anions sulfures (sulfosels) (thiosulfate et tétrathionate), un floculant (Magnafloc 10) et deux substances chimiques utilisées pour faire précipiter les métaux (Nalmet 8702 et chaux).
Résultats et analyse
Réactifs de procédés et sous-produits
Xanthates. Bien que très peu de renseignements existent sur les concentrations résiduelles de xanthates dans les effluents rejetés, les essais de toxicité réalisés et les données publiées semblent indiquer que les xanthates peuvent être considérés comme étant des substances toxiques potentielles. Les deux xanthates ont montré une toxicité pour les trois espèces analysées, c'est-à-dire C. dubia, P. subcapitata et L. minor, à l'intérieur des intervalles de concentrations attendues dans l'effluent rejeté. L'espèce la plus sensible a été l'algue P. subcapitata avec une concentration inhibitrice (CI25) après 72 heures d'environ 0,5 mg/L pour les deux xanthates, tandis que l'espèce la moins sensible était C. dubia avec une CI25 d'environ 3 mg/L pour les deux xanthates (figure 1). Ces résultats d'essais de toxicité sont comparables aux données mentionnées dans la documentation. Xu et al. (1988) ont signalé une concentration inhibitrice pour L. minor inférieure à 10 mg/L pour l'éthylxanthate de sodium, l'isopentylxanthate de sodium et l'isobutylxanthate de sodium. Xu et al. (1988) ont aussi signalé une concentration effective 50 % (CE50) après 48 heures pour Daphnia magna de 0,35 mg/L pour l'éthylxanthate de sodium et de 3,7 ppm pour l'isopropylxanthate de sodium. Il est difficile d'estimer l'exposition potentielle aux xanthates dans le milieu aquatique. Tout d'abord, la demi-vie des xanthates dans un milieu ambiant est d'environ quatre jours (Boening, 1998). Ensuite, il existe peu d'information sur les concentrations attendues de ces composés dans les eaux recevant l'effluent, ou dans l'effluent en tant que tel, mais les concentrations signalées varient de 10 µg/L à 4,0 mg/L. Ces valeurs laissent entendre que la possibilité de toxicité reliée à ces composés ne peut pas être écartée puisque toutes nos CI25 mesurées se situent dans cette plage.
Sulfosels. Le thiosulfate (S2O32-) était généralement plus toxique que le tétrathionate (S4O62-), tel que l'indique sa CI25 inférieure (figure 2). La sensibilité aux sulfosels variait d'aucune réponse pour la Truite arc-en-ciel à une CI25 de 59,4 mg S2O3/L pour C. dubia (figure 2). La toxicité aiguë du thiosulfate pour D. magna était aussi supérieure à celle du tétrathionate (figure 2, CE50 à environ 300 et 750 mg/L, respectivement). En comparaison, des concentrations allant jusqu'à 800 mg/L ont été mises à l'essai, puisque certains signalements font état de concentrations atteignant 700 mg/L dans des effluents miniers. Pour tous les essais réalisés avec le thiosulfate et le tétrathionate, les solutions de sulfosel étaient stables, c'est-à-dire qu'aucune diminution du pH n'a été observée pendant la durée de l'essai. À notre connaissance, aucune donnée n'est disponible dans la documentation sur la toxicité des sulfosels pour ces organismes aquatiques ou pour tout autre organisme aquatique. Le potentiel de toxicité du thiosulfate est tout de même assez faible, car les concentrations inhibitrices seront dans la plupart des cas supérieures aux concentrations attendues dans les effluents. Cependant, la toxicité relativement élevée du thiosulfate pour C. dubia (7 jours, CI25 reprod. = 59 mg/L) représente une préoccupation potentielle. En outre, certaines espèces de sulfosels s'oxydent facilement, et la production d'acide dans une solution à partir de la dégradation de sulfosels a été observée au cours d'essais de toxicité réalisés en laboratoire et in situ. Ce potentiel de diminution du pH dans le milieu en aval représente un mode possible de toxicité indirecte qui n'a pas été examiné dans cette étude.
Produits chimiques de traitement des eaux usées et leurs sous-produits
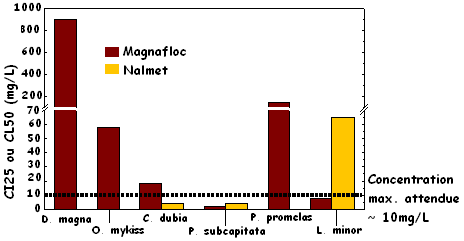
Magnafloc 10. Les paramètres de toxicité sublétale ont montré une sensibilité supérieure à Magnafloc 10 comparativement à la toxicité aiguë, sauf pour l'organisme le moins sensible soumis aux essais de toxicité sublétale, soit P. promelas, avec une CI25 à sept jours de 141 mg/L (croissance, figure 3). Aucune donnée n'est présente dans la documentation scientifique sur la toxicité sublétale de Magnafloc 10 ou la toxicité sublétale de tout floculant polyacrylamide anionique pour P. subcapitata, L. minor ou P. promelas. La concentration létale à 96 heures de Magnafloc 10 pour la Truite arc-en-ciel était de 58 mg/L, ce qui est dans le même ordre de grandeur que la valeur signalée de 18 mg/L (Ciba, 2004). La puce d'eau Daphnia magna s'est révélée être l'organisme le moins sensible parmi les organismes soumis à l'essai, avec seulement 10 % de mortalité observée à la concentration la plus élevée (CL50 à 48 heures, > 903 mg/L). Cette concentration létale 50 % (CL50) est supérieure à celle des autres valeurs de CE50 signalées pour D. magna (212 mg/L, Ciba, 2003; > 50 mg/L, Ciba, 2004). La concentration maximale attendue de floculant dans l'effluent final se situe à environ 4 mg/L, d'après une hypothèse exagérément conservatrice voulant que tous les floculants ajoutés soient déversés dans l'effluent final.
Nalmet. Nous avons réalisé des essais de toxicité sublétale avec Nalmet sur deux espèces, C. dubia et P. subcapitata, qui ont montré des sensibilités similaires (figure 3). La CI25 croissance à 72 heures pour P. subcapitata était de 4,2 mg/L et la CI25 reproduction à sept jours pour C. dubia était de 3,9 mg/L. Les variables de létalité pour C. dubia ont également été consignées. Pour C. dubia, un taux de mortalité de 100 % a été observé aux deux concentrations de Nalmet les plus élevées (100 et 1000 mg/L). La documentation scientifique actuelle ne comporte aucune donnée permettant de comparer ces valeurs de toxicité aux concentrations résiduelles pour les effluents miniers. Les concentrations déversées pourraient varier de moins de 2 mg/L jusqu'à 10-40 mg/L, ce qui est la dose habituelle pour cet usage dans les eaux usées (NICNAS, 1996).
Chaulage. Nous avons évalué les concentrations de calcium (sous forme de CaSO4) chez trois espèces soumises aux essais de toxicité sublétale, c'est-à-dire C. dubia, L. minor et P. subcapitata, à des concentrations s'approchant de celles mesurées dans un effluent chaulé. Les résultats ont montré que C. dubia était l'organisme le moins sensible des trois, avec une CI25 moyenne de 460 mg de Ca/L. L. minor était l'organisme le plus sensible au Ca, avec une CI25 moyenne de 59 et de 106 mg de Ca/L (nombre de frondes et poids sec, respectivement). P. subcapitata présentait une sensibilité intermédiaire avec une CI25 de 492 mg de Ca/L. Nos résultats de toxicité se situent dans le même intervalle que les autres résultats obtenus pour la CL50 de Ca signalés par Goodfellow et al. (2000), où les valeurs de toxicité aiguë calculées étaient les suivantes : Daphnia pulex, CE50 à 48 heures de 499 mg/L; P. promelas, CL50 à 96 heures de 266 mg/L.
Conclusion
Mis ensemble, les renseignements existants suggèrent que les constituants non métalliques des effluents devraient être considérés comme causes potentielles des effets précédents. Cet aspect pourrait s'avérer particulièrement important, puisque la plupart de ces constituants ne sont pas traités ou sont présentement générés par le processus de traitement conventionnel des effluents miniers. Enfin, la recherche des causes pour les effluents de mines de métaux ne doit pas se limiter aux substances dangereuses indiquées dans le REMM, ni aux paramètres de surveillance des ESEE.
Remerciements
Nous aimerions souligner la contribution de Jennifer Beyak (anciennement CANMET-LMSM), d'Isabelle Gosselin (anciennement CANMET-LMSM) et de Morgan King pour les analyses de toxicité. Nous désirons aussi remercier Carrie Rickwood pour la révision de la version préliminaire du présent résumé long. Enfin, nous voulons aussi souligner le soutien offert par Thiosalts Consortium, Xstrata Nickel Canada et Iron Ore Company of Canada.
Figure 1 : Toxicité sublétale de l'isopropylxanthate de sodium (NAX) et de l'amylxanthate de potassium (KAX) pour Ceriodaphnia dubia (reproduction), Pseudokirchneriella subcapitata (croissance) et Lemna minor (nombre de frondes)
La figure 1 est un diagramme à barres illustrant la toxicité sublétale de l'isopropylxanthate de sodium (NAX) et de l'amylxanthate de potassium (KAX) pour Ceriodaphnia dubia (reproduction), Pseudokirchneriella subcapitata (croissance) et Lemna minor (nombre de frondes). Les barres jaunes représentent l'isopropylxanthate de sodium (NAX), tandis que les barres de couleur bordeaux représentent l'amylxanthate de potassium (KAX). La concentration maximale attendue est fixée à 400 g/L.
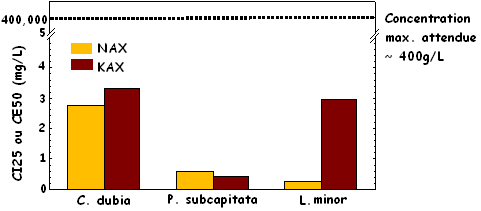
Figure 2 : Toxicité aiguë du thiosulfate et du tétrathionate pour Daphnia magna (létalité) et Oncorhynchus mykiss (létalité pour la Truite arc-en-ciel) et toxicité sublétale pour Ceriodaphnia dubia (reproduction), Pseudokirchneriella subcapitata (croissance), Pimephales promelas (Méné à grosse tête, croissance) et Lemna minor (nombre de frondes et poids sec)
La figure 2 est un diagramme à barres illustrant la toxicité aiguë du thiosulfate et du tétrathionate pour Daphnia magna (létalité) et Oncorhynchus mykiss (létalité pour la truite arc-en-ciel) et la toxicité sublétale pour Ceriodaphnia dubia (reproduction), Pseudokirchneriella subcapitata (croissance), Pimephales promelas (méné à grosse tête, croissance) et Lemna minor (nombre de frondes et poids sec). Les barres de couleur bordeaux représentent le thiosulfate, tandis que les barres jaunes représentent le tétrathionate.
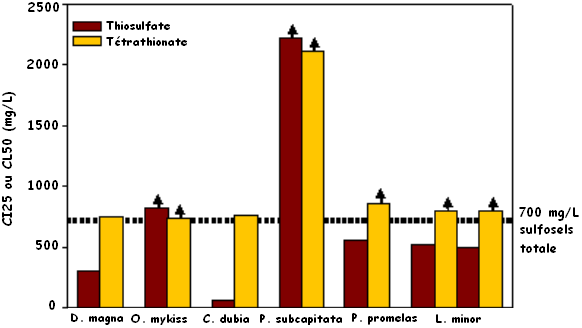
Figure 3 : Toxicité aiguë de Magnafloc 10 et de Nalmet pour Daphnia magna (létalité) et Oncorhynchus mykiss (létalité pour la Truite arc-en-ciel) et toxicité sublétale pour Ceriodaphnia dubia (reproduction), Pseudokirchneriella subcapitata (croissance), Pimephales promelas (Méné à grosse tête, croissance) et Lemna minor (nombre de frondes)
La figure 3 est un diagramme à barres illustrant la toxicité aiguë du Magnafloc 10 et du Nalmet pour Daphnia magna (létalité) et Oncorhynchus mykiss (létalité pour la truite arc-en-ciel) et la toxicité sublétale pour Ceriodaphnia dubia (reproduction), Pseudokirchneriella subcapitata (croissance), Pimephales promelas (méné à grosse tête, croissance) et Lemna minor (nombre de frondes). Les barres de couleur bordeaux représentent le floculant Magnafloc, tandis que les barres jaunes représentent la substance Nalmet.
Références
Boening, D.W. 1998. « Aquatic toxicity and environmental fate of xanthates », Min. Eng., 50 : 65 68.
Ciba. 2003. Fiche signalétique - Magnafloc 10. Ciba Spécialités Chimiques Canada Inc.
Ciba. 2004. Fiche signalétique - Magnafloc 10. Ciba Spécialités Chimiques Canada Inc.
De Rosemond, S.J.C., et K. Liber. 2004. « Wastewater treatment polymers identified as the toxic component of a diamond mine effluent », Environ. Toxicol. Chem., 23 : 2234-2242.
Elphick, J.R., H.C. Bailey et P.M. Murphy. 2001. « Toxicity Identification Evaluation of effluent from a mine », dans 25th Annual British Columbia Mine Reclamation Symposium, September 24 - 27, 2001, Campbell River, BC.
Goodfellow, W.L., L.W. Ausley, D.T. Burton et al. 2000. « Major ion toxicity in effluents: A review with permitting recommendations », Environ. Toxicol. Chem., 19 : 175-182.
NICNAS - National Industrial Chemicals Notification and Assessment Scheme. 1996. Polymer in NALMET 8702. Camperdown (NSW, Australia). File No: NA/458.
Stekoll, M.S., W.W. Smoker, B.J. Failor-Rounds et al. 2009. « Response of the early developmental stages of hatchery reared salmonids to major ions in a simulated mine effluent », Aquacult., 298 : 172-181.
Xu, Y., J.P. Lay et F. Korte. 1988. « Fate and effects of xanthates in laboratory freshwater systems », Bull. Environ. Contam. Toxicol., 41 : 683-689.
Questions/Discussion
Q : Y a-t-il des concentrations de non-métaux ayant une incidence sur l'absorption de nutriants chez les poissons?
R : Oui, il est possible que des constituants non métalliques de l'effluent aient une incidence sur l'absorption des nutriants par les poissons. Cependant, l'étude actuelle ne nous a pas permis d'obtenir de données appuyant cette hypothèse. Aucune des données sur la toxicité présentées n'est nécessairement reliée aux données sur les algues et les plantes.
Commentaire : Le calcium est très réactif avec cet essai, mais il peut aussi avoir une incidence sur l'absorption de nutriants chez les poissons.
Commentaire : Les études portant sur les xanthates doivent être publiées afin que les mines connaissent davantage les résultats et les répercussions de cette situation sur l'industrie des mines de métaux.
Détails de la page
- Date de modification :