Évaluation et Rapport de situation du COSEPAC sur l’anzie mousse-noire Anzia colpodes au Canada - 2015

Photo : © Environnement Canada, 2015
Description longue pour la figure de la couverture
Photographie d'une colonie d'anzie mousse-noire (Anzia colpodes), un lichen dont les thalles forment des rosettes gris verdâtre. Les lobes pleins du thalle reposent sur un coussin spongieux épais et dense de filaments noirs (l'hypothalle). Des rhizines robustes, mais épars, poussent du cortex inférieur jusqu'au substrat à travers l'hypothalle spongieux.
- Table des matières
- Sommaire de l’évaluation
- Résumé
- Résumé technique
- Description et importance de l’espèce sauvage
- Répartition
- Habitat
- Biologie
- Taille et tendances de la population
- Menaces et facteurs limitatifs
- Nombre de localités
- Protection, statuts et classements
- Remerciements et experts contactés
- Sources d’information
- Sommaire biographique des rédactrices du rapport
- Collections examinées
- Figure 1. Gros plan du thalle de l’A. colpodes montrant une apothécie et son disque de couleur brune (à droite) ainsi que les pycnides noires à l’extrémité des lobes (à gauche). L’hypothalle noir, semblable à de la mousse, se trouve sous le thalle de couleur gris verdâtre (photo : Troy McMullin)
- Figure 2. Répartition de l’Anzia colpodes aux États-Unis. La mention en Utah est très probablement erronée
- Figure 3. Répartition de l’A. colpodes au Canada. Les occurrences considérées comme existantes à l’heure actuelle, d’après le travail sur le terrain effectué pour le présent rapport, sont indiquées par des points jaunes (elles ont été trouvées après 1995). Les étoiles noires indiquent les occurrences qui ont été découvertes avant 1995 et qui n’ont pas été visitées à nouveau, tandis que les carrés rouges indiquent les occurrences revisitées où le lichen était absent
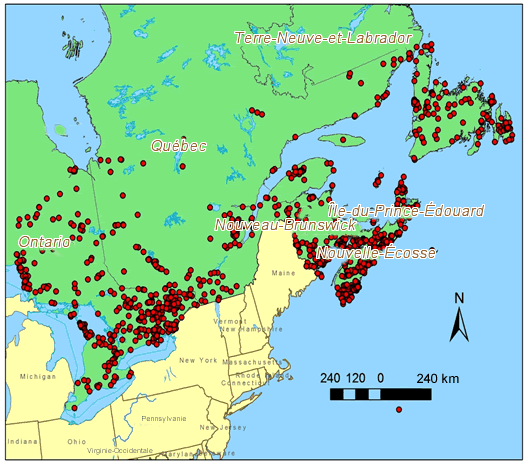
- Figure 4. Activités de recherche et de récolte (cercles rouges) ciblant les Parméliacées, la famille de lichens à laquelle l’Anzia colpodes appartient (voir Classification). Cette famille inclut des genres tels que Parmelia, Hypogymnia et Melanelia, qui poussent sur des arbres feuillus
- Figure 5. Sites où des lichens épiphytes, dont l’Anzia colpodes, ont été cherchés pendant le travail sur le terrain effectué pour le présent rapport et au cours de relevés récents (points noirs)
- Figure 6. Climat idéal modélisé pour l’Anzia colpodes à l’aide des précipitations annuelles et des températures mensuelles maximales moyennes. La carte à gauche est celle des données d’observation sur le climat de 1961 à 1990 et la carte à droite est celle des données sur le climat prévu jusqu’en 2099. Les couleurs jaune, orange et rouge indiquent les zones dont le climat est de plus en plus idéal pour ce lichen. Les zones bleues et bleu foncé sont celles où le climat est moins idéal
- Figure 7. Dommages causés par le broutage sur un thalle d’A. colpodes; notez aussi les pycnides à l’extrémité des lobes, dont le contenu semble avoir été mangé (comparer avec la figure 1) (photo : Frances Anderson)
- Tableau 1. Relevés généraux des lichens au cours desquels des recherches visant l’Anzia colpodes ont été effectuées. Ce tableau n’inclut pas les sites qui ont été visités à nouveau, les nouveaux sites résultant de recherches ciblées (voir le tableau 2) ni les relevés historiques réalisés par Wolfgang Maass (voir le tableau 3)
- Tableau 2. Occurrences d’Anzia colpodes qui ont été visitées à nouveau pendant le travail sur le terrain en 2013 et en 2014 et occurrences qui ont été découvertes depuis 1995 et n’ont pas été revisitées*
- Tableau 3. Mentions d’Anzia colpodes antérieures à 1983 dans des sites qui n’ont pas été visités à nouveau pour le présent rapport. Les mentions pour la Nouvelle-Écosse résultent de récoltes faites par Wolfgang Maass. Ces données ont été compilées après la réalisation des relevés de 2013 décrits ci-dessus (voir le tableau 2). Les données ont été mises au jour à la suite du transfert de l’herbier de W. Maass au Musée du Nouveau-Brunswick, où la collection se trouve actuellement
COSEPAC
Comité sur la situation
des espèces en péril
au Cananda

COSEWIC
Committee on the Status
of Endangered Wildlife
in Canada
Les rapports de situation du COSEPAC sont des documents de travail servant à déterminer le statut des espèces sauvages que l’on croit en péril. On peut citer le présent rapport de la façon suivante :
COSEPAC. 2015. Évaluation et Rapport de situation du COSEPAC sur l’anzie mousse-noire (Anzia colpodes) au Canada. Comité sur la situation des espèces en péril au Canada. Ottawa. x + 51 p. (Registre public des espèces en péril site Web).
Le COSEPAC remercie David Richardson, Frances Anderson, Robert Cameron, Stephen Clayden et Troy McMullen d’avoir rédigé le rapport de situation sur l’anzie mousse-noire (Anzia colpodes)au Canada, aux termes d’un contrat conclu avec Environnement Canada. La supervision et la révision du rapport ont été assurées par René Belland, coprésident du Sous-comité de spécialistes des mousses et lichens du COSEPAC.
Pour obtenir des exemplaires supplémentaires, s’adresser au :
Secrétariat du COSEPAC
a/s Service canadien de la faune
Environnement Canada
Ottawa (Ontario)
K1A 0H3
Tél. : 819-938-4125
Téléc. : 819-938-3984
Courriel : COSEPAC courriel
Site web : COSEPAC
Also available in English under the title COSEWIC Assessment and Status Report on the Black-foam Lichen Anzia colpodes in Canada.
Anzie mousse-noire -- fournie par l’auteur.
L’anzie mousse-noire, Anzia colpodes, est un lichen foliacé qui forme des rosettes gris verdâtre pouvant atteindre 20 cm de diamètre sur le tronc d’arbres feuillus. Les lobes pleins, de 1 à 2 mm de largeur, reposent sur un tissu noir, épais et spongieux composé d’hyphes filamenteux. Les corps fructifères de couleur brun rougeâtre sur la face supérieure renferment des asques qui sont inhabituels en ce qu’ils contiennent un grand nombre de spores minuscules qui constituent le seul moyen de reproduction de ce lichen.
L’anzie mousse-noire est considérée comme endémique à l’Amérique du Nord, bien qu’elle ait été signalée à une occasion dans l’est de la Russie. Aux États-Unis, elle a été recueillie dans les Appalaches, de la Géorgie au Maine, mais aussi sur le plateau des monts Ozark et en Illinois, au Wisconsin et au Michigan. Au Canada, où elle se trouve à la limite nord de son aire de répartition, elle a été observée en Ontario, au Québec, au Nouveau-Brunswick et en Nouvelle-Écosse. Des relevés récents indiquent que l’anzie mousse-noire est maintenant absente des deux premières provinces, et sa présence n’a pas été signalée au Nouveau-Brunswick au cours de la dernière décennie. Ce lichen est répandu mais n’est pas commun en Nouvelle-Écosse.
L’anzie mousse-noire croît sur le tronc de feuillus matures qui poussent sur des terrains plats ou en pente où l’humidité élevée est apportée par les milieux humides, les lacs ou les cours d’eau avoisinants. Son hôte est le plus souvent l’érable rouge, mais elle pousse aussi sur le frêne blanc, l’érable à sucre, le chêne rouge et, très rarement, sur d’autres espèces.
On observe fréquemment sur l’anzie mousse-noire des corps fructifères qui constituent son seul moyen de reproduction. Les spores qu’ils éjectent doivent se poser sur le tronc d’un arbre hôte et y rencontrer une algue verte compatible. Cette algue est alors enveloppée d’hyphes filamenteux, et les deux organismes finissent par constituer un thalle visible. La durée d’une génération est probablement d’environ 17 ans. À la différence de nombreux autres lichens foliacés qui croissent sur des troncs d’arbre, l’anzie mousse-noire ne produit pas de propagules végétatives spécialisées qui constitueraient un moyen de reproduction asexuée.
L’anzie mousse-noire semble avoir toujours été moins commune en Ontario et au Québec, et dans les États adjacents des États-Unis, qu’au Nouveau-Brunswick et en Nouvelle-Écosse. Dans les deux premières provinces, la présence du lichen n’a été signalée que quatre fois; tous les sites ont été visités de nouveau, mais l’anzie mousse-noire n’y a pas été retrouvée. Au Nouveau-Brunswick, on compte douze mentions de l’espèce, qui n’a pu être retrouvée pendant les recherches faites à six de ces sites en 2013.
En Nouvelle-Écosse, l’anzie mousse-noire n’est pas commune, mais elle est répandue. Trente-cinq occurrences ont été répertoriées dans la province depuis 1995. La population a été recensée aux neuf occurrences où elle a été observée pendant le travail sur le terrain effectué pour le présent rapport de situation. D’après ce recensement, la population totale de ce lichen au Canada pourrait s’établir à 3 700 individus, presque tous en Nouvelle-Écosse. De plus, le lichen n’était plus présent à trois des sept occurrences postérieures à 2006 qui ont été visitées à nouveau, ce qui indique un déclin d’environ 40 % au cours des dix dernières années.
En Ontario et au Québec, la principale menace qui pèse sur l’anzie mousse-noire semble être la perturbation de l’habitat. Dans les rares sites où elle a été observée par le passé, l’étalement de la banlieue, les terrains à bâtir, les routes et les sentiers ont remplacé la forêt où elle poussait jadis. Les autres menaces probables dans ces provinces sont la pollution atmosphérique et la modification du régime climatique. La cause de la disparition de l’anzie mousse-noire de ces provinces n’est pas établie avec certitude, mais il est significatif que des déclins aient aussi été constatés dans les États adjacents des États-Unis.
Au Nouveau-Brunswick et en Nouvelle-Écosse, la principale menace est à l’heure actuelle l’abattage des vieilles forêts de feuillus. Le broutage par des mollusques introduits est une autre menace dont l’impact est inconnu. L’anzie mousse-noire a peu de substances secondaires qui dissuaderaient les herbivores de la brouter. On croit que les changements du régime climatique ont accéléré la propagation et augmenté l’impact des mollusques brouteurs, et que ceux-ci peuvent nuire à la capacité de reproduction du lichen. Les minuscules spores de l’anzie mousse-noire renferment peu de ressources permettant au tube germinatif de se développer à la recherche d’un partenaire algal compatible, processus qui doit se reproduire à chaque génération. De plus, ses crampons robustes mais clairsemés, qui permettent aux petits thalles de s’agripper fermement à l’écorce des arbres, relâchent leur prise à mesure que le lichen croît, de sorte que celui-ci est susceptible d’être détaché par le vent, la pluie ou les animaux.
À long terme, les changements climatiques et les modifications du régime climatique devraient, selon les prévisions, réduire les précipitations ou augmenter l’évaporation. Ces facteurs auront vraisemblablement des répercussions sur la survie de l’anzie mousse-noire, puisque cette espèce a besoin d’une combinaison particulière de caractéristiques climatiques et de caractéristiques du peuplement forestier. L’anzie mousse-noire est dans une grande mesure limitée aux arbres qui poussent près de plans d’eau, comme les marécages, le bord des marécages, les lacs et les cours d’eau.
NatureServe a attribué la cote mondiale G3 (vulnérable)/G5 (non en péril) à l’anzie mousse-noire. La cote mondiale arrondie est G4 (apparemment non en péril). Aux États-Unis, la cote nationale de l’espèce est NNR (non classée). Au Michigan, en Caroline du Nord et en Pennsylvanie, elle est cotée SNR (pas encore évaluée), mais au Wisconsin, elle est cotée SX (présumée disparue) et on pense qu’elle est disparue aussi en Ohio. Au Canada, l’anzie mousse-noire est cotée NNR (non classée) par NatureServe. En Ontario, sa cote est SH (peut-être disparue); au Québec, sa cote est SNR (pas encore évaluée).
À l’heure actuelle, l’anzie mousse-noirenebénéficie d’aucune protection ni d’aucun statut juridique au Canada, bien qu’un certain nombre d’occurrences soient protégées en Nouvelle-Écosse parce qu’elles se trouvent dans des zones sauvages protégées par la province ou dans des parcs nationaux.
| Question | Information |
|---|---|
| Durée d’une génération (généralement, âge moyen des parents dans la population; indiquer si une méthode d’estimation de la durée d’une génération autre que celle qui est présentée dans les lignes directrices de l’UICN [2008] est utilisée). Incertaine, mais entre 10 et 30 ans, 17 ans étant la meilleure estimation possible. | 17 ans |
| Y a-t-il un déclin continu [observé, inféré ou prévu] du nombre total d’individus matures? | Oui, observé et prévu |
| Pourcentage estimé de déclin continu du nombre total d’individus matures sur [cinq ans ou deux générations] (52-60 ans). | Inconnu |
| Pourcentage [observé, estimé, inféré ou présumé] [de réduction ou d’augmentation] du nombre total d’individus matures au cours des [dix dernières années ou trois dernières générations] (78-90 ans). Le lichen ne se trouvait plus à deux des cinq occurrences postérieures à 2006 qui ont été visitées à nouveau. | ~ 40 % |
| Pourcentage [prévu ou présumé] [de réduction ou d’augmentation] du nombre total d’individus matures au cours des [dix prochaines années ou trois prochaines générations]. (78-90 ans). L’ampleur exacte est inconnue, mais un déclin continu est inféré sur la base du déclin récent et continu des forêts de feuillus matures, qui constituent un milieu essentiel pour ce lichen. | ~ 30 % |
| Pourcentage [observé, estimé, inféré ou présumé] [de réduction ou d’augmentation] du nombre total d’individus matures au cours de toute période de [dix ans ou trois générations] commençant dans le passé et se terminant dans le futur. | Inconnu |
| Est-ce que les causes du déclin sont clairement réversibles et comprises et ont effectivement cessé? | Non |
| Y a-t-il des fluctuations extrêmes du nombre d’individus matures? | Probablement pas |
| Question | Information |
|---|---|
| Superficie estimée de la zone d’occurrence (La superficie a été calculée à partir des occurrences découvertes depuis 1995 ou d’occurrences plus anciennes qui ont été visitées à nouveau. Elle n’inclut pas les occurrences antérieures à 1983 du tableau 3, parce qu’aucune d’entre elles n’est géoréférencée et qu’on ne sait pas si le lichen s’y trouve encore.) | 30 555 km² |
Indice de zone d’occupation (IZO) L’indice a été calculé à partir des occurrences découvertes depuis 1995 ou d’occurrences plus anciennes qui ont été visitées à nouveau, mais non des occurrences anciennes qui n’ont pas été revisitées (p. ex. les sites visités par W. Maass, au tableau 3), parce qu’aucune de ces occurrences n’est géoréférencée et qu’on ne sait pas si le lichen s’y trouve encore. |
108 km² |
| La population est-elle gravement fragmentée? Elle est largement dispersée et la distance de dispersion de l’espèce est probablement limitée. | Probablement pas |
| Nombre de localités. Le nombre total d’occurrences au Canada est d’une centaine environ, mais le lichen n’est plus présent à certaines d’entre elles. Il est possible que d’autres d’occurrences soient trouvées en Nouvelle-Écosse; le nombre total probable de localités est donc estimé à moins de 100. Chacune des occurrences est considérée comme une localité parce que les menaces sont variées et que les principales, pouvant mener à la disparition de l’espèce, ne sont pas bien connues. | < 100 |
| Y a-t-il un déclin continu observé de la zone d’occurrence? | Oui |
| Y a-t-il un déclin continu [observé, inféré ou prévu] de l’indice de zone d’occupation? | Oui |
| Y a-t-il un déclin continu [observé, inféré ou prévu] du nombre de populations? Déclin observé de 77 % dans les populations qui ont été visitées à nouveau au Canada (le lichen était absent à 17 des 22 occurrences visitées à nouveau). | Oui |
| Y a-t-il un déclin continu [observé, inféré ou prévu] du nombre de localités? | Oui |
| Y a-t-il un déclin continu [observé, inféré ou prévu] de [la superficie, l’étendue ou la qualité] de l’habitat? Déclin prévu inféré en raison des changements climatiques. | Oui |
| Y a-t-il des fluctuations extrêmes du nombre de populations? | Non |
| Y a-t-il des fluctuations extrêmes du nombre de localités? | Non |
| Y a-t-il des fluctuations extrêmes de la zone d’occurrence? | Non |
| Y a-t-il des fluctuations extrêmes de l’indice de zone d’occupation? | Non |
| Population | Nombre d’individus matures |
|---|---|
| Nombre de colonies connues existant en Ontario = 0, au Québec = 0, au Nouveau-Brunswick = 0, en Nouvelle-Écosse = 3 700, si les occurrences récentes et historiques sont incluses dans l’estimation. | Incertain, vraisemblablement < 4 000 |
| Total | < 4 000 |
| Question | Information |
|---|---|
| La probabilité de disparition à l’état sauvage est d’au moins [20 % sur 20 ans ou 5 générations, ou 10 % sur 100 ans]. | Pas effectuée |
| Exploitation forestière, fragmentation de l’habitat et déclin de la qualité de l’habitat, changements du régime climatique et broutage par des gastéropodes introduits. |
| Question | Information |
|---|---|
| Situation des populations de l’extérieur. L’Anzia colpodes semble être disparu du Wisconsin et de l’Ohio et être très rare dans tous les États frontaliers, à l’exception du Maine où cinq occurrences sont connues. | En déclin, et disparues dans deux États |
| Une immigration a-t-elle été constatée ou est-elle possible? | Très improbable |
| Des individus immigrants seraient-ils adaptés pour survivre au Canada? | Peut-être, s’il y avait des arbres hôtes appropriés |
| Y a-t-il suffisamment d’habitat disponible au Canada pour les individus immigrants? | Oui, tout au moins dans les Maritimes |
| La possibilité d’une immigration depuis des populations externes existe-t-elle? | Possible mais peu probable |
| Question | Information |
|---|---|
| L’information concernant l’espèce est-elle de nature délicate? | Non |
Espèce désignée « menacée » en mai 2015.
Le Comité sur la situation des espèces en péril au Canada (COSEPAC) a été créé en 1977, à la suite d’une recommandation faite en 1976 lors de la Conférence fédérale-provinciale sur la faune. Le Comité a été créé pour satisfaire au besoin d’une classification nationale des espèces sauvages en péril qui soit unique et officielle et qui repose sur un fondement scientifique solide. En 1978, le COSEPAC (alors appelé Comité sur le statut des espèces menacées de disparition au Canada) désignait ses premières espèces et produisait sa première liste des espèces en péril au Canada. En vertu de la Loi sur les espèces en péril (LEP) promulguée le 5 juin 2003, le COSEPAC est un comité consultatif qui doit faire en sorte que les espèces continuent d’être évaluées selon un processus scientifique rigoureux et indépendant.
Le Comité sur la situation des espèces en péril au Canada (COSEPAC) évalue la situation, au niveau national, des espèces, des sous-espèces, des variétés ou d’autres unités désignables qui sont considérées comme étant en péril au Canada. Les désignations peuvent être attribuées aux espèces indigènes comprises dans les groupes taxinomiques suivants : mammifères, oiseaux, reptiles, amphibiens, poissons, arthropodes, mollusques, plantes vasculaires, mousses et lichens.
Le COSEPAC est composé de membres de chacun des organismes responsables des espèces sauvages des gouvernements provinciaux et territoriaux, de quatre organismes fédéraux (le Service canadien de la faune, l’Agence Parcs Canada, le ministère des Pêches et des Océans et le Partenariat fédéral d’information sur la biodiversité, lequel est présidé par le Musée canadien de la nature), de trois membres scientifiques non gouvernementaux et des coprésidents des sous-comités de spécialistes des espèces et du sous-comité des connaissances traditionnelles autochtones. Le Comité se réunit au moins une fois par année pour étudier les rapports de situation des espèces candidates.
Remarque : Catégorie « DSIDD » (données insuffisantes pour donner une désignation) jusqu’en 1994, puis « indéterminé » de 1994 à 1999. Définition de la catégorie (DI) révisée en 2006.
Le Service canadien de la faune d’Environnement Canada assure un appui administratif et financier complet au Secrétariat du COSEPAC.
Lichen colpodes Ach. Lichenographiae Sueciae Prodromus : 124, 1798.
Parmelia colpodes (Ach.) Ach. Methodus qua Omnes Detectos Lichenes Secundum Organa Carpomorpha ad Genera, Species et Varietates Redigereatque
Observationibus Illustrare Tentavit Erik Acharius : 251, 1803.
Anzia colpodes (Ach.), Stizenberger, Flora (Regensburg), 45 : 243, 1862
Le genre Anzia fait partie des Parméliacées, une grande famille de lichens foliacés. Des tentatives récentes de comprendre les relations phylogénétiques au sein de cette famille ont révélé que 88 genres sont monophylétiques et qu’il est possible de distinguer six clades bien établis. La position phylogénétique de huit genres, y compris Anzia, n’est toujours pas résolue, bien que des marqueurs ribosomiques et des séquences de l’espaceur transcrit interne (ITS), de la tubuline et d’autres séquences aient été utilisés (Thell et al., 2004; Crespo et al., 2007).
Le genre Anzia est divisé en deux sections. Anzia sect. Anzia est confinée à l’Asie orientale et à l’est de l’Amérique du Nord. Anzia sect. Nervosa est présente dans les tropiques avec des centres en Asie du Sud-Est et en Amérique tropicale; elle se distingue, comme le genre Usnea, par la présence d’un axe (Yoshimura, 1987; Yoshimura et al., 1997). L’Anzia colpodes appartient à la section Anzia et est l’une des trois espèces présentes en Amérique du Nord, les deux autres étant A. americana et A. ornata (Esslinger et Eagan, 1995; Hinds et Hinds, 2007). Selon Jayalal et al. (2013), sur 11 espèces du genre Anzia étudiées, l’espèce la plus étroitement apparentée à l’A. colpodes sur le plan phylogénétique est l’A. opuntiella, qui croît au Japon.
Le nom « anzie mousse-noire » (Fournier, 2006) fait référence au tissu spongieux sous le thalle.
Nom commun anglais : Black-foam Lichen (Brodo et al., 2001)
L’Anzia colpodes est un lichen foliacé. Le thalle forme des rosettes gris verdâtre qui peuvent atteindre 20 cm de diamètre environ (Brodo et al., 2001). Les lobes pleins du thalle ont de 1 à 2 mm de largeur et reposent sur un coussin spongieux épais et dense de filaments noirs appelé hypothalle. Des rhizines robustes, mais épars, poussent du cortex inférieur jusqu’au substrat à travers l’hypothalle spongieux. La forme lobée du thalle et la couleur noire de l’hypothalle le font ressembler quelque peu aux espèces du genre Hypogymnia, dont le thalle est creux. La zone méristématique, à l’extrémité des lobes de l’Anzia colpodes, produit d’abord une petite quantité de cortex inférieur, puis le tissu spongieux (parfois appelé « spongiostratum » en anglais) (Lawrey, 1984; Hensen et Dobelman, 1987; Jahns, 1988).
Les apothécies sont communes sur les thalles de l’A. colpodes.Elles sont formées d’un disque brun dont la marge épaisse enroulée vers l’intérieur s’amincit et devient moins visible à mesure que les apothécies mûrissent. Les asques qu’elles contiennent possèdent un coussin apical et une couche externe (Budel et Scheidegger, 2008). La plupart des lichens produisent huit spores par asque mais, chez ce lichen, les asques renferment plus d’une centaine de spores minuscules dont la taille n’est que d’environ 1 × 3 µm. Des pycnides noires se trouvent aussi fréquemment près de l’extrémité des lobes (figure 1) et renferment des pycnidiospores simples incurvées (voir Cycle vital et reproduction).

Description longue pour la figure 1
Photographie rapprochée du thalle de l’A. colpodes montrant une apothécie et son disque de couleur brune ainsi que les pycnides noires à l’extrémité des lobes. L’hypothalle noir, semblable à de la mousse, se trouve sous le thalle de couleur gris verdâtre
Le photobionte est vert; d’après la littérature, il s’agit du Trebouxia jamesii (Ahmadjian, 1993), mais les méthodes moléculaires ont révélé que toutes les algues attribuées à cette espèce devraient être incluses dans la dénomination Trebouxia simplex; c’est donc le nom le plus récent utilisé dans ce cas (Beck, 2002; Opanowicz et Grube, 2004).
L’Anzia colpodes ne produit pas de propagules végétatives spécialisées, à la différence des deux autres espèces d’Anzia de l’Amérique du Nord.
Le cortex supérieur est K+ jaune dans les essais à la goutte et la médulle est UV+ blanche, en raison respectivement de la présence d’atranorine et d’acide divaricatique. L’acide divaricatique représente 1,4 % en poids sec du thalle (Hale, 1955; Culberson, 1961), bien qu’une analyse plus récente arrive à un chiffre inférieur, soit 0,42 % (Yoshimura et Kurokawa, 1977). Certains spécimens peuvent aussi renfermer des traces d’acide sekikaique qui est dérivé de l’acide divaricatique (Yoshimura, 1987).
On sait peu de choses de la structure de la population d’Anzia colpodes et de sa variabilité, mais sa dispersion est vraisemblablement très limitée et les sites d’occurrence distincts sont considérés comme des sous-populations différentes (voir Dispersion).
L’Anzia colpodes a déjà été présent dans au moins deux, et peut-être trois, aires écologiques nationales (aire boréale, plaines des Grands Lacs et Atlantique) et par-delà une disjonction d’au moins plusieurs centaines de kilomètres (de l’ouest du Québec au centre du Nouveau-Brunswick – voir Répartition). L’anzie mousse-noire en Ontario et au Québec ainsi que dans les Maritimes satisfait vraisemblablement au critère relatif au caractère distinct servant à l’établissement d’unités désignables (UD). Cependant, compte tenu de ce que (i) rien n’indique qu’il existe des différences phénotypiques entre les lichens de ces régions, (ii) qu’aucune étude moléculaire n’a été effectuée sur l’espèce et (iii) que les sous-populations du Québec et de l’Ontario sont historiques, l’anzie mousse-noire est traitée comme une seule UD.
L’Anzia colpodes, à l’exception d’une mention possible dans l’est de la Russie, est considéré comme endémique à l’Amérique du Nord. L’espèce est inhabituelle en ce que son hypothalle est semblable à de la mousse et en ce que les asques renferment de nombreuses spores minuscules plutôt que huit spores, comme chez la plupart des lichens. On l’observe dans le plateau des monts Ozark et dans les Appalaches, mais rarement ailleurs. Au Canada, elle semble maintenant limitée à la Nouvelle-Écosse.
Anzia est un très vieux genre de lichens dont il existe un spécimen fossilisé datant de 40 millions d’années environ (Rikkinen et Poinar, 2002). Trente-quatre espèces du genre Anzia des hémisphères oriental et occidental ont été décrites, pour la plupart dans les régions subtropicales et tropicales (Jayalal et al., 2013). Pendant le Tertiaire, une végétation similaire de plantes vasculaires s’étendait de l’Amérique du Nord à l’Asie et au Japon, en passant par l’Europe qui, à ce moment-là, était jointe à l’Amérique, mais cette végétation et sa flore lichénique ont par la suite subsisté à l’état de populations reliques (Culberson, 1972) que la glaciation a réduites encore davantage (Poelt, 1963). L’évolution de ces populations a mené à des espèces étroitement apparentées dont la chimie ou la morphologie différait, p. ex. l’A. colpodes en Amérique du Nord et l’A. colpota au Japon et en Corée (Culberson, 1972; Park, 1990). L’A. colpodes est considéré comme endémique à l’Amérique du Nord, mais cette espèce a récemment été signalée au col Nogeevskaya, à la limite de la réserve Lazo, dans l’est de la Russie (Leif Tibell, 1991 dans GBIF-Sweden, 2014). Cependant, Tibell (comm. pers., 2014) n’a pu confirmer l’identification parce que le spécimen n’avait pas d’apothécies.L’Anzia ornata est une autre espèce nord-américaine ayant une répartition disjointe en Asie. Compte tenu de ce fait et des fossiles européens trouvés, il semblerait que les espèces de la section Anzia étaient jadis présentes à l’échelle de la Laurasie, mais ont par la suite disparu d’Europe (Yoshimura, 1987; Rikkinen et Poinar, 2002).
L’Anzia colpodes est la plus commune des trois espèces du genre aux États-Unis, les deux autres étant l’A. ornata et l’A. americana. Sa répartition aux États-Unis (figure 2) inclut une mention isolée en Utah, sur le mont Bull, dans les montagnes Henry, qui est probablement erronée et ne peut pas être vérifiée parce que le spécimen et les renseignements sur la localité manquent dans l’herbier de l’Université d’État de l’Arizona (Arizona State University). Selon la littérature, l’A. colpodes est de plus en plus rare. Au Maine, on ne le trouve maintenant que dans cinq forêts anciennes (Hinds et Hinds, 2007). L’espèce est probablement disparue de l’Ohio et est gravement en péril au Michigan et au Wisconsin (Showman et Flenniken, 2004; NatureServe, 2014; Bennett et Will-Wolf, comm. pers., 2014). Selon les données du Consortium of North American Herbaria, la répartition de l’A. colpodes est centrée dans l’est de l’Amérique du Nord et l’espèce est plus commune dans les régions chaudes des États-Unis, comme le Tennessee et l’Arkansas. Dans les monts Ozark, rien n’indique un déclin au cours des deux dernières décennies (Doug Ladd, comm. pers., 2014).
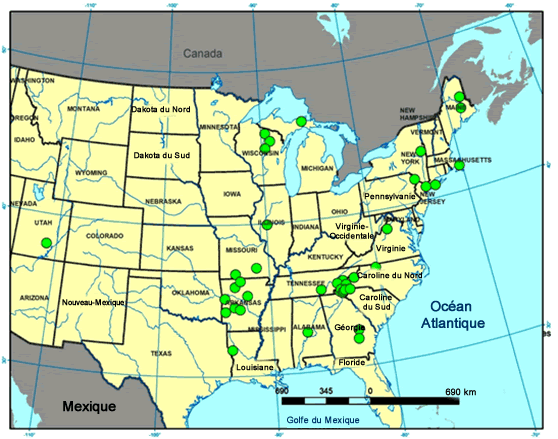
Description longue pour la figure 1
Carte montrant la répartition de l’Anzia colpodes aux États-Unis, centrée sur la partie est du pays. L’espèce est plus commune dans les régions chaudes des États-Unis, comme le Tennessee et l’Arkansas. La mention indiquée en Utah est probablement erronée.
Par le passé, l’Anzia colpodes a été observé dans quatre provinces du Canada : l’Ontario, le Québec, le Nouveau-Brunswick et la Nouvelle-Écosse (figure 3). Les occurrences historiques et actuelles d’A. colpodes au Canada représententà peu près la moitié des occurrences mondiales connues.
Des spécimens d’Anzia colpodes datant du XIXe siècle ont été récoltés par John Macoun et le rév. B. Ducharme à quatre occurrences en Ontario et au Québec (énumérées dans Macoun, 1902). Il s’agissait du mont Rigaud, dans le comté de Vaudreuil, et du mont King, à Chelsea, au Québec, ainsi que de Central Ontario Junction, dans le comté de Hastings, et de Prescott, dans le comté de Grenville, près d’Ottawa (Ontario). Il existe aussi des spécimens d’A. colpodes provenant de l’île Grand Manan, au Nouveau-Brunswick, qui ont été récoltés par Henry Willey en 1879 et qui se trouvent dans l’herbier de l’Université du Minnesota (University of Minnesota).
Depuis les années 1970, des spécimens d’Anzia colpodes ont été récoltés dans le centre et le sud de la partie continentale du Nouveau-Brunswick et dans la plus grande partie de la Nouvelle-Écosse (figure 3). Par le passé, des récoltes ont été faites à la fin du XIXe siècle et au début du XXe siècle. Il y a eu d’autres récoltes importantes dans les années 1980 et très peu de récoltes au début des années 1990. Tom Neily a entrepris des recherches approfondies dans les années 1990. La rupture entre les deux phases de récolte (1980-1995) représente presque une génération d’A. colpodes. Pour cette raison, 1995 constitue un point logique où séparer les occurrences historiques de celles où le lichen est probablement encore présent.
La zone d’occurrence au Canada est d’environ 30 555 km² selon les observations d’A. colpodes effectuées depuis 1995 et les occurrences plus anciennes qui ont été visitées à nouveau. Elle n’inclut pas les occurrences antérieures à 1983 qui n’ont pas été revisitées pour le présent rapport puisqu’elles n’étaient pas géoréférencées et qu’on ne sait pas si le lichen est encore présent à l’heure actuelle à ces sites. La même approche a été utilisée pour le calcul de l’indice de zone d’occupation, qui a été estimé à 108 km² environ.
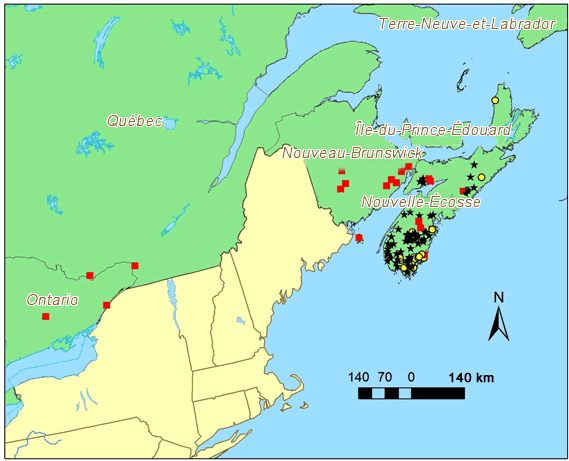
Description longue pour la figure 3
Carte montrant la répartition de l’Anzia colpodes au Canada, où l’espèce a été observée dans quatre provinces par le passé : l’Ontario, le Québec, le Nouveau-Brunswick et la Nouvelle-Écosse. La carte indique l’emplacement des occurrences considérées comme existantes à l’heure actuelle, d’après le travail sur le terrain effectué pour le présent rapport, de même que les occurrences qui ont été découvertes avant 1995 et qui n’ont pas été visitées à nouveau et les occurrences revisitées où le lichen était absent.
La récolte de lichens a lieu depuis longtemps dans l’est du Canada (Goward et al., 1998, p. 6; Clayden, 2010, p. 157) et en Ontario (figure 4). Avant le début du travail sur le terrain réalisé pour le présent rapport, la recherche de lichens n’a pas porté sur l’A. colpodes, bien que l’espèce soit bien connue de ceux qui effectuent les relevés généraux mentionnés dans les références citées au tableau 1.
Description longue pour la figure 4
Carte montrant les localités au Canada qui ont été recherchés pour les lichens dans la famille Parméliacées, la famille à laquelle appartient l’Anzia colpodes.
| Province | Zones fouillées | Chercheur | Date |
|---|---|---|---|
| Ontario | Sites dans un quadrilatère borné par Ottawa, Peterborough, Haliburton et Watertown | McMullin | 2013 |
| Ontario | Parc national de la Péninsule-BruceNote étoile* | Divers | 2008 |
| Ontario | Ottawa et ses environs | Brodo | 1970 à 2014 |
| Ontario | Rive sud de la baie Georgienne, parc provincial Awenda | McMullin | 2013 |
| Ontario | Réserve naturelle, Guelph | McMullin | 2012 |
| Québec | Mont Orford | S. Clayden | 2004 |
| Québec | Mont Gosford | Clayden | 2004 |
| Québec | Cantons de l’Est | F. LeBlanc | 1960, 1963 |
| Québec | Parc de la GaspésieNote étoile* | Divers | 2012, 2013 |
| Québec | Parc du Bic | Barney | 2013 |
| Nouveau-Brunswick | Zone naturelle protégée du Grand Lake | Clayden | 2013 |
| Nouveau-Brunswick | Plaine d’inondation du fleuve Saint-Jean | Clayden | 2013 |
| Nouveau-Brunswick | Parc national Fundy | Clayden, Anderson` | 2013 |
| Nouveau-Brunswick | Parc nat. Fundy | Clayden | 1976 |
| Nouveau-Brunswick | Réservoir de Grand-SaultNote étoile* | Divers | 2011 |
| Nouveau-Brunswick | Ruisseau Love LakeNote étoile* | Divers | 2011 |
| Nouveau-Brunswick | Excursion mycologique du parc nat. Fundy | Divers | 2013 |
| Nouveau-Brunswick | Parc national Kouchibouquac | Clayden, Koffman | 2001 |
| Nouveau-Brunswick | BFC Gagetown | Clayden | 2013 |
| Nouveau-Brunswick | Mont Currie | Clayden | 2013 |
| Nouveau-Brunswick | Keswick Ridge | Clayden | 2013 |
| Nouveau-Brunswick | Près de la rivière Iroquois, Madawaska | Clayden | 2013 |
| Nouveau-Brunswick | Rivière Gounamitz | Clayden | 2013 |
| Nouvelle-Écosse | Extrémité occidentale des montagnes CobequidNote étoile* | Divers | 2004 |
| Nouvelle-Écosse | Parc provincial du cap Chignecto | Barney | 2004, 2005, 2006, 2007, 2008, 2009 |
| Nouvelle-Écosse | Mont Uniacke | Richardson | 2013 |
| Nouvelle-Écosse | Réserve naturelle Blandford | Barney | 2005, 2006 |
| Nouvelle-Écosse | Bioblitz du lac Abraham | Barney | 2012 |
| Nouvelle-Écosse | Bioblitz du lac Long | Richardson, Anderson | 2008 |
| Nouvelle-Écosse | Île West Ironbound | Barney | 2009 |
| Nouvelle-Écosse | Antigonish et sa région | Anderson Neily | 2009, 2010 |
| Nouvelle-Écosse | Refuge faunique Tobeatic | Barney | 2010 |
| Nouvelle-Écosse | Réserve naturelle Blandford | Barney | 2005, 2006 |
| Nouvelle-Écosse | Territoire domanial du comté de Shelburne | Neily | 2006-2014 |
| Nouvelle-Écosse | Territoire domanial du comté de Queens | Neily | 2006-2014 |
| Nouvelle-Écosse | Territoire domanial du comté de Guysborough | Neily | 2006-2014 |
| Nouvelle-Écosse | Partie orientale de l’île du Cap-Breton, lac Bras d’Or, baie St. Ann | Neily, Anderson | 2009-2010, 2013 |
| Nouvelle-Écosse | Ruisseau Lockhart, île du Cap-Breton | Barney | 2010 |
| Île-du-Prince-Édouard | Extrémité occidentale, comté de Prince | McMullin | 2009 |
| Province et comté | Occurrence | Date décou-verte | Date nouv. relevé | Présence nouv. relevé | Nbre est. de colonies | Arbre hôte | Dommages brouteurs | Propriété et protection | Menaces | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Ontario - Grenville | Prescott | 1861 | 2013 | N | - | s.o. | s.o. | Terrain privé | PA | ||
| Ontario - Hastings | Central Ontario Junction | 1893 | 2013 | N | - | s.o. | s.o. | Terrain privé | PA | ||
| Québec - Québec | Chelsea, mont King, parc de la Gatineau | 1902 | 2013 | N | - | s.o. | s.o. | Parc provincial | PA | ||
| Québec - Vaudreuil | Mont Rigaud | Années 1890 | 2013 | N | - | s.o. | s.o. | Inconnu | PA | ||
| Nouveau-Brunswick - Albert | Chemin Laverty, chemin de la tour d’observation, parc nat. Fundy | 1976 | 2013 | N | - | Érable à sucre | s.o. | Parc national | PA | ||
| Nouveau-Brunswick - Albert | Chemin Laverty, tour d’observation, sentier vers la rivière Alma, parc nat. Fundy | c. 1980 | 2013 | N | - | Érable à sucre | s.o. | Parc national | PA | ||
| Nouveau-Brunswick - Albert | Goshen, S.-O. d’Elgin | 1978 | 2013 | N | - | Hêtre | s.o. | Terrain privé | PA | ||
| Nouveau-Brunswick - Kings | Waterford, mont Poley | 2001 | 2013 | N | - | Érable à sucre | s.o. | Terrain privé | PA | ||
| Nouveau-Brunswick - Kings | Waterford, colline McDermott | 2005 | 2013 | N | - | Érable à sucre, hêtre | s.o. | Terrain privé | PA | ||
| Nouveau-Brunswick - Charlotte | Île Grand Manan | 1879 | 2013 | N | - | s.o. | s.o. | Terrain privé | PA | ||
| Nouvelle-Écosse - Colchester | Rivière Economy, chutes Economy | 1992 | 2013 | N | - | Érable à sucre | s.o. | Réserve intégrale | B, C | ||
| Nouvelle-Écosse - Colchester | Lac Simpson, chutes Economy | 1977 | 2013 | N | - | Érable à sucre | s.o. | Réserve intégrale | B, C | ||
| Nouvelle-Écosse - Halifax | Ouest du lac Scraggy | 2008 | 2013 | O | 35 | Érable à sucre | s.o. | Territoire domanial | F, B, H, C | ||
| Nouvelle-Écosse - Halifax | Ship Harbour, colline Reid | 2008 | 2013 | N | - | Érable à sucre | s.o. | Réserve intégrale | B, C | ||
| Nouvelle-Écosse - Inverness | Ruisseau Corney, parc nat. des Hautes-Terres-du-Cap-Breton | 2008 | 2013 | O | 2 | Érable à sucre | s.o. | Parc national | B, C | ||
| Nouvelle-Écosse - Lunenburg | Lac Hirtle, chemin Upper Branch | 1982 | 2014 | N | - | Érable rouge | s.o. | Terrain privé | F, B, H, C | ||
| Nouvelle-Écosse - Lunenburg | Lac Rhodes | 2009 | 2013 | N | - | Érable rouge | s.o. | Terrain privé | F, B, H, C | ||
| Nouvelle-Écosse - Lunenburg | Franey’s Corner | 2008 | 2013 | O | 15 | Chêne rouge, érable rouge | O | Terrain privé | F, B, H, C | ||
| Nouvelle-Écosse - Lunenburg | Colpton, ruisseau Ash | 2008 | 2013 | N | - | Érable rouge | s.o. | Terrain privé | F, B, H, C | ||
| Nouvelle-Écosse - Queens | Parc provincial Thomas Raddall | 1992 | 2013 | N | - | Érable rouge | s.o. | Parc provincial | B, C | ||
| Nouvelle-Écosse - Queens | Marais Main Parkway Kejimkujik | 2006 | 2013 | O | 12 | Érable rouge | N | Parc national | B, C | ||
| Nouvelle-Écosse - Queen | Granite Village | 2011 | 2013 | O | 5 | Érable rouge | O | Terrain privé | F, B, H, C | ||
| Occurrences postérieures à 1995 non revisitées | Occurrence | Date décou-verte | Date nouv. relevé | Présence nouv. relevé | Nbre est. de colonies | Arbre hôte | Dommages brouteurs | Propriété et protection | Menaces possibles |
| Nouvelle-Écosse - Annapolis | Terres de Bowater McGill | 2005 | - | - | - | Érable rouge | - | Territoire domanial | F, B, H, C |
| Nouvelle-Écosse - Digby | Lac Great Pubnico | 2012 | - | - | - | Érable rouge | - | Terrain privé | F, B, H, C |
| Nouvelle-Écosse - Guysborough | Lacs Melopsoketch et West River | 2012 | - | - | - | Érable rouge | - | Territoire domanial | F, B, H, C |
| Nouvelle-Écosse - Hants | Près des chutes Baker | 2013 | - | - | 4 | Frêne | N | Terrain privé | F, B, H, C |
| Nouvelle-Écosse - Lunenburg | Rhodes Corner, lac Beck | 2011 | - | - | - | Frêne, érable rouge | O | Terrain privé | F, B, H, C |
| Nouvelle-Écosse - Lunenburg | Lac Sherbrooke, chemin Barss Corner | 2014 | - | - | 3 | Érable rouge | N | Terrain privé | F, B, H, C |
| Nouvelle-Écosse - Lunenburg | Lac Timber Bowater | 2007 | - | - | - | Érable rouge | - | Terrain privé | F, B, H, C |
| Nouvelle-Écosse - Nouvelle-Écosse | Lac Rocky, rivière Clyde | 2007 | - | - | - | Érable rouge | - | Terrain privé | F, B, H, C |
| Nouvelle-Écosse - Queens | Lac Rossignol | 2006 | - | - | 75+ | Érable rouge | s.o. | Réserve intégrale | B, C |
| Nouvelle-Écosse - Queens | Lac Pebbeloggitch Kejimkujik | 2011 | - | - | - | Érable rouge | - | Parc national | B, C |
| Nouvelle-Écosse - Shelburne | Réserve intégrale Bowers Meadow | 2012 | - | - | - | Érable rouge | - | Réserve intégrale | B, C |
| Nouvelle-Écosse - Shelburne | Ruisseau Northwest | 2007 | - | - | - | Érable rouge | - | Territoire domanial | F, B, H, C |
| Nouvelle-Écosse - Shelburne | Ruisseau Birchtown | 2007 | - | - | - | Érable rouge | - | Terrain privé | F, B, H, C |
| Nouvelle-Écosse - Shelburne | Lac Misery | 2013 | - | - | 8+ | Érable rouge | O | Territoire domanial | F, B, H, C |
| Nouvelle-Écosse - Shelburne | Ruisseau Misery | 2012 | - | - | - | Érable rouge | - | Territoire domanial | F, B, H, C |
| Nouvelle-Écosse - Shelburne | Lac North, nord du lac Canada Hill | 2012 | - | - | - | Érable rouge | - | Territoire domanial | F, B, H, C |
| Nouvelle-Écosse - Shelburne | Rivière Jordan Ouest | 2012 | - | - | - | Érable rouge | - | Territoire domanial | F, B, H, C |
| Nouvelle-Écosse - Shelburne | Nord des chutes Jordan | 2008 | - | - | - | Érable rouge | - | Territoire domanial | F, B, H, C |
| Nouvelle-Écosse - Shelburne | East Sable River | 2011 | - | - | - | Érable rouge | - | Territoire domanial | F, B, H, C |
| Nouvelle-Écosse - Shelburne | Lac Johnstons | 2011 | - | - | - | Érable rouge | - | Terrain privé | F, B, H, C |
| Nouvelle-Écosse - Yarmouth | Lac Rushy | 2008 | - | - | - | Érable rouge | - | Territoire domanial | F, B, H, C |
| Nouvelle-Écosse - Yarmouth | Lac Great Pubnico | 2012 | - | - | - | Érable rouge | - | Terrain privé | F, B, H, C |
| Nouvelle-Écosse - Yarmouth | Lac Louis | 2013 | - | - | - | Érable rouge | - | Territoire domanial | F, B, H, C |
| Province et comté | Occurrence | Date découverte | Arbre hôte | Propriété et protection |
|---|---|---|---|---|
| Nouveau-Brunswick - Albert | Sentier Rat-tail, parc national Fundy | 1981 | - | Parc national |
| Nouveau-Brunswick - Kings | Ruisseau Weldon | 1er juin 1977 | Érable à sucre | Terrain privé |
| Nouveau-Brunswick - York | Ruisseau Nashwaaksis | 11 mai 1977 | Pruche du Canada | Terrain privé |
| Nouveau-Brunswick - York | Love's Sugar Bush, Mactaquac | 1er avril 1973 | Érable à sucre | Terrain privé |
| Nouveau-Brunswick - ? | Chemin Walker | 5 novembre 1977 | Érable à sucre | Terrain privé |
| Nouveau-Brunswick - ? | Ferme biologique Maple Vale, Greenhill | 1er septembre 1971 | Érable rouge | Terrain privé |
| Nouvelle-Écosse - Annapolis | Jakes Landing | 13 juin 1981 | Érable | Parc national Kejimkujik |
| Nouvelle-Écosse - Annapolis | Ruisseau Peskowesk, Kejimkujik | 19 novembre 1981 | Érable | Parc national |
| Nouvelle-Écosse - Annapolis | Maitland Bridge, Kejimkujik | 15 avril 1982 | Érable | Parc national |
| Nouvelle-Écosse - Annapolis | New Albany | 22 mai 1982 | Chêne rouge | Terrain privé |
| Nouvelle-Écosse - Annapolis | Chemin Nichols, Clarence | 20 mai 1994 | Érable à sucre | Terrain privé |
| Nouvelle-Écosse - Cumberland | New Canaan | 8 juin 1981 | Érable rouge | Terrain privé |
| Nouvelle-Écosse - Cumberland | Ruisseau Wentworth | 17 avril 1982 | Érable | Terrain privé |
| Nouvelle-Écosse - Cumberland | Lac Philip | 26 avril 1982 | Frêne et érable | Terrain privé |
| Nouvelle-Écosse - Cumberland | Versant nord des montagnes Cobequid | 18 septembre 1982 | Érable à sucre | Terrain privé |
| Nouvelle-Écosse - Digby | Meteghan Station | 19 juin 1981 | Érable | Terrain privé |
| Nouvelle-Écosse - Digby | St. Joseph | 17 avril 1982 | Érable rouge | Terrain privé |
| Nouvelle-Écosse - Digby | Maxwellton Station | 24 avril 1982 | Érable | Terrain privé |
| Nouvelle-Écosse - Digby | Weaver Settlement/Havelock | 24 avril 1982 | Érable | Terrain privé |
| Nouvelle-Écosse - Digby | Rivière Shelburne/rivière Kedge | 25 avril 1982 | Érable | Terrain privé |
| Nouvelle-Écosse - Guysborough | Chemin Main, refuge faunique Liscomb | 1er juillet 1981 | Érable | Terrain privé |
| Nouvelle-Écosse - Guysborough | Pont au-dessus de l’embranchement du ruisseau Birch Hill | 20 juin 1981 | Érable | Terrain privé |
| Nouvelle-Écosse - Halifax | Devon | 11 mars 1982 | Érable | Terrain privé |
| Nouvelle-Écosse - Halifax | Lac Porters, route 7/107 | 10 avril 1982 | Érable | Terrain privé |
| Nouvelle-Écosse - Halifax | Eaux d’amont du lac Porters | 25 avril 1982 | Érable | Territoire domanial |
| Nouvelle-Écosse - Halifax | Sheet Harbour, route 224 | 25 avril 1982 | Bouleau | Terrain privé |
| Nouvelle-Écosse - Halifax | Lac Charlotte/Mooseland | 26 avril 1982 | Érable | Terrain privé |
| Nouvelle-Écosse - Halifax | Rivière Moose | 22 mai 1982 | Érable à sucre | Terrain privé |
| Nouvelle-Écosse - Kings | Rivière Fales | 11 mai 1977 | Érable rouge | Terrain privé |
| Nouvelle-Écosse - Lunenburg | Lac Snake, Kejimkujik | 19 novembre 1981 | Érable | Parc national |
| Nouvelle-Écosse - Lunenburg | Stanburne/East Dalhousie | 5 septembre 1982 | Érable rouge | Terrain privé |
| Nouvelle-Écosse - Queens | Ruisseau Burnaby, rivière Medway | 16 mars 1982 | Chêne rouge | Terrain privé |
| Nouvelle-Écosse - Queens | Molega | 10 avril 1982 | Érable | Terrain privé |
| Nouvelle-Écosse - Queens | Lac Tupper | 10 avril 1982 | Érable rouge | Terrain privé |
| Nouvelle-Écosse - Queens | Harmony Mills/Westfield | 10 avril 1982 | Frêne et érable | Terrain privé |
| Nouvelle-Écosse - Queens | Rivière Shelburne | 25 avril 1982 | Chêne rouge | Terrain privé |
| Nouvelle-Écosse - Queens | Ruisseau Porcupine, lac Rossignol | 1er mai 1982 | Érable | Terrain privé |
| Nouvelle-Écosse - Queens | Ruisseau Porcupine, lac Rossignorl | 16 mai 1982 | Érable | Terrain privé |
| Nouvelle-Écosse - Queens | Lac Cameron | 22 mai 1982 | Frêne | Parc provincial de pique-niques |
| Nouvelle-Écosse - Queens | Lac Snake, lac McGinty, Kejimkujik | 26 juillet 1982 | Chêne rouge | Parc national |
| Nouvelle-Écosse - Queens | Lac Ten Mile, Middlefield | 5 septembre 1982 | Chêne rouge | Parc provincial de pique-niques |
| Nouvelle-Écosse - Queens | Rivière Medway/ruisseau Burnaby | 1er septembre 1971 | Chêne rouge | Terrain privé |
| Nouvelle-Écosse - Shelburne | Lac Deception/embranchement ouest de la rivière Roseway | 16 mai 1981 | Érable | Territoire domanial |
| Nouvelle-Écosse - Shelburne | Rivière Clyde/Middle Clyde River | 20 juin 1981 | Érable rouge | Terrain privé |
| Nouvelle-Écosse - Shelburne | Lac Deception, rivière Clyde/Shelurne | 20 juin 1981 | Érable | Territoire domanial |
| Nouvelle-Écosse - Shelburne | Welshtown/Upper Clyde | 20 juin 1981 | Érable | Terrain privé |
| Nouvelle-Écosse - Shelburne | Twenty Click, rivière Clyde | 11 juillet 1981 | Sapin baumier | Terrain privé |
| Nouvelle-Écosse - Shelburne | Middle Clyde River | 11 octobre 1981 | Érable | Terrain privé |
| Nouvelle-Écosse - Shelburne | Lac Pug | 11 mars 1982 | Érable | Terrain privé |
| Nouvelle-Écosse - Shelburne | Oak Park | 18 avril 1982 | Érable | Terrain privé |
| Nouvelle-Écosse - Shelburne | Ruisseau Harlow, S.-O. du lac Rossignol | 22 mai 1982 | Érable | Terrain privé |
| Nouvelle-Écosse - Yarmouth | Glenwood | 11 mai 1981 | Érable | Terrain privé |
| Nouvelle-Écosse - Yarmouth | Quinan/Tusket | 22 août 1981 | Érable | Terrain privé |
| Nouvelle-Écosse - Yarmouth | East Kemptville/Indian Fields | 19 novembre 1981 | Érable | Terrain privé |
| Nouvelle-Écosse - Yarmouth | Lac Little Tusket/lac Tusket | 17 avril 1982 | Érable | Terrain privé |
| Nouvelle-Écosse - Yarmouth | Lac Kegeshook, East Quinan | 18 avril 1982 | Érable | Terrain privé |
| Nouvelle-Écosse - Yarmouth | Lac Jesse | 18 avril 1982 | Érable | Terrain privé |
| Nouvelle-Écosse - Yarmouth | Plage Port Maitland | 4 septembre 1982 | Érable | Terrain privé |
| Nouvelle-Écosse - ? | Lynn | 11 juillet 1981 | Érable rouge | Terrain privé |
La plupart des découvertes récentes d’A. colpodes au Canada atlantique ont été faites pendant le travail sur le terrain effectué pour le présent rapport et en conséquence des relevés de Tom Neily. Les relevés effectués à l’Île-du-Prince-Édouard dans trois sites pour lesquels il n’y a pas de mentions historiques d’A. colpodes n’ont pas permis d’y découvrir l’espèce (figure 5). De plus, l’A. colpodes n’a pas été trouvé à Terre-Neuve-et-Labrador malgré le fait qu’il existe, selon la modélisation, des conditions climatiques qui lui conviendraient dans cette province (voir Tendances en matière d’habitat).
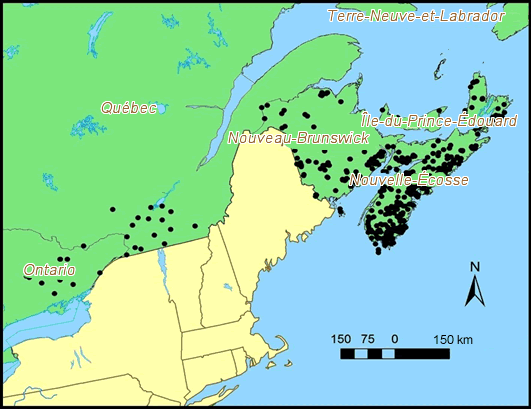
Description longue pour la figure 5
Carte des sites où des lichens épiphytes, dont l’Anzia colpodes, ont été cherchés au Canada pendant le travail sur le terrain effectué pour le présent rapport et au cours de relevés récents.
L’Anzia colpodes n’a été observé à aucun des sites historiques qui ont été visités à nouveau (figure 3). L’espèce a d’abord été cherchée à Prescott, une région où le couvert forestier était probablement plus étendu en 1861, année où le lichen y a été découvert, qu’il ne l’est aujourd’hui. Maintenant à l’extrémité d’une banlieue, la zone est entourée par des lotissements sur trois côtés et par l’autoroute 401 de l’autre. Le deuxième site, Ontario Central Junction, était autrefois une gare de chemin de fer et se trouve maintenant au point de rencontre d’un important sentier de motoneiges et du Sentier transcanadien. Une partie de ce site abrite encore un riche peuplement ancien de feuillus en terrain élevé qui pourrait convenir à l’A. colpodes. Enfin, au cours d’un relevé sur le terrain ciblant le Physconia subpallida, un milieu pouvant convenir à l’A. colpodes a été examiné en onze endroits dans un quadrilatère délimité par Ottawa, Waterton, Peterborough et Haliburton (McMullin, 2013 et comm. pers., 2014). L’A. colpodes n’a été trouvé à aucun des sites visités (figure 5). L’A. colpodes est présent,mais très rare, dans le nord du Wisconsin et du Michigan. Il serait peut-être possible de trouver ce lichen dans les régions avoisinantes au Canada, peut-être près de Sault Ste. Marie, sur la rive nord du lac Supérieur, dans les hautes terres d’Almaguin, sur l’île Manatoulin, près du lac Temiskaming, en Temagami et en Abitibi (S. Brinker, comm. pers., 2014).
Deux sites où la présence de l’A. colpodes avait déjà été attestée ont été visités de nouveau au Québec en 2013, sans qu’on y retrouve l’espèce. L’un de ces sites se trouvait sur le mont King, à Gatineau, qui a été visité deux fois. La flore lichénique y était riche et intéressante, en particulier au sommet où il y avait de nombreux gros feuillus âgés. L’autre site est celui du mont Rigaud, où se trouve une riche forêt ancienne mixte. Ce site est assez fortement perturbé par de nombreux sentiers et par l’activité humaine. La forêt donne aussi sur un gros campus collégial.
Aucun site hébergeant l’A. colpodes n’a été découvert dans le sud-est du Québec (à l’est de la vallée du Saint-Laurent), malgré les relevés effectués dans la région, y compris dans les peuplements dominés par l’érable à sucre (Acer saccharum) autour du mont Orford et du mont Gosford (Clayden, comm. pers., 2014). Des études sur les lichens épiphytes et les bryophytes des forêts de feuillus des Cantons de l’Est ont aussi été effectuées, mais la présence de l’A. colpodes n’a pas été consignée (LeBlanc, 1960, fig. 1-3; LeBlanc, 1963).
Douze sites historiques de l’espèce sont connus au Nouveau-Brunswick, dont le site signalé par Henry Willey en 1879 sur l’île Grand Manan. En 2013, six de ces sites ont été visités à nouveau. Deux des six sites historiques restants n’ont pas pu être visités parce qu’une coupe à blanc a été effectuée dans l’un (chemin Walker) et que le sentier d’accès à l’autre n’est plus entretenu (sentier Rat-tail, parc national Fundy). La partie inférieure des troncs d’arbre (jusqu’à 2 m au-dessus du sol) et de nombreuses branches tombées ont été examinées. Une visite à l’île Grand Manan a été effectuée pour retrouver le site signalé par Willey en 1879. On a mené des recherches ciblant l’A. colpodes du côté nord de l’île dans une forêt mixte où poussent des érables à sucre et on a examiné d’autres arbres, sans succès (tableau 2).
Huit autres sites potentiels à l’intérieur et à l’extérieur de l’aire de répartition connue de l’A. colpodes dans la province ont également été fouillés. Le site Weldon, dans le comté d’Albert, est proche de la zone naturelle protégée de la gorge Caledonia, où des relevés exhaustifs ont été réalisés pendant plusieurs semaines en 2011 et en 2012. Les peuplements de feuillus matures ont été examinés près de Fredericton, à l’île Bear, dans le parc provincial Mactaquac, autour du lac Ayers et en divers endroits près de la rivière Meduxnekeag. Comme un lotissement résidentiel haut de gamme et à faible densité a empiété sur le site du ruisseau Nashwaaksis, il n’a pas été possible de se rendre à ce site. La zone naturelle protégée du Grand Lake a été visitée pendant 10 jours de travaux sur le terrain dans le cadre d’une étude sur la biodiversité. Il y avait beaucoup d’érables rouges (Acer rubrum) dans les forêts mixtes mésiques à humides, mais aucun n’abritait l’A. colpodes. Peu de recherches ont été réalisées dans la partie supérieure de la vallée de la rivière Nashwaak (site Greenhill), mais la coupe à blanc et la coupe par bandes des feuillus matures ont été intensives et généralisées dans cette région, comme dans les milieux en terrain élevé du comté d’Albert.
Grâce à de très modestes activités de recherche réalisées dans les années 1970, Stephen Clayden, Hal Hinds et Hinrich Harries ont pu trouver des occurrences largement dispersées d’A. colpodes dans le sud du Nouveau-Brunswick. Au cours des dernières années, après des recherches bien plus intensives, la présence de l’espèce n’a été constatée nulle part.
Au moment où le travail sur le terrain a commencé pour le présent rapport de situation en 2013, on croyait qu’avant 2000 l’A. colpodes n’avait été récolté que dans les comtés de Colchester, de Cumberland et de Queens par Harries en 1977 et en 1994, trois spécimens ayant aussi été récoltés par Maass et Hoisington (1982) et confiés au Musée de la Nouvelle-Écosse. L’A. colpodes avait aussi été trouvé dans le comté de Queens pendant l’atelier de 1999 de Tuckerman (LaGreca et Lay, comm. pers., 2013). Cependant, ces mentions n’ont pas été publiées et les premiers articles sur l’A. colpodes en Nouvelle-Écosse ont été ceux de McMullin et al. (2008) et de McMullin (2009).
Douze des trente-cinq occurrences connues ont été visitées en 2013 et en 2014 (tableau 2). On a fouillé un drumlin sur la colline Reid, dans le comté d’Halifax, où l’A. colpodes était commun, ainsi qu’un peuplement de feuillus en terrain élevé où il n’a pas été trouvé de nouveau. Un des deux sites dans le parc national Kejimkujik a été visité et le lichen s’y trouvait, mais il n’était pas commun. D’anciens sites à Franey's Corner et à Granite Village ont été visités, tout comme le site d’Hinrich Harries dans le comté de Colchester, le site du ruisseau Ash dans le comté de Lunenburg et le site de Thomas Raddall dans le comté de Queens, mais sans que le lichen y soit trouvé. La région des chutes Economy, où Stephen Clayden avait trouvé l’A. colpodes en 1992, et les zones avoisinantes ont été fouillées en 2013, tout comme un drumlin dans la région du mont Uniacke, sans que l’A. colpodes y soit trouvé.
L’herbier privé de Wolfgang Maass a été transféré au Musée du Nouveau-Brunswick et le conservateur, Stephen Clayden, a cherché en 2013 des mentions de l’A. colpodes dans la collection. Les résultats n’ont été accessibles qu’après la fin du travail sur le terrain décrit ci-dessus. Maass a recueilli des spécimens partout en Nouvelle-Écosse au cours de sa très longue carrière. Parmi ses collections se trouvent 53 mentions d’A. colpodes en Nouvelle-Écosse, la plupart datant des années 1980 et toutes étant antérieures à 1995 (tableau 3). D’après ces données et les récoltes effectuées plus récemment, il est évident que l’A. colpodes est loin d’être commun dans la province, mais est répandu (Tom Neily, comm. pers., 2014). La présence de l’espèce est signalée dans les 18 comtés, à l’exception de cinq : Antigonish, Cap-Breton, Pictou, Richmond et Victoria.
Il n’y a pas de mentions historiques de l’A. colpodes àTerre-Neuve. Bien que, selon la modélisation climatique, le climat de Terre-Neuve soit peut-être favorable à l’espèce(voir Tendances en matière d’habitat ci-après), l’absence de substrat approprié (p. ex. l’écorce d’érable) rend la présence de celle-ci peu probable. De plus, des relevés exhaustifs des lichens effectués par W. Maass et T. Ahti à Terre-Neuve ainsi que le relevé de la presqu’île Avalon effectué par le groupe de lichénologues de Tuckerman n’ont pas permis de découvrir sa présence. Enfin, les études d’Eugene Conway et d’Ian Goudie (Newfoundland Lichen Education and Research Group), de Mac Pitcher et de Claudia Hanel (gouvernement de Terre-Neuve-et-Labrador) et de John McCarthy n’ont pas non plus permis de trouver l’espèce, bien qu’ils ciblaient surtout des cyanolichens.
L’Anzia colpodes a besoin d’un habitat de feuillus matures où l’humidité et l’intensité lumineuse sont élevées. L’humidité nécessaire est fournie par les milieux humides, les ruisseaux avoisinants, les lacs ou la position de l’hôte sur une pente au-dessus d’un plan d’eau. Dans le sud-ouest de la Nouvelle-Écosse, où ce lichen est assez commun, les précipitations annuelles vont de 1 400 à 1 500 mm, la température mensuelle moyenne étant de 10 à 12 °C, tandis que, dans le nord de cette province, les précipitations annuelles sont de 1 000 à 1 400 mm et la température mensuelle moyenne est de 10 à 11 °C. Aux États-Unis, l’A. colpodes se rencontre le plus souvent dans les montagnes Smokey et les monts Ozark, où les précipitations sont similaires respectivement aux deux régions mentionnées ci-dessus de la Nouvelle-Écosse, mais où les températures sont plus élevées (16-19 °C et 19-23 °C). En Nouvelle-Écosse, l’A. colpodes a été observé à moins de un kilomètre de la côte au parc provincial Thomas Raddall. Cependant, la proximité d’un plan d’eau ou d’une source d’eau semble plus importante que la proximité de la côte.
En Nouvelle-Écosse, le tronc des arbres hôtes (dans les peuplements forestiers) n’est habituellement pas entouré par un sous-étage dense, et le lichen se trouve en général à la hauteur du sous-étage ou plus haut (dans les marais et les tourbières minérotrophes). Hale (1979) estimait qu’on ne voit probablement pas l’A. colpodes parce qu’il pousse en hauteur sur les troncs d’arbre. Quelques-uns des spécimens d’A. colpodes recueillis au Nouveau-Brunswick et en Nouvelle-Écosse sont censés provenir d’un couvert d’érables rouges (Acer rubrum). Au cours de recherches récentes, on a observé que l’A. colpodes poussait sur le tronc des arbres à une hauteur variant entre 20 cm au-dessus du sol et 2 m. Bien que les chercheurs aient porté une attention particulière aux thalles qui auraient pu se trouver en hauteur, ils n’en ont repéré aucun.
L’A. colpodes semble avoir besoin d’une écorce moyennement rugueuse, à un stade de maturité des arbres où le couvert est encore assez ouvert. Si les arbres deviennent trop gros, ou si le couvert forestier est trop dense, ce lichen semble ne pas pouvoir se développer aussi bien. Les trouées dans la forêt ou au voisinage de celle-ci peuvent permettre à des arbres matures ayant l’écorce appropriée de croître. L’A. colpodes, compte tenu de sa production élevée de spores, a alors de bonnes chances de coloniser le milieu. L’hôte le plus fréquent de l’A. colpodes est l’érable rouge (Acer rubrum), mais on l’a aussi observé au Canada sur le chêne rouge (Quercus rubra), le frêne blanc (Fraxinus americana), l’érable à sucre et les amélanchiers (Amelanchier spp.). Des spécimens isolés ont été récoltés sur le sapin baumier (Abies balsamea), le bouleau jaune (Betula alleghaniensis), le hêtre à grandes feuilles (Fagus grandifolia) et la pruche du Canada (Tsuga canadensis).
Un modèle de l’habitat de l’Anzia colpodes a été créé pour la Nouvelle-Écosse à l’aide de l’arbre de classification et de régression (CART) (Cameron, données inédites). Les variables dépendantes du modèle étaient les sites connus depuis 1995, utilisés comme données sur la présence et l’absence qu’on a dérivées en choisissant de façon aléatoire 250 localités dans la base de données des localités des lichens tenue par le ministère de l’Environnement de la Nouvelle-Écosse. Les variables prédictives étaient l’altitude, les précipitations annuelles moyennes, la température moyenne en juillet et les attributs de la forêt. CART divise les données, en se fondant sur un test statistique qui explique de façon optimale la variation, en une séquence hiérarchique de groupes. Ces groupes et divisions sont présentés sous forme d’arborescence. Malheureusement, la majorité des mentions de Wolfgang Maass récemment découvertes ne comportent pas de données suffisamment précises quant à l’emplacement exact de la récolte pour qu’il soit possible de les intégrer dans le modèle.
D’après les résultats, le modèle est très bien parvenu à prédire les occurrences (87,2 %) et les absences (96,3 %) d’individus de l’espèce; l’aire sous la courbe ROC était de 0,983 (la courbe ROC est une mesure courante de la performance d’un modèle; un résultat de 0,5 ne vaut pas mieux que le hasard et un résultat de 1,0 indique une concordance parfaite). D’après ce modèle, il y a environ 120 000 ha d’habitat prévu en Nouvelle-Écosse, ce qui représente à peu près 2,2 % de la province. Cet habitat est réparti dans toute la province, à l’exception de la vallée orientale et des hautes terres du Cap Breton. Il existe cependant un site connu dans les basses terres du comté d’Inverness, à l’île du Cap-Breton.
Malgré une densité relativement élevée des sites d’A. colpodes dans le sud-ouest de la Nouvelle-Écosse, la densité de l’habitat prévu y est faible, en raison de la faible densité des peuplements de feuillus dans cette région par comparaison au nord de la province. Le modèle indique peut-être qu’en dépit d’un climat favorable dans le sud-ouest de la Nouvelle-Écosse, il y a peu de peuplements forestiers qui présentent des attributs favorables. Dans le nord, les peuplements forestiers possédant les bonnes caractéristiques sont plus fréquents, mais le climat n’est pas aussi idéal.
Le modèle indique de plus que l’absence de la bonne combinaison de conditions climatiques et de peuplement forestier possédant des attributs favorables limite peut-être cette espèce. Bien que la majorité des peuplements où l’A. colpodes pousse soient assez ouverts (couvert peu fermé), le modèle semble indiquer que, dans certaines conditions, un couvert très fermé peut être toléré en terrain élevé (> 60 m au-dessus du niveau de la mer) dans les forêts matures (p. ex. les collines Cobequid) et à basse altitude lorsque les températures moyennes de juillet sont moins élevées (p. ex. la région Eastern Shore). L’A. colpodes était absent lorsque les sites des collines Cobequid et du parc national Fundy ont été visités à nouveau. C’est peut-être dû à l’effet négatif de la fermeture du couvert qui à la fois inhibe la croissance du lichen et favorise les dommages causés par les mollusques brouteurs (voir Menaces). Dans l’ensemble, le modèle indique que les bonnes conditions forestières associées aux bonnes conditions climatiques se présentent très rarement pour l’A. colpodes en Nouvelle-Écosse.
On a superposé la base de données des lichens au modèle de l’habitat pour déterminer si certaines parties de l’habitat prévu avaient déjà été fouillées et si l’A. colpodes y avait été découvert. Les résultats ont montré que des relevés des lichens ont été effectués par le passé dans 24 des polygones d’habitat prévu. Ces recherches ont permis de découvrir deux occurrences d’A. colpodes, ce qui semble indiquer que 8 % seulement environ de l’habitat prévu abrite réellement l’A. colpodes et que 92 % de l’habitat n’est pas occupé. Le faible taux d’occupation de l’habitat prévu vient peut-être de ce qu’il s’agit d’une espèce peu fréquente ou de ce que le modèle d’habitat prédit une plus grande superficie que celle qui constitue véritablement l’habitat de l’espèce. Selon les estimations, pas plus de 9 600 ha, soit à peu près 0,17 % de la province, abriteraient l’A. colpodes.
Un modèle du climat pour le Canada a aussi été créé pour l’A. colpodes à l’aide des méthodes de Cameron et al. (2011). Toutes les occurrences actuelles et les occurrences historiques connues (au moment où ce modèle a été créé), ce qui inclut des données de l’Ontario, du Québec, du Nouveau-Brunswick et de la Nouvelle-Écosse, ont été utilisées pour l’établissement des résultats (figure 6). Ce modèle indique qu’il pourrait exister des conditions propices pour l’A. colpodes à Terre-Neuve, mais ce lichen n’y a pas été découvert (voir Activités de recherche). La statistique D2 de Mahalanobis a été calculée à partir des précipitations annuelles et des températures maximales mensuelles moyennes pour 1961 à 1990 tirées de Price et al. (2004). La statistique D2 est une mesure de la distance entre un point et un autre dans un espace multidimensionnel, dans ce cas les précipitations et la température. On peut appliquer cette approche en se servant des données sur la présence seulement, et elle est suffisamment robuste pour qu’on puisse l’utiliser avec des données à distribution non normale. D’après ce modèle, dans le climat idéal, les précipitations annuelles moyennes sont supérieures à 1 400 mm et les températures mensuelles moyennes varient entre 6 °C et 12 °C.
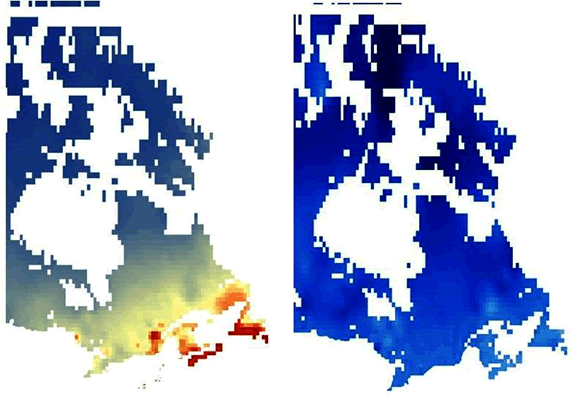
Description longue pour la figure 6
Deux cartes illustrant les résultats d’une modélisation climatique réalisée pour le Canada en fonction des précipitations annuelles et des températures mensuelles maximales moyennes. Une carte correspond aux données d’observation sur le climat de 1961 à 1990, tandis que l’autre correspond aux données sur le climat prévu jusqu’en 2099. Les cartes montrent l’adéquation relative des zones climatiques pour l’Anzia colpodes. La comparaison des cartes donne à penser que d’ici 2099, il pourrait ne pas y avoir de conditions climatiques optimales pour ce lichen au Canada.
Un deuxième modèle climatique a été conçu à l’aide de scénarios sur le climat futur créés par Price et al. (2004). La comparaison du modèle climatique actuel et du modèle du climat futur (figure 6) montre que, d’ici 2099, les conditions climatiques se situeront en dehors de la plage moyenne historique établie pour l’A. colpodes dansl’ensemble du Canada, de sorte qu’en 2099, il pourrait ne pas y avoir de conditions climatiques optimales (voir ci-dessus) pour l’espèce au Canada. Selon Lines et al. (2009), cette situation pourrait être due au fait que les printemps et les automnes seront plus humides et que les étés seront plus chauds et plus secs en Nouvelle-Écosse. Price et al. (2004) estiment qu’il pourrait se produire une légère augmentation des précipitations annuelles dans de nombreuses régions au nord de l’aire de répartition actuelle de l’A. colpodes,mais ce ne serait pas suffisant pour que le seuil de 1 400 mm qui, selon le modèle, constitue la quantité optimale, soit atteint. Dans d’autres régions, par exemple l’Ontario, où l’A. colpodes était présent par le passé, les tendances en matière de changements climatiques seront différentes, mais la probabilité que des individus immigrants provenant de l’occurrence la plus proche aux États-Unis réussissent à s’établir est très faible en raison de la distance en cause. Une des hypothèses de la technique de modélisation de Mahalanobis est que l’environnement idéal peut être décrit comme une moyenne multivariée. Ce n’est peut-être pas toujours le cas pour toutes les variables. Selon une autre hypothèse, les échantillons originaux ayant servi à caractériser la moyenne multivariée reflètent des conditions optimales. Les données climatiques disponibles pour la création de ces modèles étant limitées, ce pourrait ne pas être le cas, si bien qu’il faut faire preuve de prudence en interprétant les résultats. Ceux-ci semblent néanmoins indiquer que les changements climatiques auront un effet négatif sur l’A. colpodes.
L’effet de la dynamique des peuplements naturels sur l’A. colpodes est incertain. Les sites en terrain élevé sont dominés par des arbres feuillus tolérants, et la dynamique fait en sorte que les arbres individuels et les petites trouées sont remplacés après une perturbation (Forcier, 1974). Les tempêtes de verglas et les vents des ouragans peuvent créer de plus grandes trouées dans la forêt (Davis et Browne, 1996). Si ces forêts ne sont pas perturbées, les conditions des forêts anciennes s’y maintiennent probablement pendant des siècles dans un microclimat qui varie assez peu. Cependant, l’activité humaine peut modifier de façon importante la dynamique des peuplements naturels. Par exemple, une grande superficie avoisinant l’occurrence de la rivière Economy, en Nouvelle-Écosse, a récemment subi une coupe à blanc et des conifères y ont été plantés. Dans les forêts humides des basses terres, la dynamique des peuplements est moins bien connue. Ces forêts semblent être composées d’assez vieux érables rouges, de sapins baumiers relativement jeunes et, parfois, d’épinettes noires ou de bouleaux jaunes. Les sapins baumiers peuvent parvenir à maturité et mourir, tandis que l’érable rouge se maintient, de sorte que le couvert forestier est continu au fil du temps. Cameron (2009) a constaté qu’il y a souvent de jeunes arbres dans le sous-étage, la strate arbustive et la strate herbacée de ces forêts. Il a supposé que ces forêts se régénèrent elles-mêmes si elles ne sont pas perturbées. Même si la totalité ou la plupart des sapins baumiers meurent d’un coup, les niveaux de lumière n’augmentent pas de façon significative parce que l’érable rouge maintient toujours le couvert. La lumière supplémentaire peut donner à l’A. colpodes une occasion de croître et de se reproduire jusqu’à ce qu’une nouvelle cohorte de sapins baumiers parviennent à maturité.
L’Anzia colpodes se reproduit au moyen d’ascospores éjectées par les corps fructifères qui se trouvent sur la face supérieure du thalle. Les spores germent sur un substrat approprié fourni par l’écorce d’arbres feuillus. Elles forment des filaments qui croissent en direction d’algues compatibles appelées Trebouxia simplex et qui enveloppent ces algues. Un thalle lichénique se développe alors. Fait inhabituel, les ascospores de l’A. colpodes sont minuscules par comparaison à celles de la plupart des autres lichens et disposent donc de ressources limitées pour assurer la croissance du tube germinatif à la recherche d’une algue compatible.
On sait peu de choses du taux de croissance de l’A. colpodes, sinon que les lobes des lichens foliés croissent de 1,5 à 5,0 mm par année, 3 mm environ étant une valeur commune (Lawrey, 1984; Palmqvist et al., 2008). Lorsque le thalle lichénique atteint quelques centimètres de diamètre, des pycnides, petites structures en forme de poire, se développent à l’extrémité des lobes (voir la figure 1). Les pycnidiospores des pycnides s’échappent sous l’effet de l’humidité et s’attachent aux trichogynes surmontant la surface du thalle. Lorsque les noyaux des pycnidiospores ont migré dans le trychogyne, les corps fructifères (apothécies) se développent, la méiose a lieu pendant la formation des asques et des spores sont produites. Les spores sont éjectées et le cycle vital est terminé (Honegger et Scherrer, 2008). L’effet des conditions environnementales sur ce processus de fertilisation est très mal connu.
La durée d’une génération varie de 10 ans chez les lichens à colonisation rapide qui sont communs dans les milieux eutrophisés, comme le Xanthoria parietina, à plus de 17 ans chez les lichens comme Lobaria pulmonaria qui croissent dans les forêts matures (Scheidegger et Goward, 2002; Larsson et Gauslaa, 2010). Comme l’A. colpodes croît sur le tronc d’arbres matures où le Lobaria pulmonaria est aussi observé, la durée d’une génération dans son cas est vraisemblablement de 17 ans environ.
La distance de dispersion des propagules végétatives des lichens en forêt n’est que de 15 m à 30 m (Juriado et al., 2011). L’A. colpodes ne produit pas ce genre de propagules et les fragments du thalle sont vraisemblablement dispersés encore plus lentement. Les ascospores du lichen sont éjectées de l’apothécie à une distance d’environ 1 cm et la dispersion dépend ensuite du vent et de la saison où le rejet se produit. Dans les forêts matures où le vent est très faible, les distances de dispersion ne sont probablement pas supérieures à la distance de dispersion des propagules.
Les lichens renferment une variété de composés ayant des propriétés antibiotiques et de défense contre les herbivores qui dissuadent les insectes ou les mollusques de les brouter. Certains lichens renferment des concentrations élevées de ces composés pouvant aller jusqu’à 10 % ou plus en poids sec, et on sait que des composés lichéniques particuliers dissuadent les insectes ou les mollusques brouteurs (Asplund et Wardl, 2013). Comme nous l’avons déjà mentionné, l’A. colpodes contient de l’atranorine et de l’acide divaricatique, ce dernier représentant entre 0,42 % et 1,4 % en poids sec du thalle, ce qui est peu comparativement à de nombreux autres lichens épiphytes chez lesquels des concentrations de 5 % à 10 % sont fréquentes, et peuvent atteindre 20 % (Muggia et al., 2009). Certains spécimens d’A. colpodes contiennent aussi des traces d’acide sekikaique, dérivé de l’acide divaricatique (Yoshimura, 1987). Aucun de ces composés ne fait partie de ceux qui sont particulièrement efficaces contre les herbivores (voir la section Menaces).
Des adaptations pour le stockage et la conduction de l’eau ont été étudiées chez d’autres lichens parmélioïdes (Jahns, 1988; Rundel, 1988; Rikkinen, 1997; Rikkinen et Poinar, 2002), mais il y a eu peu de recherches sur l’A. colpodes. Cette espèce est munie de rhizoïdes solides grâce auxquels elle se fixe au substrat, tandis que l’hypothalle spongieux conserve l’humidité et prolonge la période de la photosynthèse chez un lichen qui croît sur les troncs d’arbre dans des peuplements forestiers assez ouverts. D’autres espèces du genre Anzia préfèrent aussi de façon générale des niveaux de luminosité relativement élevés. Par exemple, dans les forêts denses de Tasmanie, les thalles d’Anzia se trouvent souvent sur les branches du couvert, alors que dans les régions plus dégagées de cet État et dans l’est de l’Amérique du Nord, ils se trouvent sur les troncs d’arbre (Bratt et al.,1976).
La dispersion de l’A. colpodes dépend du transport par le vent des ascospores éjectées vers l’écorce d’arbres feuillus matures, qui sont le plus souvent des érables rouges. Si les ascospores en germination rencontrent une algue compatible, un nouveau thalle est formé. Comme nous l’avons déjà dit, la stratégie de l’A. colpodes consiste à produire un grand nombre de spores minuscules disposant de peu de ressources pour germer, croître et entrer en contact avec une algue appropriée. Dans les régions boisées, les spores ne sont probablement dispersées qu’à quelques centaines de mètres.
L’A. colpodes n’a pas de moyen de reproduction végétative spécialisé (sorédies ou isidies), à la différence de nombreux autres lichens. Les lobes des jeunes thalles sont fixés fermement à l’écorce mais, à mesure que le thalle croît, l’hypothalle soulève l’extrémité des lobes et l’éloigne de l’écorce. Des portions du thalle peuvent alors se séparer, mais le faible nombre de rhizines et le poids supplémentaire de l’hypothalle, en particulier lorsqu’il est mouillé, nuisent vraisemblablement à la dispersion et à la fixation des fragments. Il n’arrive donc probablement pas très souvent que les morceaux qui se détachent se fixent ailleurs sur des troncs d’arbre ou se dispersent à une certaine distance. Aucune donnée génétique qui permettrait d’estimer les distances de dispersion n’a été recueillie, mais les caractéristiques du cycle vital dont il a été question ci-dessus semblent indiquer que la dispersion est limitée et que chacune des occurrences correspond à une sous-population indépendante, du moins sur une seule ou sur quelques générations.
Les lichens sont utilisés comme source d’éléments nutritifs par un large éventail d’invertébrés, dont des thysanoures, des collemboles, des psocoptères, des chenilles de lépidoptères, des acariens oribatides et des gastéropodes (Seaward, 2008) de même que par des champignons lichénicoles. Aucune étude, cependant, ne semble avoir porté sur les associations entre ces organismes et l’A. colpodes. Le broutage à grande échelle de ce lichen (figure 7) par des gastéropodes dont la propension à causer des dommages est bien connue a été observé (Lawrey, 1984). Dans le sud-ouest de la Norvège, le nombre accru de gastéropodes a provoqué une augmentation du broutage des lichens et a joué un rôle dans la disparition du Pseudocyphellaria crocata (Gauslaa, 2008). En Norvège, le broutage du Lobaria pulmonaria par les mollusques était 17 fois plus important sous un couvert ombragé, où les conditions étaient plus humides, que dans les zones plus sèches et plus ouvertes (Asplund et Gauslaa, 2008). Asplund et Gauslaa (2008) ont également observé que les jeunes thalles de lichens sont plus vulnérables et que, pour une consommation donnée, un petit thalle est détruit alors qu’un gros thalle mature est plus en mesure de se régénérer (voir la section Menaces).

Description longue pour la figure 7
Photographie rapprochée montrant les dommages causés par le broutage sur un thalle d’A. colpodes. Le contenu des pycnides à l’extrémité des lobes semble avoir été mangé.
Des relevés sur le terrain ont eu lieu à l’été et à l’automne 2013. Pour inclure quelques-unes des découvertes faites par Maass, qui ont été connues après la fin du travail réalisé en 2013, des travaux supplémentaires ont été effectués sur le terrain en 2014 (voir les tableaux 1 et 2 et la section Activités de recherche ci-dessus). En Ontario, 28 sites ont été fouillés et 169 l’ont été au Québec et dans les Maritimes. Dans le cadre des inventaires de l’érioderme boréal (Erioderma pedicellatum) en cours depuis 2003, des personnes pouvant identifier l’A. colpodes ont effectué des recherches dans plusieurs centaines de forêts marécageuses à érable rouge des basses terres. L’espèce a également été cherchée dans une forêt mélangée de feuillus située à proximité (Neily, comm. pers., 2014). Enfin, le ministère de l’Environnement de la Nouvelle-Écosse a établi 50 placettes permanentes d’échantillonnage des lichens en lien avec la qualité de l’air entre 2004 et 2008 dans une forêt de feuillus tolérants située en terrain élevé. Jusqu’à maintenant, l’A. colpodes n’a pas été découvert dans les placettes.
Il semble qu’à l’heure actuelle toutes les occurrences existantes d’A. colpodes se trouvent en Nouvelle-Écosse, puisque de nouvelles visites effectuées pour les occurrences du XIXe siècle en Ontario et au Québec et pour celles du Nouveau-Brunswick qui remontent à une décennie ou plus n’ont pas permis de confirmer la présence de l’A. colpodes dans ces provinces (tableaux 1 et 2). En Nouvelle-Écosse, les occurrences incluent 12 occurrences visitées à nouveau (tableau 1, partie 1), 35 découvertes récentes (tableau 1, partie 2) et 53 découvertes antérieures à 1983 (tableau 3) qui ont été révélées après que le travail sur le terrain pour le présent rapport a été terminé. La meilleure estimation possible du nombre maximal d’occurrences existantes à l’heure actuelle est de 88. La population d’individus matures a été recensée aux neuf occurrences (tableau 2). Cent cinquante-neuf colonies ont été trouvées, la taille moyenne de la population étant de 18 colonies à chacune des occurrences et l’écart-type étant de 24. L’extrapolation de ces chiffres aux 88 occurrences ci-dessus indique que la population d’A. colpodes compte 1 584 individus au Canada, mais qu’elle pourrait atteindre 3 696 individus (18 + 24 x 88). Il est probable que l’A. colpodes ne soit plus présent à un nombre important de sites découverts avant 1983, mais d’autres travaux sur le terrain en Nouvelle-Écosse révéleront vraisemblablement des occurrences supplémentaires qui pourraient compenser ces pertes.
L’Anzia colpodes n’a de toute évidence jamais été abondante en Ontario et au Québec, et ne pousse plus dans l’une ou l’autre province. La même chose est vraie au Nouveau-Brunswick, où il n’y a que quelques observations historiques qui remontent toutes à plus d’une décennie. L’absence de nouvelles occurrences en Ontario, au Québec et au Nouveau-Brunswick ainsi que l’incapacité de retrouver le lichen à des sites antérieurs ayant fait l’objet d’un nouveau relevé semblent indiquer que le déclin des populations de l’est du Canada est réel. La présence répandue, mais non commune, de l’A. colpodes en Nouvelle-Écosse et sa disparition de certains sites récents (depuis 1995) indiquent que le déclin est moins rapide dans cette province. Si seules les découvertes les plus récentes en Nouvelle-Écosse sont prises en compte, le lichen ne se trouvait plus à trois des sept occurrences postérieures à 2006 qui ont été visitées à nouveau, ce qui représente un déclin de 40 % environ par rapport à la dernière décennie. Si les sites qui ont été découverts depuis 1995 sont inclus, le déclin est de 50 % (5/10, tableau 2). Cependant, ces déclins reposent sur l’examen d’un petit nombre d’occurrences. De plus, 23 sites historiques découverts depuis 1995, et 51 autres découverts entre 1980 et 1994 en Nouvelle-Écosse (et un au N.-B.) n’ont pas été visités à nouveau (tableaux 2, 3), de sorte que les taux de déclin doivent être traités avec prudence. Compte tenu du déclin observé de certaines colonies, des menaces actuelles et des tendances en matière d’habitat, un déclin continu d’au moins 30 % de la population de ce lichen est inféré.
Dans la plus grande partie des États-Unis, l’aire de répartition rétrécit et l’A. colpodes devient moins fréquent, les occurrences étant formées de petits thalles qui portent peu d’apothécies, sinon aucune. Ce lichen est présumé disparu de l’Ohio et sa présence dans l’État de New York doit être confirmée (Harris, 2004, annexe 2). Il est gravement en péril au Wisconsin et au Michigan, où un seul spécimen par État a été trouvé depuis 1997 (Bennett et Will-Wolf, comm. pers., 2014). Les raisons de ce changement de l’abondance dans les États américains limitrophes du Canada sont incertaines, mais peuvent être liées à la perturbation de l’habitat et à la modification du régime climatique (voir la section Menaces). Hinds et Hinds (2007) ont fait une liste de 22 espèces, dont A. colpodes, qui sont rares ou en déclin en Nouvelle-Angleterre. L’impossibilité de trouver A. colpodes dans le parc national Acadia, au Maine, où elle a déjà été présente (Cleavitt et al., 2009), peut-être en conséquence de la modification des pratiques forestières (Root et al., 2007), est particulièrement préoccupante.
Dans les régions méridionales plus chaudes des États-Unis, rien n’indique un déclin au cours des deux dernières décennies (Doug Ladd, comm. pers., 2014). Dans le plateau des monts Ozark, l’A. colpodes croît en général sur les branches inférieures du couvert et la partie supérieure des fûts des chênes, mais il n’est jamais abondant. Il semble que l’espèce ait été plus commune par le passé, plus d’une centaine de spécimens se trouvant dans l’herbier du Jardin botanique de New York (James Lendemer, comm. pers., 2013). Les spécimens anciens (jusqu’au milieu du XXe siècle et) sont plus souvent fertiles que les spécimens contemporains, bien qu’aucun déclin des occurrences ne se soit produit dans cette région des États-Unis (Ladd, comm. pers., 2014).
L’Anzia colpodes pourraitvraisemblablementêtre transporté vers des sites propices au Canada depuis l’Ohio, le Michigan, le Wisconsin, l’État de New York ou le Maine. Cette espèce est toutefois considérée comme disparue du Wisconsin et de l’Ohio; de plus, il n’y a qu’un seul site au Michigan et dans l’État de New York, et cinq sites dans le Maine (figure 2) (Hinds et Hinds, 2007). Les distances en cause sont grandes et l’absence de propagules végétatives signifie qu’une algue compatible devrait se trouver sur l’écorce sur laquelle les ascospores du lichen se posent. L’immigration à partir des populations américaines, qui déclinent de toute façon, est donc très improbable.
L’impact des diverses menaces auxquelles l’A. colpodes est confronté a été évalué à l’aide du calculateur des menaces et a été coté élevé à très élevé (annexe 1). L’exploitation forestière et la récolte du bois ont été considérées comme la plus grande menace, alors que celles que représentent les gastéropodes indigènes et exotiques et les changements climatiques ont été considérées comme généralisées, bien que leur impact global soit inconnu. La nature et la gravité des menaces pouvant mener à la disparition de ce lichen à des occurrences particulières ne sont pas bien comprises (voir le tableau 2). L’impact des activités forestières est lié à l’abattage d’arbres pour la production de biomasse énergétique, de pâte à papier et de grumes de sciage. Les menaces qui pèsent sur l’A. colpodes sont analysées ci-après.
En Nouvelle-Écosse, les activités forestières menacent l’A. colpodes parce qu’elles entraînent l’élimination d’arbres hôtes ou d’arbres qui pourraient être colonisés dans les peuplements forestiers avoisinants, comme des recherches effectuées ailleurs sur des lichens épiphytes l’ont montré (Edman et al., 2008). Entre 1990 et 2000, la récolte annuelle de bois de feuillus en Nouvelle-Écosse est passée de 400 000 m3 à plus de 800 000 m3. Il s’en est suivi une diminution considérable, de 1998 à 2003, de la superficie des forêts où les arbres ont plus de 60 ans (Nova Scotia Department of Natural Resources, 2008). Il faut vraisemblablement au moins 50 ans avant que les arbres en régénération possèdent l’écorce mature qui semble être le substrat dont cette espèce a besoin. Les peuplements forestiers du comté de Guysborough et des comtés avoisinants subissent à l’heure actuelle une pression particulière. Récemment, une société forestière a demandé à avoir accès à 500 000 tonnes métriques vertes de fibres provenant du territoire domanial dans le sud-ouest de la Nouvelle-Écosse, là où l’A. colpodes est le plus fréquent, mais le gouvernement l’a limitée aux 125 000 tonnes métriques vertes supplémentaires qui avaient déjà été convenues (Gorman et Zaccagna, 2014). La différence viendra probablement de terrains boisés privés.
Au Nouveau-Brunswick, il s’est produit entre 1980 et aujourd’hui une diminution de plus de 20 % de la quantité de vieilles forêts de feuillus, selon une analyse des données de l’inventaire forestier sur le territoire domanial et dans les petites forêts privées en tenure franche qui, ensemble, représentent plus de 80 % des terres forestières au Nouveau-Brunswick (NB DNR, données inédites). La coupe en bandes de forêts de feuillus tolérants de fin de succession est effectuée à l’heure actuelle dans des zones de terrain élevé du Nouveau-Brunswick se trouvant dans l’aire de répartition connue de l’A. colpodes. Des coupes de jardinage secondaires commencent à avoir lieu, si bien que les effets négatifs augmenteront vraisemblablement, compte tenu de la diminution de la quantité de vieux arbres feuillus tolérants (Clayden, 2014).
Cameron et al. (2013) ont conclu que l’exploitation forestière au voisinage du paysage, et à l’intérieur de celui-ci, a eu des effets négatifs sur le microclimat de l’habitat. Les modifications du microclimat nuiront vraisemblablement à la capacité des minuscules spores de l’A. colpodes de germer ou à la capacité de l’algue compatible de croître sur les troncs d’arbre disponibles possédant l’écorce convenant à l’espèce.
L’utilisation de la biomasse pour la production d’énergie a entraîné en Nouvelle-Écosse l’enlèvement d’arbres pour lesquels l’intérêt commercial était auparavant limité. Ces arbres sont l’érable rouge, le frêne blanc et les espèces du genre Amelanchier qui poussent sur des pentes en terrain élevé relativement accessibles et dans des forêts marécageuses mixtes à érable rouge. L’élimination de ces essences hôtes limite l’habitat disponible et donc l’établissement à long terme et la survie de l’A. colpodes. L’accroissement des besoins en biomasse découle de la mise en service de la centrale de cogénération de 60 MW de Port Hawkesbury. Cette centrale a besoin de 500 000 tonnes de biocombustible chaque année (Simpson et Plourde, 2011; Bundale, 2012a; King, 2012; Erskine, 2013). Pour fournir ce combustible, il faudra procéder à l’abattage d’arbres dans le territoire domanial et sur des terres privées.
En Nouvelle-Écosse, les propriétaires se tournent également de plus en plus vers les granulés de bois pour chauffer leur maison. La production de granulés utilise surtout des feuillus, ce qui accroît aussi la demande pour des essences qui, auparavant, n’étaient pas récoltées, souvent à un stade de croissance précoce. Le prix du pétrole et du gaz naturel augmentant, la demande pour les granulés de bois et le bois de chauffage augmente. Cette récolte est associée à des changements rapides du paysage dont on pense qu’ils limitent gravement la présence des lichens, compte tenu du fait que ceux-ci ont besoin de coloniser une écorce mature (T. Neily, comm. pers., 2014).
L’établissement de parcs d’éoliennes exige la construction d’un réseau routier important, ce qui peut éliminer ou endommager les peuplements de feuillus en terrain élevé. La fracturation hydraulique (qui fait en ce moment l’objet d’un moratoire au Nouveau-Brunswick et en Nouvelle-Écosse) exige aussi une infrastructure routière et peut avoir des effets négatifs sur les eaux souterraines (voir ci-après).
Au Nouveau-Brunswick, les herbicides sont utilisés pour limiter la régénération des feuillus dans les peuplements de conifères et, en Nouvelle-Écosse, ils le sont dans les zones où poussent des arbres de Noël. L’incidence de leur utilisation sur les zones avoisinantes de forêts et sur l’A. colpodes n’est pas connue, mais des effets négatifs sur l’occurrence et la biomasse ont été observés ailleurs (McMullin et al., 2011, 2013). Les herbicides limitent la régénération des feuillus et peuvent représenter une menace à long terme s’ils empêchent la croissance d’arbres feuillus matures, qui sont les hôtes de l’A. colpodes.
Le broutage par des gastéropodes peut jouer un rôle important dans la formation de la végétation épiphyte des forêts de feuillus. Les jeunes thalles semblent particulièrement en danger (Asplund et Gauslaa, 2008). De très importants dommages causés par les limaces aux lichens épiphytes ont également été signalés dans certaines zones côtières du sud du Nouveau-Brunswick au cours des derniers étés, au parc national Fundy et dans la zone naturelle protégée de la gorge Caledonia (Clayden, comm. pers., 2013). La Nouvelle-Écosse et le Nouveau-Brunswick ont connu des étés inhabituellement humides, surtout en juin et en juillet, ces dernières années. Le nombre de limaces pouvant représenter une menace pour les lichens a donc pu être plus élevé que la moyenne. Les limaces sont actives le matin et le soir, lorsque le temps est humide (Annegret Nicolai, comm. pers., 2014). En ce qui concerne l’A. colpodes en Nouvelle-Écosse, les occurrences situées dans le sud-ouest de la province, où les conditions forestières humides prévalent, courent un grand risque d’être endommagées par les limaces, surtout dans les zones marécageuses. Le risque est moins grand en bordure des milieux humides et encore moins grand dans les milieux en terrain élevé, comme les drumlins. Aux chutes Economy, en Nouvelle-Écosse, des recherches à grande échelle menées en 2013 sous les chutes et au-dessus de celles-ci, où l’A. colpodes avait été observé en 1992, n’ont pas permis de trouver le lichen. Bien que l’écorce des arbres soit sèche près des chutes, les limaces avaient fréquemment brouté les lichens épiphytes. L’A. colpodes semble être une espèce susceptible d’être broutée (figure 7), peut-être parce que les faibles quantités de composés lichéniques de défense contre les herbivores que renferme son thalle ne dissuadent pas les limaces (Asplund et Wardl, 2013; Asplund, comm. pers., 2014) (voir Physiologie et adaptabilité et Relations interspécifiques).
Outre l’abondance accrue de limaces brouteuses indigènes, les Maritimes comptent maintenant deux espèces de limaces introduites, l’Arion subfuscus et le Deroceras reticulatum. Ces limaces sont plus grosses et plus agressives que les espèces indigènes. L’Arion subfuscus a été souvent observé sur des lichens en 2007 (Asplund, comm. pers., 2014). Ces limaces introduites ont été vues en train de manger des espèces rares, dont l’érioderme boréal en Nouvelle-Écosse (Cameron, 2009; R. Forsyth, comm. pers., 2014).
Cameron (2009) a conclu qu’en Nouvelle-Écosse, 80 % des gastéropodes arboricoles qu’il a étudiés étaient des espèces introduites, dont la majorité appartenait au genre Arion. La dominance et l’abondance de l’A. fuscus/subfuscus semblent indiquer qu’il s’agit d’une menace relativement nouvelle pour les lichens et que ces espèces pourraient combler une niche auparavant inoccupée. Ces limaces pourraient représenter une nouvelle menace pour les lichens ou supplanter les espèces de limaces indigènes. Quoi qu’il en soit, il s’agit vraisemblablement d’un problème pour les lichens dans les Maritimes (Cameron, comm. pers., 2014).
Les occurrences en Ontario et au Québec où l’A. colpodes a été observé au XIXe siècle ont subi de grands changements. L’étalement de la banlieue, les terrains à bâtir et les routes ont fait disparaître la forêt où ce lichen poussait autrefois. Les occurrences au Québec semblent aussi avoir été très perturbées, car la forêt est perturbée par de nombreux sentiers et par l’activité humaine (voir aussi Activités de recherche).
Les occurrences au Nouveau-Brunswick et en Nouvelle-Écosse où l’A. colpodes a été observé par le passé n’ont pas souffert ainsi parce que la population humaine y est plus petite, que sa densité est plus faible et que le lent étalement urbain n’a pas empiété beaucoup sur l’habitat de l’espèce.
La recherche de nouvelles sources d’énergie, dont la biomasse, le gaz naturel obtenu par fracturation hydraulique et les parcs d’éoliennes, nécessite toujours des routes d’accès dans des terrains boisés. Bien que ces activités utilisent souvent des chemins forestiers existant déjà avec de courtes dérivations, elles peuvent modifier l’hydrologie des bassins versants. Ce fait est important, car l’A. colpodes croît sur les érables rouges et d’autres feuillus qui poussent dans des marécages, en bordure de marécages et dans des zones en terrain élevé maintenues humides par des plans d’eau avoisinants. Les activités de fracturation hydraulique peuvent de plus modifier la stabilité géologique et l’écoulement des eaux souterraines (Entrekin et al., 2011; Bundale, 2012b). À l’heure actuelle, la fracturation hydraulique est suspendue en Nouvelle-Écosse et au Nouveau-Brunswick. Enfin, la construction d’un pipeline qui amènera du pétrole brut de l’Alberta au Nouveau-Brunswick est prévue, ce qui exigera qu’un nouveau corridor soit dégagé de la frontière du Québec à Saint John (Anon., 2014a).
La pollution atmosphérique, qui peut acidifier l’écorce ou avoir une incidence négative sur la croissance des lichens, pourrait avoir joué un rôle dans la disparition de l’A. colpodes en Ontario et au Québec ou la disparition des occurrences près de Saint John, au Nouveau-Brunswick. Les polluants incluent les pluies acides transfrontalières et les émissions locales de dioxyde de soufre. Des arbres comme l’érable rouge et divers frênes ont une écorce dont le pH est élevé, mais les polluants mentionnés ci-dessus peuvent acidifier l’écorce et annuler son pouvoir tampon de sorte qu’elle ne puisse plus être colonisée (Nieboer et al., 1984). L’A. colpodes,dont le symbiote est une algue verte, est moins sensible aux effets directs de ces polluants que les cyanolichens, comme le Degelia plumbea et l’Erioderma pedicellatum. L’A. colpodes semble avoir besoin d’un équilibre délicat entre l’adéquation et l’âge du substrat associé à des conditions microclimatiques favorables (combinaison d’humidité suffisante et de température appropriée). Ces facteurs sont nécessaires pour que des souches d’algues croissent sur l’écorce des arbres et soient colonisées par les minuscules spores de l’A. colpodes.
Comme nous l’avons indiqué précédemment (voir Tendances en matière d’habitat, ci-dessus), les prévisions indiquent clairement que des changements climatiques importants se produiront en Nouvelle-Écosse (figure 6) dans les zones colonisées par l’A. colpodes. Un nombre accru de phénomènes météorologiques extrêmes, de tempêtes et d’inondations est également prévu. Leur impact est incertain, puisque le renversement des arbres qui en résulte pourrait, s’il n’est pas trop répandu, améliorer les niveaux de luminosité et rendre les conditions plus adéquates pour l’A. colpodes. Par contre, l’augmentation des précipitations peut accroître la propagation et l’impact des mollusques brouteurs, et l’accroissement des températures estivales peut avoir un effet négatif sur la capacité de reproduction de ce lichen. L’A. colpodes est plus sensible que de nombreux autres lichens aux changements du régime climatique parce qu’il ne possède pas de moyen de reproduction végétative et que ses minuscules spores disposent de peu de ressources pour croître et trouver un partenaire algal compatible (voir Cycle vital et reproduction). Au Nouveau-Brunswick, des températures plus chaudes et des précipitations accrues sont aussi prévues, ainsi qu’un plus grand nombre de pluies extrêmes et de tempêtes violentes (Anon., 2014b).
Il est impossible de prévoir quelles occurrences seront touchées par les diverses menaces à un moment donné, et les principales menaces menant à la disparition de ce lichen ne sont pas bien comprises. La meilleure estimation que l’on puisse faire consiste donc à considérer que le nombre de localités est égal au nombre total d’occurrences connues. À l’heure actuelle, il semble que toutes les occurrences existantes se trouvent en Nouvelle-Écosse, puisque les nouvelles visites aux occurrences du XIXe siècle en Ontario et au Québec et à celles qui datent d’une décennie ou plus au Nouveau-Brunswick n’ont pas permis de confirmer la présence de l’A. colpodes dans ces provinces (tableaux 1 et 2).
Les occurrences en Nouvelle-Écosse incluent 12 sites visités à nouveau (tableau 1, partie 1), 35 découvertes récentes (tableau 1, partie 2) et 53 découvertes antérieures à 1983 (tableau 3) qui ont été révélées après que le travail sur le terrain pour le présent rapport a été terminé. La meilleure estimation possible du nombre maximal d’occurrences existantes est donc de 88, c’est-à-dire qu’il est inférieur à 100, et puisqu’il n’est pas possible de prévoir lesquelles seront touchées par les diverses menaces à un moment donné, chacune des occurrences est considérée comme une localité distincte.
L’A. colpodes n’est pas commun, mais l’espèce est largement dispersée. Il n’y a pas de données génétiques qui permettraient d’estimer les distances de dispersion, et les caractéristiques du cycle vital (voir Biologie et Dispersion) donnent à penser que la dispersion est limitée. Nous concluons par conséquent que chacune des occurrences correspond à une sous-population indépendante, du moins sur une seule ou sur quelques générations.
À l’échelle mondiale, NatureServe a attribué à l’espèce la cote G3 (vulnérable)/G5 (non en péril); cette cote a été revue pour la dernière fois le 5 décembre 2000 et a été modifiée pour la dernière fois le 21 janvier 2001. La cote mondiale arrondie est G4 (apparemment non en péril).
Au Canada, NatureServe a attribué à l’espèce la cote NNR (non classée), tandis qu’en Ontario, l’espèce est cotée SH (peut-être disparue). Au Québec, l’espèce est cotée SNR (pas encore évaluée) (CESCC, 2011; NatureServe, 2014).
Aux États-Unis, la cote nationale de l’espèce est NNR (non classée); au Michigan, en Caroline du Nord et en Pennsylvanie, elle est cotée SNR (pas encore évaluée), mais au Wisconsin, elle est cotée SX (présumée disparue), tout comme en Ohio (Showman et Flenniken, 2002). Cependant, une mention a récemment été consignée au Wisconsin (2002), de sorte que le statut pourrait être modifié pour S1 (gravement en péril) (Jim Bennett, comm. pers., 2014). Quelques mentions seulement d’A. colpodes ont été consignées en Géorgie et il est probable que l’espèce sera cotée S1 (gravement en péril) ou S2 (en péril) en 2015-2016, après examen par le Department of Natural Resources de Géorgie (Malcolm Hodges, comm. pers.).
À l’heure actuelle, l’A. colpodes nebénéficie d’aucune protection ni d’aucun statut juridique au Canada.
Certaines occurrences en Nouvelle-Écosse sont protégées parce qu’elles se trouvent dans des réserves intégrales bénéficiant de la protection de la province ou dans des parcs nationaux ou provinciaux.
Un grand nombre de collègues ont aidé les rédacteurs du présent rapport à répertorier les occurrences et la répartition de l’A. colpodes au Canada et aux États-Unis. Les rédacteurs remercient les personnes suivantes d’avoir généreusement pris le temps de les aider.
Nous remercions Claude Roy, botaniste à l’Herbier Louis-Marie de Université Laval.
Nous remercions Wayne Clifford, Steven Selva, Martin Turgeon et Reginald Webster de s’être joints à Stephen Clayden pour certaines excursions sur le terrain, et à Gerry Redmond d’avoir donné accès à sa terre à bois.
Nous remercions Rosemary Curley d’avoir facilité les relevés des lichens, en particulier dans le boisé Townshend.
Nous remercions particulièrement Tom Neily et Chris Pepper d’avoir donné accès aux renseignements qu’ils ont recueillis sur l’A. colpodes dans le cadre des relevés exhaustifs des lichens qu’ils ont effectués en Nouvelle-Écosse et d’avoir accompagné Frances Anderson pendant certaines excursions sur le terrain.
Des membres de l’atelier Tuckerman sur les lichens et un grand nombre de collègues ont aidé à répertorier les occurrences et la répartition de l’Anzia colpodes, notamment :
Au Canada : Irwin Brodo, Jennifer Doubt
Aux États-Unis : Jim Bennett, Bill Buck, Bob Dirig, Scott LaGreca, Alan Friday, Dick Harris, Alan Fryday, Malcom Hodges, Doug Ladd, Elizabeth Lay, Jim Hinds, Malcolm Hodges, Doug. Ladd, James Lawrey, Les Landrum, James Lendemer, Tom Nash, Michaela Schmull, Larry St. Clair
En Finlande : Teuvo Ahti
En Norvège : Johan Asplund et Yngvar Gauslaa
En Nouvelle-Zélande : David Galloway
Au Royaume-Uni : Mark Seaward, Rebecca Yahr, Heidi Doring
En Suède : Leif Tibell
En Suisse : Christoph Scheidegger
Ahmadjian, V 1993. The Lichen Symbiosis. John Wiley and Sons, New York, p. 33.
Anon. 2008a. The Public Forest: State of the Forest Report [PDF], New Brunswick. (Également disponible en français : Anon. La forêt publique – Rapport sur l’état des forêts 2008 [PDF], Nouveau-Brunswick.
Anon. 2008b. A strategy for crown lands forest management, New Brunswick [PDF; 508 Ko] (Également disponible en français : Anon. Stratégie de gestion des forêts de la Couronne, Nouveau-Brunswick [PDF; 526 Ko].
Anon. 2014a. Energy East pipeline Project (en anglais seulement).
Anon. 2014b. New Brunswick climate change action plan, 2014-2020 [PDF; 382 Ko]. (Également disponible en français : Anon. Plan d’action du Nouveau-Brunswick sur les changements climatiques, 2014-2020 [PDF; 419 Ko].
Asplund, J. et Wardle, D.A. 2013 The impact of secondary compounds and functional characteristics on lichen palatability and decomposition. Journal of Ecology 101:689-700.
Asplund, J. et Gauslaa, Y. 2008 Mollusc grazing limits growth and early development of the old forest lichen Lobaria pulmonaria in broadleaved deciduous forests. Oecologia 155, 93–99.
Beck, A. 2002.Selektivat der Symbiotenschwer-metalltoeranterFlechen. Thèse, Munich.
Bratt, G.C., Blackman, A.J. et Cashin, J.A. 1976. The genus Anzia in Tasmania. Lichenologist 8;69-77.
Brodo, I.M., Sharnoff, S,D. et Sharnoff, S. 2001. Lichens of North America. Yale University Press, New Haven, 795 pp.
Budel, B. et Scheidegger, C. 2008. Thallus morphology and Anatomy. In Lichen Biology (T.H.Nash, ed.) Cambridge University Press, Cambridge, p. 62.
Bundale, B. 2012a. Mill gets millions in N.S. cash (en anglais seulement). 20 août.
Bundale, B. 2012b. Energy Company: Exploration didn’t cause N.B. quake. Chronicle Herald, March 13: C1.
Cameron, R.P. 2009. Red maple, Acer rubrum, wetland composition and structure in Nova Scotia. Canadian Field Naturalist 123: 221-229.
Cameron, R.P. 2009. Are non-native gastropods a threat to endangered lichens? Canadian Field Naturalist 123: 169-171.
Cameron, R.P., Neily, T. et Clayden, S.R. 2011. Distribution model for Erioderma mollissimum in Atlantic Canada. The Bryologist 114: 231-238.
Cameron, R.P., Neily, T. et Clapp, H. 2013. Forest harvesting impacts on mortality of an endangered lichen at the landscape and stand scales. Canadian Journal of Forest Research 43: 507-511.
Clayden, S. R. 2010. Lichens and allied fungi of the Atlantic Maritime Ecozone. Pp. 153-178. In D. F. McAlpine et I. M. Smith (eds.), Assessment of Species Diversity in the Atlantic Maritime Ecozone. NRC Research Press, National Research Council Canada, Ottawa.
Clayden, S.R. 2014. Old tolerant hardwood forests in New Brunswick going down fast. New Brunswick Naturalist pp. 60-66.
Cleavitt, N.L., Dibble, A.C. et Werier, D.A. 2009. Influence of tree composition upon epiphytic macrolichens and bryophytes in old forests of Acadia National Park, Maine. Bryologist 112.467-487.
Culberson, W.L. 1961 A second Anzia in North America. Brittonia13:381-384.
Crespo. A., Lumbsch, H.T., Mattsson, J., Blanco, O., Divakar, P.K., Articus, K., Wiklund, E., Bawingan, P.A. et Wedin, M. 2007. Testing morphology-based hypotheses of phyologenetic relationships in Parmeliaceae (Ascomycota) using three ribosomal markers and the nuclear RPB1 gene. Molecular Phylogenetics and Evolution, 44:812-824.
Culberson, W.L. Disjunctive distributions in the lichen-forming fungi. 1972. Annals of the Missouri Botanical Garden 59:165-173.
Culberson, W.L. 1961. A second Anzia in North America. Brittonia13:381-384.
Davis, D. et S. Browne. 1996. Natural History of Nova Scotia 2 volumes. Nimbus Publishing. Halifax. 502 pp.
Edman, M., Eriksson, A. et Villard, M. 2008. Effects of selection cutting on the abundance and fertility of indicator lichens Lobaria pulmonaria and Lobaria quercizans. Journal of Applied Ecology 45:26-33.
Entrekin, S., Evans-White, M., Johnson, B. et Hagenbuch, E. 2011. Rapid expansion of natural gas development poses a threat to surface waters. Frontiers in Ecology and the Environment 9:503–511.
Erskine, B. 2013. NSP biomass site aims for 4% of power needs of N.S: plant in operation after test. Chronicle Herald, Halifax, B2, July 3rd.
Esslinger, T.L. et Egan, R.S. A sixth checklist of the lichen-forming, lichenicolous and allied fungi of the Continental United States and Canada. Bryologist 98:467-549.
Forcier, L.K. 1975. Re-productive strategies and the co-occurrence of climax tree species. Science 189 : 808-810.
Fournier, R. 2006. Liste des lichens de l'est du Canada. Université de Moncton [PDF; 152 Ko], Campus d'Edmundston. 38 p. (Téléchargé en avril 2010).
Gauslaa, Y. (2008) Mollusc grazing may constrain the ecological niche of the old forest lichen Pseudocyphellaria crocata. Plant Biology 10: 711–717.
GBIF (Global Biogeographic Information Facility) 2014. Anzia Colpodes (en anglais seulement).
Gorman, M. et Zaccagna, R. 2014. No Bail-out for Northern Pulp. Chronicle Herald (en anglais seulement) January 30.
Goward, T., Brodo, I.M. et Clayden, S.R. 1998. Rare lichens of Canada: a review and provisional listing. Committee on the Status of Endangered Wildlife in Canada, Ottawa. 74 pp.
Hale, M.E. 1955. Studies on the chemistry and distribution of North American lichens (1-5) The Bryologist 58:242-246.
Hale, M. E. 1979. How to Know the Lichens. Second Edition.
Harris, R.C. 2004. A Preliminary List of the Lichens of New York. Opuscula Philolichenum 1: 55-74, see p. 71.
Hensen, A. et Dobelmann, A. 1987. Development of the spongiostratum in Anzia and Pannoparmelia. In Progress and Problems in Lichenology in the Eighties. Bibliotheca Lichenologica 25:103-108.
Hinds, J.W. et Hinds, P.L. 2007.The Macrolichens of New England. New York Botanical Garden Press, New York, pp 51 and 123.
Honegger, R et Schearrer, S. 2008. Sexual Reproduction in lichen-forming Ascomycetes. In Lichen Bology, T.H. Nash, ed. Cambridge University Press, Pp. 94-103.
Jahns, H.M. 1988. The lichen thallus. In CRC Handbook of Lichenology. ( M. Galun ed.) CRC Press, Boca Raton, Vol 1, p. 127.
Jayalal, U., Wolseley, P., Gueidan, C., Aptroot, A., Wijesundara, S. et Karunaratne, V. 2012. Anzia mahaeliyensis and Anzia flavotenuis, two new lichen species from Sri Lanka. Lichenologist 44:381-389.
Juriado, I., Liira, J., Csencsics, D., Widmer, I., Adolph, C., Kohu, K. et Scheidegger, C., 2011. Dispersal ecology of the endangered woodland lichen bggg in a managed hemiboreal forest landscape. Biodiversity and Conservation 20:1803-1819.
King, N. 2012. Nova Scotia Power wants to talk to potential biomass suppliers. Cape Breton Post Business Section, 20th September.
Larsson, P. et Gauslaa, Y. 2010. Rapid juvenile development in old forest lichens. Botany 89:65-72.
Lawrey, J.D. 1984. Biology of Lichenized Fungi, Praeger Scientific, New York, pp 5-8; 236-244.
LeBlanc, F. 1960. Écologie et phytosociologie des épiphytes corticoles du sud du Québec. Thèse de doctorat. Université de Montréal.
LeBlanc, F. 1963. Quelques sociétés ou unions d’épiphytes du sud du Québec. Canadian Journal of Botany41: 591-638.
Lines, G.S., Pancura, M., lander, C. et Titus, L. 2009. Climate change scenarios for Atlantic Canada ustilizing a statistical downscaling model based on two global climate models. Meterological Service of Canada, Atlantic Region, Science Report Series 2009-01, Dartmouth 17 pp.
Maass, W.S.G. Hoisington, B.L. et Harries, H. 1986. Pannaria lurida in Atlantic Canada. Proceedings of the Nova Scotian Institute of Science 36:131-135.
Macoun, J. 1902. Catalogue of Canadian Plants, Part VII- Lichenes and Hepaticae, Geological Survey of Canada, Government Printing Bureau, Ottawa, p.71.
McMullin, R.T. 2013. An Interim Survey of Pysconia subpallida in Canada A report prepared for the Canadian Wildlife Federation, 36 pp.
McMullin, R.T.; Thompson, I.D.; Newmaster, S.G. 2013. Lichen conservation in heavily managed boreal forests. Conservation Biology 27:1020-1030.
McMullin, R.T., Bell, W.F. et Newmaster, S.G. 2011. The effects of triclopyr and glyphosate on lichens. Forest Ecology and Management264: 90-97.
McMullin, R.T., Duinker, P.N., Cameron,R.P. Richardson, D.H.S. et Brodo, I.M. 2008. Lichens of coniferous old-growth forests of southwestern Nova Scotia, Canada; diversity and present status. The Bryologist 111: 620-637.
McMullin, R.T. 2009. Lichens of Kejimkujik National Park and National Historic Site, Nova Scotia, Canada (Prov isional List). Opuscula Philolichenum 7: 71-78.
Muggia, L., Schmitt, I. et Grube, M. 2009. Lichens as treasure chests of natural products. SIM News, May/June, pp. 85-97.
NatureServe (2014) (en anglais seulemment).
Nieboer, E., McFarlane, J.D. et Richardson, D.H.S. 1984. Modification of plant cell buffering capacities by gaseous air pollutants. pp. 313-333, In Koziol, M., and F.R. Whatley (eds.), Gaseous Air Pollutants and Plant Metabolites, Butterworths, London.
Nova Scotia Department of Natural Resources. 2008. State of the Forest Report 1995-2005. Report FOR 2008-3. Nova Scotia Department of Natural Resources, Halifax, p. 40.
Opanowicz, M. et Grube, M. 2004. Photobiont variation in Flavocetraria nivalis from Poland (Parmeliaceae, Lichenized Ascomycota). Lichenologist36:125-131.
Palmqvist, K., Dahlman, L., Jonsson, A et Nash, T.H. 2008. The carbon economy of lichens. In Lichen Biology, (T.H. Nash Ed.). Cambridge University Press, pp 182-215.
Park, Y.S. 1990. The macrolichen flora of South Korea. Bryologist 93:105-160.
Phillips, H.C. 1970. An annotated list of foliose and fruticosse lichens in land between the lakes. Journal of the Tennessee Academy of Science 45:97-109.
Poelt J. 1963. Flechtenflora und Eiszeit in Europa. PhytonAnnalesReiBotanicae 10:206-215.
Price D.T., McKenney, D.W.,. Papadopol, P., Logan, T. et Hutchinson., M.F. 2004. High Resolution Future Scenario Climate Data for North America.26th Conference on Agricultural and Forest Meteorology. Sunday, 22 August 2004.
Rikkinen, J. 1997. Habitat shifts and morphological variation
Rikkinen, J et Poinar, G.O. 2002. FossilisedAnzia (Lecanorales, lichen-forming Ascomycota) from European Tertiary amber. Mycological Research 106:984-990.
Root, H.T., McGee, G.G. et Nyland R.D. 2007. Effects of two silvicultural regimes with large tree retention on epiphytic macrolichen communities in Adirondack northern hardwoods, New York, USA. Canadian Journal of Forest Research 37:1854-1866.
Rikkinen, J. (1997). Habitat shifts and morphological variation of Pseudevernia furfuracea along a topographic gradient, Symbolae Botanicae Upsalienses 32:223-245
Rikkinen, J. et Poinar, G.O. 2002. Fossilised Anzia (Lecanorales, lichen-forming Ascomycota) from European Tertiary amber. Mycological Research 106:984-990.
Rundel, P.W. 1988. Water Relations. In CRC Handbook of Lichenology (M. galun ed.) CRC Press, Boca Raton, Vol 2:17-36.
Scheidegger, C. et Goward, T. (2002). Monitoring lichens for conservation: red lists and conservation action plans. In Monitoring with lichens – Monitoring lichens (P.L. Nimis, C. Scheidegger et P.A. Walseley eds.) Kluwer Academic, Dordrecht pp. 163-181
Seaward, M.R.D. 2008. Environmental role of lichens. In Lichen Biology, 2nd edition. (T.H. Nash, ed), Cambridge University Press, Cambridge, pp. 274-298.
Showman, R.E. et Flenniken, D.G. 2004. The Macrolichens of Ohio. Ohio Biological Survey, Columbus, p. 29.
Simpson, J. et Plourde, R. 2011. Nova Scotia achieves the worst possible scenario for biomass energy. Ecology Action Centre, Jan. 26. Halifax.
Thell, A., Feurer, T., Karnfelt, I., Myllys, L. et Stenroos, S. 2004. Monophyletic groups within the Parmeliaceae identified by ITS rDNA, B-tubulin and GAPDH sequences. Mycological Progress 34:297-314.
Yoshimura, I et Kurokawa T. 1977. Sensitivities of thin-layer chromatographic tests for some lichen substances. Bulletin Kochi Gakuen Junior College 8:27-31.
Yoshimura, I. 1987. Taxonomy and speciation of Anzia and Pannoparmelia. In Progress and Problems in Lichenology in the Eighties. Bibliotheca lichenologica 25:185-195.
Yoshimura, I., Singh, K.P. et Elix, J.A. 1997. The genus Anzia (lichenized Ascomycetes) in India. Journal of the Hattoria Botanical Laboratory 82:342-352.
David Richardson est doyen émérite à l’Université Saint Mary’s (Saint Mary’s University). Il étudie les lichens depuis 1963 et est le seul auteur de deux livres sur le sujet : The Vanishing Lichens et Pollution Monitoring with Lichens. Il a également écrit plus d’une vingtaine de chapitres de livres et d’une centaine d’articles scientifiques sur divers aspects de la lichénologie. Il a étudié les lichens en Australie, au Canada, en Irlande et au Royaume-Uni.
Frances Anderson est agrégée de recherche au Nova Scotia Museum of Natural History, à Halifax. Elle étudie les lichens de Nouvelle-Écosse sur le terrain depuis plus de cinq ans et elle possède une vaste expérience des relevés lichénologiques. Elle travaille actuellement à une liste des macrolichens de la province.
Robert Cameron étudie les lichens depuis plus de dix ans. Ses premiers travaux ont porté sur les effets des pratiques forestières sur ces organismes, dans le cadre d’une maîtrise en biologie à l’Université Acadia (Acadia University). Depuis quelques années, M. Cameron s’intéresse aux effets de la pollution atmosphérique sur les lichens, aux cyanolichens des forêts côtières et plus particulièrement à l’érioderme boréal. Il est actuellement l’écologiste de la Protected Areas Branch du Department of Environment and Labour de la Nouvelle-Écosse, où il est chargé du programme de recherches sur les aires protégées.
Stephen Clayden est conservateur de la botanique au Musée du Nouveau-Brunswick. C’est un naturaliste de longue date qui a commencé à s’intéresser aux lichens pendant ses études de premier cycle à l’Université Mount Allison (Mount Allison University). Il a étudié la dynamique des communautés riches en lichens en Abitibi, au Québec, pour sa maîtrise ès sciences et a obtenu son doctorat au Kings College (Londres, R.-U.) pour des recherches sur le cycle vital des espèces du genre Rhizocarpon. Il a recueilli des lichens partout au Canada atlantique et au Québec afin de les étudier; il est coauteur, avec Trevor Goward et Irwin Brodo, de The Rare Lichens of Canada: A Review and Provisional Listing.
Troy McMullin est boursier de recherches postdoctorales à l’Université de Guelph (Guelph University). Il a commencé à étudier les lichens en 2004, pendant sa maîtrise à l’Université Dalhousie (Dalhousie University), où il a examiné les lichens dans les vieilles forêts acadiennes. Pendant son doctorat, il a examiné la conservation et la gestion des lichens dans la forêt boréale de l’Ontario, ce qu’il continue de faire. En tant que consultant, Troy collabore régulièrement avec diverses organisations qui font l’inventaire des lichens et les utilisent pour la surveillance écologique. Ses études sur les lichens l’ont mené de la Californie et de Haida Gwaii aux Maritimes et aux Everglades. Troy est également le gestionnaire des collections de lichens à l’Institut de la biodiversité de l’Herbier de l’Ontario (Biodiversity Institute, Ontario Herbarium).
Les rédacteurs ont consulté les mentions d’A. colpodes dans les herbiers et sites Web ci-dessous.
Musée canadien de la nature, Ottawa.
The Consortium of North American Lichen Herbaria CPALH
Herbier Louis-Marie, Université Laval, Québec
Musée de la Nouvelle-Écosse, Halifax
Musée du Nouveau-Brunswick, Saint John
De plus, les rédacteurs ont communiqué avec les lichénologues américains et internationaux dont le nom est mentionné à la section Remerciements et avec les membres de l’atelier Tuckerman pour obtenir des précisions sur les collections d’A. colpodes dans leur herbier privé ou l’herbier de leur université.
Nom scientifique de l'espèce ou de l'écosystème : Anzia colpodes, Anzie mousse-noire
Identification de l'élément :
Code de l'élément :
Date (Ctrl + ";" pour la date d'aujourd'hui) : 04/06/2014
Évaluateurs : David Richardson, Dwayne Lepitzki, Dave Fraser, Mary Sabine, Vivian Brownell, Sherman Boates, Jean Gagnon, Marie-France Noel, Stephen Clayden, Frances Anderson, Robert Cameron, Julie Perrault
Références :
| Impact des menaces | Comptes des menaces de niveau 1 selon l'intensité de leur impact Maximum de la plage d’intensité |
Comptes des menaces de niveau 1 selon l'intensité de leur impact Minimum de la page d’intensité |
|---|---|---|
| A - Très élevé | 0 | 0 |
| B - Élevé | 2 | 0 |
| C - Moyen | 0 | 1 |
| D - Faible | 2 | 3 |
Impact global des menaces calculé :
- Comptes des menaces de niveau 1 selon l'intensité de leur impact - Maximum de la plage d’intensité : Très élevé
- Comptes des menaces de niveau 1 selon l'intensité de leur impact - Minimum de la page d’intensité : Élevé
Valeur de l'impact global attribuée : AB = Très élevé – Élevé
Ajustement de la valeur de l'impact – justification : Le lichen n'était plus présent dans 17 des 22 sites visités à nouveau, ce qui représente une diminution ~ 70 % en N. É.; il n'est plus présent en Ont., au Qc ou au N. B.
Impact global des menaces – commentaires : Espèce de lichen répandue, mais non commune, qui semble être en voie de disparaître dans une bonne partie de son aire de répartition au Canada et dans les États avoisinants des É. U. La combinaison des menaces qui a mené à cet état de choses est difficile à définir.
| [No.] | Menace | Impact (calculé) | Impact (calculé) | Portée (10 prochaines années) | Gravité (10 ans ou 3 générations) | Immédiateté | Commentaires |
|---|---|---|---|---|---|---|---|
| 1 | Développement résidentiel et commercial | - | Négligeable | Négligeable (< 1 %) | Extrême (71-100 %) | Élevée (continue) | - |
| 1.1 | Zones résidentielles et urbaines | - | Négligeable | Négligeable (< 1 %) | Extrême (71-100 %) | Élevée (continue) | La destruction de l'habitat consécutive au développement résidentiel semble avoir eu un grand impact sur les populations de ce lichen par le passé en Ontario et au Québec. |
| 1.2 | Zones commerciales et industrielles | - | - | - | - | - | s.o. |
| 1.3 | Zones touristiques et récréatives | - | Négligeable | Négligeable (< 1 %) | Modérée (11-30 %) | Élevée (continue) | L'aménagement de sentiers en Nouvelle-Écosse a eu et a encore un impact sur une petite superficie. |
| 2 | Agriculture et aquaculture | - | - | - | - | - | s.o. |
| 2.1 | Cultures annuelles et pérennes de produits autres que le bois | - | - | - | - | - | - |
| 2.2 | Plantations pour la production de bois et de pâte | - | - | - | - | - | - |
| 2.3 | Élevage de bétail | - | - | - | - | - | - |
| 2.4 | Aquaculture en mer et en eau douce | - | - | - | - | - | - |
| 3 | Production d'énergie et exploitation minière | - | Négligeable | Négligeable (< 1 %) | Extrême (71-100 %) | Modérée (peut-être à court terme, < 10 ans) | - |
| 3.1 | Forage pétrolier et gazier | - | Inconnu | Petite (1-10 %) | Inconnue | Modérée (peut-être à court terme, < 10 ans) | La fracturation peut avoir des effets négatifs sur la stabilité géologique et l'écoulement des eaux souterraines et entraîner le drainage des forêts marécageuses à érable rouge où l'anzie mousse-noire est commune; les routes associées à cette activité peuvent aussi entraîner des modifications de l'hydrologie, provoquant un assèchement de l'habitat qui nuit au lichen. Le pompage des eaux souterraines est également un facteur dans ce contexte et il est pris en compte dans l'évaluation ici plutôt qu'au point 7.2 (gestion de l'eau). |
| 3.2 | Exploitation de mines et de carrières | - | Négligeable | Négligeable (< 1 %) | Extrême (71-100 %) | Modérée (peut-être à court terme, < 10 ans) | Cette menace tient compte de l'empreinte des mines d'or qui ont récemment été mises en exploitation en Nouvelle-Écosse; elle pourrait nuire à certaines populations d'anzie mousse-noire. |
| 3.3 | Énergie renouvelable | - | - | - | - | - | Récolte de la biomasse ligneuse pour la production d'énergie. L'évaluation de cet impact est incluse dans la section sur la récolte du bois, tandis que les routes qui lui sont associées le sont dans les menaces que représentent les routes. Les routes aménagées pour l'expansion des parcs d'éoliennes sont également prises en compte à cette section. |
| 4 | Corridors de transport et de service | D | Faible | Petite (1-10 %) | Modérée (11-30 %) | Élevée (continue) | - |
| 4.1 | Routes et voies ferrées | D | Faible | Petite (1-10 %) | Modérée (11-30 %) | Élevée (continue) | Inclut la construction de routes pour l'exploitation minière, les activités forestières, la récolte de la biomasse, la construction de parcs d'éoliennes et l'accès à ces parcs, etc. Les effets de bordure sont importants et sont inclus. |
| 4.2 | Lignes de services publics | - | Négligeable | Négligeable (< 1 %) | Modérée (11-30 %) | Modérée (peut-être à court terme, < 10 ans) | Le nouveau pipeline proposé au Nouveau-Brunswick pourrait avoir un impact sur des milieux qui pourraient être colonisés par l'anzie mousse-noire, à la fois directement, le long du corridor pendant la construction du pipeline, et par un effet de bordure dans les zones forestières voisines. |
| 4.3 | Voies de transport par eau | - | - | - | - | - | - |
| 4.4 | Corridors aériens | - | - | - | - | - | - |
| 5 | Utilisation des ressources biologiques | BC | Élevé – moyen | Grande – restreinte (11-70 %) | Élevée (31-70 %) | Élevée (continue) | - |
| 5.1 | Chasse et capture d'animaux terrestres | - | - | - | - | - | - |
| 5.2 | Cueillette de plantes terrestres | - | - | - | - | - | - |
| 5.3 | Exploitation forestière et récolte du bois | BC | Élevé – moyen | Grande – restreinte (11-70 %) | Élevée (31-70 %) | Élevée (continue) | Dans les milieux situés en terrain élevé, en particulier, l'abattage de feuillus pour la production de grumes de sciage, de granulés de bois et de bois de chauffage peut entraîner la perte d'arbres hôtes et d'arbres colonisés par l'anzie mousse-noire. La récolte de la biomasse ligneuse pour la production d'énergie, qui s'élève à plus de 500 000 tonnes par année, est une autre menace importante. La partie de cette activité qui touche les feuillus entraîne l'élimination de l'hôte de l'anzie mousse-noire. De plus, les routes qui lui sont associées peuvent modifier le drainage dans les terrains boisés adjacents, provoquant un assèchement de l'habitat qui nuit à ce lichen. Ce dernier facteur est évalué dans la section sur les routes. Bien qu'il existe des règlements, les zones riveraines ne sont pas suffisamment protégées pendant la récolte, surtout dans les boisés privés où ils sont difficiles à appliquer. |
| 5.4 | Pêche et récolte de ressources aquatiques | - | - | - | - | - | - |
| 6 | Intrusions et perturbations humaines | - | Négligeable | Négligeable (< 1 %) | Négligeable (< 1 %) | Élevée (continue) | - |
| 6.1 | Activités récréatives | - | Négligeable | Négligeable (< 1 %) | Négligeable (< 1 %) | Élevée (continue) | - |
| 6.2 | Guerre, troubles civils et exercices militaires | - | - | - | - | - | - |
| 6.3 | Travail et autres activités | - | Négligeable | Négligeable (< 1 %) | Négligeable (< 1 %) | Élevée (continue) | Récolte pour des recherches sur les espèces et les communautés lichéniques |
| 7 | Modifications des systèmes naturels | - | - | - | - | - | - |
| 7.1 | Incendies et suppression des incendies | - | - | - | - | - | - |
| 7.2 | Gestion et utilisation de l'eau et exploitation de barrages | - | - | - | - | - | Le pompage de l'eau souterraine est inclus dans le forage pétrolier. |
| 7.3 | Autres modifications de l'écosystème | - | - | - | - | - | - |
| 8 | Espèces et gènes envahissants ou autrement problématiques | - | Inconnu | Généralisée (71-100 %) | Inconnue | Élevée (continue) | - |
| 8.1 | Espèces exotiques (non indigènes) envahissantes | - | Inconnu | Généralisée (71-100 %) | Inconnue | Élevée (continue) | Deux limaces exotiques envahissantes sont maintenant répandues et abondantes au Nouveau-Brunswick et en Nouvelle-Écosse, où elles peuvent causer des dommages aux lichens épiphytes qu'elles broutent dans les forêts marécageuses à érable rouge qui sont un habitat commun pour l'anzie mousse-noire. Cette évaluation s'applique au pourcentage de la population brouté par des limaces non indigènes. L'impact du broutage est connu pour certains lichens, mais il ne l'est pas encore pour l'anzie mousse-noire et est analysé dans le rapport. |
| 8.2 | Espèces indigènes problématiques | - | - | - | - | - | En Nouvelle-Écosse, une espèce de limace indigène commune et plusieurs autres gastéropodes qui se nourrissent de lichens broutent également l'anzie mousse-noire. Cependant, rien n'indique jusqu'à maintenant qu'ils ont un effet négatif sur les populations d'anzie mousse-noire. |
| 8.3 | Matériel génétique introduit | - | - | - | - | - | - |
| 9 | Pollution | D | Faible | Restreinte (11-30 %) | Légère (1-10 %) | Élevée (continue) | - |
| 9.1 | Eaux usées domestiques et urbaines | - | - | - | - | - | - |
| 9.2 | Effluents industriels et militaires | - | Négligeable | Négligeable (< 1 %) | Légère (1-10 %) | Élevée (continue) | Bassins de décantation des résidus miniers |
| 9.3 | Effluents agricoles et sylvicoles | - | - | - | - | - | - |
| 9.4 | Déchets solides et ordures | - | - | - | - | - | - |
| 9.5 | Polluants atmosphériques | D | Faible | Restreinte (11-30 %) | Légère (1-10 %) | Élevée (continue) | La pollution atmosphérique est peut-être un des facteurs qui ont joué un rôle dans la disparition de l'anzie mousse-noire en Ontario et au Québec, et qui a peut-être aussi eu un effet au Nouveau-Brunswick et en Nouvelle-Écosse. Les polluants sont les pluies acides ainsi que les contaminants qui proviennent des activités forestières et minières. Les données concernant l'impact sur ce lichen en particulier ou la quantification de l'acidification de l'écorce des arbres sur lesquels pousse l'anzie mousse-noire manquent pour la Nouvelle-Écosse et le Nouveau-Brunswick. Beaucoup d'espèces de cyanolichens très sensibles à la pollution poussent dans de nombreux sites où croît l'anzie mousse-noire; l'impact sur cette espèce est donc faible. |
| 9.6 | Apports excessifs d'énergie | - | - | - | - | - | - |
| 10 | Phénomènes géologiques | - | - | - | - | - | - |
| 10.1 | Volcans | - | - | - | - | - | - |
| 10.2 | Tremblements de terre et tsunamis | - | - | - | - | - | - |
| 10.3 | Avalanches et glissements de terrain | - | - | - | - | - | - |
| 11 | Changements climatiques et phénomènes météorologiques violents | BD | Élevé – faible | Généralisée – grande (31-100 %) | Élevée – légère (1-70 %) | Modérée (peut-être à court terme, < 10 ans) | Les étés plus secs qui sont prévus pourraient nuire à la capacité de l'anzie mousse-noire de compléter son cycle vital; les précipitations accrues au printemps et à l'automne pourraient par ailleurs accroître le broutage par des espèces agressives de mollusques introduits. |
| 11.1 | Déplacement et altération de l'habitat | - | Inconnu | Généralisée – grande (31-100 %) | Inconnue | Modérée (peut-être à court terme, < 10 ans) | Les hivers plus doux résultant du réchauffement de la planète pourraient augmenter la survie et l'activité des mollusques introduits qui broutent l'anzie mousse-noire. Rien n'indique jusqu'à maintenant si la population de limaces augmentera par suite de l'augmentation des températures. La menace est cotée pour les 10 prochaines années, mais les modèles montrent que le changement du climat pourrait être de 100 % dans 50 ans et que l'impact pourrait être bien plus grand dans 30 ans, bien que l'immédiateté et la gravité de la menace soient incertaines. De plus, les modifications de l'humidité pourraient avoir un effet positif sur la survie de l'anzie mousse-noire. |
| 11.2 | Sécheresses | - | - | - | - | - | Les sécheresses pourraient ne pas avoir d'impact en Nouvelle-Écosse, car les modèles prévoient une augmentation des précipitations; les niveaux de brouillard ont toutefois diminué. |
| 11.3 | Températures extrêmes | - | - | - | - | - | - |
| 11.4 | Tempêtes et inondations | BD | Élevé – faible | Généralisée – grande (31-100 %) | Élevée – légère (1-70 %) | Modérée (peut-être à court terme, < 10 ans) | L'immédiateté et la gravité de cette menace sont incertaines. De plus, l'augmentation des précipitations et de l'humidité pourrait avoir un effet positif sur ce lichen. L'impact n'est pas connu à court terme, mais on prévoit qu'il sera plus important à long terme. L'impact est coté pour les 10 prochaines années. Les modèles montrent toutefois qu'il y aura une augmentation de 100 % dans 50 ans et un impact considérable est prévu dans 30 ans. |