Crapaud de Fowler (Anaxyrus fowleri): évaluation et rapport de situation du COSEPAC 2010
Table des matières
- COSEPAC – Sommaire de l’évaluation
- COSEPAC – Résumé
- Information sur l’espèce
- Nom et classification
- Description morphologique
- Description génétique
- Unités désignables
- Répartition
- Aire de répartition mondiale
- Aire de répartition canadienne
- Habitat
- Besoins en matière d'habitat
- Variabilité de l’habitat
- Autres considérations liées à l’habitat
- Tendances en matière d'habitat
- Protection et propriété des terrains
- Biologie
- Cycle vital et reproduction
- Alimentation et prédation
- Physiologie
- Déplacements et dispersion
- Relations interspécifiques
- Adaptabilité
- Taille et tendances des populations
- Activités de recherche
- Abondance
- Fluctuations et tendances
- Immigration de source externe
- Analyse de la viabilité de la population
- Méthodes
- Résultats
- Interprétation
- Facteurs limitatifs et menaces
- Aménagement de la rive et stabilisation artificielle
- Espèces envahissantes
- Contaminants agricoles et industriels
- Importance de l’espèce
- Protection actuelle ou autres désignations de statut
- Résumé technique
- Remerciements et experts contactés
- Sources d’information
- Sommaire biographique des rédacteurs du rapport
- Collections examinées
Liste des figures
- Figure 1. Crapaud de Fowler. A) Mâle, Long Point (Ontario) (photographie de D.M. Green); B) Têtards, baie Gravelly, région du Niagara (photographie de Rob Tervo)
- Figure 2. Arbre NJ (neighbour-joining) de la divergence des séquences (p-distance) dans la région de contrôle de l’ADNmt des populations du crapaud de Fowler de la limite septentrionale de leur aire de répartition
- Figure 3. Aire de répartition nord–américaine du crapaud de Fowler
- Figure 4. Mentions canadiennes du crapaud de Fowler
- Figure 5. Polygone convexe minimal englobant l’aire de répartition actuelle du crapaud de Fowler au Canada; distinction entre les superficies habitables à l’intérieur du polygone, qui peuvent être utilisées pour l’estimation de la zone d’occurrence, et les superficies non habitables, y compris les eaux libres
- Figure 6. Estimations de l’abondance dans les trois populations du crapaud de Fowler au Canada
- Figure 7. Caractérisation de l’habitat du crapaud de Fowler sur la rive du lac Érié, à l’ouest de la rive du lac qui est située dans la région du Niagara
- Figure 8. Caractérisation de l’habitat du crapaud de Fowler sur la rive du lac Érié, dans la région du Niagara
- Figure 9. Diminution des effectifs des crapauds de Fowler mâles appelants et étendue de l’invasion du roseau commun (Phragmites australis) dans le marais Crown, à Long Point (Ontario)
- Figure 10. Courbe de survie des crapauds de Fowler métamorphosés établie selon les données de marquage et de recapture provenant de Long Point (Ontario)
- Figure 11. Probabilités de disparition moyennes pour la population du crapaud de Fowler de Long Point simulées sur une période de 100 ans et fondées sur 1 000 itérations du modèle d’analyse de la viabilité de la population
- Figure 12. Probabilités de disparition moyennes pour chacune des trois populations canadiennes du crapaud de Fowler simulées sur une période de 50 ans et fondées sur 1 000 itérations du modèle d’analyse de la viabilité de la population. De plus, l’effet de la perte d’habitat attribuable à l’expansion du roseau envahissant Phragmites est simulé seulement pour la population de Long Point
- Figure 13. Probabilités de disparition moyennes pour les populations canadiennes du crapaud de Fowler estimées sur une période de 50 ans et fondées sur 1 000 itérations du modèle d’analyse de la viabilité de la population selon divers scénarios de dispersion entre les populations (bassins) et la perte d’habitat modélisée et attribuable à la propagation du Phragmites
Liste des tableaux
- Tableau 1. Taux de dispersion (pourcentage) entre les 17 sous-populations du modèle d’analyse de la viabilité de la population
- Tableau 2. Estimations de la superficie (ha), du pourcentage de la superficie totale et du pourcentage de changement annuel de la superficie occupée par le roseau commun (Phragmites australis) envahissant, à Long Point, de 1999 à 2006 (tiré de Badzinski et al., 2008)
- Tableau 3. Résumé des modèles d'analyse de la viabilité de la population et résultats de l’analyse
- Tableau 4. Lois fédérales actuelles qui protègent directement ou indirectement le crapaud de Fowler ou son habitat (adapté de Green et al., 2008)
- Tableau 5. Lois provinciales actuelles de l’Ontario qui protègent directement ou indirectement le crapaud de Fowler ou son habitat (adapté de Green et al., 2008)
Crapaud de Fowler Anaxyrus fowleri

En voie de disparition - 2010
COSEPAC – Comité sur la situation des espèces en péril au Canada

Les rapports de situation du COSEPAC sont des documents de travail servant à déterminer le statut des espèces sauvages que l’on croit en péril. On peut citer le présent rapport de la façon suivante :
COSEPAC. 2010. Évaluation et Rapport de situation du COSEPAC sur le vrapaud de Fowler (Anaxyrus fowleri) au Canada. Comité sur la situation des espèces en péril au Canada. Ottawa. viii + 64 p.
Rapport(s) précédent(s) :
COSEPAC. 2000. Évaluation et Rapport de situation du COSEPAC sur le crapaud de Fowler (Bufo fowleri) au Canada. Comité sur la situation des espèces en péril au Canada. Ottawa. v + 14 p.
Green, David M. 1999. Rapport du COSEPAC sur la situation du crapaud de Fowler (Bufo fowleri) au Canada – Mise à jour. Comité sur la situation des espèces en péril au Canada. Pages 1-14.
Green, D. M. 1986. COSEWICstatus report on the Fowler’s Toad Bufo woodhousii fowleri in Canada. Comité sur la situation des espèces menacées de disparition au Canada. 51 p.
Note de production :
Le Comité sur la situation des espèces en péril au Canada (COSEPAC) remercie David M. Green et M. Alexander Smith pour la rédaction du rapport de situation sur le crapaud de Fowler (Anaxyrus fowleri)au Canada, préparé dans le cadre d'un contrat avec Environnement Canada. Sa participation à la préparation du rapport de situation a pris fin avec l’adoption du rapport provisoire. Ronald Brooks, président du Sous–comité de spécialistes des amphibiens et des reptiles du COSEPAC, a effectué la révision du rapport.
Pour obtenir des exemplaires supplémentaires, s’adresser au :
Secrétariat du COSEPAC
a/s Service canadien de la faune
Environnement Canada
Ottawa (Ontario)
K1A 0H3
Tél. : 819–953–3215
Téléc. : 819–994–3684
Courriel
Site Web
Also available in English under the title COSEWIC Assessment and Status Report on the Fowler's Toad Anaxyrus fowleri in Canada.
Illustration/photo de la couverture :
Crapaud de Fowler -- Andrée Jenks, Guelph (Ontario).
© Sa Majesté la Reine du chef du Canada, 2010.
No de catalogue CW69-14/124-2010F-PDF
ISBN978-1-100-94736-5

Sommaire de l’évaluation – Avril 2010
Nom commun
Crapaud de Fowler
Nom scientifique
Anaxyrus fowleri
Statut
En voie de disparition
Justification de la désignation
Cette espèce ne se trouve que sur des plages sablonneuses dans trois secteurs isolés géographiquement le long de la rive nord du lac Érié. Elle est disparue d'un grand nombre de sites historiques situés sur la rive du lac Érié et son abondance et son nombre de populations continuent de diminuer par suite de la perte et de la dégradation de l'habitat causées par les espèces envahissantes (roseau commun, moule zébrée) et les activités anthropiques, dont l'aménagement du littoral, le nettoyage des plages, la construction de brise-lames, les perturbations causées par les bouldozeurs sur les plages, l'utilisation de véhicules sur les plages et les contaminants agricoles et industriels. De plus, un modèle d'analyse de la viabilité des populations (AVP) indique que depuis la dernière décennie, la probabilité de disparition de l'espèce au Canada au cours des 20 prochaines années a considérablement augmenté.
Répartition
Ontario
Historique du statut
Espèce désignée « préoccupante » en avril 1986. Réexamen du statut : l'espèce a été désignée « menacée » en avril 1999. Réexamen et confirmation du statut en novembre 2000. Réexamen du statut : l'espèce a été désignée « en voie de disparition » en avril 2010.

Crapaud de Fowler Anaxyrus fowleri
Information sur l’espèce
Chez le crapaud de Fowler (Anaxyrus fowleri) adulte, la longueur du museau au cloaque (LMC) est de 50 à 80 mm, et la femelle est plus grosse que le mâle. Le dos est de couleur grise ou chamois, avec de petites verrues et des tubercules. Le ventre est blanc et on ne trouve qu'une tache pectorale foncée. L'appel du mâle est plutôt un cri aigu. Le têtard a une longueur totale ne dépassant pas 27 mm et est tacheté de gris et de noir. La senteur du crapaud de Fowler est particulière et semblable à celle d'arachides non grillées. Jusqu'à récemment, l'espèce était classée dans le genre Bufo.
Répartition
Même si le crapaud de Fowler est présent dans une grande partie de l'Amérique du Nord à l'est des grandes plaines et au sud des Grands Lacs, on le trouve au Canada seulement sur la rive nord du lac Érié, dans l'extrême sud de l'Ontario. La présence de l'espèce se limite de nos jours au parc provincial Rondeau, à Long Point, et à la rive allant de Low Point à Fort Erie (région du Niagara). L'espèce est considérée comme une espèce disparue de nombreux sites historiques. La zone d'occurrence au Canada, qui exclut la rive non habitable et les eaux libres du lac Érié, est d'environ 1 200 km². On estime que la zone de la rive habitée est de moins de 65 km².
Habitat
Le crapaud de Fowler est présent sur la rive du lac Érié où on trouve des sols sablonneux bien drainés ou des dunes, des plages sablonneuses, des boisés décidus à sols sablonneux et des secteurs rocheux à végétation peu dense. Les oeufs et les têtards ont besoin d'étangs à végétation éparse, de bassins à fond sablonneux, de hauts-fonds rocheux ou de bassins rocheux. De tels milieux sont instables et sujets aux processus naturels dynamiques du lac, comme l'érosion et le dépôt de sable, les tempêtes et la fluctuation des niveaux d'eau. Le cycle vital complexe du crapaud de Fowler nécessite l'utilisation de milieux aquatiques et de milieux terrestres. Les milieux occupés par l'espèce subissent un déclin général, causé principalement par le développement de la rive, la stabilisation des plages, la circulation de véhicules et l'utilisation à des fins récréatives dans la région du Niagara, et la propagation du roseau commun, le Phragmites australis australis, une espèce envahissante, à Long Point et dans le parc provincial Rondeau. Une grande partie de l'aire de répartition du crapaud de Fowler au Canada se trouve sur des terres domaniales, y compris des parcs provinciaux et des réserves nationales de faune dans le parc provincial Rondeau et à Long Point, même si 91 % de la rive dans la région du Niagara sont des propriétés privées.
Biologie
À la fin du printemps, les crapauds de Fowler mâles adultes se rassemblent dans des sites de reproduction aquatiques pour y attirer des femelles. La période larvaire s'étend sur 40 à 60 jours, et les jeunes crapauds émergent au milieu de l'été. La croissance est rapide durant la première année, et la plupart des individus atteignent la taille d'un adulte en un an. Le crapaud de Fowler semble avoir une durée de vie de trois à cinq ans, mais le taux de mortalité annuel est élevé à tous les stades du cycle vital.
Le crapaud de Fowler est un insectivore qui consomme des fourmis et des coléoptères. Les couleuvres du genre Thamnophisspp. sont les principaux prédateurs de l'espèce et ne sont pas découragés par les sécrétions cutanées nocives du crapaud. Par ailleurs, le crapaud de Fowler évite principalement les prédateurs en creusant des trous sous la surface du sol.
Durant la nuit, on trouve le crapaud de Fowler assis en eaux peu profondes ou sur le sable humide des plages. Généralement sédentaires, la plupart des individus ne se déplacent que d'au plus quelques mètres le long de la rive durant l'année. Cependant, quelques individus se sont déplacés sur plus de 10 kilomètres en un an.
Le crapaud de Fowler s'hybride avec le crapaud d'Amérique, Anaxyrus americanus, à Long Point; cependant, l'introgression semble y être limitée.
Taille et tendances des populations
L'abondance totale des crapauds de Fowler adultes au Canada ne peut être déterminée avec précision, en raison surtout de la variation stochastique de la taille des populations. L'estimation la plus précise de la taille effective des populations est de moins de 5 000 crapauds adultes. L'effet d'une immigration de source externe entre les populations ou en provenance des populations des États-Unis sur la rive sud du lac Érié est très peu probable.
Selon l'analyse de la viabilité de la population menée au moyen du programme VORTEX et fondée sur la répartition actuelle et des estimations de l'abondance et des caractéristiques démographiques du crapaud de Fowler au Canada, la probabilité de disparition du crapaud de Fowler du Canada est supérieure à 20 % en 20 ans et près de 100 % en 100 ans, selon tous les scénarios.
Menaces et facteurs limitatifs
Le crapaud de Fowler est menacé principalement par la perte et la dégradation de son habitat de plages et de dunes riveraines. Les menaces sont les suivantes : développement et stabilisation artificielle de la rive, y compris la construction de brise-lames, de routes, de terrains de stationnement, de quais et d'épis; intensives activités d'entretien mécanique des plages comme le terrassement, l'entretien et l'enlèvement des algues au moyen de machines ou de buteurs; utilisation intensive des plages et des dunes à des fins récréatives par les humains, y compris la circulation de véhicules; perte et dégradation de l'habitat attribuables à des espèces envahissantes, en particulier les moules zébrées (Dreissena polymorpha) et le roseau commun; polluants agricoles et industriels.
Importance de l’espèce
La plus grande importance du crapaud de Fowler réside peut-être dans le fait que l'espèce a été l'objet de la plus longue (> 30 ans) étude des populations et étude démographique menée sur un amphibien du Canada. Cette étude a élucidé en grande partie les facteurs démographiques, intrinsèques et extrinsèques de la variation et de l'abondance des populations chez une espèce d'anoures. De plus, on commence à comprendre les impacts des humains sur l'espèce. Le crapaud de Fowler est un important insectivore, qui consomme des fourmis et des coléoptères, alors que les têtards sont d'importants détritivores dans les petits étangs, les bassins rocheux et les baies.
Protection actuelle
La majeure partie de l'habitat du crapaud de Fowler qui se trouve dans les secteurs du parc provincial Rondeau et de Long Point est située dans des aires protégées, dans lesquelles il n'existe aucune menace directe associée au développement industriel ou à l'urbanisation. Cependant, il existe une faible protection légale de l'espèce sur la rive du lac Érié, dans la région du Niagara, à l'extérieur du parc provincial James N. Allan. Le crapaud de Fowler est actuellement inscrit sur la liste des espèces menacées de l'annexe 1 de la Loi sur les espèces en péril du gouvernement fédéral et en vertu de la Loi de 2007 sur les espèces en voie de disparition de l'Ontario. L'espèce figure aussi sur la liste des « amphibiens spécialement protégés » de la Loi de 1997 sur la protection du poisson et de la faune de l'Ontario. Elle n'est pas inscrite sur la liste des espèces préoccupantes aux États-Unis ni dans celle des États adjacents à l'Ontario.

Historique du COSEPAC
Le Comité sur la situation des espèces en péril au Canada (COSEPAC) a été créé en 1977, à la suite d’une recommandation faite en 1976 lors de la Conférence fédérale–provinciale sur la faune. Le Comité a été créé pour satisfaire au besoin d’une classification nationale des espèces sauvages en péril qui soit unique et officielle et qui repose sur un fondement scientifique solide. En 1978, le COSEPAC (alors appelé Comité sur le statut des espèces menacées de disparition au Canada) désignait ses premières espèces et produisait sa première liste des espèces en péril au Canada. En vertu de la Loi sur les espèces en péril (LEP) promulguée le 5 juin 2003, le COSEPAC est un comité consultatif qui doit faire en sorte que les espèces continuent d’être évaluées selon un processus scientifique rigoureux et indépendant.
Mandat du COSEPAC
Le Comité sur la situation des espèces en péril au Canada (COSEPAC) évalue la situation, au niveau national, des espèces, des sous–espèces, des variétés ou d’autres unités désignables qui sont considérées comme étant en péril au Canada. Les désignations peuvent être attribuées aux espèces indigènes comprises dans les groupes taxinomiques suivants : mammifères, oiseaux, reptiles, amphibiens, poissons, arthropodes, mollusques, plantes vasculaires, mousses et lichens.
Composition du COSEPAC
Le COSEPAC est composé de membres de chacun des organismes responsable des espèces sauvages des gouvernements provinciaux et territoriaux, de quatre organismes fédéraux (le Service canadien de la faune, l’Agence Parcs Canada, le ministère des Pêches et des Océans et le Partenariat fédéral d’information sur la biodiversité, lequel est présidé par le Musée canadien de la nature), de trois membres scientifiques non gouvernementaux et des coprésidents des sous–comités de spécialistes des espèces et du sous–comité des connaissances traditionnelles autochtones. Le Comité se réunit au moins une fois par année pour étudier les rapports de situation des espèces candidates.
Définitions (2009)
- Espèce sauvage
-
Espèce, sous–espèce, variété ou population géographiquement ou génétiquement distincte d’animal, de plante ou d’une autre organisme d’origine sauvage (sauf une bactérie ou un virus) qui est soit indigène du Canada ou qui s’est propagée au Canada sans intervention humaine et y est présente depuis au moins cinquante ans.
- Disparue (D)
-
Espèce sauvage qui n’existe plus.
- Disparue du pays (DP)
-
Espèce sauvage qui n’existe plus à l’état sauvage au Canada, mais qui est présente ailleurs.
- En voie de disparition (VD)*
-
Espèce sauvage exposée à une disparition de la planète ou à une disparition du pays imminente.
- Menacée (M)
-
Espèce sauvage susceptible de devenir en voie de disparition si les facteurs limitants ne sont pas renversés.
- Préoccupante (P)**
-
Espèce sauvage qui peut devenir une espèce menacée ou en voie de disparition en raison de l'effet cumulatif de ses caractéristiques biologiques et des menaces reconnues qui pèsent sur elle.
- Non en péril (NEP)***
-
Espèce sauvage qui a été évaluée et jugée comme ne risquant pas de disparaître étant donné les circonstances actuelles.
- Données insuffisantes (DI)****
- Une catégorie qui s’applique lorsque l’information disponible est insuffisante (a) pour déterminer l’admissibilité d’une espèce à l’évaluation ou (b) pour permettre une évaluation du risque de disparition de l’espèce.
* Appelée « espèce disparue du Canada » jusqu’en 2003.
** Appelée « espèce en danger de disparition » jusqu’en 2000.
*** Appelée « espèce rare » jusqu’en 1990, puis « espèce vulnérable » de 1990 à 1999.
**** Autrefois « aucune catégorie » ou « aucune désignation nécessaire ».
***** Catégorie « DSIDD» (données insuffisantes pour donner une désignation) jusqu’en 1994, puis « indéterminé » de 1994 à 1999. Définition de la catégorie (DI) révisée en 2006.
Le Service canadien de la faune d’Environnement Canada assure un appui administratif et financier complet au Secrétariat du COSEPAC.
Rapport de situation du COSEPAC sur le crapaud de Fowler Anaxyrus fowleri au Canada – 2010
Le crapaud de Fowler a été décrit officiellement et différencié du crapaud d’Amérique Anaxyrus americanuspar Hinckley (1882) après que S.P. Fowler, naturaliste du Massachusetts, eut constaté durant les années 1860 que deux types de crapauds vivaient près de chez lui (Myers, 1931; Dexter, 1973; Green, 1989). Jusqu’à tout récemment, le crapaud de Fowler était considéré comme une sous–espèce du crapaud de Woodhouse (A. woodhousii), une forme plus occidentale, mais certains signes indiquent que cette classification n’est pas justifiable (Sullivan et al., 1996; Crother et al., 2008). Jusqu’à la récente étude de Frost et al. (2007), le crapaud de Fowler et les espèces apparentées étaient classés dans le genre Bufo (mais voir Pauly et al., 2004).
Chez le crapaud de Fowler (Anaxyrus fowleri) adulte (figure 1A), la longueur du museau au cloaque (LMC) est de 50 à 80 mm; en général, la femelle est plus grosse que le mâle (Green, 1989, 2005). Le dos est de couleur grise ou chamois avec des taches foncées et de nombreuses petites verrues brun rougeâtre; la peau est granuleuse. On compte habituellement au moins trois petites verrues par tache dorsale foncée, bien que cette caractéristique ne soit pas toujours une caractéristique fiable pour identifier l’espèce, parce que les taches peuvent être petites chez certains spécimens, en particulier au Canada. La différence entre une population canadienne et une autre est à peine perceptible; les individus de la région du Niagara ont tendance à avoir des taches dorsales assez marquées, mais les individus de Long Point ont tendance à être de couleur plus uniforme et leurs taches dorsales sont plus petites et moins distinctes. Le dessous est finement granuleux et de couleur blanche ou crème et ne porte aucune tache ou ne porte qu’une seule tache pectorale foncée entre les pattes avant. Chez le mâle adulte, la gorge est foncée, alors qu’elle est blanche chez la femelle et le jeune crapaud. Le museau est court et arrondi, et les crêtes crâniennes de la tête sont peu prononcées.
Figure 1. Crapaud de Fowler. A) Mâle, Long Point (Ontario) (photographie de D.M. Green); B) Têtards, baie Gravelly, région du Niagara (photographie de Rob Tervo).
A

B

L’appel du crapaud de Fowler mâle a été décrit de diverses manières : un cri prolongé et assez aigu, un cri presque d’angoisse, un cri pénétrant et monotone, un étrange cri plaintif ou un cri assourdi comme celui qui provient d’un petit mouton en détresse (Green, 2005). Les caractéristiques de l’appel varient selon la température; ainsi, lorsque la température augmente, le rythme de l’appel augmente et sa durée diminue (Zweifel, 1968). La fréquence dominante est négativement corrélée avec la taille corporelle. Le mâle émet aussi un vibrant cri de relâche pour manifester son mécontentement lorsqu’il est touché, que ce soit par des humains ou d’autres crapauds (Brown et Littlejohn, 1972); ce cri lui sert à annoncer son sexe lorsqu’il est pris par un autre mâle. Les femelles sont silencieuses.
Les œufs d’un diamètre de 3 à 4 mm sont pondus en deux longs chapelets. Le nombre d’œufs ovariens se situe entre 2 000 à 10 000 par femelle mais, à Long Point, la taille moyenne d’une ponte pour les crapauds, établie selon le dénombrement direct des œufs pondus, est d’environ 4 200 (Green, 2005). Les plus grosses femelles ont tendance à pondre un plus grand nombre d’œufs. L’éclosion des œufs survient en moins d’une semaine après la ponte. Les têtards sont tachetés de gris et de noir (figure 1B), leur bouche forme un disque rond échancré, et leurs yeux sont en position dorsale. Leur longueur totale ne dépasse pas 27 mm. Le rapport entre la hauteur de la queue et la hauteur de la musculature de la queue est supérieur à 2,00, ce qui permet de différencier les têtards du crapaud de Fowler des têtards du crapaud d’Amérique (Hinckley, 1882).
La senteur du crapaud de Fowler est particulière et semblable à celle d’arachides non grillées (Green, 2005) ou, selon Miller et Chapin (1910), à celle du bois de l’ailante glanduleux.
On remarque une structure phylogéographique importante dans la variabilité génétique des populations canadiennes du crapaud de Fowler (figure 2). Parmi 161 crapauds de 21 localités canadiennes (Smith et Green, 2004), on a trouvé deux lignées distinctes d’ADN mitochondrial (ADNmt) ou phylogroupes selon la variation observée dans les séquences de la région de contrôle (boucle D) et de la cytochrome coxydase 1 (CO1). Les deux séquences de la région de contrôle divergent de 6 %. Le phylogroupe 2 comprend le crapaud de Fowler de Long Point ainsi que les populations du centre et du sud des États–Unis, tandis que le phylogroupe 1 comprend les autres populations du crapaud de Fowler trouvées autour du lac Érié. L’ADNmt du phylogroupe 1 du crapaud de Fowler est presque identique à celui du crapaud d’Amérique de la même région. Il semble qu’à plus grande échelle géographique, il y aurait également d’autres variations dans l’ADNmt des populations du crapaud de Fowler (Smith et Green, 2004).
Figure 2. Arbre NJ (neighbour-joining) de la divergence des séquences (p-distance) dans la région de contrôle de l’ADNmt des populations du crapaud de Fowler de la limite septentrionale de leur aire de répartition. Les valeurs Bootstrap > 80 % sont indiquées. Tiré de Smith et Green (2004).

La diversité inhabituelle de l’ADNmt des populations de crapaud de Fowler de la région du lac Érié pourrait s’expliquer par l’introgression, par hybridation, de l’ADNmt du crapaud d’Amérique dans les populations du crapaud de Fowler (Smith et Green, 2004). Chez le phylogroupe 1 du crapaud de Fowler, la variation dans les séquences de la CO1 et de la région de contrôle de l’ADNmt (Smith et Green, 2004) révèle que cette introgression n’est pas récente. On trouve également, chez le phylogroupe 1, trois sous–divisions entre lesquelles le degré de divergence est inférieur à 0,5 % (figure 2), correspondant à peu près à la structure du bassin du lac Érié et aux trois secteurs de Rondeau, de Long Point et de la région du Niagara où vivent les crapauds et chez lesquels on trouve peu de variation génétique (Smith et Green, 2004). Ainsi, les populations du parc provincial Rondeau, de Long Point et de la région du Niagara sont trois populations distinctes, puisque les estimations génétiques et démographiques de la superficie habitée sont supérieures aux superficies occupées par les nombreuses localités de reproduction qui semblent secondaires.
La rétention de ce qui semble un haplotype ancestral d’ADNmt du crapaud de Fowler chez les crapauds de Long Point (phylogroupe 2) résulte probablement de multiples invasions du crapaud de Fowler dans le bassin du lac Érié après la glaciation du Pléistocène (Smith et Green, 2004). Certaines informations sur la séquence de l’ADN nucléaire corroborent cette explication, bien que cette séquence ne soit pas aussi variable que les séquences d’ADNmt. De plus chez les populations du crapaud de Fowler de Long Point, du parc provincial Rondeau et de la région du Niagara, aucune variation de séquence n’a été constatée dans les locus nucléaires des gènes Rag–1 (Recombination-activating gene) et de l’ARNr 18S (Smith et Green, en préparation). On remarque toutefois une différence d’un seul nucléotide dans l’ARNr 18S du crapaud de Fowler et du crapaud d’Amérique, ce qui constitue un polymorphisme de nucléotide simple, SNP, permettant de différencier deux espèces. La région de ce gène nucléaire présente donc un tableau différent de celui illustré par les séquences d’ADNmt, en ce sens que ces dernières réunissent les deux phylogroupes du crapaud de Fowler à l’exclusion du crapaud d’Amérique. Cette hypothèse ne peut expliquer la structure du phylogroupe d’ADNmt des populations canadiennes du crapaud de Fowler que s’il y a eu, par le passé, hybridation entre le matériel génétique du crapaud de Fowler et celui du crapaud d’Amérique résultant en l’introgression de l’ADNmt du crapaud d’Amérique dans le matériel génétique du crapaud de Fowler, donnant naissance au phylogroupe 1.
Les trois populations du crapaud de Fowler au Canada (Rondeau, Long Point et région du Niagara) sont génétiquement distinctes et, pour l’œil averti, morphologiquement différenciables. Rien n’indique qu’il y a des échanges continus importants de matériel génétique entre les trois populations (Smith et Green, 2004), et chaque population montre peu de variation intrapopulation. Il existe une différence génétique entre les crapauds de Long Point et ceux des deux autres secteurs, et cette différence est attribuable à une hybridation passée avec le crapaud d’Amérique, qui s’est produite avant que les crapauds de Fowler de Long Point n’envahissent le lac Érié. Même si on remarque une disjonction entre les trois populations, on ne peut déterminer si cette disjonction est d’origine naturelle ou anthropique. De la même manière, étant donné qu’on ne connaît pas les génotypes des populations disparues (p. ex. les sous–populations de l’île Pelée, de la pointe Pelée et de la région du Niagara), la distribution phylogéographique originale le long du lac Érié est incertaine aussi. Les trois populations occupent la même écozone. Pour ce qui est de leur importance relative, la situation n’est pas claire non plus. Il existe une variation des séquences de l’ADNmt, mais aucune variation des séquences de l’ADN nucléaire. Étant donné que l’importance de la variation de l’ADNmt n’est pas claire, on ne sait pas si la perte d’une des populations représente une perte considérable pour l’espèce au Canada. Les populations ne sont pas présentes dans des milieux écologiques uniques. De plus, les menaces à la survie des populations de la région du Niagara diffèrent quelque peu de celles qui planent sur les populations du parc provincial Rondeau et de Long Point; cependant, les menaces se chevauchent d’un secteur à un autre (voir Facteurs limitatifs et menaces). Les trois populations peuvent donc être qualifiées d’unités désignables distinctes, ou on pourrait discuter de cette conclusion. Peu importe la conclusion, il est clair que chaque population pourrait être qualifiée d’unité désignable distincte ou en tant que partie de l’ensemble de l’espèce en voie de disparition; ce faisant, on ajoute toutefois une évaluation négligeable ou une valeur de conservation négligeable lors de l’évaluation de deux ou de trois unités désignables distinctes et, vu les indications contradictoires, la décision la plus prudente consisterait à traiter les trois populations comme une seule unité désignable.
Le crapaud de Fowler est présent dans une grande partie de l’Amérique du Nord, à l’est des grandes plaines et au sud des Grands Lacs (Green, 2005), mais il est absent du sud de la plaine côtière de l’Atlantique depuis les Carolines jusque dans le nord de la Floride (figure 3). À l’extrémité ouest de l’aire de répartition, l’aire de répartition du considérablement plus gros crapaud de Woodhouse, qui est une forme plus occidentale, chevauche celle du crapaud de Fowler le long d’une ligne qui va du sud du lac Michigan jusqu’à la côte du golfe du Mexique, à la frontière du Texas et de la Louisiane (Meacham, 1962). La limite septentrionale de l’aire de répartition de l’espèce comprend le côté ouest de la péninsule inférieure du Michigan et atteint presque le détroit de Mackinac, les rives du lac Érié en Ohio et en Ontario et le nord de la Pennsylvanie; elle s’étend au New Jersey, au sud–est de l’État de New York et au sud du Vermont et du New Hampshire pour atteindre la côte atlantique presque jusqu’au Maine (Green, 2005). Les populations présentes le long de la rive sud du lac Érié en Pennsylvanie et en Ohio ne sont pas continues avec d’autres populations de l’espèce recensées plus au sud. Selon des indications récentes, elles seraient associées à des populations du Canada présentes sur la rive nord du lac, et en seraient peut–être dérivées; elles subiraient peut–être aussi les mêmes menaces (Smith, 2004).
Figure 3. Aire de répartition nord–américaine du crapaud de Fowler (d’après Conant et Collins, 1998).
Carte montrant l’aire de répartition nord-américaine du crapaud de Fowler.

Au Canada, le crapaud de Fowler n’est présent que sur certaines pointes sableuses ou rocheuses et sur certaines plages sableuses de la rive nord et des îles du bassin ouest du lac Érié dans l’extrême sud de l’Ontario (figure 4). L’espèce est de nos jours limitée au parc provincial Rondeau, à Long Point et à la rive est (région du Niagara) du lac Érié, de Low Point (parc provincial James N. Allan) à Fort Erie. Elle a disparu de nombreux sites historiques. Par exemple, le crapaud de Fowler a été signalé pour la dernière fois à Fisher’s Glen en 1927, à la pointe Pelée en 1949, à Turkey Point en 1956, à l’île Pelée en 1960 et à Rock Point (ainsi qu’à Port Maitland, qui lui est adjacent) en 1986 (Green, 2000; Green et al., 2008; Yagi et Tervo, 2006a).

Afin d’estimer la zone d’occurrence du crapaud de Fowler au Canada, un polygone convexe minimal incluant les trois populations du parc provincial Rondeau, de Long Point et de Niagara peut être tracé (figure 5). La zone d’occurrence estimée est de 4 670 km². Cependant, les rives qui sont situées entre les trois populations comportent dans une large mesure des falaises ou autre habitat ne convenant pas aux crapauds, et le polygone couvre une grande surface d’eau libre du lac. Si on exclut ces secteurs du calcul, la zone d’occurrence est d’environ 1 200 km².
Figure 5. Polygone convexe minimal englobant l’aire de répartition actuelle du crapaud de Fowler au Canada; distinction entre les superficies habitables à l’intérieur du polygone, qui peuvent être utilisées pour l’estimation de la zone d’occurrence, et les superficies non habitables, y compris les eaux libres.

Aucune mention vérifiée du crapaud de Fowler au Canada ne provient de plus d’un demi–kilomètre de la rive du lac Érié. On peut donc présumer que l’espèce occupe une aire de répartition pratiquement linéaire, le long de la rive habitée (figures 6 et 7), qui consiste en des milieux de type 1 et de type 2, tel que défini par Yagi et Tervo (2006a,b), et qui est utilisée comme base logique pour estimer une zone d’occurrence valable. Ces milieux occupent en tout environ 129 kilomètres de la rive du lac Érié (64 kilomètres de Low Point à Fort Erie, 42 kilomètres de la plage Hahn jusqu’à l’extrémité de Long Point et 23 kilomètres au parc provincial Rondeau, d’Erie Beach jusqu’à la rive, au sud de Morpeth. En supposant de manière assez généreuse une zone occupée d’une largeur d’environ 500 mètres, la zone d’occurrence est de moins de 65 km². L’utilisation d’une grille superposée de 1 x 1 kilomètre pour estimer l’indice de la zone d’occupation (IZO) donne une estimation maximale de 129 x 0,5 = 120 km². Un IZO fondé sur une grille de 2 x 2 km² donne une estimation de 480 km². Il s’agit encore une fois d’une estimation maximale, étant donné qu’il est présumé qu’il n’existe aucun chevauchement entre les mailles de la grille et que les crapauds occupent l’ensemble de la rive. Aucune des deux hypothèses n’est correcte.
Figure 6. Estimations de l’abondance dans les trois populations du crapaud de Fowler au Canada. A) Relevé annuel printanier des mâles le long d’environ 8 km de rive dans la portion basale de Long Point. Les estimations sont fondées sur des données de marquage et de recapture intensifs effectués durant la nuit et durant 6 semaines, de mai jusqu’au début de juin, et ont été calculées au moyen de l’estimateur M(th) du programme CAPTURE. B) Relevés estivaux de l’ensemble des crapauds > 48 mm à la plage Nickel, dans la région du Niagara, au moyen d’une estimation Lincoln–Peterson fondée sur des relevés hebdomadaires. C) Relevés estivaux de l’ensemble des crapauds > 48 mm à Rondeau, qui couvrent toute la rive habitée par les crapauds, au moyen d’une estimation Lincoln–Peterson fondée sur trois relevés menés durant l’été. Aucun relevé n’a été mené dans le parc provincial Rondeau en 2006.

Figure 7. Caractérisation de l’habitat du crapaud de Fowler sur la rive du lac Érié, à l’ouest de la rive du lac qui est située dans la région du Niagara. Les habitats sont évalués du type 1 (crapauds présents dans l’habitat propice) au type 4 (habitat non propice dans l’ensemble). Adapté de Yagi et Tervo (2006).

Figure 8. Caractérisation de l’habitat du crapaud de Fowler sur la rive du lac Érié, dans la région du Niagara. Les habitats sont évalués du type 1 (crapauds présents dans l’habitat propice) au type 4 (habitat non propice dans l’ensemble). Adapté de Yagi et Tervo (2006a).

Le crapaud de Fowler est présent dans les secteurs à sols non compacts, graveleux et bien drainés ou sablonneux, y compris les dunes, les forêts décidues à sols sablonneux et les secteurs rocheux, où la végétation est peu dense (Hubbs, 1918; Smith, 1961; Minton, 1972; Brown, 1974; Green, 1989; Klemens, 1993). Wright et Wright (1949) ont mentionné que, dans l’est des États–Unis, le crapaud de Fowler était commun sur le bord des routes, à proximité des maisons, ainsi que dans les champs, les pâturages, les jardins et les dunes. L’espèce est typique des landes à pin du New Jersey (Zampella et Bunnell, 2000). Comparativement au crapaud d’Amérique, qui est présent dans les forêts ombragées et les hautes terres humides, le crapaud de Fowler préfère les broussailles sèches, les dunes et les terrains dégagés (Lazell, 1976; Klemens, 1993).
Le cycle vital complexe du crapaud de Fowler nécessite l’utilisation de milieux aquatiques et de milieux terrestres (Tupper et Cook, 2008). Pour achever leur développement, les œufs et les têtards ont besoin d’étangs à eaux stagnantes à végétation éparse et à fond sablonneux, de hauts–fonds rocheux ou d’étangs peu profonds à fond rocheux qui persistent jusqu’au milieu de l’été. Les jeunes crapauds et les crapauds adultes vivent sur les rives sableuses de lacs sans couvert végétal ou à végétation éparse et ont besoin de dunes pour hiberner, de plages dégagées pour se nourrir et se réhydrater et de plages sableuses et d’avant–dunes pour se cacher durant la journée au cours de la saison active. Le crapaud de Fowler a donc besoin de cinq types d’habitat : a) l’habitat d’hibernation; b) l’habitat de reproduction, de ponte et de développement des têtards; c) l’habitat d’alimentation et d’hydratation, d) l’habitat servant de refuge durant la journée et à l’estivation; e) l’habitat servant de corridor de dispersion. Pour soutenir une population, ces types d’habitat doivent être situés très près les uns des autres.
Le crapaud de Fowler doit creuser dans les zones sableuses pour éviter les températures extrêmes et les conditions rigoureuses du milieu. Ces zones comprennent les barres de sable, les plages et les dunes situées sur la rive du lac Érié. Le trou occupé est un espace souterrain d’une zone sableuse dégagée ou modérément dégagée qui est assez profonde et assez bien drainée pour que le crapaud puisse creuser sous la ligne de gel jusqu’à immédiatement au–dessus de la nappe phréatique et y demeurer durant l’hiver (de 7 à 8 mois, de la fin de septembre à la mi–mai) (Green et al., 2008). Contrairement à certaines grenouilles, le crapaud de Fowler ne tolère pas le gel et doit donc creuser un trou assez profond pour hiberner sous la ligne de gel. Dans la région du Niagara, dans les sols sablonneux de la rive du lac Érié, la profondeur du gel a été supérieure à 2 mètres durant les hivers rudes (Yagi, 2008). Le trou étant humide, cela facilite le métabolisme aérobie, mais les crapauds ne peuvent s’asseoir dans l’eau, parce qu’ils continueraient à absorber de l’eau par la peau et enfleraient. Par conséquent, les eaux de la nappe phréatique, dont le niveau fluctue, ne doivent pas atteindre le trou, sinon les crapauds se noieraient (Green et al., 2008). Compte tenu de la proximité des trous et de la rive et des hauts niveaux d’eau durant l’hiver, la mince zone se situant entre la ligne de gel et la nappe phréatique pourrait être de première importance pour la survie de l’espèce durant l’hibernation (S. Hecnar, comm. pers., janvier 2010).
Le crapaud de Fowler se reproduit dans des étangs d’eaux stagnantes peu profonds et semi–permanents, des basses terres inondées, des étangs temporaires, des étangs de promontoires rocheux et sur des rives de lacs dans des baies peu profondes (Wright et Wright, 1949; Smith, 1961; Mount, 1975; Collins et Wilbur, 1979; Green et Pauley, 1987; Breden, 1988; Dundee et Rossman, 1989; Tupper et Cook, 2008). Breden (1988) et Smith et Green (2004) ont décrit les étangs de reproduction utilisés par les crapauds comme étant peu profonds et à fond sablonneux, à pente douce et à végétation composée principalement de cyperacées et de quenouilles. Les sites de reproduction sont des étangs, des milieux humides, des bassins ou des bassins rocheux oligotrophes à fond sablonneux dégagés ou à végétation modérément abondante; ils sont situés à l’intérieur de la plage de variation des niveaux du lac Érié (Green et al., 2008).
Durant la saison active, dans les secteurs de dunes comme ceux de Long Point et de Rondeau, le crapaud de Fowler utilise le bas de plage à proximité de l’eau pour se nourrir durant la nuit et s’hydrater et le haut de plage et l’avant–dune comme refuges durant la journée (Green, 2008). Le crapaud peut utiliser des endroits particuliers pour se cacher durant la journée, comme du bois flotté, ou s’enfouir dans le sable jusqu’au niveau de la couche de sable humide. Cependant, il peut aussi se reposer dans le sable sec à la surface du sol en n’exposant que la tête ou la tête et le dos.
Au parc provincial Rondeau et à Long Point, l’impact des humains sur les plages et les avant–dunes n’est pas aussi marqué que dans la région du Niagara (Green et al., 2008; Yagi et Tervo, 2008), où les plages sont durcies par la circulation de véhicules et où les dunes sont renforcées et stabilisées. Par conséquent, les refuges utilisés durant la journée par les crapauds y sont moins nombreux, et les crapauds doivent être philopatriques en ce qui concerne les endroits où ils se cachent. Les crapauds qui vivent sur la rive du lac Érié de la région du Niagara, se cachent sans doute dans des crevasses et des fissures des parois rocheuses et des brise–lames.
Le crapaud de Fowler est adapté aux dunes et aux rives de lacs en début de succession écologique (Breden, 1988; Green, 2005). Ces milieux sont instables et subissent les processus dynamiques naturels du lac que sont l’érosion et le dépôt de sable, les tempêtes et la fluctuation des niveaux d’eau. Les orages violents et destructeurs, qui peuvent modifier radicalement la rive, sont communs sur le lac Érié (Hazen, 2000). Lorsque les niveaux sont hauts, les plages et les dunes s’érodent, et le sable se fait déplacer et se dépose de nouveau en raison de la dérive littorale. Les creux de déflation de dunes causés par des tempêtes constituent un milieu dégagé et sablonneux qui est important pour le crapaud de Fowler. Lorsque l’eau est calme et que les niveaux sont bas, le sable s’accumule dans les mêmes secteurs de dunes et de plages. L’espèce est adaptée à ce milieu changeant, et les processus naturels qui y ont cours ne la menacent pas.
À titre d’exemple des processus dynamiques qui ont cours sur les rives du lac Érié, des signes de changements constants dans le passé à Long Point sont déjà visibles (Stone, 1988; Hazen, 2000). En avril et une autre fois en décembre 1985, de hauts niveaux d’eau et des vents de tempête ont inondé et détruit de grandes sections des dunes et de la basse plage à Long Point, y compris environ 56 chalets (Hazen, 2000). Les tempêtes ont formé des creux de déflation dans la basse plage et recouvert certaines portions du marais de bandes de nouveau sable. Ainsi, même si la tempête a décimé la population du crapaud de Fowler en hibernation, elle a formé de nouveaux milieux dégagés et des étangs à fond sablonneux qui ont par la suite été utilisés comme sites de reproduction par les crapauds survivants. Les altérations causées par la tempête étaient cependant temporaires, et la majeure partie des milieux dégagés a été rapidement envahie par la végétation. À l’unité du Service canadien de la faune (SCF) de la pointe Thoroughfare, un petit étang à fond dégagé, qui s’était formé lors de la tempête de 1985 et qui avait été adopté par les crapauds, était en 1996 complètement étouffé par les quenouilles et les cypéracées. Aucun chant n’y a été entendu depuis 1994 (D.M. Green, obs. pers.).
L’habitat de dunes et de plages dont a besoin le crapaud de Fowler est affecté et maintenu par le déplacement du sable sur les rives du lac Érié. Le parc provincial Rondeau et Long Point sont de longues flèches de sable maintenues de manière dynamique par les tempêtes qui surviennent sur le lac Érié, la fluctuation des niveaux d’eau et les processus de dérive littorale. Des systèmes de plages et de dunes de la rive du lac Érié, dans la région du Niagara, se forment dans les baies situées entre les promontoires rocheux et affectent la vitesse d’érosion de la rive et de dépôt du sable. Le transport du sable le long de la rive entraîne le dépôt de sable dans la baie, puis l’action des vagues et du vent pousse le sable vers la plage. Le vent laisse des dépôts de sable non consolidé et sec sur les dunes. Par conséquent, des phénomènes et des paysages situés à une certaine distance des secteurs immédiats où se trouvent les crapauds ont des effets tangibles sur l’habitat de l’espèce. Le déplacement de grandes quantités de sable a pour effet de recréer, de reformer et de faire déplacer les plages et les dunes. Le sable des plages est déplacé le long de la rive par l’action des vagues, du vent et des courants, et les dunes sont formées par le sable balayé par le vent. Bon nombre de grandes dunes de l’intérieur du lac Érié se sont formées il y a 4 000 à 6 000 ans durant la période post-glaciaire au Nipissing et sont d’importantes sources de sable. Dans la région de la pointe Pelée, d’où est disparu le crapaud de Fowler, des opérations de dragage du sable menées dans le passé au large de l’extrémité de la pointe ainsi que l’augmentation des mesures de protection de la rive des deux côtés du parc national de la Pointe–Pelée ont entraîné une réduction de la production de sédiments vers la rive et expliquent peut–être en partie la disparition des crapauds de l’endroit.
Le crapaud de Fowler utilise de manière périodique ou accidentelle de nombreux milieux d’origine anthropique, en particulier le long de la rive du lac Érié, dans la région du Niagara. Ces milieux comprennent les collecteurs d’eaux pluviales, les étangs, les milieux humides, les ponceaux, les routes, les fissures des structures des murs riverains, les jardins, les bateaux, les quais, les terrasses en bois, les débris, les déblais meubles et la litière, les accumulations de sable et d’algues. Beaucoup de ces caractéristiques constituent peut–être des « gouffres comportementaux », dans le sens où les crapauds peuvent les utiliser de manière accidentelle parce qu’ils sont situés entre certaines caractéristiques de l’habitat dont a besoin l’espèce et qu’ils interfèrent avec la dispersion et les déplacements normaux. Les crapauds semblent présents à ces endroits seulement parce que ces derniers se trouvent à l’intérieur de la gamme des activités de l’espèce et non pas parce qu’ils constituent son habitat préféré. Dans d’autres cas, l’altération de l’habitat causée par les humains peut sembler attirer les crapauds. Par exemple, une portion du canal de drainage Casey à la pointe Morgans et les étangs d’alimentation artificiels du parc provincial Long Point attirent les rassemblements de crapauds reproducteurs (Yagi et al., 2006). On ne sait pas dans quelle mesure ils constituent de bons lieux de reproduction pour ce qui est du recrutement de jeunes crapauds. S’ils attirent des adultes reproducteurs, mais qu’ils ne sont pas propices à la croissance et à la métamorphose des têtards, ces milieux constituent des gouffres démographiques néfastes.
L’habitat dont a besoin le crapaud de Fowler subit en général un déclin, principalement en raison de l’aménagement des rives, de la stabilisation des plages, de la circulation des véhicules et des activités récréatives dans la région du Niagara et de la progression de l’espèce envahissante appelée roseau commun (Phragmites australis australis) à Long Point et dans le parc provincial Rondeau.
Pour le crapaud de Fowler (Green, 1981, 1989), le marais Crown à Long Point a déjà été un site de reproduction très productif et peuplé, mais l’espèce ne l’utilise plus comme site de reproduction depuis bon nombre d’années (Green et Sanderson, 2006,; idem, 2007a; Green et Summerfield, 2008). Le site utilisé par le crapaud de Fowler se trouve immédiatement au nord du boulevard Erie (route 59), entre les rues transversales de la promenade Winston et de la promenade Pines à Long Point (figure 9). Les crapauds se sont reproduits à ce site durant les périodes de basses eaux, comme au début des années 1990, et durant les périodes de hautes eaux, comme à la fin des années 1990. Le secteur est un creux de déflation à fond sablonneux et est dominé par les quenouilles et les carex durets. Le Phragmites a commencé à envahir le site durant les années 1990 et, depuis environ 2003, le domine complètement (D.M. Green, obs. pers.; Meyer, 2003; Badzinski et al., 2008).
Figure 9. Diminution des effectifs des crapauds de Fowler mâles appelants et étendue de l’invasion du roseau commun (Phragmites australis) dans le marais Crown, à Long Point (Ontario). A) Mâles appelants observés dans le marais Crown, 1990 – 2009 (D.M. Green, données inédites. B) Étendue du Phragmites et d’autres types de végétation en 2006 dans la région du marais Crown, autrefois utilisée par les crapauds (encadré) (d’après Badzinski et al., 2007). Depuis 2005, aucun crapaud n’a appelé depuis le marais Crown.
Graphique et carte.
A 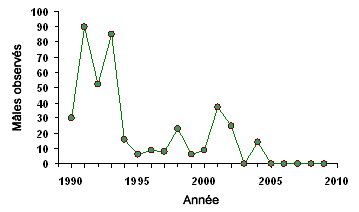
B 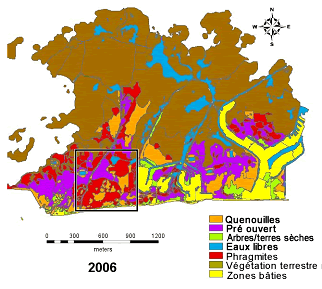

De la même manière, la perte d’habitat semble la cause sous–jacente à la disparition du crapaud de Fowler dans le parc provincial de Rock Point (PPRP) (A. Yagi, comm. pers.). Au milieu des années 1980, les dunes à Rock Point ont subi une forte érosion lors de tempêtes sur le lac Érié. Les gestionnaires du parc ont entrepris la végétalisation des dunes qui subsistaient afin de protéger la rive sans revêtement artificiel. Dans le PPRP, aucun crapaud de Fowler n’a été vu depuis le milieu des années 1980. En 2003, on a commencé à enlever soigneusement une partie de la végétation qui était présente sur les dunes dans le but de les dégager pour attirer les crapauds. Par ailleurs, dans le but d’améliorer la qualité du site de reproduction, on a enlevé une quantité de coquilles de moule zébrée (Dreissena polymorpha) et de moule quagga (D. rostriformis bugensis) équivalant à plusieurs camions dans des secteurs d’étangs à fond rocheux situés devant les dunes. La recolonisation du secteur du PPRP est importante pour le site James N. Allan, le site le plus proche à l’ouest.
La majeure partie de l’aire de répartition du crapaud de Fowler au Canada est située sur des terres publiques, y compris des parcs provinciaux et des réserves nationales fauniques (RNF). L’espèce est disparue du parc provincial Turkey Point et du parc national de la Pointe–Pelée et est peut–être de nos jours absente du PPRP.
Dans le parc provincial Rondeau, on compte environ 290 chalets familiaux privés, deux églises, un club de navigation de plaisance et un centre communautaire, tous situés sur des terrains loués par le parc. La présence des chalets fait augmenter le nombre de crapauds tués sur la route ainsi que les plantes envahissantes sur les dunes; on constate aussi la perte de l’habitat de savane à chênes, qui est remplacé par de la pierre concassée qu’on importe pour l’aménagement de terrains de stationnement, de routes et de secteurs récréatifs. Le bail arrive à échéance en 2017, après quoi toutes les installations doivent être démolies (Welsman, 2009).
Long Point fait partie de la réserve de la biosphère de Long Point. La majeure partie de la pointe est une zone protégée, qui comprend les RNFde Big Creek et de Long Point relevant du SCF, le parc provincial de Long Point en deux sections et l’extrémité de Long Point, qui est gérée par Transports Canada. La Long Point Company entretient et protège une grande section située au milieu de la pointe comme réserve privée de chasse et de pêche. La Anderson Property occupe une plus petite partie du côté nord de la pointe extérieure. Le marais Crown, relevant du SCF, est situé du côté de la baie intérieure de la pointe, à proximité de l’ancienne section du parc provincial de Long Point. Dans la portion basale de la pointe, du marais de Big Creek à l’ouest jusqu’à la nouvelle section du parc provincial de Long Point, se trouvent de nombreux chalets privés, un motel et des restaurants. Plusieurs marinas privées occupent le côté nord de la pointe, dans la baie intérieure.
Contrairement au parc provincial Rondeau et à Long Point, 91 % de la rive est du lac Érié, à proximité de la région du Niagara, est privée (Yagi et Tervo, 2006a). Bon nombre de chalets d’été bordent la rive, qui est un secteur populaire pour les activités récréatives estivales. Même si on y trouve aussi de petits parcs provinciaux et des aires de conservation, la majeure partie de la péninsule de la pointe Abino est privée et appartient à des propriétaires américains de chalets saisonniers. Sherkston Shores, qui est adjacent, est un terrain de camping privé saisonnier, même s’il est en voie de devenir un terrain de caravanage presque permanent. Crystal Beach, à l’est de la pointe Abino, était un parc d’attractions populaire, qui a fermé ses portes en 1989 (Jackson, 1967). On y trouve de nos jours le quartier privé appelé Crystal Beach Tennis and Yacht Club. La ville de Fort Erie occupe l’extrémité est de la rive du lac Érié, dans la région du Niagara, et comprend l’habitat du crapaud de Fowler de la pointe Windmill. La ville de Port Colborne est située à l’entrée du lac Érié vers le canal Welland et comprend la plage Nickel, qui appartient à INCO. Le parc provincial James N. Allan, à la pointe Low, le parc provincial de Rock Point, l’aire de conservation de Long Beach et l’aire de conservation de la pointe Morgans font tous l’objet d’activités récréatives intenses durant l’été (Yagi et al., 2006).
Les crapauds de Fowler se rassemblent aux sites de reproduction à la fin du printemps, selon la température et la pluie (Green, 2005a). Le crapaud mâle chante lorsque sa température corporelle atteint au moins environ 13 °C. Au lac Érié, les crapauds de Fowler commencent à appeler à n’importe quel moment entre les derniers jours d’avril et la dernière semaine de mai et, selon les conditions météorologiques, continuent à appeler durant trois à quatre semaines. Habituellement, on peut entendre les appels des crapauds de Fowler à Long Point jusqu’au début de juin. Dans la région du Niagara, les rassemblements commencent habituellement quelques semaines plus tard durant l’année, période qui correspond à des températures de l’eau plus fraîches qui persistent dans l’est du lac Érié (Yagi, 2008). Les rassemblements de reproducteurs comprennent surtout des mâles appelants, qui répondent aux vocalisations des autres. Les femelles s’orientent en fonction des appels de mâles particuliers, selon la persistance et l’intensité des appels (Given, 1996). En général, elles sont attirées par les mâles qui appellent plus souvent, peu importe la température (Sullivan, 1982; idem, 1983). Cependant, dans un rassemblement de reproducteurs, ce ne sont pas tous les mâles qui appellent; l’intensité des appels n’est donc pas un bon indicateur du nombre réel d’individus présents (Shirose et al., 1997).
Il arrive que l’on observe de grands rassemblements de têtards dans les cours d’eau et les étangs; habituellement dans les eaux stagnantes, les individus se reposent sur un substrat boueux ou sablonneux. La période larvaire dure 40 à 60 jours, et les têtards se métamorphosent lorsque la LMC est d’environ 8 à 12 mm. Logier (1931) a signalé récemment la présence d’individus récemment métamorphosés à Long Point le 13 juillet 1929. À la plage Nickel, à proximité de Port Colborne, des individus ayant subi la métamorphose ont été observés dès le 25 juin 2007 (LMC de 10,7 à 28,8 mm) et aussi tard que le 25 juillet 2006 (Yagi, 2008).
Durant la première année, la croissance est rapide. Clarke (1974b) a mentionné une augmentation moyenne de la croissance de la taille de 6,58 fois durant la première année chez des individus du Connecticut. La croissance des femelles étant plus rapide que celle des mâles, les femelles atteignent une plus grande taille (Clarke, 1974b). Environ un an après la métamorphose, la plupart des mâles commencent à afficher des caractéristiques sexuelles secondaires. Les femelles atteignent la taille adulte environ un mois plus tard, mais aussi en général à l’âge de deux ans (Breden, 1987). Une proportion variable des individus de la cohorte des jeunes d’un an atteint la maturité sexuelle durant la première année (Kellner et Green, 1995). Cependant, en ce qui concerne les autres années, la maturité sexuelle peut être à ce point retardée que certains individus ne deviennent sexuellement matures qu’à l’âge de trois ans.
Le crapaud de Fowler semble avoir une durée de vie possible de trois à cinq ans (Clarke, 1977; Kellner et Green, 1995), mais le taux de mortalité annuelle est élevé à tous les stades du cycle vital (Green, 1999a). La survie des têtards à l’âge d’un an a été estimée à seulement 0,0013 (Green, 1999a). On ne sait pas dans quelle mesure le taux de survie est affecté par la survie des têtards jusqu’à la métamorphose ou par la survie ultérieure des jeunes crapauds durant le premier hiver. Clarke (1977) a calculé un taux de survie annuel de 30 % chez les individus ayant accompli la métamorphose à un site au Connecticut; le plus haut taux de mortalité était associé aux jeunes de l’année avant le premier hiver. Parmi 17 000 têtards identifiés par électrophorèse et introduits dans une population d’Indiana, Breden (1987) a retrouvé 8 539 jeunes crapauds métamorphosés et, sur ce nombre, en a recapturé 37 qui étaient devenus des adultes reproducteurs. Green (1999) a calculé un taux de survie annuel de 27 % pour les adultes.
Le crapaud de Fowler est un insectivore, qui se nourrit surtout de fourmis et de coléoptères (Judd, 1957; Bush et Melnick, 1962). Durant la saison active, il se nourrit sur les plages pendant la nuit. Les têtards sont d’importants détritivores dans les petits étangs, les bassins rocheux et les baies.
Les couleuvres, en particulier celles du genre Thamnophis, sont les principaux prédateurs des crapauds, y compris des têtards et des jeunes crapauds. La couleuvre rayée (Thamnophis sirtalis) est assez abondante à Long Point et la couleuvre à nez plat (Heterodon platirhinos), qui est une espèce menacée en Ontario, sont des consommateurs spécialisés de crapauds. La couleuvre d’eau (Nerodia sipedon) est aussi un prédateur des crapauds. On a aussi observé que le raton laveur (Procyon lotor), l’achigan à grande bouche (Micropterus salmoides), le ouaouaron (Lithobates catesbeiana) et certains oiseaux, comme les butors et les hiboux, mangeaient des crapauds de Fowler. Dans le parc provincial James N. Allan, le Goéland à bec cerclé (Larus delawarensis) a été vu en train de manger un crapaud mâle adulte et de jeunes crapauds de la population de la région du Niagara (Smith et Green, 2002; idem, 2005a). Des signes de prédation par les couleuvres du genre Thamnophis et par le raton laveur ont été relevés dans le cadre de la réalisation d’études de télémesure récentes sur la population de crapauds de la région du Niagara (Limnoterra, 2006). Un Thamnophis spp. a consommé un crapaud télémesuré et a été suivi durant plusieurs jours sur la plage Nickel, à Port Colborne. Un autre émetteur a été retrouvé dans un arbre, à plusieurs mètres au–dessus du sol, dans l’aire de conservation de la pointe Morgans. Le transmetteur et des restes du crapaud ayant été retrouvés sur la fourche de l’arbre, on peut supposer qu’il y a eu prédation par le raton laveur. On a soupçonné le raton laveur, plutôt que les hiboux, parce qu’il ne tolère pas les toxines de la peau des crapauds et qu’il mange le ventre des crapauds et qu’il laisse la peau (Green, obs. pers.). Certains prédateurs possibles blessent souvent les crapauds. Les nématodes parasitent le crapaud de Fowler (Green, obs. pers.), mais aucune donnée sur les taux de mortalité attribuable à de telles infections n’est disponible.
Il arrive souvent que le crapaud de Fowler demeure immobile lorsqu’il est dérangé, en particulier lorsqu’il est menacé par la présence de couleuvres. Chez le crapaud, la réaction de peur habituelle est la suivante : il se gonfle les poumons, se redresse le corps et baisse la tête en direction de la menace éventuelle. Les sécrétions nocives et toxiques de la peau rendent en général les crapauds immangeables pour la plupart des prédateurs éventuels. Cependant, les couleuvres Thamnophis, Nerodia et Heterodon tolèrent assez bien les toxines de la peau des crapauds.
Le crapaud de Fowler évite principalement les prédateurs en s’enfouissant pour se cacher ou par camouflage. Le dos de couleur gris pâle et marbrée se mélange bien aux substrats sablonneux. Un tel comportement a été confirmé à plusieurs reprises durant des études de télémesure menées dans la région du Niagara (Limnoterra, 2006; Yagi, 2008) et à Long Point (Green, 2008). Durant la journée, les crapauds ont été trouvés juste sous la surface du sable, dans des trous sur les crêtes dunaires, sous des débris présents sur la rive (billes de bois, végétation rejetée sur la rive), dans des fissures des roches et sous des pierres.
Comme tous les amphibiens terrestres, le crapaud de Fowler métamorphosé doit continuellement maintenir un équilibre hydrique optimal (Hillman et al., 2009). Durant la saison active, il y parvient en se déplaçant depuis les endroits où il se cache durant la journée, qui se trouvent sous le couvert végétal dans des secteurs frais, secs et sablonneux et dans lesquels il perd de l’eau, jusqu’à la rive du lac Érié durant la nuit, où il absorbe de l’eau par la peau. Durant la nuit, on trouve de grands nombres de crapauds assis en eaux peu profondes ou sur le sable humide durant la saison active. Selon les conditions météorologiques, les crapauds peuvent y demeurer seulement quelques minutes ou plus longtemps (Yagi et al., 2008).
La plupart des crapauds de Fowler se déplacent sur de petites distances le long des rives de lacs ou de grands étangs, mais ne sont pas du tout territoriaux (Green, 2008). Sur les lacs Michigan et Érié, les crapauds émergent du sable durant la soirée depuis jusqu’à 400 mètres du bord de l’eau et se déplacent vers la plage pour se réhydrater et se nourrir sur une largeur de rive d’environ 8 mètres. Durant les soirées pluvieuses, ils ne nourrissent sur la plage et les dunes de la basse plage. Généralement sédentaires, environ 70 % des individus, tant les jeunes que les adultes des deux sexes, se déplacent latéralement sur une distance de moins de quelques mètres le long de la rive d’une journée à l’autre ou même d’un mois à l’autre (Smith et Green, 2004). Cependant, les crapauds adultes et les jeunes crapauds sont capables de se disperser sur de longues distances, parce qu’environ 2 % des individus se déplacent sur plus de 10 kilomètres par année, et même jusqu’à 35 kilomètres à Long Point (Smith, 2004; Smith et Green, 2006). À la plage Nickel, à proximité de Port Colborne, des crapauds adultes télémesurés (n = 356) se déplacent saisonnièrement sur plus de 1 kilomètre le long de la rive depuis les sites de reproduction jusqu’aux sites d’hibernation, leur déplacement saisonnier moyen étant de 70 mètres par année et leur déplacement quotidien moyen, de 12 mètres par jour (Yagi, 2008). Après plusieurs années de données de marquage et de recapture, certains signes montrent qu’un faible pourcentage des crapauds qui avaient été marqués à l’extérieur de la plage Nickel ont été repris à la plage Nickel (Planck et Blott, 2006; Yagi, 2008). Ces observations concordent avec l’analyse de l’ADN qui montre la similarité génétique des populations de la région du Niagara (Smith et Green, 2004).
Les crapauds juvéniles et adultes se dispersent sur de grandes distances et peuvent recoloniser des milieux laissés vacants si aucun obstacle n'entrave leur migration le long des plages.De telles barrières existent cependant (figures 6 et 7). La présence de falaises abruptes sur une grande partie de la rive du lac Érié limite les secteurs pouvant constituer des sites de reproduction propices ou un habitat d’alimentation disponible. L’absence de tels secteurs pour la dispersion pourrait expliquer en partie l'absence continue du crapaud de Fowler à l'île Pelée et à la pointe Pelée, deux endroits qui sont isolés du reste de l'aire de répartition de l'espèce au Canada.
Depuis le début du siècle (Green, 1984; Green et Parent, 2003), des hybrides entre le crapaud d’Amérique et le crapaud de Fowler ont été signalés à divers endroits de l’est de l’Amérique du Nord, y compris à Long Point, en Ontario. Le crapaud d’Amérique est en général plus gros que le crapaud de Fowler; le ventre du premier est souvent abondamment tacheté, et ses verrues sont plus grosses. L’appel du crapaud d’Amérique est un long trille saccadé, qui se différencie facilement de l’appel chevrotant du crapaud de Fowler (Zweifel, 1968; Green, 1982). Les différences entre les deux espèces ont été résumées par Wright et Wright (1949) et par Zweifel (1968). Les hybrides sont viables et fertiles, bien que l’introgression à Long Point semble limitée actuellement (Green, 1984; Green et Parent, 2003). Il semble que l’étendue de l’hybridation puisse varier d’une année à l’autre et d’un emplacement à un autre, selon les conditions locales.
Le crapaud de Fowler est un spécialiste des rives et des dunes à la limite septentrionale de son aire de répartition au Canada, où sa présence est réduite à un nombre limité de sites pouvant convenir à l’espèce sur la rive du lac Érié. Parce qu’il se reproduit de préférence dans des étangs oligotrophes à fond sablonneux de milieux de début de succession, il dépend des sites de reproduction qui sont continuellement créés ou maintenus par des perturbations, sinon ces sites seraient envahis par la végétation et eutrophes à cause de la succession écologique. Les crapauds juvéniles et adultes se dispersent sur de grandes distances (Clarke, 1974a; Breden, 1987; idem, 1988; Smith et Green, 2005b; idem, 2006) et peuvent recoloniser des milieux laissés vacants si aucun obstacle n'entrave leur migration le long des plages.
Le crapaud de Fowler est peut–être l’amphibien du Canada qui a été étudié et qui a fait l’objet de relevés de la manière la plus complète. L’étendue de ces travaux permet d’estimer dans leur ensemble les changements concernant la taille approximative et la constitution des populations du crapaud de Fowler.
Green (1981) a entrepris des recherches poussées du crapaud de Fowler le long de la rive nord du lac Érié, de 1978 à 1981. De 2001 à 2003, Alex Smith a mené aussi une recherche poussée du crapaud de Fowler (Smith, 2004), et Anne Yagi et son personnel (ministère des Richesses naturelles de l’Ontario) ont étudié la rive du lac Érié pour caractériser l’habitat qui pouvait convenir à l’espèce (Yagi et Tervo, 2006a,b).
Des relevés intensifs ont aussi été menés à Long Point, dans le parc provincial Rondeau et dans la région du Niagara. Depuis 1988, l’écologie et l’abondance du crapaud de Fowler dans la portion basale de Long Point ont été étudiées chaque année (Laurin et Green, 1989; Green et Cantin, 1990; Green et Porebski, 1991; Green et al., 1991; idem, 1993; idem, 1995; Green et Chan Tang, 1994; Green et Rabinowitz, 1996; Green, 1997a; idem, 1999; Green et Hensley, 1998; Green et Bol, 1999; Green et Smith, 2000; idem, 2003; Green et McTavish, 2005; Green et Sanderson, 2006; idem, 2007b,c; Green et Summerfield, 2008). Les études menées à Long Point ont été effectuées en grande partie durant les saisons de l’émergence et de la reproduction (de mai à juin) afin d’estimer et de décrire la population totale chaque année et, par conséquent, de comprendre les paramètres démographiques. Des études des populations utilisant le marquage et la recapture ont été réalisées dans le parc provincial Rondeau en 2004, 2005, 2007 et en 2008 (Dobbyn, 2005; idem, 2008) ainsi qu’à la pointe Morgans, à la baie Gravelly et à la plage Nickel, sur la rive du lac Érié, dans la région du Niagara (Yagi et Mills, 2003; Yagi et al., 2004; Yagi et Tervo, 2006a; Yagi, 2008). Certains crapauds ont été télémesurés à la baie Gravelly (Yagi, 2008) et sur les plages Thoroughfare et Hahn, à Long Point (Sanderson et Green, 2007; Green, 2008).
Malgré la réalisation de relevés intensifs, l’abondance totale des crapauds de Fowler adultes au Canada ne peut être déterminée précisément, surtout en raison de la variation stochastique de la taille des populations observée dans les trois populations (figure 6). Les épisodes stochastiques de hausse et de baisse au sein d'une population font que sa taille effective est inférieure à sa taille réelle (nombre d'individus présents). Ce facteur est plus utile pour estimer la survie à long terme de l’espèce que les pics ou une moyenne à long terme des effectifs (Meffe et Carroll, 1994). Chez des populations aussi fortement variables, la moyenne harmonique de l’abondance, plutôt que la moyenne arithmétique, représente la meilleure approximation de la taille effective des populations.
Durant une étude de quatre ans menée dans le parc provincial Rondeau, les effectifs estimés de crapauds adultes se situaient entre 195 ± 64 (erreur-type) et 1 401 ± 107 (Dobbyn, données inédites), avec une moyenne harmonique de 386. Au site d’étude de la portion basale de Long Point, entre le marais de Big Creek et l’unité du SCFde la pointe Thoroughfare, les effectifs estimés des mâles se situaient entre 12 ± 0 et 515 ± 62 par année durant 21 ans (Green et Summerfield, 2008), avec une moyenne harmonique de 63. En multipliant ces valeurs par deux pour obtenir les effectifs des femelles (à un rapport des sexes 1:1) et en supposant que ce secteur constitue l’un des huit secteurs de reproduction (emplacements de reproduction) pour les crapauds à Long Point, on obtient une estimation de la moyenne harmonique égale à environ 1 090 crapauds adultes à Long Point. À la plage Nickel, dans la région du Niagara, les effectifs estimés de crapauds adultes se situaient entre 257 ± 21 et 861 ± 126 durant six ans (Yagi, 2008), et la moyenne harmonique est de 420. En présumant que la plage Nickel est l’un des huit secteurs de reproduction de la région du Niagara, on obtient une estimation de la moyenne harmonique d’environ 3 360 crapauds adultes dans la région. De cette manière, la taille effective totale des populations est donc de moins de 5 000 crapauds adultes.
La taille des populations du crapaud de Fowler montre de grandes fluctuations, même d’une année à l’autre (figure 6). De telles fluctuations ont également été observées chez de nombreuses autres espèces d'anoures qui se reproduisent dans les étangs, en particulier chez les espèces à longévité réduite présentant une forte mortalité en bas âge (Berven, 1990; idem, 1995; Green, 1997b; Pelchmann et al., 1991; Green, 1997b). Le crapaud de Fowler survit rarement plus de trois ans après la métamorphose. Des analyses squelettochronologiques ont permis la découverte d'un seul crapaud âgé de cinq ans dans la population de Long Point (Green, données inédites). La plupart des adultes reproducteurs sont âgés de deux ans (Kellner et Green, 1995). D'après les taux de survie calculés à Long Point (Green, données inédites) et ailleurs (Clarke, 1977), le taux de survie de l'œuf à l'adulte est de seulement 0,0007 (soit un adulte pour 1 430 œufs pondus). Avec de telles caractéristiques démographiques, on peut s’attendre à une forte stochasticité intrinsèque dans la taille des populations et à des disparitions locales (Blaustein et al.,1995; Pechmann et Wilbur, 1996). Le repeuplement des parcelles d’habitat dépeuplées dépend normalement de la dispersion des crapauds adultes et juvéniles depuis des sites adjacents, comme l’indiquent les observations concernant les épisodes de dispersion sur de longues distances.
En raison de la taille très variable des populations, il est difficile de distinguer les tendances relatives à l’abondance. Au site d’étude de la portion basale de Long Point, la tendance globale de l’abondance est à la baisse. Durant une période de 21 ans, l’abondance maximale est associée au début des années 1990, et les effectifs ont connu une diminution constante au cours des dernières années. Ces observations peuvent être trompeuses parce qu’il est clair que les conditions de l’habitat ont changé durant la même période et que les crapauds se reproduisent sans doute dans d’autres secteurs. Il est probable que toute tempête d’une force assez grande pour créer de nouveaux sites de reproduction très productifs aura aussi un effet négatif transitoire sur l’abondance globale.
Il existe une faible possibilité, voire aucune, d’une immigration de source externe entre le parc provincial Rondeau à l’ouest, Long Point au centre et la région du Niagara à l’est, ou provenant des populations des États–Unis, sur la rive sud du lac Érié. Les distances entre ces populations sont trop grandes pour que les crapauds puissent les franchir, et on n’y trouve aucun habitat d’hibernation qui pourrait convenir à l’espèce (Yagi et Tervo, 2006a,b). Selon le séquençage de l’ADNmitochondrial, les crapauds de Long Point seraient génétiquement distincts des crapauds d’autres populations, ce qui indiquerait qu’il n’y a eu aucun échange d’individus entre ces populations durant des milliers d’années. De plus, tout crapaud qui aurait été emporté vers les eaux libres aurait tendance à être transporté par les courants de surface dans le lac Érié, de la rive nord à la rive sud. Par conséquent, les populations des États–Unis sont plus susceptibles de profiter d’une immigration de source externe provenant du Canada plutôt que l’inverse (Smith et Green, 2004).
Une analyse de la viabilité de la population a été effectuée à l’aide du programme VORTEX, version 9.4. Le modèle est fondé sur l’aire de répartition actuelle, l’abondance estimée et les caractéristiques démographiques connues ou estimées du crapaud de Fowler au Canada.
Pour pouvoir utiliser VORTEX, le modèle a été structuré spatialement afin de représenter les trois populations du crapaud de Fowler au Canada, en postulant l’existence de multiples sous–populations reliées par divers degrés de dispersion : trois sous–populations ont été utilisées pour représenter la population du parc provincial Rondeau, six sous–populations pour représenter la population de Long Point et huit sous–populations pour représenter celle de la rive du bord du lac Érié, dans la région du Niagara. Les dix–sept sous–populations étaient fondées sur des secteurs connus ou probables d’habitat essentiel, caractérisés par la proximité de plages, de dunes et de sites de reproduction.
VORTEX ne considérant pas les populations et les sous–populations de manière hiérarchique, l’existence d’un niveau élevé de structure des populations a donc été simulée dans le modèle par l’établissement de divers degrés de dispersion éventuelle entre les sous–populations. Les valeurs de la dispersion éventuelle ont été calculées d’après l’approximation obtenue selon la loi de puissance du noyau de la dispersion, dérivé par Smith et Green (2006) à l’aide de méthodes de marquage et de recapture. Les degrés de dispersion ainsi obtenus sont modérés à élevés à l’intérieur des populations et faibles entre les populations (tableau 1). Les âges minimal et maximal des crapauds au moment de la dispersion ont été fixés à un an et à cinq ans, respectivement. Dans ce modèle, les femelles aussi bien que les mâles peuvent se disperser. VORTEXconsidérant la dispersion comme étant le pourcentage des individus se déplaçant chaque année d’une sous–population à l’autre, le taux de survie durant la dispersion pourrait varier dans le modèle en appliquant un multiplicateur exprimé en pourcentage. Dans le modèle de base, le taux de survie est fixé à 50 %, mais d’autres scénarios ont été étudiés aussi à des taux de survie plus élevés et moins élevés.
| Population | Sous–population | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 Région du Niagara | Chemin Kraft | 74.64 | 6.22 | 4.96 | 3.84 | 2.84 | 2.01 | 1.43 | 0.84 | 0.51 | 0.45 | 0.42 | 0.41 | 0.40 | 0.39 | 0.21 | 0.21 | 0.21 |
| 2 Région du Niagara | Chemin TB | 6.22 | 50.35 | 20.48 | 8.99 | 4.95 | 2.85 | 1.80 | 0.95 | 0.55 | 0.48 | 0.45 | 0.44 | 0.42 | 0.41 | 0.22 | 0.22 | 0.22 |
| 3 Région du Niagara | Plage Crystal | 4.96 | 20.48 | 71.59 | 15.16 | 6.04 | 3.17 | 1.93 | 0.99 | 0.56 | 0.49 | 0.46 | 0.44 | 0.42 | 0.42 | 0.22 | 0.22 | 0.22 |
| 4 Région du Niagara | Pointe Abino | 3.84 | 8.99 | 15.16 | 52.96 | 8.56 | 3.77 | 2.15 | 1.04 | 0.58 | 0.50 | 0.47 | 0.45 | 0.43 | 0.42 | 0.23 | 0.22 | 0.22 |
| 5 Région du Niagara | Sherkston | 2.84 | 4.95 | 6.04 | 8.56 | 63.84 | 6.25 | 2.72 | 1.15 | 0.61 | 0.52 | 0.48 | 0.47 | 0.45 | 0.44 | 0.23 | 0.23 | 0.22 |
| 6 Région du Niagara | Plage Nickel | 2.01 | 2.85 | 3.17 | 3.77 | 6.25 | 72.16 | 4.54 | 1.37 | 0.66 | 0.56 | 0.52 | 0.50 | 0.48 | 0.47 | 0.24 | 0.24 | 0.23 |
| 7 Région du Niagara | Pointe Morgans | 1.43 | 1.8 | 1.93 | 2.15 | 2.72 | 4.54 | 79.26 | 1.89 | 0.75 | 0.62 | 0.57 | 0.55 | 0.53 | 0.51 | 0.25 | 0.25 | 0.24 |
| 8 Région du Niagara | Lowpoint | 0.84 | 0.95 | 0.99 | 1.04 | 1.15 | 1.37 | 1.89 | 86.04 | 1.12 | 0.87 | 0.78 | 0.75 | 0.70 | 0.67 | 0.28 | 0.28 | 0.27 |
| 9 Long Point | Tip | 0.51 | 0.55 | 0.56 | 0.58 | 0.61 | 0.66 | 0.75 | 1.12 | 84.04 | 2.95 | 2.01 | 1.76 | 1.49 | 1.37 | 0.35 | 0.35 | 0.34 |
| 10 Long Point | Cordon Courtright | 0.45 | 0.48 | 0.49 | 0.50 | 0.52 | 0.56 | 0.62 | 0.87 | 2.95 | 76.29 | 5.77 | 4.09 | 2.83 | 2.44 | 0.39 | 0.39 | 0.37 |
| 11 Long Point | Pointe Thoroughfare | 0.42 | 0.45 | 0.46 | 0.47 | 0.48 | 0.52 | 0.57 | 0.78 | 2.01 | 5.77 | 64.83 | 12.82 | 5.21 | 3.99 | 0.41 | 0.41 | 0.39 |
| 12 Long Point | Marais Crown | 0.41 | 0.44 | 0.44 | 0.45 | 0.47 | 0.50 | 0.55 | 0.75 | 1.76 | 4.09 | 12.82 | 62.23 | 8.28 | 5.54 | 0.42 | 0.42 | 0.40 |
| 13 Long Point | Big Creek | 0.40 | 0.42 | 0.42 | 0.43 | 0.45 | 0.48 | 0.53 | 0.70 | 1.49 | 2.83 | 5.21 | 8.28 | 61.63 | 15.44 | 0.44 | 0.44 | 0.42 |
| 14 Long Point | Marais Lee Brown | 0.39 | 0.41 | 0.42 | 0.42 | 0.44 | 0.47 | 0.51 | 0.67 | 1.37 | 2.44 | 3.99 | 5.54 | 15.44 | 66.16 | 0.45 | 0.45 | 0.43 |
| 15 Rondeau | North | 0.21 | 0.22 | 0.22 | 0.23 | 0.23 | 0.24 | 0.25 | 0.28 | 0.35 | 0.39 | 0.41 | 0.42 | 0.44 | 0.45 | 79.63 | 10.10 | 5.93 |
| 16 Rondeau | Plage de l’est | 0.21 | 0.22 | 0.22 | 0.22 | 0.23 | 0.24 | 0.25 | 0.28 | 0.35 | 0.39 | 0.41 | 0.42 | 0.44 | 0.45 | 10.10 | 77.01 | 8.56 |
| 17 Rondeau | Plage du sud | 0.21 | 0.22 | 0.22 | 0.22 | 0.22 | 0.23 | 0.24 | 0.27 | 0.34 | 0.37 | 0.39 | 0.40 | 0.42 | 0.43 | 5.93 | 8.56 | 100.00 |
Le modèle a été par la suite paramétrisé au moyen des données de base sur les populations qui ont été dérivées d’études menées dans la portion basale occidentale de Long Point (Green, 2000 et données inédites), complétées par les données sur le parc provincial Rondeau (Dobbyn, 2008) et la région du Niagara (Yagi, 2008). Le stade larvaire du cycle vital, à savoir de l’œuf à la métamorphose, n’a pas été pris en considération aux fins de l’établissement des paramètres concernant les variables démographiques du modèle, parce que l’inclusion de milliers d’œufs produits même par une seule femelle a donné des valeurs que VORTEXne pouvait pas traiter. Green et Summerfield (2008) ont estimé que la taille de la ponte moyenne, fondée sur le dénombrement des œufs pondus, était de 4 618 ± 1 317 œufs (n = 30). Toutefois, d'après le modèle, les jeunes d'un an constituaient la classe d'âge 0, comme si les femelles donnaient directement naissance à des portées de crapauds juvéniles. La taille moyenne des « portées » (jeunes d'un an par femelle) était de 10,5 ± 16 selon le nombre total de femelles présentes. Cependant, cette valeur a été corrigée dans le modèle en tenant compte du fait que le bassin de reproducteurs comprenait 90 % des femelles adultes présentes et en prenant en considération la variance interindividuelle de la taille des pontes. Cinquante pour cent des femelles disponibles devaient se reproduire durant les années de faible densité, alors que 100 % des femelles disponibles pouvaient se reproduire certaines années à la capacité biotique. Dans le modèle de la structure selon l’âge, le taux de survie des jeunes d’un an (année 0) aux adultes de deux ans (année 1) a été paramétrisé à 17,2 ± 19,8 % (écart-type) de la cohorte de départ. Le taux de survie des plus vieilles classes d’âge était de 4,2 ± 3,8 % à l’année 2, de 1,6 ± 3,7% à l’année 3 et de 0,01 ± 0,02 % à l’année 4 (figure 10). L’âge de la première reproduction a été modélisé comme étant l’âge d’un an, parce que les crapauds se reproduisent souvent à l’âge de deux ans (Kellner et Green, 1995). L’âge maximal pour la reproduction a été fixé à 5 ans et le rapport des sexes à la naissance, à 1:1. Nous avons considéré le régime d’accouplement comme étant polygyne, avec 20 % des mâles adultes entrant dans le bassin de reproducteurs et 90 % ± 45 (écart-type) des femelles adultes ayant une progéniture.
L’abondance initiale des individus des sous–populations modélisées a été fixée à 500 individus métamorphosés dans l’ensemble des populations de la rive du lac Érié, dans la région du Niagara, dans une sous–population de Long Point et dans deux des trois sous–populations du parc provincial Rondeau. Le reste des sous–populations a été fixé au départ à 1 000 individus. La capacité biotique (K) a été fixée, avec optimisme, à 5 000 ± 1 500 (écart-type) individus. La disparition a été définie comme l’absence d’animaux de l’un ou de l’autre sexe. Ni la dépression de consanguinité ni de dépendance à la densité n’a été modélisée parce que les effets de ces deux phénomènes sont probablement minimes.
Afin de tenir compte de phénomènes aléatoires associés à la météorologie et au climat, un degré de stochasticité environnementale limité (p. ex.associé aux tempêtes importantes) a été intégré au modèle. De telles tempêtes peuvent faire disparaître des sous–populations à l’échelle locale mais, en même temps, peuvent créer un nouvel habitat de dune et mener de la sorte à une augmentation temporaire des effectifs des sous–populations, dans la mesure où les crapauds sont capables d’envahir le nouvel habitat. La pression de plus en plus forte exercée par le développement rend plus difficile la dispersion des crapauds d’une sous–population à une autre (voir Facteurs limitatifs et menaces). De plus, une tempête du siècle survenant de manière stochastique (ou catastrophe environnementale, telle que définie par VORTEX) a été introduite dans le modèle afin de simuler les effets des tempêtes particulièrement violentes; cependant, la faible fréquence de ces tempêtes représente probablement une sous–estimation de la fréquence réelle des tempêtes dévastatrices sur le lac Érié (voir Hazen, 2000). La modélisation d’autres catastrophes ferait augmenter la vitesse de la disparition simulée. On a calculé des probabilités moyennes de disparition pour chaque simulation d’après les résultats de 1 000 itérations du modèle, chaque passage du modèle équivalant à 100 ans.
En utilisant le modèle de base, on a simulé les effets probables de menaces particulières ou de caractéristiques des populations en modifiant les paramètres appropriés dans divers scénarios. Par conséquent, l’effet de la fragmentation était simulé en modifiant le taux de survie durant la dispersion estimé et, ainsi, la connectivité entre les sous–populations. Des scénarios supposant des taux de survie durant la dispersion de 25 %, de 50 %, de 75 % et de 100 % ont été modélisés pour les sous–populations de Long Point. De manière semblable, l’effet de la perte d’habitat, par exemple l’expansion de la lignée envahissante du roseau commun (Phragmites a. australis) à Long Point, a été modélisé comme étant une réduction déterministe dans la capacité biotique estimée des sous–populations. Dans le cas du Phragmites, l’importance de la réduction a été fondée sur l’estimation effectuée par Badzinski et al. (2008) d’un taux de prolifération moyen annuel de 25,3 % de la superficie pour le Phragmites à Long Point, de 1999 à 2006 (tableau 2).
Finalement, l’effet de l’isolement des trois populations a été examiné grâce à l’élaboration de deux scénarios comprenant des estimations différentes de la structure de la dispersion. Selon un des scénarios, des pourcentages faibles mais positifs d’individus pourraient se disperser d’une population à une autre, alors que selon l’autre scénario, les individus ne pouvaient se disperser avec succès que d’une sous–population à une autre à l’intérieur de chaque population. Ce dernier scénario, lequel est plus structuré, est presque certainement le plus précis.
Tous les scénarios examinés à l’aide du modèle ont pu reproduire fidèlement les fluctuations des effectifs documentées à Long Point, dans la région du Niagara (plage Nickel) et dans le parc provincial Rondeau (figure 6). Le modèle était à peu près insensible aux modifications de la structure selon l’âge, que ce soit pour 50 % ou 90 % des crapauds juvéniles (tableau 2) mais, comme l’analyse antérieure réalisée par Green (2000), il a réagi au nombre de populations employées, aux degrés postulés d’immigration et d’émigration et aux degrés de variance dans les paramètres démographiques.
La modification du taux de survie durant la dispersion a grandement affecté la viabilité des populations (figure 11; tableau 3). Si l’on prend Long Point comme exemple, selon le scénario le plus optimiste supposant un taux de survie de 100 % durant la dispersion, le temps moyen à la première disparition était de 29,56 ans ± 1,12 (écart-type) et le taux moyen de croissance (r) était de 0,1241 ± 0,0119 (écart-type). Cependant, le scénario supposant un taux de survie de 25 % a produit un temps moyen à la première disparition de 22,14 ans ± 0,81 (écart-type) et un r moyen de –0,2647 ± 0,0154 (écart-type).

Lorsque les trois populations canadiennes du crapaud de Fowler ont été analysées individuellement, la population du parc provincial Rondeau, ne comprenant que trois sous–populations, a obtenu les plus faibles résultats et est ressortie comme étant celle qui était la plus susceptible de disparaître (r = -0,123 ± 0,686 écart-type), alors que celles de Long Point (r = -0,251 ± 0,607 écart-type) et de la région du Niagara (r = -0,271 ± 0,590 écart-type) obtenaient des résultats très semblables (figure 12). L’effet de la perte d’habitat à Long Point, modélisée comme étant attribuable à l’expansion du Phragmites, a néanmoins été dramatique parce que, selon ce scénario, r était réduit à –0,267 ± 0,709 (écart-type).
Figure 12. Probabilités de disparition moyennes pour chacune des trois populations canadiennes du crapaud de Fowler simulées sur une période de 50 ans et fondées sur 1 000 itérations du modèle d’analyse de la viabilité de la population. De plus, l’effet de la perte d’habitat attribuable à l’expansion du roseau envahissant Phragmites est simulé seulement pour la population de Long Point.

Figure 13. Probabilités de disparition moyennes pour les populations canadiennes du crapaud de Fowler estimées sur une période de 50 ans et fondées sur 1 000 itérations du modèle d’analyse de la viabilité de la population selon divers scénarios de dispersion entre les populations (bassins) et la perte d’habitat modélisée et attribuable à la propagation du Phragmites.

Considérant de manière collective les populations canadiennes du crapaud de Fowler selon le scénario de base supposant une connectivité élevée entre les populations et aucune perte d’habitat, le temps moyen à la première disparition était de 23,28 années ± 0,26 (écart-type) et le r était de –0,2140 ± 0,0044 (écart-type). La probabilité de disparition était de 37,6 % ± 1,53 en 20 ans (tableau 3). En ajoutant la perte d’habitat, comme celle qui est attribuable à l’expansion du Phragmites, le temps moyen à la première disparition a été réduit à 19,94 ans ± 0,22 (écart-type), et le r moyen à 0,2085 ± 0,0052 (écart-type), alors que la probabilité de disparition a augmenté à 58 % en 20 ans. Si on inclut la très forte probabilité que les trois populations sont dans l’ensemble isolées l’une de l’autre, rendant improbable l’immigration de source externe, le temps moyen à la première disparition est réduit à 19,10 ans ± 0,23 (écart-type), et le r moyen à -0,1793 ± 0,0051 (écart-type). Selon ce scénario le plus pessimiste mais néanmoins le plus plausible, la probabilité de disparition de l’ensemble des populations après 20 ans était de 69 % (tableau 3).
Selon l’analyse de viabilité de la population, la probabilité de disparition du crapaud de Fowler au Canada est supérieure à 20 % d’ici 20 ans, et la probabilité de disparition d’ici 100 ans est de presque 100 %, selon tous les scénarios des conditions existantes, si les paramètres du modèle sont valides. La perte d’habitat, comme celle qui est causée par l’invasion du roseau commun (Phragmites), ressort comme étant la principale cause de l’augmentation de la probabilité de disparition, suivie de la fragmentation de l’habitat qui entraîne la perte de connectivité entre les populations (tableau 3).
Les fluctuations simulées de l’abondance du crapaud de Fowler qui sont très évidentes dans tous les scénarios du modèle d’analyse de la viabilité sont largement dues aux fortes variances des paramètres démographiques des populations, particulièrement des taux de survie et de recrutement. Des fluctuations démographiques de plusieurs ordres de grandeur ne sont pas rares chez les amphibiens (Green, 2003). Par exemple, en Caroline du Sud, Pechmann et al. (1991) ont signalé des fluctuations des effectifs de femelles reproductrices et du recrutement des individus juvéniles de plus de trois ordres de grandeur chez trois espèces de salamandres et une espèce de grenouille. Par conséquent, la disparition de sous–populations dans le modèle d’analyse de la viabilité est en grande partie attribuable à une variation stochastique de la taille des populations, ce qui rend le modèle sensible à certains paramètres en particulier, comme les effectifs initiaux des populations, la modification de la capacité biotique, le nombre de sous–populations, les taux d’immigration et d’émigration, les taux de mortalité tant des individus juvéniles que des adultes et la stochasticité démographique. La réduction de la capacité biotique causée par la perte d’habitat et la réduction connexe du recrutement de crapauds juvéniles est particulièrement néfaste. En réalité, cela se traduit par des menaces qui ont pour effet de réduire la possibilité de dispersion, le taux de survie et la capacité biotique et, par conséquent, d’affecter la viabilité des populations du crapaud de Fowler au Canada.
Le présent modèle d’analyse de la viabilité, comme les autres estimations semblables, comporte des limites. De nombreux paramètres demeurent seulement des approximations bien fondées, et il faudrait obtenir des données sur les populations s’étendant sur un plus grand nombre d’années pour pouvoir estimer précisément les variances qui leur sont associées. Le modèle est souple en ce qui concerne les changements dans ses variables; il pourrait prévoir la pérennité des populations avec des taux de recrutement plus élevés et des variances plus basses, mais l’étendue des données sur un plus grand nombre d’années est peut–être un luxe que ne peut se permettre l’étude en cours sur le crapaud de Fowler au Canada. Il semble que la taille des populations du crapaud de Fowler, comme celle du crapaud calamite (Anaxyrus calamita) et de nombreux autres amphibiens (Berven et Grudzien, 1990; Berven, 1995; Beebee et al., 1996; Scribner et al., 1997) , soit fortement tributaire du recrutement, sujette à des disparitions aléatoires et qu’elle puisse être sauvée par l’immigration. Il y a donc tout lieu de craindre que le crapaud de Fowler finisse par disparaître du pays si ses populations y deviennent de plus en plus isolées dans des milieux réduits où le recrutement est diminué.
Le crapaud de Fowler est extrêmement limité par l’habitat. Étant confinée seulement à la rive du lac Érié dans des secteurs où existe une bonne combinaison de plages naturelles, de dunes accessibles et oligotrophes, d’étangs et de marais d’eaux stagnantes, l’espèce est vulnérable à divers événements ou à diverses menaces qui ont cours sur la rive du lac. Les principales menaces à la survie du crapaud de Fowler au Canada sont donc associées à la perte d’habitat et à dégradation de l’habitat, y compris la perte pure et simple de l’habitat physique, la perte de connectivité entre certains secteurs de l’habitat et une diminution de la qualité de l’habitat.
Le crapaud de Fowler est adapté aux processus naturels associés aux changements de la rive et n’est pas menacé par ces processus. De tels changements sont nécessaires au crapaud de Fowler et à d’autres espèces d’amphibiens qui sont des spécialistes de l’habitat de début de succession (Beebee et al., 1996). Par contre, des interventions artificielles visant à stabiliser la rive par la réduction et le contrôle des agents naturels de changement constituent de sérieuses menaces pour l’espèce.
L’aménagement et la stabilisation de la rive ont des conséquences majeures pour l’habitat des crapauds. Il se peut que les brise–lames éliminent complètement des sites ou en entravent l’accès depuis la plage. De plus, le retour de vague qui frappe les brise–lames accélère l’enlèvement du sable et interrompt l’entretien naturel des plages. La perte de plage est facilement visible devant les brise–lames, tout le long de la rive, et prive les crapauds de sites d’alimentation et de corridors de dispersion, parce qu’elle transforme la rive du lac en falaises artificielles où les crapauds ne survivent pas.
Jusqu’à récemment, les chalets saisonniers situés sur la rive du lac Érié dans bon nombre de secteurs occupés par les crapauds, y compris la portion basale de Long Point, l’est du parc provincial Rondeau et une grande partie de la rive du lac Érié, dans la région du Niagara, n’étaient pas très néfastes pour les crapauds. Cependant, les petits chalets saisonniers cèdent de plus en plus leur place à des aménagements intenses de maisons plus grandes destinées à être occupées à l’année. Ce type d’urbanisation de la rive est particulièrement évident à Long Point et dans les comtés de Fort Erie, de Port Colborne et de Wainfleet, dans la péninsule du Niagara. Les chalets existants ont été agrandis ou rénovés en propriétés plus grandes dont la valeur s’est considérablement accrue. Une conséquence directe de ces aménagements réside dans la construction d’ouvrages de protection des rives devant les dunes afin de protéger les propriétés riveraines de valeur contre le sable balayé par le vent, les hauts niveaux d’eau et les tempêtes qui surviennent sur le lac. Les intenses tempêtes de 1985 et les hauts niveaux d’eau de la fin des années 1990 ont particulièrement fait accélérer la construction d’ouvrages en rive.
Depuis le début de la colonisation, des jetées et des épis ont été construits sur la rive du lac Érié. Dans certains cas, comme les jetées à Port Maitland et le canal Welland à Port Colborne, les travaux ont été réalisés pour que les voies de navigation demeurent ouvertes. Dans d’autres cas, on a construit des structures plus petites afin de protéger les rives contre les dommages causés par l’érosion ou les vagues. Les jetées à Port Maitland ont de toute évidence été touchées par le processus de dérive littorale, qui a entraîné des déplacements de sable dans le lac; le dépôt de sable du côté ouest et l’érosion du sable du côté est sont deux phénomènes qui s’intensifient. Les structures étant perpendiculaires à la rive, elles peuvent entraver la dispersion des crapauds, ce qui explique peut–être pourquoi les crapauds n’ont pas recolonisé certains secteurs habitables.
Les dunes sont aussi naturellement stabilisées par la colonisation des plantes indigènes et non indigènes durant les périodes de bas niveaux et les rares tempêtes. Cependant, le taux de colonisation est plus élevé lorsque les processus d’érosion naturels sont entravés par la construction de routes, de brise–lames et d’épis ainsi que par la compaction nécessaire à l’aménagement de terrains de stationnement. Lorsque les dunes deviennent couvertes de végétation, la population de crapauds connaît un déclin. Un tel phénomène a été observé au cours des trois dernières années dans l’aire de conservation de la pointe Morgans et, durant les vingt dernières années, dans le parc provincial de Rock Point, d’où les crapauds sont disparus (Yagi et al., 2006). À la plage Nickel, à Port Colborne, certaines parties des dunes ont été colonisées par plusieurs espèces exotiques telles que les fétuques (Festuca sp.), le pin sylvestre (Pinus sylvestris), le roseau commun (Phragmites a. australis) et le peuplier blanc (Populus alba) (Limnoterra, 2006; A. Yagi, comm. pers.).
Les activités de nettoyage des plages, comme le nivellement, l’entretien et l’enlèvement des algues, sont fréquentes le long des rives, en particulier sur les plages publiques. De telles activités entraînent la mortalité directe des crapauds qui se reposent sur le sable ou qui sont enfouis près de la surface du sable. Il n’existe actuellement aucune réglementation interdisant la réalisation de ces activités sur les plages et les dunes qui se trouvent au–dessus de la laisse de mer saisonnière. Dans le parc provincial de Long Point, le nettoyage des plages à l’aide de machines a été stoppé par John Marchington, ancien superviseur du parc, en 2007.
Dans la région du Niagara, certaines plages, y compris la plage de la baie Gravelly, connaissent de nombreux déplacements de véhicules de manière saisonnière ou servent de terrains de stationnement. Les plages de sable compacté sont inhospitalières pour les crapauds, et la circulation de véhicules représente une source de mortalité directe pour les crapauds, surtout lorsque les véhicules circulent sur la plage durant la nuit. Même si aucun relevé précis n’a été mené afin de quantifier les taux de mortalité, il existe certaines observations de crapauds écrasés et tués par des véhicules sur de telles plages (Yagi, 2008).
Situé sur le bord du lac Érié, immédiatement à l’ouest de la pointe Morgans, à Wainfleet, le Lakewood Easter Seals Camp for Children with Disabilities a fermé ses portes en 2005. Il était ouvert depuis 1953 et constitue une localité connue pour le crapaud de Fowler. En avril 2007, une grande quantité du sable des plages et des dunes a été enlevée illégalement au moyen d’équipement lourd dans un site d’amélioration de l’habitat du crapaud de Fowler et déposée sur un terrain privé pour remblayer un milieu humide (A. Yagi, comm. pers.). En septembre 2007, le conseil du comté de Wainfleet a voté afin de modifier un règlement de zonage pour permettre au nouveau propriétaire du terrain de construire 35 condominiums résidentiels (Speck, 2007). L’ensemble du plan prévoit la construction de 56 condominiums en deux étapes (Bott, 2007). La possibilité qu’un tel aménagement résidentiel ait un effet fortement négatif sur les crapauds de Fowler présents sur le terrain (Watts, 2009) a été soulevée et examinée par la Commission des affaires municipales de l’Ontario en vertu de la Loi sur l’aménagement du territoire de l’Ontario (cas n° PL070864; le 5 mai 2008). Le conseil du comté de Wainfleet s’est depuis libéré de toute responsabilité en ce qui concerne l’entretien ou l’exploitation des réseaux d’approvisionnement en eau et d’égouts connexes à la construction domiciliaire (Welland Tribune, mai 2009).
Les dunes sont souvent menacées par l’aménagement de plus en plus intense des rives du lac Érié. Certaines dunes bien établies ont été enlevées au cours de la réalisation de projets de construction domiciliaire à plusieurs emplacements de la péninsule du Niagara. De plus, le sable balayé par le vent s’accumule autour de tout brise–lame ou objet se trouvant sur la rive, y compris les édifices. Ces nouvelles dunes, formées naturellement, qu’on trouve sur des terrains et des routes d’accès sont, dans la plupart des cas, enlevées dans le cadre des travaux d’entretien habituels des routes et des terrains. À Long Point, le sable accumulé est régulièrement dégagé au bouteur depuis les propriétés riveraines jusqu’au niveau de l’eau. Durant les relevés de crapauds effectués en soirée à Long Point, on a constaté que les crapauds étaient beaucoup plus présents le long de la plage devant deux sections du parc provincial de Long Point, où la plage n’est pas travaillée, que dans les sections intermédiaires de la plage perturbée situées devant les chalets riverains.
La disparition des crapauds de la pointe Pelée, où se trouve un parc national très fréquenté et attirant un nombre considérable de personnes, constitue un inquiétant précédent (Green et al., 2008). Entre 1894 et 1895, environ 60 % de l’ancienne zone de milieux humides située entre la pointe Pelée et le marais Hillman a été drainée; il en a probablement résulté une réduction de l’habitat de reproduction disponible. En 1953, les rigoles de drainage à la plage Marentette ont asséché la dernière section de marais située immédiatement au nord du parc. La construction de chalets et de maisons sur la rive à l’ouest du parc a commencé au milieu des années 1930 et, à l’est du parc, en 1953. Parce qu’elle a intensifié l’utilisation du secteur par les humains, elle a probablement aussi réduit la quantité de milieux disponibles pour le crapaud de Fowler.
La lignée envahissante du roseau commun (Phragmites a. australis) semble constituer une menace de plus en plus importante pour les aires de reproduction du crapaud de Fowler dans le parc provincial Rondeau et à Long Point (tableau 1) ainsi que pour de nombreuses espèces qui dépendent des milieux humides (Badzinski et al., 2008; S. Dobbyn, comm. pers., 2008). À Long Point, certains anciens sites de reproduction, tels le marais Crown, sont de nos jours envahis par le Phragmiteset ne sont plus utilisés (D. Green, données inédites). Le Phragmites est une nouvelle espèce envahissante et agressive qui est présente dans l’ensemble de Grands Lacs d’aval (Wilcox et al., 2003; Tulbure et al., 2007).
Dans la région du Niagara, durant les périodes de bas niveaux d’eau, les sites de reproduction du crapaud de Fowler consistent en des bassins rocheux inondés et situés à proximité de promontoires et en des collecteurs d’eaux pluviales à proximité de plages. Les grandes accumulations de coquilles de moule zébrée (Dreissena polymorpha) observées récemment dans les secteurs de bassins rocheux ont éliminé l’habitat de reproduction (A. Yagi, comm. pers.). Dans le cadre d’un projet d’amélioration d’habitat mené dans le parc national de Rock Point, on a enlevé une quantité de coquilles de moule zébrée équivalant à plusieurs camions (A. Yagi, comm. pers.). L’abondance de moules zébrées constitue peut–être un risque de botulisme pour les poissons et les oiseaux des Grands Lacs (Riley et al., 2008) et peut–être aussi pour le crapaud de Fowler. La toxine du botulisme est produite par la bactérie Clostridium botulinum qui prolifère en conditions anaérobies (Reed et Rocke, 1992). Les moules zébrées peuvent favoriser la croissance d’algues benthiques près de la rive (Hecky et al., 2004) et, lorsque les moules zébrées mortes et les tapis d’algues en décomposition sont rejetés sur la rive, leur dégradation crée les conditions anoxiques dont a besoin le C. botulinum (Riley et al.s, 2008). Les invertébrés qui consomment la bactérie peuvent passer la toxine à leurs prédateurs (Jensen et Allen, 1960).
La majeure partie de l’habitat du crapaud de Fowler est trop sablonneux et trop proche du lac Érié pour être propice à l’agriculture. Cependant, l’utilisation de produits chimiques en agriculture a peut–être contribué au déclin des populations de crapauds dans le sud–ouest de l’Ontario. La pointe Pelée et l’île Pelée, en particulier, ont fait l’objet d’activités agricoles intenses depuis la Seconde Guerre mondiale. Sanders (1970) a trouvé que les têtards du A. fowleri étaient très sensibles à l’herbicide Trifluralin et à l’insecticide Endrin en particulier. Les têtards devenaient plus sensibles à mesure qu’ils vieillissaient. Les crapauds adultes sont également sensibles à l’empoisonnement par de tels produits chimiques (Ferguson et Gilbert, 1968). Campbell (1975) a mentionné que de grandes concentrations sublétales de produits chimiques s’étaient accumulées dans certains spécimens du A. fowleri provenant de l’Ontario. La dernière observation du crapaud de Fowler dans le parc national de Pointe Pelée en 1949 coïncide de près avec le début de l’utilisation du DDT pour lutter contre les moustiques dans le parc (Russell et al., 1999).
Il existe un grand risque de contamination par les métaux à la plage Nickel et aux environs. La société Vale INCO est propriétaire de la plage Nickel et de la raffinerie de Port Colborne, qui produit des métaux du groupe du platine et emballe le nickel à des fins de distribution. La raffinerie a été mise en service en 1918. Selon un recours collectif de 2001 intenté contre INCO par des résidents de Port Colborne, le sol de la région était contaminé par des concentrations aussi élevées que 14 000 parties par million de nickel, y compris l’oxyde de nickel qui est cancérogène, à savoir une concentration 70 fois supérieure à la concentration considérée comme ne présentant aucun danger pour des secteurs résidentiels en Ontario (Globe and Mail, le 27 mars 2001). Modifié en 2005 (Cour d’appel de l’Ontario, rôle d’audience C42414), le recours doit toujours être soumis au tribunal. Néanmoins, on ne connaît pas les effets de la contamination par des métaux lourds présents dans l’environnement sur les populations du crapaud de Fowler. Des essais en laboratoire portant sur la toxicité des métaux (Birge et al., 2000; Linder et Grillitsch, 2000) ont montré que le crapaud de Fowler a une tolérance plus élevée pour certains métaux, comme le césium (CL50 = 1 076 mg/L) et le magnésium (CL50 = 807 mg/L), que pour d’autres métaux, comme le zinc (CL50 = 87 mg/L ), le cuivre (CL50 = 25 mg/L), le chrome (CL50 = 0,11 mg/L), le gallium (CL50 = 0,13 mg/L), le titanium (CL50= 0,24 mg/L) ou l’aluminium (CL50 = 0,28 mg/L).
Tel que mentionné dans d’autres sections du présent rapport (voir les sections Description génétique, Unités désignables, Analyse de la viabilité de la population et Facteurs limitatifs et menaces), le crapaud de Fowler est présent dans trois populations qui sont assez distinctes et génétiquement isolées l’une de l’autre. De plus, les sous–populations, en particulier dans la région du Niagara, sont de plus en plus isolées les unes des autres en raison de la pression exercée par les humains et de la destruction et de la dégradation de l’habitat. Par exemple, les figures 7 et 8 indiquent les superficies non habitables de la rive, qui sont de plus en plus grandes. Il est donc moins probable que les disparitions à l’échelle locale, associées aux tempêtes ou à la perte d’habitat en raison de la présence de plantes envahissantes, puissent être compensées par les déplacements d’une sous–population à une autre. Selon certaines récentes méta–analyses (Reed et al., 2003; Traill et al., 2007) et recherches citées dans le présent rapport, des populations de 4 000 à 5 000 individus assureraient la viabilité à long terme. Tel que mentionné dans la section Abondance, la taille effective des populations pour le crapaud de Fowler au Canada n’est probablement que d’environ 5 000 individus. Par conséquent, la viabilité des trois populations isolées, et encore plus celle des petites sous–populations isolées, n’est probablement pas assurée. Une telle conclusion découle en grande partie de l’analyse de la viabilité de la population. L’espèce peut donc être qualifiée de très fragmentée.
Le crapaud de Fowler joue le rôle d’un petit insectivore, car il consomme des fourmis et des coléoptères (Judd, 1957; Bush et Melnick, 1962). Dans les petits étangs, les bassins rocheux et les baies, les têtards sont d’importants détritivores. Aucun autre anoure de la région des Grands Lacs n’a l’habitude de se nourrir principalement sur les rives des lacs et les dunes. Par contre, des carnivores de niveau trophique plus élevé, y compris des couleuvres, des oiseaux, des poissons, des mammifères et des grenouilles, consomment les crapauds de Fowler.
Dans les secteurs du parc provincial Rondeau et de Long Point, la majeure partie de l’habitat du crapaud de Fowler se trouve à l’intérieur d’un parc provincial ou d’une réserve nationale faunique, dans lesquels n’existe aucune menace directe associée au développement industriel ou à l’urbanisation. Cependant, les activités humaines qui ont cours à l’intérieur et aux environs des parcs affectent la qualité de l’habitat disponible et sa quantité à l’intérieur de telles zones protégées. Dans la région du Niagara, la grande partie de l’habitat du crapaud de Fowler se trouve sur des terres privées. La seule terre publique abritant une population du crapaud de Fowler est le parc provincial James N. Allan. Dans le passé, on trouvait l’espèce dans le parc provincial Rock Point. Des individus ont été trouvés dans les aires de conservation de Long Beach et de la pointe Morgans.
En 1986, le COSEPAC a évalué que le crapaud de Fowler était une « espèce rare », puis l’espèce a été classée comme une « espèce vulnérable » et une « espèce préoccupante », parce que le Comité a modifié la terminologie relative au classement des espèces. L’espèce a été évaluée comme « espèce menacée » en 1999 (Green, 1999b), et cette évaluation a été confirmée en 2000 (Green, 2000). En 2003, l’espèce était inscrite sur la liste des espèces en péril de l'annexe 1 de la Loi sur les espèces en péril (LEP). La LEP ne visant que les terres publiques, elle ne protège les crapauds que dans les réserves nationales fauniques de Big Creek et de Long Point ainsi qu’à l’extrémité de Long Point, sous la responsabilité du ministère des Transports. La Loi sur les pêches et la Loi canadienne sur l'évaluation environnementale du gouvernement fédéral (tableau 4) s’appliquent aussi de manière indirecte à l’habitat du crapaud de Fowler.
Le crapaud de Fowler est inscrit sur la liste des espèces menacées de la Loi de 2007 sur les espèces en voie de disparition de l’Ontario, en vertu de laquelle il est interdit de tuer, de blesser, de harceler, de transporter, de vendre des individus, etc. ou d’endommager ou de détruire l’habitat de l’espèce. Un programme de rétablissement est exigé en vertu de la Loi. Il est néanmoins possible d’obtenir un permis. Selon la Loi de 1997 sur la protection du poisson et de la faune de l’Ontario, le crapaud de Fowler est considéré comme un « amphibien spécialement protégé » et, par conséquent, il est interdit de le chasser, de le piéger ou de le garder en captivité. Il est néanmoins possible d’obtenir un permis. D’autres lois provinciales (tableau 5) s’appliquent aussi de manière indirecte à l’habitat du crapaud de Fowler. L’espèce n’est pas inscrite sur la liste des espèces préoccupantes des États–Unis ni sur celle de tout autre État adjacent à l’Ontario. Selon NatureServe, le crapaud de Fowler a une cote G5 (non en péril).
Tableau 4. Lois fédérales actuelles qui protègent directement ou indirectement le crapaud de Fowler ou son habitat (adapté de Green et al., 2008)
| Nom de la Loi | Applicabilité | Article | + |
|---|---|---|---|
| Loi sur les espèces en péril | Interdiction de tuer, de blesser ou de harceler, etc., de posséder, de collectionner ou de vendre des individus, etc., ou d’endommager ou de détruire la résidence. Protection de l’habitat essentiel | Tous les aspects de l'habitat | Ne s’applique qu’aux terres domaniales. |
| Loi sur les pêches | Destruction de l'habitat des poissons | Sites de reproduction, sites de grossissement des têtards à proximité de la rive |
Le calendrier des travaux dans l’eau protégeant les pêches peut nuire au grossissement des têtards. |
| Loi sur les pêches | Substances nocives | Sites de reproduction, sites de grossissement des têtards à proximité de la rive | On ne sait pas si les mesures de protection des pêches protègent aussi les têtards et les œufs. |
| Loi canadienne sur l’évaluation environnementale | Territoire domanial, projets fédéraux ou projets qui demandent l’application de lois fédérales | Voir ci-dessus | Voir ci-dessus. |
Genre et espèce : Anaxyrus fowleri
Crapaud de Fowler – Fowler’s Toad
Données démographiques
de deux ans. Sur une ponte moyenne d’environ 4 500 œufs,
environ 10 crapauds survivent jusqu’à l’âge de un an. Le
taux de survie des jeunes de un an jusqu’au stade adulte de
deux ans a été estimé à 17 % de la cohorte de départ. Le
taux de survie des plus vieilles classes d’âge a été estimé
à 4 % jusqu’à l’âge de trois ans, à 1 % jusqu’à l’âge de
quatre ans et à 0,01 % jusqu’à l’âge de cinq ans. (Voir la
section Analyse de la viabilité de la population et la figure 10).
d'individus matures pendant [cinq années ou deux générations]
réduction ou l'augmentation] du nombre total d'individus
matures au cours des [dix dernières années ou trois
dernières générations]
des [dix prochaines années ou trois prochaines générations].
réduction ou l'augmentation] du nombre total d'individus
matures au cours de toute période de [dix ans ou trois
générations] couvrant une période antérieure et ultérieure.
Information sur la répartition
Estimée par la méthode du polygone convexe minimum pour
toutes les localités existantes (= 4 690 km²) moins les portions
non habitables de la rive du lac.
D’après la longueur de la rive occupée par les populations existantes, la zone d’occupation est d’environ 65 km². Cette méthode d’estimation est appropriée, parce que l’espèce est limitée à l’habitat linéaire de la rive et qu’on ne la trouve pas à 500 m de la rive, à l’intérieur des terres. Un IZO estimé à l’aide d’une grille de 1 x 1 km² est de 120 km², alors que l’IZO estimé
à l’aide d’une grille de 2 x 2 km² est de 480 km².
IZO (1 x 1 km²) = 120 km²
IZO (2 x 2 km²) = 480 km²
Les trois populations sont isolées. Pour ce qui est de la
population de la région du Niagara, l’aménagement de la
rive a isolé davantage les sous–populations les unes des
autres. (Voir la section à la fin de Facteurs limitatifs et menaces)
pourraient être considérées comme trois localités.
Oui, en raison des pertes de sites de reproduction à Rock Point
et à Port Maitland et à l’invasion du roseau commun à Long Point
et dans le parc provincial Rondeau.
de populations?
de localités?
Déclin de l’habitat attribuable principalement à l’aménagement
et à la perturbation de la rive du lac Érié, dans la région du
Niagara ainsi qu’à l’invasion du roseau commun à Long Point
et dans le parc provincial Rondeau.
Nombre d'individus matures (dans chaque population)
moyenne harmonique des adultes de 2004 à 2008)
à 2008, en estimant que la superficie couverte
lors des relevés représentait environ un cinquième
de la zone d'occurrence à Long Point).
harmonique des estimations du nombre d’adultes
à la plage Nickel de 2003 à 2008, en estimant
que la superficie couverte lors des relevés
représentait environ un cinquième de la zone
d'occurrence de la région du Niagara)
Analyse quantitative
Menaces (réelles ou imminentes pour les populations ou les habitats)
- Perte ou détérioration de l’habitat attribuable à l’aménagement et à la stabilisation artificielle de la rive, y compris la construction de brise–lames, de routes, de terrains de stationnement, de quais et d’épis.
- Entretien mécanique intensif des plages, p. ex. terrassement, entretien et enlèvement des algues au moyen de machines ou de bouteurs.
- Utilisation intensive des plages et des dunes à des fins récréatives par les humains, y compris la circulation de véhicules.
- Perte et dégradation de l’habitat attribuable à des espèces envahissantes, en particulier les moules zébrées et le roseau commun.
- Polluants agricoles et industriels.
Immigration de source externe (immigration de l'extérieur du Canada)
est-elle possible?
Le lac Érié sépare les populations des États–Unis
de celles du Canada.
Canada pour les individus immigrants?
Statut existant
Statut et justification de la désignation
Justification de la désignation :
Cette espèce ne se trouve que sur des plages sablonneuses dans trois secteurs isolés géographiquement le long de la rive nord du lac Érié. Elle est disparue d’un grand nombre de sites historiques situés sur la rive du lac Érié et son abondance et son nombre de populations continuent de diminuer par suite de la perte et de la dégradation de l’habitat causées par les espèces envahissantes (roseau commun, moule zébrée) et les activités anthropiques, dont l’aménagement du littoral, le nettoyage des plages, la construction de brise-lames, les perturbations causées par les bouldozeurs sur les plages, l’utilisation de véhicules sur les plages et les contaminants agricoles et industriels. De plus, un modèle d’analyse de la viabilité des populations (AVP) indique que depuis la dernière décennie, la probabilité de disparition de l’espèce au Canada au cours des 20 prochaines années a considérablement augmenté.
Applicabilité des critères
Critère A (déclin du nombre total d'individus matures) : Ne respecte pas le critère A, puisqu’on ne peut déterminer l’importance du déclin.
Critère B (petite aire de répartition, et déclin ou fluctuation) : Correspond aux critères de la catégorie « espèce en voie de disparition », B1ab(ii,iii,v)c(iv)+2ab(ii,iii,v)c(iv), puisque l’aire de répartition est très fragmentée, la zone d’occurrence (1 200 km²) et l’IZO (480 km²) sont inférieurs aux seuils établis, et que la zone d’occupation, la superficie et la qualité de l’habitat, ainsi que le nombre d’individus matures, connaissent un déclin. Respecte le critère c(iv), puisque les effectifs de la population fluctuent de plus d’un ordre de grandeur.
Critère C (nombre d'individus matures peu élevé et en déclin) : Sans objet. Même si le nombre minimal d’individus matures trouvés à Rondeau, à Long Point et dans la région du Niagara est inférieur au seuil établi pour les espèces en voie de disparition (2 347), le nombre moyen d’individus matures (4 740) dépasse le seuil établi pour les espèces en voie de disparition, les taux de déclin ne sont pas calculables, les effectifs de certaines populations dépassent 250 individus matures, et aucune population ne contient plus de 95 % de l’ensemble des individus matures.
Critère D (très petite population totale ou répartition restreinte) : Ne correspond pas au critère D, puisque le nombre total d’individus matures dépasse le seuil établi.
Critère E (analyse quantitative) : Correspond aux critères de la catégorie « espèce en voie de disparition » du critère E, puisqu’une analyse quantitative fondée sur un modèle de l’analyse de la viabilité de la population intégrant un degré de stochasticité environnementale limité, aucune connectivité entre les populations, des estimations selon l’âge de l’abondance et la perte d’habitat causée par l’invasion du roseau commun Phragmites donne une estimation de la probabilité de disparition du pays de l’espèce de 69 % en 20 ans, selon le scénario le plus réaliste. Selon le meilleur scénario, on obtient une probabilité de disparition de 22 % en 20 ans.
Anne R. Yagi (ministère des Richesses naturelles de l’Ontario) et Sandy Dobbyn (Parcs Ontario) ont été des sources d’information et de commentaires particulièrement précieux pour la préparation du rapport. Les autres membres suivants de l’équipe de rétablissement du crapaud de Fowler ont aussi aidé à la préparation du rapport (en ordre alphabétique) : James Duncan (Conservation de la nature Canada), Kim Frohlich (Office de protection de la nature de la péninsule du Niagara), Ron Gould (ministère des Richesses naturelles de l’Ontario), Kate Hayes (Environnement Canada), Deb Jacobs (ministère des Richesses naturelles de l’Ontario), Bob Johnson (Zoo de Toronto), Kate Macintyre (ministère des Richesses naturelles de l’Ontario), John Marchington (Parcs Ontario), Vicki McKay (Agence Parcs Canada), Devin Mills (ministère des Richesses naturelles de l’Ontario), Michael Oldham (ministère des Richesses naturelles de l’Ontario), Sherry Pineo (Parcs Ontario), Jeff Robinson (Service canadien de la faune), Tim Seburn (Bert Miller Nature Club), à Fort Erie, Rob Tervo (ministère des Richesses naturelles de l’Ontario), Wayne Weller (Ontario Power Group), Allen Woodliffe (ministère des Richesses naturelles de l’Ontario). Sara Lourie (Université McGill) a produit la carte de l’aire de répartition de l’espèce au Canada (figure 4).
Badzinski, S.S., S. Proracki, S.A. Petrie et D. Richards. 2007. Changes in the distribution & abundance of common reed (Phragmites australis) between 1999 & 2006 in marsh complexes at Long Point – Lake Erie, rapport inédit au ministère des Richesses naturelles de l’Ontario.
Badzinski, S.S., S. Proracki, S.A. Petrie et D. Richards. 2008. Changes in the distribution & abundance of common reed (Phragmites australis) between 1999 & 2006 in marsh complexes at Long Point – Lake Erie, ministère des Richesses naturelles de l’Ontario, Peterborough.
Beebee, T.J.C., J.S. Denton et J. Buckley. 1996. Factors affecting population densities of adult natterjack toads, Bufo calamita, in Britain, Journal of Applied Ecology33:263-268.
Berven, K.A. 1990. Factors affecting population fluctuations in larval and adult stages of the wood frog, (Rana sylvatica), Ecology 71:1599-1608
Berven, K.A. 1995. Population regulation in the wood frog, Rana sylvatica, from three diverse localities, Australian Journal of Ecology 20:385-392.
Berven, K.A., et T.A. Grudzien. 1990. Dispersal in the wood frog (Rana sylvatica): implications for population structure, Evolution 44:2047-2056.
Birge, W.J., A.G. Westerman et J.A. Spromberg. 2000. Comparative toxicology and risk assessment of amphibians, p. 727-791, in D.W. Sparling, G. Linder et C.A. Bishop (éd.), Ecotoxicology of amphibians and reptiles, SETAC Press, Pensacola (Floride).
Blaustein, A.R., L.K. Belden, D.H. Olson, D.M. Green, T.L. Root et J.M. Kiesecker. 2001. Amphibian breeding and climate change, Conservation Biology15:1804-1809.
Bossert, M., M. Draud et T. Draud. 2003. Bufo fowleri(Fowler's Toad) andMalaclemys terrapin terrapin (Northern Diamondback Terrapin), Refugia and nesting, Herpetological Review 34(2):135.
Bott, L. 2007. Wainfleeters must fight urbanization, Welland Tribune, octobre 2007.
Breden, F. 1987. The effects of post-metamorphic dispersal on the population genetic structure of Fowler’s Toad Bufo fowleri, Copeia1987:386-395.
Breden, F. 1988. Natural history and ecology of Fowler’s Toad, Bufo woodhousei fowleri (Amphibia: Bufonidae), in the Indiana Dunes National Lakeshore, Fieldiana: Zoology 49:1-16.
Brown, L.E., et M.J. Littlejohn. 1972. Male release call in the Bufo americanusgroup, pages 310-323, in W.F. Blair (éditeur), Evolution in the Genus Bufo, University of Texas Press, Austin (Texas).
Brown, R.L. 1974. Diets and habitat preferences of selected anurans in southeast Arkansas, American Midland Naturalist 91:468-473.
Bush, F.M., et E.F. Melnick. 1962. The food of Bufo woodhousei fowleri, Herpetologica 18:110-114.
Campbell, C.A. 1975. Reproduction and ecology of turtles and other reptiles and amphibians of lakes Erie and St. Clair in relation to toxic chemicals, rapport inédit présenté au Service canadien de la faune.
Clarke, R.D. 1974a. Postmetamorphic growth rates in a natural population of Fowler’s Toad, Bufo woodhousei fowleri, Canadian Journal of Zoology 52:1489-1497.
Clarke, R.D. 1974b. Activity and movement patterns in a population of Fowler’s Toad, Bufo fowleri, American Midland Naturalist 92:257-74
Clarke, R.D. 1977. Postmetamorphic survivorship of Fowler’s Toad, Bufo woodhousei fowleri, Copeia 1977:594-597.
Collins, J.P., et H.M. Wilbur. 1979. Breeding habits and habitats of the amphibians of the Edwin S. George Reserve Michigan and notes on the local distribution of fishes, Occasional Paper of the Museum of Zoology, University of Michigan 686:1-34.
Conant, R., et J.T. Collins. 1998. A Field Guide to Reptiles and Amphibians of Eastern and Central North America, 3eédition, Houghton Mifflin Company, Boston.
Crother, B.I. (éd.). 2008. Scientific and standard English names of amphibians and reptiles of North America north of Mexico, SSARHerpetological Circular 37:1-84.
Dexter, R.W. 1973. Nomenclatural history and status of Fowler’s toad (Bufo fowleri), HISS News Journal 1:155-157.
Dobbyn, S. 2005. A Preliminary Assessment of the Fowler’s Toad Population in Rondeau Provincial Park, 2004 Field Season Report, Parcs Ontario, Morpeth (Ontario), 20 p.
Dobbyn, S. 2008. Rondeau Provincial Park Fowlers Toad Mark/Recapture Study 2004-2008, rapport provisoire, Parcs Ontario, Morpeth (Ontario).
Dundee, H.A., et D.A. Rossman. 1989. The Amphibians and Reptiles of Louisiana, Louisiana State University Press, Baton Rouge (Louisiane).
Ferguson, D.E., et C.C. Gilbert. 1968. Tolerances of three species of anuran amphibians to five chlorinated hydrocarbon insecticides, Journal of the Mississippi Academy of Sciences 13:135-138.
Frost, D.R., T. Grant, J. Faivovich, R. Bain, A. Haas, C.F.B. Haddad, R. de Sá, A. Channing, M. Wilkinson, S.C. Donnellan, C. Raxworthy, J.A. Campbell, B.L. Blotto, P. Moler, R.C. Drewes, R.A. Nussbaum, J.D. Lynch, D.M. Green et W. Wheeler. 2007. The amphibian tree of life, Bulletin of the American Museum of Natural History 297:1-370.
Gerhardt, H.C. 1975. Sound pressure levels and radiation patterns of the vocalizations of some North American frogs and toads, Journal of Comparative Physiology A 102:1-12.
Given, M.F. 1996. Intensity modulation of advertisement calls in Bufo woodhousii fowleri, Copeia 1996:970-977.
Given, M.F. 2002. Interrelationships among calling effort, growth rate, and chorus tenure in Bufo fowleri, Copeia2002:979-987.
Green, D.M. 1982. Mating call characteristics of hybrid toads (Bufo americanus x B. fowleri) at Long Point, Ontario, Canadian Journal of Zoology60:3293-3297.
Green, D.M. 1981. Theoretical analysis of hybrid zones derived from an examination of two dissimilar zones of hybridization in toads (genusBufo), thèse de doctorat, University of Guelph.
Green, D.M. 1984. Sympatric hybridization and allozyme variation in the toads Bufo americanus and B. fowleri in southern Ontario, Copeia 1984:18-26.
Green, D.M. 1989. Fowler’s Toads, (Bufo woodhousii fowleri) in Canada: Biology and population status, Canadian Field-Naturalist 103:486-496.
Green, D.M. 1997a. Temporal variation in abundance and age structure in Fowler’s Toads, Bufo fowleri, at Long Point, Ontario, pages 45-56, in D.M. Green (éditeur), Amphibians in decline: Canadian studies of a global problem, Society for the Study of Amphibians and Reptiles, St. Louis.
Green, D.M. 1997b. Population Ecology of Fowler's Toads, Bufo fowleri, at Long Point, Ontario, Fonds mondial pour la nature, Fonds de rétablissement des espèces canadiennes en péril.
Green, D.M. 1999a. Status report update on Fowler’s Toad; Bufo fowleri, in Canada, Comité sur la situation des espèces en péril au Canada, Ottawa (Ontario).
Green, D.M. 1999b. Population ecology of Fowler’s Toads, Bufo fowleri,at Long Point, Ontario, in 1999, Fonds mondial pour la nature, Fonds de rétablissement des espèces canadiennes en péril.
Green, D.M. 2000. Rapport de situation sur le crapaud de Fowler (Bufo fowleri) au Canada–Mise à jour, Comité sur la situation des espèces en péril au Canada, Ottawa (Ontario).
Green, D.M. 2003. The ecology of extinction: population fluctuation and decline in amphibians, Biological Conservation 111:331-343.
Green, D.M. 2005. Bufo fowleri, Fowler’s toad, p. 766-778, in Amphibian Declines: the conservation status of United States species, M.J. Lannoo (éd.), University of California Press, Berkeley.
Green, D.M. 2008. Movements and habitat use by Fowler’s Toads, Bufo(Anaxyrus) fowleri, at Hahn Beach, Big Creek NWA, Long Point, Ontario, rapport présenté au Service canadien de la faune, Environnement Canada, 30 p.
Green, D.M., et L. Bol. 1999. Population ecology of Fowler’s Toads, Bufo fowleri, at Long Point, Ontario, in 1998, ministère des Richesses naturelles de l’Ontario, Service canadien de la faune, et le Fonds mondial pour la nature, Fonds de rétablissement des espèces canadiennes en péril.
Green, D.M., et D. Cantin. 1990. Spring emergence and breeding behaviour of Fowler's Toads, Bufo woodhousii fowleriat Long Point, Ontario, in 1989, rapport présenté au ministère des Richesses naturelles de l’Ontario et au Service canadien de la faune.
Green, D.M., et H.S. Chan Tang. 1994. Breeding activity and growth rate in Fowler's Toads(Bufo woodhousii fowleri) at Long Point, Ontario in 1993, ministère des Richesses naturelles de l’Ontario, Service canadien de la faune et Fonds mondial pour la nature–Canada.
Green, D.M., et J. Hensley. 1998. Age structure, and abundance of Fowler’s Toads, Bufo fowleri, at Long Point, Ontario, in 1997, ministère des Richesses naturelles de l’Ontario, Service canadien de la faune, et le Fonds mondial pour la nature, Fonds de rétablissement des espèces canadiennes en péril.
Green, D.M., et E.J.B. McTavish. 2005. Population ecology of Fowler's Toad (Bufo fowleri) at Long Point, Ontario, Field Report for 2004, ministère des Richesses naturelles de l’Ontario.
Green, D.M., et C. Parent. 2003. Variable and asymmetric introgression in a hybrid zone in the toads, Bufo americanus, and Bufo fowleri, Copeia 2003:34-43.
Green, N.B., et T.K. Pauley. 1987. Amphibians and Reptiles in West Virginia, University of Pittsburgh Press, Pittsburgh (Pennsylvanie).
Green, D.M., et Z.S. Porebski. 1991. Breeding activity of Fowler's Toads, Bufowoodhousii fowleri at Long Point, Ontario, in 1990, rapport au ministère des Richesses naturelles de l’Ontario et au Service canadien de la faune.
Green, D.M., et J. Rabinowitz. 1996. Spring emergence, age structure, and abundance of Fowler’s Toads, Bufo fowleri, at Long Point, Ontario, in 1995, ministère des Richesses naturelles de l’Ontario, Service canadien de la faune, et Fonds mondial pour la nature–Canada.
Green, D.M., et N.K. Sanderson. 2006. Population Ecology of Fowler's Toad (Bufo fowleri) at Long Point, Ontario, Field Report for 2005, ministère des Richesses naturelles de l’Ontario et Service canadien de la faune.
Green, D.M., et N.K. Sanderson. 2007. Population ecology of Fowler's Toad (Bufo fowleri) at Long Point, Ontario, Field Report for 2006, ministère des Richesses naturelles de l’Ontario et Service canadien de la faune.
Green, D.M., et N.K. Sanderson. 2007. Population ecology of Fowler's Toad (Bufo fowleri) at Long Point, Ontario, Field Report for 2007, ministère des Richesses naturelles de l’Ontario et Service canadien de la faune.
Green, D.M., et N.K. Sanderson. 2007. Radio–tracking Fowler's Toads in Long Point, Ontario, Field Report for 2007, Service canadien de la faune, Région de l’Ontario.
Green, D.M., et M.A. Smith. 2000 Ecology and viability of Fowler's Toads (Bufo fowleri) Populations, Fonds mondial pour la nature, Fonds de rétablissement des espèces canadiennes en péril.
Green, D.M., et M.A. Smith. 2003. Spatial ecology of Fowler’s toad (Bufo fowleri) populations in Canada, Fonds mondial pour la nature, Fonds de rétablissement des espèces canadiennes en péril.
Green, D.M., et A. Summerfield. 2008. Population ecology of Fowler's Toad (Bufo fowleri) at Long Point, Ontario, Field Report for 2008, ministère des Richesses naturelles de l’Ontario et Service canadien de la faune.
Green, D.M., C.W. Zeyl et A. El-Yassir. 1991. Spring emergence and abundance of Fowler's Toads, Bufo woodhousii fowleriat Long Point, Ontario, in 1991: implications for conservation, rapport au ministère des Richesses naturelles de l’Ontario, Service canadien de la faune, et Fonds mondial pour la nature–Canada.
Green, D.M., A. Valachovic, G. Tambasco et A. Kelner. 1993. Spring emergence, age structure, and abundance of Fowler's Toads, Bufowoodhousii fowleri, at Long Point, Ontario, in 1992, rapport au ministère des Richesses naturelles de l’Ontario et au Service canadien de la faune.
Green, D.M., M. Ouellet et C. Saumure. 1995. Breeding activity and growth rate in Fowler's Toads (Bufo woodhousii fowleri) at Long Point, Ontario in 1994, ministère des Richesses naturelles de l’Ontario, Service canadien de la faune Fonds mondial pour la nature–Canada.
Green, D.M., A.R. Yagi, M.A. Smith, S. Dobbyn, J. Duncan, K. Frohlich, R. Gould, K. Hayes, D. Jacobs, B. Johnson, K. Macintyre, J. Marchington, V. McKay, D. Mills, M. Oldham, S. Pineo, J. Robinson, T. Seburn, R. Tervo, W. Weller et A. Woodliffe. 2008. Recovery Strategy for the Fowler’s Toad (Bufo [Anaxyrus] fowleri) in Ontario, Série de Programmes de rétablissement de la Loi sur les espèces en péril, ministère des Richesses naturelles de l’Ontario, Peterborough, 68 p. (ébauche).
Hazen, S. (éd.) 2000. Down by the Bay: a history of Long Point and Port Rowan 1799-1999, Boston Mills Press, Erin (Ontario).
Hecky, R.E., R.E.H. Smith, D.R. Barton, S.J. Guilford et W.D. Taylor. 2004. The nearshore phosphorus shunt: a consequence of ecosystem engineering by dreissenids in the Laurentian Great Lakes, Canadian Journal of Fisheries and Aquatic Sciences 61:1285-1293.
Hillman, S.S., P.C. Withers, R.C. Drewes et S.D. Hillyard 2009. Ecological and Environmental Physiology of Amphibians, Oxford University Press, Oxford.
Hinckley, M.H. 1882. On some differences in the mouth-structure of tadpoles of the anurous batrachians found in Milton, Massachusetts, Proceedings of the Boston Society of Natural History 21:307-314.
Hubbs, C.L. 1918. Bufo fowleri in Michigan, Indiana and Illinois, Copeia55:40-43.
Jackson, J.N. 1967. Recreational development and the Lake Erie shore, Niagara Regional Development Council, St. Catharines (Ontario).
Jensen, W.I., et J.P. Allen. 1960. A possible relationship between aquatic invertebrates and avian botulism, Transactions of the North American Wildlife Natural Resources Conference 25:171-180.
Judd, W.W. 1957. Fowler’s Toads on the Lake Erie shore, Bulletin of the Federation of Ontario Naturalists 78:13-15.
Kellner, A., et D.M. Green. 1995. Age structure and age at maturity in Fowler’s Toads, Bufo woodhousii fowerli, at their northern range limit, Journal of Herpetology29:485-489.
Klemens, M.W. 1993. Amphibians and reptiles of Connecticut and adjacent regions, Bulletin of the State Geological and Natural History Survey of Connecticut112:1-318.
Laurin, G., et D.M. Green 1989. Spring emergence and male breeding behaviour of Fowler's Toads, Bufo woodhousii fowleri,at Long Point, Ontario, rapport présenté au ministère des Richesses naturelles de l’Ontario et au Service canadien de la faune.
Laurin, G., et D.M. Green. 1990. Spring emergence and male chorus behaviour in Fowler’s Toads, Bufo woodhousii fowleri, at Long Point, Ontario, Canadian Field-Naturalist 104:429-434.
Lazell, J.D., Jr. 1976. This broken archipelago, Cape Cod and the islands, amphibians and reptiles, Demeter Press (New York).
Limnoterra Ltd. 2006. Nickel Beach, Port Colborne, Fowler’s Toad (Bufo fowleri) Data Analysis and Management Implications, (ébauche), préparé pour le Fowler’s Toad Recovery Team, 69 p.
Linder, G., et B. Grillitsch. 2000. Ecotoxicology of metals, p.325-459, in D.W. Sparling, G. Linder et C.A. Bishop (éd.), Ecotoxicology of amphibians and reptiles, SETACPress, Pensacola (Floride).
Logier, E.B.S. 1931. The amphibians and reptiles of Long Point, Transactions of the Royal Canadian Institute 18:229-236.
Meacham, W.R. 1962. Factors affecting secondary intergradation between two allopatric populations in the Bufo woodhousei complex, American Midland Naturalist67:282-304.
Meffe, G.K., et C.R. Carroll. 1994. Principles of Conservation Biology, Sinauer Associates, Inc. Sunderland (Massachusetts), 600 p.
Meyer, S.M. 2003. Comparative use of Phragmites australis and other habitats by birds, amphibians, and small mammals at Long Point, Ontario, thèse de maîtrise ès sciences, Faculty of Graduate Studies University of Western Ontario London (Ontario), Canada, septembre 2003.
Miller, W.deW., et J. Chapin. 1910. The toads of the northeastern United States, Science 32:315-317.
Minton, S.A. 1972. Amphibians and Reptiles of Indiana, Monograph Number 3, Indiana Academy of Science, Indianapolis (Indiana).
Mount, R.M. 1975. The Reptiles and Amphibians of Alabama, Auburn University Press, Auburn(Alabama).
Myers, G.S. 1931. The original descriptions of Bufo fowleri and Bufo americanus, Copeia1931:94-96.
Pauly, G.B., D.M. Hillis et D.C. Cannatella. 2004. The history of a Nearctic colonization: Molecular phylogenetics and biogeography of the Nearctic toads (Bufo), Evolution58(11):2517-2535.
Pechmann, J.H.K., D.E. Scott, R.D. Semlitsch, J.P. Caldwell, L.J. Vitt et J.W. Gibbons. 1991. Declining amphibian populations: the problem of separating human impacts from natural fluctuations, Science253:892-895.
Pechmann, J.H.K., Wilbur, H.M., 1996. Putting declining amphibian populations in perspective, natural fluctuations and human impacts,Herpetologica 50:65-84
Planck, R.J., et C. Blott. 2006. Draft Nickel Beach Port Colborne, Fowler’s Toad (Bufo fowleri) Data Analysis and Management Implications prepared for the National Fowler’s Toad Recovery Team.
Reed, D.H., J.J. O’Grady, B.W. Brook, J.D. Ballou et R. Frankam. 2003. Estimates of minimum viable population sizes for vertebrates and factors influencing those estimates, Biological Conservation113:23-34.
Reed, T.M., et T.E. Rocke. 1992. The role of avian carcasses in botulism epizootics, Wildlife Society Bulletin 20:175-182.
Riley, S.C., K.R. Munkittrick, A.N. Evans et C.C. Krueger. 2008. Understanding the ecology of disease in Great Lakes fish populations, Aquatic Ecosystem Health and Management 11:321-334.
Russell, R.W., S.J. Hecnar, G. Mouland et G.D. Haffner. 1999. Pesticide accumulation in Point Pelee amphibians, Proceedings of the Parks Research Forum of Ontario, 1999 Annual Meeting, Guelph (Ontario), avril 1999.
Sanders, H.D. 1970. Pesticide toxicities to tadpoles of the western chorus frog, Pseudacris triseriata, and Fowler’s Toad, Bufo woodhousei fowleri, Copeia 1970:246-251.
Scribner, K.T., J.W. Arntzen et T. Burke. 1997. Effective number of breeding adults inBufo bufo estimated from age-specific variation at mini-satellite loci, Molecular Ecology 6:701-712.
Shirose, L.J., C.A. Bishop, D.M. Green, C.J. Macdonald, R.J. Brooks et N.J. Helferty. 1997. Validation tests of an amphibian call count survey technique in Ontario, Canada, Herpetologica 53:312-320.
Smith, M.A. 2004. Spatial ecology of Bufo fowleri, thèse de doctorat, département de biologie, McGill University, Montréal.
Smith, M.A., et D.M. Green. 2002. Bufo fowleri(Fowler's Toad), Predation, Herpetological Review 33(2):125.
Smith, M.A., et D.M. Green. 2004. Phylogeography of Bufo fowleri at its northern range limit, Molecular Ecology 13:3723-3733.
Smith, M.A., et D.M. Green. 2005a. Bufo fowleri(Fowler's Toad) Predation, Herpetological Review 36(2):159-160.
Smith, M.A, et D.M. Green. 2005b. Are all amphibian populations metapopulations? Dispersal and the metapopulation paradigm in amphibian ecology, Ecography 28:110-128.
Smith, M.A, et D.M. Green. 2006. Sex, isolation and fidelity: unbiased long distance dispersal in a terrestrial amphibian, Ecography29:649-658.
Smith, P.W. 1961. The Amphibians and Reptiles of Illinois, Illinois Natural History Survey Bulletin 28:1-298.
Speck, M. 2007. Development at Lakewood Beach camp approved, Niagara This Week, le 14 septembre 2007.
Stone, D. 1988. Long Point: Last Port of Call, Boston Mills Press, Erin (Ontario).
Sullivan, B.K. 1982. Significance of site, temperature and call attributes to sexual selection in Bufo woodhousei australis, Journal of Herpetology 16:103-106.
Sullivan, B.K. 1983. Sexual selection in Woodhouse's toad (Bufo woodhousei). II. Female choice, Animal Behaviour 31:1011-1017.
Sullivan, B.K., K.B. Malmos ET M.F. Given. 1996. Systematics of the Bufo woodhousiiComplex (Anura: Bufonidae): advertisement call variation, Copeia1996:274-280.
Traill, L.W., C.J.A. Bradshaw et B.W. Brook. 2007. Minimum viable population size: A meta-analysis of 30 years of published estimates, Biological Conservation 139: 159-166.
Tulbure, M.G., C.A. Johnston et D.L. Auger. 2007. Rapid invasion of a Great Lakes coastal wetland by non-native Phragmites australisand Typha, Journal of Great Lakes Research 33:269-279.
Tupper, T.A., et R.P. Cook. 2008. Habitat variables influencing breeding effort in northern clade Bufo fowleri: Implications for conservation, Applied Herpetology 5:101-119.
Vences, M., M.W. Penuel-Matthews, D.R. Vietites et R. Altig. 2003. Rana temporaria (Common Frog) andBufo fowleri (Fowler's Toad) tadpoles, Protozoan infestation, Herpetological Review 34(3):237-238.
Watts, A. 2009. Fowler conflict, Welland Tribune, avril 2009.
Welsman, P. 2009. Cottager Asks Important Questions, Letter to the Editor. The Chatham Daily News, le samedi 28 février.
Wilcox, K.L., S.A. Petrie, L.A. Maynard et S.W. Meyer. 2003. Historical distribution and abundance of Phragmites australis at Long Point, Lake Erie, Ontario, Journal of Great Lakes Research 29:664-680.
Wright, A.H., et A.A. Wright. 1949. Handbook of Frogs and Toads, 3rdedition, Comstock, Ithaca (New York).
Yagi, A.R. 2008. Fowler’s Toad (Bufo fowleri) distribution and abundance in the Niagara Population Region 2001 to 2006, rapport en préparation, ministère des Richesses naturelles de l’Ontario.
Yagi, A.R., et D. Mills. 2003. Fowler’s Toad (Bufo fowleri) abundance and habitat use at Morgan’s Point Conservation Area with habitat enhancement recommendations, Summer 2003, rapport du ministère des Richesses naturelles de l’Ontario.
Yagi, A.R., D. Mills et R. Tervo. 2004. Aylmer District Fowler’s toad (Bufo fowleri) Field Trip 2004 - Historic Elemental Occurrence Verification, Current Presence/Absence information with notes on Preliminary Habitat Characterization for Recovery Planning Purposes, rapport du ministère des Richesses naturelles de l’Ontario.
Yagi, A.R., et R. Tervo. 2006. Distribution of Fowler’s Toad (Bufo fowleri) in Aylmer District based upon field surveys conducted in 2004 and 2005 with notes on Habitat for Recovery Planning Purposes, rapport préparé pour le ministère des Richesses naturelles de l’Ontario, District d’Aylmer et Espèces en péril, MRNO, 21 p.
Yagi, A.R., et R. Tervo. 2008. Species at Risk Habitat Mapping for the Fowler’s toad(Bufo fowleri) - a Test of Draft Habitat Mapping Guidelines, ministère des Richesses naturelles de l’Ontario, 19 p.
Yagi, A.R., A. Brant, S.Meyer, D.M. Green, S.Dobbyn, K.Frohlich, K. Hayes, B. Johnson, M. Oldham et R. Tervo. 2008. The Fowler’s Toad Stewardship Guide, préparé pour le Programme d’intendance de l’habitat d’Environnement Canada, 60 p.
Yagi, A.R., D. Mills et R. Tervo. 2004. Aylmer District Fowler’s Toad (Bufo fowleri) field trip 2004 - Historic elemental occurrence verification, current presence/absence information with notes on preliminary habitat characterization for recovery planning purposes, rapport du ministère des Richesses naturelles de l’Ontario.
Yagi, A.R., R. Tervo et K. Frohlich. 2006. Fowler’s Toad Habitat Enhancement Projects in the Vicinity of Morgan’s Point and the Easter Seal Camp Lakewood in Wainfleet, rapport intermédiaire inédit, Programme d’intendance de l’habitat d’Environnement Canada, 31 p.
Zampella, R.A., et J.F. Bunnell. 2000. The distribution of anurans in two river systems of a coastal plain watershed, Journal of Herpetology34:210-221.
Zweifel, R.G. 1968. Effects of temperature, body size and hybridization on mating call of toads, Bufo a. americanus and Bufo woodhousei fowleri, Copeia1968:269-285.
Le professeur David M. Green est né à Vancouver, en Colombie–Britannique. Il a obtenu un baccalauréat spécialisé en zoologie de l’Université de la Colombie–Britannique (1976) ainsi qu’une maîtrise (1979) et un doctorat (1982), les deux également en zoologie, de l’Université de Guelph. Il a obtenu une bourse de recherche postdoctorale du Conseil de recherches en sciences naturelles et en génie (CRSNG) au Museum of Vertebrate Zoology (Université de la Californie), à Berkeley, et s’est joint au Musée Redpath de l’Université McGill en 1986 comme chercheur du CRSNGet professeur adjoint. Il y est nommé professeur titulaire en 2004, et il est directeur du Musée Redpath depuis 2005.
Les recherches du professeur Green portent sur l’écologie, la génétique et l’évolution des amphibiens, plus particulièrement les espèces en péril, y compris les déterminants de l’aire de répartition des espèces et des déclins des populations, la dynamique des populations, la dispersion et le recrutement chez les amphibiens et le déclin des populations d’amphibiens. M. Green est l’auteur de plus de 120 publications à comité de lecture et de plus de 100 autres publications et rapports divers. Il est notamment l’auteur des livres intitulés The Amphibians and Reptiles of British Columbia (2007), Amphibians in Decline. Canadian Studies of a Global Problem (1997) et Amphibian Cytogenetics and Evolution (1991). Rares sont ses publications dans lesquelles il n’est pas question de grenouilles ou de crapauds d’une manière ou d’une autre.
Le professeur Green est un membre de la Linnean Society et membre de l’American Society of Ichthyologists and Herpetologists, de la Society for the Study of Amphibians and Reptiles, de la Herpetologists' League et de la Society for Conservation Biology. Il est, ou a déjà été, éditeur adjoint de Diversity and Distributions, (2007 – ), d’Ecography (2007 – ), de The Zoological Journal of the Linnean Society (2006 – ) et d’Herpetologica (1995 – 2002). Il fait partie des comités de rédaction du Canadian Journal of Zoology (2005 – ) et deBiochemical Systematics and Ecology (1996 – ). Il a été président de la Society for the Study of Amphibians and Reptiles de 2001 – 2002 et président–fondateur de l’Association canadienne des herpétologistes de 1987 à 1990. Il a été le premier coordonnateur national du Groupe de travail sur les populations d'amphibiens en déclin au Canada (DAPCAN) de 1991 à 1994, le précurseur du Réseau canadien de conservation des amphibiens et des reptiles (RCCAR). Il a présidé au Comité sur la situation des espèces en péril au Canada (COSEPAC) de 1998 à 2002, coprésidé au Sous–comité de spécialistes des amphibiens et reptiles du COSEPAC de 1995 à 2009 et a été membre du Conseil consultatif scientifique de Pêches et Océans Canada de 2002 à 2005.
Le professeur M. Alexander (Alex) Smith a grandi dans la vallée de l’Outaouais, en Ontario. Il a obtenu un baccalauréat spécialisé et une maîtrise en biologie (1998) de l’Université Trent, et un doctorat (2004) de l’Université McGill. Il a été chercheur au niveau postdoctoral du FQAR à l’Université de Guelph et, en 2008, y a été embauché comme professeur adjoint en écologie moléculaire. À titre de biologiste, il travaille à l’intégration de la biologie de terrain et de la biologie moléculaire à certaines questions importantes sur le plan de l’écologie et de l’évolution dans une perspective de conservation. Il participe présentement à de multiples projets qui comprennent des estimations moléculaires de la biodiversité et la distribution de la diversité phylogénétique, l’écologie de la coévolution des relations hôte – parasitoïde – symbiote et la phylogéographie des fourmis et des amphibiens.
Aucune autre collection n'a été réexaminée dans le cadre de la préparation de la présente mise à jour.