Quiscale rouilleux (Euphagus carolinus) : évaluation et rapport de situation du COSEPAC 2017
Quiscale rouilleux

Préoccupante
2017
Table des matières
- Table des matières
- COSEPAC Sommaire de l’évaluation
- COSEPAC Résumé
- Résumé technique
- Préface
- Description et importance de l’espèce sauvage
- Répartition
- Habitat
- Biologie
- Taille et tendances des populations
- Activités et méthodes d’échantillonnage
- Abondance
- Fluctuations et tendances
- Recensement des oiseaux de Noël (RON)
- Relevé des oiseaux nicheurs d’Amérique du Nord (BBS)
- Atlas des oiseaux nicheurs
- étude des populations d’oiseaux du Québec (ÉPOQ)
- Réseau canadien de surveillance des migrations (RCSM)
- Analyses qualitatives des comptes rendus historiques pour les Etats-Unis
- Résumé des tendances des populations
- Immigration de source externe
- Menaces et facteurs limitatifs
- Menaces
- Développement résidentiel et commercial (menace no 1 de l’UICN); agriculture et aquaculture (menace no 2 de l’UICN); production d’énergie et exploitation minière (menace no 3 de l’UICN)
- Utilisation des ressources biologiques (menace no 5 de l’UICN)
- Modifications des systèmes naturels (menace no 7 de l’UICN)
- Pollution (menace no 9 de l’UICN)
- Espèces et gènes envahissants ou autrement problématiques (menace no 8 de l’UICN)
- Changements climatiques et phénomènes météorologiques violents (menace no 11 de l’UICN)
- Facteurs limitatifs
- Nombre de localités
- Menaces
- Protection, statuts et classements
- Remerciements
- Experts contactés
- Sources d’information
- Sommaire biographique du rédacteur du rapport
Liste des figures
- Figure 1. Quiscale rouilleux mâle adulte en plumage nuptial
- Figure 2. Répartition nord-américaine du Quiscale rouilleux durant la période de reproduction (gris pâle) et la période d’hivernage (gris foncé).
- Figure 3. Aire de reproduction (zone ombrée) et zone d’occurrence (zone délimitée par la ligne) du Quiscale rouilleux au Canada.
- Figure 4. Qualité relative de l’habitat pour la reproduction du Quiscale rouilleux au Canada, selon des modèles utilisant les données de l’ensemble de données du Projet de modélisation de l’avifaune boréale concernant les écorégions qui recoupent la portion sud de la région hémiboréale.
- Figure 5. Modèle de densité dans l’aire de reproduction du Quiscale rouilleux dans la forêt boréale (mâles/ha), pour la période 1961-1990.
- Figure 6. Nombre médian de Quiscales rouilleux détectés par heure-équipe dans le cadre du Recensement des oiseaux de Noël en Amérique du Nord entre 1970 et 2012.
- Figure 7. Indices annuels d’abondance de Quiscales rouilleux pour le Canada entre 1970 et 2014 (avec intervalles de confiance à 95 %), selon un modèle bayésien hiérarchique appliqué aux données du Relevé des oiseaux nicheurs d’Amérique du Nord.
- Figure 8. Répartition du Quiscale rouilleux en Ontario durant la période 2001-2005.
- Figure 9. Comparaison de la répartition du Quiscale rouilleux au Québec entre la période du premier atlas des oiseaux nicheurs (1985-1990, à gauche) et celle du deuxième atlas (2010-2015, à droite).
- Figure 10. Comparaison de la répartition du Quiscale rouilleux dans les Maritimes entre la période du premier atlas des oiseaux nicheurs (1985-1990) et celle du deuxième atlas (2010-2015).
- Figure 11. Indice d’abondance annuel pour le Quiscale rouilleux au Québec entre 1975 et 2013 selon la base de données de l’ÉPOQ.
Liste des tableaux
- Tableau 1. Taille estimée de la population canadienne de Quiscales rouilleux selon le Relevé des oiseaux nicheurs d’Amérique du Nord, les atlas et les données des Territoires du Nord Ouest et du Nunavut (Partners in Flight Science Committee, 2013).
- Tableau 2. Tendances annuelles des effectifs de Quiscales rouilleux au Canada selon les données du Relevé des oiseaux nicheurs d’Amérique du Nord dans le long terme (1970-2014) et le court terme (2004-2014), avec les limites inférieure et supérieure des intervalles de crédibilité à 95 %. Les résultats en caractères gras sont des baisses statistiquement significatives (c’est à dire que les intervalles de crédibilité à 95 % n’englobent pas zéro; A. Smith, données inédites).
- Tableau 3. Tendances des populations à court et à long terme avec intervalles de crédibilité à 95 % (IC) pour les Quiscales rouilleux en migration dénombrés à des stations de surveillance des migrations dans l’est du Canada (CMMN, 2016). Les tendances en caractères gras sont statistiquement significatives.
- Tableau 4. Cotes de conservation de NatureServe pour le Quiscale rouilleux (NatureServe, 2015)
Liste des annexes
- Annexe A. Calculateur des menaces (version de juin 2016).
Information sur le document
Évaluation et rapport de situation du COSEPAC sur le Quiscale rouilleux (Euphagus carolinus), 2017

COSEPAC
Comité sur la situation
des espèces en péril
au Canada

COSEWIC
Committee on the Status
of Endangered Wildlife
in Canada
Les sommaires du statut de l’espèce du COSEPAC sont des documents de travail servant à déterminer le statut des espèces sauvages au Canada que l’on croit en péril. On peut citer le présent document de la façon suivante :
COSEPAC. 2017. Évaluation et Rapport de situation du COSEPAC sur le Quiscale rouilleux (Euphagus carolinus) au Canada. Comité sur la situation des espèces en péril au Canada. Ottawa. xi + 70 p. (Registre public des espèces en péril site Web).
Rapport(s) précédent(s) :
COSEPAC. 2006. Évaluation et Rapport de situation du COSEPAC sur le le Quiscale rouilleux (Euphagus carolinus) au Canada. Comité sur la situation des espèces en péril au Canada. Ottawa. vi + 30 p.
Note de production :
Le COSEPAC remercie Dendroica Environnement et Faune (Carl Savignac) d’avoir rédigé le rapport de situation sur le Quiscale rouilleux (Euphagus carolinus) au Canada, qui a été préparé avec le soutien financier d’Environnement et Changement climatique Canada. La supervision et la révision du rapport ont été assurées par Jon McCracken et Richard Elliot, coprésidents du Sous-comité de spécialistes des oiseaux du COSEPAC.
Pour obtenir des exemplaires supplémentaires, s’adresser au :
Secrétariat du COSEPAC
a/s Service canadien de la faune
Environnement Canada
Ottawa (Ontario)
K1A 0H3
Tél. : 819-938-4125
Téléc. : 819-938-3984
Courriel : COSEPAC courriel
Site Web du COSEPAC
Also available in English under the title COSEWIC Assessment and Status Report on the Rusty Blackbird Euphagus carolinus in Canada.
Illustration/photo de la couverture :
Quiscale rouilleux - Photo prise par Carl Savignac.
COSEPAC sommaire de l’évaluation
Sommaire de l’évaluation - avril 2017
- Nom commun
- Quiscale rouilleux
- Nom scientifique
- Euphagus carolinus
- Statut
- Préoccupante
- Justification de la désignation
- La répartition et l’abondance connues de cet oiseau ont augmenté de façon significative en raison de la recherche sur le terrain et de la collecte depuis l’évaluation initiale de l’espèce par le COSEPAC en 2004, résultant ainsi à une diminution du risque d’extinction. L’espèce est maintenant observée en Colombie-Britannique et en Saskatchewan, et une quantité considérable d’habitat potentiel inexploré existe. De faibles déclins ont été observés, et des menaces potentielles, incluant la présence de bétail, les changements climatiques, la conversion de l’habitat naturel en zones agricoles, ainsi que les espèces envahissantes, ont été identifiées. L’espèce demeure en péril et pourrait devenir « menacée » à moins que les menaces soient atténuées avec une efficacité démontrée.
- Répartition
- Colombie-Britannique, Saskatchewan
- Historique du statut
- Espèce désignée « en voie de disparition » en novembre 2004. Réexamen du statut : l'espèce a été désignée « préoccupante » en avril 2017.
COSEPAC résumé
Quiscale rouilleux
Euphagus carolinus
Description et importance de l’espèce sauvage
Le Quiscale rouilleux (Euphagus carolinus) est un passereau de taille moyenne. Les oiseaux des deux sexes ont les yeux jaune pâle et un bec noir légèrement courbé. Pendant la période de reproduction, le plumage du mâle est entièrement noir et légèrement irisé de vert sur le corps et de violet sur la tête et le cou. Le plumage gris brunâtre de la femelle n’est pas irisé. En hiver, le plumage des deux sexes est plutôt roussâtre. Dans les provinces de l’Ouest, il est facile de confondre le Quiscale rouilleux avec le Quiscale de Brewer (E. cyanocephalus), qui présente toutefois un bec plus épais, une queue et des pattes plus longues et un plumage plus irisé. Comme 85 % de l’aire de répartition du Quiscale rouilleux se trouve au Canada, la conservation de cette espèce relève en grande partie du Canada.
Répartition
Le Quiscale rouilleux est largement réparti dans les régions boréales du Canada et se reproduit dans l’ensemble des provinces et territoires du pays. L’aire d’hivernage de l’espèce comprend la majeure partie du centre et de l’est des États-Unis, et cet oiseau hiverne aussi irrégulièrement dans l’extrême sud du Canada.
Habitat
L’aire de reproduction canadienne du Quiscale rouilleux se trouve presque entièrement dans la forêt boréale. Il y niche dans des forêts dominées par des conifères adjacentes à des milieux humides, comme des ruisseaux à faible débit, des tourbières, des cypéraçaies, des marais, des marécages et des étangs de castors. Durant ses migrations, l’espèce fréquente surtout des milieux humides boisés. En hiver, elle occupe principalement des milieux humides forestiers de basses terres, des champs cultivés et des bosquets de pacaniers. L’habitat convenant au Quiscale rouilleux semble en diminution dans l’aire de reproduction et les quartiers d’hiver de l’espèce, principalement du fait de la perte et de la dégradation de milieux humides causées par les activités humaines.
Biologie
Les Quiscales rouilleux nichent à la bordure de milieux humides en couples isolés, mais aussi parfois en colonies lâches. Les nids sont aménagés dans des arbustes ou de petits arbres à proximité ou au-dessus de l’eau. La femelle pond de trois à sept œufs. L’incubation dure 14 jours, et les oisillons demeurent au nid pendant environ 13 jours. Les oiseaux de l’est du Canada hivernent principalement à l’est des Appalaches, tandis que ceux qui nichent dans le centre et l’ouest du Canada hivernent principalement dans la vallée du Mississippi.
Taille et tendances populations
La population nicheuse canadienne, qui comprend environ 87 % de la population mondiale, est estimée à 4,4 millions d’oiseaux. D’après le Recensement des oiseaux de Noël et le Relevé des oiseaux nicheurs d’Amérique du Nord, le Quiscale rouilleux a connu l’une des plus importantes baisses d’effectif enregistrées chez les oiseaux du Canada. Il a présenté des taux annuels de diminution de 5,5 % et de 6,3 % dans ces deux relevés, respectivement, pour une réduction totale de la population de 85 à 90 % depuis 1970. Ce déclin semble avoir débuté dès les années 1920. Cependant, des analyses des tendances à court terme pour le Canada montrent que la population a été assez stable entre 2004 et 2014.
Menaces et facteurs limitatifs
On pense que les menaces les plus graves pesant sur le Quiscale rouilleux concernent les lieux d’hivernage de l’espèce dans le sud-est des États-Unis. Elles comprennent la perte et la dégradation d’habitat d’hivernage découlant de la conversion de milieux humides à des fins agricoles et résidentielles, des modifications de l’hydrologie de surface dues aux activités associées aux barrages, les programmes de lutte à grande échelle contre les ictéridés dans les zones agricoles, et la mortalité causée par les pesticides agricoles. Dans les quartiers d’hiver, les menaces concernent les milieux humides : contamination par le mercure, acidification, et dégradation due aux changements climatiques.
Protection, statuts et classements
Bien que le Quiscale rouilleux soit migrateur, il n’est pas protégé au Canada par la Loi de 1994 sur la convention concernant les oiseaux migrateurs. Il est actuellement inscrit en tant qu’espèce préoccupante à l’annexe 1 de la Loi sur les espèces en péril. Cet oiseau bénéficie d’une protection générale en vertu de la législation sur les espèces sauvages de l’ensemble des provinces et territoires, et trois provinces l’ont inscrit dans leur législation sur les espèces en péril, soit le Nouveau-Brunswick, la Nouvelle-Écosse et Terre-Neuve-et-Labrador. Au Québec, le Quiscale rouilleux figure sur la liste des espèces fauniques susceptibles d’être désignées menacées ou vulnérables.
Résumé technique
- Nom scientifique:
- Euphagus carolinus
- Nom français:
- Quiscale rouilleux
- Nom anglais:
- Rusty Blackbird
- Répartition au Canada:
- Yukon, Territoires du Nord-Ouest, Nunavut, Colombie-Britannique, Alberta, Saskatchewan, Manitoba, Ontario, Québec, Nouveau-Brunswick, Île-du-Prince-Édouard, Nouvelle Écosse, Terre-Neuve-et-Labrador
Information démographique
| Sujet | Information |
|---|---|
| Durée d’une génération (généralement, âge moyen des parents dans la population) | 2 à 3 ans |
| Y a-t-il un déclin continu [observé, inféré ou prévu] du nombre total d’individus matures? | Non; les déclins pourraient avoir été suivis d’une stabilisation des effectifs entre environ 2004 et 2014. |
| Pourcentage estimé de déclin continu du nombre total d’individus matures sur [cinq ans ou deux générations]. | Inconnu; aucun changement statistiquement significatif n’a été observé. |
| Pourcentage [observé, estimé, inféré ou présumé] [de réduction ou d’augmentation] du nombre total d’individus matures au cours des [dix dernières années ou trois dernières générations]. | Pas de changement statistiquement significatif observé, estimé, inféré ou présumé. |
| Pourcentage [prévu ou présumé] [de réduction ou d’augmentation] du nombre total d’individus matures au cours des [dix prochaines années ou trois prochaines générations]. | Inconnu |
| Pourcentage [observé, estimé, inféré ou présumé] [de réduction ou d’augmentation] du nombre total d’individus matures au cours de toute période de [dix ans ou trois générations] commençant dans le passé et se terminant dans le futur. | Inconnu |
| Est-ce que les causes du déclin sont a) clairement réversibles et b) comprises et c) ont effectivement cessé? | a. Non b. Non; largement inconnues. c. Non; elles pourraient ne pas avoir cessé. |
| Y a-t-il des fluctuations extrêmes du nombre d’individus matures? | Non |
Information sur la répartition
| Sujet | Information |
|---|---|
| Zone d’occurrence estimée | 9,9 millions de km2; selon le plus petit polygone convexe couvrant l’aire de reproduction de l’espèce au Canada (voir la figure 3). |
| Indice de zone d’occupation (IZO) | Inconnu, mais bien supérieur à 2 000 km2. |
| La population totale est-elle gravement fragmentée, c.-à-d. que plus de 50 % de sa zone d’occupation totale se trouvent dans des parcelles d’habitat qui sont a) plus petites que la superficie nécessaire au maintien d’une population viable et b) séparées d’autres parcelles d’habitat par une distance supérieure à la distance de dispersion maximale présumée pour l’espèce? | a. Non b. Non |
| Nombre de localités? Voir « Définitions et abréviations » sur le Site Web du site web du COSEPAC et IUCN (février 2014; en anglais seulement) pour obtenir des précisions sur ce terme. (utilisez une fourchette plausible pour refléter l’incertitude, le cas échéant) |
Inconnu, mais bien supérieur à 10. |
| Y a-t-il un déclin [observé, inféré ou prévu] de la zone d’occurrence? | On ne sait pas. |
| Y a-t-il un déclin [observé, inféré ou prévu] de l’indice de zone d’occupation? | Possiblement inféré; cependant, les baisses apparentes dans le sud pourraient être contrebalancées par des hausses dans le nord. |
| Y a-t-il un déclin [observé, inféré ou prévu] du nombre de sous-populations? | Sans objet |
| nombre de localités? Voir « Définitions et abréviations » sur le Site Web du site web du COSEPAC et IUCN (février 2014; en anglais seulement) pour obtenir des précisions sur ce terme. ? |
Sans objet |
| Y a-t-il un déclin [observé, inféré ou prévu] de [la superficie, l’étendue ou la qualité] de l’habitat? | Oui; déclin de la qualité de l’habitat observé. |
| Y a-t-il des fluctuations extrêmes du nombre de sous-populations? | Non |
| Y a-t-il des fluctuations extrêmes du nombre de localités? Voir « Définitions et abréviations » sur le Site Web du site web du COSEPAC et IUCN (février 2014; en anglais seulement) pour obtenir des précisions sur ce terme. ? |
Non |
| Y a-t-il des fluctuations extrêmes de la zone d’occurrence? | Non |
| Y a-t-il des fluctuations extrêmes de l’indice de zone d’occupation? | Non |
Nombre d’individus matures dans chaque population
| Sujet | Information |
|---|---|
| Sous-populations (donnez des fourchettes plausibles) | Nombre d’individus matures |
| Total | 4,4 millions; selon l’estimation de Partenaires d’envol (voir la section « Abondance »). |
Analyse quantitative
| Sujet | Information |
|---|---|
| La probabilité de disparition de l’espèce à l’état sauvage est d’au moins [20 % sur 20 ans ou 5 générations, ou 10 % sur 100 ans]. | On ne sait pas; l’analyse quantitative pertinente n’a pas été réalisée. |
Menaces (menaces directes, de l’impact le plus élevé à l’impact le plus faible, selon le calculateur des menaces de l’UICN)
| Sujet | Information |
|---|---|
| Un calculateur des menaces a-t-il été rempli pour l’espèce? | Oui, le 5 mai 2016 (Suzanne Carrière, Kaytlin Cooper, Bruno Drolet, Richard Elliot, Dave Fraser, Marcel Gahbauer, Joanna James, Jeff Keith, Jon McCracken, Carl Savignac, Pam Sinclair, Karen Timm, Steve Van Wilgenberg, Alana Westwood)
Quels autres facteurs limitatifs sont pertinents? Sans objet |
Immigration de source externe (immigration de l’extérieur du Canada)
| Sujet | Information |
|---|---|
| Situation des populations de l’extérieur les plus susceptibles de fournir des individus immigrants au Canada. | Les États-Unis n’abritent que moins de 15 % de la population nicheuse mondiale, et la qualité de l’habitat y diminue. Les tendances des effectifs étatsuniens sont difficiles à évaluer statistiquement, mais elles sont probablement à la baisse. |
| Une immigration a-t-elle été constatée ou est-elle possible? | Oui; possible. |
| Des individus immigrants seraient-ils adaptés pour survivre au Canada? | Oui |
| Y a-t-il suffisamment d’habitat disponible au Canada pour des individus immigrants? | Probable; si on suppose que l’habitat demeure stable. |
| Les conditions se détériorent-elles au Canada Voir le tableau 3 (Lignes directrices pour la modification de l’évaluation de la situation d’après une immigration de source externe)? |
Oui; la qualité de l’habitat diminue. |
| Les conditions de la population source se détériorent-elles? | Oui; la qualité de l’habitat diminue en Alaska et dans le nord-est des États-Unis. |
| La population canadienne est-elle considérée comme un puits? | Non |
| La possibilité d’une immigration depuis des populations externes existe-t-elle? | Non |
Nature délicate de l’information sur l’espèce
| Sujet | Information |
|---|---|
| L’information concernant l’espèce est-elle de nature délicate? | Non |
Historique du statut
| Sujet | Information |
|---|---|
| COSEPAC : Espèce désignée « préoccupante » en avril 2006. | Réexamen et confirmation du statut en avril 2017. |
Statut et justification de la désignation
| Sujet | Information |
|---|---|
| Statut | Espèce préoccupante |
| Code alphanumérique | Sans objet |
| Justification de la désignation | Les facteurs qui menacent la persistance de l’espèce au Canada n’ont pas été renversés ni efficacement gérés depuis que cette espèce a été évaluée « espèce préoccupante » en 2006. L’espèce a connu des déclins de population prononcés au cours du 20e siècle, déclins qui pourraient s’être stabilisés récemment. Il ne s’agit peut-être là que d’un sursis temporaire puisque de nombreuses menaces importantes contribuant à ces déclins n’ont pas été corrigées, en particulier en ce qui concerne l’aire d’hivernage aux États-Unis. Ces problèmes incluent la perte et la dégradation de l’habitat d’hivernage dues à la conversion des milieux humides et à la construction de barrages, les programmes de lutte contre les « oiseaux noirs » dans les zones agricoles et les effets de l’utilisation des pesticides agricoles. Les menaces continues qui pèsent sur les lieux de reproduction canadiens incluent la contamination par le mercure, et la dégradation des milieux humides découlant du réchauffement planétaire, de l’acidification et des conditions climatiques de plus en plus sèches. |
Applicabilité des critères
| Sujet | Information |
|---|---|
| Critère A (déclin du nombre total d’individus matures) | Sans objet; la réduction estimée du nombre total d’individus matures n’atteint pas les seuils. |
| Critère B (petite aire de répartition, et déclin ou fluctuation) | Sans objet; l’étendue de la répartition de l’espèce dépasse tous les seuils. |
| Critère C (nombre d’individus matures peu élevé et en déclin) | Sans objet; le nombre d’individus matures dépasse tous les seuils. |
| Critère D (très petite population totale ou répartition restreinte) | Sans objet; le nombre d’individus matures dépasse tous les seuils. |
| Critère E (analyse quantitative) | Analyse non réalisée. |
Preface
Au cours des dix dernières années, de nouvelles activités de recherche visant le Quiscale rouilleux ont été menées, en grande partie par l’International (Canada-U.S.A.) Rusty Blackbird Working Group (groupe de travail international [Canada-États-Unis] sur le Quiscale rouilleux). Ces travaux ont été centrés sur les points suivants :
- utilisation de l’habitat et succès reproducteur dans les lieux de reproduction;
- répartition et utilisation de l’habitat dans les lieux d’hivernage et aux haltes migratoires;
- connectivité migratoire entre les régions de reproduction et d’hivernage;
- menaces et facteurs limitatifs dans les lieux de reproduction et les lieux d’hivernage aux États-Unis;
- tendances des populations dans les lieux de reproduction.
Les travaux menés dans les lieux de reproduction ont été principalement réalisés en Alaska et en Nouvelle-Angleterre. Les données sur l’utilisation de l’habitat dans les lieux d’hivernage ont été recueillies dans la vallée alluviale du Mississippi et dans la plaine côtière atlantique. Depuis l’évaluation de l’espèce de 2006, d’importantes connaissances sur les menaces et les facteurs limitatifs ont été acquises à la grandeur des aires de reproduction et d’hivernage, connaissances centrées de façon générale sur les impacts des changements climatiques, de la contamination par le mercure et les pesticides, des pratiques d’aménagement forestier et du parasitisme des nids. Au Canada, les tendances de population du Quiscale rouilleux ont été étudiées dans les Territoires du Nord-Ouest, où des changements d’effectif ont été observés entre les années 1970 et 2006, ainsi qu’au Québec à l’aide de données de dénombrement recueillies lors des migrations par l’Observatoire d’oiseaux de Tadoussac.
Historique du COSEPAC
Le Comité sur la situation des espèces en péril au Canada (COSEPAC) a été créé en 1977, à la suite d’une recommandation faite en 1976 lors de la Conférence fédérale-provinciale sur la faune. Le Comité a été créé pour satisfaire au besoin d’une classification nationale des espèces sauvages en péril qui soit unique et officielle et qui repose sur un fondement scientifique solide. En 1978, le COSEPAC (alors appelé Comité sur le statut des espèces menacées de disparition au Canada) désignait ses premières espèces et produisait sa première liste des espèces en péril au Canada. En vertu de la Loi sur les espèces en péril (LEP) promulguée le 5 juin 2003, le COSEPAC est un comité consultatif qui doit faire en sorte que les espèces continuent d’être évaluées selon un processus scientifique rigoureux et indépendant.
Mandat du COSEPAC
Le Comité sur la situation des espèces en péril au Canada (COSEPAC) évalue la situation, au niveau national, des espèces, des sous-espèces, des variétés ou d’autres unités désignables qui sont considérées comme étant en péril au Canada. Les désignations peuvent être attribuées aux espèces indigènes comprises dans les groupes taxinomiques suivants : mammifères, oiseaux, reptiles, amphibiens, poissons, arthropodes, mollusques, plantes vasculaires, mousses et lichens.
Composition du COSEPAC
Le COSEPAC est composé de membres de chacun des organismes responsables des espèces sauvages des gouvernements provinciaux et territoriaux, de quatre organismes fédéraux (le Service canadien de la faune, l’Agence Parcs Canada, le ministère des Pêches et des Océans et le Partenariat fédéral d’information sur la biodiversité, lequel est présidé par le Musée canadien de la nature), de trois membres scientifiques non gouvernementaux et des coprésidents des sous-comités de spécialistes des espèces et du sous-comité des connaissances traditionnelles autochtones. Le Comité se réunit au moins une fois par année pour étudier les rapports de situation des espèces candidates.
Définitions (2016)
- Espèce sauvage
- Espèce, sous-espèce, variété ou population géographiquement ou génétiquement distincte d’animal, de plante ou d’un autre organisme d’origine sauvage (sauf une bactérie ou un virus) qui est soit indigène du Canada ou qui s’est propagée au Canada sans intervention humaine et y est présente depuis au moins cinquante ans.
- Disparue (D)
- Espèce sauvage qui n’existe plus.
- Disparue du pays (DP)
- Espèce sauvage qui n’existe plus à l’état sauvage au Canada, mais qui est présente ailleurs.
-
En voie de disparition (VD)
(Remarque : Appelée « espèce disparue du Canada » jusqu’en 2003.) - Espèce sauvage exposée à une disparition de la planète ou à une disparition du pays imminente.
- Menacée (M)
- Espèce sauvage susceptible de devenir en voie de disparition si les facteurs limitants ne sont pas renversés.
-
Préoccupante (P)
(Remarque : Appelée « espèce en danger de disparition » jusqu’en 2000.) - Espèce sauvage qui peut devenir une espèce menacée ou en voie de disparition en raison de l'effet cumulatif de ses caractéristiques biologiques et des menaces reconnues qui pèsent sur elle.
-
Non en péril (NEP)
(Remarque : Appelée « espèce rare » jusqu’en 1990, puis « espèce vulnérable » de 1990 à 1999.) - Espèce sauvage qui a été évaluée et jugée comme ne risquant pas de disparaître étant donné les circonstances actuelles.
-
Données insuffisantes (DI)
(Remarque :Autrefois « aucune catégorie » ou « aucune désignation nécessaire ».) - Une catégorie qui s’applique lorsque l’information disponible est insuffisante (a) pour déterminer l’admissibilité d’une espèce à l’évaluation ou (b) pour permettre une évaluation du risque de disparition de l’espèce.
Remarque : Catégorie « DSIDD » (données insuffisantes pour donner une désignation) jusqu’en 1994, puis « indéterminé » de 1994 à 1999. Définition de la catégorie (DI) révisée en 2006.
Le Service canadien de la faune d’Environnement et Changement climatique Canada assure un appui administratif et financier complet au Secrétariat du COSEPAC.
Description et importance de l’espèce sauvage
Nom et classification
Le nom français de l’espèce Euphagus carolinus (Müller, 1776) est « Quiscale rouilleux ». Son nom anglais est « Rusty Blackbird ». Sa taxinomie est comme suit :
Classe : Oiseaux (Aves)
Ordre : Passériformes
Famille : Ictéridés
Genre : Euphagus
Espèce : Euphagus carolinus
Deux espèces d’ictéridés du genre Euphagus sont présentes en Amérique du Nord : le Quiscale rouilleux et le Quiscale de Brewer (E. cyanocephalus; American Ornithologists’ Union [AOU], 1957).
Description morphologique
Le Quiscale rouilleux est un passereau de taille moyenne (longueur du corps : de 21 à 25 cm; Godfrey, 1986; figure 1). Les oiseaux des deux sexes ont les yeux jaune pâle, et le bec et les pattes noirs. Durant la période de reproduction, le plumage du mâle est uniformément noir et faiblement irisé de vert sur le corps et légèrement irisé de violet sur la tête et le cou. Le plumage est différent en automne, la bordure des rémiges tertiaires, des scapulaires, des tectrices sus-alaires et des plumes de la tête, de la poitrine et du dos prenant une couleur rouille (Pyle, 1997). Durant la période de reproduction, le plumage de la femelle est gris brunâtre, sans irisation (Pyle 1997). Le plumage d’hiver de la femelle est globalement de couleur rouille, le croupion étant gris. Durant l’automne, les immatures sont semblables aux adultes (Pyle, 1997), les juvéniles ayant toutefois l’iris foncé.
Durant l’été, le Quiscale rouilleux peut être confondu avec le Quiscale de Brewer, qui est de taille et de coloration similaires (Avery, 2013). Le plumage du Quiscale de Brewer mâle est cependant plus irisé que celui du Quiscale rouilleux mâle, et le bec du Quiscale de Brewer est plus court, plus droit et plus épais que celui du Quiscale rouilleux. Les pattes et la queue du Quiscale de Brewer sont aussi généralement plus longues que celles du Quiscale rouilleux. Durant l’été, les femelles diffèrent quant à la coloration de l’iris, lequel est jaune chez le Quiscale rouilleux et foncé chez le Quiscale de Brewer. Dans les bandes migratrices et hivernantes comptant divers ictéridés, les Quiscales rouilleux peuvent aussi être confondus avec les Quiscales bronzés (Quiscalus quiscula), dont la queue est cependant plus longue.

Description longue de la figure 1
Photo d’un Quiscale rouilleux mâle en période de reproduction. L’oiseau est entièrement noir. Son corps a un léger reflet verdâtre, alors que sa tête et son cou ont un léger reflet violet.
Structure spatiale et variabilité de la population
Peu d’études moléculaires ou génétiques ont été réalisées en ce qui concerne la parenté entre le Quiscale rouilleux et d’autres espèces. Le séquençage du gène codant pour le cytochrome-b laisse entendre que, au plan phylogénétique, le Quiscale rouilleux est le plus étroitement apparenté au Quiscale de Brewer (Lanyon et Omland, 1999). Par ailleurs, il n’existe pas d’information sur la structure spatiale ou la variabilité de la population du Quiscale rouilleux.
Unités désignables
Le Quiscale rouilleux compte deux sous-espèces reconnues. L’E. c. carolinus est présent dans la majeure partie de l’aire de répartition de l’espèce, et il hiverne du sud de la Colombie-Britannique jusque dans le sud de l’Ontario, et vers le sud (de façon générale à l’est des Grandes Plaines) jusque dans l’est du Texas et le nord de la Floride. L’E. c. nigrans (Burleigh et Peters, 1948) se reproduit à Terre-Neuve-et-Labrador, en Nouvelle-Écosse, au Québec aux îles de la Madeleine, et peut-être dans l’est du Nouveau-Brunswick (AOU, 1957; Godfrey, 1986), et son aire d’hivernage se trouve apparemment dans les Carolines et en Géorgie (AOU, 1957), où elle chevaucherait probablement celle de l’E. c. carolinus. Par rapport à l’E. c. carolinus, l’E. c. nigrans mâle a le corps généralement plus foncé et une irisation bleue sur la tête, et la femelle en période de reproduction est d’un gris plus foncé (Peters et Burleigh, 1951), la couleur rouille des bordures de plumes étant plus foncée à l’automne. Globalement, si l’on tient compte de la variation individuelle, on peut dire que les différences morphologiques entre les deux sous-espèces sont subtiles (Pyle, 1997).
Le présent rapport de situation considère l’E. carolinus comme une seule unité désignable, étant donné que les faibles fondements scientifiques sur lesquels reposent la distinction entre les deux sous-espèces (différences mineures de plumage), dont la ségrégation dans les aires de reproduction et d’hivernage est de plus limitée, indiquent que les différences entre les deux sous-espèces ne sont pas suffisamment marquées et importantes sur le plan évolutionnaire pour que ces dernières soient considérées comme des unités désignables séparées.
Importance de l’espèce
Il n’existe aucune étude faisant état de l’importance économique du Quiscale rouilleux. Dans ses quartiers d’hiver, le Quiscale rouilleux se mêle souvent à des bandes d’autres espèces d’ictéridés, dans des dortoirs comptant des milliers d’oiseaux, lesquels peuvent constituer une nuisance pour les infrastructures en raison de l’accumulation de déjections et causer des dommages aux cultures (Dolbeer et al., 1997; Avery, 2013). Avec d’autres ictéridés, le Quiscale rouilleux est depuis longtemps considéré comme étant une espèce nuisible, mais dans son cas, cette réputation est largement non justifiée. En ce qui concerne les sources de connaissances traditionnelles autochtones concernant le Quiscale rouilleux, une recherche à ce sujet n’a pas permis d’en trouver pour le Canada (Chiblow, 2013).
Répartition
Aire de répartition mondiale
Le Quiscale rouilleux n’est présent qu’en Amérique du Nord. Son aire de reproduction comprend l’ensemble des provinces et territoires du Canada, la majeure partie de l’Alaska et certaines parties du Minnesota, du Michigan, du Vermont, du New Hampshire, du Maine, de l’État de New York et du Massachusetts (Avery, 2013; figure 2).
L’aire d’hivernage de l’espèce comprend le Massachusetts, l’État de New York, la Pennsylvanie, la Virginie, l’Ohio, le Michigan, le Wisconsin, l’Iowa, le Kansas, l’Oklahoma et les États américains de la côte atlantique (figure 2). On pense que les principaux lieux d’hivernage se trouvent dans la partie sud de la vallée du Mississippi, ainsi que dans la plaine côtière, à l’est des Appalaches (Niven et al., 2004; Hamel et Ozdenerol, 2008; Greenberg et al., 2011; Avery 2013). De fortes concentrations de Quiscales rouilleux sont également observées en hiver en Alabama, en Géorgie, au Texas, en Caroline du Nord et en Caroline du Sud (Smithsonian Institution, 2015). De faibles effectifs hivernent aussi localement et sporadiquement dans le sud de la plupart des provinces canadiennes (Avery, 2013; figure 2).
Aire de répartition canadienne
L’aire de répartition canadienne du Quiscale rouilleux s’étend depuis Terre-Neuve-et-Labrador jusque dans le Yukon et comprend l’ensemble des provinces et territoires du Canada (Avery, 2013; figure 3). La limite nord de cette aire passe par la région d’Old Crow, dans le nord du Yukon (Sinclair et al., 2003), le delta du Mackenzie, le Grand lac de l’Ours et le Grand lac des Esclaves, dans les Territoires du Nord-Ouest (Norment et al., 1999; Avery, 2013), le sud du Kivalliq, au Nunavut (eBird Canada, 2015), le littoral sud de la baie d’Hudson au Manitoba et en Ontario (Cadman et al., 2007; BBAMB, 2015), le lac Guillaume-Delisle et Kuujjuaq, dans le nord du Québec (BBAQ, 2015), Davis Inlet, au Labrador, et la côte nord de l’île de Terre-Neuve (eBird Canada, 2015). La limite sud de l’aire de répartition canadienne de l’espèce passe par le centre-sud de la Colombie-Britannique à l’est de la chaîne Côtière, le centre de l’Alberta, le centre de la Saskatchewan, le sud du Manitoba (p. ex. Delta Beach), le sud de l’Ontario (p. ex. péninsule Bruce), le sud du Québec (p. ex. l’Outaouais et l’Estrie), et le sud du Nouveau-Brunswick et de la Nouvelle-Écosse (figure 3).
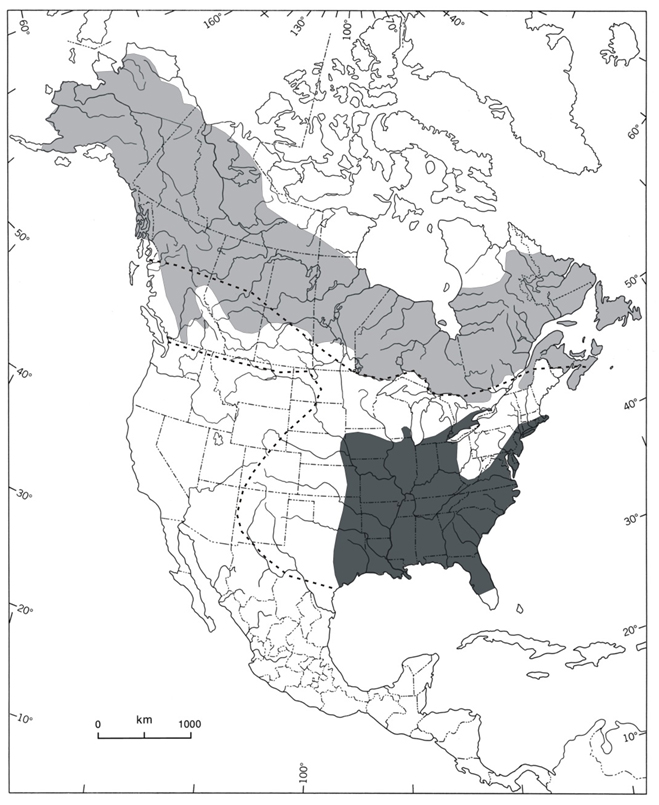
Description longue de la figure 2
Carte de l’aire de répartition du Quiscale rouilleux en Amérique du Nord pendant les périodes de reproduction et d’hivernage. L’aire de reproduction comprend toutes les provinces et tous les territoires au Canada, la majorité de l’Alaska et certaines régions des États du Minnesota, du Michigan, du Vermont, du New Hampshire, du Maine, de New York et du Massachusetts. L’aire d’hivernage comprend les États du Massachusetts, de New York, de Pennsylvanie, de Virginie, de l’Ohio, du Michigan, du Wisconsin, de l’Iowa, du Kansas, de l’Oklahoma et de la côte atlantique.
Zone d’occurrence et zone d’occupation
La zone d’occurrence du Quiscale rouilleux au Canada, établie par traçage du plus petit polygone convexe couvrant l’aire de répartition de l’espèce, est d’environ 9,9 millions de kilomètres carrés (figure 3). Cette superficie est nettement supérieure à celle calculée par le COSEPAC dans son rapport de situation précédent (COSEWIC, 2006), ce qui s’explique par le grand nombre de parcelles d’atlas où l’espèce a été signalée dans le nord du Québec lors des travaux du deuxième Atlas des oiseaux nicheurs du Québec (BBAQ, 2015), et par l’existence de mentions nordiques ailleurs au Canada provenant d’eBird Canada (2015). La zone d’occupation biologique de l’espèce est d’environ 242 000 km2. Cette valeur est fondée sur une superficie moyenne des territoires de nidification de 0,11 km2 (voir la section « Domaine vital et territoire »), multipliée par une estimation de la population de 2,2 millions de couples nicheurs (Partners in Flight Science Committee, 2013). L’indice de zone d’occupation, qui serait normalement établi à l’aide d’une grille à carrés de 2 km de côté superposée aux zones connues pour être occupées par l’espèce, n’a pas pu être calculé en raison du manque d’information détaillée sur tous les sites de nidification, mais il est certainement supérieur au seuil de 2 000 km2 établi par le COSEPAC.
Il y a eu réduction de la répartition du Quiscale rouilleux dans le sud de plusieurs provinces canadiennes, dont l’Alberta, la Saskatchewan et le Manitoba (Federation of Alberta Naturalists, 2007; Greenberg et al. 2011; BBAMB, 2015; Government of Saskatchewan, 2015). Powell (2008) a aussi rapporté une contraction de 160 km de l’aire de reproduction de l’espèce au Maine depuis 1983, et les données d’atlas des oiseaux nicheurs pour le Vermont indiquent aussi une réduction de l’aire de reproduction dans cet État (Fisher et Powell, 2013). De plus, la comparaison des données d’atlas des oiseaux nicheurs recueillies dans les années 2010 avec les données correspondantes compilées dans les années 1980 en Ontario, au Québec et dans les Maritimes laisse penser qu’il y a eu réduction de la répartition dans le sud de l’Ontario, au Québec, au Nouveau-Brunswick et en Nouvelle-Écosse (Cadman et al., 2007; BBAQ, 2015; Stewart et al., 2015). Cependant, la réduction de répartition pourrait être moins importante dans le nord-ouest du Canada, particulièrement le long de la vallée du Mackenzie, où l’occupation des milieux humides, suivie au début des années 1970 et en 2006, est demeurée la même (Machtans et al., 2007).
Activités de recherche
L’aire de reproduction canadienne du Quiscale rouilleux a été déterminée principalement sur la base de travaux associés à divers atlas des oiseaux nicheurs (Sinclair et al., 2003; Cadman et al., 2007; Federation of Alberta Naturalists, 2007; BBABC, 2015; BBAMB, 2015; BBAQ, 2015; Government of Saskatchewan, 2015; Stewart et al., 2015), et à partir de données provenant d’eBird Canada (2015) et du Projet de modélisation de l’avifaune boréale (BAM, 2015). Toutefois, il existe encore des lacunes dans les données pour les parties nord de l’aire de reproduction de l’espèce, notamment pour le nord de la Colombie-Britannique, où une grande partie de la population occupe des milieux humides d’altitude inaccessibles (David Fraser, comm. pers.).
En ce qui concerne l’aire d’hivernage, une analyse des données du Recensement des oiseaux de Noël (RON) pour la période 1946-2001 a permis de déterminer la répartition générale de l’espèce ainsi que les zones de concentration (Hamel et Ozdenerol, 2008). L’International Rusty Blackbird Working Group(IRBWG, groupe de travail international sur le Quiscale rouilleux) a été créé en 2005 (Greenberg et al., 2011; International Rusty Blackbird Working Group, 2013). En collaboration avec le programme eBird, l’IRBWG a réalisé le Rusty Blackbird Winter Hotspot Blitz (relevé hivernal intensif des concentrations de Quiscales rouilleux), ensemble de relevés couvrant l’est des États-Unis effectués sur deux semaines (du 31 janvier aux 14 février) de 2009 à 2011. Ce programme a permis de recueillir de l’information sur les zones de concentration de l’espèce dans ses quartiers d’hiver (Evans et al., 2014) et de caractériser les déplacements migratoires à grande échelle (LaSorte et al., 2016). En 2014, l’IRBWG a aussi entrepris le Rusty Blackbird Spring Migration Blitz (relevé intensif des Quiscales rouilleux durant la migration printanière), relevé triennal reposant sur les efforts d’ornithologues amateurs de l’ensemble des provinces et territoires du Canada (sauf le Nunavut) et de 38 États américains, mené entre le début de mars et la mi-juin.
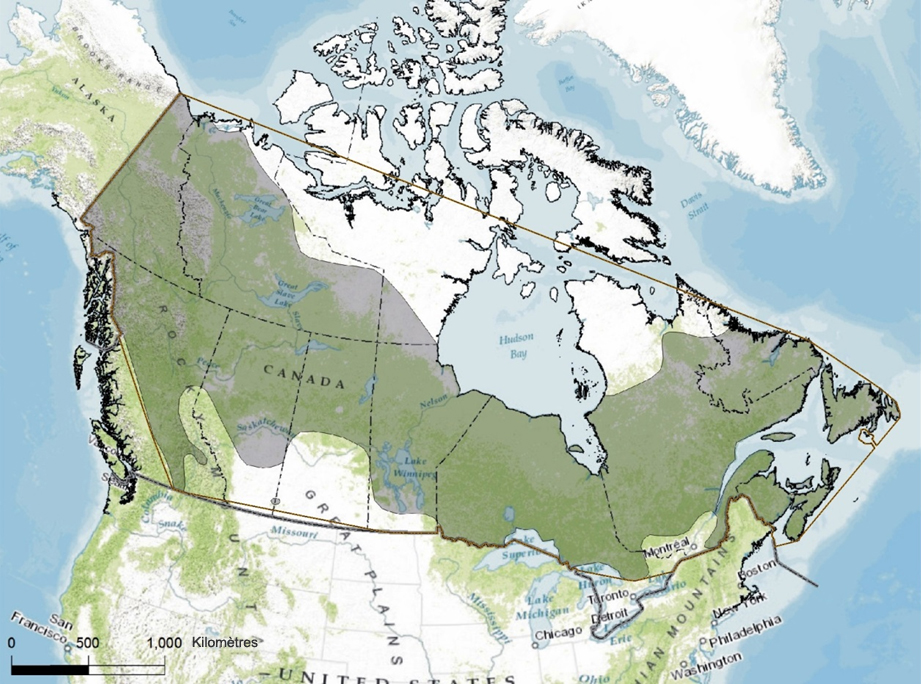
Description longue de la figure 3
Carte illustrant l’aire de reproduction du Quiscale rouilleux au Canada, qui s’étend de Terre Neuve et Labrador au Yukon, ainsi que dans toutes les provinces et tous les territoires au Canada.
Habitat
Besoins en matière d’habitat
Habitat de reproduction
Au Canada, l’aire de reproduction du Quiscale rouilleux chevauche presque entièrement les écozones terrestres de la forêt boréale et de la taïga (Erskine, 1992; Gauthier et Aubry, 1996; Campbell et al., 1997; Sinclair et al., 2003; Cadman et al., 2007; Avery 2013; Boreal Avian Modeling Project, 2015). Dans ces écozones, l’espèce est présente dans des cypéraçaies, des étangs de castors, des muskegs, des marécages, des bandes riveraines broussailleuses d’îles, de lacs, et de fleuves, rivières et ruisseaux, ainsi que des fourrés d’aulnes et de saules (DesGranges et Houde, 1989; Darveau et al., 1995; Larue et al., 1995; Gauthier et Aubry, 1996; Campbell et al., 1997; Whitaker et Montevecchi, 1999; Sinclair et al., 2003; Machtans et al., 2007; Matsuoka et al., 2008, 2010a, b; Powell et al., 2010a, b; McCormack, 2012; Scarl, 2013).
Dans le sud-est de son aire de reproduction, la nidification du Quiscale rouilleux a aussi été signalée dans des habitats de début de succession créés par des perturbations comme des incendies et des chablis (Ellison, 1990; Powell et al., 2010b). En Nouvelle-Écosse, et plus précisément au cap Breton, il est également présent à l’occasion dans des environnements plus secs, comme des pâturages (Erskine, 1992). Dans les Territoires du Nord-Ouest, on le trouve principalement en bordure de lacs (Machtans et al., 2007). Dans le nord-ouest de son aire de reproduction, les paramètres qui prédisent le mieux l’habitat de reproduction sont la proportion régionale d’étangs et de lacs d’eau douce et la présence de milieux humides peu profonds à végétation émergente (Matsuoka et al., 2008, 2010b). Cette espèce évite généralement les forêts sèches de terrain élevé pour se reproduire (DesGranges et Houde, 1989; Larue et al., 1995; Whitaker et Montevecchi, 1999; Matsuoka et al., 2010a). En Nouvelle-Angleterre, l’occupation des milieux humides par le Quiscale rouilleux était le mieux expliquée par les variables associées à l’habitat utilisé par l’espèce pour son alimentation (étangs peu profonds) et sa nidification (peuplements de conifères adjacents en terrain élevé), et à la présence de castors (Powell et al., 2014).
À l’échelle du microhabitat, le Quiscale rouilleux choisit des sites de reproduction dans des zones présentant des peuplements denses de conifères en régénération de 1 à 3 m de hauteur, mais généralement à couvert ouvert (Ellison, 1990; Matsuoka et al., 2010b; Powell et al., 2010b; Buckley, 2013). En Alaska, il niche dans des sites dominés par l’épinette noire (Picea mariana) ou des saules (Salix sp.; Matsuoka et al., 2010a).
Les Quiscales rouilleux s’alimentent en eaux peu profondes, où ils recherchent des proies aquatiques dans la litière de feuilles (Avery 2013, Powell et al., 2014). Il est fortement soupçonné que la superficie d’eaux peu profondes (≤ 6 cm de profondeur) détermine de façon importante le choix d’habitat. Les eaux peu profondes non reliées à des eaux courantes regorgent souvent de proies (p. ex. têtards et odonates; L. Powell, obs. pers.), vraisemblablement parce qu’elles sont exemptes de poissons prédateurs et qu’elles ne sont pas sujettes à l’assèchement saisonnier. En Nouvelle-Angleterre, les œufs et larves d’amphibiens ainsi que les larves d’invertébrés constituent probablement des aliments facilement accessibles riches en calories dans les sites présentant des eaux peu profondes (Powell et al., 2014).
La création de milieux humides par les castors est connue pour influer sur la structure des communautés d’invertébrés en remplaçant les taxons vivant en eaux vives par des taxons d’eaux peu profondes, comme les libellules (Naiman et al., 1988), lesquelles comptent parmi les principales proies des Quiscales rouilleux (Avery, 2013). Powell et al. (2014) avancent que la présence de castors accroît la probabilité d’occupation du milieu par l’espèce. Les castors créent de l’habitat d’alimentation et de nidification pour les Quiscales rouilleux en enlevant sélectivement les feuillus, ce qui accroît les ouvertures et favorise la croissance d’arbres comme les épinettes (Johnston et Naiman, 1990). McDowell et Naiman (1986) ont aussi observé que les castors accroissent la densité de matière organique particulaire grossière et la biomasse d’invertébrés de 2 à 5 fois, et accroissent spécifiquement l’abondance de quatre des principales proies des Quiscales rouilleux : libellules (Odonata), demoiselles (Odonata), trichoptères (Trichoptera) et gastéropodes (Gastropoda) (Avery, 2013).
Les modèles prédictifs de qualité relative de l’habitat de reproduction du Quiscale rouilleux indiquent que la qualité de l’habitat augmente avec la latitude (figure 4; Boreal Avian Modeling Project, 2015).
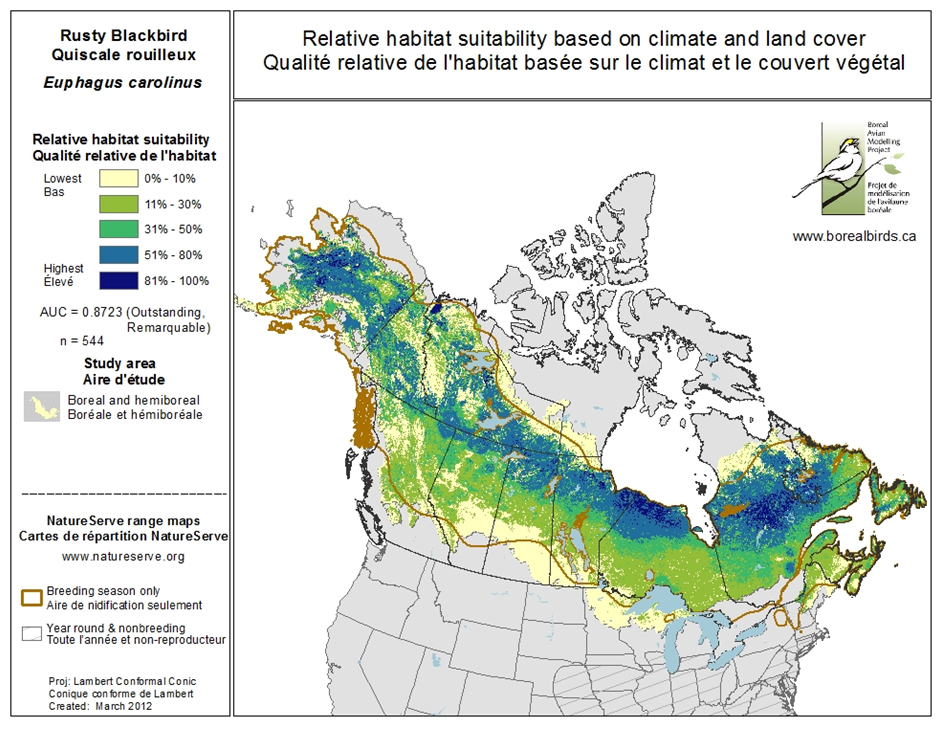
Description longue de la figure 4
Carte illustrant l’adéquation relative de l’habitat de reproduction du Quiscale rouilleur au Canada. Cinq catégories d’adéquation de l’habitat sont indiquées, et l’adéquation augmente habituellement avec la latitude.
Habitat de migration et d’hivernage
En migration, le Quiscale rouilleux est associé aux milieux humides boisés, comme les forêts inondés, aux étangs de castors et aux broussailles bordant les lacs et les fleuves, rivières et ruisseaux (Cyr et Larivée, 1995; Campbell et al., 1997; Avery 2013). Il est aussi présent dans une moindre mesure dans des habitats d’origine humaine, comme des pâturages, des champs labourés, des bassins d’épuration des eaux usées et de petites décharges (Campbell et al., 1997; Sinclair et al., 2003; Avery, 2013; Canham, 2014). Au Missouri, la plupart des mentions de Quiscales rouilleux en migration concernent des milieux humides dominés par des herbacées, des petits plans d’eau, des prairies et des cultures agricoles (Canham, 2014). Trois Quiscales rouilleux munis de géolocalisateurs ont migré de l’Alaska aux Grandes Plaines en fréquentant les habitats suivants durant leur migration : cultures agricoles (60 %), prairies (36 %), plans d’eau (2 %), et milieux humides et autres habitats (1 %) (Johnson et al., 2012).
Dans ses quartiers d’hiver, le Quiscale rouilleux occupe une grande variété d’habitats, mais il est plus abondant en forêt continue semi-inondée qu’en habitat plus sec (Dias, 2008; Luscier et al., 2010). Il y a association positive entre taille des bandes de Quiscales rouilleux et utilisation de forêts inondées de terrain bas (Evans et al., 2014). En Caroline du Sud, une utilisation importante de champs de maïs secs, humides ou récemment drainés, ainsi que d’anciens bassins de riziculture, a aussi été observée (Dias, 2008). Dans la vallée du Mississippi, les champs agricoles semblent constituer un important habitat pour les Quiscales rouilleux hivernants, car ils offrent des aliments de rechange, comme les grains de maïs laissés au sol, quand ils ne peuvent trouver de proies aquatiques et de glands et autre noix (Luscier et al., 2010). Les champs agricoles utilisés par les ictéridés se trouvent généralement à proximité de milieux humides (Luscier et al., 2010).
L’espèce utilise aussi de façon importante des vergers de pacaniers (Carya illinoiensis) et des fragments de forêt riveraine (Mettke-Hofmann et al., 2015). Dans ces habitats, elle se nourrit près des bordures des plans d’eau peu profonds, sans égard à la densité du couvert arbustif ou de la distance par rapport aux lisières forestières. En Louisiane, la présence d’eau stagnante et d’une litière de feuilles humide semblent être les deux principales variables prédisant l’occupation d’un site par l’espèce (DeLeon, 2014). Il a aussi été observé que, en hiver, le Quiscale rouilleux choisit des habitats renfermant une forte densité d’arbres matures produisant des glands et d’autres noix, ainsi que des habitats renfermant des sols humides inondés de façon régulière ou permanente lui offrant une population adéquate de proies invertébrées (Newell, 2013; Borchert et Stauffer, 2014).
À la différence des habitats d’alimentation, les dortoirs hivernaux se trouvent habituellement dans des habitats présentant une végétation dense près du sol, ainsi que dans des champs à végétation courte ou dans des habitats renfermant des arbustes ou des arbres conifériens en zones résidentielles (Dias, 2008). En Caroline du Sud, les dortoirs se trouvent surtout dans des marais à quenouille (Typha sp.) adjacents à des marais salés (Dias, 2008).
Il semble y avoir ségrégation selon le sexe et l’âge dans les quartiers d’hiver, les femelles et les jeunes paraissant hiverner plus loin au sud que les mâles plus vieux (DeLeon, 2012; Mettke-Hofmann et al., 2015). En outre, la disponibilité et la qualité de nourriture sont supérieures dans les sites d’alimentation utilisés par les mâles (Mettke-Hofmann et al., 2015; DeLeon, 2012).
Tendances en matière d’habitat
Habitat de reproduction
En raison de son étroite association avec les étangs de castors, l’habitat du Quiscale rouilleux pourrait avoir été affecté dans le passé par la perte à grande échelle de milieux humides causée par les activités commerciales de récolte des castors, qui ont conduit cette espèce au bord de l’extinction en Amérique du Nord, menées du 17e siècle au début du 20e siècle (Novak, 1987; Naiman et al., 1988). Dans une étude réalisée sur 54 ans dans le parc national du Canada Elk Island, en Alberta, on rapporte une superficie d’eau libre neuf fois plus élevée que dans une période où les castors étaient absents. Depuis les années 1950, les populations de castors semblent s’être bien rétablies dans l’ensemble du Canada (Hood et Bayley, 2008), de sorte que ce type d’habitat associé aux castors, favorable aux Quiscales rouilleux, devrait être en augmentation.
Dans certaines parties de l’aire de reproduction canadienne du Quiscale rouilleux, de grandes superficies de milieux humides ont été perdues par suite de leur transformation à des fins agricoles et industrielles (Greenberg et Droege, 1999; Hobson et al., 2002; Greenberg et Matsuoka, 2010; Greenberg et al., 2011). Par exemple, Greenberg et al. (2011) ont estimé que plus de 1 million d’hectares de milieux humides boisés ont été inondés par suite de la création de réservoirs hydroélectriques dans le nord du Québec. En outre, il a été estimé que 73 % de la zone de transition boréale en Saskatchewan a été transformée en terres agricoles depuis la colonisation européenne (Hobson et al., 2002). Des niveaux similaires de modification de l’habitat ont été rapportés pour l’Alberta (Young et al., 2006).
En ce qui concerne l’impact des activités d’exploration et d’exploitation gazières et pétrolières, il a été estimé que, en date de 2003, 8 % du biome de la forêt boréale au Canada avait été affecté à un degré assez important (Greenberg et al., 2011). Le drainage et le pompage d’énormes quantités d’eau douce provenant des réserves d’eau souterraine et superficielle aux fins d’extraction de gaz et de pétrole peuvent aussi affecter l’habitat du Quiscale rouilleux (Griffiths et Woynillowicz, 2003). L’habitat de l’espèce au Canada aurait connu une baisse de 5 % jusqu’en 2000, et on prévoit une baisse supplémentaire de 4 % d’ici 2050 (Global Forest Watch Canada, 2000; Hayeur, 2001; Griffiths et Woynillowicz, 2003; Kling et al., 2003).
Les changements climatiques, qui donneront lieu à une augmentation importante de la température dans la forêt boréale d’ici 2100, devraient réduire la quantité d’habitat potentiellement convenable pour la reproduction du Quiscale rouilleux. Une étude utilisant des images satellitaires couvrant les zones boréale, subarctique et arctique a montré que, entre 2000 et 2009, la superficie totale d’étangs peu profonds et de lacs boréaux a diminué de 6 700 km2 (Carroll et al., 2011). Cette réduction des milieux humides boréaux est due en partie au dégel du pergélisol causé par l’augmentation de la température (Yoshikawa et Hinzman, 2003). Plusieurs scénarios issus de modèles climatiques fondés sur le changement de l’enveloppe climatique et la répartition existante de l’habitat prévoient une réduction de 64-90 % de l’habitat principal du Quiscale rouilleux d’ici 2100 (Stralberg et al., 2015a). Compte tenu des prévisions récentes des tendances de réchauffement et d’assèchement pour les régions boréales, les castors joueront probablement un rôle important en maintenant des eaux libres et en atténuant l’impact de la sécheresse (Hood et Bayley, 2008).
En résumé, il y a eu des baisses de la superficie totale d’habitat du Quiscale rouilleux dans l’aire de reproduction canadienne de l’espèce au cours des récentes décennies en raison de l’expansion de l’agriculture dans le sud de la forêt boréale, de la perte de milieux humides due aux changements climatiques et de l’accroissement du nombre d’aménagements industriels dans la forêt boréale. De plus, l’habitat de reproduction de l’espèce connaîtra probablement dans le futur des baisses supplémentaires du fait de l’accroissement prévu des effets des changements climatiques.
Habitat d’hivernage
Une grande partie de l’aire d’hivernage du Quiscale rouilleux comprend les plaines inondables de la vallée du Mississippi, du sud de l’Illinois à la côte de la Louisiane (Hamel et Ozdenerol, 2008; Avery, 2013). La transformation des milieux humides boisés dans les lieux d’hivernage du sud des États-Unis est considérée comme l’une des principales causes de la baisse de population de cet oiseau (Greenberg et Droege, 1999; Hamel et al., 2009). Des milieux humides boisés ont été transformés en plantations de pins (Pinus sp.) et en zones résidentielles (Hamel et al., 2009; Greenberg et Matsuoka, 2010). Il est estimé que, entre 1780 et 1980, environ 57 % des milieux humides dans les quartiers d’hiver du Quiscale rouilleux ont été perdus dans les basses terres du Mississippi, tandis que dans le sud de la plaine côtière atlantique, la perte de milieux humides a été de 36 % (Dahl, 1990).
La perte de milieux humides dans le sud-est des États-Unis entre 1950 et 1980 causée par la transformation en terres agricoles et en plantations forestières a été estimée à 1,3 million d’hectares (Hefner et al., 1994) et est considérée comme une cause importante de la baisse de population du Quiscale rouilleux (Greenberg et al., 2011). Selon Greenberg et al. (2011), avant 1970, les milieux humides boisés de la vallée du Mississippi étaient peu utilisés à des fins agricoles parce qu’ils n’étaient pas profitables en raison du coût élevé de leur transformation. À partir de 1970, cependant, la transformation de ces milieux en terres agricoles est devenue rentable en raison de la hausse des prix du soja sur le marché. À la fin des années 1980, quand les prix du soja ont tombé sous le seuil de rentabilité, des activités de reboisement ont été entreprises dans le sud-est des États-Unis (King et al., 2006), et il a été estimé que 162 000 ha de terres agricoles non rentables ont été retransformés en milieux humides boisés entre 1990 et 2005 (Ducks Unlimited, 2007). Dans cette même période, des programmes de séquestration du carbone ont été lancés, ce qui a aussi favorisé la remise en état de grandes superficies de milieux humides boisés dans le sud-est des États-Unis (Houghton, 2002; Shoch et al., 2009).
En conclusion, malgré certains gains d’habitat récents, il y a eu perte nette d’habitat dans les quartiers d’hiver de l’espèce depuis la colonisation européenne.
Biologie
Cycle vital et reproduction
Le Quiscale rouilleux est habituellement monogame, des cas de polygamie ayant toutefois été observés (Scurr, 2013). Les couples nichent en solitaire ou rarement en colonie lâche (Spindler et Kessel, 1980; Orians, 1985; Avery, 2013). Généralement, la nidification débute au début de mai dans la partie sud de l’aire de reproduction et du milieu à la fin de mai dans la partie nord, et elle se termine à la mi-juillet (Matsuoka et al., 2010b; Rousseu et Drolet, 2015). Les nids sont habituellement aménagés dans des fourrés de petits conifères, dans des arbustes à feuilles caduques ou dans des arbres morts, généralement au-dessus ou à proximité d’un plan d’eau (Campbell et al., 1997; Matsuoka et al., 2008, 2010b). Le Quiscale rouilleux produit une couvée par année, mais des nids de remplacement peuvent être aménagés si le premier nid est détruit (Avery, 2013).
La couvée compte habituellement de 3 à 7 œufs, la moyenne étant de 4,5 œufs (Matsuoka et al., 2008; Avery, 2013; Loomis, 2013). L’incubation dure 14 jours (Matsuoka et al., 2010b). Les oisillons demeurent au nid de 11 à 13 jours (Gauthier et Aubry, 1996; Campbell et al., 1997; Matsuoka et al., 2010b).
Aucune étude sur la survie des nids n’a été réalisée au Canada. En Alaska, le taux de survie quotidien des nids est généralement élevé (0,98 ± 0,003), d’où un succès de nidification moyen de 0,56 (IC à 95 % CI : 0,47–0,64; Matsuoka et al., 2010b; Loomis, 2013). Dans cet État, chez 69 nids qui ont survécu jusqu’à la fin de la période d’incubation, le taux d’éclosion a été de 90 % (n = 373 œufs). De plus, pour les 63 nids chez lesquels au moins un jeune a quitté le nid, 96 % de 312 jeunes ont survécu jusqu’au départ du nid. Sur les 150 nids dont la survie a été suivie, 96 (64 %) ont produit au moins un jeune ayant quitté le nid, et 54 (36 %) ont échoué (Matsuoka et al., 2010b). Parmi les nids qui n’ont pas survécu, 89 % (48 nids) ont été détruits par des prédateurs, quatre ont été abandonnés pour des raisons inconnues et deux sont tombés dans l’eau (Matsuoka et al., 2010b). Généralement, le succès de nidification moyen est similaire en Alaska (56 %; Matsuoka et al., 2010b) et en Nouvelle-Angleterre (62 %; Powell, 2008), et il est beaucoup plus élevé que le succès de nidification relevé chez d’autres ictéridés (30-39 %; Martin, 1995).
On pense que la durée d’une génération chez le Quiscale rouilleux est de deux à trois ans (COSEWIC, 2006), durée habituelle chez les passereaux de taille moyenne.
Taux de survie
Il n’existe pas de données sur les taux de survie des adultes dans les lieux de reproduction. Dans des quartiers d’hiver, le taux de survie d’adultes et d’individus immatures sur 12 semaines a été estimé à 0,84 et 0,53, respectivement (Wohner et al., 2014). D’après ces auteurs, ces taux de survie sont comparables à ceux d’autres passereaux d’Amérique du Nord. Pour le moment, on ne sait pas bien pourquoi ces taux de survie relativement élevés dans les quartiers d’hiver ne se traduisent pas par un accroissement de population. Des études de survie devront être menées dans les lieux de reproduction pour évaluer le taux de survie post-migration des adultes.
Le plus vieil individu connu est un oiseau bagué qui a été réobservé en 1939, dont la longévité a été d’au moins huit ans et neuf mois (Cooke, 1942, cité dans Avery, 2013).
Dispersion et migration
Selon la latitude, la migration automnale débute entre la fin de juillet et septembre (Campbell et al., 1997; Sinclair et al., 2003; Johnson et al., 2012; Scarl et al., 2014). Au Canada, la migration printanière se déroule principalement entre la mi-mars et la première semaine de mai, le gros des oiseaux migrant en avril (Campbell et al., 1997; Sinclair et al., 2003; Johnson et al., 2012). Dans la partie nord de l’aire de reproduction de l’espèce au Canada, des groupes de Quiscales rouilleux en migration comptant jusqu’à plusieurs centaines d’individus ont été observés (Manitoba Avian Research Committee, 2003). Aux États-Unis, les bandes comptent jusqu’à 275 individus (Scarl et al., 2014), la moyenne étant de 20-25 oiseaux (DeLeon, 2012; Canham, 2014).
Les retours de Quiscales rouilleux bagués en Amérique du Nord, ainsi qu’une étude examinant les ratios d’isotopes stables de l’hydrogène dans les plumes, laissent penser que les individus provenant de l’Alaska jusqu’au centre du Canada migrent en direction sud-est vers le sud de la vallée du Mississippi, tandis que les populations se reproduisant dans les régions du nord-est (Québec et Maritimes) hivernent habituellement dans la plaine côtière atlantique (Brewer et al., 2006; Hobson et al., 2010). Les Appalaches pourraient constituer une barrière naturelle séparant les populations hivernantes de l’espèce (Hamel et Ozdenerol, 2008).
Dix-sept Quiscales rouilleux adultes munis de dispositifs de pistage (« géolocalisateurs » photosensibles) à l’automne ont migré de l’Alaska jusque dans le sud-est des États-Unis, en traversant le nord-est de la Colombie-Britannique, le nord-ouest de l’Alberta, le centre de la Saskatchewan, le Dakota du Nord, le Dakota du Sud et l’Iowa, et/ou en y faisant périodiquement halte. Après avoir parcouru en moyenne 4 400 km, ces oiseaux ont atteint leurs sites d’hivernage, qui étaient répartis depuis le Dakota du Sud jusque dans le nord de la Louisiane (Johnson et al., 2012). Au printemps, le chemin de retour emprunté était de façon générale le même que le parcours de la migration de l’automne précédent pour les trois oiseaux pistés. Ces derniers sont retournés à leurs sites de reproduction de l’année précédente (Johnson et al., 2012).
Une analyse de données d’eBird provenant de la Louisiane laisse penser que dans les quartiers d’hiver, les mêmes sites d’alimentation semblent être régulièrement utilisés par des groupes de Quiscales rouilleux à l’intérieur des périodes d’hivernage et entre ces dernières (DeLeon, 2012).
Aucune donnée sur la dispersion natale n’est disponible.
Régime alimentaire et comportement d’alimentation
Dans les lieux de reproduction, les Quiscales rouilleux se nourrissent principalement d’invertébrés, particulièrement de nymphes de libellules (97 %; Loomis 2013). Ils consomment aussi des salamandres, des coléoptères aquatiques, des araignées, des petits poissons, des crustacés, des gastéropodes et des moustiques (Cade, 1953; Matsuoka et al., 2010a; Powell et al., 2010a; Avery, 2013).
Durant l’automne et l’hiver, le régime alimentaire du Quiscale rouilleux est plus varié et est composé d’invertébrés aquatiques, de graines et de petits fruits (Avery, 2013;Newell, 2013;Mettke-Hofmann et al., 2015). Un suivi effectué à deux importants sites d’hivernage de Caroline du Sud a révélé que l’espèce s’alimentait dans des champs de maïs secs, humides ou récemment drainés, des bassins de riziculture anciens (drainés ou inondés) et des milieux humides boisés (Dias, 2008). Les Quiscales rouilleux fréquentent aussi irrégulièrement les mangeoires d’oiseaux en hiver (Cyr et Larivée, 1995; Campbell et al., 1997).
L’espèce consomme aussi des glands, mais ceux-ci doivent avoir été décortiqués par des écureuils ou de plus gros oiseaux, comme des Quiscales bronzés ou des Geais bleus (Cyanocitta cristata; Newell 2013). Selon Newell (2013), les Quiscales rouilleux hivernant en Caroline du Sud ou en Géorgie consomment souvent des pacanes tombées au sol. En raison de leur forte teneur en matières grasses (Fredrickson et Reid, 1988), les pacanes sont consommées dans les hivers froids et aident les ictéridés à survivre quand il y a une moins grande disponibilité de glands et d’invertébrés de milieux humides. Pour pouvoir être consommées par les Quiscales rouilleux, les pacanes tombées au sol doivent avoir été écrasées, par exemple par des automobiles ou par les pieds d’humains ou de cerfs (Newell, 2013). Le Quiscale rouilleux s’alimente aussi dans les parterres résidentiels, où ils consomment principalement des vers aquatiques et des vers de terre (Newell, 2013). Il a été rapporté que le régime alimentaire des Quiscales rouilleux qui hivernent sur les plateaux appalachiens comporte une plus forte proportion de glands et autres noix que celui des individus qui hivernent dans la plaine côtière (34 % contre 19 %; Newell, 2013).
Relations interspécifiques
La prédation d’œufs par des écureuils roux (Tamiasciurus hudsonicus)et des cerfs de Virginie (Odocoileus virginianus) a été fréquemment rapportée (Buckley, 2013). L’agressivité manifestée par les Quiscales rouilleux à l’égard de la martre d’Amérique (Martes americana) laisse croire que cette dernière est un prédateur potentiel (Avery, 2013). Parmi les prédateurs aviaires potentiels de nids, d’adultes et de jeunes ayant récemment quitté le nid, on compte le Mésangeai du Canada (Perisoreus canadensis; Campbell et al., 1997), la Pie d’Amérique (Pica hudsonia), le Grand Corbeau (Corvus corax), le Pygargue à tête blanche (Haliaeetus leucocephalus), le Busard Saint-Martin (Circus cyaneus), l’Épervier brun (Accipiter striatus), l’Autour des palombes (A. gentilis), la Buse à queue rousse(Buteo jamaicensis) et le Faucon émerillon (Falco columbarius), ainsi que le Geai bleu et la Corneille d’Amérique (Corvus brachyrhynchos; Matsuoka et al., 2010b; Powell et al., 2010b; Buckley, 2013).
Les Quiscales rouilleux pourraient aussi être naturellement limités par la présence d’espèces plus dominantes, comme le Carouge à épaulettes (Agelaius phoeniceus) et le Quiscale bronzé, dans les lieux de reproduction (Ellison, 1990; Erskine, 1992). En Ontario, par exemple, les régions d’où sont absents le Carouge à épaulettes et le Quiscale bronzé sont celles qui présentent les plus fortes densités de Quiscales rouilleux (Cadman et al., 2007).
En migration et dans leurs quartiers d’hiver, les Quiscales rouilleux se joignent régulièrement à des bandes mixtes composées d’autres ictéridés, comme le Carouge à épaulettes, l’Étourneau sansonnet (Sturnus vulgaris) et le Quiscale bronzé (Dolbeer et al., 1997; Luscier et al., 2010; Greenberg et al., 2011; Avery, 2013). Il a été avancé que la formation de groupes mixtes réduit le risque de prédation à l’échelle des individus (Morse, 1977).
Domaine vital et territoire
Aucune étude concernant la taille du domaine vital et du territoire chez le Quiscale rouilleux n’a été réalisée au Canada. Cependant, au Maine, la taille moyenne des domaines vitaux a été estimée à 37,5 +/- 12,6 ha, et la taille moyenne des territoires, à 11,1 +/- 2,8 ha (Powell et al., 2010a). Le domaine vital comprend des habitats boisés de terrain bas parsemés de milieux humides interreliés ou non, et des habitats boisés de terrain élevé renfermant de petites parcelles humides (Powell et al., 2010a). Les Quiscales rouilleux occupent des domaines vitaux plus vastes que ceux d’autres ictéridés parce qu’ils utilisent souvent de multiples milieux humides pour s’alimenter (Powell et al., 2010a). Ils nichent aussi dans certains cas en petites colonies lâches (Matsuoka et al., 2010b; Powell et al., 2010c), ce qui assurerait une meilleure protection des nids contre la prédation (Powell et al., 2010c). De plus, Powell et al. (2010a) avancent que les adultes nichant en colonie profitent pour s’alimenter de la découverte par leurs semblables de sources d’insectes aquatiques, dont l’émergence est imprévisible.
Comportement et adaptabilité
Les Quiscales rouilleux fréquentent des milieux humides perturbés par des activités humaines (Darveau et al., 1995; Campbell et al., 1997; Whitaker et Montevecchi, 1999; Powell et al., 2010b; Buckley, 2013), des bassins d’épuration des eaux usées en milieux forestiers (R. Popko, comm. pers., 2015) et des berges de réservoirs hydroélectriques (J. Gauthier, comm. pers., 2015), mais la productivité de la reproduction dans les habitats transformés par l’homme est inconnue au Canada.
Le Quiscale rouilleux semble utiliser des habitats créés par des perturbations naturelles se produisant fréquemment et à de grandes échelles spatiales, comme des inondations, des infestations d’insectes et des incendies de forêt (Ellison, 1990; Machtans et al., 2007; Matsuoka et al., 2010a). Buckley (2013) et d’autres ont rapporté une forte association de l’espèce avec la présence d’étangs de castors.
Le suivi migratoire des Quiscales rouilleux à Tadoussac, sur la côte nord du Saint-Laurent au Québec, entre 1996 et 2010 indique que l’espèce présente un cycle d’abondance de cinq ans dans la forêt boréale (Savard et al., 2011). Ce cycle semble corrélé positivement avec l’oscillation nord-atlantique, phénomène climatique qui jouerait un rôle dans le cycle de quatre ans de petits rongeurs dans la forêt boréale, lequel influe sur les cycles prédateur-proie (Savard et al., 2011).
Dans ses quartiers d’hiver, le Quiscale rouilleux s’alimente régulièrement dans d’anciennes terres agricoles qui ont été reconverties en milieux humides (Hamel et al., 2009), ainsi que dans des parterres résidentiels humides et des plantations de pacaniers (Newell, 2013). L’espèce semble baser son comportement de recherche de nourriture sur une interaction complexe de conditions météorologiques antérieures, présentes et attendues dans le court terme ainsi que sur la disponibilité de ressources (Newell, 2013). Hamel et Ozdenarol (2008) ont aussi avancé que les précipitations influent sur les variations interannuelles de la répartition du Quiscale rouilleux dans la vallée du Mississippi.
Taille et tendances des populations
Activités et méthodes d’échantillonnage
Recensement des oiseaux de Noël (RON)
Le Recensement des oiseaux de Noël (RON) documente les tendances des populations de Quiscales rouilleux en Amérique du Nord en hiver (Audubon, 2015). Les bénévoles notent toutes les espèces observées à l’intérieur d’un cercle de 24 km au cours d’une journée entre le 14 décembre et le 5 janvier (Sauer et al., 1996). Le RON permet d’effectuer le suivi d’espèces boréales, comme le Quiscale rouilleux, qui nichent dans des régions nordiques inaccessibles et dont la majorité de la population hiverne dans des régions accessibles situées plus au sud (Audubon, 2015). Ainsi, le principal avantage de cette méthode est qu’elle permet de recenser les effectifs de Quiscales rouilleux dans l’ensemble de l’aire d’hivernage de l’espèce (Sauer et al., 1996), le RON étant considéré comme la source la plus fiable d’information sur les tendances des effectifs de cette espèce.
L’une de principales limitations du RON est qu’il peut sous-estimer l’abondance des Quiscales rouilleux du fait que ces derniers se joignent souvent à des groupes d’oiseaux d’espèces similaires dans les quartiers d’hiver. Cependant, cela ne devrait pas nécessairement influer sur l’estimation des tendances, à moins que les effectifs des autres espèces n’évoluent différemment.
Relevé des oiseaux nicheurs d’Amérique du Nord (BBS)
Le Relevé des oiseaux nicheurs d’Amérique du Nord (BBS) est effectué au Canada depuis 1970 (Environnent Canada, 2014). Les données sur l’abondance des oiseaux nicheurs sont recueillies par des bénévoles le long de parcours de 39,2 km dans lesquels les observations sont réalisées à 50 points d’écoute espacés de 0,8 km et couvrant chacun un rayon de 400 m. Les relevés sont généralement réalisés en juin, durant la période de reproduction de la plupart des oiseaux. Les données canadiennes du BBS sont analysées au moyen de modèles bayésiens hiérarchiques (Smith et al., 2014).
Le BBS comporte trois inconvénients pour le suivi des tendances des populations de Quiscales rouilleux : 1) l’espèce n’est détectée que dans seulement environ le tiers des parcours effectués au Canada (soit 150 parcours), la plupart n’ayant été réalisés que sporadiquement et par des observateurs qui ont changé au fil du temps (Greenberg et al., 2011); 2) le relevé ne couvre que moins de 30 % de l’aire de reproduction de l’espèce et est concentré dans le sud de la forêt boréale; 3) le relevé est habituellement effectué un mois après la période de chant maximale de l’espèce, ce qui fait que les résultats du BBS peuvent ne pas être représentatifs des tendances existantes aux latitudes plus nordiques (Greenberg et al., 2011).
Depuis l’estimation d’abondance originale du COSEPAC, réalisée en 2006, l’estimation de population de Partenaires d’envol, programme qui utilise les données brutes du BBS, a été améliorée avec les données du programme de listes quotidiennes des oiseaux des Territoires du Nord-Ouest, afin d’accroître la précision de l’estimation pour la forêt boréale (Blancher et al., 2013).
Atlas des oiseaux nicheurs
Les travaux menés dans le cadre des deux atlas des oiseaux nicheurs de l’Ontario pour les périodes 1981-1985 et 2001-2005 fournissent des données qui permettent de comparer la répartition et la probabilité d’observation du Quiscale rouilleux sur une période de 20 ans (Cadman et al., 2007). Les données de ces atlas ont été recueillies par des bénévoles qui ont couvert des parcelles de 10 km x 10 km durant la période de reproduction. Pour l’Ontario, le pourcentage de changement dans la répartition des Quiscales rouilleux sur la période de 20 ans a été calculé en comparant le pourcentage de parcelles de 10 km de côté avec indice de nidification dans la première période d’atlas à celui obtenu dans la deuxième période d’atlas, avec ajustement pour l’effort d’observation (Cadman et al., 2007). Dans la période 2001-2005, l’abondance relative a aussi été estimée au moyen de points d’écoute de 5 minutes.
De même, les travaux de terrain pour les deuxièmes atlas des oiseaux nicheurs du Québec et des Maritimes ont aussi été récemment achevés (BBAQ, 2015; Stewart et al., 2015). Plusieurs autres deuxièmes atlas ont été finalisés dans le nord-est des États-Unis (p. ex. État de New York et Vermont), tandis que des premiers atlas l’ont été récemment en Colombie-Britannique et au Manitoba.
Les atlas fournissent une très bonne information sur la répartition des nicheurs et, plus récemment, sur leur abondance. La principale contrainte de cette méthode est que les comparaisons entre les périodes sont habituellement faites sur la base de l’occurrence plutôt qu’en termes de changement d’abondance. Néanmoins, les ajustements permettant de comparer la probabilité d’observation entre deux périodes d’atlas sont considérés comme adéquats pour obtenir une estimation générale des tendances du Quiscale rouilleux (voir par exemple Cadman et al., 2007).
étude des populations d’oiseaux du Québec (ÉPOQ)
Ce programme, entrepris en 1969, gère des milliers de listes d’oiseaux produites au Québec par des bénévoles (Cyr et Larivée, 1995). La base de données couvre toutes les régions se trouvant au sud du 52e parallèle et toutes les saisons (Cyr et Larivée, 1995). Le principal inconvénient de cette méthode est qu’elle couvre principalement les régions habitées et facilement accessibles. Ce programme permet néanmoins d’estimer les tendances de population à partir des observations de Quiscales rouilleux faites durant la migration à travers le sud du Québec (Cyr et Larivée, 1995; Scarl et al., 2014).
Réseau canadien de surveillance des migrations (RCSM)
Ce programme est conçu pour assurer le suivi des populations de passereaux migrateurs à plus de 20 stations de surveillance réparties dans tout le Canada (Crewe et al., 2008). Les observations faites durant la migration automnale, en particulier, peuvent fournir de l’information sur les tendances des populations pour les oiseaux nichant dans la forêt boréale et plus au nord, lors de leur déplacement depuis leurs lieux de reproduction nordiques vers leurs lieux d’hivernage du sud. Les principales activités menées à ces stations sont le baguage d’oiseaux et le dénombrement visuel quotidien des oiseaux durant les migrations.
L’interprétation des tendances des populations observées aux stations du RCSM pourrait être améliorée grâce à de nouvelles méthodes d’estimation des régions de provenance des oiseaux migrateurs dénombrés aux stations du RCSM, utilisant à la fois des analyses d’isotopes stables de l’hydrogène dans les plumes (feathers) (δ2Hf) et des données sur les trajectoires migratoires potentielles des oiseaux prédites à partir des données de récupération de bagues (Hobson et al., 2015).
Une des faiblesses de ce programme de suivi est la supposition que la variation du nombre d’oiseaux comptés à un site est représentative de la tendance régionale de la population, alors qu’elle pourrait n’être que le reflet des conditions locales. Une autre limitation est le risque que des Quiscales rouilleux en migration soient l’objet d’une identification erronée ou ne soient pas repérées, ces oiseaux formant souvent des grandes bandes mixtes avec d’autres espèces d’ictéridés.
Données d’abondance issues de comptes rendus ornithologiques historiques
Afin de déterminer si le déclin du Quiscale rouilleux au cours des 40 dernières années s’inscrit dans une tendance à plus long terme, Greenberg et Droege (1999) et Greenberg et al. (2011) ont analysé des données d’abondance qualitatives tirées de comptes rendus ornithologiques concernant des sites d’hivernage du sud-est des États-Unis remontant jusqu’en 1890.
Abondance
Selon la base de données de Partenaires d’envol (Partners in Flight Science Committee, 2013), qui repose sur les données du BBS pour la période 1998-2007, avec correction fondée sur des données tirées de milliers d’autres stations d’écoute établies dans la forêt boréale, la population canadienne de Quiscales rouilleux est estimée à environ 4,4 millions d’individus nicheurs (soit 2,2 millions de couples nicheurs), ce qui représente environ 86 % de la population mondiale (tableau 1; Partners in Flight Science Committee, 2013). Cette estimation ne doit pas être considérée comme indiquant un véritable accroissement par rapport à l’estimation maximale précédente de 1,4 million d’oiseaux (COSEWIC, 2006), mais plutôt comme le résultat de la prise en compte de nouvelles informations et techniques d’analyse. Les provinces comptant les plus fortes populations de Quiscales rouilleux sont le Québec, l’Ontario, le Manitoba et Terre-Neuve-et-Labrador (tableau 1).
Sur la base des données de 40 500 stations d’écoute établies dans la zone boréale et hémiboréale de l’Amérique du Nord, les modèles de répartition et densité concernant le Quiscale rouilleux pour la période 1961-1990 laissent penser que les densités (mâles/ha) sont faibles partout au Canada, sauf dans le centre-ouest du Québec (à l’est de la baie James) et dans la plaine hudsonienne dans le nord de l’Ontario, où les densités sont de plus de 0,04 mâle/ha (Stralberg et al., 2015b; figure 4 et figure 5).
| Province / territoire | Taille de la population (individus adultes) |
|---|---|
| Yn | 200 000 |
| T.N.-O./Nt | 180 000 |
| C.B. | 40 000 |
| Alb. | 40 000 |
| Sask. | 10 000 |
| Man. | 700 130 |
| Ont. | 1 000 000 |
| Qc | 1 517 000 |
| N.-B. | 4 000 |
| N.-É. | 11 000 |
| Î.-P.-É. | 300 |
| T.-N.-L. | 700 000 |
| Total | 4 402 730a |
a Partenaires d’envol (Partners in Flight, 2013) a arrondi à la baisse cet effectif à 4 000 000 d’individus.
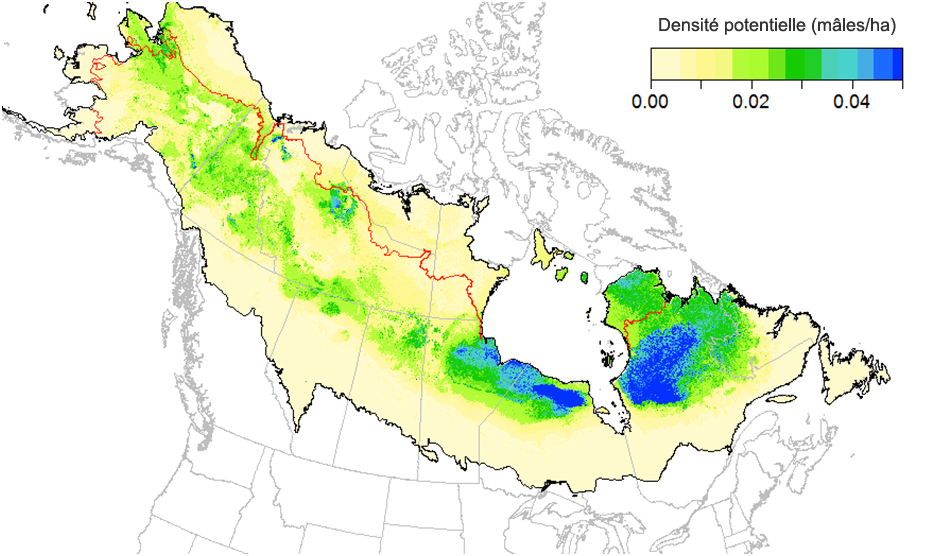
Description longue de la figure 5
Carte illustrant la densité relative des mâles adultes dans l’aire de reproduction du Quiscale rouilleux dans la forêt boréale, pour la période de 1961 à 1990.
Fluctuations et tendances
Recensement des oiseaux de Noël (RON)
Comme mentionné plus haut, les données du RON sont considérées comme les plus fiables aux fins d’analyse des tendances de population pour cette espèce. Selon l’analyse du RON pour l’Amérique du Nord pour la période 1970-2012, la population de Quiscale rouilleux a connu une baisse statistiquement significative de 2,5 % par année (IC à 95 : -4,9, -0,5; figure 6; A. Smith, données inédites), ce qui correspond à une baisse totale de 65,5 % sur 42 ans. Pour une période légèrement plus longue, soit de 1966 à 2013, Soykan et al. (2016) ont calculé une baisse annuelle de 3,1 % (IC à 95 % : -5,7, -1,1), ce qui correspond à une baisse à l’échelle du continent de 77,2 % sur 48 ans.
Les résultats du RON indiquent un déclin à long terme dans toutes les régions où des Quiscales rouilleux ont été détectés, mais le taux de déclin s’est mis à diminuer à partir de 1990 (Greenberg et al., 2011). Pour la courte période 2002-2012, la tendance globale de la population a été incertaine mais apparemment à la hausse, quoique les intervalles de confiance sont très étendus (hausse de 16,9 % par année; IC à 95 % : -29,6, 111; A. Smith, données inédites).
Une analyse des données du RON réalisée par Hamel et al. (2009) pour la période 1953-2001 a indiqué que les effectifs de Quiscales rouilleux rapportés durant les années 1950 et le début des années 1960 étaient élevés et variables, quoiqu’ils avaient probablement diminué au cours des décennies précédentes. Une baisse marquée de la population hivernante s’est produite vers 1965 (Hamel et al., 2009).
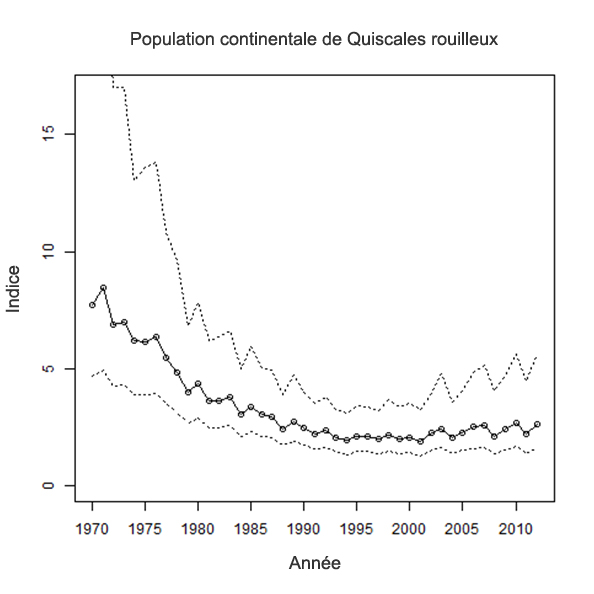
Description longue de la figure 6
Graphique illustrant les nombres médians de Quiscales rouilleux détectés par heure équipe dans le cadre du Recensement des oiseaux de Noël en Amérique du Nord, entre 1970 et 2012.
Relevé des oiseaux nicheurs d’Amérique du Nord (BBS)
Au Canada, on observe une baisse statistiquement significative de 3,5 % par année (n = 19 parcours, intervalle de crédibilité [IC] à 95 % : -6.5, -0,6) pour la longue période 1970-2014 (figure 7, tableau 2; A. Smith, données inédites), soit une baisse de population de 79,1 % au cours des 44 dernières années. Pour la période décennale 2004-2014, une baisse non significative de 2,6 % par année a été calculée (n = 158 parcours, IC à 95 % : -8,4, 4,1; tableau 2). À l’échelle provinciale, des baisses à long terme significatives allant de 4,6 % à 6,7 % par année ont été calculées pour les provinces de l’est que sont l’Ontario, le Québec, Terre-Neuve-et-Labrador, le Nouveau-Brunswick et la Nouvelle-Écosse (tableau 2). L’espèce montre aussi de plus faibles baisses, statistiquement non significatives, dans toutes les provinces et territoires dans la période 2004-2014 (tableau 2).
Aux États-Unis, des baisses annuelles statistiquement non significatives sont apparentes tant dans le long terme (1966-2013 : -2,1 %) que dans le court terme (2003-2013 : -1,5 %), quoique les échantillons sont beaucoup plus petits (n = 59 parcours) qu’au Canada (Sauer et al., 2014).
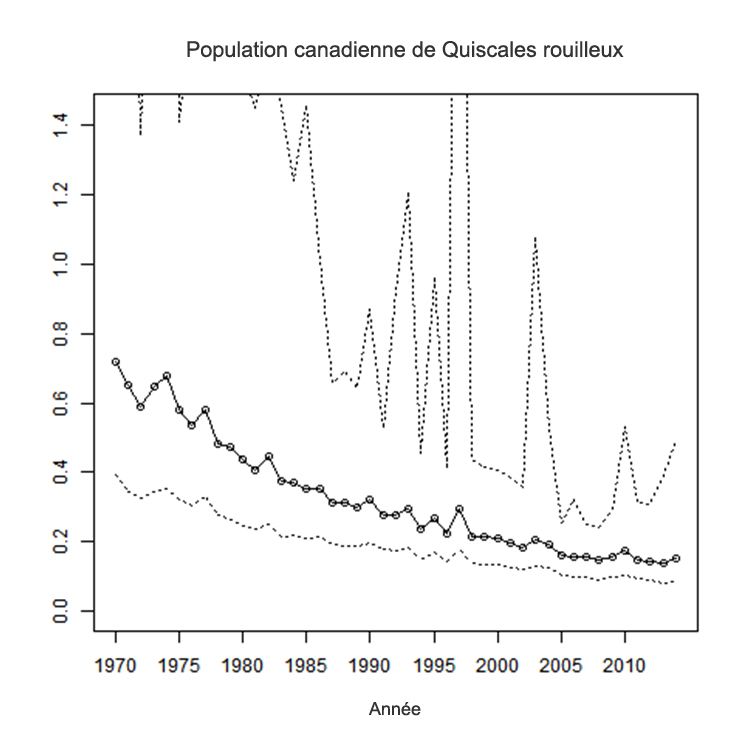
Description longue de la figure 7
Graphique illustrant les indices d’abondance annuels des Quiscales rouilleux au Canada entre 1970 et 2014, selon un modèle bayésien hiérarchique des données du Relevé des oiseaux nicheurs.
| Province/territoire | Période | Tendance annuelle | Limites Inférieure |
Limites Supérieure |
Nombre de parcours effectués |
|---|---|---|---|---|---|
| Canada | 1970-2014 | -3,5 | -6,55 | -0,58 | 191 |
| Canada | 2004-2014 | -2,58 | -8,43 | 4,06 | 158 |
| Alberta | 1971-2014 | -4,62 | -11,5 | 2,13 | 19 |
| Alberta | 2004-2014 | -3,46 | -11,8 | 3,85 | 24 |
| Colombie-Britannique | 1970-2014 | -3,17 | -8,25 | 3,38 | 21 |
| Colombie-Britannique | 2004-2014 | -1,5 | -19,8 | 28,4 | 18 |
| Territoires du Nord-Ouest | 1989-2014 | -2,72 | -6,46 | 1,64 | 15 |
| Territoires du Nord-Ouest | 2004-2014 | -2,62 | -8,78 | 4,68 | 14 |
| Manitoba | 1970-2014 | -3,42 | -12,2 | 6,64 | 6 |
| Manitoba | 2004-2014 | -2,65 | -8,68 | 4,7 | 6 |
| Nouveau-Brunswick | 1970-2014 | -6,71 | -9,01 | -4,35 | 24 |
| Nouveau-Brunswick | 2004-2014 | -6,59 | -11,8 | 1,09 | 19 |
| Terre-Neuve-et-Labrador | 1976-2014 | -6,33 | -9,35 | -3,58 | 23 |
| Terre-Neuve-et-Labrador | 2004-2014 | -2,73 | -8,52 | 4,17 | 21 |
| Ontario | 1970-2014 | -4,61 | -7,68 | -1,4 | 37 |
| Ontario | 2004-2014 | -2,68 | -8,61 | 4,23 | 31 |
| Québec | 1970-2014 | -5,32 | -7,88 | -2,71 | 30 |
| Québec | 2004-2014 | -2,61 | -8,62 | 4,47 | 21 |
| Nouvelle-Écosse / Île-du-Prince-Édouard | 1970-2014 | -5,89 | -7,99 | -3,87 | 29 |
| Nouvelle-Écosse / Île-du-Prince-Édouard | 2004-2014 | -6,17 | -13,8 | 0,84 | 26 |
| Yukon | 1973-2014 | -2,65 | -5,87 | 0,96 | 25 |
| Yukon | 2004-2014 | -2,59 | -7,67 | 3,75 | 23 |
Atlas des oiseaux nicheurs
En Ontario, la comparaison de la répartition du Quiscale rouilleux entre les périodes de relevé du premier atlas (1981-1985) et du deuxième atlas (2001-2005) montre une baisse non significative de la probabilité d’observation de 5 % à l’échelle de la province pour la période entière de 20 ans (figure 8; Cadman et al., 2007). La baisse a été statistiquement significative dans la région du Sud du Bouclier (-30 %) et dans l’est de la région du Nord du Bouclier (-32 %). L’espèce a aussi connu une baisse non significative dans la région de Lac Simcoe (-49 %; Cadman et al., 2007). Cependant, une hausse significative a été calculée pour la région des Basses-Terres de la baie d’Hudson (+37 %; Cadman et al., 2007).
Au Québec, la comparaison visuelle du nombre de parcelles d’atlas occupées entre les années 1980 et les années 2010 laisse croire à une réduction du nombre de parcelles occupées par l’espèce dans certaines parties du sud de la province, dont l’Outaouais, les Laurentides et les Appalaches (figure 9; BBAQ, 2015). Pour la figure 9, il est à noter que les régions situées au nord du 50e parallèle n’avaient pas été couvertes lors des travaux du premier atlas. Par ailleurs, les corrections pour les différences d’effort d’observation n’ont pas encore été réalisées.
Dans les Maritimes, la comparaison du nombre de parcelles d’atlas occupées entre les années 1980 et les années 2010 laissent croire à une réduction de 55 % (442 parcelles contre 275; figure 10; Stewart et al., 2015). Ici encore, les corrections pour les différences d’effort d’observation n’ont pas été effectuées.
Les travaux d’atlas effectués au Vermont et dans l’État de New York dans les périodes 1980-1985 et 2000-2005 indiquent des baisses du nombre de parcelles occupées par des Quiscales rouilleux nicheurs de 23 % et de 42 %, respectivement (McCormack, 2012).
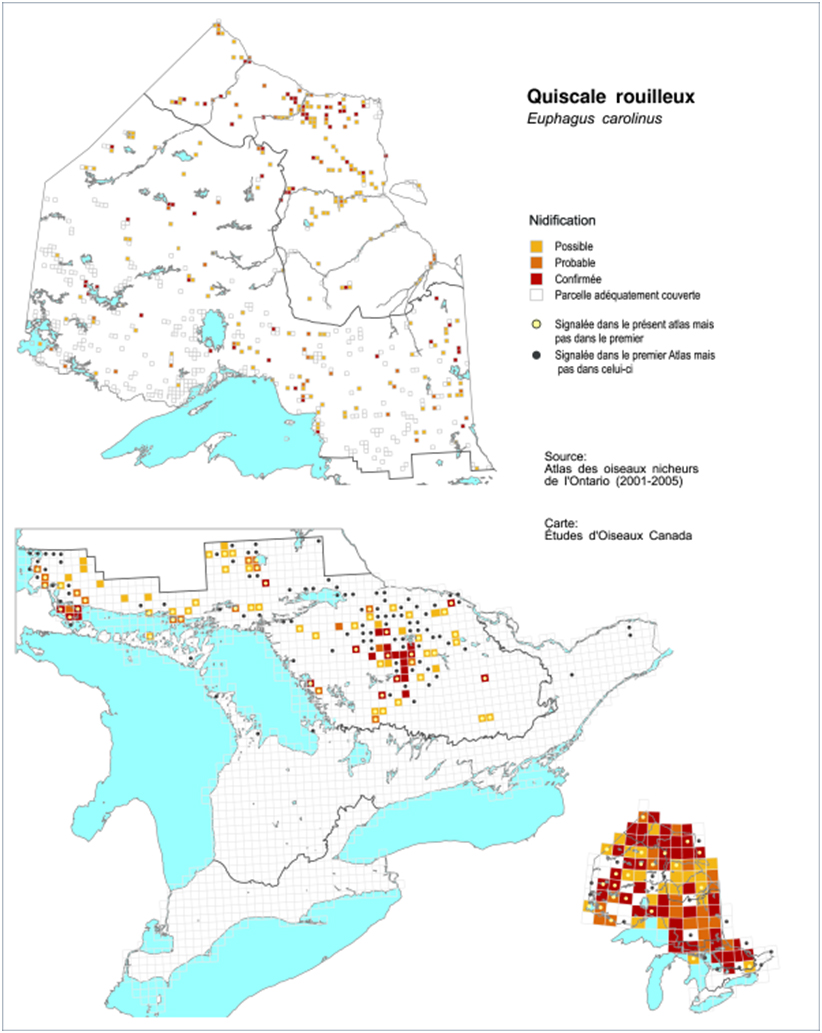
Description longue de la figure 8
Cartes illustrant l’aire de répartition du Quiscale rouilleux en Ontario au cours de la première (de 1980 à 1985) et de la deuxième (de 2001 à 2005) période de l’Atlas des oiseaux nicheurs.
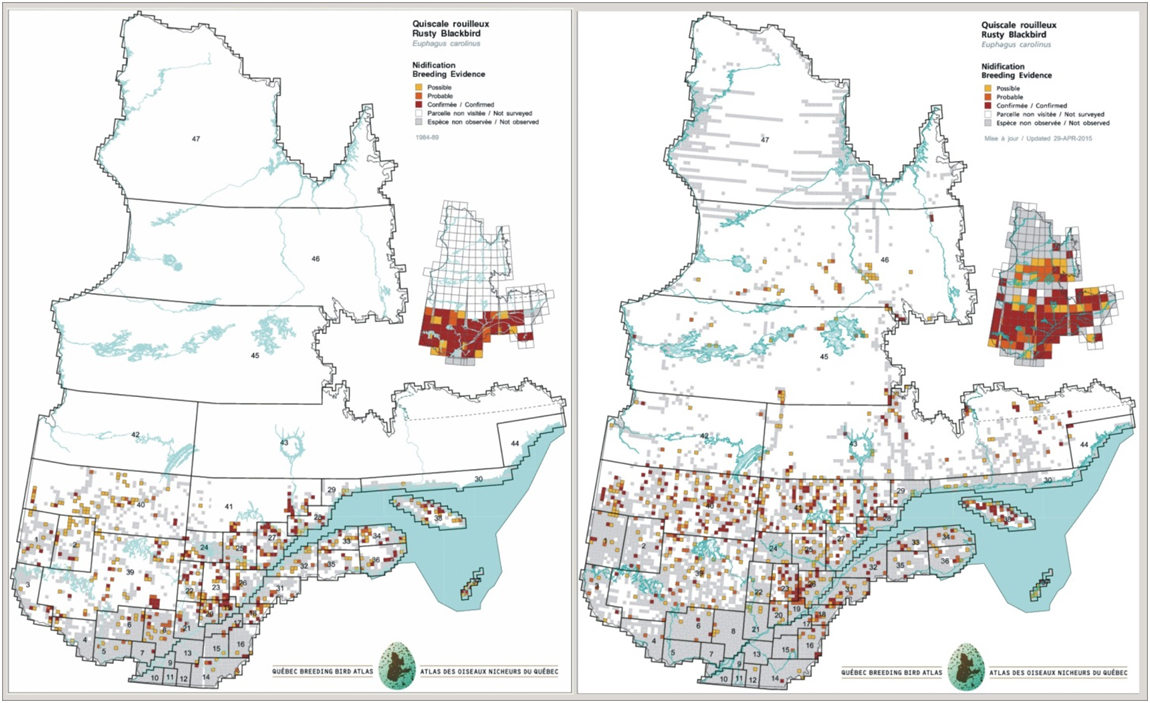
Description longue de la figure 9
Cartes illustrant l’aire de répartition du Quiscale rouilleux au Québec au cours de la première (de 1985 à 1990) et de la deuxième (de 2010 à 2015) période de l’Atlas des oiseaux nicheurs.
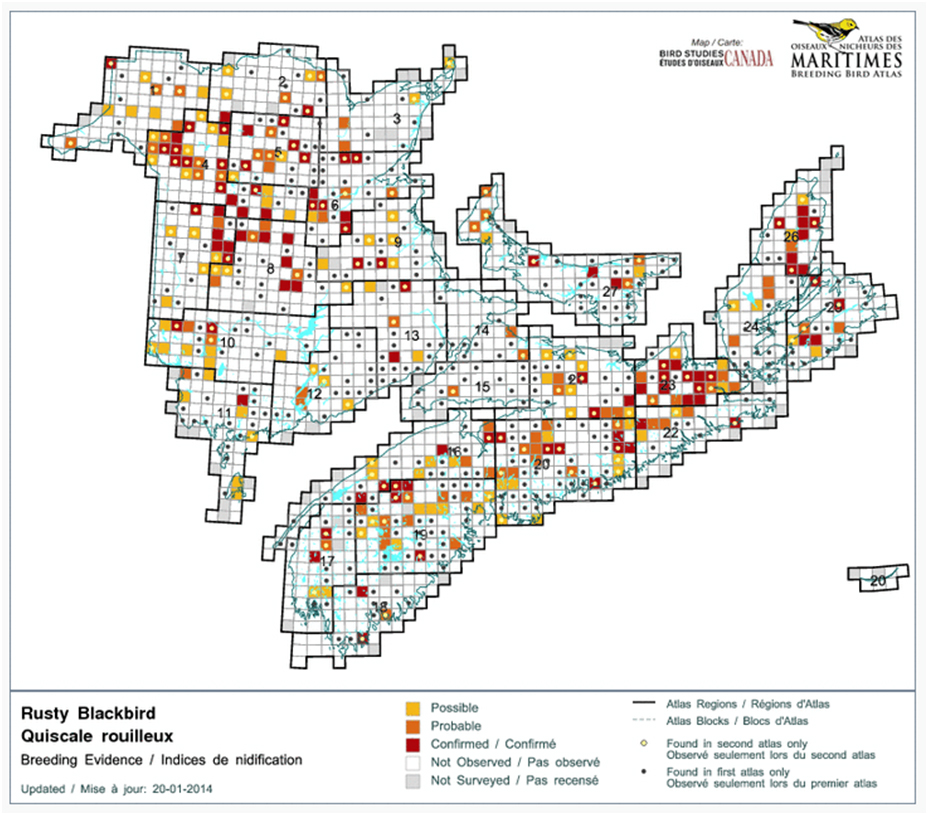
Description longue de la figure 10
Carte illustrant l’aire de répartition du Quiscale rouilleux dans les Maritimes au cours de la première (de 1985 à 1990) et de la deuxième (de 2010 à 2015) période de l’Atlas des oiseaux nicheurs.
étude des populations d’oiseaux du Québec (ÉPOQ)
L’indice d’abondance printanier de l’Étude des populations d’oiseaux du Québec (ÉPOQ) pour le Quiscale rouilleux au Québec fondé sur les données de la période 1975-2013 indique une baisse annuelle statistiquement non significative de 0,9 % (figure 11; Larivée, 2015). L’indice d’abondance pour l’estimation à court terme couvrant la période 2003-2013 montre une baisse statistiquement significative (R2 = 0,57, p = 0,01).
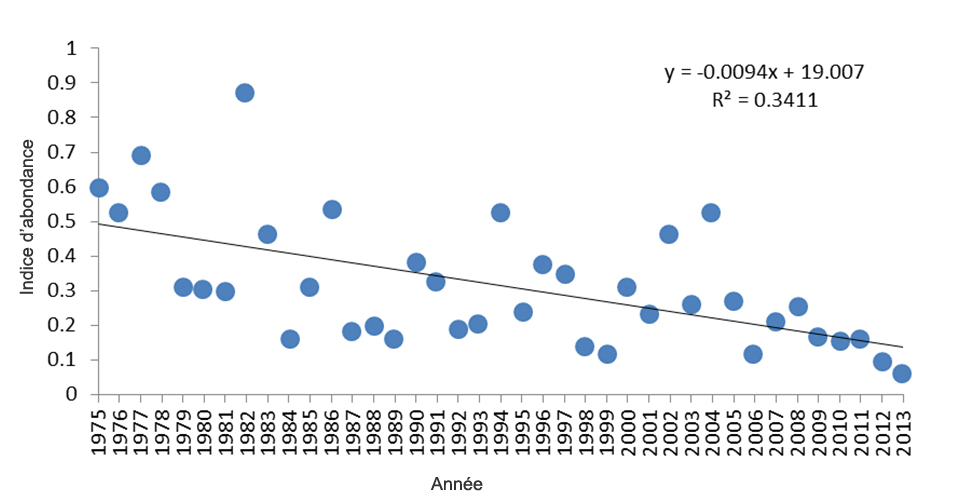
Description longue de la figure 11
Graphique illustrant les indices d’abondance annuels des Quiscales rouilleux au Québec entre 1975 et 2013, selon la base de données de l’Étude des populations d’oiseaux du Québec (ÉPOQ).
Réseau canadien de surveillance des migrations (RCSM)
Les tendances des populations ont été établies à partir des données de cinq stations de surveillance des migrations situées en Ontario et au Québec, où le Quiscale rouilleux est considéré bien couvert (données pour au moins 10 ans et couvrant au moins 75 % de sa migration locale; Dunn et al., 2016). Toutes les stations présentent une forte variabilité annuelle des dénombrements des Quiscales rouilleux. Sur la base des dénombrements de l’Observatoire d’oiseaux de Tadoussac, Savard et al. (2011) ont avancé que la population de Quiscale rouilleux nichant dans le nord du Québec fluctue selon des intervalles de 4-5 ans.
Les stations de surveillance des migrations montrent des résultats hétérogènes, soit des tendances à court terme pour la période 2004-2014 tant positives que négatives (tableau 3), dont une hausse annuelle statistiquement significative de 27 % pour Tadoussac, dans l’est du Québec, et une baisse annuelle significative de 17 % pour la pointe Pelée, dans le sud-ouest de l’Ontario (CMMN, 2016). Cependant, les tendances à court terme pourraient ne pas être représentatives de la situation actuelle pour une espèce présentant des fluctuations cycliques de ses effectifs (Savard et al., 2011). Les tendances à long terme établies sur la base des dénombrements quotidiens sont généralement positives, mais dans tous les cas non significatives sur le plan statistique (CMMN, 2016; tableau 3).
| Station | Rég. | Sais. | À court terme | Tend. (%) | IC-lim. infér. (%) | IC-lim. supér. (%) | À long terme | Tend. (%) | IC-lim. infér. (%) | IC-lim. supér. (%) | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| PEPBO | E. de l’Ont. | Aut. | 2004-2014 | 11,40 | -14,71 | 38,79 | cellule vide | 2001-2014 | 14,68 | -3,03 | 24,02 |
| IPBO | E. de l’Ont. | Print. | 2004-2014 | 6,48 | -27,2 | 47,3 | cellule vide | 1997-2014 | 4,07 | -13,76 | 23,1 |
| OOT | O. du Qc | Aut. | 2004-2014 | 27,05 | 3,69 | 60,51 | cellule vide | 1996-2014 | 4,49 | -6,17 | 18,54 |
| PIBO | S.-O. de l’Ont. | Aut. | 2004-2014 | -17,49 | -28,64 | -3,49 | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| TCBO | N.-O. de l’Ont. | Aut. | 2004-2014 | -7,66 | -24,44 | 8,06 | cellule vide | 1995-2014 | -0,86 | -9,95 | 6,44 |
PEPBO : Prince Edward Point Bird Observatory; IPBO : Innis Point Bird Observatory, OOT : Observatoire d’oiseaux de Tadoussac, PIBO : Pelee Island Bird Observatory, TCBO : Thunder Cape Bird Observatory
Analyses qualitatives des comptes rendus historiques pour les Etats-Unis
Deux analyses qualitatives de comptes rendus ornithologiques publiés aux États-Unis avant la mise en œuvre des programmes modernes de surveillance (soit avant 1950) indiquent dans le long terme un changement dans la description de l’abondance de l’espèce, la terminologie descriptive étant passée de « commun – abondant » à « rare – peu commun » (Greenberg et al. 2011). Selon cette dernière analyse, le déclin de l’espèce a commencé au début du 20e siècle, soit bien avant le déclin relevé par le BBS et le RON. Une deuxième étude portant sur un plus grand échantillon de listes d’oiseaux est parvenue à la même conclusion, soit que l’espèce était considérée comme très commune ou abondante dans 56 % des comptes rendus publiés avant 1920, pourcentage qui a chuté à 19 % entre 1921 et 1950, puis à 7 % après 1950 (Greenberg et Droege, 1999). Selon Greenberg et al. (2011), les résultats de ces deux études laissent penser que ce déclin à long terme s’explique davantage par la perte d’habitat connue dans les quartiers d’hiver que par les changements environnementaux observés dans la forêt boréales, plus récents. Cependant, il y a bel et bien eu des changements à grande échelle dans les habitats dans l’ensemble de l’aire de reproduction du Quiscale rouilleux dans la période 1700-1900 en raison de l’importante activité de piégeage commercial du castor menée par les Européens dans une grande partie de l’aire de répartition de ce rongeur, qui en a frôlé l’extinction (Naiman et al., 1988; Humphries et Winemiller, 2009). Cela pourrait avoir directement réduit la disponibilité de milieux humides boisés pour les Quiscales rouilleux avant 1950.
Résumé des tendances des populations
Les deux plus grandes sources de données assurant le suivi des effectifs de Quiscales rouilleux (le RON et le BBS) indiquent que la population de l’espèce a connu un déclin à long terme de 66 % à 80 % au cours des 44 dernières années. Dans la période de 10 ans la plus récente, cependant, le BBS et le RON indiquent tous deux que la population a été plus ou moins stable, quoiqu’il y ait des incertitudes statistiques à cet égard. Divers atlas des oiseaux nicheurs montrent aussi une baisse à long terme de l’espèce, soit entre les années 1990 et les années 2010, et, dans certains cas, une réduction apparente de la répartition de l’espèce dans le sud au cours des deux dernières décennies. Les tendances relevées aux stations du RCSM sont hétérogènes, des hausses étant observées à certaines stations et des baisses à d’autres. Les analyses des comptes rendus historiques pour les États-Unis laissent penser que le déclin à long terme des populations de Quiscales rouilleux a probablement débuté au début du 20e siècle. Somme toute, il semble que la tendance à long terme à la baisse aurait évolué plutôt vers une stabilisation au cours de la dernière décennie.
Immigration de source externe
En cas de disparition de la population canadienne de Quiscales rouilleux, il semble peu probable que l’immigration d’individus depuis les États de la Nouvelle-Angleterre serait suffisante pour la rétablir en raison du fait que ces États américains n’abritent qu’une faible proportion de la population globale, et que l’espèce y a connu une baisse significative entre 1966 et 2013, particulièrement au Vermont (-11,5 % an-1; IC à 95 % : -20,7, -2,6 % an-1) et au New Hampshire (-9,5 % an-1; IC à 95 % : -15,4, -3,9 % an-1; Sauer et al., 2014). Par ailleurs, l’immigration d’individus d’Alaska paraît également peu probable en raison de la perte d’habitat actuelle dans cet État du fait des changements climatiques (Riordan et al., 2006). La population étatsunienne de Quiscales rouilleux n’est que d’environ 16 % de la population canadienne (Partners in Flight Science Committee, 2013), d’où un potentiel de sauvetage par immigration de source externe d’autant plus réduit, particulièrement s’il y a baisse des populations dans les deux pays.
Menaces et facteurs limitatifs
Menaces
Selon l’évaluation des menaces, l’impact global de ces dernières est moyen (voir l’annexe A pour des précisions). Les menaces sont présentées ci-dessous par ordre décroissant d’impact. Greenberg et Matsuoka (2010) affirment qu’il subsiste de nombreuses inconnues en ce qui concerne les raisons du déclin du Quiscale rouilleux. Certaines des menaces dont l’impact est évalué comme étant inconnu sont traitées ci-dessous étant donné qu’elles peuvent avoir en fait des impacts importants sur les populations de l’espèce, mais elles devraient être étudiées plus avant pour permettre l’évaluation de leur importance.
La perte d’habitat dans les quartiers d’hiver du Quiscale rouilleux, du fait de la conversion de 75-80 % des milieux humides boisés du sud des États-Unis, serait l’un des plus importants facteurs responsables du déclin à long terme de l’espèce (Greenberg et Droege 1999; Greenberg et al., 2011). Cependant, selon Hamel et al. (2009), la perte récente d’habitat d’hivernage du Quiscale rouilleux n’avait pas été aussi prononcée que la baisse d’effectif de l’espèce estimée au moyen des données du RON. Par conséquent, ces auteurs étaient d’avis qu’il était trop tôt pour affirmer que cette perte d’habitat était la principale cause des baisses de population récentes.
Développement résidentiel et commercial (menace no 1 de l’UICN); agriculture et aquaculture (menace no 2 de l’UICN); production d’énergie et exploitation minière (menace no 3 de l’UICN)
Ces trois menaces contribuent directement à la perte d’habitat du Quiscale rouilleux à un moment ou l’autre de son cycle vital, d’où leur regroupement ici (voir l’annexe A pour des précisions). L’impact calculé pour chacune de ces menaces est faible.
Dans les quartiers d’hiver de l’espèce, des milieux humides boisés ont été transformés pour faire place à des activités agricoles, des plantations de pins et des aménagements résidentiels (Hamel et al., 2009; Greenberg et Matsuoka 2010). On estime qu’entre 1780 et 1980, la superficie de milieux humides dans les quartiers d’hiver a diminué de 57 % dans les basses terres du Mississippi et de 36 % dans le sud de la plaine côtière atlantique (Hamel et al., 2009). Plus récemment, la perte d’habitat pour ce qui est des milieux humides boisés restants a aussi été importante, particulièrement de 1970 à 1990, du fait de la transformation de ces milieux à des fins de production de soja, cette culture étant devenue très rentable (Greenberg et al., 2011). Cependant, la superficie d’habitat convenable pour le Quiscale rouilleux s’est subséquemment accrue après la baisse des prix du soja à la fin des années 1980, époque où ont été menés des programmes de reboisement à grande échelle (Greenberg et al., 2011).
Dans l’aire de reproduction, la perte d’habitat du Quiscale rouilleux se produit à un rythme lent mais croissant dans certaines régions du Canada. Par exemple, dans la partie sud de l’aire de reproduction canadienne de l’espèce, de vastes superficies de milieux humides ont été transformées à des fins agricoles et industrielles (Greenberg et Droege 1999; Hobson et al., 2002; Young et al., 2006; Greenberg et al., 2011). Au total, l’habitat de reproduction au Canada aurait diminué de 5 % depuis la colonisation par les Européens, et une réduction additionnelle de 4 % est prévue d’ici 2050 (Global Forest Watch Canada, 2000; Griffiths et Woynillowicz, 2003; Kling et al., 2003; Rooney et al., 2012). On estime que, en date de 2003, 8 % de la forêt boréale canadienne avait été touchée par des activités d’exploration et d’extraction gazières et pétrolières (Greenberg et al., 2011)
Utilisation des ressources biologiques (menace no 5 de l’UICN)
L’impact global calculé pour cette menace est faible, comme la portée de cette dernière est considérée comme petite, mais sa gravité est considérée comme extrême.
Chasse et capture d’animaux terrestres
Les programmes visant à réduire les populations d’ictéridés considérés comme constituant une nuisance du fait qu’ils endommagent des récoltes sont une cause de mortalité pour les populations hivernantes de Quiscales rouilleux dans l’est des États-Unis (Avery, 2013). De 1974 à 1992, les programmes de lutte contre les Carouges à épaulettes et les Étourneaux sansonnets (Heisterberg et al., 1987) qui ont utilisé le poison PA-14 Avian Stressing Agent à 83 dortoirs situés au Kentucky, au Tennessee et en Alabama ont exterminé 38 millions d’oiseaux, parmi lesquels on estime qu’il se trouvait 120 000 Quiscales rouilleux (Meanley, 1976; Dolbeer et al., 1997). La période d’utilisation de ce produit, qui a depuis été retiré du marché, coïncide de façon générale avec la période de plus forte baisse des populations de Quiscales rouilleux (Greenberg et al., 2011).
Les populations migrantes et hivernantes de Quiscales rouilleux pourraient par ailleurs être affectées par les programmes de lutte antiaviaire utilisant le DCR-1339 (Starlicide®), produit actuellement utilisé dans le centre et le sud-est des États-Unis, particulièrement dans les cultures de tournesol et de riz (Linz et al., 2002; Blackwell et al., 2003; Custer et al., 2003). De plus, l’utilisation d’appâts empoisonnés pour lutter contre la présence d’ictéridés dans les parcs d’engraissement de bovins aux États-Unis pourrait affecter des Quiscales rouilleux en migration ou en hivernage (Greenberg et Matsuoka, 2010).
Exploitation forestière et récolte du bois
En Nouvelle-Angleterre, l’exploitation forestière est une menace pour le Quiscale rouilleux selon Powell et al. (2010b). Dans leur étude portant sur 43 nids d’ictéridés, ces auteurs ont démontré que les oiseaux qui nichaient dans des milieux humides à proximité d’une exploitation forestière récente présentaient une probabilité de prédation 2,3 fois supérieure à celle des oiseaux nichant dans des milieux humides où il n’y avait pas eu d’exploitation forestière dans les 20 dernières années. Dans cette région, les prédateurs potentiels sont le Mésangeai du Canada, le Geai bleu et l’écureuil roux (Powell et al., 2010b), qui, du moins en ce qui concerne le Geai bleu, sont généralement plus abondants dans les forêts fragmentés (Robinson et al., 1995). Cependant, une autre étude réalisée en Nouvelle-Angleterre, qui a porté sur un plus grand nombre de nids, a démontré que le succès de nidification des Quiscales rouilleux était élevé dans un paysage de forêt aménagée (Buckley, 2013). Il est donc trop tôt pour affirmer que l’exploitation forestière a un impact global négatif sur les populations nicheuses de Quiscales rouilleux. De plus, ces deux études ne sont pas directement applicables au contexte écologique différent dans lequel se trouvent les Quiscales rouilleux dans la forêt boréale du Canada. L’impact global calculé pour cette menace est faible, comme la portée de cette dernière est petite, et sa gravité est modérée.
Modifications des systèmes naturels (menace no 7 de l’UICN)
L’impact global calculé pour cette menace est faible, comme la portée de cette dernière est considérée comme grande et sa gravité est considérée comme modérée-légère.
La principale menace dans cette catégorie a trait aux barrages et à la gestion et aux utilisations de l’eau. Dans ses quartiers d’hiver, le Quiscale rouilleux semble sensible aux changements de l’hydrologie de surface causés par les activités qui entraînent le drainage de milieux humides, la dérivation de cours d’eau et la régularisation des eaux, ainsi qu’au déplacement des eaux souterraines (Greenberg et al., 2011). Les Quiscales rouilleux préfèrent les milieux humides dont le niveau d’eau fluctue de manière régulière (Mettke-Hofmann et al., 2015); on les trouve moins souvent dans les réservoirs qui sont inondés sur de longues périodes et dont les eaux sont profondes (Batema et al., 1985). Les activités industrielles ayant cours dans les lieux de reproduction et les routes migratoires (p. ex. exploitation des sables bitumineux et d’hydroélectricité) pourraient aussi altérer le régime hydrologique dans l’habitat du Quiscale rouilleux (Greenberg et al., 2011).
Pollution (menace no 9 de l’UICN)
L’impact calculé pour cette menace est faible, comme la portée de cette dernière est considérée comme grande à restreinte, et sa gravité est légère.
Effluents agricoles et sylvicoles
Plusieurs études récentes ont laissé entendre que les pesticides sont une cause importante de mortalité directe chez diverses espèces d’oiseaux présentes dans des zones agricoles (Boatman et al., 2004; Mineau, 2005; Mineau et Whiteside, 2013). Durant ses migrations et son hivernage, le Quiscale rouilleux fréquente des zones fortement agricoles, où il s’alimente de céréales, notamment de maïs (Dias, 2008).
Une analyse nationale du risque de mortalité aviaire dû à l’exposition à des pesticides actuellement utilisés aux États-Unis a indiqué que les plus fortes mortalités d’oiseaux ont probablement lieu dans les États du sud-est du pays, en raison de la forte proportion d’exploitations agricoles faisant usage de pesticides dans cette région (Mineau et Whiteside, 2013). Cette région est au cœur de l’aire d’hivernage du Quiscale rouilleux (Hamel et Ozdenerol, 2008).
De 1970 à 1980, l’utilisation répandue de pesticides granulaires à base de carbofuran dans les cultures en rangs dans les prairies d’Amérique du Nord a causé la mort de quelque 17 à 91 millions d’oiseaux de diverses espèces par année dans les seuls champs de maïs (Mineau et al., 2005). Les préparations granulaires à base de carbofuran ne sont plus utilisées aux États-Unis et au Canada, mais elles ont probablement contribué aux baisses des populations de Quiscales rouilleux avant leur retrait du marché.
Le DDT (dichlorodiphényltrichloroéthane) a été utilisé à grande échelle, y compris dans des programmes de lutte contre la tordeuse des bourgeons de l’épinette dans l’est du Canada de 1952 à 1967 (Environment Canada, 1991; Walker et al., 2012). Au Canada, on estime que 67 millions d’hectares de forêt ont été traités avec des pesticides (principalement le DDT) pour lutter contre les infestations de tordeuses de 1952 à 1990, le pic d’épandage ayant eu lieu au milieu des années 1970 (Walker et al., 2012). Même à de faibles concentrations, le DDT est très toxique pour les invertébrés aquatiques, y compris les larves d’odonates (Ide, 1967; Wilkes et Weiss, 1971; World Health Organization, 1989), principal aliment des Quiscales rouilleux durant la période de reproduction (Loomis, 2013). Les Quiscales rouilleux se reproduisant dans l’ensemble de la forêt boréale canadienne pourraient aussi avoir été affectés par le DDT, même dans le nord de la forêt boréale, où le DDT n’a pas été utilisé dans le passé, cette substance pouvant se volatiliser dans l’atmosphère et ainsi contaminer les chaînes alimentaires dans des zones très éloignées de ses lieux d’épandage (Braune, 1993; Muir et al.,1995). Des études ont montré que les sols forestiers ayant reçu du DDT peuvent demeurer contaminés des décennies après le traitement (Lichenstein et Shulz, 1959; Stewart et Chisholm 1971). Le DDT a aussi été intensivement utilisé dans l’aire d’hivernage de l’espèce (particulièrement dans la vallée du Mississippi) de 1947 à 1951 pour éradiquer la malaria (Centers for Disease Control and Prevention, 2012). Bien que le DDT ait été interdit en Amérique du Nord dans les années 1970, il pourrait avoir contribué au déclin de l’espèce.
Récemment, soit dans les années 1990, on a assisté à l’introduction des insecticides néonicotinoïdes. Plus de 11 millions d’hectares de terres agricoles ont été traités avec ces insecticides dans les Prairies canadiennes (Main et al., 2014). Ces pesticides ont été associés au déclin de plusieurs espèces d’oiseaux champêtres en Europe, parce qu’ils réduisent les populations d’insectes proies (Hallmann et al., 2014). L’incidence des néonicotinoïdes sur le Quiscale rouilleux est inconnue, mais on pense que leurs effets éventuels se produiraient en dehors de la période de reproduction.
Polluants atmosphériques
Le dépôt de mercure découlant d’activités industrielles (Des granges et al., 1998; Fitzgerald et al., 1998; Porvari et al., 2003; Wiener et al., 2003) et la libération de méthylmercure due au dégel du pergélisol dans la forêt boréale (Klaminder et al., 2008; Edmonds et al., 2010) constituent une source importante de contamination des milieux aquatiques au Canada. L’exposition au mercure peut réduire le succès reproducteur des oiseaux en altérant leur réponse immunitaire et peut aussi causer des troubles comportementaux et physiologiques (Scheuhammer et al., 2007). Des études menées dans plusieurs parties de l’aire de répartition du Quiscale rouilleux ont révélé la présence de fortes concentrations de mercure dans ses aliments du fait de l’habitude de l’espèce de se nourrir dans des milieux humides acides, où le mercure est facilement converti en méthylmercure, la forme la plus toxique (Evers et al., 2005; Edmonds et al., 2010; Greenberg et Matsuoka, 2010). Les Quiscales rouilleux se reproduisant dans la forêt boréale du Canada, d’Alaska et de Nouvelle-Angleterre présentent aussi des concentrations sanguines de mercure notablement plus élevées que les oiseaux en hivernage dans le sud des États-Unis (Matsuoka et al., 2008; Edmonds et al., 2010), ce qui laisse penser que les oiseaux se trouvant dans leurs lieux de reproduction seraient plus sujets à l’exposition au mercure que les oiseaux en hivernage, en raison du régime alimentaire davantage centré sur les insectes durant la période de reproduction (Evers et al., 2005).
On croit aussi que le Quiscale rouilleux est affecté par l’acidification due aux pluies acides (Schindler, 1988), particulièrement dans l’est de son aire de reproduction (DesGranges et Houde, 1989; Greenberg et Droege, 1999). Greenberg et Droege (1999) ont avancé que l’acidification des milieux humides affecterait les Quiscales rouilleux par l’entremise d’une perte de calcium et d’autres minéraux essentiels à la formation des os et des coquilles des œufs. Comme les Quiscales rouilleux mangent des gastéropodes et des mollusques, ils pourraient être vulnérables à un manque de calcium si l’abondance de ces aliments diminuait à cause de l’acidification (voir Graveland et al. 1994). L’acidification a aussi pour effet d’accroître la libération de mercure dans les milieux humides (voir plus haut).
Espèces et gènes envahissants ou autrement problématiques (menace no 8 de l’UICN)
L’impact global de cette menace est inconnu. De récentes analyses d’échantillons sanguins prélevés chez des adultes nichant en Alaska et au Maine et chez des individus en hivernage (Mississippi et Arkansas) montrent que la prévalence d’infection par des hématozoaires (principalement par des Leucocytozoon) était de 44 % (43 oiseaux) en Alaska et de 67 % (12 oiseaux) au Maine (Barnard et al., 2010). En hiver, la prévalence globale a été estimée à 49 % (aussi principalement des Leucocytozoon), pourcentage considéré comme plus élevé que les valeurs attendues pour cette période de l’année, où la transmission de parasites est généralement faible (Barnard et al. 2010). Les parasites ne sont pas considérés comme un danger direct pour la santé des ictéridés, mais une forte prévalence durant l’hiver laisse penser que les Quiscales rouilleux pourraient être exposés à des stress ou souffrir d’un affaiblissement de leur système immunitaire (Barnard et al. 2010). Il pourrait en découler un accroissement de l’impact des maladies et d’autres infections parasitaires, plus graves (Barnard et al., 2010). Cependant, la mesure dans laquelle cela constitue une menace véritable plutôt qu’un facteur limitatif est actuellement inconnue.
Changements climatiques et phénomènes météorologiques violents (menace no 11 de l’UICN)
L’impact global calculé pour cette menace est inconnu, comme la portée de cette dernière est considérée comme généralisée à grande mais sa gravité est inconnue.
Déplacement et altération de l’habitat
Les effets des changements climatiques dans les milieux humides boréaux pourraient être une des causes du déclin de l’espèce (Matsuoka et al., 2010a), aussi bien dans le passé que pour le futur. Stralberg et al. (2015b) ont utilisé des données climatiques et des données de points d’écoute pour 80 espèces d’oiseaux nichant dans l’ensemble de la zone boréale du Canada afin de modéliser les incidences potentielles des changements climatiques sur les populations. Leurs modèles prévoient une baisse future de l’abondance du Quiscale rouilleux qui pourrait être de 55 % pour 2100 (limite inférieure de l’IC, au 5e percentile : -150 %, limite supérieure de l’IC, au 95e percentile : -18 %; Stralberg et al., 2015b).
Il est prévu que les changements climatiques dans la zone boréale entraîneront une hausse importante des températures annuelles moyennes d’ici 2100 (Price et al., 2013), qui aura des impacts négatifs sur le Quiscale rouilleux, notamment un rétrécissement de son aire de reproduction. En effet, les changements climatiques pourraient être une cause sous-jacente d’une rétraction apparente de l’aire de reproduction de l’espèce vers le nord reflétant une perte d’habitat pour cet oiseau (McClure et al., 2012; Stralberg et al., 2015a, b). Selon ces auteurs, la probabilité de disparition du Quiscale rouilleux à l’échelle locale est plus élevée dans la partie sud de son aire de reproduction, et la limite sud de cette dernière s’est rétractée vers le nord d’environ 143 km depuis 1966.
L’assèchement et la dégradation de milieux humides dans une grande partie de la forêt boréale, causés par l’abaissement de la nappe phréatique lié au dégel du pergélisol et à l’accroissement de l’évapotranspiration, ont déjà été observés (Yoshikawa et Hinzman, 2003; Klein et al., 2005; Riordan et al., 2006; Matsuoka et al., 2010a; Carroll et al., 2011). Dans l’étude qu’ils ont menée au Canada, Carroll et al. (2011) ont conclu que la superficie de lacs et d’étangs peu profonds dans les zones boréale, subarctique et arctique a diminué de 6 700 km2 entre 2000 et 2009. Cet assèchement des milieux humides boréaux entraîne des changements dans les communautés d’invertébrés aquatiques, qui pourraient comprendre une réduction de la biomasse de ressources alimentaires importantes pour les Quiscales rouilleux, qu’on pense aux gastéropodes, aux amphipodes et aux larves de chironomidés (Corcoran et al., 2009). McClure et al. (2012) ont aussi avancé l’hypothèse que les changements climatiques et l’assèchement des milieux humides dans la forêt boréale pourraient déplacer le moment de l’émergence d’insectes proies, particulièrement des odonates, lequel ne serait alors plus synchronisé avec la phénologie de reproduction des Quiscales rouilleux.
Facteurs limitatifs
Prédation
La prédation n’est pas considérée comme étant une menace, mais elle constitue un facteur limitatif relativement important pour le Quiscale rouilleux durant la période de nidification (Powell et al., 2010b; Savard et al., 2011). Le suivi des migrations d’ictéridés à Tadoussac, au Québec, laisse croire que les pics d’abondance du Quiscale rouilleux à l’automne sont étroitement associés aux fluctuations de la pression exercée par les prédateurs (corvidés et petits mustélidés) dans la forêt boréale, laquelle fluctue à son tour suivant le cycle d’abondance de quatre ou cinq ans du campagnol de Gapper (Clethrionomys gapperi; Savard et al., 2011). Ces auteurs avancent l’hypothèse que quand les petits rongeurs sont abondants dans la forêt boréale, la pression de prédation sur les nids de Quiscales rouilleux se trouve grandement réduite, ce qui se solderait par une plus forte présence de quiscales l’automne suivant.
En Alaska, une étude a montré une fluctuation marquée du succès de nidification du Quiscale rouilleux, de 21 % en 2006 à 64 % en 2007 et 2008 (Matsuoka et al., 2010a). Ces auteurs ont attribué le faible taux de succès de 2006 à une forte pression de prédation (perte de 89 % des nids). En Nouvelle-Angleterre, l’écureuil roux est le principal prédateur des nids de Quiscales rouilleux, et il y aurait augmentation de la prédation de nids quand la population d’écureuils augmente durant les années subséquentes à une forte production de cônes (Buckley, 2013). Dans les quartiers d’hiver, le suivi de la prédation de Quiscales rouilleux pistés par télémesure a révélé que les principaux prédateurs étaient des rapaces diurnes de la famille des Accipitridés (Newell, 2013), dont les populations sont en croissance depuis l’interdiction du DDT (Greenberg et Matsuoka, 2010).
Nombre de localités
Le nombre de localités pour le Quiscale rouilleux est actuellement inconnu, mais, compte tenu de sa vaste répartition au Canada et du grand nombre de couples nicheurs, il y a beaucoup plus que 10 localités où un phénomène menaçant fortement plausible ou imminent pourrait rapidement affecter tous les Quiscales rouilleux présents. Dans les critères quantitatifs du COSEPAC pour l’évaluation de la situation des espèces sauvages, ce nombre de 10 est une valeur seuil parmi les critères associés à la désignation « espèce menacée ».
Protection, statuts et classements
Statuts et protection juridique
Bien que le Quiscale rouilleux soit un oiseau migrateur, il n’est pas officiellement protégé au Canada en vertu de la Loi de 1994 sur la convention concernant les oiseaux migrateurs (Environment Canada, 2015). La plupart des ictéridés ont été exclus de cette loi en 1916, tout comme d’autres oiseaux considérés alors comme nuisibles. En conséquence, le Quiscale rouilleux est normalement protégé dans toutes les provinces et territoires du Canada aux termes de leur législation sur les espèces sauvages.
Le Quiscale rouilleux est actuellement inscrit en tant qu’espèce préoccupante à l’annexe 1 de la Loi sur les espèces en péril, et un plan de gestion a été élaboré pour lui (Environment Canada, 2015). Il est inscrit comme espèce vulnérable à l’Endangered Species Act de Terre-Neuve-et-Labrador, espèce préoccupante à la Loi sur les espèces en péril du Nouveau-Brunswick, et en voie de disparition à l’Endangered Species Act de la Nouvelle-Écosse. Au Québec, le Quiscale rouilleux figure sur la liste des espèces fauniques susceptibles d’être désignées menacées ou vulnérables, aux termes de la Loi sur les espèces menacées ou vulnérables (RLRQ, c. E-12.01).
Statuts et classement non juridiques
NatureServe (2015) attribue au Quiscale rouilleux la cote mondiale G4 (apparemment non en péril; tableau 4). Selon la Liste rouge de l’UICN, l’espèce est considérée comme apparemment non en péril (NatureServe, 2015). Aux États-Unis, la cote nationale de l’espèce est N4 (apparemment non en péril; NatureServe, 2015), même si sa cote infranationale est S1 (gravement en péril) dans un État, S2 (en péril) dans cinq États et S3 (vulnérable) dans quinze États (NatureServe, 2015). Dans le Plan nord-américain de conservation des oiseaux terrestres de Partenaires d’envol (Rich et al., 2004), le Quiscale rouilleux figure parmi les espèces « d’importance continentale ».
Au Canada, le Quiscale rouilleux est considéré comme apparemment non en péril (N4) par NatureServe (NatureServe, 2015; tableau 4). Il est considéré comme en péril (S2) à l’Île-du-Prince-Édouard et en Nouvelle-Écosse, et vulnérable (S3) au Yukon, dans les Territoires du Nord-Ouest, en Colombie-Britannique, au Manitoba, au Québec, au Nouveau-Brunswick et à Terre-Neuve-et-Labrador. En Saskatchewan et en Ontario, l’espèce est considérée comme peu commune (S4; tableau 4).
Protection et propriété de l’habitat
Au Canada, l’habitat de reproduction propice au Quiscale rouilleux se trouve principalement dans des terres publiques dans la région boréale (Boreal Avian Modeling Project, 2015). On estime que 9 % de l’aire de répartition de l’espèce se trouve protégée dans des parcs nationaux et provinciaux, des refuges d’oiseaux migrateurs et des réserves nationales de faune (Wells et al., 2011), mais de plus vastes superficies devraient être protégées en Ontario et au Québec au cours de la prochaine décennie (D. Kraus comm. pers., 2016). Le Quiscale rouilleux est régulièrement présent dans au moins 23 aires protégées gérées par l’Agence Parcs Canada (Parks Canada, 2015), dont 12 parcs nationaux où il est considéré comme nicheur. L’espèce est aussi présente dans de nombreuses autres terres publiques fédérales administrées par d’autres ministères et par des gouvernements autochtones, dans de nombreux parcs et réserves écologiques provinciaux ainsi que dans d’autres types de réserves naturelles et aires de conservation.
| Région | Coteb |
|---|---|
| Monde entier | G4 |
| États-Unis | N4 |
| Canada | N4 |
| Yukon | S3B |
| Nunavut | SNRB |
| Territoires du Nord-Ouest | S3B |
| Colombie-Britannique | S3S4B |
| Alberta | S4 |
| Saskatchewan | S4B |
| Manitoba | S3S4B |
| Ontario | S4B |
| Québec | S3S4 |
| Nouveau-Brunswick | S3B |
| Nouvelle-Écosse | S2S3B |
| Île-du-Prince-Édouard | S2B |
| Terre-Neuve | S2S3B |
| Labrador | S3B |
b G = classement à l’échelle mondiale; S = classement à l’échelle infranationale (province ou État); N = classement à l’échelle nationale. La cote S1 signifie que l’espèce est gravement en péril, soit en raison de son extrême rareté (souvent 5 occurrences ou moins), soit parce qu’un ou plusieurs autres facteurs, par exemple un déclin très prononcé, la rendent particulièrement susceptible de disparaître; la cote S2 signifie que l’espèce est en péril, soit en raison de sa rareté, soit parce qu’un ou plusieurs autres facteurs la rendent très susceptible de disparaître (généralement entre 6 et 20 occurrences, ou un petit nombre d’individus [1 000 à 3 000 individus]); la cote S3 signifie que l’espèce est vulnérable, soit parce qu’elle est rare ou peu commune, soit parce que son aire de répartition est restreinte, soit parce qu’un ou plusieurs autres facteurs la rendent susceptible de disparaître; la cote S4 signifie que l’espèce est peu commune sans être rare, mais qu’elle suscite une certaine préoccupation à long terme à cause de baisses d’effectif ou d’autres facteurs; la cote S5 signifie que l’espèce n’est pas en péril parce qu’elle est commune, répandue et abondante globalement.
Remerciements
Le rédacteur du présent rapport remercie Christian Artuso, Ruben Boles, Mike Burrell, Suzanne Carrière, Kaytlin Cooper, Todd Copeland, Dean Demarest, Bruno Drolet, Richard Elliot, Dave Fraser, Marcel Gahbauer, Eric Gross, Samuel Hache, Jessica Humber, Colin Jones, Lisa Keable, Jeff Keith, Dan Kraus, Steven Matsuoka, Jon McCracken, Claudia Mettke-Hofmann, Greg Mitchell, Brian Naylor, Luke Powell, Chris Risley, Jean-Pierre Savard, Ken De Smet, Pam Sinclair, Adam Smith, Diana Stralberg, Don Sutherland, Marc-André Villard, Alana Westwood et Steven Van Wilgenburg pour leurs commentaires sur les versions antérieures du rapport et/ou leur contribution à l’évaluation des menaces. Le rédacteur du rapport remercie aussi le Regroupement QuébecOiseaux, le Service canadien de la faune d’Environnement et Changement climatique Canada et Études d’Oiseaux Canada pour avoir fourni les données de l’atlas des oiseaux nicheurs du Québec, ainsi que les milliers de participants qui ont recueilli les données d’atlas. Le présent rapport a été financé par Environnement et Changement climatique Canada.
Experts contactés
- Service canadien de la faune – Environnement et Changement climatique Canada
- Yves Aubry – Biologiste spécialiste de la faune – Oiseaux migrateurs, Québec, Qc
- Luc Belanger – Gestionnaire, Planification et intendance en matière de conservation, Québec, Qc
- Ruben Boles – Agent de projets scientifiques sur les espèces en péril, Gatineau, Qc
- Andrew Boyne – Chef, Planification et mobilisation en matière de conservation, Dartmouth, N.-É
- Shelagh Bucknell – Adjointe aux services administratifs, Delta, C.-B.
- Syd Cannings – Biologiste spécialiste des espèces en péril, Whitehorse, Yn
- Vanessa Charlwood – Chef de section aux Territoires du Nord-Ouest, Yellowknife, T.N.-O.
- Bruno Drolet – Biologiste principal spécialiste des oiseaux forestiers, Québec, Qc
- David Duncan – Gestionnaire, État et évaluation des populations, Edmonton, Alb.
- Samara Eaton – Biologiste spécialiste des espèces en péril, Sackville, N.-B.
- Jean Gauthier – Ornithologue, Québec, Qc
- Siu-Ling Han – Chef de section au Nunavut, Iqaluit, Nt
- Bruce Macdonald – Gestionnaire pour le Nord, Yellowknife, T.N.-O.
- Rhonda Millikin – Chef de section, Delta, C.-B.
- Michel Robert – Biologiste spécialiste de la faune – Inventaires d’oiseaux migrateurs, Québec, Qc
- Rich Russell – Biologiste spécialiste de la faune, Ottawa, Ont.
Agence Parcs Canada
- Patrick Nantel – Bureau du scientifique en chef des écosystèmes, Agence Parcs Canada, Gatineau, Qc
Représentants provinciaux et territoriaux pour les espèces en péril
- David Fraser – Scientific Authority Assessment, Ecosystems Protection and Sustainability Branch, BC Ministry of Environment, Victoria, BC
- Gordon Court – Provincial Wildlife Status Biologist, Fish and Wildlife Division,
Dept. of Sustainable Resource Development, Edmonton, AB - Richard Quinlan – Biologist, Fish and Wildlife Division,
Dept. of Sustainable Resource Development, Edmonton, AB - Steven Blaney – Biologiste, Direction de la protection de la faune et des écosystèmes, ministère de la Conservation du Manitoba, Winnipeg, Man.
- William Watkins – Direction de la protection de la faune et des écosystèmes, ministère de la Conservation du Manitoba, Winnipeg, Man.
- Vivian Brownell – Biologiste, ministère des Richesses naturelles et des Forêts de l’Ontario, Peterborough, Ont.
- Michael Oldham – Biologiste, ministère des Richesses naturelles et des Forêts de l’Ontario, Peterborough, Ont.
- Isabelle Gauthier – Coordonnatrice provinciale des espèces fauniques menacées ou vulnérables, Direction générale de la gestion de la faune et des habitats, ministère des Forêts, de la Faune et des Parcs de Québec, Québec, Qc
- Jérôme Lemaître – Biologiste spécialiste des oiseaux, Direction générale de la gestion de la faune et des habitats, ministère des Forêts, de la Faune et des Parcs de Québec, Québec, Qc
- Annie Lévesque – Biologiste, Direction générale de la gestion de la faune et des habitats, ministère des Forêts, de la Faune et des Parcs de Québec, Québec, Qc
- Pascal Giasson – Gestionnaire, Programme des espèces en péril, Direction de la faune et du poisson, ministère des Ressources naturelles, Fredericton, N.-B.
- Mary Sabine – Biologiste, Programme des espèces en péril, Direction de la faune et du poisson, ministère des Ressources naturelles, Fredericton, N.-B.
- Sherman Boates, Manager – Biodiversity, Wildlife Division, Nova Scotia Department of Natural Resources, Kentville, NS
- Rosemary Curley – Biologist, Forests, Fish and Wildlife Division, Prince Edward Department of Communities, Lands and Environment, Charlottetown, PEI
- Shelley Pardy – Ecosystem Management Ecologist, Endangered Species and Biodiversity Section, Newfoundland and Labrador Department of Environment and Conservation, Corner Brook, NL
- Suzanne Carrière – Biologist (Biodiversity), Wildlife Division, Northwest Territories Department of Environment and Natural Resources, Yellowknife, NWT
- Thomas Jung, Biologist - Senior Wildlife Biologist, Fish and Wildlife Branch, Environment Yukon, Whitehorse, YK
Secrétariat du COSEPAC, Environnement et Changement climatique Canada
- Alain Filion – Agent de projets scientifiques et SIG, Gatineau, Qc
- Jenny Wu – Agente de projets scientifiques, Gatineau, Qc
Autres experts contactés
- R. Anderson – Biologiste spécialiste de la faune, Musée canadien de la nature, Ottawa, Ont.
- Robert Bellizi – Biologiste spécialiste de la faune, ministère de la Défense nationale, Ottawa, Ont.
- Rick Page – Biologiste spécialiste de la faune, Victoria, C.-B.
- Tim Birt – Wildlife Biologist, Queen University, Kingston, ON
- Jean-Pierre Savard – Scientifique émérite, Sciences de la faune et du paysage, Environnement et Changement climatique Canada, Québec, Qc
- Diana Stralberg – Wildlife biologist, Boreal Avian Modeling Project, University of Alberta, Edmonton, AB
Sources d’information
American Ornithologists' Union (AOU). 1957. Check-list of North American Birds. 5th edition, Washington, D.C.
Atlas of the Breeding Birds of Québec (BBAQ). 2015. Données obtenues en réponse à une demande adressée au bureau de l’Atlas. Regroupement QuébecOiseaux, Environment Canada’s Canadian Wildlife Service and Bird Studies Canada. Québec, Québec, Canada [consultation en octobre 2014]. (Renseignements pour l’édition française : Atlas des oiseaux nicheurs du Québec (AONQ). 2015. Données obtenues en réponse à une demande adressée au bureau de l’Atlas. Regroupement QuébecOiseaux, Service canadien de la faune d’Environnement Canada et Études d'Oiseaux Canada. Québec (Québec, Canada))
Audubon. 2015. Christmas Bird Count. Site Web : https://www.audubon.org/conservation/science/christmas-bird-count [consulté en décembre 2015].
Avery, M.L. 2013. Rusty Blackbird. The Birds of North America Online (A. Poole, Ed.). Ithaca: Cornell Lab of Ornithology. Extrait de The Birds of North America Online : http://bna.birds.cornell.edu/bna/species/200
Barnard, W.H., C. Mettke-Hofmann et S.M. Matsuoka. 2010. Prevalence of hematozoa infections among breeding and wintering Rusty Blackbirds. Condor 112:849–853.
Batema, D.L, G.S., Henderson et L.H. Frederickson. 1985. Wetland invertebrate distribution in bottomland hard- woods as influenced by forest type and flooding regime. Fifth Central Hardwood Conference, University of Illinois, Urbana. Disponible à : www.ncrs.fs.fed.us/pubs/ch/ch05/CHvolume05page196.pdf [consulté le 27 octobre 2014].
Blackwell, B.F., E. Huszar, G.M. Linz et D.R.A. Dolbeer. 2003. Lethal control of Red-winged Blackbirds to manage damage to sunflower: an economic evaluation. Journal of Wildlife Management 67:818-828.
Blancher, P.J., K.V. Rosenberg, A.O. Panjabi, B. Altman, A.R. Couturier, W.E. Thogmartin et le Partners in Flight Science Committee. 2013. Handbook to the Partners in Flight Population Estimates Database, Version 2.0. PIF Technical Series No 6. http://www.partnersinflight.org/pubs/ts/
Boatman, N.D., N.W. Brickle, J.D. Hart, T.P. Milsom, A.J. Morris, A.W. Murray, K A. Murray et P.A. Robertson. 2004. Evidence for the indirect effects of pesticides on farmland birds. Ibis 146:131-143.
Borchert, S.M., et P.C. Stauffer. 2014. Site-specific habitat and landscape associations of Rusty Blackbirds wintering in Louisiana. PowerPoint presentation to the Rusty Blackbird Working Group at the AOU/COS/SCO Joint Meeting: recent advances in Rusty Blackbird research, Estes Park, Colorado.
Boreal Avian Modelling Project (BAM). 2015. Edmonton, AB. Disponible à : www.borealbirds.ca [consulté en août 2015]. (Également disponible en français : Projet de modélisation de l'avifaune boréale (PMAB). 2015. Edmonton (Alb.). Disponible à : http://www.borealbirds.ca/index.php.)
Braune, B.M. 1993. Trends and effects of environmental contaminants in arctic seabirds, waterfowl, and other wildlife. Study I. Contaminants in waterfowl: Native harvest in Labrador. In: Synopsis of research conducted under the 1992/93 Northern Contaminants Program, Environmental Studies #70, J.L. Murray and R.G. Shearer, eds. Indian Affairs and Northern Development Canada, Northern Affairs Program, Ottawa.
Breeding Bird Atlas of British Columbia (BBABC). 2015. British Colombia Breeding Bird Atlas. Site Web : http://www.birdAtlas.bc.ca/bcdata/maps.jsp?lang=fr. [consulté en août 2015]. (Également disponible en français : Atlas des oiseaux nicheurs de Colombie-Britannique. 2015. Atlas des oiseaux nicheurs de Colombie-Britannique. Site Web : http://www.birdAtlas.bc.ca/bcdata/maps.jsp?lang=fr.)
Breeding Bird Atlas of Manitoba (BBAMB). 2015. Manitoba Breeding Bird Atlas. Site Web : http://www.birdAtlas.mb.ca/index_en.jsp. [consulté en juillet 2015]. (Également disponible en français : Atlas des oiseaux nicheurs du Manitoba (AONM). 2015. Atlas des oiseaux nicheurs du Manitoba. Site Web : http://www.birdatlas.mb.ca/index_fr.jsp)
Brewer, D., A. Diamond, E.J. Woodsworth, B.T. Collins et E.H. Dunn. 2000. Canadian Atlas of Bird Banding. Volume 1: Doves, Cuckoos, and Hummingbirds through Passerines, 1921-1995, Special Publication, Canadian Wildlife Service. (Également disponible en français : Brewer, D., A. Diamond, E.J. Woodsworth, B.T. Collins et E.H. Dunn. 2000. Atlas des oiseaux bagués ou repris au Canada. Volume 1 : Pigeons et tourterelles, coulicous, colibris et passereaux, 1921-1995, publication spéciale, Service canadien de la faune.)
Buckley, S.H. 2013. Rusty Blackbirds in northeastern U.S. industrial forests: a multi-scale study of nest habitat selection and nest survival. Mémoire de maîtrise, State University of New York, Syracuse, New York. 151 pp.
Burleigh, T.D., et H.S. Peters. 1948. Geographic variation in Newfoundland birds. Proc. Biol. Soc. Wash. 61:111-126.
Cade, T.J. 1953. Aerial feeding of the Rusty Blackbird on mosquitoes. Wilson Bulletin 65:52-53.
Cadman, M.D., P.F.J. Eagles et F.M. Helleiner (eds.). 1987. Atlas of the Breeding Birds of Ontario, University of Waterloo Press, Waterloo, Ontario.
Cadman, M.D., D.A. Sutherland, G.G. Beck, D. Lepage, et A.R. Couturier (eds). 2007. Atlas of the Breeding Birds of Ontario, 2001-2005. Bird Studies Canada, Environment Canada, Ontario Field Ornithologists, Ontario Ministry of Natural Resources, and Ontario Nature. Toronto. xxii + 706 pp. (Également disponible en français : Cadman, M.D., D.A. Sutherland, G.G. Beck, D. Lepage et A.R. Couturier (dir.). 2010. Atlas des oiseaux nicheurs de l'Ontario, 2001-2005. Environnement Canada, Études d'Oiseaux Canada, le ministère des Richesses naturelles de l'Ontario, Ontario Field Ornithologists, et Ontario Nature. Toronto. xxii + 706 p.)
Campbell, R.W., N.K. Dawa, I. McTaggart-Cowan, J.M. Cooper, G.W. Kaiser, M.C.E. McNall et G.E.J. Smith. 1997. The Birds of British Columbia. Volume 3: Passerines, Flycatchers through Vireos. UBC Press, Vancouver. 252 pp.
Canadian Migration Monitoring Network (CMMN). 2016. Population trends and seasonal abundance. NatureCounts, Bird Studies Canada. Site Web : http://www.bsc-eoc.org/birdmon/cmmn/popindices.jsp [consulté en novembre 2016]. (Également disponible en français : Réseau canadien de surveillance des migrations (RCSM). 2016. Population trends and seasonal abundance. NatureCounts, Études d'Oiseaux Canada. Site Web : https://www.bsc-eoc.org/birdmon/cmmn/popindices.jsp?switchlang=FR)
Canham, L. 2014. Rusty Blackbird (Euphagus carolinus) fall migratory habitat dynamics in Missouri. Mémoire de maîtrise, Truman State University, Kirksville, Missouri. 48 pp.
Carroll, M.L., J.R.G. Townshend, C.M. DiMiceli, T. Loboda et R.A Sohlberg. 2011. Shrinking lakes of the Arctic: spatial relationships and trajectory of change. Geophysical Research Letters 38: L20406, doi:10.1029/2011GL049427
Centers for Disease Control and Prevention. 2012. Elimination of Malaria in the United States (1947-1951). Site Web : www.cdc.gov [consulté en mai 2016].
Chiblow, S. 2013. ATK Source Report on the Rusty Blackbird Euphagus carolinus in Canada. Prepared for Aboriginal Traditional Knowledge subcommittee of the Committee on the Status of Endangered Wildlife in Canada. 7 pp.
Cooke, M. T. 1942. Returns from banded birds-some longevity records of wild birds. Bird-Banding no. 13:110-119.
Corcoran, R. M., J. Lovvorn et P. Heglund. 2009. Long-term change in limnology and invertebrates in Alaskan boreal wetlands. Hydrobiologia 620:77-89.
COSEWIC. 2006. COSEWIC assessment and status report on the Rusty Blackbird Euphagus carolinus in Canada. Committee on the Status of Endangered Wildlife in Canada. Ottawa. vi + 28 pp. (www.sararegistry.gc.ca/status/status_e.cfm). (Également disponible en français : COSEPAC. 2006. Évaluation et Rapport de situation du COSEPAC sur le Quiscale rouilleux (Euphagus carolinus) au Canada. Comité sur la situation des espèces en péril au Canada. Ottawa. vi + 30 p. (http://www.registrelep.gc.ca/status/status_f.cfm))
Crewe, T.L., J.D. McCracken, P.D. Taylor, D. Lepage et A.E. Heagy. 2008. The Canadian Migration Monitoring Network - Réseau Canadien de Surveillance Des Migrations: Ten-Year Report on Monitoring Landbird Population Change. CMMN-RCSM Scientific Technical Report #1.
Custer, T.W., C.M. Custer, P.M. Dummer, G.M. Linz, L. Sileo, R.S. Stahl et J.J. Johnston. 2003. Nontarget bird exposure to DRC-1339 during fall in North Dakota and spring in South Dakota, pp. 64-70, in G.M. Linz (ed.), Management of North American Blackbirds, National Wildlife Research Center, Fort Collins, Colorado.
Cyr, A., et J. Larivée. 1995. Atlas saisonnier des oiseaux du Québec. Les Presses de l’Université de Sherbrooke et la Société de Loisir ornithologique de l’Estrie, Sherbrooke, Québec.
Dahl, T.E. 1990. Wetlands Losses in the United States, 1780s to 1980s. U.S. Department of Interior, U.S. Fish and Wildlife Service, Washington, DC.
Darveau, M., P. Beauchesne, L. Bélanger, J. Huot et P. Larue. 1995. Riparian forest strips as habitat for breeding birds in boreal forest. Journal of Wildlife Management 59:67-78.
DeLeon, E.E. 2012. Ecology of Rusty Blackbirds wintering in Louisiana: seasonal trends, flock composition and habitat associations. Mémoire de maîtrise, Louisiana State University. 106 pp.
DesGranges, J.-L., et B. Houde. 1989. Influence de l’acidité et d’autres paramètres environnementaux sur la distribution des oiseaux lacustres au Québec, pp. 7-44, in J.-L. DesGranges (éd.), Étude des effets de l’acidification sur la faune aquatique au Canada : les oiseaux lacustres et leurs habitats au Québec, Environnement Canada, Service canadien de la faune, Région du Québec, Publication hors série no 67, 73 p.
DesGranges, J.-L., J. Rodrigue, B. Tardif et M. Laperle. 1998. Mercury accumulation and biomagnification in Ospreys (Pandion haliaetus) in the James Bay and Hudson Bay regions of Québec. Archives of Environmental Contamination and Toxicology 35:330-341.
Dias, N.W. 2008. Reliable locations of significant Rusty Blackbird flocks in South Carolina: characteristics and shared features of the most reliable sites. PowerPoint presentation to the Rusty Blackbird Working Group. Site Web : http://rustyblackbird.org/wp-content/uploads/7-RUBL_Dias.pdf [consulté en août 2015].
Dolbeer, R.A., D.F. Mott et J.L. Belant. 1997. Blackbirds and starlings killed at winter roosts from PA-14 applications, 1974-1992: implications for regional population management. Proceedings Eastern Wildlife Damage Control Conference. 7:77-86.
Ducks Unlimited. 2007. Wetlands Reserve Program: helping to restore bottomland hardwoods in the Mississippi Alluvial Valley. Ducks Unlimited. <http://www.ducks.org/Conservation/Government Affairs/1622/WetlandsReserveProgram.html, July 2007>.
Dunn, E., B. Drolet, D. Collister, D. Okines et J. McCracken. 2016. Canadian Migration Monitoring Network status assessment. Rapport inédit. 9 pp. + Appendices.
eBird Canada. 2015. Site Web : http://ebird.org/content/canada/ [consulté en août 2015]. (Également disponible en français : eBird Canada. 2015. Site Web : http://ebird.org/content/canada/?lang=fr).
Edmonds, S.T., D.C. Evers, D.A. Cristol, C. Mettke-Hofmann, L.L. Powell, A.J. McGann, J.W. Argimer, O.P. Lane, D.F. Tessler, et P. Newell, K. Heyden et N.J. O’Driscoll. 2010. Geographic and seasonal variation in mercury exposure of the declining Rusty Blackbird. Condor 112:789–799.
Ellison, W.G. 1990. The status and habitat of the Rusty Blackbird in Caledonia and Essex counties. Vermont Fish and Wildlife Department, Woodstock, Vermont.
Environment Canada. 1991. The State of Canada’s Environment - 1991. Environment Canada. Minister of Supply and Services, Ottawa. (Également disponible en français : Environnement Canada. 1991. L'état de l'environnement au Canada, 1991. Environnement Canada. Ministre des Approvisionnements et Services, Ottawa.)
Environment Canada. 2009. Status of Birds in Canada website: http://ec.gc.ca/soc-sbc/index-eng.aspx?sY=2011&sL=e [consulté en décembre 2015]. (Également disponible en français : Environnement Canada. 2009. Site Web de Situation des oiseaux au Canada : http://www.ec.gc.ca/soc-sbc/index-fra.aspx?sY=2011&sL=f)
Environment Canada. 2014. Breeding Bird Survey Results. Trend results for Rusty Blackbird. Site Web : http://www.ec.gc.ca/ron-bbs/P004/A001/?lang=f&m=s&r=RUBL&p=L [consulté en juillet 2015]. (Également disponible en français : Environnement Canada. 2014. Résultats du Relevé des oiseaux nicheurs. Tendances annuelles : Quiscale rouilleux. Site Web : http://www.ec.gc.ca/ron-bbs/P004/A001/?lang=f&m=s&r=RUBL&p=L)
Environment Canada. 2015. Management Plan for the Rusty Blackbird (Euphagus carolinus) in Canada. Species at Risk Act Management Plan Series. Environment Canada, Ottawa. iv + 26 pp. (Également disponible en français : Environnement Canada. 2015. Plan de gestion du Quiscale rouilleux (Euphagus carolinus) au Canada. Série de plans de gestion de la Loi sur les espèces en péril. Environnement Canada, Ottawa. iv + 30 p.)
Erskine, A.J. 1992. Atlas of Breeding Birds of the Maritime Provinces. Nimbus Publ. Ltd. and Nova Scotia Mus., Halifax.
Evans, B.S., L.L. Powell et R. Greenberg. 2014. The distribution of Rusty Blackbirds on their wintering grounds: potential hotpots and habitat associations. PowerPoint presentation to the Rusty Blackbird Working Group at the AOU/COS/SCO Joint Meeting: Recent advances in Rusty Blackbird research. Estes Park, Colorado. Site Web : http://rustyblackbird.org/wp-content/uploads/EvansRustyBlackBirdAOU.pdf [consulté en août 2015].
Evers, D.C., N.M. Burgess, L. Champoux, B. Hoskins, A. Major, W.M. Goodale, R.J. Taylor, R. Poppenga et T. Daigle. 2005. Patterns and interpretation of mercury exposure in freshwater avian communities in northeastern North America. Ecotoxicology 14:193–221.
Federation of Alberta Naturalists (FAN). 2007. The Atlas of Breeding Birds of Alberta: a second look. Federation of Alberta Naturalists, Edmonton, vii + 626 p.
Fisher, C., et L. Powell, 2013. Rusty Blackbird. In The Second Atlas of Breeding Birds of Vermont. Rosalind B. Renfrew, editor. University Press of New England. 576 pp.
Fitzgerald, W.F., D.R. Engstrom, R.P. Mason et E.A. Nater. 1998. The case for atmospheric mercury contamination in remote areas. Environmental Science & Technology 32:1-7.
Fraser, D., comm. pers. 2017. Correspondance par courriel adressée à R.D. Elliot, avril 2017.
Fredrickson, L.H. et F.A Reid. 1988. Nutritional values of waterfowl foods. Waterfowl Management Handbook. Fish and Wildlife Leaflet 13.1.1, U.S. Fish and Wildlife Service, Washington, DC. 6 pp.
Gauthier, J., et Y. Aubry. (Eds). 1996. The Breeding Birds of Québec: Atlas of the Breeding Birds of Southern Québec. Association québécoise des groupes d’ornithologues, Société québécoise de protection des oiseaux, Service Canadien de la faune, Environment Canada, Montréal, xviii + 1302 pp. (Également disponible en français : Gauthier, J. et Y. Aubry. (sous la direction de). 1995. Les oiseaux nicheurs du Québec : Atlas des oiseaux nicheurs du Québec méridional. Association québécoise des groupes d’ornithologues, Société québécoise de protection des oiseaux, Service canadien de la faune, Environnement Canada, région du Québec, xviii + 1302 p.)
Gauthier, J., comm. pers. 2004. Communication avec C. Savignac, juillet 2004.
Global Forest Watch Canada. 2000. Canada’s Forests at a Crossroads: An Assessment in the Year 2000. World Resources Institute, Washington, DC. (Également disponible en français : Global Forest Watch Canada. 2000. Les forêts du Canada à la croisée des chemins : bilan 2000. World Resources Institute, Washington (DC).)
Godfrey, W.E. 1986. The Birds of Canada. Revised Edition. National Museum of Natural Sciences, National Museums of Canada, Ottawa, ON. 595 pp. (Également disponible en français : Godfrey, W.E. 1986. Les oiseaux du Canada. Édition révisée. Musée national des sciences naturelles, Musées nationaux du Canada, Ottawa (Ont.). 650 p.).
Gouvernement du Québec. 2006. Liste des espèces désignées menaces ou vulnérables au Québec. Site Web : http://www3.mffp.gouv.qc.ca/faune/especes/menacees/liste.asp#oiseaux. [consulté en juin 2016].
Government of Saskatchewan. 2015. Saskatchewan bird atlas. Site Web : http://gisweb1.serm.gov.sk.ca/imf/imf.jsp?site=birds [consulté en juin 2015].
Graveland, J., R. van der Wal, J.H. van Balen et J. van Noordwijk. 1994. Poor reproduction in forest passerines from decline of snail abundance on acidified soils. Nature368:446-448.
Greenberg, R., et S. Droege. 1999. On the decline of the Rusty Blackbird and the use of ornithological literature to document long-term population trends. Conservation Biology 13:553-559.
Greenberg, R., et S.M. Matsuoka. 2010. Rusty Blackbird: mysteries of a species in decline. Condor 112: 770-777.
Greenberg, R., D.W. Demarest, S.M. Matsuoka, C. Mettke-Hofmann, D. Evers, P.B. Hamel, J. Luscier, L.L. Powell, D. Shaw, M.L. Avery, K.A. Hobson, P.J. Blancher et D.K. Niven. 2011. Understanding declines in Rusty Blackbirds. Pp. 107–126 in J.V. Wells (editor). Boreal birds of North America: a hemispheric view of their conservation links and significance. Studies in Avian Biology (no. 41). University of California Press, Berkeley, CA.
Griffiths, M., et D. Woynillowicz. 2003. Oil and troubled waters: Reducing the impact of the oil and gas industry on Alberta’s water resources. Pembina Institute for Appropriate Development. 35 pp.
Hallmann, C.A., R.P. Foppen, C.A. van Turnhout, H. de Kroon et E. Jongejans. 2014. Declines in insectivorous birds are associated with high neonicotinoid concentrations. Nature 511:341-343.
Hamel, P.B., et E. Ozdenerol. 2008. Using the spatial filtering process to evaluate the nonbreeding range of Rusty Blackbird Euphagus carolinus. Proceedings of the Fourth International Partners in Flight Conference: Tundra to the Tropics. Pp. 334–340.
Hamel, P.B., D. DeSteven, T. Leininger et R. Wilson. 2009. Historical trends in Rusty Blackbird nonbreeding habitat in forested wetlands. Proceedings of the Fourth International Partners in Flight Conference: Tundra to the Tropics. pp. 341–353.
Hayeur, G. 2001. Synthèse des connaissances environnementales acquises en milieu nordique de 1970 à 2000, Montréal, Hydro-Québec. 110 pp.
Hefner, J.M., B.O. Wilen, T.E. Dahl et W.E. Frayer. 1994. Southeastern wetlands: status and trends, mid-1970s to mid-1980s. U.S. Fish and Wildlife Service and U.S. Environmental Protection Agency, Atlanta, GA.
Heisterberg, J.F., A.R. Stickley, Jr., K.M. Garner et P.D. Foster, Jr. 1987. Controlling blackbirds and starlings at winter roosts using PA-14. Proceedings of the Eastern Wildlife Damage Control Conference 3:177–183.
Hobson, K.A., E.M. Bayne et S.L. Van Wilgenburg. 2002. Large-scale conversion of forest to agriculture in the Boreal Plains of Saskatchewan. Conservation Biology 16:1530-1541.
Hobson, K.A., R. Greenberg, S.l. Van Wilgenburg, et C. Mettke-Hofmann. 2010. Migratory connectivity in the Rusty Blackbird: isotopic evidence from feathers of historical and con- temporary specimens. Condor 112:778–788.
Hobson, K. A., S. L. Van Wilgenburg, E. H. Dunn, D. J. T. Hussell, P. D. Taylor, et D. M. Collister. 2015. Predicting origins of passerines migrating through Canadian migration monitoring stations using stable-hydrogen isotope analyses of feathers: a new tool for bird conservation. Avian Conservation and Ecology 10: 3. http://dx.doi.org/10.5751/ACE-00719-100103
Hood, G.A., et S.E. Bayley. 2008. Beaver (Castor canadensis) mitigate the effects of climate on the area of open water in boreal wetlands in western Canada. Biological Conservation 141:556-567
Houghton, R.A. 2002. Magnitude, distribution and causes of terrestrial carbon sinks and some implications for policy. Climate Policy 2:71–88.
Humphries, P., et K.O. Winemiller. 2009. Historical impacts on river fauna, shifting baselines, and challenges for restoration. BioScience 59:673-684.
Ide, F.P. 1967. Effects of forest spraying with DDT on aquatic insects of salmon streams in New Brunswick. Journal of the Fisheries Research Board of Canada 24:769-805.
International Rusty Blackbird Working Group. 2013. Site Web :http://rustyblackbird.org [consulté en août 2015].
Johnson, J.A., S.M. Matsuoka, D.F. Tessler, R. Greenberg et J.W. Fox. 2012. Identifying migratory pathways used by Rusty Blackbirds breeding in southcentral Alaska. The Wilson Journal of Ornithology 124:698–703.
Johnston, C.A., et R.J. Naiman. 1990. Browse selection by beaver: effects on riparian forest composition. Canadian Journal of Forest Research 20:1036–1043.
Kennard, F.H. 1920. Notes on the breeding habits of the Rusty Blackbird in northern New England. Auk 37:412-422.
King, S.L., D.J. Twedt et R.R. Wilson. 2006. The role of the Wetland Reserve Program in conservation efforts in the Mississippi River Alluvial Valley. Wildlife Society Bulletin 34:914–920.
Klaminder, J., K. Yoo, J. Rydberg et R. Giesler. 2008. An explorative study of mercury export from a thawing palsa mire. Journal of Geophysical Research Biogeosciences 113:1–9.
Klein, E., E.E. Berg et R. Dial. 2005. Wetland drying and succession across the Kenai Peninsula Lowlands, south-central Alaska. Canadian Journal of Forest Research 35:1931–1941.
Kling, G.W., K. Hayhoe, L.B. Johnson, J.J. Magnuson, S. Polasky, S.K. Robinson, B.J. Shuter, M.M. Wander, D.J. Wuebbles, D.R. Zak, R.L. Lindroth, S.C. Moser et M.L. Wilson. 2003. Confronting Climate Change in the Great Lakes Region: Impacts on our Communities and Ecosystems. The Union of Concerned Scientists, Cambridge (Massachusetts), and The Ecological Society of America, Washington, DC. 92 pp.
Kraus, D., comm. pers. 2016. Nature Conservancy of Canada. Communication par courriel avec J. McCracken, novembre 2016.
Lanyon, S.M., et K.E. Omland. 1999. A molecular phylogeny of the blackbirds (Icteridae): five lineages revealed by cytochrome-B sequence data. Auk 116:629-639.
Larivée, J. 2015. Étude des populations d'oiseaux du Québec (Version 2015-05-15) [base de données]. Rimouski, Québec : Regroupement QuébecOiseaux.
Larue, P., L. Bélanger et J. Huot. 1995. Riparian edge effects on boreal balsam fir bird communities. Canadian Journal of Forest Research 25:555-566.
La Sorte, F.A., D. Fink, W.M. Hochachka et S. Kelling. 2016. Convergence of broad-scale migration strategies in terrestrial birds. Proceedings of the Royal Society B.
Linz, G.M., M.J. Kenyon, H.J. Homan et W.J. Bleier. 2002. Avian use of rice baited corn stubble in east-central South Dakota. International Biodeterioration and Biodegradation 49:179-184.
Loomis, D. 2013. Reproductive Success and Foraging Ecology of the Rusty Blackbird on the Copper River Delta, Alaska. Mémoire de maîtrise, Oregon State University. 85 pp.
Luscier, J.D., S.E. Lehnen et K.G. Smith. 2010. Habitat occupancy by Rusty Blackbirds wintering in the Lower Mississippi Alluvial Valley. Condor 112:841–848.
Machtans, C.S., S.L.V. Wilgenburg, L.A. Armer et K.A. Hobson. 2007. Retrospective comparison of the occurrence and abundance of Rusty Blackbird in the Mackenzie Valley, Northwest Territories. Avian Conservation and Ecology 2(3): 1. Disponible à http://www.ace-eco.org/vol2/iss1/art3/.
Main, A.R., J.V. Headley, K.M. Peru, N.L. Michel, A.J. Cessna et C.A. Morrissey. 2014. Widespread use and frequent detection of neonicotinoid insecticides in wetlands of Canada's prairie pothole region. PLoS One 9(3): e92821.
Manitoba Avian Research Committee. 2003. The Birds of Manitoba. Winnipeg. 600 pp.
Martin, T.E. 1995. Avian life history evolution in relation to nest sites, nest predation, and food. Ecological Monographs 65:101–127.
Matsuoka, S.M., D. Shaw et J.A. Johnson. 2008. Assessing the value of Department of Defense lands in Alaska to a declining species, the Rusty Blackbird. National and International Initiatives. U.S. Fish and Wildlife Service, Migratory Bird Management, Anchorage, AK. 27 pp.
Matsuoka, S.M., D. Shaw et J.A. Johnson. 2010a. Estimating the abundance of nesting Rusty Blackbirds in relation to wetland habitats in Alaska. Condor 112:825–833.
Matsuoka, S.M., D. Shaw, P.H. Sinclair, J.A. Johnson, R.M. Corcoran, N.C. Dau, P.M. Meyers et N.A. Rojek. 2010b. Nesting ecology of the Rusty Blackbird in Alaska and Canada. Condor 112:810–824.
McClure, C.J.W., B.W. Rolek, K. McDonald et G.E. Hill. 2012. Climate change and the decline of a once common bird. Ecology and Evolution 2:370–378.
McCormack, M. 2012. Occupancy of Rusty Blackbirds (Euphagus carolinus) in the Adirondack Region of New York State. Mémoire de maîtrise, Green Mountain College, Poultney, VT. 47 pp.
McDowell, D.M., et R.J. Naiman. 1986. Structure and function of a benthic invertebrate stream community as influenced by beaver (Castor canadensis). Oecologia 68:481-489.
Meanley, B. 1976. Distribution and ecology of blackbird and starling roosts in the United States. Progress report of the U.S. Fish and Wildlife Service.
Mettke-Hofmann, C., P.B. Hamel, G. Hofmann, T.J. Zenzal Jr., A. Pellegrini, J. Malpass, M. Garfinkel, N. Schiff et R. Greenberg. 2015. Competition and habitat quality influence age and sex distribution in wintering Rusty Blackbirds. PLoS ONE 10(5): e0123775.
Mineau, P. 2005. Direct losses of birds to pesticides - beginnings of a quantification. Pp. 1065-1070 In Bird Conservation Implementation and Integration in the Americas: Proceedings of the Third International Partners in Flight Conference 2002. USDA Forest Service, GTR-PSW-191. Albany, CA.
Mineau, P., C.M. Downes, D.A. Kirk, E. Bayne et M. Csizy. 2005. Patterns of bird species abundance in relation to granular insecticide use in the Canadian prairies. Ecoscience 12:267-278.
Mineau, P., et M. Whiteside. 2013. Pesticide acute toxicity is a better correlate of US grassland bird declines than agricultural intensification. PLoS One 8(2): e57457.
Morse, D.H. 1977. Feeding behaviour and predator avoidance in heterospecific groups. BioScience 27:332-339.
Muir, D.C., R, Wagemann, B.T. Hargrave, D.J. Thomas, D.B. Peakall et R.J. Norstrom. 1995. Spatial trends and historical profiles of organochlorine pesticides in Arctic lake sediments. Science of the Total Environment 160/161:444-457.
Naiman, R.J., C.A. Johnston et J.C. Kelley. 1988. Alteration of North American streams by beaver. Bioscience 39:753-762.
NatureServe. 2015. NatureServe Explorer: An online encyclopedia of life [application Web], version 4.0. NatureServe, Arlington, Virginia. Disponible à http://www.natureserve.org/explorer consulté en juillet 2015.
Newell, P.J. 2013. Winter Ecology of the Rusty Blackbird (Euphagus carolinus). Thèse de doctorat, University of Georgia, Athens, Georgia. 182 pp.
Niven, D.K., J.R. Sauer, G.S. Butcher et W.A. Link. 2004. Christmas Bird Count provides insights into population change in land birds that breed in the boreal forest. American Birds 58:10–20.
Norment, C.J., A. Hall et P. Hendricks. 1999. Important bird and mammal records in the Thelon River Valley, Northwest Territories: range expansions and possible causes. Canadian Field-Naturalist 113:375-385.
Novak, M., 1987. Beaver. pp. 283–312 In: Novak, M., Baker, J.A., Obbard, M.E., Malloch, B. (eds.), Wild Furbearer Management and Conservation in North America. Ontario Trappers Association, Toronto.
Orians, G.H. 1985. Blackbirds of the Americas. University of Washington Press, Seattle.
Parks Canada. 2015. Biotic Web Explorer. Site Web : http://www.pc.gc.ca/apps/bos/bosfieldselection_e.asp?oqqc=aqs [consulté en août 2015]. (Également disponible en français : Parcs Canada. 2015. Explorateur Web Biotics. Site Web : http://www.pc.gc.ca/apps/bos/bosfieldselection_f.asp?oqqc=aqs)
Partners in Flight Science Committee. 2013. Population Estimates Database, version 2013. Site Web : http://rmbo.org/pifpopestimates [consulté en juillet 2015].
Peters, H.S., et T.D. Burleigh. 1951. The Birds of Newfoundland. Houghton Mifflin Co. Boston, MA.
Popko, R., comm. pers. 2014. Technicien de la faune, ministère des Ressources, de la Faune et du Développement économique, gouvernement des Territoires du Nord-Ouest, Norman Wells. Rencontre avec C. Savignac, juillet 2014.
Porvari, P., M. Verta, J. Munthe et M. Haapanen. 2003. Forestry practices increase mercury and methylmercury output from boreal forest catchments. Environmental Science & Technology 37:2389-2393.
Powell, L.L. 2008. Habitat occupancy, status, and reproductive ecology of Rusty Blackbirds in New England. Mémoire de maîtrise, University of Maine, Orono, Maine.
Powell, L.L., T.P. Hodgman et W.E. Glanz. 2010a. Home ranges of Rusty Blackbirds breeding in wetlands: how much would buffers from timber harvest protect habitat? The Condor 112:834–840.
Powell, L.L., T.P. Hodgman, W.E. Glanz, J.D. Osenton et C.M. Fisher. 2010b. Nest-site selection and nest survival of the Rusty Blackbird: does timber management adjacent to wetlands create ecological traps? Condor 112:800–809.
Powell, L.L., T.P. Hodgman, W.E. Glanz, J.D. Osenton et D.M. Ellis. 2010c. A loose colony of Rusty Blackbirds nesting in northern Maine. Northeastern Naturalist 17:639-646.
Powell L.L., T.P. Hodgman, I.J. Fiske et W.E. Glanz. 2014. Habitat occupancy of Rusty Blackbirds (Euphagus carolinus) breeding in northern New England, USA. The Condor 116:122-133.
Price, D.T., R. Alfaro, K. Brown, M. Flannigan, R. Fleming, E. Hogg, M. Girardin, T. Lakusta, M. Johnston et D. McKenney. 2013. Anticipating the consequences of climate change for Canada’s boreal forest ecosystems. Environmental Reviews 21:322-365.
Pyle, P. 1997. Identification Guide to North American Birds. Slate Creek Press, Bolinas, California.
Rich, T.D., C.J. Beardmore, H. Berlanga, P.J. Blancher, M.S.W. Bradstreet, G.S. Butcher, D.W. Demarest, E.H. Dunn, W.C. Hunter, E.E. Iñigo-Elias, J.A. Kennedy, A.M. Martell, A.O. Panjabe, D.N. Pashley, K.V. Rosenberg, C.M. Rustay, J.S. Wendt et T.C. Will. 2004. Partners in Flight North American Landbird Conservation Plan. Cornell Lab of Ornithology. Ithaca, NY. (Également disponible en français : Rich, T.D., C.J. Beardmore, H. Berlanga, P.J. Blancher, M.S.W. Bradstreet, G.S. Butcher, D.W. Demarest, E.H. Dunn, W.C. Hunter, E.E. Iñigo-Elias, J.A. Kennedy, A.M. Martell, A.O. Panjabi, D.N. Pashley, K.V. Rosenberg, C.M. Rustay, J.S. Wendt et T.C. Will. 2008. Plan nord-américain de conservation des oiseaux terrestres de Partenaires d’envol. Environnement Canada. Ottawa (Ont.).)
Riordan, B., D. Verbyla et A.D. McGuire. 2006. Shrinking ponds in subarctic Alaska based on 1950–2002 remotely sensed images. Journal of Geophysical Research, Biogeosciences 111:G04002.
Robinson, S.K., F.R. Thompson, T.M. Donovan, D.R. Whitehead et J. Faaborg. 1995. Regional forest fragmentation and the nesting success of migratory birds. Science 267:1987-1990.
Rooney, R.C., S.E. Bayley and D.W. Schindler. 2012. Oil sands mining and reclamation cause massive loss of peatland and stored carbon. Proceedings of the National Academy of Sciences 109, no. 13 (2012). http://www.pnas.org/content/early/2012/03/06/11176 93108.full.pdf
Rousseu, F., et B. Drolet. 2015. Prediction of the nesting phenology of birds in Canada. In J. Hussell and D. Lepage. 2015. Bird Nesting Calendar Query Tool. Project NestWatch. Bird Studies Canada, URL : http://www.birdscanada.org/volunteer/pnw/rnest/warning.jsp [consulté en juillet 2015]. (Également disponible en français : Rousseu, F., et B. Drolet. 2015. Prédiction de la phénologie de nidification des oiseaux au Canada. Dans J. Hussell et D. Lepage. 2015. Outil de requête des calendriers de nidification. Programme de suivi des nids d’oiseaux. Études d’Oiseaux Canada, site Web : http://www.birdscanada.org/volunteer/pnw/rnest/warning.jsp)
Sauer, J.R., J.E. Hines, J.E. Fallon, K.L. Pardieck, D.J. Ziolkowski, Jr. et W.A. Link. 2014. The North American Breeding Bird Survey, Results and Analysis 1966 - 2012. Version 02.19.2014 USGS Patuxent Wildlife Research Center, Laurel, MD.
Sauer, J.R., S. Schwartz et B. Hoover. 1996. The Christmas Bird Count home page. Version 95.1. Patuxent Wildlife Research Center, Laurel, MD.
Savard, J-P. L., M. Cousineau et B. Drolet. 2011. Exploratory analysis of correlates of the abundance of Rusty Blackbirds (Euphagus carolinus) during fall migration. Ecoscience 18:402-408.
Savard, J.-P.L., B. Drolet et M. Cousineau. 2006. Evidence of a four-year population cycle for the Rusty Blackbird (Euphagus carolinus). Wildlife and Landscape Science Directorate & Canadian Wildlife Service. Presentation to the Rusty Blackbird Working Group. Site Web : http://rustyblackbird.org/wp-content/uploads/0945_Savard_Rusty-Blackbirds_BD-2.pdf. [consulté en août 2015].
Scarl, J. 2013. Rusty Blackbirds 2012: Building Connections for a Declining Species. Vermont Center for Ecostudies. 15 pp.
Scarl, J.C., C. Foss, D. Demarest, K. Heyden et P. Sinclair. 2014. Mobilizing Two Countries for Conservation: Rusty Blackbird Spring Migration. PowerPoint presentation to the Rusty blackbird Working Group at the AOU/COS/SCO Joint Meeting: Recent advances in Rusty Blackbird Research. Estes Park, Colorado. Site Web : http://rustyblackbird.org/wp-content/uploads/Scarl-AOU-2014-Rusties-FINAL-smaller.pdf [consulté en août 2015].
Scheuhammer, A.M., M.W. Meyer, M.B. Sandheinrich et M.W. Murray. 2007. Effects of environmental methylmercury on the health of wild birds, mammals, and fish. Ambio 36:12-19.
Schindler, D.W. 1988. Effects of acid rain on freshwater ecosystems. Science 239:149-239.
Scurr, A. 2013. Mating system and social behavior of Rusty Blackbirds on Yukon Flats National Wildlife Refuge. Mémoire de maîtrise, Humboldt State University. 31 pp.
Shoch, D.T., G. Kaster, A. Hohl et R. Souter. 2009. Carbon storage of bottomland hardwood afforestation in the Lower Mississippi Valley, USA. Wetlands 29:535–542.
Sinclair, P.H., W.A. Nixon, C.D. Eckert et N.L. Hughes. 2003. Birds of the Yukon Territory. UBC Press, Vancouver. 595 pp.
Smith, A.C., M.-A.R. Hudson, C. Downes et C.M. Francis. 2014. Estimating breeding bird survey trends and annual indices for Canada: how do the new hierarchical Bayesian estimates differ from previous estimates? Canadian Field-Naturalist 128:119–134.
Smithsonian Institution. 2015. Smithsonian Migration Bird Center. The Rusty Blackbird Blitz--Year 3. Site Web : http://nationalzoo.si.edu/scbi/migratorybirds/blog/?id=333 [consulté en juillet 2015].
Soykan, C.U., J. Sauer, J.G. Schuetz, G.S. LeBaron, K.Dale et G.M. Langham. 2016. Population trends for North American winter birds based on hierarchical models. Ecosphere 7(5):e01351. 10.1002/ecs2.1351
Spindler, M.A., et B. Kessel. 1980. Avian population and habitat use in interior Alaska taiga. Syesis 13:61-104.
Stewart, D., and D. Chisholm. 1971. Long-term persistence of BHC, DDT and chlordane in sandy loam soil. Canadian Journal of Soil Science 51:379–383.
Stewart, R.L.M., K.A. Bredin, A.R. Couturier, A.G. Horn, D. Lepage, S. Makepeace, P.D. Taylor, M.-A. Villard et R.M. Whittam (eds.). 2015. Second Atlas of Breeding Birds of the Maritime Provinces. Bird Studies Canada, Environment Canada, Natural History Society of Prince Edward Island, Nature New Brunswick, New Brunswick Department of Natural Resources, Nova Scotia Bird Society, Nova Scotia Department of Natural Resources, and Prince Edward Island Department of Agriculture and Forestry, Sackville, NB. 528 + 28 pp. (Également disponible en français : Stewart, R.L.M., K.A. Bredin, A.R. Couturier, A.G. Horn, D. Lepage, S. Makepeace, P.D. Taylor, M.-A. Villard et R.M. Whittam (dir.). 2015. Deuxième atlas des oiseaux nicheurs des Maritimes. Environnement Canada, Études d’Oiseaux Canada, ministère des Ressources naturelles du Nouveau-Brunswick, Natural History Society of Prince Edward Island, Nature NB, Nova Scotia Bird Society, Nova Scotia Department of Natural Resources, et Prince Edward Island Department of Agriculture and Forestry, Sackville (N.-B.). 528 + 28 p.)
Stralberg, D., E.M. Bayne, S.G. Cumming, P. Solymos, S.J. Song et F.K.A. Schmiegelow. 2015a. Conservation of future boreal forest bird communities considering lags in vegetation response to climate change: a modified refugia approach. Diversity and Distributions 1–17.
Stralberg, D., S.M. Matsuoka, A. Hamann, E.M. Bayne, P. Solymos, F.K.A. Schmiegelow, X. Wang, S.G. Cumming et S.J. Song. 2015b. Projecting boreal bird responses to climate change: the signal exceeds the noise. Ecological Applications 25:1112-1128.
Walker, C.H., R.M. Sibly, S.P. Hopkin et D.B. Peakall. 2012. Principles of Ecotoxicology, Fourth Edition. CRC Press. 386 pp.
Wells, J.V. 2011. Boreal forest threats and conservation status. Pp. 1-6 in J.V. Wells (editor). Boreal birds of North America: a hemispheric view of their conservation links and significance. Studies in Avian Biology (no. 41). University of California Press, Berkeley, CA.
Whitaker, D.H., et W.A. Montevecchi. 1999. Breeding bird assemblages inhabiting riparian buffer strips in Newfoundland, Canada. Journal of Wildlife Management 63:167-179.
Wiener, J.G., D.P. Krabbenhoft, G.H. Heinz et A.M. Scheuhammer. 2003. Ecotoxicology of mercury. Pp. 407-461 In D.J. Hoffman, B.A. Rattner, G.A. Burton and J. Cairns (eds.). Handbook of Ecotoxicology, 2nd edition. CRC Press. Boca Raton, Florida.
Wilkes, F.G., et C.M. Weiss. 1971. The accumulation of DDT by the dragonfly nymph, Tetragoneuria. Transactions of the American Fisheries Society 100:222-226.
Wohner, P.N., C.R. Foss, R. Greenberg et R. Cooper. 2014. Rusty Blackbird survivorship and habitat selection during the postfledging period. PowerPoint presentation to the Rusty Blackbird Working Group at the AOU/COS/SCO Joint Meeting: Recent advances in Rusty Blackbird Research. Estes Park, Colorado.
World Health Organization. 1989. DDT and its derivatives: Environmental aspects. Environmental health criteria 83. Geneva.
Yoshikawa, K., et L. Hinzman. 2003. Shrinking thermokarst ponds and groundwater dynamics in discontinuous permafrost. Permafrost Periglacial Process. 14:151-160.
Young, J. E., G. A. Sánchez-Azofeifa, S. J. Hannon et R. Chapman. 2006. Trends in land cover change and isolation of protected areas at the interface of the southern boreal mixedwood and aspen parkland in Alberta, Canada. Forest Ecology and Management 230:151-161.
sommaire biographique du rédacteur du rapport
Carl Savignac est le directeur de Dendroica Environnement et Faune, entreprise d’experts-conseils en écologie des oiseaux qui est spécialisée dans les études concernant la conservation des espèces en péril et des milieux humides et l’évaluation des impacts des projets d’aménagement industriel sur la faune et les espèces en péril aviaires. Monsieur Savignac étudie les oiseaux depuis plus de 25 ans et a mené de nombreuses études de terrain dans plusieurs provinces et territoires du Canada. Il a rédigé divers rapports et publications scientifiques, dont plus d’une douzaine de rapports sur la situation d’espèces aviaires à l’échelle du Canada et du Québec. Enfin, il a dirigé un certain nombre de projets d’intendance visant des espèces en péril dans le sud du Québec, notamment le Pic à tête rouge, la Paruline à ailes dorées, la Paruline azurée, la Paruline du Canada et le Faucon pèlerin.
Annexe A. Calculateur des menaces (version de juin 2016).
Tableau d’évaluation des menaces
- Nom scientifique de l’espèce ou de l’écosystème
- Quiscale rouilleux
- Date
- 30 May 2016
- Évaluateur(s) :
- Carl Savignac, Jon McCracken, Dave Fraser, Jeff Keith, Suzanne Carrière , Kaytlin Cooper, Marcel Gahbauer, Richard Elliot, Pam Sinclair, Bruno Drolet, Alana Westwood, Steven Van Wilgenberg, Karen Timm, Joanna James
| Impact des menaces | Impact des menaces (descriptions) | Comptes des menaces de niveau 1 selon l’intensité de leur impact : Maximum de la plage d’intensité |
Comptes des menaces de niveau 1 selon l’intensité de leur impact : Minimum de la plage d’intensité |
|---|---|---|---|
| A | Très élevé | 0 | 0 |
| B | Élevé | 0 | 0 |
| C | Moyen | 0 | 0 |
| D | Faible | 6 | 6 |
| - | Impact global des menaces calculé : | Moyen | Moyen |
- Commentaires sur l’impact global des menaces
- Comme l’impact global des menaces s’accorde avec la tendance existante, il n’est pas nécessaire d’apporter des changements.
| Menace | Menace | Impact (calculé) | Impact (calculé) | Portée (10 prochaines années) | Gravité (10 ans ou 3 générations) | Immédiateté | Commentaires |
|---|---|---|---|---|---|---|---|
| 1 | Développement résidentiel et commercial | D | Faible | Petite (1-10 %) | Modérée (11-30 %) | Élevée (menace toujours présente) | Élevée (menace toujours présente) |
| 1.1 | Zones résidentielles et urbaines | D | Faible | Petite (1-10 %) | Modérée (11-30 %) | Élevée (menace toujours présente) | Perte et dégradation d’habitat dans l’aire d’hivernage. Concerne seulement l’aire d’hivernage (É.-U.), comme cette menace serait négligeable dans les lieux de reproduction en forêt boréale. L’espèce utilise des zones suburbaines dans son aire d’hivernage, mais la menace est difficile à évaluer sans données additionnelles pour les États-Unis. |
| 1.2 | Zones commerciales et industrielles | cellule vide | Négligeable | Négligeable (< 1 %) | Élevée (31-70 %) | Élevée (menace toujours présente) | Perte et dégradation d’habitat dans l’aire d’hivernage. Les usines, centres commerciaux, etc. n’affectent pas les nicheurs, mais ont une incidence dans les lieux d’hivernage. La gravité est considérée comme élevée parce que l’espèce peut utiliser des zones suburbaines (mais pas des zones industrielles), des aménagements et une expansion industriels/commerciaux considérables étant associés à une expansion urbaine dans le sud-est des États-Unis (cœur de l’aire d’hivernage). |
| 1.3 | Zones touristiques et récréatives | cellule vide | Négligeable | Négligeable (< 1 %) | Élevée (31-70 %) | Élevée (menace toujours présente) | Menace peu probable dans les lieux de reproduction; menace peut-être mineure dans les lieux d’hivernage, mais le tourisme et les activités récréatives vont de pair avec la protection/conservation des habitats naturels de l’espèce (p. ex. pour la chasse et la pêche), ou n’ont pas cours là où les impacts sur l’espèce pourraient être importants. |
| 2 | Agriculture et aquaculture | D | Faible | Grande restreinte (11-70 %) | Légère (1-10 %) | Élevée (menace toujours présente) | Élevée (menace toujours présente) |
| 2.1 | Cultures annuelles et pérennes de produits autres que le bois | D | Faible | Grande – restreinte 11-70 %) | Légère (1-10 %) | Élevée (menace toujours présente) | Perte et dégradation d’habitat dans l’aire d’hivernage. Cette menace concerne les routes migratoires et les lieux d’hivernage, principalement aux États-Unis; ne concerne pas les lieux de reproduction en forêt boréale. Portée : pourrait être une menace importante en raison de la conversion d’habitat naturel à des fins agricoles, et des modifications des terres agricoles et des pratiques existantes, qui ont souvent lieu à cause des changements des prix des produits. La fourchette de valeurs pour la portée reflète le besoin d’information additionnelle pour les États-Unis. Comme l’espèce passe du temps au Dakota du Nord, etc. durant la migration, il faut tenir compte des terres agricoles dans ces régions également. Il manque de données pour la population de l’est du Canada (Manitoba et reste du pays vers l’est). La portée concerne tous les oiseaux exposés aux activités agricoles – tous les individus sont affectés, car tous passent dans des zones agricoles durant la migration. Cependant, la conversion d’habitat naturel à des fins agricoles a moins cours aujourd’hui que dans le passé. Les données du présent rapport de situation montrent que les niveaux de population ont été assez stables au cours des 10 dernières années, après de fortes baisses. Même si la conversion d’habitat n’avait à partir de maintenant que de faibles effets, elle ne serait pas sans impact réel étant donné que l’habitat a déjà été dégradé. |
| 2.2 | Plantations pour la production de bois et de pâte | cellule vide | Négligeable | Négligeable (< 1 %) | Élevée (31-70 %) | Élevée (menace toujours présente) | L’exploitation forestière n’est pas considérée comme étant une menace directe, ses effets étant variés selon les circonstances. La conversion d’habitat naturel en plantations de pins est une menace là où la production de bois et de pâte affecte la disponibilité et la qualité de l’habitat d’hivernage propice à l’espèce, soit dans jusqu’à 1 % de l’aire d’hivernage. Dans ces zones, cette menace peut avoir des impacts graves sur l’espèce. |
| 2.3 | Élevage de bétail | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | Peut concerner les individus en migration dans le centre des États-Unis. Activité non incluse parmi les menaces du fait d’un manque de données justificatives. |
| 2.4 | Aquaculture en mer et en eau douce | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | L’élevage de poissons-chats et d’écrevisses constitue deux formes d’aquaculture qui pourraient avoir des impacts sur les Quiscales rouilleux hivernant dans le sud-est des États-Unis, en raison de l’altération/dégradation d’habitat et des changements associés des régimes hydrologiques. Cependant, dans certains cas, la création de milieux humides faiblement inondés par des élevages d’écrevisses est favorable au Quiscale rouilleux, dans les régions autrement exemptes d’habitat d’hivernage présentant des eaux peu profondes. |
| 3 | Production d’énergie et exploitation minière | D | Faible | Petite (1-10 %) | Élevée (31-70 %) | Élevée (menace toujours présente) | Élevée (menace toujours présente) |
| 3.1 | Forage pétrolier et gazier | D | Faible | Petite (1-10 %) | Élevée (31-70 %) | Élevée (menace toujours présente) | Cette menace ne concerne pas la majorité de la population nicheuse étant donné qu’elle n’existe pas à l’est du Manitoba. Elle serait le plus importante en Alberta, province où l’effectif de l’espèce a été réduit. Cette menace ne comprend que les nouvelles activités de forage, qui seront probablement inexistantes dans les milieux humides boréaux. Le forage ne devrait être pratiqué que dans des sites secs (petite portée). Les lignes sismiques peuvent aussi altérer les écosystèmes du fait des aménagements linéaires et des modifications des régimes de drainage et du pergélisol. Ces lignes peuvent être maintenues et utilisées à d’autres fins une fois leur utilisation sismique terminée. |
| 3.2 | Exploitation de mines et de carrières | cellule vide | Négligeable | Négligeable (< 1 %) | Extrême (71-100 %) | Élevée (menace toujours présente) | Portée négligeable et gravité extrême, les mines à ciel ouvert et l’exploitation des sables bitumineux pouvant avoir un impact local négatif marqué. |
| 3.3 | Énergie renouvelable | cellule vide | Négligeable | Négligeable (< 1 %) | Inconnue | Élevée (menace toujours présente) | La production d’hydroélectricité n’est pas incluse ici. Aucune donnée disponible pour les impacts des parcs éoliens, mais ceux-ci devraient avoir un impact global négligeable à l’échelle de la population. L’impact global est mal connu du fait du manque de données, mais les observations anecdotiques laissent penser que très peu d’individus sont affectés. |
| 4 | Corridors de transport et de service | cellule vide | Négligeable | Généralisée (71-100%) | Négligeable (< 1 %) | Élevée (menace toujours présente) | Élevée (menace toujours présente) |
| 4.1 | Routes et voies ferrées | cellule vide | Négligeable | Généralisée (71-100 %) | Négligeable (< 1 %) | Élevée (menace toujours présente) | Les impacts comprennent la perte d’habitat et les collisions avec des véhicules, qui ne constituent une menace (légère) que dans les lieux d’hivernage, étant donné qu’il y a peu de routes dans les milieux humides où l’espèce se reproduit. |
| 4.2 | Lignes de services publics | cellule vide | Négligeable | Généralisée (71-100 %) | Négligeable (< 1 %) | Inconnue | Plus de 70 % de la population est susceptible de rencontrer des lignes de services, particulièrement en dehors de la période de reproduction. |
| 4.3 | Voies de transport par eau | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 4.4 | Corridors aériens | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 5 | Utilisation des ressources biologiques | D | Faible | Petite (1-10 %) | Extrême (71-100 %) | Élevée (menace toujours présente) | Élevée (menace toujours présente) |
| 5.1 | Chasse et capture d’animaux terrestres | D | Faible | Petite (1-10 %) | Extrême (71-100 %) | Élevée (menace toujours présente) | Comprend les programmes de lutte contre les oiseaux nuisibles (utilisant par exemple des avicides), comme le programme étatsunien de lutte contre les ictérides. Le Quiscale rouilleux a été retiré de la liste des oiseaux pouvant être détruits, ce qui fait que les impacts sont difficiles à évaluer, l’espèce pouvant encore être touchée du fait de son association étroite avec d’autres ictéridés ciblés. Les programmes de lutte existant pour les oiseaux se rassemblant en dortoirs et pour les champs de tournesol et de riz peuvent affecter un grand nombre d’oiseaux, mais il existe peu de données sur la mortalité touchant le Quiscale rouilleux. Les Quiscales rouilleux n’hivernent pas tous dans des régions où sont appliqués des programmes de lutte contre les oiseaux nuisibles. |
| 5.2 | Cueillette de plantes terrestres | cellule vide | cellule vide | cellule vide | cellule vide | Élevée (menace toujours présente) | cellule vide |
| 5.3 | Exploitation forestière et récolte du bois | D | Faible | Petite (1-10 %) | Modérée-légère (1-30 %) | Élevée (menace toujours présente) | Une partie de la forêt boréale et une certaine portion de l’aire d’hivernage sont exposées à cette menace. Les zones riveraines sont habituellement protégées, mais pas toujours (il peut y avoir coupe de récupération après incendie ou destruction de peuplements par des insectes). Des données indiquent que le Quiscale rouilleux utilise les milieux ayant fait l’objet de coupes récentes davantage que les milieux non exploités, mais on manque d’information sur le succès reproducteur de l’espèce dans ces habitats. On a besoin de données pour établir l’effet de l’exploitation forestière sur la reproduction, car il se pourrait que cette activité crée un puits écologique. Les activités d’exploitation forestière commerciale pourraient toucher près de 1 % de la forêt boréale par année. La récolte d’arbres dans les quartiers d’hiver de l’espèce (p. ex. cyprès) pourrait avoir un effet négatif. Davantage d’information est requise concernant l’exploitation forestière aux États-Unis, mais la plupart des activités commerciales de récolte du bois dans le sud-est de ce pays ne devraient pas perturber de façon importante l’intégrité des habitats concernés pour le Quiscale rouilleux. Ces activités commerciales de récolte du bois sont souvent bénéfiques pour l’espèce, étant donné qu’elles laissent les terres boisées dans un état presque naturel, lesquelles pourraient autrement être transformées en vue d’utilisations non compatibles avec l’espèce. Nombre de pratiques de sylviculture des feuillus apportent des améliorations en termes de structure et d’hétérogénéité forestières qui sont favorables à l’espèce. |
| 5.4 | Pêche et récolte de ressources aquatiques | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 6 | Intrusions et perturbations humaines | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 6.1 | Activités récréatives | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 6.2 | Guerre, troubles civils et exercices militaires | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 6.3 | Travail et autres activités | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 7 | Modifications des systèmes naturels | D | Faible | Grande (31-70 %) | Légère (1-10 %) | Élevée (menace toujours présente) | Élevée (menace toujours présente) |
| 7.1 | Incendies et suppression des incendies | cellule vide | Inconnu | Petite (1-10 %) | Inconnue | Élevée (menace toujours présente) | Indépendamment du régime naturel des incendies, la fréquence des feux pourrait être augmentée par les changements climatiques ou d’autres causes d’origine humaine. L’espèce pourrait ne pas être affectée par les incendies de forêt (elle semble nicher dans les milieux humides se trouvant en zones forestières aussi bien incendiées que non incendiées), mais cette menace est incluse ici en raison de la vaste aire de répartition de l’espèce. La gravité des incendies pour l’espèce est inconnue, des recherches supplémentaires étant requises à ce sujet. |
| 7.2 | Gestion et utilisation de l’eau et exploitation de barrages | D | Faible | Grande (31-70 %) | Légère (1-10 %) | Élevée (menace toujours présente) | Ne comprend que les nouveaux aménagements – milieux inondées et endiguées, et sites drainés. Les effets peuvent être positifs ou négatifs, comme les aménagements peuvent créer davantage d’habitat riverain, mais peuvent aussi détruire de petits milieux humides et créer de vastes milieux humides non propices à l’espèce. |
| 7.3 | Autres modifications de l’écosystème | cellule vide | Inconnu | Généralisée (71-100 %) | Inconnue | Élevée (menace toujours présente) | Diverses activités (p. ex. l’exploitation forestière) pourraient causer de vastes modifications à l’échelle des écosystèmes (inondations, sécheresses) se manifestant à des centaines de kilomètres de l’endroit où ces activités ont cours. Les perturbations linéaires (p. ex. lignes sismiques et routes en zone boréale) peuvent constituer des menaces indirectes en changeant le régime hydrologique. Une réduction des insectes proies pourrait avoir lieu du fait de substances toxiques (néonicotinoïdes, mercure, pluie acide), qui peuvent finir par se retrouver dans les milieux humides (dans les routes migratoires et les lieux d’hivernage). Les pluies acides réduisent la quantité de calcium dans les espèces proies (lieux de reproduction). |
| 8 | Espèces et gènes envahissants ou autrement problématiques | cellule vide | Inconnu | Inconnue | Inconnue | Inconnue | cellule vide |
| 8.1 | Espèces exotiques (non indigènes) envahissantes | cellule vide | Inconnu | Inconnue | Inconnue | Inconnue | Il manque de données sur les maladies aviaires. Davantage d’information doit être recueillie concernant l’impact potentiel du virus du Nil occidental. |
| 8.2 | Espèces indigènes problématiques | cellule vide | Inconnu | Inconnue | Inconnue | Inconnue | Des charges de parasites supérieures aux charges attendues pourraient indiquer que les individus subissent des stress, comme un accroissement de la compétition avec d’autres ictéridés dans la forêt boréale en raison de l’expansion de leurs aires de répartition. La prédation par les écureuils roux pourrait augmenter. Les moustiques et les mouches noires pourraient émerger plus tôt au printemps et affecter les oisillons. Les populations de rapaces augmentent depuis l’interdiction du DDT, mais on présume qu’elles s’approchent de leurs niveaux historiques. |
| 8.3 | Matériel génétique introduit | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 9 | Pollution | cellule vide | Faible | Grande – restreinte (11-70 %) | Légère (1-10 %) | Élevée (menace toujours présente) | cellule vide |
| 9.1 | Eaux usées domestiques et urbaines | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 9.2 | Effluents industriels et militaires | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 9.3 | Effluents agricoles et sylvicoles | cellule vide | Faible | Grande – restreinte (11-70 %) | Légère (1-10 %) | Élevée (menace toujours présente) | Ingestion de maïs traité aux pesticides – la majorité de la population est exposée durant la migration et dans les lieux d’hivernage. Néonicotinoïdes – question à examiner dans les lieux d’hivernage – voir la menace 7.3 (Autres modifications de l’écosystème). |
| 9.4 | Déchets solides et ordures | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 9.5 | Polluants atmosphériques | cellule vide | Inconnu | Généralisée - grande (31-100 %) | Inconnue | Élevée (menace toujours présente) | Pollution par le mercure et pluies acides. Des niveaux élevés de mercure sont observés dans la partie est de l’aire de répartition de l’espèce, liés à des niveaux élevés de pluie acide. Le Quiscale rouilleux accumule de fortes concentrations de mercure en mangeant des insectes. |
| 9.6 | Apports excessifs d’énergie | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 10 | Phénomènes géologiques | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 10.1 | Volcans | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 10.2 | Tremblements de terre et tsunamis | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 10.3 | Avalanches et glissements de terrain | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 11 | Changements climatiques et phénomènes météorologiques violents | cellule vide | Inconnu | Généralisée - grande (31-100 %) | Inconnue | Élevée (menace toujours présente) | Élevée (menace toujours présente) |
| 11.1 | Déplacement et altération de l'habitat | cellule vide | Inconnu | Généralisée - grande (31-100 %) | Inconnue | Élevée (menace toujours présente) | L’impact pourrait être plus fort dans le long terme, soit dans plus de10 ans. Les milieux humides vont probablement diminuer, mais de moins de 10 % dans les 10 prochaines années. Le dégel du pergélisol pourrait créer de nouveaux milieux humides, mais dans le nord, les tourbières ombrotrophes deviennent des tourbières minérotrophes, ces dernières n’étant pas propices à l’espèce. Les impacts pourraient comprendre un changement des moments d’émergence des insectes, d’où une désynchronisation d’avec la période de nidification. |
| 11.2 | Sécheresses | cellule vide | Inconnu | Inconnue | Inconnue | Inconnue | Problème qui pourrait affecter l’espèce surtout dans le nord. On a besoin de plus d’information concernant les sécheresses dans les lieux d’hivernage. |
| 11.3 | Températures extrêmes | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 11.4 | Tempêtes et inondations | cellule vide | Inconnu | Inconnue | Inconnue | Inconnue | Risques possibles d’inondation ou de tempêtes de neige tardives affectant les nids, lesquels se trouvent souvent au-dessus ou à proximité de l’eau. |