Tortue peinte de l’Ouest (Chrysemys picta bellii) : évaluation et rapport de situation du COSEPAC 2016

Population de la côte du Pacifique - Menacee
Population intramontagnarde - des Rocheuses - Preoccupante
Population des Prairies / boréale de l'Ouest - Bouclier canadien - Non en péril
Table des matières
- Table des matières
- Sommaire de l’évaluation
- Résumé
- Résumé technique : population de la côte du Pacifique
- Résumé technique : population intramontagnarde – des Rocheuses
- Résumé technique : population des Prairies/boréale de l’Ouest – Bouclier canadien
- Préface
- Description et importance de l’espèce sauvage
- Répartition
- Habitat
- Biologie
- Taille et tendances de la population
- Menaces et facteurs limitatifs
- Protection, statuts et classements
- Remerciements et experts contactés
- Sources d’information
- Sommaire biographique des rédactrices du rapport
- Collections examinées
Liste des figures
- Figure 1. Tortues peintes de l’Ouest (Chrysemys picta bellii) s’exposant au soleil; la dossière (partie dorsale de la carapace) lisse et arrondie est visible. Photo : Evanne Barrett, VAST Resource Solutions.
- Figure 2. Couleur vive et motifs réticulés caractéristiques du plastron (partie ventrale de la carapace) de la tortue peinte de l’Ouest (Chrysemys picta bellii). Photo : Evanne Barrett, VAST Resource Solutions.
- Figure 3. Emplacements (A) et diagramme à barres de STRUCTURE (B), moyenné sur 10 itérations, pour la tortue peinte de l’Ouest dans les localités échantillonnées par Jensen et al. (2014a) en Colombie-Britannique. Les groupes génétiques présentés dans l’image B correspondent à l’étoile de couleur située à côté du nom du groupe, sous le diagramme à barres. À noter que le groupe de la Sunshine Coast (en violet) est formé de deux sites (étoiles) qui sont pratiquement superposés à cette échelle. Voir la figure 4 dans Jensen et al. (2014a) pour une explication exhaustive du diagramme à barres.
- Figure 4. Ensemble des observations signalées de la tortue peinte de l’Ouest (Chrysemys picta bellii) au Canada; la figure indique si les occurrences sont jugées comme étant existantes (présentes naturellement) ou présumées/soupçonnées introduites. Voir le tableau 1 pour les sources des données.
- Figure 5. Aire de répartition mondiale de la tortue peinte (Chrysemys picta). La carte montre quatre sous-espèces reconnues : la tortue peinte de l’Ouest (C. p. bellii) en bleu; la tortue peinte du Centre (C. p. marginata) en orange; la tortue peinte du Sud (C. p. dorsalis) en vert; la tortue peinte de l’Est (C. p. picta) en rouge. Les zones d’intergradation sont indiquées par un mélange de ces couleurs, aux endroits où les aires de répartition des sous-espèces se chevauchent. Source : adaptation de Wikimedia Commons (2014). La carte a été modifiée pour montrer les zones d’intergradation entre les sous-espèces bellii et marginata à l’est du lac Supérieur; l’aire de répartition en Alberta atteint le bassin de la rivière Missouri (Milk); l’aire de répartition en Colombie-Britannique tient davantage compte des occurrences connues.
- Figure 6. Aire de répartition et occurrence de la tortue peinte de l’Ouest (Chrysemys picta bellii) en Alberta, en Saskatchewan, au Manitoba et en Ontario. Les zones ombrées en orange correspondent aux principaux bassins versants (source de la carte : National Hydro Network, 2007). La limite nord de l’aire de répartition dans l’est de la Saskatchewan et au Manitoba à l’ouest du lac Winnipeg est inconnue. Voir le tableau 1 pour les sources des données sur la tortue peinte de l’Ouest en Alberta (symboles verts), en Saskatchewan (symboles bleus) et au Manitoba (symboles orange); Ontario : les cercles violets proviennent de l’atlas des reptiles et des amphibiens de l’Ontario; les cercles roses proviennent de S. Hecnar, données inédites. Les carrés bleus indiquent les occurrences d’intergradation entre le C. p. marginata et le C. p.bellii (S. Hecnar, données inédites).
- Figure 7. Estimation de l’abondance minimale dans les sites occupés par la tortue peinte de l’Ouest de la population de la côte du Pacifique. Petit cercle jaune : < 10 individus; cercle bleu moyen : 10 à 100 individus; grand cercle vert : > 100 individus; carré rouge : disparue. À noter que la taille des populations est caractérisée par une forte incertitude, particulièrement dans l’île de Vancouver, au nord du district régional de la capitale.
- Figure 8. Principales routes en lien avec les occurrences de la tortue peinte de l’Ouest en Colombie-Britannique : A) population de la côte du Pacifique; B) population intramontagnarde – des Rocheuses.
- Figure 9. Principales routes en lien avec les occurrences de la tortue peinte de l’Ouest pour la population des Prairies/boréale de l’Ouest – Bouclier canadien.
Liste des tableaux
- Tableau 1. Sources de données pour la tortue peinte de l’Ouest (Chrysemys picta bellii); mentions par population.
- Tableau 2. Croissance prévue de la population humaine à l’échelle régionale au cours des 26 prochaines années (portée maximale des projections) dans les régions de la Colombie-Britannique où existe la tortue peinte de l’Ouest (Chrysemys picta bellii), divisée par unité désignable. Source : BC Stats (2014).
- Tableau 3. Proportion des effectifs de la tortue peinte de l’Ouest, population de la côte du Pacifique, par région. Les données proviennent du tableau 4. Les limites inférieures et supérieures devraient être considérées avec une très grande prudence, particulièrement dans le cas de l’île de Vancouver et de l’île Saltspring, où peu de sites ont fait l’objet d’études de marquage-recapture.
- Tableau 4. Situation des sites connus de la tortue peinte de l’Ouest, population de la côte du Pacifique, par sous-population (groupe d’observations) et région. Le tableau est adapté et mis à jour d’après le tableau 4 de l’annexe 1 du plan de rétablissement provincial (Western Painted Turtle Recovery Team, 2016). Les numéros de groupe de 1 à 37 correspondent à ceux du document mentionné ci-dessus et comprennent 1 groupe avec habitat de rétablissement seulement (n° 23) et 1 site historique/de rétablissement (n° 5), alors que les numéros de 38 à 41 représentent des groupes/sous-populations supplémentaires (qui ne sont pas dans le plan de rétablissement de 2016).
- Tableau 5. Nombre observé ou estimé de tortues peintes de l’Ouest (TPO) d’après des études récentes sur le terrain de deux unités désignables en Colombie-Britannique. Le nombre minimal d’individus vivants (NMIV) doit être considéré avec prudence, parce qu’il est fondé sur le nombre d’individus observés au cours de relevés (uniques ou répétés) à un moment ou à un autre ou sur le nombre d’individus observés au gré des occasions sans appliquer de correction pour la détectabilité, ou, dans certains cas, dans les basses terres continentales ou la Sunshine Coast, sur des estimations d’après les données de marquage-recapture.
- Tableau 6. Résumé de l’impact des menaces pour chaque population/unité désignable de la tortue peinte de l’Ouest. Voir le tableau 7 pour un résumé selon le niveau d’impact et les annexes 2 à 4 pour les calculateurs des menaces complets.
- Tableau 7. Menaces pesant sur les trois populations de la tortue peinte de l’Ouest (Chrysemys picta bellii), classées selon leur impact.
- Tableau 8. Cotes de conservation de la tortue peinte de l’Ouest selon NatureServe (2016). Les taxons évalués ne sont pas les mêmes selon l’autorité responsable. Des cotes sont attribuées à l’espèce, à la sous-espèce et à la population aux échelles mondiale et nationale. À l’échelle infranationale, des cotes sont attribuées au niveau taxinomique le plus bas.
Liste des annexes
- Annexe 1. Évaluation des menaces pour la tortue peinte de l’Ouest, population de la côte du Pacifique.
- Annexe 2. Évaluation des menaces pour la tortue peinte de l’Ouest, population intramontagnarde – des Rocheuses.
- Annexe 3. Évaluation des menaces pour la tortue peinte de l’Ouest, population des Prairies/boréale de l’Ouest – Bouclier canadien.
Information sur le document
COSEPAC
Comité sur la situation
des espèces en péril
au Canada

COSEWIC
Committee on the Status
of Endangered Wildlife
in Canada
Les rapports de situation du COSEPAC sont des documents de travail servant à déterminer le statut des espèces sauvages que l’on croit en péril. On peut citer le présent rapport de la façon suivante :
COSEPAC. 2016. Évaluation et Rapport de situation du COSEPAC sur la tortue peinte de l'Ouest (Chrysemys picta bellii), population intramontagnarde – des Rocheuses et population des Prairies / boréal de l’Ouest- Bouclier canadien au Canada. Comité sur la situation des espèces en péril au Canada. Ottawa. xxiii + 116 p. (Registre public des espèces en péril site Web).
Rapport(s) précédent(s) :
COSEPAC. 2006. Évaluation et Rapport de situation du COSEPAC sur la tortue peinte de l’Ouest (Chrysemys picta bellii) population de la côte du Pacifique, population intramontagnarde – des Rocheuses et population des Prairies / Boréal de l’Ouest- Bouclier canadien, au Canada. Comité sur la situation des espèces en péril au Canada. Ottawa. vii + 44 p.
Note de production :
Le COSEPAC remercie Ian Adams et Leigh Anne Isaac d’avoir rédigé le rapport de situation sur la tortue peinte de l’Ouest (Chrysemys picta bellii) aux termes d’un marché conclu avec Environnement Canada. La supervision et la révision du rapport ont été assurées par Kristiina Ovaska, coprésidente du sous-comité de spécialistes des amphibiens et des reptiles du COSEPAC.
Pour obtenir des exemplaires supplémentaires, s’adresser au :
Secrétariat du COSEPAC
a/s Service canadien de la faune
Environnement et Changement climatique Canada
Ottawa (Ontario)
K1A 0H3
Tél. : 819-938-4125
Téléc. : 819-938-3984
Courriel : COSEPAC courriel
Site web : COSEPAC
Also available in English under the title COSEWIC Assessment and Status Report on the Western Painted Turtle Chrysemys picta bellii, Pacific Coast population, Intermountain-Rocky Mountain population and Prairie/Western Boreal - Canadian Shield population,in Canada.
Illustration/photo de la couverture :
Tortue peinte de l’Ouest (Chrysemys picta bellii) au nord-est de Cranbrook (Colombie-Britannique); gracieuseté de Ben Meunier.
COSEPAC Sommaire de l’évaluation
Sommaire de l’évaluation – novembre 2016
- Nom commun:
- Tortue peinte de l’Ouest - population de la côte du Pacifique
- Nom scientifique:
- Chrysemys picta bellii
- Statut:
- Menacée
- Justification de la désignation:
- La répartition de cette population chevauche une zone où la population humaine est dense dans le sud-ouest de la Colombie-Britannique, y compris la vallée du bas Fraser, où la perte de milieux humides est considérable. Dans l’ensemble de son aire de répartition, cette population continue de faire face à de multiples menaces résultant de la perte et de l’altération de l’habitat, de la mortalité routière et des espèces introduites, comme les ouaouarons et les tortues introduites. Les relevés effectués au cours des 10 dernières années ont révélé bon nombre de nouvelles localités, amenant le nombre total de plans d’eau occupés à plus de 80, répartis en 39 groupes. Toutefois, la population canadienne et les sous-populations locales sont petites, et nombre d’entre elles, particulièrement dans la vallée du bas Fraser, connaissent un déclin ou sont considérées comme non viables. La persistance à long terme de la population canadienne demeure précaire.
- Répartition:
- Colombie-Britannique
- Historique du statut:
- Espèce désignée « en voie de disparition » en avril 2006. Réexamen du statut : l'espèce a été désignée « menacée » en novembre 2016.
Sommaire de l’évaluation – novembre 2016
- Nom commun:
- Tortue peinte de l’Ouest - population intramontagnarde - des Rocheuses
- Nom scientifique:
- Chrysemys picta bellii
- Statut:
- Préoccupante
- Justification de la désignation:
- Cette population se trouve principalement dans de plus grandes vallées, lesquelles ont connu des pertes considérables de milieux humides et l’altération de l’habitat causée par les activités anthropiques. La population est soupçonnée d’être en déclin en raison de la perte et de la fragmentation continues des habitats ainsi que de la mortalité routière. Le nombre de tortues est probablement faible, et la population pourrait devenir « menacée » si les menaces ne sont ni renversées ni gérées avec une efficacité démontrée.
- Répartition:
- Colombie-Britannique
- Historique du statut:
- Espèce désignée « préoccupante » en avril 2006. Réexamen et confirmation du statut en novembre 2016.
Sommaire de l’évaluation – novembre 2016
- Nom commun:
- Tortue peinte de l’Ouest - population des Prairies / boréale de l'Ouest - Bouclier canadien
- Nom scientifique:
- Chrysemys picta bellii
- Statut:
- Non en péril
- Justification de la désignation:
- Cette population se trouve dans de nombreux plans d’eau situés dans sa vaste aire de répartition. Les déclins locaux ont sans aucun doute été causés par la perte, l’altération et la fragmentation de l’habitat, et ces menaces se poursuivent. Toutefois, il n’y a pas d’indication de déclins généralisés ou de réduction de l’aire de répartition, et les grandes zones d’habitat sont toujours relativement isolées, et les menaces pesant sur elles sont faibles.
- Répartition:
- Alberta, Saskatchewan, Manitoba, Ontario
- Historique du statut:
- Espèce désignée « non en péril » en avril 2006. Réexamen et confirmation du statut en novembre 2016.
COSEPAC Résumé
Tortue peinte de l’Ouest
Chrysemys picta bellii
Description et importance de l’espèce sauvage
La tortue peinte de l’Ouest (Chrysemys picta bellii; Gray, 1831) est une tortue peinte de taille relativement grande; la dossière (partie dorsale de la carapace) des adultes peut atteindre une longueur de 25 cm. Cette sous-espèce possède un plastron (partie ventrale) orange vif distinctif, qui présente aussi un motif complexe de lignes noires réticulées.
Au Canada, la tortue peinte de l’Ouest est présente dans trois grandes régions distinctes, qui correspondent aux unités désignables suivantes : la population de la côte du Pacifique et la population intramontagnarde – des Rocheuses en Colombie-Britannique, et la population des Prairies/boréale de l’Ouest – Bouclier canadien à l’est des Rocheuses. Les populations de tortues peintes de l’Ouest en Colombie-Britannique affichent une forte différenciation génétique, parfois sur de courtes distances. Le présent rapport tient compte de cette différenciation, mais maintient les trois unités désignables établies dans l’évaluation précédente du COSEPAC (COSEWIC, 2006) en raison de considérations relatives au caractère distinct des unités et à l’importance des variations.
Répartition
L’aire de répartition de la population des Prairies/boréale de l’Ouest – Bouclier canadien s’étend depuis la région d’Algoma, dans le nord de l’Ontario, jusqu’au sud-est de l’Alberta, en passant par le sud des Prairies. Son aire de répartition naturelle en Alberta se limite au bassin versant de la rivière Milk, mais il existe de nombreuses sous-populations introduites dont certaines sont bien établies depuis près d’un siècle, voire plus. La population intramontagnarde – des Rocheuses est surtout présente au fond des grandes vallées des chaînes de montagnes qui caractérisent l’intérieur méridional de la Colombie-Britannique. Parmi les centres de population les plus importants, on compte les vallées de la Thompson et de l’Okanagan, le sud du sillon de la région de Kootenay-Est et le sud de la région de Cariboo. La population de la côte du Pacifique est présente dans la vallée du bas Fraser, depuis le secteur de Chilliwack jusqu’au Grand Vancouver, depuis le nord de la Sunshine Coast jusqu’à la rivière Powell au nord, dans l’île Texada et dans certains secteurs de l’île de Vancouver, dont le district régional de la capitale, la région de Nanaimo et la vallée Alberni.
Habitat
La tortue peinte de l’Ouest est dans une très large mesure une espèce aquatique, présente dans les eaux peu profondes des étangs, des lacs, des méandres abandonnés et des marais, ainsi que dans les tronçons à faible débit et les bras morts de cours d’eau. Son habitat comporte généralement un substrat boueux, de la végétation aquatique émergente, des nattes racinaires exposées, des rondins flottants et des rives ouvertes. Les tortues peintes préfèrent les rondins flottants, les branches et d’autres objets émergents pour s’exposer au soleil. L’habitat de nidification se trouve dans les milieux terrestres adjacents à l’habitat aquatique utilisé pour la recherche de nourriture, habituellement à moins de 200 m du plan d’eau, sur des pentes douces orientées vers le sud. La ponte a lieu dans le sol, le sable ou le gravier, dans des sites bien drainés où la couverture végétale est minime ou absente.
Biologie
Les tortues peintes de l’Ouest adultes sont omnivores et s’alimentent de plantes aquatiques, de charogne et de petites proies vivantes dans les eaux peu profondes durant la saison active, soit du printemps à l’automne. Les jeunes tortues tendent à être plus carnivores et s’alimentent d’une variété d’invertébrés et de têtards. Les œufs éclosent à l’automne, mais les nouveau-nés demeurent habituellement dans le nid durant leur premier hiver. Ces derniers peuvent tolérer le gel jusqu’à une température de -10 °C au moins. On considère que les tortues peintes comptent parmi les vertébrés les plus tolérants en conditions d’hypoxie (pauvres en oxygène). La prédation des œufs et des nouveau-nés peut être très élevée. On pense que l’âge des individus à la maturité varie entre 4 à 10 ans chez les mâles et de 6 à 15 ans chez les femelles. La durée d’une génération est estimée à quelque 25 à 30 ans pour la population de la côte du Pacifique et à entre 30 et 40 ans pour la population intramontagnarde – des Rocheuses et la population des Prairies/boréale de l’Ouest – Bouclier canadien.
Taille et tendances de la population
On ne dispose d’aucune estimation précise quant à la taille des trois populations. La population de la côte du Pacifique contient probablement quelque 3 000 adultes ou moins. La population intramontagnarde – des Rocheuses pourrait compter entre 5 000 et 10 000 adultes, tandis que la population des Prairies/boréale de l’Ouest – Bouclier canadien pourrait compter des dizaines de milliers d’adultes. Aucune de ces estimations n’est toutefois fondée sur des méthodes robustes. On peut inférer, d’après les pertes d’habitat, que la population de la côte du Pacifique a subi une baisse par rapport à ses niveaux historiques, mais le pourcentage de ce déclin est inconnu. Grâce à des activités de recherche, le nombre de localités connues a grandement augmenté au cours des dix dernières années. Il est probable que la population intramontagnarde – des Rocheuses ait aussi subi une baisse par rapport à ses niveaux historiques, particulièrement dans la vallée de l’Okanagan, d’après les tendances en matière d’habitat. On ignore quelles sont les tendances en matière de population au sein de la population des Prairies/boréale de l’Ouest – Bouclier canadien, mais des baisses d’effectif sont probables à l’échelle locale.
Menaces et facteurs limitatifs
Les principales menaces qui pèsent sur la tortue peinte de l’Ouest sont la perte et l’altération de l’habitat, ainsi que la mortalité routière. La perte et l’altération de l’habitat découlent de diverses menaces, dont le développement résidentiel et industriel, les activités agricoles associées au drainage ou au remblayage des plans d’eau et le bétail en liberté qui dégrade les plans d’eau. Les tortues sont exposées à la menace de la mortalité routière durant leurs migrations saisonnières, lorsque les femelles se déplacent depuis les cours d’eau jusqu’à leurs aires de nidification en milieu terrestre, et lorsque les mâles et les femelles se dispersent. Parmi les autres menaces qui pèsent sur l’espèce, on compte les espèces envahissantes comme le ouaouaron, qui s’alimente des nouveau-nés dans les zones côtières, ainsi que des plantes qui réduisent la qualité des aires de nidification. Les activités récréatives peuvent aussi perturber les tortues qui s’exposent au soleil ou nidifient. De plus, la conduite de véhicules hors route risque de dégrader les étangs et l’habitat riverain adjacent ou endommager les sites de nidification. Le ruissellement d’eaux polluées peut aussi réduire la qualité de l’eau; parmi les sources de pollution, on compte le ruissellement provenant des fosses septiques agricoles et les polluants industriels. L’impact global des menaces pesant sur la population de la côte du Pacifique a été calculé comme étant « très élevé », celui des menaces pesant sur la population intramontagnarde – des Rocheuses a été calculé comme étant « élevé », et celui des menaces pesant sur la population des Prairies/boréale de l’Ouest – Bouclier canadien a été calculé comme étant « moyen ».
Protection, statuts et classements
Le COSEPAC a évalué la tortue peinte de l’Ouest en 2006 en tenant compte de trois populations : population de la côte du Pacifique – en voie de disparition; population intramontagnarde – des Rocheuses – préoccupante; population des Prairies/boréale de l’Ouest – Bouclier canadien – non en péril. La population de la côte du Pacifique et la population intramontagnarde – des Rocheuses ont été inscrites à l’annexe 1 de la Loi sur les espèces en péril (LEP) selon leurs désignations respectives. Un plan de rétablissement provincial ciblant la population de la côte du Pacifique a été achevé en juin 2016. La délimitation de l’habitat essentiel a été ébauchée, mais cet habitat n’a pas encore été désigné aux termes de la LEP. Aucune mesure de protection précise n’a été adoptée pour la tortue peinte de l’Ouest. L’espèce bénéficie de certaines mesures de planification municipale conçues pour conserver les zones écosensibles et certains plans d’eau, mais ces mesures ont une portée et une application limitées.
Résumé technique : population de la côte du Pacifique
- Nom scientifique :
- Chrysemys picta bellii
- Nom français :
- Tortue peinte de l’Ouest, population de la côte du Pacifique Western Painted Turtle, Pacific Coast Population
- Nom anglais :
- Répartition au Canada : Colombie-Britannique
- Répartition au Canada :
- Colombie-Britannique
Données démographiques
| Éléments du résumé technique | Information |
|---|---|
| Durée d’une génération (généralement, âge moyen des parents dans la population; indiquez si une méthode d’estimation de la durée d’une génération autre que celle qui est présentée dans les lignes directrices de l’UICN [2011] est utilisée). | ~ 25 à 30 ans |
| Y a-t-il un déclin continu [observé, inféré ou prévu] du nombre total d’individus matures? | Oui; déclin inféré et prévu |
| Pourcentage estimé de déclin continu du nombre total d’individus matures sur [cinq ans ou deux générations] | Inconnu. Il est difficile de quantifier tout déclin à cause du manque de données de référence. Le COSEPAC (COSEWIC, 2006) indiquait en 2006 qu’il y avait « probablement moins de 250 adultes ». L’estimation actuelle atteint les milliers d’adultes, mais ce nombre découle de l’amélioration des inventaires, et non d’une augmentation du nombre de tortues. |
| Pourcentage [observé, estimé, inféré ou présumé] [de changement, de réduction ou d’augmentation] du nombre total d’individus matures au cours des [dix dernières années ou trois dernières générations]. | Un déclin inféré ou présumé de > 30 % au cours des 3 dernières générations (75 à 90 ans) est probable en raison de la perte de milieux humides. Dans de grands secteurs de l’aire de répartition de l’espèce (vallée du bas Fraser et Grand Victoria), les pertes ont été de > 70 %. |
| Pourcentage [prévu ou présumé] [de changement, de réduction ou d’augmentation] du nombre total d’individus matures au cours des [dix prochaines années ou trois prochaines générations]. | Un déclin présumé de > 30 % est plausible, d’après les menaces et l’empiètement des zones peuplées dans l’aire de répartition de l’espèce (on s’attend à une croissance de la population humaine de 14,3 % dans les 10 prochaines années). Dans le calculateur des menaces, un impact global « très élevé – élevé » indique un déclin de 50 à 100 % pour un impact « très élevé » ou de 10 à 70 % pour un impact « élevé ». |
| Pourcentage [observé, estimé, inféré ou présumé] [de changement, de réduction ou d’augmentation] du nombre total d’individus matures au cours de toute période de [dix ans ou trois générations] commençant dans le passé et se terminant dans le futur. | Un déclin inféré et présumé de > 30 % est plausible en raison de la perte d’habitat et des menaces continues (voir la 5e case ci-dessus). |
| Est-ce que les causes du déclin sont a) clairement réversibles et b) comprises et c) ont effectivement cessé? |
|
| Y a-t-il des fluctuations extrêmes du nombre d’individus matures? | Non |
Information sur la répartition
| Éléments du résumé technique | Information |
|---|---|
| Superficie estimée de la zone d’occurrence | 19 256 km² (y compris l’océan); 12 483 km2 si l’océan est exclu. |
| Indice de zone d’occupation (IZO) (Fournissez toujours une valeur établie à partir d’une grille à carrés de 2 km de côté). |
528 km² d’après la méthode de la grille de 2 km de côté et les localités connues; un petit nombre de localités non documentées pourraient exister. |
| La population totale est-elle gravement fragmentée, c.-à-d. que plus de 50 % de sa zone d’occupation totale se trouvent dans des parcelles d’habitat qui sont a) plus petites que la superficie nécessaire au maintien d’une population viable et b) séparées d’autres parcelles d’habitat par une distance supérieure à la distance de dispersion maximale présumée pour l’espèce? |
|
| Nombre de localitési (utilisez une fourchette plausible pour refléter l’incertitude, le cas échéant) | >>> 10 Les « localités » peuvent être décrites comme étant les plans d’eau distincts qui abritent actuellement des tortues peintes de l’Ouest, car chacun est exposé à différents ensembles de menaces (n > 80). |
| Y a-t-il un déclin continu [observé, inféré ou prévu] de la zone d’occurrence? | Déclin possible inféré d’après la perte de milieux humides. |
| Y a-t-il un déclin continu [observé, inféré ou prévu] de l’indice de zone d’occupation? | Déclin inféré d’après la perte de milieux humides et prévu d’après les menaces, particulièrement pour les petites populations dans la vallée du Fraser. |
| Y a-t-il un déclin continu [observé, inféré ou prévu] du nombre de sous-populations? | Oui, déclin inféré et prévu d’après les tendances en matière d’habitat et les menaces. Certains sites (plans d’eau) pourraient être en voie de disparaître. |
| Y a-t-il un déclin continu [observé, inféré ou prévu] du nombre de localitési? | Oui, déclin inféré et prévu. Certains plans d’eau comptent très peu d’individus, et la reproduction n’y a pas été observée. |
| Y a-t-il un déclin continu [observé, inféré ou prévu] de [la superficie, l’étendue ou la qualité] de l’habitat? | Oui, déclin observé, inféré et prévu. Une baisse continue de la quantité d’habitat et de la qualité de l’habitat est prévue surtout en raison de l’aménagement urbain et rural continu. |
| Y a-t-il des fluctuations extrêmes du nombre de sous-populations? | Non |
| Y a-t-il des fluctuations extrêmes du nombre de localitési? | Non |
| Y a-t-il des fluctuations extrêmes de la zone d’occurrence? | Non |
| Y a-t-il des fluctuations extrêmes de l’indice de zone d’occupation? | Non |
i (Voir « Définitions et abréviations » sur le site Web du COSEPAC et IUCN 2010 (en anglais seulement) pour obtenir des précisions sur ce terme.)
Nombre d’individus matures (dans chaque sous-population)
| Population : | Nombre d’individus matures |
|---|---|
Sous-population (utilisez une fourchette plausible) : 39 occurrences groupées, chacune pouvant représenter une sous-population, dans les secteurs suivants Vallée du bas Fraser (~ 30 % à 43 % de la population); la plupart des sous-populations sont petites (nombre d’adultes bien inférieur à 100); la population du marécage Nicomen pourrait compter de 300 à 350 adultes. Sunshine Coast/îles Texada et Nelson (~ 35 % à 43 % de la population) : la plupart des sous-populations comptent moins de 100 adultes; une population (baie Garden – lac Ruby) compterait de 355 à 605 adultes; une autre (île Nelson) pourrait en compter de 100 à 400. Vallée Alberni/Nanaimo/îles Gulf (~ 12 % à 16 % de la population) : la taille des sous-populations est inconnue. District régional de la capitale, île de Vancouver (~ 10 % à 11 % de la population) : la plupart des sous-populations sont probablement petites (nombre d’adultes bien inférieur à 100). |
Probablement ~ 3 000 adultes (possiblement moins de 2 500 adultes), mais on ne dispose d’aucune estimation robuste de la population. Le nombre d’individus dans de nombreux sites sur l’île de Vancouver, plus particulièrement, est inconnu. |
Analyse quantitative
| Éléments du résumé technique | Information |
|---|---|
| La probabilité de disparition de l’espèce à l’état sauvage est d’au moins [20 % sur 20 ans ou 5 générations, ou 10 % sur 100 ans] | Analyse non effectuée en raison du manque de données. |
Menaces (réelles ou imminentes pour les populations ou leur habitat, de l’impact le plus élevé à l’impact le plus faible)
| Éléments du résumé technique | Information |
|---|---|
| Menaces à impact élevé-moyen : | espèces et gènes envahissants ou autrement problématiques |
| Menaces à impact moyen et moyen-faible : | développement résidentiel et commercial; corridors de transport et de service; modifications des systèmes naturels |
| Menaces à impact faible : | agriculture et aquaculture; production d’énergie et exploitation minière; utilisation des ressources biologiques; intrusions et perturbations humaines |
| Menaces à impact est inconnu : | pollution; changements climatiques et phénomènes météorologiques violents |
| Un calculateur des menaces a-t-il été rempli pour l’espèce? | Oui, le 27 janvier 2015. Examen final : décembre 2015. |
Immigration de source externe (immigration de l’extérieur du Canada)
| Éléments du résumé technique | Information |
|---|---|
| Situation des populations de l’extérieur les plus susceptibles de fournir des individus immigrants au Canada. | État de Washington : S4S5 Seules les tortues peintes du secteur de la mer des Salish (baie Puget) pourraient fournir des individus immigrants. |
| Une immigration a-t-elle été constatée ou est-elle possible? | Possible dans la vallée du bas Fraser, impossible dans les secteurs de l’île de Vancouver et de la Sunshine Coast. |
| Des individus immigrants seraient-ils adaptés pour survivre au Canada? | Oui |
| Y a-t-il suffisamment d’habitat disponible au Canada pour les individus immigrants? | De l’habitat est actuellement disponible, mais il est en déclin et fragmenté. |
| Les conditions se détériorent-elles au Canadaii? | Dans certains secteurs, oui. |
| Les conditions de la population source se détériorent-elles? | Dans certains secteurs, oui. |
| La population canadienne est-elle considérée comme un puits? | Non |
| La possibilité d’une immigration depuis des populations externes existe-t-elle? | Non. Une immigration naturelle ne pourrait provenir que des tortues de la vallée du bas Fraser, mais elle est peu probable; la région connaît un développement intensif. L’immigration de source externe n’est pas considérée comme étant possible sans intervention humaine dans les régions de l’île de Vancouver et de la Sunshine Coast. |
ii Voir le tableau 3 (Lignes directrices pour la modification de l’évaluation de la situation d’après une immigration de source externe)
Nature délicate de l’information sur l’espèce
| Éléments du résumé technique | Information |
|---|---|
| L’information concernant l’espèce est elle de nature délicate? | Non |
Historique du statut
| Éléments du résumé technique | Information |
|---|---|
| COSEPAC: | Espèce désignée « en voie de disparition » en avril 2006. Réexamen du statut : l’espèce a été désignée « menacée » en novembre 2016. |
Statut et justification de la désignation :
| Éléments du résumé technique | Information |
|---|---|
| Statut : | Menacée |
| Code alphanumérique : | A2ce+3ce+4ce; C2a(i) |
| Justification de la désignation : | La répartition de cette population chevauche une zone où la population humaine est dense dans le sud-ouest de la Colombie-Britannique, y compris la vallée du bas Fraser, où la perte de milieux humides est considérable. Dans l’ensemble de son aire de répartition, cette population continue de faire face à de multiples menaces résultant de la perte et de l’altération de l’habitat, de la mortalité routière et des espèces introduites, comme les ouaouarons et les tortues introduites. Les relevés effectués au cours des 10 dernières années ont révélé bon nombre de nouvelles localités, amenant le nombre total de plans d’eau occupés à plus de 80, répartis en 39 groupes. Toutefois, la population canadienne et les sous-populations locales sont petites, et nombre d’entre elles, particulièrement dans la vallée du bas Fraser, connaissent un déclin ou sont considérées comme non viables. La persistance à long terme de la population canadienne demeure précaire. |
Applicabilité des critères :
| Éléments du résumé technique | Information |
|---|---|
| Critère A (déclin du nombre total d’individus matures) : |
Correspond au critère d’espèce menacée A2ce d’après la perte de milieux humides par le passé, qui est inférée et présumée avoir entraîné une baisse de population de > 30 %. Correspond au critère A3ce en raison d’un déclin présumé de la population d’au moins 30 % fondé sur une combinaison de perte d’habitat, telle qu’inférée d’après la croissance prévue de la population humaine, et des résultats du calculateur de menaces, soit un impact global « très élevé » (déclin de 50 à 100 %) à « élevé » (déclin de 10 à 70 %). Correspond aussi au critère d’espèce menacée A4ce d’après la perte d’habitat passée et future inférée et d’après les déclins présumés découlant de multiples menaces qui, selon les résultats du calculateur de menaces, excèdent probablement 30 %. Le sous-critère c s’applique parce qu’une baisse de l’indice de zone d’occupation, de la zone d’occurrence et/ou de la qualité de l’habitat est inférée ou présumée. Le sous-critère e est un facteur contributif à cause des effets de taxons introduits, principalement le ouaouaron, un prédateur des nouveau-nés, et des tortues introduites, comme la tortue de Floride, qui peut entrer en concurrence avec la tortue peinte de l’Ouest. |
| Critère B (petite aire de répartition, et déclin ou fluctuation) : |
Ne correspond pas au critère. Même si la zone d’occupation et l’indice de zone d’occupation sont inférieurs aux seuils de la catégorie d’espèce menacée, un seul sous-critère (b) est satisfait. |
| Critère C (nombre d’individus matures peu élevé et en déclin) : |
Correspond au critère d’espèce menacée C2a(i) parce qu’il y a un déclin continu inféré et prévu, que la taille de la population est inférieure au seuil de 10 000, et qu’aucune sous-population ne compte plus de 1 000 adultes. Correspond presque au critère d’espèce menacée C2a(i) parce qu’il est plausible que la population compte moins de 2 500 adultes et que la plupart des sous-populations comptent beaucoup moins de 250 adultes; la taille estimée de deux et possiblement trois sous-populations dépasse cependant ce seuil. |
| Critère D (très petite population totale ou répartition restreinte) : |
Ne correspond pas au critère. La population n’est ni très petite ni très restreinte selon la définition du critère. |
| Critère E (analyse quantitative) : |
Ne correspond pas au critère. L’analyse de viabilité de la population n’a pas été effectuée en raison d’un manque de données. |
Résumé technique : population intramontagnarde – des Rocheuses
- Nom scientifique :
- Chrysemys picta bellii
- Nom français :
- Tortue peinte de l’Ouest, population intramontagnarde – des Rocheuses
- Nom anglais :
- Western Painted Turtle, Intermountain – Rocky Mountain Population
- Répartition au Canada :
- Colombie-Britannique
Données démographiques
| Éléments du résumé technique | Information |
|---|---|
| Durée d’une génération (généralement, âge moyen des parents dans la population; indiquez si une méthode d’estimation de la durée d’une génération autre que celle qui est présentée dans les lignes directrices de l’UICN [2011] est utilisée). | 30 à 40 ans |
| Y a-t-il un déclin continu [observé, inféré ou prévu] du nombre total d’individus matures? | Oui, des déclins probables passés sont inférés dans certains secteurs (p. ex. vallée de l’Okanagan) d’après la perte d’habitat; un déclin est prévu d’après les menaces. |
| Pourcentage estimé de déclin continu du nombre total d’individus matures sur [cinq ans ou deux générations] | Inconnu |
| Pourcentage [observé, estimé, inféré ou présumé] [de changement, de réduction ou d’augmentation] du nombre total d’individus matures au cours des [dix dernières années ou trois dernières générations]. | Inconnu |
| Pourcentage [prévu ou présumé] [de changement, de réduction ou d’augmentation] du nombre total d’individus matures au cours des [dix prochaines années ou trois prochaines générations]. | Déclin présumé de 10 % à 70 % (impact des menaces « élevé ») ou de 8 % à 30 % (impact « moyen ») d’après les résultats du calculateur de menaces. |
| Pourcentage [observé, estimé, inféré ou présumé] [de changement, de réduction ou d’augmentation] du nombre total d’individus matures au cours de toute période de [dix ans ou trois générations] commençant dans le passé et se terminant dans le futur. | Inconnu |
| Est-ce que les causes du déclin sont a) clairement réversibles et b) comprises et c) ont effectivement cessé? |
|
| Y a-t-il des fluctuations extrêmes du nombre d’individus matures? | Non |
Information sur la répartition
| Éléments du résumé technique | Information |
|---|---|
| Superficie estimée de la zone d’occurrence | 118 454 km2 |
| Indice de zone d’occupation (IZO) (Fournissez toujours une valeur établie à partir d’une grille à carrés de 2 km de côté). |
Probablement pas
|
| La population totale est-elle gravement fragmentée, c.-à-d. que plus de 50 % de sa zone d’occupation totale se trouvent dans des parcelles d’habitat qui sont a) plus petites que la superficie nécessaire au maintien d’une population viable et b) séparées d’autres parcelles d’habitat par une distance supérieure à la distance de dispersion maximale présumée pour l’espèce? | Probablement pas
|
| Nombre de localitésiii (utilisez une fourchette plausible pour refléter l’incertitude, le cas échéant) | >>> 10 On estime qu’environ 200 plans d’eau abritent des tortues peintes de l’Ouest. Ces plans d’eau correspondent à des localités, car chacun est exposé à un ensemble distinct de menaces. |
| Y a-t-il un déclin continu [observé, inféré ou prévu] de la zone d’occurrence? | Non |
| Y a-t-il un déclin continu [observé, inféré ou prévu] de l’indice de zone d’occupation? | Inconnu, déclin probable inféré d’après la perte de milieux humides. |
| Y a-t-il un déclin continu [observé, inféré ou prévu] du nombre de sous-populations? | Inconnu |
| Y a-t-il un déclin continu [observé, inféré ou prévu] du nombre de localitésiii? | Inconnu |
| Y a-t-il un déclin continu [observé, inféré ou prévu] de [la superficie, l’étendue ou la qualité] de l’habitat? | Inconnu |
| Y a-t-il des fluctuations extrêmes du nombre de sous-populations? | Non |
| Y a-t-il des fluctuations extrêmes du nombre de localitésiii? | Non |
| Y a-t-il des fluctuations extrêmes de la zone d’occurrence? | Non |
| Y a-t-il des fluctuations extrêmes de l’indice de zone d’occupation? | Non |
iii (Voir « Définitions et abréviations » sur le site Web du COSEPAC et IUCN 2010 (en anglais seulement) pour obtenir des précisions sur ce terme.)
Nombre d’individus matures (dans chaque sous-population)
| Sous populations (utilisez une fourchette plausible) Il y a des groupes d’occurrences dans les secteurs suivants : |
Nombre minimum d’individus vivants : |
|---|---|
| Okanagan / Thompson / Nicola | Le nombre de tortues et de plans d’eau abritant des tortues est inconnu. Il y a probablement plus de 100 plans d’eau. Nombre estimé à > 1 500 (incluant probablement des subadultes) dans 13 étangs, dans une étude ciblant le sud de la vallée de l’Okanagan. |
| Creston | Nombre d’adultes estimé à > 200; il y en a probablement plus. |
| Revelstoke | De 160 à 325 adultes et subadultes. |
| Kootenay-Est | Inconnu. Minimum de 41 plans d’eau contenant des tortues; aucun n’a été récemment ciblé par des relevés ou des estimations de la population. |
| Kootenay-Ouest | Inconnu. Minimum de 13 plans d’eau contenant des tortues; aucun n’a été récemment ciblé par des relevés ou des estimations de la population. |
| Lacs Nisconlith / Shuswap | 462 (incluant probablement des subadultes) dans 15 plans d’eau; on sait que plusieurs autres plans d’eau abritent des tortues. |
| Cariboo | Inconnu. Minimum de 30 plans d’eau abritant des tortues; aucun n’a été ciblé par une estimation de la population. |
| Total | Inconnu, mais des milliers; possiblement de 5 000 à 10 000. Il est difficile de distinguer les adultes des subadultes; c’est pourquoi ils sont rarement différenciés. La plupart des rapports fournissent le nombre d’individus observés. Le nombre d’individus dans un plan d’eau donné peut varier entre < 10 et > 100. |
Analyse quantitative
| Éléments du résumé technique | Information |
|---|---|
| La probabilité de disparition de l’espèce à l’état sauvage est d’au moins [20 % sur 20 ans ou 5 générations, ou 10 % sur 100 ans] | Analyse non effectuée en raison du manque de données. |
Menaces (réelles ou imminentes pour les populations ou leur habitat, de l’impact le plus élevé à l’impact le plus faible)
| Éléments du résumé technique | Information |
|---|---|
| Menaces à impact moyen-faible : | corridors de transport et de service |
| Menaces à impact faible : | développement résidentiel et commercial; agriculture et aquaculture; utilisation des ressources biologiques; intrusions et perturbations humaines; modifications des systèmes naturels |
| Menaces à impact inconnu : | espèces et gènes envahissants ou autrement problématiques; pollution; changements climatiques et phénomènes météorologiques violents |
| Un calculateur des menaces a-t-il été rempli pour l’espèce? | Oui, le 27 janvier 2015. Examen final : décembre 2015. |
Immigration de source externe (immigration de l’extérieur du Canada)
| Éléments du résumé technique | Information |
|---|---|
| Situation des populations de l’extérieur les plus susceptibles de fournir des individus immigrants au Canada. | État de Washington : S4S5; Idaho : S4; Montana : S4 |
| Une immigration a-t-elle été constatée ou est-elle possible? | Possible, mais limitée |
| Des individus immigrants seraient-ils adaptés pour survivre au Canada? | Oui |
| Y a-t-il suffisamment d’habitat disponible au Canada pour les individus immigrants? | Oui |
| Les conditions se détériorent-elles au Canadaiv? | Dans certains secteurs de l’UD, oui |
| Les conditions de la population source se détériorent-elles? | Non |
| La population canadienne est-elle considérée comme un puits? | Non |
| La possibilité d’une immigration depuis des populations externes existe-t-elle? | Une recolonisation naturelle en provenance des États-Unis est possible, mais elle serait très lente et s’effectuerait sur de nombreuses générations. |
iv Voir le tableau 3 (Lignes directrices pour la modification de l’évaluation de la situation d’après une immigration de source externe)
Nature délicate de l’information sur l’espèce
| Éléments du résumé technique | Information |
|---|---|
| L’information concernant l’espèce est-elle de nature délicate? | Non |
Historique du statut
| Éléments du résumé technique | Information |
|---|---|
| COSEPAC: | Espèce désignée « préoccupante » en avril 2006. Réexamen et confirmation du statut en novembre 2016. |
Statut et justification de la désignation :
| Éléments du résumé technique | Information |
|---|---|
| Statut : | Préoccupante |
| Code alphanumérique : | Sans objet |
| Justification de la désignation : | Cette population se trouve principalement dans de plus grandes vallées, lesquelles ont connu des pertes considérables de milieux humides et l’altération de l’habitat causée par les activités anthropiques. La population est soupçonnée d’être en déclin en raison de la perte et de la fragmentation continues des habitats ainsi que de la mortalité routière. Le nombre de tortues est probablement faible, et la population pourrait devenir « menacée » si les menaces ne sont ni renversées ni gérées avec une efficacité démontrée. |
Applicabilité des critères :
| Éléments du résumé technique | Information |
|---|---|
| Critère A (déclin du nombre total d’individus matures) : |
Ne correspond pas au critère. Une baisse du nombre d’adultes est inférée d’après la perte d’habitat et la croissance de la population humaine, et présumée d’après les menaces (impact des menaces « élevé » à « moyen », indiquant un déclin de 8 % à 70 % au cours des 3 prochaines générations); il persiste toutefois beaucoup d’incertitude quant à l’ampleur du déclin. |
| Critère B (petite aire de répartition, et déclin ou fluctuation) : |
Ne correspond pas au critère. Même si l’indice de zone d’occupation est inférieur au seuil de la catégorie d’espèce menacée, un seul sous-critère (b) est satisfait. |
| Critère C (nombre d’individus matures peu élevé et en déclin) : |
Ne correspond pas au critère. La taille de la population se situe probablement sous le seuil de la catégorie d’espèce menacée (10 000 adultes), quoiqu’on ne dispose pas d’estimation robuste, et il y a un déclin continu inféré et prévu. Toutefois, de nombreuses sous-populations ne sont pas bien définies, et leur taille est inconnue. Par conséquent, le sous-critère a(i) n’est pas satisfait. |
| Critère D (très petite population totale ou répartition restreinte) : |
Ne correspond pas au critère. La population n’est ni très petite ni très restreinte selon la définition du critère. |
| Critère E (analyse quantitative) : |
L’analyse de viabilité de la population n’a pas été effectuée en raison d’un manque de données. |
Résumé technique : population des Prairies/boréale de l’Ouest – Bouclier canadien
- Nom scientifique :
- Chrysemys picta bellii
- Nom français :
- Tortue peinte de l’Ouest, population des Prairies/boréale de l’Ouest – Bouclier canadien
- Nom anglais :
- Western Painted Turtle, Prairie/Western Boreal – Canadian Shield Population
- Répartition au Canada :
- Alberta, Saskatchewan, Manitoba, Ontario
Données démographiques
| Éléments du résumé technique | Information |
|---|---|
| Durée d’une génération (généralement, âge moyen des parents dans la population; indiquez si une méthode d’estimation de la durée d’une génération autre que celle qui est présentée dans les lignes directrices de l’UICN [2011] est utilisée). | 30 à 40 ans |
| Y a-t-il un déclin continu [observé, inféré ou prévu] du nombre total d’individus matures? | Oui, déclin inféré; certaines baisses ont sans doute eu lieu à l’échelle locale, particulièrement dans les Prairies en raison de la perte d’habitat. |
| Pourcentage estimé de déclin continu du nombre total d’individus matures sur [cinq ans ou deux générations] | Inconnu |
| Pourcentage [observé, estimé, inféré ou présumé] [de changement, de réduction ou d’augmentation] du nombre total d’individus matures au cours des [dix dernières années ou trois dernières générations]. | Inconnu |
| Pourcentage [prévu ou présumé] [de changement, de réduction ou d’augmentation] du nombre total d’individus matures au cours des [dix prochaines années ou trois prochaines générations]. | Réduction présumée de 8 % à 30 % d’après l’impact global « moyen » issu des résultats du calculateur de menaces. La valeur réelle se situe probablement vers la limite inférieure de cette fourchette (< 10 %), d’après la grande répartition des tortues, y compris dans les secteurs isolés. |
| Pourcentage [observé, estimé, inféré ou présumé] [de changement, de réduction ou d’augmentation] du nombre total d’individus matures au cours de toute période de [dix ans ou trois générations] commençant dans le passé et se terminant dans le futur. | Inconnu |
| Est-ce que les causes du déclin sont a) clairement réversibles et b) comprises et c) ont effectivement cessé? |
|
| Y a-t-il des fluctuations extrêmes du nombre d’individus matures? | Non |
Information sur la répartition
| Éléments du résumé technique | Information |
|---|---|
| Superficie estimée de la zone d’occurrence | 449 944 km² |
| Indice de zone d’occupation (IZO) (Fournissez toujours une valeur établie à partir d’une grille à carrés de 2 km de côté). |
1 336 km2 d’après les observations connues; la zone d’occupation réelle est probablement beaucoup plus grande. |
| La population totale est-elle gravement fragmentée, c.-à-d. que plus de 50 % de sa zone d’occupation totale se trouvent dans des parcelles d’habitat qui sont a) plus petites que la superficie nécessaire au maintien d’une population viable et b) séparées d’autres parcelles d’habitat par une distance supérieure à la distance de dispersion maximale présumée pour l’espèce? |
|
| Nombre de localitésv (utilisez une fourchette plausible pour refléter l’incertitude, le cas échéant) | >>> 10 Un millier ou plus de plans d’eau distincts pourraient être occupés, chacun exposé à un ensemble de menaces différent. |
| Y a-t-il un déclin continu [observé, inféré ou prévu] de la zone d’occurrence? | Non |
| Y a-t-il un déclin continu [observé, inféré ou prévu] de l’indice de zone d’occupation? | Non |
| Y a-t-il un déclin continu [observé, inféré ou prévu] du nombre de sous-populations? | Déclin inféré d’après la perte d’habitat; certaines sous-populations locales dans des plans d’eau distincts ont vraisemblablement disparu. |
| Y a-t-il un déclin continu [observé, inféré ou prévu] du nombre de localitésv? | Inconnu |
| Y a-t-il un déclin continu [observé, inféré ou prévu] de [la superficie, l’étendue ou la qualité] de l’habitat? | Inconnu |
| Y a-t-il des fluctuations extrêmes du nombre de sous-populations? | Non |
| Y a-t-il des fluctuations extrêmes du nombre de localitésv? | Non |
| Y a-t-il des fluctuations extrêmes de la zone d’occurrence? | Non |
| Y a-t-il des fluctuations extrêmes de l’indice de zone d’occupation? | Non |
v (Voir « Définitions et abréviations » sur le site Web du COSEPAC et IUCN 2010 (en anglais seulement) pour obtenir des précisions sur ce terme.)
Nombre d’individus matures (dans chaque sous-population)
| Sous populations (utilisez une fourchette plausible) | Nombre d’individus matures |
|---|---|
| Total | Inconnu, mais probablement des dizaines de milliers, d’après la grande répartition des tortues. |
Analyse quantitative
| Éléments du résumé technique | Information |
|---|---|
| La probabilité de disparition de l’espèce à l’état sauvage est d’au moins [20 % sur 20 ans ou 5 générations, ou 10 % sur 100 ans] | Analyse non effectuée en raison du manque de données. |
Menaces (réelles ou imminentes pour les populations ou leur habitat, de l’impact le plus élevé à l’impact le plus faible)
| Éléments du résumé technique | Information |
|---|---|
| Menaces à impact faible : | développement résidentiel et commercial; production d’énergie et exploitation minière; corridors de transport et de service; utilisation des ressources biologiques; intrusions et perturbations humaines; modifications des systèmes naturels. |
| Menaces à impact inconnu : | espèces et gènes envahissants ou autrement problématiques; pollution; changements climatiques et phénomènes météorologiques violents |
| Un calculateur des menaces a-t-il été rempli pour l’espèce? | Oui, le 29 janvier 2015. |
| Examen final : | décembre 2015. |
Immigration de source externe (immigration de l’extérieur du Canada)
| Éléments du résumé technique | Information |
|---|---|
| Situation des populations de l’extérieur les plus susceptibles de fournir des individus immigrants au Canada. | Montana : S4; Dakota du Nord : S5; Minnesota : S5; Wisconsin : SNR; Michigan : S5 |
| Une immigration a-t-elle été constatée ou est-elle possible? | Possible, mais limitée |
| Des individus immigrants seraient-ils adaptés pour survivre au Canada? | Oui |
| Y a-t-il suffisamment d’habitat disponible au Canada pour les individus immigrants? | Oui |
| Les conditions se détériorent-elles au Canadavi? | Non, mais des déclins sont possibles à une échelle locale |
| Les conditions de la population source se détériorent-elles? | Les conditions ne sont pas significativement différentes par rapport au Canada |
| La population canadienne est-elle considérée comme un puits? | Non |
| La possibilité d’une immigration depuis des populations externes existe-t-elle? | Possible, mais limitée d’après les capacités de dispersion limitées des tortues. |
Nature délicate de l’information sur l’espèce
| Éléments du résumé technique | Information |
|---|---|
| L’information concernant l’espèce est-elle de nature délicate? | Non |
Historique du statut
| Éléments du résumé technique | Information |
|---|---|
| COSEPAC: | Espèce désignée « non en péril » en avril 2006. Réexamen et confirmation du statut en novembre 2016. |
Statut et justification de la désignation :
| Éléments du résumé technique | Information |
|---|---|
| Statut : | Non en péril |
| Code alphanumérique : | Sans objet |
| Justification de la désignation : | Cette population se trouve dans de nombreux plans d’eau situés dans sa vaste aire de répartition. Les déclins locaux ont sans aucun doute été causés par la perte, l’altération et la fragmentation de l’habitat, et ces menaces se poursuivent. Toutefois, il n’y a pas d’indication de déclins généralisés ou de réduction de l’aire de répartition, et les grandes zones d’habitat sont toujours relativement isolées, et les menaces pesant sur elles sont faibles. |
Applicabilité des critères :
| Éléments du résumé technique | Information |
|---|---|
| Critère A (déclin du nombre total d’individus matures) : |
Ne correspond pas au critère. Des baisses d’effectifs ont sans doute eu lieu à une échelle locale en raison de la perte, de la modification et de la fragmentation de l’habitat, mais l’ampleur du déclin au sein de l’ensemble de la population canadienne est inconnue; on s’attend à ce qu’elle soit faible (valeurs bien inférieures aux seuils). |
| Critère B (petite aire de répartition, et déclin ou fluctuation) : |
Ne correspond pas au critère. L’IZO calculé est inférieur au seuil de la catégorie d’espèce menacée, mais il est probablement sous-estimé en raison du manque de données dans l’ensemble de l’aire de répartition de la population. En outre, un seul sous-critère (b) est satisfait. |
| Critère C (nombre d’individus matures peu élevé et en déclin) : |
Ne correspond pas au critère. Bien que le nombre d’adultes soit inconnu, il est probable qu’il dépasse grandement les seuils. |
| Critère D (très petite population totale ou répartition restreinte) : |
Ne correspond pas au critère. La population n’est ni très petite ni très restreinte d’après la définition du critère. |
| Critère E (analyse quantitative) : |
L’analyse de viabilité de la population n’a pas été effectuée en raison d’un manque de données. |
Préface
Les nouvelles connaissances recueillies sur la tortue peinte de l’Ouest depuis le rapport de situation du précédent (COSEWIC, 2006) concernent la structure génétique et la répartition des populations de l’espèce en Colombie-Britannique. On connaît maintenant l’ensemble du génome de la tortue peinte de l’Ouest (Shaffer et al., 2013), et les travaux réalisés en Colombie-Britannique ont permis de mieux comprendre la génétique de conservation des sous-espèces (Jensen, 2013; Jensen et al., 2014a). Le nombre de localités connues sur la côte sud-ouest de la Colombie-Britannique, particulièrement dans l’île de Vancouver, a grandement augmenté grâce aux relevés effectués au cours de la dernière décennie. Il demeure toutefois que l’information sur l’espèce est rare à l’est de la Colombie-Britannique, quoique la tortue peinte de l’Ouest fasse désormais l’objet d’un suivi par le gouvernement de l’Ontario à titre d’espèce d’intérêt.
Un programme de rétablissement provincial concernant la population de la côte du Pacifique a été publié, et comprend une ébauche de la délimitation de l’habitat essentiel de l’espèce (Western Painted Turtle Recovery Team, 2016). Un rapport sur les sources de connaissances traditionnelles autochtones (CTA) a par ailleurs été préparé pour la tortue peinte de l’Ouest (Armstrong, 2014). Ce rapport mentionne trois sources possibles d’information sur les tortues en Colombie-Britannique; un seul rapport était disponible.
Historique du COSEPAC
Le Comité sur la situation des espèces en péril au Canada (COSEPAC) a été créé en 1977, à la suite d’une recommandation faite en 1976 lors de la Conférence fédérale-provinciale sur la faune. Le Comité a été créé pour satisfaire au besoin d’une classification nationale des espèces sauvages en péril qui soit unique et officielle et qui repose sur un fondement scientifique solide. En 1978, le COSEPAC (alors appelé Comité sur le statut des espèces menacées de disparition au Canada) désignait ses premières espèces et produisait sa première liste des espèces en péril au Canada. En vertu de la Loi sur les espèces en péril (LEP) promulguée le 5 juin 2003, le COSEPAC est un comité consultatif qui doit faire en sorte que les espèces continuent d’être évaluées selon un processus scientifique rigoureux et indépendant.
Mandat du COSEPAC
Le Comité sur la situation des espèces en péril au Canada (COSEPAC) évalue la situation, au niveau national, des espèces, des sous-espèces, des variétés ou d’autres unités désignables qui sont considérées comme étant en péril au Canada. Les désignations peuvent être attribuées aux espèces indigènes comprises dans les groupes taxinomiques suivants : mammifères, oiseaux, reptiles, amphibiens, poissons, arthropodes, mollusques, plantes vasculaires, mousses et lichens.
Composition du COSEPAC
Le COSEPAC est composé de membres de chacun des organismes responsables des espèces sauvages des gouvernements provinciaux et territoriaux, de quatre organismes fédéraux (le Service canadien de la faune, l’Agence Parcs Canada, le ministère des Pêches et des Océans et le Partenariat fédéral d’information sur la biodiversité, lequel est présidé par le Musée canadien de la nature), de trois membres scientifiques non gouvernementaux et des coprésidents des sous-comités de spécialistes des espèces et du sous-comité des connaissances traditionnelles autochtones. Le Comité se réunit au moins une fois par année pour étudier les rapports de situation des espèces candidates.
Définitions (2016)
- Espèce sauvage
- Espèce, sous-espèce, variété ou population géographiquement ou génétiquement distincte d’animal, de plante ou d’un autre organisme d’origine sauvage (sauf une bactérie ou un virus) qui est soit indigène du Canada ou qui s’est propagée au Canada sans intervention humaine et y est présente depuis au moins cinquante ans.
- Disparue (D)
- Espèce sauvage qui n’existe plus.
- Disparue du pays (DP)
- Espèce sauvage qui n’existe plus à l’état sauvage au Canada, mais qui est présente ailleurs.
-
En voie de disparition (VD)
(Remarque : Appelée « espèce disparue du Canada » jusqu’en 2003.) - Espèce sauvage exposée à une disparition de la planète ou à une disparition du pays imminente.
- Menacée (M)
- Espèce sauvage susceptible de devenir en voie de disparition si les facteurs limitants ne sont pas renversés.
-
Préoccupante (P)
(Remarque : Appelée « espèce en danger de disparition » jusqu’en 2000.) - Espèce sauvage qui peut devenir une espèce menacée ou en voie de disparition en raison de l'effet cumulatif de ses caractéristiques biologiques et des menaces reconnues qui pèsent sur elle.
-
Non en péril (NEP)
(Remarque : Appelée « espèce rare » jusqu’en 1990, puis « espèce vulnérable » de 1990 à 1999.) - Espèce sauvage qui a été évaluée et jugée comme ne risquant pas de disparaître étant donné les circonstances actuelles.
-
Données insuffisantes (DI)
(Remarque :Autrefois « aucune catégorie » ou « aucune désignation nécessaire ».) - Une catégorie qui s’applique lorsque l’information disponible est insuffisante (a) pour déterminer l’admissibilité d’une espèce à l’évaluation ou (b) pour permettre une évaluation du risque de disparition de l’espèce.
Remarque : Catégorie « DSIDD » (données insuffisantes pour donner une désignation) jusqu’en 1994, puis « indéterminé » de 1994 à 1999. Définition de la catégorie (DI) révisée en 2006.
Le Service canadien de la faune d’Environnement et Changement climatique Canada assure un appui administratif et financier complet au Secrétariat du COSEPAC.
Description et importance de l’espèce sauvage
Nom et classification
La tortue peinte (Chrysemys picta; Schneider, 1783) est un membre de la famille des tortues des marais et des étangs, les Émydidés, et représente le seul membre du genre Chrysemys (Ernst, 1971). Au Canada, trois sous-espèces de tortue peinte sont actuellement reconnues : la tortue peinte de l’Ouest(C. p. bellii; Gray, 1831), la tortue peinte du Centre (C. p. marginata; Agassiz, 1857) et la tortue peinte de l’Est(C. p. picta; Schneider, 1783). Une quatrième sous-espèce, la tortue peinte du Sud(C. p. dorsalis; Agassiz, 1857), est présente dans le sud des États-Unis (Ernst et Lovich, 2009). La différenciation entre les sous-espèces est largement fondée sur des caractéristiques morphologiques telles que la taille corporelle ainsi que la couleur et les motifs de la carapace (Ernst et Lovich, 2009). Les études génétiques récentes qui visent la tortue peinte de l’Ouest indiquent qu’il s’agit d’une sous-espèce distincte au sein du complexe C. picta (Jensen et al., 2015).
Description morphologique
La tortue peinte de l’Ouest est une tortue d’eau douce de taille moyenne, la plus grosse sous-espèce de tortue peinte; la carapace des adultes atteint quelque 25 cm de longueur (Matsuda et al., 2006; Ernst et Lovich, 2009). Marchand et al. (2015) ont récemment décrit le plus gros individu documenté du C. picta, une femelle du marais Wascana (Regina, Saskatchewan) dont la longueur mesurée en ligne droite de la carapace atteignait 266 mm et dont le poids était de 2 590 g. Les tortues peintes ont une carapace basse et lisse de coloration foncée (figure 1). Chez les différentes sous-espèces, le plastron (partie ventrale de la carapace) non articulé présente une couleur qui varie entre complètement jaune et orange avec un motif noir réticulé (figure 2). Le plastron de la tortue peinte de l’Ouest est orange vif ou rougeâtre, et une marque foncée longe la ligne médiane ventrale, en s’étendant vers l’extérieur pour former un motif complexe de lignes noires réticulées. La tête, la queue et les membres sont foncés et présentent des bandes jaunes. Les motifs colorés de la carapace et des membres sont présents à tous les stades du cycle vital.
Les femelles adultes tendent à être plus grosses que les mâles. Les mâles possèdent cependant de plus longues griffes sur leurs pattes avant palmées ainsi qu’une queue plus longue et plus large. En outre, l’ouverture cloacale chez le mâle est située plus près de l’extrémité de la queue que la dossière (partie dorsale de la carapace), par rapport à ce que l’on observe chez les femelles (Stebbins, 1966).

Description longue pour la figure 1
Photo de deux tortues peintes de l’Ouest s’exposant au soleil sur des débris ligneux flottants. La dossière est lisse, arrondie et foncée; la tête, la queue et les membres sont foncés et présentent des bandes jaunes.

Description longue pour la figure 2
Photo du plastron d’une tortue peinte de l’Ouest, qui montre sa couleur vive et ses motifs réticulés. Le fond orange vif est divisé par une marque foncée qui longe la ligne médiane ventrale, en s’étendant vers l’extérieur pour former un motif complexe de lignes noires réticulées.
Structure spatiale et variabilité de la populations
On dispose d’information génétique sur les populations présentes en Colombie-Britannique (Jensen et al., 2014a), mais pas sur la population des Prairies/boréale – Bouclier canadien. Compte tenu de l’ampleur de la variation génétique entre les populations en Colombie-Britannique, il est probable que des différences semblables caractérisent la population des Prairies/boréale – Bouclier canadien; elles demeurent toutefois inconnues.
La géographie physique du sud de la Colombie-Britannique présente des obstacles considérables aux déplacements des tortues. La population de la côte du Pacifique est isolée des autres populations à l’est par la chaîne côtière et la chaîne des Cascades. Cette séparation est évidente pour les tortues peintes de l’Ouest qui vivent dans l’ouest de l’État de Washington et en Colombie-Britannique (Barela et Olson, 2014). De même, des montagnes bloquent les déplacements des tortues entre les bassins versants de l’Okanagan et du Columbia (entre la population intramontagnarde et celle des Rocheuses) et au sein de la population des Rocheuses entre le Columbia et le cours inférieur de la Kootenay (vallée de Creston, en Colombie-Britannique, et bassin du cours supérieur de la Kootenay [région du Kootenay-Est]).
À la limite septentrionale de la répartition de la tortue peinte de l’Ouest en Colombie-Britannique, on constate une absence d’occurrences entre la région de Kamloops/rivière Thompson et le sud de la région de Cariboo (plateau de Bonaparte). Les données génétiques (Jensen et al., 2014a) indiquent que les tortues peintes de l’Ouest dans la région de Cariboo sont distinctes par rapport à d’autres populations, mais cette constatation provient d’un échantillon de tortues (n = 24) provenant d’un seul lac à proximité de Williams Lake.
On pense que la limite septentrionale de l’aire de répartition de la tortue peinte est régie par la faible température en hiver et/ou l’anoxie dans les plans d’eau (St. Clair et Gregory, 1990). Malgré ces facteurs, des populations introduites ont persisté bien au nord de la limite de leur aire de répartition naturelle (p. ex., au nord de Grande Prairie ainsi qu’à Edmonton [Alberta], à Saskatoon [Saskatchewan] et à McBride [Colombie-Britannique]). Par conséquent, la limite septentrionale actuelle pourrait être historique et refléter l’expansion de l’aire de répartition de la tortue peinte de l’Ouest à la suite de la glaciation, plutôt qu’être due à l’incapacité des tortues à survivre plus loin au nord (Starkey et al., 2003).
Jensen et al. (2014a) ont recueilli un échantillon de 475 tortues peintes de l’Ouest dans 25 plans d’eau du sud de la Colombie-Britannique (moyenne = 19 tortues par plan d’eau; écart-type = 6,5; fourchette = 6 à 37 individus) et établi le génotype des individus à neuf locus de microsatellites neutres. Ils ont constaté des valeurs significatives de différenciation par paire dans le cadre d’une comparaison entre les différents plans d’eau (voir le tableau 2 dans Jensen et al., 2014a). Six groupes génétiques ont été identifiés : trois le long de la côte sud, un pour la région de Cariboo (d’après un seul plan d’eau), un pour la région de la Thompson et de l’Okanagan (y compris Revelstoke) et un pour la région des Kootenay (figure 3). Les fréquences génotypiques variaient grandement entre les six groupes, et ces derniers expliquent la majeure partie de la variation (d’après une analyse de la variance moléculaire; AMOVA) par rapport au statu quo de deux unités désignables en Colombie-Britannique ou de trois provinces fauniques (Jensen et al., 2014a). Jensen et al. (2014a) ont séquencé la région de contrôle de l’ADN mitochondrial (ADNmt) d’un sous-ensemble des individus susmentionnés et n’ont constaté aucune division profonde. L’haplotype le plus courant se retrouvait dans l’ensemble de l’aire de répartition en Colombie-Britannique. En outre, deux nouveaux haplotypes n’ayant pas encore été détectés dans l’aire de répartition nord-américaine ont été découverts. Un réseau d’haplotypes en forme d’étoile a été reconstruit et n’indique aucune structuration régionale; il concorde toutefois avec la colonisation relativement récente qui a suivi la dernière glaciation, tel qu’avancé par Starkey et al. (2003).
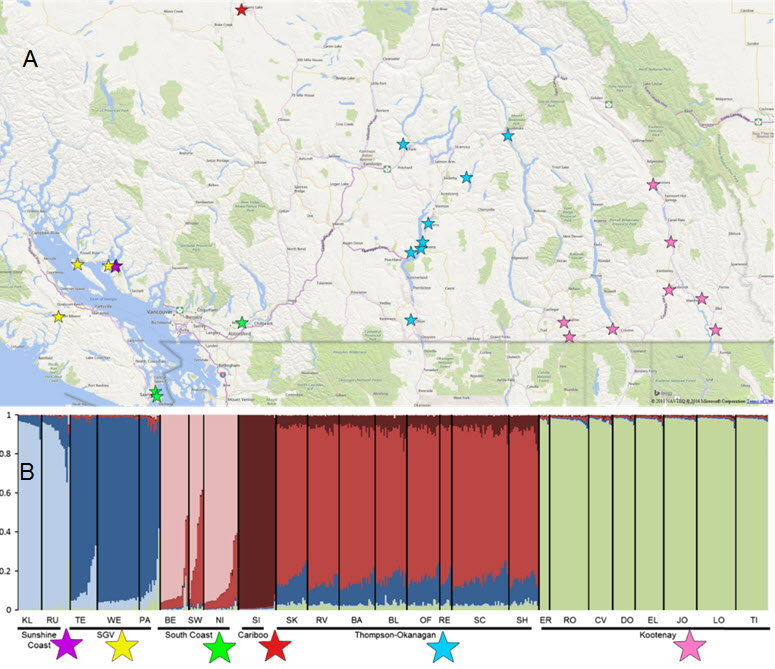
Description longue pour la figure 3
Image composite montrant une carte des emplacements et un diagramme à barres de structure pour la tortue peinte de l’Ouest, d’après l’échantillonnage de Jensen et al. (2014a) en Colombie-Britannique. Les groupes génétiques indiqués dans le diagramme à barres sont représentés par des symboles colorés sur la carte.
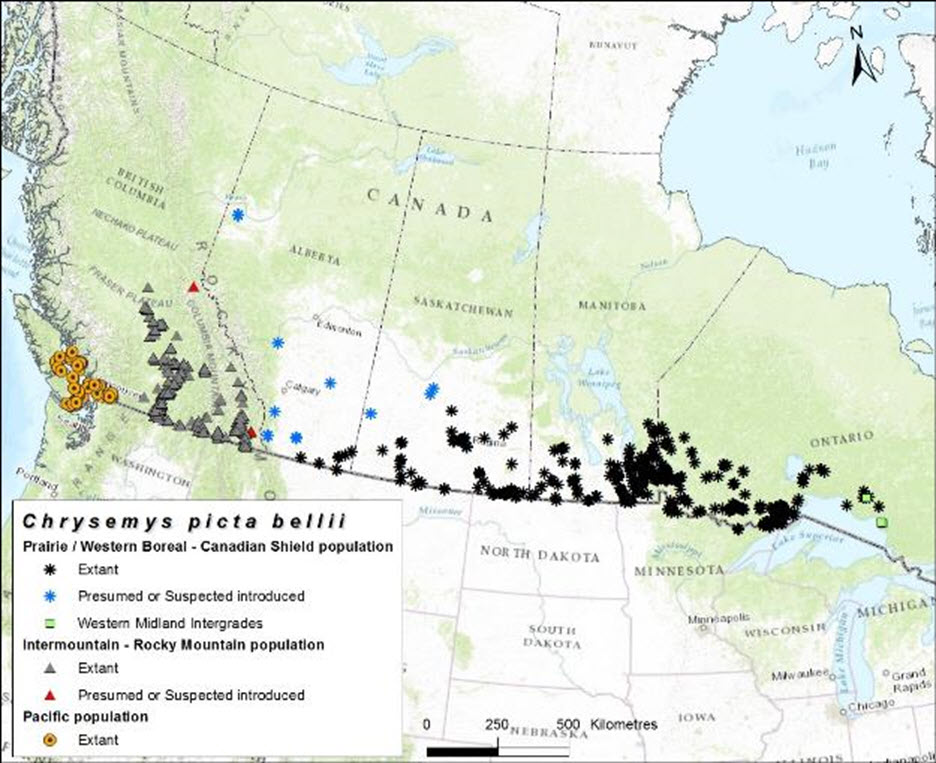
Description longue pour la figure 4
Carte montrant l’ensemble des observations de la tortue peinte de l’Ouest au Canada, indiquant si les occurrences sont jugées comme étant existantes (présentes naturellement) ou présumées/soupçonnées introduites.
Unités désignables
La tortue peinte de l’Ouest a été précédemment évaluée par le COSEPAC comme trois unités désignables (UD), d’après les tendances en matière de répartition et les combinaisons de cinq provinces fauniques d’amphibiens et de reptiles terrestres (COSEWIC, 2013): 1) côte du Pacifique; 2) intramontagnarde et des Rocheuses (combinées); 3) Prairies/boréale de l’Ouest et Bouclier canadien (combinées). Le présent rapport conserve ces trois UD.
Des données génétiques récentes (Jensen et al., 2014a) indiquent que la tortue peinte de l’Ouest présente un degré élevé de variation génétique entre les régions, et il a été avancé que six UD pourraient être justifiées en Colombie-Britannique seulement. Les divisions de Jensen et al. (2014a) sont principalement fondées sur les fréquences génotypiques dans chaque population, d’après des analyses des microsatellites. Les différences sur le plan de la fréquence sont considérées comme étant moins robustes pour satisfaire au critère du caractère distinct entre les UD (COSEWIC, 2013). Il y a aussi peu de données, voire aucune, pour soutenir le critère de l’importance (COSEWIC, 2013). En outre, on ne dispose d’aucune donnée génétique indiquant des adaptations uniques à l’échelle locale parmi les populations de tortues peintes de l’Ouest au Canada, hormis la détection de « nouveaux haplotypes de la région de contrôle » en Colombie-Britannique qui n’ont pas été trouvés ailleurs en Amérique du Nord (Jensen et al., 2014a, p. 269).
Au sein des deux UD en Colombie-Britannique, il n’existe aucune différence significative dans le contexte écologique qui justifierait une division supplémentaire. Les recommandations de Jensen et al. (2014a) sont fondées sur des tortues peintes de l’Ouest provenant d’un nombre limité de plans d’eau (n = 25 de quelque 500 plans d’eau). Elles tiennent compte d’une population de la Sunshine Coast basée sur deux étangs séparés l’un de l’autre par une distance de 5 km (dans les capacités de dispersion des individus). Ces deux populations (lac Ruby et lac Klein) sont génétiquement distinctes de la population du lac West (au sein de leur population putative « Sunshine Coast – île Golfe – milieu de l’île de Vancouver » [SGV]) qui se situe à seulement 10 km de distance, sur l’île Nelson, de l’autre côté du chenal marin Agamemnon d’une largeur de quelque 1,5 km. Les tortues du lac West, cependant, sont génétiquement liées à d’autres tortues de la « SGV » qui sont beaucoup plus isolées (par de grandes étendues d’eau, dont le détroit de Georgia) sur l’île Texada et dans la vallée Alberni. Le fait que les tortues au lac West aient conservé des haplotypes similaires malgré une durée d’isolement inconnue des tortues de l’île Texada et de la vallée Alberni, mais qu’elles soient très différentes des tortues situées à proximité sur la péninsule Sechelt, n’a pas beaucoup de sens sur le plan écologique.
Compte tenu du débat de longue date sur les origines de la tortue peinte de l’Ouest sur la côte de la Colombie-Britannique (p. ex., Storer, 1937; McTaggart Cowan, 1938; Carl, 1952 in Engelstoft et Ovaska, 2008) et de la question à savoir à quel endroit les tortues sont « indigènes » et à quel endroit elles sont introduites, une approche prudente consisterait à rassembler toutes les tortues peintes de la côte sud de la Colombie-Britannique en une seule UD. Même si d’autres divisions pourraient être reconnues à titre d’unités de gestion, on ne dispose pas d’assez d’information à l’heure actuelle pour diviser davantage l’UD.
S’il n’est pas recommandé de diviser la population de la côte du Pacifique d’après une variation génétique démontrée et l’existence d’haplotypes uniques, on ne recommande pas non plus la division des provinces fauniques intramontagnarde et des Rocheuses d’après les mêmes facteurs génétiques. La géographie de l’intérieur de la Colombie-Britannique ne favorise pas la dispersion des tortues entre les principales vallées (p. ex., de la région de Cariboo à celle des Kootenay, en passant par l’Okanagan et le Columbia); c’est pourquoi on s’attend à un certain degré d’isolement entre les tortues dans chacune de ces vallées. Toutefois, il existe une grande similarité écologique dans l’ensemble de l’aire de répartition de l’UD intramontagnarde – des Rocheuses, de la région de Cariboo à la vallée de l’Okanagan, jusqu’à la région de Kootenay-Est. La plupart des tortues sont présentes dans des petits lacs ou étangs situés dans des écosystèmes secs de fond de vallée, habituellement dans les zones biogéoclimatiques intérieure à douglas, à pin ponderosa et à graminées cespiteuses (voir Meidinger et Pojar [1991] et BC Ministry of Forests and Range [non daté] pour des descriptions des zones biogéoclimatiques).
Une division de la population des Prairies/boréale de l’Ouest – Bouclier canadien pourrait être justifiée à l’avenir, à mesure que d’autres données seront recueillies. Ces deux zones écologiques sont distinctes l’une de l’autre, et l’habitat de la tortue peinte de l’Ouest semble être différent dans ces deux zones. En effet, dans les Prairies, l’espèce vit surtout dans des milieux de cours d’eau, notamment dans des lacs en croissant associés à des rivières sinueuses des prairies où le débit est faible (MacCullough et Secoy, 1983a). Dans le Bouclier canadien, on trouve la tortue peinte de l’Ouest dans des petits lacs, milieux humides et étangs à castors ainsi que dans d’autres milieux lentiques; elle évite généralement les cours d’eau où le courant est fort (Ernst et Lovich, 2009), comme beaucoup des cours d’eau du Bouclier canadien. Toutefois, on dispose de très peu d’information sur les tortues peintes de l’Ouest à l’est de la Colombie-Britannique : on manque de données génétiques, et on en sait peu sur la répartition et l’abondance de l’espèce. En outre, il n’y a pas d’écart apparent dans la répartition ou l’occurrence de l’espèce le long de la limite de la zone écologique dans le sud-est du Manitoba (figure 4). Par conséquent, ces populations demeurent groupées en une seule UD dans le présent rapport.
Importance de l’espèce
La tortue peinte de l’Ouest est l’une des deux seules espèces de tortues d’eau douce existantes à l’ouest de l’Ontario. Elle n’a pas de valeur économique directe au Canada, mais elle pourrait jouer un rôle important dans le fonctionnement des écosystèmes aquatiques (p. ex. décomposition de la litière), comme d’autres espèces de tortues (Lindsey et al., 2013).
Au Canada, la tortue peinte de l’Ouest est présente à la limite septentrionale de son aire de répartition géographique (figure 5). On sait que les populations périphériques diffèrent souvent sur le plan génétique par rapport aux populations principales, en raison de pressions de sélection supplémentaires, ce qui leur permet d’occuper des milieux où les conditions sont moins favorables (Safriel et al., 1994; Lesica et Allendorf, 1995). Les populations périphériques peuvent devenir plus adaptées à vivre dans des milieux de transition, et jouent un rôle important dans l’expansion de l’aire de répartition de l’espèce (Lesica et Allendorf, 1995; Frazier et al., 2006) en réaction aux changements du climat (Hickling et al., 2006). Les haplotypes uniques que l’on trouve dans les populations de la tortue peinte de l’Ouest en Colombie-Britannique (Jensen et al., 2014a) soutiennent l’hypothèse voulant qu’il se soit produit une divergence génétique par rapport aux populations les plus centrales, et que cette divergence puisse accroître la valeur de conservation de ces populations périphériques.
La tortue peinte de l’Ouest possède des caractéristiques telles que la détermination environnementale des sexes, la tolérance au gel (chez les nouveau-nés) et la capacité de tolérer des conditions d’extrême anoxie, ce qui en fait un organisme modèle important pour les études physiologiques et génétiques.
Les tortues sont importantes pour les Premières Nations et trois rapports à ce sujet ont été trouvés mais, au moment de la rédaction du présent document, un seul était accessible (Jamieson et al., 2009). Ce rapport mentionne que la tortue peinte de l’Ouest existe sur le territoire de la bande indienne des Shuswap et fournit quelques notes écologiques de base, mais ne contient aucune information pertinente à l’évaluation de la situation de l’espèce.
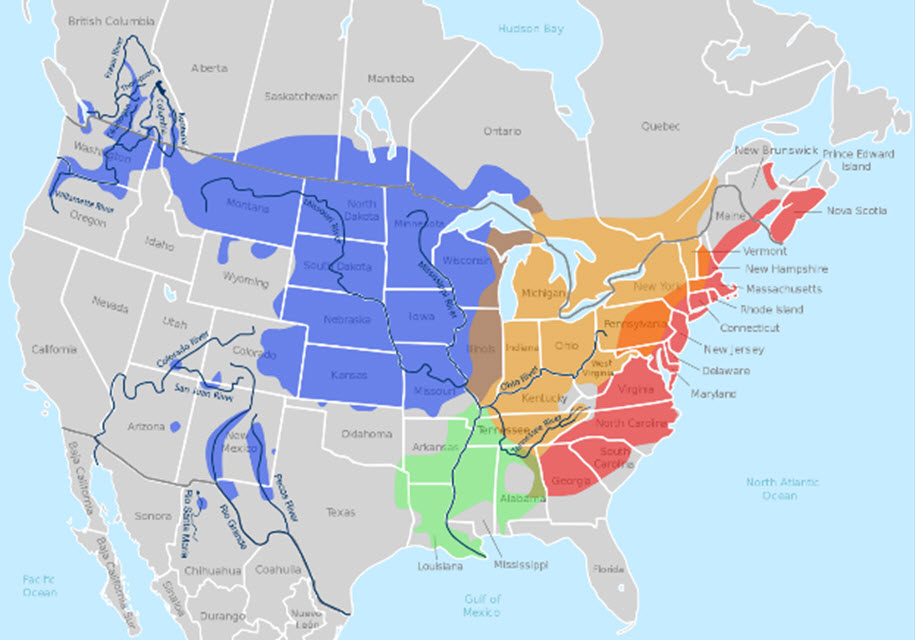
Description longue pour la figure 5
Carte montrant l’aire de répartition mondiale de chacune des quatre sous-espèces reconnues de tortues peintes en Amérique du Nord. À l’échelle de l’espèce, la tortue peinte est présente dans l’ensemble des latitudes moyennes depuis la côte du Pacifique en Colombie-Britannique et dans l’État de Washington jusqu’à la côte de l’Atlantique des États-Unis et jusqu’aux provinces des Maritimes du Canada, à l’est. Au Canada, la sous-espèce de la tortue peinte de l’Ouest est présente dans l’habitat convenable dans la majeure partie de la partie sud des quatre provinces de l’Ouest et de la partie sud du nord-ouest de l’Ontario.
Répartition
Aire de répartition mondiale
Au niveau de l’espèce, le Chrysemys picta est présent dans l’ensemble des latitudes moyennes en Amérique du Nord, depuis la côte du Pacifique en Colombie-Britannique et dans l’État de Washington jusqu’à la côte de l’Atlantique aux États-Unis et aux provinces des Maritimes au Canada (figure 5). Les occurrences naturelles les plus au nord de la tortue peinte de l’Ouest se trouvent dans la région de Cariboo, dans le centre de la Colombie-Britannique (figure 5; voir aussi Ernst et Lovich, 2009).
Des formes intermédiaires de tortue peinte de l’Ouest et de C. p. marginata se trouvent dans la péninsule supérieure du Michigan et dans le district d’Algoma de l’Ontario (Weller et al., 2010); cette intergradation se poursuit vers le sud en Illinois et dans l’est du Missouri (figure 5). L’aire de répartition de la tortue peinte de l’Ouest est plus ou moins contiguë dans l’ensemble des prairies des États-Unis et du sud du Canada, mais devient fragmentée dans le sud-ouest des États-Unis. Des populations isolées sont présentes au Nouveau-Mexique, dans le sud-ouest du Colorado, dans l’Utah et en Arizona, mais on pense que beaucoup d’entre elles sont introduites. On sait qu’il existe une population dans le Chihuahua, dans le nord du Mexique (Dengenhardt et al., 1996). Dans l’ouest, la tortue peinte de l’Ouest est présente dans la majeure partie du Montana, du nord de l’Idaho, du bassin du Columbia dans l’État de Washington et de la vallée de la Willamette en Oregon. La tortue peinte de l’Ouest existe aussi dans la région du Puget Sound, dans le nord-ouest de l’État de Washington; il s’agit du reste de la population de la côte du Pacifique qui existe en Colombie-Britannique.
Aire de répartition canadienne
Au Canada, la tortue peinte de l’Ouest occupe l’habitat convenable dans la majeure partie du sud des quatre provinces de l’ouest et dans la partie sud du nord-ouest de l’Ontario (figure 4). Les sections suivantes décrivent en détail la répartition régionale de chaque population.
Population de la côte du Pacifique
On sait que la tortue peinte de l’Ouest est présente dans plus de 80 plans d’eau distincts. Ces plans d’eau représentent 39 groupesNote1de bas de page d’occurrences ou sous-populations (« unités démographiques ») dans lesquels sont combinés les plans d’eau séparés par une distance permettant normalement ou raisonnablement aux tortues de se déplacer entre eux (Western Painted Turtle Recovery Team, 2016; Engelstoft et Ovaska, données inédites, 2016). Chaque groupe compte de 1 à 13 plans d’eau distincts.
La population de la côte du Pacifique est présente dans l’ensemble de la vallée du bas Fraser en Colombie-Britannique, environ depuis Chilliwack jusqu’à la côte dans le Grand Vancouver. D’autres occurrences se trouvent dans le secteur de la péninsule Sechelt/Sunshine Coast et dans la région de la rivière Powell, au nord-ouest de Vancouver, sur l’île Texada et sur l’île de Vancouver. Dans l’île de Vancouver, la tortue peinte de l’Ouest est présente depuis Sooke jusqu’au centre de la péninsule de Saanich, en passant par la région du Grand Victoria; on compte plusieurs étangs occupés à Nanaimo; un site à proximité de Courtenay; plusieurs plans d’eau dans la vallée Alberni et des observations fortuites entre les secteurs susmentionnés, sur la côte est de l’île. Dans le sud des îles Gulf, la tortue peinte de l’Ouest n’a été trouvée que dans l’île Saltspring.
Le débat à savoir si la tortue peinte de l’Ouest est une espèce indigène sur la côte de la Colombie-Britannique dure depuis des décennies (voir COSEWIC [2006] pour plus de détail). McTaggart Cowan (1938) considère que l’espèce est indigène, et mentionne que des tortues peintes de l’Ouest sont présentes sur l’île Texada, à Pender Harbour (bras de mer et collectivité dans la péninsule Sechelt/Sunshine; il n’est pas question ici de l’île Pender dans le sud des îles Gulf) ainsi que dans « plusieurs petits lacs du district d’Alberni ». En outre, les données génétiques provenant de diverses localités au sein de la population de la côte du Pacifique indiquent un long historique postglaciaire chez la tortue peinte dans la région, ce qui soutient l’hypothèse voulant que l’espèce soit indigène (Jensen, 2013). Cependant, on sait que des tortues peintes ont été déplacées par les humains tant par le passé (McTaggart Cowan, 1936; Carl, 1952) que récemment et, sans analyses génétiques, il est impossible de savoir si des occurrences locales en particulier sont introduites. Jensen (2013) indique que des occurrences de 1 à 3 tortues par plan d’eau pourraient résulter de translocations.
Population intramontagnarde – des Rocheuses
On estime à quelque 200 le nombre de plans d’eau distincts qui abritent des tortues peintes de l’Ouest de la population intramontagnarde – des Rocheuses. Le nombre d’« unités démographiques », qui représente le nombre de plans d’eau interconnectés, tel que défini pour la population de la côte du Pacifique, est inconnu.
À l’est de la chaîne des Cascades et de la chaîne côtière, la tortue peinte de l’Ouest vit surtout au fond des principales vallées, entre les montagnes. Les principales occurrences se trouvent dans la vallée de l’Okanagan, dans la vallée de la Thompson et dans le sud de la région de Cariboo, approximativement depuis 70 Mile House jusqu’à Williams Lake. Dans la région des Kootenay/du Columbia, en Colombie-Britannique, on sait que la tortue peinte de l’Ouest est présente dans la partie sud de la région de Kootenay-Ouest, notamment dans des plans d’eau à proximité de Nelson, de Castlegar, de Trail et de Salmo. On ne dispose d’aucune explication claire sur le plan écologique en ce qui concerne la répartition de la population dans la région de Kootenay-Ouest. Une population importante occupe des étangs dans les milieux humides de la vallée de Creston, le long du cours inférieur de la Kootenay (Isaac, 2016). Dans la région de Kootenay-Est, la tortue peinte de l’Ouest occupe de nombreux plans d’eau dans le sillon des Rocheuses, depuis la frontière des États-Unis au Montana jusqu’à la collectivité de Wasa (Colombie-Britannique), au nord. On compte des mentions isolées dans les milieux humides associés au Columbia entre Invermere et Donald, notamment à Spillamacheen, à Parson (observations de nidification) et à Golden. La plupart des mentions proviennent d’observations effectuées à proximité des milieux humides plutôt que dans les étangs eux-mêmes; ces résultats pourraient toutefois découler du fait que peu de gens accèdent aux étangs des milieux humides du Columbia. Parmi les occurrences apparemment isolées, on compte : Revelstoke, la vallée du cours inférieur de la Kettle (y compris Grand Forks), l’extrémité nord du lac Kootenay, Invermere et Fernie.
D’un point de vue écologique, on peut décrire la répartition de la tortue peinte de l’Ouest comme étant constituée des étangs et des petits lacs convenables à basse altitude dans les sous-zones plus sèches des zones biogéoclimatiques à graminées cespiteuses, à pin ponderosa et intérieure à douglas (Meidinger et Pojar, 1991; BC Ministry of Forests and Range, non daté). La disponibilité de l’habitat donne lieu à une répartition étroite et allongée dans l’ensemble des paysages diversifiés sur le plan écologique de l’intérieur-sud de la Colombie-Britannique.
Population des Prairies/boréale de l’Ouest – Bouclier canadien
La répartition de la tortue peinte de l’Ouest, population des Prairies/boréale de l’Ouest – Bouclier canadien, peut être décrite comme couvrant les principaux bassins versants du sud du pays qui s’écoulent dans les lacs Winnipeg et Winnipegosis, au Manitoba, et dans le lac Supérieur. La plupart des occurrences proviennent du bassin de la Missouri/du Mississippi (y compris le bassin de la rivière Milk) et des bassins des rivières Qu’Appelle, Souris, Assiniboine et Red, dans le sud des provinces des Prairies, qui s’écoulent dans la baie d’Hudson (figure 6). Des mentions fortuites ont été faites au-delà de ces limites, dans la partie sud du bassin de la rivière Saskatchewan (p. ex. ruisseau Swift Current) et dans le centre-est de la Saskatchewan, mais l’espèce est généralement absente de ce bassin. Dans la province faunique du Bouclier canadien, les occurrences proviennent des bassins des rivières Winnipeg, Manitogan, Bloodvein et English, qui s’écoulent dans le lac Winnipeg. Dans le bassin versant des Grands Lacs, les mentions de la tortue peinte de l’Ouest proviennent de la région de Thunder Bay/du lac Nipigon. L’espèce est absente de tout bassin versant du Bouclier canadien qui s’écoule dans la baie d’Hudson. Les limites les plus à l’est de la répartition de la tortue peinte de l’Ouest au Canada se trouvent dans le district d’Algoma, au nord de l’extrémité est du lac Supérieur, dans les bassins des rivières White et Michipicoten. Weller et al. (2010) ont signalé l’existence d’un écart de 130 km entre les mentions de la tortue peinte de l’Ouest et celles de la tortue peinte du Centre dans le district d’Algoma, dans le nord de l’Ontario; les formes intermédiaires documentées se situent surtout dans le parc provincial du lac Supérieur (figure 6).
Le bassin de la rivière Missouri (Milk) représenterait la limite de la répartition de la tortue peinte de l’Ouest en Alberta; cette hypothèse est soutenue par des mentions d’occurrence de la tortue peinte de l’Ouest au Montana qui indiquent que l’espèce est aussi absente du bassin du cours inférieur de la Saskatchewan dans cet État (Montana Field Guide, 2014). La plupart des autres mentions au-delà de ces bassins versants en Alberta (p. ex. parc provincial Moonshine Lake, au nord de Grande Prairie, Rocky Mountain House, Hanna, région de Crowsnest, Lethbridge et parc national du Canada des Lacs-Waterton) et en Saskatchewan (p. ex. lac Pike) sont considérées comme étant des occurrences introduites. Certaines de ces populations pourraient être établies depuis des décennies (Pearson, 2005; Quinlan, comm. pers., 2014; Kendall, comm. pers., 2014; Didiuk, comm. pers., 2014). Par exemple, les tortues au lac Pike, au sud de Saskatoon, pourraient avoir été introduites dès les années 1920, lorsque le secteur était utilisé comme centre de villégiature (Didiuk, comm. pers., 2014). De même, le lac Lees, dans la région de Crowsnest Pass dans le sud-ouest de l’Alberta, abrite des tortues depuis au moins les années 1920 (Pearson, 2005). Certains soupçonnent que ces tortues ont été introduites (Pearson, comm. pers., 2014), mais d’autres les considèrent comme étant indigènes (Quinlan, comm. pers., 2014).
Certaines occurrences de la tortue peinte de l’Ouest dans des ruisseaux du bassin versant du cours inférieur de la Saskatchewan pourraient provenir d’une émigration naturelle. Le ruisseau Swift Current abrite des tortues peintes de l’Ouest dans de nombreuses localités (figure 6), et ces occurrences pourraient très bien être des tortues qui ont naturellement colonisé les lacs en croissant sur cette rivière à partir des bassins versants adjacents du cours supérieur de la rivière Qu’Appelle et/ou de la rivière Frenchman. On ne sait pas exactement où se situe la limite nord de l’aire de répartition de l’espèce au Manitoba et dans l’est de la Saskatchewan. Des tortues peintes de l’Ouest pourraient être présentes au nord, dans la région d’Entre-les-Lacs, et au nord du parc national du Canada du Mont-Riding. Cependant, la seule mention enregistrée dans ces régions provient des terres de la Première Nation de Peguis (figure 6).
Il est difficile d’estimer le nombre de plans d’eau qui soutiennent la tortue peinte de l’Ouest, population des Prairies/boréale de l’Ouest – Bouclier canadien, en raison du manque de relevés. La tortue peinte de l’Ouest n’a fait l’objet d’aucun suivi par les provinces qui abritent cette population (remarque : l’Ontario a entamé un suivi en 2014); c’est pourquoi les données ne sont recueillies que fortuitement, et bon nombre de mentions sont historiques. Les milieux principalement fluviaux utilisés par la tortue peinte de l’Ouest dans les prairies compliquent aussi l’identification des plans d’eau distincts qu’elle utilise. Dans le nord-ouest de l’Ontario, la tortue peinte de l’Ouest pourrait occuper d’innombrables lacs, milieux humides et étangs à castors isolés.
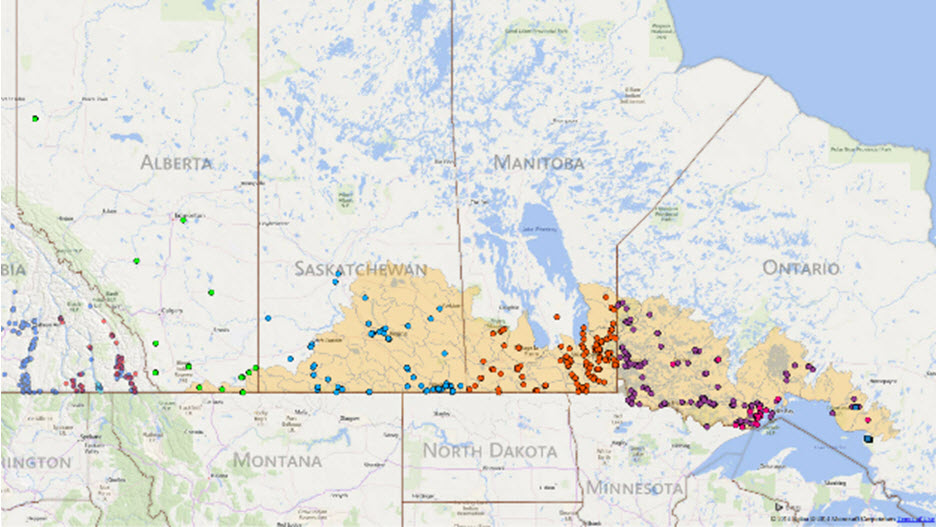
Description longue pour la figure 6
Carte montrant la répartition de la tortue peinte de l’Ouest en Alberta, en Saskatchewan, au Manitoba et en Ontario. (La carte montre aussi une partie de l’aire de répartition de la tortue peinte de l’Ouest en Colombie-Britannique.) Les principaux bassins hydrographiques sont indiqués par les zones ombrées.
Zone d’occurrence et zone d’occupation
La zone d’occurrence pour la population de la côte du Pacifique au Canada est estimée à 19 256 km2 d’après la méthode du plus petit polygone convexe. L’indice de zone d’occupation (IZO) est de 528 km2, d’après la méthode de la grille de 2 km de côté. L’augmentation des activités de recherche donne lieu à la découverte de nouvelles occurrences, en permettant notamment de combler les vides dans la répartition sur la côte est de l’île de Vancouver, mais il est peu probable que l’IZO soit beaucoup plus élevé qu’à l’heure actuelle.
La zone d’occurrence pour la population intramontagnarde – des Rocheuses au Canada est estimée à 118 454 km2 d’après la méthode du plus petit polygone convexe. L’IZO est de 1 176 km2, d’après la méthode de la grille de 2 km de côté. Ces données excluent les sous-populations soupçonnées comme étant introduites à Fernie et à McBride, en Colombie-Britannique. Des occurrences non documentées pourraient exister, ce qui mènerait à une augmentation de l’IZO.
La zone d’occurrence pour la population des Prairies/boréale de l’Ouest – Bouclier canadien au Canada est estimée à 449 944 km2 d’après la méthode du plus petit polygone convexe. L’IZO est de 1 336 km2, d’après la méthode de la grille de 2 km de côté. Cette estimation est fondée sur la cartographie des observations connues, y compris les mentions historiques. L’IZO réel est probablement plus élevé.
Activités de recherche
Les données sur la tortue peinte de l’Ouest proviennent de nombreuses sources, dont : des rapports inédits réalisés aux fins de projets de recherche/suivi (p. ex., Engelstoft et Ovaska, 2008, 2011, 2013 à 2015; Weller, 2009; Ovaska et Engelstoft 2009, 2010, 2012; Hawkes et al., 2013; Isaac, 2014; Jensen et al., 2014a; Tesche, 2014; Engelstoft et Thorpe, 2015), des biologistes professionnels, des centres de données sur la conservation, des atlas des reptiles et des amphibiens et des organismes provinciaux et fédéraux du Canada, notamment Parcs Canada, le Service canadien de la faune et le ministère de la Défense nationale (tableau 1). En plus des demandes officielles de données, un questionnaire a été élaboré et diffusé pour solliciter d’autres renseignements sur la taille des populations, les tendances en matière d’habitat et les menaces à la conservation. Neuf questionnaires remplis ont été reçus, de l’Ontario à la côte de la Colombie-Britannique, et les réponses ont été incorporées aux sections pertinentes du rapport.
| Région | Source des données | Province | Mentiona | Nbre de mentions | Plage de dates |
|---|---|---|---|---|---|
| Population de la côte du Pacifique | Conservation Data Centre de la Colombie-Britannique | C.-B. | Plan d’eau | 93 | Inconnu |
| Population de la côte du Pacifique | Ministère de l’Environnement de la Colombie-Britannique | C.-B. | Individus | 62 | 1931-2015 |
| Population de la côte du Pacifique | Habitat Acquisition Trust | C.-B. | Plan d’eau | 30 | 2008-2015 |
| Population intramontagnarde – des Rocheuses | Conservation Data Centre de la Colombie-Britannique | C.-B. | Plan d’eau | 35 | Inconnu |
| Population intramontagnarde – des Rocheuses | Ministère de l’Environnement de la Colombie-Britannique | C.-B. | Individus | 585 | 1932-2016 |
| Population intramontagnarde – des Rocheuses | Experts régionauxb | C.-B. – Kootenay | Plan d’eau | 58 | 2016 |
| Population intramontagnarde – des Rocheuses | Creston Turtle Project (Isaac, 2016) |
C.-B. – Kootenay |
Plan d’eau | 26 | 2013-2015 |
| Population des Prairies/boréale de l’Ouest – Bouclier canadien | Fisheries and Wildlife Management Information System de l’Alberta | Alb. | Individus | 56 | 1975-2012 |
| Population des Prairies/boréale de l’Ouest – Bouclier canadien | Conservation Data Centre de la Saskatchewan | Sask. | Individus | 128 | 1913-2014 |
| Population des Prairies/boréale de l’Ouest – Bouclier canadien | Manitoba Herps Atlas (2014) | Man. | Individus | 200 | 1989-2014 |
| Population des Prairies/boréale de l’Ouest – Bouclier canadien | Atlas des reptiles et des amphibiens de l’Ontario (Ontario Nature), par l’entremise du Centre d’information sur le patrimoine naturel de l’Ontario | Ont. | Individus | 224 | 1924-2012 |
| Population des Prairies/boréale de l’Ouest – Bouclier canadien | S. Hecnar, données inédites | Ont. | Individus | 28 | 2006-2011 |
a Indique si les données concernent des « individus » (mention d’un individu ou de multiples observations de tortues à un même endroit) ou un « plan d’eau » (mention d’un étang, d’un lac, d’un milieu humide ou d’un cours d’eau soutenant une population de tortues peintes de l’Ouest de taille indéterminée).
b A. Dzilums, comm. pers., 2014.; L. Halverson, comm. pers., 2014.; M. Machmer, comm. pers., 2014.; P. Ohanjanian, comm. pers., 2014.; L-A. Walker, comm. pers., 2014.
| Région | 2015 | 2025 | % hausse sur 10 ans | 2041 | % hausse sur 26 ans |
|---|---|---|---|---|---|
| Côte du Pacifique | 20 932 | 22 756 | 8,7 % | 25 106 | 19,9 % |
| Côte du Pacifique | 29 918 | 33 741 | 12,8 % | 39 113 | 30,7 % |
| Côte du Pacifique | 294 008 | 337 141 | 14,7 % | 399 752 | 36,0 % |
| Côte du Pacifique | 2 505 357 | 2 877 627 | 14,9 % | 3 407 191 | 36,0 % |
| Côte du Pacifique | 377 535 | 420 006 | 11,2 % | 471 729 | 24,9 % |
| Côte du Pacifique | 31 181 | 32 617 | 4,6 % | 34 258 | 9,9 % |
| Côte du Pacifique | 3 258 931 | 3 723 888 | 14,3 % | 4 377 149 | 34,3 % |
| Intramontagnarde – des Rocheuses | 63 212 | 65 338 | 3,4 % | 66 246 | 4,8 % |
| Intramontagnarde – des Rocheuses | 133 141 | 144 657 | 8,6 % | 157 358 | 18,2 % |
| Intramontagnarde – des Rocheuses | 83 170 | 91 611 | 10,1 % | 103 259 | 24,2 % |
| Intramontagnarde – des Rocheuses | 190 388 | 224 890 | 18,1 % | 276 858 | 45,4 % |
| Intramontagnarde – des Rocheuses | 82 218 | 88 280 | 7,4 % | 95 134 | 15,7 % |
| Intramontagnarde – des Rocheuses | 30 740 | 30 758 | 0,1 % | 29 857 | -2,9 % |
| Intramontagnarde – des Rocheuses | 59 378 | 62 100 | 4,6 % | 64 909 | 9,3 % |
| Intramontagnarde – des Rocheuses | 57 779 | 60 249 | 4,3 % | 61 843 | 7,0 % |
| Intramontagnarde – des Rocheuses | 700 026 | 767 883 | 9,7 % | 855 464 | 22,2 % |
Habitat
Besoins en matière d’habitat
La tortue peinte de l’Ouest est dans une très large mesure une espèce aquatique, présente dans les eaux peu profondes des étangs, des lacs, des méandres abandonnés et des marais, ainsi que dans les tronçons à faible débit et les bras morts de cours d’eau. L’habitat optimal de la tortue peinte de l’Ouest présente des substrats boueux accompagnés de végétation aquatique émergente, de mattes de quenouilles (Typha sp.) exposées, de rondins flottants et de rives ouvertes (Matsuda et al., 2006). Les tortues peintes préfèrent les rondins flottants, les branches et d’autres objets émergents qui se trouvent à proximité du rivage ou en eaux plus profondes pour s’exposer au soleil (Nussbaum et al., 1983; Macartney et Gregory, 1985).
La plupart des activités saisonnières, comme l’alimentation, l’exposition au soleil et l’accouplement, sont généralement effectuées hors de l’eau (Matsuda et al., 2006). L’espèce passe très peu de temps en milieu terrestre; elle se limite à de brèves excursions durant la période de nidification de l’été et à des déplacements occasionnels de dispersion terrestre entre les plans d’eau, particulièrement lorsque les étangs s’assèchent (McAuliffe, 1978).
Pour nidifier, les femelles choisissent des parcelles exposées de sol, de sable ou de gravier souvent situées en bordure des champs, des pâturages, des plages ou des accotements routiers, là où il est possible pour elles de creuser (Nussbaum et al., 1983; Matsuda et al., 2006). Les sols dans les sites de nidification doivent être bien drainés, présenter des couches superficielles meubles et des couches de sous-sol assez compactes, et être composés d’un mélange de gravier, de limon et de sable à granulométrie faible à moyenne et à faible teneur en matière organique (Macartney et Gregory, 1985). Des pentes douces et chaudes (orientées vers le sud) ainsi qu’un étage dominant d’arbustes clairsemés sont nécessaires (Schwarzkopf et Brooks 1987; Refsnider et al., 2013). La plupart des nids sont situés à moins de 200 m du plan d’eau; certaines rares mentions ont toutefois été faites jusqu’à 600 m (Ernst et Lovich, 2009).
Les plans d’eau et cours d’eau utilisés par la tortue peinte de l’Ouest semblent quelque peu différents dans la partie des Prairies de la province faunique des Prairies/boréale de l’Ouest. Si ailleurs les tortues se rencontrent principalement dans des plans d’eau généralement petits et à débit minime, comme des étangs, des petits lacs ou des marécages (St. Clair et Gregory, 1990; Basaraba, 2014; Isaac, 2014; Tesche, 2014), dans les Prairies, la tortue peinte de l’Ouest utilise surtout des milieux fluviaux ou des lacs en croissant liés à des rivières (MacCulloch et Secoy, 1983b; Watkins, comm. pers., 2014). Très peu de mentions, voire aucune, proviennent de milieux humides naturels des prairies. La grande bibliothèque de recherche de l’Institute for Wetland and Waterfowl Research, qui est axée sur les milieux humides des prairies, ne contient aucune mention de tortues (Glass, comm. pers., 2014), ce qui laisse croire qu’elles sont à tout le moins peu communes dans les milieux humides typiques des cuvettes des prairies. Bon nombre de ces milieux humides s’assèchent au cours des mois d’été et/ou gèlent en hiver; chacune de ces situations serait mortelle pour la tortue peinte de l’Ouest. En outre, beaucoup de lacs qui ne sont pas éphémères présentent des concentrations élevées de sel qui seraient intolérables pour les tortues.
Les cours d’eau des Prairies sont souvent décrits comme étant calmes, sinueux et lents (MacCullough et Secoy, 1983a); ces conditions sont idéales pour les tortues peintes, qui tendent à éviter les plans d’eau agités (Ernst et Lovich, 2009). L’eau y est assez profonde pour éviter l’assèchement ou le gel, et le débit y est assez élevé pour que les concentrations de sel demeurent basses et pour que les tortues disposent de suffisamment de ressources.
Tendances en matière d’habitat
Population de la côte du Pacifique
Le développement urbain et agricole continu, particulièrement dans la vallée du bas Fraser et dans le sud de l’île de Vancouver, réduira vraisemblablement la quantité d’habitat et la qualité de l’habitat disponible pour la tortue peinte de l’Ouest. L’habitat essentiel se trouve souvent en parcelles isolées au sein des paysages modifiés par les humains. Les prévisions en matière de population humaine indiquent une croissance considérable au cours des prochaines périodes de 10 et de 26 ans (portée maximale des projections démographiques; tableau 2) dans la région de la côte sud de la Colombie-Britannique, où la tortue peinte de l’Ouest est présente. L’augmentation de la densité de la population humaine risque fortement d’accroître les pressions découlant du développement, de la construction de routes et de la circulation routière, ce qui donnera lieu à des problèmes d’isolement de l’habitat et de déplacement pour la tortue peinte de l’Ouest.
En 1990, dans la vallée du bas Fraser, il ne restait qu’environ 1 % des milieux humides d’origine (par rapport à ce que l’on trouvait avant la colonisation en 1820), tandis que la superficie des terres urbaines et agricoles avait augmenté pour couvrir 26 % du paysage du bassin (Boyle et al., 1997). Dans le delta du Fraser, quelque 70 % des milieux humides d’origine ont été modifiés par la construction de digues et l’adoption de plans de drainage (Habitat Group, 1978). Les milieux humides visés comprennent pratiquement tous les prés humides saisonniers et 84,6 % des tourbières (Butler et Campbell, 1987). Les milieux humides du lac Sumas (autrefois parmi les plus productifs en Amérique du Nord) ont été drainés aux fins de l’agriculture dans les années 1920 (Environnement Canada, 1992). Après la Deuxième Guerre mondiale, plus de 2 800 hectares ont été endigués et drainés entre le lac Pitt et la rivière Pitt, ce qui a donné naissance au site de Pitt Polder, un secteur de basses terres converties pour l’agriculture par l’endigage et le drainage. Des parties du lac Cheam, du Pitt Polder et du lac Hatzic ont aussi été drainées.
Les pertes de milieux humides se poursuivent depuis 1990. Entre 1989 et 1999, un milieu humide sur cinq dans les basses terres du Fraser a été détruit par l’empiètement des milieux urbains et agricoles; le quart des milieux humides restants ont subi une perte de superficie supplémentaire de 5 à 15 % (Moore et al., 2003). Entre 1989 et 2009, 1 352 ha de la superficie initiale de milieux humides de 29 448 ha (4,6 %) ont été perdus (Major et al., 2009). On ignore combien de ces milieux humides pourraient avoir abrité la tortue peinte de l’Ouest. Les principales causes de la perte de milieux humides naturels sont : l’agriculture (surtout la production de canneberges et d’autres baies; 43 %), les terrains de golf (18 %), la construction domiciliaire (15 %) et les décharges (11 %). Ensemble, ces facteurs sont responsables de 87 % de la perte observée de milieux humides (Major et al., 2009).
Sur l’île de Vancouver, l’habitat de la tortue peinte de l’Ouest a été particulièrement touché dans le secteur du Grand Victoria et le long de la côte est. Environ 70 % des milieux humides d’origine ont été perdus dans la « région de Victoria » (qui correspond probablement au Grand Victoria) (Wetland Stewardship Partnership, 2010). Du côté est de l’île de Vancouver et des îles Gulf, seul 1,7 % du territoire était couvert par des milieux humides naturels en 1992 (la couverture initiale est inconnue), et il s’est produit une perte de milieux humides de l’ordre de 2 % de 1992 à 2002 d’après l’interprétation de photos aériennes (Wetland Stewardship Partnership, 2010).
L’aménagement urbain et la construction de grands réseaux routiers ont fragmenté l’habitat convenable, et celui-ci a été dégradé davantage par l’introduction d’espèces exotiques (Ovaska et Engelstoft, 2012). Dans la vallée Alberni, l’habitat se trouve dans des terres visées par l’exploitation forestière. Les milieux humides, particulièrement les étangs à eaux peu profondes que préfère la tortue peinte de l’Ouest, sont peu abondants dans le sud-est de l’île de Vancouver (Ward et al., 1998); sur l’île, la tortue peinte de l’Ouest n’a été trouvée que dans (13 %) de 245 plans d’eau examinés entre 2008 et mai 2016 (Engelstoft et Ovaska, 2008, 2011, 2013 à 2015; Ovaska et Engelstoft, 2009, 2010, 2012; Engelstoft et Thorpe, 2015; Engelstoft, données inédites, 2016), ce qui indique une répartition éparse. Par contre, la tortue de Floride (Trachemys scripta) a été trouvée dans 54 (22 %) des plans d’eau, ce qui laisse croire qu’au moins certains des plans d’eau non occupés par la tortue peinte de l’Ouest offraient un habitat convenable. On ne dispose d’aucune estimation de la perte historique de milieux humides dans le sud de l’île de Vancouver (McPhee et al., 2000).
Environ 65 % des individus dans l’ensemble de la population de la côte du Pacifique pourraient se trouver dans la Sunshine Coast et dans l’île Texada (figure 7); c’est pourquoi les tendances en matière d’habitat et les menaces sont particulièrement importantes dans les milieux humides de ces secteurs. Cependant, on ne dispose d’aucune information sur les tendances récentes ou historiques à cet égard. Une perte de milieux humides peut être inférée d’après l’aménagement domiciliaire le long des régions côtières situées entre Gibsons et Powell River, qui a augmenté au cours de la dernière décennie. On s’attend à de nouvelles pressions découlant du développement dans ce secteur à l’avenir, puisque les taux de croissance de la population humaine n’y sont pas beaucoup moins élevés que dans la vallée du bas Fraser (tableau 2). Une augmentation de 12,8 % de la population humaine est en effet prévue au cours de la prochaine période de 10 ans. Le développement (habitations, routes) dans la région se concentre dans la même plaine côtière relativement peu accidentée, qui contient de l’habitat convenable pour la tortue peinte. L’exploitation forestière continue aussi de modifier les milieux, particulièrement dans les basses altitudes le long de la côte (Sunshine Coast Regional District, 2003).
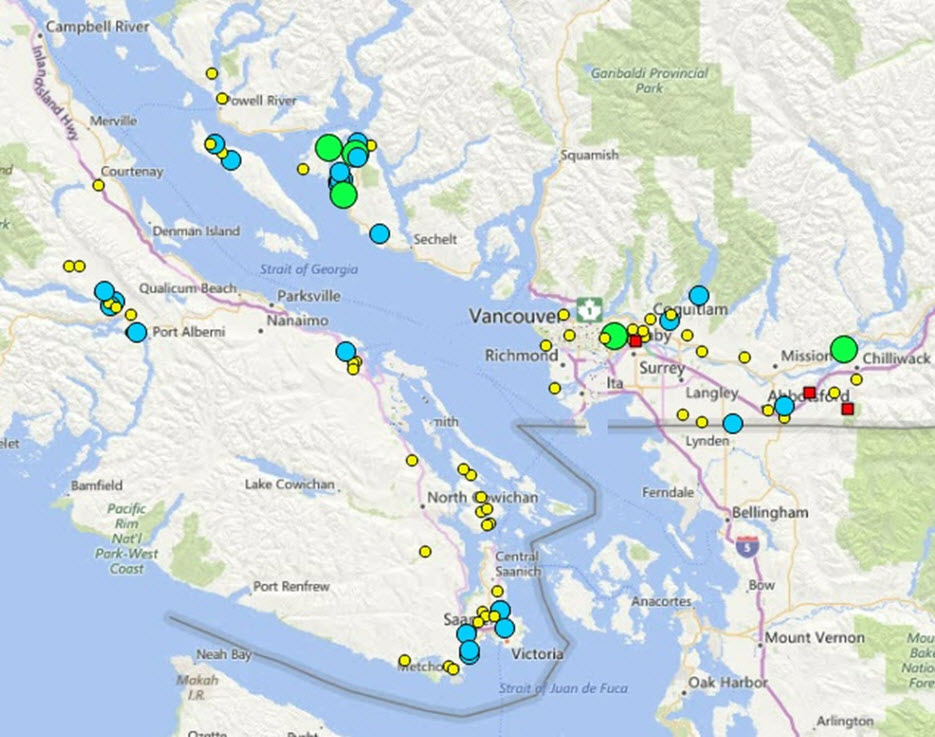
Description longue pour la figure 7
Carte du sud de la Colombie-Britannique indiquant l’estimation de l’abondance minimale de la tortue peinte de l’Ouest dans les sites occupés par la population de la côte du Pacifique.
Population intramontagnarde – des Rocheuses
De manière générale, on considère que l’habitat de la tortue peinte de l’Ouest est abondant dans certains secteurs localisés au sein de l’aire de répartition de cette population. Les répondants au questionnaire ont jugé que les tendances en matière d’habitat de la tortue peinte de l’Ouest variaient considérablement entre les régions. Certains secteurs (p. ex. lac Nisconlith) pourraient connaître une augmentation de la superficie d’habitat disponible grâce à des changements du débit qui fournissent davantage d’eau aux lacs de kettle et à d’autres milieux occupés par les tortues (Ballin, comm. pers., 2014). Dans la région de Cariboo du centre de la Colombie-Britannique, l’augmentation de la densité des routes, y compris l’élargissement des routes et l’augmentation connexe de la circulation, a accru la mortalité routière pour l’espèce. On s’attend à ce que cette tendance se maintienne (Steciw, comm. pers., 2014).
Dans la région du sud de la vallée de l’Okanagan, une zone écologique essentielle, 85 % des milieux humides naturels ont été perdus à cause de la canalisation des cours d’eau, du drainage agricole et de l’aménagement domiciliaire (Sarrell, 1990). La cartographie de l’écosystème réalisée par le passé dans la vallée de l’Okanagan par Lea (2008) a révélé que plus de 90 % de certains types de communautés écologiques de milieux humides avaient été perdus. En effet, la région de l’Okanagan a subi des déclins considérables de 85 % et de plus de 90 % de certains types de communautés écologiques de milieux humides entre 1800 et 2003 (Sarrell, 1990; Lea, 2008). Les taux de perte des milieux humides les plus récents sont inconnus, mais les pressions découlant des activités humaines se poursuivent. Ailleurs (régions des Kootenay et de Cariboo), des milieux humides ont été drainés aux fins de l’agriculture, ou leurs fonctions ont été réduites par le bétail. Des barrages aménagés sur le fleuve Columbia et sur les rivières Kootenay et Duncan ont par ailleurs entraîné l’inondation de milliers d’hectares de terres au fond des vallées, y compris des milieux humides, là où les tortues sont les plus nombreuses.
Les sources de la perte et de la dégradation des milieux humides comprennent les activités agricoles comme les vergers, les vignobles, les terres agricoles travaillées et le piétinement par le bétail aux plans d’eau (voir Menaces et facteurs limitatifs). Les effets sur les tortues découlent du remblayage direct des milieux humides et de la modification des régimes de l’eau souterraine qui alimente beaucoup de lacs, d’étangs et de milieux humides de l’intérieur-sud de la Colombie-Britannique (Iverson et al., 2008). L’aménagement de structures linéaires donne aussi lieu à des pressions de plus en plus importantes en augmentant la mortalité routière, particulièrement pour les femelles reproductrices et les individus en dispersion. L’aménagement urbain continu, tant domiciliaire qu’industriel, peut agir sur l’habitat des tortues, malgré les mesures de protection de l’habitat accrues qui sont prévues dans le cadre des règlements municipaux visant à maintenir les valeurs sensibles de l’environnement et les cours d’eau (voir Protection et propriété de l’habitat).
Dans le secteur où la tortue peinte de l’Ouest est la plus vulnérable dans la région – la vallée de l’Okanagan, la croissance de la population humaine et de l’utilisation de l’eau aux fins de l’agriculture dans la plupart des scénarios de changements climatiques devrait entraîner une hausse de la consommation d’eau de 5 % à 40 %, voire plus dans le pire des cas (Polar Geoscience, 2012). On s’attend à ce que la croissance de la population humaine soit la plus forte dans la vallée de l’Okanagan (tableau 2), particulièrement dans la région centrale, notamment à Kelowna. Les régions des Kootenay et de Cariboo, plus rurales, devraient connaître un degré de croissance beaucoup plus faible. L’augmentation de la population humaine accentue les pressions du développement qui pèsent sur les zones naturelles, et intensifie inévitablement la densité des routes et de la circulation qui menacent les tortues.
Population des Prairies/boréale de l’Ouest – Bouclier canadien
Les tendances historiques de l’habitat de la tortue peinte de l’Ouest au sein de la population des Prairies/boréale de l’Ouest – Bouclier canadien sont incertaines. On sait que l’abondance des milieux humides a diminué par rapport aux niveaux historiques (Watmough et Schmoll, 2007), et il est probable que les déclins se poursuivent. Dans les Prairies, la tortue peinte de l’Ouest utilise davantage de milieux fluviaux que de milieux humides des cuvettes; elles pourraient donc être moins exposées à la perte d’habitat. L’ampleur du déclin des milieux fluviaux et des lacs en croissant à court et à long terme est inconnue.
Il est probable que les tendances en matière d’habitat dans les écosystèmes des Prairies varient entre une relative stabilité et une baisse au cours des dix prochaines années. Les menaces qui pèsent sur l’habitat des tortues proviennent d’activités qui agissent sur les niveaux d’eau, tant les eaux de surface dans les cours d’eau et dans les marécages associés aux lacs en croissant que les réserves d’eaux souterraines susceptibles d’alimenter les étendues d’eau de surface. Les bassins versants occupés par la tortue peinte de l’Ouest dans les Prairies ne sont pas alimentés par la fonte des glaciers dans les Rocheuses (Schindler et Donahue, 2006), mais dépendent plutôt de la fonte des neiges et de la pluie. Tout changement dans les quantités de précipitations pourrait donc agir directement sur les niveaux d’eau et l’habitat de l’espèce. La région des cuvettes des Prairies (où la tortue peinte de l’Ouest est présente mais n’utilise pas nécessairement les milieux humides des cuvettes) a connu des conditions de plus en plus sèches au cours du 20e siècle (Werner et al., 2013), et on s’attend à ce que la rareté de l’eau présente une difficulté majeure dans la région (Sauchyn et Kulshreshtha, 2008). La plupart des études se sont penchées sur les milieux humides des cuvettes et sur les cours d’eau alimentés par les glaciers (p. ex. bassins des rivières Saskatchewan Nord et Sud; Schindler et Donahue, 2006; Werner et al., 2013), mais on peut s’attendre à ce que l’assèchement, de manière générale, agisse aussi sur les eaux occupées par la tortue peinte de l’Ouest. Ce facteur s’ajoute à une utilisation déjà élevée des eaux de surface (p. ex. usage domestique, irrigation) dans la majeure partie de l’aire de répartition des Prairies de la tortue peinte de l’Ouest au Canada (Environment Canada, 2012). L’ampleur selon laquelle l’exploration et l’exploitation pétrolières agiront sur l’habitat des tortues est incertaine. La plus grande répercussion de cette activité sur l’habitat est vraisemblablement l’expansion connexe du réseau routier et l’intensification de la menace de la mortalité routière.
Il est probable que les tendances en matière d’habitat dans le nord-ouest de l’Ontario soient généralement stables, mais les sous-populations de tortues peintes de l’Ouest dans cette région semblent petites et inégalement réparties, ce qui accroît leur vulnérabilité à toute perte d’habitat. L’exploration et l’exploitation minières à l’échelle locale ainsi que l’empiètement de l’exploitation forestière dans certains plans d’eau, que ce soit par les coupes ou les routes, représentent aussi certaines menaces possibles pour la tortue peinte de l’Ouest.
Biologie
Cycle vital et reproduction
Le cycle vital de la tortue peinte de l’Ouest est assez typique des tortues d’étang. Au début du printemps, à mesure que l’eau se réchauffe, la parade et l’accouplement commencent en eaux peu profondes (Ernst et Lovich, 2009). Des épisodes d’accouplement ont aussi été documentés à l’automne (Pearce et Avise, 2001). Les femelles s’accouplent en majorité avant chaque période de nidification, mais elles ont aussi la capacité de conserver du sperme viable pour une période pouvant atteindre 4 ans (Pearce et Avise, 2001).
Les femelles commencent à nidifier de la fin mai à juin et recherchent les sols bien drainés ou les substrats sableux, souvent le long des routes, des champs et des plages orientées vers le sud ou le sud-ouest (Schwarzkopf et Brooks, 1987; COSEWIC, 2006). Une fois qu’elles ont trouvé un site convenable, les femelles creusent un nid en forme de flacon de 4 à 14 cm de profondeur, et pondent environ 12 œufs entre la fin de l’après-midi et le début du soir (Pearse et Avise, 2001; COSEWIC, 2006). Une fois la ponte accomplie et le nid recouvert, les femelles laissent les œufs à eux-mêmes.
L’incubation des œufs dans le nid dure quelque 76 jours; les œufs éclosent à la fin de l’été ou en automne, au cours de la même période de reproduction (COSEWIC, 2006). Le sexe de bon nombre de tortues d’eau douce, dont la tortue peinte de l’Ouest, est déterminé par la température au cours de l’incubation (Bull, 1980). Au Canada, les nouveau-nés passent habituellement l’hiver dans le nid, et émergent au cours du printemps suivant (Packard et al., 2002; Costanzo et al., 2004). Ils ont la capacité de demeurer dans leur nid en région nordique parce qu’ils sont tolérants au gel, et peuvent survivre à des températures inférieures à -10 °C (Packard et al., 2002).
Les adultes comme les juvéniles passent les mois chauds de l’été à s’exposer au soleil et à rechercher de la nourriture, et se déplacent vers un habitat d’hivernage convenable à l’automne, lorsque la température de l’air et de l’eau diminue. Hors de la période de parade et d’accouplement, les tortues peintes mâles et femelles ont l’habitude de s’éviter (Munoz, 2004). Les tortues peintes de l’Ouest hibernent dans des eaux peu profondes sous la limite de congélation. Durant l’hiver, elles peuvent accomplir de petits déplacements, mais elles entrent en dormance dans les substrats boueux lorsque les conditions deviennent anoxiques (Taylor et Nol, 1989).
On pense que la maturité sexuelle chez les tortues peintes repose davantage sur la taille que sur l’âge des individus (Ernst et Lovich, 2009); elle peut donc varier en fonction des régions. Citant plusieurs sources, Ernst et Lovich (2009) avancent que les tortues peintes de l’Ouest mâles atteignent la maturité à une longueur de plastron de 7,0 à 9,5 cm, habituellement au cours des années 2 à 4, mais possiblement aussi tard que la sixième année dans certaines populations nordiques. Les femelles atteignent la maturité à une plus grande taille, à une longueur de plastron de 9,7 à 12,8 cm, voire jusqu’à 17,7 cm dans certaines populations, habituellement vers 6 à 10 ans (Ernst et Lovich, 2009).
On dispose de très peu de données sur la survie et l’âge de la maturité chez la tortue peinte de l’Ouest. En étudiant les tortues peintes du Centre dans le centre de l’Ontario, Samson (2003) a estimé que la maturité sexuelle était atteinte entre 7 à 10 ans chez les mâles (n = 15; moyenne = 8,3; écart-type = 0,93) et entre 12 à 15 ans chez les femelles (n = 32; moyenne = 14,1; écart-type non disponible). Samson a constaté que le taux de mortalité annuel des adultes était très faible, à 0,03. La durée de vie des tortues peintes s’établirait entre au moins 30 ans et 40 ans (Congdon et al., 2003; Ernst et Lovich, 2009), et pourrait atteindre jusqu’à 60 ans (information à l’appui dans Midwood et al., 2015). Vu les grands écarts climatiques dans l’ensemble de l’aire de répartition de la tortue peinte de l’Ouest au Canada, d’un climat tempéré sur la côte ouest à un climat continental dans les Prairies et le nord-ouest de l’Ontario, la durée d’une génération pourrait considérablement varier entre les trois unités désignables. La durée de vie de la population de la côte du Pacifique, qui serait de 25 à 30 ans, est vraisemblablement la plus courte, tandis que celle de la population intramontagnarde – des Rocheuses et de la population des Prairies/boréale de l’Ouest – Bouclier canadien serait de 30 et 40 ans. Ces deux dernières estimations s’accordent avec celles qui ont été établies pour les tortues peintes du Centre et de l’Est (Moldowan, comm. pers., 2015).
Physiologie et adaptabilité
L’exposition au soleil est un comportement couramment observé chez une variété d’espèces de tortues d’eau douce. Cette exposition a comme principale utilité de hausser rapidement la température corporelle chez les tortues, qui sont ectothermes (Boyer, 1965; Ernst, 1972; Lefevre et Brooks, 1995), et comporte plusieurs avantages. En effet, l’exposition au soleil favorise le métabolisme et la digestion (Avery et al., 1993; Hammond et al., 1988), aide à éliminer les ectoparasites (Ryan et Lambert, 2005) et accélère le développement des œufs chez les femelles (Carrière et al., 2008). En outre, l’exposition au soleil pourrait faire partie intégrante du processus de renouvellement de la peau et de la carapace, en synthétisant la vitamine D3 (Acierno et al., 2006) et en favorisant l’élimination périodique des scutelles usées (Boyer, 1965).
Durant l’hiver, la tortue peinte de l’Ouest entre en dormance et hiberne sur le substrat boueux des étangs, des lacs ou d’autres types de milieux aquatiques où les eaux sont calmes. Lorsque les tortues sont dormantes, leur besoin en oxygène est fortement réduit (Ultsch et al., 1999), et elles absorbent peut-être de l’oxygène de l’eau par la peau, les muqueuses de la gorge et les sacs à paroi mince du cloaque. Il semble néanmoins que les tortues peintes soient incapables de maintenir un métabolisme aérobie pendant une longue hibernation. Elles survivent plutôt par respiration anaérobie en utilisant les carbonates de calcium et de magnésium qu’elles tirent de leur carapace pour réguler l’accumulation de lactate dans leurs tissus (Jackson, 2000). Cette tolérance extrême aux conditions anaérobies a été associée à des changements dans la régulation de gènes de vertébrés largement conservés, ce qui laisse croire qu’elle pourrait avoir un fondement génétique (Shaffer et al., 2013).
Par contre, certains nouveau-nés hibernent en milieu terrestre, dans leur chambre de nidification natale (Ultsch, 1989). Comme les petits n’émergent généralement pas avant le printemps suivant, ils risquent d’être exposés à des températures pouvant atteindre -10 ˚C durant l’hibernation. La survie à l’hiver est favorisée par la tolérance au gel et la capacité de surfusion, selon la température corporelle des individus. Les nouveau-nés gèlent lorsque leur température corporelle demeure supérieure à -4 °C (Storey et al., 1988; Churchill et Storey, 1992; Costanzo et al., 1995), tandis qu’ils font appel à la surfusion lorsque la température passe sous ce seuil (Packard et al., 1997).
Régime alimentaire
Les jeunes tortues peintes se nourrissent principalement de têtards et d’invertébrés aquatiques, notamment des insectes, des écrevisses et des escargots. Elles se tournent vers des proies plus grosses comme des grenouilles et des poissons à mesure qu’elles croissent (Marchand, 1942; Matsuda et al., 2006). Lorsque la tortue atteint sa maturité et que son taux de croissance diminue, elle est de plus en plus omnivore, se nourrissant d’animaux vivants ou morts, ainsi que de l’abondante végétation des zones humides (Raney et Lachner, 1942; Matsuda et al., 2006). Les populations nordiques seraient plus fréquemment carnivores que celles du sud (MacCollough et Secoy, 1983a; Lindeman, 1996).
Déplacements et dispersion
Il n’est pas rare d’observer des déplacements sur plusieurs centaines de mètres en milieu terrestre (House et al., 2010) lorsque les individus tentent, on le présume, d’accroître la fréquence des rencontres avec d’éventuels partenaires (Thomas et Parker, 2000), d’accéder à des ressources non disponibles dans leur habitat aquatique précédent (Stone, 2001) ou d’échapper à une baisse considérable de la qualité de leur habitat (Roe et Georges, 2008). Quelques tortues utilisent des étangs d’hivernage et de reproduction différents. Elles doivent donc se déplacer entre les deux au printemps et à l’automne (Ernst et Lovich, 2009). Les migrations et les déplacements sur de grandes distances sont également possibles dans les régions plus sèches de l’aire de répartition canadienne de l’espèce, et les individus doivent effectuer leurs déplacements en milieu terrestre d’une étendue d’eau à une autre, ou de façon linéaire le long des cours d’eau (MacCulloch et Secoy, 1983b). Le long des cours d’eau ou aux endroits permettant la connectivité entre les plans d’eau, les tortues peuvent facilement se déplacer en aval ou en amont des eaux (Ernst et Lovich, 2009). Des mâles présents dans les milieux fluviaux de la Saskatchewan ont parcouru entre 21 et 26 km, et des femelles, moins de la moitié de cette distance (7 à 8 km) (MacCullough et Secoy, 1983a). Les tortues qui occupent des étangs et des milieux humides parcourent probablement des distances beaucoup plus courtes (Ernst et Lovich, 2009).
Relations interspécifiques
Le stade de l’œuf représente une phase du cycle vital de la tortue peinte de l’Ouest où celle-ci est très vulnérable. Les prédateurs des nids apprennent à trouver ces derniers à proximité des plans d’eau, et peuvent facilement creuser pour atteindre les œufs dans les nids peu profonds (Spackman et Hughes, 1995). Par conséquent, le taux de prédation des œufs de tortue peinte de l’Ouest est souvent très élevé (Macartney et Gregory, 1985; Clark et Grueing, 2002). Parmi les prédateurs des œufs de la tortue peinte, on compte le raton laveur (Procyon lotor), le coyote (Canis latrans), les moufettes (Mephites spp.), les mustélidés, l’ours noir (Ursus americanus), les sciuridés, les corvidés ainsi que les chats domestiques (Felis catus)et les chiens domestiques (Canis familiaris) (voir Maltby, 2000; Clark et Gruenig, 2002; Marchand et Litvaitis, 2004; Ernst et Lovich, 2009).
On sait que la tortue de Floride est présente dans la majeure partie de l’aire de répartition de la tortue peinte de l’Ouest, et pourrait entrer en concurrence avec l’espèce en s’appropriant les sites d’exposition au soleil ou de nidification. Bien que l’on ait fréquemment observé la tortue de Floride en train de creuser des nids, on ne dispose pas d’assez de données pour déterminer si l’éclosion des œufs de cette espèce peut s’accomplir avec succès dans la nature. Cependant, des jeunes vivants ont récemment été extraits d’un nid dans le sud-ouest de la Colombie-Britannique (Welstead, comm. pers., 2015a), ce qui laisse croire qu’ils peuvent, du moins à l’occasion, survivre à l’hiver dans le climat plus doux de la côte. La présence de matériel génétique provenant de la tortue peinte de l’Est a été montrée chez des tortues peintes de l’Ouest de la population de la côte du Pacifique (Jensen et al., 2014b), ce qui indique une hybridation probable avec des espèces non indigènes relâchées dans la nature.
Taille et tendances de la population
Activités et méthodes d’échantillonnage
Une estimation de la taille de la population de la côte du Pacifique a été fournie par un groupe de travail; elle était fondée principalement sur l’avis de spécialistes. Les données sur le nombre minimal d’individus vivants sont présentées lorsqu’elles sont disponibles; cependant, si on s’éloigne de la vallée du bas Fraser, qui a fait l’objet de relevés menés de manière intensive, il s’agit généralement du nombre d’individus capturés ou aperçus à un moment ou à un autre au cours de relevés visant à délimiter la répartition de l’espèce ou au cours d’autres projets sur le terrain dont l’objectif n’était pas d’estimer la population locale (voir par exemple Engelstoft et Ovaska, 2011, 2013, 2014, 2015; Jensen, 2013).
Abondance
La taille des populations de tortues peintes (toutes sous-espèces confondues) varie grandement; les populations peuvent être très denses ou ne comprendre qu’un petit nombre d’individus (Ernst et Lovich, 2009; Eskew et al., 2010). La densité des tortues varie considérablement entre plans d’eau (Ballin, données inédites, 2014; Tesche, 2014). Les populations fluviales (qui sont dans les provinces des Prairies) ont généralement une plus faible densité, parce qu’il est facile aux individus de se disperser et de se déplacer vers l’amont et l’aval des cours d’eau (Ernst et Lovich, 2009). Il est donc impossible d’extrapoler une estimation de la population régionale à partir d’une estimation du nombre moyen de tortues par plan d’eau.
Des estimations fiables de l’abondance ne sont disponibles pour aucune population de tortues peintes de l’Ouest au Canada. Les dénombrements visuels dans les plans d’eau ne permettent pas, généralement, de produire des estimations fiables. En effet, il est difficile de dénombrer correctement les individus en raison de l’incapacité de faire la distinction entre les adultes et les jeunes (Ernst et Lovich, 2009) et de la capacité très variable d’observation des tortues au-dessus de l’eau à un moment donné. Pour déterminer avec précision la classe d’âge, il faut pouvoir examiner les individus de près. La plupart des estimations de l’abondance sont basées sur des dénombrements visuels effectués à distance, et les totaux regroupent donc généralement les adultes et les jeunes. Les rapports d’âge varient grandement d’un site à l’autre (Basaraba, 2014; Tesche, 2014); par conséquent, il n’y a pas de rapport global pouvant, de façon fiable, être appliqué à tous les sites.
Population de la côte du Pacifique
On ne dispose d’aucune estimation solide pour cette population, étant donné que les relevés à l’extérieur de la vallée du bas Fraser visaient principalement à documenter les tendances de répartition. Cependant, il est peu probable que la population dépasse de beaucoup 3 000 adultes, compte tenu du petit nombre d’individus observés au cours des relevés dans la plupart des sites et du nombre de plans d’eau occupés (tableaux 3 et 4). La taille des populations dans de nombreux sites sur l’île de Vancouver, en particulier, est inconnue, car les relevés effectués visaient principalement à clarifier la répartition, et les études de marquage-recapture ont été effectuées dans quelques sites seulement. Environ 35 à 43 % de la population se trouve dans la Sunshine Coast et sur l’île Texada, et environ 30 à 43 % de la population se trouve dans les basses terres continentales/la vallée du Fraser. Le sud de l’île de Vancouver (district régional de la capitale) hébergerait environ 10 à 11 % de la population, et les composantes vallée Alberni/Nanaimo/îles Gulf, environ 12 à 16 % de la population (tableau 3). De nouvelles occurrences continuent à être relevées grâce à l’intensification des recherches, particulièrement sur l’île de Vancouver au nord du district régional de la Capitale, et le pourcentage de la population sur l’île pourrait être supérieur à celui indiqué ci-dessus.
| Région | Limite inférieure | % du total de la limite inf. | Limite supérieure | % du total de la limite sup. |
| Alberni, Nanaimo et îles Gulfc | 208 | 12,0 | 492 | 15,8 |
| District régional de la Capitale, île de Vancouverc | 167 | 9,6 | 350 | 11,2 |
| Basses terres continentales, vallée du Fraser | 755 | 43,4 | 930 | 29,8 |
| Sunshine Coast, île Texada | 609 | 35,0 | 1 351 | 43,3 |
| Totaux | 1 739 | blanc | 3 123 | blanc |
c Plusieurs sites n’ont été visités qu’une fois dans la vallée Alberni et dans le district régional de la capitale, île de Vancouver, pour clarifier la répartition. Dans le cas de la limite inférieure, aucune correction n’a été appliquée pour la détectabilité; dans le cas de la limite supérieure, on a supposé que les petits milieux humides pour lesquels le nombre d’adultes possible est indiqué comme étant inconnu dans le tableau 4 hébergeaient de 10 à 20 adultes et que les grands milieux humides hébergeaient 50 adultes, aux fins du présent tableau.
Il y a au moins 24 sites connus de la tortue peinte de l’Ouest dans la vallée du bas Fraser, depuis Chilliwack jusqu’à la côte, dans la Réserve nationale de faune Alaksen. Cependant, les populations de bon nombre de ces sites ne sont pas autosuffisantes. Dans de nombreux cas, seulement une ou deux tortues ont été observées, ce qui semble indiquer que ces individus ont été introduits ou que les populations ont atteint des niveaux dangereusement bas. Compte tenu de la grande longévité des tortues peintes (de 30 à 40 ans; Ernst et Lovich, 2009), une population d’une ou deux tortues peut persister pendant des décennies sans qu’il n’y ait de recrutement.
Chacun des 39 groupes de sites existants peut être considéré comme étant une sous-population (voir le tableau 4 pour une distribution détaillée). La plupart des sous-populations sont petites, comprenant moins de 10 ou de 100 adultes, mais on suppose que quelques-unes sont plus grandes avec des effectifs pouvant atteindre jusqu’à 400 (Western Painted Turtle Recovery Team, 2016). Les sous-populations les plus grandes sont les suivantes : baie Garden-lac Ruby dans la Sunshine Coast avec des effectifs estimés à 355-605 adultes, marécage Nicomen dans la vallée du bas Fraser avec des effectifs estimés à 300-350 adultes et île Nelson avec des effectifs estimés à 100-400 adultes. La taille de nombreuses sous-populations, particulièrement dans la vallée Alberni sur l’île de Vancouver, est inconnue.
Tableau 4. Situation des sites connus de la tortue peinte de l’Ouest, population de la côte du Pacifique, par sous population (groupe d’observations) et région. Le tableau est adapté et mis à jour d’après le tableau 4 de l’annexe 1 du plan de rétablissement provincial (Western Painted Turtle Recovery Team, 2016). Les numéros de groupe de 1 à 37 correspondent à ceux du document mentionné ci dessus et comprennent 1 groupe avec habitat de rétablissement seulement (n° 23) et 1 site historique/de rétablissement (n° 5), alors que les numéros de 38 à 41 représentent des groupes/sous populations supplémentaires (qui ne sont pas dans le plan de rétablissement de 2016).
« Augmentée » signifie que des juvéniles ont été relâchés ou que des adultes ont été transférés (translocation) dans des zones où la viabilité des populations est faible.
La réintroduction (mention réintroduite) est la translocation d’adultes ou le lâcher d’individus dans un site historique.
« Nombre d’adultes » est fondé sur le nombre minimal de tortues vivantes observées par site sans appliquer de correction pour la détectabilité. Dans le cas de certains sites des basses terres continentales et de la Sunshine Coast, ce nombre est fondé sur des estimations à partir de données de marquage-recapture.
| Localisation | ID du groupe | Nom du groupe par région | Site | Situation | Nombre d’adultes possible | Commentaires |
|---|---|---|---|---|---|---|
| Sunshine Coast et île Texada | 29 | Cranberry | Lac Cranberry | Sous-pop. existante | 5 | blanc |
| Sunshine Coast et île Texada | 30 | Étang Dogleg | Étang Dogleg | Sous-pop. existante | 1 | blanc |
| Sunshine Coast et île Texada | 28 | Garden Bay - Ruby Lake | Lac Brown | Sous-pop. existante | < 10 | Le site n'a pas fait l'objet d'un piégeage systématique. |
| Sunshine Coast et île Texada | 28 | Garden Bay - Ruby Lake | Milieu humide de la pointe Daniel | Sous-pop. existante | < 5 | blanc |
| Sunshine Coast et île Texada | 28 | Garden Bay - Ruby Lake | Lac de la baie Garden | Sous-pop. existante | < 5 | La mortalité routière est un problème, et les effectifs peu nombreux continuent de diminuer. |
| Sunshine Coast et île Texada | 28 | Garden Bay - Ruby Lake | Lac Hotel | Sous-pop. existante | 20-40 | Marquage-recapture |
| Sunshine Coast et île Texada | 28 | Garden Bay - Ruby Lake | Milieu humide de l’Iris Griffith Centre | Sous-pop. existante | < 5 | Marquage-recapture |
| Sunshine Coast et île Texada | 28 | Garden Bay - Ruby Lake | Lac Katherine | Sous-pop. existante | 30-50 | Marquage-recapture |
| Sunshine Coast et île Texada | 28 | Garden Bay - Ruby Lake | Lac Klein | Sous-pop. existante | 20-40 | Marquage-recapture |
| Sunshine Coast et île Texada | 28 | Garden Bay - Ruby Lake | Lac Little Goose | Sous-pop. existante | < 10 | Marquage-recapture |
| Sunshine Coast et île Texada | 28 | Garden Bay - Ruby Lake | Lac et milieu humide Mixal | Sous-pop. existante | 10-30 | Marquage-recapture |
| Sunshine Coast et île Texada | 28 | Garden Bay - Ruby Lake | Lac North | Sous-pop. existante | 70-100 | Marquage-recapture |
| Sunshine Coast et île Texada | 28 | Garden Bay - Ruby Lake | Lac Ruby | Sous-pop. existante | 20-40 | Marquage-recapture |
| Sunshine Coast et île Texada | 28 | Garden Bay - Ruby Lake | Lagune du lac Ruby | Sous-pop. existante | 40-70 | Marquage-recapture |
| Sunshine Coast et île Texada | 28 | Garden Bay - Ruby Lake | Lac Sakinaw | Sous-pop. existante | 70-120 | Marquage-recapture |
| Sunshine Coast et île Texada | 31 | Parc Madeira | Étang de la pointe Francis 1 | Sous-pop. existante | 50-80 | Marquage-recapture |
| Sunshine Coast et île Texada | 31 | Parc Madeira | Étang de la pointe Francis 2 | Sous-pop. existante | Inconnu | Petit milieu humide; n'a jamais fait l'objet de relevés systématiques. |
| Sunshine Coast et île Texada | 31 | Parc Madeira | Lac Lily (Paq) | Sous-pop. existante | 80-120 | Marquage-recapture |
| Sunshine Coast et île Texada | 34 | Île Nelson | Étang de la baie Cockburn | Sous-pop. existante | < 10 | blanc |
| Sunshine Coast et île Texada | 34 | Île Nelson | Lac West | Sous-pop. existante | 100-400 | Relevés limités; estimation très approximative. |
| Sunshine Coast et île Texada | 37 | Île Texada | Lac Cap Sheaf | Sous-pop. existante | 10-50 | blanc |
| Sunshine Coast et île Texada | 37 | Île Texada | Lac Case | Sous-pop. existante/augmentée | < 10 | blanc |
| Sunshine Coast et île Texada | 37 | Île Texada | Lac Emily (Turtle) | Sous-pop. existante/augmentée | 15-50 | blanc |
| Sunshine Coast et île Texada | 37 | Île Texada | Lac Priest | Sous-pop. existante | < 10 | blanc |
| Sunshine Coast et île Texada | 32 | Lac Trout/baie Halfmoon | Lac Trout | Sous-pop. existante | 10-30 | Relevés limités |
| Sunshine Coast et île Texada | 32 | Lac Trout/baie Halfmoon | Baie Halfmoond | Sous-pop. existante | 15-30 | N'a jamais fait l'objet de relevés systématiques; nouveau site qui n'est pas dans le plan de rétablissement |
| Vallée du bas Fraser | 1 | Réserve nationale de faune Alaksen | Réserve nationale de faune Alaksen | Sous-pop. existante | 3 | blanc |
| Vallée du bas Fraser | 2 | Lac Aldergrove | Lac Aldergrove | Sous-pop. existante | 22-25 | blanc |
| Vallée du bas Fraser | 3 | Lac Burnaby/lac Deer | Lac Burnaby | Sous-pop. existante/augmentée | 200-225 | blanc |
| Vallée du bas Fraser | 3 | Lac Burnaby/lac Deer | Lac Deer | Sous-pop. existante | 25-30 | blanc |
| Vallée du bas Fraser | 4 | Vallée Campbell Valley - lac Livingstone | Parc régional de Campbell Valley - étang McLean | Sous-pop. existante/ augmentée | 46-50 | blanc |
| Vallée du bas Fraser | 4 | Campbell Valley - lac Livingstone | Lac Livingston/ chemin Murchie | Sous-pop. existante | 5-20 | blanc |
| Vallée du bas Fraser | 5 | Coquitlam | Colony Farm | Sous-pop. existante | 1-5 | blanc |
| Vallée du bas Fraser | 5 | Coquitlam | Ruisseau Como (ponceau) | Sous-pop. existante | 1 | blanc |
| Vallée du bas Fraser | 5 | Coquitlam | Ruisseau Como (est) | Historique - habitat de rétablis-sement | 0 | blanc |
| Vallée du bas Fraser | 5 | Coquitlam | Lac Como | Sous-pop. existante | 1 | blanc |
| Vallée du bas Fraser | 5 | Coquitlam | Lac Lafarge | Sous-pop. existante | Données manquantes | blanc |
| Vallée du bas Fraser | 5 | Coquitlam | Lac Lost, parc Mundy | Sous-pop. existante/ augmentée | 5-10 | blanc |
| Vallée du bas Fraser | 6 | Lac Cultus | Lac Cultus | Sous-pop. existante | 1 | blanc |
| Vallée du bas Fraser | 7 | Réserve naturelle Great Blue Heron | Réserve naturelle Great Blue Heron | Sous-pop. existante | 1-5 | blanc |
| Vallée du bas Fraser | 8 | Iona | Plage Iona | Sous-pop. existante | 5-10 | blanc |
| Vallée du bas Fraser | 9 | Jerry Sulina | Jerry Sulina | Sous-pop. existante | 1 | blanc |
| Vallée du bas Fraser | 10 | Ruisseau Kanaka | Secteur de la route de contournement Haney et du ruisseau Kanaka | Sous-pop. existante | 1-5 | blanc |
| Vallée du bas Fraser | 11 | Marais Lakemount | Marais Lakemount | Sous-pop. existante | 1 | blanc |
| Vallée du bas Fraser | 12 | Lagune Lost/parc Stanley | Lagune Lost | Sous-pop. existante | 1 | blanc |
| Vallée du bas Fraser | 13 | Ruisseau Marshall | Ruisseau Marshall | Sous-pop. existante | 1 | blanc |
| Vallée du bas Fraser | 14 | Lac Mill | Lac Mill | Sous-pop. existante | 5-10 | blanc |
| Vallée du bas Fraser | 15 | Minnekhada - Pitt-Addington | Marécage Deboville/ ruisseau McLean |
Sous-pop. existante | 10-20 | blanc |
| Vallée du bas Fraser | 15 | Minnekhada - Pitt-Addington | Parc régional Minnekhada | Sous-pop. existante/ augmentée | 26-30 | blanc |
| Vallée du bas Fraser | 15 | Minnekhada - Pitt-Addington | Marais Pitt-Addington | Sous-pop. existante/ réintroduite | 25 | blanc |
| Vallée du bas Fraser | 16 | Marécage Nicomen | Marécage Nicomen | Sous-pop. existante | 300-350 | blanc |
| Vallée du bas Fraser | 17 | Parc Queen Elizabeth | Parc Queen Elizabeth | Sous-pop. existante | 1 | blanc |
| Vallée du bas Fraser | 18 | Étang Sardis | Étang Sardis | Sous-pop. existante | 5-10 | blanc |
| Vallée du bas Fraser | 19 | Lac Silvermere | Lac Silvermere | Sous-pop. existante | 5-10 | blanc |
| Vallée du bas Fraser | 20 | Ranch Vicarro | Domaine du Ranch Vicarro, bassin versant du ruisseau McKee | Sous-pop. existante | 25-50 | blanc |
| Vallée du bas Fraser | 21 | Milieux humides de Westcreek | Milieux humides de Westcreek | Sous-pop. existante/ réintroduite | 32 | blanc |
d Nouvelles observations qui ne sont pas dans le programme de rétablissement provincial (source : Evelyn, comm. pers., 2016)
| Localisation | ID du groupe | Nom du groupe par région | Site | Situation | Nbre max. observé/ relevé | Nombre d’adultes possible | Commentaires |
|---|---|---|---|---|---|---|---|
| District régional de la capitale, île de Vancouver | 22 | Langford - Saanich | Parc Adam Kerr | Sous-pop. existante | 1 | ND | Dans la mouille d'un ruisseau; probablement de passage |
| District régional de la capitale, île de Vancouver | 22 | Langford - Saanich | Parc régional Elk-Beaver Lake | Sous-pop. existante | 34 | 50-100 | Relevés à répétition des lacs et des étangs connexes |
| District régional de la capitale, île de Vancouver | 22 | Langford - Saanich | Lac Eagles et étangs connexes | Sous-pop. existante | 2 | Inconnu | Aucun relevé effectué dans les eaux dormantes |
| District régional de la capitale, île de Vancouver | 22 | Langford - Saanich | Lac Florence | Sous-pop. existante | 2 | 2 | Relevés à répétition du petit lac |
| District régional de la capitale, île de Vancouver | 22 | Langford - Saanich | Lac Glen | Sous-pop. existante | 3 | < 5 | Relevés à répétition du petit lac |
| District régional de la capitale, île de Vancouver | 22 | Langford - Saanich | Lac Langford | Sous-pop. existante | 37 | 50-100 | Relevés à répétition |
| District régional de la capitale, île de Vancouver | 22 | Langford - Saanich | Lac Maltby | Sous-pop. existante | 1 | Inconnu | Signalement par un propriétaire avec photos |
| District régional de la capitale, île de Vancouver | 22 | Langford - Saanich | Lac McKenzie | Sous-pop. existante | 4 | Inconnu | blanc |
| District régional de la capitale, île de Vancouver | 22 | Langford - Saanich | Étangs du chemin Metchosin | Sous-pop. existante | 10 | Inconnu | blanc |
| District régional de la capitale, île de Vancouver | 22 | Langford - Saanich | Olympic View | Sous-pop. existante | 25 | Inconnu | blanc |
| District régional de la capitale, île de Vancouver | 22 | Langford - Saanich | Lac Swan | Sous-pop. existante | 11 | < 15 | Étude de marquage-recapture effectuée en 2010-2013 |
| District régional de la capitale, île de Vancouver | 22 | Langford - Saanich | Étang Viaducte | Sous-pop. existante | 1 | < 10 | Petit étang |
| District régional de la capitale, île de Vancouver | 24 | Pointe Rocky | Lac Matheson | Sous-pop. existante | 1 | < 10 | Relevés à répétition |
| District régional de la capitale, île de Vancouver | 24 | Pointe Rocky | Chemin Rocky Point* | Sous-pop. existante | 1 | ND | Compte tenu de l'observation d'une femelle adulte traversant la route. |
| District régional de la capitale, île de Vancouver | 25 | Sooke - Metchosin | Lac Kemp | Sous-pop. existante | 1 | < 10 | Relevés à répétition |
| Vallée Alberni, Nanaimo et îles Gulf | 41e | Vallée Alberni - lac Summit | Lac Summit (marécage)e | Sous-pop. existante | 9 | Inconnu | blanc |
| Vallée Alberni, Nanaimo et îles Gulf | 36 | Alberni Nord | Lac McLaughlin | Sous-pop. existante | 1 | Inconnu | 1 adulte observé sur une route à proximité |
| Vallée Alberni, Nanaimo et îles Gulf | 36 | Alberni Nord | Lac Turnbull | Sous-pop. existante | 5 | Inconnu | blanc |
| Vallée Alberni, Nanaimo et îles Gulf | 35 | Alberni Sud | Milieux humides de l'aéroport | Sous-pop. existante | 56 | 50-150 | Relevés à répétition |
| Vallée Alberni, Nanaimo et îles Gulf | 35 | Alberni Sud | Ash Main, au kilomètre 26e | Sous-pop. existante | 4 | Inconnu | Possiblement un habitat saisonnier |
| Vallée Alberni, Nanaimo et îles Gulf | 35 | Alberni Sud | Ash Main, au kilomètre 6e | Sous-pop. existante | 1 | Inconnu | Possiblement un habitat saisonnier |
| Vallée Alberni, Nanaimo et îles Gulf | 35 | Alberni Sud | Lac Devil’s Den | Sous-pop. existante | 10 | 10-20 | Relevés à répétition |
| Vallée Alberni, Nanaimo et îles Gulf | 35 | Alberni Sud | Étang - ligne de transp. d'électricité 1e | Sous-pop. existante | 10 | Inconnu | blanc |
| Vallée Alberni, Nanaimo et îles Gulf | 35 | Alberni Sud | Lac Little Turtle | Sous-pop. existante | 2 | Inconnu | blanc |
| Vallée Alberni, Nanaimo et îles Gulf | 35 | Alberni Sud | Marécage McKenzie, rivière Stamp | Sous-pop. existante | 4 | Inconnu | Seule une petite partie de ces milieux humides étendus a fait l'objet de relevés une fois |
| Vallée Alberni, Nanaimo et îles Gulf | 35 | Alberni Sud | Lac Patterson | Sous-pop. existante | 1 | Inconnu | Plusieurs creusages observés sur l'île et sur la rive |
| Vallée Alberni, Nanaimo et îles Gulf | 35 | Alberni Sud | Lac Sumner | Sous-pop. existante | 9 | Inconnu | Identifié par erreur comme un site historique seulement dans le plan de rétablissement de 2016. Des déplacements réguliers du lac Patterson au lac Sumner sont une possibilité. |
| Vallée Alberni, Nanaimo et îles Gulf | 38e | Chemainus | Lac Chemainuse | Sous-pop. existante | 2 | Inconnu | blanc |
| Vallée Alberni, Nanaimo et îles Gulf | 39e | Cobble Hill | Pont à chevalets Kinsole | Sous-pop. existante | 1 | Inconnu | Observation fortuite |
| Vallée Alberni, Nanaimo et îles Gulf | 40e | Comox Valley | Lac Maple, Cumberlande | Sous-pop. existante | 1 | Inconnu | blanc |
| Vallée Alberni, Nanaimo et îles Gulf | 33 | Nanaimo | Marais Buttertubs | Sous-pop. existante | 3 | Inconnu | Seule une petite partie de ces milieux humides a fait l'objet de relevés |
| Vallée Alberni, Nanaimo et îles Gulf | 33 | Nanaimo | Cathers Lakee | Sous-pop. existante | 1 | Inconnu | blanc |
| Vallée Alberni, Nanaimo et îles Gulf | 33 | Nanaimo | Lac Diver | Sous-pop. existante | 13 | Inconnu | blanc |
| Vallée Alberni, Nanaimo et îles Gulf | 33 | Nanaimo | Lac Morrell, Parc Westwood Lakee | Sous-pop. existante | 1 | Inconnu | blanc |
| Vallée Alberni, Nanaimo et îles Gulf | 23 | Île Pender | Lac Greenburn | Non occupé | ND | ND | Désigné dans le plan de rétablissement en Colombie-Britannique à titre d’habitat de rétablissement convenable; seules des tortues peintes de l’Est (sous-espèce introduite) ont été observées dans ce site. |
| Vallée Alberni, Nanaimo et îles Gulf | 27 | Île Saltspring Nord | Lac Bullock | Sous-pop. existante | 8 | < 10 | blanc |
| Vallée Alberni, Nanaimo et îles Gulf | 27 | Île Saltspring Nord | Lac St. Mary’s | Sous-pop. existante | 46 | Inconnu | Données de relevés de 2016; plus nombreux que dans les années antérieures, mais cela comprenait les juvéniles |
| Vallée Alberni, Nanaimo et îles Gulf | 26 | Île Saltspring Sud | Lac Cusheon | Sous-pop. existante | 2 | < 5 | blanc |
| Vallée Alberni, Nanaimo et îles Gulf | 26 | Île Saltspring Sud | Vallée Fulford | Sous-pop. existante | 2 | < 5 | Introduites par les humains |
| Vallée Alberni, Nanaimo et îles Gulf | 26 | Île Saltspring Sud | Pointe Isabella | Sous-pop. existante | 1 | < 5 | blanc |
| Vallée Alberni, Nanaimo et îles Gulf | 26 | Île Saltspring Sud | Chemin Mountain | Sous-pop. existante | 3 | < 5 | Introduites par les humains |
| Vallée Alberni, Nanaimo et îles Gulf | 26 | Île Saltspring Sud | Lac Stowel | Sous-pop. existante | 12 | Inconnu | blanc |
e Nouvelles observations qui ne sont pas dans le programme de rétablissement provincial (source : C. Engelstoft et K. Ovaska, données inédites, 2016)
Population intramontagnarde – des Rocheuses
On ne dispose d’aucune estimation fiable de la taille de la population intramontagnarde – des Rocheuses. De nombreux projets propres aux sites fournissent des estimations du nombre minimal d’individus vivants et des estimations bornées de la population sont disponibles d’après certaines études sur le terrain (tableau 5). Comme ci-dessus, peu d’études font la distinction entre les tortues adultes et subadultes. Par conséquent, on devrait supposer que les estimations fournies comprennent les deux, sauf indication contraire. En se basant sur l’extrapolation de ces estimations de l’abondance limitées et propres aux sites, on présume qu’il y aurait plus de 5 000 individus matures (adultes) dans la population, possiblement moins de 10 000, mais ce ne sont que des estimations très approximatives.
| Localisation | Zone | NMIV (TPO)f | Année(s) | Notes | Source |
|---|---|---|---|---|---|
| Côte du Pacifique | Île de Vancouver | Total de 879 observations de 1 à 56 tortues/site/relevé (principalement des adultes) | Annuellement de 2008 à mai 2016 | 245 plans d’eau ont fait l’objet de relevés pour détecter la présence de l’espèce; elle a été trouvée dans 33. | Engelstoft et Ovaska, 2008, 2011, 2013-2014; Ovaska et Engelstoft, 2009, 2010, 2012; Engelstoft et Thorpe, 2015; Engelstoft, données inédites, 2016 |
| Côte du Pacifique | 8 sites pour l’UD entière (voir la figure 3) | 139 tortues observées, sans égard à l’âge | 2011-2012 | Des échantillons ont été prélevés chez des tortues dans 8 sites à des fins d’analyses génétiques. Nombre moyen de tortues chez lesquelles on a prélevé des échantillons par site = 17,4 (écart-type = 5,1; intervalle = 10 à 27) | Jensen, 2013 |
| Population intramontagnarde – des Rocheuses | Vallée de l’Okanagan | 826, sans égard à l’âge | 2009 | 13 plans d’eau; NMIV = 1 à 322 tortues par plan d’eau. 1 534 tortues estimées au total (IC de 95 % = 1 215-1 852)g | Tesche, 2014 |
| Population intramontagnarde – des Rocheuses | Vallée de Creston | 236 au total 199 adultes |
2013-2014 | Échantillonnage dans > 25 plans d’eau. Nombre de recaptures pas assez élevé pour des analyses de marquage-recapture; la taille de la population serait beaucoup plus élevée. | Isaac, 2014, 2016 |
| Population intramontagnarde – des Rocheuses | Nisconlith/ Shuswap | 462, sans égard à l’âge | 2009 | 15 plans d’eau; NMIV = 1 à 98 tortues par plan d’eau. | Ballin, 2010 |
| Population intramontagnarde – des Rocheuses | Revelstoke – marais de l’aéroport et marécage Montana | 43 adultes | 2010-2011 | 57 adultes capturés dans 32 sites en 2010, 43 adultes capturés dans les mêmes sites en 2011; total du NMIV adultes et du NMIV juvéniles = 76 (2010) et 57 (2011) dans les mêmes sites. | Schiller et Larsen, 2012 |
| Population intramontagnarde – des Rocheuses | Revelstoke – marais de l’aéroport et marécage Montana, lac Williamson | 81 femelles adultes, 13 mâles adultes | 2010-2011 | Nombre de tortues estimé à 242 (IC de 95 % = 160-325) « excluant les nouveau-nés » : c.-à-d. nombre d’adultes et de juvéniles calculé au moyen de la méthode de Lincoln-Petersen. | Basaraba, 2014 |
| Population intramontagnarde – des Rocheuses | 17 sites pour l’UD entière (voir la figure 3) | 336, sans égard à l’âge | 2011-2012 | Des échantillons ont été prélevés chez des tortues dans 17 sites à des fins d’analyses génétiques. Nombre moyen de tortues chez lesquelles on a prélevé des échantillons par site = 19,8 (écart-type = 7,0; intervalle = 6 à 37) | Jensen, 2013 |
f NMIV = Nombre minimal d’individus vivants
g Somme des estimations de la population pour 13 étangs au moyen de la méthode de marquage-recapture de Petersen modifiée selon Chapman.
Population des Prairies/boréale de l’Ouest – Bouclier canadien
De même, on ne dispose d’aucune estimation des effectifs à l’échelle de la population des Prairies/boréale de l’Ouest – Bouclier canadien. Compte tenu du nombre de plans d’eau réputés abriter des tortues peintes de l’Ouest dans la province faunique du Bouclier canadien et de la grande probabilité que de nombreux autres plans d’eau n’ayant pas fait l’objet de mentions de l’espèce abritent des tortues, l’estimation globale de la population est probablement de plus de 10 000 tortues adultes dans la seule province faunique du Bouclier canadien. Dans les Prairies, la situation est moins certaine. La limite nord de l’aire de répartition de l’espèce descend vers le sud lorsqu’on se dirige vers l’ouest, l’aire d’indigénat étant limitée au bassin versant de la rivière Missouri dans le sud-est de l’Alberta (figure 6). L’abondance diminue probablement vers les limites ouest de la répartition de la population, en raison de l’aire de répartition réduite et de la quantité limitée d’habitat convenable, comparativement au Bouclier canadien, qui est riche en ressources hydriques.
Fluctuations et tendances
Étant donné qu’on dispose d’un nombre très limité d’estimations de la population actuelle et qu’on ne dispose de pratiquement aucune donnée historique outre quelques mentions d’occurrence, il n’y a pas d’information disponible sur les tendances de la population. Un déclin de la population à long terme peut être inféré d’après la perte d’habitat dans certaines zones, y compris pour une grande partie de la population de la côte du Pacifique, particulièrement dans les zones des basses terres continentales et du sud de l’île de Vancouver, où la croissance de la population humaine et le développement ont été le plus marqués (voir la section Tendances en matière d’habitat pour obtenir les taux de perte de milieux humides). Des pertes abruptes de milieux humides se sont produites dans la vallée du bas Fraser et le district régional de la capitale au cours des 75 à 90 dernières années (ce qui correspond à trois générations de l’espèce). Ces deux zones représentent presque 50 % de l’aire de répartition de la population de la côte du Pacifique. Bien que le taux de perte de milieux humides ailleurs dans l’aire de répartition soit, en grande partie, peu connu, des pertes se sont presque certainement produites. On peut inférer qu’il y a eu une perte d’habitat d’au moins 35 % (70 % de l’habitat d’environ la moitié de la population) au cours des trois dernières générations.
On projette que la croissance démographique humaine à l’avenir sera de 14 % sur 10 ans et de 30 % sur 26 ans dans la Sunshine Coast, là où se trouve 65 % de la population de la côte du Pacifique, et les taux de croissance sont semblables presque partout où l’UD est présente (tableau 2).
La population intramontagnarde – des Rocheuses fait face à une situation semblable, car des pertes d’habitat sont survenues dans le passé dans une grande partie de la vallée de l’Okanagan, et on prévoit que les aménagements humains continueront à augmenter dans cette région (tableau 2). Dans la région de Kootenay-Est, l’absence d’observations de tortues peintes de l’Ouest dans les milieux humides du fleuve Columbia, entre Invermere et Golden, est surprenante. Il est possible que l’espèce y ait été plus largement répartie dans le passé (Larsen, comm. pers., 2015), mais, actuellement, il y a seulement trois localités connues dans un complexe de milieux humides s’étendant sur 140 km. De même, des tortues peintes de l’Ouest étaient fréquemment aperçues le long de la rivière Eagle, entre Revelstoke et Sicamous, en Colombie-Britannique, dans les années 1970 (Larsen, comm. pers., 2015); cependant, il n’y a aucune mention récente pour cette zone. Le manque de relevés systématiques dans une grande partie de la répartition de cette UD complique l’interprétation des données.
Une tendance générale de la population ne peut pas être inférée pour la population des Prairies/boréale de l’Ouest – Bouclier canadien.
Immigration de source externe
La capacité de recolonisation naturelle par la tortue peinte de l’Ouest au Canada est restreinte principalement par la capacité limitée de dispersion naturelle de l’espèce (voir la section Déplacements et dispersion). Si une population de tortues venait à disparaître, la recolonisation naturelle depuis les populations des États adjacents des États-Unis prendrait probablement plusieurs générations.
Population de la côte du Pacifique
La tortue peinte de l’Ouest est présente à l’ouest de la chaîne Côtière et des Cascades dans la région de Puget Sound de l’État de Washington et dans la vallée de la Willamette, en Oregon (Barela et Olson, 2014). Il y a donc des populations existantes qui pourraient immigrer et contribuer au rétablissement de la population de la côte du Pacifique. Toutefois, il est peu probable que l’espèce soit capable de recolonisation naturelle. L’habitat est très fragmenté dans la vallée du bas Fraser, en Colombie-Britannique, ce qui entrave, voire empêche, les déplacements à partir des États-Unis. La possibilité d’immigration vers l’île de Vancouver et les autres plus petites îles alentour est nulle, étant donné que ces îles sont entourées d’eau salée que les tortues d’eau douce ne peuvent traverser. Si une population disparaît, la recolonisation pourra seulement se faire par le biais d’une intervention humaine et d’une réintroduction. Les profils génétiques très variables des tortues peintes de l’Ouest présentes sur la côte de la Colombie-Britannique (Jensen et al., 2014a) compliquent toute proposition de réintroduction.
Population intramontagnarde – des Rocheuses
Les populations de la tortue peinte de l’Ouest de la région intérieure de la Colombie-Britannique semblent être, généralement, contiguës aux populations des régions adjacentes des États-Unis (Barela et Olson, 2014). Les déplacements et l’immigration se dérouleraient dans le fond des vallées généralement nord-sud où vivent les tortues (p. ex. dans le sud de la vallée de l’Okanagan et le sillon de la région de Kootenay-Est). Des déplacements est-ouest sur de grandes distances sont peu probables au sein de cette population, étant donné les chaînons accidentés qui séparent les fonds des vallées. La recolonisation à partir des États-Unis est possible, mais elle se ferait très lentement, sur de nombreuses générations.
Population des Prairies/boréale de l’Ouest – Bouclier canadien
Les populations de tortues peintes de l’Ouest des Prairies sont contiguës aux populations de l’espèce se trouvant aux États-Unis. Les bassins versants des rivières Missouri, Souris et Rouge sont tous transfrontaliers, ce qui facilite les déplacements d’un bord à l’autre de la frontière par les cours d’eau de ces bassins. Aucun obstacle important ne sépare ces bassins de ceux des rivières Qu’Appelle et Assiniboine, situés plus au nord, où sont présentes la grande majorité des tortues peintes de l’Ouest en Saskatchewan et au Manitoba. Plus loin vers l’est, dans le nord-ouest de l’Ontario, le lac Supérieur et le paysage plus accidenté du Bouclier canadien, réduisent les probabilités d’une recolonisation naturelle. Les tortues peintes de l’Ouest se seraient déplacées vers le district d’Algoma, à l’est du lac Supérieur, à partir de la haute péninsule du Michigan (Weller et al., 2010), où il y a eu intergradation avec des tortues peintes du Centre.
Menaces et facteurs limitatifs
Facteurs limitatifs
La répartition nordique des tortues peintes de l’Ouest serait limitée soit par les basses températures hivernales et/ou par des conditions d'hypoxie grave en hiver (St. Clair et Gregory, 1990). Cependant, la persistance de l’espèce et des signes de reproduction dans le parc provincial de Moonshine Lake, au nord de la rivière de la Paix, en Alberta (Kirtley-Wark, comm. pers., 2014; figure 4), depuis au moins le milieu des années 1990 semblent indiquer que la tolérance des tortues peintes de l’Ouest au froid est beaucoup plus grande qu’on le croyait. La répartition pourrait être davantage limitée par la capacité de dispersion nécessaire pour coloniser d’autres bassins versants.
Le cycle vital « lent », qui comprend une maturité tardive, des petites couvées et une grande longévité, limite le potentiel de rétablissement des populations locales après une perturbation. Étant donné que les tortues peuvent vivre durant des décennies, leur présence dans un étang, même sur de nombreuses années, peut ne pas représenter une population viable.
Menaces
Les tortues peintes de l’Ouest font face à une gamme étendue de menaces dans leur aire de répartition canadienne. Selon une classification générale, les principales menaces sont la perte/l’altération de l’habitat découlant de sources anthropiques et la mortalité routière, de l’avis des répondants au questionnaire, et ce, pour toutes les populations. La perte et l’altération de l’habitat ont diverses sources, y compris le développement résidentiel et industriel; les activités agricoles qui drainent ou remplissent les plans d’eau; le bétail de pâturage qui dégrade les plans d’eau; les espèces végétales non indigènes envahissantes, terrestres et aquatiques, qui dégradent l’habitat de nidification et les plans d’eau, respectivement; et les espèces de tortues non indigènes (tortue de Floride) qui pourraient supplanter les tortues peintes de l’Ouest ou s’hybrider avec elles (d’autres sous-espèces de tortues peintes).
L’impact global des menaces est très élevé à élevé pour la population de la côte du Pacifique; il est élevé à moyen pour la population intramontagnarde – des Rocheuses; et il est moyen pour la population des Prairies/boréale de l’Ouest – Bouclier canadien (tableau 6; voir les annexes 1 à 3 pour les calculateurs des menaces). L’impact des menaces de niveau 1 est souvent différent pour chaque population; ces menaces sont donc abordées ci-dessous de façon détaillée dans l’ordre des numéros de menace.
| # | Menace | Côte du Pacifique | Intramont./des Rocheuses | Prairies/ boréale de l’Ouest – Bouclier can. |
|---|---|---|---|---|
| 1 | Développement résidentiel et commercial | Moyen | Faible | Faible |
| 1.1 | Zones résidentielles et urbaines | Moyen | Faible | Faible |
| 1.2 | Zones commerciales et industrielles | Faible | Faible | Négligeable |
| 1.3 | Zones touristiques et récréatives | Faible | Faible | Négligeable |
| 2 | Agriculture et aquaculture | Faible | Faible | Négligeable |
| 2.1 | Cultures annuelles et pérennes de produits autres que le bois | Faible | Faible | Négligeable |
| 2.2 | Plantations pour la production de bois et de pâte | blanc | blanc | blanc |
| 2.3 | Élevage de bétail | Faible | Faible | Négligeable |
| 2.4 | Aquaculture en mer et en eau douce | blanc | blanc | blanc |
| 3 | Production d’énergie et exploitation minière | Faible | Négligeable | Faible |
| 3.1 | Forage pétrolier et gazier | blanc | blanc | Négligeable |
| 3.2 | Exploitation de mines et de carrières | Faible | Négligeable | Faible |
| 3.3 | Énergie renouvelable | blanc | blanc | blanc |
| 4 | Corridors de transport et de service | Moyen | Moyen-faible | Faible |
| 4.1 | Routes et voies ferrées | Moyen | Moyen-faible | Faible |
| 4.2 | Lignes de services publics | Négligeable | Négligeable | Négligeable |
| 4.3 | Voies de transport par eau | blanc | blanc | blanc |
| 4.4 | Corridors aériens | blanc | blanc | blanc |
| 5 | Utilisation des ressources biologiques | Faible | Faible | Faible |
| 5.1 | Chasse et capture d’animaux terrestres | Faible | Faible | Faible |
| 5.2 | Cueillette de plantes terrestres | blanc | blanc | blanc |
| 5.3 | Exploitation forestière et récolte du bois | Faible | Négligeable | Faible |
| 5.4 | Pêche et récolte de ressources aquatiques | Inconnu | Faible | Inconnu |
| 6 | Intrusions et perturbations humaines | Faible | Faible | Faible |
| 6.1 | Activités récréatives | Faible | Faible | Faible |
| 6.2 | Guerre, troubles civils et exercices militaires | blanc | blanc | blanc |
| 6.3 | Travail et autres activités | Faible | Négligeable | blanc |
| 7 | Modifications des systèmes naturels | Moyen-faible | Faible | Faible |
| 7.1 | Incendies et suppression des incendies | blanc | Inconnu | Inconnu |
| 7.2 | Gestion et utilisation de l’eau et exploitation de barrages | Moyen-faible | Faible | Faible |
| 7.3 | Autres modifications de l’écosystème | Faible | Négligeable | Inconnu |
| 8 | Espèces et gènes envahissants ou autrement problématiques | Élevé-moyen | Inconnu | Inconnu |
| 8.1 | Espèces exotiques (non indigènes) envahissantes | Élevé-moyen | Inconnu | Inconnu |
| 8.2 | Espèces indigènes problématiques | Inconnu | Inconnu | Inconnu |
| 8.3 | Matériel génétique introduit | Négligeable | Négligeable | Négligeable |
| 9 | Pollution | Inconnu | Inconnu | Inconnu |
| 9.1 | Eaux usées domestiques et urbaines | Inconnu | Inconnu | Inconnu |
| 9.2 | Effluents industriels et militaires | Inconnu | Négligeable | Négligeable |
| 9.3 | Effluents agricoles et sylvicoles | Inconnu | Inconnu | Inconnu |
| 9.4 | Déchets solides et ordures | blanc | Inconnu | blanc |
| 9.5 | Polluants atmosphériques | blanc | blanc | blanc |
| 9.6 | Apports excessifs d’énergie | blanc | blanc | blanc |
| 10 | Phénomènes géologiques | blanc | Négligeable | blanc |
| 10.1 | Volcans | blanc | blanc | blanc |
| 10.2 | Tremblements de terre et tsunamis | blanc | blanc | blanc |
| 10.3 | Avalanches et glissements de terrain | blanc | Négligeable | blanc |
| 11 | Changements climatiques et phénomènes météorologiques violents | Inconnu | Inconnu | Inconnu |
| 11.1 | Déplacement et altération de l’habitat | blanc | blanc | blanc |
| 11.2 | Sécheresses | Inconnu | Inconnu | Inconnu |
| 11.3 | Températures extrêmes | Inconnu | Inconnu | Inconnu |
| 11.4 | Tempêtes et inondations | Inconnu | Inconnu | Inconnu |
| blanc | blanc | blanc | blanc | blanc |
| blanc | Impact global des menaces (maximum de la plage d’intensité/minimum de la plage d’intensité) : | Très élevé-élevé | Élevé-moyen | Moyen-moyen |
La menace dont l’impact est le plus élevé est la menace 8 (Espèces et gènes envahissants ou autrement problématiques); son impact varie de élevé à moyen pour la population de la côte du Pacifique, mais il est « inconnu » pour la population intramontagnarde – des Rocheuses et pour la population des Prairies/boréale de l’Ouest – Bouclier canadien. Parmi les menaces dont l’impact est moyen et moyen à faible, on retrouve la menace 1 (Développement résidentiel et commercial) pour la population de la côte du Pacifique, la menace 4 (Corridors de transport et de service) pour la population de la côte du Pacifique et la population intramontagnarde – des Rocheuses et la menace 7 (Modifications des systèmes naturels) pour la population de la côte du Pacifique. Toutes les menaces touchant la population des Prairies/boréale de l’Ouest – Bouclier canadien ont un impact faible (voir le tableau 7 pour une comparaison de l’impact des catégories de menaces touchant chacune des populations).
| Impact de la menace | Pop. de la côte du Pacifique | Population intramontagnarde – des Rocheuses | Pop. des Prairies/boréale de l’Ouest – Bouclier canadien |
|---|---|---|---|
| Élevé-moyen | 8. Espèces et gènes envahissants ou autrement problématiques | blanc | blanc |
| Moyen | 1. Développement résidentiel et commercial 4. Corridors de transport et de service |
blanc | blanc |
| Moyen-faible | 7. Modifications des systèmes naturels | 4. Corridors de transport et de service | blanc |
| Faible | 2. Agriculture et aquaculture 3. Production d’énergie et exploitation minière 5. Utilisation des ressources biologiques 6. Intrusions et perturbations humaines |
1. Développement résidentiel et commercial 2. Agriculture et aquaculture 5. Utilisation des ressources biologiques 6. Intrusions et perturbations humaines 7. Modifications des systèmes naturels |
1. Développement résidentiel et commercial 3. Production d’énergie et exploitation minière 4. Corridors de transport et de service 5. Utilisation des ressources biologiques 6. Intrusions et perturbations humaines 7. Modifications des systèmes naturels |
| Inconnu | 9. Pollution 11. Changements climatiques et phénomènes météorologiques violents |
8. Espèces et gènes envahissants ou autrement problématiques 9. Pollution 11. Changements climatiques et phénomènes météorologiques violents |
8. Espèces et gènes envahissants ou autrement problématiques 9. Pollution 11. Changements climatiques et phénomènes météorologiques violents |
Menace 1 : Développement résidentiel et commercial
La perte d’habitat, à la fois d’étangs productifs et de l’habitat de nidification naturel, est une des principales menaces pesant sur la tortue peinte de l’Ouest dans certaines parties de son aire de répartition. La perte d’habitat est souvent totale quand les milieux humides sont remblayés à des fins de développement résidentiel et commercial. Les milieux non touchés par la perte d’habitat sont souvent modifiés par la fragmentation des aires estivales et de nidification, la dégradation des rives et de zones riveraines, les changements à l’hydrologie locale et la contamination de l’eau. Les taux de développement sont abordés à la section Tendances en matière d’habitat pour chacune des populations. Les nouveaux projets de développement résidentiel et commercial sont surtout une menace pour la population de la côte du Pacifique et dans des zones particulières pour la population intramontagnarde – des Rocheuses (p. ex. la vallée de l’Okanagan) et la population des Prairies/boréale de l’Ouest – Bouclier canadien (p. ex. Regina).
En plus de constituer une menace directe pour l’habitat de la tortue peinte de l’Ouest, les nouveaux projets de développement résidentiel et commercial aggravent aussi l’impact de plusieurs autres menaces, particulièrement à cause de l’agrandissement de réseaux routiers près des plans d’eau, ce qui augmente les risques que représentent la mortalité routière (menace 4), les espèces envahissantes (menace 8), la perte de structures d’exposition au soleil et les modifications de l’habitat de nidification (menace 7), la possibilité accrue de récolte d’individus pour en faire des animaux de compagnie ou à des fins de consommation (menace 5) et la pollution accrue (menace 9).
Menace 2 : Agriculture et aquaculture
Dans les milieux agricoles, la perte d’habitat découle souvent de la conversion de milieux humides en terres arables ou en pâturages. Les endroits où il n’y a pas de perte d’habitat peuvent être touchés par des activités entraînant p. ex. des changements à l’hydrologie locale ou par la dégradation de sites de nidification due au labourage. Les perturbations des milieux humides peu profonds par le bétail peuvent causer une importante dégradation des rives et des zones riveraines dans les paysages dégagés des prairies, les parcours dans les piémonts et les parcours semi-désertiques. Les perturbations physiques de l’habitat sont probablement plus problématiques que la pollution de l’eau par le bétail. Lindsay et Dorcas (2001) ont constaté que les tortues peintes, en Caroline du Nord, ne sont pas trop touchées par le bétail ayant accès aux plans d’eau. L’enlèvement du couvert végétal indigène, l’érosion des berges, le compactage du sol et la pollution de l’eau (ou l’eutrophisation, si un milieu humide est surchargé de déchets azotés) qui s’ensuivent peuvent tous avoir une incidence sur les tortues. On prévoit que peu de nouvelles terres seront converties à l’agriculture au cours des dix prochaines années; cependant, on peut s’attendre à une intensification de l’exploitation des terres agricoles existantes, particulièrement dans les zones agricoles où se trouve la population de la côte du Pacifique.
Menace 3 : Production d’énergie et exploitation minière
La production d’énergie et l’exploitation minière ne sont pas considérées comme des menaces importantes pour les populations se trouvant en Colombie-Britannique. On prévoit que peu de nouvelles mines ouvriront dans les zones de basse altitude où les tortues peintes de l’Ouest sont présentes en Colombie-Britannique, et il n’y a pas d’exploration ni d’exploitation pétrolières dans l’aire de répartition de la tortue peinte de l’Ouest dans la province. Toutefois, pour la population des Prairies/boréale de l’Ouest – Bouclier canadien, à la fois l’exploration et l’exploitation pétrolières ainsi que l’exploitation minière représentent des menaces potentielles. Des activités d’exploitation pétrolière d’envergure sont en cours dans le bassin de Williston, dans le sud de la Saskatchewan (Morgan, 2014), qui chevauche directement la répartition de la tortue peinte de l’Ouest. L’impact le plus important découlera probablement de l’agrandissement du réseau routier qui augmentera le risque de mortalité routière (voir la menace 4 : Corridors de transport et de service). L’ampleur des perturbations directes sur les tortues/l’habitat des tortues est inconnue, mais peut comprendre la modification de la quantité et de la qualité de l’eau, en particulier la perturbation potentielle des eaux souterraines due aux méthodes de fracturation hydraulique utilisées pour accéder au pétrole. L’exploitation minière est une menace potentielle localisée dans le nord-ouest de l’Ontario, où les sites d’exploration sont nombreux.
Menace 4 : Corridors de transport et de service
Les routes qui traversent des milieux humides ou qui sont près de ceux-ci sont une importante cause de mortalité pour les tortues peintes de l’Ouest, et elles créent des obstacles à la migration et à la dispersion (Gillies et St. Clair, 1997; COSEWIC, 2006; Griffin, 2007; Engelstoft et Ovaska, 2013). Un taux de mortalité atteignant jusqu’à 13 % de la population de tortues locale estimée a été enregistré (Griffin, 2007) au cours d’une année où les milieux humides de l’ouest du Montana se sont asséchés, forçant les tortues à se déplacer vers d’autres étangs. Les répondants au questionnaire dans le cadre de ce rapport ont régulièrement déclaré que la mortalité routière était la principale menace ou la deuxième menace en ordre d’importance pesant sur les tortues peintes de l’Ouest dans leur aire de répartition. Cependant, la mortalité routière ne se traduit pas nécessairement par un déclin des populations locales. Dorland et al. (2014) ont vérifié si les étangs à proximité de routes avaient fait l’objet de déclins de la population de tortues, comparativement aux étangs qui n’étaient pas touchés par cette menace, et ils n’ont constaté aucune différence.
La densité du réseau routier varie considérablement dans l’aire de répartition canadienne de la tortue peinte de l’Ouest (figures 8 et 9). Par exemple, les routes sont relativement rares dans le nord-ouest de l’Ontario. En Colombie-Britannique, cependant, la densité du réseau routier peut être assez élevée, particulièrement dans la partie de la vallée du bas Fraser occupée par la population de la côte du Pacifique. Dans le cas de la population intramontagnarde – des Rocheuses, la plupart des routes à forte circulation se trouvent au fond des vallées, et c’est là aussi que se trouvent les tortues peintes de l’Ouest. En ce qui concerne la population des Prairies/boréale de l’Ouest – Bouclier canadien, les routes sont réparties de façon plus uniforme dans le paysage, particulièrement dans les Prairies. En outre, la densité de la circulation sur ces routes varie aussi considérablement. L’exploration pétrolière dans le sud des Prairies pourrait augmenter de façon significative la densité du réseau routier dans les dix prochaines années et au-delà pour la population des Prairies/boréale de l’Ouest – Bouclier canadien.
Certaines études semblent indiquer que les routes ont une incidence principalement sur les femelles, parce qu’elles coupent les corridors de déplacement entre les milieux aquatiques et l’habitat de nidification à proximité (Baldwin et al., 2004). Ainsi, on a observé des populations chez lesquelles le rapport des sexes est biaisé en faveur des mâles dans les milieux humides associés à des zones où la densité du réseau routier est élevée (Aresco, 2004; Steen et Gibbs, 2004). D’autres auteurs n’ont observé aucun biais lié au sexe en ce qui concerne la mortalité routière (Griffin, 2007). Les nouveau-nés sont aussi touchés, parce qu’ils suivent aussi ce corridor traversé par des routes pour se rendre depuis le nid où ils sont nés jusqu’à des plans d’eau.
Les routes pourraient aussi attirer les femelles en période de ponte, car les matériaux de remblayage ou les talus exposés le long des routes peuvent constituer un substrat idéal pour la nidification. C’est ce qui est arrivé à Cranbrook, en Colombie-Britannique, à la fin des années 1990, lorsque des tortues peintes de l’Ouest au lac Elizabeth ont été tuées en grand nombre lorsqu’elles traversaient la route 3 pour accéder à un talus exposé utilisé comme habitat de nidification (Gillies et St. Clair, 1997).
La mortalité routière peut modifier la structure des populations de tortues, étant donné que leur cycle vital est caractérisé par un taux de recrutement annuel faible, un taux de survie élevé des adultes et une maturité sexuelle tardive (Steen et Gibbs, 2004). Combinées, ces caractéristiques limitent considérablement la capacité des populations de tortues à faire face à un taux de mortalité accru des adultes (voir par exemple Brooks et al., 1991; mais voir aussi Dorland et al.,2014). Les routes peuvent aussi avoir une incidence sur la diversité génétique des tortues peintes. Laporte et al. (2013) ont rapporté une diversité de l’ADN mitochondrial réduite (jusqu’à trois fois moins d’haplotypes) chez les populations de tortues peintes du Centre vivant près de routes dans l’est du Québec, comparativement aux populations non touchées par la menace que représentent les routes.
Les routes ont un impact négatif sur la qualité des milieux humides, et leur influence peut s’étendre sur un rayon de plus de 100 m (Forman et Deblinger, 2000). La construction de routes dans le voisinage immédiat de milieux humides peut aussi détruire directement les nids de tortues (Maltby, 2000). De plus, les routes constituent des corridors linéaires facilitant la dispersion et la stratégie d’alimentation des prédateurs des tortues, notamment les ratons laveurs, les mouffettes, les coyotes et les renards (Frey et Conover, 2006). Les routes alentour des milieux humides peuvent donc augmenter considérablement les taux de prédation, particulièrement dans le cas des petites tortues qui se déplacent lentement et de leurs œufs qui sont relativement accessibles.
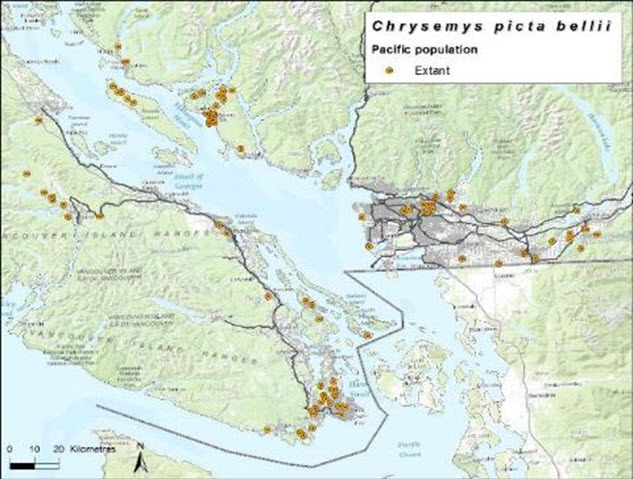
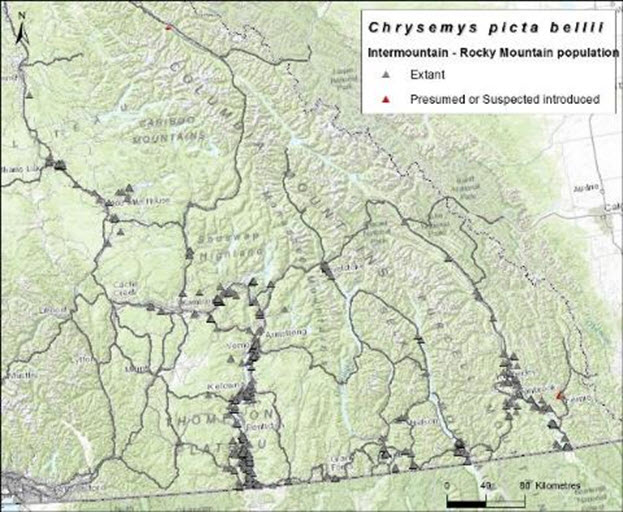
Description longue pour la figure 8
Deux cartes illustrant l’emplacement des principales routes par rapport à la population de la côte du Pacifique (carte du haut) et à la population intramontagnarde – des Rocheuses (carte du bas) de la tortue peinte de l’Ouest.
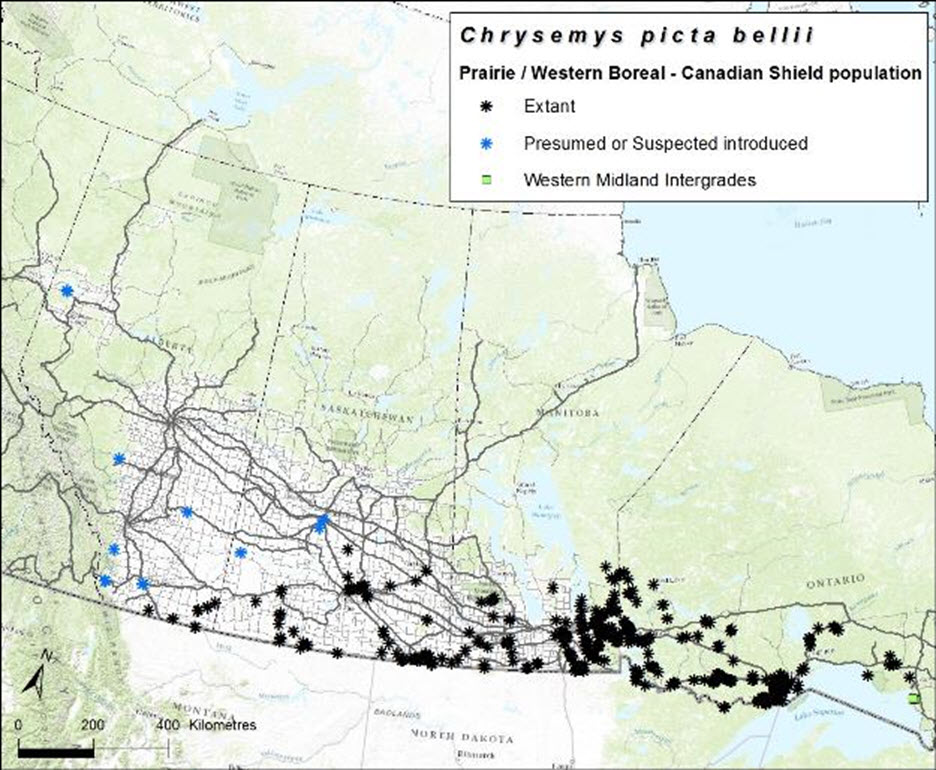
Description longue pour la figure 9
Deux cartes illustrant l’emplacement des principales routes par rapport à la population des Prairies/boréale de l’Ouest – Bouclier canadien de la tortue peinte de l’Ouest.
Menace 5 : Utilisation des ressources biologiques
Les tortues peintes de l’Ouest sont parfois capturées comme animaux de compagnie, particulièrement par des familles avec de jeunes enfants. On ne sait pas si la récolte d’individus à ces fins est suffisamment élevée pour nuire aux populations locales, mais si cela arrive de façon répétée au cours d’une même saison dans une zone où la population de tortues est déjà peu nombreuse, cela pourrait réduire la viabilité à l’échelle locale. Il faut se préoccuper davantage, peut-être, de la détermination et de la gestion des plans d’eau utilisés par des tortues peintes de l’Ouest indigènes par opposition à ceux utilisés par des tortues peintes de l’Ouest introduites. L’introduction d’un prédateur de niveau moyen, comme la tortue peinte de l’Ouest, dans un nouveau plan d’eau aura probablement des impacts écologiques sur l’écosystème. Si des tortues peintes de l’Ouest sont déjà présentes, le fait d’introduire des haplotypes potentiellement très différents chez cette population pourrait avoir des conséquences sur la valeur d’adaptation des individus.
La récolte de tortues qui vivent longtemps peut être problématique, parce que leur longévité est associée à une faible fécondité, à une maturité sexuelle tardive et à un taux de survie élevé des adultes, ce qui signifie que les populations ne peuvent pas demeurer stables (ou augmenter) lorsque les individus adultes ou les juvéniles plus âgés font l’objet de taux de récolte élevés (Congdon et al., 1993; Kiester et Olson, 2011). Bien que le commerce des animaux de compagnie et la récolte à des fins de consommation représentent une menace pour de nombreuses espèces de tortues (Gibbons et al.,2000; Kiester et Olson, 2011), ils ne sont pas considérés comme une menace importante pour la tortue peinte de l’Ouest au Canada pour le moment, mais pourraient devenir un problème dans le cas de certaines sous-populations, particulièrement dans la Sunshine Coast (Evelyn, comm. pers., 2016). On a conclu que la récolte de tortues peintes de l’Ouest au Minnesota avait probablement eu un impact sur les populations, mais on ne sait pas si une récolte élevée pouvait être considérée comme durable (Gamble et Simons, 2004). La pêche à la ligne contribue aussi à la mortalité des tortues; des tortues ont été trouvées mortes avec le bas de leur mâchoire déchiré par des hameçons, les rendant incapables de se nourrir (COSEWIC, 2006; Welstead, comm. pers., 2015).
Les impacts de l’exploitation forestière ne touchent essentiellement que quelques sites de la population de la côte du Pacifique dans les zones de la Sunshine Coast et de la vallée Alberni (Western Painted Turtle Recovery Team, 2016) et dans le nord-ouest de l’Ontario. En Colombie-Britannique, le règlement exige rarement une bande riveraine de plus de 30 m durant la récolte, et, selon les conclusions de Semlitsch et Bodie (2003), cela ne suffit pas pour protéger les reptiles et les amphibiens. Les activités d’exploitation forestière nécessitent aussi des réseaux de routes étendus, ce qui expose davantage les populations locales à la mortalité routière (menace 4). Elles sont considérées comme une menace négligeable pour la tortue peinte de l’Ouest, population intramontagnarde – des Rocheuses, parce que les forêts commercialisables sont peu nombreuses alentour de la majorité des milieux humides où vivent les individus de l’espèce.
Menace 6 : Intrusions et perturbations humaines
Les tortues adultes peuvent être perturbées par les gens et leurs animaux de compagnie près de leurs lieux de nidification (Gervais et al., 2009). Les femelles en période de ponte pourraient abandonner leur tentative de creusement de nid si elles sont dérangées par des humains ou des animaux de compagnie en liberté (Maltby, 2000). Cela pourrait les inciter à retourner dans un milieu humide et à entreprendre une nouvelle tentative de nidification plus tard. Ce faisant, elles passent plus de temps hors de l’eau et sont davantage exposées aux prédateurs et à la mortalité routière.
Les humains peuvent aussi avoir une incidence directe sur les tortues peintes de l’Ouest s’ils les perturbent dans leurs sites de nidification ou d’exposition au soleil, ce qui arrive couramment dans les lieux récréatifs populaires (Maltby, 2000; COSEWIC, 2006) ou s’ils les capturent comme animaux de compagnie (Orchard, 1986). Les perturbations involontaires, p. ex. le fait de creuser le sable ou le gravier fin des plages, peuvent affecter les œufs ou augmenter les probabilités de prédation des nids après que les humains soient partis. D’autres facteurs de stress environnementaux liés à la dégradation de l’habitat pourraient aussi se traduire par le développement de maladies (Gibbons et al., 2000).
Menace 7 : Modifications des systèmes naturels
L’utilisation de l’eau souterraine et/ou de surface peut avoir une incidence sur l’habitat des tortues (quantité d’eau). La quantité d’eau, particulièrement dans le sud des Prairies, peut constituer un problème pour les tortues peintes. L’utilisation moyenne d’eau sur 30 ans (de 1980 à 2009) dans les bassins versants des rivières Missouri et Souris est considérée comme « élevée » (plus de 40 % de l’eau de surface disponible est utilisée), ce qui correspond à un « stress hydrique élevé » (Environment Canada, 2012). Elle est considérée comme « modérée » (de 10 à 20 % de l’eau disponible est utilisée) dans le bassin versant de la rivière Assiniboine pour la même période. Seul le bassin de l’Okanagan a été analysé pour la Colombie-Britannique. On lui a attribué la cote « moyenne » (de 20 à 40 % de l’eau disponible est utilisée, ce qui indique que l’approvisionnement et la demande en eau doivent être gérés). D’autres régions se sont vu attribuer la cote « faible » (< 10 % de l’eau disponible est utilisée) (Environment Canada, 2012).
La prolifération des graminées et des espèces végétales envahissantes dans les lieux de nidification constitue une menace importante pour les tortues, parce que cela limite la quantité d’habitat de nidification disponible. La végétation peut être utilisée par les femelles en période de ponte pour se cacher, mais les racines des plantes peuvent compliquer le creusement de nids, et l’ombrage peut réduire la température du sol (Maltby, 2000). Des températures du sol plus basses peuvent modifier la température de nids, ce qui peut avoir une incidence sur la détermination du sexe des tortues, qui dépend de la température, et sur le rapport des sexes de la couvée (Refsnider et Janzen, 2012). La non-disponibilité de nids et la mauvaise qualité des sites de nidification près des milieux humides peuvent faire en sorte que les tortues doivent chercher des zones plus convenables à la nidification, ce qui peut les faire traverser des routes plus souvent.
En plus de réduire l’habitat de nidification disponible, les plantes envahissantes représentent également une menace directe pour les tortues durant leur développement. Les racines de plantes peuvent pousser à travers les nids sous le sol, pénétrer dans les œufs et s’enchevêtrer autour des nouveau-nés (Maltby, 2000), causant leur mortalité directe. Elles peuvent gêner physiquement les nouveau-nés au moment où ceux-ci tentent de sortir du nid ou les envelopper complètement, entraînant leur mort (Maltby, 2000). La mortalité accrue des nouveau-nés aggrave leur taux de survie naturellement faible (Iverson, 1991) et réduit davantage le recrutement (Gervais et al., 2009).
Menace 8 : Espèces et gènes envahissants ou autrement problématiques
On sait que les ouaouarons (Lithobates catesbeianus) se nourrissent de nouveau-nés de la tortue peinte de l’Ouest (Jancowski et Orchard, 2013) et de la tortue de l’Ouest (Actinemys marmorata) (Sloan, 2012). Cette menace est le plus marquée pour la population de la côte du Pacifique sur l’île de Vancouver et dans les basses terres continentales de la Colombie-Britannique. Cependant, les ouaouarons sont aussi présents à plusieurs localités de la population intramontagnarde – des Rocheuses, notamment dans le sud de la vallée de l’Okanagan (BC Frogwatch, 2015); à Nelway, en Colombie-Britannique, dans la région de Kootenay-Ouest (Anderson, comm. pers., 2015); à moins de 7 km de la frontière canadienne avec l’Idaho, en amont de Creston, en Colombie-Britannique (Beaucher, comm. pers., 2015) et dans un petit lac près de Brisco, en Colombie-Britannique (Conroy, comm. pers., 2016).
Les tortues de Floride sont souvent abandonnées et relâchées par leurs propriétaires dans de nombreux plans d’eau; de tels cas ont principalement été documentés dans les zones occupées par la population de la côte du Pacifique. On sait maintenant que les tortues de Floride se reproduisent avec succès, au moins à l’occasion, dans le sud-ouest de la Colombie-Britannique (Welstead, comm. pers., 2015a). Dans les basses terres continentales, 15 % des tortues peintes de l’Ouest capturées à des fins de translocation présentaient des maladies respiratoires, qui leur ont probablement été transmises par des tortues de Floride (Welstead, comm. pers., 2015c). L’incertitude est grande, cependant, en ce qui concerne les effets qu’ont les espèces introduites sur la population, et, par conséquent, une fourchette de valeurs est attribuée à la gravité de cette menace (modérée à élevée).
La prédation des nids de tortue par divers prédateurs, comme les ratons laveurs, les mouffettes, les coyotes et les renards, est très commune. Au Québec, les ratons laveurs sont le principal prédateur des nids de tortues peintes : 85,7 % des nids ont été détruits la nuit même où les œufs avaient été pondus (Christens et Bider, 1987). Les nids sont exposés à un risque élevé de prédation s’ils sont regroupés et près du rivage, parce que les ratons laveurs se nourrissent près des bords des étangs (Marchand et Litvaitis, 2004). La destruction de nids par des prédateurs constitue une menace immédiate à la survie des nouveau-nés, puisque les œufs sont mangés par les prédateurs. Non seulement le taux de survie des nouveau-nés d’un nid pillé par un prédateur sera nul, mais cela aura une incidence sur la structure globale de la population, étant donné qu’aucun juvénile ne sera recruté.
Il semble que le nombre de goélands et de mouettes et de ratons laveurs, des commensaux des humains, soit en train d’augmenter dans certaines localités, et il en va de même du nombre de grands hérons (Ardea herodias) et de mouffettes, qui sont des prédateurs des nids et des nouveau-nés. Les proliférations de cyanobactéries saisonnières dans plusieurs sites (p. ex. au lac Swan et au lac Beaver [île de Vancouver]) peuvent avoir une incidence négative sur les tortues, mais on ne dispose d’aucune donnée à cet égard. Le taux de prédation des nids au lac Burnaby est de 100 % si les nids ne sont pas protégés (Western Painted Turtle Recovery Team, 2016). Il est difficile de distinguer les niveaux de prédation naturels des niveaux de prédation accrus résultant de la modification de l’habitat par l’humain. La valeur « inconnue » est donc attribuée à la gravité de cette menace dans les calculateurs des menaces.
Il existe des preuves d’hybridation avec d’autres sous-espèces de tortues peintes au lac Burnaby (Jensen et al., 2014b), cette hybridation étant probablement associée à la remise en liberté d’individus de sous-espèces de C. picta vendus dans des animaleries. Les impacts à long terme de cette hybridation intraspécifique ne sont pas clairs.
Menace 9 : Pollution
Le nombre de produits chimiques utilisés à des fins industrielles et agricoles continue d’augmenter. On connaît mal les effets de ces polluants sur les reptiles (Pauli et al.,2010). Étant donné que les tortues peintes de l’Ouest vivent fréquemment dans des plans d’eau à l’intérieur de zones urbaines, recevant les eaux de ruissellement et les rejets provenant de diverses sources, et qu’elles accumulent des toxines au cours de leur vie qui est relativement longue, la pollution constitue un risque important pour elles. L’exposition aux contaminants est considérée comme une des six principales causes du déclin des reptiles à l’échelle mondiale (Gibbons et al., 2000).
Les biphényles polychlorés (BPC), les pesticides organochlorés, les dioxines et les furanes peuvent s’accumuler dans les tissus des organismes aquatiques, y compris chez les tortues. Dans la région industrielle du sud de l’Ontario, les résidus toxiques dans le foie et les tissus adipeux de tortues serpentines (Chyledra serpentina) atteignent communément des concentrations supérieures aux valeurs recommandées pour la consommation humaine (de Solla et Fernie, 2004). Ces toxines se bioaccumulent en fortes concentrations chez les tortues serpentines, une espèce longévive. Étant donné que les tortues peintes vivent au moins aussi longtemps que les tortues serpentines (Congdon et al., 2003; Samson, 2003), on peut s’attendre à ce que les tortues peintes adultes aient aussi accumulé des concentrations élevées de ces résidus dans les sites où ces produits chimiques sont présents à des concentrations élevées dans le milieu aquatique. Dans une étude sur les tortues molles à épines (Apalone spinifera) dans le sud de l’Ontario, par exemple, de Solla et al. (2003) ont constaté que les concentrations de BPC et de pesticides contaminants étaient corrélées positivement avec la viabilité des œufs. Il n’y avait, toutefois, aucun signe indiquant que les BPC ou les pesticides ont des effets négatifs sur le succès d’éclosion. Crews et al. (1995) ont remarqué que les BPC pouvaient modifier la structure d’une population de tortues peintes en inversant le sexe des gonades à des températures qui, autrement, auraient produit des mâles. Malgré que l’intensité d’industrialisation ne soit généralement pas la même dans le centre et l’ouest du Canada, les pesticides, les herbicides et les engrais chimiques sont utilisés sur l’ensemble des parcours, des terres cultivées, des vignobles et des vergers. Certains milieux humides pourraient être plus touchés que d’autres par ces apports toxiques, selon leurs caractéristiques bathymétriques et hydrologiques et l’exposition aux produits chimiques (proximité et concentrations). Même si l’utilisation de ces pesticides est répandue, très peu de recherches ont été effectuées concernant leurs effets sur les reptiles, y compris les tortues (Pauli et al., 2010).
On a observé la pulvérisation d’herbicides à base de glyphosate sur des nids de tortue peinte de l’Ouest de la population de la côte du Pacifique au marécage Nicomen. Chez les tortues de Floride, il a été démontré que le glyphosate diminue le succès d’éclosion et entraîne des déformations génétiques, mais à des doses plus élevées que celles généralement utilisées dans la plupart des produits appliqués (Sparling et al., 2006 in de Solla, 2010).
Il a également été démontré que plusieurs polluants émergents, notamment des fongicides, des composés perfluorés (PFC), des produits ignifuges bromés, des agents de surface anioniques et des antibiotiques, s’accumulent chez diverses espèces de tortues (McConnell et Sparling, 2010). Actuellement, on connaît peu les impacts, principalement en raison du manque de recherches. Dans le cadre d’une étude, on a observé l’inversion du sexe chez des tortues serpentines durant l’incubation à des températures qui, habituellement, favorisent le sexe masculin (Place et al., 2001).
La majorité de la contamination par la pollution se produit dans les grandes zones urbaines, y compris dans les basses terres continentales de la Colombie-Britannique (population de la côte du Pacifique). La lagune Lost dans le parc Stanley, à Vancouver, est essentiellement un bassin de retenue des eaux pluviales. De nombreux autres plans d’eau en Colombie-Britannique sont également très près de routes et reçoivent des eaux de ruissellement contaminées. La baignade est d’ailleurs interdite dans de nombreux lacs des basses terres continentales en raison de concentrations élevées de coliformes. On ne connaît pas les impacts de cette pollution sur les tortues peintes de l’Ouest, malgré que, en Caroline du Nord, les tortues peintes n’ont pas semblé être affectées par l’accès du bétail à l’eau ni par la pollution de l’eau qui en résulte (Lindsay et Dorcas, 2001).
Menace 11 : Changements climatiques et phénomènes météorologiques violents
Les changements climatiques auront probablement des effets variables à l’échelle de l’aire de répartition de la tortue peinte de l’Ouest. En Colombie-Britannique, particulièrement dans la région intérieure du sud de la Colombie-Britannique, les changements prévus consistent, généralement, en des températures plus élevées et des conditions plus humides dans l’ensemble. Cependant, on prévoit que la majorité des précipitations tomberont pendant les mois d’hiver (plus sous forme de pluie que de neige, particulièrement dans les basses altitudes où les tortues sont présentes) et que les étés et le début de l’automne seront beaucoup plus secs (Murdock et Werner, 2011; Hamlet et al.,2013). Des sécheresses plus importantes sont prévues dans les Prairies (Sauchyn et Kulshreshtha, 2008). Les changements climatiques pourraient aussi avoir une incidence sur la disponibilité de l’eau, accentuant les autres besoins en eau (voir la menace 7 : Modifications des systèmes naturels).
On présume que les changements climatiques ont un impact négatif sur les espèces chez lesquelles la détermination du sexe dépend de la température, comme les tortues peintes, car ils peuvent avoir comme effet de biaiser le rapport des sexes (Janzen, 1994). Il a été démontré que les tortues femelles font preuve de plasticité relativement au moment de la nidification et du choix des sites de nidification, ce qui semble indiquer qu’elles ont probablement un certain contrôle sur les conditions thermiques de leurs nids (Janzen et Morjan, 1997; Schwanz et Jansen, 2008). Il est donc possible que la phénologie de la reproduction puisse s’adapter chez les femelles en réponse au changement des températures, bien que les températures estivales après la ponte puissent avoir un effet plus marqué dans la détermination du rapport des sexes de la couvée (Schwanz et Janzen, 2008).
Une augmentation de la température moyenne liée aux changements climatiques pourrait avoir une incidence grave sur les tortues, car cela pourrait donner lieu à des populations d’individus d’un seul sexe (Mitchell et al., 2008); cependant, d’autres auteurs estiment que les fluctuations de la température pourraient avoir des conséquences différentes (Escobedo-Galvan, 2013). Il se pourrait que cela ne soit pas important dans le cas des populations canadiennes, puisqu’elles existent à la limite nord de la répartition mondiale de l’espèce, qui s’étend bien plus loin au sud, là où les températures naturelles sont semblables à celles attendues en raison des changements climatiques.
Nombre de localités
La façon la plus logique de définir une localité de la tortue peinte de l’Ouest sur la base d’une menace serait à l’échelle du plan d’eau ou du bassin versant. En Colombie-Britannique et en Ontario, il pourrait s’agir d’un étang ou d’un petit lac qu’une menace (p. ex. déversement de produit chimique, remblayage, assèchement) pourrait détruire ou dont l’habitat serait susceptible d’être altéré assez rapidement, affectant toutes les tortues présentes dans ce site. Dans certains cas, il peut s’agir d’un complexe de milieux humides plus grand (p. ex. les milieux humides de la vallée de Creston dans le sud-est de la Colombie-Britannique qui peuvent être considérés comme étant une « localité »).
Si la définition à l’échelle du plan d’eau est appliquée, la population de la côte du Pacifique compte 82 localités connues (BC Ministry of Forests, Lands and Natural Resource Operations, données inédites). Toutefois, bon nombre de ces localités n’abritent probablement pas des populations autosuffisantes. Dans le cas de la population intramontagnarde – des Rocheuses, des observations ont été effectuées dans environ 200 plans d’eau distincts, qui pourraient se qualifier comme des localités.
Il est plus difficile d’estimer le nombre de localités dans le cas de la population des Prairies/boréale de l’Ouest – Bouclier canadien, parce que, dans les Prairies, les tortues peintes de l’Ouest vivent davantage dans des cours d’eau, bien que bon nombre d’occurrences se rapportent à des lacs en croissant isolés. On pourrait donc délimiter une localité en fonction d’une certaine distance ou d’un tronçon de rivière. Quoi qu’il en soit, le nombre de localités pour l’UD atteint facilement plusieurs centaines, lorsqu’on tient compte des lacs et des étangs occupés dans la province faunique du Bouclier canadien.
Si on considère qu’une localité englobe plusieurs plans d’eau situés à proximité, le nombre de localités sera réduit (p. ex. il y a 36 « unités démographiques » dans la côte du Pacifique qui combinent les plans d’eau à proximité). Les feux de forêts catastrophiques, l’éclosion de maladies, les sécheresses ou d’autres menaces pourraient potentiellement affecter les tortues peintes de l’Ouest à une échelle plus régionale. Il est plus difficile d’estimer le nombre total de localités selon ce scénario, mais chacune des populations compte probablement quand même bien au-delà de dix localités.
Protection, statuts et classements
Statuts et protection juridiques
La population de la côte du Pacifique (aussi connue comme la « pop. 1 » en Colombie-Britannique) et la population intramontagnarde – des Rocheuses (la « pop. 2 » en Colombie-Britannique) de la tortue peinte de l’Ouest ont toutes les deux été inscrites à l’annexe 1 de la Loi sur les espèces en péril en 2007 à titre d’espèce en voie de disparition et d’espèce préoccupante, respectivement.
En Colombie-Britannique, les tortues peintes de l’Ouest sont protégées en vertu du Wildlife Act de la province, qui interdit de tuer, de capturer et de harceler tous les vertébrés indigènes sans permis. De façon générale, la possession de tortues peintes de l’Ouest est interdite en vertu des lois provinciales sur la faune en Colombie-Britannique, en Alberta et en Saskatchewan, sauf si on détient un permis ou une licence. Au Manitoba, la tortue peinte de l’Ouest a été déclarée espèce protégée en 2015 et inscrite à la section 6 de la Loi sur la conservation de la faune de la province; par conséquent, la capture d’individus pour une utilisation personnelle n’est plus permise. En Ontario, il est interdit de capturer ou de tuer des tortues peintes de l’Ouest, une espèce qui est inscrite à titre de « reptile spécialement protégé » à l’annexe 9 de la Loi de 1997 sur la protection du poisson et de la faune de la province. Même si, en Alberta, on a attribué la cote S1 à la tortue peinte de l’Ouest (tableau 8), étant donné que son aire d’indigénat est très limitée, l’espèce n’est pas inscrite sur la liste des espèces en voie de disparition en vertu du Wildlife Act de la province (Government of Alberta, 2014).
| Échelle | Autorité resp. | Taxon | NatureServeh |
|---|---|---|---|
| Mondiale | blanc | C. picta | G5 |
| Mondiale | blanc | C. p. bellii | G5T5 |
| Mondiale | blanc | C. p. bellii, côte du Pacifique | G5T2 |
| Mondiale | blanc | C. p. bellii, intramontagnarde – des Rocheuses | G5T2/T3 |
| Mondiale | blanc | C. p. bellii, Prairies/boréale de l’Ouest – Bouclier canadien | G5TNR |
| Nationale | Canada | C. picta | N5 |
| Nationale | Canada | C. p. bellii | N4N5 |
| Nationale | Canada | C. p. bellii, côte du Pacifique | N2 |
| Nationale | Canada | C. p. bellii, intramontagnarde – des Rocheuses | N2N3 |
| Nationale | Canada | C. p. bellii, Prairies/boréale de l’Ouest – Bouclier canadien | NNR |
| Nationale | États-Unis | C. picta | N5 |
| Nationale | États-Unis | C. p. bellii | N5 |
| Infranationale : Canada | Colombie-Britannique | C. p. bellii, côte du Pacifique | S2 |
| Infranationale : Canada | Colombie-Britannique | C. p. bellii, intramontagnarde – des Rocheuses | S2S3 |
| Infranationale : Canada | Alberta | C. p. bellii, Prairies/boréale de l’Ouest – Bouclier canadien | S1 |
| Infranationale : Canada | Saskatchewan | C. p. bellii | SNR |
| Infranationale : Canada | Manitoba | C. p. bellii | S4 |
| Infranationale : Canada | Ontario | C. p. bellii | S3? |
| Infranationale : États-Unis | Washington | C. picta | S4S5 |
| Infranationale : États-Unis | Oregon | C. picta | S2 |
| Infranationale : États-Unis | Idaho | C. picta | S4 |
| Infranationale : États-Unis | Montana | C. picta | S4 |
| Infranationale : États-Unis | Wyoming | C. p. bellii | S4 |
| Infranationale : États-Unis | Utah | C. picta | SNA |
| Infranationale : États-Unis | Colorado | C. p. bellii | S5 |
| Infranationale : États-Unis | Arizona | C. p. bellii | S1 |
| Infranationale : États-Unis | Nouveau-Mexique | C. p. bellii | SNR |
| Infranationale : États-Unis | Dakota du Nord | C. picta | SNR |
| Infranationale : États-Unis | Dakota du Sud | C. picta | S5 |
| Infranationale : États-Unis | Nebraska | C. picta | S5 |
| Infranationale : États-Unis | Kansas | C. picta | S5 |
| Infranationale : États-Unis | Oklahoma | C. p. bellii | S2 |
| Infranationale : États-Unis | Texas | C. p. bellii | S1 |
| Infranationale : États-Unis | Minnesota | C. picta | S5 |
| Infranationale : États-Unis | Wisconsin | C. p. bellii | SNR |
| Infranationale : États-Unis | Michigan | C. picta | S5 |
| Infranationale : États-Unis | Iowa | C. picta | S5 |
| Infranationale : États-Unis | Missouri | C. p. bellii | S5 |
| Infranationale : États-Unis | Illinois | C. p. bellii | S5 |
h Cotes de NatureServe : G : mondiale; N : nationale; S : infranationale; 1 = gravement en péril; 2 = en péril; 3 = préoccupante, susceptible de disparaître du territoire ou de la planète; 4 = apparemment non en péril; 5 = manifestement répandue, abondante et non en péril; NA = non applicable; NR = non classée (classement non établi). Les cotes doubles (p. ex. N2N3) signifient qu’il y a incertitude. T = taxon infraspécifique.
Statuts et classements non juridiques
La cote mondiale G5T5 a été attribuée à la tortue peinte de l’Ouest (« manifestement répandue, abondante et non en péril »). Les cotes nationales au niveau de la sous-espèce indiquent aussi que cette dernière n’est pas en péril si on tient compte de son aire de répartition en entier (tableau 8). Les cotes infranationales attribuées à la tortue peinte de l’Ouest varient selon le taxon et l’autorité compétente. Dans de nombreux États des États-Unis, à l’intérieur de l’aire de répartition de la tortue peinte de l’Ouest, on n’attribue pas de cote au niveau infraspécifique (tableau 8). Les cotes infranationales au Canada varient de S1 (Alberta) à S4 (Manitoba). La cote S5 est attribuée à la tortue peinte ou à la tortue peinte de l’Ouest dans plusieurs États, mais aucune autorité responsable au Canada ne considère que l’espèce est manifestement non en péril (cote S5).
En Colombie-Britannique, la population de la côte du Pacifique (pop. 1) est inscrite sur la « liste rouge » du Conservation Data Centre de la Colombie-Britannique, tandis que la population intramontagnarde – des Rocheuses (pop. 2) est inscrite sur la « liste bleue ». Ces inscriptions sont analogues aux statuts fédéraux correspondants d’« espèce en voie de disparition » et d’« espèce préoccupante », mais n’accordent aucune protection juridique.
Protection et propriété de l’habitat
À l’échelle de leur aire de répartition canadienne, les tortues peintes de l’Ouest sont présentes sur diverses terres de la Couronne (principalement des terres provinciales, quelques-unes des terres municipales et domaniales/fédérales) et de terres privées. Un plan de rétablissement provincial a été finalisé pour la population de la côte du Pacifique (« en voie de disparition » dans l’annexe 1 de la LEP), qui comprend une description de l’habitat essentiel (Western Painted Turtle Recovery Team, 2016), bien que l’habitat essentiel n’ait pas été désigné en vertu de la LEP. Lorsqu’elles se trouvent dans le territoire domanial, les tortues peintes de l’Ouest de la population de la côte du Pacifique sont protégées en vertu de la LEP. Les sites de la tortue peinte de l’Ouest suivants font partie du territoire domanial : Réserve nationale de faune Alaksen, marécage Nicomen, Silvermere et Réserve naturelle Great Blue Heron, qui sont tous dans les basses terres continentales/la vallée du Fraser (les tortues du lac Greenburn, sur l’île Pender, dans la réserve de parc national des Îles-Gulf, semblent être des C. p. picta plutôt que des C. p. bellii; Paleczny, comm. pers., 2014). L’équipe de rétablissement de la tortue peinte de l’Ouest (Western Painted Turtle Recovery Team, 2016) indique que 36 % des sites connus se trouvent sur des terres privées et que la « majorité » des sites se trouvent dans des parcs ou des zones protégées gérées par le gouvernement fédéral ou des gouvernements provinciaux ou par des administrations régionales/municipales.
Les tortues de la population intramontagnarde – des Rocheuses sont présentes dans la Réserve nationale de faune Vaseux-Bighorn, dans la vallée de l’Okanagan, et pourraient être présentes dans la Réserve nationale de faune Columbia, dans la région de Kootenay-Est, en Colombie-Britannique. Elles vivent dans de nombreux parcs provinciaux et régionaux/municipaux.
Des tortues de la population des Prairies/boréale de l’Ouest – Bouclier canadien sont observées à l’occasion dans le Parc national des Lacs-Waterton, mais on considère qu’il s’agit d’individus introduits (Johnston, comm. pers., 2014). Elles ont été observées dans le parc national du Canada des Prairies, en Saskatchewan, et dans le parc national du Canada du Mont-Riding, au Manitoba.
En Colombie-Britannique, les menaces posées par le développement résidentiel et commercial peuvent être gérées, du moins en partie, au niveau municipal. Des pratiques exemplaires de gestion sont disponibles (Ovaska et al., 2004), mais n’ont pas de fondement juridique. De nombreux districts régionaux (semblables à des comtés) ont des règlements en vertu de plans communautaires officiels exigeant l’approbation des permis de développement. De tels instruments municipaux peuvent aider à réduire ou à atténuer la menace que représente le développement, mais ils sont rarement juridiquement contraignants. D’autres lois et règlements provinciaux de la Colombie-Britannique peuvent accorder une certaine protection aux éléments d’habitat de la tortue peinte de l’Ouest : le Riparian Areas Regulation, le Fish Protection Act et le Water Sustainability Act.
Remerciements et experts contactés
La photo de la couverture a été prise par Ben Meunier (Cranbrook, Colombie-Britannique). Les travaux SIG ont été effectués par Jenny Wu (Secrétariat du COSEPAC). Le soutien logistique a été assuré par Kristiina Ovaska (coprésidente du Sous-comité de spécialistes des amphibiens et des reptiles du COSEPAC), Monique Goit, Bev McBride et Angele Cyr (Secrétariat du COSEPAC). Nous remercions tout le personnel et tous les représentants des ministères provinciaux, des ministères fédéraux, des centres de données sur la conservation, des chercheurs et des consultants qui nous ont fourni des données, qui ont répondu à nos demandes d’information et qui ont révisé les versions préliminaires du présent rapport. Nous remercions spécialement Kristiina Ovaska qui a dirigé la rédaction du rapport au travers de nombreuses révisions et étapes ainsi que pour ses modifications et recommandations très utiles. Les commentaires fournis par les membres du Sous-comité de spécialistes des amphibiens et des reptiles ont grandement contribué à l’amélioration de ce rapport.
Adama, Doug. Biologiste de la faune, LGL Environmental Research Consultants Ltd. Sidney (Colombie-Britannique).
Basaraba, Nicole. Summit Environmental Consultants. Vernon (Colombie-Britannique).
Beaucher, Marc-André. Head of Operations Creston Valley Wildlife Management Area, Creston (Colombie-Britannique).
Didiuk, Andrew. Biologiste de la faune, Service canadien de la faune. Saskatoon (Saskatchewan).
Dzilums, Andy. Guide de rivière (ancien), Fairmont Hot Springs Resort. Fairmont Hot Springs (Colombie-Britannique).
Englestoft, Christian. Biologiste de la faune, Alula Consulting. Victoria (Colombie-Britannique).
Evelyn, Michelle. Research Affiliate, UBC Biodiversity Research Centre, University of British Columbia, Vancouver (Colombie-Britannique).
Gregory, Patrick. Professeur, University of Victoria. Victoria (Colombie-Britannique).
Halverson, Larry. Park Naturalist (retraité), parc national du Canada Kootenay, Parcs Canada. Radium Hot Springs (Colombie-Britannique).
Hawkes, Virgil. Biologiste de la faune, LGL Environmental Research Consultants Ltd. Sidney (Colombie-Britannique).
Hobbs, Jared. Biologiste de la faune, Hemmera Inc. Victoria (Colombie-Britannique).
Johnston, Barb. Biologiste de la faune, Parc national des Lacs-Waterton. Waterton Lakes (Alberta).
Kendell, Kris. Senior Biologist, Alberta Conservation Association. Edmonton (Alberta).
Leeming, Amy. Étudiante diplômée, Thompson River’s University. Kamloops (Colombie-Britannique).
Machmer, Marlene. Biologiste de la faune, Pandion Ecological Research. Nelson (Colombie-Britannique).
Matthias, Laura. Biologiste, Salt Spring Island Conservancy, Ganges (Colombie-Britannique).
Ohanjanian, Penny. Biologiste de la faune, Kimberley (Colombie-Britannique).
Ovaska, Kristiina. Biologiste de la faune, Biolinx Environmental Research Ltd., Victoria (Colombie-Britannique).
Quinlan, Richard. Instructor- Environmental Science, Lethbridge College. Lethbridge (Alberta).
Rutherford, Pamela. Associate Professor, Brandon University. Brandon (Manitoba).
Walker, Lee-Anne. Naturaliste. Fernie (Colombie-Britannique).
Watkins, Bill. Zoologiste, conservation de la biodiversité. Conservation et Gestion des ressources hydriques Manitoba. Winnipeg (Manitoba).
Wind, Elke. Herpétologiste-conseil. Nanaimo, BC.
Sources d’information
Acierno, M.J., M.A. Mitchell, M.K. Roundtree et T.T. Zachariah. 2006. Effects of ultraviolet radiation on 25-hydroxyvitamin D3 synthesis in red-eared slider turtles (Trachemys scripta elegans). American Journal of Veterinary Research 67:2046-2049.
Anderson, Lindsay, comm. pers. 2015. Correspondance par courriel adressée à L.A. Isaac, août 2015. Biologiste des espèces en péril, Ministry of Forests, Lands and Natural Resource Operations de la Colombie-Britannique. Nelson (Colombie-Britannique).
Aresco, M.J. 2004. The effect of sex-specific terrestrial movements and roads on the sex ratio of freshwater turtles. Biological Conservation 123:37-44.
Armstrong, J. 2014. Aboriginal Traditional Knowledge source report for the Western Painted Turtle. Unpubl. report prepared for the COSEWIC ATK Subcommittee. 16 pp.
Avery, H.W., J.R. Spotila, J.D. Congdon, R.U. Fischer Jr., E.A. Standora, E.A. et S.B. Avery. 1993. Roles of Diet Protein and Temperature in the Growth and Nutritional Energetics of Juvenile Slider Turtles, Trachemys scripta. Physiological Zoology 66:902-925
Baldwin, E. A., M.N. Marchard et J.A. Litvalis. 2004. Terrestrial habitat use by nesting Painted Turtles in landscapes with different levels of fragmentation. Northwestern Naturalist 11:41-48.
Ballin, P. 2010. Annual report for HCTF #3-275. Habitat Conservation Trust Foundation, Victoria, BC (rapport de projet provisoire). 17pp.
Ballin, Peter, comm. pers. 2014. Correspondance par courriel adressée à L.A. Isaac. Juillet 2014. Biologiste. Vancouver Community College, Vancouver (Colombie-Britannique).
Barela, K.L. et D.H. Olson. 2014. Mapping the Western Pond Turtle (Actinemys marmorata) and Painted Turtle (Chrysemys picta) in western North America. Northwestern Naturalist 95:1-12.
Basaraba, N.R.C. 2014. The ecology of Western Painted Turtles (Chrysemys picta belli) in a northern Canadian reservoir. Mémoire de maîtrise. Thompson Rivers University, Kamloops, British Columbia.
BC Frogwatch. 2015. Bullfrog. BC Ministry of Environment [en anglais seulement]. [consulté en décembre 2015].
BC Ministry of Forests and Range. Undated. Biogeoclimatic ecosystem classification 1074 program [en anglais seulement]. [consulté en juillet 2016].
BC Stats. 2014. Population estimates. BC Ministry of Technology, Innovation and Citizens’ Services [en anglais seulement]. [consulté en décembre 2014].
Beaucher, Marc-André, comm. pers. 2015. Conversation téléphonique avec L.A. Isaac. Juillet 2015. Creston Valley Wildlife Management Area, Creston (Colombie-Britannique).
Boyer, D.R. 1965. Ecology of basking habitat in turtles. Ecology 46:99-118.
Boyle, C.A., L. Lavkulich, H. Schreier et E. Kiss. 1997. Changes in land cover and subsequent effects on Lower Fraser Basin ecosystems from 1827 to 1990. Environmental Management 21(2): 185-196.
Brooks, R.J., G.P. Brown et D.A. Galbraith. 1991. Effects of a sudden increase in natural mortality of adults on a population of the common snapping turtle (Chelydra serpentina). Canadian Journal of Zoology 69:1314-1320.
Bull, J.J. 1980. Sex determination in reptiles. Quarterly Review of Biology 55:3–21.
Butler, R. et W. Campbell. 1987. The Birds of the Fraser River Delta: Populations, Ecology and International Significance. Canadian Wildlife Service, Environment Canada, Occasional Paper 65, 16 pp.
Carl, C. 1952. Western painted turtle gets around. Victoria Naturalist 9:25-26.
Carrière M-C., N. Rollinson, A.N. Suley et R.J. Brooks. 2008. Thermoregulation When The Growing Season Is Short: Sex-Biased Basking Patterns in a Northern Population of Painted Turtles (Chrysemys picta). Journal of Herpetology 42:206-209.
Christens, E. et J.R. Bider. 1987. Nesting activity and hatchling success of the Painted Turtle (Chrysemys picta marginata) in southwestern Québec. Herpetologica 43:55-65.
Churchill, T.A. et K.B. Storey. 1992. Natural freezing survival by Painted Turtles Chrysemys picta marginata and C. p. bellii. American Journal of Physiology 262:R530–37.
Clark, R. et A. Grueing. 2002. Painted Turtle (Chrysemys picta bellii) nest site enhancement and monitoring, Elizabeth Lake, Cranbrook, B.C. Columbia Basin Fish and Wildlife Compensation Program, Nelson, British Columbia.
Congdon, J.D., A.E. Dunham et R.C. van Loben Sels. 1993. Delayed sexual maturity and demographics of Blanding’s turtles (Emydoidea blandingii): implications for conservation and management of long-lived organisms. Conservation Biology 7:826-833.
Congdon, J.D., R.D. Nagle, O.M. Kinney et R.C. van Loben Sels, T. Quinter et D.W. Tinkle. 2003. Testing hypotheses of aging in long-lived Painted Turtles (Chrysemys picta). Experimental Gerontology 38:765-772.
Conroy, Cathy, comm. pers. 2015. Correspondance par courriel adressée à L.A. Isaac. Janvier 2016. Biologiste de la faune, Kimberley (Colombie-Britannique).
COSEWIC. 2004. COSEWIC assessment and update status report on the Red-legged Frog Rana aurora in Canada. Committee on the Status of Endangered Wildlife in Canada. Ottawa. vi + 46 pp. (Également disponible en français : COSEPAC. 2004. Évaluation et rapport de situation du COSEPAC sur la grenouille à pattes rouges (Rana aurora) au Canada – Mise à jour. Comité sur la situation des espèces en péril au Canada. Ottawa. vii + 54 p.)
COSEWIC. 2006. COSEWIC assessment and status report on the western Painted Turtle Chrysemys picta bellii (Pacific Coast population, Intermountain-Rocky Mountain population and Prairie/Western Boreal - Canadian Shield population) in Canada. Committee on the Status of Endangered Wildlife in Canada. Ottawa: vii + 40 pp. (Également disponible en français : COSEPAC. 2006. Évaluation et Rapport de situation du COSEPAC sur la tortue peinte de l’Ouest (Chrysemys picta bellii) population de la côte du Pacifique, population intramontagnarde – des Rocheuses et population des Prairies/boréale de l’Ouest – Bouclier canadien, au Canada. Comité sur la situation des espèces en péril au Canada. Ottawa. vii + 44 p.)
COSEWIC. 2013. Guidelines for recognizing Designatable Units. Committee on the Status of Endangered Wildlife in Canada. Site Web : http://www.cosewic.gc.ca/eng/sct2/sct2_5_e.cfm [consulté en février 2014]. (Également disponible en français : COSEPAC. 2013. Lignes directrices pour reconnaître les unités désignables. Comité sur la situation des espèces en péril au Canada. Site Web : http://web.archive.org/web/20160303210031/http://www.cosewic.gc.ca/fra/sct2/sct2_5_f.cfm)
Costanzo, J.P., J.B. Iverson, M.F. Wright et R.E. Lee Jr. 1995. Cole hardiness and overwintering strategies of hatchlings in an assemblage of northern turtles. Ecology 76:1772-1785.
Costanzo, J.P., S.A. Dinkelacker, J.B. Iverson et R.E. Lee. 2004. Physiological ecology of overwintering in the hatchling Painted Turtle: multiple-scale variation in response to environmental stress. Physiological and Biochemical Zoology 77:74-79.
Crews, D., J.M. Bergeron et J.A. McLachlan. 1995. The role of estrogen in turtle sex determination and the effect of PCBs. Environmental Health Perspectives 103 (suppl. 7):73-77.
de Solla, S.R. 2010. Organic contaminants in reptiles. Pp. 289-324 in D.W. Sparling, G. Linder, C.A. Bishop et S.K. Krest (eds.). Ecotoxicology of Amphibians and Reptiles. 2nd Ed. SETAC Press, Pensacola, Florida.
de Solla, S.R. et K.J. Fernie. 2004. Characterization of contaminants in snapping turtles (Chelydra serpentina) from Canadian Lake Erie areas of Concern: St. Clair River, Detroit River, and Wheatley Harbour. Environmental Pollution 132:101-112.
de Solla, S.R., M.L. Fletcher et C.A. Bishop. 2003. Relative contributions of organochlorine contaminants, parasitism, and predation to reproductive success of eastern spiny softshell turtles (Apalone spiniferus spiniferus) from southern Ontario, Canada. Ecotoxicology 12:261-270.
Degenhardt, W.G., C.W. Painter et A.H. Price. 1996. Amphibians and reptiles of New Mexico. University of New Mexico Press. 100 pp.
Didiuk, Andrew. comm. pers. 2014. Conversation téléphonique avec I. Adams. Juin 2014. Biologiste de la faune. Service canadien de la faune. Saskatoon (Saskatchewan).
Dorland, A., T. Rytwinski et L. Fahrig. 2014. Do roads reduce painted turtle (Chrysemys picta) populations? PLoS One 9:e98414.
Dzilums, A., comm. pers. 2014. Correspondance par courriel adressée à I. Adams. Novembre 2014. Guide/naturaliste. Fairmont Hot Springs (Colombie-Britannique).
Dyer, O., comm. pers. 2015. Conversation durant la conférence téléphonique sur le calculateur des menaces. Janvier 2015. Recovery planning biologist, Ministry of Environment de la Colombie-Britannique, Penticton (Colombie-Britannique).
Engelstoft, C. et K. Ovaska. 2008. Western Painted Turtle surveys on Galiano, Pender, and Vancouver Island, 2008, including surveys in selected CRD Regional Parks. Unpubl. report Prepared for CRD Parks and Habitat Acquisition Trust, Victoria, British Columbia. 46 pp.
Engelstoft, C. et K. Ovaska. 2011, 2013-2015. Western Painted Turtle surveys and stewardship activities on Vancouver Island in 2010. Annual reports prepared for Habitat Acquisition Trust, Victoria, British Columbia [en anglais seulement]. [consulté en mai 2016].
Engelstoft, C. et K. Ovaska, données inédites, 2016. Data files from Habitat Acquisition Trust, Victoria, British Columbia.
Engelstoft, C. et S. Thorpe. 2015. Western Painted Turtle visual surveys and eDNA sampling on the east coast of Vancouver Island, 2014. Unpubl. report prepared for Ministry of Forests, Lands and Natural Resource Operations, Nanaimo, British Columbia. 21 pp.
Environment Canada. 1992. State of the Environment for the Lower Fraser River Basin, Ottawa: Environment Canada and BC Ministry of Environment, Lands and Parks, 66 pp.
Environment Canada. 2012. Canada Water Act: Annual Report for April 2011 to March 2012. Environment Canada. Gatineau, QC. x + 47 pp. (Également disponible en français : Environnement Canada. 2012. Loi sur les ressources en eau du Canada : Rapport annuel d'avril 2011 à mars 2012. Environnement Canada. Gatineau, QC.)
Ernst, C.H. 1971. Population dynamics and activity cycles of Chrysemys picta in Southeastern Pennsylvania. Journal of Herpetology 5:151-160.
Ernst, C.H. 1972. Temperature-activity relationship in the Painted Turtle, Chrysemys picta. Copeia 1972:217-222.
Ernst, C.H. et J.E. Lovich. 2009. Turtles of the United States and Canada. 2nd edition. The Johns Hopkins University Press, Baltimore, MD. xii + 827 pp.
Escobedo-Galvan, A.H. 2013. Temperature-dependent sex determination in an uncertain world: advances and perspectives. Revista Mexicana de Biodiversidad 84:727-730.
Eskew, E.A., S.J. Price et M.E. Dorcas. 2010. Survivorship and population densities of Painted Turtles (Chrysemys picta) in recently modified suburban landscapes. Chelonian Conservation and Biology 9:244-249.
Evelyn, M., comm. pers. 2016. Correspondance par courriel adressée à K. Ovaska. Septembre à novembre 2016.Research Affiliate, UBC Biodiversity Research Centre, University of British Columbia, Vancouver (Colombie-Britannique).
Forman, R.T.T. et R.D. Deblinger. 2000. The ecological road-effect zone of a Massachusetts (U.S.A.) suburban highway. Conservation Biology 14:36–46.
Frazier, M.R., R.B. Huey et D. Berrigan. 2006. Thermodynamics constrains the evolution of insect population growth rates: “warmer is better”. The American Naturalist 168:512-520.
Frey, S.N. et M.R. Conover. 2006. Habitat use by meso-predators in a Corridor Environment. Journal of Wildlife Management 70:1111-1118.
Gamble, T. et A.M. Simons. 2004. Comparison of harvested and nonharvested painted turtle populations. Wildlife Society Bulletin 32:1269–1277.
Gervais, J., D. Rosenberg, S. Barnes, C. Puchy et E. Stewart. 2009. Conservation Assessment For The Western Painted Turtle In Oregon (Chrysemys picta bellii). Version 1.1. US Bureau of Land Management, US Fish & Wildlife Service, US Forest Service, Oregon Department of Fish and Wildlife, City of Portland. Portland, Oregon.
Gibbons, J.W., D.E. Scott, T.J. Ryan, K.A. Buhlmann, T.D. Tuberville, B.W. Metts, J.L. Greene, T. Mills, Y. Leiden, S. Poppy et C.T. Winne. 2000. The Global Decline of Reptiles, Déjà Vu Amphibians. Bioscience 50:653-666.
Gillies, C., et R. St. Clair. 1997. Painted turtle crossing assessment, Elizabeth Lake, Cranbrook, B.C. Prepared for Columbia Basin Fish and Wildlife Compensation Program, Nelson, British Columbia.
Glass, Ian, comm. pers. 2014. Correspondance par courriel adressée à I. Adams. Juin 2014. Librarian, Institute for Wetland and Waterfowl Research, Ducks Unlimited Canada. Stonewall (Manitoba).
Government of Alberta. 2014. Species assessed by Alberta’s Endangered Species Conservation Committee. July 4, 2014. Alberta Environment and Sustainable Resource Development. Edmonton, Alberta. 2 pp.
Grayson, K.L. et M.E. Dorcas. 2004. Seasonal temperature variation in the Painted Turtle (Chrysemys picta). Herpetologica 60:325-336.
Griffin, K.A. 2007. Spatial population dynamics of Western Painted Turtles in a wetland ecosystem in northwestern Montana. Thèse de doctorat. University of Montana. Missoula, MT. vii + 221 pp.
Habitat Group. 1978. Fraser River Estuary Study - Habitat Report. Fraser River Estuary Steering Committee, Government of Canada and Province of British Columbia. 181 pp.
Halverson, Larry, comm. pers. 2014. Correspondance par courriel adressée à I. Adams. Novembre 2014. Park Naturalist (à la retraite), Kootenay National Park, Radium Hot Springs (Colombie-Britannique).
Hamlet, A.F. M. McGuire Elsner, G.S. Mauger, S-Y. Lee, I. Tohver et R.A. Norheim. 2013. An Overview of the Columbia Basin Climate Change Scenarios Project: Approach, Methods, and Summary of Key Results. Atmosphere-Ocean 51:392-415
Hammond, K.A., J.R. Spotila et E.A. Standora. 1988. Basking behavior of the turtle Pseudemys scripta: effects of digestive state, acclimation temperature, sex and season. Physiological and Biochemical Zoology 61:69–77.
Hawkes, V.C., K. Tuttle, A. Leeming et D. Adama. 2013. CLBMON-11B3 Revelstoke Reach Painted Turtle Monitoring Program. Annual Report – 2012. LGL Report EA3414. Unpubl. report by Okanagan Nation Alliance and LGL Limited environmental research associates, Sidney, British Columbia, for BC Hydro Generation, Water Licence Requirements, Burnaby, British Columbia. 34 pp.
Hecnar, Steve, comm. pers. 2014. Correspondance par courriel adressée à L.A. Isaac. Décembre 2014. Professeur, Department of Biology, Lakehead University, Thunder Bay (Ontario).
Hickling, R., D.G. Roy, J.K. Hill, R. Fox et C.D. Thomas. 2006. The distributions of a wide range of taxonomic groups are expanding poleward. Global Change Biology 12:450-455.
House, W.J., Nall, I.M. et B. Thomas. 2010. Interpond movements of Western Painted Turtles (Chrysemys picta) in East-Central Kansas. The Southwestern Naturalist 55:403-410.
Isaac, L.A. 2014. Ecology of a focal wetland species: the Western Painted Turtle in the Creston Valley. Report to Columbia Fish and Wildlife Compensation Program. Castlegar, British Columbia.
Isaac, L.A. 2016. Ecology of a focal wetland species: Western Painted Turtle in the Creston Valley Year 3. Report to Columbia Fish and Wildlife Compensation Program. Castlegar, British Columbia.
Iverson, J.B. 1991. Patterns of survivorship in turtles (Testudines). Canadian Journal of Zoology. 69:385-391.
Iverson, K., D., Curran, T. Fleming et A. Haney. 2008. Sensitive Ecosystems Inventory – Okanagan Valley: Vernon to Osoyoos, 2000 – 2007. Methods, Ecological Descriptions, Results and Conservation Tools. Technical Report Series No. 495, Canadian Wildlife Service, Pacific and Yukon Region, Delta, British Columbia. xiii + 224 pp.
Jackson, D.C. 2000. How a turtle’s shell helps it survive prolonged anoxic acidosis. News in Physiological Science 15:181–185.
Jamieson, B., M. Thomas, T. Kinley et M. Worgan. 2009. A Management strategy for species at risk in a semi-urban landscape on the Shuswap Reserve Lands at Invermere, B.C. Report for Kinbasket Developoment Corporation and the Shuswap Indian Band. Invermere, British Columbia. 86 pp.
Jancowski, K. et S.A. Orchard. 2013. Stomach contents from invasive American bullfrogs Rana catesbeianus (= Lithobates catesbeianus) on southern Vancouver Island, British Columbia, Canada. NeoBiota 16: 17–37
Janzen, F.J. 1994. Climate change and temperature-dependent sex determination in reptiles. Proceedings of the National Academy of Sciences of the United States of America 91:7487-7490.
Janzen, F.J. et C.L. Morjan. 1997. Repeatability of microenvironment-specific nesting behaviour in a turtle with environmental sex determination. Animal Behaviour 62:73-82.
Jensen, E.L. 2013. Genetic assessment of taxonomic uncertainty and conservation units in Painted Turtles, with a focus on the at-risk Chrysemys picta bellii in British Columbia. Mémoire de maîtrise. University of British Columbia Okanagan, Kelowna, British Columbia.
Jensen, E.L., P. Govindarajulu et M.A. Russello. 2014a. When the shoe doesn’t fit: Applying conservation unit concepts to western Painted Turtles at their northern periphery. Conservation Genetics 15:261–274.
Jensen, E.L., P. Govindarajulu, J. Madsen et M.A. Russello. 2014b. Extirpation by introgression? Genetic evidence reveals hybridization between introduced Chrysemys picta and endangered Western Painted Turtles (C. p. bellii) in British Columbia’. Herpetological Conservation and Biology 9:342-353.
Jensen, E L., P. Govindarajulu et M.A. Russello. 2015. Genetic Assessment of Taxonomic Uncertainty in Painted Turtles. Journal of Herpetology 49:314-324.
Johnston, Barb, comm. pers. 2014. Correspondance par courriel adressée à I. Adams. Juillet 2014. Biologiste de la faune. Waterton Lakes National Park, Waterton Lakes (Alberta).
Kendell, K., comm. pers. 2014. Correspondance par courriel adressée à L.A. Isaac. Août 2014. Biologiste principal, Alberta Conservation Association, Sherwood Park (Alberta).
Kiester, A.R. et D.H. Olson. 2011. Prime time for turtle conservation. Herpetological Review 42:198–204.
Kirtley-Wark, Monica, comm. pers. 2014. Correspondance par courriel adressée à L.A. Isaac. Décembre 2014. Conservation Officer. Alberta Ministry of Justice and Solicitor General. Grande Prairie (Alberta).
Laporte, M., C-O Silva Beaudry et B. Angers. 2013. Effects of road proximity on genetic diversity and reproductive success of the Painted Turtle (Chrysemys picta). Conservation Genetics 14:21-30.
Larsen, Karl, comm. pers. 2015. Discussion avec I. Adams. Juin 2015. Professeur. Department of Natural Resource Sciences, Thompson Rivers University. Kamloops (Colombie-Britannique).
Lea, T. 2008. Historical (pre-settlement) ecosystems of the Okanagan Valley and Lower Similkameen Valley of British Columbia – pre-European contact to the present. Davidsonia 19:3-36.
Lefevre, K. et R.J. Brooks. 1995. Effects of sex and body size on basking behavior in a northern population of the Painted Turtle, Chrysemys picta. Herpetologica 51:217-224.
Lesica, P. et F.W. Allendorf. 1995. When are peripheral populations valuable for conservation? Conservation Biology 9:753-760.
Lindeman, P.V. 1996. Comparative life history of Painted Turtles (Chrysemys picta) in two habitats in the inland Pacific Northwest. Copeia 1996:114-130.
Lindsay, S. D. et M. E. Dorcas. 2001. Effects of cattle on reproduction and morphology of pond dwelling turtles in North Carolina. The Journal of the Elisha Mitchell Scientific Society 117:249-257.
Lindsey, M.K., Zhang, Y., Forstner, M.R.J. et D. Hahn. 2013. Effects of the freshwater turtle Trachemys scripta elegans on ecosystem functioning: an approach in experimental ponds. Amphibia-Reptilia 34:75-84.
Macartney, M.J. et P.T. Gregory. 1985. The western Painted Turtle in Kikomun Creek Provincial Park. Department of Biology, University of Victoria, Victoria, British Columbia. 95 pp.
MacCulloch, R.D. et D.M. Secoy. 1983a. Demography, growth, and food of western painted turtles, Chrysemys picta bellii (Gray), from southern Saskatchewan. Canadian Journal of Zoology 61:1499-1509.
MacCulloch, R.D. et D.M. Secoy. 1983b. Movement in a river population of Chrysemys picta bellii in southern Saskatchewan. Journal of Herpetology 17:283-285.
Machmer, Marlene, comm. pers. 2014. Correspondance par courriel adressée à I. Adams. Novembre 2014. Biologiste de la faune, Pandion Ecological Research, Ltd. Nelson (Colombie-Britannique).
McTaggart Cowan, I. 1938. Distribution of turtles in coastal British Columbia. Coepia 1938:91.
Major, D., K. Moore, D. Buffett et T. Tam. 2009. An Analysis of Loss and Conservation Prioritization of Fraser Lowland Wetlands 1989-2009. Site Web : http://www.verney.ca/assets/SSEC_Presentations/Session%209/9D_DanBuffett_Abstract.pdf [consulté en décembre 2014].
Maltby, J. 2000. Painted Turtle (Chrysemys picta) nest site enhancement and monitoring, Red Devil Hill nest site. Unpubl. report prepared for Columbia Basin Fish and Wildlife Compensation Program. 18 pp.
Marchand, K.A., A. Stulberg, C.M. Somers et R.G. Poulin. 2015. Western Painted Turtle - Record Carapace Length. Herpetological Review 46:617.
Marchand, L.J. 1942. A contribution to the knowledge of the natural history of certain freshwater turtles. Mémoire de maîtrise, University of Florida. Gainsville, Florida.
Marchand, M.N. et J.A. Litvaitis. 2004. Effects of landscape composition, habitat features and nest distribution on predation rates of simulated turtle nests. Biological Conservation 117:243-251.
Matthias, L., comm. pers. 2016. Correspondance par courriel adressée à K. Ovaska. Septembre 2016. Biologiste, Salt Spring Island Conservancy, Ganges (Colombie-Britannique).
Matsuda, B., D. Green et P.T. Gregory. 2006. Amphibians & Reptiles of British Columbia. Royal BC Museum, Victoria, British Columbia. 288 pp.
McAuliffe, J.R. 1978. Seasonal Migration Movements of a Population of the Western Painted Turtle, Chrysemys picta bellii (Reptilia, Testudines, Testudinae). Journal of Herpetology 12:143-149.
McConnell, L.L. et D.W. Sparling. 2010. Emerging contaminants and their potential effects on amphibians and reptiles. Pp. 487-509 in D.W. Sparling, G. Linder, C.A. Bishop and S.K. Krest (eds.). Ecotoxicology of Amphibians and Reptiles. 2nd Ed. SETAC Press, Pensacola, Florida.
McPhee, M., P. Ward, J. Kirkby, L. Wolfe, N. Page, K. Dunster, N. K. Dawe et I. Nykwist. 2000. Sensitive Ecosystems Inventory: East Vancouver Island and Gulf Islands, 1993 - 1997. Volume 2: Conservation Manual. Canadian Wildlife Service, Pacific and Yukon Region, Delta, British Columbia. xiv + 224 pp.
McTaggart Cowan, I. 1936. A review of reptiles and amphibians of British Columbia. Pp K16-25 in Report of the provincial museum of natural history. Province of British Columbia,Victoria, British Columbia.
Meidinger, D. et J. Pojar (eds.). 1991. Ecosystems of British Columbia. British Columbia Ministry of Forests Special Report Series No. 6, Victoria, British Columbia. 330 pp.
Midwood J.D., N.A. Cairns, L.J. Stoot, S.J. Cooke et G. Blouin-Demers. 2015. Bycatch mortality can cause extirpation in four freshwater turtle species. Aquatic Conservation: Marine and Freshwater Ecosystems 25:71–80.
Moldowan, Patrick, comm. pers. 2015. Correspondance par courriel adressée à I. Adams. Décembre 2015. Biologiste de la faune. Laurentian University, Sudbury (Ontario).
Montana Field Guide. 2014. Chrysemys picta. Montana Natural Heritage Program and Montana Fish, Wildlife and Parks [en anglais seulement]. [consulté en juin 2014].
Moore, K, P. Ward et K. Roger. 2003. Urban and agricultural encroachment onto Fraser Lowland Wetlands – 1989 to 1999 [PDF ; 156 Ko] [en anglais seulement]. 2003 Georgia Basin/Puget Sound Research Conference Proceedings. Abstract only. [consulté en décembre 2014].
Morgan, G. 2014. Saskatchewan’s Torquay play slowly proving up its potential [en anglais seulement]. Alberta Oil. September 2014 issue. [consulté en décembre 2014].
Munoz, A. 2004. Chemo-orientation using conspecific chemical cues in the stripe- necked terrapin (Mauremys leprosa). Journal of Chemical Ecology 30:519-530.
Murdock, T.Q. et A.T. Werner. 2011. Canadian Columbia Basin Climate Trends and Projections: 2007- 2010 Update. Pacific Climate Impacts Consortium, University of Victoria, Victoria, British Columbia. viii + 43 pp.
National Hydro Network. 2007. Natural Resources Canada, Earth Sciences Sector, Mapping Information Branch, Centre for Topographic Information – Sherbrooke, Quebec. Site Web : http://www.geobase.ca/geobase/en/data/nhn/index.html [consulté en novembre 2014]. (Également disponible en français : Réseau hydro national. 2007. Ressources naturelles Canada, Secteur des sciences de la terre, Direction de l’information cartographique, Centre d'information topographique – Sherbrooke, Québec. Site Web : http://www.geobase.ca/geobase/en/data/nhn/index.html.)
NatureServe. 2016. NatureServe Explorer: An online encyclopedia of life [application Web]. NatureServe, Arlington, Virginia. Site Web : www.natureserve.org/explorer [consulté en juin 2016].
Nussbaum, R.A., E.D. Brodie Jr. et R.M. Storm. 1983. Amphibians and Reptiles of the Pacific Northwest. University of Idaho Press, Moscow, Idaho.
Ohanjanian, P. comm. pers. 2014. Correspondance par courriel adressée à L.A. Isaac. Octobre 2014. Biologiste de la faune. Kimberley (Colombie-Britannique).
Orchard, S. 1986. Painted turtle (Chrysemys picta) habitat use information and habitat suitability index model. Unpubl. report for Research Branch, Ministry of Forests, Victoria, British Columbia. 24 pp.
Ovaska, K. et C. Engelstoft. 2009. Surveys for the endangered Western Painted Turtle within CRD Regional Parks in 2009. Unpubl. report prepared for CRD Parks, Victoria, British Columbia. 33 pp.
Ovaska, K. et C. Engelstoft. 2010, 2012. Western Painted Turtle surveys and stewardship activities on Vancouver Island and the Gulf Islands in 2009 and 2011. Annual reports prepared for Habitat Acquisition Trust, Victoria, British Columbia. Site Web : http://www.hat.bc.ca/focal-species-publications/western-painted-turtle-publications [consulté en mai 2016].
Ovaska, K., S. Lennart, C. Engelstoft, L. Matthias, E. Wind et J. MacGarvie. 2004. Best management practices for amphibians and reptiles in urban and rural environments in British Columbia. Report prepared for the BC Ministry of Water Land and Air Protection, Nanaimo, British Columbia. 151 pp.
Place, A.R., J. Lang, S. Gavasso et P. Jeyasuria. 2001. Expression of P4arom in Malaclemys terrapin and Chelydra serpentina: a tale of two sites. J. Exp. Zool. 290:673-690
Packard, G.C. et M.J. Packard. 2001. The Overwintering strategy of hatchling painted turtles, or how to survive in the cold without freezing. Bioscience 51:199-207.
Packard, G.C., S.L. Fasano, M.B. Attaway, L.D. Lohmiller et T.L. Lynch. 1997. Thermal environment for overwintering hatchlings of the Painted Turtle (Chrysemys picta). Canadian Journal of Zoology 13:401–406.
Packard, G.C., M.J. Packard, C.L. Morjan et F.J. Janzen. 2002. Cold-tolerance of hatchling Painted Turtles (Chrysemys picta bellii) from the southern limit of distribution. Journal of Herpetology 36:300-304.
Paleczny, Michelle, comm. pers. 2014. Correspondance par courriel adressée à L.A. Isaac. Août 2014. Resource Management Officer. Gulf Islands National Park, Sidney, (Colombie-Britannique).
Pauli, B.D., S. Money et D.W. Sparling. 2010. Ecotoxicology of pesticides in reptiles. Pp. 201-224 in D.W. Sparling, G. Linder, C.A. Bishop et S.K. Krest (eds.). Ecotoxicology of Amphibians and Reptiles. 2nd Ed. SETAC Press, Pensacola, FL.
Pearse, D.E. et J.C. Avise. 2001. Turtle mating systems: behavior, sperm storage, and genetic paternity. Journal of Heredity 92:206-211.
Pearson, K.J. 2005. Southern headwaters at risk project (SHARP) amphibian and western Painted Turtle (Chrysemys picta) surveys, 2003-2004. Alberta Sustainable Resource Development, Fish and Wildlife Division, Alberta Species at Risk Report No. 97. Edmonton, Alberta. vii + 29 pp.
Pearson, Kimberley, comm. pers. 2014. Conversation téléphonique avec I. Adams. Novembre 2014. Biologiste de la faune. Waterton Lakes National Park, Waterton Lakes (Alberta).
Place, A.R., J. Lang, S. Gavasso et P. Jeyasuria. 2001. Expression of P4arom in Malaclemys terrapin and Chelydra serpentina: a tale of two sites. Journal of Experimental Zoology 290:673-690.
Polar Geoscience. 2012. Phase 3 Okanagan Basin Water Supply and Demand Project: Projected Water Supply and Use in the Okanagan Basin (2011-2040) - Okanagan Basin Water Accounting Model Results. Okanagan Basin Water Board, Kelowna, British Columbia. vii + 58 pp + Appendices.
Quinlan, Richard, comm. pers. 2014. Correspondance par courriel adressée à L.A. Isaac en 2014. Fish and Wildlife Technology Instructor, Lethbridge College. Lethbridge (Alberta).
Raney, E.C. et E.A. Lachner. 1942. Summer food of Chrysemy picta marginata in Chautauqua Lake, New York. Copeia 1942:83-85.
Regional District of East Kootenay. 2014. Development Permit Area - Procedures and Application Information Regional District of East Kootenays [en anglais seulement]. Cranbrook, BC. [consulté en décembre 2014].
Regional District of Okanagan Similkameen. 2014. Environmental Planning. Regional District of Okanagan Similkameen. Penticton, BC. Site Web : http://www.rdos.bc.ca/departments/development-services/planning/environmental-planning/ [consulté en décembre 2014]
Refsnider J. M. et F.J. Janzen. 2012. Behavioural plasticity may compensate for climate change in a long-lived reptile with temperature-dependent sex determination. Biological Conservation 152:90-95
Refsnider, J.M., Warner, D.A. et F.J. Janzen. 2013. Does shade cover availability limit nest-site choice in two populations of a turtle with temperature-dependent sex determination? Journal of Thermal Biology 38:152-158.
Roe, J.H. et A. Georges. 2008. Maintenance of variable responses for coping with wetland drying in freshwater turtles. Ecology 89:485-494.
Ryan, T.J. et A. Lambert. 2005. Prevalence and colonization of Placobdella on two species of freshwater turtles (Graptemys geographica and Sternotherus odoratus). Journal of Herpetology 39:284-287.
Safriel, U.N., S. Volis et S. Karr. 1994. Core and peripheral populations and global climate. Israel Journal of Plant Science 42:331-345.
Salafsky, N., D. Salzer, A.J. Stattersfield, C. Hilton-Taylor, R. Neugarten, S.H.M. Butchart, B. Collen, N. Cox, L.L. Master, S. O’Connor et D. Wilkie. 2008. A standard lexicon for biodiversity conservation: unified classifications of threats and action. Conservation Biology 22:897-911.
Samson. J. 2003. The life history strategy of a northern population of midland Painted Turtle (Chrysemys picta marginata). Mémoire de maîtrise, University of Guelph, Guelph, Ontario. 154 pp.
Sarell, M. 1990. Survey of Relatively Natural Wetlands in the South Okanagan.BC Ministry of Environment, Lands and Parks. Penticton, BC.
Sauchyn, D. et S. Kulshreshtha 2008. Prairies. Pp 275-328 in D.S. Lemmen, F.J. Warren, J. Lacroix and E. Bush (eds.) From Impacts to Adaptation: Canada in a Changing Climate 2007. Government of Canada, Ottawa, Ontario. (Également disponible en français : Sauchyn, D. et S. Kulshreshtha 2008. Prairies. p. 275-328 in D.S. Lemmen, F.J. Warren, J. Lacroix et E. Bush (eds.) Vivre avec les changements climatiques au Canada : édition 2007. Gouvernement du Canada, Ottawa, Ontario.)
Schiller, N.R. et K.W. Larsen. 2012. Revelstoke Reach Western Painted Turtle monitoring program. Kamloops, British Columbia. Unpubl. report prepared for BC Hydro. Burnaby, British Columbia. 77 pp.
Schindler, D.W. et W.F. Donahue. 2006. An impending water crisis in Canada’s western prairie provinces. Proceedings of the National Academy of Science USA 103:7210-7216.
Schwanz, L.E. et F. J. Janzen. 2008. Climate Change and Temperature-Dependent Sex Determination: Can Individual Plasticity in Nesting Phenology Prevent Extreme Sex Ratios? Physiological and Biochemical Zoology 81:826-834.
Schwarzkopf, L. et R.J. Brooks. 1987. Nest-site selection and offspring sex ratio in Painted Turtles, Chrysemys picta. Copeia 1987:53-61.
Semlitsch, R.D. et J.R. Bodie. 2003. Biological criteria for buffer zones around wetlands and riparian habitats for amphibians and reptiles. Conservation Biology 17:1219-1228.
Shaffer, H.B. et al. (59 auteurs). 2013. The western painted turtle genome, a model for the evolution of extreme physiological adaptations in a slowly evolving lineage. Genome Biology 14:R28.
Sloan, L.M. 2012. Population structure, life history, and terrestrial movements of western pond turtles (Actinemys marmorata) in lentic habitats along the Trinity River, California. Mémoire de maîtrise. Humboldt State University. Arcata, California. xv + 96 pp.
Spackman, S.C. et J.W. Hughes. 1995. Assessment of minimum stream corridor width for biological conservation: species richness and distribution along mid-order streams in Vermont, USA. Biological Conservation 71:325-332.
Sparling, D.W., G. Linder, C.A. Bishop et S.K. Krest. (eds.). 2010. Ecotoxicology of amphibians and reptiles. 2nd Ed. SETAC Press, Pensacola, Florida. 944 pp.
St. Clair, R.J. et P.T. Gregory. 1990. Factors affecting the northern range limit of Painted Turtles (Chrysemys picta) – winter acidosis or freezing. Copeia 1990:1083-1089.
Starkey, D.E., H.B. Shaffer, R.I. Burke, M.R. Forstner, J.B. Iverson, F.J. Janzen, A.G.J. Rhodin et G.R. Ultsch. 2003. Molecular systematics, phylogeography, and the effects of Pleistocene glaciation in the Painted Turtle (Chrysemys picta) complex. Evolution 57:119-128.
Stebbins, R.C. 1966. A Field Guide to Western Reptiles and Amphibians. The Peterson Field Guide Series. Sponsored by the National Audubon Society. Houghton Mifflin Co., Boston, Massachusetts. 279 pp.
Steciw, Julie., comm. pers. 2014. Correspondance par courriel adressée à Ian Adams. Août 2014. Biologiste des espèces en péril. BC Ministry of Forests, Lands and Natural Resource Operations. Williams Lake (Colombie-Britannique).
Steen, D.A. et J.P. Gibbs. 2004. Effects of Roads on the Structure of Freshwater Turtle Populations. Conservation Biology 18:1143-1148.
Stone, P.A. 2001. Movements and demography of the Sonoran mud turtle, Kinosternon sonoriense. Southwestern Naturalist 46:41–53.
Storer, T.I. 1937. Further notes on the turtles of the north Pacific coast of North America. Copeia 1:9-11.
Storey, K.B., J.M. Storey, S.P.J. Brooks, T.A. Churchill et R.J. Brooks. 1988. Hatchling turtles survive freezing during winter hibernation. Proceedings of the National Academy of Sciences USA 13:8350–8354.
Sunshine Coast Regional District. 2003. Sunshine Coast Habitat Atlas; forest cover map [PDF; 8.84 Mo; en anglais seulement]. [consulté en juillet 2016].
Taylor, G.M. et E. Nol. 1989. Movements and hibernation sites of overwintering Painted Turtles in southern Ontario. Canadian Journal of Zoology 67:1877-1881.
Tesche, M.R. 2014. Effective sampling and detecting biogeographic trends of the Painted Turtle, Chrysemys picta. Mémoire de maîtrise. University of British Columbia Okanagan. Kelowna, British Columbia. vii + 63 pp.
Thomas, R.B. et W.S. Parker. 2000. Intrasexual variations in overland movements of slider turtles. Journal of Herpetology 34:469-472.
Ultsch, G.R. 1989. Ecology and physiology of hibernation and overwintering among freshwater fishes, turtles, and snakes. Biological Reviews 64:435-515.
Ultsch, G.R., M.E. Carwile, C.E. Crocker et D.C. Jackson. 1999. The physiology of hibernation among Painted Turtles: The eastern Painted Turtle Chrysemys picta picta. Physiological and Biochememical Zoology 72:493-501.
Ultsch, G.R., G.M. Ward, B.R. Kuhajda et E.R. Steward. 2001. Intergradation and origins of subspecies of the turtle Chrysemys picta: morphological comparisons. Canadian Journal of Zoology 79:485-498.
Walker, Lee Anne, comm. pers. 2014. Correspondance par courriel adressée à I. Adams. Juin 2014. Naturaliste. Fernie (Colombie-Britannique).
Ward, P., G. Radcliffe, J. Kirkby, J. Illingworth et C. Cadrin. 1998. Sensitive Ecosystems Inventory: East Vancouver Island and Gulf Islands 1993-1997. Volume 1: Methodology, Ecological Descriptions and Results. Technical Report Series No. 320, Canadian Wildlife Service, Pacific and Yukon Region, Delta, British Columbia. x + 146 pp.
Watkins, Bill, comm. pers. 2014. Correspondance par courriel adressée à I. Adams. Décembre 2014. Biodiversity Conservation Zoologist Manitoba Conservation and Water Stewardship. Winnipeg (Manitoba).
Watmough, M.D. et M.J. Schmoll. 2007. Environment Canada’s Prairie and Northern Region Habitat Monitoring Program Phase II: Recent habitat trends in the Prairie Habitat Joint Venture. Technical Report Series No. 493. Environment Canada, Canadian Wildlife Service, Edmonton, Alberta Canada.
Weller, W. 2009. New Distribution Records for Painted Turtles, Chrysemys picta, from Northwestern and Northeastern Ontario. The Canadian Field-Naturalist. 123:375-376.
Weller, W.F., J.S. Hecnar, D.R. Hecnar, G.S. Casper et F.N. Dawson. 2010. Quantitative assessment of intergradation between two subspecies of Painted Turtles, Chrysemys picta bellii and C. p. marginata, in the Algoma District of West Central Ontario, Canada. Herpetological Conservation and Biology 5:166-173.
Welstead, K., comm. pers. 2015a. Correspondance par courriel adressée à L.A. Isaac. Février 2015. Présidente de la Pacific Coast Western Painted Turtle Recovery Team et biologiste des espèces en péril, Ministry of Forests, Lands and Natural Resource Operations de la Colombie-Britannique. Surrey (Colombie-Britannique).
Welstead, K., comm. pers. 2015b. Correspondance par courriel adressée à I. Adams. Novembre 2015. Présidente de la Pacific Coast Western Painted Turtle Recovery Team et biologiste des espèces en péril, Ministry of Forests, Lands and Natural Resource Operations de la Colombie-Britannique. Surrey (Colombie-Britannique).
Weldstead, K, comm. pers. 2015c. Communication durant la conférence téléphonique sur le calculateur des menaces. Janvier 2015. Présidente de la Pacific Coast Western Painted Turtle Recovery Team et biologiste des espèces en péril, Ministry of Forests, Lands and Natural Resource Operations de la Colombie-Britannique. Surrey (Colombie-Britannique).
Welstead, Kym, comm. pers. 2016. Correspondance par courriel adressée à K. Ovaska. Août 2016. Présidente de la Pacific Coast Western Painted Turtle Recovery Team et biologiste des espèces en péril, Ministry of Forests, Lands and Natural Resource Operations de la Colombie-Britannique. Surrey (Colombie-Britannique).
Werner, B.A., W.C. Johnson et G.R. Guntenspergen. 2013. Evidence for 20th century climate warming and wetland drying in the North American Prairie Pothole Region. Ecology and Evolution 3:3471-3482.
Western Painted Turtle Recovery Team. 2016. Recovery plan for the Painted Turtle – Pacific Coast Population (Chrysemys picta pop. 1), in British Columbia. B.C. Ministry of Environment, Victoria, BC. 89 pp.
Wetland Stewardship Partnership. 2010. A Wetland Action Plan for British Columbia. Wetland Stewardship Partnership. Site Web : http://bcwetlands.ca/wp-content/uploads/BCWetlandActionPlan_WSP_2010.pdf [consulté en juillet 2016].
Wikimedia Commons. 2014. Painted Turtle. Site Web : http://en.wikipedia.org/wiki/Painted_turtle [consulté en juillet 2014].
Sommaire biographique des rédactrices du rapport
Ian Adams a plus de 20 ans d’expérience en biologie de la faune; il a travaillé depuis l’Ontario jusqu’à la côte Ouest et au Yukon. Il est spécialisé dans la gestion et le rétablissement des espèces en péril. Il s’agit de son troisième rapport de situation du COSEPAC. Auparavant, il a écrit les rapports de situation sur le blaireau d’Amérique (2012) et le petit polatouche (2006). Il détient un mémoire de maîtrise en écologie de la faune de l’Université de Guelph et demeure dans la région de Kootenay-Est, en Colombie-Britannique, depuis 1997.
Leigh Anne Isaac est spécialisée en écologie des reptiles et des amphibiens. Elle a participé à divers projets d’inventaire et d’évaluation de la tortue peinte de l’Ouest dans les réservoirs Kinbasket et Revelstoke, en Colombie-Britannique. Plus récemment, elle a effectué des travaux sur le terrain dans le cadre d’une étude pluriannuelle sur les tortues peintes (UD : population intramontagnarde – des Rocheuses) à Creston, en Colombie-Britannique, qui était axée sur la structure de la population, l’utilisation de l’habitat, les habitudes de déplacement et l’évaluation de l’impact des menaces et qui contribuera à éclairer directement le travail effectué pour le rétablissement de l’espèce. À titre de professeure associée à l’Université Thompson Rivers, elle participe aux comités d’étudiants diplômés contribuant aux projets de maîtrise, notamment sur l’écologie hivernale de la tortue peinte de l’Ouest.
Collections examinées
Aucune collection n’a été examinée pour l’élaboration de cette mise à jour du rapport de situation.
Annexe 1. Tableau d’évaluation des menaces.
Tableau d’évaluation des menaces
- Nom scientifique de l’espèce ou de l’écosystème :
- Chrysemys picta, pop. 1 (population de la côte du Pacifique)
- Identification de l’élément :
- 24166
- Code de l’élément :
- ARAAD01015
- Date :
- 1/27/2015
- Évaluateur(s) :
- I. Adams et L-A Isaac (rédateurs du rapport), K. Ovaska (facilitatrice), B. McBride (Secrétariat du COSEPAC), G. Wilson, J. Steciw, O. Dyer, K. Welstead, P. Govindarajulu, M-A. Beaucher, R. Reudink, J. Bogart; certaines valeurs ont été révisées par la suite, compte tenu de l’examen par l’équipe et des commentaires reçus par courriel d’autres personnes qui ont examiné le rapport.
- Références :
- Version provisoire du programme de rétablissement; version provisoire de la mise à jour du rapport de situation du COSEPAC (2015)
| Impact des menaces | Impact des menaces (descriptions) | Comptes des menaces de niveau 1 selon l’intensité de leur impact : Maximum de la plage d’intensité |
Comptes des menaces de niveau 1 selon l’intensité de leur impact : Minimum de la plage d’intensité |
|---|---|---|---|
| A | Très élevé | 0 | 0 |
| B | Élevé | 1 | 0 |
| C | Moyen | 3 | 3 |
| D | Faible | 4 | 5 |
| - | Impact global des menaces calculé : | Très élevé | Élevé |
- Valeur de l’impact global attribuée :
- AB = Très élevé – élevé
- Ajustement de la valeur de l’impact – justification :
- -
- Commentaires sur l’impact global des menaces :
- La durée d’une génération est estimée à 15 ans; par conséquent, un horizon de 45 ans a été utilisé pour déterminer la gravité de l’impact. On ignore la taille de la population, mais elle compte vraisemblablement moins de 5 000 individus matures. Note : Dans le rapport de situation du COSEPAC de 2016, la durée d’une génération est plutôt de 25-30 ans pour cette population. Il est peu probable que ce changement ait une incidence sur les évaluations, qui deviennent de plus en plus incertaines lorsqu’on les projette loin dans l’avenir.
| # | Menace | Impact (calculé) | Impact (description) | Portée (10 prochaines années) | Gravité (10 ans ou 3 générations) | Immédiateté | Commentaires |
|---|---|---|---|---|---|---|---|
| 1 | Développement résidentiel et commercial | C | Moyen | Restreinte (11-30 %) | Élevée (31-70 %) | Élevée (menace toujours présente) | blanc |
| 1.1 | Zones résidentielles et urbaines | C | Moyen | Restreinte (11-30 %) | Élevée (31-70 %) | Élevée (menace toujours présente) | Les impacts touchent principalement l’habitat riverain et les sites de nidification. La portée reflète principalement les tendances quant au développement dans les basses terres continentales et la Sunshine Coast. Sur l’île de Vancouver, il y a quelques nouveaux projets de développement (p. ex. au lac Langford : développement récent et continu à l’extrémité nord-ouest), mais, dans le district régional de la capitale, le développement a déjà été fait en grande partie, et il est donc surtout historique. Dans les basses terres continentales, le marécage Nicomen est l’emplacement d’un projet futur de développement résidentiel; Silvermere fait l’objet de propositions de projets résidentiels et de construction de quais; il y a aussi un essor du développement dans la région d’Abbottsford. Dans la Sunshine Coast, des chalets et des quais sont construits au bord du lac Ruby, et il y a de nombreux chalets au bord du lac Sakinaw et de plus en plus de quais y sont construits. De nombreux sites se trouvent dans des parcs régionaux (p. ex. les parcs régionaux Aldergrove Lake, Beaver-Elk Lake et Buttertubs Marsh), mais les parcs subissent toujours des impacts dus aux projets de développement avoisinants. (Les quais sont pris en compte dans cette catégorie s’ils se trouvent sur des terres privées et qu’ils ne font pas partie d’installations récréatives. S’ils font partie de telles installations, ils sont pris en compte dans la catégorie 1.3.) |
| 1.2 | Zones commerciales et industrielles | D | Faible | Petite (1-10 %) | Extrême (71-100 %) | Élevée (menace toujours présente) | Il y a quelques exemples de développement industriel continu dans les basses terres continentales : lac Burnaby (une importante zone industrielle se trouve derrière la limite du parc et au nord de celle-ci); il y a une usine de transformation du bois au lac Silvermere, et l’on déplace les billes sur le lac – l’action des vagues peut nuire aux tortues s’exposant au soleil. La portée est inférieure à 1 % sur l’île de Vancouver (un exemple : les eaux dormantes du lac Langford au lac Kettle ont récemment fait l’objet d’exploitation à des fins industrielles). |
| 1.3 | Zones touristiques et récréatives | D | Faible | Petite (1-10 %) | Modérée (11-30 %) | Élevée (menace toujours présente) | La portée tient compte de l’aménagement d’installations récréatives principalement dans les basses terres continentales et la Sunshine Coast (> 1 %). Quelques exemples dans les basses terres continentales : marécage Nicomen - construction de quais; lac Burnaby - aménagement de plages, couloirs d’aviron de taille olympique et proposition d’un grand bâtiment pour le club d’aviron. Quelques exemples dans la Sunshine Coast : aménagement potentiel de terrains de camping aux lacs Ruby et Sakinaw et expansion potentielle du terrain de camping du lac Catherine. La portée pour l’île de Vancouver et l’île Saltspring est inférieure à 1 %. |
| 2 | Agriculture et aquaculture | D | Faible | Petite (1-10 %) | Modérée (11-30 %) | Élevée (menace toujours présente) | blanc |
| 2.1 | Cultures annuelles et pérennes de produits autres que le bois | D | Faible | Petite (1-10 %) | Modérée (11-30 %) | Élevée (menace toujours présente) | Bien que la perte d’habitat due au développement agricole soit surtout historique, ce dernier continue d’avoir une incidence sur l’habitat des tortues dans les basses terres continentales; la portée est donc > 1 %. Dans les basses terres continentales, environ 1 % de l’aire de répartition actuelle (60 ha de forêts) est en train d’être converti à l’agriculture au marécage Nicomen; une population nombreuse de tortues (350 à 400 adultes) est exposée à cette menace. L’expansion agricole a lieu à un rythme plus rapide que ce à quoi on s’attendait dans cette région. Les terres sont converties en pâturages et à la culture en serre dans les basses terres continentales. Certaines des terres converties sont désormais végétalisées durant une partie de la saison. La conversion des forêts à l’agriculture peut, parfois, augmenter le nombre d’aires de nidification, mais, de façon globale, les impacts sont considérés comme négatifs. |
| 2.2 | Plantations pour la production de bois et de pâte | blanc | blanc | blanc | blanc | blanc | blanc |
| 2.3 | Élevage de bétail | D | Faible | Petite (1-10 %) | Modérée (11-30 %) | Élevée (menace toujours présente) | Ce n’est pas un problème dans la Sunshine Coast ni sur l’île de Vancouver. Dans les basses terres continentales, de plus en plus de pâturages sont convertis pour faire l’élevage intensif d’animaux de ferme (poulets, bovins laitiers); aussi, un certain piétinement par des animaux d’élevage (chevaux) a été observé alentour de Nicomen. La portée est « petite », mais se situe plus près de 1 % que de 10 %. Bien que l’élevage d’animaux de ferme puisse avoir certains effets bénéfiques, notamment en créant des aires de nidification, il pourrait devenir un puits de population; l’impact net est probablement négatif, surtout si des pratiques intensives sont utilisées. |
| 2.4 | Aquaculture en mer et en eau douce | blanc | blanc | blanc | blanc | blanc | blanc |
| 3 | Production d’énergie et exploitation minière | D | Faible | Petite (1-10 %) | Modérée-légère (1-30 %) | Élevée (menace toujours présente) | blanc |
| 3.1 | Forage pétrolier et gazier | blanc | blanc | blanc | blanc | blanc | blanc |
| 3.2 | Exploitation de mines et de carrières | D | Faible | Petite (1-10 %) | Modérée-légère (1-30 %) | Élevée (menace toujours présente) | Principalement dans les basses terres continentales, mais des activités d’extraction de petite échelle pour la construction et l’entretien de routes forestières ont lieu dans la vallée Alberni. L’exploitation des placers est une possibilité dans certaines zones; il y a de nombreuses concessions, mais on ne sait pas si elles se trouvent dans l’habitat des tortues ni si elles seront exploitées. Dans la zone de Nicomen, la source de gravier pour l’endiguement (non active actuellement) se trouve immédiatement à côté d’un site de nidification de tortues, et l’extraction de gravier pourrait détruire les nids (environ 50 % de la population de tortues des basses terres continentales se trouve dans la zone de Nicomen); cela pourrait devenir un habitat puits. Il y a des concessions minières sur l’île Texada, et bon nombre d’entre elles ont été renouvelées aussi récemment qu’en 2012, mais leur exploitation est incertaine. Il y a des inquiétudes en ce qui concerne les épinoches dans le lac Emily, mais les impacts sur les tortues n’ont pas été abordés. Les fosses-réservoirs/emprunts pour la construction de routes pourraient avoir un impact positif sur les tortues au début, car ils pourraient fournir de l’habitat de nidification, mais ils pourraient devenir des puits de population. L’incertitude des impacts se reflète dans la fourchette de valeurs attribuée à la gravité. |
| 3.3 | Énergie renouvelable | blanc | blanc | blanc | blanc | blanc | blanc |
| 4 | Corridors de transport et de service | C | Moyen | Généralisée (71-100 %) | Modérée (11-30 %) | Élevée (menace toujours présente) | blanc |
| 4.1 | Routes et voies ferrées | C | Moyen | Généralisée (71-100 %) | Modérée (11-30 %) | Élevée (menace toujours présente) | La construction de nouvelles routes et la mortalité sur les routes existantes sont comprises dans cette catégorie. La densité des routes et la circulation augmentent partout dans l’aire de répartition de cette UD. Des études ont été publiées sur l’impact qu’ont les routes sur les tortues (voir par exemple Baldwin et al.,2004). Au lac Ruby (Sunshine Coast), par exemple, on a observé des cas de mortalité routière, plus précisément il y a eu destruction de nids à un site dans le voisinage immédiat d’une route principale (à quelques mètres; Gordon Bay Rd.); de plus, des cas de mortalité routière et des déclins importants ont été observés ailleurs, causés par la circulation liée à l’augmentation de la densité des chalets, et ce, malgré la prise de mesures d’atténuation (clôtures et site de nidification sécuritaire). Dans la zone de Nicomen, il y a nidification des tortues sur des digues et le terrassement routier les tue. On estime que le nombre de voies ferrées devrait quadrupler en raison du transport de bitume dans les basses terres continentales - les voies ferrées constituent des obstacles à la dispersion et créent des aires de nidification non sécuritaires. Néanmoins, les routes demeurent le principal problème. Sur l’île de Vancouver, l’habitat des tortues dans la région de Victoria est fragmenté par un réseau de routes; des chemins forestiers sont adjacents à des milieux humides où vivent des tortues dans la vallée Alberni; cependant, le taux de mortalité routière enregistré est bas, malgré la sollicitation d’observations du public par l’Habitat Acquisition Trust (en revanche, les observations de tortues dans les étangs et les lacs sont fréquentes). Aussi, les populations semblent persistantes dans les paysages urbains et ruraux (p. ex. au lac Langford, au lac Elk-Beaver et au lac Swan). La portée de cette menace est généralisée, mais l’impact moyen global dans l’aire de répartition de cette UD comporte beaucoup d’incertitude. |
| 4.2 | Lignes de services publics | blanc | Négligeable | Négligeable (< 1 %) | Légère (1-10 %) | Élevée (menace toujours présente) | Des lignes de transport d’électricité ou des pipelines existent ou sont proposés dans les basses terres continentales (pipeline de Kinder-Morgan qui devrait traverser jusqu’au lac Burnaby et peut-être d’autres habitats de tortues). Les pipelines sont soit souterrains ou élevés, de sorte qu’il y aurait des impacts seulement durant la phase de construction. |
| 4.3 | Voies de transport par eau | blanc | blanc | blanc | blanc | blanc | blanc |
| 4.4 | Corridors aériens | blanc | blanc | blanc | blanc | blanc | blanc |
| 5 | Utilisation des ressources biologiques | D | Faible | Grande (31-70 %) | Légère (1-10 %) | Élevée (menace toujours présente) | blanc |
| 5.1 | Chasse et capture d’animaux terrestres | D | Faible | Grande (31-70 %) | Légère (1-10 %) | Élevée (menace toujours présente) | La portée de cette menace est grande, parce que la capture de tortues pour en faire des animaux de compagnie ou la translocation vers d’autres plans d’eau peuvent avoir lieu dans une grande partie de l’aire de répartition à l’intérieur de zones urbaines et rurales. Sur l’île de Vancouver et dans la Sunshine Coast, certaines populations se trouvent dans l’arrière-pays et sont probablement moins exposées au risque de capture. Dans les basses terres continentales, il y avait des pièges à tortues au lac Deer, ce qui a probablement décimé les tortues qui s’y trouvaient. Selon des observations anecdotiques, des tortues auraient été enlevées de lacs dans la Sunshine Coast et des tortues auraient été transférées ailleurs individuellement par le public sur l’île de Vancouver. On ne connaît pas les impacts à l’échelle des populations, mais l’impact moyen de la collecte est probablement faible dans les zones étendues où les tortues sont exposées à cette menace. |
| 5.2 | Cueillette de plantes terrestres | blanc | blanc | blanc | blanc | blanc | blanc |
| 5.3 | Exploitation forestière et récolte du bois | D | Faible | Restreinte (11-30 %) | Légère (1-10 %) | Élevée (menace toujours présente) | De l’exploitation forestière est possiblement prévue sur l’île Texada. Des blocs de coupe sont proposés aux lacs Emily et Priest, et il y a un bloc de coupe géant à l’ouest de la lagune du lac Ruby. Il y a des blocs de coupe au lac Cranberry. Dans les basses terres continentales, le fond des vallées a déjà été exploité, mais des travaux de coupe à blanc sont en cours à petite échelle sur des terres privées, p. ex. dans la zone du marécage Nicomen. Dans la Sunshine Coast et sur l’île de Vancouver (vallée Alberni), les tortues sont présentes dans les paysages forestiers. Cette menace a des impacts sur la dispersion et constitue un obstacle aux déplacements. Des bandes tampons riveraines sont censées être établies, mais rien n’est garanti, particulièrement si l’exploitation forestière a lieu sur des terres privées. La menace la plus grande due à l’exploitation forestière est probablement la construction de routes (évaluée dans une autre catégorie). |
| 5.4 | Pêche et récolte de ressources aquatiques | blanc | Inconnu | Grande (31-70 %) | Inconnue | Élevée (menace toujours présente) | Cette catégorie comprend la récolte de tortues à des fins alimentaires et la mortalité attribuable aux prises accessoires de la pêche à la ligne. La capture à des fins alimentaires a eu lieu dans la zone de Nicomen. La pêche récréative intensive est pratiquée dans de nombreux lacs où des tortues sont présentes. Les impacts sont associés à la mortalité de tortues causée par des leurres de pêche qui restent pris dans leur bouche; ce sont généralement les individus adultes qui sont touchés, car les jeunes sont souvent trop petits pour mordre à l’hameçon. Dans les basses terres continentales, 3 tortues sur une population d’environ 1 000 ont été amenées durant une année avec un hameçon pris dans la bouche. Aucun cas n’a été signalé dans la Sunshine Coast ni sur l’île de Vancouver, mais la pêche récréative est pratiquée sur de nombreux lacs où il y a des tortues, même dans les parcs. Les impacts pourraient être élevés à l’échelle locale si ce sont les adultes reproducteurs qui sont touchés, mais, si on fait la moyenne, compte tenu de la portée qui est grande, les impacts sont probablement faibles. Cependant, on ne dispose pas de données suffisantes pour déterminer quels pourraient être les effets sur la population; on sait seulement qu’ils sont négatifs. |
| 6 | Intrusions et perturbations humaines | D | Faible | Généralisée (71-100 %) | Légère (1-10 %) | Élevée (menace toujours présente) | blanc |
| 6.1 | Activités récréatives | D | Faible | Généralisée (71-100 %) | Légère (1-10 %) | Élevée (menace toujours présente) | De nombreux sites se trouvent dans des parcs ou des zones récréatives. Ce sont principalement les sites de nidification, les femelles en période de ponte et les nouveau-nés qui sont touchés. Les impacts sont causés notamment par les enfants qui creusent le sable et perturbent les nids (exemples sur l’île Saltspring), les chiens et les personnes qui les promènent, et le piétinement de la végétation riveraine. Dans la Sunshine Coast, des impacts sont causés par les bateaux à moteur et le sillage qu’ils laissent, les terrains de camping et les utilisateurs de VTT. Dans les basses terres continentales, les VTT passent par la digue à Nicomen, et les barrières et clôtures ne dissuadent pas les utilisateurs de passer par là. Bien que la plupart des sites occupés soient exposés aux activités récréatives dans une certaine mesure et que la portée de cette menace soit généralisée, il y a des sites, particulièrement sur l’île de Vancouver, dans lesquels les tortues semblent coexister avec les utilisateurs récréatifs (plusieurs sites dans le district régional de la capitale) ou dans lesquels les activités récréatives semblent avoir un impact minimal sur les tortues (vallée Alberni). Par conséquent, en moyenne, on attribue la valeur « légère » à la gravité dans l’aire de répartition de l’UD. |
| 6.2 | Guerre, troubles civils et exercices militaires | blanc | blanc | blanc | blanc | blanc | blanc |
| 6.3 | Travail et autres activités | D | Faible | Petite (1-10 %) | Modérée-légère (1-30 %) | Élevée (menace toujours présente) | L’élimination des herbes aquatiques dans les lacs pourrait entraîner la mortalité de tortues. C’est le cas dans plusieurs zones des basses terres continentales : aux lacs Mill et Burnaby (bateaux faucardeurs – bateaux munis de grandes lames qui coupent toute la végétation); à l’île de Vancouver : lac Langford (jusqu’à 6 tortues par heure sont prises dans les rouleaux pendant la coupe de la végétation et sont remises dans l’eau apparemment indemnes - informations anecdotiques fournies par les conducteurs de bateaux); aux lacs Elk et Beaver (CRD a récemment acheté un nouveau désherbeur pour utiliser dans ces lacs afin d’améliorer la qualité de l’eau). L’incertitude est grande concernant les effets de cette activité sur la population. |
| 7 | Modifications des systèmes naturels | CD | Moyen-faible | Grande (31-70 %) | Modérée-légère (1-30 %) | Élevée (menace toujours présente) | blanc |
| 7.1 | Incendies et suppression des incendies | blanc | blanc | blanc | blanc | blanc | blanc |
| 7.2 | Gestion et utilisation de l’eau et exploitation de barrages | CD | Moyen-faible | Grande (31-70 %) | Modérée-légère (1-30 %) | Élevée (menace toujours présente) | Le prélèvement d’eau et la modification du régime hydrologique due aux activités humaines ont lieu partout dans l’aire de répartition de cette UD. Dans la Sunshine Coast, il y a captage des eaux dans l’habitat des tortues; dans les basses terres continentales, il y a endiguement, y compris de l’entretien qui nécessite l’élimination de la végétation, le drainage des milieux humides et l’entretien des fossés (dragage); le marécage Nicomen en est un exemple. Sur l’île Texada, les lacs Priest et Emily sont utilisés comme une source d’eau. Les impacts sont dus à l’assèchement des milieux humides (les lacs plus grands sont souvent utilisés comme source d’eau, ce qui a un impact minimal sur les tortues). Il est possible que les sites d’hivernage soient touchés. Les mesures de contrôle des castors et l’enlèvement d’anciens barrages (des infrastructures vieillissantes partout dans l’aire de répartition) constituent aussi un problème potentiel, car ils peuvent entraîner l’assèchement des milieux humides ou l’inondation des nids. |
| 7.3 | Autres modifications de l’écosystème | D | Faible | Petite (1-10 %) | Légère (1-10 %) | Élevée (menace toujours présente) | L’expansion des milieux humides par la succession naturelle est un problème dans certains sites, p. ex. Colony Farms dans les basses terres continentales et lac Patterson - île de Vancouver; les plantes envahissantes sont en train de transformer l’habitat riverain (île Saltspring - salicaire commune, iris jaune; marécage Nicomen : myriophylle en épi). L’enlèvement des troncs d’arbres sur lesquels les tortues s’exposent au soleil est aussi une inquiétude dans certains sites. Des mesures de contrôle des castors qui créent naturellement des milieux humides sont aussi appliquées dans l’aire de répartition de l’espèce. |
| 8 | Espèces et gènes envahissants ou autrement problématiques | BC | Élevé-moyen | Généralisée (71-100 %) | Élevée-modérée (11-70 %) | Élevée (menace toujours présente) | blanc |
| 8.1 | Espèces exotiques (non indigènes) envahissantes | BC | Élevé-moyen | Généralisée (71-100 %) | Élevée-modérée (11-70 %) | Élevée (menace toujours présente) | La prédation sur les nouveau-nés par les ouaouarons introduits est un problème sur l’île de Vancouver et dans les basses terres continentales; Orchard (2013) rapporte que des nouveau-nés de tortue peinte ont été trouvés dans l’estomac d’ouaouarons. Des données existent sur les interactions tortue-ouaouaron en Californie (« Western Pond Turtle Population Health in Lentic Habitats along the Trinity River, California » par Leah Sloan, où l’on rapporte qu’il y avait plus de jeunes tortues dans les étangs sans ouaouarons). Les chiens peuvent perturber les tortues en période de ponte. Des tortues de Floride (anciens animaux de compagnie) continuent d’être libérées dans les plans d’eau; il y a maintenant des signes qu’elles peuvent se reproduire avec succès en Colombie-Britannique (une Grue du Canada a été aperçue en train de creuser un nid de tortues de Floride dans lequel il y avait des nouveau-nés vivants au refuge d’oiseaux de Reifel). Dans les basses terres continentales, 15 % des tortues utilisées à des fins de translocation présentaient des maladies respiratoires, qui leur ont probablement été transmises par des tortues de Floride. L’incertitude est grande, cependant, en ce qui concerne les effets qu’ont les espèces introduites sur la population, et, par conséquent, une fourchette de valeurs est attribuée à la gravité de cette menace (modérée à élevée). |
| 8.2 | Espèces indigènes problématiques | blanc | Inconnu | Généralisée (71-100 %) | Inconnue | Élevée (menace toujours présente) | Il semble que le nombre de mouettes et de goélands et de ratons laveurs, considérés comme des commensaux des humains, soit en train d’augmenter, et il en va de même du nombre de grands hérons et de mouffettes, qui sont des prédateurs des nids et des tortues naissantes. Il y a des proliférations de cyanobactéries à plusieurs sites (p. ex. au lac Swan et au lac Beaver à l’île de Vancouver), qui peuvent avoir une incidence négative sur les tortues, mais on ne dispose d’aucune donnée à cet égard. Alentour du lac Burnaby, les canards et les oies creusent le substrat et accaparent l’habitat d’exposition au soleil. Le taux de prédation des nids au lac Burnaby est de 100 % si les nids ne sont pas protégés. Il est difficile de distinguer les niveaux de prédation naturels des niveaux de prédation accrus résultant de la modification de l’habitat par l’humain. La valeur « inconnue » est donc attribuée à la gravité de cette menace. |
| 8.3 | Matériel génétique introduit | blanc | Négligeable | Restreinte (11-30 %) | Négligeable (< 1 %) | Élevée (menace toujours présente) | L’hybridation principalement avec d’autres sous-espèces de tortues peintes et le maintien de l’intégrité génétique entre sous-unités, tel que révélé par l’analyse des microsatellites, sont inclus dans cette menace. Il existe des signes d’hybridation avec d’autres sous-espèces de tortues peintes au lac Burnaby (les populations du lac Burnaby et de l’île Pender seront piégées à l’été 2015 afin d’effectuer d’autres analyses génétiques). Des tortues peintes des sous-espèces de l’Est et du Centre ont été vendues dans des animaleries. |
| 9 | Pollution | blanc | Inconnu | Généralisée (71-100 %) | Inconnue | Élevée (menace toujours présente) | blanc |
| 9.1 | Eaux usées domestiques et urbaines | blanc | Inconnu | Généralisée (71-100 %) | Inconnue | Élevée (menace toujours présente) | Les eaux de ruissellement pourraient constituer un problème dans la Sunshine Coast, où la plupart des sites sont entourés de zones résidentielles et où les routes longent souvent des milieux humides et des lacs. Les eaux de ruissellement des cours résidentielles, les eaux usées, le ruissellement des eaux pluviales contribuent à la contamination des sites de tortues. Toutefois, on ne sait pas si les fuites des fosses septiques sont nuisibles aux tortues – des charges élevées en nutriments pourraient même améliorer l’habitat par eutrophisation. Des concentrations élevées d’E. coli ont été signalées dans de nombreux lacs occupés, et des malformations ont été observées chez des tortues dans le parc Stanley. Les produits pharmaceutiques et les perturbateurs endocriniens sont particulièrement préoccupants. Les impacts sur les tortues sont largement inconnus. |
| 9.2 | Effluents industriels et militaires | blanc | Inconnu | Petite (1-10 %) | Inconnue | Élevée (menace toujours présente) | Les polluants industriels peuvent constituer un problème dans certains sites des basses terres continentales, notamment lorsqu’il y a contamination des plans d’eau par des billes traitées et du ruissellement contaminé par les hydrocarbures. Des tumeurs dont la cause est inconnue ont été observées chez certaines tortues. La Réserve naturelle Great Blue Heron reçoit des effluents militaires; le plan de gestion de cette réserve comporte de nombreuses références concernant les effets des polluants (HAP) sur diverses espèces. Même si on a démontré que l’impact est minimal pour les tortues adultes, il pourrait y avoir des impacts sur la reproduction. Déversements causés par le déraillement de trains (p. ex. le déraillement d’un train transportant du charbon devant la plage de nidification du lac Burnaby). Des voies ferrées se trouvent à proximité immédiate de nombreux sites de tortues. Les tortues sont sensibles aux substances qui se bioaccumulent à cause de leur longévité. |
| 9.3 | Effluents agricoles et sylvicoles | blanc | Inconnu | Restreinte (11-30 %) | Inconnue | Élevée (menace toujours présente) | Le ruissellement d’herbicides et de pesticides agricoles qui se produit actuellement et ne cesse d’augmenter est préoccupant. Dans la zone de Nicomen, du glyphosate a été pulvérisé sur l’eau et dans les aires de nidification de tortues (on y a observé des femelles adultes dont la carapace avait une teinte orange inhabituelle). Des études effectuées sur les tortues de Floride ont révélé une faible natalité et des dommages génétiques. Les substances qui se bioaccumulent sont particulièrement préoccupantes dans le cas des espèces qui vivent longtemps, y compris les tortues. Les impacts à l’échelle des populations sont inconnus. |
| 9.4 | Déchets solides et ordures | blanc | blanc | blanc | blanc | blanc | blanc |
| 9.5 | Polluants atmosphériques | blanc | blanc | blanc | blanc | blanc | blanc |
| 9.6 | Apports excessifs d’énergie | blanc | blanc | blanc | blanc | blanc | blanc |
| 10 | Phénomènes géologiques | blanc | blanc | blanc | blanc | blanc | blanc |
| 10.1 | Volcans | blanc | blanc | blanc | blanc | blanc | blanc |
| 10.2 | Tremblements de terre et tsunamis | blanc | blanc | blanc | blanc | blanc | blanc |
| 10.3 | Avalanches et glissements de terrain | blanc | blanc | blanc | blanc | blanc | blanc |
| 11 | Changements climatiques et phénomènes météorologiques violents | blanc | Inconnu | Généralisée (71-100 %) | Inconnue | Modérée (peut-être à court terme, < 10 ans/ 3 gén.) | Menace évaluée sur un horizon de 10 ans, mais il est probable que, à long terme, les impacts seront plus grands que ce que les valeurs attribuées laissent supposer. |
| 11.1 | Déplacement et altération de l’habitat | blanc | blanc | blanc | blanc | blanc | blanc |
| 11.2 | Sécheresses | blanc | Inconnu | Généralisée (71-100 %) | Inconnue | Modérée (peut-être à court terme, < 10 ans/ 3 gén.) | Le maintien d’un taux d’humidité convenable est une préoccupation dans le cas des nids. La fréquence accrue de sécheresses qui est prévue pourrait assécher les nids, réduisant le succès d’éclosion. Les tortues peuvent sélectionner des microhabitats appropriés en termes de température; par conséquent, la dessiccation constitue une plus grande préoccupation que l’augmentation de la température. |
| 11.3 | Températures extrêmes | blanc | Inconnu | Grande (31-70 %) | Inconnue | Modérée (peut-être à court terme, < 10 ans/ 3 gén.) | La température a une incidence sur le rapport des sexes, mais les tortues peintes de l’Ouest connaissent déjà des températures plus élevées qu’en Colombie-Britannique dans bon nombre de régions à l’intérieur de leur aire de répartition mondiale – les températures extrêmes ne sont donc pas considérées comme un problème. |
| 11.4 | Tempêtes et inondations | blanc | Inconnu | Grande (31-70 %) | Inconnue | Modérée (peut-être à court terme, < 10 ans/ 3 gén.) | Les nids peuvent résister à un certain niveau d’inondation (les œufs/nouveau-nés peuvent survivre à de courtes immersions, mais pas durant des mois). L’élévation du niveau de la mer ne constitue pas un problème pour les sites sur l’île de Vancouver, mais quelques sites se trouvant dans les basses terres continentales pourraient être touchés (Iona et Alaksen). Si une inondation survenait pendant l’hibernation des tortues et que cela entraînait des glissements de terrain, cela pourrait avoir des effets graves sur les tortues au marécage Nicomen et ailleurs dans les basses terres continentales. |
Annexe 2. Évaluation des menaces pour la tortue peinte de l’Ouest, population intramontagnarde – des Rocheuses.
Tableau d’évaluation des menaces
- Nom scientifique de l’espèce ou de l’écosystème :
- Chrysemys picta, pop. 2, population intramontagnarde – des Rocheuses
- Identification de l’élément :
- -
- Code de l’élément :
- -
- Date :
- 1/27/2015
- Évaluateur(s) :
- I. Adams et L-A Isaac (rédacteurs du rapport), K. Ovaska (facilitatrice), B. McBride (Secrétariat du COSEPAC), G. Wilson, J. Steciw, O. Dyer, S. Ashpole; certaines valeurs ont été révisées par la suite, compte tenu de l’examen par l’équipe et des commentaires reçus par courriel d’autres personnes qui ont examiné le rapport.
- Références :
- Version provisoire de la mise à jour du rapport de situation du COSEPAC (2015)
| Impact des menaces | Impact des menaces (descriptions) | Comptes des menaces de niveau 1 selon l’intensité de leur impact : Maximum de la plage d’intensité |
Comptes des menaces de niveau 1 selon l’intensité de leur impact : Minimum de la plage d’intensité |
|---|---|---|---|
| A | Très élevé | 0 | 0 |
| B | Élevé | 0 | 0 |
| C | Moyen | 1 | 0 |
| D | Faible | 5 | 6 |
| - | Impact global des menaces calculé : | Élevé | Moyen |
- Valeur de l’impact global attribuée :
- BC = Élevé – moyen
- Ajustement de la valeur de l’impact – justification :
- -
- Commentaires sur l’impact global des menaces :
- La durée d’une génération est estimée à 15 ans; par conséquent, un horizon de 45 ans a été utilisé pour déterminer la gravité de l’impact. On ignore la taille de la population, mais elle compte vraisemblablement moins de 10 000 individus matures. Note : Dans le rapport de situation du COSEPAC de 2016, la durée d’une génération est plutôt de 30-40 ans pour cette population. Il est peu probable que ce changement ait une incidence sur les évaluations, qui deviennent de plus en plus incertaines lorsqu’on les projette loin dans l’avenir.
| # | Menace | Impact (calculé) | Impact (description) | Portée (10 prochaines années) | Gravité (10 ans ou 3 générations) | Immédiateté | Commentaires |
|---|---|---|---|---|---|---|---|
| 1 | Développement résidentiel et commercial | D | Faible | Petite (1-10 %) | Extrême (71-100 %) | Élevée (menace toujours présente) | blanc |
| 1.1 | Zones résidentielles et urbaines | D | Faible | Petite (1-10 %) | Élevée (31-70 %) | Élevée (menace toujours présente) | Les populations de l’intérieur sont principalement rurales, mais certains étangs à tortues se trouvent dans des zones urbaines; il est plus probable que la menace provienne du développement récréatif/saisonnier, y compris de la construction de nouveaux quais. Il est peu probable que la portée dépasse 10 % dans la vallée de l’Okanagan et dans toute l’aire de répartition. |
| 1.2 | Zones commerciales et industrielles | D | Faible | Petite (1-10 %) | Extrême (71-100 %) | Élevée (menace toujours présente) | Les plans d’eau sont peu nombreux dans les zones commerciales/industrielles. Sur environ 100 sites de tortues dans la vallée de l’Okanagan, seulement quelques-uns ont un potentiel d’expansion/de développement industriel. La portée a une valeur qui se situe vers la limite inférieure de l’intervalle de « petite » portée. |
| 1.3 | Zones touristiques et récréatives | D | Faible | Petite (1-10 %) | Modérée (11-30 %) | Élevée (menace toujours présente) | Peu de nouvelles installations sont susceptibles d’ouvrir, mais de nombreuses installations sont déjà en place. On ne dispose d’aucun exemple connu de nouveaux projets. Dans la vallée de l’Okanagan, de nouvelles zones récréatives sont en train d’être aménagées, mais ne comprennent pas des milieux humides; dans la zone du lac Williams, la plupart des tortues se trouvent à l’intérieur de zones récréatives existantes. La portée pourrait être légèrement supérieure à 1 % ou négligeable. Impacts : Le développement riverain pourrait perturber les tortues en hibernation; ce n’est pas un problème aussi important que sur la côte pour les tortues en période de nidification, en raison de différences dans l’habitat de nidification. |
| 2 | Agriculture et aquaculture | D | Faible | Généralisée (71-100 %) | Légère (1-10 %) | Élevée (menace toujours présente) | blanc |
| 2.1 | Cultures annuelles et pérennes de produits autres que le bois | D | Faible | Petite (1-10 %) | Modérée (11-30 %) | Élevée (menace toujours présente) | La conversion de terres à l’agriculture et l’intensification de l’exploitation des terres agricoles existantes seront probablement faibles; il est probable que des terres soient converties à des utilisations plus nuisibles (p. ex. des terres agricoles vendues aux fins de développement résidentiel, malgré que la réserve de terres agricoles de la Colombie-Britannique soit censée empêcher que cela ne se produise). Des bandes tampon minimales sont généralement laissées le long des milieux humides, mais, dans le sud de la vallée de l’Okanagan, il y a très peu de bandes tampon entre les terres agricoles et les milieux humides, de sorte que le potentiel de perturbation de l’habitat est élevé. |
| 2.2 | Plantations pour la production de bois et de pâte | blanc | blanc | blanc | blanc | blanc | blanc |
| 2.3 | Élevage de bétail | D | Faible | Généralisée (71-100 %) | Légère (1-10 %) | Élevée (menace toujours présente) | L’élevage de bétail est répandu dans une grande partie de l’aire de répartition de l’espèce (Thompson, Kootenay-Est, Cariboo), et les étangs à tortues sont exposés au bétail en liberté. Dans la région de Cariboo, du bétail est élevé près des lacs et des sites riverains, et des activités d’aménagement des terres sont effectuées près du centre des villes, et on a donc des préoccupations relatives au succès de nidification chez les plus grandes populations se trouvant près de Williams Lake et de 150 Mile house. Les impacts sont associés au piétinement des nids et des nouveau-nés et à l’altération de la végétation riveraine (pour la contamination de l’eau - voir Pollution) ainsi qu’aux niveaux d’eau réduits dans les étangs dus à l’activité du bétail. En moyenne, on attribue la valeur « légère » à la gravité dans l’aire de répartition de l’UD. |
| 2.4 | Aquaculture en mer et en eau douce | blanc | blanc | blanc | blanc | blanc | blanc |
| 3 | Production d’énergie et exploitation minière | blanc | Négligeable | Négligeable (< 1 %) | Modérée-légère (1-30 %) | Élevée (menace toujours présente) | blanc |
| 3.1 | Forage pétrolier et gazier | blanc | blanc | blanc | blanc | blanc | blanc |
| 3.2 | Exploitation de mines et de carrières | blanc | Négligeable | Négligeable (< 1 %) | Modérée-légère (1-30 %) | Élevée (menace toujours présente) | Peu de nouvelles mines sont prévues dans la région (une mine potentielle est la mine Ajax près de Kamloops – mais on ne sait pas s’il y a des tortues à cet endroit). Il est peu probable que des activités d’extraction soient entreprises à proximité de l’habitat des tortues – il est plus probable qu’elles se déroulent loin des plans d’eau. Les carrières pourraient avoir une incidence sur les sites de nidification, si la question n’est pas abordée durant le processus d’EE; les carrières d’emprunt pour la construction de routes pourraient être plus problématiques (comme pour l’UD de la côte du Pacifique), mais aucune donnée n’est disponible. |
| 3.3 | Énergie renouvelable | blanc | blanc | blanc | blanc | blanc | blanc |
| 4 | Corridors de transport et de service | CD | Moyen-faible | Généralisée (71-100 %) | Modérée-légère (1-30 %) | Élevée (menace toujours présente) | blanc |
| 4.1 | Routes et voies ferrées | CD | Moyen-faible | Généralisée (71-100 %) | Modérée-légère (1-30 %) | Élevée (menace toujours présente) | Les routes constituent une menace majeure pour cette espèce, la plupart des occurrences ayant été observées au fond des vallées, là où il y a des routes. Chaque fois que les tortues doivent traverser une route pour accéder à l’habitat de nidification, elles sont à risque. Dans la région de Cariboo, la plupart des populations de tortues connues se trouvent près d’autoroutes, et le taux de mortalité y est élevé; les autoroutes à quatre voies dans la région sont nuisibles aux tortues. L’utilisation de VTT est également une menace, mais elle est évaluée sous 6.1. La valeur « modérée-légère » est attribuée à la gravité à l’échelle de l’aire de répartition complète de l’UD, parce que bon nombre de routes sont secondaires et peu utilisées ou qu’elles ne croisent pas les couloirs de migration vers les aires de nidification et, aussi, parce que la portée « généralisée » tient compte de toutes les routes, y compris les routes secondaires où la circulation est faible. |
| 4.2 | Lignes de services publics | blanc | Négligeable | Négligeable (< 1 %) | Légère (1-10 %) | Élevée (menace toujours présente) | Il se peut que de nouvelles lignes de transport d’électricité soient construites; cependant, elles ne sont généralement pas installées près des milieux humides. Il y aurait des impacts seulement durant la phase de construction. |
| 4.3 | Voies de transport par eau | blanc | blanc | blanc | blanc | blanc | blanc |
| 4.4 | Corridors aériens | blanc | blanc | blanc | blanc | blanc | blanc |
| 5 | Utilisation des ressources biologiques | D | Faible | Grande (31-70 %) | Légère (1-10 %) | Élevée (menace toujours présente) | blanc |
| 5.1 | Chasse et capture d’animaux terrestres | D | Faible | Petite (1-10 %) | Légère (1-10 %) | Élevée (menace toujours présente) | Des tortues sont capturées et amenées à la maison comme « animaux de compagnie » – cela se produit, mais probablement que ça arrive rarement. Il est plus probable que les tortues en migration soient capturées au gré des occasions, plutôt que dans le cadre d’une chasse aux tortues. Cette activité est plus susceptible d’avoir lieu près des agglomérations plutôt que dans l’arrière-pays – par conséquent, la portée de cette menace est petite. Les femelles risquent le plus d’être capturées, comparativement aux mâles, parce qu’elles sont plus exposées. La gravité varie selon la population locale. Il est peu probable que la capture d’une ou deux tortues dans un étang où il y a plus de 100 tortues ait un impact, mais si la population est petite, les impacts seront beaucoup plus importants. En moyenne, on attribue donc la valeur « légère » à la gravité dans l’aire de répartition de l’UD. |
| 5.2 | Cueillette de plantes terrestres | blanc | blanc | blanc | blanc | blanc | blanc |
| 5.3 | Exploitation forestière et récolte du bois | blanc | Négligeable | Négligeable (< 1 %) | Légère (1-10 %) | Élevée (menace toujours présente) | L’exploitation forestière est relativement faible dans les terres à basse altitude, là où les étangs à tortues se trouvent généralement. Des bandes riveraines sont censées être établies, mais rien ne garantit que cela soit fait, particulièrement lorsque l’exploitation forestière a lieu sur des terres privées. La plus grande menace associée à l’exploitation forestière est probablement la construction de routes (menace 4.1). |
| 5.4 | Pêche et récolte de ressources aquatiques | D | Faible | Grande (31-70 %) | Légère (1-10 %) | Élevée (menace toujours présente) | Les menaces comprennent la mortalité attribuable aux prises accessoires (leurres de pêche qui restent accrochés dans la bouche des tortues); il existe des mentions de tortues capturées par des pêcheurs et de tortues qui se sont retrouvées avec des hameçons accrochés dans la bouche, au lac Gardom, et quelques autres mentions occasionnelles ont aussi été enregistrées (O. Dyer, comm. pers., 2015). De nombreuses populations sont probablement exposées à la pêche, même dans les parcs, mais il faut superposer la répartition des tortues sur une carte des étangs/lacs de pêche pour pouvoir estimer avec exactitude la portée de cette menace. Selon des mentions non confirmées, la récolte de tortues à des fins alimentaires serait effectuée dans un site (étangs Hardy/Gorman’s; O. Dyer, comm. pers., 2015). Une grande incertitude entoure l’impact sur la population, et ce problème nécessite de la documentation et des études supplémentaires. En moyenne, on attribue la valeur « légère » à la gravité dans l’aire de répartition de l’UD, ce qui correspond à la pression et aux impacts variables exercés par les activités de pêche dans les milieux humides occupés. L’enchevêtrement dans des filets ne constitue pas un problème. |
| 6 | Intrusions et perturbations humaines | D | Faible | Restreinte-petite (1-30 %) | Légère (1-10 %) | Élevée (menace toujours présente) | blanc |
| 6.1 | Activités récréatives | D | Faible | Restreinte-petite (1-30 %) | Légère (1-10 %) | Élevée (menace toujours présente) | La perturbation de tortues exposées au soleil ou en période de nidification constitue une préoccupation majeure, et elle peut être causée par presque n’importe quelle activité, p. ex. la promenade de chiens, la randonnée pédestre, l’observation d’oiseaux, le canotage et le camping. Les étangs occupés où des bateaux à moteur circulent sont peu nombreux – la plupart des étangs sont trop petits pour cette activité. Cependant, là où ils sont présents, les bateaux à moteur peuvent perturber les tortues qui s’exposent au soleil, et le sillage qu’ils laissent peut avoir une incidence sur les sites de nidification. Il est peu probable que des tortues subissent des blessures directes. L’utilisation de VTT dans l’habitat riverain et les aires de nidification constitue une plus grande inquiétude. Les courses de VTT dans la boue (Mud-bogging) sont populaires dans certaines régions, mais on ne sait pas si elles ont lieu dans l’habitat des tortues. Les embarcations non motorisées peuvent perturber les tortues, particulièrement interrompre leur exposition au soleil. |
| 6.2 | Guerre, troubles civils et exercices militaires | blanc | blanc | blanc | blanc | blanc | Il y a une population de tortues dans la zone du camp militaire de Vernon, mais les activités d’entraînement ont peu d’incidence en raison de mesures d’atténuation et de l’évitement des étangs en général. Ce n’est pas considéré comme une menace. |
| 6.3 | Travail et autres activités | blanc | Négligeable | Négligeable (< 1 %) | Élevée-modérée (11-70 %) | Élevée (menace toujours présente) | La portée se limite aux étangs occupés dans les zones agricoles. Les impacts sont les dommages causés aux nids et aux individus par la machinerie et l’équipement agricole utilisés pour le labourage et le fauchage. Note : Cette menace aurait dû être incluse dans la catégorie 2.1. |
| 7 | Modifications des systèmes naturels | D | Faible | Grande (31-70 %) | Légère (1-10 %) | Élevée (menace toujours présente) | blanc |
| 7.1 | Incendies et suppression des incendies | blanc | Inconnu | Petite (1-10 %) | Inconnue | Élevée (menace toujours présente) | On pense que le largage de produits ignifuges a une incidence sur les amphibiens, mais l’incidence sur les tortues est incertaine/n’a pas été étudiée. Des impacts sont possibles sur la qualité de l’eau. Le prélèvement d’eau dans les milieux humides à des fins de suppression des incendies est aussi possible. |
| 7.2 | Gestion et utilisation de l’eau et exploitation de barrages | D | Faible | Grande (31-70 %) | Légère (1-10 %) | Élevée (menace toujours présente) | Dans le passé, des barrages ont sûrement inondé des zones étendues d’habitat des tortues (p. ex. au lac Koocanusa), mais il est peu probable que de nouveaux barrages importants soient construits. Les barrages plus petits, souvent construits par des propriétaires fonciers sans permis, peuvent entraîner d’autres problèmes, soit en asséchant l’habitat, en créant de nouveaux étangs (permanents ou temporaires), ou en altérant les régimes hydrologiques/des eaux souterraines. L’eau utilisée pour l’irrigation provient directement des étangs à tortues ou de sources d’eaux souterraines qui alimentent ces étangs; l’irrigation peut donc avoir une incidence. De nombreux milieux humides dans la vallée de l’Okanagan sont visés par des projets de gestion de l’eau. La plupart de l’eau est prélevée dans des grands lacs, ce qui a peu ou n’a pas d’incidence sur les tortues; les tortues sont désormais présentes dans des sites où les fluctuations demeurent à l’intérieur de leurs seuils de tolérance (c.-à-d. que les impacts ont déjà eu lieu). Certains avantages découlent de la gestion de l’eau par le biais de la création d’habitat (p. ex. à Williams Lake : création de fondrières; projets de Canards illimités), ce qui ramène la valeur globale attribuée à la gravité à « légère ». |
| 7.3 | Autres modifications de l’écosystème | blanc | Négligeable | Négligeable (< 1 %) | Inconnue | Élevée (menace toujours présente) | Le dragage et l’élimination des plantes envahissantes peuvent être nuisibles aux tortues, notamment l’élimination d’herbes aquatiques à l’aide d’arracheuses mécaniques. Le dragage effectué en hiver pourrait perturber, voire tuer, des tortues en hibernation. La gestion de plantes envahissantes (aquatiques et terrestres) entraîne l’altération de la structure de l’habitat et pourrait potentiellement blesser ou tuer des individus de l’espèce. À Shuswap, la gestion du myriophylle en épi est effectuée le long de tous les lacs de la vallée de l’Okanagan; un rotoculteur est utilisé dans la boue sous la surface pour libérer les mauvaises herbes; cela se fait généralement en hiver. Les plantes introduites dans l’habitat terrestre (les racines de centaurées ou de graminées s’entremêlant autour des nouveau-nés ou poussant là où ils se trouvent) et l’habitat aquatique continuent d’altérer les étangs à l’intérieur de la Colombie-Britannique, dans l’aire de répartition de cette UD. Toutefois, une grande incertitude entoure les impacts de l’élimination des mauvaises herbes à l’échelle de la population; des études doivent être effectuées. |
| 8 | Espèces et gènes envahissants ou autrement problématiques | blanc | Inconnu | Grande-restreinte (11-70 %) | Inconnue | Élevée (menace toujours présente) | blanc |
| 8.1 | Espèces exotiques (non indigènes) envahissantes | blanc | Inconnu | Grande (31-70 %) | Inconnue | Élevée (menace toujours présente) | Il y a des tortues de Floride introduites dans certains lacs et aussi des achigans – l’incertitude entoure les impacts qu’ils peuvent avoir sur les populations de tortues. Par conséquent, on attribue la valeur « inconnue » à la gravité. |
| 8.2 | Espèces indigènes problématiques | blanc | Inconnu | Inconnue | Inconnue | Élevée (menace toujours présente) | L’étendue de la prédation sur les nids est inconnue, mais pourrait être très élevée dans certaines localités, les prédateurs pouvant être des hérons, des mouffettes, des ratons laveurs (qui ne sont pas indigènes partout dans l’aire de répartition), des visons, des loutres, etc. Dans la région de Creston, une proportion élevée des nids fait l’objet de prédation, mais on ne sait pas exactement quelle proportion s’ajoute aux taux de prédation naturels. |
| 8.3 | Matériel génétique introduit | blanc | Négligeable | Petite (1-10 %) | Négligeable (< 1 %) | Élevée (menace toujours présente) | Le déplacement de tortues peintes par les humains est bien documenté. Par conséquent, le potentiel de mélange génétique est élevé, en grande partie, parce que des individus d’autres sous-espèces de tortues peintes ayant été des animaux de compagnie sont remis en liberté. Le croisement avec des tortues de Floride relâchées est aussi une possibilité. On se préoccupe du fait que le croisement pourrait engendrer une submersion génétique. Bien que cela puisse constituer un problème chez les petites populations côtières en Colombie-Britannique, rien n’indique que cela constitue un problème pour cette UD. On a documenté un degré élevé de variation génétique entre régions en Colombie-Britannique (Jensen et al., 2014). |
| 9 | Pollution | blanc | Inconnu | Grande (31-70 %) | Inconnue | Élevée (menace toujours présente) | blanc |
| 9.1 | Eaux usées domestiques et urbaines | blanc | Inconnu | Petite (1-10 %) | Inconnue | Élevée (menace toujours présente) | On se préoccupe du suintement des fosses septiques ainsi que des eaux usées qui continuent d’être rejetées dans les grands lacs. Le ruissellement d’engrais provenant de pelouses n’est pas aussi préoccupant dans la région, car il y a peu de développement résidentiel alentour de la plupart des étangs à tortues. Toutefois, on ne sait pas si les fuites des fosses septiques sont nuisibles aux tortues – des charges élevées en nutriments pourraient même améliorer l’habitat par eutrophisation. Les produits pharmaceutiques, y compris les perturbateurs endocriniens, sont plus préoccupants, mais les impacts sur les tortues sont inconnus. |
| 9.2 | Effluents industriels et militaires | blanc | Négligeable | Négligeable (< 1 %) | Inconnue | Élevée (menace toujours présente) | Des fuites de résidus miniers pourraient se produire (le mont Polley où un déversement s’est produit dernièrement n’est pas proche des occurrences de tortues). Il n’y a pas beaucoup de pollution industrielle dans les Kootenays, mais il y en a quelque peu dans la vallée de l’Okanagan, mais les effluents sont dirigés principalement vers les grands cours d’eau où il n’y a pas de tortues. |
| 9.3 | Effluents agricoles et sylvicoles | blanc | Inconnu | Grande (31-70 %) | Inconnue | Élevée (menace toujours présente) | Le ruissellement d’engrais et de pesticides agricoles est préoccupant. Les polluants persistants, comme le DDT, sont toujours présents dans les régions de l’Okanagan et de Creston, et la plupart des lacs de basse altitude sont contaminés – les impacts pourraient continuer à se faire sentir. Les substances qui se bioaccumulent sont préoccupantes dans le cas des espèces qui vivent longtemps, y compris les tortues. |
| 9.4 | Déchets solides et ordures | blanc | Inconnu | Petite (1-10 %) | Inconnue | Élevée (menace toujours présente) | Le rejet de déchets dans les milieux humides dans les zones rurales est encore une préoccupation partout dans la région intérieure de la Colombie-Britannique, y compris dans le sud de la vallée de l’Okanagan : environ 30 % des milieux humides contiennent des déchets, mais la situation s’améliore. La proportion est probablement semblable dans la région de Thompson. Les impacts sur les tortues sont inconnus. |
| 9.5 | Polluants atmosphériques | blanc | blanc | blanc | blanc | blanc | blanc |
| 9.6 | Apports excessifs d’énergie | blanc | blanc | blanc | blanc | blanc | blanc |
| 10 | Phénomènes géologiques | blanc | Négligeable | Négligeable (< 1 %) | Élevée-légère (1-70 %) | Modérée (peut-être à court terme, < 10 ans/ 3 gén.) | blanc |
| 10.1 | Volcans | blanc | blanc | blanc | blanc | blanc | blanc |
| 10.2 | Tremblements de terre et tsunamis | blanc | blanc | blanc | blanc | blanc | blanc |
| 10.3 | Avalanches et glissements de terrain | blanc | Négligeable | Négligeable (< 1 %) | Élevée-légère (1-70 %) | Modérée (peut-être à court terme, < 10 ans/ 3 gén.) | Les glissements de terrain pourraient avoir une incidence sur les étangs à tortues ou sur l’habitat de nidification des tortues (p. ex. le glissement de terrain à Oliver en 2010 – ruisseau Lyndon; on ne sait pas si les milieux aquatiques ont été touchés). Un glissement de terrain s’étendant sur une longueur de 30-40 m s’est produit récemment au lac Vaseux, mais il n’a pas eu grand impact. Cela pourrait arriver dans un avenir rapproché, mais les probabilités sont faibles. |
| 11 | Changements climatiques et phénomènes météorologiques violents | blanc | Inconnu | Généralisée (71-100 %) | Inconnue | Élevée (menace toujours présente) | Menace évaluée sur un horizon de 10 ans, mais il est probable que, à long terme, les impacts seront plus grands que ce que les valeurs attribuées laissent supposer. |
| 11.1 | Déplacement et altération de l’habitat | blanc | blanc | blanc | blanc | blanc | blanc |
| 11.2 | Sécheresses | blanc | Inconnu | Généralisée (71-100 %) | Inconnue | Élevée (menace toujours présente) | Les tendances à l’assèchement à long terme pourraient être catastrophiques aux populations de tortues. De nombreux étangs dépendent probablement de sources d’eau souterraine. De plus, les sécheresses auraient une incidence sur le régime d’humidité dans les nids de tortues et vraisemblablement sur le succès d’éclosion. Pour le bassin du Columbia, les modèles climatiques prévoient des étés plus chauds et plus secs et des hivers plus humides, et, par conséquent, il est sans doute peu probable que des changements des eaux souterraines significatifs à long terme se produisent. L’étendue, l’échelle temporelle et la probabilité des sécheresses au cours des 10 prochaines années sont toutes incertaines, et il n’est donc pas facile d’attribuer une valeur à la gravité. La demande pour le prélèvement de l’eau de surface et souterraine sera plus grande avec l’évolution des changements climatiques. Les effets des sécheresses sont synergiques et cumulatifs avec ceux causés par les activités humaines (évalués sous des catégories distinctes) qui changent les régimes hydrologiques. |
| 11.3 | Températures extrêmes | blanc | Inconnu | Grande (31-70 %) | Inconnue | Élevée (menace toujours présente) | Les changements de température peuvent avoir une incidence sur l’incubation et biaiser le rapport des sexes, mais ont probablement un impact moins marqué que les sécheresses. L’aire de répartition mondiale de cette espèce est étendue, et, dans de nombreuses régions, les individus sont régulièrement soumis à des températures beaucoup plus élevées qu’en Colombie-Britannique. |
| 11.4 | Tempêtes et inondations | blanc | Inconnu | Restreinte (11-30 %) | Inconnue | Élevée (menace toujours présente) | Les nids peuvent résister à un certain niveau d’inondation (les œufs/nouveau-nés peuvent survivre de courtes immersions, mais pas durant des mois). Les tempêtes sont probablement moins significatives dans la région intérieure que le long de la côte. |
Annexe 3. Évaluation des menaces pour la tortue peinte de l’Ouest, population des Prairies/boréale de l’Ouest – Bouclier canadien.
Tableau d’évaluation des menaces
- Nom scientifique de l’espèce ou de l’écosystème :
- Chrysemys picta, population des Prairies/boréale de l’Ouest – Bouclier canadien
- Identification de l’élément :
- -
- Code de l’élément :
- -
- Date :
- 1/29/2015
- Évaluateur(s) :
- I. Adams et L-A Isaac (rédateurs du rapport), K. Ovaska (facilitatrice), B. McBride (Secrétariat du COSEPAC), J. Bogart, R. Poulin, C. Paszkowski, J. Keith, Patrick Moldowan; certaines valeurs ont été révisées par la suite, compte tenu de l’examen par l’équipe et des commentaires reçus par courriel d’autres personnes qui ont examiné le rapport.
- Références :
- Version provisoire de la mise à jour du rapport de situation du COSEPAC (2015))
| Impact des menaces | Impact des menaces (descriptions) | Comptes des menaces de niveau 1 selon l’intensité de leur impact : Maximum de la plage d’intensité |
Comptes des menaces de niveau 1 selon l’intensité de leur impact : Minimum de la plage d’intensité |
|---|---|---|---|
| A | Très élevé | 0 | 0 |
| B | Élevé | 0 | 0 |
| C | Moyen | 0 | 0 |
| D | Faible | 6 | 6 |
| - | Impact global des menaces calculé : | Moyen | Moyen |
- Valeur de l’impact global attribuée :
- C = Moyen
- Ajustement de la valeur de l’impact – justification :
- -
- Commentaires sur l’impact global des menaces :
- La durée d’une génération est estimée à 15 ans; par conséquent, un horizon de 45 ans a été utilisé pour déterminer la gravité de l’impact; la répartition canadienne est très grande, depuis le sud est de l’Alberta jusqu’à l’est du lac Supérieur en Ontario; la taille de la population totale se situe probablement dans les dizaines de milliers; les sites où l’espèce a été introduite (en Alberta, à l’extérieur de Milk River; près de Saskatoon, etc.) NE sont PAS pris en compte dans cette évaluation. Note : Dans le rapport de situation du COSEPAC de 2016, la durée d’une génération est plutôt de 30-40 ans pour cette population. Il est peu probable que ce changement ait une incidence sur les évaluations, qui deviennent de plus en plus incertaines lorsqu’on les projette loin dans l’avenir.
| # | Menace | Impact (calculé) | Impact (description) | Portée (10 prochaines années) | Gravité (10 ans ou 3 générations) | Immédiateté | Commentaires |
|---|---|---|---|---|---|---|---|
| 1 | Développement résidentiel et commercial | D | Faible | Petite (1-10 %) | Élevée (31-70 %) | Élevée (menace toujours présente) | blanc |
| 1.1 | Zones résidentielles et urbaines | D | Faible | Petite (1-10 %) | Élevée (31-70 %) | Élevée (menace toujours présente) | L’habitat des tortues se trouve principalement dans des zones rurales, mais comprend aussi des zones suburbaines, p. ex. Regina, Winnipeg, Brandon, et de plus petites agglomérations qui connaissent peut-être une certaine expansion. Dans la portion du Bouclier canadien, la construction de chalets saisonniers peut toucher de nombreuses régions – Whiteshell, lac des Bois, à l’extérieur de Thunder Bay, etc. Les chalets sont souvent construits sur des terrains rocheux (particulièrement en Ontario) et rarement dans de l’habitat convenable aux tortues. En Saskatchewan, les tortues sont présentes principalement dans les rivières, et le chevauchement avec les zones faisant l’objet de développement est limité. La portée a une valeur qui se situe vers la limite inférieure de l’intervalle de « petite » portée (peut-être légèrement supérieure à 1 %), particulièrement dans les Prairies. |
| 1.2 | Zones commerciales et industrielles | blanc | Négligeable | Négligeable (< 1 %) | Extrême (71-100 %) | Élevée (menace toujours présente) | blanc |
| 1.3 | Zones touristiques et récréatives | blanc | Négligeable | Négligeable (< 1 %) | Modérée (11-30 %) | Élevée (menace toujours présente) | Comprend les terrains de camping, les centres de villégiature au bord de lacs, les parcours de golf, etc. Les impacts touchent le plus probablement le nord-ouest de l’Ontario et le sud-est du Manitoba; il y a eu un essor significatif des lotissements de villégiature en Saskatchewan au cours des cinq dernières années, mais pas nécessairement dans l’habitat des tortues. Dans l’aire de répartition de cette UD, le nombre de nouveaux projets de développement est probablement faible – de nombreux centres de villégiature sont déjà établis. Aucun employé répondant aux appels n’était au courant de nouveaux projets ou propositions de villégiature d’envergure dans l’habitat des tortues. |
| 2 | Agriculture et aquaculture | blanc | Négligeable | Négligeable (< 1 %) | Modérée (11-30 %) | Élevée (menace toujours présente) | blanc |
| 2.1 | Cultures annuelles et pérennes de produits autres que le bois | blanc | Négligeable | Négligeable (< 1 %) | Modérée (11-30 %) | Élevée (menace toujours présente) | Peu de nouvelles terres devraient être converties à l’agriculture dans l’aire de répartition; la proportion pourrait être < 1 % – la perte d’habitat attribuable à cette source est surtout historique. Ce n’est pas un problème dans le Bouclier canadien, sauf dans la région de Rainy River, où (là aussi) très peu de nouvelles terres devraient être converties. On laisse toujours des bandes tampon terrestres le long de méandres de rivières en Saskatchewan; les probabilités que les méandres morts soient remblayés sont faibles (et c’est très coûteux). |
| 2.2 | Plantations pour la production de bois et de pâte | blanc | blanc | blanc | blanc | blanc | blanc |
| 2.3 | Élevage de bétail | blanc | Négligeable | Négligeable (< 1 %) | Légère (1-10 %) | Élevée (menace toujours présente) | L’exposition de l’habitat des tortues au bétail en liberté constitue surtout un problème en Alberta et dans le sud-ouest de la Saskatchewan, où les tortues sont relativement peu nombreuses. La portée a une valeur qui se situe vers la limite inférieure de l’intervalle de « petite » portée ou est probablement « négligeable ». Les tortues occupent des rivières en Saskatchewan; elles ont donc peu d’interactions avec le bétail. L’exposition de certains étangs à tortues au bétail en liberté pourrait avoir des impacts continus. Les impacts sont associés au piétinement des nids et des nouveau-nés (ce qui arrive probablement rarement) ou de la végétation riveraine (la contamination de l’eau est évaluée sous Pollution), ou sont associés à la réduction des niveaux d’eau dans les étangs due à l’activité du bétail. |
| 2.4 | Aquaculture en mer et en eau douce | blanc | blanc | blanc | blanc | blanc | L’aquaculture de truites en eau douce est effectuée dans certaines régions des Prairies et de l’Alberta; il n’y a pas de chevauchement avec l’habitat des tortues en Alberta; par conséquent, ce n’est pas une menace actuellement. |
| 3 | Production d’énergie et exploitation minière | D | Faible | Petite (1-10 %) | Élevée-modérée (11-70 %) | Élevée (menace toujours présente) | blanc |
| 3.1 | Forage pétrolier et gazier | blanc | Négligeable | Négligeable (< 1 %) | Inconnue | Élevée (menace toujours présente) | Sur un horizon de 10 ans, il y aura probablement quelques activités de fracturation hydraulique liées au gaz/pétrole, particulièrement dans le sud de la Saskatchewan (nord du champ de Bakken). Actuellement, la portée est < 1 %, compte tenu de l’aire de répartition de cette UD au complet. Les conséquences de la fracturation hydraulique sur les eaux souterraines constituent une menace potentiellement importante, mais incertaine : il faut mieux comprendre les impacts sur la qualité et la quantité d’eau (abordées dans les catégories Pollution et Gestion de l’eau, respectivement). Il y a des activités pétrolières et gazières dans le sud-est de la Saskatchewan, mais ces activités évitent les rivières où des tortues sont présentes, de sorte que l’interaction est minimale; en Alberta, il y a peu d’interaction dans le sud-est, là où les tortues sont présentes (pour les espèces de poissons se trouvant dans cette région, l’agriculture est un plus grand problème que les activités pétrolières et gazières). La majeure partie de l’exploitation pétrolière et gazière évite d’engendrer des perturbations directes sur l’eau de surface. |
| 3.2 | Exploitation de mines et de carrières | D | Faible | Petite (1-10 %) | Élevée-modérée (11-70 %) | Élevée (menace toujours présente) | La portée a une valeur qui se situe vers la limite inférieure de l’intervalle de « petite » portée. La plupart des nouvelles mines se trouveront probablement dans le nord-ouest de l’Ontario. Des infrastructures de mine de potasse en Saskatchewan pourraient constituer un problème (mais elles sont très loin sous terre). Seules trois mines de potasse se trouvent dans l’aire de répartition de cette UD en Saskatchewan et ont des terrils de déchets à une échelle très locale, ayant un impact minimal, voire nul, sur l’eau de surface. Bon nombre des mines, réparties à travers la portion de l’aire de répartition de cette UD située dans les Prairies, utilisent d’importants volumes d’eau provenant de systèmes de distribution d’eau à proximité dans le cadre de leurs activités. L’abaissement des niveaux d’eau dû à l’intensification de l’exploitation de mines de potasse, généralement effectuée au moyen de techniques d’extraction par solution, pourrait avoir des impacts sur l’habitat des tortues. Les gravières et les carrières d’emprunt et les nouvelles mines potentielles pourraient être plus problématiques. Des carrières d’emprunt sont mises en place pour des chemins forestiers dans la région du Bouclier canadien, mais elles sont généralement situées loin des zones riveraines (en Alberta, les « carrières d’emprunt » sont utilisées par des amphibiens). L’empreinte de chaque mine considérée individuellement est très faible relativement à l’aire de répartition étendue de cette UD, mais, là où une mine chevauche l’habitat des tortues, les impacts pourraient être élevés à l’échelle locale. La fourchette de valeurs attribuée à la gravité reflète l’incertitude de l’impact global attribuable à divers types d’activités. |
| 3.3 | Énergie renouvelable | blanc | blanc | blanc | blanc | blanc | blanc |
| 4 | Corridors de transport et de service | D | Faible | Restreinte (11-30 %) | Légère (1-10 %) | Élevée (menace toujours présente) | blanc |
| 4.1 | Routes et voies ferrées | D | Faible | Restreinte (11-30 %) | Légère (1-10 %) | Élevée (menace toujours présente) | Comprend les nouvelles routes et la mortalité due à la circulation sur les routes existantes (des individus sont tués sur les routes, et des nids sur le bord des routes risquent d’être écrasés). Les préoccupations relatives à la mortalité routière dans les Prairies sont limitées et locales. Les routes de gravier et les talus le long des routes dans le nord-ouest de l’Ontario sont peut-être utilisés de façon disproportionnée comme habitat de nidification, particulièrement là où les substrats nécessaires à la nidification sont limités dans les zones de substrat rocheux exposé. Chaque fois que les tortues doivent traverser une route (quelle qu’elle soit) pour accéder à l’habitat de nidification, elles sont à risque. La densité de la circulation est plus faible sur de nombreuses routes secondaires dans l’aire de répartition de cette UD que dans les basses terres continentales de la Colombie-Britannique – par conséquent, la valeur attribuée à la gravité est moins élevée pour cette UD. Les plateformes de chemins de fer peuvent empêcher les déplacements dans certaines régions. La valeur « restreinte » est attribuée à la portée, parce que de nombreux sites de tortues se trouvent dans des zones relativement éloignées, loin des routes, dans l’aire de répartition étendue de cette UD. |
| 4.2 | Lignes de services publics | blanc | Négligeable | Négligeable (< 1 %) | Légère (1-10 %) | Élevée (menace toujours présente) | Possibilité de nouvelles lignes de transport d’électricité. Des impacts se manifesteraient seulement dans la phase de construction. |
| 4.3 | Voies de transport par eau | blanc | blanc | blanc | blanc | blanc | blanc |
| 4.4 | Corridors aériens | blanc | blanc | blanc | blanc | blanc | blanc |
| 5 | Utilisation des ressources biologiques | D | Faible | Petite (1-10 %) | Légère (1-10 %) | Élevée (menace toujours présente) | blanc |
| 5.1 | Chasse et capture d’animaux terrestres | D | Faible | Petite (1-10 %) | Légère (1-10 %) | Élevée (menace toujours présente) | Des tortues sont régulièrement capturées et amenées à la maison comme « animaux de compagnie ». Les femelles risquent le plus d’être capturées, comparativement aux mâles, parce qu’elles sont plus exposées en milieu terrestre lorsqu’elles se déplacent vers les aires de nidification. En Alberta et en Saskatchewan, la grande majorité des tortues se trouvent dans des zones rurales plutôt que des zones urbaines, où la capture d’individus pour en faire des animaux de compagnie n’est pas un problème. Cela pourrait être plus problématique dans l’habitat qui se trouve dans le Bouclier canadien au Manitoba et en Ontario, là où il y a des chalets, mais il est moins probable que ce soit une menace dans le nord-ouest de l’Ontario, où de nombreux lacs/étangs sont dans des zones éloignées. La gravité dépend de la taille et de la situation de la population locale. Il est peu probable que la capture d’une ou deux tortues dans un étang où il y a plus de 100 tortues ait un impact, mais si la population est petite, les impacts seront beaucoup plus importants. |
| 5.2 | Cueillette de plantes terrestres | blanc | blanc | blanc | blanc | blanc | blanc |
| 5.3 | Exploitation forestière et récolte du bois | D | Faible | Petite (1-10 %) | Légère (1-10 %) | Élevée (menace toujours présente) | Une proportion appréciable de tortues est exposée à l’exploitation forestière dans le Bouclier canadien, particulièrement dans le nord de l’Ontario, mais les tortues ne sont pas très exposées à cette menace ailleurs. L’exploitation forestière demeure une préoccupation mineure pour cette espèce, pourvu que des bandes tampon appropriées soient maintenues alentour des étangs. Si des bandes riveraines ne sont pas maintenues, il pourrait y avoir des impacts à l’échelle locale, car les déplacements seraient perturbés et des barrières entraveraient la migration (les routes liées à l’exploitation forestière sont davantage un problème). |
| 5.4 | Pêche et récolte de ressources aquatiques | blanc | Inconnu | Petite (1-10 %) | Inconnue | Élevée (menace toujours présente) | Les menaces comprennent les leurres de pêche qui restent pris dans la bouche des tortues et causent leur mort, mais, même s’il ne fait aucun doute que cela arrive (tel que signalé en Colombie-Britannique), aucun signalement n’a été fait dans l’aire de répartition de cette UD. Cela pourrait arriver à l’occasion, mais il se peut que les impacts sur les populations plus grandes ne soient pas significatifs; les effets à l’échelle de la population sont inconnus. La récolte de cette espèce à des fins alimentaires n’est pas considérée comme une menace actuellement. |
| 6 | Intrusions et perturbations humaines | D | Faible | Restreinte-petite (1-30 %) | Légère (1-10 %) | Élevée (menace toujours présente) | blanc |
| 6.1 | Activités récréatives | D | Faible | Restreinte-petite (1-30 %) | Légère (1-10 %) | Élevée (menace toujours présente) | Là où ils sont présents, les bateaux à moteur peuvent perturber les tortues qui s’exposent au soleil, et le sillage qu’ils laissent peut avoir une incidence sur les sites de nidification. L’exposition à cette menace est variable à l’échelle de l’aire de répartition étendue de l’UD et pourrait être plus grande vers l’est. En Saskatchewan, il y a un certain niveau d’activités récréatives associées aux lotissements de chalets près des quelques lacs situés à l’intérieur de l’aire de répartition de l’espèce; on y pratique notamment du ski sur motomarine. Il y a une possibilité de mortalité directe attribuable aux collisions avec les bateaux à moteur et les hélices de bateaux; cependant, les tortues peintes se tiennent généralement dans les zones marécageuses et s’enfoncent dans l’eau lorsqu’elles sont perturbées, et elles sont donc moins vulnérables que d’autres espèces de tortues. Les embarcations non motorisées peuvent aussi perturber les tortues et interrompre leur exposition au soleil. Des VTT sont parfois utilisés, mais de façon très localisée; ils peuvent endommager les milieux riverains et les lieux de nidification. Les fourchettes de valeurs attribuées, en moyenne, à la portée et à la gravité à l’échelle de l’aire de répartition reflètent l’incertitude. |
| 6.2 | Guerre, troubles civils et exercices militaires | blanc | blanc | blanc | blanc | blanc | blanc |
| 6.3 | Travail et autres activités | blanc | blanc | blanc | blanc | blanc | blanc |
| 7 | Modifications des systèmes naturels | D | Faible | Petite (1-10 %) | Modérée-légère (1-30 %) | Élevée (menace toujours présente) | blanc |
| 7.1 | Incendies et suppression des incendies | blanc | Inconnu | Petite (1-10 %) | Inconnue | Élevée (menace toujours présente) | On pense que le largage de produits ignifuges a une incidence sur les amphibiens, mais l’incidence sur les reptiles et les tortues est incertaine/n’a pas été étudiée. C’est surtout un problème dans le Bouclier canadien. |
| 7.2 | Gestion et utilisation de l’eau et exploitation de barrages | D | Faible | Petite (1-10 %) | Modérée-légère (1-30 %) | Élevée (menace toujours présente) | Les barrages existants ont probablement détruit une partie de l’habitat des tortues et en ont créé ailleurs. Utilisation potentielle de l’eau de surface pour la fracturation hydraulique. Les barrages plus petits, souvent construits par des propriétaires fonciers, peuvent entraîner d’autres problèmes, soit en asséchant l’habitat, en créant de nouveaux étangs, ou en altérant les régimes hydrologiques/des eaux souterraines. L’irrigation, pour laquelle l’eau est prélevée directement dans les étangs à tortues ou à partir de sources d’eaux souterraines qui alimentent ces étangs, peut avoir une incidence. La prise en compte de ce problème est particulièrement pertinente à l’extrémité ouest de l’aire de répartition de cette UD, où la quantité d’eau suscite des préoccupations, p. ex. dans le sud-est de l’Alberta ou ailleurs dans les Prairies (voir le document d’Environnement Canada sur l’utilisation de l’eau dans l’ouest du Canada). |
| 7.3 | Autres modifications de l’écosystème | blanc | Inconnu | Petite (1-10 %) | Inconnue | Élevée (menace toujours présente) | La portée a une valeur qui se situe plus près de 1 %. Exemples d’activités qui auraient une incidence sur les tortues : l’élimination de la végétation aquatique et émergente; la modification des plages dans une zone de villégiature (chalets); l’enlèvement des troncs d’arbres sur lesquels les tortues s’exposent au soleil. |
| 8 | Espèces et gènes envahissants ou autrement problématiques | blanc | Inconnu | Restreinte-petite (1-30 %) | Inconnue | Élevée (menace toujours présente) | blanc |
| 8.1 | Espèces exotiques (non indigènes) envahissantes | blanc | Inconnu | Restreinte-petite (1-30 %) | Inconnue | Élevée (menace toujours présente) | Parmi les espèces envahissantes qui constituent des menaces potentielles, on retrouve le cladocère épineux en Ontario (pas en Alberta – de nombreuses espèces exotiques de zooplancton ne se sont pas encore rendues jusque-là; et probablement pas en Saskatchewan non plus), la carpe asiatique et la carpe commune ainsi que d’autres espèces d’animaux aquatiques. Il y a un plus grand nombre d’espèces aquatiques envahissantes dans l’aire de répartition de cette UD que dans les aires de répartition des UD qui se trouvent en Colombie-Britannique. Les plantes envahissantes sont également une source de préoccupations, à la fois les plantes terrestres (en Colombie-Britannique, les racines de graminées peuvent s’entremêler autour des nouveau-nés ou pousser là où ils se trouvent) et les plantes aquatiques qui altèrent les étangs (ces dernières sont abordées sous Modifications de l’écosystème, à moins que les impacts sur les tortues ne soient directs). |
| 8.2 | Espèces indigènes problématiques | blanc | Inconnu | Restreinte-petite (1-30 %) | Inconnue | Élevée (menace toujours présente) | On ne connaît pas l’ampleur de la prédation, mais celle exercée par les hérons, les mouffettes et les ratons laveurs (qui ne sont pas indigènes partout dans l’aire de répartition) les visons, les loutres, etc., pourrait être très élevée dans certaines localités. Il est difficile de distinguer les niveaux de prédation naturels des niveaux résultant de l’abondance accrue de commensaux des humains. |
| 8.3 | Matériel génétique introduit | blanc | Négligeable | Petite (1-10 %) | Négligeable (< 1 %) | Élevée (menace toujours présente) | Le déplacement de tortues peintes par les humains est bien documenté. Par conséquent, le potentiel de mélange génétique est élevé, en grande partie, parce que des individus d’autres sous-espèces de tortues peintes ayant été des animaux de compagnie sont remis en liberté. Le croisement avec des tortues de Floride relâchées est aussi une possibilité. On se préoccupe du fait que le croisement pourrait engendrer une submersion génétique. Bien que cela puisse constituer un problème chez les petites populations côtières en Colombie-Britannique, rien n’indique que cela constitue un problème pour cette UD. Toutefois, aucune donnée génétique n’est disponible pour cette UD (des études génétiques sont nécessaires afin de clarifier la structure d’UD à l’échelle de cette UD nominale). |
| 9 | Pollution | blanc | Inconnu | Restreinte (11-30 %) | Inconnue | Élevée (menace toujours présente) | blanc |
| 9.1 | Eaux usées domestiques et urbaines | blanc | Inconnu | Petite (1-10 %) | Inconnue | Élevée (menace toujours présente) | Dans les zones urbaines (p. ex. au lac Wascana, à Regina) et dans des zones rurales plus peuplées, le ruissellement provenant des fosses septiques, les eaux usées urbaines et le ruissellement d’engrais sont inquiétants (tous les chalets ont des fosses septiques). Toutefois, on ne sait pas si les fuites des fosses septiques sont nuisibles aux tortues – des charges élevées en nutriments pourraient même améliorer l’habitat par eutrophisation. Les produits pharmaceutiques, y compris les perturbateurs endocriniens, sont plus préoccupants, mais les impacts sur les tortues sont inconnus. |
| 9.2 | Effluents industriels et militaires | blanc | Négligeable | Négligeable (< 1 %) | Inconnue | Élevée (menace toujours présente) | Il existe un potentiel de contamination de l’habitat des tortues par des fuites de résidus miniers. La pollution due aux déversements est aussi possible dans les étangs urbains à proximité d’activités industrielles. Les usines de pâte contribuent également à cette catégorie. Il y a aussi possibilité de contamination due à la fracturation hydraulique ou d’une contamination des eaux souterraines causée par des activités pétrolières et gazières. Les impacts sur les tortues sont largement inconnus. |
| 9.3 | Effluents agricoles et sylvicoles | blanc | Inconnu | Restreinte (11-30 %) | Inconnue | Élevée (menace toujours présente) | Le ruissellement d’engrais et de pesticides agricoles est préoccupant dans les Prairies et dans le district de Rainy River (nord-ouest de l’Ontario). Peu d’études ont été publiées concernant les effets directs sur les tortues peintes, mais on sait que de nombreux pesticides sont nuisibles aux reptiles (Sparling et al., 2010). La plupart des tortues dans les Prairies sont exposées au ruissellement agricole à un moment ou à un autre de leur vie, mais les niveaux d’exposition varient grandement selon leur proximité à la source du ruissellement. Des pesticides et des herbicides sont utilisés dans le cadre d’activités d’exploitation forestière. Tous les produits ci-dessus contiennent des composés chimiques plus dangereux que ceux contenus dans le ruissellement provenant des zones urbaines et des fosses septiques. Les substances qui se bioaccumulent sont particulièrement préoccupantes. Dans la région intérieure de la Colombie-Britannique, on continue de trouver des résidus de DDT dans presque tous les lacs; on ne sait pas ce à quoi ressemble la situation à l’est de la Colombie-Britannique, mais des produits chimiques persistants sont probablement présents dans certaines parties de l’aire de répartition de cette UD. Toutes les catégories de pollution sont indiquées comme étant inconnues et doivent faire l’objet d’études. |
| 9.4 | Déchets solides et ordures | blanc | blanc | blanc | blanc | blanc | blanc |
| 9.5 | Polluants atmosphériques | blanc | blanc | blanc | blanc | blanc | blanc |
| 9.6 | Apports excessifs d’énergie | blanc | blanc | blanc | blanc | blanc | blanc |
| 10 | Phénomènes géologiques | blanc | blanc | blanc | blanc | blanc | blanc |
| 10.1 | Volcans | blanc | blanc | blanc | blanc | blanc | blanc |
| 10.2 | Tremblements de terre et tsunamis | blanc | blanc | blanc | blanc | blanc | blanc |
| 10.3 | Avalanches et glissements de terrain | blanc | blanc | blanc | blanc | blanc | blanc |
| 11 | Changements climatiques et phénomènes météorologiques violents | blanc | Inconnu | Grande (31-70 %) | Inconnu | Modérée (peut-être à court terme, < 10 ans/3 gén.) | Menace évaluée sur un horizon de 10 ans, mais il est probable que, à long terme, les impacts seront plus grands que ce que les valeurs attribuées laissent supposer. |
| 11.1 | Déplacement et altération de l’habitat | blanc | blanc | blanc | blanc | blanc | blanc |
| 11.2 | Sécheresses | blanc | Inconnu | Restreinte (11-30 %) | Inconnue | Modérée (peut-être à court terme, < 10 ans/3 gén.) | Une tendance à l’assèchement à long terme pourrait représenter un problème localement pour les tortues, selon le type de milieu humide et de bassin versant, étant donné que les étangs et les marais peu profonds deviendraient plus petits et seraient moins persistants. Les sécheresses estivales prolongées peuvent aussi assécher les substrats dans les lieux de nidification, réduisant le succès d’éclosion. Les effets les plus importants et les plus immédiats se font probablement ressentir dans les Prairies à l’extrémité ouest de l’aire de répartition de cette UD. Selon les prévisions, les changements climatiques toucheront plus durement la partie de l’aire de répartition se trouvant en Alberta, mais l’eau pourrait ne pas devenir un facteur limitatif dans le Bouclier canadien, du moins à court terme; en Saskatchewan, les tortues sont généralement associées avec des plans d’eau plus permanents, de sorte que la gravité de cette menace sera moindre que si elles se trouvaient dans des plans d’eau plus éphémères. Cependant, de nombreux méandres morts et rivières pourraient dépendre de sources d’eau souterraine. L’étendue, l’échelle temporelle et la probabilité des sécheresses au cours des 10 prochaines années sont toutes incertaines, et il n’est donc pas facile d’attribuer une valeur à la gravité. La demande pour le prélèvement de l’eau de surface et souterraine sera plus grande avec l’évolution des changements climatiques. Les effets des sécheresses sont synergiques et cumulatifs avec ceux causés par les activités humaines (évalués sous des catégories distinctes) qui changent les régimes hydrologiques. |
| 11.3 | Températures extrêmes | blanc | Inconnu | Grande (31-70 %) | Inconnue | Modérée (peut-être à court terme, < 10 ans/3 gén.) | Les changements de température peuvent avoir une incidence sur l’incubation et biaiser le rapport des sexes chez les tortues; cependant, l’espèce a une aire de répartition mondiale étendue, qui est déjà caractérisée par des régimes de température très variés. Le moment où les saisons débutent pourrait être plus important que les températures extrêmes en tant que telles (car il peut avoir une incidence sur le succès de nidification chez les tortues ainsi que chez les oiseaux; une inquiétude dans les Prairies). Une augmentation des températures pourrait être bénéfique si elle étend vers le nord la zone géographique où les tortues peuvent se reproduire. |
| 11.4 | Tempêtes et inondations | blanc | Inconnu | Restreinte (11-30 %) | Inconnue | Modérée (peut-être à court terme, < 10 ans/3 gén.) | Les modèles des changements climatiques prévoient qu’il y aura des orages violents plus fréquents en Alberta, ce qui pourrait causer des dommages aux nids et à l’habitat. Les nids peuvent résister à un certain niveau d’inondation (les œufs/nouveau-nés peuvent survivre de courtes immersions, mais pas durant des mois – voir les notes pour l’UD de la côte du Pacifique). |