Programme de rétablissement pour multiespèces en péril dans les prés maritimes des écosystèmes du chêne de Garry : chapitre 4
3. Information sur les espèces
- 3.1 Marbré insulaire (Euchloe ausonides insulanus)
- 3.2 Damier de Taylor (Euphydryas editha taylori)
- 3.3 Triphysaire versicolore (Triphysaria versicolor ssp. versicolor)
- 3.4 Sanicle patte-d’ours (Sanicula arctopoides)
- 3.5 Grand silène de scouler (Silene scouleri ssp. grandis)
- 3.6 Castilléjie dorée (Castilleja levisecta)
- 3.7 Lupin élégant (Lupinus lepidus var. lepidus)
- 3.8 Sanicle bipinnatifide (Sanicula bipinnatifida)
- 3.9 Lotier splendide (Lotus formosissimus)
Nom commun :
Marbré insulaire
Nom scientifique :
Euchloe ausonides
Statut :
Espèce disparue du pays
Dernier examen ou dernière modification :
Mai 2000 (aucune modification).
Justification de la désignation :
Ce papillon se trouvait auparavant sur deux îles au large de la côte Ouest, mais il a disparu des deux sites en 1910 en raison de la perte de la plante-hôte de ses larves. Il n'a pas été observé au Canada depuis lors.
Présence au Canada :
Colombie-Britannique
Historique du statut :
Espèce disparue du Canada avant 1910. Espèce désignée « disparue du pays » en avril 1999. Réexamen et confirmation du statut en mai 2000. Dernière évaluation fondée sur un rapport de situation existant.
L'Euchloe ausonides ssp. insulanus est un taxon bien défini selon la description fournie dans le rapport de situation du COSEPAC (Shepard, 2000b). L'espèce a été reconnue comme une sous-espèce distincte, selon la description fournie par Guppy et Shepard (2001).
Le marbré insulaire est un papillon diurne blanc et noir grisâtre. Le dessous des ailes postérieures est marbré, tandis que le sommet des ailes antérieures porte des marques noires. Les nervures des ailes postérieures sont surlignées de jaune, ce qui confère à l'espèce son aspect marbré. Les sexes sont semblables, mais chez la femelle, les marbrures de l'aile postérieure sont d'un jaune plus foncé et la couleur principale des ailes est jaune, alors qu'elle est blanche chez le mâle. Le corps est recouvert d'une pubescence jaune blanchâtre qui lui confère un aspect pelucheux.
L'Euchloe ausonides insulanus est isolé des autres sous-espèces. Considérée dans son ensemble, l'espèce se rencontre de l'Alaska à la Californie et au Colorado et, vers l'est, jusqu'en Ontario et au Minnesota.
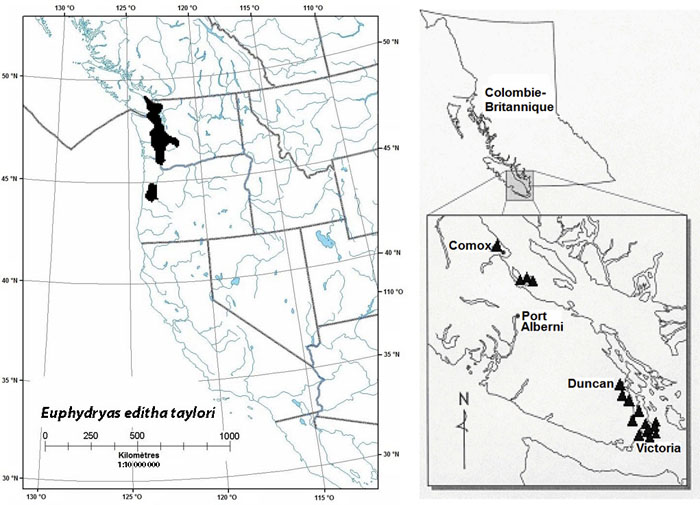
À l'échelle mondiale, la sous-espèce insulanus est actuellement représentée par une seule population dans l'État de Washington (S1). Cette population a été découverte en 1998 dans le parc historique San Juan (American Camp), dans l'île San Juan (figure 1) (J. Fleckenstein, comm. pers., 2002). Cette sous-espèce n'a été observée nulle part ailleurs aux États-Unis et est disparue de la Colombie-Britannique (Hinchliff 1994, 1996; Layberry et al., 1998).
Figure 1 : Répartition mondiale et canadienne approximative de l'Euchloe ausonides insulanus
La population existante est désignée par une étoile, et les populations disparues, par un triangle.
Description longue pour la figure 1
La carte illustre la répartition mondiale et canadienne des populations du Marbré insulaire.
Le marbré insulaire compte 14 mentions historiques pour le Canada. Selon ces mentions, cinq populations naturellement fragmentées auraient existé dans la région du Grand Victoria (Langford, parc Beacon Hill et baie James) et à Nanaimo (Wellington), dans l'île de Vancouver, et dans l'île Gabriola (figure 1). La mention la plus ancienne, qui date de 1860, se rattache à un spécimen dont l'étiquette indique simplement « Vancouver »; cette mention désigne fort probablement l'île de Vancouver. L'espèce aurait disparu du Canada autour de 1910, car la dernière mention de sa présence au pays, à l'île Gabriola, remonte à 1908. Les relevés récents n'ont révélé la présence d'aucune nouvelle population au Canada.
Au Canada, la disparition du marbré insulaire des écosystèmes du chêne de Garry est antérieure à la perte d'une portion importante des habitats de ces écosystèmes. On pense que le broutement par les moutons ou le bétail avant ou durant la Première Guerre mondiale aurait causé l'élimination de la plante hôte (présumément l'arabette hirsute [Arabis hirsuta]) et aurait ainsi constitué le principal facteur à l'origine de la disparition du marbré insulaire en Colombie-Britannique (Shepard, 2000b). Toutefois, l'ensemble des facteurs à l'origine de cette disparition demeurent inconnus.
Il n'existe aucune estimation publiée de l'abondance de la seule population connue au monde, établie dans l'île San Juan. Au moins 20 individus ont été observés en 2002 (Fleckenstein, comm. pers., 2002; Miskelly, comm. pers., 2004), et au moins 100 en 2003 (Pyle, comm. pers., 2003), mais la taille de cette population n'a jamais été estimée. On ignore également quelle était la taille de la population totale au Canada.
Comme le marbré insulaire n'a pas été observé au Canada depuis 1908, notre connaissance de ses besoins en matière d'habitat est fondée sur les caractéristiques de l'habitat privilégié par la population de l'île San Juan, aux États-Unis, et sur des descriptions récentes des milieux qu'il a déjà occupés.
La population de l'île San Juan occupe un vaste (> 100 ha) territoire dégagé englobant trois habitats distincts, soit une prairie mésique perturbée, des dunes et une zone littorale. Cette aire est principalement orientée à l'ouest et ne compte aucun arbre de grande taille. Les secteurs occupés par le marbré insulaire ne sont pas escarpés, les pentes allant de nulle à 50 % (Miskelly, obs. pers., 2004). Les crucifères (Brassicacées) introduites forment des colonies éparses mais sont abondantes dans la prairie et les dunes, tandis que les plantes hôtes indigènes sont abondantes le long du littoral. Les espèces envahissantes de crucifères, qu'elles soient indigènes ou introduites, atteignent généralement leur densité maximale dans des milieux modérément perturbés. Les espèces des prairies se rencontrent dans les secteurs perturbés par les mammifères fouisseurs (Fleckenstein, comm. pers., 2002; Miskelly, comm. pers., 2004; Pyle, comm. pers., 2003). Il n'existe aucun autre habitat similaire de cette échelle au Canada.
À l'île San Juan (Washington), les femelles déposent leurs œufs sur trois espèces de crucifères, soit la moutarde des oiseaux (Brassica campestris) et le sisymbre élevé (Sisymbrium altissimum), deux mauvaises herbes d'origine européenne, et la lépidie de Virginie (Lepidium virginicum), espèce indigène (Fleckenstein, comm. pers., 2002; Miskelly, comm. pers., 2004; Pyle, comm. pers., 2003). Les autres sous-espèces de l'Euchloe ausonides se nourrissent également à l'état larvaire de crucifères envahissantes introduites (Opler, 1975). La moutarde des oiseaux pousse dans des milieux plus mésiques que les espèces indigènes d'arabettes (Arabis) et est par conséquent moins vulnérable au dessèchement précoce.
Au Canada, le marbré insulaire était probablement associé aux stades de succession de prairie ouverte des chênaies de Garry et des écosystèmes associés. En Colombie-Britannique, ses plantes hôtes étaient probablement des arabettes (Arabis spp.), peut-être l'A. hirsuta (Shepard, 2000a; 2000b), ainsi que la lépidie de Virginie (Lepidium virginicum). Les arabettes (Arabis spp.) sont les principales plantes hôtes de la sous-espèce mayi dans l'intérieur sud de la Colombie-Britannique. Il n'existe cependant aucune mention historique des plantes hôtes ou des habitats utilisés par le marbré insulaire.
On ignore quelle est la superficie d'habitat minimale pour maintenir une population viable. Vraisemblablement, la survie à long terme de la sous-espèce dépend de la présence d'une parcelle d'habitat relativement grande ou de parcelles d'habitat favorable à proximité. La superficie d'habitat de qualité requise pourrait atteindre 50 à 100 hectares, si l'on se fie à la superficie du territoire occupé actuellement par la population de l'île San Juan, estimée à 100 ha. De plus amples recherches s'imposent pour déterminer la superficie d'habitat minimale dont l'espèce a besoin pour survivre. Très peu de parcelles d'habitat adéquat de cette superficie existent encore en Colombie-Britannique.
Les œufs éclosent entre la fin de mai et la fin de juin, et les chenilles se nourrissent jusqu'à la nymphose, qui survient entre la fin de juin et la fin de juillet.
Les taux de mortalité larvaire sont élevés si les plantes hôtes se dessèchent avant que les chenilles aient achevé leur développement. Les quantités de précipitations au printemps et au début de l'été influent sur la date de sénescence des plantes hôtes et, par conséquent, sur le taux de nymphose du marbré insulaire.
Le rôle écologique de ce papillon n'a fait l'objet d'aucune recherche. Les adultes jouent probablement un rôle mineur à titre d'agents pollinisateurs. Les chenilles infligent des dommages négligeables aux crucifères hôtes et se nourrissent de fleurs et de fruits. Les adultes, les chenilles et les chrysalides sont les proies d'oiseaux insectivores, de petits mammifères et d'insectes prédateurs (famille des Braconidés). Les œufs, les chenilles et les chrysalides sont probablement les hôtes de divers insectes parasitoïdes (van Nouhys et Hanski, 2004).
On sait très peu de choses sur les facteurs limitatifs sur le plan biologique pour le marbré insulaire.
La capacité de vol et de dispersion du marbré insulaire n'a pas été étudiée. Des observations du comportement de la sous-espèce mayi donnent à croire que les adultes peuvent parcourir de grandes distances durant leur vie. En Californie, dans des régions situées près de l'océan, des déplacements pouvant atteindre un kilomètre ont été observés chez l'E. ausonides (Scott, 1975a; 1975b).
Les chenilles du marbré insulaire se nourrissent activement à la fin de mai et en juin, soit dans la dernière partie de la période durant laquelle les applications de Btk sont effectuées dans l'aire de répartition historique de l'espèce en Colombie-Britannique (Nealis, comm. pers., 2003).
Nom commun :
Damier de Taylor
Nom scientifique :
Euphydryas editha taylori
Statut :
Espèce en voie de disparition.
Dernier examen ou dernière modification :
Novembre 2000 (nouvelle).
Justification de la désignation :
Ce papillon a connu une importante diminution de sa population dans toute son aire de répartition. Jusqu'à récemment, il subsistait à un site au Canada dans des prés de chênes de Garry. Une grande partie de son habitat a été détruite, et les plantes envahissantes ont éliminé la plante hôte de ses larves dans la majeure partie du site restant.
Présence au Canada :
Colombie-Britannique.
Historique du statut :
Espèce désignée « en voie de disparition » en novembre 2000. Évaluation fondée sur un nouveau rapport de situation.
Le damier de Taylor est un papillon diurne de taille moyenne. Le dessus des ailes est orné de bandes alternées distinctes noires et orange. En dessous, les ailes présentent un motif en damier formé de bandes orange, blanches, rouges, crème pâle et noires marginées de noir. Ces bandes s'étendent parallèlement au thorax et à l'abdomen, qui sont noirs. Le sommet des ailes antérieures est arrondi. Les mâles sont légèrement plus petits que les femelles. Les chenilles sont noires, avec des bandes orange. Les œufs sont jaune pâle, transparents.
L'Euphydryas editha taylori est un taxon bien défini selon la description fournie dans le rapport de situation du COSEPAC (Shepard, 2000c).
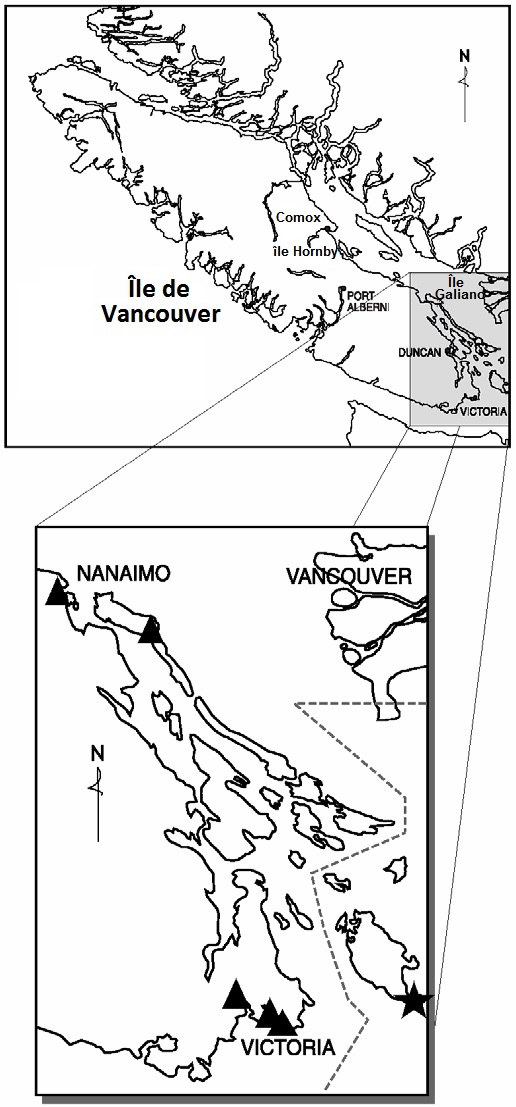
L'aire de répartition mondiale actuelle consiste en quinze stations réparties dans le comté de Clallum et la portion sud de Puget Sound (Washington) (S1) ainsi que dans la vallée de la Willamette (Oregon) (S1) (figure 2). Au Canada, le damier de Taylor compte 22 populations historiques naturellement fragmentées : quinze dans la région du Grand Victoria, trois dans la région s'étendant de Mill Bay à Duncan, trois dans l'île de Hornby et une près de Courtenay (figure 2). Les mentions sont échelonnées de 1887 à 1995. L'espèce est actuellement considérée comme en voie de disparition (2000), mais des relevés récents effectués en 2001 et 2003 dans les dernières stations occupées connues ont indiqué que l'espèce a probablement disparu du Canada (Miskelly, 2003). Toutefois, en 2005, 15 individus ont été trouvés à l'île Denman, près de Courtenay (île de Vancouver) (Jennifer Heron, comm. pers., 2005).
Figure 2 : Répartition mondiale et canadienne de l'Euphydryas editha taylori
Les populations disparues sont désignées par un triangle.
Description longue pour la figure 2
La carte à gauche illustre la répartition mondiale du Damier de Taylor et la carte à droite illustre la répartition canadienne des populations du Damier de Taylor.
Bon nombre des populations connues de la région de Victoria se sont maintenues jusqu'aux années 1950. La disparition de la population du parc Beacon Hill remonterait cependant au début des années 1930. En 1989, le damier de Taylor n'était plus représenté que par une seule population occupant une emprise de ligne électrique, à 3 km au sud-ouest de Mill Bay (Shepard 2000c). Cette population avait disparu en 1995 (Shepard, 2000a). Plusieurs populations ont été découvertes à l'île Hornby en 1995. Ces populations étaient encore présentes l'année suivante (Shepard, 1995; Shepard, 2000b; 2000c), mais elles semblaient avoir disparu en 2001 (Guppy et Fischer, 2001).
Bien qu'on ne connaisse pas les tendances de l'habitat du damier de Taylor, on sait que les chênaies de Garry et les écosystèmes associés ont subi un déclin considérable. La suppression des incendies et l'empiétement par les conifères des zones de résurgence et des secteurs à sol plus profond, conjugués à la sécheresse, pourraient être à l'origine de la disparition de la population du parc Helliwell à l'île Hornby.
La taille des populations dans l'État de Washington est inconnue. Les effectifs des deux populations de l'Oregon ont été estimés à 1 000 individus (Vaughan et Black, 2002b) et à 500 individus (Black, comm. pers., 2004). Au Canada, les populations de l'île Hornby et de Mill Bay, aujourd'hui disparues, comptaient respectivement 1 100 individus (1996) et 1 000 individus (1989) (Shepard, 2000c). On ignore à combien s'élevait la population canadienne totale autrefois.
Les descriptions de l'habitat du damier de Taylor sont fondées sur des observations effectuées dans les dernières stations occupées connues et sur des descriptions récentes de milieux anciennement occupés. Aucune étude de l'habitat du damier au Canada n'a encore été achevée, mais une recherche est en cours à l'Université de Victoria (Eastman et al., 2002).
Le damier de Taylor fréquente les milieux non boisés (Shepard, 2000b; 2000c). Il n'est pas confiné aux écosystèmes indigènes, et certains milieux qui ont été déboisés par les humains, comme les emprises de ligne électrique, satisfont à ses besoins (Vaughan et Black, 2002b; Shepard, 2000b; 2000c). Des relevés récents effectués dans l'État de Washington ont révélé la présence de populations prospères dans de nouvelles localités peu caractéristiques des milieux anciennement occupés, dont un milieu déboisé et brûlé situé à 600 m d'altitude comportant des falaises escarpées parsemées de colonies d'espèces indigènes (holodisque discolore [Holodiscus discolor], céanothe [Ceanothus sp.], divers Ribes spp.) (Miskelly, comm. pers., 2004).
Aux États-Unis, les plantes hôtes des populations existantes sont le plantain lancéolé (Plantago lanceolata), la castilléjie hispide (Castilleja hispida), la collinsie à grandes fleurs (Collinsia grandiflora), le plectritis rosé (Plectritis congesta) et la triphysaire naine (Triphysaria pusilla - une seule mention) (Grosboll, comm. pers., 2004; Potter, comm. pers., 2003; 2005). Le plantain maritime (Plantago maritima), la castilléjie dorée (Castilleja levisecta) et peut-être d'autres espèces de triphysaires (Murphy et al., 1983; Pelham, comm. pers., 2003) pourraient également être utilisés.
On ignore si certaines des populations autrefois présentes en Colombie-Britannique utilisaient d'autres espèces que le plantain lancéolé (Plantago lanceolata) comme plante hôte primaire ou secondaire (Shepard, 2000b; 2000c; Danby, 1890). On croit que les populations de la Colombie-Britannique pourraient avoir exploité les mêmes autres plantes hôtes que les populations de l'État de Washington.
Le nectar ne joue pas un rôle essentiel dans la reproduction, mais la production d'œufs chez la sous-espèce E. editha bayensis varie selon la disponibilité des sources de nectar et est deux fois plus élevée lorsque l'apport de nectar est important (Murphy et al., 1983). Les principales plantes nectarifères visitées par le damier de Taylor aux États-Unis incluent la camassie camash (Camassia quamash), diverses espèces de fraisiers (Fragaria spp.), le lomatium utriculé (Lomatium utriculatum) et le plectritis rosé (Plectritis congesta) (Potter, comm. pers., 2003; Grosboll, comm. pers., 2003; Ross, comm. pers., 2003). Les plantes nectarifères des populations autrefois présentes en Colombie-Britannique ne sont pas connues.
Le damier de Taylor est particulièrement vulnérable à l'invasion de son habitat par les espèces arbustives exotiques, car celles-ci déplacent ses plantes hôtes et en réduisent la disponibilité. L'invasion par le genêt à balais (Cytisus scoparius) de milieux déboisés par les humains est à l'origine de la disparition de la population à proximité de Mill Bay (Colombie-Britannique) (Shepard, 2000b; 2000c). La prolifération d'espèces exotiques envahissantes a également entraîné la disparition d'au moins une population du damier de Taylor dans l'État de Washington et pourrait menacer une des dernières populations encore existantes en Oregon (Vaughan et Black, 2002b). En Colombie-Britannique, la disparition de la population du parc provincial Bright Angel, au sud de Duncan, a été imputée au lotissement entrepris à proximité du parc et à la prolifération d'espèces arbustives dans le parc (Guppy, comm. pers., 2003).
Pour survivre à long terme, une population a besoin d'une parcelle d'habitat de qualité (présentant un abondant couvert de plantain lancéolé [Plantago lanceolata] ou de castilléjie hispide [Castilleja hispida] et de plantes nectarifères) de 5 à 20 hectares. Ces valeurs sont fondées sur des estimations des superficies occupées anciennement par des populations aujourd'hui disparues (Guppy, comm. pers., 2003). Plusieurs populations occupent actuellement des territoires de moins d'un hectare (Miskelly, comm. pers., 2004).
Chez la sous-espèce Euphydryas editha bayensis, les femelles déposent normalement une première masse de 130 à 180 œufs, puis plusieurs autres masses de plus en plus petites (Murphy et al., 1983). Cette observation correspond assez bien à la taille des groupes de chenilles du premier stade du damier de Taylor découverts au sud-ouest de Mill Bay (Guppy, comm. pers., 2003). Les œufs éclosent en mai ou au début de juin, et les chenilles s'alimentent jusqu'à la fin du troisième stade avant d'entrer en diapause.
Diverses techniques d'application facile peuvent être utilisées pour obtenir des pontes en captivité, que les femelles aient été fécondées en captivité ou non (p. ex. Murphy et al., 1983). En 1988 et en 1989, Guppy (comm. pers., 2003) a élevé avec succès des chenilles de damier de Taylor recueillies sur le terrain au deuxième stade, près de Mill Bay, en Colombie-Britannique. En 2004, des expériences d'élevage ont été réalisées avec 20 à 40 chenilles de damier de Taylor recueillies à Thurston et dans le comté de Clallum, en Oregon. Un programme d'élevage plus rigoureux est planifié pour 2005 (Potter, comm. pers., 2005). L'existence possible d'importantes différences phénologiques entre les populations du Canada et des États-Unis pourrait refléter un certain degré de divergence génétique entre ces populations (Guppy, comm. pers. à Miskelly, 2004).
Aucune évaluation du rôle écologique de ce papillon n'a été entreprise à ce jour. Les adultes, lorsqu'ils sont présents en grands nombres, pourraient jouer un rôle important dans la pollinisation des plantes printanières indigènes. Lorsque les effectifs larvaires sont élevés, les chenilles peuvent infliger des dommages importants au plantain lancéolé, allant même jusqu'à défolier complètement leurs plantes hôtes dans certains parcelles (Guppy, comm. pers., 2003). Rien n'indique toutefois que cette herbivorie puisse compromettre la viabilité des populations de plantain. Les adultes, les chenilles et les chrysalides peuvent être les proies d'oiseaux insectivores, de petits mammifères et d'insectes prédateurs, mais comme ils contiennent des glucosides iridoïdes (substances produites par les plantes hôtes et séquestrées par le damier), ils sont non palatables pour la plupart des prédateurs. Les œufs, les chenilles et les chrysalides sont probablement les hôtes de divers insectes parasitoïdes (van Nouhys et Hanski, 2004).
La capacité de dispersion du damier de Taylor n'a pas été évaluée. Les adultes des sous-espèces bayensis et wrighti ne parcourent pas plus de 200 à 300 pieds à l'intérieur des parcelles d'habitat adéquat lorsque les conditions environnementales sont favorables, mais ils peuvent se disperser sur de plus grandes distances en conditions de sécheresse ou de forte densité. Ces sous espèces ont de la difficulté à établir de nouvelles populations même lorsqu'elles sont introduites dans un nouvel habitat (Ehrlich 1961; Ehrlich et al., 1980; Harrison, 1989; Murphy et White, 1984). L'E. editha taylori semble présenter une meilleure capacité de dispersion, et des adultes ont été observés alors qu'ils traversaient des zones boisées et d'autres barrières (Potter, comm. pers., 2003; Vaughn, comm. pers., 2003; Black, comm. pers., 2004). Les métapopulations de la sous-espèce bayensis ont besoin d'une importante population centrale stable comme source pour former de nouvelles populations périphériques ou stabiliser les populations périphériques existantes (Harrison, 1989). Si jamais de nouvelles populations étaient rétablies au Canada, la distance entre les îlots d'habitat favorable pourrait avoir un effet déterminant sur la capacité de dispersion de ces populations. Chez la sous-espèce bayensis, plusieurs populations très rapprochées mais présentant très peu d'échanges entre elles ont fini par disparaître (Hellmann et al., 2003, McLaughlin et al., 2002).
Les chenilles peuvent mourir de faim avant d'entrer en diapause lorsque leurs plantes hôtes, en particulier le plantain, se dessèchent prématurément sous l'effet d'une sécheresse estivale (Vaughan et Black, 2002b). La famine est d'ailleurs considérée comme la principale cause de mortalité chez cette espèce. Chez la sous-espèce bayensis, en Californie, l'incidence des conditions météorologiques sur l'atteinte de la diapause et la survie des chenilles durant la diapause est considérée comme l'une des principales variables permettant de déterminer la taille des effectifs adultes et la persistance des populations (McLaughlin et al., 2002). Chez d'autres sous- espèces présentes en Californie, le seuil de viabilité des populations s'établit à environ 1 000 individus (Ehrlich, 1961; Hellmann et al., 2003); le risque de disparition due à la sécheresse ou à d'autres événements stochastiques s'élève chez les populations plus petites. Toutefois, même certaines populations qui comptaient près de 1 000 individus ont disparu (Hellman, comm. pers., 2005). En limitant la variabilité de la phénologie des plantes hôtes, le changement climatique risque d'accélérer la disparition des populations du damier de Taylor (McLaughlin et al., 2002).
Les chenilles du damier de Taylor se nourrissent activement au début du printemps. Malheureusement, c'est habituellement durant cette même période que les applications de Btk sont normalement effectuées contre les ravageurs forestiers (Wagner et Miller, 1995; Nealis, comm. pers., 2003).
Nom commun :
Triphysaire versicolore
Nom scientifique :
Triphysaria versicolor ssp. versicolor
Statut :
Espèce en voie de disparition.
Dernier examen ou dernière modification :
Mai 2000 (aucune modification).
Justification de la désignation :
Espèce isolée et ayant des exigences très spécifiques en matière d'habitat, il existe peu de populations dans une aire très limitée, et l'espèce est sujette au développement et en péril à cause des activités récréatives et de la concurrence avec les plantes exotiques.
Présence au Canada :
Colombie-Britannique.
Historique du statut :
Espèce désignée « en voie de disparition » en avril 1998. Réexamen et confirmation du statut en mai 2000. Dernière évaluation fondée sur un rapport de situation existant.
Le Triphysaria versicolor Fisch. et C. Meyer ssp. versicolor est un taxon bien défini selon la définition fournie dans le rapport de situation du COSEPAC (Penny et al., 1996). La seule autre sous-espèce, le T. versicolor ssp. faucibarbatus , se rencontre uniquement en Californie (Chuang et Heckard, 1993).
La triphysaire versicolore est une petite (10 à 50 cm) herbacée annuelle à tiges et feuilles finement pubescentes. Les feuilles sont pennées et divisées en segments linéaires. L'inflorescence est un épi terminal composé de fleurs blanches ou roses et de bractées foliacées. La triphysaire versicolore peut être confondue avec la castilléjie à feuilles atténuées (Castilleja attenuatus), mais elle s'en distingue à ses corolles en forme de massue. La triphysaire versicolore ressemble également à la triphysaire naine (T. pusilla), mais celle-ci est plus petite et présente des segments foliaires encore plus étroits (Douglas et al., 2000; Penny et al., 2000). La triphysaire versicolore est une espèce parasite (hémiparasite) qui s'attaque aux racines d'un grand nombre de plantes.
La triphysaire versicolore se rencontre le long de la côte du Pacifique depuis le sud de l'île de Vancouver jusque dans le sud de la Californie (figure 3). Elle est cependant absente de l'État de Washington et du nord de l'Oregon. Les populations canadiennes sont isolées des populations les plus proches, dans le comté de Lane (Oregon), par une distance d'environ 500 km. Aux États- Unis, aucune cote n'a été attribuée à la triphysaire versicolore en Californie et en Oregon, les deux seuls États où elle est présente (NatureServe, 2004).
Au Canada, la zone d'occurrence historique couvrait une superficie d'environ 95 km2, mais la zone d'occurrence actuelle est inférieure à 15 km2. La zone d'occupation est estimée à 379 m2 dans le rapport de situation du COSEPAC. Depuis la publication de ce rapport, la découverte de deux nouvelles populations (superficie occupée combinée inférieure à 200 m2) a fait grimper la zone d'occupation au Canada à un peu moins de 600 m2.
Figure 3 : Répartition mondiale et canadienne approximative du Triphysaria versicolor ssp. versicolor
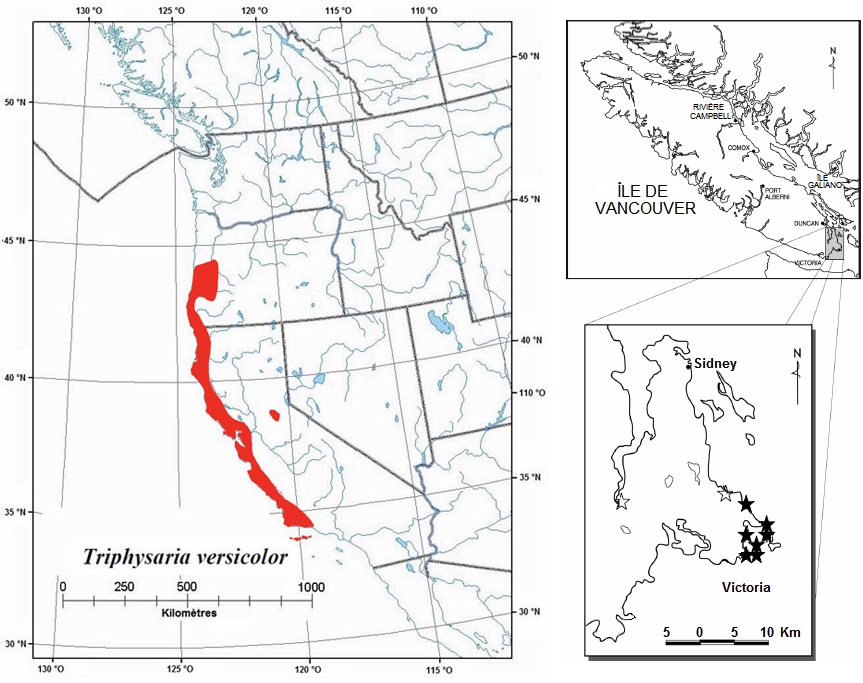
La répartition mondiale est illustrée à gauche, et la répartition canadienne, à droite. Pour le Canada, les populations disparues sont désignées par une étoile vide, et les populations existantes, par une étoile pleine.
Description longue pour la figure 3
La carte à gauche illustre la répartition mondiale du Triphysaire versicolore et la carte à droite illustre la répartition canadienne des populations du Triphysaire versicolore.
La triphysaire est actuellement représentée par sept populations. Une autre population est disparue. Ces informations ont été confirmées par la description des populations reconnues comme distinctes selon les critères du Centre de données sur la conservation de la Colombie-Britannique (les populations séparées par une distance inférieure à 1 000 m doivent être considérées comme des sous-populations) et des relevés subséquents.
Le rapport de situation du COSEPAC fait état de huit « populations » existantes et de deux ou trois autres populations (la mention de la présence de la triphysaire au mont Finlayson pourrait résulter d'une identification erronée) dont les derniers représentants ont été observés il y a déjà plus de 80 ans (Penny et al., 1996). Le rapport de situation du COSEPAC estime la taille de la population totale entre 4 000 et 5 000 individus (Penny et al., 1996). Des relevés effectués à la suite de la publication de ce rapport (tableau 11) ont toutefois révélé que les effectifs de certaines populations pourraient être plus élevés, du moins au cours des années favorables.
| Population | Régime foncier | Données tirées du rapport de situation | Données obtenues subséquemment | ||||
|---|---|---|---|---|---|---|---|
| Date | Observateurs | Nombre d'individus | Date | Observateurs | Nombre d'individus | ||
| Cedar Hill | Inconnu | 1897 | Henry | Inconnu | Aucune information additionnelle | Aucune information additionnelle | Aucune information additionnelle |
| Mont Finlayson | Inconnu | 1908 | Newcombe | Inconnu | Aucune information additionnelle | Aucune information additionnelle | Aucune information additionnelle |
| Îles au sud de Victoria | Inconnu | 1915 | Higgins | Inconnu | Peut-être issue des populations récemment décrites de l'île Mary Tod et/ou de l'île Strongtide | Peut-être issue des populations récemment décrites de l'île Mary Tod et/ou de l'île Strongtide | Peut-être issue des populations récemment décrites de l'île Mary Tod et/ou de l'île Strongtide |
| Pointe Ten Mile | Terrain privé | 1996 | Penny | 61 | 2002 | Penny | > 1 900 |
| Pointe Cattle | Municipalité d'Oak Bay (lieu désignée parc urbain) | 1996 | Penny | 1 300 | Station cartographiée en 2003, mais taille de la population non estimée | Station cartographiée en 2003, mais taille de la population non estimée | Station cartographiée en 2003, mais taille de la population non estimée |
| Victoria Golf Club | Terrain privé | 1996 | Penny | 300 | 2004 | Fairbarns | 250-400 |
| Pointe Harling | Terrain privé désigné lieu historique national | 1996 | Penny | 67 | 2002 | Fairbarns | 270 |
| Glencoe Cove | Municipalité de Saanich (lieu désigné parc urbain) | 1996 | Penny | 2 500 | 2001 | Penny | 4 100 |
| Île Mary Tod | Municipalité d'Oak Bay (lieu désigné parc urbain) | Population inconnue au moment de la rédaction du rapport de situation | Population inconnue au moment de la rédaction du rapport de situation | Population inconnue au moment de la rédaction du rapport de situation | 2001 | Douglas | 6 |
| Île Strongtide | Réserve indienne des Songhees | Population inconnue au moment de la rédaction du rapport de situation | Population inconnue au moment de la rédaction du rapport de situation | Population inconnue au moment de la rédaction du rapport de situation | 2003 | Fairbarns | 500 à 1 000 |
La triphysaire versicolore se rencontre dans des prés maritimes et des zones de suintement, généralement à moins de 10 m au-dessus du niveau de la mer et à moins de 30 m du littoral. Elle pousse dans des milieux rocheux à sol relativement peu profond. La pérennité de son habitat dégagé est souvent assurée par les effets conjugués des embruns salés, des vents, des sécheresses estivales et des suintements hivernaux, qui empêchent l'établissement des arbres, des arbustes et des herbacées plus robustes. Les communautés végétales auxquelles la triphysaire versicolore est associée sont dominées par les herbacées. Les stations où sa présence a été observée n'ont jamais été labourées, mais elles abritent souvent des populations importantes de graminées de pâturage exotiques envahissantes, dont le dactyle pelotonné (Dactylis glomerata), le brome stérile (Bromus sterilis), le brome mou (B. hordeaceus), la flouve odorante (Anthoxanthum odoratum), la crételle hérissée (Cynosurus echinatus) et la houlque laineuse (Holcus lanatus). Le sol des prés demeurent frais ou humides en hiver, mais ils s'assèchent jusqu'au point de flétrissement permanent au milieu de l'été.
La triphysaire versicolore est une plante annuelle. M. Fairbarns (observations inédites, 2003 et 2004) a documenté son cycle annuel.
La description du cycle annuel de la triphysaire versicolore est fondée sur des observations inédites (M. Fairbarns, 2003 et 2004) effectuées à la pointe Harling, au Victoria Golf Club, au parc Glencoe Cove et à l'île Strongtide. La germination débute en janvier. Au moins quelques semis ne portant que des cotylédons sont encore présents au milieu de mars. Dès février, les feuilles vraies sont apparentes chez les individus qui présentent une croissance rapide. La plupart des sujets sont morts à la fin de juin. La floraison débute en avril et peut se poursuivre jusqu'à la fin de mai. Le développement des fruits s'amorce à la fin d'avril, et la dissémination des graines peut se prolonger jusqu'en juillet chez certains individus.
Nom commun :
Sanicle patte-d'ours
Nom scientifique :
Sanicula arctopoides
Statut :
Espèce en voie de disparition.
Dernier examen ou dernière modification :
Mai 2001 (nouvelle).
Justification de la désignation :
Espèce très limitée géographiquement avec seulement cinq populations se trouvant dans un centre urbain majeur et sur de petites îles adjacentes où la perte de l'habitat a encore lieu et où les plantes exotiques représentent des risques importants.
Présence au Canada :
Colombie-Britannique.
Historique du statut :
Espèce désignée « en voie de disparition » en mai 2001. Évaluation fondée sur un nouveau rapport de situation.
Le Sanicula arctopoides Hooker et Arn. est un taxon bien défini selon la description fournie dans le rapport de situation du COSEPAC (Donovan et Douglas, 2000). Kartesz (1994) ne reconnaît aucun taxon intraspécifique chez cette espèce.
La sanicle patte-d'ours est une plante vivace à racine pivotante et à tiges étalées ou ascendantes (5 à 30 cm de longueur). Les feuilles basilaires sont disposées en rosette, irrégulièrement dentées, plutôt succulentes, souvent jaunâtres. Les feuilles caulinaires sont réduites. Les fleurs ont une corolle jaune vif entourée d'un involucelle apparent et sont disposées en ombelles compactes plus ou moins nombreuses. Les graines sont incluses dans un schizocarpe ovoïde recouvert de gros piquants terminés par des crochets. La sanicle patte-d'ours se distingue des autres espèces de sanicles par son port procombant et ses involucelles apparents (Douglas et al.,1998a; Donovan et Douglas, 2001).
La sanicle patte-d'ours est présente le long de la côte du Pacifique depuis le sud de l'île de Vancouver jusqu'au centre de la Californie (figure 4). Les populations canadiennes sont isolées par une distance d'environ 150 km des populations les plus proches, établies le long de la côte au centre de l'État de Washington. La cote S1 a été attribuée à la sanicle patte-d'ours dans l'État de Washington, et la cote SNR lui a été attribuée en Californie et en Oregon (NatureServe, 2004). Au Canada, l'espèce est présente seulement à Victoria et dans son voisinage immédiat, en Colombie-Britannique. Les aires de répartition historique et actuelle forment une étroite bande de littoral mesurant environ 100 km de longueur sur seulement environ 50 m de largeur. La zone d'occurrence n'a donc jamais couvert plus d'environ 5 km2. Le rapport de situation du COSEPAC estime la superficie de la zone d'occupation de l'espèce à 3 614 m2. La superficie combinée des territoires occupés par les populations subséquemment documentées à la pointe Rocky et dans les îles Discovery et Mary Tod est inférieure à 200 m2. Les populations de l'île Chain, de la baie Cadboro, de la pointe Clover, du mont Beacon et de la baie Foul, aujourd'hui disparues, n'ont probablement jamais occupé plus de 1 000 m2. D'après ces données, la zone d'occupation actuelle de l'espèce au Canada est estimée à 3 814 m2. Cette estimation est inférieure à la valeur historique, qui a déjà atteint 4 814 m2.
Figure 4 : Répartition mondiale et canadienne du Sanicula arctopoides
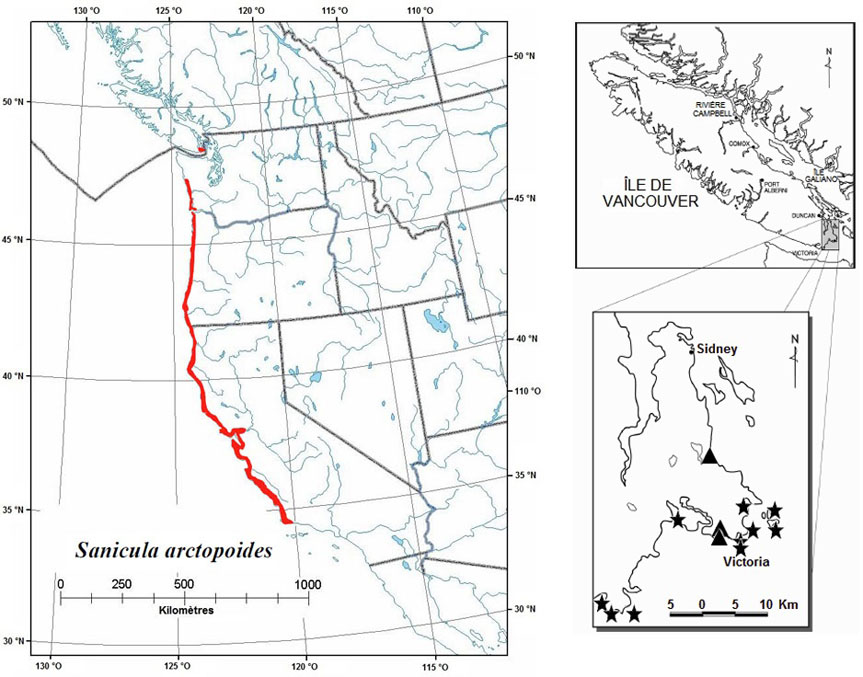
La répartition mondiale est illustrée à gauche, et la répartition canadienne, à droite. Pour le Canada, les populations disparues sont désignées par un triangle, et les populations existantes, par une étoile.
Description longue pour la figure 4
La carte à gauche illustre la répartition mondiale du Sanicle patte-d’ours et la carte à droite illustre la répartition canadienne des populations du Sanicle patte-d’ours.
Le rapport de situation du COSEPAC fait état de cinq populations existantes, d'une population au statut « inconnu » et de quatre populations disparues (Donovan et Douglas, 2000). Depuis la publication de ce rapport, quatre nouvelles populations ont été découvertes, et la disparition d'une autre population, à la pointe Cattle, a été confirmée. La sanicle patte-d'ours est donc représentée actuellement par neuf populations, et il semble que trois à quatre populations aient disparu (tableau 12).
| Population | Régime foncier | Données tirées du rapport de situation | Données obtenues subséquemment | ||||
|---|---|---|---|---|---|---|---|
| Date | Observateurs | Nombre d'individus | Date | Observateurs | Nombre d'individus | ||
| Îlot Alpha | Réserve écologique provinciale | 1999 | Donovan et Douglas | 52 | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment |
| Île Trial | Population établie sur des terres provinciales désignées réserve écologique, des terres provinciales cédées à bail à une société de radiocommunications et des terres fédérales gérées par la Garde côtière canadienne. | 1999 | Donovan et Douglas | 6 015 | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment |
| Pointe Harling | Terrain privé désigné lieu historique national | 1999 | Donovan et Douglas | 81 | 2002 | Fairbarns | 50 à 70 sujets en fleurs |
| Pointe Saxe | Municipalité d'Esquimalt (lieu désigné parc urbain) | 1999 | Donovan | 1 145 | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment |
| Île Bentinck | Terres fédérales gérées par le ministère de la Défense nationale | 1999 | Donovan et Penny | 71 | 2002 | Fairbarns | 3 |
| Île Discovery | Parc provincial | Non mentionnées | Non mentionnées | Non mentionnées | 2002 | Fairbarns | 12 |
| Île Mary Tod | Municipalité d'Oak Bay (lieu zonée pour utilisation comme parc) | Non mentionnées | Non mentionnées | Non mentionnées | 2001 | Douglas | ~ 100 |
| Île Swordfish | Terres fédérales gérées par le ministère de la Défense nationale | Non mentionnées | Non mentionnées | Non mentionnées | 2003 | Fairbarns | 6 |
| Pointe Church | Terres fédérales gérées par le ministère de la Défense nationale | Non mentionnées | Non mentionnées | Non mentionnées | 2002-3 | Fairbarns | 10 |
| Pointe Cattle | Municipalité d'Oak Bay (lieu désigné parc urbain) | Non mentionnées | Non mentionnées | Non mentionnées | 2003 | Fairbarns | Disparue |
| Baie Foul | Inconnu | 1942 | Hardy | Disparues | Possiblement la même que la population de la pointe Harling (voir ci- dessus) | Possiblement la même que la population de la pointe Harling (voir ci- dessus) | Possiblement la même que la population de la pointe Harling (voir ci- dessus) |
| Baie Cadboro | Inconnu | 1913 | Taylor | Disparues | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment |
| Pointe Clover | Ville de Victoria (lieu désigné parc urbain) | 1913 | Macoun | Disparues | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment |
| Mont Beacon | Ville de Victoria (lieu désigné parc urbain) | 1938 | Eastham | Disparues | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment |
| Île Chain | Réserve écologique provinciale | 1897 | Anderson | Inconnu | 2002 | Fairbarns | Disparue |
On ignore quelle était la taille de la population totale canadienne dans le passé. Le rapport de situation du COSEPAC estime la taille de la population totale à 7 364 individus. Cette valeur englobe toutefois les sujets florifères et non florifères. La découverte récente de nouvelles populations fait légèrement grimper cette estimation. Malheureusement, il n'existe aucune estimation précise de la population reproductrice, critère sur lequel se fonde le COSEPAC pour établir le statut des espèces.
La sanicle patte-d'ours pousse dans des prés maritimes secs. Les renseignements suivants sur la structure de l'écosystème de la sanicle patte-d'ours sont tirés du rapport de situation du COSEPAC. Cette description est enrichie d'informations amassées dans le cadre de relevés de la végétation récents (Fairbarns, obs. pers., 2004). Les prés abritant la sanicle patte-d'ours se trouvent à moins de 10 m au- dessus du niveau de la mer. Leurs sols ont plus de 15 cm de profondeur et demeurent humides durant tout l'hiver, mais ils s'assèchent jusqu'au point de flétrissement permanent à la fin du printemps. Ces milieux n'ont jamais été labourés ni fauchés, mais certains ont été légèrement broutés par le bétail et ont fort probablement déjà été touchés par des incendies dans le passé.
L'exposition aux vents et aux embruns salés et la sécheresse extrême des sols peu profonds empêchent la croissance des arbres. Ces mêmes stress environnementaux expliquent également l'absence d'arbustes, quoique le salal (Gaultheria shallon), le rosier de Nootka (Rosa nutkana) ou le genêt à balais (Cytisus scoparius), espèce exotique, s'y rencontrent occasionnellement. La strate herbacée est généralement dominée par un mélange d'espèces indigènes et introduites. Les principales espèces indigènes sont des herbacées non graminoïdes (grindélie à grandes feuilles [Grindelia integrifolia], arméria maritime [Armeria maritima], céraiste des champs [Cerastium arvense], lotier à petites fleurs [Lotus micranthus], lotier des prairies [Lotus unifoliolatus], tritéléia fausse-jacinthe [Triteleia hyacinthina], plantain à feuilles linéaires [Plantago elongata], triphysaire naine [Triphysaria pusilla]), mais quelques graminoïdes indigènes (danthonie de Californie [Danthonia californica], luzule multiflore [Luzula multiflora], pâturin des plages [Poa confinis]) peuvent également s'y rencontrer.
Parmi les espèces introduites, diverses graminées (brome raide [Bromus rigidus], brome mou [B. hordeaceus], crételle hérissée [Cynosurus echinatus], fétuque rouge [Festuca rubra], canche précoce [Aira praecox], vulpies [Vulpia spp.]) et herbacées non graminoïdes (porcelle enracinée [Hypochaeris radicata], plantain lancéolé [Plantago lanceolata], silène de France [Silene gallica], petit trèfle jaune [Trifolium dubium]) sont souvent présentes, et n'importe laquelle de ces espèces peut dominer à une station donnée.
Les mousses et les lichens occupent généralement de faibles superficies, mais le Dicranum scoparium, le Racomitrium canescens, l'Homalothecium sp. et le Cladonia portentosa sont souvent présents.
Le rapport de situation du COSEPAC fournit peu d'informations sur le cycle annuel de la sanicle patte-d'ours. Une recherche effectuée subséquemment a cependant généré des données pertinentes sur le sujet (Fairbarns, en prép. c.).
La germination survient en janvier ou en février, selon les conditions météorologiques et les caractéristiques de la station. La mortalité des semis est faible au début, et la plupart des jeunes sujets ont le temps de produire une à trois feuilles avant l'arrivée de la sécheresse estivale. La plupart des populations sont si denses qu'il est impossible de déterminer le taux de survie individuel des semis au terme de la période de dormance estivale. La forte densité des populations de cette vivace monocarpique donne à croire que la survie des semis durant la première saison de sécheresse est relativement élevée.
Une fois la saison de sécheresse estivale/automnale passée, les sujets établis produisent un nouveau feuillage. Les nouvelles rosettes peuvent se former dès septembre si des pluies viennent humidifier le sol en fin d'été, mais normalement, la dormance des jeunes sujets est levée seulement en octobre ou au début de novembre. Les sujets continuent de croître lentement durant tout l'hiver et commencent à dépérir en mai. La plupart des tiges sont mortes en juin, mais quelques grandes rosettes non florifères peuvent survivre jusqu'au début de juillet.
Les bourgeons floraux sont habituellement apparents à la mi-février, et la floraison atteint son point culminant en mars ou au début d'avril. Les fruits immatures sont apparents à la mi-mai et parviennent à maturité en juin. La libération des fruits se poursuit durant une période assez longue, et de nombreux individus conservent jusqu'à 20 % de leurs fruits jusqu'en octobre. La dispersion des fruits est généralement assurée par des animaux qui entrent en contact avec les plantes, mais elle peut également survenir lorsque les tiges fructifères mortes se rompent et roulent sur le sol.
Nom commun :
Grand silène de Scouler
Nom scientifique :
Silene scouleri ssp. grandis
Statut :
Espèce en voie de disparition.
Dernier examen ou dernière modification :
Mai 2003 (nouvelle).
Justification de la désignation :
Il s'agit d'une espèce dont l'occurrence géographique est extrêmement limitée au Canada, avec moins de 350 plantes comprenant deux populations restantes qui se trouvent sur de très petites îles. En plus d'autres disparitions du Canada de populations historiques, une population de l'île de Vancouver a récemment disparu du Canada. Ces îles sont situées au sein d'une zone comportant d'importantes activités marines et récréatives, où les plantes envahissantes et les activités anthropiques présentent des risques continus.
Présence au Canada :
Colombie-Britannique.
Historique du statut :
Espèce désignée « en voie de disparition » en mai 2003. Évaluation fondée sur un nouveau rapport de situation.
Le Silene scouleri et les espèces qui lui sont étroitement apparentées forment un complexe dont le statut taxinomique soulève des difficultés particulières (Morton, comm. pers., 2002). La plupart des auteurs considèrent le S. scouleri Hooker ssp. grandis Hitchcock et Maguire comme une sous-espèce ou une variété.
Le grand silène de Scouler est une espèce vivace dressée (15 à 80 cm) à racine pivotante et à souche ramifiée. Les feuilles basilaires sont disposées en rosette. Les feuilles caulinaires sont opposées, et leur taille diminue progressivement de bas en haut le long de la tige. Les feuilles sont pubescentes, sessiles, ni dentées ni stipulées. Les fleurs, blanc verdâtre à violettes, sont réunies en épi. Les sépales sont soudés et forment un tube distinctement nervuré. Les graines, à surface verruqueuse, sont contenues dans des capsules sèches (Douglas et al., 1998b; Fairbarns et Wilkinson, 2003).
Le grand silène de Scouler se rencontre dans un petite région du sud-est de l'île de Vancouver et dans des régions adjacentes de l'État de Washington (figure 5). Les populations nordiques se trouvent à environ 550 km des populations occupant l'aire de répartition principale de l'espèce, qui s'étend le long de la côte du Pacifique depuis le sud de l'Oregon jusqu'au bassin de San Francisco.
Au Canada, le grand silène de Scouler est confiné à deux petites îles situées près de Victoria, en Colombie Britannique. Historiquement, la zone d'occurrence couvrait environ 600 km2, mais elle ne mesure plus qu'environ 0,6 km2. La zone d'occupation de l'espèce est estimée à 1,58 ha dans le rapport de situation du COSEPAC (2002), mais selon des relevés effectués subséquemment, elle s'élèverait plutôt à 2,0 ha (Fairbarns, obs. pers., 2004).
Aucune cote n'a été attribuée au grand silène de Scouler, ni à l'échelle mondiale, ni en Californie, en Oregon et dans l'État de Washington (NatureServe, 2004). L'espèce est absente dans le centre et le sud de l'État de Washington et dans le nord et le centre de l'Oregon. Il est donc possible que les populations canadiennes (ainsi que les populations voisines du centre-nord de l'État de Washington) soient aujourd'hui génétiquement distinctes des populations occupant l'aire principale de l'espèce.
Le rapport de situation du COSEPAC décrit deux populations existantes et au moins six autres populations aujourd'hui disparues. Toutefois, jusqu'à quatre populations additionnelles ont peut-être déjà existé (tableau 13).
Le rapport de situation du COSEPAC estimait la population totale à 278 à 328 sujets matures (florifères). Des relevés effectués en 2004 ont révélé la présence de 18 autres sujets florifères à l'île Trial. Au Canada, la population totale n'a probablement jamais compris plus de 5 000 individus.
Figure 5 : Répartition mondiale et canadienne du Silene scouleri ssp. grandis
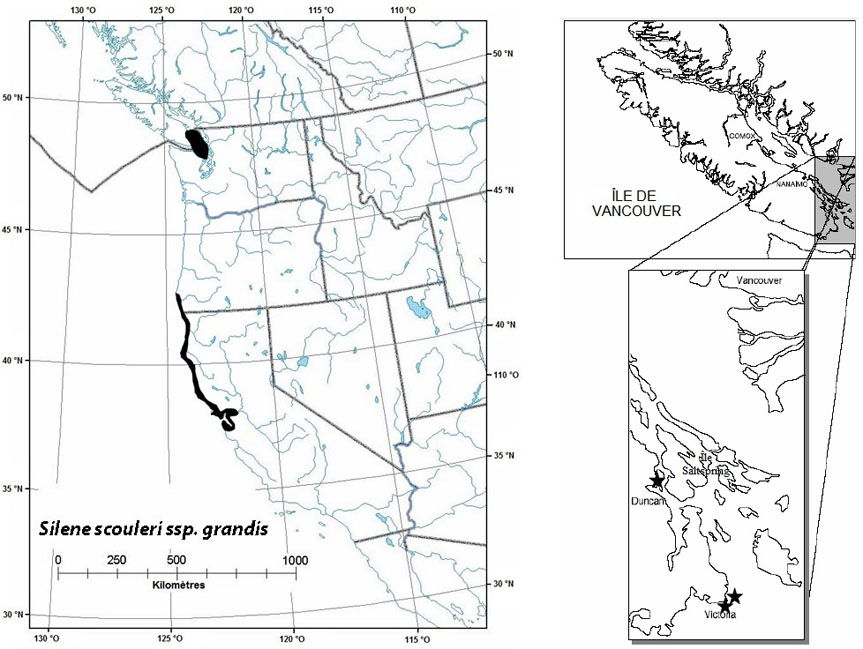
La répartition mondiale est illustrée à gauche, et la répartition canadienne, à droite. Pour le Canada, les populations existantes sont désignées par une étoile.
Description longue pour la figure 5
La carte à gauche illustre la répartition mondiale du Grand silène de Scouler et la carte à droite illustre la répartition canadienne des populations du Grand silène de Scouler.
Le grand silène de Scouler pousse dans des prés maritimes mésiques. Les renseignements suivants sur la structure de l'écosystème du grand silène de Scouler sont tirés du rapport de situation du COSEPAC. Cette description est enrichie d'informations amassées dans le cadre de relevés de la végétation récents (Fairbarns, obs. pers., 2004). Les prés convenant à l'espèce sont généralement situés à moins de 30 m au-dessus du niveau de la mer, mais la population du mont Tzuhalem se trouvait à environ 250 m d'altitude, et celle du mont Douglas, aujourd'hui disparue, se trouvait également à une altitude plus élevée par rapport au niveau de la mer. Les sols demeurent humides en hiver mais s'assèchent presque jusqu'au point de flétrissement permanent à la fin de l'été. La plupart des individus poussent dans des sols de plus de 15 cm de profondeur, et ceux qui se trouvent dans des sols moins profonds meurent avant de fleurir (sauf lorsque les étés sont très humides). Les milieux abritant l'espèce n'ont jamais été labourés ni fauchés, mais certains ont été légèrement broutés par le bétail et ont probablement déjà été touchés par des incendies dans le passé.
L'exposition aux vents et aux embruns salés et la sécheresse des sols peu profonds empêchent généralement la croissance des arbres. La station du mont Tzuhalem comportait cependant un couvert très ouvert de chêne de Garry (Quercus garryana). Les arbustes indigènes forment souvent des fourrés très épars ou sont absents, quoique la symphorine blanche (Symphoricarpos albus) et le rosier de Nootka (Rosa nutkana) soient parfois présents. Ces deux espèces arbustives forment souvent des fourrés denses en périphérie des populations du grand silène de Scouler et peuvent s'avancer dans ces dernières durant les années humides, constituant de ce fait une menace pour l'espèce. Dans le passé, les feux de friche et le brûlage pratiqué par les Autochtones pourraient avoir freiné la propagation de ces fourrés de petits arbustes. Certaines espèces arbustives exotiques envahissantes comme le genêt à balais (Cytisus scoparius) et l'ajonc d'Europe (Ulex europaeus) (et dans une proportion moindre le daphné lauréole [Daphne laureola], le lierre commun [Hedera helix] et la ronce discolore [Rubus discolor]) sont parfois abondantes et risquent d'envahir tous les milieux abritant le grand silène de Scouler si rien n'est fait pour freiner leur propagation.
La strate herbacée est généralement dominée par un mélange d'espèces indigènes et exotiques. Les principales espèces indigènes sont des herbacées non graminoïdes (fraisiers [Fragaria spp.], fougère-aigle [Pteridium aquilinum], aster rigide [Sericocarpus rigidus], Céraiste des champs [Cerastium arvense], achillée millefeuille [Achillaea millefolium], ériophylle laineux [Eriophyllum lanatum], grindélie à grandes feuilles [Grindelia integrifolia], lomatium à tige nue [Lomatium nudicaule]), mais quelques graminées indigènes (deschampsie cespiteuse [Deschampsia cespitosa], élyme glauque [Elymus glaucus], fétuque rouge [Festuca rubra]) sont également présentes dans certaines stations. La camassie camash (Camassia quamash) et la gyroselle de Henderson [Dodecatheon hendersonii] sont abondantes au printemps dans certaines stations. Les graminées introduites (houlque laineuse [Holcus lanatus], pâturin des prés [Poa pratensis], flouve odorante [Anthoxanthum odoratum], crételle hérissée [Cynosurus echinatus]) sont habituellement plus abondantes que les herbacées non graminoïdes introduites (porcelle enracinée [Hypochaeris radicata], petite oseille [Rumex acetosella], plantain lancéolé [Plantago lanceolata], vesce cultivée [Vicia sativa]).
| Population | Régime foncier | Données tirées du rapport de situation | Données obtenues subséquemment | ||||
|---|---|---|---|---|---|---|---|
| Date | Observateurs | Nombre d'individus | Date | Observateurs | Nombre d'individus | ||
| Île Trial | Cette population est largement confinée à une parcelle de terre provinciale cédée à bail à une société de radiocommunications. Il se peut qu'une faible portion de la population (< 5 individus) empiète légèrement sur une réserve écologique provinciale adjacente, mais un arpentage légal devra être effectué pour confirmer cette hypothèse. | 2001 | Fairbarns | 5 | 2004 | Fairbarns | 23 |
| Île Little Trial | Terre provinciale désignée réserve écologique | Non mentionnée | Non mentionnée | Non mentionnée | 2004 | Fairbarns | 14 |
| Îlot Alpha | Terre provinciale désignée réserve écologique | 2001 | Fairbarns | 673 | 2003 | Fairbarns | 370 à 500 |
| Mont Tzuhalem | Terre provinciale désignée réserve écologique | Disparue | Disparue | Disparue | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment |
| Pointe Ten Mile | Inconnu | Disparue | Disparue | Disparue | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment |
| Parc Uplands Park | Municipalité d'Oak Bay (lieu désigné parc urbain) | Disparue | Disparue | Disparue | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment |
| Parc Beacon Hill | City of Victoria (designated as park) | Disparue | Disparue | Disparue | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment |
| Île Bare | Réserve indienne | Disparue | Disparue | Disparue | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment |
| Cedar Hill | Municipalité de Saanich (lieu désigné parc) | Disparue | Disparue | Disparue | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment |
| Île Griffin | Terre provinciale désignée réserve écologique | Mention erronée (spécimens probablement récoltés à l'îlot Alpha) | Mention erronée (spécimens probablement récoltés à l'îlot Alpha) | Mention erronée (spécimens probablement récoltés à l'îlot Alpha) | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment |
| « Près de Victoria » | Inconnu | Mentions imprécises, pourraient correspondre à des localités mentionnées ci-dessus | Mentions imprécises, pourraient correspondre à des localités mentionnées ci-dessus | Mentions imprécises, pourraient correspondre à des localités mentionnées ci-dessus | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment |
| District de Burnside | Inconnu | Mentions imprécises, pourraient correspondre à des localités mentionnées ci-dessus | Mentions imprécises, pourraient correspondre à des localités mentionnées ci-dessus | Mentions imprécises, pourraient correspondre à des localités mentionnées ci-dessus | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment |
| Oak Bay | Inconnu | Mentions imprécises, pourraient correspondre à des localités mentionnées ci-dessus | Mentions imprécises, pourraient correspondre à des localités mentionnées ci-dessus | Mentions imprécises, pourraient correspondre à des localités mentionnées ci-dessus | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment |
Les informations fournies dans le rapport de situation du COSEPAC ont été actualisées par des relevés de la végétation effectués subséquemment à l'île Trial (Fairbarns, en prép. e.). Les sujets établis produisent de nouvelles pousses en juillet, en août et en septembre, une fois la période de sécheresse estivale terminée. La croissance des tiges est lente en hiver, mais en mai et en juin, les tiges florifères s'allongent. Certaines de ces tiges se flétrissent et meurent durant la période de sécheresse, en juillet et en août, mais celles qui sont exposées à un stress moins intense produisent des bourgeons floraux. Ces bourgeons commencent à gonfler à la fin de juin, et les fleurs apparaissent en juillet ou au début d'août. La floraison se termine généralement à la fin d'août, mais chez les sujets établis dans des sols plus humides, elle peut se prolonger jusqu'en septembre ou en octobre. Les fleurs qui s'ouvrent plus tardivement ne produisent pas de fruits viables. La déhiscence des fruits issus d'une floraison hâtive débute à la fin d'août. Sous l'action du vent qui agite les tiges, les graines sont graduellement expulsées des capsules ouvertes. Les capsules produites plus tardivement libèrent leurs graines jusqu'en novembre. La plupart des tiges mortes demeurent dressées longtemps après la dispersion des graines.
La germination survient en mars ou en avril. Occasionnellement, des groupes denses de semis se forment à la base des individus qui ont produit des graines l'année précédente. La mortalité des semis est élevée, et de nombreux semis meurent durant les brèves périodes de temps sec qui provoquent l'assèchement de la couche superficielle du sol. Les survivants croissent lentement et ne fleurissent pas la première année. On ignore à quel âge survient la floraison en nature, mais même dans des jardins bien irrigués, la plupart des individus ne fleurissent pas avant l'âge de trois ans.
Dans une année donnée, une forte proportion des tiges ne s'allongent pas, et celles qui s'allongent ne résistent pas à la sécheresse et meurent avant de produire des fleurs. Souvent, celles qui survivent jusqu'à la fin de la période de sécheresse estivale n'ont pas le temps de produire de graines viables avant l'arrivée du temps froid automnal et la fin de la saison de croissance. Les capsules immatures pourrissent durant l'hiver. Le potentiel de rétablissement du grand silène de Scouler est limité par l'incapacité de certaines populations de produire des graines viables avant l'arrivée du temps froid en automne, qui arrête la croissance.
Nom commun :
Castilléjie dorée
Nom scientifique :
Castilleja levisecta
Statut :
Espèce en voie de disparition.
Dernier examen ou dernière modification :
Mai 2000 (dans une catégorie de risque plus élevée).
Justification de la désignation :
Aire de répartition très limitée ainsi que perte de presque la moitié des populations historiques. Menaces continues provenant de la propagation des plantes exotiques.
Présence au Canada :
Colombie-Britannique.
Historique du statut :
Espèce désignée « menacée » en avril 1995. Réexamen du statut : l'espèce a été désignée « en voie de disparition » en mai 2000. Dernière évaluation fondée sur un rapport de situation existant accompagné d'un addenda.
Le Castilleja levisecta Hooker est un taxon bien défini selon la description fournie dans le rapport de situation du COSEPAC (Douglas et Ryan, 1995).
La castilléjie dorée est une herbacée vivace à plusieurs tiges, à port dressé (10 à 50 cm de hauteur), naissant d'une souche ligneuse. Les feuilles, glanduleuses, pubescentes et alternes, sont entières (feuilles inférieures) à trilobées (feuilles supérieures). L'inflorescence est un épi terminal garni de bractées jaune doré cachant les fleurs, peu visibles. Les capsules sèches contiennent un grand nombre de graines minuscules (Douglas et al., 2000; Ryan et Douglas, 1995).
La castilléjie dorée se rencontre à Victoria et dans la région avoisinante dans la portion sud de l'île de Vancouver et dans les îles situées au large, jusque dans la portion sud du bassin de Puget (figure 6). Elle est cotée S1 dans l'État de Washington, et elle est disparue de l'Oregon (SH) et du sud-ouest de l'État de Washington (NatureServe 2004).
Les aires de répartition historique et actuelle correspondent approximativement à l'ancienne zone d'occurrence d'environ 300 km2 (BC Conservation Data Centre, 2004). La zone d'occurrence actuelle est d'environ 2 à 3 km2; des relevés de végétation récents indiquent que la zone d'occupation actuelle couvre environ 50 000 à 60 000 m2 (5 à 6 ha).
Figure 6 : Répartition mondiale et canadienne du Castilleja levisecta
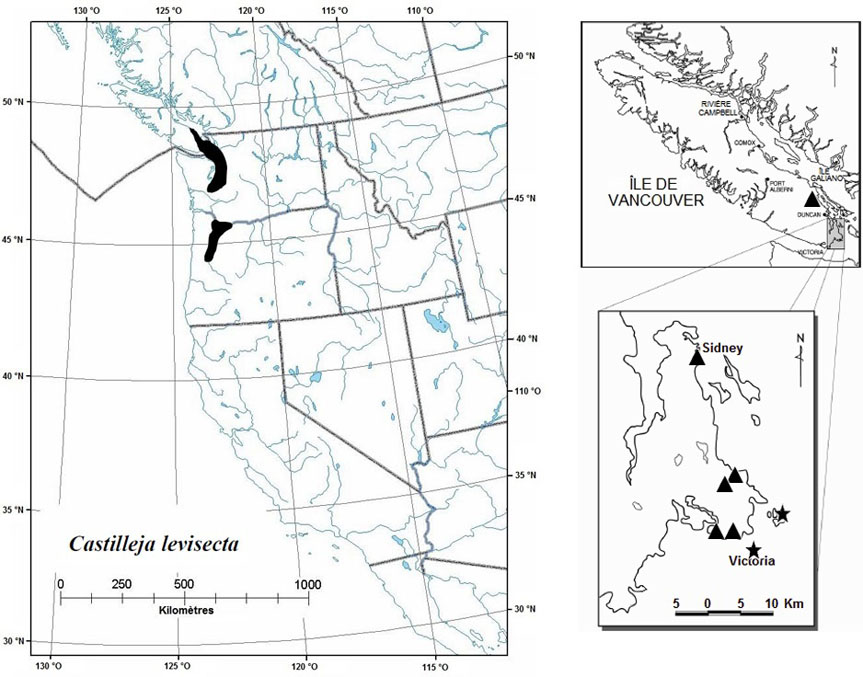
La répartition mondiale est illustrée à gauche, et la répartition canadienne, à droite. Pour le Canada, les populations disparues sont désignées par un triangle, et les populations existantes, par une étoile.
Description longue pour la figure 6
La carte à gauche illustre la répartition mondiale du Castilléjie dorée et la carte à droite illustre la répartition canadienne des populations du Castilléjie dorée.
Le rapport de situation du COSEPAC décrit trois « populations » existantes et sept autres populations qui ont disparu ou pour lesquelles on ne dispose d'aucune donnée récente (tableau 14). Une des populations mentionnées dans le rapport de situation a disparu depuis la publication du rapport, laissant seulement deux populations existantes.
Le rapport de situation du COSEPAC estime la taille de la population totale à 3 563 individus. Une estimation de 2002 évalue à 8 850 la population totale, mais les opinions sont partagées concernant la validité de cette estimation (BC Conservation Data Centre, 2004).
| Population | Régime foncier | Données tirées du rapport de situation | Données obtenues subséquemment | ||||
|---|---|---|---|---|---|---|---|
| Date | Observateurs | Nombre d'individus | Date | Observateurs | Nombre d'individus | ||
| Îlot Alpha | Réserve écologique provinciale | 1994 | Cannings | 1 000 | 2002 | Fairbarns | 2 400 |
| Îlot Alpha | Réserve écologique provinciale | 2004 | Penny | 4 000 | |||
| Île Trial | Population établie sur des terres provinciales désignées réserve écologique, des terres provinciales cédées à bail à une société de radiocommunications et des terres fédérales gérées par la Garde côtière canadienne. | 1992 | Douglas | 2 560 | 2002 | Fairbarns | 6 450 |
| Parc Beacon Hill | Ville de Victoria (lieu désigné parc urbain) | 1991 | Brayshaw | 3 | 2004 | Fairbarns | Disparue |
| Falaises Dallas | Ville de Victoria (lieu désigné parc urbain) | 1969 | Clark | Disparue | Cette mention se rapporte à une sous-population disparue de la population du parc Beacon Hill | Cette mention se rapporte à une sous-population disparue de la population du parc Beacon Hill | Cette mention se rapporte à une sous-population disparue de la population du parc Beacon Hill |
| Cedar Hill | Municipalité de Saanich (apparemment sur des terres municipales aujourd'hui désignées parc urbain) | 1887 | Macoun | Disparue | Aucune donnée obtenue subséquemment; populations présumées disparues | Aucune donnée obtenue subséquemment; populations présumées disparues | Aucune donnée obtenue subséquemment; populations présumées disparues |
| Lac Lost (Lac Blenkinsop) | Inconnu | 1945 | Hardy | Disparue | Aucune donnée obtenue subséquemment; populations présumées disparues | Aucune donnée obtenue subséquemment; populations présumées disparues | Aucune donnée obtenue subséquemment; populations présumées disparues |
| Baie Foul | Inconnu | 1918 | Carter | Disparue | Aucune donnée obtenue subséquemment; populations présumées disparues | Aucune donnée obtenue subséquemment; populations présumées disparues | Aucune donnée obtenue subséquemment; populations présumées disparues |
| Route Patricia Bay | Inconnu | 1954 | Melburn | Disparue | Aucune donnée obtenue subséquemment; populations présumées disparues | Aucune donnée obtenue subséquemment; populations présumées disparues | Aucune donnée obtenue subséquemment; populations présumées disparues |
| Sidney | Inconnu | 1927 | Goddard | Inconnu | Aucune donnée obtenue subséquemment; populations présumées disparues | Aucune donnée obtenue subséquemment; populations présumées disparues | Aucune donnée obtenue subséquemment; populations présumées disparues |
| Wellington | Inconnu | 1898 | Fletcher | Inconnu | Aucune donnée obtenue subséquemment; populations présumées disparues | Aucune donnée obtenue subséquemment; populations présumées disparues | Aucune donnée obtenue subséquemment; populations présumées disparues |
La castilléjie dorée pousse dans des prés maritimes mésiques. Les renseignements suivants sur la structure de l'écosystème de la castilléjie dorée sont tirés du rapport de situation du COSEPAC. Cette description est enrichie d'informations amassées dans le cadre de relevés de la végétation effectués subséquemment (Fairbarns, obs. pers., 2004; Chappell, 2004a). Les prés convenant à l'espèce sont situés à moins de 30 m au-dessus du niveau de la mer. Les sols ont une profondeur de plus de 30 cm et demeurent humides en hiver, mais ils s'assèchent jusqu'au point de flétrissement permanent à la fin de l'été. Les milieux abritant l'espèce n'ont jamais été labourés ni fauchés, mais certains ont été légèrement broutés par le bétail et ont probablement déjà été touchés par des incendies dans le passé.
Les arbres sont rarement présents, et leur abondance et la densité de leur couvert ne sont jamais élevées en raison des effets conjugués de l'exposition aux vents et aux embruns salés et de la sécheresse des sols, peu profonds.
Les arbustes sont habituellement absents ou forment des fourrés épars, mais quelques espèces introduites (genêt à balais [Cytisus scoparius], daphné lauréole [Daphne laureola], ajonc d'Europe [Ulex europaeus]) sont occasionnellement abondantes. Certaines espèces indigènes (mahonia à feuilles de houx [Mahonia aquifoilium], symphorine blanche [Symphoricarpos albus]) sont fréquemment présentes, mais rarement abondantes.
La strate herbacée est généralement dominée par un mélange d'espèces indigènes et introduites. Les principales espèces indigènes sont des herbacées non graminoïdes (camassie camash [Camassia quamash], camassie de Suksdorf [C. leichtlinii], fraisier des champs [Fragaria virginiana], lomatium à tige nue [Lomatium nudicaule], lomatium utriculé [L. utriculatum], fougère-aigle [Pteridium aquilinum], sanicle à tige charnue [Sanicula crassicaulis], tritéléia fausse-jacinthe [Triteleia hyacinthina]), mais quelques graminoïdes indigènes (deschampsie cespiteuse [Deschampsia cespitosa], élyme glauque [Elymus glaucus]) peuvent être présentes.
Parmi les herbacées introduites, diverses graminées (flouve odorante [Anthoxanthum odoratum], fétuque rouge [Festuca rubra], pâturin des prés [Poa pratensis], vulpie faux-brome [Vulpia bromoides]) et espèces non graminoïdes (porcelle enracinée [Hypochaeris radicata], plantain lancéolé [Plantago lanceolata], vesce cultivée [Vicia sativa]) sont souvent présentes, et n'importe laquelle de ces espèces peut dominer à une station donnée.
Les mousses et les lichens occupent habituellement de faibles superficies, mais le Cladina portentosa et le Dicranum scoparium peuvent être modérément abondants.
Les informations fournies dans le rapport de situation du COSEPAC ont été actualisées par des relevés de la végétation effectués subséquemment à l'île Trial et des observations occasionnelles à l'îlot Alpha (Fairbarns, en prép. a.).
Les sujets établis produisent de nouvelles pousses une fois la période de sécheresse estivale/automnale passée. La dormance des bourgeons au niveau du collet peut être levée dès le mois d'août si des pluies viennent humidifier le sol en fin d'été. La croissance des jeunes tiges est rapide tant que les températures demeurent élevées. En 2004, un faible pourcentage des nouvelles tiges ont produit des fleurs dès la mi-octobre.
Normalement, toutefois, le sol n'est pas assez humide pour provoquer la levée de la dormance avant le milieu de l'automne, et la croissance des tiges, qui s'effectue tout juste au-dessus de la surface du sol, est alors ralentie par le temps frais. En début de croissance, les entre-nœuds sont très rapprochés et les feuilles sont minuscules et regroupées près du collet, donc difficiles à voir. La croissance en longueur des tiges débute à la fin de février ou en mars, et les tiges atteignent généralement leur taille définitive à la fin de mai ou au début de mai. La floraison coïncide avec l'achèvement de la croissance végétative, à la fin d'avril et au début de mai. Les fruits immatures sont abondants en juin, et la plupart des fruits sont déjà mûrs à la fin de juillet. La dispersion des graines débute à la fin d'août et se poursuit jusqu'à la fin de novembre ou au début de décembre.
La castilléjie dorée est une plante parasite des racines (hémiparasite). L'association entre cette espèce et d'autres espèces hémiparasites apparentées et leurs hôtes est relativement aléatoire, et un grand nombre d'espèces végétales peuvent être parasitées (Atsatt et Strong, 1970).
Aucun semis encore pourvu de ses cotylédons n'a été observé sur le terrain au cours de trois années d'étude, mais des semis ont été trouvés en mars 2004 dans une aire expérimentale située à proximité de la parcelle de l'île Trial. Il semble que la germination ou la survie de jeunes semis soient des événements rares qui s'observent uniquement au cours d'années particulièrement favorables. Il est difficile de déterminer si les faibles taux de recrutement résultent d'un faible taux de germination ou d'une forte mortalité des jeunes semis, car les semis sont extrêmement petits et difficiles à distinguer de ceux d'autres espèces présentes dans la région. Le caractère intermittent de la reproduction chez la castilléjie dorée semble limiter le potentiel de rétablissement de l'espèce.
Nom commun :
Lupin élégant
Nom scientifique :
Lupinus lepidus var. lepidus
Statut :
Espèce en voie de disparition.
Dernier examen ou dernière modification :
Mai 2000 (aucune modification).
Justification de la désignation :
En voie de dispraition en raison d'une petite aire de répartition et de populations en déclin. Peut être disparu du Canada.
Présence au Canada :
Colombie-Britannique.
Historique du statut :
Espèce désignée « en voie de disparition » en avril 1996. Réexamen et confirmation du statut en mai 2000. Dernière évaluation fondée sur un rapport de situation existant.
La taxinomie actuelle du lupin élégant est complexe et ne fait pas l'unanimité. Douglas et Ryan (1996b) donnent une description de la classification et de la nomenclature.
Le Lupinus lepidus var. lepidus est une herbacée vivace formant une touffe de 20 à 45 cm de hauteur. Les feuilles, soyeuses, sont surtout basiliaires, la tige portant quelques feuilles alternes. Les feuilles sont palmées, à 5 à 9 folioles. Les fleurs, bleues, blanches ou violettes, sont semblables à celles du pois et réunies en grappes terminales. Elles mesurent 10 à 13 mm de longueur. Les gousses sont pubescentes, mesurent 1 à 3 cm de longueur et contiennent 2 à 4 graines. Les caractères distinctifs incluent les tiges et feuilles densément pubescentes et la base de la tige ligneuse (Douglas et al., 1999a; Ryan et Douglas, 1996).
Selon Ryan et Douglas (1996b), l'aire de répartition du lupin élégant s'étend de la Colombie-Britannique jusqu'en Oregon, en passant par l'État de Washington. La répartition de l'espèce aux États-Unis est difficile à déterminer en raison de la confusion qui règne autour de sa taxinomie et du fait qu'elle n'est pas considérée comme une espèce rare dans l'État de Washington et en Oregon (cote SNR). On lui a attribué la cote S1 en Alaska, mais l'identification du spécimen concerné a été remise en question (Ryan et Douglas, 1996b). Le lupin élégant est relativement commun dans les prairies de la portion sud de Puget Sound (comtés de Thurston et de Pierce). Bien que ces prairies soient très fragmentées et menacées, le lupin élégant y est commun et est une espèce caractéristique de l'association végétale fétuque de Roemer/aster rigide (Festuca idahoensis var. roemerii/Sericocarpus rigidus) (Chappell, comm. pers., 2004).
Au Canada, l'existence de deux populations de lupin élégant a récemment (BC Conservation Data Centre, 2005) été reconfirmée dans le sud-est de l'île de Vancouver, aux monts Braden et MacDonald. La zone d'occurrence historique du lupin élégant est difficile à déterminer à cause du faible nombre de mentions (BC Conservation Data Centre, 2004).
Le rapport de situation du COSEPAC décrit sept populations disparues ou stations pour lesquelles les indications géographiques sont imprécises. On ignore la taille de la population totale historique au Canada.
Depuis la rédaction du rapport de situation, la présence de deux populations a été confirmée, l'une au mont Braden (1996), dans l' aire de nature sauvage des Sooke Hills, et l'autre au parc régional du mont Wells (2001) (tableau 15). Aucun individu n'a été trouvé au cours des années subséquentes au mont Braden (Roemer, comm. pers., 2004), mais en juillet 2005, 2 individus y ont été observés. Au mont Wells, 7 individus ont été découverts en 2001 après un incendie (BC Conservation Data Centre, 2004). En 2003, la station était envahie par des populations denses de busserole du Columbia [Arctostaphylos columbiana] et de genêt à balais [Cytisus scoparius], espèce exotique, et seulement 2 individus (dont un qui avait fleuri et portait 2 graines dans une gousse) ont été trouvés (Maslovat, obs. pers., 2003). Aucun individu n'a été trouvé en 2004, mais les graines étaient probablement encore présentes dans le réservoir de semences (Roemer, comm. pers., 2004). Enfin, en juillet 2005, 113 individus ont été trouvés au mont MacDonald; c'était la première fois que la présence de l'espèce y était observée depuis 1913 (base de données du Centre de données sur la conservation de la Colombie-Britannique).
Figure 7 : Répartition mondiale et canadienne du Lupinus lepidus var. lepidus
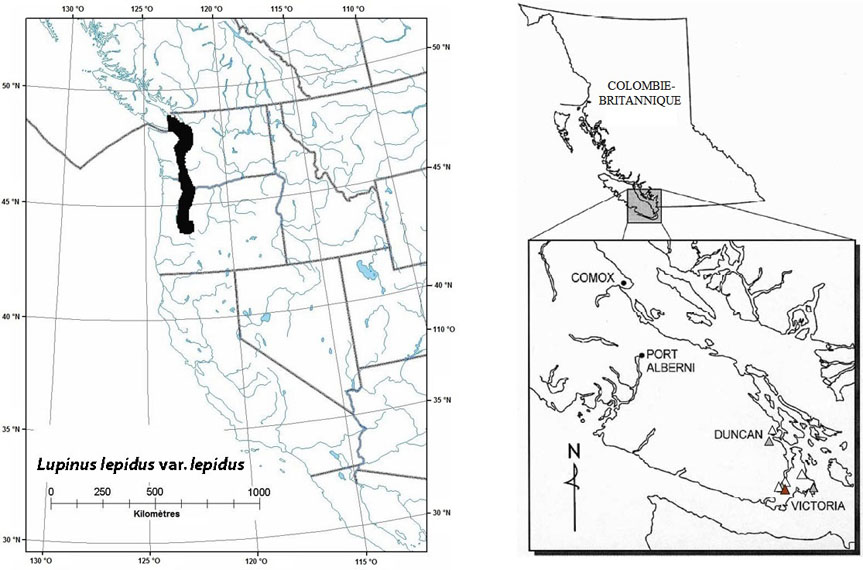
La répartition mondiale est illustrée à gauche, et la répartition canadienne, à droite. Pour le Canada, les populations disparues sont désignées par un triangle ouvert, les populations dont la situation n'a pas été vérifiée, par un triangle gris, et les populations existantes encore tout récemment, par un triangle plein.
Description longue pour la figure 7
La carte à gauche illustre la répartition mondiale du Lupin élégant et la carte à droite illustre la répartition canadienne des populations du Lupin élégant.
| Population | Régime foncier | Données tirées du rapport de situation | Données obtenues subséquemment | ||||
|---|---|---|---|---|---|---|---|
| Date | Observateurs | Nombre d'individus | Date | Observateurs | Nombre d'individus | ||
| Plaines de Langford | Inconnu | 1908 | Macoun | Disparue | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment |
| Mont MacDonald | Réserve de parc du district régional de la capitale, aire de nature sauvage des Sooke Hills | 1915 | Newcombe | Inconnu | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment |
| Observatory Hill | Institut Herzberg d'astrophysique du Conseil national de recherches | 1960 | Hardy | Inconnu | 2003 | Fairbarns | Probablement disparue |
| Vallée de la Koksilah | Inconnu | 1973 | Brayshaw | Inconnu | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment |
| Pointe Cattle | Municipalité d'Oak Bay (lieu désigné parc urbain) | 1991 | Brayshaw | Inconnu | Mention peut-être fondée sur une identification erronée (Fairbarns et Penny, 2003) | Mention peut-être fondée sur une identification erronée (Fairbarns et Penny, 2003) | Mention peut-être fondée sur une identification erronée (Fairbarns et Penny, 2003) |
| Beacon Hill | Ville de Victoria (lieu désigné parc urbain) | 1993 | Ryan | Disparue | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment |
| Lac Somenos | InconnuNote de bas de page a | 1994 | Douglas | Disparue | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment | Aucune donnée obtenue subséquemment |
| Mont Braden | Réserve de parc du district régional de la capitale, aire de nature sauvage des Sooke Hills | Population inconnue au moment de la rédaction du rapport de situation | Population inconnue au moment de la rédaction du rapport de situation | Population inconnue au moment de la rédaction du rapport de situation | 1996 | Roemer | 4 |
| Mont Braden | Réserve de parc du district régional de la capitale, aire de nature sauvage des Sooke Hills | Population inconnue au moment de la rédaction du rapport de situation | Population inconnue au moment de la rédaction du rapport de situation | Population inconnue au moment de la rédaction du rapport de situation | 1999 | Roemer | 0 |
| Mont Braden | Réserve de parc du district régional de la capitale, aire de nature sauvage des Sooke Hills | Population inconnue au moment de la rédaction du rapport de situation | Population inconnue au moment de la rédaction du rapport de situation | Population inconnue au moment de la rédaction du rapport de situation | 2005 | Roemer | 2 |
| Mont Wells | Réserve de parc du district régional de la capitale, aire de nature sauvage des Sooke Hills | Population inconnue au moment de la rédaction du rapport de situation | Population inconnue au moment de la rédaction du rapport de situation | Population inconnue au moment de la rédaction du rapport de situation | 2001 | Roemer | 7 |
| Mont Wells | Réserve de parc du district régional de la capitale, aire de nature sauvage des Sooke Hills | Population inconnue au moment de la rédaction du rapport de situation | Population inconnue au moment de la rédaction du rapport de situation | Population inconnue au moment de la rédaction du rapport de situation | 2003 | Maslovat | 2 (un ayant fleuri) |
| Mont Wells | Réserve de parc du district régional de la capitale, aire de nature sauvage des Sooke Hills | Population inconnue au moment de la rédaction du rapport de situation | Population inconnue au moment de la rédaction du rapport de situation | Population inconnue au moment de la rédaction du rapport de situation | 2004 | Roemer | Réserve de semences? |
| Mont MacDonald | Réserve de parc du district régional de la capitale, aire de nature sauvage des Sooke Hills | Population qui n'avait pas été observée depuis 1913 | Population qui n'avait pas été observée depuis 1913 | Population qui n'avait pas été observée depuis 1913 | 2005 | Roemer | 113 |
Comme le lupin élégant compte au Canada seulement quelques stations répertoriées, il est difficile de décrire de façon précise les caractéristiques de son habitat (Ryan et Douglas, 1996b). Il se rencontre généralement dans des milieux xériques exposés à sol rocailleux ou graveleux bien drainé et pauvre en éléments nutritifs (Ryan et Douglas, 1996b). Les populations se rencontrent en terrain plat ou incliné (20 %), à des altitudes variant entre 30 à 360 mètres. Au mont Wells (2001), le lupin élégant a été observé dans un secteur brûlé depuis peu, en terrain plat à sol peu profond (< 30 cm). Une station anciennement occupée était régulièrement fauchée, et une autre se trouvait dans une zone perturbée entre l'autoroute et une voie ferrée (BC Conservation Data Centre, 2004).
Au mont Wells, le lupin élégant a été trouvé en association avec la busserole du Columbia (Arctostaphylos columbiana) (sujets produisant des rejets), le groseillier sanguin (Ribes sanguineum) (semis), le groseillier de Lobb (Ribes lobbii), l'holodisque discolore (Holodiscus discolor) et diverses mauvaises herbes et graminées annuelles. Au mont Braden, il a été observé parmi des colonies éparses de fétuque de Roemer (Festuca idahoensis ssp. roemeri), de la mousse Racomitrium canescens et de lichens. Au lac Somenos, il poussait en compagnie du Racomitrium canescens et du lupin polyphylle (Lupinus polyphyllus), et le genêt à balais (Cytisus scoparius), espèce exotique, était présent en périphérie de la population (BC Conservation Data Centre, 2004).
Dans l'État de Washington, le lupin élégant semble préférer les milieux exposés à un stress hydrique, où le sol est très peu humide en été (Ewing, comm. pers., 2004).
Le lupin élégant est une plante vivace qui semble présenter une courte durée de vie. Rien n'a encore été publié sur la phénologie ou la démographie de l'espèce. Les graines semblent demeurer viables pendant de longues périodes dans le réservoir de semences (Douglas, comm. pers., 2004).
En l'absence de perturbations périodiques du sol ou d'incendies, le lupin élégant semble décliner (Ryan et Douglas, 1996b). La disparition de l'espèce pourrait être due à un manque de vigueur des sujets matures ou à la compétition (Ryan et Douglas, 1996b).
La prédation des graines (Grosboll, comm. pers., 2004) et l'herbivorie (Fagan et Bishop, 2000; Fagan et al., 2001) touchent d'autres Lupinus, mais les effets de ces facteurs chez le lupin élégant sont inconnus. Durant des essais de plantation effectués à Seattle, dans l'État de Washington, l'ajout de paillis et d'engrais a causé une diminution de la taille des semis, et une maladie inconnue a décimé la population (Ewing, 2002; Ewing, comm. pers., 2004).
Nom commun :
Sanicle bipinnatifide
Nom scientifique :
Sanicula bipinnatifida
Statut :
Espèce menacée.
Dernier examen ou dernière modification :
Mai 2001 (nouvelle).
Justification de la désignation :
Espèce limitée géographiquement et ayant une petite aire de répartition dans les biocénoses des chênes de Garry se trouvant dans une région urbanisée importante, en péril en raison de la perte et de la détérioration de l'habitat et de l'incidence des plantes exotiques.
Présence au Canada :
Colombie-Britannique.
Historique du statut :
Espèce désignée « menacée » en mai 2001. Évaluation fondée sur un nouveau rapport de situation.
Le Sanicula bipinnatifida Hooker est un taxon bien défini selon la description fournie dans le rapport de situation (Penny et Douglas, 2000). Kartesz (1994) ne reconnaît aucun taxon intraspécifique chez cette espèce.
La sanicle bipinnatifide est une plante vivace dressée (10 à 60 cm de hauteur) à tiges ramifiées et à racine pivotante. Les feuilles, basales ou insérées sur la partie inférieure des tiges, sont pinnatifides, avec un rachis denté et ailé. Les fleurs, à corolle violette et à involucelle peu apparent, sont groupées en ombelles compactes plus ou moins nombreuses. Le fruit est un schizocarpe ovoïde hérissé d'aiguillons crochus. La sanicle bipinnatifide se distingue des autres sanicles par son involucelle peu apparent et ses fleurs violet foncé (Douglas et al., 1998a; Penny et Douglas, 2001).
La sanicle bipinnatifide se rencontre le long de la côte du Pacifique et dans les vallées intérieures depuis le sud de l'île de Vancouver jusqu'à la Basse Californie (figure 8). Aucune cote (SNR) ne lui a été attribuée en Californie, en Oregon et dans l'État de Washington (NatureServe 2004). Les populations du bassin de Géorgie-Puget Sound semblent séparées par environ 100 km des populations principales, qui atteignent la limite nord de leur aire le long du Columbia. Au Canada, la sanicle bipinnatifide est confinée à une petite région du sud-est de l'île de Vancouver et à la portion sud des îles Gulf. D'après les mentions les plus récentes, la zone d'occurrence de l'espèce est estimée à environ 3 500 km2, et la zone d'occupation au Canada, à 2 à 3 ha (BC Conservation Data Centre, 2004; Fairbarns, obs. pers., 2004).
Figure 8 : Répartition mondiale et canadienne du Sanicula bipinnatifida
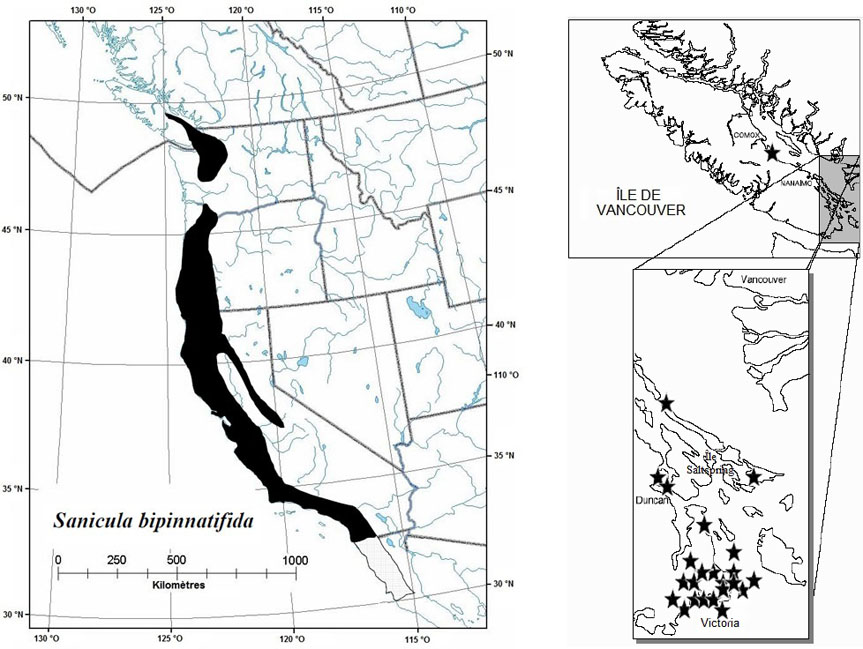
La répartition mondiale, dont l'étendue en Basse Californie est incertaine, est illustrée à gauche, et la répartition canadienne, à droite. Pour le Canada, les populations disjointes, dont la situation est incertaine, sont désignées par une étoile.
Description longue pour la figure 8
La carte à gauche illustre la répartition mondiale du Sanicle bipinnatifide et la carte à droite illustre la répartition canadienne des populations du Sanicle bipinnatifide.
Le rapport de situation du COSEPAC décrit quatorze « populations » existantes, cinq disparues et sept dont la situation est inconnue (tableau 16) (Penny et Douglas, 2000).
La description de populations séparées par moins de 1 000 m comme des sous-populations (le critère utilisé par défaut par le Centre de données sur la conservation de la Colombie-Britannique pour reconnaître des populations distinctes) et des relevés effectués subséquemment portent à 20 le nombre de populations présumées existantes et à 5 à 6 le nombre de populations présumées disparues.
La taille estimée de la population totale augmente légèrement avec la découverte récente de nouvelles sous-populations, mais il n'existe aucune estimation précise des effectifs reproducteurs. Le rapport de situation du COSEPAC estime la population totale à 3 692 individus (sujets florifères et non florifères).
| Population | Régime foncier | Données tirées du rapport de situation | Données obtenues subséquemment | ||||
|---|---|---|---|---|---|---|---|
| Date | Observateurs | Nombre d'individus | Date | Observateurs | Nombre d'individus | ||
| Îlot Flora | Réserve écologique provinciale | 1976 | Pojar | Inconnu | Aucune donné obtenue subséquemment | Aucune donné obtenue subséquemment | Aucune donné obtenue subséquemment |
| Crête Brown, île Saturna | Terrain privé | 1996 | Janszen | 140 | Aucune donné obtenue subséquemment | Aucune donné obtenue subséquemment | Aucune donné obtenue subséquemment |
| East Point, île Saturna | Terres fédérales gérées par la Garde côtière canadienne | Disparue | Disparue | Disparue | Présumée disparue | Présumée disparue | Présumée disparue |
| Parc Dionisio, île Galiano | Parc provincial | 1993 | Roemer | 1 | Aucune donné obtenue subséquemment | Aucune donné obtenue subséquemment | Aucune donné obtenue subséquemment |
| Île Little D'Arcy | Terrain privé | 1977 | A. Ceska | Inconnu | Aucune donné obtenue subséquemment | Aucune donné obtenue subséquemment | Aucune donné obtenue subséquemment |
| Îlot Alpha | Réserve écologique provinciale | 1981 | A. Ceska | Inconnu | 2002 | A. Ceska | 11 |
| Île Discovery | Parc provincial | Non mentionnée | Non mentionnée | Non mentionnée | 2002 | Fairbarns | 5 |
| Île Trial | Terre provinciale cédée à bail à une société de radiocommunications | Non mentionnée | Non mentionnée | Non mentionnée | 2004 | Fairbarns | Environ 40 |
| R.E. Tzuhalem | Réserve écologique provinciale | 1999 | Penny | 94 | Aucune donné obtenue subséquemment | Aucune donné obtenue subséquemment | Aucune donné obtenue subséquemment |
| R.I. Tzuhalem | Réserve indienne fédérale | 1999 | Penny et Douglas | 75 | Aucune donné obtenue subséquemment | Aucune donné obtenue subséquemment | Aucune donné obtenue subséquemment |
| Sidney | Inconnu | 1927 | Goddard | Inconnu | Présumée disparue | Présumée disparue | Présumée disparue |
| Cedar Hill | Inconnu | 1897 | Macoun | Disparue | Même population que celle du mont Douglas? | Même population que celle du mont Douglas? | Même population que celle du mont Douglas? |
| Mont Douglas (même population que celle du chemin Blenkinsop et de Cedar Hill?) | Municipalité de Saanich (lieu désigné parc urbain) | 1953 | Melburn | Inconnu | 2004 | Fairbarns | 2 |
| District de Cloverdale | Inconnu | 1919 | Newcombe | Disparue | Présumée disparue | Présumée disparue | Présumée disparue |
| Pointe Ten Mile | Inconnu | 1942 | Eastham | Inconnu | Présumée disparue | Présumée disparue | Présumée disparue |
| Chemin Blenkinsop | Inconnu | 1939 | Inconnu | Inconnu | Même population que celle du mont Douglas? | Même population que celle du mont Douglas? | Même population que celle du mont Douglas? |
| Glencoe Cove | Municipalité de Saanich (lieu désigné parc urbain) | 1999 | Penny | 6 | Aucune donné obtenue subséquemment | Aucune donné obtenue subséquemment | Aucune donné obtenue subséquemment |
| Tourbière Rithet's | Municipalité de Saanich (lieu désigné parc urbain) | 1999 | Penny and Hartwell | 24 | 2004 | Ansell | ~ 20 |
| Uplands Park | Municipalité d'Oak Bay (lieu désigné parc urbain) | 1983 | Van Dieren | Disparue | 2004 | Fairbarns | Sous-population disparue; même population qu'à Cattle Point |
| Pointe Cattle | Municipalité d'Oak Bay (lieu désigné parc urbain) | 1999 | Penny et Douglas | 215 | 2004 | Fairbarns | > 300 |
| Pointe Holland | Ville de Victoria (lieu désigné parc urbain) | 1999 | Penny | 63 | Aucune donné obtenue subséquemment | Aucune donné obtenue subséquemment | Aucune donné obtenue subséquemment |
| Pointe Macaulay | Terres fédérales appartenant au ministère de la Défense nationale mais cédées à bail à la Municipalité d'Esquimalt pour utilisation comme parc | 1999 | Penny et Donovan | 1 014 | Aucune donné obtenue subséquemment | Aucune donné obtenue subséquemment | Aucune donné obtenue subséquemment |
| Golf Hill | Terres fédérales appartenant au ministère de la Défense nationale | 1976 | A. Ceska | Disparue | Présumée disparue; même population que celle de la pointe Macaulay, située à <1 km | Présumée disparue; même population que celle de la pointe Macaulay, située à <1 km | Présumée disparue; même population que celle de la pointe Macaulay, située à <1 km |
| Voisinage de Francis King | Terrain privé | 1999 | Penny | 13 | 1999 | Roemer | 12 |
| Lac Thetis | Terre du district régional de la capitale désignée parc | 2000 | Ussery et Fleming | 152 | Aucune donné obtenue subséquemment | Aucune donné obtenue subséquemment | Aucune donné obtenue subséquemment |
| Mill Hill | Terre du district régional de la capitale désignée parc | 1999 | Penny et Fleming | 127 | 2003 | Roemer | 309 |
| Mill Hill | Terre du district régional de la capitale désignée parc | 2004 | Roemer | 533 | |||
| Chemin Neild | Terrain privé | 1999 | Penny | 630 | Aucune donné obtenue subséquemment | Aucune donné obtenue subséquemment | Aucune donné obtenue subséquemment |
| Lieu historique national Fort Rodd Hill | Terres fédérales gérées par Agence Parcs Canada | 1966 | Ashlee | Inconnu | 2002 | Fairbarns | Disparue |
| Albert Head | Terres fédérales appartenant au ministère de la Défense nationale | 1999 | Penny et Donovan | 1 014 | Aucune donné obtenue subséquemment | Aucune donné obtenue subséquemment | Aucune donné obtenue subséquemment |
La sanicle bipinnatifide pousse dans des prés maritimes mésiques et des prés situés en terrain élevé. Les renseignements suivants sur la structure de l'écosystème de la sanicle bipinnatifide sont tirés du rapport de situation du COSEPAC. Cette description est enrichie d'informations amassées dans le cadre de relevés de la végétation récents (Fairbarns, obs. pers., 2004). La plupart des prés convenant à l'espèce sont situés à moins de 30 m au-dessus du niveau de la mer, mais les populations du mont Hill, du mont Tzuhalem et de la crête Brown se trouvent à des altitudes variant entre 100 et 300 m d'altitude, et celle du mont Douglas, aujourd'hui disparue, se trouvait également à plus de 30 m au-dessus du niveau de la mer. Les sols ont une profondeur de plus de 30 cm et demeurent humides en hiver, mais ils s'assèchent jusqu'au point de flétrissement permanent au début de l'été. Les milieux abritant l'espèce n'ont jamais été labourés ni fauchés, mais plusieurs ont été légèrement broutés par le bétail et ont fort probablement déjà été touchés par des incendies dans le passé.
Des arbres sont parfois présents, mais leur abondance et la densité de leur couvert sont rarement élevées en raison des effets conjugués du vent, des embruns salés ou de la sécheresse des sols, peu profonds. L'importance du couvert arbustif varie considérablement d'une station à l'autre, et le genêt à balais (Cytisus scoparius), l'ajonc d'Europe (Ulex europaeus) et le lupin en arbre (Lupinus arboreus), trois espèces introduites, sont parfois abondants.
La strate herbacée est dominée par un mélange d'espèces indigènes et introduites. Les principales espèces indigènes sont des herbacées non graminoïdes (grindélie à grandes feuilles [Grindelia integrifolia], lomatium à tige nue [Lomatium nudicaule], fougère-aigle [Pteridium aquilinum]), mais quelques graminoïdes indigènes (brome caréné [Bromus carinatus], danthonie de Californie [Danthonia californica]) peuvent également être présentes.
Parmi les herbacées introduites, diverses graminées (brome mou [Bromus hordeaceus], dactyle pelotonné [Dactylis glomerata], ivraie vivace [Lolium perenne], vulpie faux-brome [Vulpia bromoides]) et espèces non graminoïdes (porcelle enracinée [Hypochaeris radicata], plantain lancéolé [Plantago lanceolata], petite oseille [Rumex acetosella], petit trèfle jaune [Trifolium dubium], vesce cultivée [Vicia sativa]) sont souvent présentes, et n'importe laquelle de ces espèces peut dominer à une station donnée.
Les mousses et les lichens occupent habituellement de faibles superficies.
Les informations fournies dans le rapport de situation du COSEPAC ont été actualisées par des relevés de la végétation réalisés subséquemment à l'île Trial et à la pointe Macaulay et des observations effectuées dans d'autres stations canadiennes (Fairbarns, en prép. d.).
Les sujets établis produisent de nouvelles pousses en janvier ou en février. Leur croissance est lente jusqu'à la fin de l'hiver ou au début du printemps, mais elle s'accélère en avril et au début de mai. Les tiges commencent à se flétrir et à dépérir lorsque les conditions de sécheresse s'installent vers la mi-mai. La plupart des tiges sont mortes à la fin de juin ou au début de juillet.
Les bourgeons floraux sont habituellement bien développés à la mi-avril, et la floraison atteint son point culminant à la fin d'avril et au début de mai. Les fruits sont apparents à la fin de mai et parviennent à maturité en juin. La libération des fruits se prolonge sur une longue période, et de nombreux plants conservent jusqu'à 20 % de leurs fruits jusqu'en octobre. La dispersion des fruits hérissés d'aiguillons est assurée par les animaux qui entrent en contact avec les sujets reproducteurs.
La germination survient entre la mi-février et la mi-avril. Au début, la mortalité des jeunes semis peut être passablement élevée, au point où seuls quelques sujets parviennent à produire un véritable feuillage. Seule une faible proportion des sujets qui ont germé parviennent à survivre à la période de dormance subséquente.
Nom commun :
Lotier splendide
Nom scientifique :
Lotus formosissimus
Statut :
Espèce en voie de disparition.
Dernier examen ou dernière modification :
Mai 2000 (aucune modification).
Justification de la désignation :
Les quelques populations restantes et leur aire d'occurence connaissent un déclin en raison de la concurrence des plantes étrangères envahissantes et des lapins.
Présence au Canada :
Colombie-Britannique.
Historique du statut :
Espèce désignée « en voie de disparition » en avril 1996. Réexamen et confirmation du statut en mai 2000. Dernière évaluation fondée sur un rapport de situation existant.
Le Lotus formosissimus Greene est un taxon bien défini selon la description fournie dans le rapport de situation du COSEPAC (Ryan et Douglas, 1996). Kartesz (1994) ne reconnaît aucun taxon intraspécifique chez cette espèce.
Le lotier splendide est une espèce vivace à tiges traînantes (20 à 50 cm) issues de stolons ou de rhizomes. Les feuilles sont alternes, pennées et habituellement composées de 5 folioles arrondies à ovées. L'inflorescence est une ombelle de 3 à 9 fleurs rose et jaune ressemblant à des fleurs de pois. Les graines, peu nombreuses, sont contenues dans des gousses linéaires à oblongues. Le lotier splendide se distingue des autres Lotus par le fait qu'il est vivace et par ses grandes stipules membraneuses sur les feuilles et ses fleurs rose et jaune (Douglas et al. 1999a; Ryan et Douglas, 1996a).
Le lotier splendide se rencontre le long de la côte du Pacifique depuis le sud de l'île de Vancouver jusqu'au centre de la Californie (figure 9). Aucune cote (SNR) ne lui a été attribuée dans l'État de Washington, en Oregon et en Californie (NatureServe, 2004). Les populations canadiennes sont séparées par environ 160 km des populations les plus rapprochées, réparties le long de la portion centrale de la côte de l'État de Washington.
Au Canada, les aires de répartition historique et actuelle du lotier splendide forment approximativement une bande côtière allongée et étroite d'environ 60 km de longueur sur seulement 50 m de largeur. En conséquence, la zone d'occurrence n'a jamais dépassé près de 3 km2. Le rapport de situation du COSEPAC estime la zone d'occupation totale au Canada à 155 m2, mais une estimation plus récente fait grimper sa superficie à presque 200 m2.
Le rapport de situation du COSEPAC décrit deux populations existantes, une population historique et deux populations qui étaient présumées disparues. Des recherches réalisées subséquemment ont confirmé l'existence de cinq populations au Canada et d'une population présumée disparue (BC Conservation Data Centre, 2004).
Le rapport de situation du COSEPAC estime à 193 individus la population totale du lotier splendide au Canada. Des relevés réalisés subséquemment (tableau 17) pour certaines populations ont indiqué que la population canadienne totale compterait plutôt entre 350 et 600 individus. La détermination de la taille exacte de la plupart des populations nécessite l'utilisation de méthodes d'échantillonnage destructives.
Figure 9 : Répartition mondiale et canadienne du Lotus formosissimus
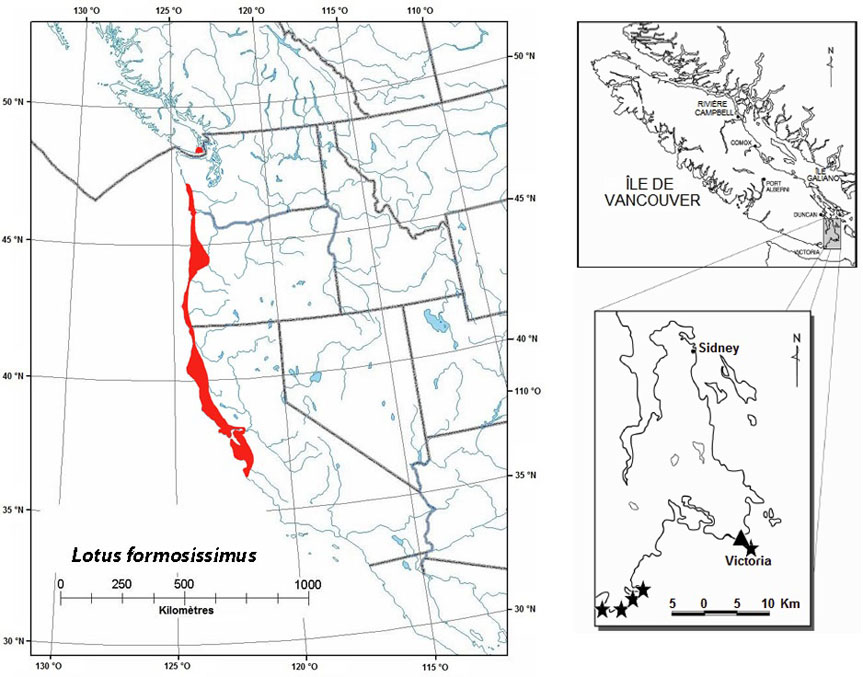
La répartition mondiale est illustrée à gauche, et la répartition canadienne, à droite. Pour le Canada, les populations existantes sont désignées par une étoile, et la population disparue, par un triangle.
Description longue pour la figure 9
La carte à gauche illustre la répartition mondiale du Lotier splendide et la carte à droite illustre la répartition canadienne des populations du Lotier splendide.
| Population | Régime foncier | Données tirées du rapport de situation | Données obtenues subséquemment | ||||
|---|---|---|---|---|---|---|---|
| Date | Observateurs | Nombre d'individus | Date | Observateurs | Nombre d'individus | ||
| Île Trial | Population établie sur des terres provinciales désignées réserve écologique, des terres provinciales cédées à bail à une société de radiocommunications et des terres fédérales gérées par la Garde côtière canadienne. | 1992 | Douglas | 28 | 2004 | Fairbarns | 100 à 200 |
| William Head | Terres fédérales gérées par le Service correctionnel du Canada | 1953 | Hardy | Présumée disparue | 2004 | Fairbarns | 7 |
| Pointe Rocky | Terres fédérales gérées par le ministère de la Défense nationale | 1993 | Ryan | 165 | 2004 | Fairbarns | 25 |
| Île Bentinck | Terres fédérales gérées par le ministère de la Défense nationale | 1977 | Ceska | Inconnu | 2002 | Fairbarns | 45 à 55 |
| Pointe Church | Terres fédérales gérées par le ministère de la Défense nationale | Non mentionnée | Non mentionnée | Non mentionnée | 2002 | Fairbarns | 200 à 300 |
| Baie Foul | Inconnu | 1912 | Macoun | Inconnu | Disparue | Disparue | Disparue |
Le lotier splendide pousse dans des prés maritimes mésiques. Les renseignements suivants sur la structure de l'écosystème du lotier splendide sont tirés du rapport de situation du COSEPAC. Cette description est enrichie d'informations amassées dans le cadre de relevés de la végétation récents (Fairbarns, obs. pers., 2004). Les prés abritant le lotier splendide se trouvent à moins de 30 m du niveau de la mer. Les sols ont plus de 20 cm de profondeur et demeurent humides durant tout l'hiver, mais ils s'assèchent presque jusqu'au point de flétrissement permanent à la fin de l'été. Les milieux abritant l'espèce n'ont jamais été labourés ni fauchés, mais plusieurs ont été légèrement broutés par le bétail et ont fort probablement déjà été touchés par des incendies dans le passé.
Un faible couvert de chêne de Garry (Quercus garryana), de pin tordu (Pinus contorta), d'arbousier d'Amérique (Arbutus menziesii) ou de douglas (Pseudotsuga menziesii) peut être présent, mais en général, l'exposition aux vents et aux embruns salés et la sécheresse des sols, peu profonds, empêchent généralement la croissance des arbres. Les arbustes indigènes sont habituellement épars ou absents, mais la symphorine blanche (Symphoricarpos albus), le rosier de Nootka (Rosa nutkana) et le salal (Gaultheria shallon) sont parfois présents. Ces espèces arbustives forment parfois des fourrés denses en périphérie des populations de lotier splendide et peuvent s'avancer dans ces dernières au cours des années humides, représentant du coup une menace pour l'espèce. Anciennement, les feux de friche et le brûlage pratiqué par les Autochtones freinaient probablement la propagation de ces petits arbustes dans certaines stations. Certaines espèces arbustives introduites et envahissantes comme le genêt à balais (Cytisus scoparius) et, dans une moindre mesure, l'ajonc d'Europe (Ulex europaeus) et le daphné lauréole [Daphne laureola], sont parfois abondantes et risquent d'envahir les stations les plus abritées du lotier splendide si rien n'est fait pour freiner leur propagation.
La strate herbacée est dominée par un mélange d'espèces indigènes et introduites. Les principales espèces indigènes sont des herbacées non graminoïdes (lotier à petites fleurs d'Amérique [Lotus micranthus], lotier des prairies [L. unifoliolatus], lupin bicolore [Lupinus bicolor], plectritis à gros éperon [Plectritis macrocera], triphysaire naine [Triphysaria pusilla]), mais quelques espèces graminoïdes (élyme glauque [Elymus glaucus], danthonie de Californie [Danthonia californica], carex dépourvu [Carex inops]) peuvent être présents.
Chez les espèces introduites, les graminées (houlque laineuse [Holcus lanatus], pâturin des prés [Poa pratensis], flouve odorante [Anthoxanthum odoratum], dactyle pelotonné [Dactylis glomerata], brome mou [Bromus hordeaceus], vulpie faux-brome [Vulpia bromoides], canches [Aira spp.]) sont habituellement plus abondantes que les herbacées non graminoïdes (plantain lancéolé [Plantago lanceolata], porcelle enracinée [Hypochaeris radicata], porcelle glabre [H. glabra], liondents [Leontodon spp.], vesce cultivée [Vicia sativa] et petit trèfle jaune [Trifolium dubium]).
Les mousses et les lichens occupent généralement de faibles superficies, mais le Dicranum scoparium et le Cladonia portentosa sont occasionnellement abondants, en particulier dans les endroits où le lotier splendide pousse à l'abri, près de rochers ou sur des affleurements rocheux peu profonds.
Les informations fournies dans le rapport de situation du COSEPAC ont été actualisées par des relevés de la végétation réalisés subséquemment aux îles Trial et Bentinck et des observations effectuées dans d'autres stations canadiennes (Fairbarns, en prép. b.).
La germination se produit en mars, en avril ou en mai, selon les conditions météorologiques et les caractéristiques de la station.
Les sujets établis produisent un nouveau feuillage une fois la période de sécheresse estivale/automnale passée. La dormance des bourgeons, concentrés au niveau du collet sous la surface du sol, peut être levée dès septembre si des pluies viennent humidifier le sol en fin d'été. Les nouvelles tiges émergent du sol entre la fin de septembre et le début d'octobre.
Normalement, toutefois, le sol n'est pas assez humide pour provoquer la levée de la dormance avant le milieu de l'automne, et la croissance des tiges est alors ralentie par le temps frais. Au début, la croissance des jeunes tiges s'effectue dans le sol ou sous la couche superficielle de mousse et de litière, et les tiges commencent à émerger seulement à la fin de février ou en mars.
La floraison atteint son point culminant en mai et en juin, et la plupart des sujets portent des fruits mûrs en juillet. La dispersion des graines débute en juillet, au moment où les plantes commencent à se flétrir, et se poursuit jusqu'en août, bien après le dépérissement de la majeure partie du feuillage. Les individus établis dans des sols secs peuvent mourir, fleurir, produire des fruits ou dépérir plus rapidement, mais leurs fruits avortent souvent ou sont plus petits et contiennent moins d'endosperme.
La croissance végétative, la floraison et la fructification peuvent être légèrement prolongées si des précipitations estivales inhabituelles retardent la sécheresse estivale. La plupart des sujets sont cependant dormants de la mi-août à décembre.
La mortalité des semis est élevée, et le nombre d'individus qui survivent à la première saison de dormance (estivale) est faible. Les sujets survivants croissent lentement et ne fleurissent pas au cours de la première année. On ignore à quel âge ils fleurissent.