Programme de rétablissement de la tortue musquée (Sternotherus odoratus) au Canada - 2016 [Proposition]

Photo : © Joe Crowley
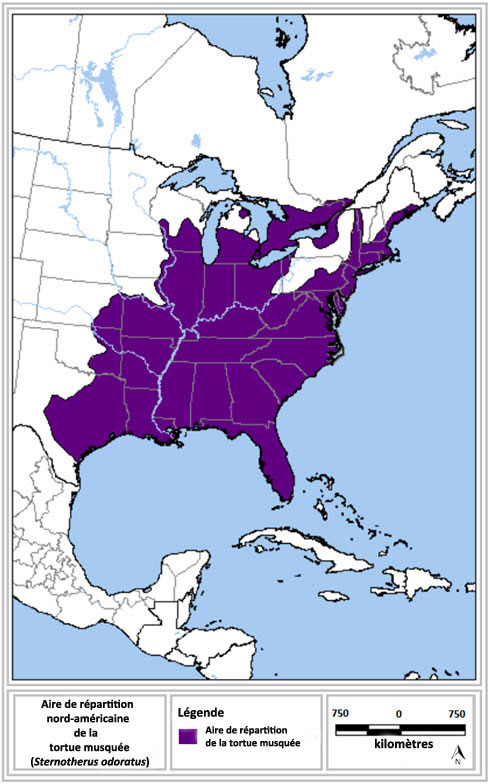
- Figure 1. Aire de répartition nord-américaine de la tortue musquée (adaptation de NatureServe, 2008). Cette carte montre l'aire de répartition générale de l'espèce et ne fournit aucune indication détaillée de la présence ou de l'absence d'observations à l'intérieur de cette aire. Pour plus de précision sur la répartition de l'espèce en Ontario et au Québec, veuillez consulter le texte.
- Figure 2. Schéma des critères de désignation de l'habitat essentiel de la tortue musquée. Une unité d'habitat essentiel est désignée là où le critère d'occupation de l'habitat est respecté. Dans une unité d'habitat essentiel, l'habitat essentiel est désigné comme étant les zones qui comprennent les caractéristiques biophysiques détaillées (décrites au tableau 3) qui sont requises pour telle ou telle activité spécifique du cycle vital. L'étendue maximale des caractéristiques biophysiques est déterminée par les connaissances écologiques et comportementales spécifiques à la tortue musquée (c. à d. une portion de cours d'eau ou de plan d'eau s'étendant jusqu'à un maximum de 1,5 km parallèlement à la rive dans les deux directions d'un lieu d'observation et l'habitat convenable adjacent jusqu'à une distance de 50 m du cours d'eau ou du plan d'eau, OU un milieu humide jusqu'à une distance radiale maximale de 1,5 km du lieu d'observation valide et l'habitat convenable adjacent jusqu'à une distance de 50 m du milieu humide, OU un site de nidification connu comprenant une zone s'étendant à une distance radiale de 50 m du point où l'observation valide du nid a été faite). L'unité d'habitat essentiel comprend également les corridors de dispersion dans les situations où deux observations valides sont faites dans un réseau hydrologique continu et qu'elles sont séparées par une distance maximale de 4,5 km (critère de connectivité de l'habitat).
- Figure 3. Carrés de quadrillage qui contiennent de l'habitat essentiel de la tortue musquée au Canada. De l'habitat essentiel de la tortue musquée est présent dans ces carrés (bordés de rouge) du quadrillage UTM de référence de 50 x 50 km, là où les critères d'occupation de l'habitat (section 7.1.1), de caractère convenable de l'habitat (section 7.1.2) et de connectivité de l'habitat (section 7.1.3) sont respectés.
- Tableau 1. Tableau d'évaluation des menaces
- Tableau 2. Tableau de planification du rétablissement
- Tableau 3. caractéristiques biophysiques détaillées de l'habitat convenable lié à chaque activité du cycle vital de la tortue musquée au Canada
- Tableau 4. De l'habitat essentiel de la tortue musquée au Canada est présent dans ces carrés du quadrillage UTM de référence de 50 x 50 km là où les critères d'occupation de l'habitat (section 7.1.1), de caractère convenable de l'habitat (section 7.1.2) et de connectivité de l'habitat (section 7.1.3) sont respectés.
- Tableau 5. Calendrier des études
- Tableau 6. Exemples d'activités susceptibles de détruire l'habitat essentiel de la tortue musquée.
Table des matières
- Information du document
- Référence recommandée
- Préface
- Remerciements
- Sommaire
- Résumé du caractère réalisable du rétablissement
- 1. Évaluation de l'espèce par le COSEPAC
- 2. Information sur la situation de l'espèce
- 3. Information sur l'espèce
- 4. Menaces
- 4.1. Évaluation des menaces
- 4.2. Description des menaces
- Conversion de terres pour l'agriculture et le développement, et altération des rives
- Mortalité due à la navigation
- Prises accessoires des pêches
- Ouvrages de régularisation des eaux
- Prédateurs favorisés par les activités humaines
- Capture illégale
- Contamination et charge en nutriments
- Espèces exotiques et envahissantes
- Réseaux routiers
- Éclosions de maladies
- Changements climatiques
- Menaces potentielles
- 5. Objectifs en matière de population et de répartition
- 6. Stratégies et approches générales pour l'atteinte des objectifs
- 7. Habitat essentiel
- 7.1. Désignation de l'habitat essentiel de l'espèce
- Tableau 3. caractéristiques biophysiques détaillées de l'habitat convenable lié à chaque activité du cycle vital de la tortue musquée au Canada
- 7.2. Calendrier des études requises pour désigner l'habitat essentiel
- 7.3. Activités susceptibles d'entraîner la destruction de l'habitat essentiel
- 8. Mesure des progrès
- 9. Énoncé sur les plans d'action
- 10. Références

Environnement Canada. 2016. Programme de rétablissement de la tortue musquée (Sternotherus odoratus) au Canada [Proposition]. Série de Programmes de rétablissement de la Loi sur les espèces en péril. Environnement Canada, Ottawa. viii + 65 p.
Pour télécharger le présent programme de rétablissement ou pour obtenir un complément d'information sur les espèces en péril, incluant les rapports de situation du Comité sur la situation des espèces en péril au Canada (COSEPAC), les descriptions de la résidence, les plans d'action et d'autres documents connexes sur le rétablissement, veuillez consulter le Registre public des espèces en péril.
Illustration de la couverture : Tortue musquée - © Joe Crowley
Also available in English under the title
"Recovery Strategy for the Eastern Musk Turtle (Sternotherus odoratus) in Canada [Proposed]"
Le contenu du présent document (à l'exception des illustrations) peut être utilisé sans permission, mais en prenant soin d'indiquer la source.
En vertu de l'Accord pour la protection des espèces en péril (1996), les gouvernements fédéral, provinciaux et territoriaux signataires ont convenu d'établir une législation et des programmes complémentaires qui assureront la protection efficace des espèces en péril partout au Canada. En vertu de la Loi sur les espèces en péril (L.C. 2002, ch. 29) (LEP), les ministres fédéraux compétents sont responsables de l'élaboration des programmes de rétablissement pour les espèces inscrites comme étant disparues du pays, en voie de disparition ou menacées et sont tenus de rendre compte des progrès réalisés dans les cinq ans suivant la publication du document final dans le Registre public de la LEP.
La ministre de l'Environnement et ministre responsable de l'Agence Parcs Canada est la ministre compétente en vertu de la LEP de la tortue musquée, et a élaboré le présent programme, conformément à l'article 37 de la LEP. Dans la mesure du possible, le programme de rétablissement a été préparé en collaboration avec la province de l'Ontario (ministère des Richesses naturelles et des Forêts Note1) et la province de Québec (ministère des Forêts, de la Faune, et des Parcs).
La réussite du rétablissement de l'espèce dépendra de l'engagement et de la collaboration d'un grand nombre de parties concernées qui participeront à la mise en œuvre des directives formulées dans le présent programme. Cette réussite ne pourra reposer seulement sur Environnement Canada, l'Agence Parcs Canada ou toute autre compétence. Tous les Canadiens et Canadiennes sont invités à appuyer le programme et à contribuer à sa mise en œuvre pour le bien de la tortue musquée et de l'ensemble de la société canadienne.
Le présent programme de rétablissement sera suivi d'un ou de plusieurs plans d'action qui présenteront de l'information sur les mesures de rétablissement qui doivent être prises par Environnement Canada, l'Agence Parcs Canada et d'autres instances et/ou organisations participant à la conservation de l'espèce. La mise en œuvre du présent programme est assujettie aux crédits, aux priorités et aux contraintes budgétaires des instances et organisations participantes.
Le programme de rétablissement établit l’orientation stratégique visant à arrêter ou à renverser le déclin de l’espèce, incluant la désignation de l’habitat essentiel dans la mesure du possible. Il fournit à la population canadienne de l’information pour aider à la prise de mesures visant la conservation de l’espèce. Lorsqu’un programme de rétablissement désigne de l’habitat essentiel, il peut y avoir des incidences réglementaires futures, selon l’endroit où se trouve l’habitat essentiel désigné. La LEP exige que l’habitat essentiel désigné se trouvant à l’intérieur d’un parc national dénommé et décrit à l’annexe 1 de la Loi sur les parcs nationaux du Canada, le parc urbain national de la Rouge créé par la Loi sur le parc urbain national de la Rouge, d’une zone de protection marine sous le régime de la Loi sur les océans, d’un refuge d’oiseaux migrateurs sous le régime de la Loi de 1994 sur la convention concernant les oiseaux migrateurs ou d’une réserve nationale de la faune sous le régime de la Loi sur les espèces sauvages du Canada, soit décrit dans la Gazette du Canada, après quoi les interdictions relatives à la destruction de cet habitat seront appliquées. Pour l’habitat essentiel se trouvant sur d’autres terres domaniales, le ministre compétent doit, soit faire une déclaration sur la protection juridique existante, soit prendre un arrêté de manière à ce que les interdictions relatives à la destruction de l’habitat essentiel soient appliquées. En ce qui concerne toute partie de l’habitat essentiel se trouvant sur des terres non domaniales, si le ministre compétent estime qu’une partie de cet habitat essentiel n’est pas protégée par les dispositions de la LEP, par les mesures prises aux termes de cette dernière ou par toute autre loi fédérale, ou par les lois provinciales ou territoriales, il doit, comme le prévoit la LEP, recommander au gouverneur en conseil de prendre un décret visant l’interdiction de détruire l’habitat essentiel. La décision de protéger l’habitat essentiel se trouvant sur des terres non domaniales et n’étant pas autrement protégé demeure à la discrétion du gouverneur en conseil.
Le présent document a été élaboré par Rachel deCatanzaro, Krista Holmes, Angela McConnell, Marie-Claude Archambault, Lee Voisin (Environnement Canada, Service canadien de la faune – Région de l'Ontario), Barbara Slezak, Carollynne Smith, Bruna Peloso, Kari Van Allen et Louis Gagnon (anciennement d'Environnement Canada, Service canadien de la faune – Région de l'Ontario). Les personnes suivantes ont apporté de précieux commentaires, révisions et suggestions : Madeline Austen, Elizabeth Rezek, Lesley Dunn (Environnement Canada, Service canadien de la faune – Région de l'Ontario), Paul Johanson (Environnement Canada, Service canadien de la faune – Région de la capitale nationale), Sylvain Giguère, Gabrielle Fortin (Environnement Canada, Service canadien de la faune – Région du Québec), Amelia Argue, Joe Crowley, Gillian Ferguson-Martin, Jay Fitzsimmons, Amanda Fracz, Aileen Wheeldon, Dana Kinsman, Jim Saunders, Rhonda Donley (ministère des Richesses naturelles et des Forêts de l'Ontario), Joanne Tuckwell, Gary Allen, Josh Van Wieren, Tammy Dobbie, Andrew Promaine, Tracy Allison (Agence Parcs Canada) et le personnel du ministère des Forêts, de la Faune et des Parcs du Québec.
De nombreuses autres personnes ont contribué à une version antérieure d'un programme de rétablissement visant plusieurs espèces de tortues, notamment Patrick Galois (Amphibia-Nature), David Seburn (Seburn Ecological Service) et Scott Gillingwater (Office de protection de la nature de la rivière Thames supérieure). Nous remercions également les employés du ministère des Richesses naturelles et des Forêts de l'Ontario, du ministère des Forêts, de la Faune et des Parcs du Québec, du Service canadien de la faune, ainsi que de diverses universités et autres organisations, qui ont apporté leurs contributions. Il convient aussi de signaler que les documents de rétablissement élaborés par l'Équipe de rétablissement des tortues du Québec et l'Équipe de rétablissement multi-espèces des tortues en péril de l'Ontario ont constitué le fondement des versions antérieures du présent document.
Des remerciements sont également adressés à toutes les autres parties qui ont fourni des conseils et des commentaires ayant permis d'enrichir le programme de rétablissement, dont divers organismes autochtones, particuliers et intervenants, qui ont fourni des renseignements et/ou participé aux réunions de consultation.
La tortue musquée (Sternotherus odoratus) est inscrite à titre d'espèce menacée à l'annexe 1 de la Loi sur les espèces en péril (LEP). Cette espèce de petite taille est essentiellement aquatique et pourvue d'une dossière Note2 très bombée, brun-gris à noire. On la rencontre généralement dans des milieux humides à eaux peu profondes stagnantes ou lentes, qui sont reliés à de grands plans d'eau permanents, ou encore à des baies peu profondes de lacs et de cours d'eau.
L'aire de répartition de la tortue musquée s'étend depuis le sud de l'Ontario et du Québec jusqu'en Floride, et depuis le centre du Texas jusque dans le Maine. En Ontario, la tortue musquée est principalement observée sur les rives des lacs Huron, Érié et Ontario, ou à proximité de celles-ci, ainsi que le long du bord méridional du Bouclier canadien. Au Québec, l'aire de répartition de l'espèce semble limitée au fleuve Saint-Laurent, de même qu'à un autre système fluvial important. On estime qu'environ 5 % de l'aire de répartition mondiale de la tortue musquée se trouve au Canada.
Au sein de l'aire de répartition canadienne de la tortue musquée, la perte et la fragmentation d'habitat sont les plus marquées dans le sud-est de l'Ontario et la région du Golden Horseshoe. Dans ces régions, des baisses d'effectif se sont produites, et la tortue musquée semble avoir disparu de plusieurs localités où elle était observée par le passé, d'après les résultats négatifs des relevés et la perte d'habitat. Ailleurs dans l'aire de répartition de l'espèce (en particulier le long du bord méridional du Bouclier canadien), l'habitat est abondant et étendu, et les populations semblent être stables. Les données sur les tendances des populations sont toutefois quasi inexistantes. L'effectif global de la tortue musquée au Canada n'est pas connu. Selon une estimation grossière, la population totale au Canada compterait plus de 10 000 individus.
Les principales menaces pesant sur l'espèce sont la conversion de terres, les ouvrages de régularisation des eaux, la mortalité due à la navigation, les prises accessoires des pêches, les prédateurs favorisés par les activités humaines Note3, la capture illégale, la contamination et la charge en nutriments, et les espèces exotiques et envahissantes. La tortue musquée est grandement vulnérable à toute augmentation du taux de mortalité des adultes ou des juvéniles plus âgés puisque l'espèce a développé une stratégie de reproduction à long terme (maturité sexuelle tardive, faible taux de reproduction, etc.).
Le caractère réalisable du rétablissement de la tortue musquée comporte des inconnues. Conformément au principe de précaution, un programme de rétablissement a été élaboré en vertu des paragraphes 41(1) et 41(3) de la LEP, tel qu'il convient de faire lorsque le rétablissement est déterminé comme étant réalisable.
L'objectif en matière de population et de répartition est de maintenir et, si possible, d'accroître l'abondance et la zone d'occupation de la tortue musquée afin d'assurer la persistance de populations locales autosuffisantes dans les régions où l'espèce est présente au Canada. Les stratégies générales à employer contre les facteurs menaçant la survie et le rétablissement de l'espèce sont exposées dans la section 6.2 (Orientation stratégique pour le rétablissement).
L'habitat essentiel de la tortue musquée est désigné dans le présent programme de rétablissement selon trois critères :
- occupation de l'habitat;
- caractère convenable de l'habitat
- connectivité de l'habitat.
L'application des critères de désignation de l'habitat essentiel aux données disponibles a mené à la détermination de 180 unités qui renferment de l'habitat essentiel de la tortue musquée au Canada, totalisant environ 75 000 ha. Bien que d'autres localités abritent peut-être encore la tortue musquée, elles n'ont pas fait l'objet de relevés récents ou ont fait l'objet de relevés incomplets. Pour cette raison, l'habitat essentiel de la tortue musquée n'a été désigné que partiellement dans le présent programme de rétablissement. Le calendrier des études (section 7.2) décrit les activités requises pour achever la désignation de l'habitat essentiel nécessaire à l'atteinte des objectifs en matière de population et de répartition. À mesure que des données supplémentaires deviendront accessibles, il sera possible de mieux préciser l'habitat essentiel ou d'ajouter des unités satisfaisant aux critères de désignation de l'habitat essentiel.
Un ou plusieurs plans d'action visant la tortue musquée seront publiés dans le Registre public des espèces en péril d'ici décembre 2023.
D'après les quatre critères suivants qu'Environnement Canada utilise pour définir le caractère réalisable du rétablissement, le rétablissement de la tortue musquée comporte des inconnues. Conformément au principe de précaution, un programme de rétablissement a été élaboré en vertu du paragraphe 41(1) de la LEP, tel qu'il convient de faire lorsque le rétablissement est déterminé comme étant réalisable. Le présent programme de rétablissement traite des inconnues entourant le caractère réalisable du rétablissement.
- Des individus de l'espèce sauvage capables de se reproduire sont disponibles maintenant ou le seront dans un avenir prévisible pour maintenir la population ou augmenter son abondance.
Oui. Il existe en Ontario et au Québec des individus capables de se reproduire pour maintenir la population ou en augmenter l'effectif. Les populations le long du bord méridional du Bouclier canadien semblent stables (Crowley, comm. pers., 2012). La population canadienne totale de tortues musquées est estimée à plus de 10 000 individus (COSEWIC, 2012). Une immigration de source externe Note4 est aussi une possibilité à partir d'États américains voisins. Il est possible que des populations canadiennes de tortues musquées d'un système fluvial important soient recolonisées par des individus de populations de l'État de New York, où l'espèce est désignée « non en péril » (NatureServe, 2013; COSEWIC, 2012).
- De l'habitat convenable suffisant est disponible pour soutenir l'espèce, ou pourrait être rendu disponible par des activités de gestion ou de remise en état de l'habitat.
Oui. Bien que de nombreux milieux utilisés par la tortue musquée aient été détruits ou dégradés en Ontario (particulièrement dans le sud-ouest de la province et dans le Golden Horseshoe) par le développement industriel, urbain et agricole, l'aire de répartition canadienne de l'espèce renferme encore de l'habitat convenable en quantité suffisante – ou pourrait en acquérir grâce à des mesures d'aménagement ou de remise en état de l'habitat – pour soutenir l'espèce. Certaines techniques d'aménagement et de remise en état pourraient permettre d'accroître la quantité d'habitat convenable (milieux humides, habitat de nidification, etc.) pour l'espèce, ainsi que la connectivité entre les populations locales.
- Les principales menaces pesant sur l'espèce ou son habitat (y compris les menaces à l'extérieur du Canada) peuvent être évitées ou atténuées.
Inconnu. Parmi les principales menaces pesant sur l'espèce figurent la conversion de terres pour l'agriculture et le développement, les ouvrages de régularisation des eaux, la mortalité due à la navigation, les prises accessoires des pêches, les prédateurs favorisés par les activités humaines et la capture illégale. Bien que les effets de la conversion de terres et des ouvrages de régularisation des eaux dans certaines régions soient probablement irréversibles ou difficiles à renverser, il pourrait être possible de remettre en état certains anciens milieux humides, et d'atténuer ou d'éviter la destruction d'habitat par l'intermédiaire de l'éducation du public et de la conservation/protection de l'habitat actuel. L'éducation du public et l'application de la loi pourraient aussi aider à atténuer l'impact des perturbations humaines et de la capture illégale d'individus. Plusieurs techniques permettant de réduire la menace posée par les prises accessoires des pêches récréative et commerciale pourraient être mises en œuvre grâce à des pratiques exemplaires de gestion (PEG), par exemple l'utilisation de dispositifs d'exclusion des tortues (Référence retirée Note5), et à une réglementation efficace, par exemple l'application de règlements saisonniers. Pour réduire le taux de mortalité due à la navigation, on pourrait envisager de mettre en œuvre une réglementation visant l'utilisation d'embarcations motorisées dans les habitats à fortes densités de tortues et de sensibiliser les plaisanciers aux impacts des bateaux sur les organismes aquatiques. Plusieurs techniques permettent de lutter contre les espèces envahissantes telles que le roseau commun (Phragmites australis) et de réduire les impacts de la prédation des nids. On ignore si les menaces peuvent être atténuées autant qu'il le faudrait pour atteindre l'objectif en matière de population et de répartition de la tortue musquée au Canada.
- Des techniques de rétablissement existent pour atteindre les objectifs en matière de population et de répartition ou leur élaboration peut être prévue dans un délai raisonnable.
Inconnu. Des techniques de rétablissement telles que la protection de l'habitat par voie d'acquisition foncière, de réglementation, de zonage et d'aménagement des paysages ainsi que des mesures d'intendance ont été employées avec succès dans le cas de certaines populations locales (Seburn et Seburn, 2000). Des PEG ont été établies et mises en œuvre, et il est probable que d'autres le soient dans un délai raisonnable de façon à favoriser la protection des populations vulnérables contre la perte et la dégradation d'habitat ainsi que la mortalité accidentelle (voir le critère 3 ci-dessus). Toutefois, on ignore l'efficacité de ces pratiques pour prévenir les déclins de populations. Des outils de sensibilisation et d'éducation du public ont été élaborés et continueront de faire partie intégrante des mesures de rétablissement de l'espèce. Des techniques telles que l'installation de cages visant à protéger les nids de la prédation et la mise en place de dispositifs de réduction des prises accessoires par les pêches ont déjà été efficacement mises en œuvre dans certaines localités, et leur application pourrait être étendue pour atténuer les menaces qui pèsent sur l'espèce. Cependant, on ne sait pas si ces techniques permettront d'atteindre l'objectif en matière de population et de répartition dans un délai raisonnable.
Date de l'évaluation : Novembre 2012
Nom commun (population) : Tortue musquée
Nom scientifique : Sternotherus odoratus
Statut selon le COSEPAC : Espèce préoccupante
Justification de la désignation : Cette espèce occupe les eaux peu profondes des lacs, rivières et étangs. Dans le sud-ouest de l'Ontario, l'espèce a connu un important déclin et est maintenant restreinte à quelques minuscules populations dispersées. Dans l'ensemble de son aire de répartition canadienne, cette espèce est vulnérable à une mortalité accrue des adultes et des juvéniles causée par la navigation de plaisance, l'aménagement et la perte d'habitat de littoral, et les prises accessoires. L'espèce a une maturité tardive et un taux de reproduction faible comportant de petites couvées. Depuis la dernière évaluation en 2002, un effort de relevé accru a permis de trouver plus de populations dans l'est de l'Ontario et dans les zones adjacentes au Québec. L'aire de répartition de l'espèce demeure inchangée, mais les pertes dans la moitié sud de son aire de répartition mènent presque à un statut « menacée ».
Présence au Canada : Ontario, Québec.
Historique du statut selon le COSEPAC : Espèce désignée « menacée » en mai 2002. Réexamen du statut : l'espèce a été désignée « préoccupante » en novembre 2012.
Au Canada, la tortue musquée est inscrite à titre d'espèce menacée Note7 à l'annexe 1 de la Loi sur les espèces en péril (LEP). Selon l'évaluation la plus récente de l'espèce par le COSEPAC (COSEWIC, 2012), celle-ci est préoccupante; toutefois, le statut légal de l'espèce en vertu de la LEP n'avait pas encore été modifié au moment de la rédaction du présent programme. En Ontario, l'espèce avait d'abord été désignée menacée Note8 aux termes de la Loi de 2007 sur les espèces en voie de disparition (L.O. 2007, ch. 6) (LEVD) en 2008, mais elle a ensuite été classée dans la catégorie de risque inférieure « espèce préoccupante » en juin 2014. Elle est également désignée « reptile spécialement protégé » aux termes de la Loi de 1997 sur la protection du poisson et de la faune (L.O. 1997, ch. 41). Au Québec, la tortue musquée est une espèce menacée Note9 aux termes de la Loi sur les espèces menacées ou vulnérables du Québec (L.R.Q., ch. E-12.01) (LEMV).
La cote mondiale attribuée à la tortue musquée est « non en péril » (G5) (NatureServe, 2013). Elle est vulnérable à l'échelle nationale (N3) au Canada et non en péril à l'échelle nationale (N5) aux États-Unis (NatureServe, 2013). À l'échelle provinciale, elle a été cotée gravement en péril (S1) au Québec et vulnérable (S3) en Ontario (NatureServe, 2013) (voir l'annexe A). L'Union internationale pour la conservation de la nature (UICN) a attribué la catégorie « préoccupation mineure » à l'espèce (van Dijk, 2013). Environ 5 % de l'aire de répartition mondiale de la tortue musquée se trouve au Canada (NatureServe, 2013).
La tortue musquée est une petite tortue (la longueur maximale du plastron Note10 est de 15 cm; Ernst et Lovich, 2009) essentiellement aquatique. La dossière est très bombée, brun-gris à noire, souvent recouverte d'une couche d'algues (Behler et King, 2002). La peau va du gris au noir. De chaque côté de la tête, deux rayures pâles s'étendent depuis l'œil jusqu'au cou; ces rayures peuvent être estompées ou discontinues (mouchetées), voire absentes chez certains individus (Ernst et Lovich, 2009). Il y a de petits barbillons charnus sur la gorge et le menton, et quatre glandes à la bordure du plastron qui produisent et sécrètent un liquide musqué malodorant, caractéristique de l'espèce (Behler et King, 2002). Le plastron est petit, beige et doté d'une seule charnière discrète, qui permet à la tortue de soulever la partie antérieure du plastron et de fermer partiellement sa carapace (Ernst et Lovich, 2009). La tortue musquée présente un dimorphisme sexuel Note11. Comparativement aux femelles, les mâles ont une queue plus longue et plus épaisse, qui se termine par une sorte d'ongle émoussé. Par ailleurs, il présente davantage de peau exposée entre les écailles du plastron, et deux plaques d'écailles bien visibles sont présentes sur la face interne de chacune de leurs pattes arrière; aucune de ces caractéristiques n'est présente chez les femelles (Carr, 1952; Ernst et Lovic, 2009).
La tortue musquée vit de 20 à 30 ans. L'âge à maturité varie selon la localité. Dans le sud des États-Unis, la maturité est atteinte à 2-7 ans, alors qu'au Michigan, les populations deviennent matures à 9-11 ans (Edmonds, 1998). Dans une population le long de la baie Georgienne, la dossière des mâles matures mesurait en moyenne 63,6 mm (entre 5 et 6 ans), et celle des femelles matures, 80,7 mm (entre 8 et 9 ans) (Edmonds, 1998). Les individus du nord atteignent la maturité sexuelle à un âge plus avancé, et une taille plus grande que les individus du sud (Edmonds, 1998).
L'aire de répartition canadienne de la tortue musquée (figure 1) s'étend depuis le sud de l'Ontario vers le nord jusqu'à North Bay et Sudbury, et vers l'est jusque dans l'extrême sud du Québec. Aux États-Unis, l'espèce se rencontre jusqu'en Floride vers le sud, ainsi que depuis le centre du Texas jusque dans le Maine (Ernst et Lovich, 2009; NatureServe, 2013).
En Ontario, la tortue musquée est principalement observée sur les rives des lacs Huron, Érié et Ontario, ou à proximité de celles-ci, ainsi que le long du bord méridional du Bouclier canadien (Ontario Reptile and Amphibian Atlas, 2013). Au Québec, l'aire de répartition de l'espèce semble limitée au fleuve Saint-Laurent (où deux individus ont été trouvés en 2014) ainsi que dans un autre système fluvial important (Chabot et St-Hilaire, 1991; Desrosiers et Giguère, 2008; Saumure, 2009; Atlas des amphibiens et des reptiles du Québec, 2013; S. Giguère, données inédites).
Au Canada, la zone d'occurrence de la tortue musquée est de 132 205 km2, et l'indice de zone d'occupation Note12, de 1 408 km2 (COSEWIC, 2012). Depuis le rapport antérieur de 2002, le COSEPAC (COSEWIC, 2012) a rapporté 36 « nouvelles » populations locales de tortues musquées (pour un total de 113 populations Note13 dans 32 divisions de recensement); cette hausse ne découlait toutefois pas d'une augmentation de l'abondance ou de l'aire de répartition, mais simplement de meilleures activités de relevé (COSEWIC, 2012). En dépit de ces activités, l'espèce n'est pas bien recensée dans l'ensemble de son aire de répartition. En date de 2012, les centres de données sur la conservation provinciaux détenaient un total de 521 mentions de la tortue musquée (480 en Ontario et 41 au Québec), qui représentaient 129 occurrences d'élément Note14 (126 en Ontario et 3 au Québec) (CDPNQ, 2012; NHIC, 2012). De nombreuses autres mentions d'observation non officiellement évaluées (c.-à-d. au moyen des méthodes de NatureServe) en Ontario (plus de 4 000 mentions) et au Québec (578 mentions) mèneront probablement à l'établissement de nouvelles occurrences d'élément et/ou à des modifications aux occurrences d'élément existantes. Bien que l'on ne connaisse pas l'effectif total de la population de tortues musquées au Canada, on dispose d'estimations pour certaines populations locales, indiquant des effectifs variant de 84 (± 77) (Référence retirée) à 1 440 (± 633) individus (Laverty, 2010). Selon une estimation grossière, la population canadienne totaliserait plus de 10 000 individus (COSEWIC, 2012).
Au sein de l'aire de répartition canadienne de la tortue musquée, la perte et la fragmentation d'habitat sont les plus marquées dans le sud-ouest de l'Ontario et la région du Golden Horseshoe (COSEWIC, 2012). Dans ces régions, des baisses d'effectif se sont produites, et la tortue musquée semble avoir disparu de plusieurs localités où elle était observée par le passé, d'après les résultats négatifs des relevés et la perte d'habitat (Edmonds, 2002; COSEWIC, 2012; Ontario Reptile and Amphibian Atlas, 2013). Dans le reste de l'aire de répartition (notamment le long du bord méridional du Bouclier canadien et au Québec), l'habitat est abondant et étendu, les populations semblent stables (Crowley, comm. pers., 2012; Giguère, comm. pers., 2015) et il est possible d'observer des effectifs élevés (DeCatanzaro et Chow-Fraser, 2010); toutefois, il n'existe pratiquement aucune information sur les tendances des populations. Dans certaines localités, des baisses d'effectif peuvent être inférées d'après les menaces connues (p. ex. prises accessoires des pêches) (voir par exemple Laverty, 2010; Larocque et al., 2012b). La perte d'habitat en cours et prévue donne à penser que le nombre d'individus matures continuera de diminuer (COSEWIC, 2012).
Description longue de la figure 1
La figure 1 représente l'aire de répartition de la tortue musquée en Amérique du Nord. Dans le nord, cette aire comprend le sud de l'Ontario jusqu'à North Bay et Sudbury, l'extrême sud du Québec, le centre du Wisconsin, le centre du Michigan et l'ouest de l'État de New York. Elle atteint aussi l'est du Maine dans l'est. L'aire de répartition de la tortue musquée s'étend vers le sud pour atteindre le centre du Texas, à l'ouest, et la Floride, à l'est.
La tortue musquée est une espèce essentiellement aquatique qui se déplace peu sur terre en raison de sa lenteur et de la rapidité avec laquelle elle se déshydrate (Ernst, 1968). En milieux aquatiques, ses déplacements diurnes sont généralement limités (de 25 à 131 m/jour) (Edmonds, 1998; Référence retirée), bien que des déplacements diurnes de 1 km (distance maximale) aient été observés au Québec (Belleau, 2008).
La tortue musquée vit habituellement dans des milieux humides aux eaux peu profondes stagnantes ou lentes qui sont reliés à de grands plans d'eau permanents ou à des baies peu profondes de lacs et de cours d'eau (Edmonds, 2002; Référence retirée; Belleau, 2008). Au Canada, la tortue musquée a été observée dans différents types de plans d'eau, notamment des lacs, des étangs, des marais, des rivières et des ruisseaux (Edmonds, 2002). Néanmoins, elle est considérée comme une espèce spécialiste en matière d'habitat (Belleau, 2008) puisqu'elle semble nécessiter des eaux à végétation aquatique émergente, flottante et submergée abondante qui forme un couvert à la surface de l'eau pouvant offrir sites d'alimentation, refuges pour les adultes et les juvéniles, et sites de thermorégulation Note15 (Edmonds, 2002; Belleau, 2008; Rowe et al., 2009; Picard et al., 2011). Elle est souvent présente dans des zones à substrat meuble comme du sable ou de la boue organique, où elle peut facilement s'enfouir (Référence retirée; Belleau, 2008), et dans des zones à fond de gravier (Harding, 1997).
La tortue musquée vit principalement dans la zone littorale Note16, jusqu'à une profondeur d'eau de 2 m (Edmonds, 2002; Belleau, 2008; Rowe et al., 2009). Dans un petit lac en Ontario, elle a été observée à une profondeur de 3 m; l'espèce trouve cependant sa nourriture et assure sa thermorégulation en eaux peu profondes (Gillingwater, comm. pers., 2012). La profondeur moyenne à laquelle des individus ont été capturés dans une zone d'étude d'un grand système fluvial était de 0,43 m (Belleau, 2008). Les zones occupées renferment habituellement des abris sous l'eau, comme des roches et des morceaux de bois submergés ainsi que des huttes de rats musqués ou de castors (Belleau, 2008; Ernst et Lovich, 2009). Bien que l'espèce affiche une préférence pour les eaux peu profondes, il est possible de la rencontrer dans des eaux de jusqu'à 9 m (Ernst et Lovich, 2009).
Hivernage
Les sites d'hivernage sont généralement situés en eaux peu profondes (jusqu'à 3 m de profondeur) (Référence retirée), là où des fonds organiques permettent aux tortues de s'enfouir dans la boue jusqu'à une profondeur de 30 cm (Edmonds, 2002; Ernst et Lovich, 2009). La tortue musquée peut aussi utiliser pour hiverner des terriers, des huttes de castors ou de rats musqués ainsi que des souches ou des roches à proximité de l'eau (Ernst et Lovich, 2009). Au Québec, l'espèce a été observée en train d'hiverner dans des zones couvertes de végétation basse à substrat sablonneux, graveleux ou rocailleux (Belleau, 2008; Belleau, données inédites). La tortue musquée est intolérante aux périodes d'anoxie Note17 prolongées, et choisit des sites d'hivernage qui demeurent bien oxygénés durant l'hiver (p. ex. des rives exposées au vent et où l'écoulement de l'eau est modéré) (Belleau, données inédites). L'espèce peut hiverner en grands groupes formés de congénères (p. ex. 450 individus; Thomas et Trautman, 1937, in COSEWIC, 2012). Les tortues musquées peuvent manifester une fidélité à leurs sites Note18 d'hivernage (Ernst et Lovich, 2009; Belleau, données inédites).
Les tortues musquées commencent à s'enfouir lorsque la température des eaux environnantes est inférieure à 10 °C (COSEWIC, 2012). La période d'hivernage varie entre populations en fonction de leur localisation géographique (Ernst et Lovich, 2009). La tortue musquée hiverne de novembre à avril au Québec (Belleau, 2008) et de novembre à mars en Pennsylvanie (Ernst, 1986), alors qu'elle peut rester active à longueur d'année en Floride (Iverson et Meshaka, 2006).
Accouplement
L'accouplement est possible en tout temps pendant la période d'activité, mais il a principalement lieu au printemps (d'avril à mai) ou à l'automne (de septembre à octobre), dans des eaux où les individus sont rassemblés dans les sites d'hivernage (Risley, 1933; McPherson et Marion, 1981; Ernst, 1986; Mendonça, 1987; Ernst et Lovich, 2009). Au Québec, la copulation a été observée à l'automne (septembre) seulement (Saumure, 2009).
Nidification
Au Canada, la tortue musquée pond ses œufs du début de juin à la fin de juillet (Lindsay, 1965; Edmonds, 1998). Les nids sont aménagés dans des zones ensoleillées ou partiellement ombragées (Edmonds, 2002). Les œufs sont pondus dans des substrats divers, mais souvent dans de la végétation en décomposition (p. ex. dans de l'humus de feuilles, ou sous des souches ou des morceaux de bois en décomposition) dans des huttes de castors ou de rats musqués, entre des touffes d'herbes sur les plages, et dans des crevasses rocheuses peu profondes remplies de gravier ou de terre (Edmonds, 2002; Gillingwater, comm. pers., 2012). Il arrive souvent que les femelles partagent des sites de ponte et qu'elles retournent dans une même zone pour nidifier (Edmonds, 2002; Ernst et Lovich, 2009). Il existe peu de données sur les distances parcourues jusqu'aux sites de nidification au Canada. Toutefois, la tortue musquée est réputée nidifier près des rives dans l'ensemble de son aire de répartition. Aux États-Unis, des nids ont été trouvés jusqu'à 50 m (moyenne de 5,5 m) de l'eau (Steen et al., 2012).
Contrairement à d'autres espèces de tortues, la tortue musquée ne creuse pas toujours un trou dans le substrat pour pondre. La plupart des nids sont peu profonds et sont aménagés par simple raclage des débris tels que la matière végétale en décomposition, l'humus de feuilles et le bois pourri; elles peuvent également aménager leurs nids sous les feuilles et sur la litière de feuilles (Ernst et Lovich, 2009). En outre, alors que d'autres espèces de tortues pondent au moins 4 ou 5 œufs par nid, la tortue musquée n'en dépose généralement que 2 (Tucker et al., 2008). Toutefois, les femelles peuvent produire de une à six pontes par année, selon la localité (Iverson et Meshaka, 2006). Les femelles de la portion sud de l'aire de répartition nord-américaine de l'espèce produisent souvent de deux à quatre pontes par année, tandis que celles de la portion nord pondent au plus une seule fois (il peut arriver qu'elle ne nidifie pas certaines années) (Edmonds, 1998). Cela peut être dû à la différence de climat entre ces régions (les populations méridionales recevant plus de soleil ou d'unités thermiques que les populations septentrionales). La durée de l'incubation varie de 65 à 86 jours, et les nouveau-nés émergent en août et septembre (Ernst et Lovich, 2009). Les connaissances sur les besoins précis des nouveau-nés une fois les œufs éclos comportent des lacunes, lesquelles devront être comblées par des travaux de recherche (voir le tableau 2 – Tableau de planification du rétablissement).
Thermorégulation
Les tortues régulent leur température corporelle en utilisant leur environnement. Elles sont capables de modifier ou de maintenir leur température en variant leur exposition au soleil, à l'ombre et à l'eau (Bulté et Blouin-Demers, 2010a). Les sites aquatiques de thermorégulation peuvent comprendre des objets flottants ou affleurants (p. ex. des roches, des morceaux de bois, de la végétation flottante ou des débris flottants), et l'espèce peut parfois effectuer sa thermorégulation en flottant à la surface de l'eau (Ernst et Lovich, 2009). La tortue musquée se chauffe souvent au soleil près de la surface de l'eau, en se laissant généralement flotter parmi ou sous la végétation aquatique telle que les feuilles de nénuphars. Dans le cadre d'une étude menée à un lac ontarien, (Référence retirée) a rapporté que la tortue musquée était le plus souvent observée enfouie dans la boue, à moins de 1 m sous l'eau (44 % des observations) et que seul un individu a été aperçu s'exposant au soleil hors de l'eau. Edmonds (2002) a également indiqué qu'il est peu courant de trouver une tortue musquée se chauffant hors de l'eau.
Alimentation
La tortue musquée est principalement omnivore Note19. Elle se nourrit généralement en marchant sur le fond du plan d'eau et en utilisant sa tête pour chercher sa nourriture dans la vase, le sable et la végétation en décomposition (Edmonds, 2002; Ernst et Lovich, 2009). Les petites tortues (longueur de la dossière < 5 cm) se nourrissent habituellement d'insectes aquatiques, d'algues et de charogne. Les individus de grande taille ont une alimentation très variée, notamment : sangsues, bivalves, escargots, insectes aquatiques, araignées, écrevisses, poissons (œufs, larves et adultes), algues filamenteuses, parties de plantes vasculaires et charogne (Schneider, 1998; Ford et Moll, 2004; Iverson et Meshaka, 2006; Ernst et Lovich, 2009). La tortue musquée s'alimente seulement lorsque la température de l'eau se situe entre 13 et 35 °C (Mahmoud, 1969). Bien que l'espèce cherche le plus souvent sa nourriture dans l'eau, certains individus ont été vus alors qu'ils sortaient de l'eau au crépuscule pour se nourrir de limaces terrestres (Ernst et Lovich, 2009).
Déplacements (déplacements locaux et dispersion) Note20
La tortue musquée se déplace régulièrement entre différents types de milieux aquatiques et terrestres pour accéder aux ressources dont elle a besoin (p. ex. sites de nidification ou d'hivernage, aliments) (Belleau, 2008). Il est donc important que les divers habitats qu'elles utilisent soient interconnectés (grâce à des corridors aquatiques), ou séparés par des distances raisonnables afin que les individus puissent se déplacer de l'un à l'autre pour accomplir les divers stades de leur cycle vital. Pour avoir accès aux multiples zones principales d'un domaine vital, la tortue musquée se déplace dans l'eau (rarement sur terre), soit dans une zone riveraine peu profonde pourvue de végétation (profondeur < 2 m) (Rowe, 2003; Belleau, 2008; Rowe et al., 2009), soit dans des eaux relativement profondes peu végétalisées ou dépourvues de végétation (Carr, 1952) (jusqu'à 9 m de profondeur) (Edmonds, 1998).
La superficie du domaine vital de la tortue musquée varie considérablement dans l'ensemble de la population canadienne; en moyenne, elle est de 6,2 à 115,4 ha (superficie minimale de 0,08 ha et superficie maximale de 430 ha) (Edmonds, 1998; Référence retirée; Belleau, 2008; Picard, 2008; Laverty, 2010). Il semble que les valeurs estimées de la superficie du domaine vital des populations du nord de l'aire de répartition nord-américaine soient plus élevées que celles des populations du sud (Mahmoud, 1969; Ernst, 1986); cette différence est sans doute attribuable à une combinaison de facteurs, comme la fragmentation d'habitat (Edmonds, 1998; Belleau, 2008), la baisse de productivité de l'habitat plus au nord (Harestad et Bunnell, 1979) et la sélection de sites d'hivernage et de milieux différents durant les périodes d'activité (Ultsch, 2006). Par exemple, la superficie exceptionnellement grande du domaine vital (de 10,64 ha à 430 ha) rapportée par Edmonds (1998) dans la baie Georgienne découlait de l'existence de parcelles d'habitat éparses (c.-à.-d. zones peu profondes autour d'îles séparées par de vastes étendues d'eaux profondes). La longueur du domaine vital de la tortue musquée n'est pas bien documentée en Ontario mais, au Québec, des études ont révélé une longueur moyenne du domaine vital de l'espèce de 1,5 km (Équipe de rétablissement des tortues du Québec, données inédites; Belleau, 2008).
D'après certaines études, les tortues se déplacent habituellement sur 25 à 131 m par jour (Belleau, 2008; Référence retirée; Laverty, 2010), mais des déplacements quotidiens de 1 km ont déjà été observés (Belleau, 2008). Les déplacements sur de longues distances se font dans l'eau la nuit, période où l'espèce est la plus active (Référence retirée). Au Québec, un individu a été observé à 14 km en amont du site qu'il occupait précédemment (Belleau, 2008; Référence retirée). Dans une étude menée en Ontario, (Référence retirée) a constaté que les tortues musquées avaient plus tendance à se déplacer sur de grandes distances le long du rivage pour trouver les ressources dont elles ont besoin (p. ex. nourriture) qu'à se déplacer sur terre vers une baie voisine, sans doute en raison de leur grande vulnérabilité à la déshydratation (Ernts, 1968). L'étude rapporte également que la majorité des tortues musquées recensées se trouvaient à proximité des rives (moyenne = 5,0 ± 0,3 m), mais qu'un individu s'est éloigné de 25 m de l'eau (Référence retirée).
On estime que les populations sont isolées les unes des autres si elles sont séparées par plus de 10 km de milieu fluvial, par 5 km d'un autre type de milieu aquatique (lac, marais, etc.) ou par 1 km de terre (COSEWIC, 2012). Les écluses et les barrages peuvent limiter la dispersion des tortues d'eau douce (Bennett et al., 2010) et limitent sans doute les déplacements des tortues musquées compte tenu de la nature essentiellement aquatique de l'espèce.
Les tortues ont en commun certains éléments de leur cycle vital qui peuvent limiter leur capacité de s'adapter à des degrés élevés de perturbation, ce qui explique en partie leur tendance à connaître des baisses d'effectif (Congdon et al., 1993; Gibbons et al., 2000; Turtle Conservation Fund, 2002). La stratégie de reproduction des tortues repose sur de forts taux de survie des adultes, qui compensent les faibles taux de recrutement, pour les raisons suivantes :
- maturité sexuelle tardive (8-9 ans chez les femelles des populations du nord; longévité de plus de 20 ans);
- taux élevé de prédation naturelle des œufs et des jeunes de moins de deux ans;
- besoin de conditions environnementales particulières pour le développement interne des œufs, et incubation externe des œufs sans soins parentaux.
En raison de ces caractéristiques biologiques, les populations de tortues, dont celles de tortues musquées, ne peuvent pas s'ajuster à une augmentation du taux de mortalité des adultes. Des études à long terme ont révélé que ces animaux ont besoin d'un taux élevé de survie des adultes (et particulièrement des femelles) pour maintenir leurs populations. Il suffit d'une augmentation de 2 ou 3 % du taux annuel de mortalité des adultes pour provoquer une diminution d'effectif (Congdon et al., 1993, 1994; Cunnington et Brooks, 1996).
Les conditions climatiques requises pour la survie des tortues musquées limitent l'aire de répartition de l'espèce dans les régions nordiques (Bleakney, 1958; McKenney et al., 1998). Le climat joue un rôle essentiel dans le recrutement Note21, car l'incubation des œufs exige des conditions que seul l'environnement peut procurer. Le temps d'incubation constitue un facteur limitatif important pour les populations de tortues des régions nordiques (Brooks, 2007), où le court été permet normalement une seule ponte par année. Le taux de recrutement peut varier d'une année à l'autre selon les conditions météorologiques, particulièrement estivales. Chez la tortue musquée, la détermination du sexe se produit au cours de l'incubation et dépend de la température (Ernst et Lovich, 2009).
Au Canada, les populations locales de tortues musquées se trouvent à la limite nord de la répartition de l'espèce (Seburn et Seburn, 2000). Comme un moins grand nombre d'unités thermiques Note22 sont disponibles vers le nord, l'espèce se trouve limitée au Canada par la plus courte période de nidification et de développement (Brooks, 2007). La disponibilité de sites d'hibernation convenables pourrait aussi constituer un autre facteur limitatif important. L'espèce est relativement intolérante aux conditions anoxiques durant l'hiver, et la couverture de glace est présente plus longtemps dans le nord (Ultsch et Cochran, 1994).
Les tortues jouent un rôle important dans les croyances et les cérémonies spirituelles des Autochtones. Pour les Premières Nations, la tortue est un maître, qui possède de vastes connaissances. Elle joue un rôle fondamental dans l'histoire de la Création, car elle a permis à la Terre d'être formée sur sa dossière. Pour cette raison, la plupart des Premières Nations appellent traditionnellement l'Amérique du Nord « île de la Tortue ». Les Autochtones utilisent aussi la carapace de la tortue pour représenter un calendrier lunaire, les 13 scutelles Note23 de la dossière représentant les 13 pleines lunes de l'année. Des hochets fabriqués à partir de carapaces de tortues sont utilisés au cours des cérémonies traditionnelles et représentent souvent la tortue dans le récit de la Création. Les tortues figurent aussi dans d'autres récits traditionnels, comme le récit des Anishinaabe intitulé « Comment la tortue a acquis sa carapace » et celui des Haudenosaunee intitulé « La tortue fait une course contre le castor » (Bell et al., 2010).
Les menaces pesant sur la tortue musquée peuvent varier régionalement et localement à l'intérieur de l'aire de répartition de l'espèce au Canada. Quoi qu'il en soit, l'information présentée au tableau 1 constitue une évaluation générale des menaces qui pèsent sur la tortue musquée au Canada. Lorsque de l'information est connue sur l'importance d'une menace à l'échelle locale, des renseignements additionnels sont fournis dans la description de la menace figurant après le tableau 1.
Les menaces présentées au tableau 1 sont classées en ordre décroissant de préoccupation dans chaque catégorie de menaces.
| Information sur les menaces | Menace | Niveau de préoccupation Note du tableaua | Étendue | Occurrence | Fréquence | Gravité Note du tableaub | Certitude causale Note du tableauc |
|---|---|---|---|---|---|---|---|
| Perte, dégradation ou fragmentation d'habitat | Conversion de terres pour l'agriculture et le développement, et altération des rives | Élevé | Généralisée | Historique/ courante | Récurrente | Élevée | Élevée |
| Perte, dégradation ou fragmentation d'habitat | Ouvrages de régularisation des eaux | Moyen/ élevé | Localisée | Historique/ courante | Récurrente | Modérée | Moyenne |
| Mortalité accidentelle | Mortalité due à la navigation | Élevé | Localisée | Courante | Saisonnière | Élevée | Élevée |
| Mortalité accidentelle | Prises accessoires des pêches | Élevé | Généralisée | Courante | Saisonnière | Élevée | Élevée |
| Mortalité accidentelle | Réseaux routiers | Faible | Généralisée | Courante | Saisonnière | Faible | Faible |
| Modifications de la dynamique écologique ou des processus naturels | Prédateurs favorisés par les activités humaines | Moyen | Localisée | Courante | Saisonnière | Inconnue | Moyenne |
| Utilisation des ressources biologiques | Capture illégale | Moyen | Généralisée | Courante | Saisonnière | Modérée | Moyenne |
| Pollution | Contamination et charge en nutriments | Moyen/ faible | Localisée | Courante | Continue/ saisonnière | Inconnue | Faible |
| Espèces exotiques, envahissantes ou introduites | Espèces exotiques et envahissantes | Moyen/ faible | Localisée | Courante/ anticipée | Continue | Inconnue | Moyenne/ faible |
| Activités ou processus naturels | Éclosions de maladies | Inconnu | Localisée | Anticipée | Continue | Inconnue | Inconnue |
| Changements climatiques | Inconnu | Généralisée | Courante | Continue | Inconnue | Inconnue |
Cette section décrit les menaces présentées dans le tableau 1, souligne les principaux éléments et fournit des renseignements supplémentaires. Les menaces sont présentées individuellement, mais il importe de tenir compte de l'effet cumulatif à long terme de ces menaces variées sur les populations locales de tortues musquées. Il est à noter que certaines menaces ne se manifestent que durant la période d'activité de l'espèce, en entraînant une mortalité directe, une mutilation ou une capture illégale d'individus. Parmi les mécanismes par lesquels les menaces peuvent affecter les populations de tortues musquées, l'isolement par perte et fragmentation d'habitat est particulièrement préoccupant, car il rompt la dynamique métapopulationnelle et limite la possibilité de rétablissement des populations locales par immigration de source externe. Les menaces sont présentées en ordre décroissant de niveau de préoccupation.
La perte d'habitat attribuable au développement et à l'agriculture est importante en ce qui concerne la tortue musquée (Edmonds, 2002). Le remblayage ou l'assèchement de milieux humides à de telles fins élimine l'habitat de la tortue, en particulier ses habitats d'exposition au soleil et d'alimentation (Référence retirée). La fragmentation d'habitat, par la construction d'infrastructures telles que des routes ou des ponts, peut isoler des populations locales de tortues (Référence retirée). L'isolement de populations pourrait compromettre l'effet d'une immigration de source externe, ce qui pourrait mener à une augmentation de la probabilité de disparition de populations locales (Stockwell et al., 2003; Marchand et Litvaitis, 2004). À long terme, une capacité réduite des individus de se disperser avec succès pourrait entraîner une réduction de la diversité génétique (Rizkalla et Swihart, 2006; Gray, 1995). La perte de variation génétique au sein de petites populations isolées peut à son tour réduire la valeur adaptative (fitness) et l'adaptabilité de ces populations et donc accroître le risque de disparition en cas de catastrophe ou d'épidémie (Frankham, 1995; Reed et Frankham, 2003).
La dégradation d'habitat riverain réduit la disponibilité de sites convenables pour la nidification et l'exposition au soleil (Edmonds, 2002; Référence retirée; Carrière et Blouin-Demers, 2010). Une telle dégradation d'habitat peut également réduire le nombre de sites d'hivernage et accroître le nombre de prédateurs (voir par exemple Ernst et Lovich, 2009). Dans de nombreuses régions, les berges sont durcies pour empêcher l'érosion, souvent à l'aide de murs de métal ou de béton, ou d'enrochements Note24 (Référence retirée). Ce durcissement des rives pourrait empêcher la tortue musquée de réaliser certaines fonctions vitales essentielles (p. ex. nidification, recherche de nourriture, hibernation et exposition au soleil) dans de grands segments d'habitat antérieurement disponible (Référence retirée). Par exemple, les rives naturelles présentent une plus grande quantité de végétation émergente et aquatique que les rives aménagées (Radomski et Goeman, 2001), et ces caractéristiques de l'habitat sont essentielles pour la tortue musquée durant la saison d'activité (Picard et al., 2011). Les travaux de construction associés à ce type d'aménagement peuvent aussi entraîner la mortalité directe de tortues.
Le dragage peut nuire directement ou indirectement aux tortues. Des individus peuvent être extraits de leurs sites d'hivernage et/ou tués par la machinerie lourde utilisée durant le dragage. Les sites d'hivernage pourraient également être détruits par le dragage. L'altération de la qualité de l'eau (attribuable à la charge sédimentaire dans les cours d'eau) et les changements morphologiques des cours d'eau pourraient quant à eux modifier la nature et la quantité des proies disponibles (Bodie, 2001).
Certaines techniques communément utilisées pour la gestion des cours d'eau et des zones riveraines, comme la réduction des embâcles créés par l'accumulation de chicots et autres morceaux de bois, l'assèchemt des rives, la canalisation et l'aménagement de réservoirs peuvent nuire aux tortues (Bodie, 2001).
Pendant qu'elles sont dans l'eau, les tortues, y compris la tortue musquée, risquent d'être blessées ou tuées en entrant en collision avec des bateaux et/ou des hélices (Bancroft et al., 1983; Edmonds, 1998; Burger et Garber, 1995; Smith et al., 2006; Référence retirée; Bulté et al., 2010). Les mortalités de tortues attribuables aux impacts avec des embarcations motorisées, même dans des plans d'eau où le trafic est faible à modéré (par rapport à « élevé ») peuvent entraîner le déclin d'une population locale de tortues d'eau douce (Bulté et al., 2010). La tortue musquée court de grands risques de graves blessures par les bateaux, car elle s'expose au soleil à la surface de l'eau et est susceptible d'être grièvement blessée ou tuée par la coque ou les hélices des bateaux (Bancroft et al., 1983; Edmonds, 1998; Référence retirée; Bulté et al., 2010; Bennett et Litzgus, 2014). Une étude menée dans la baie Georgienne a révélé que l'incidence des blessures causées aux tortues musquées par les bateaux était plus élevée dans les zones à forte utilisation récréative (Laverty, 2010). Il peut s'avérer difficile d'établir dans quelle mesure les tortues musquées sont blessées par les bateaux de plaisance parce que leur petite taille fait en sorte que tout impact avec un bateau entraîne habituellement la mort plutôt qu'une blessure (Laverty, 2010).
Lester et al. (2013) recommandent de réglementer l'utilisation des embarcations motorisées dans les habitats à fortes densités de tortues et de sensibiliser les plaisanciers aux impacts des embarcations sur la vie sauvage aquatique.
Les prises accessoires dans le cadre des pêches commerciale et récréative en eau douce constituent pour les tortues une menace sous-estimée mais bien réelle (Raby et al., 2011). Les tortues peuvent être prises accidentellement dans les lignes de pêche récréative, dans les pièges à poissons commerciaux ou les pièges destinés à la recherche scientifique, ou encore dans des filets, et se noyer. Comme il arrive souvent que les filets ne soient pas vérifiés pendant plusieurs jours, le taux de noyade des tortues est élevé. Le taux de mortalité est suffisant pour causer la disparition de populations locales de tortues (Midwood et al., 2014). Les tortues qui survivent sans se noyer dans les filets peuvent montrer des signes de blessures, lesquelles peuvent éventuellement entraîner la mort (Stoot et al., 2013).
Des recherches approfondies sur les taux de prise accessoire de tortues dans les filets réalisées récemment dans l'est de l'Ontario ont permis de constater que la tortue musquée était l'une des espèces de tortues les plus couramment capturées (Larocque, et al., 2012 b; Midwood et al., 2014; Stoot et al., 2013). Des études menées dans l'est de l'Ontario et dans le fleuve Mississippi (aux États-Unis) ont révélé que les techniques de pêche passive (verveux, etc.) peuvent entraîner une grande quantité de prises accessoires de tortues, notamment de tortues musquées (voir par exemple Barko et al., 2004; Référence retirée; Laroque et al., 2012a). En 2005, au mois 16 tortues musquées se sont noyées dans des verveux utilisés pour la pêche commerciale dans un site de l'est de l'Ontario (Référence retirée). Même quand on prend soin de s'assurer qu'une partie du piège demeure hors de l'eau, les tortues ont tendance à se rendre dans le dernier compartiment, qui est ancré au fond et qui peut donc être complètement submergé (Thompson, comm. pers., in Seburn, 2007).
En plus de risquer d'être prises accessoirement dans les filets de pêche commerciale, les tortues sont susceptibles de se blesser et de mourir en avalant les hameçons des pêcheurs récréatifs. Il arrive souvent que les tortues qui se font prendre dans les lignes de pêche soient relâchées lorsque les pêcheurs coupent la ligne; en pareil cas, l'hameçon demeure dans la tortue (Référence retirée; Référence retirée). À cause de l'utilisation d'hameçons appâtés par les pêcheurs, des tortues musquées se retrouvent fréquemment avec un hameçon dans la gueule (David Steen, obs. pers., cité dans Steen et al., 2014). L'hameçon et la ligne de nylon peuvent causer de graves lacérations du tube digestif, et les poids en plomb peuvent empoisonner les tortues (Borkowski, 1997). Les tortues musquées sont souvent prises, et fréquemment tuées par les pêcheurs ou par les blessures causées par les hameçons (Edmonds, 2002).
Les ouvrages de régularisation des eaux peuvent empêcher le déplacement des tortues dans les milieux aquatiques et, par conséquent, accroître la fragmentation d'habitat et empêcher l'accès des tortues à de l'habitat convenable (Bennett et al., 2010). Ces ouvrages sont particulièrement préoccupants pour les espèces de tortues essentiellement aquatiques, comme la tortue musquée, qui utilisent fréquemment le milieu aquatique pour se déplacer et pour qui la construction d'ouvrages de régularisation des eaux contribue potentiellement à l'isolement des populations (Edmonds, 2002; Bennett et al., 2010). L'isolement de populations pourrait compromettre l'effet d'une immigration de source externe, ce qui pourrait mener à une augmentation de la probabilité de disparition de populations locales (Stockwell et al., 2003; Marchand et Litvaitis, 2004). Une capacité réduite des individus de se disperser avec succès pourrait entraîner une réduction de la diversité génétique (Gray, 1995). La perte de variation génétique au sein des petites populations isolées peut à son tour réduire la valeur adaptative (fitness) et l'adaptabilité de ces populations et donc accroître le risque de disparition en cas de catastrophe ou d'épidémie Note25 (Frankham, 1995; Reed et Frankham, 2003).
Certaines utilisations des ouvrages de régularisation des eaux peuvent également nuire à l'habitat des tortues en modifiant les niveaux d'eau en amont et en aval, influant ainsi sur la profondeur de l'eau aux sites d'hivernage et sur la disponibilité d'habitat de nidification, d'exposition au soleil et d'alimentation. Par exemple, l'utilisation de barrages pour maîtriser les crues pourrait nuire à l'espèce en réduisant les effets de l'affouillement, attribuables aux crues maximales, sur les rives (enlèvement de la végétation riveraine), et donc la superficie de sol exposé convenant à la nidification (Seburn, 2007). La régularisation des eaux peut également avoir des effets sur le régime d'écoulement vers l'aval, et donc sur le transport des sédiments, les propriétés thermiques, les niveaux d'eau et les concentrations d'oxygène, qui sont tous des facteurs susceptibles d'influer sur le caractère convenable de l'habitat, en particulier durant l'hibernation.
La fluctuation des niveaux d'eau causée par les activités de régularisation des eaux peut également entraîner une mortalité directe : les niveaux d'eau accrus au printemps et à l'été peuvent noyer les nids (et tuer les embryons), les nids étant habituellement creusés près de l'eau, alors qu'une baisse des niveaux d'eau pendant l'hiver peut entraîner le gel (et la mort) des tortues en hivernage (Ewert, 1979).
Dans bon nombre de régions, la faible densité ou l'absence de prédateurs occupant le sommet des chaînes alimentaires ainsi que l'augmentation des aliments disponibles associés aux humains (p. ex. nourriture donnée aux animaux, déchets, cultures) ont mené à une plus grande abondance de prédateurs de tortues que ce que les conditions naturelles auraient pu soutenir dans le passé (Mitchell et Klemens, 2000; COSEWIC, 2012). Les principaux prédateurs de la tortue musquée sont le raton laveur (Procyon lotor), la moufette rayée (Mephitis mephitis), les corbeaux et corneilles (Corvus spp.) et les renards (Urocyon cinereoargenteus, Vulpes vulpes) (Harding, 1997; Marchand et al., 2002; Ernst et Lovich, 2009). Dans la région des Grands Lacs, la mortalité au nid dépasse souvent les 80 % chez la tortue musquée (Harding, 1997).
Des méthodes visant à contrer les taux élevés de prédation ont été élaborées et utilisées avec un succès variable (Seburn, 2007; Riley et Litzgus, 2013). Toutefois, dans de nombreux cas, il est impossible d'appliquer ces méthodes (notamment l'installation de dispositifs d'exclusion des prédateurs au-dessus des nids de tortues) à l'échelle requise pour protéger la population de cette menace.
Dans le monde entier, de nombreuses espèces de tortues sont touchées par la capture occasionnelle et par la capture systématique à grande échelle pour utilisation comme animaux de compagnie, aliments et remèdes traditionnels (Bodie, 2001; Référence retirée; Moll et Moll, 2004). Le taux d'exportation de tortues d'eau douce, pour leur commerce comme animaux de compagnie ou aliments, est élevé aux États Unis (Mali et al., 2014). Par exemple, de 1999 à octobre 2014, environ 750 000 tortues musquées ont été exportées légalement à des fins commerciales à partir des États-Unis, dont 40 % ont été capturées dans la nature selon les déclarations (U.S. Fish and Wildlife, 2014). Le nombre total de tortues exportées est sans doute beaucoup plus élevé, à cause des individus vendus illégalement sur le marché des animaux de compagnie. On peut s'attendre à ce que le taux de commerce illégal soit également élevé au Canada étant donné la demande dans ce commerce lucratif. Les espèces de reptiles classées comme en péril sont plus susceptibles de faire l'objet d'un commerce international comme animaux de compagnie que celles qui ne sont pas considérées comme en péril (Bush et al., 2014), du fait que les espèces sauvages rares sont particulièrement recherchées (Courchamp et al., 2006).
Au Canada, la capture, le commerce et la possession de tortues musquées sont illégaux aux termes des lois fédérales et provinciales. Néanmoins, la vente illégale de tortues musquées est à la hausse en ligne, sur des sites tels que Kijiji (Gillingwater, comm. pers., in COSEWIC, 2012). De 2008 à 2012, le ministère des Richesses naturelles et des Forêts a mené plus de 25 enquêtes concernant la vente illégale en ligne de tortues musquées (Miller, comm. pers., 2012, in COSEWIC, 2012; Zacher comm. pers., 2012, in COSEWIC, 2012). Il semble donc qu'il pourrait y avoir une forte demande pour cette espèce sur le marché des animaux de compagnie.
Même si la capture illégale de tortues musquées n'est pas nécessairement une cause de mortalité directe, elle élimine des individus de la population, ce qui, vu la stratégie reproductive de l'espèce (longévité extrême, faibles taux de recrutement), pourrait grandement réduire le taux de recrutement (Congdon et al., 1993, 1994; Burger et Garber, 1995). L'élimination annuelle ne serait-ce que de quelques individus d'une population locale peut avoir un impact important sur la santé et la viabilité des populations locales. L'ampleur de la récolte illégale organisée de tortues musquées est peu documentée au Canada et doit être étudiée davantage.
L'habitat aquatique de la tortue musquée peut être touché par la dégradation de la qualité de l'eau causée par le ruissellement des eaux contaminées provenant des zones agricoles (nutriments et pesticides) et industrielles (déchets industriels), des routes (p. ex. sels de voirie) et des zones urbaines (p. ex. métaux lourds) (Mitchell et Klemens, 2000; Bishop et al., 2010). La tortue musquée peut être vulnérable à l'accumulation de contaminants, mais les effets à long terme de ces derniers sont encore mal compris. Les tortues absorbent les contaminants présents dans l'environnement par divers processus physiologiques (p. ex. alimentation, respiration, absorption par les tissus ou les membranes, notamment par la coquille des œufs). Une étude a montré qu'il y a eu une modification du régime alimentaire de la tortue musquée, qui comprend désormais des moules zébrées, et que ce régime s'éloigne des proies naturelles de l'espèce (soit les sangsues, les bivalves, les escargots, les insectes aquatiques, les araignées, les écrevisses et les poissons) (Patterson et Linderman, 2009). Ce nouveau régime alimentaire pourrait mener à une exposition accrue à des contaminants, les moules zébrées étant réputées accumuler de fortes concentrations de substances toxiques du fait de leur alimentation par filtration (Hogan et al., 2007).
Des études récentes montrent que la dépendance de l'espèce à l'égard des sources de nourriture benthiques a peu d'effets sur l'accumulation du mercure chez la tortue peinte et la tortue musquée (Référence retirée), et que les concentrations de mercure mesurées dans le sang et les écailles n'influent pas sur le taux de parasitisme chez la tortue peinte (Slevan-Tremblay, 2013). Toutefois, l'exposition au mercure pourrait nuire au système immunitaire en réduisant le nombre de lymphocytes. Deux études menées dans le bassin des Grands Lacs ont permis de déceler plusieurs contaminants d'origine industrielle dans des œufs de la tortue serpentine. On a également observé que le taux de développement anormal des embryons augmentait avec l'exposition aux hydrocarbures aromatiques polychlorés (Bishop et al., 1998; Van Meter et al. 2006). Ces études s'intéressaient à d'autres espèces, mais des effets similaires seraient possibles chez la tortue musquée, car ces espèces utilisent des habitats semblables et montrent des comportements alimentaires similaires.
Les apports de sédiments et de matière organique issus de l'érosion et du ruissellement peuvent également modifier la qualité de l'eau et la structure de l'habitat, et menacer les populations locales de tortues musquées. L'envasement des fosses profondes a été associé au déclin de plusieurs espèces de tortues (voir Bodie, 2001) et pourrait détériorer l'habitat d'hivernage de la tortue musquée en exposant les individus au gel. Les apports de matière organique et de nutriments peuvent accroître la turbidité de l'eau et réduire la teneur de l'eau en oxygène dissous, ce qui peut nuire à la respiration durant l'hiver. On ignore dans quelle mesure ces conditions peuvent nuire à la tortue musquée.
L'augmentation de la charge en nutriments associée à l'activité humaine peut favoriser la prolifération de cyanobactéries (algues bleues) dans les eaux fréquentées par les tortues (Carpenter et al., 1998), ce qui peut menacer ces dernières, qui risquent d'ingérer les toxines produites par les algues. De plus, une augmentation de la charge en nutriments peut mener à une consommation accrue d'oxygène par les bactéries, ce qui peut entraîner des périodes de faible concentration d'oxygène dissous (hypoxie) ou même d'absence totale d'oxygène (anoxie) durant l'hiver. La tortue musquée est intolérante aux conditions hypoxiques durant l'hivernage (Ultsch, 2006); par conséquent, les individus qui hibernent dans des zones où les concentrations d'oxygène sont appauvries risquent de mourir durant l'hibernation en raison des conditions hypoxiques ou anoxiques.
La contamination des eaux souterraines liées au déversement dans les sites d'hivernage et à leur maintien constitue aussi une préoccupation. Des études s'imposent pour déterminer ses effets possibles sur les tortues ainsi que le niveau de risque qu'il pourrait présenter pour une population.
L'introduction de plantes exotiques envahissantes peut altérer la disponibilité d'habitat et la qualité de l'habitat pour la tortue musquée. Dans certaines régions, particulièrement autour des lacs Érié, Huron et Sainte-Claire, et le long de certains cours d'eau importants, le roseau commun, espèce non indigène, a envahi des milieux humides, des lacs et des cours d'eau, formant des peuplements monospécifiques Note26 qui ont altéré les conditions de l'habitat d'alimentation et de l'habitat de nidification, forçant les femelles à utiliser d'autres sites de ponte (Référence retirée; Gillingwater, données inédites, in COSEWIC, 2012). L'expansion du réseau routier favorise la propagation des espèces végétales envahissantes, ce qui est particulièrement le cas dans le sud de l'Ontario (Gelbard et Belnap, 2003).
Les tortues nidifient en terrain ouvert, sans ombrage, bien exposé à la chaleur du soleil. Dans une étude menée à un site du lac Érié, en Ontario, il a été observé que le roseau commun avait réduit la quantité d'habitat de nidification convenable de nombreuses espèces de tortues, sa propagation ayant altéré le microenvironnement (particulièrement la température) des nids de tortues durant la période d'incubation (Référence retirée). Dans un autre site du lac Érié, le roseau commun avait réduit ou éliminé l'accès des tortues musquées aux sites de nidification. Immédiatement après l'envahissement par le roseau commun, on a observé que les nids étaient concentrés dans les trouées des peuplements végétaux, où ils sont plus vulnérables à la prédation ou au piétinement accidentel par les humains, et que les anciens sites de nidification n'étaient plus utilisés (Référence retirée). La perte d'habitat de nidification convenable pour les tortues due à la présence de plantes envahissantes non indigènes, notamment le roseau commun, le houblon du Japon (Humulus japonicas) et la salicaire commune (Lythrum salicaria), a également été observée à de nombreux autres endroits dans le sud de l'Ontario (Gillingwater, comm. pers., 2012). La glycérie aquatique (Glyceria maxima) pourrait également avoir un impact sur la tortue musquée.
L'introduction d'autres espèces non indigènes peut aussi exercer un effet négatif sur la tortue musquée. Par exemple, la remise en liberté de tortues exotiques domestiques (p. ex. la tortue à oreilles rouges [Trachemys scripta ssp. elegans]) en milieu naturel après une période de captivité peut entraîner une compétition et/ou la transmission de maladies aux populations de tortues indigènes (Cadi et Joly, 2003, 2004). Ces tortues non indigènes se trouvent en grands nombres dans certains endroits de la province et pourraient se reproduire avec succès là où les conditions de l'habitat sont convenables (OMNRF, 2014, données inédites).
Les études sur l'herpétofaune Note27 font état d'une préoccupation grandissante à l'égard de la mortalité par collision avec des véhicules routiers (voir par exemple Andrews et al., 2006), particulièrement sur les routes fortement fréquentées qui traversent des milieux humides ou longent des cours d'eau et des lacs. Certaines collisions peuvent être accidentelles, mais les conducteurs qui roulent intentionnellement sur des tortues constituent également une menace (Ashley et al., 2007). Ashley et al. (2007) ont noté que les imitations de reptiles étaient percutées à un taux plus élevé que ce qui pourrait se produire au hasard; en effet, quelque 2,7 % des conducteurs de véhicules motorisés roulaient intentionnellement sur ces imitations. En Ontario, le réseau routier se développe rapidement, notamment dans la partie sud de la province, où la longueur totale des routes principales a augmenté de 28 000 km au cours des 60 dernières années (Fenech et al., 2005). La mortalité sur les routes est l'une des principales préoccupations dans cette province, et on compte dans de nombreuses régions des sections de route où les taux de mortalité des tortues d'eau douce sont élevés, y compris dans des parcs nationaux et provinciaux (Référence retirée; Crowley et Brooks, 2005; Ontario Road Ecology Group, 2010). Même s'il y a des mortalités de tortues musquées sur les routes, elles sont moins courantes comparativement à d'autres espèces de tortues puisque la tortue musquée est principalement aquatique et se déplace rarement loin de l'eau (van Dijk, 2013). La tortue musquée connaît un certain risque de mortalité routière lors de la saison de nidification en Ontario (Haxton, 2000).
Les femelles ont tendance à être plus à risque de mortalité sur les routes parce qu'elles se déplacent sur la terre ferme durant la saison de nidification (Haxton, 2000) et qu'elles peuvent aménager leur nid sur les accotements des routes Note28 (voir par exemple Aresco, 2005; Référence retirée). Ainsi, les femelles se trouvent plus fréquemment sur les routes que les mâles (Steen et al., 2006). Une étude a révélé qu'à certaines périodes, jusqu'à 72 % des tortues musquées qui traversaient la route étaient des femelles (Aresco, 2005). Cette mortalité élevée des femelles sur les routes pourrait être la raison pour laquelle, dans les milieux humides entourés d'un réseau routier dense, certaines études ont rapporté un déséquilibre des sexes en faveur des mâles dans les populations de tortues (Marchand et Litvaitis, 2004; Steen et Gibbs, 2004; Gibbs et Steen, 2005). De plus, les nouveau-nés qui sortent des nids se trouvant sur les accottements des routes peuvent être tués alors qu'ils tentent d'atteindre un habitat aquatique. Cette mortalité accroît également la possibilité de déclin de la population puisqu'elle réduit le taux de recrutement.
L'entretien des routes et des pistes peut constituer une menace pour les individus et les nids lorsque des travaux de terrassement, d'enlèvement de la végétation ou de lutte contre la végétation sont nécessaires durant l'été, l'automne et l'hiver. Les routes constituent également des obstacles aux déplacements et peuvent entraîner la fragmentation de l'habitat en diminuant la capacité de dispersion des tortues (Rizkalla et Swihart, 2006; Bennett et al., 2010). Les tortues musquées sont vulnérables à la déshydratation lorsqu'elles sont hors de l'eau (Ernst, 1968), ce qui limite leur dispersion dans les paysages fragmentés.
Des éclosions de maladies pourraient avoir un effet sur un grand nombre d'espèces, et les maladies pourraient se propager rapidement grâce aux moyens de transport internationaux (Daszak et al., 2000); ces éclosions pourraient réduire le taux de survie et avoir des conséquences graves sur les populations de tortues (COSEWIC, 2012). En Virginie, des tortues musquées ont souffert d'une maladie nécrotique affectant la peau et les scutelles (Ernst et al., 1999). La maladie n'a pas été observée dans la population de tortues musquées du Canada, mais elle a déjà été signalée au pays chez la tortue serpentine et la tortue peinte (Brooks, comm. pers., 2012 in COSEWIC, 2012). Il est donc possible que cette maladie touche tôt ou tard les populations de tortues musquées.
Le climat est le principal facteur limitatif de la répartition des tortues dans le nord de leur aire de répartition. Étant donné les effets du climat sur les taux de recrutement, il semble probable que les changements climatiques mondiaux auront un effet sur les populations de tortues, même si la nature et la portée globales de cet effet ne sont pas claires (COSEWIC, 2012). Une hausse de la température moyenne annuelle en Ontario de 2,5 à 3,7 °C d'ici 2050 (comparativement à la période 1961-1990) est prévue, en plus des changements dans les régimes saisonniers des précipitations (Expert Panel on Climate Change Adaptation, 2009).
Chez la tortue musquée, la détermination du sexe est fonction de la température et se produit durant l'incubation (Ernst et Lovich, 2009). Des températures d'incubation d'au moins 28 °C produisent presque toujours des femelles, des températures de 25 °C à 28 °C produisent un mélange de mâles et de femelles, et des températures inférieures à 25 °C donnent jusqu'à 80 % de mâles (COSEWIC, 2012). Selon un rapport, une hausse de la température mondiale de 4 °C ou plus pourrait causer un arrêt de la production de mâles, et une augmentation de 2 °C ou moins pourrait tout de même causer des changements drastiques de la répartition des sexes chez les tortues (Janzen, 1994 in COSEWIC, 2012). Ce phénomène pourrait éventuellement menacer la viabilité de l'espèce.
Des effets hydrologiques pourraient être causés par une baisse des niveaux d'eau durant l'été (Lemmen et al., 2008), laquelle pourrait augmenter la disponibilité de sites de nidification. Cependant, en absence d'une augmentation des précipitations, des températures élevées et l'augmentation de l'évaporation pourraient mener à un ruissellement faible (Expert Panel on Climate Change Adaptation, 2009) et à l'assèchement de milieux humides auparavant permanents. La baisse des niveaux d'eau dans les Grancs Lacs pourrait entraîner une perte considérable de milieux humides riverains qu'utilise la tortue musquée.
Les effets hydrologiques pourraient être marqués par une hausse des épisodes de pluie extrêmes, qui pourraient entraîner davantage d'inondations des rives abritant des œufs, et par des sécheresses plus longues et plus intenses qui causeraient la dessiccation des œufs. Si la fréquence et l'intensité des épisodes de pluie extrêmes augmentent dans le futur comme prévu (Expert Panel on Climate Change Adaptation, 2009), les sites de nidification risquent d'être inondés plus souvent, ce qui réduirait le taux d'éclosion. Des études s'imposent pour clarifier les effets attendus des changements climatiques sur la tortue musquée.
Il existe d'autres menaces qui pourraient toucher la tortue musquée. Par exemple, l'activité humaine peut avoir des effets variés sur les tortues. Le simple fait de s'approcher des tortues qui s'exposent au soleil peut les faire fuir. Le refroidissement corporel qui en résulte si les perturbations se répètent peut retarder le développement des œufs dans les femelles et nuire à la satisfaction des besoins des deux sexes et de toutes les classes d'âge (p. ex. métabolisme alimentaire, émergence printanière) (Bulté et Blouin-Demers, 2010b). De plus, la présence d'humains et/ou de bateaux peut retarder ou interrompre la nidification, et les femelles peuvent abandonner leur nid, ce qui les rend plus sujettes à la prédation (Horne et al., 2003; Moore et Seigel, 2006; Références retirées). Les activités récréatives sur les plages de nidification (p. ex. utilisation de véhicules hors route) peuvent aussi mener à l'écrasement de nids ou de nouveau-nés (Référence retirée). Les diverses espèces de tortues peuvent faire l'objet d'un harcèlement ou d'une persécution délibérée de la part d'humains, qu'on pense au lancement de roches ou au tir au fusil (voir par exemple Horne et al., 2003). Cependant, aucune étude publiée à ce jour (octobre 2014) n'a analysé ou mesuré les effets de ces activités sur la tortue musquée.
L'objectif en matière de population et de répartition est le suivant :
- Maintenir et, si possible, accroître l'abondance et la zone d'occupation de la tortue musquée afin d'assurer la persistance de populations locales autosuffisantes dans les régions où l'espèce est présente au Canada.
Les données sont limitées à propos de la taille globale de la population canadienne de tortues musquées. Selon une estimation grossière, la population totale au Canada est de plus de 10 000 individus matures, et l'indice de zone d'occupation est estimé à 1 408 km2; toutefois, plusieurs zones dans l'aire de répartition de l'espèce n'ont pas fait l'objet d'un relevé complet (COSEWIC, 2012). Il y a eu réduction des effectifs et de la répartition de l'espèce dans le sud-ouest de l'Ontario et dans la région du Golden Horseshoe, où la perte et la fragmentation d'habitat ont été les plus graves. Le but principal du présent programme de rétablissement est de mettre fin au déclin de la population et de maintenir la population et l'aire de répartition globales (c.-à-d. abondance et zone d'occupation) de l'espèce au Canada. Dans la mesure du possible, les mesures visant à accroître l'abondance et la zone d'occupation de l'espèce au Canada seront axées sur les zones de déclin connu, notamment dans le sud-ouest de l'Ontario et la région du Golden Horseshoe, où l'habitat convenable est en train de disparaître ou de se dégrader et/ou où les menaces sont élevées et ont des effets négatifs sur les populations. Il pourrait être possible d'augmenter l'effectif des populations locales lorsque le recrutement est très faible, les menaces sont évidentes et non irréversibles, et que des techniques de rétablissement éprouvées peuvent atténuer les menaces (et que des mesures d'atténuation des menaces pourraient être mises en place). Dans certaines zones, la qualité de l'habitat devra être améliorée pour que le rétablissement soit réalisé.
Cette espèce longévive a des besoins spécifiques en matière d'habitat, des besoins complexes liés au cycle vital et une capacité limitée de compenser la perte d'individus par la reproduction ou le recrutement d'individus provenant de populations adjacentes. Ainsi, pour réaliser l'objectif, il faudra appliquer activement des approches et des stratégies sur plusieurs fronts et dans de vastes régions. Au nombre de ces approches et stratégies, on compte : la protection de l'habitat convenable, la protection des individus (particulièrement les femelles reproductrices), l'amélioration des pratiques de gestion, l'atténuation des menaces, la réalisation de relevés et de suivis des populations locales, la sensibilisation du public et la réalisation de recherches pour combler les lacunes dans les connaissances.
Une superficie d'habitat suffisante et des liens entre habitats (corridors de déplacement) sont essentiels pour que les populations locales aient les éléments nécessaires requis pour leur survie et leur rétablissement. Sans corridors de déplacement, les individus pourraient être incapables d'accéder aux différents milieux de leur domaine vital afin de réaliser les activités nécessaires à leur cycle vital (p. ex. nidification, hivernage) ou de migrer dans des populations voisines, ce qui favorise l'effet d'une immigration de source externe et le flux génique. Les stratégies générales ainsi que la désignation de l'habitat essentiel aideront à assurer le maintien d'un tel habitat.
À l'échelle nationale, la Société d'herpétologie du Canada (SHC) est la principale organisation sans but lucratif qui se consacre à la conservation des amphibiens et des reptiles, y compris les tortues, en menant des études scientifiques, des programmes d'éducation du public et des projets communautaires, en effectuant la compilation et l'analyse de données historiques et en réalisant des projets de conservation ou de remise en état de l'habitat.
Depuis 2001, le gouvernement du Canada finance des projets liés à la conservation de la tortue musquée au Québec et en Ontario dans le cadre du Programme d'intendance de l'habitat (PIH) et du Fonds autochtone pour les espèces en péril (FAEP) et, depuis 2004, dans le cadre du Fonds interministériel pour le rétablissement (FIR). Les projets ont consisté notamment en des activités telles que la réalisation de relevés ciblés de l'espèce; la désignation de milieux importants pour les populations locales; l'étude de la gravité des menaces et/ou l'atténuation des menaces telles que les prises accessoires des pêches; la sollicitation d'observations auprès de la population et l'incitation du public à signaler la découverte de tortues musquées; l'information des propriétaires fonciers et/ou de la population sur l'identification de l'espèce, les menaces qui pèsent sur elles et les options en matière d'intendance.
L'équipe de rétablissement multi-espèces des tortues en péril de l'Ontario (Ontario Multi-Species Turtles at Risk Recovery Team) a été créée au début des années 2000 par un groupe de personnes intéressées par le rétablissement des tortues, en particulier des six espèces en péril suivantes : la tortue mouchetée (Emydoidea blandingii), la tortue musquée (Sternotherus odoratusem>), la tortue géographique (Graptemys geographica), la tortue-molle à épines (Apalone spinifera); la tortue ponctuée (Clemmys guttata) et la tortue des bois (Glyptemys insculpta). Ce groupe a coordonné et entrepris diverses activités de rétablissement, comme des programmes d'éducation et de sensibilisation sur les reptiles et diverses initiatives de gestion, par exemple des projets de protection des nids et de remise en état des sites de nidification (Seburn, 2007).
Le ministère des Richesses naturelles et des Forêts (MRNF) de l'Ontario a financé de nombreux projets de conservation et d'intendance concernant les tortues dans l'ensemble de la province par le biais du Fonds d'intendance des espèces en péril de l'Ontario et d'autres programmes de financement provinciaux. En 2010, le MNRF a publié le Forest Management Guide for Conserving Biodiversity at the Stand and Site Scales (le Stand and Site Guide; OMNR, 2010). Cet outil, conçu pour les gestionnaires des forêts, fournit une orientation en matière de planification et de réalisation des opérations forestières à l'échelle des peuplements et des sites (entre des dizaines de mètres carrés et des centaines de km carrés) visant à favoriser la conservation de la biodiversité des forêts. Il comprend des normes, des lignes directrices et des pratiques exemplaires de gestion visant les espèces de tortues, dont la tortue musquée, qui se trouvent dans le secteur d'exploitation forestière Note29.
Depuis 2009, Ontario Nature coordonne l'élaboration d'une nouvelle édition de l'atlas des reptiles et des amphibiens de l'Ontario, et collabore avec le Centre d'information sur le patrimoine naturel et d'autres organisations. Ce projet, dans le cadre duquel on demande au public, aux chercheurs et aux organismes gouvernementaux et non gouvernementaux de fournir des mentions d'occurrence, contribue à l'amélioration des connaissances sur la répartition et la situation des reptiles et des amphibiens en Ontario, ce qui comprend la tortue musquée (Ontario Nature, 2012; Crowley, comm. pers., 2013).
Plusieurs programmes d'inventaire, de relevé et de suivi à grande échelle visant les tortues, dont la tortue musquée, ont été mis sur pied en Ontario, comme l'Ontario Turtle Tally (Toronto Zoo), le Kawartha Turtle Watch (Trent University), des programmes de relevé et de suivi de Conservation de la nature Ontario, d'Ontario Nature et de l'Agence Parcs Canada ainsi que de nombreux programmes de relevé et de suivi locaux. En outre, des études ont été menées sur la tortue musquée dans diverses régions de l'Ontario pour combler certaines lacunes dans les connaissances, y compris des études sur les domaines vitaux, la taille des populations, les caractéristiques démographiques, l'utilisation de l'habitat et l'écologie (voir par exemple Edmonds, 1998; Ultsch, 2006; Référence retirée; Picard, 2008; Laverty, 2010).
Diverses initiatives de restauration, d'atténuation des menaces et de conservation ont été entreprises en Ontario au sujet de la tortue musquée (p. ex. par l'Agence Parcs Canada dans les parcs nationaux, par Conservation de la nature Canada et par de nombreuses autres organisations). Elles visent notamment la protection des nids et des nouveau-nés (p. ex. Agence Parcs Canada, Kawartha Turtle Trauma Centre) de même que l'élimination du roseau commun dans les aires de nidification (Agence Parcs Canada). Le Kawartha Turtle Trauma Centre (KTTC), à Peterborough, réhabilite aussi les tortues sauvages qui ont été blessées dans l'espoir de les relâcher en bonne santé. Le nombre de tortues que ce centre traite chaque année est en hausse.
De nombreux organismes offrent des programmes de sensibilisation et d'éducation sur les espèces de tortues en péril aux groupes scolaires, aux Premières Nations et au grand public (p. ex. Scales Nature Park, le Reptiles at Risk on the Road Project, la Georgian Bay Biosphere Reserve [et antérieurement le Georgian Bay Reptile Awareness Program], Ontario Nature, le MNRF, Parcs Ontario, l'Agence Parcs Canada, le Zoo de Toronto et l'Office de protection de la nature de la rivière Thames supérieure). Le programme de conservation des milieux humides Toronto Zoo Adopt-A-Pond de Toronto est l'un des nombreux projets dans le cadre desquels ont été élaborés des programmes scolaires sur la conservation des tortues, tandis que le programme de conservation Turtle Island du Zoo de Toronto encourage la conservation des tortues et la sensibilisation à celles-ci auprès des Premières Nations et de groupes non autochtones. L'organisme Turtle SHELL (Safety, Habitat, Education and Long Life) a quant à lui préparé des brochures et installé des panneaux de traverses de tortues.
De nombreux projets réalisés conformément aux exigences de la Loi de 2007 sur les espèces en voie de disparition de l'Ontario ont des effets positifs directs sur les populations locales de tortues musquées. Ainsi, les clôtures visant à empêcher le passage des tortues et les écopassages sont dorénavant intégrés dès la conception de la plupart des nouvelles routes traversant un habitat d'espèce de tortue en péril (Ontario Road Ecology Group, 2010; OMNR, 2013).
L'Équipe de rétablissement des tortues du Québec a été créée en 2005. L'un de ses mandats est d'élaborer et de mettre en œuvre un plan de rétablissement pour cinq espèces de tortues : la tortue des bois (Glyptemys insculpta), la tortue géographique (Graptemys geographica), la tortue mouchetée (Emydoidea blandingii), la tortue musquée (Sternotherus odoratus) et la tortue ponctuée (Clemmys guttata) (Équipe de rétablissement des tortues du Québec, 2005). Cette équipe a été fusionnée en 2012 avec l'Équipe de rétablissement de la tortue-molle à épines (Apalone Spinifera), qui s'est ainsi ajoutée aux cinq autres espèces. Pour assurer la mise en œuvre des mesures de rétablissement, on a établi quatre groupes, chacun travaillant sur une espèce de tortue ou sur un groupe d'espèces. Un de ces groupes a ainsi été établi pour la tortue mouchetée et la tortue musquée.
Les travaux de ce groupe de mise en œuvre – formé de partenaires provenant de diverses organisations, y compris (au fil des ans) le MFFP Note30, Environnement Canada, la Commission de la capitale nationale, Conservation de la nature Canada et l'Université McGill, et de consultants indépendants – rendent possible l'acquisition de connaissances sur divers aspects de la tortue musquée au Québec, la détermination des menaces, la mise en œuvre de mesures de protection pour l'espèce et son habitat ainsi que la sensibilisation.
Au cours des dernières décennies, on a réalisé des relevés le long d'un cours d'eau important au Québec (Chabot et St-Hilaire, 1991; Desrosiers et Giguère, 2008; Caron, 2010; Toussaint et Caron, en préparation; MFFP, données inédites) et mené des recherches sur la sélection de l'habitat, les profils de déplacement et la démographie de la tortue musquée (Belleau, 2008) dans la province. Toutes les observations de l'espèce dans la province sont consignées au Centre de données sur le patrimoine naturel du Québec. De plus, on est en train de cartographier les occurrences d'élément de la tortue musquée, ainsi que de cartographier l'habitat de l'espèce en vertu de la Loi sur les espèces menacées et vulnérables. La Direction de la protection de la faune du MFFP est également en train de préparer un plan de protection de la tortue musquée. Enfin, le plan de rétablissement de l'espèce fait l'objet d'une mise à jour.
Le MFFP, en collaboration avec des partenaires tels que Conservation de la nature Canada, a réalisé plusieurs projets d'acquisition de terres le long d'un cours d'eau important au Québec afin de protéger l'habitat d'une variété d'espèces, dont la tortue musquée. En outre, des initiatives d'intendance et de communication ont été lancées pour protéger la tortue musquée et son habitat (p. ex. distribution de brochures et de dépliants au public, présentation d'exposés dans les écoles, journées d'information à l'intention du public et élaboration d'une page Web). Toutes ces activités ont été entreprises par le gouvernement, des organisations non gouvernementales, des organismes de conservation, des établissements de recherche ou zoologiques, ou des bénévoles.
Pour atteindre l'objectif en matière de population et de répartition, les sept stratégies générales suivantes ont été mises en œuvre pour permettre le rétablissement :
- Utiliser des outils législatifs et administratifs aux fins de conservation de la tortue musquée et de son habitat.
- Réduire la mortalité et les blessures des individus de même que la capture illégale dans l'aire de répartition canadienne de la tortue musquée.
- Protéger, gérer et remettre en état l'habitat de la tortue musquée dans toute son aire de répartition au pays.
- Améliorer le recrutement dans les localités où les populations locales de tortues musquées sont en déclin ou où leur viabilité semble compromise.
- Réaliser des activités de communication, de sensibilisation et d'intendance.
- Procéder à des relevés et à des suivis des populations locales de tortues musquées, de l'habitat et des menaces.
- Mener des recherches sur la démographique des populations, les caractéristiques et l'utilisation de l'habitat, et sur les menaces et l'atténuation des menaces pour combler les lacunes dans les connaissances.
Des activités de recherche et de gestion sont recommandées pour chaque stratégie (tableau 2). Les menaces et les facteurs limitatifs de la première colonne sont numérotés comme suit aux fins de concision :
- Conversion de terres pour l'agriculture et le développement, et aménagement des rives;
- Mortalité due à la navigation;
- Prises accessoires des pêches;
- Ouvrages de régularisation des eaux;
- Prédateurs favorisés par les activités humaines;
- Capture illégale;
- Contamination et charge en nutriments;
- Espèces exotiques et envahissantes;
- Réseaux routiers;
- Éclosions de maladies;
- Changements climatiques.
| Menaces ou facteurs limitatifs | Stratégie générale pour le rétablissement | Priorité Note du tableaud | Description générale des approches de recherche et de gestion |
|---|---|---|---|
| 1, 4, 6 | Outils législatifs et administratifs aux fins de conservation de la tortue musquée et de son habitat | Élevée |
|
| 2, 3, 5, 6, 9 | Réduire la mortalité et les blessures des individus de même que la capture illégale | Élevée |
|
| 1, 4, 7, 8, 9 | Protéger, gérer et remettre en état l'habitat | Élevée |
|
| 1-10 | Améliorer le recrutement dans les localités où les populations de tortues musquées sont en déclin ou où leur viabilité semble compromise | Élevée | Cette stratégie doit être mise en œuvre en parallèle avec deux stratégies susmentionnées : « Réduire la mortalité et les blessures des individus de même que la capture illégale » et « Protéger, gérer et remettre en état l'habitat ».
|
| Toutes les menaces | Réaliser des activités de communication, de sensibilisation et d'intendance | Moyenne |
|
| Toutes les menaces | Procéder à des relevés et à des suivis | Moyenne |
|
| Toutes les menaces | Mener des recherches | Moyenne |
|
Compte tenu de la stratégie de reproduction de la tortue musquée (voir la section 3.4), le maintien du taux de survie le plus élevé chez les adultes, en particulier chez les femelles, demeure le besoin principal de l'espèce en vue du rétablissement. Malheureusement, certaines caractéristiques biologiques de la tortue musquée (c.-à-d. se chauffer au soleil en se laissant flotter à la surface de l'eau, nidifier sur les plages) la rendent vulnérable à de nombreuses activités humaines (p. ex. sports nautiques, navigation, capture illégale, activités récréatives sur les plages). Il est donc important de mettre en œuvre une approche intégrée proactive pour limiter les menaces pesant sur les tortues musquées adultes.
Les approches de rétablissement doivent mettre l'accent sur les zones et les moments de l'année où survient le plus gros de la mortalité chez les adultes. La protection, la gestion et la remise en état de l'habitat demeurent essentielles au rétablissement de l'espèce puisque de telles activités aider à maintenir, à améliorer ou à créer un habitat convenable, et contribuent aussi à réduire la mortalité des adultes (c.-à-d. réduction de la gravité des menaces). Les activités de protection et de remise en état de l'habitat doivent se concentrer principalement sur la zone aquatique et les rives désignées comme habitat essentiel (voir la section 7), où se trouvent la plus grande partie des adultes. Ces mesures doivent être mises en œuvre par le biais d'une approche intégrée faisant appel à divers groupes (p. ex. propriétaires fonciers, utilisateurs des terres, responsables de l'aménagement foncier, Premières Nations, organisations non gouvernementales, gouvernements). Afin d'éclairer ces groupes et de commencer à atténuer des menaces spécifiques (p. ex. mortalité due à la navigation et prises accessoires des pêches), des approches de communication et de sensibilisation précises doivent être mises en œuvre. Des relevés et des suivis des populations sont également nécessaires pour aider à recueillir de l'information sur l'espèce afin de définir d'autres mesures de conservation. Par ailleurs, il est nécessaire de combler les lacunes dans les connaissances relatives à l'espèce par le biais d'une vaste gamme d'études spécifiques qui aideront à atteindre l'objectif en matière de population et de répartition.
La LEP définit l'« habitat essentiel » comme « l'habitat nécessaire à la survie ou au rétablissement d'une espèce sauvage inscrite, qui est désigné comme tel dans un programme de rétablissement ou un plan d'action élaboré à l'égard de l'espèce ». L'alinéa 41(1)c) de la LEP exige que les programmes de rétablissement incluent une désignation de l'habitat essentiel de l'espèce, dans la mesure du possible, et des exemples d'activités susceptibles d'entraîner la destruction de cet habitat.
Le présent programme de rétablissement fédéral désigne dans la mesure du possible, sur la base des meilleures informations accessibles, l'habitat essentiel de la tortue musquée en date de décembre 2013 Note31. Il est reconnu que l'habitat essentiel désigné pourrait être insuffisant pour atteindre les objectifs en matière de population et de répartition fixés pour cette espèce. Un calendrier des études a été inclus pour décrire les activités nécessaires afin de compléter la désignation de l'habitat essentiel (voir la section 7.2). Après la publication du présent programme de rétablissement, de l'habitat essentiel additionnel pourrait être désigné si de nouvelles recherches appuient l'inclusion de zones au-delà de celles qui sont actuellement désignées. Dans certaines des zones désignées comme habitat essentiel, la qualité de l'habitat devra être améliorée pour favoriser le rétablissement.
L'habitat essentiel de la tortue musquée repose sur les trois critères généraux suivants : l'occupation de l'habitat, le caractère convenable de l'habitat, et la connectivité de l'habitat (entre les zones occupées). Ces critères sont décrits ci-dessous.
Ce critère se rapporte aux zones où il y a un degré de certitude raisonnable que l'espèce est présente et utilise actuellement l'habitat.
L'habitat est considéré comme occupé lorsque :
- au moins une tortue musquée y a été observée au cours d'une année dans les derniers 40 ans Note32.
Une période de 40 ans a été choisie pour le critère d'occupation de l'habitat en raison de la longue durée d'une génération Note33 chez l'espèce (de 14 à 20 ans environ) (COSEPAC, 2012). Cette longévité rend difficile l'étude de la vie complète des individus, car cela complique l'acquisition d'une quantité adéquate de données exactes sur le cycle vital. L'espèce ne fait pas l'objet de relevés suffisants dans son aire de répartition. L'utilisation d'une période de 40 ans permet l'inclusion de populations locales qui persistent vraisemblablement, mais pour lesquelles des individus de la tortue musquée pourraient ne pas avoir été détectés au cours des dernières années. Le critère d'occupation de l'habitat pour la tortue musquée repose sur le principe qu'une seule observation peut indiquer la présence d'une population locale. Cette approche convient à la tortue musquée, qui possède un domaine vital relativement petit et se limite généralement à un seul plan d'eau ou cours d'eau et ses milieux humides adjacents, et dont le taux de détection lors des relevés est faible.
L'occupation de l'habitat est fondée sur des relevés professionnels et des études télémétriques, des observations des sites de nidification et d'hivernage, des observations d'individus morts et des observations fortuites de tortues musquées. Ces données d'observation doivent être spatialement précises (≤ 150 m) ou suffisamment détaillées pour être associées à un élément hydrographique convenable particulier (p. ex. cours d'eau, lac ou milieu humide) afin d'être considérées adéquates aux fins de désignation de l'habitat essentiel. Comme les tortues musquées se déplacent peu en milieu terrestre et préfèrent rester à proximité de l'eau (Ernst et Lovich, 2009), il est généralement possible d'associer l'observation à un élément d'habitat aquatique convenable correspondant. De l'habitat essentiel n'est pas désigné pour les localités où des activités suffisantes de relevé de l'espèce ont été effectuées sur de multiples années, selon un calendrier et des méthodes appropriés, sans qu'il y ait eu confirmation de la persistance de la tortue musquée ou de son utilisation de l'habitat, sa disparition locale s'en trouvant présumée.
Le caractère convenable de l'habitat se rapporte aux zones présentant un ensemble précis de caractéristiques biophysiques qui permettent aux individus d'accomplir les composantes essentielles de leur cycle vital (c.-à-d. hivernage, accouplement, thermorégulation, nidification, alimentation) ainsi que leurs déplacements. Il est important que toutes les zones d'habitat nécessaires soient reliées par une zone aquatique ou semi-aquatique et soient à une distance raisonnable les unes des autres pour permettre aux tortues de se déplacer facilement entre ces zones. L'habitat convenable de la tortue musquée peut ainsi être décrit comme une mosaïque de milieux aquatiques et terrestres, dans laquelle des caractéristiques biophysiques précises peuvent être associées aux composantes essentielles du cycle vital. Dans une zone d'habitat convenable, les caractéristiques biophysiques requises par la tortue musquée varieront sur le plan spatial et temporel selon la nature dynamique des écosystèmes. En outre, certaines caractéristiques biophysiques seront plus importantes pour les tortues à différents moments dans le temps (p. ex. durant différents processus vitaux ou à divers moments de l'année). Les caractéristiques biophysiques de l'habitat convenable de la tortue musquée sont détaillées au Tableau 3.
Étant donné qu'il n'y a pas d'information disponible sur la superficie d'habitat nécessaire à la tortue musquée pour qu'elle puisse accomplir les activités liées à son cycle vital dans son domaine vital, l'approche suivante a été utilisée pour déterminer l'étendue d'habitat convenable pour la tortue musquée. Cette description d'habitat convenable reflète le fait que certaines caractéristiques biophysiques n'ont pas besoin d'être directement adjacentes les unes aux autres, pour autant qu'elles demeurent liées afin que les individus puissent se déplacer entre elles pour satisfaire tous leurs besoins biologiques et pour réagir à une perturbation ou pour l'éviter. Les distances déterminant l'étendue de l'habitat convenable sont particulières à la tortue musquée et sont fondées sur les exigences biologiques et comportementales de l'espèce (voir la section 3.3).
L'habitat convenable pour la tortue musquée comprend de l'habitat d'hivernage, de reproduction, de thermorégulation, de nidification et d'alimentation, ainsi que de l'habitat pour les déplacements (déplacements locaux et dispersion) entre ces différentes zones et se définit ainsi :
- un cours d'eau ou un plan d'eau convenable occupé (jusqu'à la laisse des hautes eaux), y compris des milieux humides fluviaux OU une portion convenable du cours d'eau ou du plan d'eau (c.-à-d. une zone littorale, telle que mesurée à partir de la laisse des hautes eaux jusqu'à une profondeur d'eau maximale de 9 m) ET qui s'étend sur une distance linéaire de 1,5 km parallèlement à la rive dans les deux directions à partir d'un lieu d'observation valide Note34 de tortue musquée (pour une longueur totale du site de 3 km), OU
- un milieu humide (ou un complexe de milieux humides Note35) convenable occupé qui n'est pas reconnu comme un cours d'eau ni un plan d'eau ET qui s'étend sur une distance radiale pouvant atteindre 1,5 km à partir d'un lieu d'observation valide de tortue musquée, ET
- l'habitat aquatique et terrestre convenable adjacent jusqu'à 50 m de chaque côté du cours d'eau, du plan d'eau ou du milieu humide occupé (mesuré à partir de la limite du cours d'eau, du plan d'eau ou du milieu humide).
De plus, l'habitat convenable comprend des sites de nidification confirmés, peu importe où ils se trouvent (et peu importe la distance à laquelle se trouve l'élément aquatique convenable le plus proche), comme définis ici :
- une zone qui s'étend sur une distance radiale de 50 m à partir d'un point d'observation valide de nid de tortue musquée.
La tortue musquée, essentiellement aquatique, s'éloigne rarement de l'eau, et la plupart des domaines vitaux sont associés à un plan d'eau, à un cours d'eau ou à un milieu humide permanent (Ernst et Lovich, 2009). Elle se rend cependant régulièrement dans des ruisseaux, des étangs ou des milieux humides adjacents ou reliés. La distance de 1,5 km a été déterminée selon la longueur moyenne du domaine vital de la tortue musquée calculée au Québec (Équipe de rétablissement des tortues du Québec, données inédites; Belleau, 2008). Cette distance se traduit par une longueur de site de 3 km, ce qui tient compte des distances parcourues par la tortue musquée qui ont été observées au Canada (Edmonds, 1998; Belleau, 2008). La distance de 50 m de chaque côté d'un plan d'eau, d'un cours d'eau ou d'un milieu humide est fondée sur la distance maximale par rapport aux éléments aquatiques à laquelle des sites de nidification de la tortue musquée ont été signalés aux États-Unis (Steen et al., 2012) puisque peu d'information sur les sites de nidification est disponible au Canada. Ainsi, ce critère permet de comprendre la vaste majorité de l'habitat de nidification potentiel, ce qui est important compte tenu du fait que peu de lieux précis sont connus. Cette distance de 50 m peut également comprendre certains ruisseaux, étangs ou milieux humides adjacents ou reliés qui contiennent de l'habitat convenable pour la tortue musquée, ainsi que l'habitat convenable permettant d'y accéder. La disponibilité et la sélection de sites de nidification sont vraisemblablement très importantes pour la persistance des populations locales à cause de la nature des facteurs limitatifs connus touchant la tortue musquée (p. ex. stratégie de reproduction à long terme, conditions climatiques; voir la section 3.4). À cause de la rareté de ces habitats, les sites de nidification confirmés ont également été désignés comme habitat essentiel, peu importe où ils se trouvent, y compris dans l'habitat terrestre et aquatique convenable de la tortue musquée se trouvant dans un rayon de 50 m d'observations de nidification valide. Cette zone permet la nidification et le repos, et pourrait également constituer un corridor sécuritaire pour le déplacement des femelles et des nouveau-nés entre le site de nidification et l'habitat aquatique convenable.
| Habitat | Caractéristiques | Activités du cycle vital | Références |
|---|---|---|---|
| Cours d'eau (p. ex. rivières, ruisseaux), plans d'eau (p. ex. lacs, baies, étangs, chenaux) ou milieux humides (p. ex. eaux peu profondes, marais) |
|
Alimentation, thermorégulation, accouplement | Harding, 1997; Belleau, 2008; Ernst et Lovich, 2009; Picard et al., 2011 |
| Cours d'eau (p. ex. rivières, ruisseaux), plans d'eau (p. ex. lacs, baies, étangs, chenaux) ou milieux humides (p. ex. eaux peu profondes, marais) |
|
Hivernage, accouplement | Référence retirée; Belleau, 2008; Rowe et al., 2009 |
| Cours d'eau (p. ex. rivières, ruisseaux), plans d'eau (p. ex. lacs, baies, étangs, chenaux) ou milieux humides (p. ex. eaux peu profondes, marais) |
|
Déplacements locaux et dispersion | Belleau, 2008; Ernst et Lovich, 2009; Rowe et al., 2009 |
| Habitat | Caractéristiques | Activités du cycle vital | Références |
|---|---|---|---|
| Zones riveraines ouvertes (p. ex. rives de cours d'eau, vasières, barres de sable, plages, affleurements rocheux, îles) |
|
Nidification | Lindsay, 1965; Edmonds, 2002 |
| Habitat riverain et terrestre (p. ex. rives de cours d'eau, forêts, prairies) |
|
Déplacements locaux | Edmonds, 2002 |
Le maintien des liens naturels entre les types d'habitat requis par la tortue musquée est nécessaire pour la persistance des populations locales. La connectivité entre les populations locales est nécessaire pour l'immigration et l'émigration (déplacements vers et depuis des populations locales, respectivement), ce qui augmente le flux génique (qui maintient la diversité génétique au sein des populations locales et entre celles-ci) et favorise l'effet d'une immigration de source externe qui contribue à soutenir les populations locales. La connectivité permet également à l'espèce de réagir aux facteurs de stress environnementaux (p. ex. changements des niveaux d'eau, pollution, milieux anoxiques) en se déplaçant ailleurs. Au Canada, la perte et la fragmentation d'habitat sont des menaces qui pèsent sur les populations de tortues musquées locales (voir la section 4.2; Edmonds, 2002; COSEWIC, 2012). Cette menace peut entraîner la perte de corridors de dispersion, d'où un isolement des populations locales et une réduction de la diversité génétique.
Pour permettre aux tortues musquées de parcourir les courtes distances qu'elles doivent franchir pour certaines des activités de leur cycle vital (dans de l'habitat pour leurs déplacements locaux), une connectivité est assurée dans les zones définies d'habitat convenable (déplacements saisonniers entre les habitats pour réaliser le cycle vital annuel) (voir la section 7.1.2, le tableau 3 et la figure 2). Pour permettre les déplacements sur de longues distances, comme dans le cas de l'immigration ou l'émigration (déplacements de dispersion; voir la section 3.3), le critère de connectivité de l'habitat relie les populations locales par des corridors hydrologiques appropriés établis sur la base des tendances observées de la tortue musquée de se disperser par le biais de milieux aquatiques (Référence retirée).
Le critère de connectivité de l'habitat est défini comme suit :
- un corridor hydrologique composé d'éléments d'eaux de surface (cours d'eau, plans d'eau ou milieux humides) (jusqu'à la laisse des hautes eaux) OU des portions de l'élément (à partir de la laisse des hautes eaux jusqu'à une profondeur d'eau maximale de 9 m) se trouvant entre deux lieux d'observations valides de l'espèce qui sont séparés par une distance linéaire maximale de 4,5 km.
La distance de 4,5 km est trois fois la longueur linéaire moyenne du domaine vital (1,5 km) et est fondée sur la distance de séparation maximale entre les occurrences d'élément recommandée par NatureServe (2013) pour maintenir la connectivité et réduire la probabilité d'isolement génétique. Cette distance est également conforme aux déplacements documentés de la tortue musquée au Canada (> 3 km; Edmonds, 1998).
L'habitat essentiel de la tortue musquée est désigné comme étant l'étendue d'habitat convenable (section 7.1.2) qui respecte le critère d'occupation de l'habitat (section 7.1.1). À l'heure actuelle, les limites de l'habitat convenable pour les cours d'eau, les plans d'eau et les milieux humides permanents sont établies pour la plupart des populations locales de l'Ontario et du Québec, et peuvent être utilisées pour définir les zones dans lesquelles se trouve de l'habitat essentiel, appelées ici unités d'habitat essentiel. Lorsque le critère de connectivité de l'habitat s'applique (dans les situations où deux observations valides sont faites dans un réseau d'éléments d'eaux de surface continues et qu'elles sont séparées par une distance maximale de 4,5 km), l'unité d'habitat essentiel se trouve étendue de façon à comprendre un complexe d'habitat aquatique plus vaste pour la tortue musquée (voir la figure 2). Ainsi, l'unité d'habitat essentiel représente l'étendue maximale d'habitat essentiel à une localité donnée. Les zones urbaines et/ou les structures d'origine humaine ne possèdent pas les caractéristiques biophysiques de l'habitat convenable de la tortue musquée (section 7.1.2) et ne sont donc pas désignées comme habitat essentiel.
L'application des critères de désignation de l'habitat essentiel aux données disponibles permet de désigner 180 unités renfermant en tout jusqu'à environ 75 000 ha d'habitat essentiel pour la tortue musquée au Canada (tableau 4). Cette désignation comprend l'habitat essentiel pour 105 occurrences d'élément connues au Canada (101 en Ontario et 4 au Québec) ainsi que d'autres localités qui n'ont pas encore fait l'objet d'une évaluation. Il s'agit d'une désignation partielle de l'habitat essentiel puisque pour 25 localités (25 en Ontario, 0 au Québec), il n'y a pas eu de relevé récent ou adéquat et/ou il y a un manque de certitude entourant les données nécessaires pour désigner l'habitat essentiel, ou des ententes d'échange de données sont requises. Un calendrier des études (section 7.2) a été établi aux fins d'obtention de l'information nécessaire pour que puisse être désigné suffisamment d'habitat essentiel pour permettre l'atteinte de l'objectif en matière de population et de répartition.
Vu la vulnérabilité de la tortue musquée à la capture illégale, l'habitat essentiel a été présenté au moyen de carrés du quadrillage UTM (grille de Mercator transverse universelle) de référence de 50 x 50 km (figure 3, voir également le tableau 4). Les carrés du quadrillage UTM font partie d'un système de quadrillage de référence qui indique les zones géographiques générales renfermant de l'habitat essentiel à des fins de planification de l'utilisation des terres et/ou d'évaluation environnementale. L'habitat essentiel dans chaque carré du quadrillage se trouve là où les critères d'occupation de l'habitat (section 7.1.1), de caractère convenable de l'habitat (section 7.1.2) et de connectivité de l'habitat (section 7.1.3) sont respectés. Il est possible de présenter une demande d'information au Service canadien de la faune d'Environnement Canada pour obtenir des renseignements plus détaillés sur la localisation de l'habitat essentiel à des fins de protection de l'espèce et de son habitat, à l'adresse : ec.planificationduretablissement-recoveryplanning.ec@canada.ca.
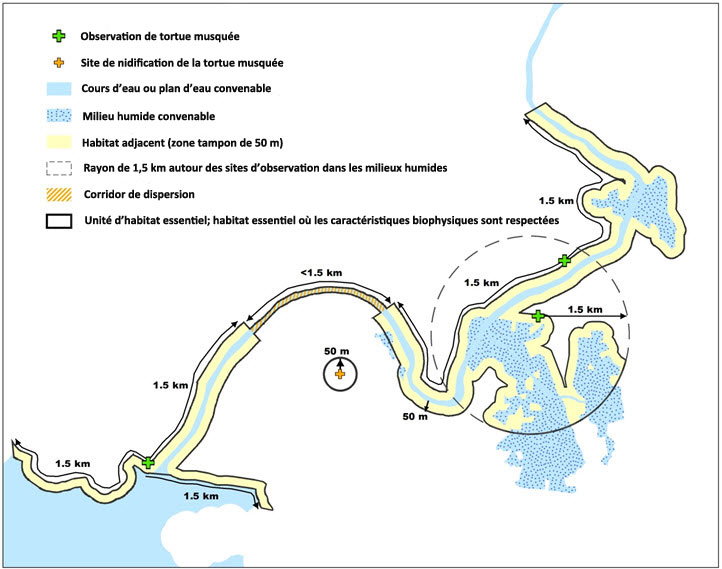
Description longue de la figure 2
La figure 2 est une représentation schématique des critères de désignation de l'habitat essentiel de la tortue musquée. Elle montre 3 observations de tortues et 1 site de nidification. Les unités d'habitat essentiel comprennent les cours d'eau ou les plans d'eau qui s'étendent sur un maximum de 1,5 km parallèlement à la ligne de rivage dans les deux directions à partir d'une observation, ainsi que l'habitat essentiel adjacent dans un rayon de 50 m du cours d'eau ou du plan d'eau. Elles peuvent aussi comprendre les milieux humides, jusqu'à une distance radiale maximale de 1,5 km d'une observation valable, ainsi que l'habitat convenable adjacent à moins de 50 m du milieu humide. En outre, les unités peuvent comprendre tout site de nidification connu, jusqu'à une distance radiale de 50 m autour d'une observation de nidification valable. Lorsque deux observations valables se situent dans un réseau hydrologique continu et sont séparées par une distance maximale de 4,5 km, les corridors de dispersion sont inclus dans les unités d'habitat essentiel.
| Numéro du carré du quadrillage UTM de référence de 50 x 50 km Note du tableaug | Province/territoire | Coordonnées du carré du quadrillage UTM Note du tableauh Abscisse |
Coordonnées du carré du quadrillage UTM Note du tableauh Ordonnée |
|---|---|---|---|
| 17TLGB | Ontario | 300000 | 4650000 |
| 17TLGC | Ontario | 350000 | 4600000 |
| 17TLGD | Ontario | 350000 | 4650000 |
| 17TMHA | Ontario | 400000 | 4700000 |
| 17TMHB | Ontario | 400000 | 4750000 |
| 17TMHD | Ontario | 450000 | 4750000 |
| 17TMMA | Ontario | 400000 | 5100000 |
| 17TNHA | Ontario | 500000 | 4700000 |
| 17TNHB | Ontario | 500000 | 4750000 |
| 17TNJC | Ontario | 550000 | 4800000 |
| 17TNKC | Ontario | 550000 | 4900000 |
| 17TNKD | Ontario | 550000 | 4950000 |
| 17TNLA | Ontario | 500000 | 5000000 |
| 17TNLB | Ontario | 500000 | 5050000 |
| 17TNLC | Ontario | 550000 | 5000000 |
| 17TNLD | Ontario | 550000 | 5050000 |
| 17TNMC | Ontario | 550000 | 5100000 |
| 17TPHB | Ontario | 600000 | 4750000 |
| 17TPJA | Ontario | 600000 | 4800000 |
| 17TPKB | Ontario | 600000 | 4950000 |
| 17TPKC | Ontario | 650000 | 4900000 |
| 17TPLA | Ontario | 600000 | 5000000 |
| 17TQJB | Ontario | 700000 | 4850000 |
| 17TQKA | Ontario | 700000 | 4900000 |
| 17TQKB | Ontario | 700000 | 4950000 |
| 18TTPB | Ontario | 258527 | 4850000 |
| 18TTQA | Ontario | 260346 | 4900000 |
| 18TUPB | Ontario | 300000 | 4850000 |
| 18TUPD | Ontario | 350000 | 4850000 |
| 18TUQA | Ontario | 300000 | 4900000 |
| 18TUQB | Ontario | 300000 | 4950000 |
| 18TUQC | Ontario | 350000 | 4900000 |
| 18TUQD | Ontario | 350000 | 4950000 |
| 18TURA | Ontario | 300000 | 5000000 |
| 18TURB | Ontario | 300000 | 5050000 |
| 18TURC | Ontario et Québec | 350000 | 5000000 |
| 18TUSA | Ontario | 300000 | 5100000 |
| 18TVQA | Ontario | 400000 | 4900000 |
| 18TVQB | Ontario | 400000 | 4950000 |
| 18TVRA | Ontario et Québec | 400000 | 5000000 |
| 18TVRC | Ontario et Québec | 450000 | 5000000 |
| 18TWQB | Ontario et Québec | 500000 | 4950000 |
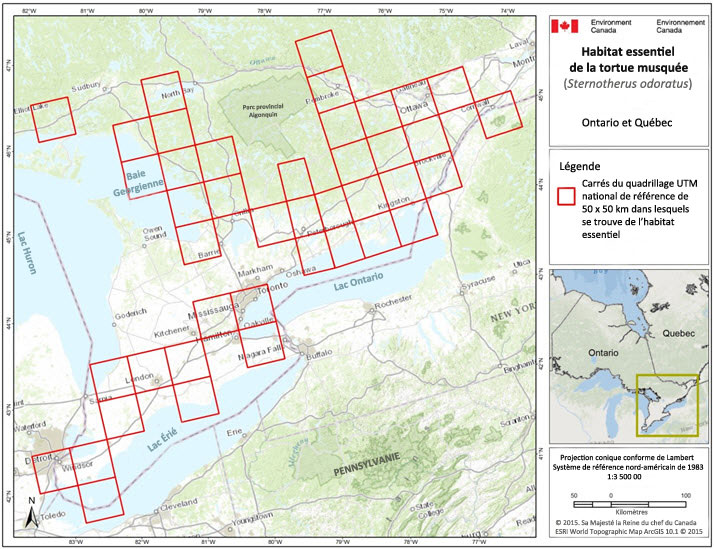
Description longue de la figure 3
La figure 3 représente une carte du sud est de l'Ontario à laquelle sont superposées des mailles de grille normalisée de 50 × 50 km qui contiennent l'habitat essentiel de la tortue musquée. L'habitat essentiel est présent aux endroits où les critères de désignation sont respectés. On trouve un site représenté par 1 maille de grille à proximité de Sudbury et d'Elliot Lake. Un autre site est formée de 9 mailles à la baie Georgienne, et s'étend de North Bay vers le sud jusqu'à Barrie, et du milieu de la baie Georgienne vers l'est jusqu'aux environs de Kearney. À proximité du lac Ontario, on trouve 21 mailles qui couvrent la zone entre le nord de Pembroke et le milieu du lac Ontario, au sud, et entre Cornwall, à l'est, et Peterborough, à l'ouest. Dans la zone terrestre située entre les lacs Érié et Huron se trouvent 11 mailles, soit dans le secteur qui s'étend jusqu'à Detroit et Windsor au sud ouest et jusqu'à Toronto et Niagara Falls au nord est, et qui descend jusqu'au milieu du lac Érié.
La désignation de l'habitat essentiel de la tortue musquée dans le présent programme de rétablissement est considérée comme partielle parce qu'on ne sait pas si l'habitat essentiel désigné est suffisant pour atteindre les objectifs en matière de population et de répartition de l'espèce (voir la section 5). Il y a des localités (p. ex. occurrences d'élément existantes ou historiques) qui pourraient encore abriter la tortue musquée mais pour lesquelles il y a un manque de certitude entourant les données, ou des ententes d'échange de données seraient nécessaires pour compléter la désignation de l'habitat essentiel. Des études sont nécessaires pour confirmer si ces zones contribuent à la viabilité globale des populations locales.
| Description de l'activité | Justification | Échéance |
|---|---|---|
| Confirmer l'occupation de l'habitat dans les localités où les observations de la tortue musquée sont imprécises sur le plan spatial ou ne peuvent être associées à des lieux précis. | Cette activité est nécessaire pour compléter la désignation de l'habitat essentiel. | 2016-2026 |
| Réaliser des relevés de la population et des évaluations de l'habitat aux sites historiques pour confirmer la présence de l'espèce dans les zones où les relevés ont été insuffisants. | Il est nécessaire d'obtenir de l'information indiquant s'il y a présence récente de l'espèce (y compris nidification) pour soutenir la désignation de l'habitat essentiel (c.-à-d. détermination de l'occupation de l'habitat). | 2016-2026 |
La compréhension de ce qui constitue la destruction de l'habitat essentiel est nécessaire à la protection et à la gestion de cet habitat. La destruction est déterminée au cas par cas. On peut parler de destruction lorsqu'il y a dégradation d'un élément de l'habitat essentiel, soit de façon permanente ou temporaire, à un point tel que l'habitat essentiel n'est plus en mesure d'assurer ses fonctions lorsque exigé par l'espèce. La destruction peut découler d'une activité unique à un moment donné ou des effets cumulés d'une ou de plusieurs activités au fil du temps.
La destruction de l'habitat essentiel de la tortue musquée peut avoir lieu à diverses échelles géographiques et dans des milieux aquatiques et terrestres. Elle peut résulter d'une activité ayant lieu à l'intérieur ou à l'extérieur des limites de l'habitat essentiel, et peut survenir durant toute l'année. À l'intérieur des limites de l'habitat essentiel, certaines activités peuvent avoir des conséquences sur les habitats offrant à l'espèce des conditions convenant à la reproduction, à la nidification, à l'alimentation, à la thermorégulation ou à l'hivernage. Certaines activités peuvent aussi avoir un effet négatif sur les corridors de dispersion et de déplacements locaux qui relient ces habitats. Dans ces corridors, il est très important de maintenir la perméabilité de l'habitat (permettant le déplacement des tortues dans cet habitat connectif pour accéder à de l'habitat convenable adjacent). De fait, certaines activités qui pourraient causer la destruction de l'habitat convenable pour l'alimentation, la reproduction, la nidification, l'hivernage et la thermorégulation pourraient ne pas entraîner de destruction dans les corridors, pour autant que la perméabilité de l'habitat y demeure suffisante. Les activités qui ont lieu à l'extérieur de l'habitat essentiel sont moins susceptibles d'entraîner la destruction d'habitat essentiel que celles qui ont lieu à l'intérieur.
Les activités décrites au tableau 6 sont des exemples d'activités susceptibles de causer la destruction de l'habitat essentiel de l'espèce, mais les activités destructrices ne se limitent pas nécessairement à celles-ci.
| Description de l'activité | Description des effets | Endroit de l'activité susceptible de détruire l'habitat essentiel À l'intérieur de l'unité d'habitat essentiel Habitat de nidification, d'alimentation, de reproduction, d'hivernage OU de thermorégulation |
Endroit de l'activité susceptible de détruire l'habitat essentiel À l'extérieur de l'unité d'habitat essentiel Habitat de déplacement |
Endroit de l'activité susceptible de détruire l'habitat essentiel À l'extérieur de l'unité d'habitat essentiel |
|---|---|---|---|---|
| Activités qui entraînent le drainage ou le remblayage de milieux humides | Le drainage ou le remblayage complet ou partiel de milieux humides à tout moment de l'année peuvent vraisemblablement causer la perte ou la dégradation permanente ou temporaire de l'habitat de thermorégulation, d'hivernage, de reproduction, de nidification, d'alimentation et de déplacement. Même des activités réalisées à l'extérieur des limites de l'habitat essentiel peuvent indirectement causer le drainage de milieux humides qui constituent un élément de l'habitat essentiel. Si ces activités devaient survenir à l'extérieur des limites de l'habitat essentiel, elles pourraient causer la destruction ou la dégradation de l'habitat essentiel si les caractéristiques des milieux humides qui contribuent au caractère convenable de l'habitat essentiel ne sont pas maintenues (p. ex. caractéristiques hydrologiques de l'habitat essentiel). Un seul événement pourrait causer la destruction de l'habitat essentiel. | X | X | X |
| Activités comme le développement résidentiel et/ou industriel; conversion d'habitat pour l'agriculture | La conversion complète ou partielle de l'habitat aquatique (p. ex. milieux humides) ou terrestre à d'autres fins (p. ex. développement, agriculture) à tout moment de l'année peut entraîner la perte ou la dégradation permanente de l'habitat de thermorégulation, d'hivernage, d'accouplement, de nidification et/ou d'alimentation. Une telle conversion peut également éliminer ou dégrader l'habitat de déplacement, ce qui peut réduire l'accès à des zones importantes (p. ex. sites de nidification) ainsi qu'isoler des populations. Si ces activités devaient survenir à l'extérieur des limites de l'habitat essentiel, elles pourraient causer la destruction indirecte de l'habitat essentiel si les caractéristiques qui contribuent au caractère convenable de l'habitat essentiel ne sont pas maintenues (p. ex. caractéristiques hydrologiques de l'habitat essentiel). À l'heure actuelle, toutes les activités de ce type survenant à l'intérieur des limites de l'habitat essentiel risquent de provoquer la destruction de l'habitat essentiel. Un seul événement pourrait causer la destruction de l'habitat essentiel. | X | X | X |
| Altération des rives (p. ex. modification du profil, linéarisation ou durcissement des rives de cours d'eau, enlèvement de la végétation) | La modification de la structure et de la composition des rives/berges (p. ex. enlèvement excessif de la végétation indigène, ajout de matériaux de stabilisation tels que du béton) à tout moment de l'année peut créer des conditions non convenables permanentes pour l'habitat de nidification, de thermorégulation, d'hivernage et d'alimentation. Le durcissement des rives peut également entraver les déplacements. Un seul événement pourrait causer la destruction de l'habitat essentiel. Ces activités devraient survenir à l'intérieur des limites de l'habitat essentiel pour avoir des incidences sur celui-ci. À l'heure actuelle, toutes les activités d'aménagement des rives à l'intérieur des limites de l'habitat essentiel risquent de provoquer la destruction de l'habitat essentiel. | X | X | - |
| Activités qui altèrent l'écoulement des eaux et/ou fragmentent l'habitat aquatique, comme la construction et l'exploitation d'ouvrages de régularisation des eaux | L'altération/interruption de l'écoulement des eaux, liée par exemple à la construction et à l'exploitation de barrages ou d'autres ouvrages de régularisation des eaux, peut mener à la dégradation ou à l'élimination temporaire ou permanente de l'habitat de nidification, d'hivernage, d'alimentation et de thermorégulation. La stabilisation des niveaux d'eau peut diminuer de façon permanente la disponibilité d'habitat de plaine inondable (p. ex. milieux humides, zones riveraines ouvertes) duquel dépend la tortue musquée pour l'hivernage, la nidification, l'alimentation et/ou la thermorégulation. Les niveaux d'eau élevés peuvent saturer les substrats de l'habitat de nidification, ce qui peut affecter la possibilité d'une utilisation fructueuse du site. En revanche, la récurrence de faibles niveaux d'eau peut favoriser la croissance de végétation dans les sites de ponte, empêchant ainsi les tortues d'y déposer leurs œufs. Il peut y avoir destruction de l'habitat d'hivernage si la profondeur de l'eau est altérée au point où les exigences en matière d'habitat d'hivernage ne sont plus comblées. De plus, la construction et l'exploitation d'ouvrages de régularisation des eaux est susceptible de créer un obstacle aux déplacements de la tortue musquée, d'où une fragmentation de l'habitat qui empêche l'espèce d'accéder à des zones d'habitat convenable dans le domaine vital et de se disperser vers des populations adjacentes. La construction et l'exploitation d'ouvrages de régularisation des eaux à l'intérieur et à l'extérieur des limites de l'habitat essentiel pourraient entraîner la destruction de celui-ci si les niveaux d'eau qui contribuent au caractère convenable de l'habitat essentiel ne sont pas maintenus (c.-à-d. caractéristiques hydrologiques de l'habitat essentiel). Il y a un risque accru que de telles activités causent la destruction de l'habitat essentiel durant les périodes de nidification et d'hivernage. De nouvelles études s'imposent pour établir les seuils/conditions à partir desquels les activités de ce type à l'intérieur et à l'extérieur des limites de l'habitat essentiel risquent de provoquer la destruction de l'habitat. |
X | X | X |
| Construction de routes et de ponts | La construction de routes et de ponts à tout moment de l'année peut mener à la dégradation ou à la destruction permanente de l'habitat de nidification, d'hivernage ou de déplacement. Si la construction d'ouvrages de franchissement de plans d'eau (ponceaux, ponts, etc.) est effectuée en hiver, elle pourrait avoir des conséquences négatives sur les sites d'hivernage du fait de l'utilisation de batardeaux pour retirer l'eau d'une zone et de l'utilisation de machinerie lourde qui peut affecter l'habitat convenable sous la laisse des hautes eaux. La construction de routes peut aussi empêcher les déplacements locaux de l'espèce (p. ex. accès aux sites de pontes). Un seul événement pourrait causer la destruction de l'habitat essentiel. De telles activités devraient avoir lieu à l'intérieur des limites de l'habitat essentiel pour avoir des incidences sur celui-ci. Les routes et les ponts existants ne sont pas inclus dans la description de l'habitat essentiel, ce qui fait que la poursuite des activités d'entretien des routes et des ponts ne devrait pas entraîner la destruction de l'habitat essentiel. | X | X | - |
| Activités qui causent la dégradation de la qualité de l'eau | Les rejets de déchets liquides ou solides résidentiels, commerciaux, industriels ou municipaux dans l'eau font partie des activités qui pourraient contaminer l'eau avec des produits chimiques et biologiques dangereux ou des métaux lourds, ou encore conduire à l'eutrophisation. Les activités menant à l'envasement ou au ruissellement de pesticides et d'engrais (p. ex. activités agricoles) peuvent également causer la dégradation de la qualité de l'eau. La dégradation de la qualité de l'eau et/ou la réduction des concentrations d'oxygène (création de conditions anoxiques) dans l'habitat aquatique à l'intérieur ou à l'extérieur des limites de l'habitat essentiel à tout moment de l'année pourraient altérer ou détruire de façon permanente ou temporaire l'habitat d'alimentation, d'hivernage et de thermorégulation. Des épisodes continus, sporadiques ou récurrents de tels rejets pourraient mener à la destruction de l'habitat. Des études s'imposent pour établir les seuils/conditions pour ces activités. | X | - | X |
| Activités qui entraînent l'introduction d'espèces exotiques et/ou envahissantes (p. ex. plantation de plantes non indigènes, déplacement de remblai) | L'introduction d'espèces exotiques et/ou envahissantes peut entraîner la dégradation ou la perte totale de l'habitat du fait d'une réduction de l'habitat de nidification, de thermorégulation, d'alimentation, d'hivernage et de déplacement. Par exemple, des peuplements denses de roseaux communs, espèce non indigène, peuvent envahir les sites de nidification et, ainsi, empêcher les tortues d'y déposer leurs œufs et/ou empêcher leurs déplacements entre les habitats de nidification, d'hivernage ou d'alimentation. Ces peuplements peuvent également diminuer l'exposition au soleil, modifiant ainsi l'habitat de thermorégulation. De tels peuplements peuvent aussi envahir les milieux humides et modifier les sites d'hivernage et/ou empêcher les tortues de pouvoir trouver leur nourriture facilement. Un seul événement à l'intérieur ou à proximité des limites de l'habitat essentiel pourrait causer sa destruction parce que, une fois les graines introduites, la propagation de l'espèce envahissante peut être rapide. | X | X | X |
L'indicateur de rendement présenté ci-dessous constitue un moyen de déterminer et de mesurer les progrès accomplis vers l'atteinte de l'objectif en matière de population et de répartition.
Indicateurs de rendement :
- L'abondance et la zone d'occupation de la population canadienne de tortues musquées sont maintenues ou augmentées afin de favoriser la persistance de populations locales autosuffisantes dans les régions où l'espèce est présente.
Un ou plusieurs plans d'action visant la tortue musquée seront affichés dans le Registre public des espèces en péril d'ici décembre 2023.
En raison de la vulnérabilité de certaines espèces à la capture illégale, les références précises fournissant de l'information sensible ont été retirées de la présente version du programme de rétablissement. À des fins de protection de l'espèce et de son habitat, la liste exhaustive des références peut être demandée, sur justification, auprès de la section Planification du rétablissement d'Environnement Canada à l'adresse ec.planificationduretablissement-recoveryplanning.ec@canada.ca.
Andrews, K. M., J.W. Gibbons et D.M. Jochimsen. 2006. Literature synthesis of the effects of roads and vehicles on amphibians and reptiles. Federal Highway Administration, U.S. Department of Transportation, Report No. FHWA-HEP-08-005. Washington, D.C. 151 p.
Aresco, M.J. 2005. The effect of sex-specific terrestrial movements and roads on the sex ratio of freshwater turtles. Biological Conservation 123:37-44.
Ashley, P.E., A. Kosloski et S.A. Petrie. 2007. Incidence of intentional vehicle-reptile collisions. Human Dimensions of Wildlife 12:137-143.
Atlas des amphibiens et des reptiles du Québec. 2013. Données de l'Atlas des amphibiens et des reptiles du Québec. [consulté en janvier 2013].
Bancroft G.T., Godley J.S., Gross D.T., Rojas N.N., Sutphen D.A et McDiarmud R.W. 1983. The herpetofauna of Lake Conway: species accounts. U.S. Army Corps Eng., Misc. Pap., A-83-5:164207.
Barko, V.A., J.T. Briggler et D.E. Ostendorf. 2004. Passive fishing techniques: a cause of turtle mortality in the Mississippi River. Journal of Wildlife Management 68:1145-1150.
Behler, J.L. et F. W. King. 2002. The Audubon Society Field Guide to North American Reptiles and Amphibians. Chanticleer Press, Inc. New York.
Bell, N., E. Conroy, K. Wheatley, B.Michaud, C. Maracle, J. Pelletier, B. Filion, B. Johnson. 2010. The ways of knowing guide. Toronto Zoo. Gage Printing.
Belleau, P. 2008. Habitat selection, movement patterns, and demography of common musk turtles (Sternotherus odoratus) in southwestern Quebec. Mémoire de maîtrise, Université McGill, 71 p.
Belleau, P. Données inédites.
Bennett, A.M., M. Keevil et J.D. Litzgus. 2010. Spatial ecology and population genetics of Northern Map Turtles (Graptemys geographica) in fragmented and continuous habitats in Canada. Chelonian Conservation and Biology 9(2):185-195.
Bennett, A. M. et J. D. Litzgus. 2014. Injury Rates of Freshwater Turtles on a Recreational Waterway in Ontario, Canada. Journal of Herpetology. Sous presse.
Bishop, C.A., P. Ng, K.E. Pettit, S.W. Kennedy, J.J. Stegeman, R.J. Norstrom et R.J. Brooks. 1998. Environmental contamination and developmental abnormalities in eggs and hatchlings of the common Snapping Turtle (Chelydra serpentina serpentina) from the Great Lakes-St. Lawrence River basin (1989-1991). Environmental Pollution 101:143-156.
Bishop, B.E., B.A. Savitzky, T. Abel-Fattah. 2010. Lead bioaccumulation in emydid turtles of an urban lake and its relationship to shell disease. Ecotoxicology and Environmental Safety 73(4):565-571.
Bleakney, J.S. 1958. A zoogeographical study of the amphibians and reptiles of eastern Canada. National Museum of Canada Bulletin 155:1-119.
Bodie, J.R. 2001. Stream and riparian management for freshwater turtles. Journal of Environmental Management 62, 443-455p.
Borkowski, R. 1997. Lead poisoning and intestinal perforations in a Snapping Turtle (Chelydra sepentina) due to fishing gear ingestion. Journal of Zoo and Wildlife Medicine. 28:109-113.
Brooks, R.J. 2007. The biology, status and conservation of Canadian freshwater turtles. In : Seburn C.N.L., Bishop C.A., editors. Ecology, conservation and status of reptiles in Canada. Herpetological Conservation, Vol. 2. Salt Lake City, Utah, Society for the Study of Amphibians and Reptiles. P. 57-84.
Brooks, R.J. 2012. Comm. pers. In : COSEWIC. 2012. Update COSEWIC Status Report on Eastern Musk Turtle Sternotherus odoratus in Canada. Prepared for the Committee on the Status of Endangered Wildlife in Canada. Ottawa xiii + 76 p. (Également disponible en français : COSEPAC. 2012. Évaluation et Rapport de situation du COSEPAC sur la Tortue musquée (Sternotherus odoratus) au Canada. Comité sur la situation des espèces en péril au Canada. Ottawa. xvi + 76 p.)
Bulté, G. et G. Blouin-Demers. 2010a. Estimating the energetic significance of basking behaviour in a temperate-zone turtle. Ecoscience 17(4):387-393.
Bulté, G et G. Blouin-Demers. 2010b. Implications of extreme sexual size dimorphism for thermoregulation in a freshwater turtle. Oecologia 162(2):313-322.
Bulté, G., M.-A. Carrière et G. Blouin-Demers. 2010. Impact of recreational power boating on two populations of northern map turtles (Graptemys geographica). Aquatic Conservation: Marine and Freshwater Ecosystems 20:31-38.
Burger, J. et Garber, S.D. 1995. Risk assessment, life history strategies, and turtles: could declines be prevented or predicted. Journal of Toxicology and Environmental Health, 46:483-500.
Bush, E.R., Baker, S.E. et MacDonald, D.W. 2014. Global Trade in Exotic Pets 2006–2012. Conservation Biology 28(3):663–676.
Cadi, A. et P. Joly. 2003. Competition for basking places between the endangered European pond turtle (Emys orbicularis galloitalica) and the introduced red-eared slider (Trachemys scripta elegans). Canadian Journal of Zoology 81(8):1392-1398.
Cadi, A. et P. Joly. 2004. Impact of the introduction of the red-eared slider (Trachemys scripta elegans) on survival rates of the European pond turtle (Emys orbicularis). Biodiversity & Conservation 13(13):2511-2518.
Caron, J. 2010. Inventaire faunique multispécifique de la rivière des Outaouais de Portage-du-Fort à Norway Bay en juillet 2010. Ministère des Ressources naturelles et de la Faune, Direction de l'expertise Faune-Forêts de l'Outaouais, rapport interne. Gatineau. 3 p.
Carpenter, S., N.F. Caraco, D.L. Correll, R.W. Howarth, A.N. Sharpley et V.H. Smith. 1998. Nonpoint Pollution of Surface Waters with Phosphorus and Nitrogen. Issues in Ecology N3, 12p .
Carr, A. 1952. Handbook of Turtles. Comstock, Ithica, New York. 542 p.
Carrière, M.-A. et G. Blouin-Demers. 2010. Habitat selection at multiple spatial scales in Northern Map Turtles (Graptemys geographica). Canadian Journal of Zoology 88:846-854 (comprend un résumé en français).
Centre de données sur le patrimoine naturel du Québec (CDPNQ). 2012.
Chabot, J. et D. St-Hilaire, 1991. Première mention de la tortue musquée, Sternotherus odoratus, au Québec. Canadian Field-Naturalist 105:411-412.
Congdon, J.D., A.E. Dunham et R.C. van Loben Sels. 1993. Delayed sexual maturity and demographics of Blanding's turtles (Emydoidea blandingii): implications for conservation and management of long-lived organisms. Conservation Biology 7:826-833.
Congdon, J.D., A.E. Dunham et R.C. van Loben Sels. 1994. Demographics of common snapping turtles (Chelydra serpentina): implications for conservation and management of long-lived organisms. American Zoologist 34:397-408.
COSEWIC. 2002. COSEWIC assessment and status report on the stinkpot Sternotherus odoratus in Canada. Committee on the Status of Endangered Wildlife in Canada. Ottawa. vi + 18p (Également disponible en français : COSEPAC. 2002. Évaluation et Rapport de situation du COSEPAC sur la tortue musquée (Sternotherus odoratus) au Canada. Comité sur la situation des espèces en péril au Canada. Ottawa. vi + 19 p.)
COSEWIC. 2009. Guidelines for use of the Index of Area of Occupancy (IAO) in COSEWIC Assessments [consulté en juin 2014] (Également disponible en français : COSEPAC. 2009. Lignes directrices sur l'utilisation de l'indice de zone d'occupation (IZO) dans les évaluations du COSEPAC.)
COSEWIC. 2012. Update COSEWIC Status Report on Eastern Musk Turtle Sternotherus odoratus in Canada. Prepared for the Committee on the Status of Endangered Wildlife in Canada. Ottawa xiii + 76 p. (Également disponible en français : COSEPAC. 2012. Évaluation et Rapport de situation du COSEPAC sur la Tortue musquée (Sternotherus odoratus) au Canada. Comité sur la situation des espèces en péril au Canada. Ottawa. xvi + 76 p.)
Courchamp, F., Angulo, E., Rivalan, P., Hall, R.J. et Signoret, L. 2006. Rarity value and species extinction: The anthropogenic Allee effect. PLoS Biol 4(12): e415. DOI: 10.1371/journal.pbio.0040415
Crowley, J.F., Brooks, R.J. 2005. Protected areas and the conservation of Ontario's reptile species at risk: safe havens or false hopes? Proc. Ontario. Parks Research Forum 8:10-17.
Crowley, J. Comm. pers. 2012. Information reçue par le Service canadien de la faune – Ontario par le biais d'une évaluation technique. Species at Risk Herpetology Specialist. Ministère des Richesses naturelles et des Forêts, Peterborough, Ontario.
Crowley, J. Comm. pers. 2013. Information reçue par le Service canadien de la faune – Ontario par le biais d'une évaluation technique. Species at Risk Herpetology Specialist. Ministère des Richesses naturelles et des Forêts, Peterborough, Ontario.
Cunnington, D.C. et R.J. Brooks. 1996. Bet-hedging theory and eigenelasticity: a comparison of the life histories of loggerhead sea turtles (Caretta caretta) and snapping turtles (Chelydra serpentina). Canadian Journal of Zoology 74:291-296 (comprend un résumé en français).
Daszak, P., A.A. Cunningham et A.D. Hyatt. 2000. Emerging infectious diseases of wildlife - Threats to biodiversity and human health. Science 287:443-449.
DeCatanzaro, R. et P. Chow-Fraser. 2010. Relationship of road density and marsh condition to turtle assemblage characteristics in the Laurentian Great Lakes. Journal of Great Lakes Research 36(2):357-365.
Desrosiers, A. et S. Giguère. 2008. Inventaire de la tortue musquée (Sternotherus odoratus) dans le tronçon Waltham – Gatineau de la rivière des Outaouais au printemps 2007. Ministère des Ressources naturelles et de la Faune, Faune Québec et Environnement Canada, Service canadien de la faune, Région du Québec, 42 p.
Edmonds, J.H. 1998. Population ecology of the stinkpot turtle (Sternotherus odoratus) in Georgian Bay, Ontario. Mémoire de maîtrise, University of Guelph, Guelph, Ontario, Canada. viii + 108 p.
Edmonds, J. 2002. COSEWIC status report on the stinkpot Sternotherus odoratus in Canada, in COSEWIC assessment and status report on the stinkpot Sternotherus odoratus in Canada. Committee on the Status of Endangered Wildlife in Canada. Ottawa. 1-18 p. (Également disponible en français : Edmonds, J. 2002. Évaluation et Rapport de situation du COSEPAC sur la tortue musquée (Sternotherus odoratus) au Canada. Comité sur la situation des espèces en péril au Canada. Ottawa. Pages 1-19.)
Équipe de rétablissement des tortues du Québec. 2005. Plan de rétablissement de cinq espèces de tortues au Québec pour les années 2005 à 2010 : la tortue des bois (Glyptemys insculpta), la tortue géographique (Graptemys geographica), la tortue mouchetée (Emydoidea blandingii), la tortue musquée (Sternotherus odoratus) et la tortue ponctuée (Clemmys guttata). Ministère des Ressources naturelles et de la Faune, Québec. 57 p.
Équipe de rétablissement des tortues du Québec. Données inédites.
Ernst, C.H. 1968. Evaporative water-loss relationships of turtles. Journal of Herpetology 2(3/4):159-161.
Ernst, C.H. 1986. Ecology of the turtle, Sternotherus odoratus, in southeastern Pennsylvania. Journal of Herpetology 20:341-352.
Ernst, C.H., T.S.B. Akre, J.C. Wilgenbusch, T.P. Wilson et K. Mills. 1999. Shell disease in turtles in the Rappanock River, Virginia. Herpetological Review 30:214-215.
Ernst, C.H. et J.E. Lovich. 2009. Turtles of the United States and Canada. Second edition. Johns Hopkins University Press, Baltimore.
Ewert, M.A. (1979) The embryo and its eggs: Development and Natural History. Les références dans Harless, M. et Morlock, H. (eds) Turtles Perspectives and research, John Wiley & Sons, 695 p.
Expert Panel on Climate Change Adaptation. 2009. Adapting to Climate Change in Ontario: Towards the Design and Implementation of a Strategy and Action Plan. Report to the Minister of the Environment, Queen's Press for Ontario, November 2009. 88 p. (Également disponible en français : Comité d'experts sur l'adaptation au changement climatique. 2009. L'adaptation au changement climatique en Ontario : vers la conception et la mise en oeuvre d'une stratégie et d'un plan d'action. Ministère de l'Environnement de l'Ontario, Toronto. 101 p.)
Fenech, A., B. Taylor, R. Hansell et G. Whitelaw. 2005. Major road changes in southern Ontario 1935-1995: Implications for protected areas. www.utoronto.ca/imap/papers/major_road_changes.pdf.
Ford, D.K. et D. Moll. 2004. Sexual and seasonal variation in foraging patterns in the stinkpot, Sternotherus odoratus, in southwestern Missouri. Journal of Herpetology 38(2):296-301.
Frankham, R. 1995. Conservation genetics. Annual Review of Genetics 29:305-327.
Gelbard, J. L. et J. Belnap. 2003. Roads as conduits for exotic plant invasions in a semiarid landscape. Conservation Biology, 17(2), 420-432.
Gibbons, J.W., D.E. Scott, T.J. Ryan, K.A. Buhlmann, T.D. Tuberville, B.S. Metts, J.L. Greene, T. Mills, Y. Leiden, S. Poppy et C.T. Winne. 2000. The global decline of reptiles, déjà vu amphibians. BioScience 50:653-666.
Gibbs, J.P. et D.A. Steen. 2005. Trends in sex ratios of turtles in the United States: implications of road mortality. Conservation Biology 19:552-556.
Giguère, S. Données inédites.
Giguère, S. Comm. pers. 2015. Information reçue par le Service canadien de la faune – Ontario par le biais d'une évaluation technique. Biologiste du rétablissement des espèces en péril. Service canadien de la faune – Québec.
Gillingwater, S.D. 2008. Science, education and sympathy, a strategy for successful stewardship of turtles in Ontario. Turtle Stewardship and Management Workshop, Scarborough, Ontario.
Gillingwater, S.D. Comm. pers. 2012. Information reçue par le Service canadien de la faune – Ontario par le biais d'une évaluation technique. Biologiste du rétablissement des espèces en péril. Upper Thames River Conservation Authority, London, Ontario.
Gillingwater, S.D. Données inédites. In : COSEWIC. 2012. Update COSEWIC Status Report on Eastern Musk Turtle Sternotherus odoratus in Canada. Prepared for the Committee on the Status of Endangered Wildlife in Canada. Ottawa xiii + 76 p. (Également disponible en français : COSEPAC. 2012. Évaluation et Rapport de situation du COSEPAC sur la Tortue musquée (Sternotherus odoratus) au Canada. Comité sur la situation des espèces en péril au Canada. Ottawa. xvi + 76 p.)
Government of Canada. 2009. Species at Risk Act Policies, Overarching Policy Framework [Draft]. Species at Risk Act Policy and Guidelines Series. Environment Canada. Ottawa. 38 p. (Également disponible en français : Gouvernement du Canada. 2009. Politiques de la Loi sur les espèces en péril, Cadre général de politiques [ébauche], Loi sur les espèces en péril, Séries de politiques et de lignes directrices, Environnement Canada, Ottawa, 42 p.)
Gray, E.M. 1995. DNA Fingerprinting Reveals a Lack of Genetic Variation in Northern Populations of the Western Pond Turtle (Clemmys marmorata). Conservation Biology 9(5):1244-1255.
Harding, J.H. 1997. Amphibians and Reptiles of the Great Lakes Region. Univ. of Mich. Press, Ann Arbor, MI. 378 p.
Harestad, A.S. et F.L. Bunnell. 1979. Home range and body weight - a reevaluation. Ecology 60:389-402.
Haxton, T. 2000. Road mortality of snapping turtles, Chelydra serpentina, in central Ontario during their nesting period. Canadian Field-Naturalist 114:106-110.
Hogan, L.S., E. Marschall, C. Folt et R.A. Stein. 2007. How non-native species in Lake Erie influence trophic transfer of mercury and lead to top predators. Journal of Great Lakes Research 33(1):46-61.
Horne, B.D., R.J. Brauman, M.J. C. Moore et R.A. Seigel. 2003. Reproductive and nesting ecology of the yellow-blotched map turtle, Graptemys flavimaculata: implications for conservation and management. Copeia 2003:729-738.
IUCN Standards and Petitions Subcommittee. 2014. Guidelines for Using the IUCN Red List Categories and Criteria. Version 11. Prepared by the Standards and Petitions Subcommittee. On peut télécharger le document à partir du site suivant : PDF.
Iverson, J.B. et Meshaka, W.E. 2006. Sternotherus odoratus - Common Musk Turtle or Stinkpot. In : P.A. Meylan (ed.), Biology and Conservation of Florida Turtles, p. 201-223. Chelonian research Foundation, Lunenburg, MA.
Janzen, F.J. 1994. Climate change and temperature-dependant sex determination in reptiles. Proceedings of the National Academy of Sciences of the United States of America 91(16):7487-7490.
Kawartha Turtle Trauma Centre. 2014. [consulté en juillet 2014].
Laroque, S.M., P. Watson, G. Blouin-Demers et S.J. Cooke. 2012a. Accidental Bait: Do deceased fish increase freshwater turtle bycatch in commercial fyke nets? Environmental Management 50:31-38.
Larocque, S.M., Colotelo, A.H., Cooke, S.J., Blouin-Demers, G., Haxton, T. et Smorowski, K.E. 2012b. Seasonal patterns in bycatch composition and mortality associated with a freshwater hoop net fishery. Animal Conservation 15:53-60.
Laverty, J.F. 2010. Measuring the effects of water-based recreation on turtle populations in an Ontario Park. Mémoire de maîtrise, Université Laurentienne, Sudbury, Ontario, Canada. xv + 131 p.
Lemmen, D.S., F.J. Warren, J. Lacroix et E. Bush (eds). 2008. From Impacts to Adaptation: Canada in a Changing Climate. Government of Canada, Ottawa, 448 p. (Également disponible en français : Lemmen, D.S., F.J. Warren, J. Lacroix et E. Bush (dir.). 2008. Vivre avec les changements climatiques au Canada : édition 2007. Gouvernement du Canada, Ottawa, 448 p.)
Lester, L.A., Avery, H.W., Harrison A.S., Standora E.A. 2013. Recreational Boats and Turtles: Behavioral Mismatches Result in High Rates of Injury. PLoS ONE 8(12): e82370. doi: 10.1371/journal.pone.0082370
Lindsay, R.V. 1965. Egg-laying habits of the musk turtle. Ontario Field Biologist 19:9-10.
Litzgus, J.D., J.P. Costanzo, R.J. Brooks et R.E. Lee, Jr. 1999. Phenology and ecology of hibernation in spotted turtles (Clemmys guttata) near the northern limit of their range. Canadian Journal of Zoology 77:1348-1357 (comprend un résumé en français).
Mahmoud, I.Y. 1969. Comparative ecology of the Kinosternid turtles of Oklahoma. Southwestern Naturalist 14(1):31-66.
Mali, I., Vandewege, M.W., Davis, S.K., Forstner, M.R.J. 2014. Magnitude of the Freshwater Turtle Exports from the US: Long Term Trends and Early Effects of Newly Implemented Harvest Management Regimes. PLoS ONE 9(1): e86478. doi:10.1371/journal.pone.0086478.
Marchand, M.N., J.A. Litvaitis, T.J. Maier et R.M. DeGraaf. 2002. Use of artificial nests to investigate predation on freshwater turtle nests. Wildlife Society Bulletin 30(4):1092-1098.
Marchand, M.N. et J.A. Litvaitis. 2004. Effects of habitat features and landscape composition on the population structure of a common aquatic turtle in a region undergoing rapid development. Conservation Biology 18:758-767.
McKenney, D.W., B.G. Mackey, J.P. Bogart, J.E. McKee, M.J. Oldham et A. Check. 1998. Bioclimatic and spatial analysis of Ontario reptiles and amphibians. Ecoscience 5(1):18-30 (comprend un résumé en français).
McPherson, R.J. et K.R. Marion. 1981. Seasonal testicular cycle of the stinkpot turtle (Sternotherus odoratus) in Central Alabama. Herpetologica 37(1):33-40.
Mendonça, M.T. 1987. Photothermal effects on the ovarian cycle of the Musk Turtle, Sternotherus odoratus. Herpetologica 43(1):82-90.
Midwood, J.D., Cairns, N.A., Stoot, L.J., Cooke, S.J. et Blouin-Demers, G. 2014. Bycatch mortality can cause extirpation in four freshwater turtle species. Aquatic Conserv: Mar. Freshw. Ecosyst. Sous presse. DOI: 10.1002/aqc.2475
Miller, V., comm. pers. 2012. In : COSEWIC. 2012. Update COSEWIC Status Report on Eastern Musk Turtle Sternotherus odoratus in Canada. Prepared for the Committee on the Status of Endangered Wildlife in Canada. Ottawa xiii +76p. (Également disponible en français : COSEPAC. 2012. Évaluation et Rapport de situation du COSEPAC sur la Tortue musquée (Sternotherus odoratus) au Canada. Comité sur la situation des espèces en péril au Canada. Ottawa. xvi + 76 p.)
Ministère des Forêts, de la Faune et des Parcs. 2014.
Ministère des Forêts, de la Faune et des Parcs (MFFP). Données inédites.
Mitchell, J.C. et M.W. Klemens. 2000. Primary and secondary effects of habitat alteration. In : M.W. Klemens (Ed.). Turtle Conservation. Smithsonian Institution Press, Washington, D.C. P. 5-32.
Moll, D. et E.O. Moll. 2004. The ecology, exploitation and conservation of river turtles. Oxford University Press, Oxford, UK, 393 p.
Moore, M.J.C. et R.A. Seigel. 2006. No place to nest or bask: effects of human disturbance on yellow-blotched map turtles (Graptemys flavimaculata). Biological Conservation 130:386-393.
Natural Heritage Information Centre (NHIC). 2012. Données brutes, jusqu'aux observations de 2012 concernant la tortue musquée, fournies par le Centre d'information sur le patrimoine naturel (CIPN) au Service canadien de la faune.
NatureServe. 2008. Eastern Musk Turtle Range Map. [consulté en septembre 2014].
NatureServe. 2013. [consulté en octobre 2013].
Ontario Ministry of Natural Resources (OMNR). 2010. Forest Management Guide for Conserving Biodiversity at the Stand and Site Scales. Toronto: Queen's Printer for Ontario. 211 p. (Également disponible en français : Ministère des Richesses naturelles de l'Ontario. Guide de gestion forestière pour la conservation de la biodiversité à l'échelle du peuplement et du site ou guide sur les peuplements et les sites.)
Ontario Ministry of Natural Resources (OMNR). 2013. Reptile and Amphibian Exclusion Fencing: Best Practices, Version 1.0. Species at Risk Branch Technical Note. Prepared for the Ontario Ministry of Natural Resources, Peterborough, Ontario. 11 p.
Ontario Ministry of Natural Resources (OMNR). 2014. Données inédites.
Ontario Nature. 2012. [consulté en décembre 2012].
Ontario Reptile and Amphibian Atlas. 2013. Data from Ontario Reptile and Amphibian Atlas Program. [consulté en janvier 2013].
Ontario Road Ecology Group. 2010. A Guide to Road Ecology in Ontario, prepared for the Environment Canada Habitat Stewardship Program for Species at Risk. PDF [consulté le 10 octobre 2014].
Patterson, J.C. et P.V. Lindeman. 2009. Effects of zebra and quagga mussel (Dreissena spp) invasion on the feeding habits of the stinkpot (Sternotherus odoratus) on Presque Isle, northwestern Pennsylvania. Northeastern Naturalist. 16:365-374.
Picard, G. 2008. Does thermal quality of the environment affect habitat selection by musk turtles (Sternotherus odoratus)?, mémoire de baccalauréat, Université d'Ottawa, Ottawa, Ontario, Canada. 55 p.
Picard, G., M.A. Carrière, G. Blouin-Demers. 2011. Common Musk Turtles (Sternotherus odoratus) select habitats of high thermal quality at the northern extreme of their range. Amphibia-Reptilia 32:83-92.
Raby, G.D., A.C. Colotelo, G. Blouin-Demers et S.J. Cooke. 2011. Freshwater commercial bycatch: an understated conservation problem. Bioscience 61:271-280.
Radomski P. et T.J. Goeman. 2001. Consequences of Human Lakeshore Development on Emergent and Floating-Leaf Vegetation Abundance. North American Journal of Fisheries Management. Vol 21:46-61.
Reed, D.H. et R. Frankham. 2003. Correlation between fitness and genetic diversity. Conservation Biology 17:230-237.
Risley, P.J. 1933. Observations on the natural history of the common musk turtle, Sternotherus odoratus. Papers of the Michigan Academy of Science, Arts, and Letters 17:685-711.
Riley, J. L. et Litzgus, J. D. 2013. Evaluation of predator-exclusion cages used in turtle conservation: cost analysis and effects on nest environment and proxies of hatchling fitness. Wildlife Research 40, 499–511.
Rizkalla, C.E. et R.K. Swihart. 2006. Community structure and differential responses of aquatic turtles to agriculturally induced habitat fragmentation. Landscape Ecology 21:1361–1375.
Rowe, J.W. 2003. Activity and movements of midland painted turtles (Chrysemys picta marginata) living in a small marsh system on Beaver Island, Michigan. J. Herpetol 37:342–353.
Rowe, J.W., G.C. Lehr, P.M. McCarthy et P.M. Converse. 2009. Activity, Movements and Activity Area Size in Stinkpot Turtles (Sternotherus odoratus) in a Southwestern Michigan Lake. The American Midland Naturalist. 162(2):266-275.
Saumure, R.A. 2009. Rapport sur la situation de la tortue musquée (Sternotherus odoratus) au Québec. Ministère des Ressources Naturelles et de la Faune du Québec, Direction du développement de la faune. 21 p.
Schneider, J.C. 1998. Fate of dead fish in a small lake. American Midland Naturalist. 140(1):192-196.
Seburn, D.C. 2007. Recovery Strategy for Species at Risk Turtles in Ontario. Ontario Multi-Species Turtles at Risk Recovery Team, 73 p.
Seburn, D.C. et C.N.L. Seburn. 2000. Conservation priorities for the amphibians and reptiles of Canada. Prepared for World Wildlife Fund Canada and Canadian Amphibian and Reptile Conservation Network. 92 p.
Slevan-Tremblay, G. 2013. Effects of mercury contamination on the immune system and on parasitism in painted turtles (Chrysemys picta). Mémoire de baccalauréat spécialisé en biologie. Université d'Ottawa, Ottawa, Ontario, Canada. 20 p.
Smith, G.R., J.B. Iverson et J.E. Rettig. 2006. Changes in a turtle community from a northern Indiana lake: a long-term study. Journal of Herpetology 40:180-185.
Steen, D.A. et J.P. Gibbs. 2004. Effects of roads on the structure of freshwater turtle populations. Conservation Biology 18:1143-1148.
Steen, D.A., M.J. Aresco, S.G. Beilke, B.W. Compton, E.P. Condon, C.K. Dodd Jr., H. Forrester, J.W. Gibbons, J.L. Greene, G. Johnson, T.A. Langen, M.J. Oldham, D.N. Oxier, R.A. Saumure, F.W. Shueler, J.M. Sleeman, L.L. Smith, J.K. Tucker et J.P. Gibbs. 2006. Relative vulnerability of female turtles to road mortality. Animal Conservation 9:269-273.
Steen D. A., J. P. Gibbs, K. A. Buhlmann, J. L. Carr, B. W. Compton, J. D. Congdon, J.S. Doody, J. C. Godwin, K. L. Holcomb, D. R. Jackson, F. J. Janzen, G., Johnson, M. T. Jones, J.T. Lamer, T. A. Langen, M. V. Plummer, J. W. Rowe, R. A. Saumure, J. K. Tucker et D. S. Wilson. 2012. Terrestrial habitat requirements of nesting freshwater turtles. Biological Conservation. 150:121-128.
Steen D.A., Hopkins B.C., Van Dyke J.U., Hopkins W.A. 2014. Prevalence of Ingested Fish Hooks in Freshwater Turtles from Five Rivers in the Southeastern United States. PLoS ONE 9(3): e91368. doi: 10.1371/journal.pone.0091368
Stockwell, C.A.; Hendry, A.P. et Kinnison, M.T. 2003. Contemporary evolution meets conservation biology. Trends in Ecology and Evolution 18(2):94-101.
Thomas E.S. et M.B. Trautman. 1937. Segregated hibernaculum of Sternotherus odoratus (Latreille). Copeia 1937(4): 231 In : COSEWIC. 2012. Update COSEWIC Status Report on Eastern Musk Turtle Sternotherus odoratus in Canada. Prepared for the Committee on the Status of Endangered Wildlife in Canada. Ottawa, xiii + 76 p. (Également disponible en français : COSEPAC. 2012. Évaluation et Rapport de situation du COSEPAC sur la tortue musquée (Sternotherus odoratus) au Canada. Comité sur la situation des espèces en péril au Canada. Ottawa. xvi + 76 p.)
Thompson, S. Comm. pers. In :Seburn, D.C. 2007. Recovery Strategy for Species at Risk Turtles in Ontario. Ontario Multi-Species Turtles at Risk Recovery Team, 73 p.
Tucker, John K., Dolan, Chad R., Lamer, James T. 2008. Sternotherus odoratus (Stinkpot) Minimum Size/ Growth. Herpetological Review 39 (1):83-84.
Turtle Conservation Fund. 2002. A global action plan for conservation of tortoises and freshwater turtles. Strategy and funding prospectus 2002-2007. Conservation International and Chelonian Research Foundation, Washington, D.C., 30 p.
Ultsch, G.R. 2006. The ecology of overwintering among turtles: where turtles overwinter and their consequences. Biological Reviews 81:339-367.
Ultsch, G.R. et D.C. Cochran. 1994. Physiology of northern and southern musk turtles (Sternotherus odoratus) during simulated hibernation. Physiological Zoology 67(1):263-281.
U.S. Fish and Wildlife Service. 2014. Exports on Spiny Softshell, Blanding's Turtle and Eastern Musk Turtle from 1999 to October 2014. U.S. Fish and Wildlife Service, Office of Law Enforcement – LEMIS (Law Enforcement Management Information System), Arlington, TX. (données inédites).
van Dijk, P.P. 2013. Sternotherus odoratus. The IUCN Red List of Threatened Species. Version 2014.2. (liste téléchargée le 24 juillet 2014.
Van Meter, R.J., J.R. Spotila et H.W. Avery. 2006. Polycyclic aromatic hydrocarbons affect survival and development of common snapping turtle (Chelydra serpentina) embryos and hatchlings. Environmental Pollution 142:466-475.
Zacher, G. Comm. pers. 2012. In : COSEWIC. 2012. Update COSEWIC Status Report on Eastern Musk Turtle Sternotherus odoratus in Canada. Prepared for the Committee on the Status of Endangered Wildlife in Canada. Ottawa xiii +76p. (Également disponible en français : COSEPAC. 2012. Évaluation et Rapport de situation du COSEPAC sur la tortue musquée (Sternotherus odoratus) au Canada. Comité sur la situation des espèces en péril au Canada. Ottawa. xvi + 76 p.)
| Cote mondiale (G) | Cote nationale (N) au Canada | Cotes infranationales (S) au Canada | Cote nationale (N) aux États-Unis | Cotes infranationales (S) aux États-Unis |
|---|---|---|---|---|
| G5 | N3 | Ontario (S3) Québec (S1) |
N5 | Alabama (S5), Arkansas (S5), Connecticut (S4), Delaware (S5), District de Columbia (S4), Floride (S5), Géorgie (S5), Illinois (S5), Indiana (S4), Iowa (S2), Kansas (S4), Kentucky (S5), Louisiane (S5), Maine (S3), Maryland (S5), Massachusetts (S4S5), Michigan (S5), Minnesota (SNR), Mississippi (S5), Missouri (S5), New Hampshire (S5), New Jersey (S5), État de New York (S5), Caroline du Nord (S5), Ohio (SNR), Oklahoma (S4), Pennsylvanie (S4), Rhode Island (S4), Caroline du Sud (SNR), Tennessee (S5), Texas (S5), Vermont (S2), Virginie (S5), Virginie-Occidentale (S5), Wisconsin (S4) |
Définitions des cotes (NatureServe, 2013)
S1 – Espèce gravement en péril : Espèce extrêmement susceptible de disparaître du territoire en raison d'une aire de répartition très limitée, d'un nombre très restreint de populations ou d'occurrences, de déclins très marqués, de menaces graves ou d'autres facteurs.
S2 – Espèce en péril : Espèce très susceptible de disparaître du territoire en raison d'une aire de répartition limitée, d'un nombre restreint de populations ou d'occurrences, de déclins marqués, de menaces graves ou d'autres facteurs.
N3/S3 – Espèce vulnérable : Espèce modérément susceptible de disparaître du territoire en raison d'une aire de répartition plutôt limitée, d'un nombre relativement faible de populations ou d'occurrences, de déclins récents et généralisés, de menaces ou d'autres facteurs.
S4 – Espèce apparemment non en péril : Espèce assez peu susceptible de disparaître du territoire en raison de la grande étendue de son aire de répartition ou du grand nombre de populations ou d'occurrences, mais pour laquelle il existe des sources de préoccupations en raison de déclins localisés récents, de menaces ou d'autres facteurs.
S4S5 – Espèce non en péril/apparemment non en péril : Espèce non susceptible à assez peu susceptible de disparaître du territoire en raison de sa grande à très vaste aire de répartition et de l'abondance de populations ou d'occurrences, et suscitant certaines préoccupations, pouvant être très peu importantes, en raison de déclins localisés récents, de menaces ou d'autres facteurs.
G5/N5/S5 – Espèce non en péril : Espèce très peu susceptible de disparaître du territoire en raison de la très vaste étendue de son aire de répartition ou de l'abondance de populations ou d'occurrences et ne suscitant aucune préoccupation associée à des déclins ou des menaces ou n'en suscitant que très peu.
SNR – Espèce non classée : Espèce dont le statut de conservation infranational n'a pas encore été évalué.
Une évaluation environnementale stratégique (ÉES) est effectuée pour tous les documents de planification du rétablissement en vertu de la LEP, conformément à La directive du Cabinet sur l'évaluation environnementale des projets de politiques, de plans et de programmes. L'objet de l'ÉES est d'incorporer les considérations environnementales à l'élaboration des projets de politiques, de plans et de programmes publics pour appuyer une prise de décision éclairée du point de vue de l'environnement et évaluer si les résultats d'un document de planification de rétablissement peuvent affecter un élément de l'environnement ou tout objectif ou cible de la Stratégie fédérale de développement durable (SFDD).
La planification du rétablissement vise à favoriser les espèces en péril et la biodiversité en général. Il est cependant reconnu que des programmes peuvent, par inadvertance, produire des effets environnementaux qui dépassent les avantages prévus. Le processus de planification fondé sur des lignes directrices nationales tient directement compte de tous les effets environnementaux, notamment des incidences possibles sur des espèces ou des habitats non ciblés. Les résultats de l'EES sont directement inclus dans le programme lui-même, mais également résumés dans le présent énoncé, ci-dessous.
Les activités entreprises pour protéger la tortue musquée et son habitat seront également bénéfiques à d'autres espèces qui utilisent un habitat similaire. La protection de l'habitat de milieux humides contribuera à maintenir la riche biodiversité soutenue par cet habitat. De plus, les mesures de réduction et d'atténuation des menaces pesant sur la tortue musquée peuvent contribuer à réduire la mortalité chez d'autres espèces (p. ex. utilisation d'écopassages pour réduire la mortalité sur les routes, mesures visant à éliminer la pollution des milieux aquatiques). Certaines de ces mesures se trouveront probablement aussi dans d'autres documents de rétablissement, notamment ceux qui traitent d'espèces aquatiques et riveraines. Le tableau B-1 présente des exemples d'espèces qui pourraient tirer avantage des mesures de rétablissement visant la population de tortues musquées au Canada.
| Nom commun | Nom scientifique | Statut en vertu de la LEP |
|---|---|---|
| Couleuvre fauve de l'Est | Pantherophis gloydi | En voie de disparition |
| Crapeau de Fowler | Anaxyrus fowleri | En voie de disparition |
| Râle élégant | Rallus elegans | En voie de disparition |
| Couleuvre d'eau du lac Érié | Nerodia sipedon insularum | En voie de disparition |
| Salamandre de Jefferson | Ambystoma jeffersonianum | En voie de disparition |
| Tortue mouchetée (population des Grands Lacs et du Saint-Laurent) | Emydoidea blandingii | Menacée |
| Petit Blongios | Ixobrychus exilis | Menacée |
| Couleuvre à nez plat | Heterodon platirhinos | Menacée |
| Tortue-molle à épines | Apalone spinifera | Menacée |
| Bec-de-lièvre | Exoglossum maxillingua | Menacée |
| Dard du sable | Ammocrypta pellucida | Menacée |
| Anguille d'Amérique | Anguilla rostrata | Menacée |
| Tortue serpentine | Chelydra serpentina | Préoccupante |
| Couleuvre tachetée | Lampropeltis triangulum | Préoccupante |
| Couleuvre mince | Thamnophis sauritus | Préoccupante |
| Brochet vermiculé | Esox americanus vermiculatus | Préoccupante |
Ces exemples ne constituent pas une liste exhaustive. Étant donné que les besoins spécifiques peuvent différer d'une espèce à l'autre, les mesures de rétablissement devraient faire l'objet d'une évaluation de leurs effets sur toutes les espèces coexistantes. Si possible, il faut maintenir les processus écosystémiques naturels et leur permettre d'évoluer sans interférence humaine, car les espèces sont adaptées à ces processus.
La possibilité que le présent programme de rétablissement entraîne des effets négatifs imprévus sur l'environnement et d'autres espèces a été examinée. Les mesures recommandées sont non intrusives et mettent l'accent sur la protection de l'habitat, les relevés et la sensibilisation. Il a donc été conclu que le programme de rétablissement est peu susceptible de produire des effets négatifs importants.