Aperçu des approbations, de la commercialisation et des prix des nouveaux médicaments, de 2018 à 2023
Présentation à la conférence ISPOR 2025, du 13 au 16 mai 2025 et à la conférence de l’ACRSPS, du 26 au 29 mai 2025
Blake Wladyka et Étienne Gaudette
Objectif
Les médicaments spécialisés onéreux dominent de plus en plus le marché des nouveaux médicaments lancés au Canada et à l’étranger. Une part croissante de ces médicaments (y compris les produits biologiques, les médicaments orphelins et les produits oncologiques) ont des coûts de traitement annuels qui se chiffrent dans les dizaines ou les centaines de milliers de dollars. La présente étude donne un aperçu des nouveaux médicaments approuvés et présente les données sur les ventes, les prix et les caractéristiques de ces produits ainsi que sur l’accès à ceux-ci au Canada et à l’étranger.
Approche et données
La présente étude explore la dynamique de mise en marché des nouvelles substances actives approuvées par Santé Canada, la Food and Drug Administration (FDA) des États-Unis ou l’Agence européenne des médicaments (EMA) de 2018 à 2023. Un nouveau médicament est sélectionné pour l’analyse s’il a reçu une autorisation de sa mise en marché de l’un ou l’autre de ces organismes de réglementation au cours de la période étudiée. L’analyse étudie la disponibilité, le coût du traitement et les ventes de ces médicaments dans l’année civile suivant leur première approbation à l’échelle internationale, et surveille l’évolution de ces indicateurs d’une année à l’autre. La base de données MIDASMD d’IQVIA représente la principale source de données, et des données supplémentaires sont tirées des bases de données en ligne sur les médicaments de Santé Canada, de la FDA des États-Unis et de l’EMA, ainsi que de l’Agence des médicaments du Canada (CDA-AMC).
Résultats
1. Tendances relatives aux approbations et aux ventes de nouveaux médicaments
- En moyenne, 52 nouveaux médicaments ont été approuvés chaque année entre 2018 et 2023. Les médicaments orphelins représentaient toujours une part importante des nouvelles approbations (Figure 1).
- En 2023, 63 nouveaux médicaments ont été approuvés, avec notamment une part plus importante de médicaments orphelins et une part stable de médicaments oncologiques.
- Au T4 2023, le Canada avait enregistré des ventes pour 85 (34 %) des 250 médicaments approuvés entre 2018 et 2022 (Figure 2). Si la proportion canadienne des nouveaux médicaments vendus était supérieure à la médiane de l’OCDE de 32 %, le Canada était classé derrière huit pays du CEPMB11.
- Au T4 2023, 80 % des ventes totales de nouveaux médicaments dans les pays de l’OCDE étaient pour des médicaments vendus au Canada, ce qui indique que le Canada approuve et vend les médicaments les plus vendus qui sont aussi approuvés à l’étranger.
Figure 1. Nouveaux médicaments approuvés par la FDA des États-Unis, l’EMA ou Santé Canada, de 2018 à 2023
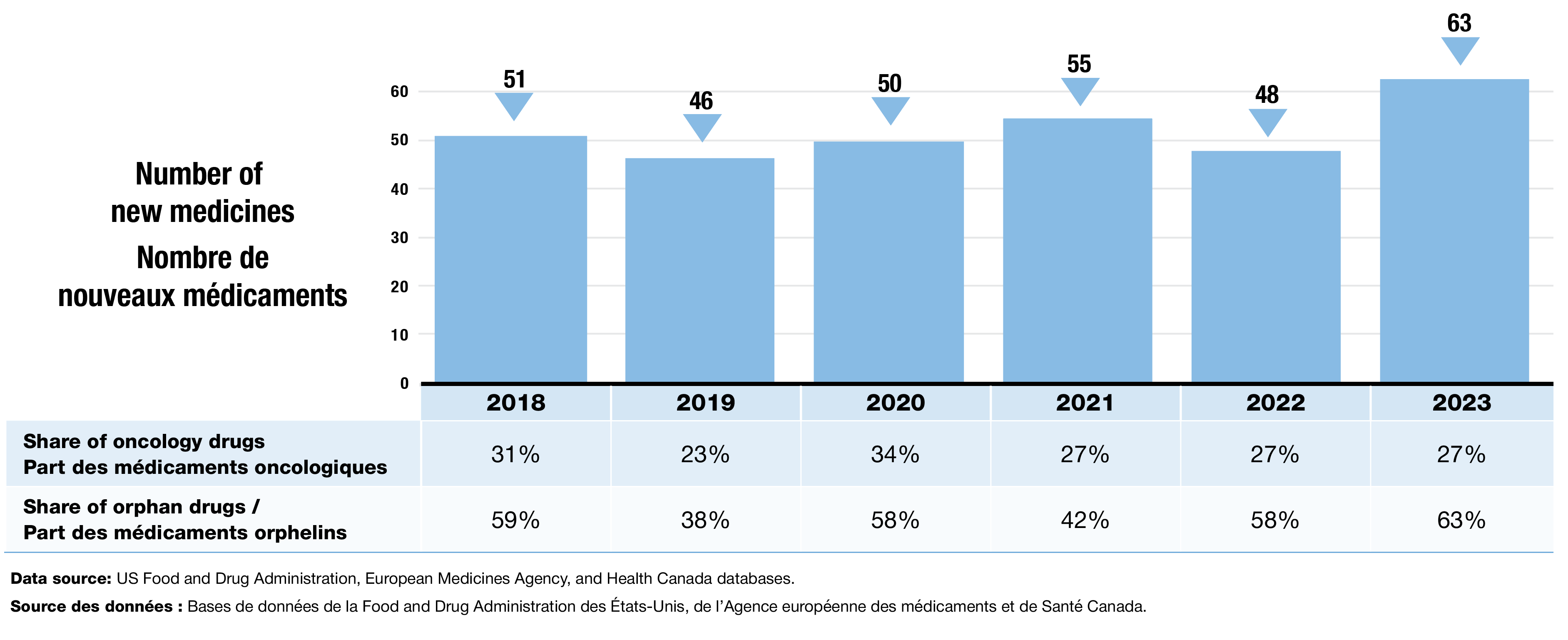
Figure - version texte
| 2018 | 2019 | 2020 | 2021 | 2022 | 2023 | |
|---|---|---|---|---|---|---|
Nombre de nouveaux médicaments |
51 |
46 |
50 |
55 |
48 |
63 |
Part des médicaments oncologiques |
31 % |
23 % |
34 % |
27 % |
27 % |
27 % |
Part des médicaments orphelins |
59 % |
38 % |
58 % |
42 % |
58 % |
63 % |
Source des données : Bases de données de la Food and Drug Administration des États-Unis, de l’Agence européenne des médicaments et de Santé Canada.
Figure 2. Part des nouveaux médicaments entre 2018 et 2022 pour lesquels les données sur les ventes étaient disponibles et leur part respective des ventes dans les pays de l’OCDE, par pays, T4 2023
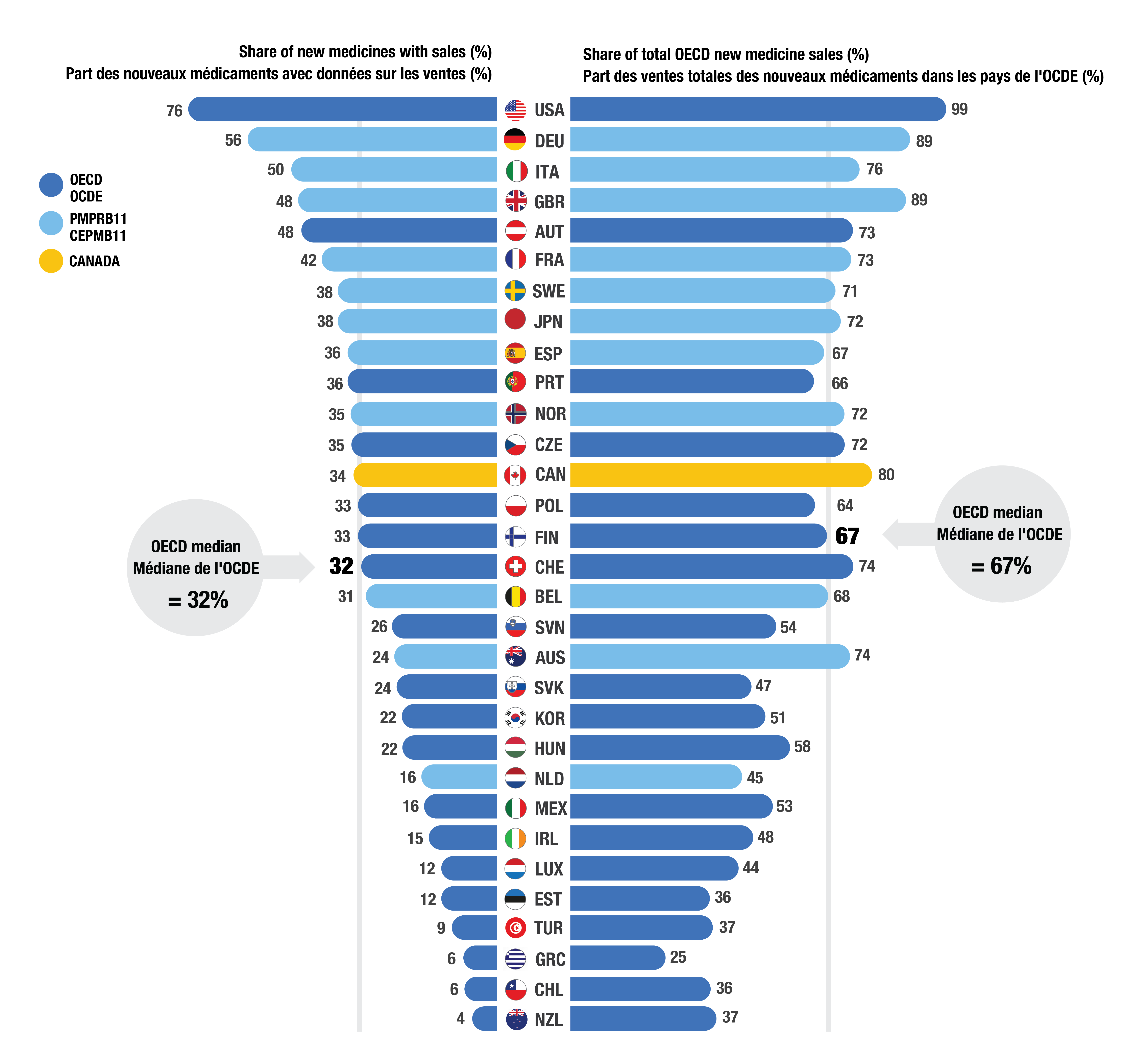
Figure - version texte
| Pays | Part des nouveaux médicaments avec données sur les ventes | Part des ventes totales des nouveaux médicaments dans les pays de l’Organisation de coopération et de développement économiques |
|---|---|---|
États-Unis |
76 % |
99 % |
Allemagne |
56 % |
89 % |
Italie |
50 % |
76 % |
Autriche |
48 % |
73 % |
Royaume-Uni |
48 % |
89 % |
France |
42 % |
73 % |
Suède |
38 % |
71 % |
Japon |
38 % |
72 % |
Espagne |
36 % |
67 % |
Portugal |
36 % |
66 % |
Tchéquie |
35 % |
72 % |
Norvège |
35 % |
72 % |
Canada |
34 % |
80 % |
Finlande |
33 % |
67 % |
Pologne |
33 % |
64 % |
Suisse |
32 % |
74 % |
Belgique |
31 % |
68 % |
Slovénie |
26 % |
54 % |
Slovaquie |
24 % |
47 % |
Australie |
24 % |
74 % |
Corée |
22 % |
51 % |
Hongrie |
22 % |
58 % |
Pays-Bas |
16 % |
45 % |
Mexique |
16 % |
53 % |
Irlande |
15 % |
48 % |
Luxembourg |
12 % |
44 % |
Estonie |
12 % |
36 % |
Türkiye |
9 % |
37 % |
Chili |
6 % |
36 % |
Grèce |
6 % |
25 % |
Nouvelle-Zélande |
4 % |
37 % |
Médiane de l’OCDE |
32 % |
67 % |
Remarque : Les ventes sont basées sur les prix courants fixés par le fabricant et comprennent les ventes dans tous les pays de l’OCDE.
Source des données : Base de données MIDAS® d’IQVIA (tous droits réservés).
2. Médicaments spécialisés et onéreux approuvés en 2022
- Presque 60 % des nouveaux médicaments ont reçu une désignation de médicaments orphelins, 52 % étaient des médicaments biologiques et 27 % étaient des médicaments oncologiques (Figure 3). Les médicaments oncologiques et orphelins ont montré le plus grand chevauchement : 12 des 13 nouveaux médicaments oncologiques ont reçu une désignation de médicament orphelin.
- Des 37 nouveaux médicaments dont les données sur les ventes étaient disponibles, 24 (65 %) avaient un coût de traitement élevé, c’est-à-dire un coût dépassant 10 000 $ par année ou 5 000 $ par cycle de 28 jours (Figure 4).
- Un total de 17 nouveaux médicaments (46 %) étaient des médicaments onéreux pour maladies rares (MOMR), à savoir des traitements ayant obtenu la désignation de médicament orphelin dont le coût annuel du traitement dépasse 100 000 $, ou 7 500 $ par cycle de 28 jours pour les médicaments oncologiques. Les MOMR représentaient plus de 12 % des ventes de nouveaux médicaments.
- Les médicaments oncologiques représentaient 43 % des nouvelles désignations de médicaments orphelins, même s’ils constituaient environ 27 % des nouveaux médicaments approuvés.
Figure 3. Répartition des nouveaux médicaments approuvés en 2022 selon le coût du traitement

Figure - version texte
| Catégorie de médicament spécialisé | Nombre de nouveaux médicaments approuvés en 2022 |
|---|---|
Médicaments biologiques seulement |
9 |
Médicaments orphelins seulement |
8 |
Médicaments oncologiques seulement |
1 |
Médicaments oncologiques et orphelins seulement |
4 |
Médicaments biologiques et oncologiques seulement |
0 |
Médicaments biologiques et orphelins seulement |
8 |
Médicaments biologiques, oncologiques et orphelins |
8 |
Remarque : Dans cette analyse, on tient compte des 37 nouveaux médicaments approuvés en 2022 dont les données sur les coûts de traitement sont disponibles en date du T3 2024.
*Les médicaments onéreux sont définis comme ceux dont les coûts de traitement dépassent 10 000 $ par an ou 5000 $ par cycle de 28 jours.
†Les médicaments onéreux pour maladies rares (MOMR) sont définis comme ceux ayant une désignation de médicament orphelin attribuée par la FDA ou l’EMA et dont les coûts de traitement dépassent 100 000 $ par an ou 7500 $ par cycle de 28 jours pour les médicaments oncologiques.
Source des données : Base de données MIDAS® d’IQVIA (tous droits réservés); rapports de l’Agence des médicaments du Canada (CDA-AMC).
Figure 4. Répartition des nouveaux médicaments spécialisés approuvés en 2022
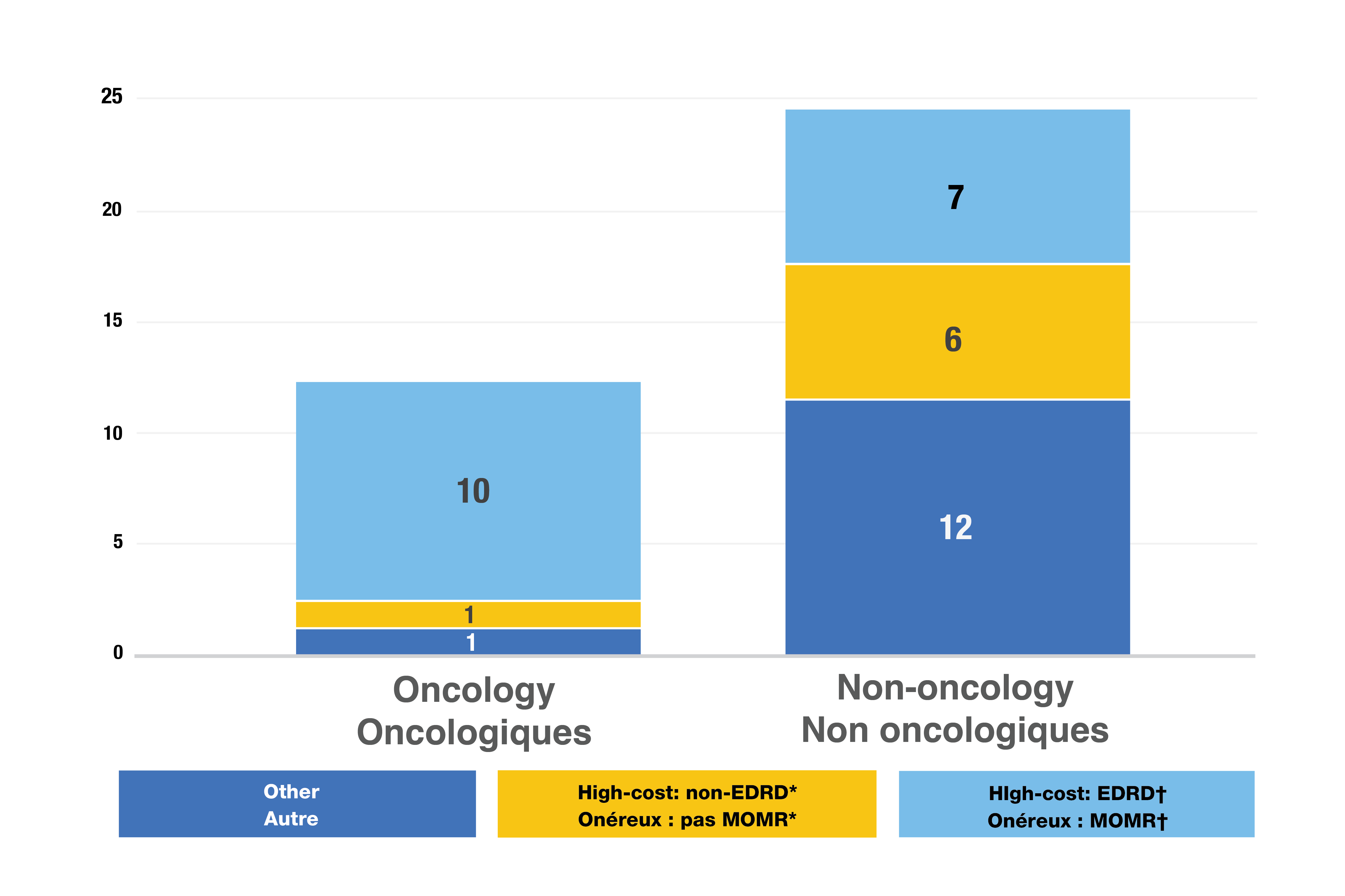
Figure - version texte
| Médicaments onéreux : médicaments onéreux pour les maladies rares† | Médicaments onéreux*, autres que les MOMR | Autres | Total | |
|---|---|---|---|---|
Médicaments oncologiques |
10 |
1 |
1 |
12 |
Médicaments non oncologiques |
7 |
6 |
12 |
25 |
Source des données : Bases de données de la Food and Drug Administration des États-Unis, de l’Agence européenne des médicaments et de Santé Canada.
3. Accès aux nouveaux médicaments au Canada
- Des 250 nouvelles substances actives approuvées à l’échelle internationale entre 2018 et 2022, 169 (68 %) sont en cours d’examen par Santé Canada en date de septembre 2024 (Figure 5). Parmi celles-ci, 153 ont reçu un avis de conformité (AC), 8 sont toujours en cours d’examen et 8 ont fait l’objet d’un examen qui a abouti à un échec.
- Un total de 81 médicaments (32 %) n’ont pas été présentés à Santé Canada. Il peut s’agir de nouveaux médicaments qui seront présentés plus tard ou dont les indications n’ont aucune prévalence au Canada (comme Dengvaxia, approuvé par la FDA pour le traitement de la dengue).
- La vente de nouvelles substances actives approuvées par Santé Canada en 2022 avait lieu en moyenne 14 mois suivant la première vente à l’étranger.
Figure 5. État de l’examen de Santé Canada de nouvelles substances actives approuvées à l’échelle internationale entre 2018 et 2022
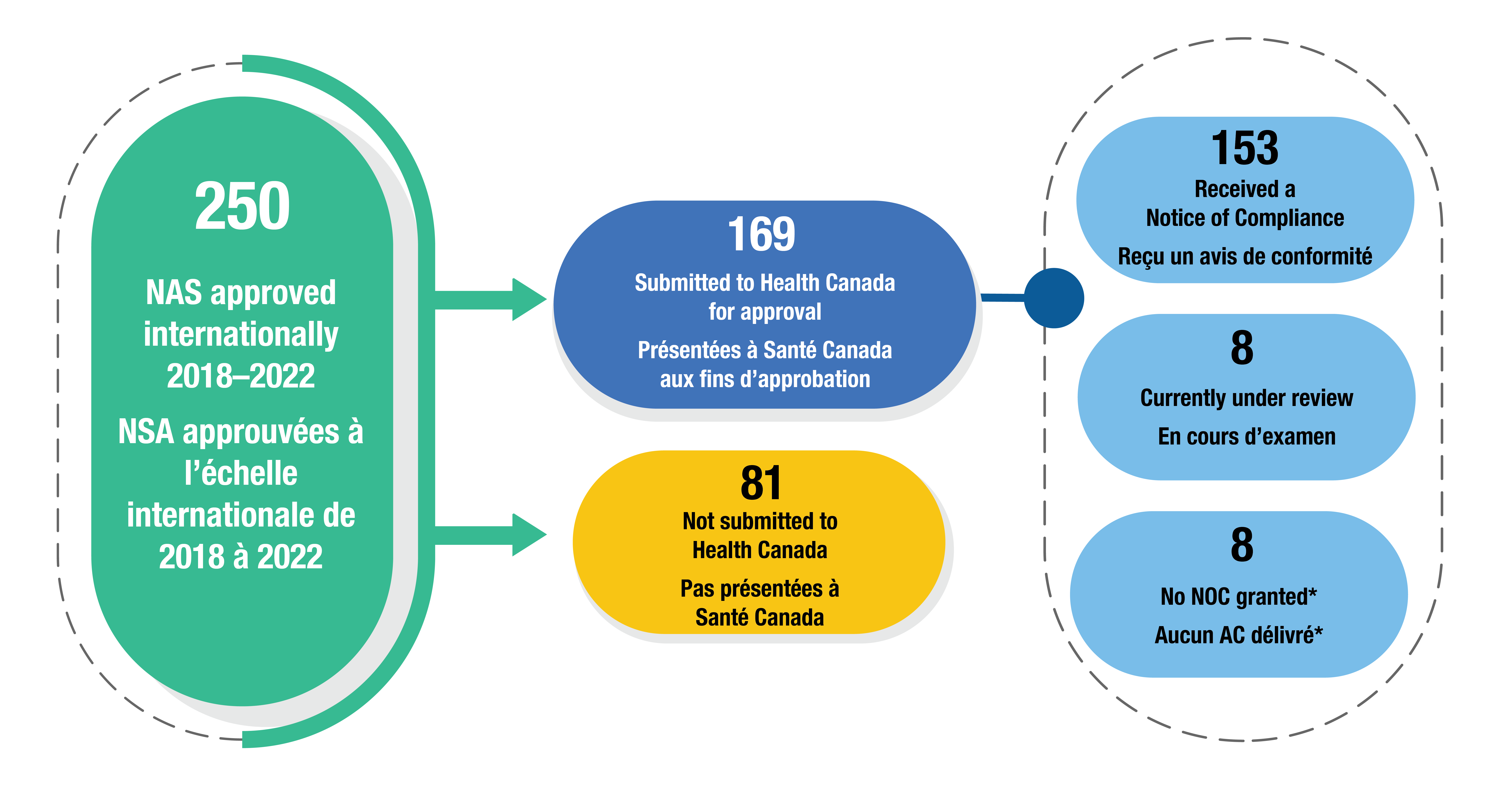
Figure - version texte
- 250 nouvelles substances actives approuvées à l’échelle internationale entre 2018 et 2022
- 81 pas présentées à Santé Canada
- 169 présentées à Santé Canada aux fins d’approbation
- 153 ont reçu un avis de conformité
- 8 en cours d’examen
- 8 aucun AC délivré*
Remarque : Les états d’examen ont été mis à jour pour la dernière fois le 25 septembre 2024.
*La présentation a donné lieu à un avis de non-conformité ou l’examen a été annulé par le promoteur.
Source des données : Base de données des avis de conformité de Santé Canada; site Web de Santé Canada sur les présentations de drogues nouvelles terminées; site Web de Santé Canada sur les présentations de drogues en cours d’examen.
Conclusion
La présente étude souligne que les médicaments onéreux et les médicaments contre les maladies rares représentent actuellement une part importante des nouveaux médicaments approuvés. Tandis que le Canada continue d’approuver et de commercialiser les nouveaux médicaments les plus vendus, il importe d’obtenir plus de renseignements sur les répercussions des nouvelles approbations sur les payeurs et les patients.
Limites
Comme la présente étude se concentre sur trois organismes d’approbation, il est possible que certains nouveaux médicaments qui y sont mentionnés aient été approuvés plus tôt par d’autres instances et que certains médicaments dont la première approbation à l’échelle internationale a eu lieu entre 2018 et 2023 ne soient pas compris dans l’analyse.
Avis de non‑responsabilité
Bien que ces informations soient en partie fondées sur des données sous licence d’IQVIAMC, les déclarations, les résultats, les conclusions, les points de vue et les opinions présentés dans le présent rapport sont exclusivement ceux du CEPMB.