Comprendre comment ternissent les objets en argent
Lyndsie Selwyn
- Objectifs d’apprentissage
- Activité : comment faire ternir un objet en argent
- Explication scientifique du ternissement de l’argent
- Fournisseurs
- Bibliographie
L’activité qui suit est destinée aux professionnels du patrimoine désireux d’apprendre comment ternit l’argent. Elle fait partie de l’atelier Soins des métaux dans les collections offert par l’Institut canadien de conservation. Il n’est pas nécessaire de disposer d’un laboratoire ni d’un système de ventilation; cette activité peut facilement être faite dans une salle de classe, un espace de travail dans un musée ou même à la maison.
Objectifs d’apprentissage
En comprenant comment ternit l’argent, les professionnels du patrimoine pourront :
- reconnaître les premiers signes du ternissement de l’argent;
- reconnaître les matériaux et les conditions ambiantes propices au ternissement de l’argent et réduire au minimum l’utilisation de ces matériaux et l’exposition des objets à de telles conditions.
Contexte
L’argent exposé aux gaz sulfurés présents dans l’air change de couleur puis noircit, car il réagit avec le gaz pour former une couche de ternissure en surface. Appelé « ternissement », ce processus est décrit ci-après dans la section Explication scientifique du ternissement de l’argent. Pour les professionnels du patrimoine, il importe de protéger les objets en argent contre le ternissement.
La ternissure dépare généralement les objets en argent. On peut l’éliminer par polissage ou d’autres techniques, mais le nettoyage demande beaucoup de travail. De plus, chaque nettoyage enlève une petite quantité d’argent. Sur les objets plaqués argent, l’opération risque d’endommager le mince placage d’argent ou même de le supprimer entièrement. Dans la mesure du possible, il est donc préférable de prévenir le ternissement, particulièrement dans le cas des pièces patrimoniales ou muséales. À cette fin, il faut protéger l’objet en argent des gaz sulfurés. Ces gaz proviennent de sources diverses. Il peut être impossible de prévenir le ternissement de l’argent quand les objets sont exposés à l’air libre dans une maison historique. Même une vitrine hermétique ne protégera pas les objets exposés si elle est fabriquée de matériaux inappropriés ou qu’elle n’est pas suffisamment étanche à l’air.
Activité : comment faire ternir un objet en argent
Cette activité pratique présente la méthode et les matériaux à utiliser pour illustrer combien la ternissure peut se former rapidement sur l’argent. Elle consiste à exposer un objet en argent à un œuf dur qu’on vient tout juste de faire cuire.
Matériel et équipement requis pour faire ternir l’argent
- Œuf dur fraîchement cuit
- Couteau pour couper l’œuf
- Échantillons d’argent, comme des objets plaqués argent ou de petits morceaux (coupons) taillés dans une feuille d’argent
- Carbonate de calcium précipité (craie précipitée)
- Contenant transparent scellable (p. ex. boîte en plastique pourvue d’un bon couvercle, boîte en plastique dans un sac en plastique scellable)
Méthode pour faire ternir un objet en argent
- Faire cuire un œuf dur.
- Nettoyer l’argent à l’eau et au savon doux pour en déloger la saleté et le gras.
- Polir l’argent avec du carbonate de calcium précipité (en utilisant la méthode décrite dans la Note de l’ICC 9/7 Le soin de l’argent).
- Placer un ou plusieurs échantillons d’argent dans un contenant transparent.
- Écaler l’œuf dur, de préférence quand il est encore chaud.
- Rincer l’œuf à l’eau du robinet, sans l’essuyer.
- Couper l’œuf en quatre à l’aide du couteau.
- Placer l’œuf dans le contenant transparent où se trouvent les échantillons.
- Poser le couvercle sur la boîte ou placer la boîte dans un sac en plastique scellable.
- Inscrire l’heure et la date.
- Surveiller la surface des échantillons d’argent pendant une heure ou deux.
- Une fois l’activité terminée, mettre l’œuf au rebut.
Résultats de l’activité
Au bout de 5 à 30 minutes, l’échantillon d’argent devrait avoir viré au jaune. (Plus l’œuf est utilisé rapidement après avoir été cuit, plus l’argent ternira vite. En principe, l’œuf devrait être utilisé lorsqu’il est encore chaud.) Au fil du temps, l’argent passera du jaune au rouge, au bleu ou au noir. Le gaz sulfuré qui provoque le ternissement est le sulfure d’hydrogène qui se dégage de l’œuf dur. Les figures 1a à 1c illustrent le changement de couleur.

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0251
Figure 1a : Boîte transparente contenant une cuillère plaquée argent et un œuf dur : début de l’exposition.

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0252
Figure 1b : Boîte transparente contenant une cuillère plaquée argent et un œuf dur : au bout de 40 minutes d’exposition.

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0253
Figure 1c : Boîte transparente contenant une cuillère plaquée argent et un œuf dur : au bout de 1 heure et 22 minutes d’exposition.
Suggestions d’essais supplémentaires
Placage d’argent comparativement à l’argent sterling
Répéter l’activité précédente en comparant la vitesse de ternissement de deux échantillons dans le même contenant : (1) un objet plaqué argent ou un coupon en argent pur et (2) un objet ou un coupon en argent sterling. L’argent sterling (alliage d’argent à 92,5 % et de cuivre à 7,5 %) ternit plus vite que l’argent pur qui sert au placage. Un exemple de cette activité est fourni dans cette vue accélérée, que l’on a réalisée en prenant un cliché par minute pendant 90 minutes. Cette vue accélérée permet de comparer le ternissement d’une cuillère plaquée argent avec le ternissement d’un couteau en argent sterling.
La vitesse plus élevée du ternissement de l’argent sterling s’explique par la présence de cuivre dans l’alliage. C’est que le cuivre est un métal plus réactif que l’argent (Graedel, 1992). En général, la vitesse à laquelle l’alliage argent-cuivre ternit augmente avec la teneur en cuivre (Selwyn, 1990).
Agents de polissage faits maison comparativement aux agents de polissage du commerce
Répéter l’activité précédente en comparant la vitesse de ternissement de deux échantillons dans le même contenant : (1) un coupon d’argent ou un objet plaqué argent nettoyé avec un agent de polissage fait maison (carbonate de calcium précipité et eau) et (2) un coupon d’argent ou un objet plaqué argent nettoyé avec un agent de polissage du commerce. La plupart des agents de polissage du commerce contiennent des inhibiteurs de ternissement qui, comme leur nom l’indique, ralentissent ou empêchent le ternissement de l’argent (Selwyn et Costain, 1991). La présence d’un inhibiteur dans un produit commercial est indiquée sur les étiquettes par des expressions comme « empêche le ternissement », « anti-ternissant » ou « anti-ternissure ». Si l’activité est faite avec un produit contenant un inhibiteur, l’argent nettoyé avec ce produit ternira moins vite que l’argent nettoyé avec le produit maison, qui renferme du carbonate de calcium précipité.
Les inhibiteurs de ternissement sont des molécules organiques qui se fixent à la surface par des liaisons chimiques entre l’argent et le soufre pour former une mince couche transparente. Ayant des propriétés analogues à celles de la cire, cette couche repousse l’eau et les gaz responsables du ternissement, ce qui protège l’argent jusqu’à un certain point. Mais quand l’argent se met vraiment à ternir, le processus n’est pas nécessairement uniforme, et l’objet aura peut-être une moins belle apparence que sous une ternissure plus épaisse mais uniforme. De plus, la couche comparable à la cire risque d’interférer avec l’application de vernis (Lins et McMahon, 1993). Dans les musées, on a donc tendance à éviter les agents de polissage commerciaux qui renferment des inhibiteurs de ternissement.
Explication scientifique du ternissement de l’argent
Ternissure sur l’argent
La ternissure sur l’argent pur est du sulfure d’argent (Ag2S, similaire au minéral acanthite), qui se forme quand l’argent réagit avec les gaz sulfurés présents dans l’air. La ternissure sur l’argent sterling comporte aussi du sulfure de cuivre (Cu2S) (Graedel, 1992). Le gaz sulfuré le plus commun est le sulfure d’hydrogène (H2S), celui qui se dégage d’un œuf dur.
Couleurs d’interférence
La couleur de la couche de ternissure change progressivement au fil du processus de ternissement. Cela s’explique par le phénomène d’« interférence par une couche mince ». Quand la lumière frappe la mince couche de ternissure sur l’argent, elle se divise : une partie de la lumière est reflétée par la surface supérieure, alors que l’autre est reflétée par l’argent sous la ternissure (figure 2).
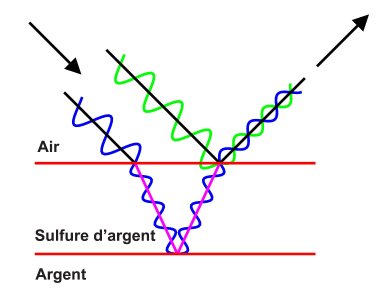
© Gouvernement du Canada, Institut canadien de conservation. ICC 127690-0001
Figure 2 : Quand la lumière frappe la couche de sulfure d’argent, une partie est reflétée par la surface supérieure, alors que l’autre est reflétée par l’argent sous la ternissure. Ces deux trajectoires lumineuses entraînent une interférence lumineuse qui produit des couleurs différentes à la surface de l’argent, selon l’épaisseur de la couche de sulfure d’argent.
Quand les rayons réfléchis par la surface et par l’argent sous la ternissure se recombinent, une partie des couleurs s’annule par interférence. La couleur qui reste dépend de l’épaisseur de la couche de ternissure. Au début du ternissement, lorsque l’épaisseur augmente de 10 à 100 nanomètres (nm), la couleur passe du jaune au brun-rouge, puis au bleu. Quand l’épaisseur dépasse environ 100 nm, elle est noire, soit la véritable couleur du sulfure d’argent (Selwyn, 2004). La figure 3 montre un exemple de tasse plaquée argent présentant des couleurs d’interférence.

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0051
Figure 3 : Tasse plaquée argent montrant les couleurs d’interférence sur une mince couche de ternissure causée par des années d’exposition à l’air libre à l’Institut canadien de conservation.
Formation de barbes
L’argent réagit parfois avec les gaz sulfurés pour former des barbes tridimensionnelles (figures 4a et 4b).

© MI-2091, Miquelet Rifle, Collection of Glenbow Museum.
Figure 4a : Barbes de sulfure d’argent formées sur des incrustations d’argent dans une pièce d’acier.

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0255
Figure 4b : Barbes de sulfure d’argent retirées d’incrustations d’argent dans de l’acier.
Même si la littérature dans le domaine de la conservation fournit plusieurs exemples de formation de barbes, on ignore encore pourquoi des barbes se créent parfois plutôt qu’une couche de ternissure uniforme (Selwyn, 2004; Eggert et al., 2008; Sease et al., 1997).
Vitesse de ternissement de l’argent
La vitesse de ternissement de l’argent dépend de la concentration des gaz sulfurés (comme le sulfure d’hydrogène) dans l’air. Dans les musées, où il faut des mois ou des années avant qu’une couche sombre de ternissure se forme, la concentration du sulfure d’hydrogène se situe généralement entre 86 et 600 parties par billion (ppb) (Ankersmit et al., 2005). (Une partie de gaz par billion signifie qu’il y a 1 molécule de ce gaz dans 1 billion, soit 1012, de molécules d’air.) La vitesse de ternissement de l’argent exposé à un œuf dur fraîchement cuit se compte en minutes plutôt qu’en mois, ce qui montre que la concentration de sulfure d’hydrogène qui se dégage de l’œuf est de beaucoup supérieure à celle qu’on trouve habituellement dans un musée.
La ternissure se développe plus rapidement sur l’argent fraîchement poli que sur l’argent déjà terni. Ainsi, même si elle affecte l’apparence de l’objet, la couche de ternissure aide à protéger l’argent d’un ternissement accru. C’est pourquoi on recommande habituellement de laisser l’argent non poli à moins que le nettoyage soit nécessaire en raison d’une exposition.
L’humidité relative (HR) influe aussi sur la vitesse de ternissement. Pour une concentration donnée de sulfure d’hydrogène, l’argent ternit plus rapidement à mesure que l’HR augmente. Par conséquent, il vaut mieux ranger l’argent au sec (à moins de 50 % d’HR). Pour plus de renseignements sur les stratégies de conservation préventive de l’argent, voir Objets en métal.
Sources de gaz provoquant le ternissement
Les gaz qui provoquent le ternissement sont d’origines diverses (Ankersmit et al., 2005; Benson, 2012; Selwyn, 2004; Selwyn, 1990) :
- Aliments (certains tels que les œufs)
- Argiles (p. ex. certaines argiles à modeler)
- Bois (récupéré de milieux anaérobiques)
- Caoutchouc vulcanisé, objets tels que les suivants :
- Bandes élastiques
- Bouchons de caoutchouc
- Ébonite
- Gants de caoutchouc
- Gants de latex
- Gommes à effacer
- Joints toriques en caoutchouc
- Matériau de moulage (caoutchouc polysulfuré)
- Vulcanite
- Cloisons sèches (de mauvaise qualité)
- Colles (celles qui sont protéiniques)
- Combustibles de chauffage (spécialement ceux à base de charbon)
- Eau (dans certains puits naturels et tourbières)
- Gaz d’égout
- Humains (gaz intestinaux renfermant du sulfure d’hydrogène)
- Industries des pâtes et papiers
- Laine et feutre de laine
- Peintures (certaines)
- Moulages en plâtre (faits de gypse)
- Soufre (soufre élémentaire), parfois utilisé dans la composition des produits suivants :
- Adhésifs
- Ciment
- Coulis
- Incrustations dans des pièces de mobilier
- Munitions
- Volcans et sources thermales
Effets supplémentaires du soufre présent dans les œufs
Lorsqu’un œuf est chauffé, les protéines contenues dans le blanc produisent du sulfure d’hydrogène (McGee, 1984). C’est le gaz qui a fait ternir l’argent dans l’activité précédente. Si une partie du gaz réagit avec le fer présent dans le jaune d’œuf, il produit du sulfure de fer (II) (FeS) brun qui forme une couche gris-vert sur le jaune de l’œuf dur, comme le montrent les figures 5a et 5b. (Pour réduire au minimum la couche gris-vert, faire cuire l’œuf le moins longtemps possible – juste assez pour que le jaune se solidifie – et le faire refroidir rapidement après la cuisson.)

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0256
Figure 5a : Vue de la surface d’un jaune d’œuf dur montrant la couche gris-vert formée par le sulfure de fer (II) (FeS).

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0257
Figure 5b : Autre vue de la surface d’un jaune d’œuf dur montrant la couche gris-vert formée par le sulfure de fer (II) (FeS).
Remerciements
Nous tenons à remercier tout spécialement Jacqueline Riddle et Avital Lang, anciennes stagiaires à l’ICC, de nous avoir aidés à élaborer cette ressource d’apprentissage.
Fournisseurs
Remarque : Les renseignements qui suivent visent uniquement à informer le lecteur. Le fait qu’une société ou une entreprise figure dans la présente liste ne signifie pas pour autant qu’elle est approuvée par l’ICC.
Carbonate de calcium précipité (craie précipitée)
Il est possible de se procurer du carbonate de calcium précipité auprès de fournisseurs de produits chimiques, notamment Fisher Scientific (carbonate de calcium en poudre). Le produit est également offert en petites quantités par des fournisseurs de produits de conservation, comme Talas (carbonate de calcium ultrafin) et Conservation Support Systems (carbonate de calcium précipité).
Argent
De minces feuilles d’argent pur (p. ex. feuille de 0,1 mm d’épaisseur) sont offertes à Sigma-Aldrich.
Argent sterling
L’argent sterling se trouve chez les fournisseurs de bijoutiers, comme Lacy & Company Ltd.
Bibliographie
ANKERSMIT, H., N. TENNENT et S. WATTS. « Hydrogen Sulphide and Carbonyl Sulphide in the Museum Environment—Part 1 », Atmospheric Environment, vol. 39, no 4 (février 2005), p. 695-707.
BENSON, P.L. « Some Unusual, Hidden, Surprising, or Forgotten Sources of (Possible) Sulfur Contamination in Museums and Historic Structures », AIC Objects Specialty Group Postprints, vol. 19 (2012), p. 85-107.
EGGERT, G., A. WOLLMANN et B. SCHWAHN. « When Glass and Metal Corrode Together », dans ICOM-Comité pour la conservation, 15e réunion triennale, New Delhi, Inde, vol. 1 (sous la direction de J. Bridgland), New Delhi (Inde), Allied Publishers, 2008, p. 211-216.
GRAEDEL, T.E. « Corrosion Mechanisms for Silver Exposed to the Atmosphere », Journal of the Electrochemical Society, vol. 139, no 7 (1992), p. 1963-1970.
McGEE, H. On Food and Cooking, New York (New York), Charles Scribner’s Sons, 1984, p. 69.
LINS, A., et N. McMAHON. « The Inhibition of Silver Tarnishing », dans Current Problems in the Conservation of Metal Antiquities (sous la direction de S. Aoki), Tokyo (Japon), Tokyo National Research Institute of Cultural Properties, 1993, p. 135-162.
SEASE, C., L.S. SELWYN, S. ZUBIATE, D.F. BOWERS et D. R. ATKINS. « Problems with Coated Silver: Whisker Formation and Possible Filiform Corrosion », Studies in Conservation, vol. 42, no 1 (1997), p. 1-10.
SELWYN, L.S. « Historical Silver: Storage, Display, and Tarnish Removal », Journal de l’ICC-GC, vol. 15 (1990), p. 12-22.
SELWYN, L. Métaux et corrosion: Un manuel pour le professionnel de la conservation, Ottawa, Institut canadien de conservation, 2004.
SELWYN, L. Le soin de l’argent, Notes de l’ICC 9/7, Ottawa (Ontario), Institut canadien de conservation, 2007.
SELWYN, L.S., et C.G. COSTAIN. « Evaluation of Silver-Cleaning Products », Journal de l’ICC-GC, vol. 16 (1991), p. 3-16.
Détails de la page
- Date de modification :