Comment plaquer une couche d’argent sur des alliages de cuivre à l’aide de produits chimiques – Notes de l’Institut canadien de conservation (ICC) 9/12
Liste des abréviations
- μm
- micromètre
- E.P.
- électroplaqué
- ICOM-CC
- Conseil international des musées – Comité pour la conservation
- M
- molarité
- nm
- nanomètre
- p/v
- poids sur volume
Introduction
L’une des techniques traditionnelles employées pour plaquer une fine couche d’argent sur du cuivre ou du laiton consiste en l’application d’une pâte contenant un sel d’argent. Ce processus porte le nom d’argenture (Birnie, 1993), d’argenture par déplétion (La Niece, 1993) ou d’argenture par remplacement électrochimique (Beentjes, 2007) dans les ouvrages consacrés à la conservation. On employait autrefois la méthode d’argenture dans la fabrication de surfaces réfléchissantes pour les lanternes, par exemple, ou pour appliquer une couche d’argent sur des cadrans d’horloge, la quincaillerie des cercueils et des meubles, ainsi que sur des composants de thermomètres et de baromètres (Beentjes, 2007; Birnie, 1993). Sur une horloge, un compas ou une balance, le placage d’argent apporte un contraste entre l’arrière-plan et les chiffres, les lettres et les symboles qui y sont gravés.
Cette Note de l’ICC décrit les étapes nécessaires à la préparation d’une pâte d’argenture, de même que la procédure à suivre pour l’utiliser afin de produire une mince couche d’argent sur du cuivre ou sur un alliage à base de cuivre, comme le laiton. Des coupons de cuivre font office d’exemples dans la présente procédure. Pour préparer la pâte d’argenture, il faut d’abord mélanger le chlorure d’argent, le chlorure de sodium et le tartrate acide de potassium (aussi connu sous le nom de crème de tartre), puis ajouter une petite quantité d’eau pour former un mélange semi-liquide. Ensuite, à l’aide d’un linge humide, on frotte la pâte d’argenture sur le cuivre jusqu’à l’obtention d’une fine couche d’argent. À la toute fin, on frotte un mélange semi-liquide composé de tartrate acide de potassium sur la couche d’argent nouvellement formée pour la faire briller.
Les restaurateurs peuvent employer cette procédure pour réparer les objets plaqués argent lorsque le métal de base contenant du cuivre est exposé en raison de légers défauts, de dommages ou de pertes résultant d’un polissage répété. Elle peut également servir à appliquer une couche d’argent sur une pièce de rechange en cuivre ou en laiton lorsqu’il n’est pas possible de se procurer la pièce originale en argent. Avant d’appliquer cette procédure à un objet, il est recommandé de commencer par s’exercer de façon répétée sur de petits coupons de cuivre de manière à acquérir suffisamment d’expérience pour obtenir le résultat escompté, c’est-à-dire une finition argentée et uniforme.
Pour obtenir de plus amples renseignements sur l’argenture et les composants de la pâte d’argenture, consulter la section Aspects scientifiques du placage.
Procédure : produire une couche d’argent sur un alliage de cuivre
Avant d’entamer cette procédure d’argenture, consulter la fiche de données de sécurité de chacun des produits chimiques qui seront utilisés. Il faut également porter l’équipement de protection individuelle recommandé, comme une protection pour les yeux, des gants jetables (par exemple, de nitrile) et des vêtements de protection. Dans la mesure du possible, il convient d’utiliser une hotte lorsqu’on travaille avec de l’acide nitrique. Il faut toujours porter des gants de nitrile jetables lorsqu’on travaille avec la pâte d’argenture, car elle tache la peau nue.
Équipement et matériel requis pour plaquer une couche d’argent sur du cuivre
- Carbonate de calcium précipité ou oxyde d’aluminium 1 μm (alumine, Al2O3)
- Pour le polissage : tampons de coton non pelucheux
- Spatules
- Balance
- Chlorure de sodium (NaCl)
- Chlorure d’argent (AgCl)
- Tartrate acide de potassium (KC4H5O6)
- Mortier et pilon pour broyer le mélange d’argenture
- Contenant en verre ambré pour conserver la poudre d’argenture (ou contenant en verre transparent enveloppé dans du papier d’aluminium)
- Eau (distillée ou déionisée)
- Linges non pelucheux, comme ceux de la marque Kimwipes (11 cm × 21 cm), ou des linges de coton carrés de 10 cm ou de la mousseline de coton lavée
- Gants de nitrile jetables
- Petit contenant en verre peu profond pour préparer la pâte (par exemple, verre de montre, nacelle de pesée ou boîte de Petri)
- Cuivre ou laiton (dans les exemples ci-dessous, on utilise des coupons de cuivre [par exemple, 5 cm × 2,5 cm ou 2,5 cm × 2,5 cm])
- Ruban adhésif double face pour maintenir les petits coupons en place
- Baguettes de verre pour mélanger
- Facultatif : acétone pour dégraisser les coupons de cuivre, au besoin
- Facultatif : laque transparente pour protéger l’argent
Préparation de la poudre d’argenture
- Travailler dans une pièce sombre pour minimiser l’exposition du chlorure d’argent à la lumière.
- Utiliser des spatules et une balance pour peser une partie en poids de chlorure d’argent, deux parties en poids de tartrate acide de potassium et trois parties en poids de chlorure de sodium (par exemple, 1 g, 2 g et 3 g, respectivement).
- Verser les trois composés dans un mortier et les broyer à l’aide d’un pilon jusqu’à l’obtention d’une poudre fine et bien mélangée.
- Verser la poudre dans un contenant en verre ambré ou transparent enveloppé dans du papier d’aluminium pour le conserver de façon temporaire.
- Rincer le mortier le plus rapidement possible, puis le laisser tremper dans de l’eau distillée ou déionisée à l’abri de la lumière. Remplacer fréquemment l’eau de trempage pour réduire au minimum les risques de taches causées par les résidus de chlorure d’argent.
Facultatif : il est possible de fabriquer du chlorure d’argent à partir de nitrate d’argent. Consulter la section Préparation de chlorure d’argent au moyen de nitrate d’argent et de chlorure de sodium.
Préparation de la surface du métal et du mélange semi-liquide de tartrate
- Préparer un mélange semi-liquide abrasif composé de carbonate de calcium précipité, ou d’oxyde d’aluminium 1 μm, et d’eau. Ce mélange, qui servira à la préparation des coupons de cuivre, peut également servir à préparer la surface de métal des objets en vue de la procédure d’argenture. Pour obtenir des directives plus détaillées sur cette préparation, consulter la Note de l’ICC 9/11 Comment fabriquer et utiliser un agent de polissage de l’argent à base de carbonate de calcium précipité.
- Enlever la couche superficielle d’oxyde qui se trouve sur le coupon de cuivre à l’aide du mélange abrasif semi-liquide et d’un tampon de coton non pelucheux. (Facultatif : commencer par dégraisser avec de l’acétone, au besoin.)
- Rincer le coupon de cuivre à l’eau et l’essuyer avec un linge non pelucheux.
- Préparer un mélange semi-liquide de tartrate acide de potassium : verser une certaine quantité (par exemple, 0,5 g) de poudre de tartrate acide de potassium dans un contenant approprié, puis ajouter de l’eau jusqu’à l’obtention d’une consistance crémeuse. Brasser le mélange à l’aide d’une baguette de verre jusqu’à ce qu’il soit homogène. Ce mélange sera utilisé à la dernière étape de la procédure d’argenture.
Procédure d’argenture
Il n’est pas nécessaire d’effectuer les étapes suivantes dans une pièce sombre. La surface de la poudre d’argenture pourrait se teinter d’une couleur légèrement mauve, mais cela n’aura aucune incidence sur les résultats. Au moment de mettre la procédure à l’essai sur les coupons de cuivre, couper un petit morceau de ruban adhésif double face et s’en servir pour maintenir le coupon de cuivre en place sur la surface de travail. (Plus le morceau de ruban est petit, plus il sera facile de détacher le coupon après les travaux de placage.)
- Juste avant de commencer la procédure, préparer un mélange semi-liquide avec la poudre d’argenture. Verser une petite quantité de poudre d’argenture (par exemple, 0,3 g de poudre suffit pour une surface d’environ 6 cm2) dans un contenant peu profond, comme un verre de montre. Ajouter suffisamment d’eau (quelques gouttes devraient suffire) pour humidifier la poudre et former un mélange semi-liquide crémeux; mélanger doucement à l’aide d’une baguette de verre. Laisser reposer environ deux minutes, en remuant de temps en temps pour qu’une partie des sels se dissolve. (Remarque : les sels ne se dissoudront pas complètement.)
- Imbiber d’eau tout le linge non pelucheux, comme le linge de marque Kimwipes utilisé dans l’exemple, et l’enrouler autour d’un doigt ganté, puis plonger le doigt dans le mélange semi-liquide d’argenture. Le linge humide épongera l’eau présente dans le mélange, qui s’épaissira pour former une pâte. S’assurer qu’une certaine quantité de pâte adhère au linge.
- Frotter doucement le linge enduit de pâte d’argenture sur toute la surface du coupon de cuivre ou de l’objet à argenter. Frotter rapidement et, ce faisant, repasser constamment sur toute la surface pour éviter qu’elle ne s’assèche. Éviter de frotter excessivement, sans quoi la surface pourrait noircir et le placage d’argent pourrait perdre de son uniformité. Éviter également de frotter trop fort pour ne pas égratigner la surface du cuivre ou le placage. Au besoin, prélever plus de pâte d’argenture à l’aide du linge. Continuer d’étendre la pâte jusqu’à ce que la surface de cuivre à plaquer soit recouverte d’argent.
- Pendant que la surface est encore humide, et sans la rincer, y verser une certaine quantité du mélange semi-liquide de tartrate acide de potassium (une pipette, un compte-gouttes ou un doigt ganté propre convient très bien pour une petite surface). Frotter brièvement le mélange sur la surface en utilisant le même linge. Tous les précipités de couleur sombre devraient alors se dissoudre. (Cette étape suit normalement celle de l’argenture, mais elle peut être faite avant que l’argenture soit terminée si la surface argentée semble noircir.)
- Rincer la surface argentée à l’eau, puis l’essuyer.
- Au besoin, répéter les étapes de l’argenture (étape 3), de la pâte de tartrate acide de potassium (étape 4) et du rinçage (étape 5). La pâte d’argenture peut être utilisée à cette fin s’il en reste une quantité suffisante, à condition de réutiliser le même linge qu’au début. (Ce linge contiendra les sels dissous provenant du mélange semi-liquide d’argenture.) Autrement, préparer de nouveau un mélange semi-liquide à l’aide de la poudre d’argenture et utiliser un nouveau linge non pelucheux humide.
Il faut de la pratique pour obtenir une couche uniforme. Le plus important est d’effectuer des mouvements de frottement rapides et uniformes sur toute la surface en exerçant une pression légère. Compte tenu de sa minceur, la couche d’argent plaqué s’élimine aisément pendant le polissage; c’est pourquoi il est souhaitable d’appliquer une laque transparente pour minimiser le ternissement.
Résultats de la procédure
La figure 1a illustre une petite quantité (environ 0,3 g) de poudre d’argenture dans un verre de montre avant l’ajout d’eau. Étant donné que le chlorure d’argent est photosensible, la poudre pourrait se teinter d’une couleur légèrement mauve lorsqu’elle est exposée à la lumière. La figure 1b illustre la poudre d’argenture dans un verre de montre après l’ajout d’une quantité d’eau suffisante pour l’humidifier et former une pâte semi-liquide ayant une consistance crémeuse. Le mélange a été bien remué à l’aide d’une baguette de verre pour favoriser la dissolution du sel.

© Gouvernement du Canada, Institut canadien de conservation. ICC 128945-0005
Figure 1a. Un verre de montre transparent (10 cm de diamètre) contenant une petite quantité de poudre d’argenture blanche au centre. Le mélange d’argenture a été broyé en une poudre fine à l’aide d’un mortier et d’un pilon.

© Gouvernement du Canada, Institut canadien de conservation. ICC 128945-0006
Figure 1b. La poudre d’argenture illustrée à la figure 1a après l’ajout d’une quantité suffisante d’eau pour former un mélange semi-liquide blanc.
Les figures 2a et 2b montrent le linge non pelucheux avant et après son trempage dans le mélange semi-liquide d’argenture.

© Gouvernement du Canada, Institut canadien de conservation. ICC 128945-0007
Figure 2a. Un linge blanc non pelucheux humidifié avec de l’eau et enroulé autour d’un index ganté, avant d’être trempé dans le mélange semi-liquide de poudre d’argenture qui se trouve au centre du verre de montre.
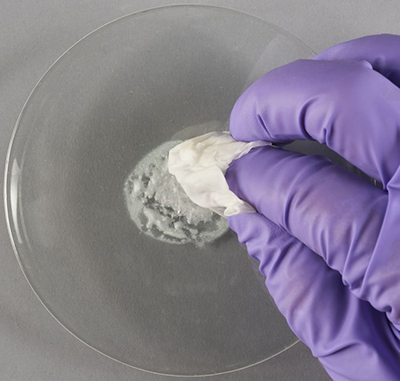
© Gouvernement du Canada, Institut canadien de conservation. ICC 128945-0008
Figure 2b. Le linge illustré à la figure 2a vient tout juste d’être trempé dans le mélange semi-liquide de poudre d’argenture. Le linge a épongé la majorité du liquide pour former une pâte humide.
La figure 3 montre la pâte sur le linge.

© Gouvernement du Canada, Institut canadien de conservation. ICC 128945-0010
Figure 3. Le linge illustré à la figure 2b, avec de la pâte d’argenture collée à sa surface. La pâte s’est légèrement teintée d’une couleur lavande.
La figure 4a montre l’application de la pâte d’argenture sur le coupon de cuivre à l’aide du linge humide. Pour les besoins de la photographie, la pâte a été appliquée dans un mouvement de va-et-vient uniquement au centre du coupon. Dans la pratique, il est préférable de l’appliquer sur toute la surface. La figure 4b montre un gros plan de l’échantillon après plusieurs frottements. La surface est plus noircie que sur la figure 4a. L’application du mélange semi-liquide de tartrate devrait permettre d’éliminer la plupart des taches plus sombres. D’ailleurs, ces taches sont moins susceptibles de se produire lorsque l’ensemble de la surface est argentée d’un seul coup.

© Gouvernement du Canada, Institut canadien de conservation. ICC 128945-0013
Figure 4a. On applique la pâte d’argenture en frottant doucement au centre d’un coupon de cuivre pur.

© Gouvernement du Canada, Institut canadien de conservation. ICC 128945-0014
Figure 4b. Un coupon de cuivre pur après la seconde application de la pâte d’argenture en son centre.
La figure 5a montre un coupon de cuivre avant la procédure d’argenture, alors que la figure 5b montre un coupon de cuivre après la procédure d’argenture.

© Gouvernement du Canada, Institut canadien de conservation. ICC 128945-0012
Figure 5a. Un coupon de cuivre pur (2,5 cm × 2,5 cm) avant la procédure d’argenture. Le coupon a une couleur uniforme rose saumon.

© Gouvernement du Canada, Institut canadien de conservation. ICC 128945-0015
Figure 5b. Un coupon de cuivre pur après la procédure d’argenture. Le coupon revêt à présent une couleur argentée uniforme.
Renseignements supplémentaires
Produits chimiques
Il est préférable d’utiliser des produits chimiques achetés auprès d’un fournisseur de substances chimiques plutôt que des produits du commerce vendus en épicerie. À titre d’exemple, le chlorure de sodium est préférable au sel de table, lequel contient parfois d’autres ingrédients, comme du silicate de calcium, de l’iodure de potassium et du thiosulfate de sodium, en plus du chlorure de sodium. Si la crème de tartre vendue pour la cuisson est parfois entièrement composée de tartrate acide de potassium pur, elle peut également contenir du sulfate de calcium, du phosphate acide de calcium, de l’acide fumarique et de la fécule de maïs, voire aucun tartrate acide de potassium. Ces autres ingrédients pourraient entraîner des conséquences imprévues et nuisibles sur le processus d’argenture.
Nettoyage abrasif
Avant d’entamer le placage, il est essentiel d’enlever la majorité du film d’oxyde qui recouvre le cuivre (La Niece, 1993). Les abrasifs sont souvent utilisés à cette fin. Certaines recettes demandent également de frotter la surface à l’aide d’une pâte de chlorure de sodium tout juste avant l’application de la pâte d’argenture (Birnie, 1993). Même si l’utilisation du chlorure de sodium est courante, on recommande, dans la présente Note, d’utiliser uniquement du carbonate de calcium ou de l’oxyde d’aluminium comme abrasif pour retirer le film d’oxyde avant d’entamer la procédure d’argenture. Les sels présents dans la pâte d’argenture devraient éliminer tous les résidus du film d’oxyde.
Méthodes traditionnelles et solutions de rechange
Dans la présente Note, la préparation contient du chlorure d’argent, de la crème de tartre et du chlorure de sodium dans une proportion de 1:2:3 en poids, conformément à l’ouvrage de De Carle (1983). D’ailleurs, une méthode traditionnelle indiquant les mêmes proportions remonte à au moins 1876 (Society of Gilders, 1990). Une préparation datant de 1905 comporte les mêmes ingrédients, mais dans une proportion de 1:1:1 en volume (Goodrich, 1905). Une méthode plus récente recommande également une proportion de 1:1:1, sans préciser toutefois s’il s’agit d’une proportion en poids ou en volume (Birnie, 1993). (Au moment de la rédaction de cette Note, on a constaté que la proportion de 1:1:1 en poids entraîne davantage de stries foncées que la proportion de 1:2:3 en poids.) Certaines préparations traditionnelles contiennent du nitrate d’argent plutôt que du chlorure d’argent (par exemple, Phin, 1879).
Certaines poudres d’argenture sont vendues en commerce, mais aucune n’a été mise à l’essai aux fins de la présente Note.
Exemples concrets
Lors des travaux effectués sur une boîte-présentoir en bois ornée de motifs en argent sterling, les restaurateurs de l’ICC ont constaté l’absence d’un certain nombre de petits clous en argent sterling. Ils ont décidé de remplacer les clous manquants par des clous en laiton argenté. Pour ce faire, ils ont eu recours à une procédure similaire à celle décrite dans la présente Note. Cependant, la poudre d’argenture contenait les ingrédients dans une proportion de 1:1:1 en poids. Pour protéger la fine couche du placage, les clous argentés ont été enduits d’une solution à 5 % (p/v) de Paraloïd B72 dans de l’acétone.
La figure 6a montre des exemples de clous avant le placage et la figure 6b montre les clous après le placage. (Ces clous en laiton, qui portent le nom « clous à tête ovale », servent à fixer des pièces en laiton sur des meubles et des objets en bois.) Pour le placage illustré à la figure 6b, un mélange composé dans une proportion de 1:1:1 en poids a été utilisé et appliqué à deux reprises. Lors de la seconde application, une petite brosse en plastique a servi à étaler la pâte d’argenture sous la tête des clous.

© Gouvernement du Canada, Institut canadien de conservation. ICC 128945-0017
Figure 6a. Les trois clous à tête ovale en laiton de couleur jaune de 0,64 cm (1/4 po) avant d’être plaqués avec de l’argent.

© Gouvernement du Canada, Institut canadien de conservation. ICC 128945-0018
Figure 6b. Les trois clous à tête ovale en laiton plaqués argent à l’aide d’une pâte d’argenture. Les clous sont maintenant de couleur argentée.
La figure 7a présente un autre exemple d’utilisation de la pâte d’argenture, cette fois pour un plateau en cuivre plaqué argent. À l’origine, ce plateau en cuivre avait été électroplaqué avec de l’argent mais, après des années de polissage abrasif, de grandes surfaces de cuivre transparaissaient au travers du placage. Le côté droit du motif gravé sur le plateau a été argenté à l’aide d’une pâte d’argenture; la figure 7b en montre une vue rapprochée. Sur la surface de droite fraîchement argentée, les parties qui étaient usées jusqu’au cuivre paraissent plus sombres que celles sur lesquelles il restait un peu d’électroplacage. Il s’agit là d’un bel exemple qui illustre l’un des avantages de cette technique d’argenture : étant donné que de l’argent ne peut être appliqué sur le placage argent existant, il n’endommage pas l’original.

© Gouvernement du Canada, Institut canadien de conservation. ICC 128945-0020
Figure 7a. Plateau en cuivre plaqué argent (portant la marque « E.P. copper » au dos). Le côté gauche montre une partie plate du plateau sur laquelle le polissage abrasif a éliminé l’argent dans une mesure suffisante pour laisser de grandes zones de cuivre à découvert. Le côté droit de la figure montre une partie plate du plateau sur laquelle la pâte d’argenture a été appliquée.

© Gouvernement du Canada, Institut canadien de conservation. ICC 128945-0020
Figure 7b. Vue rapprochée de la figure 7a.
Il est à noter que le plateau utilisé aux fins de l’exemple faisait partie du matériel didactique et n’avait aucune valeur historique. La décision concernant le placage d’un objet devrait être prise conjointement par un restaurateur et un conservateur. Il en va de même pour l’enlèvement de la ternissure d’un objet; consulter la Note de l’ICC 9/11 Comment fabriquer et utiliser un agent de polissage de l’argent à base de carbonate de calcium précipité.
La surface après le placage
Le processus d’argenture ne permet pas de camoufler les imperfections présentes sur la surface originale. Ainsi, une surface argentée sera réfléchissante uniquement si la surface originale est soigneusement polie avant la procédure d’argenture, et une surface mate le restera. Par exemple, les cadrans d’horloge sont habituellement soumis à un polissage abrasif à l’aide d’un papier abrasif de 400 ou 600 grains avant la procédure d’argenture pour leur donner une direction ou un grain. Ainsi, après la procédure d’argenture, la surface a une apparence givrée, ce qui correspond d’ailleurs à l’aspect recherché pour les cadrans d’horloge (De Carle, 1983).
Si l’aspect mat n’est pas recherché, il est possible de rendre la surface plus réfléchissante par brunissage après la procédure d’argenture, comme il est indiqué dans l’ouvrage de Clare et Lins (non daté). Le brunissage consiste à frotter un objet à la fois dur et lisse sur la surface d’un métal pour estomper les irrégularités. Des outils en agate, couramment employés pour le brunissage de feuilles d’argent et d’or, peuvent être utilisés à cette fin. Le brunissage n’élimine pas le métal de la surface; il le distribue plutôt sur toute la région afin de créer une surface lisse. Si l’outil de brunissage est appliqué avec trop de pression sur une surface de cuivre argenté, il risque d’endommager le cuivre, plus souple, qui se trouve sous la surface.
Préparation de chlorure d’argent au moyen de nitrate d’argent et de chlorure de sodium
Si l’on dispose déjà de nitrate d’argent et de chlorure de sodium (le sel de table ne convient pas), on peut s’en servir pour préparer du chlorure d’argent. L’ouvrage de Vogel et coll. (1978) en présente une procédure simple.
Aspects scientifiques du placage
Argenture par remplacement électrochimique
Le processus de placage décrit dans la présente Note se produit grâce à une réaction électrochimique. Lorsque la pâte d’argenture est appliquée sur une surface de cuivre propre, elle génère deux demi-réactions électrochimiques. Les ions argent présents dans la solution proviennent du chlorure d’argent; ils sont réduits à l’état d’argent métallique qui adhère bien à la surface du cuivre. En parallèle, le cuivre métallique s’oxyde (il se corrode) pour former des ions cuivre dans la solution. Il s’agit d’une réaction galvanique au cours de laquelle le métal le plus actif (le cuivre) s’oxyde et les ions du métal le plus noble (argent) sont réduits. Étant donné que le cuivre provoque la réduction des ions argent, il joue le rôle d’agent réducteur. L’ensemble de la réaction s’écrit suivant la formule simplifiée suivante :
Ag+ + Cu0 → Ag0 + Cu+
(Dans la préparation décrite dans cette Note, presque tous les ions positifs de la solution forment des complexes avec des ions chlorure ou tartrate, de sorte que ces ions complexes contribueront à ces réactions.) Le placage cesse lorsque la couche d’argent recouvre entièrement le cuivre et que celui-ci n’est plus exposé à la pâte d’argenture.
Ce processus porte divers noms dans l’industrie du placage, dont le placage par remplacement électrochimique, le placage par immersion, le placage par déplacement ou le dépôt galvanique (Paunovic, 2006). En métallurgie, il s’agit de la cimentation. Le processus de placage peut se produire chaque fois qu’un métal est déposé dans une solution qui contient des ions provenant d’un métal moins actif. Par exemple, étant donné qu’il est plus actif que le cuivre, si du fer est déposé dans une solution contenant des ions cuivre(II), le cuivre adhérera au fer.
Le placage par remplacement électrochimique pose parfois problème. Par exemple, après l’utilisation d’une solution de trempage pour nettoyer de l’argenterie ternie, la solution contient des ions argent sous la forme de complexes solubles d’argent et de thio-urée. Si cette solution de trempage est réutilisée sur un objet ayant des surfaces de cuivre non recouvertes, les ions argent présents dans la solution adhéreront au cuivre.
Le placage par remplacement électrochimique peut causer un autre problème lorsque la pâte d’argenture n’est pas appliquée uniformément sur la surface de cuivre, comme l’illustre la figure 4b. Cette surface est plus sombre que celle présentée à la figure 4a en raison de la corrosion du cuivre exposé et du frottement des produits de corrosion sur la surface argentée.
Le rôle des ingrédients
Parmi les trois éléments qui entrent dans la composition de la poudre d’argenture, c’est le chlorure de sodium (NaCl) qui a la solubilité la plus élevée, soit 35,9 g de NaCl dans 100 g d’eau à 20 °C (Lide, 1998). Lorsqu’on ajoute de l’eau aux éléments secs pour former un mélange semi-liquide, l’eau dissout le chlorure de sodium, ce qui produit une concentration élevée, vraisemblablement une solution saturée.
Le tartrate acide de potassium (KC4H5O6), aussi appelé « bitartrate de potassium » ou « crème de tartre », est un sel d’ion tartrate (C4H4O62-) avec de l’hydrogène et du potassium. La figure 8 illustre la structure chimique de l’ion tartrate. Le tartrate acide de potassium a une solubilité de 0,5 g dans 100 g d’eau à 20 °C (Dean, 1992) ou de 0,027 M. Dissous dans l’eau, il se sépare en ions potassium (K+), en ions hydrogène (H+) et en ions tartrate (C4H4O62-). Il agit comme un tampon qui maintient le pH d’une solution près d’une valeur constante, en l’occurrence autour de 3,6. Il forme des complexes avec des ions cuivre(II), c’est-à-dire qu’il se fixe aux ions Cu2+ présents dans la solution pour former des ions complexes, comme [Cu(C4H4O6)2]2-.
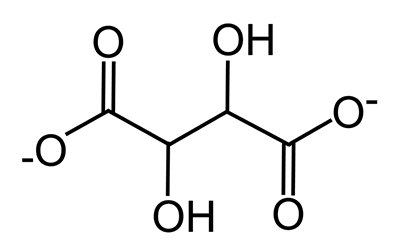
© Gouvernement du Canada, Institut canadien de conservation. ICC 128945-0021
Figure 8. Structure chimique de l’ion tartrate.
Le chlorure d’argent (AgCl) a une faible solubilité dans l’eau pure, soit d’environ 0,19 mg par 100 g d’eau, ou 1,3 × 10-5 M (calculée à partir de la racine carrée du produit de solubilité 1,77 × 10-10 M2, comme l’indique Lide [1998]). Or, dans les solutions contenant des concentrations élevées d’ions chlorure, la solubilité augmente, car les ions argent forment des complexes avec les ions chlorure, comme [AgCl2]-, [AgCl3]2- et [AgCl4]3-. Par exemple, à une concentration de 5 M de NaCl, la solubilité du chlorure d’argent est d’environ 86 mg pour 100 g d’eau, ou 6 × 10-3 M (Lin et coll., 2013). Il s’agit d’une solubilité presque 500 fois plus élevée que dans l’eau pure. Dans la préparation, l’un des rôles du chlorure du sodium est d’augmenter la concentration des ions argent dans la solution sous la forme de complexes de chlorure.
Les ions cuivre(I) et cuivre(II) forment également des complexes avec les ions chlorure, comme [CuCl2]- et [CuCl3]2- pour le cuivre(I), de même que CuCl+ pour le cuivre(II) [Smith et Martel, 2004]. Comme on l’a mentionné précédemment, les ions cuivre(II) forment également des complexes avec les ions tartrate. Ainsi, les ions chlorure et les ions tartrate ont aussi pour rôle de maintenir les ions cuivre produits dans la solution pendant la réaction de substitution électrochimique. Les ions chlorure et les ions tartrate favorisent également la dissolution des produits de corrosion, comme l’oxyde de cuivre, à la surface des objets de cuivre. D’ailleurs, une pâte composée de chlorure de sodium et de tartrate acide de potassium nettoie les ternissures de couleur foncée sur une pièce de monnaie en cuivre plus rapidement que des pâtes composées uniquement de l’un ou l’autre de ces éléments.
La sensibilité à la lumière du chlorure d’argent
Le chlorure d’argent est photosensible (Vogel et coll., 1978). Exposé à un rayonnement ultraviolet (UV) ou à une lumière bleue ayant une longueur d’onde inférieure à 410 nm environ, le chlorure d’argent se décompose pour former de l’argent métallique et du chlore gazeux (West et Gilman, 1977). Les particules d’argent métallique se dispersent dans le chlorure d’argent, ce qui lui donne une couleur mauve. Bien que le changement de couleur soit radical, seule une petite quantité de chlorure d’argent se transforme en argent, à moins que la poudre de chlorure d’argent ne soit exposée à la lumière directe du soleil et remuée fréquemment.
La figure 9a montre la couleur blanche du chlorure d’argent pur. La figure 9b montre la couleur lavande qui apparaît lorsque du chlorure d’argent pur est placé sous une lampe à rayonnement UV à 365 nm pendant 50 secondes.

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0048
Figure 9a. Poudre de chlorure d’argent blanc.

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0050
Figure 9b. Apparition d’une couleur lavande foncé à la surface de la poudre de chlorure d’argent après une exposition de 50 secondes sous une lampe à rayonnement UV à 365 nm.
Remerciements
Merci tout spécialement à Lucy ‘t Hart et à Jacqueline Riddle, deux anciennes stagiaires de l’ICC, d’avoir contribué à la conception de la présente Note.
Fournisseurs
Remarque : les renseignements qui suivent visent uniquement à informer le lecteur. Le fait qu’une entreprise figure dans la présente liste ne signifie pas pour autant qu’elle est approuvée par l’ICC.
Produits chimiques
Les produits chimiques sont vendus par des fournisseurs de substances chimiques, comme Fisher Scientific.
Alliages de cuivre
De minces feuilles de cuivre sont offertes par des fournisseurs de substances chimiques, comme Sigma-Aldrich. De minces feuilles de laiton (cales minces) sont offertes par des fournisseurs de quincaillerie, comme Lee Valley Tools. Il est aussi possible de se procurer du cuivre et des alliages de cuivre auprès de fournisseurs de métaux, comme Metal Supermarkets.
- Sigma-Aldrich (en anglais seulement)
- Lee Valley Tools
- Metal Supermarkets (en anglais seulement)
Bibliographie
Beentjes, T. P. C. « An Introduction to Silver Plating in 18th-century Europe », dans Metal 07: Proceedings of the Interim Meeting of the ICOM-CC Metal Working Group, vol. 1, Amsterdam, 17–21 September, 2007 (sous la direction de C. Degrigny, R. van Langh, I. Joosten et B. Ankersmit), Amsterdam (Pays-Bas), Rijksmuseum, 2007, p. 17-21.
Birnie, L. « Special Finishes on Non-ferrous Metals at the National Maritime Museum », dans Metal Plating and Patination: Cultural, Technical and Historical Developments (sous la direction de S. La Niece et P. Craddock), Oxford (Royaume-Uni), Butterworth-Heinemann, 1993, p. 148-154.
Clare, T. L., et A. Lins. Finishing Techniques in Metalwork (en anglais seulement), Philadelphia (Pennsylvanie), Philadelphia Museum of Art, s. d.
Dean, J. A. Lange’s Handbook of Chemistry, 14e édition, New York (New York), McGraw-Hill, 1992.
De Carle, D. Watch and Clock Encyclopedia, troisième édition, Ipswich (Royaume-Uni), NAG Press, 1983.
Goodrich, W.L. The Modern Clock: A Study of Time Keeping Mechanism; Its Construction, Regulation and Repair (en anglais seulement), Chicago (Illinois), Hazlitt and Walker, 1905, p. 434-435.
La Niece, S. « Silvering », dans Metal Plating and Patination: Cultural, Technical and Historical Developments (sous la direction de S. La Niece et P. Craddock), Oxford (Royaume-Uni), Butterworth-Heinemann, 1993, p. 201-210.
Lide, D. R. (directeur de publication). CRC Handbook of Chemistry and Physics , 79e édition, Boca Raton (Floride), CRC Press, 1998.
Lin, H., G. S. Frankel et W. H. Abbott. « Analysis of Ag Corrosion Products », Journal of The Electrochemical Society, vol. 160, no 8 (2013), p. C345-C355.
Paunovic, M., et M. Schlesinger. Fundamentals of Electrochemical Deposition, deuxième édition, New York (New York), Wiley, 2006, p. 169-175.
Phin, J. (directeur de publication). The Amateur’s Handbook of Practical Information for the Workshop and the Laboratory, deuxième édition, New York (New York), The Industrial Publication Co., 1879, p. 29.
Selwyn, L. Comment fabriquer et utiliser un agent de polissage de l’argent à base de carbonate de calcium précipité, Notes de l’ICC 9/11, Ottawa (Ontario), Institut canadien de conservation, 2016.
Smith, R. M, et A. E. Martell. NIST Critically Selected Stability Constants of Metal Complexes: Version 8.0 (en anglais seulement), Gaithersburg (Maryland), National Institute of Standards and Technology, 2004.
Society of Gilders. The Gilder’s Manual: A Complete Practical Guide to Gilding in All Its Branches, Washington (D.C.), Society of Gilders, 1990, p. 75-76 et p. 91. (Réimpression du manuel publié en 1876.)
Vogel, A., J. Bassett, R. C. Denney, G. H. Jeffery et J. Mendham. Vogel’s Textbook of Quantitative Inorganic Analysis, Including Elementary Instrumental Analysis, quatrième édition, Essex (Royaume-Uni), Longman Scientific & Technical, 1978, p. 433.
West, W., et P. B. Gilman. « Spectral Sensitivity and the Mechanism of Spectral Sensitization », dans The Theory of the Photographic Process (sous la direction de T. H. James), quatrième édition, New York (New York), Macmillan, 1977, p. 251-290.
Rédigé par Lyndsie Selwyn
© Gouvernement du Canada, Institut canadien de conservation, 2019
No de catalogue : NM95-57/9-12-2019F-PDF
ISSN 1928-5272
ISBN 978-0-660-28432-3