Comment effectuer un test de détection de l’or ou de l’étain – Notes de l’Institut canadien de conservation (ICC) 17/6
Liste des abréviations
- μm
- micromètre
- AIC
- American Institute for Conservation of Historic and Artistic Works
- g/cm3
- gramme par centimètre cube
- g/mol
- gramme par mole
- ICOM
- Conseil international des musées
- nm
- nanomètre
- p/p
- poids sur poids
- p/v
- poids sur volume
Introduction
L'or et l'étain sont deux métaux utilisés à des fins très différentes. L'or est un métal précieux servant principalement à la fabrication de bijoux et de pièces de monnaie, ainsi qu'au placage (dorure); on l'utilise également pour sa haute conductivité électrique (dans l'industrie de l'électronique) ou sa résistance à la corrosion (revêtement, dentisterie, médecine). L'étain est un métal industriel souvent présent dans des alliages et couramment utilisé pour plaquer le fer et le cuivre. Des exemples d'objets contenant ces métaux sont illustrés dans les sections Objets soumis à l'essai ponctuel de détection de l'or et Objets soumis à l'essai ponctuel de détection de l'étain.
Dans les tests décrits dans la présente procédure, on utilise une pile pour forcer la dissolution des ions métalliques dans la solution grâce à un processus appelé « électrolyse ». Une fois présents dans la solution, les ions métalliques sont détectables grâce aux changements de couleur qui se produisent lors des tests. Ces tests s'apparentent aux tests de détection du fer et du nickel décrits dans la Note de l'ICC 17/4 Comment effectuer un test de détection du fer ou du nickel, si ce n'est que la détection s'effectue au moyen de solutions préparées par l'utilisateur plutôt qu'à l'aide de papiers réactifs commerciaux. Aucun échantillon n'est prélevé sur les objets servant aux tests et aucun acide fort n'est utilisé.
Les deux tests reposent sur la puissance de réduction de l'étain à l'état d'oxydation +2 (ions Sn2+). Lors de l'essai ponctuel de détection de l'or, les ions or sont soumis à une dissolution forcée dans la solution et réagissent avec les ions Sn2+, qui réduisent les ions or à un précipité noir d'or métallique. Lors de l'essai ponctuel de détection de l'étain, les ions Sn2+ sont soumis à une dissolution forcée dans la solution et réagissent avec la cacothéline, qui prend une couleur mauve une fois réduite par les ions Sn2+.
L'essai ponctuel est l'une des techniques analytiques les plus simples pour détecter les métaux. La présente Note décrit la procédure et le matériel requis pour détecter l'or ou l'étain au moyen d'essais ponctuels. La première étape consiste à effectuer un essai avec des échantillons réputés contenir de l'or ou de l'étain afin de s'entraîner à utiliser l'électrolyse et à effectuer des essais ponctuels. Elle sert aussi à confirmer que les essais fonctionnent correctement. On peut ensuite tester des métaux inconnus. Pour en apprendre davantage sur ces essais ponctuels, consulter la section Aspects scientifiques des essais ponctuelsde détection de l'or et de l'étain.
Procédure : effectuer des essais ponctuels pour détecter l'or et l'étain
Avant d'effectuer ces essais ou de préparer les solutions, consulter la fiche de données de sécurité de chaque produit chimique utilisé. Il faut également porter l'équipement de protection individuelle recommandé, comme une protection pour les yeux, des gants jetables (par exemple, de nitrile) et des vêtements de protection. Dans la mesure du possible, il est recommandé d'utiliser une hotte lorsqu'on est appelé à transférer de l'acide chlorhydrique concentré.
Équipement et matériel requis pour des essais ponctuels de détection de l'or et de l'étain
- Objet en or ou coupon d'or (par exemple, feuille d'or)
- Objet en étain ou coupon d'étain (par exemple, feuille d'étain)
- Pile de 9 volts
- Câbles d'électrolyse artisanaux fabriqués avec des pincettes en acier inoxydable et une pince crocodile; pour connaître les détails de la fabrication, consulter la Note de l'ICC 17/4 Comment effectuer un test de détection du fer ou du nickel
- Solution mère saturée de chlorure de sodium; pour connaître les détails de la préparation, consulter la section Préparation de la solution mère saturée de chlorure de sodium
- Solution mère contenant 20 % (p/v) de chlorure d'étain(II) (SnCl2) et 15 % (p/p) d'acide chlorhydrique pour les tests de détection de l'or; pour connaître les détails de la préparation, consulter la section Préparation de la solution mère saturée de chlorure d'étain(II) et d'acide chlorhydrique
- Solution mère saturée de cacothéline pour les tests de détection de l'étain; pour connaître les détails de la préparation, consulter la section Préparation de la solution mère saturée de cacothéline
- Eau (déionisée ou distillée)
- Papier filtre (par exemple, papier filtre de grade 1 de la marque Whatman)
- Pincettes en plastique
- Ciseaux
- Pipettes (Pasteur ou plastique) ou compte-gouttes
- Petits récipients (par exemple, béchers jetables de 10 mL)
- Marqueur pour étiqueter les récipients
- Papier d'aluminium (facultatif)
- Plaque à godets (Lors du test de détection de l'or, il est plus facile de voir les changements de couleur sur des plaques à godets en porcelaine blanche; il est également possible de placer des plaques à godets en verre sur une surface blanche.)
Schéma du câblage pour l'électrolyse
La figure 1 présente le schéma du câblage qui doit être effectué aux fins de l'essai ponctuel à l'aide d'une pile. Seul le papier filtre doit toucher la surface du métal. L'extrémité des pincettes ne doit jamais toucher la surface métallique ni la pince crocodile. Il faut également s'assurer que le papier filtre est complètement imbibé entre le point où il touche les pincettes et celui où il touche la surface métallique. Si une partie du papier est sèche, le circuit ne sera pas complet, le courant ne circulera pas et le métal ne sera pas corrodé.
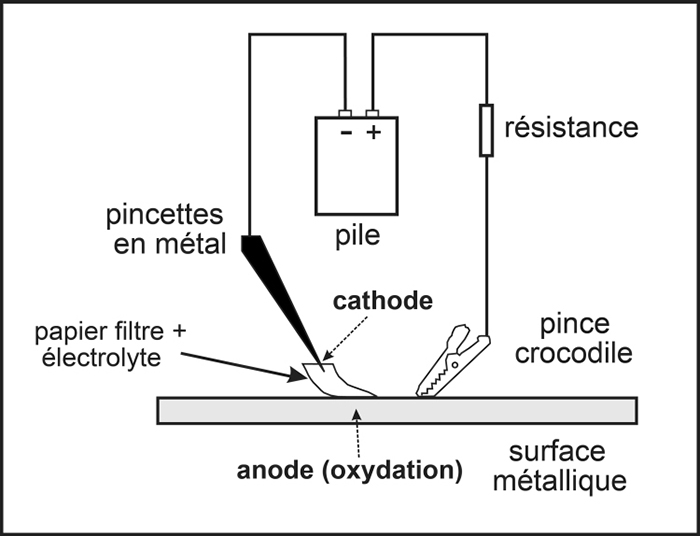
© Gouvernement du Canada, Institut canadien de conservation. ICC 128944-0025
Figure 1. Schéma du câblage utilisé avec une pile pour forcer la corrosion de la surface métallique et la formation d'ions métalliques en solution. Des pincettes en métal immobilisent le papier filtre, qui touche à la surface de métal. Une pince crocodile touche également à cette surface. Les pincettes et la pince crocodile sont reliées à une pile. La résistance placée entre la pile et la pince crocodile sert à limiter l'alimentation en courant.
Si la pince crocodile est attachée à l'objet (plutôt que d'être simplement posée contre celui-ci pour établir le contact, comme illustré à la figure 1), il est possible de placer du papier d'aluminium entre la pince et l'objet pour empêcher qu'elle ne l'égratigne. Pour obtenir une protection supplémentaire, il est également possible d'arrondir les dents de la pince à l'aide d'une lime.
Conseils généraux
- Porter des gants jetables afin d'éviter de toucher le papier filtre et les métaux à mains nues.
- Choisir une partie peu visible de l'objet pour effectuer le test, car il laisse généralement une petite marque, ou s'attendre à polir cette partie après le test pour éliminer la marque. S'abstenir d'effectuer le test sur un objet sur lequel il serait inacceptable de laisser une petite marque et qu'il n'est pas possible de polir.
- Découper des petits morceaux de forme triangulaire dans une feuille de papier filtre. Les triangles doivent avoir une pointe aiguë afin que les marques dues au test soient le moins visibles possible.
- Utiliser des pincettes en plastique (et non en métal) pour manipuler le papier filtre, sauf pendant l'étape de l'électrolyse.
- Il pourrait être nécessaire de dégraisser la surface du métal avant d'effectuer le test, car la présence de saletés pourrait interférer avec le test. Pour ce faire, utiliser de l'eau savonneuse ou de l'acétone. Le test ne fonctionnera pas si l'objet est recouvert d'un enduit, comme de la cire ou de la laque.
- Facultatif : utiliser un microscope pour observer la procédure pendant l'électrolyse. Cela permet de faire le test sur une plus petite surface.
- En prévision d'un test sur un objet constitué d'un métal non identifié, tester d'abord des échantillons dont on sait qu'ils contiennent de l'or ou de l'étain pour voir à quoi doit ressembler la réaction et s'assurer que les produits chimiques ne se sont pas détériorés. Conserver des échantillons de métal connu à portée de main à cette fin.
Procédure pour l'essai ponctuel de détection de l'or
Cette procédure s'inspire de celle décrite dans Laver (1978); Odegaard et coll. (2005) proposent une procédure légèrement différente.
- Transférer quelques millilitres de la solution mère de chlorure d'étain(II) de 20 % (p/v) et d'acide chlorhydrique de 15 % (p/p) dans un petit récipient.
- Transférer quelques millilitres de la solution mère de chlorure de sodium dans un deuxième petit récipient.
- Étiqueter les deux récipients.
- Mettre en place la pile et les câbles d'électrolyse.
- Découper un petit morceau de forme triangulaire dans du papier filtre.
- Déposer une goutte ou deux de la solution de chlorure de sodium dans l'une des cavités d'une plaque à godets.
- Tenir la pince crocodile d'une main et la mettre en contact direct avec l'or. La tenir fermement pour éviter d'égratigner l'objet (ou utiliser du papier d'aluminium).
- Dans l'autre main, tenir le papier filtre (la pointe vers l'extérieur) à l'aide des pincettes en acier inoxydable.
- Déposer la pointe du papier filtre dans la cavité pour éponger la solution. (Autrement, humidifier le papier avec quelques gouttes de la solution de chlorure de sodium à l'aide d'une pipette ou d'un compte-gouttes.) Le papier doit être humide, mais il ne faut pas l'imbiber abondamment de solution.
- Mettre le papier filtre humide en contact avec la surface métallique.
- Le maintenir en contact avec la surface pendant 10 secondes pour que l'électrolyse puisse se produire.
- Retirer le papier filtre et le placer sur la plaque à godets afin que la pointe qui était en contact avec l'or soit au-dessus de l'une des cavités de la plaque à godets.
- Ajouter une goutte de la solution de chlorure d'étain et d'acide chlorhydrique sur la plus grande partie du papier filtre (soit la partie opposée à la pointe qui était en contact avec l'or), puis laisser le papier absorber la solution jusqu'à ce qu'elle atteigne la pointe.
- Si des ions or sont présents, la pointe du papier filtre deviendra noire.
- Après le test, rincer la surface du métal à l'eau déionisée afin d'éliminer tout résidu de solution saline, puis la sécher immédiatement.
- Rincer les pincettes à l'eau claire après chaque utilisation.
Résultats de l'essai ponctuel de détection de l'or
La figure 2a montre un gros plan du dispositif d'électrolyse ayant servi à l'essai ponctuel de détection de l'or. La solution de chlorure de sodium venait tout juste d'être déposée sur le papier filtre, lequel est retenu à l'aide de pincettes. Le cylindre en or ayant servi à l'essai est en contact avec la pince crocodile et le papier filtre. La figure 2b montre le papier filtre après une électrolyse d'environ 10 secondes. La pointe du papier filtre est légèrement plus foncée à cause des ions or qui se sont dissous dans la solution au cours de l'électrolyse.

© Gouvernement du Canada, Institut canadien de conservation. ICC 128944-0002
Figure 2a. Vue rapprochée du dispositif d'électrolyse au début de l'essai ponctuel de détection de l'or.

© Gouvernement du Canada, Institut canadien de conservation. ICC 128944-0003
Figure 2b. Vue rapprochée du dispositif après 10 secondes d'électrolyse pour l'essai ponctuel de détection de l'or. La pointe du papier qui était en contact avec l'or a noirci.
La figure 3a montre le papier filtre après l'électrolyse. Il a été placé sur le bord de l'une des cavités vides d'une plaque à godets en verre. Jaunie par l'or dissous au cours de l'électrolyse, la pointe fait saillie au-dessus de la cavité. La figure 3b montre le papier filtre après l'ajout de la solution réductrice. La pointe du papier filtre a noirci, ce qui confirme la présence d'or.

© Gouvernement du Canada, Institut canadien de conservation. ICC 128944-0004
Figure 3a. Vue rapprochée du papier filtre après l'électrolyse. La pointe du papier a jauni à l'endroit qui était en contact avec l'or, comme illustré à la figure 2a.

© Gouvernement du Canada, Institut canadien de conservation. ICC 128944-0005
Figure 3b. Vue rapprochée du papier filtre après l'ajout de la solution réductrice; il s'agit de la deuxième étape de l'essai ponctuel de détection de l'or. La pointe du papier qui était en contact avec l'or est passée du jaune au noir.
La figure 4 montre la marque laissée sur une bague en or (probablement 10 carats [ct]) après l'électrolyse. Il est possible de retirer cette marque à l'aide d'un polissage abrasif, comme décrit à la section Nettoyage abrasif. L'essai peut également servir à distinguer une imitation de feuille d'or (faite en laiton) d'une feuille en or véritable, mais l'électrolyse détruirait une partie de la feuille métallique. Ce test est recommandé pour l'identification de placages en or effectués par électroplacage ou par dorure au feu (Thomson, 1991), mais il donne parfois des résultats peu, voire non concluants (Odegaard et coll., 2005).
Les objets électroplaqués ont fait leur apparition après 1840, année à laquelle cette technique a été brevetée. Avant 1840, la dorure au feu (également appelée « dorure au mercure » ou « dorure à l'amalgame ») était employée pour le dorage d'objets métalliques. À titre d'exemple, on utilisait la dorure au feu pour produire des alliages de cuivre dorés (appelé « or moulu ») qui servaient à orner des horloges, de la quincaillerie d'ameublement et des luminaires.
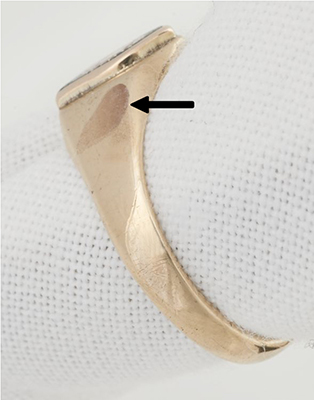
© Gouvernement du Canada, Institut canadien de conservation. ICC 128944-0009
Figure 4. La flèche indique la corrosion laissée sur une bague en or jaune après l'électrolyse.
Procédure pour l'essai ponctuel de détection de l'étain
La présente procédure s'inspire de celles décrites dans les ouvrages de Laver (1978) et de Feigl et Anger (1972). En l'occurrence, les deux solutions sont mélangées dans la cavité d'une plaque à godets plutôt que d'être ajoutées une à la fois sur le papier filtre.
- Transférer quelques millilitres de solution mère de chlorure de sodium dans un petit récipient, par exemple un bécher jetable de 10 mL.
- Transférer quelques millilitres de la solution de cacothéline dans un deuxième petit récipient.
- Étiqueter les deux récipients.
- Découper un petit morceau de forme triangulaire dans du papier filtre.
- Mettre en place la pile et les câbles d'électrolyse.
- À l'aide de pipettes distinctes, prélever une goutte de chlorure de sodium et une goutte de cacothéline dans les petits récipients et les verser dans l'une des cavités d'une plaque à godets (ou dans un petit récipient en l'absence d'une plaque à godets).
- À l'aide de pincettes en plastique propres et sèches, déposer la pointe du papier filtre dans la cavité de la plaque à godets pour éponger la solution. Le papier jaunira. Le papier doit être humide, mais il ne faut pas l'imbiber abondamment de la solution.
- Transférer le papier filtre humide des pincettes en plastique à celles en acier inoxydable du dispositif d'électrolyse. Tenir les pincettes d'une main, la pointe du papier filtre tournée vers l'extérieur (à l'écart des pincettes).
- De l'autre main, mettre la pince crocodile en contact direct avec l'objet en étain et la tenir fermement pour éviter d'égratigner l'objet (ou utiliser du papier d'aluminium).
- Mettre le papier filtre humide en contact avec la surface métallique.
- Le maintenir en contact avec la surface pendant cinq secondes pour que l'électrolyse puisse se produire.
- Si des ions étain sont présents, la pointe du papier filtre deviendra pourpre.
- Le papier filtre laisse parfois une goutte de liquide jaune ou pourpre sur l'objet. Immédiatement après l'essai, rincer la partie du métal ayant servi à l'essai avec de l'eau propre pour y retirer tout produit chimique, puis essuyer la surface.
- Rincer les pincettes à l'eau claire après chaque utilisation.
Résultats de l'essai ponctuel de détection de l'étain
La figure 5 montre la cavité d'une plaque à godets contenant la solution jaune ayant servi pendant l'essai. La pointe d'un morceau de papier filtre de forme triangulaire a été déposée dans la cavité, et le papier a épongé la solution. La figure 6 montre une vue rapprochée du dispositif d'électrolyse, juste avant le début de l'essai ponctuel de détection de l'étain. La pince crocodile et le papier filtre sont en contact avec une feuille rectangulaire d'acier étamé. La solution de cacothéline donne une couleur jaune au papier filtre. La figure 7 montre la pointe du papier filtre après l'électrolyse. La couleur pourpre indique la présence d'étain. Dans le fond de la cavité se trouve le reste de la solution jaune contenant de la cacothéline et du chlorure de sodium. Il est important de nettoyer rapidement les résidus de la solution sur le métal, sans quoi la solution laissera une marque blanche sur les surfaces ayant une teneur élevée en étain, ou une marque noire sur les alliages d'étain contenant du plomb (par exemple, du potin).

© Gouvernement du Canada, Institut canadien de conservation. ICC 128944-0014
Figure 5. Papier filtre trempé dans la solution jaune utilisée aux fins de l'essai, dans l'une des cavités d'une plaque à godets en verre.

© Gouvernement du Canada, Institut canadien de conservation. ICC 128944-0016
Figure 6. Vue rapprochée du dispositif d'électrolyse au début de l'essai ponctuel de détection de l'étain. S'y trouvent un morceau d'acier étamé, une pince crocodile en contact avec l'étain et des pincettes tenant un morceau de papier filtre de forme triangulaire. Humidifié à l'aide de la solution jaune utilisée aux fins de l'essai, le papier filtre semble plus foncé sur la surface en contact avec l'étain.

© Gouvernement du Canada, Institut canadien de conservation. ICC 128944-0018
Figure 7. Vue rapprochée du papier filtre après l'électrolyse effectuée à l'aide de l'acier étamé. La pointe du papier qui était en contact avec l'étain affiche à présent une couleur pourpre.
Renseignements supplémentaires
Nettoyage abrasif
Si l'essai laisse une marque sur l'objet en or ou en étain, on peut l'éliminer à l'aide d'un agent abrasif (comme du carbonate de calcium précipité). La Note de l'ICC 9/11 Comment fabriquer et utiliser un agent de polissage de l'argent à base de carbonate de calcium précipité contient de plus amples renseignements sur les agents de polissage abrasifs. Le polissage de l'étain à l'aide d'une pâte aqueuse composée d'agents abrasifs donne un aspect opaque au métal, car l'eau corrode légèrement l'étain fraîchement exposé. Il est préférable d'utiliser une pâte contenant de l'éthanol et un agent abrasif pour obtenir une surface plus brillante.
Pureté et couleurs des alliages d'or
L'essai ponctuel de détection de l'or est compatible avec divers alliages d'or. En joaillerie, la pureté de l'or est calculée en fonction de la fraction massique de l'or et s'exprime généralement en carats (fraction d'or multipliée par 24) ou en parties pour mille. Les degrés de pureté les plus courants sont de 18 ct, 14 ct et 10 ct.
L'alliage de l'or avec d'autres métaux modifie la couleur jaune caractéristique de l'or pur. Le cuivre ajoute une teinte de rouge, alors que l'argent ajoute une teinte de vert-blanc. L'ajout de palladium ou de nickel aux alliages d'or et de cuivre ou d'or et d'argent sert à blanchir la couleur jaune pour produire de l'or blanc (Drost et Hausselt, 1992). (Notons qu'il s'agit de l'utilisation moderne de l'expression « or blanc », qui désignait autrefois les alliages d'or et d'argent contenant un volume d'argent supérieur à 30 %). Créé pour remplacer le platine, l'or blanc sert souvent, pour la bijouterie en or, à compléter le sertissage d'un diamant ou à former un contraste avec les teintes jaunes des autres alliages d'or.
Objets soumis à l'essai ponctuel de détection de l'or
La figure 8 montre trois bagues dans lesquelles de l'or a été détecté. Pour ce qui est de la bague à droite de l'image, la pépite et l'anneau ont tous deux obtenu des résultats positifs.

© Gouvernement du Canada, Institut canadien de conservation. ICC 128944-0010
Figure 8. De gauche à droite : une bague en métal jaune vif (vraisemblablement de l'or de grande pureté), un anneau jaune gravé de motifs et portant la marque « 18K » (18 ct) et une pépite jaune montée sur un anneau d'or uni.
Les essais ponctuels de détection de l'or donnent des résultats irréguliers pour les alliages de 10 ct ou moins (Odegaard et coll., 2005). La figure 9 montre des bagues ayant quelquefois obtenu des résultats positifs lors d'essais répétés de détection de l'or.

© Gouvernement du Canada, Institut canadien de conservation. ICC 128944-0011
Figure 9. De gauche à droite : une pierre verte sertie sur un anneau jaune portant la marque « 10K » (10 ct), une bague d'école (écusson noir et rouge monté sur une bague en or ayant probablement une pureté de 10 ct, quoique la marque soit pratiquement effacée) et trois perles serties sur un anneau jaune portant la marque « 10K » (10 ct).
La figure 10 montre trois bagues en métal blanc. Seule la bague à gauche de l'image, portant la marque « 18K » (18 ct), a obtenu un résultat positif lors de l'essai ponctuel de détection de l'or. La bague d'école située au centre (portant la marque « 10K » [10 ct]) et l'anneau uni situé à droite de l'image ont obtenu un résultat négatif lors de l'essai ponctuel de détection de l'or. La densité de l'anneau uni situé à droite s'apparente à celle du platine.

© Gouvernement du Canada, Institut canadien de conservation. ICC 128944-0012
Figure 10. De gauche à droite : un anneau en métal blanc serti d'un diamant et portant la marque « 18K » (18 ct), une bague d'école (écusson noir et argent monté sur un anneau en métal blanc portant la marque « 10K » [10 ct]) et un anneau en métal blanc uni. Seule la bague apparaissant à gauche de l'image a obtenu un résultat positif lors de l'essai ponctuel de détection de l'or.
Calcul de la densité
Le calcul de la densité peut parfois remplacer les essais ponctuels décrits dans la présente Note. Par exemple, il est possible de distinguer le platine de l'or blanc par sa densité. La densité du platine pur est de 21,5 g/cm3 (Lide, 1998), celle de l'or blanc de 18 ct est d'environ 16 g/cm3 et celle de l'or blanc de 14 ct est inférieure à 15 g/cm3 (Drost et Hausselt, 1992). La densité de l'anneau de métal blanc uni illustré à la figure 10 était de 18,6 g/cm3, ce qui indique qu'il s'agit vraisemblablement d'un alliage de platine.
Le calcul de la densité est décrit dans la Note de l'ICC 9/10 Comment déterminer la densité du métal. Dans cette Note, il est question d'une balance à plateau supérieur, laquelle ne convient toutefois pas pour calculer la densité de petits objets, comme des bagues. Pour différencier une bague en platine d'une bague en or blanc, il faut plutôt utiliser une balance analytique. En plus d'être dotées d'une précision de lecture de 0,1 mg à 0,01 mg, la plupart des balances analytiques sont en mesure de peser un objet suspendu sous la balance.
Objets soumis à l'essai ponctuel de détection de l'étain
La figure 11 montre de petits objets qui ont obtenu un résultat positif lors d'un essai ponctuel de détection de l'étain. Le pendentif en forme d'ours a une longueur d'environ 3 cm. Tous les objets sont amagnétiques. La figure 12 montre de plus gros objets ayant obtenu un résultat positif lors d'un test de détection de l'étain. La boîte de conserve, l'entonnoir et la fourchette ont obtenu un résultat positif lors d'un essai ponctuel de détection de l'étain et sont tous les trois magnétiques, ce qui indique qu'ils sont faits de fer étamé. L'étain moderne, un alliage composé essentiellement d'étain et de petites quantités d'antimoine et de cuivre, n'est pas magnétique.

© Gouvernement du Canada, Institut canadien de conservation. ICC 128944-0019
Figure 11. De gauche à droite : deux petits jouets en forme de cœur, un pendentif en forme d'ours et deux petites figurines (une locomotive au-dessus et un aéronef au-dessous).

© Gouvernement du Canada, Institut canadien de conservation. ICC 128944-0020
Figure 12. De gauche à droite : une boîte de conserve, un bol en étain moderne, un entonnoir et une fourchette.
Sensibilité et interférences
Les essais ponctuels utilisés pour la détection de l'étain ont un seuil de détection pratique de 10 % massique (Townsend, 1988). Ceux servant à la détection de l'or s'avèrent fiables pour l'or de 14 ct et de pureté supérieure, mais ils donnent des résultats irréguliers pour les alliages d'or de 10 ct ou de pureté inférieure. Les objets plaqués or ne donnent que des résultats positifs faibles ou ne produisent aucun changement de couleur, ce qui indique que le métal de base interfère avec l'électrolyse (Odegaard et coll., 2005). Cet essai laisse des marques plus foncées sur l'or de 10 ct que sur l'or de pureté supérieure.
Aucune interférence n'est observée lors de l'essai ponctuel de détection de l'or, c'est-à-dire qu'aucun autre métal que l'or ne produit une tache noire (faux positif) lors de l'essai. Le cuivre et l'antimoine interfèrent avec l'essai ponctuel de détection de l'étain (Townsend, 1988). Lorsque du cuivre pur est soumis à un essai ponctuel de détection de l'étain, la pointe du papier se noircit légèrement, mais la couleur s'estompe en l'espace de quelques minutes. Les interférences avec l'antimoine sont rarement préoccupantes, car les restaurateurs sont peu susceptibles de tomber sur de l'antimoine, hormis en combinaison avec de l'étain. L'étain moderne, par exemple, contient certes un peu d'antimoine, mais il se compose essentiellement d'étain.
Entreposage
D'après Townsend (1998), la solution composée de chlorure d'étain et d'acide chlorhydrique se conserve pendant près d'un mois, alors que la solution de cacothéline se conserve pendant une à deux semaines. Dans la pratique, les solutions se conservent plus longtemps (au moins deux mois); il convient néanmoins de vérifier leur efficacité sur un échantillon connu avant de les utiliser.
Le chlorure d'étain(II) est très soluble dans l'eau. Il arrive qu'une petite quantité de poudre de chlorure d'étain(II) s'oxyde dans un vieux contenant pour former de l'oxyde d'étain(IV) blanc et insoluble dans l'eau (SnO2). Lorsque cela se produit, il se pourrait qu'une certaine quantité de poudre non dissoute [oxyde d'étain(IV)] subsiste lors de la préparation de la solution mère. Il convient d'effectuer un essai ponctuel préliminaire de détection d'or avec cette solution mère afin de vérifier si elle contient une quantité suffisante de chlorure d'étain(II) pour mener à bien le test.
Procédures supplémentaires
Préparation de la solution mère saturée de chlorure de sodium
La procédure ci-dessous peut servir à préparer 100 mL de solution de chlorure de sodium saturée. La solubilité du chlorure de sodium dans l'eau à 20 °C est de 35,9 g dans 100 mL d'eau. Il est également possible d'acheter une solution saturée de chlorure de sodium.
Équipement et matériel
- Chlorure de sodium (NaCl)
- Spatule
- Balance
- Eau (distillée ou déionisée)
- Bécher (100 mL)
- Récipient pour conserver la solution
Procédure
- À l'aide d'une spatule et d'une balance, peser environ 37 g de chlorure de sodium.
- Mettre environ 100 mL d'eau dans un bécher de 100 mL.
- Verser le chlorure de sodium dans l'eau et remuer pour le dissoudre.
- Si tout le chlorure de sodium se dissout, en ajouter un peu plus.
- Si des cristaux de chlorure de sodium non dissous apparaissent au fond du bécher, cela signifie que la solution est proche d'être saturée.
- Transférer la solution et tous les cristaux non dissous dans un récipient pour pouvoir l'entreposer à long terme. Il peut s'écouler plusieurs jours avant que la saturation soit atteinte. S'il n'y a plus de cristaux de chlorure de sodium au fond, en ajouter.
- Étiqueter le contenant.
Préparation de la solution mère saturée de chlorure d'étain(II) et d'acide chlorhydrique
La procédure suivante peut servir à préparer 25 mL d'une solution contenant 20 % (p/v) de chlorure d'étain(II) (environ 1 M) et 15 % (p/p) d'acide chlorhydrique (HCl, environ 4,4 M). Aussi connu sous le nom « chlorure stanneux », le chlorure d'étain(II) est offert sous forme anhydre (SnCl2, poids moléculaire de 189,62 g/mol) ou dihydratée (SnCl2·2H2O, poids moléculaire de 225,63 g/mol).
Équipement et matériel
- Chlorure d'étain(II) ou chlorure d'étain(II) dihydraté
- Acide chlorhydrique concentré, de 36 % à 38 % (p/p)*
- Eau (distillée ou déionisée)
- Fiole jaugée (25 mL)
- Cylindre gradué (10 mL)
- Pipettes (en verre ou en plastique) ou compte-gouttes
- Balance
- Papier de pesée
- Spatule
- Marqueur pour étiqueter les récipients
- Bouteille en verre ambré (pour conserver la solution)
* L'acide chlorhydrique concentré contient entre 36 % (p/p) et 38 % (p/p) de HCl, soit entre 11,64 M et 12,39 M. Aux fins de la présente procédure, la concentration de HCl est estimée à 37 % (p/p).
Procédure
- Verser 6 mL d'eau dans une fiole jaugée de 25 mL.
- Cette étape doit être effectuée sous une hotte. Mesurer soigneusement 9 mL d'acide chlorhydrique concentré dans un cylindre gradué de 10 mL. Transférer lentement l'acide dans la fiole jaugée de 25 mL qui contient déjà l'eau. (Important : il faut toujours verser l'acide concentré dans de l'eau.) Bien mélanger.
- À l'aide d'une spatule et d'une balance, peser précautionneusement 5,95 g de chlorure d'étain dihydraté ou 5,0 g de chlorure d'étain anhydre sur du papier de pesée, puis verser le tout dans la fiole jaugée de 25 mL. Mélanger en tournant pour dissoudre les éléments solides dans la solution.
- Ajouter de l'eau dans la fiole de 25 mL, jusqu'à ce que la solution atteigne la marque de 25 mL. Transférer la solution dans une bouteille en verre ambré, puis étiqueter la bouteille.
Préparation de la solution mère saturée de cacothéline
La procédure suivante peut servir à préparer 10 mL d'une solution aqueuse saturée de cacothéline. Sur le marché, la cacothéline est vendue sous forme d'hydrate complexe suivant la formule C21H21N3O7·HNO3·H2O. Le poids moléculaire de ce composé est de 508,44 g/mol. Dans cette formule, le composant chimique HNO3 rend la solution acide; préparée de la façon décrite ci-dessous, la solution mère a un pH d'environ 3. La cacothéline doit être traitée comme une substance toxique, même si ce ne sont pas toutes les fiches de données de sécurité qui la qualifient comme telle. Sa structure s'apparente par ailleurs à celle de la strychnine et de la brucine, qui sont toutes les deux toxiques.
Équipement et matériel
- Cacothéline
- Eau (distillée ou déionisée)
- Fiole jaugée (10 mL)
- Balance
- Papier de pesée
- Spatule
Procédure
- Mettre une petite quantité d'eau distillée dans une fiole jaugée de 10 mL.
- Peser 0,06 g de cacothéline à l'aide d'une spatule, du papier de pesée et d'une balance.
- Verser la cacothéline dans la fiole jaugée de 10 mL et la mélanger dans l'eau en tournant.
- Ajouter de l'eau distillée dans la fiole jusqu'à ce que la solution atteigne la marque de 10 mL.
- Si la cacothéline se dissout complètement, en ajouter davantage jusqu'à ce que des cristaux non dissous se déposent au fond de la fiole, et ce, pour s'assurer que la solution est saturée. (La solution est orange.)
- Étiqueter le contenant.
Aspects scientifiques des essais ponctuels de détection de l'or et de l'étain
La réaction d'oxydoréduction se produit dans les deux essais ponctuels de deux façons. En premier lieu, l'électrolyse sert à oxyder un métal et à produire les ions positifs de ce métal en solution. En deuxième lieu, la réaction d'oxydoréduction qui se produit en présence de ces ions provoque un changement de couleur. Dans les deux cas, l'oxydation mise en jeu par la réaction, qui se traduit par un changement de couleur, est la conversion des ions Sn2+ en ions Sn4+.
Électrolyse
L'électrolyse a lieu lorsqu'un courant électrique provoque des réactions d'oxydoréduction. Plus particulièrement, l'électrolyse se produit lorsque deux électrodes sont immergées dans un électrolyte (un sel dissous dans un agent solvant). Un des électrodes est soumis à une réaction d'oxydation, alors que l'autre est soumis à une réaction de réduction. Pour ce qui est de l'électrolyse effectuée dans le cadre des essais ponctuels, l'électrolyte est la solution saline servant à humidifier le papier filtre, et les deux électrodes sont l'objet de métal soumis au test et les pincettes en métal. Pour en savoir davantage, consulter la Note de l'ICC 17/4 Comment effectuer un test de détection du fer ou du nickel.
Changement de couleur : réaction entre l'or et le chlorure d'étain
Lorsqu'elle survient avec un objet en or, l'électrolyse produit des ions Au3+. Ces ions réagissent avec les ions chlorure présents dans l'électrolyte pour former des complexes de chlorure d'or [AuCl4]-. Le résultat de l'électrolyse s'écrit suivant cette formule :
Au(solide) + 4Cl- → [AuCl4]- (aqueux) + 3e-
La solution doit sa couleur jaune aux complexes [AuCl4]-.
L'ajout d'une solution acide de chlorure d'étain après l'électrolyse provoque une réaction d'oxydoréduction. Les ions Sn2+ servent d'agent réducteur. Lorsque les ions Sn2+ s'oxydent et deviennent des ions Sn4+, ils réduisent alors les ions Au3+ à des ions Au0 (or métallique). La réaction d'oxydoréduction nette (Vogel, 1945) s'écrit suivant cette formule :
3Sn2+ + 2[AuCl4]- → 3Sn4+ + 2Au(solide) + 8Cl-
L'or nouvellement formé coalesce pour former de minuscules particules colloïdales, ce qui se traduit par la couleur noire.
Extrêmement petites (taille inférieure à 1 μm), ces particules d'or n'ont pas la couleur jaune caractéristique de l'or. La couleur noire des particules colloïdales provient de la diversité de leur taille, car elles absorbent la lumière à travers tout le spectre des couleurs. On observe une couleur noire similaire sur les revêtements dits de « noir d'or », dont les particules ont une taille qui varie entre 5 nm et 8 μm (McKenzie, 1978). Par comparaison, les petites particules d'or (entre 10 nm et 100 nm) ayant une taille uniforme peuvent être colorées. À titre d'exemple, lorsque des particules d'or ont un diamètre d'environ 10 nm, elles absorbent plus facilement la lumière verte et renvoient ainsi une couleur teintée de rouge et de pourpre (Nassau, 2001). Ces particules servent à produire des pigments appelés « pourpre de Cassius » dans l'émail et le verre (Carbert, 1980).
Changement de couleur : réaction entre l'étain et la cacothéline
Lorsqu'elle survient avec un objet en étain, l'électrolyse produit des ions Sn2+. Voici la formule de cette réaction :
Sn(solide) → Sn2+ + 2e-
La détection des ions Sn2+ se fait grâce à la cacothéline, dont la formule chimique est C21H21N3O7; sa structure est illustrée à la figure 13 :
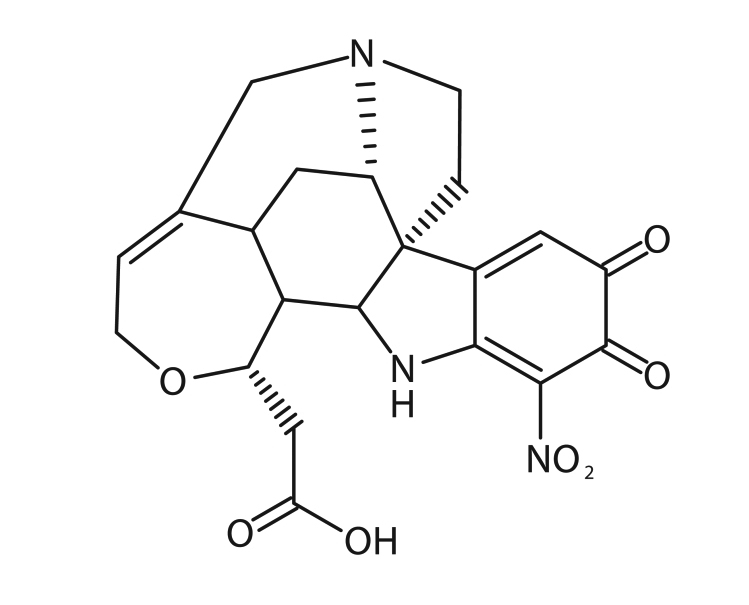
© Gouvernement du Canada, Institut canadien de conservation. ICC 128944-0022
Figure 13. Structure chimique de la cacothéline.
Les ions étain entrent en réaction avec la molécule de la cacothéline, comme illustré à la figure 14.
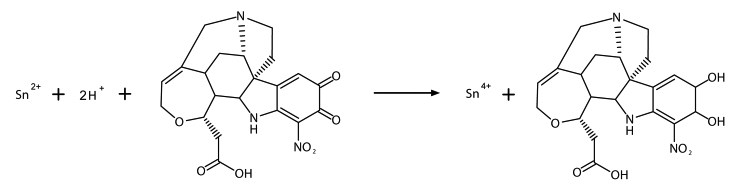
© Gouvernement du Canada, Institut canadien de conservation. ICC 128944-0023
Figure 14. Un ion étain(II), deux ions hydrogène et la molécule organique de la cacothéline, à gauche, entrent en réaction pour former un ion étain(IV) et la molécule organique de la forme réduite de la cacothéline, à droite.
Les ions étain s'oxydent à l'état d'oxydation +4 (Sn4+) et la molécule de la cacothéline est réduite (Ottaway, 1972). La forme réduite de la cacothéline, aussi appelée « cacothéline dihydro », est responsable de la couleur pourpre indiquant un résultat positif lors de l'essai ponctuel de détection de l'étain.
Remerciements
Merci tout spécialement à Ute Werner, ancienne stagiaire à l'ICC, d'avoir contribué à la rédaction de la présente Note.
Fournisseurs
Remarque : les renseignements qui suivent visent uniquement à informer le lecteur. Le fait qu'une entreprise figure dans la présente liste ne signifie pas pour autant qu'elle est approuvée par l'ICC.
Produits chimiques
Le chlorure de sodium, l'acide chlorhydrique concentré, le chlorure d'étain(II) et le papier filtre de marque Whatman sont vendus par des fournisseurs de substances chimiques, comme Fisher Scientific. Une solution saturée de chlorure de sodium fabriquée par Ricca Chemical est distribuée par différents fournisseurs de substances chimiques, dont Fisher Scientific. L'hydrate complexe de cacothéline est offert par des fournisseurs de substances chimiques. En Amérique du Nord, il est possible de s'en procurer auprès de TCI America et de Sigma-Aldrich.
- Fisher Scientific
- Ricca Chemical (en anglais seulement)
- TCI America
- Sigma-Aldrich (en anglais seulement)
Or et étain
Les minces feuilles d'or et d'étain à utiliser comme échantillons sont offertes par des fournisseurs de substances chimiques, comme Sigma-Aldrich. Des fournisseurs de dorures, dont Sepp Leaf Products, vendent également des feuilles d'or.
- Sigma-Aldrich (en anglais seulement)
- Sepp Leaf Products (en anglais seulement)
Bibliographie
Carbert, J. « Gold-based Enamel Colours: The Constitution and Applications of Purple of Cassius », Gold Bulletin, vol. 13, no 4 (1980), p. 144-150.
Drost, E., et J. Hausselt. « Uses of Gold in Jewellery », Interdisciplinary Science Reviews, vol. 17, no 3 (1992), p. 271-280.
Feigl, F., et V. Anger. Spot Tests in Inorganic Analysis, Amsterdam (Pays-Bas), Elsevier, 1972.
Laver, M. E. « Spot Tests in Conservation: Metals and Alloys », dans ICOM Committee for Conservation, 5th Triennial Meeting, Zagreb, Paris (France), Conseil international des musées, 1978, p. 78/23/8/1-11.
Lide, D. R. (directeur de publication). CRC Handbook of Chemistry and Physics, 79e édition, Boca Raton (Floride), CRC Press, 1998, p. 12-192.
McKenzie, D. R. « Gold Black and Gold Cermet Absorbing Surfaces », Gold Bulletin, vol. 11, no 2 (1978), p. 49-53.
Nassau, K. The Physics and Chemistry of Color: The Fifteen Causes of Color, deuxième édition, New York (New York), Wiley, 2001, p. 305.
Odegaard, N., S. Carroll et W. S. Zimmt. Material Characterization Tests for Objects of Art and Archaeology, deuxième édition, Londres (Royaume-Uni), Archetype Publications, 2005.
Ottaway, J. « Oxidation-reduction Indicators of E0′ < 0.76 Volt », dans Indicators (sous la direction de E. Bishop), Oxford (Royaume-Uni), Pergamon Press, 1972, p. 469-529.
Selwyn, L. Comment déterminer la densité du métal, Notes de l'ICC 9/10, Ottawa (Ontario), Institut canadien de conservation, 2016.
Selwyn, L. Comment fabriquer et utiliser un agent de polissage de l'argent à base de carbonate de calcium précipité, Notes de l'ICC 9/11, Ottawa (Ontario), Institut canadien de conservation, 2016.
Selwyn, L. Comment effectuer un test de détection du fer ou du nickel, Notes de l'ICC 17/4, Ottawa (Ontario), Institut canadien de conservation, 2016.
Thomson, C. « Last But Not Least – Examination and Interpretation of Coatings on Brass Hardware », dans AIC Annual Meeting, Albuquerque, New Mexico, Wooden Artifacts Group Specialty Session, June 6, 1991, Washington (D.C.), American Institute for Conservation, 1991.
Townsend, J. H. « The Identification of Metals: Chemical Spot Tests », dans Modern Metals in Museums (sous la direction de R. E. Child et J. M. Townsend), Londres (Royaume-Uni), Institute of Archaeology, 1988, p. 15-22.
Vogel, A. I. A Text-book of Qualitative Chemical Analysis: Including Semimicro Qualitative Analysis, troisième édition, Londres (Royaume-Uni), Longmans, Green and Co. Ltd., 1945, p. 434.
Rédigé par Lyndsie Selwyn
© Gouvernement du Canada, Institut canadien de conservation, 2019
No de catalogue : NM95-57/17-6-2019F-PDF
ISSN 1928-5272
ISBN 978-0-660-28436-1