Bureau de liaison pour la Loi sur les aliments et drogues : Rapport sur les activités, avril 2014 à mars 2015
Table des matières
Le Bureau de liaison pour la Loi sur les aliments et drogues (BLLAD) offre au personnel et aux intervenants externes la possibilité d'obtenir des renseignements et des services de résolution des différends liés à l'application de la Loi sur les aliments et drogues. En 2014-2015, le BLLAD a poursuivi ses activités fondamentales de résolution des différends et d'amélioration des relations avec les intervenants au sein de la Direction générale des produits de santé et des aliments (DGPSA). En outre, le BLLAD a dirigé la refonte du processus de révision des décisions sur les présentations de drogues pour usage humain de la Direction générale, un processus que le Bureau sera appelé à gérer. Le présent rapport annuel passe en revue les activités menées par le BLLAD en 2014-2015 et donne une idée des expériences vécues par les intervenants selon le point de vue unique du Bureau au sein de Santé Canada.

Télécharger le format de rechange
(Format PDF, 408 ko, 15 pages)
Organisation : Santé Canada
Type : Rapport
Date publiée : 2015-10-20
Résumé des réalisations
Gestion du processus de révision des décisions
En 2014, la haute direction a demandé au Bureau d'examiner les processus de révision en vigueur à la Direction générale sur les produits de santé et les aliments. Le processus de révision est un recours administratif offert par Santé Canada aux promoteurs de drogues pour usage humain qui sont en désaccord avec une décision relative à une licence. Le BLLAD a été chargé de trouver des moyens d'améliorer l'impartialité et la transparence du processus de révision des décisions remises en question par des intervenants externes. Cette initiative s'inscrit dans le cadre de l'engagement global de Santé Canada à l'égard de la transparence et de l'ouverture dans le but de renforcer encore plus la confiance dans ses décisions en matière de réglementation.
Bien qu'il y ait plus d'un processus de révision des décisions à Santé Canada, la première étape de l'examen consistait précisément à revoir le processus de révision des décisions liées aux drogues pour usage humain avant leur commercialisation qui ont été rendues par la Direction des produits thérapeutiques (DPT) et la Direction des produits biologiques et des thérapies génétiques (DPBTG). Un groupe de travail dirigé par le BLLAD a procédé à la refonte du processus. Dans le cadre du modèle revu, le BLLAD, un organisme impartial et indépendant faisant partie de la Direction générale des communications et des affaires publiques (DGCAP), s'est vu confier la responsabilité de gérer le processus de révision. Vous trouverez une description du processus dans la plus récente version de la Ligne directrice : Révision des décisions sur les présentations de drogues pour usage humain.
Les intervenants externes ont été appelés à commenter sur le modèle revu et corrigé à l'automne 2014. La rétroaction des intervenants était généralement favorable ou neutre. À la lumière des commentaires reçus, le BLLAD a mis la dernière main à la ligne directrice, laquelle a été publiée sur le site Web de Santé Canada. Le 1er avril 2015, le BLLAD a commencé la gestion de toutes les demandes de révision reçues à partir de cette date.
Au fil du temps, le BLLAD devra assumer la responsabilité de la refonte et de la gestion des processus de révision des décisions d'autres secteurs de programmes réglementaires au sein de la DGPSA. La Direction des produits de santé naturels et sans ordonnance (DPSNSO) sera la prochaine à être soumise à un examen.
Gestion de cas
En 2014-2015, la priorité de l'équipe du BLLAD est demeurée axée sur la réalisation de son mandat initial, qui consiste à offrir des services rapides et informels de résolution des différends relatifs à la Loi sur les aliments et drogues aux parties réglementées et au personnel affecté à la réglementation. Le BLLAD a géré 100 cas en 2014-2015 (voir Figure 1), ce qui est comparable à l'exercice précédent. Une tendance relevée précédemment s'est maintenue : un plus grand nombre d'entreprises communiquent avec le Bureau et ont représenté 49 % de tous les cas au cours de l'exercice écoulé.
Les services du BLLAD sont à la disposition des intervenants externes et des employés de Santé Canada. L'une ou l'autre de ces parties peut demander de l'aide impartiale pour la résolution de différends. En 2014-2015, neuf employés de Santé Canada se sont adressés au BLLAD pour obtenir de l'aide pour la gestion de relations tendues avec des intervenants.
Nous classons les cas que nous recevons en deux grandes catégories : recherche d'information et gestion des problèmes. En règle générale, les cas de gestion des problèmes concernent une plainte. Cette année, la gestion des problèmes représentait 64 % de tous les cas. Il s'agit des cas qui tirent le meilleur parti de l'expertise du BLLAD en matière de résolution de différends. Plus de détails au sujet des cas sont fournis dans une section ultérieure.
Les types de cas gérés par le BLLAD diffèrent grandement sur le plan du contenu scientifique et des domaines de litige, mais dans toutes les situations, l'intervenant veut avant tout avoir une expérience de service satisfaisante. Nous avons le même objectif, ce qui va dans le même sens que les recommandations faites par la Commission sur la réduction de la paperasse. Les efforts déployés par le BLLAD pour améliorer l'expérience de service des intervenants sont aussi conformes aux exigences énoncées dans les politiques récentes du Conseil du Trésor, notamment la Politique d'interprétation et la Politique sur les services.
Renforcement des compétences
Enfin, le BLLAD continue de jouer un rôle à Santé Canada dans le renforcement des compétences du personnel en ce qui a trait à la gestion des relations avec les intervenants au sein d'un système de réglementation complexe qui évolue sans cesse. L'an dernier, nous avons offert trois séances de deux jours du programme de formation par l'expérience intitulé « Pour tirer le maximum des communications difficiles avec les intervenants », séances qui se sont avérées populaires. Depuis notre création il y a sept ans, nous avons formé plus de 655 employés de Santé Canada et du portefeuille de la Santé (dont l'Agence de la santé publique du Canada et l'Agence de réglementation de la lutte antiparasitaire), ainsi que plus de 140 employés de la Communauté des régulateurs fédéraux de l'ensemble du gouvernement.
Commentaires reçus
Le rôle que joue le BLLAD nous donne une idée de ce que les intervenants pensent de la manière dont le Ministère applique la Loi sur les aliments et drogues pendant une année donnée. Nous faisons état des améliorations qui ont été signalées, de même que des suggestions d'améliorations futures.
Les tendances relevées dans la présente section du rapport ne sont pas forcément fondées sur un ensemble de commentaires ou de plaintes par rapport à une question quelconque. Les tendances sont plutôt cernées en fonction des cas que nous recevons et des renseignements anecdotiques que nous récoltons grâce à nos interactions avec divers intervenants.
Améliorations perçues par les intervenants
En 2014-2015, les intervenants ont fait des commentaires positifs concernant deux changements apportés par Santé Canada à la mise en application de la Loi sur les aliments et drogues.
Simplification de la réglementation de produits comportant un risque similaire
En juillet 2013, le Ministère a transféré la responsabilité de l'examen des médicaments en vente libre et des désinfectants à ce qui est maintenant appelé la Direction des produits de santé naturels et sans ordonnance (DPSNSO). Cet examen harmonisé emploie des pratiques et des méthodes semblables pour des produits comportant un risque similaire afin d'accroître l'efficacité et l'uniformité de la prise de décisions.
Les intervenants des divers secteurs d'activités ont constaté d'importantes améliorations depuis que ce changement a été apporté. Ils disent qu'il y a une meilleure communication et une plus grande harmonisation dans l'approche réglementaire liée à ces produits dont un grand nombre ont des profils de risque qui se ressemblent. Les efforts de la DPSNSO à cet égard ont été bien accueillis, y compris le projet pilote d'attestation à une monographie pour des médicaments vendus sans ordonnance en août 2014. Ce projet pilote élimine la nécessité d'une évaluation des présentations de médicaments de catégorie IV et permet l'approbation de médicaments en vente libre étayés entièrement par une de huit monographies de produit. Ce processus réglementaire accéléré cadre avec le processus d'homologation en place pour les produits de santé naturels. Cette réduction du fardeau administratif a été confirmée par bon nombre d'intervenants.
Réduction de l'arriéré dans l'examen des médicaments génériques par la Direction des produits thérapeutiques
Les présentations de médicaments génériques ont beaucoup augmenté une fois que la protection des brevets a pris fin pour un nombre record de médicaments « vedettes » entre 2008 et 2013, ce qui a créé un arriéré important dans l'examen et l'homologation des médicaments génériques. La DPT a pris diverses mesures au cours de cette période pour résorber l'arriéré et elle y est arrivée en novembre 2013.
Les fabricants de médicaments génériques se sont dits satisfaits que la DPT ait réussi à maintenir ses objectifs de rendement quant aux examens de médicaments génériques en 2014-2015 et à éviter tout retard important.
Demandes d'amélioration de la part des intervenants
Ce qui suit sont les questions de réglementation qui ont donné lieu à des plaintes et à des demandes d'amélioration.
Publication des produits au moment de l'approbation du DIN
Certaines parties réglementées ont exprimé des préoccupations quant à la décision du Ministère de rendre publics tous les produits au moment où un numéro d'identification d'une drogue (DIN) leur est attribué.
Cette initiative a d'abord été lancée dans le cadre de l'engagement du Ministère à l'égard de l'ouverture et de la transparence du processus d'approbation des médicaments. En outre, elle appuie la réglementation sur l'étiquetage en langage clair récemment adoptée et selon laquelle les entreprises sont tenues d'effectuer une évaluation de la marque nominative de tout nouveau produit pharmaceutique afin de réduire le risque que leur produit soit confondu avec un autre. Cela veut dire que les entreprises doivent faire une évaluation nominative de tous les produits pharmaceutiques homologués qui pourraient être mis sur le marché canadien.
La publication de produits immédiatement après l'homologation inquiète les associations industrielles et les entreprises dont les produits ne sont pas protégés par un brevet. Il s'agit, entre autres, des écrans solaires, des produits antipelliculaires, des produits de traitement contre l'acné, des produits anticaries contenant du fluorure et des produits de blanchiment des dents. Elles craignent que la publication de leurs produits au moment de l'approbation permette à leurs concurrents et aux fabricants de produits contrefaits de copier leurs produits non brevetés avant qu'elles n'aient eu la possibilité de lancer leurs produits et de se tailler une place sur le marché. Les entreprises estimaient qu'elles n'avaient pas été avisées suffisamment à l'avance de la décision de publier les DIN au moment de l'approbation et qu'elles n'avaient par conséquent pas pu atténuer les répercussions de cette décision sur leurs processus opérationnels.
Le BLLAD a porté ces préoccupations à l'attention de la haute direction.
Contrôle réglementaire approprié pour les produits de santé destinés aux consommateurs
Bien qu'elles appuient en général la création de la DPSNSO, certaines parties réglementées qui fabriquent ou importent des cosmétiques, des cosméceutiques et d'autres produits de soins personnels continuent de se plaindre de ce qu'elles considèrent un fardeau administratif et un manque d'efficience relativement à l'examen de certains de leurs produits. Ces produits, en particulier les écrans solaires (tant les écrans solaires primaires que secondaires, comme du fond de teint ou du baume à lèvres), peuvent être considérés comme des médicaments en vente libre, des produits de santé naturels ou des cosmétiques en fonction de leur ingrédient actif et des allégations faites sur l'étiquette. Chaque classification a ses propres exigences réglementaires à respecter, y compris certaines que ces entreprises voient comme aussi onéreuses que celles qui s'appliquent aux médicaments d'ordonnance.
L'industrie a cité deux exemples récents. Premier exemple : les fabricants d'écrans solaires ont été inclus dans l'avis envoyé par le Ministère à tous les fabricants et les importateurs de médicaments voulant qu'ils affichent l'ensemble des pénuries de médicaments et des discontinuations de médicaments prévues et actuelles sur le site des pénuries canadiennes de médicaments. Deuxième exemple : les normes liées aux bonnes pratiques de fabrication (BPF) ont été mises en place pour ce qui est des ingrédients pharmaceutiques actifs (IPA). Dans les deux cas, les membres de ce secteur de l'industrie ont demandé au Ministère de modifier les exigences liées aux cosméceutiques afin qu'un contrôle réglementaire approprié puisse être effectué.
Le BLLAD a joué un rôle essentiel en portant ces préoccupations à l'attention de la haute direction. Le Ministère a apporté des modifications à sa façon de faire afin de veiller à ce que le fardeau administratif et de conformité imposé à ce secteur soit proportionnel aux risques que présentent ses produits. De novembre 2014 à février 2015, le Ministère a tenu une consultation sur un cadre pour les produits de santé destinés aux consommateurs visant à établir une démarche cohérente et harmonisée liée à la réglementation de produits de santé de consommation (désinfectants, produits de santé naturels, produits pharmaceutiques en vente libre et cosmétiques). Cette initiative a été accueillie favorablement par l'industrie.
Délais d'examen de la conformité de sites étrangers avec les bonnes pratiques de fabrication
Les entreprises qui vendent des médicaments fabriqués à l'étranger sont tenues de fournir à Santé Canada des preuves de l'application des bonnes pratiques de fabrication (BPF) par ces établissements étrangers. Une entreprise ne peut fabriquer ni importer de produits médicamenteux destinés au marché canadien sans avoir une cote canadienne valide de conformité avec les BPF. De plus, puisque les BPF sont un bon indice du souci de la qualité d'un établissement, avant d'accepter d'examiner une présentation de médicament, la Direction des produits thérapeutiques (DPT) exige que le site de fabrication proposé dispose d'une cote canadienne valide de conformité avec les BPF. Selon les normes de rendement du Ministère, le processus (décrit dans le guide GUI-0080) devrait être terminé dans un délai de 250 jours. Les entreprises se sont plaintes que les longs délais d'examen en vue de l'attribution d'une cote de conformité d'un site étranger avec les BPF peuvent retarder considérablement la mise sur le marché canadien de nouveaux produits thérapeutiques. Cependant, au cours de la dernière année, les intervenants ont déclaré que ces délais s'étaient beaucoup améliorés et que la norme de rendement de 250 jours était largement respectée. Il n'en reste pas moins que les entreprises ne peuvent prévoir ni savoir exactement quand elles recevront leur cote de conformité, ce qui complique la planification commerciale. Les intervenants aimeraient qu'il soit plus facile de prévoir quand les examens de sites étrangers seront achevés et ils estiment qu'un système faisant la distinction entre les sites de fabrication de médicaments à faible risque et les sites de fabrication de médicaments à risque élevé serait préférable à l'actuelle approche unique.
Difficultés à l'exportation entraînées par les changements concernant l'homologation des PSN
Depuis que le Règlement sur les produits de santé naturels a été mis en vigueur en 2004, la DPSNSO a apporté de nombreux changements pour simplifier le processus d'homologation des produits. Elle a établi des monographies pour attester l'innocuité et l'efficacité d'un grand nombre de PSN couramment utilisés. En 2013, la DPSNSO a mis en place un système d'examen des produits à trois catégories selon lequel le processus d'examen dépend de ce qu'on sait sur le produit. Par exemple, dans le cas des produits à faible risque qui sont conformes à une monographie, il suffit de l'attester dans la demande, tandis que pour les produits à risque moyen ou élevé, un examen complet de l'innocuité et de l'efficacité est nécessaire.
En plus de raccourcir le délai d'homologation, le processus d'attestation de la conformité avec la monographie présente beaucoup d'autres avantages pour l'industrie. Les entreprises peuvent, après l'homologation, apporter des changements qui tiennent entièrement compte des paramètres définis par la monographie sans avoir à présenter une demande de modification de leur demande originale ou à en aviser le Ministère, selon le cas. Cependant, les changements effectués par la DPSNSO pour accélérer le processus d'homologation ont fait en sorte que les licences visant les produits à faible risque ne contiennent plus de renseignements détaillés sur les produits, comme la quantité d'ingrédients médicamenteux et la provenance des ingrédients. Les entreprises canadiennes qui souhaitent exporter leurs produits ont découvert que certains organismes de réglementation étrangers exigent des renseignements sur ce qui a été approuvé par Santé Canada avant d'autoriser l'importation et la vente des produits. Les nouvelles licences ne sont donc pas adéquates.
Le BLLAD a demandé que la DPSNSO réexamine cette question, compte tenu des répercussions éventuelles sur l'exportation de produits de santé naturels canadiens. Après avoir consulté l'industrie et en avoir discuté à l'interne, la DPSNSO a conclu que les gains d'efficacité résultant du processus d'homologation accéléré seraient neutralisés si elle recommençait à examiner en profondeur toutes les demandes afin de délivrer une licence de mise en marché détaillée. Comme solution, elle a proposé que les entreprises puissent obtenir un Certificat de commerce international (CCI) d'un tiers qui précise la situation réglementaire d'une licence de PSN délivrée par Santé Canada. Le Ministère a d'ailleurs mis en place un processus similaire en 2013 lorsqu'il a transféré la responsabilité de la délivrance des CCI à des tiers acceptant d'exercer la fonction selon les critères établis par le Ministère.
Aucune possibilité de révision dans le cas de refus partiel
Un cas cette année a fait ressortir un problème qui survient de temps à autre en ce qui concerne les présentations de drogues pour usage humain. Une entreprise a présenté une demande d'homologation d'un médicament pour plusieurs indications. Après avoir examiné les données fournies relativement à l'innocuité et à l'efficacité, le Ministère a conclu qu'elles n'appuyaient que certaines des indications. Il a donné deux choix à l'entreprise : 1) recevoir un avis de non-conformité (ANC) pour avoir la possibilité de présenter les données manquantes avant que le processus d'examen ne reprenne; 2) retirer les indications pour lesquelles il fallait des données supplémentaires concernant l'innocuité et l'efficacité et recevoir un avis de conformité (AC) du Ministère pour certaines des indications seulement. L'entreprise pouvait décider plus tard de présenter une nouvelle demande pour les autres indications une fois qu'elle disposait de données supplémentaires.
L'entreprise ne comprenait pas pourquoi elle n'avait pas l'option de demander une révision du refus du Ministère d'homologuer le médicament pour les quatre indications en raison de l'insuffisance des données relatives à l'innocuité et à l'efficacité. Ni l'un ni l'autre des choix n'officialisait le rejet de deux indications par le Ministère. Dans ce cas, l'entreprise s'est vivement opposée à la décision du Ministère d'exiger des données supplémentaires sur l'innocuité et l'efficacité et a voulu demander un processus de révision du refus du Ministère. Toutefois, comme le Ministère lui avait présenté deux choix afin de résoudre la demande, un processus de révision ne pouvait lui être offert. D'autres entreprises se sont trouvées dans la même situation par le passé.
Le Ministère approfondira cette question pour déterminer s'il y a d'autres façons de gérer les décisions de cette nature.
Qui utilise nos services
Tant des entreprises que des individus communiquent avec le BLLAD, mais les entreprises sont le type d'intervenants qui le font le plus souvent. De plus, les entreprises sont moins portées que les individus à communiquer avec le BLLAD simplement pour obtenir des renseignements.
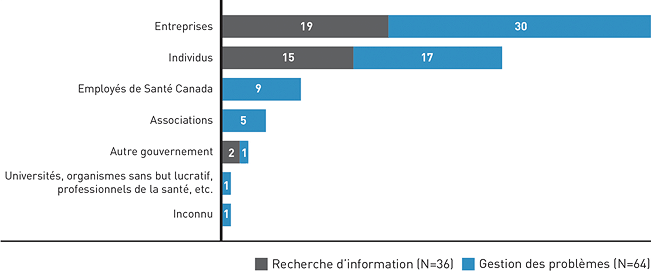
Figure 1 : Types d'intervenants et nature des cas - Équivalent textuel
| Recherche d'information | Gestion des problèmes | |
|---|---|---|
| Individus | 15 | 17 |
| Entreprises | 19 | 30 |
| Employés de Santé Canada | 0 | 9 |
| Universités, organismes sans but lucratif, professionnels de la santé, etc. | 0 | 1 |
| Autre gouvernement | 2 | 1 |
| Associations | 0 | 5 |
| Inconnus | 0 | 1 |
| Total | 36 | 64 |
De grandes entreprises et associations qui ont souvent affaire au Ministère ont commencé à recourir régulièrement aux services du BLLAD. Par ailleurs, nous nous taillons une réputation pour notre savoir-faire en gestion des problèmes (ou règlement des plaintes), car nous recevons plus de demandes de cette nature que de demandes courantes pour des renseignements. Les cas de gestion des problèmes mettent le plus à profit nos compétences comme spécialistes du règlement des différends.
Thèmes relevés
Les cas qui nous ont été soumis ont été classés dans un ou plusieurs des quatre thèmes suivants :
- Problèmes de communication (par exemple, demandes de renseignements, clients non rappelés, manque de clarté dans la correspondance ou correspondance qui ne traite pas des préoccupations des intervenants)
- Questions de politique (par exemple, désaccords au sujet de l'interprétation ou de l'application de la loi, des politiques ou des règlements, notamment en ce qui concerne la classification des produits, l'évaluation des risques ou la cohérence des politiques)
- Questions de procédure (par exemple, insatisfaction à l'égard des processus utilisés dans la prise de décisions réglementaires, notamment en ce qui concerne les délais, l'ouverture, la transparence, la prévisibilité, les préavis sur les changements concernant l'établissement des règlements)
- Problèmes interpersonnels (par exemple, traitement des intervenants par le personnel ou demandes d'aide du personnel en ce qui concerne les communications difficiles avec les intervenants)
Les cas de gestion des problèmes traités en 2014-2015 portaient surtout sur des questions de politique et de procédure, comme celles mentionnées dans le présent rapport.
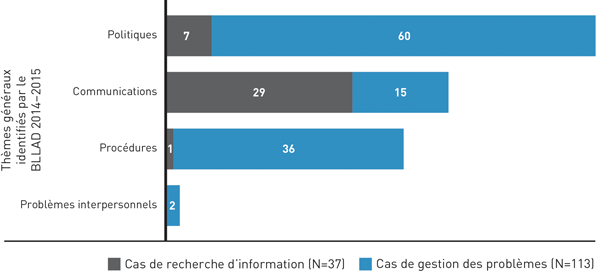
Figure 2 : Thèmes généraux identifiés pas le BLLAD - Équivalent textuel
| Cas de recherche d'information | Cas de recherche d'information | |
|---|---|---|
| Certains cas peuvent se retrouver dans plus d'un thème. | ||
| Questions liées à la communication | 29 | 15 |
| Questions de politique | 7 | 60 |
| Questions liées à la procédure | 1 | 36 |
| Questions de problèmes interpersonnels | 0 | 2 |
| Total | 37 | 113 |
Une proportion importante des plaintes de 2014-2015 avaient trait à deux questions particulières. L'une d'entre elles était la position du Ministère à l'égard des cigarettes électroniques (7 cas). L'autre était le processus de délivrance des licences de producteur autorisé de marihuana à des fins médicales (17 cas). Le BLLAD ne traite plus les plaintes relatives à la marihuana thérapeutique, car les questions liées à la Loi réglementant certaines drogues et autres substances ne sont pas de son ressort.
Le BLLAD joue toujours un rôle important dans l'obtention de précisions et d'aide pour les intervenants lorsque des produits sont saisis ou que leur entrée au Canada est refusée en raison d'une prétendue violation de la Loi sur les aliments et drogues. Dans certains cas, le BLLAD peut agir comme intermédiaire entre l'intervenant et le Ministère pour lever des obstacles à l'importation en s'assurant que les exigences réglementaires ont été satisfaites. Dans d'autres cas, le BBLAD aide l'intervenant à comprendre les motifs et le fondement juridique du refus.
Directions ayant participé à la résolution des cas
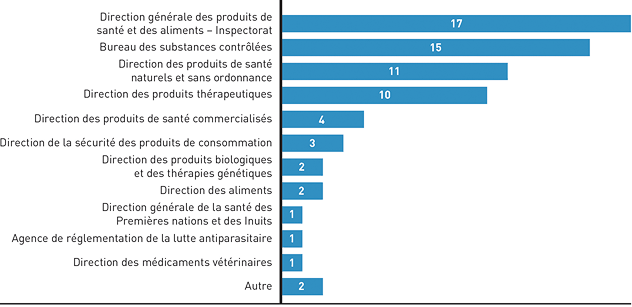
Figure 3 : Unités de travail concernées par les cas de gestion des problèmes - Équivalent textuel
Diagramme à barres horizontales expliquant les directions concernées par le règlement des plaintes.
- Inspectorat de la Direction générale des produits de santé et des aliments : 17;
- Bureau des substances contrôlées : 15;
- Direction des produits de santé naturels et sans ordonnance : 11;
- Direction des produits thérapeutiques : 10;
- Direction des produits de santé commercialisés : 4;
- Direction de la sécurité des produits de consommation : 3;
- Direction des produits biologiques et des thérapies génétiques : 2;
- Direction des aliments : 2;
- Direction générale de la santé des Premières nations et des Inuits : 1;
- Agence de réglementation de la lutte antiparasitaire : 1;
- Direction des médicaments vétérinaires : 1;
- Autre : 2.
La majorité des cas de gestion des problèmes traités par le BLLAD concernent l'Inspectorat de la Direction générale des produits de santé et des aliments (DGPSA), le Bureau des substances contrôlées (BSC), la Direction des produits de santé naturels et sans ordonnance (DPSNSO) et la Direction des produits thérapeutiques (DPT). Les demandes de renseignements sont réparties un peu plus également, mais elles concernent aussi surtout l'Inspectorat, la DPSNSO et la DPT.
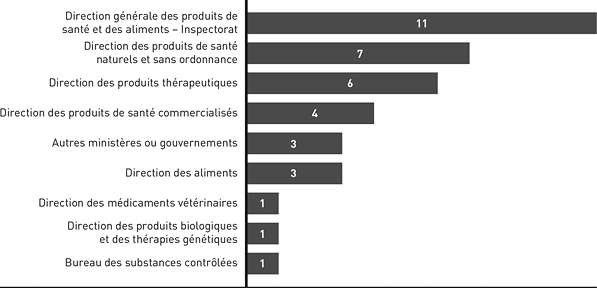
Figure 4 : Renvois de cas de recherche d'information - Équivalent textuel
Diagramme à barres horizontales indiquant les organismes auxquels le Bureau de liaison pour la Loi sur les aliments et drogues a renvoyé les intervenants.
- Inspectorat de la Direction générale des produits de santé et des aliments : 11;
- Direction des produits de santé naturels et sans ordonnance : 7;
- Direction des produits thérapeutiques : 6;
- Direction des produits de santé commercialisés : 4;
- Autres ministères ou gouvernements : 3;
- Direction des aliments : 3;
- Direction des médicaments vétérinaires : 1;
- Direction des produits biologiques et des thérapies génétiques : 1;
- Bureau des substances contrôlées : 1.
Dans certains cas, les directions ont répondu directement aux demandes de renseignements des intervenants ou ont aidé le BLLAD à le faire. Dans d'autres cas, le BLLAD a travaillé directement avec l'intervenant pour résoudre la question sans faire appel aux directions. Le BLLAD peut offrir un encadrement aux intervenants pour qu'ils puissent avoir des conversations plus fructueuses avec les employés de Santé Canada.
Une très grande proportion des cas traités par le BLLAD proviennent de l'Ontario.
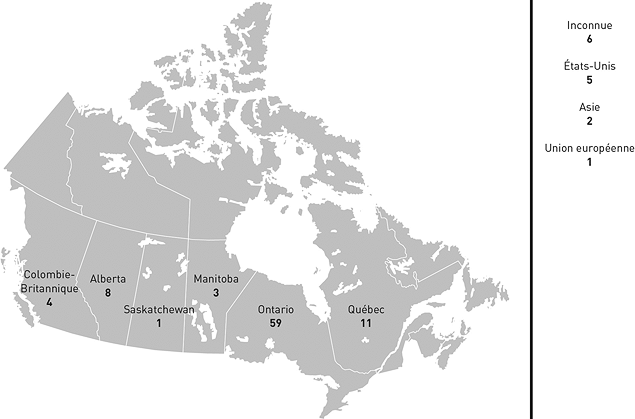
Figure 5 : Répartition géographique des cas - Équivalent textuel
Carte du Canada indiquant l'origine géographique des dossiers ouverts par le Bureau de liaison pour la Loi sur les aliments et drogues.
- Ontario : 59;
- Québec : 11;
- Colombie-Britannique : 4;
- Alberta : 8; Nouvelle-Écosse : 0;
- Saskatchewan : 1;
- Territoires du Nord-Ouest : 0;
- Manitoba : 3;
- Nouveau-Brunswick : 0;
- Île-du-Prince-Édouard : 0;
- Terre-Neuve : 0;
- Yukon : 0;
- Nunavut : 0;
- États-Unis : 5;
- Union européenne : 1;
- Asie : 2;
- Inconnu: 6.
Les prochaines étapes
Au cours de la prochaine année, le BLLAD continuera de favoriser des relations positives avec les intervenants en traitant les cas, en offrant au personnel de nouveaux programmes de formation sur la gestion des communications avec les intervenants et en appuyant les efforts du Ministère pour renouveler la fonction publique dans le cadre de l'initiative pangouvernementale Objectif 2020.
Le 1er avril 2015, le BLLAD a assumé son nouveau rôle comme responsable de l'application du processus décrit dans la nouvelle Ligne directrice : Révision des décisions sur les présentations de drogues pour usage humain. Il y va avec précaution afin d'offrir ce service dans un délai raisonnable et de manière professionnelle. Le BLLAD a également formé un nouveau groupe de travail avec la Direction des produits de santé naturels et sans ordonnance (DPSNSO) pour commencer à établir un processus de révision simplifié pour cette direction, qui répondra aux demandes provenant de ces deux secteurs réglementés.