Archivée - Évaluation horizontale du Réseau sur l’innocuité et l’efficacité des médicaments (RIEM) 2014-2015 à 2018-2019
Document préparé par le Bureau de l'audit et de l'évaluation Santé Canada et Agence de la santé publique du Canada
Version traduite. En cas de divergence entre le présent texte et le texte anglais, la version anglaise a préséance.
Mai 2020
Téléchargez le format alternative
(Format PDF, 1.30 MB, 52 pages)
Organization: Santé Canada
Table des matières
- Résumé
- Description du programme
- Description de l'évaluation
- Constatations de l'évaluation
- Conclusions et recommandations
- Réponse de la direction et plan d'action
- Annexes
Résumé
Contexte du programme
Le Réseau sur l'innocuité et l'efficacité des médicaments (RIEM) a été créé en 2009 par Santé Canada et les Instituts de recherche en santé du Canada (IRSC). Le RIEM est un réseau d'équipes de recherche financées qui mènent des études post-commercialisation sur l'innocuité et l'efficacité des médicaments au Canada. Il comprend également un programme de formation visant à développer la capacité de recherche sur l'innocuité et l'efficacité des médicaments au Canada. La recherche produite par le RIEM vise à appuyer Santé Canada et d'autres décideurs canadiens en ce qui concerne la surveillance ciblée et la prise de décisions relatives aux médicaments à usage humain.
Le RIEM dispose d'un budget de 10 millions de dollars par année, duquel 7,4 millions de dollars sont consacrés à des subventions et à des bourses pour les équipes de recherche du réseau et son volet de formation. Le financement des subventions et des bourses est administré par les IRSC.
Constatations principales
Incidence et utilisation
- Les données probantes soulignent le besoin de mener des études post-commercialisation sur l'innocuité et l'efficacité des médicaments, dans le contexte actuel de l'évolution rapide du secteur pharmaceutique. Toutefois, la plupart les décideurs ont constaté pour que les données probantes post-commercialisation du RIEM, bien que de qualité supérieure, n'étaient pas diffusées en temps opportun pour répondre aux besoins décisionnels, ce qui compromet leur pertinence et leur utilité.
Vitesse de traitement et autres modèles
- Les principaux obstacles la production en temps voulu de données probantes post-commercialisation par le RIEM sont les problèmes de communication durant le processus de traitement des requêtes, la décentralisation de la direction du réseau qui a fait en sorte que certaines responsabilités clés ne sont pas effectuées, la disponibilité des données de recherche et l'évolution constante des besoins des décideurs.
- D'autres producteurs de données probantes post-commercialisation ont obtenu de meilleurs résultats en répondant aux besoins des décideurs d'une manière plus rapide et pertinente. Une analyse des modèles de prestation adoptés par ces producteurs a identifié les principales leçons apprises qui favorisent la production de renseignements pertinents et opportuns pour les décideurs. Celles-ci comprennent une gouvernance simplifiée où décideurs et chercheurs sont réunis à la même table, des priorités et des programmes clairement établis, une application centralisée des connaissances, un accès facile aux données, et une formation et un renforcement des capacités spécialisés.
Défis liés à la mise en œuvre
- Une partie des défis que présente le RIEM peut être liée aux restrictions de conception associées aux autorisations de financement de recherche obtenues en 2008.
- Les autorisations de financement permettent aux IRSC de financer la recherche seulement au moyen de subventions et non des contrats, ce qui limite la rapidité du réseau à accéder aux études post-commercialisation menées à l'extérieur du RIEM.
- La subvention obtenue, qui est assujettie à la Politique sur les paiements de transfert, ne permet pas aux chercheurs subventionnés par le RIEM de participer à la table de gouvernance où sont prises les décisions stratégiques et où les priorités sont établies, car cela pourrait créer un conflit d'intérêts réel ou perçu dans l'administration du programme.
Recommandations
-
Envisager d'autres modèles pour fournir en temps voulu des données probantes pertinentes aux décideurs, tout en continuant à accroître les forces du RIEM en matière de renforcement des capacités liées à l'innocuité et l'efficacité des médicaments suivant leur mise en marché.
Le besoin de recueillir de l'information sur l'innocuité et l'efficacité des médicaments suivant leur mise en marché est important et, compte tenu de l'évolution rapide des innovations en matière de développement et d'approbation des médicaments, il devrait accroître de façon importante au cours de la prochaine décennie. Bien que le RIEM soit un atout précieux du point de vue de l'expertise, son contexte et ses processus opérationnels actuels ne permettent pas la production en temps opportun des données probantes dont les décideurs ont besoin. Afin d'appuyer pleinement la production de données probantes pertinentes en temps opportun et d'améliorer la valeur du programme, le modèle de prestation doit être remanié afin d'éliminer les obstacles qui empêchent actuellement d'appliquer le mécanisme de financement flexible prévu à l'origine pour le réseau.
- À l'avenir, les contraintes de la conception actuelle devraient être abordées comme suit :
- Une gouvernance simplifiée qui réunit les chercheurs et les responsables des politiques à la même table de décision, car elle favorise la communication et une culture axée sur la satisfaction des besoins des décideurs;
- Des priorités et des programmes de recherche bien établis et conformes aux besoins en matière de politiques et de prise de décisions;
- Une application centralisée des connaissances et une approche unifiée de la gestion de projet qui comprend l'utilisation de modèles de plans analytiques pour les conceptions d'études fréquemment utilisées et des approches normalisées pour répondre aux requêtes des responsables des politiques;
- Un accès facile aux données grâce à des partenariats avec les détenteurs de données, notamment le secteur privé (c.-à-d., les compagnies d'assurance privées).
Quel que soit le nouveau modèle qui découlera de la recommandation 1, le modèle choisi devra être assorti de plusieurs éléments essentiels pour en assurer le succès. Ces éléments visent à éliminer les obstacles à la communication, à promouvoir une direction centralisée et réceptive et une approche organisationnelle concertée, à assurer que le réseau fonctionne de manière à répondre aux besoins des décideurs et à soutenir la viabilité à long terme du RIEM. L'opérationnalisation de ces éléments fait partie de l'établissement d'une culture de recherche axée sur les services qui accorde la priorité aux besoins des responsables des politiques, dont les décisions ont une incidence marquée sur les cliniciens et les patients.
Description du programme
« Aucune intervention de soins de santé n'étant plus fréquente que la prescription d'une pharmacothérapie, il est fort important d'en assurer l'innocuité et l'efficacité au Canada ». [Traduction]
Chercheur du RIEM - répondant clé

Pourquoi le RIEM a-t-il été créé?
En 2007, Santé Canada a reçu l'autorisation, en vertu du Plan d'action pour assurer la sécurité des produits alimentaires et de consommationNote de bas de page a d'établir le programme du Réseau sur l'innocuité et l'efficacité des médicaments (RIEM). Le RIEM avait pour but de combler des lacunes dans les données probantes sur l'innocuité et l'efficacité des médicaments suivant leur mise en marché, ainsi que d'accroître la capacité à répondre en temps opportun aux requêtes de recherche urgentes visant à évaluer dès que possible les risques associés à un médicament.
Les données probantes produites par le RIEM étaient destinées à améliorer la capacité de Santé Canada à évaluer en continu les risques liés à l'innocuité des médicaments par rapport aux avantages thérapeutiques qu'ils procurent. Cela permettrait aux autorités gouvernementales de mieux déterminer les profils d'innocuité des médicaments et de prendre des mesures préventives pour en réduire des effets indésirables sur la santé. Plus précisément, les activités de recherche du RIEM visaient à appuyer directement la surveillance ciblée des produits pharmaceutiques et la prise de décisions selon la méthode du cycle de vie du produit à l'égard de la réglementation des médicaments.
Les données probantes produites par le RIEM devaient en outre renseigner d'autres décideurs canadiens sur les régimes d'assurance-médicaments publics et le remboursement connexe, ainsi que sur la prescription et l'utilisation sécuritaires et optimales des médicaments dans le système canadien de santé.
Pour soutenir le développement et la mise en œuvre du RIEM, Santé Canada a établi un partenariat avec les Instituts de recherche en santé du Canada (IRSC). En raison de leur expertise dans le financement de recherches et de réseaux, les IRSC ont été vus comme un atout pour répondre aux besoins de renforcement des capacités du nouveau RIEM. Ensemble, ils devaient établir des processus dans le cadre opérationnel du RIEM qui allaient :
- faciliter les efforts de recherche collaborative interdisciplinaire;
- cerner les lacunes dans les connaissances nécessaires pour prendre des décisions fondées sur des données probantes et définir les orientations stratégiques;
- établir un programme de recherche intégré et prioritaire;
- fournir un processus simplifié pour mener rapidement les recherches essentielles;
- faciliter l'échange de nouvelles connaissances scientifiques;
- établir et renforcer des partenariats nationaux et internationaux dans ce domaine de recherche.
Structure de programme
Le RIEM est un réseau de quatre équipes de recherche financées qui effectuent des recherches sur l'innocuité et l'efficacité des médicaments après la mise en marché au Canada. Les objectifs du RIEM sont d'augmenter les données probantes sur l'innocuité et l'efficacité des médicaments à la disposition des organismes de réglementation et des responsables des politiques et d'accroître la capacité d'entreprendre au Canada une recherche postcommercialisation de haute qualité dans ce domaine.
Le RIEM est administré conjointement par les IRSC et Santé Canada. Les IRSC administrent les subventions de recherche et jouent un rôle central dans la coordination des activités du réseau. Le Bureau des stratégies de gestion des produits pharmaceutiques et la Direction des produits de santé commercialisés de Santé Canada assurent la surveillance des politiques et veillent à ce que les recherches du RIEM orientent le processus décisionnel fédéral en matière réglementaire. Les activités du RIEM sont appuyées par trois comités de gouvernance : un comité directeur, un groupe de travail exécutif et un comité consultatif scientifique.
Le budget annuel du RIEM s'établit à 10 millions de dollars. Les budgets annuels prévus sont présentés dans le tableau 1.
| Subventions et bourses | Coûts de fonctionnement et de locaux des IRSC | Coûts de fonctionnement et de locaux de Santé Canada | Total par année |
|---|---|---|---|
| 7 435 516 $ | 1 578 141 $ | 986 343 $ | 10 000 000 $ |
| Source : IRSC et SC | |||
Gouvernance du RIEM en bref
Instituts de recherche en santé du Canada
Bureau de coordination du RIEM : Mettre en œuvre, faciliter et coordonner le fonctionnement du RIEM, établir les mécanismes de financement de la recherche et promouvoir l'application des connaissances.
Santé Canada
Bureau des stratégies de gestion des produits pharmaceutiques : Assurer une surveillance des politiques et coordonner la participation des provinces et territoires.
Direction des produits de santé commercialisés : Diriger et gérer la présentation des requêtes au RIEM dans l'ensemble de la direction générale, éclairer l'orientation stratégique du RIEM par moyen de son rôle au sein du comité directeur du RIEM.
Comité directeur du RIEM
Composé de divers intervenants et d'utilisateurs de connaissances, notamment des IRSC et de SC, le comité directeur formule des conseils sur l'orientation stratégique du RIEM et sur les priorités en matière de recherche, tels que définies par l'élaboration d'un programme de recherche commun.
Groupe de travail exécutif du RIEM
Composé de cadres supérieurs des IRSC et de SC, ainsi que de partenaires clés, le groupe de travail exécutif a pour mandat de faciliter la gestion horizontale entre les partenaires du RIEM grâce à une collaboration sur les initiatives stratégiques, l'orientation de politiques et l'évaluation du RIEM.
Comité consultatif scientifique du RIEM
Composé de représentants des équipes de recherche du RIEM, des organisations qui présentent des requêtes et d'autres intervenants, le comité consultatif scientifique offre un forum de discussion informel dont les membres élaborent et précisent les requêtes.
Fonctionnement du RIEM
Les décideurs admissibles peuvent présenter des requêtes au réseau sur l'innocuité et l'efficacité des médicaments suivant leur mise sur le marché par l'intermédiaire du bureau de coordination du RIEM. Ces décideurs comprennent l'organisme de réglementation fédéral, les gestionnaires des régimes d'assurance-médicaments provinciaux et territoriaux et les organismes mandatés pour appuyer les décisions fédérales, provinciales et territoriales relatives aux médicaments, comme l'Agence canadienne des médicaments et des technologies de la santé (ACMTS) et l'Institut canadien d'information sur la santé (ICIS).
Les catégories de requêtes présentées sont les suivantes :
- Si les médicaments sur ordonnance commercialisés sont sécuritaires pour différentes populations de patients
- La réaction de différents groupes à un médicament approuvé et son efficacité
- La décision d'ajouter un nouveau médicament à une couverture d'assurance publique (c.-à-d., quand il est plus efficace que ceux qui sont déjà disponibles)
- La manière sûre et optimale d'utiliser et de prescrire des médicaments précis
Si une requête est jugée réalisable (c.-à-d., qu'une équipe de recherche du RIEM peut y répondre après analyse de la méthodologie potentielle, de la durée du projet, de la disponibilité des données et des coûts), les chercheurs proposent un ou plusieurs projets de recherche à l'auteur de la requête. Pour une requête unique, l'auteur de la requête peut être offert plusieurs projets de recherche. L'auteur ensuite approuve les projets qui répondront le mieux à sa requête, et les projets sont lancés. Les résultats sont communiqués à l'auteur de la requête et, au besoin, diffusés à plus grande échelle.
Équipes de recherche du RIEM en bref
Le RIEM est composé de quatre équipes de recherche qui fournissent aux décideurs un éventail de méthodologies de recherche et leur offrent de multiples options pour répondre aux requêtes.
MAGIC (Groupe sur les méthodes et les applications pour la comparaison indirecte)
- Recueille des données en analysant la littérature, publiée ou non, des documents de réglementation, etc.
- Synthétise es données issues d'autres études pertinentes pour obtenir des résultats combinés et dégager des messages clés.
CNODES (Réseau canadien pour l'étude observationnelle des médicaments)
- Examine l'usage approprié et inapproprié des médicaments en contexte réel pour chaque province.
- Évalue l'innocuité de médicaments sur ordonnance.
- Compare l'efficacité des médicaments sur ordonnance.
- A accès facilement à des données anonymes sur les soins de santé de plus de 100 millions de patients.
CAN-AIM (Réseau canadien sur les méthodes interdisciplinaires avancées de recherche sur l'efficacité comparative)
- Analyse les données historiques de patients.
- Utilise des études observationnelles qui font le suivi prolongé de patients pour évaluer l'efficacité et l'innocuité de médicaments en contexte réel.
- Intègre des sources de données diverses, dont des cohortes cliniques
- Évalue les nouvelles sources de données (p. ex., l'utilisation des médias sociaux).
SEARCH & PREVENT (Réseau de surveillance active et d'évaluation des effets indésirables dans les soins de santé au Canada et équipe nationale de pharmacogénomique des effets indésirables)
- Mener des études sur des patients canadiens pour déterminer les facteurs cliniques et génétiques pouvant donner lieu à un risque accru de réactions indésirables à des médicaments (p. ex., enfants, femmes enceintes).
- A accès aux données de 28 hôpitaux canadiens, dont 10 hôpitaux pour enfants.
- A accès à des échantillons biologiques (p. ex., sang, salive).
Description de l'évaluation
Portée et méthode d'évaluation
Il s'agit de la deuxième évaluation du RIEM. Le Bureau de l'audit et de l'évaluation (BAE) de Santé Canada a dirigé l'évaluation, en collaboration avec les responsables de la fonction d'évaluation des IRSC. La dernière évaluation du RIEM remontait à 2014. La première évaluation a cerné un besoin d'améliorer l'efficience et l'efficacité, notamment en précisant les principaux aspects du fonctionnement des opérations et en établissant des normes de service pour la présentation des requêtes. Elle avait aussi cerné un besoin de mieux surveiller le rendement par rapport aux résultats prévus. Au 31 mars 2019, la réponse de la direction et le plan d'action provenant de cette évaluation avaient été partiellement mis en œuvre.
La première évaluation portait principalement sur la conception et l'exécution du renforcement des capacités du RIEM, les activités de coordination et l'obtention des résultats immédiats attendus. Cette deuxième évaluation a été axée sur l'évaluation des résultats intermédiaires du programme, en particulier si les données probantes produites par le RIEM sont utilisées par les décideurs dans le système de gestion des produits pharmaceutiques pour éclairer leurs décisions, et si le RIEM est considéré comme une source de renseignements pertinents en temps opportun qui appuient la prise des décisions relatives aux avantages et aux risques des médicaments sur le marché. Le modèle logique du RIEM se trouve à l'annexe a : modèle logique du riem (Decembre 2018).
Pour aider à évaluer ces objectifs, l'évaluation a reposé sur les trois questions ciblées suivantes, définies en consultation avec le programme et le comité directeur du RIEM.
- Dans quelle mesure les responsables des politiques, les organismes de réglementation, l'ACMTS, les gestionnaires de régimes d'assurance-médicaments et d'autres intervenants clés du système de gestion des produits pharmaceutiques se fient-ils aux données probantes et aux conseils produits par le RIEM suivant la mise en marché pour prendre leurs décisions sur les principales questions d'innocuité et d'efficacité des médicaments?
- Les processus et les mécanismes de financement actuels du RIEM répondent-ils aux besoins de ces mêmes intervenants en matière de données probantes et de conseils pertinents en temps opportun sur l'innocuité et l'efficacité des médicaments suivant la mise en marché?
- Quels autres modèles ou méthodes pourraient optimiser l'investissement du RIEM afin de mieux appuyer la présentation de données probantes et de conseils exhaustifs en temps opportun sur l'innocuité et l'efficacité des médicaments qui répondent aux besoins des responsables des politiques, des organismes de réglementation fédéraux, de l'ACMTS et des gestionnaires de régimes d'assurance-médicaments?
La portée de l'évaluation a compris toutes les activités du RIEM entre avril 2014 et mars 2019. Les données d'évaluation ont été recueillies à l'aide de diverses sources et méthodes, dont les suivantes :
Littérature universitaire et littérature grise
Une analyse de la littérature grise et évaluée par les pairs publiée de 2014-2015 à 2018-2019 a été réalisée avec l'aide de la Bibliothèque de la santé de Santé Canada. Soixante articles ont été retenus aux fins de l'évaluation.
Entrevues auprès de répondants clés
Les évaluateurs ont mené des entrevues auprès de 38 répondants clés (17 personnes au sein des IRSC et de Santé Canada et 21 personnes externes) :
- Programme des IRSC : 6
- Gouvernance : 9
- Décideurs ou auteurs de requêtes : 13
- Chercheurs du RIEM : 6
- Experts externes : 4
Les thèmes émergeant des entrevues ont été cernés et quantifiés à l'aide du logiciel d'analyse qualitative NVIVO.
Documents et dossiers
Le personnel du programme des IRSC et de Santé Canada a fourni aux évaluateurs des documents administratifs et de politique à des fins d'examen. Au total, 290 dossiers ont été examinés.
Données financières
Le personnel du programme des IRSC et de Santé Canada a fourni des données financières sur les dépenses prévues et réelles de programme, validées par leur bureau du dirigeant principal des finances respectif. Ces données ont été utilisées pour évaluer si les fonds ont été dépensés comme prévu et pour estimer le coût par requête des projets financés par le RIEM.
Analyse comparative
Le RIEM a été comparé à quatre autres modèles internationaux et nationaux de production de données probantes sur les médicaments mis en marché. Les réseaux utilisés à titre comparatif étaient les suivants :
- le réseau européen de centres pour la pharmacoépidémiologie et la pharmacovigilance (ENCePP)
- l'initiative Sentinel de la Food and Drug Administration (FDA) des États-Unis
- le Réseau de recherche sur les politiques ontariennes en matière de médicaments (RRPOM)
- l'Institute of Health Economics
L'analyse s'est appuyée sur un examen de documents de programme publics, de la littérature universitaire et de cinq entrevues auprès de répondants clés (trois chercheurs et deux décideurs). Une brève description des modèles de comparaison se trouve à l'annexe b : modèles comparatifs.
Examen du processus de traitement des requêtes
Un examen qualitatif et quantitatif du processus de traitement des requêtes auprès du RIEM a été effectué. À l'aide des documents de programme, les évaluateurs ont calculé la vitesse de traitement de chaque phase d'un projet du RIEM pendant la période visée par l'évaluation.
Une analyse qualitative approfondie des facteurs entravant et facilitant le processus a été effectuée pour un échantillon de quatre requêtes présentées au RIEM, à partir de l'examen des documents produits dans le cadre du processus de requête et de six entrevues auprès des répondants clés.
Les données recueillies ont été analysées par triangulation afin d'accroître la fiabilité et la crédibilité des constatations et des conclusions de l'évaluation.
Néanmoins, la plupart des évaluations sont assujetties à des contraintes susceptibles d'avoir des répercussions sur la validité et la fiabilité des constatations et des conclusions qui en découlent. L'annexe c : contraintes et stratégies d'atténuation présente les contraintes rencontrées au cours de l'évaluation et les stratégies d'atténuation employées pour que les résultats obtenus soient fiables.
Constatations de l'évaluation
Ce que l'on a découvert sur l'utilisation des données probantes et des conseils post-commercialisation du RIEM
L'information du RIEM est parfois utilisée par l'organisme de réglementation, les responsables des politiques et d'autres intervenants clés pour éclairer certaines décisions liées aux médicaments. L'incidence du RIEM est néanmoins limitée, car les renseignements produits sont souvent reçus en dehors de la période d'élaboration de politiques ou de prise de décisions de l'utilisateur.
Question 1 : Utilisation des données probantes post-commercialisation du RIEM
Appui aux décideurs
Le mandat du RIEM consiste à fournir aux décideurs du système de réglementation et de gestion des produits pharmaceutiques des données probantes pertinentes en temps opportun sur l'innocuité et l'efficacité des médicaments post-commercialisation. Ces données probantes visent à éclairer les décisions réglementaires et l'élaboration de politiques relatives aux médicaments commercialisés au Canada.Note de fin de document 1
Besoin croissant de données probantes post-commercialisation au Canada
L'évaluation a révélé un besoin croissant de données probantes sur l'innocuité et l'efficacité des médicaments commercialisés au Canada.
Les médicaments comme intervention thérapeutique
Les dépenses en médicaments du Canada augmentent plus rapidement que celles consacrées aux hôpitaux ou aux médecins, et une grande proportion de ces dépenses sont consacrées à des médicaments coûteux utilisés par un petit nombre de personnes.Note de fin de document 2
En 2018, Santé Canada a approuvé 217 médicaments, dont 135 médicaments génériques, 4 médicaments biosimilaires et 78 médicaments nouveaux, dont 40 comportant de nouvelles substances actives (c.-à-d., des ingrédients médicinaux dont la vente n'avait jamais été approuvée au Canada)Note de fin de document 3 La nécessité de surveiller l'innocuité et l'efficacité des médicaments approuvés tout au long de leur cycle de vie afin d'éclairer les décisions de l'organisme de réglementation ne fera qu'augmenter chaque fois qu'un nouveau médicament sera approuvé.
Plusieurs intervenants du milieu estiment que les innovations rapides dans le secteur des produits pharmaceutiques et l'utilisation accrue de l'approbation de produits par voie d'examen accéléré, comme l'Avis de conformité avec conditionsNote de bas de page b, augmentent le besoin de données probantes sur les médicaments commercialisés. En 2018, 35 % des demandes de nouvelles substances actives ont été approuvées par Santé Canada par voie d'examen accéléré.Note de fin de document 3
Manque de données pour certaines sous-populations
Selon la littérature, les essais cliniques utilisés pour approuver les nouveaux médicaments excluent généralement des sous-populations, telles que les femmes enceintes ou allaitantes, les enfants, les personnes âgées, les personnes ayant des antécédents médicaux complexes et les personnes atteintes de maladies multiples. Cela cause un manque de données en ce qui touche l'innocuité et l'efficacité des médicaments pour ces sous-populations.
Les données concrètes recueillies dans le cadre de diverses études sont considérées comme une source d'information essentielle pour combler ces lacunes et déterminer les risques et les avantages associés aux produits pharmaceutiques. Au cours des entrevues, plusieurs répondants clés ont d'ailleurs relevé la nécessité de données probantes dans ce domaine.
Étant donné que les effets des produits pharmaceutiques sur les sous-groupes suscitent un intérêt accru et les dépenses en médicaments augmentent rapidement, les responsables des politiques, en particulier les gestionnaires de régimes d'assurance-médicaments, ont un besoin accru pour des renseignements sur l'innocuité et l'efficacité des médicaments.
Évolution des priorités du gouvernement
Certains intervenants du RIEM ont aussi prédit l'établissement de nouveaux mécanismes de gestion des listes de médicaments sur ordonnance (c.-à-d., inscrits d'un régime d'assurance maladie en particulier ou d'un système de santé ou d'un hôpital en particulier) et la négociation des prix des médicaments, qui reposent sur des données probantes avant et après la mise en marché, dans le cadre des aspirations fédérales pour un programme national d'assurance-médicaments annoncé dans le budget de 2019.Note de fin de document 4 Selon ces intervenants, cela accroît le besoin des données probantes rigoureuses, pertinentes et en temps opportun de la part du RIEM pour informer les décideurs.
Utilisation des renseignements du RIEM
En 2018, les IRSC ont réalisé une analyse d'utilité et d'incidence sur un échantillon de commodité stratifié de 28 projets de recherche du RIEM (sur 81 requêtes retenues). Bien que cette méthodologie permette de représenter plusieurs auteurs de requête, elle ne permet pas de généraliser les résultats. Elle donne néanmoins un aperçu de la perspective d'un groupe d'auteurs de requêtes. L'analyse a montré que 64 % (n=18) des répondants ont déclaré que les renseignements obtenus en réponse à la requête étaient utiles sur le plan décisionnel, voir figure 1.
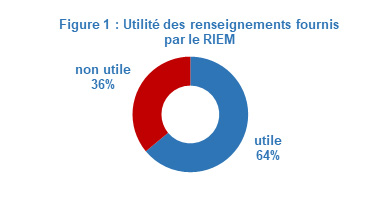
Figure 1 : Utilité des renseignements fournis par le RIEM : Équivalent textuel
La figure illustre le pourcentage de répondants qui ont indiqué que les renseignements fournis par le RIEM étaient utiles (64 %) et le pourcentage de répondants qui ont indiqué que les renseignements fournis par le RIEM n'étaient pas utiles (36 %).
| S / O | Pourcentage |
|---|---|
| Utiles | 64 % |
| Inutiles | 36 % |
Source : Analyse d'utilité et d'impact des IRSC
De plus, selon les résultats d'une analyse bibliométrique menée en 2019 par les IRSC, de toutes les publications du RIEM de 2010 à 2016, environ 31 % ont eu une incidence au-delà du milieu universitaire, et peuvent être liées à une décision de politique. Il convient de mentionner que ce chiffre pourrait être une sous-estimation de l'incidence, car les documents de politique ne citent pas toujours leurs sources.
Exemples d'utilisation
Santé Canada
Les résultats d'une requête de SC sur l'innocuité des thérapies à base d'incrétine, utilisées pour gérer le diabète, ont contribué à un examen de l'innocuité.
Une étude sur le lévétiracétam, un médicament utilisé pour traiter l'épilepsie, a été utilisée par SC, en plus des données probantes provenant d'autres sources, pour mettre à jour les renseignements d'innocuité concernant une interaction potentielle avec un autre médicament.
Les données probantes du RIEM ont également été utilisées pour faire progresser les travaux sur les politiques dans le domaine de la prescription appropriée d'opioïdes.
ACMTS
Les données probantes du RIEM sur les facteurs de croissance endothéliaux anti-vasculaires (généralement utilisés pour traiter divers types de cancers) ont été utilisées par l'ACMTS pour éclairer la décision d'utiliser ces médicaments pour traiter diverses affections rétiniennes.
Les données probantes du RIEM sur les traitements de l'hépatite C ont été utilisées pour éclairer l'inscription des thérapies de l'hépatite C dans les listes de médicaments, y compris les thérapies de l'hépatite C sans interféron.
Autres auteurs de requêtes
Le gouvernement du Nunavut a utilisé des données sur le traitement de la tuberculose latente pour formuler sa politique de traitement.
L'Agence de la santé publique du Canada a utilisé les données probantes du RIEM sur le vaccin contre l'herpès zoster pour éclairer la politique d'immunisation dans ce domaine.
Utilisation plus faible que prévu
Étant donné que les requêtes soumises au RIEM proviennent directement des besoins d'information de l'organisme de réglementation et des responsables des politiques, on s'attendait à ce qu'ils utilisent plus souvent les données probantes produites par le réseau.
La plupart des décideurs interrogés ont indiqué que, même si les données du RIEM étaient de grande qualité, leur utilité était surtout limitée parce qu'elles étaient fournies tardivement, ce qui nuisait à leur pertinence. Ils ont ajouté que les données probantes produites étaient plus souvent utilisées pour appuyer ou compléter une décision déjà prise, plutôt que d'appuyer directement la décision initiale. Par conséquent, les besoins de la plupart des décideurs interrogés ont rarement été satisfaits.
La question du caractère opportun de traitement sera examinée plus en détail à la question 2 : vitesse de traitement de ce rapport.
Nombre de requêtes
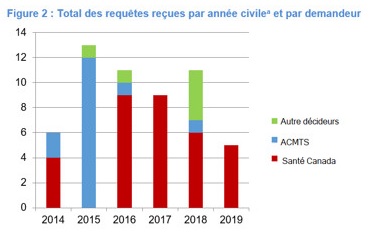
Le nombre de requêtes reçues par le RIEM au cours de la période d'évaluation est resté stable. Pour la période allant de janvier 2014 à mars 2019, 56 requêtes ont été reçues, dont 45 ont fait l'objet de recherches. La figure 2 représente le nombre de requêtes par an et par organisation qui les a présentées. Bien que le nombre de requêtes reçues au cours des cinq dernières années soit légèrement supérieur à celui des cinq années précédentes, soit 47 requêtes reçues et 29 en cours de recherche de 2009 à 2013, cette légère augmentation semble être principalement attribuable à l'utilisation du réseau par Santé Canada. Comme le montre la figure 2, les requêtes reçues de Santé Canada sont stables depuis 2015, tandis que celles reçues d'autres décideurs sont inégales.
Figure 2 : Total des requêtes reçues par année civileFigurenote a et par auteur
Figurenotes
- Figurenote a
-
Les données de 2019 ne comprennent que les requêtes reçues jusqu'à la fin mars 2019.
Source : Bureau de coordination du RIEM
Figure 2 : Total des requêtes reçues par année civile a et par auteur : Équivalent textuel
La figure illustre le nombre de demandes de renseignements reçues par année civile de 2014 à 2019. Pour l'année civile 2019, seules les demandes reçues jusqu'à la fin du mois de mars sont incluses.
| N/A | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|---|
| Santé Canada | 4 | 0 | 9 | 9 | 6 | 5 |
| ACMTS | 2 | 12 | 1 | 0 | 1 | 0 |
| Autres décideurs | 0 | 1 | 1 | 0 | 4 | 0 |
Certaines requêtes n'ont pas mené à des recherches
Parmi les requêtes représentées dans la figure 2, 11 requêtes n'ont pas mené à des recherches : trois de l'ACMTS (toutes reçues en 2015) et huit de Santé Canada (trois reçues en 2014, une en 2016, deux en 2017 et deux en 2018). De ces huit requêtes, deux ont été retirées parce que l'auteur a trouvé une autre source de données, deux ont été retirées en raison d'un manque de propositions provenant d'équipes de recherche, deux ont été retirées parce que l'auteur de la requête a trouvé que la proposition reçue avait peu de valeur décisionnelle, et une a été retirée en raison d'une évolution des signaux d'innocuité. Malheureusement, les raisons du retrait des quatre autres requêtes n'ont pas été documentées.
Requêtes de l'ACMTS
L'ACMTS, qui devait être l'un des principaux utilisateurs du RIEM, a soumis la majorité de ses requêtes en 2014 et 2015. Comme le montre la figure 2, l'ACMTS n'a présenté que deux requêtes au RIEM de 2016 à 2019. De plus, l'examen documentaire a révélé que la requête de l'ACMTS en 2018 a été lancée conjointement avec l'une des équipes de recherche.
Selon l'examen documentaire, l'ACMTS a reçu, de 2013 à 2015, une subvention réservée du RIEM des IRSC pour créer un portail permettant aux gestionnaires de régimes d'assurance-médicaments provinciaux et territoriaux d'interagir efficacement avec le RIEM.Note de fin de document 5 La documentation indique que la subvention réservée a été créée lorsque la direction du RIEM a constaté après trois ans d'existence des lacunes dans l'interface entre ces gestionnaires et les chercheurs du RIEM.Note de fin de document 5 Selon la même source documentaire, l'ACMTS dispose de mécanismes de consultation avec les représentants des régimes d'assurance-médicaments provinciaux et territoriaux et est vue comme un intermédiaire essentiel entre eux et le RIEM.
Les années visées par cette subvention réservée correspondent à la plus forte utilisation du RIEM par l'ACMTS. Malheureusement, il est impossible de connaître le nombre de requêtes présentées par l'ACMTS pendant cette période qui provenaient des régimes d'assurance-médicaments provinciaux et territoriaux par rapport au nombre de requêtes de l'ACMTS, ce degré de détail n'ayant pas été exigé à la fin de la subvention. Le RIEM n'a pas accordé d'autre subvention à l'ACMTS. Selon les commentaires de certains répondants clés, l'ACMTS a refusé le renouvellement de la subvention réservée, ce qui coïncide avec une baisse du nombre de requêtes présentées au RIEM par l'ACMTS (voir la figure 2).
Bien que les requêtes de l'ACMTS au RIEM aient diminué, les résultats des entrevues auprès de représentants de l'ACMTS indiquent que leur besoin de données probantes sur les médicaments commercialisés est demeuré constant et devrait augmenter à l'avenir. Les mêmes répondants ont indiqué qu'au lieu d'utiliser le RIEM, l'ACMTS s'efforce de répondre à ses besoins en matière de données probantes sur les médicaments commercialisés en impartissant la recherche à l'extérieur du RIEM. Une telle impartition permettrait à l'ACMTS de réduire les délais de recherche grâce à son propre processus de gestion de projet. Les répondants ont indiqué que cela avait permis d'améliorer la pertinence et l'utilité des résultats de la recherche, qui répondent mieux à leurs besoins.
En 2016, l'ACMTS a cessé d'assumer le rôle de liaison entre le RIEM et les représentants des régimes d'assurance-médicaments provinciaux et territoriaux, lorsque la subvention réservée n'a pas été renouvelée. Toutefois, selon certains répondants clés internes des IRSC et de Santé Canada, l'ACMTS demeure le portail d'acheminement des requêtes des gestionnaires de régimes d'assurance-médicaments provinciaux et territoriaux au RIEM.
Requêtes d'autres décideurs
Dans la figure 2, les six requêtes soumises par d'autres décideurs depuis 2014 comprennent une requête du Nunavut, une de l'Agence de la santé publique du Canada et quatre de l'Institut national de l'excellence en santé et en services sociaux (INESSS). Selon un examen documentaire et les résultats des entrevues, la requête du Nunavut et les quatre requêtes de l'INESSS ont d'abord été proposées par une équipe de recherche du RIEM et subventionnées par un décideur, alors que celle de l'ASPC est provenue de ses propres besoins.
Les décideurs interrogés qui ont participé à certaines de ces recherches ont été globalement impressionnés par leur expérience au sein du RIEM, plus particulièrement par la qualité des recherches produites et l'accès à des données nationales. Ils ont toutefois déploré les longs délais d'exécution de la recherche.
Malgré le faible nombre de requêtes reçues d'autres organisations, les entrevues avec certains représentants de ces organisations ont permis de constater qu'ils ont toujours besoin de données probantes sur les médicaments commercialisés. La majorité des répondants clés des autorités provinciales et territoriales interrogés ont souligné que les gestionnaires de médicaments ont souvent besoin de renseignements post-commercialisation en réponse à des signaux d'innocuité causés par des effets indésirables d'un médicament, et que ces signaux doivent être analysés très rapidement (c.-à-d., 90 à 180 jours). Les mêmes répondants clés ont dit douter que le RIEM puisse leur répondre aussi rapidement. Un représentant d'une autorité provinciale-territoriale a indiqué n'avoir jamais envisagé de recourir aux services du RIEM, bien qu'il soit au courant de son travail depuis dix ans, car il doit prendre des décisions trop rapidement pour le RIEM.
Il convient de mentionner qu'en novembre 2019 (après la fin de la période d'évaluation), le RIEM avait reçu trois requêtes de la part d'autres décideurs; une d'une province et deux de l'ASPC. L'évaluation n'a pas permis de déterminer si ces requêtes provenaient des besoins du demandeur ou si elles avaient été initiées par une équipe de recherche du RIEM.
Les décideurs obtiennent des données probantes d'autres sourcess
Tous les décideurs interrogés qui ont déjà utilisé le RIEM, autres que ceux de Santé Canada, ont indiqué ne pas utiliser ce réseau lorsque le respect des délais était essentiel. Ils ont dit préférer obtenir des données probantes sur les médicaments commercialisés d'autres sources, et beaucoup d'entre eux ont dit obtenir des services de recherche contractuels de spécialistes du domaine. Ces décideurs se sont dits satisfaits de la pertinence des recherches et de la vitesse de traitement des requêtes de ces autres sources.
La présentation du produit final nuit à son utilisation
La plupart des décideurs et certains spécialistes en matière de données probantes sur les médicaments commercialisés ont estimé que la présentation des produits de connaissance du RIEM nuit à leur utilisation. Les responsables des politiques ont trouvé, notamment, que la nature excessivement technique des rapports du RIEM complique leur application aux décisions de politique.
Plusieurs décideurs ont signalé que la présentation finale des rapports semblait souvent s'adresser davantage aux chercheurs qu'aux responsables des politiques. Certains ont également indiqué avoir dû faire transposer les résultats de recherche du RIEM dans un produit répondant mieux à leurs besoins.
Constations à l'égard de la vitesse de traitement des requêtes et de l'utilité des données probantes produites
La plupart des utilisateurs ont trouvé que les données probantes sur l'innocuité et l'efficacité des médicaments commercialisés étaient de grande qualité, mais qu'elles ne répondaient pas à temps à leurs besoins décisionnels. Ils ont ajouté que les longs délais de diffusion nuisaient à la pertinence des renseignements et, conséquemment, à leur utilité décisionnelle.
Voici les principaux obstacles nuisant à la production à temps de données probantes utiles :
- Problèmes de communication durant le processus de traitement des requêtes;
- Absence d'une gestion centralisée des projets;
- Disponibilité des données;
- Direction décentralisée faisant en sorte que certaines responsabilités clés ne sont pas effectuées.
Question 2 : Vitesse de traitement
Pourquoi la vitesse de traitement est-elle importante?
En vertu de son rôle réglementaire, Santé Canada a utilisé le RIEM principalement pour recueillir des renseignements afin de répondre à des signaux d'innocuité. Un signal d'innocuité se définit comme des renseignements sur un événement indésirable nouveau ou connu pouvant être associé à un médicament.Note de fin de document 6 Des mesures peuvent être prises en réponse aux constatations d'évaluation des signaux d'innocuité dont, notamment, la transmission des nouvelles données sur l'innocuité d'un médicament au public et aux professionnels de la santé, la recommandation de modifications de l'étiquetage et, s'il y a lieu, le retrait d'un médicament du marché dans les situations les plus graves.Note de fin de document 6 Santé Canada dispose de 90 à 180 jours pour prendre une première décision en réponse à un signal d'innocuité. En 2018, Santé Canada a reçu 1 091 696 déclarations d'effets indésirables suivant la mise en marché et a pris 620 mesures post-commercialisation pour les médicaments à usage humain.
D'autres utilisateurs du RIEM, comme les gestionnaires de régimes d'assurance-médicaments provinciaux et territoriaux et l'ACMTS, doivent également traiter de contraintes de temps semblables lorsqu'ils prennent des décisions concernant les médicaments couverts par ces régimes.
Selon l'examen documentaire, il a été déterminé, dès la conception du RIEM, que la diffusion rapide des données probantes était essentielle à l'efficacité du réseau. La plupart des décideurs interrogés ont déclaré que, la plupart du temps, ils devaient obtenir des données probantes sur l'innocuité et l'efficacité des médicaments commercialisés dans un délai d'un an ou moins pour éclairer leur processus décisionnel.
Délai moyen de production par le RIEM de données probantes sur les médicaments commercialisés
Au cours des cinq dernières années, il a fallu, en moyenne, 620 jours civils au RIEM pour réaliser un projet de recherche et la valeur médiane est de 569 jours. Par comparaison, le Réseau de recherche sur les politiques ontariennes en matière de médicaments (RRPOM) peut achever la plupart de ses études, y compris les études sur l'innocuité et l'efficacité des médicaments, dans un délai de 30 jours à 60 jours.Note de fin de document 7 Pour les projets de recherche plus complexes, comme l'examen des classes de médicaments, le RRPOM peut les achever dans un délai de 203 à 238 jours.Note de fin de document 8 L'initiative Sentinel de la Food and Drug Administration (FDA) américaine peut, quant à elle, répondre à la plupart des requêtes en quelques mois et aux requêtes urgentes en quelques jours seulement.Note de fin de document 9 À noter que la durée prévue des études menées par chacun de ces réseaux peut varier.
Si l'évaluation n'a pas permis d'établir si les produits provenant d'autres modèles dans des délais plus courts étaient de qualité comparable à ceux du RIEM, certaines sources ont fourni des renseignements sur leur utilité et sur leur pertinence décisionnelle. À cet égard, des documents publics sur le rendement du RRPOM et de l'initiative Sentinel ont été examinés, et un utilisateur clé du RRPOM, qui, par ailleurs, utilise le RIEM depuis plusieurs années, a été consulté. Les données provenant de ces sources ont indiqué un degré élevé de pertinence et d'utilité des données probantes produites par ces autres modèles.
La figure 3 présente les résultats d'une analyse d'utilité et d'impact qu'ont réalisée les IRSC en 2018 sur un échantillon de commodité stratifié de 28 projets de recherche du RIEM (sur 81 requêtes retenues). Selon les résultats, 39 % (n=11) des projets de recherche ont été traités à temps et 61 % (n=17) ne l'ont pas été. Si seules les requêtes présentées par Santé Canada (n=16) sont considérées, 68 % des auteurs de requêtes (10 sur 16) se sont dits insatisfaits.
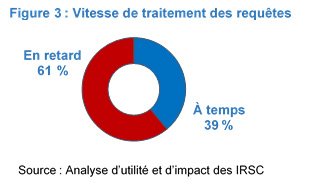
Figure 3 : Vitesse de traitement des requêtes : Équivalent textuel
La figure illustre le pourcentage de répondants qui ont indiqué que le traitement des requêtes présentées au RIEM était effectué à temps (39 %) et le pourcentage de répondants qui ont indiqué que le traitement des requêtes présentées au RIEM était effectué en retard (61 %).
| S / O | Pourcentage |
|---|---|
| À temps | 39 % |
| En retard | 61 % |
Source : Analyse d'utilité et d'impact des IRSC
D'après un échantillon de projets de recherche du RIEM pour lesquels des données principales recueillies dans le cadre du processus de suivi des requêtes étaient accessibles (c.-à-d., la date de livraison du projet demandée par l'auteur de la requête, la date de livraison convenue et la date d'achèvement de la requête), le délai d'achèvement d'environ 77 % des requêtes reçues par le RIEM était initialement de 12 mois ou moins. La grande majorité de ces projets (16 sur 20) ont été livrés en moyenne un an après la date de livraison demandée par l'auteur de la requête.
D'après un sous-échantillon de 13 projets de recherche, les IRSC ont analysé la différence entre le délai initialement demandé par l'auteur de la requête, le délai négocié et la date de livraison finale, ce qui a révélé que :
- dix projets avaient négocié des délais qui étaient, en moyenne, 432 jours plus longs que le délai initialement demandé, tandis que trois projets avaient négocié des délais plus courts, qui étaient, en moyenne, de 73 jours plus courts;
- des 13 projets, 11 ont été livrés plus tard que le délai négocié par une moyenne de 56 jours, et deux ont été livrés plus tôt, un jour plus tôt pour un et 90 jours pour l'autre.
Bien qu'une partie des requêtes de recherche présentées au RIEM soit propice à des délais plus longs, p. ex., la recherche prospective, pour la majorité des requêtes reçues (plus de 75 %), la vitesse de traitement est urgente pour le décideur.
Obstacles à la vitesse de traitement
Les problèmes concernant la vitesse de traitement n'étaient pas liés à un manque d'expertise en recherche. Au contraire, tous les utilisateurs ont reconnu que le RIEM était constitué de chercheurs respectés dans le domaine de la recherche sur les médicaments commercialisés. Les problèmes de production de recherches pertinentes en temps voulu sur l'innocuité et l'efficacité des médicaments commercialisés découlaient plutôt du processus de traitement des requêtes, d'un manque de données et d'un modèle de direction décentralisé faisant en sorte que des rôles et responsabilités clés ne sont pas effectués.
Communication durant le processus de traitement des requêtes
Selon les auteurs de requêtes et les chercheurs, le processus de traitement des requêtes du RIEM, dont le schéma du processus se trouve à l'annexe d : schéma du processus de traitement des requêtes, nuit à la communication directe. Cela a compliqué le processus de clarification rapide ou la confirmation de la compréhension générale de la requête.
Les requêtes présentées ne sont pas toutes bien comprises par les chercheurs et les méthodologies de recherche ne sont pas toutes bien comprises par les auteurs de requêtes. L'examen documentaire a fourni des exemples de retards qui pourront être attribuables à une mauvaise compréhension de la requête ou de la méthodologie proposée. Les décideurs et les chercheurs interrogés estiment essentiel que les deux parties soient en communication directe dès le début du processus afin de clarifier la nécessité d'une requête, ce qui permettrait de choisir la meilleure méthodologie pour répondre au besoin en temps voulu. Le bureau de coordination du RIEM a souligné qu'à la fin de l'exercice 2018-2019, un processus de discussions préliminaires entre chercheurs et auteurs de requêtes a été ajouté. L'évaluation n'a pas permis de vérifier ou d'évaluer les résultats liés à ce processus.
Les données examinées semblent corroborer les opinions concernant le délai de clarification des requêtes, puisque le nombre moyen de jours entre la présentation initiale de la requête et le début de la recherche était de 177 jours, 101,5 jours étant la valeur médiane, au cours des cinq dernières années. Cela représente un peu plus de 28 % de l'échéancier global de la recherche (620 jours en moyenne). De ces 177 jours, la moitié est consacrée à la clarification de la requête et à l'élaboration de propositions de recherche (89 jours en moyenne), et le reste à la finalisation et à l'approbation de la proposition de recherche et du processus de financement.
Selon une analyse du processus de traitement des requêtes, on a cerné que l'interruption des communications durant le processus pouvait être attribuable à toutes les parties (auteurs de requêtes, chercheurs et bureau de coordination du RIEM) et pouvait expliquer, partiellement, les retards. L'analyse a également révélé que les pratiques de communication du processus de traitement des requêtes du RIEM étaient caractérisées par la présence de plusieurs « intermédiaires » entre auteurs de requêtes, utilisateurs et chercheurs. Plus précisément, on parle du processus par lequel les communications passent à la fois par le bureau de coordination du RIEM et par la fonction de coordination du RIEM de Santé Canada, une fonction ajoutée par Santé Canada, ainsi que l'épidémiologique-biostatistique que le Ministère fournit pour aider les auteurs de requêtes auprès de la Direction générale des produits de santé et des aliments. Selon certains répondants internes et externes, cela ajoute souvent à la complexité des communications et crée des malentendus qui donnent lieu à des retards ou à des produits mal adaptés aux besoins des utilisateurs.
On a souligné que l'évolution des besoins des auteurs de requêtes et le roulement du personnel nuisaient au processus de traitement des requêtes. Selon les résultats des entrevues et l'examen documentaire, dans le cas de projets pluriannuels, les besoins de l'auteur de la requête peuvent évoluer à mesure que surgissent des renseignements nouveaux et imprévus. Cette évolution des besoins a prolongé le délai d'exécution du projet, car la portée de la recherche a changé, ou altéré la pertinence du produit final, si la portée de la recherche ne pouvait pas être modifiée. De plus que les délais étant plus longs, il fallait composer avec roulement du personnel de la part de l'auteur. Les nouveaux employés ayant souvent besoin de plus amples renseignements pour comprendre le projet de recherche, les délais d'exécution ont dû être prolongés.
Contourner le processus de traitement des requêtes pour améliorer les communications et les délais
Pour résoudre les problèmes de communication, les équipes de recherche et les utilisateurs finaux ont été encouragés à communiquer plus directement dès le début du processus de traitement des requêtes. L'examen de cinq requêtes traitées en moins de 180 jours a montré l'avantage d'une communication directe entre l'auteur de la requête et le chercheur dès le début du processus. L'examen a aussi montré que la communication directe entre chercheurs et auteurs de requêtes a permis de contourner les étapes préliminaires du processus de traitement des requêtes du RIEM, ce qui a permis d'en accroître la vitesse de traitement.
Gestion de projets centralisée
Les équipes de recherche, le bureau de coordination du RIEM et les auteurs de requêtes n'ont pas accès à un système centralisé pour la gestion de projets. Cela a nui à la capacité du réseau à suivre les projets pour voir s'ils accusent du retard. Même si chaque projet de recherche doit respecter un plan d'action de gestion qui en définit le chemin critique et le protocole, les avantages de ce plan semblent limités. Selon l'examen, les mises à jour apportées aux outils par les chercheurs menant un projet de recherche n'étaient pas accessibles à l'ensemble des trois parties concernées. Cela signifie que le bureau de coordination du RIEM ou l'auteur de la requête peut ignorer qu'un élément du plan a changé, ce qui peut affecter le délai d'obtention et l'utilité des livrables, qui souvent ne répondaient pas aux attentes initiales de l'auteur de la requête.
Bien que le bureau de coordination du RIEM, les équipes de recherche et les auteurs de requêtes effectuent leur propre suivi de projet, le manque de pratiques de gestion de projet centralisées et normalisées a entraîné de nombreux cas de mauvaise communication et de retards attribuables aux trois parties.
De plus, en l'absence d'une gestion centralisée des projets, il devient difficile de suivre la capacité de recherche globale du réseau et d'obtenir des données précises sur les coûts des projets de recherche. Cela empêche le programme de choisir la meilleure façon de répartir les requêtes entre les équipes, ainsi que les ressources financières. Cela empêche également le programme d'évaluer si la recherche associée à une requête en vaut l'investissement. Cela restreint la capacité des IRSC et de Santé Canada à gérer le réseau de manière à maximiser sa valeur pour les décideurs.
Disponibilité des données
Le manque de données disponibles pour mener des recherches était déjà un problème lorsque le REIM a été conçu. Les autorités du programme ont toutefois défini la responsabilité partagée des IRSC et de Santé Canada visant à régler ce problème, et pour exploiter les partenariats avec les actuels détenteurs de données. Les partenariats, les collaborations et les accords avec les détenteurs de données, tels que les autorités provinciales-territoriales et les autres intervenants FPT financés dans le cadre de l'environnement d'innocuité et d'efficacité des médicaments commercialisés, ont été considérés comme essentiels au succès du RIEM. L'accès aux données étant un problème commun aux programmes du portefeuille de la Santé, l'évaluation a permis de constater que les partenariats en matière de données au sein du RIEM étaient généralement limités, même si le programme avait souligné l'importance de ces partenariats avant même la création du réseau.
Bien que les partenariats en matière de données soient limités, l'évaluation a permis de constater l'évolution d'une pratique prometteuse au cours des dernières années. L'équipe de recherche du CNODES a reçu du financement en 2017, au moyen d'une requête de Santé Canada, pour superviser l'élaboration et la mise en œuvre d'un modèle de données commun s'inspirant de celui qu'utilise l'initiative Sentinel de la FDA.Note de fin de document 10 Pour appliquer cette méthode, le CNODES a collaboré étroitement avec un conseil consultatif composé de représentants du bureau de coordination du RIEM, de Santé Canada, de l'ACMTS, de l'ICIS et des régimes d'assurance-médicaments provinciaux et territoriaux. Ce modèle de données commun devrait faciliter l'utilisation des données provenant de multiples fonds de données, y compris des autorités des régimes d'assurance-médicaments provinciaux et territoriaux, et réduira le temps nécessaire à la collecte et au traitement de grandes quantités de données. Les renseignements permettant d'évaluer le succès à ce jour ne sont pas encore disponibles.
Bien que ce modèle soit prometteur, certains répondants clés doutent que le RIEM détient la capacité de résoudre les problèmes d'accessibilité et de corrélation d'ensembles de données au-delà du modèle de données communes. Les informateurs clés ont aussi demandé si les partenariats convenables sont en place pour soutenir la recherche sur l'efficacité.
Les données ne sont pas un problème pour tous les projets
Il convient de noter que la disponibilité des données n'est pas un problème qui touche tous les projets de recherche du RIEM. Par exemple, les projets nécessitant un examen et une méta-analyse de la littérature publiée ne sont pas touchés par les problèmes d'accessibilité des données. Ces projets ont représenté 41 % de tous les projets achevés et en cours du RIEM depuis sa création. Néanmoins, le délai moyen d'achèvement de ce type de projets au cours des cinq dernières années (n=20) a été de 510 jours, avec une valeur médiane de 521 jours; or, comme indiqué précédemment, un tel délai ne répond pas aux besoins de la plupart des utilisateurs du RIEM.
Le délai moyen pour lancer une recherche en vue de l'examen et de la méta-analyse de projets de littérature publiée était de 136 jours, et représentait 27 % de l'échéancier global des projets, ce qui est conforme à la proportion obtenue pour l'ensemble des projets de recherche (28 %) évoqués précédemment. Même si l'accès aux données n'est pas un problème pour le projet de recherche, les délais d'achèvement ne répondent pas aux besoins des utilisateurs du RIEM.
Direction décentralisée
On a prévu à l'origine que le RIEM devait être dirigé par un directeur général employé par les IRSC, lequel devait assurer la direction générale des activités du réseau, conformément à l'orientation stratégique fournie par le comité directeur du RIEM.
Le directeur général devait être soutenu par un bureau central composé de cinq équivalents temps plein (ETP), pour un total de six ETP aux IRSC. Le bureau devait administrer le programme de subventions du RIEM destinées aux recherches prioritaires, faciliter l'établissement de partenariats et de liaisons entre les équipes de recherche financées du RIEM et d'autres collaborateurs, fournir un service de secrétariat au comité directeur, soutenir l'application des connaissances et faciliter des évaluations du réseau.
Le comité directeur du RIEM a reçu le mandat de fournir une orientation stratégique et d'établir les priorités grâce à un programme de recherche commun, mais la responsabilité générale des activités du RIEM devait incomber aux IRSC.
Au sein de Santé Canada, sept ETP ont été engagés pour soutenir le programme du RIEM. Santé Canada avait pour mandat d'assurer une surveillance stratégique, de coordonner la participation provinciale et territoriale, d'identifier les besoins liés aux données probantes et à la recherche pour soutenir ses responsabilités en matière de réglementation et ses intérêts par rapport aux systèmes de santé, de participer au comité directeur, de contribuer au programme de recherches prioritaires du RIEM et d'intégrer les données probantes produites par le RIEM au sein du processus décisionnel pour les domaines de responsabilité de Santé Canada. En mars 2019, seuls cinq ETP étaient responsables des activités du RIEM à Santé Canada.
Le modèle organisationnel du REIM au sein des IRSC, qui devait être dirigés de manière centralisée par un directeur général, a été remplacé en 2015 par un modèle décentralisé où les responsabilités du directeur général ont été réparties entre plusieurs acteurs de différents niveaux opérationnels. Ce changement est le résultat d'un exercice de restructuration organisationnelle au sein des IRSC. Seuls quatre des six ETP prévus à l'origine au sein des IRSC étaient consacrés au RIEM en mars 2019.
Selon plusieurs répondants clés, notamment des chercheurs, et selon l'examen documentaire, le modèle décentralisé a fait en sorte que certains rôles et responsabilités clés ne sont pas effectués par le bureau de coordination du RIEM, Santé Canada et la gouvernance du RIEM. Parmi ces rôles et responsabilités, mentionnons l'établissement des priorités, la promotion de la participation provinciale et territoriale, l'application des connaissances, la collaboration avec d'autres producteurs de recherche et l'établissement de partenariats avec des détenteurs de données.
On peut voir l'incidence négative de l'abandon de ces rôles particulièrement en ce qui concerne la responsabilité de mobiliser les intervenants externes pour stimuler la croissance du réseau, car le nombre de requêtes provenant d'organisations extérieures à Santé Canada a généralement diminué depuis 2015. Cela nuit également à la responsabilité de négocier des accords d'échange de données, car l'accès aux données a été lent à acquérir, et cela continue d'être un problème du réseau.
Modèle de financement
Dans le but de mieux répondre aux besoins des utilisateurs, les autorités du RIEM ont établi deux volets de financement fondés sur une évaluation par les pairs :
- Financement de centres (ou subventions d'équipe) : ce financement était destiné à fournir une source de fonds stable à au moins quatre équipes de recherche afin de créer une capacité de recherche propre au programme du RIEM. Cela devait permettre à des équipes de recherche de répondre plus rapidement aux requêtes et aux questions des décideurs découlant du programme de recherche.
- Financement de projets (ou financement rapide) : ce financement était destiné à étendre la portée des activités de recherche du RIEM au-delà des équipes qu'il finance afin d'aborder des questions supplémentaires au sujet des recherches prioritaires qui ne peuvent pas être abordées par les centres du RIEM.
Mise en œuvre et défis du modèle de financement
Les deux volets de financement ont été mis en œuvre en 2011. La première subvention d'équipe a été accordée au CNODES en 2011 pour une durée de cinq ans. Entre-temps, les équipes SEARCH, PREVENT, CAN-AIM, ainsi que les trois équipes de recherche qui allaient devenir MAGIC en 2014, ont été financées au moyen du volet de financement de projets, ce qui a permis de gérer les demandes à l'égard de chaque méthodologie des équipes du RIEM et de donner aux équipes le temps d'établir leurs antécédents et de confirmer la pertinence de leurs travaux aux décideurs. L'équipe MAGIC a reçu une subvention d'équipe en septembre 2014. À la même époque, le financement des équipes SEARCH, PREVENT et de CAN-AIM a été renouvelé pour une durée de 3 à 5 ans. En avril 2018, les équipes SEARCH et PREVENT se sont fusionnées et ont reçu leur première subvention d'équipe. L'équipe CAN-AIM l'a reçu en septembre 2019.
Selon le financement de projets mis en œuvre par le RIEM, les équipes de recherche devaient demander du financement en fonction des requêtes présentées. Selon la plupart des répondants clés internes et externes, le financement de projets a ralenti le processus, en raison de l'important fardeau administratif y étant associé. Plusieurs chercheurs interrogés ont aussi estimé qu'il entravait la collaboration entre les équipes, car celles-ci devaient se faire concurrence pour obtenir des fonds.
Dans le modèle de financement de projets envisagé à l'origine (c.-à-d., ouvert aux chercheurs en dehors des équipes du RIEM), le processus de requête comprend une étape qui permettrait un appel ouvert aux chercheurs en dehors des équipes de recherche du RIEM, si les capacités requises pour répondre à une requête en particulier étaient manquantes. Cette étape n'a jamais été utilisée pour soutenir les besoins des décideurs en matière de données probantes post-commercialisation pertinentes et opportunes (c.-à-d., que les équipes non financées par le programme du RIEM n'ont jamais été invitées à présenter une demande de financement).
Les points de données recueillis dans le cadre du processus de suivi des requêtes ( les dates correspondant à la réception de la requête, à sa clarification, à l'approbation de la recherche, au lancement de la recherche, etc.) ne permettent pas de déterminer le temps de traitement du financement de projets.
Plusieurs répondants clés de Santé Canada ont relevé des problèmes importants liés au modèle de financement par subventions d'équipe. Plus précisément, ils ont constaté l'absence d'un mécanisme pour réaffecter les fonds inutilisés entre les équipes de recherche en fonction de nouvelles priorités, et le manque d'un mécanisme permettant de reporter les fonds d'année en année dans le cas de projets pluriannuels. Les répondants ont ajouté que le processus d'approbation basé sur la chronologie de présentation des requêtes plutôt que sur une hiérarchisation scientifique des requêtes empirait la situation. Ils ont précisé que ces problèmes ne permettaient pas d'affecter les fonds à des projets ou à des équipes de manière à procurer aux décideurs le meilleur rapport qualité-prix, en particulier dans un contexte d'évolution rapide des besoins.
Subvention contre financement contractuel
Le Plan d'activités pour un réseau sur l'innocuité et l'efficacité des médicamentsNote de fin de document 11 rédigé en 2007 a été présenté au Comité permanent de la santé (HESA) en 2008 aux fins d'approbation.Note de fin de document 12 Selon ce plan, la passation de contrats avec des centres, ce qui s'entend des différents types de producteurs de recherche, constituerait un mécanisme de financement du RIEM. Il incomberait au bureau de coordination du REIM de gérer les contrats.
Parmi les quatre organisations désignées pour héberger le réseau d'après divers facteurs, les IRSC ont été le choix logique. Le financement contractuel a été remplacé par un financement par subvention dans l'autorité financière initiale. Le financement par subvention permet aux IRSC de financer la recherche uniquement au moyen de subventions.
Quelles leçons peut-on tirer des autres modèles
D'autres producteurs de renseignements post-commercialisation sur l'innocuité et l'efficacité des médicaments peuvent fournir des données probantes répondant aux besoins des décideurs de manière plus rapide et plus efficace.
Un examen comparatif a permis de tirer les principales leçons d'autres modèles efficaces.
Certaines leçons ne peuvent pas être entièrement mises en œuvre par le programme actuel.
Question 3 : Autres modèles
Comment le RIEM se compare-t-il
Le tableau 2 présente les dépenses réelles du RIEM au cours des cinq dernières années. Sur le budget total prévu de 50 millions de dollars sur cinq ans, un total de 45,9 millions de dollars a été dépensé (écart de 8 %). Cet écart est généralement attribuable au coût réel des activités, qui a été de 40 % inférieur aux prévisions, soit 7,8 millions de dollars au lieu de 12,8 millions de dollars.
| Année | Subventions et bourses (S et B) | IRSC et Santé Canada Coûts de fonctionnement et de locaux | Total des dépenses de programme |
|---|---|---|---|
| 2014-15 | 8 702 821 $ | 1 755 837 $ | 10 458 658 $ |
| 2015-16 | 7 978 045 $ | 1 811 072 $ | 9 789 117 $ |
| 2016-17 | 7 325 569 $ | 1 373 067 $ | 8 698 636 $ |
| 2017-18 | 6 693 625 $ | 1 430 684 $ | 8 124 309 $ |
| 2018-19 | 7 485 516 $ | 1 439 502 $ | 8 925 018 $ |
| Total | 38 185 576 $ | 7 810 162 $ | 45 995 738 $ |
| Source : IRSC et SC | |||
Le tableau 3 présente les calculs du coût par extrant associé aux activités de recherche du RIEM de janvier 2014 à mars 2019. Au cours de cette période, 56 nouvelles requêtes ont été reçues, dont 11 n'ont pas menés a un projet de recherche. En mars 2019, les équipes de recherche avaient entrepris ou achevé un total de 84 projets de recherche, dont 23 avaient été reportés de la période précédente 2014. À noter qu'une même requête peut mener à plusieurs projets de recherche. Le tableau 3 ne tient compte que des projets de recherche entrepris depuis janvier 2014, ce qui exclut les projets reportés des années précédentes. Les coûts par extrant n'étant pas suivis par le programme, il a été impossible d'établir les coûts des projets reportés de la période précédente 2014 (c.-à-d., 23 projets reportés). À noter que les données financières sont enregistrées par année budgétaire et que les données de projets de recherche le sont par année civile. Les projets résultant de requêtes reçues dès janvier 2014 ont donc été inclus dans le calcul, même si les données financières utilisées ne s'appliquent qu'à partir d'avril 2014.
Pour donner une meilleure idée des coûts, des calculs du tableau 3 ont été effectués pour trois catégories d'extrants, y compris les coûts totaux du programme engagés au cours des cinq dernières années.
- À la première ligne se trouvent seulement les projets achevés et publiés auprès du grand public.
- À la deuxième ligne se trouvent les projets pour lesquels les décideurs ont reçu des résultats permettant de prendre une décision.
- À la troisième ligne se trouvent tous les projets entrepris, y compris les projets inachevés. Le coût par extrant de cette ligne n'inclut pas les coûts qui pourraient s'ajouter pour achever les projets en cours ou en développement.
Le coût moyen par projet du RIEM achevé, ou dont les résultats préliminaires ont été communiqués, est estimé à 1 243 128 $, toutes dépenses incluses, y compris le financement de l'équipe de formation interdisciplinaire sur l'innocuité et l'efficacité des médicaments aux fins du renforcement des capacités du RIEM. En raison des résultats généraux du programme, certains membres clés du comité directeur du RIEM ont souligné la nécessité d'envisager d'autres modèles de prestation afin d'en accroître l'incidence et la valeur globale.
| Extrant | Nombre | Coût moyen par extrant (d'après les dépenses en S et B du RIEM seulement)Note du tableau a | Coût moyen par extrant (d'après les dépenses totales du RIEM)Note du tableau b |
|---|---|---|---|
| Études dont les résultats ont été publiésNote du tableau c | 27 | 1 414 281 $ | 1 703 545 $ |
| Études dont les résultats ont été fournis aux auteurs de requêtes (y compris les études publiées, n=27) | 37 | 1 032 043 $ | 1 243 128 $ |
| Projets de recherche en cours (24) et dont les résultats ont été communiqués (n=37) | 61 | 625 993 $ | 754 028 $ |
Source : IRSC et SC Notes de tableau
|
|||
Il a été impossible de trouver un autre modèle qui se compare parfaitement au RIEM. Toutefois, deux autres producteurs de données probantes sur l'innocuité et l'efficacité des médicaments ont fourni des renseignements utiles sur les produits fabriqués et les coûts associés au processus. Bien que ces comparaisons ne sont pas parfaitement harmonisées, elles fournissent des renseignements qui permettent de mieux comprendre le rendement et les résultats globaux du RIEM.
- Au cours des cinq dernières années, le Réseau de recherche sur les politiques ontariennes en matière de médicaments (RRPOM) a réalisé 133 rapports sur la politique en matière de drogues avec un budget total d'environ 7 millions de dollars (environ 1,4 million de dollars par année, y compris les activités de renforcement des capacités). Les rapports sur les politiques du RRPOM ne sont généralement pas assujettis à une évaluation par les pairs (quoique les publications le soient), toutefois, ils sont assujettis à un examen par un comité d'éthique de la recherche. Les produits du RRPOM comprennent des études descriptives et d'utilisation, ainsi que des rapports sur la politique et l'évaluation des médicaments, ainsi que l'innocuité et l'efficacité des médicaments.
- Au cours des trois dernières années, l'initiative Sentinel de la FDA des États-Unis, qui est plutôt semblable au modèle de données communes du CNODES du RIEM, a produit quelque 383 détections et analyses de risques actifs, soit des analyses de signaux d'innocuité de médicaments.Note de fin de document 9 Les coûts propres au maintien de l'initiative Sentinel pendant cette période ne sont pas disponibles. Cependant, il a été rapporté que les coûts de maintien de l'initiative Sentinel varient entre 12 et 20 millions de dollars américains par année.
Principales leçons tirées des autres modèles efficaces
Une analyse comparative a été menée, examinant quatre autres modèles de production de données probantes post-commercialisation sur l'innocuité et l'efficacité des médicaments : le RRPOM, le réseau européen de centres pour la pharmacoépidémiologie et la pharmacovigilance (ENCePP), l'initiative Sentinel de la FDA et l'Institute of Health Economics (établi en Alberta). Ces modèles ont été choisis parce que les spécialistes du domaine des données probantes post-commercialisation estiment qu'ils répondent le mieux et le plus rapidement aux besoins de résultats d'études de qualité supérieure, et qu'ils aident les décideurs à accéder à des données probantes post-commercialisation. L'annexe b : modèles comparatifs fournit de plus amples renseignements sur ces modèles, y compris des détails sur les pratiques exemplaires adoptées par ces modèles efficaces, qui sont énumérées dans la figure suivante. L'évaluation a permis d'examiner si ces pratiques étaient mises en œuvre par le RIEM.
- Gouvernance simplifiée qui inclut les décideurs et les chercheurs
- Priorités bien établies
- Accès facile aux données
- Application centralisée des connaissances et gestion unifiée des projets
- Formation et financement exclusifs au renforcement des capacités
Gouvernance simplifiée qui inclut les décideurs et les chercheurs
Les autres modèles ont adopté un mode de gouvernance qui réunit à la même table de définition des priorités les chercheurs et les responsables des politiques. Ces comités favorisent la communication et la collaboration entre les principaux acteurs. On a constaté que ces comités sont dotés de rôles et responsabilités bien établies et pleinement exécutés.
Gouvernance du RIEM
Selon l'évaluation, l'organe de gouvernance principal du RIEM à qui il incombe d'établir les priorités, soit le comité directeur, ne compte aucun représentant des équipes de recherche du RIEM. Bien que les chercheurs participent à un niveau de gouvernance inférieur au sein du RIEM (le comité consultatif scientifique), ils ne sont pas membres du comité qui établit le programme et les priorités de recherche du réseau. La Politique sur les paiements de transfert du Conseil du Trésor restreint la capacité des IRSC à inviter des membres d'équipes de recherche du RIEM à participer aux décisions stratégiques et à l'établissement des priorités du RIEM. Cela évite que des chercheurs puissent influer l'attribution rapide de fonds ou le renouvellement éventuel de leur subvention d'équipe.
La gouvernance et la direction du RIEM sont répandues entre trois comités : le comité directeur, le groupe de travail exécutif et le comité consultatif scientifique (l'organigramme du RIEM se trouve à l'annexe e : organigramme du RIEM). Selon plusieurs répondants clés des IRSC et de Santé Canada et d'autres organisations externes assumant des fonctions de gouvernance du RIEM, la confusion à l'égard des rôles et responsabilités de ces comités a fait en sorte que certaines responsabilités clés ne sont pas menées. Cette constatation figure aussi dans l'évaluation du RIEM de 2014.
L'élaboration d'une orientation stratégique et d'un programme de recherche est un exemple de rôle clé que la gouvernance du RIEM n'a pas effectué et que devait assumer le comité directeur. Or les plans de travail mis de l'avant ces dernières années par le groupe de travail exécutif ne définissent aucune orientation stratégique pour l'ensemble du réseau.
Priorités bien établies
Il s'est révélé que les autres modèles efficaces avaient des priorités stratégiques et un processus de hiérarchisation des priorités de recherche bien établis.
Définition des priorités stratégiques et hiérarchisations des priorités de recherche du RIEM
Selon les documents examinés et les entrevues avec les répondants clés internes, le RIEM n'a défini ni méthode d'établissement des priorités stratégiques ni programme de recherche pour orienter ses activités. Toutefois, selon les autorités associées au RIEM, le comité directeur du RIEM a un rôle clé à jouer dans l'établissement d'un programme de recherche et de priorités stratégiques pour le réseau.
Selon plusieurs entrevues auprès de répondants clés et l'examen documentaire, le comité directeur du RIEM n'a pas vraiment participé à la définition des priorités du réseau ni à l'établissement d'un programme de recherche. Selon un répondant clé bien au fait de la gouvernance du RIEM, le comité directeur s'est contenté d'accepter les priorités proposées par les chercheurs, plutôt que de proposer un programme de recherche avancée en collaboration avec des décideurs et des chercheurs.
Le programme de recherche du RIEM consistait seulement à accepter les requêtes telles que présentées. Le comité directeur du RIEM a bel et bien préparé une matrice de hiérarchisation des requêtes, mais il ne l'a jamais mis en œuvre. Le RIEM n'ayant jamais reçu plus de requêtes qu'il ne pouvait en évaluer, il n'y a jamais eu lieu de classer les requêtes par ordre prioritaire. Le RIEM était mal préparé pour assumer une hausse du nombre de requêtes, car on n'a jamais vérifié si l'évolution des besoins opérationnels justifiait une actualisation ou une amélioration de la matrice.
Selon l'évaluation, l'absence d'une orientation stratégique et d'un programme de recherche a généralement nui au RIEM. La résolution de problèmes persistants que les autorités du programme initial avaient jugée prioritaire (p. ex., l'accès aux données, la participation provinciale-territoriale, l'établissement d'un programme de recherche avancé) a été négligée par la direction. Par conséquent, l'efficacité du réseau en a été limitée.
Ressources consacrées à l'application des connaissances et la gestion de projet
Selon l'examen documentaire, les fournisseurs de données probantes post-commercialisation sur les médicaments les plus efficaces consacraient du personnel à l'application des connaissances.Note de fin de document 13 La plupart d'entre eux ont fait en sorte que leurs recherches soient rendues publiques dans différents formats.
Au sujet de la gestion de projet, on a constaté que les producteurs efficaces s'étaient dotés d'un processus de gestion de projet unifié pour présenter en temps opportun des études rigoureuses aux décideurs. Certains ont recours à des matrices de plans analytiques pour les études plus fréquentes afin de faciliter la tâche des chercheurs.Note de fin de document 14
L'application des connaissances du RIEM
L'un des rôles initiaux du bureau du directeur général du RIEM était d'entreprendre des activités d'application des connaissances appuyant l'ensemble du RIEM. Bien que le bureau de coordination du RIEM ait mené des activités favorisant l'application des connaissances (p. ex., des discussions entre décideurs et chercheurs), plusieurs des auteurs de requêtes interrogés maintenaient que la forme et le fond des rapports de recherche qu'ils recevaient étaient excessivement techniques et compliqués.
L'application des connaissances pour les résultats de recherche est avant tout la responsabilité de chaque équipe de recherche, et il incombe au bureau de coordination d'établir une orientation générale. Cependant, le bureau de coordination du RIEM n'a pas surveillé le degré de conformité des équipes de recherche avec l'orientation établie.
Le CNODES a créé sa propre méthode d'application des connaissances pour répondre aux besoins des utilisateurs, ainsi qu'un système d'évaluation, qui ne semble pas avoir intégré la rétroaction des décideurs.Note de fin de document 15 Cependant, rien n'indique que d'autres équipes de recherche du RIEM aient adopté de telles méthodes.
Bien que le document d'orientation sur l'application des connaissances pour les chercheurs du RIEM fournisse un cadre encourageant des pratiques exemplaires d'application des connaissances, beaucoup des personnes interrogées ont estimé que les pratiques d'application des connaissances étaient davantage axées sur la communication entre chercheurs que sur la communication entre chercheurs et décideurs.Note de fin de document 16,Note de fin de document 17 Certains décideurs ont même noté qu'il fallait interpréter les recherches du RIEM pour les utiliser aux fins d'élaboration de politiques.
Le document d'orientation proposait des résumés et des rapports complets, s'intégrant à un dépôt d'application des connaissances du RIEM.Note de fin de document 17 Selon les constatations de l'évaluation, des restrictions de politique empêchent les IRSC, qui hébergent les pages web du RIEM, de publier les rapports du RIEM sur leur site web. Cela nuit à la diffusion générale des résultats de recherche du RIEM, et restreint sa visibilité.
Gestion de projets du RIEM
Les pratiques de gestion de projet du RIEM ont été abordées dans le paragraphe intitulé obstacles à la vitesse de traitement à la question 2 : vitesse de traitement (page 16 du présent rapport).
Accès facile aux données
L'évaluation a déterminé que les autres modèles efficaces ont conclu beaucoup de partenariats ou d'accords de collaboration, ce qui leur permet d'accéder facilement aux données, y compris aux données privées.
Les partenariats de données du RIEM
L'accès du RIEM à des données probantes post-commercialisation a été défini comme une priorité dès le début du programme. Selon l'examen documentaire, les partenariats d'échange de données se sont formés lentement. Bien qu'une évaluation des actifs du RIEN effectuée en 2017 ait indiqué que les équipes de recherche pouvaient accéder à plusieurs ensembles de données et savaient les utiliser, l'accès rapide aux données demeurait problématique. Selon les réponses à la question 2 : vitesse de traitement du présent rapport, la plupart des répondants clés interrogés, y compris les chercheurs, ont indiqué que l'accès aux données était un obstacle au traitement en temps opportun.
Formation spécialisée et renforcement des capacités
Selon les répondants, le renforcement des capacités grâce à un programme de formation destiné aux chercheurs dans le domaine de la recherche post-commercialisation sur l'innocuité et l'efficacité des médicaments est un élément important à intégrer.
Renforcement des capacités du RIEM
Au cours des dernières années, le RIEM a acquis un haut niveau d'expertise dans le domaine de la recherche post-commercialisation sur l'innocuité et l'efficacité des médicaments. De plus que ses quatre équipes de recherche, le RIEM finance un programme de renforcement des capacités appelé le Programme de formation interdisciplinaire sur l'innocuité et l'efficacité des médicaments (DSECT). Ce programme offre une formation aux scientifiques afin qu'ils se familiarisent avec divers aspects de la recherche sur les médicaments et de collaborer avec des cliniciens et des responsables des politiques, en ce qui touche principalement l'innocuité et l'efficacité des médicaments sur le marché. Cent cinquante-cinq stagiaires ont suivi le programme jusqu'à présent. Selon plusieurs répondants clés interrogés, le programme est un facteur important dans l'atteinte de l'objectif de renforcement des capacités du RIEM.
Facteurs à considérer pour la mise en œuvre d'autres modèles
À l'exception de la gestion de projet spécialisée, les autres éléments associés aux modèles susmentionnés ont été décrits dans les autorisations de programme initiales du RIEM. Ces éléments ont été considérés comme essentiels pour la production de données probantes post-commercialisation pertinentes en temps opportun pour les décideurs. Si le financement du DSECT a permis d'intégrer efficacement une fonction de renforcement des capacités, les autres éléments n'ont pas été mis en œuvre comme prévu initialement.
De plus, le modèle de passation de contrats initialement décrit dans le planNote de fin de document 11 d'activités de 2007 du RIEM n'a pas été mis en œuvre. L'autorité financière demandée ne concernait que le financement par subventions. Par conséquant, le modèle du RIEM ne peut être utilisé pour la passation de contrats de recherche. Si certains décideurs peuvent passer des contrats avec des fournisseurs autres que le RIEM, Santé Canada doit passer par les équipes de recherche du RIEM pour obtenir des données probantes post-commercialisation.
Parmi les autres facteurs à considérer, mentionnons les pratiques d'administration financière flexibles qui pourraient soutenir un réseau agile axé sur la création de valeur. Par exemple, aucun mécanisme ne permet actuellement de réaffecter les fonds inutilisés entre les équipes de recherche pour répondre aux nouvelles priorités ou pour financer des requêtes plus prometteuses. Aucun mécanisme ne permet de réserver des fonds pour les années à venir à des projets dont la priorité peut être levée durant l'exercice en cours, mais qui présentent toujours un intérêt. Selon certains répondants clés, le processus d'approbation et d'exécution basé sur la chronologie de présentation des requêtes plutôt que sur une hiérarchisation des requêtes empire ces contraintes.
Selon certains répondants clés, il y a lieu de se demander si la meilleure organisation pour héberger le RIEM est effectivement les IRSC, compte tenu des problèmes d'application de la vision initiale du RIEM et des contraintes législatives et de politique, notamment les obstacles à la passation de contrats et le manque de participation des chercheurs à l'établissement des priorités du RIEM. Plusieurs organismes pancanadiens de recherche en santé peuvent passer des contrats de recherche pour obtenir des résultats pour leurs intervenants. Ces organisations ne sont pas assujetties aux politiques du Conseil du Trésor, mais elles doivent néanmoins rendre des comptes au public sur leur rendement et leurs finances, par la publication de rapports annuels, les évaluations de programme et la présentation de rapports sur le financement des subventions.
Il faut souligner que l'une des recommandations du rapport de 2015 intitulé Libre cours à l'innovation proposait de transférer les responsabilités, actuellement assumées par les IRSC, à une organisation dont les activités sont davantage en affinité avec celles d'acteurs fédéraux ou financés par le gouvernement fédéral dans le domaine de la recherche post-commercialisation.Note de fin de document 18
Conclusions et recommandations
Conclusions
Incidence du RIEM
Le RIEM a eu une incidence limitée, car le caractère opportun souvent été au-delà de la période d'élaboration de politiques ou de prise de décisions, ce qui en a restreint l'utilité. Ces résultats, combinés aux problèmes persistants d'administration du programme, soulignent la nécessité d'envisager d'autres modèles de prestation afin d'accroître l'incidence et la valeur globale du programme.
Traitement en temps opportun
Dans la plupart des cas, le RIEM n'a pas satisfait aux besoins de ses utilisateurs de recevoir des résultats de recherche en temps opportun. Cette lacune s'est répercutée sur la capacité du RIEM à relever les défis éventuels d'un contexte pharmaceutique en rapide évolution, pour lequel les décideurs doivent être bien renseignés pour prendre des décisions optimales.
Il y a plusieurs causes de cette situation qui indiquent qu'il faut adopter une méthode de recherche plus centrée sur les utilisateurs. Il faut simplifier la gouvernance du réseau et améliorer l'établissement de ses priorités et son programme de planification de recherche afin d'harmoniser l'orientation stratégique aux besoins des utilisateurs. Il faut repenser le processus de traitement des requêtes de sorte à améliorer la communication entre utilisateurs du RIEM et chercheurs. Malgré les récents progrès dans ce domaine, et les modifications qui ont été lancées en 2018, la mise en œuvre complète de ces modifications a eu lieu après mars 2019 et les résultats n'en ont pas encore été confirmés.
Limites de la conception
Une partie des défis que présente le RIEM peut être liée aux restrictions de conception associées au financement de recherche obtenu en 2008.
- Les autorisations de financement permettent aux IRSC de financer la recherche seulement au moyen de subventions et non par contrats, ce qui limite les possibilités du réseau d'accéder aux études post-commercialisation menées par des équipes de recherche qui ne font pas partie du RIEM.
- La subvention obtenue, qui est assujettie à la Politique sur les paiements de transfert, ne permet pas non plus aux chercheurs subventionnés par le RIEM de participer à la table de gouvernance où sont prises les décisions stratégiques et où les priorités sont établies, car cela pourrait créer un conflit d'intérêts réel ou perçu dans l'administration du programme. Cette séparation entre les deux groupes ralentit l'échange de perspectives, ce qui nuit à l'harmonisation des besoins des chercheurs et des décideurs et, par conséquent, à l'adaptabilité du réseau.
Défis liés à la mise en œuvre
Le manque de données disponibles pour mener des recherches était déjà un problème lorsque le REIM a été conçu. Le modèle de données communes, qui est prometteur, n'a été mis en œuvre que tout récemment. Toutefois, dans l'ensemble, les partenariats favorisant l'accès aux données ont progressé lentement, qui a nui à la capacité du RIEM de fournir rapidement des résultats de recherche.
Initialement, la direction du réseau devait être centralisée, et le modèle décentralisé actuel fait en sorte que certains rôles et responsabilités clés sont délaissés. Le manque d'orientation stratégique et de programme de recherche a nui à la capacité du réseau à régler des problèmes persistants comme la participation des provinces et des territoires et l'accès aux données.
Le RIEM parvient mal à surveiller ses activités de recherche et à les adapter aux besoins des décideurs, en l'absence d'une gestion de projet centralisée et de pratiques et protocoles d'application des connaissances entre les équipes de recherche, le bureau de coordination du RIEM et Santé Canada.
Recommandations
La présente évaluation propose deux recommandations pour aborder les contraintes actuelles du RIEM et le rendre apte à répondre aux besoins de ses utilisateurs.
Recommandation 1 : Envisager d'autres modèles pour fournir en temps voulu des données probantes pertinentes aux décideurs, tout en continuant à accroître les forces du RIEM en matière de renforcement des capacités liées à l'innocuité et l'efficacité des médicaments après leur mise en marché.
Il est important de recueillir de l'information post-commercialisation sur l'innocuité et l'efficacité des médicaments et, compte tenu du rythme rapide de l'innovation dans le développement et l'approbation des médicaments, on s'attend à ce que ce besoin augmente considérablement au cours de la prochaine décennie. Bien que le RIEM soit un atout précieux en matière d'expertise, son contexte et ses processus opérationnels actuels ne permettent pas la production en temps opportun des données probantes dont les décideurs ont besoin. Afin d'appuyer pleinement la production de données probantes pertinentes en temps opportun et d'améliorer la valeur du programme, le modèle de prestation doit être repensé pour éliminer les obstacles qui empêchent actuellement d'appliquer le mécanisme de financement flexible prévu à l'origine pour le réseau.
Recommandation 2 : À l'avenir, les contraintes de la conception actuelle devraient être abordées comme suit :
- Une gouvernance simplifiée qui réunit les chercheurs et les responsables des politiques à la même table de décision, car elle favorise la communication et une culture axée sur la satisfaction des besoins des décideurs;
- Des priorités et des programmes de recherche bien établis et conformes aux besoins en matière de politiques et de prise de décisions;
- Une application centralisée des connaissances et une approche unifiée de la gestion de projet qui comprend l'utilisation de modèles de plans analytiques pour les conceptions d'études fréquemment utilisées et des approches normalisées pour répondre aux requêtes des responsables des politiques;
- Un accès facile aux données grâce à des partenariats avec les détenteurs de données, notamment le secteur privé, comme les compagnies d'assurance privées;
Quel que soit le nouveau modèle qui découlera de la recommandation 1, le modèle choisi devra être assorti de plusieurs éléments essentiels pour en assurer le succès. Ces éléments visent à éliminer les obstacles à la communication, à promouvoir une direction centralisée et réceptive et une approche organisationnelle concertée, à assurer le réseau fonctionne de manière à répondre aux besoins des décideurs et à soutenir la viabilité à long terme du RIEM. L'opérationnalisation de ces éléments fait partie de l'établissement d'une culture de recherche axée sur les services qui accorde la priorité aux besoins des responsables des politiques, dont les décisions ont une incidence marquée sur les cliniciens et les patients.
Réponse de la direction et plan d'action
Deuxième évaluation horizontale du Réseau sur l’innocuité et l’efficacité des médicaments (RIEM) 2014-2019
Recommandation 1
Envisager d'autres modèles pour fournir en temps opportun des données probantes pertinentes aux décideurs, tout en continuant à accroître les forces du RIEM en matière de renforcement des capacités liées à l'innocuité et l'efficacité des médicaments après leur mise en marché.
Réponse de la direction
La direction est d'accord avec la recommandation. La direction choisira d'autres modèles et mettra en œuvre l'option retenue tout en continuant à renforcer la capacité en matière de recherche.
| Plan d'action | Livrables | Date d'achèvement prévue | Responsabilités | Ressources |
|---|---|---|---|---|
1.1 Identifier d'autres modèles pour le RIEM (y compris un hôte) et mettre en œuvre l'option préférée. |
1.1.1 et 2.1 Document établissant la portée présentant les options possibles ainsi qu'une recommandation au sujet d'un nouveau modèle et d'une structure de gouvernance connexe (voir la recommandation 2a) |
1.1.1 Juin 2020 - Décembre 2020 |
1. Responsable : Directeur exécutif (DE) du Bureau des stratégies de gestion des produits pharmaceutiques (BSGPP) de Santé Canada et sous-ministre adjoint (SMA) de la Direction générale de la politique stratégique (DGPS) En collaboration avec les Instituts de recherche en santé du Canada (IRSC) et Direction générale des produits de santé et des aliments (DGPSA) |
1.1.1 et 2.1 Ressources existantes du RIEM à Santé Canada et de la direction de programmes des IRSC, avec rétroaction des décideurs et des chercheurs pour 2a) |
1.1.2 Élaboration d'un chemin critique et d'un plan de transition pour la mise en œuvre d'un nouveau modèle de RIEM |
1.1.2 Juin 2020 - Décembre 2020 |
S / O | ||
1.1.3 Mise en œuvre d'un nouveau modèle |
1.1.3 Janvier 2021 - Juin 2021 |
S / O | ||
1.2 Identifier les investissements actuels du RIEM en matière de renforcement de la capacité de recherche sur l'IEM et déterminer les meilleurs mécanismes pour appuyer et renforcer la formation en matière d'IEM et la capacité |
1.2.1 Effectuer une analyse de la capacité actuelle de recherche et des besoins futurs possibles en matière de recherche sur l'IEM au Canada (ressources humaines et méthodes). Identification des lacunes potentielles. |
1.2.1 Juin 2020 - Décembre 2020 |
1.2 Ressources existantes du RIEM de Santé Canada et des IRSC, avec rétroaction des décideurs et des chercheurs |
|
1.2.2 Élaborer une stratégie de formation du RIEM qui permettra d'assurer le suivi des besoins en matière de formation et de renforcement des capacités en ce qui a trait à l'IEM et appuyer ces besoins. |
1.2.2 Juin 2020 - Décembre 2020 |
Recommandation 2
À l'avenir, les contraintes de la conception actuelle devraient être abordées comme suit :
- une gouvernance simplifiée qui réunit les chercheurs et les décideurs à la même table de décision, car elle favorise la communication et une culture axée sur la satisfaction des besoins des décideurs;
- des priorités et des programmes de recherche bien établis et conformes aux besoins en matière de politiques et de prise de décisions;
- une application centralisée des connaissances et une approche unifiée de la gestion de projet qui comprend l'utilisation de modèles de plans analytiques pour les conceptions d'études fréquemment utilisées et des approches normalisées pour répondre aux requêtes des décideurs;
- un accès facile aux données grâce à des partenariats avec les détenteurs de données, notamment le secteur privé, comme les compagnies d'assurance privées.
Réponse de la direction
La direction est d'accord avec la recommandation. En tenant compte des mesures entreprises en réponse à la recommandation 1 consistant à élaborer un nouveau modèle, ce dernier devrait également comprendre les éléments clés indiqués dans la recommandation 2.
| Plan d'action | Livrables | Date d'achèvement prévue | Responsabilités | Ressources |
|---|---|---|---|---|
2 Tenir compte des limites de la conception actuelle qui sont indiquées dans les quatre volets de la recommandation 2 dans le contexte de l'élaboration et de la mise en œuvre du nouveau modèle élaboré aux termes de la recommandation 1. |
2.1 Voir le livrable 1.1 ci-dessus |
2.1 Voir le livrable 1.1 ci-dessus |
Responsable : DE du BSGPP et SMA de la DGPS en collaboration avec les IRSC et la DGPSA |
2.1 Voir le livrable 1.1 ci dessus |
2.2 Au sein de la nouvelle structure de gouvernance, créer un forum stratégique de planification et de priorisation qui tient compte des besoins et des priorités des décideurs. |
2.2 Janvier 2021 - Juin 2021 |
2.2 Ressources existantes du RIEM de Santé Canada et des IRSC, avec rétroaction des décideurs et des chercheurs |
||
2.3.1 Établir une composante centralisée d'application des connaissances (AC) au sein du programme. Examiner et mettre à jour les directives existantes du RIEM en matière d'AC et élaborer de nouveaux livrables en matière d'AC qui répondent aux besoins des décideurs. |
2.3.1 Janvier 2021 - Juin 2021 |
2.3 Ressources existantes du RIEM de Santé Canada et des IRSC, avec rétroaction des décideurs et des chercheurs |
||
2.3.2 Élaborer un processus de gestion des projets et des demandes qui permet de répondre aux besoins des décideurs. Élaborer une stratégie connexe de mesure du rendement et d'évaluation. |
2.3.2 Janvier 2021 - Juin 2021 |
|||
2.4 Réaliser une analyse pour déterminer l'accès aux données existantes par les chercheurs et les décideurs au Canada. Cerner les lacunes et les éléments à prendre en considération. Élaborer des directives en matière d'accès aux données (pour optimiser les droits des chercheurs et des décideurs à l'égard des conclusions dérivées du RIEM). |
2.4 Juin 2020 - Juin 2021 |
2.4 Contrat externe, appuyé par les ressources existantes du RIEM de Santé Canada et des IRSC, avec rétroaction des décideurs et des chercheurs |
Remarque : En raison des circonstances extraordinaires liées à la COVID-19, une situation qui continue, il est possible que les échéanciers des mesures à suivre de la RPAD soient affectés davantage. La direction du RIEM (Santé Canada et les IRSC) est consciente de ceci et répondra au besoin, en consultation avec le Bureau de l'audit et de l'évaluation.
Annexes
Annexe A : Modèle logique du RIEM (Decembre 2018)
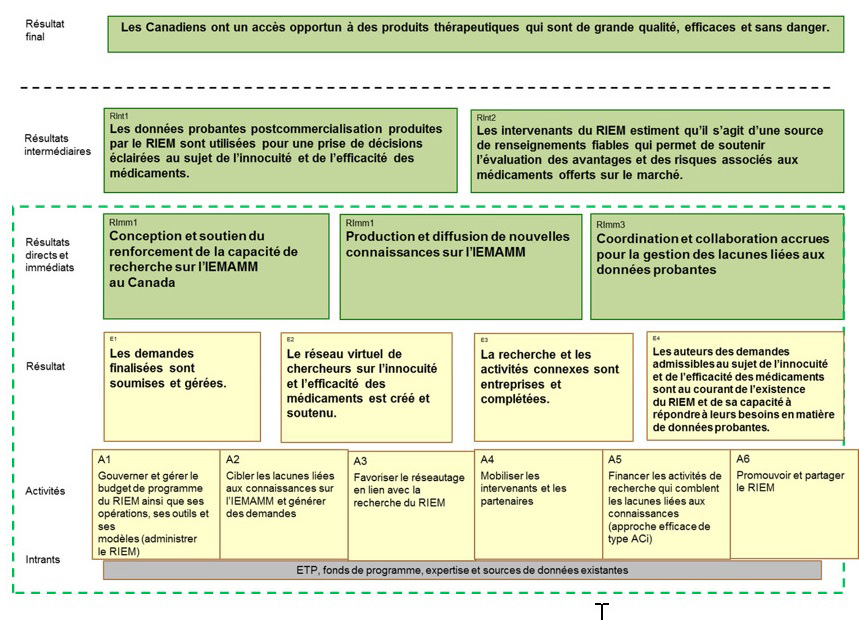
Modèle logique du RIEM : Équivalent textuel
Ce diagramme illustre les composantes du modèle logique du RIEM en reproduisant visuellement les intrants (ressources), activités, extrants et résultats prévus du programme.
Les intrants du RIEM comprennent les ressources humaines et financières, les connaissances spécialisées et les sources de données existantes.
En utilisant ces intrants, le RIEM mène des activités, notamment l'administration du réseau; la détermination des lacunes liées aux connaissances sur l'innocuité et l'efficacité des médicaments après leur mise en marché et la production de demandes; la favorisation du réseautage en lien avec la recherche sur l'innocuité et l'efficacité des médicaments après leur mise en marché; la mobilisation des intervenants et des partenaires; le financement d'activités de recherche qui comblent les lacunes liées aux connaissances, et la promotion et la communication du RIEM.
Les résultats de ces activités se combinent pour produire les éléments suivants :
- Finalisation des demandes qui sont soumises et gérées pour étude;
- Création et maintien d'un réseau virtuel de chercheurs sur l'innocuité et l'efficacité des médicaments;
- Mise en œuvre et achèvement de la recherche et des activités connexes;
- Connaissance des auteurs de demandes admissibles au sujet de l'innocuité et de l'efficacité des médicaments de l'existence du RIEM et de sa capacité à répondre à leurs besoins en matière de données probantes.
Les résultats immédiats qui découlent des extrants sont :
- L'élaboration et le maintien d'une capacité accrue de recherche sur l'innocuité et l'efficacité des médicaments après leur mise en marché;
- La production et la diffusion de nouvelles connaissances sur l'innocuité et l'efficacité des médicaments après leur mise en marché;
- Le renforcement de la coordination et de la collaboration en vue de combler les lacunes liées aux données probantes.
Ces résultats immédiats devraient mener aux résultats intermédiaires suivants :
- Utilisation des données probantes post-commercialisation produites par le RIEM pour éclairer la prise de décisions au sujet de l'innocuité et de l'efficacité des médicaments;
- Reconnaissance du RIEM par les intervenants comme source de renseignements fiables qui permet de soutenir l'évaluation des avantages et des risques associés aux médicaments offerts sur le marché.
Le résultat final du RIEM est de s'assurer que les Canadiens ont un accès opportun à des produits thérapeutiques qui sont de grande qualité, efficaces et sans danger.
Annexe B : Modèles comparatifsNote de fin de document 19
Réseau européen de centres pour la pharmacoépidémiologie et la pharmacovigilance
Le réseau européen de centres pour la pharmacoépidémiologie et la pharmacovigilance (ENCePP) est un réseau coordonné par l'Agence européenne des médicaments. Les membres de ce réseau (les partenaires de l'ENCePP) sont des institutions publiques et des organismes de recherche par contrat effectuant des études en pharmacoépidémiologie et pharmacovigilance. Outre l'innocuité des médicaments, les sujets de recherche peuvent porter, notamment, sur les avantages et risques des médicaments, sur l'épidémiologie des maladies et sur l'utilisation des médicaments. La participation à l'ENCePP est volontaire. L'ENCePP vise à accroître la surveillance de l'équilibre entre les avantages et les risques des médicaments en Europe comme suit :
- Faciliter la réalisation d'études post-approbation indépendantes, multicentriques et de haute qualité, axées sur la recherche observationnelle
- Réunir l'expertise et les ressources en matière de pharmacoépidémiologie et de pharmacovigilance à l'échelle de l'Europe, et fournir une plateforme de collaboration
- Établir et maintenir des normes méthodologiques et des principes de gouvernance en recherche
L'initiative Sentinel de la Food and Drug Administration des États-Unis
L'initiative Sentinel a été lancée en 2008 dans le cadre d'un effort pluriannuel visant à créer un système électronique national de surveillance du rendement des produits médicaux réglementés par la FDA. Sentinel répond à une exigence réglementaire selon laquelle la FDA doit collaborer avec des entités publiques, universitaires et privées pour mettre au point un système permettant d'obtenir les données électroniques actuelles sur les soins de santé de sources multiples afin d'évaluer l'innocuité des produits médicaux approuvés. Voici certaines de réalisations de l'initiative Sentinel :
- La création d'un modèle de données communes et d'une méthode de données distribuées qui permet à la FDA de surveiller le rendement des produits médicaux tout en protégeant la vie privée des patients
- La création d'une base de données réparties de haute qualité, sans double compte et dûment conservées sur plus de 300 millions d'années-personnes.
- L'établissement de processus permettant de transformer des questions d'innocuité à l'égard d'un produit médical de la part de la FDA en requêtes lancées dans le système de données distribuées Sentinel auxquelles les partenaires de données peuvent répondre rapidement, souvent en quelques semaines, en conformité avec les besoins réglementaires de la FDA.
Réseau de recherche sur les politiques ontariennes en matière de médicaments
Établi en 2008, le Réseau de recherche sur les politiques ontariennes en matière de médicaments (RRPOM) regroupe des chercheurs sur les politiques de médicaments de tout l'Ontario. Il a été créé pour répondre rapidement aux requêtes des responsables des politiques, qui ont besoin de données de recherche pertinentes pour étayer leurs décisions. Le RRPOM peut produire des données probantes scientifiques rigoureuses sur l'utilisation, l'innocuité, l'efficacité et le coût des médicaments en Ontario, et il a établi des partenariats permettant de comparer l'innocuité et l'utilisation des médicaments entre les provinces. Les chercheurs du RRPOM sont spécialisés dans la recherche sur les politiques en matière de produits pharmaceutiques du point de vue des résultats, des facteurs économiques et des études. Les objectifs du RRPOM sont les suivants :
- Appuyer des décisions de politiques en matière de médicaments étayées par des données probantes grâce à des études menées rapidement
- Être un chef de file dans la production de données de recherche de haute qualité, pertinentes et en temps opportun, qui sont précieuses pour les cliniciens, les responsables des politiques, les universitaires et le grand public
- Communiquer efficacement les résultats aux intervenants
- Fournir un environnement de formation stimulant pour les étudiants s'intéressant à la pharmacoépidémiologie et à la recherche sur les politiques en matière de médicaments.
Institute of Health Economics
L'Institute of Health Economics est une organisation indépendante sans but lucratif dotée de compétences clés en matière de modèles analytiques d'économie de la santé et de décisions, d'évaluation des technologies de la santé, d'application et d'échange des connaissances. Il a pour mission d'éclairer l'élaboration de politiques et de pratiques de santé coordonnées, innovantes et fondées sur des données probantes.
Il a établi des partenariats avec le milieu universitaire, les secteurs privé et public, à l'échelle provinciale, nationale et internationale, qui lui donnent accès à des capacités et compétences importantes, et amplifient la contribution de l'organisation par la diffusion en réseau de données probantes et de renseignements.
| S / O | RRPOM | SENTINEL | ENCePP | IHE |
|---|---|---|---|---|
| Gouvernance simplifiée englobant décideurs et chercheurs | Le Comité consultatif des intervenants est le comité de surveillance générale du RRPOM qui mène les activités de recherche indépendantes et fournit des conseils scientifiques et de politique.Note de fin de document 20 Il est constitué des personnes suivantes :
|
Le conseil de planification comprend des représentants de la FDA, de chacune des institutions collaboratrices, y compris des chercheurs, ainsi que des détenteurs de données et des représentants des patients.Note de fin de document 21 Le conseil informe le centre d'opérations de Sentinel et à la FDA, et il constitue un forum de communication entre les différentes entités. |
L'ENCePP est mené par un groupe directeur composé de membres du milieu universitaire et de centres de recherche collaborateurs, de représentants de l'Agence européenne des médicaments et d'autres groupes d'intervenants, dont des patients et un observateur de l'industrie.Note de fin de document 22Note de fin de document 23 L'efficacité de l'ENCePP est en partie attribuable à son rigoureux modèle de gouvernance, à une représentation diversifiée, et à son utilisation d'assemblées plénières pour stimuler l'élaboration de pratiques exemplaires et d'orientations réglementaires.Note de fin de document 24 |
L'Institute of Health Economics est constitué d'un conseil d'administration composé de dirigeants de l'institut ainsi que de représentants du milieu universitaire, du gouvernement et des autorités publiques. |
| Priorités bien établies | Le programme de recherche du RRPOM répond aux priorités stratégiques de son principal client à l'échelon provincial (le ministère de la Santé de l'Ontario). Selon le système de hiérarchisation de la recherche du RRPOM, la majorité des activités du réseau (jusqu'à 70 %) est consacrée à des projets découlant des besoins des responsables des politiques, ce qui permet néanmoins de réaliser divers types de recherche initiés par les chercheurs.Note de fin de document 25 |
Le conseil de gouvernance Sentinel définit l'orientation stratégique à long terme. La FDA a établi divers plans stratégiques pour Sentinel, dont le plus récent, publié en janvier 2019, porte sur les activités jusqu'en 2023.Note de fin de document 26 Si les principaux objectifs du plan sont de répondre aux besoins de renseignements sur les produits médicaux post-commercialisation, ils soutiennent également l'innovation et l'élaboration de méthodologies. |
Le groupe directeur de l'ENCePP a établi divers plans de travail pour encadrer l'expansion générale du réseau. Le principal objectif de son plan de travail 2017-2019 était d'optimiser la contribution du réseau aux décisions d'ordre réglementaire, ainsi que de viser l'élaboration de méthodes de recherche à impact élevé.Note de fin de document 27 | L'IHE a publié son plan stratégique 2018-2021 en avril 2018. |
| Ressources consacrées à l'application des connaissances et gestion de projet | Les rapports du RRPOM sont facilement accessibles en ligne, et le Réseau a du personnel responsable de préparer des résumés de recherche et des infographies pour appuyer certains produits de recherche. Des gestionnaires de projet et des administrateurs de recherche spécialisés forment une équipe de gestion de projet au sein de l'unité principale de réponse rapide, qui supervise le travail des différentes unités du RRPOM. Des matrices de plans analytiques pour les études plus fréquentes afin de faciliter la tâche des chercheurs.Note de fin de document 28 |
Sentinel met en ligne tous les rapports, outils de surveillance, évaluations et documents de communication, et fournit un outil de recherche pour aider à trouver ces produits.Note de fin de document 29 Sentinel énumère certaines de ses analyses qui ont influencé la prise de décision.Note de fin de document 30 La gestion de projet est centralisée, grâce à l'utilisation d'un logiciel de gestion de projet spécialisé à source ouverte et de pages wiki qui encouragent la transparence et la communication entre la FDA et Sentinel sur l'avancement des projets. Sentinel utilise souvent des méthodes normalisées pour accélérer les réponses aux requêtes de recherche.Note de fin de document 31 |
L'ENCePP donne aux membres de l'Agence européenne des médicaments accès au registre des études d'innocuité post-approbation (EU PAS Register), qui a transformé le paysage de la pharmacoépidémiologie et de la pharmacovigilance en permettant au public de consulter les évaluations de médicaments et de risques d'innocuité et en diffusant des renseignements sur les chercheurs, les données disponibles, les méthodes et les sources de financement.Note de fin de document 32 |
L'Institute of Health Economics offre une fonction de recherche en ligne facilitant la diffusion de ses études et s'est doté d'un secteur d'activité spécialisé dans l'application des connaissances.Note de fin de document 33,Note de fin de document 34 |
| Accès facile aux données | Le RRPOM collabore étroitement avec l'Institute for Clinical Evaluative Sciences (ICES) de l'Ontario et a conclu des accords et des partenariats avec Qualité des services de santé Ontario, Santé publique Ontario et l'ICIS, ce qui donne principalement accès au Système national d'information sur l'utilisation des médicaments prescrits (SNIUMP). Le réseau a aussi conclu des accords avec des sources de données privées, telles que Green Shield et IQVIA, une multinationale américaine au service des secteurs combinés des technologies de l'information sur la santé et de la recherche clinique. Il a aussi eu recours aux données du Bureau du coroner en chef de l'Ontario pour divers projets. |
Le système Sentinel peut accéder à divers fonds de données, dont de grandes quantités de données privées, grâce à des partenariats avec, notamment, des instituts de recherche et des fournisseurs de soins de santé. |
Les efforts de collaboration de l'ENCePP ont permis de réunir plus de 168 centres de recherche (privés, publics et sans but lucratif) et le réseau a facilité l'établissement de consortiums de recherche qui étudient l'innocuité des médicaments.Note de fin de document 35 |
Le plan stratégique de l'IHE indique qu'une des priorités sera de collaborer avec le ministère de la Santé de l'Alberta pour accroître l'utilisation des données probantes concrètes de l'Alberta. |
Annexe C : Contraintes et stratégies d'atténuation
La plupart du temps, les évaluateurs font face à des contraintes susceptibles d'avoir une incidence sur la validité et la fiabilité de leurs constatations et de leurs conclusions. Le tableau suivant présente les contraintes rencontrées lors de la mise en œuvre des méthodes sélectionnées pour cette évaluation et les stratégies d'atténuation adoptées pour garantir que les résultats de l'évaluation sont suffisamment rigoureux.
| Contrainte | Incidence | Stratégie d'atténuation |
|---|---|---|
| Les publications universitaires évaluées par les pairs décrivant les besoins spécifiques du Canada en matière de données probantes post-commercialisation sur l'innocuité et l'efficacité des médicaments sont peu nombreuses. | Cela a restreint la capacité à évaluer complètement les besoins actuels et prévus en matière de données probantes post-commercialisation au Canada. | La littérature grise et des sources internationales ont été utilisées pour compléter les publications canadiennes évaluées par les pairs. |
| Les responsables des politiques consultant plusieurs sources de données pour éclairer leurs décisions, ce qui fait en sorte qu'il est difficile d'attribuer directement un changement de politique à des projets de recherche en particulier. | Cela a restreint la capacité à quantifier l'incidence de la recherche financée par le RIEM au-delà du milieu universitaire. | Des données qualitatives supplémentaires ont été utilisées pour mieux comprendre les facteurs persuadant ou dissuadant les responsables des politiques d'utiliser les données de recherche. |
| Les procédures actuelles de déclaration des données financières à Santé Canada et aux IRSC ont restreint l'accès aux renseignements sur l'affectation des ressources humaines (ETP). | Cela a restreint la capacité à évaluer si les ressources humaines ont été affectées conformément aux autorités du programme initiales. | Les données sur les affectations d'ETP ont été complétées par des données provenant d'entrevues avec la direction générale afin de déterminer la source réelle des affectations de ressources humaines. |
| La répartition des fonds par projet ou équipe de recherche n'était pas indiquée dans les rapports financiers. | Cela a restreint la capacité à comparer directement l'efficacité des équipes de recherche et la rentabilité du RIEM, par rapport à d'autres réseaux de recherche. | Un calcul global du coût par requête pour chaque équipe a été produit, sur la base des affectations totales de subventions et de contributions. |
| Les entrevues avec les répondants clés sont de nature rétrospective, fournissant une perspective récente sur des événements passés. | Cela peut affecter la validité des évaluations des activités ou des résultats qui peuvent avoir changé au fil du temps. | La triangulation avec d'autres sources de données probantes a permis de confirmer et de fournir de plus amples renseignements sur les données recueillies dans le cadre des entrevues. L'examen documentaire a permis d'obtenir des renseignements organisationnels. |
| Une stratégie de mesure du rendement du programme et un modèle logique ont été établis vers la fin de la période visée par l'évaluation. | Les données relatives à la mesure du rendement n'ont pas été recueillies de manière cohérente au cours de la période de cinq ans visée par l'évaluation. | Un cadre et une matrice d'évaluation, validés auprès d'un représentant du programme, ont été élaborés pour garantir que les renseignements disponibles étaient suffisants pour répondre à toutes les questions d'évaluation. |
| La qualité des données de suivi des requêtes était inégale, à cause, entre autres, d'une utilisation incohérente de la terminologie et de données manquantes ou incomplètes. | Il a été impossible d'analyser en profondeur chaque point dans le temps associé aux divers projets de recherche visés par l'évaluation. | Une stratégie d'échantillonnage a été adoptée afin d'analyser le délai de traitement des requêtes à partir des meilleures données connues. |
Annexe D : Schéma du processus de traitement des requêtes
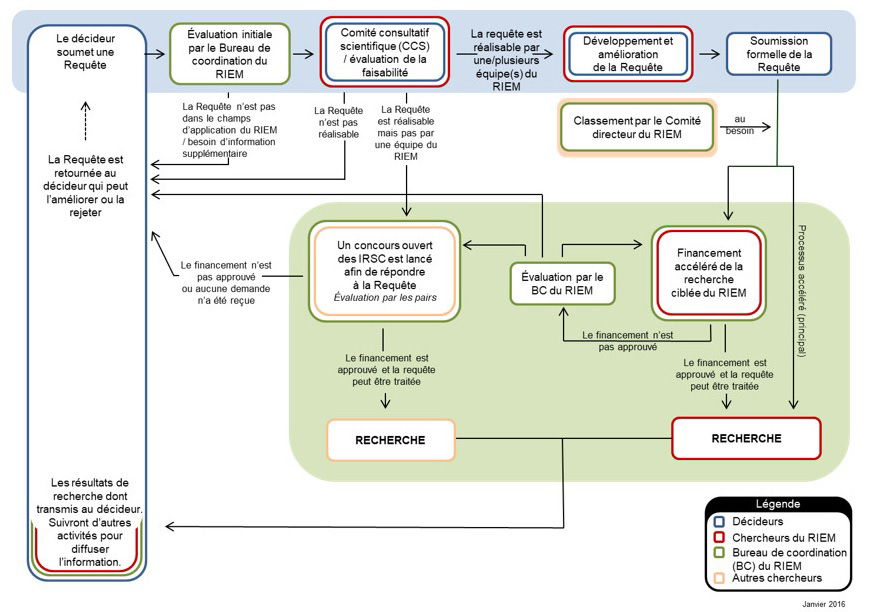
Schéma du processus de traitement des requêtes : Équivalent textuel
Cette figure illustre les différentes étapes du processus de requête.
Étape 1 : Le décideur soumet une requête.
Étape 2 : Évaluation initiale par le Bureau de coordination du RIEM
- Si la requête est acceptable, elle passe à la prochaine étape.
- Si la requête ne correspond pas au champ d'application du RIEM ou si on a besoin d'information supplémentaire, la requête est retournée au décideur qui peut l'améliorer ou l'annuler.
Étape 3 : Évaluation de la faisabilité par le comité consultatif scientifique (CCS)
- Si la requête est réalisable par une ou plusieurs équipes du RIEM, elle passe à la prochaine étape.
- Si la requête est réalisable, mais pas par une équipe du RIEM, un appel ouvert est lancé afin de déterminer si on peut répondre à cette requête au moyen des outils de financement des IRSC.
- Si la requête ne correspond pas au champ d'application du RIEM ou si on a besoin d'information supplémentaire, la requête est retournée au décideur qui peut l'améliorer ou l'annuler.
Étape 4 : Élaboration et amélioration de la requête
Étape 5 : Soumission officielle de la requête
Étape 6 : Le comité directeur est informé des résultats de l'ADM et établit le niveau de priorité de la requête.
- La proposition est soumise à l'évaluation par les pairs et étudiée par le BC du RIEM (elle peut être retournée à l'équipe qui l'a soumise aux fins d'amélioration).
- Si l'une des six autres équipes peut répondre à la requête, une subvention pour le financement accéléré de la recherche ciblée du RIEM est demandée.
- La proposition est soumise à l'évaluation par les pairs et étudiée par le BC du RIEM (elle peut être retournée à l'équipe qui l'a soumise aux fins d'amélioration).
- Si la proposition est approuvée, elle passe à l'étape de la recherche.
- Si la requête est réalisable, mais pas par une équipe du RIEM, un appel ouvert est lancé afin de déterminer si on peut répondre à cette requête au moyen des outils de financement des IRSC.
- Si le financement n'est pas approuvé ou aucune proposition n'a été reçue, la requête est retournée au décideur qui peut l'améliorer ou l'annuler.
- La proposition est soumise à l'évaluation par les pairs et étudiée par le BC du RIEM (elle peut être retournée à l'équipe qui l'a soumise aux fins d'amélioration).
Étape 7 : Les résultats de la recherche sont transmis au décideur avant qu'ils soient diffusés.
Annexe E : Organigramme du RIEM
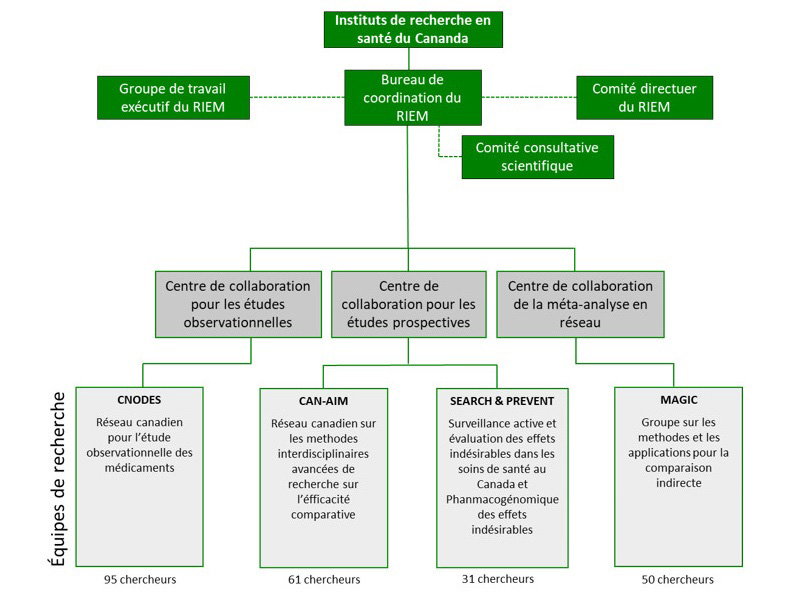
Organigramme du RIEM : Équivalent textuel
Cette figure illustre l'organigramme du Réseau sur l'innocuité et l'efficacité des médicaments (RIEM).
Le RIEM est chapeauté par les Instituts de recherche en santé du Canada et le bureau de coordination du RIEM. Le bureau de coordination du RIEM possède des liens horizontaux avec trois entités consultatives : le comité directeur du RIEM et le comité consultatif scientifique à droite et le groupe de travail exécutif du RIEM à gauche.
Sous le bureau de coordination du RIEM se trouvent les centres de collaboration, répartis selon leurs méthodologies. Ces centres de collaboration se concentrent sur les études observationnelles, les études prospectives et la méta-analyse en réseau, et ils sont formés de quatre équipes de recherche financées par le RIEM.
Le Centre de collaboration pour les études observationnelles est formé du Réseau canadien pour l'étude observationnelle des médicaments (CNODES - 95 chercheurs). Le Réseau du RIEM de surveillance active et d'évaluation des effets indésirables des médicaments dans les soins de santé au Canada et l'équipe nationale de pharmacogénomique des effets indésirables (SURVEILLANCE ACTIVE ET ÉVALUATION DES EFFETS INDÉSIRABLES DES MÉDICAMENTS DANS LES SOINS DE SANTÉ AU CANADA ET ÉQUIPE NATIONALE DE LA PHARMACOGÉNOMIQUE DES EFFETS INDÉSIRABLES - 31 chercheurs), et le Réseau canadien sur les méthodes interdisciplinaires avancées de recherche sur l'efficacité comparative - 61 chercheurs, forment ensemble le Centre de collaboration pour les études prospectives. Le Centre de collaboration de la méta-analyse en réseau comprend une seule équipe : le Groupe sur les méthodes et les applications pour la comparaison directe - 50 chercheurs.
Notes de fin de document
- Note de fin de document 1
-
Canada. Parlement. Sénat. Comité sénatorial permanent des affaires sociales, des sciences et de la technologie. 17 octobre 2012. Témoignages, 41e législature, 1re session (2 juin 2011-13 septembre 2013).
Sur Internet : https://sencanada.ca/fr/Content/Sen/committee/411/soci/49733-f - Note de fin de document 2
-
Institut canadien d'information sur la santé. 2018 Les dépenses en médicaments du Canada augmentent plus rapidement que celles consacrées aux hôpitaux ou aux médecins..
Sur Internet : https://www.cihi.ca/fr/les-depenses-en-medicaments-du-canada-augmentent-plus-rapidement-que-celles-consacrees-aux-hopitaux - Note de fin de document 3
-
Canada. Ministère de la Santé. 2018. Faits saillants sur les médicaments et les instruments médicaux 2018 : Pour maintenir et améliorer votre santé.
Sur Internet : https://www.canada.ca/content/dam/hc-sc/documents/services/publications/drugs-health-products/drug-medical-device-highlights-2018/faits-saillants-2018-medicaments-dispositifs-medicaux.pdf. - Note de fin de document 4
-
Canada. 2019. Le budget de 2019 : Aller de l'avant avec la mise en œuvre du programme national d'assurance-médicaments.
Sur Internet : https://www.budget.canada.ca/2019/docs/themes/pharmacare-assurance-medicaments-fr.html. - Note de fin de document 5
-
Détails concernant la possibilité de financement : Subvention réservée : RIEM-ACMTS, archivé.
https://www.researchnet-recherchenet.ca/rnr16/viewOpportunityDetails.do?browseArc=true&fodAgency=CIHR&org=CIHR&progCd=10446&view=browseArchive&language=F - Note de fin de document 6
-
Canada. Ministère de la Santé. 2018. Faits saillants sur les médicaments et les instruments médicaux 2018 : Pour maintenir et améliorer votre santé.
Sur Internet : https://www.canada.ca/content/dam/hc-sc/documents/services/publications/drugs-health-products/drug-medical-device-highlights-2018/faits-saillants-2018-medicaments-dispositifs-medicaux.pdf - Note de fin de document 7
-
Khan, Sobia, Julia E. Moore, Tara Gomes et coll. « The Ontario Drug Policy Research Network: Bridging the gap between Research and Drug policy », Health Policy, vol. 117, 2014, p. 392-398.
- Note de fin de document 8
-
Réseau de recherche sur les politiques ontariennes en matière de médicaments. Review Process (seulement disponible en anglais).
Sur Internet : https://odprn.ca/research/core-themes/drug-class-reviews/review-process/ - Note de fin de document 9
-
Sentinel. Active Risk Identification and Analysis (seulement disponible en anglais).
Sur Internet : https://www.sentinelinitiative.org/active-risk-identification-and-analysis-aria - Note de fin de document 10
-
Sentinel. Common Data Model. (seulement disponible en anglais)
Sur Internet : https://www.sentinelinitiative.org/sentinel/data/distributed-database-common-data-model - Note de fin de document 11
-
Médicaments efficaces pour les Canadiens et les Canadiennes : Plan d'activités pour un réseau sur l'innocuité et l'efficacité des médicaments, février 2007.
- Note de fin de document 12
-
Canada. Chambre des communes. 2008. La surveillance post-commercialisation des produits pharmaceutiques : Rapport du Comité permanent de la santé, juin 2008. https://www.ourcommons.ca/Content/Committee/392/HESA/Reports/RP3598191/hesarp07/hesarp07-f.pdf
- Note de fin de document 13
-
Réseau de recherche sur les politiques ontariennes en matière de médicaments. Knowledge Translation Unit (KTU) (seulement disponible en anglais).
Sur Internet : https://odprn.ca/about-the-odprn/odprn-units/knowledge-translation-department/ - Note de fin de document 14
-
Réseau de recherche sur les politiques ontariennes en matière de médicaments Rapid Response Unit (seulement disponible en anglais).
Sur Internet : https://odprn.ca/about-the-odprn/odprn-units/rapid-response-unit/ - Note de fin de document 15
-
Sketris, I.S., N. Carter, R.L. Traynor, D. Watts et K. Kelly au nom des membres actifs de l'équipe d'application des connaissances (Knowledge Translation Team) du Réseau canadien pour l'étude observationnelle des médicaments : Pierre Ernst, J.M. Gamble, Brenda Hemmelgarn, Colleen Metge, Michael Paterson, Robert Platt et Gary Teare. « Building a framework for the evaluation of knowledge translation for the Canadian Network for Observational Drug Effect Studies ». Pharmacoepidemiol Drug Saf. 2019; 1-18.
- Note de fin de document 16
-
Réseau sur l'innocuité et l'efficacité des médicaments. 2014.
Sur Internet : https://cihr-irsc.gc.ca/f/documents/dsen_kt_guidance_doc-fr.pdf - Note de fin de document 17
-
Réseau sur l'innocuité et l'efficacité des médicaments. 2014. Document d'orientation sur l'application des connaissances pour les chercheurs et les intervenants du RIEM.
Sur Internet : https://cihr-irsc.gc.ca/f/49134.html - Note de fin de document 18
-
Groupe consultatif sur l'innovation des soins de santé. 2015. Libre cours à l'innovation : soins de santé excellents pour le Canada.
Sur Internet : https://www.canada.ca/content/dam/canada/health-canada/migration/healthy-canadians/publications/health-system-systeme-sante/report-healthcare-innovation-rapport-soins/alt/report-healthcare-innovation-rapport-soins-fra.pdf - Note de fin de document 19
-
Réseau européen de centres pour la pharmacoépidémiologie et la pharmacovigilance. What is ENCePP? (seulement disponible en anglais)
Sur Internet : http://www.encepp.eu/structure/index.shtml;
Réseau de recherche sur les politiques ontariennes en matière de médicaments. About the ODPRN. (seulement disponible en anglais)
Sur Internet : https://odprn.ca/about-the-odprn/;
Sentinel. Background Information.
Sur Internet : https://www.sentinelinitiative.org/background;
Institute of Health Economics. About us. (seulement disponible en anglais)
Sur Internet : https://www.ihe.ca/about/about-ihe - Note de fin de document 20
-
Réseau de recherche sur les politiques ontariennes en matière de médicaments. Stakeholder Advisory Panel (seulement disponible en anglais) consulté le 8 octobre 2019.
Sur Internet : https://odprn.ca/about-the-odprn/odprn-units/stakeholder-advisory-panel/ on 2019-10-08. - Note de fin de document 21
-
Sentinel. Coordinating Centre (seulement disponible en anglais) consulté le 5 novembre 2019.
Sur Internet : https://www.sentinelinitiative.org/coordinating-center - Note de fin de document 22
-
Sultana, J., et coll. « Healthcare Database Networks for Drug Regulatory Policies: international Workshop on the Canadian, US and Spanish Experience and Future Steps for Italy » (seulement disponible en anglais). Drug Safety, Springer Nature Switzerland AG, 2019, 22 octobre 2019.
Sur Internet : https://doi.org/10.1007/s40264-019-00871-w - Note de fin de document 23
-
Réseau européen de centres pour la pharmacoépidémiologie et la pharmacovigilance
Sur Internet : http://www.encepp.eu/structure/documents/CompositionofENCePPSG2017_2019.pdf - Note de fin de document 24
-
Kurz, X., S. Perez‐Gutthann et le groupe directeur de l'ENCePP. « Strengthening standards, transparency, and collaboration to support medicine evaluation: Ten years of the European Network of Centres for Pharmacoepidemiology and Pharmacovigilance (ENCePP) », Pharmacoepidemiology and Drug Safety, vol. 27, no 3 (mars 2018), p. 245-252.
- Note de fin de document 25
-
Khan, Sobia, Julia E. Moore, Tara Gomes et coll. « The Ontario Drug Policy Research Network: Bridging the gap between Research and Drug policy », Health Policy, vol. 117, 2014, p. 392-398.
- Note de fin de document 26
-
Sentinel System - Five-Year Strategy 2019-2023.
Sur Internet : https://www.fda.gov/media/120333/download - Note de fin de document 27
-
ENCePP Work Plan 2017-2019.
Sur Internet : http://www.encepp.eu/publications/documents/ENCePPWorkPlan2017-2019.pdf - Note de fin de document 28
-
Réseau de recherche sur les politiques ontariennes en matière de médicaments. Rapid Response Unit (seulement disponible en anglais).
Sur Internet : https://odprn.ca/about-the-odprn/odprn-units/rapid-response-unit/ - Note de fin de document 29
-
Sentinel. Report Finder (seulement disponible en anglais) consulté le 5 novembre 2019.
Sur Internet : https://www.sentinelinitiative.org/communications/report-finder on 2019-11-05. - Note de fin de document 30
-
Sentinel. How ARIA Analyses Have Been Used by FDA. (seulement disponible en anglais)
Sur Internet : https://www.sentinelinitiative.org/drugs/how-aria-analyses-have-been-used-fda - Note de fin de document 31
-
Khan, Sobia, Julia E. Moore, Tara Gomes et coll. « The Ontario Drug Policy Research Network: Bridging the gap between Research and Drug policy », Health Policy, vol. 117, 2014, p. 392-398.
- Note de fin de document 32
-
Kurz, X., S. Perez‐Gutthann et le groupe directeur de l'ENCePP. « Strengthening standards, transparency, and collaboration to support medicine evaluation: Ten years of the European Network of Centres for Pharmacoepidemiology and Pharmacovigilance (ENCePP) », Pharmacoepidemiology and Drug Safety, vol. 27, no 3 (mars 2018), p. 245-252. Publié sur Internet le 11 janvier 2018
- Note de fin de document 33
-
Institute of Health Economics. (seulement disponible en anglais)
Sur Internet : https://www.ihe.ca/advanced-search?type=1020 - Note de fin de document 34
-
Institute of Health Economics. Knowledge Transfer & Dissemination. (seulement disponible en anglais)
Sur Internet : https://www.ihe.ca/research-programs/knowledge-transfer-dissemination - Note de fin de document 35
-
Kurz, X., S. Perez‐Gutthann et le groupe directeur de l'ENCePP. « Strengthening standards, transparency, and collaboration to support medicine evaluation: Ten years of the European Network of Centres for Pharmacoepidemiology and Pharmacovigilance (ENCePP) », Pharmacoepidemiology and Drug Safety, vol. 27, no 3 (mars 2018), p. 245-252.
Notes de bas de page
- Note de bas de page a
-
Ce plan visait à renforcer le système de salubrité du Canada, y compris son système de médicaments, grâce à des pratiques modernes de réglementation, d'intervention rapide et de surveillance permettant d'agir rapidement en cas de risques.
- Note de bas de page b
-
Un avis de conformité avec conditions (AC-C) permet à Santé Canada de fournir un accès anticipé à la mise en marché d'un médicament pouvant sauver des vies.
