L'aluminium dans l'eau potable : Document technique pour consultation

Télécharger le format de rechange
(Format PDF, 952 KB, 71 pages)
Organization: Santé Canada
Date published: 2019-06-28
Objet de la consultation
Le présent document technique décrit l'évaluation de l'information disponible sur l'aluminium dans le but de mettre à jour la ou les valeurs de recommandation relativement à la présence d'aluminium dans l'eau potable. La présente consultation vise à solliciter des commentaires sur la recommandation proposée et la valeur opérationnelle recommandée (VOR), la démarche suivie pour l'élaborer et les coûts possibles de sa mise en œuvre.
Le document technique existant sur l'aluminium, élaboré en 1998, préconisait des VOR pour les stations de traitement utilisant des coagulants à base d'aluminium comme suit : inférieures à 0,1 mg/L (100 µg/L) pour les stations de traitement classiques et inférieures à 0,2 mg/L (200 µg/L) pour les autres types de systèmes de traitement (p. ex. stations de filtration directe ou en ligne, adoucisseurs à chaux). Aucune recommandation fondée sur la santé n'avait été établie à l'époque, du fait qu'il n'existait aucune preuve convaincante et solide indiquant que l'aluminium dans l'eau potable peut être la cause d'effets nocifs chez l'être humain.
Compte tenu des effets neurologiques observés chez les rats, il est proposé dans le présent document de fixer à 2,9 mg/L (2 900 µg/L) la concentration maximale admissible (CMA) d'aluminium total dans l'eau potable. Une VOR de 0,050 mg/L (50 μg/L) est proposée pour l'aluminium total afin d'optimiser le traitement de l'eau et les réseaux de distribution.
Le document fait l'objet d'une consultation publique d'une durée de 60 jours.
Veuillez faire parvenir vos commentaires (avec justification, au besoin) à Santé Canada par courriel :
Au besoin, vous pouvez envoyer vos commentaires par la poste à l'adresse suivante :
Bureau de la qualité de l'eau et de l'air, Santé Canada
269, avenue Laurier Ouest, indice de l'adresse : 4903D
Ottawa (Ontario) K1A 0K9
Les commentaires doivent nous parvenir avant le 30 août 2019. Les commentaires reçus dans le cadre de la consultation seront transmis, avec le nom et l'affiliation de leurs auteurs, aux membres Comité fédéral-provincial-territorial sur l'eau potable (CEP). Les personnes ne souhaitant pas que leur nom et leur affiliation soient communiqués aux membres du CEP doivent joindre à leurs commentaires une déclaration à cet égard.
Il convient de noter que le présent document technique sera révisé après évaluation des commentaires reçus et que, s'il y a lieu, une recommandation pour la qualité de l'eau potable sera formulée. Ce document doit donc être considéré uniquement comme une ébauche aux fins de commentaires.
Recommandation proposée
Une concentration maximale acceptable (CMA) de 2,9 mg/L (2 900 μg/L) est proposée pour l'aluminium total dans l'eau potable, sur la base d'une moyenne courante annuelle par emplacement calculée à l'aide d'échantillons prélevés dans le réseau de distribution chaque trimestre, au minimum.
Une valeur opérationnelle recommandée (VOR) de 0,050 mg/L (50 μg/L) est proposée pour l'aluminium total afin d'optimiser le traitement de l'eau et les réseaux de distribution.
Résumé
Le présent document technique a été préparé en collaboration avec le Comité fédéral-provincial-territorial sur l'eau potable et comprend une évaluation de tous les renseignements disponibles sur l'aluminium.
Exposition
L'aluminium est un métal largement répandu dans la nature. Il peut être présent dans l'eau de sources naturelles ou à la suite d'activités humaines. Ce métal est utilisé à de nombreuses fins : la production de matériaux de construction, de véhicules, d'avions, d'appareils électroniques, de produits pharmaceutiques et de produits de soins personnels, ainsi que comme additifs alimentaires et composants de matériaux d'emballage d'aliments. Des sels d'aluminium sont couramment ajoutés comme coagulants pendant le traitement de l'eau pour éliminer la turbidité, la matière organique et les microorganismes. L'aluminium est également une impureté présente dans d'autres produits chimiques de traitement de l'eau et peut s'infiltrer dans l'eau potable à partir de tuyaux ou de revêtements en mortier de ciment.
La population canadienne est exposée à l'aluminium en raison de sa présence dans l'environnement et dans divers produits et procédés. La principale source d'exposition des Canadiens est la nourriture, suivie par le sol, l'eau potable et l'air, dans cet ordre. Les concentrations d'aluminium dans l'eau varient à travers le Canada; les eaux de surface présentent généralement des concentrations plus élevées que les eaux souterraines. L'aluminium provenant de l'eau potable ne devrait pas être absorbé par contact cutané ni par inhalation.
Effets sur la santé
L'aluminium n'est pas un élément essentiel. Des études chez les humains ont mis en évidence des liens possibles entre l'ingestion d'aluminium et des maladies du système nerveux. Cependant, ces études ont un certain nombre de limitations de conception et ne fournissent pas de preuves solides que l'aluminium peut causer ces maladies. Des études sur les animaux ont toujours révélé des effets neurologiques indésirables par suite d'une ingestion de fortes concentrations d'aluminium, ce qui confirme les effets observés dans les études chez l'humain. La CMA proposée de 2,9 mg/L repose sur les effets neurologiques observés chez le rat.
Considérations opérationnelles et esthétiques
L'aluminium peut agir comme un puits d'accumulation pour d'autres contaminants tels que l'arsenic, le chrome, le manganèse et le nickel; il peut également influer sur les concentrations de plomb et de cuivre. Une VOR de 0,050 mg/L est proposée à la fois pour le point d'entrée et pour le réseau de distribution afin de minimiser la possibilité d'accumulation et de rejet d'aluminium et de contaminants concomitants.
L'aluminium peut recouvrir les conduites principales, les conduites de service et les compteurs d'eau, entraînant des pertes de pression, des dysfonctionnements des compteurs et la présence d'eau turbide/décolorée. Une VOR de 0,050 mg/L est proposée à la fois pour le point d'entrée et le réseau de distribution afin d'éviter également ces problèmes.
Analyse et traitement
Plusieurs méthodes existent pour analyser l'aluminium total dans l'eau potable à des concentrations bien inférieures aux CMA et VOR proposées. Les analyseurs colorimétriques en ligne ou portables sont d'une grande utilité pour obtenir une indication rapide des modifications de concentration d'aluminium. Ces mesures peuvent être utilisées pour effectuer des ajustements rapides du traitement, qui sont essentiels au bon fonctionnement de l'installation. Les services d'eau devraient vérifier auprès de l'autorité responsable en matière d'eau potable dans le secteur de compétence concerné si les résultats de ces modèles peuvent être utilisés pour produire des rapports de conformité.
Les stratégies de traitement de l'eau devraient minimiser la concentration d'aluminium entrant dans le réseau de distribution à partir de la station de traitement. Dans les stations de traitement des eaux utilisant des coagulants à base d'aluminium, le résidu d'aluminium est un paramètre important (comme le pH, la température, la turbidité et d'autres mesures) en vue d'une coagulation optimale. Une maîtrise rigoureuse du pH et un dosage adéquat du coagulant sont nécessaires pour optimiser la coagulation et minimiser les concentrations résiduelles d'aluminium. Il est également important de noter que le sous-dosage de coagulant peut dégrader fortement la capacité d'élimination des agents pathogènes. Les stratégies visant à minimiser les concentrations résiduelles d'aluminium ne doivent pas compromettre l'efficacité d'élimination des agents pathogènes ou des matières organiques naturelles (MON) (c.-à-d. précurseurs des sous-produits de désinfection).
Des mesures devraient également être mises en place pour évaluer la contribution de l'aluminium provenant d'autres produits chimiques de traitement de l'eau.
Concernant la présence naturelle d'aluminium dans les sources d'approvisionnement en eau, la seule technologie de traitement efficace connue est la coagulation, qui n'est généralement pas utilisée dans les petits réseaux ni dans les réseaux privés. Dans les situations où il est nécessaire d'enlever l'aluminium et où la coagulation n'est pas possible, il faut communiquer avec l'autorité compétente responsable de l'eau potable de l'administration concernée pour discuter des options possibles.
Réseau de distribution
Il est recommandé aux services d'eau d'élaborer un plan de gestion du réseau de distribution afin de minimiser l'accumulation et le rejet d'aluminium et de contaminants concomitants. Cela nécessite généralement de minimiser la concentration d'aluminium entrant dans le réseau de distribution et de mettre en œuvre les meilleures pratiques afin de maintenir la stabilité des conditions de qualité chimique et biologique de l'eau dans tout le réseau, ainsi que pour minimiser les perturbations physiques et hydrauliques.
Application de la recommandation
Remarque : Il est conseillé de demander des indications précises concernant la mise en œuvre des recommandations pour l'eau potable auprès des autorités compétentes du territoire visé.
En raison de l'effet du pH, de la température et de la MON sur les concentrations d'aluminium, les tendances saisonnières peuvent être très pertinentes, même pour les réseaux qui n'ajoutent pas de coagulants. Les modifications de traitement et d'autres pratiques opérationnelles peuvent également avoir une incidence sur les concentrations d'aluminium. Ainsi, les services d'eau devraient surveiller attentivement les concentrations d'aluminium total, de la source au réseau de distribution, car ces concentrations peuvent varier. Des plans de surveillance propres à chaque installation devraient être élaborés pour englober toutes les conditions saisonnières de qualité de l'eau aux fins de comparaison avec la VOR proposée de 0,050 mg/L.
On devrait calculer la moyenne annuelle par emplacement courante d'aluminium total dans l'eau potable à partir d'un nombre minimal d'échantillons prélevés à une fréquence trimestrielle, afin d'établir des comparaisons avec la CMA proposée de 2,9 mg/L.
Considérations internationales
D'autres organisations nationales et internationales utilisent des lignes directrices, des normes et des VOR pour l'eau potable. Les valeurs varient en fonction de la date à laquelle remonte l'évaluation sur laquelle elles sont fondées, et en fonction des différences relatives aux politiques et aux démarches appliquées, y compris en ce qui concerne le choix de l'étude principale ou les taux de consommation, les poids corporels et les facteurs d'attribution différents.
L'United States Environmental Protection Agency (U.S. EPA), l'Union européenne et le National Health and Medical Research Council de l'Australie n'ont pas fixé de limites réglementaires fondées sur la santé pour l'aluminium dans l'eau potable. Ces organismes et d'autres organismes internationaux ont plutôt fixé des VOR allant de 0,050 mg/L à 0,20 mg/L, en fonction de considérations esthétiques ou opérationnelles.
Dans son évaluation de l'aluminium dans l'eau potable de 2010, l'Organisation mondiale de la Santé (OMS) a calculé une valeur non réglementaire basée sur la santé de 0,9 mg/L, mais a souligné qu'il était important de ne pas dépasser les niveaux réalisables de 0,1 à 0,2 mg/L. La recommandation proposée du Canada est différente de la valeur basée sur la santé de l'OMS parce que le Canada a pris en compte des avancements dans la science depuis 2010. L'évaluation de l'OMS est basée sur l'apport hebdomadaire tolérable provisoire d'aluminium de 1 mg/kg de poids corporel par jour du Comité mixte FAO/OMS d'experts des additifs alimentaires (JECFA) (JECFA, 2007). Le JECFA a depuis révisé son apport hebdomadaire tolérable provisoire d'aluminium à 2 mg/kg poids corporel par jour (JECFA, 2012), basé sur l'étude principale, Poirier et coll. 2011, qui est utilisé dans la recommandation canadienne.
Table des matières
- Objet de la consultation
- Recommandation proposée
- Résumé
- Exposition
- Effets sur la santé
- Considérations opérationnelles et esthétiques
- Analyse et traitement
- Réseau de distribution
- Application de la recommandation
- Considérations internationales
- 1.0 Examen des aspects liés à l'exposition
- 2.0 Considérations relatives à la santé
- 3.0 Dérivation de la valeur basée sur la santé
- 4.0 Considérations liées à l'analyse et au traitement
- 5.0 Stratégies de contrôle
- 6.0 Considérations internationales
- 7.0 Justification
- 8.0 Références
- Annexe A : Liste d'acronymes
- Annexe B : Répercussions provinciales et territoriales prévues
- Annexe C : Données sur la qualité des eaux au Canada
1.0 Examen des aspects liés à l'exposition
1.1 Sources et utilisations
L'aluminium est le troisième métal en abondance dans la croûte terrestre. L'extraction et l'altération des minéraux entraînent la libération d'aluminium; par conséquent, cet élément se retrouve naturellement dans les sols, les eaux souterraines, les eaux de surface et les produits agricoles tels que les légumes, les céréales et la viande. Le Canada est le troisième producteur mondial d'aluminium. Ce métal est largement utilisé dans les matériaux de construction (p. ex. pour les bâtiments et les infrastructures), les véhicules, les aéronefs, le matériel électronique et les matériaux d'emballage (RNCan, 2018). Des composés à base d'aluminium sont également utilisés par l'industrie pharmaceutique dans les produits de soins personnels, dans les emballages alimentaires et comme additif dans les aliments. De plus, l'aluminium est largement utilisé dans les stations de traitement de l'eau potable, des eaux usées et de l'eau industrielle. Dans le traitement de l'eau potable, les sels d'aluminium sont utilisés pour éliminer la turbidité, les matières organiques et les microorganismes. Selon Statistique Canada (2013), les coagulants à base d'aluminium sont utilisés dans le processus de traitement de 69,2 % des eaux de surface et de 6,7 % des eaux souterraines/ESSIDES (eau souterraine sous l'influence directe d'eau de surface). On a constaté que l'aluminium s'infiltre dans l'eau potable à partir des tuyaux ou des revêtements de mortier de ciment (Leroy et coll., 1996), et qu'il est également présent sous forme d'impureté dans d'autres produits chimiques utilisés dans le traitement de l'eau (p. ex. pour ajuster le pH).
1.2 Identité de la substance
L'aluminium (numéro de registre 7429-90-5 du Chemical Abstracts Service) est un métal ductile ayant un poids moléculaire de 26,98 et une pression de vapeur de 1 mm Hg à 1 284 °C (ATSDR, 2008). Les effets des propriétés chimiques de l'aluminium présent dans les milieux aquatiques sont complexes. La spéciation, la mobilité et le cloisonnement de l'aluminium sont influencés par de nombreuses caractéristiques environnementales, notamment la température, la présence ou le type de divers ligands et le pH (ATSDR, 2008). En raison de sa nature réactive, l'aluminium dissous n'existe pas à l'état élémentaire, mais se lie plutôt à des ligands inorganiques (p. ex. hydroxyde, fluorure, sulfate) ou organiques (p. ex. matière organique naturelle (NOM)) pour former de nombreux types de complexes. À faible pH, le cation complexe d'aluminium hydraté [Al(H2O)6]3+, communément appelé « aluminium libre » et abrégé Al3+, est la forme la plus soluble d'aluminium (Environnement Canada et Santé Canada, 2010). À pH élevé, l'anion complexe (Al(OH)4-) est le plus répandu et est très soluble. (Voir la section 4.2 pour de plus amples renseignements sur les effets du pH.)
1.3 Exposition
Tel qu'indiqué dans un rapport d'évaluation de la liste des substances d'intérêt prioritaire (Environnement Canada et Santé Canada, 2010), la principale source d'exposition des Canadiens à l'aluminium est l'alimentation, suivie par le sol, l'eau potable et l'air, dans cet ordre (tableau 1). L'exposition par l'eau potable constitue moins de 10 % de la dose journalière moyenne d'aluminium dans tous les groupes d'âge (tableau 1).
Tableau 1. Dose journalière moyenne estimée d'aluminium total fondée sur des données canadiennes
Dose journalière moyenne estimée d'aluminium total (μg/kg p.c./jour) |
|||||||
Source |
Nourrissons (0-6 mois) |
Tout-petits (0,5-4 ans) |
Enfants (5-11 ans) |
Adoles-cents (12-19 ans) |
Adultes (20 - 59 ans) |
Personnes âgées |
|
| Allaités (exclusive-ment) | Non allaités | ||||||
| Eau potablea | 0 | 16,75 | 7,09 | 5,5 | 3,17 | 3,32 | 3,49 |
| Aliments et boissons | 12,2 | 85,0 | 268 | 341 | 270 | 143 | 113 |
| Air ambiant | 0,05 |
0,10 | 0,08 | 0,05 | 0,04 | 0,03 | |
| Air intérieur | 0,37 |
0,78 | 0,61 | 0,35 | 0,30 | 0,26 | |
| Sol | 166 |
268 | 87 | 21 | 18 | 17 | |
| TOTAL | 179 | 268 | 544 | 434 | 295 | 165 | 134 |
Remarque : Adapté de Environnement Canada et Santé Canada, 2010
a Selon la concentration moyenne d'aluminium total observée dans les eaux de surface canadiennes et mesurée dans les stations de traitement; estimée à 157 μg/L (voir tableau 2). Cette valeur a été choisie comme estimation prudente de l'exposition, étant donné que la concentration moyenne d'aluminium dans les eaux souterraines était inférieure. Les valeurs par défaut pour le poids corporel et les doses étaient les mêmes que celles utilisées par Environnement Canada et Santé Canada (2010).
Les données provinciales et territoriales (sources municipales et non municipales; tableau 2) de surveillance de l'eau tirées de l'Enquête nationale sur l'eau potable (Santé Canada, 2017) (Annexe C) et fournies par Environnement et Changement climatique Canada (Environnement et Changement climatique Canada, 2017) montrent que la quantité d'aluminium total :
- est décelée dans tous les types d'eaux, mais qu'elle varie d'une région à l'autre du Canada;
- que les concentrations sont généralement plus élevées dans les eaux de surface que dans les eaux souterraines;
- que les concentrations sont plus élevées dans les rivières, probablement en raison de la teneur élevée de matière particulaire totale;
- que les concentrations sont généralement faibles pour l'eau brute, traitée et distribuée, mais les teneurs médianes, moyennes et du 90e percentile d'aluminium total dans les eaux de surface municipales (traitées et distribuées) peuvent dépasser 0,05 mg/L;
- que le 90e percentile des sources d'approvisionnement non municipales (eaux souterraines généralement non traitées) tend à être supérieur à la concentration des eaux souterraines brutes municipales dans le même secteur de compétence;
- que la concentration maximale des sources non municipales et des eaux municipales de surface (traitées et distribuées) peut dépasser la CMA proposée.
Tableau 2. Présence d'aluminium total dans l'eau au Canada (2012-2017)
Administrations (LDM mg/L) |
Type d'eau |
Nombre détectés/ échantillons |
Valeurs supérieures à la LDM (mg/L) |
|||
| Médiane | Moyenne | 90e cen-tile | Max | |||
Terre-Neuve1 |
Municipale : | |||||
| Souterraine - brute | 42/102 | 0,020 | 0,044 | 0,109 | 0,280 | |
| Souterraine - distribution | 629/1 686 | 0,016 | 0,044 | 0,082 | 1,000 | |
| Surface - brute | 600/646 | 0,080 | 0,109 | 0,240 | 0,800 | |
| Surface - distribution | 2 820/3 178 | 0,080 | 0,145 | 0,300 | 6,600 | |
Nouvelle-Écosse2 |
Non municipale : souterraine | 574/574 | 0,005 | 0,039 | 0,057 | 3,400 |
| Municipal : | ||||||
| Souterraine - brute | 77/133 | 0,009 | 0,009 | 0,013 | 0,032 | |
| Souterraine - traitée | 29/50 | 0,009 | 0,016 | 0,020 | 0,089 | |
| Souterraine - distribution | 35/52 | 0,013 | 0,015 | 0,022 | 0,060 | |
| Surface - brute | 88/88 | 0,082 | 0,101 | 0,212 | 0,501 | |
| Surface - traitée | 180/187 | 0,056 | 0,088 | 0,180 | 0,724 | |
| Surface - distribution | 197/204 | 0,025 | 0,081 | 0,112 | 5,700 | |
Nouveau-Brunswick3 (0,001 - 0,025) |
Non municipale : souterraine | 90/443 | 0,003 | 0,027 | 0,061 | 0,580 |
| Municipale : | ||||||
| Souterraine - brute | 289/924 | 0,003 | 0,007 | 0,014 | 0,120 | |
| Souterraine - distribution | 225/550 | 0,011 | 0,015 | 0,022 | 0,270 | |
| Surface - brute | 104/139 | 0,037 | 0,046 | 0,090 | 0,228 | |
| Surface - distribution | 338/391 | 0,020 | 0,029 | 0,061 | 0,300 | |
Québec4 |
Municipale : | |||||
| Souterraine - brute | 77/147 | 0,011 | 0,022 | 0,059 | 0,160 | |
| Souterraine - traitée | 1/2 | 0,037 | 0,037 | 0,037 | 0,037 | |
| Souterraine - distribution | 32/67 | 0,009 | 0,018 | 0,036 | 0,110 | |
| Surface - brute | 6/6 | 0,275 | 0,244 | 0,330 | 0,330 | |
| Surface - traitée | 6/6 | 0,029 | 0,084 | 0,200 | 0,360 | |
Ontario5 (0,001) |
Municipale : | |||||
| Souterraine et surface - traitée | 1 316/1 438 | 0,026 | 0,051 | 0,101 | 1,500 | |
| Souterraine et surface - distribuée | 1 212/1 387 | 0,029 | 0,049 | 0,114 | 1,340 | |
Manitoba6 |
Non municipale : souterraine | 51/144 | 0,004 | 0,021 | 0,017 | 0,266 |
| Municipale : | ||||||
| Souterraine - brute | 309/877 | 0,002 | 0,022 | 0,021 | 2,490 | |
| Souterraine - traitée | 194/606 | 0,005 | 0,016 | 0,006 | 0,381 | |
| Souterraine - distribution | 72/96 | 0,002 | 0,010 | 0,007 | 0,392 | |
| Surface - brute | 392/413 | 0,149 | 0,429 | 0,673 | 32,400 | |
| Surface - traitée | 396/443 | 0,042 | 0,189 | 0,337 | 7,970 | |
| Surface - distribution | 71/72 | 0,022 | 0,152 | 0,284 | 3,900 | |
Saskatchewan7 (0,0005-0,025/ |
Non municipale : souterraine | 1 938/4 128 | 0,003 | 0,046 | 0,031 | 14,000 |
| Municipale : | ||||||
| Souterraine - brute | 216/216 | 0,001 | 0,010 | 0,008 | 0,740 | |
| Souterraine et surface - traitée | 293/293 | 0,011 | 0,106 | 0,272 | 2,030 | |
| Souterraine et surface - distribution | 2 102/2 102 | 0,003 | 0,056 | 0,052 | 1,420 | |
| Surface - brute | 148/148 | 0,040 | 1,746 | 0,210 | 3,173 | |
Alberta8 |
Non municipale : souterraine | 1 355/1 686 | 0,005 | 0,032 | 0,025 | 5,100 |
| Municipale : | ||||||
| Surface - brute | 147/148 | 0,184 | 0,631 | 1,746 | 6,200 | |
| Surface - traitée | 278/286 | 0,062 | 0,074 | 0,130 | 0,301 | |
| Surface - distribution | 462/474 | 0,062 | 0,068 | 0,120 | 0,304 | |
| Colombie Britannique9 (0,005-0,050) | Non municipale : non spécifié | 313/352 | 0,025 | 0,065 | 0,060 | 3,000 |
Yukon10 |
Municipale : | |||||
| Souterraine - brute | 48/219 | 0,005 | 0,009 | 0,012 | 0,061 | |
| Souterraine - traitée | 11/68 | 0,003 | 0,005 | 0,010 | 0,019 | |
| Surface - traitée | 0/10 | S.O. | S.O. | S.O. | S.O. | |
Canadac |
Municipale : | |||||
| Souterraine - traitée | 0,016 | |||||
| Souterraine - distribution | 0,033 | |||||
| Surface - traitée | 0,157 | |||||
| Surface - distribution | 0,123 | |||||
LDM = limite de détection de la méthode
a Les sources d'approvisionnement non municipales ont tendance à être des eaux souterraines non traitées (p. ex. eau souterraine brute); par conséquent, les résultats de qualité de l'eau ne sont pas sous-catégorisés. Certains de ces échantillons ont été prélevés au robinet, mais on ne sait pas si les canalisations des lieux ont été vidangées avant l'échantillonnage et, le cas échéant, pendant combien de temps. Au Manitoba, des échantillons ont été prélevés dans des puits de surveillance des eaux souterraines. En Saskatchewan, ces sources ne sont pas réglementées.
b Au Manitoba, les sources semi-publiques sont comprises dans les données municipales; en Ontario et en Saskatchewan, les résultats de traitement et de distribution n'ont pas été sous-catégorisés par type d'eau.
c Les valeurs canadiennes ont été calculées comme étant la moyenne pondérée des concentrations d'aluminium des provinces/territoires (P/T) ci-dessus [somme de (nombre d'échantillons P/T) × (concentration moyenne d'Al P/T)]/nombre total d'échantillons.
Références :
1 Ministère des Affaires municipales et Environnement de Terre-Neuve-et-Labrador (2017)
2 Nova Scotia Environment (2018)
3 Ministère de l'Environnement et des Gouvernements locaux du Nouveau-Brunswick (2018)
4 Ministère du Développement durable, de l'Environnement et de la Lutte contre les changements climatiques du Québec (2017)
5 Ministère de l'Environnement et de l'Action en matière de changement climatique de l'Ontario (2017)
6 Développement durable Manitoba (2017)
7 Saskatchewan Water Security Agency (2017)
8 Alberta Environment and Parks (2017);
9 British Columbia Ministry of Health (2017)
10 Yukon Health and Social Services (2017)
L'aluminium est naturellement présent dans de nombreux aliments; certaines substances contenant de l'aluminium peuvent également être utilisées comme additifs alimentaires. Les concentrations les plus élevées d'aluminium (>10 µg/g) parmi les échantillons d'aliments composites analysés dans le cadre de l'Étude sur l'alimentation totale des Canadiens, entre 2008 et 2012, ont été observées dans les herbes et épices, la poudre à pâte, divers produits de boulangerie, les produits de poulet transformés et la gomme à mâcher (Santé Canada, 2007). L'analyse de l'aluminium dans les préparations pour nourrissons a révélé la présence de 0,040 à 0,171 µg/g dans les préparations à base de lait et de 0,258-0,476 µg/g dans celles à base de soja (Santé Canada, 2016). Des résultats comparables ont été rapportés dans le projet sur les aliments pour enfants de l'Agence canadienne d'inspection des aliments et dans d'autres enquêtes ciblées (ACIA, 2018).
Les Canadiens sont également exposés à l'aluminium dans des produits de consommation (p. ex. déodorants, crèmes, maquillage et produits pour les cheveux ou les ongles) et des médicaments (p. ex. traitements antiulcéreux, antidiarrhéiques, antisudorifiques pour traiter l'hyperhidrose). Fait notable, l'aluminium est présent dans les antiacides (~300-600 mg d'hydroxyde d'aluminium par comprimé) et représente une source importante d'exposition chez les personnes qui prennent régulièrement des antiacides (ATSDR, 2008).
Les concentrations d'aluminium dans les sols canadiens varient selon le lieu d'échantillonnage; les valeurs moyennes varient de 12 000 mg/kg en Nouvelle-Écosse à 87 633 mg/kg en Colombie-Britannique. La concentration moyenne d'aluminium total dans les sols canadiens, calculée d'après plus de 40 études couvrant 10 provinces, était d'environ 41 000 mg/kg (Environnement Canada et Santé Canada, 2010).
Les concentrations d'aluminium dans l'air ambiant canadien varient égalementLes concentrations vont de la limite de détection (non fournie) à 24,94 μg/m3; la concentration moyenne d'aluminium total dans les PM10 est de 0,17 µg/m3 (Environnement Canada et Santé Canada, 2010). On s'attend à ce que les concentrations d'aluminium dans l'air intérieur soient plus élevées que dans l'air extérieur; toutefois, ces concentrations ne constituent néanmoins pas une grande source d'exposition (Environnement Canada et Santé Canada, 2010).
2.0 Considérations relatives à la santé
2.1 Cinétique
Absorption : L'aluminium ingéré par voie orale est peu absorbé par le tractus gastro-intestinal. Alors que le milieu acide de l'estomac favorise la formation de l'ion aluminium le plus soluble [Al(H2O)6]3+, le pH plus neutre de l'intestin entraîne la formation de complexes insolubles d'hydroxyde d'aluminium, qui sont ensuite généralement excrétés dans les selles. Cependant, de petites quantités d'aluminium qui se sont associées à des molécules organiques dans l'estomac pour former des complexes resteront solubles à un pH plus élevé dans l'intestin grêle (Santé Canada, 1998). L'absorption est généralement accrue lorsque les composés d'aluminium sont plus solubles; cependant, l'absorption de l'aluminium par l'estomac ou les intestins varie et dépend fortement de la présence de constituants chimiques de l'alimentation et des types de complexes que l'aluminium forme avec les ligands alimentaires (Zhou et Yokel, 2005). L'absorption intestinale de l'aluminium peut augmenter en présence d'anions, de carboxylates (y compris le citrate et le lactate), de fluorure et de suppléments de vitamine D. Le citrate (base conjuguée de l'acide citrique) est un des agents de formation de complexes les plus influents dans l'absorption d'aluminium chez les humains. L'apport d'acide citrique peut contribuer à augmenter fortement les concentrations d'aluminium dans le sang et les tissus, sans augmentation de l'apport d'aluminium proprement dit. Inversement, l'absorption d'aluminium peut diminuer en raison de la présence de phosphates, de silicones, de polyphénols et de suppléments d'acide folique (ATSDR, 2008). La biodisponibilité de l'aluminium dans l'eau potable a été mesurée dans des études chez l'humain et chez les animaux. Chez l'humain, l'absorption de l'aluminium contenu dans des complexes de citrate, de chlorure, d'hydroxyde ou de lactate se situe entre 0,01 % et 0,65 %. Chez les animaux de laboratoire, les valeurs signalées varient entre 0,01 % et 5,1 % (Environnement Canada et Santé Canada, 2010). La biodisponibilité de l'aluminium chez les humains et les animaux est estimée avec prudence à 0,3 %, d'après les études sur les humains menées par Stauber et coll. (1999) et une revue critique des données chez les animaux réalisée par Krewski et coll. (2007).
Distribution : L'aluminium se lie principalement à la transferrine; il est absorbé lentement par les tissus et les organes et s'accumule essentiellement dans les os. Dans une moindre mesure, l'aluminium peut s'accumuler dans le cerveau en traversant soit la barrière hématoencéphalique, soit le plexus choroïde dans le liquide céphalorachidien des ventricules cérébraux. L'aluminium est également décelé dans les poumons, la peau, le tractus gastro-intestinal inférieur, les nœuds lymphatiques, les surrénales, les glandes parathyroïdes et la plupart des organes de tissus mous (AESA, 2008; Environnement Canada et Santé Canada, 2010). L'aluminium peut également se trouver dans le placenta, le fœtus et le lait maternel (ATSDR, 2008). La répartition de l'aluminium peut être influencée par d'autres métaux, notamment le fer (en corrélation négative avec l'accumulation d'aluminium dans les tissus), le calcium et le magnésium (une carence peut contribuer à l'accumulation d'aluminium dans le cerveau et les os) (ASEA, 2008).
Métabolisme : La forme libre de l'aluminium (Al3+) se lie facilement à de nombreuses substances; par conséquent, c'est l'affinité avec le ligand et le sort métabolique du complexe qui détermine le métabolisme de l'aluminium. L'aluminium peut former des complexes de faible poids moléculaire en se combinant à des acides organiques, des acides aminés, des nucléotides, des phosphates et des glucides assez stables. L'aluminium peut également former des complexes macromoléculaires stables en combinaison avec des protéines, des polynucléotides et des glycosaminoglycanes. Certains complexes sont si stables que le cation aluminium ne peut être échangé contre un autre cation. Comme l'aluminium a une grande affinité avec ces ligands organiques, une grande partie de l'aluminium présent dans l'organisme existe sous forme de complexes macromoléculaires (ATSDR, 2008).
Élimination : Chez les humains, plus de 95 % de l'aluminium mobile est éliminé par les reins (Krewski et coll., 2007). Les personnes dont la fonction rénale est affaiblie présentent donc un risque accru de toxicité liée à l'aluminium (Willhite et coll., 2014). La majeure partie de la portion restante est éliminée par excrétion biliaire dans les selles. Dans une moindre mesure, l'aluminium peut également être évacué avec la sueur, la salive et le liquide séminal (Krewski et coll., 2007). La demi-vie d'élimination de l'aluminium de tout l'organisme est très variable; elle s'étend de quelques heures à plusieurs années (Priest et coll., 1995; Talbot et coll., 1995; Priest, 2004). Le taux d'élimination est influencé par un certain nombre de facteurs, dont la présence de complexes chimiques dans le sang (p. ex. les complexes de citrate d'aluminium sont plus facilement éliminés que l'aluminium lié à la transferrine) (ATSDR, 2008). De plus, une élimination lente et une exposition accrue avec l'âge contribuent à l'accumulation d'aluminium dans l'organisme (NSCFS, 2013). Dans les études sur des animaux, on a observé que chez le rat l'aluminium était éliminé plus rapidement dans les tissus bien irrigués (comme les reins et les poumons) que dans les tissus peu irrigués (comme les os et la rate), la demi-vie allant de 2,3 à 113 jours (Environnement Canada et Santé Canada, 2010). Cependant, l'aluminium avait un taux d'élimination plus lent à partir du cerveau, bien qu'il s'agisse d'un organe bien irrigué, la demi-vie s'étendant de 13 à 1 635 jours (Krewski et coll., 2007). Les durées de rétention de l'aluminium semblent être plus brèves chez les rongeurs que chez l'homme, bien qu'on ne dispose pas de données découlant de la mise à l'échelle allométrique (AESA, 2008).
Modélisation pharmacocinétique physiologique : Aucun modèle applicable à l'évaluation actuelle des risques n'a été recensé.
2.2 Effets sur la santé
La base de données sur la toxicité orale de l'aluminium est vaste et couvre de nombreux paramètres (p. ex. effets sur les os, les reins, le système nerveux et le système immunitaire) et divers types d'exposition chez les animaux et les humains (voir Krewski et coll. (2007), ATSDR (2008) et Willhite (2014) pour un examen plus approfondi). La documentation porte toutefois en priorité sur la neurotoxicité et la toxicité pour la reproduction et le développement; l'intérêt centré sur ces paramètres est probablement attribuable aux résultats des études de cas chez l'humain (c.-à-d. encéphalopathie chez les patients ayant des troubles rénaux exposés à l'aluminium dans des liants phosphate d'aluminium et dialysat; déficience cognitive des prématurés exposés à l'aluminium en solution nutritionnelle parentérique). Une évaluation de l'ensemble de la base de données indique clairement que le système nerveux est la cible la plus sensible à la toxicité de l'aluminium (ATSDR, 2008). Les autres examens de la documentation appuient également cette conclusion (ASEA, 2008; Environnement Canada et Santé Canada, 2010; JECFA, 2012). Par conséquent, les études portant sur les paramètres neurologiques sont abordées dans les sections suivantes du présent document. En outre, les auteurs s'intéressent en particulier aux études orales, qui sont les plus pertinentes pour l'évaluation des risques liés à l'eau potable. La revue sur l'aluminium effectuée précédemment par Environnement Canada et Santé Canada (2010) couvre la documentation scientifique jusqu'en 2008. Toutes les données antérieures sont prises en compte dans l'évaluation actuelle de la présence d'aluminium dans l'eau potable; toutefois, les données présentées dans le présent document portent sur les données publiées entre 2009 et 2017.
2.3 Effets chez les humains
Malgré l'abondance d'aluminium dans l'environnement, il est généralement admis que cet élément n'est pas nécessaire aux systèmes biologiques et ne contribue à aucun processus biologique essentiel (Exley, 2013). En ce qui concerne les expositions aiguës, on a signalé des cas de nausées, de vomissements, de diarrhées, d'aphtes, d'ulcères cutanés, d'éruptions cutanées et de douleur arthritique de courte durée chez 20 000 personnes, au plus, ayant été exposées à des concentrations d'aluminium de 500 à 3 000 fois la VOR établie par l'OMS (0,200 mg/L) lors d'une contamination accidentelle d'approvisionnements d'eau à Camelford (Lowermoor Incident Health Advisory Group, Royaume-Uni, 1989). Après cette exposition aiguë, plusieurs études ont été menées, mais aucune n'a permis d'établir de façon concluante les effets à long terme (McMillan et coll., 1993a, 1993b; Altmann et coll., 1999; Exley, 2006; UK Committee on Toxicology, 2013).
En ce qui concerne les expositions à plus long terme, un nombre limité d'études ont porté sur les effets de l'aluminium sur des populations saines (voir les études de Krewski et coll. (2007), ATSDR (2008), et d'Environnement Canada et de Santé Canada (2010)). Plusieurs études transversales et écologiques publiées après 2009 ont porté sur les associations entre l'aluminium et les effets sur les os (Dahl et coll., 2014; Callan et coll., 2015), les reins (Callan et coll., 2015; Panhwar et coll., 2016), la reproduction et le développement (Huang et coll., 2011; Giaccio et coll., 2012; Karakis et coll., 2014), la composition corporelle (Skalnaya et coll., 2014; Cetin et coll., 2017) et d'autres paramètres chez l'humain (Lv et coll., 2011; Lindquist et coll., 2011; Lind et coll., 2012; Guo et coll., 2013; Vandenplas et coll., 2014).
Il existe une solide documentation sur la neurotoxicité de l'aluminium dans les études chez les humains; cependant, bon nombre de ces études se rapportaient à des cas de traitement médical de maladies précises (p. ex. patients atteints d'insuffisance rénale). Le lien entre l'exposition à l'aluminium et les critères d'effet neurotoxique chez des personnes par ailleurs en bonne santé est moins concluant; un tel lien, particulièrement dans le cas de la maladie d'Alzheimer (MA), fait l'objet de nombreuses recherches et débats (Lidsky, 2014; Walton, 2014). Les études examinant le lien entre l'aluminium et la MA ont porté sur un certain nombre de points, notamment les concentrations d'aluminium dans l'organisme en rapport avec la MA. Par le passé, les résultats de ces études avaient tendance à être mixtes : des liens positifs ont été notés dans certaines études, mais pas dans d'autres, et cela demeure vrai dans les études plus récentes (Baum et coll., 2010; Akatsu et coll., 2011; Rusina et coll., 2011; Bhattacharjee et coll., 2013; Virk et Eslick, 2015; Mirza et coll., 2017; Xu et coll., 2018). D'autres études portant sur la concentration d'aluminium dans le cerveau en relation avec la présence de plaques bêta-amyloïdes et d'enchevêtrements neurofibrillaires (caractéristiques primaires de la pathogenèse de la MA) ont également donné des résultats mitigés (Strozyk et coll., 2009; Walton, 2010; Exley et coll., 2012).
D'autres études récentes ont porté sur les liens entre la présence d'aluminium et l'apparition de diverses maladies ou troubles neurologiques autres que la MA, dont la sclérose latérale amyotrophique (Garzillo et coll., 2014), la sclérose en plaques (Arain et coll., 2015; Tamburo et coll., 2015), le trouble du déficit de l'attention avec hyperactivité (Nicolescu et coll., 2010), les troubles du spectre autistique (Albizzati et coll., 2012), les difficultés d'apprentissage (do Nascimento et coll., 2014) et la dysfonction cognitive (Bakar et coll., 2010). La plupart de ces études n'ont pas trouvé de lien positif significatif entre les concentrations d'aluminium dans l'organisme et le paramètre neurologique correspondant. Malheureusement, bon nombre de ces études étaient de faible portée, ne tenaient pas compte des facteurs de confusion et ne comportaient pas de populations témoins adéquates.
Une revue de documentation a mis en évidence plusieurs études épidémiologiques et examiné le lien entre l'exposition à l'aluminium dans l'eau potable et le développement de la MA et d'autres troubles neurodégénératifs (JECFA, 2012). Une vaste étude prospective menée par Rondeau et coll. (2009) a révélé un lien significatif entre les fortes expositions à l'aluminium dans l'eau potable (>0,1 mg/j) et les risques de déclin cognitif, de démence et de MA. Cependant, cette étude était de faible portée; 13 sujets (6 cas) seulement avaient été exposés à ≥ 0,1 mg/jour. De plus, elle manquait d'information sur l'exposition à l'aluminium par l'alimentation, qui était considérée comme la cause de 95 % de l'exposition orale totale. Une méta-analyse récente d'études de cohortes et d'études cas-témoins (y compris l'étude de Rondeau et coll., 2009) a révélé que l'exposition chronique à l'aluminium menait à un risque accru de MA de l'ordre de 71 % (Wang et coll., 2016). Il est à noter que seulement huit études ont été prises en compte et que la moitié de ces études ont évalué l'exposition professionnelle plutôt que l'exposition à l'eau potable.
Dans l'ensemble, la base de données épidémiologiques ne fournit que des indications incertaines de lien entre l'exposition à l'aluminium et les maladies neurologiques, dont la MA. Bien que des examens récents et des évaluations internationales concluent invariablement à un manque de données probantes pour établir un lien de causalité entre l'exposition à l'aluminium et la MA, on s'entend également pour dire que cette hypothèse ne devrait pas être écartée (ATSDR, 2008; EFSA, 2008; Environnement Canada et Santé Canada, 2010; JECFA, 2012; Willhite et coll., 2014). En plus de l'absence d'un point de départ (PDD) clair nécessaire pour l'analyse dose-réponse, les limites des études épidémiologiques comprennent le manque de données sur l'exposition individuelle, la faible taille des échantillons, la mauvaise détermination de la maladie et le manque de contrôle des facteurs confusionnels. Ces limites empêchent d'utiliser les résultats des études dans une évaluation quantitative des risques. Toutefois, ces résultats peuvent être utilisés qualitativement pour appuyer le choix du principal paramètre utilisé pour effectuer l'évaluation quantitative chez les animaux.
2.4 Effets chez les animaux
Il est bien connu que l'exposition à l'aluminium provoque un certain nombre d'effets sur la santé dans les modèles animaux. Des revues de ces études sont publiées dans Krewski et coll. (2007), ATSDR (2008) et Willhite (2014). L'exposition orale aiguë de rats et de souris à divers composés d'aluminium a entraîné des niveaux DL50 de 222 à 980 mg Al/kg (Ondreicka et coll., 1966 Yokel et McNamara, 1985; Llobet et coll., 1987; Vucetic-Arsic et coll., 2013; Yu et coll., 2016). Dans d'autres études, publiées après 2009, on a rapporté des effets dans les os à des doses de AlCl3 >100 mg/L (Li et coll., 2011a, 2011b, 2015; Sun et coll., 2015, 2016, 2017), dans le foie à des doses de AlCl3 >34 mg/kg p.c. par jour (Turkez et coll., 2010; Bhasin et coll., 2012; Zhu et coll., 2013; Abdel Moneim et coll., 2013; Belaid-Nouira et coll., 2013b; She et coll., 2015; Ghorbel et coll., 2016a) et dans les reins à des doses de AlCl3 > 34 mg/kg p.c. par jour (Abdel Moneim et coll., 2013; Belaid-Nouira et coll., 2013a; Wasana et coll., 2015; Liu et coll., 2016; Ghorbel et coll., 2016b).
La grande majorité des études sur les animaux ont porté sur la possibilité que l'aluminium ait des effets neurotoxiques, neurocomportementaux, ainsi que des effets sur la reproduction et le développement (y compris la toxicité pour le développement neurologique). Bon nombre de ces expériences visaient à étudier le rôle de l'aluminium dans le développement des maladies neurodégénératives (y compris les études mécanistes), les marqueurs périphériques de la neurotoxicité de l'aluminium et les propriétés protectrices de divers agents contre la toxicité de l'aluminium. Un résumé des récentes études (publiées après 2009) les plus pertinentes pour la présente évaluation de l'aluminium est fourni au tableau 3. Ce tableau inclut des études d'une durée d'exposition supérieure à 30 jours dans lesquelles l'aluminium a été administré par l'eau potable. Les études portant sur l'exposition par gavage ou par voie alimentaire ont été incluses uniquement si elles portaient sur des doses multiples. Dans le tableau 3, ainsi que dans l'ensemble du présent document, lorsque des données suffisantes ont été fournies dans le cadre de l'étude, les doses du composé de l'aluminium ont également été exprimées en mg d'aluminium, afin de faciliter les comparaisons entre études. Il convient de noter que, dans de nombreuses études, il n'était pas clair si la dose déclarée reflétait l'ion aluminium ou le composé de l'aluminium (p. ex. AlCl3-6H2O). Par conséquent, la dose telle que fournie par les auteurs de l'étude est indiquée dans le tableau, sauf indication contraire.
Neurotoxicité : Les paramètres pris en compte dans les études de neurotoxicité énumérées au tableau 3 comprennent les effets histopathologiques (dégénérescence neuronale, vacuolisation autour du neurone, congestion des vaisseaux sanguins) et les effets biochimiques (p. ex. réactions de stress oxydatif, déséquilibres des ions métalliques, fonction altérée des neurotransmetteurs). Dans ces études, des rats, des souris et des lapins ont été exposés à l'aluminium pendant des périodes de 30 jours à 18 mois. Les composés d'aluminium étudiés comprenaient le chlorure d'aluminium, le sulfate d'aluminium et le maltolate d'aluminium. La plupart des études utilisaient des doses d'aluminium significativement supérieures à celles d'une exposition humaine dans des conditions normales. La dose la plus faible à laquelle des effets neurotoxiques indésirables ont été observés était de 10 mg/kg p.c. par jour d'AlCl3 (≈2 mg Al/kg p.c. par jour) (Rui et Yongjian, 2010). On n'a trouvé aucune donnée sur la réversibilité des effets neurotoxiques lors de la cessation de l'exposition.
Neuro-comportemental : Les critères d'évaluation pris en compte dans les études neurocomportementales comprennent les modifications des réflexes, de l'activité motrice, de l'apprentissage, de la mémoire et des paramètres sensoriels. Au cours de ces études, des rats et des souris ont été exposés à du chlorure d'aluminium pendant des périodes de 42 jours à 14 mois. Le traitement avec 100 mg/kg p.c. de chlorure d'aluminium par jour pendant 6 semaines (42 jours) est un modèle bien connu pour induire la démence (perte de mémoire spatiale) chez les animaux. La dose la plus faible à laquelle des effets neurocomportementaux nocifs ont été observés (c.-à-d. la LOAEL, ou dose minimale avec effet nocif observé) est de 1,5 mg Al/kg p.c. par jour, ce qui est considéré équivalent aux niveaux d'exposition à l'aluminium par voie alimentaire chez les humains (Martinez et coll., 2017a).
Toxicité pour la reproduction/le développement (y compris toxicité neurodéveloppementale) : Dans les études sur la reproduction et le développement présentées au tableau 3, des rats, des souris et des cochons d'Inde ont été exposés à diverses concentrations de chlorure d'aluminium, de citrate d'aluminium, de sulfate d'aluminium et de sulfate d'aluminium ammonium. Ces études montrent que l'aluminium peut affecter les paramètres de reproduction, y compris les taux d'hormones de reproduction, la numération des spermatozoïdes, la motilité, la morphologie des spermatozoïdes et l'histologie du testicule. De plus, l'exposition à l'aluminium pendant la gestation ou l'allaitement peut avoir des effets sur le développement, notamment une diminution du poids des petits (souvent en présence d'effets maternels), un retard de maturation, une altération du comportement neurologique et des modifications de la biochimie du cerveau. Les doses les plus faibles auxquelles aucun effet indésirable n'a été observé sont de 8 à 14 mg Al/kg p.c. par jour de sulfate d'aluminium (Hirata-Koizumi, 2011a) et de 5 à 9 mg Al/kg p.c. par jour de sulfate d'aluminium et d'ammonium (Hirata-Koizumi, 2011b). Ces doses sans effet nocif observé (NOAEL) étaient fondées sur une diminution du gain pondéral et un retard léger, mais significatif de l'ouverture vaginale à la dose la plus élevée dans les deux études. Malheureusement, l'interprétation des résultats de l'étude a été faussée par les réductions de la consommation d'aliments et de liquides liées au traitement (probablement en raison du goût astringent et de la palatabilité réduite de l'eau traitée à l'aluminium). Les auteurs ont déclaré qu'ils ne pouvaient pas dissocier les effets de la diminution de la consommation d'eau des effets associés au traitement à l'aluminium. De plus, comme d'autres événements hormono-dépendants, p. ex. ceux qui régissent le cycle œstral et la distance anogénitale postnatale, n'ont pas été touchés chez les groupes traités à l'aluminium, les auteurs ont indiqué qu'il était peu probable que l'aluminium ait un net impact sur la transmission des messages hormonaux pendant le développement. Par conséquent, si ces résultats n'ont pas été pris en compte, la prochaine NOAEL est de 30 mg Al/kg p.c. par jour de citrate d'aluminium (Poirier et coll., 2011). De plus, la LOAEL relative aux effets sur la reproduction est de 1,5 mg Al/kg p.c. par jour (Martinez et coll., 2017b).
Tableau 3 : Résumé des études pertinentes sur la neurotoxicité, le comportement neurologique et la toxicité pour la reproduction et le développement publiées entre 2009 et 2017, dans lesquelles des animaux ont été exposés à l'aluminium principalement par l'eau potableb pendant ≥ 30 jours
NOAEL/ LOAEL (mg Al/ kg-jour)a |
Espèce, sexe, nombre | Durée de l'exposition | Composé et dose(s)b | Effet(s) critique(s) | Principales force et faiblessec |
Réf. |
| N/2 | Souris, ICR, (15/groupe) | 100 jours | AlCl3; 0, 10, 50, 300 mg/kg p.c. par jour dans l'alimentation | Neurotoxicité : Augmentation de la peroxydation des lipides (MDA); diminution de la SOD; augmentation des dommages à l'ADN (test des comètes); augmentation des dommages oxydatifs de l'ADN mitochondrial (8-OHdG) | Critères limités | (Rui et Yongjian, 2010) |
| N/10 | Souris, Balb-c, M (10/groupe) | 5 semaines | AlCl3; 0, 50 mg/kg p.c. par jour |
Neurotoxicité : Augmentation de la peroxydation lipidique (MDA); diminution de l'activité antioxydante (GSH); diminution de l'activité de l'AChE et de la butyrylcholinestérase; activation de la monoamine-oxydase du cerveau (MAO-A et MAO-B) mais inhibition du MAO-B cérébelleux | Dose unique | (Linardaki et coll., 2013) |
| N/20 | Rats, Wistar, M (10/groupe) | 6 semaines | AlCl3; 0, 100 mg/kg p.c. par jour |
Neurotoxicité : Augmentation de l'AchE cérébral; diminution de l'acétylcholine, de la dopamine, de la noradrénaline, de l'adrénaline et de la SOD; augmentation de l'oxyde nitrique et du H2O2, du cortisol et des hormones corticotropes; formation de plaques amyloïdes et nécrose des neurones | Dose forte unique | (ElBaz et coll., 2017) |
| N/20 | Rats, Sprague-Dawley, M (6-8/groupe) |
8 semaines | AlCl3; 0, 100 mg/kg p.c. par jour |
Neurotoxicité : Diminution des neurotransmetteurs, AchE; augmentation de la L-citrulline, de l'oxyde nitrique et de la monoamine-oxydase; augmentation de la tau, de la protéine précurseur amyloïde, de la protéine acide fibrillaire gliale, de l'ubiquitine, de α-synuclein et Hsp 70; modifications dans la neurohistoarchitecture (perte des cellules de Purkinje et pyramidales) | Dose forte unique | (Singla et Dhawan, 2017) |
| 100/N | Souris, Tg2576 et Tg2576 /tau, F (6/groupe) |
4 ou 10 mois | AlCl3; 0, 100 mg/kg p.c. par jour (exprimé en Al) |
Neurotoxicité : La dose à long terme d'Al n'a pas accéléré l'accumulation de Aβ chez les souris Tg2576 ni l'accumulation de Aβ et de tau chez les souris Tg2576/tau. | Dose forte unique | (Akiyama et coll., 2011) |
| N/101 | Rats, Wistar, M | 30 jours | AlCl3; 0, 500 mg/kg p.c. par jour |
Neurotoxicité : Réduction des taux de catalase et de GSH; légères modifications dégénératives du cortex préfrontal; aucun signe de dépôts amyloïdes. | Dose forte unique | (Akinola et coll., 2015) |
| N/? | Rats, Wistar, F (10/groupe) | 5 mois | AlCl3; 0, 500 mg/kg p.c. par jour, i.g., pendant un mois, puis 1 600 ppm dans de l'eau potable pendant 4 mois | Neurotoxicité : Augmentation de la peroxydation des lipides dans le cerveau postérieur; modification du métabolisme des lipides | Dose forte unique | (Belaid-Nouira et coll., 2012) |
| N/? | Rats, Wistar, F (10/groupe) | 5 mois | AlCl3; 0, 500 mg/kg p.c. par jour, i.g., pendant un mois, puis 1 600 ppm dans de l'eau potable pendant 4 mois | Neurotoxicité : Production réduite d'interleukine-6 (marqueur de l'inflammation) dans le cerveau postérieur; immunoréactivité réduite au GFAP (marqueur de l'activation des astroglies) dans l'hippocampe et le cortex cérébral; nombre réduit de cellules GFAP positives | Dose forte unique | (Belaid-Nouira et coll., 2013c) |
| N/? | Rats, Wistar, M (5/groupe) | 6, 12 ou 18 mois | AlCl3; 0,18, 0,72, 3,6 g/L | Neurotoxicité : L'accumulation d'aluminium dans le cerveau variait en fonction des doses et de la durée d'exposition. Altérations histopathologiques dans le gyrus denté : effet destructeur sur la couche sous-granulaire et la couche granulaire | Aucune donnée sur la consommation d'eau pour calculer les doses | (Hichem et coll., 2014) |
| N/35 | Rats, Sprague-Dawley, M (10/groupe) | 12 semaines | AlCl3; 0, 2 000 mg/L | Neurotoxicité : Augmentation de Aβ dans l'hippocampe et le cortex cérébral; indices histologiques de neurones rétrécis et enflés; densité réduite des neurones normaux | Dose unique | (Zhang et coll., 2013a) |
| N/71 | Rats, Wistar (10/groupe) | 3 mois | AlCl3; 0, 0,2 %, 0,4 %, 0,6 % | Neurotoxicité : Diminution de l'activité de la protéine kinase C et de la protéine kinase activée par les mitogènes; expression réduite des kinases régulées par le signal extracellulaire (ERK1/2) et de la protéine kinase II dépendante de la calmoduline Ca2+ (CaMKII) dans l'hippocampe; atténuation de l'amplitude des pics de population quant à l'amplitude de potentialisation à long terme (indicateur de plasticité synaptique) de la région hippocampique CA1 | Doses quotidiennes réelles d'Al non rapportées | (Wang et coll., 2010) |
| N/72 | Rats, Wistar (20/groupe) | 3 mois | AlCl3; 0, 0,2 %, 0,4 %, 0,6 % | Neurotoxicité : Impact sur le mécanisme de signal Ras/ERK : augmentation de l'expression de Ras par les protéines et l'ARNm; diminution de l'expression de Raf1 et ERK2 dans les hippocampes | Doses quotidiennes réelles d'Al non rapportées | (Cui et coll., 2012) |
| N/? | Rats, Wistar, M (5/groupe) | 30 jours | AlCl3; 0, 10, 100 ppm | Neurotoxicité : Induction du stress oxydatif (augmentation de l'MDA, diminution des niveaux de SOD); activation de l'astrogliose, de la microglie et de l'infiltration des cellules B dans le cortex préfrontal; certaines preuves de la relation dose-réaction | Étude à court terme | (Akinrinade et coll., 2015) |
| N/N | Lapins, Nouvelle-Zélande, M (5/groupe) | 10 semaines | Sulfate d'Al; 0, 0,36 ppm (exprimé en Al) | Neurotoxicité : Aucune augmentation du nombre de neurones réactifs bêta-amyloïdes, mais augmentation du nombre de neurones immunopositifs ABCA1, chez des lapins traités à l'Al ayant reçu une alimentation à 2 % de cholestérol | Dose unique | (Schreurs et Sparks, 2016) |
| N/? | Souris, T 44 tau Tg et de type sauvage (5-13/groupe) | 3, 6, 9 et 12 mois | Maltolate d'aluminium; 0, 2 mM |
Neurotoxicité : Agrégation tau accélérée, apoptose et dysfonctionnement neurologique dans un modèle murin avec accumulation tau progressive lente | Dose unique | (Oshima et coll., 2013) |
| N/1,5 | Rats, Wistar, M (6/groupe) | 60 jours, 42 jours | AlCl3· 6H2O 1,5, 8,3, 100 mg/kg p.c. par jour (exprimé en Al) | Comportement neurologique : Mémoire de reconnaissance altérée (test de mémoire de reconnaissance d'objet) | Étude bien menée | (Martinez et coll., 2017a) |
| N/10 | Souris, Balb-c, M (10/groupe) | 5 semaines | AlCl3; 0, 50 mg/kg p.c. par jour |
Comportement neurologique : Troubles de la mémoire à long terme (tâche d'évitement passif) | Dose unique | (Linardaki et coll., 2013) |
| N/50 | Souris, Balb-c, M (5-9/groupe) | 42 jours | AlCl3; 0, 250 mg/kg p.c. par jour |
Comportement neurologique : Déficits d'apprentissage et anxiété accrue (extinction de la peur et tests en espace ouvert) | Dose forte unique | (Farhat et coll., 2017a) |
| N/50 | Souris, Balb-c, M (5-9/groupe) | 42 jours | AlCl3; 0, 250 mg/kg p.c. par jour |
Comportement neurologique : Mémoire de reconnaissance altérée (test de reconnaissance d'objets nouveaux), sociabilité réduite (test de préférence de nouveauté sociale) | Dose forte unique | (Farhat et coll., 2017b) |
| N/71 | Rats, Wistar (10/groupe) | 3 mois | AlCl3; 0, 0,2 %, 0,4 %, 0,6 % | Comportement neurologique : Troubles de la mémoire (test dégressif) | Doses quotidiennes réelles d'Al non rapportées | (Wang et coll., 2010) |
| N/35 | Rats, Sprague-Dawley, M (10/groupe) | 12 semaines | AlCl3; 0, 2 000 mg/L | Comportement neurologique : Troubles de l'apprentissage spatial et de la mémoire (labyrinthe aquatique Morris) | Dose unique | (Zhang et coll., 2013a) |
| N/13 | Rats, Wistar, M (10/groupe) | 120 jours | AlCl3; 0, 64,18, 128,36, 256,72 mg/kg p.c. par jour |
Reproduction : Suppression de la testostérone et de l'hormone lutéinisante; diminution de l'expression de la protéine du récepteur androgénique et de l'ARNm | Ne tenait pas compte de l'aluminium dans l'alimentation ni de l'eau consommée | (Sun et coll., 2011) |
| N/13 | Rats, Wistar, F (10/groupe) | 120 jours | AlCl3; 0, 64,18, 128,36 et 256,72 mg/kg p.c. par jour | Reproduction : Diminution des taux d'œstrogènes, de progestatifs, d'hormone folliculostimulante et d'hormone lutéinisante dans le sérum | Ne tenait pas compte de l'aluminium dans l'alimentation ni de l'eau consommée | (Wang et coll., 2012) |
| N/13 | Rats, Wistar, F (20/groupe) | 120 jours | AlCl3; 0, 64, 128, 256 mg/kg p.c. par jour |
Reproduction : Structure ovarienne endommagée; altération des taux de fer, de zinc et de cuivre; diminution de l'activité de la Na(+)-K(+)-ATPase, de la Mg(2+)-ATPase et de la Ca(2+)-ATPase dans l'ovaire; diminution de l'hormone folliculostimulante et expression des protéines de l'hormone lutéinisante | Ne tenait pas compte de l'Al dans l'alimentation | (Fu et coll., 2014) |
| N/13 | Rats, Wistar, M (10) | 120 jours | AlCl3; 0, 64,18, 128,36, 256,72 mg/kg p.c. par jour |
Reproduction : Diminution du nombre de spermatozoïdes; augmentation des malformations de spermatozoïdes; diminution des enzymes testiculaires; altération des taux de fer, de zinc et de cuivre | Ne tenait pas compte de l'aluminium dans l'alimentation ni de l'eau consommée | (Zhu et coll., 2014) |
| N/? | Rats, diabétiques et non-diabétiques, Wistar, M (10/groupe) |
30 jours | AlCl3; 0, 250 ppm |
Reproduction : Diminution du nombre et de la motilité des spermatozoïdes; diminution de l'hormone folliculo-stimulante; élévation des taux d'œstradiol | Dose unique | (Akinola et coll., 2016) |
| N/? | Cochons d'Inde, M (13/groupe) | 13 semaines | AlCl3; 0, 300 mg/L |
Reproduction : Diminution du nombre de spermatozoïdes; augmentation des malformations de spermatozoïdes; diminution de la testostérone; expression réduite des gènes et des protéines StAR et P450scc | Dose unique | (Dong et coll., 2016) |
| N/1,5 | Rats, Wistar, M (6/groupe) | 60 jours, 42 jours |
AlCl3·6H2O; 1,5, 8,3, 100 mg/kg p.c. par jour | Reproduction : Diminution du nombre de spermatozoïdes, de la production quotidienne de spermatozoïdes, de motilité des spermatozoïdes et du nombre de spermatozoïdes morphologiquement normaux; histologie altérée des testicules; stress oxydatif accru dans les organes reproducteurs; inflammation des testicules | Étude bien menée | (Martínez et coll., 2017b) |
| N/? | Rats, Wistar, M (7-10/ groupe) | 6 mois (3 générations) | Sulfate d'aluminium; 0, 200, 400, 1000 ppb | Reproduction : Baisse du taux de testostérone; diminution du nombre de spermatozoïdes; pourcentage accru de spermatozoïdes immobiles et anormaux; diminution du poids des testicules; altérations de l'histoarchitecture des testicules | Peu de détails de l'étude rapportés | (Muselin et coll., 2016) |
| 8-14/31-56 | Rats, Sprague-Dawley, M et F (24/sexe/groupe) | 2 générations | Sulfate d'aluminium; 0, 120, 600, 3 000 ppm | Reproduction/Développement : Aucun effet indésirable sur les paramètres de reproduction et de fertilité; retard de l'ouverture vaginale | Effets confondants de la diminution de la consommation d'eau | (Hirata-Koizumi et coll., 2011a) |
| 5-9/36-61 | Rats, Sprague-Dawley, M et F (24/sexe/groupe) | 2 générations | Sulfate d'aluminium; 0, 50, 500, 5 000 ppm | Reproduction/Développement : Aucun effet indésirable sur les paramètres de reproduction et de fertilité; retard de l'ouverture vaginale | Effets confondants de la diminution de la consommation d'eau | (Hirata-Koizumi et coll., 2011b) |
| N/N | Rats, Wistar, M et F (10/sexe/groupe) | M : 28 jours; F : 37-53 jours | AlCl3; 0, 3,6, 18, 90 mg/kg p.c. par jour (exprimé en Al); par gavage |
Reproduction/Développement : Aucun effet sur la reproduction, l'accouplement ou le développement postnatal précoce | Étude BPL | (Beekhuijzen, 2007, tel que publié dans le JECFA, 2012) |
| 30/100 | Rats, Sprague-Dawley, M et F (80/sexe/groupe) | Gestation, allaitement, jusqu'à l'âge d'un an | Citrate d'Al; 0, 30, 100, 300 mg/kg p.c. par jour (exprimé en Al) | Développement : Déficits de la force de préhension des membres antérieurs et postérieurs et affaissement du pied | Étude BPL | (Poirier et coll., 2011) |
| N/? | Rats, Wistar, M et F (5-10/groupe) | Gestation, allaitement, puis exposition directe pendant 4 mois | AlCl3; 0, 0,3 % | Développement : Diminution de l'activité locomotrice; augmentation de l'anxiété; modifications du système glial; augmentation du marquage des protéines acides fibrillaires gliales et du nombre d'astrocytes dans le cerveau; diminution de l'activité locomotrice; effets sur les neurones dopaminergiques | Dose unique | (Erazi et coll., 2010; Erazi et coll., 2011) |
| N/60 | Souris, Swiss Webster, M et F | Gestation et lactation (JPN 15) | AlCl3; 0, 300, 600 mg/kg p.c. par jour | Développement : Pré-sevrage : Diminution proportionnelle à la dose du gain de poids corporel et retards dans l'ouverture des yeux et l'apparition du duvet de poils; suppression proportionnelle à la dose des réflexes de redressement, de rotation et d'évitement de la falaise Post-sevrage : Déficits proportionnels à la dose de l'activité et de l'apprentissage locomoteurs Différents points dans le temps : diminution proportionnelle à la dose des neurotransmetteurs dans le cerveau antérieur |
Aucune donnée sur la consommation de liquides malgré une nette réduction de la consommation | (Abu-Taweel et coll., 2012) |
| N/231 | Rats, Wistar, M et F (6-10/groupe) |
Lactation, puis exposition directe pendant 3 mois | AlCl3; 0, 0,2 %, 0,4 %, 0,6 % | Développement : Troubles de la mémoire spatiale; modifications des ultrastructures neuronales et synaptiques de l'hippocampe; altération électrophysiologique de la potentialisation à long terme en phase tardive | Étude bien conçue, mais DMENO relativement élevée | (Zhang et coll., 2013b) |
| N/231 | Rats, Wistar, M et F (6-10/groupe) |
Lactation, puis exposition directe pendant 3 mois | AlCl3; 0, 0,2 %, 0,4 %, 0,6 % | Développement : Dommages à la mémoire à long terme; modifications de l'ultrastructure neuronale et synaptique et répression de la voie de signalisation cAMP-PKA-CREB | Étude bien conçue, mais DMENO relativement élevée | (Zhang et coll., 2014) |
| N/10 | Rats, Wistar, F (6/groupe) | Gestation et lactation (JPN 14) | AlCl3; 0, 50 mg/kg p.c. par jour |
Développement : Diminution du poids corporel, diminution des niveaux d'antioxydants enzymatiques et non enzymatiques, diminution des activités AChE et augmentation des niveaux de malondialdéhyde et de protéine d'oxydation avancée | Dose unique | (Ghorbel I. et coll., 2016c) |
| N/? | Rats, Wistar, M et F (5/groupe) | Gestation, lactation, puis exposition directe pendant 4 mois | AlCl3 : 0,3 % | Développement : Effets sur la neurotransmission de la sérotonine dans le cerveau; diminution de la glycoprotéine RF (impliquée dans la détoxification du liquide céphalorachidien) | Dose unique | (Laabbar et coll., 2014) |
Aβ : bêta-amyloïde; AChE : acétylcholinestérase; BPL : bonnes pratiques de laboratoire; GSH : glutathion; i.g. : intragastrique; MDA : malondialdéhyde; JPN : jour postnatal; SOD : superoxyde dismutase
a Sauf indication contraire dans l'étude, les valeurs de la NOAEL et de la LOAEL ont été calculées pour l'ion aluminium à partir des données fournies dans l'étude N = L'étude ne comportait pas de NOAEL/LOAEL; ? = Données insuffisantes fournies dans l'étude pour calculer la NOAEL/LOAEL
b Sauf indication contraire, l'eau potable était la source d'exposition. Les études portant sur l'exposition par gavage ou par voie alimentaire ont été incluses uniquement si elles portaient sur des doses multiples.
c Facteur clé pour déterminer si une étude peut ou non être considérée comme une étude clé potentielle
Malgré l'abondance de recherches disponibles sur la toxicité de l'aluminium, de nombreuses études (dont plusieurs parmi celles énumérées au tableau 3) ont des limites courantes, comme l'incapacité de quantifier l'aluminium dans l'alimentation de base à l'étude. Des concentrations typiques de 250 et 350 ppm d'aluminium dans la nourriture des rongeurs pourraient entraîner une augmentation de 13 à 18 mg Al/kg p.c. par jour chez le rat et de 33 à 46 mg Al/kg chez la souris (Environnement Canada et Santé Canada, 2010). Cela devient un problème sérieux lorsque la dose d'essai est inférieure à la dose de référence dans l'alimentation, et que la dose combinée n'a pas été quantifiée ou signalée. Les autres contraintes liées aux études comprennent l'emploi de doses uniques (ce qui empêche d'évaluer une relation dose-réponse et de déterminer un PDD), le manque d'information détaillée sur les conditions d'exposition, le fait de ne pas tenir compte de l'acidité et de la palatabilité réduite des solutions d'aluminium dans l'eau potable, les concentrations d'exposition qui sont considérablement plus élevées que celles auxquelles sont exposés les humains, ainsi que les expositions de courte durée qui sont beaucoup plus brèves que la durée de la vie humaine.
2.5 Génotoxicité et cancérogénicité
Les composés de l'aluminium ne sont généralement pas considérés comme des mutagènes génétiques, mais semblent agir comme des clastogènes et agissent probablement selon des mécanismes d'action indirects. Comme le résume l'AESA (2008), les mécanismes d'action potentiels comprennent la réticulation de l'ADN avec les protéines chromosomiques, les interactions avec l'assemblage de microtubules et le fonctionnement du fuseau mitotique, l'induction de dommages oxydatifs et la destruction des membranes lysosomales par la libération de DNase. Malgré les dommages causés à l'ADN, le groupe scientifique de l'AESA a estimé que la génotoxicité de l'aluminium n'était probablement pas pertinente pour l'humain, étant donné le seuil présumé et les faibles expositions orales. Il n'existe aucune preuve concluante de la cancérogénicité de l'aluminium dans les modèles animaux (Hackenberg, 1972; Schroeder et Mitchener, 1975a, 1975b; Oneda et coll., 1994). Le Centre international de recherche sur le cancer (CIRC) n'a pas examiné la cancérogénicité de l'aluminium proprement dit, mais a déterminé qu'il existe suffisamment de preuves de cancérogénicité chez les humains à la suite d'expositions professionnelles à divers produits chimiques pendant la « production d'aluminium » (c'est-à-dire la classification du groupe 1). Il est à noter que le danger est fondé sur l'exposition à des cancérogènes connus (principalement des hydrocarbures aromatiques polycycliques) et non sur l'aluminium (CIRC, 2012).
2.6 Mode d'action
Bien que de nombreuses études aient tenté d'élucider le mode d'action de la toxicité de l'aluminium, aucun mécanisme n'a été identifié, et il est probable que plusieurs processus entrent en jeu. Les mécanismes qui participent à la neurotoxicité de l'aluminium sont résumés dans plusieurs études (ATSDR, 2008; Environnement Canada et Santé Canada, 2010; Willhite et coll., 2014) et comprennent, entre autres, les dommages oxydatifs, les réponses inflammatoires, les changements dans les protéines cytosquelettiques neuronales (agrégats de neurofilaments), les modifications dans l'activité cholinergique, les effets sur les voies de transduction du signal, les effets des membranes et les déséquilibres en ions métalliques. Les études publiées à ce jour ne fournissent aucune indication d'une différence entre le mode d'action chez les animaux et celui chez les humains. Aucune analyse complète du mode d'action de la toxicité de l'aluminium n'a été réalisée, car cette analyse n'est pas essentielle au calcul d'une valeur basée sur la santé (VBS) pour l'aluminium.
2.7 Études retenues
Deux études clés ont été prises en compte dans l'évaluation des risques liés à l'aluminium : une étude neurodéveloppementale chez le rat par Poirier et coll. (2011) et une étude reproductive (qualité du sperme) chez le rat par Martinez et coll. (2017b).
Dans l'étude de Poirier et coll. (2011), les effets du citrate d'aluminium chez le rat ont été examinés conformément aux bonnes pratiques de laboratoire (BPL) et à une conception fondée sur la ligne directrice 426 de l'OCDE : Étude de neurotoxicité pour le développement. Le citrate d'aluminium a été choisi intentionnellement, car il s'agit du composé d'aluminium le plus soluble et le plus biodisponible, donc il peut traverser la barrière hématoencéphalique. Dans cette étude à double insu, des rats Sprague-Dawley mâles et femelles ont été exposés à 30, 100 et 300 mg Al/kg p.c. par jour in utero, pendant la lactation, puis dans l'eau potable après le sevrage jusqu'à l'âge d'un an. De faibles concentrations d'aluminium (<10 µg/g) étaient ajoutées à l'alimentation. On a observé une morbidité et une mortalité importantes chez les petits mâles du groupe recevant la dose la plus élevée, de même qu'un trouble rénal associé au traitement à l'aluminium. En ce qui concerne les résultats sur le plan de la reproduction, aucun effet sur la durée de gestation ou sur le nombre de petits et de portées n'a été observé chez les groupes traités à l'aluminium comparativement aux témoins. Un retard du développement sexuel des jeunes mâles et femelles a été observé dans le groupe recevant la dose élevée de citrate d'aluminium. Cet effet a été considéré comme lié au traitement, mais comme le poids corporel était également faible, les auteurs n'ont pu conclure avec certitude que les effets sur le développement étaient secondaires à une diminution du poids corporel. Sur le plan du développement neuromusculaire, les chercheurs ont noté un déficit de la force de préhension des membres antérieurs et postérieurs et, dans une moindre mesure, de l'écartement des pieds chez les groupes exposés aux doses moyenne et élevée Dans la présente évaluation, des données neuromusculaires individuelles ont été reçues et examinées. Une ré-évaluation des données a confirmé un manque significatif dans les trois effets neuromusculaires chez la ratte et un manque dans la force de préhension des membres postérieurs chez le rat. Comme le citrate d'aluminium se trouvait dans l'eau potable, la dose d'aluminium variait selon l'importance de la consommation d'eau. En général, les doses étaient au niveau cible (ou légèrement inférieures) pendant la gestation, supérieures au niveau cible pendant la lactation et inférieures au niveau cible pendant le reste de l'étude. Bien que la réduction de la consommation d'eau ait influé sur l'apport d'aluminium dans les dernières étapes de l'étude et ait pu avoir des résultats confondants, l'effet sur la force de préhension était encore important chez les jeunes animaux lorsque l'exposition à l'aluminium était principalement due à des expositions in utero ou pendant la lactation, lorsque les rates recevaient des doses appropriées ou supérieures à la cible. D'après les observations cliniques, les changements biochimiques cliniques et les effets sur la physiopathologie rénale et la fonction neuromusculaire, les auteurs ont attribué une LOAEL de 100 mg Al/kg par jour (concentration cible) et une NOAEL de 30 mg Al/kg par jour (concentration cible).
Dans le cadre de l'étude de Martinez et coll. (2017b), les effets de faibles doses de chlorure d'aluminium sur la reproduction ont été étudiés chez des rats mâles. Dans cette étude non conforme aux bonnes pratiques de laboratoire et non conforme aux lignes directrices de l'OCDE, les rats étaient répartis en deux groupes. Le premier groupe de rats était exposé pendant 60 jours à 1,5 et 8,3 mg Al/kg p.c. par jour sous forme d'AlCl3‧6H20 dans l'eau potable (équivalent aux niveaux alimentaires chez les humains), tandis que le second groupe était exposé pendant 42 jours à 100 mg Al/kg p.c. par jour sous forme de AlCl3‧6H20 par gavage (un modèle de neurotoxicité reconnu). Quant aux effets sur la reproduction, l'exposition à l'aluminium a entraîné une diminution proportionnelle à la dose du nombre de spermatozoïdes, de la production quotidienne de spermatozoïdes et de la normalité morphologique des spermatozoïdes. Une motilité réduite des spermatozoïdes et une altération histologique des testicules ont également été observées. En utilisant le même modèle d'étude, les auteurs ont également étudié les effets neurocomportementaux associés aux mêmes doses (Martinez et coll., 2017a). Aucun effet n'a été observé sur l'activité exploratoire/locomotrice (test en milieu ouvert), l'anxiété (test du labyrinthe en croix surélevé) ou le seuil de douleur (test de la plaque chaude). Cependant, l'exposition à de faibles doses d'aluminium ainsi qu'à la dose neurotoxique connue a entraîné une altération de la mémoire de reconnaissance dans le cadre du test de reconnaissance des objets. Il est à noter que dans l'étude de toxicité pour la reproduction, les effets observés à la dose de 8,3 mg Al/kg p.c. par jour étaient parfois plus importants et plus significatifs que les effets observés à la dose neurotoxique (100 mg/kg p.c. par jour). Bien que les auteurs affirment que d'autres études seront nécessaires pour expliquer ces résultats, ils laissent entendre que la dose n'est peut-être pas le déterminant le plus important de la toxicité de l'aluminium; les conditions d'exposition, les caractéristiques intrinsèques et individuelles, la distribution et la biodisponibilité dans le corps peuvent également être importantes. Dans les études sur le comportement neurologique et la reproduction, on a noté une augmentation des marqueurs du stress oxydatif en lien avec les effets, et on a souligné qu'il s'agissait d'un mécanisme d'action potentiel.
En fin d'analyse, l'étude de Poirier et coll. (2011) a été retenue comme l'étude la plus appropriée pour l'évaluation des risques. Bien que l'étude de Martinez et coll. (2017b) ait été bien menée et qu'elle ait utilisé un PDD plus faible, des préoccupations ont été soulevées quant à l'ampleur des changements dans la qualité du sperme. Les changements étaient souvent plus faibles à la dose de 100 mg Al/kg p.c. par jour qu'à la dose de 8,3 mg Al/kg p.c. par jour, malgré la dose maximale élevée et l'exposition cumulative à la dose de 100 mg Al/kg p.c. par jour. Aucune explication scientifiquement fondée n'a pu être fournie à l'appui de cette conclusion. L'étude de Poirier et coll. (2011) inspire confiance, car il s'agit d'une vaste étude à l'aveugle menée conformément aux normes de BPL et aux lignes directrices de l'OCDE. L'étude a spécifiquement été conçue et entreprise pour répondre à des besoins de recherche déjà identifiés (JECFA, 2007), et elle a permis d'évaluer de multiples doses ainsi que de multiples paramètres d'évaluation liés à la toxicité pour le développement et à la neurotoxicité. La sélection de l'étude de Poirier et coll. (2011) est appuyée par l'étude du JECFA (2012), qui a utilisé la même étude clé et le même PDD pour calculer l'apport hebdomadaire tolérable provisoire d'aluminium dans l'alimentation. L'effet critique d'une diminution de la fonction neuromusculaire, et plus particulièrement d'une diminution de la force de préhension des membres antérieurs et postérieurs, a été utilisé dans une autre évaluation internationale (ATSDR, 2008) et est appuyé par des études antérieures. L'exposition de la mère à l'aluminium pendant la gestation et la lactation a toujours entraîné une diminution de la force de préhension chez les jeunes rongeurs (Donald et coll., 1989; Golub et coll., 1992a, 1995; Golub et Germann, 2001; Colomina et coll., 2005). Des études portant sur l'exposition des adultes à l'aluminium ont donné des résultats mitigés pour ce qui est de la force de préhension (Donald et coll., 1989; Golub et coll., 1992a, 1992b, 1995, 2000; Oteiza et coll., 1993; Drobyshev et coll., 2018).
3.0 Dérivation de la valeur basée sur la santé
À l'instar du rapport d'Environnement Canada et de Santé Canada (2010), la neurotoxicité et la toxicité pour la reproduction et le développement sont considérées comme les critères d'effet préoccupants dans la présente évaluation. Ces effets ont été observés chez diverses espèces (y compris les humains), à des doses et selon des durées d'exposition variées, ainsi qu'au moyen de divers essais expérimentaux. Depuis la publication du rapport de 2010, plusieurs études clés robustes ont été publiées; ces études ont permis de combler des lacunes précédemment identifiées dans les données (JECFA, 2007; Environnement Canada et Santé Canada, 2010). Comme nous l'avons déjà mentionné, l'étude de Poirier et coll. (2011) a été retenue comme fondement de l'évaluation actuelle des risques. La NOAEL de 30 mg Al/kg p.c. par jour établie par les auteurs repose sur une diminution proportionnelle à la dose des paramètres neuromusculaires (c.-à-d. écartement des pieds, force de préhension des membres antérieurs et postérieurs) ainsi que sur des observations cliniques, des modifications biochimiques cliniques et des effets sur la physiopathologie rénale. Des effets neuromusculaires ont déjà été observés chez des animaux jeunes et adultes ayant des points de départ similaires, et il est peu probable que les jeunes soient plus sensibles que les populations adultes (ATSDR, 2008).
Les composés d'aluminium en général ont une très faible biodisponibilité (~0,3 %) dans l'eau potable. Dans l'étude de Poirier et coll. (2011), le citrate d'aluminium a été utilisé, car il est considéré comme le composé d'aluminium le plus soluble et le plus biodisponible, donc il peut traverser la barrière hématoencéphalique. Une VBS basée sur le PDD avec le citrate d'aluminium est considérée comme prudente et protectrice de l'exposition à toutes les espèces d'aluminium. Les facteurs modificateurs potentiels qui pourraient influer sur la biodisponibilité et la toxicité de l'aluminium chez les humains comprennent la forme chimique de l'aluminium, la présence d'autres constituants chimiques de l'alimentation et les types de complexes que l'aluminium forme avec ces ligands alimentaires. Par exemple, l'absorption de l'aluminium peut augmenter en présence d'acides carboxyliques comme le citrate (naturellement présent dans de nombreux aliments et jus de fruits), mais peut diminuer en présence de composés contenant du silicone (probablement en raison de la formation d'hydroxyaluminosilicate insoluble). Selon les matières présentes dans le tractus gastro-intestinal, l'absorption d'aluminium par voie orale peut varier selon un facteur de 10 simplement en fonction du type de complexe (ATSDR, 2008; AESA, 2008).
La modélisation des données dose-réponse de l'étude de Poirier et coll. (2011) est jugée inappropriée, compte tenu du faible nombre de doses (pour les rats : deux doses en plus de la dose contrôle, étant donné le taux de mortalité élevé dans le groupe ayant reçu une dose élevée) et de la variabilité des doses entre les différentes étapes de l'étude (les doses reçues varient selon la consommation d'eau de l'animal). Par conséquent, les données ne se prêtent pas à des approches telles que la modélisation des doses de référence pour calculer le PDD. La NOAEL de 30 mg/kg p.c. par jour a donc été retenue comme PDD.
En utilisant la NOAEL de 30 mg/kg p.c. par jour, l'apport quotidien tolérable (AQT) pour l'aluminium est calculé comme suit :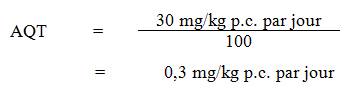
Equation 1
L'AQT est 0,3 mg/kg p.c. par jour. Ceci est calculé par divisant 30 mg/kg p.c. par jour par le facteur d'incertitude de 100.
où :
- 30 mg/kg p.c. par jour est la NOAEL tirée de Poirier et coll. (2011), d'après les effets neuromusculaires (c.-à-d. un déficit de l'écartement du pied et de la force de préhension des membres antérieurs et postérieurs à 100 mg/kg p.c. par jour); et
- 100 est le facteur d'incertitude, choisi pour tenir compte des variations entre espèces (×10) et des variations intraespèces (×10).
À l'aide de cet AQT, la VBS de l'aluminium dans l'eau potable est calculée comme suit :
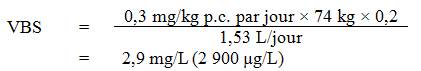
Equation 2
Le VBS est 2,9 mg/L. Ceci est calculé par mutlipliant 0,3 mg/kg p.c. par jour par 74 kg, ensuite par 0,20. Ce produit est ensuite divisé par 1,53 L/jour.
où
- 0,3 mg/ kg p.c. par jour est l'AQT calculé ci-dessus;
- 74 kg est le poids corporel moyen d'un adulte (Santé Canada, en préparation);
- 0,2 est le facteur d'attribution pour l'eau potable. Étant donné que les aliments représentent la principale source d'exposition et que l'eau potable a peu contribué à l'exposition totale à l'aluminium, une valeur plancher de 0,2 a été appliquée comme approche de protection de la santé (Krishnan et Carrier, 2013);
- 1,53 L par jour est le volume quotidien d'eau consommé par un adulte canadien(Santé Canada, en préparation). En raison de la faible volatilité et de la faible absorption cutanée de l'aluminium (Flarend et coll., 2001; Pineau et coll., 2012), il est peu probable que l'exposition à ce métal lors de la douche ou du bain soit importante; par conséquent, une évaluation de l'exposition par plusieurs voies, telle que décrite par Krishnan et Carrier (2008), n'a pas été réalisée.
4.0 Considérations liées à l'analyse et au traitement
4.1 Méthodes d'analyse utilisées pour déceler l'aluminium
4.1.1 Méthodes normalisées
Les méthodes normalisées qui permettent de déceler l'aluminium total dans l'eau potable et leurs limites de détection (LDM) respectives sont résumées au tableau 4. Les LDM dépendent de la matrice de l'échantillon, des instruments et des conditions de fonctionnement choisies; elles varient d'un laboratoire à l'autre. Les tests visant l'aluminium doivent être effectués selon les directives de l'autorité responsable en matière d'eau potable dans le secteur de compétence concerné. Les services d'eau devraient confirmer que les limites de détection déclarables sont suffisamment basses pour permettre une quantification précise à des concentrations inférieures à la CMA et à la VOR.
4.1.2 Analyseurs colorimétriques en ligne et portatifs
Il existe des analyseurs commerciaux en ligne et portatifs qui permettent de quantifier l'aluminium dissous dans l'eau de source et l'eau potable; l'analyse est généralement basée sur le SM 3500-Al C (APHA et coll., 1995). Il faut acidifier l'échantillon avant l'analyse pour mesurer l'aluminium total. Ces analyseurs peuvent servir à obtenir une indication rapide ou continue (modèles en ligne uniquement) des changements de concentrations d'aluminium; ces changements sont cruciaux pour la surveillance des procédés dans les stations de traitement d'eau (Haught et Fabris, 2002). En général, les méthodes commerciales en ligne permettent de mesurer des concentrations d'aluminium de l'ordre de 5 à 1 500 µg/L; une dilution est nécessaire pour les concentrations plus élevées. Les limites de détection vont de 1 µg/L à 10 µg/L. Pour mesurer avec précision la concentration d'aluminium à l'aide de ces analyseurs, les services d'eau doivent élaborer un programme d'assurance et de contrôle de la qualité (AQ/AC comme ceux décrits dans le document SM 3020 (APHA et coll., 2017). De plus, il est recommandé de vérifier périodiquement les résultats à l'aide d'un laboratoire agréé. Les services d'eau devraient vérifier auprès de l'autorité responsable en matière d'eau potable dans le secteur de compétence concerné si les résultats de ces modèles peuvent être utilisés pour produire des rapports de conformité.
Tableau 4. Méthodes normalisées d'analyse de l'aluminium dans l'eau potable
Méthode (Référence) |
Méthodologie | LDM (µg/L) | Interférences/Commentaires |
Méthodes U.S EPA |
|||
| EPA 200.5 Rév. 4.2 (U.S. EPA, 2003) |
Spectrométrie d'émission atomique à couplage inductif en visée axiale (AVICP-AES) | 2,2 | Interférences de la matrice : calcium, magnésium et sodium > 125 mg/L et silice > 250 mg/L |
| EPA 200.7 Rév. 4.4 (U.S. EPA, 1994a) |
Spectrométrie d'émission atomique de masse à plasma à couplage inductif (ICP-AES) | 20 | Interférences de la matrice : solides dissous totaux > 0,2 % en poids par volume (p/v) |
| EPA 200.8 Rév. 5.4 (U.S. EPA, 1994b) |
Spectrométrie de masse à plasma à couplage inductif (ICP-MS) | 1a-1,7b | Interférence de la matrice : solides dissous totaux > 0,2 % p/v |
| EPA 200.9 Rév 2.2 (U.S. EPA, 1994c) |
Spectrométrie d'absorption atomique au four graphite (GFAA) | 7,8 | L'utilisation d'acide chlorhydrique peut causer des interférences dans l'état de vapeur des ions chlorure. Une teneur élevée en aluminium dans la matrice de palladium entraîne une absorption élevée des blancs. |
Méthodes normalisées de l'APHA (APHA et coll., 2017, sauf indication contraire) |
|||
| SM 3111D et SM 3111E |
Spectrométrie d'absorption atomique à flamme directe (SM 3111D) ou par extraction (3111E) d'oxyde nitreux acétylène | 100 | SM 3111E : Applicable à la détermination des concentrations d'aluminium <900 µg/L; interférence de la matrice : fer >10 mg/L |
| SM 3113B | Spectrométrie d'absorption atomique électrothermique | 3 | |
| SM 3120B | Spectrométrie d'émission atomique de masse à plasma à couplage inductif (ICP-AES) | 40 | Interférence de la matrice : matières solides dissoutes totales> 1 500 mg/L |
| SM 3125 | Spectrométrie de masse à plasma à couplage inductif (ICP-MS) | 0,03 | Interférence de la matrice : matières solides dissoutes totales > 0,5 % p/v |
| SM 3500-Al B | Méthode colorimétrique utilisant un colorant ériochrome cyanine R et spectrophotomètre (535 nm) | 6 | Les fluorures, les phosphates et le fer ferrique peuvent provoquer des interférences. Des procédures et des facteurs de correction peuvent être nécessaires pour obtenir des mesures précises. |
| SM 3500-Al C (APHA et coll., 1995) |
Méthode colorimétrique utilisant le violet de pyrocathechol et spectrophotomètre (580 nm) | 7-10 | |
a LDM en mode balayage b LDM en mode contrôle ionique sélectif
4.1.3 Conservation et préparation des échantillons
L'aluminium total comprend la fraction dissoute et la fraction particulaire (en suspension) de l'aluminium dans un échantillon d'eau; il est analysé à l'aide de méthodes de récupération totale de l'aluminium. Il faut analyser l'aluminium total pour permettre sa comparaison avec la CMA et la VOR. Il peut être nécessaire de déterminer la concentration des fractions dissoutes et particulaires pour surveiller le procédé (voir la section 4.2.1.1).
Les considérations relatives au traitement des échantillons pour l'analyse de l'aluminium dans l'eau potable se trouvent dans les références énumérées au tableau 4. La quantification précise de l'aluminium dissous, particulaire et total dans les échantillons dépend des étapes de conservation et de traitement des échantillons. La méthode SM 3030B fournit des directives sur les procédures de filtration et de préservation (acidification) pour la détermination des métaux dissous ou particulaires (APHA et coll., 2017). Il est important de noter que pour déterminer les concentrations d'aluminium dissous, les échantillons doivent être filtrés, et le filtrat devrait être acidifié à un pH <2 au moment de la collecte (pas au laboratoire). La distinction entre les fractions dissoutes et particulaires d'un échantillon dépend du type de filtre et de la taille des pores; par conséquent, les services d'eau qui peuvent observer des particules ou des colloïdes plus petits présents dans l'eau devraient considérer si la taille standard du filtre (membrane de 0,4-0,45 µm de diamètre des pores) convient.
Actuellement, les méthodes EPA 200.7 et 200.8 et SM 3111D, SM 3113B, SM 3120B n'exigent pas de digestion acide à chaud pour les métaux récupérables totaux, à moins que la turbidité de l'échantillon soit supérieure à une (1) unité de turbidité néphélométrique (UTN). L'APHA et coll. (2017) recommande de vérifier s'il y a eu récupération adéquate des métaux dans différentes matrices d'échantillons par une comparaison des échantillons digérés et non digérés. La digestion assistée par micro-ondes (SM 3030K) est recommandée pour l'analyse des métaux récupérables totaux à l'aide de méthodes SM basées sur l'ICP-MS.
4.2 Considérations relatives au traitement
La forme d'aluminium (p. ex. particules ou dissous) dépend de nombreux paramètres environnementaux, dont le pH, la température, la MON et la présence de ligands inorganiques comme le fluorure, le sulfate, le silicate et le phosphore (Environnement Canada et Santé Canada, 2010). L'aluminium est fortement insoluble dans la plage de pH voisine du point neutre (Appelo et Postma, 1996). Selon les conditions de qualité de l'eau, divers précipités chimiques peuvent se former, notamment de l'oxyde, de l'hydroxyde, du silicate et du phosphate (Snoeyink et coll., 2003; Friedman et coll., 2010). Dans des conditions de pH faible ou élevé, la plupart des formes d'aluminium deviennent très solubles. La solubilité de l'aluminium varie également selon la température. Dans le cas du sulfate d'aluminium (alun), le pH de solubilité minimale se situe à 6,2 à 20 °C et passe à 6,7 à 5 °C (voir figure 1). Au pH de solubilité minimale, on s'attend à des concentrations d'aluminium soluble de 0,005 à 0,014 mg/L (-6,7 M et -6,3 M, respectivement, à la figure 1). Ce taux augmente considérablement pour atteindre 27 mg/L à un pH de 9,7 et une température de 20 °C (-3 M) (Van Benschoten et coll., 1992). Dans le cas des formes préhydrolysées d'aluminium (p. ex., chlorure de polyaluminium; PACl), le pH de solubilité minimale d'un coagulant à haute basicité se situe à 6,4 à 20 °C et passe à 6,9 à 5 °C (voir figure 2). Par conséquent, les coagulants PACl peuvent généralement être utilisés à des pH plus élevés (Pernitsky, 2003) et à un plus grand étendu de température, à des doses de coagulant plus faibles (Matilainen et coll., 2010). Cependant, à des valeurs de pH inférieures au pH de solubilité minimale, les concentrations d'aluminium dissous augmentent beaucoup plus rapidement que celles de l'alun (p. ex. 27 mg/L autour d'un pH de 6 et une température de 20 °C (-3 M à la figure 2)) (Pernitsky et Edzwald, 2006). Ainsi, le pH et la température auront une forte influence sur la concentration d'aluminium dans l'eau traitée et potentiellement sur les dépôts et l'accumulation d'aluminium dans les réseaux de distribution.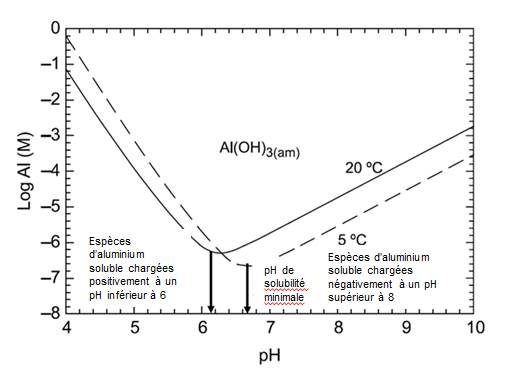
Figure 1
Un graphique qui montre la solubilité de l'alun. L'axe vertical indique la concentration en aluminium sur une échelle de log en moles allant de -8 à 0 et l'axe horizontal indique un pH allant de 4 à 10. La courbe de solubilité a la forme d'une parabole avec le point de solubilité minimale à la base. Le côté gauche de la parabole se soulève sur une pente de 2,5% et le côté droit sur une pente de 2. Deux courbes de solubilité sont fournies - une pour 20 ° C avec la base à pH 6,2 et une pour 5 ° C décalée vers la droite avec la base à pH 6,7.
(Adapté de JWSRT - AQUA Vol. 55, no 2, pp. 121-141, avec la permission des détenteurs des droits d'auteur, IWA Publishing)
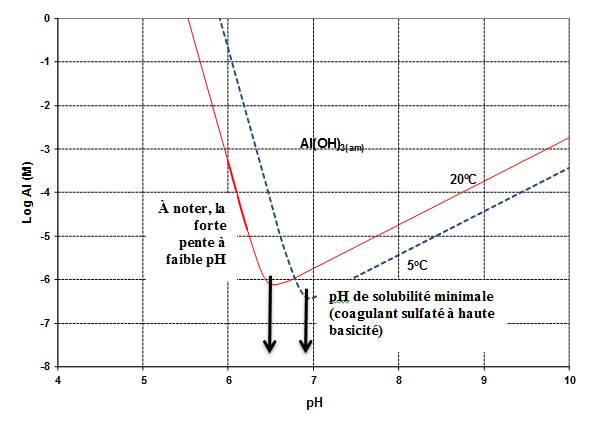
Figure 2
Un graphique qui montre la solubilité du chlorure de polyaluminium. L'axe vertical indique la concentration en aluminium sur une échelle de log en moles allant de -8 à 0 et l'axe horizontal indique un pH allant de 4 à 10. La courbe de solubilité a la forme d'une parabole avec le point de solubilité minimale à la base. Le côté gauche de la parabole augmente fortement avec une pente de 7 tandis que le côté droit augmente plus progressivement avec une pente de 3. Deux courbes de solubilité sont fournies - une pour 20 ° C avec la base à pH 6,4 et une pour 5 ° C décalée à droite avec la base à pH 6,9.
(Adapté de JWSRT - AQUA Vol. 55, no 2, pp. 121-141, avec la permission des détenteurs des droits d'auteur, IWA Publishing)
Il est important de minimiser la concentration d'aluminium dans l'eau traitée, car elle peut avoir un impact sur la qualité de l'eau :
- les concentrations d'aluminium peuvent dépasser la CMA proposée (Kim et coll., 2011; Cantwell et coll., 2012; Locco et coll., 2018; tableau 2);
- les précipités d'aluminium peuvent piéger et protéger les microorganismes, ce qui peut nuire à l'efficacité des procédés de désinfection à l'usine de traitement et dans le réseau de distribution (Letterman et Driscoll, 1988);
- les précipités d'aluminium dans le réseau de distribution peuvent influencer les concentrations de plomb et de cuivre (Kvech et Edwards, 2001), adsorber et libérer l'arsenic et le chrome (Kim et coll., 2011) et servir de puits d'accumulation pour d'autres contaminants (Snoeyink et coll., 2003; Friedman et coll., 2010);
- les précipités d'aluminium peuvent adsorber ou co-précipiter le plomb et le cuivre, contribuant ainsi à la coaccumulation et au risque de rejets de particules de plomb et de cuivre (Knowles et coll., 2015; Cantor, 2017);
- l'hydroxyde d'aluminium a une forte affinité pour le manganèse à un pH > 7,5 (Wang et coll., 2012a);
- l'aluminium peut perturber les stratégies de maîtrise de la corrosion du plomb et du cuivre, entraînant ainsi la passivation des orthophosphates en empêchant la formation de dépôts protecteurs (AWWA, 2011a; Wasserstrom et coll., 2017).
La précipitation de l'aluminium dans le réseau de distribution peut également occasionner des problèmes opérationnels :
- diminution de la capacité de charge des conduites principales et perte de pression associée, ou augmentation des coûts de pompage (Baylis, 1953; Hudson, 1966; Cooper and Knowles, 1975; Foley, 1980; Costello, 1984; Kriewall et coll., 1996; Grigg, 2010);
- dépôts d'aluminium sur les compteurs d'eau, provoquant leur mauvais fonctionnement, ainsi que dans les conduites, ce qui entraîne une faible pression dans le réseau domestique (Halton, 2001);
- eau d'apparence trouble ou décolorée (p. ex. eau « laiteuse » ou « trouble ») (Costello, 1984; Dietrich, 2015; NHMRC and NRMCC, 2011; Locco et coll., 2018).
À des concentrations élevées (5-6 mg/L), l'aluminium peut conférer un goût désagréable à l'eau, et à des concentrations très élevées (100-500 mg/L), l'eau peut donner la sensation d'être « collante » (Hrudey et Hrudey, 2014). Des concentrations élevées ont été observées à la suite d'accidents dans des stations de traitement de l'eau à grande échelle qui utilisaient des coagulants à base d'aluminium. D'où la nécessité de procédures d'exploitation normalisées, d'alarmes et de mécanismes d'enclenchement, ainsi que de plans d'urgence lorsque des produits chimiques sont utilisés pour le traitement de l'eau.
4.2.1 Traitement à l'échelle municipal
La seule technique de traitement efficace connue pour contrer l'aluminium naturellement présent dans l'eau de source est la coagulation. Ce traitement fait appel à une technologie complexe qui n'est généralement pas utilisée dans les petits systèmes et les sources d'approvisionnement en eau souterraine. Dans les situations où l'enlèvement de l'aluminium est nécessaire et où la coagulation n'est pas possible, il faut communiquer avec l'autorité responsable en matière d'eau potable dans le secteur de compétence concerné pour discuter des solutions possibles.
4.2.1.1 Utilisation de coagulants à base d'aluminium
La coagulation a de multiples objectifs; pour obtenir des conditions de coagulation optimale, il faut respecter une dose de coagulant et un pH qui :
- maximisent l'élimination de la turbidité (particules) par les procédés en aval;
- maximisent l'élimination des MON (précurseurs de sous-produits de désinfection); et
- minimisent la quantité de résidus de coagulant dans l'eau traitée.
Lorsqu'on ajoute des coagulants à base d'aluminium dans l'eau, il se produit des réactions chimiques avec les particules ainsi qu'avec la matière organique naturellement présente dans l'eau de source. La MON agit comme un ligand qui crée des complexes à partir des ions d'aluminium chargés positivement, ce qui augmente la quantité de coagulant nécessaire pour obtenir la floculation (Edzwald et Haarhoff, 2012). Si la dose de coagulant ne suffit pas à répondre à ce besoin, l'aluminium reste sous forme dissoute, ce qui entraîne la présence de résidus d'aluminium élevés et l'élimination sous-optimale des particules (Jekel et Heinzmann, 1989; Edzwald et Van Benschoten, 1990; Van Benschoten et Edzwald, 1990a; Srinivasan et coll., 1999; Edzwald et Kaminski, 2009). Dans des conditions acides, le surdosage peut aussi faire augmenter le taux de résidu d'aluminium (Van Benschoten et Edzwald, 1990a). Les changements de pH et de température peuvent aussi causer la précipitation post-traitement de particules causant de la turbidité, ainsi que le dépôt et l'accumulation de particules dans les réseaux de distribution (Snoeyink et coll., 2003; Pernitsky et Edzwald, 2006).
Une revue d'échantillons d'eau brute et d'eau traitée prélevés par paire dans des stations de traitement des eaux de surface de trois provinces (Nouvelle-Écosse, Manitoba, Alberta) a révélé une diminution des concentrations d'aluminium dans 70 à 82 % des échantillons. Les concentrations dans l'eau traitée tendaient à augmenter lorsque les concentrations d'aluminium dans l'eau brute étaient faibles (voir le tableau 5). Ces hausses de concentration illustrent clairement les effets d'une coagulation inadéquate sur les résidus d'aluminium et la possibilité que les concentrations dans l'eau traitée dépassent la CMA proposée, bien que l'utilisation d'autres produits chimiques de traitement de l'eau puisse avoir contribué à cette augmentation (voir la section 4.2.1.3). La diminution des concentrations donne une indication des faibles concentrations (0,010-0,032 mg/L) pouvant être obtenues.
Tableau 5. Augmentations et diminutions les plus fortes de concentration d'aluminium dans des échantillons d'eau brute et d'eau traitée appariés (2012-2017)
Province |
Nombre d'échantillons appariés | Augmentation des concentrations | Diminution des concentrations |
| Nouvelle-Écosse1 | 54 échantillons issus de 24 installations | n 15/54 (28 %) Brute 0,071 mg/L Traitée 0,724 mg/L Augm. (%) 920 % |
n 39/54 (72 %) Brute 0,180 mg/L Traitée 0,010 mg/L Baisse (%) 94,4 % |
| Manitoba2 | 154 échantillons issus de 34 installations | n 46/154 (30 %) Brute 0,047 mg/L Traitée 7,97 mg/L Augm. (%) 16 714 % |
n 108/154 (70 %) Brute 32,4 mg/L Traitée 0,032 mg/L Baisse (%) 99,9 % |
| Alberta3 | 136 échantillons issus de 3 installations | n 24/136 (18 %) Brute 0,052 mg/L Traitée 0,256 mg/L Augm. (%) 392 % |
n 112/136 (82 %) Brute 5,68 mg/L Traitée 0,025 mg/L Baisse (%) 99,6 % |
1 Nova Scotia Environment (2018)
2 Développement durable Manitoba (2017)
3 Alberta Environment and Parks (2017)
Un examen de 10 études de cas en grandeur réelle a permis d'évaluer la concentration résiduelle d'aluminium pouvant être obtenue dans les plages de températures observées au Canada (Santé Canada, 2018a). Les résultats, résumés au tableau 6, montrent que les stations de traitement de l'eau qui ajoutent des coagulants à base d'aluminium peuvent obtenir des concentrations dépassant parfois 0,05 mg/L, que l'eau soit froide ou chaude. Les stations qui pratiquent la coagulation à pH acide ont tendance à présenter des concentrations d'aluminium plus élevées dans l'eau froide, car c'est dans ces conditions que leurs concentrations s'éloignent le plus du point de solubilité minimale (voir les figures 1 et 2). Inversement, les stations qui pratiquent la coagulation à pH alcalin présentent généralement des concentrations d'aluminium plus élevées dans les conditions d'eau tiède, car c'est à ce moment qu'elles atteignent des concentrations les plus éloignées du point de solubilité minimale. D'autres publications scientifiques ont présenté des conclusions similaires (Van Benschoten et Edzwald, 1990b; Anderson et coll., 1998; Halton, 2001; Kundert et coll., 2004). De plus, l'examen en question a révélé que les stations de traitement de l'eau dont la teneur en MON variait ont observé des concentrations élevées en résidus d'aluminium, en raison d'une dose insuffisante de coagulant. L'augmentation de la dose de coagulant a réduit les concentrations résiduelles d'aluminium de 0,16-0,50 mg/L à 0,06-0,07 mg/L. (Srinivasan et coll., 1999; Anderson et coll., 2017; Santé Canada, 2018a).
Tableau 6. Incidence du pH et de la température sur les concentrations résiduelles d'aluminium
Conditions de pH |
Température de l'eau à laquelle les résidus d'aluminium sont élevés | Concentrations d'aluminium |
| PH acide constant (non corrigé selon les saisons) | ≤5 °C | Augmentation de <0,05 mg/L à ~ 0,300 mg/L |
| pH corrigé selon variations saisonnières | S.O. | Inférieure à 0,06 mg/L pour toutes les saisonsa, sauf deux mesuresb |
| PH alcalin constant (non corrigé selon les saisons) | ≥15 °C | Augmentation de <0,05 mg/L à ~ 0,400 mg/L |
a Période de données : décembre 2014 à novembre 2017
b En hiver 2016 (0,10 mg/L) et en été 2017 (0,18 mg/L)
Un contrôle strict du pH et un dosage adéquat du coagulant sont nécessaires pour minimiser les concentrations résiduelles d'aluminium dans l'eau traitée (Driscoll et Letterman, 1995). Lorsqu'on optimise la coagulation, il est conseillé de fixer un objectif de turbidité de l'effluent filtrant de 0,1 UTN afin de minimiser la présence de résidus d'aluminium. (Jekel et Heinzmann, 1989; Van Benschoten et coll., 1992). L'essai en pot peut s'avérer une solution utile pour optimiser le processus de coagulation et tester d'autres coagulants et agents floculants (AWWA, 2011b). La surveillance de l'aluminium résiduel devrait inclure les concentrations d'aluminium total et d'aluminium dissous. L'aluminium dissous fournit une indication de l'adéquation du pH de coagulation, tandis que l'aluminium particulaire indique le niveau de rendement des opérations de filtration. Dans ce cas, il est acceptable de considérer que l'aluminium particulaire représente la différence entre l'aluminium total et l'aluminium dissous.
Il faut envisager avec prudence d'utiliser des coagulants de remplacement à base de fer pour réduire au minimum les concentrations résiduelles d'aluminium, car le fer aurait des effets néfastes sur la santé (Rao et Adlard, 2018). Il est également important de noter que le sous-dosage de coagulant peut détériorer fortement la capacité d'élimination des agents pathogènes (Huck et coll., 2001). Il est donc essentiel que les efforts visant à réduire au minimum les concentrations résiduelles d'aluminium ne compromettent pas l'efficacité de la capacité de réduction logarithmique des agents pathogènes ou d'élimination de la MON (c.-à-d. les précurseurs de sous-produits de désinfection).
4.2.1.2 Orthophosphate
L'ajout d'orthophosphate pendant le mélange rapide et après l'ajout de coagulant s'est avéré être une stratégie possible pour diminuer les résidus d'aluminium, ce composé peut former des précipités d'aluminium-phosphate qui peuvent être éliminés par filtration. (Frommel et coll., 2004; Wang et coll., 2012b; Santé Canada, 2018a). Toutefois, cette approche n'est pas recommandée, car l'ajout de phosphore provoque des réactions chimiques concurrentes pendant le traitement de l'eau. Selon les conditions de qualité de l'eau, des précipités de phosphate d'aluminium se forment, entraînant la perte d'orthophosphate requis pour empêcher la corrosion, et le phosphore introduit une charge négative aux flocs d'hydroxyde d'aluminium, ce qui nuit à la filtration. Ainsi, si on ajoute de l'orthophosphate pour empêcher la corrosion, cela devrait avoir lieu en aval du réservoir afin d'éviter d'introduire du phosphore dans les filtres pendant le rétrolavage (Edzwald, 2018).
Il est également recommandé de faire preuve de prudence lorsqu'on utilise de l'orthophosphate pour contrôler la corrosion, car l'aluminium peut perturber la passivation du plomb (Cantor, 2017). Les modèles théoriques de solubilité du système carbonate-orthophosphate de plomb supposent généralement la formation d'hydroxypyromorphite (Pb5(PO4)3OH), mais l'orthophosphate peut précipiter avec l'aluminium résiduel (de 29 à 110 μg/L dans cette étude), formant des dépôts poreux riches en aluminium et en phosphore qui adhèrent mal aux surfaces des conduites et ne freinent pas efficacement la libération de plomb (Wasserstrom et coll., 2017). Cantor (2017) a examiné les stratégies de lutte contre la corrosion utilisant du phosphate dans 12 systèmes municipaux et non municipaux d'approvisionnement en eaux souterraines et de surface, et a constaté une forte corrélation entre le rejet de particules de plomb et de cuivre et le rejet de particules d'aluminium. Les précipités de phosphate d'aluminium peuvent également contribuer aux dépôts dans le réseau de distribution (voir la section 4.3), à la turbidité et à une coloration blanc laiteux au point d'utilisation. Une concentration maximale cible d'aluminium de 0,05 mg/L est recommandée pour le point d'entrée et pour le réseau de distribution afin d'éviter ces problèmes (AWWA, 2011a).
4.2.1.3 Utilisation de produits chimiques certifiés à teneur minimale en aluminium
Santé Canada a commandé un rapport pour déterminer la contribution potentielle de l'aluminium à l'eau potable en évaluant cinq types de produits chimiques offerts dans le commerce et certifiés selon la norme 60 (NSF International (NSF)/American National Standards Institute (ANSI) (NSF/ANSI, 2017)) qui peuvent avoir contenu de l'aluminium comme impureté : sulfate d'ammonium (chloramination), hypochlorite de calcium (désinfectant), hydroxyde de calcium (ajustement du pH), oxyde de calcium (ajustement du pH) et silicate de sodium (lutte contre la corrosion). Les données ont été compilées à partir des évaluations de certification des produits et de la surveillance continue exercée entre 2016 et 2017 (NSF, 2018). Pour être conformes à la norme NSF/ANSI 60, les produits chimiques ne doivent pas dépasser une concentration au robinet de 2 mg/L d'aluminium.
Les concentrations d'aluminium mesurées dans les types de produits chimiques sont résumées au tableau 7. À partir de ces résultats, il est possible de calculer des estimations de la quantité d'aluminium ajoutée à l'eau potable à la concentration maximale d'utilisation du produit (c.-à-d. normalisée). Ces résultats normalisés sont résumés au tableau 8. Il importe de noter qu'il s'agit de concentrations estimatives et non de concentrations exactes mesurées dans l'eau potable traitée.
Un examen des données du tableau 8 indique qu'une installation qui utilise de l'hydroxyde de calcium et du silicate de sodium pourrait ajouter jusqu'à 51 μg/L d'aluminium dans l'eau potable. Bien que ces valeurs soient considérablement inférieures à celles permises par la norme NSF/ANSI 60, elles peuvent entraîner une accumulation d'aluminium dans le réseau de distribution (voir section 4.3). Afin de réduire au minimum la quantité d'aluminium ajoutée à l'eau traitée, la dose maximale prévue qui sera appliquée à l'installation de traitement devrait être prise en compte lors du choix des produits chimiques.
Tableau 7. Teneur en aluminium (mg/kg) des produits chimiques testés
Type de produit chimique |
Nbre détectés / échantillons | Minimum (mg/kg) |
Médiane (mg/kg) |
95e centile (mg/kg) |
Maximum (mg/kg) |
| Sulfate d'ammonium | 0/25 | 0 | 0 | 0 | 0 |
| Hypochlorite de calcium | 21/23 | 121 | 223 | 437 | 485 |
| Hydroxyde de calcium | 30/31 | 0,6 | 11 | 33 | 93 |
| Oxyde de calcium | 25/27 | 0,1 | 1,0 | 22 | 30 |
| Silicate de sodium | 31/36 | 46 | 99 | 392 | 550 |
Tableau 8. Concentrations d'aluminium calculées (normalisées) au robinet (μg/L)
Type de produit chimique |
Nbre détectés / échantillons | Minimum (μg/L) |
Médiane (μg/L) |
95e centile (μg/L) |
Maximum (μg/L) |
| Sulfate d'ammonium | 0/25 | 0 | 0 | 0 | 0 |
| Hypochlorite de calcium | 21/23 | 0,7 | 2,5 | 5,8 | 6,1 |
| Hydroxyde de calcium | 30/31 | 0,7 | 8 | 21 | 28 |
| Oxyde de calcium | 25/27 | 0,3 | 2,6 | 11 | 15 |
| Silicate de sodium | 31/36 | 1,9 | 3,9 | 15 | 23 |
Remarque : Les concentrations ont été calculées en supposant que le produit est utilisé à son niveau d'application maximal.
4.2.1.4 Autres options de traitement pour l'aluminium d'origine naturelle
Il existe peu d'études publiées sur les technologies autres que la coagulation pour l'enlèvement de l'aluminium d'origine naturelle. On sait que l'aluminium encrasse les membranes d'osmose inverse (Allenby, 2004); les résines d'échange de cations doivent être modifiées et utilisées à un pH extrêmement bas (Vanloot et coll., 2007); l'adoucissement par la chaux peut augmenter les concentrations d'aluminium (Reijnen et coll., 1991; Alabdula'aly, 1998; Kettunen et Keskitalo, 2000; AWWA, 2011a); et les oxydants chimiques tels que le chlore sont inefficaces, car l'état d'oxydation de l'aluminium ne change pas (Edzwald, 2018). D'après les données d'occurrence présentées dans le tableau 2, les concentrations au 90e centile sont inférieures à la CMA proposée, tandis que certaines valeurs maximales sont supérieures à celle-ci. Pour les sources dont les concentrations d'aluminium sont supérieures à la CMA proposée, une évaluation au site serait nécessaire pour déterminer la solution de traitement la plus appropriée si la coagulation n'est pas réalisable. La réalisation d'essais pilotes est recommandée pour s'assurer que la source d'approvisionnement en eau peut être traitée avec succès. À défaut, on peut utiliser un autre approvisionnement d'eau potable sûr.
4.2.2 Traitement à l'échelle résidentiel
Dans les cas où il est souhaitable d'enlever l'aluminium au niveau de la résidence, par exemple, lorsqu'un ménage obtient son eau potable d'un puits privé, le traitement risque de s'avérer difficile, d'après les renseignements présentés à la section 4.2.1. Il faut communiquer avec l'autorité responsable en matière d'eau potable dans le secteur de compétence concerné pour discuter des options possibles.
4.3 Considérations relatives au réseau de distribution
4.3.1 Dépôt et accumulation d'aluminium
Des observations de dépôts d'aluminium sur les conduites du réseau de distribution ont été rapportées dans les publications scientifiques depuis 1953 (Baylis, 1953; Hudson, 1966; Cooper et Knowles, 1975; Foley, 1980; Costello, 1984; Kriewall et coll., 1996; Halton, 2001; Muylwyk et MacDonald, 2001; Schock et Holm, 2003; Lytle et coll., 2004; Schock, 2005; Friedman et coll., 2010; Grigg, 2010; Li et coll., 2018). L'aluminium peut s'accumuler sur tous les matériaux des conduites (Hudson, 1966) et être libéré, avec d'autres contaminants d'origine sanitaire, lorsque la qualité de l'eau change (p. ex., pH ou température) (Fuge et coll., 1992; Kriewall et coll., 1996; Halton, 2001; Snoeyink et coll., 2003; Kim et coll., 2011). Les perturbations physiques/hydrauliques peuvent également causer le détachement de dépôts mal ancrés (p. ex. travaux routiers, rinçage des bornes d'incendie, bris de conduites d'eau, installation de compteurs, réparation de fuites, lutte contre les incendies) (Friedman et coll., 2010; Hill et coll., 2010; Del Toral et coll., 2013; Wasserstrom et coll., 2017). De plus, les changements de pH et de température dans le réseau de distribution peuvent faire en sorte que l'aluminium entre et sorte de la solution et soit transporté et déposé dans tout le réseau (Driscoll et coll., 1987; Halton, 2001; Snoeyink et coll., 2003; Munk et Faure, 2004).
L'ampleur de l'accumulation d'aluminium dans divers types de systèmes est fournie au tableau 9. La majorité des résultats présentés au tableau 9 porte sur les systèmes s'approvisionnant en eau souterraine, dont les concentrations d'aluminium tendent à être plus faibles. Néanmoins, Lytle et coll. (2004) et Friedman et coll. (2010) ont rapporté des concentrations d'aluminium au 90e percentile dans les solides de tronçons de conduites qui étaient comparables dans les systèmes s'approvisionnant en eaux souterraines et en eau de surface, alors que les concentrations maximales étaient 5,5 et 1,8 fois supérieures dans les eaux souterraines comparativement à l'eau de surface. Bien que les données sur les eaux de surface soient limitées, elles démontrent que l'aluminium s'accumule dans tous les systèmes d'approvisionnement en eau.
En ce qui concerne les solides de rinçage des bornes d'incendie (voir tableau 9), Lytle et coll. (2004) ont rapporté la plus forte concentration d'aluminium (144 265 μg/g) dans un système d'approvisionnement en eau souterraine utilisant de l'alun. Ce réseau présentait également les concentrations de cuivre, de plomb et de nickel les plus élevées. Dans les systèmes d'approvisionnement en eau souterraine n'ajoutant pas d'alun, la concentration maximale d'aluminium était 19 fois plus faible. Li et coll. (2018) ont mesuré une concentration d'aluminium de 55 000 μg/g dans les solides de rinçage unidirectionnel provenant du tuyau en fonte d'un système d'approvisionnement en eau de surface ajoutant du PACl (teneur résiduelle moyenne en aluminium = 0,050 mg/L). Les auteurs ont rapporté que l'aluminium (et le manganèse) contribue à la formation de dépôts friables qui sont plus facilement emportés sous l'effet des perturbations hydrauliques.
Tableau 9. Concentrations d'aluminium dans les dépôts accumulés dans les solides de section de conduite et dans les solides de rinçage des bornes d'incendie
Nature du dépôt |
Type d'eau | Nombre d'échant. | Min (μg/g) |
Médiane (μg/g) |
90e (μg/g) |
Max (μg/g) |
Solides de section de conduite |
Lytle et coll., 2004a |
|||||
| Eau souterraine | 35 | 28 | 718 | 2 789 | 7 286 | |
| Eau de surface additionnée d'alun | 1 | 1 324 | 1 324 | 1 324 | 1 324 | |
Friedman et coll., 2010b |
||||||
| Eau souterraine | 22 | 105 | 536 | 3 294 | 8 880 | |
| Mixte - eaux souterraines et de surfacec | 8 | 374 | 1 422 | 8 322 | 20 256 | |
| Mixte - eaux de surfaced et eaux souterraines | 3 | 561 | 759 | 944 | 990 | |
| Eau de surface additionnée d'alun | 2 | 4 373 | 4 669 | 4 906 | 4 965 | |
Solides dans les eaux de rinçage des bornes d'incendie |
Lytle et coll., 2004a |
|||||
| Eau souterraine | 22 | 96 | 375 | 2 905 | 7 512 | |
| Eau souterraine additionnée d'alun | 4 | 11 708 | 103 602 | 139 252 | 144 265 | |
Friedman et coll., 2010b |
||||||
| Eau souterraine | 21 | 33 | 446 | 1 066 | 1 659 | |
| Mixte - eaux souterraines et de surfacee | 2 | 1 545 | 5 911 | 9 403 | 10 276 | |
a Les échantillons ont été prélevés sur de la fonte, de la fonte doublée de ciment, de l'amiante-ciment, du ciment, du PVC, du plastique et des matériaux de tuyaux inconnus.
b Les échantillons ont été prélevés sur des tuyaux en fonte, en fonte doublée de ciment, en fonte galvanisée, en acier et en PEHD.
c La composante eau de surface comprend de l'eau achetée d'une municipalité voisine (coagulant non spécifié), de l'eau de surface additionnée de chlorure ferrique et l'eau de surface traitée (coagulant non spécifié).
d La composante eau de surface comprend de l'eau achetée d'une municipalité voisine (coagulant non spécifié).
e La composante eau de surface comprend de l'eau achetée d'une municipalité voisine (coagulant non spécifié).
Li et coll. (2018) discutent du processus cumulatif des mélanges de dépôt et ont avancé que l'aluminium et le manganèse sont les principaux agents de piégeage qui servent à adsorber les autres métaux. Les auteurs ont affirmé que des mesures visant à minimiser les dépôts d'aluminium et de manganèse dans le réseau de distribution sont essentielles pour réduire les risques liés aux métaux lourds. En moyenne, l'aluminium se classait huitième sur 13 éléments (le manganèse était septième) en ce qui concerne les concentrations des dépôts dans Lytle et coll. (2004), tandis que l'aluminium se classait troisième sur 12 éléments (le manganèse était cinquième) dans Friedman et coll. (2010). Schock (2005) a publié des données sur l'accumulation de métaux dans les entrées de service en plomb et du tartre dans les conduites en fer pour divers types d'eau. En moyenne, l'aluminium se classait au quatrième rang sur 13 éléments (le manganèse se classait au sixième rang) pour ce qui est de la concentration des dépôts. Ces données montrent que les solides d'aluminium et de manganèse peuvent représenter une part importante des dépôts accumulés de longue date dans le réseau de distribution.
Les contaminants d'origine sanitaire qui se sont accumulés peuvent être rejetés dans l'eau distribuée sous forme d'espèces dissoutes ou particulaires en cas de changements dans les propriétés chimiques de l'eau (Schock, 2005; Hill et coll., 2010; Kim et coll., 2011; Trueman et Gagnon, 2016; Cantwell et coll., 2012). Kim et coll. (2011) ont mesuré des concentrations d'aluminium de l'ordre de 2 à 7 mg/L entre les pH 9 et 10 lors d'essais de dissolution par lots de produits de corrosion provenant d'une conduite en plomb. Cantwell et coll. (2012) ont signalé des concentrations d'aluminium de 1 060 à 4 610 μg/L avec des pH entre 7,1 et 7,6 lors d'une étude avec des tuyaux en boucle. Des co-libérations d'arsenic, de chrome et de plomb ont également été rapportées (Kim et coll., 2011; Cantwell et coll., 2012).
Ces observations mettent en évidence une complication des stratégies de contrôle des rejets de contaminants en fonction du pH : tandis que certains contaminants sont libérés en réaction à une baisse du pH (p. ex. plomb, manganèse), d'autres le sont en réaction à une hausse du pH (p. ex. arsenic, cuivre, chrome) (Kim et coll., 2011). Dans le cas de l'aluminium, les caractéristiques de solubilité peuvent varier d'une saison à l'autre sous l'effet de changements de température, de pH et de concentrations de MON. Des températures estivales accrues, par exemple, peuvent permettre à l'aluminium de rester sous forme dissoute et de ne pas précipiter. Si la hausse de température est suffisamment élevée pour que le système subisse des conditions de sous-saturation, les dépôts d'aluminium accumulés antérieurement (c.-à-d. des dépôts anciens) peuvent se dissoudre et libérer des contaminants coprécipités. Les variations saisonnières d'autres paramètres (p. ex., phosphate, silicate) peuvent également influer sur les processus d'équilibrage chimique. Par conséquent, une stratégie de maîtrise englobante (voir la section 5) s'impose pour atteindre les objectifs concomitants de qualité de l'eau liés à l'aluminium, aux produits de corrosion et aux autres contaminants d'origine sanitaire pouvant s'accumuler dans le réseau de distribution (Cantor, 2017; Li et coll., 2018).
4.3.2 Relargage de l'aluminium à partir de matériaux à base de ciment
L'aluminium peut pénétrer dans le réseau de distribution par relargage à partir de matériaux et de revêtements à base de ciment (Leroy et coll., 1996), même lorsque ces matériaux et revêtements sont certifiés et appliqués conformément aux normes de l'industrie (U.S. EPA, 2002). Mlynska et Zielina (2017) ont réalisé une étude en laboratoire pour comparer le relargage de l'aluminium à partir de deux échantillons de tuyaux ayant des revêtements de ciment différents : un revêtement préfabriqué de ciment pour tuyaux et un revêtement préparé sur place lors d'une rénovation de tuyaux. Les deux échantillons de conduite ont été remplis d'eau prélevée dans une station de traitement de l'eau (concentration d'aluminium non fournie). Des échantillons d'eau ont été prélevés sur chaque spécimen de conduite après des intervalles précis pouvant atteindre 56 jours. À la fin de l'expérience, les concentrations d'aluminium étaient d'environ 0,03 mg/L et 8 mg/L dans l'échantillon de conduite avec revêtement préfabriqué et dans l'échantillon de revêtement appliqué sur place, respectivement. Toutefois, il est important de noter que cette étude présente des conditions de stagnation rarement observées dans les réseaux de distribution. Lors d'un essai à grande échelle, Zielina et coll. (2015) ont rapporté le relargage d'aluminium après l'application d'un revêtement de mortier de ciment dans une conduite en acier de 500 mm (longueur de 614,5 m). Les concentrations d'aluminium sont passées de 0,043 mg/L à 0,293 mg/L après 3 heures et ont diminué à 0,052 mg/L après 11 heures. Berend et Trouwborst (1999) ont rapporté des concentrations d'aluminium de 650 μg/L 6 semaines après la pose d'un revêtement de mortier de ciment dans une conduite en fonte ductile de 2 200 mètres. Étant donné que les concentrations d'aluminium peuvent augmenter lorsque les conduites d'eau principales sont revêtues de mortier de ciment, il faudrait envisager de surveiller la qualité de l'eau.
Des directives supplémentaires concernant le relargage de l'aluminium à partir de matériaux et de revêtements à base de ciment sont disponibles dans le document de la U.S. EPA (2002).
4.4 Gestion des résidus
Les technologies de traitement peuvent générer une variété de résidus contenant de l'aluminium (p. ex. eau de lavage à contre-courant, eau/concentré de rejet). Si les résidus sont rejetés directement dans un plan d'eau ou si le processus de traitement des résidus comporte un rejet dans un plan d'eau, il faut communiquer avec l'autorité responsable en matière d'eau potable dans le secteur de compétence concerné pour vérifier les exigences applicables. On peut obtenir des recommandations auprès d'autres sources (CCME, 2003; CCME, 2007).
Dans certains cas, les flux résiduels riches en aluminium (p. ex. lavage à contre-courant des filtres, épaississeur surnageant) sont recyclés à l'entrée de la station de traitement pour améliorer les taux de récupération d'eau. Dans la mesure du possible, ces flux devraient être traités avant le recyclage pour éliminer les solides (y compris les particules d'aluminium et les contaminants coprécipités), ce qui améliorera et stabilisera la qualité de l'eau traitée (Confluence Engineering, 2018). Dans tous les cas, les flux résiduels recyclés devraient être traités avant d'être recyclés, afin de réduire les risques liés aux protozoaires entériques et aux virus (Santé Canada, 2019a, 2019b).
5.0 Stratégies de contrôle
Tous les services d'eau devraient mettre en œuvre une approche de gestion des risques, comme l'approche de la source au robinet ou du plan de gestion de la sécurité sanitaire de l'eau pour assurer la salubrité de l'eau (CCME, 2004; OMS, 2011, 2012). Ces approches exigent une évaluation du système pour caractériser la source d'approvisionnement en eau, décrire les obstacles au traitement qui empêchent ou réduisent la contamination, déterminer les conditions pouvant entraîner une contamination et mettre en œuvre des mesures de contrôle. La surveillance opérationnelle est ensuite établie, et des protocoles opérationnels et de gestion sont mis en place (p. ex. procédures opérationnelles normalisées, mesures correctives et interventions en cas d'incident). La surveillance de la conformité est déterminée, et d'autres protocoles de validation du plan de salubrité de l'eau sont mis en œuvre (p. ex. tenue de dossiers, satisfaction des consommateurs). La formation des opérateurs est également nécessaire pour assurer l'efficacité en tout temps du plan de salubrité de l'eau (Smeets et coll., 2009).
5.1 Stratégies de contrôle
Comme il est difficile de maîtriser l'accumulation et le rejet d'aluminium et d'autres contaminants d'origine sanitaire dans le réseau de distribution, la stratégie de contrôle devrait permettre de minimiser la concentration d'aluminium à la sortie de la station de traitement et à l'entrée du réseau de distribution. Deuxièmement, le réseau de distribution devrait être géré de manière à ce que l'eau potable se rende de la station de traitement au point de consommation avec le moins de perte de qualité possible. Étant donné que les sources d'approvisionnement en eau, les stations de traitement et les réseaux de distribution peuvent différer considérablement, une stratégie de contrôle spécifique au réseau sera nécessaire.
5.1.1 Traitement
Les services d'eau ont accès à de nombreuses recommandations qui les aident à mieux comprendre les mécanismes entourant la coagulation. (Edzwald, 1993; Pernitsky, 2003; Dempsey, 2006; O'Melia, 2006; Pernitsky et Edzwald, 2006; Shin et coll., 2008; Edzwald et Kaminski, 2009; AWWA, 2011b; Davis et Edwards, 2014). L'essai en pot est préférable pour les études d'optimisation. Il permet en effet d'effectuer facilement des tests utilisant différents types de coagulants, différentes doses, pH et vitesses de mélange. Le choix du coagulant dépend des caractéristiques de l'eau à traiter. Dans de nombreuses sources d'approvisionnement en eau, le dosage du coagulant sera déterminé par la quantité de MON présente plutôt que par la turbidité (Edzwald et Van Benschoten, 1990; Pernitsky et Edzwald, 2006; Edzwald et Kaminski, 2009; Santé Canada, 2018b).
Une stricte maîtrise du pH est nécessaire pour minimiser les concentrations résiduelles d'aluminium à la sortie de la station de traitement. Au tableau 10 sont présentées les plages de pH optimales qui conviennent le mieux aux coagulants d'alun et de PACl dans les eaux froides et tièdes (Edzwald, 2018). La concentration résiduelle d'aluminium pouvant être obtenue est également notée (p. ex, <0,03 mg/L à des températures <10 °C et <0,05 mg/L à des températures >10 °C). Les services d'eau devraient donc s'efforcer de réduire la quantité totale d'aluminium à <0,05 mg/L dans l'eau filtrée (avant l'ajout de fluorure ou de phosphore) et s'efforcer d'atteindre l'objectif de <0,03 mg/L lorsque les températures sont <10 °C (voir tableau 10).
Lors de la mise en œuvre des mesures de maîtrise du pH, les services d'eau doivent être conscients de l'impact de la post-chloration sur le pH (p. ex. diminution avec le chlore gazeux ou augmentation avec l'hypochlorite de sodium), particulièrement si la dose est ajustée sur une base saisonnière (Larson et Sollo, 1967; Costello, 1984; Reijnen et coll., 1991). Lorsqu'ils choisissent une dose de coagulant, les services d'eau doivent savoir qu'un sous-dosage destiné à diminuer le résidu d'aluminium peut entraîner une forte baisse de la capacité d'élimination des agents pathogènes (Huck et coll., 2001). Le bon dosage du coagulant et une maîtrise stricte du pH sont nécessaires pour obtenir une coagulation optimale et minimiser l'aluminium résiduel.
Tableau 10. Plages de pH optimales pour la coagulation en fonction de la température de l'eau
Coagulant |
Eau froide (<10 °C) |
Eau tiède (> 10 °C) |
||
| Plage de pH optimale | Teneur en aluminium réalisable |
Plage de pH optimale | Concentration d'aluminium réalisable | |
| Alun | 6,5 à 7 | 0,01-0,03 mg/L | 6,0 à 6,5 | 0,02-0,05 mg/L |
| PACl | 6,8 à 7,3 | 0,02-0,03 mg/L | 6,3 à 6,8 | 0,02-0,05 mg/L |
5.1.2 Réseau de distribution
Il est de plus en plus reconnu que les réseaux de distribution d'eau constituent un milieu complexe et dynamique, où peuvent survenir de nombreuses interactions et réactions susceptibles d'influer sur les concentrations d'aluminium au point de consommation. Les fluctuations saisonnières de la qualité de l'eau de source, les modifications du contrôle des procédés ou d'autres causes peuvent ultimement affecter le devenir et le déplacement de l'aluminium dans le réseau de distribution, entraînant une augmentation des concentrations d'aluminium au robinet. D'autres événements ou pratiques des services publics de distribution d'eau peuvent également entraîner des changements dans les propriétés chimiques de l'eau (p. ex., mélange de différentes sources, nitrification) (Hill et coll., 2010).Pour réduire au minimum la dégradation de la qualité de l'eau, les services d'eau devraient assurer la stabilité des propriétés chimiques de l'eau afin de favoriser la solubilité constante de l'aluminium basée sur l'équilibre, de préférence par sous-saturation afin de réduire le risque de précipitation et d'accumulation de l'aluminium dans l'ensemble du réseau de distribution. La stabilité des conditions chimiques de l'eau minimise également le risque de désorption (libération) de l'aluminium et des contaminants d'origine sanitaire qui peuvent former des complexes ou être coprécipités sur ou dans les dépôts d'aluminium existants (ainsi que dans les dépôts de manganèse et d'autres solides). Les principaux paramètres de qualité de l'eau se rapportant à ces mécanismes comprennent le pH, la température, le potentiel d'oxydoréduction, la MON, le sulfate, le carbone inorganique dissous, le fluorure et les concentrations résiduelles d'orthophosphate ou de silicate (lorsqu'ils sont utilisés pour contrôler la corrosion). De plus, il faudrait maintenir la qualité de l'eau de façon à éviter la détérioration du béton, des tuyaux de ciment et des revêtements de mortier de ciment, et ce afin de minimiser le relargage de l'aluminium (et du calcium, etc.) de ces matrices (Leroy et coll., 1996). Les services d'eau devraient déterminer la qualité de base de l'eau à l'entrée de leur réseau ainsi que pendant son transit dans le réseau, puis fixer des conditions limites à l'extérieur desquelles tout écart pourrait déclencher un rejet (Friedman et coll., 2016).
Selon la situation, il existe diverses méthodes pour améliorer la stabilité de ces paramètres, comme le choix de l'installation de traitement, la modification des procédés de traitement existants, l'amélioration de la surveillance et du contrôle des procédés (à la station de traitement et dans le réseau de distribution), l'admission graduelle et contrôlée de sources nouvelles ou saisonnières et le mélange contrôlé de sources dissemblables (Confluence Engineering, 2018). Avant d'admettre une nouvelle source et d'appliquer un procédé de traitement nouveau ou modifié à une source existante, il faut réaliser des essais pilotes sur des échantillons prélevés dans des segments du réseau afin de tenir compte des points suivants et d'éviter les conséquences non intentionnelles (Hill et Giani, 2017) :
- évaluer la présence et l'inventaire d'aluminium et d'autres contaminants d'origine sanitaire dans le calcaire accumulé dans les canalisations;
- déterminer le comportement des conduites et des dépôts ou du calcaire en réaction à la nouvelle source d'approvisionnement en eau ou à sa nouvelle composition chimique;
- évaluer les approches visant à atténuer toute réaction indésirable observée.
La variabilité du pH du réseau de distribution devrait être réduite au minimum, soit à ±0,2 unité (Muylwyk et MacDonald, 2001; Friedman et coll., 2010; Santé Canada, 2015).
La biostabilité du réseau de distribution est une autre importante condition à surveiller pour minimiser l'accumulation et le rejet de contaminants. Il est possible de maintenir la biostabilité en réduisant au minimum la présence d'éléments nutritifs dans l'eau (p. ex. carbone organique, ammoniac, nitrate/nitrite, phosphore total), en surveillant la durée de séjour de l'eau dans le réseau et en maintenant un résidu suffisant de désinfectant (Cantor, 2017; Santé Canada, 2018b).
Les autres mesures qui contribuent à maintenir des conditions chimiques et biologiques stables dans le réseau de distribution comprennent le nettoyage des conduites (p. ex., rinçage unidirectionnel, ramonage des conduites), le remplacement des conduites et l'exécution d'un traitement conçu pour réduire au minimum la charge des autres puits de contaminants (p. ex., fer, manganèse) et la diminution des concentrations de contaminants entrant dans le réseau (p. ex., arsenic, baryum, chrome et manganèse) (Friedman et coll., 2010; Cantor, 2017).
Dans les réseaux utilisant l'orthophosphate pour lutter contre la corrosion, ce produit devrait être appliqué à tous les points d'entrée du réseau, et une concentration résiduelle devrait être maintenue à un niveau constant dans tout le réseau de distribution pour favoriser la stabilité du calcaire contenant du phosphate (Friedman et coll. 2010). À noter que les polyphosphates (c.-à-d. les produits ortho/poly mélangés) peuvent ramollir les matrices de ciment et causer le relargage de l'aluminium (calcium, etc.) dans le réseau de distribution (Leroy et coll., 1996).
5.2 Surveillance
Les concentrations d'aluminium peuvent varier d'une source d'approvisionnement en eau à l'autre et à l'intérieur des stations de traitement et des réseaux de distribution. Par conséquent, les programmes de surveillance doivent être établis de manière à permettre aux services d'eau de tenir compte des concentrations d'aluminium de la source au robinet. Les programmes de surveillance doivent être conçus pour permettre de vérifier que les stratégies de contrôle fonctionnent comme prévu et pour tenir compte des facteurs de risque qui contribuent à la probabilité d'une teneur élevée en aluminium dans le système d'approvisionnement en eau potable.
5.2.1 Caractérisation de la source d'approvisionnement en eau
La caractérisation des sources d'approvisionnement en eau devrait faire partie des évaluations de routine du réseau et devrait inclure une bonne connaissance des concentrations d'aluminium dans l'eau de source (eaux souterraines et eaux de surface) et des conditions susceptibles de causer des changements dans ces concentrations. La surveillance ponctuelle de la source d'approvisionnement en eau devrait être effectuée chaque trimestre, en même temps que la surveillance du réseau de traitement et de distribution, comme il est indiqué ci-dessous.
5.2.2 Surveillance opérationnelle
Comme l'aluminium est un paramètre de procédé important pour assurer une coagulation optimale, les services d'eau qui utilisent des coagulants à base d'aluminium doivent effectuer un contrôle quotidien ou plus fréquent de l'aluminium total (Edzwald, 2018). Ces mesures doivent être effectuées sur place à l'aide d'un analyseur colorimétrique en ligne ou portatif (Edzwald, 2018). Un programme approprié d'AQ/CQ et de vérification devrait également être en place. Afin de minimiser les interférences, il faut prélever les échantillons après la filtration et avant tout ajout de fluorure ou de phosphate. La surveillance des concentrations d'aluminium dissous est également recommandée pour le contrôle du procédé. Les services d'eau qui utilisent des coagulants à base d'aluminium doivent viser une VOR de 0,050 mg/L et s'efforcer d'atteindre une cible de 0,030 mg/L pour l'aluminium total.
Des mesures devraient également être mises en place pour évaluer la contribution de l'aluminium provenant d'autres produits chimiques de traitement de l'eau. Il est possible de déterminer cette contribution en comparant les concentrations d'aluminium dans l'effluent du filtre et dans l'eau traitée lorsque des coagulants à base d'aluminium sont utilisés, ou en comparant les concentrations d'aluminium brut et traité dans d'autres réseaux.
5.2.3 Surveillance du réseau de distribution
Étant donné que les concentrations d'aluminium peuvent changer à la grandeur du réseau de distribution (Halton, 2001), il faut exercer une bonne surveillance dans le réseau de distribution (Friedman et coll., 2010) et prélever des échantillons appariés d'eau brute et d'eau traitée. Compte tenu du lien étroit entre l'élimination de la MON, l'optimisation de la coagulation et les résidus d'aluminium, il est recommandé de mesurer les concentrations d'aluminium à une fréquence trimestrielle dans des échantillons à écoulement libre, de pair avec la surveillance des sous-produits de désinfection (Santé Canada, 2018c). Cette surveillance devrait porter notamment sur les concentrations d'aluminium dissous et total, le pH, la température et les résidus d'orthophosphate (le cas échéant) (Cantor, 2017). On devrait aussi calculer la moyenne annuelle courante à partir d'un nombre minimal d'échantillons prélevés à une fréquence trimestrielle, afin d'établir des comparaisons avec la CMA et la VOR. Afin de réduire au minimum le risque d'accumulation et de rejet d'aluminium et de contaminants concomitants, d'interférence avec l'orthophosphate (le cas échéant) et de problèmes liés à l'apparence visuelle (p. ex., couleur, turbidité), les services d'eau devraient s'efforcer de maintenir les concentrations d'aluminium sous 0,050 mg/L dans le réseau.
De plus, il faut surveiller les événements inhabituels pendant les périodes où les conditions augmentent le risque de rejet, par exemple à la suite de perturbations d'ordre hydraulique (rinçage des conduites d'eau, etc.) ou de changements dans les propriétés chimiques de l'eau (p. ex., changements du pH, de la température, du type de source d'approvisionnement en eau, du chlore résiduel) ainsi qu'en cas de signalement de décoloration de l'eau (Friedman et coll., 2016). Des échantillons devraient être prélevés à divers points du réseau de distribution (comme les bornes d'incendie et les valves) ainsi qu'aux robinets d'eau potable des édifices publics ou privés, afin de mieux déterminer la cause des événements et les concentrations d'aluminium au point d'utilisation (c.-à-d., le robinet). Les échantillons prélevés lors d'événements inhabituels devraient également être analysés afin de déterminer la présence concomitante d'autres métaux dans le réseau de distribution et leur rejet avec l'aluminium (p. ex. arsenic, chrome, cuivre, fer, plomb, plomb, manganèse, nickel).
Lors des opérations de revêtement des conduites d'eau principales sur place avec du mortier de ciment, il faut surveiller la qualité de l'eau afin de déterminer si de l'aluminium s'infiltre dans l'eau potable.
5.2.4 Surveillance de la conformité
On devrait calculer la moyenne annuelle courante par emplacement d'aluminium total dans l'eau potable à partir d'un nombre minimal d'échantillons prélevés dans le réseau de distribution à une fréquence trimestrielle, afin d'établir des comparaisons avec la CMA. Il faut communiquer avec l'autorité responsable en matière d'eau potable dans le secteur de compétence concerné afin de confirmer comment la VOR proposée de 0,050 mg/L sera appliquée aux installations utilisant des coagulants à base d'aluminium et un plan de gestion du réseau de distribution.
Les services d'eau qui prennent des mesures préventives dans des conditions hydrauliques, physiques, chimiques et biologiques stables et qui disposent de données de référence indiquant l'absence d'aluminium dans leur réseau peuvent réduire la fréquence de leurs contrôles.
5.2.5 Caractérisation et inventaire des dépôts
Il existe peu de données indiquant que les contaminants d'origine sanitaire mesurés au robinet (p. ex., le plomb) proviennent des dépôts d'aluminium. D'autres travaux devront être réalisés pour déterminer si ces interactions sont semblables à celles qui existent entre le plomb et le fer dans les systèmes d'approvisionnement en eau potable. La caractérisation des dépôts dans les conduites peut aider à mieux connaître les interactions entre l'aluminium et les autres éléments. La spéciation de l'aluminium (c.-à-d. particules et éléments dissous) et d'autres éléments au point d'utilisation peut permettre de déterminer les voies par lesquelles les contaminants inorganiques à l'état de traces sont mobilisés (p. ex., particules riches en aluminium et plomb adsorbé). Cette recherche s'appuie sur des méthodes spécialisées pouvant nécessiter un partenariat entre les services d'eau et les universités ou les laboratoires commerciaux de pointe.
Il est également conseillé de faire un inventaire de masse (c.-à-d. masse par surface de paroi de conduite) de l'aluminium et des autres contaminants présents dans les dépôts du réseau de distribution, afin d'obtenir des hausses de concentration propres au site susceptibles de survenir dans un scénario de rejet (Brandhuber et coll., 2015). L'étude de Friedman et coll. (2010) fournit des conseils sur le prélèvement d'échantillons de tuyaux afin d'établir un inventaire de la masse et de la composition des solides du réseau de distribution.
6.0 Considérations internationales
Cette section présente les recommandations, normes et conseils relatifs à l'eau potable qu'ont établis d'autres organismes nationaux et internationaux. Les valeurs varient en fonction de la date à laquelle remonte l'évaluation sur laquelle elles sont fondées, et en fonction des différences relatives aux politiques et aux démarches appliquées, y compris en ce qui concerne le choix de l'étude principale ou les taux de consommation, les poids corporels et les facteurs d'attribution employés.
À l'exception de l' EPA de la Californie, aucun autre organisme national ou international n'a fixé de limites pour l'aluminium dans l'eau potable en fonction de considérations sanitaires. Les VOR non prévues par la réglementation ont plutôt été établies en fonction de considérations opérationnelles ou esthétiques. L'OMS a fixé des valeurs pratiques de 0,1-0,2 mg/L fondées sur l'optimisation du processus de coagulation dans les stations de traitement de l'eau (OMS, 2010). L'U.S. EPA a fixé une concentration maximale secondaire de contaminants de 0,05 à 0,2 mg/L (U.S. EPA, 2018), tandis que l'Australie a choisi un objectif esthétique de 0,2 mg/L (NHMRC et NRMMC, 2011) et la Nouvelle-Zélande a fixé une valeur de recommandation de 0,1 mg/L pour des considérations esthétiques (New Zealand Ministry of Health, 2008).
Dans son évaluation de l'aluminium dans l'eau potable, l'OMS (2010) a calculé une valeur basée sur la santé de 0,9 mg/L (arrondi) mais a insisté sur la nécessité de ne pas dépasser les niveaux pratiques de 0,1-0,2 mg/L pour assurer l'optimisation du processus de coagulation, afin de prévenir la contamination microbienne et minimiser le dépôt de floc d'aluminium dans le réseau de distribution. La recommandation proposée du Canada est différente de la valeur basée sur la santé de l'OMS parce que le Canada a pris en compte des avancements dans la science depuis 2010. L'évaluation de l'OMS est basée sur l'apport hebdomadaire tolérable provisoire d'aluminium précédent de 1 mg/kg de poids corporel par jour du JECFA (JECFA, 2007). Le JECFA a depuis révisé son apport hebdomadaire tolérable provisoire d'aluminium à 2 mg/kg poids corporel par jour (JECFA, 2012), basé sur l'étude principale, Poirier et coll. 2011, qui est utilisé dans la recommandation canadienne
L'EPA de la Californie (2008) a établi un objectif de santé publique non réglementaire pour l'aluminium de 0,6 mg/L, d'après des concentrations sériques élevées d'aluminium dans une étude sur l'équilibre de masse d'un humain (Greger et Baier, 1993), ainsi que sur la détérioration du développement neurologique chez les nourrissons prématurés qui reçoivent de l'aluminium parentéral (Bishop et coll. 1997).
7.0 Justification
La CMA proposée de 2,9 mg/L (2 900 μg/L) protège des effets potentiels sur la santé et peut être mesurée de façon fiable par les méthodes d'analyse disponibles et obtenue par coagulation. Cependant, la présence d'aluminium à de faibles concentrations peut causer des difficultés d'ordre opérationnel et esthétique dans le réseau de distribution. Par conséquent, une VOR de 0,050 mg/L (50 μg/L) est également proposée pour l'aluminium total afin d'éviter ces problèmes.
L'aluminium est présent dans les sources d'approvisionnement en eau potable à la fois naturellement et par suite des activités humaines. Les concentrations d'aluminium dans l'eau varient d'un bout à l'autre du Canada, les eaux de surface présentant généralement des concentrations plus élevées que les eaux souterraines. Des sels d'aluminium sont couramment ajoutés comme coagulants pendant le traitement de l'eau afin d'éliminer la turbidité, la matière organique et les microorganismes. L'aluminium est également une impureté que l'on retrouve dans d'autres produits chimiques utilisés dans le traitement de l'eau et qui entre dans l'eau potable à partir des tuyaux ou des revêtements de mortier de ciment. Compte tenu des propriétés chimiques de l'aluminium, l'absorption d'aluminium présent dans l'eau potable se fait par ingestion et ne devrait pas se produire par contact cutané ou par inhalation pendant la douche ou le bain.
Le système nerveux est généralement considéré comme la principale cible de la toxicité de l'aluminium. Des études chez les animaux ont constamment démontré des effets neurologiques indésirables à la suite de l'ingestion de fortes concentrations d'aluminium, ce qui confirme les effets observés dans les études chez l'humain. Des études chez l'humain ont révélé des associations possibles entre l'ingestion d'aluminium et des maladies neurologiques comme la démence et la maladie d'Alzheimer; toutefois, des limites de conception empêchent l'utilisation de ces études comme base pour développer la VHB. Une VHB de 2,9 mg/L (2 900 μg/L) pour l'aluminium total a été établie en fonction des effets neurologiques observés chez les rats. La VHB repose sur les données scientifiques les plus récentes, et en particulier sur des études rigoureuses qui n'étaient pas disponibles pour le calcul des VHB antérieures (p. ex. la VHB de 0,9 mg/L de l'OMS et la VHB de 0,6 mg/L de l'EPA de la Californie). Aux fins de la présente évaluation des risques, la VHB est désignée comme la CMA parce qu'elle peut être obtenue au moyen d'un traitement et qu'elle est mesurée de façon fiable. La VOR proposée de 0,050 mg/L (50 μg/L) vise à réduire au minimum le risque d'accumulation et de rejet d'aluminium et de contaminants concomitants dans le réseau de distribution d'eau, ainsi que leur interférence avec l'orthophosphate (le cas échéant).
Santé Canada continuera, dans le cadre de son processus continu de révision des recommandations, à suivre les nouvelles recherches nationales et internationales à ce sujet, et recommandera au besoin toute modification jugée appropriée.
8.0 Références
Abdel Moneim, A., Othman, M.S., Mohmoud, S.M. and El-Deib, K.M. (2013). Pomegranate peel attenuates aluminum-induced hepatorenal toxicity. Toxicol. Mech. Method., 23(8): 624-633.
Abu-Taweel, G.M., Ajarem, J.S. and Ahmad, M. (2012). Neurobehavioral toxic effects of perinatal oral exposure to aluminum on the developmental motor reflexes, learning, memory and brain neurotransmitters of mice offspring. Pharmacol. Biochem. Be., 101(1): 49-56.
ACIA (2018). Résidus chimiques dans les aliments : Rapport du projet sure les aliments destinés aux enfants 2013-2014 et Arsenic, cadmium, plomb, mercure et aluminum dans les préparations pour nourrissons 2011-2012. Direction des sciences de la salubrité des aliments, Agence canadienne d'inspection des aliments, Ottawa. Accessible à l'adresse : http://www.inspection.gc.ca/aliments/residus-chimiques-microbiologie/residus-chimiques/fra/1324258929171/1324264923941
Akatsu, H., Hori, A., Yamamoto, T., Yoshida, M., Mimuro, M., Hashizume, Y., Tooyama, I. and Yezdimer, E.M. (2011). Transition metal abnormalities in progressive dementias. Biometals, 25(2): 337-350.
Akinola, O.B., Biliaminu, S.A., Adediran, R.A., Adeniye, K.A. and Abdulquadir, F.C. (2015). Characterization of prefrontal cortex microstructure and antioxidant status in a rat model of neurodegeneration induced by aluminium chloride and multiple low-dose streptozotocin. Metab. Brain Dis., 30(6): 1531-1536.
Akinola, O.B., Biliaminu, S.A., Adedeji, O.G., Oluwaseun, B.S., Olawoyin, O.M. and Adelabu, T.A. (2016). Combined effects of chronic hyperglycaemia and oral aluminium intoxication on testicular tissue and some male reproductive parameters in Wistar rats. Andrologia, 48(7): 779-786.
Akinrinade, I.D., Memudu, A.E., Ogundele, O.M. and Ajetunmobi, O.I. (2015). Interplay of glia activation and oxidative stress formation in fluoride and aluminium exposure. Pathophysiology, 22(1): 39-48.
Akiyama, H., Hosokawa, M., Kametani, F., Kondo, H., Chiba, M., Fukushima, M. and Tabira, T. (2011). Long-term oral intake of aluminium or zinc does not accelerate Alzheimer pathology in ABPP and ABPP/tau transgenic mice. Neuropathology, 32(4): 390-397.
Alabdula'aly, A. (1998). Trace metals in groundwater and treatment plant product water of the central region of Saudi Arabia. Desalination, 120(1-2): 163-168.
Alberta Environment and Parks (2017). Personal communication with Donald Reid, Operations Division.
Albizzati, A., More, L., Di Candia, D., Saccani, M. and Lenti, C. (2012). Normal concentrations of heavy metals in autistic spectrum disorders. Minerva Pediatr., 64(1): 27-31.
Allenby, M. (2004). Aluminum compounds cause operational problems in a reverse osmosis plant. Mater. Perform., 43(5): 44-46.
Altmann, P., Cunningham, J., Dhanesha, U., Ballard, M., Thompson, J. and Marsh, F. (1999). Disturbance of cerebral function in people exposed to drinking water contaminated with aluminium sulphate: Retrospective study of the Camelford water incident. BMJ, 319(7213): 807-811.
Anderson, W.B., Jasim, S.Y., Urfer, D. and Huck, P.M. (1998). Coagulant and pH control alternatives for soluble aluminum control. In: Proceedings of the American Water Works Association Water Quality Technology Conference, San Diego, California. American Water Works Association, Denver, Colorado.
Anderson, L.E., Krkošek, W.H., Stoddart, A.K., Trueman, B.F. and Gagnon, G.A. (2017). Lake recovery through reduced sulfate deposition: A new paradigm for drinking water treatment. Environ. Sci. Technol., 51(3): 1414-1422.
APHA, AWWA and WEF (1995). Standard methods for the examination of water and wastewater. 19th edition. American Public Health Association, American Water Works Association and Water Environment Federation, Washington, DC.
APHA, AWWA and WEF (2017). Standard methods for the examination of water and wastewater. 23rd edition. American Public Health Association, American Water Works Association and Water Environment Federation, Washington, DC.
Appelo, C.A.J. and Postma, D. (1996). Geochemistry, groundwater and pollution. Third edition. A.A. Balkema, Rotterdam, Netherlands.
Arain, M.S., Afridi, H.I., Kazi, T.G., Talpur, F.N., Arain, M.B., Kazi, A., Arain, S.A. and Ali, J. (2015). Correlation of aluminum and manganese concentration in scalp hair samples of patients having neurological disorders. Environ. Monit. Assess., 187(2): 10.
ATSDR (2008). Toxicological profile for aluminum. Agency for Toxic Substances and Disease Registry, Public Health Service, U.S. Department of Health and Human Services, Atlanta, GA.
AWWA (2011a). Internal corrosion control in water distribution systems: Manual of water supply practices M58. First edition. American Water Works Association, Denver, Colorado.
AWWA (2011b). Operational control of coagulation and filtration processes: Manual of water supply practices M37. Third edition. American Water Works Association, Denver, Colorado.
Bakar, C., Karaman, H., Baba, A. and Sengunalp, F. (2010). Effect of high aluminum concentration in water resources on human health, case study: Biga Peninsula, northwest part of Turkey. Arch. Environ. Contam. Toxicol., 58(4): 935-944.
Baum, L., Chan, I.H., Cheung, S.K., Goggins, W.B., Mok, V., Lam, L., Leung, V., Hui, E., Ng, C., Woo, J., Chiu, H.F., Zee, B.C., Cheng, W., Chan, M.H., Szeto, S., Lui, V., Tsoh, J., Bush, A.I., Lam, C.W. and Kwok, T. (2010). Serum zinc is decreased in Alzheimer's disease and serum arsenic correlates positively with cognitive ability. Biometals, 23(1): 173-179.
Baylis, J.R. (1953). Cast-iron pipe coatings and corrosion. J. Am. Water Works Assoc., 45(8): 807-831.
Belaid-Nouira, Y., Bakhta, H., Bouaziz, M., Flehi-Slim, I., Haouas, Z. and Cheikh, H.B. (2012). Study of lipid profile and parieto-temporal lipid peroxidation in AlCl3 mediated neurotoxicity. Modulatory effect of fenugreek seeds. Lipids Health Dis., 11(1): 16.
Belaid-Nouira, Y., Bakhta, H., Haouas, Z., Flehi-Slim, I. and Cheikh, H.B. (2013a). Fenugreek seeds reduce aluminum toxicity associated with renal failure in rats. Nutr. Res. Pract., 7(6): 466.
Belaid-Nouira, Y., Bakhta, H., Haouas, Z., Flehi-Slim, I., Neffati, F., Najjar, M.F. and Cheikh, H.B. (2013b). Fenugreek seeds, a hepatoprotector forage crop against chronic AlCl3 toxicity. BMC Vet. Res., 9(1): 22.
Belaid-Nouira, Y., Bakhta, H., Samoud, S., Trimech, M., Haouas, Z. and Cheikh, H.B. (2013c). A novel insight on chronic AlCl3 neurotoxicity through IL-6 and GFAP expressions: Modulating effect of functional food fenugreek seeds. Nutr. Neurosci., 16(5): 218-224.
Berend, K. and Trouwborst, T. (1999). Cement-mortar pipes as a source of aluminum. J. Am. Water Works Assoc., 91(7): 91-100.
Bhasin, P., Singla, N. and Dhawan, D.K. (2012). Protective role of zinc during aluminum-induced hepatotoxicity. Environ. Toxicol., 29(3): 320-327.
Bhattacharjee, S., Zhao, Y., Hill, J.M., Culicchia, F., Kruck, T.P.A., Percy, M.E., Pogue, A.I., Walton, J.R. and Lukiw, W.J. (2013). Selective accumulation of aluminum in cerebral arteries in Alzheimer's disease (AD). J. Inorg. Biochem., 126: 35-37.
Bishop, N.J., Morley, R., Day, J.P. and Lucas, A. (1997). Aluminum neurotoxicity in preterm infants receiving intravenous-feeding solutions. N. Engl. J. Med., 336: 1557-1561.
Brandhuber, P., Craig, S., Friedman, M., Hill, A., Booth, S. and Hanson, A. (2015). Legacy of manganese accumulation in water systems. Water Research Foundation, Denver, Colorado.
British Columbia Ministry of Health (2017). Personal communication with Drinking Water Manager David Fishwick.
Cal EPA (2001). Public health goal for aluminum in drinking water. Office of Environmental Health Hazard Assessment, California Environmental Protection Agency. April 2001.
Callan, A.C., Devine, A., Qi, L., Ng, J.C. and Hinwood, A.L. (2015). Investigation of the relationship between low environmental exposure to metals and bone mineral density, bone resorption and renal function. Int. J. Hyg. Environ. Health, 218(5): 444-451.
Cantor, A. (2017). Optimization of phosphorus-based corrosion control chemicals using a comprehensive perspective of water quality. Water Research Foundation, Denver, Colorado.
Cantwell, R.E., Muylwyk, Q., Waller, M., Stuart, J., Rossi, G. and Snoeyink, V.L. (2012). Role of pH for phosphate-based lead control in Windsor, Ontario, Canada. In: Proceedings of the American Water Works Association Water Quality Technology Conference, Toronto, Ontario. American Water Works Association, Denver, Colorado.
CCME (2003). Guide concernant l'application propre à un lieu des Recommandations pour la qualité des eaux au Canada : procédures d'établissement d'objectifs numériques de qualité de l'eau, Conseil canadien des ministres de l'environnement, Winnipeg (Manitoba).
CCME (2004). De la source au robinet : guide d'application de l'approche à barrières multiples pour une eau potable saine, Conseil canadien des ministres de l'environnement, Winnipeg (Manitoba).
CCME (2007). Protocole d'élaboration des recommandations pour la qualité des eaux en vue de protéger la vie aquatique, Conseil canadien des ministres de l'environnement, Winnipeg (Manitoba).
Cetin, I., Nalbantcilar, M.T., Tosun, K. and Nazik, A. (2017). How trace element levels of public drinking water affect body composition in Turkey. Biol. Trace Elem. Res., 175(2): 263-270.
CIRC (2012). Chemical agents and related occupations. A review of human carcinogens. Occupational exposures during aluminum production. International Agency for Research on Cancer Monograph Vol 100F. IARC, Lyon.
Colomina, M.T., Roig, J.L., Torrente, M., Vicens, P. and Domingo, J.L. (2005). Concurrent exposure to aluminum and stress during pregnancy in rats: Effects on postnatal development and behavior of the offspring. Neurotoxicol. Teratol. 27(4): 565-574.
Confluence Engineering (2018). Personal communication. Seattle, Washington.
Cooper, R.E. and Knowles, W.L. (1975). Loss in capacity of a large diameter water pipeline. In: Proceedings of the American Water Works Association Water Quality Technology Conference, Minneapolis, Minnesota. American Water Works Association, Denver, Colorado.
Costello, J.J. (1984). Postprecipitation in distribution systems. J. Am. Water Works Assoc., 76(11): 46-49.
Cui, X., Wang, B., Zong, Z., Liu, S. and Xing, W. (2012). The effects of chronic aluminum exposure on learning and memory of rats by observing the changes of ras/raf/ERK signal transduction pathway. Food Chem. Toxicol., 50(2): 315-319.
Dahl, C., Sogaard, A.J., Tell, G.S., Flaten, T.P., Hongve, D., Omsland, T.K., Holvik, K., Meyer, H.E. and Aamodt, G. (2014). Do cadmium, lead, and aluminum in drinking water increase the risk of hip fractures? A NOREPOS study. Biol. Trace Elem. Res., 157(1): 14-23.
Davis, C.C. and Edwards, M. (2014). Coagulation with hydrolyzing metal salts: Mechanisms and water quality impacts. Crit. Rev. Environ. Sci. Technol., 44(4): 303-347.
Del Toral, M.A., Porter, A. and Schock, M.R. (2013). Detection and evaluation of elevated lead release from service lines: A field study. Environ. Sci. Technol., 47(16): 9300-9307.
Dempsey, B.A. (2006). Coagulant characteristics and reactions. Chapter 2 in: Interface science in drinking water treatment: Theory and applications. G. Newcombe and D. Dixon (eds). Academic Press, London, United Kingdom. pp. 5-24.
Dietrich, A.M. (2015). EPA secondary maximum contaminants levels: A strategy for drinking water quality and consumer acceptability. Water Research Foundation, Denver, Colorado.
Donald, J.M., Golub, M.S., Gershwin, M.E. and Keen, C.L. (1989). Neurobehavioral effects in offspring of mice given excess aluminum in diet during gestation and lactation. Neurotoxicol. Teratol. 11(4): 345-351.
do Nascimento, S.N., Charao, M.F., Moro, A.M., Roehrs, M., Paniz, C., Baierle, M., Brucker, N., Gioda, A., Barbosa, F., Bohrer, D., Avila, D.S. and Garcia, S.C. (2014). Evaluation of toxic metals and essential elements in children with learning disabilities from a rural area of southern Brazil. Int. J. Environ. Res. Public. Health., 11(10): 10806-10823.
Dong, C., Cao, J., Cao, C., Han, Y., Wu, S., Wang, S. and Wang, J. (2016). Effects of fluoride and aluminum on expressions of StAR and P450scc of related steroidogenesis in guinea pigs' testis. Chemosphere, 147: 345-351.
Driscoll, C.T. and Letterman, R.D. (1995). Factors regulating residual aluminium concentrations in treated waters. Environmetrics, 6(3): 287-305.
Driscoll, C.T., Letterman, R.D. and Fitch, D.E. (1987). Residual aluminum in filtered water. American Water Works Association, Denver, Colorado.
Drobyshev, E.J., Solovyev, N.D., Gorokhovskiy, B.M. and Kashuro, V.A. (2018). Accumulation patterns of sub-chronic aluminum toxicity model after gastrointestinal administration in rats. Biol. Trce Elem. Res., 185(2): 384-394.
Edzwald, J.K. (1993). Coagulation in drinking water treatment: Particles, organics and coagulants. Water Sci. Technol., 27(11): 21-35.
Edzwald, J.K. (2018). Personal communication. University of Massachusetts, Potsdam, New York.
Edzwald, J.K. and Van Benschoten, J.E. (1990). Aluminum coagulation of natural organic matter. In: Chemical water and wastewater treatment: Proceedings of the 4th Gothenburg Symposium, Madrid, Spain. pp. 341-359.
Edzwald, J.K. and Kaminski, G.S. (2009). A practical method for water plants to select coagulant dosing. J. N. Engl. Water Works Assoc., 123(1): 15-31.
Edzwald, J.K. and Haarhoff, J. (2012). Dissolved air flotation for water clarification. McGraw Hill, New York.
EFSA (2008). Safety of aluminium from dietary intake - scientific opinion of the panel on food additives, flavourings, processing aids and food contact materials (AFC). European Food Safety Authority. EFSA Journal, (7): 1-34.
ElBaz, F.K., Aly, H.F. and Ali, G.H. (2017). Haematococcus pluvialis modulating effect on neurotransmitters, hormones and oxidative damage-associated with Alzheimer's disease in experimental rat's model. Int. J. Pharm. Pharm. Sci., 9(2) : 198-206.
Environnement et Changement climatique Canada (2017). Données nationales de monitoring de la qualité de l'eau à long terme. Accessible à l'adresse : http://donnees.ec.gc.ca/data/substances/monitor/national-long-term-water-quality-monitoring-data/?lang=fr
Environnement Canada et Santé Canada (2010). Liste des substances d'intérêt prioritaire - Rapport d'évaluation - Suivi du rapport sur l'état de la science, 2000 : Chlorure d'aluminium, Nitrate d'aluminium, Sulfate d'aluminium, Ottawa. Accessible à l'adresse : https://www.ec.gc.ca/lcpe-cepa/default.asp?lang=Fr&n=AA0EAAFE-1
Erazi, H., Sansar, W., Ahboucha, S. and Gamrani, H. (2010). Aluminum affects glial system and behavior of rats. C. R. Biol., 333(1) : 23-27.
Erazi, H., Ahboucha, S. and Gamrani, H. (2011). Chronic exposure to aluminum reduces tyrosine hydroxylase expression in the substantia nigra and locomotor performance in rats. Neurosci. Lett., 487(1): 8-11.
Exley, C. (2006). Severe cerebral congophilic angiopathy coincident with increased brain aluminium in a resident of Camelford, Cornwall, UK. J. Neurol. Neurosur. Ps., 77(7): 877-79.
Exley, C. (2013). Aluminum in biological systems. In: Encyclopedia of metalloproteins. Aluminum in biological systems. Springer, New York. pp. 33-34.
Exley, C., House, E., Polwart, A. and Esiri, M.M. (2012). Brain burdens of aluminum, iron, and copper and their relationships with amyloid-beta pathology in 60 human brains. J. Alzheimers Dis., 31(4): 725-730.
Farhat, S.M., Mahboob, A. and Ahmed, T. (2017a). Cortex- and amygdala-dependent learning and nicotinic acetylcholine receptor gene expression is severely impaired in mice orally treated with AlCl3. Biol. Trace Elem. Res., 179(1): 91-101.
Farhat, S.M., Mahboob, A., Iqbal, G. and Ahmed, T. (2017b). Aluminum-induced cholinergic deficits in different brain parts and its implications on sociability and cognitive functions in mouse. Biol. Trace Elem. Res., 177(1): 115-121.
Flarend, R., Bin, T., Elmore, D. and Hem, S.L. (2001). A preliminary study of the dermal absorption of aluminium from antiperspirants using aluminium-26. Food Chem. Toxicol., 39(2): 163-168.
Foley, P.D. (1980). Experience with direct filtration at Ontario's Lake Huron Treatment Plant. J. Am. Water Works Assoc., 72(3): 162-164.
Friedman, M.J., Hill, A.S., Reiber, S.H., Valentine, R.L. and Korshin, G.V. (2010). Assessment of inorganics accumulation in drinking water system scales and sediments. Water Research Foundation, Denver, Colorado.
Friedman, M., Hill, A., Booth, S., Hallett, M., McNeill, L., McLean, J., Sorensen, D., Hammer, T., De Haan, M., MacArthur, K. and Mitchell, K. (2016). Metals accumulation and release within the distribution system: Evaluation and mitigation. Water Research Foundation, Denver, Colorado.
Frommell, D.M., Feld, C.M., Snoeyink, V.L., Melcher, B. and Feizoulof, C. (2004). Aluminum residual control using orthophosphate. J. Am. Water Works Assoc., 96(9): 99-109.
Fu, Y., Jia, F.B., Wang, J., Song, M., Liu, S.M., Li, Y.F., Liu, S.Z. and Bu, Q.W. (2014). Effects of sub-chronic aluminum chloride exposure on rat ovaries. Life Sci., 100(1): 61-66.
Fuge, R., Pearce, N.J.G. and Perkins, W.T. (1992). Unusual sources of aluminium and heavy metals in potable waters. Environ. Geochem. Health, 14(1): 15-18.
Garzillo, E.M., Lamberti, M., Genovese, G., Pedata, P., Feola, D., Sannolo, N., Daniele, L., Trojsi, F., Monsurro, M.R. and Miraglia, N. (2014). Blood lead, manganese, and aluminum levels in a regional Italian cohort of ALS patients. J. Occup. Environ. Med., 56(10): 1062-1066.
Ghorbel, I., Chaabane, M., Elwej, A., Boudawara, O., Abdelhedi, S., Jamoussi, K., Boudawara, T. and Zeghal, N. (2016a). Expression of metallothioneins I and II related to oxidative stress in the liver of aluminium-treated rats. Arch. Physiol. Biochem., 122(4): 214-222.
Ghorbel, I., Maktouf, S., Fendri, N., Jamoussi, K., Ellouze, C.S., Boudawara, T. and Zeghal, N. (2016b). Co-exposure to aluminum and acrylamide disturbs expression of metallothionein, proinflammatory cytokines and induces genotoxicity: Biochemical and histopathological changes in the kidney of adult rats. Environ. Toxicol., 31(9): 1044-1058.
Ghorbel I., Amara I.B., Ktari N., Elwej A., Boudawara O., Boudawara T. and Zeghal, N. (2016c). Aluminium and acrylamide disrupt cerebellum redox states, cholinergic function and membrane-bound ATPase in adult rats and their offspring. Biol. Trace Elem. Res., 174(2): 335-346.
Giaccio, L., Cicchella, D., Vivo, B.D., Lombardi, G. and Rosa, M.D. (2012). Does heavy metals pollution affect semen quality in men? A case of study in the metropolitan area of Naples (Italy). J. Geochem. Explor., 112: 218-225.
Golub, M.S. and Germann, S.L. (2001). Long-term consequences of developmental exposure to aluminum in a suboptimal diet for growth and behavior of Swiss Webster mice. Neurotoxicol. Teratol., 23(4): 365-372.
Golub, M.S., Keen, C.L. and Gershwin, M.E. (1992a). Neurodevelopmental effect of aluminum in mice: Fostering studies. Neurotoxicol. Teratol. 14(3): 177-182.
Golub, M.S., Han, B., Keen, C.L. and Gershwin, M.E. (1992b). Effects of dietary aluminum excess and manganese deficiency on neurobehavioral endpoints in adult mice. Toxicol. Appl. Pharmacol., 112(1): 154-160.
Golub, M.S., Han, B., Keen, C.L., Gershwin, M.E. and Tarara, R.P. (1995). Behavioral performance of Swiss Webster mice exposed to excess dietary aluminum during development or during development and as adults. Toxicol. Appl. Pharmacol., 133(1): 64-72.
Golub, M.S., Germann, S.L., Han, B. and Keen, C.L. (2000). Lifelong feeding of a high aluminum diet to mice. Toxicology, 150(1-3): 107-117.
Greger, J.L. and Baier, M.H. (1983). Excretion and retention of low or moderate levels of Al by human subjects. Food Chem. Toxicol., 21: 473-477.
Grigg, N.S. (2010). Secondary impacts of corrosion control on distribution system and treatment plant equipment. Water Research Foundation, Denver, Colorado.
Guo, C., Chen, P., Hsia, S., Hsu, G.W. and Liu, P. (2013). The relationship of plasma aluminum to oxidant-antioxidant and inflammation status in asthma patients. Environ. Toxicol. Pharmacol., 35(1): 30-38.
Hackenberg, U. (1972). Chronic ingestion by rats of standard diet treated with aluminum phosphide. Toxicol. Appl. Pharmacol., 23(1): 147-158.
Halton (2001). Investigation of material deposits in the Burlington distribution system. Regional Municipality of Halton, Oakville, Ontario.
Haught, R. and Fabris, M. (2002). Inorganic monitors. Chapter 6 in: Online monitoring for drinking water utilities. American Water Works Association, Denver, Colorado. pp. 133-162.
Hichem, N., May, M.E., Ladhari, N., Mrabet, A. and Gharbi, R. (2014). Aluminum chloride impacts dentate gyrus structure in male adult albino Wistar rats. Tissue Cell, 46(6): 409-414.
Hill, A. and Giani, R. (2017). Magnified manganese release after switching sources to the Sacramento River. In: Proceedings of the American Water Works Association Water Quality Technology Conference, Portland, Oregon. American Water Works Association, Denver, Colorado.
Hill, A.S., Friedman, M.J., Reiber, S.H., Korshin, G.V. and Valentine, R.L. (2010). Behaviour of trace inorganic contaminants in drinking water distribution systems. J. Am. Water Works Assoc., 102(7): 107-118.
Hirata-Koizumi, M., Fujii, S., Ono, A., Hirose, A., Imai, T., Ogawa, K., Ema, M. and Nishikawa, A. (2011a). Two-generation reproductive toxicity study of aluminium sulfate in rats. Food Chem. Toxicol., 31(2): 219-230.
Hirata-Koizumi, M., Fujii, S., Ono, A., Hirose, A., Imai, T., Ogawa, K., Ema, M. and Nishikawa, A. (2011b). Evaluation of the reproductive and developmental toxicity of aluminium ammonium sulfate in a two-generation study in rats. Food Chem. Toxicol., 49(9): 1948-1959.
Hrudey, S.E. and Hrudey, E.J. (2014). Ensuring safe drinking water: Learning from frontline experience with contamination. American Water Works Association, Denver, Colorado.
Huang, J., Wu, J., Li, T., Song, X., Zhang, B., Zhang, P. and Zheng, X. (2011). Effect of exposure to trace elements in the soil on the prevalence of neural tube defects in a high-risk area of China. Biomed. Environ. Sci., 24(2):94-101.
Hudson, W.D. (1966). Studies of distribution system capacity in seven cities. J. Am. Water Works Assoc., 58(2): 157-164.
Huck, P.M., Emelko, M.B., Coffey, B.M., Maurizio, D. and O'Melia, C. (2001). Filter operation effects on pathogen passage. American Water Works Association Research Foundation, Denver, Colorado (Report No. 90874).
JECFA (2007). Evaluation of certain food additives and contaminants. Sixty-seventh report of the Joint FAO/WHO Expert Committee on Food Additives (JECFA). WHO Technical Report Series, 940, Geneva.
JECFA (2012). Safety evaluation of certain food additives. Prepared by the Seventy-Fourth Meeting of the Joint FAO/WHO Expert Committee on Food Additives (JEFCA). WHO Food Additives Series, 65, Geneva.
Jekel, M.R. and Heinzmann, B. (1989). Residual aluminum in drinking-water treatment. J. Water Supply Res. Technol. AQUA, 38: 281-288.
Karakis, I., Sarov, B., Landau, D., Manor, E., Yitshak-Sade, M., Rotenberg, M., Hershkovitz, R., Grotto, I., Gurevich, E. and Novack, L. (2014). Association between prenatal exposure to metals and neonatal morbidity. J. Toxicol. Env. Health. A., 77(21): 1281-1284.
Kettunen, R. and Keskitalo, P. (2000). Combination of membrane technology and limestone filtration to control drinking water quality. Desalination, 131(1-3): 271-283.
Kim, E.J., Herrera, J.E., Huggins, D., Braam, J. and Koshowski, S. (2011). Effect of pH on the concentrations of lead and trace contaminants in drinking water: A combined batch, pipe loop and sentinel home study. Water Res., 45(9): 2763-2774.
Knowles, A.D., Nguyen, C.K., Edwards, M.A., Stoddart, A., McIlwain, B. and Gagnon, G.A. (2015). Role of iron and aluminum coagulant metal residuals and lead release from drinking water pipe materials. J. Environ. Sci. Health Part A Toxic Hazard. Subst. Environ. Eng., 50(4): 414-423.
Krewski, D., Yokel, R.A., Nieboer, E., Borchelt, D., Cohen, J., Harry, J., Kacew, S., Lindsay, J., Mahfouz, A.M. and Rondeau, V. (2007). Human health risk assessment for aluminium, aluminium oxide, and aluminium hydroxide. J. Toxicol. Environ. Health, Pt. B, 10(supp1): 1-269.
Kriewall, D., Harding, R., Maisch, E. and Schanz, L. (1996). The impact of aluminum residual on transmission main capacity. Public Works, 127(12): 28-31.
Krishnan, K. and Carrier, R. (2008). Approaches for evaluating the relevance of multiroute exposures in establishing guideline values for drinking water contaminants. J. Environ. Sci. Health. C. Environ. Carcinog. Ecotoxicol. Rev., 26(3): 300-316.
Krishnan, K. and Carrier, R. (2013). The use of exposure source allocation factor in the risk assessment of drinking-water contaminants. J. Toxicol. Environ. Health B Crit. Rev., 16(1): 39-51.
Kundert, K., Meilke, L., Elford, T., Maksymetz, B. and Pernitsky, D.J. (2004). Evaluating pH adjustment to investigate seasonal changes in aluminum residuals at a large conventional water treatment plant. In: Proceedings of the American Water Works Association Water Quality Technology Conference, San Antonio, Texas. American Water Works Association, Denver, Colorado.
Kvech, S. and Edwards, M. (2001). Role of aluminosilicate deposits in lead and copper corrosion. J. Am. Water Works Assoc., 93(11): 104-112.
Laabbar, W., Elgot, A., Kissani, N. and Gamrani, H. (2014). Chronic aluminum intoxication in rat induced both serotonin changes in the dorsal raphe nucleus and alteration of glycoprotein secretion in the subcommissural organ: Immunohistochemical study. Neurosci. Lett., 577: 72-76.
Larson, T.E. and Sollo Jr., F.W. (1967). Loss in water main carrying capacity. J. Am. Water Works Assoc., 60(12): 1565-1572.
Leroy, P., Schock, M.R., Wagner, I. and Holtshulte, H. (1996). Cement-based materials. In: Internal corrosion of water distribution systems. Second edition. American Water Works Association Research Foundation and DVGW-Technologiezentrum Wasser. pp. 313-388.
Letterman, R.D. and Driscoll, C.T. (1988). Survey of residual aluminum in filtered water. J. Am. Water Works Assoc., 80(4): 154-158.
Li, G., Ding, Y., Xu, H., Jin, J. and Shi, B. (2018). Characterization and release profile of (Mn, Al)-bearing deposits in drinking water distribution systems. Chemosphere, 197: 73-80.
Li, P., Luo, W., Zhang, H., Zheng, X., Liu, C. and Ouyang, H. (2015). Effects of aluminum exposure on the bone stimulatory growth factors in rats. Biol. Trace Elem. Res., 172(1): 166-171.
Li, X., Hu, C., Zhu, Y., Sun, H., Li, Y. and Zhang, Z. (2011a). Effects of aluminum exposure on bone mineral density, mineral, and trace elements in rats. Biol. Trace Elem. Res., 143(1): 378-385.
Li, X., Zhang, L., Zhu, Y. and Li, Y. (2011b). Dynamic analysis of exposure to aluminum and an acidic condition on bone formation in young growing rats. Environ. Toxicol. Pharmacol., 31(2): 295-301.
Lidsky, T.I. (2014). Is the aluminum hypothesis dead? J. Occup. Environ. Med., 56(5 Suppl): S73-9.
Linardaki, Z.I., Orkoula, M.G., Kokkosis, A.G., Lamari, F.N. and Margarity, M. (2013). Investigation of the neuroprotective action of saffron (crocus sativus L.) in aluminum-exposed adult mice through behavioral and neurobiochemical assessment. Food Chem. Toxicol., 52: 163-170.
Lind, P.M., Olsen, L. and Lind, L. (2012). Circulating levels of metals are related to carotid atherosclerosis in elderly. Sci. Total Environ., 416 : 80-88.
Lindquist, B., Lingstrom, P., Fandriks, L. and Birkhed, D. (2011). Influence of five neutralizing products on intra-oral pH after rinsing with simulated gastric acid. Eur. J. Oral Sci., 119(4): 301-304.
Liu, J., Wang, Q., Sun, X., Yang, X., Zhuang, C., Xu, F., Cao, Z. and Li, Y. (2016). The toxicity of aluminum chloride on kidney of rats. Biol. Trace Elem. Res., 173(2): 339-344.
Llobet, J.M., Domingo, J.L., Gomez, M., Tomas, J.M. and Corbella, J. (1987). Acute toxicity studies of aluminium compounds: Antidotal efficacy of several chelating agents. Pharmacol. Toxicol., 60(4): 280-283.
Locco, D., Waller, M., Giani, R., Nikolica, P., Hill, A. and Friedman, M. (2018). Pilot testing for optimized unidirectional flushing in the Hamilton distribution system. In: Proceedings of the American Water Works Association Annual Conference and Exposition, Las Vegas, Nevada. American Water Works Association, Denver, Colorado.
Lowermoor Incident Health Advisory Group. (1989). Water pollution at Lowermoor, North Cornwall. Report of the Lowermoor Incident Health Advisory Group. Chairman: Professor Dame Barbara Clayton. Truro: Cornwall and Isles of Scilly Health Authority.
Lv, J., Wang, W., Krafft, T., Li, Y., Zhang, F. and Yuan, F. (2011). Effects of several environmental factors on longevity and health of the human population of Zhongxiang, Hubei, China. Biol. Trace Elem. Res., 143(2): 702-716.
Lytle, D.A., Sorg, T.J. and Frietch, C. (2004). Accumulation of arsenic in drinking water distribution systems. Environ. Sci. Technol., 38(20): 5365-5372.
Manitoba Sustainable Development (2017). Personal communication with Kim Philip, Office of Drinking Water.
Martinez, C.S., Alterman, C.D.C., Pecanha, F.M., Vassallo, D.V., MelloCarpes, P.B., Miguel, M. and Wiggers, G.A. (2017a). Aluminum exposure at human dietary levels for 60 days reaches a threshold sufficient to promote memory impairment in rats. Neurotox. Res., 31(1): 20-30.
Martinez, C.S., Escobar, A.G., Uranga-Ocio, J.A., Pecanha, F.M., Vassallo, D.V., Exley, C., Miguel, M. and Wiggers, G.A. (2017b). Aluminum exposure for 60 days at human dietary levels impairs spermatogenesis and sperm quality in rats. Reprod. Toxicol., 73: 128-141.
Matilainen, A., Vepsäläinen, M. and Sillanpää, M. (2010). Natural organic matter removal by coagulation during drinking water treatment: A review. Adv. Colloid Interface Sci., 159(2): 189-197.
McMillan, T.M., Dunn, G. and Colwill, S.J. (1993a). Psychological testing on schoolchildren before and after pollution of drinking water in North Cornwall. J. Child Psychol. Psychiatry, 34(8): 1449-1459.
McMillan, T.M., Freemont, A.J., Herxheimer, A., Denton, J., Taylor, A.P., Pazianas, M., Cummin, A.R. and Eastwood, J.B. (1993b). Camelford water poisoning accident: Serial neuropsychological assessments and further observations on bone aluminium. Hum. Exp. Toxicol., 12(1) : 37-42.
Ministère de l'Environnement et de l'Action en matière de changement climatique de l'Ontario (2017). Résultats de la qualité de l'eau provenant de systèmes d'approvisionnement en eau potable sélectionnés dans des stations de traitement de l'Ontario, dans le cadre du Programme de surveillance de l'eau potable (2013-2017). Accessible à l'adresse : https://www.ontario.ca/fr/donnees/programme-de-surveillance-de-leau-potable
Ministère de l'Environnement et Gouvernements locaux du Nouveau-Brunswick (2018). Communication personnelle avec Kevin Gould, Direction des Environnements en santé.
Ministère des Affaires municipales et Environnement de Terre-Neuve-et-Labrador (2017). Communication personnelle avec Haseen Khan, Division de la gestion des ressources en eau.
Ministère du Développement durable, de l'Environnement et de la Lutte contre les changements climatiques (2017). Personal communication with Caroline Robert, Direction de l'eau potable et des eaux souterraines.
Mirza, A., King, A., Troakes, C. and Exley, C. (2017). Aluminium in brain tissue in familial Alzheimer's disease. J. Trace Elem. Med. Biol., 40 : 30-36.
Mlynska, A. and Zielina, M. (2017). The influence of prefabricated pipe cement coatings and those made during pipe renovation on drinking water quality. In: E3S Web of Conferences. 17. 00061. 10.1051/e3sconf/20171700061.
Munk, L. and Faure, G. (2004). Effects of pH fluctuations on potentially toxic metals in the water and sediment of the Dillon Reservoir, Summit County, Colorado. Appl. Geochem., 19(7): 1065-1074.
Muselin, F., Cristina, R.T., Igna, V., Dumitrescu, E., Brezovan, D. and Trif, A. (2016). The consequences of aluminium intake on reproductive function in male rats: A three-generation study. Turk. J. Med. Sci., 46(4): 1240-1248.
Muylwyk, Q. and MacDonald, J. (2001). Aluminum deposits in the distribution system: What can you do? In: Proceedings of the American Water Works Association Water Quality Technology Conference, Nashville, Tennessee. American Water Works Association, Denver, Colorado.
New Zealand Ministry of Health (2008). Drinking-water standards for New Zealand 2005 (Revised 2008). Ministry of Health, Wellington.
NHMRC and NRMMC (2011). Australian drinking water guidelines. Paper 6. National Water Quality Management Strategy.
National Health and Medical Research Council, National Resource Management Ministerial Council, Commonwealth of Australia, Canberra, Version 3.4. Updated October 2017. Accessible à l'adresse : https://www.nhmrc.gov.au/_files_nhmrc/file/publications/nhmrc_adwg_6_version_3.4_final.pdf
Nicolescu, R., Petcu, C., Cordeanu, A., Fabritius, K., Schlumpf, M., Krebs, R., Kramer, U. and Winneke, G. (2010). Environmental exposure to lead, but not other neurotoxic metals, relates to core elements of ADHD in Romanian children: Performance and questionnaire data. Environ. Res., 110(5): 476-483.
Nova Scotia Environment (2018). Personal communication with Angelina Polegato, Drinking Water Management Unit.
NSCFS (2013). Risk Assessment of the exposure to aluminum through food and the use of cosmetic products in the Norwegian population. Opinion of the Panel on Food Additives, Flavourings, Processing Aids, Materials in Contact with Food and Cosmetics and of the Panel on Contaminants of the Norwegian Scientific Committee for Food Safety. Doc. No. 11-504_final. Accessible à l'adresse : https://vkm.no/download/18.175083d415c86c573b59c179/1501678206406/a729a67e65.pdf
NSF (2018). Aluminum contaminant concentrations in water treatment chemicals. Préparé pour Santé Canada, Ottawa, Ontario.
NSF/ANSI (2017). NSF International/American National Standards Institute Standard 60: Drinking water treatment chemicals: Health effects. NSF International, Ann Arbor, Michigan.
O'Melia, C.R. (2006). Fundamentals of particle stability. Chapter 18 in: Interface science in drinking water treatment: theory and applications. G. Newcombe and D. Dixon (eds). Academic Press, London, United Kingdom. pp. 317-362.
OMS (2010). Aluminium in drinking-water. Background document for development of WHO guidelines for drinking-water quality. World Health Organization, WHO/HSE/WSH/10.01/13, Geneva.
OMS (2017). Directives de qualité pour l'eau de boisson, quatrième édition. Organisation mondiale de la Santé, Genève, Suisse. Accessible à l'adresse : https://www.who.int/water_sanitation_health/publications/drinking-water-quality-guidelines-4-including-1st-addendum/fr/
OMS (2012). Planifier la gestion de la sécurité sanitaire de l'eau pour l'approvisionnement en eau des petites communautés, Organisation mondiale de la Santé, Genève, Suisse. Accessible à l'adresse : https://www.who.int/water_sanitation_health/publications/small-comm-water_supplies/fr/
Ondreicka, R., Ginter, E. and Kortus, J. (1966). Chronic toxicity of aluminium in rats and mice and its effects on phosphorus metabolism. Br. J. Ind. Med., 23(4): 305-312.
Oneda, S., Takasaki, T., Kuriwaki, K., Ohi, Y., Umekita, Y., Hatanaka, S., Fujiyoshi, T., Yoshida, A. and Yoshida, H. (1994). Chronic toxicity and tumorigenicity study of aluminum potassium sulfate in B6C3F1 mice. In Vivo, 8(3): 271-278.
Oshima, E., Ishihara, T., Yokota, O., Nakashima-Yasuda, H., Nagao, S., Ikeda, C., Naohara, J., Terada, S. and Uchitomi, Y. (2013). Accelerated tau aggregation, apoptosis and neurological dysfunction caused by chronic oral administration of aluminum in a mouse model of tauopathies. Brain Pathol., 23(6): 633-644.
Oteiza, P.I., Keen, C.L., Han, B. and Golub, M.S. (1993). Aluminum accumulation and neurotoxicity in Swiss-Webster mice after long-term dietary exposure to aluminum and citrate. Metabolism, 42(10): 1296-1300.
Panhwar, A.H., Kazi, T.G., Afridi, H.I., Arain, S.A., Arain, M.S., Brahaman, K.D., Naeemullah and Arain, S.S. (2016). Correlation of cadmium and aluminum in blood samples of kidney disorder patients with drinking water and tobacco smoking: Related health risk. Environ. Geochem. Health, 38(1): 265-274.
Pernitsky, D.J. (2003). Coagulation 101. In: Proceedings of the Technology Transfer Conference, University of Calgary, Alberta, Canada.
Pernitsky, D.J. and Edzwald, J.K. (2003). Solubility of polyaluminium coagulants. J. Water Supply Res. Technol. Aqua, 52(6): 395-406.
Pernitsky, D.J. and Edzwald, J.K. (2006). Selection of alum and polyaluminum coagulants: Principles and applications. J. Water Supply Res. Technol. AQUA, 55(2): 121-141.
Pineau, A., Guillard, O., Favreau, F., Marrauld, A. and Fauconneau, B. (2012). In vitro study of percutaneous absorption of aluminum from antiperspirants through human skin in the Franz diffusion cell. J. Inorg. Biochem., 110: 21-26.
Poirier, J., Semple, H., Davies, J., Lapointe, R., Dziwenka, M., Hiltz, M. and Mujibi, D. (2011). Double-blind, vehicle-controlled randomized twelve-month neurodevelopmental toxicity study of common aluminum salts in the rat. Neuroscience, 193: 338-362.
Priest, N.D. (2004). The biological behaviour and bioavailability of aluminium in man, with special reference to studies employing aluminium-26 as a tracer: Review and study update. J. Environ. Monit., 6(5): 375-403.
Priest, N., Newton, D., Day, J., Talbot, R. and Warner, A. (1995). Human metabolism of aluminium-26 and gallium-67 injected as citrates. Hum. Exp. Toxicol., 14(3): 287-293.
Rao, S.S. and Adlard, P.A. (2018). Untangling tau and iron: Exploring the interaction between iron and tau in neurodegeneration. Front. Mol. Neurosci., 11: 276.
Reijnen, G.K., Kostense, A., Verdouw, J. and Hiemstra, P. (1991). Aluminum in groundwater, origin, sampling, analysis and removal. In: Proceedings of the International Water Supply Association, Copenhagen, Denmark. International Water Supply Association, The Netherlands.
RNCan (2018). Faits sur l'aluminium, Ressources naturelles Canada. Dernière mise à jour le : 20 avril 2018. Gouvernement du Canada, Ottawa. Accessible à l'adresse : https://www.rncan.gc.ca/mines-materiaux/faits/aluminium/20568
Rondeau, V., Jacqmin-Gadda, H., Commenges, D., Helmer, C. and Dartigues, J.F. (2009). Aluminum and silica in drinking water and the risk of Alzheimer's disease or cognitive decline: Findings from 15-year follow-up of the PAQUID cohort. Am. J. Epidemiol., 169(4): 489-496.
Rui, D. and Yongjian, Y. (2010). Aluminum chloride induced oxidative damage on cells derived from hippocampus and cortex of ICR mice. Brain Res., 1324: 96-102.
Rusina, R., Matej, R., Kasparova, L., Kukal, J. and Urban, P. (2011). Higher aluminum concentration in Alzheimer's disease after box-cox data transformation. Neurotox. Res., 20(4): 329-333.
Santé Canada (1998). Recommandations pour la qualité de l'eau potable au Canada : document technique - Aluminium, Santé Canada, Ottawa.
Santé Canada (2007). Concentrations de contaminants et d'autres produits chimiques dans les aliments composites. Extrait du site : https://www.canada.ca/fr/sante-canada/services/aliments-nutrition/surveillance-aliments-nutrition/etude-canadienne-alimentation-totale/concentrations-contaminants-autres-produits-chimiques-aliments-composites.html
Santé Canada (2015). Recommandations pour la qualité de l'eau potable au Canada : document technique - Le pH. Bureau de la qualité de l'eau et de l'air, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Accessible à l'adresse : https://www.canada.ca/content/dam/hc-sc/documents/services/publications/healthy-living/guidelines-canadian-drinking-water-quality-guideline-technical-document-ph-fra.pdf
Santé Canada (2016). Concentrations de contaminants et d'autres produits chimiques dans les aliments composites - Résultats de l'Étude canadienne sur l'alimentation totale - Micro éléments, Direction générale des produits de santé et des aliments, Santé Canada, Ottawa. Accessible à l'adresse : https://www.canada.ca/fr/sante-canada/services/aliments-nutrition/surveillance-aliments-nutrition/etude-canadienne-alimentation-totale/concentrations-contaminants-autres-produits-chimiques-aliments-composites.html#a10
Santé Canada (2017). Communication personnelle avec Anca-Maria Tugulea, Bureau de la science et de la recherche en santé environnementale.
Santé Canada (2018a). Assessment of the impacts of temperature on the efficacy of the coagulation/flocculation process in drinking water treatment. Préparé par Y.S. Vadasarukkai pour Santé Canada, Bureau de la qualité de l'eau et de la santé, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible sur demande.
Santé Canada (2018b). Document de conseils sur la matière organique naturelle dans l'eau potable, Bureau de la qualité de l'eau et de la santé, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario).
Santé Canada (2018c). Assessment of the impacts of aluminum in drinking water distribution systems. Préparé par Armview Engineering Limited pour Santé Canada, Bureau de la qualité de l'eau et de la santé, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible sur demande.
Santé Canada (2019a). Les Protozoaires entériques : Giardia et Cryptosporidium, Document technique. Bureau de la qualité de l'eau et de la santé, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Accessible à l'adresse : https://www.canada.ca/fr/sante-canada/services/sante-environnement-milieu-travail/rapports-publications/qualite-eau/protozoaires-enteriques-giardia-cryptosporidium.html
Santé Canada (2019b). Les virus entériques. Document techniques. Bureau de la qualité de l'eau et de la santé, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Accessible à l'adresse : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/recommandations-pour-qualite-eau-potable-canada-document-technique-virus-enteriques.html
Santé Canada (en préparation). Canadian exposure factors used in human health risk assessments. Health Canada, Ottawa, Ontario.
Saskatchewan Water Security Agency (2017). Personal communication with Sam Ferris, Environmental and Municipal Management Services Division.
Schock, M.R. (2005). Distribution systems as reservoirs and reactors for inorganic contaminants. Chapter 6 in: Distribution system water quality challenges in the 21st century: A strategic guide. American Water Works Association, Denver, Colorado. pp. 105-140.
Schock, M.R. and Holm, T.R. (2003). Are we monitoring in the right places for inorganics and radionuclides? J. N. Engl. Water Works Assoc., 117(2): 102-116.
Schreurs, B.G. and Sparks, D.L. (2016). Dietary high cholesterol and trace metals in the drinking water increase levels of ABCA1 in the rabbit hippocampus and temporal cortex. J. Alzheimers Dis., 49(1): 201-209.
Schroeder, H.A. and Mitchener, M. (1975a). Life-term effects of mercury, methyl, mercury, and nine other trace metals on mice. J. Nutr., 105(4): 452-458.
Schroeder, H.A. and Mitchener, M. (1975b). Life-term studies in rats: Effects of aluminum, barium, beryllium and tungsten. J. Nutr., 105(4): 421-427.
She, Y., Zhao, H., Zhu, Y., Han, Y., Xia, S., Bai, C., Zhang, J. and Li, Y. (2015). Aluminum trichloride disorders bile acid secretion and induces hepatocyte apoptosis in rats. Cell Biochem. Biophys., 71(3): 1569-1577.
Shin, J.Y., Spinette, R.F. and O'Melia, C.R. (2008). Stoichiometry of coagulation revisited. Environ. Sci. Technol., 42(7): 2582-2589.
Singla, N. and Dhawan, D.K. (2017). Zinc improves cognitive and neuronal dysfunction during aluminium-induced neurodegeneration. Mol. Neurobiol., 54(1): 406-422.
Skalnaya, M.G., Tinkov, A.A., Demidov, V.A., Serebryansky, E.P., Nikonorov, A.A. and Skalny, A.V. (2014). Hair toxic element content in adult men and women in relation to body mass index. Biol. Trace Elem. Res., 161(1): 13-19.
Smeets, P.W.M.H., Medema, G.J. and Van Dijk, J.C. (2009). The Dutch secret: How to provide safe drinking water without chlorine in The Netherlands. Drink. Water Eng. Sci., 2(1): 1-14.
Snoeyink, V.L., Schock, M.R., Sarin, P., Wang, L., Chen, A.S-C. and Harmon, S.M. (2003). Aluminium-containing scales in water distribution systems: Prevalence and composition. J. Water Supply Res. Technol. AQUA, 52(7): 455-474.
Srinivasan, P.T., Viraraghavan, T. and Bergman, J. (1999). Factors influencing residual aluminium levels at the Buffalo Pound Water Treatment Plant, Saskatchewan, Canada. J. Water Supply Res. Technol. AQUA, 48(4): 167-175.
Statistique Canada (2013). Enquête sur les usines de traitement de l'eau potable, 2011, ministre de l'Industrie, 16-403-X, Ottawa.
Stauber, J., Florence, T., Davies, C., Adams, M. and Buchanan, S. (1999). Bioavailability of Al in alum-treated drinking water. J. Am. Water Works Assoc., 91(11): 84-93.
Strozyk, D., Launer, L.J., Adlard, P.A., Cherny, R.A., Tsatsanis, A., Volitakis, I., Blennow, K., Petrovitch, H., White, L.R. and Bush, A.I. (2009). Zinc and copper modulate Alzheimer Abeta levels in human cerebrospinal fluid. Neurobiol. Aging, 30(7): 1069-1077.
Sun, H., Hu, C., Jia, L., Zhu, Y., Zhao, H., Shao, B., Wang, N., Zhang, Z. and Li, Y. (2011). Effects of aluminum exposure on serum sex hormones and androgen receptor expression in male rats. Biol. Trace Elem. Res., 144(1): 1050-1058.
Sun, X., Cao, Z., Zhang, Q., Liu, S., Xu, F., Che, J., Zhu, Y., Li, Y., Pan, C. and Liang, W. (2015). Aluminum trichloride impairs bone and downregulates Wnt/β-catenin signaling pathway in young growing rats. Food Chem. Toxicol., 86: 154-162.
Sun, X., Liu, J., Zhuang, C., Yang, X., Han, Y., Shao, B., Song, M., Li, Y. and Zhu, Y. (2016). Aluminum trichloride induces bone impairment through TGF-β1/Smad signaling pathway. Toxicology, 371: 49-57.
Sun, X., Wang, H., Huang, W., Yu, H., Shen, T., Song, M., Han, Y., Li, Y. and Zhu, Y. (2017). Inhibition of bone formation in rats by aluminum exposure via Wnt/β-catenin pathway. Chemosphere, 176: 1-7.
Talbot, R.J., Newton, D., Priest, N.D., Austin, J.G. and Day, J.P. (1995). Inter-subject variability in the metabolism of aluminium following intravenous injection as citrate. Hum. Exp. Toxicol., 14(7): 595-599.
Tamburo, E., Varrica, D., Dongarra, G. and Grimaldi, L.M. (2015). Trace elements in scalp hair samples from patients with relapsing-remitting multiple sclerosis. PLoS One, 10(4): e0122142.
Trueman, B.F. and Gagnon, G.A. (2016). A new analytical approach to understanding nanoscale lead-iron interactions in drinking water distribution systems. J. Hazard. Mater., 311: 151-157.
Turkez, H., Yousef, M.I. and Geyikoglu, F. (2010). Propolis prevents aluminium-induced genetic and hepatic damages in rat liver. Food Chem. Toxicol., 48(10): 2741-2746.
UE (1998). Directive 98/83/CE du Conseil du 3 novembre 1998 relative à la qualité des eaux destinées à la consommation humaine, Journal officiel des Communautés européennes, L 330, 5/12/1998. p. 32-54.
UK Committee on Toxicology. (2013). Subgroup report on the Lowermoor water pollution incident. Accessible à l'adresse : https://cot.food.gov.uk/sites/default/files/cot/lwpiapp811.pdf
U.S. EPA (1994a). Method 200.7 revision 4.4. Determination of metals and trace elements in water and wastes by inductively coupled plasma-atomic emission spectrometry. Environmental Monitoring Systems Laboratories. Office of Research and Development, United States Environmental Protection Agency, Cincinnati, Ohio.
U.S. EPA (1994b). Method 200.8 revision 5.4. Determination of trace elements in waters and wastes by inductively coupled plasma - mass spectrometry. Environmental Monitoring Systems Laboratories, Office of Research and Development, United States Environmental Protection Agency, Cincinnati, Ohio.
U.S. EPA (1994c). Method 200.9. revision 4.2. Determination of trace elements by stabilized temperature graphite furnace atomic adsorption. Environmental Monitoring Systems Laboratories, Office of Research and Development, United States Environmental Protection Agency, Cincinnati, Ohio.
U.S. EPA (2002). Distribution system issue paper - Permeation and leaching. Prepared by AWWA with assistance from Economic and Engineering Services, Inc. for U.S. EPA, Office of Water, Office of Ground Water and Drinking Water.
U.S. EPA (2003). Method 200.5 revision 4.2. Determination of trace elements in drinking water by axially viewed inductively coupled plasma - atomic emission spectrometry. EPA 600-R-06-115. National Exposure Research Laboratory, Office of Research and Development, United States Environmental Protection Agency, Cincinnati, Ohio.
U.S. EPA (2018). Secondary drinking water standards: Guidance for nuisance chemicals. Accessible à l'adresse : https://www.epa.gov/dwstandardsregulations/secondary-drinking-water-standards-guidance-nuisance-chemicals
Van Benschoten, J.E. and Edzwald, J.K. (1990a). Chemical aspects of coagulation using aluminum salts-II. Coagulation of fulvic acid using alum and polyaluminum chloride. Water Res., 24(12): 1527-1535.
Van Benschoten, J.E. and Edzwald, J.K. (1990b). Measuring aluminum during water treatment. Methodology and application. J. Am. Water Works Assoc., 82(5): 71-78.
Van Benschoten, J.E., Edzwald, J.K. and Rahman, M.A. (1992). Effects of temperature and pH on residual aluminium for alum and polyaluminium coagulants. Water Supply, 10(4): 49-54.
Vandenplas, Y., Castrellon, P.G., Rivas, R., Gutierrez, C.J., Garcia, L.D., Jimenez, J.E., Anzo, A., Hegar, B. and Alarcon, P. (2014). Safety of soya-based infant formulas in children. Br. J. Nutr., 111(8): 1340-1360.
Vanloot, P., Boudenne, J-L., Brach-Papa, C., Sergent, M. and Coulomb, B. (2007). An experimental design to optimize the flow extraction parameters for the selective removal of Fe(III) and Al(III) in aqueous samples using salicylic acid grafted on Amberlite
XAD-4 and final determination by GF-AAS. J. Hazard. Mater., 147(1-2): 463-470.
Virk, S.A. and Eslick, G.D. (2015). Aluminum levels in brain, serum, and cerebrospinal fluid are higher in Alzheimer's disease cases than in controls: A series of meta-analyses. J. Alzheimers Dis., 47(3): 629-638.
Vucetic-Arsic, S., Radonjic, N.V., Jovanovic, M., Selakovic, V., Nikolic, T., Velimirovic, M., Stojkovic, T., Milovanovic, A., Milovanovic, J. and Petronijevic, N. (2013). Oxidative stress precedes mitochondrial dysfunction in gerbil brain after aluminum ingestion. Environ. Toxicol. Pharmacol., 36(3): 1242-1252.
Walton, J.R. (2010). Evidence for participation of aluminum in neurofibrillary tangle formation and growth in Alzheimer's disease. J. Alzheimers Dis., 22(1): 65-72.
Walton, J.R. (2014). Chronic aluminum intake causes Alzheimer's disease: Applying Sir Austin Bradford Hill's causality criteria. J. Alzheimers Dis., 40(4): 765-838.
Wang, B., Xing, W., Zhao, Y. and Deng, X. (2010). Effects of chronic aluminum exposure on memory through multiple signal transduction pathways. Environ. Toxicol. Pharmacol., 29(3): 308-313.
Wang, N., She, Y., Zhu, Y., Zhao, H., Shao, B., Sun, H., Hu, C. and Li, Y. (2012). Effects of subchronic aluminum exposure on the reproductive function in female rats. Biol. Trace Elem. Res., 145(3): 382-387.
Wang, W., Zhang, X., Wang, H., Wang, X., Zhou, L., Liu, R. and Liang, Y. (2012a). Laboratory study on the adsorption of Mn2+ on suspended and deposited amorphous Al(OH)3 in drinking water distribution systems. Water Res., 46(13): 4063-4070.
Wang, W., Li, H., Ding, Z., Wang, X. and Liu, R. (2012b). Effects of humic acid on residual Al control in drinking water treatment plants with orthophosphate addition. Front. Environ. Sci. Eng. China, 6(4): 470-476.
Wang, Z., Wei, X., Yang, J., Suo, J., Chen, J., Liu, X. and Zhao, X. (2016). Chronic exposure to aluminum and risk of Alzheimer's disease: A meta-analysis. Neurosci. Lett., 610: 200-206.
Wasana, H.M., Perera, G.D., De Gunawardena, P.S. and Bandara, J. (2015). The impact of aluminum, fluoride, and aluminum-fluoride complexes in drinking water on chronic kidney disease. Environ. Sci. Pollut. Res. Int., 22(14) : 11001-11009.
Wasserstrom, L.W., Miller, S.A., Triantafyllidou, S., Desantis, M.K. and Schock, M.R. (2017). Scale formation under blended phosphate treatment for a utility with lead pipes. J. Am. Water Works Assoc., 109(11): E464-E478.
Willhite, C.C., Karyakina, N.A., Yokel, R.A., Yenugadhati, N., Wisniewski, T.M., Arnold, I.M., Momoli, F. and Krewski, D. (2014). Systematic review of potential health risks posed by pharmaceutical, occupational and consumer exposures to metallic and nanoscale aluminum, aluminum oxides, aluminum hydroxide and its soluble salts. Crit. Rev. Toxicol., 44 (Suppl. 4) : 1-80.
Xu, L., Zhang, W., Liu, X., Zhang, C., Wang, P. and Zhao, X. (2018). Circulatory levels of toxic metals (aluminum, cadmium, mercury, lead) in patients with Alzheimer's disease: A quantitative meta-analysis and systematic review. J. Alzheimers Dis., 62(1): 361-372.
Yokel, R.A. and McNamara, P.J. (1985). Aluminum bioavailability and disposition in adult and immature rabbits. Toxicol. Appl. Pharmacol., 77(2): 344-352.
Yu, L., Zhai, Q., Liu, X., Wang, G., Zhang, Q., Zhao, J., Narbad, A., Zhang, H., Tian, F. and Chen, W. (2016). Lactobacillus plantarum CCFM639 alleviates aluminium toxicity. Appl. Microbiol. Biotechnol., 100(4): 1891-1900.
Yukon Health and Social Services. (2017). Personal communication with Pat Brooks, Drinking Water Program Coordinator.
Zhang, C., Li, Y., Wang, C., Lv, R. and Song, T. (2013a). Extremely low-frequency magnetic exposure appears to have no effect on pathogenesis of Alzheimer's disease in aluminum-overloaded rat. PLoS One, 8(8): e71087.
Zhang, L., Jin, C., Liu, Q., Lu, X., Wu, S., Yang, J., Du, Y., Zheng, L. and Cai, Y. (2013b). Effects of subchronic aluminum exposure on spatial memory, ultrastructure and L-LTP of hippocampus in rats. J. Toxicol. Sci., 38(2): 255-268.
Zhang, L., Jin, C., Lu, X., Yang, J., Wu, S., Liu, Q., Chen, R., Bai, C., Zhang, D., Zheng, L., Du, Y. and Cai, Y. (2014). Aluminium chloride impairs long-term memory and downregulates cAMP-PKA-CREB signalling in rats. Toxicology, 323(Suppl. C): 95-108.
Zhou, Y, and Yokel, R.A. (2005). The chemical species of aluminum influences its paracellular flux across and uptake into Caco-2 cells, a model of gastrointestinal absorption. Tox. Sci. 87(1), 15-26.
Zhu, Y., Han, Y., Zhao, H., Li, J., Hu, C., Li, Y. and Zhang, Z. (2013). Suppressive effect of accumulated aluminum trichloride on the hepatic microsomal cytochrome P450 enzyme system in rats. Food Chem. Toxicol., 51(Suppl. C): 210-214.
Zhu, Y.Z., Sun, H., Fu, Y., Wang, J., Song, M., Li, M., Li, Y.F. and Miao, L.G. (2014). Effects of sub-chronic aluminum chloride on spermatogenesis and testicular enzymatic activity in male rats. Life Sci., 102(1): 36-40.
Zielina, M., Mlynska, A. and Zaba, T. (2015). Experimental research on deterioration of drinking water quality after cement mortar pipe lining. Technical Transactions: Civil Engineering, 4-B: 145-152.
Annexe A : Liste d'acronymes
- Aβ
- Bêta-amyloïde
- AChE
- Acétylcholinestérase
- AESA
- Autorité européenne de sécurité des aliments
- Al
- Aluminium
- ANSI
- American National Standards Institute
- APHA
- American Public Health Association
- AQ/CQ
- Assurance de la qualité et contrôle de la qualité
- AQT
- Apport quotidien tolérable
- ATSDR
- Agency for Toxic Substances and Disease Registry
- AVICP-AES
- Spectrométrie d'émission atomique à couplage inductif en visée axiale
- AWWA
- American Water Works Association
- AWWARF
- American Water Works Association Research Foundation
- BPL
- Bonnes pratiques de laboratoire
- CCME
- Conseil canadien des ministres de l'environnement
- CIRC
- Centre international de recherche sur le cancer
- CMA
- Concentration maximale acceptable
- GSH
- Glutathion
- ICP-AES
- Spectrométrie de masse avec plasma à couplage inductif
- ICP-SM
- Spectrométrie de masse à plasma inductif
- JECFA
- Comité mixte FAO/OMS d'experts des additifs alimentaires
- LDM
- Limite de détection de la méthode
- LOAEL
- Dose minimale entraînant un effet nocif observé
- M Moles
- MA
- Maladie d'Alzheimer
- MC
- Méthode courante
- MDA
- Malondialdéhyde
- NHMRC
- National Health and Medical Research Council (Australia)
- NOAEL
- Dose sans effet nocif observé
- NRMCC
- Natural Resources Management Ministerial Council (Australia)
- NSF
- NSF International
- OCDE
- Organisation de coopération et de développement économiques
- OMS
- Organisation mondiale de la santé
- PM10
- Matières particulaires ayant un diamètre de 10 micromètres ou moins
- PACl
- Chlorure de polyaluminium
- p/v
- Poids par volume
- SC
- Santé Canada
- SOD
- Superoxyde dismutase
- U.S.
- EPA United States Environmental Protection Agency
- UTN
- Unité de turbidité néphélométrique
- VFS
- Valeur fondée sur la santé
- VOR
- Valeur opérationnelle recommandée
Annexe B : Répercussions provinciales et territoriales prévues
Veuillez noter que ces renseignements ne sont pas disponibles dans les deux langues officielles parce que leur source n'est pas assujettie à la Loi sur les langues officielles
Prince Edward Island
As no drinking water supply systems in the province of PEI employ conventional water treatment processes with the addition of aluminum bearing additives, and naturally occurring aluminum levels are low in the groundwater from which all potable water is derived, no impact of this guideline is expected.
Newfoundland and Labrador
Monitoring-The Province of Newfoundland and Labrador is responsible for extensive monitoring for inorganic parameters including aluminum in the province. Aluminum monitoring is conducted semi-annually for all surface water public water supplies in the province, annually for all groundwater public water supplies, and quarterly for populations larger than 5,000.
Cost of Implementing Guideline-A total of 6 public surface water drinking water supplies have had an aluminum exceedance of the proposed MAC of 2.9 mg/L. This analysis is based on individual values and not locational running annual averages. Of the 6 supplies, 5 were from supplies that utilize alum-based coagulants. Of the 6 supplies, only 2 have semi-regular exceedances that could cause potential exceedances of the proposed MAC based on the locational running annual averages. Optimization of these two systems would require only minor infrastructure upgrades and operator training at a minimal cost.
Quarterly aluminum sampling for all public water supplies would have high cost implementation due to additional analysis cost and field time for existing staff. Due to workload constraints, this additional sampling requirement would not be possible using existing staff only.
Other Comments-The 6 drinking water supplies that have had aluminum levels above the proposed MAC are currently sampled 2 times per year for aluminum and other metals.
Action Items-Continue to monitor for aluminum at the current frequency with the exception of the two supplies that have semi-regular exceedances. These two systems to be monitored quarterly to assess the locational running annual averages.
Nova Scotia
Health Canada is proposing to establish a maximum acceptable concentration (MAC) of 2.9 mg/L for total aluminum in drinking water and to lower the operational guideline (OG) to 0.050 mg/L.
Nova Scotia's drinking water program consists of both public and private supplies. Public systems include municipal and registered facilities. Nova Scotia Environment (NSE) requires public drinking water supplies to comply with the health-based criteria for parameters listed in the Guidelines for Canadian Drinking Water Quality. Municipal supplies are also required by their operating approval to comply with the OG for aluminum.
The proposed MAC will have a negligible impact; however, the reduction to the OG will have a significant impact for our municipal drinking water systems.
Based on 2015 data obtained from annual reports, 15 of our 31 municipal water treatment facilities using aluminum-based coagulants will exceed an OG of 0.050 mg/L. Aluminum concentrations in the source water ranged from 0.006 - 0.501 mg/L with an average of 0.101 mg/L. Treated water concentrations ranged from <0.005 - 0.724 mg/L with an average of 0.053 mg/L. Facilities exceeding the proposed OG provide water to approximately 40% of the population served by a municipal drinking water facility. No treated water samples for aluminum from municipal facilities exceed the proposed MAC.
Of the 1668 registered water supplies, aluminum data is available for 741 facilities. Based on available data, <1% of facilities will exceed the proposed MAC and approximately 10% will exceed the OG.
While NSE does not regulate water quality at private water supplies, <1% are expected to exceed the proposed MAC.
NSE supports the establishment of a health-based guideline for total aluminum in drinking water; however, the proposed OG will have a significant impact for our municipal systems. While it is likely that facilities can improve the aluminum concentration in their filtered water through optimization of their coagulation process (e.g. strict pH control and adequate coagulant dosing), others (e.g. direct filtration plants) will not be able to achieve the proposed OG without impacting their filtration process.
New Brunswick
Based on the analytical data that we have available, it is not anticipated that establishing a MAC for Aluminum would result in impacts that would require additional treatment for most (if not all) New Brunswick drinking water systems. However, we do not monitor specifically for Aluminum and the introduction of an Aluminum MAC would likely result in additional sampling and monitoring requirements. Achieving the Operational Guideline for water quality in all distribution systems (e.g., ground and surface water systems) based on a locational running annual average of a minimum of quarterly samples taken in the distribution system could have implications. Based on the analytical data that we have, potential exists for some systems to exceed the OG, but this would need to be confirmed with additional sampling and monitoring. Corrosion Control is not a mandated operational practice in New Brunswick, and most ground water systems do not use any form of pH adjustment.
Quebec
Au Québec, étant donné que l'aluminium ne fait pas l'objet d'une norme au Règlement sur la qualité de l'eau potable, les résultats d'aluminium dont dispose le ministère de l'Environnement et de la Lutte contre les changements climatiques découlent des campagnes d'échantillonnage réalisées par le Ministère dans le cadre du Programme de surveillance de la qualité de l'eau potable. De 2012 à 2016, près de 230 analyses de l'aluminium ont été réalisées dans 60 installations de production d'eau potable majoritairement alimentées en eau souterraine. Peu de donnée sont disponibles actuellement en ce qui concerne les installations de production d'eau potable alimentées en eau de surface.
Aucun des échantillons prélevés par le Ministère n'a présenté un résultat supérieur à la CMA proposée de 2.9 mg/L (2900 μg/L). Par ailleurs, 6 (5,5 %) des échantillons prélevés à l'eau produite dépassaient la valeur de référence opérationnelle proposée de 0.05 mg/L (50 μg/L), ce qui concerne 4 (6,7 %) des installations visitées.
Considérant les résultats d'analyse disponibles, les impacts attendus de l'ajout d'une norme pour l'aluminium au Règlement sur la qualité de l'eau potable, en fonction de la révision de la recommandation publiée par Santé Canada, seraient faibles.
Ontario
Ontario supports the derivation of the health-protective guideline value for aluminum. The more stringent operational guideline will require more monitoring and optimization to ensure that aluminum removal is effective. The impact of the proposed health guideline value is minimal.
Manitoba
No impact paragraph has been provided by the province.
Saskatchewan
The Water Security Agency (WSA) has reviewed the proposed guideline technical document for Aluminum in drinking water and supports the proposed Maximum Acceptable Concentration (MAC) of 2.9 mg/L. An operational guideline value (OG) of 0.050 mg/L for Water Treatment Plants (WTPs) also proposed and is based on 1) a running annual average of monthly values determined from daily measurements of filtered water entering the distribution system and 2) on a locational running annual average of quarterly samples taken in the distribution system; the WSA noted that the new proposed OG is nearly 50% reduction of the existing operational guidance value of 0.100 mg/L aluminum in drinking water. Although most of the WTPs regulated by the WSA meet the new proposed OG, some of the WTPs may face challenges in meeting the proposed OG for aluminum in drinking water.
A review of the provincial water quality database showed that there are 2363 samples submitted for aluminum levels in treated drinking water and water from the distribution system over for the last 5 years (2013 to 2018) and data analysis revealed that aluminum levels in drinking water at the WSA regulated waterworks across the province are well below the proposed MAC of 2.9 mg/L.
In terms of drinking water treatment, the WSA will ensure that all the WTPs regulated by the WSA that use aluminum-based coagulants adopt appropriate water treatment strategies, such as strict pH control, adequate coagulant dosing etc to minimize the aluminum levels in treated water if there are any exceedances of regulated level. Considering aluminum levels in treated water, use of innovative Best Available Treatment (BAT) systems and adoption of appropriate operational controls by the WTPs in the province, the Water Security Agency believes that the new MAC for aluminum, if eventually adopted as a drinking water standard in the province, may not pose a significant compliance challenge. A comprehensive cost estimation for treatment plant upgrades at regulated waterworks cannot be developed or may not be needed at this time. Before formal adoption of any drinking water standard for aluminum in Saskatchewan, WSA will conduct further studies/data analysis to determine aluminum levels in treated water of selective water treatment systems in the province and compliance.
Alberta
In Alberta, municipal drinking water systems serve about 85% of the population and are regulated by the ministry of Environment and Parks under the Potable Water Regulation, a regulation within the Environmental Protection and Enhancement Act (EPEA). For Alberta's larger municipalities, the source of drinking water is typically a river, many of which have considerable variability in flow rates, water quality, and water chemistry depending on seasonal conditions. For example, during spring months when ice cover is breaking up on the North Saskatchewan River (Edmonton's source water), the concentration of suspended solids or particulates can increase by 3 orders of magnitude (or x 1,000) to over 2,000 mg/L compared to values as low as 2 mg/L during winter ice cover. For the City of Calgary, the Bow River also has varying water quality depending on the seasonal condition but with lesser extremes that pose water treatment challenges. The treatment process for these highly variable surface water surfaces has of course been optimized for each seasonal condition. Alum is used by both major cities in Alberta as a coagulant in the water clarification process. For 2017/2018, both waterworks systems had typical average concentrations of about 70 ppb for total aluminum in the treated water. This meets the current Operational Guidance value of 100 ppb.
In reviewing the aluminum consultation document, the following comments serve as the impact statement for the Alberta regulatory jurisdiction for drinking water on behalf of Environment and Parks. Treatment processes to produce safe, reliable drinking water quality are fundamentally about risk management and weighing costs, benefits, and different risks - namely infectious risks versus trace chemical hazard risks. This is well understood for chlorine as a chemical disinfectant, for example, and managing risks of waterborne pathogens and production of disinfection by-products. Ideally there should be a minimum of total aluminum in the finished treated water. The proposed MAC for total aluminum is 2,900 ppb and the new Operational Guideline value is 50 ppb. For Alberta drinking water facilities, the proposed MAC of 2,900 ppb should not pose any issue. This value is quite high (based on the neurological animal study findings), and Alberta drinking water facilities would be expected to not exceed this MAC of 2,900 ppb by using optimized alum dosing strategies. On the other hand, the new proposed O.G. value of 50 ppb will be a challenge to meet on a monthly basis, especially given challenges with seasonally variable source water quality.
Material impacts from trying to meet the lower 50 ppb O.G. value for total aluminum could include treatment process challenges, an increased risk for carry through of particulates and related increased risk for waterborne pathogens, more complexity in treatment if pH acidification is required and additional OH&S risks for operators. For Edmonton and Calgary's waterworks systems, for example, the annual average for total aluminum was about 70 ppb in 2017/2018. It should be advised that multi-year piloting studies would be needed to try to further optimize the coagulation treatment process, minimize trace levels aluminum in the finished treated water, without compromising treatment removal efficiencies. This would entail additional cost for water utilities and municipalities which would likely pose an additional fiscal challenge to the smaller municipal drinking water systems in Alberta.
British Columbia
A review of available data on aluminum in BC drinking water show less than one percent of water systems have aluminum values above the proposed health-based MAC of 2.9 mg/L. About 9% may have challenges with meeting the proposed operational guidelines of 0.05 0mg/L, most of which would likely be related to carryover from alum applications. It is not known how difficult it may be for these systems to adjust their operations to reduce values to below this operational guideline.
Yukon
It is not possible to quantify the impact of the proposed technical document and MAC for aluminum at this point in time for Yukon.
Yukon drinking water regulatory framework is primarily focused on water treatment and provision of safe drinking water as it leaves the water treatment plant to the distribution system. Provisions of the Drinking Water Regulation specify specific monitoring requirements for raw and treated water (at the point of water leaving the plant). While there is a requirement for monitoring of free chlorine, total coliforms and E. coli within the distribution system, there are currently no specific requirements for routine monitoring of other parameters.
Environmental Health Services (EHS) regulatory mandate extends to curb stop for large public drinking water systems. Routine compliance monitoring and regulatory requirements for large public drinking water system owners beyond this point is not within the current mandate. Further policy development would be needed to incorporate testing at the tap.
Currently all Yukon large public drinking water systems (LPDWS) meet the proposed MAC for aluminum entering the distribution system.
EHS is doing policy development in terms of monitoring of the distribution system for aluminum and other metals. LPDWS owners will be required to do an annual sample for specific parameters including aluminum in the upcoming calendar year.
Northwest Territories
No impact paragraph has been provided by the territory.
Nunavut
No impact paragraph has been provided by the territory.
Indigenous Services Canada
Based on the review of available data for First Nations south of 60° (excluding transferred communities in SK) a small number public or semi-public water treatment systems could be affected by the proposed maximum acceptable concentration (MAC) of 2.9 mg/L. It is noted that no system was identified as currently exceeding this value.
Workload and costs for drinking water monitoring conducted by Environmental Public Health Officers (EPHOs) is expected to increase as a result of the recommendation to assess compliance with a locational running annual average of a minimum of quarterly samples taken in the distribution system. EPHO sampling of drinking water is meant to validate operational monitoring conducted by the Water System Operator (WSO) and aluminum is not currently in the list of parameters that EPHOs are to sample quarterly. Any costs associated with addressing MAC exceedances will depend on the treatment system and the cause of the exceedance.
The proposed operational guidance (OG) of 0.05 mg/L is recommended to be applied to locational running annual averages of monthly values for filtered water in treatment plants using aluminum-based coagulants and to all distribution systems based on a locational running annual average of quarterly values. This OG may be difficult to achieve in small plants that have elevated levels of naturally-occurring aluminum in the source water and/or in small plants where an aluminum-based coagulant is used and coagulation pH is not strictly controlled.
ISC is not responsible for and does not regularly monitor private wells or systems with fewer than five connections where the public does not have access. As such, the impacts on these systems or private wells are difficult to quantify. It is noted that, for the timeframe studied (2012-2017), none of the available private system results were above the health based guideline of 2.9 mg/L.
Annexe C : Données sur la qualité des eaux au Canada
Tableau C-1. Résumé des concentrations d'aluminium total de l'Enquête nationale sur l'eau potable (2009-2010)
Type d'eau |
Été (μg/L)a |
Hiver (μg/L)a |
||||||||
| Détect./ échant. | Médi-ane | Moy-enne | 90e | Max | Détect./ Échant. |
Médi-ane | Moy-enne | 90e | Max | |
| Puits - brute | 7/17 | 8 | 10 | 17 | 17 | 6/9 | 8 | 28 | 70 | 130 |
| Puits - traitée | 9/16 | 9 | 12 | 24 | 32 | 7/9 | 6 | 12 | 26 | 36 |
| Puits - distribution | 6/17 | 19 | 17 | 27 | 31 | 6/9 | 15 | 16 | 24 | 31 |
| Lac - brute | 16/16 | 27 | 59 | 146 | 310 | 10/11 | 16 | 39 | 72 | 230 |
| Lac - traitée | 16/16 | 21 | 34 | 71 | 120 | 10/11 | 14 | 52 | 114 | 280 |
| Lac - distribution | 21/21 | 16 | 56 | 130 | 330 | 8/8 | 23 | 43 | 99 | 140 |
| Rivière - brute | 22/22 | 175 | 462 | 1 172 | 2 600 | 11/11 | 91 | 357 | 370 | 2 800 |
| Rivière - traitée | 22/22 | 35 | 89 | 220 | 390 | 9/11 | 53 | 74 | 122 | 270 |
| Rivière - distribution | 26/26 | 34 | 68 | 155 | 330 | 9/10 | 43 | 55 | 95 | 210 |
Source : Santé Canada, 2017,a Limite de détection de la méthode = 5 μg/L. Les échantillons ont été analysés par digestion acide à chaud.
Tableau C-2. Concentrations d'aluminium total dans certains bassins hydrographiques du Canada, tirées des données de surveillance à long terme de l'aluminium d'Environnement Canada (2000-2015)
Région |
Bassin fluvial | Nombre d'échant. | Nombre détectésa | Médiane (μg/L) |
Moy-enne (μg/L) |
90e centile (μg/L) |
Maximum (μg/L) |
Est |
Littoral - Maritimes | 583 | 583 | 168 | 337 | 335 | 84 800 |
| Terre-Neuve et Labrador | 1 127 | 1 126 | 82 | 128 | 216 | 4 120 | |
| Côte-Nord - Gaspé | 42 | 42 | 113 | 140 | 166 | 887 | |
| Saint John - St. Croix | 89 | 88 | 35 | 72 | 153 | 634 | |
| Centre | Winnipeg | 53 | 53 | 166 | 173 | 248 | 347 |
Prairies |
Assiniboine-Rouge | 829 | 827 | 320 | 875 | 2 348 | 16 100 |
| Churchill | 292 | 280 | 38 | 97 | 235 | 1 880 | |
| Bas Saskatchewan - Nelson | 394 | 394 | 161 | 362 | 960 | 3 120 | |
| Missouri | 94 | 94 | 280 | 1 052 | 1 744 | 22 800 | |
| Saskatchewan Nord | 491 | 491 | 105 | 525 | 1 060 | 19 300 | |
| Saskatchewan Sud | 750 | 748 | 66 | 925 | 1 440 | 58 500 | |
Pacifique |
Colombia | 4 418 | 4 395 | 25 | 138 | 348 | 9 850 |
| Fraser | 3 689 | 3 689 | 167 | 617 | 1 580 | 24 800 | |
| Okanagan-Similkameen | 1 153 | 1 152 | 41 | 287 | 542 | 21 200 | |
| Côte du Pacifique | 2 789 | 2 789 | 123 | 693 | 1 762 | 25 900 | |
| Paix-Athabasca | 393 | 393 | 121 | 776 | 1 896 | 21 000 | |
Arctique |
Côte de l'Arctique | 136 | 136 | 392 | 2 357 | 6 275 | 26 600 |
| Keewatin - Sud de l'île de Baffin | 39 | 39 | 11 | 13 | 24 | 39 | |
| Bas Mackenzie | 919 | 916 | 73 | 577 | 1 510 | 12 800 | |
| Yukon | 642 | 632 | 42 | 165 | 454 | 3 080 |
Source : Santé Canada, 2017,a Limite de détection de la méthode = 0,2 à 20 μg/L