Le baryum dans l’eau potable - Document technique pour consultation publique

Télécharger le format de rechange
(Format PDF, 545 Ko, 52 pages)
Organisation : Santé Canada
Date publiée : 2018-11-23
La période de consultation se termine le 15 février 2019
Table des matières
- But de la consultation
- Partie I. Vue d’ensemble et application
- Partie II. Science et considérations techniques
- 4.0 Propriétés, utilisation et sources dans l’environnement
- 5.0 Exposition
- 6.0 Méthodes analytiques
- 7.0 Considérations relatives aux techniques de traitement et aux réseaux de distribution
- 8.0 Cinétique et métabolisme
- 9.0 Effets sur la santé
- 10.0 Classement et évaluation
- 11.0 Justification
- 12.0 Références
- Annexe A : Liste des acronymes
But de la consultation
On a évalué l’information disponible sur le baryum dans le but d’établir une recommandation pour la qualité de l’eau potable et son document technique. Cette ébauche du document technique propose d’établir une recommandation maximale acceptable (CMA) de 2 mg/L (2 000 µg/L) pour le baryum dans l’eau potable, en fonction des effets observés sur les reins de souris mâles.
Ce document est mis à la disposition du public pour une période de consultation de 60 jours. La présente consultation vise à solliciter des commentaires sur la recommandation proposée, la démarche suivie pour l’élaborer et les coûts possibles de sa mise en œuvre, ainsi que pour déterminer la disponibilité d’autres données d’exposition. Les commentaires, avec justification pertinente le cas échéant, sont les bienvenus. Ils peuvent être envoyés à Santé Canada par courrier électronique (HC.water-eau.SC@canada.ca) ou au besoin par la poste au Bureau de la qualité de l’eau et de l’air, Santé Canada, 269, avenue Laurier Ouest, IA 4903D, Ottawa (Ontario) K1A 0K9. Les commentaires doivent nous parvenir avant le 15 février 2019.
La recommandation actuelle pour le baryum, dont la dernière version remonte à 1990, fixe la concentration maximale acceptable (CMA) à 1,0 mg/L (1 000 µg/L), valeur fondée sur l’absence d’effets nocifs sur la tension artérielle chez l’humain. Ce nouveau document renferme des données scientifiques à jour et des renseignements sur les effets du baryum sur la santé et décrit également ses effets sur les reins de souris mâles. Il présente les méthodes analytiques et les technologies disponibles de traitement dans les systèmes municipaux et résidentiels.
Les commentaires reçus dans le cadre de la consultation seront transmis, avec le nom et l’affiliation de leurs auteurs, aux membres concernés du Comité fédéral-provincial-territorial sur l’eau potable (CEP). Les personnes qui ne veulent pas que leur nom et leur affiliation soient communiqués aux membres du CEP doivent joindre à leurs commentaires une déclaration à cet égard.
Il est à noter que le présent document technique sur le baryum dans l’eau potable sera révisé après l’analyse des commentaires reçus et qu’une recommandation pour l’eau potable sera établie. Ce document devrait donc être considéré strictement comme une ébauche pour commentaires.
Partie I. Vue d’ensemble et application
1.0 Recommandation proposée
Une concentration maximale acceptable (CMA) de 2,0 mg/L (2 000 µg/L) est proposée pour le baryum total dans l’eau potable.
2.0 Sommaire
Dans l’environnement, le baryum est présent dans divers composés, soit naturellement ou du fait de l’activité humaine. Bien que le baryum soit surtout utilisé comme additif pour les fluides de forage dans le secteur de l’exploration pétrolière et gazière, il est aussi employé comme produit de contraste dans les examens radiologiques diagnostiques et dans un large éventail de produits, notamment les plastiques, les caoutchoucs, la peinture, le verre, les moquettes, les céramiques, les produits d’étanchéité, le mobilier, les engrais et les pesticides. Le baryum à l’état naturel est présent dans la plupart des types de roches et peut pénétrer dans les eaux de surface et les eaux souterraines par lessivage et érosion des roches sédimentaires. Au total, plus de 20 isotopes radioactifs du baryum, présentant des degrés divers de stabilité et de radioactivité, ont été recensés dans l’environnement. Le présent document porte toutefois uniquement sur les propriétés chimiques du baryum.
Le présent document technique passe en revue et évalue tous les risques pour la santé associés à la présence de baryum dans l’eau potable. Il évalue les nouvelles études et démarches et tient compte de la disponibilité des technologies de traitement appropriées. À la lumière de cet examen, on a proposé comme recommandation pour le baryum dans l’eau potable une concentration maximale acceptable de 2,0 mg/L.
Lors de sa réunion de l’automne 2017, le Comité fédéral-provincial-territorial sur l’eau potable a examiné le document technique sur le baryum et approuvé qu’il soit rendu public à des fins de consultation.
2.1 Effets sur la santé
Le Centre international de recherche sur le cancer n’a pas classé le baryum en fonction de sa cancérogénicité. L’Environmental Protection Agency des États-Unis a conclu qu’il était peu probable qu’une exposition par ingestion au baryum soit cancérigène pour les humains; d’autres organismes internationaux reconnaissent que rien ne démontre qu’une exposition au baryum par ingestion puisse causer le cancer.
Des études ont établi des liens entre l’ingestion de baryum et des effets indésirables sur la tension artérielle chez l’animal et l’humain. Cependant, des effets nocifs sur les reins ont démontré une forte corrélation avec une exposition chronique par voie orale au baryum. Chez l’humain, des effets ont été observés sur les reins après une exposition à des concentrations élevées de baryum dans des cas d’intoxication; chez l’animal, les effets rénaux sont considérés comme l’effet sur la santé le plus sensible associé à une ingestion à long terme de baryum, en particulier chez la souris, l’espèce la plus sensible. Par conséquent, la CMA proposée de 2,0 mg/L a été établie pour protéger la population générale, à la lumière des études réalisées sur les effets rénaux chez la souris.
2.2 Exposition
Les Canadiens sont surtout exposés au baryum par les aliments et l’eau potable, les aliments demeurant la principale source d’exposition. Au Canada, les concentrations de baryum dans les produits alimentaires varient considérablement, selon le produit et les conditions pédologiques. Les concentrations de baryum dans l’eau potable du Canada peuvent aussi varier énormément, selon les formations géologiques et les activités anthropiques présentes aux abords de la source d’approvisionnement. Il ne devrait pas y avoir absorption du baryum contenu dans l’eau potable par contact cutané ou inhalation.
2.3 Analyse et traitement
Plusieurs méthodes peuvent être employées pour l’analyse du baryum total dans l’eau potable à des concentrations inférieures à la CMA proposée. Dans un échantillon d’eau, le baryum total comprend le baryum à l’état dissous et à l’état particulaire. Par conséquent, si les deux formes sont mesurées séparément, il faut additionner les deux concentrations et comparer leur somme à la CMA.
Bien que le traitement de coagulation classique ne permette pas d’éliminer efficacement le baryum, plusieurs méthodes peuvent être utilisées pour traiter l’eau potable des sources d’approvisionnement municipales. Ces technologies comprennent l’adoucissement à la chaux et l’adoucissement par échange d’ions ainsi que les procédés de séparation par membrane haute pression comme l’osmose inverse et la nanofiltration. Parmi les autres mécanismes de contrôle, mentionnons le choix d’une autre source, le mélange et l’interconnexion avec un autre réseau d’alimentation en eau.
Au niveau résidentiel, il existe des appareils de traitement domestiques certifiés qui éliminent le baryum de l’eau potable. Les technologies en mesure d’éliminer efficacement le baryum de l’eau potable comprennent l’échange d’ions et l’osmose inverse. Il convient de souligner que les systèmes d’osmose inverse doivent être installés uniquement au point d’utilisation, car l’eau traitée peut être corrosive pour les éléments internes de plomberie.
2.4 Considérations internationales
Les recommandations, normes et / ou directives relatives à la qualité de l'eau potable établies par des gouvernements étrangers ou des agences internationales peuvent varier en raison des connaissances scientifiques disponibles au moment de l'évaluation, ainsi que de l'utilisation de différentes politiques et approches, telles que le choix d'une étude clé, et l'utilisation de taux de consommation, de poids corporels et de facteurs d'attribution différents.
D’autres organisations ont établi des recommandations ou normes relatives aux niveaux de barium dans l’eau potable. L’Organisation Mondiale de la Santé a établi une recommandation de 1,3 mg/L pour le baryum dans l’eau potable. Le niveau maximal acceptable de l’Environmental Protection Agency des États-Unis et la recommandation du National Health and Medical Research Council de l’Australie ont tous deux été établis à 2 mg/L pour le baryum dans l’eau potable. L’Union Européenne n’a pas établi de limites pour le baryum dans l’eau potable.
3.0 Application de la recommandation
Remarque : Il est conseillé de demander des indications précises concernant la mise en œuvre des recommandations pour l’eau potable auprès des autorités compétentes du territoire visé.
Pour les sources d’approvisionnement en eau potable qui, à l’occasion, dépassent pendant de courtes périodes la valeur recommandée pour le baryum, il est suggéré d’élaborer un plan et de le mettre en œuvre pour faire face à ces situations. Dans le cas de dépassements plus importants et de plus longue durée qui ne peuvent être corrigés par un traitement, il est suggéré d’envisager le choix d’autres sources d’approvisionnement.
3.1 Surveillance
3.1.1 Caractérisation de l’eau à la source
Il faut caractériser les sources d’eau afin de déterminer si elles contiennent du baryum. Si la concentration de baryum approche de la CMA proposée ou s’il est connu ou prévu que la concentration varie avec le temps (p. ex., si des activités anthropiques sont introduites), il faudrait faire un suivi annuel de la source. Les autorités peuvent envisager une surveillance réduite si des données suffisantes montrent que le baryum est présent à des concentrations inférieures à 2,0 mg/L dans la source d’approvisionnement ou si un traitement approprié est mis en place.
Les services publics qui adoptent des mécanismes de contrôle pour réduire la concentration de baryum dans la source d’approvisionnement devraient évaluer la qualité de l’eau provenant de nouvelles sources afin de s’assurer qu’elle n’a pas d’incidences sur les procédés de traitement en place et le réseau de distribution et ne cause pas d’autres problèmes de qualité de l’eau.
3.1.2 Surveillance opérationnelle
Les services publics qui utilisent un traitement pour éliminer le baryum de leur eau doivent assurer un suivi fréquent de l’eau traitée afin d’apporter les ajustements nécessaires au procédé et de s’assurer que les procédés de traitement éliminent efficacement le baryum et les autres contaminants présents et ramènent leurs concentrations en-deçà de leur CMA respective.
Les services publics qui ont recours à un procédé d’adoucissement à la chaux pour éliminer le baryum devraient effectuer une surveillance opérationnelle du pH. Ceux qui utilisent un procédé d’adoucissement de l’eau par échange d’ions (résine échangeuse de cations fortement acide [SAC] sous sa forme sodium) pour réduire la dureté et éliminer le baryum de leur source d’approvisionnement devraient surveiller, pour chaque appareil, le moment à partir duquel le procédé d’échange d’ion cesse de réduire la dureté de l’eau (percée) afin de déterminer à quel moment la résine doit être régénérée et d’assurer une élimination efficace du baryum. Parmi les facteurs opérationnels à prendre en compte lorsqu’on utilise des résines SAC sous forme d’hydrogène, mentionnons les pics chromatographiques. Étant donné la sélectivité des résines échangeuses d’ions envers le baryum et le calcium, des pics chromatographiques peuvent être observés pour certains ions, comme le sodium et le magnésium dans l’eau produite. Le traitement à l’aide de résines SAC sous forme d’hydrogène et de résines échangeuses de cations faiblement acides (WAC) doit être suivi d’une étape d’extraction du dioxyde de carbone et d’une étape d’ajustement du pH ou de l’alcalinité afin de réduire la corrosivité de l’eau produite. Les services publics qui utilisent des résines échangeuses SAC sous forme de sodium doivent savoir que ce procédé peut introduire des quantités indésirables de sodium dans l’eau traitée.
L’osmose inverse (OI), l’échange d’ions et l’électrodialyse/électrodialyse inverse (ED/EDI) font souvent intervenir la canalisation et le mélange d’une partie de l’influent (flux entrant) avec l’eau traitée afin d’obtenir la qualité d’eau voulue. Lorsque ce mécanisme de contrôle est utilisé, il est important de surveiller l’eau traitée mélangée afin de déterminer la concentration finale en baryum.
3.1.3 Surveillance de conformité
Lorsqu’un traitement est en place pour assurer la réduction du baryum (y compris des mesures de contrôle), il est recommandé de faire un suivi de la conformité au moins une fois par année afin de s’assurer que la CMA proposée n’est pas dépassée. Il faut prélever les échantillons après le traitement et avant la distribution (généralement au point d’entrée du réseau de distribution). Il faudrait recueillir des échantillons appariés de l’eau à la source et de l’eau traitée afin de vérifier l’efficacité du traitement ou de la mesure de contrôle.
3.1.4 Réseau de distribution
Comme les autres substances inorganiques, le baryum peut s’accumuler dans les réseaux de distribution et être libéré par intermittence. Une surveillance de l’eau dans le système de distribution devrait donc être effectuée si du baryum est présent ou a déjà été présent dans la source d’eau. Étant donné que la stabilité des métaux accumulés dans le tartre de la tuyauterie est imprévisible, il est difficile d’établir un programme de surveillance du baryum dans les réseaux de distribution. Le nombre de sites de surveillance du baryum et leur emplacement dans le réseau de distribution doivent tenir compte des accumulations localisées et des facteurs de risque de mobilisation. Les facteurs qui influent sur l’accumulation de baryum (dépôts de manganèse, produits de la corrosion du fer et précipités de phosphates) et sa remobilisation (changements dans la chimie de l’eau et perturbations physiques ou hydrauliques dans le réseau de distribution) peuvent indiquer à quel moment et à quel endroit le baryum est libéré.
Lorsque la qualité de l’eau change ou que des perturbations physiques surviennent dans le réseau, la présence d’eau décolorée ou un accroissement de la turbidité résultant de la libération des dépôts ou du tartre présents sur la paroi des tuyaux peuvent indiquer que du baryum et d’autres contaminants ont été mobilisés. Il faudrait dans ce cas surveiller le baryum et les autres contaminants lorsque le système fonctionne de nouveau normalement. L’absence de changement de couleur de l’eau ne signifie pas nécessairement qu’il n’y a pas eu de libération de métaux. La surveillance du baryum doit être effectuée conjointement avec celle d’autres métaux susceptibles d’apparaître simultanément dans le réseau de distribution (p. ex., fer, manganèse, arsenic, plomb).
On encourage les propriétaires qui possèdent des puits privés à faire analyser leur eau afin de s’assurer que la concentration de baryum dans leur source d’eau est inférieure à la CMA. Les propriétaires qui ont des puits privés et qui utilisent un appareil de traitement résidentiel devraient analyser périodiquement l’eau qui pénètre dans l’appareil et l’eau traitée afin de s’assurer de l’efficacité de l’appareil de traitement. Les propriétaires qui utilisent un adoucisseur échangeur d’ions doivent savoir que l’appareil de traitement peut introduire des quantités indésirables de sodium dans l’eau traitée.
Partie II. Science et considérations techniques
4.0 Propriétés, utilisation et sources dans l’environnement
Le baryum (Ba; numéro du CAS 7440-39-3) est un élément mou de couleur blanc argenté. C’est un cation divalent qui appartient au groupe IIA (métaux alcalino-terreux) du tableau périodique des éléments. Il a une masse volumique de 3,6 à 25 °C, un point de fusion de 727 °C et un point d’ébullition de 1 897 °C (CRC, 2017). Le baryum est largement répandu dans toute la croûte terrestre (0,04 %), sa concentration moyenne variant de 10 à 425 mg/kg, et se classe au 16e rang pour ce qui est de l’abondance parmi les éléments non gazeux (Taylor, 1964; Schroeder et coll., 1972). La houille peut contenir des concentrations de baryum pouvant atteindre 3 000 mg/kg (OMS, 2001; ATSDR, 2007). À l’état naturel, le baryum est une combinaison de sept isotopes stables. On a toutefois recensé plus de 20 isotopes, dont la plupart sont hautement radioactifs et dont la demi-vie varie entre plusieurs millisecondes et plusieurs minutes (OMS, 1990; Boffito, 1991; U.S. EPA, 2005). Seules les formes non radiologiques du baryum seront étudiées dans le présent document.
Le baryum n’est pas présent sous sa forme élémentaire dans la nature; il se présente sous forme de cation divalent associé à d’autres éléments, surtout dans les roches ignées, sédimentaires et métamorphiques (Boffito, 1991). Les composés les plus courants du baryum sont le sulfate de baryum (barytine), le carbonate de baryum (withérite), le chlorure de baryum, l’hydroxyde de baryum, l’oxyde de baryum et le sulfure de baryum. Le baryum réagit avec l’eau pour former de l’hydroxyde de baryum. Les composés solubles du baryum (sels) comprennent l’acétate, l’hydroxyde, le silicate, le chlorure, le nitrate, le thiocyanate, le cyanure, l’oxyde et les halogénures (excluant le fluorure); les autres sels (arséniate, carbonate, citrate, fluorure, oxalate, et tartrate) ne sont que légèrement hydrosolubles mais ils sont solubles dans les acides. Le chromate et le phosphate de baryum sont insolubles dans l’eau mais ils sont solubles dans les acides, tandis que le sulfate de baryum est insoluble dans l’eau et n’est que légèrement soluble dans les acides. Pour tous les sels de baryum, à l’exception du sulfate, la solubilité augmente à mesure que le pH diminue (OMS, 1990). Le tableau 1 présente les propriétés physicochimiques des composés courants du baryum.
| Substance | Formule chimique | Description physique | Poids moléculaire (g/mol) | Pression de vapeur (mm Hg)Note de bas de page a | Solubilité (g/100 g d’eau) |
|---|---|---|---|---|---|
| Baryum | Ba | Métal jaune argenté (cubique) | 137 | 6,65 × 10-4 à 630 °C | Réagit avec l’eau |
| Carbonate de baryum | BaCO3 | Cristaux blancs orthorhombiques |
197,34 | Essentiellement nulle | 0,0014 à 20 °C |
| Chlorure de baryum | BaCl2 | Cristaux blancs orthorhombiques; hygroscopique |
208,3 | Essentiellement nulle | 37,0 à 25 °C |
| Sulfate de baryum | BaSO4 | Cristaux blancs orthorhombiques |
233,39 | Aucune donnée | 0,00031 à 20 °C |
| Hydroxyde de baryum | Ba(OH)2 | Poudre blanche | 171,34 | 0 à 15 °C | 4,91 à 25 °C |
| Oxyde de baryum | BaO | Poudre blanche jaunâtre; cubique et hexagonal |
153,33 | Essentiellement nulle | 1,5 à 20 °C |
| Sulfure de baryum | BaS | Cristaux cubiques incolores ou poudre grise |
169,39 | Aucune donnée | 8,94 à 25 °C |
|
|||||
Le baryum est surtout utilisé (sous forme de barytine) comme additif pour augmenter la densité des fluides de forage (pression hydrostatique) dans des applications comme l’exploration pétrolière et gazière, qui représentent 85 % de l’utilisation mondiale. La barytine est aussi utilisée comme produit de contraste afin d’améliorer la visibilité de certains organes dans les examens radiologiques diagnostiques. Dans le secteur chimique, elle sert à la fabrication des produits en plastique et en caoutchouc, des peintures, du verre, des moquettes, des céramiques, des produits d’étanchéité, des meubles, du ciment, des pellicules supraconductrices et des réacteurs nucléaires (Dumont, 2007; CCME, 2013). Le nitrate de baryum entre dans la fabrication de pièces pyrotechniques. Le chlorure de baryum est utilisé dans la production d’hydroxyde de sodium, d’alliages d’aluminium, de pigments et de textiles et dans le traitement de l’eau de chaudière (Dibello et coll., 2003). Le baryum entre aussi dans la fabrication de certains pesticides, notamment le métaborate de baryum (utilisé comme microbicide et microbiostatique dans les peintures, le papier et les produits de papier, les adhésifs et les enduits industriels) et le carbonate de baryum, utilisé comme rodenticide (U.S. EPA, 1993; ATSDR, 2007).
La barytine et la withérite sont deux composés commerciaux du baryum largement répandus dans tout le Canada, qui compte plus de 150 gisements et quatre grands corps minéralisés (Giant Mascot et Mineral King en Colombie-Britannique, Buchans à Terre-Neuve-et-Labrador et Walton en Nouvelle-Écosse) (CCME, 2013). De petits gisements de withérite ont été découverts à Thunder Bay (Dumont, 2007). En 2007, la production canadienne de barytine et de withérite était estimée à 7 196 tonnes, alors que 68 971 tonnes étaient utilisées au Canada (Dumont, 2007).
4.1 Devenir dans l’environnement
Le baryum est naturellement présent dans les roches métamorphiques, ignées et sédimentaires à différentes concentrations; cependant, les activités anthropiques (comme l’épandage d’insecticides et d’engrais riches en baryum, les boues de forage et l’exploitation des gaz de schiste) peuvent aussi en augmenter la concentration. Les sulfates et les carbonates précipitent le baryum dans le sol, et les oxydes et les hydroxydes métalliques favorisent son adsorption sur les particules de sol. La mobilité du baryum dans le sol est généralement faible parce qu’il est facilement adsorbé à la surface des minéraux argileux et de la matière organique; il a tendance à former des sels insolubles et des complexes humiques non solubles. Dans des milieux acides, anaérobies et à forte teneur en chlorure et à faible teneur en sulfate ainsi que dans des conditions où le potentiel d’oxydo-réduction est réduit, la mobilité du baryum augmente, ce qui favorise sa migration dans les eaux souterraines (Kravchenko et coll., 2014).
La production d’énergie électrique, les centrales thermiques, la combustion de l’essence, les fonderies de métaux, les fours des cimenteries ainsi que l’exploitation minière et l’incinération des déchets peuvent être à l’origine de rejets de baryum dans l’atmosphère (CCME, 2013). Les sources ponctuelles de baryum comprennent les effluents et les déblais de forage, car la barytine est souvent utilisée comme principal constituant des suspensions des boues de forage (Breuer et coll., 2004). Le baryum présent dans l’air est associé aux particules et se présente surtout sous des formes insolubles (p. ex., sulfate) (Kravchenko et coll., 2014).
Le baryum peut être présent à l’état naturel dans les roches ignées, métamorphiques et sédimentaires. Le lessivage et l’érosion du baryum présent dans les roches sédimentaires peuvent constituer une source importante de baryum dans les eaux de surface et les eaux souterraines; les concentrations de baryum sont déterminées par les concentrations d’ions dissous (surtout des sulfates et des carbonates) et par l’adsorption des ions de baryum sur les particules en suspension, l’argile et les oxydes et hydroxydes métalliques (Taylor, 1964; OMS, 2001; Colbert et McManus, 2005; CCME, 2013). En présence d’ions sulfate, le baryum est précipité (CCME, 2013). Lorsque le pH baisse, les espèces soufrées présentes dans l’eau seront réduites à un état d’oxydation inférieur, ce qui accroîtra la solubilité dans l’eau des composés du baryum, le sulfate de baryum (BaSO4) et le carbonate de baryum (BaCO3) étant plus dépendants du pH que le chlorure de baryum (BaCl2) (ATSDR, 2007; Kravchenko et coll., 2014). La présence de chlorure et d’autres anions, comme des nitrates (NO3) et des carbonates (CO32-), augmente généralement la solubilité du sulfate de baryum, et lorsque le pH de l’eau est inférieur à 9,3, 98 % du baryum se présentera sous forme de cation divalent libre (Ba2+), tandis que moins de 2 % sera présent sous la forme d’autres espèces chimiques, notamment BaB(OH)4+, BaCl+, BaCO3, BaNO3+ et BaOH+ (Venugopal et Luckey, 1978; ATSDR, 2007; Tudorache et coll., 2010; CCME, 2013). Lorsque le pH de l’eau est supérieur à 9,3, l’espèce chimique dominante est BaCO3, ce qui en limite la solubilité (ATSDR, 2007). D’importantes quantités de baryum peuvent être libérées en raison de réactions d’échange ionique ou de dissolution d’oxydes aux abords de sources sous-marines profondes (Charette et Sholkovitz, 2006; Moore, 2010). Le baryum et le sulfure de baryum (BaS) peuvent être libérés de la barytine par solubilisation lors de la respiration anaérobie des bactéries réductrices de sulfates (Baldi et coll., 1996).
5.0 Exposition
Les aliments et l’eau potable constituent les principales sources d’exposition au baryum pour la population générale; les données disponibles indiquent toutefois que les apports provenant de ces sources peuvent être extrêmement variables. La teneur en baryum de l’eau potable peut aussi varier considérablement, selon les formations géologiques et les activités anthropiques présentes aux abords de la source d’approvisionnement en eau. L’exposition par l’air, les produits de consommation ou le sol devrait être négligeable. On estime à 20 % la contribution de l’eau potable aux sources de baryum, car les données disponibles sur l’exposition, présentées ci-dessous, donnent à penser que les aliments sont la principale source d’exposition au baryum et que, si l’eau potable demeure une source importante, elle y contribue néanmoins dans une plus faible mesure.
5.1 Eau
À l’Île-du-Prince-Édouard, on a analysé 14 236 échantillons provenant de puits forés privés et de puits municipaux utilisant le même aquifère et mesuré la teneur en baryum pendant une période de sept ans (de juin 2010 à février 2017) (Ministère des Communautés, des Terres et de l’Environnement de l’Î.-P.-É., 2017). Des 14 236 échantillons, 1 006 présentaient des concentrations égales ou inférieures à la limite de détection (LD) de 10 µg/L ou de 2 µg/L, selon le moment où les échantillons ont été prélevés; la concentration moyenne de baryum était de 290 µg/L, la concentration médiane, de 17 µg/L et la concentration maximale détectée, de 5 452 µg/L.
À Terre-Neuve-et-Labrador, on a enregistré les niveaux de baryum de 483 réseaux publics d’approvisionnement en eau potable de 2012 à 2016 en utilisant une LD de 1 µg/L (Ministère de l’Environnement et de la Conservation de Terre-Neuve-et-Labrador, 2017). On a constaté que 169 des 762 échantillons prélevés dans les eaux de surface non traitées et 25 des 101 échantillons d’eau souterraine brute présentaient des concentrations inférieures à la LD. Pour les eaux de surface non traitées, la concentration moyenne était de 20 µg/L, la concentration médiane, de 10 µg/L et la concentration maximale, de 130 µg/L; dans le cas des eaux souterraines brutes, les concentrations moyenne et médiane s’établissaient à 90 µg/L, et la concentration maximale était de 560 µg/L. Pour les eaux de surface traitées, 2 590 des 3 259 échantillons affichaient des concentrations sous la LD; la concentration moyenne était de 20 µg/L, la concentration médiane, de 10 µg/L, et la concentration maximale, de 140 µg/L. Pour les eaux souterraines traitées, 567 des 1 683 échantillons présentaient des concentrations sous la LD; la concentration moyenne était de 90 µg/L, la concentration médiane, de 60 µg/L, et la concentration maximale, de 700 µg/L.
Au Nouveau-Brunswick, on a mesuré les concentrations de baryum dans l’eau potable fournie par 231 réseaux d’État (puits d’eau souterraine seulement) et 476 réseaux municipaux (eau souterraine et de surface) entre 2007 et 2017 en utilisant une LD de 10 µg/L (Ministère de la Santé du Nouveau-Brunswick, 2017). Dans les réseaux d’État, 364 des 1 544 échantillons affichaient des concentrations inférieures à la LD. Dans l’eau souterraine traitée, la concentration moyenne mesurée était de 111 µg/L, la concentration médiane, de 54 µg/L et la concentration maximale, de 1 300 µg/L. Dans l’eau souterraine brute, la concentration moyenne mesurée était de 52 µg/L, la concentration médiane, de 53 µg/L et la concentration maximale, de 301 µg/L. Dans les réseaux municipaux, les concentrations étaient inférieures à la LD dans 590 des 4 203 échantillons. Dans les réseaux municipaux de distribution d’eau, la concentration moyenne mesurée était de 70 µg/L, la concentration médiane, de 25 µg/L et la concentration maximale, de 3 330 µg/L. Dans l’eau municipale brute, la concentration moyenne mesurée était de 120 µg/L, la concentration médiane, de 65 µg/L et la concentration maximale, de 986 µg/L. Dans les sources municipales d’eau de surface, la concentration moyenne était de 28 µg/L, la concentration médiane, de 15 µg/L et la concentration maximale, de 746 µg/L; dans les sources d’eau souterraine, la concentration moyenne était de 126 µg/L, la concentration médiane, de 76 µg/L et la concentration maximale, de 986 µg/L.
Au Québec, on a prélevé 11 889 échantillons d’eau potable traitée provenant de 3 178 réseaux de distribution entre 2013 et 2016 (Ministère du Développement durable, de l’Environnement et de la Lutte contre les changements climatiques, 2017). Dans 3 843 échantillons, les concentrations étaient inférieures à la LD de 0,2 à 50 µg/L (32 %); la concentration moyenne mesurée était de 69 µg/L, la concentration médiane, de 20 µg/L et la concentration maximale, de 11 000 µg/L. Dans le cadre d’une étude de longue durée sur les eaux souterraines, plus de 1 719 analyses ont été réalisées entre 1971 et 2014 dans diverses régions du Québec; les données sur le baryum sont tirées de divers projets de recherche utilisant différentes méthodes d’analyse. Pour un total de 1 490 puits d’observation, puits individuels et installations de distribution d’eau potable, la concentration moyenne de baryum mesurée était de 153 µg/L et la concentration maximale, de 10,00 µg/L.
Le projet Géochimie des eaux souterraines ambiantes vise à caractériser l’état chimique des eaux souterraines du sud de l’Ontario (superficie de 96 000 km2), et environ 2 300 échantillons ont été prélevés à cette fin entre 2007 et 2014 (Hamilton, 2015). Dans 40 des 2 255 échantillons, les concentrations étaient inférieures à la LD de 0,1 µg/L (1,8 %); la concentration moyenne était de 128 µg/L, la concentration médiane, de 64,5 µg/L et la concentration maximale, de 4 940 µg/L.
Au Manitoba, de 2009 à 2017, on a analysé 1 478 échantillons d’eau brute et 1 722 échantillons d’eau traitée et mesuré le baryum total en utilisant une LD de 0,3 µg/L (Manitoba, 2017). Dans l’eau brute, la concentration moyenne mesurée était de 70 µg/L, la concentration médiane, de 30 µg/L et la concentration maximale, de 2 473 µg/L; dans l’eau traitée (incluant les données sur les réseaux de distribution), la concentration moyenne était de 50 µg/L, la concentration médiane, de 20 µg/L et la concentration maximale, de 2 170 µg/L. Les eaux de surface du Manitoba sont surveillées par le biais d’une série de programmes de surveillance, comme le Long‐term Water Quality Monitoring Program (É.-U.), le Programme de surveillance du lac Winnipeg et le Programme de surveillance coordonnée du milieu aquatique. Entre 2006 et 2017, les concentrations moyenne et médiane de baryum total dans les eaux de surface étaient de 52 µg/L et de 43 µg/L, respectivement, la concentration maximale s’établissant à 1 720 µg/L; dans un seul échantillon sur 6 777, les concentrations étaient inférieures à la LD de 0,2 µg/L. Dans les lacs et les cours d’eau du nord du Manitoba, une concentration moyenne inférieure à 10 µg/L (plage de 4,6 à 8,7 µg/L; n = 5) a été mesurée (CCME, 2013).
En Saskatchewan, les concentrations de baryum total dans l’eau potable ont été mesurées entre 2007 et 2017 en utilisant une LD de 0,1 à 0,5µg/L (Saskatchewan Water Security Agency, 2017). Dans les eaux souterraines (brutes) (n = 1243), la concentration moyenne était de 51 µg/L, la concentration médiane, de 14 µg/L et la concentration maximale, de 1 210 µg/L. Dans les eaux de surface (brutes) (n = 451), la concentration moyenne était de 51 µg/L, la concentration médiane, de 46 µg/L et la concentration maximale, de 920 µg/L. Dans les eaux de surface traitées (n = 223), la concentration moyenne était de 78,3 µg/L, la concentration médiane, de 64 µg/L et la concentration maximale, de 1 440 µg/L.
Une concentration moyenne de 91 µg/L a été enregistrée pour cinq bassins fluviaux de l’Alberta (plage de 7 à 389 µg/L; n = 748) (CCME, 2013).
En Colombie-Britannique, le baryum n’est pas visé par les analyses types de l’eau potable; cependant, l’Interior Health Authority a mesuré 11 concentrations élevées de baryum, variant entre 1 500 et 106 000 µg/L, à six installations de distribution d’eau potable traitée (Ministère de la Santé de Colombie-Britannique, 2016).
Au Yukon, la teneur en baryum de l’eau potable a été mesurée dans des échantillons recueillis entre 2009 et 2017 (Service d’hygiène du milieu du Yukon, 2017). Dans l’ensemble, la concentration moyenne était de 59 µg/L, la concentration médiane, de 27 µg/L et la concentration maximale, de 819 µg/L; dans 29 des 315 échantillons, les concentrations étaient inférieures à la LD de 0,1 à 25 µg/L. Les concentrations moyenne et médiane étaient de 95 µg/L et de 80 µg/L, respectivement, pour l’eau brute, et de 50 µg/L et de 25 µg/L pour l’eau souterraine. La concentration moyenne mesurée était de 57 µg/L dans l’eau traitée (n = 30) et de 26 µg/L dans l’eau de surface (n = 5).
Dans le cadre de l’Enquête nationale sur les sous-produits de désinfection et certains contaminants émergents dans l’eau potable au Canada, Santé Canada a prélevé de l’eau potable à trois endroits des réseaux de distribution de 65 sites au cours des mois d’été et d’hiver de 2009 et de 2010 (LD = 5 µg/L) (Santé Canada, 2016). Dans les échantillons d’eau de surface brute (n = 89), la concentration moyenne de baryum était de 27 µg/L, la concentration médiane, de 19 µg/L et la concentration maximale, de 120 µg/L. Dans l’eau de surface traitée (n = 70), la concentration moyenne était de 24 µg/L, la concentration médiane, de 16 µg/L et la concentration maximale, de 120 µg/L. Dans les échantillons d’eau de puits brute (n = 35), la concentration moyenne mesurée était de 103 µg/L, la concentration médiane, de 52 µg/L et la concentration maximale, de 500 µg/L. Dans l’eau de puits traitée (n = 27), la concentration moyenne de baryum était de 105 µg/L, la concentration médiane, de 80 µg/L et la concentration maximale, de 510 µg/L.
Entre 2000 et 2016, Environnement Canada a recueilli des données sur la qualité de l’eau douce à plus de 200 sites de prélèvement fédéraux et fédéraux-provinciaux, à divers emplacements et à diverses fréquences d’échantillonnage, dans l’ensemble des écosystèmes aquatiques du Canada (ECCC, 2017). Pour le baryum total, les 18 985 échantillons prélevés présentaient tous des concentrations supérieures à la LD de 0,02 à 1 µg/L; la concentration moyenne mesurée était de 40,1 µg/L, la concentration médiane, de 25,3 µg/L et la concentration maximale, de 1 900 µg/L.
L’Étude canadienne sur l’alimentation totale (ECAT) est une initiative de Santé Canada qui vise à mesurer les concentrations de différents produits chimiques dans les aliments et à utiliser ces données pour estimer les expositions alimentaires de la population canadienne en fonction du sexe et du groupe d’âge (Santé Canada, 2012b). Dans cette étude, on a mesuré les concentrations de baryum dans l’eau du robinet de neuf villes entre 2000 et 2012. À St. John’s, le niveau moyen observé variait entre une valeur inférieure à 3,6 et 57 µg/L, à Halifax, il se situait entre 5,9 et 73 µg/L, à Québec, entre 21 et 61 µg/L, à Montréal, entre 15 et 247 µg/L, à Toronto, entre une valeur inférieure à 1 et 14 µg/L, à Ottawa, entre 13 et 42 µg/L, à Winnipeg, entre 1,2 et 14 µg/L, à Calgary, entre 31 et 46 µg/L et à Vancouver, entre une valeur inférieure à 11 et 62 µg/L.
À la lumière des données de surveillance recueillies à l’échelle provinciale et territoriale dans le cadre de l’ECAT présentées ci-dessus ainsi que des données fournies par l’Enquête nationale sur les sous-produits de désinfection et certains contaminants émergents dans l’eau potable au Canada, on a pu calculer une valeur moyenne d’environ 88 µg/L en se fondant sur les concentrations moyennes mesurées dans l’eau potable traitée; pour un poids corporel chez l’adulte de 70 kg et une consommation d’eau potable de 1,5 L/jour (Santé Canada, 1994), on peut calculer un apport estimatif de 2 µg/kg poids corporel (p. c.) par jour (valeur arrondie) pour le baryum dans l’eau potable chez les adultes de la population générale du Canada.
5.2 Aliments
L’alimentation est considérée comme la principale source d’exposition au baryum pour la population générale canadienne. Au Canada, l’exposition moyenne par voie alimentaire a été évaluée dans le cadre de l’ECAT (Santé Canada, 2012a). À la lumière des données recueillies entre 1993 et 2010 pour neuf villes canadiennes (St. John’s, Halifax, Montréal, Ottawa, Toronto, Winnipeg, Calgary, Vancouver et Whitehorse), on a estimé que l’exposition moyenne au baryum par voie alimentaire, exprimée en fonction du poids corporel, se situait entre 12,4 et 27,7 µg/kg p. c. par jour pour les nourrissons de 0 à 6 mois, entre 16,6 et 26,6 µg/kg p. c. par jour pour les enfants de 7 mois à 4 ans, entre 14,5 et 19,9 µg/kg p. c. par jour pour les enfants de 5 à 11 ans, entre 9 et 12,4 µg/kg p. c. par jour pour les enfants de 12 à 19 ans et entre 5,1 et 10,1 µg/kg p. c. par jour pour les personnes âgées de 20 ans et plus.
Selon les données de l’ECAT recueillies entre 1993 et 2012, les concentrations moyennes de baryum dans les aliments courants variaient selon les années et les villes canadiennes. Les sources d’exposition par voie alimentaire comprennent les produits de base, comme les aliments à base de céréales, les fruits, les légumes, les noix et les herbes et épices (Santé Canada, 2012b). Selon l’ECAT, les concentrations moyennes de baryum étaient de 19 à 5 403 μg/kg dans les produits à base de céréales, de 15 à 3 169 μg/kg dans les fruits, de 3 à 4 023 μg/kg dans les légumes, de 1 755 à 5 033 μg/kg dans les noix et de 20 750 à 38 172 μg/kg dans les herbes et les épices. Les concentrations moyennes de baryum dans les préparations pour nourrissons et les préparations à base de soja variaient entre 16 µg/L et 216 µg/L. Le Conseil canadien des ministres de l’environnement (CCME) a estimé que les concentrations moyennes de baryum dans le lait maternel humain étaient de 3,61 µg/L, en se basant sur les concentrations moyennes mesurées dans le cadre de six études internationales (Canada, Autriche, Italie et Émirats) (CCME, 2013). Environnement et Changement climatique Canada (ECCC) (2016) a enregistré des apports moyens et au percentile 95 de 0,21 μg/kg p. c. par jour et de 0,24 μg/kg p. c. par jour, respectivement, pour les nourrissons, en se fondant sur les concentrations mesurées dans le lait maternel de 2001 mères canadiennes entre 2008 et 2011 dans le cadre de l’Étude mère-enfant sur les composés chimiques de l’environnement (Maternal–Infant Research on Environmental Chemicals ou MIREC).
5.3 Air
Dans l’air, le baryum est associé à des poussières et à des particules en suspension. Le baryum est surtout présent sous forme de sulfate ou de carbonate et, éventuellement, sous d’autres formes insolubles (OMS, 1990; ATSDR, 2007). Les données recueillies dans le cadre du programme du Réseau national de surveillance de la pollution atmosphérique (RNSPA) donnent à penser que le baryum présent dans l’air ambiant est lié à la fraction grossière de la matière particulaire (MP) (2,5 à 10 μm) (CCME, 2013). Le RNSPA recueille des données sur plus de 300 contaminants atmosphériques dans l’ensemble du Canada (Environnement Canada, 2013). Pour les particules fines (MP2,5), la concentration moyenne était de 7 ng/m3, la concentration médiane, de 4 ng/m3, et la concentration maximale, de 58 ng/m3 (n = 157). Pour les particules grossières (MP10), la concentration moyenne était de 9 ng/m3, la concentration médiane, de 6 ng/m3, et la concentration maximale, de 50 ng/m3 (n = 1 735). Une valeur moyenne de 2,7 ng/m3 a été établie pour la concentration de fond dans l’air intérieur au Canada à partir de deux petites études de surveillance (deux maisons canadiennes en Alberta et une maison de retraite américaine; écart type = 4,2; n = 40 échantillons) (CCME, 2013). Dans un document sur l’approche scientifique (DAS) élaboré par ECCC (2016), les concentrations médianes de baryum dans des échantillons de poussière de 1 025 maisons étaient de 277 μg/g (95e centile, 528 μg/g); les concentrations médianes de baryum de l’air extérieur et de l’air intérieur associées à PM2,5 étaient de 0,94 ng/m3 (plage de 0,04 à 18,89 ng/m3; n = 910) et de 1,06 ng/m3 (95e centile; 4,71 ng/m3), respectivement (Environnement Canada, 2011; Rasmussen et coll., 2016).
5.4 Produits de consommation
La barytine est autorisée dans les produits naturels de santé bucco-dentaire au Canada et comme produit de contraste radiologique pour l’opacification du tractus gastro-intestinal; le composé est toutefois insoluble et son absorption est considérée négligeable (Santé Canada, 2017). Les produits pour la peau, les cosmétiques et les encres de tatouage peuvent aussi contenir du baryum (CCME, 2013; Ministère de la Santé de la Nouvelle-Zélande, 2013). On n’a toutefois pas estimé l’apport quotidien de ces produits, car aucune donnée n’est disponible sur la proportion de la population générale qui les utilise et que l’absorption par la peau est jugée négligeable, compte tenu des propriétés physicochimiques de l’élément.
5.5 Sol
Les concentrations de baryum dans le sol varient selon les formations géologiques et les apports anthropiques de 15 à 3 000 mg/kg (et peuvent atteindre 37 000 mg/kg à proximité des dépôts de barytine). La Commission géologique du Canada a enregistré une concentration moyenne de 140 mg/kg dans le sol canadien (écart type = 120; n = 7,397) (CCME, 2013). On a par ailleurs estimé à 305,3 mg/kg (écart type = 311,3; n = 165) la concentration moyenne de baryum dans la poussière intérieure en se fondant sur l’étude réalisée par Rasmussen et coll. (2001) sur les résidences d’Ottawa.
5.6 Données de biosurveillance
L’urine est la matrice biologique la plus souvent utilisée comme indicateur d’une exposition au baryum dans les études de biosurveillance. Aux États-Unis, le National Health and Nutrition Examination Survey (NHANES) III (1988–1994) ainsi que sept cycles consécutifs des Centers for Disease Control (CDC)-NHANES (jusqu’en 2012) fournissent des données sur les concentrations urinaires de baryum (normalisées en concentrations de créatinine) à partir d’un échantillon représentatif de la population américaine de tous âges (n = 2 502 au cours du cycle de 2011–2012) (Paschal et coll., 1998; CDC, 2015). Règle générale, les concentrations urinaires de baryum sont demeurées relativement stables au cours des ans, les enfants (âgés de 6 à 11 ans) présentant des concentrations urinaires de baryum (valeur médiane, 2,18 µg/g créatinine (intervalle de confiance [IC] de 95 % = 1,70 à 2,61) considérablement plus élevées que les adolescents (âgés de 12 à 19 ans; valeur médiane, 1,42 µg/g créatinine (IC de 95 % = 1,24 à 1,78) et que les adultes (âgés de 20 ans et plus; valeur médiane, 1,31 µg/g créatinine (IC de 95 % = 1,20 à 1,43). Au cours du cycle de 2011–2012, on a déterminé que les femelles présentaient des concentrations urinaires médianes de baryum sensiblement plus élevées que les mâles, soit 1,51 et 1,17 mg/g créatinine, respectivement; cet écart ne serait toutefois pas statistiquement significatif au niveau du 95e centile. De même, dans une étude allemande réalisée par Heitland et Koster (2006), on a enregistré des concentrations urinaires moyennes de baryum de 1,2 µg/g créatinine chez 72 enfants (âgés de 2 à 17 ans) et de 1,3 µg/g créatinine chez 87 adultes (âgés de 18 à 65 ans); dans une étude française effectuée par Goullé et coll. (2005), on a observé une concentration médiane de 0,89 mg/L (corrigée aux fins de la détermination enzymatique de la créatinine) dans l’urine de 100 adultes en santé.
5.7 Exposition par voies multiples par l’eau potable
Le baryum peut être absorbé par inhalation; cependant, une exposition aux vapeurs de baryum lors de la douche ou du bain est peu probable car le baryum n’est pas volatil (pression de vapeur quasi nulle). L’absorption par voie cutanée du baryum lors de la douche ou du bain est considérée négligeable parce que la constante de perméabilité de la peau est de 1 × 10-3 cm/h (U.S. EPA, 2004), ce qui indique que la voie cutanée représenterait moins de 10 % de la consommation d’eau potable (Krishnan et Carrier, 2008). Par conséquent, il est peu probable qu’une exposition par inhalation et par voie cutanée contribue de façon importante à l’exposition totale.
6.0 Méthodes analytiques
L’U.S. Environmental Protection Agency (EPA) approuve actuellement trois méthodes (méthode 200.5 révision 4.2, méthode 200.7 révision 4.4 et méthode 200.8 révision 5.4) pour l’analyse du baryum total dans l’eau potable. L’U.S. EPA a également approuvé plusieurs méthodes (SM 3111D, SM 3113B et SM 3120B) mises au point par un organisme d’élaboration de normes volontaires consensuelles (U.S. EPA, 2016).
Les limites de détection des méthodes (LDM) dépendent de la matrice de l’échantillon, des instruments et des conditions d’utilisation choisies et varient d’un laboratoire à l’autre.
| Méthode (référence) | Méthodologie | LDM (µg/L) | Interférences/commentaires |
|---|---|---|---|
| EPA 200.5 rév. 4.2 (U.S. EPA, 2003) |
Spectroscopie d’émission avec plasma induit par haute fréquence avec signaux vus en direction axiale (AVICP-AES) | 0,05 | Sujette à des interférences spectrales, physiques, chimiques et attribuables à la mémoire. Interférences dues à la matrice Ca, Mg et Na >125 mg/L et Si >250 mg/L |
| EPA 200.7 rév. 4.4 et SM 3120B (U.S. EPA, 1994a; APHA et coll., 1992, 1995, 1998, 2005, 2012) |
Spectrométrie d’émission atomique à source plasma couplée par induction (ICP-AES) | 1,0 | Sujette à des interférences spectrales, physiques, chimiques et attribuables à la mémoire. Interférences dues à la matrice MDT > 0,2 % (p/v) pour EPA 200.7 et MDT > 1 500 mg/L pour SM 3120B |
| EPA 200.8 rév. 5.4 (U.S. EPA, 1994b) |
Spectrométrie de masse avec plasma à couplage inductif (ICP-MS) | 0,04Note de bas de page a – 0,8Note de bas de page b | Sujette à des interférences isobariques dues à des éléments et à des ions polyatomiques et à des interférences physiques. Interférences dues à la matrice MDT > 0,2 % (p/v) |
| SM 3111D (APHA et coll., 1992, 1995, 2005, 2012) |
Spectrométrie d’absorption atomique en mode de flamme | 30,0 | Sujette à plusieurs interférences, principalement des interférences chimiques (absence d’adsorption par les atomes). Pour prévenir l’ionisation du baryum, les cations Na+, K+ and Li+ sont ajoutés en excès. |
| SM 3113B (APHA et coll., 1992, 1995, 2005, 2012) |
Spectrométrie d’absorption atomique électrothermique | 2,0 | Sujette à une absorption moléculaire, à des interférences chimiques et à des interférences dues à la matrice. |
|
|||
La limite pratique de quantification (LPQ) de l’U.S. EPA pour le baryum est actuellement de 0,15 mg/L; cette valeur est fondée sur la capacité des laboratoires à mesurer les concentrations de baryum dans des limites raisonnables de précision et d’exactitude. Dans le deuxième cycle d’examen de six ans du National Primary Drinking Water Regulations, les données d’évaluation de la performance et les épreuves de compétence donnent à penser que la LPQ actuelle pourrait être plus basse; cette réduction pourrait toutefois être minime, compte tenu du faible taux de réussite des laboratoires à la plus faible concentration de l’ajout dosé. On n’a approuvé aucune méthode nouvelle ou révisée susceptible d’améliorer la performance analytique dans le voisinage de la LPQ actuelle pour la détection du baryum dans l’eau potable (U.S. EPA, 2009).
6.1 Préservation et préparation des échantillons
Règle générale, les considérations opérationnelles liées à l’analyse du baryum dans l’eau potable (préservation et entreposage des échantillons) sont décrites dans les documents de référence présentés au tableau 2 ci-dessous. Pour quantifier précisément le baryum dissous, particulaire (en suspension) et total dans les échantillons, il faut s’assurer de préserver et de préparer correctement les échantillons. La méthode SM 3030B fournit des directives sur les procédures de filtration et de préservation à effectuer pour le dosage des métaux dissous ou particulaires (APHA et coll., 2012). Pour le dosage des métaux dissous, les échantillons doivent être filtrés (diamètre des pores de 0,45 µm) au moment du prélèvement à l’aide d’un dispositif de filtration en plastique prétraité, sous vide ou sous pression. Le filtrat doit être acidifié à un pH < 2 avec de l’acide nitrique concentré. Pour la détermination du baryum particulaire, le filtre doit être conservé et les particules qu’il contient doivent être digérées en laboratoire par une méthode appropriée (APHA et coll., 2012).
Actuellement, les méthodes EPA 200.7 et EPA 200.8 ainsi que les méthodes SM 3111D, SM 3113B et SM 3120B, ne requièrent de digestion thermique en milieu acide des échantillons pour l’analyse des métaux extractibles totaux que si la turbidité d’un échantillon préservé dans l’acide est supérieure à une (1) unité de turbidité néphélémétrique (uTN). Dans le cas des méthodes EPA, la digestion est réalisée en transférant une aliquote de l’échantillon dans une solution d’acide nitrique et d’acide chlorhydrique, puis en chauffant doucement la solution à une température d’environ 85 °C (digestion thermique) (U.S. EPA, 1994a, 1994b). Il est recommandé d’effectuer une digestion par micro-ondes (SM 3030 K) lorsque l’analyse des métaux récupérables totaux est effectuée à l’aide d’une méthode SM qui fait appel à l’ICP-MS. Bien que les méthodes énoncées ci-dessus ne requièrent pas de digestion thermique en milieu acide à moins que la turbidité dépasse 1 uTN, des recherches menées sur d’autres métaux comme le plomb et le chrome ont indiqué que cela ne permettait pas de quantifier avec précision la concentration totale d’un métal dans un échantillon. Dans ces conditions, le protocole actuel pourrait sous-estimer le baryum total dans l’eau potable en présence de baryum particulaire. Par exemple, les exigences en matière d’analyse de l’UCMR3 prescrivent de solubiliser l’échantillon préservé dans l’acide par chauffage léger à l’aide d’acide nitrique, peu importe la turbidité de l’échantillon ou la méthode utilisée (U.S. EPA, 2012a).
7.0 Considérations relatives aux techniques de traitement et aux réseaux de distribution
7.1 Baryum dans l’eau
Dans les milieux aqueux, le baryum est généralement présent sous la forme Ba2+, un ion divalent. Dans certaines conditions, le baryum peut former des précipités métalliques sous forme de sulfate, de carbonate ou de chromate (Friedman et coll., 2010). En présence d’un sulfate (SO42–) à une concentration égale ou supérieure à 2 mg/L et d’un pH inférieur à 9,3, la barytine insoluble (BaSO4) peut être précipitée et devenir l’espèce dominante de baryum. La plupart des sources d’eau contiennent une concentration suffisante de SO42- pour précipiter BaSO4 et maintenir ainsi des faibles concentrations de baryum. En présence d’ions carbonate (CO32-) et lorsque le pH est supérieur à 9,3, la withérite (BaCO3) affiche une cinétique de précipitation rapide et devient l’espèce dominante, ce qui limite la solubilité du baryum (Rai et coll., 1984; Snyder et coll., 1986; McComish et Ong, 1988; ATSDR, 2007; Menzie et coll., 2008). Les ions baryum forment des complexes faibles avec Cl-, OH- et NO3-, et la solubilité de ces complexes est moins liée au pH que celle de la barytine ou de la withérite (Menzie et coll., 2008; Tang et Johannesson, 2010; Kravchenko et coll., 2014).
Le baryum n’est pas facilement oxydé ou réduit (Menzie et coll., 2008; Groschen et coll., 2009). Kravchenko et coll. (2014) indiquent que des changements dans l’état d’oxydation n’ont pas d’incidence directe sur la solubilité du baryum dans l’eau naturelle. Cependant, le potentiel d’oxydoréduction peut avoir un effet sur les espèces de soufre. Par exemple, si l’état d’oxydation du SO42- est réduit à un état inférieur (p. ex., H2S), la teneur réduite en SO42- aura pour effet d’augmenter la solubilité du baryum.
En raison de la nature cationique des espèces solubles, le baryum peut être associé à diverses matrices solides, comme les oxydes métalliques, l’argile et la matière organique. Une étude a révélé que le baryum peut déplacer les autres métaux alcalino-terreux sorbés du dioxyde de manganèse (MnO2), du dioxyde de silicium (SiO2) et du dioxyde de titane (TiO2). Cependant, ces métaux alcalins peuvent déplacer le baryum de l’oxyde d’aluminium (Al2O3) (Rai et coll., 1984). Comme pour la plupart des métaux traces cationiques, les propriétés de sorption du baryum sont augmentées à des valeurs de pH élevées (Friedman et coll., 2010).
7.2 Traitement à l’échelle municipale
Les données sur l’élimination du baryum à l’état naturel dans l’eau potable sont limitées. L’U.S. EPA (1998) considère que l’adoucissement à la chaux, l’échange d’ions, l’osmose inverse et l’électrodialyse/électrodialyse inverse sont les procédés de traitement les plus efficaces pour éliminer le baryum de l’eau potable.
Les techniques traditionnelles de coagulation/filtration affichent un faible rendement pour ce qui est de l’élimination du baryum de l’eau potable (au plus 30 %). Les procédés de coagulation en deux étapes peuvent être plus efficaces (élimination à environ 80 %) que les procédés classiques de coagulation, mais ils ne sont pas couramment utilisés au Canada (Sorg et Logsdon, 1980; Lovins et coll., 1999).
Dans des études pilotes et à grande échelle plus anciennes, on a établi que les procédés d’adoucissement à la chaux permettaient d’éliminer jusqu’à 95 % du baryum présent dans l’eau potable à des valeurs de pH variant de 10,0 à 10,5. Le baryum dissous est précipité sous forme de carbonate de baryum; c’est ce même mécanisme qui entre en jeu pour éliminer le calcium lors du traitement de l’eau dure (Sorg et Logsdon, 1980). L’une des techniques les plus efficaces pour réduire la concentration de baryum dans l’eau potable est basée sur l’adoucissement par échange d’ions. Les données d’un nombre limité d’études à grande échelle et d’un certain nombre d’études exhaustives en banc d’essai indiquent que les résines échangeuses d’ions SAC et WAC éliminent 95 à 97 % du baryum, ramenant la concentration dans l’eau traitée à moins de 1,0 mg/L (Kojola et coll., 1978; Snoeyink et coll., 1984, 1987a, 1987b; Myers et coll., 1985; Snyder et coll., 1986).
Les procédés de séparation membranaire à haute pression comme l’OI et la nanofiltration (NF) sont des techniques éprouvées pour la réduction de la dureté de l’eau potable et devraient donc être très efficaces pour l’élimination du baryum. L’électrodialyse/électrodialyse inverse est moins souvent citée; ce procédé est toutefois efficace pour éliminer le baryum de l’eau potable. L’électrodialyse est généralement utilisée pour la désalinisation de l’eau de mer et des eaux saumâtres présentant une faible turbidité (Sorg et Logsdon, 1980; Krause et Stover, 1982).
Le choix et l’efficacité de chaque stratégie de traitement reposent sur plusieurs facteurs, dont la chimie de l’eau de la source d’approvisionnement, la concentration de baryum, les procédés de traitement préexistants, les conditions d’utilisation de la méthode de traitement, les objectifs de traitement du service public et les enjeux et coûts liés au traitement des résidus. Il est important de choisir avec soin la technique adaptée à chaque application parce que la qualité chimique de l’eau traitée influe sur l’efficacité de chaque technique de traitement.
Le cas échéant, il faudrait consulter les autorités compétentes afin de s’assurer que l’élimination des résidus liquides et solides produits par le traitement de l’eau potable est conforme aux règlements en vigueur.
7.2.1 Mécanismes de contrôle
Les mécanismes de contrôle types pour réduire les concentrations excessives de baryum dans l’eau potable comprennent le choix d’une nouvelle source d’approvisionnement, le mélange de l’eau et l’interconnexion avec un autre réseau de distribution ou encore, l’achat d’eau d’un autre réseau (Willey, 1987; U.S. EPA, 2012b). Il faut accorder une attention particulière à la qualité de l’eau d’une nouvelle source d’approvisionnement avant d’apporter des changements à la source existante. Il faut caractériser la qualité de l’eau afin d’évaluer les effets que les mécanismes de contrôle pourraient avoir sur cette qualité et de déterminer les incidences potentielles sur les procédés de traitement en place et le réseau de distribution. Ainsi, si l’eau de la nouvelle source est plus agressive, elle peut entraîner un lessivage du plomb ou du cuivre dans le réseau de distribution. Un changement dans la qualité de l’eau ne devrait jamais causer d’autres problèmes de conformité. Il faudrait utiliser le même type de désinfectant (chlore ou chloramine) lorsqu’on mélange de l’eau provenant de deux sources différentes afin de prévenir les problèmes de qualité de l’eau et de désinfection.
Le choix d’une nouvelle source peut nécessiter le forage d’un nouveau puits dans un aquifère à faible teneur en baryum, la fermeture des zones productrices d’eau qui contiennent de fortes concentrations de baryum ou la recherche d’une source d’eau de surface non contaminée. Le choix d’une autre source peut aussi être limité par la disponibilité de ces sources, les droits relatifs à l’eau ou les coûts de transport de l’eau de la nouvelle source à l’installation de traitement.
Le mélange consiste à diluer les concentrations de baryum d’une source contaminée avec une autre source ne contenant que peu ou pas de baryum. Afin de réduire au minimum la tuyauterie nécessaire pour acheminer l’eau des deux sources à un point de mélange commun, les sources devraient idéalement être proches l’une de l’autre. Le mélange se fait ordinairement dans un réservoir de stockage ou un collecteur commun et permet d’obtenir des concentrations inférieures à la CMA. Il faut prendre en compte les problèmes de corrosion lorsqu’on mélange des eaux de qualité différente.
Pour réaliser une interconnexion avec un autre réseau de distribution, il faut prendre en compte différents facteurs. On doit notamment déterminer si le réseau récepteur se trouve à proximité d’une source d’alimentation en eau qui ne dépasse pas la CMA de baryum, si une entente d’interconnexion ou de fusion peut être conclue avec cet autre réseau et si le réseau interconnecté peut prendre en charge la demande accrue résultant de l’ajout de nouveaux clients. Il faut également tenir compte des coûts avant de prendre cette décision.
7.2.2 Coagulation classique
La coagulation classique à l’alun et aux sels ferriques est un procédé peu efficace pour l’élimination du baryum (Krause et Stover, 1982). Lors d’un essai de floculation, la coagulation traditionnelle a éliminé à peu près 30 % du baryum total, faisant passer les concentrations de 7,0 à 8,5 mg/L à environ 5,0 mg/L dans l’eau souterraine, avec des doses d’alun ou de sulfate de fer pouvant atteindre 120,0 mg/L et des valeurs de pH variant de 7,5 à 8,0 (Sorg et Logsdon, 1980). L’essai a montré que la formation de BaSO4 était un processus très lent et que la coagulation ne constituait pas un mécanisme efficace pour l’élimination du baryum. En raison de la forte solubilité de l’hydroxyde de baryum [Ba(OH)2] et du chlorure de baryum (BaCl2), on a également établi que la formation de ces complexes était en partie responsable de l’inefficacité du traitement de coagulation classique (Sorg et Logsdon, 1980).
Un procédé de coagulation en deux étapes peut éliminer plus efficacement le baryum; il n’est toutefois pas recommandé parce que la deuxième étape est coûteuse et qu’il faut prévoir de l’espace supplémentaire pour le stockage de l’eau traitée entre les deux étapes. Dans une étude en banc d’essai, on a déterminé que la coagulation en deux étapes permettait d’éliminer jusqu’à 80 % du baryum, faisant passer la concentration d’environ 8,0 mg/L de l’eau d’alimentation à moins de 1,6 mg/L. On a utilisé 100,0 mg/L d’alun ou de sulfate de fer et alloué une heure pour la sédimentation, puis procédé à une deuxième étape en utilisant des doses de 20,0 mg/L de coagulant et alloué une autre heure pour la sédimentation (Sorg et Logsdon, 1980).
7.2.3 Précipitation chimique
On utilise couramment un procédé de précipitation chimique dans les installations de traitement des eaux pour adoucir l’eau et éliminer les métaux lourds, comme le fer et le manganèse, ainsi que le baryum, le radium, le cadmium, l’arsenic, le plomb, le strontium et l’uranium. On peut aussi recourir à la précipitation chimique comme prétraitement ou traitement intermédiaire dans les systèmes à membrane afin de réduire le risque d’entartrage ou d’encrassement des membranes par les sels minéraux.
L’adoucissement à la chaux est l’application la plus courante de la précipitation chimique. Dans ce procédé, le baryum dissous est précipité sous forme de BaCO3; c’est ce même mécanisme qui entre en jeu pour éliminer le calcium lors du traitement de l’eau dure. Les données des essais de floculation et des études pilotes et les données limitées des études à grande échelle indiquent que le baryum a été efficacement éliminé de l’eau et que l’efficacité de ce procédé dépendait du pH. Des essais de floculation ont révélé qu’une concentration de baryum de 7,0 à 8,0 mg/L dans l’eau souterraine était efficacement réduite par un adoucissement à la chaux. L’élimination était dépendante du pH et est passée de 65 % à un pH de 8,7 à une valeur maximale de 98 % à un pH de 10,5, puis a baissé à 55 % à des pH supérieurs à 11,6. Les courbes d’élimination du baryum et de réduction de la dureté suivent la même tendance sauf dans une plage de pH de 10,6 à 11,4, où la courbe de réduction de la dureté affiche une forte hausse en raison de l’élimination du magnésium. À un pH supérieur à 11,0, le baryum peut devenir plus soluble sous forme d’hydroxyde de baryum et être donc plus difficile à éliminer. Les données fournies par les essais pilotes et à grande échelle ont confirmé ces tendances pour ce qui est du lien entre l’élimination du baryum et le pH. Dans les essais pilotes, des concentrations de baryum dans l’eau brute de 12,6 mg/L, de 10,1 mg/L et de 10,4 mg/L ont été réduites à 2,0 mg/L, à 0,7 mg/L et à 1,6 mg/L dans l’eau filtrée à des pH de 9,2, de 10,5 et de 11,6, respectivement. La dureté est passée de 214 mg/L à 109 mg/L, de 216 mg/L à 86 mg/L et de 209 mg/L à 42 mg/L, respectivement. Les échantillons instantanés de deux installations pleine grandeur d’adoucissement à la chaux fonctionnant à des pH de 10,5 et de 10,3 affichaient une réduction du baryum de 88,0 % et de 95,3 %, respectivement. L’eau à la source présentait des concentrations de départ moyennes de 7,5 mg/L et de 17,4 mg/L et une dureté moyenne de 272 mg/L et de 246 mg/L as CaCO3, respectivement (Sorg et Logsdon, 1980).
Bien qu’il ne s’agisse pas d’une méthode d’adoucissement classique, Parks et Edwards (2006) ont constaté que l’adoucissement par précipitation au moyen de carbonate de sodium (Na2CO3) uniquement était hautement efficace pour l’élimination du baryum. Leur étude, au cours de laquelle 370 sources d’eau brute ont été échantillonnées (deux tiers d’eau souterraine et un tiers d’eau de surface), avait principalement pour but d’examiner la plage de réduction des contaminants inorganiques des procédés d’adoucissement par précipitation au moyen de Na2CO3. Ils ont signalé que l’élévation du pH des échantillons d’eau à 10,3 à l’aide d’une dose fixe de Na2CO3 a permis d’éliminer à peu près 100 % du baryum de 145 échantillons d’eau brute présentant des concentrations de 10 à 884 µg/L. Ces résultats donnent à penser qu’il faudrait effectuer d’autres recherches sur l’adoucissement de l’eau à l’aide de Na2CO3 lorsqu’il s’agit d’éliminer uniquement le baryum plutôt que de réduire la dureté totale.
Étant donné que le BaSO4 est relativement insoluble dans l’eau dans des conditions alcalines, il peut être précipité lorsqu’on utilise un composé contenant du sulfate, comme le gypse [sulfate de calcium (CaSO4)], comme agent chimique de précipitation et de l’hydroxyde de sodium pour ajuster le pH (Krause et Stover, 1982). Krause et Stover (1982) ont commenté l’efficacité d’un système à échelle réduite faisant appel à une précipitation chimique suivie d’une filtration directe. Avec l’ajout de 100 g/L de CaSO4 et de 352 mg/L de NaOH, une concentration approximative de baryum de 6,0 mg/L a été ramenée à 0,5 mg/L dans l’eau traitée à un pH de 11,0 (élimination de 91,0 %). L’élimination a été effectuée à un taux de chargement hydraulique du filtre de 1,5 gal/min/pi2 (2,4 mm/sec) avec une perte de charge dans le filtre de 27 po (69 cm) après un cycle de 8 heures (fin du cycle). Le procédé de précipitation a éliminé le BaSO4 ainsi que le calcium responsable de la dureté de l’eau potable. Les autres produits chimiques (comme l’alun, l’hydroxyde de calcium et le sulfate de fer) utilisés pour précipiter le baryum se sont révélés moins efficaces. Étant donné que la concentration de sodium dans l’eau traitée augmente, en raison de l’ajustement du pH au moyen d’hydroxyde de sodium, les auteurs ont indiqué qu’il faudrait modifier les produits chimiques utilisés pour ajuster le pH. Bien que les auteurs aient testé la précipitation du BaSO4 à un pH de 11, il est peu probable qu’un pH aussi élevé soit nécessaire, selon plusieurs études cinétiques du BaSO4 (Aoun et coll., 1996; van Leeuwen et coll., 1996; Kugler et coll., 2015). En outre, les fortes doses de produits chimiques utilisées auraient une incidence sur le coût et la production de boues. Il faudra procéder à des études sur banc d’essai, pilotes et à grande échelle sur la précipitation du BaSO4 dans les sources d’approvisionnement en eau potable.
7.2.4 Échange d’ions
L’application la plus courante de l’échange ionique dans le traitement de l’eau potable est l’adoucissement. On a réalisé des recherches approfondies sur l’applicabilité des résines échangeuses d’ions SAC et WAC pour l’élimination des cations calcium (Ca2+) et magnésium (Mg2+) qui forment du tartre et, dans une moindre mesure, d’autres métaux alcalino-terreux (dont le Ba2+ et le radium [Ra2+]) de l’eau potable (Sorg et Logsdon, 1980; Krause et Stover, 1982; Snoeyink et coll., 1984, 1987a, 1987b; Myers et coll., 1985; Snyder et coll., 1986; Clifford, 1999; Elder et Budd, 2011). Ces types de résines échangeuses d’ions se présentent sous différentes formes. Les résines SAC sous forme de sodium (Na+), d’hydrogène (H+) et de Ca2+ ainsi que les résines WAC sous forme de H+ peuvent être utilisées pour éliminer le baryum de l’eau potable.
Clifford et coll. (2011) ont comparé les facteurs de séparation d’un certain nombre de cations sur des résines SAC et produit une séquence de sélectivité ionique pour dix cations divalents. La séquence décrit l’ordre de sélectivité dans lequel les cations sont préférés par les résines SAC et semble indiquer qu’au cours du processus d’adoucissement, les cations Ba2+ sont éliminés avant les formes Ca2+ et Mg2+. Les résines WAC présentent la même séquence de sélectivité que les résines SAC, sauf que l’ion H+ est alors le cation préféré (Clifford et coll., 2011).
7.2.4.1 Résines SAC sous forme de sodium et d’hydrogène
Les résines SAC sous forme de Na+ ou de H+ remplacent les cations Na+ ou H+ par des cations Ca2+, Mg2+ et d’autres cations comme Ba2+ dans l’eau, de dureté carbonatée ou de dureté non carbonatée, à des valeurs de pH variant entre 2 et 11. Le pH et l’alcalinité de l’eau traitée à l’aide de résines SAC (Na+) sont demeurés à peu près inchangés pendant tout le cycle de production. Cependant, la résine SAC (H+) est rarement utilisée pour l’adoucissement de l’eau parce qu’elle produit une eau acide et corrosive (Clifford, 1999) qui nécessite des matériaux résistants aux acides, une étape d’extraction du CO2 et un ajustement du pH (Snoeyink et coll., 1984, 1987a, 1987b; Myers et coll., 1985; Snyder et coll., 1986).
Le baryum affichait des courbes de percée semblables pour les résines SAC (Na+) et SAC (H+); la dureté présentait dans courbes comparables (Snyder et coll., 1986; Snoeyink et coll., 1987a). Parmi les principales considérations opérationnelles à prendre en compte lorsqu’on utilise un traitement par échange d’ions, en particulier dans le cas de résines SAC (H+), mentionnons les pics chromatographiques, où les ions pour lesquels la résine a le moins d’affinité (Na+ et Mg2+) sont déplacés par les ions pour lesquels elle a la plus forte préférence (Ba2+ et Ca2+), de sorte que les concentrations en Na+ et de Mg+ de l’effluent sont supérieures aux concentrations de départ (Snoeyink et coll., 1987a; Clifford, 1999). Dans le cas d’un procédé classique d’adoucissement utilisant une résine SAC (Na+), les pics chromatographiques ne constituent pas une considération opérationnelle importante si le cycle de traitement s’interrompt lorsque la résine est saturée et cesse de réduire la dureté.
Avec des résines SAC (Na+), qui ont une forte affinité pour le baryum, il peut être difficile d’éliminer cette substance de la résine épuisée. Le baryum s’accumule sur la résine suivant des cycles répétitifs d’épuisement et de régénération, et il faut de fortes doses de régénérant pour restaurer la capacité de la résine. La courbe de régénération de la résine SAC (H+) régénérée au moyen d’acide chlorhydrique (HCl) suit la même tendance que la courbe de régénération de la résine SAC (Na+) régénérée à l’aide de chlorure de sodium (NaCl). Bien que le baryum puisse être précipité dans la saumure de NaCl épuisée avant d’être éliminé, les auteurs précisent que cette saumure ne pouvait pas être réutilisée en raison de l’appauvrissement en ions Na+ (Snoeyink et coll., 1984, 1987a, 1987b; Myers et coll., 1985). Cependant, une recherche récente a montré qu’on pouvait réutiliser une saumure épuisée (après élimination du baryum) en ajoutant du NaCl afin de maintenir la concentration en Na+ de la saumure (Clifford et coll., 2011).
Dans une étude antérieure, on a constaté que deux installations pleine grandeur d’adoucissement par échange d’ions permettaient d’atteindre une concentration de baryum de 1,0 mg/L dans l’eau traitée (Sorg et Logsdon, 1980). La première installation comportait deux lits de résine échangeuse d’ions fonctionnant en mode parallèle et assurait le traitement d’eau souterraine dont la concentration en baryum était de 10,0 mg/L (dureté de 218 mg/L de CaCO3). La deuxième installation était composée de trois lits parallèles de résine et traitait une eau souterraine d’une concentration de baryum de 19,0 mg/L (dureté de 230 mg/L de CaCO3). Des échantillons d’eau brute et d’eau traitée ont été prélevés lors d’un cycle de traitement dans un lit de résine échangeuse d’ions de chaque installation de traitement. Le cycle de traitement de la première installation a été interrompu avant que la membrane ne soit épuisée et ne puisse plus éliminer la dureté ou le baryum. Le cycle de la deuxième installation a été interrompu au-delà de la capacité d’échange de la membrane pour la dureté et le baryum. Les lits échangeurs testés ont réduit les concentrations de baryum à 1,0 mg/L pour 153 volumes de lit (VL) (7,14 × 105 L) et 100 VL (7,87 × 105 L) pour les installations 1 et 2, respectivement. L’installation 1 a éliminé 94 à 99 % du baryum et 95 à 99 % de la dureté. Cependant, l’installation 2 avait réduit la dureté et la concentration de baryum à 142 mg/L et à 5,8 mg/L, respectivement, lorsque le processus a été interrompu. Dans les deux installations de traitement, on a mélangé une partie de l’eau brute à l’eau traitée afin d’augmenter la dureté et de stabiliser l’eau distribuée. Étant donné que les eaux mélangées présentaient des concentrations de baryum de 1,5 à 4,5 mg/L, les auteurs ont conclu qu’il n’était pas possible de mélanger les eaux à ces deux installations parce que les concentrations de départ élevées feraient grimper les concentrations de baryum au-delà de l’objectif de traitement de 1,0 mg/L même si une petite partie de l’eau brute était mélangée à l’eau traitée (Sorg et Logsdon, 1980).
Dans des études exhaustives en laboratoire, on a testé une résine SAC (Na+) d’une capacité d’échange de 1,8 mEq/mL (4,8 mEq/g résine) dans des cycles répétitifs d’épuisement et de régénération pour la réduction du baryum, du radium et de la dureté dans l’eau potable (Snoeyink et coll., 1984; 1987a). La résine vierge était en mesure de réduire une concentration de baryum de départ de 20,0 mg/L à 1,0 mg/L pour environ 1 200 VL. Les résultats indiquent que la teneur en magnésium de l’eau traitée avait atteint une concentration maximale correspondant à deux fois la concentration de départ, à environ 600 VL, et était par la suite revenue à la concentration de départ, après environ 1 200 VL. La concentration en calcium de l’effluent était aussi supérieure à la concentration de départ à la fin du même traitement, réalisé avec la résine vierge. Chaque cycle d’épuisement a été interrompu au moment de la percée pour ce qui est de l’élimination de la dureté, à 40,0 mg de CaCO3/L, et une dose de régénérant de 1,8 mEq NaCl/mL résine [6,5 lb NaCl/pi3 résine (3 kg NaCl/m3 résine)], a été utilisée dans le cycle de régénération. Pendant plusieurs cycles répétitifs d’épuisement et de régénération, la résine régénérée pouvait traiter environ 225 VL d’eau avant d’arriver à saturation pour le baryum et la dureté (simultanément), à 1,0 mg/L et à 40,0 mg de CaCO3/L, respectivement. Une dose de régénérant de 2,7 mEq NaCl/mL résine [9,75 lb NaCl/pi3 résine (4 kg NaCl/m3 résine)] a permis de faire passer à 260-270 le nombre de VL traités par cycle d’épuisement. Cependant, en augmentant la dose de régénérant de 1,8 à 2,7 mEq NaCl/mL résine, on a réduit l’efficacité de régénération de 60 % à 46 %. La percée hâtive de la résine indique que le baryum s’accumulait sur la résine. La concentration sur la résine vierge est passée de 0,15 mEq Ba2+/mL à une valeur constante de 0,38 mEq Ba2+/mL après plusieurs cycles de régénération utilisant une dose de régénérant de 1,8 mEq NaCl/mL résine. À l’état stable (lorsque la quantité de baryum absorbée par la résine est égale à la quantité éliminée par la régénération), la dose de régénérant de 1,8 mEq NaCl/mL n’a éliminé de la résine que 20 % du baryum accumulé. Malgré l’accumulation de baryum, le nombre de VL nécessaires pour la résine ne puisse plus éliminer la dureté est demeuré constant. L’étude a révélé que la concentration de baryum était effectivement réduite en-deçà de 1,0 mg/L jusqu’à ce que la résine SAC (Na+) ne soit plus en mesure de permuter les ions responsables de la dureté (Snoeyink et coll., 1984; 1987a). Ces résultats ont été confirmés par des colonnes SAC (Na+) pleine grandeur utilisées pour réduire la dureté et éliminer le baryum dans l’eau souterraine (Snoeyink et coll., 1987a). Une des colonnes SAC (Na+) a fonctionné au-delà de la percée de la résine et produit une dureté et des concentrations de baryum de 153 mg de CaCO3/L et de 6,4 mg/L, respectivement. Cependant, une autre colonne, utilisée pour le traitement de l’eau de surface provenant d’un autre puits situé sur le même site et dont le cycle d’épuisement s’est poursuivi jusqu’à la percée de la résine, a pu réduire la dureté et les concentrations de baryum à 7,0 mg de CaCO3/L et à 0,3 mg/L, respectivement.
Snoeyink et coll. (1987a) ont conclu que, pour une qualité d’eau brute comparable à celle de l’eau utilisée dans l’étude en laboratoire décrite ci-dessus, deux colonnes SAC (Na+) parallèles fonctionnant en mode de régénération décalée et utilisant une dose de régénérant de 1,8 mEq NaCl/mL pouvaient effectivement ramener la concentration de baryum sous 1,0 mg/L dans une eau traitée mélangée, si les cycles d’épuisement étaient interrompus au moment où la résine cessait d’éliminer la dureté. L’utilisation de plusieurs colonnes à fonctionnement parallèle et à régénération décalée présente l’avantage important de produire une eau de qualité moins variable que les installations à une seule colonne. Ce facteur peut être important lorsque les fuites de contaminant ou les pics chromatographiques sont élevés pendant une partie du cycle d’épuisement (Clifford et coll., 2011).
Il convient de souligner que l’utilisation de résines SAC (Na+) peut introduire des quantités indésirables de sodium dans l’eau traitée. Par conséquent, les résines SAC (Ca2+ et H+) et WAC (H+) sont des solutions de rechange qui peuvent être utilisées pour produire de l’eau traitée ne contenant pas de sodium. Il faut toutefois prendre des mesures pour réduire la corrosivité de l’eau traitée.
7.2.4.2 Résine SAC sous forme de calcium
Plusieurs études ont fait état de l’efficacité de la résine SAC (Ca2+) pour réduire les concentrations de baryum et de radium dans l’eau potable (Myers et coll., 1985; Snoeyink et coll., 1987b; Clifford, 1999; Atassi et coll., 2007). Cependant, jusqu’à environ 100 à 200 VL du cycle d’épuisement de la résine SAC (Ca2+), les ions calcium sont échangés pour tous les cations présents dans l’eau d’alimentation, ce qui produit une eau traitée très dure; après ce point, la dureté totale diminue pour atteindre la dureté de départ. Pour régénérer une résine SAC (Ca2+) épuisée, on utilise une saumure de chlorure de calcium (CaCl2), et on peut réutiliser cette saumure après précipitation et élimination du baryum. Il faut utiliser des doses appropriées de CaSO4 pour précipiter le baryum sous forme de BaSO4 dans la saumure épuisée et prévenir l’encrassement de la résine au cours du cycle de régénération suivant. Si du Ra2+ est aussi présent dans la saumure, il sera coprécipité avec le BaSO4 et sera également éliminé (Myers et coll., 1985).
Un système SAC (Ca2+) pilote a été testé pendant plusieurs cycles répétitifs d’épuisement et de régénération. La résine régénérée a pu ramener une concentration de baryum de départ de 12,0 mg/L à 1,0 mg/L pour des durées d’environ 1 300 VL pendant le troisième cycle en charge (épuisement). La régénération a été effectuée avec une dose de régénérant de 6,0 Eq CaCl2/L résine (comparativement à seulement 1,8 Eq NaCl/L résine [Snoeyink et. al., 1987]), et la saumure de CaCl2 épuisée a été récupérée et réutilisée. La résine SAC (Ca2+) épuisée nécessitait des régénérations moins fréquentes que la résine de sulfate de calcium SAC (Na+) (Atassi et coll., 2007).
Dans des essais en laboratoire, une résine SAC (Ca2+) vierge a pu réduire une concentration de baryum pouvant atteindre 23,0 mg/L à moins de 1,0 mg/L dans l’eau traitée pour un cycle d’environ 1 200 VL, à un taux de charge de 5,4 gal/min/pi2 (13,2 m/h) et un temps de contact en lit vide de 2,5 min (Myers et coll., 1985). La dureté, l’alcalinité et le pH de l’eau sont demeurés à peu près inchangés pendant tous les cycles de traitement. La résine SAC (Ca2+) épuisée a été efficacement régénérée (élimination de 92 à 100 % du baryum de la colonne) avec une dose de régénérant de 6 Eq 0,85 CaCl2/L. La concentration et la dose de régénérant ont eu un effet sur la concentration de baryum dans l’eau traitée au cours des cycles d’épuisement subséquents. Lorsque les doses de régénérant ont été augmentées de 4,0-6,0 et à 8,0 Eq CaCl2/L résine, une concentration de baryum de 1,0 mg/L a été atteinte pour des cycles de 500, de 900 et de 1 100 VL, respectivement. On précise qu’un rapport molaire de 1,1 : 1 (CaSO4 : baryum) avait permis de réduire la concentration de baryum dans la saumure usée et que la saumure avait été réutilisée avec succès (Myers et coll., 1985). Snoeyink et coll. (1987b) ont indiqué que l’utilisation de la résine SAC (Ca2+) en parallèle avec une résine SAC (Na+) pouvait produire une eau traitée présentant le niveau voulu de dureté tout en éliminant le baryum. Cependant, pour prévenir une augmentation de la concentration de sodium dans l’eau traitée, on peut utiliser la résine SAC (Ca2+) conjointement avec les résines SAC (H+) et WAC (H+) et faire suivre le traitement d’une étape d’extraction du dioxyde de carbone.
7.2.4.3 Résine WAC sous forme d’hydrogène
Les résines WAC (H+) comportent des groupes fonctionnels d’acides faibles et n’échangent les ions que dans une plage de pH allant de neutre à alcaline. Le processus d’échange ionique procure un adoucissement partiel, et l’eau traitée est peu alcaline et présente une faible teneur en matières dissoutes totales (MDT). Les résines WAC (H+) nécessitent aussi l’utilisation d’un matériau résistant aux acides, une extraction du CO2 et un ajustement du pH de l’eau produite (Snoeyink et coll., 1984, 1987a, 1987b; Myers et coll., 1985; Snyder et coll., 1986). Bien qu’il soit possible de régénérer les résines WAC (H+) au moyen d’acides faibles, à peine plus forts que le groupe fonctionnel de la résine, on utilise ordinairement des acides forts, comme l’acide chlorhydrique (HCl). On ne doit toutefois pas utiliser d’acide sulfurique (H2SO4) car le BaSO4 est alors précipité sur la résine et en neutralise l’efficacité. Comme le baryum peut aisément être enlevé de la résine WAC (H+) épuisée à l’aide d’un excédent de régénérant de 5 à 10 %, il ne s’accumule pas sur la résine. La régénération de la résine WAC (H+) produisait moins de régénérant usé par unité de volume que la régénération de la colonne SAC (Snyder et coll., 1986; Clifford, 1999; Elder et Budd, 2011). Les systèmes WAC (H+) peuvent être complexes à utiliser et à entretenir et représenter des coûts élevés, en raison des produits chimiques et des matériaux utilisés (Snoeyink et coll., 1984, 1987a, 1987b; Clifford, 1999; Clifford et coll., 2011).
Dans des essais en laboratoire, on a constaté que la résine WAC (H+) éliminait efficacement le baryum (22,0 mg/L) et le radium et réduisait la dureté sans augmenter la concentration en sodium de l’eau traitée. Une résine vierge WAC (H+) (capacité de 11,5 mEq/g résine) montre une sélectivité à peu près identique pour les ions baryum et calcium, car la percée de la résine pour les deux contaminants survient à environ 800 VL, tandis qu’elle se produit plus tôt, à environ 650 VL, dans le cas des ions magnésium. La résine WAC (H+) vierge affiche une capacité plus faible pour le baryum mais une plus grande efficacité pour l’alcalinité et la dureté que la résine SAC (H+) vierge dans des conditions de service similaires. Pendant plusieurs cycles répétitifs d’épuisement et de régénération, la résine WAC (H+) pouvait produire une eau traitée présentant une concentration en baryum de moins de 1,0 mg/L (concentration de départ de 22,0 mg/L) pour des cycles de 600 à 650 VL. Une dose de régénérant de 8,5 mEq HCl/g résine (à peine 75 % de la quantité stœchiométrique) a permis d’atteindre une efficacité de régénération de 93 à 95 % et d’éliminer plus de 99 % des ions divalents de la résine. Cependant, l’utilisation d’une dose de régénérant de 7,6 mEq HCl/g résine (soit 66 % de la quantité stœchiométrique) a produit des concentrations plus élevées de baryum, variant de 0,5 à 1,3 mg/L dans l’eau traitée en raison de l’élimination incomplète du baryum de la résine pendant les cycles de régénération (Snyder et coll., 1986).
Dans les applications d’adoucissement de l’eau, il est de pratique courante de dévier une partie de l’influent autour du récipient de traitement et de mélanger l’eau déviée à l’eau traitée. Le mélange de l’eau traitée et de l’eau brute peut stabiliser l’eau traitée et réduire les coûts de traitement en diminuant le volume d’eau traitée, ce qui se traduit par une plus faible fréquence de régénération et des coûts moindres de produits chimiques et d’élimination de la saumure (Clifford, 1999). Il faut toutefois tenir compte de la concentration en baryum de l’eau déviée afin de s’assurer que la concentration dans l’eau traitée ne dépasse pas la CMA.
7.2.5 Technologie des membranes
Les technologies membranaires efficaces pour l’élimination du baryum dans l’eau potable comprennent l’OI, la NF, ainsi que l’électrodialyse/électrodialyse inverse (U.S. EPA, 1998; Odell, 2010). La principale différence entre l’OI et la NF réside dans la taille des contaminants dissous pouvant être éliminés. Les membranes d’OI réduisent efficacement les MDT et les ions monovalents tandis que les membranes de NF servent surtout à réduire la dureté (Ca2+, Mg2+) et les matières organiques (précurseurs des sous-produits de désinfection). L’électrodialyse/électrodialyse inverse est généralement utilisée pour réduire la teneur en MDT et éliminer les ions inorganiques (U.S. EPA, 2012b).
Les systèmes de traitement par OI nécessitent généralement une étape de préfiltration pour éliminer les particules et comportent souvent d’autres étapes de prétraitement, comme l’ajout d’agents antitartre, la déchloration ou l’adoucissement. Un prétraitement est nécessaire pour préserver la durabilité des membranes car la présence de chlore résiduel, de particules et d’ions incrustants (Ca2+, Ba2+, fer et silice) dans l’eau d’alimentation peut avoir un effet néfaste sur la performance des procédés d’OI.
Le post-traitement du perméat d’OI (eau traitée) comporte ordinairement un ajustement du pH, l’ajout d’inhibiteurs de corrosion et une désinfection. Il faut également tenir compte du concentré d’OI dans la conception et l’exploitation des stations d’OI. Les systèmes qui intègrent deux ou plusieurs procédés membranaires ou qui combinent un procédé à membrane et d’autres procédés de traitement (système à membrane intégrée [SMI]) permettent d’améliorer le taux global de récupération de l’eau de traitement et de réduire les concentrations dans le flux de déchets (Ning et coll., 2006; Gabelich et coll., 2007).
Dans des essais pilotes, on a évalué l’efficacité de cinq différentes membranes d’OI pour la réduction de contaminants inorganiques, testées selon les spécifications du fabricant. Certaines membranes affichaient un taux élevé de rejet (98 % à > 99 %) pour le baryum, dans diverses conditions de service. Les concentrations de départ mesurées variaient entre 1,1 mg/L et 3,7 mg/L (Huxstep et Sorg, 1988).
On a évalué le rendement d’un SMI pour l’élimination du baryum de mai 1998 à janvier 1999 à une installation de traitement de 56,6 mgd située à East St. Louis, en Illinois (Lovins et coll., 1999). On a alimenté le SMI en eau de surface prétraitée au moyen de procédés classiques de coagulation, de sédimentation et de filtration (CSF). L’eau brute présentait une faible concentration de baryum (concentration moyenne de 0,11 mg/L), et le prétraitement CSF a permis d’obtenir une concentration moyenne de baryum de 0,07 mg/L. L’appareil SMI était composé de trois membranes de NF tangentielle enroulées en spirale et pouvant résister à une pression d’au plus 400 lb/po2 (27 bars) : une membrane en composite à film mince présentant un seuil de coupure de 100–200 Da et une surface de filtration de 85 m2 (CSF-NF1), une membrane en composite à film mince présentant un seuil de coupure de 150–300 Da et une surface de filtration de 97 m2 (CSF-NF2) et une membrane en acétate de cellulose présentant un seuil de coupure de 300 Da et une surface de filtration de 123 m2 (CSF-NF3). La qualité de l’eau du perméat inorganique variait selon le type de membrane et l’eau produite, les concentrations moyennes de baryum s’établissant à 0,002, à 0,026 et à 0,021 mg/L, respectivement, ce qui correspond à une élimination moyenne du baryum de 97,1 %, de 62,9 % et de 70,0 %, respectivement. Étant donné que la membrane CSF-NF1 ramenait aussi la dureté et l’alcalinité à des valeurs inférieures à la LD (non fournies), il a fallu prendre des mesures anticorrosion afin de stabiliser l’eau traitée. En revanche, les membranes CSF-NF2 et CSF-NF3 ont laissé davantage d’alcalinité et de dureté passer dans le perméat, ce qui a produit une eau plus stable et moins corrosive. La membrane CSF-NF3 était plus résistante à l’encrassement que les membranes CSF NF1 et CSF-NF2, tandis que les membranes CSF-NF1 et CSF-NF2 étaient plus sensibles aux conditions de service (p. ex., flux et récupération) et à la chimie de l’eau d’alimentation (p. ex., pH) (Lovins et coll., 1999).
7.2.5.1 Amélioration du taux de récupération des procédés d’osmose inverse
Dans les procédés d’OI, la formation de tartre inorganique (p. ex., silice, sulfate de baryum et carbonate de calcium) demeure un obstacle important à l’atteinte d’un taux élevé de récupération. La formation de tartre qui résulte de la précipitation de sels à l’intérieur du module à membrane entraîne une baisse de débit du perméat et réduit la durée de vie de la membrane. Lorsque l’eau traverse la membrane d’OI, les ions Ba2+ rejetés s’accumulent près de la surface de la membrane, et sa concentration peut augmenter au point où les sels de baryum sont précipités (Boerlage et coll., 2000; Gabelich et coll., 2007). Le sulfate de baryum peut poser un problème dans tous les procédés de traitement de l’eau potable qui concentrent le baryum (Boerlage et coll., 2000; Ning et coll., 2006; Gabelich et coll., 2007; WQA, 2014). Ainsi, l’entartrage de la membrane par le sulfate de baryum peut réduire le taux de récupération, ralentir le débit et causer de graves dommages à la membrane (Boerlage et coll., 2000; Ning et coll., 2006).
Un adoucissement à la chaux, suivi d’une filtration et d’un ajustement du pH, constitue un prétraitement efficace qui améliore la performance de l’OI et l’élimination des dépôts des sels minéraux présents dans les sources d’approvisionnement. Dans les stratégies de stabilisation chimique du concentré intermédiaire (SCCI), on fait subir un adoucissement classique ou au moyen de granules à un concentré primaire d’OI (premier passage) afin d’éliminer les composés incrustants, comme le baryum, suivi d’un traitement d’OI secondaire visant à améliorer le taux global de récupération du système (He et coll., 2011). En appliquant la technologie SCCI basée sur un procédé classique d’adoucissement à la chaux (concentré primaire d’OI soumis à un traitement d’OI secondaire), on a pu améliorer le taux global de récupération du système, qui est passé de 85 % à 92,5-95,5 % (He et coll., 2011). Avec une dose de chaux de 1 220 mg/L, la SCCI ramène une concentration moyenne de baryum de 0,34 mg/L dans le concentré d’OI à une concentration moyenne de 0,05 mg/L (réduction de 86 %), à un pH de 10,5. À ce pH, les concentrations de silice, de strontium et de calcium ont également été réduites de 76 %, de 84 % et de 77 %, respectivement. Les auteurs ont constaté qu’une technique SCCI utilisant des granules éliminait moins de baryum, de silice, de strontium et de calcium du concentré d’OI primaire que la SCCI basée sur un adoucissement classique à la chaux (He et coll., 2011).
Ning et coll. (2006) ont présenté les résultats d’une étude en banc d’essai et d’une étude pilote réalisées à une grande usine de désalinisation située à l’intérieur des terres, à El Paso, au Texas. On a évalué l’adoucissement par précipitation au moyen de poudre d’hydroxyde de magnésium [Mg(OH)2] et l’adoucissement classique à la chaux à l’aide de poudre d’hydroxyde de calcium [Ca(OH)2] pour l’élimination de la silice et du baryum du concentré d’OI, qu’on a ensuite soumis à un traitement d’OI secondaire afin de démontrer l’amélioration du taux de récupération. Le traitement à la poudre de Mg(OH)2 a réduit la concentration de baryum de 0,9 mg/L à 0,34 mg/L dans le concentré (réduction de 64 %) en une heure de traitement à des valeurs de pH variant entre 7,8 et 9,1, mais n’a pas permis d’abaisser suffisamment la concentration de silice (à peine 16 %). Un adoucissement classique à la chaux réalisé au moyen de Ca(OH)2 a réduit la concentration de baryum de 0,9 mg/L à 0,43 mg/L (50 %) et la concentration de silice de 143 mg/L à 48 mg/L (66 %) à un pH de 10,3 à 10,6 en une heure de traitement. L’adoucissement avec excès de chaux à un pH de 12,0 a amélioré la décantabilité des boues en raison de l’effet coagulant des précipités de Mg(OH)2. Cependant, une concentration de départ de baryum de 0,9 mg/L n’a été réduite que de 30 % et de 67 % après une heure et trois heures, respectivement. La concentration de silice de 155 mg/L a été réduite de 96 % et de 98 % après une heure et trois heures, respectivement. On a conclu qu’un adoucissement classique à la chaux à un pH de 11,5 pendant 1 à 3 heures constituait la meilleure façon de traiter le concentré des membranes d’OI primaires (premier passage). Dans l’étude pilote, les auteurs ont constaté que le taux de récupération du concentré primaire d’OI ne dépassait pas 85–90 %, en raison de la présence de silice et de précipité de sulfate de baryum. Le traitement du concentré primaire d’OI par adoucissement à la chaux, suivi d’une OI secondaire, a suffisamment réduit l’encrassement de la membrane en abaissant les concentrations de silice et de baryum et porté à environ 97 % le taux global de récupération du système.
De même, Rahardianto et coll. (2007) et Gabelich et coll. (2007) ont montré qu’une désalinisation par OI, complétée par un traitement d’adoucissement par précipitation du concentré d’OI primaire, constituait une démarche efficace pour éliminer les dépôts de sels minéraux, dont le sulfate de baryum, et faire passer le taux de récupération du système à 95–98 %. Gabelich et coll. (2007) ont avancé que l’élimination du baryum lors de l’adoucissement par précipitation était améliorée par l’inclusion de carbonate de calcium dans ou sur un réseau cristallin pendant la précipitation.
7.2.6 Technologies émergentes
7.2.6.1 Milieux adsorbants
Araissi et coll. (2016) ont mis à l’essai une matrice adsorbante en zéolite 4A pour éliminer le baryum dans des expériences par lots utilisant une eau d’alimentation présentant des concentrations de baryum allant de 0,3 mmol (41,1 mg/L) à 25 mmol (3 432 mg/L) à des valeurs de pH de 8,2 à 11,0. Les échantillons en contact avec 0,15 g de la matrice ont été agités pendant 14 heures. La capacité maximale d’adsorption observée était de 2,25 mmol Ba2+/g. Les auteurs ont indiqué que le mécanisme d’élimination du baryum était considéré comme un procédé d’échange d’ions. On a également réalisé des expériences par lots à l’aide d’un système binaire de baryum et de strontium, et les auteurs ont constaté que le strontium était éliminé par la zéolite avant le baryum. On a aussi précisé que la zéolite pouvait constituer un matériau échangeur d’ions efficace pour l’élimination du baryum dans l’eau. Sato et coll. (2011) ont commenté l’utilisation de filtres à zéolite 4A pour l’élimination des contaminants radioactifs, y compris le baryum, des eaux potables touchées par le grave incident survenu à la centrale nucléaire de Fukushima-Daiichi. Les auteurs ont constaté que la zéolite 4A synthétique éliminait efficacement le césium, le strontium et le baryum mais n’ont pas donné de détails sur la capacité des filtres ou les conditions de services.
7.2.7 Considérations relatives au réseau de distribution
L’accumulation de contaminants inorganiques traces (CIT) dans le réseau de distribution d’eau potable est une fonction complexe de plusieurs facteurs, dont la concentration de contaminants dans l’eau traitée, le pH et les conditions d’oxydoréduction dans le réseau de distribution et le matériau de la tuyauterie. Les oxyhydroxydes de fer et les oxydes de manganèse hydratés constituent d’importants réservoirs où peuvent s’accumuler les CIT en raison de leur affinité adsorbante pour ces substances. Les changements dans la qualité de l’eau ou les perturbations physiques dans le réseau de distribution peuvent remobiliser les contaminants dans l’eau libre. Les indicateurs d’une libération potentielle de CIT dans le réseau de distribution comprennent la présence d’eau décolorée ou une augmentation de la turbidité.
Du baryum a été détecté à plusieurs reprises dans les échantillons de tartre provenant de la tuyauterie de réseaux de distribution et les solides mobilisés lors de la purge de bornes d’incendie (Schock et coll., 2008; Freidman et coll., 2010; Peng et coll., 2012; Lytle et coll., 2014). Le dépôt de baryum dans les réseaux de distribution est principalement dû à des réactions d’adsorption superficielle pouvant être accompagnées d’une coprécipitation mettant en jeu certaines espèces solubles de baryum (Ba2+) et qui sont intensifiées à des pH élevés (Friedman et coll., 2010). L’accumulation de baryum est fortement influencée par la co-occurrence de dépôts de manganèse, de précipités de phosphates ou de groupes superficiels de phosphates et, dans une moindre mesure, par la concentration de baryum dans l’eau (McComish et Ong, 1988; Sugiyama et coll., 1992; Charette et Sholkovitz, 2006; Schock et coll., 2008; Friedman et coll., 2010; Peng et coll., 2012). Le baryum peut aussi pénétrer dans l’eau du réseau de distribution s’il y a lessivage des revêtements et des matériaux à base de ciment sous l’effet d’une eau agressive ou de conditions hydrauliques défavorables. Le lessivage du baryum contenu dans les revêtements en mortier de ciment peut causer la précipitation de BaCO3 et de BaSO4 dans le réseau (Friedman et coll., 2010). Guo et coll. (1998) ont réalisé des essais de laboratoire afin de déterminer le degré de lessivage des tuyaux en fonte ductile revêtus in situ de mortier en ciment Portland (type I). Les tuyaux ont été revêtus, durcis puis désinfectés conformément aux normes ANSI/AWWA. On a mené les essais en se servant de l’eau du robinet provenant d’un réseau de distribution du New Jersey. Dans des conditions statiques, on a progressivement augmenté la concentration de baryum jusqu’à 18 % du seuil de 2,0 mg/L fixé dans la norme de l’U.S. EPA sur l’eau potable pendant les 14 premiers jours de stagnation de l’eau. Le ciment utilisé pour revêtir les tuyaux d’essai contenait une quantité de métaux moins importante que la plupart des ciments vendus dans le commerce.
Des impuretés de baryum peuvent être présentes dans divers produits chimiques (comme l’alun, l’hydroxyde de calcium, l’hypochlorite de calcium et le polychlorure d’aluminium) qui sont utilisés dans le traitement de l’eau potable (NHMRC, 2011). Les normes NSF/ANSI 60 et 61 établissent chacune une concentration maximale pour le baryum qui peut être présent dans les matériaux et les produits chimiques de traitement qui entrent en contact avec l’eau potable. Cette concentration maximale est appelée « concentration permissible par produit individuel » (CCPI). La concentration maximale admissible fixée pour le baryum dans les normes NSF/ANSI 60 et 61 est de 0,2 mg/L (NSF/ANSI, 2015; 2016d).
Les échantillons de tartre prélevés sur 91 échantillons de tuyauteries de service en plomb et revêtues de plomb de 26 réseaux de distribution d’eau aux États-Unis présentaient une concentration moyenne de baryum de 199,0 mg/kg tartre (plage de 1,0 mg/kg à 2 850 mg/kg tartre). Du baryum a été détecté à des concentrations supérieures au seuil de notification de 5,0 mg/kg dans 87 des 91 échantillons (95 %) (Schock et coll., 2008).
Le baryum était le contaminant inorganique le plus concentré décelé dans les échantillons de tartre et les sédiments prélevés dans les réseaux de distribution de 20 services publics américains alimentés par des sources d’eau souterraine, d’eau de surface et d’eau mélangée (Friedman et coll., 2010; Peng et coll., 2012). Les concentrations de baryum dans l’eau distribuée variaient de 0,002 à 0,6 mg/L, les valeurs de pH, de 7,1 à 8,5 et l’alcalinité, de 48 à 289 mg/L de CaCO3. Friedman et coll. (2010) ont mesuré une concentration médiane de baryum de 94 µg/g pour tous les échantillons de dépôts de calcaire et de sédiments. Plus précisément, les concentrations médianes dans les dépôts de calcaire et les solides évacués lors de la purge des bornes d’incendie étaient de 88 µg/g et de 104 µg/g, respectivement. Cinq des échantillons de dépôt dont les concentrations de baryum variaient entre 460 µg/g et 2 400 µg/g présentaient aussi des concentrations élevées de manganèse (372 à 46 700 µg/g) et de phosphore (2 000 à 12 300 µg/g). Zasoski et Burau (1988) ont indiqué que le dioxyde de manganèse s’était révélé extrêmement efficace pour l’adsorption d’espèces cationiques comme le baryum. De même, Peng et coll. (2012) ont observé une corrélation perceptible entre les concentrations de baryum et de manganèse dans les dépôts de calcaire. Cette corrélation vient étayer les données d’études antérieures (Murray, 1975; Sugiyama et coll., 1992) montrant que les oxydes de manganèse qui se forment dans les produits de corrosion interagissent plus fortement avec le baryum que les oxydes de fer.
Les concentrations de baryum mesurées dans 22 solides évacués lors de la purge des bornes incendie et deux échantillons prélevés dans des tuyaux des réseaux de distribution de 12 services publics d’approvisionnement en eau se situaient entre 60,8 µg/g et 9 276 µg/g (Lytle et coll., 2014). Toutes les eaux présentaient des valeurs de pH de 7,0 à 8,0 et une alcalinité de 251 à 476 mg/L de CaCO3 et provenaient de sources souterraines.
Friedman et coll. (2010) ont enregistré une masse estimative de 76,0 lb accumulée sur un tuyau d’une longueur de 100 milles (pour un diamètre de tuyau de 12 po). Les auteurs ont déterminé qu’en théorie, 16 à 26 % du dépôt de calcaire devraient être libérés pour dépasser la norme de l’U.S. EPA, qui limite à 2,0 mg/L la concentration de baryum dans l’eau potable.
7.3 Traitement dans les systèmes résidentiels
Dans les cas où l’on souhaite éliminer le baryum à l’échelle résidentielle, par exemple lorsque l’eau potable d’une maison provient d’un puits privé, un dispositif de traitement résidentiel peut être employé pour réduire les concentrations de baryum.
Santé Canada ne recommande aucune marque particulière de dispositif de traitement, mais conseille fortement aux consommateurs d’utiliser des dispositifs dont la conformité aux normes pertinentes de NSF International (NSF) et de l’American National Standards Institute (ANSI) est attestée par un organisme de certification agréé. Ces normes visent à préserver la qualité de l’eau potable en garantissant la sûreté des matériaux et l’efficacité des produits qui entrent en contact avec l’eau potable. Les organismes de certification, qui doivent être accrédités par le Conseil canadien des normes (CCN), garantissent qu’un produit ou un service est conforme aux normes en vigueur. Au Canada, les organismes suivants sont accrédités par le CCN pour la certification de la conformité aux normes NSF/ANSI des dispositifs de traitement de l’eau potable et des produits qui entrent en contact avec l’eau potable (CCN, 2015) :
- Groupe CSA (www.csagroup.org);
- NSF International (www.nsf.org);
- Water Quality Association (www.wqa.org);
- UL LLC (www.ul.com);
- Bureau de normalisation du Québec (www.bnq.qc.ca);
- International Association of Plumbing & Mechanical Officials (www.iapmo.org); et
- Truesdail Laboratories Inc. (www.truesdail.com).
- La liste à jour des organismes de certification accrédités peut être obtenue auprès du CCN (2015).
Les technologies de traitement de l’eau pouvant être certifiées selon les normes NSF pour ce qui est de la réduction du baryum comprennent l’échange de cations, l’osmose inverse et la distillation. Les normes NSF/ANSI applicables sont les normes NSF/ANSI 44-2016a : Cation Exchange Water Softeners; NSF/ANSI 58- 2016b : Reverse Osmosis Drinking Water Treatment Systems et NSF/ANSI 62-2016c : Drinking Water Distillation Systems.
- Pour que les dispositifs de traitement de l’eau potable soient certifiés selon les normes NSF/ANSI 44, 58 et 62 pour la réduction des concentrations de baryum, ils doivent pouvoir ramener une concentration moyenne de départ (concentration de provocation) de 10,0 mg/L à une concentration finale maximale de 2,0 mg/L ou moins. Par ailleurs, les dispositifs de traitement certifiés selon les normes 44 et 62 peuvent être certifiés expressément pour la réduction du baryum (comme il est indiqué ci-dessus) ou pour l’élimination de la dureté et des MDT, respectivement, qui sont utilisés comme substitut du baryum dans ces normes. Des adoucisseurs d’eau (systèmes d’échange de cations utilisant une résine de polystyrène divinylbenzène sulfonée) certifiés selon la norme NSF/ANSI 44 et pouvant réduire à moins de 1,0 gpg (17,1 mg/L) une dureté de départ de 20 gpg (342 mg/L) seront en mesure de réduire efficacement le baryum contenu dans l’eau potable. Les dispositifs de traitement certifiés selon la norme NSF/ANSI 62, qui utilise les MDT comme substitut, doivent assurer une réduction minimale des MDT de 99 % à partir d’une concentration de départ de 1 000 mg/L.
- Les systèmes d’OI sont conçus pour être installés au point d’utilisation, car de grandes quantités d’eau brute sont nécessaires pour obtenir le volume requis d’eau traitée, ce qui n’est généralement pas envisageable aux points d’entrée des réseaux résidentiels. Les systèmes d’OI devraient être installés uniquement au point d’utilisation, car l’eau ainsi traitée peut être corrosive pour les éléments de plomberie internes. Le consommateur peut devoir préchauffer l’eau brute afin de réduire l’encrassement et de prolonger la vie utile de la membrane. Les systèmes de distillation sont aussi conçus pour n’être installés qu’au point d’utilisation. Le procédé de distillation élimine efficacement les contaminants inorganiques mais nécessite un apport d’énergie électrique.
- Le choix du système de traitement le plus efficace pour un foyer dépend de divers facteurs, dont la concentration de baryum, et d’autres paramètres, comme la dureté, l’alcalinité et le pH de la source d’eau. Avant d’installer un dispositif de traitement, il faut analyser l’eau afin d’en déterminer les propriétés chimiques générales et sa concentration en baryum. Il faudrait faire analyser périodiquement l’eau qui pénètre dans le dispositif de traitement et l’eau traitée par un laboratoire agréé afin de s’assurer de l’efficacité du dispositif. Les dispositifs de traitement perdent de leur capacité d’élimination avec l’usage et le temps et doivent être entretenus ou remplacés. Les consommateurs devraient vérifier la longévité prévue des composants de leur dispositif de traitement en regard des spécifications du fabricant et assurer l’entretien requis.
- On a échantillonné au hasard divers adoucisseurs d’eau domestique afin d’évaluer leur capacité à éliminer le baryum. Les concentrations de baryum de départ variaient de 0,5 mg/L à 6,4 mg/L et la dureté de départ allait de 205 mg/L à 248 mg/L as CaCO3. Tous les adoucisseurs d’eau mis à l’essai réduisaient les concentrations de baryum en deçà de 1,0 mg/L et ramenaient la dureté entre 2 mg/L et 35 mg/L de CaCO3 (Snoeyink et coll., 1987a).
Les propriétaires qui ont un puits privé et utilisent des adoucisseurs à échange d’ions sous forme de sodium doivent savoir que l’appareil de traitement peut introduire des quantités indésirables de sodium dans l’eau traitée.
8.0 Cinétique et métabolisme
8.1 Absorption
Chez les humains, l’absorption du baryum provenant des aliments serait très variable, allant généralement de 1 % à 60 % (LeRoy et coll., 1966; Schroeder et coll., 1972; Legget, 1992; Kravchenko et coll., 2014). Les facteurs qui influent sur l’absorption comprennent l’âge, l’espèce chimique et sa solubilité, l’état de jeûne, le niveau de vitamine D et la présence d’autres ions dans la diète (Legget, 1992). En dépit de la variabilité et de l’incertitude des résultats, Legget (1992) a proposé une absorption de 20 % des formes de baryum solubles dans l’eau par le tractus gastro-intestinal, ce qui, au moment de l’examen, coïncidait avec la valeur appliquée par la Commission internationale de protection radiologique (CIPR, 1980). La concentration sanguine maximale serait atteinte deux heures après l’ingestion de chlorure de baryum, dont la demi-vie sérique serait de 3 heures (Downs et coll., 1995).
Une plage étendue de valeurs d’absorption a aussi été établie chez les animaux de laboratoire (1 à 95 %), les formes solubles dans l’eau présentant les taux d’absorption les plus élevés (Venugopal et Luckey, 1978; Kravchenko et coll., 2014). Chez le rat, 85 % du BaCl2 ont été absorbés à l’âge de 14 à 18 jours, 63 % à l’âge de 22 jours et 6 % à l’âge de 6 semaines et plus (Taylor et coll., 1962). Le jeûne des rats adultes pendant 18 heures avant l’exposition a augmenté l’absorption d’un facteur de trois. Chez les rats qui avaient reçu 10 mg /L de baryum sous forme de sulfate de baryum par intubation, les concentrations sanguines maximales de baryum étaient atteintes 15 minutes après l’administration de la dose, 50 % demeurant dans le sang pendant 4 heures après l’exposition (McCauley et Washington, 1983). La concentration maximale dans le sang était plus élevée pour le sulfate de baryum que pour le chlorure de baryum ou le carbonate de baryum. Chez le chien, l’absorption orale de chlorure de baryum se situerait entre 1 à 7 % et 50 % (Cuddihy et Griffith, 1972).
Legget (1992) a cité plusieurs études non publiées dans lesquelles les taux d’absorption variaient entre 1 % et 50 %. Parmi les rats auxquels du chlorure de baryum avait été administré par gavage, les jeunes rats (14 à 22 jours) absorbaient le baryum plus efficacement que les animaux plus âgés (6 à 70 semaines) (63 à 84 % chez les jeunes animaux et 7 à 8 % chez les animaux plus vieux) (Taylor et coll., 1962). Dans cette même étude, on a aussi constaté que le jeûne faisait passer l’absorption de 7–8 % à 20 %. L’absorption au bout des sept premières heures qui suivent l’administration n’a pas été étudiée. La CIPR (1993) et l’Organisation mondiale de la santé (OMS, 1990) ont aussi indiqué que l’absorption de baryum pouvait être plus importante chez les enfants que chez les adultes; la CIPR (1993) a estimé à 60 % l’absorption orale de baryum soluble chez les nourrissons, à 30 % chez les enfants de 1 à 15 ans et à 20 % chez les adultes.
La solubilité des composés du baryum dans les conditions ambiantes n’influe pas nécessairement sur leur absorption dans l’organisme. McCauley et Washington (1983) ont comparé l’efficacité d’absorption de différents composés du baryum et constaté que les taux d’absorption des doses uniques, administrées par gavage, de Ba131 sous forme de sulfate et de chlorure de baryum (totalisant 10 mg de baryum) étaient comparables, comme le montraient les concentrations mesurées dans le sang et les tissus chez les rats. Les auteurs ont indiqué que ces rendements d’absorption comparables peuvent être attribuables à la solubilisation de la faible dose de sulfate de baryum par l’acide chlorhydrique de l’estomac. Dans un véhicule contenant du bicarbonate de sodium, le carbonate de baryum était faiblement absorbé, vraisemblablement en raison du pouvoir tampon du bicarbonate de sodium, qui peut avoir entravé la conversion par l’acide chlorhydrique en chlorure de baryum. Ces résultats donnent à penser que les composés solubles du baryum ou les composés qui produisent des ions baryum dans le milieu acide de l’estomac présentent une efficacité d’absorption comparable.
8.2 Distribution
Le baryum se dépose surtout dans les os et les tissus conjonctifs, les os contenant environ 66 à 90 % de la charge corporelle totale (Schroeder et coll., 1972; Venugopal et Luckey 1978; Tardiff et coll., 1980). Le baryum s’accumule aussi dans les dents, comme le montre une étude réalisée par Miller et coll. (1985), dans laquelle le rapport du baryum au calcium observé dans les dents des enfants d’une collectivité dont l’eau potable contenait de fortes concentrations de baryum (10 mg/L) était cinq fois plus élevé que chez les enfants d’une autre collectivité où la concentration de baryum était de 0,2 mg/L, en dépit d’une origine ethnique et d’une situation socioéconomique semblables. Le baryum est aussi largement distribué dans différents tissus, les poumons, les graisses, les muscles, la peau, les tissus conjonctifs et les tissus mous contenant 0,1 à 0,5 mg de baryum chez les humains adultes aux États-Unis (Schroeder et coll., 1972).
On n’a relevé aucune différence dans la distribution entre les sexes chez les rats exposés à 10 à 250 mg/L de baryum sous forme de chlorure pendant 4 à 13 semaines (Tardiff et coll., 1980). On a également établi que le baryum traversait la barrière placentaire (Venugopal et Luckey, 1978; McCauley et Washington, 1983). Chez les rats intubés auxquels on a administré10 mg/L de chlorure de baryum pendant 24 heures, les plus fortes concentrations de baryum ont été mesurées dans le cœur, les muscles, les yeux, le foie et les reins (McCauley et Washington, 1983).
8.3 Métabolisme
Le baryum n’est pas métabolisé dans le corps humain. Sous forme d’ion, il est monovalent et son état d’oxydation n’est pas susceptible de changer.
8.4 Excrétion
Chez l’humain, le baryum est excrété dans les selles et l’urine, les selles constituant la principale voie d’excrétion; Schroeder et coll. (1972) ont indiqué que pour un apport total de 1,33 mg/jour (1,24, 0,086 et 0,001 mg/jour dans les aliments, l’eau et l’air, respectivement), environ 90 % du baryum est excrété dans les selles et 2 % dans l’urine. Des résultats comparables ont été obtenus par Tipton et coll. (1969); deux hommes ont excrété 95 % à 98 % et 2 % à 5 % d’un apport quotidien en baryum, dans les selles et l’urine, respectivement.
8.5 Modèles pharmacocinétiques à base physiologique (PBPK)
Aucun modèle PBPK n’a été recensé pour le baryum dans les documents actuellement disponibles.
9.0 Effets sur la santé
Le baryum n’est pas considéré comme un élément essentiel pour la santé (Venugopal et Luckey, 1978; Ferrante et coll., 2014; Chellan et Sadler, 2015).
Les différents composés du baryum présentent des solubilités différentes dans l’eau et les fluides corporels, ce qui influe sur leur toxicité. L’ion Ba2+ et les composés solubles du baryum (surtout le chlorure, le nitrate et l’hydroxyde) sont toxiques pour les humains et les animaux. Le carbonate de baryum, bien que relativement insoluble dans l’eau, est soluble dans le tractus gastro-intestinal et peut ainsi être absorbé dans le sérum et les tissus et avoir des effets. Les composés insolubles du baryum, comme le sulfate de baryum, constituent des sources inefficaces de Ba2+ ion et ne sont donc généralement pas toxiques pour les humains. En raison de son innocuité, le sulfate de baryum est utilisé dans des applications médicales, par exemple, comme produit de contraste pour les examens radiologiques du tractus gastro-intestinal. Cependant, le sulfate de baryum et d’autres composés insolubles du baryum, peuvent devenir toxiques si le tractus gastro-intestinal est atteint (p. ex., dans le cas d’un cancer du côlon) et que le baryum peut pénétrer dans le flux sanguin (ATSDR, 2007).
9.1 Effets chez les humains
La base de données sur les effets d’une exposition au baryum sur la santé humaine est limitée. Les effets sur la santé d’une exposition aigüe à des concentrations élevées de carbonate ou de chlorure de baryum seraient en grande partie liés à l’hypokaliémie, qui peut entraîner des complications, comme la tachycardie ventriculaire, l’hypertension ou l’hypotension, une faiblesse musculaire et la paralysie. Des effets gastro-intestinaux, comme les vomissements, les crampes abdominales et les diarrhées aqueuses, ont également été signalés peu après l’ingestion de fortes doses. Les corrélations entre la présence de baryum dans l’eau potable et la mortalité due à une maladie cardiovasculaire sont en grande partie négatives; cependant, une étude rétrospective fait état d’une corrélation positive, mais un contrôle insuffisant des facteurs aggravants et une caractérisation inadéquate de l’exposition rendent les résultats peu fiables. Les incidences d’une exposition au baryum sur la toxicité pour le développement et la reproduction, ainsi que sur la perte auditive, ont été évaluées; les résultats sont toutefois peu concluants, surtout en raison de la caractérisation inadéquate de l’exposition. La cancérogénicité du baryum n’a pas été évaluée chez l’humain.
9.1.1 Toxicité aigüe
Une intoxication aigüe aux sels de baryum peut survenir chez l’humain (concentrations non indiquées) en cas d’ingestion accidentelle par voie orale ou de tentative de suicide. Dans ces situations, le baryum a causé une hypokaliémie (baisse du taux sérique de potassium), qui a entraîné des effets neuromusculaires (p. ex., faiblesse musculaire et paralysie, réflexes anormaux, picotements, étourdissements) et cardiovasculaires (p. ex., arythmies, anomalies à l’électrocardiogramme) (McNally, 1925; Diengott et coll., 1964; Lewi et coll., 1964; Ogen et coll., 1967; Talwar et Sharma, 1979; Deng et coll., 1991; Downs et coll., 1995; Koch et coll., 2003; Rhyee et Heard, 2009; Payen et coll., 2011; Bhoelan et coll., 2014). Dans une étude de cas, le baryum absorbé provenait d’un sel de carbonate présent dans la farine qui avait été solubilisé en raison du pH acide de l’estomac.
Les effets gastro-intestinaux (douleurs gastriques, vomissement, diarrhée, serrement dans la gorge, sécheresse de la bouche, hémorragie) seraient des effets aigus d’une ingestion de baryum. Les réactions aigües peuvent se traduire par une augmentation de la tension artérielle, une paralysie musculaire progressive, une insuffisance cardiovasculaire et respiratoire, voire la mort (Downs et coll., 1995; Jourdan et coll., 2001; Bhoelan et coll., 2014). La présence d’hémoglobine dans les urines et une insuffisance rénale ont aussi été observées (Morton, 1945; Gould et coll., 1973; Wetherill et coll., 1981; Phelan et coll., 1984; Jha et coll., 1993; Silva et coll., 2003; Koch et coll., 2003; Lukasik-Glebocka et coll., 2014). Des doses de 1 à 15 g de sulfure de baryum ont causé la mort. Cependant, dans un autre cas, le traitement médical administré après une exposition à 133 g de carbonate de baryum a prévenu une issue fatale (Downs et coll., 1995).
9.1.2 Toxicité subchronique et chronique et cancérogénicité
9.1.2.1 Toxicité cardiovasculaire
Dans une étude rétrospective, on a constaté que les taux de mortalité (p < 0,05) attribuables à toutes les maladies cardiovasculaires et maladies cardiaques étaient plus élevés (données tirées des certificats de décès datant de 1971 à 1975) dans des collectivités de l’Illinois où l’eau potable présentait des concentrations de baryum de 2 à 10 mg/L que dans les collectivités où ces concentrations étaient inférieures à 0,2 mg/L (25 433 adultes de quatre collectivités où les concentrations de baryum étaient élevées et 46 905 adultes provenant de sept collectivités où ces concentrations étaient faibles) (Brenniman et Levy, 1979; Brenniman et coll., 1985). Les collectivités ont été appariées en fonction de leurs caractéristiques démographiques et de leur situation socio-économique; cependant, aucun ajustement n’a été effectué pour tenir compte de l’utilisation d’adoucisseurs d’eau, de la prise de médicaments, du tabagisme, de la diète et de l’exercice. Par ailleurs, le taux de mouvements démographiques était d’environ 70 % dans les collectivités associées aux plus fortes concentrations au cours de la décennie qui a précédé l’étude, et aucun renseignement n’est fourni sur la durée du séjour des personnes dans une collectivité donnée. L’exposition était par ailleurs mal caractérisée, et aucun renseignement n’était fourni sur le taux de consommation d’eau du robinet. Dans une autre étude portant sur la morbidité cardiovasculaire, on n’a observé aucune différence dans la tension artérielle, les accidents vasculaires cérébraux et les maladies cardiaques ou rénales (p < 0,05) entre une collectivité de l’Illinois où l’eau potable contenait en moyenne 7,3 mg/L (n = 1 175 adultes à West Dundee) et une autre collectivité où la concentration moyenne était de 0,1 mg/L (n = 1 203 adultes à McHenry) pour les années 1976–1977 (Brenniman et Levy, 1981; résumé dans Brenniman et coll., 1985).
Aucune corrélation n’a pu être établie entre l’apport de baryum provenant de l’eau potable et les marqueurs de maladie cardiovasculaire (taux de cholestérol, de glucose et de triglycérides, tension artérielle, fréquence cardiaque, indicateurs électrocardiographiques) chez 11 volontaires américains de sexe masculin (âgés de 27 à 61 ans) (Wones et coll., 1990). On a administré du baryum dans de l’eau potable à des concentrations successives de 0 ppm pour les 2 premières semaines, de 5 ppm pour les 4 semaines suivantes et de 10 ppm (sous forme de chlorure de baryum) pour les 4 dernières semaines. Les facteurs associés au risque de maladie cardiovasculaire (comme l’exercice et l’apport alimentaire) ont été contrôlés. Cependant, le petit nombre de sujets, la courte durée de l’exposition et l’absence de données sur l’absorption limitent l’interprétation des résultats de cette étude.
9.1.3 Toxicité pour le développement et la reproduction
Les études sur les humains renferment peu d’information sur les effets sur la reproduction et le développement des composés solubles du baryum. Dans une petite étude épidémiologique prospective, aucune différence n’a été observée (dans l’âge gestationnel, le poids à la naissance et les malformations majeures ou mineures; p = 1,0) entre les nouveau-nés (n = 32) de mères qui avaient avalé par inadvertance du sulfate de baryum utilisé dans les examens radiologiques au cours du premier trimestre de leur grossesse et les bébés d’un groupe témoin de 94 mères (Han et coll., 2011). Rien n’indique non plus que le baryum ait un effet tératogène chez les nourrissons (n = 5) nés de mères accidentellement exposées au baryum au cours d’un lavement (Han et coll., 2010). Néanmoins, la faible solubilité et les bas taux d’absorption du sulfate de baryum utilisé dans les examens médicaux peuvent fausser l’interprétation de ces résultats pour ce qui est des composés solubles du baryum.
Dans une petite étude cas-témoins menée sur un seul site, on a constaté que le baryum comptait parmi les métaux dont les concentrations étaient élevées dans les cheveux (p = 0,003) et l’urine (p = 0,002) de 25 enfants (âge moyen de 5 ans) atteints de troubles du spectre de l’autisme en Arabie saoudite comparativement à 25 enfants non autistes jumelés par âge et sexe. Cette étude présentait toutefois plusieurs lacunes : les mères des enfants autistes avaient été exposées à de la fumée secondaire; les sujets témoins choisis étaient des cas recommandés, et aucune tentative n’a été faite pour déterminer quels autres éléments traces et métaux lourds auraient pu être responsable de ces corrélations (Blaurock-Busch et coll., 2011).
9.1.4 Autres effets
Dans une étude pilote transversale, Ohgami et coll. (2016) ont établi une corrélation entre les pertes auditives (seuils d’audition) et des concentrations de baryum dans les cheveux (rapport de cotes (RC) = 4,75 (intervalle de confiance (IC) de 95 % : 1,44, 17,68) à 8 kHz et RC = 15,48 [IC de 95 %: 4,04, 79,45] à 12 kHz) et les ongles d’orteils (RC = 3,20 [IC de 95 % : 1,35, 7,85] à 8 kHz et RC = 3,63 [IC de 95 % : 1,58, 8,55] à 12 kHz) au Bangladesh (n = 145 individus des deux sexes âgés de 12 à 55 ans); cependant, aucune corrélation n’ayant été établie avec les taux mesurés dans l’urine et les sources d’expositions n’ayant pas été caractérisées, les résultats de cette étude ne permettent pas conclure à une corrélation entre l’exposition au baryum et les pertes auditives.
En utilisant les données de NHANES 1999–2002 afin d’explorer la corrélation entre le tour de taille et l’indice de masse corporelle et la charge corporelle de divers métaux toxiques, Padilla et coll. (2010) ont constaté qu’il existait une corrélation positive directe entre la présence de baryum dans les urines et l’indice de masse corporelle et le tour de taille (p < 0,05), ce qui donne à penser que l’exposition environnementale au baryum (et à d’autres métaux) peut influer sur les variations de gain ou de perte de poids chez l’humain.
9.2 Effets sur les animaux de laboratoire
La base de données sur les effets sur la santé chez les animaux d’une exposition au baryum est plutôt limitée. Les recherches sur la fonction cardiovasculaire n’ont généralement pas permis d’observer de changements notables dans la tension artérielle ou les données d’électrocardiogrammes après une exposition par voie orale à une faible dose. Dans certaines études, on a constaté une augmentation importante de la tension artérielle; le choix d’une diète faible en minéraux n’offrant pas un apport suffisant en calcium peut avoir influencé les résultats de l’étude.
L’effet nocif le plus sensible du baryum semble être la toxicité rénale. Une néphropathie a été observée chez les rats et les souris après une exposition par voie orale de courte et de longue durée, des courbes dose–réponse abruptes ayant été enregistrées chez les deux espèces; les données sur les souris suggèrent que la gravité et la sensibilité aux lésions rénales sont liées à la durée de l’exposition.
Les études menées sur la reproduction et le développement sont limitées, les résultats étant généralement négatifs pour ce qui est des incidences sur les tissus reproducteurs ou la performance reproductive chez les rats et les souris. On a observé une réduction du nombre de spermatozoïdes et de leur qualité ainsi qu’une diminution de la durée des cycles œstraux et des changements morphologiques dans les ovaires chez les rats; les lacunes de l’étude rendent toutefois ces résultats peu concluants. On a constaté une diminution du poids à la naissance des petits et une réduction non significative de la taille des portées chez la progéniture des rats exposés à du chlorure de baryum administré dans l’eau potable avant l’accouplement. Enfin, plusieurs études ont montré qu’une exposition par voie orale au baryum n’augmentait pas sensiblement l’incidence de tumeurs.
9.2.1 Toxicité aigüe
On a signalé la présence de liquide dans la trachée, une inflammation de l’intestin grêle et du colon, un rapport pondéral foie-cerveau plus faible, un rapport pondéral rein-cerveau plus élevé, un foie plus foncé, des écoulements oculaires et une diminution du poids corporel chez les rats auxquels on avait administré par gavage 60 à 960 mg Ba/kg sous forme de chlorure de baryum dans de l’eau (Borzelleca et coll., 1988). Dans cette étude, les valeurs de la DL50 (dose létale moyenne) étaient de 419 et de 408 mg BaCl2/kg p. c. chez des rats Sprague-Dawley mâles et femelles, respectivement. Dans une autre étude, on a obtenu une DL50 de 132 mg Ba/kg p. c. et de 220 mg Ba/kg p. c. chez des rats Charles River adultes et sevrés (souche non précisée), respectivement, auxquels on a administré par gavage du chlorure de baryum dans de l’eau (Tardiff et coll., 1980). On a par ailleurs observé des anomalies à l’électrocardiogramme, de la tachycardie, une fibrillation ventriculaire, une paralysie musculaire, de la salivation, de la diarrhée, de l’hypertension, une paralysie respiratoire, de l’hypokaliémie et la mort après une perfusion intraveineuse de chlorure de baryum chez des chiens bâtards (Roza et Berman, 1971).
9.2.2 Exposition à court terme
9.2.2.1 Effets rénaux
Le National Toxicology Program (NTP, 1994) a réalisé des études toxicologiques sur des rats F344/N et des souris B6C3F1 auxquels on a administré du chlorure de baryum dihydraté (pur à 99 %) dans de l’eau potable pendant 15 jours et 13 semaines. Dans les études de 15 jours, on a administré aux rats (âgés de 70 jours; 5/sexe/dose) du baryum à des concentrations de 0, de 125, de 250, de 500, de l 000 ou de 2 000 ppm (10, 15, 35, 60 ou 110 mg/kg p. c. par jour pour les mâles et les femelles), et les souris (âgées de 77 jours; 5/sexe/dose) ont reçu 0, 40, 80, 173, 346 ou 692 ppm (10, 30, 65, 110 ou 200 mg/kg p. c. par jour pour les mâles et 10, 35, 65, 115 ou 180 mg/kg p. c. par jour pour les femelles). Chez les rats, on n’a constaté aucun décès associé à une substance chimique, ni différence dans les poids corporels finals moyens ou signe clinique de toxicité; on n’a pas non plus signalé de différences significatives dans les poids absolus ou relatifs des organes ou les paramètres hématologiques, biochimiques ou neurocomportementaux. La consommation d’eau des mâles et des femelles du groupe qui recevait la plus forte dose était légèrement inférieure (≤16 %) à celle du groupe témoin pendant la deuxième semaine. Chez les souris, on n’a constaté aucun décès associé à une substance chimique, ni différences dans les poids corporels moyens et la consommation d’eau; on n’a pas non plus relevé de signe clinique ou histopathologique de toxicité; dans le groupe qui recevait la plus forte dose, le poids relatif du foie des mâles et les poids absolu et relatif du foie des femelles étaient significativement plus élevés que dans le groupe témoin.
Dans les études de 13 semaines, on a administré aux rats F344/N et aux souris B6C3F1 (âgés de 43 jours; 10/sexe/dose) du baryum (sous forme de chlorure de baryum dans de l’eau potable à volonté) à des concentrations de 0, de 125, de 500, de 1 000, de 2 000 et de 4 000 mg/L (0, 10, 30, 65, 110 ou 200 mg Ba/kg p. c. par jour pour les rats mâles et de 0, de 10, de 35, de 65, de 115 ou de 180 mg Ba/kg p. c. par jour pour les rats femelles et à des concentrations de 0, de 15, de 55, de 100, de 205 ou de 450 mg Ba/kg p. c. par jour pour les souris mâles et de 0, de 15, de 60, de 110, de 200 ou de 495 mg Ba/kg p. c. par jour pour les souris femelles, tel que déterminé par les auteurs de l’étude) (NTP, 1994). Chez les rats, la consommation d’eau des mâles et des femelles du groupe qui recevait la plus forte dose était de 30 % inférieure à celle du groupe témoin; des lésions rénales associées à une substance chimique (trois mâles et trois femelles) et des décès (trois mâles et une femelle) ont aussi été observés dans ce groupe posologique. Aucun changement dans la tension artérielle n’a été décelé dans aucun des groupes posologiques au cours de la période de 13 semaines. Les poids absolu et relatif des reins des femelles des groupes qui recevaient une dose de 115 ou de 180 mg/kg p. c. par jour et ceux des mâles du groupe qui recevait une dose de 200 mg/kg p. c. par jour étaient significativement plus élevés que ceux des groupes témoins et associés à des lésions rénales induites par des substances chimiques. L’étude a permis de déterminer que la dose sans effet nocif observé (no observed adverse effect level ou NOAEL) était de 65 mg/kg p. c. par jour pour ce qui est de l’augmentation du poids des reins chez les rats femelles. Chez les souris, les poids corporels finals moyens des mâles et des femelles du groupe qui recevait la plus forte dose étaient significativement plus faibles que dans les groupes témoins, et les mâles consommaient 18 % moins d’eau que les animaux témoins. On a observé des lésions rénales plus graves chez les souris que chez les rats, ainsi qu’une néphropathie multifocale à diffuse (dilatation, régénération et atrophie des tubules), la présence de cristaux et de cylindres éosinophiles dans les tubules atrophiés et une mortalité accrue chez les deux sexes dans le groupe ayant reçu la plus forte dose; cette étude a permis d’établir une NOAEL de 200 mg/kg p. c. par jour pour les lésions rénales chez les souris femelles.
Des rats Fisher-344/N et des souris B6C3F1 ont reçu du chlorure de baryum (10 animaux/sexe/espèce/dose) dans l’eau potable à des concentrations de 0, de 1 000, de 2 000 ou de 4 000 mg Ba/L (équivalant à des doses de 0, de 65, de 110 et de 200 mg Ba/kg p. c. par jour pour les mâles et à des doses de 0, de 65, de 115 et de 180 mg Ba/kg p. c. par jour pour les femelles, selon les estimations des auteurs de l’étude) pendant 13 semaines (Dietz et coll., 1992). La mortalité s’établissait à 10 à 30 % chez les rats et à 60 à 70 % chez les souris, dans les groupes ayant reçu la plus forte dose. Chez les souris, la mortalité était attribuable à une toxicité rénale liée au traitement, tandis que chez les rats, les lésions rénales étaient moins graves et n’ont pas contribué à la mortalité dans le groupe à forte dose. On a observé une néphrose toxique et des cristaux dans la lumière des tubules rénaux (que les auteurs supposent être des sels de baryum insolubles) chez plus de 80 % des souris des deux sexes dans le groupe ayant reçu la dose la plus élevée. Les lésions rénales étaient caractérisées par une dilatation (présence de cylindres éosinophiles granuleux et de cristaux), une régénération et une atrophie (tapissage de cellules épithéliales avec cytoplasme basophile teinté) des cellules tubulaires chez les souris. On a enregistré une dépression irrégulière de la capsule rénale à proximité des tubules collabés. On a par ailleurs observé un accroissement du tissu fibreux entre les tubules dans le cortex et la médullaire externe. Seuls quelques foyers de tubules dilatés ont été observés dans la médullaire externe chez les rats des deux sexes à la dose la plus élevée. Une NOAEL de 2 000 mg Ba/L (110 mg Ba/kg p. c. par jour) a été établie par les auteurs de cette étude.
Dans une étude portant sur les effets protecteurs de la pelure de la grenade contre les dommages rénaux induits par le baryum, un seul groupe de six rats Wistar adultes exposé à du chlorure de baryum (67 ppm, équivalant à 10 mg/kg p. c. par jour, tel qu’indiqué par les auteurs de l’étude) pendant 21 jours présentait une clairance réduite de la créatinine (indicateur de dysfonctionnement glomérulaire) par rapport aux animaux témoins (Elwej et coll., 2016a). Le groupe qui avait reçu du baryum présentait également divers foyers hémorragiques et une infiltration de leucocytes visible dans la capsule de Bowman qui entoure les glomérules.
Des rats Sprague-Dawley femelles auxquels on avait administré par gavage pendant 10 jours 100, 145, 209 et 300 Ba/kg p. c. par jour dans l’eau présentaient un rapport pondéral rein-cerveau réduit dans tous les groupes posologiques, sauf le groupe ayant reçu la dose la plus élevée. Cependant, les auteurs ont conclu que ces résultats n’étaient vraisemblablement pas liés au baryum, compte tenu de l’absence d’effets dans le groupe ayant reçu la plus forte dose (Borzelleca et coll., 1988).
Aucun effet nocif n’a été observé chez les jeunes rats adultes (rats Charles River; 30 animaux/sexe/ dose) exposés à 0, à 10, à 50 ou à 250 mg Ba/L sous forme de chlorure de baryum dans l’eau potable (équivalant à 2–3, à 6–13 ou à 28–64 mg Ba/kg p. c. par jour pour les mâles et à 2–3, à 7–15 ou à 36–68 mg Ba/kg p. c. par jour pour les femelles, tel qu’indiqué par les auteurs de l’étude) pendant 13 semaines (Tardiff et coll., 1980).
9.2.2.2 Effets cardiovasculaires
Une dépression accrue de la fonction contractile myocardique induite par les barbituriques a été observée chez les jeunes rats à capuchon femelles Long-Evans exposés pendant 16 mois à 100 ppm de chlorure de baryum dans l’eau potable (Kopp et coll., 1985). Une augmentation de la tension artérielle systolique a été mesurée chez les rats traités au baryum par rapport aux animaux témoins (n = 12). Une vitesse réduite des contractions myocardiques du système de conduction dans la région du nœud atrioventriculaire et des perturbations du métabolisme énergétique ont aussi été observées après 16 mois d’exposition.
9.2.2.3 Autres effets
Une diminution de l’activité motrice (souris et rats), de la force de préhension (souris) et de la sensibilité thermique (souris) a également été observée à une dose de 4 000 ppm dans le cadre de l’étude du NTP (1994), décrite ci-dessus; la force de préhension des membres antérieurs des souris femelles recevant 4 000 ppm était aussi réduite après 90 jours d’exposition.
Les souris ICR femelles (n = 5) exposées à du chlorure de baryum dans l’eau potable pendant 2 semaines ou 2 mois (équivalant à des doses de 0,14 et de 1,4 mg Ba/kg p. c. par jour, tel qu’indiqué par les auteurs) présentaient des pertes auditives graves dans les deux groupes posologiques après 2 semaines et une dégénération importante de l’oreille interne après 2 mois (Ohgami et coll., 2012) par rapport aux animaux témoins. L’étude présentait plusieurs lacunes, qui limitent l’interprétation de ces résultats, notamment l’utilisation d’une souche de souris dont il a été démontré qu’elle présente une perte auditive progressive (cette étude doit être reproduite avec d’autres espèces); la mesure des concentrations de baryum dans l’oreille interne a été effectuée longtemps (11 semaines) après l’évaluation audiologique (5 semaines); aucune différence n’a été observée dans les concentrations de baryum dans les os entre les groupes de traitement, et les concentrations de baryum dans d’autres tissus (dont les reins, le foie et le cœur) étaient indétectables, ce qui va à l’encontre de ce à quoi on pourrait s’attendre après une exposition au baryum.
9.2.3 Exposition de longue durée et cancérogénicité
9.2.3.1 Effets rénaux
Dans le cadre de l’étude du NTP décrite ci-dessus (NTP, 1994), des rats et des souris (60/sexe/dose) ont aussi été exposés à du chlorure de baryum dans l’eau potable à des concentrations de 0, de 500, de 1 250 et de 2 500 mg/L (sous forme de baryum) (0, 15, 30, 60 mg Ba/kg p. c. par jour pour les rats mâles et 0, 15, 45, 75 mg Ba/kg p. c. par jour pour les rats femelles; 0, 30, 75 ou 160 mg Ba/kg p. c. par jour pour les souris mâles et 0, 40, 90 ou 200 mg Ba/kg p. c. par jour pour les souris femelles, selon les estimations des auteurs de l’étude) pendant 103–105 semaines. Chez les rats, aucun effet associé à des substances chimiques n’a été observé à aucune dose. Chez les souris, on a observé une néphropathie légère à grave chez les mâles et les femelles (régénération de l’épithélium des tubules corticaux et médullaires, dilatation, formation de cylindres hyalins, fibrose interstitielle multifocale et glomérulosclérose chez certains animaux; présence de cristaux bruns dans les lumières des tubules et de kystes interstitiels et rénaux chez les mâles), et une mortalité accrue due à des lésions rénales a été enregistrée dans le groupe à forte dose. Au cours de l’évaluation intermédiaire de 15 mois, les taux d’azote uréique étaient élevés chez les souris dans tous les groupes posologiques (ce résultat ne serait toutefois pas statistiquement significatif, selon les auteurs), ce qui indique que, chez certains animaux, des changements commencent à survenir dans la fonction rénale qui confirment la pathologie observée, même à de faibles doses. Une NOAEL de 75 mg/kg p. c. par jour peut être établie pour une néphropathie chez les souris mâles.
Dans le cas de rats Long-Evans exposés à 5 mg Ba/L (52/sexe; sous forme d’acétate de baryum) dans l’eau potable, une hausse de la protéinurie a été mesurée uniquement chez les mâles qui avaient été exposés toute leur vie durant, tandis que les femelles n’affichaient aucune différence significative par rapport aux animaux témoins; les auteurs n’ont observé aucune lésion rénale chez les rats traités (Schroeder et Mitchener, 1975a). Une diminution de la survie a été enregistrée chez les souris suisses mâles de la souche Charles River CD (mais non chez les femelles) exposées à 5 mg Ba/L (sous forme d’acétate de baryum) dans l’eau potable; cependant, les auteurs n’ont constaté aucune lésion rénale chez les souris traitées (Shroeder et Mitchener, 1975b).
Chez les rats auxquels on avait administré du chlorure de baryum dans l’eau potable à des concentrations de 1–1 000 mg Ba/L (les auteurs ont simplement précisé que 10 ppm équivalaient à 1,5 mg Ba/kg p. c. par jour) pendant 16–68 semaines, on a observé des changements structuraux dans les glomérules à la dose la plus élevée de 1 000 ppm (soit environ 150 mg/kg p. c. par jour) (McCauley et coll., 1985); cette étude a permis d’établir une dose minimale avec effet nocif observé (LOAEL) de 150 mg/kg p. c. par jour.
9.2.3.2 Effets cardiovasculaires
Perry et coll. (1985, 1989) ont exposé des rats femelles Long-Evans sevrés (13 par groupe posologique) à du chlorure de baryum dans l’eau potable à des concentrations de 0, de 1, de 10 ou de 100 ppm pendant 1–16 mois. Une augmentation de la tension artérielle systolique moyenne a été observée dans le groupe ayant reçu 10 ppm après 8–16 mois. Dans le groupe qui avait reçu la dose de 100 ppm, cette hausse a été observée du premier mois jusqu’à la fin de l’étude. Dans d’autres études, on n’a pas établi ces corrélations après des expositions à doses atteignant 150 mg/kg p. c. par jour (1 000 ppm) (McCauley et coll., 1985) et 180 mg/kg p. c. par jour (4 000 ppm) (NTP, 1994). On a administré aux animaux utilisés dans les études de Perry et coll. (1985, 1989) une diète à base de seigle dont les niveaux de calcium étaient en deçà de l’apport quotidien recommandé (NRC, 1995), ce qui peut les avoir rendus plus sensibles aux effets cardiovasculaires du baryum; étant donné que certaines données relevées chez les humains indiquent qu’un apport alimentaire de calcium réduit est un facteur de risque d’hypertension (McCarron et coll., 1984), il n’est pas certain que les résultats de ces études soient pertinents.
9.2.3.3 Autres effets
Une déplétion lymphoïde a été observée dans la rate, le thymus et les ganglions lymphatiques des souris et des rats exposés à 2 500 ppm de chlorure de baryum dihydraté pendant 103–105 semaines (NTP, 1994). Cette étude a permis d’établir une NOAEL de 180 mg/kg p. c. par jour pour les rats et de 205 mg/kg p. c. par jour pour les souris.
9.2.3.4 Cancérogénicité
Aucune augmentation de l’incidence des tumeurs n’a été observée chez les rats Fisher 344/N ou les souris B6C3F1 exposés à des concentrations pouvant atteindre 2 500 mg/L de baryum (60–75 mg/kg p. c. par jour pour les rats et 160–200 mg/kg p. c. par jour pour les souris) administrées dans l’eau potable pendant 2 ans (NTP, 1994). Des diminutions statistiquement significatives ont été observées dans les tendances de leucémies à cellules mononuclées et les néoplasmes ainsi que dans les lésions non néoplasiques de la glande surrénale chez les rats mâles et des glandes mammaires chez les rats femelles. Par ailleurs, des diminutions statistiquement significatives d’adénomes hépatocellulaires ont été observées chez les souris mâles. Aucune augmentation des tumeurs n’a par ailleurs été enregistrée chez les rats Long-Evans ou les souris suisses (52 animaux/espèce/sexe) exposés à 5 ppm d’acétate de baryum dans l’eau potable pendant 540 jours (Schroeder et Mitchener, 1975a, 1975b) ou après que des rats SD mâles aient été exposés à 1–100 ppm de chlorure de baryum pendant 68 semaines (McCauley et coll., 1985).
9.2.4 Génotoxicité
Dans les études in vitro, on n’a généralement pas constaté de génotoxicité pour le baryum; dans une étude in vivo, on a observé une augmentation d’un type de mutation somatique à une dose élevée.
9.2.4.1 Résultats in vitro
Le chlorure de baryum (10 à 10 000 µg/plaque) n’a pas causé d’augmentation significative de la fréquence de mutation génétique dans Salmonella typhimurium (TA97, TA98, TA100, TA1535 et TA1537) avec et sans activateur S9 (foie de rat ou de hamster traité à l’Aroclor-1254) (Rossman et coll., 1991; NTP, 1994). Par ailleurs, aucune augmentation de mutations génétiques ni dommages à l’ADN n’ont été constatés (lors d’un essai au moyen des souches H17 et M45 de Bacillus subtilis, d’un essai de polymérisation de l’ADN au moyen du virus de la myéloblastose aviaire et d’un essai microtamis avec Escherichia coli WP2) avec le nitrate de baryum et le chlorure de baryum (Nishioka, 1975; Sirover et Loeb, 1976a, 1976b; Kanematsu et coll., 1980; Rossman et coll., 1991). Le chlorure de baryum n’a par ailleurs pas induit d’échanges de chromatides sœurs, d’aberrations chromosomiques ou de retard du cycle cellulaire dans les cellules ovariennes de hamsters chinois (NTP, 1994). Cependant, le chlorure de baryum (à des doses de 250 µg/ml et plus) a causé des mutations génétiques dans les cellules L5178Y de lymphome de souris en présence d’activation métabolique (aucune augmentation du nombre de colonies mutantes n’a été observée sans activateur S9) (NTP, 1994).
9.2.4.2 Résultats in vivo
Yesilada (2001) a observé des augmentations des petites taches simples sur les ailes (le test de mutation des ailes est un indicateur de mutations somatiques) chez Drosophila melanogaster après exposition à de fortes concentrations de nitrate de baryum (10 mM), mais non à des concentrations plus faibles (1 mM). L’effet du baryum sur les grandes taches simples et doubles n’était pas concluant aux concentrations de 1 et de 10 mM.
9.2.5 Toxicité pour la reproduction et le développement
Dans l’étude du NTP (1994), décrite ci-dessus, une augmentation significative du poids des testicules (p ≤ 0,01) et de l’utérus (p ≤ 0,05) a été observée chez les rats du groupe qui avait reçu une dose de 2 500 ppm (60 mg Ba/kg p. c. par jour pour les mâles et 75 mg Ba/kg p. c. par jour pour les femelles) après 15 mois d’exposition par l’eau potable; aucun changement significatif n’a été enregistré dans le poids des organes reproducteurs chez les souris. Cette étude a permis d’établir une NOAEL de 60 mg/kg p. c. par jour pour les rats et de 160 mg/kg p. c. par jour pour les souris. Cependant, la portée de ces résultats est inconnue, car la toxicité pour la reproduction et le développement n’a pas été évaluée.
Dietz et coll. (1992) ont procédé à un essai d’accouplement sur une génération dans lequel les groupes de rats mâles et femelles F-344/N et de souris B6C3F1 (20/sexe/espèce/groupe) ont été exposés à du chlorure de baryum dihydraté administré dans l’eau potable à des concentrations de 0, de 1 000, de 2 000 ou de 4 000 ppm pour les rats et de 0, de 500, de 1 000 ou de 2 000 ppm pour les souris pendant 60 jours (mâles) ou 30 jours (femelles). Les doses estimatives (tirées d’une étude subchronique réalisée par les mêmes auteurs, décrite à la section 9.2.2) pour les rats étaient de 0, de 65, de 110 et de 200 mg/kg par jour pour les mâles et de 0, de 65, de 115 et de 180 mg/kg par jour pour les femelles; pour les souris, les doses estimatives étaient de 0, de 55, de 100 et de 205 mg/kg par jour pour les mâles et de 0, de 60, de 110 et de 200 mg/kg par jour pour les femelles. Après la période d’exposition, les mâles et les femelles des mêmes groupes d’exposition ont été logés ensemble jusqu’à ce qu’il y ait une indication d’accouplement ou jusqu’à la fin de la période d’accouplement (8 jours). De nombreux paramètres reproductifs ont été évalués. Pour les rats et les souris, aucun changement n’a été observé dans le nombre de spermatozoïdes dans l’épididyme, la motilité des spermatozoïdes, la morphologie des spermatozoïdes, le poids des testicules ou de l’épididyme ou la cytologie vaginale. Chez les rats, les taux de gravidité étaient en deçà des valeurs normales historiques pour le laboratoire; ces faibles taux n’étaient toutefois pas liés au traitement. Aucune modification significative de la durée de la gestation, de la survie des petits ou de l’occurrence d’anomalies externes n’a été constatée. Une diminution statistiquement significative (p < 0,01) du poids des ratons vivants à la naissance a été enregistrée dans le groupe qui avait reçu 4 000 ppm; cependant, 5 jours après la naissance, aucune modification significative du poids corporel des petits n’a été mesurée. Chez les souris, aucune modification du gain pondéral des mères, de la durée moyenne de la gestation, de la survie des petits ou du poids des petits n’a été observée. Une diminution statistiquement significative (p < 0,05) de la taille moyenne des portées est survenue aux jours 0 et 5 dans le groupe de traitement ayant reçu 1 000 ppm mais non dans le groupe ayant reçu 2 000 ppm. Aucune anomalie externe n’a été observée chez la progéniture. Cette étude a permis d’établir une NOAEL de 115 mg/kg p. c. par jour pour les rats et de 200 mg/kg p. c. par jour pour les souris.
Une diminution du poids des ovaires et du rapport pondéral ovaires-cerveau a été relevée chez les rats Sprague-Dawley âgés de 29 à 37 jours (10 animaux/sexe/dose) exposés à une dose de 198 mg Ba/kg de chlorure de baryum administrée par gavage dans l’eau une fois par jour pendant 10 jours, mais non à une dose de 138 mg Ba/kg (Borzelleca et coll., 1988); cette étude a donc permis d’établir une NOAEL de 138 mg Ba/kg.
9.3 Mode d’action
Comme il est indiqué à la section 9.2, des études chroniques et subchroniques menées chez les rats et les souris ont montré que le rein est une cible sensible aux effets toxiques du baryum; cependant, le mode d’action des effets toxiques rénaux induits par le baryum n’a pas été entièrement élucidé. Les données disponibles indiquent que la toxicité rénale peut être associée aux processus oxydatifs. Des rats Wistar ayant reçu 67 mg/L de chlorure de baryum pendant 21 jours présentaient une augmentation des marqueurs de stress oxydatif au niveau hépatique et rénal (lipoperoxyde dans les tissus, hydroperoxydes dans les lipides, produits protéiques d’oxydation avancée, malondialdéhyde et concentrations de H2O2), une diminution de l’activité enzymatique de la catalase, des niveaux de superoxyde dismutase, de glutathion peroxydase, de vitamine C et de glutathion et de thiol non protéique. Une augmentation de la teneur en métallothionéine a également été observée (Elwej et coll., 2016a, 2016b). Le stress oxydatif pourrait donc être responsable des dommages causés aux macromolécules cellulaires, comme les protéines, et aux membranes cellulaires pouvant être accompagnés d’une perturbation de la chaîne de respiration mitochondriale (Storz et coll., 2005). L’hypothèse du stress oxydatif est étayée par les concentrations élevées de H2O2, de malondialdéhyde et de produits protéiques d’oxydation avancée. Plus précisément, le H2O2 peut être converti en radical hydroxyle, qui peut causer une peroxydation rapide des lipides et une diminution des taux de glutathion, une vulnérabilité accrue des organes au stress oxydatif. Par ailleurs, l’administration par voie orale de poudre de pelure de pomme grenade (5 % de la diète) a atténué les dommages rénaux et hépatiques induits par le baryum, peut-être en agissant comme donneur d’électrons (antioxydant).
La toxicité cardiovasculaire et neuromusculaire aigüe du baryum, rapportée dans des études de cas, a été attribuée à son effet hypokaliémique (Roza et Berman, 1971; Koch et coll., 2003). En tant qu’antagoniste de canal potassique, le baryum augmente les taux de potassium intracellulaire et diminue les taux de potassium extracellulaire en bloquant la sortie du potassium cellulaire et en augmentant l’activité de la pompe sodium-potassium (ATPase) (Payen et coll., 2011). Il se peut que des concentrations plus élevées de potassium intracellulaire réduisent le potentiel de repos membranaire; cependant, certains signes attestent d’une dépolarisation de la membrane et d’un blocage neuromusculaire induits par le baryum (Phelan et coll., 1984; Thomas et coll., 1998). Par ailleurs, comme le baryum possède des propriétés chimiques semblables à celles du calcium, les deux substances peuvent interagir par des voies biochimiques faisant intervenir des protéines de liaison du calcium et entrer en compétition pour les sites de fixation (IPCS, 1990). Les effets hypertenseurs du baryum chez les rats, signalés par Perry et coll. (1989), peuvent avoir été causés par un apport alimentaire insuffisant en calcium.
10.0 Classement et évaluation
Le Centre international de recherche sur le cancer (CIRC) n’a pas classé le baryum en fonction de sa cancérogénicité. L’U.S. EPA (2005) a conclu qu’il était peu probable que le baryum soit cancérogène pour les humains par absorption orale. D’autres organismes ont conclu qu’il n’était pas démontré que le baryum était cancérogène par voie orale (PISSC, 2001; OMS, 2016). Dans plusieurs études menées sur des animaux, on n’a observé aucune augmentation des tumeurs après une exposition de longue durée au baryum dans l’eau potable à des concentrations pouvant atteindre 2 500 mg/L (60 à 75 mg/kg p. c. par jour chez les rats; 160 à 200 mg/kg p. c. par jour chez les souris) (Schroeder et Mitchener, 1975a, 1975b; McCauley et coll., 1985; NTP, 1994).
Chez la souris, la néphropathie est considérée comme l’effet sur la santé le plus sensible d’une exposition chronique par voie orale aux sels solubles de baryum. Chez l’humain, une insuffisance rénale a été observée après une exposition à de fortes concentrations lors d’intoxications au baryum (voir la section 9.1). L’étude réalisée par le NTP (1994) sur la toxicité chronique chez les souris a été retenue comme étude clé pour la détermination d’une valeur basée sur la santé (VBS) pour le baryum dans l’eau potable pour les raisons suivantes : elle portait sur un nombre suffisant d’animaux (60/sexe/dose); le baryum était administré dans l’eau potable; l’analyse histopathologique a indiqué que les lésions rénales observées étaient morphologiquement différentes des lésions rénales dégénératives spontanées couramment observées chez les souris âgées; la souris semble être la plus sensible des espèces animales évaluées, affichant la plus faible NOAEL pour les effets rénaux (75 mg/kg p. c. par jour). Une relation dose–réponse a par ailleurs été établie; un nombre statistiquement significatif de souris du groupe ayant reçu une forte dose affichaient une néphropathie faible à grave (ainsi qu’une hausse importante de la mortalité en raison des lésions rénales liées au traitement), et dans le deuxième groupe ayant reçu la plus forte dose, une femelle et deux mâles (sur 60 souris) ont présenté une néphropathie liée à des substances chimiques légère à modérée.
De l’hypertension a aussi été constatée chez les animaux et les humains après une exposition au baryum; les données sont toutefois contradictoires. Chez les humains, les données sur la relation dose–réponse ne sont pas suffisantes pour étayer une corrélation entre une exposition chronique au baryum et l’hypertension. Les résultats des études épidémiologiques sont limités soit par la taille réduite des échantillons, la courte durée de l’exposition, une caractérisation insuffisante de l’exposition, un contrôle inadéquat d’importants facteurs de risque d’hypertension ou une combinaison de ces facteurs. Chez les animaux, les résultats sont équivoques; les résultats positifs peuvent être influencés par une diète expérimentale faible en calcium, une carence qui est reconnue comme un facteur de risque possible pour l’hypertension chez les humains. Les données sur les effets hypertenseurs ont été jugées inadéquates aux fins du calcul de la VBS. On a effectué
On a effectué une modélisation de la dose de référence (benchmark dose ou BMD) en utilisant l’incidence de néphropathie chez la souris indiquée dans l’étude de deux ans du NTP (1994), à savoir une incidence accrue de 10 % et de 5 % par rapport aux taux historiques (réponses de référence – BMR). Les données sur les souris mâles et femelles ont été modélisées séparément et combinées, la dose moyenne et les doses propres à chaque sexe donnant des résultats comparables. Parmi les modèles qui offraient une concordance raisonnable (après évaluation de la validité de l’ajustement; valeur p > 0,1; BMD/BMDL [limite inférieure de l’intervalle de confiance de la dose de référence]; rapport < 5 et examen visuel de la courbe), le modèle offrant le meilleur ajustement (critère d’information d’Akaike le plus faible) ainsi que les valeurs BMD/BMDL les plus prudentes était le modèle pluriétagé 3 pour les souris mâles. Une BMR de 5 % a été choisie en raison des facteurs statistiques et biologiques suivants : la conception de l’étude offrait une puissance statistique suffisante (p. ex., 50–100 animaux/dose/sexe); la BMR se situe près de la limite inférieure de la plage de doses avec effet observable; les valeurs BMD et BMDL sont comparables et la valeur seuil pour la santé est restrictive. Comme la limite inférieure de l’intervalle de confiance à 95 % de la dose de référence pour une réponse de 5 % (BMDL5), qui est de 58 mg/kg p. c. par jour, est plus faible pour les souris mâles que les valeurs correspondantes pour les femelles et mâles combinés et les femelles, cette limite a été retenue comme point de départ pour le calcul de la VBS pour le baryum dans l’eau potable.
On dispose de peu de données sur les différences liées à l’âge pour ce qui est de la vulnérabilité au baryum. Bien que les adultes aient présenté des symptômes, les enfants ne semblaient pas être touchés lors de deux incidents d’intoxication alimentaire mettant en jeu du carbonate de baryum carbonate (Lewi et Bar-Khayim, 1964; Deng et coll., 1991); cependant, le fait que les enfants n’ont pas été examinés et l’incertitude liée à leur apport en baryum limitent l’interprétation de ces résultats. Des différences liées à l’âge dans l’absorption du baryum ingéré ont été observées chez les animaux et les humains. Les études réalisées par Taylor et coll. (1962) et Cuddihy et Griffith (1972) indiquent que l’absorption orale de baryum chez les jeunes animaux peut être plus importante d’un ordre de grandeur que chez les animaux plus âgés; par ailleurs, la CIPR (1993) estime l’absorption orale de baryum soluble à 60 % chez les nourrissons, à 30 % chez les enfants de 1 à 15 ans et à 20 % chez les adultes. Avec une absorption accrue du baryum et un remodelage osseux plus rapide chez les nourrissons et les enfants que chez les adultes, le baryum risque davantage de s’accumuler dans les os; la portée de ces conclusions est toutefois inconnue et devrait être étudiée plus en détail.
À l’aide de la BMDL5 indiquée ci-dessus, on a pu calculer comme suit l’apport quotidien tolérable (AQT) :
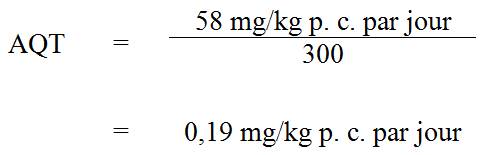
Text equivalent - Équation 1
L’AQT pour le baryum est de 0,19 mg/kg de poids corporel par jour. Cet AQT est obtenu en divisant la BMDL5 de 58 mg/kg poids corporel par jour par le facteur d’incertitude de 300.
où :
- 58 mg/kg p. c. par jour correspond à la limite inférieure de l’intervalle de confiance à 95 % de la dose de référence (BMDL5) pour une incidence accrue de néphropathie chez les souris mâles, comme il est décrit ci-dessus; et
- 300 est le facteur d’incertitude (10 pour la variabilité interspécifique et 10 pour la variation intraspécifique et 3 pour tenir compte des lacunes de la base de données, notamment l’absence d’étude sur la toxicité pour la reproduction sur deux générations).
À l’aide de cet AQT, on peut calculer comme suit la VBS pour le baryum dans l’eau potable pour les effets non cancérigènes :

Text equivalent - Équation 2
La VBS pour le baryum dans l’eau potable est de 2,0 mg/L (arrondie). Cette valeur est calculée en multipliant l’AQT de 0,19 mg/kg de poids corporel par jour par 70 kg, le poids corporel moyen d’un adulte, puis par le facteur d’attribution de 0,2, qui tient compte de la contribution de l’eau potable à l’apport quotidien tolérable, et en divisant le résultat par 1,5 L par jour, l’apport en eau potable pour un adulte.
où :
- 0,19 mg/kg p. c. par jour correspond à l’AQT calculée ci-dessus;
- 70 kg est le poids corporel moyen d’un adulte (Santé Canada, 1994);
- 0,2 est le facteur d’attribution relatif à l’eau potable, puisque les aliments constituent la principale source d’exposition et que l’eau potable représente une source importante mais moindre d’exposition (voir la section 5.0); et
- 1,5 L/jour est l’apport en eau potable pour un adulte.
10.1 Considérations internationales
L’U.S. EPA (1995) a établi un niveau maximal de contaminant de 2 mg/L en se fondant sur la possibilité d’une augmentation de la tension artérielle chez les humains. Dans une évaluation plus récente, l’IRIS de l’U.S. EPA a calculé une dose de référence (RfD) de 200 µg/kg p. c. par jour pour la néphrotoxicité en se fondant sur la limite inférieure de l’intervalle de confiance à 95 % de la dose de référence (BMDL5) de 63 mg/kg p. c. par jour, tirée d’une étude de deux ans sur la souris (U.S. EPA, 2005); à la lumière de cette récente évaluation, l’U.S. EPA a révisé la concentration équivalente pour le baryum dans l’eau potable à 7 mg/L (U.S. EPA, 2012c).
L’OMS (2016) a établi une recommandation pour l’eau potable de 1,3 mg/L pour le baryum en se basant sur le même facteur d’incertitude (300) et la même BMDL5 de 63 mg/kg p. c. par jour que l’U.S. EPA (2005). Un facteur d’attribution de 20 %, un poids corporel chez l’adulte de 60 kg et une consommation d’eau potable de 2 L par jour ont été utilisés aux fins du calcul de la valeur finale de la recommandation.
Le gouvernement australien a fixé une recommandation de 2,0 mg/L pour l’eau potable en se fondant sur la NOAEL de 0,2 mg/kg p. c. par jour établie par Brenniman et Levy (1985) pour la dose sans effet nocif observé sur la tension artérielle et la maladie rénale (NHMRC, 2011).
11.0 Justification
Le baryum est présent dans de nombreuses sources d’eau potable, tant à l’état naturel que du fait de l’activité humaine. Les niveaux de baryum dans l’eau potable canadienne varient considérablement, selon les formations géologiques et les activités anthropiques, dont l’exploration pétrolière et gazière et l’utilisation d’engrais et de pesticides. Le baryum se présente sous la forme d’un mélange de plus de 20 radioisotopes naturels présentant divers niveaux de radioactivité. Le présent document porte essentiellement sur les propriétés chimiques du baryum. Compte tenu de ces propriétés chimiques, l’exposition au baryum contenu dans l’eau potable ne serait préoccupante qu’en cas d’ingestion, et une exposition par inhalation ou par voie cutanée ne poserait pas de risque.
Le CIRC n’a pas classé le baryum en fonction de sa cancérogénicité. L’U.S. EPA a conclu qu’il était peu probable que le baryum soit cancérogène pour les humains par ingestion, et d’autres organismes internationaux ont déterminé que rien n’indiquait que le baryum pouvait causer le cancer par ingestion.
Les reins sont considérés comme la principale cible des effets toxiques du baryum. Chez les humains, une insuffisance rénale a été observée après une exposition à des doses élevées de baryum lors d’intoxications; chez les animaux, les effets rénaux sont considérés comme l’effet sur la santé le plus sensible d’une exposition chronique par voie orale, en particulier chez la souris, l’espèce la plus sensible. Pour ces raisons, on a établi qu’une VBS de 2,0 mg/L permettait de protéger la population générale, compte tenu des effets rénaux observés lors d’une étude sur les souris.
Une CMA de 2,0 mg/L est proposée pour le baryum dans l’eau potable. La CMA proposée offre une protection contre les effets potentiels sur la santé, peut être mesurée de façon fiable au moyen des méthodes analytiques disponibles et peut être atteinte à l’aide des techniques de traitement utilisées à l’échelle municipale et résidentielle. Dans le cadre de ce processus continu d’examen de la recommandation, Santé Canada continuera à suivre les nouvelles recherches menées dans ce domaine et recommandera toutes les modifications jugées nécessaires.
12.0 Références
Aoun, M., Plasari, E., David, R. and Villermaux, J. (1996). Are barium sulfate kinetics sufficiently well known for testing precipitation reactor models? Chem. Eng. Sci., 51(10): 2449–2458.
APHA, AWWA and WEF (1992). Standard methods for the examination of water and wastewater, 18th edition. American Public Health Association, American Water Works Association and Water Environment Federation, Washington, DC.
APHA, AWWA and WEF (1995). Standard methods for the examination of water and wastewater 19th edition. American Public Health Association, American Water Works Association and Water Environment Federation, Washington, DC.
APHA, AWWA and WEF (1998). Standard methods for the examination of water and wastewater 20th edition. American Public Health Association, American Water Works Association and Water Environment Federation, Washington, DC.
APHA, AWWA and WEF (2005). Standard methods for the examination of water and wastewater, 21st edition. American Public Health Association, American Water Works Association and Water Environment Federation, Washington, DC.
APHA, AWWA and WEF (2012). Standard methods for the examination of water and wastewater, 22nd edition. American Public Health Association, American Water Works Association and Water Environment Federation, Washington, DC.
Araissi, M., Ayed, I., Elaloui, E. and Moussaoui, Y. (2016). Removal of barium and strontium from aqueous solution using zeolite 4A. Water Sci. Technol., 73(7): 1628-1636.
Atassi, A., Feizoulof, C., Lecuyer, E., Nebel, J. and Medler, S. (2007). Barium removal using selective ion exchange with calcium chloride regeneration for reducing chloride discharge. Proceedings of the American Water Works Association Water Quality Technology Conference, Toronto, Ontario.
ATSDR (2007). Toxicological profile for barium. Agency for Toxic Substances and Disease Registry, U.S. Department of Health and Human Services, Public Health Service, Atlanta, Georgia.Available at: www.clearwater.asn.au/user-data/resource-files/Aust_drinking_water_guidelines.pdf
Baldi, F., Pepi, M., Burrini, D., Kniewald, G., Scali, D. and Lanciotti, E. (1996). Dissolution of barium from barite in sewage sludges and cultures of desulfovibrio desulfuricans. Appl. Environ. Microbiol., 62(7): 2398-2404.
Bhoelan, B. S., Stevering, C. H., van der Boog, A. T. J. and van der Heyden, M. A. G. (2014). Barium toxicity and the role of the potassium inward rectifier current. Clin. Toxicol., 52(6): 584-593.
Blaurock-Busch, E., Amin, O.R. and Rabah, T. (2011). Heavy metals and trace elements in hair and urine of a sample of arab children with autistic spectrum disorder. Mædica, 6(4): 247-257.
Boerlage, S., Kennedy, M.D., Bremere, I., Witkamp, G.J., Van Der Hoek, J.P. and Schippers, J.C. (2000). Stable barium sulphate supersaturation in reverse osmosis. J. Membr. Sci., 179(1–2): 53-68.
Boffito, C. (1991). Barium. Kirk-Othmer encyclopedia of chemical technology. 4th Edition. John Wiley and Sons., Hoboken, New Jersey, 3: 902-908.
Borzelleca, J.F., Condie, L.W. and Egle, J.L. (1988). Short-term toxicity (one-and ten-day gavage) of barium chloride in male and female rats. Int. J. Toxicol., 7(5): 675-685.
Brenniman, G.R., Namekata, T., Kojola, W.H., Carnow, B.W. and Levy, P.S. (1979). Cardiovascular disease death rates in communities with elevated levels of barium in drinking water. Environ. Res., 20(2): 318-324.
Brenniman, G.R., Kojola, W.H., Levy, P.S., Carnow, B.W. and Namekata, T. (1981). High barium levels in public drinking water and its association with elevated blood pressure. Arch. Environ. Health, 36(1): 28-32.
Breuer, M., Ditrich, K., Habicher, T., Hauer, B., Kesseler, M., Sturmer, R. and Zelinski, T. (2004). Industrial methods for the production of optically active intermediates. Angew. Chem. Int. Ed. Engl., 43(7): 788-824.
British Columbia Ministry of Health (2017). Personal communication from D. Fishwick.
CCME (2013). Canadian soil quality guidelines for barium: Protection of human health. Scientific criteria document PN 1493 ISBN 978-1-896997- 97-1 PDF. Canadian Council of Ministers of the Environment. Available at: www.ccme.ca/files/Resources/supporting_scientific_documents/pn_1493_basqg_scd_prob_1.0.pdf
CDC (2015). Fourth national report on human exposure to environmental chemicals. Updated tables, February. U.S. Department of Health and Human Services. Centers for Disease Control and Prevention, Atlanta, Georgia. Available at: www.cdc.gov/biomonitoring/pdf/FourthReport_UpdatedTables_Feb2015.pdf
Charette, M.A. and Sholkovitz, E.R. (2006). Trace element cycling in a subterranean estuary: Part 2. Geochemistry of the pore water. Geochim. Cosmochim. Acta, 70(4): 811-826.
Chellan, P. and Sadler, P.J. (2015). The elements of life and medicines. Philos. Trans. A Math. Phys. Eng. Sci., 373(2037).
Clifford, D.A. (1999). Ion exchange and inorganic adsorption. Chapter 9 in: Water quality and treatment: a handbook of community water supplies, 5th edition. Letterman, R.D. (ed). American Water Works Association. Denver, Colorado.
Clifford, D., Sorg, T. and Ghurye, G. (2011). Ion exchange and adsorption of inorganic contaminants. Chapter 12 in: Water quality and treatment: A handbook of drinking water. 6th edition. Edzwald, J.K. (ed.). American Water Works Association, Denver, Colorado.
Colbert, D. and McManus, J. (2005). Importance of seasonal variability and coastal processes on estuarine manganese and barium cycling in a Pacific Northwest estuary. Cont. Shelf Res., 25(11): 1395-1414.
CRC (2017). CRC handbook of chemistry and physics. Rumble, J.R.. (ed.). 98th edition. Available at: http://hbcponline.com/faces/contents/ContentsSearch.xhtml
Cuddihy, R.G. and Griffith, W.C. (1972). A biological model describing tissue distribution and whole-body retention of barium and lanthanum in beagle dogs after inhalation and gavage. Health Phys., 23(5): 621-633.
Deng, J.F., Jan, I.S. and Cheng, H.S. (1991). The essential role of a poison center in handling an outbreak of barium carbonate poisoning. Vet. Hum. Toxicol., 33(2): 173-175.
Dibello, P. M., Manganaro, J. L., Aguinaldo, E. R., Mahmood, T. and Lindahl, C. B. (2003). Barium compounds. Kirk-Othmer encyclopedia of chemical technology. Available at: http://onlinelibrary.wiley.com/ doi/10.1002/0471238961.0201180904090205.a01.pub2/pdf
Diengott, D., Rozsa, O., Levy, N. and Muammar, S. (1964). Hypokalaemia in barium poisoning. Lancet, 284(7355): 343-344.
Dietz, D.D., Elwell, M.R., Davis, W.E. and Meirhenry, E.F. (1992). Subchronic toxicity of barium chloride dihydrate administered to rats and mice in the drinking water. Fundam. Appl. Toxicol., 19:527–537.
Downs, J.C.U., Milling, D. and Nichols, C.A. (1995). Suicidal ingestion of barium-sulfide-containing shaving powder. Am. J. Forensic Med. Pathol., 16(1): 56-61.
Dumont, M. (2007). Barite and witherite. Canadian minerals yearbook. Natural Resources Canada, Minerals and Metals Sector. [as cited in CCME, 2013]
ECCC (2016). Science approach document biomonitoring-based approach 2 for barium-containing substances molybdenum-containing substances silver-containing substances thallium-containing substances inorganic tin-containing substances. Environment and Climate Change Canada. Available at: www.ec.gc.ca/ese-ees/default.asp?lang=En&n=D335D89F-1#toc03
ECCC (2017). National long-term water quality monitoring data. Environment and Climate Change Canada. Available at: http://open.canada.ca/data/en/dataset/5133b19b-6a92-44b2-8b12-a49731b56421
Elder, D. and Budd, G.C. (2011). Overview of water treatment processes. Chapter 5 in: Water quality and treatment: a handbook on drinking water. 6th edition. Edzwald, J.K. (ed.). American Water Works Association, Denver, Colorado.
Elwej, A., Ghorbel, I., Marrekchi, R., Boudawara, O., Jamoussi, K., Boudawara, T., Zeghal, N. and Sefi, M. (2016a). Improvement of kidney redox states contributes to the beneficial effects of dietary pomegranate peel against barium chloride-induced nephrotoxicity in adult rats. Arch. Physiol. Biochem., 122(3): 130-140.
Elwej, A., Grojja, Y., Ghorbel, I., Boudawara, O., Jarraya, R., Boudawara, T. and Zeghal, N. (2016b). Barium chloride induces redox status unbalance, upregulates cytokine genes expression and confers hepatotoxicity in rats—alleviation by pomegranate peel. Environ. Sci. Pollut. Res., 23(8): 7559-7571.
Environment Canada (2011). National Air Pollution Surveillance Program. PM Speciation - WICPMS metals data (9 files). Available at: http://maps-cartes.ec.gc.ca/rnspa-naps/data.aspx?lang=en
Environment Canada (2013) National air pollution surveillance (NAPS) monitoring results. Environment Canada. Available at: http://maps-cartes.ec.gc.ca/rnspa-naps/data.aspx?lang=en
Ferrante, M., Conti, G.O., Rasic-Milutinovic, Z. and Jovanovic, D. (2014). Health effects of metals and related substances in drinking water. Ferrante, M., Conti, G.O., Rasic-Milutinovic, Z. and Jovanovic, D. (eds.). EWA Publishing, London, United Kingdom.
Friedman, M.J., Hill, A.S., Reiber, S.H., Valentine, R.L., Larsen, G., Young, A., Korshin, G.V. and Peng, C-Y. (2010). Assessment of inorganics accumulation in drinking water system scales and sediments. Water Research Foundation and United States Environmental Protection Agency, Denver, Colorado.
Gabelich, C.J., Williams, M.D., Rahardianto, A., Franklin, J.C. and Cohen, Y. (2007). High-recovery reverse osmosis desalination using intermediate chemical demineralization. J. Membr. Sci., 301(1–2): 131-141.
Gould, D.B. (1973). Barium sulfide poisoning. Some factors contributing to survival. Arch. Intern. Med., 132(6): 891-894.
Goullé, J.P., Mathieu, L., Castermant, J., Neveu, N., Bonneau, L., Laine, G., Bouige, D. and Lacroix, C. (2005). Metal and metalloid multi-elementary ICP-MS validation in whole blood, plasma, urine and hair. Reference values. Forensic Sci. Int. 153 (1): 39-44.
Groschen, G.E., Arnold, T.L., Morrow, W.S. and Warner, K.L. (2009). Occurrence and distribution of iron, manganese, and selected trace elements in ground water in the glacial aquifer system of the Northern United States. U.S. Geological Survey. Available at: https://pubs.usgs.gov/sir/2009/5006/pdf/SIR2009-5006.pdf
Hamilton, S.M. (2015). Ambient groundwater geochemistry data for southern Ontario, 2007–2014; Ontario Geological Survey, Miscellaneous Release—Data 283–Revised. Available at: www.geologyontario.mndm. gov.on.ca/mndmaccess/mndm_dir.asp?type=pub&id=MRD283-REV
Han, B.H., Han, J.Y., Ahn, H.K. and Nava-Ocampo, A.A. (2010). Conventional barium enema in early pregnancy. J. Obstet. Gynaecol., 30(6): 559-562.
Han, B.H., Lee, K.S., Han, J.Y., Choi, J.S., Ahn, H.K., Ryu, H.M., Yang, J.H., Han, H.W. and Nava-Ocampo, A.A. (2011). Pregnancy outcome after 1st-trimester inadvertent exposure to barium sulphate as a contrast media for upper gastrointestinal tract radiography. J. Obstet. Gynaecol., 31(7): 586-588.
He, C., Gross, M., Westerhoff, P.K., Fox, P. and Li, K. (2011). Comparing conventional and pelletized lime softening concentrate chemical stabilization. Water Research Foundation and City of Phoenix Water Services Department, Denver, Colorado.
Health Canada (1994). Canadian Environmental Protection Act. Human health risk assessment for priority substances. Available at: www.hc-sc.gc.ca/ewh-semt/pubs/contaminants/approach/index-eng.php
Health Canada (2012a). Dietary intakes of contaminants and other chemicals for different age-sex groups of Canadians for Total Diet Study (1993–2007). Bureau of Chemical Safety, Health Products and Food Branch, Health Canada, Ottawa, Ontario. Available at: www.canada.ca/en/health-canada/services/food-nutrition/food-nutrition-surveillance/canadian-total-diet-study.html
Health Canada (2012b). Concentrations (ng/g) of trace elements in total diet study composites (1992–2012). Bureau of Chemical Safety, Health Products and Food Branch, Health Canada, Ottawa, Ontario. Available at: www.canada.ca/en/health-canada/services/food-nutrition/food-nutrition-surveillance/canadian-total-diet-study.html
Health Canada (2016). Personal communication from A. M. Tugulea.
Health Canada (2017). Licensed Natural Health Products Database.Available at: http://webprod.hc-sc.gc.ca/nhpid-bdipsn/search-rechercheReq.do
Heitland, P. and Koster, H.D. (2006). Biomonitoring of 30 trace elements in urine of children and adults by ICP-MS. Clin. Chim. Acta, 365 (1-2): 310-318.
Huxstep, M. and Sorg, T. (1988). Reverse osmosis treatment to remove inorganic contaminants from drinking water. Water Engineering Research Laboratories, Cincinnati, Ohio. (EPA/600/S2-87/109).
ICRP (1980). Limits for intakes of radionuclides by workers. International Commission on Radiation Protection, Oxford, Permagon Press, ICRP Publication 30, Part 2.
ICRP (1993). Age-dependent doses to members of the public from intake of radionuclides - Part 2, Ingestion dose coefficients. International Commission on Radiation Protection, Publication 67, Ann. ICRP, 23 (3–4).
IPCS (1990). Barium. Geneva, World Health Organization, International Programme on Chemical Safety (Environmental Health Criteria 107). Available at: www.inchem.org/documents/ehc/ehc/ehc107.htm
Jha, S.K., Kumar, R. and Verma, B.S. (1993). A case of barium carbonate poisoning. J. Assoc. Physicians India, 41(11): 750-751.
Jourdan, S., Bertoni, M., Sergio, P., Michele, P. and Rossi, M. (2001). Suicidal poisoning with barium chloride. Forensic Sci. Int., 119(2): 263-265.
Kanematsu, N., Hara, M. and Kada, T. (1980). Rec assay and mutagenicity studies on metal compounds. Mutat. Res./Gen. Toxicol., 77(2): 109-116.
Koch, M., Appoloni, O., Haufroid, V., Vincent, J. and Lheureux, P. (2003). Acute barium intoxication and hemodiafiltration. J. Toxicol. Clin. Toxicol., 41(4): 363-367.
Kojola, W.H., Brenniman, G.R. and Carnow, B.W. (1979). A review of environmental characteristics and health effects of barium in public water supplies. Rev. Environ. Health, 3(1): 79-95.
Kopp, S.J., Perry, H.M., Feliksik, J.M., Erlanger, M. and Perry, E.F. (1985). Cardiovascular dysfunction and hypersensitivity to sodium pentobarbital induced by chronic barium chloride ingestion. Toxicol. Appl. Pharmacol., 77(2): 303-314.
Krause, T.L. and Stover, E.L. (1982). Evaluating water treatment techniques for barium removal. J. Am. Water Works Assoc., 74(9): 478-485.
Kravchenko, J., Darrah, T.H., Miller, R.K., Lyerly, H.K. and Vengosh, A. (2014). A review of the health impacts of barium from natural and anthropogenic exposure. Environ. Geochem. Health, 36(4): 797-814.
Krishnan, K. and Carrier, R. (2008). Approaches for evaluating the relevance of multiroute exposures in establishing guideline values for drinking water contaminants. J. Environ. Sci. Health C, 26: 300-316.
Kugler, R.T., Doyle, S. and Kind, M. (2015). Fundamental insights into barium sulfate precipitation by time-resolved in situ synchrotron radiation wide-angle X-ray scattering (WAXS). Chem. Eng. Sci, 133: 140-147.
Legget, R.W. (1992). Fractional absorption of ingested barium in adult humans. Health Phys., 62(6): 556-561.
LeRoy, G.V., Rust, J.H. and Hasterlik, R.J. (1966). The consequences of ingestion by man of real and simulated fallout. Health Phys., 12(4): 449-473.
Lewi, Z., Warsaw, D.M. and Bar-Khayim, Y. (1964). Food-poisoning from barium carbonate. Lancet, 284(7355): 342-343.
Lovins, W., Taylor, J., Kozic, R.M., Abbasedegan, M., LeChevallier, M. and Ajy, K. (1999). Multi-contaminant removal by integrated membrane systems. Proceedings of the American Water Works Association Water Quality and Technology Conference, Denver, Colorado.
Lukasik-Głębocka, M., Sommerfeld, K., Hanć, A., Grzegorowski, A., Barałkiewicz, D., Gaca, M. and Zielińska-Psuja, B. (2014). Barium determination in gastric contents, blood and urine by inductively coupled plasma mass spectrometry in the case of oral barium chloride poisoning. J. Anal. Toxicol., 38(6): 380-382.
Lytle, D.A., Sorg, T., Wang, L. and Chen, A. (2014). The accumulation of radioactive contaminants in drinking water distribution systems. Water Res., 50: 396-407.
Manitoba Conservation and Water Stewardship (2017). Personal communication with J. Muenster and K. Philip.
McCarron, D.A., Morris, C.D., Henry, H.J. and Stanton, J.L. (1984). Blood pressure and nutrient intake in the United States. Science, 224: 1392-1398.
McCauley, P.T. and Washington, I.S. (1983). Barium bioavailability as the chloride, sulfate, or carbonate salt in the rat. Drug Chem. Toxicol., 6(2): 209-217.
McCauley, P.T., Douglas, B.H., Laurie, R.D. and Bull, R.J. (1985). Investigations into the effect of drinking water barium on rats. In: Advances in modern environmental toxicology. Vol. IX. Princeton Publishing Co., Princeton, NJ. (ed.). pp. 197.
McComish, M.F. and Ong, J.H. (1988). Trace metals. Chapter 7 in: Environmental inorganic chemistry. Bodek, I., Lyman, W.J., Reehl, W.F. and Rosenblatt, D.H. (eds.). Pergamon Press, Amsterdam.
McNally, W.D. (1925). Two deaths from the administration of barium salts. J. Am. Med. Assoc., 84(24): 1805-1807.
Menzie, C.A., Southworth, B., Stephenson, G. and Feisthauer, N. (2008). The importance of understanding the chemical form of a metal in the environment: The case of barium sulfate (barite). Hum. Ecol. Risk Assess. 14(5): 974-991.
Miller, R., Featherstone, J., Curzon, M., Mills, T., and Shields, C. (1985). Barium in teeth as indicator of body burden. Adv. Mod. Env., 9: 211.
Ministère du Développement durable, de l’Environnement et de la Lutte contre les changements climatiques (2017). Personal communication from C. Robert and A. Bolduc.
Moore, W.S. (2010). A reevaluation of submarine groundwater discharge along the southeastern coast of North America. Global Biogeochem. Cycles, 24(4): n/a-n/a.
Morton, W. (1945). Poisoning by barium carbonate. Lancet, 246(6380): 738-739.
Murray, J.W. (1975). The interaction of metal ions at the manganese dioxide-solution interface. Geochim. Cosmochim. Acta, 39(4): 505-519.
Myers, A.G., Snoeyink, V.L. and Snyder, D.W. (1985). Removing barium and radium through calcium cation exchange. J. Am. Water Works Assoc., 77(5): 60-66.
New Brunswick Department of Health (2017). Personal communication with K. Gould.
New Zealand Ministry of Health (2013). Survey of selected samples of tattoo inks for the presence of heavy metals. Ministry of Health, Wellington.
Newfoundland and Labrador Department of Environment and Conservation (2017). Personal communication from H. Khan.
NHMRC (2011). Australian drinking water guidelines. National Health and Medical Research Council. Available at: www.nhmrc.gov.au/_files_nhmrc/file/publications/nhmrc_adwg_6_version_3.3_2.pdf
Ning, R.Y., Tarquin, A., Trzcinski, M. and Patwardhan, G. (2006). Recovery optimization of RO concentrate from desert wells. Desalination, 201(1–3): 315-322.
Nishioka, H. (1975). Mutagenic activities of metal compounds in bacteria. Mutat. Res. Envir. Muta., 31(3): 185-189.
NRC (1995). Nutrient requirements of laboratory animals. National Research Council. National Academy Press, Washington, DC, p. 13.
NSF/ANSI (2015). Standard 60: Drinking water treatment chemicals—health effects. NSF International/American National Standards Institute, Ann Arbor, Michigan.
NSF/ANSI (2016a). Standard 44: Residential cation exchange water softeners. NSF International/American National Standards Institute, Ann Arbor, Michigan.
NSF/ANSI (2016b). Standard 58: Reverse osmosis drinking water treatment systems. NSF International/American National Standards Institute, Ann Arbor, Michigan.
NSF/ANSI (2016c). Standard 62: Drinking water distillation systems. NSF International/American National Standards Institute, Ann Arbor, Michigan.
NSF/ANSI (2016d). Standard 61: Drinking water system components—health effects. NSF International/American National Standards Institute, Ann Arbor, Michigan.
NTP (1994). Toxicology and carcinogenesis studies of barium chloride dihydrate (CAS No. 10326-27-9) in: F344/N rats and B6C3F1 mice (Drinking Water Studies). National Toxicology Program, Tech. Rep. Ser., 432: 1-285.
Odell, L. (2010). Treatment technologies for groundwater. American Water Works Association. Denver, Colorado.
Ogen, S., Rosenbluth, S. and Eisenberg, A. (1967). Food poisoning due to barium carbonate in sausage. Isr. J. Med. Sci., 3(4): 565-568.
Ohgami, N., Hori, S., Ohgami, K., Tamura, H., Tsuzuki, T., Ohnuma, S. and Kato, M. (2012). Exposure to low-dose barium by drinking water causes hearing loss in mice. Neurotoxicol., 33(5): 1276-1283.
Ohgami, N., Mitsumatsu, Y., Ahsan, N., Akhand, A.A., Li, X., Iida, M., Yajima, I., Naito, M., Wakai, K., Ohnuma, S. and Kato, M. (2016). Epidemiological analysis of the association between hearing and barium in humans. J. Expos. Sci. Environ. Epidemiol., 26(5): 488-493.
Padilla, M.A., Elobeid, M., Ruden, D.M. and Allison, D.B. (2010). An examination of the association of selected toxic metals with total and central obesity indices: NHANES 99-02. Int. J. Environ. Res. Public Health, 7: 3332-3347.
Parks, J.L. and Edwards, M. (2006). Precipitative removal of As, Ba, B, Cr, Sr and V using sodium carbonate, ASCE J. Environ. Eng., 132(5): 489-496.
Paschal, D.C., Ting, B.G., Morrow, J.C., Pirkle, J.L., Jackson, R.J., Sampson, E.J., Miller, D.T. and Caldwell, K.L. (1998). Trace metals in urine of United States residents: reference range concentrations. Environ. Res., 76 (1): 53-59.
Payen, C., Dellinger, A., Pulce, C., Cirimele, V., Carbonnel, V., Kintz, P. and Descotes, J. (2011). Intoxication by large amounts of barium nitrate overcome by early massive K supplementation and oral administration of magnesium sulphate. Hum. Exp. Toxicol., 30(1): 34-37.
PEI Department of Communities, Land and Environment (2017). Personal communication from G. Somers.
Peng, C., Hill, A.S., Friedman, M.J., Valentine, R.L., Larson, G.S., Romero, A.M.Y., Reiber, S.H. and Korshin, G.V. (2012). Occurrence of trace inorganic contaminants in drinking water distribution systems. J. Am. Water Works Assoc., 104(3): 53-54.
Perry, H.M., Perry, E.F., Erlanger, M.W. and Kopp, S.J. (1985). Barium-induced hypertension. Chapter 20 in: Inorganics in drinking water and cardiovascular disease. Calabrese, E. (ed). Princeton, New Jersey, Princeton Publishing Co., pp. 221–229.
Perry Jr, H.M., Perry, H.M., Kopp, S.J., Kopp, S.J., Perry, E.F., Perry, E.F., Erlanger, M.W. and Erlanger, M.W. (1989). Hypertension and associated cardiovascular abnormalities induced by chronic barium feeding. J. Toxicol. Environ. Health, 28(3): 373-388.
Phelan, D.M., Hagley, S.R. and Guerin, M.D. (1984). Is hypokalaemia the cause of paralysis in barium poisoning? Br. Med. J., 289(6449): 882.
Rahardianto, A., Gao, J., Gabelich, C.J., Williams, M.D. and Cohen, Y. (2007). High recovery membrane desalting of low-salinity brackish water: Integration of accelerated precipitation softening with membrane RO. J. Membr. Sci., 289(1–2): 123-137.
Rai, D., Zahara, J., Schwab, A., Schmidt, R., Girvin, D. and Rogers, J. (1984). Chemical attenuation rates, coefficients and constant in leachate migration. Vol I: A critical review. Pacific Northwest Laboratories, Richland, Washington.
Rasmussen, P.E., Subramanian, K.S. and Jessiman, B.J. (2001). A multi-element profile of housedust in relation to exterior dust and soils in the city of Ottawa, Canada. Sci. Total Environ., 267(1–3): 125-140.
Rasmussen et coll. (2016). Preliminary exposure data for five metals from 2014-2017 CMP(3) research. February 15, 2016. Exposure and Biomonitoring Division, Health Canada, Ottawa, Ontario. Personal communication, unpublished data [as cited in ECCC, 2016].
Rhyee, S.H. and Heard, K. (2009). Acute barium toxicity from ingestion of "snake" fireworks. J. Med. Toxicol., 5(4): 209-213.
Rossman, T.G., Molina, M., Meyer, L., Boone, P., Klein, C.B., Wang, Z., Li, F., Lin, W.C. and Kinney, P.L. (1991). Performance of 133 compounds in the lambda prophage induction endpoint of the Microscreen assay and a comparison with S. typhimurium mutagenicity and rodent carcinogenicity assays. Mutat. Res./Gen. Toxicol., 260(4): 349-367.
Roza, O. and Berman, L.B. (1971). The pathophysiology of barium: hypokalemic and cardiovascular effects. J. Pharmacol. Exp. Ther., 177(2): 433-439.
Saskatchewan Water Security Agency (2017). Personal communication from S. Ferris.
Sato, I., Kudo, H. and Tsuda, S. (2011). Removal efficiency of water purifier and adsorbent for iodine, cesium, strontium, barium and zirconium in drinking water. J. Toxicol. Sci., 36(6): 829-834.
SCC (2015). Directory of accredited product, process and service certification bodies. Standards Council of Canada, Ottawa, Ontario. Available at: www.scc.ca/en/accreditation/product-process-and-service-certification/directory-of-accreditedclients
Schock, M. Hyland, R. and Welch, M. (2008). Occurrence of contaminant accumulation in lead pipe scales from domestic drinking-water distribution systems. Environ. Sci. Technol, 42(12): 4285-4291.
Schroeder, H.A., Tipton, I.H. and Nason, P. (1972). Trace metals in man: strontium and barium. J. Chronic Dis., 25: 491-517.
Schroeder, H.A. and Mitchener, M. (1975a). Life-term studies in rats: effects of aluminum, barium, beryllium, and tungsten. J. Nutr., 105(4): 421-427.
Schroeder, H.A. and Mitchener, M. (1975b). Life-term effects of mercury, methyl mercury, and nine other trace metals on mice. J. Nutr, 105(4): 452-458.
Silva, T.A., Freitas, K.A. and Damasceno, J.J.R. (2003). Experimental evaluation of conical-cylindrical thickeners operating with aqueous barium sulfate suspensions. Mater. Sci. Forum, 416–418(1): 731-736.
Sirover, M.A. and Loeb, L.A. (1976a). Infidelity of DNA synthesis in vitro: screening for potential metal mutagens or carcinogens. Science, 194(4272): 1434-1436.
Sirover, M.A. and Loeb, L.A. (1976b). Metal-induced infidelity during DNA synthesis. Proc. Natl. Acad. Sci. U. S. A., 73(7): 2331-2335.
Snoeyink, V., Jongeward, C., Myers, A. and Richter, S. (1984). Barium and radium in water treatment plant wastes. U. S. Environment Protection Agency. Municipal Environmental Research Laboratory, Cincinatti, Ohio. EPA 600-S2-85-006.
Snoeyink, V.L., Cairns-Chambers, C. and Pfeffer, J.L. (1987a). Strong-acid ion exchange for removing barium, radium, and hardness. J. Am. Water Works Assoc., 79(8): 66-72.
Snoeyink, V., Chambers, C., Schmidt, C., Manner, r., Myers, A., Pfeffer, J., Richter, J., Richter, S. and Snyder, D. (1987b). Removal of barium and radium from groundwater. Water Engineering Research Laboratory, U. S. Environment Protection Agency, Cincinatti, Ohio. EPA 600-M-86-021.
Snyder, D.W., Snoeyink, V.L. and Pfeffer, J.L. (1986). Weak-acid ion exchange for removing barium, radium, and hardness. J. Am. Water Works Assoc., 78(9): 98-104.
Sorg, T.J. and Logsdon, G.S. (1980). Treatment technology to meet the interim primary drinking water regulations for inorganics: Part 5. J. Am. Water Works Assoc., 72(7): 411-422.
Storz, P., Döppler, H. and Toker, A. (2005). Protein kinase d mediates mitochondrion-to-nucleus signaling and detoxification from mitochondrial reactive oxygen species. Mol. Cell. Biol. 25(19): 8520-8530.
Sugiyama, M., Hori, T., Kihara, S. and Matsui, M. (1992). A geochemical study on the specific distribution of barium in Lake Biwa, Japan. Geochim. Cosmochim. Acta, 56(2): 597-605.
Talwar, K.K. and Sharma, B.K. (1979). Myocardial damage due to barium chloride poisoning. Indian Heart J., 31(4): 244-245.
Tang, J. and Johannesson, K.H. (2010). Ligand extraction of rare earth elements from aquifer sediments: implications for rare earth element complexation with organic matter in natural waters. Geochim. Cosmochim. Acta, 74(23): 6690-6705.
Tardiff, R.G., Robinson, M. and Ulmer, N.S. (1980). Subchronic oral toxicity of BaCl2 in rats. J. Environ. Pathol. Toxicol., 4(5–6): 267.
Taylor, D.M., Bligh, P.H. and Duggan, M.H. (1962). The absorption of calcium, strontium, barium and radium from the gastrointestinal tract of the rat. Biochem. J., 83: 25-29.
Taylor, S.R. (1964). Abundance of chemical elements in the continental crust: A new table. Geochim. Cosmochim. Acta, 28: 1273-1285.
Thomas, M., Bowie, D. and Walker, R. (1998). Acute barium intoxication following ingestion of ceramic glaze. Postgrad. Med. J., 74(875): 545-546.
Tipton, I. H., Stewart, P. L. and Dickson, J. (1969). Patterns of elemental excretion in long term balance studies. Health. Phys. 16: 455-462.
Tudorache, A., Marin, C., Badea, I.A. and Vladescu, L. (2010). Barium concentrations and speciation in mineral natural waters of central Romania. Environ. Monit. Assess., 165(1–4): 113-123.
U.S. EPA (1993). Barium metaborate R.E.D. facts. U.S. Environmental Protection Agency. Available at: www3.epa.gov/pesticides/chem_search/reg_actions/reregistration/fs_PC-011101_1-Dec-93.pdf
U.S. EPA. (1994a). Method 200.7 Revision 4.4. Determination of metals and trace elements in water and wastes by inductively coupled plasma-atomic emission spectrometry. Environment Monitoring Systems Laboratories, Office of Research and Development, U.S. Environmental Protection Agency, Cincinnati, Ohio.
US EPA. (1994b). Method 200.8 Revision 5.4. Determination of trace elements in waters and wastes by inductively coupled plasma-mass spectrometry. Environment Monitoring Systems Laboratories, Office of Research and Development, U.S. Environmental Protection Agency, Cincinnati, Ohio.
U.S. EPA (1995). National primary drinking water regulations. Barium. Office of Water, U.S. Environmental Protection Agency. EPA-811-F-95-002b-T. Available at: www.epa.gov/ground-water-and-drinking-water/national-primary-drinking-water-regulations#Inorganic
U.S. EPA. (1998). Small system compliance technology list for the non-microbial contaminants regulated before 1996. Office of Water, U.S. Environmental Protection Agency, Washington, DC. EPA 815-R-98-002.
U.S. EPA. (2003). Method 200.5 Revision 4.2. Determination of trace elements in drinking water by axially viewed inductively coupled plasma - atomic emission spectrometry. National Exposure Research Laboratory, Office of Research and Development, U.S. Environmental Protection Agency, Cincinnati, Ohio. EPA 600-R-06-115.
U.S. EPA (2004). Risk assessment guidance for superfund. Volume I: Human health evaluation manual (Part E, Supplemental guidance for dermal risk assessment). Office of Superfund Remediation and Technology Innovation, U.S. Environmental Protection Agency, Washington, DC. EPA/540/R/99/005 OSWER 9285.7-02EP PB99-963312.
U.S. EPA (2005). Toxicological review of barium and compounds (CAS No. 7440-39-3) In support of summary information on the Integrated Risk Information System (IRIS). U.S. Environmental Protection Agency, Washington, DC. EPA/635/R-05/001.
U.S. EPA. (2009). Analytical feasibility support document for the second six-year review of existing national primary drinking water regulations. Office of Water, U.S. Environmental Protection Agency, Washington, DC. EPA 815-B-09-003.
U.S. EPA. (2012a). Federal Registry Part II. Revisions of the unregulated contaminant monitoring regulation (UCMR 3) for public water systems; final rule. Vol 77, No 85. May 2, 2012. U.S. Environmental Protection Agency, Washington, DC.
U.S. EPA. (2012b). Drinking water treatability database. Office of Research and Development, U.S. Environmental Protection Agency, Washington, DC. Available at: http://iaspub.epa.gov/tdb/pages/general/home.do
U.S. EPA (2012c). 2012 Edition of the drinking water standards and health advisories. Office of Water, U.S. Environmental Protection Agency, Washington, DC. Available at: https://nepis.epa.gov/Exe/ZyPDF.cgi/ P100N01H.PDF?Dockey=P100N01H.PDF
U.S. EPA. (2016). Analytical methods approved for drinking water compliance. Monitoring of inorganic contaminants and other inorganic constituents. Office of Water (MS-4606M), U.S. Environmental Protection Agency, Washington, DC. EPA 815-B-16-014.
Van Leeuwen, M.L.J., Bruinsma, O.S.L. and van Rosmalen, G.M. (1996). Three zone approach for precipitation of barium sulphate. J. Crystal Growth, 166: 1004-1008.
Venugopal, B. and Luckey, T.D. (1978). Metal toxicity in mammals, Volume 2: Chemical toxicity of metals and metalloids. Plenum Press, New York.
Wetherill, S.F., Guarino, M.J. and Cox, R.W. (1981). Acute renal failure associated with barium chloride poisoning. Ann. Intern. Med., 95(2): 187-188.
WHO (1990). Environmental health criteria 107. Barium. World Health Organization, International Program on Chemical Safety. Available at: www.inchem.org/documents/ehc/ehc/ehc107.htm
WHO (2001). Barium and barium compounds. Concise international chemical assessment document, World Health Organization, Geneva, Switzerland.
WHO (2016). Barium in drinking-water. Background document for development of WHO guidelines for drinking-water quality. World Health Organization, Geneva, Switzerland. Available at: www.who.int/water_sanitation_health/ water-quality/guidelines/chemicals/barium-background-jan17.pdf
Willey, B.R. (1987). Finding treatment options for inorganics. Water Eng. Manage., 134(10): 28-31.
Wones, R.G., Stadler, B.L. and Frohman, L.A. (1990). Lack of effect of drinking water barium on cardiovascular risk factors. Environ. Health Perspect., 85: 355-359.
Yesilada, E. (2001). Genotoxicity testing of some metals in the drosophila wing somatic mutation and recombination test. Bull. Environ. Contam. Toxicol., 66(4): 464-469.
Yukon Environmental Health Services (2017). Personal communication with P. Brooks.
Zasoski, R.J. and Burau, R.G. (1988). Sorption and sorptive interaction of cadmium and zinc on hydrous manganese oxide. Soil Sci. Soc. Am. J., 52:81–87.
Annexe A : Liste des acronymes
- ATSDR
- Agency for Toxic Substances and Disease Registry
- BMD
- Dose de référence
- BMDL
- Limite inférieure de l’intervalle de confiance de la dose de référence
- PC
- Poids corporel
- CCME
- Conseil canadien des ministres de l’environnement
- CDC
- Centers for Disease Control
- IC
- Intervalle de confiance
- CSA
- Association canadienne de normalisation
- ECAT
- Étude canadienne sur l’alimentation totale
- LD
- Limite de détection
- ADN
- Acide désoxyribonucléique
- ECG
- Électrocardiogramme
- ED/EDR
- Électrodialyse/électrodialyse inverse
- EPA
- Environmental Protection Agency (É.-U.)
- VBS
- Valeur basée sur la santé
- CIRC
- Centre international de recherche sur le cancer
- CIPR
- Commission internationale de protection radiologique
- PISSC
- Programme international sur la sécurité des substances chimiques
- IX
- Échange d’ions
- DL50
- Dose léthale moyenne
- LOAEL
- Dose minimale avec effet nocif observé
- LDM
- Limite de détection de la méthode
- NF
- Nanofiltration
- NHANES
- National Health and Nutrition Examination Survey
- NOAEL
- Dose sans effet nocif observé
- NRC
- National Research Council
- NSF
- NSF International
- NTP
- National Toxicology Program (É.-U.)
- RC
- Rapport de cotes
- OI
- Osmose inverse
- SAC
- Cation fortement acide
- CCN
- Conseil canadien des normes
- AQT
- Apport quotidien tolérable
- MDT
- Matières dissoutes totales
- WAC
- Cation faiblement acide
- OMS
- Organisation mondiale de la santé