Le cuivre dans l'eau potable : Document technique pour consultation
Table des matières
- Le cuivre dans l'eau potable : Document technique pour consultation publique
- Objet de la consultation
- Partie I : Vue d'ensemble et application
-
Part II. Science et considérations techniques
- 4.0 Propriétés, utilisation et sources dans l'environnement
- 5.0 Exposition
- 6.0 Méthodes d'analyse
- 7.0 Techniques de traitement
- 7.1 Échelle municipale
- 7.2 Facteurs qui influent sur la corrosion uniforme du cuivre
- 7.3 Cas d'eau bleue
- 7.4 Alliages de laiton
- 7.5 Corrosion par piqûres
- 7.6 Effets des changements du traitement ou de la qualité de l'eau sur la libération du cuivre
- 7.7 Atténuation de la libération de cuivre
- 7.8 Effets des ions de cuivre sur la libération du plomb
- 7.9 Échelle résidentielle
- 8.0 Toxicocinétique
- 9.0 Effets sur la santé
- 10.0 Classification et évaluation
- 11.0 Justification
- 12.0 Bibliographie
- Annexe A. Liste des abréviations
- Annexe B. Répercussions provinciales et territoriales prévues

Télécharger le format de rechange
(Format PDF, 725 KB, 92 page)
mars 2018
Objet de la consultation
Le Comité fédéral-provincial-territorial sur l'eau potable (CEP) a évalué l'information disponible sur le cuivre dans le but de mettre à jour la recommandation pour la qualité de l'eau potable ainsi que le document technique sur le cuivre dans l'eau potable. La présente consultation vise à solliciter des commentaires sur la recommandation proposée, la démarche suivie pour l'élaborer et les coûts possibles de sa mise en œuvre, ainsi qu'à déterminer la disponibilité d'autres données d'exposition. La recommandation actuelle pour le cuivre dans l'eau potable, mise à jour en 1992, établit un objectif d'ordre esthétique ≤ 1,0 mg/L pour assurer la palatabilité de l'eau et pour réduire au minimum les taches sur la lessive et les accessoires de plomberie. Le présent document actualisé pro
pose une concentration maximale acceptable (CMA) basée sur la santé de 2 mg/L de cuivre dans l'eau potable. La CMA proposée est considérée comme protectrice aussi bien contre les effets à court terme (c.-à-d. les effets sur le tractus gastro-intestinal [GI]) que contre les effets à long terme (dont les effets potentiels sur le foie et les reins). Le document repose sur les études et approches scientifiques disponibles à ce jour et tient compte du mode d'action. Il renferme des renseignements relatifs à l'exposition au cuivre ainsi que des considérations concernant l'échantillonnage, les méthodes d'analyse et les technologies de traitement du cuivre dans l'eau potable. Le document propose également un objectif d'ordre esthétique (OE) de 1 mg/L, qui tient compte du goût de l'eau et des taches qu'elle peut causer.
Le CEP a demandé que le document technique de la recommandation pour le cuivre dans l'eau potable soit rendu public aux fins de consultation. Les commentaires, avec justification pertinente le cas échéant, sont les bienvenus. Ils peuvent être envoyés au Secrétariat du CEP par courrier électronique (water_eau@hc-sc.gc.ca) ou au besoin par la poste au Secrétariat du CEP, Bureau de la qualité de l'eau et de l'air, Santé Canada, 3e étage, 269, avenue Laurier Ouest, IA 4903D, Ottawa (Ontario) K1A 0K9. Tous les commentaires doivent nous parvenir avant le 25 mai 2018.
Les commentaires reçus dans le cadre de la consultation seront transmis, avec le nom et l'affiliation de leurs auteurs, aux membres concernés du CEP. Les personnes qui ne veulent pas que leur nom et leur affiliation soient communiqués aux membres du CEP doivent joindre à leurs commentaires une déclaration à cet égard.
Il est à noter que le présent document technique sur le cuivre dans l'eau potable sera révisé après l'analyse des commentaires reçus et qu'une recommandation pour l'eau potable sera établie s'il y a lieu. Ce document devrait donc être considéré strictement comme une ébauche pour commentaires.
Partie I : Vue d'ensemble et application
1.0 Recommandation proposée
Une concentration maximale acceptable (CMA) de 2 mg/L (2000 µg/L) est proposée pour le cuivre total dans l'eau potable d'après un échantillon d'eau pris au robinet. Un objectif d'ordre esthétique (OE) de 1 mg/L (1 000 µg/L) est également proposé pour le cuivre total dans l'eau potable.
2.0 Sommaire
La présence de cuivre dans l'eau du robinet est surtout attribuable au relargage des composants des réseaux de distribution et des systèmes de plomberie qui renferment du cuivre. Le cuivre a été, et continue d'être, largement utilisé dans des applications liées à l'eau potable, notamment dans les tuyaux de plomberie résidentielle et les raccords.
Ce document technique passe en revue et évalue tous les risques connus pour la santé qui sont associés à la présence de cuivre dans l'eau potable. Il tient compte des nouvelles études et approches, ainsi que de la disponibilité de techniques de traitement appropriées afin de proposer une CMA qui est protectrice de la santé humaine, qui est mesurable et qui est atteignable grâce aux techniques de traitement aussi bien municipales que résidentielles. D'après cet examen, la recommandation proposée pour le cuivre dans l'eau potable comprend une CMA de 2 mg/L (2 000 µg/L) et un OE de 1 mg/L (1 000 µg/L).
À sa réunion de l'automne 2016, le Comité fédéral-provincial-territorial sur l'eau potable a examiné le document technique sur le cuivre dans l'eau potable et en a autorisé la diffusion à des fins de consultation publique.
2.1 Effets sur la santé
Le cuivre est un élément essentiel pour les humains. Une carence en cuivre peut provoquer plusieurs effets sur la santé, mais elle ne devrait pas constituer un problème au Canada, en raison de l'apport en cuivre provenant des aliments. La National Academy of Medicine des États-Unis (auparavant appelée Institute of Medicine) a établi un apport quotidien recommandé de 900 µg/jour pour les adultes et de 340 à 890 µg/jour pour les enfants, et un apport maximal tolérable de 10 000 µg/jour pour les adultes et entre 1 000 et 8 000 µg/jour pour les enfants.
Les organismes internationaux ont déterminé que les données disponibles sur le cuivre ne sont pas suffisantes pour classer cette substance selon le risque de cancérogénicité. L'exposition au cuivre à court terme peut provoquer des effets sur le tractus gastro-intestinal (nausées, douleur et vomissements, diarrhée. Les effets à long terme sont moins bien documentés; les données probantes actuelles indiquent que, dans la population générale, une exposition prolongée à de très grandes concentrations de cuivre peut provoquer des effets sur le foie et les reins. La CMA proposée a été établie en fonction des bébés nourris au biberon (âgés de 0 à 6 mois), et elle est considérée comme suffisante pour protéger la population contre tous les effets possibles du cuivre sur la santé, qu'ils soient à court ou à long terme.
2.2 Considérations esthétiques
La présence de cuivre dans l'eau peut altérer le goût de celle-ci et tacher la lessive et les accessoires de plomberie, même lorsque les concentrations sont inférieures à la CMA proposée. Bien que ces concentrations ne soient associées à aucun effet nocif, elles peuvent avoir une influence sur l'acceptabilité de l'eau par les consommateurs. L'OE pour le cuivre dans l'eau potable est de 1 mg/L (1 000 µg/L), mais certaines personnes peuvent percevoir facilement le cuivre à des concentrations inférieures. Cela dit, les mesures de contrôle de la corrosion doivent cibler la CMA et non l'élimination des problèmes d'ordre esthétique, car la poursuite de l'OE pourrait nuire à d'autres priorités relatives à la qualité de l'eau, comme la limitation du plomb. Les services publics peuvent choisir d'utiliser l'OE pour ouvrir une enquête sur la qualité de l'eau ou sur la corrosion d'un emplacement en particulier.
2.3 Exposition
Le cuivre est présent naturellement dans la croûte terrestre, sous forme de gisement minéral ou, moins fréquemment, sous forme de métal. Il peut entrer dans les sources d'eau par des processus naturels, comme le vieillissement climatique des sols, ou par l'activité humaine, comme l'agriculture, l'exploitation minière et la fabrication. Le Code national de la plomberie du Canada considère le cuivre comme une matière acceptable pour les entrées de service et les installations de plomberie. Par conséquent, le cuivre dans l'eau potable peut aussi provenir de la corrosion des tuyaux et des raccords dans les réseaux de distribution et les installations de plomberie qui renferment du cuivre, si la composition chimique de l'eau y est favorable.
La population canadienne peut être exposée au cuivre par l'alimentation, l'eau potable, l'air, le sol et les produits de consommation. Bien que l'apport en cuivre de la population générale provienne principalement de l'alimentation, la biodisponibilité du cuivre dans l'eau potable peut être supérieure à celle des aliments. En raison des propriétés physiques et chimiques du cuivre, l'exposition au cuivre dans l'eau potable par inhalation et par absorption cutanée n'est pas anticipée.
2.4 Analyse et traitement
Pour établir une recommandation sur la qualité de l'eau potable, il faut tenir compte de la capacité de mesurer le contaminant. Il existe plusieurs méthodes d'analyse du cuivre total dans l'eau potable. Selon la capacité des laboratoires commerciaux au Canada, on dispose de méthodes d'analyse permettant de mesurer de manière fiable le taux de cuivre total dans l'eau potable à des concentrations inférieures à la CMA proposée. Les méthodes doivent inclure la préparation des échantillons afin d'assurer la détection du cuivre dissous et du cuivre particulaire.
La concentration de cuivre dans la source d'approvisionnement en eau est typiquement très faible. Bien qu'il existe des techniques de traitement capables d'éliminer efficacement le cuivre à l'usine de traitement, le traitement par les municipalités ne constitue généralement pas une stratégie efficace, car le cuivre est considéré comme une matière acceptable pour les entrées de service et les installations de plomberie. Toutefois, le cuivre peut être libéré dans l'eau potable à cause de la corrosion des tuyaux, des entrées de service et des raccords en laiton en présence de certaines qualités d'eau. La méthode de traitement pour le cuivre consiste généralement à lutter contre la corrosion, notamment en ajustant la qualité de l'eau et en employant des inhibiteurs de corrosion.
Comme la présence de cuivre dans l'eau potable est principalement attribuable au relargage des composants des réseaux de distribution et des installations de plomberie, les dispositifs de traitement de l'eau potable s'avèrent une option efficace à l'échelle résidentielle, même si leur utilisation ne doit pas être considérée comme une solution permanente. Il existe de nombreux dispositifs de traitement à usage résidentiel certifiés capables de faire passer la concentration du cuivre dans l'eau potable sous la CMA proposée.
3.0 Application de la recommandation
Remarque : Des conseils spécifiques concernant l'application des recommandations pour l'eau potable devraient être obtenus auprès de l'autorité appropriée en matière d'eau potable dans le secteur de compétence concerné.
La CMA proposée pour le cuivre est établie de manière à protéger la santé des bébés nourris au biberon et celle de la population générale contre les effets sur le tractus gastrointestinal à court terme et contre les effets à long terme. Étant donné que les concentrations de cuivre au robinet du consommateur peuvent être considérablement plus élevées que celles qui sont observées à l'usine de traitement ou dans le réseau de distribution, les stratégies visant à réduire l'exposition au cuivre devront être axées sur le contrôle de la corrosion dans les réseaux de distribution et les installations de plomberie. Les facteurs de qualité de l'eau qui ont le plus d'effets sur la corrosion du cuivre sont le pH et l'alcalinité. Il est également important de tenir compte de l'oxygène dissous et du chlore résiduel et autres oxydants. La surveillance du cuivre doit surtout être assurée là où il existe ou pourrait exister des installations de plomberie neuves en cuivre et où les conditions de qualité de l'eau sont potentiellement corrosives (c.-à-d. pH bas, culs-de-sac, alcalinité faible ou élevée), et dans les installations consécutives.
Le dépassement de la CMA proposée doit faire l'objet d'une enquête, puis de la prise de mesures correctives appropriées afin de faire passer la concentration de cuivre sous la CMA. Les mesures correctives englobent notamment une nouvelle analyse des échantillons, l'éducation du public et la prise de mesures de contrôle de la corrosion. Toutefois, elles doivent être fondées sur une évaluation de la cause du dépassement de la CMA au moyen de protocoles adéquats, comme ceux qui figurent dans le Document de conseils sur le contrôle de la corrosion dans les réseaux de distribution d'eau potable.
3.1 Surveillance
Les protocoles d'échantillonnage varient en fonction de l'objectif souhaité (c.-à-d. identification des sources de cuivre, contrôle de la corrosion, évaluation de la conformité, estimation de l'exposition au cuivre, etc.). Comme la surveillance du cuivre au robinet peut se faire au moyen de différents protocoles d'échantillonnage, il importe de choisir ce dernier en fonction de l'objectif à atteindre. Bien qu'il soit possible de réaliser l'analyse des métaux à partir d'un même flacon d'échantillon, il est à noter que les sites de prélèvement pour le cuivre et pour le plomb diffèrent. Ainsi, il est improbable que les résultats de l'analyse du cuivre dans les échantillons provenant de sites de prélèvement du plomb permettent de bien déterminer les endroits où la concentration de cuivre pose problème.
L'objectif des protocoles d'échantillonnage de ce document est de surveiller l'exposition typique de la population au cuivre total, pour déterminer si des effets sur la santé humaine suscitent des préoccupations. Une surveillance de la conformité doit être effectuée au robinet du consommateur dans les endroits qui disposent ou sont susceptibles de disposer d'installations neuves de plomberie en cuivre et doit inclure les endroits ou les zones (aires géographiques au sein desquelles la qualité de l'eau potable est considérée comme approximativement uniforme) qui sont approvisionnés en eau potentiellement corrosive (p. ex. pH bas, alcalinité basse ou élevée). Plus spécifiquement, la priorité doit être accordée aux endroits qui disposent d'installations neuves de plomberie en cuivre et à ceux qui sont approvisionnés en eau dont le pH est inférieur à 7 (avec ou sans procédé de désinfection ou d'oxydation) et dont l'alcalinité est inférieure à 25 mg CaCO3/L, ou dont le pH est supérieur à 7 et dont l'alcalinité est supérieure à 200 mg CaCO3/L (avec procédé de désinfection et d'oxydation), quel que soit l'âge des tuyaux en cuivre.
L'ajout d'inhibiteurs de corrosion peut prévenir la formation d'incrustations stables de malachite ou déloger les oxyanions sorbés (p. ex. cuivre) de la tuyauterie des réseaux de distribution. La présence de cuivre est également à surveiller dans les systèmes d'eau qui emploient un traitement de contrôle de la corrosion à l'orthophosphate dont le PO4 résiduel est inférieur à 3,3 mg PO4/L. Elle est à surveiller en priorité dans l'eau distribuée aux garderies, pour que la population la plus vulnérable (c.-à-d. les nourrissons) soit prise en compte. L'échantillonnage doit être effectué au moins une fois par an, le nombre d'emplacements à surveiller étant déterminé en fonction de la taille du système d'eau potable et du type de bâtiment. La fréquence d'échantillonnage peut être réduite si aucun test n'a échoué pendant une période déterminée par l'organisme de réglementation compétent ou si les conditions de qualité de l'eau ne favorisent pas la corrosion du cuivre.
Partie II : Science et considérations techniques
4.0 Propriétés, utilisation et sources dans l'environnement
4.1 Propriétés physiques et chimiques
Le cuivre (Cu, numéro de registre du Chemical Abstracts Service : 7440-50-8) est un élément de transition qui se trouve naturellement en quatre états d'oxydation : cuivre métallique élémentaire (Cu(0) ou Cu0), ion (monovalent) cuivreux (Cu(I) ou Cu+), ion (bivalent) cuivrique(Cu(II) ou Cu2+) et, plus rarement, ion cuivre trivalent (Cu(III) ou Cu3+). Le cuivre possède deux isotopes stables (63Cu et 65Cu) et 27 isotopes moins stables (Turnlund et coll., 1998; Riedel, 2008; EFSA, 2015). Le cuivre métallique possède une couleur brun-rouge, une masse atomique de 63,55 Da, une densité de 8,92 g/cm3 et un point d'ébullition de 2 350 °C (Georgopoulos et coll., 2001; Kiaune et Singhasemanon, 2011; Ellingsen et coll., 2015). Dans ce document, « cuivre total » renvoie à tous les principaux états d'oxydation. Employé seul, le mot « cuivre » renvoie aux ions Cu(I) et Cu(II), qui alternent d'état (voir la section 9.1), sont solubles et biodisponibles et sont considérés comme les plus pertinents d'un point de vue toxicologique (voir les sections 4.3, 8 et 9.3). Dans les autres cas, le nom de la forme particulière est employé.
4.2 Sources et utilisations
D'une concentration moyenne de 50 ppm dans la croûte terrestre, le cuivre est présent dans plusieurs gisements minéraux primaires, principalement comme minerais sulfurés (les plus abondants étant la chalcopyrite et la chalcocite) et moins souvent comme métal (CCME, 1999; Mauceri et Mishra, 2014). En général, le vieillissement climatique de ces gisements minéraux primaires libère des formes secondaires de cuivre, dont les minerais de carbonate de cuivre (p. ex. malachite et azurite) et les minerais d'oxyde de cuivre (p. ex. cuprite) (CCME, 1999; ATSDR, 2004; Ellingsen et coll., 2007; Riedel, 2008; Mauceri et Mishra, 2014). De plus, l'activité humaine — comme l'exploitation minière, la gestion des déchets industriels et municipaux, l'agriculture (p. ex. les pesticides) et le traitement de l'eau (p. ex. présence de sulfate de cuivre pentahydraté dans les algicides) — peut générer des accumulations localisées de cuivre et augmenter la concentration de cuivre dans un voisinage (ATSDR, 2004; Mauceri et Mishra, 2014). Ainsi, le cuivre peut entrer dans les sources d'eau par des processus naturels (p. ex. vieillissement climatique des sols), par l'activité humaine (p. ex. lessivage des terres cultivées) ou par la corrosion des tuyaux et des raccords des réseaux de distribution d'eau; la corrosion dépend de la composition chimique de l'eau (p. ex. pH bas, haute température, dureté réduite) (OMS, 1998; NRC, 2000; Ellingsen et coll., 2007).
Au Canada, l'industrie minière a produit 580 082, 652 595 et 695 513 tonnes de cuivre total respectivement en 2012, 2013 et 2014 (British Geological Survey, 2016). Grâce à sa malléabilité, sa conductivité, sa possibilité d'alliage et sa résistance à la corrosion et à l'usure, le cuivre métallique est utilisé dans de nombreux produits, comme les tuyaux, les pigments de peinture, les agents antisalissures et les huiles produites en raffinerie, de même que dans les matériaux de construction, comme les composants électroniques clignotants, les tubes, les feuilles et les paratonnerres (ATSDR, 2004; OMS, 2011; Stewart et coll., 2012; Gaetke et coll., 2014; Ellingsen et coll., 2015). Comme composant du bronze et du laiton, il est utilisé, entre autres, dans les équipements nautiques, les ustensiles de cuisine et les pièces de monnaie. Les nanoparticules de cuivre sont de plus en plus utilisées, par exemple dans les produits antimicrobiens comme les dispositifs biomédicaux et chirurgicaux (Ingle et coll., 2014) et dans les nanofils de cuivre (Yang et coll., 2014). De plus, le cuivre total est utilisé dans l'industrie de la santé comme composant des contraceptifs oraux, des dispositifs intra-utérins (DIU), des amalgames dentaires, des agents antimicrobiens/antibactériens et des compléments de vitamines et minéraux, ainsi que par l'industrie alimentaire comme colorant (Barceloux, 1999; Grass et coll., 2011; Park et coll., 2012; Stewart et coll., 2012; Shaligram et Campbell, 2013). Enfin, le cuivre est utilisé comme ingrédient actif dans les pesticides (fongicides, algicides et antimicrobiens). Au Canada, il existe actuellement neuf composés de cuivre (p. ex. oxyde cuivreux, sulfate de cuivre, carbonate de cuivre) homologués comme pesticides, pour usage en combinaison avec d'autres ingrédients actifs (Santé Canada, 2009a).
La présence de cuivre dans l'eau du robinet est surtout attribuable à la dissolution ou au relargage (c.-à-d. corrosion) provenant des composants des réseaux de distribution et des installations de plomberie qui renferment du cuivre, plus particulièrement en raison de l'utilisation intensive des tuyaux en cuivre dans les installations de plomberie domestiques. De plus, les raccords ou les entrées de service domestiques et les raccords en laiton peuvent également être une source de cuivre (Schock et Neff, 1988; Kimbrough, 2001, 2007, 2009). Le relargage du cuivre varie en fonction du type d'alliage utilisé et des procédés de fabrication et de production (Lytle et Schock, 1996, 2000; Oliphant et Schock, 1996; Dudi et coll., 2005). Plusieurs facteurs peuvent avoir des effets sur la corrosion du cuivre, notamment l'âge des tuyaux et les caractéristiques de la qualité de l'eau dans les installations. Ces facteurs sont abordés plus en détail à la section 7.2.
La libération de cuivre peut colorer l'eau en bleu, ce qui peut alors tacher les accessoires de salle de bain et les cheveux en raison de la présence de cuivre particulaire. La cause de la corrosion du cuivre particulaire est plus difficile à déterminer, mais on suppose que ce type de corrosion est principalement causé par des facteurs microbiologiques, chimiques ou physiques, ou par une combinaison de facteurs qui provoquent également une corrosion par piqûres, une défaillance des tuyaux ou les deux (Edwards et coll. 2000; Bremer et coll. 2001; Arnold et coll., 2012). Les défaillances les plus importantes qui se produisent dans les installations de plomberie domestiques à cause de la corrosion interne sont les piqûres de corrosion du cuivre et les fuites microscopiques. La corrosion par piqûres est une cause encore mal comprise de libération du cuivre qui peut gravement endommager les installations de plomberie en cuivre, entraînant des fuites qui peuvent à leur tour provoquer des dommages considérables aux résidences et mener à la formation de moisissures (Scardina et coll., 2008). La corrosion par piqûres se produit parfois assez rapidement (quelques mois à quelques années) après l'installation d'un réseau d'eau froide alors qu'elle prend généralement des années (typiquement plus de huit ans) à perforer les parois des tuyaux des réseaux d'eau chaude (Ferguson et coll., 1996).
4.3 Devenir dans l'environnement
Dans la nature, le cuivre métallique et le Cu(I) sont instables. Le Cu(II) est plus stable. Il s'agit d'ailleurs de l'espèce de cuivre la plus abondante et la plus fréquemment trouvée dans la nature, notamment dans les systèmes aquatiques et biologiques (Georgopoulos et coll., 2001; Ellingsen et coll., 2007; Riedel, 2008; Shike, 2009; Kiaune et Singhasemanon, 2011; Omur-Ozbek et Dietrich, 2011; Gaetke et coll., 2014; Ellingsen et coll., 2015). Par conséquent, l'oxydation de surface produit en général de l'oxyde ou de l'hydroxyde de cuivre(I); mais, en raison de son instabilité, le Cu(I) est fréquemment oxydé en Cu(II) (OMS, 2004). Le Cu(II) est sujet aux réactions d'oxydoréduction et tend à s'hydrater. Le Cu(II) hydraté est rarement présent sous sa forme libre et s'adsorbe généralement sur des matières particulaires ou sur divers composés dissous (organiques et inorganiques) comme les oxydes de métaux hydratés (p. ex. ceux du fer, de l'aluminium et du manganèse), les anions organiques polyvalents et les acides humiques (OMS, 1996, 2004; IPCS, 1998).
Dans l'air, le cuivre est principalement retiré de l'atmosphère par les dépôts humides (pluie et neige), puis par les dépôts par gravité et par les dépôts secs (Kieber et coll., 2004; OMS, 2004). Dans le sol, le cuivre s'adsorbe fortement sur des particules, en plus d'avoir une faible mobilité, avec une rétention maximale à un pH neutre (Santé Canada, 2009a). Le cuivre appliqué persiste habituellement dans la terre végétale, s'accumulant dans les couches supérieures (≈15 cm) (CCME, 1999; Kiaune et Singhasemanon, 2011). Son devenir et sa disponibilité dans les sols dépendent de nombreuses caractéristiques : type de sols (mobilité plus grande dans les sables que les argiles), pH (une acidité et une capacité élevée de réduction favorisent la libération des complexes d'oxydes), pouvoir d'échange cationique, teneur en eau, teneur en matières organiques et inorganiques, potentiel d'oxydoréduction (Eh), et présence d'oxydes (p. ex. oxyde de fer, de manganèse, d'aluminium) et d'argile (IPCS, 1998; Kiaune et Singhasemanon, 2011). De plus, le cuivre n'est pas bioaccumulable, ne s'hydrolyse pas et ne se fragmente pas dans les sols (Santé Canada, 2009a).
Dans l'eau, la spéciation du cuivre est complexe et elle est le jeu de nombreux facteurs comme la source d'eau (p. ex. le Cu(II) est moins biodisponible dans l'eau dure que dans l'eau douce), la composition chimique de l'eau (alcalinité, force ionique, oxygène dissout, pH et Eh), l'interaction sédiments-argiles humides (tributaire du pH), ainsi que la présence de ligands complexants (organiques et inorganiques), de matières particulaires en suspension ainsi que de carbone (OMS, 2004; Cuppett et coll., 2006; Kiaune et Singhasemanon, 2011). La formation de complexes de Cu(I) et de Cu(II) peut altérer la solubilité, la couleur et le goût de l'eau. En effet, lorsque dissous, le Cu(I) est incolore, alors que la plupart des composés de Cu(II) donnent une couleur bleu-vert pâle et un goût métallique et amer à l'eau potable (Georgopoulos et coll., 2001; Cuppett et coll., 2006; Omur-Ozbek et Dietrich, 2011). Dans l'eau brute, le cuivre est surtout présent sous forme de complexe de Cu(II) et, dans une moindre mesure, de particules de Cu(II) précipitées (matières particulaires de Cu(II)), qui ont des valeurs de pH et des potentiels d'oxydoréduction typiques (Lide, 1993). Les ligands primaires complexant le cuivre sont des molécules dissoutes comme les espèces organiques (p. ex. matière ou carbone organique dissous) et inorganiques. D'une part, les complexes organiques de cuivre et les composés de matières particulaires et de cuivre précipitent le plus souvent, les rendant non biodisponibles (Kiaune et Singhasemanon, 2011). D'autre part, les ligands inorganiques forment communément des complexes de cuivre(I) et de cuivre(II) et des complexes hydroxo-cuivre ubiquitaires; ces derniers, toutefois, précipitent généralement en hydroxyde de cuivre (normalement à un pH de 6,5 à 12) (Cuppett et coll., 2006). Ainsi, la dissolution d'une plus grande partie des complexes de cuivre restants et la stabilité relative du Cu(II) comparativement au Cu(I) font du Cu(II) libre l'espèce prévalente dans l'eau potable (Cuppett et coll., 2006; Kiaune et Singhasemanon, 2011; Omur-Ozbek et Dietrich, 2011). C'est pourquoi ce document est principalement axé sur le cuivre dissous.
4.4 Caractéristiques d'ordre esthétique
Le cuivre dans l'eau peut être détecté par le goût ou par une inspection visuelle (par la coloration). Le seuil de perception du goût du cuivre varie de 0,0035 à > 5 mg/L (Zacarias et coll., 2001; Omur-Ozbek et Dietrich, 2011) et de 0,4 à 0,8 mg/L (Cuppett et coll., 2006); les valeurs seuils signalées varient grandement en raison des diverses méthodes d'essai sensoriel employées, des concentrations de métaux mises à l'essai, du type d'eau utilisé et du type d'analyse des données réalisée. Les propriétés d'ordre esthétique du cuivre sont altérées par la solubilité, car le goût du cuivre soluble est plus facile à déceler que celui du cuivre particulaire (Cuppett et coll., 2006). Cependant, il n'y a pas de différence entre le Cu(I) et le Cu(II) sur le plan de la détectabilité. Les deux ions donnent un goût légèrement amer et salé à l'eau et procurent une sensation astringente en bouche (Omur-Ozbek et Dietrich, 2011). Omur-Ozbek et Dietrich (2011) estiment que 79 % de la population sont capables de déceler le goût du cuivre à une concentration de 2 mg/L, alors que 72 % en sont capables à une concentration de 1 mg/L. La détection visuelle du cuivre dans l'eau dépend du passage de la lumière dans l'eau, des particules déposées et de la concentration de cuivre dans l'eau (Edwards et coll., 2000). Par exemple, le cuivre peut être visible à une concentration de 0,3 mg/L dans une baignoire blanche à une distance d'environ 460 mm (18 po) (distance d'observation typique), mais une concentration de 3 mg/L est nécessaire pour remarquer la présence de cuivre particulaire dans un verre d'eau.
5.0 Exposition
Les Canadiens peuvent être exposés au cuivre total par l'alimentation, l'eau potable, l'air, le sol et les produits de consommation. Pour la population générale, les aliments sont la principale source d'exposition (plus de 90 % de l'apport alimentaire), suivie de l'eau potable (moins de 10 % de l'apport alimentaire) et des suppléments contenant du cuivre (OMS, 2004; Sadhra et coll., 2007; Cockell et coll., 2008; de Romana et coll., 2011; Shaligram et Campbell, 2013; Mauceri et Mishra, 2014; EFSA, 2015). Toutefois, l'eau potable peut être une source importante d'exposition si elle est distribuée par des tuyaux corrodés, particulièrement pour les bébés nourris à l'aide de préparations pour nourrissons (enrichies, qui ne sont pas à base de soya) reconstituées à l'aide d'eau provenant d'une telle source (Cockell et coll., 2008; Chambers et coll., 2010). La spéciation du cuivre dans l'eau diffère de celle dans les aliments (NRC, 2000), ce qui peut influer sur sa solubilité et sa biodisponibilité. En fait, dans les aliments, le cuivre se lie par covalence aux macromolécules (IOM, 2001; OEHHA, 2008; Ceko et coll., 2014). En revanche, le cuivre est présent dans l'eau potable sous sa forme libre ou sous forme de complexes avec des ligands. Ainsi, le cuivre dans l'eau potable peut atteindre plus rapidement les vaisseaux sanguins, en évitant la synthèse par le foie. Par conséquent, la biodisponibilité du cuivre dans l'eau potable ingérée à jeun est plus grande que celle du cuivre dans les aliments (OEHHA, 2008; Mauceri et Mishra, 2014; Ellingsen et coll., 2015).
5.1 Aliments
L'Étude canadienne sur l'alimentation totale (ECAT), réalisée par Santé Canada, permet de mesurer les concentrations de diverses substances chimiques dans les aliments et d'utiliser ces données pour estimer l'apport alimentaire de divers groupes d'âge-sexe de la population canadienne (Santé Canada, 2009b). Selon l'ECAT, l'apport alimentaire moyen en cuivre de la population canadienne, pour tous les groupes d'âge, a été mesuré entre 1993 et 2007 dans sept villes du pays (Montréal, Ottawa, St John's, Vancouver, Winnipeg, Toronto et Halifax). Voici les estimations de l'apport alimentaire en µg/kg de poids corporel (p.c.) par jour : 40 à 91 pour les 0 à 6 mois, 36 à 57 pour les 6 mois à 4 ans, 36 à 48 pour les 5 à 11 ans, 19 à 35 pour les 12 à 19 ans et 13 à 32 pour ceux ayant atteint ou dépassé 20 ans. Selon l'apport en cuivre des hommes et des femmes d'un âge égal ou supérieur à 20 ans, on estime que l'exposition au cuivre par voie alimentaire d'un adulte canadien pesant 70 kg est de 910 à 2 240 µg/jour.
Selon les données obtenues dans le cadre de l'ECAT menée entre 1993 et 2007, au Canada, les concentrations en cuivre dans les produits alimentaires les plus courants varient, les concentrations les plus élevées se trouvant dans les abats rouges, comme le foie et les reins. Les plus faibles concentrations de cuivre se trouvent dans le lait (25 à 70 µg/kg), alors que les préparations de lait pour nourrissons présentent des concentrations de 650 à 850 µg/L et que le lait maternel en présente entre 200 et 300 µg/L (Lonnerdal, 1998; Bauerly et coll., 2005). L'Organisation mondiale de la santé (OMS) et l'Organisation des Nations Unies pour l'alimentation et l'agriculture (FAO) ont recommandé un minimum de 35 µg de Cu/100 kcal dans les préparations (liquides ou en poudre) destinées à la vente afin de satisfaire aux exigences nutritionnelles normales des nourrissons. Elles reconnaissent aussi qu'une modification des limites peut être nécessaire dans les régions où la teneur en cuivre est élevée (FAO et OMS, 2011).
Bien que la concentration en cuivre du lait maternel soit inférieure à celle des préparations, ce cuivre est hautement biodisponible (Lonnerdal, 1996, 1998; Bauerly et coll., 2005). En revanche, les phytates (chélateurs du zinc et du cuivre présents en grandes concentrations dans les préparations pour nourrissons à base de soya) et les protéines de soya dans les préparations pour nourrissons réduisent la biodisponibilité du cuivre (Gibson, 1994; NRC, 2000; IOM, 2001; OMS, 2004; EFSA, 2006, 2009; Stern et coll., 2007; OEHHA, 2008; Collins et Klevay, 2011).
5.2 Eau
L'exposition au cuivre dans l'eau potable ne peut être évaluée correctement qu'en surveillant les concentrations de cuivre au robinet. En effet, la présence de cuivre dans l'eau du robinet est surtout attribuable à la dissolution (corrosion) provenant des composants des réseaux de distribution et des installations de plomberie domestique qui contiennent du cuivre. Toutefois, la concentration de cuivre est moins variable que celle du plomb, tant dans un réseau que dans un même site (Kirmeyer et coll., 1994; Schock et coll., 1995), ce qui rend l'évaluation de l'exposition au cuivre dans l'eau potable nettement moins difficile que pour le plomb. La surveillance du cuivre au robinet peut se faire au moyen de divers protocoles d'échantillonnage; le choix du protocole se fait en fonction de l'objectif fixé, par exemple, repérer les sources de cuivre, contrôler la corrosion ou estimer l'exposition au cuivre.
5.2.1 Exposition de la population canadienne au cuivre provenant de l'eau potable
En général, dans les provinces et territoires, les concentrations médianes de cuivre au robinet sont faibles (inférieures à 1 mg/L). Dans certains cas, toutefois, des concentrations élevées de cuivre dans l'eau ont été observées.
À l'Île-du-Prince-Édouard, la concentration de cuivre dissous (passé dans un filtre de 0,45 µm avant la conservation de l'échantillon) a été mesurée dans l'eau souterraine, dans les installations centrales d'approvisionnement en eau des municipalités, dans les systèmes privés centraux d'approvisionnement en eau, ainsi que dans les puits privés et les systèmes indépendants. Les données recueillies de 2013 à 2015 ont été analysées. Dans les installations centrales d'approvisionnement en eau des municipalités, 48 % des échantillons étaient sous la limite de détection (0,005 mg/L). Pour ceux situés au-dessus de la limite de détection (n = 117), la concentration médiane de cuivre dissous était de 0,03 mg/L, et la valeur maximale rapportée, de 0,9 mg/L. Dans les installations centrales d'approvisionnement en eau des municipalités, la valeur correspondant au 95e centile était de 0,12 mg/L, et celle correspondant au 97e centile était de 0,19 mg/L. Dans les systèmes privés centraux d'approvisionnement en eau, 67 % des échantillons étaient sous la limite de détection. Pour ceux situés au-dessus de la limite de détection (n = 13), la concentration médiane de cuivre dissous était de 0,013 mg/L, et la valeur maximale rapportée, de 0,044 mg/L. Dans les puits privés et les systèmes indépendants, 27 % des échantillons étaient sous la limite de détection. Pour ceux situés au-dessus de la limite de détection (n = 2 798), la concentration médiane de cuivre dissous était de 0,017 mg/L, et la valeur maximale rapportée, de 1,8 mg/L.
À Terre-Neuve, tous les échantillons (n = 62) d'eau de source prélevés en 2013 et en 2014 étaient au-dessus de la limite de détection, avec une concentration médiane de cuivre total de 0,0020 mg/L et un intervalle de 0,001 à 0,073 mg/L. Dans les échantillons d'eau prélevés à la source, la valeur correspondant au 95e centile était de 0,031 mg/L et celle correspondant au 97e centile était de 0,033 mg/L. Des 1 968 échantillons d'eau du robinet prélevés en 2013 et en 2014, 97 % étaient au-dessus de la limite de détection. Dans les échantillons d'eau du robinet au-dessus de la limite de détection (n = 1 905), la concentration médiane de cuivre total était de 0,035 mg/L et l'intervalle, de 0,001 à 2,5 mg/L. Dans les échantillons d'eau du robinet, la valeur correspondant au 95e centile était de 0,4 mg/L et celle correspondant au 97e centile était de 0,49 mg/L.
En Nouvelle-Écosse, des 845 échantillons d'eau traitée par les municipalités prélevés entre 2005 et 2012, 73 % avaient une concentration de cuivre total supérieure à la limite de détection, soit 0,002 mg/L. Pour les échantillons d'eau traitée au-dessus de la limite de détection, la concentration médiane de cuivre total était de 0,014 mg/L et l'intervalle, de 0,002 à 0,490 mg/L. Dans les échantillons d'eau traitée, la valeur correspondant au 95e centile était de 0,12 mg/L et celle correspondant au 97e centile était de 0,17 mg/L.
Au Nouveau-Brunswick, pour les échantillons prélevés entre 2010 et 2015, la limite de détection était comprise entre 0,000026 mg/L et 0,0004 mg/L. Les échantillons sont préparés par conservation avec de l'acide nitrique, avant d'être analysés à la recherche de cuivre dissous et de cuivre dilué labile en milieu acide, à l'état de traces, ce qui se rapproche d'un échantillon de cuivre total. Des échantillons d'eau brute, 71 % avaient une concentration de cuivre total inférieure à la limite de détection. Pour les échantillons au-dessus de la limite de détection (n = 367), la concentration médiane de cuivre était de 0,006 mg/L, et la valeur maximale, de 8,3 mg/L. Tous les échantillons provenant d'usines de traitement de l'eau avaient une concentration de cuivre total supérieure à la limite de détection (n = 17), avec une médiane de 0,029 mg/L et une valeur maximale de 0,11 mg/L. Pour les échantillons d'eau prélevés dans les usines de traitement de l'eau, la valeur correspondant au 95e centile était de 0,083 mg/L et celle correspondant au 97e centile était de 0,094 mg/L. Des échantillons prélevés dans les réseaux de distribution, 20 % étaient sous la limite de détection. Pour les échantillons au-dessus de la limite de détection (n = 1 129), la concentration médiane de cuivre était de 0,021 mg/L, et la valeur maximale, de 3,1 mg/L. Pour les échantillons provenant des réseaux de distribution, la valeur correspondant au 95e centile était de 0,48 mg/L, et celle correspondant au 97e centile était de 0,63 mg/L.
Au Québec, l'échantillonnage du cuivre est effectué au robinet après avoir fait couler l'eau pendant cinq minutes. Des 17 863 échantillons prélevés entre 2012 et 2015, 12,5 % avaient une concentration de cuivre total inférieure à la limite de détection (entre 0,001 et 0,01 mg/L) et 119 échantillons (0,7 %) dépassaient 1,0 mg/L. La concentration médiane de cuivre total était de 0,028 mg/L et la valeur maximale détectée était de 15 mg/L.
Au Manitoba, les concentrations de cuivre total des échantillons prélevés entre 2009 et 2015 ont été analysées, et la limite de détection rapportée était de 0,001 mg/L. Des échantillons prélevés d'eau brute, 6 % étaient sous la limite de détection. Pour ceux situés au-dessus de la limite de détection (n = 969), la concentration médiane de cuivre était de 0,003 mg/L, et la valeur maximale, de 0,94 mg/L. Pour les échantillons d'eau brute, la valeur correspondant au 95e centile des concentrations de cuivre total était de 0,03 mg/L et celle correspondant au 97e centile était de 0,05 mg/L. Tous les échantillons d'eau distribuée étaient au-dessus de la limite de détection; la concentration médiane de cuivre était de 0,016 mg/L; la concentration maximale rapportée était de 0,193 mg/L et la concentration minimale rapportée, de 0,002 mg/L (n = 9). Dans les échantillons d'eau distribuée, la valeur correspondant au 95e centile était de 0,133 mg/L et celle correspondant au 97e centile était de 0,157 mg/L. Des échantillons d'eau traitée, 2 % étaient sous la limite de détection. Pour les échantillons au-dessus de la limite de détection (n = 1 026), la valeur médiane de concentration de cuivre était de 0,009 mg/L, et la valeur maximale, de 0,8 mg/L. Dans les échantillons d'eau traitée, la valeur correspondant au 95e centile était de 0,12 mg/L et celle correspondant au 97e centile, de 0,19 mg/L. Des échantillons d'eau non traitée, 6 % avaient une concentration de cuivre total inférieure à la limite de détection; pour les échantillons au-dessus de la limite de détection (n = 165), la concentration médiane de cuivre était de 0,005 mg/L, et la valeur maximale, de 0,62 mg/L. Dans les échantillons d'eau potable désinfectée, la valeur correspondant au 95e centile était de 0,08 mg/L et celle correspondant au 97e centile était de 0,13 mg/L.
En Saskatchewan, des 2 423 échantillons prélevés dans les sites de distribution entre 2005 et 2015, 90 % avaient une concentration de cuivre total supérieure à la limite de détection; la médiane était de 0,012 mg/L et l'intervalle, de 0,002 à 3,9 mg/L. La valeur correspondant au 95e centile était de 0,12 mg/L et celle correspondant au 97e centile était de 0,18 mg/L.
En Alberta, la limite de détection de la concentration de cuivre dissous dans les échantillons prélevés entre 2010 et 2015 était comprise entre 0,002 et 0,003 mg/L. Des échantillons d'eau brute ou d'eau arrivant à l'usine de traitement de l'eau, 43 % avaient une concentration de cuivre inférieure à la limite de détection. Pour les échantillons au-dessus de la limite de détection (n = 131), la concentration médiane de cuivre était de 0,005 mg/L, et la valeur maximale, de 0,025 mg/L. Des échantillons prélevés à la sortie d'usines de traitement de l'eau, 94 % avaient une concentration de cuivre inférieure à la limite de détection. Pour les échantillons au-dessus de la limite de détection (n = 9), la concentration médiane de cuivre était de 0,003 mg/L, et la valeur maximale, de 0,17 mg/L. Dans les échantillons prélevés à la sortie d'usines de traitement de l'eau, la valeur correspondant au 95e centile était de 0,105 mg/L et celle correspondant au 97e centile était de 0,131 mg/L. Des échantillons provenant de réseaux de distribution, 82 % avaient une concentration de cuivre inférieure à la limite de détection. Pour ceux situés au-dessus de la limite de détection (n = 50), la concentration médiane de cuivre était de 0,004 mg/L, et la valeur maximale, de 0,147 mg/L. Dans les échantillons provenant de réseaux de distribution, la valeur correspondant au 95e centile était de 0,047 mg/L et celle correspondant au 97e centile était de 0,096 mg/L.
En Colombie-Britannique, parmi les échantillons prélevés entre 2010 et 2015, 11 % avaient une concentration de cuivre totale inférieure à la limite de détection (entre 0,0002 et 0,005 mg/L). Pour les échantillons au-dessus de la limite de détection (n = 473), la concentration médiane de cuivre était de 0,0077 mg/L, et la valeur maximale rapportée, de 0,549 mg/L. La valeur correspondant au 95e centile était de 0,0824 mg/L et celle correspondant au 97e centile était de 0,13 mg/L.
Au Yukon, les échantillons prélevés entre 2012 et 2015 dans 20 communautés ont été examinés : 19 % des échantillons d'eau brute et 10 % des échantillons d'eau traitée avaient une concentration de cuivre total inférieure à la limite de détection (0,001 à 0,002 mg/L). Dans les échantillons d'eau brute au-dessus de la limite de détection (n = 51), la concentration médiane de cuivre total était de 0,0029 mg/L, et la valeur maximale rapportée, de 0,13 mg/L. Dans les échantillons d'eau brute, la valeur correspondant au 95e centile était de 0,054 mg/L et celle correspondant au 97e centile était de 0,09 mg/L. Dans les échantillons d'eau traitée au-dessus de la limite de détection (n = 26), la concentration médiane de cuivre total était de 0,003 mg/L, et la valeur maximale rapportée, de 0,0712 mg/L. Dans les échantillons d'eau traitée, la valeur correspondant au 95e centile était de 0,067 mg/L et celle correspondant au 97e centile était de 0,07 mg/L.
Des concentrations élevées de cuivre dans l'eau du robinet de résidences canadiennes ont également été documentées. Une étude menée en 1985 a démontré que, dans 50 % des foyers de milieux ruraux en Nouvelle-Écosse, l'eau avait une concentration de cuivre supérieure à 1 mg/L. Les 55 foyers sondés étaient tous desservis par des puits privés, dans trois différentes zones de substrat rocheux (granite, quartzite et calcaire). Les auteurs n'ont pas trouvé de corrélation significative entre les indices de Langelier et de Ryszar, les indices d'agressivité, le rapport de masse entre le chlorure et le sulfate, l'alcalinité ou le pH et la corrosion. Ils ont également remarqué que, d'une maison à l'autre, il y avait une grande variation de la mobilisation des métaux (cuivre, plomb, zinc) (Maessen et coll., 1985).
5.2.2 Échantillonnage visant à évaluer l'exposition au cuivre dans l'eau potable
Les protocoles d'échantillonnage varient en fonction de l'objectif souhaité (c.-à-d. détection des sources de cuivre, contrôle de la corrosion, évaluation de la conformité, estimation de l'exposition au cuivre, etc.). Comme la surveillance du cuivre au robinet peut se faire au moyen de différents protocoles d'échantillonnage, il est important que le protocole choisi soit approprié afin d'atteindre l'objectif fixé. La surveillance de l'exposition typique au cuivre total doit être faite au robinet du consommateur en accordant la priorité aux résidences qui disposent d'installations de plomberie neuves en cuivre ou qui sont approvisionnées en eau à pH faible ou instable, ou encore qui sont situées près d'un cul-de-sac, puisqu'elles sont susceptibles de présenter les concentrations de cuivre les plus élevées. La surveillance dans les garderies doit également être prioritaire pour que la population la plus vulnérable (c.-à-d. les bébés nourris au biberon) soit prise en compte. L'échantillonnage doit être effectué au moins une fois par année, le nombre de sites à surveiller étant déterminé en fonction de la taille du système d'approvisionnement en eau potable et des caractéristiques relatives à la qualité de l'eau.
5.3 Air
En 2014, dans le cadre du Réseau national de surveillance de la pollution atmosphérique au Canada, on a rapporté des teneurs en cuivre sous forme de particules fines (PM2,5) (Environnement Canada, 2014). En tout, 75,2 % des échantillons dépassaient la limite de détection (0,28 à 0,85 ng/m3), 14 échantillons étaient au-dessus de 50 ng/m3 et 7 étaient au-dessus de 100 ng/m3. La moyenne était de 3,4 ng/m3, la médiane était de 1,2 ng/m3, la valeur correspondant au 75e centile était de 2,4 ng/m3 et la valeur maximale était de 430,3 ng/m3. Des résultats semblables ont été observés dans le cadre d'une étude de l'air intérieur et extérieur (n = 3 000 sites à Edmonton, Halifax, Ottawa, Sault-Saint-Marie et Windsor), avec une moyenne des teneurs de 2,9 ng/m3 et une médiane inférieure à 2 ng/m3 (Santé Canada, 2015). Des teneurs en cuivre dans l'air intérieur de 8,2 ng/m3 (intervalle : entre 3,8 et 17,8) et de 11,4 ng/m3 (intervalle : entre 3,9 et 56,9) ont été observées dans 10 résidences respectivement de milieux urbains et ruraux canadiens (filtre PM2,5) (Rasmussen et coll., 2006). Il a été démontré que le cuivre est principalement associé à la phase organique de la poussière domestique, ce qui augmente sa biodisponibilité (Rasmussen et coll., 2008). Ces faibles concentrations de cuivre dans l'air ambiant permettent de supposer que l'apport provenant de l'air est négligeable par rapport à celui provenant d'autres sources.
5.4 Produits de consommation
Les estimations quantitatives de l'exposition au cuivre total dans les produits de consommation sont assez rares au Canada. Toutefois, les composés de cuivre, p. ex. l'acétate de cuivre(II), le carbonate de cuivre(II), le chlorure de cuivre(II) et le sulfate de cuivre(II), font partie de divers produits médicinaux offerts au Canada, et peuvent être consommés par voie orale dans des formules thérapeutiques naturelles, à raison d'un maximum de 0,7 mg/jour pour les enfants de 1 à 3 ans et jusqu'à 8 mg/jour pour les adultes d'un âge égal ou supérieur à 19 ans (Santé Canada, 2007). L'utilisation d'un DIU contenant du cuivre peut également être à l'origine d'une exposition quotidienne à environ 80 µg de cuivre, parfois moins, qui diminue après les premières semaines suivant l'insertion (IPCS, 1998; Gaetke et coll., 2014; Ellingsen et coll., 2015). Bien que des amalgames aient été reconnus comme une source de cuivre, l'exposition à cette source est considérée comme minime (IPCS, 1998).
5.5 Sol
La distribution du cuivre dans les roches et le sol varie en fonction des caractéristiques minéralogiques du matériau parental et de la proximité des sources d'origine anthropique. La teneur moyenne en cuivre total dans le sol au Canada a été estimée à 20 mg/kg (intervalle : entre 2 et 100 mg/kg); cette teneur était inférieure dans le Bouclier canadien (11 mg/kg) et supérieure dans la région de la Cordillère (46 mg/kg) (CCME, 1999). Des teneurs ont été relevées dans les forêts-parcs de l'Ontario (entre 41 et 65 mg/kg), dans l'ouest du Manitoba (25 mg/kg) et dans les zones rurales de l'Alberta (entre 17 et 19 mg/kg). La poussière des rues à Halifax avait une teneur de 87 mg/kg. La teneur en cuivre a été mesurée dans le sol de jardin (moyenne géométrique [MG] : 12,3 mg/kg; valeur correspondant au 95e centile : 19,4 mg/kg), la poussière domestique (MG : 170,7 mg/kg; valeur correspondant au 95e centile : 489,0 mg/kg) et la poussière de rue (MG : 38,1 mg/kg; valeur correspondant au 95e centile : 236,2 mg/kg) provenant respectivement de 50, 48 et 45 résidences d'Ottawa (Rasmussen et coll., 2001). Le cuivre est utilisé comme supplément alimentaire pour les animaux de ferme (Nicholson et coll., 1999; Xiong et coll., 2010) : une partie du cuivre est absorbée par l'animal et le reste est excrété. Il a été rapporté, dans le cadre d'une étude menée en Chine, que la teneur en cuivre du fumier était de 699,6 mg/kg (porcins); de 31,8 mg/kg (bovins); de 81,8 mg/kg (volaille); et de 66,85 mg/kg (ovins). Une étude menée en Angleterre et au Pays de Galles a relevé des teneurs de 360 mg Cu/kg dans le fumier de porcins, de 80 mg Cu/kg dans le fumier de volaille et de 50 mg Cu/kg dans le fumier de bovins. Dans une étude canadienne portant sur le ruissellement des andains de compost de fumier (un mélange de fumier de bovins et de paille d'orge), la teneur en cuivre du compost se situait dans un intervalle de 49 à 55 mg Cu/kg (Larney et coll., 2014). Sur une période de 224 jours, des mesures régulières ont été prises dans le ruissellement provenant du fumier. Au 18e jour (première mesure), la concentration de cuivre se situait dans un intervalle de 0,3 à 0,62 mg/L. La concentration de cuivre dans les ruissellements a atteint un sommet de 0,78 mg/L au 26e jour. La concentration de cuivre a diminué considérablement durant la décomposition du compost, soit, de 67 % du 26e jour au 40e jour.
5.6 Concentrations dans le sang et l'urine de la population canadienne
Les données sur les concentrations de cuivre dans le sang et l'urine de la population canadienne figurent dans l'Enquête canadienne sur les mesures de la santé (Cycle 2), menée par Statistique Canada, Santé Canada et l'Agence de la santé publique du Canada. Dans cette étude de prévalence, des données sur la santé et des échantillons de matériel biologique ont été recueillis dans 257 sites, auprès de 6 070 Canadiens et Canadiennes âgés de 3 à 79 ans, répartis en six groupes d'âge (3 à 5, 6 à 11, 12 à 19, 20 à 39, 40 à 59 et 60 à 79 ans). La moyenne géométrique de la concentration de cuivre dans le sang total était de 900 μg/L (intervalle de confiance [IC] à 95 % = 900-910 μg/L; n = 6 070) et la moyenne géométrique des concentrations de cuivre dans l'urine était de 10 μg/L (IC à 95 % = 10-11 μg/L; n = 6 311) pour l'ensemble de la population canadienne âgée de 3 à 79 ans (Santé Canada, 2013).
Une étude menée par le gouvernement des Territoires du Nord-Ouest et Santé Canada entre 1994 et 1999 a démontré que la moyenne géométrique des concentrations de cuivre dans le plasma maternel et dans celui des cordons ombilicaux de 523 femmes dans l'Arctique canadien était de 2,1 mg/L (Butler Walker et coll., 2006). Les concentrations ne variaient pas entre les groupes ethniques.
5.7 Voies multiples d'exposition
Les propriétés physiques et chimiques du cuivre permettent de supposer que l'exposition au cuivre dans l'eau potable par inhalation et par voie cutanée est probablement négligeable. L'exposition au cuivre par les vapeurs d'eau dans la douche n'est pas censée se produire, puisque le cuivre est non volatil, et aucun cas d'absorption de cuivre par inhalation n'a été rapporté. Bien que la production de gouttelettes dans la douche puisse rendre possible l'inhalation de cuivre sous forme d'aérosol, l'évaluation habituelle des voies multiples d'exposition, qui mesure l'exposition, par inhalation, aux produits chimiques volatils produits pendant la douche ou le bain, ne permettrait pas de rendre compte de façon exacte de l'inhalation de cuivre sous forme d'aérosol pendant une douche. Peu d'information est disponible sur l'absorption du cuivre par voie cutanée; toutefois, le fait de prendre un bain ou une douche n'est pas censé représenter une exposition considérable, comme il est indiqué dans une évaluation des risques de la présence de métaux-traces dissous dans l'eau potable (Karim, 2011). Conséquemment, il est improbable que l'exposition par voie cutanée et par inhalation pendant la douche ou le bain contribue considérablement à l'exposition totale au cuivre présent dans l'eau potable.
6.0 Méthodes d'analyse
L'Agence des États-Unis pour la protection de l'environnement (en anglais, United States Environmental Protection Agency ou U.S. EPA) possède plusieurs méthodes approuvées pour mesurer la concentration de cuivre dans l'eau potable :
- EPA 200.5 Rev 4.2 (U.S. EPA, 2003a)
- EPA 200.7 Rev 4.4 (U.S. EPA, 1994a)
- EPA 200.8 Rev 5.4 (U.S. EPA, 1994b)
- EPA 200.9 Rev 2.2 (U.S. EPA, 1994c)
- ASTM D1688-95A, ASTM D1688-02A, ASTM D1688-07A, D1688-12A (ASTM, 1995, 2002, 2007, 2012).
- ASTM D1688-95C, ASTM D1688-02C, ASTM D1688-07C, D1688-12C (ASTM, 1995, 2002, 2007, 2012).
- Hach 8026, Hach 10272 (Hach, 2014, 2016)
- SM 3111B (1992, 1995, 2005, 2012) and the online version of SM3111B (1999) (APHA et al., 1992, 1995, 1999, 2005, 2012)
- SM 3113B (1992, 1995, 2005, 2012) (APHA et al., 1992, 1995, 1999, 2004, 2005, 2010, 2012)
- SM 3120 B (1992, 1995, 1998, 2005, 2012) and the online version of SM 3120B (1999) (APHA et al., 1992, 1995, 1999, 2005, 2012).
Les limites de détection de la méthode (LDM) pour les méthodes citées ci-dessus se situent entre 0,02 et 500 µg/L. Toutefois, il est à noter que les LDM dépendent de la matrice de prélèvement, des instruments utilisés et des conditions de mesures choisies, et qu'elles varieront d'un laboratoire à l'autre. Dans la sélection d'une méthode d'analyse, la matrice d'eau doit être prise en considération afin de minimiser l'effet des agents d'interférence par l'utilisation d'un prétraitement prescrit d'échantillon; il est également possible d'avoir recours à un procédé d'atténuation pour aider à éliminer ou à diminuer ces effets.
ASTM D1688A, ASTMD1688C, EPA Rev 2.2, SM 3111B et SM 3113B sont toutes des méthodes fondées sur l'absorption atomique. La source lumineuse est propre à chaque élément mesuré, puisque chaque métal a une longueur d'onde d'absorption caractéristique (APHA et coll., 2012). ASTM D1688 utilise une méthode directe d'absorption atomique dont le domaine d'utilisation est de 0,5 à 5 mg/L (ASTM, 1995, 2002, 2007, 2012); ASTM D1688C utilise plutôt une méthode d'absorption atomique en four graphite à dont le domaine d'utilisation est de 5 à 100 µg/L (ASTM, 1995, 2002, 2007, 2012). EPA 200.9 Rev 2.2 utilise une méthode d'absorption atomique en four graphite et présente une LDM de 0,7 µg/L (U.S. EPA, 1994c). SM 3111B (1992, 1995, 2005, 2012) et la version en ligne de SM 3111B (1999) utilisent une méthode de spectrométrie d'absorption atomique de flamme, qui présente une limite de détection de l'instrument de 0,01 mg/L (APHA et coll., 1992, 1995, 1999, 2005, 2012) SM 3113B (1992, 1995, 2005, 2012) et la version en ligne de SM 3113B (1999, 2004, 2010) utilisent une méthode de spectrométrie d'absorption atomique électrothermique, qui présente un seuil de détection estimé à 0,7 µg/L et un intervalle de concentration optimal de 5 à 100 µg/L (APHA et coll., 1992, 1995, 1999, 2004, 2005, 2010, 2012). L'absorption atomique de flamme est exposée à quelques interférences, principalement de nature chimique, qui nuisent à l'absorption par les atomes, car ces derniers sont liés en molécules ou s'ionisent dans la flamme. La méthode en four graphite/électrothermique présente habituellement des seuils de détection de 20 à 1 000 fois plus bas que les méthodes de flamme, et ce, en raison de la densité atomique accrue dans le four (APHA et coll., 2012). Toutefois, la méthode en four graphite/électrothermique est exposée à des interférences supplémentaires, notamment les interférences spectrales, les interférences de la matrice et les inférences liées à la mémoire (U.S. EPA, 1994c), et peut nécessiter un temps d'analyse supplémentaire par rapport aux méthodes de flamme (APHA et coll., 2012).
EPA 200.7 Rev 4.4 utilise une méthode de spectroscopie d'émission atomique avec plasma induit par haute fréquence (ICP-AES), qui présente une LDM de 0,003 mg/L (U.S. EPA, 1994a). EPA 200.5 Rev 4.2 utilise une méthode d'ICP-AES avec visée axiale, qui présente une LDM de 0,3 µg/L et une limite à rapporter calculée de 0,7 µg/L (U.S. EPA, 2003a). EPA 200.8 Rev 5.4 utilise une méthode de spectrométrie de masse avec plasma induit par haute fréquence ICP-MS, qui présente une LDM de 0,5 µg/L en mode balayage et de 0,02 µg/L en mode de détection d'ions uniques (U.S. EPA, 1994b). SM 3120 B (1992, 1995, 1998, 2005, 2012) et la version en ligne de SM 3120B (1999) utilisent une méthode de plasma induit par haute fréquence, qui présente un niveau de détection estimé à 6 µg/L (APHA et coll., 1992, 1995, 1999, 2005, 2012). Les sources d'interférence peuvent comprendre les effets de matrice et les interférences causées par les éléments isobares et les ions polyatomiques. En règle générale, tant avec la méthode d'ICP-AES qu'avec la méthode d'ICP-MS, une grande quantité de matières solides dissoutes dans un échantillon peut interférer avec la transmission d'ions, et des interférences peuvent se produire quand les matières dissoutes dépassent 0,2 % (p/v) (U.S. EPA, 1994b; APHA et coll., 2012).
Les méthodes colorimétriques Hach 8026 et 10272 pour le titrage du cuivre sont basées sur la complexation du Cu(I) par l'acide bicinchoninique. La méthode Hach 8026 a un domaine d'utilisation de 0,04 à 5 mg/L (Hach, 2014), et la Hach 10272 a une LDM de 0,06 mg/L (Hach, 2016). Dans la méthode colorimétrique, le Cu(II) est réduit en Cu(I), et la concentration est déterminée par la spectrophotométrie à 560 nm. Il existe plusieurs agents d'interférence pour les méthodes Hach 8026 (Al3+, CN-, Fe3+, Ag+, dureté, pH ≤ 2) et Hach 10272 (CN-, Ag+, pH ≤ 2), dont les effets peuvent être limités par l'utilisation d'un agent de chélation ou l'ajustement au pH prescrit.
Le niveau pratique d'évaluation quantitative (NPEQ) est de 0,05 mg/L (U.S. EPA, 2009). Dans le deuxième examen sur six ans des règlements nationaux existants sur l'eau potable aux États-Unis, l'U.S. EPA a indiqué que bien que le taux de succès des analyses de laboratoire soit élevé, les données sur l'évaluation du rendement et les épreuves de compétence concernant le cuivre sont non concluantes ou insuffisantes pour justifier la baisse du NPEQ (U.S. EPA, 2009).
6.1 Préparation d'échantillon
La concentration de cuivre est beaucoup moins variable que celle du plomb, tant dans un réseau que dans un même site (Kirmeyer et coll., 1994; Schock et coll., 1995), ce qui facilite en général l'analyse du cuivre total. La préparation des échantillons de manière à pouvoir détecter les fractions particulaire et dissoute du cuivre constitue une pratique exemplaire, particulièrement si l'objectif est de poser un diagnostic. En général, toutes les méthodes susmentionnées observent les mêmes étapes de conservation, notamment l'utilisation d'une solution d'acide nitrique à 0,15 %, un délai d'attente de 16 heures et l'ajout d'acide chlorhydrique pour la digestion thermique lorsque la turbidité des échantillons est supérieure à 1 unité de turbidité néphélémétrique (UTN). Il a été démontré que la méthode de conservation classique par acidification (pH < 2) permet de quantifier le cuivre total dans les échantillons d'eau (U.S. EPA, 1994b; APHA et coll., 2012). Toutefois, tout comme pour le plomb et d'autres métaux, lorsque des particules de cuivre sont présentes dans un échantillon, il est possible qu'elles soient mal dispersées et qu'elles se déposent au fond de la bouteille de prélèvement, entraînant ainsi une turbidité inférieure à 1 UTN. Par conséquent, le protocole actuel pourrait sous-estimer la quantité totale de cuivre dans l'eau potable en présence de cuivre particulaire; c'est pourquoi la pratique exemplaire à l'étape de conservation est importante. L'augmentation de la concentration d'acide nitrique à 2 % pour l'étape de conservation peut améliorer la récupération de la plupart des formes de cuivre particulaire, comme il a été observé avec les particules de plomb (Haas et coll., 2013; Triantafyllidou et coll., 2013; Clark et coll., 2014).
La pratique exemplaire pour une estimation optimale des métaux totaux consiste notamment à garantir qu'aucun transfert d'aliquote ou de volume ne survient avant l'étape de la conservation ou de l'analyse, à conserver les échantillons sur place dans la mesure du possible, à maintenir un délai d'attente minimal de 16 heures après l'étape de conservation, à bien mélanger l'échantillon avant de procéder à son analyse et à prélever l'aliquote directement du flacon à échantillon d'origine (Cartier et coll., 2013; Haas et coll., 2013; Triantafyllidou et coll., 2013). Il importe de souligner que l'ajout d'acide nitrique à 2 % doit être réalisé par du personnel qualifié qui prendra les précautions nécessaires. À cette fin, si l'échantillonnage est effectué par les propriétaires des maisons, l'échantillon ne doit être acidifié et mis en attente qu'à son arrivée au laboratoire.
7.0 Techniques de traitement
7.1 Échelle municipale
La libération de cuivre a toujours été considérée comme une nuisance esthétique dans les cas où elle rend l'eau bleue, et comme une nuisance financière dans les cas où elle entraîne une défaillance des tuyaux en raison d'une corrosion par piqûres et des fuites microscopiques qui en résultent. Les concentrations de cuivre dans l'eau prélevée à la source sont généralement très faibles et, la plupart du temps, le cuivre est introduit dans l'eau potable après qu'elle ait quitté l'usine de traitement. La méthode de traitement pour le cuivre est généralement axée sur le contrôle de la corrosion. Parmi les méthodes anticorrosion utilisées, mentionnons les ajustements relatifs à la qualité de l'eau (p. ex. pH, alcalinité) et l'emploi d'inhibiteurs de corrosion. Le choix d'une stratégie appropriée pour minimiser la concentration de cuivre au robinet et, par le fait même, l'exposition au cuivre, dépend de nombreux facteurs, notamment des caractéristiques de la source d'eau brute et du type de corrosion (Santé Canada, 2009c). Les services publics doivent mener des études pilotes ou de banc d'essais de tuyaux afin de comprendre comment les modifications de la qualité de l'eau visant à contrôler le cuivre influenceront les divers constituants chimiques de l'eau traitée (p. ex. fer et manganèse) ainsi que les matériaux du réseau de distribution (p. ex. stabilité des incrustations, composants qui contiennent du plomb).
Des investigations sur un site en particulier peuvent s'avérer utiles lorsque les concentrations de cuivre trop élevées ne concernent qu'un bâtiment ou un quartier. Dans le cadre d'une enquête portant sur un bris majeur et rapide dans les installations de plomberie en cuivre (2 mois après l'installation) d'un hôpital en Allemagne, Fischer et coll. (1992) ont trouvé des signes de corrosion uniforme et par piqûres dans la tuyauterie en cuivre. Plusieurs couches de biofilm ont également été trouvées entre les produits de corrosion et ont contribué à la libération de cuivre. Les auteurs ont également découvert que les zones ayant subi le plus de corrosion se trouvaient dans les réseaux fortement ramifiés de canalisations horizontales dans lesquels l'eau stagnait longtemps. Arnold et coll. (2012) ont enquêté sur un site en particulier, à savoir une école nouvellement construite aux États-Unis, où la libération de cuivre dépassait 6 mg/L et où l'on a observé de l'eau bleue. Des enquêtes ciblées ont permis d'élaborer une stratégie pratique de traitement prolongé (enlèvement de la matière organique naturelle [MON]) pour l'école.
7.1.1 Considérations relatives au traitement
Bien que les concentrations de cuivre dans l'eau prélevée à la source soient généralement faibles, l'efficacité des technologies conventionnelles de traitement des eaux pour l'élimination du cuivre a été démontrée tant en laboratoire ou à échelle pilote, qu'à pleine échelle. Stover et Kincannon (1983) ont mené des études de traitabilité pilotes ou en laboratoire portant sur l'eau souterraine brute (pH 6). Des ajustements du pH à l'aide de chaux a permis de réduire la concentration en cuivre : de 0,1 mg/L à < 0,001 mg/L (à pH 9,1 et 9,9) et à 0,008 (à pH 11,3). L'adsorption sur charbon actif a également fait diminuer la concentration de cuivre de 0,1 mg/L à < 0,001 mg/L (Stover et Kincannon, 1983). Une enquête sur le rendement de douze usines de traitement de l'eau au Colorado et en Californie a également permis de recueillir des données probantes sur l'élimination du cuivre de l'eau prélevée à la source (concentration moyenne de l'eau influente de 0,03 mg/L) par un microtamis (14 %), un clarificateur (26 %) et des étapes de filtration (37 %), pour une élimination totale de 49 % (Zemansky, 1974). Les performances de trois couches filtrantes au charbon actif en grains (CAG) ont été comparées dans une usine de traitement de l'eau approvisionnée en eau fluviale dans le sud de la Pologne. L'usine de traitement de l'eau était formée de deux chaînes de traitement parallèles qui précédaient l'étape des filtres CAG et qui étaient constituées soit de processus de préozonisation, de coagulation, de floculation, de sédimentation et de filtration rapide sur sable, soit de processus de préozonisation, de coagulation, de clarification/floculation, de filtration rapide sur sable et d'ozonisation. Après l'étape des filtres CAG suivait celle du stockage, où la dernière désinfection avait lieu. L'eau entrant dans les filtres CAG avait un pH de 6,8 et une turbidité de 0,2 UTN. Les auteurs ont découvert que la concentration de cuivre avait augmenté de 130 à 253 % dans la couche filtrante Chemviron F-300 et de 1 965 % dans la couche filtrante Norit ROW 08 au cours de la première année d'exploitation (concentration de l'eau influente non rapportée). Dans la troisième couche filtrante (WG-12), l'adsorption du cuivre était irrégulière, et une désorption (libération) de cuivre a été observée (Dabioch et coll., 2013). En ce qui a trait aux réseaux publics d'approvisionnement en eau, l'U.S. EPA a déterminé que l'échange d'ions (à l'aide de résines cationiques) et l'osmose inverse (OI) au point d'utilisation étaient des technologies d'élimination du cuivre qui assuraient la conformité des petits réseaux (c.-à-d. qui desservent moins de 10 000 personnes) pour l'élimination du cuivre (U.S. EPA, 1998). Ces technologies sont également pertinentes pour le traitement à l'échelle résidentielle (voir la section 7). L'alcalinité de l'eau prête au débit est influencée par l'utilisation du processus d'OI. Ce processus, qui consiste à retirer le sodium, le sulfate, le chlorure, le calcium et les ions bicarbonates, produit une eau traitée qui est corrosive (Taylor et Wiesner, 1999). Le résultat de ce processus souligne l'importance des ajustements de processus, comme l'ajout d'une base et l'aération du flux de perméat pour rétablir l'alcalinité avant la distribution.
7.1.2 Considérations relatives aux réseaux de distribution
Selon le Code national de la plomberie du Canada (CNP), le cuivre est un matériau acceptable pour les entrées de service et les installations de plomberie (CNRC, 2010), indépendamment de la qualité de l'eau. La réglementation sur les installations de plomberie mise en œuvre par chaque province et territoire repose sur le CNP. Toutefois, dans certaines qualités d'eau, le cuivre peut être libéré dans l'eau potable tant sous forme soluble que particulaire à partir des tuyaux de plomberie en cuivre, des entrées de service en cuivre et du cuivre présent dans les raccords en laiton, lesquels sont utilisés tant dans les installations de plomberie résidentielles que dans les conduites principales de distribution, faisant monter la concentration de cuivre dans l'eau au-dessus de la CMA proposée.
7.2 Facteurs qui influent sur la corrosion uniforme du cuivre
Schock et Lytle (2011) indiquent que les variables les plus importantes pour la corrosion générale uniforme du cuivre et la libération du cuivre sont le pH, l'alcalinité, l'Eh et l'âge des installations de plomberie. Quelques autres facteurs peuvent jouer sur la corrosion uniforme du cuivre, notamment la durée de stagnation de l'eau, le débit d'eau dans les tuyaux, la température et d'autres conditions de qualité de l'eau, ainsi que la MON et les biofilms.
7.2.1 pH
L'effet du pH sur la solubilité des produits de corrosion formés durant le processus de corrosion est souvent la clé pour comprendre la concentration de métaux dans l'eau du robinet. En général, lorsque l'eau distribuée a un pH élevé, elle réduit la solubilité des produits de corrosion formés dans le réseau de distribution. La corrosion du cuivre s'intensifie rapidement à mesure que le pH chute sous 6. De plus, les vitesses de corrosion uniformes peuvent être élevées à pH bas (inférieur à 7), ce qui a pour effet d'amincir le métal. À pH élevé (supérieur à 8), les problèmes de corrosion du cuivre sont presque toujours associés à des processus de corrosion non uniforme ou par piqûres (Edwards et coll., 1994a; Ferguson et coll., 1996). Edwards et coll. (1994b) ont découvert que pour les surfaces en cuivre neuves exposées à de simples solutions contenant du bicarbonate, du chlorure, du nitrate, du perchlorate ou du sulfate, une augmentation du pH de 5,5 à 7,0 réduisait d'environ de moitié la vitesse de corrosion; cependant, une augmentation du pH au-delà de ces valeurs ne produisait que des changements subtils. Pour prévoir les concentrations de cuivre dans l'eau potable, on s'appuie sur la solubilité et les propriétés physiques des formes solides de l'oxyde de cuivre(II), de l'hydroxyde de cuivre(II) et des carbonates de cuivre(II) basiques qui composent la plupart des incrustations dans les réseaux d'approvisionnement en eau en cuivre (Schock et coll., 1995). Dans le modèle de l'hydroxyde de cuivre(II) de Schock et coll. (1995), la diminution de la solubilité du cuivre à un pH plus élevé est évidente. À un pH supérieur à environ 9,5, on prévoit une remontée de la solubilité causée par les complexes de carbonate et d'hydroxyde, qui augmentent la solubilité de l'hydroxyde de cuivre(II). Les solides de cuivre vieillissent également beaucoup plus rapidement, se transformant en phases d'hydroxyde de cuivre(II) beaucoup moins solubles, à un pH et des températures beaucoup plus élevés (Hidmi et Edwards, 1999). La solubilité du cuivre est élevée dans l'eau souterraine froide, à alcalinité élevée et à concentration élevée de sulfate jusqu'à un pH d'environ 7,9 (Edwards et coll., 1994a).
7.2.2 Alcalinité
L'alcalinité est une mesure de la capacité de l'eau à neutraliser les acides et sert à réguler l'effet tampon dans la plupart des systèmes d'eau. Ainsi, une alcalinité minimale est nécessaire pour que le pH soit stable dans le réseau de distribution, ce qui est nécessaire pour limiter la corrosion. L'alcalinité est influencée par la présence de bases conjuguées de carbone inorganique (HCO3- et CO32-), d'acides organiques et d'ions OH−. Elle est exprimée en mg CaCO3/L (Edzwald et Tobiason, 2011). En général, les paramètres alcalinité et carbone inorganique dissous (CID) sont utilisés de manière interchangeable. La relation entre l'alcalinité, le pH et la dissolution du cuivre est complexe, et la forme des matières solides qui limitent la libération du cuivre est d'une importance capitale. Les eaux souterraines dures et à alcalinité élevée sont particulièrement agressives à l'égard des matériaux de cuivre (Schock et Lytle, 2011). Par exemple, des libérations de cuivre de 1,4 à 2,4 mg/L ont été observées dans les échantillons d'eau à alcalinité élevée (273 mg CaCO3/L) et à un pH de 7,4 prélevés au robinet, dans les installations de plomberie en cuivre récentes (moins de 6 ans) de gros immeubles. L'ajout d'orthophosphate à 3 mg/L était suffisant pour réduire la libération de cuivre à moins de 1,3 mg/L (Grace et coll., 2012). Schock et Fox (2001) ont fait une observation semblable : dans l'eau à alcalinité élevée (280 mg CaCO3/L) et à un pH de 7.3, la valeur correspondant au 90e centile des concentrations de cuivre était supérieure à 1,63 mg/L. Edwards et coll. (1999) ont découvert que la combinaison d'un pH faible (< 7,8) et d'une alcalinité élevée (> 74 mg CaCO3/L) produisait le pire résultat possible en se basant sur la valeur correspondant au 90e centile des concentrations de cuivre. Les expériences en laboratoire et dans les services publics ont démontré que la libération de cuivre due à la corrosion est pire à alcalinité élevée (Edwards et coll., 1994b, 1996; Schock et coll., 1995; Ferguson et coll., 1996; Broo et coll., 1998). Ces effets sont probablement dus à la formation de complexes de bicarbonate de cuivre(II) et de carbonate de cuivre(II) solubles (Schock et coll., 1995; Edwards et coll., 1996) et dans certaines eaux, comme dans celles où il ne se forme pas d'incrustation de malachite insoluble (Arnold et coll., 2012). La complexation du carbonate et le pH ont tous deux un grand effet sur la solubilité du cuivre présent dans les installations de plomberie récentes. On a également démontré, dans le cadre d'une expérience dans les services publics, qu'une alcalinité faible (< 25 mg CaCO3/L) était problématique (Schock et coll., 1995). Pour les eaux à alcalinité élevée, les seules solutions pratiques pour contrer la baisse de solubilité du cuivre sont l'adoucissement à la chaux, le retrait de bicarbonate ou l'ajout d'assez grandes quantités d'orthophosphate (U.S. EPA, 2003b). On peut corréler de faibles concentrations de cuivre à une alcalinité élevée si la formation de malachite et de ténorite, qui sont moins solubles, a été favorisée (Schock et coll., 1995; Edwards et coll., 2002).
7.2.3 Potentiel d'oxydoréduction
L'importance du Eh réside principalement dans la détermination des conditions dans lesquelles des ions Cu(II) sont formés (c.-à-d. à un potentiel d'oxydation élevé). Dans des conditions où l'Eh est faible, le cuivre n'est pas sensible à la corrosion, ou bien il y a formation d'oxyde de cuivre(I) ou d'hydroxyde de cuivre(I), des solides fortement insolubles, et les concentrations de cuivre résultantes dans l'eau sont extrêmement faibles (Schock et coll., 1995; Ferguson et coll., 1996). De nombreuses eaux souterraines non traitées à pH neutre et à alcalinité élevée font partie de cette catégorie.
La vitesse de libération du cuivre dans l'eau est influencée par la concentration d'agents oxydants dans le réseau, en particulier le chlore libre. Même à faible concentration (c.-à-d. 0,2 mg/L), ces agents affectent la vitesse d'oxydation et de corrosion (Schock et Lytle, 2011). Reiber (1989) a démontré que l'effet du chlore est beaucoup plus important que celui de l'oxygène dissous dans l'eau potable dans des conditions normales.
L'acide hypochloreux est la forme prédominante de chlore libre dans l'eau potable à un pH inférieur à 7,5 et l'agent oxydant dominant des surfaces en cuivre (Atlas et coll., 1982; Reiber, 1987, 1989; Hong et Macauley, 1998). On a démontré qu'une concentration résiduelle de chlore libre favorisait la corrosion du cuivre à un pH moins élevé (Atlas et coll., 1982; Reiber, 1989). Par contre, il réduisait le taux de corrosion du cuivre à un pH de 9,3 (Edwards et Ferguson, 1993; Edwards et coll., 1999). Toutefois, Schock et coll. (1995) ont conclu que les espèces de chlore libre influencent le produit de solubilité du cuivre en stabilisant les phases solides du Cu(II), ce qui a pour effet d'augmenter considérablement la libération de cuivre. Les auteurs n'ont observé aucun effet direct du chlore libre sur la solubilité du Cu(II), si ce n'est le changement de valence et son effet indirect sur le potentiel de dissolution du cuivre.
Parfois, les concentrations de cuivre dans l'eau qui a stagné dans les installations de plomberie peuvent augmenter pendant 48 à 72 heures, particulièrement dans les cas assez rares d'eau bleue (Edwards et coll., 2000). Pour cette raison, un échantillon d'eau qui a stagné pendant une nuit n'est pas nécessairement représentatif du pire scénario envisageable d'exposition au cuivre (Schock et coll., 1995). Inversement, la raréfaction des oxydants pourrait réduire les concentrations de cuivre (Edwards et coll., 1996; Schock et Lytle, 2011). L'introduction de procédés d'oxydation, comme ceux utilisés pour le retrait du fer ou du manganèse, ou le début d'une désinfection à la suite de conditions d'Eh faible pourraient augmenter, diminuer ou ne pas modifier la concentration de cuivre, selon les circonstances.
Peu de renseignements existent dans la documentation scientifique concernant l'effet d'autres désinfectants sur le cuivre. Dans une étude en laboratoire, Rahman et coll. (2007) ont évalué l'effet de trois désinfectants (le chlore, le dioxyde de chlore et les chloramines) à deux pH (7,2 et 8,5) et à deux conditions d'alcalinité (10 ou 100 mg CaCO3/L). Les auteurs n'ont observé aucune différence notable au chapitre de la libération de cuivre dissous entre une solution témoin sans désinfectant et une solution contenant n'importe lequel des désinfectants utilisés dans l'étude. De façon générale, l'étude a révélé que l'utilisation de désinfectant réduisait la libération de cuivre, avec la plus faible libération de cuivre total observée à un pH 8,5, une alcalinité de 10 mg CaCO3/L et une concentration de chlore de 1,0 mg/L. Selon les auteurs, la faible quantité de biomasse (non évaluée dans l'étude) pourrait expliquer en partie les effets bénéfiques du désinfectant, et les longues périodes de stagnation (72 heures) mèneraient à un faible taux de chlore résiduel. Les auteurs croient également que, dans le cas du dioxyde de chlore, la présence de chlorite (un sous-produit) peut avoir agi comme un inhibiteur de corrosion.
Boyd et coll. (2010) ont étudié les effets d'un changement de désinfectant — en remplaçant le chlore libre par les chloramines et vice versa — sur les vitesses de relargage des métaux et les concentrations de métaux pour les composants du réseau de distribution contenant du plomb, du laiton ou du cuivre. On a utilisé l'eau du robinet provenant du réseau local et les paramètres relatifs à la qualité de l'eau (désinfectant résiduel, pH, alcalinité et concentration d'orthophosphate) ont été surveillés et maintenus. Les auteurs ont effectué des tests dans des tuyaux en boucle en utilisant des tubes en cuivre neufs et des tuyaux en bronze (comme substitut du laiton standard) avec divers couplages galvaniques (cuivre-bronze, plomb-bronze et plomb-cuivre). Les concentrations de cuivre dans les boucles de cuivre et de bronze dépassivées étaient sensibles au chlore libre et aux chloramines, mais les effets étaient transitoires et n'étaient pas liés à un désinfectant en particulier. Une étude a évalué le potentiel de relargage de divers composants dans l'eau chlorée et l'eau chloraminée, selon les protocoles de la norme 61 de NSF International (NSF)/American National Standards Institute (ANSI). L'étude a également testé ces composants en utilisant 28 eaux différentes (chlorées et chloraminées) prélevées dans des services publics aux États-Unis, lesquels ont également fait l'objet d'une enquête concernant les problèmes de libération de cuivre et de plomb. Les auteurs ont découvert que ni le chlore ni la chloramine ne constituaient un facteur dominant du relargage du cuivre dans les conditions de l'expérience, tant dans les eaux synthétiques que dans celles des services publics. Ceci reflète les résultats de l'enquête sur les services publics, qui a révélé certains problèmes de libération de cuivre (et de plomb) lorsque des chloramines étaient utilisées pour la deuxième désinfection (Sandvig et coll., 2012).
7.2.4 Âge des tuyaux et solubilité du cuivre
La libération de cuivre dans l'eau potable dépend beaucoup du type d'incrustations qui se forment dans les installations de plomberie, notamment, si elles se présentent sous la forme de films adhérents et minces de produits de corrosion comme l'oxyde de cuivre(I) (cuprite, Cu2O), l'oxyde de cuivre(II) (ténorite, CuO), ou le carbonate de cuivre (malachite, Cu2(OH)2CO3) (Schock et Lytle, 2011). On peut supposer qu'à un âge donné, un produit de corrosion déterminera la quantité de cuivre libéré dans l'eau potable. En ce qui concerne la corrosion uniforme, la solubilité de l'hydroxyde de cuivre(I) [Cu(OH)2] est la plus élevée et celles de la ténorite [CuO] et de la malachite [Cu2(OH)2CO3] sont les plus basses (Schock et coll., 1995). De même, Lagos et coll. (2001) ont observé une relation linéaire entre l'âge des tuyaux et la concentration moyenne de cuivre dissous dans l'eau. On a démontré que les incrustations les plus stables (malachite et ténorite) étaient également les plus vieilles, et que les moins stables (langite) étaient les plus jeunes. Les concentrations de cuivre continuent de diminuer avec l'âge des matériaux des installations de plomberie, même après 10 ou 20 ans d'utilisation, lorsque les incrustations de ténorite ou de malachite tendent à prédominer (Sharrett et coll., 1982; Neuman,1995; Edwards et McNeill, 2002). À court terme, le sulfate et le phosphate peuvent réduire les concentrations de cuivre en formant de la bronchantite et du phosphate de cuivre(II), mais, à long terme, ils peuvent prévenir la formation d'incrustations de ténorite et de malachite stables (Edwards et coll., 2002; Schock et Sandvig, 2009; Arnold et coll., 2012).
7.2.5 Temps de stagnation, âge de l'eau et débit
Les longs tuyaux de cuivre de petit diamètre produisent les concentrations les plus élevées lorsque l'eau y stagne (Kuch et Wagner, 1983; Ferguson et coll., 1996). Le comportement du cuivre est complexe en fonction de la stagnation de l'eau. Les concentrations de cet élément augmentent au début de la stagnation, mais elles peuvent ensuite diminuer ou continuer d'augmenter selon les teneurs de l'eau en oxydants. Lytle et Schock (2000) ont montré que les concentrations de cuivre augmentent rapidement avec la durée de la stagnation de l'eau, mais qu'elles retombent rapidement dès que la concentration d'oxygène dissout (OD) passe sous le seuil de 1 mg/L. Sorg et coll. (1999) ont également observé que lorsque l'eau est adoucie, les concentrations de cuivre augmentent jusqu'à atteindre des valeurs maximales de 4,4 et 6,8 mg/L après environ 20 à 25 heures de stagnation, et qu'elles retombent ensuite à 0,5 mg/L après 72 à 92 heures. Les concentrations maximales correspondent au moment où la teneur en OD est réduite à 1 mg/L ou moins. Dans l'eau non adoucie, la concentration maximale est atteinte en moins de 8 heures, puisque la concentration d'OD diminue plus rapidement dans les tuyaux en boucle exposés à ces conditions. En général, l'âge de l'eau dans une maison conventionnelle est de un jour. En comparaison, dans les bâtiments écologiques, l'âge de l'eau observée était de 2,7 jours dans une maison à bilan énergétique nul, de 8 jours dans un établissement de soins de santé ayant la cote « Or » de la norme LEED, et de 1 à 6 mois dans un bureau à bilan énergétique nul (Rhoads et coll., 2016). Une corrélation a été établie entre l'augmentation de l'âge de l'eau et la détérioration de sa qualité (perte de désinfectant résiduel, baisse du pH) (Masters et coll., 2015) et l'augmentation de sa population de microbes (Masters et coll., 2015; Rhoads et coll., 2016), et cela pourrait augmenter l'effet de corrosion de l'eau sur le cuivre. Alors que les technologies utilisées dans les bâtiments écologiques sont de plus en plus courantes, les conséquences de l'âge avancé de l'eau sur sa qualité et sur la corrosion devraient être prises en considération.
Les vitesses d'écoulement élevées peuvent parfois être associées à la corrosion par érosion ou au retrait mécanique de l'incrustation protectrice (corrosion par effet mécanique de l'eau) dans les tuyaux en cuivre. Une vitesse d'écoulement élevée, combinée à des propriétés corrosives de l'eau, peut rapidement altérer les matériaux des tuyaux. Par exemple, la combinaison d'une concentration élevée de Cl2, d'une vitesse d'écoulement continue, d'un pH faible et d'une alcalinité élevée est extrêmement agressive pour le cuivre (Sarver et coll., 2011; Schock et Lytle, 2011).
7.2.6 Température
Il n'existe pas de rapport simple entre la température et les processus de corrosion, puisque la température influe sur plusieurs paramètres de la qualité de l'eau, comme la solubilité de l'OD, la viscosité de la solution, les taux de diffusion, les coefficients d'activité, l'enthalpie des réactions, la solubilité des composés, les taux d'oxydation et l'activité biologique (McNeill et Edwards, 2002). Ces paramètres influent à leur tour sur le taux de corrosion, les propriétés des incrustations formées et le relargage des substances dans le réseau de distribution. Dans les systèmes d'eau chaude des bâtiments, la température élevée (> 60 °C) de l'eau, lorsqu'elle s'écoule à grande vitesse, est un facteur de corrosion par érosion (Ferguson et coll., 1996). Dans une étude portant sur la concentration de sous-produits de la corrosion du cuivre dans l'eau potable de tours d'habitation et de maisons unifamiliales du district régional du grand Vancouver, Singh et Mavinic (1991) ont observé que les concentrations de cuivre mesurées au robinet d'eau froide correspondaient généralement au tiers de celles mesurées au robinet d'eau chaude. On a comparé en laboratoire la teneur en cuivre d'une eau douce et de faible alcalinité à des températures de 4, 20, 24 et 60 °C. L'eau à 60 °C contenait plus de cuivre, mais la différence observée entre 4 et 24 °C était minime (Boulay et Edwards, 2001). On a toutefois indiqué que la solubilité de l'hydroxyde de cuivre diminuait à mesure que la température augmentait (Edwards et coll., 1996; Hidmi et Edwards, 1999). Une étude réalisée auprès de 365 services publics visés par la Lead and Copper Rule (LCR) de l'U.S. EPA n'a révélé aucune tendance notable entre la température et la concentration en cuivre de l'eau (Dodrill et Edwards, 1995).
7.2.7 Chlorure et sulfate
Traditionnellement, on croyait que le chlorure était très corrosif pour le cuivre, mais on a découvert qu'il était moins nuisible à sa solubilité que ce qui était estimé précédemment (Edwards et coll., 1994b). On a démontré que les concentrations élevées de chlorure (71 mg/L) réduisaient le taux de corrosion du cuivre à un pH de 7 à 8 (Edwards et coll., 1994a, 1994b, 1996; Broo et coll., 1997, 1999). Edwards et McNeill (2002) avancent que cette dichotomie peut s'expliquer si on prend en compte les effets à long terme plutôt que les effets à court terme : le chlorure augmente le taux de corrosion du cuivre à court terme, mais les sous-produits de cette corrosion protègent la surface de cuivre à plus long terme. Le sulfate est un puissant catalyseur de la corrosion qui participe à la corrosion du cuivre par piqûres (Schock, 1990; Edwards et coll., 1994b; Ferguson et coll., 1996; Berghult et coll., 1999). Bien qu'il ait été démontré que le sulfate réduit les concentrations de cuivre dans les matériaux de cuivre neufs, on a découvert que lorsque ces matériaux vieillissent, c.-à-d. qu'ils passent d'hydroxyde de cuivre(II) à oxyde de cuivre(II), les concentrations élevées de sulfate font augmenter les concentrations de cuivre dans l'eau (Edwards et coll., 2002). Les auteurs ont conclu que cela était dû à la capacité du sulfate à prévenir la formation d'incrustations de malachite et de ténorite, plus stables et moins solubles, appuyant ainsi l'hypothèse de Schock et coll. (1995), selon laquelle il est peu probable que les complexes de sulfate aqueux influencent considérablement la solubilité du cuivre dans l'eau potable.
7.2.8 Matières organiques naturelles
Des études portant sur la corrosion par piqûres de la plomberie de cuivre ont donné à conclure que certaine MON pourrait réduire la tendance de l'eau à causer ce type de corrosion, en favorisant la formation d'incrustations plus protectrices (Campbell, 1954a, 1954b, 1971; Campbell et Turner, 1983; Edwards et coll., 1994a; Korshin et coll., 1996; Edwards et Sprague, 2001). Toutefois, la MON contient des groupes complexants puissants, et on a démontré qu'elle pouvait augmenter la solubilité des produits de la corrosion du cuivre (Korshin et coll., 1996; Rehring et Edwards, 1996; Broo et coll., 1998, 1999; Berghult et coll., 1999, 2001; Edwards et coll., 1999; Boulay et Edwards, 2001; Edwards et Sprague, 2001). Néanmoins, on n'a pas démontré de façon concluante l'importance de la MON dans la solubilité du cuivre par rapport à celle des ligands concurrents (Schock et coll., 1995; Ferguson et coll., 1996). Une étude a démontré que la MON favorisait initialement la corrosion par piqûres dans certaines qualités d'eau et dans certains intervalles de concentration de MON limités. Toutefois, sur de longues périodes et avec des concentrations de MON plus élevées, on a observé une diminution de la corrosion par piqûres (Korshin et coll., 1996). De façon générale, l'étude a permis de conclure que la MON interagissaient avec le cuivre par sorption, augmentant la vitesse de relargage du cuivre et la dispersion des incrustations de corrosion.
Les travaux mécanistes d'Edwards et Sprague (2001) ont permis d'élucider certains des effets complexes et apparemment contradictoires de la MON sur le cuivre. On a démontré que la MON contribuait à la libération de sous-produits du cuivre par la complexation ou la mobilisation de colloïdes. La MON peut interférer dans le vieillissement des tuyaux en favorisant la formation d'hydroxyde de cuivre(II), de carbonate de cuivre et de complexes cuivre-MON très solubles et ainsi prévenir la formation du solide plus stable, la malachite. De façon réciproque, la MON peut être une bonne source de nourriture pour les bactéries, qui en retour consomment l'OD, déclenchant le redépôt du cuivre sur le tuyau en présence d'un catalyseur approprié (p. ex. le chlorure). En pratique, Arnold et coll. (2012) ont démontré, à l'échelle du laboratoire, que le l'enlèvement de la MON était une méthode pratique et efficace pour réduire la libération de cuivre dans une école aux prises avec des problèmes d'eau bleue. L'enlèvement de la MON augmentait la quantité d'OD (et la vitesse de corrosion) et augmentait conséquemment la formation d'incrustations. Les auteurs ont émis l'hypothèse qu'en absence de MON, la vitesse de corrosion augmentait, accélérant le processus de vieillissement naturel. Une inspection visuelle des tuyaux de cuivre a révélé un solide bleu vert associé aux cristaux stables de la malachite.
7.2.9 Corrosion influencée par les microorganismes
La corrosion influencée par les microorganismes est le résultat d'une réaction entre le matériau des tuyaux et les organismes qui s'y trouvent ou leurs sous-produits métaboliques, ou les deux (Schock et Lytle, 2011). L'activité microbienne peut influencer le pH, la solubilité du métal et l'Eh du microenvironnement avoisinant. Les biofilms sont des communautés de bactéries qui adhèrent aux surfaces, et leur interaction avec les surfaces de cuivre est complexe. Les bactéries peuvent interagir avec la surface de façon physique ou métabolique, ou encore servir de réservoir qui emmagasine les métaux libérés. Lorsque des biofilms se forment sur la surface, des microenvironnements corrosifs peuvent se former. Par exemple, l'espace sous le biofilm se trouve privé d'oxygène (anaérobie) et peut agir comme une anode pour la surface métallique avoisinante (cathode), provoquant ainsi une corrosion localisée (Javaherdashti, 2008). Les produits métaboliques acides peuvent également diminuer le pH de façon localisée (Little et coll., 1991) et faire diminuer le pH de l'eau libre (Davidson et coll., 1996). Les bactéries contenues dans un biofilm produisent des substances exopolymériques poisseuses qui tendent à être chargées négativement, offrant ainsi un site de liaison pour les ions métalliques chargés positivement (Qin-qin et coll., 2012). Précisément, on a démontré que le biofilm agissait comme un réservoir pour le cuivre libéré (Davidson et coll., 1996; Lehtola et coll., 2006; Qin-qin et coll., 2012; Payne et coll., 2016), ce qui représente une autre source potentielle d'exposition au cuivre dans l'éventualité où le biofilm se détacherait.
Plusieurs études en laboratoire, ainsi que des autopsies d'installations de plomberie en cuivre corrodé, ont indiqué que les bactéries et les biofilms jouaient un rôle important dans la solubilité du cuivre. Dutkiewicz et Fallowfield (1998) ont découvert que la libération de cuivre est plus importante lorsque le cuivre est exposé à l'espèce Agrobacterium (isolée à partir d'un biofilm dans un tuyau de cuivre trouvé à Adélaïde, en Australie), comparativement à un milieu témoin stérile. Dans le cadre d'une étude menée en Australie, des espèces de Sphingomonas et une espèce d'Acidovorax ont été associées à des surfaces de cuivre corrodé, et on a observé une espèce d'Acidovorax qui, dans un environnement de laboratoire où elle était nourrie avec des substances qui contenaient du cuivre, accumulait du cuivre pendant sa croissance (Critchley et coll., 2004). À l'inverse, on a observé que d'autres bactéries, comme la Stenotrophomonas maltophilia, avaient des effets de protection sur le cuivre, ce que les auteurs ont supposé être le résultat de la liaison des ions chlorure aux substances exopolymériques (Critchley et coll., 2003).
Le cuivre a des propriétés antimicrobiennes (Grass et coll., 2011) et, dans l'eau potable, on a observé un retard dans la formation de biofilm sur les tuyaux en cuivre par rapport aux tuyaux de polyéthylène. Même si, après 200 jours, la présence de virus sur le biofilm formé sur les tuyaux de cuivre avait grandement diminué, il n'y avait aucune différence significative dans le nombre de microorganismes (Lehtola et coll., 2004). Un lien de causalité entier ou partiel a été établi entre les biofilms et les cas d'eau bleue (Arens et coll., 1996; Critchley et coll., 2004), ainsi que la corrosion par piqûres (Fischer et coll., 1992; Reyes et coll., 2008; Burleigh et coll., 2014).
7.3 Cas d'eau bleue
La dissolution du cuivre peut rendre l'eau bleue ou verte, et elle se caractérise souvent par une fine dispersion de produits de corrosion du cuivre. Le cuivre particulaire paraît bleu pâle sous forme d'hydroxyde de cuivre et noir sous forme de sulfure de cuivre. Il est difficile de percevoir visuellement l'eau bleue, puisque l'eau colorée peut être purgée à la première chasse d'eau des toilettes ou à la première ouverture du robinet. La distance à laquelle on observe l'eau colorée influe également sur la perception. En effet, lorsqu'on observe l'eau dans une baignoire, à une distance typique, la coloration est visible à une concentration de 0,3 mg/L, mais cette concentration doit être de 3 mg/L pour que le cuivre particulaire soit visible dans un verre d'eau (Edwards et coll., 2000).
Aucune cause unique n'a été identifiée pour les incidents d'eau bleue : on présume qu'ils résultent d'une combinaison d'activité microbienne avec certaines conditions de qualité de l'eau. Critchley et coll. (2004) ont réussi à produire de l'eau bleue en laboratoire en inoculant des tuyaux de cuivre avec des extraits de corrosion de cuivre non stériles, même si l'eau utilisée n'était pas représentative de l'eau potable. Les auteurs ont noté un temps de réponse de neuf semaines avant que l'eau bleue ne soit apparente, ce qui permet de croire que le processus d'apparition de ce type de corrosion présente une phase initiale d'établissement. Auparavant, Arens et coll. (1996) avaient enquêté sur un cas d'eau bleue dans des tuyaux en cuivre récemment mis en service. On soupçonnait que la corrosion influencée par les microorganismes en était la cause, et Arens et coll. (1996) ont découvert que des sources variées de nourriture (p. ex le mastic d'étanchéité) augmentaient l'activité microbienne et la libération de cuivre. Arnold et coll. (2012) ont également rapporté la présence d'eau bleue et des concentrations élevées de cuivre (> 6 mg/L) dans les installations de plomberie neuves en cuivre lorsque l'eau présentait une alcalinité élevée (200 mg CaCO3/L) et un pH situé entre 7,15 et 7,4. L'enlèvement de la MON rendait le cuivre stable à long terme, puisqu'elle accélérait le vieillissement des tuyaux.
7.4 Alliages de laiton
Les laitons sont des alliages de cuivre, de zinc et d'autres constituants mineurs, comme le plomb. On croit que la dézincification du laiton est soit un relargage sélectif du zinc, soit un processus à étapes multiples dans lequel le zinc et le cuivre sont relargués par corrosion uniforme et le cuivre est redéposé, ce qui crée un effet net de relargage du zinc. Les deux mécanismes ont pour résultat de rendre la surface de cuivre poreuse et de l'affaiblir (Lytle et Schock, 1996; Sarver et coll., 2011). Les produits de corrosion de l'oxyde de zinc peuvent s'accumuler et former une structure comparable à de la meringue qui limite le débit, ce qui peut causer des fuites et des éclatements. Les laitons sont particulièrement vulnérables à la dézincification dans l'eau à alcalinité faible et à concentration de chlorure élevée (Sarver et coll., 2011). Idéalement, les laitons utilisés dans les installations de plomberie des bâtiments doivent avoir une faible concentration de zinc pour aider à rendre le laiton résistant à la dézincification. Toutefois, il est important de savoir que, dans les installations de plomberie en polyéthylène réticulé (PER), l'utilisation de raccords en laiton à teneur élevée en zinc (laiton jaune) est fréquente. Beaucoup de défaillances d'installations de plomberie associées au PER et à la dézincification des raccords en laiton ont été documentés en Amérique du Nord (U.S. District Court, 2011; Cour supérieure de justice de l'Ontario, 2011; Cour supérieure du Québec, 2011). En plus de la corrosion du laiton, qui a des conséquences financières, d'autres métaux sont libérés, dont le cuivre. Lytle et Schock (1996) ont démontré que la composition de l'alliage de laiton était un important facteur de la quantité de cuivre libéré et que de faibles changements de pH avaient un grand effet sur la libération du cuivre. À pH 8,5 et 7, les laitons rouges (à faible teneur en zinc) libéraient plus de cuivre que les laitons jaunes (à teneur élevée en zinc) et certains laitons rouges libéraient des concentrations de cuivre semblables à celles du cuivre pur. Les laitons libéraient plus de cuivre à pH 7 qu'à pH 8,5. Il est également important de souligner qu'à pH 7, les libérations de cuivre étaient plus sporadiques. En pratique, le laiton peut représenter une source considérable de libération de cuivre. En effet, dans un groupe de maisons dans le sud de la Californie, toutes équipées d'installations de plomberie en plastique, les raccords en laiton étaient la principale source de libération de cuivre. Les concentrations médianes de trois échantillonnages se trouvaient dans un intervalle de 85 à 185 µg/L.
7.5 Corrosion par piqûres
La corrosion par piqûres est une forme de corrosion non uniforme qui se produit dans tous les types de tuyaux et de tubes en cuivre et qui peut causer des fuites minuscules, une défaillance de plomberie coûteuse (Scardina et coll., 2008). Elle survient là où une pile de corrosion localisée se forme en raison de plusieurs mécanismes, comme une différence de taux d'oxygène ou un pH différentiel à la surface du tuyau. Dans la pile de corrosion localisée, la zone cathodique est protégée et la zone anodique est oxydée. Ainsi, des électrons sont libérés et le cuivre est appauvri, ce qui crée une cavité. La cavité peut finir par atteindre la paroi de cuivre, ce qui crée une petite piqûre. Si le cuivre est exposé à des conditions de qualité de l'eau non favorables avant qu'une incrustation protectrice ne se forme, une grave corrosion par piqûres peut se produire (Schock et Lytle, 2011). Le mécanisme responsable de l'amorçage de piqûres pourrait être le résultat d'un seul facteur ou de plusieurs facteurs combinés, notamment les imperfections de la surface, les résidus de carbone provenant de la fabrication, le flux de brasage tendre, la mauvaise qualité de l'eau ou l'activité des microorganismes. Certaines conditions relatives à la qualité de l'eau, à l'écoulement et à la microbiologie semblent provoquer ou propager des cavités, notamment : les eaux à pH élevé et à alcalinité faible, la présence de chlorure (Lytle et Schock, 2008; Lytle et Nadagouda, 2010) et de sulfures (Jacobs et coll., 1998; Jacobs et Edwards, 2000); le chlore, un pH élevé, une alcalinité faible (Sarver et coll., 2011); la présence de certains biofilms (Fischer et coll., 1992; Reyes et coll., 2008; Burleigh et coll., 2014); la configuration du tuyau (Fisher et coll., 1992) et une vitesse de courant élevée (Custalow, 2009). Schock et Lytle (2011) décrivent les trois types de corrosion par piqûres du cuivre (en se basant sur les propriétés chimiques et physiques) : par l'eau froide (type 1), par l'eau chaude (type 2) et par l'eau douce (type 3), ainsi que les conditions généralement associées à chaque type. Il est important de souligner que le sulfate et le chlorure sont généralement associés, d'une manière ou d'une autre, à toutes les formes de piqûres, bien que l'importance du chlorure dans la corrosion par piqûres du cuivre comparativement à celle du sulfate soit encore l'objet d'un débat (Schock et Lytle, 2011).
Dans des expériences en laboratoire, le fait d'ajouter 3 mg PO4/L ou d'augmenter la concentration de CID à 50 mg/L (à partir d'une concentration située entre 5 et 25 mg/L) était efficace pour prévenir l'amorçage de piqûres à pH 9 (Lytle et Schock, 2008). On a émis l'hypothèse que le phosphate pourrait déplacer d'autres anions de l'anode et faire concurrence au Cu(II) pour les sites de liaison pour former ainsi une incrustation relativement stable, et que l'alcalinité diminuerait l'amorçage de piqûres, soit en limitant les différences de pH à la surface, soit en formant des carbonates de cuivre et en diminuant les précipités à la surface. Selon Ha et Scully (2013), l'ajout de phosphate (sous la forme Na2HPO4) inhiberait l'amorçage de piqûres en augmentant la passivation et en empêchant la dissolution du cuivre. Lytle et Nadagouda (2010) ont analysé la composition élémentaire des cavités de cuivre dans les installations de plomberie résidentielle et ont découvert que le chlorure était concentré au fond des cavités ainsi que dans les fentes et les imperfections à proximité de la surface, ce qui portait à croire que le chlorure joue un grand rôle dans la propagation des cavités. Bien qu'on ait démontré que la présence de chlorure jouait un rôle crucial dans l'amorçage de piqûres, Edwards et coll. (1994a) ont émis l'hypothèse qu'en raison des expositions prolongées (avec formation d'une grande quantité d'incrustations) le chlorure pourrait avoir un effet de protection. On a démontré que les sulfures représentaient également un important facteur causal de la corrosion du cuivre et qu'ils étaient associés à la corrosion par piqûres à pH 9,2 (Jacobs et Edwards, 2000).
Burleigh et coll. (2014) ont étudié la corrosion par piqûres dans les tubes en cuivre de multiples conduites d'eau froide à Santa Fe, au Nouveau-Mexique, et ont découvert la présence d'actinobactéries au fond des cavités. Selon les auteurs, le rôle des actinobactéries dans la corrosion par piqûres du cuivre pourrait consister soit à excréter un produit métabolique acide, soit à utiliser du cuivre comme source d'énergie (Burleigh et coll., 2014). Reyes et coll. (2008) ont comparé deux communautés au Chili, une en milieu rural (pH 6,2; CaCO3 = 63 mg/L; absence de chlore) et une en milieu urbain (pH 6,9; CaCO3 = 98 mg/L; traitement au chlore). Bien que la qualité de l'eau était semblable dans les deux communautés, les concentrations de cuivre dans l'eau stagnante étaient différentes. Dans les maisons en milieu rural, les concentrations de cuivre dans l'eau stagnante étaient de 5 mg/L, alors que celles dans les maisons en milieu urbain étaient de 0,4 mg/L. Pendant l'enquête sur la libération de cuivre dans les maisons en milieu rural, les auteurs ont découvert que seul un quart de la libération de cuivre pouvait être attribué aux facteurs de qualité de l'eau et on a suspecté les microorganismes comme autre agent causal de la libération de cuivre. Dans les tuyaux des maisons en milieu rural contenant des biofilms, de la corrosion par piqûres a été observée sur la surface, alors qu'en absence de biofilms, aucune corrosion par piqûres n'a été observée. On a également démontré qu'une vitesse du courant élevée augmentait la corrosion par piqûres dans l'eau chlorée à pH élevé (Custalow, 2009), probablement parce qu'elle entraîne un apport continu d'agents oxydants aux régions cathodiques d'une pile de corrosion localisée (Sarver et coll., 2011). Des fuites dans les tuyaux présentent un risque supplémentaire pour la santé, puisqu'elles sont susceptibles d'entraîner la formation de moisissures (Scardina et coll., 2008) et nuire ainsi à la qualité de l'air intérieur (Santé Canada, 2016).
7.6 Effets des changements du traitement ou de la qualité de l'eau sur la libération du cuivre
Les dépôts et les incrustations de corrosion dans les réseaux de distribution sont en équilibre fragile avec l'environnement aqueux, et les gestionnaires de services publics doivent savoir que des changements de qualité de l'eau peuvent avoir des répercussions sur la stabilité des incrustations dans le réseau de distribution. Certaines techniques de traitement peuvent augmenter la quantité de cuivre dans l'eau potable en modifiant des paramètres de qualité de l'eau qui ont une influence sur la libération de cuivre. Tout changement apporté au traitement de l'eau en vue de régler un problème pourrait se répercuter négativement sur un autre objectif du traitement. Par exemple, on a démontré que le remplacement d'un agent de coagulation contenant du sulfate par un agent de coagulation contenant du chlorure augmentait le rapport de masse chlorure/sulfate et la libération de plomb dans les matériaux de plomberie des bâtiments (Edwards et Triantafyllidou, 2010).
Dans le processus d'échange d'anions destiné à éliminer des contaminants comme l'uranium, la résine échangeuse d'ions fraîchement régénérée élimine les ions bicarbonate. Cela a pour effet de réduire le pH et l'alcalinité totale durant les 100 premiers volumes du lit d'un passage en colonne, et il peut être nécessaire d'augmenter le pH de l'eau traitée au début d'un passage en colonne pour empêcher la corrosion (Clifford, 1999; Wang et coll., 2010; Clifford et coll., 2011). La régénération fréquente d'une résine échangeuse d'ions peut affecter la corrosion. Dans une étude de cas réalisée dans le Maine, il était nécessaire de régénérer souvent la résine pour réduire les concentrations d'uranium dans le débit concentrat (résidus). Cela a entraîné une diminution considérable et continue du pH et, subséquemment, un relargage de cuivre et de plomb dans l'eau potable (Lowry, 2009, 2010). Comme l'OI élimine continuellement et complètement l'alcalinité de l'eau, elle diminuera sans cesse le pH de l'eau et augmentera sa corrosivité. Par conséquent, le pH de l'eau ainsi traitée doit être ajusté afin d'éviter des problèmes de corrosion dans le réseau de distribution, comme le relargage du plomb et du cuivre (Schock et Lytle, 2011; U.S. EPA, 2012). De plus, le fait de passer de l'adoucissement à la chaux — qui équilibre la dureté et l'alcalinité à un pH élevé — à l'adoucissement par échange d'ions peut entraîner une alcalinité élevée, corrosive pour le cuivre (Schock et Lytle, 2011).
D'ailleurs, tout changement apporté à l'eau prête au débit en vue de régler un problème de corrosion peut provoquer d'autres changements non désirés dans le réseau de distribution. Par exemple, en élevant le pH de l'eau prête au débit au-dessus de 9 afin de réduire la libération de cuivre des installations de plomberie d'un bâtiment, on provoque la précipitation de manganèse dissous dans l'eau traitée et des problèmes d'ordre esthétique peuvent en découler.
De plus, il importe de tenir compte du fait que les dépôts dans les réseaux de distribution sont sensibles aux variations de la qualité de l'eau. Les dépôts dans les réseaux de distribution sont constitués du matériau sous-jacent corrodé (p. ex. la fonte) et des substances inorganiques trace qui se sont accumulées au cours de la durée de vie utile de la conduite maîtresse. Friedman et coll. (2010) ont découvert que des contaminants inorganiques trace (notamment du baryum, du plomb, du nickel, du vanadium, de l'arsenic, du radium, du chrome et de l'uranium) s'étaient accumulés dans les dépôts de manganèse dans les réseaux de distribution. Gerke et coll. (2016) ont rapporté une accumulation de cuivre dans les dépôts de manganèse formés dans les réseaux de distribution chlorés et chloraminés. La stabilité des dépôts de substances inorganiques dépend du maintien de la stabilité des conditions de qualité de l'eau (p.ex., pH, Eh, contrôle de la corrosion), ainsi que d'éviter le mélange non maîtrisé aussi bien de l'eau prélevée à la source [souterraine et de surface] que de l'eau chlorée et de l'eau chloraminée) (Friedman et coll., 2010).
Avant de modifier la qualité de l'eau en vue d'atteindre un nouvel objectif de traitement, comme le contrôle de la corrosion, les services publics devraient réaliser des études pilotes afin de comprendre comment une modification proposée de la qualité de l'eau affectera les divers composants de leur réseau de distribution.
7.7 Atténuation de la libération de cuivre
Le choix d'une stratégie d'atténuation de la libération du cuivre, y compris les ajustements de la qualité de l'eau, doit tenir compte des autres métaux présents, puisque d'une stratégie à l'autre, les effets sur les différents métaux peuvent varier. Il est recommandé d'utiliser des bancs d'essais de tuyaux dans les conditions de qualité de l'eau propres au site, puisque le procédé d'essais peut aider à choisir une stratégie anticorrosion efficace et à anticiper les effets non désirés. En général, la concentration de métaux trace augmente lorsque l'eau stagne, mais il peut y avoir une variation en fonction de la qualité de l'eau. Par exemple, dans l'eau qui stagne dans les installations de plomberie où il y a présence d'oxydants, les concentrations de cuivre peuvent augmenter pendant 48 à 72 heures. Ainsi, la purge de l'eau présente dans les installations de plomberie peut réduire considérablement les concentrations de cuivre. C'est pourquoi elle est considérée comme une stratégie d'atténuation. Toutefois, la purge du robinet d'eau froide risque de ne pas suffire pour réduire les concentrations de cuivre (Singh et Mavinic, 1991; Murphy, 1993; Barn et coll., 2014). Il est donc préférable, pour que la qualité de l'eau soit acceptable toute la journée, d'effectuer des purges périodiques au cours de la journée et de plus grosses purges après les périodes de stagnation prolongées (vacances, fins de semaine).
Il est également possible de réduire provisoirement l'exposition au cuivre en utilisant des dispositifs de traitement de l'eau potable. Cependant, il faut savoir que lorsque les concentrations de cuivre sont élevées, la capacité des dispositifs de traitement risque de diminuer, et il sera nécessaire de les remplacer plus fréquemment.
7.7.1 Alcalinité et pH
La solubilité du cuivre est grandement influencée par l'alcalinité (en raison de la complexation du carbonate) et le pH dans les installations de plomberie relativement récentes (Edwards et coll., 1994b; Dodrill et Edwards, 1995). Toutefois, on a également remarqué que les eaux souterraines à alcalinité élevée sont particulièrement agressives envers les matériaux de cuivre (Schock et Lytle, 2011).
L'ajustement du pH à l'usine de traitement de l'eau est la méthode la plus courante pour réduire la corrosion dans les réseaux de distribution d'eau potable et le relargage de contaminants, comme le cuivre, dans l'eau distribuée. La hausse du pH est l'une des méthodes permettant de réduire efficacement la corrosion du cuivre, et de réduire ainsi au minimum les concentrations de cuivre dans l'eau potable. En général, le contrôle de la corrosion uniforme du cuivre est optimal à un pH supérieur à 7, la valeur exacte dépendant de l'alcalinité (Schock et Lytle, 2011). Les produits chimiques utilisés dans le traitement en vue d'ajuster le pH comprennent la soude caustique, la potasse, la chaux et l'acide sulfurique. L'utilisation du CO2 avec soit du carbonate de sodium (Na2CO3), soit du bicarbonate de sodium (NaHCO3) permet également un ajustement minimal du pH, mais cette méthode sert principalement à ajuster l'alcalinité. L'aération est une méthode de traitement sans produits chimiques qui introduit de l'air dans l'eau, ce qui élimine le CO2 et fait augmenter le pH. Une autre méthode d'ajustement du pH est l'utilisation de contacteurs au calcaire : l'eau circule à travers un lit de calcaire concassé, qu'elle dissout, ce qui fait augmenter le pH (ainsi que l'alcalinité et la concentration de calcium). Ces deux dernières méthodes ne permettent pas de réguler précisément le pH. Une combinaison de chaux ou de soude caustique et de dioxyde de carbone améliore la précision, car elle permet d'ajuster le pH et l'alcalinité de l'eau séparément (Schock, 1999).
L'alcalinité, combinée au pH, sert à réguler l'effet tampon dans la plupart des systèmes d'eau. Ainsi, une alcalinité minimale est nécessaire pour que le pH soit stable dans le réseau de distribution, ce qui est nécessaire pour limiter la corrosion du cuivre (et d'autres métaux, comme le plomb). L'alcalinité peut améliorer le pouvoir tampon à un pH donné. Une hausse ou une baisse du pH peut augmenter considérablement le pouvoir tampon de l'eau, comme on peut le constater dans les courbes d'intensité de l'effet tampon établies par Schock et Lytle (2011). Ceci a été démontré en pratique par Clement et coll. (1998) dans une étude sur le terrain réalisée à Concord, au New Hampshire, dans laquelle des ajustements mineurs du pH et de l'alcalinité ont amélioré la stabilité du pH dans le réseau de distribution, ainsi que le contrôle de la corrosion. Dans les eaux à très faible alcalinité, il est possible d'ajuster l'alcalinité en ajoutant des ions carbonate, avec du Na2CO3 ou du NaHCO3. Comme il a été mentionné précédemment, ces produits chimiques sont également utilisés pour ajuster le pH car ils ajoutent des ions carbonate (CO32−) ou bicarbonate (HCO3−). Il importe de souligner que le nombre d'ions carbonate présents dans la solution est une fonction complexe du pH, de la température et d'autres paramètres relatifs à la qualité de l'eau (Schock, 1999).
7.7.2 Ajout d'inhibiteurs de corrosion
Les inhibiteurs de corrosion à base de phosphate et de silicate sont généralement utilisés pour contrôler la corrosion dans l'eau potable. Les plus communs sont ceux à base de phosphate, avec ou sans zinc, notamment l'orthophosphate ou le polyphosphate (généralement des polyphosphates mélangés). Les inhibiteurs de corrosion à base de silicate (c.-à-d. les silicates de sodium) ont également été utilisés pour contrôler la corrosion. L'efficacité des inhibiteurs de corrosion est souvent testée par des essais pilotes ou en laboratoire et dépend à la fois de la qualité de l'eau et des conditions présentes dans le réseau de distribution. L'efficacité des inhibiteurs de corrosion dépend en grande partie du maintien d'une concentration résiduelle de l'inhibiteur dans l'ensemble du réseau de distribution, ainsi que du pH et de l'alcalinité de l'eau. La mesure de la concentration d'inhibiteurs dans le réseau de distribution fait partie des bonnes pratiques de contrôle de la corrosion. En général, il est impossible d'établir des corrélations directes entre la concentration résiduelle d'inhibiteurs dans le réseau de distribution et la concentration de métaux au robinet, dont celle du cuivre.
Santé Canada recommande aux services d'eau utilisent des additifs pour l'eau potable, comme les inhibiteurs de corrosion, qui ont été certifiés conformes à la norme basée sur la santé NSF/ANSI applicable. Les inhibiteurs de corrosion à base de phosphate et de silicate sont compris dans la norme 60 de NSF/ANSI, intitulée Drinking Water Treatment Chemicals – Health Effects (NSF International, 2015a). Les normes ont été conçues pour préserver la qualité de l'eau potable en garantissant que les additifs respectent les exigences minimales quant à leurs effets sur la santé et que leur présence dans l'eau potable ne pose pas de danger.
7.7.2.1 Inhibiteurs à base de phosphate
L'orthophosphate et l'orthophosphate de zinc sont les inhibiteurs que la documentation scientifique signale le plus souvent comme étant efficaces pour la réduction de la concentration de cuivre dans l'eau potable (Bancroft, 1988; Reiber, 1989; Boffardi, 1993; Johnson et coll., 1993; Dodrill et Edwards, 1995; Rezania et Anderl, 1995, 1997; Schock et coll., 1995; Boireau et coll., 1997; MacQuarrie et coll., 1997; Churchill et coll., 2000; Schock et Fox, 2001; Becker, 2002; Dudi, 2004; Kirmeyer et coll., 2004). L'orthophosphate est généralement utilisé pour limiter la contamination par le plomb lorsque la régulation du pH et l'ajustement de l'alcalinité ne suffisent pas à enrayer la corrosion (Vik et coll., 1996) : ses effets sur le cuivre sont considérés comme secondaires.
Selon certains auteurs, l'utilisation de l'orthophosphate entraînerait à court terme une réduction des concentrations de cuivre, mais préviendrait, à plus long terme, la formation d'incrustations plus stables comme la malachite et la ténorite (Schock et Clement, 1998; Edwards et coll., 2001; Cantor et coll., 2003; Schock et Sandvig, 2009). Il semble par ailleurs qu'un traitement au phosphate d'abord jugé inefficace pour la réduction de la corrosion du cuivre ait donné de bons résultats après une augmentation des concentrations de phosphate utilisées ou après une optimisation du pH et des concentrations d'orthophosphate (Schock et coll., 1996; Schock et Fox, 2001). Schock et Fox (2001) ont obtenu une réduction concluante de la corrosion du cuivre dans de l'eau très alcaline en utilisant de l'orthophosphate dans des conditions où les ajustements du pH et de l'alcalinité ne donnaient pas de bons résultats. De façon similaire, Grace et coll. (2012) ont découvert que l'orthophosphate dosé à 3 mg/L réduisait efficacement des concentrations de cuivre de 1,4 mg/L à 2,4 mg/L à des concentrations inférieures à 1,3 mg/L dans de l'eau très alcaline (273 mg/L) au pH neutre (7,4). Des résultats obtenus à l'échelle du laboratoire laissaient également présager qu'une augmentation du pH à 8,4 aurait également pu être efficace; toutefois, en raison de la forte alcalinité de l'eau, cette option a été écartée, puisqu'on craignait la formation d'un dépôt de carbonate de calcium sur les composants du réseau de distribution (Grace et coll., 2012).
Une étude réalisée dans 365 services publics visés par la LCR de l'U.S. EPA a également révélé que les services publics qui utilisaient de l'orthophosphate n'avaient des concentrations de cuivre très basses que lorsque le pH était inférieur à 7,8 et que l'alcalinité était inférieure à 74 mg CaCO3/L (Dodrill et Edwards, 1995). Les données disponibles concernant l'effet des polyphosphates sur la solubilité du cuivre sont limitées. En règle générale, les polyphosphates augmentent la vitesse de corrosion du cuivre (Vik et coll., 1996). Dans une étude de cas, Cantor et coll. (2000) ont rapporté que l'utilisation d'un mélange de polyphosphates, à l'une des trois installations à l'étude, augmentait les concentrations de cuivre au robinet. Dans une étude de banc d'essais de tuyaux de cuivre, Edwards et coll. (2002) ont rapporté que bien que les polyphosphates réduisent généralement les concentrations de cuivre soluble, ils augmentent également de façon considérable ces concentrations à un pH de 7,2 et une alcalinité de 300 mg CaCO3/L, puisqu'ils entravent la formation d'incrustation de malachite plus stables.
McNeill et Edwards (2004) se sont servis d'expériences en laboratoire pour comparer l'efficacité de l'orthophosphate, des polyphosphates et de l'orthophosphate de zinc. L'ajout d'orthophosphate (1 mg/L) a été associé à une diminution de la libération de cuivre soluble, même si aucune différence n'a été observée quant à la libération de cuivre particulaire par rapport à la solution témoin. L'ajout de polyphosphates (1 mg/L) a entraîné une diminution de la libération de cuivre soluble comparativement à l'orthophosphate, mais également une augmentation de la libération de cuivre particulaire. L'ajout d'orthophosphate de zinc a réduit la libération de cuivre soluble, mais a fait augmenter la libération de cuivre particulaire par rapport à l'orthophosphate, sauf à pH 9,5. De plus, la libération de cuivre particulaire a augmenté avec le vieillissement des tuyaux de cuivre traités à l'orthophosphate de zinc. La comparaison des inhibiteurs de corrosion à base de phosphate souligne l'importance d'utiliser dans les tests une qualité de l'eau propre au site et de réaliser des études pilotes ou de banc d'essais de tuyaux avant de choisir un inhibiteur de corrosion approprié pour un système d'eau donné. Il est également important de savoir que le phosphate peut réduire les concentrations de cuivre en formant du phosphate de cuivre(II), mais qu'il peut également prévenir la formation des incrustations plus stables de ténorite et de malachite (Edwards et coll., 2002; Arnold et coll., 2012).
7.7.2.2 Inhibiteurs à base de silicate
Les données disponibles concernant l'effet du silicate de sodium sur la solubilité du cuivre sont limitées. Comme il s'agit d'un composé chimique basique, sa présence est toujours associée à une augmentation du pH. Il est donc difficile de lui attribuer la réduction des concentrations de cuivre, puisqu'une augmentation du pH pourrait produire le même résultat. Une étude menée par Schock (2005) dans un service public de taille moyenne a permis de résoudre simultanément un problème de fer dans la source d'eau ainsi qu'un problème de relargage de cuivre et de plomb dans le système de plomberie, grâce à l'ajout de silicate de sodium associé à une chloration. Du silicate de sodium a été ajouté dans les trois puits qui présentaient des concentrations élevées de fer et de manganèse et qui approvisionnaient des foyers équipés d'entrées de service en plomb. Un quatrième puits n'a nécessité qu'une chloration et un ajustement de pH à l'aide d'hydroxyde de sodium. Dans les trois premiers puits, une dose initiale de 25 à 30 mg/L de silicate a fait augmenter le pH de 6,3 à 7,5 et a fait diminuer immédiatement les concentrations de plomb et de cuivre respectivement de 55 et 87 %. Une augmentation de la dose de silicate à 45 55 mg/L a fait monter le pH à 7,5 et donné lieu à une réduction encore plus importante des concentrations de plomb et de cuivre (respectivement 0,002 mg/L et 0,27 mg/L).
Lintereur et coll. (2011) ont comparé trois doses différentes de silicate de sodium (3 mg/L, 6 mg/L et 12 mg/L) et découvert que le silicate de sodium entraînait effectivement une réduction de la libération de cuivre, comparativement au témoin (c.-à-d. aucun traitement) et au témoin avec augmentation du pH. La réduction semblait dépendre de la dose : les libérations de cuivre les plus faibles ont été observées avec les doses de silicate de sodium les plus élevées. En outre, une analyse de l'incrustation a révélé la formation d'un dépôt de silicate de cuivre sur des coupons de corrosion recueillis dans les systèmes traités au silicate, ce qui prouve que la formation d'un dépôt de silicate est au moins en partie responsable de l'action inhibitoire des silicates de sodium. Woszczynski et coll. (2015) ont découvert que les silicates de sodium (18 mg-Si/L, pH de 7,3 et pH de 6,3) n'avaient pas d'effet sur le contrôle du cuivre, comparativement au traitement à l'aide de phosphate (0,8 mg-PO4/L, pH de 7,3). Les auteurs ont constaté que le pH avait une incidence sur l'efficacité du silicate et ont supposé que les conditions de qualité de l'eau pourraient avoir une incidence sur l'efficacité du silicate de sodium.
7.7.3 Atténuation des cas d'eau bleue
L'eau bleue demeure un phénomène difficile à comprendre, et les conseils relatifs à sa gestion sont limités. Les stratégies de gestion à court terme incluent le choc thermique (> 60 °C) (Arens et coll., 1996) ou un traitement intensif par surchlorination unique (Edwards et coll., 2000), bien que le phénomène d'eau bleue puisse survenir de nouveau. Arnold et coll. (2012) ont découvert que L'enlèvement de la MON à l'aide de CAG constituait une solution pratique à long terme en vue de résoudre un problème d'eau bleue.
Les agents séquestrants, tels que les polyphosphates, masquent la libération de cuivre, ce qui améliore la qualité esthétique de l'eau sans réduire les concentrations en cuivre, et peut, dans certains cas, augmenter les concentrations en cuivre. Cantor et coll. (2000) ont produit un rapport sur un incident survenu au Wisconsin, où des polyphosphates étaient utilisés pour la séquestration du fer dans l'eau souterraine, dure et fortement alcaline, d'une collectivité parmi un groupe de trois. Après ce traitement, des maladies associées au cuivre ont été signalées au Department of Health and Family Services du Wisconsin, qui les a ensuite confirmées (Knobeloch et coll., 1994). Les plus fortes concentrations de cuivre (jusqu'à 5 mg/L) ont été découvertes dans les maisons nouvellement construites et nouvellement rénovées. Ces concentrations ont diminué avec le temps, une fois que les polyphosphates ont cessé d'être employés (Cantor et coll., 2000). De façon générale, l'emploi d'agents séquestrants n'est pas recommandé pour atténuer la libération du cuivre.
7.7.4 Atténuation de la corrosion par piqûres de cuivre et dézincification
Étant donné la variation des conditions relatives à la qualité de l'eau, aux microorganismes et à l'écoulement, qui peuvent exercer une influence sur la tendance à la corrosion par piqûres, les services publics devraient considérer l'utilisation d'outils tels que ceux découverts au cours de l'étude menée par Sarver et coll. (2011). Ces outils aident les services publics à éviter ou à atténuer la corrosion par piqûres et à adopter d'importants changements de qualité de l'eau, y compris le L'enlèvement de la MON, des phosphates et du silicate, de même que le traitement des eaux contenant du chlorure, ou présentant un pH élevé ou une faible alcalinité. En outre, les services publics devraient mener des essais pilotes afin d'évaluer la qualité de leur eau ainsi que tout changement potentiel à apporter à la qualité de leur eau, l'objectif étant à la fois de diagnostiquer les problèmes et de déterminer les solutions possibles (Lytle et Schock, 2008; Lytle et coll., 2012). Les services publics pourraient se servir du système de tuyauterie en boucle à faible coût décrit par Lytle et coll. (2012) comme instrument évaluatif.
Les conditions de qualité de l'eau associées à la tendance à la dézincification ne sont pas clairement définies comparativement au phénomène de corrosion par piqûres du cuivre. Toutefois, une eau à faible concentration de chlorure et à forte alcalinité est associée à une diminution de la dézincification (Sarver et coll., 2011). Lytle et Schock (1996) ont découvert que l'orthophosphate ne présentait pas d'avantages clairs à un pH de 7 et de 8,5, bien qu'ils aient supposé que l'orthophosphate pourrait être plus efficace contre le relargage du cuivre provenant du laiton à un pH de 6,5 (Lytle et Schock, 1996). Sarver et coll. (2011) ont proposé que les services publics déterminent l'agressivité de leur eau sur les laitons spéciaux, communiquent ces renseignements aux intéressés (consommateurs et promoteurs immobiliers) et encouragent l'utilisation de laitons spéciaux résistants à la dézincification.
7.8 Effets des ions de cuivre sur la libération du plomb
Il a également été observé que le cuivre jouait un rôle dans la libération de plomb dans les installations de plomberie en aval. Clark et coll. (2015) ont constaté que les dépôts de cuivre sur les surfaces en plomb sous certaines conditions augmentaient considérablement la libération de plomb. Les dépôts de cuivre pourraient agir à titre de petites connexions galvaniques sur la surface en plomb, selon une hypothèse. La solubilité du cuivre est directement corrélée au dépôt de cuivre et à la libération de plomb. D'après des études menées en laboratoire, Hu et coll. (2012) ont déduit qu'entre 37 et 92 % du Cu2+ présent dans l'eau chloraminée et qu'entre 62 et 91 % du Cu2+ présent dans l'eau chlorée s'est accumulé sur un nouveau tuyau en plomb, dans des conditions de stagnation. En outre, on a observé que les conditions relatives à la stagnation et au débit de l'eau ont une incidence sur le dépôt de cuivre : la libération de plomb était maximale dans un système chloré lorsque l'eau s'écoulait, tandis que lorsque l'eau stagnait, la libération était plus grande dans un système chloraminé. Toutefois, les conditions d'écoulement et les qualités d'eau précisément responsables de l'aggravation des effets du dépôt de cuivre nécessitent davantage d'études. L'effet du dépôt de cuivre sur la libération de plomb pourrait être un facteur important à considérer lorsque la tuyauterie de cuivre en amont est suivie de matériaux contenant du plomb, par exemple en cas de remplacement partiel des entrées de service en plomb.
7.9 Échelle résidentielle
Il n'est généralement pas recommandé d'utiliser des dispositifs de traitement de l'eau potable pour un traitement additionnel des eaux déjà traitées par une municipalité. Cependant, comme la première source de cuivre dans l'eau potable est le relargage provenant des composants de plomberie et du réseau de distribution, un dispositif résidentiel privé de traitement de l'eau potable représente la meilleure option pour réduire les concentrations de cuivre dans l'eau du robinet. Par contre, l'utilisation de tels dispositifs ne devrait pas être considérée comme une solution permanente.
Avant d'installer un dispositif de traitement, il convient de faire analyser l'eau afin d'en caractériser la chimie générale et d'en vérifier la concentration en cuivre. Il faut faire analyser régulièrement l'eau pénétrant dans l'appareil de traitement, de même que l'eau traitée, par un laboratoire agréé afin de s'assurer que l'appareil en question est efficace. Les dispositifs fonctionnant par adsorption peuvent devenir moins efficaces avec l'usage et le temps et doivent donc être entretenus ou remplacés. Les consommateurs doivent suivre les instructions du fabricant en ce qui concerne la durée de vie prévue des composants de leur dispositif de traitement qui servent à l'adsorption, et faire réviser le dispositif quand il le faut.
Santé Canada ne recommande pas de dispositifs de traitement de marques particulières, mais recommande fortement aux consommateurs d'utiliser un dispositif qu'un organisme de certification accrédité a certifié conforme aux normes applicables aux unités de traitement de l'eau NSF/ANSI. Ces normes visent à préserver la qualité de l'eau potable en aidant à assurer l'innocuité des matériaux et l'efficacité des produits qui entrent en contact avec elle. Les organismes de certification garantissent qu'un produit est conforme aux normes en vigueur et doivent être accrédités par le Conseil canadien des normes (CCN). Au Canada, les organismes suivants ont été accrédités par le CCN pour certifier que les dispositifs et le matériel de traitement de l'eau potable sont conformes aux normes NSF/ANSI (CCN, 2016) :
- CSA Group;
- NSF International;
- Water Quality Association;
- UL LLC;
- Bureau de normalisation du Québec;
- Truesdail Laboratories;
- International Association of Plumbing & Mechanical Officials.
On peut obtenir une liste à jour des organismes de certification accrédités par le CCN en s'adressant directement au CCN (2016).
En milieu résidentiel, les dispositifs de traitement de l'eau potable peuvent être installés au robinet (point d'utilisation) ou à l'endroit où l'eau entre dans la maison (point d'entrée) pour réduire les concentrations de contaminants. Il est préférable d'utiliser des systèmes au point d'utilisation pour éliminer le cuivre, car les concentrations de cuivre peuvent augmenter dans l'installation de plomberie et l'exposition à ces contaminants présents dans l'eau potable ne constitue un problème que s'ils sont ingérés (c.-à-d. que l'absorption cutanée et l'absorption par inhalation ne sont pas des voies d'exposition importantes). Ainsi, ces dispositifs de traitement au point d'utilisation installés sur chaque robinet d'eau potable sont considérés comme étant le meilleur moyen de réduire les concentrations à des niveaux sécuritaires immédiatement avant la consommation d'eau ou la préparation d'aliments ou de boissons.
Il existe un certain nombre de dispositifs de traitement à usage résidentiel certifiés capables d'abaisser la concentration de cuivre dans l'eau potable à un niveau inférieur à la CMA de 2 mg/L. L'adsorption (c.-à-d. charbon en bloc/résine), l'OI et la distillation sont des techniques de traitement efficaces à l'échelle résidentielle pour éliminer le au robinet. Il existe à l'heure actuelle des dispositifs résidentiels certifiés pour la réduction du cuivre dans l'eau potable par un traitement d'adsorption, d'OI et de distillation.
Pour qu'un dispositif de traitement de l'eau potable soit certifié conforme à la norme NSF/ANSI 53 (Drinking Water Treatment Units – Health Effects) pour l'enlèvement du cuivre, il doit pouvoir diminuer une concentration de cuivre de 3 mg/L dans l'influent à une concentration finale maximale inférieure à 1,3 mg/L (NSF/ANSI, 2015b). Les dispositifs certifiés conformes à la norme NSF/ANSI 53 reposent généralement sur une technique d'adsorption sur charbon actif.
Les systèmes d'OI certifiés conformes à la norme NSF/ANSI 58 (Reverse Osmosis Drinking Water Treatment Systems) peuvent également être certifiés pour la réduction de la teneur en cuivre à une concentration finale inférieure à 1,3 mg/L (NSF/ANSI, 2015c). Les systèmes d'OI certifiés conformes à cette norme ne sont conçus que pour une installation au point d'utilisation, car l'eau traitée par de tels systèmes peut avoir un effet corrosif sur la plomberie. L'OI nécessite des quantités relativement grandes d'eau influente pour obtenir le volume souhaité d'eau potable, car ces systèmes rejettent une partie de l'eau influente. Il arrive parfois que le consommateur doive prétraiter l'eau influente afin de réduire l'encrassement et de prolonger la durée de vie de la membrane.
Les systèmes de distillation certifiés conformes à la norme NSF/ANSI 62 (Drinking Water Distillation Systems) peuvent également être certifiés pour la réduction de la teneur en cuivre à une concentration finale inférieure à 1,3 mg/L (NSF/ANSI, 2015d). Les systèmes de distillation qui seraient certifiés conformes à cette norme sont également conçus uniquement pour une installation au point d'utilisation, pour les mêmes raisons que celles évoquées précédemment. La distillation est efficace pour réduire la quantité de cuivre, mais elle nécessite une alimentation en énergie électrique.
Santé Canada recommande fortement que tout composant utilisé dans ces systèmes de traitement soit certifié conforme à la norme NSF/ANSI 61, Drinking Water System Components – Health Effects (NSF/ANSI, 2016a), ainsi qu'à la norme 372, Drinking Water Systems Components – Lead Content (NSF/ANSI, 2016b).
8.0 Toxicocinétique
La toxicocinétique, le stockage et la prise en charge du cuivre sont régulés par des mécanismes homéostatiques (Petris et coll., 1996; Peña et coll., 1999).
8.1 Absorption
Chez les humains, le Cu(II) provenant de l'alimentation est principalement absorbé dans le tractus GI supérieur après exposition orale. L'absorption maximale survient dans les 1 à 3 heures après l'exposition (Linder, 1991; Lonnerdal, 1996; Tapiero et coll., 2003; Stern et coll., 2007; Shike, 2009; Corkins, 2011). Les études sur l'absorption du cuivre chez les humains sont limitées : des taux d'absorption moyens de 50 à 55 % (intervalle : 12 à 60 %) ont été rapportés pour un apport normal en cuivre (de 0,6 à 1,6 mg/jour) provenant de régimes mixtes; l'absorptivité théorique maximale rapportée était de 63 à 75 % (Turnlund et coll., 1989; Wapnir, 1998; NRC, 2000; Tapiero et coll., 2003; Turnlund et coll., 2005; Klevay, 2010; Collins et Klevay, 2011; EFSA, 2015; Ellingsen et coll., 2015). Toutefois, dans les régimes alimentaires typiques des pays développés, l'absorption du cuivre serait en moyenne de 30 à 40 % (Wapnir, 1998). L'absorption alimentaire de Cu(II) est modulée par plusieurs facteurs, notamment l'apport en cuivre d'une personne ainsi que la teneur en cuivre de son organisme, l'âge de la personne, la quantité de métal contenu dans le tractus GI, l'état de valence du cuivre et la présence d'autres facteurs alimentaires ou de métaux (essentiels ou non) qui entrent en compétition avec le cuivre Turnlund et coll., 1989; Wapnir, 1998; NRC, 2000; EFSA, 2006; Stern et coll., 2007; van den Berghe et Klomp, 2009; Stern, 2010; Collins et Klevay, 2011; de Romana et coll., 2011; Gaetke et coll., 2014). Bien que limitées, les études menées sur des humains au moyen de différentes méthodologies (p. ex. l'excrétion fécale du cuivre, la rétention du 65Cu) ont démontré que les taux d'absorption varient de façon inversement proportionnelle à l'apport alimentaire en cuivre. De façon plus précise, des taux d'absorption supérieurs à 50 % ont été rapportés pour des apports en cuivre inférieurs à 1 mg/jour tandis que des taux d'absorption inférieurs à 20 % ont été rapportés pour des apports en cuivre supérieurs à 5 mg/jour (Turnlund et coll., 1989, 1998; Stern et coll., 2007). En revanche, la rétention du cuivre (ou bilan) augmente en fonction de l'augmentation des apports alimentaires. Par exemple, une augmentation de la rétention de cuivre de 0,06 mg/jour pour un apport alimentaire de 1,6 mg/jour à 0,67 mg/jour pour un apport alimentaire de 7,8 mg/jour a été rapportée. La quantité retenue diminue toutefois avec le temps, ce qui suggère un rétablissement du bilan normal avec le temps (Turnlund et coll., 2005).
La solubilité des complexes Cu(II) influence leur biodisponibilité (OEHHA, 2008; Mauceri et Mishra, 2014; EFSA, 2015). Ce phénomène a été observé dans une étude menée par Lind et Glynn (1999), avec des concentrations élevées de Cu(II) mesurées dans le sang de rats auxquels on avait administré du cuivre dans de l'eau désionisée, comparativement aux valeurs mesurées dans le sang de rats auxquels on avait administré un mélange d'acide fulvique dans une préparation pour nourrissons. En outre, il a été rapporté que le stade de développement a une influence sur l'absorption du Cu(II) : une plus grande absorption intestinale est attendue chez les nouveau-nés (Lonnerdal, 1998; Bauerly et coll., 2005; Collins et Klevay, 2011). Ce phénomène pourrait s'expliquer par le fait que les mécanismes digestifs et homéostatiques n'ont pas encore atteint leur maturité à ce stade (OMS, 2004; Araya et coll., 2005a; Collins et Klevay, 2011). Enfin, certains résultats laissent à penser que l'absorption du Cu(II) augmente au cours de la grossesse et en cas de cancer (Tapiero et coll., 2003).
8.2 Distribution
À sa sortie du tractus GI, le Cu(II) est immédiatement lié à l'albumine, à la transcupréine ou à des molécules de faible poids moléculaire (p. ex. des peptides ou des acides aminés, en particulier l'histidine) avant d'atteindre la circulation porte hépatique (Linder, 1991; IPCS, 1998; Linder, 2002; Talcott, 2013; Ellingsen et coll., 2015). Au cours de ce premier passage, environ 40 % du cuivre est absorbé par le foie (Gaetke et coll., 2014; Pal, 2014; EFSA, 2015) Le Cu(II) atteint ensuite la circulation post-hépatique en se liant à la céruloplasmine (Cp) pour être distribué dans l'organisme. De ce fait, sous des conditions physiologiques humaines, le cuivre plasmatique est généralement divisé en deux ensembles : l'un se lie par covalence à la Cp (environ 75 à 98 % du cuivre plasmatique) et le reste (environ 7 % tout au plus), également connu sous le nom de « cuivre libre », se lie librement à l'albumine et à d'autres molécules de faible poids moléculaire (IPCS, 1998; Bradberry, 2007; Montes et coll., 2014; Ellingsen et coll., 2015). La Cp est une ferroxydase synthétisée par le foie, où elle se lie au cuivre, en vue d'approvisionner les tissus périphériques (OEHHA, 2008; Shike, 2009; Montes et coll., 2014). Les augmentations de cuivre et de Cp coïncident donc (Turnlund et coll., 2004). En outre, la Cp est une protéine de phase aiguë dont les concentrations et l'action peuvent être augmentées par un traitement hormonal substitutif (p. ex. des contraceptifs oraux ou des hormones stéroïdes), et qui réagit à plusieurs altérations physiologiques (p. ex. l'inflammation, certaines maladies non spécifiques, certains cancers, la grossesse et d'autres perturbations hormonales) et au tabagisme (Kehoe et coll., 2000; Turnlund et coll., 2004; Shike, 2009; Collins et Klevay, 2011). La différence de concentration et d'action de la Cp entre les sexes est bien documentée, les femmes présentant des concentrations plus élevées de Cp (Kehoe et coll., 2000).
Le « cuivre libre » est principalement composé de Cu(I) et de Cu(II) libres et, dans une moindre mesure, de complexes de ces ions avec des ligands labiles, dans les liquides organiques (Donnelly et coll., 2007). En outre, le « cuivre libre » constitue le gros de la fraction échangeable du cuivre contenu dans le plasma sanguin et (probablement) dans le liquide interstitiel, dont les concentrations ont été estimées à 2 × 10–16 M ou 43 ± 30 mg (Linder, 2001; Harvey et coll., 2005). Ces concentrations sont étroitement régulées par les mécanismes homéostatiques (IOM, 2001; Bertinato et L'Abbé, 2004; Cockell et coll., 2008; Collins et Klevay, 2011) et sont très faibles à l'intérieur des cellules (Rae et coll., 1999; Rosenzweig, 2001; Prohaska, 2008; Boal et Rosenzweig, 2009; Kaplan et Lutsenko, 2009; Brewer, 2010). Certains de ces mécanismes prennent forme grâce à des protéines de transport telles que ATP7A et ATP7B (Kim et coll., 2008; Qian et coll., 2012; Montes et coll., 2014), des protéines de stockage telles que la métallothionéine (Tapia et coll., 2004) et des protéines chaperonnes tels que la chaperonne de la superoxyde dismutase (SOD), la chaperonne du cytochrome c oxydase (COX17) et la protéine ATOX1 (Shike, 2009; Bertinato et coll., 2010; Boveris et coll., 2012; Talcott, 2013).
Ainsi, le cuivre est acheminé à tous les tissus de l'organisme (y compris le foie) sous forme de complexe Cu(II)-Cp. Un volume de distribution de 1,95 L/kg a été estimé pour des sujets en santé (OEHHA, 2008; Shike, 2009; Montes et coll., 2014). La quantité totale moyenne de cuivre contenu dans l'organisme est d'environ 110 mg (intervalle : 50 à 150 mg) (Turnlund et coll., 2005), dont approximativement 50 % se trouvent dans les muscles et les os. Toutefois, les plus fortes concentrations se trouvent dans le foie (environ 40 µg/g du poids sec ou entre 8 et 10 % de la quantité totale contenue dans l'organisme) et dans le cerveau (environ 5 µg/g) (Prohaska, 1990; Turnlund, 1998; Gaggelli et coll., 2006; Gurusamy et Davidson, 2007; Madsen et Gitlin, 2007; Collins et Klevay, 2011; Kumar et coll., 2015). Il est à noter qu'il existe une différence documentée entre les sexes concernant la cuprémie chez les humains de tous les âges. Les femmes, en particulier celles qui prennent des œstrogènes, présentent des concentrations plasmiques plus élevées (Ellingsen et coll., 2015). Chez les humains, les concentrations de cuivre fœtales augmentent durant la gestation et atteignent leur concentration maximale autour du troisième trimestre (de 13 à 1 218 µg/g de poids humide), puis déclinent avec l'âge (Zlotkin et coll., 1995; Lonnerdal, 1996; Bauerly et coll., 2005; Michaluk et Kochman, 2007). Les estimations de la quantité de cuivre présente dans le foie des nourrissons sont plutôt variables. Des concentrations hépatiques de plus de 90 % du cuivre total contenu dans l'organisme (4 à 5 mg/kg p.c.) ont été rapportées chez des nouveau-nés (OMS, 1996). Toutefois, une étude a rapporté des concentrations chez les nouveau-nés semblables à celles observées chez les adultes, tandis qu'une autre a trouvé que le rapport entre les concentrations observées chez les nouveau-nés et les adultes pouvait aller jusqu'à 16:1 (EFSA, 2015, et documents qui y sont cités).
8.3 Métabolisme
Le métabolisme du cuivre fait intervenir tous les processus qui permettent son absorption, sa distribution, sa biotransformation et son utilisation par les cellules de l'organisme. Les deux principaux organes métaboliques sont les intestins et le foie, qui assurent respectivement les étapes du métabolisme présystémique et postsystémique.
8.3.1 Métabolisme présystémique
Chez les mammifères, le Cu(II) ingéré est d'abord réduit en Cu(I) par les métalloréductases entérocytaires pour être ensuite stocké par la métallothionéine (MT), utilisé par les enzymes intestinales ou absorbé dans le sang (par le transporteur affecté par la maladie de Menkes). À sa sortie de l'intestin, le Cu(I) est réoxydé en Cu(II), se lie à l'albumine et est ensuite sécrété dans la circulation porte (Peña et coll., 1999; Shike, 2009; Ellingsen et coll., 2015).
8.3.2 Métabolisme postsystémique
Le foie joue un rôle important dans le stockage, la régulation de l'absorption et l'excrétion biliaire (Talcott, 2013; Ellingsen et coll., 2015). Lorsque le Cu(II) lié à l'albumine pénètre dans les hépatocytes, il est d'abord réduit en Cu(I). Ce dernier est complexé davantage par le glutathion (GSH), avant d'être incorporé sous forme de complexe Cu(I)-GSH dans la MT (pour le stockage) ou dans diverses protéines chaperonnes du cuivre. Ultérieurement, ces protéines chaperonnes transfèrent le cuivre à la Cp ou aux nombreuses apolipoprotéines naissantes qui nécessitent du cuivre, à l'intérieur du cytoplasme des hépatocytes et des compartiments intracellulaires. Toutefois, la plus importante de ces voies métaboliques hépatiques est le transfert du cuivre d'une protéine chaperonne à la protéine ATP7B (le transporteur affecté par la maladie de Wilson), puis à la Cp. Le complexe Cu(II)-Cp est ensuite excrété soit dans la bile, soit dans la grande circulation (IPCS, 1998; Roelofsen et coll., 2000; Linder, 2002; Bradberry, 2007; de Romana et coll., 2011; Boveris et coll., 2012; Gitlin, 2014).
8.4 Élimination
Chez les humains, le cuivre absorbé est principalement excrété par l'organisme dans les matières fécales (jusqu'à 98 % ou environ 2 500 µg/jour) et, dans une moindre mesure, dans l'urine, la sueur, les menstruations et les cheveux (Turnlund et coll., 1990; Wijmenga et Klomp, 2004; Stern et coll., 2007; Mauceri et Mishra, 2014). Le cuivre contenu dans les matières fécales provient presque en totalité de l'excrétion biliaire, laquelle est proportionnelle, dans une certaine mesure, à l'apport alimentaire en cuivre (Linder, 1991; Turnlund et coll., 1998; Harvey et coll., 2005; Stern et coll., 2007). L'excrétion biliaire représente le principal mécanisme par lequel est régulée la quantité totale de cuivre dans l'organisme (Scott et Turnlund, 1994; Turnlund, 1998; Miller et coll., 2006; van den Berghe et Klomp, 2009). Après une exposition à des apports alimentaires en cuivre faibles (1,6 mg/jour) et élevés (7,8 mg/jour) pendant 18 jours, une excrétion fécale quotidienne (valeur moyenne sur 12 jours) de respectivement 100 % (1,6 mg/jour) et 91 % (7,1 mg/jour) a été mesurée chez 9 hommes (Turnlund et coll., 2005). Il est à noter que l'infusion intraveineuse de 460 µg de 63Cu a donné lieu à une excrétion considérablement plus élevée (46 %) (p < 0,05) en cas d'apport élevé, comparativement à un apport faible (27 %; erreur-type = 2,3) (Turnlund et coll., 2005).
Les estimations quantitatives de l'excrétion urinaire sont limitées. Toutefois, l'augmentation des excrétions est solidaire de celle des apports (Turnlund et coll., 2004; Turnlund et coll., 2005); des concentrations moyennes de moins de 3 % sont généralement observées (OMS, 1996; Turnlund et coll., 2004, 2005). Turnlund et coll. (2004, 2005) ont rapporté que l'excrétion urinaire moyenne de 9 hommes était de 26 µg/jour ou de 20 µg/jour (intervalle : 18,5 à 30,9; erreur-type sur les moyennes = 3,3) au cours des périodes respectivement à apport élevé (7,8 mg/jour) et à apport faible (1,6 mg/jour). Même si les auteurs n'ont pas estimé la perte quotidienne par voie capillaire, ils ont constaté une augmentation considérable de la concentration de cuivre dans les cheveux (moyenne ± écart-type [ET]) au cours des périodes où l'apport alimentaire était élevé, comparativement aux périodes où l'apport était faible : de 9,2 ± 3,1 à 21,1 ± 5,9 µg/g de cheveu (intervalle : 3 à 40 µg/g de cheveu), selon les mesures prises le 15e jour de la période d'exposition de 18 jours (Turnlund et coll., 2004, 2005). Ces concentrations ne variaient pas de façon importante entre les sujets (Turnlund et coll., 2004). Linder (1991) a estimé une excrétion quotidienne totale dans les cheveux, les ongles, la peau et la sueur de 200 µg chez les adultes. La demi-vie du cuivre est estimée à 2 à 5 semaines pour les adultes en santé après une administration par voie orale (Ellingsen et coll., 2007). L'excrétion biliaire est limitée dans les premiers stades de la vie, en raison du faible développement du système de transport biliaire à la naissance. Des pertes excrétoires de 50 µg/kg p.c. par jour ont été estimées pour les nourrissons (Aggett, 1999).
9.0 Effets sur la santé
9.1 Effets chez les humains
9.1.1 Caractère essentiel
Le cuivre est un élément essentiel. En effet, sa capacité à passer de la forme oxydée Cu(II) à la forme réduite Cu(I) est à l'origine des propriétés catalytiques de diverses métalloenzymes nécessaires au métabolisme (p. ex. du glucose) et à la respiration cellulaire (p. ex. SOD, cytochrome C oxydase) (IOM, 2001; Bertinato et L'Abbé, 2004; Gitlin, 2014). Le cuivre intervient également dans de nombreux processus physiologiques, notamment la formation des tissus neurologiques, immunologiques et connectifs, ainsi que la régulation thermique et l'érythropoïèse (Tapiero et coll., 2003; Stern et coll., 2007; Gambling et coll., 2011).
Une carence en cuivre peut entraîner des anomalies dans ces systèmes; des cas de carence en cuivre ont été rapportés chez des nourrissons prématurés nourris de préparations pour nourrissons non enrichies, chez des nourrissons gravement sous-alimentés et atteints de diarrhée chronique, et chez des patients recevant une alimentation parentérale prolongée sans apport complémentaire de cuivre (IOM, 2001). La carence en cuivre se caractérise entre autres par une anémie, une leucopénie, une neutropénie, ainsi que des anomalies neurologiques et osseuses. Puisque l'alimentation est la source principale d'apport en cuivre, la population canadienne n'est pas censée souffrir d'une telle carence. En effet, l'ECAT (Santé Canada, 2011) montre que la population reçoit les apports quotidiens recommandés (AQR) établis par le Institute of Medicine des États-Unis (IOM, 2001) et Santé Canada (2010). L'AQR est défini comme l'apport quotidien moyen suffisant pour satisfaire le besoin nutritionnel de 97,5 % de la population apparemment en bonne santé d'un âge et d'un sexe donné (de Romana et coll., 2011). Les AQR pour le cuivre ont été établis à 900 µg/jour pour les adultes des deux sexes (de 19 à 70 ans et au-delà) et de 340 à 890 µg/jour pour les enfants (de 1 à 18 ans, inclusivement) (IOM, 2001; Santé Canada, 2010). Aucun AQR n'a été établi pour les nourrissons, mais des apports suffisants de 200 µg/jour pour les 0 à 6 mois et de 220 µg/jour pour les 7 à 12 mois ont été établis à partir des concentrations de cuivre dans le lait maternel (200 à 250 µg/L).
Vu les effets nocifs sur la santé que pourrait causer l'ingestion de grandes quantités de cuivre, les apports maximaux tolérables (AMT) ont été estimés à 1 000 µg/jour pour les 1 à 3 ans, à 3 000 µg/jour pour les 4 à 8 ans, à 5 000 µg/jour pour les 9 à 13 ans, à 8 000 µg/jour pour les 14 à 18 ans, à 10 000 µg/jour pour ceux ayant atteint ou dépassé 19 ans et, enfin, à entre 8 000 et 10 000 µg/jour pour les femmes enceintes ou allaitantes (IOM, 2001). Les AMT ont été déterminés en fonction de l'absence d'effets sur le foie et sur le tractus GI dans une étude à double insu à petite échelle sur 12 semaines, peu détaillée, portant sur la prise en charge des douleurs dorsales pour sept sujets humains adultes (Pratt et coll., 1985). L'étude a conclu qu'un apport de 10 mg/jour de cuivre sous forme de sel de gluconate n'a causé aucun effet nocif chez les sujets.
9.1.2 Syndromes causés par la toxicité du cuivre
La dyshoméostasie du cuivre peut entraîner des effets nocifs sur la santé, notamment des maladies résultant de troubles métaboliques héréditaires comme la maladie de Menkes et la maladie de Wilson (Cockell et coll., 2008; Govindaraju et coll., 2013; Gaetke et coll., 2014; Jazvinscak Jembrek et coll., 2014).
La maladie de Menkes, un trouble récessif rare lié au chromosome X, est causée par une mutation du gène codant la translocase ATP7A. Les symptômes des patients atteints de cette maladie correspondent aux symptômes d'une carence en cuivre grave. Par conséquent, la maladie de Menkes (et sa forme atténuée, le syndrome de la corne occipitale [SCO]) se caractérise par une réduction de l'absorption généralisée du Cu(II) par les intestins et la barrière hémato-céphalique, une accumulation excessive de cuivre dans les muqueuses intestinales, ainsi que de faibles concentrations de cuivre et de Cp dans le sérum, et de faibles niveaux de cuivre dans le foie et le cerveau (NRC, 2000; Shike, 2009; Montes et coll., 2014; Ellingsen et coll., 2015). La plupart des patients atteints de la maladie de Menkes meurent très jeunes (avant dix ans, généralement même avant trois ans) alors que les patients atteints du SCO vivent plus longtemps (Kaler, 1998; Camakaris et coll., 1999; Schaefer et Gitlin, 1999).
La maladie de Wilson (une dégénérescence hépatolenticulaire) est un trouble monogénique autosomique récessif qui est causé par une mutation du gène codant la translocase ATP7B (parmi les 500 mutations recensées) (Harris et Gitlin, 1996; Schilsky, 1996; Shike, 2009; Boveris et coll., 2012; Bandmann et coll., 2015; Ellingsen et coll., 2015; Kumar et coll., 2015). Cette maladie se caractérise par une excrétion biliaire altérée du cuivre en excès, un processus d'expulsion du cuivre des cellules déficient et une synthèse de la Cp altérée, ce qui entraîne une accumulation de cuivre dans certains tissus (particulièrement le foie, le cerveau et les reins). Par conséquent, les patients atteints de cette maladie souffrent souvent d'insuffisance hépatique (p. ex. maladies, cirrhoses) et de divers symptômes neuropsychiatriques et comportementaux (Das et Ray, 2006; Machado et coll., 2008; Shike, 2009; Montes et coll., 2014). Habituellement, le dysfonctionnement hépatique apparaît avant l'âge de 10 ans et le dysfonctionnement neurologique avant 20 ans (Ala et coll., 2007). Ces patients sont normalement sous surveillance médicale. On suppose que les sujets hétérozygotes porteurs du gène déficient de cette maladie sont sensibles au cuivre, mais les données probantes à cet effet sont insuffisantes, se limitant à des concentrations élevées de cuivre dans le foie (IPCS, 1998; NRC, 2000; OMS, 2004).
Voici d'autres intoxications au cuivre très rares, mais bien documentées, qui touchent les enfants : cirrhose amérindienne infantile (une maladie qui touche principalement les enfants de moins de 5 ans), cirrhose tyrolienne infantile endémique et intoxication idiopathique au cuivre (Madsen et Gitlin, 2007; Pal, 2014) . Ces maladies se caractérisent par des concentrations extrêmes de cuivre dans le foie au début de l'enfance, ce qui entraîne une hépatomégalie, une fibrose péricellulaire, une nécrose et même la mort (Muller et coll., 1996; Tanner, 1998; Johncilla et Mitchell, 2011). Cependant, l'étiologie de ces syndromes semble plus complexe, pouvant comprendre des facteurs environnementaux, comme un apport très élevé en cuivre, en plus des facteurs génétiques (Olivares et Uauy, 1996; Scheinberg et Sternlieb, 1996; ATSDR, 2004; OEHHA, 2008; Shike, 2009; Ellingsen et coll., 2007, 2015). Enfin, les personnes atteintes d'un déficit en glucose-6-phosphate déshydrogénase peuvent être sujettes à l'anémie hémolytique causée par une surexposition au cuivre (OEHHA, 2008).
9.1.3 Rapports de cas
Plusieurs cas d'intoxication par ingestion de cuivre ont été signalés, dans lesquels étaient principalement touchés le tractus GI, le foie, les reins, le système hématopoïétique et le système nerveux central (SNC) (IPCS, 1998; NRC, 2000).
En 1992 et 1993, la Division of Health du Wisconsin a enquêté sur des cas de trouble GI que l'on supposait être liés avec le cuivre dans l'eau potable. Les chercheurs ont conclu que les symptômes apparaissaient plus fréquemment chez les nourrissons et les enfants, de même que chez les habitants de maisons nouvellement construites ou rénovées (Knobeloch et coll., 1994). Chez les adultes, selon des rapports anecdotiques, les symptômes immédiats à la suite de la consommation de boissons ou d'eau potable contaminées comprennent un goût métallique et une perturbation du tractus GI (p. ex. nausées, douleur abdominale et vomissements combinés; diarrhée). Ces symptômes se manifestent généralement comme les symptômes d'une intoxication alimentaire, de 15 à 60 minutes après l'ingestion, et à des concentrations aussi basses que 3 à 4 mg Cu(II)/L d'eau potable. La nausée et les vomissements (généralement passagers) sont habituellement plus fréquents que la diarrhée. On a également signalé une anorexie, des céphalées, des étourdissements, une hypotension et des états de choc. Les symptômes à retardement, à de plus fortes doses, comprennent une anémie, une hémoglobinurie, une ictère, une insuffisance rénale et hépatique, et même la mort. Au cours d'autopsies, des lésions rénales (p. ex. congestion des glomérules, nécrose) et des érosions des muqueuses gastriques ont été découvertes (Wyllie, 1957; Spitalny et coll., 1984; Mehta et coll., 1985; Gulliver, 1991; Araya et coll., 2001). Des rhabdomyolyses (blessures musculaires) ont également été signalées (Jantsch et coll., 1984; Takeda et coll., 2000).
Chez les enfants, les données limitées indiquent des effets similaires. En effet, des rapports de cas ont attribué les effets nocifs (p. ex. diarrhée et amaigrissement) à des concentrations de Cu(II) dans l'eau potable variant de 0,22 à 1,0 mg/L (Stenhammar, 1999) ou de 1,0 à 6,5 mg/L (Berg et coll., 1981). Par ailleurs, les nouveau-nés et les nourrissons semblent être plus sensibles au cuivre en raison d'une absorption intestinale accrue et d'un système hépatobiliaire immature (Collins et Klevay, 2011).
Enfin, il existe quelques rapports de cas d'exposition prolongée. Selon les données disponibles, l'ingestion d'une quantité excessive de cuivre à long terme peut causer des effets sur le tractus GI des nourrissons, ainsi qu'une insuffisance rénale et hépatique chez les adultes (O'Donohue et coll., 1993, 1999; Stenhammar, 1999; Cech et coll., 2006; Stern et coll., 2007).
9.1.4 Exposition à court terme
On a découvert que les symptômes GI, définis dans la plupart des études comme la survenue simultanée ou non de nausées, d'une douleur épigastrique, de vomissements ou de diarrhée, étaient les principaux effets de l'exposition à court terme au Cu(II) ingéré. La nausée, qui est transitoire, est le premier symptôme à apparaître (entre 15 et 60 minutes après l'ingestion) et c'est aussi le plus fréquent (Pizarro et coll., 1999a, 1999b; Araya et coll., 2001; Olivares et coll., 1998, 2001).
Lors d'une étude prospective à double insu avec répartition aléatoire, menée auprès de 60 Chiliennes en bonne santé (15 par groupe), Pizarro et coll. (1999b) ont observé des effets aigus sur le tractus GI de ces femmes à la suite d'une exposition de deux semaines à de l'eau potable contenant au moins 3 mg Cu(II)/L (sous forme de sulfate de cuivre). Dans cette étude, les effets sur le tractus GI (nausées, douleur abdominale ou vomissements), à l'exception de la diarrhée, étaient nettement accentués (en général, χ2 = 11,3; p < 0,01). Même si les seuils pour chaque symptôme n'ont pu être dérivés, les auteurs ont pu déterminer que la nausée était un bon indicateur pour évaluer les effets. Par ailleurs, la sensibilité à l'exposition au cuivre variait selon les sujets et la majorité des symptômes ont disparu après la fin de l'exposition. À partir de cette étude, la dose minimale avec effet nocif observé (LOAEL) a été établie à 3 mg Cu(II)/L lorsque l'on combinait les résultats relatifs à la nausée, aux douleurs abdominales et aux vomissements.
Sachant que la nausée était le premier symptôme GI à apparaître, plusieurs chercheurs ont entrepris des démarches pour déterminer un seuil approximatif de la dose d'exposition. Olivares et coll. (2001) ont utilisé un modèle carré latin avec répartition aléatoire pour administrer des concentrations de 0, 2, 4, 6, 8, 10 ou 12 mg Cu(II)/L, sous forme de sulfate de cuivre, dans de l'eau purifiée ou dans une boisson à l'orange à des adultes chiliens apparemment en bonne santé. Dans cette étude, les sujets (au nombre de 47 à 61 par groupe) ont reçu, après une nuit de jeûne, un volume fixe de 200 mL de la solution durant une séance d'une heure, une fois par semaine, pendant un maximum théorique de 12 semaines. Les doses d'exposition étaient donc respectivement de 0; 0,4; 0,8; 1,2; 1,6; 2 et 2,4 mg Cu(II). Aucune différence relative à l'âge ou au sexe n'a été observée entre les groupes, et aucune réaction n'a été observée jusqu'à la dose de 0,4 mg (ce qui équivaut à la dose sans effet nocif observé [NOAEL] basée sur la nausée). Toutefois, une nausée légère après l'ingestion a été le symptôme le plus fréquemment signalé à partir de la dose de 0,8 mg Cu(II), avant d'atteindre un plateau entre 1,6 et 2,4 mg. L'incidence des vomissements, qui se sont manifestés pour la première fois à 1,2 mg, était basse (11,5 %), mais augmentait de deux fois entre 2 et 2,4 mg. L'apparition concomitante de la nausée et des vomissements était moins fréquente, l'incidence la plus élevée (12 % des sujets) ayant été mesurée à 2,4 mg. Une diarrhée et des crampes abdominales se manifestaient rarement dans la plage de concentration étudiée. Comme un intervalle de sensibilité avait été observé auparavant (Pizarro et coll., 1999b), les auteurs ont utilisé une approche de dose de référence (BMD) pour dériver les limites inférieures de l'IC à 95 % des concentrations dans l'eau potable pour une réponse observée pour 5 % de la population (BMDL05). Les BMDL05 calculées étaient respectivement de 0,4 mg Cu(II) (2 mg/L) et de 0,84 mg Cu(II) (4,2 mg/L) pour les cas de nausée apparents et confirmés. La BMDL05 des cas de nausée apparents est très proche de la NOAELbasée sur la nausée (0,4 mg Cu(II)); la LOAEL basée sur la nausée était de 0,8 mg Cu(II), qui correspondait également à la NOAEL basée sur les vomissements.
Le même groupe de chercheurs a mené la phase I d'une étude prospective et comparative, à double insu et multicentrique (Chili, Irlande du Nord et États-Unis) auprès d'adultes volontaires apparemment en bonne santé, ayant également pour but de déterminer le seuil de nausée (Araya et coll., 2001). Après une nuit de jeûne, les sujets (au nombre de 179 par groupe) ont reçu au hasard une quantité de 0; 0,4; 0,8; 1,2; ou 1,6 mg Cu(II) (sous forme de sel de sulfate de cuivre) dans un bolus de 200 mL d'eau distillée et désionisée (ce qui équivaut à une concentration de 0, 2, 4, 6, ou 8 mg Cu(II)/L) une fois par semaine pendant cinq semaines consécutives. Les résultats de cette étude permettaient aussi de croire que les femmes sont plus sensibles au cuivre. En effet, au fur et à mesure que la dose augmentait, les femmes signalaient davantage de nausées et de symptômes GI que les hommes (probabilités : 2,66; p < 0,004 pour la nausée; et 1,68; p < 0,05 pour les symptômes GI). La nausée, qui était transitoire, était le symptôme le plus prévalent (prévalence moyenne = 27,3 % parmi tous les sujets) et était le symptôme le plus rapporté pendant les 15 premières minutes. De plus, on a relevé une relation dose-réponse claire (1) aux symptômes GI combinés (nausée, vomissements, diarrhée ou douleur abdominale) et (2) à la nausée seule. Le signalement des effets a nettement augmenté à 1,2 et 1,6 mg Cu(II). Contrairement aux douleurs abdominales et à la diarrhée, la nausée et les symptômes GI dans leur ensemble étaient fortement associés aux concentrations de Cu(II), puisque les incidences augmentaient nettement (p < 0,0001) à mesure que les concentrations augmentaient (probabilité de 0,66; 3,53; 7,67 et 17,15 pour la nausée et de 0,87; 1,83; 3,54 et 7,29 pour les symptômes GI, à des concentrations respectives de 2, 4, 6 et 8 mg/L; p < 0,0001). Les nausées et les autres symptômes GI ont augmenté nettement (p < 0,002) à la LOAEL de 1,2 mg Cu(II), mais pas à la NOAEL de 0,8 mg Cu(II). La modélisation dose-réponse réalisée a permis de déterminer que la BMDL05 basée uniquement sur la nausée était de 0,7 à 0,8 mg Cu(II) (3,5 à 4 mg/L). La limite supérieure de cet intervalle est similaire à la NOAEL de 0,8 mg basée sur la nausée et les autres symptômes GI. En général, les résultats (apparition de la nausée, aucune corrélation avec la diarrhée et LOAEL ≥ 3 mg Cu(II)/L) concordaient avec les résultats de Olivares et coll. (2001) et de Pizarro et coll. (1999b).
Les résultats — présentés ci-dessus — de la phase I de l'étude réalisée par Araya et coll. (2001), dans laquelle le cuivre a été administré dans de l'eau distillée et désionisée, ont été confirmés lors de la phase II de cette étude (Araya et coll., 2003a). Dans cette deuxième phase, multicentrique et réalisée à double insu, 269 femmes adultes recevaient du sulfate de cuivre(II) dans 200 mL d'eau embouteillée de source naturelle une fois par semaine pendant 11 semaines consécutives. Un plan factoriel 3 × 3 à double insu a été utilisé pour administrer aux sujets (au nombre de 58 à 73 par site) une dose de 0,4; 0,8 ou 1,2 mg Cu(II) sous forme de sel de sulfate dans 100, 150 ou 200 mL d'eau. Les doses de 0 et 1,6 mg Cu(II) ont été ajoutées à un volume de 200 mL. Il est important de noter que toutes les autres études à court terme utilisaient un volume de dosage constant de 200 mL. Les résultats obtenus par Araya et coll. (2003a) ont démontré que la dose de cuivre (p = 0,0001) et le volume d'eau (p = 0,032) contribuent grandement à l'incidence de la nausée. En effet, l'augmentation de la nausée était solidaire avec celle de la dose de cuivre et avec la diminution du volume d'eau. De plus, les auteurs ont réalisé une analyse de la BMD pour établir l'incidence de la nausée dans le cas d'un bolus de 200 mL. La BMD calculée pour une réponse de 10 % était de 0,94 mg Cu(II) (4,8 mg/L; p = 0,94) et la BMDL10 correspondante était de 0,84 mg Cu(II) (4,2 mg/L). La BMDL10 est très proche de la NOAEL de 0,8 mg Cu(II) (4 mg/L); cette dernière, qui a été déterminée pour les femmes, correspond à la NOAEL basée sur la nausée et les autres symptômes GI qui a été déterminée aussi bien pour les hommes que pour les femmes au cours de la phase I de l'étude menée par Araya et coll. (2001).
Globalement, selon les études à court terme décrites ci-dessus, la dose minimale avec effet est une BMDL05 de 0,7 mg (ou 3,5 mg/L) basée sur la nausée seule et une exposition non continue (Araya et coll., 2001).
9.1.5 Exposition à long terme
La toxicité chronique due au cuivre est habituellement observée pour les patients atteints de la maladie de Wilson, d'hémochromatose et de cirrhose infantile (Olivares et coll., 1998; Mauceri et Mishra, 2014). Comme la maladie de Wilson dépasse la simple accumulation de cuivre, il est probable que certains des symptômes typiques de cette maladie soient liés à l'exposition prolongé e à une quantité excessive de cuivre (voir la section 9.1.2). Toutefois, les données probantes actuelles, provenant principalement de données mécanistes, mais aussi de cas limités et d'études cliniques, indiquent qu'une exposition prolongée à de très fortes concentrations de cuivre, supérieures à celles qui sont associées aux maladies GI, peut provoquer des lésions hépatiques et rénales dans la population générale (O'Donohue et coll., 1993; IPCS, 1998; O'Donohue et coll., 1999; Pizarro et coll., 1999b; Stenhammar, 1999; Stern et coll., 2007).
9.1.5.1 Effets sur le tractus gastro-intestinal
Araya et coll. (2004) ont mené une étude avec répartition aléatoire, à double insu, axée sur la collectivité et d'une durée de deux mois, dans laquelle 1 365 adultes apparemment en bonne santé (répartis en groupes de 327 à 355 personnes) recevaient jusqu'à 6 mg Cu(II)/L. L'eau renfermant du cuivre était utilisée pour boire et préparer d'autres boissons (p. ex. thé, café, infusion et bouillon), et la consommation moyenne de liquides était de 1,5 L/jour. Contrairement aux résultats obtenus lors d'études précédentes sur l'exposition à court terme (Pizarro et coll., 1999b; Araya et coll., 2001, 2003a; Olivares et coll., 2001), les douleurs abdominales et la nausée étaient prévalentes, et le signalement des symptômes a nettement diminué avec le temps pour les deux sexes, ce qui indique une réponse adaptative. Toutefois, plus important encore, une LOAEL de 6 mg Cu(II) (4 mg/L) a été relevée pour les femmes, la population la plus sensible. Cette LOAEL, qui n'était plus valide à partir de la semaine 4, est similaire à la BMDL05 de 4 mg/L basée sur la nausée, calculée auparavant en fonction d'exposition à court terme (Araya et coll., 2001, 2003a; Olivares et coll., 2001). De plus, comme pour les études à court terme, les risques de symptômes étaient corrélés à la concentration de cuivre et au sexe féminin, et étaient inversement corrélés au temps. En fait, le risque d'effets sur le tractus GI était nettement plus élevé pour les femmes pendant la première semaine, mais ce n'était plus le cas à partir de la semaine 4. Globalement, les auteurs ont trouvé que la concentration de Cu(II) et le volume de la dose étaient les principaux déterminants de la réponse, et que la dose appliquée et le véhicule étaient moins importants.
Une étude prospective menée par Olivares et coll. (1998) a montré que les nourrissons qui recevaient continuellement, sous forme de sulfate de cuivre, jusqu'à 31,48 μmol Cu(II)/L d'eau potable (c.-à-d. 2 mg/L) pendant les neuf derniers mois de leur première année de vie demeuraient asymptomatiques, grandissaient normalement et ne présentaient pas un risque accru de diarrhée comparativement à ceux qui recevaient moins de 1,57 μmol Cu(II)/L (c.-à-d. moins de 0,1 mg/L). L'objectif principal de cette étude était d'évaluer la tolérance et l'innocuité relatives à l'exposition prolongée des nourrissons au cuivre en fonction de la valeur de la recommandation provisoire précédente (OMS, 1993) pour la population générale. Dans cette étude contrôlée contre placebo, 128 nourrissons chiliens âgés de 3 mois, apparemment en bonne santé, venant du même milieu socioéconomique et pesant plus de 2 kg à la naissance, ont été répartis au hasard en deux groupes : l'un recevait 1,57 μmol Cu(II)/L d'eau potable chaque jour pendant 9 mois, l'autre en recevait 31,48 μmol Cu(II)/L. Les nourrissons allaités l'ont été exclusivement jusqu'à ce qu'ils aient au moins 6 mois et ceux qui étaient nourris d'une préparation pour nourrissons avaient partiellement ou totalement arrêté de se nourrir au sein à 3 mois. Plus précisément, au début de l'étude, les nourrissons de 3 mois ont été séparés en quatre groupes : groupe 1 – nourrissons nourris d'une préparation pour nourrissons recevant 31,48 μmol Cu(II)/L (n = 56); groupe 2 – nourrissons alimentés d'une préparation pour nourrissons recevant 1,57 μmol Cu(II)/L (n = 27); groupe 3 – nourrissons allaités recevant 31,48 μmol Cu(II)/L (n = 24); groupe 4 – nourrissons allaités recevant 1,57 μmol Cu(II)/L (n = 21). Les mères qui allaitaient (groupe 3 et 4) ont également reçu de l'eau contenant la concentration de Cu(II) correspondante. Ainsi, deux litres d'eau potable ont été préparés chaque jour par les mères pour la consommation quotidienne, soit à partir d'une solution fraîche standard contenant du sulfate de cuivre (0,8 g Cu (II)/L) pour les groupes exposés (1 et 3), soit à partir d'un volume équivalent de placebo pour les groupes non exposés (2 et 4). Les auteurs n'ont pas clairement défini ce placebo, mais ils ont indiqué qu'il était identique à la solution à base de cuivre sur le plan organoleptique. L'eau pour la consommation quotidienne était utilisée pour boire, préparer les repas et préparer (par dilution) le lait de vache en poudre et les préparations à base de lait de vache en poudre. Ces dernières étaient enrichies de 7,87 µmol de cuivre/L. Toute eau supplémentaire nécessaire était préparée de la même manière. Les nourrissons nourris de préparations ont commencé à recevoir de la nourriture solide à 3 mois, tandis que les nourrissons allaités ont commencé à être sevrés et à recevoir une préparation de lait de vache non enrichie et de la nourriture solide à 6 mois. Même si le Cu(II) du lait maternel n'a pas été pris en compte pour calculer l'apport total, le cuivre provenant des aliments, des préparations de lait et de l'eau utilisée pour la préparation des repas et des préparations l'ont été. Pendant l'étude, un travailleur de terrain visitait chaque maison une fois par semaine pour noter l'apport en eau et les troubles GI, respiratoires et autres, comme mentionnés par les mères. Chaque nourrisson a également subi des évaluations clinique et anthropométrique une fois par mois. Globalement, l'ingestion chronique d'une quantité de cuivre allant jusqu'à 31,48 µmol Cu/L par les nourrissons (dans les préparations [F], les aliments et l'eau potable) de l'âge de trois mois à un an n'a causé aucun effet aigu ou chronique. Plus précisément, aucune différence relative aux épisodes de maladie (p. ex. diarrhée et infections respiratoires) n'a été observée entre les quatre groupes étudiés, comme l'indiquent les analyses réalisées. À neuf mois, une différence importante dans l'activité de la Cp a tout de même été observée chez les sujets exposés au Cu(II) (groupes 1 et 3) comparativement aux sujets non exposés (groupes 2 et 4) (350 ± 85 mg/L comparativement à 322 ± 75 mg/L; F = 5,42; p = 0,02). Cette différence était plus prononcée dans les groupes de bébés allaités (groupes 3 et 4). Cependant, la teneur globale en cuivre de l'organisme (basée sur la cuprémie, les taux ou l'activité de la Cp, et les taux de Cu-Zn-SOD érythrocytaire et de métallothionéine érythrocytaire) pour les nourrissons n'a pas changé de manière importante entre l'âge de 6, 9 et 12 mois. De plus, aucune différence marquée relative au fonctionnement du foie (basé sur la bilirubine, l'aspartate aminotransférase [ASAT], l'alanine-aminotransférase [ALAT] et la gamma-glutamyl-transférase [γ-GT]) n'a été observée entre les nourrissons de 6, 9 et 12 mois. Les auteurs ont indiqué les résultats obtenus pour trois temps de mesure (4 à 6 mois, 6 à 9 mois et 9 à 12 mois). Toutefois, comme il est indiqué plus haut (voir section 9.1.3), les nourrissons présentent un risque accru d'exposition au cuivre pendant les six premiers mois de leur vie, lorsque leur système hépatobiliaire est encore immature. Comme aucun effet toxique n'a été signalé durant l'ensemble de l'étude, les résultats de la fenêtre d'exposition la plus élevée, soit de quatre à six mois (l'équivalent de quatre mois d'exposition), seront pris en compte. Selon les auteurs, pour cette période d'exposition, les apports quotidiens totaux (moyenne ± ET) étaient les suivants : 318,7 ± 107,3 µg/kg p.c. par jour (groupe 1); 122,7 ± 107,4 µg/kg p.c. par jour (groupe 2); 52,2 ± 48,5 µg/kg p.c. par jour (groupe 3); 37,8 ± 36,7 µg/kg p.c. par jour (groupe 4).
9.1.5.2 Effets hépatiques et rénaux
L'hépatotoxicité causée par la surexposition au cuivre a principalement été étudiée et observée chez les populations vulnérables (p. ex. personnes atteintes de la maladie de Wilson ou de cirrhoses infantiles); toutefois, il existe quelques études portant sur la population générale. Ainsi, une augmentation transitoire marquée de l'activité enzymatique hépatique (ASAT, ALAT et γ-GT; analyse de la variance [ANOVA] : p < 0,01) a été observée au cours d'un essai prospectif comparatif mené auprès d'adultes chiliens apparemment en bonne santé (n = 87, avec des taux de Cp sériques inférieurs à 0,05 et supérieurs au quantile 0,95 de la courbe de distribution) qui recevaient 10 mg Cu(II)/jour (0,17 mg/kg p.c. par jour, pour un adulte d'un poids moyen de 60 kg) sous forme de sel de sulfate en gélule pendant 60 jours (Araya et coll., 2005b). Toutefois, non seulement les résultats se trouvaient dans les intervalles cliniques normaux, mais les participants sont également demeurés asymptomatiques et l'augmentation de l'activité enzymatique hépatique a cessé un an après la fin de l'étude.
Dans une étude à double insu menée par Pratt et coll. (1985) , aucun effet sur le foie ou sur le tractus GI n'a été constaté chez les sept adultes ayant reçu un apport complémentaire de 10 mg Cu/jour (0,08 mg/kg p.c. deux fois par jour) sous forme de sel de gluconate en gélule pendant 12 semaines. En outre, on n'a signalé aucun changement majeur : (1) des concentrations de cuivre dans les cheveux, le sérum et l'urine; (2) de l'hématocrite, du taux sérique de triglycérides et de cholestérol, (3) du taux sérique d'enzymes comme la phosphatase alcaline, la γ-GT, l'ASAT et la lactate-déshydrogénase.
Un essai multicentrique sur l'alimentation, contrôlé par placebo, à double insu et mené en Europe n'a pas montré non plus d'association entre la fonction hépatique et l'apport complémentaire en cuivre pendant six semaines (séquence : 0,05 mg/kg p.c. par jour de sel de sulfate de cuivre et 0,12 mg/kg p.c. par jour de chélates d'acides aminés; O'Connor et coll., 2003).
Aucun changement majeur des indicateurs de la fonction hépatique (ASAT, ALAT, γ-GT) n'a été observé chez des adultes ayant ingéré jusqu'à 6 mg Cu(II)/L (0,10 mg/kg p.c. par jour, pour un adulte d'un poids moyen de 60 kg) sous forme de sel de sulfate pendant deux mois (Araya et coll., 2003b).
L'exposition à long terme des nourrissons et des jeunes enfants à de l'eau potable contenant du cuivre n'a pas été associée à une augmentation importante de la prévalence des maladies hépatiques (Fewtrell et coll., 1996; Olivares et coll., 1998; Zietz et coll., 2003a).
9.1.5.3 Effets biochimiques
En général, les résultats des études d'une durée de moins de trois mois ont indiqué que l'apport complémentaire en cuivre ne modifie pas les indices de la teneur en cuivre de l'organisme. Ainsi, aucun changement majeur des marqueurs de la teneur en cuivre de l'organisme (concentrations de cuivre dans le sérum, les érythrocytes et les cellules monocellulaires; taux sérique de Cp; taux de cuivre non lié à la Cp; activité de la SOD) n'a été constaté chez des adultes en santé ayant reçu soit jusqu'à 6 mg Cu(II)/L sous forme de sulfate (~ 0,20 mg/kg p.c. par jour pour 2 L d'eau/jour) (Araya et coll., 2003b, 2004; Mendez et coll., 2004) , soit des comprimés de 10 mg/jour (0,17 mg/kg p.c. par jour) de sulfate de cuivre pendant deux mois (Mendez et coll., 2004), soit des compléments diététiques allant jusqu'à 6 mg Cu(II)/jour (0,09 mg/kg p.c. par jour) sous forme de sel de sulfate ou de chélate d'acide aminé (Kehoe et coll., 2000; Turnlund et coll., 2004). Toutefois, certains changements ont été observés à la suite d'un apport complémentaire sur une plus longue période, ce qui laisse entendre qu'un apport élevé en cuivre peut produit des effets nocifs. C'est pourquoi une étude portant sur neuf hommes a été menée pour déterminer les effets à long terme d'un apport élevé en cuivre (Turnlund et coll., 2004). Après que ces hommes aient reçu un apport complémentaire allant jusqu'à 7,8 mg Cu(II)/jour (0,11 mg/kg p.c. par jour, pour un adulte d'un poids moyen de 70 kg) pendant cinq mois, les chercheurs ont constaté des changements de plusieurs marqueurs de fonction. Ainsi, en ce qui concerne la fonction immunitaire, ils ont constaté des baisses importantes (p < 0,05) du taux de neutrophiles circulant, du taux sérique du récepteur à l'interleukine 2 et du taux d'anticorps dirigés contre la souche d'influenza Beijing. En ce qui concerne la défense antioxydante, ils ont observé une augmentation nette (p < 0,05) du nombre de substances réactives à l'acide thiobarbiturique (TBARS) dans l'urine, mesure indirecte des dommages oxydatifs. Enfin, ils ont également remarqué des changements mineurs, mais significatifs, de certains indices de la teneur en cuivre de l'organisme (p. ex. activité de la Cp et de la SOD), même si les concentrations plasmatiques de cuivre et de Cp n'avaient pas changé (Turnlund et coll., 2004).
En conclusion, pour une exposition de moins de trois mois, les résultats se sont révélés négatifs. Ainsi, un apport complémentaire allant jusqu'à 0,17 mg/kg p.c. par jour pour les adultes n'a pas modifié de façon notable les indices de lésions hépatiques (O'Connor et coll., 2003; Araya et coll., 2005b) ou de la teneur en cuivre de l'organisme (Kehoe et coll., 2000; Mendez et coll., 2004; Turnlund et coll., 2004); on retrouve les mêmes résultats à la suite d'une exposition prolongée à de l'eau potable contenant jusqu'à 0,2 mg/kg p.c. par jour (Araya et coll., 2003b; Araya et coll., 2004; Mendez et coll., 2004). Cependant, pour une exposition supérieure à cinq mois, les résultats indiquent que des effets nocifs se produisent à la suite d'un apport élevé en cuivre pendant une plus longue période (Turnlund et coll., 2004). Par conséquent, compte tenu du manque d'études sur l'exposition chronique, les données recueillies (Turnlund et coll., 2004) et les symptômes ressentis par les patients atteints de la maladie de Wilson peuvent nous éclairer sur le type d'effets nocifs à attendre après une surexposition prolongée au cuivre.
9.1.5.4 Neurotoxicité
Les enzymes à cuivre jouent un rôle essentiel dans les fonctions neurologiques. De nombreuses analyses ont indiqué des résultats contradictoires concernant l'association entre l'exposition au cuivre et l'apparition de maladies neurodégénératives, comme la maladie d'Alzheimer (MA) ou de Parkinson (Bush et coll., 2003; Squitti et coll., 2006; Rivera-Mancia et coll., 2010; Tiffany-Castiglioni et coll., 2011; Montes et coll., 2014; Pal et coll., 2014). Par exemple, deux études cas/témoins menées en Italie ont révélé que la cuprémie des patients atteints de la MA était nettement supérieure à celle des témoins du même âge ou du même sexe (p < 0,001), et qu'elle corrélait avec de faibles résultats aux tests neuropsychologiques; toutefois, les concentrations rapportées se situaient dans la norme (Squitti et coll., 2002; Brenner, 2003). De plus, on a découvert que les plaques séniles et les neuropiles des amygdales cérébrales de neuf patients atteints de la MA contenaient des concentrations de cuivre nettement supérieures à celles des neuropiles des amygdales de cinq sujets témoins (p < 0,05) (Lovell et coll., 1998) et des régions sans plaques séniles de deux patients atteints de la MA. Toutefois, les concentrations de cuivre corrélaient également avec celles du zinc (Miller et coll., 2006).
D'autres études n'ont pas appuyé les résultats présentés ci-dessus. Par exemple, dans une étude, les concentrations de cuivre dans le liquide céphalorachidien et dans le sérum n'étaient pas nettement différentes entre les patients atteints de la MA (n = 26) et les personnes appariées témoins (n = 28) (Molina et coll., 1998). Dans une autre étude, les patients ayant une cuprémie plus basse obtenaient un score ADAS-cog (partie cognitive de l'échelle d'évaluation de la maladie d'Alzheimer) nettement moins bon comparativement aux patients ayant une cuprémie plus élevée (valeur p pour l'ANOVA : < 0,001; tous les patients [n = 32] avaient des cuprémies normales) (Pajonk et coll., 2005). Enfin, des taux plus élevés des biomarqueurs de la MA corrèlent avec une cuprémie plus faible pour les patients atteints de la MA (Mann-Whitney : p = 0,03; n total = 29) (Kessler et coll., 2006).
En conclusion, d'après les résultats présentés ci-dessus, il semble que le rôle précis du cuivre dans la survenue des maladies neurodégénératives, qui sont multifactorielles, reste flou.
9.1.6 Cancérogénicité
De nombreuses études épidémiologiques ont porté sur l'association entre la teneur en cuivre de l'organisme ou l'apport en cuivre, la cuprémie et les divers types de cancer. En général, les données probantes relatives à la cancérogénicité du cuivre ne sont pas concluantes et il n'existe aucune donnée probante claire ou substantielle relative au rôle étiologique de ce nutriment dans la survenue de cancers chez les humains.
Une étude cas/témoins menée en France (Senesse et coll., 2004) a révélé une augmentation des probabilités d'apparition d'un cancer colorectal pour les personnes dont l'apport en cuivre se situait dans le quartile supérieur, comparé à celles dont l'apport se situait dans le quartile inférieur (rapport des cotes [RC] = 2,4; IC à 95 % : 1,3 à 4,6; p < 0,01). Une autre étude cas/témoins réalisée au sein d'une grande cohorte sur les maladies chroniques menée aux Pays-Bas (n > 10 000) a révélé un risque accru de décès causé par le cancer (RC = 3,7; IC à 95 % : 1,5 à 9,1) pour les participants dont la cuprémie était supérieure à 1,4 mg/L, comparativement aux participants ayant une cuprémie entre 1,1 et 1,4 mg/L, après un ajustement en fonction de l'indice de masse corporelle, du taux de cholestérol, du niveau d'éducation et de la pression artérielle; toutefois, les cofacteurs importants n'ont pas été ajustés dans l'étude (Kok et coll., 1988). En outre, une étude de cas/témoins (n = 133 cas, 241 témoins) réalisée au sein d'une cohorte de travailleurs (n = 5 000) à Washington a également révélé un risque accru de cancer pour les sujets dont la cuprémie se situait entre 126 et 276 µg/dL, comparativement à ceux dont la cuprémie se situait entre 43 et 92 µg/dL (RC = 2,4; IC à 95 % : 1,1 à 5,1). Cependant, selon les auteurs, les résultats indiquaient plutôt qu'une augmentation de la cuprémie était une conséquence de la maladie, c.-à-d. le cancer (Coates et coll., 1989). Enfin, une étude cas/cohorte portant sur un échantillon aléatoire de cas (n = 46) venant d'une cohorte de femmes anglaises a révélé un risque accru de cancer du sein (RC = 3,2 %; IC à 95 % : 1,1 à 9,4) pour les femmes dont la cuprémie était supérieure à 1,3 mg/L, comparativement à celles dont la cuprémie se situait entre 1,0 et 1,2 mg/L, après un ajustement en fonction de l'âge, du poids et des antécédents familiaux; toutefois, il n'y a eu aucune dose-réponse et d'autres facteurs peuvent expliquer cette association (Overvad et coll., 1993). Par ailleurs, de nombreuses études cas/témoins n'ont pas étayé les associations entre l'apport en cuivre ou la cuprémie et le risque de cancer du sein ou de l'œsophage (Cavallo et coll., 1991; Dabek et coll., 1992; Prasad et coll., 1992). De même, aucune association entre l'apport en cuivre et le cancer des poumons n'a été observée dans une étude de cohorte rétrospective (Mahabir et coll., 2010). Dans une étude de cohorte portant sur les associations entre de multiples antioxydants et des cancers chez les femmes, les risques de lymphome non hodgkinien, de lymphome diffus à grandes cellules B ou de lymphome folliculaire n'augmentaient pas pour les participantes dont l'apport en cuivre était plus important (Thompson et coll., 2010).
En conclusion, les résultats des études présentées ci-dessus sont équivoques, puisque (1) l'exposition individuelle était mal caractérisée et (2) l'augmentation de la cuprémie pourrait être liée à des altérations de la prise en charge du cuivre, conséquences de la maladie (ici, le cancer). De plus, comme mentionné plus tôt, plus de 90 % du cuivre sérique est normalement lié à la Cp. Cette dernière est une protéine de phase aiguë dont la concentration augmente en cas de stress (voir la section 8.2).
9.1.7 Génotoxicité
En général, le cuivre n'est pas censé être génotoxique lorsque l'apport est normal. Cependant, on a constaté des augmentations de la génotoxicité et des dommages oxydatifs chez les patients souffrant de dyshoméostasie du cuivre (NRC, 2000). Par exemple, on a observé des lésions de l'ADN dans les hépatocytes de patients atteints de cirrhose amérindienne infantile, que l'on pense être dues à l'accumulation excessive de cuivre dans le noyau, qui entraîne la production de radicaux libres (Prasad et coll., 1996). En outre, des adduits à l'ADN volumineux (par rapport aux adduits de 8-hydroxy 2'-déoxyguanosine) ont été observés dans le foie de patients atteints de la maladie de Wilson (Carmichael et coll., 1995). Par ailleurs, un essai croisé à double insu d'une durée de six semaines (n = 15 à 17) n'a indiqué aucune différence majeure en ce qui concerne les lésions de l'ADN des leucocytes (test des comètes) entre les participants qui recevaient un apport complémentaire de 3 mg/jour de sulfate de cuivre, ou encore, de 3 ou 6 mg/jour de chélate de glycine de cuivre et ceux qui recevaient des placebos (valeur p du test t > 0,05) (O'Connor et coll., 2003).
9.1.8 Toxicité pour le développement et la reproduction
Il n'existe aucune donnée probante convaincante de la toxicité pour le développement et la reproduction des humains en ce qui concerne l'apport oral de cuivre (IPCS, 1998; NRC, 2000; EFSA, 2006; Heinemann et coll., 2015) . Cependant, il faut noter que les femmes atteintes de la maladie de Wilson qui ne suivent aucun traitement vivent fréquemment des avortements spontanés (NRC, 2000).
9.2 Effets chez les animaux de laboratoire
La toxicité du cuivre varie d'un animal à l'autre et d'une espèce chimique à l'autre. Les organes cibles sont d'abord ceux qui absorbent et excrètent les métaux (le foie, les reins, l'estomac antérieur). L'hépatotoxicité et la néphrotoxicité étaient les principaux effets signalés chez de jeunes rongeurs exposés à de fortes doses de cuivre pendant des périodes courtes ou subchroniques. On a également observé une récupération qui indique une adaptation physiologique à un apport élevé en cuivre chez des rats (Haywood, 1980, 1985; Haywood et Loughran, 1985; Haywood et coll., 1985a, 1985b; Fuentealba et Haywood, 1988; Fuentealba et coll., 1989a, 1989b). Des effets sur le système nerveux central ont également été constatés; toutefois, les données probantes relatives à ces effets sont faibles et peu concluantes. L'exposition à des concentrations élevées de cuivre semble plus toxique lorsque ce dernier provient de l'eau potable plutôt que des aliments, et les rats étaient généralement plus sensibles au cuivre que les souris. Les sels de cuivre, en particulier le sulfate de cuivre(II), étaient communément utilisés, et leur toxicité était attribuée à la forme ionique. Aucune étude de qualité sur l'exposition chronique n'a été trouvée.
9.2.1 Toxicité aiguë
Des doses létales orales (DL50) de 15 à 1 600 mg Cu/kg p.c. pour diverses formes de cuivre ont été rapportées chez plusieurs espèces; par exemple, pour les rats la DL50 était de 120 à 300 mg/kg p.c. pour le sulfate de cuivre(II) et de 15 à 90 mg/kg p.c. pour le chlorure de cuivre(II) (Stern et coll., 2007; OEHHA, 2008; Ellingsen et coll., 2015). La mort était généralement précédée d'une hémorragie gastrique, d'un dysfonctionnement cardiovasculaire et d'une paralysie (IPCS, 1998). L'estomac étant le principal site de la réponse émétique, les vomissements apparaissent en quelques minutes chez les beagles, les chiens bâtards et les furets exposés à une solution aqueuse de sulfate de cuivre(II) (OMS, 2004). Comme les rats et les souris ne vomissent pas, la plupart des études utilisant les vomissements comme indicateur de toxicité n'ont pas pu observer de réponse chez les rats et les souris à des concentrations comparables à celles qui suscitent une réponse chez les autres espèces (Horn et coll., 2013). Les sels solubles, comme le sulfate de cuivre(II), déclenchent généralement des réponses plus fortes que les formes insolubles; de plus, les rongeurs étaient plus sensibles que les furets, les moutons, les chiens et les chats (IPCS, 1998; OMS, 2004).
9.2.2 Toxicité subchronique et à court terme
9.2.2.1 Effets hépatiques
Une inflammation hépatique (c.-à-d. hépatite multifocale, accumulation de macrophages, augmentation de l'activité enzymatique hépatique dans le sérum) et une nécrose des hépatocytes ont été observés chez des rats F344 jeunes (~6 à 10 semaines) et adultes des deux sexes qui ingéraient de 1 500 à 16 000 ppm de sulfate de cuivre(II) dans leur nourriture pendant 2 à 18 semaines (Hebert et coll., 1993; NTP, 1993; Fuentealba et coll., 2000; Aburto et coll., 2001). Les effets étaient plus prononcés chez les rats mâles et chez les jeunes. Par ailleurs, des altérations de l'intégrité et de la taille des lysosomes, du réticulum endoplasmique, des mitochondries et du noyau ont été observées chez des rats ayant reçu 1 500 Cu/kg de nourriture pendant 16 semaines (Fuentealba et Haywood, 1988).
Aucune donnée probante sur la toxicité du cuivre ou sur les lésions hépatiques n'a été recueillie lors de l'observation de bébés singes rhésus ayant reçu 6,6 mg de sulfate de cuivre(II)/L (900 µg/kg p.c. par jour, n = 5) jusqu'à l'âge de cinq mois; toutefois, un nombre accru de cellules de Kupffer a été observé dans le foie, ce qui indique une inflammation (Araya et coll., 2005a). De plus, aucune donnée probante clinique, biochimique ou histologique de lésions hépatiques n'a été relevée pour les capucins nouveau-nés et adultes (deux femelles et deux mâles pour chaque groupe) exposés pendant 36 mois à respectivement 5,5 mg et 7,5 mg de gluconate de cuivre(II)/kg par jour; cependant, une augmentation des gènes inflammatoires (p. ex. HGF, TGFβ et NFκB) a été notée (Araya et coll., 2012). Enfin, aucun effet nocif n'a été noté chez des chiens Beagle nourris avec du gluconate de cuivre(II) à des concentrations allant jusqu'à 8,4 mg/kg p.c. pendant 6 à 12 mois, et les légères modifications du fonctionnement hépatique observées aux doses les plus fortes se sont résorbées après l'arrêt de l'exposition (NRC, 2000).
9.2.2.2 Effets rénaux
Une augmentation des gouttelettes protéiniques cytoplasmiques a été observée dans les tubes contournés des reins de rats mâles ayant reçu de l'eau contenant 300 ppm de sulfate de cuivre(II) pendant deux semaines (Hebert et coll., 1993; NTP, 1993). Des effets similaires ont été observés chez les rats ayant reçu de la nourriture contenant au moins 2 000 ppm de sulfate de cuivre(II) pendant 2 à 15 semaines (Haywood, 1980; Hebert et coll., 1993; NTP, 1993). Les effets étaient plus prononcés chez les mâles.
9.2.2.3 Autres effets
Une hyperplasie et une hyperkératose de la ligne suturale du rumen ont été observées chez les rats et les souris des deux sexes à des doses d'au moins 2 000 ppm de sulfate de cuivre(II) reçues dans la nourriture pendant 2 à 13 semaines, avec une sensibilité supérieure observée chez les rats (Hebert et coll., 1993; NTP, 1993). Les symptômes variaient de l'œdème et l'inflammation du stroma, à la formation de projections papillaires avec expansion du noyau stromal et de la muqueuse squameuse chez les rats gravement atteints.
Un appauvrissement en cellules de la moelle osseuse, une diminution de l'hématopoïèse de la rate et de la moelle osseuse, des changements transitoires des paramètres hématologiques, des lésions aux organes et un décès ont été observés chez les rats qui consommaient de fortes doses de cuivre (plus de 2 000 ppm) (NTP, 1993; Bertinato et coll., 2010).
9.2.3 Cancérogénicité
Il n'a pas été démontré que le cuivre est cancérogène pour les animaux. En effet, les données limitées disponibles n'indiquent pas que le cuivre ou ses sels sont cancérogènes pour les animaux dont l'homéostasie du cuivre est normale. Plus particulièrement, les données disponibles présentent plusieurs lacunes qui font obstacle à une évaluation adéquate, dont l'âge des études, la taille insuffisante des groupes, les essais sur dose orale unique, l'étendue limitée de l'examen histopathologique et les rapports inadéquats (NRC, 2000; EFSA, 2006; Abe et coll., 2008; OEHHA, 2008). Aucune étude n'a été relevée sur l'exposition au cuivre par inhalation et les taux de cancer ou de maladies chroniques chez les animaux. Cependant, les données recueillies sur le rat Long Evans Cinnamon (LEC), modèle animal de la maladie de Wilson, appuient l'hypothèse que la cirrhose provoquée par le cuivre peut être un facteur étiologique du cancer du foie (NRC, 2000).
9.2.4 Génotoxicité
Même si des réponses positives ont été observées avec les tests Mutatox et SOS Chromotest (Codina et coll., 1995), le cuivre n'est généralement pas génotoxique. Par ailleurs, les tests de mutation microbienne réalisés avec divers sels de cuivre se sont avérés négatifs. En effet, le sulfate de cuivre(II) n'a provoqué aucune mutation des souches TA98, TA100, TA102, TA1535 et TA1537 de Salmonella Typhimurium (Moriya et coll., 1983). Également, aucune mutation n'a été observée avec du gluconate de cuivre(II) — lors du test d'Ames — ou du chlorure de cuivre(II) dans les souches d'Escherichia coli WP2, avec ou sans activation microsomique (Wong, 1988; Hujita et coll., 1998).
9.2.5 Neurotoxicité
Il existe quelques données probantes d'une relation entre l'exposition au cuivre et la neurotoxicité. Par exemple, une faible activité antioxydative et des altérations des propriétés cinétiques de la dopamine ont été observées dans le cerveau de rats exposés à des taux élevés de cuivre (1 g Cu/L ou 46 mg Cu/kg p.c.) dans l'eau potable pour une période de 1 à 11 mois (De Vries et coll., 1986; Ozcelik et Uzun, 2009). Également, des altérations de la synthèse de la protéine amyloïde-bêta et des troubles d'apprentissage ont été observés chez les souris et les lapins modèles de la MA ayant subi une exposition chronique au cuivre (Sparks et Schreurs, 2003; Kitazawa et coll., 2009). Toutefois, aucune augmentation de la sensibilité neurologique n'a été relevée chez les rats LEC ni chez les terriers Bedlington, des modèles animaux génétiques de la toxicose au cuivre (NRC, 2000; Pal et coll., 2013), et aucune manifestation neurocomportementale n'a été observée chez les rats exposés à 1 ppm de sulfate de cuivre(II) dans l'eau potable pendant six semaines (Fujiwara et coll., 2006). Par conséquent, les résultats relatifs à la neurotoxicité sont équivoques, et les effets nocifs n'ont été observés qu'à de très fortes doses ou uniquement chez des animaux présentant des anomalies génétiques.
9.2.6 Toxicité pour la reproduction et le développement
Certaines études ont rapporté des changements dans les testicules, les vésicules séminales, l'utérus et les ovaires de rats, de souris et de campagnols roussâtres après une exposition à des concentrations élevées de cuivre (27 à 200 mg/kg p.c. par jour) (EFSA, 2006; Roychoudhury et coll., 2015). Même si on rapporte une tératogénicité et une létalité fœtale à la suite de l'ingestion de cuivre à de fortes doses (plus de 80 à 390 mg/kg p.c.), ces résultats sont attribués à la toxicité des mères (IPCS, 1998; NRC, 2000; EFSA, 2006). Par ailleurs, aucun effet nocif n'a été rapporté pour chacun des paramètres de reproduction étudiés chez les rats et les souris des deux sexes ayant été exposés à du sulfate de cuivre(II) (jusqu'à 8 000 mg/kg de nourriture ou 140 mg/kg p.c.) pendant 13 semaines (NTP, 1993).
9.3 Mode d'action
Le cuivre exerce sa toxicité par deux voies principales : la voie neuronale, dans le cas des effets sur le tractus GI, et la voie de toxicité cellulaire (particulièrement celle du stress oxydatif), dans le cas des autres effets nocifs. Pour que les effets toxiques se manifestent, le cuivre doit être dans sa forme ionique libre ou cuivre libre. Les sections suivantes décrivent brièvement le mode d'action présumé de la toxicité du cuivre.
9.3.1 Effets sur le tractus gastro-intestinal
Le cuivre exerce sa toxicité sur le tractus GI en irritant directement l'estomac, ce qui active la sécrétion de sérotonine par les cellules entérochromaffines (NRC, 2000; Bradberry, 2007; OEHHA, 2008). Le mode d'action de cette réponse neuromusculaire est un mécanisme de réflexe médié par le SNC. Dans une étude comprenant plusieurs agents émétiques, Bhandari et Andrews (1991) ont conclu que le sulfate de cuivre entraîne des vomissements par l'activation des chémorécepteurs GI des afférences du nerf vague et que ce processus comprend fort probablement une forme d'activation des récepteurs 5-hydroxytryptamine-4 (des sous-types de récepteurs qui répondent à la sérotonine). La sérotonine peut rendre sensibles les terminaisons des nerfs parasympathiques des muqueuses gastriques et ainsi activer le centre du cerveau responsable des vomissements. Ce dernier médie les messages efférents du tractus GI, ce qui déclenche une réponse (OEHHA, 2008). L'infusion de l'estomac avec une solution de sulfate de cuivre entraîne des vomissements chez sept furets sur neuf, tandis que l'infusion du duodénum avec une solution similaire entraîne des vomissements uniquement chez un animal sur neuf (Makale et King, 1992). Les chiens dont les nerfs vagues et les nerfs gastriques sympathiques sont coupés présentent une réponse émétique altérée (Fukui et coll., 1994). Cette réponse est modulée par de nombreux facteurs, comme la sensibilité individuelle, la forme de cuivre et la nature du contenu gastrique. On a également démontré une adaptation de la réponse (NRC, 2000). Comme les réponses du tractus GI au cuivre sont liées aux effets locaux qui se produisent aux portes d'entrée, la mesure appropriée pour l'évaluation des risques est la concentration.
9.3.2 Autres effets nocifs
La toxicité cellulaire est le principal mode d'action par lequel le cuivre exerce ses autres effets nocifs. C'est d'ailleurs celui qui a été le plus étudié (Gaetke et Chow, 2003; Gaetke et coll., 2014). Plusieurs mécanismes ont été proposés pour expliquer la toxicité cellulaire provoquée par le cuivre. Toutefois, les dommages oxydatifs aux membranes et aux macromolécules biologiques sont les plus étudiés et les plus constants (Bremner, 1998; Gaetke et Chow, 2003; Jomova et Valko, 2011; Mauceri et Mishra, 2014). On a déterminé que le cuivre libre était le groupe toxique caractéristique qui causait le stress oxydatif (EFSA, 2006; Bertinato et coll., 2010; Stern, 2010; Montes et coll., 2014). Le Cu(I) et le Cu(II) possèdent tous deux un Eh et peuvent catalyser la production d'espèces réactives de l'oxygène (ERO), en particulier le radical hydroxyle (OH•). Cependant, afin d'exercer sa cytotoxicité, le Cu(II) doit être réduit (p. ex. par le GSH ou l'ascorbate) en Cu(I) (EFSA, 2006; Bertinato et coll., 2010; Stern, 2010; Formigari et coll., 2013; Montes et coll., 2014), qui peut alors catalyser la formation de OH• à partir de peroxyde d'hydrogène (H2O2) par les réactions de Haber-Weiss et de Fenton (Bremner, 1998; Bradberry, 2007; Bertinato et coll., 2010; Stern, 2010; Formigari et coll., 2013; Gaetke et coll., 2014; Jazvinscak Jembrek et coll., 2014; Montes et coll., 2014). En effet, le stress oxydatif provoqué par le cuivre entraîne la formation de radicaux hydroxyles extrêmement réactifs, capables d'initier l'un des trois principaux événements cellulaires les plus fréquemment relevés(Gaetke et coll., 2014; Jazvinscak Jembrek et coll., 2014). Le premier événement, la peroxydation des lipides membranaires, est la conséquence de l'élimination d'un hydrogène d'un acide gras non saturé par le radical hydroxyle, ce qui crée un radical lipidique. Ce processus provoque entre autres la dégradation de la membrane des lysosomes hépatiques (Burkitt, 2001; Letelier et coll., 2010; Gaetke et coll., 2014). Le second événement important, l'oxydation des protéines, est causé par l'élimination par OH• d'un hydrogène d'un carbone porteur d'un groupe amino, qui crée un radical protéique centré sur le carbone, puis mène à la désactivation des enzymes, par exemple. Le troisième événement important, les dommages à l'ADN, est la conséquence de la rupture des brins d'ADN et de l'oxydation des bases par OH•, ce qui provoque par exemple des mutations (Gaetke et Chow, 2003; Jomova et Valko, 2011; Gaetke et coll., 2014). Ces événements importants d'oxydation peuvent mener à l'inflammation et à la mort cellulaire (Yoshida et coll., 1993; NRC, 2000; Jomova et Valko, 2011; Formigari et coll., 2013; Gaetke et coll., 2014), ce qui explique potentiellement les effets toxiques du cuivre de même que les altérations moléculaires et morphologiques observées dans le foie, les reins, le cerveau et les érythrocytes à de fortes doses dans les études sur les animaux (Eskici et Axelsen, 2012; Shaligram et Campbell, 2013; Jazvinscak Jembrek et coll., 2014). Comme la formation des ERO provoquées par le cuivre dépend du temps et de la dose, ce mode d'action a été proposé il y a longtemps pour expliquer l'hépatotoxicité déclenchée par ce métal (Formigari et coll., 2013). Les données probantes actuelles indiquent de plus que les mitochondries hépatiques sont une cible importante des dommages oxydatifs provoqués par le cuivre (Jiménez Del Rı́o et Vélez-Pardo, 2004; EFSA, 2006; Kawakami et coll., 2008; Paris et coll., 2009; Tardito et coll., 2011; Formigari et coll., 2013; Gaetke et coll., 2014).
Par conséquent, les données provenant des études expérimentales appuient l'hypothèse que les dommages oxydatifs provoqués par les ERO représentent le mode d'action de la toxicité du cuivre. Par exemple, la peroxydation des lipides, l'oxydation des protéines, la baisse de potentiel des membranes mitochondriales et l'expulsion du cytochrome C par les mitochondries, qui précèdent toutes la mort cellulaire, ont été relevées après une exposition à du cuivre en excès (Kumar et coll., 2015). Également, les rats ayant été nourris avec de fortes concentrations de cuivre alimentaire présentaient une augmentation de la peroxydation des lipides de la membrane mitochondriale, mesurée par une augmentation des taux de diènes conjugués et de TBARS (Sokol et coll., 1990). Enfin, la formation de radical hydroxyle a été mesurée dans la bile des rats ayant reçu des doses de cuivre et d'acide ascorbique (Kadiiska et coll., 1992).
De plus, les effets neurotoxiques observés à fortes doses pourraient s'expliquer par la production d'ERO, comme la production d'un radical hydroxyle, sous-produit du métabolisme de la monoamine-oxydase (Eskici et Axelsen, 2012; Formigari et coll., 2013; Govindaraju et coll., 2013; Shaligram et Campbell, 2013; Zhao et coll., 2013; Gaetke et coll., 2014; Jazvinscak Jembrek et coll., 2014; Montes et coll., 2014). L'épuisement de la GSH-réductase (qui dépend également du nicotinamide-adénine-dinucléotide-phosphate hydrogéné [NADPH]) et la génération de radicaux hydroxyles pourraient également provoquer des effets hémolytiques (IPCS, 1998; Grass et coll., 2011). La méthémoglobinémie souvent observée dans les cas d'empoisonnement aigu au cuivre semble être une conséquence de l'oxydation directe du fer héminique de sa forme ferreuse (Fe2+) à sa forme ferrique (Fe3+) par le cuivre (IPCS, 1998; Bradberry, 2007).
D'autres modes d'action — comme l'interaction directe du cuivre avec les macromolécules essentielles et le déplacement des cofacteurs des métalloenzymes — ont également été proposés. Comme le cuivre est un composant de nombreuses métalloenzymes, il est probable que de fortes concentrations de cuivre puissent modifier les protéines qui contiennent des groupes sulfhydryle en interagissant directement avec les macromolécules (p. ex ADN, membranes biologiques, protéines). La liaison irréversible et non spécifique du cuivre aux groupes sulfhydryle peut modifier la structure des macromolécules (p. ex. GSH, monooxygénase) et les rendre ainsi inactives. Ce mode d'action a été proposé pour expliquer l'anémie hémolytique et la méthémoglobinémie observées à la suite d'un empoisonnement aigu au sulfate de cuivre. Le cuivre peut entrer dans les érythrocytes, où il peut se lier aux groupes sulfhydryle et rendre inactif la glucose-6-phosphate déshydrogénase, essentielle à la formation de NADPH, un intermédiaire dans la chaîne de transfert des électrons (Pamp et coll., 2005).
10.0 Classification et évaluation
Les données actuelles sont insuffisantes pour classer le cuivre selon le risque de cancérogénicité. L'U.S. EPA (1988) a classé le cuivre dans le groupe D, non classifiable en ce qui a trait au risque de cancérogénicité pour les humains. Le Centre International de Recherche sur le Cancer n'a pas classé le cuivre et ses sels solubles (p. ex. sulfate, chlorure) selon le risque de cancérogénicité..
10.1 Évaluation des risques autres que les risques de cancer
Le cuivre est un élément essentiel qui intervient dans de nombreux processus biologiques (p. ex. comme composant des métalloenzymes); toutefois, une carence en cuivre et une surexposition au cuivre peuvent toutes deux provoquer des effets nocifs. Comme il a été traité à la section 9.1.1, la carence en cuivre et la surexposition au cuivre sont rares chez les Canadiens et les Canadiennes en bonne santé dont l'alimentation est équilibrée, puisque les mécanismes homéostatiques régulent les concentrations de nutriments (Santé Canada, 2011).
Les effets sur la santé d'une exposition au cuivre peuvent être influencés par le mode d'exposition. Le cuivre alimentaire est exposé à l'effet de premier passage hépatique qui peut réduire la dose globale; le cuivre libre, le groupe toxique qui pose problème dans l'eau potable, peut ne pas être exposé à un tel effet, ce qui peut nettement augmenter la dose interne (Brewer, 2009, 2014).
La banque de données des études sur les effets sur la santé humaine de l'ingestion de cuivre est vaste et contient suffisamment de données pour déterminer la concentration acceptable de cuivre dans l'eau potable. En général, l'exposition à court terme entraîne des effets sur le tractus GI, généralement observés à des concentrations de cuivre supérieures à 3 mg/L d'eau (voir les sections 9.1.3 et 9.1.4). En outre, lorsque l'on considère les données probantes actuelles (tirées principalement d'études mécanistes et d'études menées sur des animaux), le principal effet d'une surexposition prolongée au cuivre semble être une accumulation de métal dans le foie et dans les reins, qui peut mener à des lésions structurelles et biochimiques (Linder et Hazegh-Azam, 1996; IPCS, 1998; Tapiero et coll., 2003; Cockell et coll., 2008).
Plusieurs études comparatives, avec répartition aléatoire, portent sur les effets nocifs sur la santé de l'exposition au cuivre. Bien que principalement observés chez les adultes, les résultats de ces études indiquent qu'une exposition orale à court terme au cuivre présent dans l'eau potable en état de jeûne provoque des effets sur le tractus GI (habituellement des nausées, des douleurs abdominales et des vomissements combinés, et une diarrhée), qui, bien que transitoires, sont les effets cliniques les plus sensibles (Pizarro et coll., 1999b; Araya et coll., 2001, 2003a; Olivares et coll., 2001). Le symptôme le plus fréquemment signalé a été les nausées, qui surviennent généralement dans les 15 minutes suivant l'ingestion; la diarrhée a été signalée moins fréquemment aux différentes doses étudiées, et les femmes semblent les plus vulnérables. En outre, les effets sur le tractus GI observés disparaissaient lorsque l'exposition cessait, ce qui laisse présager une réaction adaptative avec le temps (Araya et coll., 2004). De plus, les résultats indiquent que la concentration en cuivre (c.-à-d. la dose bolus contenue dans l'eau ingérée à jeun divisée par le volume de dosage) est le principal déterminant de l'incidence de la nausée (Araya et coll., 2001, 2003a). Elle est ainsi considérée comme la mesure la plus adéquate de la dose pour l'évaluation des risques, selon les données recueillies sur le mode d'action. Il est à noter, toutefois, que bien que les études susmentionnées (à l'exception de l'étude menée par Araya et coll., 2004) aient duré jusqu'à 12 semaines, l'exposition n'était pas continue, et le cuivre était systématiquement administré en doses bolus uniques (dans l'eau du robinet ou dans de l'eau distillée et désionisée) sur de courtes périodes (c.-à-d. une fois par semaine). Les résultats pourraient donc ne pas refléter précisément les effets d'une exposition prolongée à une faible dose de cuivre dans l'eau potable.
Bien que les études sur l'exposition prolongée au cuivre soient limitées, leurs résultats portent à croire que le temps a une incidence. En effet, les données disponibles sur l'exposition des adultes au cuivre dans l'eau potable pendant moins de 3 mois ont permis de confirmer les résultats des études sur l'exposition à court terme (Araya et coll., 2004). Toutefois, les résultats des études portant sur un apport complémentaire pour les adultes indiquaient la survenue d'effets nocifs sur la santé après l'exposition à des apports importants sur de longues périodes (plus de 5 mois; Turnlund et coll., 2004).
Les sous-groupes considérés comme vulnérables à une surexposition prolongée au cuivre sont les personnes présentant des troubles génétiques liés au métabolisme du cuivre (par exemple les patients atteints de la maladie de Wilson), les personnes présentant un déficit en glucose-6-phosphate déshydrogénase, les enfants atteints de syndromes de cirrhose infantile (cirrhose amérindienne infantile, intoxication idiopathique au cuivre et cirrhose tyrolienne infantile endémique) et les nourrissons (de moins d'un an). Parmi ces sous-groupes, les nourrissons sont considérés comme les plus vulnérables, puisqu'ils risquent de subir la plus forte exposition en raison de l'immaturité de leur système hépatobiliaire et de leur plus fort taux d'absorption du cuivre.
Une étude prospective avec répartition aléatoire menée par Olivares et coll. (1998) visait à évaluer les effets de l'exposition au cuivre chez les nourrissons (âgés de 3 à 12 mois) nourris au sein et à la préparation pour nourrissons qui ont ingéré de l'eau potable présentant des concentrations élevées de cuivre (31,48 µmol Cu(II)/L ou 2 mg/L) ou faibles (moins de 1,57 µmol Cu(II)/L ou 0,1 mg/L) — sous forme de sulfate de cuivre(II) — pendant 9 mois selon différents modes de consommation (p. ex. dans les aliments, dans la préparation pour nourrissons, dans l'eau potable). Les résultats cliniques et biochimiques ont été notés à l'âge de 6, 9 et 12 mois. Au cours et à la fin de l'étude, aucun effet clinique aigu (c.-à-d. diarrhée ou symptômes respiratoires) ou chronique (c.-à-d. différences dans les marqueurs de la fonction hépatique) n'a été observé chez les sujets après une exposition à de l'eau potable contenant 2 mg/L de cuivre (ce qui correspond à un apport quotidien moyen ± ET de 318,7 ± 107,3 µg/kg p.c. par jour), lorsque comparés aux témoins.
L'étude menée par Olivares et coll. (1998) a été retenue comme l'étude décisive permettant de déterminer la CMA proposée, puisqu'elle a été menée sur des nourrissons, impliquait une exposition continue au Cu(II) dans l'eau potable sur une période plus longue que celle des études menées chez les adultes (habituellement jusqu'à 3 mois); de plus, cette étude tenait compte de plusieurs intervalles temporels, y compris des nourrissons âgés de 4 à 6 mois, soit la période où le système hépatobiliaire n'a pas encore atteint sa maturité et où l'absorption intestinale est à son niveau le plus élevé. Puisque les nourrissons nourris à la préparation pour nourrissons sont censés présenter l'exposition la plus élevée au cuivre, la limite supérieure de la NOAEL — déterminée en fonction des effets sur le tractus GI et de la fonction hépatique, pour le sous-groupe nourri à la préparation pour nourrissons (moyenne ± ET = 318,7 ± 107,3 µg/kg p.c. par jour pour 56 nourrissons âgés de 4 à 6 mois) — a été sélectionnée à titre de point de départ : cette dose (c.-à-d. 426 µg/kg p.c. par jour) représente la dose la plus élevée administrée sans que des effets nocifs soient observés.
Bien que la banque de données comporte certaines incertitudes relativement à la toxicité du cuivre (notamment des données limitées sur l'exposition au cuivre pour les nourrissons âgés de moins de 6 mois et sur le niveau de variabilité entre les jeunes groupes d'âge pour ce qui est l'absorption du cuivre, de même qu'un manque d'études sur l'exposition chronique), le point de départ déterminé au cours de l'étude d'Olivares et coll. (1998) est considéré comme prudent, puisqu'aucun symptôme d'intoxication au cuivre n'a été observé à cette dose durant toute l'étude (9 mois). En outre, en raison de la régulation homéostatique de l'absorption et de l'excrétion du cuivre, il a été démontré que l'absorption du cuivre diminue à mesure que les apports alimentaires en cuivre augmentent (voir la section 8.1). Par conséquent, un facteur d'incertitude qui justifie les lacunes des bases de données n'est pas garanti. De ce fait, il a été déterminé que la dose de 426 µg/kg p.c. par jour était l'apport quotidien tolérable en ce qui concerne le cuivre libre.
La CMA proposée pour le cuivre total peut être calculée de la façon suivante : 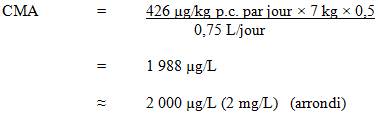
Description : Equation
La CMA est calculée en multipliant 426 microgrammes par kilogramme de poids corporel par jour par 7 kilogrammes, est par 0,5. Le produit résultant est ensuite divisé par 0,75 litres par jour. La valeur résultante de 1988 microgrammes par litre est ensuite arrondie à 2000 microgrammes par litre (2 milligrammes par litre).
- 426 µg/kg p.c. par jour est l'apport quotidien tolérable (AQT) en fonction des effets sur le tractus GI et de la fonction hépatique chez les nourrissons nourris à la préparation pour nourrissons au cours des 9 mois de l'étude menée par Olivares et coll. (1998);
- 7 kg est le poids corporel moyen d'un nourrisson (0 à 6 mois) (Santé Canada, 1994);
- 0,5 est le facteur d'attribution estimé pour l'eau potable; étant donné que le lait maternisé constitue l'alimentation totale des nourrissons qui ne sont pas nourris au sein au cours des premiers mois de leur vie, l'eau potable et le lait maternisé représentent les deux principales sources d'exposition au cuivre, et l'apport provenant d'autres sources est considéré comme insignifiant pour ce groupe d'âge (OMS, 1996). Ainsi, l'attribution de 50 % de l'apport à l'eau potable est jugée appropriée, puisque seules deux principales sources d'exposition ont été déterminées (Krishnan et Carrier, 2013) et que les données relatives à ces sources d'exposition sont très variables;
- 0,75 L/jour est le volume estimé d'eau du robinet consommé par un nourrisson nourri au biberon dans le groupe des 0 à 6 mois (Santé Canada, 1994).
La CMA proposée est considérée comme suffisante pour protéger la santé humaine contre les effets aussi bien à court terme (c.-à-d. effets sur le tractus GI) qu'à long terme (dont les effets potentiels sur le foie et les reins).
10.2 Considérations internationales
Cette section présente les recommandations et les normes relatives à l'eau potable qu'ont établies d'autres organismes nationaux et internationaux. Les différences entre les limites indiquées peuvent être attribuées à l'ancienneté des évaluations ou à des politiques et des approches divergentes, notamment le choix de l'étude clé et l'utilisation de différents taux de consommation, de poids corporels et de facteurs d'attribution.
L'OMS (1993) a établie une directive provisoire basée sur la santé de 2 mg/L pour le cuivre dans l'eau potable en fonction de l'apport quotidien tolérable maximum provisoire (AQTMP) de 0,5 mg/kg suggéré par le JECFA en 1982 et d'un facteur d'attribution de 10 % de cette valeur à l'eau potable. L'AQTMP a été établi en fonction de l'hépatotoxicité observée au cours d'une étude menée sur des chiens et financée par l'industrie (Shanaman et coll., 1972); la directive est considérée provisoire en raison des incertitudes liées à la toxicité du cuivre pour les humains (OMS, 1996). Toutefois, après une évaluation effectuée en 2003, l'OMS a décidé de maintenir cette valeur à 2 mg/L en soutenant que cette valeur suffisait à protéger contre les effets aigus du cuivre sur le tractus GI et laissait une marge de sécurité convenable pour la population présentant une homéostasie du cuivre normale (OMS, 2011). En 2004, la directive de 2 mg/L a été confirmée, perdant ainsi son statut provisoire (Olivares et coll., 1998, 2001; Pizarro et coll., 1999b, 2001; Araya et coll., 2001, 2003a; Zietz et coll., 2003b).
Aux États-Unis, l'U.S. EPA (1991) a établi son maximum contaminant level goal (MCLG) et son maximum contaminant level (MCL) pour le cuivre dans l'eau potable à 1,3 mg/L, en s'appuyant sur des données sur les effets nocifs affectant le tractus GI après une exposition aiguë au cuivre, provenant d'une étude de cas menée auprès d'infirmières ayant consommé une boisson alcoolisée conservée dans des contenants en cuivre(Wyllie, 1957). Un MCL seccondaire de 1 mg/L a été établi pour le cuivre en fonction de considérations d'ordre esthétique (goûts et taches bleues/vertes). L'U.S. EPA réglemente toutefois les concentrations de cuivre par la LCR (U.S. EPA, 1991, 2000), le règlement sur le plomb et le cuivre qui est fondé sur le traitement et qui a établi un seuil d'intervention de 1,3 mg/L pour le cuivre dans l'eau potable. Les grands réseaux de distribution d'eau (dotés de plus de 50 000 branchements), à moins qu'ils ne soient constitués de matières jugées non corrosives, sont tenus d'installer un « traitement anticorrosion optimal » et de respecter les exigences précises des limites de fonctionnement relatives à la qualité de l'eau. Si le 90e. centile des concentrations de cuivre dans les échantillons prélevés au robinet des consommateurs dans les sites répartis selon un ordre de priorité précis (échantillons de premier jet qui ont reposé pendant au moins 6 heures) excède le seuil d'intervention de 1,3 mg/L, les responsables du réseau doivent entreprendre un certain nombre d'interventions additionnelles pour limiter la corrosion et sensibiliser le public. Le nombre de sites, la fréquence de la surveillance et l'étendue des interventions requises varient selon la taille du réseau. La LCR fait actuellement l'objet d'une révision en profondeur, qui devrait s'achever après 2017.
La California EPA (OEHHA, 2008) a établi un objectif de santé publique non réglementaire de 0,3 mg/L pour le cuivre dans l'eau potable en fonction des nourrissons, considérés comme une population vulnérable, et cet objectif est perçu comme une protection adéquate contre tout effet nocif aigu ou chronique découlant de l'exposition au cuivre. Cet objectif est fondé sur l'absence d'effets nocifs observés au cours de l'étude clinique menée par Olivares et coll. (1998) sur des nourrissons qui ont été exposés au cuivre dans l'eau potable, et tient compte des données d'autres études sur les effets sur le tractus GI en tant qu'effets clés.
Les directives sur l'eau potable de l'Australie (Australian Drinking Water Guidelines) recommandent deux concentrations en cuivre : de 1 mg/L pour des raisons esthétiques, afin de prévenir les taches et les problèmes de goût, et de 2 mg/L pour prévenir les problèmes de santé (NHMRC, 2011).
11.0 Justification
Le cuivre est un nutriment essentiel présent naturellement dans la croûte terrestre, que ce soit sous forme de gisement minéral ou, moins fréquemment, sous forme de métal. La National Academy of Medicine des États-Unis (auparavant appelée Institute of Medicine) a fixé des apports quotidiens recommandés ainsi que des apports maximaux tolérables pour le cuivre.
Le cuivre est utilisé dans une vaste de gamme de produits, notamment parce qu'il entre dans la composition du bronze et du laiton. Selon le CNP, le cuivre est une matière acceptable pour les entrées de service et les installations de plomberie. Les principales sources anthropiques du cuivre dans l'environnement comprennent l'exploitation minière, le lessivage des terres cultivées, la gestion des déchets et le traitement de l'eau.
La population canadienne est principalement exposée au cuivre par l'ingestion d'aliments, d'eau potable et de suppléments nutritionnels. Les organismes internationaux ont déterminé que les données disponibles sur le cuivre ne sont pas suffisantes pour le classer selon le risque de cancérogénicité. Les effets observés sur la santé peuvent être associés à une carence en cuivre et à une exposition à des concentrations de cuivre nettement supérieures à l'apport quotidien recommandé. La carence en cuivre n'est pas considérée comme un problème au Canada.
Une CMA de 2 mg/L (2 000 µg/L) a été proposée pour le cuivre présent dans l'eau potable. La CMA proposée est considérée comme suffisante pour protéger la santé humaine contre les effets aussi bien à court terme (c.-à-d. effets sur le tractus GI) qu'à long terme (dont les effets potentiels sur le foie et les reins). La CMA peut être atteinte au moyen des technologies de traitement existantes, et elle est mesurable par les méthodes d'analyse existantes. Toutefois, puisque l'eau potable contient généralement du cuivre en raison du relargage dans les systèmes de plomberie et de distribution, les stratégies de réduction de l'exposition au cuivre provenant de l'eau potable devraient être axées sur le contrôle de la corrosion, à l'aide de méthodes comme des ajustements de la qualité de l'eau et l'utilisation d'inhibiteurs de corrosion.
Dans son processus permanent de révision des recommandations, Santé Canada continuera à suivre les recherches dans ce domaine et recommandera au besoin toute modification de la recommandation qu'il juge appropriée.
12.0 Bibliographie
Aburto, E.M., Cribb, A.E., Fuentealba, I.C., Ikede, B.O., Kibenge, F.S. et Markham, F. (2001). Morphological and biochemical assessment of the liver response to excess dietary copper in fischer 344 rats. Can. J. Vet. Res., 65(2): 97–103.
Aggett, P.J. (1999). An overview of the metabolism of copper. Eur. J. Med. Res., 4: 214–216. (tel que cité dans EFSA, 2006).
Ala, A., Walker, A.P., Ashkan, K., Dooley, J.S. et Schilsky, M.L. (2007). Wilson's disease. The Lancet, 369(9559): 397–408.
APHA, AWWA et WEF (1992). Standard methods for the examination of water and wastewater. 18e édition. American Public Health Association, American Water Works Association et Water Environment Federation, Washington, D.C.
APHA, AWWA et WEF (1995). Standard methods for the examination of water and wastewater. 19e édition. Association, American Water Works Association et Water Environment Federation, Washington, D.C.
APHA, AWWA et WEF (1999). Standard methods for the examination of water and wastewater. En ligne. American Public Health Association, American Water Works Association et Water Environment Federation, Washington, D.C.
APHA, AWWA et WEF (2004). Standard methods for the examination of water and wastewater. En ligne. American Public Health Association, American Water Works Association et Water Environment Federation, Washington, D.C.
APHA, AWWA et WEF (2005). Standard methods for the examination of water and wastewater. 21e édition. American Public Health Association, American Water Works Association et Water Environment Federation, Washington, D.C.
APHA, AWWA et WEF (2010). Standard methods for the examination of water and wastewater. En ligne. American Public Health Association, American Water Works Association et Water Environment Federation, Washington, D.C.
APHA, AWWA et WEF (2012). Standard methods for the examination of water and wastewater. 22e édition. American Public Health Association, American Water Works Association et Water Environment Federation, Washington, D.C.
Araya, M., McGoldrick, M.C., Klevay, L.M., Strain, J.J., Robson, P., Nielsen, F., Olivares, M., Pizarro, F., Johnson, L.A. et Poirier, K.A. (2001). Determination of an acute no-observed-adverse-effect level (NOAEL) for copper in water. Regul. Toxicol. Pharmacol., 34(2): 137–145.
Araya, M., Chen, B., Klevay, L.M., Strain, J.J., Johnson, L., Robson, P., Shi, W., Nielsen, F., Zhu, H., Olivares, M., Pizarro, F. et Haber, L.T. (2003a). Confirmation of an acute no-observed-adverse-effect and low-observed-adverse-effect level for copper in bottled drinking water in a multi-site international study. Regul. Toxicol. Pharmacol., 38(3): 389–399.
Araya, M., Olivares, M., Pizarro, F., Gonzalez, M., Speisky, H. et Uauy, R. (2003b). Gastrointestinal symptoms and blood indicators of copper load in apparently healthy adults undergoing controlled copper exposure. Am. J. Clin. Nutr., 77(3): 646–650.
Araya, M., Olivares, M., Pizarro, F., Llanos, A., Figueroa, G. et Uauy, R. (2004). Community-based randomized double-blind study of gastrointestinal effects and copper exposure in drinking water. Environ. Health Perspect., 112(10): 1068–1073.
Araya, M., Kelleher, S.L., Arredondo, M.A., Sierralta, W., Vial, M.T., Uauy, R. et Lonnerdal, B. (2005a). Effects of chronic copper exposure during early life in rhesus monkeys. Am. J. Clin. Nutr., 81(5): 1065–1071.
Araya, M., Olivares, M., Pizarro, F., Mendez, M.A., Gonzalez, M. et Uauy, R. (2005b). Supplementing copper at the upper level of the adult dietary recommended intake induces detectable but transient changes in healthy adults. J. Nutr., 135(10): 2367–2371.
Araya, M., Núñez, H., Pavez, L., Arredondo, M., Méndez, M., Cisternas, F., Pizarro, F., Sierralta, W., Uauy, R. et González, M. (2012). Administration of high doses of copper to capuchin monkeys does not cause liver damage but induces transcriptional activation of hepatic proliferative responses. J. Nutr., 142(2): 233–237.
Arens, P., Tuschewitzki, G-J., Follner, H., Jacobi, H. et Leuner, S. (1996). Experiments for stimulating microbiologically induced corrosion of copper pipes in a cold-water plumbing system. Mater. Corros., 47: 96–102.
Arnold, R.B., Griffin, A. et Edwards, M. (2012). Controlling copper corrosion in new construction by organic matter removal. J. Am. Water Works Assoc., 104(5): E310-E317.
ASTM (1995). ASTM D1688-95 Standard test methods for copper in water. ASTM International, West Conshohocken, Pennsylvanie.
ASTM (2002). ASTM D1688-02 Standard test method for copper in water. ASTM International, West Conshohocken, Pennsylvanie.
ASTM (2007). ASTM D1688-07 Standard test method for copper in water. ASTM International, West Conshohocken, Pennsylvanie.
ASTM (2012). ASTM D1688-12 Standard test method for copper in water. ASTM International, West Conshohocken, Pennsylvanie.
Atlas, D., Coombs, J. et Zajcek, O.T. (1982). The corrosion of copper by chlorinated drinking waters. Water Res., 16: 693–698.
ATSDR (2004). Toxicological profile for copper. Agency for Toxic Substances and Disease Registry. U.S. Department of Health and Human Services. Public Health Service. Atlanta, Georgia.
Bancroft, D.A. (1988). Corrosion control program in Danvers, Massachusetts. J. N. Engl. Water Works Assoc., 102(3): 163–171.
Bandmann, O., Weiss, K.H. et Kaler, S.G. (2015). Wilson's disease and other neurological copper disorders. Lancet Neurol., 14(1): 103–113.
Barceloux, D.G. (1999). Copper. J. Toxicol. Clin. Toxicol., 37(2): 217–230.
Barn, P., Nicol, A.M., Struck, S., Dosanjh, S., Li, R. et Kosatsky, T. (2014). Investigating elevated copper and lead levels in school drinking water. Environ. Health Rev., 56(4): 96–102.
Bauerly, K.A., Kelleher, S.L. et Lonnerdal, B. (2005). Effects of copper supplementation on copper absorption, tissue distribution, and copper transporter expression in an infant rat model. Am. J. Physiol. Gastrointest. Liver Physiol., 288(5): G1007–14.
Becker, A. (2002). The effect of corrosion inhibitors in drinking water installations of copper. Mater. Corros., 53: 560–567.
Berg, R., Lundh, S., Jansonn, G. et Rappe, A. (1981). Copper contamination of drinking water as a cause of diarrhea in children. Halsovardskontakt 1:6-10. [tel que cité dans OEHHA, 2008]
Berghult, B., Hedberg, T. et Broo, A.E. (1999). Drinking water distribution: corrosion control in Swedish municipalities. J. Water Supply Res. Technol. – AQUA, 48(2): 44–52.
Berghult, B., Broo, A.E. et Hedberg, T. (2001). Corrosion control measures in Sweden and the effect of succession order. Water Sci. Technol. Water Supply, 1(3): 47–58
Bertinato, J. et L'Abbé, M.R. (2004). Maintaining copper homeostasis: Regulation of copper-trafficking proteins in response to copper deficiency or overload. J. Nutr. Biochem., 15(6): 316–322.
Bertinato, J., Sherrard, L. et Plouffe, L.J. (2010). Decreased erythrocyte CCS content is a biomarker of copper overload in rats. Int. J. Mol. Sci., 11(7): 2624–2635.
Bhandari, P. et Andrews, P.L. (1991). Preliminary evidence for the involvement of the putative 5-HT4 receptor in zacopride- and copper sulphate-induced vomiting in the ferret. Eur. J. Pharmacol., 204(3): 273–280.
Boal, A.K. et Rosenzweig, A.C. (2009). Structural biology of copper trafficking. Chem. Rev., 109(10): 4760–4779.
Boffardi, B.P. (1993). The chemistry of polyphosphate. Mater. Perform., 8: 50–53
Boireau, A., Benezet-Toulze, M., Randon, G. et Cavard, J. (1997). Limitation de la solubilisation du plomb par ajout de produit filmogène. Transposition d'une étude sur pilote à un réseau réel. Tech. Sci. Meth. Gen. Urbain Gen. Rural, 92(5): 63–72.
Boulay, N. et Edwards, M. (2001). Role of temperature, chlorine, and organic matter in copper corrosion byproduct release in soft water. Water Res., 35(3): 683–690.
Boveris, A., Musacco-Sebio, R., Ferrarotti, N., Saporito-Magrina, C., Torti, H., Massot, F. et Repetto, M.G. (2012). The acute toxicity of iron and copper: Biomolecule oxidation and oxidative damage in rat liver. J. Inorg. Biochem., 116: 63–69.
Boyd, G.R., McFadden, M.S., Reiber, S.H., Sandvig, A.M., Korshin, G.V., Giani, R. et Frenkel, A.I. (2010). Effects of changing disinfectants on distribution system lead and copper release: Part 2—research results. Water Research Foundation, Denver, Colorado.
Bradberry, S. (2007). Copper. Poisoning part 2 of 3. Medicine, 35(11): 608.
Bremer, P., Webster, B.J. et Wells, D.B, (2001). Biocorrosion of copper in potable water. J. Am. Water Works Assoc., 93(8): 82–91.
Bremner, I. (1998). Manifestations of copper excess. Am. J. Clin. Nutr., 67(Suppl. 5): 1069S-1073S.
Brenner, I.B. et Zander, A.T. (2000). Axially and radially viewed inductively coupled plasmas – a critical review. Spectrochimica Acta Part B: Atomic Spectroscopy, 55(8): 1195–1240.
Brenner, S. (2003). Elevation of serum copper levels in Alzheimer's disease. Neurology, 60(9): 1559; author 1559.
Brewer, G.J. (2009). The risks of copper toxicity contributing to cognitive decline in the aging population and to Alzheimer's disease. J. Am. Coll. Nutr., 28(3): 238–242.
Brewer, G.J. (2010). Copper toxicity in the general population. Clin. Neurophysiol., 121(4): 459-460.
Brewer, G.J. (2014). Alzheimer's disease causation by copper toxicity and treatment with zinc. Front. Aging Neurosci., 6: 92.
British Geological Survey (2016). World mineral production 2010-2014. Natural Environmental Research Council (NERC). ISBN : 978-0-85272-856-7 (version papier). ISBN : 978-0-85272-857-4 (version Web).
Broo, A.E., Berghult, B. et Hedberg, T. (1997). Copper corrosion in drinking water distribution systems—The influence of water quality. Corros. Sci., 39(6): 1119–1132.
Broo, A.E., Berghult, B. et Hedberg, T. (1998). Copper corrosion in water distribution systems—The influence of natural organic matter (NOM) on the solubility of copper corrosion products. Corros. Sci., 40(9): 1479–1489.
Broo, A.E., Berghult, B. et Hedberg, T. (1999). Drinking water distribution—The effect of natural organic matter (NOM) on the corrosion of iron and copper. Water Sci. Technol., 40(9): 17–24.
Burkitt, M.J. (2001). A critical overview of the chemistry of copper-dependent low density lipoprotein oxidation: Roles of lipid hydroperoxides, alpha-tocopherol, thiols, and ceruloplasmin. Arch. Biochem. Biophys., 394(1): 117–135.
Burleigh, T.D, Gierke, C.G., Fredy, N. et Boston, P.J. (2014). Copper tube pitting in Sante Fe municipal water caused by microbial induced corrosion. Materials, 7: 4321–4334.
Bush, A.I., Masters, C.L. et Tanzi, R.E. (2003). Copper, beta-amyloid, and Alzheimer's disease: Tapping a sensitive connection. Proc. Natl. Acad. Sci. U. S. A., 100(20): 11193–11194.
Butler Walker, J., Houseman, J., Seddon, L., McMullen, E., Tofflemire, K., Mills, C., Corriveau, A., Weber, J., LeBlanc, A., Walker, M., Donaldson, S.G. et Van Oostdam, J. (2006). Maternal and umbilical cord blood levels of mercury, lead, cadmium, and essential trace elements in arctic Canada. Environ. Res., 100(3): 295–318.
Camakaris, J., Voskoboinik, I. et Mercer, J.F. (1999). Molecular mechanisms of copper homeostasis. Biochem. Biophys. Res. Commun., 261(2): 225–232.
Campbell, H.S. (1954a). The influence of the composition of supply waters, especially of traces of natural inhibitor on pitting corrosion of copper water pipes. Proc. Soc. Water Treat. Exam., 3: 100–117.
Campbell, H.S. (1954b). A natural inhibitor of pitting corrosion of copper in tap waters. J. Appl. Chem., 4: 633–647.
Campbell, H.S. (1971). Corrosion, water composition and water treatment. Proc. Soc. Water Treat. Exam., 20: 11–34.
Campbell, H.S. et Turner, M.E.D. (1983). The influence of trace organics on scale formation and corrosion. J. Inst. Water Eng. Sci., 37(1): 55–72.
Cantor, A.F., Denig-Chakroff, D., Vela, R.R., Oleinik, M.G. et Lynch, D.L. (2000). Use of polyphosphate in corrosion control. J. Am. Water Works Assoc., 92(2): 95–102.
Cantor, A.F., Park, J.K. et Vaiyavatjamai, P. (2003). Effect of chlorine on corrosion. J. Am. Water Works Assoc., 95(5): 112–123.
Carmichael, P.L., Hewer, A., Osborne, M.R., Strain, A.J. et Phillips, D.H. (1995). Detection of bulky DNA lesions in the liver of patients with Wilson's disease and primary haemochromatosis. Mutat. Res., 326(2): 235–243.
Cartier, C., Doré, E., Laroche, L., Nour, S., Edwards, M. et Prévost, M. (2013). Impact of treatment on Pb release from full and partially replaced lead service lines (LSLs). Water Res., 47(2): 661–671.
Cavallo, F., Gerber, M., Marubini, E., Richardson, S., Barbieri, A., Costa, A., DeCarli, H. et Pujol, A. (1991). Zinc and copper in breast cancer: A joint study in Northern Italy and Southern France. Cancer, 67: 738–745. [comme cité dans IPCS, 1998].
CCME (1999). Cuivre. Recommandations canadiennes pour la qualité des sols : Environnement et santé humaine. Recommandations canadiennes pour la qualité de l'environnement. Conseil canadien des ministres de l'environnement.
CCN (2016). Conseil canadien des normes. Disponible à : www.scc.ca/fr.
Cech, I., Smolensky, M.H., Afshar, M., Broyles, G., Barczyk, M., Burau, K. et Emery, R. (2006). Lead and copper in drinking water fountains--information for physicians. South. Med. J., 99(2): 137–142.
Ceko, M.J., Aitken, J.B. et Harris, H.H. (2014). Speciation of copper in a range of food types by X-ray absorption spectroscopy. Food Chem., 164: 50–54.
Chambers, A., Krewski, D., Birkett, N., Plunkett, L., Hertzberg, R., Danzeisen, R., Aggett, P.J., Starr, T.B., Baker, S., Dourson, M., Jones, P., Keen, C.L., Meek, B., Schoeny, R. et Slob, W. (2010). An exposure-response curve for copper excess and deficiency. J. Toxicol. Environ. Health B Crit. Rev., 13(7–8): 546–578.
Churchill, D.M., Mavinic, D.S., Neden, D.G. et MacQuarrie, D.M. (2000). The effect of zinc orthophosphate and pH–alkalinity adjustment on metal levels leached into drinking water. Can. J. Civil Eng., 27(1) : 33–43.
Clark, B., Masters, S. et Edward, M. (2014). Profile sampling to characterize particulate lead risks in potable water. Environ. Sci. Technol., 48(12): 6836–6843. doi: 10.1021/es501342j
Clark, B., St. Clair, J. et Edwards, M. (2015). Copper deposition corrosion elevates lead release to potable water. J. Am. Water Works Assoc., 107(11): E627–E637.
Clement, J.A., Daly, W.J., Shorney, H.J. et Capuzzi, A.J., (1998). An innovative approach to understanding and improving distribution system water quality. Dans : Proceedings of the 1998 AWWA Water Quality Technology Conference, San Diego, CA. American Water Works Association, Denver, Colorado.
Clifford, D.A. (1999). Ion exchange and inorganic adsorption. Chapitre 9 dans : Letterman, R.D. (éd.), Water quality and treatment: a handbook of community water supplies. 5e édition American Water Works Association. Denver, Colorado. McGraw-Hill, New York, New York.
Clifford, D., Sorg, T. et Ghurye, G. (2011). Ion exchange and adsorption of inorganic contaminants. Chapitre 12 dans : Edzwald, J.K. (éd.), Water quality and treatment: a handbook of community water supplies. 6 e édition. American Water Works Association, Denver, Colorado. McGraw-Hill, New York, New York.
CNRC (2010). Code national de la plomberie. Conseil national de recherche du Canada, Ottawa, Ontario.
Coates, R.J., Weiss, N.S., Daling, J.R., Rettmer, R.L. et Warnick, G.R. (1989). Cancer risk in relation to serum copper levels. Cancer Res., 49(15): 4353–4356.
Cockell, K.A., Bertinato, J. et L'Abbé, M.R. (2008). Regulatory frameworks for copper considering chronic exposures of the population. Am. J. Clin. Nutr., 88(3): 863S–866S.
Codina, J.C., Perez-Torrente, C., Perez-Garcia, A., Cazorla, F.M. et de Vicente, A. (1995). Comparison of microbial tests for the detection of heavy metal genotoxicity. Arch. Environ. Contam. Toxicol., 29(2): 260–265.
Collins, J.F. et Klevay, L.M. (2011). Copper. Adv. Nutr., 2(6): 520–522.
Corkins, M.R. (2011). Copper metabolism and pediatric cholestasis. Curr. Opin. Clin. Nutr. Metab. Care, 14(6): 642–646.
Cour supérieure de justice de l'Ontario. (2011). Nicholas Rosati et Anthony Bellissimo v. IPEX USA LLC et IPEX Inc. Action en justice en vertu de la Loi sur les recours collectifs, 1992. CV-09-13459. 29 novembre 2011.
Cour supérieure du Québec (2011). Karen Cooke et Terry Cooke et Coopérative d'habitation Lézarts et Stéphane Morissette c. Ipex inc. Jugement – Sur requête pour l'approbation d'un règlement – (Article 1025 du Code de procédure civile). No 200-06-000121-098. District de Québec. 9 décembre.
Critchley, M.M., Cromar, N.J., McClure, N.C. et Fallowfield, H.J. (2003). The influence of the chemical composition of drinking water on cuprosolvency by biofilm bacteria. J. of Appl. Microbiol., 94: 501–507.
Critchley, M., Pasetto, R. et O’Halloran, R.J. (2004). Microbiological influences in ‘blue water’ copper corrosion. J. of Appl. Microbiol., 97: 590–597.
Cuppett, J.D., Duncan, S.E. et Dietrich, A.M. (2006). Evaluation of copper speciation and water quality factors that affect aqueous copper tasting response. Chem. Senses, 31(7): 689–697.
Custalow, B.D. (2009). Influences of water chemistry and flow conditions on non-uniform corrosion in copper tube. Virginia Polytechnic Institute and State University, Blacksburg, VA (mémoire de maîtrise).
Dabek, J.T., Hyvonen-Dabek, M., Harkonen, M. et Adlercreutz, H. (1992). Evidence for increased non-ceruloplasmin copper in early-stage human breast cancer serum. Nutr Cancer, 17: 195–201. [comme cité dans IPCS, 1998].
Dabioch, M., Storek, R., Kita, A., Janoska, P., Pytlakowska, K., Zerzucha, P. et Sitko, R. (2013). A study on adsorption of metals by activated carbon I a large-scale(municipal) process of surface water purification. Central European Journal of Chemistry, 11(5): 742–753.
Das, S.K. et Ray, K. (2006). Wilson’s disease: An update. Nat. Clin. Pract. Neurol., 2(9): 482–493.
Davidson, D., Beheshti, B. et Mittelman, M.W. (1996). Effects of arthrobacter sp., acidovorax delafieldii, and bacillus megaterium colonisation on copper solvency in a laboratory setting. Biofouling, 9(4): 279–292.
de Romana, D.L., Olivares, M., Uauy, R. et Araya, M. (2011). Risks and benefits of copper in light of new insights of copper homeostasis. J. Trace Elem. Med. Biol., 25(1): 3–13.
De Vries, D.J., Sewell, R.B. et Beart, P.M. (1986). Effects of copper on dopaminergic function in the rat corpus striatum. Exp. Neurol., 91(3): 546–558.
Dodrill, D.M. et Edwards, M. (1995). Corrosion control on the basis of utility experience. J. Am. Water Works Assoc., 87(7): 74–85.
Donnelly, P.S., Xiao, Z. et Wedd, A.G. (2007). Copper and Alzheimer’s disease. Bioinorganic chemistry / biocatalysis and biotransformation. Curr. Opin. Chem. Biol., 11(2): 128–133.
Dudi, A. (2004). Galvanic corrosion of lead bearing plumbing devices. Dans : Reconsidering lead corrosion in drinking water: Product testing, direct chloramine attack and galvanic corrosion. Faculty of the Virginia Polytechnic Institute and State University, Blacksburg, VA. pp. 69–105 (mémoire de maîtrise).
Dudi, A., Schock, M., Murray, N. et Edwards, M. (2005). Lead leaching from inline brass devices: a critical evaluation of the existing standard. J. Am. Water Works Assoc., 97(8): 66–78.
Dutkiewicz, C. et Fallowfield, H. (1998). Assessment of microbial involvement in the elevation of copper levels in drinking water. J. Appl. Microbiol., 85:597-602.
Edwards, M. et Ferguson, J.F. (1993). Accelerated testing of copper corrosion. J. Am. Water Works Assoc., 85(10): 105–113.
Edwards, M. et McNeill, L.S. (2002). Effect of phosphate inhibitors on lead release from pipes. J. Am. Water Works Assoc., 94(1): 79–90.
Edwards, M. et Sprague, N. (2001). Organic matter and copper corrosion by-product release: a mechanistic study. Corros. Sci., 43(1): 1–18.
Edwards, M. et Triantafyllidou, S. (2010). Chloride-to-sulphate mass ratio and lead leaching to water. J. Am. Water Works Assoc., 99(7): 96–109.
Edwards, M., Ferguson, J.F. et Reiber, S.H. (1994a). The pitting corrosion of copper. J. Am. Water Works Assoc., 86(7): 74–90.
Edwards, M., Meyer, T.E. et Rehring, J.P. (1994b). Effect of selected anions on copper corrosion rates. J. Am. Water Works Assoc., 86(12): 73–81.
Edwards, M., Schock, M.R. et Meyer, T.E. (1996). Alkalinity, pH, and copper corrosion by-product release. J. Am. Water Works Assoc., 88(3): 81–94.
Edwards, M., Jacobs, S. et Dodrill, D.M. (1999). Desktop guidance for mitigating Pb and Cu corrosion by-products. J. Am. Water Works Assoc., 91(5): 66–77.
Edwards, M., Jacobs, S. et Taylor, R.J. (2000). The blue water phenomenon. J Am. Water Works Assoc., 92(7): 72–82.
Edwards, M., Powers, K., Hidmi, L. et Schock, M.R. (2001). The role of pipe ageing in copper corrosion by-product release. Water Sci. Tech., 1(3):25–32.
Edwards, M., Hidmi, L. et Gladwell, D. (2002). Phosphate inhibition of soluble copper corrosion by-product release. Corros. Sci., 44(5): 1057–1071.
Edzwald, J.K. et Tobiason, J.E. (2011). Chemical principles, source water composition, and watershed protection. Chapitre 3 dans : Water quality and treatment: A handbook on drinking water, 6e édition. Edzwald, J.K. (éd.). American Water Works Association, Denver, Colorado; McGraw-Hill, New York, New York.
EFSA (2006). Tolerable upper intake levels for vitamins and minerals. Scientific Committee on Food. Scientific panel on dietetic products, nutrition and allergies. European Food Safety Authority. ISBN : 92-9199-014-0.
EFSA (2009). Scientific opinion of the panel on food additives and nutrient sources added to food on copper(II) oxide as a source of copper added for nutritional purposes to food supplements following a request from the European commission. EFSA Journal, 1089: 1–15.
EFSA (2015). EFSA NDA panel (EFSA panel on dietetic products, nutrition and allergies). Scientific opinion on dietary reference values for copper. EFSA journal, 13(10): 4253, 51 pp.
Ellingsen, D.G., Horn, N. et Aaseth, J. (2007). Chapter 26 - essential metals: Assessing risks from deficiency and toxicity. Dans : Handbook on the toxicology of metals. Nordberg, G.F., Fowler, B.A., Nordberg, M. et Friberg, L.T. (éds). 3e édition. Academy Press, San Diego, pp. 163–176.
Ellingsen, D.G., Møller, L.B. et Aaseth, J. (2015). Chapitre 35 - copper. Dans : Handbook on the toxicology of metals (4e édition). Nordberg, G.F.N.A.F. (éd.). Academic Press, San Diego, California. pp. 765–786.
Environnement Canada (2014). National air pollution surveillance network (NAPS) monitoring results: NAPS quality assured data products.
Eskici, G. et Axelsen, P.H. (2012). Copper and oxidative stress in the pathogenesis of Alzheimer’s disease. Biochemistry, 51(32): 6289–6311.
FAO et OMS (2011). Norme pour les préparations destinées aux nourrissons et les préparations données à des fins méciales spéciales aux nourrissons. CODEX STAN 72-1981. Adoptée comme Norme mondiale en 1981. Amendement : 1983, 1985, 1987, 2011 et 2015. Révision : 2007. Codex Alimentarius. Organisation des Nations Unies pour l’alimentation et l’agriculture. Organisation mondiale de la Santé.
Ferguson, J.F., Franqué, O.V. et Schock, M.R. (1996). Corrosion of copper in potable water systems. Dans : Internal corrosion of water distribution systems. 2e édition. American Water Works Association Research Foundation and DVGW Technologiezentrum Wasser. Denver, Colorado. pp. 231–268.
Fewtrell, L., Kay, D., Jones, F., Baker, A. et Mowat, A. (1996). Copper in drinking water--an investigation into possible health effects. Public Health, 110(3): 175–177.
Fischer, W., Paradies, H.H., Wagner, D. et Hänβel, I. (1992). Copper deterioration in a water distribution system of a county hospital in Germany caused by microbially induced corrosion- I. Description of the problem. Werkstoffe und Korrosion, 43: 56–62.
Formigari, A., Gregianin, E. et Irato, P. (2013). The effect of zinc and the role of p53 in copper-induced cellular stress responses. J. Appl. Toxicol., 33(7): 527–536.
Friedman, M.J., Hill, A.S., Reiber, S.H., Valentine, R.L., Larsen, G., Young, A., Korshin, G.V. et Peng, C-Y. (2010). Assessment of inorganics accumulation in drinking water system scales and sediments. Water Research Foundation and United States Environmental Protection Agency. Denver, Colorado.
Fuentealba, I. et Haywood, S. (1988). Cellular mechanisms of toxicity and tolerance in the copper-loaded rat. I. ultrastructural changes in the liver. Liver, 8(6): 372–380.
Fuentealba, I., Haywood, S. et Foster, J. (1989a). Cellular mechanisms of toxicity and tolerance in the copper-loaded rat. II. pathogenesis of copper toxicity in the liver. Exp. Mol. Pathol., 50(1): 26–37.
Fuentealba, I.C., Haywood, S. et Foster, J. (1989b). Cellular mechanisms of toxicity and tolerance in the copper-loaded rat. III. ultrastructural changes and copper localization in the kidney. Br. J. Exp. Pathol., 70(5): 543–556.
Fuentealba, I.C., Mullins, J.E., Aburto, E.M., Lau, J.C. et Cherian, G.M. (2000). Effect of age and sex on liver damage due to excess dietary copper in fischer 344 rats. J. Toxicol. Clin. Toxicol., 38(7): 709–717.
Fujiwara, N., Iso, H., Kitanaka, N., Kitanaka, J., Eguchi, H., Ookawara, T., Ozawa, K., Shimoda, S., Yoshihara, D., Takemura, M. et Suzuki, K. (2006). Effects of copper metabolism on neurological functions in wistar and Wilson’s disease model rats. Biochem. Biophys. Res. Commun., 349(3): 1079–1086.
Fukui, H., Yamamoto, M., Sasaki, S. et Sato, S. (1994). Possible involvement of peripheral 5-HT4 receptors in copper sulfate-induced vomiting in dogs. Eur. J. Pharmacol., 257(1–2): 47–52.
Gaetke, L.M. et Chow, C.K. (2003). Copper toxicity, oxidative stress, and antioxidant nutrients. Toxicology, 189(1–2): 147–163.
Gaetke, L.M., Chow-Johnson, H.S. et Chow, C.K. (2014). Copper: Toxicological relevance and mechanisms. Arch. Toxicol., 88(11): 1929–1938.
Gaggelli, E., Kozlowski, H., Valensin, D. et Valensin, G. (2006). Copper homeostasis and neurodegenerative disorders (Alzheimer’s, prion, and Parkinson’s diseases and amyotrophic lateral sclerosis). Chem. Rev., 106(6): 1995–2044.
Gambling, L., Kennedy, C. et McArdle, H.J. (2011). Iron and copper in fetal development. Semin. Cell Dev. Biol., 22(6): 637–644.
Georgopoulos, P.G., Roy, A., Yonone-Lioy, M.J., Opiekun, R.E. et Lioy, P.J. (2001). Environmental copper: Its dynamics and human exposure issues. J. Toxicol. Environ. Health B Crit. Rev., 4(4): 341–394.
Gerke, T.L., Little, B.J. et Maynard, B. (2016). Manganese deposition in drinking water distribution systems. Science of the Total Environment, 541: 184–193.
Gibson, R.S. (1994). Content and bioavailability of trace elements in vegetarian diets. Am. J. Clin. Nutr., 59(5 Suppl): 1223S–1232S.
Gitlin, J.D. (2014). Copper homeostasis: Specialized functions of the late secretory pathway. Dev. Cell., 29(6): 631–632.
Govindaraju, M., Shekar, H.S., Sateesha, S.B., Vasudeva Raju, P., Sambasiva Rao, K.R., Rao, K.S.J. et Rajamma, A.J. (2013). Copper interactions with DNA of chromatin and its role in neurodegenerative disorders. J. Pharm. Anal., 3(5): 354–359.
Grace, S., Lytle, D.A. et Goltz, M.N. (2012). Control of new copper corrosion in high-alkalinity drinking water. J. Am. Water Works Assoc. 104(1), E15–E25.
Grass, G., Rensing, C. et Solioz, M. (2011). Metallic copper as an antimicrobial surface. Appl. Env. Microbiol., 77(5): 1541–1547.
Gulliver, J.M. (1991). A fatal copper sulfate poisoning. J. Anal. Toxicol., 15(6): 341–342.
Gurusamy, K. et Davidson, B.R. (2007). Trace element concentration in metastatic liver disease – A systematic review. J. Trace Elem. Med. Biol., 21(3): 169–177.
Ha, H.M. et Scully, J.R. (2013). Effects of phosphate on pit stabilization and propagation in copper in synthetic potable waters. Corrosion, 69(7): 703–718.
Haas, C., Koch, L., Kelty, K., Lytle, D. et Triantafyllidou, S. (2013). Effectiveness of the preservation protocol within the Environmental Protection Agency (EPA) Method 200.8 for soluble and particulate lead recovery in drinking water. U.S. Environmental Protection Agency, Washington, D.C. (EPA/600/R-13/222).
Hach (2014). Hach 8026 (CuVer2). Bicinchoninate Method. 9e édition. Hach Company, Loveland, Colorado.
Hach (2016). Hach 10272 Copper Bicinchoninate Method. 5e édition. Hach Company, Loveland, Colorado.
Harris, Z.L. et Gitlin, J.D. (1996). Genetic and molecular basis for copper toxicity. Am. J. Clin. Nutr., 63(5): 836S–841S.
Harvey, L.J., Dainty, J.R., Hollands, W.J., Bull, V.J., Beattie, J.H., Venelinov, T.I., Hoogewerff, J.A., Davies, I.M. et Fairweather-Tait, S.J. (2005). Use of mathematical modeling to study copper metabolism in humans. Am. J. Clin. Nutr, 81(4): 807–813.
Haywood, S. (1980). The effect of excess dietary copper on the liver and kidney of the male rat. J. Comp. Pathol., 90(2): 217–232.
Haywood, S. (1985). Copper toxicosis and tolerance in the rat: I. Changes in copper content of the liver and kidney. J. Pathol., 145(2): 149–158.
Haywood, S. et Loughran, M. (1985). Copper toxicosis and tolerance in the rat: II. Tolerance--a liver protective adaptation. Liver, 5(5): 267–275.
Haywood, S., Loughran, M. et Batt, R.M. (1985a). Copper toxicosis and tolerance in the rat: III. Intracellular localization of copper in the liver and kidney. Exp. Mol. Pathol., 43(2): 209–219.
Haywood, S., Trafford, J. et Loughran, M. (1985b). Copper toxicosis and tolerance in the rat: IV. Renal tubular excretion of copper. Br. J. Exp. Pathol., 66(6): 699–707.
Hebert, C.D., Elwell, M.R., Travlos, G.S., Fitz, C.J. et Bucher, J.R. (1993). Subchronic toxicity of cupric sulfate administered in drinking water and feed to rats and mice. Fundam. Appl. Toxicol., 21(4): 461–475.
Heinemann, K., Reed, S., Moehner, S. et Do Minh, T. (2015). Risk of uterine perforation with levonorgestrel-releasing and copper intrauterine devices in the European active surveillance study on intrauterine devices. Contraception, 91(4): 274–279.
Hidmi, L. et Edwards, M. (1999). Role of temperature and pH in Cu(OH)2 solubility. Environ. Sci. Technol., 33(15): 2607–2610.
Hong, P.K.A. et Macauley, Y. (1998). Corrosion and leaching of copper tubing exposed to chlorinated drinking water. Water Air Soil Pollut., 108(3–4): 457–471.
Horn, C.C., Kimball, B.A., Wang, H., Kaus, J., Dienel, S., Nagy, A., Gathright, G.R., Yates, B.J. et Andrews,P.L. (2013). Why can't rodents vomit? A comparative behavioral, anatomical, and physiological study. PLoS One, 8(4): 1–16.
Hu, J., Gan, F., Triantafyllidou, S., Nguyen, C.K. et Edwards, M.A. (2012). Copper-induced metal release from lead pipe in drinking water. Corrosion, 68(11): 1037–1048.
Hujita, H., Nakano, M. et Sasaki, M. (1998). Mutagenicity of food additives in the Ames Salmonella/microsome assay. Tokyo Metropolitan Research Laboratory of Public Health Annual Reports, 39, pp. 343–350. cité par Abe et coll., 2008].
Ingle, A.P., Duran, N. et Rai, M. (2014). Bioactivity, mechanism of action, and cytotoxicity of copper-based nanoparticles: A review. Appl. Microbiol. Biotechnol., 98(3): 1001–1009.
IOM (2001). Dietary reference intakes for vitamin A, vitamin K, arsenic, boron, chromium, copper, iodine, iron, manganese, molybdenum, nickel, silicon, vanadium, and zinc. Food and Nutrition Board, Institute of Medicine. National Academy Press, Washington, DC, USA, 797 pp.
IPCS (1998). Environmental Health Criteria 200: Copper. International Programme on Chemical Safety. World Health Organization, Geneva.
Jacobs, S. et Edwards, M. (2000). Sulfide scale catalysis of copper corrosion. Wat. Res., 34(10): 2798–2808.
Jacobs, S., Reiber, S. et Edwards, M. (1998). Sulfide-induced copper corrosion, J. Am. Water Works Assoc., 90(7): 62–73.
Jantsch, W., Kulig, K. et Rumack, B.H. (1984). Massive copper sulfate ingestion resulting in hepatotoxicity. J. Toxicol. Clin. Toxicol., 22(6): 585–588.
Javaherdashti, R. (2008). Chapitre 4 : Microbiologically influenced corrosion (MIC). Dans : Microbiologically Influenced Corrosion. 1e édition. Springer-Verlag London Limited.
Jazvinscak Jembrek, M., Vlainic, J., Radovanovic, V., Erhardt, J. et Orsolic, N. (2014). Effects of copper overload in P19 neurons: Impairment of glutathione redox homeostasis and crosstalk between caspase and calpain protease systems in ROS-induced apoptosis. Biometals, 27(6): 1303–1322.
Jiménez Del Rı́o, M. et Vélez-Pardo, C. (2004). Transition metal-induced apoptosis in lymphocytes via hydroxyl radical generation, mitochondria dysfunction, and caspase-3 activation: An in vitro model for neurodegeneration. Arch. Med. Res., 35(3): 185–193.
Johncilla, M. et Mitchell, K.A. (2011). Pathology of the liver in copper overload. Semin. Liver Dis., 31(3): 239–244.
Johnson, B., Yorton, R., Tran, T. et Kim, J. (1993). Evaluation of corrosion control alternatives to meet the Lead and Copper Rule for eastern Massachusetts. J. N. Engl. Water Works Assoc., 107(3): 24–45.
Jomova, K. et Valko, M. (2011). Advances in metal-induced oxidative stress and human disease. Toxicology, 283(2–3): 65–87.
Kadiiska, M.B., Hanna, P.M., Hernandez, L. et Mason, R.P. (1992). In vivo evidence of hydroxyl radical formation after acute copper and ascorbic acid intake: Electron spin resonance spin-trapping investigation. Mol. Pharmacol., 42(4): 723–729.
Kaler, S.G. (1998). Metabolic and molecular bases of Menkes disease and occipital horn syndrome. Pediatr. Dev. Pathol., 1(1): 85–98.
Kaplan, J.H. et Lutsenko, S. (2009). Copper transport in mammalian cells: Special care for a metal with special needs. J. Biol. Chem., 284(38): 25461–25465.
Karim, Z. (2011). Risk assessment of dissolved trace metals in drinking water of Karachi, Pakistan. Bull. Environ. Contam. Toxicol., 86(6): 676–678.
Kawakami, M., Inagawa, R., Hosokawa, T., Saito, T. et Kurasaki, M. (2008). Mechanism of apoptosis induced by copper in PC12 cells. Food Chem. Toxicol., 46(6): 2157–2164.
Kehoe, C.A., Turley, E., Bonham, M.P., O'Connor, J.M., McKeown, A., Faughnan, M.S., Coulter, J.S., Gilmore, W.S., Howard, A.N. et Strain, J.J. (2000). Response of putative indices of copper status to copper supplementation in human subjects. Br. J. Nutr., 84(2): 151–156.
Kessler, H., Pajonk, F.G., Meisser, P., Schneider-Axmann, T., Hoffmann, K.H., Supprian, T., Herrmann, W., Obeid, R., Multhaup, G., Falkai, P. et Bayer, T.A. (2006). Cerebrospinal fluid diagnostic markers correlate with lower plasma copper and ceruloplasmin in patients with Alzheimer's disease. J. Neural Transm. (Vienna), 113(11): 1763–1769.
Kiaune, L. et Singhasemanon, N. (2011). Pesticidal copper (I) oxide: Environmental fate and aquatic toxicity. Dans : Reviews of environmental contamination and toxicology. volume 213. Chapitre 1. Whitacre, D.M. (éd.). Springer, pp. 1–26.
Kieber, R.J., Skrabal, S.A., Smith, C. et Willey, J.D. (2004). Redox speciation of copper in rainwater: Temporal variability and atmospheric deposition. Environ. Sci. Technol., 38(13): 3587–3594.
Kim, B.E., Nevitt, T. et Thiele, D.J. (2008). Mechanisms for copper acquisition, distribution and regulation. Nat. Chem. Biol., 4(3): 176–185.
Kimbrough, D.E. (2001). Brass corrosion and the LCR monitoring program. J. Am. Water Works Assoc., 93(2): 81–91.
Kimbrough, D.E. (2007). Brass corrosion as a source of lead and copper in traditional and all-plastic distribution systems. J. Am. Water Works Assoc., 99(8): 70–76.
Kimbrough, D.E. (2009). Source identification of copper, lead, nickel, and zinc loading in wastewater reclamation plant influents from corrosion of brass in plumbing fixtures. Environmental Pollution, 157: 1310–1316.
Kirmeyer, G., Sandvig, A.M., Pierson, G.L. et Neff, C.H. (1994). Development of a pipe loop protocol for lead control. Water Research Foundation, Denver, Colorado. AWWA Research Foundation Report #90650.
Kirmeyer, G., Murphy, B., Sandvig, A., Korshin, G., Shaha, B., Fabbricino, M. et Burlingame, G. (2004). Post-optimization lead and copper control monitoring strategies. Awwa Research Foundation, Denver, Colorado.
Kitazawa, M., Cheng, D. et Laferla, F.M. (2009). Chronic copper exposure exacerbates both amyloid and tau pathology and selectively dysregulates cdk5 in a mouse model of AD. J. Neurochem., 108(6): 1550–1560.
Klevay, L.M. (2010). Copper. Dans : Encyclopedia of dietary supplements. pp. 175–184.
Knobeloch, L., Ziarnik, M., Howard, J., Theis, B., Farmer, D., Anerson, H. et Proctor, M. (1994). Gastrointestinal upsets associated with ingestion of copper-contaminated water. Env. Health Persp. 102(11): 958–961.
Kok, F.J., Van Duijn, C.M., Hofman, A., Van der Voet, G.B., De Wolff, F.A., Paays, C.H. et Valkenburg, H.A. (1988). Serum copper and zinc and the risk of death from cancer and cardiovascular disease. Am. J. Epidemiol., 128(2): 352–359.
Korshin, G.V., Pery, S.A.L. et Ferguson, J.F. (1996). Influence of NOM on copper corrosion. J. Am. Water Works Assoc., 88(7): 36–47.
Krishnan, K., Carrier, R. (2013). The use of exposure source allocation factor in the risk assessment of drinking-water contaminants. J. Toxicol. Environ. Health B Crit. Rev., 16(1): 39–51.
Kuch, A. et Wagner, I. (1983). A mass transfer model to describe lead concentrations in drinking water. Water Supply, 17(10): 1330–1307.
Kumar, V., Kalita, J., Misra, U.K. et Bora, H.K. (2015). A study of dose response and organ susceptibility of copper toxicity in a rat model. J. Trace Elem. Med. Biol., 29: 269–274.
Larney, F.J., Olson, A.F., Miller, J.J. et Tovell, B.C. (2014). Soluble salts, copper, zinc and solids constituents in surface runoff from cattle manure compost windrows. Rev. can. sci. sol / Can. J. Soil Sci., 94: 515–527.
Lagos, G.E., Cuadrado, C.A. et Letelier, V. (2001). Aging of copper pipes by drinking water. J. Am. Water Works Assoc., 93(11): 94–103.
Lehtola, M.J., Miettinen, I.T., Keinänen, Kekki, T.K., Laine, O., Hirvonen, A., Vartiainen, T. et Martikainen, P.J. (2004). Microbiology, chemistry and biofilm development in a pilot drinking water distribution system with copper and plastic pipes. Water Research, 38: 3769–3779.
Lehtola, M.J., Laxander, M., Miettinen, I.T., Hirvonen, A., Vartiainen, T. et Martikainen, (2006). The effects of changing water flow velocity on the formation of biofilms and water quality in pilot distribution system consisting of copper or polyethylene pipes. Water Research, 40: 2151–2160.
Letelier, M.E., Sanchez-Jofre, S., Peredo-Silva, L., Cortes-Troncoso, J. et Aracena-Parks, P. (2010). Mechanisms underlying iron and copper ions toxicity in biological systems: Pro-oxidant activity and protein-binding effects. Chem. Biol. Interact., 188(1): 220–227.
Lide, D.R. (1993). CRC Handbook of Chemistry and Physics, 73e édition. CRC Press, Boca Raton, Florida.
Lind, Y. et Glynn, A.W. (1999). Intestinal absorption of copper from drinking water containing fulvic acids and an infant formula mixture studied in a suckling rat model. Biometals, 12(2): 181–187.
Linder, M.C. (1991). Biochemistry of copper. Plenum Press, New York, New York.
Linder, M.C. (2001). Copper and genomic stability in mammals. Mutat. Res., 475(1–2): 141–152.
Linder, M.C. (2002). Biochemistry and molecular biology of copper in mammals. Dans : Handbook of Copper Pharmacology and Toxicology. Massaro, E.J. et Totowa (éds), N.J. Humana Press, 3–32.
Linder, M.C. et Hazegh-Azam, M. (1996). Copper biochemistry and molecular biology. Am. J. Clin. Nutr., 63(5): 797S–811S.
Lintereur, P.A., Duranceau, S.J. et Taylor, J.S. (2011). Sodium silicate impacts on copper release in a potable water comprised of ground, surface and desalted sea water supplies. Desalination and Water Treatment, 30: 348–360.
Little, B., Wagner, P. et Mansfeld, F. (1991). Microbially influence corrosion of metals and alloys. International Materials Reviews, 36(6): 253–272.
Lonnerdal, B. (1996). Bioavailability of copper. Am. J. Clin. Nutr., 63(5): 821S–829S.
Lonnerdal, B. (1998). Copper nutrition during infancy and childhood. Am. J. Clin. Nutr., 67(Suppl. 5): 1046S–1053S.
Lovell, M.A., Robertson, J.D., Teesdale, W.J., Campbell, J.L. et Markesbery, W.R. (1998). Copper, iron and zinc in Alzheimer's disease senile plaques. J.Neurol.Sci., 158(1): 47–52.
Lowry, J. (2009). Lakhurst Acres, ME: Compliance issues engineering problems and solutions. U.S. EPA Sixth annual drinking water workshop: Small drinking water system challenges and solutions. 4-6 août. Cincinnati, Ohio.
Lowry, J. (2010). Corrosion control with air stripping. American water work association. Inorganic contaminants workshop, Denver, Colorado.
Lytle, D.A. et Nadagouda, M.N. (2010). A comprehensive investigation of copper pitting corrosion in a drinking water distribution system. Corrosion Science, 52: 1927–1938.
Lytle, D.A. et Schock, M.R. (1996). Stagnation time, composition, pH, and orthophosphate effects on metal leaching from brass. Office of Research and Development. U.S. EPA, Cincinnati, OH. EPA.600.R-96.103
Lytle, D.A. et Schock, M.R. (2000). Impact of stagnation time on metal dissolution from plumbing materials in drinking water. Journal of Water Supply Research and Technology – AQUA, 49(5): 243–257.
Lytle, D.A. et Schock, M.R. (2008). Pitting corrosion of copper in waters with high pH and low alkalinity. J. Am Water Works Assoc., 100(3): 115–129.
Lytle, D.A., Williams, D. et White, C. (2012). A simple approach to assessing copper pitting corrosion tendencies and developing control strategies. J Water Supply: Research and Technology – AQUA, 63(3): 164–175.
Machado, A.A., Deguti, M.M., Genschel, J., Cancado, E.L., Bochow, B., Schmidt, H. et Barbosa, E.R. (2008). Neurological manifestations and ATP7B mutations in Wilson's disease. Parkinsonism Relat. Disord., 14(3): 246–249.
MacQuarrie, D.M., Mavinic, D.S. et Neden, D.G. (1997). Greater Vancouver Water District drinking water corrosion inhibitor testing. Revue canadienne de recherche vétérinaire/Can. J. Civil Eng., 24(1): 34–52.
Madsen, E. et Gitlin, J.D. (2007). Copper and iron disorders of the brain. Annu. Rev. Neurosci., 30: 317–337.
Maessen, O., Freedman, B. et McCurdy, R. (1985). Metal mobilization in home well water systems in Nova Scotia. J. Am. Water Works Assoc., 77(6): 73–80.
Mahabir, S., Forman, M.R., Dong, Y.Q., Park, Y., Hollenbeck, A. et Schatzkin, A. (2010). Mineral intake and lung cancer risk in the NIH-American association of retired persons diet and health study. Cancer Epidemiol. Biomarkers Prev., 19(8): 1976–1983.
Makale, M.T. et King, G.L. (1992). Surgical and pharmacological dissociation of cardiovascular and emetic responses to intragastric CuSO4. Am. J. Physiol., 263(2 Pt 2): R284–291.
Masters, S., Wang, H., Pruden, A. et Edwards, M.A. (2015). Redox gradients in distribution systems influence water quality, corrosion, and microbial ecology. Water Research, 68: 140–149.
Mauceri, C. et Mishra, S. (2014). Copper. Chapitre 18. Dans : Health effects of metals and related substances in drinking water. Ferrante, M., Conti, O.,G., Rasic-Milutinovic, Z. et Jovanovic, D. (éds). IWA Publishing, Alliance House, London, UK, pp. 50–52.
McNeill, L.S. et Edwards, M. (2002). Phosphate inhibitor use at U.S. utilities. J. Am. Water Works Assoc., 94(7): 57–63.
McNeill, L.S. et Edwards, M. (2004). Importance of Pb and Cu particulate species for corrosion control. J. Environ. Eng., 130(2):136–144.
Mehta, A., Patney, N.L., Bhati, D.P. et Singh, S.P. (1985). Copper sulphate poisoning--its impact on kidneys. J. Indian Med. Assoc., 83(4): 108–110.
Mendez, M.A., Araya, M., Olivares, M., Pizarro, F. et Gonzalez, M. (2004). Sex and ceruloplasmin modulate the response to copper exposure in healthy individuals. Environ. Health Perspect., 112(17): 1654–1657.
Michaluk, A. et Kochman, K. (2007). Involvement of copper in female reproduction. Reprod. Biol., 7(3): 193–205.
Miller, L.M., Wang, Q., Telivala, T.P., Smith, R.J., Lanzirotti, A. et Miklossy, J. (2006). Synchrotron-based infrared and X-ray imaging shows focalized accumulation of cu and zn co-localized with beta-amyloid deposits in Alzheimer's disease. J. Struct. Biol., 155(1): 30–37.
Molina, J.A., Jimenez-Jimenez, F.J., Aguilar, M.V., Meseguer, I., Mateos-Vega, C.J., Gonzalez-Munoz, M.J., de Bustos, F., Porta, J., Orti-Pareja, M., Zurdo, M., Barrios, E. et Martinez-Para, M.C. (1998). Cerebrospinal fluid levels of transition metals in patients with Alzheimer's disease. J. Neural Transm. (Vienna), 105(4–5): 479–488.
Montes, S., Rivera-Mancia, S., Diaz-Ruiz, A., Tristan-Lopez, L. et Rios, C. (2014). Copper and copper proteins in Parkinson's disease. Oxid. Med. Cell. Longev., 2014: 147251.
Moriya, M., Ohta, T., Watanabe, K., Miyazawa, T., Kato, K. et Shirasu, Y. (1983). Further mutagenicity studies on pesticides in bacterial reversion assay systems. Mutat. Res., 116(3–4): 185–216.
Muller, T., Feichtinger, H., Berger, H. et Muller, W. (1996). Endemic Tyrolean infantile cirrhosis: An ecogenetic disorder. Lancet, 347(9005): 877–880.
Murphy, E.A. (1993). Effectiveness of flushing on reducing lead and copper levels in school drinking water. Environ. Health Perspect., 101(3): 240–241.
Neuman, W.E. (1995). AWWC experience with zinc orthophosphate treatment. J. N. Engl. Water Works Assoc., 109: 57–60.
Nicholson, F.A., Chambers, B.J., Williams, J.R. et Unwin, R.J. (1999). Heavy metal contents of livestock feeds and animal manures in England and Wales. Biores. Tech., 70: 23–31.
NHMRC (2011). Australian drinking water guidelines. Paper 6: National water quality management strategy. Version 3.1, mise à jour en mars 2015. National Health and Medical Research Council, National Resource Management Ministerial Council, Commonwealth of Australia, Canberra. ISBN en ligne : 1864965118.
NRC (2000). Copper in drinking water. National Research Council. National Academy Press. Washington, DC.
NSF International (2015a). NSF/ANSI Standard 60: Drinking water treatment chemicals—health effects. NSF International, Ann Arbor, Michigan.
NSF International (2015b). NSF/ANSI Standard 53: Drinking water treatments units—Health effects. NSF International, Ann Arbor, Michigan.
NSF International (2015c). NSF/ANSI Standard 58: Reverse osmosis drinking water treatment systems. NSF International, Ann Arbor, Michigan.
NSF International (2015d). NSF/ANSI Standard 62: Drinking water distillation systems. NSF International, Ann Arbor, Michigan.
NSF International (2016a). NSF/ANSI Standard 61: Drinking water system components—health effects. NSF International, Ann Arbor, Michigan.
NSF International (2016b). NSF/ANSI Standard 372: Drinking water system components—lead content. NSF International, Ann Arbor, Michigan.
NTP (1993). NTP Technical report on toxicity studies of cupric sulfate (CAS No. 7758-99-8) administered in drinking water and feed to F344/N rats and B6C3F1 mice. National Toxicology Program, National Institute of Health. Rapport no 29.
O'Connor, J.M., Bonham, M.P., Turley, E., McKeown, A., McKelvey-Martin, V.J., Gilmore, W.S. et Strain, J.J. (2003). Copper supplementation has no effect on markers of DNA damage and liver function in healthy adults (FOODCUE project). Ann. Nutr. Metab., 47(5): 201–206.
O'Donohue, J., Reid, M.A., Varghese, A., Portmann, B. et Williams, R. (1993). Micronodular cirrhosis and acute liver failure due to chronic copper self-intoxication. Eur. J. Gastroenterol. Hepatol., 5: 561–562.
O'Donohue, J., Reid, M., Varghese, A., Portmann, B. et Williams, R. (1999). A case of adult chronic copper self-intoxication resulting in cirrhosis. Eur. J. Med. Res., 4(6): 252.
OEHHA (2008). Public Health Goal for Copper in Drinking Water. Office of Environmental Health Hazard Assessment (OEHHA). California Environmental Protection Agency. Disponible à : https://oehha.ca.gov/media/downloads/water/chemicals/phg/copperphg020808_0.pdf
Oliphant, R.J. et Schock, M.R. (1996). Chapitre 6 : Copper alloys and solders. Dans : Internal corrosion of water distribution systems. 2e édition. American Water Works Association Research Foundation and DVGW-Technologiezentrum Wasser, Denver, Colorado. pp. 269–312.
Olivares, M. et Uauy, R. (1996). Copper as an essential nutrient. Am. J. Clin. Nutr., 63(5): 791S–796S.
Olivares, M., Pizarro, F., Speisky, H., Lonnerdal, B. et Uauy, R. (1998). Copper in infant nutrition: Safety of world health organization provisional guideline value for copper content of drinking water. J. Pediatr. Gastroenterol. Nutr., 26(3): 251–257.
Olivares, M., Araya, M., Pizarro, F. et Uauy, R. (2001). Nausea threshold in apparently healthy individuals who drink fluids containing graded concentrations of copper. Regul. Toxicol. Pharmacol., 33(3): 271–275.
OMS (1993). Directives de qualité pour l'eau de boisson. Organisation mondiale de la Santé, Genève (Suisse). 2e édition.
OMS (1996). Guidelines for drinking-water quality, 2nd ed. Volume 2: Health criteria and other supporting information. . Organisation mondiale de la Santé, Genève (Suisse). p. 219–226.
OMS (1998). Guidelines for drinking-water quality, 2nd ed. Addendum to volume 2: Health criteria and other supporting information. Organisation mondiale de la Santé, Genève (Suisse).
OMS (2004). Copper in drinking-water. Background document for development of WHO guidelines for drinking-water quality. . Organisation mondiale de la Santé, Genève (Suisse).
OMS (2011). Guidelines for drinking-water quality, 4th ed. . Organisation mondiale de la Santé, Genève (Suisse). ISBN: 978 92 4 154815 1.
Omur-Ozbek, P. et Dietrich, A.M. (2011). Retronasal perception and flavour thresholds of iron and copper in drinking water. J. Water. Health, 9(1): 1–9.
Overvad, K., Wang, D.Y., Olsen, J., Allen, D.S., Thorling, E.B., Bulbrook, R.D. et Hayward, J.L. (1993). Copper in human mammary carcinogenesis: A case-cohort study. Am. J. Epidemiol., 137(4): 409–414.
Ozcelik, D. et Uzun, H. (2009). Copper intoxication; antioxidant defenses and oxidative damage in rat brain. Biol. Trace Elem. Res., 127(1): 45–52.
Pajonk, F.G., Kessler, H., Supprian, T., Hamzei, P., Bach, D., Schweickhardt, J., Herrmann, W., Obeid, R., Simons, A., Falkai, P., Multhaup, G. et Bayer, T.A. (2005). Cognitive decline correlates with low plasma concentrations of copper in patients with mild to moderate Alzheimer's disease. J. Alzheimer's Dis., 8(1): 23–27.
Pal, A. (2014). Copper toxicity induced hepatocerebral and neurodegenerative diseases: An urgent need for prognostic biomarkers. Neurotoxicology, 40: 97–101.
Pal, A., Badyal, R.K., Vasishta, R.K., Attri, S.V., Thapa, B.R. et Prasad, R. (2013). Biochemical, histological, and memory impairment effects of chronic copper toxicity: A model for non-Wilsonian brain copper toxicosis in wistar rat. Biol. Trace Elem. Res., 153(1–3): 257–268.
Pal, A., Jayamani, J. et Prasad, R. (2014). An urgent need to reassess the safe levels of copper in the drinking water: Lessons from studies on healthy animals harboring no genetic deficits. Neurotoxicology, 44: 58–60.
Pamp, K., Bramey, T., Kirsch, M., De Groot, H. et Petrat, F. (2005). NAD(H) enhances the cu(II)-mediated inactivation of lactate dehydrogenase by increasing the accessibility of sulfhydryl groups. Free Radic. Res., 39(1): 31–40.
Paris, I., Perez-Pastene, C., Couve, E., Caviedes, P., Ledoux, S. et Segura-Aguilar, J. (2009). Copper dopamine complex induces mitochondrial autophagy preceding caspase-independent apoptotic cell death. J. Biol. Chem., 284(20): 13306–13315.
Park, H.J., Nguyen, T.T., Yoon, J. et Lee, C. (2012). Role of reactive oxygen species in Escherichia coli inactivation by cupric ion. Environ. Sci. Technol., 46(20): 11299–11304.
Payne, S.J., Piorkowski, G.S., Truelstrup Hansen, L. et Gagnon, G.A. (2016). Impact of zinc orthophosphate on simulated drinking water biofilms influenced by lead and copper, J. Environ.. Eng., 142(2).
Peña, M.M.O., Lee, J. et Thiele, D.J. (1999). A delicate balance: Homeostatic control of copper uptake and distribution. The Journal of Nutrition, 129(7): 1251–1260.
Petris, M.J., Mercer, J.F., Culvenor, J.G., Lockhart, P., Gleeson, P.A. et Camakaris, J. (1996). Ligand-regulated transport of the Menkes copper P-type ATPase efflux pump from the Golgi apparatus to the plasma membrane: A novel mechanism of regulated trafficking. EMBO J., 15(22): 6084–6095.
Pizarro, F., Olivares, M., Gidi, V. et Araya, M. (1999a). The gastrointestinal tract and acute effects of copper in drinking water and beverages. Rev. Environ. Health, 14(4): 231–238.
Pizarro, F., Olivares, M., Uauy, R., Contreras, P., Rebelo, A. et Gidi, V. (1999b). Acute gastrointestinal effects of graded levels of copper in drinking water. Environ. Health Perspect., 107(2): 117–121.
Pizarro, F., Olivares, M., Araya, M., Gidi, V. et Uauy, R. (2001). Gastrointestinal effects associated with soluble and insoluble copper in drinking water. Environ. Health Perspect., 109(9): 949–952.
Prasad, M.P.R., Krishna, T.P., Pasricha, S., Krishnaswamy, K. et Quereshi, M.A. (1992). Esophageal cancer and diet a case-control study. Nutr. Cancer, 18: 85–93. [comme cité dans IPCS, 1998].
Prasad, R., Kaur, G., Nath, R. et Walia, B.N. (1996). Molecular basis of pathophysiology of Indian childhood cirrhosis: Role of nuclear copper accumulation in liver. Mol. Cell. Biochem., 156(1): 25–30.
Pratt, W.B., Omdahl, J.L. et Sorenson, J.R. (1985). Lack of effects of copper gluconate supplementation. Am. J. Clin. Nutr., 42(4): 681–682.
Prohaska, J.R. (1990). Development of copper deficiency in neonatal mice. J. Nutr. Biochem., 1(8): 415–419.
Prohaska, J.R. (2008). Role of copper transporters in copper homeostasis. Am. J. Clin. Nutr., 88(3): 826S–829S.
Qian, Y., Zheng, Y., Taylor, R. et Tiffany-Castiglioni, E. (2012). Involvement of the molecular chaperone Hspa5 in copper homeostasis in astrocytes. Brain Res., 1447: 9–19.
Qin-qin, T., Zhi-rong, L., Ying, D. et Xin-xing, Z. (2012). Biosorption properties of extracellular polymeric substances towards Zn (II) and Cu (II). Desalination and Water Treatment, 45(1–3): 40–47.
Rae, T.D., Schmidt, P.J., Pufahl, R.A., Culotta, V.C. et O'Halloran, T.V. (1999). Undetectable intracellular free copper: The requirement of a copper chaperone for superoxide dismutase. Science, 284(5415): 805–808.
Rahman, S., McDonald, B.C. et Gagnon, G.A. (2007). Impact of secondary disinfectants on copper corrosion under stagnation conditions. Journal of Environmental Engineering, 133(2): 180–185.
Rasmussen, P.E., Subramanian, K.S. et Jessiman, B.J. (2001). A multi-element profile of housedust in relation to exterior dust and soils in the city of Ottawa, Canada. Sci. Total Environ., 267(1–3): 125–140.
Rasmussen, P.E., Dugandzic, R., Hassan, N., Murimboh, J. et Grégoire, D.C. (2006). Challenges in quantifying airborne metal concentrations in residential environments. Can. J. Anal. Sci. Spectrosc., 51(1): 2–8.
Rasmussen, P.E., Beauchemin, S., Nugent, M., Dugandzic, R., Lanouette, M. et Chénier, M. (2008). Influence of matrix composition on the bioaccessibility of copper, zinc, and nickel in urban residential dust and soil. Hum. Ecol. Risk Assess., 14(2): 351–371.
Rehring, J.P. et Edwards, M. (1996). Copper corrosion in potable water systems: impacts of natural organic matter and water treatment processes. Corrosion, 52(4): 301–317.
Reiber, S.H. (1987). Corrosion monitoring and control in the Pacific Northwest. J. Am. Water Works Assoc., 71(2): 71–74.
Reiber, S.H. (1989). Copper plumbing surfaces: an electrochemical study. J. Am. Water Works Assoc., 87(7): 114.
Reyes, A., Letelier, M.V., De la Igledia, R., González, B. et Lagos, G. (2008). Microbiologically induced corrosion of copper pipes in low-pH water. International Biodeterioration & Biodegradation, 61: 135–141.
Rezania, L.W. et Anderl, W.H. (1995). Copper corrosion and iron removal plants. The Minnesota experience. Dans : Proceedings of the 1995 AWWA Water Quality Technology Conference, New Orleans, LA. American Water Works Association, Denver, Colorado.
Rezania, L.W. et Anderl, W.H. (1997). Corrosion control for high DIC groundwater phosphate or bust. Dans : Proceedings of the 1997 AWWA Annual Conference, Atlanta, GA. American Water Works Association, Denver, Colorado.
Rhoads, W.J., Pruden, A. et Edwards, M.A. (2016). Survey of green building water systems reveals elevated water age and water quality concerns. Environmental Science Water Research & Technology, 2: 164–173.
Riedel, G.F. (2008). Copper. Dans : Encyclopedia of ecology. volume 1 A-C. Jorgensen, S.E. et Fath, B.D. (éds). pp. 778–783.
Rivera-Mancia, S., Perez-Neri, I., Rios, C., Tristan-Lopez, L., Rivera-Espinosa, L. et Montes, S. (2010). The transition metals copper and iron in neurodegenerative diseases. Chem. Biol. Interact., 186(2): 184–199.
Roelofsen, H., Wolters, H., Van Luyn, M.J.A., Miura, N., Kuipers, F. et Vonk, R.J. (2000). Copper-induced apical trafficking of ATP7B in polarized hepatoma cells provides a mechanism for biliary copper excretion. Gastroenterology, 119(3): 782–793.
Rosenzweig, A.C. (2001). Copper delivery by metallochaperone proteins. Acc. Chem. Res., 34(2): 119–128.
Roychoudhury, S., Nath, S., Massanyi, P., Stawarz, R., Kacaniova, M. et Kolesarova, A. (2015). Copper induced changes in reproductive functions: Review of in vivo and in vitro effects. Physiol. Res., 65(1): 11–22.
Sadhra, S.S., Wheatley, A.D. et Cross, H.J. (2007). Dietary exposure to copper in the European union and its assessment for EU regulatory risk assessment. Sci. Total Environ., 374(2–3): 223–234.
Sandvig, A., Martel, K., Beggs, K., Jaffe Murray, A., Greiner, P., Kneen, K., McLellan, C., Bennet, D. et Terrell, J. (2012). Is NSF 61 relevant for chloraminating utilities? Water Research Foundation, Denver, Colorado (Water Research Foundation Project No. 4243).
Santé Canada (1994). L'évaluation du risque à la santé humaine des substances d'intérêt prioritaire. Loi canadienne sur la protection de l'environnement. Disponible à : www.hc-sc.gc.ca/ewh-semt/alt_formats/hecs-sesc/pdf/pubs/contaminants/approach/approche-fra.pdf
Santé Canada (2007). Cuivre. Base de données d'ingrédients de produits de santé naturels, Direction des produits de santé naturels, Ottawa (Ontario).
Santé Canada (2009a). Pesticides contenant du cuivre. Projet de décision de réévaluation. Agence de réglementation de la lutte antiparasitaire. PRVD 2009-04.
Santé Canada (2009b). Étude canadienne sur l'alimentation totale. Direction générale des produits de santé et des aliments, Santé Canada, Ottawa, Ontario. Disponible à : www.canada.ca/fr/sante-canada/services/aliments-nutrition/surveillance-aliments-nutrition/etude-canadienne-alimentation-totale.html
Santé Canada (2009c). Document de conseils sur le contrôle de la corrosion dans les réseaux de distribution d'eau potable. Bureau de l'eau, de l'air et des changements climatiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario).
Santé Canada (2010). Tableaux des ANREF. Direction générale des produits de santé et des aliments. Disponible à : www.canada.ca/fr/sante-canada/services/aliments-nutrition/saine-alimentation/apports-nutritionnels-reference/tableaux.html
Santé Canada (2011). Apports alimentaires moyens (µg/kg poids corporel/jour) de microéléments chez les Canadiens de différents groupes d'âge-sexe, Étude de la diète totale menée entre 1993 et 1996. Disponible à : www.canada.ca/fr/sante-canada/services/aliments-nutrition/surveillance-aliments-nutrition/etude-canadienne-alimentation-totale/apports-alimentaires-contaminants-autres-produits-chimiques-chez-canadiens-selon-groupes-sexe/apports-alimentaires-moyens-poids-corporel-jour-microelements-chez-canadiens-differents-groupes-sexe-etude-diete-totale-menee-entre-1993.html
Santé Canada (2013). Deuxième rapport sur la biosurveillance humaine des substances chimiques de l'environnement au Canada. Disponible à : www.canada.ca/fr/sante-canada/services/sante-environnement-milieu-travail/rapports-publications/contaminants-environnementaux/deuxieme-rapport-biosurveillance-humaine-substances-chimiques-environnement-canada-sante-canada-2013.html.
Santé Canada (2015). Communication personnelle avec T. Shin. Direction générale de la santé environnementale et de la sécurité des consommateurs.
Santé Canada (2016). Lignes directrices sur la qualité de l'air intérieur résidentiel : Moisissures. Disponible à : http://canadiensensante.gc.ca/publications/healthy-living-vie-saine/mould-moisissure/alt/mould-moisissures-fra.pdf.
Sarver, E., Zhang, Y. et Edwards, M. (2011). Copper pitting and brass dezincification: chemical and physical effects. Water Research Foundation, Denver, Colorado.
Scardina, P., Edwards, M., Bosch, D.J., Loganathan, G.V. et Dwyer, S.K. (2008). Assessment of non-uniform corrosion in copper piping. Water Research Foundation, Denver, Colorado.
Schaefer, M. et Gitlin, J.D. (1999). Genetic disorders of membrane transport. IV. Wilson's disease and Menkes disease. Am. J. Physiol., 276(2 Pt 1): G311–G314.
Scheinberg, I.H. et Sternlieb, I. (1996). Wilson disease and idiopathic copper toxicosis. Am. J. Clin. Nutr., 63(5): 842S–845S.
Schilsky, M.L. (1996). Wilson disease: Genetic basis of copper toxicity and natural history. Semin. Liver Dis., 16(1): 83–95.
Schock, M.R. (1990). Causes of temporal variability of lead in domestic plumbing systems. Environ. Monit. Assess., 15(1): 59–82.
Schock, M.R. (1999). Chapitre 17 : Internal corrosion and deposition control. Dans : Letterman, R.D. (éd.), Water quality and treatment: a handbook on drinking water. 5e édition. McGraw Hill and American Water Works Association, Denver, Colorado. pp. 87–88.
Schock, M.R. (2005). Distribution systems as reservoirs and reactors for inorganic contaminants. Dans : Distribution system water quality challenges in the 21st century: a strategic guide. American Water Works Association, Denver, Colorado.
Schock, M.R. et Clement, J.A. (1998). Lead and copper control with non-zinc orthophosphate. J. N. Engl. Water Works Assoc., 112(1): 20–33
Schock, M.R. et Fox, J.C. (2001). Solving copper corrosion problems while maintaining lead control in a high alkalinity water using orthophosphate. Dans : Proceedings of the 2001 AWWA Annual Conference, Washington, DC. American Water Works Association, Denver, Colorado.
Schock, M.R. et Lytle, D. (2011). Chapitre 20 : Internal corrosion and deposition control. Dans : J.K. Edzwald (éd.), Water quality and treatment: a handbook on drinking water. 6e édition. McGraw Hill and American Water Works Association, Denver, Colorado.
Schock, M.R. et Neff, C.H. (1988). Trace metal contamination from brass fittings. J. Am. Water Works Assoc., 80(11): 47–56.
Schock, M.R. et Sandvig, A.M. (2009). Long-term effects of orthophosphate treatment on copper concentration. J. Am. Water Works Assoc., 101(7): 71–82.
Schock, M.R., Lytle, D.A. et Clement, J.A. (1995). Effect of pH, DIC, orthophosphate, and sulfate on drinking water cuprosolvency. U.S. Environmental Protection Agency, Cincinnati, OH (Report No. EPA/600/R-95/085).
Schock, M.R., Wagner, I. et Oliphant, R.J. (1996). Corrosion and solubility of lead in drinking water. Dans : Internal corrosion of water distribution systems. 2e édition. American Water Works Association Research Foundation and DVGW Technologiezentrum Wasser, Denver, Colorado. pp. 131–230.
Scott, K.C. et Turnlund, J.R. (1994). A compartmental model of zinc metabolism in adult men used to study effects of three levels of dietary copper. Am. J. Physiol., 267(1 Pt 1): E165–173.
Senesse, P., Meance, S., Cottet, V., Faivre, J. et Boutron-Ruault, M. (2004). High dietary iron and copper and risk of colorectal cancer: A case-control study in burgundy, France. Nutr. Cancer, 49(1): 66–71.
Shaligram, S. et Campbell, A. (2013). Toxicity of copper salts is dependent on solubility profile and cell type tested. Toxicol. in Vitro., 27(2): 844–851.
Shanaman et coll. (1972). [ comme cité par l'OMS, 1993.
Sharrett, A.R., Carter, A.P., Orheim, R.M. et Feinleib, M. (1982). Daily intake of lead, cadmium, copper, and zinc from drinking water: the Seattle study of trace metal exposure. Environ. Res., 28: 456–475.
Shike, M. (2009). Copper in parenteral nutrition. Gastroenterology, 137(5 Suppl): S13–S17.
Singh, I. et Mavinic, D.S. (1991). Significance of building and plumbing specifics on trace metal concentrations in drinking water. Revue canadienne de génie civil/Can. J. Civil Eng., 18(6): 893–903.
Sokol, R.J., Devereaux, M., Mierau, G.W., Hambidge, K.M. et Shikes, R.H. (1990). Oxidant injury to hepatic mitochondrial lipids in rats with dietary copper overload. Modification by vitamin E deficiency. Gastroenterology, 99(4): 1061–1071.
Sorg, T.J., Schock, M.R. et Lytle, D.A. (1999). Ion exchange softening: effects on metal concentrations. J. Am. Water Works Assoc., 91(8): 85–97.
Sparks, D.L. et Schreurs, B.G. (2003). Trace amounts of copper in water induce beta-amyloid plaques and learning deficits in a rabbit model of Alzheimer's disease. Proc. Natl. Acad. Sci. USA, 100(19): 11065–11069.
Spitalny, K.C., Brondum, J., Vogt, R.L., Sargent, H.E. et Kappel, S. (1984). Drinking-water-induced copper intoxication in a Vermont family. Pediatrics, 74(6): 1103–1106.
Squitti, R., Lupoi, D., Pasqualetti, P., Dal Forno, G., Vernieri, F., Chiovenda, P., Rossi, L., Cortesi, M., Cassetta, E. et Rossini, P.M. (2002). Elevation of serum copper levels in Alzheimer's disease. Neurology, 59(8): 1153–1161.
Squitti, R., Barbati, G., Rossi, L., Ventriglia, M., Dal Forno, G., Cesaretti, S., Moffa, F., Caridi, I., Cassetta, E., Pasqualetti, P., Calabrese, L., Lupoi, D. et Rossini, P.M. (2006). Excess of nonceruloplasmin serum copper in AD correlates with MMSE, CSF [beta]-amyloid, and h-tau. Neurology, 67(1): 76–82.
Stenhammar, L. (1999). Diarrhoea following contamination of drinking water with copper. Eur. J. Med. Res., 4(6): 217–218.
Stern, B.R. (2010). Essentiality and toxicity in copper health risk assessment: Overview, update and regulatory considerations. J. Toxicol. Environ. Health A, 73(2): 114–127.
Stern, B.R., Solioz, M., Krewski, D., Aggett, P., Aw, T.C., Baker, S., Crump, K., Dourson, M., Haber, L., Hertzberg, R., Keen, C., Meek, B., Rudenko, L., Schoeny, R., Slob, W. et Starr, T. (2007). Copper and human health: Biochemistry, genetics, and strategies for modeling dose-response relationships. J. Toxicol. Environ. Health B Crit. Rev., 10(3): 157–222.
Stewart, J.H., Macintosh, D., Allen, J. et McCarthy, J. (2012). Chapitre 11 - germanium, tin, and copper. Dans : Patty's toxicology. 6e édition. Volume 1. Bingham, E. et Cohrssen, B. (éds). John Wiley & Sons, Inc., pp. 355–380.
Stover, E.L. et Kincannon, D.F. (1983). Contaminated groundwater treatability - a case study. J. Am. Water Works Assoc., 75(6): 292–298.
Takeda, T., Yukioka, T. et Shimazaki, S. (2000). Cupric sulfate intoxication with rhabdomyolysis, treated with chelating agents and blood purification. Intern. Med., 39(3): 253–255.
Talcott, P.A. (2013). Copper. Chapitre 41. Dans : Small animal toxicology. Peterson, M. E., Talcott, P.A. (éds), 3e édition.
Tanner, M.S. (1998). Role of copper in Indian childhood cirrhosis. Am. J. Clin. Nutr., 67(Suppl. 5): 1074S–1081S.
Tapia, L., Gonzalez-Aguero, M., Cisternas, M.F., Suazo, M., Cambiazo, V., Uauy, R. et Gonzalez, M. (2004). Metallothionein is crucial for safe intracellular copper storage and cell survival at normal and supra-physiological exposure levels. Biochem. J., 378(Pt 2): 617–624.
Tapiero, H., Townsend, D.M. et Tew, K.D. (2003). Trace elements in human physiology and pathology. copper. Biomed. Pharmacother., 57(9): 386–398.
Tardito, S., Bassanetti, I., Bignardi, C., Elviri, L., Tegoni, M., Mucchino, C., Bussolati, O., Franchi-Gazzola, R. et Marchio, L. (2011). Copper binding agents acting as copper ionophores lead to caspase inhibition and paraptotic cell death in human cancer cells. J. Am. Chem. Soc., 133(16): 6235–6242.
Taylor, J.S. et Wiesner, M. (1999). Membranes. Chapitre 11. Dans : Letterman, R.D. (éd), Water quality and treatment: a handbook of community water supplies, 5e édition. American Water Works Association. Denver, Colorado. McGraw-Hill, New York, New York.
Thompson, C.A., Habermann, T.M., Wang, A.H., Vierkant, R.A., Folsom, A.R., Ross, J.A. et Cerhan, J.R. (2010). Antioxidant intake from fruits, vegetables and other sources and risk of non-Hodgkin's lymphoma: The Iowa women's health study. Int. J. Cancer, 126(4): 992–1003.
Tiffany-Castiglioni, E., Hong, S. et Qian, Y. (2011). Copper handling by astrocytes: Insights into neurodegenerative diseases. Int. J. Dev. Neurosci., 29(8): 811–818.
Triantafyllidou, S., Nguyen, K., Zhang, Y. et Edwards, M. (2013). Lead (Pb) quantification in potable water samples: implications for regulatory compliance and assessment of human exposure. Environ. Monit. Assess., 185: 1355–1365. doi: 10.1007/s10661-012-2637-6
Turnlund, J.R. (1998). Human whole-body copper metabolism. Am. J. Clin. Nutr., 67(Suppl. 5): 960S–964S.
Turnlund, J.R., Keyes, W.R., Anderson, H.L. et Acord, L.L. (1989). Copper absorption and retention in young men at three levels of dietary copper by use of the stable isotope 65Cu. Am. J. Clin. Nutr., 49(5): 870–878.
Turnlund, J.R., Keen, C.L. et Smith, R.G. (1990). Copper status and urinary and salivary copper in young men at three levels of dietary copper. Am. J. Clin. Nutr., 51(4): 658–664.
Turnlund, J.R., Keyes, W.R., Peiffer, G.L. et Scott, K.C. (1998). Copper absorption, excretion, and retention by young men consuming low dietary copper determined by using the stable isotope 65Cu. Am. J. Clin. Nutr., 67(6): 1219–1225.
Turnlund, J.R., Jacob, R.A., Keen, C.L., Strain, J.J., Kelley, D.S., Domek, J.M., Keyes, W.R., Ensunsa, J.L., Lykkesfeldt, J. et Coulter, J. (2004). Long-term high copper intake: Effects on indexes of copper status, antioxidant status, and immune function in young men. Am. J. Clin. Nutr., 79(6): 1037–1044.
Turnlund, J.R., Keyes, W.R., Kim, S.K. et Domek, J.M. (2005). Long-term high copper intake: Effects on copper absorption, retention, and homeostasis in men. Am. J. Clin. Nutr., 81(4): 822–828.
U.S. District Court (2011). Order certifying class for settlement and approving class action settlement. Case no. 09-MD-2098. Dans : re: Kitec Plumbing system products liability litigation. Northern District of Texas, Dallas Division. November.
U.S. EPA (1988). Copper; CASRN 7440-50-8. Chemical Assessment Summary. Integrated Risk Information System (IRIS). National Center for Environmental Assessment. U.S. Environmental Protection Agency.
U.S. EPA (1991). Maximum contaminant level goals and national primary drinking water regulation for lead and copper; Final Rule. U.S. Environmental Protection Agency. Fed Reg 56 (110): 26460–26464. June.
U.S. EPA (1994a). Method 200.9 rev. 2.2 determination of trace elements by stabilized temperature graphite furnace atomic absorption. Environmental Monitoring Systems Laboratory, Office of Research and Development, Cincinnati, Ohio.
U.S. EPA (1994b). Method 200.8 rev 5.4 determination of trace elements in waters and wastes by inductively coupled plasma - mass spectrometry. Environmental Monitoring Systems Laboratory, Office of Research and Development, Cincinnati, Ohio.
U.S. EPA (1994c). Method 200.7 rev. 4.4 determination of metals and trace elements in water and wastes by inductively coupled plasma-atomic emission spectrometry. Environmental Monitoring Systems Laboratory, Ofice of Research and Development, Cincinnati, Ohio.
U.S. EPA (1998). Small system compliance technology list for the non-microbial contaminants regulated before 1996. Office of Water, U.S. Environmental Protection Agency, Washington, DC. (EPA 815-R-98-002).
U.S. EPA (2000). 40 CFR Parts 141 and 142, National Primary Drinking Water Regulations for Lead and Copper; Final Rules. U.S. Environmental Protection Agency, Washington, DC.
U.S. EPA (2003a). Method 200.5 rev 4.2 determination of trace elements in drinking water by axially viewed inductively coupled plasma-atomic energy emission spectrometry. National Exposure Research Laboratory, Office of Research and Development, Cincinnati, Ohio.
U.S. EPA (2003b). Revised guidance manual for selecting lead and copper control strategies. U.S. Environmental Protection Agency, Washington, DC. (EPA-816-R-03-001).
U.S. EPA (2009). National Primary Drinking Water Regulations. U.S. Environmental Protection Agency, Washington, DC. Disponible à : www.epa.gov/ground-water-and-drinking-water/table-regulated-drinking-water-contaminants.
U.S. EPA (2012). Radionuclides in drinking water, compliance options: Treatment technology descriptions. U.S. Environmental Protection Agency. Disponible à : http://cfpub.epa.gov/safewater/radionuclides/radionuclides.cfm
van den Berghe, P.V. et Klomp, L.W. (2009). New developments in the regulation of intestinal copper absorption. Nutr. Rev., 67(11): 658-672.
Vik, E.A., Ryder, R.A., Wagner, I. et Ferguson, J.F. (1996). Mitigation of corrosion effects. Dans : Internal corrosion of water distribution systems. 2e édition. American Water Works Association Research Foundation and DVGW Technologiezentrum Wasser, Denver, Colorado. pp. 389–444.
Wapnir, R.A. (1998). Copper absorption and bioavailability. Am. J. Clin. Nutr., 67(Suppl. 5): 1054S–1060S.
Wijmenga, C. et Klomp, L.W. (2004). Molecular regulation of copper excretion in the liver. Proc. Nutr. Soc., 63(1): 31–39.
Wong, P.K. (1988). Mutagenicity of heavy metals. Bull. Environ. Contam. Toxicol., 40(4): 597–603.
Woszczynski, M., Bergese, J., Payne, S.J. et Gagnon, G.A. (2015). Comparison of sodium silicate and phosphate for controlling lead release from copper pipe rigs. Revue canadienne de génie civil / Canadian Journal of Civil Engineering, 42: 953–959.
Wyllie, J. (1957). Copper poisoning at a cocktail party. Am. J. Publ. Health, 47: 617.
Xiong, X., Yanxia, L., Wei, L., Chunye, L., Wei, H. et Ming, Y. (2010). Copper content in animal manures and potential risk of soil copper pollution with animal manure use in agriculture. Resour. Conserv. Recy., 54: 985–990.
Yang, H.J., He, S.Y. et Tuan, H.Y. (2014). Self-seeded growth of five-fold twinned copper nanowires: Mechanistic study, characterization, and SERS applications. Langmuir, 30(2): 602–610.
Yoshida, Y., Furuta, S. et Niki, E. (1993). Effects of metal chelating agents on the oxidation of lipids induced by copper and iron. Biochim. Biophys. Acta, 1210(1): 81–88.
Zacarias, I., Yanez, C.G., Araya, M., Oraka, C., Olivares, M. et Uauy, R. (2001). Determination of the taste threshold of copper in water. Chem. Senses, 26(1): 85–89.
Zemansky, G.M. (1974). Removal of trace metals during conventional water treatment. J. Am. Water Works Assoc. 66(10), 606–609.
Zhao, L., Wang, J., Wang, Y. et Fa, X. (2013). Apigenin attenuates copper-mediated β-amyloid neurotoxicity through antioxidation, mitochondrion protection and MAPK signal inactivation in an AD cell model. Brain Res., 1492: 33–45.
Zietz, B.P., de Vergara, J.D. et Dunkelberg, H. (2003a). Copper concentrations in tap water and possible effects on infant's health--results of a study in Lower Saxony, Germany. Environ. Res., 92(2): 129–138.
Zietz, B.P., Dieter, H.H., Lakomek, M., Schneider, H., Kessler-Gaedtke, B. et Dunkelberg, H. (2003b). Epidemiological investigation on chronic copper toxicity to children exposed via the public drinking water supply. Sci. Total Environ., 302(1–3): 127–144.
Zlotkin, S.H., Atkinson, S. et Lockitch, G. (1995). Trace elements in nutrition for premature infants. Clin. Perinatol., 22(1): 223–240.Annexe A: Liste des abréviations
ADN acide désoxyribonucléique
ALAT alanine-aminotransférase
ANOV Aanalyse de la variance
ANSI American National Standards Institute
AQ Rapport quotidien recommandé
ASAT aspartate aminotransférase
CAG charbon actif en grains
CID carbone inorganique dissous
CMA concentration maximale acceptable
CNP Code national de la plomberie du Canada
Cp céruloplasmine
Cu cuivre
Cu(I )ion cuivre(I)
Cu(II) ion cuivre(II)
DIU dispositif intra-utérin
BMD dose de référence
BMDL05 limite de confiance inférieure de la dose de référence pour une réponse de 5 %
BMDL10 limite de confiance inférieure de la dose de référence pour une réponse de 10 %
ECAT Étude canadienne sur l'alimentation totale
Eh potentiel d'oxydoréduction
ET écart-type
γ-GT gamma-glutamyl-transférase
GI gastro-intestinal
GSH glutathion
IC intervalle de confiance
LCR Lead and Copper Rule
LDM limite de détection de la méthode
LEC Long Evans Cinnamon
LOAEL dose minimale avec effet nocif observé
MA maladie d'Alzheimer
MG moyenne géométrique
MON matière organique naturelle
MT métallothionéine
NOAEL dose sans effet nocif observé
NPEQ niveau pratique d'évaluation quantitative
NSF NSF International
OD oxygène dissous
OE objectif d'ordre esthétique
OI osmose inverse
OMS Organisation mondiale de la Santé
p.c. poids corporel
PER polyéthylène réticulé
RC rapport des cotes
SCO syndrome de la corne occipitale
SNC système nerveux central
SOD superoxyde dismutase
TBARS substances réactives à l'acide thiobarbiturique
U.S. EPA United States Environmental Protection Agency
UTN unité de turbidité néphélémétrique
Annexe B : Répercussions provinciales et territoriales prévues
Veuillez noter que l'information suivante n'est pas dans les deux langues officielles, puisque la source de l'information n'est pas assujettie à la Loi sur les langues officielles.
Île-du-Prince-Édouard
Based on available data, no impact is anticipated.
Terre-Neuve-et-Labrador
The Province of Newfoundland and Labrador is responsible for extensive monitoring for inorganic parameters including copper in the province. Copper monitoring is conducted semi-annually for all public water supplies in the province, and quarterly for populations larger than 5,000. pH in the province is typically low and below the guideline of 6.5–8.5. There are typically greater than 300 pH exceedances in the province annually. As discussed in the technical document, the low pH in the province causes issues with corrosion and can affects the copper concentration levels in drinking water.
There are 4 communities that may not meet the new proposed MAC of 2.0 mg/L. There are currently 16 communities that occasionally exceed the existing AO of 1.0 mg/L. There could be a moderate cost of implementing the proposed guideline for copper in Newfoundland and Labrador. Due to naturally low pH issues experienced by many water systems in the province, prevention of corrosion in household plumbing will require some communities to install pH adjustment systems or upgrade their existing pH adjustment systems to maintain appropriate pH levels within the distribution system. Water pH in some communities is so low, that even with treatment, it would be difficult to dose enough chemical to meet both pH and copper guidelines.
Due to this, new treatment systems and/or significant upgrades may be required to a number of existing systems. The province will continue to monitor for copper and pH at the current frequency, and to assist communities in ensuring their pH adjustment systems are working effectively to increase pH levels and keep corrosion control measures in place.
Nouvelle-Écosse
Health Canada proposes to establish a maximum acceptable concentration (MAC) of 2 mg/L for total copper in drinking water while maintaining the existing aesthetic objective of 1 mg/L.
Available data suggests that utilities will not be impacted as a result of the proposed reduction; however, this data represents flushed samples collected from the distribution system and is not representative of total copper concentrations at the customer’s tap. Existing data prevents an accurate determination of the true impact. The widespread use of copper in plumbing and distribution system components coupled with the lack of enforceable corrosion control program requirements likely result in consumer exposures to copper that are above the concentrations currently reported by utilities.
For Nova Scotia, the revised guideline will require the development and enforcement of copper sampling protocols in addition to clear requirements for corrosion control programs. This will likely result in challenges for the utilities and the Inspection, Compliance, and Enforcement Division of Nova Scotia Environment. Specific challenges are likely to include: lack of willing participants; access for sample collection; and increased costs for laboratory analysis./p>
Nouveau-Brunswick
New Brunswick is supportive of a copper guideline that is protective of public health. Based on historical drinking water quality results for both regulated municipal and crown systems, as well as private wells, there is no evidence that this guideline will cause any significant immediate impacts. However, copper is not a regulated parameter in New Brunswick as there is no health based guideline. For the most part, water quality data for regulated drinking water systems has been obtained from samples and taken at the same time and location as other Inorganic parameters as part of regular compliance monitoring. The true impact of this guideline will not be known until sampling and monitoring protocols and approaches are updated to align with the recommendations of the guideline.
Québec
Au Québec, de 2012 à 2015, 17 863 analyses de cuivre ont été réalisées dans le cadre du Règlement sur la qualité de l’eau potable, dans l’eau d’un total de 3049 réseaux de distribution. Les responsables de tous les réseaux assujettis au Règlement doivent réaliser annuellement le contrôle du cuivre dans l’eau potable distribuée. Durant la période de 2012 à 2015, 119 (0,7 %) des analyses réalisées ont présenté un résultat supérieur à la norme québécoise pour le cuivre dans l’eau potable établie à 1,0 mg/L, pour 70 réseaux de distribution distincts (2 %). La concentration maximale mesurée a atteint 15 mg/L. La révision proposée de la recommandation sur le cuivre dans l’eau potable n’aurait pas d’impact pour les réseaux de distribution du Québec étant donné que la norme québécoise est plus sévère que la concentration maximale acceptable proposée dans le document.
Ontario
The proposed Guideline for Canadian Drinking Water Quality for copper of 2 mg/L and an aesthetic objective of 1 mg/L will have minimal impact in Ontario. Ontario currently has an aesthetic objective of 1 mg/L for copper. The health guideline value for copper will be appropriate to assess the health impacts of the occasional exceedance of the aesthetic objective for copper.
Manitoba
A review of available public and semi-public water system data does not provide a clear picture of potential impacts of the proposed change to the Canadian guideline for copper in drinking water from an aesthetic objective of ≤ 1 mg/L to a maximum acceptable concentration (MAC) of 2 mg/L and an aesthetic objective of 1 mg/L. Manitoba water systems have historically been monitoring for metals, including copper, at water treatment plants. The proposed guideline requires that copper samples be drawn at the consumer’s tap, which takes into consideration the effects of the main distribution system and individual home plumbing systems. Sampling at the consumer’s tap would represent a significant change for Manitoba water systems. This would likely be the most significant impact from a cost perspective as well.
Saskatchewan
The Water Security Agency (WSA) has reviewed the proposed guideline document for copper in drinking water and agrees with the proposed MAC of 2 mg/L and aesthetic objective of 1 mg/L for total copper in drinking water. Drinking water data of 3512 samples collected in the last 10 years (2006 to present) from the distribution systems of municipalities regulated by the WSA showed that total copper levels exceeded the proposed MAC and aesthetic objective in only 8 sampling locations or distribution systems of communities in the province. The WSA notes that copper in drinking water mainly results from the corrosion of copper containing pipes and fittings in the distribution and plumbing systems and based on the chemistry of water. An analysis of total copper levels in source water in the database showed that the copper levels are very low/insignificant to cause any exceedances in finished water. Some of the municipalities in Saskatchewan continue to replace the aged service lines and plumbing systems, and others have some form of replacement programs including providing an incentive to home owners to replace their aged service lines from the curb stop to the building entry. The WSA follows the corrosion control guidance document of Health Canada in dealing with exceedances of parameters such as copper and lead in the distribution system and encourages the waterworks owner to replace the service lines where related exceedances occur. The communities regulated by the WSA continue to monitor copper levels in the distribution systems as per monitoring requirements specified in the provincial document “Municipal Drinking Water Quality Monitoring Guidelines - EPB 202” and in accordance with operational permit conditions. Since studies showed that many of the water treatment systems including conventional water treatment filtration systems are effective in removing copper, and since these type of treatment systems are in existence and/or are being increasingly adopted for use in WTPs in the province the WSA believes and expects that the new standard for Total Copper will have a minimal or no impacts including cost to municipal and other regulated waterworks in the province. The WSA will also work with the affected municipalities in the province to have an improved monitoring of pH/ or alkalinity levels at the water treatment plant and the use of corrosion inhibitors, if necessary so as to minimize the copper level in the distribution system.
Alberta
Based on available data, no impact is anticipated.
Colombie-Britannique
The proposed change to the copper guidelines to maintain the aesthetic objective (AO) at 1.0 mg/L as well as the addition of a maximum acceptable concentration (MAC) of 2.0 mg/L based on studies citing an association between long term exposure to copper and liver and kidney effects is anticipated to have some notable shifts in how copper in drinking water is measured. Similar to lead, a notable impact of the new MAC will be the shift in focus from centralized sampling to point of consumption based programs. Sampling of buildings, particularly high risk institutions such as schools and daycares, will remain a cost pressure. Questions of whether this is responsibility of water suppliers or building owners will be raised.
Given that the data on water concentrations reported in section 5.2 shows very few exceedances of the MAC, it is anticipated the proposed change in the guideline will have little impact on the water delivered by water supply systems. However, as leaching from fixtures within individual buildings is likely the most significant contributor to copper concentration in water, it is therefore difficult to anticipate copper concentrations delivered at individual taps, as this will vary from building to building, depending on plumbing, and system to system, depending on how corrosive water is.
The proposed addition of a maximum acceptable concentration will also mean significantly different messaging from what health officials have historically given regarding copper. It will also require the need for clear and meaningful advice to those that have been consuming water sources that exceed the proposed MAC, who have previously been told that elevated copper is merely an aesthetic concern.
Yukon
It is not possible to quantify the impact of the proposed technical document and MAC for copper at this point in time for Yukon. The Yukon drinking water regulatory framework is primarily focused on water treatment and provision of safe drinking water as it leaves the water treatment plant to the distribution system. Provisions of the Drinking Water Regulation specify specific monitoring requirements for raw and treated water (at the point of water leaving the plant). While there is a requirement for monitoring of free chlorine, total coliforms and E.coli within the distribution system, there are currently no specific requirements for routine monitoring of other parameters.
Environmental Health Services (EHS) regulatory mandate extends to curb stop for large public drinking water systems. Routine compliance monitoring and regulatory requirements for large public drinking water system owners beyond this point is not within the current mandate. Further policy development would be needed to incorporate testing at the tap. Currently all Yukon large public drinking water systems meet the proposed MAC for copper entering the distribution system. EHS will be doing policy development in terms of monitoring of the distribution system for copper and other metals over the next few months.
Territoires du Nord-Ouest
Aucun paragraphe n'a été soumis par le territoire.
Nunavut
Aucun paragraphe n'a été soumis par le territoire.