Ébauche des recommandations pour la qualité de l'eau potable au Canada, Les trihalométhanes
Télécharger en format PDF
(3,7 Mo, 161 pages)
Organisation : Santé Canada
Date de publication : 2015-01-XX
Objectif de la consultation
Le présent document technique décrit l'évaluation de l'information disponible sur les trihalométhanes (THM) dans le but de mettre à jour la valeur de la recommandation relativement à la présence de THM dans l'eau potable. La consultation vise à solliciter des commentaires sur la recommandation proposée, la démarche suivie pour l'élaborer et les répercussions possibles de sa mise en œuvre.
Le document technique existant sur les THM, préparé en 2006 et accompagné d'un addenda en 2009, recommandait une concentration maximale acceptable (CMA) de 0,100 mg/L (100 µg/L) de THM, sur la base d'une moyenne mobile annuelle par emplacement d'échantillons prélevés au minimum une fois par trimestre au point du réseau de distribution susceptible de présenter les plus fortes concentrations de THM.
Le présent document propose de maintenir une CMA de 0,100 mg/L (100 µg/L) pour les THM totaux dans l'eau potable. Cette valeur est basée sur les effets (tumeurs intestinales chez le rat) observés à la suite d'une exposition au bromodichlorométhane (BDCM), alors que la CMA existante est basée sur les effets (kystes adipeux dans le foie des chiens) observés à la suite d'une exposition au chloroforme. La CMA proposée pour les THM se base sur une moyenne mobile annuelle par emplacement d'échantillons prélevés au minimum une fois par trimestre aux points du réseau de distribution susceptibles de présenter les plus fortes concentrations de THM.
Ce document est mis à la disposition du public pour une période de consultation de 60 jours. Veuillez faire parvenir vos commentaires (avec justification, au besoin) à Santé Canada par courriel : water-consultations-eau@hc-sc.gc.ca.
Les commentaires doivent nous parvenir avant le 4 avril 2025. Les commentaires reçus dans le cadre de la consultation seront transmis, avec le nom et l'affiliation de leurs auteurs, aux membres du Comité fédéral-provincial-territorial sur l'eau potable (CEP). Les personnes qui ne veulent pas que leur nom et leur affiliation soient communiqués aux membres du CEP doivent joindre à leurs commentaires une déclaration à cet égard.
Il est à noter que le présent document technique sera révisé après l'analyse des commentaires reçus et qu'une recommandation pour l'eau potable sera établie, au besoin. Ce document devrait donc être considéré strictement comme une ébauche pour commentaires.
Recommandation proposée
La concentration maximale acceptable (CMA) proposée pour les trihalométhanes (THM) dans l'eau potable est de 0,100 mg/L (100 µg/L), sur la base d'une moyenne mobile annuelle par emplacement d'échantillons prélevés au minimum une fois par trimestre aux points du réseau de distribution susceptibles de présenter les plus fortes concentrations de THM. On entend par THM l'ensemble des composés que constituent le chloroforme, le bromodichlorométhane, le dibromochlorométhane et le bromoforme. Les responsables des systèmes de distribution d'eau potable ne devraient ménager aucun effort pour maintenir les concentrations au niveau le plus bas qu'il soit raisonnablement possible d'atteindre sans compromettre l'efficacité de la désinfection.
Sommaire
Le présent document technique a été préparé en collaboration avec le Comité fédéral-provincial-territorial sur l'eau potable (CEP) et évalue tous les renseignements pertinents sur les THM. Une évaluation des renseignements actuels sur les THM iodés, qui sont des contaminants suscitant de nouvelles préoccupations, a également été réalisée. Toutefois, aucune valeur de la recommandation n'a été établie pour ces substances.
Exposition
Les THM sont un groupe de sous-produits de désinfection qui se forment principalement par réaction entre le chlore utilisé pour désinfecter l'eau potable et la matière organique naturellement présente dans les approvisionnements en eau brute. L'ingestion de THM présents dans l'eau potable, ainsi que l'inhalation et l'absorption par voie cutanée de THM lors d'activités liées à l'eau (par exemple le bain, la douche) constituent les principales sources d'exposition de la population canadienne à ces substances.
Le chloroforme est le THM que l'on retrouve le plus souvent et à la concentration la plus élevée dans l'eau potable. Le bromodichlorométhane (BDCM), le dibromochlorométhane (DBCM) et le bromoforme peuvent être présents, généralement à des concentrations plus faibles que le chloroforme. Les THM totaux sont la somme des quatre espèces de THM. Les concentrations les plus élevées de THM sont généralement observées dans l'eau potable en été et en automne, ainsi qu'aux endroits dans le réseau de distribution où le temps de séjour de l'eau est le plus long. Les THM iodés, s'ils sont présents, le sont généralement à de faibles concentrations.
Effets sur la santé
Des études chez l'humain ont révélé des liens entre l'exposition aux THM dans l'eau potable et le cancer de la vessie. De plus, il semble exister une association potentielle entre l'exposition aux THM dans l'eau potable et des effets sur la reproduction et le développement (en particulier, faible poids pour l'âge gestationnel). L'analyse de ces liens est compliquée, car l'exposition aux THM dans l'eau potable suppose une exposition simultanée à d'autres sous-produits de désinfection. Étant donné que l'eau potable peut contenir des centaines de sous-produits de désinfection, il est difficile de cerner le ou les substances chimiques responsables des effets sur la santé.
Des études menées chez l'animal révèlent que l'exposition aux THM touche principalement le foie et les reins. Toutefois, selon le THM, des effets sont également observés dans le côlon, la thyroïde et les tissus nasaux. Les données semblent indiquer que le chloroforme est une substance cancérogène avec seuil qui ne présente pas de risque de cancer aux concentrations décelées dans l'eau potable. Une valeur basée sur la santé (VBS) de 1,4 mg/L a été établie pour le chloroforme, sur la base d'effets sur les reins observés chez le rat. Par contre, les données donnent à penser que le BDCM est une substance cancérogène sans seuil. La VBS de 0,100 mg/L pour le BDCM a été déterminée sur la base de tumeurs intestinales observées chez le rat. La VBS tient compte de toutes les expositions liées à l'eau potable, que ce soit par ingestion, par inhalation ou par absorption cutanée. Les données étaient insuffisantes pour calculer les VBS du DBCM et du bromoforme.
Les données toxicologiques ont montré de façon constante que les sous-produits de désinfection bromés tels que le BDCM, le DBCM et le bromoforme sont plus puissants que les sous-produits de désinfection chlorés, comme le chloroforme. C'est pourquoi la CMA proposée de 0,100 mg/L pour la concentration totale de chloroforme, de BDCM, de DBCM et de bromoforme est basée sur la VBS la plus faible calculée pour le BDCM et qu'elle assure une protection contre les effets sur la santé des quatre THM.
Il existe très peu de données sur la toxicité des THM iodés; il est donc impossible de calculer une VBS pour ces substances.
Compte tenu des effets que les THM peuvent avoir sur la santé et des renseignements limités sur les incertitudes et les risques liés aux autres sous-produits de désinfection chlorés, bromés et iodés, il est recommandé que les stations de traitement s'efforcent de maintenir les concentrations de THM au niveau le plus faible qu'il soit raisonnablement possible d'atteindre. Il est important de souligner que les risques pour la santé liés aux sous-produits de désinfection, notamment les THM, sont bien moindres que les risques associés à la consommation d'une eau qui n'a pas été désinfectée. Par conséquent, les méthodes employées pour contrôler les concentrations de THM dans l'eau potable ne doivent pas compromettre l'efficacité de la désinfection de l'eau.
Considérations relatives à l'analyse et au traitement
Pour établir une recommandation sur la qualité de l'eau potable, il faut tenir compte de la capacité de mesurer le contaminant et de réduire sa concentration dans l'eau potable. Plusieurs méthodes d'analyse existent pour mesurer les THM dans l'eau à des concentrations bien inférieures à la CMA proposée. Les mesures devraient porter sur les THM totaux, soit le chloroforme, le BDCM, le DBCM et le bromoforme, dans un échantillon d'eau.
L'approche visant à réduire l'exposition aux THM est généralement axée sur la réduction de la formation de sous-produits de désinfection chlorés. Il est possible de réduire les concentrations de THM et d'autres sous-produits de la désinfection par le chlore dans l'eau potable à la station de traitement en enlevant la matière organique naturelle de l'eau avant l'ajout de chlore, en optimisant le procédé de désinfection, en adoptant une autre stratégie de désinfection ou en utilisant une source d'eau différente. Il est primordial que les méthodes utilisées pour contrôler les concentrations de THM ne compromettent pas l'efficacité de la désinfection. La consommation d'eau non traitée ou inadéquatement traitée doit être évitée.
Réseau de distribution
Les THM continuent à se former dans le réseau de distribution. C'est pourquoi on recommande aux responsables de systèmes d'approvisionnement d'eau potable d'élaborer un plan de gestion du réseau de distribution afin de réduire au minimum la formation de THM. Des stratégies visant à réduire la formation de THM dans le réseau de distribution peuvent être mises en œuvre, entre autres, l'optimisation de la chloration du réseau de distribution, le remplacement par des chloramines, la réduction du temps de séjour de l'eau et le rinçage du système. Des modèles de réseaux de distribution bien élaborés, bien étalonnés et bien entretenus peuvent constituer une autre option pour évaluer le temps de séjour de l'eau et simuler la dégradation du chlore et la formation de THM. L'aération peut permettre de réduire les THM déjà formés. Là encore, les stratégies de contrôle ne doivent pas compromettre l'efficacité de la désinfection.
Application de la recommandation
Remarque : Des conseils spécifiques concernant l'application des recommandations pour l'eau potable devraient être obtenus auprès de l'autorité appropriée en matière d'eau potable.
Les responsables de systèmes d'approvisionnement en eau potable devraient mettre en œuvre un plan complet et à jour de gestion des risques en matière de salubrité de l'eau. Il convient d'adopter une approche « de la source au robinet » qui assure le maintien de la salubrité de l'eau. Cette approche exige une évaluation du réseau pour caractériser la source d'approvisionnement en eau, décrire les procédés de traitement qui empêchent ou réduisent la contamination, déterminer les conditions pouvant entraîner une contamination et mettre en œuvre des mesures de contrôle. Une surveillance opérationnelle est ensuite établie, et des protocoles de fonctionnement et de gestion sont instaurés (par exemple procédures opérationnelles normalisées, mesures correctives et interventions en cas d'incident). La surveillance de la conformité est déterminée, et d'autres protocoles de vérification du plan de gestion de la salubrité de l'eau sont adoptés (par exemple tenue de registres, satisfaction de la clientèle). La formation des opérateurs est également nécessaire pour assurer l'efficacité du plan de salubrité de l'eau en tout temps.
La recommandation proposée est fondée sur une moyenne mobile annuelle par site d'échantillonnage faisant l'objet d'un prélèvement une fois par trimestre aux points du réseau de distribution susceptibles de présenter les plus fortes concentrations de THM (par exemple emplacement où l'eau séjourne longtemps, culs-de-sac). Par « moyenne mobile annuelle par site », on entend la concentration moyenne des échantillons prélevés à un emplacement et à une fréquence précisée pendant les 12 derniers mois. Les concentrations de THM peuvent varier au fil du temps, y compris selon les saisons, en fonction de facteurs tels que les concentrations de matières organiques et composés inorganiques, la température et le pH. Lorsque la moyenne mobile annuelle par site d'échantillonnage faisant l'objet d'un prélèvement une fois par trimestre dépasse la CMA proposée, il est recommandé de procéder à une enquête, suivie de mesures correctives appropriées. Si la concentration de THM dans un échantillon dépasse 100 μg/L, cela signifie qu'il faut évaluer la cause et déterminer les prochaines étapes à suivre. La priorité devrait toujours être d'assurer une désinfection adéquate. Toute mesure visant à réduire les THM ne doit pas entraîner de problèmes microbiens.
La principale approche pour réduire l'exposition aux THM consiste à réduire au minimum leur formation. Lorsque des stratégies appropriées de traitement de l'eau potable sont mises en œuvre pour réduire les THM, il est également possible de réduire les concentrations d'autres sous-produits de désinfection. Cela peut se faire par l'adoption de pratiques comme l'enlèvement des précurseurs, la mise en place de stratégies de désinfection de rechange ou optimisées et une bonne gestion des réseaux de distribution. Les changements mis en œuvre pour enlever les THM devraient être envisagés de manière globale afin de s'assurer qu'ils ne compromettent pas la désinfection, qu'ils n'augmentent pas la concentration d'autres sous-produits de désinfection (par exemple les acides haloacétiques), qu'ils n'entraînent pas d'autres problèmes de conformité ou qu'ils n'augmentent pas par inadvertance les concentrations ou le relargage d'autres contaminants, comme le plomb, dans l'eau distribuée.
Table des matières
- 1.0 Considérations relatives à l'exposition
- 2.0 Considérations relatives à la santé
- 3.0 Calcul de la valeur basée sur la santé
- 4.0 Considérations relatives à l'analyse et au traitement
- 5.0 Stratégies de gestion
- 6.0 Considérations internationales
- 7.0 Justification
- 8.0 Références
- Annexe A : Liste des abréviations
- Annexe B : Données sur la qualité de l'eau au Canada
- Annexe C : Évaluation des mélanges
- Annexe D : Paramètres de surveillance proposés
- Annexe E : Précurseurs inorganiques susceptibles d'influer sur la formation de THM
- Annexe F : Enlèvement de la MON et des précurseurs
1.0 Considérations relatives à l'exposition
1.1 Identité de la substance
Les trihalométhanes (THM) sont un groupe de produits chimiques qui se forment au cours des procédés de désinfection de l'eau. Les THM sont des composés constitués d'un seul atome de carbone lié à des halogènes, de formule générale CHX3, où X représente un halogène, qui peut être le chlore, le brome, le fluor ou l'iode, ou une combinaison de ces éléments. Au cours du traitement de l'eau potable, la vitesse et l'ampleur de la formation de THM dépendent de la concentration des précurseurs organiques d'origine naturelle, de la dose de chlore, du temps de contact, du pH et de la température (Stevens et coll., 1976; Amy et coll., 1987). En présence de bromure, ce sont des THM bromés qui se forment essentiellement, et en présence d'iodure, des THM iodés peuvent se former.
Les THM que l'on retrouve le plus couramment dans l'eau potable sont 1) le chloroforme; 2) le bromodichlorométhane (BDCM), aussi appelé dichlorobromométhane; 3) le dibromochlorométhane (DBCM), aussi appelé chlorodibromométhane; et 4) le bromoforme. Les renseignements relatifs à ces quatre composés ont été pris en compte dans l'élaboration des recommandations pour la qualité de l'eau potable visant les THM. Ils sont liquides à température ambiante et relativement à extrêmement volatils. Le chloroforme est très soluble dans l'eau, tandis que les trois autres THM sont modérément solubles dans l'eau (ATSDR, 1997; ATSDR, 2005; ATSDR, 2020). Compte tenu de leurs propriétés physiques, les THM devraient être très mobiles dans le sol et se diffuser davantage dans l'air et l'eau que dans le sol.
Les THM iodés sont des contaminants d'intérêt émergent. Les THM iodés les plus courants sont le bromochloroiodométhane (BCIM), le bromodiiodométhane (BDIM), le chlorodiiodométhane (CDIM), le dibromoiodométhane (DBIM), le dichloroiodométhane (DCIM) et le triiodométhane (TIM). Seulement les informations pertinentes se rapportant à ces composés sont considérées dans l'élaboration de recommandations pour la qualité de l'eau potable visant les THM iodés. Ces THM iodés sont moins solubles dans l'eau et généralement moins volatils que les quatre THM susmentionnés. La présence de THM iodés dans l'eau potable est associée à des odeurs et à des goûts « médicinaux ». Les seuils olfactifs obtenus expérimentalement auprès de sujets humains se situent entre 0,003 µg/L et 5,8 µg/L pour les divers THM iodés, les composés les plus fortement iodés présentant les seuils les plus bas (Cancho et coll., 2001). Les propriétés physicochimiques générales des THM et des THM iodés sont présentées au tableau 1.
| Composé | No CAS | Poids moléculaire (g/mol) | Solubilité dans l'eau (mg/L à 25 °C, sauf indication contraire) | Pression de vapeur (mm Hg à 25 °C, sauf indication contraire) | Log Koe (octanol-eau) | Constante de la loi de Henry (atm-m3/mol à 25 °C) |
|---|---|---|---|---|---|---|
| Chloroforme (CHCl3) |
67-66-3 | 119,37 | 7 220 to 9 300 | 160 at 20 °C | 1,97 | 4,06 x 10-3 |
| BDCM (CHBrCl2) |
75-27-4 | 163,8 | 4 500 | 50 at 20 °C | 2,1 | 2,12 x 10-3 |
| DBCM (CHClBr2) |
124-48-1 | 208,3 | 2 700 at 20 °C | 76 | 2,16 | 9,9 x 10-4 |
| Bromoforme (CHBr3) |
75-25-2 | 252,7 | 3 100 | 5 at 20 °C | 2,4 | 5,6 x 10-4 |
| BCIM (CHBrClI) |
34970-00-8 | 255,28 | 346 | 1,25 | 2,11 | 2,3 x 10-4 |
| BDIM (CHBrI2) |
557-95-9 | 346,73 | 38 | 0,15 | 2,62 | 4,73 x 10-5 |
| CDIM (CHClI2) |
638-73-3 | 302,28 | 82 | 0,29 | 2,53 | 1,45 x 10-4 |
| DBIM (CHBr2I) |
593-94-2 | 299,73 | 162 | 0,58 | 2,20 | 7,30 x 10-5 |
| DCIM (CHCl2I) |
594-04-7 | 210,83 | 717 | 9,14 | 2,03 | 6,82 x 10-4 |
| TIM (CHI3) |
75-47-8 | 393,73 | 100 | 0,02 | 3,03 | 3,06 x 10-5 |
| BCIM = bromochloroiodométhane, BDCM = bromodichlorométhane, BDIM = bromodiiodométhane, CDIM = chlorodiiodométhane, DBCM = dibromochlorométhane, DBIM = dibromoiodométhane, DCIM = dichloroiodométhane, Koe = coefficient de partage (octanol/eau), TIM = triiodométhane Sources des données : chloroforme : ATSDR (1997); BDCM : ATSDR (2020); DBCM et bromoforme : ATSDR (2005); THM iodés : Postigo et coll. (2017) |
||||||
1.2 Sources et utilisations
Les THM sont un groupe de sous-produits de désinfection (SPD) qui se forment principalement par réaction entre le chlore utilisé pour désinfecter l'eau potable et la matière organique naturellement présente dans les approvisionnements en eau brute. De même, les THM sont formés comme sous-produits dans les effluents chlorés des installations industrielles et des stations municipales d'épuration des eaux usées, ainsi que dans les eaux de refroidissement des installations industrielles et des centrales électriques. Les THM fabriqués sont utilisés comme solvants ou produits chimiques intermédiaires dans la production de produits chimiques organiques, de réfrigérants, de pesticides, d'agents propulsifs, de produits chimiques ignifuges et de liquides de jauge (Keith et Walters, 1985; Environnement Canada et Santé Canada, 2001). Une faible proportion des THM est aussi formée à l'état naturel par les algues marines et par des processus naturels de dégradation et de transformation (Class et coll., 1986; Ohsawa et coll., 2001; Colomb et coll., 2008).
1.3 Exposition
L'ingestion de THM présents dans l'eau potable, ainsi que l'inhalation et l'absorption par voie cutanée de THM lors d'activités liées à l'eau (par exemple le bain, la douche) constituent les principales sources d'exposition de la population canadienne aux THM (y compris les THM iodés). La contribution de l'air extérieur, des aliments et d'autres sources à l'exposition aux THM est considérablement moindre (Environnement Canada et Santé Canada, 2001).
1.3.1 Eau
Les données de surveillance de l'eau des réseaux de distribution ont été obtenues auprès des provinces et des territoires (PT) (tableau 2, figure 1) et de l'étude nationale sur l'eau potable (ENEP) (tableau 3). Les concentrations de chloroforme, de BDCM, de DBCM et de bromoforme ont été analysées. Le chloroforme était le THM prédominant présent. On ignore si les données sur l'exposition ont été recueillies à des fins de conformité ou à des fins opérationnelles. Toutefois, la plupart des échantillons proviendraient d'emplacements où les concentrations de THM seraient les plus élevées. En outre, d'autres facteurs influant sur les concentrations de THM n'ont pu être pris en compte dans cette analyse (par exemple la saison, la stratégie de désinfection, les conditions du réseau de distribution). Les données sur l'exposition fournies par les PT reflètent les différentes limites de détection (LD) des laboratoires accrédités utilisés au sein des secteurs de compétence et entre elles, ainsi que les différences dans leurs programmes de surveillance respectifs. Par conséquent, l'analyse statistique des données sur l'exposition ne fournit qu'un tableau partiel de la situation. Dans l'ensemble, l'analyse des données obtenues auprès des PT affiche une certaine variabilité.
| Jurisdiction (DL μg/L) [Dates] |
Paramètre | Chloroforme (μg/L) |
BDCM (μg/L) |
DBCM (μg/L) |
Bromoforme (μg/L) |
THM totauxNote de bas de tableau 2 - a (μg/L) |
|---|---|---|---|---|---|---|
| Colombie-BritanniqueNote de bas de tableau 2 - 1 (1) [2015 à 2019] |
Nb de détections/N | 5/5 | 5/5 | ND | 3/5 | 5/5 |
| % de détection | 100,0 | 100,0 | ND | 60,0 | 100,0 | |
| Médiane | 47,0 | 2,0 | ND | 1,0 | 47,0 | |
| MoyenneNote de bas de tableau 2 - b | 52,9 | 3,0 | ND | 0,8 | 55,5 | |
| 90e centile | NC | NC | ND | NC | NC | |
| DGSPNI Région de l'AtlantiqueNote de bas de tableau 2 - 2 (0.5 à 9) [2014 à 2018] |
Nb de détections/N | 618/850 | 630/850 | 419/850 | 294/850 | 726/850 |
| % de détection | 72,7 | 74,1 | 49,2 | 34,6 | 85,4 | |
| Médiane | 2 | 2 | < LD | < LD | 9 | |
| MoyenneNote de bas de tableau 2 - b | 16 | 2 | 2 | 4 | 24 | |
| 90e centile | 56 | 6 | 5 | 6 | 68 | |
| DGSPNI Région de l'OntarioNote de bas de tableau 2 - 2 (0,26 à 11) [2014 à 2018] |
Nb de détections/N | 2 146/2 443 | 2 080/2 443 | 1 016/2 443 | 250/2 443 | 2 168/2 443 |
| % de détection | 87,8 | 85,1 | 41,6 | 10,2 | 88,7 | |
| Médiane | 34 | 3 | < LD | < LD | 45 | |
| MoyenneNote de bas de tableau 2 - b | 61 | 5 | 2 | 3 | 70 | |
| 90e centile | 163 | 11 | 5 | 0,2 | 180 | |
| DGSPNI Région du ManitobaNote de bas de tableau 2 - 2 (0,5 à 5,1) [2014 à 2018] |
Nb de détections/N | 90/102 | 84/102 | 43/102 | 19/102 | 154/182 |
| % de détection | 88,2 | 82,4 | 42,2 | 18,6 | 84,6 | |
| Médiane | 63 | 4 | < LD | < LD | 69 | |
| MoyenneNote de bas de tableau 2 - b | 76 | 8 | 3 | 1 | 102 | |
| 90e centile | 169 | 27 | 10 | 1 | 271 | |
| Île-du-Prince-ÉdouardNote de bas de tableau 2 - 9 (1) [2015 à 2018] |
Nb de détections/N | 1/4 | 2/4 | 4/4 | 4/4 | 4/4 |
| % de détection | 25,0 | 50,0 | 100,0 | 100,0 | 100,0 | |
| Médiane | NC | 1,3 | 2,8 | 3,0 | 6,7 | |
| MoyenneNote de bas de tableau 2 - b | 0,6 | 1,3 | 2,9 | 3,0 | 7,1 | |
| 90e centile | NC | NC | NC | NC | NC | |
| ManitobaNote de bas de tableau 2 - 4 (0,5 à 10) [2014 à 2019] |
Nb de détections/N | 1 276/1 294 | 1 254/1 294 | 900/1 294 | 344/1 294 | 1 276/1 294 |
| % de détection | 98,6 | 96,9 | 69,6 | 26,6 | 98,6 | |
| Médiane | 60,4 | 8,2 | 1,8 | < LD | 80,8 | |
| MoyenneNote de bas de tableau 2 - b | 85,0 | 13,5 | 5,2 | 0,9 | 104,3 | |
| 90e centile | 179 | 33,3 | 15,0 | 1,5 | 212,0 | |
| Nouveau-BrunswickNote de bas de tableau 2 - 3 (0,26 à 4,5) [2013 à 2019] |
Nb de détections/N | 2 679/3 322 | 2 676/3 332 | 966/3 332 | 421/3 332 | 2 818/3 322 |
| % de détection | 80,6 | 80,3 | 29,0 | 12,6 | 84,8 | |
| Médiane | 15,0 | 2,0 | < LD | < LD | 18,1 | |
| MoyenneNote de bas de tableau 2 - b | 32,6 | 3,0 | 0,8 | 0,6 | 36,3 | |
| 90e centile | 88,0 | 6,0 | 1,8 | 0,7 | 93,9 | |
| Nouvelle-ÉcosseNote de bas de tableau 2 - 6 (0,3 à 2) [2013 à 2019] |
Nb de détections/N | 203/218 | 328/355 | 87/210 | 10/200 | 702/773 |
| % de détection | 93,1 | 92,4 | 41,4 | 5,0 | 91,9 | |
| Médiane | 44,0 | 5,0 | < LD | < LD | 42,0 | |
| MoyenneNote de bas de tableau 2 - b | 53,2 | 5,6 | 1,3 | 0,6 | 45,6 | |
| 90e centile | 98,0 | 11,0 | 3,0 | < LD | 88,5 | |
| NunavutNote de bas de tableau 2 - 7 (0,5 à 1,0) [2015 à 2018] |
Nb de détections/N | 11/11 | 11/11 | 11/11 | 10/11 | 11/11 |
| % de détection | 100,0 | 100,0 | 100,0 | 90,9 | 100,0 | |
| Médiane | 23,3 | 17,3 | 14,5 | 2,1 | 58,4 | |
| MoyenneNote de bas de tableau 2 - b | 30,0 | 18,8 | 15,5 | 2,0 | 61,6 | |
| 90e centile | 58,3 | 29,1 | 27,0 | 4,0 | 106,7 | |
| OntarioNote de bas de tableau 2 - 8 (0,1 à 0,5) [2013 à 2019] |
Nb de détections/N | 1 621/1 623 | 1 619/1 623 | 1 276/1 623 | 220/1 623 | 32 571/32 573 |
| % de détection | 99,9 | 99,8 | 78,5 | 13,6 | 99,99 | |
| Médiane | 24,2 | 4,6 | 1,6 | < LD | 23,0 | |
| MoyenneNote de bas de tableau 2 - bb | 32,5 | 5,7 | 2,2 | 0,4 | 31,8 | |
| 90e centile | 73,2 | 11,2 | 5,0 | 0,5 | 70,4 | |
| QuébecNote de bas de tableau 2 - 9 (0,01 à 10) [2014 à 2018] |
Nb de détections/N | 17 309/18 040 | 16 915/18 029 | 11 360/18 027 | 3 773/18 028 | 17 242/18 026 |
| % de détection | 95,9 | 93,8 | 63,0 | 20,9 | 95,7 | |
| Médiane | 17,8 | 2,8 | 0,5 | < LD | 26,0 | |
| MoyenneNote de bas de tableau 2 - b | 27,6 | 4,2 | 1,9 | 0,9 | 34,4 | |
| 90e centile | 64,6 | 9,6 | 4,4 | 0,7 | 72,8 | |
| SaskatchewanNote de bas de tableau 2 - 10 (0,017 à 5,3) [2015 à 2019] |
Nb de détections/N | 5 211/5 371 | 5 228/5 374 | 3 936/5 374 | 1 450/5 374 | 5 243/5 314 |
| % de détection | 97,0 | 97,3 | 73,2 | 27,0 | 98,7 | |
| Médiane | 44,0 | 11,8 | 3,3 | < LD | 75,1 | |
| MoyenneNote de bas de tableau 2 - b | 55,0 | 18,0 | 7,8 | 2,6 | 82,9 | |
| 90e centile | 103,0 | 38,3 | 18,0 | 2,5 | 137,2 | |
| Terre-Neuve-et-LabradorNote de bas de tableau 2 - 11 (0,3 à 0,8) [2004 à 2018] |
Nb de détections/N | 14 851/15 930 | 13 445/15 930 | 3 845/15 930 | 758/15 930 | 14 719/15 930 |
| % de détection | 93,2 | 84,4 | 24,1 | 4,8 | 92,4 | |
| Médiane | 72,0 | 3,0 | < LD | < LD | 77,0 | |
| MoyenneNote de bas de tableau 2 - b | 95,6 | 4,8 | 0,89 | 0,67 | 101,6 | |
| 90e centile | 210 | 11,0 | 1,3 | < LD | 220,0 | |
| Territoire du YukonNote de bas de tableau 2 - 12 (0,1 à 30) [2014 à 2016] |
Nb de détections/N | 254/258 | 150/266 | 8/243 | 4/269 | 242/255 |
| % de détection | 98,4 | 56,4 | 3,3 | 1,5 | 94,9 | |
| Médiane | 8,0 | 1,0 | < LD | < LD | 9,3 | |
| MoyenneNote de bas de tableau 2 - b | 9,8 | 1,5 | 0,5 | 2,3 | 10,9 | |
| 90e centile | 19,6 | 2,4 | < LD | < LD | 22,0 | |
|
BDCM = bromodichlorométhane, DBCM = dibromochlorométhane, LD = limite de détection, < LD = valeur inférieure à la limite de détection (si le pourcentage de détection est inférieur à 10 %, le 90e centile est inférieur à la LD; si le pourcentage de détection est inférieur à 50 %, la médiane est inférieure à la LD), DGSPNI = Direction générale de la santé des Premières Nations et des Inuits, N = taille de l'échantillon, NC = non calculé en raison de la taille insuffisante de l'échantillon, ND = non déclaré, THM = trihalométhanes |
||||||
Figure 1. Concentration de THM totaux dans les réseaux de distribution au Canada
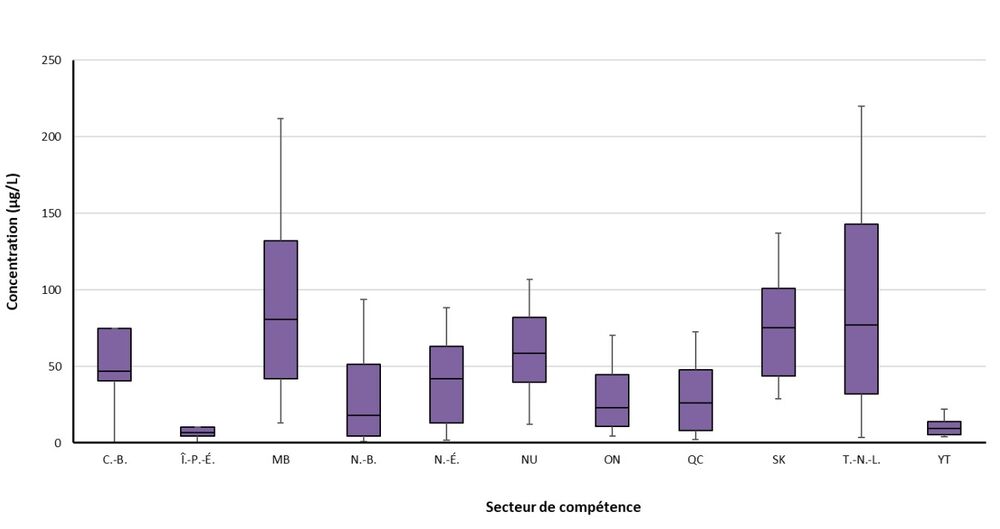
Figure 1 - Équivalent textuel
La figure décrit un tableau montrant les 10e, 25e, 75e, 90e centiles et les valeurs médianes des concentrations totales de trihalométhanes pour chaque province et territoire.
C.-B. = Colombie-Britannique, Î.-P.-É. = Île-du-Prince-Édouard, MB = Manitoba, N.-B. = Nouveau-Brunswick, N.-É. = Nouvelle-Écosse, NU = Nunavut, ON = Ontario, QC = Québec, SK = Saskatchewan, T.-N.-L = Terre-Neuve-et-Labrador, YT = Yukon
Les moustaches négatives et positives correspondent aux concentrations du 10e centile et du 90e centile, respectivement. La boîte correspond aux concentrations du 25e centile et du 75e centile, tandis que la concentration médiane est représentée par une ligne noire au centre.
| Source d'eau | Paramètre | Chloroforme | BDCM (μg/L)Note de bas de tableau 3 - b |
DBCM (μg/L)Note de bas de tableau 3 - c |
Bromoforme (μg/L)Note de bas de tableau 3 - cc |
THM totauxNote de bas de tableau 3 - d (μg/L) |
|---|---|---|---|---|---|---|
| Eau de lac | Nb de détections/N | 112/112 | 111/112 | 99/112 | 22/112 | 112/112 |
| % de détection | 100,0 | 99,1 | 88,4 | 19,6 | 100,0 | |
| Médiane | 21,8 | 4,0 | 0,4 | < LD | 28,7 | |
| MoyenneNote de bas de tableau 3 - e | 26,6 | 5,9 | 2,0 | 0,2 | 34,6 | |
| 90e centile | 52,2 | 12,3 | 9,2 | 1,0 | 66,2 | |
| Eau de rivière | Nb de détections/N | 149/155 | 149/155 | 125/155 | 48/155 | 149/155 |
| % de détection | 96,1 | 96,1 | 80,6 | 31,0 | 96,1 | |
| Médiane | 18,4 | 3,5 | 0,5 | < LD | 25,3 | |
| MoyenneNote de bas de tableau 3 - e | 25,2 | 5,7 | 1,4 | 0,1 | 32,4 | |
| 90e centile | 51,5 | 14,0 | 5,0 | 5,0 | 63,8 | |
| Eau de puits | Nb de détections/N | 98/108 | 98/108 | 91/108 | 72/108 | 100/108 |
| % de détection | 90,7 | 90,7 | 84,3 | 66,7 | 92,6 | |
| Médiane | 2,1 | 1,3 | 0,7 | 0,2 | 5,8 | |
| MoyenneNote de bas de tableau 3 - e | 4,1 | 2,6 | 2,0 | 0,9 | 9,5 | |
| 90e centile | 10,9 | 4,5 | 3,8 | 2,0 | 19,3 | |
|
BDCM = bromodichlorométhane, DBCM = dibromochlorométhane, < LD = valeur inférieure à la limite de détection (si le pourcentage de détection est inférieur à 10 %, le 90e centile est inférieur à la LD; si le pourcentage de détection est inférieur à 50 %, la médiane est inférieure à la LD), N = taille de l'échantillon, THM = trihalométhanes |
||||||
Une étude a permis d'évaluer les concentrations de THM au robinet dans trois communautés des Premières Nations établies dans des réserves (Amarawansha et coll., 2023). Ces communautés utilisent les eaux de surface comme sources d'eau traitée par un procédé conventionnel et par désinfection au chlore. Les plages de concentration de THM se situaient entre 96 et 207 μg/L pour la communauté A, entre 45 et 160 μg/L pour la communauté B et entre 57 et 122 μg/L pour la communauté C. Le chloroforme est le composé ayant contribué le plus à la concentration de THM totaux, tandis que les THM bromés (BDCM, DBCM et bromoforme) représentaient moins de 5 %. Aucune différence significative n'a été constatée entre les échantillons d'eau acheminée par canalisation jusqu'aux habitations et ceux prélevés sur l'eau transportée par camion et entreposés dans des citernes.
Pour comparer la formation de THM dans les réseaux de distribution provenant d'eaux de surface et d'eaux souterraines, des données provenant de différentes sources ont été analysées. Ces jeux de données comprennent deux études nationales et l'ENEP (annexe B : tableau B1) et des données provenant de Terre-Neuve-et-Labrador et de l'Ontario (annexe B : tableau B2). Les constatations générales sont les suivantes :
- la teneur en chloroforme est plus élevée dans les eaux de surface;
- les concentrations de BDCM sont similaires dans les eaux souterraines et dans les eaux de surface;
- les concentrations de DBCM et de bromoforme sont légèrement plus élevées dans les eaux souterraines;
- dans l'ensemble, les eaux de surface ont entraîné la formation de niveaux plus élevés de THM totaux.
Au moyen du jeu de données de l'ENEP, les données ont été appariées pour l'eau traitée et le point le plus éloigné de l'installation de traitement de l'eau potable (échantillons prélevés le même jour). Ces données ont ensuite été réparties dans les catégories « été » et « hiver » (annexe B : tableau B3). Les constatations sont les suivantes :
- les concentrations de chloroforme et de BDCM dans l'eau traitée et dans l'eau distribuée étaient plus élevées en été qu'en hiver;
- dans le cas du DBCM et du bromoforme, les variations saisonnières ou entre l'eau traitée et l'eau distribuée étaient minimes;
- les concentrations de THM totaux étaient significativement plus élevées dans l'eau distribuée que dans l'eau traitée, peu importe la saison, à l'exception du bromoforme en hiver.
Un appariement similaire a été effectué pour les données du Québec pour comparer le centre à une extrémité du réseau de distribution (annexe B : tableau B4) et pour les données de l'Ontario pour comparer l'eau traitée et l'eau distribuée (annexe B : tableau B5). Pour les deux jeux de données, on a observé une augmentation significative de chaque espèce de THM en fonction de la distance parcourue dans le réseau de distribution, à l'exception du bromoforme.
Chowdhury et coll. (2011) présentent des données sur l'exposition aux THM dans les provinces canadiennes, données qui s'étendent généralement sur une période de 4 à 5 ans au début des années 2000. Dans chaque province, des échantillons trimestriels ont été prélevés sur un nombre non déterminé jusqu'à un maximum de 467 stations de traitement de l'eau potable. Le nombre exact d'échantillons analysés n'a pas été communiqué. De manière générale, ce jeu de données montre des résultats semblables aux données des PT présentées à la figure 1.
Dans le cadre d'une autre étude, on a évalué les impacts saisonniers pour trois installation de traitement de l'eau potable en Ontario de 2000 à 2004. En général, les concentrations de THM étaient plus faibles entre décembre et avril et plus élevées entre juin et novembre (Chowdhury, 2013a).
Des systèmes d'approvisionnement en eau de Terre-Neuve-et-Labrador ont fait l'objet d'études en vue d'évaluer les incidences de la source d'eau et la taille de la station de traitement sur la population desservie. Cette étude s'est déroulée sur une période de 18 ans (de 1999 à 2016) (Chowdhury, 2018). Pour tous les systèmes, quelle que soit leur taille, ceux approvisionnés par des eaux de surface affichaient des concentrations moyennes de THM plus élevées que ceux approvisionnés par des eaux souterraines (annexe B : tableau B6).
Sur une période de trois ans, les concentrations de THM ont été mesurées dans 13 systèmes (avec divers procédés) de six pays européens. Il a été constaté que les concentrations de THM étaient plus élevées en été et en automne, avec des variations année après année (Krasner et coll., 2016a). Les systèmes approvisionnés par des eaux de surface ou des eaux mélangées affichaient des concentrations de THM plus élevées que ceux approvisionnés par des eaux souterraines.
Dans le cadre de l'Enquête canadienne sur les mesures de la santé (ECMS), des échantillons d'eau du robinet ont été analysés pour les THM au cours des cycles 3 et 4 (2012 à 2015) (Statistique Canada, 2015, 2017). Chaque cycle s'est déroulé sur des périodes de deux ans dans 16 sites d'échantillonnage au Canada. L'étude a été conçue de manière à représenter statistiquement environ 96 % de la population canadienne (Statistique Canada, 2015, 2017). La concentration moyenne de THM totaux rapportée était de 27,0 μg/L (N = 5 005). Cette moyenne est inférieure à celle de nombreuses concentrations calculées à partir de l'analyse des PT présentée dans le tableau 2. L'objectif de l'ECMS, qui consistait à déterminer les concentrations typiques de THM dans l'eau potable, sans tenir compte de la configuration du réseau de distribution, explique sans doute cette différence. Les données des PT présentées ci-dessus sont très probablement liées à l'exploitation ou à la conformité, les échantillons ayant été prélevés aux points du réseau de distribution où le temps de séjour de l'eau est long et qui présentent potentiellement les plus fortes concentrations de THM. En outre, l'ECMS a analysé des échantillons provenant de 32 systèmes d'approvisionnement en eau potable seulement (16 sites par cycle). Même si ces sites représentent statistiquement 96 % de la population, le nombre de systèmes de traitement de l'eau potable est très faible par rapport au nombre total de systèmes dans l'ensemble du pays, qui se chiffre en milliers. L'ECMS n'apporte pas de précisions sur le système de traitement de l'eau potable, comme les sources d'approvisionnement en eau, les techniques de traitement et le fonctionnement du réseau de distribution. Enfin, aucun des sites n'était situé au Manitoba, à Terre-Neuve-et-Labrador (deux des provinces affichant les plus fortes concentrations moyennes de THM totaux, voir le tableau 2), à l'Île-du-Prince-Édouard ou dans l'un des territoires.
Une étude américaine portant sur les concentrations de THM et de bromure a montré que, dans l'ensemble, les concentrations de THM n'avaient pas changé de manière significative depuis 1997. Toutefois, les concentrations extrêmement élevées, représentées par les 95e centiles, ont diminué au fil du temps (Westerhoff et coll., 2022). Dans certains systèmes de traitement de l'eau, des changements saisonniers ont été observés. En général, ces changements étaient plus fréquents dans les sources d'approvisionnement en eau provenant des rivières que des lacs. Les concentrations de bromure se sont avérées plus élevées pendant les périodes de faible débit fluvial. La quantité de bromure incorporée dans les sous-produits de désinfection pour former des sous-produits de désinfection bromés était variable, sans tendance temporelle statistique. Les sources d'eau souterraine ont tendance à avoir davantage de THM bromés.
Il existe peu de données sur les concentrations de THM iodés dans les eaux canadiennes. Dans l'étude nationale sur les sous-produits de désinfection et certains contaminants émergents, les concentrations de six THM iodés ont été mesurées dans la source d'approvisionnement en eau, dans l'eau traitée et dans l'eau distribuée de 65 installations de traitement de l'eau potable dans l'ensemble du Canada (Santé Canada, 2017; Tugulea et coll., 2018). Les concentrations de ces THM iodés dans l'eau distribuée sont présentées à l'annexe B : tableau B7; et pour les systèmes d'eau chlorée et chloraminée au tableau B8. Des THM iodés ont été détectés dans l'eau distribuée de 48 % des installations de traitement de l'eau potable en hiver et de 71 % de ces installations en été. Les concentrations totales (somme de tous les congénères des THM iodés mesurés dans un échantillon) dans les échantillons traités se situaient entre 0,02 μg/L et 21,66 μg/L. La plus forte concentration de THM iodés totaux a été mesurée dans une station de traitement de l'eau potable où la totalité des six THM iodés ont été détectés, l'iodoforme étant présent à la concentration la plus élevée. Les concentrations maximales des THM iodés décelés dans l'eau traitée étaient de 2,27 μg/L pour le DCIM, de 2,91 μg/L pour le DBIM, de 2,06 μg/L pour le BCIM, de 4,31 μg/L pour le CDIM, de 2,71 μg/L pour le BDIM et 8,3 μg/L pour le TIM. C'est dans les sources d'eau ayant des concentrations d'ammonium présent à l'état naturel, des concentrations élevées de bromure ou encore des concentrations élevées d'iodure ou d'iode total que la formation de THM iodés a été la plus importante.
Les concentrations de deux THM iodés ont été mesurées dans des eaux potables chloraminées et chlorées de 23 villes du Canada et des États-Unis (Richardson et coll., 2008). Le BCIM et le DCIM étaient présents dans la plupart des installations de traitement, à des concentrations maximales de 10,2 μg/L et de 7,9 μg/L, respectivement. Les données sur les THM provenant du Québec montrent que le DCIM affichait la concentration la plus élevée (tableau B9) (Ministère du Développement durable, de l'Environnement et de la Lutte contre les changements climatiques du Québec, 2019).
Les publications scientifiques contenaient d'autres données de surveillance de l'eau pour les emplacements à l'étranger. Une étude sur la surveillance de six THM iodés menée dans 12 stations de traitement de l'eau potable aux États-Unis a révélé des concentrations allant de 0,2 μg/L à 15 μg/L, le DCIM étant le plus fréquemment décelé (Krasner et coll., 2006). Dans le cadre d'une étude sur l'analyse des traces de SPD émergents, les concentrations de BCIM allaient de valeurs inférieures à la limite de détection à 0,120 μg/L dans quatre stations de traitement de l'eau potable aux États-Unis (Cuthbertson et coll., 2020).
Selon une étude portant sur 70 stations de traitement de l'eau potable dans 31 villes de Chine, les concentrations de DCIM et de BCIM allaient de valeurs inférieures à la limite de détection à 3,67 μg/L pour le DCIM et de valeurs inférieures à la limite de détection à 1,91 μg/L pour le BCIM. Aucun des échantillons analysés ne contenait du DBIM ou du TIM (Ding et coll., 2013). En Espagne, on a recherché la présence de six THM iodés dans un réseau d'approvisionnement en eau potable. Les concentrations oscillaient entre 0,18 et 0,31 μg/L, le DCIM ayant été détecté aux plus fortes concentrations (Postigo et coll., 2018). Dans une étude sur l'eau du robinet des ménages réalisée dans deux villes de Chypre (n = 37), le DCIM s'est avéré l'espèce dominante des deux THM iodés mesurés, à des concentrations comprises entre 0,032 μg/L et 1,65 μg/L. Du BCIM a également été détecté dans une plage allant de concentrations inférieures à la limite de détection jusqu'à 0,45 μg/L (Ioannou et coll., 2016).
1.3.2 Voies multiples d'exposition par l'eau potable
En raison de leurs propriétés physicochimiques, les THM sont très volatils et peuvent traverser la peau. Par conséquent, l'inhalation et l'absorption cutanée de THM pendant le bain ou la douche sont des voies d'exposition importantes (Jo et coll., 1990a,b, 2005; Weisel et Jo, 1996; Backer et coll., 2000; Xu et coll., 2002; Xu et Weisel, 2005). Diverses évaluations de l'exposition ont permis d'estimer la contribution relative des voies d'exposition telles l'ingestion, l'inhalation et la voie cutanée à l'apport quotidien total de THM. Les résultats de ces évaluations sont mitigés; plusieurs études semblent indiquer que l'inhalation de THM peut entraîner une exposition égale ou supérieure aux expositions dues à l'ingestion d'eau potable (Krishnan, 2003; Kim et coll., 2004; Jo et coll., 2005; Basu et coll., 2011; Pardakhti et coll., 2011; Zhang et coll., 2018a; Genisoglu et coll., 2019). Selon une autre étude, les expositions par inhalation et par voie cutanée sont comparables, mais moindres que l'exposition par ingestion (Chowdhury, 2013b), tandis qu'une autre étude donne à penser que les expositions par inhalation et par voie cutanée sont supérieures à celle par ingestion (Yanagibashi et coll., 2010). Par ailleurs, certaines études semblent indiquer que l'absorption cutanée peut contribuer davantage à la dose interne que l'inhalation et l'ingestion, en particulier dans le cas du BDCM (Krishnan, 2003; Leavens et coll., 2007; Kenyon et coll., 2016). Les facteurs susceptibles d'influer sur les taux d'absorption par les diverses voies sont notamment la température de l'eau, la durée de l'exposition et les taux de renouvellement de l'air.
Des études ont servi à calculer des facteurs de modification, exprimés en litres équivalents par jour (Leq/jour), pour mesurer la quantité de THM à laquelle les personnes sont exposées par les différentes voies (c'est-à-dire par voie cutanée et par inhalation), en particulier pendant la douche et le bain. Krishnan (2003) a déterminé les valeurs de Leq/jour dans le cas d'expositions d'adultes et d'enfants (6, 10 et 14 ans) pendant une douche de 10 minutes et un bain de 30 minutes avec de l'eau du robinet. Ces valeurs ont été calculées à l'aide de données produites par un modèle pharmacocinétique à base physiologique (PBPK) portant sur la fraction absorbée (Corley et coll., 1990, 2000; Price et coll., 2003; Haddad et coll., 2006). Les calculs ont tenu compte des différences entre substances chimiques en ce qui concerne le facteur eau-à-air (selon les différences existant entre les constantes de la loi de Henry), la fraction de la dose absorbée pendant les expositions par inhalation et par voie cutanée, ainsi que le coefficient de perméabilité de la peau. Dans le cas des expositions par inhalation et voie cutanée, la fraction absorbée tenait compte de la dose absorbée à la suite de l'exposition, ainsi que de la portion exhalée au cours des 24 heures suivantes. On a supposé que pour toutes les sous-populations, l'absorption des THM ingérés était complète (100 %). Les renseignements disponibles sur l'extraction des THM dans le foie confirment cette hypothèse (DaSilva et coll., 1999; Corley et coll., 2000).
Les valeurs de Leq/jour ont été plus élevées dans le sous-groupe des adultes pour les scénarios d'exposition par le bain et la douche. En outre, les valeurs de Leq/jour dans le cas des expositions par inhalation et par voie cutanée ont été plus élevées dans le scénario du bain de 30 minutes que dans celui de la douche de 10 minutes pour toutes les sous-populations, compte tenu de la durée plus longue de l'exposition. On considère que les valeurs associées au scénario du bain sont conservatrices, puisque la plupart des personnes vivant au Canada ne prennent pas un bain de 30 minutes tous les jours (tableau 4). De plus, si les personnes sont exposées aux THM par d'autres activités ménagères ou par un séjour prolongé dans un bain, les valeurs de Leq/jour calculées pour le scénario du bain confèrent une protection contre ces expositions supplémentaires. Les valeurs de Leq/jour calculées par Krishnan (2003) ont servi à calculer les VBS pour les THM (voir la section 3.0, Calcul de la valeur basée sur la santé).
| THM | Voie orale (L/jour) |
Inhalation (Leq/jour) | Voie cutanée (Leq/jour) | Total (Leq/jour) |
|---|---|---|---|---|
| Chloroforme | 1,5 | 1,70 | 0,91 | 4,11 |
| BDCM | 1,5 | 0,67 | 1,38 | 3,55 |
| DBCM | 1,5 | 0,50 | 1,60 | 3,60 |
| Bromoforme | 1,5 | 0,46 | 1,78 | 3,74 |
|
BDCM = bromodichlorométhane, DBCM = dibromochlorométhane |
||||
1.3.3 Piscines et bains à remous
L'exposition aux THM par voie cutanée et par inhalation peut se produire dans les piscines et bains à remous lorsque le chlore, utilisé comme désinfectant, réagit avec la matière organique (par exemple la sueur, les cheveux, les lotions) présente dans l'eau. Plusieurs études se sont penchées sur les concentrations de THM dans le plasma, l'urine et l'haleine des baigneurs et du personnel de piscine (Levesque et coll., 1994; Lindstrom et coll., 1997; Aggazzotti et coll., 1998; Whitaker et coll., 2003; Erdinger et coll., 2004; Caro et Gallego, 2008; Marco et coll., 2015; Font-Ribera et coll., 2016). En général, on a observé que les concentrations de THM dans le corps augmentaient avec le temps passé à se baigner et avec l'intensité de l'effort déployé. Selon des données limitées, l'absorption cutanée pourrait être plus importante chez les utilisateurs de bains à remous que chez les nageurs en raison de la température plus élevée de l'eau (Wilson, 1995).
1.3.4 Données de biosurveillance
Le chloroforme, le BDCM, le DBCM et le bromoforme ont été analysés dans le sang total de participants âgés de 12 à 79 ans au cycle 3 (2012 à 2013), au cycle 4 (2014 à 2015) et au cycle 5 (2016 à 2017) de l'ECMS (Santé Canada, 2019a). Les concentrations sanguines de BDCM, de DBCM et de bromoforme étaient largement sous les limites de détection pour les trois cycles de l'enquête et pour tous les groupes d'âge. Les concentrations moyennes de chloroforme dans le sang n'ont pas été calculées pour les cycles 3 et 4, étant donné que plus de 40 % des échantillons se trouvaient à une valeur inférieure à la limite de détection de 0,014 µg/L. Cependant, au cours du cycle 5, une limite de détection inférieure a été établie (0,006 µg/L) et la concentration moyenne de chloroforme dans le sang des participants âgés de 12 à 79 ans était de 0,011 µg/L. Ces concentrations sanguines étaient inférieures à la concentration de l'équivalent de biosurveillance de 0,230 µg/L dérivé de la dose de référence orale de 0,01 mg/kg de poids corporel (p.c.) par jour établie par l'Environmental Protection Agency des États-Unis (U.S. EPA), l'agence américaine de protection de l'environnement (Aylward et coll., 2008).
Même si une méthode d'analyse a été mise au point pour détecter et quantifier deux THM iodés (DCIM et BCIM) dans le sang total (limite de détection de la méthode = 2 ng/L), aucune donnée de biosurveillance n'a été recensée pour les THM iodés (Silva et coll., 2006).
2.0 Considérations relatives à la santé
2.1 Cinétique
Même si des renseignements sur la cinétique existent pour le chloroforme et les THM bromés, aucune donnée n'est disponible en ce qui concerne l'absorption, la distribution, le métabolisme, l'excrétion et la modélisation PBPK des THM iodés.
2.1.1 Absorption
2.1.1.1 Chloroforme
Le chloroforme est facilement absorbé par toutes les voies d'exposition. Après une exposition par voie orale, l'absorption gastro-intestinale du chloroforme s'élève à plus de 90 % selon le véhicule d'administration; l'absorption est plus rapide avec une solution aqueuse qu'avec une huile (Withey et coll., 1983). L'absorption du chloroforme dans les poumons est considérable, le chloroforme passant facilement de l'air au sang dans les alvéoles humaines (Corley et coll., 1990; Batterman et coll., 2002). Plusieurs études réalisées chez l'animal et l'humain ont démontré que le chloroforme peut être absorbé par la peau intacte, y compris à partir de l'eau lors de la douche et du bain. Les taux d'absorption cutanée chez des volontaires humains varient de 1,6 % à 7,8 % selon le véhicule d'administration (Jo et coll., 1990b; Bogen et coll., 1992; Dick et coll., 1995).
2.1.1.2 THM bromés
Les THM bromés sont bien absorbés après une exposition par voie orale, les taux d'absorption dans les études menées chez l'animal se situant entre 60 % et 90 % (Mink et coll., 1986; Mathews et coll., 1990). Les taux d'absorption varient en fonction du véhicule d'administration, une plus grande absorption étant observée dans les milieux aqueux (ATSDR, 2020). Bien que les données soient limitées, selon les propriétés physicochimiques, on s'attend à ce que les THM bromés soient bien absorbés par les poumons (ATSDR, 2005). Cependant, cette absorption peut être moins importante que dans le cas du chloroforme (Yoshida et coll., 1999). Les THM bromés sont facilement absorbés par la peau (ATSDR, 2005; ATSDR, 2020). Une étude in vitro utilisant la peau humaine a révélé que les THM bromés étaient davantage absorbés que le chloroforme, la peau étant la plus perméable au bromoforme u (Xu et coll., 2002).
2.1.2 Distribution
2.1.2.1 Chloroforme
Le chloroforme est distribué dans tout le corps, mais a tendance à s'accumuler dans les tissus riches en lipides. Les concentrations les plus élevées ont été observées dans les graisses, le foie, les reins, le système nerveux, les poumons et le sang (ATSDR, 1997). La distribution dépend de la voie d'exposition; les tissus extrahépatiques reçoivent une dose plus élevée de chloroforme inhalé ou absorbé par voie cutanée que de chloroforme ingéré. Le transfert placentaire du chloroforme a été démontré chez plusieurs espèces animales et chez l'humain. Le chloroforme non métabolisé est retenu plus longtemps dans les graisses que dans tout autre tissu (OMS, 2005).
2.1.2.2 THM bromés
2.1.3 Métabolisme
2.1.3.1 Chloroforme
La toxicité du chloroforme est attribuable à ses métabolites. On a identifié les voies oxydatives et réductrices du métabolisme du chloroforme, toutes deux passant par une étape de bioactivation dépendante du cytochrome P450 (CYP2E1). L'équilibre entre les voies oxydatives et réductrices dépend de l'espèce, du tissu, de la dose et de la tension d'oxygène. Parmi les tissus capables de métaboliser le chloroforme, le foie est le plus actif, suivi du nez et des reins (Environnement Canada et Santé Canada, 2001).
À des concentrations faibles, typiques de l'exposition humaine réelle au chloroforme dans l'eau potable, la majorité du chloroforme est métabolisée par oxydation par l'intermédiaire du CYP2E1 pour produire du trichlorométhanol (Gemma et coll., 2003). Le trichlorométhanol a une demi-vie extrêmement courte et se décompose spontanément pour produire du phosgène, un composé électrophile hautement réactif. Le phosgène peut ensuite être détoxiqué par réaction avec l'eau pour produire du dioxyde de carbone (principal métabolite) et de l'acide chlorhydrique. Autrement, le phosgène peut former des liaisons covalentes avec les composants nucléophiles des protéines tissulaires, ainsi qu'avec d'autres nucléophiles cellulaires, ou se lier aux têtes polaires des phospholipides; on a observé une faible liaison des métabolites du chloroforme à l'acide désoxyribonucléique (ADN). Le phosgène peut également subir une réduction glutathion-dépendante en glutathion oxydé et en monoxyde de carbone. Le phosgène et l'acide chlorhydrique peuvent tous deux endommager les tissus, et la réaction du phosgène avec les protéines des tissus est associée à des dommages cellulaires et à la mort (Environnement Canada et Santé Canada, 2001).
Outre la biotransformation oxydative, le chloroforme peut subir une déshalogénation réductrice pour produire le radical dichlorométhyl. Ces radicaux réactifs peuvent se lier de manière covalente à diverses macromolécules cellulaires. Cette voie de réduction n'est pas aussi pertinente dans le foie humain, car elle n'est active qu'à des concentrations élevées de substrat et dans des conditions strictement anaérobies.
Le métabolisme du chloroforme varie selon le sexe et l'espèce. On a observé que la souris métabolise le chloroforme plus rapidement que le rat, et que les souris mâles sont plus sensibles que les souris femelles à la toxicité rénale induite par le chloroforme en raison de l'augmentation des concentrations de CYP2E1 dans les reins sous l'effet de la testostérone (Sasso et coll., 2013).
2.1.3.2 THM bromés
Comme le chloroforme, les THM bromés sont métabolisés par les voies oxydatives et réductrices. Environ 70 % à 80 % du BDCM est métabolisé par le CYP2E1 en dioxyde de carbone par l'intermédiaire du phosgène (Lilly et coll., 1997; Allis et coll., 2002), tandis que le DBCM et le bromoforme sont métabolisés par l'intermédiaire d'analogues bromés du phosgène.
En outre, les THM bromés peuvent être métabolisés par une troisième voie : les conjugaisons catalysées par la glutathion S-transférase thêta. Contrairement au chloroforme, les THM bromés sont transformés par la glutathion S-transférase thêta 1-1 (GSTT1-1) en intermédiaires mutagènes à de faibles concentrations de substrat (Pegram et coll., 1997; Ross et Pegram, 2003). Bien que cette voie soit quantitativement moins importante par rapport à l'oxydation et à la réduction (selon l'efficacité catalytique), les métabolites mutagènes qui sont formés peuvent provoquer une réponse toxique disproportionnée (ATSDR, 2005, 2020).
Le Programme international sur la sécurité des substances chimiques (PISC, 2000) a avancé l'hypothèse que les THM bromés peuvent être plus rapidement et plus largement métabolisés que leurs homologues chlorés. Même si c'est le cas pour le BDCM, il est difficile d'appuyer cet énoncé en ce qui concerne le DBCM ou le bromoforme au vu de la documentation limitée actuellement disponible.
Dans une étude sur le chloroforme, le BDCM, le DBCM et le bromoforme, Mink et coll. (1986) ont constaté de nettes différences interspécifiques quant à la métabolisation des THM, le métabolisme de la souris étant 4 à 9 fois supérieur à celui du rat. Il convient toutefois de souligner que les doses administrées étaient élevées et que le métabolisme chez les deux espèces est plus complet après l'administration de doses plus faibles et plus pertinentes.
Chez l'humain, la variation inter-individuelle quant aux enzymes es CYP2E1 etet de la famille des glutathion S-transférases (GST) intervenant dans le métabolisme des THM peut influer sur la sensibilité aux effets toxiques des THM (OEHHA, 2020).
2.1.3.3 Mélanges de THM
DaSilva et coll. (2000) ont mis au point un modèle PBPK. Ils ont constaté que des expositions à des mélanges binaires de chloroforme et de BDCM, de DBCM ou de bromoforme produiraient probablement des augmentations importantes des concentrations sanguines de chloroforme non métabolisé comparativement au chloroforme administré seul. Cette étude a aussi démontré que des interactions toxicocinétiques entre les THM pouvaient avoir des répercussions sur la clairance des THM. Le bromoforme et le DBCM semblent persister plus longtemps dans le sang et les tissus lorsqu'ils sont administrés en même temps que le chloroforme que lorsqu'ils sont administrés seuls (GlobalTox, 2002).
2.1.4 Excrétion
2.1.4.1 Chloroforme
Le chloroforme est rapidement et principalement éliminé dans l'air expiré sous forme de dioxyde de carbone et de chloroforme non transformé. Chez l'animal, la fraction éliminée sous forme de dioxyde de carbone varie en fonction de la dose et de l'espèce (PISC, 2000). Dans les études chez l'humain, la fraction de la dose éliminée sous forme de dioxyde de carbone varie considérablement d'un individu à l'autre. Des concentrations maximales de chloroforme et de dioxyde de carbone ont été détectées dans l'air expiré, respectivement 40 minutes et 2 heures après administration par voie orale d'une seule dose de chloroforme dans de l'huile d'olive. On a constaté une relation inverse entre la teneur en chloroforme des tissus adipeux du corps et l'élimination du chloroforme par les poumons (Fry et coll., 1972).
2.1.4.2 THM bromés
À l'instar du chloroforme, la principale voie d'excrétion des THM bromés est l'air expiré, principalement sous forme de composé d'origine ou de dioxyde de carbone; de plus petites quantités sont excrétées dans l'urine et les matières fécales (Mink et coll., 1986; Mathews et coll., 1990). Lilly et coll. (1998) ont constaté que chez les animaux, la proportion du BDCM d'origine éliminée par l'expiration sans être métabolisée était plus grande après administration en solution aqueuse qu'après gavage dans de l'huile de maïs. La demi-vie des THM après l'administration d'une dose unique par voie orale chez le rat était de 0,8 heure pour le bromoforme, de 1,2 heure pour le DBCM, de 1,5 heure pour le BDCM et de 2 heures pour le chloroforme. Chez la souris, la demi-vie était de 8 heures pour le bromoforme, de 2,5 heures pour le DBCM et le BDCM et de 2 heures pour le chloroforme (Mink et coll., 1986). Chez le singe, la demi-vie du BDCM était de 4 à 8 heures (Smith et coll., 1985). On a également étudié et modélisé la cinétique de l'élimination chez les humains nageant dans des piscines chlorées (Lindstrom et coll., 1997; Pleil et Lindstrom, 1997). Des demi-vies de 53 minutes pour le chloroforme et de 23 minutes pour le BDCM, mesurées dans l'urine, ont été observées, la dose absorbée ayant été éliminée après 2 heures (Caro et Gallego, 2007). Dans le cadre d'une étude menée auprès de volontaires pendant une exposition contrôlée sous la douche, les concentrations de bromoforme dans le sang étaient, parmi les quatre THM, les plus lentes à diminuer après une douche de 10 minutes, probablement en raison de la plus grande lipophilie du bromoforme et de sa plus grande rétention dans les tissus adipeux (Silva et coll., 2013).
2.1.5 Modèles pharmacocinétiques à base physiologique
Les modèles pharmacocinétiques à base physiologique (PBPK) décrivent le taux d'absorption, de distribution, de métabolisme et d'élimination des xénobiotiques chez l'humain et les animaux de laboratoire. La modélisation PBPK fournit des renseignements utiles pour effectuer une extrapolation entre les espèces et au sein de celles-ci, et elle peut servir à affiner les facteurs d'incertitude appliqués lors d'une évaluation des risques.
2.1.5.1 Chloroforme
Un certain nombre de modèles PBPK ont été créés pour décrire la toxicocinétique du chloroforme lors d'expositions par voie orale ou par inhalation (Feingold et Holaday, 1977; Corley et coll., 1990; Gearhart et coll., 1993; ICF Kaiser, 1999; Sasso et coll., 2013). Un nombre supplémentaire de modèles a permis d'ajouter une composante d'absorption cutanée aux modèles PBPK (Chinery et Gleason, 1993; McKone, 1993; Corley et coll., 2000; Haddad et coll., 2006; Tan et coll., 2006). Bon nombre de ces modèles étaient fondés sur le modèle PBPK de Corley et coll. (1990). Le premier modèle complet pour le chloroforme est un modèle à cinq compartiments qui décrit la toxicocinétique du chloroforme chez le rat, la souris et l'humain par les voies d'exposition orale et par inhalation, et cerne les reins et le foie comme les principaux sites de métabolisation. Plus récemment, Sasso et coll. (2013) se sont inspirés du modèle de Corley et coll. (1990) et ont fourni des estimations améliorées du métabolisme du chloroforme dans les reins en tenant compte des différences régionales quant à leur capacité métabolique. Le modèle a établi de nouveaux paramètres de vitesse de métabolisation du chloroforme chez le rat, la souris et l'humain. Aux fins de validation, le modèle a été mis à l'essai selon des hypothèses identiques à celles du modèle PBPK de Corley et a pu reproduire les résultats d'origine pour les simulations des données relatives à l'absorption, à l'expiration et au dépôt dans les tissus du chloroforme à partir des données sur l'inhalation chez les rongeurs, des données sur l'eau potable chez l'humain et des données sur le gavage oral chez les rongeurs. Le modèle a fourni des ajustements adéquats aux données, et les prédictions n'ont pas excédé un facteur de 2 par rapport aux données. Le modèle de Sasso a également été comparé à des données plus récentes fournies par le Japan Bioassay Research Center (Take et coll., 2010). Les concentrations de chloroforme mesurées dans les reins, le foie, le sang et les tissus adipeux des rats mâles étaient conformes aux prévisions du modèle PBPK pour toutes les voies d'exposition (c'est-à-dire orale, inhalation et combinaison orale/inhalation). À l'aide du modèle PBPK, les auteurs ont constaté que la mesure de la dose dans le rein était fortement influencée par le profil d'exposition orale (c'est-à-dire une dose quotidienne continue sur 24 heures à de faibles concentrations par rapport à l'administration de bolus plusieurs fois par jour). Par conséquent, étant donné que les habitudes réelles d'ingestion de l'eau sont mieux représentées par l'exposition en plusieurs événements discrets, le modèle de consommation d'eau de Spiteri (1982) a été appliqué dans les simulations PBPK. Le modèle PBPK mis au point par Sasso et coll. (2013) a été utilisé dans la présente évaluation du chloroforme pour convertir les doses administrées aux rongeurs en doses internes, puis pour estimer les doses équivalentes pour l'humain.
2.1.5.2 THM bromés
Lilly et coll. (1997) ont créé un modèle à cinq compartiments pour estimer la vitesse de métabolisation du BDCM chez le rat par inhalation. Un modèle ultérieur a permis d'établir un lien entre un sous-modèle de tractus gastro-intestinal multicompartiments et le modèle PBPK pour décrire la dosimétrie des tissus et le métabolisme du BDCM ingéré par voie orale chez le rat (Lilly et coll., 1998). Le National Toxicology Program (NTP) (2006) a mis au point un modèle PBPK fondé sur des améliorations du modèle de Lilly et coll. (1998), qui comprend une description du métabolisme propre aux tissus par la voie métabolique faisant intervenir la GST, l'inclusion de l'activité métabolique dans le gros intestin, la distribution du BDCM aux organes qui est limitée par la diffusion plutôt que par le flux, un comportement non linéaire dans l'absorption orale du BDCM, une description des vitesses de transit dans les différents compartiments du tractus gastro-intestinal et une description des habitudes de consommation d'eau des rongeurs au cours de l'essai. L'évaluation actuelle fait appel au modèle PBPK du BDCM du NTP (2006) pour convertir les doses administrées en doses internes afin de faciliter la comparaison des données entre les études.
2.2 Effets chez l'humain
Un grand nombre d'études épidémiologiques ont examiné le lien entre l'exposition humaine aux THM présents dans l'eau potable et un éventail d'effets nocifs. L'analyse de ces liens est compliquée, car l'exposition aux THM dans l'eau potable suppose une exposition simultanée à d'autres SPD. Avec plus de 600 SPD décelés dans l'eau potable, il est difficile de déterminer les facteurs ayant des effets sur la santé ou d'attribuer un lien de causalité à un seul composant (Richardson et coll., 2007). Malgré ces difficultés, la majorité des études épidémiologiques se sont concentrées sur l'évaluation du cancer et des effets sur la reproduction et le développement liés à l'exposition aux THM. On ne recense aucune étude épidémiologique évaluant des associations avec l'exposition aux THM iodés.
2.2.1 Épidémiologie du cancer
Le cancer de la vessie est l'issue la plus étudiée en ce qui concerne les THM et le cancer. Plus d'une douzaine d'études cas-témoins, d'études de cohortes et d'études écologiques confirment l'existence d'un lien entre l'exposition aux THM, utilisés comme valeurs de substitution pour les SPD dans l'eau potable, et le cancer de la vessie (voir OEHHA, 2020, pour une revue des études épidémiologiques; voir aussi Evlampidou et coll., 2020). De même, l'examen mené par le Centre international de recherche sur le cancer (CIRC) sur les SPD présents dans l'eau potable chlorée a relevé des associations cohérentes entre les THM et le cancer de la vessie (CIRC, 2013).
Une méta-analyse de six études cas-témoins et de deux études de cohorte réalisées en Amérique du Nord et en Europe a permis d'évaluer le lien entre le cancer de la vessie et la consommation d'eau potable chlorée (mais pas précisément les THM dans l'eau potable). La consommation d'eau potable chlorée a été associée à un risque accru de cancer de la vessie chez les hommes (rapport de cotes combiné [RC] = 1,4; intervalle de confiance [IC] à 95 % = 1,1 à 1,9) et chez les femmes (RC combiné = 1,2; IC = 0,7 à 1,8) (Villanueva et coll., 2003).
Une analyse groupée utilisant les données primaires provenant de six études cas-témoins en Amérique du Nord et en Europe a permis d'évaluer le cancer de la vessie sur une période d'exposition commune aux THM s'échelonnant sur 40 ans. Les résultats ont montré des risques relatifs croissants en fonction de l'augmentation de l'exposition chez les hommes, avec un RC de 1,44 (IC = 1,20 à 1,73) pour une exposition supérieure à 50 μg/L. Chez les femmes, l'exposition au THM n'a pas été associée à un risque de cancer de la vessie (RC = 0,95; IC = 0,76 à 1,20) (Villanueva et coll., 2004). Une méta-analyse ultérieure incluant certaines des mêmes études cas-témoins de Villanueva et coll. (2004) ainsi que quelques études supplémentaires a révélé une association exposition-risque significative entre les THM et le cancer de la vessie (tendance linéaire p = 0,01). En outre, les hommes exposés à une concentration supérieure à 50 μg/L ont présenté un RC significativement plus élevé (RC = 1,47; IC = 1,05 à 2,05) que celui des hommes exposés à des concentrations inférieures à 5 μg/L (Costet et coll., 2011).
Les éléments de preuve scientifiques concernant l'association entre les sous-produits de la désinfection par le chlore (ou SPD chlorés) et le cancer de la vessie chez l'humain ont été évalués par un groupe interdisciplinaire mandaté par la Water Research Foundation et l'American Water Works Association (Hrudey et coll., 2015). Cet évaluation a permis de conclure que la majorité des études cas-témoins semblent indiquer une associationentre le cancer de la vessie et l'exposition aux SPD chlorés (bien qu'il n'y ait pas de preuve de causalité), que les métaanalyses publiées soutiennent une association entre les SPD chlorés et le cancer de la vessie, et que les SPD bromés pourraient jouer un rôle plus important que les SPD chlorés en ce qui concerne l'association avec le cancer de la vessie. Il a été avancé que les THM bromés présents dans l'eau potable pourraient jouer un rôle causal dans le développement du cancer de la vessie.
Des études mécanistiques réalisées sur des modèles bactériens montrent que les THM bromés sont métaboliquement activés en composés mutagènes par l'enzyme glutathion S‑transférase thêta-1 (GSTT1) (DeMarini et coll., 1997; Pegram et coll., 1997). La GSTT1 est active dans les voies urinaires et des études ont montré que le métabolisme du BDCM catalysé par la GSTT1 produit des intermédiaires réactifs qui se lient de manière covalente à l'ADN (c'est-à-dire que le BDCM est un cancérogène mutagène potentiel) (Ross et Pegram, 2003, 2004). Des polymorphismes de la GSTT1 ont été relevés chez l'humain et il a été observé que les personnes qui expriment cette enzyme présentent un risque accru (RC = 1,8; IC = 1,1 à 3,1) de développer un cancer de la vessie lorsqu'elles sont exposées à des concentrations dans le quartile supérieur (> 49 μg/L) par rapport à celles qui n'expriment pas la GSTT1 (Cantor et coll., 2010).
Contrairement à d'autres résultats, une analyse récente a examiné l'incidence du cancer de la vessie dans huit pays au cours des 45 années ayant suivi la détection de THM dans l'eau potable chlorée. Elle a conclu que le risque de cancer de la vessie lié à l'eau potable reste discutable, en grande partie à cause des estimations imprécises de l'exposition au THM qui sont généralement utilisées dans les études épidémiologiques. Selon l'étude, les risques de cancer de la vessie liés à l'eau potable et aux THM sont probablement faibles et surpassés par d'autres facteurs de risque, tels que le tabagisme, le diabète et d'autres aspects propres à chaque pays (Cotruvo et Amato, 2019). Cette analyse repose sur une évaluation générale des concentrations moyennes nationales de THM et des taux nationaux de cancer de la vessie aux États-Unis. Elle n'a pas pris en compte chacune des études qui évaluent les concentrations précises de THM auxquelles les personnes atteintes d'un cancer de la vessie ont été exposées.
Des études épidémiologiques supplémentaires ont permis d'examiner l'incidence d'autres types de cancer en relation avec la présence de THM dans l'eau potable. Il s'agit notamment des cancers colorectal, du cerveau, du pancréas, de l'œsophage, du poumon, du rein, de l'estomac, du système lympho-hématopoïétique, de l'ovaire, de la prostate et du sein (voir OEHHA 2020 pour une revue de ces études). Même si dans certaines de ces études, on a identifié des associations avec la présence de THM dans l'eau potable, les données semblent moins cohérentes que celles des associations avec le cancer de la vessie et ne sont pas concluantes.
Dans l'ensemble, les données épidémiologiques pointent en direction d'une association entre l'exposition aux THM dans l'eau potable et le cancer de la vessie. Ces études épidémiologiques présentent toutefois plusieurs limites et ne peuvent être utilisées dans une évaluation quantitative des risques. Il s'agit notamment d'estimations imprécises de l'exposition (par exemple l'utilisation de concentrations régionales de THM dans l'eau au lieu de données sur l'exposition individuelle, la non-utilisation d'expositions qui intègrent la baignade et la consommation par voie orale, la variabilité intra-individuelle et inter-individuelle des habitudes d'utilisation de l'eau) ainsi que de limitations plus générales telles que la taille de l'étude, les facteurs de confusion et autres formes de biais. Ce qui est plus important encore, cependant, c'est le fait que de nombreux SPD sont présents dans l'eau potable; le risque ne peut donc pas être attribué exclusivement aux THM.
2.2.2 Épidémiologie de la reproduction et du développement
Bon nombre d'études se sont intéressées aux associations possibles entre l'exposition aux THM présents dans l'eau potable et les effets nocifs sur la reproduction et le développement. Divers effets ont été évalués, notamment la mortinatalité, l'avortement spontané (fausse couche), la prématurité, l'insuffisance pondérale à la naissance, le faible poids pour l'âge gestationnel (FAG) et les malformations/anomalies congénitales (qui consistent en un groupe très hétérogène de résultats [par exemple anomalies cardiaques, urinaires, respiratoires, du système nerveux, fentes palatines]). La plupart de ces études se sont centrées sur les risques pour le développement ou les effets sur la reproduction des femelles. En revanche, très peu d'études sur les effets sur la reproduction masculine (par exemple la qualité du sperme) ont été entreprises (par exemple Luben et coll., 2007; Iszatt et coll., 2013; Zeng et coll., 2016; Chen et coll., 2020; Wei et coll., 2022; Liu et coll., 2023).
En 2008, Santé Canada a réuni un groupe d'experts chargé d'examiner la toxicité pour la reproduction et le développement associée précisément au BDCM. Le groupe d'experts a conclu que « dans l'ensemble, les données probantes tirées des études épidémiologiques manquent d'uniformité et, selon les normes internationales, le poids actuel de la preuve n'est pas suffisant pour étayer une association entre les effets nocifs sur la reproduction et le développement de l'humain et les expositions environnementales au BDCM » (Santé Canada, 2008a).
Depuis, plusieurs analyses groupées et méta-analyses ont examiné la relation entre l'exposition à long terme aux THM et les effets sur la reproduction et le développement. Une revue et méta-analyse de 15 études cas-témoins et transversales en population menées en Amérique du Nord, en Europe et à Taïwan a permis d'évaluer l'exposition aux SPD chlorés et les anomalies congénitales. Les études individuelles examinées ont montré des résultats contradictoires quant à l'existence d'une association entre les SPD et le risque de toutes les anomalies congénitales combinées ainsi que pour des groupes précis d'anomalies. La méta-analyse a révélé un excès de risque statistiquement significatif pour une exposition élevée par rapport à une exposition faible à l'eau chlorée ou aux THM et pour toutes les anomalies congénitales combinées (17 %; IC = 3 à 34), d'après un petit nombre d'études. Elle a également indiqué un excès de risque statistiquement significatif pour les communications interventriculaires (58 %; IC = 21 à 107), mais ce résultat ne s'appuyait que sur trois études, et il y avait peu d'éléments de preuve confirmant une relation exposition-réponse (Nieuwenhuijsen et coll., 2009). Une étude ultérieure portant sur les anomalies crâniofaciales congénitales a révélé des rapports de cotes ajustés élevés pour les fentes palatines et les THM, ainsi que pour les anomalies oculaires et le chloroforme, même si aucune tendance exposition-réponse n'a pu être identifiée (Kaufman et coll. 2018).
Une autre méta-analyse composée de 15 études cas-témoins populationnelles, études de cohorte rétrospectives de femmes enceintes ou études de cohorte prospectives de femmes enceintes a examiné les associations entre l'exposition aux THM dans l'eau potable et des indicateurs de croissance fœtale et de prématurité. L'analyse a révélé peu ou pas de données probantes pour les associations avec la plupart des indicateurs de croissance fœtale et de naissance prématurée, à l'exception peut-être du FAG. Les risques de FAG liés à une exposition aux THM durant le troisième trimestre à des concentrations de 80 μg/L et de 100 μg/L se traduisent par un RC de 1,08 (IC = 1,01 à 1,17) et de 1,10 (IC = 1,01 à 1,21), respectivement (Grellier et coll., 2010).
Dans le cadre d'une autre étude, on a examiné de manière systématique les données probantes sur les risques de fausse couche, de naissance prématurée, de faible poids à la naissance et FAG associés à l'exposition aux THM. Neuf des 29 études examinées ont mis en évidence une association entre l'exposition de la mère aux THM et des issues défavorables de la grossesse (Dodds et coll., 1999; Aggazzotti et coll., 2004; MacLehose et coll., 2008; Grazuleviciene et coll., 2011; Levallois et coll., 2012; Rivera-Núñez et Wright, 2013; Iszatt et coll., 2014; Kumar et coll., 2014; Cao et coll., 2016). Vingt études ont déterminé qu'il n'y avait aucune association avec des issues défavorables de la grossesse. Dans l'ensemble, l'exposition maternelle aux THM a été associée à un risque de FAG et à un risque légèrement accru de fausse couche (Mashau et coll., 2018). Une autre étude individuelle a révélé une augmentation des rapports de cotes ajustés pour la mortinatalité et l'exposition au chloroforme et au BDCM (RiveraNúñez et coll., 2018).
Une autre revue systématique s'est précisément intéressée aux répercussions du chloroforme sur la reproduction et le développement. Sur les 42 études examinées, la plupart (30) ont porté sur des effets sur le développement, les autres ont porté sur des effets sur la reproduction chez l'homme et la femme. Le poids de la preuve examiné dans cette revue n'a pas permis d'établir une association entre l'exposition au chloroforme pendant la grossesse et le risque de malformations congénitales, de gain de poids postnatal ou de FAG. En outre, les données probantes ont révélé une association protectrice possible entre l'exposition au chloroforme et la naissance prématurée, peut-être en raison d'un facteur de confusion (par exemple un statut socioéconomique plus élevé et un mode de vie plus sain) (Williams et coll., 2018).
De 2005 à 2015, une vaste étude de cohorte prospective nationale a été menée en Suède afin d'évaluer l'association entre les THM totaux dans l'eau potable et le risque de FAG, d'accouchement prématuré et de malformations congénitales. Portant sur environ 500 000 naissances, cette étude a permis d'observer une hausse significative du FAG dans le groupe le plus exposé aux THM (THM totaux > 15 μg) dans les régions où l'eau est traitée à l'hypochlorite par rapport au groupe non exposé (RC = 1,20; IC = 1,08, 1,33). Aucune association évidente n'a été observée entre les THM et les accouchements prématurés (Säve‑Söderbergh et coll., 2020). Sur la base de plus de 620 000 naissances, des associations ont été observées entre les groupes les plus exposés aux THM totaux dans les régions utilisant de la chloramine et les malformations du système nerveux (RC = 1,82; IC = 1,07, 3,12), du système urinaire (RC = 2,06; IC = 1,53, 2,78), des organes génitaux (RC = 1,77; IC = 1,38, 2,26), et des membres (RC = 1,34; IC = 1,10, 1,64) (Säve-Söderbergh et coll., 2021).
Malgré l'existence de quelques études bien réalisées avec des échantillons de grande taille, une meilleure évaluation de l'exposition individuelle et la prise en compte de multiples voies d'exposition, les conclusions de chacune des études varient, certaines suggérant des associations nocives avec les THM, d'autres indiquant une absence d'association. Parmi les revues et les méta-analyses, il semble qu'il y ait des indications d'une association potentielle avec le FAG. Cependant, les éléments de preuve épidémiologiques sont insuffisants pour déterminer si les associations observées sont causales. De plus, comme de nombreux SPD sont présents dans l'eau potable, il est impossible d'attribuer un quelconque risque exclusivement aux THM.
2.3 Effets chez les animaux
Il est bien connu que l'exposition aux THM entraîne un certain nombre d'effets nocifs dans les modèles animaux. Le foie et les reins semblent être les principaux organes cibles des effets nocifs, bien que, selon le THM, des effets soient également observés dans d'autres organes et tissus, notamment le côlon, la thyroïde et les tissus nasaux. Même si des effets sur la reproduction et le développement ont également été observés dans le cadre d'études animales, ces effets n'étaient pas cohérents d'un modèle animal à l'autre et se produisaient généralement à des doses élevées qui entraînaient aussi une toxicité pour la mère.
2.3.1 Effet du véhicule et mode de distribution
Dans les études de laboratoire, les animaux reçoivent des concentrations de THM nettement supérieures à celles que l'on trouve généralement dans l'eau potable. À ces concentrations plus élevées, les THM sont souvent insolubles dans l'eau potable et sont trop volatils pour être administrés par le régime alimentaire dans les aliments pour animaux (NTP, 1985). Par conséquent, dans de nombreuses études de laboratoire, les THM sont administrés par gavage dans de l'huile de maïs pour s'assurer que les animaux reçoivent la bonne dose. Cependant, l'administration de THM par gavage dans de l'huile de maïs a souvent entraîné des effets qui n'ont pas été observés lorsque les substances chimiques étaient administrées dans l'eau potable. Un certain nombre de facteurs peuvent expliquer cette situation.
Lorsque les THM sont incorporés dans l'eau potable, ils sont consommés progressivement et non en bolus, comme c'est le cas lorsqu'ils sont administrés par gavage. Les animaux auxquels on a administré des THM par l'eau potable consomment souvent moins d'eau que les animaux témoins au début, probablement en raison de la palatabilité réduite de l'eau dosée. Cependant, même lorsque la consommation d'eau et de THM augmente au fil du temps, une toxicité réduite a été observée par rapport au gavage, ce qui indique une tolérance aux effets toxiques (Coffin et coll., 2000). Cela peut s'expliquer par des concentrations plus faibles dans le foie et, par conséquent, par une plus grande possibilité de métabolisme sans surcharger les mécanismes de détoxication.
L'utilisation d'huile comme véhicule d'administration augmente l'apport calorique de l'animal et peut également modifier la toxicocinétique (par exemple l'absorption) de la substance à l'essai (Hayes et Kruger, 2014). En outre, l'huile de maïs est connue pour agir comme un promoteur de tumeurs (Wu et coll., 2004). Ces facteurs peuvent entraîner des différences de toxicité, en particulier dans les études à long terme.
On a aussi constaté que l'huile de maïs administrée comme véhicule provoquait des changements dans le microbiome intestinal, l'expression de l'ARNm des gènes liés à la perméabilité intestinale et des gènes liés à la réponse immunitaire chez la souris CD-1, mais pas chez le rat Sprague-Dawley (Gokulan et coll., 2021). On ignore les répercussions de ces résultats sur l'évaluation de la toxicité des substances chimiques.
Les ramifications de l'utilisation du gavage à l'huile de maïs par rapport à l'eau potable dans les études d'exposition sont difficiles à discerner et peuvent varier en fonction d'autres paramètres de l'étude (par exemple la durée de l'étude, l'effet étudié, les facteurs liés à l'alimentation). Cela peut expliquer pourquoi dans certaines études comparatives on a observé des effets nocifs après l'administration de THM (en particulier le chloroforme) dans l'huile de maïs, mais pas dans l'eau potable (Bull et coll., 1986; Larson et coll., 1995a; Pereira et Grothaus, 1997), alors que d'autres études ont fait état d'effets nocifs similaires après une exposition à l'huile de maïs et à l'eau (Geter et coll., 2004a).
2.3.2 Toxicité aiguë, subchronique ou chronique
2.3.2.1 Chloroforme
La base de données sur la toxicité du chloroforme chez les animaux englobe l'exposition par inhalation et par voie orale (à savoir l'eau potable, le gavage) et décrit plusieurs effets observés chez le rat, la souris, le cobaye, le lapin et le chien (voir ATSDR [1997] et OEHHA [2020] pour des examens approfondis). Le foie et les reins semblent être les principaux organes cibles, bien qu'il existe également des signes de lésions nasales.
L'exposition orale aiguë de rats et de souris au chloroforme a donné lieu à un large éventail de valeurs de dose létale médiane (DL50) allant de 36 à 2 180 mg/kg, en partie à cause de la variabilité des souches et de l'âge au moment de l'administration de la dose (OEHHA, 2020). Des expositions aiguës élevées ont entraîné une dépression du système nerveux central et une dépression respiratoire, une arythmie cardiaque et des lésions hépatiques et rénales. Des études de courte durée menées chez le rat et la souris ont déterminé que le foie et les reins étaient des organes cibles critiques (Condie et coll., 1983; Plummer et coll., 1990; Larson et coll., 1994a, b, 1995a, b; Melnick et coll., 1998).
Un certain nombre d'études de toxicité subchronique ont porté sur l'exposition d'animaux au chloroforme par ingestion orale ou par inhalation. Ces études sont présentées dans le tableau 5 et le tableau 6, respectivement. Ces tableaux comprennent des études avec des doses multiples et des durées d'exposition de 90 jours ou plus. Des effets sur le foie et les reins ont été observés à des doses aussi faibles que 50 mg/kg par jour dans le cas des études de toxicité par voie orale et aussi faibles que 30 ppm pour les études de toxicité par inhalation. Des effets au niveau nasal ont été observés à des doses aussi faibles que 2 ppm. Une variation de la sensibilité des espèces a été signalée chez les animaux exposés au chloroforme par inhalation, les lésions hépatiques et rénales chez la souris étant les effets les plus sensibles (Torkelson et coll., 1976; Sasso et coll., 2013).
| NOAEL/LOAEL (mg/kg p.c. par jour) | Espèce, sexe, nombre | Dose et voie d'exposition | Durée de l'exposition | Effet(s) critique(s) | Référence |
|---|---|---|---|---|---|
| 150Note de bas de tableau 5 - a/410 | Rat, Sprague-Dawley SPF, M, F, 10/sexe/dose | 0, 15, 30, 150, 410 mg/kg p.c. par jour, gavage (dentifrice) | 13 semaines | Augmentation du poids du foie avec stéatose et nécrose | Palmer et coll. (1979) |
| 45/150 (M) 45/142 (F) |
Rat, Sprague-Dawley, M, F, 20/sexe/dose | 5, 50, 500 or 2 500 mg/LNote de bas de tableau 5 - b, eau potable | 90 jours (plus 90 jours de récupération) | Diminution de l'apport alimentaire et augmentation de la mortalité | Chu et coll. (1982) |
| S.O./50 (F) 125/250 (M) |
Souris, CD-1, M, F, 7 à 12/sexe/dose | 0, 50, 125, 250 mg/kg p.c. par jour, gavage (eau et Emulphor) | 90 jours | Augmentation du poids du foie et diminution de l'activité microsomale hépatique, changements microscopiques dans les tissus du foie et des reins | Munson et coll. (1982) |
| S.O./60 | Souris, B6C3F1, M, F, 10/sexe/dose | 60, 130, 270 mg/kg p.c. par jour, gavage (huile de maïs ou Emulphor à 2 %) | 90 jours | Augmentation du poids du foie (administration d'huile de maïs et d'Emulphor). Élévation de la SGOT, diminution des TG, vacuolisation et accumulation de lipides dans le foie (administration d'huile de maïs uniquement) | Bull et coll. (1986) |
|
F = femelles; LOAEL = dose minimale avec effet nocif observé, M = mâles, NOAEL = dose sans effet nocif observé, SGOT = sérum glutamo-oxaloacétique transaminase, S.O. = sans objet (l'étude ne comportait pas de NOAEL/LOAEL), TG = triglycérides |
|||||
| Espèce, sexe | Dose | Durée de l'exposition | Effet(s) critique(s) | Référence |
|---|---|---|---|---|
| Rats, lapins, cobayes, chiens, M, F | 25, 50, 85 ppmNote de bas de tableau 6 - a | 7 heures/jour, 5 jours/semaine pendant 6 mois | Toxicité pour le foie et les reins ≥ 25 ppm. Le rat était l'espèce la plus sensible et le cobaye était l'espèce la moins sensible. | Torkelson et coll. (1976) |
| Souris, B6C3F1, M, F | 0, 0,3, 2, 10, 30, 90 ppmNote de bas de tableau 6 - b | 6 heures/jour, 7 jours/semaine, 13 semaines | Lésions hépatiques ≥ 30 ppm, lésions rénales ≥ 30 ppm, effets nasaux ≥ 10 ppm | Larson et coll. (1996) |
| Rat, F344/N, M, F | 0, 2, 10, 30, 90, 300 ppmNote de bas de tableau 6 - c | 6 heures/jour, 7 jours/semaine, 13 semaines | Lésions hépatiques à 300 ppm, lésions rénales ≥ 30 ppm, effets au niveau nasal ≥ 2 ppm | Templin et coll. (1996) |
| Souris, BDF1, M, F | 0, 1, 5, 30, 90 ppmNote de bas de tableau 6 - d | 6 heures/jour, 5 jours/semaine, 13 semaines | Vacuolisation et dégénérescence hépatiques à 90 ppm, effets sur les reins ≥ 30 ppm | Templin et coll. (1998) |
| Rat, F344, M, F | 25, 50, 100, 200 ou 400 ppmNote de bas de tableau 6 - e |
6 heures/jour, 5 jours/semaine, 13 semaines | Effets au niveau nasal ≥ 25 ppm, effets sur le foie et les reins ≥ 100 ppm | Kasai et coll. (2002) |
| Souris, BDF1, M, F | 12, 25, 50, 100 ou 200 ppmNote de bas de tableau 6 - f | 6 heures/jour, 5 jours/semaine, 13 semaines | Effets sur les reins et effets au niveau nasal ≥ 12 ppm, effets sur le foie ≥ 100 ppm | Kasai et coll. (2002) |
|
F = femelles, M = mâles |
||||
Des effets sur le foie et les reins ont également été observés dans le cadre d'études de toxicité chronique menées sur des rats, des souris et des chiens exposés au chloroforme (tableau 7). Dans une étude en particulier, on a évalué les effets d'une exposition combinée au chloroforme par inhalation et par l'eau potable (Nagano et coll., 2006). Étant donné que la plupart des études de toxicité chronique sont conçues sous forme d'essais biologiques sur le cancer, de plus amples détails sur ces études et d'autres études sont disponibles dans la section 2.3.4.1, Génotoxicité et cancérogénicité.
| NOAEL/LOAEL (mg/kg p.c. par jour) | Espèce, sexe, nombre | Dose et voie d'exposition | Durée de l'exposition | Effet(s) critique(s) | Référence |
|---|---|---|---|---|---|
| 64/129 (M) 71/143 (F) |
Rat, Osborne-Mendel, M, F, 50/sexe/dose | 0, 90, 180 mg/kg (M); 0, 100, 200 mg/kg (F)Note de bas de tableau 7 - a, gavage (corn oil) | 78 semaines (5 jours/semaine) | Nécrose hépatique, hyperplasie de la vessie, hématopoïèse splénique, diminution de la prise de poids corporel et de la survie, atrophie testiculaire | NCI (1976) et réévaluation des données par Reuber (1979) |
| S.O./99 (M) S.O./170 (F) |
Souris, B6C3F1, M, F, 50/sexe/dose | 0, 138, 277 mg/kg (M); 0, 238, 477 mg/kg (F)Note de bas de tableau 7 - b, gavage (huile de maïs) | 78 semaines (5 jours/semaine) | Hyperplasie hépatique, quelques nécroses hépatiques et (chez les femelles seulement) thrombose cardiaque | NCI (1976) et réévaluation des données par Reuber (1979) |
| S.O./13 | Chien, beagle, M, F, 8/sexe/dose | 0, 15, 30Note de bas de tableau 7 - c mg/kg par gavage (base de dentifrice dans une gélule de gélatine) | 7,5 ans (6 jours/semaine) | Élévation de la SGPT et kystes adipeux dans le foie | Heywood et coll. (1979) |
| 38/81 | Rat, Osborne-Mendel, M, 50 à 330/groupe | 0, 19, 38, 81, 160 mg/kg p.c. par jour dans l'eau potable | 104 semaines | Basophilie cytoplasmique, vacuolisation cytoplasmique, encombrement nucléaire, hyperplasie des tubules rénaux | Jorgenson et coll. (1985) et réévaluation par Hard et coll. (2000) |
| S.O./34 | Souris, B6C3F1, F, 50 à 430/groupe | 0, 34, 65, 130, 263 mg/kg p.c. par jour dans l'eau potable | 104 semaines | Augmentation de la graisse hépatique | Jorgenson et coll. (1985) |
| 10/30 ppm | Rat, F344/N, M, F, 50/sexe/dose | 0, 10, 30, 90 ppm par inhalation | 104 semaines (6 heures/jour, 5 jours/semaine) | Hypertrophie nucléaire du tubule proximal et dilatation de la lumière tubulaire dans le rein; augmentation des foyers de cellules hépatiques vacuolisées | Yamamoto et coll. (2002) |
| 5/30 ppm | Souris, BDF1, M, F, 50/sexe/dose | 0, 5, 30, 90 ppm par inhalation | 104 semaines (6 heures/jour, 5 jours/semaine) | Stéatose et foyers de cellules altérées dans le foie; hyperplasie tubulaire atypique, hypertrophie nucléaire et basophilie cytoplasmique dans le rein | Yamamoto et coll. (2002) |
| Varie selon la voie d'exposition et l'effet | Rat, F344, M, 50/dose | 0, 25, 50, 100 ppm par inhalation combinée à 0 ou 1 000 ppm dans l'eau potable | 104 semaines (6 heures/jour, 5 jours/semaine) | Nodules rénaux, basophilie cytoplasmique, dilatation et hypertrophie nucléaire de la lumière tubulaire proximale, glucose urinaire positif | Nagano et coll. (2006) |
|
F = femelles, LOAEL = dose minimale avec effet nocif observé, M = mâles, NCI = National Cancer Institute, NOAEL = dose sans effet nocif observé, SGPT = sérum glutamopyruvique transaminase, S.O. = sans objet (l'étude ne comportait pas de NOAEL/LOAEL) |
|||||
2.3.2.2 BDCM
La base de données sur la toxicité du BDCM chez les animaux englobe plusieurs types d'exposition par voie orale (à savoir l'eau potable, le régime alimentaire, le gavage) chez le rat et la souris, et décrit plusieurs effets (voir ATSDR [2020] et OEHHA [2020] pour des revues approfondies). Le foie et les reins semblent être les principaux organes cibles, bien qu'il existe également des éléments probants démontrant des effets sur la thyroïde et le côlon. On n'a trouvé aucune étude d'exposition subchronique ou chronique par inhalation au BDCM.
Les valeurs de la LD50 pour l'exposition aiguë par voie orale de rats et de souris au BDCM se situaient entre 450 et 969 mg/kg (OEHHA, 2020). Des études de courte durée menées chez le rat et la souris confirment que le foie et les reins sont des organes cibles critiques (Condie et coll., 1983; NTP, 1987, 1998; Aida et coll., 1992a; Thornton-Manning et coll., 1994; Melnick et coll., 1998; Coffin et coll., 2000).
Une toxicité hépatique et rénale a été observée dans deux études de toxicité subchronique après exposition de rats et de souris au BDCM (tableau 8). Des effets sur les reins ont été observés à des doses aussi faibles que 71 mg/kg p.c. par jour chez la souris, administrées par gavage dans de l'huile de maïs.
| NOAEL/LOAEL (mg/kg p.c. par jour) | Espèce, sexe, nombre | Dose et voie d'exposition | Durée de l'exposition | Effet(s) critique(s) | Référence |
|---|---|---|---|---|---|
| 212/S.O. (M), 220/S.O. (F) | Rat, Sprague-Dawley, M, F, 20/sexe/dose | 0, 5, 50, 500, 2 500 ppmNote de bas de tableau 8 - a, eau potable avec Emulphor à 1 % | 90 jours (plus 90 jours de récupération) | Effets sur le foie et effets légers sur la thyroïde revenus à la normale après la période de récupération | Chu et coll. (1982) |
| 54/107 | Rat F344/N, M, F, 10/sexe/dose | 0, 19, 38, 75, 150, 300Note de bas de tableau 8 - b mg/kg, gavage (huile de maïs) | 13 semaines (5 jours/semaine) | Effets sur les reins (dégénérescence et nécrose; mâles seulement), effets sur le foie (dégénérescence centrolobulaire) | NTP (1987) |
| 36/71 (M) 71/143 (F) |
Souris, B6C3F1, M, F, 10/sexe/dose | 0, 6,3, 13, 25, 50, 100Note de bas de tableau 8 - c (M); 0, 25, 50, 100, 200, 400Note de bas de tableau 8 - d (F) mg/kg, par gavage (huile de maïs) | 13 semaines (5 jours/semaine) | Effets sur les reins (dégénérescence et nécrose; mâles seulement), effets sur le foie (dégénérescence centrolobulaire; femelles seulement) | NTP (1987) |
|
F = femelles, LOAEL = dose minimale avec effet nocif observé, M = mâles, NOAEL = dose sans effet nocif observé, NTP = National Toxicology Program, S.O. = sans objet (l'étude ne comportait pas de NOAEL/LOAEL) |
|||||
Des effets sur le foie et les reins ont également été observés dans le cadre d'études de toxicité chronique menées sur des rats et des souris exposés au BDCM (tableau 9). Des effets sur le foie ont été observés à des doses aussi faibles que 6 mg/kg p.c. par jour.
| NOAEL/LOAEL (mg/kg p.c. par jour) | Espèce, sexe, nombre | Dose et voie d'exposition | Durée de l'exposition | Effet(s) critique(s) | Référence |
|---|---|---|---|---|---|
| S.O./36 | Rat F344/N, M, F, 50/sexe/dose | 0, 50, 100Note de bas de tableau 9 - a mg/kg, gavage (huile de maïs) | 102 semaines (5 jours/semaine) | Effets sur le foie (nécrose et dégénérescence graisseuse), effets sur les reins (hyperplasie des cellules tubulaires, cytomégalie) | NTP (1987) |
| S.O./18 | Souris, B6C3F1, M, F, 50/sexe/dose | 0, 25, 50Note de bas de tableau 9 - b mg/kg (M); 0, 75, 150Note de bas de tableau 9 - c mg/kg (F), gavage (huile de maïs) | 102 semaines (5 jours/semaine) | Effets sur le foie (dégénérescence graisseuse; mâles seulement), effets sur les reins (cytomégalie; mâles seulement), effets sur la thyroïde (hyperplasie des cellules folliculaires) | NTP (1987) |
| S.O./6,1 | Rat, Wistar SPF, M, F, 40/sexe/dose | 0, 6,1, 26, 138 mg/kg p.c. par jour (M); 0, 8, 32, 168 mg/kg p.c. par jour (F), régime alimentaire | 2 ans | Augmentation du poids relatif du foie; dégénérescence graisseuse et granulome hépatique | Aida et coll. (1992b) |
| 25/S.O. | Rat F344/N, M, 50/sexe/dose | 175, 350 ou 700Note de bas de tableau 9 - d mg/L, eau potable | 2 ans | Aucun effet nocif observé | NTP (2006) |
| 36/S.O. | Souris, B6C3F1, F, 50/sexe/dose | 175, 350 ou 700Note de bas de tableau 9 - e mg/L, eau potable | 2 ans | Aucun effet nocif observé | NTP (2006) |
|
F = femelles, LOAEL = dose minimale avec effet nocif observé, M = mâles, NOAEL = dose sans effet nocif observé, S.O. = sans objet (l'étude ne comportait pas de NOAEL/LOAEL) |
|||||
2.3.2.3 DBCM
La base de données sur la toxicité du DBCM chez les animaux englobe plusieurs types d'exposition par voie orale (à savoir l'eau potable, le régime alimentaire, le gavage) chez le rat et la souris, et décrit plusieurs effets (voir ATSDR [2005] et OEHHA [2020] pour des revues approfondies). On n'a trouvé aucune étude d'exposition subchronique ou chronique par inhalation au DBCM. Le foie semble être l'organe cible de la toxicité induite par le DBCM, bien que des effets nocifs dans les reins et le côlon aient également été observés.
Les valeurs de la dose létale médiane (DL50) pour l'exposition aiguë par voie orale de rats, de souris et de hamsters au DBCM se situaient entre 145 et 1 186 mg/kg (OEHHA, 2020). Plusieurs études de courte durée menées chez le rat et la souris confirment que le foie est un organe cible critique (Condie et coll., 1983; NTP, 1985; Aida et coll., 1992a; Melnick et coll., 1998; Coffin et coll., 2000).
Une toxicité hépatique et rénale a été observée dans trois études de toxicité subchronique après exposition de rats et de souris au DBCM. Ces études sont présentées dans le tableau 10. Ce tableau comprend des études portant sur des doses multiples et des durées d'exposition de 90 jours ou de 13 semaines. Des effets sur le foie ont été observés à des doses orales aussi faibles que 43 mg/kg par jour chez le rat, administrées par gavage dans de l'huile de maïs.
| NOAEL/LOAEL (mg/kg p.c. par jour) | Espèce, sexe, nombre | Dose et voie d'exposition | Durée de l'exposition | Effet(s) critique(s) | Référence |
|---|---|---|---|---|---|
| 224/S.O. (M), 237/S.O. (F) | Rat, Sprague-Dawley, M, F, 20/sexe/dose | 5, 50, 500, 2 500 ppmNote de bas de tableau 10 - a, eau potable avec Emulphor à 1 % | 90 jours (plus 90 jours de récupération) | Effets sur le foie et effets légers sur la thyroïde revenus à la normale après la période de récupération | Chu et coll. (1982) |
| 21/43 | Rat F344/N, M, F, 10/sexe/dose | 0, 15, 30, 60, 125, 250Note de bas de tableau 10 - b mg/kg, gavage (huile de maïs) | 13 semaines (5 jours/semaine) | Effets sur le foie (métamorphose graisseuse grave, nécrose hépatocellulaire centrolobulaire), néphropathie toxique | NTP (1985) |
| 89/178 | Souris, B6C3F1, M, F, 10/sexe/dose | 0, 15, 30, 60, 125, 250Note de bas de tableau 10 - b mg/kg, gavage (huile de maïs) | 13 semaines (5 jours/semaine) | Mâles seulement : effets sur le foie (dégénérescence graisseuse), néphropathie toxique | NTP (1985) |
| S.O./50 | Rat, Sprague-Dawley, M, F, 10/sexe/dose | 0, 50, 100, 200 mg/kg, gavage (huile de maïs) | 90 jours | Élévation des enzymes suggérant une hépatotoxicité et une néphrotoxicité, lipidose du foie et dégénérescence des cellules des tubules proximaux du rein. | Daniel et coll. (1990) |
|
F = femelles, LOAEL = dose minimale avec effet nocif observé, M = mâles, NOAEL = dose sans effet nocif observé, S.O. = sans objet (l'étude ne comportait pas de NOAEL/LOAEL) |
|||||
Des effets sur le foie et les reins ont également été observés dans le cadre d'études de toxicité chronique menées sur des rats et des souris exposés au DBCM (tableau 11). Des effets sur le foie ont été observés à des doses aussi faibles que 29 mg/kg p.c. par jour.
| NOAEL/LOAEL (mg/kg p.c. par jour) | Espèce, sexe, nombre | Dose et voie d'exposition | Durée de l'exposition | Effet(s) critique(s) | Référence |
|---|---|---|---|---|---|
| 10/43 (M) 9/39 (F) |
Rat, Wistar SPF, M, F, 40/sexe/dose | 0, 10, 43, 230 mg/kg p.c. par jour (M); 0, 9, 39, 220 mg/kg p.c. par jour (F), régime alimentairea | 2 ans | Diminution du poids corporel, augmentation du poids du foie. (Pas de données histopathologiques) | Tobe et coll. (1982)Note de bas de tableau 11 - a |
| S.O./29 | Rat F344/N, M, F, 50/sexe/dose | 0, 40, 80Note de bas de tableau 11 - b mg/kg, gavage (huile de maïs) | 104 semaines (5 jours/semaine) | Effets sur le foie (dégénérescence graisseuse et modifications cytoplasmiques donnant un aspect de verre dépoli) et néphrose (femelles seulement) | NTP (1985) |
| S.O./36 | Souris, B6C3F1, M, F, 50/sexe/dose | 0, 50, 100Note de bas de tableau 11 - c mg/kg, gavage (huile de maïs) | 105 semaines (5 jours/semaine) | Effets sur le foie (mâles : hépatocytomégalie, nécrose, dégénérescence graisseuse; femelles : calcification et dégénérescence graisseuse), néphrose (mâles seulement), augmentation de l'hyperplasie des cellules folliculaires de la glande thyroïde (femelles) | NTP (1985) |
|
F = femelles, LOAEL = dose minimale avec effet nocif observé, M = mâles, NOAEL = dose sans effet nocif observé, S.O. = sans objet (l'étude ne comportait pas de NOAEL/LOAEL) |
|||||
2.3.2.4 Bromoforme
La base de données sur la toxicité du bromoforme chez les animaux englobe plusieurs types d'exposition par voie orale (à savoir l'eau potable, le régime alimentaire, le gavage) chez le rat et la souris, et décrit plusieurs effets (voir ATSDR [2005] et OEHHA [2020] pour des revues approfondies). Le foie semble être le principal organe cible, bien qu'il existe également des éléments probants démontrant des effets sur la thyroïde et le côlon. Les données sur les effets du bromoforme par inhalation sont extrêmement limitées, des études plus anciennes ayant mis en évidence des effets hépatiques et rénaux chez les rongeurs (Dykan, 1962, 1964).
L'exposition orale aiguë de rats et de souris à des doses élevées de bromoforme a entraîné des effets sur le système nerveux central (par exemple sédation, anesthésie) et les valeurs de DL50 se situent entre 707 et 1 550 mg/kg (OEHHA, 2020). L'identification du foie comme organe cible est étayée par plusieurs études de courte durée réalisées chez le rat et la souris (Condie et coll., 1983; Aida et coll., 1992a; Melnick et coll., 1998; Coffin et coll., 2000).
Des effets sur le foie ont été observés dans deux études de toxicité subchronique après exposition de rats et de souris au bromoforme (tableau 12).
| NOAEL/LOAEL (mg/kg p.c. par jour) | Espèce, sexe, nombre | Dose et voie d'exposition | Durée de l'exposition | Effet(s) critique(s) | Référence |
|---|---|---|---|---|---|
| 57/218 (M), 55/283 (F) | Rat, Sprague-Dawley, M, F, 20/sexe/dose | 0, 5, 50, 500, 2 500 ppmNote de bas de tableau 12 - a, eau potable avec Emulphor à 1 % | 90 jours (plus 90 jours de récupération) | Effets sur le foie (augmentation du volume cytoplasmique et vacuolisation due à une infiltration graisseuse) | Chu et coll. (1982) |
| 18/36 | Rat F344/N, M, F, 10/sexe/dose | 0, 12, 25, 50, 100, 200Note de bas de tableau 12 - b mg/kg, gavage (huile de maïs) | 13 semaines (5 jours/semaine) | Vacuolisation hépatocellulaire chez les mâles | NTP (1989a) |
| 71/143 | Souris, B6C3F1, M, F, 10/sexe/dose | 0, 25, 50, 100, 200, 400Note de bas de tableau 12 - c mg/kg, gavage (huile de maïs) | 13 semaines (5 jours/semaine) | Vacuolisation hépatocellulaire chez les mâles | NTP (1989a) |
|
F = femelles, LOAEL = dose minimale avec effet nocif observé, M = mâles, NOAEL = dose sans effet nocif observé, S.O. = sans objet (l'étude ne comportait pas de NOAEL/LOAEL) |
|||||
Des effets sur le foie ont également été observés dans le cadre d'études de toxicité chronique menées sur des rats et des souris exposés au bromoforme (tableau 13). Des effets sur le foie ont été observés à des doses aussi faibles que 68 mg/kg p.c. par jour.
| NOAEL/LOAEL (mg/kg p.c. par jour) | Espèce, sexe, nombre | Dose et voie d'exposition | Durée de l'exposition | Effet(s) critique(s) | Référence |
|---|---|---|---|---|---|
| 19/85 (M) 15/68 (F) |
Rat, Wistar SPF, M, F, 40/sexe/dose | 0, 19, 85, 514 mg/kg p.c. par jour (M); 0, 15, 68, 407 mg/kg p.c. par jour (F)Note de bas de tableau 13 - a, régime alimentaire | 2 ans | Diminution du poids corporel, augmentation du poids relatif du foie, modification des enzymes sériques, apparence modifiée du foie | Tobe et coll. (1982) |
| S.O./71 | Rat F344/N, M, F, 50/sexe/dose | 0, 100, 200Note de bas de tableau 13 - b mg/kg, gavage (huile de maïs) | 103 semaines (5 jours/semaine) | Diminution du poids corporel terminal, lésions histopathologiques du foie | NTP (1989a) |
| 71/S.O. (M) S.O./71 (F) |
Souris, B6C3F1, M, F, 50/sexe/dose | 0, 50, 100Note de bas de tableau 13 - c mg/kg (M); 0, 100, 200Note de bas de tableau 13 - b mg/kg (F), gavage (huile de maïs) | 103 semaines (5 jours/semaine) | Femelles seulement : diminution du poids corporel, stéatose du foie, hyperplasie des cellules folliculaires de la thyroïde | NTP (1989a) |
|
F = femelles, LOAEL = dose minimale avec effet nocif observé, M = mâles, NOAEL = dose sans effet nocif observé, S.O. = sans objet (l'étude ne comportait pas de NOAEL/LOAEL |
|||||
2.3.2.5 THM iodés
On ne dispose d'aucun renseignement sur la toxicité aiguë, subchronique ou chronique des THM iodés dans des modèles animaux.
2.3.3 Toxicité pour la reproduction et le développement
2.3.3.1 Chloroforme
La toxicité du chloroforme pour la reproduction et le développement a fait l'objet de plusieurs études sur des rats, des souris et des lapins exposés par gavage, par l'eau potable ou par inhalation (voir Williams et coll. [2018] pour une revue approfondie). Des effets sur le développement, notamment une diminution du poids corporel des fœtus ainsi que des altérations ou des retards de l'ossification chez les fœtus, ont été systématiquement observés dans les études avec exposition in utero. Il convient de souligner que les diminutions du poids des fœtus et les observations relatives au squelette se sont produites à des doses ayant également causé une toxicité pour la mère. Chez le rat et la souris, le poids corporel des fœtus a diminué à des doses de 300 ppm (354 mg/kg par jour) (Schwetz et coll., 1974; Baeder et Hofmann, 1988) et de 100 ppm (environ 303 mg/kg par jour) (Murray et coll., 1979), respectivement. Chez le lapin, une diminution du poids des fœtus a été observée à 20 et à 50 mg/kg par jour, mais pas à 35 mg/kg par jour (Thompson et coll., 1974). Des effets sur les os, notamment un retard de l'ossification des os crâniens et des sternèbres, des côtes lombaires, des côtes ondulées et des déviations de l'os interpariétal, ont été observés à des doses identiques ou supérieures à celles auxquelles une diminution du poids des fœtus a été observée (Schwetz et coll., 1974; Thompson et coll., 1974; Murray et coll., 1979; Ruddick et coll., 1983; Baeder et Hofmann, 1988, 1991).
Des pertes très précoces de la portée au complet (péri-implantatoires) ont été observées dans les études d'exposition in utero seulement, où l'administration de doses a commencé au 6e jour de gestation ou avant. Les effets ne sont apparus qu'à des doses élevées (≥ 200 mg/kg par jour), supérieures à celles pour lesquelles une toxicité maternelle a été observée (Schwetz et coll., 1974; Murray et coll., 1979; Ruddick et coll., 1983; Baeder et Hofmann, 1988, 1991).
Dans le cadre d'un protocole de reproduction ininterrompue de souris CD-1, aucun effet n'a été signalé sur la fertilité ou la reproduction des individus de la génération F1 auxquels on avait administré 41 mg/kg de p.c. par jour, par gavage (dans l'huile de maïs) (NTP, 1988). Aucun effet sur la reproduction n'a été constaté non plus chez des souris ICR exposées à 31 mg/kg par jour de chloroforme par gavage (dans un mélange d'huile végétale, d'Emulphor® et de solution saline) 21 jours avant l'accouplement et jusqu'au sevrage (Burkhalter et Balster, 1979). En revanche, une diminution de la performance de reproduction a été observée chez les souris CD-1 des générations F1 et F2 exposées à 950 mg/kg p.c. par jour de chloroforme dans le cadre d'une étude multigénérationnelle sur l'eau potable (Borzelleca et Carchman, 1982).
Les effets tératogènes de l'exposition au chloroforme ont été étudiés sur des embryons de poisson-zèbre (Teixido et coll., 2015). L'exposition au chloroforme dans des flacons en verre scellés (pour empêcher la volatilisation) 4 à 76 heures après la fécondation a entraîné des effets nocifs sur le développement, notamment des malformations des yeux, du cœur et de la queue, ainsi qu'un retard de croissance, de mouvement et d'éclosion. Sur les quatre THM examinés dans cette étude (c'est-à-dire le chloroforme, le BDCM, le DBCM et le bromoforme), le chloroforme a été classé comme étant le moins puissant, sa concentration efficace à 50 % (CE50) étant de 0,85 mM.
Alors que certaines organisations ont conclu que les effets de l'exposition des animaux au chloroforme sont attribuables à la toxicité maternelle (U.S. EPA, 2001; OMS, 2004), le Developmental and Reproductive Toxicant Identification Committee (DARTIC, comité d'identification des toxiques pour le développement et la reproduction) de la Californie a déterminé que le chloroforme était une substance toxique pour le développement, d'après la diminution du poids à la naissance chez l'animal et l'humain (OEHHA, 2020).
2.3.3.2 BDCM
La toxicité du BDCM pour la reproduction et le développement a fait l'objet de plusieurs études sur l'exposition par voie orale chez le rat et le lapin (voir OEHHA, 2007 pour une revue). Les effets sur le développement observés se sont généralement produits à des concentrations qui provoquaient aussi une toxicité maternelle.
Les effets du BDCM ont été étudiés chez des groupes de 15 rats Sprague-Dawley auxquels on a administré du BDCM à des doses de 50, 100 ou 200 mg/kg p.c. par jour, par gavage dans de l'huile de maïs, du 6e au 15e jour de gestation (Ruddick et coll., 1983). Aucune différence significative n'a été observée entre les groupes exposés et les groupes témoins quant au poids des fœtus, aux malformations macroscopiques des fœtus ou aux anomalies viscérales. Cependant, une augmentation des aberrations des sternèbres a été constatée dans tous les groupes exposés. La signification statistique de ces anomalies squelettiques n'a pas été signalée par les auteurs. Toutefois, selon les calculs de l'Office of Environmental Health Hazard Assessment (OEHHA) de l'Environmental Protection Agency de Californie (2020), bien qu'aucune des incidences d'aberrations des sternèbres relevées dans les groupes exposés n'ait été significativement différente de celles des témoins, une tendance significative à l'augmentation de l'incidence a été observée. Il en résulte donc une NOAEL de 200 mg/kg par jour, ce qui est supérieur à la NOAEL maternelle de 100 mg/kg par jour, basée sur une diminution du gain de poids maternel (OEHHA, 2020).
Klinefelter et coll. (1995) ont étudié la capacité du BDCM d'altérer la fonction reproductrice chez le rat mâle F344. Du BDCM a été administré dans l'eau potable pendant 52 semaines, exposant ainsi les rats à des doses moyennes de 0, 22 et 39 mg/kg p.c. par jour. L'examen histologique n'a révélé aucune lésion macroscopique des organes reproducteurs, mais l'exposition à la dose élevée de BDCM a réduit considérablement la vitesse moyenne en ligne droite, le trajet moyen et la vitesse curvilinéaire des spermatozoïdes extraits de la queue de l'épididyme.
Narotsky et coll. (1997) ont étudié les effets du BDCM chez des rats F344 exposés à des doses de 0, 25, 50 ou 75 mg/kg p.c. par jour, administrées par gavage dans des milieux aqueux ou huileux du 6e au 15e jour de gestation. Le BDCM a produit des résorptions complètes de la portée chez les groupes ayant reçu des doses en solution aqueuse (8 % et 83 %, respectivement) et dans l'huile de maïs (17 % et 21 %, respectivement). Le BDCM était toxique pour la mère à ces doses. D'après des études de suivi, le BDCM agit selon deux modes d'action qui provoquent une perte de grossesse chez les rates F344 (perturbation hypothalamo-hypophysaire de la sécrétion de l'hormone lutéinisante et perturbation de la réponse lutéale à l'hormone lutéinisante), et l'effet des résorptions complètes de la portée est spécifique de la souche de rats, les rats Sprague-Dawley n'ayant pas été affectés par l'exposition au BDCM (Bielmeier et coll., 2001, 2004, 2007).
Au cours d'une étude sur le développement réalisée par Christian et coll. (2001), on a administré à des rats Sprague-Dawley et à des lapins blancs de Nouvelle-Zélande du BDCM dans l'eau potable au cours des jours de gestation 6 à 21 chez les rats et 6 à 29 chez les lapins. Les doses moyennes consommées étaient de 0, 2,2, 18,4, 45,0 ou 82,0 mg/kg p.c. par jour chez les rats et de 0, 1,4, 13,4, 35,6 ou 55,3 mg/kg p.c. par jour chez les lapins. On a constaté des retards minimes de l'ossification des phalanges des pattes avant ainsi que des métatarses et des phalanges des pattes arrière chez les fœtus de rat exposés à 82,0 mg/kg p.c. par jour. On a jugé ces retards marginaux, réversibles et associés à une diminution importante du gain de poids de la mère. Aucun effet lié au traitement n'a été observé chez les fœtus de lapin.
Au cours d'une étude de la reproduction s'étendant sur deux générations, on a administré à des rats Sprague-Dawley des doses de BDCM dans l'eau potable à des concentrations de 0, 50, 150 ou 450 mg/L (équivalant à 0, 4,1 à 12,6, 11,6 à 40,2 ou 29,5 à 109,0 mg/kg p.c. par jour). Dans les deux groupes exposés aux doses les plus fortes, on a observé une mortalité et des signes cliniques associés à une baisse de la consommation d'eau, une diminution du poids corporel et du gain de poids, ainsi qu'une réduction de la consommation d'aliments. On a attribué à une baisse importante du poids corporel des petits un bref retard de la maturation sexuelle (séparation du prépuce, ouverture du vagin) et une augmentation du nombre de rats F1 présentant un diœstrus prolongé. Les auteurs se sont demandé si le retard de maturation sexuelle devrait être considéré comme une toxicité générale ou une toxicité pour la reproduction, étant donné qu'il était associé à une déshydratation causée par la palatabilité réduite du BDCM (Christian et coll., 2002).
Les effets tératogènes de l'exposition au BDCM ont été étudiés sur des embryons de poisson-zèbre (Teixido et coll., 2015). L'exposition au BDCM dans des flacons en verre scellés (pour empêcher la volatilisation) 4 à 76 heures après la fécondation a entraîné des effets nocifs sur le développement, notamment des malformations des yeux, du cœur et de la queue, ainsi qu'un retard de croissance, de mouvement et d'éclosion. Sur les quatre THM examinés dans cette étude, le BDCM a été classé comme ayant une puissance semblable à celle du bromoforme, avec une CE50 de 0,26 mM.
Un groupe d'experts formé par Santé Canada en 2008 pour évaluer la toxicité du BDCM a déterminé que « même s'il a été démontré que le BDCM a des effets nocifs sur la reproduction des animaux, ces effets n'ont été observés qu'à des doses toxiques pour la mère, qui sont 5 000 à 15 000 fois plus élevées que les concentrations trouvées dans l'eau potable ». Dans l'ensemble, le poids actuel de la preuve tirée des études toxicologiques ne permet pas d'établir un lien entre les effets nocifs sur la reproduction et le développement et l'exposition au BDCM à des concentrations présentes dans l'eau potable chlorée » (Santé Canada, 2008a).
2.3.3.3 DBCM
La toxicité du DBCM pour la reproduction et le développement a fait l'objet d'un petit nombre d'études. Dans ces études, l'exposition au DBCM ne semble pas avoir entraîné d'effets sur la reproduction et le développement, sauf à des concentrations qui provoquent également une toxicité maternelle.
Au cours d'une étude sur la reproduction qui s'est étendue sur plusieurs générations, on a exposé des groupes de souris ICR, 10 mâles et 30 femelles, à des doses de 0, 0,1, 1,0 ou 4,0 g/L (0, 17, 171 ou 685 mg/kg p.c. par jour) de DBMC dans de l'Emulphor administrées dans l'eau potable pendant 35 jours et on les a ensuite accouplés. Les accouplements subséquents ont eu lieu deux semaines après le sevrage (Borzelleca et Carchman, 1982). Les souris F1 ont été exposées à la même solution d'essai pendant 11 semaines après le sevrage, puis accouplées. Les accouplements suivants ont eu lieu deux semaines après le sevrage. À une dose de 17 mg/kg p.c. par jour, on n'a constaté qu'une légère baisse du poids corporel des nouveau-nés de la génération F2b. À une dose de 171 mg/kg p.c. par jour, on a constaté une baisse importante du poids corporel des femelles et une augmentation de l'apparition de pathologies macroscopiques du foie chez les souris F0 et F1b. La taille des portées et la viabilité des petits ont diminué dans les deux générations. À une dose de 685 mg/kg p.c. par jour, les effets étaient du même genre, mais plus graves. La taille des portées et la viabilité des petits ont diminué dans les deux générations. Les animaux présentaient une hypertrophie du foie et des changements morphologiques apparents. Le gain de poids corporel a diminué considérablement autant chez les mâles que chez les femelles. L'indice de gestation, la fertilité et la survie de la génération F1 ont en outre diminué considérablement. La fertilité a diminué chez la génération F2 (PISC, 2000).
Les effets du DBCM ont été étudiés chez des groupes de 15 rats Sprague-Dawley auxquels on a administré du bromoforme à des doses de 50, 100 ou 200 mg/kg p.c. par jour, par gavage dans de l'huile de maïs, du 6e au 15e jour de gestation (Ruddick et coll., 1983). Le gain de poids chez la mère a diminué dans le groupe exposé à la dose élevée. Aucune différence significative n'a été observée entre les groupes exposés et les groupes témoins en ce qui concerne les foyers de résorption, le nombre de fœtus par portée, le poids des fœtus, les malformations macroscopiques des fœtus, les anomalies squelettiques ou viscérales ou les effets histopathologiques liés au traitement.
L'absence d'effets est étayée par une étude du NTP au cours de laquelle des rats Sprague-Dawley ont été exposés à des doses de 0, 50, 150 ou 450 ppm de DBCM administrées dans l'eau potable pendant 35 jours (NTP, 1996). En raison de la réduction de l'apport en eau, les doses ont été estimées équivalentes à 4,2, 12,4 et 28,2 mg/kg par jour pour les mâles, à 6,3, 17,4 et 46,0 mg/kg par jour pour les femelles du groupe A (exposition périconceptionnelle, accouplées avec des mâles exposés) et à 7,1, 20,0 et 47,8 mg/kg par jour pour les femelles du groupe B (exposition gestationnelle, accouplées avec des mâles non exposés). Aucun signe clinique de toxicité n'a été observé, ni aucune lésion histopathologique. Aucun effet significatif sur les paramètres de reproduction ou de fertilité n'a été observé, peu importe la dose administrée. De légers changements dans les paramètres biochimiques ont été observés chez les mâles, bien qu'aucune tendance dose-réponse n'ait été relevée.
Les effets tératogènes de l'exposition au DBCM ont été étudiés sur des embryons de poisson-zèbre (Teixido et coll., 2015). L'exposition au DBCM dans des flacons en verre scellés (pour empêcher la volatilisation) 4 à 76 heures après la fécondation a entraîné des effets nocifs sur le développement, notamment des malformations des yeux, du cœur et de la queue, ainsi qu'un retard de croissance, de mouvement et d'éclosion. Sur les quatre THM examinés dans cette étude, le DBCM a été classé comme étant le plus puissant, avec une CE50 de 0,16 mM.
2.3.3.4 Bromoforme
La toxicité du bromoforme pour la reproduction et le développement a fait l'objet d'un petit nombre d'études. Les effets du bromoforme ont été étudiés chez des groupes de 15 rats Sprague-Dawley auxquels on a administré du bromoforme à des doses de 50, 100 ou 200 mg/kg p.c. par jour, par gavage dans de l'huile de maïs, du 6e au 15e jour de gestation (Ruddick et coll., 1983). Aucune différence significative n'a été observée entre les groupes exposés et les groupes témoins en ce qui concerne les foyers de résorption, le nombre de fœtus par portée, le poids des fœtus, les malformations macroscopiques des fœtus, les anomalies viscérales ou les effets histopathologiques liés au traitement. Plusieurs anomalies du squelette ont été observées chez les petits, notamment la présence d'une 14e côte, de côtes ondulées, de déviations de l'os interpariétal et d'aberrations des sternèbres. La signification statistique de ces anomalies squelettiques n'a pas été signalée par les auteurs. Cependant, les calculs de l'OEHHA (2020) révèlent que l'incidence des aberrations des sternèbres était significativement différente de celle des témoins à la plus forte dose mise à l'essai (OEHHA, 2020).
On a étudié l'effet du bromoforme sur la fertilité et la reproduction de souris Swiss CD1 suivant un protocole d'évaluation de la reproduction continue (NTP, 1989b). Dans le cadre de cette étude, les souris ont été exposées par gavage dans l'huile de maïs à des doses de 0, 50, 100 ou 200 mg/kg p.c. par jour pendant 105 jours. On n'a signalé aucun effet sur la reproduction (par exemple portées par paires, nombre de petits vivants par portée, sexe des petits vivants, poids corporel des petits) des parents ou des individus de la génération F1. Aucun effet sur la densité, la motilité ou la morphologie des spermatozoïdes dans les épididymes n'a été observé chez les mâles F1. Une légère hausse de la mortalité postnatale a été observée.
Les effets tératogènes de l'exposition au bromoforme ont été étudiés sur des embryons de poisson-zèbre (Teixido et coll., 2015). L'exposition au bromoforme dans des flacons en verre scellés (pour empêcher la volatilisation) 4 à 76 heures après la fécondation a entraîné des effets nocifs sur le développement, notamment des malformations des yeux, du cœur et de la queue, ainsi qu'un retard de croissance, de mouvement et d'éclosion. Sur les quatre THM examinés dans cette étude, le bromoforme a été classé comme ayant une puissance semblable à celle du BDCM, avec une CE50 de 0,20 mM.
2.3.3.5 Mélanges de THM
Quelques études se sont intéressées aux effets sur la reproduction et le développement de l'exposition à un mélange de THM ainsi que de l'exposition combinée aux THM et à d'autres SPD. Comme ces études portaient sur des mélanges, les effets observés n'ont pas pu être attribués à un THM donné.
Narotsky et coll. (2011) ont examiné les pertes de grossesse et les malformations oculaires chez la progéniture de rats F344 après une exposition gestationnelle à un mélange des quatre THM, à un mélange de cinq acides haloacétiques (AHA) et à un mélange de THM et d'AHA. Des rats ont été exposés par gavage (dans un émulsifiant d'éthoxylates d'huile de ricin), aux jours de gestation 6 à 20, aux trois mélanges à des concentrations faibles, moyennes et élevées (307, 613, 920 μmol/kg). Les proportions des SPD étaient basées sur les concentrations observées dans un échantillon d'eau chlorée. Une toxicité maternelle (par exemple perte de poids, diminution du gain de poids, horripilation) a été observée à toutes les concentrations de dose pour le mélange de THM. Pour tous les mélanges, une perte de grossesse a été observée à partir d'une dose de 613 μmol/kg.
Narotsky et coll. (2015) ont exposé des rats à un mélange composé, dans des proportions réalistes, de quatre THM et de cinq AHA à 0, 500 fois, 1 000 fois ou 2 000 fois les « maximum contaminant levels »(MCL) établis par l'Environmental Protection Agency des États-Unis (U.S. EPA). Les résultats de l'essai biologique multigénérationnel ont révélé qu'il n'y avait aucun effet nocif sur la fertilité, le maintien de la grossesse, la survie prénatale, la survie postnatale ou le poids à la naissance. Il est possible que la rétention des mamelons et les effets sur la motilité des spermatozoïdes chez les mâles, ainsi que les retards de puberté chez les mâles et les femelles aient été attribuables à la réduction de la consommation d'eau et du poids corporel.
Guariglia et coll. (2011) ont étudié les effets de toxicité pour le développement neurologique de souris exposées à un mélange de chloroforme, de bromoforme et de perchloroéthylène dans l'eau potable, depuis le début de la reproduction jusqu'au 30e jour postnatal. Les souris mâles, mais pas les souris femelles, ont présenté des comportements de type autistique, notamment quelques vocalisations, de l'anxiété, des comportements répétitifs et des déficiences sociales.
2.3.3.6 THM iodés
On ne dispose d'aucun renseignement sur la toxicité des THM iodés pour la reproduction et le développement.
2.3.4 Génotoxicité et cancérogénicité
La mutagénicité et la génotoxicité des THM ont été évaluées dans un large éventail d'essais et un certain nombre de conditions expérimentales (voir Richardson et coll., 2007; OEHHA, 2020; Cortes et Marcos, 2018; et de Castro Medeiros et coll., 2019 pour revues).
2.3.4.1 Chloroforme
Si le chloroforme a donné des résultats positifs dans certaines conditions d'essai, la prépondérance des données suggère toutefois qu'il présente un faible potentiel génotoxique. Dans bien des cas, les résultats positifs étaient légers et pourraient s'expliquer par les conditions expérimentales de l'essai (par exemple ils se sont produits à des concentrations cytotoxiques) (OEHHA, 2020).
Plusieurs études se sont penchées sur la cancérogénicité du chloroforme chez les rongeurs découlant d'une exposition par voie orale, d'une exposition par inhalation et d'une exposition combinée par voie orale et par inhalation. Dans quelques-unes de ces études, des tumeurs rénales ou hépatiques ont été associées à l'exposition au chloroforme.
Au cours d'une étude antérieure effectuée par le National Cancer Institute (NCI), on a administré par gavage du chloroforme dans de l'huile de maïs à des groupes de rats Osborne-Mendel et de souris B6C3F1 (50 mâles et 50 femelles). Les rats mâles ont reçu 0, 90 ou 180 mg/kg p.c. cinq fois par semaine pendant 78 semaines et les rats femelles ont reçu 0, 125 ou 250 mg/kg p.c. cinq fois par semaine au cours des 22 premières semaines, et ensuite les mêmes doses que les mâles pendant les semaines suivantes. Pendant les 18 premières semaines, on a administré des doses de 0, 100 ou 200 mg/kg p.c. aux souris mâles et de 0, 200 ou 400 mg/kg p.c. aux souris femelles. Après 18 semaines, les doses sont passées à 0, 150 et 300 mg/kg p.c. pour les souris mâles et à 0, 250 et 500 mg/kg p.c. pour les souris femelles pendant le reste de la période d'exposition (NCI, 1976).
Chez les rats mâles, on a constaté une augmentation significative, liée à la dose, de l'incidence des carcinomes du rein. Ces tumeurs n'ont pas été observées chez les rats femelles, mais on a relevé chez ces dernières une augmentation non significative des tumeurs de la thyroïde (adénocarcinomes et carcinomes). On a observé des augmentations très significatives de l'incidence des carcinomes hépatocellulaires chez les souris des deux sexes. Une hyperplasie nodulaire a aussi été observée chez les mâles exposés à de faibles doses. À la suite d'un nouvel examen d'échantillons de tissus prélevés au cours du dosage biologique de cancérogenèse effectué par le NCI, Reuber (1979) a confirmé les résultats du NCI et a aussi signalé des nodules hyperplasiques et des carcinomes hépatocellulaires chez des rats mâles et femelles, ainsi que des lymphomes malins chez des souris mâles et femelles.
Dans une étude ultérieure portant sur des espèces animales et des doses semblables, mais utilisant l'eau potable comme milieu, Jorgenson et coll. (1985) ont évalué l'exposition de rats Osborne-Mendel mâles (50 à 330 animaux par groupe) et de souris B6C3F1 femelles (50 à 430 animaux par groupe) à des doses de 0, 200, 400, 900 ou 1 800 mg/L de chloroforme pendant 104 semaines; les doses moyennes pondérées dans le temps et basées sur le poids corporel de l'animal variaient de 19 à 160 mg/kg p.c. par jour chez le rat et de 34 à 263 mg/kg p.c. par jour chez la souris. Afin d'augmenter la sensibilité nécessaire pour détecter de faibles taux de réponse, les groupes exposés à de faibles doses étaient de plus grande taille. Il y avait également deux groupes témoins (n = 330 et n = 50), dont un (n = 50) était apparié au groupe exposé à la dose élevée pour ce qui est de l'apport en eau, car les animaux des groupes recevant la dose élevée refusaient souvent de boire l'eau contenant du chloroforme et étaient donc privés d'eau.
Contrairement aux résultats du bio-essai du NCI décrits ci-dessus, au cours duquel on a observé des tumeurs hépatiques chez les souris des deux sexes, on n'a pu établir de lien entre l'exposition et l'augmentation de l'incidence de tumeurs de tous types chez les souris femelles. Jorgenson et coll. (1985) laissent entendre que les tumeurs hépatiques observées chez la souris au cours de l'étude du NCI pourraient être le résultat de l'interaction entre le chloroforme et l'huile de maïs utilisée comme milieu. En ce qui concerne les effets sur les reins, il y a eu une augmentation, liée à la dose, de l'incidence de tumeurs rénales chez le rat, bien que l'incidence d'adénomes et d'adénocarcinomes combinés des cellules tubulaires ait été légèrement inférieure aux valeurs de l'essai biologique du NCI. Une nouvelle analyse des lames d'anatomopathologie de l'étude de Jorgenson et coll. (1985) a confirmé la présence d'altérations des tubules (entre autres, basophilie cytoplasmique, vacuolisation cytoplasmique et encombrement nucléaire, ce qui est compatible avec une hyperplasie simple des tubules). L'analyse a démontré que les dommages soutenus des cellules des tubules proximaux constituent une lésion précurseur des tumeurs provoquées par le chloroforme (Hard et coll., 2000).
Dans une série d'expériences, Roe et coll. (1979) ont étudié la cancérogénicité du chloroforme sur quatre souches de souris (C57Bl, CBA, CF/1 et ICI). Les souris ont été exposées par gavage à du chloroforme administré dans de la pâte dentifrice ou de l'huile d'arachide, à des doses allant jusqu'à 60 mg/kg, six jours par semaine pendant 80 semaines. Aucune tumeur liée à l'exposition n'a été observée dans trois des quatre souches (souris C57Bl, CBA et CF/1). On a toutefois constaté une augmentation des tumeurs épithéliales du rein chez les souris ICI mâles à la dose de 60 mg/kg par jour. L'écart était plus marqué lorsqu'on a administré le chloroforme dans de l'huile d'arachide plutôt que dans de la pâte dentifrice. Les résultats de cette étude indiquent que la réponse tumorigène dans le rein de la souris est spécifique de la souche.
Palmer et coll. (1979) ont évalué la cancérogénicité du chloroforme administré à des rats SD par gavage dans du dentifrice à raison de 60 mg/kg, six jours par semaine pendant 80 semaines. Aucune tumeur rénale ou hépatique n'a été décelée dans l'un ou l'autre des groupes. Cependant, la faible capacité de survie des animaux témoins et des animaux exposés a probablement réduit la sensibilité en matière de détection des effets.
Tumasonis et coll. (1985, 1987) ont évalué la cancérogénicité du chloroforme administré à des rats Wistar dans l'eau potable pendant 180 semaines. Les doses moyennes pondérées dans le temps étaient équivalentes à 200 mg/kg par jour pour les mâles et à 240 mg/kg par jour pour les femelles. Une augmentation significative de l'incidence des nodules néoplasiques (siège non précisé) et une augmentation significative de l'incidence de l'adénofibrose hépatique ont été observées chez les rats femelles. Les rats mâles présentaient aussi une augmentation significative de l'adénofibrose hépatique. Il convient de noter qu'il y a eu un débat sur la question de savoir si les cellules du canal biliaire du rat pouvaient en fait se transformer en tumeurs adénomateuses; d'autres auteurs ont décrit des lésions similaires comme étant des carcinomes cholangiocellulaires (OEHHA, 2020).
En ce qui concerne les études d'exposition par inhalation, Yamamoto et coll. (2002) ont exposé des groupes de rats F344 et de souris BDF1 (50 mâles et 50 femelles) à des vapeurs de chloroforme à raison de six heures par jour, cinq jours par semaine pendant 104 semaines. Les rats ont été exposés à des concentrations de 0, 10, 30 ou 90 ppm et les souris à des concentrations de 0, 5, 30 ou 90 ppm. Chez les souris mâles, une augmentation significative, liée à la dose, du nombre de carcinomes et d'adénomes combinés des cellules rénales a été observée. Chez les souris femelles, une augmentation significative, liée à la dose, du nombre de carcinomes et d'adénomes hépatocellulaires combinés a été observée. Chez le rat, il n'y a eu aucune augmentation significative de l'incidence des tumeurs rénales ou hépatiques.
Nagano et coll. (2006) ont étudié l'exposition combinée des rats, par inhalation et par voie orale, au chloroforme. Des groupes de 50 rats F344 mâles ont été exposés par inhalation à 0, 25, 50 ou 100 ppm de vapeur de chloroforme (apport estimé de 20, 39 et 78 mg/kg par jour) à raison de six heures par jour, cinq jours par semaine pendant 104 semaines. Chaque groupe exposé par inhalation a également reçu 0 ou 1 000 ppm de chloroforme dans l'eau potable (apport estimé de 45 mg/kg par jour) administrée à volonté 24 heures par jour, sept jours par semaine pendant 104 semaines. Une incidence accrue des adénomes et des carcinomes à cellules rénales a été observée dans les groupes exposés à la fois par inhalation et par voie orale, mais pas dans les groupes exposés uniquement par voie orale ou par inhalation. L'étude a permis de conclure que l'exposition combinée par inhalation et par voie orale augmentait nettement la cancérogénicité du rein chez les rats mâles.
Le CIRC considère que le chloroforme est peut-être cancérogène pour l'homme (groupe 2B) (CIRC, 1999a), et l'U.S. EPA considère qu'il est probablement cancérogène pour l'humain (groupe B2) (U.S. EPA, 2001). Ces classifications reposent en grande partie sur la tumorigenèse rénale et hépatique chez les rongeurs et sont étayées par de solides données probantes selon lesquelles le chloroforme agit principalement par des mécanismes non génotoxiques faisant intervenir le métabolisme oxydatif, la cytotoxicité et la prolifération des cellules régénératives.
2.3.4.2 THM bromés
La mutagénicité et la génotoxicité du BDCM, du DBCM et du bromoforme ont été étudiées dans le cadre de divers essais in vitro et in vivo (OEHHA, 2020). Contrairement au chloroforme, le poids de la preuve permet de conclure à la mutagénicité et à la génotoxicité des THM bromés. Le pouvoir mutagène bactérien relatif des THM bromés est classé comme suit : bromoforme = DBCM > BDCM (DeMarini et coll., 1997). Dans une expérience réalisée au moyen de l'essai d'électrophorèse sur gel de cellules isolées (EGCI) sur la lignée cellulaire humaine HepG2, Zhang et coll. (2012) ont classé les THM dans l'ordre qui suit, en fonction de leur capacité à endommager l'ADN : BDCM > DBCM > bromoforme > chloroforme.
L'eau potable traitée et l'eau de piscine reconnues pour la présence de THM se sont également révélées génotoxiques pour les cellules bactériennes et animales (Cortes et Marcos, 2018; de Castro Medeiros et coll., 2019).
Plusieurs études in vivo menées sur le rat ont démontré la formation de foyers de cryptes aberrantes, des lésions prénéoplasiques, dans le côlon de rats (mais pas de souris), à la suite d'une exposition à des doses uniques de THM bromés (DeAngelo et coll., 2002; McDorman et coll., 2003; Geter et coll., 2004a, 2005). Des études sur le BDCM ont montré que la formation de foyers de cryptes aberrantes était indépendante du véhicule d'administration (à savoir de l'huile de maïs au lieu de l'eau potable) (Geter et coll., 2004a). Des facteurs liés à l'alimentation, comme les matières grasses et les folates, peuvent influer sur la promotion de lésions induites par les THM, en particulier dans le cas du bromoforme (Geter et coll., 2004a,b, 2005). Lorsque des rats étaient exposés au bromoforme dans l'eau potable en conjonction avec un régime alimentaire riche en matières grasses, une hausse de près du double de foyers de cryptes aberrantes a été observée par rapport à des rats nourris au bromoforme et par un régime alimentaire normal (Geter et coll., 2004c). En revanche, les folates alimentaires ont assuré une protection contre les foyers de cryptes aberrantes. Leur nombre a diminué de manière significative chez les rats ayant reçu du bromoforme administré dans l'eau potable en même temps qu'une alimentation normale contenant des folates, par rapport à une alimentation sans folate (Geter et coll., 2005). Les données montrent également que les foyers de cryptes aberrantes sont des lésions précurseurs du cancer du côlon (adénomes et adénocarcinomes) chez l'humain (Konstantakos et coll., 1996; Siu et coll., 1997).
2.3.4.3 BDCM
Les essais de mutagénicité et de génotoxicité du BDCM (voir OEHHA [2020] pour une revue des données) ont produit des résultats mitigés. Cependant, le poids de la preuve indique que le BDCM est probablement génotoxique. Certains essais de mutagénicité bactérienne ont donné des résultats positifs, et les essais de mutagénicité in vitro sur des cellules de lymphome de souris ont donné des résultats positifs ou équivoques. On a aussi obtenu des résultats positifs dans certains tests d'échange de chromatides sœurs et d'aberrations chromosomiques in vivo et in vitro.
Plusieurs études ont évalué la cancérogénicité du BDCM chez les rongeurs suite à une exposition orale (gavage dans de l'huile de maïs, dans les aliments et dans l'eau potable). Aucune étude portant sur la cancérogénicité par inhalation n'a été recensée.
Dans le cadre d'une étude du NTP sur la cancérogénicité, des groupes de rats F344/N et de souris B6C3F1 (50 mâles et 50 femelles) ont reçu du BDCM administré par gavage dans de l'huile de maïs à raison de cinq jours par semaine pendant 102 semaines. Les rats ont reçu 0, 50 ou 100 mg/kg p.c. par jour, les souris mâles ont reçu 0, 25 ou 50 mg/kg p.c. par jour et les souris femelles ont reçu 0, 75 ou 150 mg/kg p.c. par jour (NTP, 1987). Les données démontrent clairement la présence de cancérogénicité induite chez les rats mâles et femelles sur la base d'une augmentation de l'incidence d'adénomes et d'adénocarcinomes des cellules des tubules rénaux, ainsi que de polypes adénomateux et d'adénocarcinomes du gros intestin. L'incidence accrue d'adénomes et d'adénocarcinomes (combinés) du rein chez le mâle et d'adénomes et de carcinomes hépatocellulaires (combinés) chez la souris femelle démontre aussi clairement une cancérogénicité induite chez les souris B6C3F1 des deux sexes.
Une étude de 185 semaines menée sur des rats Wistar exposés à du BDCM administré dans l'eau potable a également donné des résultats positifs (Tumasonis et coll., 1985). Dans cette étude, les animaux ont été exposés à 2 400 mg/L pendant les 72 premières semaines, puis à 1 200 mg/L pendant les 113 semaines restantes, en raison d'une augmentation progressive de l'apport en eau. Les doses quotidiennes n'ont pas été signalées par les auteurs, mais un autre examen a permis d'estimer les valeurs tirées d'un graphique de la publication à une moyenne d'environ 175 mg/kg p.c. par jour pour les femelles et 100 mg/kg p.c. par jour pour les mâles (OEHHA, 2020). Une incidence considérablement accrue de nodules néoplasiques a été constatée dans le foie des rats femelles, mais pas dans celui des mâles. On a également observé une incidence importante d'adénofibrose hépatique (lésions prolifératives des canaux biliaires) et de lymphosarcome chez les femelles exposées.
Dans une autre étude, la cancérogénicité du BDCM a été évaluée chez des rats F344/N mâles et des souris B6C3F1 mâles. Les rats et les souris ont été exposés pendant 104 semaines à des concentrations de 0,07, 0,35 ou 0,70 g/L et de 0,05, 0,25 ou 0,5 g/L de BDCM, respectivement, dans l'eau potable (contenant 0,25 % d'Emulphor) (George et coll., 2002). Ces valeurs correspondent approximativement à des doses quotidiennes moyennes de 3,9, 20,6 et 36,3 mg/kg par jour pour les rats et de 8,1, 27,2 ou 43,4 mg/kg par jour pour les souris pendant toute la durée de l'étude. Chez le rat, les adénomes hépatocellulaires et les adénomes et carcinomes hépatocellulaires combinés ont augmenté de façon significative à la dose faible, de façon non significative à la dose moyenne et de façon comparable aux valeurs des groupes témoins à la dose élevée. Selon les auteurs, une diminution du métabolisme aux doses élevées pourrait être à l'origine de ce résultat. Chez la souris, aucune augmentation du nombre de néoplasmes hépatocellulaires ou de néoplasmes des cellules tubulaires rénales n'a été observée.
Une étude de la cancérogénicité du BDCM par le régime alimentaire n'a révélé aucune incidence significative des lésions néoplasiques chez le rat (Aida et coll., 1992b). Des rats Wistar ont reçu dans leur alimentation du BDCM microencapsulé à des concentrations équivalentes à 0, 6,1, 25,5 ou 138,0 mg/kg par jour pour les mâles et à 0, 8,0, 31,7 ou 168,4 mg/kg par jour pour les femelles pendant une période allant jusqu'à 24 mois. Les tumeurs suivantes ont été observées : trois cholangiocarcinomes et deux adénomes hépatocellulaires chez les femelles exposées à la dose élevée, un adénome hépatocellulaire chez une femelle du groupe témoin, un cholangiocarcinome chez un mâle exposé à la dose élevée et un adénome hépatocellulaire chez un mâle ayant reçu la dose faible et chez un mâle ayant reçu la dose élevée. Les auteurs de l'étude ont conclu qu'il n'y avait aucune preuve évidente que le BDCM microencapsulé était cancérogène dans les conditions de l'étude.
Comme l'a mentionné le CIRC (1999b), Voronin et coll. (1987) ont examiné la cancérogénicité du BDCM chez la souris. Des animaux ont été exposés à du BDCM administré dans l'eau potable à des concentrations de 0, 0,04, 4,0 et 400 mg/L pendant 104 semaines, ce qui équivaut à des doses quotidiennes moyennes d'environ 0, 0,007 6, 0,76 et 76 mg/kg par jour. Aucune hausse significative des tumeurs n'a été constatée, et le BDCM n'était pas considéré comme cancérogène dans les conditions de l'étude.
En vue de mieux caractériser la toxicité du BDCM, une deuxième étude du NTP a permis d'évaluer les effets du BDCM chez les rats F344/N mâles et chez les souris B6C3F1 femelles exposés par l'eau potable pendant deux ans (NTP, 2006). Des groupes de 50 rats F344/N mâles ont été exposés à des concentrations cibles équivalant à des doses quotidiennes moyennes de 0, 6, 12 ou 25 mg/kg p.c. de BDCM. Des groupes de 50 souris B6C3F1 femelles ont été exposés à des concentrations cibles équivalant à des doses quotidiennes moyennes de 0, 9, 18 ou 36 mg/kg p.c. de BDCM. Dans les conditions de cette étude de deux ans sur l'eau potable, il n'y avait aucun signe d'activité cancérogène chez les rats mâles ni chez les souris femelles. Toutefois, un polype adénomateux a été observé dans le gros intestin d'un rat du groupe ayant reçu la dose la plus élevée. Lors de l'évaluation des différences entre les résultats des études du NTP sur l'huile de maïs et sur l'eau potable, les auteurs ont déclaré que « les différentes réponses observées dans ces études ont été attribuées aux différences dans la dosimétrie des organes par ces voies d'exposition et aux influences possibles des facteurs liés à l'alimentation et des différences de poids corporel sur le développement des néoplasmes » (NTP, 2006).
D'autres études menées par le NTP visaient à caractériser la toxicité du BDCM à l'aide de deux souches de souris génétiquement modifiées : les souris hémizygotes Tg.AC et les souris à haploïde semi-dominant p53, considérées comme des modèles sensibles au développement de cancers (NTP, 2007). Les animaux ont été exposés au BDCM par gavage dans de l'huile de maïs, par l'eau potable et par voie cutanée (souris Tg. AC uniquement) pendant 6 à 9 mois. Aucune augmentation de l'incidence de tumeurs n'a été observée chez les mâles ou les femelles des deux souches de souris exposées par l'une ou l'autre des voies. Comme le BDCM a provoqué le cancer dans d'autres études menées sur différents rongeurs, le NTP a conclu que ces souris génétiquement modifiées n'étaient peut-être pas aussi sensibles que prévu pour la détection de composés cancérogènes.
Le CIRC considère que le BDCM est peut-être cancérogène pour l'homme (groupe 2B) (CIRC, 1999a), et l'U.S. EPA considère qu'il est probablement cancérogène pour l'humain (groupe B2) (U.S. EPA, 1993).
2.3.4.4 DBCM
La génotoxicité du DBCM a été évaluée dans un certain nombre d'essais (voir OEHHA [2020] pour une revue des données). Malgré des résultats mitigés, le DBCM a produit des résultats positifs à la suite des essais de mutagénicité bactérienne et de mutagénicité sur des cellules de lymphome de souris en culture. Le DBCM a également des résultats positifs en ce qui concerne l'induction d'échanges de chromatides sœurs et d'aberrations chromosomiques in vivo et in vitro, de dommages à l'ADN de bactéries et d'une aneuploïdie dans les cellules de mammifères.
Au cours d'un bio-essai de cancérogénèse effectué par le NTP, on a administré du DBCM par gavage dans de l'huile de maïs, à des doses de 0, 40 ou 80 mg/kg p.c., à raison de cinq fois par semaine pendant 104 semaines, à des groupes de 50 mâles et femelles de rats F344/N (NTP, 1985). Des groupes de 50 souris B6C3F1 mâles et femelles ont reçu de la même façon des doses de 0, 50 ou 100 mg/kg p.c. cinq fois par semaine pendant 105 semaines. Les résultats de l'étude n'ont révélé aucun signe de cancérogénicité chez le rat. Chez la souris B6C3F1 mâle, les signes de cancérogénicité étaient toutefois équivoques, d'après une augmentation significative de l'incidence des carcinomes hépatocellulaires, mais une augmentation marginale seulement des adénomes ou carcinomes hépatocellulaires (combinés) (incidence des carcinomes hépatocellulaires chez les souris témoins et les souris exposées à la dose élevée de 10/50 et 19/50, respectivement; incidence combinée des adénomes et des carcinomes hépatocellulaires de 23/50 et 27/50, respectivement). Cependant, en raison d'une erreur de dosage, le nombre de survivants dans le groupe des souris mâles exposées à la dose faible n'était pas suffisant pour permettre l'analyse. Par conséquent, il n'a pas été possible de déterminer la cancérogénicité du DBCM. On a aussi produit certaines preuves de cancérogénicité chez la souris femelle fondées sur une incidence accrue des adénomes hépatocellulaires et des adénomes ou carcinomes hépatocellulaires (combinés). L'incidence des adénomes et des carcinomes hépatiques (combinés) chez les souris témoins, les souris exposées à la dose faible et les souris exposées à la dose élevée s'est établie à 6/50, 10/49 et 19/50 respectivement, l'incidence dans le groupe exposé à la dose élevée étant considérablement différente de celle du groupe témoin.
Comme l'a mentionné le CIRC (1999 b), Voronin et coll. (1987) ont examiné la cancérogénicité du DBCM dans des groupes de 50 souris CBAxC57B1 exposées à des concentrations de 0, 0,04, 4,0 ou 400 mg/L de DBCM dans l'eau potable (0, 0,008, 0,76 ou 76 mg/kg/jour) pendant 104 semaines. Aucune augmentation significative de l'incidence de tumeurs n'a été observée.
Le DBCM est classé comme substance cancérogène possible pour l'humain (groupe C) par l'U.S. EPA (U.S. EPA, 1990a), tandis que le CIRC considère que le DBCM est inclassable quant à sa cancérogénicité pour l'homme (groupe 3) (CIRC, 1999b).
2.3.4.5 Bromoforme
Les essais de génotoxicité du bromoforme ont donné des résultats mitigés (voir OEHHA [2020] pour une revue des données). Le bromoforme a produit des résultats positifs dans certains essais in vitro ou in vivo d'induction de micronoyaux, d'échanges de chromatides sœurs, d'aberrations chromosomiques, notamment des dommages à l'ADN, de mutations létales récessives liées au sexe et d'aneuploïdie.
Au cours d'un bio-essai de la cancérogénicité effectué par le NTP, on a administré du bromoforme par gavage dans de l'huile de maïs, à raison de 0, 100 ou 200 mg/kg p.c., cinq fois par semaine pendant 103 semaines, à des groupes de 50 rats mâles et 50 rats femelles F344/N et à des souris B6C3F1 femelles (NTP, 1989a). Les souris B6C3F1 mâles ont reçu 0, 50 ou 100 mg/kg p.c. dans les mêmes conditions. L'étude a montré certaines preuves de cancérogénicité chez les rats mâles et des preuves évidentes chez les rats femelles basées sur l'incidence accrue de néoplasmes peu communs (polypes adénomateux et adénocarcinomes du gros intestin) chez les deux sexes. L'incidence de ces tumeurs (combinées) chez les femelles du groupe témoin, du groupe exposé à la dose faible et du groupe exposé à la dose élevée était de 0/50, de 1/50 et 8/50, respectivement. Chez les mâles, les valeurs comparables étaient 0/50, 0/50 et 3/50. La baisse de la survie des rats mâles exposés à la dose élevée de bromoforme a toutefois pu réduire la sensibilité du bio-essai en matière de détection d'effets cancérogènes. L'incidence de nodules néoplasiques a aussi été plus élevée chez les rats femelles exposés à la dose faible que chez les témoins. On ne considère toutefois pas qu'il s'agit de lésions néoplasiques induites chimiquement parce que, d'une part, ces lésions ne correspondent pas aux critères actuels du NTP concernant les adénomes hépatocellulaires et que, d'autre part, l'incidence chez les rats femelles exposés à la dose élevée et chez les rats mâles exposés n'a pas augmenté de façon statistiquement significative. Il n'y avait aucune preuve de cancérogénicité chez les souris mâles ou femelles.
Dans le cadre d'une étude préliminaire, des souris mâles de souche A (20/groupe) ont reçu des injections intrapéritonéales de bromoforme jusqu'à trois fois par semaine pendant huit semaines à des doses de 0, 4, 48 ou 100 mg/kg. Une période d'observation de six semaines a suivi l'arrêt du traitement. Bien qu'il n'y ait pas eu d'augmentation liée à la dose du nombre moyen de tumeurs pulmonaires, le bromoforme a induit une augmentation significative des tumeurs à la dose de 48 mg/kg (Theiss et coll., 1977).
Le bromoforme est considéré comme une substance cancérogène probable pour l'humain (groupe B2) par l'U.S. EPA (U.S. EPA, 1990b), tandis que le CIRC considère que le bromoforme est inclassable quant à sa cancérogénicité pour l'homme (groupe 3) (CIRC, 1999b).
2.3.4.6 THM iodés
Il existe très peu d'information sur la génotoxicité et la cancérogénicité des THM iodés, le TIM étant le composé le plus étudié. Le TIM a produit un résultat positif à l'essai de mutagénicité réalisé avec les souches TA98, TA100 et BA13 de Salmonella avec et sans activation métabolique (Haworth et coll., 1983), ainsi qu'à l'essai de mutation directe de résistance de Salmonella typhimurium à la l-arabinose, mais les résultats se sont avérés négatifs après l'ajout d'un système d'activation métabolique exogène (Roldan-Arjona et Pueyo, 1993). Le TIM a produit des résultats négatifs dans la plupart des autres études de génotoxicité, y compris le test du micronoyau et l'essai d'EGCI réalisé avec des cellules de rongeurs NIH3T3 (Wei et coll., 2013), l'essai d'EGCI avec des cellules ovariennes de hamster chinois (CHO) (Richardson et coll., 2008) et pour l'aberration chromosomique dans les cellules embryonnaires de hamster syrien (Hikiba et coll., 2005). L'ensemble des résultats montre que le TIM n'induit pas de mutations chromosomiques, mais plutôt des mutations génétiques. Le TIM a donné un résultat négatif à l'essai de transformation cellulaire pour lequel les résultats positifs sont considérés comme des prédicteurs de la cancérogénicité in vivo (Wei et coll., 2013). Conformément à ce résultat, le TIM ne s'est pas révélé cancérogène lors d'une étude de 78 semaines réalisée sur des rats et des souris mâles et femelles exposés par gavage (NCI, 1978).
Une autre étude a porté sur la mutagénicité de 5 THM iodés (CDIM, DCIM, DBIM, BCIM et TIM) chez la souche RSJ100 de Salmonella, qui exprime l'enzyme de métabolisation GSTT1, et son homologue TPT100, qui ne l'exprime pas. Le CDIM, le DCIM et le DBIM ont également été évalués chez la souche TA100 avec et sans l'ajout d'un système d'activation métabolique exogène. Aucun des THM iodés n'ont été mutagènes pour l'une ou l'autre des souches (DeMarini et coll., 2021).
À l'exception du CDIM, tous les THM iodés ont aussi donné un résultat négatif pour la clastogénicité lors de l'essai EGCI avec des cellules CHO (Richardson et coll., 2008). La raison de la génotoxicité du CDIM est inconnue, mais il a été avancé qu'elle était liée à des différences au niveau du métabolisme ou de la solubilité. Aucune information n'a été identifiée sur la cancérogénicité d'autres THM iodés.
2.4 Mode d'action
2.4.1 Chloroforme
Le poids de la preuve semble indiquer que le chloroforme est une substance cancérogène avec seuil et qu'un mécanisme d'action non génotoxique intervient principalement dans son activité. Le principal mode d'action fait intervenir le métabolisme oxydatif induit par le CYP2E1, ce qui entraîne la formation d'intermédiaires réactifs, dont le phosgène, qui est le métabolite prédominant. Le phosgène peut alors réagir avec les protéines tissulaires, les macromolécules cellulaires, les phospholipides et d'autres nucléophiles cellulaires pour induire une cytotoxicité soutenue et une prolifération des cellules régénératives. La division cellulaire accrue mise en cause dans la prolifération cellulaire soutenue accroît la probabilité de formation de tumeurs. Environnement Canada et Santé Canada (2001) ont conclu que le poids de la preuve lié à ce mode d'action est le plus fort pour les tumeurs hépatiques et rénales chez la souris et plus limité pour les tumeurs rénales chez le rat, bien que des données supplémentaires sur le rat aient été publiées depuis cette évaluation (Nagano et coll., 2006). Ce métabolisme oxydatif du chloroforme par le CYP2E1 est commun aux humains et aux rongeurs (U.S. EPA, 2001); les enfants ne devraient pas présenter une plus grande sensibilité que les adultes (Schoeny et coll., 2006).
La toxicité du chloroforme est clairement plus marquée chez les rongeurs lorsque l'administration se fait dans de l'huile de maïs plutôt que dans l'eau potable, ce qui appuie l'hypothèse selon laquelle la tumorigénicité du chloroforme dépend de la vitesse à laquelle il atteint les tissus cibles et indique aussi que les mécanismes de détoxication doivent être saturés avant que le chloroforme réalise tout son potentiel cancérogène (GlobalTox, 2002).
Même si on estime que le mode d'action prépondérant concerne les trois événements clés décrits ci-dessus (à savoir le métabolisme oxydatif en intermédiaires réactifs, la cytotoxicité et la régénération cellulaire soutenue), une étude menée par l'OEHHA (2020) sur les données existantes en matière de cytotoxicité et de régénération tissulaire indique la possibilité d'un mode d'action supplémentaire. Selon l'OEHHA, il est peu probable que la cytotoxicité et la prolifération régénérative soient les seules responsables de la tumorigénicité du chloroforme; il est possible qu'elles agissent en conjonction avec la toxicité génétique pour former des tumeurs. L'OEHHA mentionne que, selon la théorie actuelle, la cytotoxicité devrait être suivie par la régénération et la formation de tumeurs, et que cette dernière ne devrait pas se produire sans cytotoxicité ni régénération. Cependant, l'étude de l'OEHHA relève un certain nombre de situations dans lesquelles la régénération (mesurée par un indice de marquage dans des coupes histologiques de tissus, c'est-à-dire la proportion de cellules marquées en phase S) a précédé la cytotoxicité ou s'est produite sans celle-ci et de situations où la régénération a atteint un pic puis a été réduite à un niveau proche du bruit de fond, tandis que la cytotoxicité a persisté ou s'est aggravée. Par conséquent, il semble qu'il y ait une certaine incohérence dans les données à l'appui en ce qui concerne le principal mode d'action. En outre, l'OEHHA laisse entendre qu'il existe des preuves selon lesquelles les métabolites réactifs du chloroforme peuvent traverser les membranes nucléaires et se lier de manière covalente aux macromolécules, dont les histones, et peuvent donc influer indirectement sur l'expression de l'ADN. En fin de compte, il est possible que d'autres modes d'action interviennent dans la cancérogénicité du chloroforme. Une investigation plus approfondie de cette hypothèse est nécesssaire.
2.4.2 THM bromés
Contrairement au chloroforme, les THM bromés sont considérés comme des substances cancérogènes sans seuil agissant selon un mode d'action génotoxique. Des intermédiaires réactifs avec l'ADN sont formés lorsque les THM bromés sont métabolisés par des conjugaisons catalysées par la GSTT1-1 (DeMarini et coll., 1997; Pegram et coll., 1997; Ross et Pegram, 2003), ce qui peut conduire à la formation de produits d'addition et, par la suite, de tumeurs. Les intermédiaires réactifs avec l'ADN peuvent se former principalement dans les reins et le gros intestin où, contrairement au foie, l'exposition aux composés bromés peut dépasser la capacité métabolique des enzymes CYP2E1 (c'est-à-dire le métabolisme oxydatif) et, par conséquent, le métabolisme est détourné vers l'autre voie de conjugaison. En effet, plusieurs études in vivo menées sur des rats ont démontré la formation de lésions prénéoplasiques dans le côlon à la suite d'une exposition aux THM bromés (DeAngelo et coll., 2002; McDorman et coll., 2003; Geter et coll., 2004a, 2005).
En outre, des éléments de preuve indiquent que le BDCM induit une hypométhylation lorsqu'il est administré à des rongeurs par l'eau potable ou par gavage (Coffin et coll., 2000); Pereira et coll., 2004; Tao et coll., 2005). Cela laisse penser qu'il pourrait y avoir un mode d'action supplémentaire par l'intermédiaire d'un mécanisme non génotoxique.
2.4.3. THM iodés
Un petit nombre d'études se sont intéressées à la cytotoxicité des THM iodés dans des modèles in vitro. Richardson et coll. (2008) ont examiné la cytotoxicité de six THM iodés dans des cellules CHO. Les auteurs ont constaté que les iodo-trihalométhanes et les iodo-bromo-trihalométhanes étaient plus toxiques que leurs analogues, les iodo-chloro-trihalométhanes, selon l'ordre de cytotoxicité suivant : TIM > BDIM > DBIM > BCIM ≈ CDIM > DCIM. On a aussi comparé la cytotoxicité des THM iodés à celle de leurs analogues non iodés. Il a été déterminé que le TIM était 60 fois et 146 fois plus cytotoxique que le chloroforme et le bromoforme, respectivement. Le BDIM était 8 fois plus cytotoxique que le BDCM, et le DBIM était 3 fois plus cytotoxique que le DBCM. Cette constatation reflète un résultat commun pour les SPD : la cytotoxicité des SPD iodés est supérieure à celle de leurs analogues bromés ou chlorés, les analogues chlorés étant les moins cytotoxiques (Plewa et Wagner, 2009; DeMarini et coll., 2021).
Stalter et coll. (2016) ont mené une série de neuf bio-essais cellulaires in vitro (indiquatifs de différentes étapes de la voie de toxicité cellulaire) avec divers sous-produits de désinfection, dont les THM iodés, afin de mieux comprendre leurs mécanismes moléculaires de toxicité. En comparaison, les THM iodés étaient généralement plus cytotoxiques et activaient la réponse au stress oxydatif (essai AREc32) dans une plus large mesure que les THM. L'activation de la réponse SOS dans le test umuC bactérien (indication de dommages à l'ADN) était également plus élevée pour tous les THM iodés que pour les THM. L'activation de la protéine p53 de suppression tumorale dans l'essai p53-bla (indication de propriétés d'induction tumorale) était évidente dans les cellules exposées aux THM iodés, mais pas dans les cellules exposées aux THM.
Une autre étude a permis d'évaluer la capacité de la GSTT1 d'activer les THM iodés en composés mutagènes comme elle le fait pour les THM bromés. Aucun des cinq THM iodés à l'étude (CDIM, DCIM, DBIM, BCIM et TIM) n'a été activé en mutagènes dans la souche RSJ100 de Salmonella, laquelle exprime l'enzyme de métabolisation GSTT1. Il a été postulé que l'absence d'activation, en particulier pour les deux THM iodés qui contiennent du brome (DBIM et BCIM), pouvait être attribuable au clivage de l'iode et à la formation subséquente de produits cytotoxiques avant toute activation potentielle par la GSTT1. Une autre suggestion était que la présence d'iode les rendait stériquement incompatibles avec l'enzyme GSTT1 (DeMarini et coll., 2021).
2.5 Études clés retenues
2.5.1 Chloroforme
Comme le poids de la preuve semble indiquer que le chloroforme est une substance cancérogène avec seuil qui ne présente pas de risque de cancer aux concentrations détectées dans l'eau potable (Environnement Canada et Santé Canada, 2001; Levesque et coll., 2002; Hrudey et Fawell, 2015), une approche axée sur les effets autres que les effets cancérogènes a été retenue aux fins de l'évaluation des risques. Le point de départ le plus bas relevé dans les études sur l'exposition chronique par voie orale était une LOAEL de 15 mg/kg pour les effets hépatiques chez le chien (Heywood et coll., 1979). Cependant, cette étude ne comportait pas de NOAEL, ne couvrait pas toute la durée de vie du chien, comportait une taille d'échantillon relativement réduite et utilisait un dosage par gavage avec une base de dentifrice en gélule. Par conséquent, deux autres études clés ont été repérées : une étude d'exposition par inhalation d'une durée de deux ans chez le rat et la souris, réalisée par Yamamoto et coll. (2002), et une étude d'exposition combinée par l'eau potable et par inhalation de deux ans chez le rat, réalisée par Nagano et coll. (2006). Une troisième étude de PBPK réalisée par Sasso et coll. (2013) a servi d'étude de soutien. Combinées, ces études présentent des voies d'exposition plus pertinentes (inhalation et eau potable contre gavage avec du dentifrice), une période d'exposition plus longue (vie entière contre moins d'une vie entière), une analyse plus rigoureuse (modélisation de la dose de référence, analyse PBPK et dose équivalente chez l'humain [DEH] contre une LOAEL) et une analyse qui tient compte d'un dosage en bolus pulsé simulant la consommation d'eau potable par un humain sur 24 heures. Le rein, l'une des cibles établies de la toxicité du chloroforme chez les animaux de laboratoire, a été l'organe cible des effets critiques.
Dans l'étude de Yamamoto et coll. (2002), des groupes de 50 rats F344 et de 50 souris BDF1 des deux sexes ont été exposés au chloroforme par inhalation pendant 104 semaines (6 heures par jour, 5 jours par semaine). Les rats ont été exposés à des concentrations de 0, 10, 30 ou 90 ppm et les souris à des concentrations de 0, 5, 30 ou 90 ppm. Les effets sur les reins et le foie ont été examinés à la fin de la période d'exposition. Chez le rat, une hypertrophie nucléaire des tubules proximaux et une dilatation de la lumière tubulaire liées à la dose ont été observées dans les reins des rats des deux sexes à 30 et 90 ppm. Chez la souris, les mâles ont subi une stéatose importante du foie à 90 ppm et une augmentation significative de l'incidence de l'hyperplasie tubulaire atypique, de la basophilie cytoplasmique et de l'hypertrophie nucléaire dans les reins à 30 et 90 ppm. Quant aux femelles, elles ont présenté une hausse importante de la basophilie cytoplasmique à 90 ppm.
L'étude de Nagano et coll. (2006) s'est intéressée aux effets sur les reins d'une exposition au chloroforme à la fois par inhalation et par l'eau potable. Des groupes de 50 rats F344 mâles ont été exposés par inhalation à 0, 25, 50 ou 100 ppm de chloroforme (apport estimé de 20, 39 et 78 mg/kg par jour) à raison de six heures par jour, cinq jours par semaine pendant 104 semaines. Chaque groupe exposé par inhalation a également reçu 0 ou 1 000 ppm de chloroforme dans l'eau potable (apport estimé de 45 mg/kg par jour) administrée à volonté pendant 104 semaines. Les hyperplasies atypiques des tubules rénaux ont augmenté dans les groupes d'exposition combinée, mais pas dans les groupes exposés par une seule voie. En outre, les incidences de basophilie cytoplasmique et de dilatation de la lumière dans les tubules proximaux ont augmenté de manière significative dans les groupes exposés par inhalation à 50 et 100 ppm et dans le groupe exposé par voie orale (1 000 ppm), mais elles étaient significativement plus élevées dans les groupes exposés de manière combinée. L'incidence de l'hypertrophie nucléaire dans les cellules des tubules proximaux s'est accrue de manière significative lors des expositions par inhalation uniquement, à 50 et à 100 ppm, ainsi que lors des expositions combinées de 25 à 100 ppm, mais pas lors des expositions par voie orale uniquement.
Dans la troisième étude, Sasso et coll. (2013) ont utilisé leur modèle PBPK actualisé avec des estimations améliorées du métabolisme du chloroforme dans le rein pour évaluer les données existantes sur la toxicité rénale. Les données de Yamamoto et coll. (2002) et de Nagano et coll. (2006) ont été utilisées et, dans certains cas, combinées, car ces deux études ont été réalisées dans le même centre de recherche, sur la même souche de rats (F344) et ont évalué des effets similaires. Les expositions externes ont été converties en doses internes communes propres au site à l'aide du modèle PBPK. Les données relatives aux lésions histopathologiques ont été regroupées et des analyses de la dose repère (BMD) ont été effectuées pour évaluer la réponse à la dose et le point de départ de quatre effets de toxicité rénale : l'hypertrophie nucléaire des tubules proximaux, l'hyperplasie tubulaire atypique, la dilatation de la lumière tubulaire et la basophilie cytoplasmique. Enfin, les valeurs BMDL10 internes (limite inférieure de confiance à 95 % de la dose repère pour une réponse de 10 %) ont été utilisées avec le modèle PBPK humain pour estimer les DEH (c'est-à-dire la dose externe nécessaire pour produire les valeurs BMDL internes chez l'humain). Une BMDL de 10 a été choisie en raison de la nature binaire des données. Le tableau 14 présente un résumé des BMDL et des DEH calculées pour chaque effet de toxicité. Les courbes dose-réponse ont été grandement guidées par l'inclusion des données combinées sur l'inhalation et l'eau potable provenant à la fois de l'étude de Yamamoto et coll. (2002) et de celle de Nagano et coll. (2006). Par conséquent, la DEH de 4,18 mg/kg p.c. par jour (la plus faible des DEH résultant des expositions combinées) a été retenue comme point de départ pour le chloroforme.
Ensemble, les données sur la toxicité améliorées, les données de modélisation PBPK et la disponibilité d'une DEH pour le chloroforme réduisent le degré d'incertitude et permettent d'affiner l'approche d'évaluation des risques.
| Effet | Référence des données sur la toxicité du chloroforme | Voie | BMDL 10 (mg/kg p.c. par jour) | DEHNote de bas de tableau 14 - a (mg/kg p.c. par jour) |
|---|---|---|---|---|
| Hypertrophie nucléaire des tubules proximaux | Yamamoto et coll. (2002) | Inhalation | 45,02 | 4,27 |
| Yamamoto et coll. (2002) + Nagano et coll. (2006) |
Inhalation | 48,99 | 4,49 | |
| Yamamoto et coll. (2002) + Nagano et coll. (2006) |
Inhalation + voie orale | ~47Note de bas de tableau 14 - b | ~4,34Note de bas de tableau 14 - b | |
| Hyperplasie atypique des tubules | Nagano et coll. (2006) | Inhalation + voie orale | 106,03 | 6,48 |
| Dilatation de la lumière tubulaire | Yamamoto et coll. (2002) | Inhalation | 41,52 | 4,08 |
| Yamamoto et coll. (2002) + Nagano et coll. (2006) |
Inhalation | 43,60 | 4,24 | |
| Yamamoto et coll. (2002) + Nagano et coll. (2006) |
Inhalation + voie orale | 42,02 | 4,18 | |
| Basophilie cytoplasmique | Nagano et coll. (2006) | Inhalation + voie orale | 49,71 | 4,23 |
|
DEH = dose équivalente chez l'humain |
||||
2.5.2 BDCM
Deux études clés ont été retenues aux fins de l'évaluation des risques liés au BDCM : une étude de deux ans menée sur des rats et des souris exposés à du BDCM administré par gavage dans de l'huile de maïs (NTP, 1987) et une étude de deux ans menée sur des rats mâles et des souris femelles exposés à du BDCM dans l'eau potable (NTP, 2006).
Dans la première étude clé, des groupes de 50 mâles et de 50 femelles de rats F344/N et de souris B6C3F1 ont reçu du BDCM par gavage dans de l'huile de maïs, à raison de cinq jours par semaine pendant 102 semaines. Les rats ont reçu des doses de 0, 50 ou 100 mg/kg p.c., les souris mâles, des doses de 0, 25 ou 50 mg/kg p.c., et les souris femelles, des doses de 0, 75 ou 150 mg/kg p.c. (NTP, 1987). Les données ont clairement démontré la cancérogénicité chez les rats mâles et femelles avec des augmentations de l'incidence d'adénomes et d'adénocarcinomes des cellules des tubules rénaux (incidence combinée pour les rats des groupes témoins, des groupes exposés à la dose faible et des groupes exposés à la dose élevée, soit 0/50, 1/50 et 13/50 pour les mâles et 0/50, 1/50 et 15/50 pour les femelles) ainsi que de polypes adénomateux et d'adénocarcinomes du gros intestin (incidence combinée de 0/50, 13/50 et 45/50 pour les mâles et de 0/46, 0/50 et 12/47 pour les femelles). Les tumeurs rénales et intestinales sont toutes deux considérées comme significatives, car elles sont rares chez les rats. L'incidence accrue d'adénomes et d'adénocarcinomes (combinés) du rein chez le mâle (incidence de 1/49, 2/50 et 9/50 respectivement pour les souris témoins, les souris exposées à la dose faible et celles exposées à la dose élevée) et d'adénomes et de carcinomes hépatocellulaires (combinés) chez la souris femelle (incidence de 3/50, 18/48 et 29/50 respectivement) démontre aussi clairement la cancérogénicité chez les souris B6C3F1 des deux sexes.
Dans la deuxième étude clé, des rats F344/N mâles et des souris B6C3F1 femelles ont été exposés à du BDCM administré dans l'eau potable pendant 2 ans (NTP, 2006). On a choisi les rats mâles et les souris femelles car, dans l'étude précédente du NTP (1987) utilisant le gavage à l'huile de maïs, une plus grande fréquence de néoplasmes du gros intestin a été observée chez les rats mâles que chez les rats femelles et parce que des augmentations de la fréquence des néoplasmes hépatocellulaires ont été observées chez les souris femelles, mais pas chez les souris mâles. Des groupes de 50 rats F344/N mâles ont été exposés à des concentrations cibles de 0, 175, 300 ou 700 mg/L de BDCM (équivalant à des doses quotidiennes moyennes de 0, 6, 12 ou 25 mg/kg p.c. de BDCM). Aucune augmentation de néoplasmes liée à la dose d'exposition au BDCM n'a été observée, bien que l'apparition de polypes adénomateux ait été constatée dans le gros intestin d'un des 46 animaux du deuxième groupe ayant reçu la dose la plus élevée. Des groupes de 50 souris B6C3F11 femelles ont aussi été exposés à des concentrations cibles de 0, 175, 300 ou 700 mg/L de BDCM (équivalant à des doses quotidiennes moyennes de 0, 9, 18 ou 36 mg/kg p.c. de BDCM). Chez la souris, les incidences d'adénome ou de carcinome hépatocellulaires suivaient une tendance négative, et l'incidence dans le groupe exposé à la dose maximale était significativement réduite par rapport à celle du groupe témoin. L'incidence d'hémangiosarcome dans tous les organes a été significativement réduite dans le groupe exposé à la dose de 18 mg/kg p.c. Les auteurs de l'étude ont conclu que, dans les conditions de cette étude de deux ans sur l'eau potable, il n'y avait aucune preuve d'une activité cancérogène chez les rats mâles ni chez les souris femelles.
Un certain nombre de problèmes compliquent l'interprétation des deux études du NTP. À titre d'exemple, les doses utilisées dans l'étude du NTP (1987) sur l'huile de maïs n'ont pas été incluses dans l'étude du NTP (2006) sur l'eau potable et vice versa. En outre, l'huile de maïs utilisée comme véhicule dans l'étude du NTP (1987) peut modifier la toxicocinétique d'une substance chimique, et il a été établi qu'elle agit comme un promoteur de tumeurs (voir section 2.3.1, Effet du véhicule et mode de distribution). En outre, l'étude du NTP (2006) sur l'eau potable présentait des teneurs en fibres alimentaires plus élevées que l'étude NTP (1987) sur l'huile de maïs, et l'on sait qu'une augmentation des fibres assure une protection contre les cancers (Reddy, 1987).
En 2008, Santé Canada a convoqué un groupe d'experts chargé d'évaluer les résultats toxicologiques relatifs au BDCM, notamment les résultats de ces deux études (Santé Canada, 2008a). Le groupe d'experts a conclu que la cancérogénicité est un effet critique, car le BDCM s'est révélé cancérogène tant chez le rat que chez la souris, produisant des tumeurs à plusieurs sièges. Le groupe a pris en compte les données des deux études du NTP pour effectuer l'évaluation des risques. En particulier, l'apparition de polypes adénomateux dans le gros intestin des rats mâles a été utilisée comme effet critique. Étant donné que les deux études du NTP avaient été réalisées avec des doses et des véhicules différents, les doses administrées ont été converties en doses internes (vitesse maximale de métabolisme du BDCM par la voie de la GST, exprimée en nmol/min/g de tissu) à l'aide d'un modèle PBPK (tel que décrit dans l'étude NTP, 2006) afin de résoudre tout effet d'absorption lié au véhicule et de faciliter la comparaison des données des études. Une modélisation empirique de la courbe dose-réponse avec extrapolation linéaire à partir d'un point de départ jusqu'à l'origine a ensuite été réalisée. Des doses repères ont été calculées avec les limites de confiance inférieures à 95 % selon le modèle de Weibull proposé par le NTP (2006) et Krishnan (2008). Un point de départ représentant une augmentation de 1 % de l'incidence de tumeurs par rapport au niveau de fond a été choisi (au lieu de l'augmentation habituelle de 10 % pour les données binaires), car il reflète mieux l'ensemble des données dose-réponse des deux études du NTP. Les BMD01 et BMDL01 calculées, basées sur les tumeurs du gros intestin (côlon), étaient de 0,043 et de 0,025 nmol/min/g de tissu, respectivement. Les doses externes équivalentes, obtenues en exécutant le modèle PBPK en sens inverse, étaient respectivement de 22,9 et de 16,3 mg/kg p.c. par jour. On a choisi les tumeurs du gros intestin comme effet critique, car la modélisation a abouti à un point de départ inférieur à celui des tumeurs rénales (tableau 15). En outre, des données provenant d'études à court terme démontrent le développement de foyers de cryptes aberrantes (lésions prénéoplasiques) dans le gros intestin du rat lorsque le BDCM est administré dans l'eau potable, ce qui confirme l'effet critique (Geter et coll., 2004a).
| Effet | BMD01 interne (GST en nmol/min/g de tissu) |
BMDL01 interne (GST en nmol/min/g de tissu) |
BMD01 externe (mg/kg p.c. par jour) |
BMDL01 externe (mg/kg p.c. par jour) |
|---|---|---|---|---|
| Gros intestin | 0,043 | 0,025 | 22,9 | 16,3 |
| Rein | 0,122 | 0,051 | Non calculé | Non calculé |
|
BMD01= dose repère associée à une réponse de 1 %, BMDL01= limite inférieure de l'intervalle de confiance à 95 % associée à la dose repère pour une réponse de 1 %, GST = glutahione S-transférase |
||||
2.5.3 DBCM et bromoforme
En 2002, un groupe d'experts a été convoqué par Santé Canada pour évaluer les données toxicologiques et épidémiologiques sur les THM, dans le but de rédiger une mise à jour de la recommandation relative à l'eau potable. Parmi les documents examinés par le groupe d'experts figurait un rapport commandé par Santé Canada à Global Tox (2002) intitulé « Assessment of the Toxicology of Trihalomethanes » (évaluation de la toxicologie des trihalométhanes). Le rapport a conclu que l'ensemble des données probantes n'était pas suffisamment solide pour appuyer le calcul d'une VBS pour le DBCM ou le bromoforme. Même si des éléments de preuve semblaient démontrer la cancérogénicité du DBCM et du bromoforme, les effets se limitaient à certaines espèces ou à certains sexes, ou étaient équivoques dans certains cas.
Par exemple, le DBCM montre des signes de cancérogénicité, mais uniquement chez les souris femelles (NTP, 1985). La cancérogénicité du DBCM a été jugée équivoque chez les souris mâles, car une erreur de dosage a entraîné un nombre insuffisant d'animaux survivants dans le groupe exposé à la dose faible. Le DBCM n'est pas cancérogène, tant pour les rats mâles que pour les rats femelles. Le bromoforme a montré quelques signes de cancérogénicité chez les rats mâles et des signes évidents chez les rats femelles, mais aucun chez les souris mâles ou femelles (NTP, 1989a). En outre, ces deux études du NTP n'ont examiné que deux doses en plus du groupe témoin, ce qui est loin d'être idéal pour la modélisation de la courbe dose-réponse. Le rapport de Global Tox a conclu qu'une caractérisation plus poussée du potentiel cancérogène du DBCM et du bromoforme était nécessaire.
Depuis la réunion du groupe d'experts, aucune étude de toxicité subchronique, chronique ou pour la reproduction et le développement sur le DBCM ou le bromoforme n'a été publiée. Les nouvelles données publiées consistent principalement en des études sur la génotoxicité du DBCM et du bromoforme et en des études sur la toxicité des mélanges de THM pour la reproduction et le développement, dont aucune ne pourrait servir d'étude clé pour déterminer un point de départ pour l'une ou l'autre substance.
D'autres organismes internationaux ont établi des VBS pour le DBCM et le bromoforme (voir section 6, Considérations internationales). Toutefois, il n'y a pas de consensus entre les organismes quant à l'effet critique à utiliser, à l'étude clé à retenir ou même à la question de savoir s'il faut adopter une approche axée sur les effets cancérogènes ou non.
Par conséquent, et pour toutes ces raisons, aucune étude clé n'a été retenue pour le calcul d'une VBS pour le DBCM et le bromoforme.
2.5.4 THM iodés
Le peu de données disponibles sur la toxicité des THM iodés empêche la sélection d'une étude clé pour le calcul d'une VBS pour ces substances. Toutefois, en l'absence de données toxicologiques classiques, une extrapolation quantitative in vitro à in vivo (qIVIVE) a été utilisée pour évaluer les niveaux d'effets in vitro par rapport aux niveaux d'exposition humaine (Santé Canada, 2021a).
Wetmore (2015) donne un aperçu du processus qIVIVE. En résumé, des données pharmacocinétiques in vitro (stabilité métabolique, liaison aux protéines plasmatiques et perméabilité des cellules intestinales) ont été recueillies et utilisées pour modéliser la concentration sanguine à l'état d'équilibre de six THM iodés au moyen des approches décrites dans Pearce et coll. (2017). La méthode de Monte Carlo a servi à simuler la variabilité de la population et à calculer le 95e centile de la concentration sanguine à l'état d'équilibre. Des données de toxicité in vitro ont été recueillies dans la littérature scientifique afin de déterminer les concentrations de THM iodés pour lesquelles une bioactivité a été observée. Des données sur la cytotoxicité chronique des cellules de mammifères et des bactéries ont été utilisées pour les analyses (Richardson et coll., 2008; Stalter et coll., 2016). La dosimétrie inversée a été utilisée pour estimer la dose équivalente par voie orale chez l'humain. Il s'agit de la quantité d'une substance chimique à laquelle une personne devrait être exposée de manière externe pour atteindre des niveaux de concentration sanguine qui provoquent une activité dans les essais de toxicité in vitro.
Les doses équivalentes par voie orale chez l'humain, calculées d'après les résultats de trois bio-essais in vitro, figurent dans le tableau 16. Les données montrent que le TIM est le THM iodé le plus puissant selon les résultats des trois bio-essais. Quatre THM iodés (DCIM, BCIM, BDIM et TIM) sont plus puissants que le BDCM dans le seul essai pour lequel il existe des données comparatives sur le BDCM. Le DBIM et le CDIM semblent être moins puissants en raison de problèmes liés à la perméabilité des cellules de l'intestin. D'après les résultats des études pharmacocinétiques, une limite inférieure d'absorption de 0,1 % a été attribuée à ces composés, tandis qu'une absorption de 100 % a été attribuée aux autres THM iodés et au BDCM. Lorsque l'on compare les doses équivalentes par voie orale chez l'humain calculées aux concentrations de THM iodés dans l'eau potable auxquelles les humains sont exposés (voir section 1.3.1), il est évident que les niveaux d'exposition humaine sont inférieurs de plusieurs ordres de grandeur aux concentrations qui donneraient lieu à des concentrations sanguines semblables à celles ayant provoqué une toxicité in vitro.
L'interprétation de la qIVIVE entreprise pour les THM iodés est limitée par le manque de données de toxicité in vitro dans des systèmes pertinents qui peuvent décrire avec précision les événements moléculaires initiateurs après une exposition aux THM iodés. Il n'y a pas non plus de données abondantes sur l'exposition humaine auxquelles les doses équivalentes par voie orale peuvent être comparées. Cependant, les résultats du processus de qIVIVE fournissent toujours un contexte in vivo pour les données in vitro. De nouvelles méthodes d'approche telles que la qIVIVE pourraient servir à éclairer l'évaluation de la puissance relative et des mélanges, et pourraient être utiles en tant que premier niveau dans la hiérarchisation future des substances chimiques en vue de l'évaluation des dangers et des risques.
| THM | Facteur IVIVENote de bas de tableau 16 - a (mg/kg par jour)/uM | LTCNote de bas de tableau 16 - b (M) | DEO_LTC (mg/kg par jour) | CL50Note de bas de tableau 16 - c (M) | DEO_CL50 (mg/kg par jour) | CE50Note de bas de tableau 16 - d (M) | DEO_ CE50 (mg/kg par jour) |
|---|---|---|---|---|---|---|---|
| BDCM | 0,4262 | N. D. | N. D. | N. D. | N. D. | 0,001800 | 767,17 |
| DCIM | 0,2411 | 0,0020000 | 482,25 | 0,004130 | 995,84 | 0,000320 | 77,16 |
| BCIM | 0,1529 | 0,0022000 | 336,48 | 0,002400 | 367,06 | 0,000097 | 14,84 |
| DBIM | 92,8505 | 0,0015000 | 139 275,77 | 0,001900 | 176 415,97 | 0,000089 | 8 263,70 |
| CDIM | 68,1663 | 0,0010000 | 68 166,33 | 0,002410 | 164 280,85 | 0,000071 | 4 839,81 |
| BDIM | 0,0370 | 0,0015000 | 55,43 | 0,001400 | 51,73 | 0,000022 | 0,81 |
| TIM | 0,0140 | 0,0000100 | 0,14 | 0,000066 | 0,93 | 0,000009 | 0,13 |
|
CDIM = chlorodiiodométhane, BCIM = bromochloroiodométhane, BDCM = bromodichlorométhane, BDIM = bromodiiodométhane, DBIM = dibromoiodométhane, DCIM = dichloroiodométhane, IVIVE = extrapolation in vitro à in vivo, N. D. = non disponible, TIM = iodoforme |
|||||||
3.0 Calcul de la valeur basée sur la santé
3.1 Chloroforme
Compte tenu de l'amélioration des données de toxicité et des renseignements sur la modélisation PBPK disponibles pour le chloroforme, une approche plus précise de l'évaluation des risques au moyen d'une DEH (au lieu d'une LOAEL, par exemple) a été rendue possible. L'utilisation de la DEH réduit le niveau d'incertitude lors du calcul de la valeur basée sur la santé (VBS). En se basant sur une DEH de 4,18 mg/kg p.c. par jour basée sur la toxicité rénale (dilatation de la lumière tubulaire) chez le rat mâle (Yamamoto et coll., 2002; Nagano et coll., 2006; Sasso et coll., 2013), on calcule comme suit l'apport quotidien tolérable (AQT) pour le chloroforme :
Figure 2.
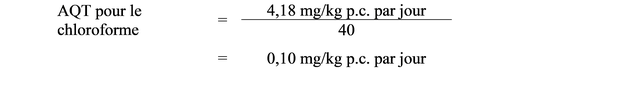
Figure 2 - Équivalent textuel
L'apport quotidien tolérable de chloroforme est de 0,10 mg/kg p.c. par jour. Ce chiffre est calculé en divisant la dose équivalente chez l'humain de 4,18 mg/kg p.c. par jour par un facteur d'incertitude de 40.
- 4,18 mg/kg p.c. par jour représente la DEH, basée sur l'observation d'effets sur les reins;
- 40 représente le facteur d'incertitude, choisi pour tenir compte de la variation interespèce (× 4 pour l'incertitude toxicodynamique et toxicocinétique résiduelle à la suite de l'utilisation du modèle PBPK) et de la variation intraespèce (×10).
D'après l'AQT de 0,10 mg/kg p.c. par jour, une VBS pour le chloroforme dans l'eau potable est calculée comme suit :
Figure 3.
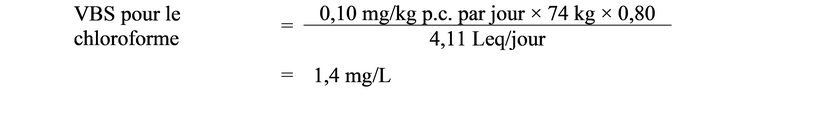
Figure 3 - Équivalent textuel
La valeur basée sur la santé pour le chloroforme est de 1,4 mg/L. Cette valeur est calculée en multipliant l'apport quotidien tolérable de 0,10 mg/kg p.c. par jour par 74 kg, le poids corporel moyen d'un adulte et par le facteur d'attribution de 0,80. Le produit est ensuite divisé par 4,11 Leq/jour, ce qui représente la contribution totale de l'exposition via l'eau potable.
- 0,10 mg/kg p.c. par jour est l'AQT calculée ci-dessus;
- 74 kg correspond au poids corporel moyen d'un adulte (Santé Canada, 2021b);
- 0,80 est le facteur d'attribution, compte tenu du fait que l'eau potable est la principale source d'exposition au chloroforme (Krishnan et Carrier, 2013);
- 4,11 Leq/jour est la contribution totale de l'eau potable à l'exposition (voir la section 1.3.2. Exposition par voies multiples par l'eau potable)
Étant donné que le chloroforme est un cancérogène avec seuil, on considère que les expositions à des concentrations de chloroforme inférieures à la VBS assurent une protection contre les effets cancérogènes et non cancérogènes.
3.2 BDCM
La BMDL01 de 16,3 mg/kg p.c. par jour, basée sur les tumeurs du gros intestin (côlon) observées chez des rats mâles (NTP, 1987; NTP, 2006), a été choisie comme point de départ. Au moyen d'une mise à l'échelle allométrique visant à représenter l'exposition humaine, une DEH a été calculée comme suit :
Figure 4.

Figure 4 - Équivalent textuel
La dose équivalente chez l’humain pour le BDCM est de 4,2 mg/kg p.c. par jour. Ce résultat est obtenu en multipliant le BMDL01 de 16,3 mg/kg p.c. par jour par le facteur de mise à l’échelle allométrique de (0,35 kg/74 kg)1⁄4.
- 16,3 mg/kg p.c. par jour représente la BMDL01 déterminée pour les tumeurs du gros intestin observées chez des rats mâles (NTP, 1987; NTP, 2006);
- 0,35 kg est le poids corporel moyen d'un rat (Santé Canada, 1994);
- 74 kg est le poids corporel moyen d'un humain adulte (Santé Canada, 2021b);
- (0,35 kg/74 kg)¼ est le facteur de mise à l'échelle allométrique prenant en compte les différences interespèces quant à la sensibilité au BDCM (U.S. EPA, 2011).
La DEH a servi à calculer le facteur de pente du cancer (FPC) :
Figure 5.

Figure 5 - Équivalent textuel
Le facteur de pente du cancer pour le CMDB est de 0,002 (mg/kg p.c. par jour) −1. Ce chiffre est calculé en divisant la réponse de référence à 1 % par la dose équivalente chez l'humain de 4,2 mg/kg p.c. par jour.
- 0,01 est la réponse de référence de 1 %;
- 4,2 mg/kg p.c. par jour est la DEH calculée ci-dessus.
La dose associée à chaque risque à vie est calculée en divisant le risque à vie par le FPC de 0,002 (mg/kg p.c. par jour)-1 (voir le tableau 17). Les concentrations estimées dans l'eau potable correspondant aux risques à vie de cancer sont calculées à l'aide de l'équation suivante :
Figure 6.

Figure 6 - Équivalent textuel
La valeur basée sur la santé pour CMDB est calculée en multipliant la dose correspondant au niveau de risque spécifique par 74 kg, le poids corporel moyen d'un adulte. Le produit est divisé par 3,55 Leq/jour, qui correspond à la contribution totale de l'exposition via l'eau potable.
- X est la dose correspondant au niveau de risque (voir le tableau 17 ci-dessous);
- 74 kg est le poids corporel moyen d'un humain adulte (Santé Canada, 2021b);
- 3,55 Leq/jour est la contribution de l'eau potable à l'exposition totale (voir la section 1.3.2. Exposition par voies multiples par l'eau potable).
| Risque à vie | Dose (mg/kg p.c. par jour) | Concentrations estimées dans l'eau potable (mg/L) |
|---|---|---|
| 10−4 | 10-4/0,002 (mg/kg bw par jour)−1 = 0,05 | (0,05 mg/kg p.c par jour × 74 kg )/3,55 Leq/jour = 1,04 |
| 10−5 | 10-5/0,002 (mg/kg p.c. par jour)−1 = 0,005 | (0,005 mg/kg p.c par jour × 74 kg )/3,55 Leq/jour = 0,104 |
| 10−6 | 10-6/0,002 (mg/kg p.c. par jour)−1 = 0,0005 | (0,0005 mg/kg p.c par jour × 74 kg )/3,55 Leq/jour = 0,0104 |
Comme l'eau potable est la principale source de BDCM, on a employé un excès de risque de cancer à vie de 10−5 pour établir une VBS de 0,100 mg/L ou 100 µg/L (arrondi) (Santé Canada, 2021c).
Puisque des effets non cancérogènes ont été constatés à la suite d'une exposition au BDCM, une évaluation des risques autres que les risques de cancer a été réalisée à des fins de comparaison. Au moyen d'une BMDL10 de 0,777 mg/kg p.c. par jour calculé à partir des données sur les effets sur le foie (dégénérescence graisseuse) chez le rat mâle de l'étude de toxicité chronique d'Aida et coll. (1992 b), un AQT de 0,008 mg/kg p.c. par jour et une VBS de 0,133 mg/L ont été obtenus. Comme l'évaluation du risque de cancer a donné une valeur plus conservatrice, pour le BDCM dans l'eau potable, que l'évaluation du risque d'effets autres que le cancer, on considère que l'évaluation du risque de cancer est le facteur le plus approprié pour fixer la CMA dans l'eau potable à proposer.
3.3 DBCM et bromoforme
Comme il est indiqué à la section 2.5.3, DBCM et bromoforme, aucune étude clé n'a été sélectionnée pour le DBCM et le bromoforme : par conséquent, aucune VBS n'a été calculée pour ces substances.
3.4 THM iodés
Le peu de données disponibles sur la toxicité des THM iodés empêche le calcul d'une VBS pour ces substances.
3.5 Évaluation des mélanges
Une « [combined] exposure to multiple substances (mixture) Risk Assessment (CRA) », c'est-à-dire une évaluation des risques liés à l'exposition combinée à plusieurs substances (mélange) (ERC) (adaptation : OMS [2017a] et EFSA [2019]), a été menée en vue de déterminer si les quatre THM devaient faire l'objet d'une évaluation et d'une gestion des risques individuelles ou collectives. L'ERC permet également de hiérarchiser les substances devant faire l'objet d'essais supplémentaires (en mettant en évidence les zones d'incertitude et en cernant les besoins en données critiques). Les THM iodés ont été exclus de l'évaluation des risques combinés, car il existe peu ou pas de données sur leur concentration, leur toxicocinétique, leur danger ou leur mode d'action. Ce type d'information est nécessaire pour déterminer si les substances peuvent être regroupées. En ce qui concerne les quatre THM, selon la formulation du problème (annexe C), il existe des éléments de preuve crédibles d'une exposition combinée à certaines ou à toutes les substances chimiques, il existe des preuves d'un potentiel d'effets nocifs chez l'humain, et il existe un potentiel de toxicité similaire ou touchant le ou les mêmes organes. Cependant, l'étude clé retenue pour calculer la VBS pour le chloroforme repose sur un critère d'effet non cancérogène, alors que celle pour le BDCM repose sur un critère d'effet cancérogène. Il existe peu de directives sur la question de savoir s'il convient d'appliquer une approche additive pour les substances cancérogènes et si les indices de danger des substances cancérogènes et non cancérogènes (c'est-à-dire des modes d'action différents) devraient être additionnés même si certains organes communs sont touchés. Par conséquent, l'ERC a été étudiée au stade de la formulation du problème et n'a pas été approfondie.
4.0 Considérations relatives à l'analyse et au traitement
4.1 Méthodes d'analyse
4.1.1 Méthodes standardisées de détection des trihalométhanes
Les méthodes standardisées pouvant servir à l'analyse de chaque THM dans l'eau potable et les limites de détection de la méthode (LDM) respectives sont résumées dans le tableau 18. Les LDM dépendent de la matrice de l'échantillon, des instruments et des conditions de fonctionnement choisies et varient d'un laboratoire à l'autre. Ces méthodes sont sujettes à diverses interférences qui sont décrites dans les références respectives. Pour la méthode EPA 551.1 Rev. 1, il a été noté que le MTBE et le pentane peuvent contenir des quantités observables de solvants chlorés (par exemple du chloroforme, du trichloréthylène et tétrachlorure de carbone) (U.S. EPA, 1995a).
Des laboratoires accrédités au Canada ont été contactés pour déterminer les LDM et les seuils de déclaration de la méthode (SDM) pour l'analyse des THM. Les LDM étaient du même ordre de grandeur que celles figurant dans le tableau 18. Les SDM variaient de 0,5 à 1,0 µg/L pour le chloroforme, de 0,4 à 1,0 µg/L pour le BDCM, de 0,4 à 1,0 µg/L pour le DBCM et de 0,2 à 2,0 µg/L pour le bromoforme (Laboratoires AGAT, 2020; Ville de Winnipeg, 2020; Metro Vancouver Laboratory, 2020; Ministère de l'Environnement de l'Ontario, 2020; RPC, 2020; Laboratoires d'analyse environnementale du SRC, 2020). Les limites de détection tirées des données des PT se situent dans les plages de 0,1 à 9,0 μg/L pour le chloroforme, de 0,07 à 2,0 µg/L pour le BDCM, de 0,02 à 1,3 µg/L pour le DBCM, de 0,08 à 2,0 µg/L pour le bromoforme et de 0,3 à 30 µg/L pour les THM totaux (voir le tableau 2).
Il est recommandé aux responsables de systèmes de distribution de l'eau potable de discuter des exigences en matière d'échantillonnage avec le laboratoire accrédité qui réalise les analyses, afin de s'assurer que les procédures de contrôle de la qualité sont respectées. Les SDM doivent être suffisamment basses pour assurer une surveillance précise à des concentrations inférieures à la CMA.
| Méthode (référence) | Méthodologie | LDM (μg/L) |
|---|---|---|
| EPA 502.2 Rev. 2.1 (U.S. EPA, 1995b) |
Chromatographie en phase gazeuse sur colonne capillaire par purge et par piégeage avec détecteurs à photoionisation et détecteurs à conductivité électrolytique en série (GC/PID/ELCD) |
|
| EPA 524.2 Rev. 4.1 (U.S. EPA, 1995c) |
Chromatographie en phase gazeuse sur colonne capillaire/spectrométrie de masse (CG-SM) |
|
| EPA 524.3 Rev. 1 (U.S. EPA, 2009) |
|
|
| EPA 524.4 (U.S. EPA, 2013) |
CG-SM avec utilisation d'azote comme gaz de purge |
|
| EPA 551.1 Rev. 1 (U.S. EPA, 1995a) |
Extraction liquide-liquide et chromatographie en phase gazeuse avec détection par capture d'électrons (LLE/GC/ECD) par :
|
MTBE
|
Pentane
|
||
| SM 6040 B (APHA et coll., 2018) |
Strippage en boucle fermée, chromatographie en phase gazeuse/spectrométrie de masse (CLSA-GC/MS) |
|
| SM 6200 B (APHA et coll., 2018) |
CG par purge et par piégeage/SM |
|
| SM 6200C (APHA et coll., 2018) |
CG par purge et par piégeage |
|
| SM 6232 B (APHA et coll., 2018) |
Méthode d'extraction liquide-liquide et CG (LLE/GC) | La LDM dépend des caractéristiques du système de chromatographie en phase gazeuse. La méthode mesure les concentrations de THM dans la plage de 0,1 à 200 µg/L. |
|
CG/SM = chromatographie en phase gazeuse/spectrométrie, BDCM = bromodichlorométhane, DBCM = dibromochlorométhane, LDM = limite de détection de la méthode, MTBE = éther de méthyle et de butyle tertiaire, S.O. = sans objet |
||
4.1.2 Préparation et conservation des échantillons
Les méthodes d'analyse présentées dans le tableau 18 mesurent la concentration de chacun des composés de THM dans l'échantillon. La concentration de THM totaux est calculée en additionnant les concentrations individuelles des quatre THM et en les comparant à la CMA.
Les références qui figurent au tableau 18 fournissent des renseignements sur le traitement des échantillons destinés aux analyses des THM dans l'eau potable (entre autres, la conservation et l'entreposage des échantillons) à l'aide des méthodes établies par l'U.S. EPA. De plus, la méthode SM 6010 B fournit des conseils sur la collecte et la conservation des échantillons pour les méthodes nommées dans les méthodes normalisées de l'American Public Health Association (APHA) (APHA et coll., 2018). Des procédures appropriées de manipulation des échantillons sont essentielles pour obtenir des données exactes, précises et fiables sur la présence et la formation de THM.
Une fois l'échantillon prélevé, il est essentiel d'arrêter rapidement la réaction avec les précurseurs organiques et inorganiques, qui peuvent continuer à former davantage de THM. On y parvient généralement par l'ajout d'agents réducteurs (de désactivation) en excès aux échantillons d'eau. Les THM ne sont pas sensibles à la décomposition chimique par des agents réducteurs (Kristiana et coll., 2014).
4.1.3 Analyseurs en ligne et portatifs
Il existe des analyseurs commerciaux en ligne et portatifs qui permettent de quantifier chacun des composés THM ainsi que les THM totaux (dans un délai de 30 à 120 minutes, selon l'analyseur). L'analyse repose généralement sur la technique de chromatographie en phase gazeuse par purge et piégeage, bien que certains dispositifs utilisent l'extraction de l'espace de tête ou l'extraction par capillarité avant la chromatographie en phase gazeuse. Il est possible d'utiliser ces analyseurs pour obtenir une indication rapide ou quasi continue des concentrations de THM. Ils peuvent également servir à déterminer le potentiel des eaux traitées à former des THM dans le réseau de distribution. La surveillance en temps réel des THM à divers emplacements du réseau de distribution permettra :
- l'optimisation des procédés de traitement à la station de production d'eau potable;
- l'exploitation plus ciblée et plus efficace des stations de production d'eau potable;
- l'identification de zones problématiques (par exemple dépôts inorganiques et organiques dans les tuyaux qui entraînent une hausse de la formation des THM);
- la détermination de l'emplacement et du moment du rinçage dans le réseau de distribution;
- l'évaluation du temps de séjour de l'eau dans les emplacements clés du réseau de distribution.
En général, ces analyseurs peuvent mesurer chaque THM dans une plage de 2 à 80 µg/L ou des THM totaux dans une plage de 1 à 1 000 µg/L.
Pour assurer la précision des mesures effectuées à l'aide de ces appareils, les responsables de systèmes de distribution d'eau potable devraient élaborer un programme d'assurance et de contrôle de la qualité. Ce programme devrait prévoir une vérification périodique des résultats par un laboratoire accrédité. Il est recommandé d'étalonner les appareils conformément aux instructions du fabricant. Les responsables des systèmes de distribution d'eau potable devraient vérifier auprès de l'autorité responsable en matière d'eau potable si les résultats de ces méthodes peuvent être utilisés pour la production des rapports de conformité.
Il existe également une méthode colorimétrique, qui peut être utilisée pour les opérations quotidiennes et qui estime les THM, selon la teneur en chloroforme, à l'aide de réactifs et d'un spectrophotomètre. Il a été démontré que cette méthode a une bonne corrélation avec les méthodes normalisées et est utilisée dans des systèmes à petite échelle (Ali et coll., 2019). Quelques études y ont eu recours pour évaluer les concentrations de THM (Ahmed et coll., 2019; Ali et coll., 2019).
4.1.4 Analyses du potentiel de formation des THM
Il est important que les responsables de systèmes de distribution d'eau potable comprennent la réactivité de la matière organique naturelle (MON) propre à la source lorsqu'ils choisissent un désinfectant, afin d'atténuer la formation de THM (Hua et Reckhow, 2007a). Des études de traitabilité propres à la source, notamment des analyses du potentiel de formation de THM (pfTHM), devraient être réalisées au moment d'évaluer différentes mesures d'atténuation et/ou d'autres options de traitement. Les méthodes d'analyse du potentiel de formation visent à évaluer les sources d'approvisionnement en eau, les procédés de traitement de l'eau et les changements saisonniers ou à prédire les concentrations de THM dans le réseau de distribution. Toutes les méthodes nécessitent un contrôle des paramètres pour obtenir des résultats reproductibles et significatifs. Ces paramètres sont notamment la température de l'eau, le pH, le temps de réaction, les doses de chlore libre et le chlore résiduel (ou de monochloramine dans le cas d'un essai en réseau de distribution simulé [RDS]) (Symons et coll., 1981; Koch et coll., 1991; Sketchell et coll., 1995; Summers et coll., 1996, APHA et coll., 2018). Ces méthodes n'évaluent pas directement l'impact du système d'approvisionnement en eau potable , les réactions avec les parois des conduites, les opérations associées aux réservoirs et d'autres facteurs liés à la qualité de l'eau.
Le tableau 19 présente les différentes méthodes d'évaluation du pfTHM ainsi que les conditions d'essai et autres considérations. Les méthodes d'analyse du potentiel de formation qui font appel à des doses très élevées de chlore pourraient ne pas permettre de déterminer correctement les variations du rendement en THM en présence de bromure. Ce phénomène a lieu parce que le chlore peut entrer en compétition avec le bromure lorsqu'il est en excès (Bond et coll., 2014). Dans les conditions normales d'opération, le bromure est beaucoup plus efficace pour former des THM que le chlore (Bond et coll., 2014). Le test des conditions uniformes de formation (UFC) fait appel à une dose de chlore représentative et ne déforme pas les espèces de THM formées. Le test UFC permet donc de comparer directement les résultats pour évaluer l'efficacité de diverses options de traitement (Summers et coll., 1996; Reckhow et Singer, 2011).
| Méthodes | Conditions d'essai | Remarques | |
|---|---|---|---|
| Chlore résiduel à la fin de l'essai | pH/T °C/temps de réaction | ||
| SM 5710 B pfTHM (APHA et coll., 2018) |
3 à 5 mg/L | Conditions de réaction standard : 7,0 ±0,2/ 25 °C/ 7 jours |
|
| SM 5710 C SDS-THM (APHA et coll., 2018) |
L'échantillon est désinfecté pour produire une concentration résiduelle comparable à celle de l'eau potable distribuée. | Les conditions d'essai (par exemple température, pH, temps d'incubation, concentration de bromure, dose de désinfectant et concentration résiduelle) reproduisent les conditions locales du réseau de distribution. |
|
| Test UFC (Summers et coll., 1996) |
1,0 ± 0,4 mg/L | 8,0 ±0.2/ 20 °C/ 1 jour |
|
| Étude de rétention (Alexander et coll., 2019) |
Évalué dans le cadre de l'essai | pH du RDEP/température du RDEP/ 0, 6, 12, 24, 48 et 96 heures |
|
| RDEP = réseau de distribution d'eau potable, RDS-THM = réseau de distribution simulé-trihalométhanes, pfTHM = potentiel de formation de trihalométhanes, UFC = conditions uniformes de formation | |||
4.2 Indicateurs opérationnels de la formation de THM
Divers paramètres opérationnels peuvent servir d'indicateurs de la formation des THM. Ils ne doivent pas servir à évaluer la conformité à la CMA, mais à fournir d'autres paramètres qui, selon l'indicateur, peuvent être mesurés plus fréquemment. Ils peuvent fournir aux opérateurs des renseignements supplémentaires pour les aider à gérer les THM.
4.2.1 Absorbance ultraviolette spécifique
L'absorbance ultraviolette spécifique (SUVA) est utilisée comme indicateur opérationnel des caractéristiques de la MON et de l'efficacité d'enlèvement de la MON (AWWA, 2011; Santé Canada, 2020a). La SUVA est définie comme l'absorbance de la lumière ultraviolette (UV) à 254 nm (m-1) divisée par la concentration de carbone organique dissous (COD) (mg/L) (AWWA, 2011; Hua et coll., 2015). Des recherches ont permis de déterminer dans quelle mesure la SUVA est liée à la composition de la MON, au COD et en tant que prédicteur de la formation de THM (voir le tableau 20). L'efficacité de la SUVA en tant que prédicteur de la formation de THM est spécifique à l'eau. En tant que paramètre global, il est possible que la SUVA ne rendre pas compte de la nature hétérogène de la MON (Ates et coll., 2007; Hua et coll., 2015; Marais et coll., 2019).
| SUVA (L/mg·m) | Composition de la MON | Composants types | Potentiel en tant que précurseur de THM | Lien entre la SUVA et le COD | SUVA en tant que prédicteur de la formation de THM |
|---|---|---|---|---|---|
| < 2 | Principalement, des composés non humiques, hydrophilesNote de bas de tableau 20 - a et de faible PM | MOANote de bas de tableau 20 - b | Peut être important lors de la présence de prolifération d'algues | Faible corrélation pour les PM < 1 kDa (la SUVA pourrait ne pas caractériser efficacement la MON ayant un PM inférieur) |
Faible corrélation La MON non humique et à faible SUVA peut contribuer de manière importante à la formation de THM |
| Glucides et sucres | Faible | ||||
| 2 à 4 | Mélange de matières humiques et non humiques, mélange de composés hydrophobes et hydrophiles, avec un PM faible à élevé | Acide fulvique | Important | Forte corrélation pour les PM > 1 kDa et corrélation plus importante avec l'augmentation du PM | Forte corrélation généralement rapportée dans la littérature |
| > 4 | Principalement, des composés humiques aquatiques, hydrophobes et de poids moléculaire élevé | Acide humique | Principal | Forte corrélation pour les PM > 1 kDa et corrélation plus importante avec l'augmentation du PM | Forte corrélation généralement signalée dans la littérature |
|
COD = carbone organique dissous, MOA = matière organique algale, MON = matière organique naturelle, PM = poids moléculaire, SUVA = absorbance ultraviolette spécifique Sources : Plummer et Edzwald, 2001; Kitis et coll., 2001, 2002, 2004; Liang et Singer, 2003; Rodriguez et coll., 2004; Ates et coll., 2007; AWWA, 2011; Edzwald et Tobiason, 2011; Chowdhury, 2013c; Hua et coll., 2015; Pivokonsky et coll., 2016; Ding et coll., 2019; Marais et coll., 2019 |
|||||
4.2.2 Différentiel d'absorbance UV
Les liens entre le différentiel d'absorbance UV (DAUV) et les SPD peuvent constituer une méthode relativement simple pour estimer la concentration de SPD et mieux éclairer les décisions opérationnelles. Le DAUV évalue la différence d'absorbance UV à des longueurs d'onde précises (généralement 272 nm) avant et après la chloration d'un échantillon et la met en corrélation avec la présence de SPD (Korshin et coll., 2002; Roccaro et coll., 2009; Özdemir et coll., 2013; Beauchamp et coll., 2018, 2019; Guilherme et Dorea, 2020).
Plusieurs études à l'échelle de banc d'essai ont permis de déterminer les relations entre le DAUV (à une longueur d'onde de 272 nm) et divers SPD (par exemple les THM et les AHA), avant et après la chloration, avec une bonne corrélation (R2 > 0,65 pour les THM) (Korshin et coll., 2002; Roccaro et coll., 2009; Özdemir et coll., 2013; Beauchamp et coll., 2018; Guilherme et Dorea, 2020). Ces études ont montré que la relation était propre au site et variait selon les saisons. Toutefois, il n'a pas été déterminé si ces mêmes relations pourraient se maintenir d'une année à l'autre (Beauchamp et coll., 2018). La relation DAUV-SPD déterminée à grande échelle diffère de celle observée à l'échelle de laboratoire. Une étude a révélé que plusieurs paramètres de régression (DAUV mesurée à diverses longueurs d'onde et absorption UV) permettaient d'établir une relation plus largement applicable entre la concentration de SPD et le DAUV (Beauchamp et coll., 2019). Une étude à l'échelle de banc d'essai réalisée par Guilherme et Dorea (2020) a montré l'importance d'établir cette relation pour une plage de concentrations de SPD potentiels.
4.2.3 Fluorescence
La fluorescence est une méthode de classification rapide de la MON qui semble prometteuse. Toutefois, des recherches se poursuivent pour déterminer comment la méthode peut être intégrée comme outil de surveillance de routine (McKnight et coll., 2001; Fellman et coll., 2010; Bridgeman et coll., 2011; Markechová et coll., 2013; Murphy et coll., 2013; Sanchez et coll., 2013; Wright et coll., 2016; Peleato et coll., 2017; Frank et coll., 2018; Li et coll., 2020a).
4.2.4 Halogènes organiques totaux et halogènes organiques totaux inconnus
Les halogènes organiques totaux (TOX) servent à caractériser l'incorporation d'un halogène dans une molécule organique (Kristiana et coll., 2009). Les TOX comprennent les THM, les AHA, les haloacétonitriles et tout autre SPD halogéné connu ou inconnu. Il s'agit d'un paramètre utilisé dans certaines études pour évaluer les répercussions globales d'un changement de traitement ou opérationnel sur tous les SPD halogénés. Les TOX inconnus représentent les SPD halogénés inconnus présents dans l'eau.
4.3 Considérations relatives aux sources d'eau
Les variations saisonnières et les changements climatiques peuvent avoir une incidence sur la qualité des sources d'approvisionnement en eau, tant pour ce qui est de la MON que des précurseurs inorganiques. Les changements de la qualité de la source d'eau peuvent ensuite influer sur la quantité et la réactivité de la MON, et avoir un impact sur l'efficacité du traitement et le potentiel de formation de THM.
4.3.1 Changements saisonniers
Les eaux ont différentes sources de MON et de précurseurs qui varient selon les saisons, ce qui a une incidence sur la formation de THM (Li et Mitch, 2018). La température, la structure et la concentration de la MON, les concentrations de composés inorganiques et le pH peuvent varier (Reckhow et Singer, 2011). Les concentrations de THM sont généralement plus élevées au cours des mois d'été et d'automne (voir le tableau 21).
La MON change selon les saisons en raison de divers facteurs, notamment la fonte des neiges, la chute des feuilles, les variations de la température et le métabolisme microbien dépendant de la température (Zhao et coll., 2018). Au printemps, il peut y avoir de fortes précipitations qui peuvent entraîner une augmentation de la MON allochtone et hydrophobe. En été, les efflorescences d'algues peuvent accroître la quantité de MON autochtone et hydrophile. En automne, les feuilles mortes introduisent de la MON terrestre dans les cours d'eau (Reckhow et Singer, 2011). Les changements de température ont un effet sur la dégradation du chlore, le taux de formation des THM, et les changements saisonniers de la MON et des composés inorganiques ont tous un impact sur les THM formés.
Awad et coll. (2017) ont examiné les changements saisonniers entre l'eau des rivières et celle des réservoirs. On a observé que les variations du COD moyen, du % de COD enlevé par coagulation à l'alun et du pfTHM étaient plus importantes pour l'eau de rivière que pour l'eau de réservoir. Le stockage de grands volumes d'eau dans un réservoir permet de mélanger l'affluent et de stabiliser la qualité de l'eau.
Westerhoff et coll. (2022) ont relevé que les variations saisonnières du bromure sont liées à l'écoulement fluvial. Une baisse de l'écoulement a donné lieu à des concentrations plus élevées de bromure.
Les événements pluvieux peuvent entraîner le ruissellement terrestre de contaminants vers les eaux de surface. Ce phénomène est compensé par une hausse du débit, ce qui entraîne une dilution (Clark et coll., 2007). Les changements dans la qualité et la quantité de la MON pendant et après un événement pluvieux peuvent mener à des variations de THM dans le réseau de distribution (Delpla et Rodriguez, 2016). En général, la concentration de carbone organique total (COT) s'est avérée plus élevée dans l'eau filtrée pendant et après les précipitations. Cela s'est traduit par une augmentation des doses de chlore et d'alun pour compenser ces changements. Les études visant à évaluer l'effet des précipitations sont présentées dans le tableau 21.
| Emplacement | Systèmes | Paramètre | Remarques | Référence |
|---|---|---|---|---|
| Effets saisonniers | ||||
| Qc et T.-N.-L. Sept. 2010 à oct. 2011 |
25 petits systèmes | THM | Maximaux en été et en automne | Scheili et coll. (2015) |
| Ont. | 3 systèmes | THM | Plus élevés de juin à novembre et plus faibles de décembre à avril | Chowdhury (2013c) |
| Qc Avril à nov. 1998 |
4 systèmes de taille moyenne | THM |
|
Rodriguez et Sérodes (2001) |
| Qc Période de 14 mois |
1 système | COT |
|
Rodriguez et coll. (2004) |
| THM | Les effets étaient 5 fois plus élevés en automne qu'en hiver. | |||
| Écosse Période d'un an |
5 systèmes | THM | Maximum atteint en septembre (plus du double de celui de mars). | Valdivia-Garcia et coll. (2019) |
| 6 pays européens | 13 systèmes | THM |
|
Krasner et coll. (2016b) |
| Événements pluvieux | ||||
| Qc 22 événements pluvieux (avril à oct. 2017) |
1 système (période sèche de 11 jours – période humide de 5 j – période sèche de 19 j) |
Absorbance UV254 |
|
Delpla et coll. (2023) |
| Turbidité |
|
|||
| 1 système (Séquence de fortes précipitations de 33 jours) |
Absorbance UV254 |
|
||
| Qc 4 événements pluvieux |
2 systèmes | THM |
|
Delpla et Rodriguez (2016) |
| Qc 4 événements pluvieux |
1 système | Cl- et Br- |
|
Delpla et Rodriguez (2017) |
| COT | Un peu plus élevé pendant et après les précipitations, ce qui entraîne une augmentation de la demande en chlore et de la dose d'alun. | |||
| THM | Augmentation pendant et après les précipitations. | |||
| COT = carbone organique total, Qc = Québec, T.-N.-L. = Terre-Neuve-et-Labrador, UV254 = absorbance UV à la longueur d'onde de 254 nm | ||||
4.3.2 Répercussions des changements climatiques
On s'attend à ce que les changements climatiques continuent d'élever la température de l'eau et de provoquer des phénomènes météorologiques extrêmes plus fréquents, plus longs et plus intenses, ainsi que les catastrophes naturelles qui y sont associées. Ces événements se traduiront par de fortes précipitations, des inondations, des vagues de chaleur, des sécheresses et des feux de forêt (Takaro et coll., 2022; Gouvernement du Canada, 2023). Par ailleurs, il y a eu une diminution des dépôts acides atmosphériques dans les dernières décennies. Cette situation a eu pour conséquence un rétablissement après l'acidification grâce à une hausse du pH et de la capacité de neutralisation des acides (ou alcalinité) des eaux de surface (Anderson et coll., 2023). Les concentrations accrues de MON à caractère plus hydrophobe ont été associées à cette amélioration de la qualité de l'eau.
On s'attend à ce que les effets des changements climatiques modifient la nature et la quantité de la MON dans les sources d'eau (voir le tableau 22) (Anderson et coll., 2023). Ces changements de la qualité de la source d'eau auront d'éventuelles conséquences sur le traitement. Il est possible que la MON ne soit pas enlevée de manière adéquate dans les conditions de traitement actuelles, d'où la nécessité pour les installations de traitement de l'eau potable d'adapter leur stratégie de traitement lorsque des changements dans les précurseurs des SPD sont constatés. Anderson et coll. (2023) présentent un examen des impacts sur les différents processus de traitement.
Le document de l'American Water Works Association (AWWA) intitulé Climate Action Plans - Adaptive Management Strategies for Utilities (plan d'action climatique, stratégies de gestion adaptative des services publics) (AWWA, 2021) constitue une bonne source de renseignements sur le changement climatique par rapport au traitement de l'eau et sur l'importance de la création et du maintien d'un plan d'action climatique.
| Événement | Éléments à prendre en considération |
|---|---|
| Changement de température |
|
| Inondations | Augmentation de la charge en sédiments et en contaminants dans les rivières et les lacs. |
| Prolongation des saisons de croissance | Modification du sol et de la végétation des bassins hydrographiques, ce qui a une incidence sur le stockage et le relargage de la matière organique dissoute et des sulfates dans les bassins versants. |
| Périodes de sécheresse |
|
| Élévation du niveau de la mer | Intrusion d'eau de mer dans les puits contenant des concentrations élevées de bromure. |
| Événements pluvieux très fréquents |
|
| Feux de forêt |
La fréquence est en hausse et peut compromettre la qualité des sources d'eau. L'hydrologie des bassins récepteurs peut être touchée par la modification des éléments suivants :
|
|
|
|
|
|
COD = carbone organique dissous, MOA = matière organique algale, MON = matière organique naturelle, SPD = sous-produit de désinfection, THM = trihalométhanes Sources : Whitehead et coll., 2009; Liao et coll., 2015; Wang et coll., 2015a, b; Kolb et coll., 2017; Ruecker et coll., 2017; Seidel et coll., 2017; Poon et Kinoshita, 2018; Chow et coll., 2019; Hohner et coll., 2019; Chen et coll., 2020; Majidzadeh et coll., 2020; Skwaruk et coll., 2020; Uzun et coll., 2020; Anderson et coll., 2023 |
|
Les études montrant les répercussions des événements extrêmes sur la formation de THM figurent au tableau 23. Une analyse plus détaillée des effets possibles du changement climatique sur la MON est accessible auprès d'autres sources (Ritson et coll., 2014; Anderson et coll., 2023). Les installations de traitement de l'eau potable peuvent bénéficier de systèmes d'alerte précoce qui avertissent les exploitants des changements dans les sources d'eau liés à des événements météorologiques extrêmes, ce qui permet d'adapter le traitement en conséquence (Barry et coll., 2016).
| Événement | Systèmes | Paramètre | Observations | Référence |
|---|---|---|---|---|
| Inondations en Caroline du Nord et en Caroline du Sud (2016) | 18 sous-bassins versants | pfTHM |
|
Majidzadeh et coll. (2020) |
| Ouragan Matthew (2016) |
2 sites | pfTHM |
|
|
| Ouragan Joaquin (2015) |
Eau prélevée dans la rivière | pfTHM |
|
Ruecker et coll. (2017) |
| Après les feux de forêt | 23 bassins hydrographiques | Nb de violations des concentrations en THM > 80 μg/LNote de bas de tableau 23 - a (intervalle de 2 ans) |
|
Pennino et coll. (2022) |
| THM | La concentration maximale après un incendie était de 0,21 mg/L. | |||
| 127 bassins hydrographiques | THM (période d'un an) |
|
||
|
Incendie de Hayman dans le Colorado (2002) Échantillons : octobre 2014 à septembre 2016 |
13 bassins hydrographiques Modérément brûlés ≡ Considérablement brûlés ≡ |
Général | Les effets ont persisté pendant 14 ans. | Chow et coll. (2019) |
| COD |
|
|||
| THM |
|
|||
| Azote | Bassins hydrographiques intensément brûlés – COD/N en moindre concentration. | |||
| Bromure | Bassins hydrographiques modérément brûlés – incorporation la plus faible de bromure dans les THM. | |||
| Nord de la Californie 2 incendies (2015) |
3 bassins versants (superficie brûlée : 0 %, 20 % et > 90 %) | THM |
|
Uzun et coll. (2020) |
|
COD = carbone organique dissous, N = azote, pfTHM = potentiel de formation des trihalométhanes, THM bromés = trihalométhanes bromés, SUVA = absorption ultraviolette spécifique |
||||
4.4 Formation de THM
Les SPD chlorés comme les THM et les AHA se forment lorsque le chlore réagit avec des précurseurs organiques et inorganiques. Le type et la quantité de THM qui se forment dépendent de nombreux facteurs, entre autres :
- les précurseurs organiques (par exemple la MON);
- les précurseurs inorganiques (par exemple le bromure et l'iodure);
- la stratégie d'oxydation et de désinfection;
- le pH;
- la température de l'eau;
- le temps de réaction
(Liang et Singer, 2003; Baribeau et coll., 2006; Srivastav et coll., 2020).
Il existe deux sources naturelles de MON : allochtone et autochtone (Reckhow et Singer, 2011). La MON allochtone est généralement issue des plantes terrestres et peut être constituée d'acides humiques et fulviques (composés généralement hydrophobes). Ce type de MON est transporté dans les eaux de surface par des phénomènes de ruissellement. La MON autochtone comprend la biomasse algale et la matière organique algale (généralement des composés hydrophiles) (Zhao et coll., 2018). Les activités anthropiques (humaines) peuvent également contribuer à la MON. La quantité et les espèces de THM formés dépendent des paramètres de la qualité de l'eau (par exemple le type et la quantité de MON, les précurseurs inorganiques, le pH, la température), de l'utilisation d'oxydants et de désinfectants ainsi que du temps de contact (temps de séjour de l'eau dans le réseau). Les THM continuent à se former au fil du temps en raison de la réaction entre les précurseurs et les désinfectants (Becker et coll., 2013; Liu et coll., 2013).
4.4.1 Précurseurs organiques
La MON est un mélange extrêmement complexe de composés organiques que l'on retrouve dans toutes les eaux souterraines et eaux de surface. Elle peut avoir un impact sur les procédés conçus pour éliminer ou inactiver les pathogènes, contribuer à la formation de SPD et favoriser la formation de biofilms dans le réseau de distribution. La traitabilité et la réactivité de la MON varient considérablement au Canada, car chaque source d'eau présente des caractéristiques particulières.
On sait généralement que la formation de SPD halogénés, comme les THM, augmente avec la teneur en composés aromatiques « activés » (définie comme riche en électrons) de la MON (Liang et Singer, 2003). Il peut y avoir une relation étroite entre le COD et la formation de THM. Toutefois, cette relation s'affaiblit lorsque l'on compare différentes sources d'eau. La nature de la NOM évoluera en fonction de l'écorégion, du rétablissement des lacs touchés par les pluies acides, des changements climatiques et des variations saisonnières (Reckhow et Singer, 2011; Anderson et coll., 2023).
La MON hydrophobe ayant une valeur SUVA élevée (par exemple les acides humiques et fulviques) est un précurseur connu des THM. Cependant, la MON hydrophile à faible SUVA peut également contribuer de manière substantielle à la formation de THM (voir le tableau 20). Lorsque la chloramination était utilisée, la corrélation entre la SUVA et les THM formés était plus faible. Ce résultat indique que les chloramines réagissent avec une gamme plus large de précurseurs que le chlore (Hua et coll., 2015).
La MON est constituée de nombreux composés organiques qu'on peut mesurer directement à l'aide de méthodes généralement complexes. Toutefois, plusieurs autres paramètres peuvent servir à donner une indication de la concentration et de la nature (à savoir les propriétés chimiques, physiques et de biodégradabilité) de la MON (voir l'annexe D). Ces paramètres sont notamment le COT, le COD, l'absorption des UV et la demande chimique en oxygène (DCO) (Santé Canada, 2020a). Le COT et le COD sont liés à la quantité de carbone organique. Dans les systèmes d'eau douce, l'absorption UV peut servir à caractériser la qualité et la quantité de la MON (Delpla et coll., 2023). La SUVA peut être utilisée pour caractériser le type de MON présent (voir le tableau 20). La demande chimique en oxygène donne une indication de la concentration de la matière organique oxydable présente dans un échantillon d'eau (Frisch et Kunin, 1960; Stoddart et Gagnon, 2014). Il est important de comprendre les variations de concentrations de MON et de sa nature pour pouvoir choisir, concevoir et exploiter les bons procédés de traitement de l'eau et de désinfection.
Selon plusieurs études, les concentrations de THM formés par les chloramines sont inférieures à celles des THM formés par le chlore (Hua et Reckhow, 2008; Bougeard et coll., 2010; AWWA, 2017; Mayer et Ryan, 2019; Mazhar et coll., 2020). La formation de THM par les chloramines reste généralement stable avec le temps de contact, le pH et la température, et elle augmente en fonction de la dose (Hong et coll., 2013).
En présence d'efflorescences d'algues, on observe une augmentation des cellules d'algues et de la MOA. La MOA peut libérer de la matière organique extracellulaire et, par lyse cellulaire, de la matière organique intracellulaire (des composés gustatifs et olfactifs et des cyanotoxines). Certaines études révèlent que la MON terrestre produit plus de THM que la MOA en raison de l'aromaticité plus faible des MOA lors de la chloration ou de la chloramination (Plummer et Edzwald, 2001; Fang et coll., 2010a, b; Li et Mitch, 2018; Zhao et coll.; Liu et coll., 2020a). Toutefois, une étude indique que certaines populations d'algues entraînent une formation plus importante de THM (Seidel et coll., 2017). Il est possible qu'une concentration élevée d'azote dans la MOA contribue à la formation de SPD azotés (Li et Mitch, 2018).
La formation de THM au cours de la chloration de l'eau en présence de MOA dépend du type d'algues et de la phase de croissance (Plummer et Edzwald, 2001). Les procédés classiques de traitement de l'eau sont peu efficaces pour éliminer les cellules d'algues et la MOA (Huang et coll., 2009; Pivokonsky et coll., 2012, 2016; Dong et coll., 2021). Pour déterminer la stratégie d'oxydation ou de désinfection de l'eau contenant de la MOA, il est important de comprendre les contributions de la matière organique extracellulaire et de la matière organique intracellulaire des différentes espèces d'algues (Liao et coll., 2015).
La préchloration inactive les cellules des algues et les lyse, ce qui libère la matière organique intracellulaire, et les matières organiques de poids moléculaire (PM) élevé sont dégradées en matières organiques de faible PM (Chen et coll., 2009; Ma et coll., 2012, 2019). Cette libération de précurseurs des THM a une incidence sur le traitement. Des études à l'échelle de banc d'essai ont permis d'évaluer la préchloration de l'eau avec différentes espèces d'algues, suivie d'un traitement conventionnel et d'une post-chloration. En général, ces études ont montré qu'à de faibles doses de chlore (0,5 mg/L), la formation de THM diminuait par rapport à la situation sans préchloration. Au fur et à mesure que la dose de chlore augmentait (2 mg/L et 4 mg/L), la formation de THM augmentait au-delà de celle du traitement sans préchloration. La dose de préchloration plus élevée peut entraîner une libération plus importante de matière organique intracellulaire, ce qui nuit à l'efficacité de la coagulation et de la sédimentation (Ma et coll., 2012; Qi et coll., 2016).
Des biofilms peuvent se développer dans le réseau de distribution et constituer un réservoir distinctif de précurseurs de SPD (Abokifa et coll., 2016; Xu et coll., 2018; Li et coll., 2020c). La MON présente dans l'eau du réseau de distribution peut être transférée au biofilm, subir une biotransformation et éventuellement se détacher (Wang et coll., 2012; Abokifa et coll., 2016). Une corrélation positive entre l'inactivation microbienne et la formation de THM indique que la dégradation des cellules bactériennes est un autre précurseur (Wang et coll., 2013, 2021). La quantité, la structure physique et la composition chimique du biofilm peuvent avoir une incidence sur le transport et la pénétration du désinfectant. Ce biofilm peut survivre et conserver des cellules viables en cas d'exposition constante à un désinfectant (Xue et coll., 2014; Liu et coll., 2016; Wang et coll., 2021). Le développement de biofilm et la croissance biologique peuvent entraîner une instabilité biologique dans le réseau de distribution. Ces systèmes sont plus susceptibles d'avoir du désinfectant résiduel instable, ce qui peut donner lieu à un ajout de chlore et donc accroître la formation de THM.
Pour de plus amples renseignements sur la MON, il est possible de consulter le document de Santé Canada intitulé Document de conseils sur la matière organique naturelle dans l'eau potable (désigné ici comme le document de conseils sur la MON) (Santé Canada, 2020a).
4.4.2 Précurseurs inorganiques
La présence de précurseurs inorganiques, comme le bromure et l'iodure, a une incidence sur le type de THM qui se formera. La présence de bromure peut entraîner la formation de THM bromés, tandis que la présence d'iodure dans l'eau entraînera la formation de THM iodés. (Tugulea et coll., 2018). La présence d'ammoniac aura également une incidence, car celui-ci réagit avec le chlore pour former de la monochloramine. Le changement de désinfectant modifie la quantité et le type de THM formés.
D'autres constituants de l'eau, comme les sels et la dureté de l'eau, peuvent avoir un impact sur la formation de THM. En général, les effets de ces constituants étaient plus faibles lorsqu'ils étaient testés dans une eau de surface que dans une eau distillée (voir l'annexe E).
4.4.2.1 Bromure
En présence de bromure, il y a changement vers la formation de THM bromés (bromoforme, DBCM, BDCM) (Summers et coll., 1993; Symons et coll., 1993; Chowdhury et coll., 2010; Hu et coll., 2010; Liu et coll., 2013; Roccaro et coll., 2014; Krasner et coll., 2016a; Neil et coll., 2019). Lorsqu'il est oxydé par le chlore, le bromure forme de l'acide hypobromeux (HOBr) et l'ion hypobromite (OBr-). Le HOBr a une activité d'halogénation plus puissante, réagit plus rapidement et attaque plus de sites dans le précurseur organique que l'acide hypochloreux (HOCl). Le HOCl restant continue de réagir avec tout ion Br- résiduel pour former davantage de HOBr (Symons et coll., 1993; Hua et Reckhow, 2013; Tian et coll., 2013; Neil et coll., 2019). Le HOBr réagit avec la MON pour former des THM bromés ainsi que d'autres SPD bromés (Hua et Reckhow, 2013). La plus faible formation de HOBr est liée à la plus faible concentration de bromure (Westerhoff et coll., 2022). Une augmentation de la concentration de bromure peut entraîner une augmentation de la concentration molaire totale de THM (somme du chloroforme et des THM bromés) (Chowdhury, 2013c).
Le facteur d'incorporation du brome (FIB) sert à déterminer la quantité et le type de THM bromés formés. Il désigne le rapport molaire des THM bromés sur les THM totaux. Ce rapport varie de 0 (tout chloroforme) à 3 (tout bromoforme) (Krasner et coll., 2006; Hong et coll., 2013). Le FIB peut servir à évaluer tout changement de condition de la source d'eau, du traitement et/ou du réseau de distribution. Le traitement peut enlever la MON hydrophobe. Par contre, le bromure n'est pas facilement à enlever, ce qui se traduit par des augmentations de Br-/COD et de Br-/chlore libre disponible. L'augmentation de ces rapports entraîne une hausse du FIB, ce qui indique que davantage de THM bromés sont formés (Summer et coll., 1993; Symons et coll., 1993; Chiu et coll., 2012; Liu et coll., 2013; Krasner et coll., 2016a; Zhang et coll., 2017; Neil et coll., 2019; Santé Canada, 2020a). En présence de chloramines, le FIB augmente aussi, mais dans une moindre mesure (Hong et coll., 2013). La MON hydrophile de plus faible poids moléculaire que le traitement ne parvient pas bien à enlever est plus réactive avec le bromure, ce qui entraîne aussi une augmentation des espèces de THM bromés (Kitis et coll., 2002; Liang et Singer, 2003; Chowdhury, 2013c).
En présence de bromure, les chloramines peuvent former de la bromamine, qui nuit aux capacités de désinfection et rend la chloramine instable (AWWA, 2017). Le bromure réagit avec les chloramines pour former du HOBr, ce qui peut mener à la formation de THM bromés. Les chloramines sont instables à des pH quasi neutres en raison de réactions d'autodécomposition. Ces réactions peuvent être augmentées de manière catalytique par le bromure (AWWA, 2017).
4.4.2.2 Iodure
Actuellement, il y a beaucoup plus d'études sur le chloroforme et les THM bromés que sur les THM iodés. La compréhension de l'incidence de l'iodure sur la formation des THM s'améliorera au fur et à mesure des recherches. À ce jour, aucune corrélation significative n'a pu être établie entre les concentrations de bromure et d'iodure dans les sources d'eau (Tugulea et coll., 2018; Westerhoff et coll., 2022). Les rapports de masse Br-/I- des sources d'approvisionnement en eau aux États-Unis et au Canada variaient de 2,9 à 238 (Richardson et coll., 2008; Weinberg et coll., 2011). La concentration d'iodure dans les sources d'eau peut présenter une forte variabilité saisonnière. Un rapport iodure/iode total de 34,4 % a été observé en hiver et de 86,6 % en été (Tugulea et coll., 2018).
Les constantes de vitesse de réaction pour l'oxydation de l'iodure et de l'acide hypoiodeux (HOI) par différents oxydants sont très variables. Il est prévu que la « probabilité » de formation de THM iodés augmente dans l'ordre suivant : ozonation < chloration < chloramination (Kumar et coll., 1986; Fábián et Gordon, 1997; Bichsel et Von Gunten, 1999). L'iodure peut être oxydé en acide HOI et ensuite en iodate (IO3-), qui est le puits souhaité, car il ne réagira plus pour former des THM iodés (Bichsel et Von Gunten, 2000).
Les HOCl/OCl- oxyderont rapidement l'iodure en HOI et ensuite en IO3- (Ullman et coll., 1990; Bichsel et Von Gunten, 1999). La vitesse de la réaction d'oxydation de l'iodure en HOI est plus rapide que celle de l'HOI en IO3-. Les réactions subséquentes de l'HOI avec la MON sont responsables de la formation des THM iodés (Bichsel et Von Gunten, 1999, 2000; Richardson, 2003, 2008; Hua et coll., 2006; Hua et Reckhow, 2007b, 2008; Gallard et coll., 2009; Jones et coll., 2012a, b; Ye et coll., 2012; Allard et coll., 2013; Zhang et coll., 2015a, 2016, 2018b; Liu et coll., 2017, 2018; Dong et coll., 2019a). Avec une dose de chlore de 0,5 mg/L, tous les THM iodés ont augmenté puis diminué lorsque la dose de chlore a augmenté jusqu'à 5,0 mg/L (Hua et coll., 2006). Les auteurs ont déclaré qu'une stratégie possible pour le contrôle des THM iodés serait d'augmenter la dose de chlore. Cependant, un coefficient CTNote de bas de page 1 de désinfection adéquat peut limiter la flexibilité. En outre, une augmentation de la dose de chlore peut accroître la formation de chloroforme et de THM bromés.
Le ClO2 oxyde rapidement l'iodure en iode (I2)) et entraîne la formation d'HOI, d'iodure et d'ions tri-iodure, puis de THM iodés (Smith et coll., 2010; Ye et coll., 2013; Zhang et coll., 2015a). Lorsqu'elle était suivie directement par la chloramine, la préoxydation avec le ClO2 a réduit la formation de TIM et de CDIM comparativement à la chloramination seule (Jones et coll., 2012b).
En présence de chloramine, l'oxydation de l'HOI en IO3- est un processus très lent, qui prolonge le temps de réaction entre l'HOI et la MON. Ce temps supplémentaire entraîne une formation plus importante de THM iodés, en particulier d'iodoforme (Bichsel et Von Gunten, 2000; Hua et Reckhow, 2007b). La stratégie de chloramination (chlore ajouté avant l'ammoniac ou chloramine préformée) et la stratégie de préchloration (dose de chlore et temps de contact) sont des facteurs importants (Bichsel et Von Gunten, 2000; Krasner et coll., 2006; Hua et coll., 2006; Hua et Reckhow, 2008; Richardson et coll., 2008; Goslan et coll., 2009; Jones et coll., 2011, 2012a; Karanfil et coll., 2011; Criquet et coll., 2012; Allard et coll., 2013; Liu et coll., 2017).
La préoxydation au permanganate de potassium, suivie de la chloramine, a entraîné une augmentation de la quantité de TIM et de THM iodés bromés par rapport à la chloramine seule (Jones et coll., 2012b). Le produit de la réduction, le dioxyde de manganèse, peut catalyser la formation de SPD iodés dans l'eau avec de l'iodure pour un pH de 5,0 à 7,0 (Gallard et coll., 2009). L'oxydation de l'ozone se produit très rapidement pour former des IO3-, réduisant ainsi la formation de THM iodés (Bichsel et Von Gunten, 1999; Liu et Reckhow, 2001; Allard et coll., 2013). Il a été démontré que les rayons UV convertissent les IO3- (forme stable) en iodure (précurseur des THM iodés) durant la post-chloramination (Liu et coll., 2012a; Zhang et coll., 2016, 2018b; Xia et coll., 2018). L'application de rayons UV devrait être considérée avec prudence dans le cas d'une eau contenant des IO3-.
Dans de l'eau contenant du bromure, le HOBr accélère le processus d'oxydation de l'HOI en IO3- dans un processus catalysé par le bromure. Cette réaction plus rapide aux IO3- entraîne une formation réduite de THM iodés (Criquet et coll., 2012; Liu et coll., 2017). Cependant, le HOBr peut mener à un plus grand nombre de précurseurs bromés pouvant réagir avec l'HOI, ce qui peut aboutir à des espèces de THM iodés plus bromés (Westerhoff et coll., 2004; Criquet et coll., 2012).
4.4.3 Facteurs supplémentaires
Les paramètres de la qualité de l'eau comme le pH et la température influent sur la formation de THM. Il est important de comprendre les conséquences des changements du pH sur la formation de toutes les espèces de THM et d'autres SPD (Chowdhury, 2013c). Une augmentation du pH peut accroître la formation de chloroforme (Reckhow et coll., 1990; Liang et Singer, 2003; Li et coll., 2007; Fu et coll., 2009; Hu et coll., 2010, 2019; Reckhow et Singer, 2011; Liu et coll., 2011; Becker et coll., 2013; Chowdhury, 2013c; Hong et coll., 2013; Hua et coll., 2015; Zhang et coll., 2018c; Carra et coll., 2020), mais peut réduire la formation de THM bromés (Chowdhury, 2013c). Si l'eau contient du bromure, diminuer le pH pour réduire la formation de chloroforme entraînera une hausse des THM bromés. Cette stratégie de gestion des THM peut également accroître la corrosivité de l'eau, entraînant la libération de métaux (par exemple plomb, cuivre) ou, en présence d'ammoniac, la formation de dichloramine, qui peut causer des problèmes de goût et d'odeur. Idéalement, une stratégie de gestion déterminera le pH qui réduirait au minimum la corrosion et d'autres effets négatifs potentiels ainsi que les concentrations de THM et la toxicité des espèces formées.
À des températures de l'eau plus élevées, les vitesses de réaction augmentent et la décomposition des SPD halogénés aromatiques en THM est favorisée (Reckhow et Singer, 2011; Becker et coll., 2013; Hong et coll., 2013; Hu et coll., 2019; Valdivia-Garcia et coll., 2019). La réaction est limitée par une dégradation du chlore plus importante lorsque la température est plus élevée. Cependant, dans la pratique, des doses supplémentaires de chlore seraient ajoutées pour maintenir des concentrations résiduelles (Rodriguez et Sérodes, 2001; Reckhow et Singer, 2011). L'incidence de la température sur la formation de THM dans le réseau de distribution n'est pas toujours directe. Par exemple, en été, quand les températures de l'eau sont maximales, la demande en eau est généralement plus importante. Cette augmentation de la demande en eau se traduit par une réduction du temps de séjour et du temps de contact de l'eau dans le réseau de distribution (Becker et coll., 2013). La hausse de la température peut également avoir des répercussions sur le désinfectant résiduel dans le réseau de distribution en raison des vitesses de réaction plus élevées, de l'augmentation de l'activité biologique et des variations de la MON (AWWA, 2017). Les changements de température de l'eau devraient être pris en compte en même temps que d'autres paramètres qui varient également d'une saison à l'autre, comme la quantité et la composition de la MON.
Les THM continuent à se former au fil du temps. Le temps de séjour est fonction de la quantité et de l'utilisation de l'eau et peut être sujet à des changements avec le temps. Ces changements de temps de séjour peuvent coïncider avec des variations de la qualité de l'eau, ce qui peut aggraver l'effet sur la formation de THM. Dans l'ensemble, il convient d'évaluer à la fois la qualité de l'eau et la quantité d'eau afin de comprendre les répercussions possibles sur les concentrations de THM.
4.5 Considérations relatives au traitement
Les services de l'eau doivent trouver un juste équilibre entre la désinfection efficace et la création de THM, car l'eau potable doit avant tout être salubre sur le plan microbiologique afin d'éviter les maladies d'origine hydrique. Quant au contrôle des THM, l'option privilégiée et la plus efficace consiste à réduire ou à limiter leur formation avant et pendant la distribution. À la station de traitement de l'eau potable, il est possible de limiter la quantité de THM en enlevant la MON de l'eau avant la chloration, en optimisant le processus de désinfection ou en modifiant la stratégie de désinfection. Dans les cas où des THM se sont formés, des options existent pour les enlever. Cette méthode n'est généralement pas aussi efficace que celle visant à réduire leur formation; elle ne devrait être envisagée que comme une stratégie provisoire pendant qu'on évalue un meilleur traitement.
4.5.1 Traitement à l'échelle municipale
Les stratégies visant à réduire la formation consistent notamment en l'enlèvement des précurseurs avant la désinfection, le recours à une méthode alternative de préoxydation ou la modification des pratiques de désinfection. Le traitement peut changer selon les saisons ou au fil du temps pour tenir compte de l'évolution des facteurs qui influent sur la formation de THM.
Les technologies utilisées pour enlever les THM qui se sont déjà formés comprennent l'aération, la filtration sur charbon actif en grains (CAG) ou la filtration sur membrane. L'aération peut être effectuée dans des stations de pompage/pompage-relais ou dans des réservoirs. La filtration sur CAG ou la filtration membranaire peuvent faire partie de la chaîne de traitement au sein de la station de traitement. En général, l'aération permet de mieux enlever le chloroforme et les THM bromés sont enlevés plus efficacement par l'adsorption sur CAG et l'osmose inverse.
Toute modification visant à contrôler ou à réduire au minimum les THM doit être évaluée par des études à l'échelle de banc d'essai et à l'échelle pilote pour s'assurer que les objectifs de traitement sont atteints, qu'une désinfection efficace est réalisée et que la modification n'entraîne pas de conséquences imprévues ni de difficultés à respecter d'autres exigences réglementaires. Ces essais doivent être répétés régulièrement pour tenir compte des changements de la qualité des sources d'eau, de la variabilité saisonnière et du changement climatique.
4.5.1.1 Options de contrôle des précurseurs
Enlèvement des précurseurs organiques
L'enlèvement des précurseurs organiques permet de réduire la formation de THM. La coagulation suivie de la clarification ou la filtration est la méthode la plus couramment utilisée, puisqu'elle est efficace dans la plupart des applications. Toutefois, son applicabilité devrait être analysée attentivement en fonction de la source, car la coagulation ne peut enlever que certaines fractions de la MON; les fractions restantes peuvent réagir avec des désinfectants, de telle sorte que d'autres recommandations pour les SPD dans l'eau potable ne sont pas respectées. En général, la MON qui présente une SUVA élevée (> 4 L/mg∙m) a tendance à être de nature hydrophobe et est généralement propice à la coagulation. Les sources à faible SUVA ont tendance à comporter de la MON hydrophile qui ne se prête pas à la coagulation (Pernitsky, 2003). Cependant, certaines fractions neutres hydrophiles peuvent présenter une SUVA élevée, ce qui peut s'avérer trompeur en ce qui concerne le potentiel d'enlèvement du carbone organique par coagulation (Edzwald, 1993). Si, après la coagulation, le COD résiduel demeure réactif, il pourrait être nécessaire de recourir à d'autres technologies ciblant l'enlèvement de fractions précises de la MON (Bond et coll., 2011). Comme les acides humiques et fulviques sont d'importants précurseurs des SPD, une élimination adéquate de la couleur peut être nécessaire.
La coagulation améliorée comporte plusieurs objectifs, notamment celui d'optimiser l'enlèvement des particules et de la turbidité, ainsi que le COT et des précurseurs de SPD. Un autre objectif est de réduire la quantité de coagulant résiduel, la production de boues et les coûts d'exploitation (White et coll., 1997; Edzwald et Tobiason, 1999). La coagulation améliorée est généralement réalisée en abaissant le pH de coagulation avec des doses plus élevées de coagulant (Gregory, 1998). Une étude à grande échelle a évalué la coagulation améliorée pour maximiser l'enlèvement des précurseurs organiques grâce à la surveillance par UV254 pour déterminer une stratégie d'ajustement de la dose (Beauchamp et coll., 2020). Sur une gamme élargie de sources d'eau, les résultats ont montré qu'une dose stœchiométrique d'alun/UV254 de 180 ± 25 mg d'alun cm/L maximisait l'enlèvement des précurseurs de SPD. Cette relation s'est avérée valable pour toutes les saisons, malgré les changements de la qualité de l'eau.
Le CAG peut enlever les précurseurs de THM, et le point de percée du pfTHM va généralement de pair avec celui du COD. Parfois, le point de percée du pfTHM est plus tardif que celui du COD, ce qui fait de ce dernier un bon paramètre de substitution à surveiller pour déterminer le moment de régénération du CAG (Reckhow et Singer, 2011). Quelques études ont examiné le CAG avec divers désinfectants/oxydants et différents lieux de mise en œuvre. Une étude a montré que l'ajout de chlore pendant la filtration sur CAG prolongeait le temps de percée de la colonne par rapport à la filtration sur CAG avec postchloration. Avec le bromure, les résultats se sont améliorés; les auteurs ont indiqué que le CAG adsorbe mieux les SPD bromés que les SPD chlorés (Jiang et coll., 2017). Une étude pilote a permis d'évaluer trois scénarios : la filtration sur CAG seule, la préchloration et la pré-ozonation/filtration sur CAG. Chaque scénario a atteint le point de percée des THM à des volumes de lit similaires (Verdugo et coll., 2020). Le traitement conventionnel avec le CAG a permis de réduire la dose de chlore pour la désinfection et de mieux contrôler les THM et d'autres SPD pendant des événements pluvieux extrêmes (Neil et coll., 2019).
L'échange d'ions (IX) au moyen d'une résine échangeuse d'anions fortement basique peut potentiellement enlever la MON (Reckhow et Singer, 2011; Santé Canada, 2020a). Toutefois, les régénérations fréquentes produisent de grands volumes de saumure très concentrée, ce qui crée des problèmes d'élimination (Amini et coll., 2018; Wright, 2022). La gestion ou l'expédition des produits chimiques régénérants peut aussi constituer un problème pour les systèmes de traitement de l'eau potable de petite taille et/ou éloignés (Amini et coll., 2018). L'échange d'ions en mode biologique (BIEX) est une technologie prometteuse. Cette approche fait appel à un biofilm formé naturellement par des microorganismes présents dans la source d'eau brute, qui consomment le COD fixé (Zimmerman et coll., 2021). Elle emploie également une résine échangeuse d'anions fortement basique, mais les cycles de régénération sont moins nombreux (des mois plutôt que des jours), ce qui permet de réduire la quantité de saumure utilisée tout en réduisant la quantité de MON. Plusieurs études à l'échelle de banc d'essai et à l'échelle pilote ont permis d'évaluer le BIEX et les facteurs qui influent sur sa performance; elles ont donné de bons résultats quant à l'enlèvement du COD et des précurseurs des SPD (Amini et coll., 2018; Liu et coll., 2020b, 2022; Edgar et Boyer, 2021; Zimmerman et coll., 2021, 2023; Wright, 2022; Lee et coll., 2023). Une revue des problèmes et des stratégies de gestion de la saumure de régénération pour l'IX est présentée dans Liu et coll. (2021a).
L'échange d'ions peut provoquer de la corrosion. Il peut s'agir d'une corrosion galvanique provoquée par un rapport massique du chlorure au sulfate dans l'eau traitée (Edwards et coll., 1999; Edwards et Dudi, 2004; Edwards et Triantafyllidou, 2007; Santé Canada, 2022a), d'une réduction du pH de la résine échangeuse d'ions fraîchement régénérée, causée par l'enlèvement d'ions bicarbonate pendant les volumes de lit initiaux d'une série (Clifford, 1999; Wang et coll., 2010; Clifford et coll., 2011) ou d'une baisse continue du pH due à la régénération fréquente d'une résine échangeuse d'ions. Une étude, qui s'est penchée sur le bicarbonate comme solution de rechange au chlorure utilisé dans l'échange d'ions pour réduire le potentiel de corrosion, a montré une réduction similaire des précurseurs de SPD (Fernandez et coll., 2021). Des stratégies d'atténuation devraient être envisagées pour résoudre les problèmes de corrosion potentiels; il est possible d'en savoir davantage en consultant d'autres sources (Santé Canada, 2022a).
Les procédés d'adsorption et d'IX sont limités par la capacité du milieu et par l'effet des ions concurrents. Leur performance sera touchée par la fréquence des lavages à contre-courant et la régénération ou le remplacement du milieu.
Le document de conseils sur la MON de Santé Canada (2020a) présente une analyse plus détaillée des différentes techniques de traitement (coagulation, osmose inverse [OI], nanofiltration [NF], coagulation suivie de la microfiltration ou de l'ultrafiltration, IX, charbon actif ou procédé biologique) qui peuvent être utilisées pour enlever la MON. Les diverses technologies de traitement présentent une sélectivité différente dans l'enlèvement des précurseurs. L'enlèvement de la MON dépend du poids molaire et des propriétés hydrophiles ou hydrophobes (Zhang et coll., 2017; Andersson et coll., 2020). La MON hydrophobe (eau à SUVA élevée) se prête généralement mieux à l'enlèvement par traitement, tandis que la MON hydrophile est plus difficile à traiter (Chow et coll., 2004, 2006). Les performances de traitement obtenues par diverses technologies sont présentées à l'annexe F. Dans l'ensemble, les résultats obtenus à grande échelle, à l'échelle pilote et à l'échelle de banc d'essai indiquent que plusieurs traitements peuvent être efficaces (Santé Canada, 2020a). Cependant, des résultats peu convaincants peuvent aussi être observés.
Le choix d'un traitement et l'élaboration d'une stratégie de contrôle efficace de la MON dépendent de nombreux facteurs et doivent reposer sur une bonne compréhension des éléments suivants (Santé Canada, 2020a) :
- le type de MON et les variations de la concentration et des caractéristiques de la MON dans la source d'eau, dont celles attribuables aux variations saisonnières, aux changements climatiques, changements au paysage ou à l'existence de programmes de protection des sources d'approvisionnement en eau;
- de l'incidence de la MON sur les procédés de traitement de l'eau et des effets du traitement de l'eau sur la MON, pour la gamme complète des conditions de qualité de l'eau;
- les interactions avec les autres constituants de l'eau (par exemple le bromure et l'iodure);
- les interactions avec les produits chimiques utilisés pendant le traitement;
- les interactions avec les procédés (par exemple encrassement des membranes);
- les effets potentiels sur la qualité de l'eau dans le réseau de distribution, les systèmes de traitement en aval et les usagers.
Parmi les options de traitement supplémentaires ou de rechange à la coagulation améliorée pour l'enlèvement de la MON figurent les procédés de nanofiltration, de coagulation/ultrafiltration, d'IX, de filtration sur charbon actif en grains (CAG) ou sur charbon actif en poudre (CAP), de filtration biologique et d'oxydation. Ces constatations révèlent la nécessité de réaliser des essais appropriés pour assurer l'enlèvement adéquat de la MON et des précurseurs de SPD et pour optimiser les paramètres opérationnels. Dans le cas de la coagulation, cela inclut les test de floculation en bécher (« jar testing »). Dans le cas des autres technologies de traitement, il s'agit d'essais au banc ou d'essais pilotes. Les changements saisonniers et temporels nécessitent un suivi afin de s'assurer que la technologie est optimisée pour une gamme complète des conditions de qualité de l'eau.
Les limitations des procédés d'OI et de NF peuvent inclure l'entartrage et l'encrassement des membranes ainsi qu'une forte consommation d'énergie et des coûts d'immobilisation élevés. Le calcium, le baryum et la silice peuvent entartrer la membrane et réduire son efficacité. Puisque l'OI enlève complètement l'alcalinité de l'eau, elle entraînera sans cesse une diminution du pH et une augmentation de la corrosivité de l'eau traitée. Par conséquent, il faudra ajuster le pH de l'eau traitée et probablement augmenter l'alcalinité pour éviter les problèmes de corrosion, comme le relargage du plomb et du cuivre, dans le réseau de distribution (Schock et Lytle, 2011; U.S. EPA, 2023).
Enlèvement des précurseurs inorganiques
L'enlèvement de précurseurs inorganiques comme le bromure et l'iodure peut également permettre de réduire la formation de THM bromés et de THM iodés. Le bromure est difficile à retirer de l'eau et, bien que techniquement réalisable, il est peu probable que ce soit une option rentable pour réduire les THM bromés (Santé Canada, 2018). Une vue d'ensemble des stratégies d'enlèvement du bromure, notamment des études à l'échelle de banc d'essai et à l'échelle pilote, est présentée dans Westerhoff et coll. (2022). Selon les auteurs, il faut améliorer considérablement les capacités d'enlèvement du bromure pour que ces technologies ainsi que d'autres soient viables à grande échelle. Il importe que les systèmes d'eau potable comprennent bien les sources et les concentrations de bromure dans leur eau d'alimentation et la variabilité saisonnière.
L'enlèvement de l'iodure peut se faire par oxydation en IO3- (composé stable qui ne forme pas de THM iodés). La préchloration et la pré-ozonation sont deux options qui peuvent oxyder les ions I- en IO3- et éviter la formation de SPD iodés (Allard et coll., 2015; Kimura et coll., 2017). Cependant, la préchloration peut former d'autres SPD. Pour assurer une oxydation efficace des ions I- en IO3-, il est possible d'optimiser le temps de contact à la préchloration avant l'ajout d'ammoniac (pour former des chloramines) (Jones et coll., 2011). En général, l'enlèvement des précurseurs organiques est plus efficace que celle des précurseurs inorganiques, et l'enlèvement des précurseurs organiques donne lieu à une augmentation des rapports Br-/COD et I-/COD, ce qui se traduit par une augmentation des THM bromés et des THM iodés.
Des études de traitabilité propres à la source, notamment les analyses en laboratoire et/ou les études pilotes, sont essentielles pour déterminer les options de traitement les plus efficaces pour enlever la MON, diminuer sa réactivité à former des THM et enlever les précurseurs inorganiques. L'absence de caractérisation de la source et d'une étude de traitabilité propre à la source peut entraîner la sélection d'un traitement inapproprié, une augmentation des THM après la mise en œuvre, des conséquences inattendues ou des difficultés à respecter d'autres exigences réglementaires (par exemple d'autres SPD comme les AHA). Comme les sources d'eau ou les procédés de traitement peuvent changer selon les saisons et au fil du temps, il est important de surveiller régulièrement la concentration et les caractéristiques des précurseurs des SPD et d'évaluer leur incidence sur le traitement, la qualité de l'eau et les conditions du réseau de distribution. Les essais au banc et à l'échelle pilote devraient être actualisés pour tenir compte de toute modification de la source d'approvisionnement en eau. Le tableau 24 présente un résumé de certaines des options de traitement qui existent pour réduire la formation de THM par l'enlèvement des précurseurs.
| Stratégie de contrôle pour l'enlèvement des précurseurs | Avantages | Inconvénients | Remarques |
|---|---|---|---|
| Coagulation améliorée (White et coll., 1997; Gregory, 1998; Edzwald et Tobiason, 1999; AWWA, 2011; Reckhow et Singer, 2011; Becker et coll., 2013; Beauchamp et coll., 2020; Santé Canada, 2020a) |
|
|
|
| Modification de la coagulation (Becker et coll., 2013) |
|
|
|
| CAP (Becker et coll., 2013; Santé Canada, 2020a) |
|
|
|
| CAG (Reckhow et Singer, 2011; Becker et coll., 2013; Santé Canada, 2020a) |
|
|
|
| CAG biologique (Wang et coll., 2023) |
|
|
La biomasse bactérienne fixée enlève la MON biodégradable présente dans l'eau. |
| Filtration membranaire (Reckhow et Singer, 2011; Becker et coll., 2013; Santé Canada, 2020a) |
|
|
|
| IX (Reckhow et Singer, 2011; Santé Canada, 2020a) |
|
|
|
| BIEX (Amini et coll., 2018; Liu et coll., 2020b, 2022; Edgar et Boyer, 2021; Zimmerman et coll., 2021, 2023; Wright, 2022; Lee et coll., 2023) |
|
|
Utilisation d'une résine échangeuse d'anions fortement basique avec moins de régénérations |
| Traitement biologique (Reckhow et Singer, 2011; Santé Canada, 2020a) |
|
|
|
| Indicateurs opérationnels de surveillance : SUVA; DAUV; COT |
|
|
Les paramètres de surveillance comme la SUVA, le DAUV et le COT peuvent aider les exploitants à gérer le réseau et à réagir aux problèmes. |
|
BIEX = échange d'ions en mode biologique, CAG = charbon actif en grains, CAP = charbon actif en poudre, COA = carbone organique assimilable, COD = carbone organique dissous, COT = carbone organique total, DAUV = différentiel d'absorbance UV, Fe = fer, IX = échange d'ions, Mn = manganèse, MOB = matière organique biologique, MON = matière organique naturelle, NF = nanofiltration, OI = osmose inverse, PM = poids moléculaire, SPD = sous-produit de désinfection, SUVA = absorbance UV spécifique |
|||
4.5.1.2 Stratégies de contrôle d'oxydation ou de désinfection
La désinfection est une étape importante du traitement de l'eau qui consiste en l'inactivation ou la destruction des microorganismes. L'oxydation fait référence à l'enlèvement ou à la décomposition d'une substance chimique (AWWA, 2017). Dans l'eau, la dégradation du désinfectant correspond à la décomposition naturelle de la substance chimique, et la demande en chlore est la réaction entre les désinfectants et les constituants de l'eau (AWWA, 2017).
Le type et les doses d'oxydant et/ou de désinfectant utilisés dans le traitement de l'eau potable ont une incidence sur la formation de THM et d'autres SPD. Le changement de désinfectant ou l'ajout d'une étape d'oxydation peut avoir un effet sur la formation de THM. Il y a aussi le risque de formation d'autres SPD comme la N-nitrosodiméthylamine (NDMA), le bromate et le chlorate/chlorite (Santé Canada, 2008b, 2011, 2018). Les stratégies de contrôle d'oxydation ou de désinfection sont d'autres options qui assurent le contrôle de la formation de THM (voir le tableau 25 pour obtenir un résumé des stratégies de contrôle).
Quelle que soit la stratégie adoptée, une désinfection adéquate doit être maintenue pour assurer la salubrité microbiologique de l'eau. Il est important d'évaluer la formation de THM tout au long du procédé de traitement et dans le réseau de distribution. Les stratégies de désinfection peuvent changer au fil du temps pour tenir compte des changements dans la source d'eau. Par exemple, en été et en automne, les températures plus élevées et l'augmentation de la MON mènent généralement à l'utilisation de doses plus élevées de désinfectant. Ces changements sont des facteurs de l'augmentation observée des concentrations de THM (Gilca et coll., 2020).
Le chlore peut être utilisé pour l'oxydation et/ou pour la désinfection primaire ou secondaire. Le chlore libre se présente généralement sous la forme de HOCl et d'OCl- et dépend du pH avec une pKa de 7,5 (Hua et Reckhow, 2008; Bond et coll., 2014; Mayer et Ryan, 2019). En présence de bromure, il y a formation de HOBr, qui conduit à la formation de THM bromés. Le chlore ou la monochloramine sont utilisés pour la désinfection secondaire dans le réseau de distribution (Reckhow et Singer, 2011, AWWA, 2017).
Le dioxyde de chlore (ClO2) est un composé hautement réactif et volatil. Sa capacité de laisser un désinfectant résiduel est limitée, et il est généralement utilisé comme oxydant. Le ClO2 se dégrade en chlorite, en chlorate et en chlorure, ce qui impose des limites à son utilisation. La dose appliquée maximale de ClO2 ne devrait pas dépasser 1,2 mg/L pour s'assurer que les concentrations de chlorite ne dépassent pas la CMA (Santé Canada, 2008b).
Dans le cadre d'une étude, on a évalué l'utilisation de ClO2 (1 mg/L) suivie de chlore (aucun traitement) sur 12 sources d'approvisionnement en eau (9 eaux de surface, 1 eau souterraine et 2 effluents d'eaux usées). L'étude a montré que l'utilisation de ClO2 suivie d'une chloration avait mené à une réduction du pfTHM (de 6 % à 45 %) dans toutes les eaux par rapport à la chloration seule (Yang et coll., 2013). Dans une étude à l'échelle de banc d'essai ayant recours à du dioxyde de chlore sur de l'eau de rivière contenant de l'acide humique, aucun THM n'a été détecté dans l'eau exempte de bromure. Une petite quantité de bromoforme a été détectée dans l'eau contenant du bromure. Selon les auteurs, le ClO2 aurait pu oxyder le bromure en HOBr, lequel a réagi avec l'acide humique (Li et coll., 1996). Une autre étude a révélé que lorsque le ClO2 était utilisé pour la désinfection, moins de 3 μg/L de THM se formaient. Les TOX inconnus ne représentaient que 5 % à 11 % de ceux formés avec le chlore libre, et aucun THM bromé ne s'est formé (Hua et Reckhow, 2007a). Cela indique qu'une moins grande quantité de SPD halogénés inconnus ont été formés avec le ClO2.
La chloramine peut servir à la désinfection secondaire, car elle est plus stable que le chlore libre. Dans une étude portant sur sept stations de traitement de l'eau potable à grande échelle utilisant divers traitements avant la désinfection, la concentration médiane en THM était de 106 μg/L pour les trois stations qui utilisaient du chlore et de 48 μg/L pour les quatre stations qui utilisaient de la chloramine (Goslan et coll., 2009). Dans une étude à l'échelle de banc d'essai utilisant une eau naturelle (SUVA = 1,96 L/m·mg et Br- = 160 μg/L), le pfTHM a été mesuré dans trois scénarios de désinfection. La chloramine a réduit le pfTHM de 88 % et la combinaison chlore-chloramine, de 68 % par rapport au chlore. Dans le scénario de désinfection à la chloramine, la composition des THM bromés à 30 minutes était principalement du BDCM, qui est passée à une plus grande concentration de DBCM et de bromoforme à mesure que le temps de réaction avançait (Tian et coll., 2013). Dans sept eaux naturelles désinfectées à la chloramine, on a constaté que les TOX inconnus représentaient 10 % à 18 % de ceux du chlore libre et qu'ils augmentaient avec le temps de contact (Hua et Reckhow, 2007a, 2008).
L'utilisation de la chloramine peut mener à la nitrification dans le réseau de distribution (Santé Canada, 2020b). La nitrification peut entraîner des problèmes de qualité de l'eau, notamment la formation de nitrites et de nitrates, la perte de désinfectant résiduel, la recroissance bactérienne et la formation de biofilms, la formation de SPD et la baisse du pH et de l'alcalinité qui peut entraîner des problèmes de corrosion (U.S. EPA, 2002; Zhang et coll., 2009, 2010; AWWA, 2013). Les responsables de systèmes d'approvisionnement en eau potable peuvent choisir de passer au chlore lors d'un épisode de nitrification. Ce changement peut toutefois entraîner une augmentation des THM. Les services d'eau qui utilisent de la chloramine dans le réseau de distribution devraient disposer de programmes de traitement complets pour enlever les précurseurs de THM s'ils choisissent d'utiliser le chlore pour lutter contre la nitrification.
Durant la nitrification, les bactéries oxydant l'ammoniac peuvent biodégrader les THM par cométabolisation (Speitel Jr. et coll., 2010). Les sous-produits de la cométabolisation des THM peuvent être toxiques pour ces bactéries oxydant l'ammoniac, réduisant ainsi la nitrification. Toutefois, la cométabolisation des THM ne devrait pas être utilisée comme stratégie pour prévenir la nitrification.
En raison de la réactivité de l'ozone (O3), il n'est pas possible de l'utiliser pour maintenir un désinfectant résiduel dans le réseau de distribution. Lorsque l'O3 est utilisé pour la désinfection primaire, il réduit la quantité de chlore nécessaire à la désinfection secondaire (Mazhar et coll., 2020). L'oxydation par l'ozone nécessite une étape ultérieure de traitement biologique pour réduire les précurseurs de THM et le potentiel de croissance du biofilm dans le réseau de distribution résultant de l'augmentation de la matière organique biologique (MOB) (Yan et coll., 2010; AWWA, 2017). L'utilisation d'O3 peut mener à la formation de bromate et d'acétaldéhydes halogénés (Liu et coll., 2014; Santé Canada, 2018; Gao et coll., 2020; Laflamme et coll., 2020). Après une préoxydation à l'O3, des études ont révélé que :
- le COT n'était généralement pas touché;
- la SUVA avait généralement diminué, ce qui indique une transformation de la structure aromatique en formes plus hydrophiles (SUVA élevée – plus touchée; faible SUVA – moins touchée);
- la MOB avait augmenté;
- une baisse de la SUVA indiquait que la partie hydrophile de la MON est biodégradable;
- grâce à divers procédés de traitement et à la postchloration, les THM avaient généralement diminué pour les eaux ayant une SUVA moyenne à élevée;
- une eau ayant une faible SUVA (1,7 L/mg·m) s'est avérée présenter une augmentation de THM, ce qui indique que l'O3 est moins efficace sur les fractions hydrophiles de la MON;
- dans l'eau contenant du bromure, les THM ont évolué vers une quantité moindre de chloroforme et une quantité plus élevée de bromoforme et de DBCM;
- dans l'eau contenant de l'iodure, des ions IO3- (forme stable souhaitée) se forment rapidement, réduisant ainsi la quantité de THM iodés
(Bichsel et Von Gunten, 1999; Liu et coll., 2001; Miltner et coll., 2008; Wert et Rosario-Ortiz, 2011; Allard et coll., 2013; Hua et Reckhow, 2013; Méité et coll., 2015; Gao et coll., 2020).
Le rayonnement UV est un procédé de désinfection physique qui inactive les agents pathogènes et génère peu ou pas de THM (Becker et coll., 2013). Normalement, on l'installe après l'enlèvement d'une bonne partie de la turbidité et de la MON (vers la fin de la chaîne de traitement) (Dotson et coll., 2010). Comme la désinfection par UV ne maintient pas une concentration résiduelle, il faut donc utiliser du chlore ou de la monochloramine dans le réseau de distribution (Mayer et Ryan, 2019).
Il existe plusieurs procédés d'oxydation avancée : O3/UV, O3/ultrasons, O3/H2O2, O3/UV/ultrasons et O3/ultrasons/FeSO4 (Ziylan et Ince, 2013). Ces procédés peuvent constituer une solution de rechange pour détruire la matière organique qui est moins sensible à la dégradation par l'O3 seul (Chin et Bérubé, 2005; Tubić et coll., 2011; Ziylan et Ince, 2013).
Le procédé UV/H2O2 génère des radicaux OH, qui transforment la MON hydrophobe moins réactive (PM plus élevé) en MON hydrophile plus réactive (PM plus faible). Le COT demeure relativement inchangé. Cette modification de la MON donne généralement lieu à une augmentation de la formation de THM et de la demande en chlore lors des divers traitements et de la désinfection subséquente (Dotson et coll., 2010; Borikar et coll., 2015; Chu et coll., 2016; Ding et coll., 2019). Le charbon actif biologique peut améliorer les performances en matière d'enlèvement du COT et de réduction du pfTHM (Sarathy et coll., 2011). Du H2O2 résiduel subsistera après l'irradiation et devra être inactivé avant la chloration par du chlore libre, du CAG ou du charbon actif biologique (Dotson et coll., 2010; Linden et Dotson, 2012). La préoxydation par UV/H2O2 suivie d'une postchloramination/chloration a fait l'objet d'une étude à l'échelle de banc d'essai (Zhang et coll., 2018b). L'administration d'une dose d'UV de 460 mJ/cm2 et d'une dose de H2O2 de 20 mg/L (eau ultrapure contenant 3,5 mg/L de COD, 10 μM d'ions Br- et 1 μM d'ions I-) a été directement suivie d'une chloration et a entraîné une réduction de THM iodés formés. L'inverse a été observé à l'étape de la postchloramination.
Au cours de l'exposition simultanée au procédé UV/Cl, le chlore libre génère diverses espèces réactives (OH, Cl, Cl2- et O-) (Gao et coll., 2019). En général, le traitement par UV/Cl forme moins de THM avec une spéciation différente que la chloration seule (Fang et coll., 2014; Wang et coll., 2015c; Zhang et coll., 2015b; Guo et coll., 2016; Li et coll., 2016). Gao et coll. (2019) ont constaté que l'augmentation de la fluence UV (dose) s'accompagnait d'une augmentation initiale suivie d'une diminution de la concentration de THM. Le procédé UV/Cl, suivi de la filtration sur CAG et de la chloration, a été évalué à l'échelle de banc d'essai (Carra et coll., 2020). Après l'étape UV/Cl, les THM ont augmenté aux pH 5,1 à 6,5, mais ont diminué aux pH 7,2 à 8,2. Après le traitement au CAG, les THM ont diminué et les meilleurs résultats ont été obtenus à un pH plus élevé. Dans tous les cas, la concentration de THM a augmenté à l'étape de la postchloration, mais sans jamais dépasser 40 μg/L.
On a évalué à l'échelle de banc d'essai l'utilisation d'UV dans un système mixte chlore/chloramine. La concentration de chloroforme a augmenté lorsque le rapport de masse HOCl:NH2Cl est passé de 5:0 (tout le chlore) à 4:1, puis a diminué lorsque le rapport est passé de 4:1 à 0:5 (toute la chloramine) (Liu et coll., 2021b).
Le ferrate [Fe(VI)] est un préoxydant potentiel capable de réduire la formation de THM lors d'une chloration ou d'une chloramination subséquente (Jiang et Lloyd, 2002). Le ferrate (20 mg/L) utilisé avant la chloration dans 12 sources d'eau (9 eaux de surface, 1 eau souterraine et 2 effluents d'eaux usées) a permis d'obtenir dans 8 eaux un taux de pfTHM inférieur à celui obtenu par le chlore utilisé seul (Yang et coll., 2013).
La préoxydation par l'ozone, le chlore, le permanganate de potassium et/ou le ferrate de potassium peut améliorer l'enlèvement des algues et potentiellement réduire les THM formés lors de la désinfection subséquente (Ma et Liu, 2002; Plummer et Edzwald, 2002; Sharma et coll., 2002; Chen et Yeh, 2005; Henderson et coll., 2008; Chu et coll., 2011, 2017; Fan et coll., 2013; Xie et coll., 2013; Zhou et coll., 2014, 2019; Chen et coll., 2018; Hu et coll., 2018; Dong et coll., 2019b, c, 2021; Ma et coll., 2019; Shi et coll., 2019; BernatQuesada et coll., 2020; Gilca et coll., 2020). La quantité et les propriétés de la matière organique extracellulaire libérée varient en fonction de l'espèce d'algue, et du type et de la dose d'oxydant. La matière organique extracellulaire se comporte comme des polymères non ioniques et des polyélectrolytes anioniques qui peuvent accroître l'efficacité de la floculation et réduire la formation de THM (Chen et coll., 2009; Shi et coll., 2019). La floculation peut être améliorée ou entravée selon la concentration et le poids moléculaire de la matière organique extracellulaire (Chen et coll., 2009). En cas de lyse cellulaire, de la matière organique intracellulaire peut être libérée, ce qui augmente la demande en coagulant et en chlore ainsi que la formation de THM (Knappe et coll., 2004; Chen et coll., 2009). La dose optimale d'oxydant est celle qui permet de modifier les cellules sans les lyser (Henderson et coll., 2008).
Dans les réseaux de distribution de plus grande taille, le temps de séjour hydraulique peut être plus long et la dégradation du chlore peut se produire dans les sections les plus à l'extrémité. Le degré de dégradation du chlore varie en fonction du temps et de l'emplacement et est influencé par les matériaux des conduites, la température et le pH (Wang, 2021). La désinfection d'appoint dans les endroits du réseau de distribution où la concentration en désinfectant résiduel est faible permet de réduire le recours à la désinfection primaire et secondaire à la station de traitement (Reckhow et Singer, 2011). L'optimisation de la chloration d'appoint peut représenter un défi, en particulier dans les systèmes de grande envergure. Une étude d'une durée d'un an portant sur un réseau de distribution d'eau à grande échelle a révélé que l'utilisation de la chloration d'appoint réduisait la formation générale de THM. Toutefois, les concentrations de THM ont augmenté à ces endroits directement après la chloration d'appoint (Zhu et coll., 2022). L'efficacité de cette stratégie est propre à chaque site et devrait être évaluée par des études à l'échelle de banc d'essai ou à l'échelle pilote.
| Stratégie de contrôle de la désinfection | Avantages | Inconvénients | Remarques |
|---|---|---|---|
| Désinfection retardée (Reckhow et Singer, 2011; Becker et coll., 2013) |
|
|
|
| Optimisation des doses de chlore (Becker et coll., 2013; Hong et coll., 2013) |
|
|
Plusieurs approches :
|
| Mise en place d'une préoxydation, une solution de rechange aux désinfectants primaires ou secondaires. (Reckhow et Singer, 2011) |
|
|
|
| Désinfection d'appoint (Reckhow et Singer, 2011) |
|
|
|
| Réduction du pH (Reckhow et Singer, 2011; Chowdhury, 2013c) |
|
|
|
|
Le coefficient CT est le produit de « C » (la concentration résiduelle de désinfectant, mesurée en mg/L) par « T » (le temps de contact du désinfectant, mesuré en minutes; « T » est habituellement calculé à l'aide d'une valeur T10, qui correspond à la durée de rétention de l'eau pendant laquelle le temps de contact requis est atteint ou dépassé pour 90 % de l'eau); SPD = sous-produit de désinfection, THM = trihalométhanes |
|||
4.5.1.3 Enlèvement des THM formés
La stratégie privilégiée pour contrôler les THM consiste à réduire au minimum la formation de THM. Toutefois, dans certains cas, une chloration préalable à l'enlèvement des précurseurs peut être nécessaire (par exemple pour le contrôle du biofilm ou de la moule zébrée, ou pour l'enlèvement d'autres contaminants) ou des concentrations élevées à des endroits précis du réseau de distribution peuvent être observées. Dans ces cas, il est possible de réduire les THM formés par un procédé de traitement (aération, CAG, OI ou NF). L'aération peut être utilisée dans les réservoirs d'eau traitée, les réservoirs d'eau ou les cuves de stockage. Le CAG, l'OI ou la NF pourraient faire partie de la chaîne de traitement. Bien que ces technologies servent généralement à enlever les précurseurs des THM, elles possèdent une certaine capacité à enlever les THM déjà formés. Après l'une ou l'autre de ces options de traitement, les THM continueront à se former, car la MON restante et le chlore continuent à réagir.
Aération : L'aération peut servir à enlever les THM lorsque d'autres SPD non volatils comme les AHA ne sont pas préoccupants (Ghosh et coll., 2015). Diverses technologies d'aération telles que les aérateurs à plateaux, à pulvérisation et en surface peuvent s'avérer efficaces (Ghosh et coll., 2015; Yoakum et Duranceau, 2018). En raison de sa constante de la loi de Henry plus élevée, le chloroforme est mieux éliminé par strippage à l'air que les THM bromés (Johnson et coll., 2009; Brooke et Collins, 2011).
L'enlèvement des THM par aération s'améliore avec l'augmentation du rapport air/eau et de la température de l'eau (Johnson et coll., 2009; Brooke et Collins, 2011; Mirzaei et Gorczyca, 2020). Une étude à grande échelle a montré une réduction des THM de 60 μg/L à 18 μg/L après l'installation d'un système d'aération sur plateaux (Yoakum et Duranceau, 2018). Une étude à l'échelle de banc d'essai sur l'aération par diffusion a permis d'enlever systématiquement le chloroforme dans une proportion supérieure à 90 % (rapports air/eau > 45:1). L'aération par pulvérisation dépend du diamètre et de la distance de parcours des gouttelettes (Duranceau et coll., 2016). Dans une étude à l'échelle pilote, la réduction des THM variait de 20 % à plus de 99,5 % selon les caractéristiques de fonctionnement (Brooke et Collins, 2011). Une ventilation adéquate est nécessaire pour enlever efficacement les THM (Cheung et coll., 2020).
Le strippage à l'air peut être utilisé dans les endroits éloignés des réseaux de distribution où les concentrations de THM posent problème (par exemple les réservoirs d'eau traitée et les culs-de-sac), ce qui permet de ne traiter qu'une fraction de l'eau (Ghosh et coll., 2015; Schneider et coll., 2015). L'efficacité du strippage à l'air dans les réservoirs de stockage est déterminée par des facteurs tels que la configuration du réservoir, le type d'entrée ou de sortie, le cycle et le mélange du réservoir, les niveaux d'eau, le temps de séjour dans le réservoir et la présence d'un nombre suffisant d'évents. Certains systèmes de stockage peuvent tout simplement nécessiter l'ajout d'un système de becs pulvérisateurs (Brooke et Collins, 2011).
Il est également possible d'installer des technologies d'aération à l'intérieur du réservoir d'eau traitée. L'enlèvement global par ce moyen dépend de nombreux facteurs, notamment du temps de séjour hydraulique, de la formation de THM dans le réservoir d'eau traitée et de l'arrivée d'eau traitée fraîchement aérée. Lorsqu'un système d'aération est utilisé dans un réservoir ou un réservoir d'eau traitée, il est probable que l'eau soit mélangée de telle sorte que le facteur d'efficacité hydraulique soit réduit (Ghosh et coll., 2015). Si le réservoir est utilisé pour des demandes de crédit liées au CT, ce changement de facteur d'efficacité hydraulique devrait être pris en compte pour s'assurer que le coefficient CT est suffisant.
Une étude a examiné un réseau de distribution de grande envergure dont l'eau passe dans des conduites de transmission de grand diamètre, des installations de stockage multiples et des zones de pression (Clark, 2016). Un système de pulvérisation d'eau doté de deux têtes de pulvérisation (contenant sept buses chacune) a été installé dans un réservoir recevant de l'eau chlorée. Le chloroforme a été enlevé plus efficacement (> 55 % à près de 70 %) que les THM bromés (DCBM : < 50 % à 60 %; DBCM : 36 % à 50 %). Le pH a augmenté de 0,15 à 0,2 unité de pH après pulvérisation en raison de la libération de dioxyde de carbone. Pendant les cinq années suivantes de l'étude, les THM ont été maintenus en dessous de l'objectif interne de 64μg/L.
L'aération créera des exigences importantes en matière de consommation énergétique et pourrait modifier la qualité de l'eau, nécessitant ainsi des ajustements opérationnels, notamment la précipitation de carbonate de calcium (Ghosh et coll., 2015) et l'augmentation du pH après l'aération (Johnson et coll., 2009). Les responsables de systèmes de distribution d'eau potable devraient vérifier auprès de l'autorité responsable en matière d'eau potable s'il y a des restrictions concernant les effluents gazeux contenant des THM.
CAG : L'application de CAG pour l'enlèvement de THM formés dans l'eau chlorée peut être possible avec une régénération fréquente (Reckhow et Singer, 2011). Dans le cadre d'une étude à l'échelle de banc d'essai, on a évalué trois CAG pour l'enlèvement des THM et on a constaté que l'ordre d'enlèvement était le suivant : bromoforme > DBCM > BDCM > chloroforme (He et coll., 2017). Les coefficients de l'isotherme d'adsorption étaient caractérisés par des constantes de Freundlich qui confirmaient ces résultats (Speth et Miltner, 1998).
Dans 12 stations de traitement de l'eau potable, la chloration au point de remontée a été utilisée pour enlever l'ammoniac d'origine naturelle (0,76 à 4,5 mg/L) (Stefán et coll., 2019). Ces stations d'épuration ont utilisé le CAG après une chloration au point critique (doses de chlore variant de 16 à 33 mg/L) pour enlever les THM qui se sont formés. Les concentrations de THM après la filtration au CAG variaient de 14,2 à 143 μg/L avec une médiane de 43,0 μg/L et une moyenne de 52,4 μg/L. Selon les auteurs, il est possible d'améliorer l'enlèvement en optimisant l'entretien et en remplaçant les filtres.
Plusieurs études à l'échelle pilote ont été consacrées à l'évaluation du CAG pour l'enlèvement des THM formés. Dans l'ensemble, ces études ont révélé qu'il est possible d'enlever les THM à l'aide de CAG, avec des performances variables selon l'emplacement du CAG dans la chaîne de traitement (Babi et coll., 2007; Lekkas et coll., 2009; Verdugo et coll., 2020). Après saturation, les concentrations de THM ont augmenté au-dessus des valeurs d'entrée. Le traitement au CAG déchlore l'eau et nécessite donc une post-chloration. Si le COD reste après le traitement par CAG, de nouveaux THM se formeront (Johnson et coll., 2009). Lors de l'évaluation du point de percée, les concentrations de COD et de THM dans l'effluent sur CAG devraient être surveillées et le CAG devrait être remplacé lorsque le premier atteint le point de percée (Babi et coll., 2007).
Une étude à l'échelle pilote a été réalisée dans un réservoir/une station de pompage (Johnson et coll., 2009). Les deux chaînes de traitement évaluées étaient le CAG et le strippage à l'air suivi du CAG avec une concentration moyenne de THM dans l'influent de 73 μg/L. Après 30 000 volumes de lit pour le CAG seul, les enlèvements pour un temps de contact en fût vide de 10, 20 et 30 minutes étaient respectivement de 20 %, 60 % et 80 %. Pour le strippage à l'air utilisé seul, le THM a été réduit de manière constante entre 75 % et 85 % (rapport air/eau de 40 à 50). Le strippage à l'air suivi du CAG a excédé 90 % d'enlèvement tout au long de l'étude complète (50 000 à 60 000 volumes de lit) à un temps de contact en fût vide de 10 minutes.
OI et NF : Les procédés de filtration sur membrane, notamment la NF et l'OI, ont été examinés pour l'enlèvement de THM formés (Uyak et coll., 2008; Zazouli et Kalankesh, 2017; Fang et coll., 2020, 2021; Li et coll., 2020b). Les membranes de NF et d'OI ont montré que l'enlèvement des THM se fait généralement dans cet ordre : THM iodés > THM bromés > chloroforme (Uyak et coll., 2008; Fang et coll., 2020, 2021). Des études à l'échelle de banc d'essai ont révélé une plage d'enlèvement des THM se situant entre 70,6 % et 99,2 % au moyen l'OI (Fang et coll., 2020, 2021), et entre 54,4 % et 98,7 % au moyen de la NF (Nasseri et coll., 2004; Uyak et coll., 2008; Fang et coll., 2020). Les résultats d'une étude pilote ont montré un faible enlèvement (34,02 % à 38,49 %) avec la NF, et aucune corrélation avec les espèces de THM en raison de la grande taille des pores de la membrane (Li et coll., 2020b).
4.5.1.4 Déchets résiduels
Les technologies de traitement peuvent produire une variété de résidus (par exemple eau de lavage à contre-courant, eau/concentré de rejet, déchets des milieux, effluents gazeux). On devrait consulter les autorités compétentes pour s'assurer que l'enlèvement de tous les déchets résiduels provenant du traitement de l'eau potable est conforme à la réglementation applicable. Il est possible d'obtenir des recommandations auprès d'autres sources (CCME, 2003, 2007).
4.5.2 Traitement à l'échelle résidentielle
Lorsque l'eau potable d'une résidence provient d'un puits privé ne faisant pas l'objet d'une désinfection par le chlore, les THM ne sont pas un problème. Pour les systèmes à petite échelle qui utilisent le chlore, un dispositif de traitement peut être une option pour réduire les concentrations de THM. Il existe des dispositifs certifiés de traitement au point d'utilisation qui sont capables de réduire les concentrations de THM. Certains dispositifs résidentiels peuvent avoir une capacité nominale permettant de traiter des volumes supérieurs à ceux d'une seule résidence, de sorte qu'ils peuvent aussi être utilisés dans des petits systèmes.
Avant d'installer un dispositif de traitement, il faut faire analyser l'eau pour en déterminer les caractéristiques chimiques générales, de même que la concentration de THM et les espèces en présence dans l'eau chlorée. Il faudrait faire analyser périodiquement l'eau qui entre dans le dispositif de traitement et sur l'eau traitée par un laboratoire accrédité afin de confirmer l'efficacité du dispositif de traitement. Comme les dispositifs de traitement peuvent perdre leur capacité d'enlèvement avec l'usage et le temps, ils doivent être entretenus et/ou remplacés au besoin. Les consommateurs devraient vérifier la durée de vie prévue des composants du dispositif de traitement selon les recommandations du fabricant et veiller à leur entretien au besoin. On peut choisir un dispositif doté d'un avertisseur (alarme, voyant lumineux) qui permet de savoir quand l'entretien est nécessaire.
Santé Canada ne recommande aucune marque particulière de dispositif de traitement de l'eau potable, mais conseille fortement aux consommateurs d'utiliser des dispositifs dont la conformité aux normes pertinentes de NSF International (NSF) ou de l'American National Standard Institute (ANSI) est certifiée par un organisme de certification accrédité. Ces normes visent à établir des exigences minimales relatives aux matériaux, à la conception et à la construction des dispositifs de traitement de l'eau potable qui peuvent être vérifiées par un tiers. On s'assure ainsi que les matériaux contenus dans le dispositif ne libèrent pas de contaminants dans l'eau potable (c.-à-d. innocuité des matériaux). Par ailleurs, les normes comportent des exigences en matière de performance qui établissent le degré d'enlèvement qui doit être assuré à l'égard de certains contaminants (par exemple, déclaration de réduction) potentiellement présents dans les approvisionnements en eau.
Les organismes de certification (c'est-à-dire des tiers), qui doivent être accrédités par le Conseil canadien des normes (CCN), garantissent qu'un produit est conforme aux normes en vigueur. Les organismes suivants ont été accrédités au Canada (CCN, 2023) :
- Groupe CSA
- NSF International
- Water Quality Association
- UL LLC
- Bureau de normalisation du Québec
- International Association of Plumbing and Mechanical Officials
- Truesdail Laboratories Inc
Il est possible d'obtenir une liste à jour des organismes de certification accrédités auprès du Conseil canadien des normes.
Les systèmes de filtration au point d'utilisation et au point d'entrée, ainsi que certains pichets filtrants utilisant des filtres à charbon actif, peuvent enlever efficacement les THM. La performance des filtres destinés à l'enlèvement des THM dépend de plusieurs facteurs, dont le type de filtre, le type de milieu, le débit, la qualité de l'eau et l'âge du filtre. L'utilisation de filtres dans les zones à turbidité élevée peut entraîner très rapidement un encrassement du filtre si l'eau n'est pas prétraitée.
Il existe des dispositifs certifiés pour l'enlèvement des THM de l'eau potable qui reposent sur une technique d'adsorption (charbon actif). Ils peuvent être certifiés pour l'enlèvement des THM en particulier ou encore pour l'enlèvement des composés organiques volatils (COV) dans leur ensemble, avec du chloroforme comme substitut. Un dispositif de traitement de l'eau potable peut être certifié pour répondre à la norme NSF/ANSI 53, Drinking Water Treatment Units – Health Effects (Drinking Water Treatment Units – Health Effects) pour la réduction des THM en utilisant le chloroforme comme substitut ou pour la réduction des COV, en utilisant également le chloroforme comme substitut. Pour qu'il soit certifié aux fins de l'enlèvement des THM, le dispositif doit être en mesure de réduire une concentration moyenne dans l'influent de 0,45 ± 30 % mg/L (450 μg/L) à une concentration maximale dans l'effluent de 0,080 mg/L (80 μg/L) (NSF/ANSI, 2022a). Pour qu'il soit certifié aux fins de l'enlèvement des COV, le dispositif doit être en mesure de réduire une concentration de provocation dans l'influent de 0,300 mg/L (300 μg/L) à moins de 0,015 mg/L (15 μg/L). Cet enlèvement représente une réduction de l'utilisation de produits chimiques de plus de 95 % (NSF International, 2022a).
Les dispositifs de traitement par OI peuvent être efficaces pour enlever les THM. Un dispositif de traitement par osmose inverse peut être certifié pour répondre à la norme NSF/ANSI 58 – Reverse Osmosis Drinking Water Treatment Systems en utilisant le chloroforme comme produit chimique de substitution. Le dispositif doit être en mesure de réduire la concentration de THM dans l'eau d'une concentration de 0,30 mg/L (300 μg/L) dans l'influent à moins de 0,015 mg/L (15 μg/L) dans l'eau traitée. Cet enlèvement représente une réduction chimiques de 95 % (NSF International, 2022b).
Dans les systèmes d'OI, les membranes peuvent facilement être endommagées par le chlore présent dans l'eau d'alimentation. Ces dommages peuvent rendre l'enlèvement moins efficace et mener au remplacement des membranes. L'eau traitée par osmose inverse peut être corrosive pour l'intérieur des composants de plomberie. Ces dispositifs devraient donc être installés uniquement au point d'utilisation. De plus, comme il faut de grandes quantités d'influent pour obtenir le volume requis d'eau traitée, ils ne sont généralement pas pratiques si on les installe au point d'entrée.
4.5.2.1 Autres stratégies de désinfection des systèmes de traitement résidentiels ou de petite taille
Comme pour l'échelle municipale, le rayonnement UV est une autre technique de désinfection qui peut être installée pour le traitement à l'échelle résidentielle ou pour les petits systèmes. Il est recommandé de communiquer avec l'autorité responsable en matière d'eau potable dans le secteur de compétence concerné pour vérifier les exigences réglementaires susceptibles de s'appliquer aux systèmes de petite taille.
La désinfection par UV dépend de la transmission de la lumière jusqu'aux microbes à travers l'eau brute. C'est pourquoi un prétraitement de l'eau brute peut être nécessaire pour garantir l'efficacité de ce type de désinfection. La diminution du COT permettra aussi de réduire le risque d'entartrage des lampes UV.
La norme NSF/ANSI 55, Ultraviolet Microbiological – Water Treatment Systems porte sur les exigences de certification des systèmes de désinfection par UV. Elle concerne les systèmes de classe A conçus pour inactiver les microorganismes et/ou les éliminer de l'eau, notamment les bactéries, les virus, les oocystes de Cryptosporidium et les kystes de Giardia. Les systèmes de classe A ne sont pas conçus pour traiter des eaux usées ou encore des eaux contaminées par des eaux usées brutes, et ils devraient être installés dans une eau limpide à l'œil (NSF International, 2022c).
4.6 Réseau de distribution et autres considérations
Dans le réseau de distribution, les concentrations de THM peuvent varier dans le temps et dans l'espace. Ces changements dépendent de nombreux facteurs, tels que les procédés de traitement, le type et la dose d'oxydant et de désinfectant, la température, le pH, le type et la quantité de MON, les précurseurs inorganiques, les microorganismes, la présence de biofilms, les matériaux de tuyauterie, la configuration et l'étendue du réseau de distribution, la présence de réservoirs de stockage, la corrosion, la présence de sédiments, les conditions hydrauliques, la durée de séjour de l'eau dans le réseau, ainsi que l'exploitation et l'entretien du réseau de distribution (Baribeau et coll., 2006). Les réseaux de distribution sont complexes et dynamiques. On trouvera de plus amples renseignements dans les documents de Santé Canada (2020a, 2022a).
Dans les réseaux de distribution chlorés, les THM continuent de se former et augmentent avec la durée de séjour de l'eau et la diminution du chlore résiduel. Le maximum est attendu à l'endroit où le temps de séjour de l'eau est le plus élevé (Baribeau et coll., 2006; Tung et Xie, 2009; Reckhow et Singer, 2011). Les concentrations de TOX augmentent avec le temps de séjour dans les réseaux de distribution qui utilisent du chlore (Westerhoff et coll., 2022). Plusieurs études ont examiné les variations de THM entre le point d'entrée et différents points du réseau de distribution (voir le tableau 26). Selon une étude, le fait de réduire la dose de chlore tout en maintenant une désinfection adéquate diminue la formation de THM, ce qui illustre bien l'importance d'optimiser la dose de chlore (Mohamed et coll., 2019). Il faut aussi tenir compte de l'emploi de la chloration d'appoint au moment de déterminer l'endroit où la concentration de THM est la plus élevée.
| Désinfectant utilisé dans le RDEP | Emplacement dans le RDEP | Paramètre | Effet | Référence |
|---|---|---|---|---|
| Chlore (24 systèmes) Chloramine (1 système) |
Près du point d'entrée | Chlore libre résiduel | Presque constant et sans variation saisonnière | Scheili et coll. (2015) |
| Loin du point d'entrée | Diminution en été et en automne, probablement à cause d'une température et d'une concentration de MON plus élevées | |||
| MRTL | THM | Maximal | ||
| Chlore | MRTL | THM | Augmentation de 452 % – Système d'approvisionnement A | Baribeau et coll. (2006) |
| MRTL | THM | Augmentation de 58 % (plus grande stabilité du chlore et durée de séjour de l'eau moins longue) – Système d'approvisionnement B | ||
| MRTL | THM | Augmentation entre 85 % et 108 % (3 systèmes) | Rodriguez et Sérodes (2001) | |
| Séjour de 5 heures | THM | Augmentation du double | Rodriguez et coll. (2004) | |
| En aval du réservoir de rechloration | THM | Concentration maximale dans le RDEP | ||
| Dans tout le réseau | THM | Plus faible quand la température est inférieure à 15 °C | ||
| Dans tout le réseau | THM | Réduction quand la dose de chlore a été ramenée de 5 mg/L à 4 mg/L et qu'une désinfection adéquate a été maintenue | Mohamed et coll. (2019) | |
| Chloramine | MRTL | THM | Relativement stable avec des baisses occasionnelles (jusqu'à 23 %) – Système d'approvisionnement C | Baribeau et coll. (2006) |
| MRTL | THM | Diminution de 46 % à 62 % (associée à des périodes de nitrification) – Système d'approvisionnement D | ||
| Chloramine et périodes de chloration | MRTL | THM | Augmentation de 20 % à 50 % pendant la chloramination Augmentation de 135 % à 161 % pendant la chloration – Système d'approvisionnement E |
Baribeau et coll. (2006) |
|
MON = matière organique naturelle, MRTL = emplacement où le temps de séjour de l'eau est maximal (« maximum residence time location »), RDEP = réseau de distribution d'eau potable |
||||
Certaines espèces d'AHA peuvent se dégrader en THM (Zhang et Minear, 2002; Reckhow et Singer, 2011). Cependant, les concentrations de ces espèces d'AHA dans les eaux canadiennes sont négligeables et ne sont pas considérées comme une source importante de THM (Rodriguez et Sérodes, 2001; Rodriguez et coll., 2004; Chowdhury, 2011; Chowdhury et coll., 2013c).
Le devenir des THM dans les chauffe-eaux résidentiels dépend de facteurs comme le pH, la température, le chlore libre résiduel et le temps de réaction. Il est donc impossible de tirer des conclusions générales sur les effets des THM (Liu et Reckhow, 2013, 2015; Legay et coll., 2019). Les concentrations de THM dans l'eau froide et l'eau chaude du robinet ont été mesurées dans 50 résidences à partir de deux réseaux de distribution chlorés. Le chauffage de l'eau résidentielle a entraîné une augmentation des concentrations moyennes de THM, et une augmentation plus importante pendant l'hiver (Legay et coll., 2019). La concentration de chloroforme présent dans l'eau froide du robinet a augmenté lors d'un réchauffement ultérieur; l'effet le plus important a été observé dans l'eau ayant séjourné le moins longtemps (Liu et Reckhow, 2013). Dans une étude portant sur les ménages desservis par trois réseaux municipaux d'eau potable utilisant du chlore pour la désinfection secondaire (Dion-Fortier et coll., 2009), les THM avaient augmenté en moyenne de 22,1 à 43,4 μg/L, du premier prélèvement d'échantillons d'eau froide au robinet jusqu'au réseau de distribution. Un effet plus important a été observé pour l'augmentation moyenne des THM (44,0 à 80,1 ug/L), du premier prélèvement d'échantillons dans le réservoir d'eau chaude jusqu'au réseau de distribution. Les concentrations de chloroforme et de THM bromés ont augmenté (Dion-Fortier et coll., 2009).
Le cuivre est présent à l'état naturel et les produits de corrosion du cuivre comme les incrustations contenant des hydroxydes, les oxydes et carbonates sur les parois des tuyaux en cuivre peuvent être relargués dans l'eau (Santé Canada, 2019b, 2022b). La présence de cuivre peut avoir un effet catalytique sur la formation de THM et dépend du type de MON, du pH et des espèces de cuivre (Blatchley III et coll., 2003; Li et coll., 2007; Fu et coll., 2009; Liu et coll., 2013; Hu et coll., 2016; Zhao et coll., 2016). Plusieurs études à l'échelle de banc d'essai ont permis d'examiner différents types de MON, de fragments aliphatiques et de fragments aromatiques en présence de cuivre, et la plupart de ces études ont montré des augmentations en pourcentage variables des THM (Blatchley III et coll., 2003; Navalon et coll., 2009; Zhao et coll., 2016).
La présence de Cu(II) dans l'eau bromée se traduit par une quantité accrue de bromure incorporée dans les THM (Liu et coll., 2013; Hu et coll., 2016; Ta et coll., 2020). Le cuivre peut favoriser la réaction entre les ions Br- et l'HOCl pour former du HOBr, qui réagit plus rapidement que le HOCl pour former des THM (Symons et coll., 1993; Neil et coll., 2019).
Une étude de bancs d'essai de tuyaux a permis d'évaluer les modifications dans la formation de THM en raison des changements de la qualité de l'eau et du séjour de l'eau dans un tuyau en cuivre (Li et coll., 2007). Les tests ont été effectués dans une bouteille en verre (témoin) et dans un tuyau en cuivre. Les produits de corrosion du cuivre ont entraîné une consommation rapide de chlore. Lorsque le pH était inférieur à 7, la quantité de THM formés dans le tuyau en cuivre était plus élevée que dans la bouteille en verre; lorsque le pH était supérieur à > 7, l'inverse a été observé. La présence de cuivre a déplacé les THM vers une plus grande quantité de bromoforme.
5.0 Stratégies de gestion
Les responsables de systèmes de distribution d'eau potable devraient mettre en œuvre un plan complet et à jour de gestion des risques en matière de salubrité de l'eau. Il convient d'adopter une approche « de la source au robinet » qui assure le maintien de la sécurité sanitaire de l'eau (CCME, 2004; OMS, 2012, 2017b). Ces approches exigent une évaluation du réseau pour caractériser la source d'approvisionnement en eau, décrire les procédés de traitement qui empêchent ou réduisent la contamination, déterminer les conditions pouvant entraîner une contamination et mettre en œuvre des mesures de contrôle. Une surveillance opérationnelle est ensuite établie, et des protocoles opérationnels et de gestion sont instaurés (par exemple procédures opérationnelles standardisées, mesures correctives et interventions en cas d'incident). Une surveillance de la conformité est établie, ainsi que d'autres protocoles permettant de valider le plan de gestion de la sécurité sanitaire de l'eau sont mis en oeuvre (par exemple tenue de registres, satisfaction des consommateurs). Les opérateurs doivent aussi recevoir une formation pour assurer en tout temps l'efficacité du plan de gestion de la sécurité sanitaire de l'eau (Smeets et coll., 2009).
La gestion des THM est généralement axée sur la réduction de leur formation. Les changements mis en œuvre pour enlever les THM devraient être envisagés de manière globale pour s'assurer qu'ils n'augmentent pas les autres sous-produits de désinfection (par exemple les AHA) ou qu'ils n'entraînent pas d'autres problèmes de conformité.
Kastl et coll. (2016) ont noté que les exigences relatives à l'enlèvement de la MON devraient être liées aux conditions du réseau de distribution. Les variations des temps de séjour et des températures dans le réseau de distribution nécessiteront un niveau d'enlèvement de la MON différent pour respecter les recommandations relatives aux SPD dans l'eau potable (pour consulter des exemples, voir Rodriguez et Sérodes, 2001; Kastl et coll., 2016).
5.1 Stratégies de contrôle
Les stratégies de contrôle privilégiées devraient inclure des méthodes qui permettent de réduire au minimum la formation de THM pendant le traitement et dans le réseau de distribution. La gestion efficace des THM exige une bonne compréhension de la demande en désinfectant ou de la dégradation du désinfectant par rapport à la formation des THM, aux effets de la température et au pH. Les installations de traitement et les réseaux de distribution peuvent être très différents les uns des autres, ce qui nécessite des stratégies de contrôle propres à chaque système.
Les services d'eau doivent trouver un juste équilibre entre la désinfection efficace et la création de THM, car l'eau potable doit être salubre sur le plan microbiologique afin d'éviter les maladies d'origine hydrique. Il convient de tenir compte des répercussions de la mise en œuvre de toute stratégie de contrôle sur le réseau de distribution. Des essais pilotes sur des échantillons de conduites prélevés dans le réseau devraient être réalisés pour évaluer les impacts de la mise en œuvre de la stratégie et les méthodes permettant d'atténuer tout effet indésirable (Giani et Hill, 2017).
5.1.1 Options de contrôle des sources d'approvisionnement en eau
Les options de contrôle des sources d'approvisionnement en eau concernant la formation de THM sont présentées au tableau 27, ainsi que les avantages et les inconvénients qui y sont associés. Il est recommandé de caractériser la qualité de l'eau et de surveiller les changements saisonniers et temporels. Il est important d'évaluer l'impact de l'utilisation de l'une ou l'autre de ces options de contrôle pour éviter que d'autres problèmes de conformité se produisent, notamment les répercussions possibles (par exemple la corrosion) sur le réseau de distribution. Toute modification de la source d'eau peut avoir un impact sur la qualité de l'eau (comme le pH ou l'alcalinité), ce qui est susceptible d'avoir une incidence sur le traitement et d'entraîner des problèmes de corrosion dans le réseau de distribution.
| Stratégie de contrôle de la source | Avantages | Inconvénients | Remarques |
|---|---|---|---|
| Changement de la source d'eau ou mélange de sources d'eau (Becker et coll., 2013) |
|
|
L'incorporation des eaux souterraines peut donner lieu à la plus importante réduction de précurseurs organiques. |
| Choisir une source d'eau sans bromure (Hong et coll., 2013) |
|
|
Le bromure peut être oxydé en HOBr, un élément important dans la formation de THM bromés. |
| Modifications de l'exploitation des réservoirs (Becker et coll., 2013) |
|
|
|
| Achat d'eau (Becker et coll., 2013) |
|
|
Achat d'eau pour mélanger les sources d'eau ou remplacer une source durant les périodes de fortes concentrations de COT. |
| Stockage et récupération d'eau dans les aquifères (Reckhow et Singer, 2011) |
|
|
|
|
HOBr = acide hypobromeux, COT = carbone organique total, HOBr = acide hypobromeux, SPD = sous-produit de désinfection, THM = trihalométhanes |
|||
5.1.2 Options de contrôle du réseau de distribution
Les THM continuent à se former dans le réseau de distribution, car le chlore continue à réagir avec la MON restante dans l'eau traitée. Les THM sont des produits finaux stables, qui ne se dégradent pas et dont les concentrations maximales sont attendues aux endroits où le temps de séjour de l'eau est le plus long (Reckhow et Singer, 2011). Dans un réseau de distribution, le temps de séjour de l'eau est dynamique et peut varier tout au long de la journée ainsi que d'une saison à l'autre. La mise en œuvre de pratiques telles que des mesures ou des campagnes d'économie d'eau peut également avoir une incidence sur le temps de séjour de l'eau. Le lecteur est invité à consulter le tableau 28 du présent document et la section B. 5 du document de Santé Canada intitulé Conseils sur la surveillance de la stabilité biologique de l'eau potable dans les réseaux de distribution pour en savoir plus sur les réseaux de distribution et les stratégies de gestion (Santé Canada, 2022a). Cette section porte sur la gestion du réseau de distribution, entre autres, la gestion des installations de stockage, le temps de séjour de l'eau (par exemple les culs-de-sac) et le nettoyage des conduites principales. Voici quelques-unes des principales pratiques exemplaires de gestion du réseau de distribution :
- la gestion du temps de séjour de l'eau (par exemple réduction des culs-de-sac);
- la gestion des impacts de la température de l'eau;
- le maintien du pH à ± 0,2 unité.
Avant de déployer l'une ou l'autre de ces stratégies, il convient d'effectuer des études à l'échelle de banc d'essai et à l'échelle pilote et de les répéter régulièrement afin de comprendre les modifications de la source d'eau, la variabilité saisonnière et les incidences des changements climatiques. Il s'agit notamment d'utiliser des échantillons de conduites pour optimiser l'approche. Les modèles de réseaux de distribution d'eau peuvent être un outil pour évaluer le temps de séjour de l'eau et simuler la dégradation du chlore et la formation de THM (Fisher et coll., 2018). Il est également important de s'assurer qu'aucun autre problème de conformité ne se posera à la suite des modifications apportées pour enlever les THM.
| Stratégie de contrôle du réseau de distribution | Avantages | Inconvénients | Remarques |
|---|---|---|---|
| Optimisation de la chloration du réseau de distribution (Becker et coll., 2013) |
|
|
Il faut ajuster les cibles en matière de chlore résiduel pour tenir compte des variations saisonnières. Cette stratégie permet de réduire la concentration de chlore résiduel et la formation de THM. |
| Chloration d'appoint (Baribeau et coll., 2006; AWWA, 2017) |
|
|
La chloration d'appoint permet d'obtenir une quantité suffisante de désinfectant résiduel à des endroits ciblés sans devoir augmenter les concentrations de chlore dans l'ensemble du réseau de distribution. |
| Optimisation du réseau de distribution : limiter le temps de séjour de l'eau dans le réseau de distribution (Becker et coll., 2013) |
|
|
|
| Optimisation du réseau de distribution : limiter le temps de séjour de l'eau dans les réservoirs de stockage |
|
|
Cela peut se faire par l'alimentation et le mélange de réservoirs. |
| Modélisation du réseau de distribution (Fisher et coll., 2018) |
|
|
Les modèles peuvent prévoir avec précision la formation de chlore libre et de sous-produits dans le réseau de distribution s'ils sont bien élaborés, étalonnés et entretenus. |
| Rinçage du système (Becker et coll., 2013; Santé Canada, 2022a) |
|
|
|
| Aération dans les réservoirs de stockage (Becker et coll., 2013) |
|
|
|
5.2 Surveillance
Il est important d'assurer un contrôle précis du procédé de traitement pour garantir une bonne qualité de l'eau et réduire au minimum la formation de THM. Les programmes de surveillance devraient être conçus de manière à tenir compte des facteurs de risque qui contribuent à la formation de THM. Les responsables des programmes devraient vérifier que les stratégies de contrôle fonctionnent comme prévu. Les analyses de tendances permettront de prévoir les changements de la qualité de l'eau et de fournir des signaux d'alerte précoce. Cette surveillance permettra la prise de mesures de contrôle et/ou de mesures proactives (Tomperi et coll., 2016).
5.2.1 Surveillance des sources d'approvisionnement en eau
La caractérisation de la source d'approvisionnement en eau devrait faire partie des évaluations périodiques du réseau. Cette caractérisation devrait viser la compréhension des concentrations et des caractéristiques de la MON, ainsi que des concentrations de bromure et d'iodure (Santé Canada, 2018, 2020a). Des paramètres tels que le fer et le manganèse, qui ont une incidence sur la stabilité du désinfectant, devraient faire l'objet d'une surveillance. La NOM varie selon les saisons, ce qui rend nécessaire une analyse systématique. Pour faciliter l'établissement d'un plan de surveillance, une liste de paramètres est présentée à l'annexe D (tableau D1). On y propose une fréquence de surveillance pour les paramètres variables et stables des sources d'eau, ainsi qu'une fréquence de surveillance idéale pour la MON. Les paramètres comme l'absorbance UV (à 254 nm) ou la transmittance UV, le COD ou le COT, la SUVA et divers précurseurs inorganiques sont mentionnés. Un programme de surveillance doit prendre en compte d'autres paramètres comme le désinfectant résiduel, la température de l'eau, le pH, le bromure, l'iodure et l'ammoniac (AWWA, 2017). Il importe d'avoir une bonne compréhension de la qualité de l'eau et des changements liés aux activités saisonnières, temporelles et anthropiques ainsi que des impacts climatiques pour gérer les opérations de traitement.
Les renseignements sur les concentrations de bromure dans les sources d'eau sont importants pour évaluer le potentiel de formation des THM bromés. Westerhoff et coll. (2022) recommandent que les sources d'eau susceptibles de présenter des variations de la teneur en bromure fassent l'objet d'une surveillance hebdomadaire. Les auteurs recommandent également d'associer les concentrations de bromure au débit des cours d'eau afin de mieux comprendre les événements propres au site. Le FIB devrait également faire l'objet d'un suivi afin de mieux comprendre la contribution relative du bromure aux THM.
Les THM iodés se forment lorsqu'il y a présence d'iodure dans l'eau. Bien qu'ils ne soient pas visés par la CMA, il est important de connaître les concentrations d'iodure pour évaluer les options de contrôle.
5.2.2 Surveillance opérationnelle
Dans le contexte des THM, la surveillance opérationnelle comprend des paramètres qui aident à comprendre l'ensemble du système de traitement de l'eau potable et à gérer la formation de ces SPD. Les paramètres établis pour la caractérisation des sources d'eau peuvent également être surveillés dans l'eau traitée (voir l'annexe D) (Santé Canada, 2020a). Dans ces tableaux figurent les endroits et les fréquences d'échantillonnage qui peuvent constituer la base d'un programme de surveillance complet et d'une bonne compréhension de la MON (Santé Canada, 2020a). La fréquence de surveillance suggérée des paramètres ayant une incidence sur la coagulation, comme la demande en coagulant et le potentiel zêta, est indiquée. Tout écart entre l'eau traitée et la source d'eau pour ces paramètres peut servir à orienter les modifications du traitement, ce qui réduira la formation de THM. Les paramètres qui constituent la base du programme de surveillance sont conçus pour évaluer la performance et apporter les modifications nécessaires, et dépendront de la ou des stratégies choisies pour réduire la formation de THM.
5.2.3 Surveillance du réseau de distribution
Les THM se forment lors du traitement et continuent à se former dans le réseau de distribution. Une surveillance devrait être effectuée à différents endroits du réseau de distribution. La surveillance aux points d'entrée du réseau de distribution servira de base de comparaison. Dans le réseau de distribution, la surveillance devrait porter sur les endroits où les concentrations de THM devraient être à leur maximum. Il s'agit notamment des endroits où le temps de contact est le plus long, où le temps de séjour de l'eau est le plus long, ainsi que des endroits ayant subi une chloration d'appoint ou des endroits comportant un cul-de-sac. Une concentration élevée de THM à un endroit donné peut orienter la gestion du réseau de distribution en vue de déterminer où les activités de rinçage et de nettoyage devraient être axées ou s'il convient d'envisager des changements dans l'exploitation du réseau de distribution. Ces pratiques contribueront à réduire le temps de séjour de l'eau et le nombre d'endroits où les concentrations de THM sont élevées.
5.2.4 Surveillance de la conformité
Il est recommandé de calculer une moyenne mobile annuelle par emplacement d'échantillons prélevés au minimum une fois par trimestre dans le réseau de distribution pour les THM totaux. Cette valeur est ensuite comparée à la CMA. L'échantillonnage se fera aux points du réseau de distribution susceptibles de présenter les plus concentrations de THM les plus élevées. Il s'agit notamment des endroits où le temps de séjour de l'eau est le plus long, après une chloration d'appoint, des réservoirs de stockage et des endroits qui ont la plus longue durée de rétention des désinfectant. Les emplacements où les concentrations sont élevées peuvent varier selon les saisons et au fil du temps. Une surveillance plus fréquente peut s'imposer dans le cas des installations qui utilisent des sources d'eau de surface (y compris les sources d'eau souterraine sous l'influence directe d'eau de surface) pendant les périodes de formation maximale de THM.
6.0 Considérations internationales
D'autres organismes nationaux et internationaux disposent de lignes directrices, de normes et/ou de valeurs recommandées pour les THM individuels et totaux dans l'eau potable. Les valeurs varient en fonction de la date à laquelle remonte l'évaluation sur laquelle elles sont fondées, et en fonction des différentes politiques et approches, notamment en ce qui concerne le choix de l'étude principale ou les taux de consommation, les poids corporels et les facteurs d'attribution liés à la source employés.
L'U.S. EPA a fixé une concentration maximale de contaminants de 0,08 mg/l pour les THM totaux (U.S. EPA, 2006), ainsi que des objectifs non réglementaires de concentration maximale de contaminants pour chaque THM (voir le tableau 29). La Directive sur l'eau potable de l'Union européenne fixe une valeur de 0,1 mg/L pour les THM totaux (UE, 2020). Dans son évaluation des THM dans l'eau potable, l'Australie recommande que les concentrations de THM, individuels ou totaux, ne devraient pas dépasser 0,25 mg/L (NHMRC, NRMMC, 2011). L'Organisation mondiale de la Santé (OMS) a fixé des VBS de 0,3, 0,1, 0,06 et 0,1 mg/L pour le chloroforme, le bromoforme, le BDCM et le DBCM, respectivement. En outre, l'OMS est d'avis qu'une approche additive à l'aide d'un indice de danger (à savoir la somme des rapports entre la concentration d'exposition et la valeur guide pour chaque composant à évaluer) pourrait être utilisée par les autorités souhaitant établir une norme pour les THM totaux (OMS, 2005).
| Organisme (année) |
Valeur (mg/L) |
Principal effet sur la santé (référence) |
Point de départ (mg/kg p.c. par jour) |
FI | Poids corporel (kg) |
Apport d'eau potable (L/j) |
FA (%) |
|---|---|---|---|---|---|---|---|
|
CMA proposée par Santé Canada (2023) |
1,4 chloroforme (VBS) | Effets sur les reins (dilatation de la lumière tubulaire) de rats mâles dans deux études de 2 ans (Yamamoto et coll., 2002; Nagano et coll., 2006) | BMDL10 = 42.02 |
40 | 74 | 4,11 | 80 |
| 0,100 BDCM (VBS) | Tumeurs du gros intestin chez les rats mâles dans deux études de 2 ans (NTP, 1987; NTP, 2006) | BMDL01 = 16,3 | S.O. | S.O. | S.O. | S.O. | |
| 0,100 pour les THM totaux (CMA) | S.O. | S.O. | S.O. | S.O. | S.O. | S.O. | |
| U.S. EPA (2006) | 0,08 pour les THM totaux (MCL) | S.O. | S.O. | S.O. | S.O. | S.O. | S.O. |
| U.S. EPA (2006) | 0,07 Chloroform (MCLG) | Hépatoxicité chez le chien dans une étude de 7,5 ans (Heywood et coll., 1979) | LOAEL = 13Note de bas de tableau 29 - a | 1000 | 70 | 2 | 20 |
| U.S. EPA (2005, 2016) | 0 BDCMNote de bas de tableau 29 - b (MCLG) |
Données sur les tumeurs rénales chez les rongeurs dans une étude de 2 ans (NTP, 1987) | S.O. | S.O. | S.O. | S.O. | S.O. |
|
0,06 DBCM (MCLG) |
Toxicité hépatique chez le rat dans une étude de 90 jours (NTP, 1985) | NOAEL = 21,4Note de bas de tableau 29 - c | 1000Note de bas de tableau 29 - d | 70 | 2 | 80 | |
|
0 BromoformNote de bas de tableau 29 - b (MCLG) |
Données sur les tumeurs du gros intestin chez les rongeurs dans une étude de 2 ans (NTP, 1989a) | S.O. | S.O. | S.O. | S.O. | S.O. | |
| UE (2020) | pour les THM totaux | S.O. | S.O. | S.O. | S.O. | S.O. | S.O. |
|
Australie (approuvé en 1996) |
0,25Note de bas de tableau 29 - e pour les THM individuels ou totaux | Effets sur le foie légers et réversibles dans une étude de 90 jours chez le rat (Chu et coll., 1982) | NOAEL = 7 | 100 | 70 | 2 | 10 |
|
OMS (2005) |
0,3 chloroforme | Hépatoxicité chez le chien dans une étude de 7,5 ans (Heywood et coll., 1979) | 12 mg/LNote de bas de tableau 29 - f | 25 | 60 | 2 | 75 |
| 0,06 BDCMNote de bas de tableau 29 - g | Adénomes et adénocarcinomes rénaux (combinés) chez la souris mâle dans une étude de 2 ans (NTP, 1987) | S.O. | S.O. | S.O. | S.O. | S.O. | |
| 0,1 DBCM | Effets histopathologiques dans le foie de rats dans une étude de 90 jours (NTP, 1985) | NOAEL = 21Note de bas de tableau 29 - h | 1000 | 60 | 2 | 20 | |
|
0,1 bromoforme |
Lésions histopathologiques dans le foie de rats dans une étude de 90 jours (NTP, 1989a) | NOAEL = 18Note de bas de tableau 29 - i | 1000 | 60 | 2 | 20 | |
|
BDCM = bromodichlorométhane, BMDL10/BMDL01 = limite inférieure de l'intervalle de confiance à 95 % de la dose de référence associée à une réponse de 10 % ou à une réponse de 1 %, CMA = concentration maximale acceptable, DBCM = dibromochlorométhane, FA = facteur d'attribution, FI = facteur d'incertitude, LOAEL = dose minimale avec effet nocif observé, MCL = « maximum contaminant level » (concentration maximale du contaminant), MCLG = objectif de « maximum contaminant level », NOAEL = dose sans effet nocif observé, NTP = National Toxicology Program, S. O. = sans objet ou valeur inconnue, THM = trihalométhanes, VBS = valeur basée sur la santé. |
|||||||
7.0 Justification
Plus de 600 SPD ont été repérés dans l'eau potable, ce qui constitue un vaste éventail de catégories de composés chimiques. Des études épidémiologiques mettent en lumière un lien entre les SPD présents dans l'eau potable et le développement du cancer de la vessie. Cependant, comme il existe des centaines de SPD dans l'eau potable, il est difficile de cerner les principales substances responsables de cette association. On a évalué le pouvoir cancérogène d'environ 20 SPD, tandis que plus de 100 SPD ont été analysés dans le cadre de diverses études toxicologiques. Les conclusions générales sont que les SPD iodés sont plus toxiques que les SPD bromés, lesquels sont plus toxiques que les SPD chlorés (Dong et coll., 2019a; DeMarini, 2020).
Dans l'évaluation actuelle des THM, des données améliorées sur la toxicité (notamment des données sur la toxicité combinée par inhalation et par voie orale) et des renseignements sur la modélisation PBPK étaient disponibles pour le chloroforme. Par conséquent, une approche de l'évaluation des risques plus précise avec un degré d'incertitude réduit a été possible, ce qui a donné lieu à une VBS de 1,4 mg/L pour le chloroforme basée sur des effets sur les reins observés chez le rat. De plus, une VBS de 0,100 mg/L a été calculée pour le BDCM basée sur des tumeurs du gros intestin observées chez le rat. Les calculs des VBS pour le chloroforme et le BDCM ont tenu compte de l'exposition par plusieurs voies (à savoir l'exposition par voie orale, par voie cutanée et par inhalation). Aucune VBS n'a été établie pour le DBCM, le bromoforme ou les THM iodés, en raison de preuves toxicologiques insuffisamment robustes pour ces substances chimiques.
Le chloroforme, le BDCM, le DBCM et le bromoforme étant généralement présents ensemble dans l'eau potable, ils sont souvent évalués ensemble sous une seule valeur de recommandation pour les THM totaux. Le chloroforme est généralement le THM prédominant dans l'eau potable. Toutefois, comme on l'a mentionné précédemment, les données toxicologiques ont toujours montré que les SPD bromés étaient plus puissants que les SPD chlorés. C'est pourquoi Santé Canada, en collaboration avec le Comité fédéral-provincial-territorial sur l'eau potable, propose une CMA de 0,100 mg/L pour la concentration totale de chloroforme, de BDCM, de DBCM et de bromoforme. Cette valeur est basée sur la VBS plus faible pour le BDCM (un THM bromé), et on juge qu'elle confère une protection contre les effets sur la santé des quatre THM. En basant la CMA sur la VBS pour le BDCM, on suppose qu'une mesure des THM pourrait être entièrement constituée de BDCM et protège donc également contre le scénario le plus défavorable. La CMA proposée se base sur une moyenne mobile annuelle par emplacement d'échantillons prélevés au minimum une fois par trimestre aux points du réseau de distribution susceptibles de présenter les plus fortes concentrations de THM.
Les THM, ainsi que les AHA, sont les SPD les plus fréquemment décelés dans l'eau potable et sont souvent détectés aux concentrations les plus élevées. La concentration de THM et d'AHA peut servir d'indicateurs ou de valeurs de substitution pour la charge totale de tous les SPD dans les sources d'approvisionnement en eau potable. C'est pourquoi il est recommandé de maintenir les concentrations de THM au niveau le plus bas qu'il soit raisonnablement possible d'atteindre (principe ALARA : « as low as reasonably achievable ». Lorsque des stratégies appropriées de traitement de l'eau potable sont mises en œuvre pour réduire les THM et les AHA, il est également possible de réduire les concentrations d'autres sous-produits de désinfection dans le procédé. Cela peut se traduire par une réduction de l'exposition et des risques potentiels liés à d'autres SPD. Tout effort visant à réduire les THM, par exemple, modifier les stratégies de désinfection, ne devrait pas compromettre la désinfection, augmenter la concentration d'autres SPD (AHA, chlorite) ni augmenter par inadvertance les concentrations ou le relargage d'autres contaminants, tel que le plomb, dans l'eau distribuée.
Comme d'autres SPD, les THM se forment principalement dans l'eau potable lorsque des désinfectants comme le chlore interagissent avec la matière organique présente dans les sources d'eau brute. Il est toutefois important de reconnaître qu'en raison de sa capacité à tuer ou à inactiver pratiquement tous les microorganismes pathogènes entériques, l'utilisation du chlore a pratiquement éliminé les maladies microbiennes d'origine hydrique. Par conséquent, afin de protéger la population contre les maladies infectieuses, les efforts déployés pour gérer les concentrations de THM dans l'eau potable ne doivent pas compromettre l'efficacité de la désinfection de l'eau. Lorsque les concentrations de THM dépassent la CMA proposée, l'étude et la mise en œuvre d'une stratégie de contrôle devraient tenir compte de la détection d'E. coli et des coliformes totaux. Par exemple, si les responsables d'un système d'approvisionnement en eau potable met en œuvre une stratégie de contrôle des THM et détecte la bactérie E. coli ou des coliformes totaux, cela suggère fortement que les procédés de désinfection ne sont plus adéquats. Il peut en résulter un risque accru pour la santé lié à des agents pathogènes microbiens (Santé Canada, 2020c). Le but de la stratégie de contrôle des THM devrait être la protection contre les risques microbiologiques en tout temps et minimiser la formation de sous-produits de désinfection. Les dépassements à court terme de la CMA sont acceptables dans l'intérêt du maintien de procédés de désinfection efficaces. Toutefois, il conviendrait d'évaluer d'autres options pour réduire les THM. La surveillance opérationnelle et l'optimisation du traitement continues permettront aux services d'eau de trouver un juste équilibre entre les risques microbiens et de SPD et la protection optimale de la santé publique pour l'ensemble des conditions influant sur la qualité de l'eau.
Dans le cadre de son processus d'examen continu des recommandations, Santé Canada continuera de surveiller les nouveaux travaux de recherche dans ce secteur et recommandera des changements dans ce document technique si le Ministère le juge nécessaire.
8.0 Références
- Abokifa, A.A., Yang, Y.J., Lo, C.S. et Biswas, P. (2016). Investigating the role of biofilms in trihalomethane formation in water distribution systems with a multicomponent model. Water Res., 104: 208–219.
- AGAT Laboratories (2020). Communication personnelle avec P. Reyno, Dartmouth, N.-É..
- Aggazzotti, G., Fantuzzi, G., Righi, E. et Predieri, G. (1998). Blood and breath analyses as biological indicators of exposure to trihalomethanes in indoor swimming pools. Sci. Total Environ., 217(1-2): 155–163.
- Aggazzotti, G., Righi, E., Fantuzzi, G., Biasotti, B., Ravera, G., Kanitz, S., Barbone, F., Sansebastiano, G., Battaglia, M.A., Leoni, V., Fabiani, L., Triassi, M., Sciacca, S. et Collaborative Group for the Study of Chlorinated Drinking Waters and Pregnancy (2004). Chlorination by-products (CBPs) in drinking water and adverse pregnancy outcomes in Italy. J. Water. Health, 2(4): 233–247.
- Ahmed, F., Khan, T.A., Fakhruddin, A.N.M., Rahman, M.M, Mazumdar, R.M., Ahmed, S., Imam, M.T., Kabir, M. et Abdullah, A.T.M. (2019). Estimation and exposure concentration of trihalomethanes (THMs) and its human carcinogenic risk in supplied pipeline water of Dhaka City, Bangladesh. Environ. Sci. Pollut. Res., 26: 16316–16330.
- Aida, Y., Takada, K., Uchida, O., Yasuhara, K., Kurokawa, Y. et Tobe, M. (1992a). Toxicities of microencapsulated tribromomethane, dibromochloromethane and bromodichloromethane administered in the diet to Wistar rats for one month. J. Toxicol. Sci., 17(3): 119–133.
- Aida, Y., Yasuhara, K., Takada, K., Kurokawa, Y. et Tobe, M. (1992b). Chronic toxicity of microencapsulated bromodichloromethane administered in the diet to Wistar rats. J. Toxicol. Sci., 17(2): 51–68.
- Allard, S., Nottle, C.E., Chan, A., Joll, C. et von Gunten, U. (2013). Ozonation of iodide-containing waters: Selective oxidation of iodide to iodate with simultaneous minimization of bromate and I-THMs. Water Res., 47(6): 1953–1960.
- Allard, S., Tan, J., Joll, C.A. et Von Gunten, U. (2015). Mechanistic study on the formation of Cl-/Br-/I-trihalomethanes during chlorination/chloramination combined with a theoretical cytotoxicity evaluation. Environ. Sci. Technol., 49(18): 11105–11114.
- Alexander, M.T., Dugan, A.G. et Wahman, D.G. (2019). Use of a hold study to assess distribution system influent water quality. Opflow, 45(5): 16.
- Ali, S.I., Arnold, M., Liesner, F. et Fesselet, J-F. (2019). Characterization of disinfection by-products levels at an emergency surface water treatment plant in a refugee settlement in Northern Uganda. Water, 11: 647.
- Allis, J.W., Anderson, B.P., Zhao, G., Ross, T.M. et Pegram, R.A. (2002). Evidence for the involvement of CYP1A2 in the metabolism of bromodichloromethane in rat liver. Toxicology, 176(1–2): 25–37.
- Amarawansha, G., Zvomuya, F., Tomy, G., et Farenhorst, A. (2023). Trihalomethanes in drinking water from three First Nation reserves in Manitoba, Canada. Environ. Monit. Assess., 195:341.
- Amini, N., Papineau, I., Storck, V., Bérubé, P.R., Mohseni, M. et Barbeau, B. (2018). Long-term performance of biological ion exchange for the removal of natural organic matter and ammonia from surface waters. Water Res. 146: 1–9.
- Amy, G.L., Chadik, P.A. et Chowdhury, Z.K. (1987). Developing models for predicting trihalomethane formation potential and kinetics. J. Am. Water Works Assoc., 79: 89–97.
- Anderson, L.E., DeMont, I., Dunnington, D.D., Bjorndahl, P., Redden, D.J., Brophy, M.J. et Gagnon, G.A. (2023). A review of long-term change in surface water natural organic matter concentration in the northern hemisphere and the implications for drinking water treatment. Sci. Total Environ., 858: 159699.
- Andersson, A., Lavonen, E., Harir, M., Gonsior, M., Hertkorn, N., Schmitt-Kopplin, P., Kylin, H. et Bastviken, D. (2020). Selective removal of natural organic matter during drinking water production changes the composition of disinfection by-products. Environ. Sci. Water Res. Technol., 6(3): 779–794.
- APHA, AWWA et WEF (2018). Standard methods for the examination of water and wastewater. 23rd edition. (version en ligne). American Public Health Association, American Water Works Association et Water Environment Federation, Washington, DC. Disponible à : https://doi.org/10.2105/SMWW.2882.112
- Ates, N., Kitis, M. et Yetis, U. (2007). Formation of chlorination by-products in waters with low SUVA‑correlations with SUVA and differential UV spectroscopy. Water Res., 41(18): 4139–4148.
- ATSDR (1997). Toxicological profile for chloroform. Agency for Toxic Substances and Disease Registry, U.S. Department of Health and Human Services, Atlanta, Géorgie.
- ATSDR (2005). Toxicological profile for bromoform and chlorodibromomethane. Agency for Toxic Substances and Disease Registry, U.S. Department of Health and Human Services, Atlanta, Géorgie.
- ATSDR (2020). Toxicological profile for bromodichloromethane. Agency for Toxic Substances and Disease Registry, U.S. Department of Health and Human Services, Atlanta, Géorgie.
- Awad, J., van Leeuwen, J., Chow, C.W.K., Smernik, R.J., Anderson, S.J. et Cox, J.W. (2017). Seasonal variation in the nature of DOM in a river and drinking water reservoir of a closed catchment. Environ. Pollut., 220: 788–796.
- AWWA (2011). Operational control of coagulation and filtration processes. Manual of water supply practices – M37. 3rd edition. AWWA, Denver, Colorado.
- AWWA (2013). Fundamentals and control of nitrification in chloraminated drinking water systems. Manual of water supply practices – M56. 2nd edition. American Water Works Association, Denver, Colorado.
- AWWA (2017). Water quality in distribution systems. Manual of water supply practices – M68. American Water Works Association, Denver, Colorado.
- AWWA (2021). Climate actions plans – Adaptive management strategies for utilities. Manual of water supply practices – M71. American Water Works Association, Denver, Colorado.
- Aylward, L.L., LaKind, J.S. et Hays, S.M. (2008). Biomonitoring equivalents (BE) dossier for trihalomethanes. Regul. Toxicol. Pharmacol., 51(3 Suppl): S68–77.
- Babi, K.G., Koumenides, K.M., Nikolaou, A.D., Makri, C.A., Tzoumerkas, F.K. et Lekkas, T.D. (2007). Pilot study of the removal of THMs, HAAs and DOC from drinking water by GAC adsorption. Desalination, 210(1–3): 215–224.
- Backer, L.C., Ashley, D.L., Bonin, M.A., Cardinali, F.L., Kieszak, S.M. et Wooten, J.V. (2000). Household exposures to drinking water disinfection by-products: Whole blood trihalomethane levels. J. Expo. Anal. Environ. Epidemiol., 10(4): 321–326.
- Baeder, C. et Hofmann, T. (1988). Inhalation embryotoxicity study of chloroform in Wistar Rats. Hoescht Aktiengesellschaft and Dow Europe S.A. Report No. 88–922000571 (citée dans Williams et al., 2018).
- Baeder, C. et Hofmann, T. (1991). Chloroform: Supplementary inhalation embryotoxicity study in Wistar Rats. Hoescht Aktiengesellschaft et Dow Europe S.A., Report No. 88–920000566 (citée dans Williams et al., 2018).
- Baribeau, H., Boulos, L., Haileselassie, H., Crozes, G., Singer, P.C., Nichols, C., Schlesinger, S.A., Gullick, R.W., Williams, S.L., Williams, R.L., Fountleroy, L., Andrews, S.A. et Moffat, E. (2006). Formation and decay of disinfection by-products in the distribution system. AWWA Research Foundation: 1–360.
- Barry, M., Chiu, C.A. et Westerhoff, P. (2016). Severe weather effects on water quality in central Arizona. J. Am. Water Works Assoc., 108(4): E221–E231.
- Basu, M., Gupta, S.K., Singh, G. et Mukhopadhyay, U. (2011). Multi-route risk assessment from trihalomethanes in drinking water supplies. Environ. Monit. Assess., 178(1-4): 121–134.
- Batterman, S., Zhang, L., Wang, S. et Franzblau, A. (2002). Partition coefficients for the trihalomethanes among blood, urine, water, milk and air. Sci. Total Environ., 284(1–3): 237–247.
- Beauchamp, N., Laflamme, O., Simard, S., Dorea, C., Pelletier, G., Bouchard, C. and Rodriguez, M. (2018). Relationships between DBP concentrations and differential UV absorbance in full-scale conditions. Water Res., 131: 110–121.
- Beauchamp, N., Dorea, C., Bouchard, C., Rodriguez, M. (2019). Multi-wavelength models expand the validity of DBP-differential absorbance relationships in drinking water. Water Res., 158: 61–71.
- Beauchamp, N., Bouchard, C., Dorea, C., Rodriguez, M. (2020). Ultraviolet absorbance monitoring for removal of DBP-precursor in waters with variable quality: Enhanced coagulation revisited. Sci. Total Environ., 717: 137225.
- Becker, W., Stanford, B. et Rosenfeldt, E.J. (2013). Guidance on complying with Stage 2 D/DBP Regulation. Water Research Foundation, 4427, Denver, Colorado.
- Bernat-Quesada, F., Álvaro, M., García, H. et Navalón, S. (2020). Impact of chlorination and pre-ozonation on disinfection by-products formation from aqueous suspensions of cyanobacteria: Microcystis aeruginosa, anabaena aequalis and oscillatoria tenuis. Water Res., 183.
- Bielmeier, S.R., Best, D.S., Guidici, D.L. et Narotsky, M.G. (2001). Pregnancy loss in the rat caused by bromodichloromethane. Toxicol. Sci., 59(2): 309–315.
- Bielmeier, S.R., Best, D.S. et Narotsky, M.G. (2004). Serum hormone characterization and exogeneous hormone rescue of bromodichloromethane-induced pregnancy loss in the F344 rat. Toxicol. Sci., 77(1): 101–108.
- Bielmeier, S.R., Murr, A.S., Best, D.S., Harrison, R.A., Pegram, R.A., Goldman, J.M. et Narotsky, M.G. (2007). Effects of bromodichloromethane on ex vivo and in vitro luteal function and bromodichloromethane tissue dosimetry in the pregnant F344 rat. Toxicol. in. Vitro., 21(5): 919–928.
- Bichsel, Y. et Von Gunten, U. (1999). Oxidation of iodide and hypoiodous acid in the disinfection of natural waters. Environ. Sci. Technol., 33(22): 4040–4045.
- Bichsel, Y. et Von Gunten, U. (2000). Formation of iodo-trihalomethanes during disinfection and oxidation of iodide-containing waters. Environ. Sci. Technol., 34(13): 2784–2791.
- Blatchley III, E.R., Margetas, D. et Duggirala, R. (2003). Copper catalysis in chloroform formation during water chlorination. Water Res., 37(18): 4385–4394.
- Bogen, K.T., Colston Jr., B.W. et Machicao, L.K. (1992). Dermal absorption of dilute aqueous chloroform, trichloroethylene, and tetrachloroethylene in hairless guinea pigs. Fundam. Appl. Toxicol., 18(1): 30–39.
- Bond, T., Goslan, E.H., Parsons, S.A. et Jefferson, B. (2011). Treatment of disinfection by-product precursors. Environ. Technol., 32(1): 1–25.
- Bond, T., Huang, J., Graham, N.J.D. et Templeton, M.R. (2014). Examining the interrelationship between DOC, bromide and chlorine dose on DBP formation in drinking water – A case study. Sci. Total Environ., 470–471: 469–479.
- Borikar, D., Mohseni, M. et Jasim, S. (2015). Evaluations of conventional, ozone and UV/H2O2 for removal of emerging contaminants and THM-FPs. Water Qual. Res. J. Can., 50(2): 140–151.
- Borzelleca, J.F. et Carchman, R.A. (1982). Effects of selected organic drinking water contaminants on male reproduction. U.S. Environmental Protection Agency, EPA 600/1 82 009, NTIS PB82 259847, Contract No. R804290, Research Triangle Park, Caroline du Nord.
- Bougeard, C.M.M., Goslan, E.H., Jefferson, B. et Parsons, S.A. (2010). Comparison of the disinfection by-product formation potential of treated waters exposed to chlorine and monochloramine. Water Res., 44(3): 729–740.
- Bridgeman, J., Bieroza, M. et Baker, A. (2011). The application of fluorescence spectroscopy to organic matter characterisation in drinking water treatment. Rev. Environ. Sci. Biotechnol., 10(3): 277–290.
- British Columbia Ministry of Health (2019). Communication personnelle avec D. Fishwick, Victoria C.-B..
- Brooke, E. et Collins, M.R. (2011). Posttreatment aeration to reduce THMs. J. Am. Water Works Assoc., 103(10): 84–96.
- Bull, R.J., Brown, J.M., Meierhenry, E.A., Jorgenson, T.A., Robinson, M. et Stober, J.A. (1986). Enhancement of the hepatotoxicity of chloroform in B6C3F1 mice by corn oil: Implications for chloroform carcinogenesis. Environ. Health Perspect., 69: 49–58.
- Burkhalter, J.E. et Balster, R.L. (1979). Behavioral teratology evaluation of trichloromethane in mice. Neurobehav. Toxicol., 1: 199–205.22
- Cancho, B., Fabrellas, C., Diaz, A., Ventura, F. et Galceran, M.T. (2001). Determination of the odor threshold concentrations of iodinated trihalomethanes in drinking water. J. Agric. Food Chem., 49(4): 1881–1884.22
- Cantor, K.P., Villanueva, C.M., Silverman, D.T., Figueroa, J.D., Real, F.X., Garcia-Closas, M., Malats, N., Chanock, S., Yeager, M., Tardon, A., Garcia-Closas, R., Serra, C., Carrato, A., Castano-Vinyals, G., Samanic, C., Rothman, N. et Kogevinas, M. (2010). Polymorphisms in GSTT1, GSTZ1, et CYP2E1, disinfection by-products, and risk of bladder cancer in Spain. Environ. Health Perspect., 118(11): 1545–1550.
- Cao, W.C., Zeng, Q., Luo, Y., Chen, H.X., Miao, D.Y., Li, L., Cheng, Y.H., Li, M., Wang, F., You, L., Wang, Y.X., Yang, P. et Lu, W.Q. (2016). Blood biomarkers of late pregnancy exposure to trihalomethanes in drinking water and fetal growth measures and gestational age in a Chinese cohort. Environ. Health Perspect., 124(4): 536–541.
- Caro, J. et Gallego, M. (2007). Assessment of exposure of workers and swimmers to trihalomethanes in an indoor swimming pool. Environ. Sci. Technol., 41(13): 4793–4798.
- Caro, J. et Gallego, M. (2008). Alveolar air and urine analyses as biomarkers of exposure to trihalomethanes in an indoor swimming pool. Environ. Sci. Technol., 42(13): 5002–5007.
- Carra, I., Fernandez Lozano, J., Autin, O., Bolton, J.R. et Jarvis, P. (2020). Disinfection by-product formation during UV/chlorine treatment of pesticides in a novel UV-LED reactor at 285 nm and the mitigation impact of GAC treatment. Sci. Total Environ., 712.
CCME (2003). Guide concernant l'application propre à un lieu des Recommandations pour la qualité des eaux au Canada : procédures d'établissement d'objectifs numériques de qualité de l'eau. Le Conseil canadien des ministres de l'environnement, Winnipeg, Manitoba. - CCME (2004). De la source au robinet : Guide d'application de l'approche à barrières multiples pour une eau potable saine. Le Conseil canadien des ministres de l'environnement, Winnipeg, Manitoba.
- CCME (2007). Protocole d'élaboration des recommandations pour la qualité des eaux en vue de protéger la vie aquatique. Le Conseil canadien des ministres de l'environnement, Winnipeg, Manitoba.
- CCN (2023). Répertoire des organismes de certification de produits, de procédés et de services accrédités. Conseil canadien des normes, Ottawa, Ontario. Disponible à : https://ccn-scc.ca/search/site?fulltext=en%20accreditation%20product%20process%20service%20certification%20directory%20of%20accredited%20clients&_gl=1*geh79*_ga*NjEwMjc2MDUxLjE3Mjc0NzAxODQ.*_ga_F1YVKC1N77*MTcyNzQ3MDE4My4xLjEuMTcyNzQ3MDM4Ni4wLjAuMA
- Chen, J.J. et Yeh, H.H. (2005). The mechanisms of potassium permanganate on algae removal. Water Res., 39(18): 4420–4428.
- Chen, J.J., Yeh, H.H. et Tseng, I.C. (2009). Effect of ozone and permanganate on algae coagulation removal – pilot and bench scale tests. Chemosphere, 74(6): 840–846.
- Chen, S., Deng, J., Li, L. et Gao, N. (2018). Evaluation of disinfection by-product formation during chlor(am)ination from algal organic matter after UV irradiation. Environ. Sci. Pollut. Res., 25(6): 5994–6002.
- Chen, Y.J., Duan, P., Meng, T.Q., Chen, H.G., Chavarro, J.E., Xiong, C.L., Pan, A., Wang, Y.X., Lu, W.Q. et Messerlian, C. (2020). Associations of blood trihalomethanes with semen quality among 1199 healthy Chinese men screened as potential sperm donors. Environ. Int., 134:105335.
- Cheung, A.Q., Rouhani, D. et Marti, E.J. (2020). Optimizing tank design to improve THM removal with spray aeration. Anonymous pp. 374–384.
- Chin, A. et Bérubé, P.R. (2005). Removal of disinfection by-product precursors with ozone-UV advanced oxidation process. Water Res., 39(10): 2136–2144.
- Chinery, R.L. et Gleason, A.K. (1993). A compartmental model for the prediction of breath concentration and absorbed dose of chloroform after exposure while showering. Risk Anal., 13(1): 51–62.
- Chiu, C.A., Westerhoff, P. et Ghosh, A. (2012). GAC removal of organic nitrogen and other DBP precursors. J. Am. Water Works Assoc., 104(7): E406–E415.
- Chow, C.W.K., Fabris, R. et Drikas, M. (2004). A rapid fractionation technique to characterise natural organic matter for the optimisation of water treatment processes. J. Water Supply Res. Technol. Aqua, 53(2): 85–92.
- Chow, C.W.K., Fabris, R., Drikas, M. et Holmes, M. (2005). A case study of treatment performance and organic character. J. Water Supply Res. Technol. Aqua, 54(6): 385–395.
- Chow, C., Fabris, R., Wilkinson, K., Fitzgerald, F. et Drikas, M. (2006). Characterising NOM to assess treatability. Water, 33(2): 74–85.
- Chow, A.T., Tsai, K.P., Fegel, T.S., Pierson, D.N. et Rhoades, C.C. (2019). Lasting effects of wildfire on disinfection by-product formation in forest catchments. J. Environ. Qual., 48(6): 1826–1834.
- Chowdhury, S., Champagne, P. et McLellan, P.J. (2010). Investigating effects of bromide ions on trihalomethanes and developing model for predicting bromodichloromethane in drinking water. Water Res., 44: 2349–2359.
- Chowdhury, S., Rodriguez, M.J. et Sadiq, R. (2011). Disinfection byproducts in Canadian provinces: Associated cancer risks and medical expenses. J. Hazard. Mater., 187(1-3): 574–584.
- Chowdhury, S. (2013a). Regional variability of disinfection by-products in Canadian drinking water. Water Int., 38(1): 61–77.
- Chowdhury, S. (2013b). Exposure assessment for trihalomethanes in municipal drinking water and risk reduction strategy. Sci. Total Environ., 463–464: 922–930.
- Chowdhury, S. (2013c). Trihalomethanes in drinking water: Effect of natural organic matter distribution. Water SA, 39(1): 1–8.
- Chowdhury, S. (2018). Occurrences and changes of disinfection by-products in small water supply systems. Environ. Monit. Assess., 190(1).
- Christian, M.S., York, R.G., Hoberman, A.M., Diener, R.M. et Fisher, L.C. (2001). Oral (drinking water) developmental toxicity studies of bromodichloromethane (BDCM) in rats and rabbits. Int. J. Toxicol., 20(4): 225–237.
- Christian, M.S., York, R.G., Hoberman, A.M., Diener, R.M. et Fisher, L.C. (2002). Oral (drinking water) two‑generation reproductive toxicity studies of bromodichloromethane in rats. Int. J. Toxicol., 21: 115–145.
- Chu, I., Villeneuve, D.C., Secours, V.E., Becking, G.C. et Valli, V.E. (1982). Trihalomethanes: II. Reversibility of toxicological changes produced by chloroform, bromodichloromethane, chlorodibromomethane and bromoform in rats. J. Environ. Sci. Health B., 17(3): 225–240.
- Chu, W., Gao, N., Deng, Y., Templeton, M.R. et Yin, D. (2011). Impacts of drinking water pretreatments on the formation of nitrogenous disinfection by-products. Bioresour. Technol., 102(24): 11161–11166.
- Chu, W., Li, D., Deng, Y., Gao, N., Zhang, Y. et Zhu, Y. (2016). Effects of UV/PS and UV/H2O2 pre-oxidations on the formation of trihalomethanes and haloacetonitriles during chlorination and chloramination of free amino acids and short oligopeptides. Chem. Eng. J., 301: 65–72.
- Chu, W., Yao, D., Deng, Y., Sui, M. et Gao, N. (2017). Production of trihalomethanes, haloacetaldehydes and haloacetonitriles during chlorination of microcystin-LR and impacts of pre-oxidation on their formation. J. Hazard. Mater., 327: 153–160.
- CIRC (1999a). Some chemicals that cause tumours of the kidney or urinary bladder in rodents and some other substances, International Agency for Research on Cancer Monographs on the Evaluation of Carcinogenic Risks to Humans, Volume 73 (non disponible en français). Centre international de Recherche sur le Cancer, Lyon, France.
- CIRC (1999b). Re-evaluation of some organic chemicals, hydrazine and hydrogen peroxide (Part 1, Part 2, Part 3), International Agency for Research on Cancer Monographs on the Evaluation of Carcinogenic Risks to Humans, Volume 71 (non disponible en français). Centre international de Recherche sur le Cancer, Lyon, France.
- CIRC (2013). Some chemicals present in industrial and consumer products, foods and drinking Water. International Agency for Research on Cancer Monographs on the Evaluation of Carcinogenic Risks to Humans, Volume 101 (non disponible en français). Centre international de Recherche sur le Cancer, Lyon, France.
- Clark, J.M., Lane, S.N., Chapman, P.J. et Adamson, J.K. (2007). Export of dissolved organic carbon from an upland peatland during storm events: Implications for flux estimates. J. Hydrol., 347(3–4): 438–447.
- Clark, T.F. (2016). DBP control in an expanding regional water supply system. J. Am. Water Works Assoc., 108(7): 43–47.
- Class, T., Kohnle, R. et Ballschmiter, K. (1986). Chemistry of organic traces in air VII: Bromo- and bromochloromethanes in air over the Atlantic Ocean. Chemosphere, 15: 429–436.
- Clifford, D.A. (1999). Ion exchange and inorganic adsorption. Ch. 9 dans: Letterman, R.D.(ed). Water quality and treatment: a handbook of community water supplies, 5th edition. American Water Works Association. Denver, Colorado. McGraw-Hill, New York, New York.
- Clifford, D., Sorg, T. et Ghurye, G. (2011). Ion exchange and adsorption of inorganic contaminants. Ch. 12 dans: Edzwald, J.K. (ed.).Water quality and treatment: a handbook of community water supplies. 6th edition. American Water Works Association,Denver, Colorado. McGraw-Hill, New York, New York.
- Coffin, J.C., Ge, R., Yang, S., Kramer, P.M., Tao, L. et Pereira, M.A. (2000). Effect of trihalomethanes on cell proliferation and DNA methylation in female B6C3F1 mouse liver. 58(2): 243–252.
- Colomb, A., Yassaa, N., Williams, J., Peeken, I. et Lochte, K. (2008). Screening volatile organic compounds (VOCs) emissions from five marine phytoplankton species by head space gas chromatography/mass spectrometry (HS-GC/MS). J. Environ. Monit., 10(3): 325–330.
- Condie, L.W., Smallwood, C.L. et Laurie, R.D. (1983). Comparative renal and hepatotoxicity of halomethanes: Bromodichloromethane, bromoform, chloroform, dibromochloromethane and methylene chloride. Drug Chem. Toxicol., 6(6): 563–578.
- Corley, R.A., Mendrala, A.L., Smith, F.A., Staats, D.A., Gargas, M.L., Conolly, R.B., Andersen, M.E. et Reitz, R.H. (1990). Development of a physiologically based pharmacokinetic model for chloroform. Toxicol. Appl. Pharmacol., 103(3): 512–527.
- Corley, R.A., Gordon, S.M. et Wallace, L.A. (2000). Physiologically based pharmacokinetic modeling of the temperature-dependent dermal absorption of chloroform by humans following bath water exposures. Toxicol. Sci., 53(1): 13–23.
- Cortes, C. et Marcos, R. (2018). Genotoxicity of disinfection byproducts and disinfected waters: A review of recent literature. Mutat. Res., 831: 1–12.
- Costet, N., Villanueva, C.M., Jaakkola, J.J., Kogevinas, M., Cantor, K.P., King, W.D., Lynch, C.F., Nieuwenhuijsen, M.J. et Cordier, S. (2011). Water disinfection by-products and bladder cancer: Is there a European specificity? A pooled and meta-analysis of European case-control studies. Occup. Environ. Med., 68(5): 379–385.
- Cotruvo, J.A. et Amato, H. (2019). National trends of bladder cancer and trihalomethanes in drinking water: A review and multicountry ecological study. Dose-Response, 17(1): 1559325818807781.
- Criquet, J., Allard, S., Salhi, E., Joll, C.A., Heitz, A. et Von Gunten, U. (2012). Iodate and iodo-trihalomethane formation during chlorination of iodide-containing waters: Role of bromide. Environ. Sci. Technol., 46(13): 7350–7357.
- Cuthbertson, A.A., Liberatore, H.K., Kimura, S.Y., Allen, J.M., Bensussan, A.V. et Richardson, S.D. (2020). Trace analysis of 61 emerging Br-, Cl-, and I-DBPs: New methods to achieve part-per-trillion quantification in drinking water. Anal. Chem., 92(4): 3058–3068.
- Da Silva, M.L., Charest-Tardif, G., Krishnan, K. et Tardif, R. (1999). Influence of oral administration of a quaternary mixture of trihalomethanes on their blood kinetics in the rat. Toxicol. Lett., 106(1): 49–57.
- Da Silva, M.L., Charest-Tardif, G., Krishnan, K. et Tardif, R. (2000). Evaluation of the pharmacokinetic interactions between orally administered trihalomethanes in the rat. J. Toxicol. Environ. Health A, 60(5): 343–353.
- Daniel, F.B., Robinson, M., Condie, L.W. et York, R.G. (1990). Ninety-day oral toxicity study of dibromochloromethane in Sprague-Dawley rats. Drug Chem. Toxicol., 13(2-3): 135–154.
- de Castro Medeiros, L., de Alencar, F.L.S., Navoni, J.A., de Araujo, A.L.C. et do Amaral, V.S. (2019). Toxicological aspects of trihalomethanes: A systematic review. Environ. Sci. Pollut. Res. Int., 26(6): 5316–5332.
- DeAngelo, A.B., Geter, D.R., Rosenberg, D.W., Crary, C.K. et George, M.H. (2002). The induction of aberrant crypt foci (ACF) in the colons of rats by trihalomethanes administered in the drinking water. Cancer Lett., 187(1–2): 25–31.
- Delpla, I. et Rodriguez, M.J. (2016). Experimental disinfection by-product formation potential following rainfall events. Water Res., 104: 340–348. DOI : 10.1016/j.watres.2016.08.031
- Delpla, I. et Rodriguez, M.J. (2017). Variability of disinfection by-products at a full-scale treatment plant following rainfall events. Chemosphere, 166: 453–462.
- Delpla, I., Bouchard, C., Dorea, C., Rodriguez, M.J. (2023). Assessment of rain event effects on source water quality degradation and subsequent water treatment operations. Sci. Total Environ., 866:161085.
- DeMarini, D.M. (2020). A review of the 40th anniversary of the first regulation of drinking water disinfection by‑products. Environ. Mol. Mutagen., 61(6): 588–601.
- DeMarini, D.M., Shelton, M.L., Warren, S.H., Ross, T.M., Shim, J.Y., Richard, A.M. et Pegram, R.A. (1997). Glutathione S-transferase-mediated induction of GC-->AT transitions by halomethanes in Salmonella. Environ. Mol. Mutagen., 30(4): 440–447.
- DeMarini, D.M., Warren, S.H., Smith, W.J., Richardson, S.D. et Liberatore, H.K. (2021). Inability of GSTT1 to activate iodinated halomethanes to mutagens in Salmonella. Environ. Mol. Mutagen., 62(3): 168–176.
- Développement durable Manitoba (2019). Communication personnelle avec K. Phillip, Office of Drinking Water, Winnipeg, MB.
- Dick, D., Ng, K.M., Sauder, D.N. et Chu, I. (1995). In vitro and in vivo percutaneous absorption of 14C‑chloroform in humans. Hum. Exp. Toxicol., 14(3): 260–265.
- Ding, H., Meng, L., Zhang, H., Yu, J., An, W., Hu, J. et Yang, M. (2013). Occurrence, profiling and prioritization of halogenated disinfection by-products in drinking water of China. Environ. Sci. Process. Impacts, 15(7): 1424–1429.
- Ding, S., Wang, F., Chu, W., Fang, C., Pan, Y., Lu, S. et Gao, N. (2019). Using UV/H2O2 pre-oxidation combined with an optimised disinfection scenario to control CX3R-type disinfection by-product formation. Water Res., 167.
- Dion-Fortier, A., Rodriguez, M.J., Sérodes, J. et Proulx, F. (2009). Impact of water stagnation in residential cold and hot water plumbing on concentrations of trihalomethanes and haloacetic acids. Water Res., 43(12): 3057–3066.
- Dodds, L., King, W., Woolcott, C. et Pole, J. (1999). Trihalomethanes in public water supplies and adverse birth outcomes. Epidemiology, 10(3): 233–237.
- Dong, H., Qiang, Z. et Richardson, S. (2019a). Formation of iodinated disinfection byproducts (I-DBPs) in drinking water: Emerging concerns and current issues. Acc.Chem. Res., 52 (4): 896–905.
- Dong, F., Liu, J., Li, C., Lin, Q., Zhang, T., Zhang, K. et Sharma, V.K. (2019b). Ferrate(VI) pre-treatment and subsequent chlorination of blue-green algae: Quantification of disinfection byproducts. Environ. Int., 133.
- Dong, F., Lin, Q., Li, C. et Zhang, T. (2019c). Evaluation of disinfection byproduct formation from extra- and intra-cellular algal organic matters during chlorination after Fe(VI) oxidation. RSC Adv., 9(70): 41022–41030.
- Dong, F., Lin, Q., Li, C., He, G. et Deng, Y. (2021). Impacts of pre-oxidation on the formation of disinfection byproducts from algal organic matter in subsequent chlor(am)ination: A review. Sci. Total Environ., 754.
- Dotson, A.D., Keen, V.S., Metz, D. et Linden, K.G. (2010). UV/H2O2 treatment of drinking water increases post‑chlorination DBP formation. Water Res., 44(12): 3703–3713.
- Duranceau, S.J. et Smith, C.T. (2016). Trihalomethane formation downstream of spray aerators treating disinfected groundwater. J. Am. Water Works Assoc., 108(2): E99–E108.
- Dykan, V.A. (1962). Changes in liver and kidney functions due to methylene bromide and bromoform. Nauchn. Tr. Ukr. Nauchn-Issled Inst. Gigieny. Truda i Profzabolevanii, 29: 82–90 (citée dans ATSDR, 2005).
- Dykan, V.A. (1964). Problems on toxicology, clinical practice, and work hygiene in the production of bromine‑organic compounds. Gigiena, 5b: 100–103 (citée dans ATSDR, 2005).
- Edgar, M. et Boyer, T.H. (2021). Removal of natural organic matter by ion exchange: Comparing regenerated and non-regenerated columns. Water Res., 189: 116661.
- Edwards, M. et Dudi, A. (2004). Role of chlorine and chloramine in corrosion of lead-bearing plumbing materials. J. Am. Water Works Assoc., 96(10): 69–81.
- Edwards, M. et Triantafyllidou, S. (2007). Chloride-to-sulfate mass ratio and lead leaching to water. J. Am. Water Works Assoc., 99(7): 96–109.
- Edwards, M., Jacobs, S. et Dodrill, D.M. (1999) Desktop guidance for mitigating Pb and Cu corrosion by‑products. J. Am. Water Works Assoc., 91(5): 66–77.
- Edzwald, J.K. (1993). Coagulation in drinking water treatment: Particles, organics and coagulants. Water Sci. Technol., 27(11): 21–35.
- Edzwald, J.K. et Tobiason, J.E. (1999). Enhanced coagulation: U.S. requirements and a broader view. Wat. Sci. Tech. 40(9): 63–70.
- Edzwald, J.K et Tobiason, J.E. (2011). Chemical principles, source water composition, and watershed protection. Ch. 3 dans : Edzwald, J.K. (ed.). Water quality and treatment: A handbook of community water supplies. 6th edition. McGraw-Hill, New York, New York.
- EFSA (2019). Guidance on harmonised methodologies for human health, animal health and ecological risk assessment of combined exposure to multiple chemicals. Autorité européenne de sécurité des aliments. EFSA J., 17(3): e05634.
- Environnement Canada et Santé Canada (2001). Liste des substances d'intérêt prioritaire – Rapport d'évaluation pour Chloroforme. Ottawa, Ontario.
- Erdinger, L., Kuhn, K.P., Kirsch, F., Feldhues, R., Frobel, T., Nohynek, B. et Gabrio, T. (2004). Pathways of trihalomethane uptake in swimming pools. Int. J. Hyg. Environ. Health, 207(6): 571–575.
- Evlampidou, I., Font-Ribera, L., Rojas-Rueda, D., Gracia-Lavedan, E., Costet, N., Pearce, N., Vineis, P., Jaakkola, J.J.K., Delloye, F., Makris, K.C., Stephanou, E.G., Kargaki, S., Kozisek, F., Sigsgaard, T., Hansen, B., Schullehner, J., Nahkur, R., Galey, C., Zwiener, C., Vargha, M., Righi, E., Aggazzotti, G., Kalnina, G., Grazuleviciene, R., Polanska, K., Gubkova, D., Bitenc, K., Goslan, E.H., Kogevinas, M. et Villanueva, C.M. (2020). Trihalomethanes in drinking water and bladder cancer burden in the European Union. Environ. Health Perspect., 128(1): 17001.
- Fábián, I. et Gordon, G. (1997). The kinetics and mechanism of the chlorine dioxide–iodide ion reaction. Inorg. Chem., 36(12): 2494–2497.
- Fan, J., Ho, L., Hobson, P. et Brookes, J. (2013). Evaluating the effectiveness of copper sulphate, chlorine, potassium permanganate, hydrogen peroxide and ozone on cyanobacterial cell integrity. Water Res., 47(14): 5153–5164.44
- Fang, J., Yang, X., Ma, J., Shang, C. et Zhao, Q. (2010a). Characterization of algal organic matter and formation of DBPs from chlor(am)ination. Water Res., 44(20): 5897–5906.
- Fang, J., Ma, J., Yang, X. et Shang, C. (2010b). Formation of carbonaceous and nitrogenous disinfection by‑products from the chlorination of microcystis aeruginosa. Water Res., 44(6): 1934–1940.
- Fang, J., Fu, Y. et Shang, C. (2014). The roles of reactive species in micropollutant degradation in the UV/free chlorine system. Environ. Sci. Technol., 48(3): 1859–1868.
- Fang, C., Ou, T., Wang, X., Rui, M. et Chu, W. (2020). Effects of feed solution characteristics and membrane fouling on the removal of THMs by UF/NF/RO membranes. Chemosphere, 260: 127625.
- Fang, C., Wang, X., Xiao, R., Ding, S., Chen, B. et Chu, W. (2021). Rejection of chlorinated, brominated, and iodinated trihalomethanes by multi-stage reverse osmosis: Efficiency and mechanisms. Chemosphere, 268: 129307.
- Feingold, A. et Holaday, D.A. (1977). The pharmacokinetics of metabolism of inhalation anaesthetics. A simulation study. Br. J. Anaesth., 49(2): 155–162.
- Fellman, J.B., Hood, E. et Spencer, R.G.M. (2010). Fluorescence spectroscopy opens new windows into dissolved organic matter dynamics in freshwater ecosystems: A review. Limnol. Oceanogr., 55(6): 2452–2462.
- Fernandez, J., Jarvis, P., Brookes, A., Knott, S. et Carra, I. (2021). Organic matter removal with bicarbonate-form ion exchange: water quality, kinetics and mass transfer mechanisms. J. Water Proc. Engineering, 44: 102337.
- Fisher, I., Kastl, G., Shang, F. et Sathasivan, A. (2018). Framework for optimizing chlorine and byproduct concentrations in drinking water distribution systems. J. Am. Water Works Assoc., 110(11): 38–49.
- Font-Ribera, L., Kogevinas, M., Schmalz, C., Zwiener, C., Marco, E., Grimalt, J.O., Liu, J., Zhang, X., Mitch, W., Critelli, R., Naccarati, A., Heederik, D., Spithoven, J., Arjona, L., de Bont, J., Gracia-Lavedan, E. et Villanueva, C.M. (2016). Environmental and personal determinants of the uptake of disinfection by-products during swimming. Environ. Res., 149: 206–215.
- Frank, S., Geoppert, N. et Goldscheider, N. (2018). Fluorescence-based multi-parameter approach to characterize dynamics or organic carbon, faecal bacteria and particles at alpine karst springs. Sci. Total Environ., 615: 1446–1459.
- Frisch, N.W. et Kunin, R. (1960). Organic fouling of anion-exchange resins. J. Am. Water Works Assoc., 52(7): 875–887.
- Fry, B.J., Taylor, T. et Hathway, D.E. (1972). Pulmonary elimination of chloroform and its metabolite in man. Arch. Int. Pharmacodyn. Ther., 196(1): 98–111.
- Fu, J., Qu, J., Liu, R., Qiang, Z., Liu, H. et Zhao, X. (2009). Cu(II)-catalyzed THM formation during water chlorination and monochloramination: A comparison study. J. Hazard. Mater., 170(1): 58–65.
- Gallard, H., Allard, S., Nicolau, R., Von Gunten, U. et Croué, J.P. (2009). Formation of iodinated organic compounds by oxidation of iodide-containing waters with manganese dioxide. Environ. Sci. Technol., 43(18): 7003–7009.
- Gao, Z.C., Lin, Y.L., Xu, B., Xia, Y., Hu, C.Y., Zhang, T.Y., Cao, T.C., Chu, W.H. et Gao, N.Y. (2019). Effect of UV wavelength on humic acid degradation and disinfection by-product formation during the UV/chlorine process. Water Res., 154: 199–209.
- Gao, J., Proulx, F. et Rodriguez, M.J. (2020). Effects of ozonation on halogenated acetaldehydes and trihalomethanes formation: Strategy of process control for a full-scale plant. J. Water Process Eng., 35: 101205.
- Gearhart, J.M., Seckel, C. et Vinegar, A. (1993). In vivo metabolism of chloroform in B6C3F1 mice determined by the method of gas uptake: The effects of body temperature on tissue partition coefficients and metabolism. Toxicol. Appl. Pharmacol., 119(2): 258–266.
- Gemma, S., Vittozzi, L. et Testai, E. (2003). Metabolism of chloroform in the human liver and identification of the competent P450s. Drug Metab. Dispos., 31(3): 266–274.
- Genisoglu, M., Ergi-Kaytmaz, C. et Sofuoglu, S.C. (2019). Multi-route – multi-pathway exposure to trihalomethanes and associated cumulative health risks with response and dose addition. J. Environ. Manage., 233: 823–831.
- George, M.H., Olson, G.R., Doerfler, D., Moore, T., Kilburn, S. et DeAngelo, A.B. (2002). Carcinogenicity of bromodichloromethane administered in drinking water to male F344/N rats and B6C3F1 mice. Int. J. Toxicol., 21(3): 219–230.
- Geter, D.R., George, M.H., Moore, T.M., Kilburn, S., Huggins-Clark, G. et DeAngelo, A.B. (2004a). Vehicle and mode of administration effects on the induction of aberrant crypt foci in the colons of male F344/N rats exposed to bromodichloromethane. J. Toxicol. Environ. Health A, 67(1): 23–29.
- Geter, D.R., Chang, L.W., Hanley, N.M., Ross, M.K., Pegram, R.A. et DeAngelo, A.B. (2004b). Analysis of in vivo and in vitro DNA strand breaks from trihalomethane exposure. J. Carcinog., 3(1): 2.
- Geter, D.R., George, M.H., Moore, T.M., Kilburn, S.R., Huggins-Clark, G. et DeAngelo, A.B. (2004c). The effects of a high animal fat diet on the induction of aberrant crypt foci in the colons of male F344/N rats exposed to trihalomethanes in the drinking water. Toxicol. Lett., 147(3): 245–252.
- Geter, D.R., Moore, T.M., George, M.H., Kilburn, S.R., Allen, J.W., Nelson, G.M., Winkfield, E. et DeAngelo, A.B. (2005). Tribromomethane exposure and dietary folate deficiency in the formation of aberrant crypt foci in the colons of F344/N rats. Food Chem. Toxicol., 43(9): 1405–1412.
- Ghosh, A., Seidel, C., Townsend, E., Pacheco, R. et Corwin, C. (2015). Reducing volatile disinfection by-products in treated drinking water using aeration technologies. Water Research Foundation, EPA, Water Environment Research Foundation, 4441, Denver, Colorado; Alexandria, Virginie; Washington, DC.
- Giani, R.E. et Hill, C.P. (2017). M58 – Internal corrosion control in water distribution systems. American Water Works Association, Denver, Colorado.
- Gilca, A.F., Teodosiu, C., Fiore, S. et Musteret, C.P. (2020). Emerging disinfection byproducts: A review on their occurrence and control in drinking water treatment processes. Chemosphere, 259: 127476.
- GlobalTox (2002). Assessment of the toxicology of trihalomethanes (THMs) in drinking water. International Consultants Inc. Rapport final. Préparé pour Santé Canada.
- Gokulan, K., Kumar, A., Lahiani, M.H., Sutherland, V.L., Cerniglia, C.E. et Khare, S. (2021). Differential toxicological outcome of corn oil exposure in rats and mice as assessed by microbial composition, epithelial permeability, and ileal mucosa-associated immune status. Toxicol. Sci., 180(1): 89–102.
- Goslan, E.H., Krasner, S.W., Bower, M., Rocks, S.A., Holmes, P., Levy, L.S. et Parsons, S.A. (2009). A comparison of disinfection by-products found in chlorinated and chloraminated drinking waters in Scotland. Water Res., 43(18): 4698–4706.
- Gouvernement du Canada (2023). Stratégie nationale d'adaptation du Canada : bâtir des collectivités résilientes et une économie forte. Gatineau, QC, Cat. No.: En4-544/2023E-PDF. Disponible à : https://publications.gc.ca/collections/collection_2023/eccc/en4/En4-544-2023-fra.pdf
- Grazuleviciene, R., Nieuwenhuijsen, M.J., Vencloviene, J., Kostopoulou-Karadanelli, M., Krasner, S.W., Danileviciute, A., Balcius, G. et Kapustinskiene, V. (2011). Individual exposures to drinking water trihalomethanes, low birth weight and small for gestational age risk: A prospective Kaunas cohort study. Environ. Health, 10: 32.
- Gregory, D. (1998). Enhanced coagulation for treating spring runoff water. Opflow, 24(2): 12–13.
- Grellier, J., Bennett, J., Patelarou, E., Smith, R.B., Toledano, M.B., Rushton, L., Briggs, D.J. et Nieuwenhuijsen, M.J. (2010). Exposure to disinfection by-products, fetal growth, and prematurity: A systematic review and meta‑analysis. Epidemiology, 21(3):300–313.
- Guariglia, S.R., Jenkins, E.C.,Jr, Chadman, K.K. et Wen, G.Y. (2011). Chlorination byproducts induce gender specific autistic-like behaviors in CD-1 mice. Neurotoxicology, 32(5): 545–553.
- Guilherme, S. et Caetano, D. (2020). Real-time estimation of disinfection by-products through differential UV absorbance. Water, 12: 2536.
- Guo, Z.B., Lin, Y.L., Xu, B., Hu, C.Y., Huang, H., Zhang, T.Y., Chu, W.H. et Gao, N.Y. (2016). Factors affecting THM, HAN and HNM formation during UV-chlor(am)ination of drinking water. Chem. Eng. J., 306: 1180–1188.
- Haddad, S., Tardif, G.C. et Tardif, R. (2006). Development of physiologically based toxicokinetic models for improving the human indoor exposure assessment to water contaminants: Trichloroethylene and trihalomethanes. J. Toxicol. Environ. Health A, 69(23): 2095–2136.
- Hard, G.C., Boorman, G.A. et Wolf, D.C. (2000). Re-evaluation of the 2-year chloroform drinking water carcinogenicity bioassay in Osborne-Mendel rats supports chronic renal tubule injury as the mode of action underlying the renal tumor response. Toxicol. Sci., 53(2): 237–244.
- Haworth, S., Lawlor, T., Mortelmans, K., Speck, W. et Zeiger, E. (1983). Salmonella mutagenicity test results for 250 chemicals. Environ. Mutagen., 5(Suppl 1): 1–142.
- Hayes, A.W. et Kruger, C.L. (eds.) (2014). Hayes' principles and methods of toxicology. 6th edition. CRC Press, Boca Raton, Floride.
- He, X., Elkouz, M., Inyang, M., Dickenson, E. et Wert, E.C. (2017). Ozone regeneration of granular activated carbon for trihalomethane control. J. Hazard. Mater., 326: 101–109.
- Henderson, R., Parsons, S.A. et Jefferson, B. (2008). The impact of algal properties and pre-oxidation on solid‑liquid separation of algae. Water Res., 42(8-9): 1827–1845.
- Heywood, R., Sortwell, R.J., Noel, P.R., Street, A.E., Prentice, D.E., Roe, F.J., Wadsworth, P.F., Worden, A.N. et Van Abbe, N.J. (1979). Safety evaluation of toothpaste containing chloroform. III. Long-term study in beagle dogs. J. Environ. Pathol. Toxicol., 2(3): 835–851.
- Hikiba, H., Watanabe, E., Barrett, J.C. et Tsutsui, T. (2005). Ability of fourteen chemical agents used in dental practice to induce chromosome aberrations in Syrian hamster embryo cells. J. Pharmacol. Sci., 97(1): 146–152.
- Hohner, A.K., Rhoades, C.C., Wilkerson, P. et Rosario-Ortiz, F.L. (2019). Wildfires alter forest watersheds and threaten drinking water quality. Acc. Chem. Res., 52: 1234–1244.
- Hong, H., Xiong, Y., Ruan, M., Liao, F., Lin, H. et Liang, Y. (2013). Factors affecting THMs, HAAs and HNMs formation of Jin Lan reservoir water exposed to chlorine and monochloramine. Sci. Total Environ., 444: 196–204.
- Hrudey, S.E., Backer, L.C., Humpage, A.R., Krasner, S.W., Michaud, D.S., Moore, L.E., Singer, P.C. et Stanford, B.D. (2015). Evaluating evidence for association of human bladder cancer with drinking-water chlorination disinfection by-products. J. Toxicol. Environ. Health B Crit. Rev., 18(5): 213–241.
- Hrudey, S.E., et Fawell, J. (2015). 40 years on: What do we know about drinking water disinfection by-products (DBPs) and human health? Water Sci. Technol. Water Supply., 15(4): 667–674.
- Hu, J., Song, H. et Karanfil, T. (2010). Comparative analysis of halonitromethane and trihalomethane formation and speciation in drinking water: The effects of disinfectants, pH, bromide, and nitrite. Environ. Sci. Technol., 44(2): 794–799.
- Hu, J., Qiang, Z., Dong, H. et Qu, J. (2016). Enhanced formation of bromate and brominated disinfection byproducts during chlorination of bromide-containing waters under catalysis of copper corrosion products. Water Res., 98: 302–308.
- Hu, J., Chu, W., Sui, M., Xu, B., Gao, N. et Ding, S. (2018). Comparison of drinking water treatment processes combinations for the minimization of subsequent disinfection by-products formation during chlorination and chloramination. Chem. Eng. J., 335: 352–361.
- Hu, S., Gong, T., Wang, J. et Xian, Q. (2019). Trihalomethane yields from twelve aromatic halogenated disinfection byproducts during chlor(am)ination. Chemosphere, 228: 668–675.
- Hua, G., Reckhow, D.A. et Kim, J. (2006). Effect of bromide and iodide ions on the formation and speciation of disinfection byproducts during chlorination. Environ. Sci. Technol., 40(9): 3050–3056.
- Hua, G. et Reckhow, D.A. (2007a). Comparison of disinfection byproduct formation from chlorine and alternative disinfectants. Water Res., 41(8): 1667–1678.
- Hua, G. et Reckhow, D.A. (2007b). Characterization of disinfection byproduct precursors based on hydrophobicity and molecular size. Environ. Sci. Technol., 41(9): 3309–3315.
- Hua, G. et Reckhow, D.A. (2008). DBP formation during chlorination and chloramination: Effect of reaction time. pH, dosage, and temperature. J. Am. Water Works Assoc., 100(8): 82–95.
- Hua, G. et Reckhow, D.A. (2013). Effect of pre-ozonation on the formation and speciation of DBPs. Water Res., 47(13): 4322–4330.
- Hua, G., Reckhow, D.A. et Abusallout, I. (2015). Correlation between SUVA and DBP formation during chlorination and chloramination of NOM fractions from different sources. Chemosphere, 130: 82–89.
- Huang, J., Graham, N., Templeton, M.R., Zhang, Y., Collins, C. et Nieuwenhuijsen, M. (2009). A comparison of the role of two blue-green algae in THM and HAA formation. Water Res., 43(12): 3009–3018.
- ICF Kaiser (1999). Development of a PBPK model for chloroform for human health risk assessment. Rapport de contrat préparé par le K.S. Crump Group, Inc. ICF Kaiser, Ruston, Louisiane (citée dans Environnement Canada et Santé Canada, 2001).
- Ioannou, P., Charisiadis, P., Andra, S.S. et Makris, K.C. (2016). Occurrence and variability of iodinated trihalomethanes concentrations within two drinking-water distribution networks. Sci. Total Environ., 543: 505–513.
- Iszatt, N., Nieuwenhuijsen, M.J., Bennett, J., Best, N., Povey, A.C., Pacey, A.A., Moore, H., Cherry, N. et Toledano, M.B. (2013). Chlorination by-products in tap water and semen quality in England and Wales. Occup. Environ. Med., 70(11): 754–760.
- Iszatt, N., Nieuwenhuijsen, M.J., Bennett, J.E. et Toledano, M.B. (2014). Trihalomethanes in public drinking water and stillbirth and low birth weight rates: An intervention study. Environ. Int., 73: 434–439.
- Jiang, J.Q. et Lloyd, B. (2002). Progress in the development and use of ferrate(VI) salt as an oxidant and coagulant for water and wastewater treatment. Water Res., 36(6): 1397–1408.
- Jiang, J., Zhang, X., Zhu, X. et Li, Y. (2017). Removal of intermediate aromatic halogenated DBPs by activated carbon adsorption: A new approach to controlling halogenated DBPs in chlorinated drinking water. Environ. Sci. Technol., 51(6): 3435–3444.
- Jo, W.K., Weisel, C.P. et Lioy, P.J. (1990a). Chloroform exposure and the health risk associated with multiple uses of chlorinated tap water. Risk Anal., 10(4): 581–585.
- Jo, W.K., Weisel, C.P. et Lioy, P.J. (1990b). Routes of chloroform exposure and body burden from showering with chlorinated tap water. Risk Anal., 10(4): 575–580.
- Jo, W.K., Kwon, K.D., Dong, J.I. et Chung, Y. (2005). Multi-route trihalomethane exposure in households using municipal tap water treated with chlorine or ozone-chlorine. Sci. Total Environ., 339(1-3): 143–152.
- Johnson, B.A., Lin, J.C., Rexing, D., Fang, M., Chan, J., Jacobsen, L. et Sampson, P. (2009). Localized treatment for disinfection by-products. Water Research Foundation, 3103, Denver, Colorado.
- Jones, D.B., Saglam, A., Triger, A., Song, H. et Karanfil, T. (2011). I-THM formation and speciation: Preformed monochloramine versus prechlorination followed by ammonia addition. Environ. Sci. Technol., 45(24): 10429–10437.
- Jones, D.B., Saglam, A., Song, H. et Karanfil, T. (2012a). The impact of bromide/iodide concentration and ratio on iodinated trihalomethane formation and speciation. Water Res., 46(1): 11–20.
- Jones, D.B., Song, H. et Karanfil, T. (2012b). The effects of selected preoxidation strategies on I-THM formation and speciation. Water Res., 46(17): 5491–5498.
- Jorgenson, T.A., Meierhenry, E.F., Rushbrook, C.J., Bull, R.J. et Robinson, M. (1985). Carcinogenicity of chloroform in drinking water to male Osborne-Mendel rats and female B6C3F1 mice. Fundam. Appl. Toxicol., 5(4): 760–769.
- Karanfil, T., Hu, J., Jones, D.B., Addison, J.W. et Song, H. (2011). Formation of halonitromethanes and iodo‑trihalomethanes in drinking water. Water Research Foundation, 4063, Denver, Colorado.
- Kasai, T., Nishizawa, T., Arito, H., Nagano, K., Yamamoto, S., Matsushima, T. et Kawamoto, T. (2002). Acute and subchronic inhalation toxicity of chloroform in rats and mice. J. Occup. Health, 44(4): 193–202.
- Kastl, G., Sathasivan, A. et Fisher, I. (2016). A selection framework for NOM removal process for drinking water treatment. Desalin. Water Treat., 57(17): 7679–7689.
- Kaufman, J.A., Wright, J.M., Evans, A., Rivera-Núñez, Z., Meyer, A. et Noratsky, M.G. (2018). Associations between disinfection by-product exposures and craniofacial birth defects. J. Occup. Environ. Med., 60(2): 109–119.
- Keith, L.H. et Walters, D.B. (eds.) (1985). Compendium of safety data sheets for research and industrial chemicals. VCH Publishers, Deerfield Beach, Floride.
- Kenyon, E.M., Eklund, C., Leavens, T. et Pegram, R.A. (2016). Development and application of a human PBPK model for bromodichloromethane to investigate the impacts of multi-route exposure. J. Appl. Toxicol., 36(9): 1095–1111.
- Kim, E., Little, J.C. et Chiu, N. (2004). Estimating exposure to chemical contaminants in drinking water. Enviro. Sci. Technol., 38(6): 1799–1806.
- Kimura, S., Zheng, W., N Hipp, T., M Allen, J. et D Richardson, S. (2017). Total organic halogen (TOX) in human urine: A halogen-specific method for human exposure studies. J. Environ. Sci. (China), 58: 285–295.
- Kitis, M., Karanfil, T., Kilduff, J.E. et Wigton, A. (2001). The reactivity of natural organic matter to disinfection by-products formation and its relation to specific ultraviolet absorbance. Water Sci. Technol., 43(2): 9–16.
- Kitis, M., Karanfil, T., Wigton, A. et Kilduff, J.E. (2002). Probing reactivity of dissolved organic matter for disinfection by-product formation using XAD-8 resin adsorption and ultrafiltration fractionation. Water Res., 36(15): 3834–3848.
- Kitis, M., Karanfil, T. et Kilduff, J.E. (2004). The reactivity of dissolved organic matter for disinfection by‑product formation. J. Eng. Environ. Sci., 28(3): 167–179.
- Klinefelter, G.R., Suarez, J.D., Roberts, N.L. et DeAngelo, A.B. (1995). Preliminary screening for the potential of drinking water disinfection byproducts to alter male reproduction. Reprod. Toxicol., 9(6): 571–578.
- Knappe, D.R.U., Belk, R.C., Briley, D.S., Gandy, S.R., Rastogi, N., Rike, A.H., Glasgow, H., Hannon, E., Frazier, W.D., Kohl, P. et Pugsley, S. (2004). Algae detection and removal strategies for drinking water treatment plants. AWWA Research Foundation et The Water Resources Research Institute, Denver, Colorado et Raleigh, Caroline du Nord.
- Koch, B., Krasner, S.W., Sclimenti, M.J. et Schimpff, W.K. (1991). Predicting the formation of DBPs by the simulated distribution system. J. Am. Water Works Assoc., 83(10): 62–70.
- Kolb, C., Pozzi, M., Samaras, C. et VanBriesen, J.M. (2017). Climate change impacts on bromide, trihalomethane formation, and health risks at coastal groundwater utilities. ASCE-ASME J. Risk Uncertain. Eng. Syst. Part A. Civ. Eng., 3(3).
- Konstantakos, A.K., Siu, I.M., Pretlow, T.G., Stellato, T.A. et Pretlow, T.P. (1996). Human aberrant crypt foci with carcinoma in situ from a patient with sporadic colon cancer. Gastroenterology, 111(3): 772–777.
- Korshin, G.V., Wu, W.W., Benjamin, M.M. et Hemingway, O. (2002). Correlations between differential absorbance and the formation of individual DBPs, Water Res., 36: 3273–3282.
- Krasner, S.W., Weinberg, H.S., Richardson, S.D., Pastor, S.J., Chinn, R., Sclimenti, M.J., Onstad, G.D. et Thruston Jr., A.D. (2006). Occurrence of a new generation of disinfection byproducts. Environ. Sci. Technol., 40(23): 7175–7185.
- Krasner, S.W., Lee, T.C.F., Westerhoff, P., Fischer, N., Hanigan, D., Karanfil, T., Beita-Sandí, W., Taylor-Edmonds, L. et Andrews, R.C. (2016a). Granular activated carbon treatment may result in higher predicted genotoxicity in the presence of bromide. Environ. Sci. Technol., 50(17): 9583–9591.
- Krasner, S.W., Kostopoulou, M., Toledano, M.B., Wright, J., Patelarou, E., Kogevinas, M., Villanueva, C.M., Carrasco-Turigas, G., Marina, L.S., Fernández-Somoano, A., Ballester, F., Tardon, A., Grazuleviciene, R., Danileviciute, A., Cordier, S., Costet, N., Righi, E., Aggazzotti, G., Stephanou, E.G., Kargaki, S. et Nieuwenhuijsen, M.J. (2016b). Occurrence of DBPs in drinking water of European regions for epidemiology studies. J. Am. Water Works Assoc., 108(10): E501–E512.
- Krishnan, K. (2003). Evaluation of the relative importance of dermal and inhalation routes for developing drinking water guidelines for total trihalomethanes. Contract report submitted to the Water Quality and Health Bureau, Santé Canada, Ottawa, Ontario.
- Krishnan, K. (2008). Cancer dose-response analysis for bromodichloromethane. Draft report summarizing work conducted under contract reference No. 4500166741 pour Santé Canada.
- Krishnan, K. et Carrier, R. (2013). The use of exposure source allocation factor in the risk assessment of drinking-water contaminants. J. Toxicol. Environ. Health B Crit. Rev., 16(1): 39–51.
- Kristiana, I., Gallard, H., Joll, C. et Croué, J.P. (2009). The formation of halogen-specific TOX from chlorination and chloramination of natural organic matter isolates. Water Res., 43(17): 4177–4186.
- Kristiana, I., Lethorn, A., Joll, C. et Heitz, A. (2014). To add or not to add: The use of quenching agents for the analysis of disinfection by-products in water samples. Water Res., 59: 90–98.
- Kumar, K., Day, R.A. et Margerum, D.W. (1986). Atom-transfer redox kinetics: General-acid-assisted oxidation of iodide by chloramines and hypochlorite. Inorg. Chem., 25(24): 4344–4350.
- Kumar, S., Forand, S., Babcock, G., Richter, W., Hart, T. et Hwang, S.A. (2014). Total trihalomethanes in public drinking water supply and birth outcomes: A cross-sectional study. Matern. Child Health J., 18(4): 996–1006.
- Laflamme, O., Sérodes, J-B., Simard, S., Legay, C., Dorea, C. et Rodriguez, M.J. (2020). Occurrence and fate of ozonation disinfection by-products in two Canadian drinking water systems. Chemosphere, 260: 127660.
- Larson, J.L., Wolf, D.C. et Butterworth, B.E. (1994a). Induced cytolethality and regenerative cell proliferation in the livers and kidneys of male B6C3F1 mice given chloroform by gavage. Fundam. Appl. Toxicol., 23(4): 537–543.
- Larson, J.L., Wolf, D.C. et Butterworth, B.E. (1994b). Induced cytotoxicity and cell proliferation in the hepatocarcinogenicity of chloroform in female B6C3F1 mice: Comparison of administration by gavage in corn oil vs ad libitum in drinking water. Fundam. Appl. Toxicol., 22(1): 90–102.
- Larson, J.L., Wolf, D.C. et Butterworth, B.E. (1995a). Induced regenerative cell proliferation in livers and kidneys of male F-344 rats given chloroform in corn oil by gavage or ad libitum in drinking water. Toxicology, 95(1–3): 73–86.
- Larson, J.L., Wolf, D.C., Mery, S., Morgan, K.T. et Butterworth, B.E. (1995b). Toxicity and cell proliferation in the liver, kidneys and nasal passages of female F-344 rats, induced by chloroform administered by gavage. Food Chem. Toxicol., 33(6): 443–456.
- Larson, J.L., Templin, M.V., Wolf, D.C., Jamison, K.C., Leininger, J.R., Mery, S., Morgan, K.T., Wong, B.A., Conolly, R.B. et Butterworth, B.E. (1996). A 90-day chloroform inhalation study in female and male B6C3F1 mice: Implications for cancer risk assessment. Fundam. Appl. Toxicol., 30(1): 118–137.
- Leavens, T.L., Blount, B.C., DeMarini, D.M., Madden, M.C., Valentine, J.L., Case, M.W., Silva, L.K., Warren, S.H., Hanley, N.M. et Pegram, R.A. (2007). Disposition of bromodichloromethane in humans following oral and dermal exposure. Toxicol. Sci., 99(2): 432–445.
- Lee, Y., Noh, J.H., Park, J.W., Yoon, S.W., Kim, S.Y., Son, H.J., Lee, W. et Maeng, S.K. (2023). Integrating biological ion exchange with biological activated carbon treatment for drinking water: A novel approach for NOM removal, trihalomethane formation potential, and biological stability. Water Res. 245: 120598.
- Legay, C., Leduc, S., Dubé, J., Levallois, P. et Rodriguez, M.J. (2019). Chlorination by-product levels in hot tap water: Significance and variability. Sci. Total Environ., 651: 1735–1741.
- Lekkas, T.D., Babi, K.G., Koumenides, K.M., Makri, C.A., Lekkas, D.T. et Nikolaou, A.D. (2009). Removal of specific DBPs by GAC in Galatsi WTP, Athens. Global Nest J., 11(3): 349–356.
- Levallois, P., Gingras, S., Marcoux, S., Legay, C., Catto, C., Rodriguez, M. et Tardif, R. (2012). Maternal exposure to drinking-water chlorination by-products and small-for-gestational-age neonates. Epidemiology, 23(2): 267–276.
- Levesque, B., Ayotte, P., LeBlanc, A., Dewailly, E., Prud'Homme, D., Lavoie, R., Allaire, S. et Levallois, P. (1994). Evaluation of dermal and respiratory chloroform exposure in humans. Environ. Health Perspect., 102(12): 1082–1087.
- Levesque, B., Ayotte, P., Tardif, R., Ferron, L., Gingras, S., Schlouch, E., Gingras, G., Levallois, P. et Dewailly, E. (2002). Cancer risk associated with household exposure to chloroform. J. Toxicol. Environ. Health A, 65(7): 489–502.
- Li, J.W., Yu, Z., Cai, X., Gao, M. et Chao, F. (1996). Trihalomethanes formation in water treated with chlorine dioxide. Wat. Res. 30(10): 2371–2376.
- Li, B., Qu, J., Liu, H. et Hu, C. (2007). Effects of copper(II) and copper oxides on THMs formation in copper pipe. Chemosphere, 68(11): 2153–2160.
- Li, T., Jiang, Y., An, X., Liu, H., Hu, C. et Qu, J. (2016). Transformation of humic acid and halogenated byproduct formation in UV-chlorine processes. Water Res., 102: 421–427.
- Li, X.F. et Mitch, W.A. (2018). Drinking water disinfection byproducts (DBPs) and human health effects: Multidisciplinary challenges and opportunities. Environ. Sci. Technol., 52(4): 1681–1689.
- Li, L., Wang, Y., Zhang, W., Yu, S., Wang, X. et Gao, N. (2020a). New advances in fluorescence excitation-emission matrix spectroscopy for the characterization of dissolved organic matter in drinking water treatment: A review. Chem. Eng. J., 381: 122676.
- Li, H., Chen, Y., Zhang, J. et Dong, B. (2020b). Pilot study on nanofiltration membrane in advanced treatment of drinking water. Water Sci. Technol. Water Supply, 20(6): 2043–2053.
- Li, L., Jeon, Y., Ryu, H., Santo Domingo, J.W. et Seo, Y. (2020c). Assessing the chemical compositions and disinfection byproduct formation of biofilms: Application of fluorescence excitation-emission spectroscopy coupled with parallel factor analysis. Chemosphere, 246: 125745.
- Liang, L. et Singer, P.C. (2003). Factors influencing the formation and relative distribution of haloacetic acids and trihalomethanes in drinking water. Environ. Sci. Technol., 37(13): 2920–2928.
- Liao, X., Liu, J., Yang, M., Ma, H., Yuan, B. et Huang, C.H. (2015). Evaluation of disinfection by-product formation potential (DBPFP) during chlorination of two algae species – blue-green Microcystis aeruginosa and diatom Cyclotella meneghiniana. Sci. Total Environ., 532: 540–547.
- Lilly, P.D., Andersen, M.E., Ross, T.M. et Pegram, R.A. (1997). Physiologically based estimation of in vivo rates of bromodichloromethane metabolism. Toxicology, 124(2): 141–152.
- Lilly, P.D., Andersen, M.E., Ross, T.M. et Pegram, R.A. (1998). A physiologically based pharmacokinetic description of the oral uptake, tissue dosimetry, and rates of metabolism of bromodichloromethane in the male rat. Toxicol. Appl. Pharmacol., 150(2): 205–217.
- Linden, K.G. et Dotson, A.D. (2012). UV-based advanced oxidation treatment of pre- and post-GAC contacted water. Water Research Foundation, 4161, Denver, Colorado.
- Lindstrom, A.B., Pleil, J.D. et Berkoff, D.C. (1997). Alveolar breath sampling and analysis to assess trihalomethane exposures during competitive swimming training. Environ. Health Perspect., 105(6): 636–642.
- Liu, B. et Reckhow, D.A. (2013). DBP formation in hot and cold water across a simulated distribution system: Effect of incubation time, heating time, pH, chlorine dose, and incubation temperature. Environ. Sci. Technol., 47(20): 11584-11591.
- Liu, B. et Reckhow, D.A. (2015). Disparity in disinfection byproducts concentration between hot and cold tap water. Water Res., 70: 196–204.
- Liu, Q., Schurter, L.M., Muller, C.E., Aloisio, S., Francisco, J.S. et Margerum, D.W. (2001). Kinetics and mechanisms of aqueous ozone reactions with bromide, sulfite, hydrogen sulfite, iodide, and nitrite ions. Inorg. Chem., 40(17): 4436–4442.
- Liu, S., Zhu, Z., Fan, C., Qiu, Y. et Zhao, J. (2011). Seasonal variation effects on the formation of trihalomethane during chlorination of water from Yangtze River and associated cancer risk assessment. J. Environ. Sci., 23(9): 1503–1511.
- Liu, W., Zhang, Z., Yang, X., Xu, Y. et Liang, Y. (2012a). Effects of UV irradiation and UV/chlorine co-exposure on natural organic matter in water. Sci. Total Environ., 414: 576–584.
- Liu, X., Chen, Z., Wang, L. et Shen, J. (2012b). Effects of metal ions on THMs and HAAs formation during tannic acid chlorination. Chem. Eng. J., 211–212: 179–185.
- Liu, S.G., Zhu, Z.L., Tan, X.C., Feng, X.H., Huang, Z.Y., Qiu, Y.L. et Zhao, J.F. (2013). The influence of Cu(II) on the formation and distribution of disinfection by-products during the chlorination of drinking water. Water Air Soil Pollut., 224(4): 1493.
- Liu, J., Luo, P., Han, L., Sun, Q. et Song, W. (2014). Effect of ozonation on trihalomethane formation potential and trihalomethane species in bromide-containing water. J. Chem. Pharm. Res., 6(1): 524–529.
- Liu, S., Gunawan, C., Barraud, N., Rice, S.A., Harry, E.J. et Amal, R. (2016). Understanding, monitoring, and controlling biofilm growth in drinking water distribution systems. Environ. Sci. Technol., 50(17): 8954–8976.
- Liu, S., Li, Z., Dong, H., Goodman, B.A. et Qiang, Z. (2017). Formation of iodo-trihalomethanes, iodo-acetic acids, and iodo-acetamides during chloramination of iodide-containing waters: Factors influencing formation and reaction pathways. J. Hazard. Mater., 321: 28–36.
- Liu, Z., Lin, Y.L., Xu, B., Hu, C.Y., Wang, A.Q., Gao, Z.C., Xia, S.J. et Gao, N.Y. (2018). Formation of iodinated trihalomethanes during breakpoint chlorination of iodide-containing water. J. Hazard. Mater., 353: 505–513.
- Liu, C., Ersan, M.S., Wagner, E., Plewa, M.J., Amy, G. et Karanfil, T. (2020a). Toxicity of chlorinated algal‑impacted waters: Formation of disinfection byproducts vs. reduction of cyanotoxins. Water Res., 184: 116145.
- Liu, Z., Maren Lompe, K., Mohseni, M., Bérubé, P.R., Sauvé, S. et Barbeau, B. (2020b). Biological ion exchange as an alternative to biological activated carbon for drinking water treatment. Water Res., 168: 115148.
- Liu, Z., Haddad, M., Sauvé, S. et Barbeau, B. (2021a). Review – Alleviating the burden of ion exchange brine in water treatment: From operational strategies to brine management. Water Res., 205: 117728.
- Liu, Z., Xu, B., Zhang, T.Y., Hu, C.Y., Tang, Y.L., Dong, Z.Y., Cao, T.C. et El-Din, M.G. (2021b). Formation of disinfection by-products in a UV-activated mixed chlorine/chloramine system. J. Hazard. Mater., 407: 124373.
- Liu, Z., Mills, E.C., Mohseni, M., Barbeau, B. et Bérubé, P.R. (2022). Biological ion exchange as an alternative to biological activated carbon for natural organic matter removal: Impact of temperature and empty bed contact time (EBCT). Chemosphere, 288: 132466.
- Liu, C., Chen, Y.J., Sun, B., Chen, H.G., Mustieles, V., Messerlian, C., Sun, Y., Meng, T.Q., Lu, W.Q., Pan, X.F., Xiong, C.L., Hou, J. et Wang, Y.X. (2023). Blood trihalomethane concentrations in relation to sperm mitochondrial DNA copy number and telomere length among 958 healthy men. Environ. Res., 216(Pt 4):114737.
- Luben, T.J., Olshan, A.F., Herring, A.H., Jeffay, S., Strader, L., Buus, R.M., Chan, R.L., Savitz, D.A., Singer, P.C., Weinberg, H.S. et Perreault, S.D. (2007). The healthy men study: An evaluation of exposure to disinfection by‑products in tap water and sperm quality. Environ. Health Perspect., 115(8): 1169–1176.
- Ma, J. et Liu, W. (2002). Effectiveness and mechanism of potassium ferrate(VI) preoxidation for algae removal by coagulation. Water Res., 36(4): 871–878.
- Ma, M., Liu, R., Liu, H., Qu, J. et Jefferson, W. (2012). Effects and mechanisms of pre-chlorination on microcystis aeruginosa removal by alum coagulation: Significance of the released intracellular organic matter. Sep. Purif. Technol., 86: 19–25.
- Ma, M., Wang, M., Cao, X., Li, Y. et Gu, J. (2019). Yield of trihalomethane, haloacetic acid and chloral upon chlorinating algae after coagulation-filtration: Is pre-oxidation necessarily negative for disinfection by-product control? J. Hazard. Mater., 364: 762–769.
- MacLehose, R.F., Savitz, D.A., Herring, A.H., Hartmann, K.E., Singer, P.C. et Weinberg, H.S. (2008). Drinking water disinfection by-products and time to pregnancy. Epidemiology, 19(3): 451–458.
- Majidzadeh, H., Uzun, H., Chen, H., Bao, S., Tsui, M.T.K., Karanfil, T. et Chow, A.T. (2020). Hurricane resulted in releasing more nitrogenous than carbonaceous disinfection byproduct precursors in coastal watersheds. Sci. Total Environ., 705: 135785.
- Marais, S.S., Ncube, E.J., Msagati, T.A.M., Mamba, B.B. et Nkambule, T.T.I. (2019). Assessment of trihalomethane (THM) precursors using specific ultraviolet absorbance (SUVA) and molecular size distribution (MSD). J. Water Process Eng., 27: 143–151.
- Marco, E., Lourencetti, C., Grimalt, J.O., Gari, M., Fernandez, P., Font-Ribera, L., Villanueva, C.M. et Kogevinas, M. (2015). Influence of physical activity in the intake of trihalomethanes in indoor swimming pools. Environ. Res., 140: 292–299.
- Markechová, D., Tomková, M. et Sádecká, J. (2013). Fluorescence excitation-emission matrix spectroscopy and parallel factor analysis in drinking water treatment: A review. Pol. J. Environ. Stud., 22(5): 1289–1295.
- Mashau, F., Ncube, E.J. et Voyi, K. (2018). Drinking water disinfection by-products exposure and health effects on pregnancy outcomes: A systematic review. J. Water Health, 16(2): 181–196.
- Mathews, J.M., Troxler, P.S. et Jeffcoat, A.R. (1990). Metabolism and distribution of bromodichloromethane in rats after single and multiple oral doses. J. Toxicol. Environ. Health, 30(1): 15–22.
- Mayer, B.K. et Ryan, D.R. (2019). Impact on disinfection byproducts using advanced oxidation processes for drinking water treatment. Applications of Advanced Oxidation Processes (AOPs) in Drinking Water Treatment. Hdb Env. Chem., 67: 345–386.
- Mazhar, M.A., Khan, N.A., Ahmed, S., Khan, A.H., Hussain, A., Rahisuddin, Changani, F., Yousefi, M., Ahmadi, S. et Vambol, V. (2020). Chlorination disinfection by-products in municipal drinking water – A review. J. Clean. Prod., 273: 123159.
- McDorman, K.S., Chandra, S., Hooth, M.J., Hester, S.D., Schoonhoven, R. et Wolf, D.C. (2003). Induction of transitional cell hyperplasia in the urinary bladder and aberrant crypt foci in the colon of rats treated with individual and a mixture of drinking water disinfection by-products. Toxicol. Pathol., 31(2): 235–242.
- McKnight, D.M., Boyer, E.W., Westerhoff, P.K., Doran, P.T., Kulbe, T. et Andersen, D.T. (2001). Spectrofluorometric characterization of dissolved organic matter for indication of precursor organic material and aromaticity. Limnol. Oceanogr., 46(1): 38–48.
- McKone, T.E. (1993). Linking a PBPK model for chloroform with measured breath concentrations in showers: Implications for dermal exposure models. J. Expo. Anal. Environ. Epidemiol., 3(3): 339–365.
- Méité, L., Fotsing, M. et Barbeau, B. (2015). Efficacy of ozone to reduce chlorinated disinfection by-products in Quebec (Canada) drinking water facilities. Ozone Sci. Eng., 37(3): 294–305.
- Melnick, R.L., Kohn, M.C., Dunnick, J.K. et Leininger, J.R. (1998). Regenerative hyperplasia is not required for liver tumor induction in female B6C3F1 mice exposed to trihalomethanes. Toxicol. Appl. Pharmacol., 148(1): 137–147.
- Metro Vancouver Laboratory (2020). Communication personnelle avec H. Neumann, Vancouver, C.-B..
- Miltner, R.J., Speth, T.F., Richardson, S.D., Krasner, S.W., Weinberg, H.S. et Simmons, J.E. (2008). Integrated disinfection by-products mixtures research: Disinfection of drinking waters by chlorination and ozonation/postchlorination treatment scenarios. J. Toxicol. Environ. Health Part A Curr. Iss., 71(17): 1133–1148.
- Ministère de la Santé du Nunavut (2019). Communication personnelle avec M. LeBlanc, Iqaluit, NU.
- Ministère de l'Environnement de la Nouvelle-Écosse (2019). Communication personnelle avec A. Polegato, , Halifax, N.-É.
Ministère de l'Environnement, de la Protection de la nature et des Parcs de l'Ontario (2019). Communication personnelle avec S. Deshpande, Toronto, ON. - Ministère de l'Environnement et des Gouvernements locaux du Nouveau-Brunswick (2019). Communication personnelle avec K. Gould, Fredericton, N.-B.
- Ministère des Communautés, des Terres et de l'Environnement de l'Île-du-Prince-Édouard (2019). Communication personnelle avec G. Somers, Charlottetown, Î.-P.-É.
Ministère du Développement durable, de l'Environnement et de la Lutte contre les changements climatiques du Québec (2019). Communication personnelle avec P. Cantin, ville de Québec, QC. - Mink, F.L., Brown, T.J. et Rickabaugh, J. (1986). Absorption, distribution, and excretion of 14C-trihalomethanes in mice and rats. Bull. Environ. Contam. Toxicol., 37(5): 752–758.
- Mirzaei, S. et Gorczyca, B. (2020). Removal of trihalomethanes from high organic matter water sources using aeration: A feasibility study. Water Qual. Res. J. Can., 55(2): 184–197.
- MOE (2020). Ministry of the Environment of Ontario. Communication personnelle avec M. Robson, Toronto, ON.
- Mohamed, F.M., El-Deen, F.N. et Abdo, M.H. (2019). Environmental hazardous optimization of chlorine disinfectant by-products of drinking water: Plants and distribution system “case study.” Egypt. J. Aquat. Biol. Fish., 23(5 Special Issue): 393–403.
- Munson, A.E., Sain, L.E., Sanders, V.M., Kauffmann, B.M., White Jr, K.L., Page, D.G., Barnes, D.W. et Borzelleca, J.F. (1982). Toxicology of organic drinking water contaminants: Trichloromethane, bromodichloromethane, dibromochloromethane and tribromomethane. Environ. Health Perspect., 46: 117–126.
- Murphy, K.R., Stedmon, C.A., Graeber, D. et Bro, R. (2013). Fluorescence spectroscopy and multi-way techniques. PARAFAC. Anal. Methods, 5: 6557–6566.
- Murray, F.J., Schwetz, B.A., McBride, J.G. et Staples, R.E. (1979). Toxicity of inhaled chloroform in pregnant mice and their offspring. Toxicol. Appl. Pharmacol., 50(3): 515–522.
- Nagano, K., Kano, H., Arito, H., Yamamoto, S. et Matsushima, T. (2006). Enhancement of renal carcinogenicity by combined inhalation and oral exposures to chloroform in male rats. J. Toxicol. Environ. Health A, 69(20): 1827–1842.
- Narotsky, M.G., Pegram, R.A. et Kavlock, R.J. (1997). Effect of dosing vehicle on the developmental toxicity of bromodichloromethane and carbon tetrachloride in rats. Fundam. Appl. Toxicol., 40(1): 30–36.
- Narotsky, M.G., Best, D.S., McDonald, A., Godin, E.A., Hunter 3rd, E.S., et Simmons, J.E. (2011). Pregnancy loss and eye malformations in offspring of F344 rats following gestational exposure to mixtures of regulated trihalomethanes and haloacetic acids. Reprod. Toxicol., 31(1): 59–65.
- Narotsky, M.G., Klinefelter, G.R., Goldman, J.M., DeAngelo, A.B., Best, D.S., McDonald, A., Strader, L.F., Murr, A.S., Suarez, J.D., George, M.H., Hunter, E.S. et Simmons, J.E. (2015). Reproductive toxicity of a mixture of regulated drinking-water disinfection by-products in a multigenerational rat bioassay. Environ. Health Perspect., 123(6): 564–570.
- Nasseri, S., Samadi, M.T., Alizadeh Fard, M.R. et Mesdaghinia, A.R. (2004). Comparison of nanofiltration and GAC adsorption processes for chloroform removal from drinking water. Iran. J. Public Health, 33(3): 47–53.
- Navalon, S., Alvaro, M. et Garcia, H. (2009). Ca2+ and Mg2+ present in hard waters enhance trihalomethane formation. J. Hazard. Mater., 169(1-3): 901–906.
- NCI (1976). Report on carcinogenesis bioassay of chloroform. National Cancer Institute, National Institute of Health, NTIS PB-264018, Bethesda, Maryland.
- NCI (1978). Bioassay of iodoform for possible carcinogenicity. National Cancer Institute, National Institute of Health, Technical Report Series No. 110. NCI-CG-TR-110, Bethesda, Maryland.
- Neil, C.W., Zhao, Y., Zhao, A., Neal, J., Meyer, M. et Yang, Y.J. (2019). Trihalomethane precursor reactivity changes in drinking water treatment unit processes during a storm event. Water Sci. Technol. Water Supply, 19(7): 2098–2106.
- Newfoundland and Labrador Department of Municipal Affairs and Environment (2019). Communication personnelle avec H. Khan, St. John's, T.-N.-L.
- NHMRC, NRMMC (2011). National water quality management strategy. Australian drinking water guidelines 6. Version 3.8 updated September 2022. National Health and Medical Research Council, National Resource Management Ministerial Council, Commonwealth of Australia, Canberra, Australie. Disponible à : https://www.Nhmrc.Gov.au/about-us/publications/australian-Drinking-Water-Guidelines
- Nieuwenhuijsen, M.J., Martinez, D., Grellier, J., Bennett, J., Best, N., Iszatt, N., Vrijheid, M. et Toledano, M.B. (2009). Chlorination disinfection by-products in drinking water and congenital anomalies: Review and meta‑analyses. Environ. Health Perspect., 117(10): 1486–1493.
- NSF International. (2022a). NSF/ANSI Standard 53: Drinking water treatment units – health effects. NSF International/American National Standards Institute. NSF International, Ann Arbor, Michigan.
- NSF International. (2022b). NSF/ANSI Standard 58: Reverse osmosis drinking water treatment systems. NSF International/American National Standards Institute. NSF International, Ann Arbor, Michigan.
- NSF International. (2022c). NSF/ANSI Standard 55: Ultraviolet microbiological water treatment systems. NSF International/American National Standards Institute. NSF International, Ann Arbor, Michigan.
- NTP (1985). Toxicology and carcinogenesis studies of chlorodibromomethane (CAS No. 124-48-1) in F344/N rats and B6C3F1 mice (Gavage studies). National Toxicology Program, National Institute of Environmental Health Sciences, NTP TR 282, Research Triangle Park, Caroline du Nord.
- NTP (1987). Toxicology and carcinogenesis studies of bromodichloromethane (CAS No. 75-27- 4) in F344/N rats and B6C3F1 mice (gavage studies). National Toxicology Program, National Institute of Environmental Health Sciences, NTP Technical Report Series No. 321, Research Triangle Park, Caroline du Nord.
- NTP (1988). Chloroform: reproduction and fertility assessment in CD-1 mice when administered by gavage. National Toxicology Program, National Institute of Environmental Health Sciences, Report No. NTP-89-018, Research Triangle Park, Caroline du Nord.
- NTP (1989a). Toxicology and carcinogenesis studies of tribromomethane (bromoform) (CAS No. 75-25-2) in F344/N rats and B6C3F1 mice (gavage studies). National Toxicology Program, National Institute of Environmental Health Sciences, NTP Technical Report Series No. 350, Research Triangle Park, Caroline du Nord.
- NTP (1989b). Bromoform: Reproduction and fertility assessment in Swiss CD-1 mice when administered by gavage. National Toxicology Program, National Institute of Environmental Health Sciences, NTP-89-068, Research Triangle Park, Caroline du Nord.
- NTP (1996). Final Report on the short term reproductive and developmental toxicity of chlorodibromomethane (CAS No. 124-48-1) administered in drinking water to Sprague-Dawley rats. National Toxicology Program, National Institute of Environmental Health Sciences, Report by R.O.W. Sciences, Inc., Gaithersburg, Maryland. Pub No. NTIS/PB97-111728, Research Triangle Park, Caroline du Nord.
- NTP (1998). Final Report on the short-term reproductive and developmental toxicity of bromodichloromethane (CAS No. 75-27-4) administered in drinking water to Sprague-Dawley rats. National Toxicology Program, National Institute of Environmental Health Sciences, Pub no. NTIS/PB99-111262, Research Triangle Park, Caroline du Nord.
- NTP (2006). Toxicology and carcinogenesis studies of bromodichloromethane (CAS no. 75-27- 4) in male F344/N rats and female B6C3F1 mice (drinking water studies). National Toxicology Program, National Institute of Environmental Health Sciences, Publication No. 06-4468, Research Triangle Park, Caroline du Nord.
- NTP (2007). Toxicology studies of bromodichloromethane (CAS no. 75-27-4) in genetically modified (FVB tg.AC hemizygous) mice (dermal, drinking water, and gavage studies) and carcinogenicity studies of bromodichloromethane in genetically modified [B6.129-Trp53(tm1Brd) (N5) haploinsufficient] mice (drinking water and gavage studies). NTP Genet. Modif. Model. Rep., 5: 1–227.
- OEHHA (2007). Proposed chemical for DARTIC consideration: Bromodichloromethane. California Environmental Protection Agency, Office of Environmental Health Hazard Assessment, Sacramento, Californie.
- OEHHA (2020). Public Health Goals for Trihalomethanes in Drinking Water: Chloroform, Bromoform, Bromodichloromethane, Dibromochloromethane. California Environmental Protection Agency, Office of Environmental Health Hazard Assessment, Sacramento, Californie.
- Ohsawa, N., Ogata, Y., Okada, N. et Itoh, N. (2001). Physiological function of bromoperoxidase in the red marine alga, Corallina pilulifera: Production of bromoform as an allelochemical and the simultaneous elimination of hydrogen peroxide. Phytochemistry, 58(5): 683–692.
- OMS (2004). Concise International Chemical Assessment Document 58. Chloroform (non disponible en français). Organisation mondiale de la Santé, Programme international sur la sécurité des substances chimique, Genève, Suisse.
- OMS (2005). Trihalomethanes in drinking-water. Background document for development of WHO guidelines for drinking-water quality (non disponible en français). Organisation mondiale de la Santé. WHO/SDE/WSH/05.08/64, Genève, Suisse.
- OMS (2012). Planifier la gestion de la sécurité sanitaire de l'eau pour l'approvisionnement en eau des petites communautés. Organisation mondiale de la Santé, Genève, Suisse.
- OMS (2017a). Chemical Mixtures in Source Water and Drinking-Water (non disponible en français). Organisation mondiale de la Santé, Licence : CC BY-NC-SA 3.0 IGO, Genève, Suisse.
- OMS (2017b). Directives sur la qualité de l'eau de boisson: Quatrième édition intégrant le premier additif. Genève, Suisse.
- Özdemir, K., Toröz, İ, Uyak, V. (2013). Assessment of trihalomethane formation in chlorinated raw waters with differential UV spectroscopy approach, Sci. World J., 890854.
- Palmer, A.K., Street, A.E., Roe, F.J., Worden, A.N. et Van Abbe, N.J. (1979). Safety evaluation of toothpaste containing chloroform. II. Long term studies in rats. J. Environ. Pathol. Toxicol., 2(3): 821–833.
- Pardakhti, A.R., Bidhendi, G.R., Torabian, A., Karbassi, A. et Yunesian, M. (2011). Comparative cancer risk assessment of THMs in drinking water from well water sources and surface water sources. Environ. Monit. Assess., 179(1–4): 499–507.
- Pearce, R.G., Setzer, R.W., Strope, C.L., Wambaugh, J.F. et Sipes, N.S. (2017). Httk: R package for high‑throughput toxicokinetics. J. Stat. Softw., 79(4): 1–26.
- Pegram, R.A., Andersen, M.E., Warren, S.H., Ross, T.M. et Claxton, L.D. (1997). Glutathione S-transferase-mediated mutagenicity of trihalomethanes in Salmonella typhimurium: Contrasting results with bromodichloromethane off chloroform. Toxicol. Appl. Pharmacol., 144(1): 183–188.
- Peleato, N.M., Legge, R.L. et Andrews, R.C. (2017). Continuous organic characterization for biological and membrane filter performance monitoring. J. Am. Water Works Assoc., 109(4): E86–E98.
- Pennino, M.J., Leibowitz, S.G., Compton, J.E., Beyene, M.T. et LeDuc, S.D. (2022). Wildfires can increase regulated nitrate, arsenic, and disinfection byproduct violations and concentrations in public drinking water supplies, Sci. Total Environ., 149890.
- Pereira, M.A. et Grothaus, M. (1997). Chloroform in drinking water prevents hepatic cell proliferation induced by chloroform administered by gavage in corn oil to mice. Fundam. Appl. Toxicol., 37(1): 82–87.
- Pereira, M.A., Wang, W., Kramer, P.M. et Tao, L. (2004). DNA hypomethylation induced by non-genotoxic carcinogens in mouse and rat colon. Cancer Lett., 212(2): 145–151.
- Pernitsky, D.J. (2003). Coagulation 101. Dans : Proceedings of the Technology Transfer Conference, University of Calgary, Alberta, Canada, 5257–5269.
- PISC (2000). Disinfectants and disinfection by-products. Environmental Health Criteria 216 (non disponible en français), Programme international sur la sécurité des substances chimiques, Organisation mondiale de la Santé, Genève, Suisse.
- Pivokonsky, M., Safarikova, J., Bubakova, P. et Pivokonska, L. (2012). Coagulation of peptides and proteins produced by microcystis aeruginosa: Interaction mechanisms and the effect of Fe-peptide/protein complexes formation. Water Res., 46(17): 5583–5590.
- Pivokonsky, M., Naceradska, J., Kopecka, I., Baresova, M., Jefferson, B., Li, X. et Henderson, R.K. (2016). The impact of algogenic organic matter on water treatment plant operation and water quality: A review. Crit. Rev. Environ. Sci. Technol., 46(4): 291–335.
- Pleil, J.D. et Lindstrom, A.B. (1997). Exhaled human breath measurement method for assessing exposure to halogenated volatile organic compounds. Clin. Chem., 43(5): 723–730.
- Plewa, M.J. et Wagner, E.D. (2009). Mammalian Cell Cytotoxicity and Genotoxicity of Disinfection by-Products. Water Research Foundation, Denver, Colorado.
- Plummer, J.D. et Edzwald, J.K. (2001). Effect of ozone on algae as precursors for trihalomethane and haloacetic acid production. Environ. Sci. Technol., 35(18): 3661–3668.
- Plummer, J.D. et Edzwald, J.K. (2002). Effects of chlorine and ozone on algal cell properties and removal of algae by coagulation. J. Water Supply Res. Technol. Aqua, 51(6): 307–318.
- Plummer, J.L., Hall, P.M., Ilsley, A.H., Jenner, M.A. et Cousins, M.J. (1990). Influence of enzyme induction and exposure profile on liver injury due to chlorinated hydrocarbon inhalation. Pharmacol. Toxicol., 67(4): 329–335.
- Poon, P.K. et Kinoshita, A.M. (2018). Spatial and temporal evapotranspiration trends after wildfire in semi-arid landscapes. J. Hydrol., 559: 71–83.
- Postigo, C., Richardson, S.D. et Barceló, D. (2017). Formation of iodo-trihalomethanes, iodo-haloacetic acids, and haloacetaldehydes during chlorination and chloramination of iodine containing waters in laboratory controlled reactions. Water treatment and disinfection by-products. J. Environ. Sci., 58: 127–134.
- Postigo, C., Emiliano, P., Barceló, D. et Valero, F. (2018). Chemical characterization and relative toxicity assessment of disinfection byproduct mixtures in a large drinking water supply network. J. Hazard. Mater., 359: 166–173.
- Price, K., Haddad, S. et Krishnan, K. (2003). Physiological modeling of age-specific changes in the pharmacokinetics of organic chemicals in children. J. Toxicol. Environ. Health A, 66(5): 417–433.
- Qi, J., Lan, H., Liu, R., Miao, S., Liu, H. et Qu, J. (2016). Prechlorination of algae-laden water: The effects of transportation time on cell integrity, algal organic matter release, and chlorinated disinfection byproduct formation. Water Res., 102: 221–228.
- Reckhow, D.A. et Singer, P.C. (2011). Formation and control of disinfection by-products. Ch. 19 dans: Edzwald, J.K. (ed.). Water quality and treatment: A handbook of community water supplies. 6th edition. McGraw-Hill, New York, New York.
- Reckhow, D.A., Singer, P.C. and Malcolm, R.L. (1990). Chlorination of humic materials: Byproduct formation and chemical interpretations. Environ. Sci. Technol., 24(11): 1655–1664.
- Reddy, B.S. (1987). Dietary fiber and colon cancer: Animal model studies. Prev. Med., 16(4): 559–565.
- Reuber, M.D. (1979). Carcinogenicity of chloroform. Environ. Health Perspect., 31: 171–182.
- Richardson, S.D. (2003). Disinfection by-products and other emerging contaminants in drinking water. Trends Anal. Chem., 22(10): 666–684.
- Richardson, S.D., Plewa, M.J., Wagner, E.D., Schoeny, R. et Demarini, D.M. (2007). Occurrence, genotoxicity, and carcinogenicity of regulated and emerging disinfection by-products in drinking water: A review and roadmap for research. Mutat. Res., 636(1–3): 178–242.
- Richardson, S.D., Fasano, F., Ellington, J.J., Crumley, F.G., Buettner, K.M., Evans, J.J., Blount, B.C., Silva, L.K., Waite, T.J., Luther, G.W., Mckague, A.B., Miltner, R.J., Wagner, E.D. et Plewa, M.J. (2008). Occurrence and mammalian cell toxicity of iodinated disinfection byproducts in drinking water. Environ. Sci. Technol., 42(22): 8330–8338.
- Ritson, J.P., Graham, N.J.D., Templeton, M.R., Clark, J.M., Gough, R. et Freeman, C. (2014). The impact of climate change on the treatability of dissolved organic matter (DOM) in upland water supplies: A UK perspective. Sci. Total Environ., 473-474: 714–30.
- Rivera-Núñez, Z. et Wright, J.M. (2013). Association of brominated trihalomethane and haloacetic acid exposure with fetal growth and preterm delivery in Massachusetts. J. Occup. Environ. Med., 55(10): 1125–1134.
- Rivera-Núñez, Z., Wright, J.M. et Meyer, A. (2018). Exposure to disinfectant byproducts and the risk of stillbirth in Massachusetts. Occup. Environ. Med., 75(10): 742–751.
- Roe, F.J., Palmer, A.K., Worden, A.N. et Van Abbe, N.J. (1979). Safety evaluation of toothpaste containing chloroform. I. Long-term studies in mice. J. Environ. Pathol. Toxicol., 2(3): 799–819.
- Roldan-Arjona, T. et Pueyo, C. (1993). Mutagenic and lethal effects of halogenated methanes in the Ara test of Salmonella typhimurium: Quantitative relationship with chemical reactivity. Mutagenesis, 8(2): 127–131.
- Roccaro, P. and Vagliasindi, F.G.A. (2009). Differential vs. absolute UV absorbance approaches in studying NOM reactivity in DBPs formation: Comparison and applicability, Water Res., 43: 744–750.
- Roccaro, P., Korshin, G.V., Cook, D., Chow, C.W.K. et Drikas, M. (2014). Effects of pH on the speciation coefficients in models of bromide influence on the formation of trihalomethanes and haloacetic acids. Water Res., 62: 117–126.
- Rodriguez, M.J. et Sérodes, J.B. (2001). Spatial and temporal evolution of trihalomethanes in three water distribution systems. Water Res., 35(6): 1572–1586.
- Rodriguez, M.J., Sérodes, J.B. et Levallois, P. (2004). Behavior of trihalomethanes and haloacetic acids in a drinking water distribution system. Water Res., 38(20): 4367–4382.
- Ross, M.K. et Pegram, R.A. (2003). Glutathione transferase theta 1-1-dependent metabolism of the water disinfection byproduct bromodichloromethane. Chem. Res. Toxicol., 16(2): 216–226.
- Ross, M.K. et Pegram, R.A. (2004). In vitro biotransformation and genotoxicity of the drinking water disinfection byproduct bromodichloromethane: DNA binding mediated by glutathione transferase theta 1-1. Toxicol. Appl. Pharmacol., 195(2): 166–181.
- RPC (2020). Communication personnelle avec B. Phillips, Fredericton, N.-B.
- Ruddick, J.A., Villeneuve, D.C., Chu, I. et Valli, V.E. (1983). A teratological assessment of four trihalomethanes in the rat. J. Environ. Sci. Health B., 18(3): 333–349.
- Ruecker, A., Uzun, H., Karanfil, T., Tsui, M.T.K. et Chow, A.T. (2017). Disinfection byproduct precursor dynamics and water treatability during an extreme flooding event in a coastal blackwater river in southeastern United States. Chemosphere, 188: 90–98.
- Sanchez, N.P., Skeriotis, A.T. et Miller, C.M. (2013). Assessment of dissolved organic matter fluorescence PARAFAC components before and after coagulation-filtration in a full scale water treatment plant. Water Res. 47(4): 1679–1690.
- Santé Canada (1994). Loi Canadienne sur la protection de l'environnement. L'évaluation du risqué à la santé humaine des substances d'intérêt prioritaire. Ottawa, Ontario.
- Santé Canada (2008a). Observations et recommandations découlant de la rencontre du groupe d'experts sur le BDCM du 22 et 23 septembre, 2008. Ottawa, Ontario (Disponible sur demande).
- Santé Canada (2008b). Recommandations pour la qualité de l'eau potable au Canada: document technique – Le chlorite et le chlorate. Bureau de la qualité de l'eau et de l'air, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Catalogue No. H128-1/08-549F, Ottawa, Ontario.
- Santé Canada (2011). Recommandations pour la qualité de l'eau potable au Canada: document technique – N-nitrosodiméthylamine. Bureau de la qualité de l'eau et de l'air, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Catalogue No. H128-1/11-662F, Ottawa, Ontario.
- Santé Canada (2017). Étude nationale sur l'eau potable. Communication personnelle avec Anca-Maria Tugulea, Bureau de la science et de la recherche en santé environnementale, Ottawa, Ontario.
- Santé Canada (2018). Recommandations pour la qualité de l'eau potable au Canada: document technique – Le bromate. Bureau de la qualité de l'eau et de l'air, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Catalogue No. H144-37/2017F-PDF, Ottawa, Ontario.
- Santé Canada (2019a). Cinquième rapport sur la biosurveillance humaine des substances chimiques de l'environnement au Canada. Ministre de la Santé, Ottawa, Ontario. Disponible à : https://www.canada.ca/fr/sante-canada/services/sante-environnement-milieu-travail/rapports-publications/contaminants-environnementaux/cinquieme-rapport-biosurveillance-humaine.html
- Santé Canada (2019b). Recommandations pour la qualité de l'eau potable au Canada: document technique – Le cuivre. Bureau de la qualité de l'eau et de l'air, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Catalogue No. H144-13/13-2019F-PDF, Ottawa, Ontario.
- Santé Canada (2020a). Conseils sur la matière organique naturelle dans l'eau potable. Bureau de la qualité de l'eau et de l'air, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Catalogue No. H144-67/2020F-PDF, Ottawa, Ontario.
- Santé Canada (2020b). Recommandations pour la qualité de l'eau potable au Canada: document technique – chloramines. Bureau de la qualité de l'eau et de l'air, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Catalogue No. H144-13/15-2019F-PDF, Ottawa, Ontario.
- Santé Canada (2020c). Recommandations pour la qualité de l'eau potable au Canada: document technique – Escherichia coli. Bureau de la qualité de l'eau et de l'air, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Catalogue No. H129-27/2020F-PDF, Ottawa, Ontario.
- Santé Canada (2021a). Quantitative in vitro to in vivo extrapolation of iodinated chemicals using high throughput toxicokinetics. Ottawa, Ontario (Disponible sur demande).
- Santé Canada (2021b). Facteurs d'exposition utilisés dans les évaluations des risques pour la santé humaine au Canada. Fiches de renseignements. Ottawa, Ontario. Disponible à : https://www.canada.ca/fr/sante-canada/services/substances-chimiques/fiches-renseignements/facteurs-exposition-evaluations-risques-sante-humaine-canada.html
- Santé Canada (2021c). Méthode d'évaluation des risques de cancer: Un sondage sur les pratiques actuelles à Santé Canada. Préparé par le Groupe de travail sur l'évaluation des risques scientifiques (GTERS). Ottawa, Ontario. Disponible à : https://www.canada.ca/fr/sante-canada/services/publications/science-recherche-et-donnees/methode-evaluation-risques-cancer-sondage-pratiques-actuelles.html
- Santé Canada (2022a). Conseils sur la surveillance de la stabilité biologique de l'eau potable dans les réseaux de distribution. Bureau de la qualité de l'eau et de l'air. Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Catalogue No. H144-96/2022F-PDF, Ottawa, Ontario.
- Santé Canada (2022b). Document de conseils sur l'échantillonnage et les mesures d'intervention pour le contrôle de la corrosion: orientations sur la consultation publique. Bureau de la qualité de l'eau et de l'air. Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa, Ontario.
- Sarathy, S.R., Stefan, M.I., Royce, A. et Mohseni, M. (2011). Pilot-scale UV/H2O2 advanced oxidation process for surface water treatment and downstream biological treatment: Effects on natural organic matter characteristics and DBP formation potential. Environ. Technol., 32(15): 1709–1718.
- Saskatchewan Water Security Agency (2019). Communication personnelle avec S. Ferris, Saskatoon, SK.
- Sasso, A.F., Schlosser, P.M., Kedderis, G.L., Genter, M.B., Snawder, J.E., Li, Z., Rieth, S. et Lipscomb, J.C. (2013). Application of an updated physiologically based pharmacokinetic model for chloroform to evaluate CYP2E1-mediated renal toxicity in rats and mice. Toxicol. Sci., 131(2): 360–374.
- Säve-Söderbergh, M., Toljander, J., Donat-Vargas, C., Berglund, M. et Åkesson, A. (2020). Exposure to drinking water chlorination by-products and fetal growth and prematurity: A nationwide register-based prospective study. Environ. Health Perspect., 128(5): 57006.
- Säve-Söderbergh, M., Toljander, J., Donat-Vargas, C. et Åkesson, A. (2021). Drinking water disinfection by-products and congenital malformations: a Nationwide register-based prospective study. Environ. Health Perspect. 129(9): 097012.
- Scheili, A., Rodriguez, M.J. et Sadiq, R. (2015). Seasonal and spatial variations of source and drinking water quality in small municipal systems of two Canadian regions. Sci. Total Environ., 508: 514–524.
- Schneider, O.D., LeChevallier, M.W., Yang, J., Hughes, D.M. et Reed, H. (2015). Localized control of disinfection by-products by spray stripping in storage tanks. Water Research Foundation and American Water, 4413, Denver, Colorado et Voorhees, New Jersey.
- Schock, M. et Lytle, D. (2011). Internal corrosion and deposition control. Ch. 20 dans : J.K. Edzwald (ed.). Water quality and treatment: a handbook on drinking water, 6th edition. McGraw Hill and American Water Works Association, Denver, Colorado.
- Schoeny, R., Haber, L. et Dourson, M. (2006). Data considerations for regulation of water contaminants. Toxicology, 221(2-3): 217–224.
- Schwetz, B.A., Leong, B.K. et Gehring, P.J. (1974). Embryo- and fetotoxicity of inhaled chloroform in rats. Toxicol. Appl. Pharmacol., 28(3): 442–451.
- Seidel, C.J., Samson, C.C., Bartrand, T., Ergul, A. et Summers, R.S. (2017). Disinfection byproduct occurrence at large water systems after stage 2 DBPR. J. Am. Water Works Assoc., 109(7): 17–30.
- Services aux Autochtones Canada (2019). Communication personnelle avec X. Redhead, Ottawa, Ontario.
- Shi, X., Bi, R., Yuan, B., Liao, X., Zhou, Z., Li, F. et Sun, W. (2019). A comparison of trichloromethane formation from two algae species during two pre-oxidation-coagulation-chlorination processes. Sci. Total Environ., 656: 1063–1070.
- Silva, L.K., Bonin, M.A., McKague, B. et Blount, B.C. (2006). Quantification of dichloroiodomethane and bromochloroiodomethane in human blood by solid-phase microextraction coupled with gas chromatography-high‑resolution mass spectrometry. J. Anal. Toxicol., 30(9): 670–678.
- Silva, L.K., Backer, L.C., Ashley, D.L., Gordon, S.M., Brinkman, M.C., Nuckols, J.R., Wilkes, C.R. et Blount, B.C. (2013). The influence of physicochemical properties on the internal dose of trihalomethanes in humans following a controlled showering exposure. J. Expo. Sci. Environ. Epidemiol., 23(1): 39–45.
- Siu, I.M., Pretlow, T.G., Amini, S.B. et Pretlow, T.P. (1997). Identification of dysplasia in human colonic aberrant crypt foci. Am. J. Pathol., 150(5): 1805–1813.
- Sketchell, J., Peterson, H.G. et Christofi, N. (1995). Disinfection by-product formation after biologically assisted GAC treatment of water supplies with different bromide and DOC content. Water Res., 29(12): 2635–2642.
- Skwaruk, J.S., Emelko, M.B., Silins, U. et Stone, M. (2020). Treatment of severely-deteriorated post-fire runoff: A comparison of conventional and high-rate clarification to demonstrate key drinking water treatment capabilities and challenges. Disponible à : https://chemrxiv.org/engage/chemrxiv/article-details/60c752cabdbb890298a3a360
- Smeets, P.W.M.H., Medema, G.J. et Van Dijk, J.C. (2009). The Dutch secret: How to provide safe drinking water without chlorine in the Netherlands. Drink. Water Eng. Sci., 2(1): 1–14.
- Smith, C., Cragg, S., Wolfe, G. et Weigel, W. (1985). Investigation of the Metabolism of Chlorinated Hydrocarbons in Subhuman Species. U.S. Environmental Protection Agency, Office of Research and Development, EPA600l85001. PB85152387, Research Triangle Park, Caroline du Nord.
- Smith, E.M., Plewa, M.J., Lindell, C.L., Richardson, S.D. et Mitch, W.A. (2010). Comparison of byproduct formation in waters treated with chlorine and iodine: Relevance to point-of-use treatment. Environ. Sci. Technol., 44(22): 8446–8452.
- Speth, T.F. et Miltner, R.J. (1998). Technical note: Adsorption capacity of GAC for synthetic organics. 90(4): 171.
- Speitel Jr., G.E., Bayer, B.M. et Kannappan, R. (2010). Significance of trihalomethanes in preventing distribution system nitrification in chloraminated waters. Water Research Foundation, Denver, Colorado.
- Spiteri, N.J. (1982). Circadian patterning of feeding, drinking and activity during diurnal food access in rats. Physiol. Behav., 28(1): 139–147.
- SRC Environmental Analytical Laboratories (2020). Communication personnelle avec J. Zimmer, Saskatoon, SK.
- Srivastav, A.L., Patel, N. et Chaudhary, V.K. (2020). Disinfection by-products in drinking water: Occurrence, toxicity and abatement. Environ. Pollut., 267: 115474.
- Stalter, D., O'Malley, E., von Gunten, U. et Escher, B.I. (2016). Fingerprinting the reactive toxicity pathways of 50 drinking water disinfection by-products. Water Res., 91: 19–30.
- Statistique Canada (2015). Guide de l'utilisateur des données de l'Enquête canadienne sur les mesures de la santé (ECMS) : cycle 3. Ottawa, Ontario. Disponible sur demande (infostats@canada.ca).
- Statistique Canada (2015). Guide de l'utilisateur des données de l'Enquête canadienne sur les mesures de la santé (ECMS) : cycle 4. Ottawa, Ontario. Disponible sur demande (infostats@canada.ca).
- Stefán, D., Erdélyi, N., Izsák, B., Záray, G. et Vargha, M. (2019). Formation of chlorination by-products in drinking water treatment plants using breakpoint chlorination. Microchem J., 149: 1–8.
- Stevens, A.A., Slocum, C.J., Seeger, D.R. et Robeck, G.G. (1976). Chlorination of organics in drinking water. J. Am. Water Works Assoc., 68: 615.
- Stoddart, A.K. et Gagnon, G.A. (2014). Application of photoelectrochemical chemical oxygen demand to drinking water. J. Am. Water Works Assoc., 106(9): E383–E390.
- Summers, R.S., Benz, M.A., Shukairy, H.M. et Cummings, L. (1993). Effect of separation processes on the formation of brominated THMs. J. Am. Water Works Assoc., 85(1): 88–95.
- Summers, R.S., Hooper, S.M., Shukairy, H.M., Solarik, G. et Owen, D. (1996). Assessing DBP yield: Uniform formation conditions. J. Am. Water Works Assoc., (June): 80–93.
- Symons, J.M., Stevens, A.A., Clark, R.M., Geldreich, E.E., Love Jr., O.T. et DeMarco, J. (1981). Treatment techniques for controlling trihalomethanes in drinking water. U.S. EPA Drinking Water Research Division, Municipal Environmental Research Laboratory, Office of Research and Development, EPA/600/2-81/156, Cincinnati, Ohio.
- Symons, J.M., Krasner, S.W., Simms, L.A. et Sclimenti, M. (1993). Measurement of THM and precursor concentrations revisited: The effect of bromide ion. J. Am. Water Works Assoc., 85(1): 51–62.
- Ta, N., Li, C., Wang, Y. et An, W. (2020). Effects of ions on THM formation during chlorination of bromide‑containing water. Water Air Soil Pollut., 231(8): 427.
- Take, M., Yamamoto, S., Ohnishi, M., Matsumoto, M., Nagano, K., Hirota, T. et Fukushima, S. (2010). Chloroform distribution and accumulation by combined inhalation plus oral exposure routes in rats. J. Environ. Sci. Health. A. Tox. Hazard. Subst. Environ. Eng., 45(12): 1616–1624.
- Takaro, T., Enright, P., Waters, S., Galway, L., Brubacher, J., Galanis, E., McIntyre, L., Cook, C., Dunn G., Fleury, M.D., Smith, B. et Kosatsky, T. (2022). Qualité, quantité et sécurité de l'eau. Dans : P. Berry et R. Schnitter (éds.) La santé des Canadiens et Canadiennes dans un climat en changement : Faire progresser nos connaissances pour agir. Ottawa, Ontario, Gouvernement du Canada.
- Tan, Y.M., Liao, K.H., Conolly, R.B., Blount, B.C., Mason, A.M. et Clewell, H.J. (2006). Use of a physiologically based pharmacokinetic model to identify exposures consistent with human biomonitoring data for chloroform. J. Toxicol. Environ. Health A, 69(18): 1727–1756.
- Tao, L., Wang, W., Li, L., Kramer, P.K. et Pereira, M.A. (2005). DNA hypomethylation induced by drinking water disinfection by-products in mouse and rat kidney. Toxicol. Sci., 87(2): 344–352.
- Teixido, E., Pique, E., Gonzalez-Linares, J., Llobet, J.M. et Gomez-Catalan, J. (2015). Developmental effects and genotoxicity of 10 water disinfection by-products in zebrafish. J. Water. Health., 13(1): 54–66.
- Templin, M.V., Larson, J.L., Butterworth, B.E., Jamison, K.C., Leininger, J.R., Mery, S., Morgan, K.T., Wong, B.A. et Wolf, D.C. (1996). A 90-day chloroform inhalation study in F-344 rats: Profile of toxicity and relevance to cancer studies. Fundam. Appl. Toxicol., 32(1): 109–125.
- Templin, M.V., Constan, A.A., Wolf, D.C., Wong, B.A. et Butterworth, B.E. (1998). Patterns of chloroform-induced regenerative cell proliferation in BDF1 mice correlate with organ specificity and dose-response of tumor formation. Carcinogenesis, 19(1): 187–193.
- Theiss, J.C., Stoner, G.D., Shimkin, M.B. et Weisburger, E.K. (1977). Test for carcinogenicity of organic contaminants of United States drinking waters by pulmonary tumor response in strain A mice. Cancer Res., 37(8 Pt 1): 2717–2720.
- Thompson, D.J., Warner, S.D. et Robinson, V.B. (1974). Teratology studies on orally administered chloroform in the rat and rabbit. Toxicol. Appl. Pharmacol., 29: 348–357.
- Thornton-Manning, J.R., Seely, J.C. et Pegram, R.A. (1994). Toxicity of bromodichloromethane in female rats and mice after repeated oral dosing. Toxicology, 94(1–3): 3–18.
- Tian, C., Liu, R., Guo, T., Liu, H., Luo, Q. et Qu, J. (2013). Chlorination and chloramination of high-bromide natural water: DBPs species transformation. Sep. Purif. Technol., 102: 86–93.
- Tobe, M., Suzuki, Y., Aida, K., Yoshimoto, H. et al. (1982). Studies on the chronic oral toxicity of tribromomethane, dibromochloromethane and bromodichloromethane. Unpublished intraagency report to the National Institute of Hygienic Sciences, Tokyo Medical and Dental University. Tokyo, Japon (citée dans OEHHA, 2020).
- Tomperi, J., Juuso, E. et Leiviskä, K. (2016). Early warning of changing drinking water quality by trend analysis. J. Water Health, 14(3): 433–442.
- Torkelson, T.R., Oyen, F. et Rowe, V.K. (1976). The toxicity of chloroform as determined by single and repeated exposure of laboratory animals. Am. Ind. Hyg. Assoc. J., 37(12): 697–705.
- Tubić, A., Agbaba, J., Dalmacija, B., Perović, S.U., Klašnja, M., Rončević, S. et Ivančev-Tumbas, I. (2011). Removal of natural organic matter from groundwater using advanced oxidation processes at a pilot scale drinking water treatment plant in the central Banat region (Serbia). Ozone Sci. Eng., 33(4): 267–278.
- Tugulea, A.M., Aranda-Rodriguez, R., Bérubé, D., Giddings, M., Lemieux, F., Hnatiw, J., Dabeka, L. et Breton, F. (2018). The influence of precursors and treatment process on the formation of iodo-THMs in Canadian drinking water. Water Res., 130: 215–223.
- Tumasonis, C.F., McMartin, D.N. et Bush, B. (1985). Lifetime toxicity of chloroform and bromodichloromethane when administered over a lifetime in rats. Ecotoxicol. Environ. Saf., 9(2): 233–240.
- Tumasonis, C.F., McMartin, D.N. et Bush, B. (1987). Toxicity of chloroform and bromodichloromethane when administered over a lifetime in rats. J. Environ. Pathol. Toxicol. Oncol., 7(4): 55–63.
- Tung, H.H. et Xie, Y.F. (2009). Association between haloacetic acid degradation and heterotrophic bacteria in water distribution systems. Water Res., 43(4): 971–978.
- Ullman, W.J., Luther III, G.W., De Lange, G.J. et Woittiez, J.R.W. (1990). Iodine chemistry in deep anoxic basins and overlying waters of the Mediterranean Sea. Mar. Chem., 31(1–3): 153–170.
- UE (2020). Directive (UE) 2020/2184 du Parlement européen et du Conseil du 16 décembre 2020 relative à la qualité des eaux destinées à la consommation humaine (refonte). Disponible à : https://eur-lex.europa.eu/legal-content/FR/TXT/PDF/?uri=CELEX:32020L2184
- U.S. EPA (1990a). Integrated Risk Information System (IRIS) Chemical Assessment Summary for Dibromochloromethane. United States Environmental Protection Agency, Washington, DC.
- U.S. EPA (1990b). Integrated Risk Information System (IRIS) Chemical Assessment Summary for Bromoform. United States Environmental Protection Agency, Washington, DC.
- U.S. EPA (1993). Integrated risk information system (IRIS) chemical assessment summary for bromodichloromethane. United States Environmental Protection Agency, Washington, DC.
- U.S. EPA (1995a). Method 502.2 revision 2.1. Volatile organic compounds in water by purge and trap capillary column gas chromatography with photoionization and electrolytic conductivity detectors in series. National Exposure Research Laboratory, Office of Research and Development, U.S. EPA, Cincinnati, Ohio.
- U.S. EPA (1995b). Method 524.2 revision 4.1. Measurement of purgeable organic compounds in water by capillary column gas chromatography/mass spectrometry. National Exposure Research Laboratory, Office of Research and Development, U.S. EPA, Cincinnati, Ohio.
- U.S. EPA (1995c). Method 551.1 revision 1.0. Determination of chlorination disinfection byproducts, chlorinated solvents, and halogenated pesticides/herbicides in drinking water by liquid-liquid extraction and gas chromatography with electron-capture detection. National Exposure Research Laboratory, Office of Research and Development. U.S. EPA, Cincinnati, Ohio.
- U.S. EPA (2001). Integrated risk information system (IRIS) chemical assessment summary for chloroform. United States Environmental Protection Agency, Washington, DC.
- U.S. EPA (2002). Nitrification. Distribution system issue paper. Office of Water, Office of Ground Water and Drinking Water, U.S. Environmental Protection Agency, Washington, DC.
- U.S. EPA (2005). Drinking Water Criteria Document for Brominated Trihalomethanes. United States Environmental Protection Agency, Office of Water, EPA-822-R-05-011, Washington, DC.
- U.S. EPA (2006). National Primary Drinking Water Regulations: Stage 2 Disinfectants and Disinfection Byproduct Rule; Final Rule. United States Environmental Protection Agency, Washington, DC, 40 CFR Parts 9, 141, and 142. Federal Register Vol. 71, No. 2. Disponible à : https://www.gpo.gov/fdsys/pkg/FR-2006-01-04/pdf/06-3.pdf
- U.S. EPA (2009). Method 524.3 Versions 1.0. Measurement of purgeable organic compounds in water by capillary column gas chromatography/mass spectrometry. EPA 815-B-09-009, Technical Support Center, Office of Groundwater and Drinking Water, U.S. EPA, Cincinnati, Ohio.
- U.S. EPA (2011). Recommended use of Body Weight ^3/4 as the Default Method in Derivation of the Oral Reference Dose. Office of the Science Advisor, EPA/100/R11/0001, Washington, DC.
- U.S. EPA (2013). Method 524.4. Measurement of purgeable organic compounds in water by gas chromatography/mass spectrometry using nitrogen purge gas. EPA 815-R-13-002 Office of Water, Cincinnati, Ohio.
- U.S. EPA (2016). Six-year review 3 Technical support document for disinfectants/disinfection byproducts rules. United States Environmental Protection Agency, Office of Water, EPA-810-R-16-012, Washington, DC.
- U.S. EPA (2023). Work breakdown structure-based cost model for reverse osmosis/nanofiltration drinking water treatment. United States Environmental Protection Agency, Office of Water, Washington, DC.
- Uyak, V., Koyuncu, I., Oktem, I., Cakmakci, M. et Toroz, I. (2008). Removal of trihalomethanes from drinking water by nanofiltration membranes. J. Hazard. Mater., 152(2): 789–794.
- Uzun, H., Dahlgren, R.A., Olivares, C., Erdem, C.U., Karanfil, T. et Chow, A.T. (2020). Two years of post‑wildfire impacts on dissolved organic matter, nitrogen, and precursors of disinfection by-products in California stream waters. Water Res., 181: 115891.
- Valdivia-Garcia, M., Weir, P., Graham, D.W. et Werner, D. (2019). Predicted impact of climate change on trihalomethanes formation in drinking water treatment. Sci. Rep., 9(1): 9967.
- Verdugo, E.M., Gifford, M., Glover, C., Cuthbertson, A.A., Trenholm, R.A., Kimura, S.Y., Liberatore, H.K., Richardson, S.D., Stanford, B.D., Summers, R.S. et Dickenson, E.R.V. (2020). Controlling disinfection byproducts from treated wastewater using adsorption with granular activated carbon: Impact of pre-ozonation and pre-chlorination. Water Res X 9: 100068.
- Villanueva, C.M., Fernandez, F., Malats, N., Grimalt, J.O. et Kogevinas, M. (2003). Meta-analysis of studies on individual consumption of chlorinated drinking water and bladder cancer. J. Epidemiol. Community Health, 57(3): 166–173.
- Villanueva, C.M., Cantor, K.P., Cordier, S., Jaakkola, J.J., King, W.D., Lynch, C.F., Porru, S. et Kogevinas, M. (2004). Disinfection byproducts and bladder cancer: A pooled analysis. Epidemiology, 15(3): 357–367.
- Ville de Winnipeg (2020). Communication personnelle avec G. Levesque, Winnipeg, MB.
- Volk, C., Wood, L., Johnson, B., Robinson, J., Zhu, H.W. et Kaplan, L. (2002). Monitoring dissolved organic carbon in surface and drinking waters. J. Environ. Monit., 4(1): 43–47.
- Voronin, V.M., Donchenko, A.I. et Korolev, A.A. (1987). Experimental study of the carcinogenicity of dichlorobromomethane and dibromochloromethane formed during chlorination of water. Gig. Sanit., 1: 19–21 (citée dans IARC 1999).
- Wang, L., Chen, A.S.C. et Wang, A. (2010). Arsenic removal from drinking water by ion exchange. U.S. EPA demonstration project at Fruitland, Idaho. Final performance evaluation report. Cincinnati, Ohio. EPA/600/R‑10/152.
- Wang, Z., Hessler, C.M., Xue, Z. et Seo, Y. (2012). The role of extracellular polymeric substances on the sorption of natural organic matter. Water Res., 46(4): 1052–1060.
- Wang, J.J., Liu, X., Ng, T.W., Xiao, J.W., Chow, A.T. et Wong, P.K. (2013). Disinfection byproduct formation from chlorination of pure bacterial cells and pipeline biofilms. Water Res., 47(8): 2701–2709.
- Wang, J.J., Dahlgren, R.A. et Chow, A.T. (2015a). Controlled burning of forest detritus altering spectroscopic characteristics and chlorine reactivity of dissolved organic matter: Effects of temperature and oxygen availability. Environ. Sci. Technol., 49(24): 14019–14027.
- Wang, J.J., Dahlgren, R.A., Erşan, M.S., Karanfil, T. et Chow, A.T. (2015b). Wildfire altering terrestrial precursors of disinfection byproducts in forest detritus. Environ. Sci. Technol., 49(10): 5921–5929.
- Wang, D., Bolton, J.R., Andrews, S.A. et Hofmann, R. (2015c). Formation of disinfection by-products in the ultraviolet/chlorine advanced oxidation process. Sci. Total Environ., 518–519: 49–57.
- Wang, Y. (2021). Inexact mλ fuzzy chance-constrained programming of booster chlorination for water distribution system under uncertainty. Environ. Monit. Assess. 193: 300.
- Wang, Z., Li, L., Ariss, R.W., Coburn, K.M., Behbahani, M., Xue, Z. et Seo, Y. (2021). The role of biofilms on the formation and decay of disinfection by-products in chlor(am)inated water distribution systems. Sci. Total Environ., 753: 141606.
- Wang, Y., Li, L., Dong, H., Wang, Q., Liu, S., Wu, M., Yu, J. et Qiang, Z. (2023). Removal of carbonaceous and nitrogenous disinfection by-product precursors in biological activated carbon process of drinking water: Is service life a pivotal factor? Chem. Eng. J., 465: 142875.
- Wei, C., Chen, Y., Yang, Y., Ni, D., Huang, Y., Wang, M., Yang, X. et Chen, Z. (2022). Assessing volatile organic compounds exposure and prostate-specific antigen: National Health and Nutrition Examination Survey, 2001–2010. Front. Public Health, 10: 957069.
- Wei, X., Wang, S., Zheng, W., Wang, X., Liu, X., Jiang, S., Pi, J., Zheng, Y., He, G. et Qu, W. (2013). Drinking water disinfection byproduct iodoacetic acid induces tumorigenic transformation of NIH3T3 cells. Environ. Sci. Technol., 47(11): 5913–5920.
- Weinberg, H.S., Kritsch, K. et Krasner, S.W. (2011). Iodoacids in drinking water supplies: Methods and occurrence. Water Research Foundation, 3175, Denver, Colorado.
- Weisel, C.P. et Jo, W.K. (1996). Ingestion, inhalation, and dermal exposures to chloroform and trichloroethene from tap water. Environ. Health Perspect., 104(1): 48–51.
- Wert, E.C. et Rosario-Ortiz, F.L. (2011). Effect of ozonation on trihalomethane and haloacetic acid formation and speciation in a full-scale distribution system. Ozone Sci. Eng., 33(1): 14–22.
- Westerhoff, P., Chao, P. et Mash, H. (2004). Reactivity of natural organic matter with aqueous chlorine and bromine. Water Res., 38(6): 1502–1513.
- Westerhoff, P., Sharma, N., Zeng, C., Karanfil, T., Kim, D., Ghosh, A., Seidel, C., Samson, C. et Eaton, A. (2022). Occurrence Survey of Bromide and Iodide in Water Supplies. Water Research Foundation, 4711, Alexandria, Virginie et Denver, Colorado.
- Wetmore, B.A. (2015). Quantitative in vitro-to-in vivo extrapolation in a high-throughput environment. Toxicology, 332: 94–101.
- Whitaker, H.J., Nieuwenhuijsen, M.J. et Best, N.G. (2003). The relationship between water concentrations and individual uptake of chloroform: A simulation study. Environ. Health Perspect., 111(5): 688–694.
- White, M.C., Thompson, J.D., Harrington, G.W. and Singer, P.C. (1997). Evaluating criteria for enhanced coagulation compliance. J. Am. Water Works Assoc., 89(5): 64–77.
- Whitehead, P.G., Wilby, R.L., Battarbee, R.W., Kernan, M. et Wade, A.J. (2009). A review of the potential impacts of climate change on surface water quality. Hydrol. Sci. J., 54(1): 101–123.
- Williams, A.L., Bates, C.A., Pace, N.D., Leonhard, M.J., Chang, E.T. et DeSesso, J.M. (2018). Impact of chloroform exposures on reproductive and developmental outcomes: A systematic review of the scientific literature. Birth Defects Res., 110(17): 1267–1313.
- Wilson, L.R. (1995). An assessment of dermal absorption and inhalation of chloroform by swimmers for the purposes of estimating dose. School of Public Health, Department of Environmental Health and Toxicology, State University of New York, Albany, New York (citée dans Environnement Canada et Santé Canada, 2001).
- Withey, J.R., Collins, B.T. et Collins, P.G. (1983). Effect of vehicle on the pharmacokinetics and uptake of four halogenated hydrocarbons from the gastrointestinal tract of the rat. J. Appl. Toxicol., 3(5): 249–253.
- Wright, B., Becker, W., Irving, J., Reinert, A., Stanford, B., Reckhow, D., Wittbold, P. et Zhao, R. (2016). Advanced techniques for monitoring changes in NOM and controlling DBPs under dynamic weather conditions. Report number 4422. Water Research Foundation, Denver, Colorado.
- Wright, J.L. (2022). Biological ion exchange for removal of natural organic matter from surface water in long-term operation. Master's thesis, University of British Columbia. Disponible à : https://open.library.ubc.ca/soa/cIRcle/collections/ubctheses/24/items/1.0412914
- Wu, B., Iwakiri, R., Ootani, A., Tsunada, S., Fujise, T., Sakata, Y., Sakata, H., Toda, S. et Fujimoto, K. (2004). Dietary corn oil promotes colon cancer by inhibiting mitochondria-dependent apoptosis in azoxymethane-treated rats. Exp. Biol. Med. (Maywood), 229(10): 1017–1025.
- Xia, Y., Lin, Y.L., Xu, B., Hu, C.Y., Gao, Z.C., Tang, Y.L., Chu, W.H., Cao, T.C. et Gao, N.Y. (2018). Effect of UV irradiation on iodinated trihalomethane formation during post-chloramination. Water Res., 147: 101–111.
- Xie, P., Ma, J., Fang, J., Guan, Y., Yue, S., Li, X. et Chen, L. (2013). Comparison of permanganate preoxidation and preozonation on algae containing water: Cell integrity, characteristics, and chlorinated disinfection byproduct formation. Environ. Sci. Technol., 47(24): 14051–14061.
- Xu, X. et Weisel, C.P. (2005). Human respiratory uptake of chloroform and haloketones during showering. J. Expo. Anal. Environ. Epidemiol., 15(1): 6–16.
- Xu, X., Mariano, T.M., Laskin, J.D. et Weisel, C.P. (2002). Percutaneous absorption of trihalomethanes, haloacetic acids, and haloketones. Toxicol. Appl. Pharmacol., 184(1): 19–26.
- Xu, J., Huang, C., Shi, X., Dong, S., Yuan, B. et Nguyen, T.H. (2018). Role of drinking water biofilms on residual chlorine decay and trihalomethane formation: An experimental and modeling study. Sci. Total Environ., 642: 516–525.
- Xue, Z., Lee, W.H., Coburn, K.M. et Seo, Y. (2014). Selective reactivity of monochloramine with extracellular matrix components affects the disinfection of biofilm and detached clusters. Environ. Sci. Technol., 48(7): 3832–3839.
- Yamamoto, S., Kasai, T., Matsumoto, M., Nishizawa, T., Arito, H., Nagano, K. et Matsushima, T. (2002). Carcinogenicity and chronic toxicity in rats and mice exposed to chloroform by inhalation. J. Occup. Health, .44(5): 283–293.
- Yan, M., Wang, D., Ma, X., Ni, J. et Zhang, H. (2010). THMs precursor removal by an integrated process of ozonation and biological granular activated carbon for typical northern China water. Sep. Purif. Technol., 72(3): 263–268.
- Yanagibashi, Y., Quan, D., Muto, T., Itoh, S., Jinno, H., Echigo, S. et Ohkouchi, T. (2010). Multi-route exposure assessment of trihalomethanes for estimating its allocation to drinking water. J. Jpn. Water Works Assoc., 79: 3–15 (citée dans Akiyama et al., 2018).
- Yang, X., Guo, W., Zhang, X., Chen, F., Ye, T. et Liu, W. (2013). Formation of disinfection by-products after preoxidation with chlorine dioxide or ferrate. Water Res., 47(15): 5856–5864.
- Ye, T., Xu, B., Lin, Y.L., Hu, C.Y., Xia, S.J., Lin, L., Mwakagenda, S.A. et Gao, N.Y. (2012). Formation of iodinated disinfection by-products during oxidation of iodide-containing water with potassium permanganate. J. Hazard. Mater., 241–242: 348–354.
- Ye, T., Xu, B., Lin, Y.L., Hu, C.Y., Lin, L., Zhang, T.Y. et Gao, N.Y. (2013). Formation of iodinated disinfection by-products during oxidation of iodide-containing waters with chlorine dioxide. Water Res., 47(9): 3006–3014.
- Yoakum, B.A. et Duranceau, S.J. (2018). Using existing cascade tray aeration infrastructure to strip total trihalomethanes. J. Am. Water Works Assoc., 110(6): E2–E12.
- Yoshida, T., Andoh, K. et Fukuhara, M. (1999). Estimation of absorption of trihalomethanes and carbon tetrachloride in low-level exposure by inhalation pharmacokinetic analysis in rats. Arch. Environ. Contam. Toxicol., 36(3): 347–354.
- Yukon Health et Social Services (2019). Communication personnelle avec P. Brooks, Whitehorse, YT.
- Zazouli, M.A. et Kalankesh, L.R. (2017). Removal of precursors and disinfection byproducts (DBPs) by membrane filtration from water; A review. J. Environ. Health Sci. Eng., 15(1).
- Zeng, Q., Zhou, B., He, D.L., Wang, Y.X., Wang, M., Yang, P., Huang, Z., Li, J. et Lu, W.Q. (2016). Joint effects of trihalomethanes and trichloroacetic acid on semen quality: A population-based cross-sectional study in China. Environ. Pollut., 212: 544–549.
- Zhang, X. et Minear, R.A. (2002). Decomposition of trihaloacetic acids and formation of the corresponding trihalomethanes in drinking water. Water Res., 36(14): 3665–3673.
- Zhang, Y., Griffin, A., Rahman, M., Camper, A., Baribeau, H. et Edwards, M. (2009). Lead contamination of potable water due to nitrification. Environ. Sci. Technol., 43(6): 1890–1895.
- Zhang, Y., Edwards, M., Pinto, A., Love, N., Camper, A., Rahman, C. et Baribeau, H. (2010). Effect of nitrification on corrosion in the distribution system. Water Research Foundation et U.S. Environmental Protection Agency, Denver, Colorado.
- Zhang, L., Xu, L., Zeng, Q., Zhang, S.H., Xie, H., Liu, A.L. et Lu, W.Q. (2012). Comparison of DNA damage in human-derived hepatoma line (HepG2) exposed to the fifteen drinking water disinfection byproducts using the single cell gel electrophoresis assay. Mutat. Res., 741(1–2): 89–94.
- Zhang, T.Y., Xu, B., Hu, C.Y., Lin, Y.L., Lin, L., Ye, T. et Tian, F.X. (2015a). A comparison of iodinated trihalomethane formation from chlorine, chlorine dioxide and potassium permanganate oxidation processes. Water Res., 68: 394–403.
- Zhang, X., Li, W., Blatchley, E.R., Wang, X. et Ren, P. (2015b). UV/chlorine process for ammonia removal and disinfection by-product reduction: Comparison with chlorination. Water Res., 68: 804–811.
- Zhang, J., Chen, D.D., Li, L., Li, W.W., Mu, Y. et Yu, H.Q. (2016). Role of NOM molecular size on iodo-trihalomethane formation during chlorination and chloramination. Water Res., 102: 533–541.
- Zhang, Y., Chu, W., Yao, D. et Yin, D. (2017). Control of aliphatic halogenated DBP precursors with multiple drinking water treatment processes: Formation potential and integrated toxicity. J. Environ. Sci. 58: 322–330.
- Zhang, Y., Zhang, N. et Niu, Z. (2018a). Health risk assessment of trihalomethanes mixtures from daily water‑related activities via multi-pathway exposure based on PBPK model. Ecotoxicol. Environ. Saf., 163: 427–435.
- Zhang, J., Liu, J., He, C.S., Qian, C. et Mu, Y. (2018b). Formation of iodo-trihalomethanes (I-THMs) during disinfection with chlorine or chloramine: Impact of UV/H2O2 pre-oxidation. Sci. Total Environ., 640-641: 764–771.
- Zhang, D., Chu, W., Yu, Y., Krasner, S.W., Pan, Y., Shi, J., Yin, D. et Gao, N. (2018c). Occurrence and stability of chlorophenylacetonitriles: A new class of nitrogenous aromatic DBPs in chlorinated and chloraminated drinking waters. Environ. Sci. Techno. Lett., 5(6): 394–399.
- Zhang, M., Ma, H., Wang, H., Du, T., Liu, M., Wang, Y., Zhang, T. et Li, Y. (2019). Effects of ion species on the disinfection byproduct formation in artificial and real water. Chemosphere, 217: 706–714.
- Zhao, Y., Yang, H.W., Liu, S.T., Tang, S., Wang, X.M. et Xie, Y.F. (2016). Effects of metal ions on disinfection byproduct formation during chlorination of natural organic matter and surrogates. Chemosphere, 144: 1074–1082.
- Zhao, R., Reckhow, D.A., Becker, W.C. et Schindler, S. (2018). Seasonal variation of disinfection byproduct precursors in a large water supply. J. Am. Water Works Assoc., 110(11): 15–32.
- Zhou, S., Shao, Y., Gao, N., Zhu, S., Li, L., Deng, J. et Zhu, M. (2014). Removal of microcystis aeruginosa by potassium ferrate (VI): Impacts on cells integrity, intracellular organic matter release and disinfection by-products formation. Chem. Eng. J., 251: 304–309.
- Zhou, J., Zhao, Z., Liu, J., Peng, W., Peng, X., Han, Y. et Xiao, P. (2019). Removal of microcystis aeruginosa and control of algal organic matters by potassium ferrate(VI) pre-oxidation enhanced Fe(II) coagulation. Korean J. Chem. Eng., 36(10): 1587–1594.
- Zhu, S., Zheng, H., Sun, H., Liu, J., Ma, X., Li, X., Li, Q., et Dietrich, A.M. (2022). Insights for booster chlorination strategy based on DBPs control in a large-scale water supply system. Sci. Total Environ., 833: 155001.
- Zimmerman, K., Wright, J., Bérubé, P., Barbeau, B. et Mohseni, M. (2021). Biological ion exchange capable of sulphate-based secondary ion exchange during long-term DOC removal. Water Res., 196:117036.
- Zimmerman, K., Chen, W.S.W., Wright, J. et Mohseni, M. (2023). Design considerations for biological ion exchange drinking water filters: Resin selection, backwash, and regenerations. AWWA Water Sci., e1356.
- Ziylan, A. et Ince, N.H. (2013). Ozonation-based advanced oxidation for pre-treatment of water with residuals of anti-inflammatory medication. Chem. Eng. J., 220: 151–160.
Annexe A : Liste des abréviations
- ADN
- acide désoxyribonucléique
- AHA
- acide haloacétique
- AQT
- apport quotidien tolérable
- B6C3F1, BDF1, C57Bl, CBA, CD-1, CF/1, F344, ICI, ICR, Sprague-Dawley
- souches de rats et de souris
- BCIM
- bromochloroiodométhane
- BDCM
- bromodichlorométhane
- BDIM
- bromodiiodométhane
- BMD
- dose repère
- BMDL
- limite inférieure de l'intervalle de confiance à 95 % de la dose repère
- CAG
- charbon actif en grains
- CDIM
- chlorodiiodométhane
- CE50
- concentration effective de 50 %
- CHO
- ovaire de hamster chinois
- CIRC
- Centre international de recherche sur le cancer
- CMA
- concentration maximale acceptable
- COD
- carbone organique dissous
- COT
- carbone organique total
- COV
- composé organique volatil
- CT
- coefficient (concentration du désinfectant x temps de contact)
- DAUV
- différentiel d'absorbance UV
- DBCM
- dibromochlorométhane
- DBIM
- dibromoiodométhane
- DCIM
- dichloroiodométhane
- DEH
- dose équivalente chez l'humain
- DL50
- dose létale médiane
- ECMS
- Enquête canadienne sur les mesures de la santé
- EGCI
- électrophorèse sur gel de cellules isolées
- ENEP
- Étude nationale sur l'eau potable
- ERC
- évaluation des risques liés à l'exposition combinée à plusieurs substances (mélange)
- FAG
- faible poids pour l'âge gestationnel
- FIB
- facteur d'incorporation du brome
- FPC
- facteur de pente du cancer
- GST
- glutathion S-transférase
- GSTT1
- glutathion S-transférase thêta 1
- GSTT1-1
- glutathion S-transférase thêta 1-1
- HOBr
- acide hypobromeux
- HOCl
- acide hypochloreux
- HOI
- acide hypoiodeux
- IC
- intervalle de confiance
- IO3-
- iodate
- IX
- échange d'ions
- LD
- limite de détection
- LDM
- limite de détection de la méthode
- Leq/jour
- litres équivalents par jour
- LOAEL
- dose minimale avec effet nocif observé
- MOA
- matière organique algale
- MOB
- matière organique biologique
- MON
- matière organique naturelle
- NCI
- National Cancer Institute
- NF
- nanofiltration
- NOAEL
- dose sans effet nocif observé
- NSF
- NSF International
- NTP
- National Toxicology Program
- O3
- ozone
- OEHHA
- Office of Environmental Health Hazard Assessment
- OI
- osmose inverse
- OMS
- Organisation mondiale de la Santé
- PBPK
- (modélisation) pharmacocinétique à base physiologique
- p.c.
- poids corporel
- pfTHM
- potentiel de formation de trihalométhanes
- PM
- poids moléculaire
- PT
- provinces et territoires
- qIVIVE
- extrapolation quantitative in vitro à in vivo
- RC
- rapport des cotes
- SDM
- seuils de déclaration de la méthode
- SPD
- sous-produit de désinfection
- SUVA
- absorbance ultraviolette spécifique
- THM
- trihalométhane(s)
- TIM
- triiodométhane ou iodoforme
- TOX
- halogènes organiques totaux
- UFC
- conditions uniformes de formation (test)
- U.S. EPA
- Environmental Protection Agency des États-Unis
- UV
- rayons ultraviolets, lumière ultraviolette
- VBS
- valeur basée sur la santé
Appendix B: Canadian water quality data
| Enquête sur l'eau potable (année) |
Source d'eau | Paramètre | Chloroforme (μg/L) |
BDCM (μg/L) |
DBCM (μg/L) |
Bromoforme (μg/L) |
|---|---|---|---|---|---|---|
| Enquête nationale (2009 à 2010) |
Eaux de surface | Nb de détections/N | 261/267 | 260/267 | 224/267 | 70/267 |
| % de détection | 97,8 | 97,4 | 83,9 | 26,2 | ||
| Médiane | 20,5 | 3,7 | 0,4 | < LD | ||
| Moyenne | 25,8 | 5,7 | 1,7 | 0,2 | ||
| 90e centile | 52,0 | 13,3 | 5,2 | 0,5 | ||
| Eaux souterraines | Nb de détections/N | 98/108 | 98/108 | 91/108 | 72/108 | |
| % de détection | 90,7 | 90,7 | 84,3 | 66,7 | ||
| Médiane | 2,1 | 1,3 | 0,7 | 0,2 | ||
| Moyenne | 4,1 | 2,6 | 2,0 | 0,9 | ||
| 90e centile | 10,9 | 4,5 | 3,8 | 2,0 | ||
| Enquête nationale ciblant les eaux fortement bromées (2007) | Eaux de surface | Nb de détections/N | 13/13 | 13/13 | 12/13 | 5/13 |
| % de détection | 100,0 | 100,0 | 92,3 | 38,5 | ||
| Médiane | 34,6 | 10,6 | 0,8 | < DL | ||
| Moyenne | 54,8 | 11,4 | 3,3 | 0,4 | ||
| 90e centile | 188,8 | 30,0 | 13,5 | 1,5 | ||
| Eaux souterraines | Nb de détections/N | 16/16 | 16/16 | 14/16 | 10/16 | |
| % de détection | 100,0 | 100,0 | 87,5 | 62,5 | ||
| Médiane | 5,4 | 3,5 | 2,3 | 0,8 | ||
| Moyenne | 9,0 | 11,1 | 9,7 | 6,5 | ||
| 90e centile | 33,2 | 57,1 | 45,5 | 24,5 | ||
| Enquête nationale ciblant les petits systèmes (1999 à 2000) |
Eaux de surface | Nb de détections/N | 160/162 | 157/162 | 101/162 | 29/162 |
| % de détection | 98,8 | 96,9 | 62,3 | 17,9 | ||
| Médiane | 40,1 | 3,7 | 0,2 | < LD | ||
| Moyenne | 68,2 | 10,8 | 2,2 | 0,2 | ||
| 90e centile | 162,5 | 33,7 | 5,3 | 1,1 | ||
|
BDCM = bromodichlorométhane, DBCM = dibromochlorométhane, N = taille de l'échantillon, THM = trihalométhanes
|
||||||
| Source d'eau |
Paramètre | Terre-Neuve-et-Labrador (2004 à 2018) | Ontario (2013 à 2019) | ||||
|---|---|---|---|---|---|---|---|
| Chloroforme (μg/L) | BDCM (μg/L) |
DBCM (μg/L) |
Bromoforme (μg/L) | THM totaux (μg/L) |
THM totaux (μg/L) |
||
| Eaux de surface | Nb de détections/N | 13 575/ 14 373 | 12 228/ 14 373 | 2 986/ 14 373 | 286/14 373 | 13 367/ 14 373 | 7 646/7 646 |
| % de détection | 94,4 | 85,1 | 20,8 | 2,0 | 93,0 | 100,0 | |
| Médiane | 77,0 | 3,0 | < DL | < DL | 81,0 | 49,8 | |
| Moyenne | 100,9 | 4,9 | 1,1 | 0,9 | 106,5 | 54,8 | |
| 90e centile | 216,0 | 11,0 | 0,9 | < DL | 227,0 | 93,4 | |
| Eaux souterraines | Nb de détections/N | 858/1 117 | 846/1 117 | 737/1 117 | 449/1 117 | 938/ 1 117 |
15 204/ 15 204 |
| % de détection | 76,8 | 75,7 | 66,0 | 40,2 | 84,0 | 100,0 | |
| Médiane | 4,7 | 2,4 | 1,4 | < LD | 16,0 | 12,3 | |
| Moyenne | 31,2 | 5,0 | 3,9 | 3,0 | 42,0 | 20,6 | |
| 90e centile | 108,0 | 13,5 | 8,0 | 4,9 | 120,0 | 48,2 | |
|
BDCM = bromodichlorométhane, DBCM = dibromochlorométhane, N = taille de l'échantillon, THM = trihalométhanes
|
|||||||
| Paramètre | Eau traitée | Endroit le plus éloigné de la station de traitement de l'eau potable | ||||
|---|---|---|---|---|---|---|
| Nb de détections/N | % de détection | Moyenne (µg/L) | Nb de détections/N | % de détection | Moyenne (µg/L) | |
| Hiver | ||||||
| Chloroforme | 53/60 | 88,3 | 7,7 | 59/60 | 98,3 | 15,0 |
| BDCM | 49/60 | 81,7 | 2,5 | 57/60 | 95,0 | 4,4 |
| DBCM | 44/60 | 73,3 | 1,1 | 51/60 | 85,0 | 1,8 |
| Bromoforme | 19/60 | 31,7 | 0,2 | 22/60 | 36,7 | 0,6 |
| Été | ||||||
| Chloroforme | 56/61 | 91,8 | 16,9 | 59/61 | 96,7 | 30,4 |
| BDCM | 53/61 | 86,9 | 4,2 | 59/61 | 96,7 | 6,3 |
| DBCM | 46/61 | 75,4 | 1,4 | 53/61 | 86,9 | 2,0 |
| Bromoforme | 21/61 | 34,4 | 0,2 | 27/61 | 44,3 | 0,3 |
| Été et hiver | ||||||
| Chloroforme | 109/121 | 90,1 | 12,3 | 118/121 | 97,5 | 22,8 |
| BDCM | 102/121 | 84,3 | 3,4 | 116/121 | 95,9 | 5,4 |
| DBCM | 90/121 | 74,4 | 1,2 | 104/121 | 86,0 | 1,9 |
| Bromoforme | 40/121 | 33,1 | 0,2 | 49/121 | 40,5 | 0,5 |
|
BDCM = bromodichlorométhane, DBCM = dibromochlorométhane, N = taille de l'échantillon, THM = trihalométhanes
|
||||||
| Paramètre | Centre | Extrémité | ||||
|---|---|---|---|---|---|---|
| Nb de détections/N | % de détection | Moyenne (µg/L) | Nb de détections/N | % de détection | Moyenne (µg/L) | |
| Chloroforme | 59/59 | 100,0 | 28,6 | 59/59 | 100,0 | 34,6 |
| BDCM | 59/59 | 100,0 | 20,2 | 59/59 | 100,0 | 24,2 |
| DBCM | 59/59 | 100,0 | 24,3 | 59/59 | 100,0 | 26,8 |
| Bromoforme | 40/59 | 67,8 | 9,5 | 40/59 | 67,8 | 10,0 |
| THM totaux | 59/59 | 100,0 | 82,5 | 59/59 | 100,0 | 95,6 |
|
BDCM= bromodichlorométhane, DBCM= dibromochlorométhane, N = taille de l'échantillon, THM = trihalométhanes
|
||||||
| Paramètre | Eau traitée | Eau distribuée | ||||
|---|---|---|---|---|---|---|
| Nb de détections/N | % de détection | Moyenne (µg/L) | Nb de détections/N | % de détection | Moyenne (µg/L) | |
| Chloroforme | 1 157/1 167 | 99,1 | 21,6 | 1 165/1 167 | 99,8 | 32,3 |
| BDCM | 1 127/1 167 | 96,6 | 4,0 | 1 165/1 167 | 99,8 | 5,8 |
| DBCM | 844/1 167 | 72,3 | 1,7 | 933/1 167 | 79,9 | 2,2 |
| Bromoforme | 101/1 167 | 8,7 | 0,4 | 159/1 167 | 13,6 | 0,4 |
| THM totaux | 1 515/1 526 | 99,3 | 28,2 | 1 525/1 526 | 99,9 | 42,2 |
|
BDCM = bromodichlorométhane, DBCM = dibromochlorométhane, N = taille de l'échantillon, THM = trihalométhanes
|
||||||
| Population desservie | Concentration de THM (μg/L) | |||
|---|---|---|---|---|
| Eaux souterraines | Eaux de surface | |||
| Moyenne | Maximale | Moyenne | Maximale | |
| < 100 | 29,06 | 772 | 112,80 | 875 |
| 101 à 250 | 43,46 | 260 | 92,63 | 859 |
| 251 à 500 | 30,87 | 360 | 94,48 | 812 |
| 501 à 1 000 | 17,07 | 75 | 101,76 | 622 |
| 1 001 à 3 000 | 21,97 | 110 | 104,52 | 1 200 |
| 3 001 à 5 000 | NA | NA | 85,36 | 435 |
| 5 001 à 10 000 | 41,50 | 244 | 75,21 | 283 |
| > 10 000 | NA | NA | 81,46 | 336 |
| Total | 32,2 | 772 | 97,6 | 1 200 |
|
S. O. = sans objet, THM = trihalométhanes
|
||||
| Source d'eau | Paramètre | DCIM (µg/L) |
BCIM (µg/L) |
DBIM (µg/L) |
CDIM (µg/L) |
BDIM (µg/L) |
TIM (µg/L) |
THM iodés totauxNote de bas de tableau B7 - a (µg/L) |
|---|---|---|---|---|---|---|---|---|
| Eau de lac | Nb de détections/N | 54/112 | 16/112 | 25/112 | 10/112 | 8/112 | 3/112 | 68/112 |
| % de détection | 48,2 | 14,3 | 22,3 | 8,9 | 7,1 | 2,7 | 60,7 | |
| Médiane | < LD | < LD | < LD | < LD | < LD | < LD | 0,075 | |
| 90e centile | 0,27 | 0,11 | 0,40 | < LD | < LD | < LD | 0,81 | |
| Eau de rivière | Nb de détections/N | 49/152 | 27/152 | 32/152 | 5/152 | 0/152 | 0/152 | 63/152 |
| % de détection | 32,2 | 17,8 | 21,1 | 3,3 | 0 | 0 | 41,5 | |
| Médiane | < LD | < LD | < LD | < LD | < LD | < LD | < LD | |
| 90e centile | 0,23 | 0,1 | 0,22 | < LD | < LD | < LD | 0,54 | |
| Eau souterraine | Nb de détections/N | 42/108 | 18/108 | 34/108 | 20/108 | 16/108 | 16/108 | 58/108 |
| % de détection | 38,9 | 16,7 | 31,5 | 18,5 | 14,8 | 14,8 | 53,7 | |
| Médiane | < LD | < LD | < LD | < LD | < LD | < LD | 0,06 | |
| 90e centile | 0,79 | 0,41 | 0,39 | 1,0 | 0,97 | 1,3 | 5,1 | |
|
BCIM = bromochloroiodométhane, BDIM = bromodiiodométhane, CDIM = chlorodiiodométhane, DBIM = dibromoiodométhane, DCIM = dichloroiodométhane, < LD = valeur inférieure à la limite de détection (si le pourcentage de détection est inférieur à 10 %, le 90e centile est inférieur à la LD; si le pourcentage de détection est inférieur à 50 %, la médiane est inférieure à la LD), N = taille de l'échantillon, TIM = iodoforme, THM = trihalométhanes Source : Santé Canada (2017) |
||||||||
| Composé | Été | Hiver | ||||||
|---|---|---|---|---|---|---|---|---|
| Chloramines | Chlore | Chloramines | Chlore | |||||
| % de détection | Moyenne (µg/L) |
% de détection | Moyenne (µg/L) |
% de détection | Moyenne µg/L) |
% de détection | Moyenne (µg/L) |
|
| DCIM | 75,0 | 0,53 | 52,9 | 0,20 | 50,0 | 0,56 | 37,3 | 0,17 |
| BCIM | 33,3 | 0,73 | 17,6 | 0,16 | 33,3 | 0,55 | 19,6 | 0,15 |
| DBIM | 50,0 | 0,51 | 33,3 | 0,54 | 16,7 | 1,17 | 19,6 | 0,23 |
| CDIM | 33,3 | 1,63 | 7,8 | 0,06 | 16,7 | 1,57 | 5,9 | 0,08 |
| BDIM | 16,7 | 2,00 | 2,0 | 0,06 | 25,0 | 1,17 | 3,9 | 0,07 |
| TIM | 16,7 | 5,83 | 3,9 | 0,06 | 16,7 | 3,42 | 3,9 | 0,15 |
|
BCIM = bromochloroiodométhane, BDIM = bromodiiodométhane, CDIM = chlorodiiodométhane, DBIM = dibromoiodométhane, DCIM = dichloroiodométhane, TIM = iodoforme, THM = trihalométhanes
|
||||||||
| Paramètre | DCIM | BCIM | DBIM | CDIM | BDIM | TIM | TBCM |
|---|---|---|---|---|---|---|---|
| Limite de détection (µg/L) | 0,3 | 1,0 | 0,4 | 0,3 | 0,4 | 1,0 | 0,3 |
| Nb de détections/N | 89/124 | 57/124 | 9/124 | 21/124 | 1/124 | 0/124 | 0/24 |
| % de détection | 71,8 | 46,0 | 7,3 | 16,9 | 0,8 | 0,0 | 0,0 |
| Médiane (µg/L) | 1,9 | 0,5 | 0,2 | 0,2 | 0,2 | < LD | < LD |
| 90e centile (µg/L) | 15,5 | 17,5 | 0,2 | 0,8 | 0,2 | < LD | < LD |
| Moyenne (µg/L) | 6,0 | 4,7 | 0,3 | 0,4 | 0,2 | < LD | < LD |
|
BCIM = bromochloroiodométhane, BDIM = bromodiiodométhane, CDIM = chlorodiiodométhane, DBIM = dibromoiodométhane, DCIM = dichloroiodométhane, < LD = valeur inférieure à la limite de détection, N = taille de l'échantillon, TBCM = tribromochlorométhane, TIM = triiodométhane, THM = trihalométhanes
|
|||||||
Annexe C : Évaluation des mélanges
| Objet/but de l'évaluation des risques : | Déterminer si l'évaluation et la gestion des risques liés à quatre THM dans l'eau potable devraient être fondées sur des valeurs de la recommandation pour chaque substance, pour un mélange des quatre substances ou pour un mélange des substances bromées seulement. Mettre en évidence les zones d'incertitude et cerner les besoins en données critiques. |
| Connaît-on la nature de l'exposition? | Oui. Il s'agit d'un mélange de composés, notamment du chloroforme, du BDCM, du DBCM et du bromoforme, dont les trois derniers sont considérés comme étant des « THM bromés ». Les données de surveillance de ces substances dans l'eau potable sont disponibles auprès de toutes les provinces et tous les territoires du Canada, à l'exception des Territoires du Nord-Ouest. |
| Est-ce qu'une exposition simultanée est probable, compte tenu du contexte? | Oui. Les quatre THM sont des sous-produits de la désinfection de l'eau potable qui se forment par réaction entre le chlore utilisé pour désinfecter l'eau potable et la matière organique naturellement présente dans les approvisionnements en eau brute. Par conséquent, on les trouve régulièrement ensemble dans l'eau potable et une exposition simultanée est probable. |
| Est-ce qu'une exposition simultanée est possible au cours d'une période donnée? |
|
| Est-il justifié de considérer le regroupement des substances pour une évaluation fondée sur les dangers? | Tous les THM ont des effets sur le foie et les reins. Les THM bromés ont également des effets sur le côlon, tandis que le chloroforme a des effets sur les voies nasales. Même si tous les THM sont métabolisés par des voies oxydatives et réductrices, les THM bromés peuvent aussi être métabolisés par conjugaison des métabolites mutagènes. Bien qu'il s'agisse d'une voie quantitativement mineure, les métabolites mutagènes sont probablement plus toxiques de façon disproportionnée. Des effets sont probablement observés dans le côlon en ce qui concerne les THM bromés, et non le chloroforme, parce que les enzymes CYP2E1 dans le côlon sont plus facilement dépassées (par rapport au foie), ce qui détourne le métabolisme vers la voie de conjugaison. Cette voie métabolique toxique est présente dans les THM bromés, mais pas dans le chloroforme. |
| Plan d'analyse | Recommandation : L'exposition simultanée aux quatre THM est probable dans un contexte et une période donnés. En outre, tous les THM peuvent avoir une incidence sur des organes cibles communs (foie et reins). Cependant, les modes d'action à l'origine des effets critiques servant à calculer les valeurs basées sur la santé sont différents pour le chloroforme (effets non cancérogènes sur les reins) et le BDCM (cancer du gros intestin). Comme il existe peu de directives sur la question de savoir s'il convient d'appliquer une approche additive pour les substances cancérogènes et si les indices de danger des substances cancérogènes et non cancérogènes (c'est-à-dire des modes d'action différents) devraient être additionnés même si certains organes communs sont touchés, la décision a été prise globalement de ne pas appliquer l'ERC. |
|
BDCM = bromodichlorométhane, ERC = évaluation des risques liés à l'exposition combinée à plusieurs substances (mélange), THM = trihalométhanes |
|
Annexe D : Paramètres de surveillance proposés
| Paramètre | Objet de surveillance | Fréquence | ||
|---|---|---|---|---|
| Source variable | Source stable | Idéalement | ||
| Couleur attribuable à la matière organique (couleur vraie) | Eau brute et eau traitée | Quotidienne | Hebdomadaire | En ligne |
| Absorbance UV (à 254 nm) ou transmittance UV | Eau brute et eau filtréeNote de bas de tableau D1 - aa | Quotidienne | Hebdomadaire | En ligne |
| Demande chimique en oxygène (DCO) | Eau brute, procédés de traitementNote de bas de tableau D1 - b et eau traitée | Quotidienne | Hebdomadaire | En ligne |
| Carbone organique dissous ou total (COD ou COT) | Eau brute et eau traitéeNote de bas de tableau D1 - a | Hebdomadaire | Mensuelle | En ligne |
| Absorbance UV spécifique (SUVA) – calculée avec l'UV254 et le COD | Eau brute et eau traitéeNote de bas de tableau D1 - a | Hebdomadaire | Mensuelle | Quotidienne |
Composés inorganiques pouvant accroître la réactivité de la MON pour former des SPD :
|
Eau brute et eau traitée |
|
|
|
| Demande en coagulant | Procédé de coagulationNote de bas de tableau D1 - c | Quotidienne | Quotidienne | En ligne |
| Potentiel zêta ou courant d'écoulement – lorsque la MON régule ou influence la dose de coagulant | Procédé de coagulationNote de bas de tableau D1 - c | En ligne | En ligne | En ligne |
Stabilité biologique :
|
Réseau de distribution |
|
|
En ligne |
Influence de la MON sur la corrosion :
|
|
|||
|
MON = matière organique naturelle Source : Santé Canada (2020a) |
||||
| Paramètre | Unité | Source avec rendement élevé en SPD spécifiques ou réseau de distribution étendu | Source avec rendement faible en SPD spécifiques |
|---|---|---|---|
| Couleur attribuable à la matière organique | UCV | 5 à 10 | < 15 |
| Absorbance UV (à 254 nm) | cm-1 | 0,02 à 0,04 | 0,02 à 0,07 |
| Transmittance UV | Pourcentage | 90 à 95 | 85 à 95 |
| DCO | mg/L O2 | < 5 | < 5 |
| COD – pour le contrôle des SPD | mg/L C | < 2 | < 4 |
| COD – pour la stabilité biologique | mg/L C | < 1,8 | < 1,8 |
|
C = carbone, COD = carbone organique dissous, DCO = demande chimique en oxygène, O2 = oxygène, SPD = sous-produits de désinfection, UCV = unités de couleur vraie
|
|||
Annexe E : Précurseurs inorganiques susceptibles d'influer sur la formation de THM
Les sources d'eau contiennent d'autres ions qui peuvent influer sur la formation de THM. Les répercussions globales dépendent du type et de la quantité de MON, de la concentration en ions et de la présence d'autres précurseurs inorganiques comme le bromure (voir le tableau 6) (Navalon et coll., 2009; Liu et coll., 2012b; Zhao et coll., 2016; Zhang et coll., 2019). Dans tous les cas, l'effet observé d'un ion sur la formation de THM était plus faible lorsqu'il était testé dans une eau de surface que dans une eau distillée.
| Ion | Effet sur la formation de THM | Références |
|---|---|---|
| Eau non bromée | ||
| Ca2+ et Mg2+ |
|
|
| Al3+ |
|
|
| Fe2+ and Fe3+ |
|
|
| Nitrites |
|
|
| Eau bromée | ||
| Ca2+, Mg2+, NH4+ et As3+ |
|
Ta et coll. (2020) |
| Al3+ et Fe3+ |
|
Ta et coll. (2020) |
| F- |
|
Ta et coll. (2020) |
|
FIB = facteur d'incorporation du brome (défini comme le rapport molaire des THM bromés sur les THM totaux : 0 signifie tout le chloroforme et 3 signifie tout le bromoforme); MON = matière organique naturelle, THM = trihalométhanes |
||
Annexe F : Enlèvement de la MON et des précurseurs
| Qualité de la source d'eau | Procédé de traitement | % d'enlèvement du COT/COD (moyenne) | Référence | |||
|---|---|---|---|---|---|---|
| ParamètreNote de bas de tableau F1 - a | Min | Max | Moyenne | |||
| COT | 0,9 | 4,5 | 2,4 | Filtration classique (alun) | 0 à 28 (8,7) |
Hargesheimer et coll. (1994) |
| COD | 1,2 | 7,8 | 2,1 à 3,5Note de bas de tableau F1 - b | Procédé conventionnel avec CAG (coagulant non précisé) | 8 à 48Note de bas de tableau F1 - c | Jacangelo et coll. (1995) |
| COD | 2,15 | 11,90 | 4,00 | Coagulation (chlorure de fer[III] et polymère cationique), floculation, clarification | 7,1 à 66 (34,7) |
Volk et coll. (2022)Note de bas de tableau F1 - d |
| UV254 | 0,037 | 0,830 | 0,118 | |||
| SUVA | 1,40 | 10,51 | 2,81 | |||
| COD | 2,15 | 11,90 | 4,00 | Procédé conventionnel (chlorure de fer[III] et polymère cationique) avec CAG | 16,9 à 72,9 (41,9) | |
| UV254 | 0,037 | 0,830 | 0,118 | |||
| SUVA | 1,40 | 10,51 | 2,81 | |||
| COD | 8,2Note de bas de tableau F1 - f | 11,8 | Non obtenue | Filtration classique (alun et polymère cationique) |
36 à 57 (47) |
Chow et coll. (2005)Note de bas de tableau F1 - e |
| COD | 11,6Note de bas de tableau F1 - f | 15,8 | Non obtenue | Filtration par flottation à l'air dissous | 56 à 65 (62) |
|
| COD | 0,9 | 2,2 | 1,3 | Filtration directe (station 1) (coagulant non précisé) | 0 à 50 (28,2) |
Carpenter et coll. (2013)Note de bas de tableau F1 - g |
| UV254 | 0,01 | 0,10 | 0,03 | |||
| SUVA | 2,00 | 4,41 | 2,73 | |||
| COD | 0,9 | 2,2 | 1,3 | Filtration directe (station 2) (coagulant non précisé) | 0 à 45 (27.9) |
|
| UV254 | 0,01 | 0,10 | 0,03 | |||
| SUVA | 2,00 | 4,41 | 2,73 | |||
| COT | 4,3 | 8,3 | 6,2 | Filtration classique (station 1) (alun) |
27 à 78 (66) |
Ministère de l'Environnement de la Nouvelle-Écosse (2016) |
| COT | 10,4 | 22,7 | 15,6 | Filtration classique (station 2) (alun) |
71 à 89 (80) |
|
|
COD = carbone organique dissous, COT = carbone organique total, MON = matière organique naturelle, SUVA = absorbance ultraviolette spécifique, UV254 = absorbance UV à 254 nm Source : Santé Canada (2020a) |
||||||
| Procédé de traitement | Pourcentage d'enlèvement (moyenne) | Références | ||
|---|---|---|---|---|
| COD | UV254 | Précurseurs de THM | ||
| Procédés de coagulation | ||||
| Coagulation par l'alun | 17 à 33 (25) | 3 à 80 (46) | 7 à 71 (36) | Bond et coll. (2011)Note de bas de tableau F2 - a |
|
|
|
|
Plourde-Lescelleur et coll. (2015)Note de bas de tableau F2 - b |
| Échange d'ions-coagulation | 42 à 79 (59) | 47 à 96 (79) | 27 à 88 (70) | Bond et coll. (2011)Note de bas de tableau F2 - a |
| 39 à 75 (63) | 47 à 90 (77) | 50 à 93 (76) | Plourde-Lescelleur et coll. (2015)Note de bas de tableau F2 - b | |
| Coagulation par l'alun-CAP | 58 à 86 (77) | 57 à 96 (88) | 73 à 93 (85) | |
| Coagulation par l'alun-ozonation | 16 à 34 (23) | 49 à 69 (61) | 47 à 58 (51) | Bond et coll. (2011)Note de bas de tableau F2 - a |
| 21 à 69 (54) | 55 à 93 (82) | 59 à 90 (78) | Plourde-Lescelleur et coll. (2015)Note de bas de tableau F2 - b | |
| Pré-ozonation˗coagulation par l'alun | 0 à 30 (15) | 42 à 69 (60) | 51 à 66 (57) | Bond et coll. (2011)Note de bas de tableau F2 - a |
| Filtration sur membrane | ||||
| Nanofiltration | 86 à 93 (90) | 89 à 99 (96) | 66 à 98 (87) | Bond et coll. (2011)Note de bas de tableau F2 - a |
| 77 à 89 (84) | 79 à 93 (87) | 75 à 98 (89) | Plourde-Lescelleur et coll. (2015)Note de bas de tableau F2 - b | |
| Procédés d'oxydation | ||||
| Ozonation | 8 à 16 (12) | 28 à 77 (58) | 0 à 43 (14) | Bond et coll. (2011)Note de bas de tableau F2 - a |
| Ozonation-filtre à sable biologique | S.O. | S.O. | -5 à 54 (42) | |
| Ozonation-UV | 17 à 56 (33) | 90 à 94 (92) | 48 à 89 (67) | |
| UV-H2O2 | -11 à 20 (-1) | 20 à 59 (34) | 8 à 73 (43) | |
| UV-H2O2-biological sand | 38 à 80 (59) | 45 à 81 (64) | 42 à 85 (60) | |
|
CAP = charbon actif en poudre, COD = carbone organique dissous, H2O2 = peroxyde d'hydrogène, THM = trihalométhanes, UV = absorbance UV, UV254 = absorbance UV à 254 nm Source : Santé Canada (2020a) |
||||
Notes de bas de page
- Note de bas de page 1
-
Le coefficient CT est le produit de « C » (la concentration résiduelle de désinfectant, mesurée en mg/L) par « T » (le temps de contact du désinfectant, mesuré en minutes; « T » est habituellement calculé à l'aide d'une valeur T10, qui correspond à la durée de rétention de l'eau pendant laquelle le temps de contact requis est atteint ou dépassé pour 90 % de l'eau).
