Document de conseils sur la matière organique naturelle dans l’eau potable

Télécharger le format de rechange
(Format PDF, 865 Ko, 80 pages)
Organisation : Santé Canada
Publiée : 2019-03-15
Document de consultation publique
Fin de la période de consultation : Le 21 mai 2019
Table des matières
- Objet de la consultation.
- Sommaire
- Partie A. Document de conseils sur la matière organique naturelle dans l'eau potable
- Partie B. Renseignements à l'appui
- B.1 Description de la matière organique naturelle
- B.2 Sources et présence de la matière organique naturelle
- B.3 Considérations environnementales
- B.4 Effet de la matière organique naturelle
- B.5 Mesure et caractérisation
- B.6 Considérations relatives au traitement et au réseau de distribution
- B.7 Objectifs de surveillance et de qualité de l'eau traitée
- B.8 Considérations internationales
- Partie C. Références, acronymes et tableaux
- C.1 Références
- C.2 Acronymes
- C.3 Tableaux
- Tableau C-3.1. Facteurs influant sur la concentration et les caractéristiques de la matière organique naturelle allochtone.
- Tableau C-3.2.Données relatives au carbone organique dissous provenant d'Environnement Canada (2000-2015)
- Tableau C-3.3.Variation spatiale et temporelle des fractions de MON pour certaines sources d'eau canadiennes
- Tableau C-3.4.Tableau de conversion pour la transmittance UV et l'absorbance UV
- Tableau C-3.5. Recommandations de paramètres à surveiller
Document de conseils sur la matière organique naturelle dans l'eau potable
Objet de la consultation
On a évalué l'information disponible sur la matière organique naturelle dans l'eau potable en vue de rédiger un document de conseils.
Ce document est mis à la disposition du public pour une période de consultation de 60 jours. La présente consultation vise à solliciter des commentaires au sujet de ce document. Les commentaires, avec justification pertinente le cas échéant, sont les bienvenus. Ils peuvent être envoyés à Santé Canada par courrier électronique (HC.water-eau.SC@canada.ca) ou au besoin par la poste au Bureau de la qualité de l'eau et de l'air, Santé Canada, 269, avenue Laurier Ouest, IA 4903D, Ottawa (Ontario) K1A 0K9. Les commentaires doivent nous parvenir avant le 21 mai 2019
Les commentaires reçus dans le cadre de la consultation seront transmis, avec le nom et l'affiliation de leurs auteurs, aux membres concernés du Comité fédéral-provincial-territorial sur l'eau potable (CEP). Les personnes qui ne veulent pas que leur nom et leur affiliation soient communiqués aux membres du CEP doivent joindre à leurs commentaires une déclaration à cet égard.
Il est à noter que ce document de conseils sur la matière organique naturelle dans l'eau potable sera révisé après l'analyse des commentaires reçus, après quoi le document définitif sera publié. Le présent document devrait donc être considéré strictement comme une ébauche pour commentaires.
Sommaire
La matière organique naturelle (MON) est un mélange extrêmement complexe de composés organiques qui se trouvent dans toutes les eaux souterraines et de surface. Même si la MON n'a pas d'incidence directe sur la santé, elle nuit à l'efficacité des procédés de traitement de l'eau potable et, par conséquent, à la salubrité de l'eau potable. La MON peut aussi affecter la satisfaction des consommateurs, car elle peut contribuer à donner une couleur, un goût et une odeur indésirables à l'eau potable.
Santé Canada a terminé son examen de la MON dans l'eau potable et l'incidence qu'elle peut avoir sur les procédés de traitement de l'eau potable. Le présent document étudie et évalue les risques associés à l'effet de la MON sur les procédés de traitement de l'eau potable et la salubrité de l'eau potable. Le présent document vise à fournir aux intervenants de l'industrie (comme les propriétaires de systèmes d'approvisionnement en eau, les experts-conseils, les fournisseurs d'équipement et les laboratoires) des conseils sur les effets de la MON sur la qualité générale de l'eau potable, y compris ses effets potentiels sur les procédés de traitement de l'eau potable et, par conséquent, la salubrité de l'eau potable. Il résume les facteurs qui influent sur la concentration et les caractéristiques de la MON et présente les points à prendre en considération au moment d'élaborer une stratégie de contrôle de la MON. Il offre également des conseils précis sur le traitement, la surveillance et les buts de la qualité de l'eau.
Ce document, pour consultation publique, a été préparé en collaboration avec le Comité fédéral provincial territorial sur l’eau potable.
Évaluation
Les effets sur la santé de la MON sont imputables à son incidence sur les procédés de traitement de l'eau potable destinés à protéger la qualité de l'eau potable et la santé publique. La MON peut interférer avec les procédés conçus pour enlever ou désactiver des pathogènes, elle peut contribuer à la formation de sous-produits de désinfection et favoriser la formation de biofilms dans le réseau de distribution. Elle pourrait également faire augmenter les concentrations de plomb ou de cuivre dans l'eau traitée.
La traitabilité et la réactivité de la MON varient grandement au Canada, car chaque source d'eau possède des caractéristiques uniques. Comme la MON est constituée de nombreux composés organiques, elle ne peut être mesurée directement. Néanmoins, de nombreux autres paramètres peuvent servir à fournir une indication de la concentration et des caractéristiques (c.‑à-d. des propriétés chimiques, physiques et de biodégradabilité) de la MON. Il est important de comprendre les variations des concentrations et des caractéristiques de la MON afin de sélectionner, de concevoir et d'appliquer les bons procédés de traitement de l'eau.
Aucune valeur pratique basée sur la santé ne peut actuellement être calculée pour la MON dans l'eau potable. L'élaboration d'une stratégie de contrôle efficace de la MON doit reposer sur une bonne compréhension des variations de la concentration et des caractéristiques de la MON dans l'eau à la source, de l'incidence de la MON sur les procédés de traitement de l'eau pour la gamme complète des conditions de qualité de l'eau et des effets potentiels sur la qualité de l'eau dans le réseau de distribution. Des études de traitabilité propres à la source doivent être réalisées afin de déterminer les solutions de rechange les plus appropriées pour enlever la MON, diminuer sa réactivité à former des sous-produits de désinfection, réduire sa capacité à contribuer à la corrosion et produire de l'eau potable stable d'un point de vue biologique.
Considérations internationales
Les recommandations, normes ou directives relatives à la qualité de l'eau potable établies par des gouvernements étrangers ou des agences internationales peuvent varier en raison des connaissances scientifiques disponibles au moment de l'évaluation, ainsi que de l'utilisation de différentes politiques et approches.
Les organisations internationales n'ont pas établi de limites numériques quant à la présence de MON dans l'eau potable. Le règlement sur les désinfectants et les sous-produits de désinfection de la United States Environmental Protection Agency prévoit l'enlevement du carbone organique total (COT) par les installations de traitement des eaux de surface utilisant un procédé de traitement de l'eau conventionnel ou un procédé d'adoucissement à la chaux, où les niveaux de COT se situent au-dessus de 2 mg/L dans l'eau à la source. L'Organisation mondiale de la Santé suggère une d'optimisée l'enlevement de la MON comme moyen de réduire la prolifération de biofilms dans le réseau de distribution. La réglementation de l'Union européenne comprend le COT comme un indicateur de la qualité générale de l'eau. En Australie, des lignes directrices ont été élaborées pour aider les services d'eau à comprendre et limiter les répercussions de la MON.
Partie A. Document de conseils sur la matière organique naturelle dans l'eau potable
A.1 Introduction
La matière organique naturelle (MON) est un mélange extrêmement complexe de composés organiques qui varient considérablement sur le plan des caractéristiques physiques et chimiques. La MON existe naturellement dans l'environnement, comme elle peut aussi découler d'activités humaines. On retrouve la MON sous forme particulaire, colloïdale et dissoute dans toutes les eaux souterraines et de surface, ainsi que dans les eaux pluviales. Même si l'exposition à la MON dans l'environnement est courante et non associée à des effets directs sur la santé, la présence et les caractéristiques de la MON auront des incidences importantes sur les procédés de traitement de l'eau potable destinés à protéger la santé publique.
La MON joue un rôle crucial dans le traitement de l'eau potable pour un certain nombre de raisons. D'abord et avant tout, la MON peut contribuer à des effets indirects sur la santé, à savoir :
- une détérioration de la capacité d'enlevement logarithmique des pathogènes en raison d'une demande accrue de coagulant, laquelle peut mener à des conditions de coagulation sous-optimales;
- une détérioration de la capacité d'inactivation logarithmique des pathogènes en raison d'une demande de désinfectants chimiques ou d'une interférence avec une désinfection aux ultraviolets (UV);
- la formation de sous-produits de désinfection (SPD);
- la formation de biofilms dans le réseau de distribution pouvant abriter des pathogènes;
- une augmentation potentielle des concentrations de plomb ou de cuivre par suite de la corrosion de matières contenant du plomb ou du cuivre (p. ex., la tuyauterie, les raccords).
Les services d'eau peuvent aussi être grandement touchés par un certain nombre de problèmes opérationnels causés par la MON, notamment :
- une dose accrue de coagulant;
- une piètre floculation ou décantation des flocs;
- des périodes de filtration raccourcies;
- des lavages à contre-courant plus fréquents;
- une production accrue de boues;
- une capacité hydraulique réduite;
- un encrassement des membranes, une pression transmembranaire et une consommation énergétique plus élevées, un nettoyage chimique plus fréquent et une durée de vie des membranes raccourcie;
- une efficacité réduite des procédés d'adsorption et d'échange d'ions.
Enfin, la MON peut mener à une augmentation de plaintes de la part des consommateurs, car elle peut donner une couleur, un goût et une odeur indésirables à l'eau potable. Ces problèmes et d'autres sont présentés en détail dans les sections suivantes du présent document.
A.2 Application
Tous les services d'eau devraient adopter une approche de gestion du risque comme une approche à l'approche de la source au robinet ou du plan de gestion de la sécurité sanitaire de l'eau, pour assurer la salubrité de l'eau. Ces approches exigent une évaluation des systèmes qui comprend : la caractérisation de la source d'eau, la description des barrières de traitement qui préviennent ou réduisent la contamination, la mise en évidence des conditions pouvant causer une contamination et la détermination de mesures de contrôle. Une surveillance opérationnelle est alors établie et des protocoles opérationnels et de gestion sont instaurés (p. ex., des procédures opératoires normalisées, des mesures correctives et des interventions en cas d'incident). Une surveillance de la conformité est établie et d'autres protocoles pour valider le plan de gestion de la sécurité sanitaire de l'eau sont mis en œuvre (p. ex., tenue de dossiers, satisfaction des consommateurs). Une formation des opérateurs est aussi requise pour assurer en tout temps l'efficacité du plan de gestion de la sécurité sanitaire de l'eau.
A.2.1 Étude de traitabilité propre à la source
Il est recommandé d'effectuer des études de traitabilité propres à la source afin de déterminer les options de traitement les plus efficaces pour enlever adéquatement la MON et atteindre les objectifs en matière de la qualité de l'eau quant à la protection microbienne, aux SPD, à la stabilité biologique et au contrôle de la corrosion. L'étude de traitabilité devrait évaluer les variations saisonnières de la MON et inclure des essais de formation potentielle de SPD représentatifs des conditions du réseau de distribution. Puisque les services d'eau devraient chercher à réduire au minimum les concentrations de SPD, de plomb et de cuivre et contrôler la formation de biofilms dans le réseau de distribution, la stratégie de contrôle de la MON devrait avoir pour but de réduire les concentrations de MON au plus bas niveau que l'on puisse raisonnablement atteindre. Des procédés de traitement multiples pourraient être nécessaires pour bien enlever la MON en tout temps de l'année.
A.2.2 Surveillance
La concentration et les caractéristiques de la MON devraient être surveillés dans l'eau brute, l'eau traitée et l'eau du réseau de distribution, afin de s'assurer que :
- le traitement est optimisé pour l'enlevement de la MON et de la turbidité;
- les concentrations de SPD, de plomb et de cuivre sont au plus bas niveau que l'on puisse raisonnablement atteindre;
- la formation de biofilms est réduite au maximum.
Un plan de surveillance propre à la source devrait être élaboré pour s'assurer que les services d'eau soient au fait :
- des changements de la qualité de l'eau brute quant à la concentration et aux caractéristiques de la MON;
- de l'effet que la MON produit sur les procédés de traitement de l'eau dans toutes les conditions de qualité de l'eau;
- de l'impact que le traitement a sur la concentration et les caractéristiques de la MON;
- des répercussions sur la qualité de l'eau du réseau de distribution.
Le plan de surveillance devrait être exhaustif et comprendre la caractérisation de la source et la surveillance opérationnelle et de la conformité, en plus de démontrer que les objectifs touchant à la qualité de l'eau sont régulièrement atteints en ce qui a trait à la protection microbienne, aux SPD, à la stabilité biologique et au contrôle de la corrosion. Les sources très variables (c.-à-d. celles qui fluctuent et connaissent des épisodes de précipitations ou de fonte de la neige) et les procédés critiques (p. ex., la coagulation) devraient idéalement faire l'objet d'une surveillance en ligne et en continu.
A.2.2.1 Évaluations de l'eau à la source
Les évaluations de l'eau à la source devraient faire partie des évaluations routinières des systèmes. Elles doivent inclure : une compréhension des sources de MON dans le bassin versant ou l'aquifère; les conditions menant à un changement des concentrations ou des caractéristiques de la MON (p. ex., épisodes de précipitations/fonte de la neige, prolifération d'algues, sécheresse, incendie); et les facteurs qui accentuent la réactivité de la MON à former des SPD (p. ex., les conditions de réaction, l'âge de l'eau, les composés inorganiques comme l'ammoniac, le bromure, l'iodure et le soufre).
La concentration et les caractéristiques de la MON et, par conséquent, sa traitabilité et sa réactivité, peuvent varier grandement en fonction du temps et du lieu en raison des processus hydrologiques et biogéochimiques uniques associés à chacune des sources d'eau. La concentration et les caractéristiques de la MON doivent être évalués dans des conditions normales, ainsi que dans le contexte d'épisodes de fonte de la neige ou de précipitations, de prolifération d'algues et d'autres événements (une sécheresse ou un incendie par exemple) susceptibles de déclencher un changement des caractéristiques de la MON. Les sources souterraines doivent aussi être caractérisées en ce qui a trait à la MON et aux composés inorganiques pouvant accroître la réactivité de la MON (c.-à-d. l'ammoniac, le bromure, l'iodure et le soufre). La fréquence de surveillance de la caractérisation des eaux à la source dépendra de la variabilité de la source; les sources très variables devraient être surveillées plus souvent.
A.2.2.2 Traitement et surveillance opérationnelle
La concentration et les caractéristiques de la MON peuvent influer grandement sur la sélection, la conception et le fonctionnement des procédés de traitement de l'eau. Pour déterminer les procédés de traitement les plus appropriés, les services d'eau doivent connaître :
- l'origine, la présence et les fluctuations de la MON;
- les interactions entre la MON et les autres constituants de l'eau (p. ex., une réactivité accrue due au bromure);
- les interactions avec les produits chimiques utilisés pendant le traitement (p. ex., la MON crée une demande de désinfectant et de coagulant qui doit être prise en charge pour assurer la salubrité microbiologique de l'eau potable);
- les interactions entre la MON et les procédés (p. ex., encrassement des matériaux adsorbants et des membranes par la MON); et
- les impacts sur la qualité de l'eau du réseau de distribution.
Le type et le niveau de traitement appropriés doivent prendre en compte les fluctuations de la qualité de l'eau propres à la source, notamment la dégradation saisonnière et à court terme, la variabilité du rendement du traitement et les conditions dans le réseau de distribution.
Un suivi opérationnel continu et l'optimisation du traitement permettra de s'assurer que les exploitants des services d'eau potable atteignent les objectifs de qualité de l'eau liés à la protection microbienne, aux SPD, à la stabilité biologique et au contrôle de la corrosion, et maximisent la protection de la santé publique pour l'ensemble des problématiques de la qualité de l'eau. Se tenir au courant des pratiques exemplaires et des avancées dans le secteur de l'eau potable est un aspect important de l'approche de la source au robinet ou du plan de gestion de la sécurité sanitaire de l'eau, pour assurer la salubrité de l'eau.
A.2.2.3 Réseau de distribution
La matière organique biodégradable (MOB) favorise la formation de biofilms dans le réseau de distribution. Les biofilms peuvent contribuer à la survie des pathogènes ayant réussi à traverser les barrières de traitement de l'eau potable ou à entrer directement dans le réseau de distribution à cause d'une rupture de l'intégrité des conduites. Les éléments les plus importants pour contrôler la croissance de bactéries dans les réseaux de distribution sont le maintien d'une concentration résiduelle de désinfectant, la limitation de la MOB et le contrôle de la corrosion. Le maintien de l'intégrité physique et hydraulique du réseau de distribution et la réduction des phénomènes de pression négative ou de basse pression constituent d'autres éléments clés d'une approche de la source au robinet ou du plan de gestion de la sécurité sanitaire de l'eau, pour assurer la salubrité de l'eau.
La qualité de l'eau du réseau de distribution doit faire l'objet d'une surveillance régulière, y compris les indicateurs de stabilité biologique (p. ex., variabilité des concentrations de chlore résiduel, taux de formation de biofilms et taux de corrosion). Des programmes de fonctionnement et d'entretien doivent aussi être en place (p. ex., contrôle de l'âge de l'eau, nettoyage de la conduite principale, prévention des retours d'eau polluée, gestion des biens), en plus d'une hygiène rigoureuse qui doit être pratiquée durant tous les travaux sur la conduite principale (p. ex., réparation, entretien et nouvelle installation), afin que l'eau potable soit acheminée jusqu'au consommateur avec une perte minimale de sa qualité.
Partie B. Renseignements à l'appui
B.1 Description de la matière organique naturelle
La MON est un mélange extrêmement complexe de composés organiques dont la polarité, l'acidité, la densité de charge, la masse moléculaire et la biodégradabilité (c.-à-d. qu'elle est labile, semi-labile, résistante ou réfractaire) peuvent varier. Puisque la MON comprend de nombreux composés organiques, elle est catégorisée en fonction de sa polarité (c.-à-d. hydrophobe ou hydrophile) et ses propriétés acides, neutres ou basiques. Cette approche donne six fractions de MON, décrites au tableau 1. Des classes de composés à l'intérieur de ces fractions ont aussi été déterminées. Les classes de composés procurent le degré de spécificité le plus élevé possible en raison du nombre de composés pouvant être présents (Minor et coll., 2014).
Selon la taille et la forme de la MON, lesquelles sont influencées par le pH et la force ionique (Ghosh et Schnitzer, 1980), certains composés peuvent afficher des propriétés tant hydrophobes qu'hydrophiles (c.-à-d. amphipathique) (Leenheer et Croué, 2003) et posséder à la fois des groupements fonctionnels de charges négatives et positives (c.-à-d. amphotère) (Her et coll., 2007; Amy, 2008). Les fractions contenant des polysaccharides, des protéines et des sucres aminés affichent les poids moléculaires les plus élevés (>10 kDa), alors que les masses moléculaires des acides humiques et fulviques se situent entre 2 à 5 kDa et 0,5 à 2 kDa, respectivement (Bond et coll., 2012; Sillanpää et coll., 2015a). Les dérivés des lignines et des tanins sont aussi abondants dans les fractions dont le poids moléculaire varie entre élevé et moyen. Les plus petites fractions de MON (<0,5 kDa) sont souvent des composés hydrophiles (Sillanpää et coll., 2015a). Les fractions les plus biodégradables comprennent des glucides, des acides aminés et des protéines, tandis que les plus résistantes contiennent des lignines, des tanins et des terpénoïdes.
| Fraction | Classe de composés |
|---|---|
| Hydrophobe | |
| Acides forts | Acides humiques et fulviques, acides d'alkyle monocarboxyliques et dicarboxyliques de masse moléculaire élevée, acides aromatiques |
| Acides faibles | Phénols (p. ex., lignine), tanins, acides d'alkyle monocarboxyliques et dicarboxyliques de masse moléculaire moyenne |
| Base | Protéines, amines aromatiques, amines d'alkyle de masse moléculaire élevée |
| Neutres | Hydrocarbures (p. ex., terpénoïdes), aldéhydes, diméthylcétones et alcools d'alkyle de masse moléculaire élevée, éthers, furannes, pyrrols |
| Hydrophile | |
| Acides | Hydroxyacides, sucres, sulphoniques, acides d'alkyle monocarboxyliques et dicarboxyliques de masse moléculaire faible |
| Base | Acides aminés, purines, pyrimidines, amines d'alkyle de masse moléculaire faible |
| Neutres | Protéines, glucides (p. ex., polysaccharides, alcools d'alkyle de masse moléculaire faible, aldéhydes et cétones), cellulose et dérivés cellulosiques |
|
|
B.2 Sources et présence de la matière organique naturelle
La concentration et les caractéristiques (c.-à-d. les propriétés chimiques, physiques et de biodégradabilité) de la MON peuvent être très variables en raison des nombreux processus hydrologiques et biogéochimiques qui touchent les sources de MON (Aiken et Cotsaris, 1995). Puisque le carbone est le constituant principal de la MON, le carbone organique particulaire (COP), dissous (COD) et total (COT) ont été considérés comme des mesures quantitatives des matières organiques particulaires, dissoutes et totales, respectivement. Dans la plupart des sources d'eau, le COD représente plus de 90 % du COT (Thurman, 1985). Le COD (c.-à-d. la MON colloïdale et dissoute) est généralement l'élément le plus problématique de la MON dans le traitement de l'eau (Karanfil et coll., 2005). La couleur a aussi été utilisée par le passé comme mesure des acides humiques et fulviques. D'autres paramètres pouvant être retenus pour mesurer et caractériser la MON sont présentés plus loin dans le présent document.
B.2.1 Sources
Il existe deux sources naturelles de MON : allochtone (c.-à-d. provenant de l'écosystème terrestre) et autochtone (c.-à-d. provenant des plantes et des microorganismes en croissance dans le plan d'eau) (Aiken et Cotsaris, 1995). Les activités anthropiques (d'origine humaine) peuvent aussi contribuer à la MON.
La MON allochtone est acheminée vers les milieux aquatiques à mesure que les précipitations se déplacent dans l'atmosphère et le couvert végétal, infiltrent les couches de sol organique et percolent à travers les couches de sol minéral (Aitkenhead-Peterson et coll., 2003). L'humus du sol, la litière végétale, la biomasse microbienne et les exsudats racinaires contribuent à la MON allochtone (Kalbitz et coll., 2000). Aitkenhead-Peterson et coll. (2003) ont estimé que la MON allochtone provient à 88 % des couches de sol organique, 7 % de la litière végétale et 1,5 % des exsudats racinaires et de la décomposition. En conséquence, la présence ou l'absence de couches de sol organique peut avoir un impact considérable sur les concentrations de MON (Kerekes et coll., 1982). La MON allochtone tend à être de nature hydrophobe. Ces facteurs et d'autres qui influent sur la concentration et les caractéristiques de la MON allochtone sont décrits au tableau C-3.1 du présent document.
La MON autochtone provient de phytoplancton, d'algues, de cyanobactéries et de macrophytes (c.-à-d. des plantes fixées sur le substrat des lacs et des cours d'eau ou enracinées dans ceux‑ci) qui peuvent représenter entre 5 et 100 % de la concentration de MON en fonction de certaines conditions (Bertilsson et Jones, 2003; Wetzel, 2003; Bade et coll., 2007; Tomlinson et coll., 2016). Si les intrants allochtones sont élevés, comme dans les sources d'eau colorée ou durant des épisodes de précipitations/fonte de la neige (c.-à-d. des conditions de débit d'orage), la proportion de MON autochtone est généralement faible. À l'inverse, si les intrants allochtones sont faibles, comme dans les sources d'eau claire ou durant des périodes de sécheresse où il y a très peu d'eaux de ruissellement, la proportion de MON autochtone est généralement élevée. La MON autochtone englobe un vaste éventail de composés, dont les monosaccharides et polysaccharides, les acides aminés, les peptides, les protéines, les acides nucléiques, les acides organiques, les lipides et les acides gras (Pivokonsky et coll., 2006, Henderson et coll., 2008). Le COD est généré par la production et la décomposition de la biomasse microbienne et végétale dans les sources d'eau (Nguyen et coll., 2002; Zhou et coll., 2014). Les algues ont tendance à dominer dans les grands lacs, alors que les macrophytes sont généralement le facteur majeur dans les petits lacs (Wetzel, 1992; Bertilsson et Jones, 2003). Les efflorescences d'algues et de cyanobactéries, en particulier, représentent une source de COD pouvant être périodique et intense. Les proliférations cyanobactériennes pourraient être liées à d'autres problèmes de qualité de l'eau imputables à la présence possible de toxines de cyanobactéries. La MON autochtone a tendance à être de nature hydrophile et riche en azote.
Les sources anthropiques de la MON comprennent les fosses septiques, le traitement des eaux usées et les rejets d'eaux pluviales, le ruissellement agricole et les rejets industriels. La MON anthropique serait en général de nature hydrophile (Imai et coll., 2001) et riche en azote (Dotson et Westerhoff, 2009; Mitch et coll., 2009). Les bassins versants fortement touchés par des sources anthropiques pourraient connaître une diminution de COT ou COD après une amélioration du traitement des eaux usées ou pluviales (Reckhow et coll., 2007).
Les concentrations de MON dans l'eau brute représentent l'effet net des processus hydrologiques et biogéochimiques dans le bassin versant ou l'aquifère (Eckhardt et Moore, 1990). La concentration et les caractéristiques de la MON et, par conséquent, sa traitabilité (c.‑à‑d. le potentiel d'enlevement) et sa réactivité (c.-à-d. le potentiel de formation de SPD), varient énormément d'une source à l'autre parce que chaque source d'eau possède ses propres caractéristiques. À titre d'exemple, Kerekes et coll. (1982) ont rapporté que deux lacs en Nouvelle-Écosse, à une distance de seulement 1 km l'un de l'autre, affichaient des concentrations de COT de 5,6 et 17,2 mg/L, respectivement. Dans le lac faible en COT, la période de rétention était de 1,27 année et il n'y avait pas de sols organiques, alors que dans le lac élevé en COT, la période de rétention était de 0,35 année et il s'y trouvait des sols organiques. Comme il est indiqué plus haut, les couches de sol organiques comptent pour environ 88 % de la MON allochtone, leur présence ou absence peut donc avoir un effet important sur les concentrations de carbone organique (Aitkenhead-Peterson et coll., 2003). En outre, les longues périodes de rétention tendent à abaisser la concentration de COD, comme le montre le tableau C-3.1. Néanmoins, Curtis et Adams (1995) ont rapporté que l'évapoconcentration de la MON réfractaire avait donné lieu à des concentrations plus élevées de COD avec une période de rétention dans les zones sous-humides et semi-arides en Alberta. D'autres chercheurs ont rapporté des constatations semblables à l'égard de la variabilité et des caractéristiques uniques de la MON dans le cas de sources situées à proximité les unes des autres (Aiken et Cotsaris, 1995; Ågren et coll., 2007; Reckhow et coll., 2007; Goss et Gorczyca, 2013; Kent et coll., 2014).
Les concentrations de MON sont en général inférieures dans les sources d'eaux souterraines parce que la matière organique est soumise à des processus d'adsorption et de dégradation microbienne à mesure qu'elle est transportée dans le sol (Aiken et Cotsaris, 1995; Aitkenhead-Peterson et coll., 2003). Ces processus sont toutefois limités par la quantité de MON biodégradable présente. Le reste de la MON tend à être de nature plus hydrophile et résistante (Diem et coll., 2013) et presque aussi réactive que la MON dans l'eau de surface sur une base de mg/L de COD (Owen et coll., 1995; Reckhow et coll., 2007; Tubić et coll., 2013).
En résumé, les conditions locales jouent un rôle très important dans l'établissement des concentrations et des caractéristiques de la MON (Bourbonniere, 1989; Mulholland, 2003; Reckhow et coll., 2007; Sillanpää, 2015). Les données relatives à la présence de MON présentées ci‑dessous mettent en évidence la variabilité possible, avec ou sans changement connexe de la concentration de COD. Les données montrent aussi que, bien que les eaux souterraines tendent à avoir des concentrations plus faibles de MON, certaines sources peuvent avoir des concentrations élevées.
B.2.2 Présence de MON
La concentration et les caractéristiques (c.-à-d. les propriétés chimiques, physiques et de biodégradabilité) de la MON peuvent être très variables en raison des nombreux processus hydrologiques et biogéochimiques qui exportent, génèrent ou dégradent la MON, tel que décrit dans le tableau C-3.1.
B.2.2.1 Concentration
La surveillance des données liées au COT et à la couleur de l'eau brute provenant des provinces et des territoires (tableau 2) montre la variabilité possible des concentrations de MON à l'échelle géographique et les tendances à la baisse de la couleur et des concentrations de COT dans les eaux souterraines (bien que certaines sources peuvent avoir des concentrations élevées). Le tableau 3 présente les données de surveillance du COD recueillies en 2009 et 2010 depuis des sources sélectionnées d'eau potable au Canada (Santé Canada, 2016a). Ces données montrent aussi des concentrations plus faibles de COD dans les eaux souterraines avec un changement minime entre les concentrations dans l'eau brute et l'eau traitée. Pour ce qui est de l'approvisionnement en eau de surface étudié, les concentrations de COD moyen dans l'eau traitée varient entre 3,2 à 3,4 mg/L en été et 2,8 à 3,5 mg/L en hiver. Le tableau C-3.2 présente des données de surveillance à long terme du COD d'Environnement Canada (2000–2015) pour des régions ou des bassins de rivière sélectionnés à la grandeur du Canada (Environnement Canada, 2017). Ces données montrent aussi que les concentrations de MON présentent une variabilité importante sur le plan spatial. Comme les conditions locales jouent un rôle très important dans l'établissement des concentrations et des caractéristiques de la MON, il est important que chaque source soit bien surveillée afin de saisir l'éventail complet des conditions pouvant se produire au cours de l'année.
| Province/territoire | COT (mg/L) |
Couleur (UCT/UCA/UC)Note de bas de page c |
|||
|---|---|---|---|---|---|
| Souterraine | De surface | Souterraine | De surface | ||
| Terre-Neuve-et-LabradorNote de bas de page a (LDMNote de bas de page b = 0,5 mg/L) (LDM = 2 UCT) |
Nbre de détections/ d'échantillons | 322/350 | 833/833 | 204/350 | 832/833 |
| Médiane | 1,2 | 6,5 | 6,0 | 43,0 | |
| Moyenne | 2,0 | 7,0 | 14,3 | 53,5 | |
| 90e percentile | 4,3 | 11,4 | 35,0 | 107,0 | |
| Nouvelle-Écosse (LDM = 0,5 mg/L) (LDM = 5 UCT) |
Nbre de détections/ d'échantillons | 53/126 | 136/140 | 50/152 | 142/149 |
| Médiane | 1,2 | 4,6 | 7,4 | 27,5 | |
| Moyenne | 2,3 | 5,8 | 11,7 | 43,5 | |
| 90e percentile | 6,7 | 10,9 | 22,0 | 86,7 | |
| Nouveau-Brunswick (LDM = 0,2 à 1,0 mg/L) (LDM = 1 à 5 UCT/UCA) |
Nbre de détections/ d'échantillons | 893/1 389 | 324/324 | 231/539 | 65/67 |
| Médiane | 2,0 | 4,8 | 14,2 | 37,0 | |
| Moyenne | 2,1 | 4,8 | 16,0 | 40,5 | |
| 90e percentile | 3,4 | 6,0 | 28,3 | 60,5 | |
| Québec (LDM = 0,2 mg/L) (LDM = 1 UCT) |
Nbre de détections/ d'échantillons | 129/129 | 91/91 | Aucune donnée n'a été fournie | 5/5 |
| Médiane | 2,8 | 6,0 | 52,0 | ||
| Moyenne | 3,1 | 6,2 | 53,2 | ||
| 90e percentile | 5,1 | 9,7 | 66,0 | ||
| Manitoba (LDM = 0,5 à 1,0 mg/L) (LDM = 5 UC) |
Nbre de détections/ d'échantillons | 564/723 | 456/458 | 225/721 | 433/458 |
| Médiane | 2,9 | 10,9 | 10,0 | 26,2 | |
| Moyenne | 4,0 | 11,6 | 14,0 | 31,5 | |
| 90e percentile | 8,2 | 16,2 | 30,0 | 60,0 | |
|
|||||
| Type de source | Type d'échantillon | COD (mg/L) en étéNote de bas de page a | COD (mg/L) en hiverNote de bas de page a | ||||||
|---|---|---|---|---|---|---|---|---|---|
| n | Médiane | Moyenne | 90e percentile |
n | Médiane | Moyenne | 90e percentile |
||
| Puits | Eau brute | 18 | 0,7 | 1,8 | 4,0 | 16 | 0,7 | 2,0 | 4,4 |
| Eau traitée | 17 | 0,8 | 1,6 | 4,3 | 15 | 0,8 | 1,7 | 4,5 | |
| Lac | Eau brute | 21 | 4,0 | 7,3 | 11,5 | 20 | 4,6 | 6,6 | 9,7 |
| Eau traitée | 21 | 2,8 | 3,2 | 5,2 | 20 | 2,4 | 3,5 | 5,6 | |
| Rivière | Eau brute | 26 | 5,9 | 7,2 | 14,2 | 21 | 4,7 | 5,8 | 10,0 |
| Eau traitée | 26 | 2,6 | 3,4 | 6,0 | 21 | 2,6 | 2,8 | 5,4 | |
|
|||||||||
B.2.2.2 Caractéristiques
Un certain nombre d'études ont caractérisé les fractions de MON dans plusieurs eaux de source canadienne (Montreuil, 2011; ministère de l'Environnement et de la Conservation de Terre-Neuve-et-Labrador, 2011; Lamsal et coll., 2012; Goss et Gorczyca, 2013). Ces études sont résumées au tableau C-3.3. Montreuil (2011) a étudié un lac en Nouvelle-Écosse et y a observé une variabilité temporelle importante dans les six fractions de MON alors que les concentrations de COD demeuraient faibles avec peu de variation. Goss et Gorczyna (2013) ont étudié une rivière au Manitoba et y ont aussi observé une variabilité temporelle importante dans les fractions de MON, mais avec des fluctuations dans les concentrations de COD. Les deux autres études ont montré que les caractéristiques de la MON peut varier grandement selon le lieu.
Les résultats de ces études de fractionnement montrent la variabilité qui peut survenir dans les caractéristiques de la MON, avec ou sans changement de la concentration de COD. En outre, les résultats indiquent que la fraction neutre hydrophile peut parfois comprendre une part importante de MON. Cette fraction peut s'avérer particulièrement problématique, comme il est expliqué dans les sections subséquentes.
La MON peut aussi être fractionnée en fonction de sa taille, comme il est souligné à la section B.5.2.4. Les propriétés de biodégradabilité de la MON sont présentées en détail dans les sections subséquentes.
B.3 Considérations environnementales
Des facteurs environnementaux pourraient changer la concentration de MON ou la contribution relative des intrants allochtones, autochtones ou anthropiques et modifier ainsi ses caractéristiques. Ces changements peuvent avoir une incidence sur les sources d'eau et les procédés de traitement de l'eau, comme il est présenté ci-dessous.
B.3.1 Effets saisonniers ou liés aux conditions météorologiques
Bon nombre de chercheurs notent une augmentation de la concentration de MON et un changement de ses caractéristiques à la suite de la fonte de la neige, du ruissellement printanier ou d'une pluie abondante (Gregory, 1998; Billica et Gertig, 2000; Tseng et coll., 2000; Goslan et coll., 2002; Volk et coll., 2002; Eikebrokk et coll., 2004; Fearing et coll., 2004a, 2004b; Hurst et coll., 2004; Chow et coll., 2006; Sharp et coll., 2006; Parsons et coll., 2007; Reckhow et coll., 2007; Kraus et coll., 2010; Carpenter et coll., 2013; Kundert, 2014; McVicar et coll., 2015; James et coll., 2016). Les concentrations de COD peuvent rapidement augmenter par un facteur de quatre à cinq durant des épisodes de précipitations et de fonte de la neige qui transportent la MON terrestre vers un plan d'eau (Thurman, 1985; Saraceno et coll., 2009). Les concentrations les plus élevées peuvent être observées en été et en automne, lorsque les températures sont plus élevées, l'activité biologique est élevée et les pluies torrentielles de forte intensité mais de courte durée sont fréquentes (Aitkenhead-Peterson et coll., 2003).
Les épisodes de précipitations et de fonte de la neige peuvent nuire grandement au procédé de coagulation, pour un certain nombre de raisons. Premièrement, les changements de la qualité de l'eau surviennent dans des conditions de débit d'orage qui créent des conditions difficiles de coagulation (p. ex., pH, alcalinité, force ionique, concentration d'ions divalents) (Gregory, 1998; Billica et Gertig, 2000; Tseng et coll., 2000; Davis et Edwards, 2014). Deuxièmement, on observe que la MON augmente avant des changements de turbidité ou de débit et qu'elle peut demeurer élevée une fois la turbidité et le débit revenus à leurs conditions de base (Soulsby, 1995; Hurst et coll., 2004; McVicar et coll., 2015; James et coll., 2016). Par conséquent, si la dose de coagulant est contrôlée en fonction du débit ou de la turbidité, elle pourrait être insuffisante et mener à des conditions de coagulation sous-optimales (Hurst et coll., 2004; Parsons et coll., 2007; Kundert, 2014; McVicar et coll., 2015; James et coll., 2016). Il est bien connu que les conditions de coagulation sous-optimales mènent à une diminution importante des taux d'enlevement logarithmique des pathogènes (Ongerth et Pecoraro, 1995; Patania et coll., 1995; Edzwald et Kelley, 1998; Coffey et coll., 1999; Emelko et coll., 1999; Dugan et coll., 2001; Harrington et coll., 2001; Huck et coll., 2001, 2002; Dai et Hozalski, 2002; Betancourt et Rose, 2004; Hendricks et coll., 2005; O'Melia, 2006; Hijnen et Medema, 2007). Les pluies torrentielles durant l'hiver ou le printemps peuvent être préoccupantes, car les basses températures peuvent réduire l'efficacité du procédé de coagulation (Hurst et coll., 2004).
Plusieurs études ont permis de constater l'apparition de maladies d'origine hydrique après des épisodes de précipitations extrêmes. Curriero et coll. (2001), ayant évalué la relation entre les épisodes de pluie et les maladies d'origine hydrique aux États-Unis, ont découvert que les éclosions étaient précédées d'épisodes de pluie au-delà du 90e percentile du cumul mensuel. Les éclosions imputables à une contamination des eaux de surface étaient plus importantes lorsque des précipitations extrêmes survenaient pendant le mème mois qu'une éclosion, tandis que les éclosions attribuables aux eaux souterraines étaient plus importantes lorsque des précipitations extrêmes survenaient deux mois avant l'éclosion. Au Canada, Thomas et coll. (2006) ont relevé que les épisodes de pluie au-dessus du 93e percentile du cumul de pluie sur une moyenne mobile de cinq jours augmentaient le risque d'une éclosion par un facteur de 2,3. Une étude en Angleterre a conclu que le risque d'éclosion était lié à deux situations : de faibles niveaux de précipitations au cours des trois semaines antérieures ou des précipitations excessives au cours de la semaine précédant l'éclosion (Nichols et coll., 2009). Drayna et coll. (2010) ont noté une corrélation significative entre les pluies et les visites au service d'urgence en raison de maladies gastro-intestinales infantiles aiguës dans une collectivité desservie par une eau de surface traitée; les visites ont augmenté de 11 % quatre jours après une précipitation.
Reckhow et coll. (2007) ont étudié 249 services d'eau de surface aux États-Unis desservant une population de 50 000 personnes ou plus pour déterminer si les orages ou les épisodes de fortes précipitations faisaient l'objet d'une surveillance en ce qui a trait à la qualité de l'eau, à l'écoulement et à la réponse du système. Les services d'eau ont répondu dans la négative dans une proportion de 60,6 %, 66,2 % et 82,4 %, respectivement, pour ces critères. Pellerin et coll. (2012) ont fait remarquer qu'une meilleure compréhension de la dynamique de la MON lors d'orages est nécessaire pour comprendre les facteurs et les effets dominants qu'elle a sur le traitement de l'eau et la qualité de l'eau potable.
B.3.2 Autres influences de l'environnement
Depuis plusieurs décennies une augmentation des concentrations de COD a été signalée en Amérique du Nord (Driscoll et coll., 2003; SanClements et coll., 2012), au Royaume-Uni (Evans et coll., 2005; Sharp et coll., 2006; Worrall et Burt, 2009), en Europe du Nord (Eikebrokk et coll., 2004) et au Japon (Imai et coll., 2001). Aux emplacements où le COD a augmenté, les eaux sont souvent aussi devenues plus colorées (Ekström et coll., 2011; Kritzberg et Ekström, 2012; Weyhenmeyer et coll., 2014).
Pagano et coll. (2014) ont mené une revue exhaustive des études sur la hausse des tendances du COD et ont noté que les chercheurs avancent que la diminution du dépôt acide atmosphérique (c.-à-d. contrôles des émissions de soufre) et les agents de changements climatiques sont deux considérations clés. Monteith et coll. (2007) ont examiné les données pour l'Amérique du Nord, le Royaume-Uni et l'Europe et ont relevé que la diminution du dépôt acide expliquait plus de 85 % de la hausse des tendances du COD, sauf au Royaume-Uni et à Terre-Neuve. Dans ces régions, l'augmentation des dépôts de sel de mer expliquait la baisse du COD dans certains secteurs. Les auteurs n'ont trouvé aucune tendance entre le COD et les agents de changements climatiques (p. ex., l'augmentation de la température et de la concentration atmosphérique de dioxyde de carbone). Ekström et coll. (2011) ont mené des expériences d'acidification sur des parcelles et ont confirmé que la réduction du dépôt acide donne lieu à des concentrations accrues de COD et de couleur, ce qui implique une hausse de la mobilité de la MON avec la limitation des émissions de soufre. En ce qui a trait à la couleur, cette tendance a été liée à la hausse des concentrations de fer (Kritzberg et Ekström, 2012) et à la complexation du fer avec le COD (Weyhenmeyer et coll., 2014). Toutefois, les mécanismes ne sont pas entièrement compris. Black et Christman (1963) ont aussi découvert que du fer était toujours présent avec la couleur, mais aucun lien n'a pu être établi entre le contenu en fer et la couleur.
Une augmentation des concentrations de COD ou de la couleur peuvent avoir des effets importants sur les services d'eau employant des procédés de coagulation et de filtration. Anderson et coll. (2017) ont signalé une augmentation quadruplée de la dose d'alun (c.-à-d. de 12,9 à 49,5 mg/L) ainsi qu'une augmentation de l'utilisation de chaux par un facteur de 1,75 dans des installations à grande échelle où la couleur est passée d'environ 20 en 1990 à environ 50 en 2015. Les auteurs ont aussi précisé que la capacité hydraulique de l'usine avait été réduite de 26 %. Parsons et coll. (2007) ont noté que la dose moyenne de coagulant à des installations à grande échelle au Royaume-Uni est passée d'environ 40 mg/L entre 1992 et 1997 à 70 à 100 mg/L entre 1998 et 2002 en raison de la couleur accrue. Eikebrokk et coll. (2004) ont mené une étude à l'échelle pilote et ont signalé qu'une hausse de 75 % de la couleur dans des eaux de faible turbidité (<0,3 UTN) a fait augmenter la dose de coagulant, la production de boues, le nombre de lavages à contre-courant et le COT résiduel de 64 %, 64 %, 87 % et 26 %, respectivement. En outre, les périodes de filtration et la capacité hydraulique ont été réduites de 47 % et 10 %, respectivement. Les auteurs prévoient aussi une consommation accrue de substances chimiques pour l'ajustement du pH et une croissance biologique accrue dans le réseau de distribution en raison des concentrations plus élevées de carbone organique résiduel. D'autres chercheurs ont remarqué que les concentrations plus élevées de carbone organique résiduel contribuent à la formation accrue de SPD (Imai et coll., 2001; Sharp et coll., 2006).
Une revue exhaustive des effets attendus des changements climatiques sur la traitabilité de la MON peut être consultée ailleurs (Ritson et coll., 2014). On s'attend à ce que les régions arctique et subarctique réagissent différemment en comparaison avec les régions tempérées (Pagano et coll., 2014).
B.4 Effet de la matière organique naturelle
Bien que la MON n'ait pas d'effet direct sur la santé, elle influe de façon importante sur le traitement de l'eau potable et peut contribuer à des effets indirects sur la santé, ainsi qu'à des problèmes opérationnels et esthétiques.
B.4.1 Effets indirects sur la santé
B.4.1.1 Réductions logarithmiques des pathogènes
Le traitement de l'eau potable comprend habituellement des procédés d'enlevement mécanique (clarification ou filtration par exemple) auxquelles sont attribuées des taux (crédits) « d'enlevement logarithmique » de pathogènes, et des procédés d'inactivation (c.-à-d. désinfection primaire) auxquelles sont attribuées des taux « d'inactivation logarithmique ». La MON a des effets importants sur les deux.
En ce qui a trait aux procédés de clarification et de filtration avec procédé chimique, la MON exerce une demande de coagulant qui doit être satisfaite avant qu'il ne se forme des flocons et en conséquence la MON interfére avec l'enlevement de la turbidité (Hall et Packham, 1965; Semmens et Field, 1980; Dempsey et coll., 1984; Edwards et Amirtharajah, 1985; Amy et coll., 1989; Edzwald et Van Benschoten, 1990; White et coll., 1997; Shin et coll., 2008). James et coll. (2016) ont signalé la présence de Cryptosporidium et une augmentation du nombre de particules (2 à 5 μm, 5 à 10 μm et 10 à 15 μm) dans une usine de traitement par filtration directe à pleine échelle en raison d'une augmentation de la couleur dans la source d'eau. McVicar (2014) a noté un sous-dosage de coagulant, en effectuant une surveillance du courant d'écoulement et de l'absorbance UV à 254 nm (UV254), à une usine de traitement par flottaison à l'air dissous à grande échelle durant trois épisodes de pluies torrentielles. La turbidité de l'eau filtrée a aussi augmenté durant ces épisodes, mais elle est demeurée inférieure à 0,244 UTN et 0,175 UTN pour les filtres 1 et 2, respectivement. D'autres chercheurs ont relevé la présence de particules de moins de 2 μm à l'échelle pilote durant des périodes de COT élevé (Billica et Gertig, 2000; Carlson et Gregory, 2000). Plusieurs autres études (Ongerth et Pecoraro, 1995; Patania et coll., 1995; Dugan et coll., 2001; Huck et coll., 2001) ont signalé que l'enlevement de Cryptosporidium par clarification/filtration peut se dégrader considérablement lorsque les conditions de coagulation ne sont pas optimales (p. ex., l'efficacité du traitement a diminué par un facteur de 2,0 à 3,4 logs par comparaison avec les conditions optimales).
Il est bien connu que la MON exerce une demande de produit chimique oxydant (c.-à-d. chlore, dioxyde de chlore, ozone) qui doit être satisfaite avant que les exigences relatives à l'inactivation logarithmique des pathogènes ne puissent l'être (AWWA, 2011a; MWH, 2012). En conséquence, une désinfection est généralement pratiquée après les procédés de traitement qui servent à enlever la MON. Cette stratégie contribue à assurer l'inactivation efficace des pathogènes et réduit au minimum la formation de SPD (voir la section B.4.1.2). Des informations supplémentaires sur la façon dont la MON influe sur la demande en oxydant, la décantation et la désinfection sont publiées ailleurs (Santé Canada, 2009a, 2018a).
Plusieurs études ont examiné l'effet des particules sur l'efficacité de la désinfection aux rayons UV; dans la majorité des cas, on a conclu que la réaction des microorganismes à la dose de rayons UV n'était pas influencée par des variations de turbidité de 10 UTN ou moins (Christensen et Linden, 2002; Batch et coll., 2004; Mamane-Gravetz et Linden, 2004; Passantino et coll., 2004). Cependant, on a constaté que la présence de particules d'acides humiques et de coagulants influe considérablement sur l'efficacité de la désinfection aux rayons UV, l'inactivation obtenue étant plus faible en présence de ces substances. Templeton et coll. (2005, 2007) ont découvert que dans des échantillons d'influents non filtrés (fourchette = 4,4 à 9,4 UTN), la désinfection aux rayons UV des bactériophages en présence de particules d'acide humique était réduite de façon statistiquement significative (≈ 0,5 log) en comparaison avec une eau sans particule. Templeton et coll. (2005) ont aussi découvert que les particules organiques qui absorbent les rayons UV (c.-à-d. la MON) protégeaient contre la lumière UV les bactériophages liés aux particules, alors que les particules inorganiques de kaolinton (c.-à-d. la turbidité) ne le faisaient pas. Le degré de protection dépend fort probablement du type de particules (p. ex., la taille, la structure, la composition chimique), du nombre de grosses particules (p. ex., 25 µm et plus), du degré d'agrégation des pathogènes avec la matière particulaire et du degré d'inactivation souhaité par rapport au degré de turbidité (Caron et coll., 2007; Hargy et Landry, 2007; Templeton et coll., 2008; Kollu et Örmeci, 2012). En outre, la transmittance UV à une longueur d'onde de 254 nm subit les effets des matières dissoutes et particulaires qui inhibent la pénétration de la lumière UV dans l'eau. En général, chaque baisse de 10 % de la transmittance des ultraviolets se traduit par une réduction de 50 % de la dose de rayons UV (Hofmann, 2008). En conséquence, le débit dans un réacteur UV doit être réduit, augmentant ainsi le nombre de réacteurs requis pour satisfaire aux exigences liées à l'inactivation logarithmique des pathogènes. Un prétraitement destiné à enlever la MON pourrait être nécessaire pour répondre à la spécification du fabricant quant à la transmittance minimale des rayons UV afin de respecter les exigences liées à l'inactivation logarithmique des pathogènes et d'assurer le fonctionnement sécuritaire de l'équipement.
Il est important que les services d'eau comprennent les réductions logarithmiques des pathogènes pouvant être réalisées dans des conditions d'exploitation optimales et l'effet des perturbations du système de traitement à court et à long terme (Hurst et coll., 2004). L'application de l'« indice de robustesse » suggérée par Huck et coll. (2001) fournit un moyen simple et pratique de repérer des événements et des périodes où les procédés de coagulation et de clarification deviennent instables. Il existe aussi de l'information sur la façon d'utiliser une évaluation quantitative du risque microbien (ÉQRM) pour évaluer la robustesse des procédés d'enlevement mécanique ou des procédés d'inactivation (Santé Canada, 2018b).
B.4.1.2 Formation de sous-produits de désinfection
Les désinfectants chimiques réagissent avec la MON pour former des SPD potentiellement nocifs (Rook, 1974; Stevens et coll., 1976). Après bon nombre d'années de recherche, il est généralement reconnu que toutes les fractions de MON contribuent à la formation de SPD, même si certaines fractions forment plus de SPD que d'autres (Hoehn et coll., 1980; Croué et coll., 1993; Owen et coll., 1993, 1995; Martin-Mousset et coll., 1997; Goslan et coll., 2002; Liang et Singer, 2003; Hua et Reckhow, 2007a; Bond et coll., 2014; Hua et coll., 2014). Il est aussi reconnu que les voies de formation et les taux de réaction sont différents pour les trihalométhanes (THM) et les acides haloacétiques (AHA) (Reckhow et Singer, 1984; Liang et Singer, 2003; Hua et Reckhow, 2007a; Bond et coll., 2012). Ainsi, Plourde-Lescelleur et coll. (2015) ont observé des rapports de formation potentielle de THM et d'AHA de 0,66 à 3,35 pour six sources canadiennes d'eau de surface (conditions d'essai = pH à 8,0, chlore résiduel à 1,0 mg/L à 22 °C pendant 24 h). Archer et Singer (2006a) ont noté qu'à mesure que la fraction hydrophile augmente, il se forme plus de THM que d'AHA.
D'autres facteurs influent sur la formation de SPD, notamment : la température de l'eau, le pH, les conditions de désinfection (c.-à-d. le désinfectant, la dose, le temps de contact, le résiduel de désinfectant) et la présence d'espèces réactives comme le bromure, l'iodure, l'ammoniac et le soufre (Liang et Singer, 2003; Ates et coll., 2007; Hua et Reckhow, 2007b; Reckhow et coll., 2007; Fabris et coll., 2008; Kristiana et coll., 2009). Il a été démontré que le bromure, en particulier, augmentait les taux de formation de SPD par un facteur de trois à dix (Symons et coll., 1993; Westerhoff et coll., 2004; Heeb et coll., 2014). En conséquence, des concentrations de COD similaires peuvent produire un vaste éventail de concentrations de SPD selon les caractéristiques et la réactivité de la MON (Fabris et coll., 2008). Par exemple, Hua et Reckhow (2007a) ont relevé que la réactivité de l'eau brute pour Winnipeg, au Manitoba, (COD = 7,9 mg/L; bromure <10 µg/L) se situait à environ la moitié de celle de Repentigny, au Québec (COD = 7,1 mg/L; bromure = 46 µg/L). Dans certains cas, la MON est riche en azote et elle contribue à la formation de SPD azotés (SPD-N) (Leenheer et Croué, 2003; Mitch et coll., 2009). Des précipitations peuvent aussi transporter du COD riche en précurseurs, augmentant ainsi les concentrations de SPD (Goslan et coll., 2002; Fearing et coll., 2004a, 2004b; Reckhow et coll., 2007; Kraus et coll., 2010; Delpla et Rodriguez, 2016; Wright et coll., 2016).
Bond et coll. (2011, 2012) ont réalisé une revue exhaustive de la littérature et ils ont résumé le potentiel de divers composants de la MON à former des THM, des AHA et des SPD-N comme le montre le tableau 4. Reckhow et coll. (2007) ont constaté que les tanins et les lignines étaient des précurseurs importants, représentant 60 % et entre 25 et 30 % du potentiel de formation des THM, respectivement. Les auteurs ont aussi avancé que les protéines pourraient être des précurseurs importants au cours des premières phases de la formation de la MON, mais qu'elles se biodégraderaient (voir la section B.4.1.3) et les terpénoïdes les remplaceraient en tant qu'autre source importante de précurseurs de THM.
| Précurseur | Potentiel d'enlevement par coagulation | Potentiel de formation | ||
|---|---|---|---|---|
| THM | AHA | SPD-N | ||
| Acides humiques et fulviques | Élevé | Source primaire | Source primaire | Possiblement importants pour les halonitrométhanes |
| Acides carboxyliques | Moyen | Espèces de β-dicarbonyl comme précurseurs importants | Espèces de β-dicarbonyl comme précurseurs importants | Probablement mineur |
| Acides aminés | Faible | Faibles sauf pour deux composésNote de bas de page b | Importants pour certains composésNote de bas de page c | Important |
| Protéines | Faible | Variable; important durant les efflorescences d'algues | Inconnu; pourrait être important | Incertain |
| Glucides | Faible | Important à un pH de 8 | Probablement mineur | Négligeable |
|
||||
Il est important que les services d'eau comprennent la réactivité de la MON propre à la source lorsqu'ils choisissent un désinfectant, afin d'atténuer la formation de SPD potentiellement nocifs (Hua et Reckhow, 2007a). Il peut être utile de déterminer le rendement de SPD spécifiques (c.-à-d. μg de SPD/mg de COD) parce que l'enlevement du COD est en général plus facile à réaliser qu'une baisse de la réactivité, surtout en présence de bromure (Croué et coll., 1993; Goslan et coll., 2002; Reckhow et coll., 2007; Fabris et coll., 2008; Tubić et coll., 2013). Différentes mesures d'atténuation pourraient s'avérer nécessaires pour réduire un groupe de SPD par rapport à un autre groupe, selon la réactivité de la MON; des technologies ciblant l'enlevement de certaines fractions de MON pourraient être nécessaires (Bond et coll., 2011). En outre, Kastl et coll. (2016) ont noté que les exigences d'enlevement de la MON devraient être liées aux conditions du réseau de distribution. Ainsi, un réseau de distribution avec un temps de séjour de 7 jours et une température supérieure à 15 °C supposera un niveau d'enlevement de la MON différent pour respecter les seuils recommandés de SPD par rapport à un réseau ayant un temps de séjour de 3 jours et une température supérieure à 4 °C (Rodiguez et Sérodes, 2001; Kastl et coll., 2016).
Des études de traitabilité propres à la source, notamment des analyses du potentiel de formation de SPD, devraient être réalisées au moment d'évaluer différentes mesures d'atténuation ou d'autres options de traitement. Pour s'assurer qu'une stratégie efficace de contrôle de la MON est mise en place, l'étude de traitabilité doit être conçue spécifiquement pour : 1) évaluer les variations saisonnières de la MON; et 2) être représentative des conditions dans le réseau de distribution. Il est important de souligner que les documents techniques portant sur les THM et les AHA précisent que les services d'eau doivent tout faire pour maintenir les concentrations au niveau le plus bas qu'il soit raisonnablement possible d'atteindre. Le but de la stratégie de contrôle de la MON devrait donc être de réduire les concentrations des précurseurs au niveau le plus bas qu'il soit raisonnablement possible d'atteindre. Il est essentiel que les efforts visant à réduire la formation de SPD ne nuisent pas à l'efficacité de la désinfection. De plus amples renseignements peuvent être obtenus dans les documents techniques sur les THM, les AHA, le chlore/chlorate, la N-nitrosodiméthylamine et le bromate (Santé Canada, 2006, 2008a, 2008b, 2011, 2018a).
B.4.1.3 Stabilité biologique
La stabilité biologique de l'eau potable fait référence au concept de maintien de la qualité microbiologique de l'eau du point de production jusqu'au point de consommation (Prest et coll., 2016). Les organismes hétérotrophes constituent la majorité des bactéries dans l'eau potable et ils tirent leur énergie de la croissance, la multiplication et la production de matières de la matrice de biofilm provenant de la dégradation des composés de carbone organique (Vu et coll., 2009; Prest et coll., 2016). La matière organique biodégradable (MOB) favorise la croissance bactérienne et la formation de biofilms dans le réseau de distribution et la plomberie des bâtiments, ce qui peut conduire à des problèmes importants pour la santé publique. Les biofilms constituent un habitat propice à la survie des pathogènes d'origine fécale susceptibles d'avoir franchi les barrières de traitement de l'eau potable ou d'être entrés directement dans le réseau de distribution en raison d'une rupture de l'intégrité des conduites (Leclerc, 2003). Il a été démontré que les virus et les protozoaires entériques peuvent être détectés dans les biofilms (Howe et coll., 2002; LeChevallier, 2003; Chang et Jung, 2004); bien que ces organismes ne peuvent croître dans ce milieu, ils peuvent s'accumuler et être libérés pendant une longue période (Howe et coll., 2002; Warnecke, 2006; Wingender et Flemming, 2011). En outre, des pathogènes opportunistes dans la plomberie des bâtiments, comme la Legionella pneumophila et les mycobactéries non tuberculeuses (p. ex., M. avium, M. intracellulare), se sont adaptés pour croître et persister dans les biofilms dans les réseaux de distribution et la plomberie. Les biofilms peuvent aussi créer des difficultés pour maintenir un niveau adéquat de désinfectants résiduels et ils peuvent contribuer à la nitrification dans le réseau de distribution si de la chloramine est employée (Wilczak, 2006).
Même si les microorganismes dans les biofilms consomment d'abord les composants dont les demi-vies de biodégradation sont les plus courtes, ils peuvent consommer tout type de composant de la MON qui quitte les installations de traitement, pour soutenir leur croissance dans le réseau de distribution (Fischer, 2003; Camper, 2014). Le tableau 5 résume la demi-vie de biodégradation des composants de la MON (Reckhow et coll., 2007).
Les procédés de traitement influent aussi grandement sur la composition et la concentration des nutriments organiques. Ainsi, des oxydants tels que le chlore et l'ozone produisent des produits biodégradables lorsqu'ils réagissent avec la MON (Alarcon-Herrera et coll., 1993; Bursill, 2001; Reckhow et coll., 2007). Il est bien connu que l'ozone transforme la MON en MOB (Owen et coll., 1993, 1995) de façon telle qu'une filtration biologique active pourrait être nécessaire pour stabiliser l'eau traitée (GLUMRB, 2012). Le chlore peut aussi réagir avec une matière organique et accroître les quantités de carbone organique assimilable (COA) et de COD biodégradable (CODB), ainsi qu'aggraver le problème de croissance des biofilms dans les réseaux de distribution (Drikas et coll., 2003; Reckhow et coll., 2007; Croft, 2012; Camper, 2014).
| Composant | Demi-vie de biodégradation (jours) |
|---|---|
| Sucres et amidons | 2 |
| Protéines | 8 |
| Hémicellulose | 25 |
| Cellulose | 40 |
| Lipides (p. ex., graisses et cires) | 60 |
| Lignines | 150 |
| Tanins | 200 |
| Terpénoïdes (p. ex., géosmine et 2-méthylisobornéol) | 400 |
|
|
Quelques publications ont mesuré cet aspect et les valeurs numériques signalées variaient d'un site à l'autre (Camper, 2014). LeChevallier et coll. (1992) ont observé des hausses de COA de 20 % et 44 % lorsque des échantillons d'eau filtrée par charbon actif et de sable traités avec 1 mg/L de chlore libre ou 2 mg/L de monochloramine pendant 30 minutes, respectivement. Zacheus et coll. (2001) ont présenté des valeurs de production de biomasse pour 16 réseaux de distribution à échelle réelle en Finlande. La production moyenne passait de 0,22 ng de carbone/L/h dans l'eau à la sortie des installations de traitement à 1,0 ng de carbone/L/h dans le réseau de distribution. Liu et coll. (2002) ont remarqué que les variations de COA dans les réseaux de distribution étaient influencées par l'oxydation au chlore (augmentation de COA) et l'activité bactérienne (baisse de COA). Des tendances différentes ont été observées dans différents réseaux de distribution et selon les saisons. Dans un réseau, les auteurs ont observé une augmentation de 120 % de la concentration de COA entre l'usine de traitement et l'extrémité du réseau de distribution durant le mois de décembre, alors qu'une baisse de 35 % de la concentration de COA a été observée aux mêmes endroits au printemps de l'année suivante (Liu et coll., 2002).
Dans le réseau d'approvisionnement en eau potable en Amérique du Nord, des seuils minimes de désinfectant résiduel sont en général recommandés pour contrôler la croissance des biofilms (LeChevallier et coll., 1996; LeChevallier et Au, 2004). Dans certains pays européens, l'approche adoptée pour atteindre une stabilité biologique passe par la réduction dans l'eau des nutriments soutenant la croissance (Lautenschlager et coll., 2013). Aux Pays-Bas, les entreprises d'approvisionnement en eau cherchent à limiter la reviviscence dans l'eau distribuée en l'absence de désinfectant résiduel en respectant des cibles strictes de COA (10 μg/L) (Lautenschlager et coll., 2013). Les niveaux de MOB (p. ex., COA, CODB) sont un facteur important dans la biostabilité de l'approvisionnement en eau potable, tout en étant qu'un seul élément influant sur les changements de la qualité de l'eau (Prest et coll., 2016). On a relevé d'autres composés jouant un rôle dans le contrôle de la croissance microbienne dans le réseau de distribution, dont le phosphore, l'ammoniac, le manganèse, le fer et les substances humifères (Camper, 2004; Prest et coll., 2016).
De multiples facteurs influent sur la biostabilité de l'eau distribuée : le type et la concentration des nutriments organiques et inorganiques; le type et la concentration de désinfectant résiduel; les biofilms et les sédiments et les conditions dans le réseau de distribution (p. ex., la désintégration du résidu de désinfectant, la température de l'eau, le temps de séjour, les conditions hydrauliques, la matière et le diamètre des tuyaux, le pH, le taux de corrosion) (LeChevallier et coll., 2015a; Prest et coll., 2016).
On peut trouver ailleurs des examens exhaustifs de la stabilité biologique (Prévost et coll., 2005; van der Kooij et van der Wielen, 2014; LeChevallier et coll., 2015a, 2015b; Prest et coll., 2016). En général, les stratégies visant à améliorer la biostabilité et réduire la formation de biofilms dans le réseau de distribution et la plomberie des bâtiments comprennent l'enlevement optimisée de la MON; le maintien d'un résidu de désinfectant efficace; le maintien de niveaux faibles d'indicateurs de biostabilité dans l'eau traitée (p. ex., COA, CODB, taux de formation des biofilms); le contrôle de la corrosion et la gestion de la température de l'eau.
B.4.1.4 Effets de la corrosion
La corrosion est la détérioration d'un matériau, résultant de son interaction avec son environnement. La corrosion dans les réseaux de distribution d'eau potable peut être causée par plusieurs facteurs, y compris le type de matériaux utilisés pour les tuyaux et les raccords, l'âge de la tuyauterie et des raccords, le temps de stagnation de l'eau et la qualité de l'eau dans le réseau, dont son pH et son alcalinité. La température et les teneurs en calcium, en chlore libre résiduel, en chloramines, en chlorure, en sulfate et en MON constituent d'autres paramètres de la qualité de l'eau potable pouvant influer sur la corrosion (Santé Canada, 2009b).
Il a été démontré que la MON influe sur la corrosion du plomb et du cuivre (Korshin et coll., 1996, 2000, 2005; Edwards et Sprague, 2001; Dryer et Korshin, 2007; Liu et coll., 2009; Valentine et Lin, 2009; Schock et Lytle, 2011; Arnold et coll., 2012; Zhou et coll., 2015; Masters et coll., 2016). Les effets de la MON sur des surfaces métalliques peuvent être variés. La MON peut servir de pellicule de protection, diminuer la corrosion (en particulier sur de longues périodes), ou elle peut augmenter la corrosion par divers mécanismes : 1) la MON pourrait s'associer à des ions calcium et empêcher la formation d'une couche protectrice; ou 2) la MON pourrait agir comme source de nourriture pour des microorganismes qui pourraient, à leur tour, s'attaquer à la surface de la tuyauterie et accroître la corrosion (Schock et Lytle, 2011).
Schock et coll. (1996) ont mis en évidence divers effets de la MON sur la solubilité du plomb et du cuivre. Dans certaines situations, on a observé que la MON formait des complexes organiques solubles avec le plomb, résultant en une augmentation des concentrations de plomb dissous. La MON peut aussi se fixer par adsorption/adhérer à la surface intérieure de la tuyauterie en plomb, réduisant la solubilité du plomb. Korshin et coll. (2005) ont démontré que la MON peut influer à la fois sur la morphologie (structure physique) et la distribution par taille des particules de plomb et peut prévenir ou réduire la formation des dépôts plus stables de cérusite et d'hydrocérusite. On a observé que la MON prévenait la formation de cérusite et réduisait la formation d'hydrocérusite (c.-à-d. on a observé des cristaux imparfaits et dispersés). Plus précisément, en l'absence de MON, environ 90 % des particules de plomb mesuraient plus de 5 µm. L'ajout de MON a diminué la taille des particules, les grosses particules ayant éclaté en raison de l'accumulation de la charge superficielle. Les hausses les plus marquées de la concentration de plomb soluble ont été observées entre 0 et 3,5 mg/L de COD (Korshin et coll., 2005) et entre 0 et 2 mg/L de COD (Korshin et coll., 2000). Dans une expérience réalisée selon un plan factoriel, Zhou et coll. (2015) ont observé que les augmentations de MON (de 1 à 7 mg/L de COD) ont mené à des hausses importantes de rejet de plomb lors de simulations de remplacement partiel des conduites de plomb. Dans le cadre de travaux récents en laboratoire menés par Trueman et coll. (2017), les auteurs ont observé que la présence d'acide humique a fait augmenter le rejet de plomb provenant de coupons de plomb, tant à la suite d'une corrosion uniforme que d'une corrosion galvanique. Même si l'ajout d'orthophosphate a réduit le rejet de plomb, l'ajout de substances humifères a rendu l'orthophosphate moins efficace. Les auteurs ont suggéré que la complexation du plomb et de substances humifères inhibe la précipitation du plomb avec le phosphate.
De même, on a observé que la MON augmentait les rejets de cuivre, même à des concentrations faibles (0,1 à 0,2 mg/L de COD), et ce, même si le rapport entre le COD et les rejets de cuivre n'a pas semblé linéaire (Korshin et coll., 1996). Les auteurs ont avancé que la MON s'adsorbe sur les structures de cristal inorganique à des concentrations élevées de COD, causant une mobilisation et une dispersion, alors qu'à de très faibles concentrations, la MON ne peut couvrir toute la surface, ce qui conduit à des plaques éparses de produit cristallin et crée des conditions de piqûres du cuivre. Les effets en apparence contradictoires de la MON sur les rejets de cuivre ont été étudiés en détail par Edwards et Sprague (2001). Les auteurs ont observé que la MON interfère avec le vieillissement des tuyaux par la formation d'hydroxyde de cuivre, de carbonate de cuivre et de complexes cuivre-MON plus solubles qui préviennent la formation de la malachite qui est plus stable. Le vieillissement des tuyaux de cuivre est un facteur important dans le contrôle des rejets de cuivre, les tuyaux de cuivre plus âgés étant associés à des incrustations de ténorite et de malachite plus stables (Lagos et coll., 2001; Edwards et McNeill, 2002). La MON peut aussi protéger le cuivre, en agissant comme source de nourriture pour les bactéries, consommant l'oxygène dissous et déclenchant le redépôt du cuivre en présence d'un catalyseur approprié (Edwards et Sprague, 2001). La présence de MON peut mener à des rejets moindres de cuivre, car la MON peut se fixer sur les surfaces fraîches de tuyaux de cuivre, ce qui diminue la capacité de complexation du cuivre soluble et cause un redépôt (Edwards et Sprague, 2001). En pratique, Arnold et coll. (2012) ont démontré que l'enlèvement de la MON était une méthode efficace pour réduire les problèmes d'eau bleue dans une école dotée d'une nouvelle plomberie en cuivre. Les auteurs ont suggéré que l'enlèvement de la MON avait accéléré le processus de vieillissement naturel.
Peng et coll. (2013) ont observé une augmentation des rejets de fer en présence de MON (COD = 1 mg/L) et que d'autres matières inorganiques (plomb, vanadium, chrome, cuivre et arsenic) pourraient être libérées par le fer à divers niveaux de chlorure (0 à 250 mg/L).
Les interactions entre la MON et les surfaces métalliques sont complexes, de multiples facteurs influant sur les interactions, comme la durée d'exposition et le pH (Korshin et coll., 2005; Liu et coll., 2009). On a aussi observé que les caractéristiques de la MON sont importantes en ce qui concerne les rejets de plomb et de cuivre (Willison et Boyer, 2012) et sans conséquence dans le cas du plomb (Dryer et Korshin, 2007). D'autres recherches sont nécessaires pour explorer l'effet important et les mécanismes de la MON et des rejets de métaux, tant dans le réseau de distribution que dans les matériaux utilisés pour la plomberie des bâtiments. Les chercheurs recommandent couramment l'enlevement de la MON pour réduire les concentrations de plomb et de cuivre (Valentine et Lin, 2009; Arnold et coll., 2012; Zhou et coll., 2015). D'autres informations sur le contrôle de la corrosion, le plomb et le cuivre peuvent être consultées ailleurs (Santé Canada, 2009b, 2017, 2018c).
B.4.2 Enjeux opérationnels
B.4.2.1 Procédé de coagulation
L'objectif de la coagulation est de déstabiliser (c.-à-d. de neutraliser la charge) les particules colloïdales (y compris les pathogènes) afin qu'elles s'agglomèrent bien pendant la floculation et soient par la suite éliminées par clarification ou filtration. La coagulation intervient aussi dans l'enlevement de la MON par un changement de phase qui convertit la matière organique dissoute en particules directement par précipitation ou adsorption sur des particules créées par le coagulant (Edzwald et Haarhoff, 2012). Si des coagulants métalliques sont ajoutés à l'eau, des réactions chimiques se produisent, tant avec les particules que la MON. Par conséquent, lorsqu'un coagulant est ajouté, la MON agit comme un ligand qui s'associe aux ions métalliques chargés positivement, exerçant une demande de coagulant devant être satisfaite avant que la floculation ne se produise (Edzwald et Haarhoff, 2012). Les caractéristiques de la MON influent beaucoup aussi sur le procédé de coagulation. Par exemple, il faut doubler la dose de coagulant pour favoriser la coagulation de concentrations de masse équivalente d'acides fulviques par comparaison avec les acides humiques (Edzwald, 1993; Rigobello et coll., 2011).
Par conséquent, la coagulation devrait être perçue comme un procédé « intégré » qui prend en considération à la fois la MON et les particules (c.-à-d. la turbidité) tout en tenant compte de leurs différentes caractéristiques de coagulation (Edzwald et Haarhoff, 2012). À titre d'exemple, en ce qui a trait aux conditions du pH de la plupart des sources d'eau (pH 6 à 8), la MON et les particules ont une charge négative qui devient plus négative avec l'augmentation du pH. Néanmoins, la charge négative de la MON se situe en général entre 5 et 15 µeq/mg de carbone, alors que celle des particules varie de 0,05 à 0,5 µeq/mg de carbone, selon le type de particule (Edzwald, 1993). Pernitsky (2003) a estimé la charge de la MON et des éléments des particules d'une variété de sources d'eau dans le but de démontrer que, dans la plupart des cas, la dose de coagulant est contrôlée par la MON, non pas par la turbidité. La turbidité doit augmenter substantiellement, en l'absence d'une augmentation connexe de la MON, pour que la turbidité contrôle la dose de coagulant. Comme les concentrations de MON peuvent augmenter rapidement, de quatre à cinq fois, durant des épisodes de fortes précipitations, il est important que les services d'eau aient une bonne compréhension de l'effet de la MON sur la dose de coagulant (Edzwald, 1993; Pernitsky, 2003; Hurst et coll., 2004 McVicar et coll., 2015; James et coll., 2016). Le fait de ne pas ajuster la dose de coagulant en fonction d'un changement de la MON peut contribuer à des conditions de coagulation sous-optimales et une baisse de la capacité d'enlevement logarithmique des pathogènes (Edzwald, 2017).
Étant donné l'importance de la chimie de coagulation pour assurer l'enlevement logarithmique des pathogènes, les services d'eau doivent tenir compte de la MON et de la turbidité au moment de définir le pH optimal et les conditions de dose de coagulant (Edzwald, 1993; Edzwald et Tobiason, 1999; Edzwald et Haarhoff, 2012). Les essais de floculation sont l'une des techniques les plus couramment employées pour simuler un traitement par coagulation et pour déterminer le potentiel de coagulation d'une source d'eau (Black et Willems, 1961; Chow et coll., 2004). Il est à noter cependant que certaines fractions de MON ne peuvent être enlevées par coagulation, peu importe le pH ou la dose (Kavanaugh, 1978; Babcock et Singer, 1979; Owen et coll., 1993, 1995; Volk et coll., 2002; Chow et coll., 2004, 2006; Carpenter et coll., 2013). Il existe ailleurs des présentations plus détaillées sur les principes de la coagulation et l'optimisation du procédé (Edzwald et Van Benschoten, 1990; Edzwald, 1993; Gregor et coll., 1997; Edzwald et Tobiason, 1999; Pernitsky, 2003; Eikebrokk et coll., 2006; Dempsey, 2006; Pernitsky et Edzwald, 2006; Edzwald et Kaminski, 2009; AWWA, 2011a, 2011b; Edzwald et Haarhoff, 2012; Davis et Edwards, 2014).
B.4.2.2 Filtration sur membranes
La MON a été observée dans de nombreuses études comme étant responsable de l'encrassement des membranes, ce qui nuit considérablement aux opérations de traitement de l'eau. Il est généralement reconnu que la fraction neutre hydrophile de la MON, comprenant des polysaccharides et des protéines sous forme macromoléculaire ou colloïdale (c.-à-d. les biopolymères) est responsable de l'encrassement des membranes (Carroll et coll., 2000; Cho et coll., 2000; Fan et coll., 2001; Kimura et coll., 2004; Lee et coll., 2006; Her et coll., 2007; Amy, 2008; Kennedy et coll., 2008; Hallé et coll., 2009; Peldszus et coll., 2011; Croft, 2012; Chen et coll., 2014; Kimura et coll., 2014; Rahman et coll., 2014; Siembida-Lösch et coll., 2014, 2015; Yamamura et coll., 2014; Chon et Cho, 2016). Aucune corrélation n'a été observée entre l'encrassement et :
- la MON hydrophobe (Cho et coll., 2000; Croft, 2012; Rahman et coll., 2014);
- la turbidité (Hallé et coll., 2009; Peldszus et coll., 2011; Croft, 2012; Kimura et coll., 2014; Rahman et coll., 2014);
- le COD (Kimura et coll., 2014; Rahman et coll., 2014);
- l'absorbance UV (Kimura et coll., 2014);
- la concentration de calcium (Amy et Cho, 1999; Kennedy et coll., 2008; Kimura et coll., 2014).
On suppose qu'une fois l'encrassement amorcé par des biopolymères, une baisse des forces électrostatiques permet à la MON hydrophobe de s'adsorber aux membranes causant ainsi un encrassement accru (Peldszus et coll., 2011; Croft, 2012; Chon et Cho, 2016). Rahman et coll. (2014) ont indiqué que des concentrations de biopolymères aussi faibles que 0,1 mg/L donnaient lieu à un encrassement réversible (c.-à-d. pouvant être enlevé par lavage à contre-courant/par injection d'air) et irréversible (c.-à-d. pouvant être enlevé par nettoyage chimique). Her et coll. (2007) ont fait état d'un encrassement par des substances semblables à des protéines qui n'ont pas été détectées dans l'eau d'alimentation en raison de leurs faibles concentrations (limite de détection non donnée).
D'autres facteurs influent sur l'encrassement des membranes, dont : les caractéristiques des membranes (type de membrane, distribution granulométrique des pores, matières, charge superficielle, hydrophobicité); les conditions de fonctionnement (flux, rendement, prétraitement, lavage à contre-courant, nettoyage chimique) et la qualité de l'eau (pH, force ionique, concentration et caractéristiques des salissures) (Amy, 2008; Huck et Sozański, 2011).
Les services d'eau devraient bien comprendre la façon dont la MON dans leur eau de source interagira avec les membranes pour éviter des configurations menant à un encrassement important. Un prétraitement (p. ex., une biofiltration) pourrait s'avérer nécessaire pour réduire les concentrations de biopolymères (Carroll et coll., 2000; Peldszus et coll., 2011; Siembida-Lösch et coll., 2014; Chon et Cho, 2016). Un prétraitement devrait être personnalisé pour chaque source, car l'efficacité est propre à la source (Fabris et coll., 2007; Siembida-Lösch et coll., 2015). Un programme de lavages à contre-courant réguliers et de nettoyage chimique périodique effectué en employant les bons produits chimiques de nettoyage en fonction des salissures, devrait aussi être en place pour enlever les salissures accumulées (Alspach et coll., 2014).
B.4.3 Valeur esthétique
Il est bien établi que la MON est responsable de diverses préoccupations esthétiques comme la couleur, le goût et l'odeur (Hassler, 1947).
La couleur causée par la présence de substances organiques peut s'observer tant dans les eaux de surface que les eaux souterraines (Black et Christman, 1963; Tan et Sudak, 1992). La couleur organique est généralement causée par la présence d'acides humiques et fulviques qui sont des substances de couleur variant du noir au jaune (Stevenson, 1982). Black et Christman (1963) ont indiqué que 87 % des composés responsables de la couleur dans dix sources aux États-Unis étaient colloïdaux et de taille variant entre 3,5 et 10 nm. Par contre, selon Ratnaweera et coll. (1999), 40 % des composés responsables de la couleur dans sept sources finlandaises étaient inférieurs à 10 kDa (environ 1 nm). Les sources très colorées tendent à avoir une concentration élevée d'acides humides de poids moléculaire élevé, ce qui pourrait expliquer les différences dans la distribution granulométrique (Edwards et Amirtharajah, 1985; Aitkenhead-Peterson et coll., 2003). Les acides fulviques représentent un mélange plus complexe de composés de faible poids moléculaire qui sont plus hydrophiles par comparaison avec les acides humiques, et ils influent grandement sur la dose de coagulant nécessaire (voir à la section B.4.2.1). En outre, une plus grande proportion d'acides fulviques n'ont pas la capacité de se coaguler, peu importe le pH ou la dose de coagulant (Hall et Packham, 1965; Kavanaugh, 1978; Babcock et Singer, 1979). Comme les acides humiques et fulviques sont des précurseurs importants de SPD, il pourrait s'avérer nécessaire d'enlever la couleur de façon adéquate pour respecter la recommandation relative aux SPD (Chaulk, 2015). À titre d'exemple, Tan et Sudak (1992) ont fait état de potentiels de formation de THM de 250 à 262 μg/L pour un approvisionnement en eaux souterraines hautement colorées (analyse du potentiel de formation sur 7 jours à 20 °C à un pH d'environ 8).
Les goûts et les odeurs peuvent être causés par des composés volatils produits par la biomasse microbienne (p. ex., des actinomycètes, des cyanobactéries, des champignons) qui provient du milieu terrestre ou est naturellement présente dans le système aquatique/l'aquifère (Hrudey et coll., 1992; Zaitlin et Watson, 2006; AWWA, 2011a). Watson (2003) a relevé environ 200 composés organiques volatils qui produisent des goûts et des odeurs indésirables. Les terpénoïdes (la géosmine et le 2-méthylisobornéol notamment), les sulfures et les acides gras polyinsaturatés ont été jugés les plus malodorants. La géosmine et le 2-méthylisobornéol sont des composés stables dans l'environnement (c.-à-d. qui ne se biodégradent pas facilement) pouvant être transportés sur de grandes distances depuis l'endroit où ils ont été produits (Satchwill et coll., 2007). D'autres chercheurs ont identifié les pyrimidines comme étant problématiques (Chorus et coll., 1992; Zaitlin et Watson, 2006; Peter et coll., 2009). Zacheus et coll. (2001) ont découvert que les actinomycètes et les champignons peuvent survivre dans les dépôts accumulés contenant de la matière organique et inorganique des réseaux de distribution d'eau. En conséquence, le réseau de distribution pourrait constituer une source de problèmes de goût et d'odeur. Les réactions du chlore avec la MON pourraient aussi contribuer aux goûts et aux odeurs (AWWA, 2011a). Il existe ailleurs des documents énonçant des recommandations pour aider les services d'eau à évaluer et réduire au minimum les goûts et odeurs inacceptables (AWWA, 2011c).
B.5 Mesure et caractérisation
Une stratégie de contrôle efficace de la MON exige une bonne compréhension de l'origine, la présence et la variation de cette matière dans l'eau de source (Volk et coll., 2002). Les services d'eau doivent avoir une bonne compréhension de :
- leur source d'eau et de la nature et la production de la MON;
- des changements qu'elle subit selon les saisons ou des épisodes de précipitations et de fonte de la neige; et
- comment elle interagit avec les procédés de traitement.
B.5.1 Mesures à envisager pour quantifier la MON
Même si les nombreux composés organiques qui contribuent à la MON ne peuvent être mesurés directement, il existe un certain nombre de substituts qui peuvent être utilisés pour fournir une indication de la concentration de MON. Le COT, le COD, l'absorbance UV et la demande chimique en oxygène (DCO) comptent parmi les substituts les plus couramment utilisés (Sillanpää et coll., 2015b). En outre, comme l'absorbance UV et la transmittance UV sont mathématiquement liées, cette dernière peut aussi donner une indication de la concentration de MON. Comme la MON contribue grandement à la couleur, ce paramètre pourrait aussi être pertinent (Matilainen et coll., 2011).
Le COT quantifie tout le carbone organique dans un échantillon d'eau et il est la somme du COP et du COD. Le COD se définit d'un point de vue opérationnel comme le carbone organique ayant traversé un filtre de 0,45 μm. Comme le filtre peut introduire un peu de carbone organique dans l'échantillon, il est recommandé de faire passer au moins 50 mL d'eau exempte de matières organiques à travers le filtre et l'ensemble de filtration avant de filtrer l'échantillon de COD (Karanfil et coll., 2002). Le COT et le COD sont mesurés indirectement à partir du dioxyde de carbone produit par une oxydation chimique catalysée par des rayons UV ou une combustion à haute température.
L'absorbance de lumière des rayons UV et rayons visible à 254, 350 et 440 nm peut être corrélée linéairement à une concentration de COD dans certains réseaux d'eau douce. Néanmoins, des corrélations linéaires sont moins susceptibles d'être établies pour les sources avec de forts intrants autochtones ou anthropiques ou là où le COD a été largement dégradé par une lumière UV naturelle (p. ex., longue période de rétention dans un lac) (Minor et coll., 2014). La mesure des rayons UV254 est utilisée depuis longtemps dans l'industrie de l'eau (Edzwald et coll., 1985). Il est généralement reconnu qu'un changement de l'absorbance UV fournit une bonne indication des changements de la MON (Pernitsky, 2003; Wright et coll., 2016). Une surveillance en ligne ou quotidienne de l'absorbance UV fournit des informations précieuses aux opérateurs sur les effets possibles sur la dose de coagulant, étant donné que les concentrations de MON peuvent changer sans fluctuation observée de l'écoulement ou de la turbidité (voir à la section B.3.1). Autrement, les opérateurs ne sont pas au courant d'une dose insuffisante de coagulant, tant qu'ils ne constatent pas des pics de turbidité dans l'eau clarifiée ou l'eau filtrée. Il est important que des corrélations soient établies sur une base propre à la source parce que la relation entre la MON et l'absorbance UV est propre à chaque source (Pernitsky, 2003). Dans certains cas, il n'est pas possible d'établir une corrélation entre l'absorbance UV254 et le COD (Cho et coll., 2010; Sadrnourmohamadi et coll., 2013; Minor et coll., 2014). La surveillance de l'absorbance des rayons UV et rayons visible sur un plus large éventail de longueurs d'onde pourrait être plus appropriée dans certains cas (Wright et coll., 2016). Alternativement, l'absence de corrélation pourrait être imputable à la présence de MON ayant une faible absorbance UV (p. ex., des protéines, des sucres) ou une teneur élevée en nitrates qui pourrait interférer avec cette mesure (Leenheer et Croué, 2003). La surveillance de l'absorbance des rayons UV et rayons visible sur un plus large éventail de longueurs d'onde pourrait aussi fournir une caractérisation plus poussée.
La transmittance UV est une mesure relative de la quantité de lumière qui traverse un échantillon d'eau (à une longueur d'onde de 254 nm en général à travers un échantillon d'une épaisseur de 1 cm) par rapport à la quantité de lumière qui traverse une eau pure désionisée (laquelle a une transmittance UV de 100 %). Comme l'absorbance UV et la transmittance UV sont liées mathématiquement selon la formule ci-dessous (Bolton, 2013), aucune information n'est perdue en choisissant un paramètre plutôt que l'autre.
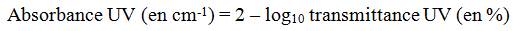
Équation - Équivalent textuel
L'absorbance UV (en cm-1) est égale à 2 moins le log10 de la transmittance UV (en pourcentage).
Un tableau pour la conversion de la transmittance UV en absorbance UV (et l'inverse) se trouve au tableau C-3.4 du présent document.
La demande chimique en oxygène sert à fournir certaines indications sur la concentration de matières organiques oxydables dans un échantillon d'eau (Frisch et Kunin, 1960; Stoddart et Gagnon, 2014). Historiquement, la méthode d'essai de la demande chimique en oxygène n'était pas suffisamment précise pour l'eau potable (Rittman et Huck, 1989). Une méthode d'essai plus sensible de la demande photoélectrochimique en oxygène (peCOD) a été élaborée (Zhao et coll., 2004) et elle est désormais offerte sur le marché (Stoddart et Gagnon, 2014; ASTM, 2017).
La couleur est depuis longtemps mesurée par colorimétrie. La véritable couleur se définit d'un point de vue opérationnel comme la couleur ayant traversé un filtre de 0,45 μm alors que la couleur apparente s'applique aux échantillons non filtrés. Les chercheurs ont aussi employé l'absorbance de la lumière visible à 420 nm pour mesurer la couleur (Ekström et coll., 2011; Kritzberg et Ekström, 2012; Weyhenmeyer et coll., 2014). Néanmoins, une longueur d'onde entre 450 et 465 nm est proposée comme méthode spectrophotométrique standard (APHA et coll., 2012).
La mesure des paramètres indiqués ci-dessous est simple et rapide à effectuer, certains pouvant être automatisés, et ils peuvent indiquer si un changement de la qualité de l'eau est en cours. Par contre, ils ne donnent aucune information à propos des caractéristiques de la MON. Edzwald et coll. (1985) ont découvert que l'absorbance UV254 divisée par le nombre de mg/L de COD était un indicateur utile des caractéristiques de la MON. Ce concept est plus tard devenu l'absorbance UV spécifique (ASUV), laquelle est expliquée ci-dessous. Le calcul d'une couleur spécifique (c.-à-d. la couleur divisée par le nombre de mg/L de COD) peut aussi fournir des renseignements utiles (Chow et coll., 2005).
B.5.2 Caractérisation de la MON
B.5.2.1 Absorbance ultraviolet spécifique
Le concept d'absorbance UV spécifique (ASUV) a été élaboré pour servir d'indicateur fonctionnel des caractéristiques de la MON et de l'efficacité de la coagulation requise pour enlever la MON (Edzwald et Van Benschoten, 1990; Edzwald et Tobiason, 1999). Le tableau 6 présente les rapports généralement acceptés entre l'ASUV, la composition de la MON, l'absorbance UV, la coagulation et l'enlevement potentielle du COT. L'ASUV est largement utilisée pour évaluer les caractéristiques de la MON, car son calcul est simple et peu coûteux, et parce qu'elle constitue un bon indicateur des changements de la qualité de l'eau à la source (Westerhoff et coll., 1999, Imai et coll., 2001, Weishaar et coll. 2003, Reckhow et coll., 2007). Par exemple, Volk et coll. (2002) ont fait le suivi journalier du COD et des UV254 dans la rivière White (Muncie, Indiana) pendant 22 mois. Au cours de cette période, l'ASUV variait de 1,40 à 10,51 L/ mg∙m. Les valeurs inférieures correspondaient à des périodes de faible ruissellement et de forte activité algale (c.-à-d. MON hydrophile et autochtone), alors que les valeurs élevées correspondaient aux périodes de fonte de la neige et de ruissellement des eaux pluviales. Au cours d'un épisode de pluie typique, l'ASUV passait de 2,6 à 4,5 L/mg∙m en 12 heures, ce qui indique que la MON hydrophobe et allochtone se déversait dans la source à partir du bassin versant terrestre. Archer et Singer (2006b) ont analysé 18 mois de données sur les eaux de surface recueillies conformément à la règle de collecte d'information de l'EPA et ont découvert un lien étroit entre l'ASUV, les caractéristiques de l'eau à la source et l'efficacité de la coagulation à enlever le carbone organique.
En général, les sources élevées d'ASUV (>4 L/mg m) comportent une MON propice à la coagulation. Cependant, la fraction neutre hydrophile peut présenter une ASUV élevée, ce qui peut s'avérer trompeur en ce qui concerne le potentiel d'enlevement du carbone organique par la coagulation (Edzwald, 1993). De plus, le respect des seuils recommandés de SPD dépendra de la concentration de MON dans l'eau brute et du potentiel d'enlevement d'une quantité suffisante de MON réactive. Si le résidu de COD post-coagulation reste réactif en ce qui concerne la formation de SPD, il pourrait être nécessaire de recourir à d'autres technologies ciblant l'enlevement de fractions spécifiques de MON (Bond et coll., 2011). Comme les acides humiques et fulviques sont d'importants précurseurs des SPD, une enlevement adéquate de la couleur peut être nécessaire pour respecter les seuils de SPD recommandés (Chaulk, 2015). Les sources à faible ASUV ont tendance à comporter de la MON qui n'est pas susceptible à la coagulation (Pernitsky, 2003).
| ASUV (L/mg∙m) |
Composition de la MON | Absorbance UV | Coagulation | Enlevement potentielle de COT |
|---|---|---|---|---|
| <2 | Composés principalement hydrophilesNote de bas de page b et à faible poids moléculaire | Faible | La MON a peu d'effet sur la dose de coagulant (c.-à-d. principalement MON non coagulable) | 0Note de bas de page c-40 %; limite supérieure pour les eaux à COT élevé |
| 2 à 4 | Mélange de composés hydrophiles et hydrophobes; poids moléculaires variés | Moyen | La MON influence la dose de coagulant | 40 à 60 %; limite supérieure pour les eaux à COT élevé |
| >4 | Composés principalement hydrophobes et à poids moléculaire élevé | Élevé | La MON dicte la dose de coagulant | 60-80 %; limite supérieure pour les eaux à COT élevé |
|
||||
B.5.2.2 Utilisation de produits chimiques
Le suivi de l'utilisation des produits chimiques (p. ex., dose de coagulant, demande de chlore) et le calcul de la dose ou de la demande spécifique (c.-à-d. mg/L par mg/L de COD) peut aider les services d'eau à évaluer les changements de propriétés de la MON. Par exemple, Chow et coll. (2005) ont montré que la dose spécifique de coagulant diminuait lorsque les intrants de MON allochtone augmentaient. De plus, Hwang et coll. (2001) ont indiqué que la fraction de base hydrophile de MON génère une importante demande de chlore, tel qu'indiqué dans le tableau 7. Cette fraction comprend des composés qui sont biodégradables (p. ex., acides aminés). Ainsi, l'enlevement de ces composés à l'aide de techniques de filtration biologique (voir section B.6.2.5) peut diminuer la demande en chlore et les SPD (Prévost et coll., 1998). Summers et coll. (2013) ont signalé l'absence de corrélation entre le COD et la demande de chlore, d'une part, et les THM et acides haloacétiques (AHA5, à savoir acide monochloroacétique, acide monobromoacétique, acide dichloroacétique, acide dibromoacétique et acide trichloroacétique) d'autre part, en raison de la présence de certains composés qui présentent une forte demande en chlore mais ne produisent pas de SPD. En revanche, Rocco et coll. (2008) ont établi une corrélation linéaire entre les THM et la consommation de chlore (R2 = 0,94). Les auteurs ont noté que la consommation de chlore pouvait être utilisée pour prévoir les concentrations de THM dans le réseau de distribution lorsque les processus d'oxydation et d'halogénation de la MON dominent par rapport aux autres réactions consommatrices de chlore (oxydation d'espèces inorganiques, processus photolytiques et corrosion). De la prudence est recommandé lors de l'évaluation des tendances liées à la demande en chlore ou à la demande spécifique en chlore, car les réactions sont d'être propres à la source et peuvent varier en fonction des saisons et des conditions météorologiques.
| Fraction | Demande en chlore |
|---|---|
| Hydrophobe | + |
| Hydrophile - acides et neutres | ++ |
| Hydrophile - bases | ++++ |
| Colloïdes | + |
+ Demande la plus faible
|
|
B.5.2.3 Sous-produits de la désinfection
Les concentrations réelles de SPD mesurées dans le réseau de distribution fournissent une bonne indication de la réactivité de la MON. Il est recommandé de mesurer les paramètres utilisés pour caractériser la MON de pair avec les échantillons de SPD afin d'estimer le rendement de SPD spécifiques (p. ex., μg SPD/mg COD). De plus, il est conseillé de déterminer les propriétés des composés inorganiques (c.-à-d. ammoniac, bromure, iodure et soufre) qui augmentent la réactivité de la MON et contribuent à la formation de SPD.
Tel que mentionné ci-dessus, il faut réaliser des analyses du potentiel de formation de SPD lors de l'évaluation des options de traitement, car il est généralement plus facile d'enlever le COD que de réduire la réactivité, notamment en présence de bromure. La méthode d'analyse du potentiel de formation choisie doit également être représentative du temps de séjour dans le réseau de distribution (Kastl et coll., 2016). Il est important de noter que les méthodes d'analyse du potentiel de formation utilisant de très fortes doses de chlore peuvent ne pas réussir à déterminer correctement les différences de rendement en SPD en présence de bromure (Bond et coll., 2014). En effet, le chlore peut supplanter le brome lorsqu'il est en excès par rapport au brome. Dans des conditions opérationnelles typiques, le brome est beaucoup plus efficace que le chlore à former des SPD (Bond et coll., 2014).
B.5.2.4 Autres méthodes
Il est possible de fractionner les composés de MON en utilisant des sorbants d'extraction en phase solide offerts sur le marché. Cependant, la mesure des six fractions de MON (voir le tableau C-3.3) exige beaucoup de temps et d'effort (Minor et coll., 2014, Goss et coll., 2015) et peut ne pas donner de corrélation claire avec les résultats du potentiel de formation de SPD (Wright et coll., 2016). Plusieurs chercheurs ont étudié des méthodes d'évaluation plus rapides (Chow et coll., 2004, 2006, Rosario-Ortiz et coll., 2007, Dittmar et coll., 2008, Ratpukdi et coll., 2009). Goss et coll. (2017) ont comparé trois cartouches d'extraction en phase solide préemballées utilisées pour isoler des fractions hydrophobes et hydrophiles de trois sources d'eau de surface au Manitoba. Les auteurs estimaient que les usines de traitement de l'eau pourraient utiliser cette méthode pour évaluer rapidement la qualité de l'eau brute, adapter les procédés de traitement et vérifier le rendement du traitement. En revanche, Wright et coll. (2016) ont indiqué que les cartouches d'extraction en phase solide laissaient échapper des quantités variables de carbone organique, faussaient les résultats de COT et produisaient une faible corrélation avec les résultats du potentiel de formation de SPD. Les auteurs se sont abstenus de recommander cette méthode comme outil de surveillance.
Les composés de MON peuvent également être fractionnés physiquement en fonction des différences de taille moléculaire en utilisant un fractionnement membranaire ou une chromatographie d'exclusion stérique sur gel (Koudjonou et coll., 2005). La MON est généralement fractionnée en quatre plages granulométriques : <1, 1-10, 10-30 et >30 kDa. La chromatographie d'exclusion stérique peut également être complétée par une détection du carbone organique ou de l'azote organique (Huber et coll., 2011). Ces méthodes sont couramment décrites dans la littérature examinée par les pairs, mais ne sont pas encore d'usage courant dans les services d'eau.
La fluorescence est une autre méthode prometteuse (Wright et coll., 2016). Les fractions fluorescentes de MON présentent des pics d'intensité à des longueurs d'onde spécifiques, ce qui permet de les classer en composés humiques, fulviques ou protéiniques. Cependant, cette méthode est exigeante en fait d'équipement, de formation des utilisateurs et de traitement des données, et son lien avec les pratiques de traitement de l'eau et la qualité de l'eau traitée reste flou.
Une revue complète de ces méthodes et d'autres méthodes d'isolement et d'analyse de la MON est présentée ailleurs (Minor et coll., 2014).
B.5.3 Stabilité biologique
Les deux paramètres les plus utilisés pour mesurer la stabilité biologique de l'eau sont le CODB et COA.
Le CODB désigne la portion de COD pouvant être utilisée par des bactéries hétérotrophes (Escobar et Randall, 2001). Les essais consistent à mesurer le COD dans l'eau avant et après incubation avec l'inoculum d'une population bactérienne naturelle. La valeur du CODB est considérée comme une mesure de la fraction hydrolysable de carbone disponible pour la recroissance bactérienne.
Le COA représente la partie du CODB la plus facilement dégradable qui peut être absorbée par les bactéries et convertie en biomasse organique (Escobar et Randall, 2001). L'analyse du COA détermine le potentiel de croissance dans l'eau en mesurant le rendement de croissance de deux souches de bactéries pures (Pseudomonas fluorescens – souche P17, Spirillum – souche NOX) sur plusieurs jours et en comparant ces observations à une courbe d'étalonnage de la croissance obtenue en utilisant des solutions standards de carbone organique (p. ex., acétate ou oxalate) (LeChevallier et coll., 2015a). La concentration de COA est considérée comme une mesure de la biostabilité de l'eau aux fins de la croissance bactérienne hétérotrophique (Escobar et Randall, 2001). Le COA est souvent utilisé comme critère pour prévoir la recroissance bactérienne, car il donne une valeur correspondant à une numération de bactéries (Escobar et Randall, 2001).
Des chercheurs ont avancé que le rapport COA/CODB peut servir d'indicateur de la stabilité biologique relative des composés organiques biodégradables présents dans l'eau potable (Escobar et Randall, 2001). Les deux méthodes prennent beaucoup de temps et nécessitent une grande expertise analytique. Camper (2004) et van der Kooij et coll. (2015) ont indiqué que les composés de carbone non mesurés par le COA et le CODB peuvent également influencer la croissance du biofilm et que ces mesures ne suffisent pas pour estimer le potentiel de recroissance.
L'industrie de l'eau potable a enquêté les avantages de méthodes plus rapides utilisant des mesures de l'adénosine triphosphate (ATP) ou la technologie de l'imagerie par cytométrie en flux (Hammes et coll., 2012; Besmer et coll., 2014; Nescerecka et coll., 2014; Pharand et coll., 2014; Gilmore et Summers, 2015; Liu et coll., 2015; van der Kooij et coll., 2015; Besmer et Hammes, 2016; Elhadidy et coll., 2016).
Les mesures de l'ATP gagnent en popularité en tant qu'indicateurs de la biomasse microbiologique (Siebel et coll., 2008). Les méthodes utilisant l'ATP sont abordables, rapides et nécessitent une formation sommaire (LeChevallier et coll., 2015a). Cependant, il est nécessaire de bien saisir la signification des mesures en rapport avec d'autres dimensions de la qualité de l'eau, comme le nombre de cellules viables et cultivables, lorsqu'on envisage d'inclure l'analyse ATP dans un programme de surveillance (Siebel et coll., 2008; Hammes et coll., 2010).
La cytométrie en flux se révèle également un outil possible de surveillance en ligne rapide de la qualité microbienne générale de l'eau (Prest et coll., 2013, 2016). En raison de sa capacité à mesurer les changements dans le nombre de cellules bactériennes, la cytométrie en flux a été proposée comme une des méthodes d'évaluation de la stabilité biologique (Lautenschlager et coll., 2013, Prest et coll., 2013, 2016, Nescerecka et coll., 2014). Il s'agit d'une technologie de pointe qui est exigeante en fait d'équipement, de formation des utilisateurs et de traitement des données (Hammes et Egli, 2010). Plusieurs études ont porté sur la surveillance de la biostabilité en ligne à l'aide de la cytométrie en flux, mais aucune méthode normalisée n'a encore été mise au point pour les applications relatives à l'eau potable (Hammes et Egli, 2010, Lautenschlager et coll., 2013, Prest et coll., 2013). Dans une étude sur les réseaux d'eau potable chlorée à pleine échelle, Nescerecka et coll. (2014) ont conclu que la cytométrie en flux en combinaison avec des mesures d'ATP fournissait des renseignements plus significatifs que les dénombrements de plaques hétérotrophes en ce qui a trait à l'évaluation et à la détermination de la stabilité biologique à divers points dans le réseau de distribution. Selon van der Kooij et coll. (2015), l'utilisation de méthodes ATP pour évaluer le potentiel de formation de biofilm et les taux d'accumulation de biofilms a permis de mieux définir l'instabilité biologique dans l'eau potable (sans un désinfectant résiduel) comparativement à ce qu'une simple évaluation du COA aurait révélé.
LeChevallier et coll. (2015a) ont réalisé une analyse statistique des données à grande échelle dans six services d'eau et ont conclu que les mesures les plus utiles pour évaluer la stabilité biologique étaient la variabilité du désinfectant résiduel (mesurée à l'aide du coefficient de variation), le taux de formation de biofilm (mesuré par l'ATP accumulé sur des coupons en acier doux) et les changements dans les taux de corrosion (mesurés d'après la résistance de polarisation linéaire à l'aide de coupons en acier doux). LeChevallier et coll. (2015b) donnent des conseils pour aider les services d'eau à fournir de l'eau biologiquement stable et à établir un programme de surveillance adapté au réseau de distribution.
B.6 Considérations relatives au traitement et au réseau de distribution
Une stratégie efficace pour contrôler la MON est nécessaire pour atteindre les objectifs concomitants de qualité de l'eau en lien avec la protection microbienne, aux SPD, à la stabilité biologique et le contrôle de la corrosion (Brown et Cornwell, 2011). La stratégie de contrôle de la MON devrait donc viser à réduire les concentrations de MON à des niveaux les plus bas qu'il soit raisonnablement possible d'atteindre.
L'approche de la source au robinet ou du plan de gestion de la sécurité sanitaire de l'eau, qui implique une sélection rigoureuse de la source d'eau en fonction de sa qualité et de la protection des sources d'eau, est universellement acceptée pour gérer les risques liés à la salubrité de l'eau potable (O'Connor, 2002; CCME, 2004; OMS, 2012). Des études de traitabilité propres à la source, notamment des analyses en laboratoire ou à l'échelle pilote, devraient être réalisées afin de déterminer les solutions de rechange les plus appropriées pour le traitement de toutes les conditions de qualité de l'eau (Valade et coll., 2009; Huck et Sozański, 2011).
Les écarts temporels de la concentration et des caractéristiques de la MON peuvent avoir une influence notable sur le choix, la conception et le déroulement des procédés de traitement de l'eau (Sillanpää, 2015). La variabilité croissante des conditions météorologiques due aux changements climatiques justifieront de porter plus d'attention au choix des procédés appropriés (Huck et Coffey, 2004) et à la surveillance journalière des procédés (Wright et coll., 2016).
B.6.1 Choix du traitement approprié
Afin de choisir, de concevoir et d'exploiter correctement les installations de traitement de l'eau, il faut bien comprendre les variations de la concentration et des caractéristiques de la MON – pour l'ensemble des conditions observées au cours de l'année dans les sources d'eaux souterraines et de surface (AWWA, 2011a; Sillanpää, 2015). Pour déterminer les procédés de traitement les plus appropriés, les services d'eau doivent aussi avoir des connaissances concernant ce qui suit (Ivančev-Tumbas, 2014) :
- l'origine, la présence et les fluctuations de la MON
- les interactions avec les autres constituants de l'eau (p. ex., réactivité accrue due au bromure)
- les interactions avec les produits chimiques utilisés pendant le traitement (p. ex., la MON suscite une demande de désinfectant et de coagulant qui doit être satisfaite pour produire une eau potable microbiologiquement sûre)
- les interactions avec les procédés individuels (p. ex., la MON encrasse les adsorbants et les membranes)
- les impacts sur la qualité de l'eau du réseau de distribution
Le type et le niveau de traitement appropriés doivent prendre en compte les fluctuations de la qualité de l'eau propres à la source, notamment la dégradation de l'eau à court terme, la variabilité du rendement du traitement et les conditions dans le réseau de distribution (Kastl et coll., 2016).
Il conviendrait de réaliser une étude de traitabilité propre à la source afin d'évaluer et de comparer les options de traitement ciblant l'enlevement de la MON (Goss et Gorczyca, 2013, Plourde-Lescelleur et coll., 2015, Kastl et coll., 2016). Cette étude de traitabilité devrait comprendre des analyses en laboratoire ou à l'échelle pilote et tenir compte des objectifs concomitants de qualité de l'eau liés à la protection microbienne, aux SPD, à la stabilité biologique et contôle de la corrosion. Les paramètres à considérer dans le cadre d'une étude de traitabilité comprennent les doses de produits chimiques et les résidus, la turbidité, le contenu organique (p. ex., COD, UV254, peCOD, couleur), les propriétés organiques (p. ex., hydrophobie, granulométrie, absorbance UV spécifique), le pH et l'alcalinité, les anions (p. ex., bromure, chlorure, fluorure, nitrate/nitrite, orthophosphate, sulfate), le potentiel de formation de SPD représentatif du réseau de distribution, la biostabilité et les caractéristiques de corrosion (Gregor et coll., 1997; Karanfil et coll., 2007; Shin et coll., 2008; Cho et coll., 2010; Brown et Cornwell, 2011). La solution optimale sera propre à la source, et il est possible que de multiples procédés de traitement seront requis pour bien enlever la MON en toute période de l'année (Collins et coll., 1986; Chang et coll., 2001; Hua and Reckhow, 2007a; Karanfil et coll., 2007; Fabris et coll., 2008; Kristiana et coll., 2009; Carpenter et coll., 2013; Hua et coll., 2015; Sillanpää, 2015).
B.6.2 Options de traitement
Plusieurs options de traitement permettent d'extraire la MON. La coagulation optimisée est certes la méthode la plus couramment utilisée, mais son applicabilité doit être soigneusement analysée : elle peut seulement enlever certaines fractions de MON, laquelle peut rester réactive après la coagulation, de sorte que les seuils recommandés pour les SPD ne sont pas respectés. Par exemple, la MON allochtone tend à être de nature hydrophobe et se prête généralement bien à la coagulation, alors que la MON hydrophile tend à être plus difficile à traiter (Volk et coll., 2002, Chow et coll., 2004, 2006). En fait, dans le cas des sources riches en MON hydrophile neutre, la coagulation enlevera peu ou pas de MON (Chow et coll., 2006). Par conséquent, il est très important de faire l'essai de floculation et l'analyse du potentiel de formation de SPD afin de déterminer la faisabilité d'une coagulation optimisée pour enlever la MON. Les autres possibilités de traitement comprennent la nanofiltration, l'échange d'ions, le charbon actif, la filtration biologique et les procédés d'oxydation.
La littérature comprend une mise en garde concernant la possibilité que la production de SPD spécifiques (c.-à-d. μg SPD/mg COD) soit parfois plus importante dans l'eau traitée que dans l'eau brute désinfectée. (Jacangelo et coll., 1995; Singer et coll., 2007; de la Rubia et coll., 2008; Ministère de l'Environnement et de la Conservation de Terre-Neuve-et-Labrador, 2011). Cette possibilité s'explique par un rapport bromure/COD plus élevé après le traitement. Comme la plupart des procédés de traitement n'éliminent pas le bromure, une quantité accrue de SPD bromés peut se former après le traitement lorsque l'enlevement de la MON est déficiente. Par conséquent, il est très important de faire une étude de traitabilité propre à la source pour évaluer et comparer les options de traitement; cette étude devra inclure des analyses en laboratoire ou à l'échelle pilote pour déterminer le potentiel de formation de SPD.
Les options de traitement sont abordées brièvement ci-dessous. De l'information plus détaillée sur le traitement est disponible dans d'autres sources (Parsons et coll., 2007; AWWA, 2011a; Bond et coll., 2011; Huck et Sozański, 2011; Sillanpää, 2015).
Il est important que les opérateurs de systèmes de traitement de l'eau comprennent bien les mécanismes d'enlevement de la MON, car les changements dans les pratiques de traitement peuvent avoir un effet notable sur la qualité de l'eau (Ivančev-Tumbas, 2014). Ainsi, les opérateurs doivent également recevoir une formation pour assurer en tout temps le bon fonctionnement des barrières de traitement (Smeets et coll., 2009). Se tenir au courant des pratiques exemplaires et des avancées dans le secteur de l'eau potable est un aspect important de l'approche de la source au robinet ou du plan de gestion de la sécurité sanitaire de l'eau, pour assurer la salubrité de l'eau.
B.6.2.1 Coagulation optimisée
La coagulation est un procédé très complexe, car la MON est constituée d'un mélange de composés qui réagissent de différentes manières au coagulant (Hall et Packham, 1965). Deux principaux mécanismes régissent la coagulation : l'un consiste en une neutralisation de la charge et la formation de précipités insolubles; l'autre fait intervenir l'adsorption de la MON sur de l'aluminium ou sur un floculat d'hydroxyde ferrique (c.-à-d. la coagulation par balayage) (Dempsey et coll., 1984). L'efficacité de chacun de ces mécanismes dépend d'un ensemble particulier de conditions opérationnelles liées au pH et à la dose de coagulant. Lorsque le pH augmente, la MON devient de plus en plus chargée négativement, mais les produits d'hydrolyse coagulants ayant une plus faible charge positive dominent. Ainsi, à un pH >7, il faut quadrupler la dose de coagulant pour surmonter la charge négative de la MON par rapport à un pH de 5,5. Lorsque le pH dépasse 7, l'efficacité d'enlevement de la MON diminue (Semmens et Field, 1980; Edzwald et Van Benschoten, 1990; Edzwald et Tobiason, 1999). Des facteurs physiques tels que le mélange de coagulants et les conditions de mélange dans le floculateur peuvent influer sur la formation de floc mais, dans la plupart des cas, la chimie de la coagulation régit le procédé (Kavanaugh, 1978; Vadasarukkai et Gagnon, 2015; Vadasarukkai, 2016).
Le choix du coagulant dépend des caractéristiques de l'eau à traiter. Sillanpää et Matilainen (2015) décrivent les choix de coagulants disponibles (p. ex., coagulants à base d'aluminium et de fer, polymères floculants inorganiques, polyélectrolytes organiques, coagulants composites et nouveaux coagulants). Alors que certains coagulants fournissent une fenêtre opérationnelle plus large en ce qui concerne le pH, il est à noter que le pH correspondant à la solubilité minimale augmente lorsque la température diminue, et ce pour tous les coagulants métalliques (Pernitsky, 2003). Pour l'alun, l'efficacité optimale se situe généralement à des pH proches du point de solubilité minimale (de 6,5 à 6,7 à 4 °C et de 6,0 à 6,2 à 20 °C) (Edzwald et Kaminski, 2009). Comme le pH de solubilité minimale est plus élevé à des températures plus basses, une dose de coagulant plus élevée peut être nécessaire pour surmonter la charge plus fortement négative de la MON avec une charge positive inférieure sur les produits d'hydrolyse coagulants, tel que mentionné ci-dessus. Une stricte surveillance du pH doit être exercée pour obtenir une coagulation optimale; même une faible variation du pH peut libérer de la MON précédemment incorporée aux flocs (Slavik et al., 2012).
La MON détermine également la taille, la structure et la force des flocs, contrôlant à la fois l'ampleur et le rythme des processus de clarification ou de filtration (Eikebrokk et Saltnes, 2001; Newcombe et Dixon, 2006; Parsons et coll., 2007). Plusieurs études ont montré que les flocs de MON de faible densité se prêtent mieux à la flottation qu'à la sédimentation (Plummer et coll., 1995; Edzwald et Kelley, 1998; Edzwald et coll., 1999, 2000, 2003; Harrington et coll., 2001; Edzwald, 2010; Gregory et Edzwald, 2011). En revanche, l'ajout d'un adjuvant coagulant (p. ex., silice activée, bentonite, chaux, polymère) peut être nécessaire pour former des flocs décantables (Semmens et Field, 1980; Edwards et Amirtharajah, 1985; Gregor et coll., 1997).
La nature de la coagulation de la MON due à la charge justifie le recours à la surveillance par électrophorèse (Bond et coll., 2011). Autrement, les opérateurs ne sont pas conscients du sous-dosage de coagulant avant que se manifestent des pics de la turbidité de l'eau décantée ou de l'eau filtrée (Pernitsky, 2003). Idéalement, on doit surveiller l'eau brute de façon continue afin d'optimiser la dose de coagulant (Pernitsky, 2003; Newcombe et Dixon, 2006; Sharp et coll., 2006; Shin et coll., 2008). Les outils de surveillance en ligne de la MON comprennent le COT, le COD, l'absorbance/transmittance UV et la peCOD; pour la déstabilisation des particules, on utilise le potentiel zêta ou le courant d'écoulement (Conio et coll., 2002; Newcombe et Dixon, 2006; AWWA, 2011b). L'enlevement de la MON est maximisée lorsque le potentiel zêta est compris entre -10 et +5 mV (Sharp et coll., 2006; Sharp, 2015). Dans le cas du courant d'écoulement, la coagulation optimale est obtenue au point de la valeur de charge nulle (point isoélectrique) (McVicar et coll., 2015).
Pour optimiser la coagulation, il faut intégrer les exigences relatives à la MON et à la réduction de la turbidité dans le processus de prise de décision (Edzwald et Haarhoff, 2012). Pour de nombreux systèmes d'approvisionnement en eau, le dosage des coagulants sera dicté par la MON plutôt que par la turbidité, tel qu'indiqué ci-dessus. Des essais de floculation doivent être réalisés pour s'assurer que la coagulation est optimisée afin d'enlever tant la MON que la turbidité. La surveillance en ligne de l'absorbance/transmittance UV, du potentiel zêta ou du courant d'écoulement fournit de l'information utile aux opérateurs sur les impacts attendus de la dose de coagulant, en particulier dans le cas des sources hautement variables. En défaut d'ajuster la dose de coagulant en réponse à une variation de la MON, l'opérateur risque de créer des conditions de coagulation sous-optimales et de réduire la capacité d'enlevement du logarithme pathogène (Edzwald, 2017).
B.6.2.2 Filtration sur membranes
Quatre types de membranes sous pression sont utilisés à l'heure actuelle pour le traitement de l'eau potable : la microfiltration (MF), l'ultrafiltration (UF), la nanofiltration (NF) et l'osmose inverse (OI). Les membranes sont généralement classées en fonction du type de substances qu'elles enlèvent, de la pression d'opération et du diamètre des pores ou du seuil de rétention de poids moléculaire. La MF et l'UF utilisent des membranes à faible pression pour retenir des particules et des organismes pathogènes. Le mécanisme d'enlevement prédominant est le criblage ou l'exclusion de particules en fonction de leur granulométrie. La NF et l'OI utilisent des membranes à haute pression servant à enlever la MON et les substances inorganiques (p. ex., sodium, chlorure, calcium, magnésium). Le mécanisme d'enlevement prédominant est la différence de solubilité ou de diffusivité.
La répartition granulométrique de la MON varie d'une source à l'autre, mais généralement plus de 50 % des molécules de MON ont un poids moléculaire <1 kDa, et 80 % ont un poids moléculaire <10 kDa (Sillanpää et coll., 2015a). Par conséquent, il faut utiliser une membrane de NF étanche pour enlever la plupart des précurseurs de SPD, comme le montre la figure 1. Des études indiquent que le seuil de masse moléculaire optimal pour l'enlevement de la MON varie de 0,2 à 0,3 kDa (Jacangelo et coll., 1995, 1997, Bond et coll., 2011, Sillanpää et coll., 2015a). La NF peut donner des taux d'enlevement élevés de précurseurs de COD, UV254 et SPD, tel qu'indiqué dans la section B.6.3.
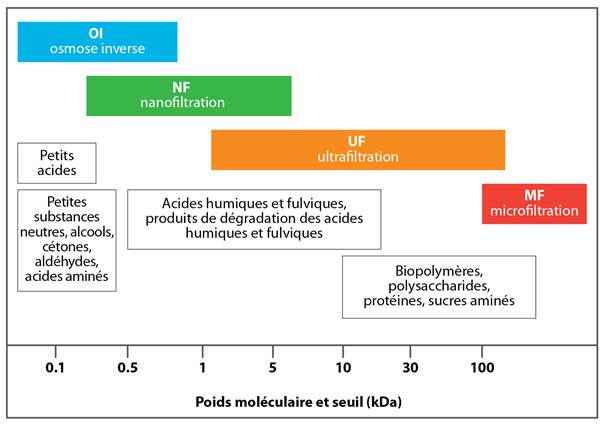
Figure 1 - Équivalent textuel
Ceci est une illustration des fractions de matière organique éliminées par des procédés membranaires. Au bas de l'illustration, une échelle de poids moléculaire commence à gauche par une valeur de 0,1 kDa et augmente à droite pour atteindre un maximum de 100 kDa. L'osmose inverse élimine un intervalle de moins de 0,1 kDa à environ 1 kDa, la nanofiltration (NF) élimine un intervalle d'environ 0,3 kDa à environ 7 kDa, l'ultrafiltration (UF) élimine un intervalle d'environ 1 kDa à un peu plus de 100 kDa et la microfiltration (MF) élimine un intervalle qui dépasse 100 kDa.
La figure 1 montre que les membranes de MF ne permettent d'enlever aucune fraction de MON à part les biopolymères. Les membranes UF peuvent enlever une partie de la MON, comme il est indiqué à la figure 1, mais le potentiel de formation de SPD peut ne pas diminuer de manière adéquate. Par exemple, Lamsal et coll. (2012) ont relevé une enlevement globale de COD de 66 % à l'aide de membranes UF (taille absolue des pores = 0,01 μm). Les potentiels de formation de THM et d'AHA ont diminué de 54 % et 77 % respectivement, mais sont restés élevés : 200 μg/L et 80 μg/L respectivement (conditions d'essai : chlore 1,0 ± 0,4 mg/L à température ambiante pendant 24 h). De plus, les membranes UF ne permettent pas d'enlever le COA (habituellement <1 kDa) à moins d'être utilisées conjointement avec une membrane NF étanche ou OI ou avec un traitement biologique (Sillanpää et coll., 2015a). L'utilisation d'un coagulant ou d'un absorbant peut améliorer l'enlevement du précurseur de SPD au moyen des procédés MF/UF (Jacangelo et coll., 1997). Les exigences de prétraitement applicables à l'enlevement de la MON doivent être prises en compte dans le cadre d'une étude de traitabilité propre à la source lorsque le seuil de rétention des molécules optimal (0,2-0,3 kDa) pour l'enlevement de la MON n'est pas utilisé.
L'encrassement de la membrane est complexe et doit également être évalué. Les indicateurs du potentiel d'encrassement comprennent une faible ASUV, une fraction hydrophile élevée, une teneur élevée en azote dissous et une forte concentration en biopolymères (Lee et coll., 2006; Amy 2008; Croft, 2012; Kimura et coll., 2014; Siembida-Lösch et coll., 2014).
B.6.2.3 Échange d'ions
L'échange d'ions est un procédé dans lequel les ions contenus dans l'eau brute sont échangés avec des ions dans la phase solide d'une résine. Au début des années 1960, on a admis que l'échange d'ions pouvait enlever la MON, principalement parce que cette dernière causait l'encrassement des résines échangeuses d'ions utilisées pour enlever d'autres contaminants (Ungar, 1962, AWWA, 2011a).
Le principal mécanisme d'enlevement (c'est-à-dire le mécanisme électrostatique) fait appel à l'échange d'ions, l'adsorption hydrophobe et la liaison avec l'hydrogène jouant également un rôle (Fu et Symons, 1990, Bolto et coll., 2002). L'échange d'ions fait l'objet d'une attention particulière depuis 2000, en raison de la mise au point de la résine MIEX® (résine magnétique échangeuse d'ions) spécialement conçue pour enlever la MON (Slunjski et coll., 2000; Drikas et coll., 2003; Fearing et coll., 2004c; Budd et coll., 2005; Parsons et coll., 2007; Singer et coll., 2007, 2009; Humbert et coll., 2008; Bond et coll., 2010; Brown et Cornwell, 2011).
Les facteurs qui influent sur l'efficacité de l'échange d'ions comprennent la concentration et les propriétés de la MON, la qualité de l'eau (en particulier la concentration d'anions concurrents, comme le bicarbonate et le sulfate), les propriétés de la résine (composition du polymère, porosité et groupes fonctionnels chargés) et les variables opérationnelles (dose de résine, durée de contact, fréquence de régénération). Cependant, le procédé d'échange d'ions n'élimine pas la turbidité, de sorte qu'il est typiquement appliqué de pair avec un procédé d'enlevement de la turbidité (Drikas et coll., 2003).
Plusieurs chercheurs ont constaté que l'échange d'ions était plus efficace que la coagulation pour l'enlevement de la MON, seul (Drikas et coll., 2003; Singer et coll., 2007, 2009) ou en combinaison avec la coagulation (Drikas et coll., 2003; Brown et Cornwell, 2011; Braun et coll., 2014). Drikas et coll. (2003) ont mené des expériences en laboratoire pour évaluer la résine MIEX® seule (dose de résine = 6-8 mL/L, contact de 15 minutes), et ont observé un taux d'enlevement de 64-74 % du COD et de 82-84 % de l'UV254. L'utilisation de la résine MIEX® de pair avec la coagulation (dose d'alun = 20-30 mg/L, dose de résine = 6 mL/L, contact de 10 à 15 minutes) a donné un taux d'enlevement se situant entre 64 et 76 % pour le COD et un taux d'absorption de 82 à 90 % pour l'UV254. Singer et coll. (2009) ont fait une revue complète de nombreuses études à l'échelle pilote et à grande échelle portant sur 21 sources en Australie et aux États-Unis, et ont constaté des taux d'enlevement de COD de 36 à 80 % (dose de résine de 0,2 à 2,8 mL/L, durée de contact non fournie). Les auteurs ont attribué cette large plage de taux d'enlevement du COD à la présence de MON hydrophile présentant une charge basique et neutre.
Le recours à l'échange d'ions de pair avec d'autres procédés peut présenter des avantages et des inconvénients sur le plan opérationnel qui doivent être pris en compte dans une étude de traitabilité propre à la source. Par exemple, l'échange d'ions avant la coagulation peut réduire la dose de coagulant et la production de boues qui en découle; la turbidité de l'eau décantée, l'utilisation de produits chimiques pour l'ajustement du pH et la dose de désinfectant et stabiliser les résidus de chlore dans le réseau de distribution (Budd et coll., 2005; Brown et Cornwell, 2011). Les procédés d'échange d'ions peuvent également enlever une partie du bromure des sources présentant une faible alcalinité et de faibles concentrations de sulfate, en raison d'une concurrence minimale autour des sites d'échange d'ions (Singer et coll., 2007). Humbert et coll. (2008) ont noté une amélioration de l'efficacité du charbon actif pour ce qui est d'enlever les pesticides lorsque l'échange d'ions était utilisé pour accroître l'enlevement de la MON. Toutefois, Brown et Cornwell (2011) ont fait remarquer que le traitement par échange d'ions et le recours à des doses plus faibles de coagulants à base de sulfate pouvaient augmenter le potentiel de corrosion à cause des changements du rapport massique du chlorure par rapport au sulfate.
Les services d'eau qui utilisent l'échange d'ions pour enlever d'autres anions (p. ex., arsenic, chrome, nitrate, uranium) doivent savoir que la MON est en concurrence autour des sites d'échange ionique et qu'elle peut donc nuire à l'efficacité du procédé (Ungar, 1962). Un prétraitement peut être nécessaire pour enlever la MON afin de s'assurer que le procédé reste économique compte tenu de l'usage auquel l'eau est destinée (Bursill, 2001).
B.6.2.4 Charbon actif
Le charbon actif est un matériau absorbant qui fournit une surface sur laquelle les ions ou les molécules contenus dans l'eau brute peuvent se concentrer. Il peut être appliqué de deux façons : dans des boues en utilisant du charbon actif en poudre (CAP) ou à l'aide de réacteurs à lit fixe contenant du charbon actif granulaire (CAG) (AWWA, 2011a). Les mécanismes d'enlevement font intervenir l'adsorption de la matière organique dissoute sur le CAP ou le CAG, ainsi que la biodégradation de la MOB dans les réacteurs à lit fixe du CAG si un biofilm actif se forme. Chowdhury et coll. (2010) ont constaté que les biofilms peuvent se former dans les macropores du CAG, même en présence de chlore.
Le CAP et le CAG sont principalement utilisés dans le traitement de l'eau pour enlever les micropolluants ainsi que les composés qui confèrent un goût et des odeurs à l'eau. L'utilisation du CAP offre l'avantage de fournir du carbone vierge lorsque cela est nécessaire (p. ex., pendant la saison où le goût et les odeurs sont plus prononcés). Les réacteurs à lit fixe de CAG fonctionnent de la même manière que les filtres classiques à débit rapide; les caractéristiques du CAG (type, granulométrie, mode de réactivation) et les conditions de fonctionnement (vitesse du filtre, durée de contact sur le lit vide, régime de lavage à contre-courant, durée de filtration) influent donc sur leur rendement.
La grande surface spécifique et une structure poreuse bien développée de CAG peuvent fournir une capacité de sorption élevée pour les molécules organiques (Simpson, 2008). Cependant, le CAG n'est pas largement utilisé comme moyen de contrôle principal de la MON, car sa capacité d'adsorption (de l'ordre de plusieurs mois) tend à s'épuiser rapidement, et la régénération peut être coûteuse (Prévost et coll., 1998; Huck et Sozański, 2011). À titre d'exemple, l'U.S. EPA (2016) fait état d'une fréquence de réactivation de 120 jours pour les systèmes présentant une teneur de COD <6 mg/L, avec une durée de contact de 10 minutes sur le lit vide. L'enlevement de la MON hydrophobe à poids moléculaire élevé par les procédés de traitement conventionnels peut augmenter notablement la durée de vie opérationnelle des filtres au CAG (Karanfil et coll., 2007). De plus, une fois la capacité d'adsorption épuisée, les filtres au CAG peuvent continuer à enlever la MON grâce au mécanisme de biodégradation, bien qu'à des taux de rendement plus faibles (Bond et coll., 2011; Gibert et al, 2013a).
Des études montrent que l'efficacité du CAG à enlever la MON dépend du volume des pores, lequel doit correspondre à la taille de la MON propre à la source (Karanfil et coll., 2007, Gibert et coll., 2013b). Karanfil et coll. (2007) font observer que la surface et le volume total des pores ne sont pas suffisants pour choisir le CAG comme moyen d'enlevement de la MON, car ces paramètres ne fournissent pas d'information sur la région des pores accessibles. Les auteurs avancent que les services d'eau demandent de l'information détaillée sur la répartition granulométrique des pores et sur le pH de la valeur de charge nulle pour les CAG envisagés. Des essais rapides en colonne à petite échelle devraient être effectués pour comparer le rendement d'autres CAG, en particulier pour les sources à faible ASUV (Ates et coll., 2007; Karanfil et coll., 2007). L'abrasion des particules de CAG doit également être prise en compte, car elle peut causer la perte de particules de CAG et sa stratification dans le lit, deux processus qui sont indésirables (Gibert et coll., 2013b).
Les services d'eau qui utilisent du charbon actif pour enlever les pesticides ou d'autres contaminants à l'état de trace doivent savoir que la MON est en concurrence autour des sites d'adsorption et qu'elle peut nuire à l'efficacité du procédé (Haist-Gulde et Happel, 2012). Un prétraitement peut être requis pour enlever la MON, afin de s'assurer que le procédé reste économique en fonction de l'usage auquel il est destiné (Bursill, 2001).
B.6.2.5 Traitement biologique
Le traitement biologique consiste à cibler l'enlevement de la fraction de MOB qui favorise la croissance du biofilm dans le réseau de distribution (section B.4.1.3) et qui augmente la demande de chlore (section B.5.2.2) (Prévost et coll., 1998). L'efficacité du traitement biologique dépend donc de la quantité de MOB présente dans l'eau à traiter, de la communauté microbienne qui consomme la MOB et de la température (Drewes et coll., 2009; Diem et coll., 2013). Il est peu probable que les processus biologiques éliminent la MON récalcitrante ou réfractaire, à moins qu'elle ne soit oxydée et se transforme en MOB. Le traitement biologique améliore généralement la stabilité biologique de l'eau et diminue les concentrations de SPD ainsi que les goûts et les odeurs (Servais et coll., 2005).
Les principaux procédés de traitement biologique de l'eau potable sont la filtration sur les berges, la filtration rapide des milieux granulaires sans le maintien d'une charge résiduelle de désinfectant à travers le lit et la filtration lente sur sable.
Filtration sur berge
La filtration sur berge (FB) consiste à installer des puits d'alimentation en eau verticaux ou horizontaux près d'une rivière afin d'utiliser les berges et l'aquifère adjacent comme filtre naturel pour enlever les contaminants, y compris la MOB. À mesure que l'eau se dirige vers la nappe phréatique, l'adsorption, la biodégradation et la dilution avec les eaux souterraines diminuent les concentrations de contaminants (Piet et Zoeteman, 1980; Bize et coll., 1981; Kuehn et Mueller, 2000; Ray et coll., 2002).
Kuehn et Mueller (2000) ont noté que la FB permet de réduire les concentrations de COD et de COA de 27 % et 63 %, respectivement. Weiss et coll. (2003) ont surveillé trois stations de FB à grande échelle et ont observé des concentrations de COT/COD et des potentiels de formation de THM/AHA plus faibles dans les puits de FB, soit de 35 à 70 % et de 50 à 80 % environ, respectivement. Wang et coll. (2002) ont constaté que la FB permet de réduire les concentrations de COT d'environ 50 % et d'enlever complètement le CODB. Drewes et coll. (2009) ont indiqué que les concentrations de COT mesurées à trois stations de FB à grande échelle étaient régulièrement réduites de 3 à 10 mg/L à entre 1 et 3,5 mg/L.
Les services d'eau qui envisagent d'utiliser la FB doivent savoir que la demande en oxygène créée par la MON biodégradable et d'autres contaminants, comme l'ammoniac, peuvent modifier les conditions d'oxydoréduction et provoquer la dissolution du manganèse, ce qui peut nécessiter un traitement (Appelo et Postma, 1996). On trouvera de l'information supplémentaire sur le manganèse dans l'eau potable ailleurs (Santé Canada, 2016b).
Filtration biologique ou biofiltration
La filtration biologique prévoit l'utilisation de filtres granulaires (anthracite/sable ou CAG) sans le besoin de maintenir un résidu de désinfectant à la largeur du lit. L'activité biologique qui a cours dans les filtres peut être influencée par plusieurs facteurs, dont la qualité de l'eau, la température, la dose et le type d'oxydant, ainsi que les procédures de lavage à contre-courant (Huck et coll., 2001). Le procédé est normalement précédé d'une étape d'oxydation (p. ex., ozonisation) qui transforme la MON en MOB pour la rendre plus facilement biodégradable (Evans et coll., 2013a). En l'absence d'une étape de traitement biologique après l'ozonisation, il faut s'attendre à une augmentation de la croissance du biofilm dans le réseau de distribution (Juhna et Melin, 2006).
Emelko et coll. (2006) ont fait état de taux d'enlevement de COT de 13 à 23 % et de MOB de 72 à 93 % (mesurés en oxalate) dans une usine d'épuration à grande échelle, et à des températures élevées (21-25 °C) et basses (1-3 °C). Evans et coll. (2013b) ont observé des taux d'enlevement moyens de COA de 31 à 42 % dans 14 filtres biologiques à grande échelle sur une période d'un an. Stoddart et Gagnon (2015) ont constaté une diminution des THM et des AHA de 10-20 μg/L et de 6-10 μg/L, respectivement, à la suite de la conversion de filtres anthracite-sable en filtres biologiques dans une usine de filtration directe à pleine échelle.
Les services d'eau qui envisagent d'adopter la filtration biologique dans une installation existante doivent savoir que certains de leurs homologues ont observé la présence d'algues indésirables ou une croissance biologique, des durées de filtration plus courtes et des difficultés liées à la présence de chlore résiduel (Brown et coll., 2016). De nombreux conseils existent pour aider les services d'eau à comprendre les mécanismes liés à la filtration biologique, ainsi qu'à isoler et à mettre en œuvre une surveillance appropriée (Prévost et coll., 2005; Juhna et Melin, 2006; Evans et coll., 2013a, 2013b; Brown et coll., 2016; Nyfennegger et coll., 2016).
Filtration lente sur sable
La filtration lente sur sable (FLS) consiste généralement à faire passer l'eau non traitée au travers d'une couche de sable poreux submergé. Pendant la filtration, une croissance biologique se produit dans le lit de sable et le substrat de gravier. De plus, des bactéries et d'autres matières provenant de la source d'eau s'accumulent à la surface pour former un « film biologique ». La croissance biologique dans le filtre et le film biologique contribuent à l'efficacité de la FLS. Selon la qualité de l'eau à la source, il peut s'écouler des semaines ou des mois avant que cette croissance biologique ne débute (Bellamy et coll., 1985a, 1985b; Logsdon et coll., 2002).
Amy et coll. (2006) ont indiqué que la FLS conventionnelle peut réduire les concentrations de CODB et de COA de <80 % et <65 %, respectivement, tandis que l'enlevement des précurseurs du COD et des THM restait limitée entre <15-30 % et <20-35 %, respectivement. Cependant, ce niveau d'enlevement ne suffit généralement pas pour respecter les seuils de SPD dans l'eau potable (Pyper, 1985; Collins et coll., 1991; Graham, 1999), particulièrement en hiver lorsque les températures basses ralentissent l'activité biologique (Collins et coll., 1992). Des chercheurs ont signalé que l'ajout d'ozone ou de CAG permet de réduire la couleur et d'améliorer l'enlevement des précurseurs de SPD (Graham, 1999; DiBernardo et Pereira Tangerino, 2006; Ødegaard et coll., 2006; Steele et coll., 2006).
Dans une revue de la littérature, Graham (1999) a relevé qu'avec la préozonisation, les taux d'enlèvement de COD et de le potentielle de formation des THMs variaient de 18 à 55 % et de 20 à 64 %, respectivement. Dans l'ensemble, l'auteur a laissé entendre que l'ajout d'ozone améliorait l'enlevement du COD de 10 % et réduisait le potentiel de formation des THMs de moitié. DiBernardo et Pereira Tangerino (2006) ont fait des expériences en laboratoire et observé que le taux d'enlevement de la couleur augmentait de 33 % à 63 % lorsqu'ils ajoutaient du CAG (après la FLS) et qu'il variait de 21,5 à 53 % lorsque l'eau était oxydée (avant la FLS) avec de l'ozone ou avec du peroxyde d'hydrogène (H2O2) et de l'ozone. Lorsque les chercheurs ont eu recours au CAG et à l'oxydation au moyen de l'ozone ou du H2O2 et de l'ozone, de pair avec la FLS, ils ont obtenu une réduction de la couleur variant entre 44 % à 68 %.
Le renforcement de la FLS par l'ajout d'ozone ou l'emploi de CAG peut présenter plusieurs difficultés d'ordre opérationnel. L'ozone peut contribuer à augmenter la perte de charge du filtre et raccourcir ainsi les cycles de filtration (Graham, 1999; Logsdon et coll., 2002; DiBernardo et Pereira Tangerino, 2006). Le résidu d'ozone doit également être neutralisé avant d'atteindre le film biologique, sinon la biomasse deviendrait inactive et le filtre produirait de l'eau biologiquement instable (Melin et coll., 2006; Ødegaard et coll., 2006). L'eau traitée filtrée peut également présenter des concentrations élevées de bactéries hétérotrophes qui devraient être éliminées/inactivées (Ødegaard et coll., 2006). Steele et coll. (2006) ont également souligné la nécessité de tenir compte de la demande en oxygène dissous lors de l'inclusion d'une couche de CAG. De plus, la température de l'eau est un facteur important dans la conception de la FLS et la sélection de tout procédé auxiliaire (Jabur, 2006).
Bien que Gottinger et coll. (2011) aient conclu que la FLS renforcée permet d'obtenir des réductions significatives de couleur et de matière organique, il est recommandé de faire des essais pilotes pour s'assurer que l'eau à la source peut être traitée avec satisfaction (Logsdon et coll., 2002). Il convient également de mentionner que l'ozonisation de l'eau contenant du bromure naturel peut entraîner la formation de bromate. Les services d'eau utilisant de l'ozone doivent évaluer les propriétés de leur eau à la source afin de connaître les paramètres de qualité de l'eau (bromure, température, pH, alcalinité, MON, ammoniac) et comment ils évoluent selon les saisons. Il est recommandé de mener une surveillance trimestrielle du bromure dans l'eau brute pour connaître les caractéristiques de l'eau à la source et permettre la corrélation avec le bromate (et les SPD bromés). On peut obtenir plus d'information sur le bromate auprès de Santé Canada (2018a).
B.6.2.6 Procédés d'oxydation
Les procédés d'oxydation comprennent l'usage d'ozone et de dioxyde de chlore ainsi que les procédés d'oxydation avancés de l'ozone / UV, de l'ozone / H2O2, UV / H2O2 et la réaction de Fenton. Dans des conditions typiques de traitement de l'eau, les procédés d'oxydation transforment la nature des composés organiques plutôt que d'enlever la MON (Owen et coll., 1993; Świetlik et coll., 2004). Par conséquent, ces procédés d'oxydation sont généralement utilisés pour la désinfection, le contrôle du goût et des odeurs et la dégradation des contaminants organiques cibles. L'ozone et le dioxyde de chlore ont tendance à réduire la réactivité de la MON au contact du chlore, ce qui provoque généralement une réduction des THM et des tri-AHA; cependant, certains SPD peuvent augmenter, notamment les halonitrométhanes et les halocétones (Reckhow, 2017). Les procédés d'oxydation avancés permettent, en principe, d'enlever une variété de MON, mais ils peuvent également accroître la formation de SPD et d'acide dichloroacétique (ADCA) en particulier (Bond et coll., 2011). Les auteurs recommandent d'évaluer minutieusement les procédés d'oxydation en vue de leur utilisation pour réduire les SPD.
Étant donné que les procédés d'oxydation peuvent entraîner la réduction de certains SPD tout en favorisant la présence d'autres SPD, les mesures d'atténuation ont tendance à porter d'abord sur la réduction de la formation de SPD en maximisant l'enlevement de la MON (AWWA, 2011a). L'utilisation d'autres désinfectants pour réduire la formation de SPD devrait donc être envisagée avec prudence (Reid Crowther & Partners, 2000).
Les services d'eau doivent savoir que tous les oxydants, y compris le chlore, génèrent des produits biodégradables lors de leur réaction avec la MON (voir section B.4.1.3). En conséquence, une filtration biologiquement active peut être nécessaire pour stabiliser l'eau traitée (voir section B.6.2.5). Les services d'eau doivent également savoir que tous les oxydants réduisent l'absorbance UV, ce qui nuit à l'ASUV sans réduction correspondante de la concentration de MON.
B.6.3 Efficacité du traitement
D'abondantes recherches ont été menées pour évaluer l'efficacité des solutions de traitement disponibles pour enlever la MON. Toutefois, les données publiées sur les mesures à grande échelle se limitent surtout à la filtration assistée chimiquement, à l'exception des données restreintes présentées à la section B.6.2 au sujet des membranes UF, de l'échange d'ions et de la filtration biologique. Par conséquent, des données à l'échelle pilote et à l'échelle du laboratoire sont présentées dans cette section pour les autres options de traitement.
Les résultats montrent que l'efficacité d'enlevement de la MON peut varier; il est donc fortement recommandé de réaliser une étude de traitabilité propre à la source pour évaluer et comparer les options de traitement (Goss et Gorczyca, 2013; Plourde-Lescelleur et coll., 2015; Kastl et coll. 2016). En général, si l'enlevement d'UV254 est supérieure à l'enlevement du COD, on peut conclure que le procédé élimine préférentiellement la MON hydrophobe à poids moléculaire élevé qui absorbe la lumière UV; une augmentation de l'ASUV après le traitement indique que le procédé élimine plus de COD comparativement à la réduction de l'absorbance UV (Lamsal et coll., 2012).
B.6.3.1 Résultats à grande échelle
Le tableau 8 résume la variabilité de l'enlevement du COD obtenue dans plusieurs usines de filtration à assistance chimique à grande échelle. Une enlevement du carbone organique allant de faible à nulle est observée à certaines périodes. Hargesheimer et coll. (1994) ont constaté un taux d'enlevement de 0 % à divers moments en 1993, soit au début de mars, en mai, en août et en décembre. Il est possible que ces périodes correspondent à des conditions de couverture de neige ou de débit de base et des apports d'eau à faible teneur en MON allochtone. Carpenter et coll. (2013) ont signalé un taux d'enlevement de 0 % au début de septembre 2011 à l'usine 1 et en août 2011 à l'usine 2. On peut s'attendre à ce que la MON provienne de sources autochtones à cette époque de l'année (c.-à-d. fin de l'été) et qu'elle serait probablement de nature hydrophile. Ces études révèlent que l'efficacité d'enlevement de la MON au moyen d'un traitement conventionnel peut varier et qu'on risque d'observer un taux d'enlevement faible ou nul, en particulier pour la fraction neutre hydrophile (Chow et coll., 2006). Tel qu'indiqué ci-dessus, il est recommandé de réaliser un essai de floculation pour déterminer la faisabilité d'une coagulation optimisée pour enlever la MON.
| Référence | Qualité de l'eau à la source | Procédés de traitement | % d'enlevement du COT/COD (moyenne) |
|||
|---|---|---|---|---|---|---|
| ParamètreNote de bas de page a | Min | Max | Moyenne | |||
| Hargesheimer et coll., 1994 | COT | 0,9 | 4,5 | 2,4 | Filtration conventionnelle | 0 à 28 (8,7) |
| Jacangelo et coll., 1995 | COD | 1,2 | 7,8 | 2,1 à 3,5Note de bas de page b | Conventionnelle avec CAG | 8 à 48Note de bas de page c |
| Volk et coll., 2002Note de bas de page d | COD | 2,15 | 11,90 | 4,00 | Coagulation, floculation, clarification | 7,1 à 66 (34,7) |
| UV254 | 0,037 | 0,830 | 0,118 | |||
| ASUV | 1,40 | 10,51 | 2,81 | |||
| Volk et coll., 2002Note de bas de page d | COD | 2,15 | 11,90 | 4,00 | Conventionnelle avec CAG | 16,9 à 72,9 (41,9) |
| UV254 | 0,037 | 0,830 | 0,118 | |||
| ASUV | 1,40 | 10,51 | 2,81 | |||
| Chow et coll., 2005Note de bas de page e | COD | 8,2Note de bas de page f | 11,8 | Non indiqué | Filtration conventionnelle | 36 à 57 (47) |
| Chow et coll., 2005Note de bas de page e | COD | 11,6Note de bas de page f | 15,8 | Non indiqué | Flottation à air dissous (FAD) et filtration | 56 à 65 (62) |
Carpenter et coll., 2013Note de bas de page g |
COD | 0,9 | 2,2 | 1,3 | Filtration directe (Usine 1) |
0 à 50 (28,2) |
| UV254 | 0,01 | 0,10 | 0,03 | |||
| ASUV | 2,00 | 4,41 | 2,73 | |||
| Carpenter et coll., 2013Note de bas de page g | COD | 0,9 | 2,2 | 1,3 | Filtration directe (Usine 2) |
0 à 45 (27,9) |
| UV254 | 0,01 | 0,10 | 0,03 | |||
| ASUV | 2,00 | 4,41 | 2,73 | |||
|
||||||
Le tableau 9 résume les données de surveillance de la conformité du COT publiées par l'U.S. EPA (2016) dans le cadre de son troisième examen sur six ans. Les données représentent le pourcentage d'enlevement du COT obtenu dans les usines de traitement conventionnel des eaux de surface en fonction de la matrice de la qualité de l'eau brute établie selon la règle des désinfectants/SPD. En général, l'U.S. EPA a conclu que les installations réglementées obtiennent des taux d'enlevement plus importants que prévu (voir la section B.8), bien que certaines installations n'aient pas été en mesure de respecter les seuils d'enlevement requis. Le rapport émet une mise en garde sur le fait que l'analyse des données n'a pas permis de savoir quelles installations sont autorisées à déterminer d'autres critères de performance ou qui pourraient avoir traité de l'eau avec un COT inférieur à 2 mg/L (U.S. EPA, 2016). Trois études antérieures ont révélé que 32 des 69 (46 %) sources d'eau présentant une large plage de qualités de l'eau (COT = 2,0 à 27,0 mg/L; alcalinité = 4 à 250 mg/L exprimé en CaCO3; turbidité = 0,2 à 151,0 UTN) ne respecteraient pas les exigences d'enlevement du COT prescrites (Krasner et Amy, 1995; White et coll., 1997; Archer et Singer, 2006b). Les auteurs ont avancé que d'autres critères de performance s'appliqueraient à de nombreuses sources.
| COT entrant (mg/L) |
Alcalinité entrante (mg/L CaCO3) | ||
|---|---|---|---|
| 0 à 60 mg/L | >60 à 120 mg/L | >120 mg/L | |
| >2 à 4 | Moyenne 41,7 % Médiane 41,6 % |
Moyenne 35,2 % Médiane 35,1 % |
Moyenne 30,4 % Médiane 30,1 % |
| >4 à 8 | Moyenne 54,7 % Médiane 54,3 % |
Moyenne 46,8 % Médiane 46,3 % |
Moyenne 44,1 % Médiane 43,9 % |
| >8 | Moyenne 66,2 % Médiane 66,4 % |
Moyenne 46,3 % Médiane 44,2 % |
Moyenne 46,9 % Médiane 47,8 % |
|
|||
Dans des installations de traitement de l'eau à grande échelle en Nouvelle-Écosse, le taux d'enlevement du COT était d'environ 46 % dans une usine recourant à la filtration directe, tandis qu'il variait de -12 à 82 % et de 1 à 77 % dans les usines utilisant le traitement conventionnel et la FAD + filtration, respectivement. Le COT de l'eau traitée tend à être inférieur à 2 mg/L dans environ 60 % des installations. Le taux de suppression de la couleur était d'environ 72 % dans une usine de filtration directe, et variait de -113 à 96 % et de 38 à 93 % dans les usines utilisant le traitement conventionnel et la FAD + filtration, respectivement. En général, la couleur de l'eau traitée était inférieure à 15 UCT. Toutefois, la MON peut demeurer réactive après le traitement, de sorte que les seuils recommandés pour les SPD ne sont pas atteints; il peut s'avérer nécessaire de réduire la couleur à 5-10 UCT (Chaulk, 2015) ou de recourir à la biofiltration (Stoddart et Gagnon, 2015).
B.6.3.2 Résultats à l'échelle pilote
Les résultats de plusieurs études pilotes sont résumés au tableau 10. Braun et coll. (2014) ont évalué quatre procédés en parallèle pendant une période de trois ans, incluant une sécheresse prolongée et deux périodes d'inondation distinctes. Les auteurs ont découvert que les procédés de traitement les plus avancés (p. ex., échange d'ions, CAG, filtration sur membrane) enlevaient plus de COD et présentaient une moindre variabilité que les traitements conventionnels; la MF/NF donnant les plus faibles concentrations de COD dans l'eau traitée.
Les chercheurs qui étudient le procédé MIEX® (seul ou avec la coagulation) ont constaté une grande variabilité dans l'enlevement du COD (voir le tableau 10). Les caractéristiques de la MON ont influé sur le taux d'enlevement du COD (Fearing et coll., 2004c, Singer et coll., 2007, Braun et coll., 2014), et les taux d'enlevement de COD augmentaient de pair avec l'ASUV (Singer et al., 2009). Braun et coll. (2014) ont noté que la qualité de l'eau était à son meilleur pendant la période de sécheresse, mais tous les procédés de traitement ont atteint leur plus faible taux d'enlevement du carbone organique et leur plus grande variabilité durant cette période. Pendant les périodes de sécheresse, la MON a tendance à être générée par des sources autochtones et à être de nature hydrophile. Cela va dans le même sens que les résultats de l'étude à grande échelle, qui indiquent que la MON hydrophile peut être difficile à traiter.
Fearing et coll. (2004c) ont mis en évidence la variabilité observée en fonction de la dose de résine et du temps de contact. Il est recommandé de faire des essais pilotes pour déterminer la configuration optimale et ainsi assurer que l'échange d'ions traitera efficacement l'eau à la source (Fearing et coll., 2004c).
| Procédés de traitement | Suppression de COD (%) | Détails du procédé | Référence |
|---|---|---|---|
| Filtration conventionnelle | 32 à 61Note de bas de page a | Dose d'alun = 20 à 160 mg/L pH de coagulation = 6,0 à 6,5 |
Braun et coll., 2014 |
| MIEX® | 35 à 67 | Dose de résine = 15 à 20 mL/L Temps de contact = 15 à 20 min |
Singer et coll. 2007 |
| 64 à 74 | Dose de résine = 6 à 8 mL/L Temps de contact = 15 min |
Drikas et coll., 2003 | |
| MIEX® et coagulation | 64 à 76 | Dose de résine = 6 mL/L Temps de contact = 10 à 15 min |
Drikas et coll., 2003 |
| 10 à 20 | Dose de résine = 2 mL/L Temps de contact = 10 à 20 min |
Fearing et coll., 2004c | |
| ≈ 50 | Dose de résine = 20 mL/L Temps de contact = 5 min |
Fearing et coll., 2004c | |
| 66,1 à 82,1 | Dose de résine = 30 mL/L Temps de contact = 60 min |
Fearing et coll., 2004c | |
| 52 à 81Note de bas de page a,Note de bas de page b | Dose de résine = 15 mL/L Temps de contact = 10 min |
Braun et coll., 2014 | |
| MIEX® avec coagulation et CAG | 74 à 91Note de bas de page a,Note de bas de page b | Dose de résine = 15 mL/L Temps de contact = 10 min | Braun et coll., 2014 |
| MF/NF | 89 à 97Note de bas de page a,Note de bas de page b | Taille MF = 0,2 μm (nominal) NF SRMNote de bas de page c = 270 Da |
Braun et coll., 2014 |
|
|||
B.6.3.3 Résultats des essais à l'échelle du laboratoire
Bond et coll. (2011) ont effectué une revue complète de la littérature et résumé les résultats de nombreuses études en laboratoire portant sur divers procédés de traitement, tel qu'indiqué au tableau 11. Dans ces études, les pourcentages d'enlevement étaient déterminés pour le COD, l'UV254, les précurseurs de THM et les précurseurs d'AHA. Dans quelques études, les différences entre la formation de ADCA et d'acide trichloroacétique (ATCA) ont également été examinées. Le tableau 11 résume également les résultats à l'échelle du laboratoire, publiés par Plourde-Lescelleur et coll. (2015) pour six sources d'eau de surface au Canada. Dans cette étude, des solutions de rechange en matière de traitement ont été mises à l'essai en parallèle pour chaque eau de surface dès réception au laboratoire, afin de permettre une comparaison directe de l'enlevement de la MON.
Les différences de taux d'enlevement des précurseurs de THM et d'AHA sont clairement démontrées dans le tableau 11. Dans les cas dénotés par des valeurs négatives, une augmentation de SPD a été observée après le traitement. Cette situation tend à se présenter dans les traitements à l'ozone et les procédés d'oxydation avancés, ce qui souligne la nécessité d'étudier soigneusement les effets du recours à l'oxydation comme moyen de contrôle des SPD.
| Procédé | Pourcentage (%) d'enlevement (moyenne) | ||||
|---|---|---|---|---|---|
| COD | UV254 | Précurseurs de THM | Précurseurs d'AHA | ||
| Coagulation Bond et coll., 2011Note de bas de page a |
17 à 33 (25) | 3 à 80 (46) | 7 à 71 (36) | 15 à 78 (38) | |
| Plourde-Lescelleur et coll., 2015Note de bas de page b Alun Ferrique |
26 à 70 (54) 13 à 74 (53) |
34 à 85 (69) 30 à 88 (68) |
48 à 83 (70) 44 à 90 (72) |
48 à 93 (79) 69 à 97 (81) |
|
| Échange d'ions–coagulation Bond et coll., 2011Note de bas de page a |
42 à 76 (59) | 47 à 96 (79) | 27 à 88 (70) | 52 à 80 (67) | |
| Plourde-Lescelleur et coll., 2015Note de bas de page b | 39 à 75 (63) | 47 à 90 (77) | 50 à 92 (76) | 61 à 97 (84) | |
| NanofiltrationNote de bas de page c Bond et coll., 2011Note de bas de page a |
86 à 93 (90) | 89 à 99 (96) | 66 à 98 (87) | 67 à 99 (87) | |
| Plourde-Lescelleur et coll., 2015Note de bas de page b | 77 à 89 (84) | 79 à 93 (87) | 75 à 98 (89) | 88 à 100 (97) | |
| Préozonisation–coagulation Bond et coll., 2011Note de bas de page a |
0 à 30 (15) | 42 à 69 (60) | 51 à 66 (57) | 48 à 76 (66) | |
| Coagulation–ozonisation Bond et coll., 2011Note de bas de page a |
16 à 34 (23) | 49 à 69 (61) | 47 à 58 (51) | 60 à 81 (71) | |
| Plourde-Lescelleur et coll., 2015Note de bas de page b | 21 à 69 (54) | 55 à 93 (82) | 59 à 90 (78) | 48 à 97 (80) | |
| Ozonisation Bond et coll., 2011Note de bas de page a |
8 à 16 (12) | 28 à 77 (58) | 0 à 43 (14) | - 50 à 20 (4) | |
| Ozonisation–sable biologique Bond et coll., 2011Note de bas de page a |
Non disponible | Non disponible | -5 à 54 (42) | -4 à 68 (51) | |
| Coagulation–CAP Plourde-Lescelleur et coll., 2015Note de bas de page b |
58 à 86 (77) | 57 à 96 (88) | 73 à 93 (85) | 91 à 99 (96) | |
| Ozonisation–UV Bond et coll., 2011Note de bas de page a |
17 à 56 (33) | 90 à 94 (92) | 48 à 89 (67) | Non disponible | |
| UV–H2O2 Bond et coll., 2011Note de bas de page a |
-11 à 20 (-1) | 20 à 59 (34) | 8 à 73 (43) | ADCA -197 à -11 (-79) |
ATCA 6 à 69 (24) |
| UV–H2O2–sable biologique Bond et coll., 2011Note de bas de page a |
38 à 80 (59) | 45 à 81 (64) | 42 à 85 (60) | ADCA 3 à 63 (36) |
ATCA 42 à 85 (62) |
|
|||||
B.6.4 Réseau de distribution
La fraction biodégradable de la MON (c.-à-d. la MOB) a des effets sur la qualité de l'eau du réseau de distribution en fournissant une source de nutriments qui contribue à la recroissance des bactéries et à la formation du biofilm. Les biofilms peuvent constituer un habitat propice à la survie des agents pathogènes d'origine fécale susceptibles d'avoir franchi toutes les barrières de traitement de l'eau potable. Les agents pathogènes opportunistes dans la plomberie des bâtiments (APOPB), comme Legionella et les mycobactéries non tuberculeuses (p. ex., M. avium, M. intracellulare) se retrouvent aussi couramment dans les biofilms des réseaux d'adduction d'eau potable (Fricker, 2003, Falkinham, 2015). La possibilité de prolifération des APOPB dans les réseaux de distribution et les biofilms des systèmes de plomberie préoccupe de plus en plus l'industrie de l'eau potable. Aux États-Unis, la cause la plus fréquente d'éclosion dans l'eau potable est la Legionella, qui prolifère dans les systèmes de plomberie des bâtiments (principalement dans les hôpitaux et les établissements de santé qui ne relèvent pas de la compétence des services d'eau) (Beer et coll., 2015).
Les chercheurs ont examiné l'incidence des taux de carbone organique sur la croissance et la survie des APOPB après le traitement de l'eau potable. Falkinham et coll. (2001) ont observé des dénombrements de mycobactéries plus élevés dans les échantillons du réseau de distribution que dans ceux prélevés directement en aval des installations de traitement, et l'augmentation était en corrélation avec les taux de COA et de CODB (r2= 0,65). Les bactéries M. avium et M. intracellulare n'ont pas été détectées dans des échantillons d'eau prélevés directement après le traitement; cependant, elles pourraient être récupérées dans le réseau de distribution et dans des échantillons de biofilm provenant de compteurs d'eau dans ces mêmes réseaux (Falkinham et coll., 2001).
Des études examinant les effets du carbone organique sur le dénombrement d'APOPB dans les réseaux de distribution d'eau potable en l'absence de désinfectant résiduel ont également été menées afin de fournir des données précises sur l'incidence des taux de nutriments sur la croissance de ces APOPB dans les biofilms. Norton et coll. (2004) ont noté que la bactérie M. avium pourrait être récupérée à partir de biofilms à des taux de nutriments de 50 μg/L COA dans des réseaux de distribution modèles où aucune désinfection n'a été appliquée. Van der Wielen et van der Kooij (2013) ont observé la présence sporadique de copies de gènes L. pneumophila dans des eaux potables non chlorées provenant d'usines de traitement des eaux de surface et des eaux souterraines présentant des taux de COA supérieurs à 10 μg/L, et ont observé leur absence dans des réseaux présentant des taux de COA inférieurs à 5 μg/L. Wullings et coll. (2011) ont observé que l'ADN de L. pneumophila était décelée plus fréquemment dans des échantillons de biofilm prélevés dans un réseau de distribution alimenté en eau potable présentant une forte concentration de MON (8 ppm de carbone) que dans des échantillons de biofilm provenant d'un réseau de distribution d'eau potable à faible concentration de MON.
Prises ensemble, ces études soulignent l'importance de l'enlevement du carbone organique et du maintien d'un résidu de désinfectant efficace pour minimiser la formation d'un biofilm dans le réseau de distribution et la plomberie des bâtiments. Des documents d'orientation visant à aider les services d'eau à élaborer des programmes de contrôle de l'eau potable traitée sont disponibles ailleurs (LeChevallier et Au, 2004). En général, les points à surveiller pour enrayer la prolifération des bactéries dans les réseaux de distribution sont le maintien d'un résidu de désinfectant, la suppression de la MON et le contrôle de la corrosion.
Les services d'eau doivent savoir que lorsqu'ils utilisent le chlore libre et les chloramines comme désinfectants secondaires, ces agents présentent une efficacité différente au chapitre du pouvoir désinfectant, de la réactivité avec les matériaux organiques et inorganiques, de la pénétration du biofilm, du potentiel de formation de SPD et de la nitrification. Des conseils détaillés sont proposés dans d'autres publications pour aider les services d'eau à choisir les désinfectants chimiques (LeChevallier et Au, 2004, AWWA 2011a, Santé Canada, 2013).
Un réseau de distribution bien entretenu est une composante essentielle de de la source au robinet visant à fournir de l'eau potable saine (Fisher et coll., 2000). L'optimisation du réseau de distribution est un processus complexe faisant intervenir de nombreux objectifs concomitants (p. ex., la protection microbienne, SPD, corrosion, intégrité physique). Il faut surveiller régulièrement la qualité de l'eau du réseau de distribution, y compris les indicateurs de stabilité biologique (voir section B.5.3). Des programmes de fonctionnement et d'entretien doivent être en place (p. ex., surveillance de la date de péremption de l'eau, nettoyage des conduites, prévention des retours d'eau polluée, gestion des biens) et une hygiène rigoureuse doit être pratiquée pendant les réparations des conduites afin que l'eau potable soit acheminée jusqu'au consommateur sans importante perte de qualité (Kirmeyer et coll., 2001, 2014).
B.7 Objectifs de surveillance et de qualité de l'eau traitée
Les services d'eau devraient recueillir de l'information sur la qualité de l'eau afin d'optimiser leurs procédés de traitement de l'eau, de respecter les exigences réglementaires relatives aux SPD, au plomb et au cuivre et de minimiser la formation de biofilms. Les conditions propres au site et les objectifs de traitement influent sur les besoins de surveillance, incluant, mais sans s'y limiter, le choix des paramètres ainsi que la méthode et la fréquence d'analyse. La fréquence de la surveillance est généralement basée sur la variabilité de la source ou la nature critique d'un procédé de traitement. Les sources d'eau hautement variables et les procédés critiques doivent faire l'objet d'un suivi plus fréquent.
Il faut effectuer une surveillance de l'eau brute pour caractériser la source et mieux comprendre les conditions qui modifient les concentrations ou les caractéristiques de la MON (p. ex., précipitations, fonte de la neige, proliférations d'algues, sécheresse, incendie) ainsi que les facteurs qui augmentent la réactivité de la MON pour former des SPD (p. ex., conditions de réaction, âge de l'eau, composés inorganiques tels que l'ammoniac, le bromure, l'iodure et le soufre). Une surveillance opérationnelle continue et l'optimisation du traitement permettront de s'assurer que les services d'eau enlèvent adéquatement la MON afin d'atteindre les objectifs concomitants de qualité de l'eau liés à la protection microbienne, aux SPD, à la stabilité biologique et la corrosion. Le tableau C-3.5 propose des paramètres et recommande des fréquences d'échantillonnage. Des conseils supplémentaires peuvent être obtenus ailleurs (Kornegay et coll., 2000; OMS, 2014).
Une fois les données recueillies, il faut les analyser pour évaluer ce qui suit :
- si la qualité de l'eau à la source change, et comment (p. ex., couleur, absorbance/transmittance UV, COD, ASUV);
- s'il existe une corrélation entre le COD dans l'eau brute et les autres substituts utilisés pour mesurer la concentration de MON (p. ex., couleur, absorbance UV, transmittance UV);
- la façon dont la MON influe sur les procédés de traitement de l'eau (p. ex., utilisation de produits chimiques et dose/demande spécifique de produits chimiques) et si des seuils de surveillance doivent être établis;
- la façon dont le traitement influe sur la MON (p. ex., concentration de MON résiduelle, modification de l'ASUV, rendement en SPD spécifiques, couleur spécifique) et si des seuils de surveillance doivent être établis;
- les incidences du réseau de distribution (p. ex., concentrations de SPD, de plomb et de cuivre);
- la stabilité biologique (p. ex., variabilité du résidu de désinfectant, taux de formation de biofilms, variation des taux de corrosion);
- s'il existe une corrélation entre les substituts de MON dans l'eau traitée (p. ex., COD, couleur, absorbance/transmittance UV) et la qualité de l'eau du réseau de distribution (p. ex., SPD, rendement en SPD spécifiques, plomb, cuivre, stabilité biologique).
Un processus d'amélioration continue devrait être mis en place pour s'assurer que le traitement de l'eau est optimisé de manière à atteindre les objectifs de qualité de l'eau et de maximiser la protection de la santé publique pour l'éventail complet des conditions de qualité de l'eau. Comme les services d'eau devraient viser à réduire au minimum les concentrations de SPD, de plomb et de cuivre et à réduire la formation de biofilms dans le réseau de distribution, le but du processus d'amélioration continue devrait être d'abaisser la concentration de MON au plus faible niveau possible. Des objectifs de qualité de l'eau traitée sont proposés au tableau 12 pour les paramètres de substitution les plus couramment utilisés afin de fournir une indication des concentrations de MON. Les objectifs de qualité de l'eau traitée seront propres à la source et au réseau pour les raisons indiquées ci-dessous.
- Certaines sources peuvent avoir un rendement en SPD spécifiques plus élevé (p. ex., μg SPD/mg COD) que d'autres sources, tel qu'indiqué à la section B.4.1.2. Cela peut s'expliquer par des différences dans les caractéristiques de la MON (p. ex., certaines fractions de MON produisent plus de SPD que d'autres) ou par la présence de composés inorganiques qui augmentent les taux de formation de SPD (p. ex., ammoniac, bromure, iodure et soufre). Les rendements en SPD propres à la source peuvent être déterminés tel qu'indiqué à la section B.5.2.3. Les sources donnant des rendements accrus en SPD spécifiques sont considérées comme étant plus « réactives ».
- Certains réseaux sont équipés de systèmes de distribution élaborés. Comme il est indiqué dans la section B.4.1.2, un réseau de distribution ayant un temps de séjour de 7 jours et une température supérieure à 15 °C devra viser un niveau différent d'enlevement de la MON pour respecter les seuils recommandés de SPD par rapport à un réseau ayant un temps de séjour de 3 jours et une température supérieure à 4 °C.
Dans le cas des sources plus réactives et des réseaux de distribution élaborés, on devrait soumettre l'eau traitée à des exigences plus strictes, en raison du potentiel accru de formation de SPD. Les sources peu réactives disposent de plus de flexibilité en ce qui concerne les seuils de contrôle maximaux pour la plupart des paramètres énumérés au tableau 12, à l'exception des suivants :
- DCO – du fait que la DCO ne mesure que la matière organique oxydable, une source hautement réactive présentant une concentration de 2 mg/L de COT et une source moins réactive présentant une concentration de 4 mg/L de COT peuvent avoir des concentrations de DCO comparables (Stoddart et Gagnon, 2014; Dabrowska, 2016).
- COD pour la stabilité biologique – on recommande un taux de COD inférieur à 1,8 mg/L pour minimiser le taux de formation de biofilms et la variabilité du désinfectant, quelle que soit la qualité de l'eau à la source ou le désinfectant secondaire utilisé pour le contrôle résiduel (LeChevallier et coll., 2015a, 2015b).
Tel qu'indiqué à la section B.6.1, plusieurs procédés de traitement peuvent être nécessaires pour bien enlever la MON dans toutes les conditions rencontrées au cours de l'année. Un programme de surveillance tel que celui suggéré au tableau C-3.5 ainsi que les objectifs de qualité de l'eau décrits au tableau 12 sont des éléments essentiels d'un programme d'amélioration continue fructueux.
Le tableau 12 est fourni à titre indicatif seulement. Certaines sources d'eau peuvent être extrêmement réactives et peuvent donc nécessiter des objectifs de qualité de l'eau plus stricts. Il incombe à les services d'eau de s'assurer de bien connaître les propriétés de la MON et de l'enlever correctement pour atteindre les objectifs de qualité de l'eau liés à la protection microbienne, aux SPD, à la stabilité biologique et la corrosion. Les services d'eau devraient communiquer avec l'autorité compétente en matière d'eau potable de la province concernée afin de vérifier si des exigences particulières s'appliquent à leur source ou à leur réseau.
| Paramètre | Unités | Source ayant un rendement en SPD spécifiques élevé ou Système à réseau de distribution élaboré |
Source ayant un rendement en SPD spécifiques inférieur | Référence(s) |
|---|---|---|---|---|
| Couleur | UCT | 5 à 10 | <15 | Chaulk, 2015 |
| UV254 | cm-1 | 0,02 à 0,04 | 0,02 à 0,07 | Edzwald et Kaminski, 2009; Elliot, 2017 |
| Transmittance UV | Pour cent | 90 à 95 | 85 à 95 | Chaulk, 2015; Elliot, 2017 |
| DCO | mg/L O2 | <5 | <5 | UE, 2014; Stoddart et Gagnon, 2014; Dabrowska, 2016 |
| COD – pour le contrôle des SPD | mg/L C | <2 | <4 | U.S. EPA, 1998 |
| COD – pour la stabilité biologique | mg/L C | <1,8 | <1,8 | LeChevallier et coll., 2015a, 2015b |
B.8 Considérations internationales
La MON a une incidence déterminante sur les procédés de traitement de l'eau potable destinés à protéger la santé publique. Par conséquent, certaines administrations ont établi des exigences réglementaires ou des cibles volontaires pour réduire au minimum les répercussions sur la qualité de l'eau potable.
L'U.S. EPA (1998) impose une technique de traitement visant à enlever le carbone organique total dans le but de réduire la formation de SPD. Cette règle s'applique aux installations d'épuration des eaux de surface utilisant un traitement d'eau conventionnel ou d'adoucissement à la chaux lorsque la teneur en COT dans l'eau à la source dépasse 2 mg/L. Les critères de rendement de cette technique de traitement sont basés sur le COT et l'alcalinité de l'eau brute. Les services d'eau qui s'approvisionnent en eau brute contenant de la MON insuffisamment enlevée par la coagulation sont autorisés à réaliser des essais de floculation afin de déterminer d'autres critères de performance et d'éviter le recours à de trop fortes doses d'alun qui ne donnent qu'une enlevement supplémentaire marginale du COT. La règle exige la surveillance des SPD, des résidus de désinfectant, du COT et de l'alcalinité. Les installations qui utilisent d'autres critères de rendement doivent également surveiller la suppression de la dureté liée au magnésium, le COD, l'UV254 et l'ASUV. Un plan de surveillance doit être élaboré et mis en œuvre, comprenant un échantillonnage mensuel du COT dans l'eau brute et dans l'eau traitée à la sortie du filtre, ainsi que la surveillance de la teneur totale en THM (c.-à-d. chloroforme, bromoforme, bromodichlorométhane et chlorodibromométhane) et en AHA5 représentatifs de l'ensemble du réseau de distribution. L'enlevement du COT est exprimée sous forme de moyenne annuelle courante calculée trimestriellement à partir d'échantillons mensuels.
L'Organisation mondiale de la santé (OMS) suggère d'effectuer une suppression optimisée de la MON comme moyen de minimiser la croissance du biofilm dans le réseau de distribution (OMS, 2011). L'OMS suggère également d'utiliser le carbone organique comme paramètre opérationnel dans les plans de sécurité sanitaire de l'eau, pour surveiller les mesures de contrôle.
La réglementation de l'Union européenne sur l'eau potable inclut le COT comme paramètre général indicateur de la qualité de l'eau pour les réseaux fournissant un volume égal ou supérieur à 10 000 m3/jour (UE, 2014). La réglementation précise « aucun changement anormal » comme valeur paramétrique. Dans certains pays, l'oxydabilité (mesurée en tant que demande chimique en oxygène) peut être utilisée à la place du COT. Une valeur guide paramétrique de 5 mg/L O2 est précisée (UE, 2014). La réglementation française énonce des limites indicatives pour les eaux traitées destinées à la consommation humaine incluant plusieurs paramètres chimiques et organoleptiques, dont le COT (c.-à-d. 2 mg/L et aucun changement anormal) et l'oxydabilité (c.-à-d. 5 mg/L O2) (gouvernement de la France, 2007).
L'approche des Pays-Bas en ce qui a trait à l'eau potable comprend des mesures visant à contrôler ou à limiter l'activité microbienne dans les réseaux de distribution en l'absence d'un résidu de désinfectant (Smeets et coll., 2009). Cela nécessite la production d'eau potable biologiquement stable avec un COA cible inférieur à 10 μg/L (van der Kooij, 2000; Smeets et coll., 2009; Lautenschlager et coll., 2013). Des investissements doivent être engagés dans l'infrastructure de traitement et les réseaux de distribution avancés pour atteindre la cible relative au COA. Les sources d'eau souterraine utilisent généralement l'aération et la filtration avec CAG dans certains cas pour enlever les contaminants chimiques, suivi d'une désinfection aux UV pour réduire le nombre de colonies après le CAG. Aux endroits à hautes concentrations de méthane, il faut intensifier l'aération, tandis que dans les endroits à fortes concentrations d'ammoniac, il faut recourir à une « filtration rapide sur sable sec » (à savoir, le lit de sable n'est pas saturé) pour favoriser le transfert d'oxygène vers l'eau. Les systèmes de filtration des eaux de surface et sur berge conjuguent plusieurs procédés de traitement : sédimentation-coagulation, filtration rapide sur sable, CAG, filtration sur dunes, adoucissement, oxydation avancée ou ozonisation, filtration sur membrane (UF ou OI) et filtration lente sur sable (Smeets, 2017).
En Australie, des lignes directrices ont été élaborées pour aider les services d'eau à comprendre et à maîtriser les effets de la MON, dans le cadre des directives australiennes sur l'eau potable (Cooperative Research Centre for Water Quality and Treatment, 2005).
Partie C. Références, acronymes et tableaux
C.1 Références
Ågren, A., I. Buffam, M. Jansson et H. Laudon. (2007). « Importance of seasonality and small streams for the landscape regulation of dissolved organic carbon export ». J. Geophys. Res. G Biogeosci., 112(3).
Aiken, G., et E. Cotsaris. (1995). « Soil and hydrology: Their effect on NOM ». J. Am. Water Works Assoc., 87(1): 36-45.
Aitkenhead-Peterson, J.A., W.H. McDowell et J.C. Neff. (2003). Sources, production and regulation of allochthonous dissolved organic matter inputs to surface waters. Chapitre 2 dans : Aquatic Ecosystems: Interactivity of dissolved organic matter. S.E.G. Findlay et R.L. Sinsabaugh, (dir. publ.). Academic Press, San Diego, Californie. p. 25–70.
Alarcon-Herrera, M.T., J.K. Bewtra et N. Biswas. (1994). « Seasonal variations in humic substances and their reduction through water treatment processes ». Can. J. Civ. Eng., 21(2): 173-179.
Alspach, B., P. Delphos, J. Pressman, J. Beaty, T. Cooke, N. Voutchkov, J. Schaefer, R. Noack, F. Marascia et D. Konstanski. (2014). Metrics and methods for MF/UF system optimization. Dans : Proceedings of the Membrane Technology Conference. American Water Works Association, Denver, Colorado.
Amy, G. (2008). « Fundamental understanding of organic matter fouling of membranes ». Desalination, 231(1-3): 44-51.
Amy, G., et J. Cho. (1999). « Interactions between natural organic matter (NOM) and membranes: Rejection and fouling ». Wat. Sci. Tech. (40(9): 131-139.
Amy, G., K. Carlson, M.R. Collins, J. Drewes, S. Gruenheid et M. Jekel. (2006). Integrated comparison of biofiltration in engineered versus natural systems. Chapitre 1 dans : Recent progress in slow sand and alternative biofiltration processes. R. Gimbel, N.J.D. Graham et M.R. Collins, (dir. publ.). IWA Publishing, Londres, R.-U. p. 3–12.
Amy, G.F., M.R. Collins, C.J. Kuo, Z.K. Chowdhury et R.C. Bales. (1989). Effect of humic substances on particle formation, growth, and removal during coagulation. Chapitre 27 dans : Aquatic Humic Substances: Influence on Fate and Treatment of Pollutants. I.H. Suffet et P. MacCarthy (dir. publ.). American Chemistry Society, Washington, DC. p. 443–452.
Anderson, L.E., W.H. Krkošek, A.K. Stoddart, B.F. Trueman et G.A. Gagnon. (2017). « Lake recovery through reduced sulfate deposition: A new paradigm for drinking water treatment ». Environ. Sci. Technol., 51(3): 1414-1422.
APHA/AWWA/WEF. (2012). Standard Methods for the Examination of Water and Wastewater, 22e éd. American Public Health Association, American Water Works Association, Water Environment Federation, Washington, DC. 9711D.
Appelo, C.A.J., et D. Postma. (1996). Geochemistry, groundwater and pollution. 3e édition. A.A. Balkema, Rotterdam, Pays-Bas.
Archer, A.D., et P.C. Singer. (2006a). « Effect of SUVA and enhanced coagulation on removal of TOX precursors ». J. Am. Water Works Assoc., 98(8): 97-107.
Archer, A.D., et P.C. Singer. (2006b). « An evaluation of the relationship between SUVA and NOM coagulation using the ICR database ». J. Am. Water Works Assoc., 98(7): 110-123.
Arnold, R.B., A. Griffin et M. Edwards. (2012). « Controlling copper corrosion in new construction by organic matter removal ». J. Am. Water Works Assoc., 104(5).
ASTM. (2017). Standard Test Method for Phototelectrochemical Oxygen Demand of Freshwater Sources for Drinking Water Treatment Plants and Treated Drinking Water. ASTM International, West Conshohocken, Pennsylvanie.
Ates, N., M. Kitis et U. Yetis. (2007). « Formation of chlorination by-products in waters with low SUVA-correlations with SUVA and differential UV spectroscopy ». Water Res., 41(18): 4139-4148.
AWWA. (2011a). Water quality and treatment: a handbook of community water supplies. 6e édition. J.K. Edzwald (ed.). McGraw-Hill, New York, New York.
AWWA. (2011b). Operational control of coagulation and filtration processes: Manual of Water Supply Practices – M37. 3e édition. American Water Works Association, Denver, Colorado.
AWWA. (2011c). Diagnosing taste and odor problems field guide. American Water Works Association, Denver, Colorado.
Babcock, D.B., et P.C. Singer. (1979). « Chlorination and coagulation of humic and fulvic acids ». J. Am. Water Works Assoc., 71(3): 149-152.
Bade, D.L., S.R. Carpenter, J.J. Cole, M.L. Pace, E. Kritzberg, M.C. Van De Bogert, R.M. Cory et D.M. McKnight. (2007). « Sources and fates of dissolved organic carbon in lakes as determined by whole-lake carbon isotope additions ». Biogeochemistry, 84(2): 115-129.
Batch, L.F., C.R. Schulz et K.G. Linden. (2004). « Evaluating water quality effects on UV disinfection of MS2 coliphage». J. Am. Water Works Assoc., 96(7): 75-87.
Beer, K.D., J.W. Gargano, V.A. Roberts, V.R. Hill, L.E. Garrison, P.K. Kutty, E.D. Hilborn, T.J. Wade, K.E. Fullerton et J.S. Yoder. (2015). Surveillance for waterborne disease outbreaks associated with drinking water — United‑States, 2011–2012. Morbidity and Mortality Weekly Report, 64 (31), p. 842-848.
Bellamy, W.D., G.P. Silverman, D.W. Hendricks et G.S. Logsdon. (1985a). « Removing Giardia cysts with slow sand filtration» . J. Am. Water Works Assoc., 77(2):52-60.
Bellamy, W.D., D.W. Hendricks et G.S. Logsdon. (1985b). « Slow sand filtration: Influences of selected process variables » . J. Am. Water Works Assoc., 77(12):22-66.
Bertilsson, S., et J.B. Jr. Jones. (2003). Supply of dissolved organic matter to aquatic ecosystems: Autochthonous sources. Dans : Aquatic Ecosystems: Interactivity of dissolved organic matter. S.E.G. Findlay et R.L. Sinsabaugh, (dir. publ.). Academic Press, San Diego, Californie. p. 3–24 (chapitre 1).
Besmer, M.D., D.G. Weissbrodt, B.E. Kratochvil, J.A. Sigrist, M.S. Weyland et F. Hammes. (2014). « The feasibility of automated online flow cytometry for in-situ monitoring of microbial dynamics in aquatic ecosystems » . Front. Microbiol., 5(JUN): 1-11.
Besmer, M.D., et F. Hammes. (2016). « Short-term microbial dynamics in a drinking water plant treating groundwater with occasional high microbial loads » . Water Res., 107: 11-18.
Betancourt, W.Q., et J.B. Rose. (2004). « Drinking water treatment processes for removal of Cryptosporidium and Giardia » . Vet. Parasitol., 126(1–2): 219–234.
Billica, J.A., et K.R. Gertig. (2000). Optimization of a coagulation process to treat high TOC, low alkalinity water and its impact on filtration performance. Dans : Proceedings of the AWWA Water Quality Technology Conference, Salt Lake City, Utah. American Water Works Association, Denver, Colorado.
Bize, J., B. Grenet et H. Maneglier. (1981). « Purifying capacity of the alluvial complex bordering a river » . Tech. Sci. Munic., 76(7): 393-401.
Black, A.P., et D.G. Willems. « Electrophoretic studies of coagulation for removal of organic color » . J. Am. Water Works Assoc., 53(5): 589-604 (1961).
Black, A.P., et R.F. Christman. (1963). « Characteristics of colored surface waters » . J. Am. Water Works Assoc., 55(6): 753-770.
Bolto, B., D. Dixon, R. Eldridge, S. King et K. Linge. (2002). « Removal of natural organic matter by ion exchange » . Water Res., 36(20): 5057-5065.
Bolton, J.R. (2013). Ultraviolet applications handbook. 3e édition. Bolton Photosciences Inc.
Bond, T., E.H. Goslan, S.A. Parsons et B. Jefferson. (2010). « Disinfection by-product formation of natural organic matter surrogates and treatment by coagulation, MIEX® and nanofiltration » . Water Res., 44(5): 1645-1653.
Bond, T., E.H. Goslan, S.A Parsons et B. Jefferson. (2011). « Treatment of disinfection by-product precursors » . Environ. Technol., 32(1): 1-25.
Bond, T., E.H. Goslan, S.A Parsons et B. Jefferson (2012). « A critical review of trihalomethane and haloacetic acid formation from natural organic matter surrogates » . Environ. Technol. Reviews, 1(1): 93-113.
Bond, T., J. Huang, N.J.D. Graham et M.R Templeton. (2014). « Examining the interrelationship between DOC, bromide and chlorine dose on DBP formation in drinking water - A case study » . Sci. Total Environ., 470-471: 469-479.
Bourbonniere, R.A. (1989). « Distribution patterns of dissolved organic matter fractions in natural waters from eastern Canada » . Org. Geochem., 14(1): 97-107.
Braun, K., R. Fabris, J. Morran, L. Ho et M. Drikas. (2014). « Drought to flood: A comparative assessment of four parallel surface water treatments during the 2010-2012 inflows to the Murray-Darling Basin, Australie-Méridionale » . Sci. Total Environ., 488-489(1): 36-45.
Brown, R.A., et D.A. Cornwell. (2011). Impact of anion exchange pre-treatment on downstream processes. Report number 4298. Water Research Foundation, Denver, Colorado.
Brown, J., G. Upadhyaya, J. Carter, T. Brown et C. Lauderdale. (2016). North American biofiltration knowledge base. Report number 4459. Water Research Foundation, Denver, Colorado.
Budd, G.C., B.W. Long, J.C. Edwards-Brandt, P.C. Singer et M. Meisch. (2005). Evaluation of MIEX® process impacts on different source waters. Water Research Foundation, Denver, Colorado
Bursill, D. (2001). « Drinking water treatment - understanding the processes and meeting the challenges » . Water Sc. Technol. Water Supply, 1(1): 1-7.
Camper, A.K. (2004). « Involvement of humic substances in regrowth » . International Journal of Food Microbiology, 92 (3), pp. 355-364.
Camper, A.K. (2014). Organic matter, pipe materials, disinfectants and biofilms in distribution systems. Dans : Microbial growth in drinking-water supplies: Problems, causes, control and research needs. D. van der Kooij, D. et P.W.J.J. van der Wielen (dir. publ.). IWA Publishing, Londres, Royaume-Uni. p. 73–94 (chapitre 4).
Carlson, K.H., et D. Gregory. (2000). « Optimizing water treatment with two-stage coagulation » . J. Environ. Eng., 126(6): 556-561.
Caron, E., G. Jr. Chevrefils, B. Barbeau, P. Payment et M. Prévost. (2007). « Impact of microparticles on UV disinfection of indigenous aerobic spores » . Water Res., 41(19): 4546-4556.
Carpenter, K.D., T.E.C. Kraus, J.H. Goldman, J.F. Saraceno, B.D. Downing, B.A. Bergamaschi, G. McGhee, et T. Triplett. (2013). Sources and characteristics of organic matter in the Clackamas River, Oregon, related to the formation of disinfection by-products in treated drinking water. U.S. Geological Survey Scientific Investigation Report 2013-5001, 78 p.
Carroll, T., S. King, S.R. Gray, B.A. Bolto et N.A. Booker. (2000). « The fouling of microfiltration membranes by NOM after coagulation treatment » . Water Res., 34(11): 2861-2868.
CCME (2004). De la source au robinet : guide d'application de l'approche à barrières multiples pour une eau potable saine. Conseil canadien des ministres de l'environnement, Winnipeg (Manitoba). Internet : http://www.ccme.ca/assets/pdf/mba_guidance_doc_f.pdf.
Chang, E.E., P.-C. Chiang, Y.-W. Ko et W.-H. Lan. (2001). « Characteristics of organic precursors and their relationship with disinfection by-products » . Chemosphere, 44(5): 1231-1236.
Chang, Y-C., et K. Jung. (2004). « Effect of distribution system materials and water quality on heterotrophic plate counts and biofilm proliferation » . J. Microbiol. Biotechnol., 14(6): 1114-1119.
Chaulk, M. (2015). Communication personnelle. CBCL Limited, Halifax (Nouvelle-Écosse).
Chen, F., S. Peldszus, R.H. Peiris, A.S. Ruhl, R. Mehrez, M. Jekel, R.L. Legge et P.M. Huck. (2014). « Pilot-scale investigation of drinking water ultrafiltration membrane fouling rates using advanced data analysis techniques » . Water Res., 48(1): 508-518.
Cho, J., G. Amy et J. Pellegrino. (2000). « Membrane filtration of natural organic matter: Factors and mechanisms affecting rejection and flux decline with charged ultrafiltration (UF) membrane » . J. Membr. Sci., 164(1-2): 89-110.
Cho, S., B. Gorczyca et C.D. Goss. (2010). Factors affecting THM formation in a typical prairie water supply system. Dans : Proceedings of the CSCE 11th International Environmental Specialty Conference, Winnipeg (Manitoba). p. 751-758.
Chon, K., et J. Cho. (2016). « Fouling behavior of dissolved organic matter in nanofiltration membranes from a pilot-scale drinking water treatment plant: An autopsy study » . Chem. Eng. J., 295: 268-277.
Chorus, I., G. Klein, J. Fastner et W. Rotard. (1992). « Off-flavors in surface waters - how efficient is bank filtration for their abatement in drinking water? » Water Sci. Technol., 25(2): 251-258.
Chow, C., R. Fabris, K. Wilkinson, F. Fitzgerald et M. Drikas. (2006). « Characterising NOM to assess treatability » . Water, 33(2): 74-85.
Chow, C.W.K., R. Fabris et M. Drikas. (2004). « A rapid fractionation technique to characterise natural organic matter for the optimisation of water treatment processes » . J. Water Supply Res. Technol. Aqua, 53(2): 85-92.
Chow, C.W.K., R. Fabris, M. Drikas et M. Holmes. (2005). « A case study of treatment performance and organic character » . J. Water Supply Res. Technol. Aqua, 54(6): 385-395.
Chowdhury, Z., A. Traviglia, J. Carter, T. Brown, R.S. Summers, C. Corwin, T. Zearley, M. Thurman, I. Ferrara, J. Olson, R. Thacker et P. Barron. (2010).Cost-effective regulatory compliance with GAC biofilters. Report number 4155. Water Research Foundation, Denver, Colorado.
Christensen, J., et K. Linden. (2002).New findings regarding the impacts of suspended particles on UV disinfection of drinking water. Dans : Proceedings of the Annual Conference of the American Water Works Association, New Orleans, LA. American Water Works Association, Denver, Colorado.
Coffey, B. M., P. M. Huck, D. D. Maurizio, M. B. Emelko, I. P. Douglas et J. Van Den Oever. (1999). The effect of optimizing coagulation on the removal of Cryptosporidium parvum and Bacillus subtilis. Dans : Proceedings of the AWWA Water Quality Technology Conference, Tampa, Floride. American Water Works Association, Denver, Colorado.
Collins, M.R., G.L. Army et C. Steelink. (1986). « Molecular weight distribution, carboxylic acidity, and humic substances content of aquatic organic matter: Implications for removal during water treatment » . Environ. Sci. Technol., 20(10): 1028-1032.
Collins, M.R., T.T Eighmy et J.P. Jr. Malley. (1991). « Evaluating modifications to slow sand filters » . J. Am. Water Works Assoc., 83(9):62–70.
Collins, M.R., T.T. Eighmy, J.M. Jr. Fenstermacher et S.K. Spanos. (1992). « Removing natural organic matter by conventional slow sand filtration » . J. Am. Water Works Assoc., 84(5):80–90.
Conio, O., M. Chioetto et E. Hargesheimer. (2002). Organic monitors. Dans : Online Monitoring for Drinking Water Utilities. E. Hargesheimer, O. Conio et J. Papovicova (dir. publ.). Awwa Research Foundation, Denver, Colorado. p. 163–202.
Cool, G., A. Lebel, R. Sadiq et M.J. Rodriguez. (2014). « Impact of catchment geophysical characteristics and climate on the regional variability of dissolved organic carbon (DOC) in surface water » . Sci. Total Environ., 490: 947-956.
Cooperative Research Centre for Water Quality and Treatment. (2005). Natural organic matter: Understanding and controlling the impact on water quality and water treatment processes: Management implications from the Research Programs of the Cooperative Research Centre for Water Quality Treatment.
Croft, J. (2012). Natural organic matter characterization of different source and treated waters; implications for membrane fouling control. Thèse de maîtrise, Université de Waterloo, Waterloo (Ontario).
Cronan, C.S., et G.R. Aiken. (1985). « Chemistry and transport of soluble humic substances in forested watersheds of the Adirondack park » , New York. Geochim. Cosmochim. Acta, 49(8): 1697-1705.
Croué, J.P., E. Lefebvre, B. Martin et B. Legube. (1993). « Removal of dissolved hydrophobic and hydrophilic organic substances during coagulation/flocculation of surface waters » . Water Sci. Technol., 27(11): 143-152.
Curriero, F.C., J.A. Patz, J.B. Rose et S. Lele. (2001). « The association between extreme precipitation and waterborne disease outbreaks in the United States » , 1948-1994. Am. J. Public Health, 91(8): 1194-1199.
Curtis, P.J., et H.E. Adams. (1995). « Dissolved organic matter quantity and quality from freshwater and saltwater lakes in east-central Alberta » . Biogeochemistry, 30(1): 59-76.
Dabrowska, L. (2016). « Removal of organic matter from surface water using coagulants with various basicity » . J. Ecol. Eng., 17(3): 66-72.
Dai, X., et R.M. Hozalski. (2002). « Effect of NOM and biofilm on the removal of Cryptosporidium parvum oocysts in rapid filters » . Water Res., 36(14): 3523-3532.
Dalva, M., et T.R. Moore. (1991). « Sources and sinks of dissolved organic carbon in a forested swamp catchment » . Biogeochemistry, 15(1): 1-19.
Davis, C.C., et M. Edwards. (2014). « Coagulation with hydrolyzing metal salts: Mechanisms and water quality impacts » . Crit. Rev. Environ. Sci. Technol., 44(4): 303-347.
de la Rubia, A., M. Rodriguez, V.M. León et D. Prats. (2008). « Removal of natural organic matter and THM formation potential by ultra- and nanofiltration of surface water » . Water Res., 42(3): 714-722.
Delpla, I., et M.J. Rodriguez. (2016). « Experimental disinfection by-product formation potential following rainfall events » . Water Res., 104: 340-348.
Dempsey, B.A. (2006). Coagulant characteristics and reactions. Chapitre 2 dans : Interface science in drinking water treatment – theory and applications. G. Newcombe et D. Dixon (dir. publ.). Academic Press, Londres, Royaume-Uni. p. 5-24.
Dempsey, B.A., R.M. Ganho et C.R. O'Melia. (1984). « The coagulation of humic substances by means of aluminum salts » . J. Am. Water Works Assoc., 76(4): 141-150.
Di Bernardo, L., et E. Pereira Tangerino. (2006). Removal of humic substances in slow sand and in slow sand/activated carbon filtration using ozone and hydrogen peroxide as pre-oxidants. Chapitre 26 dans : Recent progress in slow sand and alternative biofiltration processes. R. Gimbel, N.J.D. Graham et M.R. Collins, (dir. publ.). IWA Publishing, Londres, Royaume-Uni. p. 224–230.
Diem, S., M. Rudolf Von Rohr, J.G. Hering, H-E. Kohler, M. Schirmer et U. Von Gunten. (2013). « NOM degradation during river infiltration: Effects of the climate variables temperature and discharge » . Water Res., 47(17): 6585-6595.
Dittmar, T., B. Koch, N. Hertkorn et G. Kattner. (2008). « A simple and efficient method for the solid-phase extraction of dissolved organic matter (SPE-DOM) from seawater » . Limnol. Oceanogr. Methods, 6(JUN): 230-235.
Dotson, A., et P. Westerhoff. (2009). « Occurrence and removal of amino acids during drinking water treatment » . J. Am. Water Works Assoc., 101(9).
Drayna, P., S.L. McLellan, P. Simpson, S.-H. Li et M.H. Gorelick. (2010). « Association between rainfall and pediatric emergency department visits for acute gastrointestinal illness » . Environ. Health Perspect., 118(10): 1439-1443.
Drewes, J.E., C. Hoppe, G. Oldham, J. McCray et K. Thompson. (2009). Removal of bulk organic matter, organic micropollutants, and nutrients during riverbank filtration. Report number 3180. Water Research Foundation, Denver, Colorado.
Drikas, M., C.W.K. Chow et D. Cook. (2003). « The impact of recalcitrant organic character on disinfection stability, trihalomethane formation and bacterial regrowth: An evaluation of magnetic ion exchange resin (MIEX®) and alum coagulation » . J. Water Supply Res. Technol. Aqua, 52(7): 475-487.
Driscoll, C.T., K.M. Driscoll, K.M. Roy et M.J. Mitchell. (2003). « Chemical response of lakes in the Adirondack region of New York to declines in acidic deposition » . Environ. Sci. Technol., 37(10): 2036-2042.
Dryer, D.J., et G.V. Korshin. (2007). « Investigation of the reduction of lead dioxide by natural organic matter » . Environ. Sci. Technol., 41(15): 5510-5514.
Dugan, N.R., K.R. Fox, J.H. Owens et R.J. Miltner. (2001). « Controlling Cryptosporidium oocysts using conventional treatment » . J. Am. Water Works Assoc., 93(12): 64-76.
Eckhardt, B.W., et T.R. Moore. (1990). « Controls on dissolved organic carbon concentrations in streams, Southern Quebec » . Can. J. Fish. Aquat. Sci., 47(8): 1537-1544.
Edwards, G.A., et A. Amirtharajah. (1985). « Removing color caused by humic acids » . J. Am. Water Works Assoc., 77(3): 50-57.
Edwards, M., et N. Sprague. (2001). « Organic matter and copper corrosion by-product release: A mechanistic study » . Corros. Sci., 43(1): 1-18.
Edwards, M., et L.S. McNeill. (2002). « Effect of phosphate inhibitors on lead release from pipes » . J. Am. Water Works Assoc., 94(3): 79-90.
Edzwald, J.K. (1993). « Coagulation in drinking water treatment: Particles, organics and coagulants » . Water Sci. Technol., 27(11): 21-35.
Edzwald, J.K. (2010). « Dissolved air flotation and me » . Water Res., 44(7): 2077-2106.
Edzwald, J.K. (2017). Communication personnelle. Clarkson University, Potsdam, New York.
Edzwald, J.K., et J.E. Van Benschoten. (1990). Aluminum coagulation of natural organic matter. Dans : Chemical Water and Wastewater Treatment: Proceedings of the 4th Gothenburg Symposium, Madrid, Espagne. p. 341-359.
Edzwald, J.K., et M.B. Kelley. (1998). « Control of Cryptosporidium: From reservoirs to clarifiers to filters » . Water Sci. Technol., 37(2): 1-8.
Edzwald, J.K., et J.E. Tobiason. (1999). « Enhanced coagulation: US requirements and a broader view » . Wat. Sci. Tech., 40(9): 63-70.
Edzwald, J.K., et G.S. Kaminski. (2009). « A practical method for water plants to select coagulant dosing » . J. N. Engl. Water Works Assoc., 123(1): 15-31.
Edzwald, J.K., et J. Haarhoff. (2012). Dissolved air flotation for water clarification. McGraw Hill, New York.
Edzwald, J.K., W.C. Becker et K.L. Wattier. (1985). « Surrogate parameters for monitoring organic matter and THM precursors ». J. Am. Water Works Assoc., 77(4): 122-131.
Edzwald, J.K., J.E. Tobiason, L. M. Parento, M. B. Kelley, G. S. Kaminski, H. J. Dunn et P. B. Gallant. (1999). Clarification and filtration performance for removal of Giardia and Cryptosporidium. Dans : Proceedings of the AWWA Water Quality Technology Conference, Tampa, Floride. American Water Works Association, Denver, Colorado.
Edzwald, J.K., J.E. Tobiason, L.M. Parento, M.B. Kelley, G.S. Kaminski, H.J. Dunn et P.B. Galant. (2000). « Giardia and Cryptosporidium removals by clarification and filtration under challenge conditions » . J. Am. Water Works Assoc., 92(12): 70-84.
Edzwald, J.K., J.E. Tobiason, C. T. Udden, G. S. Kaminski, H. J. Dunn, P. B. Gallant et M. B. Kelley. (2003). « Evaluation of the effect of recycle of waste filter backwash water on plant removals of Cryptosporidium » . J. Water Supply Res. Technol. Aqua, 52(4): 243-258.
Eikebrokk, B., et T. Saltnes. (2001). « Removal of natural organic matter (NOM) using different coagulants and lightweight expanded clay aggregate filters » . Water Sc. Technol. Water Supply, 1(2): 131-140.
Eikebrokk, B., R.D. Vogt et H. Liltved. (2004). « NOM increase in northern European source waters: Discussion of possible causes and impacts on coagulation/contact filtration processes » . Water Sc. Technol. Water Supply, 4(4): 47-54.
Eikebrokk, B., T. Juhna et S.W. Østerhus. (2006). Water treatment by enhanced coagulation – Operational status and optimization issues. Techneau D 5.3.1a, 107 p.
Ekström, S.M., E.S. Kritzberg, D.B. Kleja, N. Larsson, P.A. Nilsson, W. Graneli et B. Bergkvist. (2011). « Effect of acid deposition on quantity and quality of dissolved organic matter in soil-water » . Environ. Sci. Technol., 45(11): 4733-4739.
Elhadidy, A.M., M.I. Van Dyke, S. Peldszus et P.M. Huck. (2016). « Application of flow cytometry to monitor assimilable organic carbon (AOC) and microbial community changes in water » . J. Microbiol. Methods, 130: 154-163.
Elliot, J. (2017). Communication personnelle. Ville d'Ottawa (Ontario)
Emelko, M. B., P. M. Huck et R. M. Slawson. (1999). Design and operational strategies for optimizing Cryptosporidium removal by filters. Dans : Proceedings of the AWWA Water Quality Technology Conference, Tampa, Floride. American Water Works Association, Denver, Colorado.
Emelko, M.B., P.M. Huck, B.M. Coffey et E.F. Smith. (2006). « Effects of media, backwash, and temperature on full-scale biological filtration » . J. Am. Water Works Assoc., 98(12): 61-73.
Environnement Canada. Données nationales de monitoring de la qualité de l'eau à long terme. (2017). Disponible à l'adresse : http://donnees.ec.gc.ca/data/substances/monitor/national-long-term-water-quality-monitoring-data/?lang=fr.
Escobar, I.C., et A.A. Randall. (2001). « Assimilable organic carbon (AOC) and biodegradable dissolved organic carbon (BDOC): Complementary measurements ». Water Res., 35(18): 4444-4454.
Evans, C.D., D.T. Monteith et D.M. Cooper. (2005). « Long-term increases in surface water dissolved organic carbon: Observations, possible causes and environmental impacts » . Environ. Pollut., 137(1): 55-71.
Evans, P.J., J.L. Smith, M.W. LeChevallier, O.D. Schneider, L.A. Weinrich et P.K. Jjemba. (2013a). Biological filtration monitoring and control toolbox: Guidance manual. Report number 4231a. Water Research Foundation, Denver, Colorado.
Evans, P.J., J.L. Smith, M.W. LeChevallier, O.D. Schneider, L.A. Weinrich et P.K. Jjemba. (2013b). A monitoring and control toolbox for biological filtration. Report number 4231. Water Research Foundation, Denver, Colorado.
Fabris, R., E.K. Lee, C.W.K. Chow, V. Chen et M. Drikas. (2007). « Pre-treatments to reduce fouling of low pressure micro-filtration (MF) membranes » . J. Membr. Sci., 289(1-2): 231-240.
Fabris, R., C.W.K. Chow, M. Drikas et B. Eikebrokk. (2008). « Comparison of NOM character in selected Australian and Norwegian drinking waters » . Water Res., 42(15): 4188-4196.
Falkinham III, J.O., C.D. Norton et M.W. Lechevallier. (2001). « Factors influencing numbers of Mycobacterium avium, Mycobacterium intracellulare, and other Mycobacteria in drinking water distribution systems » . Appl. Environ. Microbiol., 67(3): 1225-1231.
Falkinham, J.O. (2015). « Common features of opportunistic premise plumbing pathogens » . Int. J. Environ. Res. Public Health, 12(5): 4533-4545.
Fan, L., J.L. Harris, F.A. Roddick et N.A. Booker. (2001). « Influence of the characteristics of natural organic matter on the fouling of microfiltration membranes » . Water Res., 35(18): 4455-4463.
Fearing, D.A., J. Banks, D. Wilson, P.H. Hillis, A.T. Campbell et S.A. Parsons. (2004a). « NOM control options: The next generation » . Water Sc. Technol. Water Supply, 4(4): 139-145.
Fearing, D.A., E.H. Goslan, J. Banks, D. Wilson, P. Hillis, A.T. Campbell et S.A. Parsons. (2004b). « Staged coagulation for treatment of refractory organics » . J. Environ. Eng., 130(9): 975-982.
Fearing, D.A., J. Banks, S. Guyetand, C.M. Eroles, B. Jefferson, D. Wilson, P. Hillis, A.T. Campbell et S.A. Parsons. (2004c). « Combination of ferric and MIEX® for the treatment of a humic rich water » . Water Res., 38(10): 2551-2558.
Fischer, H. The role of biofilms in the uptake and transformation of dissolved organic matter. (2003). Dans : Aquatic Ecosystems: Interactivity of dissolved organic matter. S.E.G. Findlay et R.L. Sinsabaugh, (dir. publ.). Academic Press, San Diego, Californie. p. 285–313 (chapitre 12).
Fisher, I., M. Angles, J. Chandy, P. Cox, M. Warnecke, G. Kastl et V. Jegatheesan. (2000). « Biofilms - a sticky situation for drinking water? » Water (Australie), 27(2): 33-37.
Fricker, C.R. The presence of bacteria in water after regrowth. (2003). Dans: Heterotrophic plate counts and drinking-water safety. The significance of HPCs for water quality and human health. J. Bartram, J. Cotruvo, M. Exner, C. Fricker et A. Glasmacher (dir. publ.). IWA Publishing, Londres, Royaume-Uni. p. 137–145.
Frisch, N. W., et R. Kunin. (1960). « Organic fouling of anion-exchange resins » . J. Am. Water Works Assoc., 52(7): 875-887.
Fu, P.L.K., et J.M. Symons. (1990). « Removing aquatic organic substances by anion exchange resins » . J. Am. Water Works Assoc., 82(10): 70-77.
Ghosh, K., et M. Schnitzer. (1980). « Macromolecular structures of humic substances » . Soil Sci., 129(5): 266-276.
Gibert, O., B. Lefèvre, M. Fernández, X. Bernat, M. Paraira, M. Calderer et X. Martínez-Lladó. (2013a). « Characterising biofilm development on granular activated carbon used for drinking water production » . Water Res., 47(3): 1101-1110.
Gibert, O., B. Lefèvre, M. Fernández, X. Bernat, M. Paraira et M. Pons. (2013b). « Fractionation and removal of dissolved organic carbon in a full-scale granular activated carbon filter used for drinking water production » . Water Res., 47(8): 2821-2829.
Gilmore, P.L., et R.S. Summers. (2015). Organic matter removal via biological drinking water filters: removal efficacy based on quantifiable system factors. Dans : Proceedings of the AWWA Water Quality Technology Conference, Salt Lake City, Utah. American Water Works Association, Denver, Colorado.
GLUMRB. (2012). Recommended standards for water works. Health Education Services, Great Lakes – Upper Mississippi River Board of State and Provincial Public Health and Environmental Managers, Albany, New York.
Goslan, E.H., D.A. Fearing, J. Banks, D. Wilson, P. Hillis, A.T. Campbell et S.A Parsons. (2002). « Seasonal variations in the disinfection by-product precursor profile of a reservoir water » . J. Water Supply Res. Technol. Aqua, 51(8): 475-482.
Goss, C.D., et B. Gorczyca. (2013). « Trihalomethane formation potential of DOC fractions isolated from two Canadian Prairie surface water sources » . Water Sc. Technol. Water Supply, 13(1): 114-122.
Goss, C.D., K. Brezinski, T. Epp et B. Gorczyca. (2015). Monitoring the natural organic matter composition of surface waters using simple solid phase extraction method. Dans : Proceedings of the IWA Specialist Conference on Natural Organic Matter in Drinking Water, Malmö, Suède.
Goss, C.D., R. Wiens, B. Gorczyca et K.M. Gough. (2017). « Comparison of three solid phase extraction sorbents for the isolation of THM precursors from Manitoban surface waters » . Chemosphere, 168: 917-924.
Gottinger, A.M., D.W. McMartin, D. Price et B. Hanson. (2011). The effectiveness of slow sand filters to treat Canadian rural prairie water. Revue can. de génie civil, 38(4): 455-463.
Gouvernement de la France. Journal Officiel de la République Francaise (JORF), 31(6): 2180 (2007). Disponible à l'adresse : www.legifrance.gouv.fr/affichTexte.do?cidTexte=JORFTEXT000000465574&dateTexte=&categorieLien=id.
Graham, N.J.D. (1999). « Removal of humic substances by oxidation/biofiltration processes - A review » . Wat. Sci. Tech., 40(9): 141-148.
Gregor, J.E., C.J Nokes et E. Fenton. (1997). « Optimising natural organic matter removal from low turbidity waters by controlled pH adjustment of aluminium coagulation » . Water Res., 31(12): 2949-2958.
Gregory, D. (1998). « Enhanced coagulation for treating spring runoff water » . Opflow, 24(2): 12–13.
Gregory, R., et J. K. Edzwald. (2011). Sedimentation and flotation. Dans : Water Quality and Treatment. J. K. Edzwald (dir. publ.). McGraw Hill, New York. p. 9.1–9.98 (chapitre 9).
Grieve, I.C. (1994). « Dissolved organic carbon dynamics in two streams draining forested catchments at Loch Ard, Scotland » . Hydrol. Processes, 8(5): 457-464.
Haist-Gulde, B., et O. Happel. (2012). Removal of pesticides and their ionic degradates by adsorptive processes. Report number 4022. Water Research Foundation, Denver, Colorado.
Hall, E.S., et R.F. Packham. (1965). « Coagulation of organic color with hydrolyzing coagulants » . J. Am. Water Works Assoc., 57(9): 1149-1166.
Hallé, C., P.M. Huck, S. Peldszus, J. Haberkamp et M. Jekel. (2009). « Assessing the performance of biological filtration as pretreatment to low pressure membranes for drinking water » . Environ. Sci. Technol., 43(10): 3878-3884.
Hammes, F., et T. Egli. (2010). « Cytometric methods for measuring bacteria in water: Advantages, pitfalls and applications » . Anal. Bioanal. Chem., 397(3): 1083-1095.
Hammes, F., F. Goldschmidt, M. Vital, Y. Wang et T. Egli. (2010). « Measurement and interpretation of microbial adenosine tri-phosphate (ATP) in aquatic environments » . Water Res., 44(13): 3915-3923.
Hammes, F., T. Broger, H.-U. Weilenmann, M. Vital, J. Helbing, U. Bosshart, P. Huber, R. Peter Odermatt et B. Sonnleitner. (2012). « Development and laboratory-scale testing of a fully automated online flow cytometer for drinking water analysis » . Cytometry Part A, 81 A(6): 508-516.
Hanson, P.C., D.P. Hamilton, E.H. Stanley, N. Preston, O.C. Langman et E.L Kara. (2011). « Fate of allochthonous dissolved organic carbon in lakes: A quantitative approach » . Plos One, 6(7).
Hargesheimer, E.E., T. Satchwill et G. Beese. (1994). Evaluation of total organic carbon removal and disinfection by-product control strategies. Dans : Proceedings of the Sixth National Conference on Drinking Water, Victoria (Colombie-Britannique).
Hargy, T., et L. Landry. (2007). An Evaluation of the effects of Coquitlam source water turbidity on ozone and UV disinfection. Dans : Proceedings of the AWWA Water Quality Technology Conference, Charlotte, Caroline du Nord. American Water Works Association, Denver, Colorado.
Harrington, G. W., H.-W. Chen, A. J. Harris, I. Xagoraraki, D.A. Battigelli et J. H. Standridge. (2001). Removal of emerging waterborne pathogens. AWWA Research Foundation and American Water Works Association, Denver, Colorado.
Hassler, W.W. (1947). Taste and odor control in water purification. Githens-Sohl Corporation, New York.
Heeb, M.B., J. Criquet, S.G. Zimmermann-Steffens et U. Von Gunten. (2014). « Oxidative treatment of bromide-containing waters: Formation of bromine and its reactions with inorganic and organic compounds - A critical review » . Water Res., 48(1): 15-42.
Henderson, R.K., A. Baker, S.A Parsons et B. Jefferson. (2008). « Characterisation of algogenic organic matter extracted from cyanobacteria, green algae and diatoms » . Water Res., 42(13): 3435-3445.
Hendricks, D.W., W.F. Clunie, G.D. Sturbaum, D.A. Klein, T.L. Champlin, P. Kugrens, J. Hirsch, B. McCourt, G.R. Nordby, M.D. Sobsey, D.J. Hunt et M.J. Allen. (2005). « Filtration removals of microorganisms and particles » . J. Environ. Eng., 131(12): 1621-1632.
Her, N., G. Amy, A. Plottu-Pecheux et Y. Yoon. (2007). « Identification of nanofiltration membrane foulants » . Water Res., 41(17): 3936-3947.
Hijnen, W.A.M., et G. Medema. (2007). Microbial elimination capacity of conventional water treatment for viruses, bacteria and protozoan (oo)cysts. Dans : Proceedings of the AWWA Water Quality Technology Conference, Charlotte, Caroline du Nord. American Water Works Association, Denver, Colorado.
Hoehn, R.C., D.B. Barnes, B.C. Thompson, C.W. Randall, T.J. Grizzard et T.B. Shaffer. (1980). « Algae as sources of trihalomethane precursors » . J. Am. Water Works Assoc., 72(6): 344-350.
Hofmann, R. (2008). Ultraviolet disinfection: Everything you need to know but were afraid to ask. Drinking Water Research Group.
Howe, A.D., S. Forster, S. Morton, R. Marshall, K.S. Osborn, P. Wright et P.R. Hunter. (2002). « Cryptosporidium oocysts in a water supply associated with a cryptosporidiosis outbreak » . Emerg. Infect. Dis., 8(6): 619-624.
Hrudey, S.E., D. Rector et N. Motkosky. (1992). « Characterization of drinking water odour arising from spring thaw for an ice-covered upland river source » . Water Sci. Technol., 25(2): 65-72.
Hua, G., et D.A. Reckhow. (2007a). « Characterization of disinfection byproduct precursors based on hydrophobicity and molecular size » . Environ. Sci. Technol., 41(9): 3309-3315.
Hua, G., et D.A. Reckhow. (2007b). « Comparison of disinfection byproduct formation from chlorine and alternative disinfectants » . Water Res., 41(8): 1667-1678.
Hua, G., J. Kim et D.A. Reckhow. (2014). « Disinfection byproduct formation from lignin precursors » . Water Res., 63: 285-295.
Hua, G., D.A. Reckhow et I. Abusallout. (2015). « Correlation between SUVA and DBP formation during chlorination and chloramination of NOM fractions from different sources » . Chemosphere, 130: 82-89.
Huber, S.A., A. Balz, M. Abert et W. Pronk. (2011). « Characterisation of aquatic humic and non-humic matter with size-exclusion chromatography - organic carbon detection - organic nitrogen detection (LC-OCD-OND) » . Water Res., 45(2): 879-885.
Huck, P. M., et B. M. Coffey. (2004). « The importance of robustness in drinking-water systems » . Journal of Toxicology and Environmental Health – Part A, 67(20-22): 1581–1590.
Huck, P., et M. Sozański. (2011). 3.16 – Chemical basis for water technology. Dans : Treatise on water science. P. Wilderer (dir. publ.). Oxford: Elsevier. p. 429–469.
Huck, P.M., M.B. Emelko, B.M. Coffey, D. Maurizio et C. O'Melia. (2001). Filter operation effects on pathogen passage. Report No. 90874. Awwa Research Foundation, Denver, Colorado.
Huck, P.M., B.M. Coffey, M.B. Emelko, D.D. Maurizio, R.M. Slawson, W.B. Anderson, J. Van Den Oever, I.P. Douglas et C.R. O'Melia. (2002). « Effects of filter operation on Cryptosporidium removal » . J. Am. Water Works Assoc., 94(6): 97-111.
Humbert, H., H. Gallard, H. Suty et J.-P. Croué. (2008). « Natural organic matter (NOM) and pesticides removal using a combination of ion exchange resin and powdered activated carbon (PAC) » . Water Res., 42(6-7): 1635-1643.
Hurst, A.M., M.J. Edwards, M. Chipps, B. Jefferson et S.A.Parsons. (2004). « The impact of rainstorm events on coagulation and clarifier performance in potable water treatment » . Sci. Total Environ., 321(1-3): 219-230.
Hwang, C.J., S.W. Krasner, M.J. Sclimenti, G.L. Amy, E. Dickenson, A. Bruchet, C. Prompsy, G. Filippi, J.‑P. Croué, D. Violleau et J.A. Leenheer. (2001). Polar NOM: Characterization, DBPs, Treatment. Report number 90877. Awwa Research Foundation, Denver, Colorado.
Imai, A., T. Fukushima, K. Matsushige et Y. Hwan Kim. (2001). « Fractionation and characterization of dissolved organic matter in a shallow eutrophic lake, its inflowing rivers, and other organic matter sources » . Water Res., 35(17): 4019-4028.
Ivančev-Tumbas, I. (2014). « The fate and importance of organics in drinking water treatment: A review » . Environ. Sci. Pollut. Res., 21(20): 11794-11810.
Jabur, H.S. (2006). The effect of water temperature on the slow sand filter process. Chapitre 9 dans : Recent progress in slow sand and alternative biofiltration processes. R. Gimbel, N.J.D. Graham et M.R. Collins, (dir. publ.). IWA Publishing, London, Royaume-Uni. p. 74–77.
Jacangelo, J.G., J. DeMarco, D.M. Owen et S.J. Randtke. (1995). « Selected processes for removing NOM: An overview » . J. Am. Water Works Assoc., 87(1): 64-77.
Jacangelo, J.G., R.R. Trussell et M. Watson. (1997). « Role of membrane technology in drinking water treatment in the United States » . Desalination, 113(2-3): 119-127.
James, W., S. Craik, T. Shu, G. Solomynko et T. Xie. (2016). « Using zeta potential to determine coagulant and polymer dosage » . Environmental Science & Engineering magazine, Avril: 58–61.
Juhna, T., et E. Melin. (2006). « Ozonisation and biofiltration in water treatment – Operational status and optimization issues » . Techneau D 5.3.1 B, 79 p.
Kalbitz, K., S. Solinger, J.-H. Park, B. Michalzik et E. Matzner. (2000). « Controls on the dynamics of dissolved organic matter in soils: A review » . Soil Sci., 165(4): 277-304.
Kalbitz, K., K. Kaiser, J. Bargholz et P. Dardenne. (2006). « Lignin degradation controls the production of dissolved organic matter in decomposing foliar litter » . Eur. J. Soil Sci., 57(4): 504-516.
Karanfil, T., M.A. Schlautman et I. Erdogan. (2002). « Survey of DOC and UV measurement practices with implications for SUVA determination » . J. Am. Water Works Assoc., 94(12): 68-80.
Karanfil, T., I. Erdogan et M. Schlautman. (2005). The role of filtration in DOC, UV-254 and SUVA-254 determinations. Report number 91060F. Awwa Research Foundation, Denver, Colorado.
Karanfil, T., W. Cheng, Y. Guo, S.A. Dastgheib et H. Song. (2007). DBP formation control by modified activated carbons. Report number 91181. Awwa Research Foundation, Denver, Colorado.
Kastl, G., A. Sathasivan et I. Fisher. (2016). « A selection framework for NOM removal process for drinking water treatment » . Desalin. Water Treat., 57(17): 7679-7689.
Kavanaugh, M.C. (1978). « Modified coagulation for improved removal of trihalomethane precursors » . J. Am. Water Works Assoc., 70(11): 613-620.
Kennedy, M.D., Kamanyi, J., Heijman, B.G.J. et Amy, G. (2008). Colloidal organic matter fouling of UF membranes: Role of NOM composition & size. Desalination, 220(1-3): 200-213.
Kent, F.C., K.R. Montreuil, A.K. Stoddart, V.A. Reed et G.A. Gagnon. (2014). « Combined use of resin fractionation and high performance size exclusion chromatography for characterization of natural organic matter » . J. Environ. Sci. Health A, 49(14): 1615–1622.
Kerekes, J., G. Howell, S. Beauchamp et T. Pollock. (1982). « Characterization of three lake basins sensitive to acid precipitation in central Nova Scotia (June, 1979 to May, 1980) » . Int. Revue ges. Hydrobiol., 67(5): 679-694.
Kimura, K., K. Tanaka et Y. Watanabe. (2014). « Microfiltration of different surface waters with/without coagulation: Clear correlations between membrane fouling and hydrophilic biopolymers » . Water Res., 49: 434-443.
Kimura, K., Y. Hane, Y. Watanabe, G. Amy et N. Ohkuma. (2004). « Irreversible membrane fouling during ultrafiltration of surface water » . Water Res., 38(14-15): 3431-3441.
Kirmeyer, G.J., M. Friedman, K. Martel, D. Howie, M. LeChevallier, M. Abbaszadegan, M. Karim, J. Funk et J. Harbour. (2001). Pathogen intrusion into the distribution system. Report number 90835. AWWA Research Foundation and American Water Works Association, Denver, Colorado.
Kirmeyer, G.J., T.M. Thomure, R. Rahman, J.L. Marie, M.W. LeChevallier, J. Yang, D.M. Hughes et O. Schneider. (2014). Effective microbial control strategies for main breaks and depressurization. Report number 4037a. Water Research Foundation, Denver, Colorado.
Kollu, K., et B. Örmeci. (2012). « Effect of particles and bioflocculation on ultraviolet disinfection of Escherichia coli » . Water Res., 46(3): 750-760.
Kornegay, B.H., K.J. Kornegay et E. Torres. (2000). Natural organic matter in drinking water: Recommendations to water utilities. Awwa Research Foundation and American Water Works Association, Denver, Colorado.
Korshin, G.V., J.F. Ferguson et A.N. Lancaster. (2000). « Influence of natural organic matter on the corrosion of leaded brass in potable water » . Corros. Sci., 42(1): 53-66.
Korshin, G.V., J.F. Ferguson et A.N. Lancaster. (2005). « Influence of natural organic matter on the morphology of corroding lead surfaces and behavior of lead-containing particles » . Water Res., 39(5): 811-818.
Korshin, G.V., S.A.L. Perry et J.F. Ferguson. (1996). « Influence of NOM on copper corrosion » . J. Am. Water Works Assoc., 88(7).
Koudjonou, B., M. Prévost et N. Merlet. (2005). Characterization of organic matter in water resources and supplies. Dans : Biodegradable organic matter in drinking water treatment and distribution. Prévost, M., P. Laurent, P. Servais et J.‑C. Joret (dir. publ.). American Water Works Association, Denver, Colorado. p. 1–29 (chapitre 1).
Krasner, S.W., et G.L. Amy. (1995). Jar-test evaluations of enhanced coagulation. J. Am. Water Works Assoc., 87(10): 93-107.
Kraus, T.E.C., C.A. Anderson, K. Morgenstern, B.D. Downing, B.A. Pellerin et B.A. Bergamaschi. (2010). « Determining sources of dissolved organic carbon and disinfection byproduct precursors to the McKenzie River, Oregon » . J. Environ. Qual., 39(6): 2100-2112.
Kristiana, I., H. Gallard, C. Joll et J.-P. Croué. (2009). « The formation of halogen-specific TOX from chlorination and chloramination of natural organic matter isolates » . Water Res., 43(17): 4177-4186.
Kritzberg, E.S., et S.M. Ekström. (2012). « Increasing iron concentrations in surface waters - A factor behind brownification? » Biogeosciences, 9(4): 1465-1478.
Kuehn, W., et U. Mueller. (2000). « Riverbank filtration: An overview » . J. Am. Water Works Assoc., 92(12): 60-69.
Kundert, K. (2014). Alberta Flood 2013 – City of Calgary water treatment system resiliency. Canadian National Conference on Drinking Water, Ottawa (Ontario).
Lagos, G.E., C.A. Cuadrado et M.V. Letelier. (2001). « Aging of copper pipes by drinking water». J. Am. Water Works Assoc., 93(11): 94-103.
Lamsal, R., K.R. Montreuil, F.C. Kent, M.E. Walsh et G.A. Gagnon. (2012). « Characterization and removal of natural organic matter by an integrated membrane system ». Desalination, 303: 12-16.
Lautenschlager, K., C. Hwang, W.-T. Liu, N. Boon, O. Köster, H. Vrouwenvelder, T. Egli et F. Hammes. (2013). « A microbiology-based multi-parametric approach towards assessing biological stability in drinking water distribution networks ». Water Res., 47(9): 3015-3025.
LeChevallier, M.W. (2003). Conditions favouring coliform and HPC bacterial growth in drinking-water and on water contact surfaces. Dans : Heterotrophic plate counts and drinking-water safety. The significance of HPCs for water quality and human health. J. Bartram, J. Cotruvo, M. Exner, C. Fricker et A. Glasmacher (dir. publ.). IWA Publishing, Londres, Royaume-Uni. p. 177–197.
LeChevallier, M.W., et K.-K. Au. (2004). Water treatment and pathogen control. Process efficiency in achieving safe drinking water. Organisation mondiale de la Santé, 2004. IWA Publishing. Londres.
LeChevallier, M.W., W.C. Becker, P. Schorr et R.G. Lee. (1992). « Evaluating the performance of biologically active rapid filters ». J. Am. Water Works Assoc., 84 (4): 136-140.
LeChevallier, M.W., N.J. Welch et D.B. Smith. (1996). « Full-scale studies of factors related to coliform regrowth in drinking water ». Applied and Environmental Microbiology, 62 (7), p. 2201-2211.
LeChevallier, M.W., O.D. Schneider, L.A. Weinrich, P.K. Jjemba, P.J. Evans, J.L. Hooper et R.W. Chappell. (2015a). An operational definition of biostability in drinking water. Report number 4312b. Water Research Foundation, Denver, Colorado.
LeChevallier, M.W., O.D. Schneider, L.A. Weinrich, P.K. Jjemba, P.J. Evans, J.L. Hooper et R.W. Chappell. (2015b). Guidance manual for control of biostability in drinking water. Report number 4312a. Water Research Foundation, Denver, Colorado.
Leclerc, H. Relationships between common water bacteria and pathogens in drinking-water. (2003). Dans : Heterotrophic plate counts and drinking-water safety. The significance of HPCs for water quality and human health. J. Bartram, J. Cotruvo, M. Exner, C. Fricker et A. Glasmacher (dir. publ.). IWA Publishing, Londres, Royaume-Uni. p. 80–118.
Lee, N., G. Amy et J.-P. Croué. (2006). « Low-pressure membrane (MF/UF) fouling associated with allochthonous versus autochthonous natural organic matter ». Water Res., 40(12): 2357-2368.
Leenheer, J.A., et J.-P. Croué. (2003). « Characterizing aquatic dissolved organic matter ». Environ. Sci. Technol., 37(1).
Liang, L., et P.C Singer. (2003). « Factors influencing the formation and relative distribution of haloacetic acids and trihalomethanes in drinking water ». Environ. Sci. Technol., 37(13): 2920-2928.
Liu, H., G.V. Korshin et J.F. Ferguson. (2009). Colloidal mobilization of PbO2 by chloramine and NOM and effects of phosphate corrosion inhibitors. Dans : Proceedings of the AWWA Water Quality Technology Conference, Seattle, Washington. American Water Works Association, Denver, Colorado.
Liu, W., H. Wu, Z. Wang, S.L. Ong, J.Y. Hu et W.J. Ng. (2002). « Investigation of assimilable organic carbon (AOC) and bacterial regrowth in drinking water distribution systems ». Water Res. 36(4): 891-898.
Liu, X., J. Wang, T. Liu, W. Kong, X. He, Y. Jin et B. Zhang. (2015). « Effects of assimilable organic carbon and free chlorine on bacterial growth in drinking water ». Plos One, 10(6).
Logsdon, G.S., R. Kohne, S. Abel et S. LaBonde. (2002). « Slow sand filtration for small water systems ». J. Environ. Eng. Sci., 1(5):339–348.
Mamane-Gravetz, H., et K.G. Linden. (2004). Impact of particle aggregated microbes on UV disinfection. Dans : Proceedings of the AWWA Water Quality Technology Conference, San Antonio, Texas. American Water Works Association, Denver, Colorado.
Martin-Mousset, B., J-P. Croué, E. Lefebvre et B. Legube. (1997). « Distribution and characterization of dissolved organic matter of surface waters ». Water Res., 31(3): 541-553.
Masters, S., G.J. Welter et M.Edwards. (2016). « Seasonal variations in lead release to potable water ». Environ. Sci. Technol., 50(10): 5269-5277.
Matilainen, A., E.T. Gjessing, T. Lahtinen, L. Hed, A. Bhatnagar et M. Sillanpää. (2011). « An overview of the methods used in the characterisation of natural organic matter (NOM) in relation to drinking water treatment ». Chemosphere, 83(11): 1431-1442.
McVicar, M. (2014). Use of online monitoring instrumentation for coagulation optimization. Thèse de maîtrise, Dalhousie Waterloo, Halifax (Nouvelle-Écosse).
McVicar, M., B. Bickerton, M. Chaulk et M. Walsh. (2015). « UV254 and streaming current monitors can improve coagulation control in challenging conditions ». Opflow, 41(7): 26–28.
Melin, E., R. Skog et H. Ødegarrd. (2006). Ozonisation/biofiltration with calcium carbonate as biofilter media. Chapitre 49 dans : Recent progress in slow sand and alternative biofiltration processes. R. Gimbel, N.J.D. Graham et M.R. Collins, (dir. publ.). IWA Publishing, Londres, R.-U. p. 406–413.
Ministère de l'Environnement et de la Conservation de Terre-Neuve-et-Labrador (2011). Study on characteristics and removal of natural organic matter in drinking water systems in Newfoundland and Labrador. Disponible à l'adresse : www.ecc.gov.nl.ca/waterres/reports/drinking_water/NOM_Study_August_19_2011.pdf.
Minor, E.C., M.M. Swenson, B.M. Mattson et A.R. Oyler. (2014). « Structural characterization of dissolved organic matter: A review of current techniques for isolation and analysis ». Environ. Sci. Process. Impacts, 16(9): 2064-2079.
Mitch, W.A., S.W. Krasner, P. Westerhoff et A. Dotson. (2009). Occurrence and formation of nitrogenous disinfection by-products. Report number 91250. Water Research Foundation, Denver, Colorado.
Monteith, D.T., J.L. Stoddard, C.D. Evans, H.A. de Wit, M. Forsius, T. Høgåsen, A. Wilander, B.L. Skjelkvåle, D.S. Jeffries, J. Vuorenmaa, B. Keller, J. Kopécek et J. Vesely. (2007). « Dissolved organic carbon trends resulting from changes in atmospheric deposition chemistry ». Nature, 450(7169): 537-540.
Montreuil, K.R. (2011). Natural organic matter characterization in drinking water. Thèse de maîtrise, Université Dalhousie, Halifax (Nouvelle-Écosse).
Mulholland, P.J. (2003). Large-scale patterns in dissolved organic carbon concentration, flux and sources. Dans : Aquatic Ecosystems: Interactivity of dissolved organic matter. S.E.G. Findlay et R.L. Sinsabaugh, (dir. publ.). Academic Press, San Diego, Californie. p. 139–159 (chapitre 6).
MWH. (2012). Water treatment principles and design. 3e édition. John Wiley & Sons, New York, New York.
Nescerecka, A., J. Rubulis, M. Vital, T. Juhna et F. Hammes. (2014). « Biological instability in a chlorinated drinking water distribution network ». Plos One, 9(5).
Newcombe, G., D. Dixon. (2006). Introduction. Chapitre 1 dans : Interface science in drinking water treatment – theory and applications. G. Newcombe et D. Dixon (dir. publ.). Academic Press, Londres, Royaume-Uni. p. 1-4.
Nguyen, M-L., L.A. Baker et P. Westerhoff. (2002). « DOC and DBP precursors in western US watersheds and reservoirs ». J. Am. Water Works Assoc., 94(5): 98-112.
Nichols, G., C. Lane, N. Asgari, N.Q. Verlander et A. Charlett. (2009). « Rainfall and outbreaks of drinking water related disease and in England and Wales ». J. Water Health, 7(1): 1-8.
Norton, C.D., M.W. LeChevallier et J.O. Falkinham III. (2004). « Survival of Mycobacterium avium in a model distribution system ». Water Res., 38(6): 1457-1466.
Nyfennegger, J., S. Burns, N. Ross, G. Upadhyaya, J. Brown, C. Lauderdale, M.J. Kirisits, S. Keithley et S. Bae. (2016). Full-scale engineered biofiltration evaluation and development of a performance tracking tool. Report number 4525. Water Research Foundation, Denver, Colorado.
O'Connor, D. R. (2002). Part two report on the Walkerton inquiry: A strategy for safe drinking water. Ministère du Procureur général de l'Ontario (ISBN 0-7794-25600X).
O'Melia, C.R. Fundamentals of particle stability. (2006). Chapitre 18 dans : Interface science in drinking water treatment – theory and applications. G. Newcombe et D. Dixon (dir. publ.). Academic Press, Londres, Royaume-Uni. p. 317-362.
Ødegaard, H., E. Melin et T. Leiknes. (2006). Ozonation/biofiltration for treatment of humic surface water. Chapitre 48 dans : Recent progress in slow sand and alternative biofiltration processes. R. Gimbel, N.J.D. Graham et M.R. Collins, (dir. publ.). IWA Publishing, Londres, R.-U. p. 397–405.
OMS. (2011). Guidelines for drinking-water quality. 4e édition. Organisation mondiale de la santé, Genève, Suisse. Disponible à l'adresse : www.who.int/water_sanitation_health/publications/2011/dwq_guidelines/en/.
OMS. (2012). Water safety planning for small community water supplies. Organisation mondiale de la santé, Genève, Suisse. Disponible à l'adresse : www.who.int/water_sanitation_health/publications/2012/water_supplies/en/.
OMS. (2014). Water safety in distribution systems. Organisation mondiale de la santé, Genève, Suisse. Disponible à l'adresse : http://www.who.int/water_sanitation_health/publications/water-safety-in-distribution-system/en/.
Ongerth, J.E., et J.P. Pecoraro (1995). « Removing Cryptosporidium using multimedia filters ». J. Am. Water Works Assoc., 87(12): 83-89.
Owen, D.M., G.L. Amy et Z.K. Chowdhury. (1993). Characterization of natural organic matter and its relationship to treatability. Report number 90631. AWWA Research Foundation, Denver, Colorado.
Owen, D.M., G.L. Amy, Z.K. Chowdhury, R. Paode, G. McCoy et K. Viscosil. (1995). « NOM characterization and treatability ». J. Am. Water Works Assoc., 87(1): 46-63.
Pagano, T., M. Bida et J.E. Kenny. (2014). « Trends in levels of allochthonous dissolved organic carbon in natural water: A review of potential mechanisms under a changing climate ». Water, 6(10): 2862-2897.
Parsons, S.A., B. Jefferson, P. Jarvis, E. Sharp, D. Dixon, B. Bolto et P. Scales. (2007). Treatment of waters with elevated organic carbon. . Report Number 91161. Awwa Research Foundation, Denver, Colorado.
Passantino, L., J. Malley Jr., M. Knudson, R. Ward et J. Kim. (2004). « Effect of low turbidity and algae on UV disinfection performance ». J. Am. Water Works Assoc., 96(6): 128-137.
Patania, N.L, J.G. Jacangelo, L. Cummings, A. Wilczak, K. Riley et J. Oppenheimer. (1995). Optimization of filtration for cyst removal. Report number 90699. American Water Works Association Research Foundation and American Water Works Association. Denver, Colorado.
Peldszus, S., C. Hallé, R.H. Peiris, M. Hamouda, X. Jin, R.L. Legge, H. Budman, C. Moresoli et P.M. Huck. (2011). « Reversible and irreversible low-pressure membrane foulants in drinking water treatment: Identification by principal component analysis of fluorescence EEM and mitigation by biofiltration pretreatment ». Water Res., 45(16): 5161-5170.
Pellerin, B.A., J.F. Saraceno, J.B. Shanley, S.D. Sebestyen, G.R. Aiken, W.M Wollheim et B.A. Bergamaschi. (2012). « Taking the pulse of snowmelt: In situ sensors reveal seasonal, event and diurnal patterns of nitrate and dissolved organic matter variability in an upland forest stream ». Biogeochemistry, 108(1-3): 183-198.
Peng, C-Y., J.F. Ferguson et G.V. Korshin. (2013). « Effects of chloride, sulfate and natural organic matter (NOM) on the accumulation and release of trace-level inorganic contaminants from corroding iron ». Water Res., 47(14): 5257-5269.
Pernitsky, D.J. (2003). Coagulation 101. Dans : Proceedings of the Technology Transfer Conference, Université de Calgary, (Alberta) Canada.
Pernitsky, D.J., et J.K. Edzwald. (2006). « Selection of alum and polyaluminum coagulants: Principles and applications ». J. Water Supply Res. Technol. Aqua, 55(2): 121-141.
Peter, A., O. Köster, A. Schildknecht et U. von Gunten. (2009). « Occurrence of dissolved and particle-bound taste and odor compounds in Swiss lake waters ». Water Res., 43(8): 2191-2200.
Pharand, L., M.I. Van Dyke, W.B. Anderson et P.M. Huck. (2014). « Assessment of biomass in drinking water biofilters by adenosine triphosphate ». J. Am. Water Works Assoc., 106(10): E433-E444.
Piet, G.J., et B.C.J. Zoeteman. (1980). « Organic water quality changes during sand bank and dune filtration of surface waters in the Netherlands ». J. Am. Waterworks Assoc., 72(7 juillet 1980): 400-404.
Pivokonsky, M., O. Kloucek et L. Pivokonska. (2006). « Evaluation of the production, composition and aluminum and iron complexation of algogenic organic matter ». Water Res., 40(16): 3045-3052.
Plourde-Lescelleur, F., I. Papineau, A. Carrière, A. Gadbois et B. Barbeau. (2015). « NOM removal: Evaluating five process alternatives to alum coagulation ». J. Water Supply Res. Technol. Aqua, 64(3): 278-289.
Plummer, J.D., Edzwald, J.K. and Kelley, M.B. (1995). « Removing Cryptosporidium by dissolved air flotation ». J. Am. Water Works Assoc., 87(9):85–95.
Prest, E.I., F. Hammes, S. Kötzsch, M.C.M. van Loosdrecht et J.S. Vrouwenvelder. (2013). « Monitoring microbiological changes in drinking water systems using a fast and reproducible flow cytometric method ». Water Res., 47(19): 7131-7142.
Prest, E.I., F. Hammes, M.C.M. van Loosdrecht et J.S. Vrouwenvelder. (2016). « Biological stability of drinking water: Controlling factors, methods, and challenges ». Front. Microbiol., 7(FEB).
Prévost, M., C. Gauthier, L. Hureïki, R. Desjardins et P. Servais. (1998). « Removal of amino acids, biodegradable organic carbon and chlorine demand by biological filtration in cold water ». Environ. Technol., 19(9): 903-911.
Prévost, M., P. Laurent, P. Servais et J.-C. Joret. (2005). Biodegradable organic matter in drinking water treatment and distribution. American Water Works Association, Denver, Colorado.
Pyper, G.R. (1985). Slow sand filter and package treatment plant evaluation: Operating costs and removal of bacteria, Giardia, and trihalomethanes. U.S. Environmental Protection Agency, Cincinnati, Ohio. (EPA/600/S2‑85/052).
Rahman, I., S. Ndiongue, X. Jin, M.I. Van Dyke, W.B. Anderson et P.M. Huck. (2014). « Fouling of low-pressure membranes during drinking water treatment: Effect of NOM components and biofiltration pretreatment ». Water Sc. Technol. Water Supply, 14(3): 453-460.
Ratnaweera, H., E. Gjessing et E. Oug. (1999). « Influence of physical-chemical characteristics of natural organic matter (NOM) on coagulation properties: An analysis of eight Norwegian water sources ». Wat. Sci. Tech., 40(4-5): 89-95.
Ratpukdi, T., J.A. Rice, G. Chilom, A. Bezbaruah et E. Khan. (2009). « Rapid fractionation of natural organic matter in water using a novel solid-phase extraction technique ». Water Environ. Res., 81(11): 2299-2308.
Ray, C., T. Grischek, J. Schubert, J.Z. Wang et T.F. Speth. (2002). A perspective of riverbank filtration. J. Am. Water Works Assoc., 94(4): 149-160.
Reckhow, D.A. (2017). Communication personnelle. Université du Massachusetts, Amherst, Massachusetts
Reckhow, D.A., et P.C. Singer. (1984). « The removal of organic halide precursors by preozonisation and alum coagulation ». J. Am. Water Works Assoc., 76(4): 151-157.
Reckhow, D.A., P.L. Rees, K. Nüsslein, G. Makdissy, G. Devine, T. Conneely, A. Boutin et D. Bryan. (2007). Long-term variability of BDOM and NOM as precursors in watershed sources. Report number 91186. Awwa Research Foundation, Denver, Colorado.
Reid Crowther and Partners Ltd. (2000). Canadian Water Treatment Study Contract H4092-0-0001/001/SS Water Treatment and Disinfection Byproducts. Préparé pour Travaux publics et Services gouvernementaux Canada, Santé Canada, Environnement Canada.
Rigobello, E.S., A.D. Dantas, L. Di Bernardo et E.M. Vieira. (2011). « Influence of the apparent molecular size of aquatic humic substances on colour removal by coagulation and filtration ». Environ. Technol., 33(15-16): 1767-1777.
Ritson, J.P., N.J.D. Graham, M.R. Templeton, J.M. Clark, R. Gough et C. Freeman. (2014). « The impact of climate change on the treatability of dissolved organic matter (DOM) in upland water supplies: A UK perspective ». Sci. Total Environ., 473-474: 714-730.
Rittmann, B.E., et P.M. Huck. (1989). « Biological treatment of public water supplies ». Crit. Rev. Environ. Control, 19(2): 119-184.
Roccaro, P., H.-S. Chang, F.G.A. Vagliasindi et G.V. Korshin. (2008). « Differential absorbance study of effects of temperature on chlorine consumption and formation of disinfection by-products in chlorinated water ». Water Res., 42(8-9): 1879-1888.
Rodriguez, M.J. et J.-B. Sérodes. (2001). « Spatial and temporal evolution of trihalomethanes in three water distribution systems ». Water Res., 35(6): 1572-1586.
Rook J.J. (1974). Formation of haloforms during chlorination of natural waters. Water treatment and examination, 23: 234-243.
Rosario-Ortiz, F.L., S. Snyder et I.H. Suffet. (2007). « Characterization of the polarity of natural organic matter under ambient conditions by the polarity rapid assessment method (PRAM) ». Environ. Sci. Technol., 41(14): 4895-4900.
Sadrnourmohamadi, M., C.D. Goss et B. Gorczyca. (2013). « Removal of DOC and its fractions from surface waters of the Canadian Prairie containing high levels of DOC and hardness ». Water Sc. Technol. Water Supply, 13(3): 864-870.
SanClements, M.D., G.P. Oelsner, D.M. McKnight, J.L. Stoddard et S.J. Nelson. (2012). « New insights into the source of decadal increases of dissolved organic matter in acid-sensitive lakes of the northeastern United States ». Environ. Sci. Technol., 46(6): 3212-3219.
Santé Canada. (2006). Recommandations pour la qualité de l'eau potable au Canada : Document technique – Les trihalométhanes. Bureau de la qualité de l'eau et de la santé, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible à l'adresse : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/recommandations-pour-qualite-eau-potable-canada-trihalomethanes.html.
Santé Canada. (2008a). Recommandations pour la qualité de l'eau potable au Canada : Document technique – Les acides haloacétiques. Bureau de la qualité de l'eau et de la santé, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible à l'adresse : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/recommandations-pour-qualite-eau-potable-canada-document-technique-acides-haloacetiques.html.
Santé Canada. (2008b). Recommandations pour la qualité de l'eau potable au Canada : Document technique – Le chlorite et le chlorate. Bureau de la qualité de l'eau et de la santé, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible à l'adresse : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/recommandations-pour-qualite-eau-potable-canada-document-technique-chlorite-et-chlorate.html.
Santé Canada. (2009a). Recommandations pour la qualité de l'eau potable au Canada : Document technique – Le chlore. Bureau de la qualité de l'eau et de la santé, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible à l'adresse : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/recommandations-pour-qualite-eau-potable-canada-chlore-document-technique.html.
Santé Canada. (2009b). Document de conseils sur le contrôle de la corrosion dans les réseaux de distribution d'eau potable. Bureau de la qualité de l'eau et de la santé, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible à l'adresse : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/document-conseils-controle-corrosion-reseaux-distribution-eau-potable.html.
Santé Canada. (2011). Recommandations pour la qualité de l'eau potable au Canada : Document technique – N-nitrosodiméthylamine (NDMA). Bureau de la qualité de l'eau et de la santé, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible à l'adresse : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/recommandations-pour-qualite-eau-potable-canada-document-technique-n-nitrosodimethylamine-ndma.html.
Santé Canada. (2013). Conseils sur l'utilisation des recommandations sur la qualité microbiologique de l'eau potable. Bureau de la qualité de l'air et de l'eau. Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible à l'adresse : https://www..ca/fr/sante-canada/services/sante-environnement-milieu-travail/rapports-publications/qualite-eau/conseils-utilisation-recommandations-qualite-microbiologique-eau-potable-sante-canada-2013.html.
Santé Canada. (2016a). Communication personnelle avec Anca-Maria Tugulea.
Santé Canada. (2016b). Recommandations pour la qualité de l'eau potable au Canada : Le manganèse dans l'eau potable. Document aux fins de consultation publique. Bureau de la qualité de l'air et de l'eau. Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible à l'adresse : https://www.canada.ca/content/dam/canada/health-canada/migration/healthy-canadians/health-system-systeme-sante/consultations/manganese/alt/manganese-fra.pdf.
Santé Canada. (2017). Recommandations pour la qualité de l'eau potable au Canada : Le plomb dans l'eau potable. Document aux fins de consultation publique. Bureau de la qualité de l'eau et de l'air. Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible à l'adresse : https://www.canada.ca/fr/sante-canada/programmes/consultation-plomb-eau-potable/document.html.
Santé Canada. (2018a). Recommandations pour la qualité de l'eau potable au Canada : Document technique – Le bromate. Bureau de la qualité de l'air et de l'eau. Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible à : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/recommandations-pour-qualite-eau-potable-canada-document-technique-bromate.html.
Santé Canada.( 2018b). Conseils sur l'utilisation de l'évaluation quantitative du risque microbien dans l'eau potable. Document aux fins de consultation publique. Bureau de la qualité de l'eau et de l'air. Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible à l'adresse : https://www.canada.ca/fr/sante-canada/programmes/consultations-conseils-utilisation-evaluation-quantitative-risque-microbien-eau-portable/document.html
Santé Canada. (2018c). Recommandations pour la qualité de l'eau potable au Canada : Document technique – le cuivre. Document aux fins de consultation publique. Bureau de la qualité de l'eau et de l'air. Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible à l'adresse : https://www.canada.ca/fr/sante-canada/programmes/consultations-conseils-utilisation-evaluation-quantitative-risque-microbien-eau-portable/document.html
Saraceno, J.F., B.A. Pellerin, B.D. Downing, E. Boss, P.A.M. Bachand et B.A. Bergamaschi. (2009). « High-frequency in situ optical measurements during a storm event: Assessing relationships between dissolved organic matter, sediment concentrations, and hydrologic processes ». J. Geophys. Res. G Biogeosci., 114(4).
Satchwill, T., S.B. Watson et E. Dixon. (2007). « Odourous algal-derived alkenes: Differences in stability and treatment responses in drinking water ». Wat. Sci. Tech., 55(5): 95-102.
Schock, M. et D. Lytle. (2011). Internal corrosion and deposition control. Dans : Water Quality and Treatment. J. K. Edzwald (dir. publ.). McGraw Hill, New York. p. 20.1–20.103 (chapitre 20).
Schock, M.R., I. Wagner et R.J. Oliphant. (1996). Corrosion and solubility of lead in drinking water. Dans : Internal corrosion of water distribution systems. 2e édition. American Water Works Association Research Foundation and DVGW Technologiezentrum Wasser, Denver, Colorado, p. 131-230.
Semmens, M.J., et T.K. Field. (1980). « Coagulation: Experiences in organics removal ». J. Am. Water Works Assoc., 72(8): 476-483.
Servais, P., M. Prévost, P. Laurent, J.-C. Joret, S. Summers, B. Hamsch et C. Ventresque. (2005). Biodegradable organic matter in drinking water treatment. Dans : Biodegradable organic matter in drinking water treatment and distribution. Prévost, M., Laurent, P., Servais, P. et Joret, J-C., (dir. publ.). American Water Works Association, Denver, Colorado. p. 61–145 (chapitre 3).
Sharp, E. (2015). Using online zeta potential measurements for coagulation control: A first for the UK water industry. Dans : Proceedings of the IWA Specialist Conference on Natural Organic Matter in Drinking Water, Malmö, Suède.
Sharp, E.L., S.A. Parsons et B. Jefferson. (2006). « Seasonal variations in natural organic matter and its impact on coagulation in water treatment ». Sci. Total Environ., 363(1-3): 183-194.
Shin, J.Y., R.F. Spinette et C.R. O'Melia. (2008). « Stoichiometry of coagulation revisited ». Environ. Sci. Technol., 42(7): 2582-2589.
Siebel, E., Y. Wang, T. Egli et F. Hammes. (2008). « Correlations between total cell concentration, total adenosine tri-phosphate concentration and heterotrophic plate counts during microbial monitoring of drinking water ». Drink. Water Eng. Sci., 1(1): 1-6.
Siembida-Lösch, B., W.B. Anderson, J. Bonsteel et P.M. Huck. (2014). « Pretreatment impacts on biopolymers in adjacent ultrafiltration plants ». J. Am. Water Works Assoc., 106(9): E372-E382.
Siembida-Lösch, B., W.B. Anderson, Y. Wang, J. Bonsteel et P.M. Huck. (2015). « Effect of ozone on biopolymers in biofiltration and ultrafiltration processes ». Water Res., 70: 224-234.
Sillanpää, M. (2015). General introduction. Dans : Natural organic matter in water: Characterization and treatment methods. M. Sillanpää (dir. publ.). IWA Publishing, Oxford, Royaume-Uni. p 1-15 (chapitre 1).
Sillanpää, M., et A. Matilainen. (2015). NOM removal by coagulation. Dans : Natural organic matter in water: Characterization and treatment methods. M. Sillanpää (dir. publ.). IWA Publishing, Oxford, Royaume-Uni. p 55-80 (chapitre 3).
Sillanpää, M., S. Metsämuuronen et M. Mänttäri. (2015a). Membranes. Dans : Natural organic matter in water: Characterization and treatment methods. M. Sillanpää (dir. publ.). IWA Publishing, Oxford, Royaume-Uni. p. 113-157 (chapitre 5).
Sillanpää, M., A. Matilainen et T. Lahtinen. (2015b). Characterization of NOM. Dans : Natural organic matter in water: Characterization and treatment methods. M. Sillanpää (dir. publ.). IWA Publishing, Oxford, Royaume-Uni. p. 17-53 (chapitre 2).
Simpson, D.R. (2008). « Biofilm processes in biologically active carbon water purification ». Water Res., 42(12): 2839-2848.
Singer, P.C., M. Schneider, J. Edwards-Brandt et G.C. Budd. (2007). « MIEX for removal of DBF precursors: Pilot-plant findings ». J. Am. Water Works Assoc., 99(4).
Singer, P.C., T. Boyer, A. Holmquist, J. Morran et M. Bourke. (2009). « Integrated analysis of NOM removal by magnetic ion exchange ». J. Am. Water Works Assoc., 101(1).
Sinsabaugh, R.L., et S. Findlay. (2003). Dissolved organic matter: Out of the black box into the mainstream. Dans : Aquatic Ecosystems: Interactivity of dissolved organic matter. S.E.G. Findlay et R.L. Sinsabaugh, (dir. publ.). Academic Press, San Diego, Californie. p. 479–498 (chapitre 20).
Slavik, I., S. Müller, R. Mokosch, J.A. Azongbilla et W. Uhl. (2012). « Impact of shear stress and pH changes on floc size and removal of dissolved organic matter (DOM) ». Water Res., 46(19): 6543-6553.
Slunjski, M., K. Cadee et J. Tettersal. (2000). MIEX® resin water treatment process. Dans : Proceedings of the Annual Conference and Exhibition of the American Water Works Association, Denver, Colorado.
Smeets, P.W.M.H. (2017). Communication personnelle. KWR Watercycle Research Institute, Nieuwegein, Pays-Bas.
Smeets, P.W.M.H., G.J. Medema et J.C. Van Dijk. (2009). « The Dutch secret: How to provide safe drinking water without chlorine in the Netherlands ». Drink. Water Eng. Sci., 2(1): 1-14.
Soulsby, C. (1995). « Contrasts in storm event hydrochemistry in an acidic afforested catchment in upland Wales ». J. Hydrol., 170(1-4): 159-179.
Steele, M.E.J, H.L. Evans, J. Stephens, A. Rachal et B.A. Clarke. (2006). Dissolved oxygen issues with granular activated carbon sandwichTM slow sand filtration. Chapitre 11 dans : Recent progress in slow sand and alternative biofiltration processes. R. Gimbel, N.J.D. Graham et M.R. Collins, (dir. publ.). IWA Publishing, Londres, R.-U. p. 83–94.
Stevens, A.A., C.J. Slocum, D.R. Seeger et G.G. Robeck. (1976). « Chlorination of organics in drinking water ». J. Am. Water Works Assoc., 68(11): 615-620.
Stevenson, F.J. (1982). Humus chemistry: Genesis, composition, reactions. John Wiley & Sons, New York, New York.
Stoddart, A.K., et G.A. Gagnon. (2014). « Application of photoelectrochemical chemical oxygen demand to drinking water ». J. Am. Water Works Assoc., 106(9): E383-E390.
Stoddart, A.K., et G.A. Gagnon. (2015). « Full-scale prechlorine removal: Impact on filter performance and water quality ». J. Am. Water Works Assoc., 107(12): E638-E647.
Summers, R.S., K.M.H. Beggs, D.M. McKnight, F.L. Rosario-Ortiz et J.A. Billica. (2013). Watershed analysis of dissolved organic matter and control of disinfection by-products. Report number 4282. Water Research Foundation, Denver, Colorado.
Świetlik, J., A. Da¸browska, U. Raczyk-Stanislawiak, et J. Nawrocki. (2004). « Reactivity of natural organic matter fractions with chlorine dioxide and ozone ». Water Res., 38(3): 547-558.
Symons, J.M., S.W. Krasner, L.A. Simms et M. Sclimenti. (1993). « Measurement of THM and precursor concentrations revisited: The effect of bromide ion ». J. Am. Water Works Assoc., 85(1): 51-62.
Tan, L., et R.G. Sudak. (1992). « Removing color from a groundwater source ». J. Am. Water Works Assoc., 84(1): 79-87.
Templeton, M.R., R.C. Andrews et R. Hofmann. (2005). « Inactivation of particle-associated viral surrogates by ultraviolet light ». Water Res., 39(15): 3487-3500.
Templeton, M.R., R.C. Andrews et R. Hofmann. (2007). « Removal of particle-associated bacteriophages by dual-media filtration at different filter cycle stages and impacts on subsequent UV disinfection ». Water Res., 41(11): 2393-2406.
Templeton, M.R., R.C. Andrews et R. Hofmann. (2008). « Particle-associated viruses in water: Impacts on disinfection processes. Critical reviews in environmental science and technology ». Crit. Rev. Environ. Sci. Technol., 38(3): 137-164.
Thomas, M.K., D.F. Charron, D. Waltner-Toews, C. Schuster, A.R. Maarouf et J.D. Holt. (2006). « A role of high impact weather events in waterborne disease outbreaks in Canada, 1975-2001 ». Int. J. Environ. Health Res., 16(3): 167-180.
Thurman, E.M. (1985). Organic geochemistry of natural waters. Kluwer Academic Publishers Group, Dordrecht, Pays-Bas.
Tomlinson, A., M. Drikas et J.D. Brookes. (2016). « The role of phytoplankton as pre-cursors for disinfection by-product formation upon chlorination ». Water Res., 102: 229-240.
Trueman, B.F., G.A. Sweet, M.D. Harding, H. Estabrook, D.P. Bishop et G.A. Gagnon. (2017). « Galvanic corrosion of lead by iron (oxyhydr)oxides: potential impacts on drinking water quality ». Environ. Sci. Technol., 51:6812-6820
Tseng, T., B.D. Segal et M. Edwards. (2000). « Increasing alkalinity to reduce turbidity ». J. Am. Water Works Assoc., 92(6): 44-54.
Tubić, A., J. Agbaba, B. Dalmacija, J. Molnar, S. Maletic, M. Watson et S.U. Perovic. (2013). « Insight into changes during coagulation in NOM reactivity for trihalomethanes and haloacetic acids formation ». J. Environ. Manage., 118: 153-160.
Ungar, J. (1962). « Anion exchange resin fouling ». Effluent and Water Treatment Journal, juin : 331-334.
Union européenne. (2014). European Union (Drinking Water) Regulations 2014, Statutory Instruments. S.I. No. 122 of 2014. Disponible à l'adresse : www.fsai.ie/uploadedFiles/Legislation/Food_Legisation_Links/Water/SI122_2014.pdf
U.S. EPA. (1998). National Primary Drinking Water Regulations: Disinfectants and Disinfection Byproducts; Final rule. Federal Register, 63(241): 69390-69476. Disponible à l'adresse : www.gpo.gov/fdsys/pkg/FR-1998-12-16/pdf/98-32887.pdf.
U.S. EPA. (2016). Six-year review 3 technical support document for disinfectants/disinfection byproducts rules. Office of Water. U.S. Environmental Protection Agency, Washington, DC. (EPA-810-R-16-012).
Vadasarukkai, Y.S. (2016). Investigation of the mixing energy consumption affecting coagulation and floc aggregation. Thèse de doctorat, Université Dalhousie, Halifax (Nouvelle-Écosse).
Vadasarukkai, Y.S., et G.A. Gagnon. (2015). « Application of low-mixing energy input for the coagulation process ». Water Res., 84: 333-341.
Valade, M.T., W.C. Becker et J.K. Edzwald. (2009). « Treatment selection guidelines for particle and NOM removal ». J. Water Supply Res. Technol. Aqua, 58(6): 424-432.
Valentine, R.L., et Y.-P. Lin. (2009). The role of free chlorine, chloramines, and NOM on the release of lead into drinking water. Water Research Foundation, Denver, Colorado.
van der Kooij, D. (2000). « Biological stability: A multidimensional quality aspect of treated water ». Water Air Soil Pollut. 123(1-4): 25-34.
van der Kooij, D., B. Martijn, P.G. Schaap, W. Hoogenboezem, H.R. Veenendaal et P.W.J.J. van der Wielen. (2015). « Improved biostability assessment of drinking water with a suite of test methods at a water supply treating eutrophic lake water ». Water Res., 87: 347-355.
van der Kooij, D., et P.W.J.J. van der Wielen. (2014). Microbial growth in drinking-water supplies: Problems, causes, control and research needs. IWA Publishing, Londres, Royaume-Uni.
van der Wielen, P.W.J.J., et D. van der Kooij. (2013). « Nontuberculous mycobacteria, fungi, and opportunistic pathogens in unchlorinated drinking water in the Netherlands ». Appl. Environ. Microbiol., 79(3): 825-834.
Volk, C., L. Wood, B. Johnson, J. Robinson, H.W. Zhu et L. Kaplan. (2002). « Monitoring dissolved organic carbon in surface and drinking waters ». J. Environ. Monit., 4(1): 43-47.
Vu, B., M. Chen, R.J. Crawford et E.P. Ivanova. (2009). « Bacterial extracellular polysaccharides involved in biofilm formation ». Molecules. 14(7): 2535-54.
Wang, J.Z., S.A. Hubbs et R. Song. (2002). Evaluation of riverbank filtration as a drinking water treatment process. AWWA Research Foundation and American Water Works Association, Denver, Colorado.
Warnecke, M. (2006). Cryptosporidium oocyst interactions with drinking water pipe biofilms. Cooperative Research Centre for Water Quality and Treatment, Salisbury, Australie.
Watson, S.B. (2003). « Cyanobacterial and eukaryotic algal odour compounds: Signals or by-products? A review of their biological activity ». Phycologia, 42(4): 332-350.
Weishaar, J.L., G.R. Aiken, B.A. Bergamaschi, M.S. Fram, R. Fujii et K. Mopper. (2003). « Evaluation of specific ultraviolet absorbance as an indicator of the chemical composition and reactivity of dissolved organic carbon ». Environ. Sci. Technol., 37(20): 4702-4708.
Weiss, W.J., E.J. Bouwer, W.P. Ball, C.R. O'Melia, M.W. LeChevallier, H. Arora et T.F. Speth. (2003). « Riverbank filtration - fate of DBP precursors and selected microorganisms ». J. Am. Water Works Assoc., 95(10): 68-81.
Westerhoff, P., G. Aiken, G. Amy et J. Debroux. (1999). « Relationships between the structure of natural organic matter and its reactivity towards molecular ozone and hydroxyl radicals ». Water Res., 33(10): 2265-2276.
Westerhoff, P., P. Chao et H. Mash. (2004). « Reactivity of natural organic matter with aqueous chlorine and bromine ». Water Res., 38(6): 1502-1513.
Wetzel, R.G. (1992). Gradient-dominated ecosystems: Sources and regulatory functions of dissolved organic matter in freshwater ecosystems. Hydrobiologia, 229(1): 181-198.
Wetzel, R.G. Dissolved organic carbon: Detrital energetics, metabolic regulators, and drivers of ecosystem stability of aquatic ecosystems. (2003). Dans : Aquatic Ecosystems: Interactivity of dissolved organic matter. S.E.G. Findlay et R.L. Sinsabaugh, (dir. publ.). Academic Press, San Diego, Californie. p. 455–477 (chapitre 19).
Weyhenmeyer, G.A., Y.T. Prairie et L.J. Tranvik. (2014). « Browning of boreal freshwaters coupled to carbon-iron interactions along the aquatic continuum ». Plos One, 9(2).
White, M.C., J.D. Thompson, G.W. Harrington et P.C. Singer. (1997). « Evaluating criteria for enhanced coagulation compliance ». J. Am. Water Works Assoc., 89(5): 64-77.
Wilczak, A. Nitification in drinking water distribution systems. Dans : Fundamentals and control of nitrification in chloraminated drinking water distribution systems. Manual of Water Supply Practices – M56. 1re édition. American Water Works Association, Denver, Colorado (2006).
Willison, H. and Boyer, T.H. (2012). « Secondary effects of anion exchange on chloride, sulphate, and lead release: Systems approach to corrosion control ». Water Res., 46:2385–2394.
Wingender, J., et H.-C. Flemming. (2011). « Biofilms in drinking water and their role as reservoir for pathogens ». Int. J. Hyg. Environ. Health, 214(6): 417-423.
Worrall, F., et T.P. Burt. (2009). « Changes in DOC treatability: Indications of compositional changes in DOC trends ». J. Hydrol., 366(1-4): 1-8.
Wright, B., W. Becker, J. Irving, A. Reinert, B. Stanford, D. Reckhow, P. Wittbold et R. Zhao. (2016). Advanced techniques for monitoring changes in NOM and controlling DBPs under dynamic weather conditions. Water Research Foundation, Denver, Colorado.
Wullings, B.A., G. Bakker, D. Van Der Kooij. (2011) « Concentration and diversity of uncultured legionella spp. in two unchlorinated drinking water supplies with different concentrations of natural organic matter ». Applied and Environmental Microbiology, 77 (2), p. 634-641.
Yamamura, H., K. Okimoto, K. Kimura et Y. Watanabe. (2014). « Hydrophilic fraction of natural organic matter causing irreversible fouling of microfiltration and ultrafiltration membranes ». Water Res., 54: 123-136.
Zacheus, O.M., M.J. Lehtola, L.K. Korhonen et P.J. Martikainen. (2001). « Soft deposits, the key site for microbial growth in drinking water distribution networks ». Water Res., 35(7): 1757-1765.
Zaitlin, B., et S.B. Watson. (2006). « Actinomycetes in relation to taste and odour in drinking water: Myths, tenets and truths ». Water Res., 40(9): 1741-1753.
Zhao, H., D. Jiang, S. Zhang, K. Catterall et R. John. (2004). « Development of a direct photoelectrochemical method for determination of chemical oxygen demand ». Anal. Chem., 76(1): 155-160.
Zhou, E., S.J.O. Payne, R. Hofmann et R.C Andrews. (2015). « Factors affecting lead release in sodium silicate-treated partial lead service line replacements ». J. Environ. Sci. Health Part A Toxic Hazard. Subst. Environ. Eng., 50(9): 922-930.
Zhou, S., Y. Shao, N. Gao, Y. Deng, L. Li, J. Deng et C. Tan. (2014). « Characterization of algal organic matters of microcystis aeruginosa: Biodegradability, DBP formation and membrane fouling potential ». Water Res., 52: 199-207.
C.2 Acronymes
- ADCA
- acide dichloroacétique
- AHA
- acide haloacétique
- AHA5
- acide haloacétique 5
- APOPB
- agents pathogènes opportunistes dans la plomberie des bâtiments
- ASUV
- absorbance spécifique UV
- ATCA
- acide trichloroacétique
- ATP
- adénosine triphosphate
- CAG
- charbon actif granulaire
- CAP
- charbon actif en poudre
- COA
- carbone organique assimilable
- COD
- carbone organique dissous
- CODB
- carbone organique dissous biodégradable
- COP
- carbone organique en particules
- COT
- carbone organique total
- DCO
- demande chimique en oxygène
- FAD
- flottation à air dissous
- FB
- filtration sur berge
- FLS
- Filtration lente sur sable
- GLUMRB
- Great Lakes – Upper Mississippi River Board
- H2O2
- peroxyde d’hydrogène
- LDM
- limite de détection de la méthode
- MF
- microfiltration
- MOB
- matière organique biodégradable
- MON
- matière organique naturelle
- NF
- nanofiltration
- OI
- osmose inverse
- OMS
- Organisation mondiale de la santé
- peCOD
- demande photoélectrochimique en oxygène
- REA
- résine échangeuse d’anions
- SPD-N
- sous-produits de désinfection azotés
- SRM
- seuil de rétention des molécules
- THM
- trihalométhane
- U.S. EPA
- Environmental Protection Agency (États-Unis)
- UC
- unité de couleur
- UCA
- unité de couleur apparente
- UCT
- unité de couleur totale
- UE
- Union européenne
- UF
- ultrafiltration
- UTN
- unité de turbidité néphélémétrique
- UV
- ultraviolet
- UV254
- rayons ultraviolets à une longueur d’onde de 254 nanomètres
C.3 Tableaux
| Facteur | Commentaire | Référence(s) |
|---|---|---|
| Pourcentage de terres humides dans le bassin versant | Le taux de production de COD est élevé dans les terres humides, et le COD tend à avoir une teneur élevée en acide organique. Une couverture de terres humides d'aussi peu que 1 % peut influer sur la concentration et les caractéristiques du COD. | Eckhardt et Moore, 1990; Grieve, 1994; Dalva et Moore, 1991; Cool et coll., 2014 |
| Composition des sols | Les sols ayant le contenu organique le plus élevé (c.-à-d. l'humus) rejettent plus de COD dans l'environnement aquatique. Les sols minéraux, particulièrement ceux qui sont riches en fer, en aluminium ou en argile, ont tendance à absorber le COD. | Dalva et Moore, 1991; Kalbitz et coll., 2000; Aitkenhead-Peterson et coll., 2003 |
| Couvert forestier | Les bassins versants dominés par des conifères peuvent produire environ 50 % de COD de plus que les bassins versants dominés par des feuillus. | Cronan et Aiken, 1985; Dalva et Moore, 1991; Kalbitz et coll., 2000, 2006 |
| Période de rétention | En général, plus la période de rétention est longue, plus la concentration de COD est faible en raison des processus biogéochimiques qui dégradent et absorbent le COD. Le COD résiduel a tendance à être récalcitrant (c.-à-d. qu'il n'est pas facilement biodégrabable). | Aiken et Cotsaris, 1995; Hanson et coll., 2011; Reckhow et coll., 2007 |
| Hydrologie des bassins versants | En l'absence de terres humides, les concentrations de COD tendent à augmenter avec le débit des cours d'eau. Toutefois, toutes les tempêtes ne produisent pas les mêmes effets en raison des variations de la texture du sol, de l'humidité antérieure du sol et des conditions de précipitations/fonte de la neige. | Eckhardt et Moore, 1990; Grieve, 1994; Soulsby, 1995; Carpenter et coll., 2013 |
| Voies d'écoulement | L'eau passe dans différentes couches de sol selon la texture du sol et les conditions d'humidité antérieure du sol. Les variations dans les voies d'écoulement peuvent quintupler le taux de COD sur de courtes périodes de temps (p. ex., des heures à des jours). | Thurman, 1985; Aitkenhead-Peterson et coll., 2003; Saraceno et coll., 2009; Pellerin et coll., 2012 |
| Pente du chenal | Les bassins versants en pente douce ont tendance à présenter des concentrations plus élevées de COD que les bassins versants ayant une forte pente. | Eckhardt et Moore, 1990; Aitkenhead-Peterson et coll., 2003; Cool et coll., 2014 |
| Taille du bassin versant | Les concentrations de COD ont tendance à varier énormément dans les bassins versants de petite taille, tandis qu'elles sont moins variables dans les plus grands bassins versants. Les bassins versants dont le rapport entre la terre et l'eau est élevé présentent généralement des concentrations élevées de COD. | Sinsabaugh et Findlay, 2003; Eikebrokk et coll., 2004; Ågren et coll., 2007 |
| Région | Bassin versant | Nombre d'échan-tillons | Nombre de détectionsNote de bas de page a | 10e percentile (mg/L) |
Médiane (mg/L) |
Moyenne (mg/L) |
90e percentile (mg/L) |
|---|---|---|---|---|---|---|---|
| Est | Côte maritime | 94 | 92 | 1,00 | 2,25 | 3,43 | 8,65 |
| Terre-Neuve-et-Labrador | 1 111 | 1 111 | 2,60 | 4,70 | 5,02 | 7,60 | |
| Côte-Nord – Gaspé | 42 | 42 | 5,01 | 6,25 | 6,34 | 7,99 | |
| Saint Jean–St-Croix | 89 | 89 | 3,48 | 4,40 | 5,79 | 9,92 | |
| Centre | Winnipeg | 136 | 136 | 9,10 | 9,75 | 9,81 | 10,55 |
| Prairies | Assiniboine-Rouge | 1 153 | 1 153 | 8,14 | 10,90 | 12,46 | 18,80 |
| Churchill | 292 | 292 | 6,64 | 11,80 | 11,12 | 16,60 | |
| Bas Saskatchewan-Nelson | 507 | 507 | 4,77 | 14,00 | 12,89 | 20,80 | |
| Missouri | 188 | 188 | 1,62 | 4,02 | 4,56 | 8,33 | |
| Saskatchewan Nord | 594 | 594 | 0,24 | 2,01 | 4,98 | 14,40 | |
| Saskatchewan Sud | 818 | 818 | 0,49 | 1,24 | 2,15 | 4,79 | |
| Région du Pacifique | Columbia | 4 308 | 3 175 | 0,73 | 1,34 | 1,77 | 3,00 |
| Fraser | 3 503 | 3 374 | 1,20 | 2,95 | 3,58 | 6,70 | |
| Okanagan-Similkameen | 1 118 | 1 079 | 1,10 | 2,86 | 3,15 | 5,59 | |
| Côte du Pacifique | 2 510 | 2 217 | 0,90 | 2,00 | 2,67 | 4,70 | |
| Paix-Athabasca | 443 | 442 | 0,34 | 2,00 | 2,34 | 4,89 | |
| Arctique | Côte arctique | 148 | 136 | 0,60 | 2,45 | 3,09 | 6,50 |
| Sud de l'île de Baffin–Keewatin | 40 | 40 | 1,98 | 3,45 | 3,26 | 4,20 | |
| Bas Mackenzie | 697 | 690 | 1,10 | 3,60 | 6,26 | 16,44 | |
| Yukon | 619 | 518 | 0,70 | 1,90 | 3,51 | 9,23 | |
|
|||||||
| Étude/ Source | Date de l'échan-tillon | COD (mg/L) |
Hydrophobe (%) | Hydrophile (%) | ||||
|---|---|---|---|---|---|---|---|---|
| Acide | Basique | Neutre | Acide | Basique | Neutre | |||
| Montreuil, 2011 | ||||||||
| Lac Pockwock, Nouvelle-Écosse | Juin 2009 | 2,6 | 8,3 | 17,6 | 20,5 | 0,0 | 19,2 | 34,5 |
| Août 2009 | 2,5 | 3,6 | 0,4 | 36,8 | 6,8 | 6,4 | 46,0 | |
| Oct. 2009 | 2,9 | 0,0 | 1,3 | 31,7 | 19,1 | 35,5 | 12,4 | |
| Déc. 2009 | 2,8 | 19,1 | 29,6 | 7,6 | 2,5 | 8,3 | 32,9 | |
| Janv. 2010 | 2,9 | 16,1 | 2,1 | 22,4 | 3,5 | 11,2 | 44,8 | |
| Juil. 2010 | 2,5 | 14,0 | 1,9 | 3,2 | 7,0 | 2,5 | 71,3 | |
| Août 2010 | 2,1 | 28,0 | 4,9 | 0,9 | 12,0 | 0,9 | 53,3 | |
| Plage (Moyenne) |
2,1-2,9 (2,6) |
0,0-28,0 (12,7) |
0,4-29,6 (8,3) |
0,9-36,8 (17,6) |
0,0-19,1 (7,3) |
0,9-35,5 (12,0) |
12,4-71,3 (42,2) |
|
| Ministère de l'Environnement et de la Conservation de Terre-Neuve-et-Labrador, 2011 | ||||||||
| Collectivité A | Févr. 2011 | 3,6 | 29,7 | 2,9 | 2,9 | 8,8 | 1,8 | 53,8 |
| Collectivité B | Sept. 2010 | 7,7 | 22,0 | 1,1 | 3,4 | 50,7 | 1,6 | 21,2 |
| Collectivité C | Sept. 2010 | 10,8 | 62,4 | 0,9 | 0,0 | 5,5 | 0,2 | 31,0 |
| Collectivité D | Janv. 2011 | 5,2 | 60,5 | 1,6 | 2,0 | 9,2 | 2,0 | 24,9 |
| Collectivité E | Sept. 2010 | 8,3 | 57,7 | 1,0 | 3,0 | 3,5 | 1,0 | 33,9 |
| Collectivité F | Déc. 2010 | 9,0 | 63,5 | 6,8 | 2,1 | 11,6 | 0,8 | 15,2 |
| Plage (Moyenne) |
3,6-10,8 (7,4) |
22,0-63,5 (49,3) |
0,9-6,8 (2,4) |
0,0-3,4 (2,2) |
3,5-50,7 (14,9) |
0,2-2,0 (1,2) |
15,2-53,8 (30,0) |
|
| Lamsal et coll., 2012 | ||||||||
| Rivière French, Nouvelle-Écosse | Non indiqué | 5,3 | 35,3 | 2,2 | 4,5 | 6,1 | 1,5 | 50,4 |
| Goss et Gorczyca, 2013 | ||||||||
| Rivière Rouge, Manitoba | Sept. 2010 | 11,3 | 21,8 | 1,9 | 21,8 | 12,9 | 1,9 | 39,7 |
| Nov. 2010 | 12,0 | 36,0 | 3,6 | 18,2 | 11,6 | 5,6 | 25,1 | |
| Févr. 2011 | 8,0 | 37,1 | 7,7 | 13,2 | 17,1 | 7,0 | 17,9 | |
| Juin 2011 | 8,7 | 27,1 | 2,4 | 11,5 | 2,3 | 5,3 | 51,3 | |
| Plage (Moyenne) |
8,0-12,0 (10,0) |
21,8-37,1 (30,5) |
1,9-7,7 (3,9) |
11,5-21,8 (16,2) |
2,3-17,1 (11,0) |
1,9-7,0 (4,9) |
17,9-51,3 (33,5) |
|
| TUV (%) |
AUV (cm-1) |
TUV (%) |
AUV (cm-1) |
TUV (%) |
AUV (cm-1) |
TUV (%) |
AUV (cm-1) |
|---|---|---|---|---|---|---|---|
| 1 | 2,0000 | 26 | 0,5850 | 51 | 0,2924 | 76 | 0,1192 |
| 2 | 1,6990 | 27 | 0,5686 | 52 | 0,2840 | 77 | 0,1135 |
| 3 | 1,5229 | 28 | 0,5528 | 53 | 0,2757 | 78 | 0,1079 |
| 4 | 1,3979 | 29 | 0,5376 | 54 | 0,2676 | 79 | 0,1024 |
| 5 | 1,3010 | 30 | 0,5229 | 55 | 0,2596 | 80 | 0,0969 |
| 6 | 1,2218 | 31 | 0,5086 | 56 | 0,2518 | 81 | 0,0915 |
| 7 | 1,1549 | 32 | 0,4949 | 57 | 0,2441 | 82 | 0,0862 |
| 8 | 1,0969 | 33 | 0,4815 | 58 | 0,2366 | 83 | 0,0809 |
| 9 | 1,0458 | 34 | 0,4685 | 59 | 0,2291 | 84 | 0,0757 |
| 10 | 1,0000 | 35 | 0,4559 | 60 | 0,2218 | 85 | 0,0706 |
| 11 | 0,9586 | 36 | 0,4437 | 61 | 0,2147 | 86 | 0,0655 |
| 12 | 0,9208 | 4 | 0,4318 | 62 | 0,2076 | 87 | 0,0605 |
| 13 | 0,8861 | 38 | 0,4202 | 63 | 0,2007 | 88 | 0,0555 |
| 14 | 0,8539 | 39 | 0,4089 | 64 | 0,1938 | 89 | 0,0506 |
| 15 | 0,8239 | 40 | 0,3979 | 65 | 0,1871 | 90 | 0,0458 |
| 16 | 0,7959 | 41 | 0,3872 | 66 | 0,1805 | 91 | 0,0410 |
| 17 | 0,7696 | 42 | 0,3768 | 67 | 0,1739 | 92 | 0,0362 |
| 18 | 0,7447 | 43 | 0,3665 | 68 | 0,1675 | 93 | 0,0315 |
| 19 | 0,7212 | 44 | 0,3565 | 69 | 0,1612 | 94 | 0,0269 |
| 20 | 0,6990 | 45 | 0,3468 | 70 | 0,1549 | 95 | 0,0223 |
| 21 | 0,6778 | 46 | 0,3372 | 71 | 0,1487 | 96 | 0,0177 |
| 22 | 0,6576 | 47 | 0,3279 | 72 | 0,1427 | 97 | 0,0132 |
| 23 | 0,6383 | 48 | 0,3188 | 73 | 0,1367 | 98 | 0,0088 |
| 24 | 0,6198 | 49 | 0,3098 | 74 | 0,1308 | 99 | 0,0044 |
| 25 | 0,6021 | 50 | 0,3010 | 75 | 0,1249 | 100 | 0,0000 |
| Formule de conversion :absorbanceUV (cm-1) = 2 – log10 transmittance UV (%) | |||||||
| Paramètre | Lieu | Fréquence | ||
|---|---|---|---|---|
| Source variable | Source stable | Idéal | ||
| Couleur | Brute et traitée | Tous les jours | Toutes les semaines | En ligne |
| UV254 ou transmittance UV | Brute et filtréeNote de bas de page a | Tous les jours | Toutes les semaines | En ligne |
| DCO (optionnel) | Brute, procédé de traitementNote de bas de page b et traitée | Tous les jours | Toutes les semaines | En ligne |
| COD | Brute et traitée | Toutes les semaines | Tous les mois | En ligne |
| ASUV – calculée à partir de UV254 et COD | Brute et traitéeNote de bas de page a | Toutes les semaines | Tous les mois | Tous les jours |
| SPDc | Réseau de distribution | Tous les trimestres (mesurer le COD le même jour pour calculer les taux spécifiques de SPD afin d'évaluer la réactivité de la MON)Note de bas de page c | ||
| Plomb | Conformément au programme de contrôle de la corrosion | |||
| Cuivre | Conformément au programme de contrôle de la corrosion | |||
| Stabilité biologique – Désinfectant résiduel – ATP accumulé sur les coupons en acier doux – Résistance à la polarisation rectiligne au moyen de coupons en acier doux |
Réseau de distribution | Toutes les semaines Tous les mois Tous les mois |
Toutes les semaines Tous les mois Tous les mois |
En ligne |
| Demande de coagulant | Procédé de coagulationNote de bas de page d | Tous les jours | Tous les jours | En ligne |
| Potentiel zêta ou courant d'écoulement – lorsque la MON contrôle ou influence la dose de coagulant | Procédé de coagulationNote de bas de page d | En ligne | En ligne | En ligne |
|
||||